ERGモノクローナル抗体
ERG、およびより具体的には、ERG3のアミノ酸42-66により形成されるエピトープに結合する、モノクローナル抗体、またはその抗原結合フラグメントが開示される。このモノクローナル抗体は、非ヒト抗体から誘導されたCDR領域を有する非ヒト抗体(例えば、ウサギもしくはマウス)またはヒト化モノクローナル抗体であってよい。他の実施形態においては、前記モノクローナル抗体は、非ヒトERG抗体の軽鎖および重鎖可変領域を有する、キメラである。臨床設定においてERGもしくはERG融合事象を検出する方法などの、ERG、またはTMPRSS2/ERG、SLC45A3/ERGもしくはNDRG1/ERG融合転写物によりコードされるERGポリペプチドなどのERGポリペプチドの全部もしくは一部を含む融合タンパク質を検出するための前記抗体の使用方法も提供される。また、この抗体を用いて、ERGまたはTMPRSS2/ERG、SLC45A3/ERGもしくはNDRG1/ERG融合転写物によりコードされるERGポリペプチドなどのERGポリペプチドの全部もしくは一部を含む融合タンパク質の活性を阻害し、前立腺癌、ユーイング肉腫、急性骨髄性白血病、急性Tリンパ芽球性白血病、内皮細胞癌、および結腸癌などのERGの過剰発現またはERG融合事象と関連する悪性腫瘍を治療することもできる。
【発明の詳細な説明】
【技術分野】
【0001】
政府権益の声明
本発明は、Uniformed Services University of the Health Sciencesから、連絡番号HU0001-04-C-1502によって、およびU.S. Army Medical Research Acquisition Activityから、認可番号W81XWH-08-1-0532によって資金供給された研究から、一部米国政府の支援と共に為されたものである。米国政府は本発明において特定の権利を有する。
【0002】
関連出願に対する相互参照
本出願は、2009年4月29日に提出された米国特許仮出願第61/173,834号(その全開示は参照により本明細書に組入れられるものとする)の利益を請求し、その出願日に依存する。
【背景技術】
【0003】
ETS関連遺伝子(ERG)癌原遺伝子は、TMPRSS2とETSファミリーの遺伝子を含む遺伝子融合物の再発の結果として、前立腺腫瘍の60〜70%において過剰発現される(Petrovicsら、2005; Tomlinsら、2005; Kumar-Sinhaら、2008に概説されている)。ヒト前立腺癌標本および様々な実験モデルに関する新たな研究は、前立腺癌におけるERGの原因的な発癌機能を強調している ADDIN EN.CITE ADDIN EN.CITE.DATA (Klezovitchら、2008; Tomlinsら、2008; Sunら、2008; Wangら、2008)。多くの報告が、ERGの遺伝子活性化の診断的特徴および予測的特徴の両方を強調しており、前立腺腫瘍の約半分がアンドロゲン受容体に調節されるTMPRSS2遺伝子プロモーターとERGタンパク質コード配列との間で起こる最も一般的な遺伝子融合物を担持することを示している(Kumar-Sinhaら、2008に概説されている)。TMPRSS2遺伝子プロモーターとERGとの間の融合は、N末端トランケートされたERGまたは完全長形態のERGの過剰発現をもたらす ADDIN EN.CITE ADDIN EN.CITE.DATA (Klezovitchら、2008; ADDIN EN.CITE ADDIN EN.CITE.DATA Sunら、2008)。ergと、SLC45A3(Hanら、2008)およびNDRG1(Pfluegerら、2009)などの他のアンドロゲン誘導性プロモーター配列との間の融合事象も、前立腺癌において同定されている。
【0004】
TMPRSS2/ERG融合物の複製物または融合事象に関連する染色体喪失(Edel)を担持する腫瘍を有する患者に関する乏しい疾患転帰が強調されている ADDIN EN.CITE ADDIN EN.CITE.DATA (Attardら、2008; FitzGeraldら、2008; Mehraら、2008)。前立腺癌の現行の診断は、構造的増殖パターン、基底細胞の喪失、核異型、両染性細胞質、管腔内ブルームチン、ピンクアモルファス分泌、および有糸分裂像などの様々な組織学的特徴に基づいている(Egevad、2008)。これらの特徴のいくつかが明らかでない場合、特に、腫瘍含量が非常に限られた前立腺針生検の場合、病理学者が前立腺癌を診断することが難しいことがある(Mostofiら、1992;Mostofiら、1993)。現在では、診断を助けるために分子マーカーが用いられている。例えば、前立腺癌の診断は、特異的サイトケラチンまたはp63(CK903、p63)および腫瘍細胞関連α-メチルアシル-CoA-ラセマーゼ(AMACRまたはP504S)に関する良性腺の基底細胞染色を含んでもよい(Luoら、2002;Rubinら、2002)。しかしながら、これらの分子マーカーは、日常的な診断においては顕著な限界を有する。AMACRの発現は、良性前立腺の最大21%、腎性腺腫の58%および異型腺腫様過形成の事例の約18%などの様々な他の非悪性病変において認められる ADDIN EN.CITE ADDIN EN.CITE.DATA (Beachら、2002; Guptaら、2004; Jiangら、2001; Yangら、2002)。ERG過剰発現およびTMPRSS2/ERGゲノム再配列を評価する新しいデータは、前立腺癌の診断および予測における非常に有望な新戦略を提供している(Furusatoら、2008;Saramakiら、2008)。
【0005】
EWS-ERG融合物は、ユーイング肉腫の一部集団において記載されているが、融合物を含まないERG過剰発現は急性骨髄性白血病および急性Tリンパ芽球性白血病において強調された(Marcucciら、2005;Baldusら、2006)。ERG過剰発現はまた、巨核芽球性白血病にも関連している(Rainisら、2005)。他の研究は、ERG発現の増加がアルツハイマー病(AD)およびダウン症候群におけるAD様ニューロパシーにおいて役割を果たすことを示唆している(Shimら、2003;Ngら、2010)。
【0006】
ヒトERG遺伝子の構造は、約300キロ塩基のゲノム配列に広がり、少なくとも9個の別々の転写物を生成する少なくとも17個のエクソンを含む(Owczarekら、2004)。ERG1〜ERG5アイソフォームは、ETS部位に結合し、転写アクチベーターとして作用することができる5個の別々のポリペプチドをコードする(Owczarekら、2004)。これらの5個のアイソフォームのうち、ERG3が最も長く、479アミノ酸のポリペプチド(配列番号1;受託番号NP_891548.1)をコードする。ERG6〜ERG9アイソフォームは、他のERGアイソフォームとは異なる5'エクソンを含む選択的スプライス形態である。ERG7およびERG8はオープンリーディングフレームを有するが、ERG6は複数の停止コドンをコードし、これは、このERG転写物が機能的タンパク質をコードしないことを示唆している(Owczarekら、2004)。ERG9転写物は推定停止コドンまたは共通ポリアデニル化シグナルを含まないが、これは、それも非コード転写物であり得ることを示唆している(Owczarekら、2004)。
【0007】
ERG癌原遺伝子は20年以上前に初めて特性評価されたが(Raoら、1987a;Raoら、1987b;Reddyら、1987)、現在でも臨床標本においてERGを検出するための抗体が入手できない。ERGタンパク質は、後生動物全体に渡り保存されている、高度に相同な群のタンパク質であるETS(E-26特異的、E26形質転換特異的)多遺伝子ファミリーの転写因子に属する(TurnerおよびWatson、2008)。ETSタンパク質は、翼のあるヘリックスターンヘリックスDNA結合ドメインと、タンパク質間相互作用に関与する鋭い(SAM)ドメインとを含む。このファミリー間の高い相同性は、このタンパク質ファミリーの特定のメンバーに対する抗体を生じさせるための大きな障害となる。
【0008】
ポリクローナルERG抗体は市販されているが、これらの抗体は内因性レベルのERGタンパク質に対する低い親和性を示し、例えば、免疫組織化学試験においてその有用性を限定する高レベルの非特異的染色を示す。そのようなものとして、市販のポリクローナルERG抗体は、臨床設定(例えば、組織生検)においてERGタンパク質を検出するのに好適ではない。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Petrovics, G. et al., (2005). Oncogene 24, 3847-3852.
【非特許文献2】Tomlins, S.A. et al. (2005). Science 310, 644-647.
【非特許文献3】Kumar-Sinha, C. et al. (2008). Nat Rev Cancer 8, 497-511.
【非特許文献4】Klezovitch, O. et al. (2008). Proc Natl Acad Sci U S A 105, 2105-2110.
【非特許文献5】Tomlins, S.A. et al. (2008). Neoplasia 10, 177-188.
【非特許文献6】Sun, C. et al. (2008). Oncogene 27, 5348-5353.
【非特許文献7】Wang et al. Cancer Res. (2008). 68, 8516-24.
【非特許文献8】Han, B. et al., (2008) Cancer Res 68, 7629-7637.
【非特許文献9】Attard, G. et al. (2008). Oncogene 27, 253-263.
【非特許文献10】FitzGerald, L.M. et al. (2008). BMC Cancer 8, 230.
【非特許文献11】Mehra, R. et al. (2008). Cancer Res 68, 3584-3590.
【非特許文献12】Egevad, L. (2008). Anal Quant Cytol Histol 30, 190-198.
【非特許文献13】Mostofi, F.K. et al. (1992). Cancer 70, 235-253.
【非特許文献14】Mostofi, F.K. et al. (1993). Cancer 71, 906-932.
【非特許文献15】Luo, J. et al. (2002). Cancer Res 62, 2220-2226.
【非特許文献16】Rubin, M.A. et al. (2002). JAMA 287, 1662-1670.
【非特許文献17】Beach, R. et al. (2002). Am J Surg Pathol 26, 1588-1596.
【非特許文献18】Gupta, A. et al. (2004). Am J Surg Pathol 28, 1224-1229.
【非特許文献19】Jiang, Z. et al. (2001). Am J Surg Pathol 25, 1397-1404.
【非特許文献20】Yang, X.J. et al. (2002). Am J Surg Pathol 26, 921-925.
【非特許文献21】Furusato, B. et al. (2008). Mod Pathol 21, 67-75.
【非特許文献22】Saramaki, O.R. et al. (2008). Clin Cancer Res 14, 3395-3400.
【非特許文献23】Rainis, L. et al. (2005). Cancer Res 65, 7596-7602.
【非特許文献24】Shim et al. (2003). J. Neural Trans. Suppl. 67:39-49.
【非特許文献25】Ng, A.P. et al. (2010). Trisomy of Erg is required for myeloproliferatioon in mouse model of Down syndrome Blood, in press.
【非特許文献26】Owczarek, C.M. et al. (2004). Gene 324, 65-77.
【非特許文献27】Rao, V.N. et al. (1987a). Science 237, 635-639.
【非特許文献28】Rao, V.N. et al. (1987b). Oncogene Res 2, 95-101.
【非特許文献29】Reddy, E.S. et al. Proc Natl Acad Sci U S A 84, 6131-6135.
【非特許文献30】Turner, D.P. and Watson, D.K. (2008). Expert Rev Anticancer Ther 8, 33-42.
【発明の概要】
【0010】
本開示は、ヒトERGに結合し、例えば、前立腺癌などの、ERG融合事象および/またはERG過剰発現と関連する癌を検出および治療する方法において用いることができる抗体を提供する。この抗体は、非特異的染色をほとんど示さずに、ヒトERGに対する高い親和性を示し、かくして、組織生検、血液および尿などの臨床設定においてERGタンパク質を検出するのに好適である。
【0011】
一実施形態は、ヒトERGに結合し、より具体的には、ヒトERG3(配列番号1)のアミノ酸残基42〜66に対応し、以後「ERG 42-66エピトープ」と呼ばれる、以下のポリペプチド配列:GQTSKMSPRVPQQDWLSQPPARVTIにより形成されるエピトープに結合するモノクローナル抗体に関する。別の実施形態においては、前記抗体は、ヒトERG3(配列番号1)への抗体の結合が、ヒトERG3のアミノ酸残基42〜66に対応するポリペプチドにより競合的に阻害される、ヒトERGに結合するモノクローナル抗体である。
【0012】
一実施形態においては、前記抗体は、ハイブリドーマクローン9FYにより産生されるモノクローナル抗体(「9FY抗体」)である。別の実施形態においては、前記抗体は、ERG 42-66エピトープに結合し、ヒトERG3への9FY抗体の結合を競合的に阻害するモノクローナル抗体である。
【0013】
他の実施形態においては、前記モノクローナル抗体は、ヒト化抗体、キメラ化抗体、または完全ヒト抗体である。一態様においては、前記モノクローナル抗体は、ヒト抗体の軽鎖および重鎖可変領域のフレームワーク(FR)領域に連結された、ならびに必要に応じて、ヒト抗体の軽鎖および重鎖定常領域に連結された、ERG 42-66エピトープに結合する非ヒトERG抗体の軽鎖および重鎖可変領域の相補性決定領域(CDR)を含む。一実施形態においては、前記モノクローナル抗体は、ERG 42-66エピトープに結合し、配列番号2の3個のCDRを含む軽鎖可変ドメインと、配列番号3の3個のCDRを含む重鎖可変ドメインとを含む。このヒト化抗体は、親抗体のERG抗原特異性を保持するが、ヒト被験者における免疫原性は低い。
【0014】
別の態様においては、前記抗体はキメラモノクローナル抗体である。このキメラ抗体は、必要に応じて、ヒト抗体の軽鎖および重鎖定常領域に連結された、ERG 42-66エピトープに結合する非ヒトERG抗体の軽鎖および重鎖可変領域を含む。このキメラ抗体は、親抗体のERG抗原特異性を保持するが、ヒト被験者における免疫原性は低い。一実施形態においては、前記モノクローナル抗体は、ERG3 42-66エピトープに結合し、配列番号2のアミノ酸配列を含む軽鎖可変ドメインと、配列番号3のアミノ酸配列を含む重鎖可変ドメインとを含む。
【0015】
また、ERG 42-66エピトープに結合する完全ヒトERG抗体も意図される。
【0016】
ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を、様々な研究および医学的用途において用いることができる。例えば、本開示は、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体のいずれか1つを含む組成物ならびに例えば、前立腺癌、ユーイング肉腫、急性骨髄性白血病、巨核芽球性白血病、内皮細胞癌、および急性Tリンパ芽球性白血病などの、ERG融合事象またはERG過剰発現と関連する癌または病理学的症状を検出または治療するためのその使用を提供する。また、ERG42-66エピトープに結合するモノクローナル抗体を用いて、生物学的サンプル中で、ヒトERGまたはTMPRSS2/ERG融合転写物によりコードされるERGタンパク質などのヒトERGポリペプチドの全部もしくは一部を含む融合タンパク質を検出することもできる。
【0017】
別の態様は、ERG 42-66ポリペプチドを含む組成物に関する。一実施形態においては、前記組成物はさらに、ERG 42-66ポリペプチドに結合した、アジュバントおよび/またはKLHなどのハプテンを含む。これらの組成物を、例えば、抗体の製造方法において用いることができる。一実施形態においては、前記方法は、前記組成物を、限定されるものではないが、マウスまたはウサギなどの非ヒト動物に投与することを含む。この方法はさらに、非ヒト動物からB細胞を単離し、そのB細胞を不死化して、モノクローナル抗体を産生することができる細胞系を作製し、ERG 42-66エピトープに結合するモノクローナル抗体を選択することを含む。
【0018】
さらなる態様においては、本発明は、例えば、9FY抗体などの、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体の軽鎖および/または重鎖可変領域の1個以上のCDRのアミノ酸配列をコードする核酸配列を含む単離されたポリヌクレオチドを提供する。同様に、本発明は、例えば、9FY抗体などの、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体の軽鎖および/または重鎖可変領域のアミノ酸配列をコードするDNA配列を含む単離されたポリヌクレオチドを提供する。
【図面の簡単な説明】
【0019】
本明細書に組込まれ、その一部を構成する添付の図面は、特定の実施形態を例示するものであり、発明の詳細な説明と共に、本明細書に開示された抗体の特定の原理および方法を説明するのに役立つ。
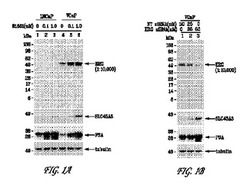
【図1】図1Aは、9FY抗体が、合成アンドロゲンホルモン(R1881)処理に応答して発現された、TMPRSS2/ERG3融合物を担持するVCaP細胞の免疫ブロットにおいて、TMPRSS2/ERG3融合転写物(50〜52 kDa)によりコードされる内因性ERGタンパク質を検出することを示す(レーン4〜6)。9FY抗体は、TMPRSS2/ERG融合タンパク質を担持しないLNCaP細胞に対しては免疫反応性を示さない(レーン1〜3)。下のパネルに、プロステイン(SLC45A3)およびPSA(KLK3)のホルモン用量依存的発現を示す。図1Bは、ERG siRNAが、R1881処理されたVCaP細胞においてERG発現を阻害することを示す。
【図2】図2Aは、9FY抗体が、ELISAアッセイにおいて免疫化ポリペプチドを認識することを示す。様々な濃度の免疫化ポリペプチドと2種の対照ポリペプチドを、ELISAのウェルに塗布し、9FY抗体の1:10,000希釈液で精査した。Y軸は、450 nmでの吸光度の値を示す。X軸上に、ERG免疫化ポリペプチドと対照ポリペプチドのlog10濃度をng/mlで示す。図2Bは、免疫化ポリペプチドが、9FY抗体結合に関してERG3タンパク質と競合することを示す。サンドイッチELISAアッセイにおいて、ERG3タンパク質溶解物を、多ウェル形式のプレートに塗布し、免疫化ポリペプチドの存在下(白色のバー)および非存在下(影付きのバー)で様々な濃度の9FY抗体を用いてアッセイした。希釈倍率をX軸上に示す。抗体力価を影付きのバーにより示す。
【図3】図3は、9FY抗体が、in vivoクロマチン免疫沈降アッセイ(ChIP)により示されるようにゲノム標的部位に由来するERGタンパク質を認識し、免疫沈降することを示す。R1881処理されたVCaP細胞を、ERG siRNA(si)によりノックダウンERGに、または対照非標的化(NT)siRNAによりトランスフェクトした。細胞をChIPアッセイのために処理し、9FY抗体を用いることによりクロマチンを免疫沈降させた。対照(NT)トランスフェクト細胞においては、ERGタンパク質はHPGDH、C-MYC、KLK3(PSA)およびSLC45A3(プロステイン)ゲノム標的配列に動員される。ERGノックダウンは、ゲノム標的部位へのERGの動員を強力に減少させる。入力ゲノムDNAアンプリコンを、ChIPアッセイのための対照として用いた。
【図4−1】図4は、9FY抗体が、免疫蛍光(IF)アッセイにおいて内因性ERGタンパク質を特異的に認識することを示す。ERGを、一次9FY抗体、次いで、ヤギ抗マウスALEXA FLUOR(登録商標)594(Invitrogen, Carlsbad, CA)二次抗体(赤色)により染色する。ERGにより負に制御されるアンドロゲン誘導性PSAを、一次ウサギポリクローナル抗PSA、次いで、ヤギ抗ウサギALEXA FLUOR(登録商標)488(Invitrogen, Carlsbad, CA)二次抗体(緑色)により染色する。DNAをDAPI(青色)により染色する。右欄の融合した画像は、ERGの核局在化を示す。図4Aは、ERG siRNAを用いるERGのノックダウンが、R1881処理されたVCaP細胞からERGおよび核9FY抗体染色を消失させることを示す。細胞質PSA発現は、VCaP細胞のホルモン誘導と一致している。図4Bは、免疫化ポリペプチド(競合ペプチド)が、9FY抗体によるERG染色を消失させることを示す。対照的に、対照ポリペプチド(非競合ペプチド)は9FY抗体染色に影響しない。図4Cは、9FY抗体がTMPRSS2/ERG融合物を担持するVCaP細胞においてはアンドロゲンホルモン(R1881)に応答するERG発現の強い活性化を検出するが、内因性ERGを発現しないLNCaP細胞においては検出しないことを示す。
【図4−2】図4Dは、9FY抗体染色が、ERG siRNAによるERGノックダウンに応答してVCaP細胞中で減少することを示す。PSA発現は、PSAの発現に対するERGの負に調節する役割と一致するERGノックダウンに応答して増加する。9FY抗体は、3.7 mg/mlの9FY抗体保存溶液の1:5,000〜1:20,000倍希釈範囲でもERGを検出する。図4Eは、9FY抗体の非存在下および二次抗体の存在下でのIFアッセイの実施が、バックグラウンド染色をもたらさないことを示す。
【図5−1】図5は、9FY抗体が、免疫組織化学分析(IHC)によりアッセイされたホルマリン固定パラフィン包埋(FFPE)ヒト前立腺全摘出術標本において前立腺腫瘍の上皮細胞を特異的に染色することを示す。図5Aは、9FY抗体で染色された前立腺切片の代表的な視野を示す。前立腺腫瘍上皮と良性上皮との優れた区別がIHCにおいて明らかである。前立腺間質の染色の欠如も明らかである。野生型ERGを発現する血管内皮は、9FY抗体により染色され、9FY抗体の適切な機能のための優れた内部参照を提供する。
【図5−2】図5Bは、FFPE切片と9FY抗体による前立腺腫瘍上皮の明確な染色の高倍率視野を示す。
【図5−3】図5Cは、ホルマリン固定パラフィン包埋(FFPE)ヒト前立腺全摘出術標本の切片上の9FY抗体によるERG染色のパノラマ視野を示す。
【図5−4】図5Dは、切片の対応するヘマトキシリンおよびエオシン染色を示す。
【図6】図6は、内因的に発現されるERGタンパク質が、免疫ブロットアッセイを用いることにより、結腸癌(COLO320)、急性骨髄性白血病(KG1)、およびヒト急性Tリンパ芽球性白血病(MOLT4)由来細胞系において9FY抗体によって検出されることを示す。
【図7】図7は、9FY抗体は、免疫ブロットにおいてTMPRSS2/ERG融合転写物によりコードされる外因的に過剰発現されたERGタンパク質を特異的に検出するが、市販のポリクローナル抗体は、同じ細胞溶解物中の複数のタンパク質を検出することを示す。空のベクターでトランスフェクトされた20μgの対照HEK293細胞溶解物を、レーン1、4および7にロードした;pIRES-TMPRSS2-ERG3でトランスフェクトされたHEK293細胞に由来する4μgおよび20μgの溶解物を、それぞれ、レーン2、5および8、ならびにレーン3、6および9にロードした。
【図8】図8Aは、ポリクローナルH95(sc-28680)抗体がLNCaPおよびVCaP細胞溶解物において複数の非特異的バンドを検出することを示す。LNCaPおよびVCaP細胞を、合成アンドロゲンホルモン(R1881)を用いて(レーン2、3、5および6)または用いずに(レーン1および4)処理した。図8Bは、ERG siRNAおよび/または非標的化(NT)RNAで処理したVCaP細胞中での未知のタンパク質へのH95抗体の非特異的結合を示す。ERG siRNAの非存在下では、H95抗体はERG発現を検出しないようである。さらに、H95抗体の場合、ERG siRNAによるERG発現の阻害を観察することができない。
【図9−1】図9AおよびBは、市販のC-20ポリクローナル抗体(sc-353)が、IFアッセイにおいて核ERGタンパク質だけでなく、非特異的細胞質タンパク質も認識することを示す。
【図9−2】図9AおよびBは、市販のC-20ポリクローナル抗体(sc-353)が、IFアッセイにおいて核ERGタンパク質だけでなく、非特異的細胞質タンパク質も認識することを示す。
【図10】図10は、市販のH95ポリクローナル抗体(sc-28680)が、IFアッセイにおいてVCaPおよびLNCaP細胞の両方において非特異的核染色および細胞質染色を示すことを示す。
【図11】図11は、市販のR20ポリクローナル抗体(sc-18136)が、IFアッセイにおいてVCaPおよびLNCaP細胞の両方において非特異的核染色および細胞質染色を示すことを示す。
【図12】図12は、9FY抗体(ERG-MAb)と市販のH95ポリクローナル抗体(sc-28680)との間のVCaP細胞中での競合的IFアッセイの結果を示す。
【図13】図13は、9FY抗体が、TMPRSS2-ERG融合物の共通のスプライス変異体によりコードされるERG癌タンパク質産物を検出することを示す。具体的には、9FY抗体は、TMPRSS2-ERG融合型A cDNA(レーン2および3)、野生型ERG3 cDNA(レーン4)ならびにTMPRSS2-ERG8融合型A cDNA(レーン5)によりコードされるERG癌タンパク質産物を認識した。
【図14】図14は、野生型およびERGトランスジェニックマウスから得られた前立腺組織における9FY抗体と市販のC20(sc 353)抗体(Santa Cruz Biotechnology, Inc, Santa Cruz, CA)との比較免疫組織化学分析の結果を示す。図14Aおよび14Cは、それぞれ、野生型およびERGトランスジェニック前立腺組織における9FY抗体染色を示す。実線矢印は前立腺を示し、破線矢印は内皮細胞を示す。図14Bおよび14Dは、それぞれ、野生型およびERGトランスジェニック前立腺組織における市販のC20(sc 353)抗体の染色パターンを示す。
【図15】図15は、分枝鎖DNAアッセイを用いることにより前立腺全摘出術で治療した35人の患者の前立腺腫瘍におけるERG癌タンパク質(IHC)およびTMPRSS2-ERG融合物mRNAの発現の略図を示す。全載FFPE前立腺標本に由来する連続組織スライドを、盲検様式で2つのアッセイに用いた。後方斜線型の三角形は陽性ERG癌タンパク質染色を表すが、前方斜線型の三角形はTMPRSS2-ERG融合物mRNAの検出を表す。中空の三角形は、ERG癌タンパク質を含まないか、または検出不可能なTMPRSS2-ERG融合転写物を含む標本を示す。
【発明を実施するための形態】
【0020】
発明の詳細な説明
ここで、様々な例示的実施形態(その例は添付の図面に例示される)を詳細に参照する。以下の詳細な説明は、本発明の特定の実施形態、特徴、および態様の詳細のより完全な理解を読者に与えるために提供されるものであり、本発明の範囲の限定として解釈されるべきではない。
【0021】
1. 定義
本発明をより容易に理解するために、特定の用語を最初に定義する。追加の定義は詳細な説明を通して説明される。
【0022】
本開示で用いられる用語「抗体」とは、免疫グロブリンまたはその抗原結合フラグメントを指す。この用語は、限定されるものではないが、ポリクローナル抗体、モノクローナル抗体、一特異的抗体、多特異的抗体、非特異的抗体、ヒト化抗体、ヒト抗体、一本鎖抗体、キメラ抗体、合成抗体、組換え抗体、ハイブリッド抗体、突然変異抗体、移植抗体、およびin vitroで生成された抗体を含む。抗体は、定常領域、またはκ、λ、α、γ、δ、εおよびμ定常領域遺伝子などのその一部を含んでもよい。例えば、IgG1、IgG2、IgG3、IgG4、IgM、IgA1、IgA2、IgDおよびIgEなどの様々なアイソタイプの重鎖定常領域を用いることができる。例えば、軽鎖定常領域はκまたはλであってよい。
【0023】
用語「抗原結合ドメイン」および「抗原結合フラグメント」とは、抗体と抗原との特異的結合を担うアミノ酸を含む抗体分子の一部を指す。特定の抗原について、抗原結合ドメインまたは抗原結合フラグメントは、その抗原の一部にのみ結合することができる。抗体により特異的に認識され、結合する抗原の部分を、「エピトープ」または「抗原決定基」と呼ぶ。抗原結合ドメインおよび抗原結合フラグメントとしては、Fab(フラグメント抗原結合);F(ab')2フラグメント、ヒンジ領域でジスルフィド架橋により連結された2個のFabフラグメントを有する二価フラグメント;Fvフラグメント;一本鎖Fvフラグメント(scFv)(例えば、Birdら(1988)Science 242:423-426;およびHustonら(1988)Proc. Natl. Acad. Sci. USA 85:5879-5883を参照されたい);2個のVHおよびCH1ドメインを有するFdフラグメント;dAb(Wardら(1989)Nature 341:544-546)、ならびに抗原結合機能を保持する他の抗体フラグメントが挙げられる。Fabフラグメントは、定常領域間でジスルフィド結合により共有結合したVH-CH1およびVL-CLドメインを有する。Fvフラグメントはより小さく、非共有結合したVHおよびVLドメインを有する。非共有結合したドメインが解離する傾向を克服するために、scFvを構築することができる。scFvは、(1)VLのN末端にVHのC末端を連結するか、または(2)VHのN末端にVLのC末端を連結する可撓性ポリペプチドを含む。15マーの(Gly4Ser)3ペプチドをリンカーとして用いてもよいが、他のリンカーも当業界で公知である。これらの抗体フラグメントを、当業者には公知の従来の技術を用いて取得し、このフラグメントを無傷の抗体と同じ様式でその機能について評価する。
【0024】
用語「有効量」とは、ERGまたはTMPRSS2/ERG融合転写物によりコードされるERGタンパク質などのヒトERGポリペプチドの全部もしくは一部を含む融合タンパク質の活性を低下させ、患者における症候の改善をもたらすか、または所望の生物学的結果を達成するのに十分である用量または量を指す。例えば、前立腺癌については、所望の生物学的結果は、腫瘍サイズの低下、Gleasonスコアの減少、および/または腫瘍分化の増加を含んでもよい。
【0025】
用語「TMPRSS2/ERG融合転写物によりコードされるERGタンパク質」とは、TMPRSS2遺伝子プロモーターとヒトERG転写物との融合事象により生成される転写物によりコードされる、ERG3などのトランケートされたERGタンパク質を指す。
【0026】
用語「融合タンパク質」とは、2個のヌクレオチド配列間の融合事象から生成される転写物から翻訳されるタンパク質を指す。ヌクレオチド配列の一方は非コード配列(例えば、TMPRSS2、SLC45A3、またはNDRG1配列)であってよいが、他方のヌクレオチド配列はコード配列(例えば、ERG)の全部または一部である。あるいは、2個のヌクレオチド配列は両方ともコード配列であってもよい。
【0027】
用語「ヒト抗体」は、例えば、参照によりその全体が本明細書に組入れられるものとする、Kabatら(Kabatら(1991) Sequences of Proteins of Immunological Interest、第5版、米国保険社会福祉省、NIH刊行物番号91-3242を参照)により記載されたものなどの、当業界で公知のヒト生殖細胞免疫グロブリン配列と実質的に一致する可変および定常領域を有する抗体を含む。ヒト抗体は、例えば、CDR、特に、CDR3中に、ヒト生殖細胞免疫グロブリン配列によりコードされないアミノ酸残基(例えば、in vitroでの無作為もしくは部位特異的突然変異誘発によるか、またはin vivoでの体細胞突然変異により導入される突然変異)を含んでもよい。ヒト抗体は、少なくとも1、2、3、4、5個以上の位置がヒト生殖細胞免疫グロブリン配列によりコードされないアミノ酸残基で置換されてもよい。
【0028】
用語「治療」または「治療すること」などは、哺乳動物、例えば、特に、ヒトまたはマウスにおける任意の疾患または症状の任意の治療を指し、疾患、症状、または疾患もしくは症状の症候を阻害すること、例えば、患者におけるその発達を停止させること、および/もしくはその開始もしくは発現を遅延させること、または疾患、症状、または疾患もしくは症状の症候を軽減すること、例えば、症状または疾患および/もしくはその症候の回帰を引き起こすことを含む。
【0029】
用語「被験体」、「宿主」、「患者」および「個体」は、本明細書では互換的に用いられ、診断または療法が望まれる任意の哺乳動物被験体、特に、ヒトを指す。
【0030】
用語「製薬上許容し得る担体」または「製薬上許容し得る賦形剤」は、医薬投与と適合する、溶媒、分散媒体、コーティング、抗微生物剤および抗菌剤、等張剤、ならびに吸収遅延剤などを意味する。製薬上活性物質のためのそのような媒体および薬剤の使用は、当業界でよく知られている。
【0031】
抗体の文脈で用いられる場合、用語「単離された」とは、その天然の環境を実質的に含まない抗体を指す。例えば、単離されたタンパク質は、それが誘導された細胞もしくは組織起源に由来する細胞材料または他のタンパク質を実質的に含まない。この用語はまた、単離されたタンパク質が医薬組成物のために十分に純粋であるか、または少なくとも70〜80%(w/w)純粋であるか;または少なくとも80〜90%(w/w)純粋であるか;または少なくとも90〜95%純粋であるか;または少なくとも95%、96%、97%、98%、99%、もしくは100%(w/w)純粋である調製物を指す。
【0032】
用語「9FY抗体」は、2008年9月17日以来、Center for Prostate Disease Research in Rockville, Marylandの研究室で連続細胞培養継代を介して維持されている9FYという名称のハイブリドーマクローンにより産生されるモノクローナル抗体である。9FYハイブリドーマクローンのアリコートもCenter for Prostate Disease Researchで標識、凍結、および保存されている。
【0033】
用語「ERG 42-66エピトープ」とは、配列番号1のアミノ酸残基42〜66により形成される立体配座エピトープまたは直線エピトープを指す。
【0034】
用語「ERG 42-66ポリペプチド」とは、配列番号1のアミノ酸残基42〜66を含む、60個以下のアミノ酸残基を有するポリペプチドを指す。特定の実施形態においては、ERG 42-66ポリペプチドは、50、40、30、または25個以下のアミノ酸残基を有する。
【0035】
用語「ヒトERG3」とは、受託番号NP_891548;VERSION NP_891548.1 GI:33667107のアミノ酸配列を有するポリペプチドを指す。
【0036】

(配列番号1)。
【0037】
2. 抗ERG抗体
上記で考察されたように、ERGはETSファミリーの転写因子に属する癌原遺伝子である。ETSファミリーのタンパク質のメンバー間は相同性の程度が高いため、このファミリーの特定のメンバーに対する抗体を生成することはいまだ課題である。さらに、現在まで、ERGに対するポリクローナル抗体は、有意な非特異的結合を保持し、ERGまたは前立腺癌において同定されているTMPRSS2/ERG、SLC45A3/ERG、もしくはNDRG1/ERG融合転写物によりコードされるERGポリペプチドなどの、ERGポリペプチドの全部もしくは一部を含む融合タンパク質を発現する癌細胞または組織の検出に役立つ臨床設定(例えば、IHC)においてそのような抗体を使用するのを妨げている。
【0038】
本開示は、ヒトERGに結合する抗体を提供する。より具体的には、前記抗体はERG 42-66エピトープに結合する。ヒトERG3のアミノ酸42-66は、ERG座のエクソン8に位置するヌクレオチド配列によりコードされる(Owczarekら、2004)。エクソン8は、ERG2、ERG3、ERG4、ERG5(部分的エクソン)、ERG7およびERG8に認められるが、ERG1には認められない(Owczarekら、2004)。かくして、本明細書に開示される抗体はERG1タンパク質と交叉反応しない。
【0039】
免疫グロブリンとしても知られる抗体は、典型的には、それぞれ約25 kDaの2個の軽鎖(L)とそれぞれ約50 kDaの2個の重鎖(H)から構成されるテトラマー糖鎖タンパク質である。λおよびκと呼ばれる、2つの型の軽鎖が抗体中に認められる。重鎖の定常ドメインのアミノ酸配列に応じて、免疫グロブリンを5つの主要なクラス:A、D、E、GおよびMに割り当て、これらのうちのいくつかをサブクラス(アイソタイプ)、例えば、IgG1、IgG2、IgG3、IgG4、IgA1、およびIgA2にさらに分割することができる。各軽鎖は、N末端可変(V)ドメイン(VL)と定常(C)ドメイン(CL)を含む。各重鎖は、N末端Vドメイン(VH)、3個または4個のCドメイン(CH)、およびヒンジ領域を含む。VHに最も近いCHドメインをCH1と呼ぶ。VHおよびVLドメインは、フレームワーク領域(FR1、FR2、FR3およびFR4)と呼ばれる比較的保存された配列の4個の領域からなり、超可変配列の3個の領域(相補性決定領域、CDR)のための足場を形成する。CDRは、抗体と抗原との特異的相互作用を担う多くの残基を含む。CDRをCDR1、CDR2およびCDR3と呼ぶ。従って、重鎖上のCDR構成要素を、H1、H2およびH3と呼ぶが、軽鎖上のCDR構成要素をL1、L2およびL3と呼ぶ。フレームワークおよびCDR残基の同定および番号付けは、Chothiaら、Structural determinants in the sequences of immunoglobulin variable domain, J Mol Biol 1998, 278:457-79(その全体が参照により本明細書に組入れられるものとする)により記載された通りである。
【0040】
典型的には、CDR3は抗体結合部位内の分子多様性の最も大きい起源である。例えば、H3は、2個のアミノ酸残基と同じぐらい短いか、または26アミノ酸より大きい。様々なクラスの免疫グロブリンのサブユニット構造および三次元配置が当業界でよく知られている。抗体構造の概説については、Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory、Harlowら(編)、1988を参照されたい。当業者であれば、それぞれのサブユニット構造、例えば、CH、VH、CL、VL、CDR、FR構造が、活性フラグメント、例えば、抗原に結合するVH、VLもしくはCDRサブユニットの一部、すなわち、抗原結合フラグメント、または、例えば、Fc受容体および/もしくは補体に結合し、および/もしくはそれを活性化するCHサブユニットの一部を含むことを認識するであろう。CDRは、典型的には、Sequences of Proteins of Immunological Interest、米国保険社会福祉省(1991)、Kabat(編)に記載のKabat CDRを指す。抗原結合部位を特性評価するための別の標準は、Chothiaにより記載された超可変ループを参照することである。例えば、Chothia, D.ら(1992) J. Mol. Biol. 227:799-817; およびTomlinsonら(1995) EMBO J. 14:4628-4638を参照されたい。さらに別の標準は、Oxford Molecular's AbM抗体モデリングソフトウェアにより用いられるAbM定義である。一般的には、例えば、Protein Sequence and Structure Analysis of Antibody Variable Domains. In: Antibody Engineering Lab Manual (編: Duebel, S.およびKontermann, R., Springer-Verlag, Heidelberg)を参照されたい。あるいは、Kabat CDRに関して記載される実施形態を、Chothiaの超可変ループまたはAbMに定義されるループに関する類似する記載された関係を用いて実施することができる。
【0041】
一実施形態においては、前記抗体は、ERG 42-66エピトープに結合し、ハイブリドーマクローン9FYにより産生されるモノクローナル抗体(「9FY抗体」)である。9FY抗体の軽鎖可変ドメインは、配列番号2のアミノ酸配列を含む。9FY抗体の軽鎖可変ドメインのCDR1、CDR2およびCDR3のアミノ酸配列は、それぞれ、SSVYY (配列番号4)、YTS、およびLQFSTSPWT (配列番号5)に対応する。9FY抗体の重鎖可変ドメインは、配列番号3のアミノ酸配列を含む。9FY抗体の重鎖可変ドメインのCDR1、CDR2およびCDR3のアミノ酸配列は、それぞれ、GYTFTNYG (配列番号6)、IDTYTGEP (配列番号7)、およびVRKRAYDYEIY (配列番号8)に対応する。
【0042】
別の実施形態においては、前記抗体は、ERG 42-66エピトープに結合し、ヒトERG3への9FY抗体の結合を競合的に阻害するモノクローナル抗体である。さらに別の実施形態においては、前記抗体は、ERG 42-66エピトープに結合し、ヒトERG3への、配列番号2のアミノ酸配列を含む可変軽鎖および配列番号3のアミノ酸配列を含む可変重鎖を有する抗体の結合を競合的に阻害するモノクローナル抗体である。前記抗体が、ヒトERG3などの、タンパク質への抗体の結合を競合的に阻害するかどうかを、例えば、本出願の実施例に記載の方法などの当業界で日常的な方法を用いて評価することができる。
【0043】
CDR配列または重鎖もしくは軽鎖可変ドメインが9FY抗体のものと実質的にのみ異なる抗体も意図される。典型的には、アミノ酸を、類似する電荷特性、疎水性、または立体化学的特性を有する関連アミノ酸により置換する。そのような置換は、当業者の通常の技術の範囲内にあるであろう。CDRと違って、抗体の結合特性に有害に影響することなく、FRにおいてより実質的な変化を作ることができる。
【0044】
特定の実施形態においては、モノクローナル抗体は、ERG 42-66エピトープに結合し、9FY抗体の重鎖可変ドメインのアミノ酸配列と少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%もしくは少なくとも約98%同一である重鎖、ならびに9FY抗体の軽鎖可変ドメインのアミノ酸配列と少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%もしくは少なくとも約98%同一である軽鎖を含む。他の実施形態においては、モノクローナル抗体はERG 42-66エピトープに結合し、9FY抗体の重鎖および軽鎖配列の6個のCDR(H1、H2、H3、L1、L2およびL3)と少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%もしくは少なくとも約98%同一である6個のCDR(H1、H2、H3、L1、L2およびL3)を有する。一実施形態においては、前記モノクローナル抗体はERG 42-66エピトープに結合し、CDR配列中の1個、最大2個、最大3個、最大4個、最大5個、最大6個、最大7個、および特定の場合、最大10個のアミノ酸置換を除いて、配列番号2と同一の軽鎖可変ドメインを含む。別の実施形態においては、前記モノクローナル抗体はERG 42-66エピトープに結合し、CDR配列中の1個、最大2個、最大3個、最大4個、最大5個、最大6個、最大7個、および特定の場合、最大10個のアミノ酸置換を除いて、配列番号3と同一の重鎖可変ドメインを含む。当業者であれば、CDR中で置換することができる特定のアミノ酸位置、ならびにこれらの位置に置換することができるドナーアミノ酸を、公開米国特許出願第2006/0099204号(その開示はその全体が参照により本明細書に組入れられるものとする)に開示されたものなどの公知の方法を用いて容易に決定することができる。
【0045】
特定の実施形態においては、前記モノクローナル抗体は、ERG 42-66エピトープに結合するヒト化抗体であり、(a)配列番号2のCDR1、CDR2およびCDR3配列を含む軽鎖可変ドメイン;(b)配列番号3のCDR1、CDR2およびCDR3配列を含む重鎖可変ドメイン;ならびに(c)ヒト抗体の軽鎖および重鎖可変領域のフレームワーク領域を含む。ヒト化抗体は必要に応じて、少なくとも1個のヒト抗体の軽鎖および重鎖定常領域をさらに含む。
【0046】
別の実施形態においては、前記モノクローナル抗体は、ERG 42-66エピトープに結合し、配列番号2のアミノ酸配列を含む軽鎖可変ドメインおよび配列番号3のアミノ酸配列を含む重鎖可変ドメインを含むキメラ抗体である。このキメラ抗体は必要に応じて、少なくとも1個のヒト抗体の軽鎖および重鎖定常領域をさらに含む。別の実施形態においては、前記モノクローナル抗体はERG 42-66エピトープに結合するヒト抗体である。
【0047】
特定の実施形態においては、ERG 42-66エピトープに結合するモノクローナル抗体は、約280 nM以下の解離定数(KD)を有する。他の実施形態においては、ERG 42-66エピトープに結合するモノクローナル抗体は、99%を超える特異性でERGを発現する癌腫を検出する。他の実施形態においては、ERG 42-66エピトープに結合するモノクローナル抗体は、ヒトFli1タンパク質と交叉反応しない。例えば、ウェスタンブロットなどの当業界で日常的な方法を用いて、交叉反応性を測定することができる。
【0048】
必要に応じて、ERG 42-66エピトープに結合する本開示に提供される抗体を単離する。
【0049】
本発明の抗体を改変して、例えば、前記アンタゴニストの抗原依存的細胞媒介性細胞傷害性(ADCC)および/または補体依存的細胞傷害性(CDC)を増強するようにエフェクター機能を改善することも望ましい。Fc領域中の1個以上のアミノ酸置換またはシステインの導入を行うことによって、内部能力ならびに/または補体媒介性細胞傷害およびADCCの増加を改善することができる。Caronら、J. Ex. Med. 176:1191-1195 (1991)およびShopes, B.J. Immunol. 148:2918-2022 (1992)(その全体が参照により本明細書に組入れられるものとする)を参照されたい。補体溶解とADCC能力の両方が増強された二重Fc領域を有する抗体融合タンパク質を調製することができる。抗体(例えば、IgG抗体)のFc領域に結合する典型的なFc受容体としては、限定されるものではないが、FcγRI、FcγRIIおよびFcγRIIIの受容体ならびにこれらの受容体の対立遺伝子変異体および選択的スプライシング形態などのFcRnサブクラスが挙げられる。Fc受容体は、RavetchおよびKinet, Annu. Rev. Immunol 9:457-92, 1991; Capelら、Immunomethods 4:25-34,1994; ならびにde Haasら、J. Lab. Clin. Med. 126:330-41, 1995に概説されている。
【0050】
3. 核酸、クローニングおよび発現系
本開示はさらに、開示された抗体またはその一部をコードする単離された核酸を提供する。この核酸はDNAまたはRNAを含んでもよく、全体的または部分的に合成のものであっても、または組換え体であってもよい。本明細書に記載のヌクレオチド配列に対する参照は、本文が別途必要としない限り、特定された配列を有するDNA分子を包含し、UがTに置換された特定された配列を有するRNA分子を包含する。
【0051】
本明細書に提供される核酸は、9FY抗体の少なくとも1個のCDR(H1、H2、H3、L1、L2、および/もしくはL3)、VLドメイン(配列番号2)、および/またはVHドメイン(配列番号3)をコードする。
【0052】
本開示はまた、9FY抗体のCDR、VHドメイン、および/またはVLドメインをコードする少なくとも1個の核酸を含むプラスミド、ベクター、ファージミド、転写または発現カセットの形態の構築物を提供する。本開示はさらに、1個以上の上記構築物を含む宿主細胞を提供する。
【0053】
また、これらの核酸によりコードされるポリペプチドを作製する方法も提供する。この方法は、コード核酸からコードされたポリペプチドを発現させることを含む。好適な条件下で前記核酸を含む組換え宿主細胞を培養することにより、発現を達成することができる。発現による産生後、VHもしくはVLドメイン、または特異的結合メンバーを、任意の好適な技術を用いて単離および/または精製した後、必要に応じて用いることができる。
【0054】
様々な異なる宿主細胞中でのポリペプチドのクローニングおよび発現のための系が当業界でよく知られている。抗体を産生するのに好適な細胞については、Gene Expression Systems, Academic Press、Fernandezら(編)、1999を参照されたい。本発明と適合する任意のタンパク質発現系を用いて、開示された抗体を製造することができる。好適な発現系としては、Gene Expression Systems, Academic Press、Fernandezら(編)、1999に記載のトランスジェニック動物が挙げられる。
【0055】
好適なベクターが、プロモーター配列、ターミネーター配列、ポリアデニル化配列、エンハンサー配列、マーカー遺伝子および必要に応じて他の配列などの好適な調節配列を含むように、それらを選択または構築することができる。
【0056】
本開示のさらなる態様は、本明細書に開示された核酸を含む宿主細胞を提供する。さらなる態様は、そのような核酸を宿主細胞中に導入することを含む方法を提供する。この導入は、任意の好適な技術を用いることができる。真核細胞については、好適な技術としては、リン酸カルシウムトランスフェクション、DEAE-デキストラン、エレクトロポレーション、リポソーム媒介性トランスフェクションおよびレトロウイルスまたは他のウイルス、例えば、ワクシニアもしくは、昆虫細胞については、バキュロウイルスを用いる形質導入が挙げられる。細菌細胞については、好適な技術としては、塩化カルシウム形質転換、エレクトロポレーションおよびバクテリオファージを用いるトランスフェクションが挙げられる。細胞への核酸の導入の後、核酸からの発現を引き起こすか、または可能にし、例えば、遺伝子の発現のための条件下で宿主細胞を培養することができる。
【0057】
4. 抗体の作製方法
当業者には公知のいくつかの方法が、抗体またはその抗原結合フラグメントを取得するために利用可能である。例えば、抗体を、組換えDNA方法を用いて製造することができる。例えば、米国特許第4,816,567号, EPO 8430268.0; EPO 85102665.8; EPO 85305604.2; PCT/GB 85/00392; EPO 85115311.4; PCT/US86/002269; および日本国特許出願第85239543号(それらの開示はその全体が参照により本明細書に組入れられるものとする)を参照されたい。
【0058】
所望の特異性を有する抗体を産生することができる不死化細胞系を調製することにより、モノクローナル抗体を作製することもできる。そのような不死化細胞系を、様々な方法で作製することができる。適当に、マウスなどの小さい脊椎動物を、所望の免疫原で超免疫する。次いで、通常は最後の免疫の数日後に、この脊椎動物を犠牲にし、脾臓細胞を取り出し、その脾臓細胞を不死化する。最も一般的な技術は、KohlerおよびMilstein (1975) Nature 256:495-497により初めて記載されたような、ミエローマ細胞融合パートナーとの融合である。他の技術としては、EBV形質転換、裸のDNA、例えば、癌遺伝子、レトロウイルスなどを用いる形質転換、または細胞系の安定的な維持およびモノクローナル抗体の産生を提供する任意の他の方法が挙げられる。モノクローナル抗体を調製するための特定の技術は、Antibodies: A Laboratory Manual、HarlowおよびLane(編)、Cold Spring Harbor Laboratory、1988(その全開示は参照により本明細書に組入れられるものとする)に記載されている。
【0059】
酵素結合免疫吸着アッセイ(ELISA)および表面プラズモン共鳴(BIACORE(商標))分析などの標準的な方法を用いて不死化細胞系をスクリーニングして、特定抗原と特異的に結合する抗体を産生する1個以上のハイブリドーマを同定することができる。免疫原として、例えば、組換え抗原、その天然形態、任意の変異体もしくはフラグメント、ならびにその抗原性ペプチドなどの任意の形態の特定抗原を用いることができる。
【0060】
抗体を作製する1つの例示的方法として、タンパク質発現ライブラリー、例えば、ファージまたはリボソーム展示ライブラリーのスクリーニングが挙げられる。ファージディスプレイは、例えば、Ladnerら、米国特許第5,223,409号; Smith (1985) Science 228:1315-1317; Clacksonら(1991) Nature, 352: 624-628; Marksら(1991) J. Mol. Biol., 222: 581-597;WO 92/18619; WO 91/17271; WO 92/20791; WO 92/15679; WO 93/01288; WO 92/01047; WO 92/09690; およびWO 90/02809(それらの開示はその全体が参照により本明細書に組入れられるものとする)に記載されている。
【0061】
展示ライブラリーの使用に加えて、特定抗原を用いて、非ヒト動物、例えば、げっ歯類、例えば、マウス、ハムスター、またはラットを免疫することができる。一実施形態においては、非ヒト動物は、ヒト免疫グロブリン遺伝子の少なくとも一部を含む。例えば、ヒトIg遺伝子座の大きい断片を用いて、マウス抗体産生に欠けるマウス株を遺伝子操作することができる。ハイブリドーマ技術を用いて、所望の特異性を有する遺伝子に由来する抗原特異的モノクローナル抗体を製造および選択することができる。例えば、XENOMOUSE(商標)、Greenら(1994) Nature Genetics 7:13-21、US 2003-0070185、1996年10月31日に公開されたWO 96/34096および1996年4月29日に提出されたPCT出願番号第PCT/US96/05928号(それらの開示はその全体が参照により本明細書に組入れられるものとする)を参照されたい。
【0062】
別の実施形態においては、モノクローナル抗体を、非ヒト動物から取得した後、改変する。例えば、ヒト化、脱免疫化、およびキメラ抗体を、当業界で公知の組換えDNA技術を用いて製造することができる。キメラ抗体を作製するための様々な手法が記載されている。例えば、Morrisonら、Proc. Natl. Acad. Sci. U.S.A. 81:6851, 1985; Takedaら、Nature 314:452, 1985, Cabillyら、米国特許第4,816,567号; Bossら、米国特許第4,816,397号; Tanaguchiら、欧州特許公開第EP171496号; 欧州特許公開第0173494号、英国特許第GB 2177096B号(それらの開示はその全体が参照により本明細書に組入れられるものとする)を参照されたい。抗体のヒト化は、非ヒト抗体の結合部位をヒト抗体上に移植することを含む。非ヒトCDRをヒトフレームワークおよび必要に応じて、ヒト定常領域上に移植するか、または非ヒト可変ドメイン全体を移植するが、特定の露出した残基の置換によりそれらをヒト様表面で隠すことにより、これを行うことができる。ヒト化抗体の作製に関する詳細は、参照により本明細書に組入れられるものとする米国特許第5,472,693号に開示されている。
【0063】
例えば、ヒト重鎖および軽鎖遺伝子を発現するが、内因性マウス免疫グロブリン重鎖および軽鎖遺伝子を発現することができないトランスジェニックマウスを用いて、ヒト化抗体を製造することもできる。Winterは、本明細書に記載のヒト化抗体を調製するのに用いることができる例示的CDR移植方法を記載している(その開示全体が参照により本明細書に組入れられるものとする米国特許第5,225,539号)。特定のヒト抗体のCDRの全部を、非ヒトCDRの少なくとも一部と置換するか、またはCDRのいくらかのみを非ヒトCDRと置換することができる。所定の抗原へのヒト化抗体の結合にとって必要とされるいくつかのCDRを置換することが必要に過ぎない。
【0064】
抗原結合に直接関与しないFv可変ドメインの置換を、ヒトFv可変ドメインに由来する等価配列と置換することにより、ヒト化抗体またはそのフラグメントを作製することができる。ヒト化抗体またはそのフラグメントを作製するための例示的方法は、Morrison (1985) Science 229:1202-1207; Oiら(1986) BioTechniques 4:214; ならびに米国特許第5,585,089号; 第5,693,761号; 第5,693,762号; 第5,859,205号; および第6,407,213号(それらの開示はその全体が参照により本明細書に組入れられるものとする)により提供されている。これらの方法は、少なくとも1個の重鎖または軽鎖に由来する免疫グロブリンFv可変ドメインの全部または一部をコードする核酸配列を単離し、操作し、および発現させることを含む。そのような核酸を、上記のような所定の標的に対する抗体を産生するハイブリドーマから、ならびに他の起源から取得することができる。次いで、ヒト化抗体分子をコードする組換えDNAを、好適な発現ベクター中にクローニングすることができる。
【0065】
特定の実施形態においては、保存的置換、コンセンサス配列置換、生殖細胞置換および/または復帰変異(backmutation)の導入により、ヒト化抗体を最適化する。そのような変化した免疫グロブリン分子を、当業界で公知のいくつかの技術のいずれか(例えば、Tengら、Proc. Natl. Acad. Sci. U.S.A., 80: 7308-7312, 1983; Kozborら、Immunology Today, 4: 7279, 1983; OlssonらMeth. Enzymol., 92: 3-16, 1982(それらの開示はその全体が参照により本明細書に組入れられるものとする))により作製することができ、またPCT公開WO92/06193またはEP 0239400(それらの開示はその全体が参照により本明細書に組入れられるものとする)の教示に従って作製することができる。典型的には、保存的置換を作製する。専らではないが、しばしば、ヒト生殖細胞抗体配列中の位置に共通のアミノ酸を用いることができる。ヒト生殖細胞配列は、例えば、Tomlinsonら(1992) J. Mol. Biol. 227:776-798; Cook, G. P.ら(1995) Immunol. Today Vol. 16 (5): 237-242; Chothia, D.ら(1992) J. Mol. Biol. 227:799-817; およびTomlinsonら(1995) EMBO J. 14:4628-4638(それらの開示はその全体が参照により本明細書に組入れられるものとする)に開示されている。V BASEディレクトリは、ヒト免疫グロブリン可変領域配列の包括的ディレクトリを提供する(Tomlinson, I.A.らにより編集、MRC Centre for Protein Engineering, Cambridge, UK)。これらの配列を、例えば、フレームワーク領域およびCDRのためのヒト配列の起源として用いることができる。コンセンサスヒトフレームワーク領域を、例えば、米国特許第6,300,064号(その開示はその全体が参照により本明細書に組入れられるものとする)に記載のように用いることもできる。
【0066】
ファージディスプレイ技術などの当業界で公知の方法を用いて、ヒト抗体を作製することができる。ファージディスプレイ技術は、抗体遺伝子の大きいライブラリーをクローニングし、ERG 42-66エピトープなどの所望の標的への結合について選択することにより、哺乳動物免疫系を模倣するものである。ファージディスプレイ技術において用いられるライブラリーを、いくつかの起源から作製することができる。例えば、ワクチン接種または疾患を介して所望の抗原に曝露されたヒトから作製された免疫ライブラリーは、そのライブラリーが比較的小さい場合でも、抗原に対する高レベルの循環抗体を有する。別の例として、非免疫化個体から単離されたmRNAから作製されたナイーブなライブラリーを繰り返し用いて、様々な抗原に対する抗体を単離することができる。さらに別の例として、生殖細胞抗体遺伝子断片をクローニングし、in vitroで組合せ配置して完全なVHおよびVL鎖をコードする遺伝子を再構成させた合成ライブラリーは、自己抗原に対する特異性を有する抗体を産生する利点を有する。1種以上の抗体フレームワークを選択し、CDRループ内の配列を無作為化することにより、半合成ライブラリーを作製することもできる。
【0067】
ファージディスプレイ技術においては、一度ライブラリーを作製したら、それをファージの表面タンパク質、一般的にはpIIIに融合させる。パンニングとして知られるプロセスにおいて、目的の抗原に特異的な抗体を展示するファージを、固定化抗原上での選択的吸着により富化する。続いて、結合したファージを表面から溶離させ、大腸菌細胞の感染を介して増幅させることができる。
【0068】
ヒト抗体を作製するためのファージディスプレイ技術の他の改変も当業界で公知である。バクテリオファージの表面の代わりに、例えば、大腸菌およびサッカロミセス・セレビジア(Saccharomyces cerevisaie)などの微生物細胞の表面上に抗体を展示することができる。この場合、バッファー中で蛍光タグ付リガンドと共にインキュベートすることによりスクリーニングを実施することができる。蛍光標識されるようになるリガンドに結合する抗体を展示する細胞を、蛍光活性化細胞選別により単離する。リボソーム展示と呼ばれる別の改変は、リボソーム、mRNAおよびポリペプチドの間の三次複合体の形成に依存する。
【0069】
ヒト抗体を製造するための当業界で公知の別の方法は、トランスジェニックマウスを用いるものである。これらのマウス中の天然免疫グロブリンレパートリーは、マウス染色体中でヒトV遺伝子で置換されている。このマウスに所望の抗原を注入し、得られた抗体を、免疫ライブラリーをクローニングおよびスクリーニングすることによるか、または従来のハイブリドーマ技術により回収することができる。これらのマウスは、糖鎖パターンにおいてのみ異なる有意なレベルの完全ヒト抗体を産生する。
【0070】
本明細書に記載の抗ERG抗体を、別の機能的分子(別のペプチドまたはタンパク質(例えば、Fabフラグメント)など)に誘導体化するか、またはそれに連結することができる。例えば、特に、別の抗体(例えば、二特異的もしくは多特異的抗体)、毒素、放射性アイソトープ、細胞傷害剤もしくは細胞増殖抑制剤などの少なくとも1種の他の分子的実体に、前記抗体を機能的に連結することができる(例えば、化学的カップリング、遺伝子融合、非共有結合などによる)。
【0071】
5. 使用方法
ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を、様々な研究用途および医学的用途において用いることができる。一態様においては、本開示は、被験体における悪性腫瘍または疾患を治療するための方法であって、製薬上許容し得るビヒクル中で製剤化されたERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体の治療上有効量を前記被験体に投与することを含み、前記悪性腫瘍または疾患が、ERG融合事象(例えば、TMPRSS2、SLC45A3、もしくはNFRG1遺伝子プロモーター配列と、ERG遺伝子配列との融合、または第1の遺伝子配列と、ERG遺伝子配列との融合)および/またはERG過剰発現により引き起こされる、前記方法を提供する。一実施形態においては、前記悪性腫瘍または疾患は、前立腺癌、ユーイング肉腫、急性骨髄性白血病、急性Tリンパ芽球性白血病、巨核芽球性白血病、結腸癌、または内皮細胞癌などの内皮細胞の疾患である。別の実施形態においては、前記疾患は、アルツハイマー病またはダウン症候群である。
【0072】
さらに、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を用いて、生物学的サンプル中で、TMPRSS2/ERG、SLC45A3/ERG、またはNDRG1/ERG融合転写物によりコードされるERGタンパク質などの、ERGポリペプチドの全部または一部を含む融合タンパク質などのERGタンパク質を検出することができる。一実施形態においては、前記方法は、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を、生物学的サンプルと接触させ、該生物学的サンプルを分析して、該生物学的サンプル中でヒトERGまたは融合タンパク質への前記モノクローナル抗体の結合を検出することを含む。一実施形態においては、ERGポリペプチドはERG3である。別の実施形態においては、TMPRSS2/ERGまたはSLC45A3/ERG融合転写物によりコードされるERGタンパク質は、トランケートされたERG3タンパク質である。一実施形態においては、生物学的サンプルは、前立腺組織または前立腺細胞などの、組織または細胞を含む。他の実施形態においては、生物学的サンプルは、尿または血液などの生物学的液体を含み、生物学的液体は前立腺癌細胞などの癌細胞を含む。他の実施形態においては、生物学的液体は、血液、血清、尿、唾液、痰、または糞便である。
【0073】
別の実施形態においては、本開示は、患者における癌または疾患を検出するための方法であって、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を、患者から得られた生物学的サンプルと接触させ、該生物学的サンプルを分析することを含み、生物学的サンプル中での前記抗体の細胞への結合が、生物学的サンプル中での癌の存在を示唆する、前記方法を提供する。一実施形態においては、前記癌は、前立腺癌である。別の実施形態においては、前記癌は前立腺癌である。別の実施形態においては、前記癌は、ユーイング肉腫、急性骨髄性白血病、急性Tリンパ芽球性白血病、巨核芽球性白血病、結腸癌、または内皮細胞癌である。一実施形態においては、生物学的サンプルは、前立腺組織または前立腺細胞などの、組織または細胞を含む。他の実施形態においては、生物学的サンプルは、尿または血液などの生物学的液体を含み、生物学的液体は前立腺癌細胞などの癌細胞を含む。他の実施形態においては、生物学的液体は、血液、血清、尿、唾液、痰、または糞便である。一実施形態においては、前記癌または疾患は、ERG融合事象(例えば、TMPRSS2、SLC45A3、もしくはNDRG1遺伝子プロモーター配列と、ERG遺伝子配列との融合)および/またはERG過剰発現と関連する。血管または毛細血管での造血細胞または内皮細胞への抗体の結合は正常であり、典型的には、癌の存在を示唆しない。しかしながら、血管または毛細血管中の正常な造血細胞または正常な内皮細胞以外の任意の細胞中での、ERGポリペプチドの全部または一部を含む融合タンパク質などのERGタンパク質の検出は、サンプル中の癌の存在を示唆する。
【0074】
また、実施例に示されるように、本明細書に記載の抗ERG抗体を用いて、ERG陽性PINを検出することができる。ERG陽性前立腺上皮内新生物(PIN)を示す患者はまた、ERG陽性前立腺癌を有することがあるか、またはERG陽性前立腺癌を生じる危険性が高い。かくして、ERG陽性前立腺癌ではなく、ERG陽性PINが患者において検出された場合、その患者は追加の生検またはより頻繁な生検を受けて、該患者における前立腺癌の発達をモニターすべきである。従って、本明細書に記載の抗ERG抗体を用いて、追加の生検または将来より頻繁な生検を実施するかどうかに関する決定を通知することができる。
【0075】
さらに別の態様においては、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を用いて、治療計画の効果をモニターすることができる。かくして、一実施形態は、ホルモン除去をモニターする方法であって、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を、ホルモン除去療法を受けた患者から得られた生物学的サンプルと接触させ、該生物学的サンプル中でのヒトERGまたはヒトERGポリペプチドの全部もしくは一部を含む融合タンパク質の発現を測定することを含み、アンドロゲン除去療法後のERG発現の低下が、ホルモン除去療法が有効であり、生存時間の増加と相関することを示唆する、前記方法に関する。ホルモン除去療法後の患者におけるERG発現のレベルを、ホルモン除去療法を開始する前の同じ患者におけるERG発現のレベルと比較するか、または上昇したレベルのERG発現を示す標準化された対照値と比較することができる。
【0076】
また、プロモーター配列などの核酸配列、またはERGポリペプチドと相互作用するポリペプチドを同定するための方法も提供する。そのような方法により同定された核酸および/またはタンパク質は、ERGネットワークにおける新しい治療標的を規定することができる。一実施形態においては、前記方法は、核酸分子またはポリペプチドを含むサンプルをERGポリペプチドと共にインキュベートし、該サンプルとERGポリペプチドを、42-66 ERGエピトープに結合する抗体と共にインキュベートし、核酸分子とERGポリペプチドの間、またはポリペプチドとERGポリペプチドとの間で複合体が形成するかどうかを決定することを含み、抗体との複合体の形成の検出は、核酸分子またはポリペプチドがERGポリペプチドと相互作用することを示唆する。そのような方法を、例えば、免疫沈降アッセイなどの当業界で従来的である技術を用いて実行することができる。
【0077】
任意の好適な標識を、本明細書に記載の方法および組成物において用いることができる。標識は、分析物、分析物類似体、検出試薬、または分光測光的手段、光化学的手段、生化学的手段、免疫化学的手段、電気的手段、光学的手段もしくは化学的手段により検出可能である結合パートナー(例えば、抗体)に結合した任意の分子または組成物である。酵素、金コロイド粒子、着色ラテックス粒子などの標識の例が開示されている(米国特許第4,275,149号; 第4,313,734号; 第4,373,932号; および第4,954,452号(それぞれ参照により本明細書に組入れられるものとする))。有用な標識のさらなる例としては、限定されるものではないが、ハプテン(例えば、ビオチン、ジゴキシゲニン(DIG)、ジニトロフェノール(DNP)など)、放射性アイソトープ、コファクター、リガンド、化学発光剤もしくは蛍光剤、タンパク質吸着銀粒子、タンパク質吸着鉄粒子、タンパク質吸着銅粒子、タンパク質吸着セレン粒子、タンパク質吸着硫黄粒子、タンパク質吸着テルル粒子、タンパク質吸着炭素粒子、およびタンパク質結合染料サックが挙げられる。標識への化合物の結合は、キレートなどにおいてみられるような、共有結合、吸着プロセス、疎水結合および/もしくは静電結合、またはこれらの結合の組合せおよび相互作用などの任意の手段を介するものであってよく、ならびに/または連結基を含んでもよい。
【0078】
典型的には、ハプテンなどのいくつかの標識を、比色検出のための検出試薬と結合させる。例えば、ビオチンをストレプトアビジン-HRP化合物に結合し、DABを用いて比色検出することができる。当業者であれば、本発明の組成物および方法において有用な検出試薬として有用である多種多様な標識および検出オプションを理解できるであろう。
【0079】
いくつかの実施形態においては、抗体(例えば、モノクローナル抗体)などの分子を、検出可能な部分とのコンジュゲーションにより直接検出する。例えば、本明細書に記載のモノクローナル抗体を、蛍光化合物(フルオレセイン、フルオレセインイソチオシアネート(FITC)、ローダミン、5-ジメチルアミン-1-ナフタレンスルホニルクロリド、フィコエリトリン、ランタニド蛍光物質、ALEXA FLUOR(登録商標)(Invitrogen, Carlsbad, CA)染料、もしくはシアニンファミリーの染料(Cy-3もしくはCy-5など)など);生物発光化合物(ルシフェラーゼ、緑色蛍光タンパク質(GFP)、黄色蛍光タンパク質など);検出可能な反応生成物を産生する酵素(西洋ワサビペルオキシダーゼ、β-ガラクトシダーゼ、ルシフェラーゼ、アルカリホスファターゼ、もしくはグルコースオキシダーゼなど)、または放射性標識(3H、14C、15N、35S、90Y、99Tc、111In、125I、もしくは131I)などの検出可能な部分に直接コンジュゲートさせることができる。
【0080】
いくつかの実施形態においては、抗体(例えば、モノクローナル抗体)などの分子を間接的に検出する。例えば、当業者には公知のように一次抗体(例えば、本明細書に記載のモノクローナルERG抗体)に対する二次抗体を生成させ、二次抗体を検出のために標識する。二次抗体を検出可能な部分にコンジュゲートさせる。例えば、二次抗体を、その後の比色検出のためにアルカリホスファターゼ(AP)または西洋ワサビペルオキシダーゼ(HRP)などのリポーター酵素にコンジュゲートさせることができる。いくつかの実施形態においては、二次抗体を、以前に記載のような蛍光部分(例えば、FITC、Cy染料、ALEXA FLUOR(登録商標)(Invitrogen, Carlsbad, CA)染料、ローダミンなど)にコンジュゲートさせる。いくつかの実施形態においては、一次モノクローナルERG抗体を、ビオチンDNP、DIGなどのハプテンにコンジュゲートさせた二次抗体を用いて間接的に検出し、ストレプトアビジン-HRPなどの検出可能な試薬分子にさらに結合させ、次いで、3,3'-ジアミノベンズイジン(DAB)との反応により比色検出する。当業者であれば、本明細書に記載のようなタンパク質間相互作用の可視化に用いられる多種多様な酵素的および発光的検出方法を理解できるであろう。
【0081】
6. 製剤および投与
本開示は、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を含む組成物を提供する。特定の実施形態においては、前記組成物は、医薬としての使用および患者への投与にとって好適である。これらの組成物は、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体と、製薬上許容し得る賦形剤とを含む。前記組成物はまた、補足的、追加的、または増強された治療機能を提供する他の活性化合物を含んでもよい。前記医薬組成物を、投与のための説明書と一緒に、容器、包装、またはディスペンサー中に含有させてもよい。一実施形態においては、前記組成物は、アルツハイマー病などの疾患または前立腺癌、ユーイング肉腫、急性骨髄性白血病、急性Tリンパ芽球性白血病、巨核芽球性白血病、結腸癌もしくは内皮細胞癌などの悪性腫瘍の治療のための、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を含む。
【0082】
本発明の医薬組成物を、その意図される投与経路と適合するように製剤化する。投与を達成するための方法は、当業者には公知である。これとしては、例えば、静脈内、血管内、動脈内、皮下、筋肉内、腫瘍内、腹腔内、心室内、硬膜内などの非経口経路による注入ならびに経口、経鼻、眼内、直腸、もしくは局所が挙げられる。デポー注射または浸食性インプラントなどの手段による、持続放出投与も具体的に意図される。腎動脈または局所腫瘍に供給する血管などの1種以上の動脈へのカテーテルを介する送達などの手段による局所送達が特に意図される。
【0083】
一実施形態においては、静脈内、筋肉内または皮下注射により、対象抗体を患者に投与する。約0.1 mg/kg〜約100 mg/kg;約1 mg/kg〜75 mg/kg;または約10 mg/kg〜50 mg/kgの用量範囲内で抗体を投与することができる。例えば、ボーラス注射またはゆっくりした注入により、抗体を投与することができる。30分〜2時間にわたるゆっくりした注入を用いることができる。
【0084】
前記組成物の毒性および治療効果を、細胞培養物または実験動物中での標準的な薬学的手順により、例えば、LD50(集団の50%に対して致死的である用量)およびED50(集団の50%において治療上有効である用量)を決定することにより決定することができる。毒性効果と治療効果との用量比は治療指数であり、それをLD50/ED50比として表すことができる。大きい治療指数を示す抗体は、毒性が低い、および/またはより治療上有効であってよい。
【0085】
7. キット
いくつかの実施形態においては、本明細書に記載のERG関連分子(例えば、モノクローナル抗体、ポリペプチドなど)を、例えば、本発明の方法を実施するのに有用なキットの形態で供給する。一実施形態においては、好適な量の少なくとも1種のERG関連分子(例えば、モノクローナル抗体、ポリペプチドなど)を、1個以上の容器中で提供する。他の実施形態においては、少なくとも1種のERG関連分子(例えば、モノクローナル抗体、ポリペプチドなど)を、例えば、水性溶液中に懸濁して、または凍結乾燥粉末として提供する。少なくとも1種のERG関連分子(例えば、モノクローナル抗体、ポリペプチドなど)を供給する容器は、供給された形態を保持することができる任意の従来の容器、例えば、マイクロ遠心管、アンプルまたはボトルであってよい。供給されるERG関連分子(例えば、モノクローナル抗体、ポリペプチドなど)の量は、任意の好適な量であってよい。
【0086】
他の実施形態においては、ERG関連分子(モノクローナル抗体、ポリペプチドなど)のための陽性および/または陰性対照として役立ち得る1種以上の組織または細胞調製物(例えば、生検、異種移植片、細胞ペレット、もしくは細胞塊)を載せた対照スライドを、好適かつ別の容器中に提供してもよい。
【0087】
他のキットの実施形態は、二次抗体などのERG関連分子の検出のための手段を含む。いくつかのそのような例においては、二次抗体を検出可能な部分(本開示の他の場所に記載)で直接標識する。他の例においては、一次または二次(もしくはより高い次数)抗体を、検出可能なように標識されたコグネイトハプテン結合分子(例えば、ストレプトアビジン(SA)-西洋ワサビペルオキシダーゼ、SA-アルカリホスファターゼ、SA-QDot(登録商標)(Invitrogen, Carlsbad, CA)など)により検出可能であるハプテン(ビオチン、DNP、DIGなど)にコンジュゲートさせる。いくつかの実施形態においては、一次または二次抗体を、蛍光検出部分(例えば、FITC、ローダミン、ALEXA FLUOR(登録商標)(Invitrogen, Carlsbad, CA)染料、Cy指定フルオロフォアなど)とコンジュゲートさせる。いくつかのキットの実施形態は、比色試薬(例えば、DAB、AECなど)の展開のための酵素で標識された一次もしくは二次(またはより高い次数)抗体に合わせて用いられる好適な溶液中にそのような比色試薬を含んでもよい。
【0088】
一実施形態においては、キットは、開示された方法でのキット内容物(例えば、ERG関連分子)の使用方法を開示する説明材料を含む。この説明材料を、限定されるものではないが、文書形態(例えば、ハードコピー紙など)、電子形態(例えば、コンピューターディスクもしくはコンパクトディスク)などの任意の数の形態で提供するか、またはそれらは視覚的であってもよい(例えば、ビデオファイル)。キットはまた、キットが設計された特定の用途を容易にするためのさらなる成分を含んでもよい。かくして、例えば、キットは、バッファーおよび特定の方法の実施に日常的に用いられる他の試薬をさらに含んでもよい。そのようなキットおよび好適な内容物は、当業者にはよく知られている。
【0089】
別途定義しない限り、本明細書で用いられる全ての技術用語および科学用語は、当業者によって一般的に理解されるものと同じ意味を有するものとする。本明細書に記載のものと類似するか、または等価である方法および材料を、本発明の実施または試験において用いることができるが、好適な方法および材料を以下に記載する。本明細書に記載の全ての刊行物、特許出願、特許、および他の参考文献は、その全体が参照により本明細書に組入れられるものとする。対立する場合、定義を含む本明細書が制御するものとする。さらに、材料、方法、および実施例は例示に過ぎず、制限的であると意図されるものではない。
【0090】
(実施例)
【実施例1】
【0091】
9FY抗体の作製
配列番号1のアミノ酸42-66と、-COOHを遊離状態(非コンジュゲート化)で保持するためにNまたはC末端に付加されたシステイン残基とを有する化学合成ポリペプチドでBalb/Cマウスを免疫することにより、ハイブリドーマクローン9FYを取得した。免疫化ポリペプチドをキーホールリンペットヘモシアニン(KLH)にコンジュゲートし、3週間間隔で3つの別々の注射部位でアジュバントをマウスに注射した。1回目の注射にはアジュバントとしてFreundの完全アジュバントを用いた。2回目および3回目の注射にはFreundの不完全アジュバントを用いた。直接ELISAスクリーンを用いて、免疫化ポリペプチドへの結合について血清出血を評価した。最も高い力価を有するマウスを、最初のハイブリドーマ融合工程のために選択した。ELISAにより8個の陽性クローンを確認し、HEK-293細胞中で異種発現されるERG3タンパク質を用いる免疫ブロットアッセイにより上清を分析した。2個のクローンが免疫ブロットアッセイにおいて陽性であることがわかった。2回目のスクリーニングに由来する1個の陰性クローンを、陰性対照として保持した。2個の陽性クローンと陰性対照を、2回目のクローニングのためにさらに処理した。最も強い陽性活性を最初に示した1個の陽性クローン(9FY)は、2回目のクローニング工程を生存した。9FYクローンを増殖させ、腹水産生のために10匹のマウスに注入した。腹水を産生させ、9FY抗体をGタンパク質カラム上で精製した。9FY抗体のサブタイプは、精製画分からIgGであると決定された。
【実施例2】
【0092】
9FY抗体は前立腺癌細胞中のERGタンパク質を特異的に認識する
VCaP細胞(Korenchuckら、2001, In Vivo, 15:163-68)は、ヒト前立腺腫瘍において検出されることが多いTMPRSS2/ERG融合物を過剰発現するヒト前立腺癌細胞系である。VCaP細胞中では、アンドロゲン誘導性TMPRSS2プロモーターにより、内因性ERG遺伝子転写が制御される。LNCaP細胞は、TMPRSS2/ERG融合物を担持せず、検出可能なレベルのERGを発現しないヒト前立腺癌細胞系である。
【0093】
1. ウェスタンブロット
LNCaP(ATCC;#CRL-1740)およびVCaP細胞(ATCC;#CRL-2876)を、それぞれ、10%ウシ胎仔血清(ATCC;#30-2020)および2 mMグルタミンを補給した、RPMI-1640(ATCC;#30-2001)およびDMEM培地(ATCC;#30-2002)中で増殖させた。LNCaPおよびVCaP細胞(2x106個)を、10 cmディッシュ上に播種し、10%活性炭剥離ウシ胎仔血清(c-FBS;#100119 Gemini Bio-Products, Calabasas, CA)を含む培地中で、それぞれ、5日間および3日間維持した。次いで、アンドロゲンの誘導のために、0.1 nM R1881または1 nM R1881を補給したc-FBSを含む新鮮な培地中でさらに48時間、細胞を増殖させた。細胞を収穫し、ウェスタンブロットおよび顕微鏡観察により分析した。
【0094】
ウェスタンブロット実験において、9FY抗体は、アンドロゲン(R1881)誘導に応答してTMPRSS2/ERG2およびTMPRSS2/ERG3によりコードされる完全長タンパク質産物(約50-52 kDa)を認識する(図1A)。9FY抗体は、TMPRSS2/ERG融合転写物を担持しないLNCaP細胞中ではERGを認識しなかった。
【0095】
9FY抗体認識の特異性を評価するために、合成アンドロゲン(R1881)により誘導されたVCaP細胞およびLNCaP細胞を、ERG特異的小分子阻害RNA(ERG siRNA)(Sunら、2008)および/または非標的化(「NT」)対照オリゴヌクレオチドでトランスフェクトした。ERG siRNAは、エクソン11中の19塩基対の領域を標的とし、前立腺細胞において全ての既知のERGスプライス変異体を阻害すると予測される(Sunら、2008)。チューブリンを、免疫ブロットアッセイにおけるローディング対照として用いた。
【0096】
NTまたはERG siRNAオリゴヌクレオチド(Dharmacon, Lafayette, CO)でトランスフェクトし、4日間インキュベートしたVCaP細胞から、プロテアーゼおよびホスファターゼ阻害剤カクテル(カタログ番号P2850 & P5726, Sigma, St. Louis, MO)を補給したM-PER(登録商標)哺乳動物タンパク質抽出試薬(カタログ番号78501, Thermo, Rockford, IL)中で、VCaP細胞溶解物を調製した。細胞を50 nM NTオリゴヌクレオチド、25 nM NTおよび25 nM ERG siRNAオリゴヌクレオチドまたは50 nM ERG siRNAオリゴヌクレオチド(レーン3)でトランスフェクトした。25μgの細胞溶解物を各レーンにロードし、NUPAGE(登録商標)SDSゲル(カタログ番号NP0335, Invitrogen, Carlsbad, CA)上で分離し、PVDF膜上に移し、1:10,000の9FY抗体を用いてウェスタンブロットした。同一のゲルをPVDF膜(カタログ番号LC2005, Invitrogen, Carlsbad, CA)上に移し、1:1,000の抗SLC45A3抗体(カタログ番号M361529-2)、1:3,000の抗PSA抗体(カタログ番号A056201-2、両方ともDAKO社製、Carpinteria, CA)および1:1000の抗α-チューブリン(カタログ番号Sc-5286, Santa Cruz, CA)を用いて精査した。
【0097】
10%活性炭剥離血清を補給したRPMI1640中で5日間増殖させ、新鮮なR1881を含まない培地中でさらに維持するか、または0.1 nMもしくは1 nMのR1881で48時間刺激した細胞から、LNCaP細胞溶解物を調製した。同様に、活性炭剥離血清を補給したDMEM中で3日間増殖させ、新鮮なR1881を含まない培地中でさらに維持するか、または0.1 nMもしくは1 nMのR1881で48時間刺激した細胞から、VCaP細胞溶解物を調製した。25μgの細胞溶解物を、記載のように各レーンにロードし、NUPAGE(登録商標)(Invitrogen, Carlsbad, CA)SDSゲル上で分離し、PVDF膜上に移し、1:10,000の9FY抗体を用いてウェスタンブロットした。同一のゲルをPVDF膜上に移し、1:1,000の抗SLC45A3抗体、1:3,000の抗PSA抗体および1:1000の抗α-チューブリンを用いて精査した。VCaP、COLO320、MOLT-4およびKG-1細胞を、M-PER(登録商標)哺乳動物タンパク質抽出試薬中で溶解し、そのタンパク質濃度を決定した。25μgの細胞溶解物を、記載のように各レーンにロードし、NUPAGE(登録商標)(Invitrogen, Carlsbad, CA)SDSゲル上で分離し、PVDF膜上に移し、1:10,000の9FY抗体を用いてウェスタンブロットした。
【0098】
従来の結果と一致して、9FY抗体(1:10,000希釈)を用いた場合、ERG siRNA処理に応答して、内因性ERGタンパク質レベルの有意な低下が検出された(図1B)。さらなる対照として、本発明者らは、ERGの負に調節される下流の標的遺伝子、プロステイン(SLC45A3)および前立腺特異的抗原PSA(KLK3)の発現応答も試験した(Sunら、2008)。予想通り、ERG siRNAに応答して、VCaP細胞中ではプロステインおよびPSAの顕著な上方調節が明らかであった(図1Aおよび図1B、下パネル)。
【0099】
2. ELISA
ELISAアッセイにおいて、本発明者らは、様々な濃度の免疫化ポリペプチド(すなわち、配列番号1のアミノ酸42-66)の力価を測定する9FY抗体の感度および特異性を評価した。直接的ELISAのために、まずプレートを、1 ng/ml、10 ng/ml、100 ng/mlおよび1μg/mlの100μlのERG3抗原で被覆し、振とう器上、4℃で16時間インキュベートした後、プレートをPBSt(300μl/ウェル)で5回洗浄した。SuperBlock B中に希釈したビオチン結合検出9FY抗体を74 pg/100μl/ウェルで添加し、プレートを振とう器上で1時間インキュベートした(この工程およびその後の全ての工程を、室温で行う)。プレートをPBSt(300μl/ウェル)で洗浄した。次に、PBS中のストレプトアビジン-西洋ワサビペルオキシダーゼ(HRP)(100μl/ウェル)を添加し、振とう器上、室温で30分間インキュベートした。次いで、プレートをPBSt(300μl/ウェル)で洗浄した後、100μl/ウェルでTMBを添加し、振とう器上で5分間展開させた後、50μl/ウェルの停止溶液を添加した。製造業者の推奨に従って、MULTISKAN(登録商標)Ascent(Thermo Scientific, Waltham, MA)ELISAプレートリーダー上、450 nmで吸光度を測定し、吸光度を抗体希釈率に対してプロットした。間接的ELISAのために、まずプレートを100μl(570 pg)/ウェルのC-エピトープ抗ERG抗体で被覆し、4℃で16時間インキュベートした。300μl/ウェルのSuperBlock(カタログ番号PI-37515, Thermo Scientific, Rockford IL)を添加し、振とう器上で1時間インキュベートした(この工程およびその後の全ての工程を室温で行う)。200 ngのERG3抗原を100μl/ウェルで添加し、振とう器上で2時間インキュベートした後、プレートをPBSt(300μl/ウェル)で洗浄した。SuperBlock B中に希釈したビオチン結合検出9FY抗体を74 pg/100μl/ウェルで添加し、プレートを振とう器上で1時間インキュベートした。プレートをPBSt(300μl/ウェル)で洗浄し、次にPBS中のストレプトアビジン-HRP(100μl/ウェル)を添加し、振とう器上で0.5時間インキュベートした(室温)。プレートをPBSt(300μl/ウェル)で再度洗浄した。次いで、テトラメチルベンズイジン(TMB)を100μl/ウェルで添加し、振とう器上で5分間展開させた後、50μl/ウェルの停止溶液を添加した。製造業者の推奨に従って、MULTISKAN(登録商標)Ascent(Thermo Scientific, Waltham, MA)ELISAプレートリーダー上、450 nmで吸光度を測定し、吸光度を抗体希釈率に対してプロットした。
【0100】
9FY抗体は、配列番号1のアミノ酸42-66に一致する免疫化ポリペプチドを認識した。抗体力価測定および競合阻害アッセイにより、2種の対照ポリペプチドではなく、免疫化ポリペプチドが、ERG3タンパク質に対する9FY抗体結合について競合し(図2A)、精製された9FY抗体が5000〜20000倍の希釈範囲で検出することができる(図2B)ことが示された。
【0101】
3. in vivoクロマチン免疫沈降アッセイ
9FY抗体の特異性をさらに評価するために、本発明者らは、in vivoクロマチン免疫沈降(ChIP)アッセイ(Sunら、2008)により以前に定義された遺伝子調節エレメントへの内因性ERGの動員を試験した。TMPRSS2/ERG融合転写物によりコードされるERGタンパク質の発現を、VCaP細胞中でR1881により誘導し、細胞をERG siRNAによりトランスフェクトしてERGをノックダウンするか、または対照非標的化(NT)siRNAによりトランスフェクトした。細胞をChIPアッセイのために処理し、9FY抗体を用いてクロマチンを免疫沈降した。ERG siRNAの非存在下では、内因性ERGタンパク質は標的遺伝子配列に対して動員される。対照的に、HPGDH、C-MYC、プロステイン(SLC45A3)およびPSA/KLK3遺伝子調節領域へのERGタンパク質結合の強固な低下(図3)が、ERGノックダウンに応答して観察された。この結果は、前記抗体によるERG結合クロマチンの特異的免疫沈降と一致している。
【0102】
4. 免疫蛍光(IF)
IF法により、VCaP細胞中で9FY抗体をさらに評価した(図4)。VCaP細胞を、NT-またはERG-siRNAオリゴヌクレオチドでトランスフェクトし、増殖培地を、10%活性炭剥離血清と0.1 nM R1881を補給した新鮮なDMEMに置換し、さらに48時間インキュベートした。免疫染色のために、まず細胞をリン酸緩衝生理食塩水(PBS)中の新鮮な4%ホルムアルデヒド中で固定し、PBS-T(PBS + 0.1%TritonX-100)中で透過処理した後、CYTOSPIN(登録商標)4(Thermo Scientific, Waltham, MA)遠心管を用いてガラススライド上で遠心分離した。次いで、細胞を、PBS-NT20(1%正常ウマ血清(カタログ番号S-2000、Vector laboratories, Burlingame, CA)および0.1%Tween-20を補給したPBS)中でブロックした。次いで、PBS-NT20中に希釈した、SLC45A3またはPSA(両方ともDAKO社製、Carpinteria, CA)に対する一次抗体と共に、室温で細胞をインキュベートした。細胞をPBS-NT20で洗浄した後、ヤギ抗マウスALEXA FLUOR(登録商標)594(Invitrogen, Carlsbad, CA; カタログ番号A11302)、ヤギ抗ウサギALEXA FLUOR(登録商標)488(Invitrogen, Carlsbad, CA; カタログ番号A11304)二次抗体およびDAPIを印加した。細胞を洗浄し、FLUOROMOUNT G(商標)(SouthernBiotech, Birmingham, AL)を用いてマウントした。OpenLabソフトウェア(Improvision, Lexington, MA)により操作される、QImaging Retiga-EX CCDカメラ(Burnaby, BC, Canada)を備えたLeica DMIRE2倒立顕微鏡上の40X/0.65 N-Plan対物レンズを用いて、画像を捕捉した。Photoshop(Adobe)を用いて、画像を色付きに変換し、融合させた。ペプチド競合について、競合免疫化ポリペプチド(配列番号1のアミノ酸42-66)および非競合対照ERGポリペプチドを保存溶液から希釈し、最終濃度の抗体に対してモル濃度で2000倍過剰量の抗体と混合した。抗体-ポリペプチド混合物を氷上で30分間インキュベートした後、記載のように組織標本に印加した。
【0103】
ERGの転写因子機能に特徴的な核染色により示されたように、9FY抗体はERGタンパク質を特異的に認識した。以前に示されたように(Sunら、2008)、ERGを効率的にノックダウンするsiRNAを用いてVCaP細胞をトランスフェクトした。実際、対照非標的化siRNAで処理した細胞と比較して、ERG siRNA処理に応答して、内因性ERGタンパク質レベルの強固な低下が観察された。ERGは、前立腺分化マーカー遺伝子のリプレッサーである(Sunら、2008;Tomlinsら、2008)。かくして、PSAレベルの上昇は、効率的なERGノックダウンと一致している(図4A)。9FY抗体の認識特異性を確立するために、VCaP細胞上でIFアッセイの前に2000倍過剰の競合免疫化ポリペプチドと前記抗体を競合させた。2000倍モル過剰の免疫化ポリペプチド(競合ペプチド)は、9FY抗体特異的様式でIFシグナルを排除するのに十分であった。対照的に、対照ERGポリペプチド(非競合ペプチド)は9FY抗体と競合できなかった(図4B)。細胞質前立腺特異的抗原(PSA)染色は、免疫化ポリペプチドまたは対照ポリペプチドにより影響されない。PSAのホルモン誘導性細胞質発現を、ERGおよびPSA遺伝子発現のアンドロゲン活性化のための陽性対照として用いた(図4C)。TMPRSS2/ERG融合物を担持せず、検出可能なレベルの内因性ERGも発現しないLNCaP細胞中では、9FY抗体はERGを認識しなかった。R1881に応答するPSAタンパク質発現は、LNCaP細胞中では容易に検出可能であり、PSAのアンドロゲン誘導性発現と一致している。9FY抗体特異性の濃度範囲の定義を目指して、本発明者らは、9FY抗体によるERG認識が、3.7 mg/ml保存液の1:5,000〜1:20,000希釈率の濃度範囲でも基準を満たすことを見出した(図4D)。9FY抗体の非存在下では、二次抗体はVCaP細胞中のエピトープを検出できない。この結果により、IF実験におけるバックグラウンドタンパク質の非特異的染色の可能性が排除された(図4E)。
【実施例3】
【0104】
FFPE標本における免疫組織化学染色
また、9FY抗体をホルマリン固定パラフィン包埋(FFPE)ヒト前立腺標本中でも試験した。前立腺全摘出術標本をホルマリン中に固定し、パラフィン中で全載標本として包埋した。それぞれの前立腺を、前立腺の後表面の長軸に対して直交する横断面で0.22 cm間隔で切片化し、全載標本として完全に包埋した。全載標本ブロックの4μm切片上で免疫組織化学(IHC)染色のために切片を分析した。
【0105】
IHCのための組織切片を、以前に記載のように調製した(Furusatoら、2007)。スライドを1:1200の9FY抗体と共にインキュベートした。発色基質としてVECTOR(登録商標)VIP(Vector Laboratories, Burlingame, CA)(紫色)を使用し、スライドをヘマトキシリンで対抗染色した。IHCにより、前立腺腫瘍細胞の核染色が示され、これはERG転写因子の細胞内局在化と一致していた(図5A-5D)。対照的に、9FY抗体は、ヒト前立腺中の正常な上皮も間質も染色しない。血管の内皮細胞は、9FY抗体による染色を示し、これは内皮細胞における野生型ERGの確立された構成的発現と一致していた(Birdseyら、2008;McLaughlinら、1999;Rainisら、2005)。かくして、病理学者であれば、腫瘍上皮のIHC反応が9FY抗体により観察される場合、内部参照として内皮細胞染色を用いることができる。150人+前立腺癌患者から得た全載標本の評価により、9FY抗体の特異性が確認された。
【実施例4】
【0106】
他の癌細胞系におけるERGタンパク質の検出
VCaP前立腺癌細胞系における9FY抗体の特異性が確立されたので、本発明者らは、COLO 320(結腸癌(Quinnら、1979))、KG1(急性骨髄性白血病(KoefflerおよびGolde, 1978))およびMOLT4(ヒト急性Tリンパ芽球性白血病(Minowadaら、1972))などの、高レベルのERG RNAを発現することが以前に記載された細胞系におけるERGタンパク質の検出のためにこの抗体をさらに評価した。Colo320(ATCC#CCL-220.1)およびMOLT-4(ATCC#CRL-1582)細胞を、10%FBSを補給したRPMI-1640中で増殖させた。KG-1細胞を、10%FBSを補給したIscove改変DMEM(カタログ番号12440-053、Invitrogen, Carlsbad, CA)中で増殖させた。細胞を収穫し、記載のようにウェスタンブロットおよび顕微鏡観察により分析した。9FY抗体を用いるCOLO 320(結腸癌(Quinnら、1979))、KG1(急性骨髄性白血病(KoefflerおよびGolde、1978)およびMOLT4(ヒト急性Tリンパ芽球性白血病(Minowadaら、1972))の免疫ブロットアッセイにより、1種の主なタンパク質種が検出されたが(図6)、これは前立腺癌以外のヒトの癌におけるERGタンパク質の検出および評価におけるこの抗体の有用性を示唆している。
【実施例5】
【0107】
9FY抗体の特異性
1. ウェスタンブロット
ウェスタンブロットを用いて、TMPRSS2/ERG3融合転写物でトランスフェクトされたHEK293細胞から得た細胞溶解物を用いて、9FY抗体の特異性を市販のポリクローナル抗ERG抗体(C-20(sc-353)またはH95(sc-28680)と比較した。9FY抗体を、1:5000で用いた;C20(sc-353)(Santa Cruz Biotechnology, Inc, Santa Cruz, CA)およびH95(sc-28680)(Santa Cruz Biotechnology, Inc, Santa Cruz, CA)を1:1000希釈率で用いた。9FY抗体は、TMPRSS2/ERG3でトランスフェクトされたHEK293細胞のウェスタンブロットにおいて単一の種としてTMPRSS2/ERG3融合転写物(52 kDa)によりコードされる外因的に発現されるERGタンパク質を検出するが、これは9FY抗体の特異性を強調している(図7)。一方、市販の抗ERGポリクローナル抗体は、同一のブロットにおいて複数のタンパク質と反応する。具体的には、市販のポリクローナルC20抗体(sc-353)およびポリクローナルH95抗体(sc-28680)は、これらのポリクローナル抗体を用いて得られたウェスタンブロットにおける複数のバンドにより証明されるように、9FY抗体の特異性を欠いていた(図7)。入手可能な商品パンフレットによれば、C20はヒトERG1、ERG2およびERG3のC末端にマッピングされるエピトープを認識するが、H95はヒトERG2およびERG3のアミノ酸26-120にマッピングされるエピトープを認識する(Owczarekら、2004)。
【0108】
ポリクローナルH95抗体の特異性を、LNCaPおよびVCaP細胞から得た細胞溶解物を用いてさらに分析した。上記のように、R1881アンドロゲンで処理した、もしくは処理しないか、または非標的化(NT)もしくはERG siRNAオリゴヌクレオチドでトランスフェクトしたLNCaPおよびVCaP細胞から、溶解物を調製した。注目すべきことに、H95抗体はLNCaPおよびVCaP細胞溶解物中の複数の非特異的バンドを検出し、TMPRSS2/ERG融合転写物によりコードされる52 kDaのトランケートされたERGポリペプチドである標的の検出は疑わしかった(図9A/Bと図1A/Bを比較されたい)。
【0109】
また、9FY抗体を用いて、TMPRSS2/ERG8融合転写物によりコードされるERG癌タンパク質を検出した。10%ウシ胎仔血清および2 mMグルタミンを補給したDMEM培地中でHEK-293細胞を増殖させた。HEK-293細胞(2x106)個を10 cmディッシュ上に播種し、2日間維持した後、4μgのプラスミドDNA:pIRES-EGFP(CMV)、pIRES-EGFP(CMV)-TMPRSS2-ERG3、pIRES-EGFP(CMV)-ERG3またはpIRES-EGFP(CMV)-TMPRSS2-ERG8でトランスフェクトした。トランスフェクションのためにLIPOFECTAMINE(商標)2000(Invitrogen, Carlsbad, CA;カタログ番号11668-027)を使用し、48時間後に細胞を収穫し、4または20μgのタンパク質に相当する総細胞溶解物を、1:5000の希釈率の9FY抗体を用いるウェスタンブロッティングにより分析した。9FY抗体は、野生型ERG3タンパク質(53 kDa)、TMPRSS2/ERG3にコードされる癌タンパク質(50-52 kDa)、およびTMPRSS2/ERG8にコードされるタンパク質(37 kDa)の予測されるサイズと一致する主要なタンパク質バンドを認識した(図13)。
【0110】
免疫化ポリペプチドは、免疫化ペプチドと48%の配列同一性を有する人Fli1タンパク質(Kuboら、2003)の断片を除いて、ヒトETSファミリーのタンパク質に属するタンパク質との有意な相同性を示さなかった。従って、9FY抗体がウェスタンブロットアッセイを用いてヒトERG3とヒトFLi1タンパク質とを識別することができるかどうかを見るために、9FY抗体を試験した。このアッセイにおいて、一過的に発現されるヒトERG3(TMPRSS2/ERG3構築物によりコードされる)またはヒトFli1タンパク質を、9FY抗体を用いて評価した。比較可能な量のヒトFli1タンパク質がアッセイ中に存在したことを確認するために、ERG3とヒトFli1タンパク質の両方を、それぞれ、C末端およびN末端FLAGタグと共に発現させた。9FY抗体は、ERG3タンパク質のみを認識し、ヒトFli1タンパク質との免疫反応性を示さなかった。
【0111】
2. 免疫蛍光(IF)染色
IFアッセイを用いて、C20およびH95抗体の特異性をさらに分析した。9FY抗体はIFアッセイにおいて前立腺腫瘍細胞の核染色を示したが(図4)、ポリクローナルC20(sc-353)抗体は、VCaP細胞において核ERGタンパク質だけでなく、非特異的細胞質タンパク質も認識する(図9A、第1列)。ERG siRNAを用いるERGノックダウンは、C-20抗体の核ERGおよび非特異的細胞質染色を完全に消失させなかった(図9A、第2列)。C20(sc-353)抗体は、Ad-ERG3アデノウイルス構築物を用いる感染によりLNCaP細胞中で過剰発現されたERG3を認識するが(図9A、第6列)、ERG siRNAを用いるノックダウン後でも依然として染色が検出された(図9A、第7列)。siRNAおよびアデノウイルス感染に関する陰性対照実験を、図9Aの第3、4および5列に示す。
【0112】
C20(sc-353)抗体は、VCaP細胞中で核ERGタンパク質を認識する(図9B、第1列、上パネル)。しかしながら、ERG siRNAを用いるノックダウンは核ERG染色を消失させなかったが、むしろバックグラウンドの増加をもたらした(図9B、第1列、下パネル)。図9Aおよび9Bにおいては、ERGを、一次C20(sc-353)抗体、次いで、ヤギ抗ウサギALEXA FLUOR(登録商標)488(Invitrogen, Carlsbad, CA)二次抗体(緑色)により染色する。図9Aにおいて、核の構造を外形を描くために、細胞をALEXA FLUOR(登録商標)594タグ付ファロイジン(Invitrogen, Carlsbad, CA;カタログ番号A12381)で対抗染色した。図9Bにおいては、ERGにより負に制御されるアンドロゲン誘導性SLC45A3を、マウスモノクローナル抗SLC45A3、次いで、ヤギ抗マウスALEXA FLUOR(登録商標)594(Invitrogen, Carlsbad, CA)二次抗体(赤色)により染色する。DNAをDAPIにより染色する(青色)。
【0113】
C-20抗体と同様、H95(sc-28680)抗体は、VCaP細胞中で核タンパク質および非特異的細胞質タンパク質(図10、第1列)を染色した。さらに、ERG siRNAを用いるERGノックダウンは、VCaP細胞中での染色に有意な差異を示さなかった(図10、第2列)。Ad-ERG3アデノウイルス構築物を用いる感染によりLNCaP細胞中で過剰発現されたERG3がH95(sc-28680)により検出されたが(図10、第6列)、染色はERG siRNAを用いるノックダウンにより影響されなかった(図10、第7列)。さらに、LNCaP細胞(TMPRSS2/ERG融合物を担持しないか、または検出可能なレベルの内因性ERGを発現しない)中でのsiRNAおよびアデノウイルス感染に関する陰性対照実験において(図10、第3、4および5列)、H95(sc-28680)抗体は高レベルの非特異的バックグラウンド染色を示す。図10においては、ERGを一次H95(sc-28680)、次いで、ヤギ抗ウサギALEXA FLUOR(登録商標)488(Invitrogen, Carlsbad, CA)二次抗体(緑色)により染色する。核の構造の外形を描くために、ALEXA FLUOR(登録商標)594(Invitrogen, Carlsbad, CA)タグ付ファロイジンを用いて、細胞を対抗染色する。DNAをDAPIにより染色する(青色)。
【0114】
また、第3の市販のERGポリクローナル抗体、R-20(sc-18136)(Santa Cruz Biotechnology, Inc, Santa Cruz, CA)を、IFにより分析した。R-20について入手可能な商品パンフレットによれば、ERG3を検出することが推奨され、それはヒトERG3の内部領域に位置するエピトープに結合する。ERG-3 R20(sc-18136)は、核染色、ならびに非特異的細胞質染色を示す(図11、第11列)。ERG siRNAを用いるERGノックダウンは核染色を減少させたが、9FY抗体を用いて観察されたように(図4A)、核染色を消失させそうになかった(図11、第2列)。Ad-ERG3アデノウイルス構築物を用いる感染によりLNCaP細胞中で過剰発現されたERG3は、R20(sc-18136)により検出された(図11、第6列)が、ERG siRNAを用いるノックダウン後にも依然として検出された(図11、第7列)。R20(sc-18136)抗体はまた、siRNAおよびアデノウイルス感染に関する陰性対照実験においても高レベルのバックグラウンド染色を示す(図11、第3、4および5列)。図11においては、ERGを一次R20(sc-18136)抗体、次いで、ロバ抗ヤギALEXA FLUOR(登録商標)488(Invitrogen, Carlsbad, CA)二次抗体(緑色)により染色する。核構造の外形を描くために、ALEXA FLUOR(登録商標)594(Invitrogen, Carlsbad, CA)タグ付ファロイジンを用いて、細胞を対抗染色した。DNAをDAPIにより染色した(青色)。
【0115】
別のIFアッセイを行って、H95および9FYが、ERGへの他の抗体の結合を競合的に阻害する能力を評価した。この競合的IFアッセイの結果により、9FY抗体が高い親和性でVCaP細胞の核のみを染色することが確認される。対照的に、H-95は、VCaP細胞の細胞質および核中の未知のタンパク質を染色する。一対一の交叉競合においては、10倍過剰の9FY抗体(2μg/ml)はH-95の核染色を阻害するが、H95による細胞質染色は残る(図12、第1列)。対照的に、0.2μg/mlの9FY抗体は、10倍過剰のH-95(2μg/ml)の存在下で、依然として異なる核染色を示す(図12、第5列)。等しい濃度の抗体(0.4μg/ml)では、9FY抗体はH95と比較して、より強く、高度に特異的であり、異なる核染色を示す(図12、第3列)。
【0116】
上記で考察された他の抗体試験と一致して、これらの結果は、9FY抗体がVCaP細胞の核中の単一のタンパク質を認識することを示している。対照的に、H-95ポリクローナル抗体は、細胞質と核の両方において複数の不明確なタンパク質と反応する。さらに、9FY抗体は、H95と比較した場合、より高い親和性を示す。
【0117】
3. 免疫組織化学染色
免疫組織化学染色を用いて、9FY抗体の特異性を、C20(sc-353)(Santa Cruz Biotechnology, Inc, Santa Cruz, CA)と呼ばれる市販のポリクローナル抗ERG抗体と比較した。9FY抗体はヒトならびにマウスのERGタンパク質を特異的に認識するため、発達中のマウスおよび成体マウスから得られたホルマリン固定パラフィン包埋(FFPE)組織中でERGの特異性を評価した。
【0118】
マウス胚および成体組織の回収:交配の9.5、14.5および17.5日後のマウス胚を、妊娠マウスから回収し、4%パラホルムアルデヒド中で12〜24時間固定した。成体オスマウスに由来する組織を回収し、4%パラホルムアルデヒド中で24時間固定した。組織をパラフィン包埋のために処理し、ミクロトームを用いて4μmの切片をスーパーフロストダブルスライド上に切り出した。
【0119】
ERGの免疫組織化学分析(IHC):脱パラフィン化の後、4μmの切片を脱水し、メタノール中の0.6%過酸化水素中で20分間ブロックした。マイクロ波中で30分間、0.1Mクエン酸バッファー中で抗原回復のために切片を処理した後、30分間冷却した。製造業者の説明書に従って、Mouse-To-Mouse IHC Detection System Kit (Millipore Inc)を用いて、IHC手順を実行した。簡単に述べると、切片をプレ抗体ブロッキング溶液と共に10分間ブロックした。ブロッキング溶液を除去し、1:1000の希釈率の9FY抗体または市販のC20(sc353)ERG抗体と共に切片を4℃で一晩インキュベートした。インキュベーション後、スライドをPBSで5分間洗浄した。スライドを、ポスト抗体ブロッキング溶液と共に10分間インキュベートし、PBSでそれぞれ5分間ずつ、2回洗浄した。スライドをすぐに使えるPoly-HRP-Anti-Mouse/Rabbit IgGと共に10分間インキュベートし、PBSで5分間、2回洗浄し、DAB試薬を用いて発色させた。次いで、切片をヘマトキシリン中で1分間、対抗染色し、脱水し、透明化し、マウントし、写真を撮影した。
【0120】
9FY抗体を用いた場合、ERGは野生型マウス前立腺内皮細胞中でのみ検出され、野生型マウス前立腺上皮中では検出されなかった。図14A(実線矢印は前立腺を示し、破線矢印は内皮細胞を示す)を参照されたい。一方、市販のC20(sc353)ERG抗体はERGに対して非特異的であり、野生型マウスから得られた組織中の前立腺内皮細胞と上皮細胞の両方を染色した(図14B)。予想通り、ERGを発現するトランスジェニックマウスにおいては、両抗体は前立腺の内皮細胞と上皮細胞中でERGを検出した。図14C-Dを参照されたい。しかしながら、市販のC20(sc 353)ERG抗体は、同じ強度で野生型およびERG陽性トランスジェニック組織を染色する。図14BおよびDを参照されたい。
【0121】
IHC分析はまた、造血細胞、内皮細胞、ならびに血管および様々な胚組織の毛細血管におけるERG発現も示した(データは示さない)。同様に、成体マウス組織におけるERGの発現も、造血細胞、内皮細胞、血管および毛細血管において検出された(データは示さない)。AMLおよびユーイング肉腫のサブセットがERG発現の上昇を示すことは既に知られている。ERG特異的抗体の利用性について、血管中の造血細胞、内皮細胞および様々な胚組織中の毛細血管の病理学的状態におけるERGの変化を効率的に追跡することができる。興味深いことに、ERGは、前立腺などの組織中の正常な上皮細胞においては検出されない。従って、血管および毛細血管中の造血細胞または内皮細胞以外の任意の組織におけるERGの検出は、癌などの、異常性および/または病理学的状態を示唆する。
【実施例6】
【0122】
9FY抗体可変ドメインの配列決定
RNAを9FYハイブリドーマ細胞系から抽出し、メッセンジャーRNAに特異的なオリゴd(T)プライマーを用いてcDNAに逆転写した。マウス抗体重鎖および軽鎖配列に特異的なプライマーを用いるPCRのための鋳型としてこのcDNA産物を用いた。
【0123】
PCR産物を標準的な配列決定ベクター中にクローニングし、陽性コロニーをPCRにより同定した。これらのコロニーを培養し、配列決定のためにプラスミドを少量調製した。ダイターミネーター法を用いて配列決定を実施し、ABI3130遺伝子分析装置上で分析した。重鎖および軽鎖可変ドメインのコンセンサス配列を、AlignXプログラムを用いる整列により決定した。
【0124】
この整列に基づいて、9FY抗体の軽鎖可変ドメインは以下のアミノ酸配列を含むと決定された(CDR1(L1)、CDR2(L2)およびCDR3(L3)に下線を付す):

(配列番号2)。
【0125】
そして9FY抗体の重鎖可変ドメインは以下のアミノ酸配列を含むと決定された(CDR1(H1)、CDR2(H2)およびCDR3(H3)に下線を付す):

(配列番号3)。
【実施例7】
【0126】
前立腺癌におけるERG癌タンパク質およびTMPRSS2/ERG融合状態の分析
腫瘍標本におけるERG癌タンパク質染色と、TMPRSS2-ERG融合状態との間の関係を評価するために、TMPRSS2-ERG mRNAおよび全ERG mRNAの検出のためのERG癌タンパク質陽性またはERG癌タンパク質陰性FFPE標本の連続組織切片上で比較分析を行った。
【0127】
前立腺標本:この分析のため、および多病巣前立腺癌におけるERG発現をマッピングするための前立腺標本(実施例8)を、以下のように取得、調製した。Center for Prostate Disease Researchプログラムに登録した132人の患者の前立腺全摘出術標本を、標本が外科的に取り出された後30分以内に、病理学者が取得した。前立腺全摘出術標本をホルマリン中で固定し、パラフィン中で全載標本として包埋し、前立腺の後表面の長軸に対して直交する横断面中、0.22 cmの間隔で切片化し、本発明者らのArmed Forces Institute of Pathology(AFIP)プロトコル(B.Furusatoら、2008)に従って、全載標本として完全に包埋した。各患者から、1〜4個の腫瘍(多くは2個の病巣)を含む1個の全載横断面を選択したところ、腫瘍は様々な等級および段階を示した。各腫瘍を、前立腺全摘出術標本および別々の腫瘍を示した2個以上の腫瘍病巣を有するスライス中で個別に診断した。
【0128】
ERGの免疫組織化学分析:脱パラフィン化の後、4μmの切片を脱水し、メタノール中の0.6%過酸化水素中で20分間ブロックした。マイクロ波中で30分間、EDTA(pH 9.0)中で抗原回収のために切片を処理した後、EDTAバッファー中で30分間冷却した。次いで、切片を1%ウマ血清中で40分間ブロックした後、1:1280の希釈率の9FYモノクローナル抗体と共に室温で60分間インキュベートした。切片を、1:200の希釈率のビオチン化ウマ抗マウス抗体(Vector Laboratories, Burlingame, CA)と共に30分間インキュベートした後、ABCキット(Vector Laboratories, Burlingame, CA)で30分間処理した。VIP(Vector Laboratories, Burlingame, CA)で5分間処理することにより、色の検出を達成した。次いで、切片をヘマトキシリン中で1分間対抗染色し、脱水し、透明化し、マウントした。9FY染色を、陽性細胞の割合(%)に従って決定した:25%まで(1+)、>25〜50%(2+)、>50〜75%(3+)および>75%(4+)。この強度を、軽度(1+)、中程度(2+)および顕著(3+)としてスコア化した。陽性細胞の割合に強度を掛けることにより、両測定値の組合せを算出し、スコアを得た。
【0129】
分枝鎖DNA(bDNA)シグナル増幅によるERG mRNAの分析:35個のFFPE全載前立腺サンプルの各々から、1個の4μm厚の切片を選択した。腫瘍として同定された領域に印を付け、擦って取り出し、600μlの組織均質化溶液(THS)中にホモジェナイズした後、12μl(50μg/ml)のプロテイナーゼKを添加した。標本を65℃で7時間インキュベートした。サンプルを室温で5分間遠心分離して、破片を沈降させた。上清を新鮮なマイクロ遠心管に移し、残留パラフィンを避けた。QUANTIGENE(登録商標)2.0アッセイ(Panomics, Fermont, CA)を用いて、全ての上清をすぐに分析した。各サンプルを2回アッセイした。40μl(5 ng)のホモジェネートを、ERGの増幅に用いた:TMPRSS2-ERGについては80μl(10 ng)ならびにハウスキーピング遺伝子:ACTB、B2MおよびRPL19については5μl(0.625 ng)。さらに、VCaP mRNAを陽性対照として用いた。標的RNAを捕捉するために、THS中で好適な容量のサンプルを混合することにより、サンプル希釈液を調製した。12μlのプローブセットと、40μlのブロッキング試薬(標的遺伝子のみのため)または40μlのヌクレアーゼ非含有水(28S RNAのため)、溶解混合物およびヌクレアーゼ非含有とを混合することにより、各標的のための実用プローブセットを調製した。実用プローブセットを混合し、室温で保持した。捕捉プレートを調製するために、60μlの各実用プローブセットを、割り当てたウェルに移した。次いで、アッセイ対照およびRNAサンプルを、ハイブリダイゼーション実用試薬(HWR)で100μlにし、55℃で一晩ハイブリダイズさせた。プレートを洗浄バッファーで3回洗浄した。次いで、プレアンプリファーを添加した後、アンプリファー、標識プローブおよび最後に化学発光基質を添加し、各試薬中でのインキュベーション後に洗浄した。Modulus Luminometer(Knudsenら、2008)中でリードアウトを測定した。
【0130】
35個の評価可能な標本の分析により、TMPRSS2-ERG融合型A転写物のmRNAレベルと、ERG癌タンパク質免疫組織化学分析との間に強い相関が示された(図15)。mRNAとタンパク質データとの82.8%の一致は、予想される感度の差異ならびに2つの技術のリードアウトにも拘わらず、明らかであった。蛍光in situハイブリダイゼーション(FISH)によるTMPRSS2-ERG遺伝子融合物分析の比較評価およびIHC(9FY抗体を用いる)によるERG癌タンパク質発現も、これらの知見を支持し、相違を示さなかった。
【実施例8】
【0131】
多病巣前立腺癌におけるERG癌タンパク質の発現マップ
アンドロゲン受容体(AR)に調節される前立腺関連遺伝子(主にTMPRSS2およびそれほどではないにせよ、SLC45A3およびNDRG1)の調節配列ならびにETS遺伝子ファミリー(主にERG)中の核転写因子のタンパク質コード配列を含む一般的な遺伝子融合物は、前立腺腫瘍におけるERGの過剰発現をもたらすことが多い。新たな研究は、前立腺癌(CaP)におけるERGおよびETVの癌原機能を示唆している(Kumar-Sinha, C.ら、2008; Klezovitch, O.ら、2008; Sun, C.ら、2008; Tomlins, S.A.ら、2008; Carver, B.S.ら、2009; King, J.C.ら、2009; Zong, Y.ら、2009に概説されている)。本発明者らの報告を含む以前の研究は、多病巣癌の文脈において遺伝子レベルまたはmRNAレベルでERG遺伝子融合を分析し、これらのデータは、同じ前立腺内で腫瘍間異種性を示した(Clark, J.ら、2007; Barry, M.ら、2007; Mehra R.ら、2007; Furusato, B.ら、2008)。遺伝子融合およびmRNA発現に関する報告は多いにも拘わらず、CaP中のERG癌タンパク質は依然として定義されていない。
【0132】
ERG 42-66エピトープに対するモノクローナル抗体を用いて、多病巣CaPの文脈においてERG癌タンパク質発現を分析した。Center for Prostate Disease Researchプログラムに登録した132人の患者の前立腺全摘出術標本を、標本が外科的に取り出された後30分以内に、病理学者が取得した。前立腺を実施例7に上記されたように全載標本として処理した。各患者から、1〜4個の腫瘍(多くは2個の病巣)を含む1個の全載横断面を選択したところ、腫瘍は様々な等級および段階を示した。各腫瘍を、前立腺全摘出術標本および別々の腫瘍を示した2個以上の腫瘍病巣を有するスライス中で個別に診断した。
【0133】
各腫瘍を個別に測定し、等級付けた。平均で、1個の全載切片(3.5 x 2.5 cmまたは4.0 x 3.5 cm)は、1 mm直径の約800〜1400個の組織マイクロアレイコアに等しい。指標腫瘍に加えて、これらの横断面の多くは、辺縁部および移行帯/尿道近傍部ならびに尿道、前立腺小室、射精管、および精嚢の良性前立腺組織を含んでいた。単一の腫瘍が51個の切片に存在し、複数の個々の腫瘍が81個の切片に存在した。腫瘍等級、病理学的状態、周辺状態および臨床データを表1にまとめる。
【表1】

【0134】
表1:前立腺癌患者の臨床病理学的特徴:(A)前立腺癌患者の人口統計および臨床病理学的特徴(分類)を示す。1pT2r1(x)腫瘍を有する患者のデータはこの分析においては用いなかった。23人の患者(事例番号83、112および132)以外の切片において示された指標腫瘍のGleasonスコアに対応する。3観察された領域での組織学的外見を示す。42つの連続的PSA≧0.2 ng/ml。(B)前立腺癌患者の人口統計および臨床病理学的特徴(続き)を示す。
【0135】
前立腺癌およびPINの両方において、上皮細胞は核染色を示した。ERGは261個の個々の腫瘍のうちの117個(44.8%)において陽性であった(表2)。核ERG染色は、良性上皮細胞中には実際には存在せず、約200,000個の個々の良性腺染色のうちの22個のみがERG陽性であり、これはERG陽性癌腫の検出におけるこのERGモノクローナル抗体の顕著な特異性(>99.9%)を示している(表2)。良性腺の数は、132個の切片を掛けた、このコホートの3つの平均サイズ切片における良性腺の数(平均1550個の良性腺/切片)の計数に基づく見積もり値を表す。
【表2】

【0136】
132個の切片のうち、6個の標本のみが、稀なERG陽性非悪性細胞を示した。3個の標本において、それぞれ単一の群の良性腺(5〜8個の腺の範囲で平均7個の腺)が、癌腫に加えてERGについて陽性であった。3個のさらなる標本において、ERGは、細胞質および核の拡大が増加し、軽度の異型、以前は「低悪性度PIN」と呼ばれた変化を示す天然の腺(3〜5個の腺)の小さい凝集体に存在した。9個の前部/移行帯腫瘍のうちの8個は陰性であった。5つの事例を除いて全ての事例において、85%を超える腫瘍細胞が、細胞質ブラッシュ(blush)に関して中程度から強い核染色を示した。
【0137】
ERG陽性腫瘍病巣を含む85個の評価可能な標本のうちの82個(96.5%)は、ERG陽性前立腺上皮内新生物(PIN)病変を含み、ERG陽性PIN病巣は全てERG陽性腫瘍と同じ位置にあった。PINは前立腺内で生じる前癌状態の増殖である。
【0138】
81個の切片が、複数の腫瘍を含んでいた;これらのうち15個において、全ての腫瘍が陽性であった;31個全てにおいて、腫瘍病巣は陰性であった;35個において、いくつかの腫瘍が拡散的に陽性であり、他は完全に陰性であった。かくして、多病巣腫瘍の文脈においては、81個の切片のうちの50個(61.7%)が1個以上のERG陽性腫瘍を有していた。1個だけの腫瘍を含む51個の切片中、36個(70.6%)がERG陽性であり、これらのうちの2個は陽性領域に包含された完全にERG陰性の腫瘍細胞のクローンを含んでいた。弱い非識別的細胞質染色が、全ての上皮細胞型(前立腺および非前立腺)において観察され、これは細胞系のデータと一致していた。
【0139】
9FY抗体は、全ての内皮細胞(リンパ球/血管内皮細胞)の核においてERGを一貫して検出したが、これはERG-IHCアッセイの固有の陽性対照として役立つ。内皮細胞中でのERG発現も他の文脈で以前に指摘されていたが、その有意性は未だ定義されていない(Baltzinger M.ら、1999; Birdsey, G.M.ら、2008; Ellet, F.ら、2009)。腫瘍細胞の多くがERG陽性核および容易に同定可能な細胞質を有する癌腫とは対照的に、ほとんど識別できない細胞質を含まないか、または含むERG陽性核により、内皮細胞を容易に同定することができる。ERG陰性のあまり分化していない/Gleasonパターン4または5の癌腫においては、内皮細胞の陽性核は一般的には線状の狭い分布を有する。
【0140】
両染性細胞質を有する腫瘍細胞は、薄いか、または泡沫状の細胞質を有するものよりも強く陽性であった。4個のムチン産生腫瘍のうちの3個がERGについて陽性であった。管状成分を有する5個の腫瘍のうちの2個のみがERGについて陽性であった。空胞化した外見/印環様の外見を有する1個の腫瘍がERGについて陽性であった。リンパ上皮種様特徴を有する病巣は陰性であった。
【0141】
前立腺切除術の時点でリンパ節転移を示した7人全ての患者において、ERG発現は指標腫瘍の発現状態を映していた。4個のERG原発腫瘍はERG陽性転移を有し、逆に3個のERG陰性原発腫瘍はERG陰性転移を有していた。FISHアッセイにより、ERG陽性原発腫瘍と対応する転移は同一の融合パターンを示した。
【0142】
尿道前立腺部および尿道周囲前立腺管の基底細胞、尿路上皮細胞は非反応性であった。射精管、精嚢、神経束、線維筋肉間質、微小腺房過形成(類義語:腺症、異型腺腫様過形成)、硬化性腺症、および基底細胞過形成などの腺過形成の変異体は、全てERGについて陰性であった。増殖性炎症性萎縮および進行性萎縮または部分的萎縮などの様々なパターンの萎縮も、ERGについて陰性であった。
【0143】
ERG癌タンパク質状態の関連性を、様々な臨床病理学的特徴を用いて評価した(表1AおよびB)。ERG発現は多くの臨床病理学的特徴との相関を示さなかったが、所与の全載標本切片中の全ての腫瘍病巣を考慮した場合、より高いGleasonスコアの合計およびより少ない分化した腫瘍は、ERG陽性免疫染色との有意な相関を示した(表3)。
【表3】

【0144】
統計分析:ERG癌タンパク質発現の感度および特異性を、132個の全載前立腺中の良性腺から全ての腫瘍病巣を識別するために分析した(227個の腫瘍病巣および200,000個を超える良性腺)。カイ二乗検定またはFisherの直接確率検定を用いて、指標腫瘍ERG癌タンパク質状態と、人種、病理学的T状態、前立腺切除術のGleasonスコアおよび周辺状態などの分類上の臨床病理学的特徴との関連を試験した。また、カイ二乗検定を用いて、ERG癌タンパク質状態と個々の腫瘍の腫瘍分化との関連を試験した。0.05のp値を統計的に有意として採用した。SASバージョン9.2を、全てのデータ分析に用いた。
【0145】
CaPにおける遺伝子融合事象は、一般的にはアンドロゲンにより調節される前立腺関連遺伝子、例えば、TMPRSS2、SLC45A3またはNDRG1の調節配列と共に、ETS遺伝子ファミリー(ERG、ETV1、ETV4-6およびELK4)中の核転写因子のタンパク質コード配列を含むため、得られるタンパク質産物は、ETS関連癌遺伝子転写因子であり、ERGが最も一般的である(Kumar-Sinha, C.ら、2008)。ERG 42-66エピトープに対するモノクローナル抗体は、ERG癌タンパク質の認識において高い程度の特異性および感度を示す。ERG癌タンパク質の陽性核染色は、65%の患者において腫瘍細胞を同定する際に高度に特異的である(>99.9%)。核ERG染色は良性上皮細胞中には実際には存在しない。
【0146】
全部で261個の個々の腫瘍の全体で44.8%がこのコホートにおいてERG陽性であったが、単一の腫瘍を有する51個の標本の70.6%がERG陽性であり、2個以上の腫瘍を有する81個の標本の62%がERG陽性であった。本明細書に記載のCaP標本におけるERG発現の全体の頻度は、ERG座を含む遺伝子融合物の報告された割合と類似している(Kumar-Sinha, C.ら、2008;Clark, J.ら、2007)。さらに、この研究は、CaPにおけるERG変化の頻度を割り当てる際にサンプルの偏りが寄与する可能性を指摘している。
【0147】
一般的には、腫瘍はERG発現について均一に陽性または陰性である。この研究は、ERG陽性PINとERG陽性腫瘍との関連(96.5%)を強調する。他の研究(Kumar-Sinha, C.ら、2008; Cerveiraら、2006; Pernerら、2007)はより低い頻度のERG融合物陽性PIN(15〜20%)を示したが、この研究の全載前立腺切片により、ERG癌タンパク質発現の文脈におけるPINおよび腫瘍のより包括的な評価が可能になる。
【0148】
稀なERG陽性良性腺および低悪性度PINと呼ばれる稀な非定型天然腺は、特に、PINおよび/または癌腫とのそれらの局所的関係の観点から、副形態学的分子変化を担持し得る。この知見は、良性前立腺の稀な事例におけるTMPRSS2-ERG融合転写物の存在を報告する以前の研究(Clark, J.ら、2007; Furusato, B.ら、2008)と一致している。これらの病巣におけるTMPRSS2-ERG融合物の確認は、そのサイズが小さいため困難である。ERG癌タンパク質発現とTMPRSS2-ERG遺伝子融合転写物状態との高い一致率を考慮する場合、ERG過剰発現をもたらす遺伝子融合物の優れた代用マーカーとしてERG IHCを用いることができる。かくして、ゲノムおよびmRNAに基づくアッセイの補完に加えて、42-66エピトープに結合する本明細書に記載の抗体を用いるERG癌タンパク質検出は、CaPにおけるERG変化を評価する際の有意な利点を提供する。例えば、ERGタンパク質コード配列と任意の5'融合パートナー(TMPRSS2、SLC45A3およびNDRG1)の調節配列との遺伝子融合事象の結果生じる翻訳産物(Petrovics, G.ら、2005; Han, B.ら、2008; Pflueger, D.ら、2009)を、ERG-MAbにより検出することができる。実用的な面では、IHCによるERGタンパク質の評価は、「初期段階」の病理設定におけるERG癌遺伝子活性化の形態学的評価にとってより迅速かつ有益であろう。
【0149】
現在用いられている診断マーカーのうち、α-メチルアシル-CoAラセマーゼ(AMACR)は、約80%の前立腺癌および様々な他の癌腫を検出する(Hameed, O.ら、2005)。しかしながら、25〜30%の良性前立腺はAMACRについて染色し得るため、AMACRの特異性はERGのものよりも低い。かくして、診断用IHCパネルにおけるERG 42-66エピトープに結合する抗体の含有は、腫瘍検出の特異性を増加させることができる。内皮細胞中での9FY抗体の強い陽性反応は、従来の内皮細胞マーカー(CD31、CD34、および第VIII因子関連抗原)を用いて以前に評価されたものよりも多くの前立腺中の毛細血管を強調する。ERG発現のこの特徴は、ERG IHC染色の解釈を複雑にすることがある。例えば、腺と密接に接触した毛細血管は、基底細胞染色を示唆し得るか、または反応性内皮を有する拡張した毛細血管は小さい腫瘍腺もしくは萎縮を模倣し得る。しかしながら、この潜在的な複雑さを、ERG陽性血管パターンを認識する経験を介して克服することができる。
【0150】
CaPにおけるERG変化の予測的特徴は未だによく理解されていないが、正および負の両方の関連が報告されている(Kumar-Sinha, C.ら、2008; Clark, J.ら、2007)。ERG癌タンパク質のこの評価において、所与の全載標本切片における全ての腫瘍病巣を考慮に入れた場合、より高いGleasonスコアの合計およびより少ない分化した腫瘍は、ERG免疫染色との相関を示した(表3)。しかしながら、進行との有意な相関はなかった(データは示さない)。多病巣腫瘍の文脈におけるERG発現を考慮すれば、より大きく、より良好な規定のコホートにおけるさらに独立した評価が保証される。
【0151】
まとめると、現在公知のCaPタンパク質生物マーカーのうち、均一で強く、高度に特異的なERG癌タンパク質の検出はCaP診断設定においてかつてない機会を提供する。これらの知見は、患者の2/3における前浸潤性CaPから浸潤性CaPへの変遷の間のクローン選択およびERG陽性腫瘍細胞の増殖におけるERG活性化の役割を具体化する。最後に、前立腺腫瘍生物学におけるERG機能のより良好な理解と共に、将来の前立腺癌のERG-モノクローナル抗体に基づく層別化を、画像化、標的化療法またはアンドロゲン除去療法の効果のモニタリングとの関連で用いることができる。
【0152】
本明細書に引用される全ての特許、特許出願、および公開された参考文献は、その全体が参照により本明細書に組入れられるものとする。本発明をその好ましい実施形態を参照して具体的に示し、説明してきたが、当業者であれば、添付の特許請求の範囲により包含される本発明の範囲から逸脱することなく、形態および詳細の様々な変更を行うことができることを理解できるであろう。
【0153】
参考文献
以下の参考文献が本出願において引用され、本発明の分野に対して一般的な情報を提供し、本出願で考察されるアッセイおよび他の詳細を提供する。以下の参考文献は、その全体が参照により本明細書に組入れられるものとする。
Attard, G. et al. (2008). Oncogene 27, 253-263.
Baltzinger, M. et al. (1999). Dev Dyn 216, 420-433.
Barry, M. et al. (2007). Urology 70, 630-633.
Beach, R. et al. (2002). Am J Surg Pathol 26, 1588-1596.
Birdsey, G.M. et al. (2008). Blood 111, 3498-3506.
Carver, B.S. et al. (2009). Nat Genet 41, 619-624.
Cerveira, N. et al., (2006) Neoplasia 8, 826-832.
Clark, J. et al. (2007). Oncogene 26, 2667-2673.
Egevad, L. (2008). Anal Quant Cytol Histol 30, 190-198.
Ellett, F. et al. (2009). Mech Dev 126, 220-229.
FitzGerald, L.M. et al. (2008). BMC Cancer 8, 230.
Furusato, B. et al. (2008). Mod Pathol 21, 67-75.
Furusato, B. et al. (2008). Prostate Cancer Prostatic Dis 11, 194-197.
Gopalan, A. et al. (2009). Cancer Res 69, 1400-1406.
Gupta, A. et al. (2004). Am J Surg Pathol 28, 1224-1229.
Hameed, O et al., (2005). Am J Surg Pathol 29, 579-587.
Han, B. et al., (2008) Cancer Res 68, 7629-7637.
Hermans, K.G., et al. (2009). Clin Cancer Res 15, 6398-6403.
Hu, Y. et al. (2008). Clin Cancer Res 14, 4719-4725.
Jiang, Z. et al. (2001). Am J Surg Pathol 25, 1397-1404.
King, J.C. et al., (2009). Nat Genet 41, 524-526.
Klezovitch, O. et al. (2008). Proc Natl Acad Sci U S A 105, 2105-2110.
B. S. Knudsen, A. N. et al. (2008). J Mol Diagn 10, 169-176.
Koeffler, H.P., and Golde, D.W. (1978). Science 200, 1153-1154.
Kubo, J. et al. (2003). Am J Pathol 163, 571-581.
Kumar-Sinha, C. et al. (2008). Nat Rev Cancer 8, 497-511.
Larkin, M.A. et al. (2007). Bioinformatics 23, 2947-2948.
Luo, J. et al. (2002). Cancer Res 62, 2220-2226.
McLaughlin, F. et al. (1999). J Cell Sci 112 ( Pt 24), 4695-4703.
Mehra, R. et al. (2007). Cancer Res 67, 7991-7995.
Mehra, R. et al. (2008). Cancer Res 68, 3584-3590.
Minowada, J. et al. (1972). J Natl Cancer Inst 49, 891-895.
Mostofi, F.K. et al. (1992). Cancer 70, 235-253.
Mostofi, F.K. et al. (1993). Cancer 71, 906-932.
Narod, S.A. et al. (2008). Br J Cancer 99, 847-851.
Ng, A.P. et al. (2010). Trisomy of Erg is required for myeloproliferatioon in mouse model of Down syndrome Blood, in press.
Owczarek, C.M. et al. (2004). Gene 324, 65-77.
Perner, S. et al., (2007). Am J Surg Pathol 31, 882-888.
Petrovics, G. et al., (2005). Oncogene 24, 3847-3852.
Pflueger, D. et al. (2009). Neoplasia 11, 804-811.
Quinn, L.A. et al. (1979). Cancer Res 39, 4914-4924.
Rainis, L. et al. (2005). Cancer Res 65, 7596-7602.
Rao, V.N. et al. (1987a). Science 237, 635-639.
Rao, V.N. et al. (1987b). Oncogene Res 2, 95-101.
Reddy, E.S. et al. Proc Natl Acad Sci U S A 84, 6131-6135.
Rubin, M.A. et al. (2002). JAMA 287, 1662-1670.
Saramaki, O.R. et al. (2008). Clin Cancer Res 14, 3395-3400.
Shim et al. (2003). J. Neural Trans. Suppl. 67:39-49.
Sun, C. et al. (2008). Oncogene 27, 5348-5353.
Tomlins, S.A. et al. (2005). Science 310, 644-647.
Tomlins, S.A. et al. (2008). Neoplasia 10, 177-188.
Turner, D.P. and Watson, D.K. (2008). Expert Rev Anticancer Ther 8, 33-42.
Wang et al. Cancer Res. (2008). 68, 8516-24.
Winnes, M. et al., (2007). Oncol Rep 17, 1033-1036.
Yang, X.J. et al. (2002). Am J Surg Pathol 26, 921-925.
Zong, Y., et al. (2009). Proc Natl Acad Sci U S A 106, 12465-12470。
【技術分野】
【0001】
政府権益の声明
本発明は、Uniformed Services University of the Health Sciencesから、連絡番号HU0001-04-C-1502によって、およびU.S. Army Medical Research Acquisition Activityから、認可番号W81XWH-08-1-0532によって資金供給された研究から、一部米国政府の支援と共に為されたものである。米国政府は本発明において特定の権利を有する。
【0002】
関連出願に対する相互参照
本出願は、2009年4月29日に提出された米国特許仮出願第61/173,834号(その全開示は参照により本明細書に組入れられるものとする)の利益を請求し、その出願日に依存する。
【背景技術】
【0003】
ETS関連遺伝子(ERG)癌原遺伝子は、TMPRSS2とETSファミリーの遺伝子を含む遺伝子融合物の再発の結果として、前立腺腫瘍の60〜70%において過剰発現される(Petrovicsら、2005; Tomlinsら、2005; Kumar-Sinhaら、2008に概説されている)。ヒト前立腺癌標本および様々な実験モデルに関する新たな研究は、前立腺癌におけるERGの原因的な発癌機能を強調している ADDIN EN.CITE ADDIN EN.CITE.DATA (Klezovitchら、2008; Tomlinsら、2008; Sunら、2008; Wangら、2008)。多くの報告が、ERGの遺伝子活性化の診断的特徴および予測的特徴の両方を強調しており、前立腺腫瘍の約半分がアンドロゲン受容体に調節されるTMPRSS2遺伝子プロモーターとERGタンパク質コード配列との間で起こる最も一般的な遺伝子融合物を担持することを示している(Kumar-Sinhaら、2008に概説されている)。TMPRSS2遺伝子プロモーターとERGとの間の融合は、N末端トランケートされたERGまたは完全長形態のERGの過剰発現をもたらす ADDIN EN.CITE ADDIN EN.CITE.DATA (Klezovitchら、2008; ADDIN EN.CITE ADDIN EN.CITE.DATA Sunら、2008)。ergと、SLC45A3(Hanら、2008)およびNDRG1(Pfluegerら、2009)などの他のアンドロゲン誘導性プロモーター配列との間の融合事象も、前立腺癌において同定されている。
【0004】
TMPRSS2/ERG融合物の複製物または融合事象に関連する染色体喪失(Edel)を担持する腫瘍を有する患者に関する乏しい疾患転帰が強調されている ADDIN EN.CITE ADDIN EN.CITE.DATA (Attardら、2008; FitzGeraldら、2008; Mehraら、2008)。前立腺癌の現行の診断は、構造的増殖パターン、基底細胞の喪失、核異型、両染性細胞質、管腔内ブルームチン、ピンクアモルファス分泌、および有糸分裂像などの様々な組織学的特徴に基づいている(Egevad、2008)。これらの特徴のいくつかが明らかでない場合、特に、腫瘍含量が非常に限られた前立腺針生検の場合、病理学者が前立腺癌を診断することが難しいことがある(Mostofiら、1992;Mostofiら、1993)。現在では、診断を助けるために分子マーカーが用いられている。例えば、前立腺癌の診断は、特異的サイトケラチンまたはp63(CK903、p63)および腫瘍細胞関連α-メチルアシル-CoA-ラセマーゼ(AMACRまたはP504S)に関する良性腺の基底細胞染色を含んでもよい(Luoら、2002;Rubinら、2002)。しかしながら、これらの分子マーカーは、日常的な診断においては顕著な限界を有する。AMACRの発現は、良性前立腺の最大21%、腎性腺腫の58%および異型腺腫様過形成の事例の約18%などの様々な他の非悪性病変において認められる ADDIN EN.CITE ADDIN EN.CITE.DATA (Beachら、2002; Guptaら、2004; Jiangら、2001; Yangら、2002)。ERG過剰発現およびTMPRSS2/ERGゲノム再配列を評価する新しいデータは、前立腺癌の診断および予測における非常に有望な新戦略を提供している(Furusatoら、2008;Saramakiら、2008)。
【0005】
EWS-ERG融合物は、ユーイング肉腫の一部集団において記載されているが、融合物を含まないERG過剰発現は急性骨髄性白血病および急性Tリンパ芽球性白血病において強調された(Marcucciら、2005;Baldusら、2006)。ERG過剰発現はまた、巨核芽球性白血病にも関連している(Rainisら、2005)。他の研究は、ERG発現の増加がアルツハイマー病(AD)およびダウン症候群におけるAD様ニューロパシーにおいて役割を果たすことを示唆している(Shimら、2003;Ngら、2010)。
【0006】
ヒトERG遺伝子の構造は、約300キロ塩基のゲノム配列に広がり、少なくとも9個の別々の転写物を生成する少なくとも17個のエクソンを含む(Owczarekら、2004)。ERG1〜ERG5アイソフォームは、ETS部位に結合し、転写アクチベーターとして作用することができる5個の別々のポリペプチドをコードする(Owczarekら、2004)。これらの5個のアイソフォームのうち、ERG3が最も長く、479アミノ酸のポリペプチド(配列番号1;受託番号NP_891548.1)をコードする。ERG6〜ERG9アイソフォームは、他のERGアイソフォームとは異なる5'エクソンを含む選択的スプライス形態である。ERG7およびERG8はオープンリーディングフレームを有するが、ERG6は複数の停止コドンをコードし、これは、このERG転写物が機能的タンパク質をコードしないことを示唆している(Owczarekら、2004)。ERG9転写物は推定停止コドンまたは共通ポリアデニル化シグナルを含まないが、これは、それも非コード転写物であり得ることを示唆している(Owczarekら、2004)。
【0007】
ERG癌原遺伝子は20年以上前に初めて特性評価されたが(Raoら、1987a;Raoら、1987b;Reddyら、1987)、現在でも臨床標本においてERGを検出するための抗体が入手できない。ERGタンパク質は、後生動物全体に渡り保存されている、高度に相同な群のタンパク質であるETS(E-26特異的、E26形質転換特異的)多遺伝子ファミリーの転写因子に属する(TurnerおよびWatson、2008)。ETSタンパク質は、翼のあるヘリックスターンヘリックスDNA結合ドメインと、タンパク質間相互作用に関与する鋭い(SAM)ドメインとを含む。このファミリー間の高い相同性は、このタンパク質ファミリーの特定のメンバーに対する抗体を生じさせるための大きな障害となる。
【0008】
ポリクローナルERG抗体は市販されているが、これらの抗体は内因性レベルのERGタンパク質に対する低い親和性を示し、例えば、免疫組織化学試験においてその有用性を限定する高レベルの非特異的染色を示す。そのようなものとして、市販のポリクローナルERG抗体は、臨床設定(例えば、組織生検)においてERGタンパク質を検出するのに好適ではない。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Petrovics, G. et al., (2005). Oncogene 24, 3847-3852.
【非特許文献2】Tomlins, S.A. et al. (2005). Science 310, 644-647.
【非特許文献3】Kumar-Sinha, C. et al. (2008). Nat Rev Cancer 8, 497-511.
【非特許文献4】Klezovitch, O. et al. (2008). Proc Natl Acad Sci U S A 105, 2105-2110.
【非特許文献5】Tomlins, S.A. et al. (2008). Neoplasia 10, 177-188.
【非特許文献6】Sun, C. et al. (2008). Oncogene 27, 5348-5353.
【非特許文献7】Wang et al. Cancer Res. (2008). 68, 8516-24.
【非特許文献8】Han, B. et al., (2008) Cancer Res 68, 7629-7637.
【非特許文献9】Attard, G. et al. (2008). Oncogene 27, 253-263.
【非特許文献10】FitzGerald, L.M. et al. (2008). BMC Cancer 8, 230.
【非特許文献11】Mehra, R. et al. (2008). Cancer Res 68, 3584-3590.
【非特許文献12】Egevad, L. (2008). Anal Quant Cytol Histol 30, 190-198.
【非特許文献13】Mostofi, F.K. et al. (1992). Cancer 70, 235-253.
【非特許文献14】Mostofi, F.K. et al. (1993). Cancer 71, 906-932.
【非特許文献15】Luo, J. et al. (2002). Cancer Res 62, 2220-2226.
【非特許文献16】Rubin, M.A. et al. (2002). JAMA 287, 1662-1670.
【非特許文献17】Beach, R. et al. (2002). Am J Surg Pathol 26, 1588-1596.
【非特許文献18】Gupta, A. et al. (2004). Am J Surg Pathol 28, 1224-1229.
【非特許文献19】Jiang, Z. et al. (2001). Am J Surg Pathol 25, 1397-1404.
【非特許文献20】Yang, X.J. et al. (2002). Am J Surg Pathol 26, 921-925.
【非特許文献21】Furusato, B. et al. (2008). Mod Pathol 21, 67-75.
【非特許文献22】Saramaki, O.R. et al. (2008). Clin Cancer Res 14, 3395-3400.
【非特許文献23】Rainis, L. et al. (2005). Cancer Res 65, 7596-7602.
【非特許文献24】Shim et al. (2003). J. Neural Trans. Suppl. 67:39-49.
【非特許文献25】Ng, A.P. et al. (2010). Trisomy of Erg is required for myeloproliferatioon in mouse model of Down syndrome Blood, in press.
【非特許文献26】Owczarek, C.M. et al. (2004). Gene 324, 65-77.
【非特許文献27】Rao, V.N. et al. (1987a). Science 237, 635-639.
【非特許文献28】Rao, V.N. et al. (1987b). Oncogene Res 2, 95-101.
【非特許文献29】Reddy, E.S. et al. Proc Natl Acad Sci U S A 84, 6131-6135.
【非特許文献30】Turner, D.P. and Watson, D.K. (2008). Expert Rev Anticancer Ther 8, 33-42.
【発明の概要】
【0010】
本開示は、ヒトERGに結合し、例えば、前立腺癌などの、ERG融合事象および/またはERG過剰発現と関連する癌を検出および治療する方法において用いることができる抗体を提供する。この抗体は、非特異的染色をほとんど示さずに、ヒトERGに対する高い親和性を示し、かくして、組織生検、血液および尿などの臨床設定においてERGタンパク質を検出するのに好適である。
【0011】
一実施形態は、ヒトERGに結合し、より具体的には、ヒトERG3(配列番号1)のアミノ酸残基42〜66に対応し、以後「ERG 42-66エピトープ」と呼ばれる、以下のポリペプチド配列:GQTSKMSPRVPQQDWLSQPPARVTIにより形成されるエピトープに結合するモノクローナル抗体に関する。別の実施形態においては、前記抗体は、ヒトERG3(配列番号1)への抗体の結合が、ヒトERG3のアミノ酸残基42〜66に対応するポリペプチドにより競合的に阻害される、ヒトERGに結合するモノクローナル抗体である。
【0012】
一実施形態においては、前記抗体は、ハイブリドーマクローン9FYにより産生されるモノクローナル抗体(「9FY抗体」)である。別の実施形態においては、前記抗体は、ERG 42-66エピトープに結合し、ヒトERG3への9FY抗体の結合を競合的に阻害するモノクローナル抗体である。
【0013】
他の実施形態においては、前記モノクローナル抗体は、ヒト化抗体、キメラ化抗体、または完全ヒト抗体である。一態様においては、前記モノクローナル抗体は、ヒト抗体の軽鎖および重鎖可変領域のフレームワーク(FR)領域に連結された、ならびに必要に応じて、ヒト抗体の軽鎖および重鎖定常領域に連結された、ERG 42-66エピトープに結合する非ヒトERG抗体の軽鎖および重鎖可変領域の相補性決定領域(CDR)を含む。一実施形態においては、前記モノクローナル抗体は、ERG 42-66エピトープに結合し、配列番号2の3個のCDRを含む軽鎖可変ドメインと、配列番号3の3個のCDRを含む重鎖可変ドメインとを含む。このヒト化抗体は、親抗体のERG抗原特異性を保持するが、ヒト被験者における免疫原性は低い。
【0014】
別の態様においては、前記抗体はキメラモノクローナル抗体である。このキメラ抗体は、必要に応じて、ヒト抗体の軽鎖および重鎖定常領域に連結された、ERG 42-66エピトープに結合する非ヒトERG抗体の軽鎖および重鎖可変領域を含む。このキメラ抗体は、親抗体のERG抗原特異性を保持するが、ヒト被験者における免疫原性は低い。一実施形態においては、前記モノクローナル抗体は、ERG3 42-66エピトープに結合し、配列番号2のアミノ酸配列を含む軽鎖可変ドメインと、配列番号3のアミノ酸配列を含む重鎖可変ドメインとを含む。
【0015】
また、ERG 42-66エピトープに結合する完全ヒトERG抗体も意図される。
【0016】
ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を、様々な研究および医学的用途において用いることができる。例えば、本開示は、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体のいずれか1つを含む組成物ならびに例えば、前立腺癌、ユーイング肉腫、急性骨髄性白血病、巨核芽球性白血病、内皮細胞癌、および急性Tリンパ芽球性白血病などの、ERG融合事象またはERG過剰発現と関連する癌または病理学的症状を検出または治療するためのその使用を提供する。また、ERG42-66エピトープに結合するモノクローナル抗体を用いて、生物学的サンプル中で、ヒトERGまたはTMPRSS2/ERG融合転写物によりコードされるERGタンパク質などのヒトERGポリペプチドの全部もしくは一部を含む融合タンパク質を検出することもできる。
【0017】
別の態様は、ERG 42-66ポリペプチドを含む組成物に関する。一実施形態においては、前記組成物はさらに、ERG 42-66ポリペプチドに結合した、アジュバントおよび/またはKLHなどのハプテンを含む。これらの組成物を、例えば、抗体の製造方法において用いることができる。一実施形態においては、前記方法は、前記組成物を、限定されるものではないが、マウスまたはウサギなどの非ヒト動物に投与することを含む。この方法はさらに、非ヒト動物からB細胞を単離し、そのB細胞を不死化して、モノクローナル抗体を産生することができる細胞系を作製し、ERG 42-66エピトープに結合するモノクローナル抗体を選択することを含む。
【0018】
さらなる態様においては、本発明は、例えば、9FY抗体などの、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体の軽鎖および/または重鎖可変領域の1個以上のCDRのアミノ酸配列をコードする核酸配列を含む単離されたポリヌクレオチドを提供する。同様に、本発明は、例えば、9FY抗体などの、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体の軽鎖および/または重鎖可変領域のアミノ酸配列をコードするDNA配列を含む単離されたポリヌクレオチドを提供する。
【図面の簡単な説明】
【0019】
本明細書に組込まれ、その一部を構成する添付の図面は、特定の実施形態を例示するものであり、発明の詳細な説明と共に、本明細書に開示された抗体の特定の原理および方法を説明するのに役立つ。
【図1】図1Aは、9FY抗体が、合成アンドロゲンホルモン(R1881)処理に応答して発現された、TMPRSS2/ERG3融合物を担持するVCaP細胞の免疫ブロットにおいて、TMPRSS2/ERG3融合転写物(50〜52 kDa)によりコードされる内因性ERGタンパク質を検出することを示す(レーン4〜6)。9FY抗体は、TMPRSS2/ERG融合タンパク質を担持しないLNCaP細胞に対しては免疫反応性を示さない(レーン1〜3)。下のパネルに、プロステイン(SLC45A3)およびPSA(KLK3)のホルモン用量依存的発現を示す。図1Bは、ERG siRNAが、R1881処理されたVCaP細胞においてERG発現を阻害することを示す。
【図2】図2Aは、9FY抗体が、ELISAアッセイにおいて免疫化ポリペプチドを認識することを示す。様々な濃度の免疫化ポリペプチドと2種の対照ポリペプチドを、ELISAのウェルに塗布し、9FY抗体の1:10,000希釈液で精査した。Y軸は、450 nmでの吸光度の値を示す。X軸上に、ERG免疫化ポリペプチドと対照ポリペプチドのlog10濃度をng/mlで示す。図2Bは、免疫化ポリペプチドが、9FY抗体結合に関してERG3タンパク質と競合することを示す。サンドイッチELISAアッセイにおいて、ERG3タンパク質溶解物を、多ウェル形式のプレートに塗布し、免疫化ポリペプチドの存在下(白色のバー)および非存在下(影付きのバー)で様々な濃度の9FY抗体を用いてアッセイした。希釈倍率をX軸上に示す。抗体力価を影付きのバーにより示す。
【図3】図3は、9FY抗体が、in vivoクロマチン免疫沈降アッセイ(ChIP)により示されるようにゲノム標的部位に由来するERGタンパク質を認識し、免疫沈降することを示す。R1881処理されたVCaP細胞を、ERG siRNA(si)によりノックダウンERGに、または対照非標的化(NT)siRNAによりトランスフェクトした。細胞をChIPアッセイのために処理し、9FY抗体を用いることによりクロマチンを免疫沈降させた。対照(NT)トランスフェクト細胞においては、ERGタンパク質はHPGDH、C-MYC、KLK3(PSA)およびSLC45A3(プロステイン)ゲノム標的配列に動員される。ERGノックダウンは、ゲノム標的部位へのERGの動員を強力に減少させる。入力ゲノムDNAアンプリコンを、ChIPアッセイのための対照として用いた。
【図4−1】図4は、9FY抗体が、免疫蛍光(IF)アッセイにおいて内因性ERGタンパク質を特異的に認識することを示す。ERGを、一次9FY抗体、次いで、ヤギ抗マウスALEXA FLUOR(登録商標)594(Invitrogen, Carlsbad, CA)二次抗体(赤色)により染色する。ERGにより負に制御されるアンドロゲン誘導性PSAを、一次ウサギポリクローナル抗PSA、次いで、ヤギ抗ウサギALEXA FLUOR(登録商標)488(Invitrogen, Carlsbad, CA)二次抗体(緑色)により染色する。DNAをDAPI(青色)により染色する。右欄の融合した画像は、ERGの核局在化を示す。図4Aは、ERG siRNAを用いるERGのノックダウンが、R1881処理されたVCaP細胞からERGおよび核9FY抗体染色を消失させることを示す。細胞質PSA発現は、VCaP細胞のホルモン誘導と一致している。図4Bは、免疫化ポリペプチド(競合ペプチド)が、9FY抗体によるERG染色を消失させることを示す。対照的に、対照ポリペプチド(非競合ペプチド)は9FY抗体染色に影響しない。図4Cは、9FY抗体がTMPRSS2/ERG融合物を担持するVCaP細胞においてはアンドロゲンホルモン(R1881)に応答するERG発現の強い活性化を検出するが、内因性ERGを発現しないLNCaP細胞においては検出しないことを示す。
【図4−2】図4Dは、9FY抗体染色が、ERG siRNAによるERGノックダウンに応答してVCaP細胞中で減少することを示す。PSA発現は、PSAの発現に対するERGの負に調節する役割と一致するERGノックダウンに応答して増加する。9FY抗体は、3.7 mg/mlの9FY抗体保存溶液の1:5,000〜1:20,000倍希釈範囲でもERGを検出する。図4Eは、9FY抗体の非存在下および二次抗体の存在下でのIFアッセイの実施が、バックグラウンド染色をもたらさないことを示す。
【図5−1】図5は、9FY抗体が、免疫組織化学分析(IHC)によりアッセイされたホルマリン固定パラフィン包埋(FFPE)ヒト前立腺全摘出術標本において前立腺腫瘍の上皮細胞を特異的に染色することを示す。図5Aは、9FY抗体で染色された前立腺切片の代表的な視野を示す。前立腺腫瘍上皮と良性上皮との優れた区別がIHCにおいて明らかである。前立腺間質の染色の欠如も明らかである。野生型ERGを発現する血管内皮は、9FY抗体により染色され、9FY抗体の適切な機能のための優れた内部参照を提供する。
【図5−2】図5Bは、FFPE切片と9FY抗体による前立腺腫瘍上皮の明確な染色の高倍率視野を示す。
【図5−3】図5Cは、ホルマリン固定パラフィン包埋(FFPE)ヒト前立腺全摘出術標本の切片上の9FY抗体によるERG染色のパノラマ視野を示す。
【図5−4】図5Dは、切片の対応するヘマトキシリンおよびエオシン染色を示す。
【図6】図6は、内因的に発現されるERGタンパク質が、免疫ブロットアッセイを用いることにより、結腸癌(COLO320)、急性骨髄性白血病(KG1)、およびヒト急性Tリンパ芽球性白血病(MOLT4)由来細胞系において9FY抗体によって検出されることを示す。
【図7】図7は、9FY抗体は、免疫ブロットにおいてTMPRSS2/ERG融合転写物によりコードされる外因的に過剰発現されたERGタンパク質を特異的に検出するが、市販のポリクローナル抗体は、同じ細胞溶解物中の複数のタンパク質を検出することを示す。空のベクターでトランスフェクトされた20μgの対照HEK293細胞溶解物を、レーン1、4および7にロードした;pIRES-TMPRSS2-ERG3でトランスフェクトされたHEK293細胞に由来する4μgおよび20μgの溶解物を、それぞれ、レーン2、5および8、ならびにレーン3、6および9にロードした。
【図8】図8Aは、ポリクローナルH95(sc-28680)抗体がLNCaPおよびVCaP細胞溶解物において複数の非特異的バンドを検出することを示す。LNCaPおよびVCaP細胞を、合成アンドロゲンホルモン(R1881)を用いて(レーン2、3、5および6)または用いずに(レーン1および4)処理した。図8Bは、ERG siRNAおよび/または非標的化(NT)RNAで処理したVCaP細胞中での未知のタンパク質へのH95抗体の非特異的結合を示す。ERG siRNAの非存在下では、H95抗体はERG発現を検出しないようである。さらに、H95抗体の場合、ERG siRNAによるERG発現の阻害を観察することができない。
【図9−1】図9AおよびBは、市販のC-20ポリクローナル抗体(sc-353)が、IFアッセイにおいて核ERGタンパク質だけでなく、非特異的細胞質タンパク質も認識することを示す。
【図9−2】図9AおよびBは、市販のC-20ポリクローナル抗体(sc-353)が、IFアッセイにおいて核ERGタンパク質だけでなく、非特異的細胞質タンパク質も認識することを示す。
【図10】図10は、市販のH95ポリクローナル抗体(sc-28680)が、IFアッセイにおいてVCaPおよびLNCaP細胞の両方において非特異的核染色および細胞質染色を示すことを示す。
【図11】図11は、市販のR20ポリクローナル抗体(sc-18136)が、IFアッセイにおいてVCaPおよびLNCaP細胞の両方において非特異的核染色および細胞質染色を示すことを示す。
【図12】図12は、9FY抗体(ERG-MAb)と市販のH95ポリクローナル抗体(sc-28680)との間のVCaP細胞中での競合的IFアッセイの結果を示す。
【図13】図13は、9FY抗体が、TMPRSS2-ERG融合物の共通のスプライス変異体によりコードされるERG癌タンパク質産物を検出することを示す。具体的には、9FY抗体は、TMPRSS2-ERG融合型A cDNA(レーン2および3)、野生型ERG3 cDNA(レーン4)ならびにTMPRSS2-ERG8融合型A cDNA(レーン5)によりコードされるERG癌タンパク質産物を認識した。
【図14】図14は、野生型およびERGトランスジェニックマウスから得られた前立腺組織における9FY抗体と市販のC20(sc 353)抗体(Santa Cruz Biotechnology, Inc, Santa Cruz, CA)との比較免疫組織化学分析の結果を示す。図14Aおよび14Cは、それぞれ、野生型およびERGトランスジェニック前立腺組織における9FY抗体染色を示す。実線矢印は前立腺を示し、破線矢印は内皮細胞を示す。図14Bおよび14Dは、それぞれ、野生型およびERGトランスジェニック前立腺組織における市販のC20(sc 353)抗体の染色パターンを示す。
【図15】図15は、分枝鎖DNAアッセイを用いることにより前立腺全摘出術で治療した35人の患者の前立腺腫瘍におけるERG癌タンパク質(IHC)およびTMPRSS2-ERG融合物mRNAの発現の略図を示す。全載FFPE前立腺標本に由来する連続組織スライドを、盲検様式で2つのアッセイに用いた。後方斜線型の三角形は陽性ERG癌タンパク質染色を表すが、前方斜線型の三角形はTMPRSS2-ERG融合物mRNAの検出を表す。中空の三角形は、ERG癌タンパク質を含まないか、または検出不可能なTMPRSS2-ERG融合転写物を含む標本を示す。
【発明を実施するための形態】
【0020】
発明の詳細な説明
ここで、様々な例示的実施形態(その例は添付の図面に例示される)を詳細に参照する。以下の詳細な説明は、本発明の特定の実施形態、特徴、および態様の詳細のより完全な理解を読者に与えるために提供されるものであり、本発明の範囲の限定として解釈されるべきではない。
【0021】
1. 定義
本発明をより容易に理解するために、特定の用語を最初に定義する。追加の定義は詳細な説明を通して説明される。
【0022】
本開示で用いられる用語「抗体」とは、免疫グロブリンまたはその抗原結合フラグメントを指す。この用語は、限定されるものではないが、ポリクローナル抗体、モノクローナル抗体、一特異的抗体、多特異的抗体、非特異的抗体、ヒト化抗体、ヒト抗体、一本鎖抗体、キメラ抗体、合成抗体、組換え抗体、ハイブリッド抗体、突然変異抗体、移植抗体、およびin vitroで生成された抗体を含む。抗体は、定常領域、またはκ、λ、α、γ、δ、εおよびμ定常領域遺伝子などのその一部を含んでもよい。例えば、IgG1、IgG2、IgG3、IgG4、IgM、IgA1、IgA2、IgDおよびIgEなどの様々なアイソタイプの重鎖定常領域を用いることができる。例えば、軽鎖定常領域はκまたはλであってよい。
【0023】
用語「抗原結合ドメイン」および「抗原結合フラグメント」とは、抗体と抗原との特異的結合を担うアミノ酸を含む抗体分子の一部を指す。特定の抗原について、抗原結合ドメインまたは抗原結合フラグメントは、その抗原の一部にのみ結合することができる。抗体により特異的に認識され、結合する抗原の部分を、「エピトープ」または「抗原決定基」と呼ぶ。抗原結合ドメインおよび抗原結合フラグメントとしては、Fab(フラグメント抗原結合);F(ab')2フラグメント、ヒンジ領域でジスルフィド架橋により連結された2個のFabフラグメントを有する二価フラグメント;Fvフラグメント;一本鎖Fvフラグメント(scFv)(例えば、Birdら(1988)Science 242:423-426;およびHustonら(1988)Proc. Natl. Acad. Sci. USA 85:5879-5883を参照されたい);2個のVHおよびCH1ドメインを有するFdフラグメント;dAb(Wardら(1989)Nature 341:544-546)、ならびに抗原結合機能を保持する他の抗体フラグメントが挙げられる。Fabフラグメントは、定常領域間でジスルフィド結合により共有結合したVH-CH1およびVL-CLドメインを有する。Fvフラグメントはより小さく、非共有結合したVHおよびVLドメインを有する。非共有結合したドメインが解離する傾向を克服するために、scFvを構築することができる。scFvは、(1)VLのN末端にVHのC末端を連結するか、または(2)VHのN末端にVLのC末端を連結する可撓性ポリペプチドを含む。15マーの(Gly4Ser)3ペプチドをリンカーとして用いてもよいが、他のリンカーも当業界で公知である。これらの抗体フラグメントを、当業者には公知の従来の技術を用いて取得し、このフラグメントを無傷の抗体と同じ様式でその機能について評価する。
【0024】
用語「有効量」とは、ERGまたはTMPRSS2/ERG融合転写物によりコードされるERGタンパク質などのヒトERGポリペプチドの全部もしくは一部を含む融合タンパク質の活性を低下させ、患者における症候の改善をもたらすか、または所望の生物学的結果を達成するのに十分である用量または量を指す。例えば、前立腺癌については、所望の生物学的結果は、腫瘍サイズの低下、Gleasonスコアの減少、および/または腫瘍分化の増加を含んでもよい。
【0025】
用語「TMPRSS2/ERG融合転写物によりコードされるERGタンパク質」とは、TMPRSS2遺伝子プロモーターとヒトERG転写物との融合事象により生成される転写物によりコードされる、ERG3などのトランケートされたERGタンパク質を指す。
【0026】
用語「融合タンパク質」とは、2個のヌクレオチド配列間の融合事象から生成される転写物から翻訳されるタンパク質を指す。ヌクレオチド配列の一方は非コード配列(例えば、TMPRSS2、SLC45A3、またはNDRG1配列)であってよいが、他方のヌクレオチド配列はコード配列(例えば、ERG)の全部または一部である。あるいは、2個のヌクレオチド配列は両方ともコード配列であってもよい。
【0027】
用語「ヒト抗体」は、例えば、参照によりその全体が本明細書に組入れられるものとする、Kabatら(Kabatら(1991) Sequences of Proteins of Immunological Interest、第5版、米国保険社会福祉省、NIH刊行物番号91-3242を参照)により記載されたものなどの、当業界で公知のヒト生殖細胞免疫グロブリン配列と実質的に一致する可変および定常領域を有する抗体を含む。ヒト抗体は、例えば、CDR、特に、CDR3中に、ヒト生殖細胞免疫グロブリン配列によりコードされないアミノ酸残基(例えば、in vitroでの無作為もしくは部位特異的突然変異誘発によるか、またはin vivoでの体細胞突然変異により導入される突然変異)を含んでもよい。ヒト抗体は、少なくとも1、2、3、4、5個以上の位置がヒト生殖細胞免疫グロブリン配列によりコードされないアミノ酸残基で置換されてもよい。
【0028】
用語「治療」または「治療すること」などは、哺乳動物、例えば、特に、ヒトまたはマウスにおける任意の疾患または症状の任意の治療を指し、疾患、症状、または疾患もしくは症状の症候を阻害すること、例えば、患者におけるその発達を停止させること、および/もしくはその開始もしくは発現を遅延させること、または疾患、症状、または疾患もしくは症状の症候を軽減すること、例えば、症状または疾患および/もしくはその症候の回帰を引き起こすことを含む。
【0029】
用語「被験体」、「宿主」、「患者」および「個体」は、本明細書では互換的に用いられ、診断または療法が望まれる任意の哺乳動物被験体、特に、ヒトを指す。
【0030】
用語「製薬上許容し得る担体」または「製薬上許容し得る賦形剤」は、医薬投与と適合する、溶媒、分散媒体、コーティング、抗微生物剤および抗菌剤、等張剤、ならびに吸収遅延剤などを意味する。製薬上活性物質のためのそのような媒体および薬剤の使用は、当業界でよく知られている。
【0031】
抗体の文脈で用いられる場合、用語「単離された」とは、その天然の環境を実質的に含まない抗体を指す。例えば、単離されたタンパク質は、それが誘導された細胞もしくは組織起源に由来する細胞材料または他のタンパク質を実質的に含まない。この用語はまた、単離されたタンパク質が医薬組成物のために十分に純粋であるか、または少なくとも70〜80%(w/w)純粋であるか;または少なくとも80〜90%(w/w)純粋であるか;または少なくとも90〜95%純粋であるか;または少なくとも95%、96%、97%、98%、99%、もしくは100%(w/w)純粋である調製物を指す。
【0032】
用語「9FY抗体」は、2008年9月17日以来、Center for Prostate Disease Research in Rockville, Marylandの研究室で連続細胞培養継代を介して維持されている9FYという名称のハイブリドーマクローンにより産生されるモノクローナル抗体である。9FYハイブリドーマクローンのアリコートもCenter for Prostate Disease Researchで標識、凍結、および保存されている。
【0033】
用語「ERG 42-66エピトープ」とは、配列番号1のアミノ酸残基42〜66により形成される立体配座エピトープまたは直線エピトープを指す。
【0034】
用語「ERG 42-66ポリペプチド」とは、配列番号1のアミノ酸残基42〜66を含む、60個以下のアミノ酸残基を有するポリペプチドを指す。特定の実施形態においては、ERG 42-66ポリペプチドは、50、40、30、または25個以下のアミノ酸残基を有する。
【0035】
用語「ヒトERG3」とは、受託番号NP_891548;VERSION NP_891548.1 GI:33667107のアミノ酸配列を有するポリペプチドを指す。
【0036】

(配列番号1)。
【0037】
2. 抗ERG抗体
上記で考察されたように、ERGはETSファミリーの転写因子に属する癌原遺伝子である。ETSファミリーのタンパク質のメンバー間は相同性の程度が高いため、このファミリーの特定のメンバーに対する抗体を生成することはいまだ課題である。さらに、現在まで、ERGに対するポリクローナル抗体は、有意な非特異的結合を保持し、ERGまたは前立腺癌において同定されているTMPRSS2/ERG、SLC45A3/ERG、もしくはNDRG1/ERG融合転写物によりコードされるERGポリペプチドなどの、ERGポリペプチドの全部もしくは一部を含む融合タンパク質を発現する癌細胞または組織の検出に役立つ臨床設定(例えば、IHC)においてそのような抗体を使用するのを妨げている。
【0038】
本開示は、ヒトERGに結合する抗体を提供する。より具体的には、前記抗体はERG 42-66エピトープに結合する。ヒトERG3のアミノ酸42-66は、ERG座のエクソン8に位置するヌクレオチド配列によりコードされる(Owczarekら、2004)。エクソン8は、ERG2、ERG3、ERG4、ERG5(部分的エクソン)、ERG7およびERG8に認められるが、ERG1には認められない(Owczarekら、2004)。かくして、本明細書に開示される抗体はERG1タンパク質と交叉反応しない。
【0039】
免疫グロブリンとしても知られる抗体は、典型的には、それぞれ約25 kDaの2個の軽鎖(L)とそれぞれ約50 kDaの2個の重鎖(H)から構成されるテトラマー糖鎖タンパク質である。λおよびκと呼ばれる、2つの型の軽鎖が抗体中に認められる。重鎖の定常ドメインのアミノ酸配列に応じて、免疫グロブリンを5つの主要なクラス:A、D、E、GおよびMに割り当て、これらのうちのいくつかをサブクラス(アイソタイプ)、例えば、IgG1、IgG2、IgG3、IgG4、IgA1、およびIgA2にさらに分割することができる。各軽鎖は、N末端可変(V)ドメイン(VL)と定常(C)ドメイン(CL)を含む。各重鎖は、N末端Vドメイン(VH)、3個または4個のCドメイン(CH)、およびヒンジ領域を含む。VHに最も近いCHドメインをCH1と呼ぶ。VHおよびVLドメインは、フレームワーク領域(FR1、FR2、FR3およびFR4)と呼ばれる比較的保存された配列の4個の領域からなり、超可変配列の3個の領域(相補性決定領域、CDR)のための足場を形成する。CDRは、抗体と抗原との特異的相互作用を担う多くの残基を含む。CDRをCDR1、CDR2およびCDR3と呼ぶ。従って、重鎖上のCDR構成要素を、H1、H2およびH3と呼ぶが、軽鎖上のCDR構成要素をL1、L2およびL3と呼ぶ。フレームワークおよびCDR残基の同定および番号付けは、Chothiaら、Structural determinants in the sequences of immunoglobulin variable domain, J Mol Biol 1998, 278:457-79(その全体が参照により本明細書に組入れられるものとする)により記載された通りである。
【0040】
典型的には、CDR3は抗体結合部位内の分子多様性の最も大きい起源である。例えば、H3は、2個のアミノ酸残基と同じぐらい短いか、または26アミノ酸より大きい。様々なクラスの免疫グロブリンのサブユニット構造および三次元配置が当業界でよく知られている。抗体構造の概説については、Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory、Harlowら(編)、1988を参照されたい。当業者であれば、それぞれのサブユニット構造、例えば、CH、VH、CL、VL、CDR、FR構造が、活性フラグメント、例えば、抗原に結合するVH、VLもしくはCDRサブユニットの一部、すなわち、抗原結合フラグメント、または、例えば、Fc受容体および/もしくは補体に結合し、および/もしくはそれを活性化するCHサブユニットの一部を含むことを認識するであろう。CDRは、典型的には、Sequences of Proteins of Immunological Interest、米国保険社会福祉省(1991)、Kabat(編)に記載のKabat CDRを指す。抗原結合部位を特性評価するための別の標準は、Chothiaにより記載された超可変ループを参照することである。例えば、Chothia, D.ら(1992) J. Mol. Biol. 227:799-817; およびTomlinsonら(1995) EMBO J. 14:4628-4638を参照されたい。さらに別の標準は、Oxford Molecular's AbM抗体モデリングソフトウェアにより用いられるAbM定義である。一般的には、例えば、Protein Sequence and Structure Analysis of Antibody Variable Domains. In: Antibody Engineering Lab Manual (編: Duebel, S.およびKontermann, R., Springer-Verlag, Heidelberg)を参照されたい。あるいは、Kabat CDRに関して記載される実施形態を、Chothiaの超可変ループまたはAbMに定義されるループに関する類似する記載された関係を用いて実施することができる。
【0041】
一実施形態においては、前記抗体は、ERG 42-66エピトープに結合し、ハイブリドーマクローン9FYにより産生されるモノクローナル抗体(「9FY抗体」)である。9FY抗体の軽鎖可変ドメインは、配列番号2のアミノ酸配列を含む。9FY抗体の軽鎖可変ドメインのCDR1、CDR2およびCDR3のアミノ酸配列は、それぞれ、SSVYY (配列番号4)、YTS、およびLQFSTSPWT (配列番号5)に対応する。9FY抗体の重鎖可変ドメインは、配列番号3のアミノ酸配列を含む。9FY抗体の重鎖可変ドメインのCDR1、CDR2およびCDR3のアミノ酸配列は、それぞれ、GYTFTNYG (配列番号6)、IDTYTGEP (配列番号7)、およびVRKRAYDYEIY (配列番号8)に対応する。
【0042】
別の実施形態においては、前記抗体は、ERG 42-66エピトープに結合し、ヒトERG3への9FY抗体の結合を競合的に阻害するモノクローナル抗体である。さらに別の実施形態においては、前記抗体は、ERG 42-66エピトープに結合し、ヒトERG3への、配列番号2のアミノ酸配列を含む可変軽鎖および配列番号3のアミノ酸配列を含む可変重鎖を有する抗体の結合を競合的に阻害するモノクローナル抗体である。前記抗体が、ヒトERG3などの、タンパク質への抗体の結合を競合的に阻害するかどうかを、例えば、本出願の実施例に記載の方法などの当業界で日常的な方法を用いて評価することができる。
【0043】
CDR配列または重鎖もしくは軽鎖可変ドメインが9FY抗体のものと実質的にのみ異なる抗体も意図される。典型的には、アミノ酸を、類似する電荷特性、疎水性、または立体化学的特性を有する関連アミノ酸により置換する。そのような置換は、当業者の通常の技術の範囲内にあるであろう。CDRと違って、抗体の結合特性に有害に影響することなく、FRにおいてより実質的な変化を作ることができる。
【0044】
特定の実施形態においては、モノクローナル抗体は、ERG 42-66エピトープに結合し、9FY抗体の重鎖可変ドメインのアミノ酸配列と少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%もしくは少なくとも約98%同一である重鎖、ならびに9FY抗体の軽鎖可変ドメインのアミノ酸配列と少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%もしくは少なくとも約98%同一である軽鎖を含む。他の実施形態においては、モノクローナル抗体はERG 42-66エピトープに結合し、9FY抗体の重鎖および軽鎖配列の6個のCDR(H1、H2、H3、L1、L2およびL3)と少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%もしくは少なくとも約98%同一である6個のCDR(H1、H2、H3、L1、L2およびL3)を有する。一実施形態においては、前記モノクローナル抗体はERG 42-66エピトープに結合し、CDR配列中の1個、最大2個、最大3個、最大4個、最大5個、最大6個、最大7個、および特定の場合、最大10個のアミノ酸置換を除いて、配列番号2と同一の軽鎖可変ドメインを含む。別の実施形態においては、前記モノクローナル抗体はERG 42-66エピトープに結合し、CDR配列中の1個、最大2個、最大3個、最大4個、最大5個、最大6個、最大7個、および特定の場合、最大10個のアミノ酸置換を除いて、配列番号3と同一の重鎖可変ドメインを含む。当業者であれば、CDR中で置換することができる特定のアミノ酸位置、ならびにこれらの位置に置換することができるドナーアミノ酸を、公開米国特許出願第2006/0099204号(その開示はその全体が参照により本明細書に組入れられるものとする)に開示されたものなどの公知の方法を用いて容易に決定することができる。
【0045】
特定の実施形態においては、前記モノクローナル抗体は、ERG 42-66エピトープに結合するヒト化抗体であり、(a)配列番号2のCDR1、CDR2およびCDR3配列を含む軽鎖可変ドメイン;(b)配列番号3のCDR1、CDR2およびCDR3配列を含む重鎖可変ドメイン;ならびに(c)ヒト抗体の軽鎖および重鎖可変領域のフレームワーク領域を含む。ヒト化抗体は必要に応じて、少なくとも1個のヒト抗体の軽鎖および重鎖定常領域をさらに含む。
【0046】
別の実施形態においては、前記モノクローナル抗体は、ERG 42-66エピトープに結合し、配列番号2のアミノ酸配列を含む軽鎖可変ドメインおよび配列番号3のアミノ酸配列を含む重鎖可変ドメインを含むキメラ抗体である。このキメラ抗体は必要に応じて、少なくとも1個のヒト抗体の軽鎖および重鎖定常領域をさらに含む。別の実施形態においては、前記モノクローナル抗体はERG 42-66エピトープに結合するヒト抗体である。
【0047】
特定の実施形態においては、ERG 42-66エピトープに結合するモノクローナル抗体は、約280 nM以下の解離定数(KD)を有する。他の実施形態においては、ERG 42-66エピトープに結合するモノクローナル抗体は、99%を超える特異性でERGを発現する癌腫を検出する。他の実施形態においては、ERG 42-66エピトープに結合するモノクローナル抗体は、ヒトFli1タンパク質と交叉反応しない。例えば、ウェスタンブロットなどの当業界で日常的な方法を用いて、交叉反応性を測定することができる。
【0048】
必要に応じて、ERG 42-66エピトープに結合する本開示に提供される抗体を単離する。
【0049】
本発明の抗体を改変して、例えば、前記アンタゴニストの抗原依存的細胞媒介性細胞傷害性(ADCC)および/または補体依存的細胞傷害性(CDC)を増強するようにエフェクター機能を改善することも望ましい。Fc領域中の1個以上のアミノ酸置換またはシステインの導入を行うことによって、内部能力ならびに/または補体媒介性細胞傷害およびADCCの増加を改善することができる。Caronら、J. Ex. Med. 176:1191-1195 (1991)およびShopes, B.J. Immunol. 148:2918-2022 (1992)(その全体が参照により本明細書に組入れられるものとする)を参照されたい。補体溶解とADCC能力の両方が増強された二重Fc領域を有する抗体融合タンパク質を調製することができる。抗体(例えば、IgG抗体)のFc領域に結合する典型的なFc受容体としては、限定されるものではないが、FcγRI、FcγRIIおよびFcγRIIIの受容体ならびにこれらの受容体の対立遺伝子変異体および選択的スプライシング形態などのFcRnサブクラスが挙げられる。Fc受容体は、RavetchおよびKinet, Annu. Rev. Immunol 9:457-92, 1991; Capelら、Immunomethods 4:25-34,1994; ならびにde Haasら、J. Lab. Clin. Med. 126:330-41, 1995に概説されている。
【0050】
3. 核酸、クローニングおよび発現系
本開示はさらに、開示された抗体またはその一部をコードする単離された核酸を提供する。この核酸はDNAまたはRNAを含んでもよく、全体的または部分的に合成のものであっても、または組換え体であってもよい。本明細書に記載のヌクレオチド配列に対する参照は、本文が別途必要としない限り、特定された配列を有するDNA分子を包含し、UがTに置換された特定された配列を有するRNA分子を包含する。
【0051】
本明細書に提供される核酸は、9FY抗体の少なくとも1個のCDR(H1、H2、H3、L1、L2、および/もしくはL3)、VLドメイン(配列番号2)、および/またはVHドメイン(配列番号3)をコードする。
【0052】
本開示はまた、9FY抗体のCDR、VHドメイン、および/またはVLドメインをコードする少なくとも1個の核酸を含むプラスミド、ベクター、ファージミド、転写または発現カセットの形態の構築物を提供する。本開示はさらに、1個以上の上記構築物を含む宿主細胞を提供する。
【0053】
また、これらの核酸によりコードされるポリペプチドを作製する方法も提供する。この方法は、コード核酸からコードされたポリペプチドを発現させることを含む。好適な条件下で前記核酸を含む組換え宿主細胞を培養することにより、発現を達成することができる。発現による産生後、VHもしくはVLドメイン、または特異的結合メンバーを、任意の好適な技術を用いて単離および/または精製した後、必要に応じて用いることができる。
【0054】
様々な異なる宿主細胞中でのポリペプチドのクローニングおよび発現のための系が当業界でよく知られている。抗体を産生するのに好適な細胞については、Gene Expression Systems, Academic Press、Fernandezら(編)、1999を参照されたい。本発明と適合する任意のタンパク質発現系を用いて、開示された抗体を製造することができる。好適な発現系としては、Gene Expression Systems, Academic Press、Fernandezら(編)、1999に記載のトランスジェニック動物が挙げられる。
【0055】
好適なベクターが、プロモーター配列、ターミネーター配列、ポリアデニル化配列、エンハンサー配列、マーカー遺伝子および必要に応じて他の配列などの好適な調節配列を含むように、それらを選択または構築することができる。
【0056】
本開示のさらなる態様は、本明細書に開示された核酸を含む宿主細胞を提供する。さらなる態様は、そのような核酸を宿主細胞中に導入することを含む方法を提供する。この導入は、任意の好適な技術を用いることができる。真核細胞については、好適な技術としては、リン酸カルシウムトランスフェクション、DEAE-デキストラン、エレクトロポレーション、リポソーム媒介性トランスフェクションおよびレトロウイルスまたは他のウイルス、例えば、ワクシニアもしくは、昆虫細胞については、バキュロウイルスを用いる形質導入が挙げられる。細菌細胞については、好適な技術としては、塩化カルシウム形質転換、エレクトロポレーションおよびバクテリオファージを用いるトランスフェクションが挙げられる。細胞への核酸の導入の後、核酸からの発現を引き起こすか、または可能にし、例えば、遺伝子の発現のための条件下で宿主細胞を培養することができる。
【0057】
4. 抗体の作製方法
当業者には公知のいくつかの方法が、抗体またはその抗原結合フラグメントを取得するために利用可能である。例えば、抗体を、組換えDNA方法を用いて製造することができる。例えば、米国特許第4,816,567号, EPO 8430268.0; EPO 85102665.8; EPO 85305604.2; PCT/GB 85/00392; EPO 85115311.4; PCT/US86/002269; および日本国特許出願第85239543号(それらの開示はその全体が参照により本明細書に組入れられるものとする)を参照されたい。
【0058】
所望の特異性を有する抗体を産生することができる不死化細胞系を調製することにより、モノクローナル抗体を作製することもできる。そのような不死化細胞系を、様々な方法で作製することができる。適当に、マウスなどの小さい脊椎動物を、所望の免疫原で超免疫する。次いで、通常は最後の免疫の数日後に、この脊椎動物を犠牲にし、脾臓細胞を取り出し、その脾臓細胞を不死化する。最も一般的な技術は、KohlerおよびMilstein (1975) Nature 256:495-497により初めて記載されたような、ミエローマ細胞融合パートナーとの融合である。他の技術としては、EBV形質転換、裸のDNA、例えば、癌遺伝子、レトロウイルスなどを用いる形質転換、または細胞系の安定的な維持およびモノクローナル抗体の産生を提供する任意の他の方法が挙げられる。モノクローナル抗体を調製するための特定の技術は、Antibodies: A Laboratory Manual、HarlowおよびLane(編)、Cold Spring Harbor Laboratory、1988(その全開示は参照により本明細書に組入れられるものとする)に記載されている。
【0059】
酵素結合免疫吸着アッセイ(ELISA)および表面プラズモン共鳴(BIACORE(商標))分析などの標準的な方法を用いて不死化細胞系をスクリーニングして、特定抗原と特異的に結合する抗体を産生する1個以上のハイブリドーマを同定することができる。免疫原として、例えば、組換え抗原、その天然形態、任意の変異体もしくはフラグメント、ならびにその抗原性ペプチドなどの任意の形態の特定抗原を用いることができる。
【0060】
抗体を作製する1つの例示的方法として、タンパク質発現ライブラリー、例えば、ファージまたはリボソーム展示ライブラリーのスクリーニングが挙げられる。ファージディスプレイは、例えば、Ladnerら、米国特許第5,223,409号; Smith (1985) Science 228:1315-1317; Clacksonら(1991) Nature, 352: 624-628; Marksら(1991) J. Mol. Biol., 222: 581-597;WO 92/18619; WO 91/17271; WO 92/20791; WO 92/15679; WO 93/01288; WO 92/01047; WO 92/09690; およびWO 90/02809(それらの開示はその全体が参照により本明細書に組入れられるものとする)に記載されている。
【0061】
展示ライブラリーの使用に加えて、特定抗原を用いて、非ヒト動物、例えば、げっ歯類、例えば、マウス、ハムスター、またはラットを免疫することができる。一実施形態においては、非ヒト動物は、ヒト免疫グロブリン遺伝子の少なくとも一部を含む。例えば、ヒトIg遺伝子座の大きい断片を用いて、マウス抗体産生に欠けるマウス株を遺伝子操作することができる。ハイブリドーマ技術を用いて、所望の特異性を有する遺伝子に由来する抗原特異的モノクローナル抗体を製造および選択することができる。例えば、XENOMOUSE(商標)、Greenら(1994) Nature Genetics 7:13-21、US 2003-0070185、1996年10月31日に公開されたWO 96/34096および1996年4月29日に提出されたPCT出願番号第PCT/US96/05928号(それらの開示はその全体が参照により本明細書に組入れられるものとする)を参照されたい。
【0062】
別の実施形態においては、モノクローナル抗体を、非ヒト動物から取得した後、改変する。例えば、ヒト化、脱免疫化、およびキメラ抗体を、当業界で公知の組換えDNA技術を用いて製造することができる。キメラ抗体を作製するための様々な手法が記載されている。例えば、Morrisonら、Proc. Natl. Acad. Sci. U.S.A. 81:6851, 1985; Takedaら、Nature 314:452, 1985, Cabillyら、米国特許第4,816,567号; Bossら、米国特許第4,816,397号; Tanaguchiら、欧州特許公開第EP171496号; 欧州特許公開第0173494号、英国特許第GB 2177096B号(それらの開示はその全体が参照により本明細書に組入れられるものとする)を参照されたい。抗体のヒト化は、非ヒト抗体の結合部位をヒト抗体上に移植することを含む。非ヒトCDRをヒトフレームワークおよび必要に応じて、ヒト定常領域上に移植するか、または非ヒト可変ドメイン全体を移植するが、特定の露出した残基の置換によりそれらをヒト様表面で隠すことにより、これを行うことができる。ヒト化抗体の作製に関する詳細は、参照により本明細書に組入れられるものとする米国特許第5,472,693号に開示されている。
【0063】
例えば、ヒト重鎖および軽鎖遺伝子を発現するが、内因性マウス免疫グロブリン重鎖および軽鎖遺伝子を発現することができないトランスジェニックマウスを用いて、ヒト化抗体を製造することもできる。Winterは、本明細書に記載のヒト化抗体を調製するのに用いることができる例示的CDR移植方法を記載している(その開示全体が参照により本明細書に組入れられるものとする米国特許第5,225,539号)。特定のヒト抗体のCDRの全部を、非ヒトCDRの少なくとも一部と置換するか、またはCDRのいくらかのみを非ヒトCDRと置換することができる。所定の抗原へのヒト化抗体の結合にとって必要とされるいくつかのCDRを置換することが必要に過ぎない。
【0064】
抗原結合に直接関与しないFv可変ドメインの置換を、ヒトFv可変ドメインに由来する等価配列と置換することにより、ヒト化抗体またはそのフラグメントを作製することができる。ヒト化抗体またはそのフラグメントを作製するための例示的方法は、Morrison (1985) Science 229:1202-1207; Oiら(1986) BioTechniques 4:214; ならびに米国特許第5,585,089号; 第5,693,761号; 第5,693,762号; 第5,859,205号; および第6,407,213号(それらの開示はその全体が参照により本明細書に組入れられるものとする)により提供されている。これらの方法は、少なくとも1個の重鎖または軽鎖に由来する免疫グロブリンFv可変ドメインの全部または一部をコードする核酸配列を単離し、操作し、および発現させることを含む。そのような核酸を、上記のような所定の標的に対する抗体を産生するハイブリドーマから、ならびに他の起源から取得することができる。次いで、ヒト化抗体分子をコードする組換えDNAを、好適な発現ベクター中にクローニングすることができる。
【0065】
特定の実施形態においては、保存的置換、コンセンサス配列置換、生殖細胞置換および/または復帰変異(backmutation)の導入により、ヒト化抗体を最適化する。そのような変化した免疫グロブリン分子を、当業界で公知のいくつかの技術のいずれか(例えば、Tengら、Proc. Natl. Acad. Sci. U.S.A., 80: 7308-7312, 1983; Kozborら、Immunology Today, 4: 7279, 1983; OlssonらMeth. Enzymol., 92: 3-16, 1982(それらの開示はその全体が参照により本明細書に組入れられるものとする))により作製することができ、またPCT公開WO92/06193またはEP 0239400(それらの開示はその全体が参照により本明細書に組入れられるものとする)の教示に従って作製することができる。典型的には、保存的置換を作製する。専らではないが、しばしば、ヒト生殖細胞抗体配列中の位置に共通のアミノ酸を用いることができる。ヒト生殖細胞配列は、例えば、Tomlinsonら(1992) J. Mol. Biol. 227:776-798; Cook, G. P.ら(1995) Immunol. Today Vol. 16 (5): 237-242; Chothia, D.ら(1992) J. Mol. Biol. 227:799-817; およびTomlinsonら(1995) EMBO J. 14:4628-4638(それらの開示はその全体が参照により本明細書に組入れられるものとする)に開示されている。V BASEディレクトリは、ヒト免疫グロブリン可変領域配列の包括的ディレクトリを提供する(Tomlinson, I.A.らにより編集、MRC Centre for Protein Engineering, Cambridge, UK)。これらの配列を、例えば、フレームワーク領域およびCDRのためのヒト配列の起源として用いることができる。コンセンサスヒトフレームワーク領域を、例えば、米国特許第6,300,064号(その開示はその全体が参照により本明細書に組入れられるものとする)に記載のように用いることもできる。
【0066】
ファージディスプレイ技術などの当業界で公知の方法を用いて、ヒト抗体を作製することができる。ファージディスプレイ技術は、抗体遺伝子の大きいライブラリーをクローニングし、ERG 42-66エピトープなどの所望の標的への結合について選択することにより、哺乳動物免疫系を模倣するものである。ファージディスプレイ技術において用いられるライブラリーを、いくつかの起源から作製することができる。例えば、ワクチン接種または疾患を介して所望の抗原に曝露されたヒトから作製された免疫ライブラリーは、そのライブラリーが比較的小さい場合でも、抗原に対する高レベルの循環抗体を有する。別の例として、非免疫化個体から単離されたmRNAから作製されたナイーブなライブラリーを繰り返し用いて、様々な抗原に対する抗体を単離することができる。さらに別の例として、生殖細胞抗体遺伝子断片をクローニングし、in vitroで組合せ配置して完全なVHおよびVL鎖をコードする遺伝子を再構成させた合成ライブラリーは、自己抗原に対する特異性を有する抗体を産生する利点を有する。1種以上の抗体フレームワークを選択し、CDRループ内の配列を無作為化することにより、半合成ライブラリーを作製することもできる。
【0067】
ファージディスプレイ技術においては、一度ライブラリーを作製したら、それをファージの表面タンパク質、一般的にはpIIIに融合させる。パンニングとして知られるプロセスにおいて、目的の抗原に特異的な抗体を展示するファージを、固定化抗原上での選択的吸着により富化する。続いて、結合したファージを表面から溶離させ、大腸菌細胞の感染を介して増幅させることができる。
【0068】
ヒト抗体を作製するためのファージディスプレイ技術の他の改変も当業界で公知である。バクテリオファージの表面の代わりに、例えば、大腸菌およびサッカロミセス・セレビジア(Saccharomyces cerevisaie)などの微生物細胞の表面上に抗体を展示することができる。この場合、バッファー中で蛍光タグ付リガンドと共にインキュベートすることによりスクリーニングを実施することができる。蛍光標識されるようになるリガンドに結合する抗体を展示する細胞を、蛍光活性化細胞選別により単離する。リボソーム展示と呼ばれる別の改変は、リボソーム、mRNAおよびポリペプチドの間の三次複合体の形成に依存する。
【0069】
ヒト抗体を製造するための当業界で公知の別の方法は、トランスジェニックマウスを用いるものである。これらのマウス中の天然免疫グロブリンレパートリーは、マウス染色体中でヒトV遺伝子で置換されている。このマウスに所望の抗原を注入し、得られた抗体を、免疫ライブラリーをクローニングおよびスクリーニングすることによるか、または従来のハイブリドーマ技術により回収することができる。これらのマウスは、糖鎖パターンにおいてのみ異なる有意なレベルの完全ヒト抗体を産生する。
【0070】
本明細書に記載の抗ERG抗体を、別の機能的分子(別のペプチドまたはタンパク質(例えば、Fabフラグメント)など)に誘導体化するか、またはそれに連結することができる。例えば、特に、別の抗体(例えば、二特異的もしくは多特異的抗体)、毒素、放射性アイソトープ、細胞傷害剤もしくは細胞増殖抑制剤などの少なくとも1種の他の分子的実体に、前記抗体を機能的に連結することができる(例えば、化学的カップリング、遺伝子融合、非共有結合などによる)。
【0071】
5. 使用方法
ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を、様々な研究用途および医学的用途において用いることができる。一態様においては、本開示は、被験体における悪性腫瘍または疾患を治療するための方法であって、製薬上許容し得るビヒクル中で製剤化されたERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体の治療上有効量を前記被験体に投与することを含み、前記悪性腫瘍または疾患が、ERG融合事象(例えば、TMPRSS2、SLC45A3、もしくはNFRG1遺伝子プロモーター配列と、ERG遺伝子配列との融合、または第1の遺伝子配列と、ERG遺伝子配列との融合)および/またはERG過剰発現により引き起こされる、前記方法を提供する。一実施形態においては、前記悪性腫瘍または疾患は、前立腺癌、ユーイング肉腫、急性骨髄性白血病、急性Tリンパ芽球性白血病、巨核芽球性白血病、結腸癌、または内皮細胞癌などの内皮細胞の疾患である。別の実施形態においては、前記疾患は、アルツハイマー病またはダウン症候群である。
【0072】
さらに、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を用いて、生物学的サンプル中で、TMPRSS2/ERG、SLC45A3/ERG、またはNDRG1/ERG融合転写物によりコードされるERGタンパク質などの、ERGポリペプチドの全部または一部を含む融合タンパク質などのERGタンパク質を検出することができる。一実施形態においては、前記方法は、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を、生物学的サンプルと接触させ、該生物学的サンプルを分析して、該生物学的サンプル中でヒトERGまたは融合タンパク質への前記モノクローナル抗体の結合を検出することを含む。一実施形態においては、ERGポリペプチドはERG3である。別の実施形態においては、TMPRSS2/ERGまたはSLC45A3/ERG融合転写物によりコードされるERGタンパク質は、トランケートされたERG3タンパク質である。一実施形態においては、生物学的サンプルは、前立腺組織または前立腺細胞などの、組織または細胞を含む。他の実施形態においては、生物学的サンプルは、尿または血液などの生物学的液体を含み、生物学的液体は前立腺癌細胞などの癌細胞を含む。他の実施形態においては、生物学的液体は、血液、血清、尿、唾液、痰、または糞便である。
【0073】
別の実施形態においては、本開示は、患者における癌または疾患を検出するための方法であって、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を、患者から得られた生物学的サンプルと接触させ、該生物学的サンプルを分析することを含み、生物学的サンプル中での前記抗体の細胞への結合が、生物学的サンプル中での癌の存在を示唆する、前記方法を提供する。一実施形態においては、前記癌は、前立腺癌である。別の実施形態においては、前記癌は前立腺癌である。別の実施形態においては、前記癌は、ユーイング肉腫、急性骨髄性白血病、急性Tリンパ芽球性白血病、巨核芽球性白血病、結腸癌、または内皮細胞癌である。一実施形態においては、生物学的サンプルは、前立腺組織または前立腺細胞などの、組織または細胞を含む。他の実施形態においては、生物学的サンプルは、尿または血液などの生物学的液体を含み、生物学的液体は前立腺癌細胞などの癌細胞を含む。他の実施形態においては、生物学的液体は、血液、血清、尿、唾液、痰、または糞便である。一実施形態においては、前記癌または疾患は、ERG融合事象(例えば、TMPRSS2、SLC45A3、もしくはNDRG1遺伝子プロモーター配列と、ERG遺伝子配列との融合)および/またはERG過剰発現と関連する。血管または毛細血管での造血細胞または内皮細胞への抗体の結合は正常であり、典型的には、癌の存在を示唆しない。しかしながら、血管または毛細血管中の正常な造血細胞または正常な内皮細胞以外の任意の細胞中での、ERGポリペプチドの全部または一部を含む融合タンパク質などのERGタンパク質の検出は、サンプル中の癌の存在を示唆する。
【0074】
また、実施例に示されるように、本明細書に記載の抗ERG抗体を用いて、ERG陽性PINを検出することができる。ERG陽性前立腺上皮内新生物(PIN)を示す患者はまた、ERG陽性前立腺癌を有することがあるか、またはERG陽性前立腺癌を生じる危険性が高い。かくして、ERG陽性前立腺癌ではなく、ERG陽性PINが患者において検出された場合、その患者は追加の生検またはより頻繁な生検を受けて、該患者における前立腺癌の発達をモニターすべきである。従って、本明細書に記載の抗ERG抗体を用いて、追加の生検または将来より頻繁な生検を実施するかどうかに関する決定を通知することができる。
【0075】
さらに別の態様においては、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を用いて、治療計画の効果をモニターすることができる。かくして、一実施形態は、ホルモン除去をモニターする方法であって、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を、ホルモン除去療法を受けた患者から得られた生物学的サンプルと接触させ、該生物学的サンプル中でのヒトERGまたはヒトERGポリペプチドの全部もしくは一部を含む融合タンパク質の発現を測定することを含み、アンドロゲン除去療法後のERG発現の低下が、ホルモン除去療法が有効であり、生存時間の増加と相関することを示唆する、前記方法に関する。ホルモン除去療法後の患者におけるERG発現のレベルを、ホルモン除去療法を開始する前の同じ患者におけるERG発現のレベルと比較するか、または上昇したレベルのERG発現を示す標準化された対照値と比較することができる。
【0076】
また、プロモーター配列などの核酸配列、またはERGポリペプチドと相互作用するポリペプチドを同定するための方法も提供する。そのような方法により同定された核酸および/またはタンパク質は、ERGネットワークにおける新しい治療標的を規定することができる。一実施形態においては、前記方法は、核酸分子またはポリペプチドを含むサンプルをERGポリペプチドと共にインキュベートし、該サンプルとERGポリペプチドを、42-66 ERGエピトープに結合する抗体と共にインキュベートし、核酸分子とERGポリペプチドの間、またはポリペプチドとERGポリペプチドとの間で複合体が形成するかどうかを決定することを含み、抗体との複合体の形成の検出は、核酸分子またはポリペプチドがERGポリペプチドと相互作用することを示唆する。そのような方法を、例えば、免疫沈降アッセイなどの当業界で従来的である技術を用いて実行することができる。
【0077】
任意の好適な標識を、本明細書に記載の方法および組成物において用いることができる。標識は、分析物、分析物類似体、検出試薬、または分光測光的手段、光化学的手段、生化学的手段、免疫化学的手段、電気的手段、光学的手段もしくは化学的手段により検出可能である結合パートナー(例えば、抗体)に結合した任意の分子または組成物である。酵素、金コロイド粒子、着色ラテックス粒子などの標識の例が開示されている(米国特許第4,275,149号; 第4,313,734号; 第4,373,932号; および第4,954,452号(それぞれ参照により本明細書に組入れられるものとする))。有用な標識のさらなる例としては、限定されるものではないが、ハプテン(例えば、ビオチン、ジゴキシゲニン(DIG)、ジニトロフェノール(DNP)など)、放射性アイソトープ、コファクター、リガンド、化学発光剤もしくは蛍光剤、タンパク質吸着銀粒子、タンパク質吸着鉄粒子、タンパク質吸着銅粒子、タンパク質吸着セレン粒子、タンパク質吸着硫黄粒子、タンパク質吸着テルル粒子、タンパク質吸着炭素粒子、およびタンパク質結合染料サックが挙げられる。標識への化合物の結合は、キレートなどにおいてみられるような、共有結合、吸着プロセス、疎水結合および/もしくは静電結合、またはこれらの結合の組合せおよび相互作用などの任意の手段を介するものであってよく、ならびに/または連結基を含んでもよい。
【0078】
典型的には、ハプテンなどのいくつかの標識を、比色検出のための検出試薬と結合させる。例えば、ビオチンをストレプトアビジン-HRP化合物に結合し、DABを用いて比色検出することができる。当業者であれば、本発明の組成物および方法において有用な検出試薬として有用である多種多様な標識および検出オプションを理解できるであろう。
【0079】
いくつかの実施形態においては、抗体(例えば、モノクローナル抗体)などの分子を、検出可能な部分とのコンジュゲーションにより直接検出する。例えば、本明細書に記載のモノクローナル抗体を、蛍光化合物(フルオレセイン、フルオレセインイソチオシアネート(FITC)、ローダミン、5-ジメチルアミン-1-ナフタレンスルホニルクロリド、フィコエリトリン、ランタニド蛍光物質、ALEXA FLUOR(登録商標)(Invitrogen, Carlsbad, CA)染料、もしくはシアニンファミリーの染料(Cy-3もしくはCy-5など)など);生物発光化合物(ルシフェラーゼ、緑色蛍光タンパク質(GFP)、黄色蛍光タンパク質など);検出可能な反応生成物を産生する酵素(西洋ワサビペルオキシダーゼ、β-ガラクトシダーゼ、ルシフェラーゼ、アルカリホスファターゼ、もしくはグルコースオキシダーゼなど)、または放射性標識(3H、14C、15N、35S、90Y、99Tc、111In、125I、もしくは131I)などの検出可能な部分に直接コンジュゲートさせることができる。
【0080】
いくつかの実施形態においては、抗体(例えば、モノクローナル抗体)などの分子を間接的に検出する。例えば、当業者には公知のように一次抗体(例えば、本明細書に記載のモノクローナルERG抗体)に対する二次抗体を生成させ、二次抗体を検出のために標識する。二次抗体を検出可能な部分にコンジュゲートさせる。例えば、二次抗体を、その後の比色検出のためにアルカリホスファターゼ(AP)または西洋ワサビペルオキシダーゼ(HRP)などのリポーター酵素にコンジュゲートさせることができる。いくつかの実施形態においては、二次抗体を、以前に記載のような蛍光部分(例えば、FITC、Cy染料、ALEXA FLUOR(登録商標)(Invitrogen, Carlsbad, CA)染料、ローダミンなど)にコンジュゲートさせる。いくつかの実施形態においては、一次モノクローナルERG抗体を、ビオチンDNP、DIGなどのハプテンにコンジュゲートさせた二次抗体を用いて間接的に検出し、ストレプトアビジン-HRPなどの検出可能な試薬分子にさらに結合させ、次いで、3,3'-ジアミノベンズイジン(DAB)との反応により比色検出する。当業者であれば、本明細書に記載のようなタンパク質間相互作用の可視化に用いられる多種多様な酵素的および発光的検出方法を理解できるであろう。
【0081】
6. 製剤および投与
本開示は、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を含む組成物を提供する。特定の実施形態においては、前記組成物は、医薬としての使用および患者への投与にとって好適である。これらの組成物は、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体と、製薬上許容し得る賦形剤とを含む。前記組成物はまた、補足的、追加的、または増強された治療機能を提供する他の活性化合物を含んでもよい。前記医薬組成物を、投与のための説明書と一緒に、容器、包装、またはディスペンサー中に含有させてもよい。一実施形態においては、前記組成物は、アルツハイマー病などの疾患または前立腺癌、ユーイング肉腫、急性骨髄性白血病、急性Tリンパ芽球性白血病、巨核芽球性白血病、結腸癌もしくは内皮細胞癌などの悪性腫瘍の治療のための、ERG 42-66エピトープに結合する本明細書に記載のモノクローナル抗体を含む。
【0082】
本発明の医薬組成物を、その意図される投与経路と適合するように製剤化する。投与を達成するための方法は、当業者には公知である。これとしては、例えば、静脈内、血管内、動脈内、皮下、筋肉内、腫瘍内、腹腔内、心室内、硬膜内などの非経口経路による注入ならびに経口、経鼻、眼内、直腸、もしくは局所が挙げられる。デポー注射または浸食性インプラントなどの手段による、持続放出投与も具体的に意図される。腎動脈または局所腫瘍に供給する血管などの1種以上の動脈へのカテーテルを介する送達などの手段による局所送達が特に意図される。
【0083】
一実施形態においては、静脈内、筋肉内または皮下注射により、対象抗体を患者に投与する。約0.1 mg/kg〜約100 mg/kg;約1 mg/kg〜75 mg/kg;または約10 mg/kg〜50 mg/kgの用量範囲内で抗体を投与することができる。例えば、ボーラス注射またはゆっくりした注入により、抗体を投与することができる。30分〜2時間にわたるゆっくりした注入を用いることができる。
【0084】
前記組成物の毒性および治療効果を、細胞培養物または実験動物中での標準的な薬学的手順により、例えば、LD50(集団の50%に対して致死的である用量)およびED50(集団の50%において治療上有効である用量)を決定することにより決定することができる。毒性効果と治療効果との用量比は治療指数であり、それをLD50/ED50比として表すことができる。大きい治療指数を示す抗体は、毒性が低い、および/またはより治療上有効であってよい。
【0085】
7. キット
いくつかの実施形態においては、本明細書に記載のERG関連分子(例えば、モノクローナル抗体、ポリペプチドなど)を、例えば、本発明の方法を実施するのに有用なキットの形態で供給する。一実施形態においては、好適な量の少なくとも1種のERG関連分子(例えば、モノクローナル抗体、ポリペプチドなど)を、1個以上の容器中で提供する。他の実施形態においては、少なくとも1種のERG関連分子(例えば、モノクローナル抗体、ポリペプチドなど)を、例えば、水性溶液中に懸濁して、または凍結乾燥粉末として提供する。少なくとも1種のERG関連分子(例えば、モノクローナル抗体、ポリペプチドなど)を供給する容器は、供給された形態を保持することができる任意の従来の容器、例えば、マイクロ遠心管、アンプルまたはボトルであってよい。供給されるERG関連分子(例えば、モノクローナル抗体、ポリペプチドなど)の量は、任意の好適な量であってよい。
【0086】
他の実施形態においては、ERG関連分子(モノクローナル抗体、ポリペプチドなど)のための陽性および/または陰性対照として役立ち得る1種以上の組織または細胞調製物(例えば、生検、異種移植片、細胞ペレット、もしくは細胞塊)を載せた対照スライドを、好適かつ別の容器中に提供してもよい。
【0087】
他のキットの実施形態は、二次抗体などのERG関連分子の検出のための手段を含む。いくつかのそのような例においては、二次抗体を検出可能な部分(本開示の他の場所に記載)で直接標識する。他の例においては、一次または二次(もしくはより高い次数)抗体を、検出可能なように標識されたコグネイトハプテン結合分子(例えば、ストレプトアビジン(SA)-西洋ワサビペルオキシダーゼ、SA-アルカリホスファターゼ、SA-QDot(登録商標)(Invitrogen, Carlsbad, CA)など)により検出可能であるハプテン(ビオチン、DNP、DIGなど)にコンジュゲートさせる。いくつかの実施形態においては、一次または二次抗体を、蛍光検出部分(例えば、FITC、ローダミン、ALEXA FLUOR(登録商標)(Invitrogen, Carlsbad, CA)染料、Cy指定フルオロフォアなど)とコンジュゲートさせる。いくつかのキットの実施形態は、比色試薬(例えば、DAB、AECなど)の展開のための酵素で標識された一次もしくは二次(またはより高い次数)抗体に合わせて用いられる好適な溶液中にそのような比色試薬を含んでもよい。
【0088】
一実施形態においては、キットは、開示された方法でのキット内容物(例えば、ERG関連分子)の使用方法を開示する説明材料を含む。この説明材料を、限定されるものではないが、文書形態(例えば、ハードコピー紙など)、電子形態(例えば、コンピューターディスクもしくはコンパクトディスク)などの任意の数の形態で提供するか、またはそれらは視覚的であってもよい(例えば、ビデオファイル)。キットはまた、キットが設計された特定の用途を容易にするためのさらなる成分を含んでもよい。かくして、例えば、キットは、バッファーおよび特定の方法の実施に日常的に用いられる他の試薬をさらに含んでもよい。そのようなキットおよび好適な内容物は、当業者にはよく知られている。
【0089】
別途定義しない限り、本明細書で用いられる全ての技術用語および科学用語は、当業者によって一般的に理解されるものと同じ意味を有するものとする。本明細書に記載のものと類似するか、または等価である方法および材料を、本発明の実施または試験において用いることができるが、好適な方法および材料を以下に記載する。本明細書に記載の全ての刊行物、特許出願、特許、および他の参考文献は、その全体が参照により本明細書に組入れられるものとする。対立する場合、定義を含む本明細書が制御するものとする。さらに、材料、方法、および実施例は例示に過ぎず、制限的であると意図されるものではない。
【0090】
(実施例)
【実施例1】
【0091】
9FY抗体の作製
配列番号1のアミノ酸42-66と、-COOHを遊離状態(非コンジュゲート化)で保持するためにNまたはC末端に付加されたシステイン残基とを有する化学合成ポリペプチドでBalb/Cマウスを免疫することにより、ハイブリドーマクローン9FYを取得した。免疫化ポリペプチドをキーホールリンペットヘモシアニン(KLH)にコンジュゲートし、3週間間隔で3つの別々の注射部位でアジュバントをマウスに注射した。1回目の注射にはアジュバントとしてFreundの完全アジュバントを用いた。2回目および3回目の注射にはFreundの不完全アジュバントを用いた。直接ELISAスクリーンを用いて、免疫化ポリペプチドへの結合について血清出血を評価した。最も高い力価を有するマウスを、最初のハイブリドーマ融合工程のために選択した。ELISAにより8個の陽性クローンを確認し、HEK-293細胞中で異種発現されるERG3タンパク質を用いる免疫ブロットアッセイにより上清を分析した。2個のクローンが免疫ブロットアッセイにおいて陽性であることがわかった。2回目のスクリーニングに由来する1個の陰性クローンを、陰性対照として保持した。2個の陽性クローンと陰性対照を、2回目のクローニングのためにさらに処理した。最も強い陽性活性を最初に示した1個の陽性クローン(9FY)は、2回目のクローニング工程を生存した。9FYクローンを増殖させ、腹水産生のために10匹のマウスに注入した。腹水を産生させ、9FY抗体をGタンパク質カラム上で精製した。9FY抗体のサブタイプは、精製画分からIgGであると決定された。
【実施例2】
【0092】
9FY抗体は前立腺癌細胞中のERGタンパク質を特異的に認識する
VCaP細胞(Korenchuckら、2001, In Vivo, 15:163-68)は、ヒト前立腺腫瘍において検出されることが多いTMPRSS2/ERG融合物を過剰発現するヒト前立腺癌細胞系である。VCaP細胞中では、アンドロゲン誘導性TMPRSS2プロモーターにより、内因性ERG遺伝子転写が制御される。LNCaP細胞は、TMPRSS2/ERG融合物を担持せず、検出可能なレベルのERGを発現しないヒト前立腺癌細胞系である。
【0093】
1. ウェスタンブロット
LNCaP(ATCC;#CRL-1740)およびVCaP細胞(ATCC;#CRL-2876)を、それぞれ、10%ウシ胎仔血清(ATCC;#30-2020)および2 mMグルタミンを補給した、RPMI-1640(ATCC;#30-2001)およびDMEM培地(ATCC;#30-2002)中で増殖させた。LNCaPおよびVCaP細胞(2x106個)を、10 cmディッシュ上に播種し、10%活性炭剥離ウシ胎仔血清(c-FBS;#100119 Gemini Bio-Products, Calabasas, CA)を含む培地中で、それぞれ、5日間および3日間維持した。次いで、アンドロゲンの誘導のために、0.1 nM R1881または1 nM R1881を補給したc-FBSを含む新鮮な培地中でさらに48時間、細胞を増殖させた。細胞を収穫し、ウェスタンブロットおよび顕微鏡観察により分析した。
【0094】
ウェスタンブロット実験において、9FY抗体は、アンドロゲン(R1881)誘導に応答してTMPRSS2/ERG2およびTMPRSS2/ERG3によりコードされる完全長タンパク質産物(約50-52 kDa)を認識する(図1A)。9FY抗体は、TMPRSS2/ERG融合転写物を担持しないLNCaP細胞中ではERGを認識しなかった。
【0095】
9FY抗体認識の特異性を評価するために、合成アンドロゲン(R1881)により誘導されたVCaP細胞およびLNCaP細胞を、ERG特異的小分子阻害RNA(ERG siRNA)(Sunら、2008)および/または非標的化(「NT」)対照オリゴヌクレオチドでトランスフェクトした。ERG siRNAは、エクソン11中の19塩基対の領域を標的とし、前立腺細胞において全ての既知のERGスプライス変異体を阻害すると予測される(Sunら、2008)。チューブリンを、免疫ブロットアッセイにおけるローディング対照として用いた。
【0096】
NTまたはERG siRNAオリゴヌクレオチド(Dharmacon, Lafayette, CO)でトランスフェクトし、4日間インキュベートしたVCaP細胞から、プロテアーゼおよびホスファターゼ阻害剤カクテル(カタログ番号P2850 & P5726, Sigma, St. Louis, MO)を補給したM-PER(登録商標)哺乳動物タンパク質抽出試薬(カタログ番号78501, Thermo, Rockford, IL)中で、VCaP細胞溶解物を調製した。細胞を50 nM NTオリゴヌクレオチド、25 nM NTおよび25 nM ERG siRNAオリゴヌクレオチドまたは50 nM ERG siRNAオリゴヌクレオチド(レーン3)でトランスフェクトした。25μgの細胞溶解物を各レーンにロードし、NUPAGE(登録商標)SDSゲル(カタログ番号NP0335, Invitrogen, Carlsbad, CA)上で分離し、PVDF膜上に移し、1:10,000の9FY抗体を用いてウェスタンブロットした。同一のゲルをPVDF膜(カタログ番号LC2005, Invitrogen, Carlsbad, CA)上に移し、1:1,000の抗SLC45A3抗体(カタログ番号M361529-2)、1:3,000の抗PSA抗体(カタログ番号A056201-2、両方ともDAKO社製、Carpinteria, CA)および1:1000の抗α-チューブリン(カタログ番号Sc-5286, Santa Cruz, CA)を用いて精査した。
【0097】
10%活性炭剥離血清を補給したRPMI1640中で5日間増殖させ、新鮮なR1881を含まない培地中でさらに維持するか、または0.1 nMもしくは1 nMのR1881で48時間刺激した細胞から、LNCaP細胞溶解物を調製した。同様に、活性炭剥離血清を補給したDMEM中で3日間増殖させ、新鮮なR1881を含まない培地中でさらに維持するか、または0.1 nMもしくは1 nMのR1881で48時間刺激した細胞から、VCaP細胞溶解物を調製した。25μgの細胞溶解物を、記載のように各レーンにロードし、NUPAGE(登録商標)(Invitrogen, Carlsbad, CA)SDSゲル上で分離し、PVDF膜上に移し、1:10,000の9FY抗体を用いてウェスタンブロットした。同一のゲルをPVDF膜上に移し、1:1,000の抗SLC45A3抗体、1:3,000の抗PSA抗体および1:1000の抗α-チューブリンを用いて精査した。VCaP、COLO320、MOLT-4およびKG-1細胞を、M-PER(登録商標)哺乳動物タンパク質抽出試薬中で溶解し、そのタンパク質濃度を決定した。25μgの細胞溶解物を、記載のように各レーンにロードし、NUPAGE(登録商標)(Invitrogen, Carlsbad, CA)SDSゲル上で分離し、PVDF膜上に移し、1:10,000の9FY抗体を用いてウェスタンブロットした。
【0098】
従来の結果と一致して、9FY抗体(1:10,000希釈)を用いた場合、ERG siRNA処理に応答して、内因性ERGタンパク質レベルの有意な低下が検出された(図1B)。さらなる対照として、本発明者らは、ERGの負に調節される下流の標的遺伝子、プロステイン(SLC45A3)および前立腺特異的抗原PSA(KLK3)の発現応答も試験した(Sunら、2008)。予想通り、ERG siRNAに応答して、VCaP細胞中ではプロステインおよびPSAの顕著な上方調節が明らかであった(図1Aおよび図1B、下パネル)。
【0099】
2. ELISA
ELISAアッセイにおいて、本発明者らは、様々な濃度の免疫化ポリペプチド(すなわち、配列番号1のアミノ酸42-66)の力価を測定する9FY抗体の感度および特異性を評価した。直接的ELISAのために、まずプレートを、1 ng/ml、10 ng/ml、100 ng/mlおよび1μg/mlの100μlのERG3抗原で被覆し、振とう器上、4℃で16時間インキュベートした後、プレートをPBSt(300μl/ウェル)で5回洗浄した。SuperBlock B中に希釈したビオチン結合検出9FY抗体を74 pg/100μl/ウェルで添加し、プレートを振とう器上で1時間インキュベートした(この工程およびその後の全ての工程を、室温で行う)。プレートをPBSt(300μl/ウェル)で洗浄した。次に、PBS中のストレプトアビジン-西洋ワサビペルオキシダーゼ(HRP)(100μl/ウェル)を添加し、振とう器上、室温で30分間インキュベートした。次いで、プレートをPBSt(300μl/ウェル)で洗浄した後、100μl/ウェルでTMBを添加し、振とう器上で5分間展開させた後、50μl/ウェルの停止溶液を添加した。製造業者の推奨に従って、MULTISKAN(登録商標)Ascent(Thermo Scientific, Waltham, MA)ELISAプレートリーダー上、450 nmで吸光度を測定し、吸光度を抗体希釈率に対してプロットした。間接的ELISAのために、まずプレートを100μl(570 pg)/ウェルのC-エピトープ抗ERG抗体で被覆し、4℃で16時間インキュベートした。300μl/ウェルのSuperBlock(カタログ番号PI-37515, Thermo Scientific, Rockford IL)を添加し、振とう器上で1時間インキュベートした(この工程およびその後の全ての工程を室温で行う)。200 ngのERG3抗原を100μl/ウェルで添加し、振とう器上で2時間インキュベートした後、プレートをPBSt(300μl/ウェル)で洗浄した。SuperBlock B中に希釈したビオチン結合検出9FY抗体を74 pg/100μl/ウェルで添加し、プレートを振とう器上で1時間インキュベートした。プレートをPBSt(300μl/ウェル)で洗浄し、次にPBS中のストレプトアビジン-HRP(100μl/ウェル)を添加し、振とう器上で0.5時間インキュベートした(室温)。プレートをPBSt(300μl/ウェル)で再度洗浄した。次いで、テトラメチルベンズイジン(TMB)を100μl/ウェルで添加し、振とう器上で5分間展開させた後、50μl/ウェルの停止溶液を添加した。製造業者の推奨に従って、MULTISKAN(登録商標)Ascent(Thermo Scientific, Waltham, MA)ELISAプレートリーダー上、450 nmで吸光度を測定し、吸光度を抗体希釈率に対してプロットした。
【0100】
9FY抗体は、配列番号1のアミノ酸42-66に一致する免疫化ポリペプチドを認識した。抗体力価測定および競合阻害アッセイにより、2種の対照ポリペプチドではなく、免疫化ポリペプチドが、ERG3タンパク質に対する9FY抗体結合について競合し(図2A)、精製された9FY抗体が5000〜20000倍の希釈範囲で検出することができる(図2B)ことが示された。
【0101】
3. in vivoクロマチン免疫沈降アッセイ
9FY抗体の特異性をさらに評価するために、本発明者らは、in vivoクロマチン免疫沈降(ChIP)アッセイ(Sunら、2008)により以前に定義された遺伝子調節エレメントへの内因性ERGの動員を試験した。TMPRSS2/ERG融合転写物によりコードされるERGタンパク質の発現を、VCaP細胞中でR1881により誘導し、細胞をERG siRNAによりトランスフェクトしてERGをノックダウンするか、または対照非標的化(NT)siRNAによりトランスフェクトした。細胞をChIPアッセイのために処理し、9FY抗体を用いてクロマチンを免疫沈降した。ERG siRNAの非存在下では、内因性ERGタンパク質は標的遺伝子配列に対して動員される。対照的に、HPGDH、C-MYC、プロステイン(SLC45A3)およびPSA/KLK3遺伝子調節領域へのERGタンパク質結合の強固な低下(図3)が、ERGノックダウンに応答して観察された。この結果は、前記抗体によるERG結合クロマチンの特異的免疫沈降と一致している。
【0102】
4. 免疫蛍光(IF)
IF法により、VCaP細胞中で9FY抗体をさらに評価した(図4)。VCaP細胞を、NT-またはERG-siRNAオリゴヌクレオチドでトランスフェクトし、増殖培地を、10%活性炭剥離血清と0.1 nM R1881を補給した新鮮なDMEMに置換し、さらに48時間インキュベートした。免疫染色のために、まず細胞をリン酸緩衝生理食塩水(PBS)中の新鮮な4%ホルムアルデヒド中で固定し、PBS-T(PBS + 0.1%TritonX-100)中で透過処理した後、CYTOSPIN(登録商標)4(Thermo Scientific, Waltham, MA)遠心管を用いてガラススライド上で遠心分離した。次いで、細胞を、PBS-NT20(1%正常ウマ血清(カタログ番号S-2000、Vector laboratories, Burlingame, CA)および0.1%Tween-20を補給したPBS)中でブロックした。次いで、PBS-NT20中に希釈した、SLC45A3またはPSA(両方ともDAKO社製、Carpinteria, CA)に対する一次抗体と共に、室温で細胞をインキュベートした。細胞をPBS-NT20で洗浄した後、ヤギ抗マウスALEXA FLUOR(登録商標)594(Invitrogen, Carlsbad, CA; カタログ番号A11302)、ヤギ抗ウサギALEXA FLUOR(登録商標)488(Invitrogen, Carlsbad, CA; カタログ番号A11304)二次抗体およびDAPIを印加した。細胞を洗浄し、FLUOROMOUNT G(商標)(SouthernBiotech, Birmingham, AL)を用いてマウントした。OpenLabソフトウェア(Improvision, Lexington, MA)により操作される、QImaging Retiga-EX CCDカメラ(Burnaby, BC, Canada)を備えたLeica DMIRE2倒立顕微鏡上の40X/0.65 N-Plan対物レンズを用いて、画像を捕捉した。Photoshop(Adobe)を用いて、画像を色付きに変換し、融合させた。ペプチド競合について、競合免疫化ポリペプチド(配列番号1のアミノ酸42-66)および非競合対照ERGポリペプチドを保存溶液から希釈し、最終濃度の抗体に対してモル濃度で2000倍過剰量の抗体と混合した。抗体-ポリペプチド混合物を氷上で30分間インキュベートした後、記載のように組織標本に印加した。
【0103】
ERGの転写因子機能に特徴的な核染色により示されたように、9FY抗体はERGタンパク質を特異的に認識した。以前に示されたように(Sunら、2008)、ERGを効率的にノックダウンするsiRNAを用いてVCaP細胞をトランスフェクトした。実際、対照非標的化siRNAで処理した細胞と比較して、ERG siRNA処理に応答して、内因性ERGタンパク質レベルの強固な低下が観察された。ERGは、前立腺分化マーカー遺伝子のリプレッサーである(Sunら、2008;Tomlinsら、2008)。かくして、PSAレベルの上昇は、効率的なERGノックダウンと一致している(図4A)。9FY抗体の認識特異性を確立するために、VCaP細胞上でIFアッセイの前に2000倍過剰の競合免疫化ポリペプチドと前記抗体を競合させた。2000倍モル過剰の免疫化ポリペプチド(競合ペプチド)は、9FY抗体特異的様式でIFシグナルを排除するのに十分であった。対照的に、対照ERGポリペプチド(非競合ペプチド)は9FY抗体と競合できなかった(図4B)。細胞質前立腺特異的抗原(PSA)染色は、免疫化ポリペプチドまたは対照ポリペプチドにより影響されない。PSAのホルモン誘導性細胞質発現を、ERGおよびPSA遺伝子発現のアンドロゲン活性化のための陽性対照として用いた(図4C)。TMPRSS2/ERG融合物を担持せず、検出可能なレベルの内因性ERGも発現しないLNCaP細胞中では、9FY抗体はERGを認識しなかった。R1881に応答するPSAタンパク質発現は、LNCaP細胞中では容易に検出可能であり、PSAのアンドロゲン誘導性発現と一致している。9FY抗体特異性の濃度範囲の定義を目指して、本発明者らは、9FY抗体によるERG認識が、3.7 mg/ml保存液の1:5,000〜1:20,000希釈率の濃度範囲でも基準を満たすことを見出した(図4D)。9FY抗体の非存在下では、二次抗体はVCaP細胞中のエピトープを検出できない。この結果により、IF実験におけるバックグラウンドタンパク質の非特異的染色の可能性が排除された(図4E)。
【実施例3】
【0104】
FFPE標本における免疫組織化学染色
また、9FY抗体をホルマリン固定パラフィン包埋(FFPE)ヒト前立腺標本中でも試験した。前立腺全摘出術標本をホルマリン中に固定し、パラフィン中で全載標本として包埋した。それぞれの前立腺を、前立腺の後表面の長軸に対して直交する横断面で0.22 cm間隔で切片化し、全載標本として完全に包埋した。全載標本ブロックの4μm切片上で免疫組織化学(IHC)染色のために切片を分析した。
【0105】
IHCのための組織切片を、以前に記載のように調製した(Furusatoら、2007)。スライドを1:1200の9FY抗体と共にインキュベートした。発色基質としてVECTOR(登録商標)VIP(Vector Laboratories, Burlingame, CA)(紫色)を使用し、スライドをヘマトキシリンで対抗染色した。IHCにより、前立腺腫瘍細胞の核染色が示され、これはERG転写因子の細胞内局在化と一致していた(図5A-5D)。対照的に、9FY抗体は、ヒト前立腺中の正常な上皮も間質も染色しない。血管の内皮細胞は、9FY抗体による染色を示し、これは内皮細胞における野生型ERGの確立された構成的発現と一致していた(Birdseyら、2008;McLaughlinら、1999;Rainisら、2005)。かくして、病理学者であれば、腫瘍上皮のIHC反応が9FY抗体により観察される場合、内部参照として内皮細胞染色を用いることができる。150人+前立腺癌患者から得た全載標本の評価により、9FY抗体の特異性が確認された。
【実施例4】
【0106】
他の癌細胞系におけるERGタンパク質の検出
VCaP前立腺癌細胞系における9FY抗体の特異性が確立されたので、本発明者らは、COLO 320(結腸癌(Quinnら、1979))、KG1(急性骨髄性白血病(KoefflerおよびGolde, 1978))およびMOLT4(ヒト急性Tリンパ芽球性白血病(Minowadaら、1972))などの、高レベルのERG RNAを発現することが以前に記載された細胞系におけるERGタンパク質の検出のためにこの抗体をさらに評価した。Colo320(ATCC#CCL-220.1)およびMOLT-4(ATCC#CRL-1582)細胞を、10%FBSを補給したRPMI-1640中で増殖させた。KG-1細胞を、10%FBSを補給したIscove改変DMEM(カタログ番号12440-053、Invitrogen, Carlsbad, CA)中で増殖させた。細胞を収穫し、記載のようにウェスタンブロットおよび顕微鏡観察により分析した。9FY抗体を用いるCOLO 320(結腸癌(Quinnら、1979))、KG1(急性骨髄性白血病(KoefflerおよびGolde、1978)およびMOLT4(ヒト急性Tリンパ芽球性白血病(Minowadaら、1972))の免疫ブロットアッセイにより、1種の主なタンパク質種が検出されたが(図6)、これは前立腺癌以外のヒトの癌におけるERGタンパク質の検出および評価におけるこの抗体の有用性を示唆している。
【実施例5】
【0107】
9FY抗体の特異性
1. ウェスタンブロット
ウェスタンブロットを用いて、TMPRSS2/ERG3融合転写物でトランスフェクトされたHEK293細胞から得た細胞溶解物を用いて、9FY抗体の特異性を市販のポリクローナル抗ERG抗体(C-20(sc-353)またはH95(sc-28680)と比較した。9FY抗体を、1:5000で用いた;C20(sc-353)(Santa Cruz Biotechnology, Inc, Santa Cruz, CA)およびH95(sc-28680)(Santa Cruz Biotechnology, Inc, Santa Cruz, CA)を1:1000希釈率で用いた。9FY抗体は、TMPRSS2/ERG3でトランスフェクトされたHEK293細胞のウェスタンブロットにおいて単一の種としてTMPRSS2/ERG3融合転写物(52 kDa)によりコードされる外因的に発現されるERGタンパク質を検出するが、これは9FY抗体の特異性を強調している(図7)。一方、市販の抗ERGポリクローナル抗体は、同一のブロットにおいて複数のタンパク質と反応する。具体的には、市販のポリクローナルC20抗体(sc-353)およびポリクローナルH95抗体(sc-28680)は、これらのポリクローナル抗体を用いて得られたウェスタンブロットにおける複数のバンドにより証明されるように、9FY抗体の特異性を欠いていた(図7)。入手可能な商品パンフレットによれば、C20はヒトERG1、ERG2およびERG3のC末端にマッピングされるエピトープを認識するが、H95はヒトERG2およびERG3のアミノ酸26-120にマッピングされるエピトープを認識する(Owczarekら、2004)。
【0108】
ポリクローナルH95抗体の特異性を、LNCaPおよびVCaP細胞から得た細胞溶解物を用いてさらに分析した。上記のように、R1881アンドロゲンで処理した、もしくは処理しないか、または非標的化(NT)もしくはERG siRNAオリゴヌクレオチドでトランスフェクトしたLNCaPおよびVCaP細胞から、溶解物を調製した。注目すべきことに、H95抗体はLNCaPおよびVCaP細胞溶解物中の複数の非特異的バンドを検出し、TMPRSS2/ERG融合転写物によりコードされる52 kDaのトランケートされたERGポリペプチドである標的の検出は疑わしかった(図9A/Bと図1A/Bを比較されたい)。
【0109】
また、9FY抗体を用いて、TMPRSS2/ERG8融合転写物によりコードされるERG癌タンパク質を検出した。10%ウシ胎仔血清および2 mMグルタミンを補給したDMEM培地中でHEK-293細胞を増殖させた。HEK-293細胞(2x106)個を10 cmディッシュ上に播種し、2日間維持した後、4μgのプラスミドDNA:pIRES-EGFP(CMV)、pIRES-EGFP(CMV)-TMPRSS2-ERG3、pIRES-EGFP(CMV)-ERG3またはpIRES-EGFP(CMV)-TMPRSS2-ERG8でトランスフェクトした。トランスフェクションのためにLIPOFECTAMINE(商標)2000(Invitrogen, Carlsbad, CA;カタログ番号11668-027)を使用し、48時間後に細胞を収穫し、4または20μgのタンパク質に相当する総細胞溶解物を、1:5000の希釈率の9FY抗体を用いるウェスタンブロッティングにより分析した。9FY抗体は、野生型ERG3タンパク質(53 kDa)、TMPRSS2/ERG3にコードされる癌タンパク質(50-52 kDa)、およびTMPRSS2/ERG8にコードされるタンパク質(37 kDa)の予測されるサイズと一致する主要なタンパク質バンドを認識した(図13)。
【0110】
免疫化ポリペプチドは、免疫化ペプチドと48%の配列同一性を有する人Fli1タンパク質(Kuboら、2003)の断片を除いて、ヒトETSファミリーのタンパク質に属するタンパク質との有意な相同性を示さなかった。従って、9FY抗体がウェスタンブロットアッセイを用いてヒトERG3とヒトFLi1タンパク質とを識別することができるかどうかを見るために、9FY抗体を試験した。このアッセイにおいて、一過的に発現されるヒトERG3(TMPRSS2/ERG3構築物によりコードされる)またはヒトFli1タンパク質を、9FY抗体を用いて評価した。比較可能な量のヒトFli1タンパク質がアッセイ中に存在したことを確認するために、ERG3とヒトFli1タンパク質の両方を、それぞれ、C末端およびN末端FLAGタグと共に発現させた。9FY抗体は、ERG3タンパク質のみを認識し、ヒトFli1タンパク質との免疫反応性を示さなかった。
【0111】
2. 免疫蛍光(IF)染色
IFアッセイを用いて、C20およびH95抗体の特異性をさらに分析した。9FY抗体はIFアッセイにおいて前立腺腫瘍細胞の核染色を示したが(図4)、ポリクローナルC20(sc-353)抗体は、VCaP細胞において核ERGタンパク質だけでなく、非特異的細胞質タンパク質も認識する(図9A、第1列)。ERG siRNAを用いるERGノックダウンは、C-20抗体の核ERGおよび非特異的細胞質染色を完全に消失させなかった(図9A、第2列)。C20(sc-353)抗体は、Ad-ERG3アデノウイルス構築物を用いる感染によりLNCaP細胞中で過剰発現されたERG3を認識するが(図9A、第6列)、ERG siRNAを用いるノックダウン後でも依然として染色が検出された(図9A、第7列)。siRNAおよびアデノウイルス感染に関する陰性対照実験を、図9Aの第3、4および5列に示す。
【0112】
C20(sc-353)抗体は、VCaP細胞中で核ERGタンパク質を認識する(図9B、第1列、上パネル)。しかしながら、ERG siRNAを用いるノックダウンは核ERG染色を消失させなかったが、むしろバックグラウンドの増加をもたらした(図9B、第1列、下パネル)。図9Aおよび9Bにおいては、ERGを、一次C20(sc-353)抗体、次いで、ヤギ抗ウサギALEXA FLUOR(登録商標)488(Invitrogen, Carlsbad, CA)二次抗体(緑色)により染色する。図9Aにおいて、核の構造を外形を描くために、細胞をALEXA FLUOR(登録商標)594タグ付ファロイジン(Invitrogen, Carlsbad, CA;カタログ番号A12381)で対抗染色した。図9Bにおいては、ERGにより負に制御されるアンドロゲン誘導性SLC45A3を、マウスモノクローナル抗SLC45A3、次いで、ヤギ抗マウスALEXA FLUOR(登録商標)594(Invitrogen, Carlsbad, CA)二次抗体(赤色)により染色する。DNAをDAPIにより染色する(青色)。
【0113】
C-20抗体と同様、H95(sc-28680)抗体は、VCaP細胞中で核タンパク質および非特異的細胞質タンパク質(図10、第1列)を染色した。さらに、ERG siRNAを用いるERGノックダウンは、VCaP細胞中での染色に有意な差異を示さなかった(図10、第2列)。Ad-ERG3アデノウイルス構築物を用いる感染によりLNCaP細胞中で過剰発現されたERG3がH95(sc-28680)により検出されたが(図10、第6列)、染色はERG siRNAを用いるノックダウンにより影響されなかった(図10、第7列)。さらに、LNCaP細胞(TMPRSS2/ERG融合物を担持しないか、または検出可能なレベルの内因性ERGを発現しない)中でのsiRNAおよびアデノウイルス感染に関する陰性対照実験において(図10、第3、4および5列)、H95(sc-28680)抗体は高レベルの非特異的バックグラウンド染色を示す。図10においては、ERGを一次H95(sc-28680)、次いで、ヤギ抗ウサギALEXA FLUOR(登録商標)488(Invitrogen, Carlsbad, CA)二次抗体(緑色)により染色する。核の構造の外形を描くために、ALEXA FLUOR(登録商標)594(Invitrogen, Carlsbad, CA)タグ付ファロイジンを用いて、細胞を対抗染色する。DNAをDAPIにより染色する(青色)。
【0114】
また、第3の市販のERGポリクローナル抗体、R-20(sc-18136)(Santa Cruz Biotechnology, Inc, Santa Cruz, CA)を、IFにより分析した。R-20について入手可能な商品パンフレットによれば、ERG3を検出することが推奨され、それはヒトERG3の内部領域に位置するエピトープに結合する。ERG-3 R20(sc-18136)は、核染色、ならびに非特異的細胞質染色を示す(図11、第11列)。ERG siRNAを用いるERGノックダウンは核染色を減少させたが、9FY抗体を用いて観察されたように(図4A)、核染色を消失させそうになかった(図11、第2列)。Ad-ERG3アデノウイルス構築物を用いる感染によりLNCaP細胞中で過剰発現されたERG3は、R20(sc-18136)により検出された(図11、第6列)が、ERG siRNAを用いるノックダウン後にも依然として検出された(図11、第7列)。R20(sc-18136)抗体はまた、siRNAおよびアデノウイルス感染に関する陰性対照実験においても高レベルのバックグラウンド染色を示す(図11、第3、4および5列)。図11においては、ERGを一次R20(sc-18136)抗体、次いで、ロバ抗ヤギALEXA FLUOR(登録商標)488(Invitrogen, Carlsbad, CA)二次抗体(緑色)により染色する。核構造の外形を描くために、ALEXA FLUOR(登録商標)594(Invitrogen, Carlsbad, CA)タグ付ファロイジンを用いて、細胞を対抗染色した。DNAをDAPIにより染色した(青色)。
【0115】
別のIFアッセイを行って、H95および9FYが、ERGへの他の抗体の結合を競合的に阻害する能力を評価した。この競合的IFアッセイの結果により、9FY抗体が高い親和性でVCaP細胞の核のみを染色することが確認される。対照的に、H-95は、VCaP細胞の細胞質および核中の未知のタンパク質を染色する。一対一の交叉競合においては、10倍過剰の9FY抗体(2μg/ml)はH-95の核染色を阻害するが、H95による細胞質染色は残る(図12、第1列)。対照的に、0.2μg/mlの9FY抗体は、10倍過剰のH-95(2μg/ml)の存在下で、依然として異なる核染色を示す(図12、第5列)。等しい濃度の抗体(0.4μg/ml)では、9FY抗体はH95と比較して、より強く、高度に特異的であり、異なる核染色を示す(図12、第3列)。
【0116】
上記で考察された他の抗体試験と一致して、これらの結果は、9FY抗体がVCaP細胞の核中の単一のタンパク質を認識することを示している。対照的に、H-95ポリクローナル抗体は、細胞質と核の両方において複数の不明確なタンパク質と反応する。さらに、9FY抗体は、H95と比較した場合、より高い親和性を示す。
【0117】
3. 免疫組織化学染色
免疫組織化学染色を用いて、9FY抗体の特異性を、C20(sc-353)(Santa Cruz Biotechnology, Inc, Santa Cruz, CA)と呼ばれる市販のポリクローナル抗ERG抗体と比較した。9FY抗体はヒトならびにマウスのERGタンパク質を特異的に認識するため、発達中のマウスおよび成体マウスから得られたホルマリン固定パラフィン包埋(FFPE)組織中でERGの特異性を評価した。
【0118】
マウス胚および成体組織の回収:交配の9.5、14.5および17.5日後のマウス胚を、妊娠マウスから回収し、4%パラホルムアルデヒド中で12〜24時間固定した。成体オスマウスに由来する組織を回収し、4%パラホルムアルデヒド中で24時間固定した。組織をパラフィン包埋のために処理し、ミクロトームを用いて4μmの切片をスーパーフロストダブルスライド上に切り出した。
【0119】
ERGの免疫組織化学分析(IHC):脱パラフィン化の後、4μmの切片を脱水し、メタノール中の0.6%過酸化水素中で20分間ブロックした。マイクロ波中で30分間、0.1Mクエン酸バッファー中で抗原回復のために切片を処理した後、30分間冷却した。製造業者の説明書に従って、Mouse-To-Mouse IHC Detection System Kit (Millipore Inc)を用いて、IHC手順を実行した。簡単に述べると、切片をプレ抗体ブロッキング溶液と共に10分間ブロックした。ブロッキング溶液を除去し、1:1000の希釈率の9FY抗体または市販のC20(sc353)ERG抗体と共に切片を4℃で一晩インキュベートした。インキュベーション後、スライドをPBSで5分間洗浄した。スライドを、ポスト抗体ブロッキング溶液と共に10分間インキュベートし、PBSでそれぞれ5分間ずつ、2回洗浄した。スライドをすぐに使えるPoly-HRP-Anti-Mouse/Rabbit IgGと共に10分間インキュベートし、PBSで5分間、2回洗浄し、DAB試薬を用いて発色させた。次いで、切片をヘマトキシリン中で1分間、対抗染色し、脱水し、透明化し、マウントし、写真を撮影した。
【0120】
9FY抗体を用いた場合、ERGは野生型マウス前立腺内皮細胞中でのみ検出され、野生型マウス前立腺上皮中では検出されなかった。図14A(実線矢印は前立腺を示し、破線矢印は内皮細胞を示す)を参照されたい。一方、市販のC20(sc353)ERG抗体はERGに対して非特異的であり、野生型マウスから得られた組織中の前立腺内皮細胞と上皮細胞の両方を染色した(図14B)。予想通り、ERGを発現するトランスジェニックマウスにおいては、両抗体は前立腺の内皮細胞と上皮細胞中でERGを検出した。図14C-Dを参照されたい。しかしながら、市販のC20(sc 353)ERG抗体は、同じ強度で野生型およびERG陽性トランスジェニック組織を染色する。図14BおよびDを参照されたい。
【0121】
IHC分析はまた、造血細胞、内皮細胞、ならびに血管および様々な胚組織の毛細血管におけるERG発現も示した(データは示さない)。同様に、成体マウス組織におけるERGの発現も、造血細胞、内皮細胞、血管および毛細血管において検出された(データは示さない)。AMLおよびユーイング肉腫のサブセットがERG発現の上昇を示すことは既に知られている。ERG特異的抗体の利用性について、血管中の造血細胞、内皮細胞および様々な胚組織中の毛細血管の病理学的状態におけるERGの変化を効率的に追跡することができる。興味深いことに、ERGは、前立腺などの組織中の正常な上皮細胞においては検出されない。従って、血管および毛細血管中の造血細胞または内皮細胞以外の任意の組織におけるERGの検出は、癌などの、異常性および/または病理学的状態を示唆する。
【実施例6】
【0122】
9FY抗体可変ドメインの配列決定
RNAを9FYハイブリドーマ細胞系から抽出し、メッセンジャーRNAに特異的なオリゴd(T)プライマーを用いてcDNAに逆転写した。マウス抗体重鎖および軽鎖配列に特異的なプライマーを用いるPCRのための鋳型としてこのcDNA産物を用いた。
【0123】
PCR産物を標準的な配列決定ベクター中にクローニングし、陽性コロニーをPCRにより同定した。これらのコロニーを培養し、配列決定のためにプラスミドを少量調製した。ダイターミネーター法を用いて配列決定を実施し、ABI3130遺伝子分析装置上で分析した。重鎖および軽鎖可変ドメインのコンセンサス配列を、AlignXプログラムを用いる整列により決定した。
【0124】
この整列に基づいて、9FY抗体の軽鎖可変ドメインは以下のアミノ酸配列を含むと決定された(CDR1(L1)、CDR2(L2)およびCDR3(L3)に下線を付す):

(配列番号2)。
【0125】
そして9FY抗体の重鎖可変ドメインは以下のアミノ酸配列を含むと決定された(CDR1(H1)、CDR2(H2)およびCDR3(H3)に下線を付す):

(配列番号3)。
【実施例7】
【0126】
前立腺癌におけるERG癌タンパク質およびTMPRSS2/ERG融合状態の分析
腫瘍標本におけるERG癌タンパク質染色と、TMPRSS2-ERG融合状態との間の関係を評価するために、TMPRSS2-ERG mRNAおよび全ERG mRNAの検出のためのERG癌タンパク質陽性またはERG癌タンパク質陰性FFPE標本の連続組織切片上で比較分析を行った。
【0127】
前立腺標本:この分析のため、および多病巣前立腺癌におけるERG発現をマッピングするための前立腺標本(実施例8)を、以下のように取得、調製した。Center for Prostate Disease Researchプログラムに登録した132人の患者の前立腺全摘出術標本を、標本が外科的に取り出された後30分以内に、病理学者が取得した。前立腺全摘出術標本をホルマリン中で固定し、パラフィン中で全載標本として包埋し、前立腺の後表面の長軸に対して直交する横断面中、0.22 cmの間隔で切片化し、本発明者らのArmed Forces Institute of Pathology(AFIP)プロトコル(B.Furusatoら、2008)に従って、全載標本として完全に包埋した。各患者から、1〜4個の腫瘍(多くは2個の病巣)を含む1個の全載横断面を選択したところ、腫瘍は様々な等級および段階を示した。各腫瘍を、前立腺全摘出術標本および別々の腫瘍を示した2個以上の腫瘍病巣を有するスライス中で個別に診断した。
【0128】
ERGの免疫組織化学分析:脱パラフィン化の後、4μmの切片を脱水し、メタノール中の0.6%過酸化水素中で20分間ブロックした。マイクロ波中で30分間、EDTA(pH 9.0)中で抗原回収のために切片を処理した後、EDTAバッファー中で30分間冷却した。次いで、切片を1%ウマ血清中で40分間ブロックした後、1:1280の希釈率の9FYモノクローナル抗体と共に室温で60分間インキュベートした。切片を、1:200の希釈率のビオチン化ウマ抗マウス抗体(Vector Laboratories, Burlingame, CA)と共に30分間インキュベートした後、ABCキット(Vector Laboratories, Burlingame, CA)で30分間処理した。VIP(Vector Laboratories, Burlingame, CA)で5分間処理することにより、色の検出を達成した。次いで、切片をヘマトキシリン中で1分間対抗染色し、脱水し、透明化し、マウントした。9FY染色を、陽性細胞の割合(%)に従って決定した:25%まで(1+)、>25〜50%(2+)、>50〜75%(3+)および>75%(4+)。この強度を、軽度(1+)、中程度(2+)および顕著(3+)としてスコア化した。陽性細胞の割合に強度を掛けることにより、両測定値の組合せを算出し、スコアを得た。
【0129】
分枝鎖DNA(bDNA)シグナル増幅によるERG mRNAの分析:35個のFFPE全載前立腺サンプルの各々から、1個の4μm厚の切片を選択した。腫瘍として同定された領域に印を付け、擦って取り出し、600μlの組織均質化溶液(THS)中にホモジェナイズした後、12μl(50μg/ml)のプロテイナーゼKを添加した。標本を65℃で7時間インキュベートした。サンプルを室温で5分間遠心分離して、破片を沈降させた。上清を新鮮なマイクロ遠心管に移し、残留パラフィンを避けた。QUANTIGENE(登録商標)2.0アッセイ(Panomics, Fermont, CA)を用いて、全ての上清をすぐに分析した。各サンプルを2回アッセイした。40μl(5 ng)のホモジェネートを、ERGの増幅に用いた:TMPRSS2-ERGについては80μl(10 ng)ならびにハウスキーピング遺伝子:ACTB、B2MおよびRPL19については5μl(0.625 ng)。さらに、VCaP mRNAを陽性対照として用いた。標的RNAを捕捉するために、THS中で好適な容量のサンプルを混合することにより、サンプル希釈液を調製した。12μlのプローブセットと、40μlのブロッキング試薬(標的遺伝子のみのため)または40μlのヌクレアーゼ非含有水(28S RNAのため)、溶解混合物およびヌクレアーゼ非含有とを混合することにより、各標的のための実用プローブセットを調製した。実用プローブセットを混合し、室温で保持した。捕捉プレートを調製するために、60μlの各実用プローブセットを、割り当てたウェルに移した。次いで、アッセイ対照およびRNAサンプルを、ハイブリダイゼーション実用試薬(HWR)で100μlにし、55℃で一晩ハイブリダイズさせた。プレートを洗浄バッファーで3回洗浄した。次いで、プレアンプリファーを添加した後、アンプリファー、標識プローブおよび最後に化学発光基質を添加し、各試薬中でのインキュベーション後に洗浄した。Modulus Luminometer(Knudsenら、2008)中でリードアウトを測定した。
【0130】
35個の評価可能な標本の分析により、TMPRSS2-ERG融合型A転写物のmRNAレベルと、ERG癌タンパク質免疫組織化学分析との間に強い相関が示された(図15)。mRNAとタンパク質データとの82.8%の一致は、予想される感度の差異ならびに2つの技術のリードアウトにも拘わらず、明らかであった。蛍光in situハイブリダイゼーション(FISH)によるTMPRSS2-ERG遺伝子融合物分析の比較評価およびIHC(9FY抗体を用いる)によるERG癌タンパク質発現も、これらの知見を支持し、相違を示さなかった。
【実施例8】
【0131】
多病巣前立腺癌におけるERG癌タンパク質の発現マップ
アンドロゲン受容体(AR)に調節される前立腺関連遺伝子(主にTMPRSS2およびそれほどではないにせよ、SLC45A3およびNDRG1)の調節配列ならびにETS遺伝子ファミリー(主にERG)中の核転写因子のタンパク質コード配列を含む一般的な遺伝子融合物は、前立腺腫瘍におけるERGの過剰発現をもたらすことが多い。新たな研究は、前立腺癌(CaP)におけるERGおよびETVの癌原機能を示唆している(Kumar-Sinha, C.ら、2008; Klezovitch, O.ら、2008; Sun, C.ら、2008; Tomlins, S.A.ら、2008; Carver, B.S.ら、2009; King, J.C.ら、2009; Zong, Y.ら、2009に概説されている)。本発明者らの報告を含む以前の研究は、多病巣癌の文脈において遺伝子レベルまたはmRNAレベルでERG遺伝子融合を分析し、これらのデータは、同じ前立腺内で腫瘍間異種性を示した(Clark, J.ら、2007; Barry, M.ら、2007; Mehra R.ら、2007; Furusato, B.ら、2008)。遺伝子融合およびmRNA発現に関する報告は多いにも拘わらず、CaP中のERG癌タンパク質は依然として定義されていない。
【0132】
ERG 42-66エピトープに対するモノクローナル抗体を用いて、多病巣CaPの文脈においてERG癌タンパク質発現を分析した。Center for Prostate Disease Researchプログラムに登録した132人の患者の前立腺全摘出術標本を、標本が外科的に取り出された後30分以内に、病理学者が取得した。前立腺を実施例7に上記されたように全載標本として処理した。各患者から、1〜4個の腫瘍(多くは2個の病巣)を含む1個の全載横断面を選択したところ、腫瘍は様々な等級および段階を示した。各腫瘍を、前立腺全摘出術標本および別々の腫瘍を示した2個以上の腫瘍病巣を有するスライス中で個別に診断した。
【0133】
各腫瘍を個別に測定し、等級付けた。平均で、1個の全載切片(3.5 x 2.5 cmまたは4.0 x 3.5 cm)は、1 mm直径の約800〜1400個の組織マイクロアレイコアに等しい。指標腫瘍に加えて、これらの横断面の多くは、辺縁部および移行帯/尿道近傍部ならびに尿道、前立腺小室、射精管、および精嚢の良性前立腺組織を含んでいた。単一の腫瘍が51個の切片に存在し、複数の個々の腫瘍が81個の切片に存在した。腫瘍等級、病理学的状態、周辺状態および臨床データを表1にまとめる。
【表1】

【0134】
表1:前立腺癌患者の臨床病理学的特徴:(A)前立腺癌患者の人口統計および臨床病理学的特徴(分類)を示す。1pT2r1(x)腫瘍を有する患者のデータはこの分析においては用いなかった。23人の患者(事例番号83、112および132)以外の切片において示された指標腫瘍のGleasonスコアに対応する。3観察された領域での組織学的外見を示す。42つの連続的PSA≧0.2 ng/ml。(B)前立腺癌患者の人口統計および臨床病理学的特徴(続き)を示す。
【0135】
前立腺癌およびPINの両方において、上皮細胞は核染色を示した。ERGは261個の個々の腫瘍のうちの117個(44.8%)において陽性であった(表2)。核ERG染色は、良性上皮細胞中には実際には存在せず、約200,000個の個々の良性腺染色のうちの22個のみがERG陽性であり、これはERG陽性癌腫の検出におけるこのERGモノクローナル抗体の顕著な特異性(>99.9%)を示している(表2)。良性腺の数は、132個の切片を掛けた、このコホートの3つの平均サイズ切片における良性腺の数(平均1550個の良性腺/切片)の計数に基づく見積もり値を表す。
【表2】

【0136】
132個の切片のうち、6個の標本のみが、稀なERG陽性非悪性細胞を示した。3個の標本において、それぞれ単一の群の良性腺(5〜8個の腺の範囲で平均7個の腺)が、癌腫に加えてERGについて陽性であった。3個のさらなる標本において、ERGは、細胞質および核の拡大が増加し、軽度の異型、以前は「低悪性度PIN」と呼ばれた変化を示す天然の腺(3〜5個の腺)の小さい凝集体に存在した。9個の前部/移行帯腫瘍のうちの8個は陰性であった。5つの事例を除いて全ての事例において、85%を超える腫瘍細胞が、細胞質ブラッシュ(blush)に関して中程度から強い核染色を示した。
【0137】
ERG陽性腫瘍病巣を含む85個の評価可能な標本のうちの82個(96.5%)は、ERG陽性前立腺上皮内新生物(PIN)病変を含み、ERG陽性PIN病巣は全てERG陽性腫瘍と同じ位置にあった。PINは前立腺内で生じる前癌状態の増殖である。
【0138】
81個の切片が、複数の腫瘍を含んでいた;これらのうち15個において、全ての腫瘍が陽性であった;31個全てにおいて、腫瘍病巣は陰性であった;35個において、いくつかの腫瘍が拡散的に陽性であり、他は完全に陰性であった。かくして、多病巣腫瘍の文脈においては、81個の切片のうちの50個(61.7%)が1個以上のERG陽性腫瘍を有していた。1個だけの腫瘍を含む51個の切片中、36個(70.6%)がERG陽性であり、これらのうちの2個は陽性領域に包含された完全にERG陰性の腫瘍細胞のクローンを含んでいた。弱い非識別的細胞質染色が、全ての上皮細胞型(前立腺および非前立腺)において観察され、これは細胞系のデータと一致していた。
【0139】
9FY抗体は、全ての内皮細胞(リンパ球/血管内皮細胞)の核においてERGを一貫して検出したが、これはERG-IHCアッセイの固有の陽性対照として役立つ。内皮細胞中でのERG発現も他の文脈で以前に指摘されていたが、その有意性は未だ定義されていない(Baltzinger M.ら、1999; Birdsey, G.M.ら、2008; Ellet, F.ら、2009)。腫瘍細胞の多くがERG陽性核および容易に同定可能な細胞質を有する癌腫とは対照的に、ほとんど識別できない細胞質を含まないか、または含むERG陽性核により、内皮細胞を容易に同定することができる。ERG陰性のあまり分化していない/Gleasonパターン4または5の癌腫においては、内皮細胞の陽性核は一般的には線状の狭い分布を有する。
【0140】
両染性細胞質を有する腫瘍細胞は、薄いか、または泡沫状の細胞質を有するものよりも強く陽性であった。4個のムチン産生腫瘍のうちの3個がERGについて陽性であった。管状成分を有する5個の腫瘍のうちの2個のみがERGについて陽性であった。空胞化した外見/印環様の外見を有する1個の腫瘍がERGについて陽性であった。リンパ上皮種様特徴を有する病巣は陰性であった。
【0141】
前立腺切除術の時点でリンパ節転移を示した7人全ての患者において、ERG発現は指標腫瘍の発現状態を映していた。4個のERG原発腫瘍はERG陽性転移を有し、逆に3個のERG陰性原発腫瘍はERG陰性転移を有していた。FISHアッセイにより、ERG陽性原発腫瘍と対応する転移は同一の融合パターンを示した。
【0142】
尿道前立腺部および尿道周囲前立腺管の基底細胞、尿路上皮細胞は非反応性であった。射精管、精嚢、神経束、線維筋肉間質、微小腺房過形成(類義語:腺症、異型腺腫様過形成)、硬化性腺症、および基底細胞過形成などの腺過形成の変異体は、全てERGについて陰性であった。増殖性炎症性萎縮および進行性萎縮または部分的萎縮などの様々なパターンの萎縮も、ERGについて陰性であった。
【0143】
ERG癌タンパク質状態の関連性を、様々な臨床病理学的特徴を用いて評価した(表1AおよびB)。ERG発現は多くの臨床病理学的特徴との相関を示さなかったが、所与の全載標本切片中の全ての腫瘍病巣を考慮した場合、より高いGleasonスコアの合計およびより少ない分化した腫瘍は、ERG陽性免疫染色との有意な相関を示した(表3)。
【表3】

【0144】
統計分析:ERG癌タンパク質発現の感度および特異性を、132個の全載前立腺中の良性腺から全ての腫瘍病巣を識別するために分析した(227個の腫瘍病巣および200,000個を超える良性腺)。カイ二乗検定またはFisherの直接確率検定を用いて、指標腫瘍ERG癌タンパク質状態と、人種、病理学的T状態、前立腺切除術のGleasonスコアおよび周辺状態などの分類上の臨床病理学的特徴との関連を試験した。また、カイ二乗検定を用いて、ERG癌タンパク質状態と個々の腫瘍の腫瘍分化との関連を試験した。0.05のp値を統計的に有意として採用した。SASバージョン9.2を、全てのデータ分析に用いた。
【0145】
CaPにおける遺伝子融合事象は、一般的にはアンドロゲンにより調節される前立腺関連遺伝子、例えば、TMPRSS2、SLC45A3またはNDRG1の調節配列と共に、ETS遺伝子ファミリー(ERG、ETV1、ETV4-6およびELK4)中の核転写因子のタンパク質コード配列を含むため、得られるタンパク質産物は、ETS関連癌遺伝子転写因子であり、ERGが最も一般的である(Kumar-Sinha, C.ら、2008)。ERG 42-66エピトープに対するモノクローナル抗体は、ERG癌タンパク質の認識において高い程度の特異性および感度を示す。ERG癌タンパク質の陽性核染色は、65%の患者において腫瘍細胞を同定する際に高度に特異的である(>99.9%)。核ERG染色は良性上皮細胞中には実際には存在しない。
【0146】
全部で261個の個々の腫瘍の全体で44.8%がこのコホートにおいてERG陽性であったが、単一の腫瘍を有する51個の標本の70.6%がERG陽性であり、2個以上の腫瘍を有する81個の標本の62%がERG陽性であった。本明細書に記載のCaP標本におけるERG発現の全体の頻度は、ERG座を含む遺伝子融合物の報告された割合と類似している(Kumar-Sinha, C.ら、2008;Clark, J.ら、2007)。さらに、この研究は、CaPにおけるERG変化の頻度を割り当てる際にサンプルの偏りが寄与する可能性を指摘している。
【0147】
一般的には、腫瘍はERG発現について均一に陽性または陰性である。この研究は、ERG陽性PINとERG陽性腫瘍との関連(96.5%)を強調する。他の研究(Kumar-Sinha, C.ら、2008; Cerveiraら、2006; Pernerら、2007)はより低い頻度のERG融合物陽性PIN(15〜20%)を示したが、この研究の全載前立腺切片により、ERG癌タンパク質発現の文脈におけるPINおよび腫瘍のより包括的な評価が可能になる。
【0148】
稀なERG陽性良性腺および低悪性度PINと呼ばれる稀な非定型天然腺は、特に、PINおよび/または癌腫とのそれらの局所的関係の観点から、副形態学的分子変化を担持し得る。この知見は、良性前立腺の稀な事例におけるTMPRSS2-ERG融合転写物の存在を報告する以前の研究(Clark, J.ら、2007; Furusato, B.ら、2008)と一致している。これらの病巣におけるTMPRSS2-ERG融合物の確認は、そのサイズが小さいため困難である。ERG癌タンパク質発現とTMPRSS2-ERG遺伝子融合転写物状態との高い一致率を考慮する場合、ERG過剰発現をもたらす遺伝子融合物の優れた代用マーカーとしてERG IHCを用いることができる。かくして、ゲノムおよびmRNAに基づくアッセイの補完に加えて、42-66エピトープに結合する本明細書に記載の抗体を用いるERG癌タンパク質検出は、CaPにおけるERG変化を評価する際の有意な利点を提供する。例えば、ERGタンパク質コード配列と任意の5'融合パートナー(TMPRSS2、SLC45A3およびNDRG1)の調節配列との遺伝子融合事象の結果生じる翻訳産物(Petrovics, G.ら、2005; Han, B.ら、2008; Pflueger, D.ら、2009)を、ERG-MAbにより検出することができる。実用的な面では、IHCによるERGタンパク質の評価は、「初期段階」の病理設定におけるERG癌遺伝子活性化の形態学的評価にとってより迅速かつ有益であろう。
【0149】
現在用いられている診断マーカーのうち、α-メチルアシル-CoAラセマーゼ(AMACR)は、約80%の前立腺癌および様々な他の癌腫を検出する(Hameed, O.ら、2005)。しかしながら、25〜30%の良性前立腺はAMACRについて染色し得るため、AMACRの特異性はERGのものよりも低い。かくして、診断用IHCパネルにおけるERG 42-66エピトープに結合する抗体の含有は、腫瘍検出の特異性を増加させることができる。内皮細胞中での9FY抗体の強い陽性反応は、従来の内皮細胞マーカー(CD31、CD34、および第VIII因子関連抗原)を用いて以前に評価されたものよりも多くの前立腺中の毛細血管を強調する。ERG発現のこの特徴は、ERG IHC染色の解釈を複雑にすることがある。例えば、腺と密接に接触した毛細血管は、基底細胞染色を示唆し得るか、または反応性内皮を有する拡張した毛細血管は小さい腫瘍腺もしくは萎縮を模倣し得る。しかしながら、この潜在的な複雑さを、ERG陽性血管パターンを認識する経験を介して克服することができる。
【0150】
CaPにおけるERG変化の予測的特徴は未だによく理解されていないが、正および負の両方の関連が報告されている(Kumar-Sinha, C.ら、2008; Clark, J.ら、2007)。ERG癌タンパク質のこの評価において、所与の全載標本切片における全ての腫瘍病巣を考慮に入れた場合、より高いGleasonスコアの合計およびより少ない分化した腫瘍は、ERG免疫染色との相関を示した(表3)。しかしながら、進行との有意な相関はなかった(データは示さない)。多病巣腫瘍の文脈におけるERG発現を考慮すれば、より大きく、より良好な規定のコホートにおけるさらに独立した評価が保証される。
【0151】
まとめると、現在公知のCaPタンパク質生物マーカーのうち、均一で強く、高度に特異的なERG癌タンパク質の検出はCaP診断設定においてかつてない機会を提供する。これらの知見は、患者の2/3における前浸潤性CaPから浸潤性CaPへの変遷の間のクローン選択およびERG陽性腫瘍細胞の増殖におけるERG活性化の役割を具体化する。最後に、前立腺腫瘍生物学におけるERG機能のより良好な理解と共に、将来の前立腺癌のERG-モノクローナル抗体に基づく層別化を、画像化、標的化療法またはアンドロゲン除去療法の効果のモニタリングとの関連で用いることができる。
【0152】
本明細書に引用される全ての特許、特許出願、および公開された参考文献は、その全体が参照により本明細書に組入れられるものとする。本発明をその好ましい実施形態を参照して具体的に示し、説明してきたが、当業者であれば、添付の特許請求の範囲により包含される本発明の範囲から逸脱することなく、形態および詳細の様々な変更を行うことができることを理解できるであろう。
【0153】
参考文献
以下の参考文献が本出願において引用され、本発明の分野に対して一般的な情報を提供し、本出願で考察されるアッセイおよび他の詳細を提供する。以下の参考文献は、その全体が参照により本明細書に組入れられるものとする。
Attard, G. et al. (2008). Oncogene 27, 253-263.
Baltzinger, M. et al. (1999). Dev Dyn 216, 420-433.
Barry, M. et al. (2007). Urology 70, 630-633.
Beach, R. et al. (2002). Am J Surg Pathol 26, 1588-1596.
Birdsey, G.M. et al. (2008). Blood 111, 3498-3506.
Carver, B.S. et al. (2009). Nat Genet 41, 619-624.
Cerveira, N. et al., (2006) Neoplasia 8, 826-832.
Clark, J. et al. (2007). Oncogene 26, 2667-2673.
Egevad, L. (2008). Anal Quant Cytol Histol 30, 190-198.
Ellett, F. et al. (2009). Mech Dev 126, 220-229.
FitzGerald, L.M. et al. (2008). BMC Cancer 8, 230.
Furusato, B. et al. (2008). Mod Pathol 21, 67-75.
Furusato, B. et al. (2008). Prostate Cancer Prostatic Dis 11, 194-197.
Gopalan, A. et al. (2009). Cancer Res 69, 1400-1406.
Gupta, A. et al. (2004). Am J Surg Pathol 28, 1224-1229.
Hameed, O et al., (2005). Am J Surg Pathol 29, 579-587.
Han, B. et al., (2008) Cancer Res 68, 7629-7637.
Hermans, K.G., et al. (2009). Clin Cancer Res 15, 6398-6403.
Hu, Y. et al. (2008). Clin Cancer Res 14, 4719-4725.
Jiang, Z. et al. (2001). Am J Surg Pathol 25, 1397-1404.
King, J.C. et al., (2009). Nat Genet 41, 524-526.
Klezovitch, O. et al. (2008). Proc Natl Acad Sci U S A 105, 2105-2110.
B. S. Knudsen, A. N. et al. (2008). J Mol Diagn 10, 169-176.
Koeffler, H.P., and Golde, D.W. (1978). Science 200, 1153-1154.
Kubo, J. et al. (2003). Am J Pathol 163, 571-581.
Kumar-Sinha, C. et al. (2008). Nat Rev Cancer 8, 497-511.
Larkin, M.A. et al. (2007). Bioinformatics 23, 2947-2948.
Luo, J. et al. (2002). Cancer Res 62, 2220-2226.
McLaughlin, F. et al. (1999). J Cell Sci 112 ( Pt 24), 4695-4703.
Mehra, R. et al. (2007). Cancer Res 67, 7991-7995.
Mehra, R. et al. (2008). Cancer Res 68, 3584-3590.
Minowada, J. et al. (1972). J Natl Cancer Inst 49, 891-895.
Mostofi, F.K. et al. (1992). Cancer 70, 235-253.
Mostofi, F.K. et al. (1993). Cancer 71, 906-932.
Narod, S.A. et al. (2008). Br J Cancer 99, 847-851.
Ng, A.P. et al. (2010). Trisomy of Erg is required for myeloproliferatioon in mouse model of Down syndrome Blood, in press.
Owczarek, C.M. et al. (2004). Gene 324, 65-77.
Perner, S. et al., (2007). Am J Surg Pathol 31, 882-888.
Petrovics, G. et al., (2005). Oncogene 24, 3847-3852.
Pflueger, D. et al. (2009). Neoplasia 11, 804-811.
Quinn, L.A. et al. (1979). Cancer Res 39, 4914-4924.
Rainis, L. et al. (2005). Cancer Res 65, 7596-7602.
Rao, V.N. et al. (1987a). Science 237, 635-639.
Rao, V.N. et al. (1987b). Oncogene Res 2, 95-101.
Reddy, E.S. et al. Proc Natl Acad Sci U S A 84, 6131-6135.
Rubin, M.A. et al. (2002). JAMA 287, 1662-1670.
Saramaki, O.R. et al. (2008). Clin Cancer Res 14, 3395-3400.
Shim et al. (2003). J. Neural Trans. Suppl. 67:39-49.
Sun, C. et al. (2008). Oncogene 27, 5348-5353.
Tomlins, S.A. et al. (2005). Science 310, 644-647.
Tomlins, S.A. et al. (2008). Neoplasia 10, 177-188.
Turner, D.P. and Watson, D.K. (2008). Expert Rev Anticancer Ther 8, 33-42.
Wang et al. Cancer Res. (2008). 68, 8516-24.
Winnes, M. et al., (2007). Oncol Rep 17, 1033-1036.
Yang, X.J. et al. (2002). Am J Surg Pathol 26, 921-925.
Zong, Y., et al. (2009). Proc Natl Acad Sci U S A 106, 12465-12470。
【特許請求の範囲】
【請求項1】
配列番号1のアミノ酸42-66により形成されるエピトープに結合するモノクローナル抗体。
【請求項2】
前記抗体が配列番号2中の3個の相補性決定領域(CDR)を含む軽鎖可変ドメインと、配列番号3中の3個のCDRを含む重鎖可変ドメインとを含む、請求項1に記載のモノクローナル抗体。
【請求項3】
軽鎖可変ドメインが配列番号2のアミノ酸配列を含み、重鎖可変ドメインが配列番号3のアミノ酸配列を含む、請求項2に記載のモノクローナル抗体。
【請求項4】
前記抗体が、配列番号1のアミノ酸配列を有するポリペプチドへの結合についてアミノ酸42-66からなるポリペプチドと競合する、請求項1〜3のいずれか1項に記載のモノクローナル抗体。
【請求項5】
前記抗体が、配列番号2のアミノ酸配列を含む軽鎖可変ドメインと、配列番号3のアミノ酸配列を有する重鎖可変ドメインとを有する抗体の、配列番号1のアミノ酸配列を有するポリペプチドへの結合を競合的に阻害する、請求項1〜4のいずれか1項に記載のモノクローナル抗体。
【請求項6】
生物学的サンプル中のヒトERGまたはヒトERGポリペプチドの全部もしくは一部を含む融合タンパク質を検出する方法であって、請求項1〜5のいずれか1項に記載のモノクローナル抗体と、前記生物学的サンプルとを接触させ、該生物学的サンプルを分析して、該生物学的サンプル中のヒトERGまたはヒトERGポリペプチドの全部もしくは一部を含む融合タンパク質への前記モノクローナル抗体の結合を検出することを含む、前記方法。
【請求項7】
生物学的サンプルが組織または細胞である、請求項6に記載の方法。
【請求項8】
組織または細胞が前立腺組織または前立腺細胞である、請求項7に記載の方法。
【請求項9】
融合タンパク質がTMPRSS2/ERG融合転写物によりコードされるERGタンパク質である、請求項6〜8のいずれか1項に記載の方法。
【請求項10】
ポリペプチドが配列番号1のアミノ酸残基42-66を含む、前記60個以下のアミノ酸残基を有するポリペプチドを含む組成物。
【請求項11】
前記ポリペプチドが40個以下のアミノ酸残基を有する、請求項10に記載の組成物。
【請求項12】
前記ポリペプチドが25個以下のアミノ酸残基を有する、請求項10に記載の組成物。
【請求項13】
アジュバントをさらに含む、請求項10〜12のいずれか1項に記載の組成物。
【請求項14】
前記ポリペプチドに結合したハプテンをさらに含む、請求項10〜13のいずれか1項に記載の組成物。
【請求項15】
製薬上許容し得る賦形剤をさらに含む、請求項10〜14のいずれか1項に記載の組成物。
【請求項16】
請求項10〜15のいずれか1項に記載の組成物を非ヒト哺乳動物に投与し、該非ヒト哺乳動物からB細胞を単離し、B細胞を不死化して、モノクローナル抗体を産生することができる細胞系を作製し、およびERG 42-66エピトープに結合するモノクローナル抗体を選択することを含む、ERG 42-66エピトープに結合するモノクローナル抗体を作製する方法。
【請求項17】
ERGポリペプチドと相互作用する核酸分子またはポリペプチドを同定する方法であって、前記核酸またはポリペプチドを含むサンプルをERGポリペプチドと共にインキュベートし、該サンプルとERGポリペプチドを、請求項1〜5のいずれか1項に記載のモノクローナル抗体と共にインキュベートし、ならびに前記核酸分子とERGポリペプチドとの間または前記ポリペプチドとERGポリペプチドとの間で複合体が形成するかどうかを決定することを含み、抗体との複合体の形成の検出が、前記核酸分子または前記ポリペプチドがERGポリペプチドと相互作用することを示す、前記方法。
【請求項1】
配列番号1のアミノ酸42-66により形成されるエピトープに結合するモノクローナル抗体。
【請求項2】
前記抗体が配列番号2中の3個の相補性決定領域(CDR)を含む軽鎖可変ドメインと、配列番号3中の3個のCDRを含む重鎖可変ドメインとを含む、請求項1に記載のモノクローナル抗体。
【請求項3】
軽鎖可変ドメインが配列番号2のアミノ酸配列を含み、重鎖可変ドメインが配列番号3のアミノ酸配列を含む、請求項2に記載のモノクローナル抗体。
【請求項4】
前記抗体が、配列番号1のアミノ酸配列を有するポリペプチドへの結合についてアミノ酸42-66からなるポリペプチドと競合する、請求項1〜3のいずれか1項に記載のモノクローナル抗体。
【請求項5】
前記抗体が、配列番号2のアミノ酸配列を含む軽鎖可変ドメインと、配列番号3のアミノ酸配列を有する重鎖可変ドメインとを有する抗体の、配列番号1のアミノ酸配列を有するポリペプチドへの結合を競合的に阻害する、請求項1〜4のいずれか1項に記載のモノクローナル抗体。
【請求項6】
生物学的サンプル中のヒトERGまたはヒトERGポリペプチドの全部もしくは一部を含む融合タンパク質を検出する方法であって、請求項1〜5のいずれか1項に記載のモノクローナル抗体と、前記生物学的サンプルとを接触させ、該生物学的サンプルを分析して、該生物学的サンプル中のヒトERGまたはヒトERGポリペプチドの全部もしくは一部を含む融合タンパク質への前記モノクローナル抗体の結合を検出することを含む、前記方法。
【請求項7】
生物学的サンプルが組織または細胞である、請求項6に記載の方法。
【請求項8】
組織または細胞が前立腺組織または前立腺細胞である、請求項7に記載の方法。
【請求項9】
融合タンパク質がTMPRSS2/ERG融合転写物によりコードされるERGタンパク質である、請求項6〜8のいずれか1項に記載の方法。
【請求項10】
ポリペプチドが配列番号1のアミノ酸残基42-66を含む、前記60個以下のアミノ酸残基を有するポリペプチドを含む組成物。
【請求項11】
前記ポリペプチドが40個以下のアミノ酸残基を有する、請求項10に記載の組成物。
【請求項12】
前記ポリペプチドが25個以下のアミノ酸残基を有する、請求項10に記載の組成物。
【請求項13】
アジュバントをさらに含む、請求項10〜12のいずれか1項に記載の組成物。
【請求項14】
前記ポリペプチドに結合したハプテンをさらに含む、請求項10〜13のいずれか1項に記載の組成物。
【請求項15】
製薬上許容し得る賦形剤をさらに含む、請求項10〜14のいずれか1項に記載の組成物。
【請求項16】
請求項10〜15のいずれか1項に記載の組成物を非ヒト哺乳動物に投与し、該非ヒト哺乳動物からB細胞を単離し、B細胞を不死化して、モノクローナル抗体を産生することができる細胞系を作製し、およびERG 42-66エピトープに結合するモノクローナル抗体を選択することを含む、ERG 42-66エピトープに結合するモノクローナル抗体を作製する方法。
【請求項17】
ERGポリペプチドと相互作用する核酸分子またはポリペプチドを同定する方法であって、前記核酸またはポリペプチドを含むサンプルをERGポリペプチドと共にインキュベートし、該サンプルとERGポリペプチドを、請求項1〜5のいずれか1項に記載のモノクローナル抗体と共にインキュベートし、ならびに前記核酸分子とERGポリペプチドとの間または前記ポリペプチドとERGポリペプチドとの間で複合体が形成するかどうかを決定することを含み、抗体との複合体の形成の検出が、前記核酸分子または前記ポリペプチドがERGポリペプチドと相互作用することを示す、前記方法。
【図1】


【図2】


【図3】


【図4−1】


【図4−2】


【図5−1】


【図5−2】


【図5−3】


【図5−4】


【図6】


【図7】


【図8】


【図9−1】


【図9−2】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4−1】


【図4−2】


【図5−1】


【図5−2】


【図5−3】


【図5−4】


【図6】


【図7】


【図8】


【図9−1】


【図9−2】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公表番号】特表2012−525404(P2012−525404A)
【公表日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願番号】特願2012−508630(P2012−508630)
【出願日】平成22年4月28日(2010.4.28)
【国際出願番号】PCT/US2010/032714
【国際公開番号】WO2010/126972
【国際公開日】平成22年11月4日(2010.11.4)
【出願人】(500213720)ザ・ヘンリー・エム・ジャクソン・ファンデイション・フォー・ジ・アドヴァンスメント・オヴ・ミリタリー・メディシン、インコーポレイテッド (5)
【Fターム(参考)】
【公表日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願日】平成22年4月28日(2010.4.28)
【国際出願番号】PCT/US2010/032714
【国際公開番号】WO2010/126972
【国際公開日】平成22年11月4日(2010.11.4)
【出願人】(500213720)ザ・ヘンリー・エム・ジャクソン・ファンデイション・フォー・ジ・アドヴァンスメント・オヴ・ミリタリー・メディシン、インコーポレイテッド (5)
【Fターム(参考)】
[ Back to top ]

