FXRリガンドを使用する線維症の処置
【課題】線維症の予防、処置、および/または逆転の方法、この目的のための薬学的組成物、キットの提供。
【解決手段】胆汁鬱滞性状態には罹患していない患者に対し、ファルネソイドXレセプター(FXR)が発現される器官において引き起こされる線維症を阻害するためのFXRの強力な活性化リガンドの有効量を投与する。
【解決手段】胆汁鬱滞性状態には罹患していない患者に対し、ファルネソイドXレセプター(FXR)が発現される器官において引き起こされる線維症を阻害するためのFXRの強力な活性化リガンドの有効量を投与する。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願)
本願は、2004年3月12日に出願された米国仮特許出願第60/552,865号(その内容は、本明細書中に全体が援用される)に対する優先権を主張する。
【0002】
(発明の分野)
本発明は、線維症の予防、処置、および/または逆転に関する。具体的には、本発明は、線維症性肝疾患を有する患者、線維症性腸疾患を有する患者、または線維症性腎疾患を有する患者(これらの患者はまた、胆汁鬱滞性状態には罹患していない)においてファルネソイドXレセプター(FXR)に対して特異的なリガンドの新規に使用して、FXRが発現される組織における線維症の発症および進行を阻害することに関する。
【背景技術】
【0003】
線維症は、関与する組織の細胞外マトリックスにおけるコラーゲンの過剰蓄積によって特徴付けられる。線維症は、有効な処置が現在は利用可能でない、長期にわたる困難な臨床問題である。コラーゲンの産生は、高度に調節される生理的プロセスであり、このコラーゲン産生の障害は、組織線維症の発症をもたらし得る。線維性組織の形成は、損傷後の治癒という通常の有益なプロセスの一部である。しかし、ある場合には、線維性物質の異常な蓄積は、罹患した組織の正常な機能を深刻に妨害し得るか、または罹患した器官の機能の完全な喪失さえ引き起こし得る。
【0004】
肝線維症は、例えば、顕著な罹病率および死亡率を伴う重大な医学的問題を示す。種々の肝疾患において、慢性損傷は、肝臓が20年間〜30年間もの長きにわたって補償可能な進行性線維症をもたらす。しかし、最終的には、患者は、重篤な線維症および肝硬変に起因する肝不全の症状および徴候を経験し始める。世界中の慢性ウイルス肝炎感染(特に、B型肝炎ウイルスおよびC型肝炎ウイルスによる)は、肝線維症の主要原因を示す。しかし、米国において、慢性アルコール消費が、伝統的に、肝線維症および肝硬変の主要原因であった。現在、一般市民において肥満の有病率が急速に増加しているので、非アルコール性脂肪肝疾患(NAFLD)が、肝線維症に関連する最も蔓延している状態になっており、ここ数年間における肝線維症関連性罹患率および肝線維症関連性死亡率の主要原因になり得る。肝線維症の他の公知の原因としては、寄生虫感染、自己免疫疾患、鉄蓄積症または銅蓄積症、および胆道閉塞が挙げられる。肝線維症は、細胞外マトリックスタンパク質の過剰沈着により特徴付けられる種々の慢性刺激に対する創傷治癒応答として分類され得る。I型コラーゲンが、この細胞外マトリックスタンパク質の中の多くを占める。この過剰な細胞外マトリックスタンパク質沈着は、肝臓の正常な構造を破壊し、器官に対する構造的損傷および機能的損傷をもたらす。未処置のままで放置された場合、肝線維症は、肝硬変へと進行し得、最終的には、器官不全および死亡へとつながる。他の多くの消耗性の疾患および致命的な可能性がある疾患もまた、器官(例えば、腸、腎臓、心臓、および肺)の線維症をもたらす。
【0005】
線維症の間のコラーゲン生成の中心的役割が原因で、多くの研究は、コラーゲン発現および線維芽細胞(コラーゲン合成を担う主要な細胞型である)増殖の調節に焦点を合わせている。肝臓において、肝星細胞(HSC)は、主要な線維原性細胞型である。
【0006】
種々の化合物が、種々の作用機構(コラーゲン発現の抑制を含む)を介して、抗線維症剤として同定されている。例えば、パンテチン(D−ビス−(N−パントテニル−β−アミノエチル)−ジスルフィド)は、肝線維症の阻害のために有効であると報告されている(特許文献1)。ヒドラジン誘導体である安息香酸ヒドラジドは、強力な抗線維症剤であることが示されている(特許文献2および特許文献3)。アンジオテンシンインヒビターを、線維症の進行を阻害するために酸化窒素刺激剤と組み合わせて使用することが、特許文献4および特許文献5に開示されている。特許文献6は、線維症を阻害するために、特定のピリドキサルベンゾイルヒドラゾンまたはそのアナログを使用する方法を、記載する。特許文献7は、線維症および硬化症を処置または予防するための、A1アデノシンレセプターアンタゴニストおよび/またはP2Xプリノセプターアンタゴニストの使用を記載する。より最近には、ソマトスタチンアゴニスト、肝細胞増殖因子(HGF)、カイメースインヒビター、およびIL−13アンタゴニストが、線維症を有効に阻害すると報告されている(特許文献8、特許文献9、特許文献10、および特許文献11)。
【0007】
ファルネソイドXレセプター(FXR)(胆汁酸レセプター(BAR)およびNR1H4としても公知である)は、リガンド活性化転写因子の核レセプタースーパーファミリーのメンバーである。このFXRは、レチノイドXレセプター(RXR)と、胆汁酸ホメオスタシスのために重要なヘテロダイマーレセプターを形成する(非特許文献1;非特許文献2)。FXRは、種々の組織(肝臓、腎臓、腸、結腸、卵巣、および副腎が挙げられる)において発現される(非特許文献1)。
【0008】
保存されたDNA結合ドメイン(DBD)およびC末端リガンド結合ドメイン(LBD)を含むので、FXRは、種々の天然に存在する胆汁酸(主要胆汁酸ケノデオキシグリコール酸(CDCA)およびそのタウリン結合体およびグリシン結合体を含む)に結合し、この胆汁酸によって活性化される(非特許文献3;非特許文献4;非特許文献5)。活性化した際、FXR−RXRへテロダイマーは、標的遺伝子のプロモーター領域に結合し、胆汁酸ホメオスタシスに関与するいくつかの遺伝子の発現を調節する。例えば、肝臓におけるFXRの活性化は、核レセプターの短いヘテロダイマーパートナー(SHP)の直接的誘導を介して、CYP7A(胆汁酸合成における律速段階を触媒する酵素をコードする遺伝子である)の発現低下をもたらす(非特許文献6)。一方、腸におけるFXRの活性化は、胆汁酸結合タンパク質(I−BABP)の発現増加をもたらす。この胆汁酸結合タンパク質は、回腸における胆汁酸の能動輸送に関与する(非特許文献7)。FXRにより調節される遺伝子のより詳細なリストについては、例えば、特許文献12第22〜23頁を参照のこと。
【0009】
胆汁酸ホメオスタシスにおけるFXRの重要性が原因で、FXR活性化リガンドは、種々の胆汁鬱滞疾患および状態(正常な腸肝胆汁流がブロックされているかまたは他の方法で止まっている(例えば、特許文献13および特許文献14を参照のこと)を処置するための使用について提唱されている。
【0010】
いかなる特定の理論に拘束されることも意図しないが、本発明者らは、FXR活性化が、SHPおよび他のFXR標的遺伝子を含む機構を介して、コラーゲン合成および生じる線維症をダウンレギュレートし得ることを示した。従って、FXR活性化リガンドは、FXRが存在する組織および器官(例えば、肝臓、腎臓、腸など)における有効な抗線維症剤である。本開示は、FXR活性化リガンドの以前には未知であった特性についての驚くべき発見に基づいて、線維症を予防、処置および/または逆転するための新規方法を提供する。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】米国特許第4,937,266号明細書
【特許文献2】米国特許第5,374,660号明細書
【特許文献3】米国特許第5,571,846号明細書
【特許文献4】米国特許第5,645,839号明細書
【特許文献5】米国特許第6,139,847号明細書
【特許文献6】米国特許第6,005,009号明細書
【特許文献7】米国特許第6,117,445号明細書
【特許文献8】米国特許第6,268,342号明細書
【特許文献9】米国特許第6,303,126号明細書
【特許文献10】米国特許第6,500,835号明細書
【特許文献11】米国特許第6,664,227号明細書
【特許文献12】国際公開第03/016288号パンフレット
【特許文献13】国際公開第02/072598号パンフレット
【特許文献14】国際公開第03/090745号パンフレット
【非特許文献】
【0012】
【非特許文献1】Formanら、Cell(1995)81:687〜693
【非特許文献2】Luら(2001)J.Biol.Chem.17:17
【非特許文献3】Makishimaら、Scinece(1999)284:1362〜1365
【非特許文献4】Parksら、Science(1999)284:1365〜1368
【非特許文献5】Wangら、Mol.Cell(1999)3:543〜553
【非特許文献6】Schwartzら、Curr.Opin.Lipidol(1998)9:113〜119
【非特許文献7】Kandaら、Biochem.J.(1998)330:261〜265
【発明の概要】
【課題を解決するための手段】
【0013】
(発明の簡単な要旨)
一局面において、本発明は、胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するための方法を提供する。この方法は、
その被験体に対して、ファルネソイドXレセプター(FXR)に対して特異的なリガンドを有効量投与して、FXRが発現される器官において生じ得る線維症を阻害する工程、を包含する。本願方法において使用されるFXRリガンドは、ケノデオキシコール酸(CDCA)でもウルソデオキシコール酸(UDCA)でもない。あるいは、このリガンドは、無細胞FXRアッセイまたは細胞ベースのFXRトランス活性化アッセイにおいて、5μM以下のEC50を有する。好ましい実施形態において、上記リガンドは、1μM以下のEC50を有する。
【0014】
いくつかの実施形態において、上記胆汁鬱滞性状態は、異常に増加した血清中アルカリホスファターゼレベル、異常に増加した血清中γ−グルタミルトランスペプチダーゼ(GGT)レベル、および異常に増加した血清中5’ヌクレオチダーゼレベルを有するものとして規定される。例示的な一実施形態において、上記の異常に増加した血清レベルは、アルカリホスファターゼについては約125IU/Lよりも高く、GGTについては約65IU/Lよりも高く、5’ヌクレオチダーゼについては約17IU/Lよりも高い。他の実施形態において、上記胆汁鬱滞性状態は、異常に増加した血清中アルカリホスファターゼレベル、異常に増加した血清中γ−グルタミルトランスペプチダーゼ(GGT)レベル、および異常に増加した血清中5’ヌクレオチダーゼレベルを有することに加えて、少なくとも1つの臨床症状を呈するものとしてさらに規定される。例示的な一実施形態において、上記臨床症状は、掻痒(itching)(痒み(pruritus))である。
【0015】
いくつかの実施形態において、本発明の方法によって阻害されるべき線維症は、肝線維症、腎線維症、または腸線維症である。他の実施形態において、上記被験体は、胆汁鬱滞状態(例えば、原発性胆汁性肝硬変、原発性硬化性胆管炎、薬物誘発性胆汁鬱滞、遺伝性胆汁鬱滞、または妊娠性肝内胆汁鬱滞)に罹患していない。なお他の実施形態において、上記被験体は、原発性肝臓癌および原発性胆道癌(primary liver and biliary cancer)、転移性癌、敗血症、慢性的完全非経口栄養法、嚢胞性線維症、または肉芽腫性肝疾患(granulomatous liver disease)などの疾患または状態に関連する胆汁鬱滞には罹患していない。
【0016】
いくつかの実施形態において、上記FXRリガンドは、6ECDCA、タウロ(tauro)−6ECDCA、6EUDCA、GW4064、6α−MeCDCA、6α−PrCDCA、フェキサラミン(fexaramine)、またはググルステロン(guggulsterone)である。
【0017】
いくつかの実施形態において、阻害されるべき線維症は、B型肝炎;C型肝炎;寄生虫性肝疾患;移植後の細菌感染、移植後のウイルス感染、および移植後の真菌感染;アルコール性肝疾患(ALD);非アルコール性脂肪肝疾患(NAFLD);非アルコール性脂肪肝炎(NASH);メトトレキサートにより誘発される肝疾患、イソニアジドにより誘発される肝疾患、オキシフェニスタチンにより誘発される肝疾患、メチルドパにより誘発される肝疾患、クロルプロマジンにより誘発される肝疾患、トルブタミドにより誘発される肝疾患、またはアミオダロンにより誘発される肝疾患;自己免疫肝炎;サルコイドーシス;ウィルソン病;ヘモクロマトーシス;ゴーシェ病;III型糖原病、IV型糖原病、VI型糖原病、IX型糖原病、およびX型糖原病;α1アンチトリプシン欠損症;ツェルヴェーガー症候群;チロシン血症;果糖血症;ガラクトース血症;バッド−キアーリ症候群に関連する脈管障害、静脈閉塞病に関連する脈管障害、または門脈血栓症に関連する脈管障害;または先天性肝線維症;などの疾患に関連する肝線維症である。
【0018】
他の実施形態において、阻害されるべき線維症は、クローン病、潰瘍性大腸炎、照射後発生性大腸炎(post−radiation colitis)、または顕微鏡的大腸炎(microscopic colitis)などの疾患に関連する腸線維症である。
【0019】
いくつかのさらなる実施形態において、阻害されるべき線維症は、糖尿病性腎症、高血圧性腎硬化症、慢性糸球体腎炎、慢性移植片糸球体症、慢性腸腎炎、または多発性嚢胞腎などの疾患に関連する腎線維症である。
【0020】
別の局面において、本発明は、胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するためのキットを提供する。この阻害されるべき線維症は、ファルネソイドXレセプター(FXR)が発現される器官において生じる。このキットは、
FXRに対して特異的な有効量のリガンド;および
その患者へのそのリガンドの投与についての適応症、投与量、およびスケジュールを教示する、指示資料(instructional material);
を備える。本願キットにおけるFXRリガンドは、ケノデオキシコール酸(CDCA)でもウルソデオキシコール酸(UDCA)でもない。あるいは、上記リガンドは、無細胞FXRアッセイまたは細胞ベースのFXRトランス活性化アッセイにおいて5μM以下のEC50を有する。好ましい実施形態において、上記リガンドは、1μM以下のEC50を有する。
【0021】
いくつかの実施形態において、上記キットは、肝線維症、腎線維症、または腸線維症を阻害するために使用される。他の実施形態において、上記キットは、FXRリガンド(例えば、6ECDCA、タウロ−6ECDCA、6EUDCA、GW4064、6α−MeCDCA、6α−PrCDCA、フェキサラミン、またはググルステロン)を含む。なお他の実施形態において、本願キットにおけるFXRは、経口投与または静脈内投与のために適切な薬学的組成物中にて提示される。
【図面の簡単な説明】
【0022】
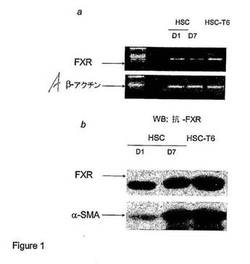
【図1】図1は、HSCの初代培養物およびHSC−T6の初代培養物におけるFXR発現を、RT−PCRによりmRNAレベル(パネルa)で、およびウェスタンブロット分析によりタンパク質レベル(パネルb)で、示す。パネルbはまた、HSC中のFXR量が培養の間に経時的に増加し、その増加は、α−平滑筋アクチン(αSMA)(HSCから筋線維芽細胞様細胞への分化についてのマーカーである)の発現と並行することを示す。
【図2】図2は、HSCにおけるNTCP、BSEP、CYP7A1、およびSHPの発現(パネルa)、ならびにFXRリガンドにより調節されるこれらの遺伝子の発現(パネルb)を示す。図2bにおける定量的RT−PCRの結果は、6−ECDCA(合成FXRリガンド)に対する曝露およびCDCA(天然のFXRリガンド)に対する曝露が、SHP mRNAおよびBSEP mRNAの2倍の増加と、NTCP mRNAおよびCYP7A1 mRNAの50%〜70%の減少とをもたらすことを示す。
【図3】図3aは、RT−PCRの結果および定量的RT−PCRの結果を示す。これは、FXRリガンドである6−ECDCA(1μM)、CDCA(20μM)、またはGW4064(100nM)に対するHSCの曝露が、種々の方法によってα1 mRNA発現を評価することによって測定した場合に、I型コラーゲンの発現を減少することを示す。図3bは、ノーザンブロット分析の結果を示す。この結果により、パネルaの結果が確認される。
【図4】図4は、HSC増殖アッセイの結果を示す。これは、6−ECDCAは、[3H]−チミジン取込み(パネルaおよびパネルb)または細胞計数(パネルc)によって評価した場合に、トロンビン、PDGF、またはTGFβ1により誘導されるHSC増殖を防止しないことを示す。さらに、FXRリガンドは、HSCをアポトーシスへと駆動しない(パネルd)。
【図5】図5は、細胞上清中のヒドロキシプロリン濃度を決定することによって測定した場合に、コラーゲンα1放出のFXRリガンド媒介性阻害を示す(パネルaおよびパネルb)。
【図6】図6は、QRT−PCRおよびノーザンブロット分析によって測定した場合に、HSC−T6におけるSHP過剰発現が、休止HSC−T6におけるα1発現を排除し、トロンビン、TGFβ1およびPDGFにより引き起こされるα1誘導を防止することを、示す。
【図7】図7は、特異的な小さな干渉RNA(siRNA)によるSHP発現排除が、FXRリガンドにより引き起こされるα1 mRNA阻害を逆転させることを示す。SHPのサイレンシングはまた、有糸分裂促進因子(例えば、トロンビン、TGFβ、およびPDGF)で処理したHSCにおいてFXRリガンドにより誘導されるα1発現の阻害を防止する。α1 mRNAに対するSHPの影響を確認するノーザンブロット分析の結果がまた、図7において示される。
【図8】図8は、6ECDCAで処理したBDLラットまたは処理していないBDLラットの肝臓における、コラーゲン沈着レベル、ヒドロキシプロリンレベル、およびα1コラーゲンmRNAレベルを示す。
【発明を実施するための形態】
【0023】
(定義)
「線維症」とは、組織または器官における過度の線維性結合組織(例えば、瘢痕組織)の発生を含む状態を指す。そのような瘢痕組織発生は、疾患、外傷、化学的毒性などに起因する、その器官の感染、炎症、または損傷に応答して生じ得る。線維症は、種々の組織および器官(肝臓、腎臓、腸、肺、心臓などが挙げられる)において発症し得る。
【0024】
用語「阻害する」または「阻害」とは、本明細書中で使用される場合には、疾患または状態の発症もしくは進行に対する、検出可能な何らかの前向きの効果を指す。そのような前向きの効果は、その疾患もしくは状態の少なくとも1つの症状もしくは徴候の開始の遅延もしくは防止、その症状もしくは徴候の改善もしくは逆転、およびその症状もしくは徴候のさらなる悪化の遅延もしくは防止を包含し得る。
【0025】
本明細書中で使用される場合、「胆汁鬱滞状態」とは、肝臓からの胆汁排出が損なわれているかまたはブロックされている任意の疾患もしくは状態を指し、これは、肝臓または胆管のいずれかにおいて生じ得る。肝臓内胆汁鬱滞および肝臓外胆汁鬱滞が、胆汁鬱滞状態の2つの型である。肝臓内胆汁鬱滞(これは、肝臓の内部で生じる)は、原発性胆汁性肝硬変、原発性硬化性胆管炎、敗血症(全身感染)、急性アルコール性肝炎、薬物毒性、完全非経口栄養法(静脈内から給餌される)、悪性腫瘍、嚢胞性線維症、および妊娠において最も一般的に観察される。肝臓外胆汁鬱滞(これは、肝臓の外部で生じる)は、胆管腫瘍、狭窄症、嚢胞、憩室、総胆管における胆石形成、膵炎、膵臓腫瘍、または偽嚢胞、および近傍器官における塊もしくは腫瘍に起因する圧縮によって、引き起こされ得る。
【0026】
胆汁鬱滞状態の臨床的症状および徴候としては、掻痒(itching)(痒み(pruritus))、疲労、黄疸性の皮膚または眼、特定の食物を消化できないこと、悪心、嘔吐、白色便(pale stool)、濃い尿、および腹部の右上部四分の一の痛みが挙げられる。胆汁鬱滞状態の患者は、一組の標準的な臨床実験検査(患者の血清中における、アルカリホスファターゼレベル、γ−グルタミルトランスペプチダーゼ(GGT)レベル、5’ヌクレオチダーゼレベル、ビリルビンレベル、胆汁酸レベル、およびコレステロールレベルの測定が挙げられる)に基づいて臨床的に診断および追跡され得る。一般的に、患者は、診断マーカーであるアルカリホスファターゼ、GGT、および5’ヌクレオチダーゼの3つすべての血清レベルが異常に増加していると見なされる場合に、胆汁鬱滞状態を有すると診断される。これらのマーカーの正常血清レベルは、試験プロトコルに依存して、実験室間および手順間である程度変化し得る。従って、医師は、特定の実験室および試験手順に基づいて、これらのマーカーの各々について何が異常に増加した血液レベルであるかを決定可能である。例えば、胆汁鬱滞状態に罹患している患者は、一般的には、血液中で、約125IU/Lよりも高いアルカリホスファターゼ、約65IU/Lよりも高いGGT、そして約17IU/Lよりも高い5’ヌクレオチダーゼを有する。血清マーカーレベルの変動性が原因で、胆汁鬱滞状態は、上記の症状のうちの少なくとも1つ(例えば、掻痒(itching)(痒み(pruritus)))に加えて、これら3つのマーカーの異常なレベルに基づいて、診断され得る。
【0027】
FXRに対して特異的な「リガンド」とは、FXRに結合しそれによってリガンド依存性FXR転写活性を(いかなるリガンドもない状態で測定されるベースラインレベルとは異なるように)特異的に刺激可能である、天然化合物または合成化合物を指す。本願において、用語「FXRリガンド」は、「FXR活性化リガンド」と互換可能である。
【0028】
用語「有効量」とは、本明細書中で使用される場合、適切な用量を投与された場合に急性治療効果または慢性治療効果を生じる、化合物(例えば、FXR活性化リガンド)の量を指す。この効果としては、疾患/状態(例えば、肝臓、腎臓、または腸の線維症)および関連する合併症の症状、徴候、および基礎となる病理を、何らかの検出可能な程度まで予防、矯正、阻害、または逆転することが挙げられる。正確な量および投与スケジュールは、処置の目的に依存し、公知技術(例えば、Lieberman,Pharmaceutical Dosage Forms(vols.1−3,1992);Lloyd,The Art,Science and Technology of Pharmaceutical Compounding(1999);およびPickar,Dosage Calculations(1999)を参照のこと)を使用して当業者によって達成可能である。
【0029】
用語「器官」とは、細胞および組織からなり、かつ生物において何らかの特定の機能を実施する、分化した構造(心臓、肺、腎臓、肝臓などにおけるようなもの)を指す。この用語はまた、機能を実施するかまたは活性に協力する、身体部分(例えば、眼、および視覚器官を構成する関連構造)を包含する。用語「器官」は、潜在的に完全な構造へと発達可能な、分化した細胞および組織の何らかの部分的構造(例えば、肝臓の葉すなわち部分)をさらに包含する。
【0030】
(発明の詳細な説明)
最初に、ファルネソイドXレセプター(FXR)に対して特異的なリガンド(特に、低濃度でFXRを活性化可能なリガンド)は、胆汁鬱滞状態に罹患していない患者において、組織または器官(例えば、肝臓、腎臓、および腸)における線維症を処置または予防する際に有効であることが示される。
【0031】
いかなる特定の理論にも拘束されないが、本発明者らは、FXRがリガンド依存性様式で直接調節するSHPの作用を主に介して、コラーゲン合成を調節する際にFXRが重要な役割を果たすことを、発見した。従って、この発見によって、(特に、FXRリガンドの使用が以前に示唆された何らかの状態(例えば、胆汁鬱滞状態(FXRリガンドの抗胆汁鬱滞治療効果もまた線維症を間接的に阻害し得る))に罹患してない患者において)FXRが発現される組織における線維症の有効な予防、処置、および/または逆転のためのFXR活性化リガンドの使用が可能になる。
【0032】
(I.患者集団の同定)
本発明は、(1)線維症に罹患しているか、またはFXRが発現される組織もしくは器官において線維症をもたらすことが公知である特定の疾患/状態に罹患している患者;および(2)肝線維症を続発的に引き起こし得る胆汁鬱滞状態に罹患していない患者における、FXRリガンドの予防的使用および治療的使用に関し、そのような患者は、進行中の肝線維症を阻害するため、または肝線維症の発症を予防するために、FXRリガンドで処置される。下記の説明は、患者が本発明による処置のために適切な集団に当てはまるか否かの決定を可能にする。
【0033】
(A.器官におけるFXRの発現)
最初に、器官または組織におけるFXR発現状態を、FXRリガンドがその器官において線維症を有効に阻害するために使用され得るか否かを決定する前に決定しなければならない。FXR発現の検出は、異なる2つのレベル(核酸レベルおよびポリペプチドレベル)にて達成され得る。
【0034】
(1.核酸レベルにおけるFXR発現)
ヒトFXRをコードするポリヌクレオチド配列は、Formanら(Cell 81:687〜93,1995)によって同定されており、GenBank登録番号NM_005123として利用可能である。この情報に基づいて、FXR遺伝子発現は、ヒト患者サンプルにおいて核酸レベルで検出され得る。核酸ハイブリダイゼーション技術を使用して特定のDNAおよびRNAを測定する種々の方法が、一般的に使用される(例えば、SambrookおよびRussel,Molecular Cloning,A Laboraroty Manual(第3版)2001)。ある方法は、電気泳動分離を含む(DNAを検出するためのサザンブロット、およびRNAを検出するためのノーザンブロット)が、DNAまたはRNAの検出は、電気泳動を用いなくても(例えば、ドットブロットによって、または検出が標的組織内で行われるインサイチュハイブリダイゼーションによって)実行され得る。特定の器官の細胞におけるFXRコード核酸の存在はまた、ポリメラーゼ連鎖反応(PCR)またはPCRベースの方法(例えば、リアルタイムPCRおよび逆転写ポリメラーゼ連鎖反応(RT−PCR))によって、配列特異的なプライマーを使用して検出され得る。
【0035】
(2.タンパク質レベルにおけるFXR発現)
器官におけるFXR発現は、この器官に由来する組織サンプルにおけるFXRタンパク質を検出することによって、確認され得る。ヒトFXRのアミノ酸配列は、そのコード配列(例えば、GenBank登録番号NM_51023)に基づいて決定され得、これは、WO00/76523などの公開公報において示される。種々の免疫学的アッセイ(例えば、酵素結合免疫吸着アッセイ(ELISA)、ウェスタンブロット、および免疫組織化学)が、FXR遺伝子産物レベルを測定するために、特に、そのFXRポリペプチドと特異的に反応するポリクローナル抗体またはモノクローナル抗体を使用して、当業者によって使用され得る(例えば、HarlowおよびLane,Antibodies,A Laboratory Manual,Chapter 14,Cold Spring Harbor,1988;KohlerおよびMilstein,Nature 256,495〜497,1975)。そのような技術には、FXRポリペプチドに対する高い特異性を有する抗体またはその抗原性部分を選択することによる抗体調製が必要である。ポリクローナル抗体およびモノクローナル抗体を惹起するための方法は、十分に確立されており、その説明は、文献(例えば、HarlowおよびLane(上記);KohlerおよびMilstein,Eur.J.Immunol.6:511〜519,1976を参照のこと)において見出され得る。
【0036】
(FXRに対する抗体の生成)
対象とする免疫原と特異的に反応するポリクローナル抗体およびモノクローナル抗体を生成するための方法は、当業者にとって公知である(例えば、Coligan,Current Protocols in Immunology,Wiley/Greene,NY,1991;HarlowおよびLane,Antibodies:A Laboratory Manual,Cold Spring Harbor Press,NY,1989;Stilesら編,Basic and Clinical Immunology(第4版)Lange Medical Publications,Los Altos,CAおよびその中に引用文献;Goding,Monoclonal Antibodies:Principles and Practice(第2版)Academic Press,New York,NY、1986;ならびにKohlerおよびMilstein,Nature 256:495〜497,1975を参照のこと)。そのような技術は、ファージまたは同様のベクターにおける組換え抗体ライブラリーから抗体を選択することによって、抗体を調製することを包含する(Huseら、Science 246:1275〜1281,1989;およびWardら、Nature 341:544〜546,1989を参照のこと)。
【0037】
望ましい特異性を有する抗体を含む抗血清を生成するために、対象となるポリペプチド(例えば、ヒトFXR)またはその抗原性フラグメントが、適切な動物(例えば、マウス、ラット、ウサギ、ヤギ、ウマ、またはサル)を免疫するために使用され得る。標準的なアジュバント(例えば、フロイントアジュバント)が、標準的な免疫プロトコルに従って使用され得る。あるいは、その特定のポリペプチドに由来する合成抗原性ペプチドが、キャリアタンパク質に結合体化され得、そしてその後に免疫原として使用され得る。
【0038】
その免疫原調製物に対するその動物免疫応答は、試験採血を採取すること、そして対象抗原に対する反応性力価を測定することによって、モニターされる。その抗原に対する適切に高い力価の抗体が得られた場合、その動物から血液が採取され、抗血清が調製される。その抗原に対して特異的に反応する抗体を濃縮するためのその抗血清のさらなる分画と、その抗体の精製とが、その後実施され得る(HarlowおよびLane(上記)と、上記に提供されるタンパク質精製の一般的説明とを参照のこと)。
【0039】
モノクローナル抗体が、当業者が精通している種々の技術を使用して得られる。代表的には、望ましい抗原で免疫された動物に由来する脾細胞が、一般的には骨髄腫細胞との融合によって、不死化される(KohlerおよびMilstein、Eur.J.Immunol.6:511〜519,1976を参照のこと)。代替的な不死化方法としては、例えば、エプスタイン−バーウイルスによる形質転換、オンコジーンによる形質転換、またはレトロウイルスによる形質転換、あるいは当業者にとって周知の他の方法が挙げられる。単一の不死化細胞から生じるコロニーが、上記抗原に対する望ましい特異性および親和性の抗体生成についてスクリーニングされる。そのような細胞により生成されるモノクローナル抗体の収率は、種々の技術(脊椎動物宿主の腹腔へと注射が挙げられる)によって増強され得る。
【0040】
さらに、モノクローナル抗体はまた、Huseら(上記)によって概略された一般的プロトコルに従ってヒトB細胞cDNAライブラリーをスクリーニングすることによって、望ましい特異性を有する(例えば、ヒトFXRを特異的に認識する)抗体またはそのような抗体の結合フラグメントをコードする核酸配列を同定して、組換え生成され得る。上記で考察された組換えポリペプチド生成についての一般的な原理および方法は、組換え方法による抗体生成に対して適用可能である。
【0041】
(FXR発現を検出するための免疫アッセイ)
一旦、FXRに対して特異的な抗体が利用可能になると、サンプル(例えば、組織の小切片)におけるFXRの存在および量が、当業者に対して定性的結果および定量的結果を提供する種々の免疫アッセイ方法(例えば、ELISAまたはウェスタンブロット)によって測定され得る。一般的な免疫学的手順および免疫アッセイ手順の概説については、例えば、Stites(上記);米国特許第4,366,241号;米国特許第4,376,110号;米国特許第4,517,288号;および米国特許第4,837,168号を参照のこと。
【0042】
((a)免疫アッセイにおける標識化)
免疫アッセイは、上記抗体と標的タンパク質(例えば、ヒトFXR)とによって形成される結合複合体に対して特異的に結合してその結合複合体を標識する、標識化因子を使用する。その標識化因子は、それ自体が、上記抗体/標的タンパク質複合体を含む部分のうちの1つであり得るか、またはその抗体/標的タンパク質複合体に特異的に結合する第三の部分(例えば、別の抗体)であり得る。標識は、分光測定的手段、光化学的手段、生化学的手段、免疫化学的手段、電気的手段、光学的手段、または化学的手段によって、検出可能であり得る。例としては、磁気ビーズ(例えば、DynabeadTM)、蛍光色素(例えば、フルオレセインイソチオシアナート、テキサスレッド、ローダミンなど)、放射性標識(例えば、3H、125I、35S、14C、または32P)、酵素(例えば、西洋ワサビペルオキシダーゼ、アルカリホスファターゼ、およびELISAにおいて一般的に使用される他の酵素)、および比色分析用標識(例えば、コロイド状金、または有色ガラスビーズもしくは有色プラスチック(例えば、ポリスチレン、ポリプロピレン、ラテックスなど)ビーズ)が挙げられるが、これらに限定されない。
【0043】
いくつかの場合、上記標識化因子は、検出可能な標識を保有する二次抗体である。あるいは、この二次抗体は、標識を欠くが、その後、この二次抗体が誘導された種の抗体に対して特異的な第三の標識抗体によって結合され得る。この二次抗体は、第三の標識分子(例えば、酵素標識されたストレプトアビジン)が特異的に結合し得る検出可能な部分(例えば、ビオチン)を用いて改変され得る。
【0044】
免疫グロブリン定常領域に特異的に結合可能な他のタンパク質(例えば、プロテインAまたはプロテインG)もまた、上記標識化因子として使用され得る。これらのタンパク質は、連鎖球菌細菌の細胞壁の通常構成成分である。これらのタンパク質は、種々の種に由来する免疫グロブリン定常領域と強い非免疫原性反応性を示す(一般的には、Kronvalら、J.Immunol.111:1401〜1406(1973);およびAkerstromら、J.Immunol.135:2589〜2542(1985)を参照のこと)。
【0045】
((b)免疫アッセイの形式)
サンプルから対象標的タンパク質(例えば、FXR)を検出するための免疫アッセイは、競合的であっても、非競合的であっても、いずれでもよい。非競合的免疫アッセイは、捕捉された標的タンパク質の量が直接測定されるアッセイである。好ましい「サンドイッチ」アッセイにおいて、例えば、その標的タンパク質に対して特異的な抗体は、その抗体が固定された固体基材に直接結合され得る。その後、その抗体は、試験サンプル中の上記標的タンパク質を捕捉する。そのようにして固定された抗体/標的タンパク質複合体は、標識化因子(例えば、上記のような標識を保有する第二の抗体または第三の抗体)によって結合される。
【0046】
競合アッセイにおいて、サンプル中の標的タンパク質の量は、標的タンパク質に対して特異的な抗体から、サンプル中に存在する標的タンパク質によって置換された(競合して押し退けられた(competed away))、添加された(外因性)標的タンパク質の量を測定することによって、間接的に測定される。そのようなアッセイの代表的例において、その抗体は固定され、外因性標的タンパク質は標識される。その抗体に結合された外因性標的タンパク質の量は、サンプル中に存在する標的タンパク質濃度と逆比例するので、サンプル中の標的タンパク質レベルは、上記抗体に結合してこのように固定された外因性標的タンパク質の量に基づいて、このように測定され得る。例えば、Karlsonら、Lab.Invest.,70:705〜710(1994)を参照のこと。
【0047】
いくつかの場合において、ウェスタンブロット(免疫ブロット)分析が、サンプル中のFXRの存在を検出してそのFXRを定量するために使用され得る。この技術は、一般的には、分子量に基づいてゲル電気泳動によってサンプルタンパク質を分離すること、分離されたタンパク質を適切な固体支持体(例えば、ニトロセルロースフィルター、ナイロンフィルター、または誘導体化ナイロンフィルター)に移すこと、およびそのサンプルを、標的タンパク質に特異的に結合する抗体とともにインキュベートすることを包含する。これらの抗体は、直接標識されてもよいし、またはFXRに対する抗体に特異的に結合する標識化抗体(例えば、標識化ヒツジ抗マウス抗体)を使用して、後に検出されてもよい。例えば、Pinedaら、J.Neurotrauma,18:625〜634(2001);Bowlerら、J.Biol.Chem.277:16505〜16511(2002)を参照のこと。
【0048】
FXRに対する抗体を使用する種々のインサイチュ免疫化学染色法もまた、組織サンプルにおけるFXRの存在を示すために有用である。
【0049】
他のアッセイ形式としては、リポソーム免疫アッセイ(LIA)(これは、特定の分子(例えば、抗体)に結合し、そして封入された試薬もしくはマーカーを放出するように設計された、リポソームを使用する)が挙げられる。この放出された化学物質は次いで、標準的な技術に従って検出される(Monroeら、Amer.Clin.Prod.Rev.5:34〜41(1986)を参照のこと)。
【0050】
さらに、機能的アッセイもまた、組織サンプルにおけるFXRの存在を検出するために実施され得る。FXRの生物学的活性を検出するためのアッセイが、一般的に、後の節において記載されている。
【0051】
(B.線維症の診断)
線維症は、ウイルス感染、細菌感染、炎症、自己免疫疾患、外傷、薬物毒性などに起因する、組織損傷に応答する病態生理学的プロセスである。このプロセスの間に、過度な量のコラーゲンが発現され、線維性物質が、罹患組織の細胞外空間において形成される。従って、線維症は、一般的には、線維症が疑われる器官の生検における線維性組織の特徴的形態に基づいて認識され得る。線維症の存在または線維症発症を検出するための他の手段としては、コンピューター断層撮影(CATまたはCT)スキャン、超音波、磁気共鳴画像化(MRI)、および線維症を示すことが公知である1種以上の血清マーカー(例えば、種々の型のコラーゲン)のレベルにモニタリングが、挙げられる。
【0052】
線維症を診断するための明確な様式もまた、線維症プロセスが生じる器官に依存して変化する。例えば、生検が、ほとんどの器官の線維症を診断するために一般的には有効であり、一方、光ファイバー機器を備える内視鏡(例えば、S状結腸鏡または結腸鏡)は、特定の器官(例えば、腸)の線維症を検出するための、比較的外傷を生じない代替法であり得る。
【0053】
(1.肝線維症を検出するための生検)
所定の期間から生検を得るための標準的手順が、確立されている。例えば、肝臓標本は、予備手術の間に取得され得るが、より頻繁には、皮膚を通して肝臓中に生検針を挿入することによって取得され得る。この手順(経皮肝臓生検と呼ばれる)が実施される前に、局所麻酔を与える。超音波またはCTスキャンが、その検体が取得される異常領域を位置決めするために使用され得る。
【0054】
経静脈的肝臓生検において、カテーテルが、頚部静脈中に挿入され、心臓を通され、肝臓から流れる肝静脈のうちの1つに配置されえる。その後、そのカテーテルの針が、その静脈の壁を通して肝臓中へと挿入される。この手順は、経皮的肝臓生検よりも肝臓を損傷させる可能性が低い。この手順は、出血しやすいヒト(重篤な肝疾患の合併症である)において特に有用である。
【0055】
肝臓生検を得ると、そのサンプルが試験され、そのサンプルにおける線維症の存在およびレベルを示すスコアが与えられる。最も頻繁に使用されるスコア付けシステムとしては、METAVIRスコア付けシステムまたは改変型HAI(ISHAK)スコア付けシステムが挙げられる。Knodellスコア付けシステムはまた、肝臓サンプルを分析するために使用され得る。肝臓サンプルのスコア付けにおいて使用される基準は、十分に確立されており、当業者にとって公知である。例えば、METAVIRシステムは、以下の5つのグレード付けを提供する:F0は、線維症が存在しないことを示す;F1は、隔壁のない門脈線維症を示す;F2は、門脈線維症およびいくつかの隔壁を示す;F3は、肝硬変を伴わない隔壁線維症を示す;F5は、肝硬変の存在を示す。例えば、BedossaおよびPoynard,Hepatology 24:289〜293,1996を参照のこと。
【0056】
生検は、肝線維症の診断のために有用であるばかりでなく、本発明の線維症処置方法/線維症予防方法の有効性を、当該分野で公知の方法論を使用して線維症の進行をモニターすることによって医師が評価するのもまた助け得る。例えば、Poynardら、Lancet 349:825,1997を参照のこと。
【0057】
(2.肝臓線維症についての血清マーカー)
肝線維症の存在および/または重篤度をそのレベルが示し得る、多数の公知の血清マーカーが存在する。従って、確立された方法に従ってマーカー(例えば、ヒアルロン酸、ラミニン、ウンデュリン(undulin)(IV型コラーゲン)、I型コラーゲンからのプロペプチド、II型コラーゲンからのプロペプチド、およびIV型コラーゲンからのプロペプチド、リシルオキシダーゼ、プロリルヒドロキシダーゼ、リシルヒドロキシラーゼ、PIIINP、PICP、コラーゲンVI、テナシン、コラーゲンXIV、ラミニンP1、TIMP−1、MMP−2、α2マクログロブリン、ハプトグロブリン、γグルタミルトランスペプチダーゼ、γグロブリン、総ビリルビン、アポリポタンパク質A1など)を測定する血液検査が、肝臓における線維症の診断および線維症進行にモニタリングのために、有用であり得る。
【0058】
(3.他のマーカー)
さらなるマーカー(例えば、核酸マーカー)が、線維症を検出および/またはモニターするために使用され得る。例えば、Wnt−4が、腎線維症において重要な役割を果たす遺伝子として、研究室の実験において最近示されており、そのmRNA発現は、腎臓における線維性組織において有意に増加される(例えば、Surendranら、J Pediatr.140:119〜24,2002を参照のこと)。この型のマーカーの遺伝子発現の定量的検出は、線維症の診断およびモニタリングにおいて有用であり得る。
【0059】
(C.線維症を発症するリスクが増加した患者の同定)
本発明の方法はまた、線維症発症の予防のため、または発症後の線維症進行の遅延のために、有用であるので、線維症リスクが増加している患者は、本発明の方法を使用して処置するために適切な患者集団に当てはまる。そのような患者は、線維症をもたらすことが公知である特定の疾患および状態の予備診断に基づいて、同定される。以下の節は、これらの疾患および状態のうちのいくつかを診断するための手段を記載する。しかし、人生の後期に患者が線維症を発症するリスクを増加させることが公知であり、かつ医師によって容易に診断され得る、さらなる疾患/状態が存在する。線維症を予防、阻害、または逆転するためにFXRリガンドを用いて、これらの疾患/状態のうちのいずれかに罹患している患者を処置することは、本発明の企図に含まれ、本発明の範囲内にある。そのような処置は、人生の経過を通じて短いことが保証され得る。同様に、所定の疾患/状態を有する所定の患者について保証され、そのような患者を処置することの当業者によって決定される。
【0060】
(1.肝線維症)
以下は、肝線維症を患者が発症するリスクを有意に増加させることが公知である疾患のいくつかの例である:(i)慢性肝臓感染(慢性B型肝炎ウイルス感染および慢性C型肝炎ウイルス感染;住血吸虫症および他の寄生生物肝臓疾患;移植後の細菌感染、移植後のウイルス感染、および移植後の真菌感染が挙げられる);(ii)アルコール性肝疾患;(iii)非アルコール性脂肪肝疾患(NAFLD)または非アルコール性脂肪肝炎(NASH);(iv)薬物誘発性肝疾患および化学物質誘発性肝疾患(メトトレキサートにより誘発される肝疾患、イソニアジドにより誘発される肝疾患、オキシフェニスタチンにより誘発される肝疾患、メチルドパにより誘発される肝疾患、クロルプロマジンにより誘発される肝疾患、トルブタミドにより誘発される肝疾患、およびアミオダロンにより誘発される肝疾患が挙げられる);(v)自己免疫疾患(自己免疫肝炎;サルコイドーシス;およびルポイド肝炎が挙げられる);(vi)先天性代謝異常から生じる蓄積症(ウィルソン病;ヘモクロマトーシス;ゴーシェ病;III型糖原病、IV型糖原病、VI型糖原病、IX型糖原病、およびX型糖原病;α1アンチトリプシン欠損症;ツェルヴェーガー症候群;チロシン血症;果糖血症;およびガラクトース血症が挙げられる);(vii)脈管障害(バッド−キアーリ症候群、静脈閉塞病、および門脈血栓症が挙げられる);ならびに(viii)先天性肝線維症。
【0061】
(B型肝炎)
B型肝炎は、B型肝炎ウイルス(HBV)(ヘパドナウイルス科に属するDNAウイルス)による感染に起因する肝臓の炎症を引き起こす。急性HBV感染は、通常は、回復するが、まれには、急性肝不全にもなり得、時には、慢性感染にもなり得る。この慢性感染は、健常なキャリア状態をもたらし得るか、または線維症から肝硬変およびその合併症(肝臓癌を含む)へと進行し得る。
【0062】
急性B型肝炎は、HBV感染から生じる、初期の、急速に発症する、持続期間が短い疾患である。急性B型肝炎を有する成人のうちの約70%は、ほとんど症状を有さないかまたは全く症状を有さないが、一方、残りの30%は、HBVに対する曝露の2ヶ月間後〜4ヶ月間後に、顕著な症状を発症する。急性B型肝炎の最も一般的な症状は、疲労、食欲喪失、悪心、嘔吐、濃い尿、明るい色の糞便、および肝臓領域一帯にわたる腹部疼痛である。黄疸が、しばしば、これらの他の症状に伴う。
【0063】
慢性B型肝炎の診断は、定義によれば、急性B型肝炎の発症からほんの6ヵ月後に行われ得る。慢性B型肝炎を有するほとんどの個体は、多年の(二十年または三十年までもの)間、無症候性のままである。この時間の間、患者の肝臓血液試験は、通常は、せいぜい軽度に異常であり、肝臓の炎症および瘢痕(すなわち、線維症)が、ゆっくり進行する。しかし、時には、他の点では不活性の慢性B型肝炎を有するこれらの個体は、急性症状の発赤(再活性化)、肝臓血液検査の増加、および肝臓の炎症を発症し得る。これらの発赤は、急性肝炎と類似しており、肝線維症のより急速な進行を引き起こし得る。
【0064】
上記の症状に加えて、B型肝炎の診断は、HBVに対する抗体を検出する血液検査によって確認される。
【0065】
(C型肝炎)
C型肝炎ウイルス(HCV)(フラビウイルス科のメンバーであるRNAウイルス)による感染は、肝臓を冒す最も顕著な健康上の問題のうちの1つである。400万人よりも多くのアメリカ人(米国の人口のうちの1.3%)および世界中で推定17億人(世界中の人口のうちの3%)が、HCVに感染する。このウイルスに最初に感染した個体のうちの約85%は、通常は数十年の間、慢性的に感染する。HCV感染個体のうちの他の15%は、単に急性感染を有するに過ぎない。
【0066】
HCV感染の初めに、患者のうちの約25%だけしか、急性肝炎の特徴的症状を示さない。これらの症状としては、疲労、筋肉痛、食欲不振、および低い発熱(low−grade fever)が挙げられる。まれに、皮膚の黄色化および/または眼の黄色化(黄疸)もまた、生じる。
【0067】
この肝炎が慢性的になると、ほとんどの個体は、無症状のままであり、そしてHCV抗体が検出された場合に、慣用的血液研究を介して診断され得るに過ぎない。十分に補償された疾患において、感染した個体は、慢性感染進行の普遍的特徴であるその進行性の肝臓の炎症、壊死、および線維症にも関わらず、何の症状を示さないかもしれない。他の患者は、疾患の進行の結果として、慢性疲労または断続的疲労、および幸福感の減少を経験し得る。一方、疲労が、比較的軽度の疾患を有する何人かの個体において記載されている。
【0068】
多数の診断検査が、HCV感染のために現在利用可能である。スクリーニング検査が、血液中の抗HCV抗体の存在を決定するためになされる。酵素免疫吸着アッセイ(EIA)は、HCV抗原に対する特異的抗体を測定することによって、HCV感染を診断するための従来の初期スクリーニング検査である。従って、この検査は、抗HCV抗体検査と呼ばれる。肝臓酵素(ALT/AST)および/またはHCVリスクファクターのうちのいずれかが増加している患者は、EIAが陽性である場合に、95%よりも高い確実性でHCVを有すると診断され得る。
【0069】
低いHCV感染リスクを有する個体がEIAによって陽性であると検査された場合に、確認検査が、HCVタンパク質に対する抗体について同様に試験する特殊なアッセイを使用して実施される。このアッセイは、組換え免疫ブロットアッセイ(RIBA)と呼ばれる。
【0070】
HCVは、RNAウイルスであるので、いくつかの診断アッセイは、患者の血液中のHCV RNAの検出に基づく。これらの検査は、分子検査と呼ばれる。なぜなら、これらの検査は、分子レベルでこのウイルスを試験するからである。HCV RNAを測定するための最も一般的な2種類のシステムは、逆転写ポリメラーゼ連鎖反応(RT−PCR)アッセイおよび分枝鎖DNA(bDNA)アッセイである。最近、第三の型のアッセイ(転写媒介性増幅(TMA)と呼ばれる)が、利用可能となっている。
【0071】
(アルコール性肝疾患)
アルコール性肝疾患(ALD)は、アルコールの過剰消費によって引き起こされる慢性肝疾患である。ALDの症状は、通常は、非特異的であり、基礎となる肝臓損傷の重篤度を必ずしも示さない。一般的なALDの症状としては、疲労、悪心および嘔吐、下痢、または腹痛が挙げられる。多くの患者は(進行性肝線維症および毒性によって特徴付けられる進行型ALDを有する患者でさえ)、何の症状も有さないかもしれず、その状態は、肝臓血液検査によって診断されるに過ぎない。代謝障害型ALD(重篤なアルコール性肝炎または肝硬変)のより進行した段階においてのみ、より特異的な肝臓関連症状(例えば、黄疸、腹水、吐血、または脳障害)を有する罹患者が存在する。
【0072】
ALDの診断は、アルコール乱用歴、肝臓損傷の存在および重篤度を示す血液検査に基づいて、確立される。肝臓の超音波スキャンは、疾患の重篤度を評価すること、および類似する症状を有する他の状態を排除することを、助け得る。肝臓生検は、ALDの存在おおび病期を決定するための最も信頼できる手段である。
【0073】
(非アルコール性脂肪肝疾患)
非アルコール性脂肪肝疾患(NAFLD)は、単純な脂肪肝(脂肪症)から、非アルコール性脂肪肝炎(NASH)から肝硬変に及ぶ範囲の、広範な肝臓疾患を指す。NAFLDの病期はすべて、共通して、肝細胞における脂肪蓄積を有する。NASHにおいて、この脂肪蓄積は、種々の程度の肝臓の炎症(肝炎)および瘢痕(線維症)に関連する。NAFLDおよびNASHは、過剰な量のアルコールを生じない個体において生じる。しかし、多くの点において、NAFLD生検の組織学的写真は、アルコール乱用によって引き起こされる肝疾患において観察され得るものと類似する。NAFLDおよびNASHは、主要な脂肪肝疾患と見なされる。続発性脂肪肝疾患としては、他の型の肝疾患において生じる脂肪肝疾患が挙げられる。このように、アルコール性肝疾患(ALD)は、最も頻繁な続発性脂肪肝疾患である。続発性脂肪肝はまた、慢性C型肝炎ウイルス(HCV)、慢性B型肝炎ウイルス(HBV)、慢性自己免疫肝炎(AIH)、およびウィルソン病においても生じ得る。
【0074】
NAFLDの症状と、NASHの症状とは、同じである。これらは、通常は、劇的ではなく、非特異的である(他の疾患においても観察され得る)傾向がある。その症状は、ほとんどの患者において最小限である。しかし、この患者は、時に、腹部の右上部四分の一の痛みを漠然と経験し得る。この疼痛は、特徴的には、鈍くかつうずき、予測可能な発生パターンを有さない。この疼痛は、例えば胆石の場合に生じ得るように、強く突然のひどい痛みではない。NAFLDおよびNASHにおける腹部疼痛は、肝臓が拡大する場合および/または肝臓に炎症が存在する場合の、肝臓被膜(膜)の伸長に起因すると考えられる。ALD、B型肝炎、またはC型肝炎とは対照的に、重篤な急性肝不全の症状(例えば、黄疸、激しい疲労、食欲喪失、悪心、嘔吐、および錯乱)は、NAFLDでもNASHでも観察されない。肥満および関連状態(例えば、糖尿病、高血圧)は、NAFLDまたはNASHに罹患しているヒトにおいて頻繁に観察される。インスリン抵抗性の古典的徴候が、しばしば、NAFLDおよびNASHにおける身体検査を支配する。黒色表皮症(腋および頚部の皮膚の黒色色素沈着)は、インスリン抵抗性の徴候であり得、そしてNASHの小児において頻繁に観察される。肝臓が触診された場合、肝臓は、通常は正常に感じられる。しかし、非常に大量の脂肪が肝臓に蓄積した場合、肝臓は、極めて大きくなり得、医師によって容易に感じられ得る軟らかく丸い縁を有するようになり得る。
【0075】
上記の症状に加えて、NAFLDまたはNASHの診断は、以下の基準に基づいてなされる:慢性的に増加したALT;超音波における脂肪肝の徴候、ALT増加に関する他の原因の排除、および脂肪肝。しかし、肝臓生検のみが、明確な診断を確立し得、そしてNAFLDまたはNASHの重篤度を決定し得る。
【0076】
(寄生生物肝疾患)
種々の寄生生物疾患は、肝臓を損傷させて線維症に到るかまたは肝硬変にまでも到ることが、公知である。肝吸虫症は、例えば、肝吸虫Clonorchis sinensisによる感染である。この寄生生物に最初に感染した患者は、通常は、寄生虫負荷(load)が500を超えるまでは症状を有さない。一般的症状は、悪寒、下痢、発熱、下腹部痛、黄疸、および肝臓腫脹である。この疾患を診断するためには、病歴(食事に関する質問、旅行に関する質問、以前に滞在していた地域に関する質問を含む)が、問診されるべきである。身体検査は、肝臓の丁寧な触診を含むべきである。さらなる検査は、内視鏡検査、および卵についての糞便サンプルの検査を含む。
【0077】
O.tunuicollis(O.felineus)およびO.viverriniは、Clonorchisに対して近縁である他の2種の寄生生物であり、持続的肝臓損傷をもたらし得る。その診断方法は、上記の方法と同様である。卵と成体寄生虫との形態比較が、これらの寄生生物による感染を区別するために必要である。
【0078】
住血吸虫症は、住血吸虫(汚染された水と接触するヒトに寄生する吸虫綱吸虫類である)によって引き起こされる、肝臓、胃腸管、および膀胱の別の寄生生物疾患である。
【0079】
ヒトにおいて疾患を引き起こす3つの主要な種のこれらの吸虫綱吸虫類(吸虫類)−Schistosoma haematobium、S.japonicum、およびS.mansoni−が存在する。感染後数日以内に、患者は、発疹または皮膚掻痒を発症し得る。発熱、咳、および筋肉痛が、感染1〜2ヶ月以内に始まり得るが、ほとんどのヒトは、感染初期には症状を有さない。これらの寄生生物の卵は、肝臓へと移動するかまたは腸もしくは膀胱へと達する。まれに、卵が、脳または脊髄において見出され、発作、麻痺、または脊髄炎症を引き起こし得る。多年にわたって繰り返し感染するヒトについて、この寄生生物は、肝臓、腸、肺、および膀胱に損傷を与え得る。
【0080】
住血吸虫症の診断は、卵および/または成体寄生生物に関する、患者の糞便または尿のサンプルの検査を含む。血液検査が、この寄生生物に対する抗体を検出するために開発されている。汚染された水に対して曝露された可能性を反映する病歴もまた、適切な診断を行うために有益である。
【0081】
(自己免疫肝炎)
自己免疫肝炎(ルポイド肝炎としても公知である)は、肝臓の正常細胞を外来組織または病原体と間違える免疫細胞によって引き起こされる肝臓の炎症を含む。自己免疫肝炎を有するヒトは、血流中を循環する自己抗体を有し、この自己抗体は、免疫系に肝臓を攻撃させる。この疾患は、他の自己免疫疾患(甲状腺炎、1型糖尿病、潰瘍性大腸炎、溶血性貧血、および増殖性糸球体腎炎が挙げられる)に関連する。
【0082】
自己免疫肝炎の症状としては、濃い尿、食欲喪失、疲労、全身の不快感、不安、または病気の感覚(倦怠感)、腹部膨満、全身の痒み、白色便または粘土色の糞便、悪心、および嘔吐が挙げられ得る。
【0083】
診断は、いくつかの基準(例えば、慢性肝炎および線維症を示す肝臓生検、異常な肝機能検査、ならびに自己免疫肝炎に関連する検査(例えば、陽性抗核抗体、陽性抗平滑筋抗体、陽性抗肝腎ミクロソーム抗体、陽性抗ミトコンドリア抗体、沈降速度増加、血清IgG増加))に基づいて、なされ得る。
【0084】
(サルコイドーシス)
肝臓を冒す別の自己免疫疾患が、サルコイドーシスである。サルコイドーシスは、広範囲の身体組織において発症する慢性炎症に起因して、小さい塊すなわち肉芽腫を引き起こす疾患である。サルコイドーシスは、ほぼすべての身体器官において生じ得るが、最も頻繁には、肺またはリンパ節において始まる。サルコイドーシスはまた、眼、肝臓、および皮膚を冒し、それ程頻繁ではないが、脾臓、骨、関節、骨格金、心臓、および中枢神経系(例えば、脳および脊髄)を冒す。大多数の症例において、肉芽種は、処置によって治癒するか、または処置なしで治癒する。肉芽種が治癒せず消失しない症例において、その組織は、炎症したままで線維性になる傾向がある。
【0085】
(新生児肝疾患)
新生児肝疾患は、新生児期間(すなわち、人生の最初の60日間)に新生児において生じる重篤な肝障害を指す。可能性があるこれらの障害の原因としては、ウイルス感染、遺伝性代謝病、新生物、および脈管の問題が挙げられ得る。罹患した幼児は、頻繁に、黄疸を有し、体重が増加せず正常に成長せず、そして膨張した肝臓および脾臓を有する。その幼児は、適切な成長のためのビタミンを吸収できない。
【0086】
上記の症状に加えて、新生児肝疾患の診断は、特にその状態がウイルス感染によって引き起こされたものではない場合に、肝臓生検によって補助される。
【0087】
(ウィルソン病)
ウィルソン病は、身体に過剰な銅が蓄積する、遺伝性常染色体劣性障害である。銅の蓄積は出生児に始まるが、この障害の症状は、それよりも後の人生において6歳〜40歳に現れる。ウィルソン病の診断的特徴は、カイザー−フライシャー輪(角膜の縁の周知の深銅色の輪)と呼ばれるものである。これは、眼における銅沈着物を示す。
【0088】
ウィルソン病患者のうちの約40%についての最も顕著な臨床的結果は、肝臓疾患である。他の患者において、最初の症状は、神経学的症状もしくは精神医学的症状、またはその両方であり、その症状としては、震え、硬直、流涎、発話困難、急激な人格変化、極めて不適切な挙動、および学校もしくは仕事の成績の不可解な低下、神経症、または精神病が挙げられる。
【0089】
ウィルソン病はまた、変異した遺伝子(13番染色体の13q14.3−q21.1に位置決めされている)の両方のコピーを同定するために遺伝学的検査によって診断され得る。
【0090】
(ヘモクロマトーシス)
ヘモクロマトーシスは、鉄の過剰な身体蓄積の遺伝的障害である。これは、白色人種において一般的であり、ヨーロッパ人の先祖を有する400人中約1人の個体が罹患する。ヘモクロマトーシスの患者は、その食事から過剰量の鉄を吸収し、この鉄が、肝臓、骨髄、膵臓、皮膚、および精巣に経時的に蓄積されると考えられる。
【0091】
初期ヘモクロマトーシス患者は、症状を有さない。この疾患は、血中鉄レベル増加に慣用的血液検査によって気付いた時に発見され得る。男性において、症状は、40歳〜50歳まで現れないかもしれない。皮膚における鉄沈着物は、皮膚の黒ずみを引き起こす。女性は、月経での血液喪失を介して鉄を失うので、女性は、男性よりも平均して15年〜20年間遅く、鉄蓄積からの器官損傷を発症する。
【0092】
下垂体および精巣における鉄沈着物は、精巣の収縮およびインポテンスを引き起こす。膵臓における鉄沈着物は、インスリン産生の低下を引き起こし、これは、真性糖尿病を生じる。心筋における鉄沈着物は、心不全および異常な心リズムを引き起こし得る。肝臓における鉄蓄積は、肝臓の瘢痕形成(線維症および肝硬変)ならびに肝臓癌発症リスクの増加を引き起こす。
【0093】
ヘモクロマトーシスについての初期スクリーニングは、血中鉄レベルおよび血中フェリチンレベルのついての検査を含む。後者は、身体に貯蔵される鉄の量の指標として役立つ血中タンパク質である。血中鉄レベルおよび血中フェリチンレベルは、ヘモクロマトーシス患者において高い。フェリチンはまた、特定の感染症(例えば、ウイルス肝炎および身体中の他の炎症)において上昇し得るので、フェリチン増加のみでは、ヘモクロマトーシスを正確に診断するためには十分ではない。
【0094】
ヘモクロマトーシスについての最も正確な検査は、生検によって得られる肝臓組織の鉄含有量を測定することである。生検は、分析用の肝臓組織サンプルの取り出しを含み、これは通常は、局所麻酔下で針を用いて実施される。皮膚組織およびその下の組織を麻痺させた後、医師は、時には、超音波の案内の下で、右下部胸郭を通して肝臓中に針を挿入する。その針によって得られた組織は、肝臓損傷または肝硬変について、顕微鏡下で研究される。肝臓中の鉄の量は、通常は、ヘモクロマトーシスにおいて顕著に増加する。
【0095】
最後に、遺伝的検査は、ヘモクロマトーシスの診断を有効に確認し得る。遺伝的ヘモクロマトーシスの遺伝子(HFE)が、1996年において同定された。この遺伝子は、北部ヨーロッパ人の先祖を有する患者のうちの90%の血液検査において同定され得る。
【0096】
(グリコーゲン蓄積症)
グリコーゲン蓄積症(GSD)(糖原病としても公知である)は、グリコーゲン代謝を調節する酵素に関与する遺伝的に連鎖する代謝障害であり、組織における異常な型の一定量のグリコーゲンの蓄積によって特徴付けられる。GSDは、しばしば、患者の新生児期または小児において、初期にその症状を示す。しかし、いくつかの場合において、成人期まで、または老齢になるまで、検出されないままであり得る。型によって変動して、代表的には医師にGSDを疑わせる4種の主要な症状が存在する:低血糖、肝臓腫脹、成長遅延、および異常な血液生化学プロフィール。決定的な診断は、罹患器官の生検によって得られ、その生検サンプルは、そのグリコーゲン含量について検査され、そして酵素活性についてアッセイされる。より容易に入手可能なサンプル(例えば、血液または皮膚)からある種のGSDを診断するための、DNAベースの技術が存在する。これらのDNA技術はまた、出生前検査のために使用され得る。
【0097】
特定の型のGSDにおいて、グリコーゲン代謝の破壊は、しばしば、異常な代謝副産物の蓄積をもたらし、これは、肝臓および腎臓などの器官を損傷させ得る。すべてのGSDの中で、III型、IV型、VI型、IX型、およびX型は、肝線維症の発症に最も関連する。
【0098】
III型コラーゲン蓄積症(コーリ病)は、脱分枝酵素(限界デキストリン型の多糖の蓄積を引き起こす、アミロ−1,6−グルコシダーゼ)が存在しないことによって特徴付けられる。肝臓および筋肉において蓄積されるグリコーゲンの構造は、異常であり、その量は、顕著に増加する。最も顕著であるのは、そのグリコーゲンの短い外分枝であり、従って、この異常なグリコーゲンのほんの小さな部分は、接近可能なグルコース供給源として機能的に活性である。この障害の症状としては、肝臓の腫脹、低血糖症、ケトーシス、尿酸過剰血症、高脂血症などが挙げられる。この疾患に罹患している若年者において、成長が損なわれ、思春期がしばしば遅れ、骨が骨粗鬆症によって弱められ得る。血小板もまた、影響を受け、頻繁な鼻血および容易に挫傷すること(bruising)が、一般的である。主要な症状は、加齢に伴って改善するが、20歳〜30歳よりも後には、肝臓腫瘍、慢性腎疾患、および通風が現れ得る。この状態の診断は、上記の症状に基づき、そのグリコーゲン構造の検査によって確認される。
【0099】
IV型グリコーゲン蓄積症(アンダーセン病)は、分枝酵素(α−1,4→α−1,6)が存在しないことによって特徴付けられ、IV GSDにおいて構築されるグリコーゲンは、非常に長い外分枝を有して不溶性であるという結果になる。異常なグリコーゲンが細胞中に蓄積すると、細胞死は、器官損傷をもたらす。GSD IVを有して生まれた乳児は、出生児には正常であるように見えるが、腫脹した肝臓と1年以内に生き延びられないこととによって診断される。最初の誕生日よりも長く生きる乳児は、3歳〜5歳までに肝硬変を発症し、慢性肝不全の結果として死ぬ。この疾患の診断は、特徴的な異常なグリコーゲン構造の検出によって補助される。
【0100】
VI型グリコーゲン蓄積症(エール病)は、肝ホスホリラーゼ欠損によって引き起こされる。この肝ホスホリラーゼ欠損は、グリコーゲン分解の最初の工程をブロックする。他のほとんどのGSD(常染色体変異を含む)とは対照的に、VI型GSDは、X染色体に連鎖する。この疾患において、ホスホリラーゼ欠損は、肝臓におけるグリコーゲン量の増加をもたらす。症状としては、肝臓の腫脹、低血糖症、ケトーシス、尿酸過剰血症、高脂血症などが挙げられる。低血糖は、重要な症状のうちの1つである。軽い成長の遅れが、罹患した若年者において生じ得る。
【0101】
IX型グリコーゲン蓄積症は、肝グリコーゲンホスホリラーゼキナーゼ(PhK)欠損によって引き起こされ、IX型グリコーゲン蓄積症の症状は、VI型GSDに非常に類似している。主要な違いは、その症状は、重篤ではないかもしれず、筋肉における運動に関連する問題(例えば、疼痛および痙攣)も含み得ることである。その症状は、思春期の後に、適切な処置によって軽減する。GSD IXのほとんどの症例は、X染色体に関連し、従って、男性を冒す。酵素的検査およびグリコーゲン含量測定は、決定的な診断を提供する。
【0102】
グリコーゲンホスホリラーゼを活性化して種々の組織におけるグリコーゲン分解を刺激させる酵素(PhK)は、種々のGSD IXサブタイプの原因である4つの異なるサブユニット(αβγδ)から構成される四量体酵素である。これらのサブタイプは、罹患した組織(肝臓/筋肉/RBC/心臓組織)と遺伝形質様式の両方が異なる。αサブユニット、βサブユニット、およびγサブユニットの遺伝子は、クローニングされており、X染色体(α)、染色体16q12(β)、および染色体7q12(γ)にマッピングされている。
【0103】
PhK欠損の最も一般的な形態は、X連鎖形態であり、この形態は、主に肝臓を冒す。臨床的には、この形態のPhK欠損を有する患者は、肝腫を有する乳児、軽度低血糖症を有する乳児、成長遅延を有する乳児、高脂血症を有する乳児、高ケトン症(hyperketosis)を有する乳児、および運動発達遅延を有する乳児において、存在する。これらの症状は、加齢とともに改善し、成人患者は、正常な状態および正常な肝臓を有する。
【0104】
常染色体劣性形態のPhK欠損は、変異がその酵素のαサブユニットに存在しているかまたはβサブユニットに存在しているかに依存して、肝臓および筋肉の両方に影響を与える。症状は、筋肉痙攣を伴う軽度の筋障害から、重篤な筋障害形態までの範囲に及び得る。
【0105】
X型グリコーゲン蓄積症は、環状アデノシン一リン酸(AMP)依存性ホスホグリセレートムターゼの欠損によって引き起こされる常染色体劣性疾患であり、GSD VIおよびGSD IXと同様の症状を示す。この状態に関与する遺伝子は、染色体7p12−p13にマッピングされている。
【0106】
(α1−アンチトリプシン欠損症)
α1−アンチトリプシン欠損症は、正常レベルよりも低いレベルのα1−アンチトリプシンが肺において存在する、遺伝性疾患である。α1−アンチトリプシンは、肝臓において生成された後に血流中に放出されるタンパク質である。正常な肺において、α1−アンチトリプシンは、好中球エラスターゼの有害な影響から肺を保護する。α1−アンチトリプシン欠損症に罹患している患者において、好中球エラスターゼによる肺組織に対する損傷は、気腫および呼吸困難をもたらし得る。この障害の最も顕著な症状は、日常活動の間に呼吸が短いことである。この疾患に関連する肝疾患としては、初期発症する肝疾患(例えば、肝炎または新生児黄疸)または後期発症する肝疾患(例えば、肝硬変および原発性肝臓癌(肝細胞癌))が挙げられる。
【0107】
α1−アンチトリプシン欠損症は、呼吸の短さおおび慢性的咳などの症状に基づいて診断され得る。α1−アンチトリプシンレベルについての血液検査および肺機能検査もまた、その診断を補助し得る。この疾患は、常染色体劣性変異によって引き起こされるので、最も決定的な診断は、遺伝子検査の結果に基づく。
【0108】
(ゴーシェ病)
ゴーシェ病は、酵素グルコセレブロシダーゼにおける遺伝的欠損によって引き起こされる。この酵素は、化学物質グルコセレブロシドを身体が分解するのを補助する。ゴーシェ病患者におけるこの欠損酵素は、脾臓、肝臓、およびリンパ節におけるグルコセレブロシドの蓄積をもたらす。ゴーシェ病は、アシュケナージユダヤ人(ヨーロッパ出身のユダヤ人)において最も一般的であるが、変化形が、すべての民族グループにおいて記載されている。この疾患の明確な型に依存して、罹患した患者は、種々の程度の症状を有し得る。ゴーシェ病の最も頻繁な初期徴候は、脾臓の腫脹である。関連する疲労、貧血、および血小板数の少なさが、存在し得る。重篤な骨の病変(bone involvement)は、腰、肩、および脊椎の骨の痛みおよび崩壊(無菌壊死)をもたらし得る。貧弱な肺および脳の機能が、そして発作さえもが、生じ得る。
【0109】
ゴーシェ病の診断は、線維芽細胞の活性のβ−グルコセレブロシダーゼの活性が測定される特別な検査によって確認される。ゴーシェ病の患者は、正常レベルの15%未満のグルコセレブロシダーゼしか有さない。この疾患の遺伝的性質によって、遺伝子検査に基づく診断もまた可能である。
【0110】
(ツェルヴェーガー症候群)
ツェルヴェーガー症候群は、肝臓、腎臓、および脳の細胞におけるペルオキシソームの減少またはペルオキシソームが存在しないことによって特徴付けられる、遺伝的障害(脳肝腎症候群とも呼ばれる)である。ツェルヴェーガー症候群は、白質萎縮症と呼ばれる一群の障害のうちの1つである。それらの一群の障害は、すべて、ミエリン鞘(脳の中の神経線維に対する絶縁体として作用する脂肪の覆い)を冒す。ツェルヴェーガー症候群の最も一般的な特徴としては、腫脹した肝臓、高レベルの血中鉄および血中銅、ならびに視力障害が挙げられる。罹患した乳児には、出生前成長不全を示すものもあり得る。出生児の症状としては、筋肉の緊張の欠如、および運動不能が挙げられ得る。他の症状としては、異常な顔の特徴、精神遅滞、発作、および吸い込みおよび/嚥下ができないことが、挙げられ得る。黄疸および胃腸出血もまた、生じ得る。
【0111】
この疾患は、ペルオキシソーム形成に関与するいくつかの種々の遺伝子のうちのいずれかにおける変異によって引き起こされる。これらの遺伝子は、少なくとも2つの異なる染色体位置(第2染色体(領域2p15)および第7染色体(領域7q21−22)に存在する。従って、その診断は、遺伝子検査によって確認され得る。
【0112】
(チロシン血症)
遺伝性チロシン血症は、新生児期における重篤な肝疾患に関連する代謝の先天性遺伝子異常である。この疾患は、常染色体劣性様式で遺伝される。その疾患の臨床的特徴は、2つの分類に分かれる傾向がある:この疾患の急性形態において、異常は、人生の最初の月に現れる。乳児は、貧弱な体重増加、肝臓腫脹および脾臓腫脹、膨張した腹部、脚の腫脹、および出血傾向(特に、鼻血)の増加を示し得る。黄疸が顕著であるかもしれないし、顕著ではないかもしれない。より慢性的な形態のチロシン血症において、肝臓の拡大および脾臓の拡大が、顕著であり、腹部が、液体で膨張し、体重増加は乏しいものであり得、嘔吐および下痢が頻繁に生じる。罹患した患者は、通常は、肝硬変およびその合併症を発症する。老齢の患者において、増加した肝臓癌リスクが存在する。
【0113】
この疾患を診断する際に、肝臓検査が、しばしば使用される。低い血清アルブミンおよび低い血清凝固因子が、頻繁に見出される。肝臓の酵素であるトランスアミナーゼは、軽度〜中程度に増加し得るが、ビリルビンが、種々の程度まで増加する。その生化学的欠損が原因で、異常な生成物が、尿において測定され得、これによって診断を確認する。これらは、パラヒドロキシフェニル酢酸およびパラヒドロキシフェニルピルビン酸である。さらに、スクシニルアセトンおよびスクシニルアセトアセテートが、尿において見出される。低血糖症および尿において特定物質(糖、タンパク質、およびアミノ酸が挙げられる)が損失している証拠が、存在し得る。基本となる生化学的欠損は、必須アミノ酸であるフェニルアラニンの代謝における重要な酵素の異常である。この酵素は、フマニルアセトアセテートヒドロラーゼ(FAH)であり、これが、罹患患者において顕著に減少される。出生前診断が、可能であり、羊水中のスクシニルアセトンまたは羊水細胞中のフマニルアセトアセテートヒドロラーゼ(FAH)を測定することによって、実施され得る。
【0114】
(果糖血症)
果糖血症(フルクトース不耐症またはフルクトースアルドラーゼB欠損症としても公知である)は、酵素1−ホスホフルクトアルドラーゼ(すなわち、フルクトースアルドラーゼB)が存在しないことによって引き起こされる代謝病である。遺伝性フルクトース不耐症は、常染色体劣性疾患として遺伝される。これは、いくつかのヨーロッパの国々においては、20,000人中1人程度の一般性であり得る。フルクトース不耐症において、フルクトース(果糖)およびスクロース(甘藷糖または甜菜糖、グラニュー糖)の摂取は、複雑な化学変化を生じ、この変化は、酵素1−ホスホフルクトアルドラーゼが存在しないことが原因で修正され得ない。フルクトースの摂取は、顕著な低血糖症および進行性肝損傷を引き起こす。この状態の診断は、フルクトース不耐症の症状、フルクトースアルドラーゼBレベルを測定する検査結果、および上記遺伝子における変異を同定するための遺伝子分析に基づく。
【0115】
(ガラクトース血症)
ガラクトース血症は、乳児における肝硬変のみならず、より重篤には、迅速に診断されない場合には早くにひどくなる病気ももたらす稀な遺伝性の疾患である。この疾患は、上昇した血中ガラクトースレベル(これは、肝臓の酵素であるGALT(ガラクトース−1−ホスフェートウリジルトランスフェラーゼ)の欠損から生じ、その代謝に必要とされる)によって引き起こされる。ガラクトース血症は、常染色体劣性形質として遺伝する。この疾患には2つの型があり、それは、GALT欠損(古典的ガラクトース血症)およびガラクトースキナーゼ欠損である。2つのうち、GALT欠損は、最も重篤である。このGALT遺伝子は、染色体9pl3に存在する。
【0116】
ガラクトース血症に罹患した人々は、単純な糖であるガラクトースを代謝できない。ガラクトース血症に罹患した乳児が乳を与えられると、その乳児の系の中でガラクトースが増え、肝臓、脳、腎臓および目に損傷を引き起こす。ガラクトース血症に罹患した患者は、いかなる形態の乳にも(ヒトでもそうでなくても)耐性がなく、いかなる他のガラクトース含有食品にも耐性がない。乳製品に曝露すると、肝臓損傷、精神遅滞、白内障の形成および腎不全を生じる。代表的には、ガラクトース血症に罹患した新生児は、乳を与えると、黄疸、嘔吐、嗜眠、被刺激性、および痙攣を発生させる。肝臓が腫大し、血糖が低くなり得る。乳製品を乳児に与え続けると、肝硬変を生じ、眼の中に部分的な失明をもたらす白内障が形成され、および精神遅滞を引き起こす。
【0117】
ガラクトース血症の症状としては、黄疸、嘔吐、不十分な栄養補給、不十分な体重増加、嗜眠、被刺激性、痙攣、および眼のレンズ中の混濁が挙げられる。検出される徴候としては、肝腫、低血糖、アミノ酸尿、肝硬変、腹水、白内障、および精神遅滞が挙げられる。
【0118】
その診断は、通常、赤血球中の酵素GALTの活性の欠如を実証することに基づく。出生前診断はまた、酵素を直接測定することによって実行可能である。DNAベースの試験はまた、その状態を診断するために可能である。
【0119】
(慢性炎症状態)
慢性炎症性の肝臓状態は、進行性の肝臓疾患であり、完全な肝不全が生じる場合に線維症または死をもたらし得る。この状態の原因は、細菌感染またはウイルス感染、毒性因子への曝露、またはある場合には、未知であり得る。
【0120】
この疾患の臨床徴候は、軽度なものから重度なものまで及び得る。代表的な症状としては、疲労、体重減少、悪心、嘔吐、増加した排尿および排便が、腹部に流体が集まること(腹水)、黄疸、糞便中の血、および異常な神経学的な挙動が挙げられ得る。慢性炎症性肝臓疾患の最終的な診断は、生検標本の試験によってなされる。
【0121】
(血管障害(vascular Derangement))
血管障害(vascular disorder)はまた、肝臓線維症の危険性の高まりに寄与し得る。肝臓に影響を及ぼすその最も頻繁な循環異常は、欝血性心不全であり、肝臓からの血液の流出量の減少をもたらす。他の肝臓鬱血の原因としては、梗塞性心外膜炎、下大静脈および肝静脈の閉塞(バッド−キアーリ症候群)、小さな肝静脈の閉塞(静脈閉塞)、および門脈血栓症が挙げられる。肝静脈流出量に対する抵抗性の増大は、欝血性肝腫、肝静脈および洞様毛細血管の拡張、ならびに低酸素症を生じる。次に、低酸素症は、肝細胞損傷と、考えられる線維症および肝硬変をもたらす。
【0122】
(薬物毒性)
毒素(例えば、アルコール、薬物または毒)は、直接的に(肝臓組織に損傷を引き起こすことによって)または間接的に(防御が低下するかまたは自己免疫応答を刺激することによって)肝炎を引き起こし得る;両方が、肝臓線維症を引き起こし得る。
【0123】
アルコールは、主に肝臓によって代謝され、種々の代謝産物を生成し、この代謝産物は、肝臓損傷を引き起こし得る。肝臓毒性の危険性は、40gより多いアルコール、または約4杯(drinks)が、一日で消費されると増大する。
【0124】
多くの医薬品が肝臓に損傷を引き起こし得、この損傷は、肝臓の作用における軽度の、無症候性の変化から肝不全および死亡までに及び得る。肝臓毒性は、用量に関連していても、関連していなくてもよい。ダイランチン(抗痙攣薬)、メトトレキサート(種々の新生物疾患、乾癬および慢性関節リウマチを処置するために使用される薬物)、クロルプロマジン(抗精神病薬物)、およびイソニアジド(抗結核薬剤)は、「ウイルス様」肝炎を引き起こし得る薬物の例である。
【0125】
環境毒素および産業毒素の両方が、肝臓における広範に種々の変化を引き起こし得る。肝臓の損傷は、必ずしも用量依存性でなく、軽度の、無症候性の炎症から劇症不全または進行性の線維症および肝硬変にまで及び得る。
【0126】
薬物または毒素への曝露に起因して肝臓線維症を発症する危険性のある患者は、一般に、彼らの病歴の検討および彼らの肝機能の連続モニタリングによって同定される。
【0127】
(先天性肝臓線維症)
先天性肝臓線維症(CHF)は、不規則な形状の増殖総胆管、肝臓内門脈圧亢進および食道静脈瘤を伴う、門脈周囲の線維症によって特徴づけられる稀な遺伝性障害である。CHFは、腎機能の損傷と関連し、通常、常染色体劣性多発性嚢胞腎疾患(ARPKD)によって引き起こされる。この疾患は、常染色体劣性の様式で遺伝するが、散発性の場合もある。代表的な肝臓異常としては、肝腫、門脈圧亢進、および肝臓線維症が挙げられる。CHFに罹患している多くの患者はまた、胃腸管からの(例えば,胃および腸からの)出血を示す。CHFの診断は、これらの症状、特に、ARPKDとの関連性に基づいて行われる。遺伝子試験はまた、この状態を診断するために考えられる手段である。
【0128】
(2.腸線維症)
いくつかの疾患が、腸線維症を発生させる患者の危険性を増大することが公知である。その疾患としては以下が挙げられる:クローン病、潰瘍性大腸炎、放射線発生性大腸炎、および顕微鏡的大腸炎。
【0129】
(クローン病)
クローン病は、腸の慢性炎症疾患である。これは、主に、小腸および大腸の潰瘍形成(管壁(lining)における中断)を引き起こすが、口から肛門までの消化器系全てに影響を及ぼし得る。これはまた、肉芽腫性腸炎もしくは大腸炎、限局性腸炎、回腸炎、または限局性腸炎(terminal ileitis)とよばれる。クローン病の原因は、未だ分かっていない。クローン病は、自己免疫疾患として伝統的に分類されており、ある科学者は、今では、特定の細菌(例えば、mycobacteriumの株)による乾癬が、この疾患の原因であり得ると推測している。
【0130】
クローン病の一般的な症状としては、腹痛、下痢、および体重減少が挙げられる。あまり一般的ではない症状としては、食欲不振(poor appetite)、熱、寝汗、直腸疼痛、および直腸出血が挙げられる。クローン病の症状は、炎症の位置、程度、および重篤度に依存する。クローン病およびそれらの症状の異なるサブタイプは、以下のとおりである:
(1)クローン大腸炎(Crohn’s colitis)は、結腸に制限された炎症である。腹痛および出血性下痢(bloody diarrhea)が、一般的な症状である。肛門フィステルおよび直腸周囲膿瘍も、起こり得る。
(2)クローン腸炎(Crohn’s enteritis)は、小腸(空腸といわれる第1の部分または回腸といわれる第2の部分)に制限された炎症をいう。回腸のみが関わっているときは、クローン回腸炎(Crohn’s ileitis)といわれる。腹痛および下痢が、一般的な症状である。小腸の閉塞もまた起こり得る。
(3)クローン限局性腸炎(Crohn’s terminal ileitis)は、小腸のごく末端(結腸に最も近い小腸部分)にのみ影響を及ぼす炎症(小腸下部の閉塞)である。腹痛および下痢が、一般的な症状である。小腸閉塞もまた、起こり得る。
(4)クローン腸炎および大腸炎(Crohn’s entero−colitis and ileo−colitis)は、小腸および結腸の両方に関連する炎症を記載するための用語である。出血性下痢および腹痛が、一般的な症状である。小腸閉塞もまた、起こり得る。
【0131】
クローン限局性腸炎および大腸炎は、クローン病の最も一般的な型である。クローン病に罹患した患者の3分の1までが、肛門領域に関する、以下の状態のうちの1以上を有し得る:
(1)肛門括約筋(排便を制御する結腸の末端にある筋肉)組織の膨脹。
(2)肛門括約筋内に潰瘍および裂溝(長い潰瘍)が発生すること。これらの潰瘍および裂溝は、排便と同時に出血および疼痛を引き起こし得る。
(3)肛門または直腸と、肛門周囲の皮膚との間に肛門フィステル(異常なトンネル)が発生すること。粘液および膿が、皮膚上のフィステルの開口部から排出され得る。
(4)直腸周囲膿瘍(肛門および直腸領域に膿が集まること)の発生。直腸周囲膿瘍は、肛門周囲の熱、疼痛および圧痛を引き起こし得る。
【0132】
クローン病の診断は、熱、腹痛および圧痛、出血を伴う下痢もしくは出血を伴わない下痢、および肛門疾患を有する患者において推測される。研究室での血液検査は、上昇した白血球数および沈降速度を示し得る。上昇した白血球数および沈降速度の両方ともが、感染または炎症を示唆する。他の血液検査は、低い赤血球数(貧血)、低い血中タンパク質、および低い身体ミネラルを示し得、これらのことは、慢性下痢に起因するこれらの要素の喪失を示す。
【0133】
バリウムx線研究は、疾患の分布、性質、および重篤度を規定するために使用され得る。バリウムは、x線によって見ることができる白亜色の物質であり、x線フィルム上に白く写る。バリウムが口(上部GI系列)から摂取されると、腸を満たし、胃および小腸の写真(x線)が撮影され得る。バリウムが直腸から投与される(バリウム注腸)と、結腸および回腸終末の写真が得られ得る。バリウムx線は、潰瘍形成、狭窄化、およびときには腸のフィステルを示し得る。
【0134】
結腸および大腸の直接的な可視化は、可撓性の観察チューブ(viewing tube)(結腸鏡)により達成され得る。結腸鏡検査法は、小さな潰瘍または結腸および回腸終末の小さな炎症領域を検出することにおいて、バリウムx線より正確である。結腸鏡検査法はまた、小腸サンプルを採取する(生検)ことを可能にし、顕微鏡下での試験のために送付されて、クローン病の診断が確認される。結腸鏡検査法はまた、炎症の程度(活性)を評価することにおいて、バリウムx線より正確である。
【0135】
コンピューター連動断層撮影(CATまたはCT)スキャン法は、腹部および骨盤全体の画像化を可能にするコンピューター処理x線技術である。これは、膿瘍を検出することにおいて特に有用であり得る。
【0136】
直近では、ビデオカプセル直達検査法(video capsule endoscopy)が、クローン病を診断するための診断試験のリストに加えられた。ビデオカプセル直達検査法については、小型のビデオカメラを備えるカプセルが飲み込まれる。カプセルが小腸を通って移動するにつれて、これは、小腸の管壁のビデオ画像を腰のベルトに付けたレシーバーに送る。この画像はダウンロードされ、次いで、コンピューター上で検査される。ビデオカプセル直達検査法の価値は、クローン病の初期の、軽度の異常を同定できることである。ビデオカプセル直達検査法は、クローン病の疑いが強いが、バリウムx線では正常である(バリウムx線は、初期の軽度のクローン病を同定するのはあまり得意でない)ときに、特に有用であり得る。
【0137】
(潰瘍性大腸炎)
潰瘍性大腸炎は、クローン病に密接に関連しているが、通常は、直腸、または直腸とS状結腸(直腸の遠位端にある)にのみ関連する、別の慢性炎症状態である。これらは、それぞれ、潰瘍性直腸炎および直腸S状結腸炎といわれる。クローン病および潰瘍性大腸炎は、炎症性腸疾患(IBD)とまとめていわれることが多い。
【0138】
潰瘍性大腸炎の一般的な症状としては、直腸出血および下痢が挙げられるが、この疾患に罹患した患者には広い範囲の症状が存在する。症状の変動性は、疾患の程度(すなわち、炎症を起こした結腸および直腸の総体)および炎症の強度の差異を示す。一般に、直腸および直腸に隣接した結腸の短いセグメントに炎症が制限されている患者は、より軽度の症状を有し、より拡がった結腸の炎症を有する患者よりも良好な予後を有する。潰瘍性大腸炎の異なる型は、炎症の位置および程度に従って分類される:
(1)潰瘍性直腸炎とは、直腸に制限された炎症をいう。潰瘍性直腸炎に罹患した多くの患者において、軽度の周期性の直腸出血が、唯一の症状であり得る。より重篤な結腸の炎症を有する他の患者は、さらに、直腸の疼痛、促迫(urgency)(突然の排便しなければという感覚および汚す心配のためにトイレに駆け込む必要性)、およびテネスムス(腸を動かすのに効果のない、疼痛を伴う力み(urge))を経験し得る。
(2)直腸S状結腸炎は、直腸およびS状結腸(直腸に続いている、結腸の短いセグメント)の炎症を伴う。直腸S状結腸炎の症状としては、直腸炎と同様に、直腸の出血、促迫、およびテネスムスが挙げられる。直腸S状結腸炎に罹患したいくらかの患者はまた、出血性の下痢および痙攣を発生させる。
(3)左側の大腸炎は、直腸で始まって、左側結腸(S状結腸および下行結腸)まで拡がる炎症を伴う。左側の大腸炎の症状としては、出血性の下痢、腹部痙攣、体重減少、および左側の腹痛が挙げられる。
(4)全大腸炎(pancolitis)または全体的な大腸炎(universal colitis)とは、結腸全体(右結腸、左結腸、横行結腸および直腸)に影響を及ぼす炎症をいう。全体大腸炎の症状としては、出血性の下痢、腹痛および痙攣、体重減少、疲労、熱、ならびに寝汗が挙げられる。全体大腸炎に罹患したいくらかの患者は、医薬品に容易に応答する、低い段階の炎症および軽度の症状を有する。しかし、一般には、大腸炎を有する患者は、より重度の疾患に罹患しており、潰瘍性大腸炎のより制限された形態を有する患者よりも処置が難しい。
(5)劇症大腸炎は、稀であるが、重篤な大腸炎の形態である。劇症大腸炎に罹患した患者は、脱水症状、重篤な腹痛、出血を伴う長引く下痢、およびさらにはショックを伴い、極めて不健康である。彼らは、中毒性巨大結腸(重篤な炎症に起因する、結腸の顕著な拡張)および結腸破裂(colon rupture)(穿孔)を発症させる危険性がある。劇症大腸炎および中毒性巨大結腸に罹患した患者は、強力な静脈内投薬により、病院で処置される。彼らが処置に迅速に応答しなければ、結腸破裂を防ぐために、病的な結腸を外科的に除去する必要がある。
【0139】
潰瘍性大腸炎の診断は、腹痛、結腸の出血、および下痢の症状によって示唆される。第1の工程として、糞便標本が分析のために集められて、感染および寄生体が除かれる。なぜなら、これらの状態は、潰瘍性大腸炎によく似た大腸炎を引き起こし得るからである。次いで、血液検査が行われ得、貧血および上昇した白血球数または沈降速度(一般には、SED速度といわれる)を示し得る。上昇した白血球数およびSED速度はともに、結腸で発生している炎症を示す。潰瘍性大腸炎の確認には、大腸を可視化するための試験が必要である。直腸を通して挿入された可撓性のチューブ(S状結腸鏡および結腸鏡)により、結腸の内部を直接可視化することが可能になって、診断が確立され、大腸炎の程度が測定される。小さな組織サンプル(すなわち、生検)が、大腸炎の重篤度を決定するための手順の間に得られ得る。大腸炎の程度および重篤度の認識は、処置選択肢を選ぶことにおいて重要である。バリウム注腸x線はまた、潰瘍性大腸炎の診断を示し得る。バリウム注腸の間に、白亜色の物質は直腸に投与され、結腸に注入される。バリウムは、放射線非透過性であり、x線写真上で結腸の輪郭を明らかにし得る。バリウム注腸は、潰瘍性大腸炎の診断において直接可視化技術より正確ではなく、有用でない。
【0140】
(放射線発生性大腸炎)
放射線発生性大腸炎は、重大な量の照射に以前に曝された患者(例えば、癌を処置するために放射線療法を受けた患者)において発生する持続性の結腸過敏(colon irritation)の型である。全身の症状は、照射に関連しない過敏な結腸状態の症状(例えば、疼痛および慢性的な下痢)に類似であるが、放射線発生性大腸炎に罹患している患者は、彼らの病歴に基づいて容易に同定される。
【0141】
(顕微鏡的大腸炎)
顕微鏡的大腸炎(MC)は、コラーゲン蓄積大腸炎(CC)およびリンパ球性大腸炎(LC)の2つの形態的に異なる実体を包含する。MCに罹患した患者は、一般に、慢性の下痢を示し、この慢性の下痢は、痙攣および鼓脹と関連し得る。内視鏡検査および放射線検査は、通常は、正常である。組織学的評価により、主にリンパ球性炎症からなる炎症が明らかになり、厚くなった上皮下コラーゲン帯が、CCの診断になる。LCおよびCCはともに、セリアック病、糖尿病、関節炎、および甲状腺炎のような自己免疫疾患と関連し得るが、この病理状態に関与する正確な機構は未だ未知のままである。
【0142】
(3.腎線維症)
種々の腎臓疾患および状態は、患者が腎線維症を発症する可能性を増大させ、最終的には、末期の腎疾患をもたらし、透析および移植が必要になることが公知である。これらの疾患および状態としては、糖尿病性腎症、高血圧性腎硬化症、慢性糸球体腎炎、慢性移植糸球体症、慢性間質性腎炎、多発性嚢胞腎疾患、および腎臓に影響を及ぼす他のあまり一般的でない疾患が挙げられる。
【0143】
(糖尿病性腎症)
糖尿病性腎症は、長期間持続する糖尿病と関連した腎疾患である。キンメルスティール−ウィルソン病(またはキンメルスティール−ウィルソン症候群)としても公知であり、糖尿病性腎症は、糸球体(腎臓における重要な構造体であり、毛細血管から構成され、血液濾過に極めて必須である)における微小血管のネットワーク(毛細血管系)に影響を及ぼす。
【0144】
この疾患の症状としては、尿への過剰なタンパク質濾過(タンパク尿)、泡立つ尿(尿中タンパク質の前兆)、高血圧(high blood pressure)(高血圧(hypertension))、脚の腫脹(歩行/起立後に悪化する)、掻痒、悪心/嘔吐、不明な体重減少、疲労/嗜眠、夜間に排尿する必要性の増大、および糖尿病を制御するために丸剤またはインスリンの必要性が減少することが挙げられる。
【0145】
糖尿病性腎症は、一般に、腎機能が徐々に損なわれる。その重篤な形態では、この疾患は、腎不全および末期腎疾患をもたらし得、患者は、慢性的な腎透析または腎移植を必要とし得る。糖尿病性腎症はまた、毛細管内糸球体腎炎(intercapillary glomerulonephritis)といわれる。
【0146】
(高血圧性腎硬化症)
高血圧性腎硬化症は、高血圧症と関連した腎臓の硬化(hardening)(硬化症(sclerosis))である。腎臓は、血圧調節において重要な役割を果たす。腎疾患は、腎機能に影響を及ぼし得、このような調節を妨害し得、血圧上昇を生じる。他方で、腎損傷は、長期間の高血圧症から生じ得、高血圧が、血管を狭くし、厚くすることによって、心臓血管系に影響を及ぼし得る。
【0147】
その初期段階で、高血圧性腎硬化症は、長期間にわたって、いかなる重大な症状も示さないかもしれない。存在する場合、一般的な症状としては、以下が挙げられる:高血圧、頭痛、頸部の不快感、疲労、悪心または嘔吐、および尿中タンパク質(タンパク尿)。
【0148】
(慢性糸球体腎炎)
糸球体腎炎は、主に糸球体(腎臓におけるネフロンの濾過する起始部(filtering head))に影響を及ぼす炎症状態である。慢性糸球体腎炎は、通常、末期腎臓疾患をもたらす。
【0149】
糸球体腎炎の一般的な症状としては、尿中の血液またはタンパク質、泡立つ尿(通常は、尿中タンパク質の指標)、濃色またはピンク色の尿、脚の腫脹、全身的な症状発現(例えば、不明な体重減少、関節炎または皮膚発疹)を伴う糖尿病または自己免疫疾患のような全身的な疾患が挙げられる。
【0150】
糸球体腎炎を引き起こし得るかまたは糸球体腎炎から生じ得る多くの異なる状態が存在する。これらの状態のいくらかは、以下で議論される。糸球体腎炎に関連する状態の一例は、IgA腎症(腎臓の糸球体内部でIgAが沈着する腎疾患)である。このIgA沈着は、この濾過プロセスを妨げ、尿中の血液またはタンパク質の症状、および手および脚の膨脹をもたらす。この疾患は、腎機能の損傷または完全な喪失すら最終的に生じる糸球体の炎症を引き起こす。
【0151】
自己免疫疾患はまた、糸球体腎炎を生じ得る。1つのこのような例は、ループス腎炎(または狼瘡に伴う糸球体腎炎)である。他の場合には、細菌(例えば、Streptococcus)またはウイルス(例えば、HIVまたはHBV)による感染、特に10歳未満の小児における感染は、感染後糸球体腎炎を引き起こし得る。
【0152】
糸球体腎炎はまた、巣状分節状糸球体硬化症(FSGS)(腎臓の糸球体のいくらかにおいて瘢痕組織を形成する場合に生じる病気)に関する。用語「巣状」とは、糸球体のいくらかが瘢痕状になる一方で、他は正常なままであることを意味する。用語「分節状」とは、個々の糸球体の一部分のみが損傷を受けていることを意味する。FSGSの症状としては、泡立つ尿、身体の腫脹(すなわち、保持した液体から全身に広がった浮腫)、体重増加、および食欲不振が挙げられる。
【0153】
診断は、以下に基づいて行われ得る:タンパク質(少量の血液を伴うまたは伴わない)を示す尿検査;瘢痕の証拠を示す腎生検;およびIgMの沈着を示す免疫蛍光顕微鏡試験。
【0154】
膜増殖性糸球体腎炎には2つの型が存在し、これらの型は、妨げられた腎機能または低下した腎機能を生じる類似の症状を有する腎障害であり、炎症および腎細胞の顕微鏡的構造における変化によって引き起こされる。症状としては、以下が挙げられる:尿中の血液、濃色の尿、濁った尿、尿容量の減少、身体の任意の部分の腫脹、精神状態の変化(例えば、注意力の低下(decreased alertness)、集中力の低下)。身体検査により、種々の程度までこれらの症状が明らかになる。尿検査により診断が補助され、腎生検によって確認される。
【0155】
急速進行性糸球体腎炎は、腎臓の内部構造に対する損傷および機能の急速な喪失を引き起こす腎疾患の形態であり、三日月型の異常が腎臓の生検で示される。一般的な症状としては以下が挙げられる:浮腫、濃色の尿または煙色の尿、尿中の血液、尿体積の減少、熱、筋肉痛、関節痛、息切れ、咳、全身が病気である感覚、腹痛、食欲喪失、下痢など。この状態を診断するために、身体検査と血液検査および尿検査と組み合わせると、上記の症状の多く、ならびにBUNと尿クレアチニンの増加、クレアチニン−クリアランスの低下、および/または抗糸球体基底膜抗体と抗好中球細胞質抗体(ANCA)の存在が明らかになり得る。腎生検により、三日月型の糸球体腎炎が確認される。
【0156】
強皮症は、結合組織の自己免疫疾患であり、全身性強皮症ともいわれる。この状態は、皮膚および身体器官における線維症によって特徴づけられる。強皮症の診断は、病気の臨床的特徴を見出すことに基づく。強皮症に罹患したほぼ全ての患者が、自己免疫を示唆する血液検査結果(抗核抗体(ANA))を有する。特定の抗体(抗セントロメア抗体)は、専ら、強皮症の制限された、すなわちCREST形態で見出される。抗Scl70抗体(抗トポイソメラーゼI抗体)は、強皮症の拡散形態を有する患者において最も頻繁にみられる。
【0157】
脈管炎は、種々の血管の壁に損傷をもたらす血管の炎症を特徴とする稀な疾患の群に対する一般的用語である。活発な脈管炎を有する患者の血液または体液の研究室での試験は、一般に、身体における炎症を示す。器官の状況の程度に依存して、種々の器官の機能試験は、異常である可能性があり、よって、その状態の指標であり得る。脈管炎の診断は、最終的に、血管炎症のパターンを示す、関連した組織(例えば、腎臓)の生検後に確立される。状況に依存して、生検の代替は、血管のx線検査(例えば、血管造影法)であり得る。
【0158】
ヴェーゲナー肉芽腫症(WG)は、呼吸器系を含む多くの種々の器官(洞、鼻、気管、および肺)および腎臓に影響を及ぼす稀な疾患である。疾患の主な特徴のうちの1つは、血管の炎症(脈管炎)である。炎症は血管を狭くし、罹患した気管への血流を減少させ、その後、罹患した組織および気管に損傷を与える。
【0159】
WGの正確な原因は、未知のままであるが、自己免疫状態に関連すると考えられる。実際に、自己抗体は、数名のWG患者においてしばしば検出される。WGの最も一般的な症状のうちの1つは、慢性の鼻水の出る鼻であり、他は、標準的な処置に応答しない風邪様の症状である。風邪の症状は徐々に悪化し、静脈洞炎(洞の炎症)、中耳感染(中耳炎)、咳、喀血(coughing of blood)、および肺の炎症(胸膜炎および肺炎)をもたらし得る。他の症状としては、熱、疲労、食欲喪失、体重減少、関節痛、寝汗、尿の色の変化、および衰弱が挙げられる。腎疾患は、WGの最も重篤な発現である。
【0160】
WG患者の血液検査は、しばしば、貧血(低い赤血球数)および高い白血球数を示す。腎臓に影響がある場合、顕微鏡下で見たときに尿中に赤血球がみられる。また、腎機能の測定を目的とした血液検査は、異常を示し得る。胸部X線は、肺に影響があるか否かを決定するために使用される。腎生検および洞または肺のCTスキャン法はまた、WGを診断することにおいて使用される重要なツールである。
【0161】
抗好中球細胞質抗体(ANCA)といわれる特定の型の抗体が、WGに罹患した患者の約90%の血液で見られる。このANCAは、個体自身の白血球(すなわち、好中球)に対する自己抗体の型である。これらの抗好中球細胞質抗体はまた、他の炎症状態および疾患(例えば、HIV感染)において見出される。このANCA試験は、WGの診断を確認するために有用であるが、診断を行うためにそれ自体を使用することはできない。
【0162】
結節性多発性動脈炎(PAN)は、身体の動脈の自然発生的な炎症によって特徴づけられる稀な自己免疫疾患である。最も一般的な影響を受ける器官は、腸および腎臓を含む。これらの器官のいずれかにおける機能の損傷または疼痛が、症状であり得る。腸への乏しい血液供給は、腹痛および出血を引き起こし得る。疲労、体重減少、および熱はまた、患者においてしばしば観察される。PANの原因は未知であるが、HBV感染の後に報告された。
【0163】
PANの診断は、炎症(血液沈降速度およびc反応性タンパク質の上昇を含む)を示す試験によって支持される。白血球数および血小板数は、上昇し得る一方で、赤血球数は、減少する(貧血)。いくらかの患者は、HBV試験に陽性であり得る。尿検査は、尿中のタンパク質および尿中赤血球の存在を示し得る。ある場合には、異常は、神経機能試験において観察され得る。診断は、生検または影響を受けた器官の血管造影(炎症を受けた血管を明らかにする)によって確認される。
【0164】
さらに、グッドパスチャー症候群は、肺と腎臓疾患の組み合わせ(特に、肺胞および腎臓の糸球体における基底膜の成分に対する抗体の形成による、肺の肺胞および腎臓の糸球体の基底膜における重篤な炎症に起因する、肺出血(肺における出血)および糸球体腎炎(糸球体の炎症))によって特徴づけられる自己免疫疾患である。臨床症状は、血痰(bloody sputum)を伴う咳、血尿、減少した尿生成量、疲労、高血圧、腫脹(浮腫)、および不明な体重減少が挙げられる。その症候群はまた、抗糸球体基底膜抗体疾患と名付けられた。
【0165】
(慢性移植糸球体症)
慢性移植糸球体症は、腎移植を受けかつ腎構造の特徴的な変化(メサンギウム基質膨脹、メサンギウム増殖、二重輪郭(double contour)を有する基底膜肥厚化、および辺縁メサンギウム介入が挙げられる)を有し、ときおり、巣状分節状硬化症が付随する患者に生じる種々の状態をいう。これらの変化は、通常、顕著なタンパク尿と、しばしば、ネフローゼの範囲において関連する。これらの状態の診断は、病歴(患者が移植レシピエントか否か)、尿検査および腎生検を検討することに基づいて行われる。
【0166】
(慢性間質性腎炎)
間質性腎炎は、腎臓内の結合組織の障害、重篤なアレルギー反応、毒性物質への曝露、移植拒絶、尿の妨害物(urinary blockage)または他の要因に起因する腎炎の型であり、尿細管の間の空間に炎症を生じ、尿細管の炎症を含み得る。間質性腎炎の症状としては、熱、腎臓領域の疼痛、尿生成量の増大または減少、熱、精神状態の変化(嗜眠状態から昏睡にいたる錯乱までに及ぶ)、悪心または嘔吐、発疹、身体の腫脹、液体の欝滞に起因する体重増加、および尿中の血液または尿中のタンパク質が挙げられ得る。
【0167】
間質性腎炎に罹患している患者の検査により、浮腫または液体過大容積(fluid overload)、または容積消耗の徴候(signs of volume depletion)が明らかになり得、聴診器をあてて心音または肺音を聴いていると、異常な音が聞こえる。血圧は、一般に高い。尿検査により、少量のタンパク質またはときには赤血球、尿細管細胞、および他の異常が示される。尿中に、WBCおよびWBC円柱(特に好酸球)がしばしば見られる。CBCは、好酸球増多症(正常な好酸球数より高い)を実証し得る。尿比重および重量オスモル濃度は、水の摂取を制限したときにすら尿を濃縮することができないことを示す。尿のpHは、尿を適切に酸性化することができないことを示し得る。動脈血検査(arterial blood gase)および血液化学により、代謝性アシドーシスが示され得る。BUNおよびクレアチニンレベルは、腎機能のレベルを評価するために使用される。RBC−尿は、赤血球の増大を示し、腎疾患を示す。最後に、腎生検により、間質性腎炎の診断が確認され得、腎生検は、腎臓に対する損傷の程度を評価するために使用され得る。
【0168】
(多発性嚢胞腎疾患)
多発性嚢胞腎疾患(PKD)は、腎臓中の多くの嚢胞の成長によって特徴づけられる障害である。この嚢胞は、液体で満たされている。PKDの嚢胞は、腎臓の大きさの大部分に取って代わり得る。このことによって、腎機能が低下し、腎不全がもたらされる。PKDが腎臓の不全を引き起こす場合(これは通常何年も後になってのみ起こる)、患者は、透析または腎移植が必要になる。PKDの一次形態を有する人々の約2分の1が、腎不全または末期腎疾患(ESRD)に進行する。
【0169】
PKDは、肝臓中に嚢胞を引き起こし得、他の器官(例えば、心臓および脳血管)においては問題を引き起こし得る。これらの合併症は、医師が、PKDと、人生のもっと後になって腎臓においてしばしば形成する通常の無害な「単なる」嚢胞とを区別する助けになる。
【0170】
PKDには2つの主要な遺伝性の形態と、遺伝しない形態とが存在する。常染色体優性PKDは、最も一般的であり、遺伝性の形態である。症状は、一般に、30歳〜40歳の間に発現するが、幼児期早くに始まり得る。全てのPKDのうちの約90%が、常染色体優性PKDである。最も一般的な症状は、背部および側部(肋骨と臀部の間)の疼痛と、頭痛である。鈍い疼痛が、一次的にまたは持続してあり、それは軽度または重度であり得る。常染色体優性PKDに罹患した人々はまた、以下の問題を経験し得る:尿路感染症;血尿(尿中の血液);肝臓および膵臓の嚢胞;異常な心臓弁;高血圧;腎臟結石;脳における動脈瘤(血管壁における膨脹);ならびに憩室症(結腸にある小さな嚢)。
【0171】
常染色体優性PKDを診断するために、医師は、代表的には、超音波画像化を用いて3つ以上の腎臓の嚢胞を観察する。この診断は、常染色体優性PKDの家族歴および他の器官に嚢胞が存在することによって裏付けられる。
【0172】
常染色体優性PKDの最も多い例では、個人の身体状態が、数年の間、数十年にわたっても正常に見えるので、その疾患は、見過ごされ得る。身体検査ならびに血液検査および尿検査は、診断にまで至らないかもしれない。しかし、一旦嚢胞が形成されると、画像化技術により診断が可能である。超音波が最も頻繁に使用される。超音波画像化は、色素の注入も用いられず、照射も用いられないので、妊婦を含め、全ての患者に安全である。超音波画像化は、胎児の腎臓中の嚢胞も検出できる。
【0173】
CATスキャンおよびMRIのような、より強力な画像化法によっても、嚢胞が検出され得る。分子技術における進歩がまた、DNA試験を可能性のあるものにし、嚢胞が発生する前に、常染色体優性PKDの診断が確認される。
【0174】
常染色体劣性PKDは、この疾患の第2の遺伝性の形態である。これは比較的稀である。常染色体劣性PKDは、常染色体優性PKDを引き起こす物とは異なる遺伝的欠損によって引き起こされる。この疾患を有さない親は、両親ともに異常な遺伝子を有しかつこの両親が彼らの子供にこの遺伝子を伝える場合に、この疾患を有する子供が生まれ得る。(両親が異常な遺伝子を有する場合に)これが起こる可能性は、4人に1人である。一方の親のみが異常な遺伝子を有するのであれば、その子供は、この疾患になることはない。
【0175】
常染色体劣性PKDの症状は、生後数ヶ月で始まり得、子宮にいる間ですら始まり得るので、しばしば「乳児PKD」といわれる。常染色体劣性PKDをもって生まれた子供は、通常、数年以内に腎不全を発症する。この疾患の重篤度は、様々である。最悪の症例の赤ん坊は、生まれてから数時間または数日で死亡する。乳児バージョンを有する子供は、数年にわたって、正常な活動のための十分な腎機能を有し得る。若年性バージョンを有する人々は、彼らが10代および20代になっても生きる可能性があり、通常は、肝臓の問題にも苦しむ。
【0176】
常染色体劣性PKDに罹患した子供は、高血圧、尿路感染症、および頻繁な排尿を含む症状を示す。この疾患は、通常、肝臓、膵臓および膵臓に影響を及ぼすので、低血球数、拡張蛇行静脈、および痔核を引き起こす。腎機能が初期の肉体的発達にとって重要であるので、常染色体劣性PKDに罹患した子供は、通常、平均的な大きさより小さい。
【0177】
この疾患を診断するにあたって、胎児および新生児の超音波画像化により、腎臓の嚢胞が明らかになり得るが、常染色体劣性PKDの嚢胞と、常染色体優性PKDの嚢胞との区別はつかない。親族の腎臓を超音波検査が、正確な診断を行うにあたって助けとなり得る。例えば、常染色体優性PKDの嚢胞を有する親または祖父母がいると、胎児または子供における常染色体優性PKDの診断を確認する上で助けになり得る。常染色体劣性PKDを有する個人が親になることは、極めて稀であるものの、不可能ではない。常染色体劣性PKDは、肝臓を瘢痕化する傾向があるので、肝臓の超音波画像化はまた、診断の助けになる。
【0178】
常染色体優性PKDの診断と同様に、常染色体劣性PKDも、DNA分析に基づいて明確に診断され得る。
【0179】
後天性嚢胞腎疾患(ACKD)は、遺伝しない形態のPKDであり、人生のもっと後になって起こる傾向がある。ACKDはしばしば、長期の腎臓の問題(例えば、腎臓損傷および瘢痕化)と関連して、特に、腎不全を有する患者および長期間の透析を続けている患者において発症する。5年間透析を続けている人々のうちの約90%が、ACKDを発症する。ACKDに罹患している患者は、糸球体腎炎または糖尿病によって引き起こされる腎疾患のような任意の根底にある腎疾患を有し得る。
【0180】
ACKDの嚢胞は、出血し得る。従って、ACKDの第1の顕著な症状は、尿中の血液、すなわち血尿である。ACKDの診断は、腎臓の超音波、CATスキャン、またはMRIを使用して確認される。さらに、腎臓腫瘍(腎臓癌(kidney cancer、renal cancer)はまた、ACKDに罹患した人々において発症し得る。腎臓癌は稀であるが、ACKD患者において、一般的な集団の少なくとも2倍程度の頻度で、発生する。
【0181】
(II.胆汁欝滞状態の除外)
(A.胆汁欝滞状態)
種々の胆汁欝滞状態が、肝臓線維症をもたらすようであるが、本発明は、胆汁欝滞状態(例えば、原発性胆汁性肝硬変、原発性硬化性胆管炎、薬物誘導性胆管炎、遺伝性胆汁欝滞および妊娠性肝内胆汁欝滞、完全非経口栄養法に伴う胆汁欝滞、敗血症、ならびに嚢胞性線維症)に既に罹患している患者における肝臓線維症の処置/予防を包含しない。以下は、本発明を実施する場合に、これらの胆汁欝滞状態に罹患した患者をどのように除外するかを記載する。
【0182】
(B.胆汁欝滞状態の診断)
胆汁欝滞状態の代表的な症状としては、掻痒(痒み)、疲労、黄疸を呈した(jaundiced)皮膚もしくは眼、特定の食物が消化できないこと、悪心、嘔吐、白色便、濃色の尿、および右上4分の1の腹痛が挙げられる。器官不全が、敗血症の場合に起こり得(しかし、胆汁欝滞自体からは起こらない)、発疹または熱は、薬物誘導性胆汁欝滞のいくらかの場合において生じ得る。
【0183】
胆汁欝滞状態の診断は、一般に、患者の血中の、抱合型ビリルビン、アルカリホスファターゼ、γ−グルタミルトランスペプチダーゼ(GGT)、5’ヌクレオチダーゼ、胆汁酸、およびコレステロールのレベルの上昇の検出に基づく。上記に挙げた状態の各々について、特定の診断基準が適用され得る。
【0184】
原発性胆汁性肝硬変(PBC)は、ゆっくりと進行する炎症および肝臓内の小さな胆管の破壊によって特徴づけられる慢性疾患である。その炎症および破壊は、胆汁の排出を妨害し、瘢痕化を引き起こし、最終的に、肝硬変をもたらす。PBCの初期段階において、主要な問題は、血中で物質(胆汁酸、コレステロールのような)の増加であり、この物質は、通常、胆汁の中に排出される。多くのPBC患者は、疾患の症状を有さず、慣用的な肝臓血液検査で異常を見出すことによって、診断される。掻痒および疲労が一般的な症状である。他の徴候としては、黄疸、皮膚におけるコレステロール沈着、足首および腹部での液体蓄積、ならびに皮膚の色が暗くなることが挙げられる。いくつかの他の障害は、しばしば、PBCと関連する。涙腺および唾液腺の機能障害、ドライアイまたはドライマウスを引き起こすことが最も一般的である。関節炎および甲状腺の問題も、現れ得る。腎結石および胆石が、発生し得る。骨折をもたらす骨の軟化および脆弱性は、この疾患の後期段階で起こり得る。
【0185】
PBCの診断は、いくつかの指標に基づく:その患者は、胆管損傷を示唆する症状(例えば、掻痒)を有し得る;研究室試験(例えば、アルカリホスファターゼ活性試験)によって、その診断が確認され得る。抗ミトコンドリア抗体(AMA)についての試験が、ほぼ全てのPBC患者において陽性であるので、特に有用である。稀であるが、胆管は、胆管疾患(例えば、閉鎖症)の他の原因の可能性を排除するためにX線照射される。肝臓生検は、その診断を確認することにおいて、および肝臓損傷の重篤度および程度に関する情報を与えることにおいて有用である。
【0186】
PBCの最終的な診断の基準は、古典的なPBCに罹患した患者全てを同定し、疑わしい診断を有する全ての患者を排除するために確立された。PBCの最終的な診断は、以下の内の3つ全てを有する患者においてなされる:胆汁欝滞の肝臓検査(ALTおよびASTより上昇しているアルカリホスファターゼおよびGGT);1:40以上の力価でのAMA陽性;ならびに診断のためのまたは適合性の肝臓生検の陽性の解釈。
【0187】
原発性硬化性胆管炎(PSC)に罹患している患者において、肝臓内外の胆管は、炎症を起こしており、瘢痕している。瘢痕化が増大するにつれて、胆管は遮断され、このことによって、肝臓中の胆汁の増加をもたらし、肝臓細胞が損傷を受ける。PSCの種々の原因が推測されており、その原因としては、細菌感染もしくはウイルス感染、または免疫系の異常が挙げられる。
【0188】
PSCの主要な症状は、掻痒、疲労、および黄疸である。胆管における感染は、悪寒および熱を引き起こし得る。PSCは、胆管造影法によって診断され、この胆管造影法は、色素を胆管に注入する工程、およびX線画像を撮影する工程を必要とする。胆管造影法は、内視鏡手技(内視鏡的逆行性胆道膵管造影法、ERCP)として、放射線医学または外科手術を介して、または磁気共鳴画像法(MRI)により、行われ得る。
【0189】
薬物誘導性胆汁欝滞とは、特定の薬物適用に起因して、肝臓からの胆汁の流れが遮断されていることをいう。多くの薬物が、この型の胆汁欝滞を引き起こし得る。いくつかのより一般的な元凶としては、以下が挙げられる:金の塩類、ニトロフラントイン、アナボリック・ステロイド、経口避妊薬、クロルプロマジン、プロクロルペラジン、スリンダク、シメチジン、エリスロマイシン、トブタミド(tobutamide)、イミプラミン、アンピシリン、および他のペニシリンベースの抗生物質。他の薬物適用はまた、いくらかの個体において胆汁欝滞を予測外にも引き起こし得る。薬物誘導性胆汁欝滞の症状は、他の胆汁欝滞状態、すなわち、掻痒、黄疸を呈した皮膚もしくは眼、非常に濃い尿、非常に色の淡い糞便、薬物感受性に由来する熱もしくは発疹、右上4分の1の腹痛、ならびに悪心/嘔吐に類似である。薬物誘導性胆汁欝滞の診断は、血液検査に基づいて行われ、この血液検査によって、病歴を注意深く見ることに加えて、上昇したビリルビンおよびアルカリホスファターゼのレベルが明らかになる。
【0190】
遺伝性の胆汁欝滞は、胆汁欝滞状態の遺伝性形態である、常染色体劣性疾患である。胆汁欝滞の非遺伝性形態のものと類似の多くの症状を有し、この状態は、症状および家族性の病歴の初期の発症に基づいて診断され、非遺伝型とは区別される。遺伝子試験は、この状態を有する患者を同定するための最も信頼性の高い方法である。例えば、ATP8B1(FIC1)およびABCB11(BSEP)は、遺伝性の胆汁欝滞に関与する2つの遺伝子として同定された(例えば、van Milら,Semin Liver Dis.21:535−44,2001;Chenら,J Pediatr.140:119−24,2002)。
【0191】
妊娠性肝内胆汁欝滞(ICP)は、妊婦において認められる胆汁欝滞状態である。女性のICPは、食欲不振、疲労、脂肪性の糞便、色の濃い尿、および上胃部の不快感のような症状を示し得る。尿路感染は、罹患していない妊婦よりICPに罹患している妊婦でより一般的である。最後に、ビタミンKの欠損は、ICPの長期経歴を有する女性において発症し得る。ICPの診断は、血液検査に基づいており、この血液検査によって、上昇した胆汁酸レベルおよび特定の肝臓酵素レベル(例えば、アルカリホスファターゼ、GGT、5’ヌクレオチダーゼ)が示される。初期発疹(primary rash)なしの掻痒の存在はまた、その診断を確認する一助になる。肝臓生検または超音波が、その診断を確立するために稀に必要とされる。
【0192】
完全非経口栄養法に関連する胆汁欝滞は、これらの栄養を非経口的に100%受ける患者に存在する胆汁欝滞の型である。その臨床的特徴は、他の胆汁欝滞状態に類似であり得るが、これらの患者は、彼らが、カテーテルによって静脈内で液体栄養を与えられている場合に、同定しやすい。
【0193】
潜在的に生命を脅かす状態である敗血症はまた、「血流感染」といわれる。この状態は、感染に対するその身体の応答を示し、感染性生物(例えば、細菌、ウイルス、真菌、酵母、寄生生物など)または血中もしくは他の身体組織中のそれらの毒素の存在を特徴とする。敗血症は、全身性の疾患の臨床症状(例えば、熱、悪寒、倦怠感、低血圧、および精神的覚醒低下(reduced mental alertness)と関連し得る。敗血症の診断は、身体の別の部位から拡がり得る、細菌または酵母の存在を検出するための血液培養に基づく。
【0194】
嚢胞性線維症(CF)は、常染色体劣性様式で遺伝する遺伝的欠損によって引き起こされ、身体の粘液腺の慢性で進行性の、そして頻繁に致死的な疾患である。この疾患の臨床的特徴としては、以下が挙げられる:肺の慢性感染、気腫、進行性呼吸不全、胃腸の問題(膵臓および肝臓を含む)、膵臓不全(トリプシンおよび他の消化酵素の腸への分泌がない)、出生時腸閉塞、膵臓酵素の連続的な欠損、胆管閉塞、総胆管の狭窄、肝硬変、腹部右下部分の疼痛の再発性のエピソード、回腸の腺癌、心臓の問題(例えば、肺性心)、および生殖の問題(例えば、男性の不妊症)。研究室での試験は、CFを診断するために必要である。CF患者は、しばしば、陽性の汗試験の結果を示し、糞便中にトリプシンがない(血清中に高レベルのトリプシンがある)。CFに影響を与える遺伝子が同定されたので、DNA試験が、この状態についての最も信頼性の高い診断ツールである。
【0195】
(III.FXRリガンド)
A.FXRリガンドを同定するためのアッセイ
いくつかのアッセイ系は、FXRリガンド、特に、FXR活性化させる高い能力を有するFXRリガンドを同定するために確立された。例えば、候補化合物は、その化合物が、FXR活性化リガンドであるか否かおよびその効力があるか否かを決定するために、無細胞同時制御因子増加(co−regulator recruitment)アッセイにおいて試験され得る。簡潔には、この系は、FXRと同時制御因子のタンパク質またはペプチドとの間の結合を利用する。同時制御因子は、FXRがそのリガンド(例えば、SRC1)に結合する際に、FXRに対して補充されることが公知の核タンパク質である。同時調節因子タンパク質またはペプチドの、FXRへのリガンド依存性の補充は、種々の方法(例えば、蛍光共鳴エネルギー移動(FRET)、蛍光偏光または発光近接アッセイ)によって測定される。ヒトFXRまたはラットFXRのいずれかが、この目的で使用され得る。このアッセイ系の詳細な説明については、例えば、Maloneyら,J.Med.Chem.,43:2971−2974,2000;Pellicciariら,J.Med.Chem.,45:3569−3572,2002;Cuiら,J.Bio.Chem.,277:25963−25969,2002;およびJonesら,Methods Enzymol,364:53−71,2003を参照のこと。
【0196】
あるいは、候補化合物は、ゲル濾過またはシンチレーション近接アッセイ(このアッセイにおいて、放射性リガンドが使用される)のような無細胞アッセイにおいてFXRに対する結合能力について試験され得る。例えば、Jonesら,Methods Enzymol.,364:53−71,2003を参照のこと。
【0197】
化合物をそのFXRリガンド特性について試験するために有用な別のアッセイ系は、リガンド活性化FXRに応答性の転写調節エレメントによって制御されるレポーター遺伝子(例えば、ルシフェラーゼまたはβ−ガラクトシダーゼ)を伴う完全細胞モデル(例えば、肝星細胞において)である。ヒトFXRまたはラットFXRのいずれかが、このアッセイにおいて使用され得る。レポーター活性のレベルは、FXR活性化リガンドとしての試験化合物の有効性を示す。このようなレポーター遺伝子ベースのスクリーニング系の詳細な説明に関しては、例えば、Goodwinら,Mol. Cell,6:517−526,2000;Cuiら,J.Bio.Chem.,277:25963−25969,2002を参照のこと。
【0198】
上記のアッセイ系のうちの2つのクラスのいずれかにおいて、特定のFXRリガンドの有効性が、アッセイの間に実証されるそのEC50(すなわち、測定される効果の最大値の50%を生じるために必要なリガンドの濃度)によって測定される。本発明における使用に適したFXRリガンドは、上記に挙げた参考文献中に記載される方法に従って、ヒトFXRまたはラットFXRを用いて、無細胞FXRアッセイまたは細胞ベースのトランス活性化アッセイにおいて決定された場合に、5μM以下、好ましくは、2μM以下、より好ましくは、1.5μM以下、最も好ましくは、1μM以下のEC50を有するリガンドである。
【0199】
さらに、FXRに特異的なであって、他の核レセプター(特に、RXR)には特異的でないリガンドのスクリーニングのための確立された方法が存在する。例えば、WO 00/76523は、組換えRXRが、RXRリガンド結合部位を除去するために、単一の点置換によって変異され(RXRD322P)、その結果、FXR−RXRD322Pヘテロ二量体の使用がFXR活性を調節し得る化合物の明白な同定を可能にするようなアッセイ系を記載する。
【0200】
類似の化学構造または似ていない化学構造の化合物が、これら化合物が特異的にFXRを結合する能力を示した。例えば、WO00/40965、WO00/76523、WO03/015771、WO03/015777、WO03/016280、WO03/016288、WO03/030612、およびWO03/043581は、FXRを活性化するリガンドについての潜在的な候補としてこのような化合物の長いリストを提供する。
【0201】
(B.既知のFXRを活性化するリガンドの例)
既知のFXR特異的リガンドの増大しつつあるリストは、ケノデオキシコール酸(CDCA)、6ECDCA、GW4064、6α−MeCDCA、6α−PrCDCA、フェキサラミン、リトコール酸(LCA)、コール酸(cholate)(CA)、得るソデオキシコール酸(UDCA)、およびデオキシコール酸(DCA)を含む(例えば、Pellicciariら,J.Med.Chem.,45:3569−3572,2002を参照のこと)。FXRリガンドの中でも、より低いEC50(例えば、5μM以下、好ましくは、2μM以下、より好ましくは、1.5μM以下、および最も好ましくは、1μM以下を有するものが、ヒトFXRまたはラットFXRを用いる無細胞アッセイまたは細胞ベースのトランス活性化アッセイにおいて試験される場合、本発明の実施に有効である。0.2μM以下、または0.1μM以下のEC50を示すFXRリガンド(例えば、6ECDCA)は、本発明の処置方法に特に有効である(例えば、Fiorucciら,Gastroenterology 127:1497−1512,2004を参照のこと)。これらのFXRリガンドは、周知の方法に従って化学合成され得るか、または業者(例えば、Sigma−Aldrich(USA)、Erregierre(Italy)、およびHengchanlong Pharmaceuticals(China))から購入され得る。
【0202】
(IV.薬学的組成物および投与)
本発明はまた、予防適用および治療適用の両方において線維症を処置するための有効量のFXRリガンドを含む薬学的組成物を提供する。本発明の薬学的組成物は、種々の薬物送達系における使用に適している。本発明における使用に適した処方は、Remington’s Pharmaceutical Sciences,Mack Publishing Company,Philadelphia,PA,第17版(1985)において見出される。薬物送達の方法の簡潔な総説に関しては、Langer,Science 249:1527−1533(1990)を参照のこと。
【0203】
本発明の薬学的組成物は、種々の経路(例えば、経口経路、皮下経路、筋肉内経路、静脈内経路、または腹腔内経路)によって投与され得る。薬学的組成物を投与する言及される経路は、70kgの成人ヒトについて、約0.01〜5000mg/日、好ましくは、5〜500mg/日のFXRリガンドの一日用量の経口、皮下、および静脈内である。適切な用量は、1日1用量でまたは適切な間隔で示される分割用量(例えば、1日あたり2分の1用量、3分の1用量、4分の1用量または4分の1用量以下)として投与され得る。
【0204】
FXRリガンドを含む薬学的組成物を調製するために、不活性で薬学的に受容可能なキャリアが使用される。この薬学的キャリアは、固体または液体のいずれかであり得る。固体形態の調製物としては、例えば、散剤、錠剤、分散顆粒、カプセル剤、カシェ、および坐剤が挙げられる。固体キャリアは、希釈剤、矯味矯臭剤、安定化剤、滑沢剤、懸濁剤、結合剤または錠剤崩壊剤として作用し得る1種以上の物質であり得る;これはまた、包む材料でもあり得る。
【0205】
散剤において、キャリアは、一般に、微細に分割された活性成分(例えば、FXRリガンド)との混合物である、微細に分割された固体である。錠剤において、その活性成分(FXRリガンド)は、適切な割合で必要な結合特性を有するキャリアと混合され、望ましい形状および大きさに圧縮される。
【0206】
坐剤の形態において薬学的組成物を調製するために、低融点ワックス(例えば、脂肪酸グリセリドとカカオ脂との混合物)が最初に溶かされ、活性成分がその中に、例えば、攪拌によって分散される。次いで、この溶かされた均質な混合物は、従来の大きさに作られた型に注がれ、冷却および固化される。
【0207】
散剤および錠剤は、好ましくは、約5重量%〜約70重量%の間のFXRリガンド活性成分を含む。適切なキャリアとしては、例えば、炭酸マグネシウム、ステアリン酸マグネシウム、タルク、ラクトース、糖類、ペクチン、デキストリン、澱粉、トラガカント、メチルセルロース、カルボキシメチルセルロースナトリウム、低融点ワックス、カカオ脂などが挙げられる。
【0208】
上記薬学的組成物は、FXRリガンドの活性化合物を、キャリアとしての包む材料と一緒に処方し、そのキャリアが化合物と会合しているように、FXRリガンド(他のキャリアを含んでまたはこれを含まずに)がそのキャリアによって囲まれるカプセル剤を提供することを包含し得る。類似の様式で、カシェもまた含まれ得る。錠剤、散剤、カシェ、およびカプセル剤は、経口投与に適した固体投与形態として使用され得る。
【0209】
液体の薬学的組成物は、例えば、経口投与もしくは非経口投与に適した溶液、懸濁液、および経口投与に適したエマルジョンが挙げられる。その活性成分(例えば、FXRリガンド)の滅菌水溶液または溶媒(水、緩衝された水、生理食塩水、PBS、エタノール、もしくはプロピレングリコールを含む)中のその活性成分の滅菌溶液は、非経口投与に適した液体組成物の例である。その組成物は、おおよその生理学的条件に必要とされる薬学的に受容可能な補助物質(例えば、pH調節剤および緩衝化剤、張度調節剤、湿潤剤、界面活性剤など)を含み得る。
【0210】
滅菌溶液は、上記活性成分(例えば、FXRリガンド)を望ましい溶媒系に溶解し、次いで、その得られた溶液を膜フィルターに通して、この溶液を滅菌することによってか、または代わりに、滅菌条件下で予め滅菌した溶媒中に滅菌化合物を溶解することによって調製され得る。この得られた水溶液は、そのまま包装されてもよいし、凍結乾燥されてもよく、その凍結乾燥調製物は、投与前に滅菌水溶液と合わせられる。その調製物のpHは、代表的には、3〜11の間、より好ましくは、5〜9、および最も好ましくは、7〜8である。
【0211】
FXRリガンドを含む薬学的組成物は、予防処置および/または治療処置のために投与され得、治療用途において、組成物は、この疾患およびその合併症の症状を予防するか、治癒するか、逆転するか、または少なくとも部分的に遅延させるかまたは抑えるために十分な量で、FXRが発現される器官の線維症に既に罹患している患者に投与される。これを達成するために十分な量は、「治療上有効な用量」として規定される。この用途に有効な量は、この疾患または状態の重篤度、および患者の体重および全身状態に依存するが、一般に、70kgの患者に対して、1日あたり約0.1mg〜約2,000mgの化合物の範囲であり、70kgの患者に対して1日あたり約5mg〜約500mgの化合物の投薬量が、より一般に使用される。
【0212】
予防用途において、FXRリガンドを含む薬学的組成物は、FXRが発現される器官(例えば、肝臓、腎臓、腸など)における線維症を発症しやすい患者またはそうでなければその発症の危険性がある患者に、その線維症の症状の発症を遅らせるかもしくは予防するに十分な量で、投与される。このような量は、「予防上有効な用量」であると規定される。この用途において、FXRリガンドの正確な量は、繰り返すと、患者の健康状態および体重に依存するが、一般に、70kgの患者に対して、1日あたり約0.1mg〜約2,000mg、より一般には、70kgの患者に対して、1日あたり約5mg〜約500mgの範囲である。
【0213】
その組成物の1回の投与または複数回の投与は、処置する医師によって選択される用量レベルおよびパターンで行われる。いずれにしても、その薬学的処方物は、その患者における線維症を有効に、治療上または予防上のいずれかで阻害するに十分な量のFXRリガンドを提供しなければならない。
【0214】
(V.キット)
本発明はまた、本発明の方法に従って、線維症を予防するか、処置するかまたは改善するためのキットを提供する。このキットは、代表的には、FXRに対して特異的でありかつFXRの転写活性を刺激し得るリガンドの有効量を含む薬学的組成物、およびこの薬学的組成物をどのように与えるかという指示を含む(処置され得る患者のタイプ(例えば、FXRが発現されているが胆汁欝滞状態には罹患していない器官において肝線維症を発症する危険性のある個体)の説明、投与スケジュール(例えば、用量および頻度)および投与経路などを含む)情報資料を含む。
【実施例】
【0215】
以下の実施例は、例示によってのみ提供されるであって、限定によって提供されるのではない。当業者は、本質的に類似の結果を生じるように変更もしくは改変され得る、種々の重要でないパラメーターを容易に認識する。
【0216】
(実施例1:肝星細胞(HSC)におけるコラーゲンα1型発現のFXRリガンド媒介性抑制)
最終的に肝硬変をもたらす肝臓線維症は、線維形成の増加および創傷収縮の両方の要素を含む、肝臓の瘢痕化プロセスである。肝星細胞(HSC)は、肝臓の線維形成を担う主な細胞型として認識されている。慢性肝臓疾患において、HSCは、「活性化」表現型を獲得し、この表現型としては、増大した増殖、収縮性、線維形成、マトリクス分解、走化性、およびサイトカイン放出が挙げられる(Friedman,J.Biol.Chem.275:2247−2250,2000)。現時点のパラダイムは、HSCの活性化状態が、その変更された微小環境を介して達成されると仮定する。この微小環境は、増殖因子である、血小板由来増殖因子(PDGF)およびトランスホーミング増殖因子(TGF)−β、反応性酸素中間体によって一部支援される。この反応性酸素中間体は、肝星細胞によって、および先に活性化されたHSCによって生成される原線維マトリクスによって、ならびにトロンビンとそのI型レセプター(プロテイナーゼ活性化レセプター1、またはPAR−1)(Fiorucciら,Hepatology,39:365−75,2004)での刺激に応答して放出される。コラーゲンIのα−1型(αI)は、正常肝臓および硬変肝臓において見出される主要なコラーゲン亜型の代表である(Friedman,J.Biol.Chem.,275:2247−2250,2000)。コラーゲンα1は、活性化HSCによって、線維性で硬変性の肝臓において生成される。
【0217】
胆汁酸は、ファルネソイドXレセプター(FXR)(NR1H4および胆汁酸レセプター(BAR)、胆汁酸に曝される組織(例えば、肝臓、腸、胆嚢、および腎臓)において発現される核レセプターとしても公知)に結合してこのレセプターを活性化させることによって、胆汁酸自体の生合成および輸送を制御するシグナル伝達分子として作用する。FXRは、9−cis−レチノイン酸(9−cis−RA)レセプター(RXR(NR2B1としても公知))とのヘテロダイマーとして、1つのヌクレオチドによって分離されている2つの逆反復(IR−I)から構成されるDNA配列に結合することによって、転写を変化させる。肝細胞において、活性化の際に、FXRは、肝細胞内の胆汁酸の濃度を減少させるように機能する遺伝子のコホートの転写を開始する。具体的には、活性化されたFXRは、BSEPをコードする遺伝子、多剤耐性タンパク質3(MDR3;ABCB4)をコードする遺伝子、およびMRP2をコードする遺伝子の発現を誘導する。さらに、FXRの天然に存在するリガンド(例えば、ケノデオキシコール酸、CDCA)および合成リガンド(例えば、6ECDCAおよびGW4064)の両方によるFXRの活性化は、Na+/タウロコール酸共輸送ポリペプチド(NTCP;SLC10A1)、CYP7A1およびCYP8B1のフィードバック抑制をもたらす。これらの遺伝子は、コレステロール 7α−ヒドロキシラーゼおよびステロール 12α−ヒドロキシラーゼをコードし、これらの酵素はともに、コレステロールからの胆汁酸の合成の中心である。CYP7A1のFXR依存性抑制は、転写リプレッサー、短いヘテロダイマーパートナー(SHP;NR0B2)、DNA結合ドメインを欠いている非定型核レセプターによって媒介される。従って、活性化の際に、FXRは、SHPの発現を直接誘導し、SHPは、続いて、肝臓レセプターホモログ−1(LRH−I;NR5A2)(CYP7A1の既知の正の調節因子)と相互作用し、その転写活性を抑制する。妨害されたSHP遺伝子を有するマウスにおいて行った研究によって、CYP7A1の抑制におけるFXR−SHP−LRH−1カスケードの重要性が確認された(例えば、Formanら,Cell 81:687−693,1995;Seolら,Mol.Endocrinol.9:72−85,1995;Sinaiら,Cell 102:731−744,2000;Ananthanarayananら,J.Biol.Chem.,276:28857−28865,2001;Holtら,Genes Dev.,17:1581−91,2003;Kastら,J.Biol.Chem.,277:2908−2915,2002;Goodwinら,Mol.Cell 6:517−526,2000;およびLuら,Mol Cell 6:507−515,2000を参照のこと)。
【0218】
本明細書中以降に示される研究の目的は、以下のとおりである:1)HSCがFXRを発現するか否かを実証すること;2)FXRリガンドが、コラーゲンα1発現および合成をインビトロで調節するか否かを実証すること;ならびに3)この効果の分子中間体を明らかにすること。HSCの2つのタイプを、この研究において使用した。このタイプは、初代培養物中の新たに単離された細胞であるか、ラットHSCから得た不死化細胞株(HSC−T6)であるかのいずれかであった。
【0219】
図1に示される結果は、HSCの初代培養物およびHSC−T6がともに、逆転写ポリメラーゼ連鎖反応(RT−PCR)でmRNA(パネルa)を、およびウェスタンブロット分析でタンパク質(パネルb)を測定することによって評価される場合、FXRを発現することを実証する。パネルbは、HSCにおけるFXRの量が、培養している間、経時的に増大し、その増加は、α−平滑筋アクチン(αSMA)(これは、筋線維芽細胞様細胞へのHSCの分化のマーカーである)の発現と並行して生じることを実証する。従って、HSCは、それらの分化した表現型を獲得すると同時に、FXRもまた発現する。このことと一致して、FXR発現はまた、HSC−T6において検出された。
【0220】
次いで、HSCが既知のFXR転写標的である遺伝子を発現するか否かを評価した。図2のパネルaにおいて示されるように、NTCP、BSEP、CYP7A1、およびSHPの発現を、HSCにおいて検出した。さらに、図2のパネルbにおいて示されるように、HSCにおけるこれらの遺伝子の発現は、FXRリガンドによって調節される。図2bに示される定量的RT−PCRは、合成FXRリガンドである6ECDCAに(1μMの濃度で)、および天然のFXRリガンドであるCDCAに(20μMの濃度で)曝すと、SHP mRNAおよびBSEP mRNAの2倍の増加、ならびにNTCP mRNAおよびCYP7A1 mRNAの50〜70%の減少が生じることを図示する。
【0221】
図3aに図示されるように、HSCをFXRリガンドである6ECDCA(1μM)、CDCA(20μM)、およびGW4064(100μM)に曝すと、RT−PCRおよび定量的RT−PCRによってα1 mRNA発現を評価することによって測定される場合、I型コラーゲンの発現が減少する。これらの観察は、図3bにおいて示されるように、ノーザンブロット分析によって確認された。
【0222】
α1コラーゲンの合成に対してインビトロで発揮される阻害効果のFXRリガンドは、HSC増殖の阻害またはHSCの死の誘導に関連しない。なぜなら、図4a〜cに図示されるように、[3H]−チミジン取り込みを決定すること(パネルaおよびパネルb)または細胞計数(パネルc)によって評価される場合、6ECDCAは、トロンビン、PDGF、およびTGFβ1によって誘導されるHSC増殖を妨げないからである。さらに、FXRリガンドの曝露は、いかなるHSCアポトーシスも生じない(パネルd)。
【0223】
図5に図示されるように、FXRリガンドはまた、細胞上清中のヒドロキシプロリン濃度(これは、HSCからのコラーゲン放出の尺度である)を決定することによって測定される場合、コラーゲンα1放出を阻害する。
【0224】
このα1遺伝子は、α1プロモーターを結合するためにFXRによって使用され得るIRを欠いているので、本発明者らは、HSCにおけるFXRリガンドによって誘導されるα1発現の阻害に関与するメディエーターを調査し、α1発現を阻害するために、FXRリガンドがSHP誘導を厳密に必要とするという証拠を見出した。実際に、図6に図示されるように、HSC−T6におけるSHP過剰発現は、QRT−PCRによって(パネルa)およびノーザンブロット分析(パネルb)によって測定される場合に、休止中のHSC−T6に対してα1発現を停止させ、かつトロンビン、TGFβ1およびPDGFによって引き起こされるα1誘導を妨げる。
【0225】
対照的に、図7に図示されるように、特定の小さな干渉RNA(siRNA)によるSHP発現の停止は、mRNA阻害が、FXRリガンドによって引き起こされることを明らかにした(パネルa)。また、SHPのサイレンシングにより、マイトジェン因子(例えば、トロンビン、TGFおよびPDGF)で処理したHSCにおける、FXRリガンドによって誘導されるα1発現の阻害が妨げられた(パネル7c)。これらデータを、ノーザンブロット分析によって確認した。
【0226】
まとめると、本明細書で提示されるデータは、HSC(肝臓においてコラーゲンを生成しかつ肝臓線維症の原因である細胞)がFXRを発現しかつこれら細胞をFXRの天然リガンドまたは合成リガンドに曝すと、コラーゲンα1 mRNAおよびSHPの誘導を伴う機構による分泌をダウンレギュレートすることを実証する。
【0227】
(材料および方法)
(リアルタイムPCR)
その発現遺伝子の定量を、リアルタイムポリメラーゼ連鎖反応(Q−RTPCR)によって行った。総RNAを、24時間飢餓状態にして、FXRリガンドである6ECDCA 1μMで18時間刺激した、ラット肝星細胞(HSC)またはT6細胞株から単離した(TRIzol試薬−Invitrogen)。1μg RNAを、室温で15分間のDNaseI処理(Invitrogen)によって、ゲノムDNAから精製した。このDNaseIを、2.5μM EDTAの存在下で、95℃で5分間、不活性化する。そのRNAを、20μlの反応容積中、Superscript II(Invitrogen)で無作為に逆転写した。100ngのテンプレートを、リアルタイムPCRの25μlの最終容積の反応系において使用した。この反応系は、以下の試薬を含んでいた:0.3μMの各プライマーおよび12.5μlの2×SYBR Green PCR Master MIX(Bio−Rad)。全ての反応を、三連で行い、サーマルサイクリング条件は以下のとおりであった:iCycler iQ機器(Biorad,Hercules,CA)において、95℃で2分間、続いて、95℃を10秒間と60℃を30秒間とが50サイクル。各サンプルに対する複製物の平均値を計算し、サイクル閾値として表した(CT:各PCR反応が所定の蛍光閾値(全ての反応の線形範囲内で設定される)に達するサイクル数)。次いで、この遺伝子発現量を、標的遺伝子に関するサンプルのCT値と、内因性コントロール(アクチン)に関するサンプルの平均CT値との間の差異(ΔCT)として計算した。相対的発現を、各標的遺伝子に関して、試験サンプルのΔCT値とコントロールサンプルのΔCT値(WT)との間の差異(ΔΔCT)として計算した。相対的定量値を表し、2−ΔΔCTとして示した。全てのPCRプライマーを、NCBIデータベースから公にされた配列データを用いて、ソフトウェアPRIMER3−OUTPUTを用いて設計した。
【0228】
【化1】

【0229】
(ノーザンブロット分析)
コラーゲンI αIのレベルを、初代肝星細胞(HSC)、T6細胞株およびHepG2細胞株から調製された総RNAサンプルのノーザンブロット分析によって決定した。この目的で、10μgの総RNAを、ゲル電気泳動で分離した(0.98M ホルムアルデヒドを含む1% アガロース)。電気泳動の直後に、そのRNAを正に荷電したナイロン膜(Amersham Life Sciences crop.)に転写した。この転写したRNAを、UV光によってこの膜に架橋させた。この膜を、6×SSCおよび2% SDS中で4時間プレハイブリダイズして、その後、コラーゲンI αIまたはGAPDH(内部コントロールとして)に関する32P−標識プローブと65℃で20時間ハイブリダイズした。ハイブリダイズさせた膜を、最終的なストリンジェンシー1×SSC、1.0% SDSで、65℃で洗浄し、Kodak AR−2フィルムに、−80℃で露出した。このデータを、内部GAPDHに対して相対的に表す。
【0230】
(ウェスタンブロット分析)
HSCまたはT6細胞株のコンフルエントな培養物を、48時間の間、血清を欠乏させて、その後、トロンビン(10単位/ml)、6ECDCA(1μM)のいずれかありまたはなしのDMEM中で、37℃で18時間インキュベートした。全溶解物を、細胞をSDS Laemmlyサンプル緩衝液(62.5mM Tris−HCl(pH6.8)、10% グリセロール、2% SDS、0.015% プロモフェノールブルー)中に溶解することによって調製し、3〜4×105個の細胞を、10% ポリアクリルアミドゲル上での電気泳動に供した。次いで、分離したタンパク質を、ニトロセルロース膜(BioRad)に転写し、その膜を、c−Jun、JunD、SHP、FXR、αSMAに対する一次抗体(Santa Cruz Biotechnology)でプローブした。この抗免疫グロブリンG西洋ワサビペルオキシダーゼ結合体(Bio−Rad)を、二次抗体として添加し、特異的タンパク質バンドを、製造業者が示唆したプロトコルに従って、増強ケミルミネッセンス(ECL;Amersham corp.)を用いて可視化した。
【0231】
(同時免疫沈降アッセイ)
免疫沈降のための抽出物を調製するために、初代HSC細胞、またはT6細胞およびT6過剰発現SHP細胞を、まず、氷冷PBSで3回洗浄し、その後、これらの細胞を、E1A緩衝液(50mM Hepes(pH7)、250mM NaCl、0.1% NP−40、5mM EDTA、1mM DTT、1mM フェニルメチルスルホニルフルオリド、1mg/ml ロイペプチン、1mg/ml アプロチニンおよび1mg/ml ペプスタチンA)中で超音波処理することによって溶解した。この溶解物を、13,000gで10分間遠心分離することによって膜残渣を除去して清澄にし、その上清抽出物中のタンパク質濃度を、1mg/mlに合わせた。1〜4mgの総タンパク質または107個の細胞溶解物を、10μl プロテインAセファロース(Amersham Pharmacia Biotechnology,Piscataway,New Jersey)の存在下で、抗SHP、抗JunDまたは抗c−Jun(Santa Cruz Biotechnology,Santa Cruz,California)または無関係の抗体としての抗CD28(コントロール)で、一晩+4℃で免疫沈降した。得られた免疫沈降物を、EIAで5回洗浄した後、SDS−PAGEに供し、免疫沈降において使用した抗体(逆抗体(reverse))と一緒にイムノブロットした。
【0232】
(T6細胞におけるウイルスベクター媒介性SHP遺伝子の形質導入)
このSHPコード配列を、ラット初代肝細胞からクローニングした。簡潔には、1μgの総RNAを、0.3μM ランダムヘキサマーを用いて、20μlの反応系において、SuperScript III逆転写酵素(Invitrogen)により逆転写した。200個のcDNAテンプレートを用いて、50μl PCR反応系において、特異的プライマー:
【0233】
【化2】

を用いて、SHPのコード配列をPfu DNAポリメラーゼ(Stratagene)により増幅した。SHPコード配列を、pCR2.1ベクター(TOPO−TAクローニング−Invitrogen)において最初にクローニングし、次いで、レトロウイルスベクターPINCOにおいてサブクローニングした。293T改変パッケージング細胞(ΦNX)を、10%FBSおよびリン酸カルシウムを含有するDMEM培地中で培養し、PINCO−SHPキメラおよびネガティブコントロールとしてのPINCOのみで一過性にトランスフェクトした。トランスフェクトして48時間後に、上清中のウイルスを回収し、T6細胞を感染するために使用した。PINCOベクターは、感染細胞(緑色)を非感染細胞から分離することを可能にするEGFP(エメラルドグリーン蛍光タンパク質)遺伝子を率いている。SHPを発現するT6細胞の純粋な集団を、FACS(蛍光活性化セルソーター)分離によって得た。このSHP発現を、ウェスタンブロット分析によって検出した。
【0234】
(実施例2:FXRリガンドの投与は、胆管結紮(BDL)ラットにおいて線維症の減少を生じる)
BDLは、慢性胆汁欝滞のモデルである。しかし、このモデルにおいて、進行性肝臓線維症は、結紮してから3〜4週間後に、肝硬変の発症をもたらすので、肝臓線維症のモデルとしても使用される(Kountourasら,Br.J.Exp.Pathol,65:305−311,1984)。このモデルによって、本発明者らが抗線維症療法の効果を試験することが可能であるので、本発明者らは、BDLして3日後に、2週間にわたって、経口で、1日あたり1mg/kgおよび3mg/kgの用量の6ECDCAをラットに投与した。このプロトコルの研究は、Animal Study Committee of the University of Perugiaによって認可された。肝臓線維症を、BDLによって8〜9週齢のオスWistarラット(Charles River,Monza,Italy)において誘導した。BDLを、Kountourasら(Br.J.Exp.Pathol.65:305−311;1984)によって最初に記載されたように行った。BDLの1週間後に、ラットを無作為化して、以下の処置の内の1つを与えた:プラセボ(100μL PBSの皮下注射)または1mg/kg/日および3mg/kg/日の用量の6ECDCA(経口で)。次いで、動物を、3週間にわたって追跡した。
【0235】
研究の最後に、生き残っているラットをペントバルビタールナトリウム麻酔(50mg/kg i.p)下で屠殺し、最終的に心臓穿刺により採血した。その血液を、7250gで20分間、4℃で遠心分離した;その得られた血清を、分析するまで−20℃で保存した(最長2週間)。死亡したときに、胆管結紮が、総胆管の近位拡張を伴って損なわれていないことを確認した。秤量後、肝臓標本を液体窒素中で即時に凍結し、その後の分析のために−70℃で保存した。組織学的試験のために、各動物の肝臓の右葉および左葉の一部(10〜15mg/各葉)を、10%ホルマリン中で固定し、パラフィン中に包埋し、切片を作製し、ヘマトキシリンとエオシンまたはシリウスレッドで染色した。シリウスレッド染色のために、その切片を、0.1% シリウスレッドF3B(Sigma Chemical Co.)(飽和ピクリン酸および0.1% ファストグリーンを含有する)中で30分間インキュベートした。蒸留水で2回すすいだ後、切片を70% エタノールで短時間脱水し、カバースリップをかけた。肝臓サンプルからのコラーゲン表面密度を、以前に記載されるようにコンピューター補助画像分析システム(Image Acquisition System Ver.005,Delta Sistemi,Rome,Italy)を用いて定量した。盲検状態にした標本におけるコラーゲンの表面密度を、RockeyおよびChung(Rockey,D.C.,Chung,J.J. J.Clin.Invest.98:1381−1388,1996)によって記載される方法に従ってビデオスクリーンディスプレイ拡大写真で測定し、パーセントとして表した(コラーゲン表面積/総分析視野表面の比率)。10個の無作為の視野からとったスコアの平均を、各動物の肝臓に対する単一の巣かを作るために使用した。
【0236】
図8に図示されるように、6ECDCAのインビボ送達は、シリウスレッド染色のスコア付け(図8a)、肝臓ヒドロキシプロリン含有量(図8b)、およびRT−PCRによる肝臓α1 mRNA(図8c)によって測定される場合に、肝臓コラーゲン沈着の有意な減少を生じた。肝臓におけるシリウスレッド染色コラーゲンの定量分析によって、6ECDCAでの処置後に、肝臓コラーゲン含有量の62%減少が実証された。図8において、データは平均±SEである;*は、偽手術に対してP<0.01を、**は、BDLに対してP<0.01を示す。「中心」および「門脈」は、中心静脈および門脈領域、ならびにこれら空間に直ぐ隣接して取り囲む実質領域をいう。「全て」とは、低倍率下で可視化される全肝臓面積をいう。
【0237】
(実施例3:線維症を阻害するためのFXRリガンドの投与)
本発明は、以下の実施例に従って実施され得る。58歳の老年の女性患者(体重約60kg)は、慢性C型肝炎(HCV)感染に罹患しており、肝臓線維症の発症および進行を阻害するための処置を捜し求めている。この患者のアルカリホスファターゼ、GGTおよび5’ヌクレオチダーゼの血清レベルは、胆汁欝滞状態を示さない範囲内に入っていると考えられる。肝臓線維症状態を評価し、ならびに肝臓生検および/もしくは非侵襲性血清マーカーの測定を行うことによってステージを決定した後に、6ECDCAを含む錠剤を、1日2回のスケジュールの経口投与でその患者に処方する。合計300mgの6ECDCAを、各々の日に服用させる。その患者は、彼女の残りの寿命の間、このスケジュールに従う。肝臓線維症の発症および進行は、血清マーカーを測定するかまたは肝臓生検を分析することに基づいてモニターされ得る。
【0238】
本願で引用される全ての特許、特許出願、および他の刊行物は、全ての目的でその全体が本明細書に参考として援用される。
【技術分野】
【0001】
(関連出願)
本願は、2004年3月12日に出願された米国仮特許出願第60/552,865号(その内容は、本明細書中に全体が援用される)に対する優先権を主張する。
【0002】
(発明の分野)
本発明は、線維症の予防、処置、および/または逆転に関する。具体的には、本発明は、線維症性肝疾患を有する患者、線維症性腸疾患を有する患者、または線維症性腎疾患を有する患者(これらの患者はまた、胆汁鬱滞性状態には罹患していない)においてファルネソイドXレセプター(FXR)に対して特異的なリガンドの新規に使用して、FXRが発現される組織における線維症の発症および進行を阻害することに関する。
【背景技術】
【0003】
線維症は、関与する組織の細胞外マトリックスにおけるコラーゲンの過剰蓄積によって特徴付けられる。線維症は、有効な処置が現在は利用可能でない、長期にわたる困難な臨床問題である。コラーゲンの産生は、高度に調節される生理的プロセスであり、このコラーゲン産生の障害は、組織線維症の発症をもたらし得る。線維性組織の形成は、損傷後の治癒という通常の有益なプロセスの一部である。しかし、ある場合には、線維性物質の異常な蓄積は、罹患した組織の正常な機能を深刻に妨害し得るか、または罹患した器官の機能の完全な喪失さえ引き起こし得る。
【0004】
肝線維症は、例えば、顕著な罹病率および死亡率を伴う重大な医学的問題を示す。種々の肝疾患において、慢性損傷は、肝臓が20年間〜30年間もの長きにわたって補償可能な進行性線維症をもたらす。しかし、最終的には、患者は、重篤な線維症および肝硬変に起因する肝不全の症状および徴候を経験し始める。世界中の慢性ウイルス肝炎感染(特に、B型肝炎ウイルスおよびC型肝炎ウイルスによる)は、肝線維症の主要原因を示す。しかし、米国において、慢性アルコール消費が、伝統的に、肝線維症および肝硬変の主要原因であった。現在、一般市民において肥満の有病率が急速に増加しているので、非アルコール性脂肪肝疾患(NAFLD)が、肝線維症に関連する最も蔓延している状態になっており、ここ数年間における肝線維症関連性罹患率および肝線維症関連性死亡率の主要原因になり得る。肝線維症の他の公知の原因としては、寄生虫感染、自己免疫疾患、鉄蓄積症または銅蓄積症、および胆道閉塞が挙げられる。肝線維症は、細胞外マトリックスタンパク質の過剰沈着により特徴付けられる種々の慢性刺激に対する創傷治癒応答として分類され得る。I型コラーゲンが、この細胞外マトリックスタンパク質の中の多くを占める。この過剰な細胞外マトリックスタンパク質沈着は、肝臓の正常な構造を破壊し、器官に対する構造的損傷および機能的損傷をもたらす。未処置のままで放置された場合、肝線維症は、肝硬変へと進行し得、最終的には、器官不全および死亡へとつながる。他の多くの消耗性の疾患および致命的な可能性がある疾患もまた、器官(例えば、腸、腎臓、心臓、および肺)の線維症をもたらす。
【0005】
線維症の間のコラーゲン生成の中心的役割が原因で、多くの研究は、コラーゲン発現および線維芽細胞(コラーゲン合成を担う主要な細胞型である)増殖の調節に焦点を合わせている。肝臓において、肝星細胞(HSC)は、主要な線維原性細胞型である。
【0006】
種々の化合物が、種々の作用機構(コラーゲン発現の抑制を含む)を介して、抗線維症剤として同定されている。例えば、パンテチン(D−ビス−(N−パントテニル−β−アミノエチル)−ジスルフィド)は、肝線維症の阻害のために有効であると報告されている(特許文献1)。ヒドラジン誘導体である安息香酸ヒドラジドは、強力な抗線維症剤であることが示されている(特許文献2および特許文献3)。アンジオテンシンインヒビターを、線維症の進行を阻害するために酸化窒素刺激剤と組み合わせて使用することが、特許文献4および特許文献5に開示されている。特許文献6は、線維症を阻害するために、特定のピリドキサルベンゾイルヒドラゾンまたはそのアナログを使用する方法を、記載する。特許文献7は、線維症および硬化症を処置または予防するための、A1アデノシンレセプターアンタゴニストおよび/またはP2Xプリノセプターアンタゴニストの使用を記載する。より最近には、ソマトスタチンアゴニスト、肝細胞増殖因子(HGF)、カイメースインヒビター、およびIL−13アンタゴニストが、線維症を有効に阻害すると報告されている(特許文献8、特許文献9、特許文献10、および特許文献11)。
【0007】
ファルネソイドXレセプター(FXR)(胆汁酸レセプター(BAR)およびNR1H4としても公知である)は、リガンド活性化転写因子の核レセプタースーパーファミリーのメンバーである。このFXRは、レチノイドXレセプター(RXR)と、胆汁酸ホメオスタシスのために重要なヘテロダイマーレセプターを形成する(非特許文献1;非特許文献2)。FXRは、種々の組織(肝臓、腎臓、腸、結腸、卵巣、および副腎が挙げられる)において発現される(非特許文献1)。
【0008】
保存されたDNA結合ドメイン(DBD)およびC末端リガンド結合ドメイン(LBD)を含むので、FXRは、種々の天然に存在する胆汁酸(主要胆汁酸ケノデオキシグリコール酸(CDCA)およびそのタウリン結合体およびグリシン結合体を含む)に結合し、この胆汁酸によって活性化される(非特許文献3;非特許文献4;非特許文献5)。活性化した際、FXR−RXRへテロダイマーは、標的遺伝子のプロモーター領域に結合し、胆汁酸ホメオスタシスに関与するいくつかの遺伝子の発現を調節する。例えば、肝臓におけるFXRの活性化は、核レセプターの短いヘテロダイマーパートナー(SHP)の直接的誘導を介して、CYP7A(胆汁酸合成における律速段階を触媒する酵素をコードする遺伝子である)の発現低下をもたらす(非特許文献6)。一方、腸におけるFXRの活性化は、胆汁酸結合タンパク質(I−BABP)の発現増加をもたらす。この胆汁酸結合タンパク質は、回腸における胆汁酸の能動輸送に関与する(非特許文献7)。FXRにより調節される遺伝子のより詳細なリストについては、例えば、特許文献12第22〜23頁を参照のこと。
【0009】
胆汁酸ホメオスタシスにおけるFXRの重要性が原因で、FXR活性化リガンドは、種々の胆汁鬱滞疾患および状態(正常な腸肝胆汁流がブロックされているかまたは他の方法で止まっている(例えば、特許文献13および特許文献14を参照のこと)を処置するための使用について提唱されている。
【0010】
いかなる特定の理論に拘束されることも意図しないが、本発明者らは、FXR活性化が、SHPおよび他のFXR標的遺伝子を含む機構を介して、コラーゲン合成および生じる線維症をダウンレギュレートし得ることを示した。従って、FXR活性化リガンドは、FXRが存在する組織および器官(例えば、肝臓、腎臓、腸など)における有効な抗線維症剤である。本開示は、FXR活性化リガンドの以前には未知であった特性についての驚くべき発見に基づいて、線維症を予防、処置および/または逆転するための新規方法を提供する。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】米国特許第4,937,266号明細書
【特許文献2】米国特許第5,374,660号明細書
【特許文献3】米国特許第5,571,846号明細書
【特許文献4】米国特許第5,645,839号明細書
【特許文献5】米国特許第6,139,847号明細書
【特許文献6】米国特許第6,005,009号明細書
【特許文献7】米国特許第6,117,445号明細書
【特許文献8】米国特許第6,268,342号明細書
【特許文献9】米国特許第6,303,126号明細書
【特許文献10】米国特許第6,500,835号明細書
【特許文献11】米国特許第6,664,227号明細書
【特許文献12】国際公開第03/016288号パンフレット
【特許文献13】国際公開第02/072598号パンフレット
【特許文献14】国際公開第03/090745号パンフレット
【非特許文献】
【0012】
【非特許文献1】Formanら、Cell(1995)81:687〜693
【非特許文献2】Luら(2001)J.Biol.Chem.17:17
【非特許文献3】Makishimaら、Scinece(1999)284:1362〜1365
【非特許文献4】Parksら、Science(1999)284:1365〜1368
【非特許文献5】Wangら、Mol.Cell(1999)3:543〜553
【非特許文献6】Schwartzら、Curr.Opin.Lipidol(1998)9:113〜119
【非特許文献7】Kandaら、Biochem.J.(1998)330:261〜265
【発明の概要】
【課題を解決するための手段】
【0013】
(発明の簡単な要旨)
一局面において、本発明は、胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するための方法を提供する。この方法は、
その被験体に対して、ファルネソイドXレセプター(FXR)に対して特異的なリガンドを有効量投与して、FXRが発現される器官において生じ得る線維症を阻害する工程、を包含する。本願方法において使用されるFXRリガンドは、ケノデオキシコール酸(CDCA)でもウルソデオキシコール酸(UDCA)でもない。あるいは、このリガンドは、無細胞FXRアッセイまたは細胞ベースのFXRトランス活性化アッセイにおいて、5μM以下のEC50を有する。好ましい実施形態において、上記リガンドは、1μM以下のEC50を有する。
【0014】
いくつかの実施形態において、上記胆汁鬱滞性状態は、異常に増加した血清中アルカリホスファターゼレベル、異常に増加した血清中γ−グルタミルトランスペプチダーゼ(GGT)レベル、および異常に増加した血清中5’ヌクレオチダーゼレベルを有するものとして規定される。例示的な一実施形態において、上記の異常に増加した血清レベルは、アルカリホスファターゼについては約125IU/Lよりも高く、GGTについては約65IU/Lよりも高く、5’ヌクレオチダーゼについては約17IU/Lよりも高い。他の実施形態において、上記胆汁鬱滞性状態は、異常に増加した血清中アルカリホスファターゼレベル、異常に増加した血清中γ−グルタミルトランスペプチダーゼ(GGT)レベル、および異常に増加した血清中5’ヌクレオチダーゼレベルを有することに加えて、少なくとも1つの臨床症状を呈するものとしてさらに規定される。例示的な一実施形態において、上記臨床症状は、掻痒(itching)(痒み(pruritus))である。
【0015】
いくつかの実施形態において、本発明の方法によって阻害されるべき線維症は、肝線維症、腎線維症、または腸線維症である。他の実施形態において、上記被験体は、胆汁鬱滞状態(例えば、原発性胆汁性肝硬変、原発性硬化性胆管炎、薬物誘発性胆汁鬱滞、遺伝性胆汁鬱滞、または妊娠性肝内胆汁鬱滞)に罹患していない。なお他の実施形態において、上記被験体は、原発性肝臓癌および原発性胆道癌(primary liver and biliary cancer)、転移性癌、敗血症、慢性的完全非経口栄養法、嚢胞性線維症、または肉芽腫性肝疾患(granulomatous liver disease)などの疾患または状態に関連する胆汁鬱滞には罹患していない。
【0016】
いくつかの実施形態において、上記FXRリガンドは、6ECDCA、タウロ(tauro)−6ECDCA、6EUDCA、GW4064、6α−MeCDCA、6α−PrCDCA、フェキサラミン(fexaramine)、またはググルステロン(guggulsterone)である。
【0017】
いくつかの実施形態において、阻害されるべき線維症は、B型肝炎;C型肝炎;寄生虫性肝疾患;移植後の細菌感染、移植後のウイルス感染、および移植後の真菌感染;アルコール性肝疾患(ALD);非アルコール性脂肪肝疾患(NAFLD);非アルコール性脂肪肝炎(NASH);メトトレキサートにより誘発される肝疾患、イソニアジドにより誘発される肝疾患、オキシフェニスタチンにより誘発される肝疾患、メチルドパにより誘発される肝疾患、クロルプロマジンにより誘発される肝疾患、トルブタミドにより誘発される肝疾患、またはアミオダロンにより誘発される肝疾患;自己免疫肝炎;サルコイドーシス;ウィルソン病;ヘモクロマトーシス;ゴーシェ病;III型糖原病、IV型糖原病、VI型糖原病、IX型糖原病、およびX型糖原病;α1アンチトリプシン欠損症;ツェルヴェーガー症候群;チロシン血症;果糖血症;ガラクトース血症;バッド−キアーリ症候群に関連する脈管障害、静脈閉塞病に関連する脈管障害、または門脈血栓症に関連する脈管障害;または先天性肝線維症;などの疾患に関連する肝線維症である。
【0018】
他の実施形態において、阻害されるべき線維症は、クローン病、潰瘍性大腸炎、照射後発生性大腸炎(post−radiation colitis)、または顕微鏡的大腸炎(microscopic colitis)などの疾患に関連する腸線維症である。
【0019】
いくつかのさらなる実施形態において、阻害されるべき線維症は、糖尿病性腎症、高血圧性腎硬化症、慢性糸球体腎炎、慢性移植片糸球体症、慢性腸腎炎、または多発性嚢胞腎などの疾患に関連する腎線維症である。
【0020】
別の局面において、本発明は、胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するためのキットを提供する。この阻害されるべき線維症は、ファルネソイドXレセプター(FXR)が発現される器官において生じる。このキットは、
FXRに対して特異的な有効量のリガンド;および
その患者へのそのリガンドの投与についての適応症、投与量、およびスケジュールを教示する、指示資料(instructional material);
を備える。本願キットにおけるFXRリガンドは、ケノデオキシコール酸(CDCA)でもウルソデオキシコール酸(UDCA)でもない。あるいは、上記リガンドは、無細胞FXRアッセイまたは細胞ベースのFXRトランス活性化アッセイにおいて5μM以下のEC50を有する。好ましい実施形態において、上記リガンドは、1μM以下のEC50を有する。
【0021】
いくつかの実施形態において、上記キットは、肝線維症、腎線維症、または腸線維症を阻害するために使用される。他の実施形態において、上記キットは、FXRリガンド(例えば、6ECDCA、タウロ−6ECDCA、6EUDCA、GW4064、6α−MeCDCA、6α−PrCDCA、フェキサラミン、またはググルステロン)を含む。なお他の実施形態において、本願キットにおけるFXRは、経口投与または静脈内投与のために適切な薬学的組成物中にて提示される。
【図面の簡単な説明】
【0022】
【図1】図1は、HSCの初代培養物およびHSC−T6の初代培養物におけるFXR発現を、RT−PCRによりmRNAレベル(パネルa)で、およびウェスタンブロット分析によりタンパク質レベル(パネルb)で、示す。パネルbはまた、HSC中のFXR量が培養の間に経時的に増加し、その増加は、α−平滑筋アクチン(αSMA)(HSCから筋線維芽細胞様細胞への分化についてのマーカーである)の発現と並行することを示す。
【図2】図2は、HSCにおけるNTCP、BSEP、CYP7A1、およびSHPの発現(パネルa)、ならびにFXRリガンドにより調節されるこれらの遺伝子の発現(パネルb)を示す。図2bにおける定量的RT−PCRの結果は、6−ECDCA(合成FXRリガンド)に対する曝露およびCDCA(天然のFXRリガンド)に対する曝露が、SHP mRNAおよびBSEP mRNAの2倍の増加と、NTCP mRNAおよびCYP7A1 mRNAの50%〜70%の減少とをもたらすことを示す。
【図3】図3aは、RT−PCRの結果および定量的RT−PCRの結果を示す。これは、FXRリガンドである6−ECDCA(1μM)、CDCA(20μM)、またはGW4064(100nM)に対するHSCの曝露が、種々の方法によってα1 mRNA発現を評価することによって測定した場合に、I型コラーゲンの発現を減少することを示す。図3bは、ノーザンブロット分析の結果を示す。この結果により、パネルaの結果が確認される。
【図4】図4は、HSC増殖アッセイの結果を示す。これは、6−ECDCAは、[3H]−チミジン取込み(パネルaおよびパネルb)または細胞計数(パネルc)によって評価した場合に、トロンビン、PDGF、またはTGFβ1により誘導されるHSC増殖を防止しないことを示す。さらに、FXRリガンドは、HSCをアポトーシスへと駆動しない(パネルd)。
【図5】図5は、細胞上清中のヒドロキシプロリン濃度を決定することによって測定した場合に、コラーゲンα1放出のFXRリガンド媒介性阻害を示す(パネルaおよびパネルb)。
【図6】図6は、QRT−PCRおよびノーザンブロット分析によって測定した場合に、HSC−T6におけるSHP過剰発現が、休止HSC−T6におけるα1発現を排除し、トロンビン、TGFβ1およびPDGFにより引き起こされるα1誘導を防止することを、示す。
【図7】図7は、特異的な小さな干渉RNA(siRNA)によるSHP発現排除が、FXRリガンドにより引き起こされるα1 mRNA阻害を逆転させることを示す。SHPのサイレンシングはまた、有糸分裂促進因子(例えば、トロンビン、TGFβ、およびPDGF)で処理したHSCにおいてFXRリガンドにより誘導されるα1発現の阻害を防止する。α1 mRNAに対するSHPの影響を確認するノーザンブロット分析の結果がまた、図7において示される。
【図8】図8は、6ECDCAで処理したBDLラットまたは処理していないBDLラットの肝臓における、コラーゲン沈着レベル、ヒドロキシプロリンレベル、およびα1コラーゲンmRNAレベルを示す。
【発明を実施するための形態】
【0023】
(定義)
「線維症」とは、組織または器官における過度の線維性結合組織(例えば、瘢痕組織)の発生を含む状態を指す。そのような瘢痕組織発生は、疾患、外傷、化学的毒性などに起因する、その器官の感染、炎症、または損傷に応答して生じ得る。線維症は、種々の組織および器官(肝臓、腎臓、腸、肺、心臓などが挙げられる)において発症し得る。
【0024】
用語「阻害する」または「阻害」とは、本明細書中で使用される場合には、疾患または状態の発症もしくは進行に対する、検出可能な何らかの前向きの効果を指す。そのような前向きの効果は、その疾患もしくは状態の少なくとも1つの症状もしくは徴候の開始の遅延もしくは防止、その症状もしくは徴候の改善もしくは逆転、およびその症状もしくは徴候のさらなる悪化の遅延もしくは防止を包含し得る。
【0025】
本明細書中で使用される場合、「胆汁鬱滞状態」とは、肝臓からの胆汁排出が損なわれているかまたはブロックされている任意の疾患もしくは状態を指し、これは、肝臓または胆管のいずれかにおいて生じ得る。肝臓内胆汁鬱滞および肝臓外胆汁鬱滞が、胆汁鬱滞状態の2つの型である。肝臓内胆汁鬱滞(これは、肝臓の内部で生じる)は、原発性胆汁性肝硬変、原発性硬化性胆管炎、敗血症(全身感染)、急性アルコール性肝炎、薬物毒性、完全非経口栄養法(静脈内から給餌される)、悪性腫瘍、嚢胞性線維症、および妊娠において最も一般的に観察される。肝臓外胆汁鬱滞(これは、肝臓の外部で生じる)は、胆管腫瘍、狭窄症、嚢胞、憩室、総胆管における胆石形成、膵炎、膵臓腫瘍、または偽嚢胞、および近傍器官における塊もしくは腫瘍に起因する圧縮によって、引き起こされ得る。
【0026】
胆汁鬱滞状態の臨床的症状および徴候としては、掻痒(itching)(痒み(pruritus))、疲労、黄疸性の皮膚または眼、特定の食物を消化できないこと、悪心、嘔吐、白色便(pale stool)、濃い尿、および腹部の右上部四分の一の痛みが挙げられる。胆汁鬱滞状態の患者は、一組の標準的な臨床実験検査(患者の血清中における、アルカリホスファターゼレベル、γ−グルタミルトランスペプチダーゼ(GGT)レベル、5’ヌクレオチダーゼレベル、ビリルビンレベル、胆汁酸レベル、およびコレステロールレベルの測定が挙げられる)に基づいて臨床的に診断および追跡され得る。一般的に、患者は、診断マーカーであるアルカリホスファターゼ、GGT、および5’ヌクレオチダーゼの3つすべての血清レベルが異常に増加していると見なされる場合に、胆汁鬱滞状態を有すると診断される。これらのマーカーの正常血清レベルは、試験プロトコルに依存して、実験室間および手順間である程度変化し得る。従って、医師は、特定の実験室および試験手順に基づいて、これらのマーカーの各々について何が異常に増加した血液レベルであるかを決定可能である。例えば、胆汁鬱滞状態に罹患している患者は、一般的には、血液中で、約125IU/Lよりも高いアルカリホスファターゼ、約65IU/Lよりも高いGGT、そして約17IU/Lよりも高い5’ヌクレオチダーゼを有する。血清マーカーレベルの変動性が原因で、胆汁鬱滞状態は、上記の症状のうちの少なくとも1つ(例えば、掻痒(itching)(痒み(pruritus)))に加えて、これら3つのマーカーの異常なレベルに基づいて、診断され得る。
【0027】
FXRに対して特異的な「リガンド」とは、FXRに結合しそれによってリガンド依存性FXR転写活性を(いかなるリガンドもない状態で測定されるベースラインレベルとは異なるように)特異的に刺激可能である、天然化合物または合成化合物を指す。本願において、用語「FXRリガンド」は、「FXR活性化リガンド」と互換可能である。
【0028】
用語「有効量」とは、本明細書中で使用される場合、適切な用量を投与された場合に急性治療効果または慢性治療効果を生じる、化合物(例えば、FXR活性化リガンド)の量を指す。この効果としては、疾患/状態(例えば、肝臓、腎臓、または腸の線維症)および関連する合併症の症状、徴候、および基礎となる病理を、何らかの検出可能な程度まで予防、矯正、阻害、または逆転することが挙げられる。正確な量および投与スケジュールは、処置の目的に依存し、公知技術(例えば、Lieberman,Pharmaceutical Dosage Forms(vols.1−3,1992);Lloyd,The Art,Science and Technology of Pharmaceutical Compounding(1999);およびPickar,Dosage Calculations(1999)を参照のこと)を使用して当業者によって達成可能である。
【0029】
用語「器官」とは、細胞および組織からなり、かつ生物において何らかの特定の機能を実施する、分化した構造(心臓、肺、腎臓、肝臓などにおけるようなもの)を指す。この用語はまた、機能を実施するかまたは活性に協力する、身体部分(例えば、眼、および視覚器官を構成する関連構造)を包含する。用語「器官」は、潜在的に完全な構造へと発達可能な、分化した細胞および組織の何らかの部分的構造(例えば、肝臓の葉すなわち部分)をさらに包含する。
【0030】
(発明の詳細な説明)
最初に、ファルネソイドXレセプター(FXR)に対して特異的なリガンド(特に、低濃度でFXRを活性化可能なリガンド)は、胆汁鬱滞状態に罹患していない患者において、組織または器官(例えば、肝臓、腎臓、および腸)における線維症を処置または予防する際に有効であることが示される。
【0031】
いかなる特定の理論にも拘束されないが、本発明者らは、FXRがリガンド依存性様式で直接調節するSHPの作用を主に介して、コラーゲン合成を調節する際にFXRが重要な役割を果たすことを、発見した。従って、この発見によって、(特に、FXRリガンドの使用が以前に示唆された何らかの状態(例えば、胆汁鬱滞状態(FXRリガンドの抗胆汁鬱滞治療効果もまた線維症を間接的に阻害し得る))に罹患してない患者において)FXRが発現される組織における線維症の有効な予防、処置、および/または逆転のためのFXR活性化リガンドの使用が可能になる。
【0032】
(I.患者集団の同定)
本発明は、(1)線維症に罹患しているか、またはFXRが発現される組織もしくは器官において線維症をもたらすことが公知である特定の疾患/状態に罹患している患者;および(2)肝線維症を続発的に引き起こし得る胆汁鬱滞状態に罹患していない患者における、FXRリガンドの予防的使用および治療的使用に関し、そのような患者は、進行中の肝線維症を阻害するため、または肝線維症の発症を予防するために、FXRリガンドで処置される。下記の説明は、患者が本発明による処置のために適切な集団に当てはまるか否かの決定を可能にする。
【0033】
(A.器官におけるFXRの発現)
最初に、器官または組織におけるFXR発現状態を、FXRリガンドがその器官において線維症を有効に阻害するために使用され得るか否かを決定する前に決定しなければならない。FXR発現の検出は、異なる2つのレベル(核酸レベルおよびポリペプチドレベル)にて達成され得る。
【0034】
(1.核酸レベルにおけるFXR発現)
ヒトFXRをコードするポリヌクレオチド配列は、Formanら(Cell 81:687〜93,1995)によって同定されており、GenBank登録番号NM_005123として利用可能である。この情報に基づいて、FXR遺伝子発現は、ヒト患者サンプルにおいて核酸レベルで検出され得る。核酸ハイブリダイゼーション技術を使用して特定のDNAおよびRNAを測定する種々の方法が、一般的に使用される(例えば、SambrookおよびRussel,Molecular Cloning,A Laboraroty Manual(第3版)2001)。ある方法は、電気泳動分離を含む(DNAを検出するためのサザンブロット、およびRNAを検出するためのノーザンブロット)が、DNAまたはRNAの検出は、電気泳動を用いなくても(例えば、ドットブロットによって、または検出が標的組織内で行われるインサイチュハイブリダイゼーションによって)実行され得る。特定の器官の細胞におけるFXRコード核酸の存在はまた、ポリメラーゼ連鎖反応(PCR)またはPCRベースの方法(例えば、リアルタイムPCRおよび逆転写ポリメラーゼ連鎖反応(RT−PCR))によって、配列特異的なプライマーを使用して検出され得る。
【0035】
(2.タンパク質レベルにおけるFXR発現)
器官におけるFXR発現は、この器官に由来する組織サンプルにおけるFXRタンパク質を検出することによって、確認され得る。ヒトFXRのアミノ酸配列は、そのコード配列(例えば、GenBank登録番号NM_51023)に基づいて決定され得、これは、WO00/76523などの公開公報において示される。種々の免疫学的アッセイ(例えば、酵素結合免疫吸着アッセイ(ELISA)、ウェスタンブロット、および免疫組織化学)が、FXR遺伝子産物レベルを測定するために、特に、そのFXRポリペプチドと特異的に反応するポリクローナル抗体またはモノクローナル抗体を使用して、当業者によって使用され得る(例えば、HarlowおよびLane,Antibodies,A Laboratory Manual,Chapter 14,Cold Spring Harbor,1988;KohlerおよびMilstein,Nature 256,495〜497,1975)。そのような技術には、FXRポリペプチドに対する高い特異性を有する抗体またはその抗原性部分を選択することによる抗体調製が必要である。ポリクローナル抗体およびモノクローナル抗体を惹起するための方法は、十分に確立されており、その説明は、文献(例えば、HarlowおよびLane(上記);KohlerおよびMilstein,Eur.J.Immunol.6:511〜519,1976を参照のこと)において見出され得る。
【0036】
(FXRに対する抗体の生成)
対象とする免疫原と特異的に反応するポリクローナル抗体およびモノクローナル抗体を生成するための方法は、当業者にとって公知である(例えば、Coligan,Current Protocols in Immunology,Wiley/Greene,NY,1991;HarlowおよびLane,Antibodies:A Laboratory Manual,Cold Spring Harbor Press,NY,1989;Stilesら編,Basic and Clinical Immunology(第4版)Lange Medical Publications,Los Altos,CAおよびその中に引用文献;Goding,Monoclonal Antibodies:Principles and Practice(第2版)Academic Press,New York,NY、1986;ならびにKohlerおよびMilstein,Nature 256:495〜497,1975を参照のこと)。そのような技術は、ファージまたは同様のベクターにおける組換え抗体ライブラリーから抗体を選択することによって、抗体を調製することを包含する(Huseら、Science 246:1275〜1281,1989;およびWardら、Nature 341:544〜546,1989を参照のこと)。
【0037】
望ましい特異性を有する抗体を含む抗血清を生成するために、対象となるポリペプチド(例えば、ヒトFXR)またはその抗原性フラグメントが、適切な動物(例えば、マウス、ラット、ウサギ、ヤギ、ウマ、またはサル)を免疫するために使用され得る。標準的なアジュバント(例えば、フロイントアジュバント)が、標準的な免疫プロトコルに従って使用され得る。あるいは、その特定のポリペプチドに由来する合成抗原性ペプチドが、キャリアタンパク質に結合体化され得、そしてその後に免疫原として使用され得る。
【0038】
その免疫原調製物に対するその動物免疫応答は、試験採血を採取すること、そして対象抗原に対する反応性力価を測定することによって、モニターされる。その抗原に対する適切に高い力価の抗体が得られた場合、その動物から血液が採取され、抗血清が調製される。その抗原に対して特異的に反応する抗体を濃縮するためのその抗血清のさらなる分画と、その抗体の精製とが、その後実施され得る(HarlowおよびLane(上記)と、上記に提供されるタンパク質精製の一般的説明とを参照のこと)。
【0039】
モノクローナル抗体が、当業者が精通している種々の技術を使用して得られる。代表的には、望ましい抗原で免疫された動物に由来する脾細胞が、一般的には骨髄腫細胞との融合によって、不死化される(KohlerおよびMilstein、Eur.J.Immunol.6:511〜519,1976を参照のこと)。代替的な不死化方法としては、例えば、エプスタイン−バーウイルスによる形質転換、オンコジーンによる形質転換、またはレトロウイルスによる形質転換、あるいは当業者にとって周知の他の方法が挙げられる。単一の不死化細胞から生じるコロニーが、上記抗原に対する望ましい特異性および親和性の抗体生成についてスクリーニングされる。そのような細胞により生成されるモノクローナル抗体の収率は、種々の技術(脊椎動物宿主の腹腔へと注射が挙げられる)によって増強され得る。
【0040】
さらに、モノクローナル抗体はまた、Huseら(上記)によって概略された一般的プロトコルに従ってヒトB細胞cDNAライブラリーをスクリーニングすることによって、望ましい特異性を有する(例えば、ヒトFXRを特異的に認識する)抗体またはそのような抗体の結合フラグメントをコードする核酸配列を同定して、組換え生成され得る。上記で考察された組換えポリペプチド生成についての一般的な原理および方法は、組換え方法による抗体生成に対して適用可能である。
【0041】
(FXR発現を検出するための免疫アッセイ)
一旦、FXRに対して特異的な抗体が利用可能になると、サンプル(例えば、組織の小切片)におけるFXRの存在および量が、当業者に対して定性的結果および定量的結果を提供する種々の免疫アッセイ方法(例えば、ELISAまたはウェスタンブロット)によって測定され得る。一般的な免疫学的手順および免疫アッセイ手順の概説については、例えば、Stites(上記);米国特許第4,366,241号;米国特許第4,376,110号;米国特許第4,517,288号;および米国特許第4,837,168号を参照のこと。
【0042】
((a)免疫アッセイにおける標識化)
免疫アッセイは、上記抗体と標的タンパク質(例えば、ヒトFXR)とによって形成される結合複合体に対して特異的に結合してその結合複合体を標識する、標識化因子を使用する。その標識化因子は、それ自体が、上記抗体/標的タンパク質複合体を含む部分のうちの1つであり得るか、またはその抗体/標的タンパク質複合体に特異的に結合する第三の部分(例えば、別の抗体)であり得る。標識は、分光測定的手段、光化学的手段、生化学的手段、免疫化学的手段、電気的手段、光学的手段、または化学的手段によって、検出可能であり得る。例としては、磁気ビーズ(例えば、DynabeadTM)、蛍光色素(例えば、フルオレセインイソチオシアナート、テキサスレッド、ローダミンなど)、放射性標識(例えば、3H、125I、35S、14C、または32P)、酵素(例えば、西洋ワサビペルオキシダーゼ、アルカリホスファターゼ、およびELISAにおいて一般的に使用される他の酵素)、および比色分析用標識(例えば、コロイド状金、または有色ガラスビーズもしくは有色プラスチック(例えば、ポリスチレン、ポリプロピレン、ラテックスなど)ビーズ)が挙げられるが、これらに限定されない。
【0043】
いくつかの場合、上記標識化因子は、検出可能な標識を保有する二次抗体である。あるいは、この二次抗体は、標識を欠くが、その後、この二次抗体が誘導された種の抗体に対して特異的な第三の標識抗体によって結合され得る。この二次抗体は、第三の標識分子(例えば、酵素標識されたストレプトアビジン)が特異的に結合し得る検出可能な部分(例えば、ビオチン)を用いて改変され得る。
【0044】
免疫グロブリン定常領域に特異的に結合可能な他のタンパク質(例えば、プロテインAまたはプロテインG)もまた、上記標識化因子として使用され得る。これらのタンパク質は、連鎖球菌細菌の細胞壁の通常構成成分である。これらのタンパク質は、種々の種に由来する免疫グロブリン定常領域と強い非免疫原性反応性を示す(一般的には、Kronvalら、J.Immunol.111:1401〜1406(1973);およびAkerstromら、J.Immunol.135:2589〜2542(1985)を参照のこと)。
【0045】
((b)免疫アッセイの形式)
サンプルから対象標的タンパク質(例えば、FXR)を検出するための免疫アッセイは、競合的であっても、非競合的であっても、いずれでもよい。非競合的免疫アッセイは、捕捉された標的タンパク質の量が直接測定されるアッセイである。好ましい「サンドイッチ」アッセイにおいて、例えば、その標的タンパク質に対して特異的な抗体は、その抗体が固定された固体基材に直接結合され得る。その後、その抗体は、試験サンプル中の上記標的タンパク質を捕捉する。そのようにして固定された抗体/標的タンパク質複合体は、標識化因子(例えば、上記のような標識を保有する第二の抗体または第三の抗体)によって結合される。
【0046】
競合アッセイにおいて、サンプル中の標的タンパク質の量は、標的タンパク質に対して特異的な抗体から、サンプル中に存在する標的タンパク質によって置換された(競合して押し退けられた(competed away))、添加された(外因性)標的タンパク質の量を測定することによって、間接的に測定される。そのようなアッセイの代表的例において、その抗体は固定され、外因性標的タンパク質は標識される。その抗体に結合された外因性標的タンパク質の量は、サンプル中に存在する標的タンパク質濃度と逆比例するので、サンプル中の標的タンパク質レベルは、上記抗体に結合してこのように固定された外因性標的タンパク質の量に基づいて、このように測定され得る。例えば、Karlsonら、Lab.Invest.,70:705〜710(1994)を参照のこと。
【0047】
いくつかの場合において、ウェスタンブロット(免疫ブロット)分析が、サンプル中のFXRの存在を検出してそのFXRを定量するために使用され得る。この技術は、一般的には、分子量に基づいてゲル電気泳動によってサンプルタンパク質を分離すること、分離されたタンパク質を適切な固体支持体(例えば、ニトロセルロースフィルター、ナイロンフィルター、または誘導体化ナイロンフィルター)に移すこと、およびそのサンプルを、標的タンパク質に特異的に結合する抗体とともにインキュベートすることを包含する。これらの抗体は、直接標識されてもよいし、またはFXRに対する抗体に特異的に結合する標識化抗体(例えば、標識化ヒツジ抗マウス抗体)を使用して、後に検出されてもよい。例えば、Pinedaら、J.Neurotrauma,18:625〜634(2001);Bowlerら、J.Biol.Chem.277:16505〜16511(2002)を参照のこと。
【0048】
FXRに対する抗体を使用する種々のインサイチュ免疫化学染色法もまた、組織サンプルにおけるFXRの存在を示すために有用である。
【0049】
他のアッセイ形式としては、リポソーム免疫アッセイ(LIA)(これは、特定の分子(例えば、抗体)に結合し、そして封入された試薬もしくはマーカーを放出するように設計された、リポソームを使用する)が挙げられる。この放出された化学物質は次いで、標準的な技術に従って検出される(Monroeら、Amer.Clin.Prod.Rev.5:34〜41(1986)を参照のこと)。
【0050】
さらに、機能的アッセイもまた、組織サンプルにおけるFXRの存在を検出するために実施され得る。FXRの生物学的活性を検出するためのアッセイが、一般的に、後の節において記載されている。
【0051】
(B.線維症の診断)
線維症は、ウイルス感染、細菌感染、炎症、自己免疫疾患、外傷、薬物毒性などに起因する、組織損傷に応答する病態生理学的プロセスである。このプロセスの間に、過度な量のコラーゲンが発現され、線維性物質が、罹患組織の細胞外空間において形成される。従って、線維症は、一般的には、線維症が疑われる器官の生検における線維性組織の特徴的形態に基づいて認識され得る。線維症の存在または線維症発症を検出するための他の手段としては、コンピューター断層撮影(CATまたはCT)スキャン、超音波、磁気共鳴画像化(MRI)、および線維症を示すことが公知である1種以上の血清マーカー(例えば、種々の型のコラーゲン)のレベルにモニタリングが、挙げられる。
【0052】
線維症を診断するための明確な様式もまた、線維症プロセスが生じる器官に依存して変化する。例えば、生検が、ほとんどの器官の線維症を診断するために一般的には有効であり、一方、光ファイバー機器を備える内視鏡(例えば、S状結腸鏡または結腸鏡)は、特定の器官(例えば、腸)の線維症を検出するための、比較的外傷を生じない代替法であり得る。
【0053】
(1.肝線維症を検出するための生検)
所定の期間から生検を得るための標準的手順が、確立されている。例えば、肝臓標本は、予備手術の間に取得され得るが、より頻繁には、皮膚を通して肝臓中に生検針を挿入することによって取得され得る。この手順(経皮肝臓生検と呼ばれる)が実施される前に、局所麻酔を与える。超音波またはCTスキャンが、その検体が取得される異常領域を位置決めするために使用され得る。
【0054】
経静脈的肝臓生検において、カテーテルが、頚部静脈中に挿入され、心臓を通され、肝臓から流れる肝静脈のうちの1つに配置されえる。その後、そのカテーテルの針が、その静脈の壁を通して肝臓中へと挿入される。この手順は、経皮的肝臓生検よりも肝臓を損傷させる可能性が低い。この手順は、出血しやすいヒト(重篤な肝疾患の合併症である)において特に有用である。
【0055】
肝臓生検を得ると、そのサンプルが試験され、そのサンプルにおける線維症の存在およびレベルを示すスコアが与えられる。最も頻繁に使用されるスコア付けシステムとしては、METAVIRスコア付けシステムまたは改変型HAI(ISHAK)スコア付けシステムが挙げられる。Knodellスコア付けシステムはまた、肝臓サンプルを分析するために使用され得る。肝臓サンプルのスコア付けにおいて使用される基準は、十分に確立されており、当業者にとって公知である。例えば、METAVIRシステムは、以下の5つのグレード付けを提供する:F0は、線維症が存在しないことを示す;F1は、隔壁のない門脈線維症を示す;F2は、門脈線維症およびいくつかの隔壁を示す;F3は、肝硬変を伴わない隔壁線維症を示す;F5は、肝硬変の存在を示す。例えば、BedossaおよびPoynard,Hepatology 24:289〜293,1996を参照のこと。
【0056】
生検は、肝線維症の診断のために有用であるばかりでなく、本発明の線維症処置方法/線維症予防方法の有効性を、当該分野で公知の方法論を使用して線維症の進行をモニターすることによって医師が評価するのもまた助け得る。例えば、Poynardら、Lancet 349:825,1997を参照のこと。
【0057】
(2.肝臓線維症についての血清マーカー)
肝線維症の存在および/または重篤度をそのレベルが示し得る、多数の公知の血清マーカーが存在する。従って、確立された方法に従ってマーカー(例えば、ヒアルロン酸、ラミニン、ウンデュリン(undulin)(IV型コラーゲン)、I型コラーゲンからのプロペプチド、II型コラーゲンからのプロペプチド、およびIV型コラーゲンからのプロペプチド、リシルオキシダーゼ、プロリルヒドロキシダーゼ、リシルヒドロキシラーゼ、PIIINP、PICP、コラーゲンVI、テナシン、コラーゲンXIV、ラミニンP1、TIMP−1、MMP−2、α2マクログロブリン、ハプトグロブリン、γグルタミルトランスペプチダーゼ、γグロブリン、総ビリルビン、アポリポタンパク質A1など)を測定する血液検査が、肝臓における線維症の診断および線維症進行にモニタリングのために、有用であり得る。
【0058】
(3.他のマーカー)
さらなるマーカー(例えば、核酸マーカー)が、線維症を検出および/またはモニターするために使用され得る。例えば、Wnt−4が、腎線維症において重要な役割を果たす遺伝子として、研究室の実験において最近示されており、そのmRNA発現は、腎臓における線維性組織において有意に増加される(例えば、Surendranら、J Pediatr.140:119〜24,2002を参照のこと)。この型のマーカーの遺伝子発現の定量的検出は、線維症の診断およびモニタリングにおいて有用であり得る。
【0059】
(C.線維症を発症するリスクが増加した患者の同定)
本発明の方法はまた、線維症発症の予防のため、または発症後の線維症進行の遅延のために、有用であるので、線維症リスクが増加している患者は、本発明の方法を使用して処置するために適切な患者集団に当てはまる。そのような患者は、線維症をもたらすことが公知である特定の疾患および状態の予備診断に基づいて、同定される。以下の節は、これらの疾患および状態のうちのいくつかを診断するための手段を記載する。しかし、人生の後期に患者が線維症を発症するリスクを増加させることが公知であり、かつ医師によって容易に診断され得る、さらなる疾患/状態が存在する。線維症を予防、阻害、または逆転するためにFXRリガンドを用いて、これらの疾患/状態のうちのいずれかに罹患している患者を処置することは、本発明の企図に含まれ、本発明の範囲内にある。そのような処置は、人生の経過を通じて短いことが保証され得る。同様に、所定の疾患/状態を有する所定の患者について保証され、そのような患者を処置することの当業者によって決定される。
【0060】
(1.肝線維症)
以下は、肝線維症を患者が発症するリスクを有意に増加させることが公知である疾患のいくつかの例である:(i)慢性肝臓感染(慢性B型肝炎ウイルス感染および慢性C型肝炎ウイルス感染;住血吸虫症および他の寄生生物肝臓疾患;移植後の細菌感染、移植後のウイルス感染、および移植後の真菌感染が挙げられる);(ii)アルコール性肝疾患;(iii)非アルコール性脂肪肝疾患(NAFLD)または非アルコール性脂肪肝炎(NASH);(iv)薬物誘発性肝疾患および化学物質誘発性肝疾患(メトトレキサートにより誘発される肝疾患、イソニアジドにより誘発される肝疾患、オキシフェニスタチンにより誘発される肝疾患、メチルドパにより誘発される肝疾患、クロルプロマジンにより誘発される肝疾患、トルブタミドにより誘発される肝疾患、およびアミオダロンにより誘発される肝疾患が挙げられる);(v)自己免疫疾患(自己免疫肝炎;サルコイドーシス;およびルポイド肝炎が挙げられる);(vi)先天性代謝異常から生じる蓄積症(ウィルソン病;ヘモクロマトーシス;ゴーシェ病;III型糖原病、IV型糖原病、VI型糖原病、IX型糖原病、およびX型糖原病;α1アンチトリプシン欠損症;ツェルヴェーガー症候群;チロシン血症;果糖血症;およびガラクトース血症が挙げられる);(vii)脈管障害(バッド−キアーリ症候群、静脈閉塞病、および門脈血栓症が挙げられる);ならびに(viii)先天性肝線維症。
【0061】
(B型肝炎)
B型肝炎は、B型肝炎ウイルス(HBV)(ヘパドナウイルス科に属するDNAウイルス)による感染に起因する肝臓の炎症を引き起こす。急性HBV感染は、通常は、回復するが、まれには、急性肝不全にもなり得、時には、慢性感染にもなり得る。この慢性感染は、健常なキャリア状態をもたらし得るか、または線維症から肝硬変およびその合併症(肝臓癌を含む)へと進行し得る。
【0062】
急性B型肝炎は、HBV感染から生じる、初期の、急速に発症する、持続期間が短い疾患である。急性B型肝炎を有する成人のうちの約70%は、ほとんど症状を有さないかまたは全く症状を有さないが、一方、残りの30%は、HBVに対する曝露の2ヶ月間後〜4ヶ月間後に、顕著な症状を発症する。急性B型肝炎の最も一般的な症状は、疲労、食欲喪失、悪心、嘔吐、濃い尿、明るい色の糞便、および肝臓領域一帯にわたる腹部疼痛である。黄疸が、しばしば、これらの他の症状に伴う。
【0063】
慢性B型肝炎の診断は、定義によれば、急性B型肝炎の発症からほんの6ヵ月後に行われ得る。慢性B型肝炎を有するほとんどの個体は、多年の(二十年または三十年までもの)間、無症候性のままである。この時間の間、患者の肝臓血液試験は、通常は、せいぜい軽度に異常であり、肝臓の炎症および瘢痕(すなわち、線維症)が、ゆっくり進行する。しかし、時には、他の点では不活性の慢性B型肝炎を有するこれらの個体は、急性症状の発赤(再活性化)、肝臓血液検査の増加、および肝臓の炎症を発症し得る。これらの発赤は、急性肝炎と類似しており、肝線維症のより急速な進行を引き起こし得る。
【0064】
上記の症状に加えて、B型肝炎の診断は、HBVに対する抗体を検出する血液検査によって確認される。
【0065】
(C型肝炎)
C型肝炎ウイルス(HCV)(フラビウイルス科のメンバーであるRNAウイルス)による感染は、肝臓を冒す最も顕著な健康上の問題のうちの1つである。400万人よりも多くのアメリカ人(米国の人口のうちの1.3%)および世界中で推定17億人(世界中の人口のうちの3%)が、HCVに感染する。このウイルスに最初に感染した個体のうちの約85%は、通常は数十年の間、慢性的に感染する。HCV感染個体のうちの他の15%は、単に急性感染を有するに過ぎない。
【0066】
HCV感染の初めに、患者のうちの約25%だけしか、急性肝炎の特徴的症状を示さない。これらの症状としては、疲労、筋肉痛、食欲不振、および低い発熱(low−grade fever)が挙げられる。まれに、皮膚の黄色化および/または眼の黄色化(黄疸)もまた、生じる。
【0067】
この肝炎が慢性的になると、ほとんどの個体は、無症状のままであり、そしてHCV抗体が検出された場合に、慣用的血液研究を介して診断され得るに過ぎない。十分に補償された疾患において、感染した個体は、慢性感染進行の普遍的特徴であるその進行性の肝臓の炎症、壊死、および線維症にも関わらず、何の症状を示さないかもしれない。他の患者は、疾患の進行の結果として、慢性疲労または断続的疲労、および幸福感の減少を経験し得る。一方、疲労が、比較的軽度の疾患を有する何人かの個体において記載されている。
【0068】
多数の診断検査が、HCV感染のために現在利用可能である。スクリーニング検査が、血液中の抗HCV抗体の存在を決定するためになされる。酵素免疫吸着アッセイ(EIA)は、HCV抗原に対する特異的抗体を測定することによって、HCV感染を診断するための従来の初期スクリーニング検査である。従って、この検査は、抗HCV抗体検査と呼ばれる。肝臓酵素(ALT/AST)および/またはHCVリスクファクターのうちのいずれかが増加している患者は、EIAが陽性である場合に、95%よりも高い確実性でHCVを有すると診断され得る。
【0069】
低いHCV感染リスクを有する個体がEIAによって陽性であると検査された場合に、確認検査が、HCVタンパク質に対する抗体について同様に試験する特殊なアッセイを使用して実施される。このアッセイは、組換え免疫ブロットアッセイ(RIBA)と呼ばれる。
【0070】
HCVは、RNAウイルスであるので、いくつかの診断アッセイは、患者の血液中のHCV RNAの検出に基づく。これらの検査は、分子検査と呼ばれる。なぜなら、これらの検査は、分子レベルでこのウイルスを試験するからである。HCV RNAを測定するための最も一般的な2種類のシステムは、逆転写ポリメラーゼ連鎖反応(RT−PCR)アッセイおよび分枝鎖DNA(bDNA)アッセイである。最近、第三の型のアッセイ(転写媒介性増幅(TMA)と呼ばれる)が、利用可能となっている。
【0071】
(アルコール性肝疾患)
アルコール性肝疾患(ALD)は、アルコールの過剰消費によって引き起こされる慢性肝疾患である。ALDの症状は、通常は、非特異的であり、基礎となる肝臓損傷の重篤度を必ずしも示さない。一般的なALDの症状としては、疲労、悪心および嘔吐、下痢、または腹痛が挙げられる。多くの患者は(進行性肝線維症および毒性によって特徴付けられる進行型ALDを有する患者でさえ)、何の症状も有さないかもしれず、その状態は、肝臓血液検査によって診断されるに過ぎない。代謝障害型ALD(重篤なアルコール性肝炎または肝硬変)のより進行した段階においてのみ、より特異的な肝臓関連症状(例えば、黄疸、腹水、吐血、または脳障害)を有する罹患者が存在する。
【0072】
ALDの診断は、アルコール乱用歴、肝臓損傷の存在および重篤度を示す血液検査に基づいて、確立される。肝臓の超音波スキャンは、疾患の重篤度を評価すること、および類似する症状を有する他の状態を排除することを、助け得る。肝臓生検は、ALDの存在おおび病期を決定するための最も信頼できる手段である。
【0073】
(非アルコール性脂肪肝疾患)
非アルコール性脂肪肝疾患(NAFLD)は、単純な脂肪肝(脂肪症)から、非アルコール性脂肪肝炎(NASH)から肝硬変に及ぶ範囲の、広範な肝臓疾患を指す。NAFLDの病期はすべて、共通して、肝細胞における脂肪蓄積を有する。NASHにおいて、この脂肪蓄積は、種々の程度の肝臓の炎症(肝炎)および瘢痕(線維症)に関連する。NAFLDおよびNASHは、過剰な量のアルコールを生じない個体において生じる。しかし、多くの点において、NAFLD生検の組織学的写真は、アルコール乱用によって引き起こされる肝疾患において観察され得るものと類似する。NAFLDおよびNASHは、主要な脂肪肝疾患と見なされる。続発性脂肪肝疾患としては、他の型の肝疾患において生じる脂肪肝疾患が挙げられる。このように、アルコール性肝疾患(ALD)は、最も頻繁な続発性脂肪肝疾患である。続発性脂肪肝はまた、慢性C型肝炎ウイルス(HCV)、慢性B型肝炎ウイルス(HBV)、慢性自己免疫肝炎(AIH)、およびウィルソン病においても生じ得る。
【0074】
NAFLDの症状と、NASHの症状とは、同じである。これらは、通常は、劇的ではなく、非特異的である(他の疾患においても観察され得る)傾向がある。その症状は、ほとんどの患者において最小限である。しかし、この患者は、時に、腹部の右上部四分の一の痛みを漠然と経験し得る。この疼痛は、特徴的には、鈍くかつうずき、予測可能な発生パターンを有さない。この疼痛は、例えば胆石の場合に生じ得るように、強く突然のひどい痛みではない。NAFLDおよびNASHにおける腹部疼痛は、肝臓が拡大する場合および/または肝臓に炎症が存在する場合の、肝臓被膜(膜)の伸長に起因すると考えられる。ALD、B型肝炎、またはC型肝炎とは対照的に、重篤な急性肝不全の症状(例えば、黄疸、激しい疲労、食欲喪失、悪心、嘔吐、および錯乱)は、NAFLDでもNASHでも観察されない。肥満および関連状態(例えば、糖尿病、高血圧)は、NAFLDまたはNASHに罹患しているヒトにおいて頻繁に観察される。インスリン抵抗性の古典的徴候が、しばしば、NAFLDおよびNASHにおける身体検査を支配する。黒色表皮症(腋および頚部の皮膚の黒色色素沈着)は、インスリン抵抗性の徴候であり得、そしてNASHの小児において頻繁に観察される。肝臓が触診された場合、肝臓は、通常は正常に感じられる。しかし、非常に大量の脂肪が肝臓に蓄積した場合、肝臓は、極めて大きくなり得、医師によって容易に感じられ得る軟らかく丸い縁を有するようになり得る。
【0075】
上記の症状に加えて、NAFLDまたはNASHの診断は、以下の基準に基づいてなされる:慢性的に増加したALT;超音波における脂肪肝の徴候、ALT増加に関する他の原因の排除、および脂肪肝。しかし、肝臓生検のみが、明確な診断を確立し得、そしてNAFLDまたはNASHの重篤度を決定し得る。
【0076】
(寄生生物肝疾患)
種々の寄生生物疾患は、肝臓を損傷させて線維症に到るかまたは肝硬変にまでも到ることが、公知である。肝吸虫症は、例えば、肝吸虫Clonorchis sinensisによる感染である。この寄生生物に最初に感染した患者は、通常は、寄生虫負荷(load)が500を超えるまでは症状を有さない。一般的症状は、悪寒、下痢、発熱、下腹部痛、黄疸、および肝臓腫脹である。この疾患を診断するためには、病歴(食事に関する質問、旅行に関する質問、以前に滞在していた地域に関する質問を含む)が、問診されるべきである。身体検査は、肝臓の丁寧な触診を含むべきである。さらなる検査は、内視鏡検査、および卵についての糞便サンプルの検査を含む。
【0077】
O.tunuicollis(O.felineus)およびO.viverriniは、Clonorchisに対して近縁である他の2種の寄生生物であり、持続的肝臓損傷をもたらし得る。その診断方法は、上記の方法と同様である。卵と成体寄生虫との形態比較が、これらの寄生生物による感染を区別するために必要である。
【0078】
住血吸虫症は、住血吸虫(汚染された水と接触するヒトに寄生する吸虫綱吸虫類である)によって引き起こされる、肝臓、胃腸管、および膀胱の別の寄生生物疾患である。
【0079】
ヒトにおいて疾患を引き起こす3つの主要な種のこれらの吸虫綱吸虫類(吸虫類)−Schistosoma haematobium、S.japonicum、およびS.mansoni−が存在する。感染後数日以内に、患者は、発疹または皮膚掻痒を発症し得る。発熱、咳、および筋肉痛が、感染1〜2ヶ月以内に始まり得るが、ほとんどのヒトは、感染初期には症状を有さない。これらの寄生生物の卵は、肝臓へと移動するかまたは腸もしくは膀胱へと達する。まれに、卵が、脳または脊髄において見出され、発作、麻痺、または脊髄炎症を引き起こし得る。多年にわたって繰り返し感染するヒトについて、この寄生生物は、肝臓、腸、肺、および膀胱に損傷を与え得る。
【0080】
住血吸虫症の診断は、卵および/または成体寄生生物に関する、患者の糞便または尿のサンプルの検査を含む。血液検査が、この寄生生物に対する抗体を検出するために開発されている。汚染された水に対して曝露された可能性を反映する病歴もまた、適切な診断を行うために有益である。
【0081】
(自己免疫肝炎)
自己免疫肝炎(ルポイド肝炎としても公知である)は、肝臓の正常細胞を外来組織または病原体と間違える免疫細胞によって引き起こされる肝臓の炎症を含む。自己免疫肝炎を有するヒトは、血流中を循環する自己抗体を有し、この自己抗体は、免疫系に肝臓を攻撃させる。この疾患は、他の自己免疫疾患(甲状腺炎、1型糖尿病、潰瘍性大腸炎、溶血性貧血、および増殖性糸球体腎炎が挙げられる)に関連する。
【0082】
自己免疫肝炎の症状としては、濃い尿、食欲喪失、疲労、全身の不快感、不安、または病気の感覚(倦怠感)、腹部膨満、全身の痒み、白色便または粘土色の糞便、悪心、および嘔吐が挙げられ得る。
【0083】
診断は、いくつかの基準(例えば、慢性肝炎および線維症を示す肝臓生検、異常な肝機能検査、ならびに自己免疫肝炎に関連する検査(例えば、陽性抗核抗体、陽性抗平滑筋抗体、陽性抗肝腎ミクロソーム抗体、陽性抗ミトコンドリア抗体、沈降速度増加、血清IgG増加))に基づいて、なされ得る。
【0084】
(サルコイドーシス)
肝臓を冒す別の自己免疫疾患が、サルコイドーシスである。サルコイドーシスは、広範囲の身体組織において発症する慢性炎症に起因して、小さい塊すなわち肉芽腫を引き起こす疾患である。サルコイドーシスは、ほぼすべての身体器官において生じ得るが、最も頻繁には、肺またはリンパ節において始まる。サルコイドーシスはまた、眼、肝臓、および皮膚を冒し、それ程頻繁ではないが、脾臓、骨、関節、骨格金、心臓、および中枢神経系(例えば、脳および脊髄)を冒す。大多数の症例において、肉芽種は、処置によって治癒するか、または処置なしで治癒する。肉芽種が治癒せず消失しない症例において、その組織は、炎症したままで線維性になる傾向がある。
【0085】
(新生児肝疾患)
新生児肝疾患は、新生児期間(すなわち、人生の最初の60日間)に新生児において生じる重篤な肝障害を指す。可能性があるこれらの障害の原因としては、ウイルス感染、遺伝性代謝病、新生物、および脈管の問題が挙げられ得る。罹患した幼児は、頻繁に、黄疸を有し、体重が増加せず正常に成長せず、そして膨張した肝臓および脾臓を有する。その幼児は、適切な成長のためのビタミンを吸収できない。
【0086】
上記の症状に加えて、新生児肝疾患の診断は、特にその状態がウイルス感染によって引き起こされたものではない場合に、肝臓生検によって補助される。
【0087】
(ウィルソン病)
ウィルソン病は、身体に過剰な銅が蓄積する、遺伝性常染色体劣性障害である。銅の蓄積は出生児に始まるが、この障害の症状は、それよりも後の人生において6歳〜40歳に現れる。ウィルソン病の診断的特徴は、カイザー−フライシャー輪(角膜の縁の周知の深銅色の輪)と呼ばれるものである。これは、眼における銅沈着物を示す。
【0088】
ウィルソン病患者のうちの約40%についての最も顕著な臨床的結果は、肝臓疾患である。他の患者において、最初の症状は、神経学的症状もしくは精神医学的症状、またはその両方であり、その症状としては、震え、硬直、流涎、発話困難、急激な人格変化、極めて不適切な挙動、および学校もしくは仕事の成績の不可解な低下、神経症、または精神病が挙げられる。
【0089】
ウィルソン病はまた、変異した遺伝子(13番染色体の13q14.3−q21.1に位置決めされている)の両方のコピーを同定するために遺伝学的検査によって診断され得る。
【0090】
(ヘモクロマトーシス)
ヘモクロマトーシスは、鉄の過剰な身体蓄積の遺伝的障害である。これは、白色人種において一般的であり、ヨーロッパ人の先祖を有する400人中約1人の個体が罹患する。ヘモクロマトーシスの患者は、その食事から過剰量の鉄を吸収し、この鉄が、肝臓、骨髄、膵臓、皮膚、および精巣に経時的に蓄積されると考えられる。
【0091】
初期ヘモクロマトーシス患者は、症状を有さない。この疾患は、血中鉄レベル増加に慣用的血液検査によって気付いた時に発見され得る。男性において、症状は、40歳〜50歳まで現れないかもしれない。皮膚における鉄沈着物は、皮膚の黒ずみを引き起こす。女性は、月経での血液喪失を介して鉄を失うので、女性は、男性よりも平均して15年〜20年間遅く、鉄蓄積からの器官損傷を発症する。
【0092】
下垂体および精巣における鉄沈着物は、精巣の収縮およびインポテンスを引き起こす。膵臓における鉄沈着物は、インスリン産生の低下を引き起こし、これは、真性糖尿病を生じる。心筋における鉄沈着物は、心不全および異常な心リズムを引き起こし得る。肝臓における鉄蓄積は、肝臓の瘢痕形成(線維症および肝硬変)ならびに肝臓癌発症リスクの増加を引き起こす。
【0093】
ヘモクロマトーシスについての初期スクリーニングは、血中鉄レベルおよび血中フェリチンレベルのついての検査を含む。後者は、身体に貯蔵される鉄の量の指標として役立つ血中タンパク質である。血中鉄レベルおよび血中フェリチンレベルは、ヘモクロマトーシス患者において高い。フェリチンはまた、特定の感染症(例えば、ウイルス肝炎および身体中の他の炎症)において上昇し得るので、フェリチン増加のみでは、ヘモクロマトーシスを正確に診断するためには十分ではない。
【0094】
ヘモクロマトーシスについての最も正確な検査は、生検によって得られる肝臓組織の鉄含有量を測定することである。生検は、分析用の肝臓組織サンプルの取り出しを含み、これは通常は、局所麻酔下で針を用いて実施される。皮膚組織およびその下の組織を麻痺させた後、医師は、時には、超音波の案内の下で、右下部胸郭を通して肝臓中に針を挿入する。その針によって得られた組織は、肝臓損傷または肝硬変について、顕微鏡下で研究される。肝臓中の鉄の量は、通常は、ヘモクロマトーシスにおいて顕著に増加する。
【0095】
最後に、遺伝的検査は、ヘモクロマトーシスの診断を有効に確認し得る。遺伝的ヘモクロマトーシスの遺伝子(HFE)が、1996年において同定された。この遺伝子は、北部ヨーロッパ人の先祖を有する患者のうちの90%の血液検査において同定され得る。
【0096】
(グリコーゲン蓄積症)
グリコーゲン蓄積症(GSD)(糖原病としても公知である)は、グリコーゲン代謝を調節する酵素に関与する遺伝的に連鎖する代謝障害であり、組織における異常な型の一定量のグリコーゲンの蓄積によって特徴付けられる。GSDは、しばしば、患者の新生児期または小児において、初期にその症状を示す。しかし、いくつかの場合において、成人期まで、または老齢になるまで、検出されないままであり得る。型によって変動して、代表的には医師にGSDを疑わせる4種の主要な症状が存在する:低血糖、肝臓腫脹、成長遅延、および異常な血液生化学プロフィール。決定的な診断は、罹患器官の生検によって得られ、その生検サンプルは、そのグリコーゲン含量について検査され、そして酵素活性についてアッセイされる。より容易に入手可能なサンプル(例えば、血液または皮膚)からある種のGSDを診断するための、DNAベースの技術が存在する。これらのDNA技術はまた、出生前検査のために使用され得る。
【0097】
特定の型のGSDにおいて、グリコーゲン代謝の破壊は、しばしば、異常な代謝副産物の蓄積をもたらし、これは、肝臓および腎臓などの器官を損傷させ得る。すべてのGSDの中で、III型、IV型、VI型、IX型、およびX型は、肝線維症の発症に最も関連する。
【0098】
III型コラーゲン蓄積症(コーリ病)は、脱分枝酵素(限界デキストリン型の多糖の蓄積を引き起こす、アミロ−1,6−グルコシダーゼ)が存在しないことによって特徴付けられる。肝臓および筋肉において蓄積されるグリコーゲンの構造は、異常であり、その量は、顕著に増加する。最も顕著であるのは、そのグリコーゲンの短い外分枝であり、従って、この異常なグリコーゲンのほんの小さな部分は、接近可能なグルコース供給源として機能的に活性である。この障害の症状としては、肝臓の腫脹、低血糖症、ケトーシス、尿酸過剰血症、高脂血症などが挙げられる。この疾患に罹患している若年者において、成長が損なわれ、思春期がしばしば遅れ、骨が骨粗鬆症によって弱められ得る。血小板もまた、影響を受け、頻繁な鼻血および容易に挫傷すること(bruising)が、一般的である。主要な症状は、加齢に伴って改善するが、20歳〜30歳よりも後には、肝臓腫瘍、慢性腎疾患、および通風が現れ得る。この状態の診断は、上記の症状に基づき、そのグリコーゲン構造の検査によって確認される。
【0099】
IV型グリコーゲン蓄積症(アンダーセン病)は、分枝酵素(α−1,4→α−1,6)が存在しないことによって特徴付けられ、IV GSDにおいて構築されるグリコーゲンは、非常に長い外分枝を有して不溶性であるという結果になる。異常なグリコーゲンが細胞中に蓄積すると、細胞死は、器官損傷をもたらす。GSD IVを有して生まれた乳児は、出生児には正常であるように見えるが、腫脹した肝臓と1年以内に生き延びられないこととによって診断される。最初の誕生日よりも長く生きる乳児は、3歳〜5歳までに肝硬変を発症し、慢性肝不全の結果として死ぬ。この疾患の診断は、特徴的な異常なグリコーゲン構造の検出によって補助される。
【0100】
VI型グリコーゲン蓄積症(エール病)は、肝ホスホリラーゼ欠損によって引き起こされる。この肝ホスホリラーゼ欠損は、グリコーゲン分解の最初の工程をブロックする。他のほとんどのGSD(常染色体変異を含む)とは対照的に、VI型GSDは、X染色体に連鎖する。この疾患において、ホスホリラーゼ欠損は、肝臓におけるグリコーゲン量の増加をもたらす。症状としては、肝臓の腫脹、低血糖症、ケトーシス、尿酸過剰血症、高脂血症などが挙げられる。低血糖は、重要な症状のうちの1つである。軽い成長の遅れが、罹患した若年者において生じ得る。
【0101】
IX型グリコーゲン蓄積症は、肝グリコーゲンホスホリラーゼキナーゼ(PhK)欠損によって引き起こされ、IX型グリコーゲン蓄積症の症状は、VI型GSDに非常に類似している。主要な違いは、その症状は、重篤ではないかもしれず、筋肉における運動に関連する問題(例えば、疼痛および痙攣)も含み得ることである。その症状は、思春期の後に、適切な処置によって軽減する。GSD IXのほとんどの症例は、X染色体に関連し、従って、男性を冒す。酵素的検査およびグリコーゲン含量測定は、決定的な診断を提供する。
【0102】
グリコーゲンホスホリラーゼを活性化して種々の組織におけるグリコーゲン分解を刺激させる酵素(PhK)は、種々のGSD IXサブタイプの原因である4つの異なるサブユニット(αβγδ)から構成される四量体酵素である。これらのサブタイプは、罹患した組織(肝臓/筋肉/RBC/心臓組織)と遺伝形質様式の両方が異なる。αサブユニット、βサブユニット、およびγサブユニットの遺伝子は、クローニングされており、X染色体(α)、染色体16q12(β)、および染色体7q12(γ)にマッピングされている。
【0103】
PhK欠損の最も一般的な形態は、X連鎖形態であり、この形態は、主に肝臓を冒す。臨床的には、この形態のPhK欠損を有する患者は、肝腫を有する乳児、軽度低血糖症を有する乳児、成長遅延を有する乳児、高脂血症を有する乳児、高ケトン症(hyperketosis)を有する乳児、および運動発達遅延を有する乳児において、存在する。これらの症状は、加齢とともに改善し、成人患者は、正常な状態および正常な肝臓を有する。
【0104】
常染色体劣性形態のPhK欠損は、変異がその酵素のαサブユニットに存在しているかまたはβサブユニットに存在しているかに依存して、肝臓および筋肉の両方に影響を与える。症状は、筋肉痙攣を伴う軽度の筋障害から、重篤な筋障害形態までの範囲に及び得る。
【0105】
X型グリコーゲン蓄積症は、環状アデノシン一リン酸(AMP)依存性ホスホグリセレートムターゼの欠損によって引き起こされる常染色体劣性疾患であり、GSD VIおよびGSD IXと同様の症状を示す。この状態に関与する遺伝子は、染色体7p12−p13にマッピングされている。
【0106】
(α1−アンチトリプシン欠損症)
α1−アンチトリプシン欠損症は、正常レベルよりも低いレベルのα1−アンチトリプシンが肺において存在する、遺伝性疾患である。α1−アンチトリプシンは、肝臓において生成された後に血流中に放出されるタンパク質である。正常な肺において、α1−アンチトリプシンは、好中球エラスターゼの有害な影響から肺を保護する。α1−アンチトリプシン欠損症に罹患している患者において、好中球エラスターゼによる肺組織に対する損傷は、気腫および呼吸困難をもたらし得る。この障害の最も顕著な症状は、日常活動の間に呼吸が短いことである。この疾患に関連する肝疾患としては、初期発症する肝疾患(例えば、肝炎または新生児黄疸)または後期発症する肝疾患(例えば、肝硬変および原発性肝臓癌(肝細胞癌))が挙げられる。
【0107】
α1−アンチトリプシン欠損症は、呼吸の短さおおび慢性的咳などの症状に基づいて診断され得る。α1−アンチトリプシンレベルについての血液検査および肺機能検査もまた、その診断を補助し得る。この疾患は、常染色体劣性変異によって引き起こされるので、最も決定的な診断は、遺伝子検査の結果に基づく。
【0108】
(ゴーシェ病)
ゴーシェ病は、酵素グルコセレブロシダーゼにおける遺伝的欠損によって引き起こされる。この酵素は、化学物質グルコセレブロシドを身体が分解するのを補助する。ゴーシェ病患者におけるこの欠損酵素は、脾臓、肝臓、およびリンパ節におけるグルコセレブロシドの蓄積をもたらす。ゴーシェ病は、アシュケナージユダヤ人(ヨーロッパ出身のユダヤ人)において最も一般的であるが、変化形が、すべての民族グループにおいて記載されている。この疾患の明確な型に依存して、罹患した患者は、種々の程度の症状を有し得る。ゴーシェ病の最も頻繁な初期徴候は、脾臓の腫脹である。関連する疲労、貧血、および血小板数の少なさが、存在し得る。重篤な骨の病変(bone involvement)は、腰、肩、および脊椎の骨の痛みおよび崩壊(無菌壊死)をもたらし得る。貧弱な肺および脳の機能が、そして発作さえもが、生じ得る。
【0109】
ゴーシェ病の診断は、線維芽細胞の活性のβ−グルコセレブロシダーゼの活性が測定される特別な検査によって確認される。ゴーシェ病の患者は、正常レベルの15%未満のグルコセレブロシダーゼしか有さない。この疾患の遺伝的性質によって、遺伝子検査に基づく診断もまた可能である。
【0110】
(ツェルヴェーガー症候群)
ツェルヴェーガー症候群は、肝臓、腎臓、および脳の細胞におけるペルオキシソームの減少またはペルオキシソームが存在しないことによって特徴付けられる、遺伝的障害(脳肝腎症候群とも呼ばれる)である。ツェルヴェーガー症候群は、白質萎縮症と呼ばれる一群の障害のうちの1つである。それらの一群の障害は、すべて、ミエリン鞘(脳の中の神経線維に対する絶縁体として作用する脂肪の覆い)を冒す。ツェルヴェーガー症候群の最も一般的な特徴としては、腫脹した肝臓、高レベルの血中鉄および血中銅、ならびに視力障害が挙げられる。罹患した乳児には、出生前成長不全を示すものもあり得る。出生児の症状としては、筋肉の緊張の欠如、および運動不能が挙げられ得る。他の症状としては、異常な顔の特徴、精神遅滞、発作、および吸い込みおよび/嚥下ができないことが、挙げられ得る。黄疸および胃腸出血もまた、生じ得る。
【0111】
この疾患は、ペルオキシソーム形成に関与するいくつかの種々の遺伝子のうちのいずれかにおける変異によって引き起こされる。これらの遺伝子は、少なくとも2つの異なる染色体位置(第2染色体(領域2p15)および第7染色体(領域7q21−22)に存在する。従って、その診断は、遺伝子検査によって確認され得る。
【0112】
(チロシン血症)
遺伝性チロシン血症は、新生児期における重篤な肝疾患に関連する代謝の先天性遺伝子異常である。この疾患は、常染色体劣性様式で遺伝される。その疾患の臨床的特徴は、2つの分類に分かれる傾向がある:この疾患の急性形態において、異常は、人生の最初の月に現れる。乳児は、貧弱な体重増加、肝臓腫脹および脾臓腫脹、膨張した腹部、脚の腫脹、および出血傾向(特に、鼻血)の増加を示し得る。黄疸が顕著であるかもしれないし、顕著ではないかもしれない。より慢性的な形態のチロシン血症において、肝臓の拡大および脾臓の拡大が、顕著であり、腹部が、液体で膨張し、体重増加は乏しいものであり得、嘔吐および下痢が頻繁に生じる。罹患した患者は、通常は、肝硬変およびその合併症を発症する。老齢の患者において、増加した肝臓癌リスクが存在する。
【0113】
この疾患を診断する際に、肝臓検査が、しばしば使用される。低い血清アルブミンおよび低い血清凝固因子が、頻繁に見出される。肝臓の酵素であるトランスアミナーゼは、軽度〜中程度に増加し得るが、ビリルビンが、種々の程度まで増加する。その生化学的欠損が原因で、異常な生成物が、尿において測定され得、これによって診断を確認する。これらは、パラヒドロキシフェニル酢酸およびパラヒドロキシフェニルピルビン酸である。さらに、スクシニルアセトンおよびスクシニルアセトアセテートが、尿において見出される。低血糖症および尿において特定物質(糖、タンパク質、およびアミノ酸が挙げられる)が損失している証拠が、存在し得る。基本となる生化学的欠損は、必須アミノ酸であるフェニルアラニンの代謝における重要な酵素の異常である。この酵素は、フマニルアセトアセテートヒドロラーゼ(FAH)であり、これが、罹患患者において顕著に減少される。出生前診断が、可能であり、羊水中のスクシニルアセトンまたは羊水細胞中のフマニルアセトアセテートヒドロラーゼ(FAH)を測定することによって、実施され得る。
【0114】
(果糖血症)
果糖血症(フルクトース不耐症またはフルクトースアルドラーゼB欠損症としても公知である)は、酵素1−ホスホフルクトアルドラーゼ(すなわち、フルクトースアルドラーゼB)が存在しないことによって引き起こされる代謝病である。遺伝性フルクトース不耐症は、常染色体劣性疾患として遺伝される。これは、いくつかのヨーロッパの国々においては、20,000人中1人程度の一般性であり得る。フルクトース不耐症において、フルクトース(果糖)およびスクロース(甘藷糖または甜菜糖、グラニュー糖)の摂取は、複雑な化学変化を生じ、この変化は、酵素1−ホスホフルクトアルドラーゼが存在しないことが原因で修正され得ない。フルクトースの摂取は、顕著な低血糖症および進行性肝損傷を引き起こす。この状態の診断は、フルクトース不耐症の症状、フルクトースアルドラーゼBレベルを測定する検査結果、および上記遺伝子における変異を同定するための遺伝子分析に基づく。
【0115】
(ガラクトース血症)
ガラクトース血症は、乳児における肝硬変のみならず、より重篤には、迅速に診断されない場合には早くにひどくなる病気ももたらす稀な遺伝性の疾患である。この疾患は、上昇した血中ガラクトースレベル(これは、肝臓の酵素であるGALT(ガラクトース−1−ホスフェートウリジルトランスフェラーゼ)の欠損から生じ、その代謝に必要とされる)によって引き起こされる。ガラクトース血症は、常染色体劣性形質として遺伝する。この疾患には2つの型があり、それは、GALT欠損(古典的ガラクトース血症)およびガラクトースキナーゼ欠損である。2つのうち、GALT欠損は、最も重篤である。このGALT遺伝子は、染色体9pl3に存在する。
【0116】
ガラクトース血症に罹患した人々は、単純な糖であるガラクトースを代謝できない。ガラクトース血症に罹患した乳児が乳を与えられると、その乳児の系の中でガラクトースが増え、肝臓、脳、腎臓および目に損傷を引き起こす。ガラクトース血症に罹患した患者は、いかなる形態の乳にも(ヒトでもそうでなくても)耐性がなく、いかなる他のガラクトース含有食品にも耐性がない。乳製品に曝露すると、肝臓損傷、精神遅滞、白内障の形成および腎不全を生じる。代表的には、ガラクトース血症に罹患した新生児は、乳を与えると、黄疸、嘔吐、嗜眠、被刺激性、および痙攣を発生させる。肝臓が腫大し、血糖が低くなり得る。乳製品を乳児に与え続けると、肝硬変を生じ、眼の中に部分的な失明をもたらす白内障が形成され、および精神遅滞を引き起こす。
【0117】
ガラクトース血症の症状としては、黄疸、嘔吐、不十分な栄養補給、不十分な体重増加、嗜眠、被刺激性、痙攣、および眼のレンズ中の混濁が挙げられる。検出される徴候としては、肝腫、低血糖、アミノ酸尿、肝硬変、腹水、白内障、および精神遅滞が挙げられる。
【0118】
その診断は、通常、赤血球中の酵素GALTの活性の欠如を実証することに基づく。出生前診断はまた、酵素を直接測定することによって実行可能である。DNAベースの試験はまた、その状態を診断するために可能である。
【0119】
(慢性炎症状態)
慢性炎症性の肝臓状態は、進行性の肝臓疾患であり、完全な肝不全が生じる場合に線維症または死をもたらし得る。この状態の原因は、細菌感染またはウイルス感染、毒性因子への曝露、またはある場合には、未知であり得る。
【0120】
この疾患の臨床徴候は、軽度なものから重度なものまで及び得る。代表的な症状としては、疲労、体重減少、悪心、嘔吐、増加した排尿および排便が、腹部に流体が集まること(腹水)、黄疸、糞便中の血、および異常な神経学的な挙動が挙げられ得る。慢性炎症性肝臓疾患の最終的な診断は、生検標本の試験によってなされる。
【0121】
(血管障害(vascular Derangement))
血管障害(vascular disorder)はまた、肝臓線維症の危険性の高まりに寄与し得る。肝臓に影響を及ぼすその最も頻繁な循環異常は、欝血性心不全であり、肝臓からの血液の流出量の減少をもたらす。他の肝臓鬱血の原因としては、梗塞性心外膜炎、下大静脈および肝静脈の閉塞(バッド−キアーリ症候群)、小さな肝静脈の閉塞(静脈閉塞)、および門脈血栓症が挙げられる。肝静脈流出量に対する抵抗性の増大は、欝血性肝腫、肝静脈および洞様毛細血管の拡張、ならびに低酸素症を生じる。次に、低酸素症は、肝細胞損傷と、考えられる線維症および肝硬変をもたらす。
【0122】
(薬物毒性)
毒素(例えば、アルコール、薬物または毒)は、直接的に(肝臓組織に損傷を引き起こすことによって)または間接的に(防御が低下するかまたは自己免疫応答を刺激することによって)肝炎を引き起こし得る;両方が、肝臓線維症を引き起こし得る。
【0123】
アルコールは、主に肝臓によって代謝され、種々の代謝産物を生成し、この代謝産物は、肝臓損傷を引き起こし得る。肝臓毒性の危険性は、40gより多いアルコール、または約4杯(drinks)が、一日で消費されると増大する。
【0124】
多くの医薬品が肝臓に損傷を引き起こし得、この損傷は、肝臓の作用における軽度の、無症候性の変化から肝不全および死亡までに及び得る。肝臓毒性は、用量に関連していても、関連していなくてもよい。ダイランチン(抗痙攣薬)、メトトレキサート(種々の新生物疾患、乾癬および慢性関節リウマチを処置するために使用される薬物)、クロルプロマジン(抗精神病薬物)、およびイソニアジド(抗結核薬剤)は、「ウイルス様」肝炎を引き起こし得る薬物の例である。
【0125】
環境毒素および産業毒素の両方が、肝臓における広範に種々の変化を引き起こし得る。肝臓の損傷は、必ずしも用量依存性でなく、軽度の、無症候性の炎症から劇症不全または進行性の線維症および肝硬変にまで及び得る。
【0126】
薬物または毒素への曝露に起因して肝臓線維症を発症する危険性のある患者は、一般に、彼らの病歴の検討および彼らの肝機能の連続モニタリングによって同定される。
【0127】
(先天性肝臓線維症)
先天性肝臓線維症(CHF)は、不規則な形状の増殖総胆管、肝臓内門脈圧亢進および食道静脈瘤を伴う、門脈周囲の線維症によって特徴づけられる稀な遺伝性障害である。CHFは、腎機能の損傷と関連し、通常、常染色体劣性多発性嚢胞腎疾患(ARPKD)によって引き起こされる。この疾患は、常染色体劣性の様式で遺伝するが、散発性の場合もある。代表的な肝臓異常としては、肝腫、門脈圧亢進、および肝臓線維症が挙げられる。CHFに罹患している多くの患者はまた、胃腸管からの(例えば,胃および腸からの)出血を示す。CHFの診断は、これらの症状、特に、ARPKDとの関連性に基づいて行われる。遺伝子試験はまた、この状態を診断するために考えられる手段である。
【0128】
(2.腸線維症)
いくつかの疾患が、腸線維症を発生させる患者の危険性を増大することが公知である。その疾患としては以下が挙げられる:クローン病、潰瘍性大腸炎、放射線発生性大腸炎、および顕微鏡的大腸炎。
【0129】
(クローン病)
クローン病は、腸の慢性炎症疾患である。これは、主に、小腸および大腸の潰瘍形成(管壁(lining)における中断)を引き起こすが、口から肛門までの消化器系全てに影響を及ぼし得る。これはまた、肉芽腫性腸炎もしくは大腸炎、限局性腸炎、回腸炎、または限局性腸炎(terminal ileitis)とよばれる。クローン病の原因は、未だ分かっていない。クローン病は、自己免疫疾患として伝統的に分類されており、ある科学者は、今では、特定の細菌(例えば、mycobacteriumの株)による乾癬が、この疾患の原因であり得ると推測している。
【0130】
クローン病の一般的な症状としては、腹痛、下痢、および体重減少が挙げられる。あまり一般的ではない症状としては、食欲不振(poor appetite)、熱、寝汗、直腸疼痛、および直腸出血が挙げられる。クローン病の症状は、炎症の位置、程度、および重篤度に依存する。クローン病およびそれらの症状の異なるサブタイプは、以下のとおりである:
(1)クローン大腸炎(Crohn’s colitis)は、結腸に制限された炎症である。腹痛および出血性下痢(bloody diarrhea)が、一般的な症状である。肛門フィステルおよび直腸周囲膿瘍も、起こり得る。
(2)クローン腸炎(Crohn’s enteritis)は、小腸(空腸といわれる第1の部分または回腸といわれる第2の部分)に制限された炎症をいう。回腸のみが関わっているときは、クローン回腸炎(Crohn’s ileitis)といわれる。腹痛および下痢が、一般的な症状である。小腸の閉塞もまた起こり得る。
(3)クローン限局性腸炎(Crohn’s terminal ileitis)は、小腸のごく末端(結腸に最も近い小腸部分)にのみ影響を及ぼす炎症(小腸下部の閉塞)である。腹痛および下痢が、一般的な症状である。小腸閉塞もまた、起こり得る。
(4)クローン腸炎および大腸炎(Crohn’s entero−colitis and ileo−colitis)は、小腸および結腸の両方に関連する炎症を記載するための用語である。出血性下痢および腹痛が、一般的な症状である。小腸閉塞もまた、起こり得る。
【0131】
クローン限局性腸炎および大腸炎は、クローン病の最も一般的な型である。クローン病に罹患した患者の3分の1までが、肛門領域に関する、以下の状態のうちの1以上を有し得る:
(1)肛門括約筋(排便を制御する結腸の末端にある筋肉)組織の膨脹。
(2)肛門括約筋内に潰瘍および裂溝(長い潰瘍)が発生すること。これらの潰瘍および裂溝は、排便と同時に出血および疼痛を引き起こし得る。
(3)肛門または直腸と、肛門周囲の皮膚との間に肛門フィステル(異常なトンネル)が発生すること。粘液および膿が、皮膚上のフィステルの開口部から排出され得る。
(4)直腸周囲膿瘍(肛門および直腸領域に膿が集まること)の発生。直腸周囲膿瘍は、肛門周囲の熱、疼痛および圧痛を引き起こし得る。
【0132】
クローン病の診断は、熱、腹痛および圧痛、出血を伴う下痢もしくは出血を伴わない下痢、および肛門疾患を有する患者において推測される。研究室での血液検査は、上昇した白血球数および沈降速度を示し得る。上昇した白血球数および沈降速度の両方ともが、感染または炎症を示唆する。他の血液検査は、低い赤血球数(貧血)、低い血中タンパク質、および低い身体ミネラルを示し得、これらのことは、慢性下痢に起因するこれらの要素の喪失を示す。
【0133】
バリウムx線研究は、疾患の分布、性質、および重篤度を規定するために使用され得る。バリウムは、x線によって見ることができる白亜色の物質であり、x線フィルム上に白く写る。バリウムが口(上部GI系列)から摂取されると、腸を満たし、胃および小腸の写真(x線)が撮影され得る。バリウムが直腸から投与される(バリウム注腸)と、結腸および回腸終末の写真が得られ得る。バリウムx線は、潰瘍形成、狭窄化、およびときには腸のフィステルを示し得る。
【0134】
結腸および大腸の直接的な可視化は、可撓性の観察チューブ(viewing tube)(結腸鏡)により達成され得る。結腸鏡検査法は、小さな潰瘍または結腸および回腸終末の小さな炎症領域を検出することにおいて、バリウムx線より正確である。結腸鏡検査法はまた、小腸サンプルを採取する(生検)ことを可能にし、顕微鏡下での試験のために送付されて、クローン病の診断が確認される。結腸鏡検査法はまた、炎症の程度(活性)を評価することにおいて、バリウムx線より正確である。
【0135】
コンピューター連動断層撮影(CATまたはCT)スキャン法は、腹部および骨盤全体の画像化を可能にするコンピューター処理x線技術である。これは、膿瘍を検出することにおいて特に有用であり得る。
【0136】
直近では、ビデオカプセル直達検査法(video capsule endoscopy)が、クローン病を診断するための診断試験のリストに加えられた。ビデオカプセル直達検査法については、小型のビデオカメラを備えるカプセルが飲み込まれる。カプセルが小腸を通って移動するにつれて、これは、小腸の管壁のビデオ画像を腰のベルトに付けたレシーバーに送る。この画像はダウンロードされ、次いで、コンピューター上で検査される。ビデオカプセル直達検査法の価値は、クローン病の初期の、軽度の異常を同定できることである。ビデオカプセル直達検査法は、クローン病の疑いが強いが、バリウムx線では正常である(バリウムx線は、初期の軽度のクローン病を同定するのはあまり得意でない)ときに、特に有用であり得る。
【0137】
(潰瘍性大腸炎)
潰瘍性大腸炎は、クローン病に密接に関連しているが、通常は、直腸、または直腸とS状結腸(直腸の遠位端にある)にのみ関連する、別の慢性炎症状態である。これらは、それぞれ、潰瘍性直腸炎および直腸S状結腸炎といわれる。クローン病および潰瘍性大腸炎は、炎症性腸疾患(IBD)とまとめていわれることが多い。
【0138】
潰瘍性大腸炎の一般的な症状としては、直腸出血および下痢が挙げられるが、この疾患に罹患した患者には広い範囲の症状が存在する。症状の変動性は、疾患の程度(すなわち、炎症を起こした結腸および直腸の総体)および炎症の強度の差異を示す。一般に、直腸および直腸に隣接した結腸の短いセグメントに炎症が制限されている患者は、より軽度の症状を有し、より拡がった結腸の炎症を有する患者よりも良好な予後を有する。潰瘍性大腸炎の異なる型は、炎症の位置および程度に従って分類される:
(1)潰瘍性直腸炎とは、直腸に制限された炎症をいう。潰瘍性直腸炎に罹患した多くの患者において、軽度の周期性の直腸出血が、唯一の症状であり得る。より重篤な結腸の炎症を有する他の患者は、さらに、直腸の疼痛、促迫(urgency)(突然の排便しなければという感覚および汚す心配のためにトイレに駆け込む必要性)、およびテネスムス(腸を動かすのに効果のない、疼痛を伴う力み(urge))を経験し得る。
(2)直腸S状結腸炎は、直腸およびS状結腸(直腸に続いている、結腸の短いセグメント)の炎症を伴う。直腸S状結腸炎の症状としては、直腸炎と同様に、直腸の出血、促迫、およびテネスムスが挙げられる。直腸S状結腸炎に罹患したいくらかの患者はまた、出血性の下痢および痙攣を発生させる。
(3)左側の大腸炎は、直腸で始まって、左側結腸(S状結腸および下行結腸)まで拡がる炎症を伴う。左側の大腸炎の症状としては、出血性の下痢、腹部痙攣、体重減少、および左側の腹痛が挙げられる。
(4)全大腸炎(pancolitis)または全体的な大腸炎(universal colitis)とは、結腸全体(右結腸、左結腸、横行結腸および直腸)に影響を及ぼす炎症をいう。全体大腸炎の症状としては、出血性の下痢、腹痛および痙攣、体重減少、疲労、熱、ならびに寝汗が挙げられる。全体大腸炎に罹患したいくらかの患者は、医薬品に容易に応答する、低い段階の炎症および軽度の症状を有する。しかし、一般には、大腸炎を有する患者は、より重度の疾患に罹患しており、潰瘍性大腸炎のより制限された形態を有する患者よりも処置が難しい。
(5)劇症大腸炎は、稀であるが、重篤な大腸炎の形態である。劇症大腸炎に罹患した患者は、脱水症状、重篤な腹痛、出血を伴う長引く下痢、およびさらにはショックを伴い、極めて不健康である。彼らは、中毒性巨大結腸(重篤な炎症に起因する、結腸の顕著な拡張)および結腸破裂(colon rupture)(穿孔)を発症させる危険性がある。劇症大腸炎および中毒性巨大結腸に罹患した患者は、強力な静脈内投薬により、病院で処置される。彼らが処置に迅速に応答しなければ、結腸破裂を防ぐために、病的な結腸を外科的に除去する必要がある。
【0139】
潰瘍性大腸炎の診断は、腹痛、結腸の出血、および下痢の症状によって示唆される。第1の工程として、糞便標本が分析のために集められて、感染および寄生体が除かれる。なぜなら、これらの状態は、潰瘍性大腸炎によく似た大腸炎を引き起こし得るからである。次いで、血液検査が行われ得、貧血および上昇した白血球数または沈降速度(一般には、SED速度といわれる)を示し得る。上昇した白血球数およびSED速度はともに、結腸で発生している炎症を示す。潰瘍性大腸炎の確認には、大腸を可視化するための試験が必要である。直腸を通して挿入された可撓性のチューブ(S状結腸鏡および結腸鏡)により、結腸の内部を直接可視化することが可能になって、診断が確立され、大腸炎の程度が測定される。小さな組織サンプル(すなわち、生検)が、大腸炎の重篤度を決定するための手順の間に得られ得る。大腸炎の程度および重篤度の認識は、処置選択肢を選ぶことにおいて重要である。バリウム注腸x線はまた、潰瘍性大腸炎の診断を示し得る。バリウム注腸の間に、白亜色の物質は直腸に投与され、結腸に注入される。バリウムは、放射線非透過性であり、x線写真上で結腸の輪郭を明らかにし得る。バリウム注腸は、潰瘍性大腸炎の診断において直接可視化技術より正確ではなく、有用でない。
【0140】
(放射線発生性大腸炎)
放射線発生性大腸炎は、重大な量の照射に以前に曝された患者(例えば、癌を処置するために放射線療法を受けた患者)において発生する持続性の結腸過敏(colon irritation)の型である。全身の症状は、照射に関連しない過敏な結腸状態の症状(例えば、疼痛および慢性的な下痢)に類似であるが、放射線発生性大腸炎に罹患している患者は、彼らの病歴に基づいて容易に同定される。
【0141】
(顕微鏡的大腸炎)
顕微鏡的大腸炎(MC)は、コラーゲン蓄積大腸炎(CC)およびリンパ球性大腸炎(LC)の2つの形態的に異なる実体を包含する。MCに罹患した患者は、一般に、慢性の下痢を示し、この慢性の下痢は、痙攣および鼓脹と関連し得る。内視鏡検査および放射線検査は、通常は、正常である。組織学的評価により、主にリンパ球性炎症からなる炎症が明らかになり、厚くなった上皮下コラーゲン帯が、CCの診断になる。LCおよびCCはともに、セリアック病、糖尿病、関節炎、および甲状腺炎のような自己免疫疾患と関連し得るが、この病理状態に関与する正確な機構は未だ未知のままである。
【0142】
(3.腎線維症)
種々の腎臓疾患および状態は、患者が腎線維症を発症する可能性を増大させ、最終的には、末期の腎疾患をもたらし、透析および移植が必要になることが公知である。これらの疾患および状態としては、糖尿病性腎症、高血圧性腎硬化症、慢性糸球体腎炎、慢性移植糸球体症、慢性間質性腎炎、多発性嚢胞腎疾患、および腎臓に影響を及ぼす他のあまり一般的でない疾患が挙げられる。
【0143】
(糖尿病性腎症)
糖尿病性腎症は、長期間持続する糖尿病と関連した腎疾患である。キンメルスティール−ウィルソン病(またはキンメルスティール−ウィルソン症候群)としても公知であり、糖尿病性腎症は、糸球体(腎臓における重要な構造体であり、毛細血管から構成され、血液濾過に極めて必須である)における微小血管のネットワーク(毛細血管系)に影響を及ぼす。
【0144】
この疾患の症状としては、尿への過剰なタンパク質濾過(タンパク尿)、泡立つ尿(尿中タンパク質の前兆)、高血圧(high blood pressure)(高血圧(hypertension))、脚の腫脹(歩行/起立後に悪化する)、掻痒、悪心/嘔吐、不明な体重減少、疲労/嗜眠、夜間に排尿する必要性の増大、および糖尿病を制御するために丸剤またはインスリンの必要性が減少することが挙げられる。
【0145】
糖尿病性腎症は、一般に、腎機能が徐々に損なわれる。その重篤な形態では、この疾患は、腎不全および末期腎疾患をもたらし得、患者は、慢性的な腎透析または腎移植を必要とし得る。糖尿病性腎症はまた、毛細管内糸球体腎炎(intercapillary glomerulonephritis)といわれる。
【0146】
(高血圧性腎硬化症)
高血圧性腎硬化症は、高血圧症と関連した腎臓の硬化(hardening)(硬化症(sclerosis))である。腎臓は、血圧調節において重要な役割を果たす。腎疾患は、腎機能に影響を及ぼし得、このような調節を妨害し得、血圧上昇を生じる。他方で、腎損傷は、長期間の高血圧症から生じ得、高血圧が、血管を狭くし、厚くすることによって、心臓血管系に影響を及ぼし得る。
【0147】
その初期段階で、高血圧性腎硬化症は、長期間にわたって、いかなる重大な症状も示さないかもしれない。存在する場合、一般的な症状としては、以下が挙げられる:高血圧、頭痛、頸部の不快感、疲労、悪心または嘔吐、および尿中タンパク質(タンパク尿)。
【0148】
(慢性糸球体腎炎)
糸球体腎炎は、主に糸球体(腎臓におけるネフロンの濾過する起始部(filtering head))に影響を及ぼす炎症状態である。慢性糸球体腎炎は、通常、末期腎臓疾患をもたらす。
【0149】
糸球体腎炎の一般的な症状としては、尿中の血液またはタンパク質、泡立つ尿(通常は、尿中タンパク質の指標)、濃色またはピンク色の尿、脚の腫脹、全身的な症状発現(例えば、不明な体重減少、関節炎または皮膚発疹)を伴う糖尿病または自己免疫疾患のような全身的な疾患が挙げられる。
【0150】
糸球体腎炎を引き起こし得るかまたは糸球体腎炎から生じ得る多くの異なる状態が存在する。これらの状態のいくらかは、以下で議論される。糸球体腎炎に関連する状態の一例は、IgA腎症(腎臓の糸球体内部でIgAが沈着する腎疾患)である。このIgA沈着は、この濾過プロセスを妨げ、尿中の血液またはタンパク質の症状、および手および脚の膨脹をもたらす。この疾患は、腎機能の損傷または完全な喪失すら最終的に生じる糸球体の炎症を引き起こす。
【0151】
自己免疫疾患はまた、糸球体腎炎を生じ得る。1つのこのような例は、ループス腎炎(または狼瘡に伴う糸球体腎炎)である。他の場合には、細菌(例えば、Streptococcus)またはウイルス(例えば、HIVまたはHBV)による感染、特に10歳未満の小児における感染は、感染後糸球体腎炎を引き起こし得る。
【0152】
糸球体腎炎はまた、巣状分節状糸球体硬化症(FSGS)(腎臓の糸球体のいくらかにおいて瘢痕組織を形成する場合に生じる病気)に関する。用語「巣状」とは、糸球体のいくらかが瘢痕状になる一方で、他は正常なままであることを意味する。用語「分節状」とは、個々の糸球体の一部分のみが損傷を受けていることを意味する。FSGSの症状としては、泡立つ尿、身体の腫脹(すなわち、保持した液体から全身に広がった浮腫)、体重増加、および食欲不振が挙げられる。
【0153】
診断は、以下に基づいて行われ得る:タンパク質(少量の血液を伴うまたは伴わない)を示す尿検査;瘢痕の証拠を示す腎生検;およびIgMの沈着を示す免疫蛍光顕微鏡試験。
【0154】
膜増殖性糸球体腎炎には2つの型が存在し、これらの型は、妨げられた腎機能または低下した腎機能を生じる類似の症状を有する腎障害であり、炎症および腎細胞の顕微鏡的構造における変化によって引き起こされる。症状としては、以下が挙げられる:尿中の血液、濃色の尿、濁った尿、尿容量の減少、身体の任意の部分の腫脹、精神状態の変化(例えば、注意力の低下(decreased alertness)、集中力の低下)。身体検査により、種々の程度までこれらの症状が明らかになる。尿検査により診断が補助され、腎生検によって確認される。
【0155】
急速進行性糸球体腎炎は、腎臓の内部構造に対する損傷および機能の急速な喪失を引き起こす腎疾患の形態であり、三日月型の異常が腎臓の生検で示される。一般的な症状としては以下が挙げられる:浮腫、濃色の尿または煙色の尿、尿中の血液、尿体積の減少、熱、筋肉痛、関節痛、息切れ、咳、全身が病気である感覚、腹痛、食欲喪失、下痢など。この状態を診断するために、身体検査と血液検査および尿検査と組み合わせると、上記の症状の多く、ならびにBUNと尿クレアチニンの増加、クレアチニン−クリアランスの低下、および/または抗糸球体基底膜抗体と抗好中球細胞質抗体(ANCA)の存在が明らかになり得る。腎生検により、三日月型の糸球体腎炎が確認される。
【0156】
強皮症は、結合組織の自己免疫疾患であり、全身性強皮症ともいわれる。この状態は、皮膚および身体器官における線維症によって特徴づけられる。強皮症の診断は、病気の臨床的特徴を見出すことに基づく。強皮症に罹患したほぼ全ての患者が、自己免疫を示唆する血液検査結果(抗核抗体(ANA))を有する。特定の抗体(抗セントロメア抗体)は、専ら、強皮症の制限された、すなわちCREST形態で見出される。抗Scl70抗体(抗トポイソメラーゼI抗体)は、強皮症の拡散形態を有する患者において最も頻繁にみられる。
【0157】
脈管炎は、種々の血管の壁に損傷をもたらす血管の炎症を特徴とする稀な疾患の群に対する一般的用語である。活発な脈管炎を有する患者の血液または体液の研究室での試験は、一般に、身体における炎症を示す。器官の状況の程度に依存して、種々の器官の機能試験は、異常である可能性があり、よって、その状態の指標であり得る。脈管炎の診断は、最終的に、血管炎症のパターンを示す、関連した組織(例えば、腎臓)の生検後に確立される。状況に依存して、生検の代替は、血管のx線検査(例えば、血管造影法)であり得る。
【0158】
ヴェーゲナー肉芽腫症(WG)は、呼吸器系を含む多くの種々の器官(洞、鼻、気管、および肺)および腎臓に影響を及ぼす稀な疾患である。疾患の主な特徴のうちの1つは、血管の炎症(脈管炎)である。炎症は血管を狭くし、罹患した気管への血流を減少させ、その後、罹患した組織および気管に損傷を与える。
【0159】
WGの正確な原因は、未知のままであるが、自己免疫状態に関連すると考えられる。実際に、自己抗体は、数名のWG患者においてしばしば検出される。WGの最も一般的な症状のうちの1つは、慢性の鼻水の出る鼻であり、他は、標準的な処置に応答しない風邪様の症状である。風邪の症状は徐々に悪化し、静脈洞炎(洞の炎症)、中耳感染(中耳炎)、咳、喀血(coughing of blood)、および肺の炎症(胸膜炎および肺炎)をもたらし得る。他の症状としては、熱、疲労、食欲喪失、体重減少、関節痛、寝汗、尿の色の変化、および衰弱が挙げられる。腎疾患は、WGの最も重篤な発現である。
【0160】
WG患者の血液検査は、しばしば、貧血(低い赤血球数)および高い白血球数を示す。腎臓に影響がある場合、顕微鏡下で見たときに尿中に赤血球がみられる。また、腎機能の測定を目的とした血液検査は、異常を示し得る。胸部X線は、肺に影響があるか否かを決定するために使用される。腎生検および洞または肺のCTスキャン法はまた、WGを診断することにおいて使用される重要なツールである。
【0161】
抗好中球細胞質抗体(ANCA)といわれる特定の型の抗体が、WGに罹患した患者の約90%の血液で見られる。このANCAは、個体自身の白血球(すなわち、好中球)に対する自己抗体の型である。これらの抗好中球細胞質抗体はまた、他の炎症状態および疾患(例えば、HIV感染)において見出される。このANCA試験は、WGの診断を確認するために有用であるが、診断を行うためにそれ自体を使用することはできない。
【0162】
結節性多発性動脈炎(PAN)は、身体の動脈の自然発生的な炎症によって特徴づけられる稀な自己免疫疾患である。最も一般的な影響を受ける器官は、腸および腎臓を含む。これらの器官のいずれかにおける機能の損傷または疼痛が、症状であり得る。腸への乏しい血液供給は、腹痛および出血を引き起こし得る。疲労、体重減少、および熱はまた、患者においてしばしば観察される。PANの原因は未知であるが、HBV感染の後に報告された。
【0163】
PANの診断は、炎症(血液沈降速度およびc反応性タンパク質の上昇を含む)を示す試験によって支持される。白血球数および血小板数は、上昇し得る一方で、赤血球数は、減少する(貧血)。いくらかの患者は、HBV試験に陽性であり得る。尿検査は、尿中のタンパク質および尿中赤血球の存在を示し得る。ある場合には、異常は、神経機能試験において観察され得る。診断は、生検または影響を受けた器官の血管造影(炎症を受けた血管を明らかにする)によって確認される。
【0164】
さらに、グッドパスチャー症候群は、肺と腎臓疾患の組み合わせ(特に、肺胞および腎臓の糸球体における基底膜の成分に対する抗体の形成による、肺の肺胞および腎臓の糸球体の基底膜における重篤な炎症に起因する、肺出血(肺における出血)および糸球体腎炎(糸球体の炎症))によって特徴づけられる自己免疫疾患である。臨床症状は、血痰(bloody sputum)を伴う咳、血尿、減少した尿生成量、疲労、高血圧、腫脹(浮腫)、および不明な体重減少が挙げられる。その症候群はまた、抗糸球体基底膜抗体疾患と名付けられた。
【0165】
(慢性移植糸球体症)
慢性移植糸球体症は、腎移植を受けかつ腎構造の特徴的な変化(メサンギウム基質膨脹、メサンギウム増殖、二重輪郭(double contour)を有する基底膜肥厚化、および辺縁メサンギウム介入が挙げられる)を有し、ときおり、巣状分節状硬化症が付随する患者に生じる種々の状態をいう。これらの変化は、通常、顕著なタンパク尿と、しばしば、ネフローゼの範囲において関連する。これらの状態の診断は、病歴(患者が移植レシピエントか否か)、尿検査および腎生検を検討することに基づいて行われる。
【0166】
(慢性間質性腎炎)
間質性腎炎は、腎臓内の結合組織の障害、重篤なアレルギー反応、毒性物質への曝露、移植拒絶、尿の妨害物(urinary blockage)または他の要因に起因する腎炎の型であり、尿細管の間の空間に炎症を生じ、尿細管の炎症を含み得る。間質性腎炎の症状としては、熱、腎臓領域の疼痛、尿生成量の増大または減少、熱、精神状態の変化(嗜眠状態から昏睡にいたる錯乱までに及ぶ)、悪心または嘔吐、発疹、身体の腫脹、液体の欝滞に起因する体重増加、および尿中の血液または尿中のタンパク質が挙げられ得る。
【0167】
間質性腎炎に罹患している患者の検査により、浮腫または液体過大容積(fluid overload)、または容積消耗の徴候(signs of volume depletion)が明らかになり得、聴診器をあてて心音または肺音を聴いていると、異常な音が聞こえる。血圧は、一般に高い。尿検査により、少量のタンパク質またはときには赤血球、尿細管細胞、および他の異常が示される。尿中に、WBCおよびWBC円柱(特に好酸球)がしばしば見られる。CBCは、好酸球増多症(正常な好酸球数より高い)を実証し得る。尿比重および重量オスモル濃度は、水の摂取を制限したときにすら尿を濃縮することができないことを示す。尿のpHは、尿を適切に酸性化することができないことを示し得る。動脈血検査(arterial blood gase)および血液化学により、代謝性アシドーシスが示され得る。BUNおよびクレアチニンレベルは、腎機能のレベルを評価するために使用される。RBC−尿は、赤血球の増大を示し、腎疾患を示す。最後に、腎生検により、間質性腎炎の診断が確認され得、腎生検は、腎臓に対する損傷の程度を評価するために使用され得る。
【0168】
(多発性嚢胞腎疾患)
多発性嚢胞腎疾患(PKD)は、腎臓中の多くの嚢胞の成長によって特徴づけられる障害である。この嚢胞は、液体で満たされている。PKDの嚢胞は、腎臓の大きさの大部分に取って代わり得る。このことによって、腎機能が低下し、腎不全がもたらされる。PKDが腎臓の不全を引き起こす場合(これは通常何年も後になってのみ起こる)、患者は、透析または腎移植が必要になる。PKDの一次形態を有する人々の約2分の1が、腎不全または末期腎疾患(ESRD)に進行する。
【0169】
PKDは、肝臓中に嚢胞を引き起こし得、他の器官(例えば、心臓および脳血管)においては問題を引き起こし得る。これらの合併症は、医師が、PKDと、人生のもっと後になって腎臓においてしばしば形成する通常の無害な「単なる」嚢胞とを区別する助けになる。
【0170】
PKDには2つの主要な遺伝性の形態と、遺伝しない形態とが存在する。常染色体優性PKDは、最も一般的であり、遺伝性の形態である。症状は、一般に、30歳〜40歳の間に発現するが、幼児期早くに始まり得る。全てのPKDのうちの約90%が、常染色体優性PKDである。最も一般的な症状は、背部および側部(肋骨と臀部の間)の疼痛と、頭痛である。鈍い疼痛が、一次的にまたは持続してあり、それは軽度または重度であり得る。常染色体優性PKDに罹患した人々はまた、以下の問題を経験し得る:尿路感染症;血尿(尿中の血液);肝臓および膵臓の嚢胞;異常な心臓弁;高血圧;腎臟結石;脳における動脈瘤(血管壁における膨脹);ならびに憩室症(結腸にある小さな嚢)。
【0171】
常染色体優性PKDを診断するために、医師は、代表的には、超音波画像化を用いて3つ以上の腎臓の嚢胞を観察する。この診断は、常染色体優性PKDの家族歴および他の器官に嚢胞が存在することによって裏付けられる。
【0172】
常染色体優性PKDの最も多い例では、個人の身体状態が、数年の間、数十年にわたっても正常に見えるので、その疾患は、見過ごされ得る。身体検査ならびに血液検査および尿検査は、診断にまで至らないかもしれない。しかし、一旦嚢胞が形成されると、画像化技術により診断が可能である。超音波が最も頻繁に使用される。超音波画像化は、色素の注入も用いられず、照射も用いられないので、妊婦を含め、全ての患者に安全である。超音波画像化は、胎児の腎臓中の嚢胞も検出できる。
【0173】
CATスキャンおよびMRIのような、より強力な画像化法によっても、嚢胞が検出され得る。分子技術における進歩がまた、DNA試験を可能性のあるものにし、嚢胞が発生する前に、常染色体優性PKDの診断が確認される。
【0174】
常染色体劣性PKDは、この疾患の第2の遺伝性の形態である。これは比較的稀である。常染色体劣性PKDは、常染色体優性PKDを引き起こす物とは異なる遺伝的欠損によって引き起こされる。この疾患を有さない親は、両親ともに異常な遺伝子を有しかつこの両親が彼らの子供にこの遺伝子を伝える場合に、この疾患を有する子供が生まれ得る。(両親が異常な遺伝子を有する場合に)これが起こる可能性は、4人に1人である。一方の親のみが異常な遺伝子を有するのであれば、その子供は、この疾患になることはない。
【0175】
常染色体劣性PKDの症状は、生後数ヶ月で始まり得、子宮にいる間ですら始まり得るので、しばしば「乳児PKD」といわれる。常染色体劣性PKDをもって生まれた子供は、通常、数年以内に腎不全を発症する。この疾患の重篤度は、様々である。最悪の症例の赤ん坊は、生まれてから数時間または数日で死亡する。乳児バージョンを有する子供は、数年にわたって、正常な活動のための十分な腎機能を有し得る。若年性バージョンを有する人々は、彼らが10代および20代になっても生きる可能性があり、通常は、肝臓の問題にも苦しむ。
【0176】
常染色体劣性PKDに罹患した子供は、高血圧、尿路感染症、および頻繁な排尿を含む症状を示す。この疾患は、通常、肝臓、膵臓および膵臓に影響を及ぼすので、低血球数、拡張蛇行静脈、および痔核を引き起こす。腎機能が初期の肉体的発達にとって重要であるので、常染色体劣性PKDに罹患した子供は、通常、平均的な大きさより小さい。
【0177】
この疾患を診断するにあたって、胎児および新生児の超音波画像化により、腎臓の嚢胞が明らかになり得るが、常染色体劣性PKDの嚢胞と、常染色体優性PKDの嚢胞との区別はつかない。親族の腎臓を超音波検査が、正確な診断を行うにあたって助けとなり得る。例えば、常染色体優性PKDの嚢胞を有する親または祖父母がいると、胎児または子供における常染色体優性PKDの診断を確認する上で助けになり得る。常染色体劣性PKDを有する個人が親になることは、極めて稀であるものの、不可能ではない。常染色体劣性PKDは、肝臓を瘢痕化する傾向があるので、肝臓の超音波画像化はまた、診断の助けになる。
【0178】
常染色体優性PKDの診断と同様に、常染色体劣性PKDも、DNA分析に基づいて明確に診断され得る。
【0179】
後天性嚢胞腎疾患(ACKD)は、遺伝しない形態のPKDであり、人生のもっと後になって起こる傾向がある。ACKDはしばしば、長期の腎臓の問題(例えば、腎臓損傷および瘢痕化)と関連して、特に、腎不全を有する患者および長期間の透析を続けている患者において発症する。5年間透析を続けている人々のうちの約90%が、ACKDを発症する。ACKDに罹患している患者は、糸球体腎炎または糖尿病によって引き起こされる腎疾患のような任意の根底にある腎疾患を有し得る。
【0180】
ACKDの嚢胞は、出血し得る。従って、ACKDの第1の顕著な症状は、尿中の血液、すなわち血尿である。ACKDの診断は、腎臓の超音波、CATスキャン、またはMRIを使用して確認される。さらに、腎臓腫瘍(腎臓癌(kidney cancer、renal cancer)はまた、ACKDに罹患した人々において発症し得る。腎臓癌は稀であるが、ACKD患者において、一般的な集団の少なくとも2倍程度の頻度で、発生する。
【0181】
(II.胆汁欝滞状態の除外)
(A.胆汁欝滞状態)
種々の胆汁欝滞状態が、肝臓線維症をもたらすようであるが、本発明は、胆汁欝滞状態(例えば、原発性胆汁性肝硬変、原発性硬化性胆管炎、薬物誘導性胆管炎、遺伝性胆汁欝滞および妊娠性肝内胆汁欝滞、完全非経口栄養法に伴う胆汁欝滞、敗血症、ならびに嚢胞性線維症)に既に罹患している患者における肝臓線維症の処置/予防を包含しない。以下は、本発明を実施する場合に、これらの胆汁欝滞状態に罹患した患者をどのように除外するかを記載する。
【0182】
(B.胆汁欝滞状態の診断)
胆汁欝滞状態の代表的な症状としては、掻痒(痒み)、疲労、黄疸を呈した(jaundiced)皮膚もしくは眼、特定の食物が消化できないこと、悪心、嘔吐、白色便、濃色の尿、および右上4分の1の腹痛が挙げられる。器官不全が、敗血症の場合に起こり得(しかし、胆汁欝滞自体からは起こらない)、発疹または熱は、薬物誘導性胆汁欝滞のいくらかの場合において生じ得る。
【0183】
胆汁欝滞状態の診断は、一般に、患者の血中の、抱合型ビリルビン、アルカリホスファターゼ、γ−グルタミルトランスペプチダーゼ(GGT)、5’ヌクレオチダーゼ、胆汁酸、およびコレステロールのレベルの上昇の検出に基づく。上記に挙げた状態の各々について、特定の診断基準が適用され得る。
【0184】
原発性胆汁性肝硬変(PBC)は、ゆっくりと進行する炎症および肝臓内の小さな胆管の破壊によって特徴づけられる慢性疾患である。その炎症および破壊は、胆汁の排出を妨害し、瘢痕化を引き起こし、最終的に、肝硬変をもたらす。PBCの初期段階において、主要な問題は、血中で物質(胆汁酸、コレステロールのような)の増加であり、この物質は、通常、胆汁の中に排出される。多くのPBC患者は、疾患の症状を有さず、慣用的な肝臓血液検査で異常を見出すことによって、診断される。掻痒および疲労が一般的な症状である。他の徴候としては、黄疸、皮膚におけるコレステロール沈着、足首および腹部での液体蓄積、ならびに皮膚の色が暗くなることが挙げられる。いくつかの他の障害は、しばしば、PBCと関連する。涙腺および唾液腺の機能障害、ドライアイまたはドライマウスを引き起こすことが最も一般的である。関節炎および甲状腺の問題も、現れ得る。腎結石および胆石が、発生し得る。骨折をもたらす骨の軟化および脆弱性は、この疾患の後期段階で起こり得る。
【0185】
PBCの診断は、いくつかの指標に基づく:その患者は、胆管損傷を示唆する症状(例えば、掻痒)を有し得る;研究室試験(例えば、アルカリホスファターゼ活性試験)によって、その診断が確認され得る。抗ミトコンドリア抗体(AMA)についての試験が、ほぼ全てのPBC患者において陽性であるので、特に有用である。稀であるが、胆管は、胆管疾患(例えば、閉鎖症)の他の原因の可能性を排除するためにX線照射される。肝臓生検は、その診断を確認することにおいて、および肝臓損傷の重篤度および程度に関する情報を与えることにおいて有用である。
【0186】
PBCの最終的な診断の基準は、古典的なPBCに罹患した患者全てを同定し、疑わしい診断を有する全ての患者を排除するために確立された。PBCの最終的な診断は、以下の内の3つ全てを有する患者においてなされる:胆汁欝滞の肝臓検査(ALTおよびASTより上昇しているアルカリホスファターゼおよびGGT);1:40以上の力価でのAMA陽性;ならびに診断のためのまたは適合性の肝臓生検の陽性の解釈。
【0187】
原発性硬化性胆管炎(PSC)に罹患している患者において、肝臓内外の胆管は、炎症を起こしており、瘢痕している。瘢痕化が増大するにつれて、胆管は遮断され、このことによって、肝臓中の胆汁の増加をもたらし、肝臓細胞が損傷を受ける。PSCの種々の原因が推測されており、その原因としては、細菌感染もしくはウイルス感染、または免疫系の異常が挙げられる。
【0188】
PSCの主要な症状は、掻痒、疲労、および黄疸である。胆管における感染は、悪寒および熱を引き起こし得る。PSCは、胆管造影法によって診断され、この胆管造影法は、色素を胆管に注入する工程、およびX線画像を撮影する工程を必要とする。胆管造影法は、内視鏡手技(内視鏡的逆行性胆道膵管造影法、ERCP)として、放射線医学または外科手術を介して、または磁気共鳴画像法(MRI)により、行われ得る。
【0189】
薬物誘導性胆汁欝滞とは、特定の薬物適用に起因して、肝臓からの胆汁の流れが遮断されていることをいう。多くの薬物が、この型の胆汁欝滞を引き起こし得る。いくつかのより一般的な元凶としては、以下が挙げられる:金の塩類、ニトロフラントイン、アナボリック・ステロイド、経口避妊薬、クロルプロマジン、プロクロルペラジン、スリンダク、シメチジン、エリスロマイシン、トブタミド(tobutamide)、イミプラミン、アンピシリン、および他のペニシリンベースの抗生物質。他の薬物適用はまた、いくらかの個体において胆汁欝滞を予測外にも引き起こし得る。薬物誘導性胆汁欝滞の症状は、他の胆汁欝滞状態、すなわち、掻痒、黄疸を呈した皮膚もしくは眼、非常に濃い尿、非常に色の淡い糞便、薬物感受性に由来する熱もしくは発疹、右上4分の1の腹痛、ならびに悪心/嘔吐に類似である。薬物誘導性胆汁欝滞の診断は、血液検査に基づいて行われ、この血液検査によって、病歴を注意深く見ることに加えて、上昇したビリルビンおよびアルカリホスファターゼのレベルが明らかになる。
【0190】
遺伝性の胆汁欝滞は、胆汁欝滞状態の遺伝性形態である、常染色体劣性疾患である。胆汁欝滞の非遺伝性形態のものと類似の多くの症状を有し、この状態は、症状および家族性の病歴の初期の発症に基づいて診断され、非遺伝型とは区別される。遺伝子試験は、この状態を有する患者を同定するための最も信頼性の高い方法である。例えば、ATP8B1(FIC1)およびABCB11(BSEP)は、遺伝性の胆汁欝滞に関与する2つの遺伝子として同定された(例えば、van Milら,Semin Liver Dis.21:535−44,2001;Chenら,J Pediatr.140:119−24,2002)。
【0191】
妊娠性肝内胆汁欝滞(ICP)は、妊婦において認められる胆汁欝滞状態である。女性のICPは、食欲不振、疲労、脂肪性の糞便、色の濃い尿、および上胃部の不快感のような症状を示し得る。尿路感染は、罹患していない妊婦よりICPに罹患している妊婦でより一般的である。最後に、ビタミンKの欠損は、ICPの長期経歴を有する女性において発症し得る。ICPの診断は、血液検査に基づいており、この血液検査によって、上昇した胆汁酸レベルおよび特定の肝臓酵素レベル(例えば、アルカリホスファターゼ、GGT、5’ヌクレオチダーゼ)が示される。初期発疹(primary rash)なしの掻痒の存在はまた、その診断を確認する一助になる。肝臓生検または超音波が、その診断を確立するために稀に必要とされる。
【0192】
完全非経口栄養法に関連する胆汁欝滞は、これらの栄養を非経口的に100%受ける患者に存在する胆汁欝滞の型である。その臨床的特徴は、他の胆汁欝滞状態に類似であり得るが、これらの患者は、彼らが、カテーテルによって静脈内で液体栄養を与えられている場合に、同定しやすい。
【0193】
潜在的に生命を脅かす状態である敗血症はまた、「血流感染」といわれる。この状態は、感染に対するその身体の応答を示し、感染性生物(例えば、細菌、ウイルス、真菌、酵母、寄生生物など)または血中もしくは他の身体組織中のそれらの毒素の存在を特徴とする。敗血症は、全身性の疾患の臨床症状(例えば、熱、悪寒、倦怠感、低血圧、および精神的覚醒低下(reduced mental alertness)と関連し得る。敗血症の診断は、身体の別の部位から拡がり得る、細菌または酵母の存在を検出するための血液培養に基づく。
【0194】
嚢胞性線維症(CF)は、常染色体劣性様式で遺伝する遺伝的欠損によって引き起こされ、身体の粘液腺の慢性で進行性の、そして頻繁に致死的な疾患である。この疾患の臨床的特徴としては、以下が挙げられる:肺の慢性感染、気腫、進行性呼吸不全、胃腸の問題(膵臓および肝臓を含む)、膵臓不全(トリプシンおよび他の消化酵素の腸への分泌がない)、出生時腸閉塞、膵臓酵素の連続的な欠損、胆管閉塞、総胆管の狭窄、肝硬変、腹部右下部分の疼痛の再発性のエピソード、回腸の腺癌、心臓の問題(例えば、肺性心)、および生殖の問題(例えば、男性の不妊症)。研究室での試験は、CFを診断するために必要である。CF患者は、しばしば、陽性の汗試験の結果を示し、糞便中にトリプシンがない(血清中に高レベルのトリプシンがある)。CFに影響を与える遺伝子が同定されたので、DNA試験が、この状態についての最も信頼性の高い診断ツールである。
【0195】
(III.FXRリガンド)
A.FXRリガンドを同定するためのアッセイ
いくつかのアッセイ系は、FXRリガンド、特に、FXR活性化させる高い能力を有するFXRリガンドを同定するために確立された。例えば、候補化合物は、その化合物が、FXR活性化リガンドであるか否かおよびその効力があるか否かを決定するために、無細胞同時制御因子増加(co−regulator recruitment)アッセイにおいて試験され得る。簡潔には、この系は、FXRと同時制御因子のタンパク質またはペプチドとの間の結合を利用する。同時制御因子は、FXRがそのリガンド(例えば、SRC1)に結合する際に、FXRに対して補充されることが公知の核タンパク質である。同時調節因子タンパク質またはペプチドの、FXRへのリガンド依存性の補充は、種々の方法(例えば、蛍光共鳴エネルギー移動(FRET)、蛍光偏光または発光近接アッセイ)によって測定される。ヒトFXRまたはラットFXRのいずれかが、この目的で使用され得る。このアッセイ系の詳細な説明については、例えば、Maloneyら,J.Med.Chem.,43:2971−2974,2000;Pellicciariら,J.Med.Chem.,45:3569−3572,2002;Cuiら,J.Bio.Chem.,277:25963−25969,2002;およびJonesら,Methods Enzymol,364:53−71,2003を参照のこと。
【0196】
あるいは、候補化合物は、ゲル濾過またはシンチレーション近接アッセイ(このアッセイにおいて、放射性リガンドが使用される)のような無細胞アッセイにおいてFXRに対する結合能力について試験され得る。例えば、Jonesら,Methods Enzymol.,364:53−71,2003を参照のこと。
【0197】
化合物をそのFXRリガンド特性について試験するために有用な別のアッセイ系は、リガンド活性化FXRに応答性の転写調節エレメントによって制御されるレポーター遺伝子(例えば、ルシフェラーゼまたはβ−ガラクトシダーゼ)を伴う完全細胞モデル(例えば、肝星細胞において)である。ヒトFXRまたはラットFXRのいずれかが、このアッセイにおいて使用され得る。レポーター活性のレベルは、FXR活性化リガンドとしての試験化合物の有効性を示す。このようなレポーター遺伝子ベースのスクリーニング系の詳細な説明に関しては、例えば、Goodwinら,Mol. Cell,6:517−526,2000;Cuiら,J.Bio.Chem.,277:25963−25969,2002を参照のこと。
【0198】
上記のアッセイ系のうちの2つのクラスのいずれかにおいて、特定のFXRリガンドの有効性が、アッセイの間に実証されるそのEC50(すなわち、測定される効果の最大値の50%を生じるために必要なリガンドの濃度)によって測定される。本発明における使用に適したFXRリガンドは、上記に挙げた参考文献中に記載される方法に従って、ヒトFXRまたはラットFXRを用いて、無細胞FXRアッセイまたは細胞ベースのトランス活性化アッセイにおいて決定された場合に、5μM以下、好ましくは、2μM以下、より好ましくは、1.5μM以下、最も好ましくは、1μM以下のEC50を有するリガンドである。
【0199】
さらに、FXRに特異的なであって、他の核レセプター(特に、RXR)には特異的でないリガンドのスクリーニングのための確立された方法が存在する。例えば、WO 00/76523は、組換えRXRが、RXRリガンド結合部位を除去するために、単一の点置換によって変異され(RXRD322P)、その結果、FXR−RXRD322Pヘテロ二量体の使用がFXR活性を調節し得る化合物の明白な同定を可能にするようなアッセイ系を記載する。
【0200】
類似の化学構造または似ていない化学構造の化合物が、これら化合物が特異的にFXRを結合する能力を示した。例えば、WO00/40965、WO00/76523、WO03/015771、WO03/015777、WO03/016280、WO03/016288、WO03/030612、およびWO03/043581は、FXRを活性化するリガンドについての潜在的な候補としてこのような化合物の長いリストを提供する。
【0201】
(B.既知のFXRを活性化するリガンドの例)
既知のFXR特異的リガンドの増大しつつあるリストは、ケノデオキシコール酸(CDCA)、6ECDCA、GW4064、6α−MeCDCA、6α−PrCDCA、フェキサラミン、リトコール酸(LCA)、コール酸(cholate)(CA)、得るソデオキシコール酸(UDCA)、およびデオキシコール酸(DCA)を含む(例えば、Pellicciariら,J.Med.Chem.,45:3569−3572,2002を参照のこと)。FXRリガンドの中でも、より低いEC50(例えば、5μM以下、好ましくは、2μM以下、より好ましくは、1.5μM以下、および最も好ましくは、1μM以下を有するものが、ヒトFXRまたはラットFXRを用いる無細胞アッセイまたは細胞ベースのトランス活性化アッセイにおいて試験される場合、本発明の実施に有効である。0.2μM以下、または0.1μM以下のEC50を示すFXRリガンド(例えば、6ECDCA)は、本発明の処置方法に特に有効である(例えば、Fiorucciら,Gastroenterology 127:1497−1512,2004を参照のこと)。これらのFXRリガンドは、周知の方法に従って化学合成され得るか、または業者(例えば、Sigma−Aldrich(USA)、Erregierre(Italy)、およびHengchanlong Pharmaceuticals(China))から購入され得る。
【0202】
(IV.薬学的組成物および投与)
本発明はまた、予防適用および治療適用の両方において線維症を処置するための有効量のFXRリガンドを含む薬学的組成物を提供する。本発明の薬学的組成物は、種々の薬物送達系における使用に適している。本発明における使用に適した処方は、Remington’s Pharmaceutical Sciences,Mack Publishing Company,Philadelphia,PA,第17版(1985)において見出される。薬物送達の方法の簡潔な総説に関しては、Langer,Science 249:1527−1533(1990)を参照のこと。
【0203】
本発明の薬学的組成物は、種々の経路(例えば、経口経路、皮下経路、筋肉内経路、静脈内経路、または腹腔内経路)によって投与され得る。薬学的組成物を投与する言及される経路は、70kgの成人ヒトについて、約0.01〜5000mg/日、好ましくは、5〜500mg/日のFXRリガンドの一日用量の経口、皮下、および静脈内である。適切な用量は、1日1用量でまたは適切な間隔で示される分割用量(例えば、1日あたり2分の1用量、3分の1用量、4分の1用量または4分の1用量以下)として投与され得る。
【0204】
FXRリガンドを含む薬学的組成物を調製するために、不活性で薬学的に受容可能なキャリアが使用される。この薬学的キャリアは、固体または液体のいずれかであり得る。固体形態の調製物としては、例えば、散剤、錠剤、分散顆粒、カプセル剤、カシェ、および坐剤が挙げられる。固体キャリアは、希釈剤、矯味矯臭剤、安定化剤、滑沢剤、懸濁剤、結合剤または錠剤崩壊剤として作用し得る1種以上の物質であり得る;これはまた、包む材料でもあり得る。
【0205】
散剤において、キャリアは、一般に、微細に分割された活性成分(例えば、FXRリガンド)との混合物である、微細に分割された固体である。錠剤において、その活性成分(FXRリガンド)は、適切な割合で必要な結合特性を有するキャリアと混合され、望ましい形状および大きさに圧縮される。
【0206】
坐剤の形態において薬学的組成物を調製するために、低融点ワックス(例えば、脂肪酸グリセリドとカカオ脂との混合物)が最初に溶かされ、活性成分がその中に、例えば、攪拌によって分散される。次いで、この溶かされた均質な混合物は、従来の大きさに作られた型に注がれ、冷却および固化される。
【0207】
散剤および錠剤は、好ましくは、約5重量%〜約70重量%の間のFXRリガンド活性成分を含む。適切なキャリアとしては、例えば、炭酸マグネシウム、ステアリン酸マグネシウム、タルク、ラクトース、糖類、ペクチン、デキストリン、澱粉、トラガカント、メチルセルロース、カルボキシメチルセルロースナトリウム、低融点ワックス、カカオ脂などが挙げられる。
【0208】
上記薬学的組成物は、FXRリガンドの活性化合物を、キャリアとしての包む材料と一緒に処方し、そのキャリアが化合物と会合しているように、FXRリガンド(他のキャリアを含んでまたはこれを含まずに)がそのキャリアによって囲まれるカプセル剤を提供することを包含し得る。類似の様式で、カシェもまた含まれ得る。錠剤、散剤、カシェ、およびカプセル剤は、経口投与に適した固体投与形態として使用され得る。
【0209】
液体の薬学的組成物は、例えば、経口投与もしくは非経口投与に適した溶液、懸濁液、および経口投与に適したエマルジョンが挙げられる。その活性成分(例えば、FXRリガンド)の滅菌水溶液または溶媒(水、緩衝された水、生理食塩水、PBS、エタノール、もしくはプロピレングリコールを含む)中のその活性成分の滅菌溶液は、非経口投与に適した液体組成物の例である。その組成物は、おおよその生理学的条件に必要とされる薬学的に受容可能な補助物質(例えば、pH調節剤および緩衝化剤、張度調節剤、湿潤剤、界面活性剤など)を含み得る。
【0210】
滅菌溶液は、上記活性成分(例えば、FXRリガンド)を望ましい溶媒系に溶解し、次いで、その得られた溶液を膜フィルターに通して、この溶液を滅菌することによってか、または代わりに、滅菌条件下で予め滅菌した溶媒中に滅菌化合物を溶解することによって調製され得る。この得られた水溶液は、そのまま包装されてもよいし、凍結乾燥されてもよく、その凍結乾燥調製物は、投与前に滅菌水溶液と合わせられる。その調製物のpHは、代表的には、3〜11の間、より好ましくは、5〜9、および最も好ましくは、7〜8である。
【0211】
FXRリガンドを含む薬学的組成物は、予防処置および/または治療処置のために投与され得、治療用途において、組成物は、この疾患およびその合併症の症状を予防するか、治癒するか、逆転するか、または少なくとも部分的に遅延させるかまたは抑えるために十分な量で、FXRが発現される器官の線維症に既に罹患している患者に投与される。これを達成するために十分な量は、「治療上有効な用量」として規定される。この用途に有効な量は、この疾患または状態の重篤度、および患者の体重および全身状態に依存するが、一般に、70kgの患者に対して、1日あたり約0.1mg〜約2,000mgの化合物の範囲であり、70kgの患者に対して1日あたり約5mg〜約500mgの化合物の投薬量が、より一般に使用される。
【0212】
予防用途において、FXRリガンドを含む薬学的組成物は、FXRが発現される器官(例えば、肝臓、腎臓、腸など)における線維症を発症しやすい患者またはそうでなければその発症の危険性がある患者に、その線維症の症状の発症を遅らせるかもしくは予防するに十分な量で、投与される。このような量は、「予防上有効な用量」であると規定される。この用途において、FXRリガンドの正確な量は、繰り返すと、患者の健康状態および体重に依存するが、一般に、70kgの患者に対して、1日あたり約0.1mg〜約2,000mg、より一般には、70kgの患者に対して、1日あたり約5mg〜約500mgの範囲である。
【0213】
その組成物の1回の投与または複数回の投与は、処置する医師によって選択される用量レベルおよびパターンで行われる。いずれにしても、その薬学的処方物は、その患者における線維症を有効に、治療上または予防上のいずれかで阻害するに十分な量のFXRリガンドを提供しなければならない。
【0214】
(V.キット)
本発明はまた、本発明の方法に従って、線維症を予防するか、処置するかまたは改善するためのキットを提供する。このキットは、代表的には、FXRに対して特異的でありかつFXRの転写活性を刺激し得るリガンドの有効量を含む薬学的組成物、およびこの薬学的組成物をどのように与えるかという指示を含む(処置され得る患者のタイプ(例えば、FXRが発現されているが胆汁欝滞状態には罹患していない器官において肝線維症を発症する危険性のある個体)の説明、投与スケジュール(例えば、用量および頻度)および投与経路などを含む)情報資料を含む。
【実施例】
【0215】
以下の実施例は、例示によってのみ提供されるであって、限定によって提供されるのではない。当業者は、本質的に類似の結果を生じるように変更もしくは改変され得る、種々の重要でないパラメーターを容易に認識する。
【0216】
(実施例1:肝星細胞(HSC)におけるコラーゲンα1型発現のFXRリガンド媒介性抑制)
最終的に肝硬変をもたらす肝臓線維症は、線維形成の増加および創傷収縮の両方の要素を含む、肝臓の瘢痕化プロセスである。肝星細胞(HSC)は、肝臓の線維形成を担う主な細胞型として認識されている。慢性肝臓疾患において、HSCは、「活性化」表現型を獲得し、この表現型としては、増大した増殖、収縮性、線維形成、マトリクス分解、走化性、およびサイトカイン放出が挙げられる(Friedman,J.Biol.Chem.275:2247−2250,2000)。現時点のパラダイムは、HSCの活性化状態が、その変更された微小環境を介して達成されると仮定する。この微小環境は、増殖因子である、血小板由来増殖因子(PDGF)およびトランスホーミング増殖因子(TGF)−β、反応性酸素中間体によって一部支援される。この反応性酸素中間体は、肝星細胞によって、および先に活性化されたHSCによって生成される原線維マトリクスによって、ならびにトロンビンとそのI型レセプター(プロテイナーゼ活性化レセプター1、またはPAR−1)(Fiorucciら,Hepatology,39:365−75,2004)での刺激に応答して放出される。コラーゲンIのα−1型(αI)は、正常肝臓および硬変肝臓において見出される主要なコラーゲン亜型の代表である(Friedman,J.Biol.Chem.,275:2247−2250,2000)。コラーゲンα1は、活性化HSCによって、線維性で硬変性の肝臓において生成される。
【0217】
胆汁酸は、ファルネソイドXレセプター(FXR)(NR1H4および胆汁酸レセプター(BAR)、胆汁酸に曝される組織(例えば、肝臓、腸、胆嚢、および腎臓)において発現される核レセプターとしても公知)に結合してこのレセプターを活性化させることによって、胆汁酸自体の生合成および輸送を制御するシグナル伝達分子として作用する。FXRは、9−cis−レチノイン酸(9−cis−RA)レセプター(RXR(NR2B1としても公知))とのヘテロダイマーとして、1つのヌクレオチドによって分離されている2つの逆反復(IR−I)から構成されるDNA配列に結合することによって、転写を変化させる。肝細胞において、活性化の際に、FXRは、肝細胞内の胆汁酸の濃度を減少させるように機能する遺伝子のコホートの転写を開始する。具体的には、活性化されたFXRは、BSEPをコードする遺伝子、多剤耐性タンパク質3(MDR3;ABCB4)をコードする遺伝子、およびMRP2をコードする遺伝子の発現を誘導する。さらに、FXRの天然に存在するリガンド(例えば、ケノデオキシコール酸、CDCA)および合成リガンド(例えば、6ECDCAおよびGW4064)の両方によるFXRの活性化は、Na+/タウロコール酸共輸送ポリペプチド(NTCP;SLC10A1)、CYP7A1およびCYP8B1のフィードバック抑制をもたらす。これらの遺伝子は、コレステロール 7α−ヒドロキシラーゼおよびステロール 12α−ヒドロキシラーゼをコードし、これらの酵素はともに、コレステロールからの胆汁酸の合成の中心である。CYP7A1のFXR依存性抑制は、転写リプレッサー、短いヘテロダイマーパートナー(SHP;NR0B2)、DNA結合ドメインを欠いている非定型核レセプターによって媒介される。従って、活性化の際に、FXRは、SHPの発現を直接誘導し、SHPは、続いて、肝臓レセプターホモログ−1(LRH−I;NR5A2)(CYP7A1の既知の正の調節因子)と相互作用し、その転写活性を抑制する。妨害されたSHP遺伝子を有するマウスにおいて行った研究によって、CYP7A1の抑制におけるFXR−SHP−LRH−1カスケードの重要性が確認された(例えば、Formanら,Cell 81:687−693,1995;Seolら,Mol.Endocrinol.9:72−85,1995;Sinaiら,Cell 102:731−744,2000;Ananthanarayananら,J.Biol.Chem.,276:28857−28865,2001;Holtら,Genes Dev.,17:1581−91,2003;Kastら,J.Biol.Chem.,277:2908−2915,2002;Goodwinら,Mol.Cell 6:517−526,2000;およびLuら,Mol Cell 6:507−515,2000を参照のこと)。
【0218】
本明細書中以降に示される研究の目的は、以下のとおりである:1)HSCがFXRを発現するか否かを実証すること;2)FXRリガンドが、コラーゲンα1発現および合成をインビトロで調節するか否かを実証すること;ならびに3)この効果の分子中間体を明らかにすること。HSCの2つのタイプを、この研究において使用した。このタイプは、初代培養物中の新たに単離された細胞であるか、ラットHSCから得た不死化細胞株(HSC−T6)であるかのいずれかであった。
【0219】
図1に示される結果は、HSCの初代培養物およびHSC−T6がともに、逆転写ポリメラーゼ連鎖反応(RT−PCR)でmRNA(パネルa)を、およびウェスタンブロット分析でタンパク質(パネルb)を測定することによって評価される場合、FXRを発現することを実証する。パネルbは、HSCにおけるFXRの量が、培養している間、経時的に増大し、その増加は、α−平滑筋アクチン(αSMA)(これは、筋線維芽細胞様細胞へのHSCの分化のマーカーである)の発現と並行して生じることを実証する。従って、HSCは、それらの分化した表現型を獲得すると同時に、FXRもまた発現する。このことと一致して、FXR発現はまた、HSC−T6において検出された。
【0220】
次いで、HSCが既知のFXR転写標的である遺伝子を発現するか否かを評価した。図2のパネルaにおいて示されるように、NTCP、BSEP、CYP7A1、およびSHPの発現を、HSCにおいて検出した。さらに、図2のパネルbにおいて示されるように、HSCにおけるこれらの遺伝子の発現は、FXRリガンドによって調節される。図2bに示される定量的RT−PCRは、合成FXRリガンドである6ECDCAに(1μMの濃度で)、および天然のFXRリガンドであるCDCAに(20μMの濃度で)曝すと、SHP mRNAおよびBSEP mRNAの2倍の増加、ならびにNTCP mRNAおよびCYP7A1 mRNAの50〜70%の減少が生じることを図示する。
【0221】
図3aに図示されるように、HSCをFXRリガンドである6ECDCA(1μM)、CDCA(20μM)、およびGW4064(100μM)に曝すと、RT−PCRおよび定量的RT−PCRによってα1 mRNA発現を評価することによって測定される場合、I型コラーゲンの発現が減少する。これらの観察は、図3bにおいて示されるように、ノーザンブロット分析によって確認された。
【0222】
α1コラーゲンの合成に対してインビトロで発揮される阻害効果のFXRリガンドは、HSC増殖の阻害またはHSCの死の誘導に関連しない。なぜなら、図4a〜cに図示されるように、[3H]−チミジン取り込みを決定すること(パネルaおよびパネルb)または細胞計数(パネルc)によって評価される場合、6ECDCAは、トロンビン、PDGF、およびTGFβ1によって誘導されるHSC増殖を妨げないからである。さらに、FXRリガンドの曝露は、いかなるHSCアポトーシスも生じない(パネルd)。
【0223】
図5に図示されるように、FXRリガンドはまた、細胞上清中のヒドロキシプロリン濃度(これは、HSCからのコラーゲン放出の尺度である)を決定することによって測定される場合、コラーゲンα1放出を阻害する。
【0224】
このα1遺伝子は、α1プロモーターを結合するためにFXRによって使用され得るIRを欠いているので、本発明者らは、HSCにおけるFXRリガンドによって誘導されるα1発現の阻害に関与するメディエーターを調査し、α1発現を阻害するために、FXRリガンドがSHP誘導を厳密に必要とするという証拠を見出した。実際に、図6に図示されるように、HSC−T6におけるSHP過剰発現は、QRT−PCRによって(パネルa)およびノーザンブロット分析(パネルb)によって測定される場合に、休止中のHSC−T6に対してα1発現を停止させ、かつトロンビン、TGFβ1およびPDGFによって引き起こされるα1誘導を妨げる。
【0225】
対照的に、図7に図示されるように、特定の小さな干渉RNA(siRNA)によるSHP発現の停止は、mRNA阻害が、FXRリガンドによって引き起こされることを明らかにした(パネルa)。また、SHPのサイレンシングにより、マイトジェン因子(例えば、トロンビン、TGFおよびPDGF)で処理したHSCにおける、FXRリガンドによって誘導されるα1発現の阻害が妨げられた(パネル7c)。これらデータを、ノーザンブロット分析によって確認した。
【0226】
まとめると、本明細書で提示されるデータは、HSC(肝臓においてコラーゲンを生成しかつ肝臓線維症の原因である細胞)がFXRを発現しかつこれら細胞をFXRの天然リガンドまたは合成リガンドに曝すと、コラーゲンα1 mRNAおよびSHPの誘導を伴う機構による分泌をダウンレギュレートすることを実証する。
【0227】
(材料および方法)
(リアルタイムPCR)
その発現遺伝子の定量を、リアルタイムポリメラーゼ連鎖反応(Q−RTPCR)によって行った。総RNAを、24時間飢餓状態にして、FXRリガンドである6ECDCA 1μMで18時間刺激した、ラット肝星細胞(HSC)またはT6細胞株から単離した(TRIzol試薬−Invitrogen)。1μg RNAを、室温で15分間のDNaseI処理(Invitrogen)によって、ゲノムDNAから精製した。このDNaseIを、2.5μM EDTAの存在下で、95℃で5分間、不活性化する。そのRNAを、20μlの反応容積中、Superscript II(Invitrogen)で無作為に逆転写した。100ngのテンプレートを、リアルタイムPCRの25μlの最終容積の反応系において使用した。この反応系は、以下の試薬を含んでいた:0.3μMの各プライマーおよび12.5μlの2×SYBR Green PCR Master MIX(Bio−Rad)。全ての反応を、三連で行い、サーマルサイクリング条件は以下のとおりであった:iCycler iQ機器(Biorad,Hercules,CA)において、95℃で2分間、続いて、95℃を10秒間と60℃を30秒間とが50サイクル。各サンプルに対する複製物の平均値を計算し、サイクル閾値として表した(CT:各PCR反応が所定の蛍光閾値(全ての反応の線形範囲内で設定される)に達するサイクル数)。次いで、この遺伝子発現量を、標的遺伝子に関するサンプルのCT値と、内因性コントロール(アクチン)に関するサンプルの平均CT値との間の差異(ΔCT)として計算した。相対的発現を、各標的遺伝子に関して、試験サンプルのΔCT値とコントロールサンプルのΔCT値(WT)との間の差異(ΔΔCT)として計算した。相対的定量値を表し、2−ΔΔCTとして示した。全てのPCRプライマーを、NCBIデータベースから公にされた配列データを用いて、ソフトウェアPRIMER3−OUTPUTを用いて設計した。
【0228】
【化1】

【0229】
(ノーザンブロット分析)
コラーゲンI αIのレベルを、初代肝星細胞(HSC)、T6細胞株およびHepG2細胞株から調製された総RNAサンプルのノーザンブロット分析によって決定した。この目的で、10μgの総RNAを、ゲル電気泳動で分離した(0.98M ホルムアルデヒドを含む1% アガロース)。電気泳動の直後に、そのRNAを正に荷電したナイロン膜(Amersham Life Sciences crop.)に転写した。この転写したRNAを、UV光によってこの膜に架橋させた。この膜を、6×SSCおよび2% SDS中で4時間プレハイブリダイズして、その後、コラーゲンI αIまたはGAPDH(内部コントロールとして)に関する32P−標識プローブと65℃で20時間ハイブリダイズした。ハイブリダイズさせた膜を、最終的なストリンジェンシー1×SSC、1.0% SDSで、65℃で洗浄し、Kodak AR−2フィルムに、−80℃で露出した。このデータを、内部GAPDHに対して相対的に表す。
【0230】
(ウェスタンブロット分析)
HSCまたはT6細胞株のコンフルエントな培養物を、48時間の間、血清を欠乏させて、その後、トロンビン(10単位/ml)、6ECDCA(1μM)のいずれかありまたはなしのDMEM中で、37℃で18時間インキュベートした。全溶解物を、細胞をSDS Laemmlyサンプル緩衝液(62.5mM Tris−HCl(pH6.8)、10% グリセロール、2% SDS、0.015% プロモフェノールブルー)中に溶解することによって調製し、3〜4×105個の細胞を、10% ポリアクリルアミドゲル上での電気泳動に供した。次いで、分離したタンパク質を、ニトロセルロース膜(BioRad)に転写し、その膜を、c−Jun、JunD、SHP、FXR、αSMAに対する一次抗体(Santa Cruz Biotechnology)でプローブした。この抗免疫グロブリンG西洋ワサビペルオキシダーゼ結合体(Bio−Rad)を、二次抗体として添加し、特異的タンパク質バンドを、製造業者が示唆したプロトコルに従って、増強ケミルミネッセンス(ECL;Amersham corp.)を用いて可視化した。
【0231】
(同時免疫沈降アッセイ)
免疫沈降のための抽出物を調製するために、初代HSC細胞、またはT6細胞およびT6過剰発現SHP細胞を、まず、氷冷PBSで3回洗浄し、その後、これらの細胞を、E1A緩衝液(50mM Hepes(pH7)、250mM NaCl、0.1% NP−40、5mM EDTA、1mM DTT、1mM フェニルメチルスルホニルフルオリド、1mg/ml ロイペプチン、1mg/ml アプロチニンおよび1mg/ml ペプスタチンA)中で超音波処理することによって溶解した。この溶解物を、13,000gで10分間遠心分離することによって膜残渣を除去して清澄にし、その上清抽出物中のタンパク質濃度を、1mg/mlに合わせた。1〜4mgの総タンパク質または107個の細胞溶解物を、10μl プロテインAセファロース(Amersham Pharmacia Biotechnology,Piscataway,New Jersey)の存在下で、抗SHP、抗JunDまたは抗c−Jun(Santa Cruz Biotechnology,Santa Cruz,California)または無関係の抗体としての抗CD28(コントロール)で、一晩+4℃で免疫沈降した。得られた免疫沈降物を、EIAで5回洗浄した後、SDS−PAGEに供し、免疫沈降において使用した抗体(逆抗体(reverse))と一緒にイムノブロットした。
【0232】
(T6細胞におけるウイルスベクター媒介性SHP遺伝子の形質導入)
このSHPコード配列を、ラット初代肝細胞からクローニングした。簡潔には、1μgの総RNAを、0.3μM ランダムヘキサマーを用いて、20μlの反応系において、SuperScript III逆転写酵素(Invitrogen)により逆転写した。200個のcDNAテンプレートを用いて、50μl PCR反応系において、特異的プライマー:
【0233】
【化2】

を用いて、SHPのコード配列をPfu DNAポリメラーゼ(Stratagene)により増幅した。SHPコード配列を、pCR2.1ベクター(TOPO−TAクローニング−Invitrogen)において最初にクローニングし、次いで、レトロウイルスベクターPINCOにおいてサブクローニングした。293T改変パッケージング細胞(ΦNX)を、10%FBSおよびリン酸カルシウムを含有するDMEM培地中で培養し、PINCO−SHPキメラおよびネガティブコントロールとしてのPINCOのみで一過性にトランスフェクトした。トランスフェクトして48時間後に、上清中のウイルスを回収し、T6細胞を感染するために使用した。PINCOベクターは、感染細胞(緑色)を非感染細胞から分離することを可能にするEGFP(エメラルドグリーン蛍光タンパク質)遺伝子を率いている。SHPを発現するT6細胞の純粋な集団を、FACS(蛍光活性化セルソーター)分離によって得た。このSHP発現を、ウェスタンブロット分析によって検出した。
【0234】
(実施例2:FXRリガンドの投与は、胆管結紮(BDL)ラットにおいて線維症の減少を生じる)
BDLは、慢性胆汁欝滞のモデルである。しかし、このモデルにおいて、進行性肝臓線維症は、結紮してから3〜4週間後に、肝硬変の発症をもたらすので、肝臓線維症のモデルとしても使用される(Kountourasら,Br.J.Exp.Pathol,65:305−311,1984)。このモデルによって、本発明者らが抗線維症療法の効果を試験することが可能であるので、本発明者らは、BDLして3日後に、2週間にわたって、経口で、1日あたり1mg/kgおよび3mg/kgの用量の6ECDCAをラットに投与した。このプロトコルの研究は、Animal Study Committee of the University of Perugiaによって認可された。肝臓線維症を、BDLによって8〜9週齢のオスWistarラット(Charles River,Monza,Italy)において誘導した。BDLを、Kountourasら(Br.J.Exp.Pathol.65:305−311;1984)によって最初に記載されたように行った。BDLの1週間後に、ラットを無作為化して、以下の処置の内の1つを与えた:プラセボ(100μL PBSの皮下注射)または1mg/kg/日および3mg/kg/日の用量の6ECDCA(経口で)。次いで、動物を、3週間にわたって追跡した。
【0235】
研究の最後に、生き残っているラットをペントバルビタールナトリウム麻酔(50mg/kg i.p)下で屠殺し、最終的に心臓穿刺により採血した。その血液を、7250gで20分間、4℃で遠心分離した;その得られた血清を、分析するまで−20℃で保存した(最長2週間)。死亡したときに、胆管結紮が、総胆管の近位拡張を伴って損なわれていないことを確認した。秤量後、肝臓標本を液体窒素中で即時に凍結し、その後の分析のために−70℃で保存した。組織学的試験のために、各動物の肝臓の右葉および左葉の一部(10〜15mg/各葉)を、10%ホルマリン中で固定し、パラフィン中に包埋し、切片を作製し、ヘマトキシリンとエオシンまたはシリウスレッドで染色した。シリウスレッド染色のために、その切片を、0.1% シリウスレッドF3B(Sigma Chemical Co.)(飽和ピクリン酸および0.1% ファストグリーンを含有する)中で30分間インキュベートした。蒸留水で2回すすいだ後、切片を70% エタノールで短時間脱水し、カバースリップをかけた。肝臓サンプルからのコラーゲン表面密度を、以前に記載されるようにコンピューター補助画像分析システム(Image Acquisition System Ver.005,Delta Sistemi,Rome,Italy)を用いて定量した。盲検状態にした標本におけるコラーゲンの表面密度を、RockeyおよびChung(Rockey,D.C.,Chung,J.J. J.Clin.Invest.98:1381−1388,1996)によって記載される方法に従ってビデオスクリーンディスプレイ拡大写真で測定し、パーセントとして表した(コラーゲン表面積/総分析視野表面の比率)。10個の無作為の視野からとったスコアの平均を、各動物の肝臓に対する単一の巣かを作るために使用した。
【0236】
図8に図示されるように、6ECDCAのインビボ送達は、シリウスレッド染色のスコア付け(図8a)、肝臓ヒドロキシプロリン含有量(図8b)、およびRT−PCRによる肝臓α1 mRNA(図8c)によって測定される場合に、肝臓コラーゲン沈着の有意な減少を生じた。肝臓におけるシリウスレッド染色コラーゲンの定量分析によって、6ECDCAでの処置後に、肝臓コラーゲン含有量の62%減少が実証された。図8において、データは平均±SEである;*は、偽手術に対してP<0.01を、**は、BDLに対してP<0.01を示す。「中心」および「門脈」は、中心静脈および門脈領域、ならびにこれら空間に直ぐ隣接して取り囲む実質領域をいう。「全て」とは、低倍率下で可視化される全肝臓面積をいう。
【0237】
(実施例3:線維症を阻害するためのFXRリガンドの投与)
本発明は、以下の実施例に従って実施され得る。58歳の老年の女性患者(体重約60kg)は、慢性C型肝炎(HCV)感染に罹患しており、肝臓線維症の発症および進行を阻害するための処置を捜し求めている。この患者のアルカリホスファターゼ、GGTおよび5’ヌクレオチダーゼの血清レベルは、胆汁欝滞状態を示さない範囲内に入っていると考えられる。肝臓線維症状態を評価し、ならびに肝臓生検および/もしくは非侵襲性血清マーカーの測定を行うことによってステージを決定した後に、6ECDCAを含む錠剤を、1日2回のスケジュールの経口投与でその患者に処方する。合計300mgの6ECDCAを、各々の日に服用させる。その患者は、彼女の残りの寿命の間、このスケジュールに従う。肝臓線維症の発症および進行は、血清マーカーを測定するかまたは肝臓生検を分析することに基づいてモニターされ得る。
【0238】
本願で引用される全ての特許、特許出願、および他の刊行物は、全ての目的でその全体が本明細書に参考として援用される。
【特許請求の範囲】
【請求項1】
胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するための方法であって、
該方法は、
該被験体に対して、ファルネソイドXレセプター(FXR)に対して特異的なリガンドを有効量投与する工程、
を包含し、該阻害されるべき線維症は、FXRが発現される器官において生じ、但し、該リガンドは、ケノデオキシコール酸(CDCA)でもウルソデオキシコール酸(UDCA)でもない、
方法。
【請求項2】
胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するための方法であって、
該方法は、
該被験体に対して、ファルネソイドXレセプター(FXR)に対して特異的なリガンドを有効量投与する工程、
を包含し、該阻害されるべき線維症は、FXRが発現される器官において生じ、該リガンドは、無細胞FXRアッセイまたは細胞ベースのFXRトランス活性化アッセイにおいて、5μM以下のEC50を有する、
方法。
【請求項3】
請求項2に記載の方法であって、前記リガンドは、1μM以下のEC50を有する、方法。
【請求項4】
請求項1または請求項2に記載の方法であって、前記胆汁鬱滞性状態は、異常に増加した血清中アルカリホスファターゼレベル、異常に増加した血清中γ−グルタミルトランスペプチダーゼ(GGT)レベル、および異常に増加した血清中5’ヌクレオチダーゼレベルを有するものとして規定される、方法。
【請求項5】
請求項4に記載の方法であって、前記胆汁鬱滞性状態は、少なくとも1つの臨床症状を呈するものとしてさらに規定される、方法。
【請求項6】
請求項5に記載の方法であって、前記症状は、掻痒(痒み)である、方法。
【請求項7】
請求項1または請求項2に記載の方法であって、前記線維症は、肝線維症、腎線維症、および腸線維症からなる群より選択される、方法。
【請求項8】
請求項1または請求項2に記載の方法であって、前記鬱滞性状態は、原発性胆汁性肝硬変、原発性硬化性胆管炎、薬物誘発性胆汁鬱滞、遺伝性胆汁鬱滞、および妊娠性肝内胆汁鬱滞からなる群より選択される、方法。
【請求項9】
請求項1または請求項2に記載の方法であって、前記被験体は、原発性肝臓癌および原発性胆道癌、転移性癌、敗血症、慢性的完全非経口栄養法、嚢胞性線維症、および肉芽腫性肝疾患からなる群より選択される疾患または状態に関連する胆汁鬱滞には罹患していない、方法。
【請求項10】
請求項1または請求項2に記載の方法であって、前記リガンドは、6ECDCA、タウロ−6ECDCA、6EUDCA、GW4064、6α−MeCDCA、6α−PrCDCA、フェキサラミン、およびググルステロンからなる群より選択される、方法。
【請求項11】
請求項1または請求項2に記載の方法であって、前記被験体は、B型肝炎;C型肝炎;寄生虫性肝疾患;移植後の細菌感染、移植後のウイルス感染、および移植後の真菌感染;アルコール性肝疾患(ALD);非アルコール性脂肪肝疾患(NAFLD);非アルコール性脂肪肝炎(NASH);メトトレキサートにより誘発される肝疾患、イソニアジドにより誘発される肝疾患、オキシフェニスタチンにより誘発される肝疾患、メチルドパにより誘発される肝疾患、クロルプロマジンにより誘発される肝疾患、トルブタミドにより誘発される肝疾患、またはアミオダロンにより誘発される肝疾患;自己免疫肝炎;サルコイドーシス;ウィルソン病;ヘモクロマトーシス;ゴーシェ病;III型糖原病、IV型糖原病、VI型糖原病、IX型糖原病、およびX型糖原病;α1アンチトリプシン欠損症;ツェルヴェーガー症候群;チロシン血症;果糖血症;ガラクトース血症;バッド−キアーリ症候群に関連する脈管障害、静脈閉塞病に関連する脈管障害、または門脈血栓症に関連する脈管障害;ならびに先天性肝線維症;からなる群より選択される疾患に関連する肝線維症を有する、方法。
【請求項12】
請求項1または請求項2に記載の方法であって、前記被験体は、クローン病、潰瘍性大腸炎、照射後発生性大腸炎、および顕微鏡的大腸炎からなる群より選択される疾患に関連する腸線維症を有する、方法。
【請求項13】
請求項1または請求項2に記載の方法であって、前記被験体は、糖尿病性腎症、高血圧性腎硬化症、慢性糸球体腎炎、慢性移植片糸球体症、慢性腸腎炎、多発性嚢胞腎疾患からなる群より選択される疾患に関連する腎線維症を有する、方法。
【請求項14】
胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するためのキットであって、該阻害されるべき線維症は、ファルネソイドXレセプター(FXR)が発現される器官において生じ、該キットは、
FXRに対して特異的な有効量のリガンドであって、但し、該リガンドは、ケノデオキシコール酸(CDCA)でもウルソデオキシコール酸(UDCA)でもない、リガンド;および
該患者への該リガンドの投与についての適応症、投与量、およびスケジュールを教示する、指示資料;
を備える、キット。
【請求項15】
胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するためのキットであって、該阻害されるべき線維症は、ファルネソイドXレセプター(FXR)が発現される器官において生じ、該キットは、
FXRに対して特異的な有効量のリガンドであって、該リガンドは、無細胞FXRアッセイまたは細胞ベースのFXRトランス活性化アッセイにおいて5μM以下のEC50を有する、リガンド;および
該患者への該リガンドの投与についての適応症、投与量、およびスケジュールを教示する、指示資料;
を備える、キット。
【請求項16】
請求項15のキットであって、前記リガンドは、1μM以下のEC50を有する、キット。
【請求項17】
請求項14または請求項15に記載のキットであって、前記線維症は、肝線維症、腎線維症、および腸線維症からなる群より選択される、キット。
【請求項18】
請求項14または請求項15に記載のキットであって、前記リガンドは、6ECDCA、タウロ−6ECDCA、6EUDCA、GW4064、6α−MeCDCA、6α−PrCDCA、フェキサラミン、およびググルステロンからなる群より選択される、キット。
【請求項19】
請求項14または請求項15に記載のキットであって、前記リガンドは、経口投与または静脈内投与のために適切な薬学的組成物中にて提示される、キット。
【請求項1】
胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するための方法であって、
該方法は、
該被験体に対して、ファルネソイドXレセプター(FXR)に対して特異的なリガンドを有効量投与する工程、
を包含し、該阻害されるべき線維症は、FXRが発現される器官において生じ、但し、該リガンドは、ケノデオキシコール酸(CDCA)でもウルソデオキシコール酸(UDCA)でもない、
方法。
【請求項2】
胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するための方法であって、
該方法は、
該被験体に対して、ファルネソイドXレセプター(FXR)に対して特異的なリガンドを有効量投与する工程、
を包含し、該阻害されるべき線維症は、FXRが発現される器官において生じ、該リガンドは、無細胞FXRアッセイまたは細胞ベースのFXRトランス活性化アッセイにおいて、5μM以下のEC50を有する、
方法。
【請求項3】
請求項2に記載の方法であって、前記リガンドは、1μM以下のEC50を有する、方法。
【請求項4】
請求項1または請求項2に記載の方法であって、前記胆汁鬱滞性状態は、異常に増加した血清中アルカリホスファターゼレベル、異常に増加した血清中γ−グルタミルトランスペプチダーゼ(GGT)レベル、および異常に増加した血清中5’ヌクレオチダーゼレベルを有するものとして規定される、方法。
【請求項5】
請求項4に記載の方法であって、前記胆汁鬱滞性状態は、少なくとも1つの臨床症状を呈するものとしてさらに規定される、方法。
【請求項6】
請求項5に記載の方法であって、前記症状は、掻痒(痒み)である、方法。
【請求項7】
請求項1または請求項2に記載の方法であって、前記線維症は、肝線維症、腎線維症、および腸線維症からなる群より選択される、方法。
【請求項8】
請求項1または請求項2に記載の方法であって、前記鬱滞性状態は、原発性胆汁性肝硬変、原発性硬化性胆管炎、薬物誘発性胆汁鬱滞、遺伝性胆汁鬱滞、および妊娠性肝内胆汁鬱滞からなる群より選択される、方法。
【請求項9】
請求項1または請求項2に記載の方法であって、前記被験体は、原発性肝臓癌および原発性胆道癌、転移性癌、敗血症、慢性的完全非経口栄養法、嚢胞性線維症、および肉芽腫性肝疾患からなる群より選択される疾患または状態に関連する胆汁鬱滞には罹患していない、方法。
【請求項10】
請求項1または請求項2に記載の方法であって、前記リガンドは、6ECDCA、タウロ−6ECDCA、6EUDCA、GW4064、6α−MeCDCA、6α−PrCDCA、フェキサラミン、およびググルステロンからなる群より選択される、方法。
【請求項11】
請求項1または請求項2に記載の方法であって、前記被験体は、B型肝炎;C型肝炎;寄生虫性肝疾患;移植後の細菌感染、移植後のウイルス感染、および移植後の真菌感染;アルコール性肝疾患(ALD);非アルコール性脂肪肝疾患(NAFLD);非アルコール性脂肪肝炎(NASH);メトトレキサートにより誘発される肝疾患、イソニアジドにより誘発される肝疾患、オキシフェニスタチンにより誘発される肝疾患、メチルドパにより誘発される肝疾患、クロルプロマジンにより誘発される肝疾患、トルブタミドにより誘発される肝疾患、またはアミオダロンにより誘発される肝疾患;自己免疫肝炎;サルコイドーシス;ウィルソン病;ヘモクロマトーシス;ゴーシェ病;III型糖原病、IV型糖原病、VI型糖原病、IX型糖原病、およびX型糖原病;α1アンチトリプシン欠損症;ツェルヴェーガー症候群;チロシン血症;果糖血症;ガラクトース血症;バッド−キアーリ症候群に関連する脈管障害、静脈閉塞病に関連する脈管障害、または門脈血栓症に関連する脈管障害;ならびに先天性肝線維症;からなる群より選択される疾患に関連する肝線維症を有する、方法。
【請求項12】
請求項1または請求項2に記載の方法であって、前記被験体は、クローン病、潰瘍性大腸炎、照射後発生性大腸炎、および顕微鏡的大腸炎からなる群より選択される疾患に関連する腸線維症を有する、方法。
【請求項13】
請求項1または請求項2に記載の方法であって、前記被験体は、糖尿病性腎症、高血圧性腎硬化症、慢性糸球体腎炎、慢性移植片糸球体症、慢性腸腎炎、多発性嚢胞腎疾患からなる群より選択される疾患に関連する腎線維症を有する、方法。
【請求項14】
胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するためのキットであって、該阻害されるべき線維症は、ファルネソイドXレセプター(FXR)が発現される器官において生じ、該キットは、
FXRに対して特異的な有効量のリガンドであって、但し、該リガンドは、ケノデオキシコール酸(CDCA)でもウルソデオキシコール酸(UDCA)でもない、リガンド;および
該患者への該リガンドの投与についての適応症、投与量、およびスケジュールを教示する、指示資料;
を備える、キット。
【請求項15】
胆汁鬱滞性状態に罹患していない被験体において線維症を阻害するためのキットであって、該阻害されるべき線維症は、ファルネソイドXレセプター(FXR)が発現される器官において生じ、該キットは、
FXRに対して特異的な有効量のリガンドであって、該リガンドは、無細胞FXRアッセイまたは細胞ベースのFXRトランス活性化アッセイにおいて5μM以下のEC50を有する、リガンド;および
該患者への該リガンドの投与についての適応症、投与量、およびスケジュールを教示する、指示資料;
を備える、キット。
【請求項16】
請求項15のキットであって、前記リガンドは、1μM以下のEC50を有する、キット。
【請求項17】
請求項14または請求項15に記載のキットであって、前記線維症は、肝線維症、腎線維症、および腸線維症からなる群より選択される、キット。
【請求項18】
請求項14または請求項15に記載のキットであって、前記リガンドは、6ECDCA、タウロ−6ECDCA、6EUDCA、GW4064、6α−MeCDCA、6α−PrCDCA、フェキサラミン、およびググルステロンからなる群より選択される、キット。
【請求項19】
請求項14または請求項15に記載のキットであって、前記リガンドは、経口投与または静脈内投与のために適切な薬学的組成物中にて提示される、キット。
【図4】


【図5】


【図8】


【図1】


【図2】


【図3】


【図6】


【図7】




【図5】


【図8】


【図1】


【図2】


【図3】


【図6】


【図7】


【公開番号】特開2012−162556(P2012−162556A)
【公開日】平成24年8月30日(2012.8.30)
【国際特許分類】
【出願番号】特願2012−90651(P2012−90651)
【出願日】平成24年4月12日(2012.4.12)
【分割の表示】特願2007−503111(P2007−503111)の分割
【原出願日】平成17年3月14日(2005.3.14)
【出願人】(506306868)インターセプト ファーマシューティカルズ, インコーポレイテッド (8)
【Fターム(参考)】
【公開日】平成24年8月30日(2012.8.30)
【国際特許分類】
【出願日】平成24年4月12日(2012.4.12)
【分割の表示】特願2007−503111(P2007−503111)の分割
【原出願日】平成17年3月14日(2005.3.14)
【出願人】(506306868)インターセプト ファーマシューティカルズ, インコーポレイテッド (8)
【Fターム(参考)】
[ Back to top ]

