Foxp3+ナチュラルキラーT細胞および免疫関連疾患の治療方法
【課題】 Foxp3+ナチュラルキラーT細胞、および、免疫関連疾患の治療方法を提供することを課題とする。
【解決手段】 一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を有する遊離細胞集団を提供し、さらに、Foxp3+ナチュラルキラーT細胞を生成する方法と、肝臓、および、肺を含む特定の臓器内での免疫反応を抑制するための方法とを提供する。
【解決手段】 一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を有する遊離細胞集団を提供し、さらに、Foxp3+ナチュラルキラーT細胞を生成する方法と、肝臓、および、肺を含む特定の臓器内での免疫反応を抑制するための方法とを提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、「Foxp3+Regulatory natural killer T cells and a method for their generation」という発明の名称で2008年11月13日出願の米国仮出願番号61/114,362の35U.S.C.§119(e)での有用性を請求するものである。
【0002】
本出願は、「New process and use of cells」という発明の名称で2009年9月25日出願のポルトガル仮出願番号104764の有用性を請求するものである。
【0003】
上記の各出願の全体の内容は、参照によって本出願に組み入れられる。
【背景技術】
【0004】
免疫システムを制御するNKT細胞の役割が近年大きな注目を浴びている。NKT細胞の機能は、細胞致死、とりわけサイトカイン放出に依存する。特に、NKT細胞は、Th1型反応、Th2型反応、Th17型反応のサイトカインの特徴を産生することが可能で、適応免疫に影響を及ぼす(1)(2)(3)(4)(5)(6)(7)。通常のT細胞に対する影響とは、NKT細胞によって抑制されるか増幅される免疫病態であると言える(8)(9)(10)(11)(12)(13)。適応免疫に対するこのNKT細胞の影響は、移植(14)、アレルギー(15)、自己免疫(16)(17)、他の炎症病態(18)(19)で報告されている。
【発明の概要】
【0005】
一態様において、本発明は、遊離されたFoxp3+ナチュラルキラーT細胞、およびFoxp3+ナチュラルキラーT細胞を有する細胞集団を提供する。一態様において、本発明は、TGF-βおよび少なくとも1つのNKT刺激剤を使用しFoxp3+ナチュラルキラーT細胞を生成する方法を更に提供する。Foxp3+ナチュラルキラーT細胞は、in vitroで産生され、被験in situも産生される。本文書では、Foxp3+ナチュラルキラーT細胞は、Treg細胞と同様の免疫抑制特性を有することが示されており、そのため、Foxp3+ナチュラルキラーT細胞は、様々な免疫不全や免疫状態を治療するために使用される。
【0006】
Foxp3+ナチュラルキラーT細胞は、全身に投与された場合、肝臓と肺に集まる。一態様において、本発明は、これによりFoxp3+ナチュラルキラーT細胞の全身投与によって肝臓と肺の中で、免疫不全と免疫状態を治療するための方法を提供する。このような免疫不全と免疫状態には、移植片対宿主病や、肝臓移植および膵島細胞移植に関わってかひきおこされた好ましくない副作用、およびぜんそくがある。Foxp3+ナチュラルキラーT細胞の肝臓と肺への分布により、これらの組織への治療用ポリペプチドと他の物質の投与も実現する。
【0007】
さらに本発明では、Foxp3+ナチュラルキラーT細胞は、特定の解剖学的な部位(例、組織)のin situで、TGF-βとNKT刺激剤の局所投与によって生成されうる。さらに、本発明では、特定の解剖学的な部位の中で十分な量を得られる場合には、TGF-βまたはNKT刺激剤の投与の必要はない。そのため、一態様において、本発明は、Foxp3+ナチュラルキラーT細胞の局所のin situでの生成により、ある特定の解剖学的な部位での免疫不全と免疫状態を治療するための方法を提供する。
【0008】
一態様において、本発明は、遊離Foxp3+ナチュラルキラーT細胞を提供する。
【0009】
一態様において、本発明は、(a)0.001%以上のFoxp3+ナチュラルキラーT細胞と、(b)10個以上のFoxp3+ナチュラルキラーT細胞を有する遊離細胞集団を提供する。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の割合は、少なくとも0.001%、少なくとも0.01%、少なくとも0.05%、少なくとも0.1%、少なくとも0.5%、少なくとも1%、少なくとも5%、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%である。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の数は、少なくとも1個、少なくとも10個、少なくとも50個、少なくとも100個、少なくとも500個、少なくとも1,000個、少なくとも5,000個、少なくとも10,000個、少なくとも50,000個、少なくとも100,000個、少なくとも1x106個、少なくとも1×107個、少なくとも1×108である。また、いくつかの実施例において、細胞集団は、血球集団、白血球集団、T細胞集団、またはナチュラルキラーT細胞集団である。また、いくつかの実施例において、細胞群はT細胞集団である。
【0010】
一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を生成する方法、すなわち、TGF-βとFoxp3+ナチュラルキラーT細胞を十分に生成するのに十分な量の1個以上のNKT刺激剤の組み合わせを伴うナチュラルキラーT細胞を有する細胞集団へ接触する方法を提供する。いくつかの実施例において、この方法は、IL-2を伴う細胞集団との接触をさらに有する方法である。また、いくつかの実施例において、IL-7、IL-15、IL-2のいずれか、またはこれらのいずれかの組み合わせを伴う細胞集団との接触をさらに有する方法である。さらに、いくつかの実施例において、抗IFNγ抗体、抗IL-4抗IL-4、抗IL-6抗体、抗IL12抗IL-4、抗IL-27抗体で構成されるグループから選択された中和抗体のいずれか、またはこれらのいずれかの組み合わせを伴う細胞群との接触をさらに有する方法である。さらに、いくつかの実施例において、細胞集団は、血球集団、白血球集団、T細胞集団、またはナチュラルキラーT細胞集団である。また、いくつかの実施例において、細胞集団は被験から採取される。
【0011】
一態様において、本発明は、Foxp3+ナチュラルキラーT細胞の数を増やす方法、すなわち、TGF-βと、NKT刺激剤、サイトカインを誘発する少なくとも1つの増殖や少なくとも1つのFoxp3+ナチュラルキラーT細胞の数の増加に十分な量の中和抗体の組み合わせを伴う少なくとも1つのFoxp3+ナチュラルキラーT細胞を有する細胞集団との接触を有する方法を提供する。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の数が、少なくとも2倍、少なくとも5倍、少なくとも10倍、少なくとも50倍、少なくとも100倍、少なくとも200倍、少なくとも500倍、少なくとも1,000倍、少なくとも10,000倍、少なくとも100,000倍、少なくとも106倍、少なくとも107倍増加する。また、いくつかの実施例において、サイトカインを誘発する増殖は、IL-2、IL-7、IL-15、およびIL-21のいずれか、またはこれらのいずれかの組み合わせである。また、いくつかの実施例において、中和抗体は、抗IFNγ抗体、抗IL-4抗体、抗IL-6抗IL-4、抗IL-12、および抗IL-27抗体のいずれか、またはこれらのいずれかの組み合わせである。
【0012】
一態様において、本発明は、ナチュラルキラーT細胞を被験の肝臓または粘膜組織へ送るための方法、すなわちFoxp3+ナチュラルキラーT細胞の被験への全身投与を有する方法を提供する。さらに一態様において、本発明は、ナチュラルキラーT細胞を被験の肝臓または粘膜組織へ送るための方法、すなわちFoxp3+ナチュラルキラーT細胞の被験への局所的な投与を有する方法を提供する。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は自己細胞である。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、Foxp3+ナチュラルキラーT細胞を生成するために十分な量の1個以上のNKT細胞刺激剤とTGF-βを伴うナチュラルキラーT細胞との接触により生成される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、肝臓または粘膜組織内での免疫反応を抑制する効果的な量が投与される。さらに、いくつかの実施例において、肝臓内における免疫反応の抑制は、移植片対宿主病、膵島移植により引き起こされるかそれに関わる好ましくない免疫反応、または肝臓移植もしくは肝臓への免疫介在性炎症により引き起こされるかそれに関わる好ましくない免疫反応を治療するために投与される。いくつかの実施例においてFoxp3+ナチュラルキラーT細胞は、膵島移植もしくは肝移植と関連して管理される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞のゲノムは、ポリペプチドをコード化する核酸を有し、肝臓におけるポリペプチドの発現を肝臓へのFoxp3+ナチュラルキラーT細胞の送り込みがどこでなされるかに起因する。
【0013】
一態様において、本発明は、被験の組織の中の免疫反応を抑制する方法、すなわち、その組織の中の免疫反応を十分に抑制する1個以上のNKT刺激剤の量の局所的な送り込みを有する方法を提供する。いくつかの実施例において、この方法は、その組織の中の免疫反応を十分に抑制するTGF-βの量の局所的な送り込みをさらに有する。さらにいくつかの実施例において、この免疫反応は、抗原に対する免疫反応である。さらにいくつかの実施例において、この組織とは消化管または肺である。さらにいくつかの実施例において、免疫反応の抑制とは、炎症性腸疾患、クローン病、またはぜんそくである。さらにいくつかの実施例において、組織への局所的な送り込みとは、粘膜組織への送り込みである。
【0014】
一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を有する細胞群を有する医薬組成物を提供する。いくつかの実施例において、細胞群は血球集団である。さらにいくつかの実施例において、細胞群は白血球集団である。さらにいくつかの実施例において、細胞群はT細胞集団である。さらにいくつかの実施例において、細胞集団はNKT細胞集団である。
【0015】
一態様において、本発明は、TGF-βおよび1個以上のNKT刺激剤を有する薬品構成を提供する。
【0016】
本発明の限界はそれぞれ本発明の様々な実施例のすべてに適用しうる。そのため、いずれか1つの要素、または要素の組み合わせを含む本発明の各限界は、本発明の各態様に含まれうる。本発明は、以下の記述で明記する図に記載した要素の構造と配列の詳細な適用に限定されない。本発明は、他の実施例の他、様々な方法で実践または実施されうる。さらに、本文書で使用される表現や用語は説明を目的としており、制限と認識されてはならない。本文書内で使用されている「含む」、「有する」、「持つ」、「内包する」、「関わる」等は、以後列記された項目に適用し、付随項目でも同様であることを意味する。
【図面の簡単な説明】
【0017】
図は図示を目的としており、本文書で公開した発明の使用可能性のために必要なものではない。
【図1】図1は、TGF-βが存在する所でiNKT細胞がFoxp3の発現を増加させる状態を示す図である。(a)C57Bl/6ノックインマウスまたはFoxp3gfpノックインマウスの脾臓からのiNKT細胞およびCD4+CD25−T細胞は、IL-2とIL-15が存在する環境下でTGF-βの添加ありとなしの条件でFACSソートされ3日間培養された。左のフ゜ロットは、iNKTの細胞ソートのために使用されるゲーティング手法、およびエンプティCD1dテトラマーを使い評価した背景対照染色を示す。培養後に分析に使用されたゲーティング手法は、iNKTセル(上のパネル)、およびTCRβ+群(下のパネル)の中のCD4 T細胞に示すことである。Foxp3の発現はiNKT(上の列)の中の細胞内染色とC57G1/6マウスから分離された対照CD4 T細胞培養(下の列)か、Foxp3gfpノックインマウスから分離された細胞内のGFP蛍光によって評価された。示されているドットプロットは、3つの個別の実験のトリプリケート培養の代表例である。(b)C57Bl/6ノックインマウス(上)またはFoxp3gfpノックインマウス(下)からの胸腺のiNKT細胞がソートされ、IL-2、IL-15、およびTGF-βが存在する環境下で培養され、図示するとおりFoxp3発現のために分析された。(c)iNKT細胞によるFoxp3の発現は、共焦点顕微鏡観察により1細胞レベルで確認された。Foxp3gfp細胞は、3日間培養された後FACSソートされ、その不変TCRは、PEでラベルされたCD1d/PBS57テトラマー(赤)で再染色され、核小体はDAPI(青)で対比染色された。Foxp3の発現は緑で蛍光発色した。(d)C57B1/6マウスのiNKT細胞とCD4+CD25−T細胞を脾臓から取り出し、IL-2が5ng/mlありTGF-βの濃度が異なる環境で3日間培養された。培地は同一物を2個用意し、その結果は3種類の個別の実験の代表例である。(e)脾臓のiNKT細胞とCD4+CD25−T細胞(図示せず)は、プレート結束の抗CD3の濃度が異なる環境で3日間培養された。示されているドットプロットは、3つの個別の実験のトリプリケート培養の代表例である。
【図2】図2は、サイトカインの条件が異なる環境下でのBalb/c iNKT細胞の培養を示す図である。iNKT細胞は、Balb/cマウスの脾臓から取り出し、CD1d/PBS57テトラマーとpan TCR-β MAbの両方の発現に従ってFACSソートされ、3μg/mLのプレート結束の抗CD3で3日間指定の条件で刺激された。結果は3種類の個別の実験の代表例である。
【図3】図3は、表現形とFoxp3+iNKT細胞のin vivo安定性を示す図である。ネス゛ミiNKT細胞とCD4+CD25−細胞は、FACSソートされ、TGF-βとIL-2が存在する環境下で3日間培養され、Foxp3と表示分子のために両方が染色された。(aとb)示された動向は、iNKT細胞またはCD4細胞の部位でゲートされた(図6の図に定めたとおり)。結果は、少なくとも2つの個別の実験の代表例である。(c)TGF-βとIL-2が存在する環境下での3日間培養された後のFACSソートされたiNKT細胞またはCD4細胞からのFoxp3とPLZFのためにコード化されたmRNAのRT-PCRである。各遺伝子の発現は、EF1Aの発現と比較して示されている。
【図4】図4は、Foxp3+iNKT細胞のin vivo安定性を示す図である。脾臓iNKT細胞とCD4+CD25− T細胞は、Foxp3gfpノックインマウスから取り出され、TGF-βとIL-2が存在する環境下で3日間培養された。Foxp3-GFP+細胞FACSでソートされ、5´104iNKT細胞(上のパネル)またはCD4+CD25− T細胞(下のパネル)がRAG2−/−受容宿主の静脈内に注入された。これらのマウスは21日後に処分され、iNKT細胞とCD4 T細胞の存在が、複数の組織で評価された。この図に、肝臓とリンパ節の塊の中でのiNKT細胞とCD4 T細胞のFoxp3とCD25の発現を示す。iNKT細胞は肝臓でのみで検出された。
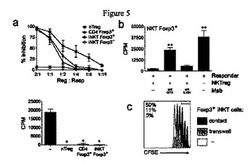
【図5】図5は、GITR介在接触依存機構によるT細胞の増殖を抑制するFoxp3+ iNKT細胞を示す図である。(a)Foxp3+iNKT細胞、Foxp3− iNKT細胞、またはiTreg細胞は、偏光条件下でFoxp3gfpノックインマウスからのiNKT細胞とCD4 T細胞のin vitro培養からソートされ、nTreg細胞は元のC57B1/6マウスから分離された。ソートされた細胞は、可溶性抗CD3 MAbが存在する環境下で96時間、マイトマイシンC処理脾細胞とFACSソートCD4+CD25−(キラー細胞)T細胞と共に、異なる割合において、トリプリケートで相互に培養された。増殖は、培養の最後の12時間での[3H]チミシ゛ン結合により高まった。上のパネルに、キラー細胞のみの増殖に標準化された3つの個別の実験(それぞれトリプリケートで)からの増殖抑制の平均値を示す(平均±SEM)。下のパネルに、2:1の比(調節細胞8000:キラー細胞4000)での代表的な実験でのデータを示す。増殖の抑制は統計的に有意(n=3,*P<0.05)だった。(b)抗IL10Rブロック抗体ではなく、抗GITRの添加は、増殖効果を無くした(n=4,**P<0.01)。(c)Foxp3+iNKT細胞は、(a)の場合のように刺激されたキラー細胞と共に1:1の割合にてTranswellで培養された。黒の柱状グラフは、キラー細胞がFoxp3+iNKT細胞と同じ培地で共に培養された時のキラー細胞の増殖を、ク゛レーの柱状グラフは、キラー細胞がFoxp3+iNKT細胞と別の培地で培養された時のキラー細胞の増殖を、波線の柱状グラフは、調節細胞が存在しない環境下でのキラー細胞の増殖を示す。ハ゜ーセントは、指定ゲート内の3条件でのキラー細胞の頻度を示す。
【図6】図6は、Foxp3+iNKT細胞のin vivo変換がTGF-βに依存しているることを示す図である。(a)肝臓から取り出したリンパ球、リンパ節の塊、パイエル板、未使用C57B1/6マウスの脾臓と胸腺の中でのFoxp3の発現の分析である。iNKT細胞は、リンパ球ゲートの中をPBS57とpan TCR-β抗体で満たされたCD1dテトラマーで共に染色することで見分けられた。iNTK細胞の背景染色は、エンプティCD1dテトラマーを使用した平行染色ですべての組織について評価された(肝臓の場合のみ図示)。(b)Foxp3発現は、細胞内抗体染色で分析した。Foxp3+細胞は、CD1d/PBS57−細胞の中にのみ存在した。Foxp3+細胞が、CD4+ Tリンパ球であることを確認した(右のドットプロットでLNの場合のみ図示)。結果は、2つの個別の実験での3匹のマウスの代表例である。(c)1週間にわたるα-GalCerの胃内投与を実施したC57BL/6マウスまたはdnTGFβRIIマウスのMLNからのiNKT細胞でのFoxp3の発現の分析。(d)Foxp3の発現、および慢性または急性のアレルギー性気道疾患のマウスの肺から遊離したiNKT細胞またはCD4 T細胞内のハウスキーピング遺伝子EF1Aの分析である。各動物の肺から1,000個から5,000個のiNKT細胞が、フローサイトメトリーによりソートされ、個別に帯状に示した。操作を受けていない未使用のマウス5匹からの肺のiNKT細胞とCD4 T細胞が少ないために一緒に集められた。実験は、C57Bl/6マウスとBALB/cマウスで個別に実施された。
【図7】図7は、未使用のBalb/cノックインマウスとFoxp3gfpノックインマウスからのiNKT細胞で、Foxp3発現がないことを示す図である。肝臓から取り出したリンパ球、リンパ節の塊、パイエル板、未使用Balb/cマウスとFoxp3gfp マウスの脾臓と胸腺の中でのFoxp3の発現の分析である。iNKT細胞は、リンパ球ゲートの中をPBS57とpan TCR-β抗体で満たされたCD1dテトラマーで共に染色することで見分けられた。
【図8】図8は、アレルギー性気道疾患のBalb/cマウスとC57Bl/6マウスの肺から採取したiNKT細胞の摘出物を示す図である。Balb/cマウスまたはC57Bl/6マウスの5匹のグループは、アレルギー性気道疾患の慢性または急性の状態を引き起こしたため、OVA-alum i.p.で反応性を高めた指定の日数塩水内の50μgのOVAで鼻内負荷を受けた。(a)慢性または急性のアレルギー性気道疾患を引き起こすための手順を図示した。(b)気管支肺胞洗浄(BAL)における好酸球増加と、肺の細胞内容である。(c)各実験グループの代表的な1匹のマウスの肺の中のiNKT細胞とCD4 T細胞の染色を示すFACSデータで、定量RT-PCR分析前で重複排除(図示せず)後のiNKT細胞(左列)とCD4 T細胞をソートするために使用するゲートを示した。(d)慢性(上のパネル)、急性(中のパネル)、未使用(下のパネル)のマウスからの肺組織の組織切片に、ヘマトキシリン/エオシンを使い染色した。
【図9】図9は、EAEから守られたマウスの頚部リンパ節内にFoxp3+iNKT細胞が蓄積した様子を示す図である。EAEは、CFAと百日咳毒素とMOGペプチドの両方の投与によりC57B1/6マウスで引き起こされた。マウスの一部は、各所で示すとおりα-GalCerを使い同時に治療された26。EAEは臨床記録され、中枢神経系に浸透し、頚部リンパ節(LN)のリンパ球数と脾臓が評価された。(a)左パネルに、頚部リンパ節内のiNKT集団、右パネルにiNKTゲート内のFoxp3発現を示す。(b)iNKT細胞(上のパネル)と、Foxp3+ iNKT細胞(下のパネル)の具体的な数が示され、それぞれの記号は、未使用、MOG介在、MOG+α-GalCer処理実験のグループからの1匹の個別のマウスに対応する。細い横棒は平均、太い横棒はグループ間の統計的優位性を示す(n=4または5,*P<0.05)。
【図10】図10は、Foxp3の発現がヒトiNKT細胞の中で引き起こりうることを示す図である。末梢血からのヒトiNKT細胞とCD4+細胞は、磁気的に強められ、TGF-β、抗IL4抗IL-4、抗IL12抗IL-4、抗IFN-γ抗体、抗CD28 MAbs抗IL-4を含む変換混合液が存在する環境と存在しない環境下で5日間相互に培養された。iNKT細胞は、リンパ球ゲート(上)の中のPBS57と抗TCR-Vβ11 MAbで満たされたヒトCD1dテトラマーの相互の染色によって見分けた。iNKT細胞の背景染色は、エンプティヒトCD1dテトラマーを使い平行染色で評価された(左上)。CD4 T細胞は、CD1d/PBS57ネガティブ区域の中でゲートされた(右上)。下のパネルは、Foxp3、およびiNKT(上の列)とCD4+ T細胞(下の列)の中のCD25、CD127、GITR、またはCD161の同時発現を示す。結果は、条件ごとに少なくとも3つの重複した培養で異なる血液ト゛ナーによる3つの個別の実験の代表例である。
【発明を実施するための形態】
【0018】
一態様において、本発明は遊離されたFoxp3+ナチュラルキラーT細胞とFoxp3+ナチュラルキラーT細胞を有する細胞集団を提供する。一態様において、本発明はTGF-βや少なくとも1つのNKT細胞刺激剤を用いながら、Foxp3+ナチュラルキラーT細胞を産生する方法を提供する。Foxp3+ナチュラルキラーT細胞はin vitroで産生され、被検者(被験?統一されていませんが)においてin situにおいて産生された。Foxp3+ナチュラルキラーT細胞は、Treg細胞に対し免疫抑制力に似た特性をもち、そしてFoxp3+ナチュラルキラーT細胞が様々な免疫疾患や免疫状態を処置するために用いることが可能であることが、この点で、証明された。
【0019】
Foxp3+ナチュラルキラーT細胞
【0020】
一態様において、本発明は遊離されたFoxp3+ナチュラルキラーT細胞とFoxp3+ナチュラルキラーT細胞を有する遊離された集団を提供する。
【0021】
ナチュラルキラーT細胞(以下NKT細胞)は、NK1.1 and NKG2D(19)を含むNK直系からのCD1d分子や受容体によって出現された糖脂質抗原を認識するαβ TCRを発現する胸腺由来のリンパ球である。ナチュラルキラーT細胞はType 1 NKT(invariant)、Type 2 NKT、 NKT様に分類される。最もよく研究されたNKT細胞のサブセットはinvariantなα鎖(マウスではVα14-Jα18,ヒトではVα24-Jα18)と制御されたTCR-β鎖レハ゜ートリー(マウスでは、Vβ8.2,Vβ7,Vβ2,ヒトではVβ11)を有するsemi-invariant TCRを有する。これらの細胞は、タイフ゜I、クラシカルまたはinvariant なNKT(iNKT)細胞として知られ、CD1d分子に関連するMHCクラスIの中にある糖脂質を認識することができる。認識に用いられる特有のTCRを有しながらも、iNKT細胞は、多くの分子表面をT細胞と共有する。すなわちマウスではCD3とCD4そしてヒトではCD8(19)(20)である。T細胞もNKT細胞もともに胸腺で成熟する。invariantなTCRをもとにしたNKT細胞の正の選択は、従来のTリンパ球(21)に関し胸腺上皮細胞にかわって細胞を発現しているCD1d+抗原として働くDP胸腺リンパ球によって伝えられる。NKT細胞は、細胞系マーカーPLZF(22)の発現によって分子レベルで特徴付けられるTリンパ球から分化した系と考えられている。
【0022】
in vivoで確認されているiNKT細胞サブセットは、Th1細胞(IFN-γを産生)、Th2細胞(IL-4とIL-13を産生)で、さらに最近においてはTh17細胞(IL-17を産生)に類似している機能的特徴を示すとされている(1)(2)(3)(4)(5)。興味深いことに、TCR刺激によるiNKT細胞サイトカイン産生は従来のTリンパ球(23)の機能的分化を左右しているのと同じ転写機能によって影響されているわけではないようである。
【0023】
一態様において、本発明は、Foxp3+を発現するために変化しているNKT細胞を提供している。FoxP3を発現しているNKT細胞は、ここではFoxp3+NKT細胞,Foxp3+ナチュラルキラーT細胞,Foxp3+TregNKT細胞、NKTreg細胞、ナチュラルキラーTreg細胞、TregNKT細胞、Foxp3+TregナチュラルキラーT細胞、Foxp3+TregulatoryナチュラルキラーT細胞として言及されている。いくつかの実施例において、本発明はFoxp3+細胞に分化しており、またここではiNKTregとして関係しているinvariantなNKT細胞(iNKT)を提供している。いくつかの実施例において、本発明は、NKT Foxp3+細胞へと分化しているnon-iNKT細胞(タイフ゜2 NKTまたはNKT様細胞)を提供している。Foxp3の発現は一般的にTreg細胞と関連付けられ、かつてはNKT細胞上では見つかっていなかった。Treg細胞は、有力な免疫抑制特性を持ちそして病的な自己反応(すなわち、自己免疫疾患)やそしてアレルギー、炎症性腸疾患、移植片対宿主病、移植拒絶反応などの免疫疾患などを防ぐと考えられている。興味深いことに、Foxp3+NKT細胞は、Foxp3+Tregリンパ球に似ている表現型を提示する。つまりCD25+、CTLA-4+、GITR+であり、そして機能的に、効果的にFoxp3+Treg細胞と比べ、T細胞増殖を抑制することができる。
【0024】
ここで示されているFoxp3+ナチュラルキラーT細胞は、NKT表現型(例えば、マーカー)とTreg表現型(例えば、Foxp3マーカー)の両者を有する。加えて、ここで示されているFoxp3+ナチュラルキラーT細胞は、Treg細胞(T細胞増殖を抑制する能力)と機能的同様を有する。しかしFoxp3+ナチュラルキラーT細胞は、Foxp3ナチュラルキラーT細胞、Treg細胞の両者、そしていずれの他の細胞タイフ゜からも見分けることが可能であることが分かるる。Foxp3+ナチュラルキラーT細胞は、NKT細胞とFoxP3マーカーに特有な少なくとも1つのマーカーとの認識によって少なくとも特徴付けられる。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、α--GalCerのような糖脂質にあるCD1dに結合する能力によって特徴付けられ、またFoxP3マーカーを持つ。さまざまなNKT細胞をCD1dとこの定量に用いられるさまざまなリガンドへの結合決定のための具体的な定量を下に示す。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、CD25+、CTLA-4+、GITR+、CD103+、IL7-Rα-、CD27-、CD62L-、NK1.1-、DX5-、NKGD2+そしてPLZF+のマーカー表現型のいずれかとの組み合わせがある。Foxp3+ナチュラルキラーT細胞は、CD4+もしくはCD4-のいずれかになりうる。これらのマーカーのすべてがFoxp3+NKT細胞として分類される細胞上で発現されなければならないわけではないことが分かる。
【0025】
iNKT細胞上でのFoxp3発現の誘導は、Foxp3+Treg細胞によっても発現される遺伝子パネルのアップレギュレーションと調整される。機能的にFoxp3+NKT細胞は、強力な調節の可能性を示している。しかT細胞特有の表現型選択はいくつかの独自の特徴を持つFoxp3+NKTreg細胞とともに絶対的ではなかった。例えば、Foxp3+iTregはCD62Lの発現のためのへテロ先天性であって、二次リンパ系器官へ高内皮差性細静脈(HEV)を通過して再循環するための能力を持つものもあることを示している。対照的にNKTreg細胞はCD62Lをもたず、それゆえ、その周辺での免疫学の状況において介在が制限されているようである。
【0026】
Foxp3+ナチュラルキラーT細胞は、機能的定量によって特徴付けられることを正しく理解されたい。Foxp3+NKT細胞は、NKT細胞としての同等の量と組成においてサイトカインを分泌する能力を失っている。Foxp3+ナチュラルキラーT細胞は、Treg細胞として同様の免疫抑制力の特性を有する。細胞免疫抑制力の特性は、例えば、活性化されたCD4+CD25−キラー細胞増殖の抑制のための細胞の能力によって測られる。Foxp3+NKT細胞の免疫抑制機能は、免疫抑制特性の抑止となるこの相互作用遮断としてのGITR-GITRL相互作用によって伝えられると考えられている。
本発明は、遊離されたFoxp3+ナチュラルキラーT細胞とFoxp3+ナチュラルキラーT細胞のみより構成される細胞の集団と、Foxp3+ナチュラルキラーT細胞を有する集団を含む。細胞もしくは細胞集団に付属しているときに「遊離」とは、被験以外(すなわち、ヒトもしくはヒト以外の動物)の細胞や細胞集団に関する。いくつかの実施例において、細胞は十分に他の細胞から分離され、もしくは、自己同一性が確認され、ここで述べられた方法に従って特徴が確かめられ活用された他の細胞に対し、細胞の数が増したものである。例えば、遊離された細胞や細胞集団は、被験から採取され、in vitroで増殖されたか、他の細胞より産生された。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞からなる細胞集団は、少なくとも0.001%、少なくとも0.01%、少なくとも0.05%、少なくとも0.1%、少なくとも0.5%、少なくとも1%、少なくとも5%、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%のFoxp3+ナチュラルキラーT細胞を有する。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞を有する細胞集団は、少なくとも1、少なくとも10、少なくとも50、少なくとも100、少なくとも500、少なくとも1,000、少なくとも5,000、少なくとも10,000、少なくとも50,000、少なくとも100,000、少なくとも1x106、少なくとも1x107、少なくとも1x108のFoxp3+ナチュラルキラーT細胞を有する。細胞集団(すなわち、FoxP3細胞以外)の細胞の残余は、他の性質を有することがある。したがって例えば、本発明は、Foxp3+ナチュラルキラーT細胞とFoxP3−ナチュラルキラーT細胞の集団と、Foxp3+ナチュラルキラーT細胞とT細胞(他のサフ゛クラス)の集団とを含む。いくつかの実施例において細胞集団は、Foxp3+ナチュラルキラーT細胞と血球(いずれのサフ゛クラス、例えば赤血球)の組み合わせである。いくつかの実施例において細胞集団は、Foxp3+ナチュラルキラーT細胞と血球以外の細胞の組み合わせである。いくつかの実施例において、細胞集団は、Foxp3+ナチュラルキラーT細胞、血球、血球以外の細胞の組み合わせである。本発明は、Foxp3+ナチュラルキラーT細胞や、いずれの起源(例えば、ヒトやマウスのような動物)もしくは、いずれの組織由来の(例えば、脾臓や胸腺など)のFoxp3+ナチュラルキラーT細胞からなる細胞集団を含む。
【0027】
Foxp3+ナチュラルキラーT細胞の生成
【0028】
一態様において、本発明は、Foxp3+ナチュラルキラーT細胞の生成方法を提供する。いくつかの実施例において、TGF-βとFoxp3+ナチュラルキラーT細胞を十分に生成するのに十分な量の1個以上のNKT刺激剤の組み合わせを伴うナチュラルキラーT細胞を有する細胞集団への接触を有する方法を有する。いくつかの実施例において、細胞集団はIL-2にも接触している。いくつかの実施例において、細胞集団はIL-7、IL-15およびまたはIL-21にも接触している。いくつかの実施例において、中和抗体である抗IFNγ抗体、抗IL-4抗体、抗IL-6抗体、抗IL12抗IL-4およびまたは抗IL-27抗体とも接触している。いくつかの実施例において、細胞群は血球集団、白血球集団、T細胞集団である。いくつかの実施例において、細胞集団は被験から採取される。
【0029】
ここに記載されたFoxp3+ナチュラルキラーT細胞の生成方法はFoxP3−ナチュラルキラーT細胞(すなわち、「正常な」ナチュラルキラーT細胞)によるものを示している。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の生成はin vitroで行われた。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の生成はin vivoで行われた。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の生成はin situである特定の解剖学的な部位(例、臓器)で行われた。Foxp3+細胞から生成されたNKT細胞はいかなる臓器にもなりうる。さらに、いくつかの実施例において、NKT細胞はマウス細胞である。さらに、いくつかの実施例において、NKT細胞はヒト細胞である。さらに、いくつかの実施例において、NKT細胞は肝臓、脾臓、胸腺から採取される。さらに、いくつかの実施例において、NKT細胞は血液から採取される。
【0030】
少なくともFoxp3+ナチュラルキラーT細胞の生成方法は1個以上のNKT刺激剤とTGF-Βの接触により有することを示す。
【0031】
本発明は、刺激されたNKT細胞内でFoxP3を発現させた、いかなるTGF-βの使用もしくはTGF-βアナロク゛の使用を含んでいる。そのため、Foxp3+ナチュラルキラーT細胞を生成するために使用されたとおり、TGF-βには、TGF-βの3つのイソ型(TGF-Β1、TGF-Β2、TGF-Β3)、タンパク質前駆体TGF-β、成熟TGF-βがある。ここで使用されるTGF-βとして、TGF-β変異体およびTGF-β(例、cytomodulin-10)と同様の機能を有するTGF-Β同類物も含まれる。
本発明は、TGF-Βを排出する細胞も含む。加えて、元々臓器にTGF-βが豊富に存在するため、任意でこれら臓器内にin vivoでFoxp3+ナチュラルキラーT細胞を生成するために追加のTGF-Β投与をすることはないことが分かる。腸管、両肺、骨髄、肝臓のように、癌細胞の付着した臓器をふくみ、内臓にはTGF-Βが元々豊富に存在する。TGF-βが豊富な環境を提供するために、1つの臓器内の全細胞がTGF-Βを十分有する必要はなく、豊富でなくともNKT細胞からFoxp3+陽性細胞への転換ができることが分かる。しかしTGF-Βが豊富な臓器内でFoxp3+ナチュラルキラーT細胞を産生するにはやはり1個以上のNKT刺激剤の投与が必要である。いくつかの実施例において、NKT細胞からFoxp3+ナチュラルキラーT細胞を生成する条件として、少なくとも1ng/mlのTGF-β、少なくとも2ng/mlのTGF-β、少なくとも3ng/mlのTGF-β、少なくとも4ng/mlのTGF-β、少なくとも5ng/mlのTGF-β、少なくとも10ng/mlのTGF-β、少なくとも100ng/mlのTGF-β、少なくとも1microg/mlのTGF-β1、少なくとも10microg/mlのTGF-βの細胞への接触を含む。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の産生はin vitroで行われTGF-β濃度は少なくとも10ng/mlである。TGF-β濃度はNKT細胞とNKT細胞の性質を有した細胞集団の組成に最低限しか左右されない。すべての実施例において、NKT細胞内のFoxP3発現に至ったTGF-β濃度は好ましいものである。当業者はFoxP3発現の測定ならびにTGF-β濃度の調整を要求があれば容易に行える。
【0032】
NKT細胞刺激剤は、当技術分野では公知であり、CD1d(α-GalCなど)や、抗CD3抗体などの受容体からの経路の下流で作用するいくつかの物質によって出現するいずれかの糖脂質を含む。NKT刺激剤には、抗CD3抗体と、フィトヘムアグルチニン(PHA)と、コンカナバリンA(ConA)と、ホルボール12-ミリスタート13-アセタート(PMA)と、イオノマイシン、およびリガンド(α-GalCer、PBS57、GSL-1、OCH、その他を含むCD1dリガンド)で満たされたテトラマーのなどのTCRアゴニストとを有する。CD1dによって出現されるすべての糖脂質はNKT刺激剤として機能する。さらに、NKT細胞を刺激する糖脂質の類似体がいくつか存在する。NKT刺激剤はまた、機能的定量においても認められる。例えば、NKT細胞は、細胞と仮想の刺激剤を出現する抗原を用いて培養され、そのNKT細胞がIL-2、IL-4およびIFN-γなどのサイトカインを排出するかを評価することで、そのNKT細胞の刺激に対する分析がなされる。Foxp3+NKT細胞のin vitroでの生成におけるNKT細胞の刺激は、例えば、そのNKT細胞に固定化した抗CD3抗体を接触、またはそのNKT細胞の生育培地にNKT刺激剤を添加することで実施される。加えて、これらのNKT刺激剤のいずれかによって満たされた抗原提供細胞は、そのNKT集団に混合できる。In vivoでのNKT細胞の刺激はα-GalCerのようなNKT刺激剤を被験に投与することで実施される。そのNKT細胞は複数のNKT刺激剤にも接触することが分かる。NKT刺激剤の濃度は、そのNKT刺激剤の本質、そのNKT細胞の本質およびそのNKT細胞を有する細胞集団の組成に最小限に依存する。すべての実施例において、NKT刺激剤の濃度は、そのNKT細胞を刺激して得られることが望ましい。当業者は、必要に応じて、NKT細胞が刺激されたかを直ちに判定し、NKT刺激剤の濃度を調整することができる。
【0033】
いくつかの実施例において、TGF-Βと1個以上のNKT刺激剤に加え、そのNKT細胞はIL-2にも接触される。IL-2は、本文書で使用するとき、IL-2およびIL-2と同様の生物学的機能を持つ変異体のことを指す。IL-2に接触するとは、本文書で使用するとき、特定のIL-2の種や特定のIL-2の変異体に限定されるものではない。したがって、非ヒトIL-2が交差反応性であるならば、ヒトNKT細胞はその非ヒトIL-2に接触できる。さらに、IL-2の機能的変異体(e.g.R38AやF42Kのようなアミノ酸突然変異を含む)の説明とは、これらの変異体と、IL-2の機能的断片とこれらのIL-2の変異体もまた、この発明に含まれる。いくつかの実施例において、その細胞は少なくとも濃度5ng/mlのIL-2に曝される。さらに、いくつかの実施例において、TGF-Βに加えて、1個以上のNKT刺激剤と、任意のIL-2と、1個以上のサイトカインまたはサイトカイン中和抗体が、そのNKT細胞に加えられる。さらに、いくつかの実施例において、そのNKT細胞は、IL-7、IL-15もしくはIL-21またはそれらの機能的変異体および類似体に接触される。いくつかの実施例において、そのNKT細胞は、抗IFNγ抗体、抗IL-4抗体、抗IL-6抗体、抗IL-12抗体、抗IL-27抗体と接触される。サイトカインとサイトカイン中和抗体の濃度と組み合わせは、そのNKT細胞の本質(e.g.ネス゛ミかヒトか)、そのNKT細胞の起源(e.g.胸腺由来か血液由来か)、そのNKT細胞を有する細胞集団の組成、または使用されるサイトカインもしくは中和抗体の本質によって変化することが分かる。例えば、サイトカインと中和抗体の組み合わせと濃度は、主にNKT細胞を有する集団と、主に非NKT血球とわずかな量のみのNKT細胞を有する細胞集団とでは異なることがある。当業者は、本文書に示された方法に従って、サイトカインとサイトカイン中和抗体の組み合わせと濃度を調整して、望ましい程度のFoxp3+NKT細胞を入手できる。いくつかの実施例において、そのNKT細胞はヒト細胞で、そのヒトNKT細胞は少なくとも10ng/mlのTGF-Β、少なくとも5microg/mlの抗IL-12抗体、少なくとも5microg/mlの抗IL-4抗体、少なくとも5microg/mlの抗IFN-γ抗体、少なくとも2microg/mlの抗CD28および20U/mlのIL-2に曝される。
【0034】
Foxp3+NKT細胞は、少なくとも1個のNKT細胞を有するいずれの細胞集団からも生成される。例えば、Foxp3+NKT細胞は、NKT細胞の0.001%から1%を構成する末梢血から生成される。いくつかの実施例において、末梢血は被験から採取される。さらに、いくつかの実施例において、末梢血はNKT刺激剤とTGF-Βに接触しFoxp3+NKT細胞を生成する。血球のわずかな割合のみがNKT細胞であっても、そのNKT刺激剤へ曝すことによるNKT細胞の選択的刺激によって、血球集団中のNKT細胞の数が増加し、したがって産生したFoxp3+NKT細胞集団の数も増加する。いくつかの実施例において、その血球集団は、その細胞をTGF-ΒやNKT刺激剤に曝す前に、精製または洗浄される。精製のそれぞれの段階において、NKT細胞を持たない細胞集団が取り除かれ、したがって残余中のNKT細胞の割合は増加する。例えば、可溶性物質を取り除くために、血液を遠心分離することで、その細胞が洗浄されることがある。同様に、白血球(NKT細胞を有するもの)のみを単離するために血液が精製されることがあり、引き続きその白血球集団中のNKT細胞をFoxp3+NKT細胞に変化させるために、その白血球はTGF-ΒとNKT刺激剤に曝されることがある。同じように、T細胞とそのNKT細胞を有するT細胞集団のみを単離するために、血液はさらに精製されることがある。T細胞は、その後TGF-ΒやNKT刺激剤に接触されることがある。いくつかの実施例において、NKT細胞はその血球集団より精製され、(基本的に)NKT細胞集団のみがTGF-ΒとNKT刺激剤に曝される。NKT細胞とNKT細胞を有する細胞集団(T細胞など)は、非血液源から採取されることがある。いくつかの実施例において、NKT細胞は脾臓または胸腺または他の臓器から採取される。いくつかの実施例において、細胞集団(e.g.T細胞)はそれらの臓器から採取され、その後TGF-ΒとNKT刺激剤に曝される。必要があれば、TGF-ΒとNKT刺激剤に曝露する前に、そのNKT細胞を臓器から採取した細胞集団から精製することができる。
【0035】
Foxp3+NKT細胞の精製と生成の段階は入れ替えられることが分かるる。したがって、血球集団はTGF-ΒとNKT刺激剤に接触され、そのFoxp3+NKT細胞またはすべてのNKT細胞(Foxp3+NKT細胞とFoxP3-NKT細胞)は、その後残りの血球より精製される。
【0036】
本発明は、このFoxp3+NKT細胞の生成の方法の特定の生成率に限定されるものではない。いくつかの実施例において、そのNKT細胞の、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%がFoxp3+NKT細胞に変化する。いくつかの実施例において、少なくともそのNKT細胞の40%がFoxp3+NKT細胞に変化する。これらのFoxp3+NKT細胞の生成率は、少なくともそのNKT細胞の本質(e.g.ヒト対ネス゛ミ、臓器由来対血液由来)とそのNKT細胞を有する細胞集団に依存することが理解される。また、Foxp3+NKT細胞の最終の割合は、細胞集団中のNKT細胞の初期の割合に依存することも理解される。したがって、血球集団は、NKT細胞の0.001%から1%の間であるならば、少数のNKT細胞のみを有することがあり、そのためNKT刺激剤とTGF-Βへの接触が終了した後には、少数のFoxp3+NKT細胞のみを有することがある。しかし、そのNKT細胞のみが刺激され、したがってそのNKT細胞は細胞集団中に存在するいかなる他の細胞よりも速い速度で成長するため、そのNKT細胞の割合は最初の0.001%から1%よりも高くなる。
【0037】
一態様において、本発明は、1個以上のFoxp+3ナチュラルキラーT細胞を有する集団から始め、Foxp3+ナチュラルキラーT細胞の数を増やす方法を提供する。いくつかの実施例において、この方法は、TGF-Βと、1個以上のNKT刺激剤と、サイトカインを誘発する1個以上の増殖と、1個以上のFoxp3+ナチュラルキラーT細胞の数の増加に十分な量の中和抗体の組み合わせを伴う少なくとも1個のFoxp+3ナチュラルキラーT細胞を有する細胞集団との接触を有する。この手順は、Foxp3+ナチュラルキラーT細胞のみの集団、またはFoxp3+ナチュラルキラーT細胞と他の細胞の両者を有する集団の、双方において実践されることが理解される。細胞集団がnon-Foxp3+NKT細胞を有する場合、いくつかのNKT細胞がFoxp3+ナチュラルキラーT細胞中に変化し、後に増加する場合がある。したがって、Foxp3+ナチュラルキラーT細胞とnon-Foxp3+ナチュラルキラーT細胞を含む細胞組成を刺激することは、事実上増殖を通したFoxp3+ナチュラルキラーT細胞の数の増加と、変化の組み合わせである。いくつかの実施例において、サイトカインを誘発する増殖はIL-2、IL-7、IL-15、またはIL-21である。いくつかの実施例において、中和抗体は抗IFN-γ抗体、抗IL-4抗体、抗IL-6抗体、抗IL-12抗体、または抗IL-27抗体である。サイトカインを誘発する増殖と中和抗体の望ましい最適な組み合わせと濃度は、そのFoxp3+ナチュラルキラーT細胞の本質、そのFoxp3+ナチュラルキラーT細胞の割合、そしてその細胞集団中のnon-Foxp3ナチュラルキラーT細胞の本質に依存することが理解される。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の数は、少なくとも2倍、少なくとも5倍、少なくとも10倍、少なくとも50倍、少なくとも100倍、少なくとも200倍、少なくとも500倍、少なくとも1,000倍、少なくとも10,000倍、少なくとも100,000倍、少なくとも106倍、少なくとも107倍増加する。
【0038】
本発明が、NKT細胞の数を増やす方法と、Foxp3+ナチュラルキラーT細胞の数を増やす方法と、NKT細胞をFoxp3+ナチュラルキラーT細胞に変換する方法の組み合わせとを、含むことが分かる。したがって、例えば、Foxp3+ナチュラルキラーT細胞の集団は、NKT細胞の集団を増加し、その後NKT細胞をFoxp3+ナチュラルキラーT細胞に変換し、そのFoxp3+ナチュラルキラーT細胞を増加することで産生される。
【0039】
Foxp3+NKT細胞の免疫反応抑制
【0040】
Foxp3+NKT細胞は、Treg細胞と同様に免疫反応抑制の性質を有する。Treg細胞とは、Foxp3+であるが、移植拒絶、移植片対宿主病(GVHD)、アレルギー性疾患、自己免疫、他の炎症病状に効果的であることが示されている(24)。事実、これらの報告は、現在実施されているFoxp3+Treg細胞の臨床試験のための実例で活用されている(25)。Foxp3+NKTreg細胞とFoxp3+Treg細胞の機能的な特徴を考慮すると、これらは臨床への応用において同じ可能性を有することが理解される。さらに、NKTreg細胞はinvariant TCRを有するため、NKTreg細胞はTreg細胞よりも効果的である。invariant TCRを有する細胞は、不変TCRを有さない細胞(Treg細胞)よりも分離されやすく刺激されやすい。
【0041】
NKTreg細胞の不変の特異性の重要性とは、抗原非特異性免疫調節である。よって、Foxp3+NKTreg細胞は、抗体特有活動に反して、一般的な免疫抑制活動を引き起こしがちで、Treg細胞が適用される治療目的に利用できる。多クローン性Treg細胞の集団は、少なくとも部分的に、同じ非特有免疫抑制効果を持つが、これは、おそらく自己抗原を伴う相互反応による(26)。リンパ球減少による増殖と移植片対宿主病GVHDからの保護において、Treg抑制の基盤として作用するのが、この非特有効果である(27,28)。GVHDとは、Tregに起因する干渉を想定する臨床条件の1つで、Treg臨床試験は、この条件で実施されてきた(29-32)。組織移植は、移植片の拒絶を防止するために明瞭な非特有Tregに基づく調節からの恩恵を受ける。非特有抑制の幾分かの程度を提供することで、自然抗原特有調節機構は、許容限界に向かい免疫反応をリセットする機会を得るころだろう。
【0042】
Foxp3+NKT細胞を肝臓と肺に送る方法
【0043】
一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を肝臓に送る方法と、肝臓の中の免疫反応を抑制するための方法を提供する。また、一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を肺に送る方法と、肺の中の免疫反応を抑制するための方法を提供する。Foxp3+ナチュラルキラーT細胞を肝臓に送る方法と、肝臓の中の免疫反応を抑制するための方法を提供する。さらに、一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を粘膜組織に送る方法と、粘膜組織の中の免疫反応を抑制するための方法を提供する。前述の実施例において、この方法は、Foxp3+ナチュラルキラーT細胞を被験への全身投与を含む。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は自己細胞である。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、Foxp3+ナチュラルキラーT細胞を生成するために十分な量のNKT細胞刺激剤とTGF-Βを伴うナチュラルキラーT細胞との接触により生成される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、肝臓内での免疫反応を抑制する効果的な量が投与される。さらに、いくつかの実施例において、細胞刺激剤またはTGF-βは、粘膜(例、腸や肺)内の免疫反応を抑制するために十分な量のFoxp3+ナチュラルキラーT細胞を生じるために効果的な量が投与される。さらに、いくつかの実施例において、肝臓内における免疫反応の抑制は、移植片対宿主病、膵島移植により引き起こされるかそれに関わる好ましくない免疫反応、または肝臓移植もしくは肝臓への免疫介在性炎症により引き起こされるかそれに関わる好ましくない免疫反応の治療である。さらに、いくつかの実施例において、肝臓の免疫介在炎症は、自己免疫性肝炎、原発性胆汁性肝硬変、または脂肪性肝炎である。いくつかの実施例においてFoxp3+ナチュラルキラーT細胞は、膵島移植もしくは肝移植と関連して投与される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞のゲノムは、ポリペプチドをコード化する核酸を有し、ここで、肝臓へのFoxp3+ナチュラルキラーT細胞の送り込みが肝臓におけるポリペプチドを発現させる。
【0044】
予期しなかった発見として、Foxp3+NKTreg細胞を静脈から被験に送ると、Foxp3+の発現は、リンパ節ではなく、肝臓に蓄積されるiNKT細胞によって安定して維持されることがわかった。Foxp3+NKTreg細胞の一部はさらに、肺の粘膜内で見つかり、投与後は最初に脾臓で見つかった。そのため、1つの実施例において、本発明は、Foxp3+ナチュラルキラーT細胞の全身への投与を含むFoxp3+ナチュラルキラーT細胞を肝臓、肺、または脾臓に送るための方法を提供する。しかし、これは、Foxp3+ナチュラルキラーT細胞が肝臓、肺、脾臓への局所的な投与が可能であることが分かる。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞を肝臓に送る方法には、Foxp3+ナチュラルキラーT細胞を産生するために十分な量の1つ以上のNKT細胞刺激剤とTGF-βを伴うナチュラルキラーT細胞を有する細胞の集団との接触を含む。Foxp3+ナチュラルキラーT細胞は、その結果全身に投与される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞を有する医薬組成物が投与される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、自己細胞である。そのため、いくつかの実施例において、この方法には、被験から血液の採取、血液細胞の集団とFoxp3+ナチュラルキラーT細胞を産生するために十分な量の1つ以上のNKT細胞刺激剤とTGF-βとの接触、Foxp3+ナチュラルキラーT細胞を有する血液細胞の集団の最終的な被験への投与を含む。細胞集団は、1つ以上のNKT細胞刺激剤とTGF-βに接触する前に純化され濃縮されてNKT細胞の数が増加することが理解されている。さらに、この細胞集団は、Foxp3+ナチュラルキラーT細胞が産生した後も純化されて、Foxp3+ナチュラルキラーT細胞の割合を増加させることができる。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は投与の前に増殖する。
【0045】
Foxp3+ナチュラルキラーT細胞が肝臓と肺に集まることができるため、肝臓と肺の中のFoxp3+ナチュラルキラーT細胞の先天的な特性(すなわち、免疫抑制機能)を利用して治療方法を実践することができる。Foxp3+ナチュラルキラーT細胞は、例えば静脈への投与により、肺と肝臓の両方または一方への免疫反応を抑制することが求められる場合、全身に投与される。さらに、Foxp3+ナチュラルキラーT細胞が肝臓や肺に集まることができるため、この細胞の中で産生するか含まれる組み換えポリペプチドと他の物質の両方または一方を肺と肝臓に送る他の細胞の集合特性を使用できる。そのため、NKTreg細胞は、免疫介在疾患に対する細胞治療を提供するが、それは、肝臓の自己免疫や肝臓移植に限らず、免疫原細胞または分子の蓄積のための免疫優遇部位としての肝臓の利用(すなわち、膵島移植または遺伝子治療)である。さらに、肝臓特有の活動は、全身の免疫の抑制に関わる目標以外の効果を低下させる。iNKT細胞の肝臓特有の蓄積は、肝臓炎症、例えば、移植、自己免疫疾患、ウイルス性炎症性変化、脂肪性肝炎、および肝臓被毒に関わる炎症の処置として治療のために使用される。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、肝臓内での免疫反応を効果的に抑制できる量を投与されるが、ここで、肝臓内での免疫反応の抑制は、移植片対宿主病や、膵島細胞移植に関わるかこれによってひきおこされた好ましくない免疫反応、肝臓移植または肝臓の免疫介在炎症に関わるかこれによってひきおこされた好ましくない免疫反応である。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、膵島細胞移植または肝臓移植に伴い投与される。
【0046】
いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の集合特性が変わることが分かる。投与するFoxp3+ナチュラルキラーT細胞は、特定の組織にこの細胞が集合しやすくなるように、腎臓マーカーや腸マーカーといった細胞組織マーカー(例、細胞表面タンパク質)を有する。Foxp3+ナチュラルキラーT細胞がマーカーを含むように修正する技術と方法で既知の組織マーカー(例、セルのゲノムにマーカーをコード化する核酸を導入)も同様に知られている。そのため、1つの実施例において、本発明は、細胞表面タンパク質を有するFoxp3+ナチュラルキラーT細胞を提供する。いくつかの実施例において、細胞表面タンパク質を含むFoxp3+ナチュラルキラーT細胞は、細胞表面タンパク質をコード化する核酸をFoxp3+ナチュラルキラーT細胞のゲノムの中に導入することで産生できる。
【0047】
肝臓と肺への物質とポリペプチドの送り出し
【0048】
免疫反応抑制特性を有するFoxp3+ナチュラルキラーT細胞を送ることで、計画的な免疫抑制を伴わない免疫優遇部位(肝臓または肺)が形成される。この発見は、例えば静脈を通した直接投与で、免疫原性の治療薬を肝臓に安全に送るために、他の免疫原性の治療薬との組み合わせにおいて実践されうる。例としていくつかあげられる治療として、糖尿病の治療のための膵島移植(静脈から定期的に投与)や細胞が可溶物を作り出す他の細胞の移植治療(凝固障害の凝固因子、リソソーム蓄積症の治療のための酵素交換治療)である。
【0049】
一態様において、本発明は、物質(例、治療薬、ポリペプチド、診断薬)を肝臓または肺に送る方法を提供する。1つの実施例において、この方法は、肝臓または肺に物質を送ることができるように、Foxp3+ナチュラルキラーT細胞を変化させる方法を含む。変化は、例えば、Foxp3+ナチュラルキラーT細胞の細胞表面タンパク質または細胞表面糖にその物質を付着させることで実現する。それに加えて、Foxp3+ナチュラルキラーT細胞のゲノムは、Foxp3+ナチュラルキラーT細胞が肝臓または肺に移った時に、発現していくポリペプチドをコード化する核酸を含むように変化することができる。そのため、1つの実施例において、本発明は、Foxp3+ナチュラルキラーT細胞のゲノムがポリペプチドをコード化する核酸を含むように変化することと、変化したゲノムを有するFoxp3+ナチュラルキラーT細胞を投与することを含む肝臓または肺にペプチドを送る方法を提供するが、ここで、Foxp3+ナチュラルキラーT細胞の投与は、Foxp3+ナチュラルキラーT細胞を肝臓または肺に結果的に送り、さらに、肝臓または肺の中でポリペプチドを結果的に発現させる。
【0050】
いくつかの実施例において、肝臓に送られたポリペプチドは、代謝酵素である。そのため、1つの実施例において、本発明は、肝臓に機能的代謝酵素を送ることでリソソーム蓄積症を治療してリソソーム蓄積症の被験者に欠損する代謝酵素を補完できるようにする方法を提供する。1つの実施例において、肝臓に送られたポリペプチドは、血液恒常性(例、凝固因子)においてある機能を有するポリペプチドである。そのため、1つの実施例において、本発明は、血液恒常性においてある機能を有する機能性ポリペプチドを肝臓に送ることで、血液疾患を治療するための方法を提供する。
【0051】
いくつかの実施例において、肺に送られるポリペプチドは酵素である。そのため、1つの実施例において、本発明は、治療用ポリペプチドの投与により治療できる肺疾患に対する方法を提供する。例えば、酵素ドルナーゼアルファを嚢胞性線維症の治療のため送ってよい。
【0052】
いくつかの実施例において、ポリペプチドといった物質を自己細胞と共に肝臓または肺に送る。自己細胞は「自身」として体の中で認識され、好ましくない免疫効果を防止する。1つの実施例において、血液細胞は被験から採取し、状況に応じて、純化してNKT細胞の数が増加する。その後、NKT細胞は変えられ、細胞に物質を付着させるか、求めるペプチドを細胞のゲノムにコード化する核酸を含むようになる。NKT細胞の変更の後、この細胞とTGF-ΒとNKT刺激剤と接触し、この細胞がFoxp3+ナチュラルキラーT細胞に変わる。付着物質またはポリペプチドをコード化する核酸を有する変化したFoxp3+ナチュラルキラーT細胞は、その後、被験に投与されて変化した細胞が肝臓または肺に送られる。これらの過程の順序の変更はありえることが分かる。例えば、NKT細胞は、最初Foxp3+ナチュラルキラーT細胞に変わり、その後核酸または物質を含むように変わる。
【0053】
臓器特有の免疫反応
【0054】
一態様において、本発明は、臓器など特定の解剖学的な部位におけるFoxp3+ナチュラルキラーT細胞のin situ生成の方法、およびそれらの部位における免疫反応の抑制方法を提供する。一態様において、本発明は、被験の臓器の中の免疫反応を抑制する方法、すなわち、その臓器の中の免疫反応を十分に抑制する1個以上のNKT刺激剤の量の局所的な送り込みを有する方法を提供する。この方法は、その臓器の中の免疫反応を十分に抑制するTGF-Βの量の局所的な送り込みをさらに有する。さらに、いくつかの実施例において、この免疫反応は、抗原に対する免疫反応である。さらにいくつかの実施例において、この免疫反応は、自己免疫反応である。さらにいくつかの実施例において、この臓器とは消化管である。さらに、いくつかの実施例において、免疫反応の抑制とは、炎症性腸疾患である。さらに、いくつかの実施例において、臓器への局所的な送り込みとは、粘膜組織への送り込みである。さらに、いくつかの実施例において、臓器への局所的な送り込みとは、肺の粘膜組織への送り込みである。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、被験者の体内がそれらの生成に十分な量のTGF-βを内包していれば、1個以上のNKT刺激剤の投与により、体内で生成される。
【0055】
さらにいくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、被験者の体内がそれらの生成に十分な量のNKT細胞を内包していれば、TGF-βの投与により、体内で生成される。
【0056】
一態様において、本発明はその臓器の中の免疫反応を十分に抑制する1個以上のNKT刺激剤の局所的な送り込みにより被験の臓器におけるFoxp3+ナチュラルキラーT細胞のin situ生成の方法を提供する。特定の臓器への部分的な局所的送り込み方法は人工的な方法では既知であり、下記でより詳細に説明する。例えば、消化管のNKTreg細胞を誘発することはTGF-βの豊富な状態でNKT細胞作用薬α-Galactosylceramide(α-GalCer)を胃内投与することにより可能であることが示されている。TGF-βの豊富な臓器の例としては、他に肺、肝臓、骨髄、そしてある種のがん細胞である。これらの臓器のすべての細胞がTNF-βに富んでいるわけではないことが分かる。すべての臓器がTGF-βに豊富というわけではなく、TGF-βが豊富でない臓器におけるFoxp3+ナチュラルキラーT細胞のin situ生成は、TGF-βと1個以上のNKT刺激剤の両方を局所的に投与することにより可能である。TGF-βとNKT刺激剤を組み合わせた送り込みは、TGF-βに富んだ臓器に対してももちろん可能である。元々十分な量のNKT刺激剤が備わっている臓器では、TGF-βのみ投与してFoxp3+ナチュラルキラーT細胞のin situ生成を行う。
【0057】
臓器など、特定の解剖学的な部位におけるNKT細胞からのFoxp3+ナチュラルキラーT細胞in situ生成は、他の臓器における免疫反応を抑制することなく、その臓器における免疫抑制効果を誘発することが見込める。したがって此処に説明する方法は、消化管障害(例、クローン病、炎症性腸疾患、潰瘍性大腸炎)や肝臓障害(例、自己免疫性肝炎,初期の胆汁性肝硬変、非アルコール性およびアルコール性の脂肪性肝炎(NASHおよびASH)、肝硬変、C型肝炎およびB型肝炎ウイルス(HCVおよびHBV))、肺障害(例、ぜんそく)に関連する免疫治療や、中枢神経系の炎症や関節炎にも利用可能である。免疫抑制性Foxp3+ナチュラルキラーT細胞の局所生成は、移植手術が行われるあらゆる臓器や区域において、免疫反応を抑制する能力を見込むことができる。
【0058】
Foxp3+ナチュラルキラーT細胞の検出
【0059】
Foxp3+ナチュラルキラーT細胞はCD1d分子により提供される糖脂質を化学結合する能力により特徴づけられ、マーカーFoxp3+を持つ。TypeI 1NKT細胞は、スルファチト゛を含有したCD1d四量体と細胞を化学結合することにより同定されえる(参照例、J Exp Med.2004 Apr 5;199(7):947-57)。TypeII NKT細胞は、不変NKT細胞とも呼ばれ、以下の化合物の1種類を伴う四量体を含有するCD1dと化学結合することにより同されえる。α‐ガラクトシルセラミド(α-GalCer)、リン酸緩衝生理食塩水-57、OCH、GSL-1、isoglobotrihexosylceramide(iGb3)、α-C-ガラクトシルセラミド、また、下記URL参照
(http://www.bdbiosciences.com/external_files/pm/doc/tds/dimerx/live/web_enabled/557764.pdf)。TypeINKT細胞は、それらの不変マーカーにより同定されることもある。
【0060】
CD1d分子は、非多形で、種間で保存され、所有している狭くて深い疎水性リガンド結合ポケットにより特徴づけられる非古典的要組織適合性遺伝子複合体分子である。こうした結合ポケットは、糖脂質とリン脂質をナチュラルキラーT(NKT)細胞に提供する能力がある。最良に特徴づけられたCD1dリガンドはα‐ガラクトシルセラミド(α-GalCer)で、元は海綿抽出物に由来する。CD1d分子によるα-GalCerの提供は、NKT細胞の認識とIFN-γならびにIL-4の急速な大量生産という結果を生じ、α-GalCerに治療効果を授ける。最近になって、リソソーム酸スフィンゴ脂質isoglobotrihexosylceramide(iGb3)はCD1dリガンドと同定された。この内因性スフィンゴ脂質は、NKT細胞の発達に関与すると考えられている。ProImmuneは便宜上、最初からα-GalCerが組み込まれている蛍光標識されたマウスのCD1d四量体と、最適なリガンドをユーサ゛ーにより含有するために空けてある蛍光標識されたマウスのCD1d四量体を提供する。四分割のCD1dの脂質複合体は(使用された脂質リガンドによる)特定の選択性があるNKT細胞のTCRsと化学結合し、これによりフローサイトメトリーによる抗原特異的CD1d限定のNKT細胞の同定と列挙が可能となる。細胞内サイトカインのためのさらなる相互染色(例、IFN-γ/IL-2)ならびに、もしくは表面マーカー(例、CD69)は、抗原特異的小集団のための機能データを生み出しえる。
【0061】
PBS-57は、ポール・サビジ博士と同僚が開発したα-ガラクトシルセラミドの類似体である。独立した3つの研究所は、PBS-57の活動はα-ガラクトシルセラミドと区別できないと示している。NIH Tetramer FacilityはCD1d分子とCD1d四量体に対しキレート化合物にされたPBS-57リガンドを提供する。
【0062】
OCHは、先端を切った側鎖を伴ったガラクトシルセラミドの類似体で、ナチュラルキラーT細胞内のTh-2バイアスのサイトカイン生産を促す。このリガンドは、動物モデルにおける実験的自己免疫性脳脊髄炎の開始を遅らせることを示した。精製されたOCHリガンドは、体外のNKT細胞の促進と体内動物研究のためにまた、得られる場合がある。
【0063】
最近の研究では、Sphingomonadaceaeバクテリアファイリーからの糖脂質は、CD1d分子にリガンドがあると、ナチュラルキラーT細胞を刺激することが判明した。GSL-1は構造的にPBS-57とα-ガラクトシルセラミドと同じである。純化したGSL-1リガンドは、in vitroでNK T細胞を刺激することで、またはin vivoでの動物実験にて得られる。GSL-1は、ツイーン/サッカロース/ヒスチジンの中和剤に溶解し、滅菌し、圧力瓶に入れられ凍結乾燥される。できたがった粉末は、最終濃度が0.2mg/mLになるように水で戻される。
【0064】
α-ガラクトシルセラミドの同類のα-C-ガラクトシルセラミドは、ナチュラルキラーT細胞を潜在的に刺激し、ある種の感染症と癌から動物を護ることが知られている。
【0065】
NKT細胞のシミュレーション
【0066】
本発明は、NKT細胞を変化させ、NKT細胞(Foxp3+NKT細胞を含む)の数を増加させる方法を提供する。NKT細胞を刺激する方法は、当業者の周知であり、以下の1つ以上のNKT刺激剤との接触を含む。抗CD3抗体(プレートバインドか他の表面、ビーズなど、細胞中に抗原があると溶解)、Phytohemaglutinin(PHA)、Concanavalin A(ConA)、Phorbol 12-ミリスチン塩酸13-アセテート(PMA)+イオミシン、CD1dが存在する特定のリガンドなど、上記と、CD1dヘ゛アリンク゛細胞に添加されたリガンド(またはCD1dコーティングビーズ)。これらには、NKT細胞をシミュレーションできる糖脂質と類似の物質が数多く存在する(アルファ-GalCerなど)。NKT刺激剤の組み合わせががこれらの細胞に接触できることは理解されている。
【0067】
免疫不全
【0068】
1つの実施例において、本発明は免疫抑制性特性により細胞を生成する方法を提供する。1つの実施例において、本発明はこれらの細胞を使用し、免疫不全を治療する方法を提供する。ここで用いられる免疫不全は、自己免疫反応およびアレルゲンへの免疫反応も含め、好ましくない免疫反応を持ついずれの病気または障害をも含む。ここで用いられる免疫不全は、臓器移植や異物実体(細胞やたんぱく質など代償療法で使用されるもの)の導入を含め移植手術に関連、または原因として生じた可能性のある、好ましくない免疫反応も含む。免疫不全は、全身エリテマトーデス(SLE)、シェーグレン症候群、慢性関節リューマチ、若年型糖尿病、ヴェゲナー肉芽腫症、炎症性腸疾患、多発性筋炎、皮膚筋炎、複数の内分泌の失敗、シュミット症候群、自己免疫ブドウ膜炎、アジソン病、副腎炎、グレーブス病、甲状腺炎、橋本病、自己免疫甲状腺の病気、悪性貧血、胃萎縮、慢性肝炎、類狼瘡肝炎、アテローム性動脈硬化症、初老期痴呆、脱髄性病気、多発性硬化症、やや鋭い皮膚紅斑性狼瘡、副甲状腺機能低下症、ドレスラー症候群、重症筋無力症、自己免疫血小板減少、原因不明の血小板減少紫斑病、溶血性貧血、尋常性天疱瘡、天疱瘡、ヘルペス状の皮膚炎、円形脱毛症、類天疱瘡、硬皮症、汎発性強皮症、CREST症候群(石灰沈着症、レイノー現象、食道運動障害、強指症と毛細管拡張症)、成人期発症糖尿病(Type II糖尿病)、男性および女性の自己免疫不妊性、強直性脊椎炎、潰瘍性大腸炎、クローン病、混合結合組織病、結節性動脈炎、全身性壊死性脈管炎、若年性慢性関節リューマチ、糸球体腎炎、アトピー性皮膚炎、アトピー性鼻炎、グッドパスチャー症候群、シャガス病、類肉腫症、リューマチ熱、喘息、再発性流産、抗リン脂質症候群、農夫肺、多形性紅斑、心臓切開後症候群、クッシング症候群、自己免疫慢性活動性肝炎、愛鳥家肺、アレルギー疾患、アレルギー性脳脊髄炎、中毒性表皮の表皮壊死症、脱毛症、アルポート症候群、肺胞炎、アレルギー性肺胞炎、線維化性肺胞炎、間質性肺疾患、結節性紅斑、膿皮症壊疽、輸血反応、ハンセン病、マラリア、リーシュマニア症、トリパノソーマ症、高安動脈炎、リウマチ性多発性筋痛、側頭動脈炎、住血吸虫症、巨細胞動脈炎、回虫症、アスペルギルス症も含むが、これらに限定されない、サンプター症候群、湿疹、リンパ腫肉芽腫症、ベーチェット病、カプラン症候群、川崎病、デング熱、脳脊髄炎、心内膜炎、心内膜心筋線維症、眼内炎、持久性隆起性紅斑、乾癬、胎児赤芽球症、好酸球性筋膜炎、シャルマン症候群、フェルティー症候群、フィラリア症、毛様体炎、慢性毛様体炎、異虹彩色性毛様体炎、フックス毛様体炎、IgAネフロパシー、ヘーノホ‐シェーンライン紫斑病、糸球体腎炎、移植片対宿主病、移植拒否、ヒト免疫不全ウイルス感染症、エコーウイルス感染症、心筋症、アルツハイマー病、パーボウイルス感染症、風疹ウイルス感染症、ポスト予防接種症候群、先天性風疹感染症、ホジキンおよび非ホジキン性リンパ腫、腎臓細胞癌、多発性骨髄腫、イートン‐ランバート症候群、再発性多発軟骨炎、悪性黒色腫、クリオグロブリン血症、ウォルデンシュトルム・マクログロブリン血症、エプスタイン‐バーウイルス感染症、耳下腺炎、エヴァン症候群、自己免疫性腺機能不全。
【0069】
ここで用いられる免疫不全は、特に、ぜんそくを含むと理解される。ここに用いられる「喘息」は、狭くなった気道と吸入した薬品に対する気道の反応の増加による炎症を特徴とする、一時的な呼吸器系障害を指す。ぜんそくはしばしば発症するもので、必ずしもアトヒ゜ー性またはアレルギー性の症状に付随するものではない。ぜんそくの症状は、呼吸困難、咳、喘鳴を含むものと広く認識されており、これら3つの症状すべて表れることが一般的だが、これらの症状が併発することがぜんそくの診断の必要条件ではない。
【0070】
一つの実施例において、喘息を治療する方法は、グルココルチコイド、ベータ・アドレナリン作用作動筋、メチルキサンチン、抗コリン作用薬、クロモリン、ネドクロミル、抗ヒスタミン剤、抗IgE抗体からなるグループから選択された抗ぜんそく剤の投与も含まれる。
【0071】
あらゆる実施例において、抗ぜんそく剤は以下のいずれかである。つまりベクロメタゾン二プロピオン酸塩(VANCERIL(登録商標),Schering)、フルニソリド(AEROBID(登録商標),Forest)、フルチカゾンプロピオン酸エステル(FLOVENT(登録商標),GlaxoSmithKline)、プレドニゾン、メチルプレドニゾロン、トリアムシノロン・アセトニド(AZMACORT(登録商標),Aventis)、硫酸アルブテロール(VENTOLIN(登録商標),GlaxoSmithKline;PROVENTIL(登録商標),Schering)、エピネフリン、塩酸イソプロテレノール、硫酸メタプロテレノール(ALUPENT(登録商標),Boehringer Ingelheim)、テルブタリン(BRETHINE(登録商標),LAMISIL(登録商標), Novartis)、臭化イプラトロピウム(ATROVENT(登録商標),Boehringer Ingelheim)、テオフィリン、クロモリン、ネドクロミル、抗IgE抗体(omalizumab;XOLAIR(登録商標);Genentech/Novartis)である。
【0072】
リソソーム貯蔵障害
【0073】
本発明がリソソーム貯蔵障害を治療する方法を提供する1つの実施例においてリソソーム貯蔵障害は、通常、脂質、グリコプロテイン(タンパク質を含んでいる砂糖)またはいわゆるムコ多糖の代謝のために必要な1つの酵素の欠乏の結果として、リソソーム機能障害に起因する。リソソーム貯蔵障害は、当分野では周知であり、活性化因子欠乏症/GM2ガングリオシド蓄積症、アルファ・マンノース症、アスパルチルグルコサミン尿症、コレステリルエステル蓄積症、慢性ヘキソサミニダーゼA欠乏症、シスチン症、ダノン病、ファブリー病、ファーバー病、フコシド症、遺伝性糖タンパク質蓄積症、ゴーシェ病、GM1ガングリオシド蓄積症、I細胞病/ムコ脂質症II型、乳児シアル酸蓄積症/ISSD、若年性ヘキソサミニダーゼA欠乏症、クラッベ病、異染性白質ジストロフィー、ムコ多糖症障害、偽性ハーラー・ポリジストロフィー/ムコ脂質症III A型、MPS-Iハーラー症候群、MPS-Iシャイエ症候群、MPS-Iハーラー-シャイエ症候群、MPS-IIハンター症候群、サンフィリポ症候群A型/MPS-IIIAサンフィリポ症候群B型/MPS-III B、サンフィリポ症候群C型/MPS-III C、サンフィリポ症候群D型/MPS-III D、モルキオA型/MPS IVA、モルキオB型/MPS IVB、MPS IXヒアルロニダーゼ欠乏症、MPS VIマトローラミー、MPS VIIスライ症候群、ムコ脂質症I/シアリドーシス、ムコ脂質症IIIC、ムコ脂質症IV型、多発性スルファターゼ欠損症、ニーマン・ピック病、神経セロイドリポフスチン症、CLN6病、バッテン・シュピールマイアー・フォークト病/若年性NCL/CLN3病、Finnish Variant Late Infantile CLN5、ジャンスキー・ビルショウスキー病/乳児後期CLN2/TPP1病、Kufs/Adult-onset NCL/NCL病、Northern Epilepsy/異型乳児後期CLN8、Santavuori-Haltia/乳児CLN1/PPT病、Beta-mannosidosis、ポンぺ病/グリコーゲン貯蔵障害II型、Pycnodysostosis、Sandhoff病/成人発病/GM2ガングリオシド蓄積症、Sandhoff病/GM2ガングリオシド蓄積症−乳児、Sandhoff病/G
M2ガングリオシド蓄積症−若年、シンドラー病、Salla病/シアル酸貯蔵障害、Tay-Sachs/GM2ガングリオシド蓄積症、そしてウォルマン病がある。
【0074】
血液疾患
【0075】
1つの実施例において、本発明は血液疾患を治療する方法を提供する。1つの実施例において、血液疾患とは、凝固のように、患者が血液恒常性維持のために必要な十分な量のポリペプチドを持たない遺伝子疾患である。血液疾患には、血友病、von Willebrand 病、Bernard-Soulier症候群、Wiskott-Aldrish症候群、そしてグランツマン血小板無力症があるが、これらに限定されるものではない。
【0076】
Foxp3+NKT細胞におけるポリペプチドの発現
【0077】
一態様において、本発明は、ポリペプチドを肝臓と肺へ送るための方法を提供する。いくつかの実施例において、Foxp3+NKT細胞に分化するFoxp3+NKT細胞のゲノムとNKT細胞のゲノムは、肝臓と肺に発現されるポリペプチドをコード化する核酸を含むよう変えられる。肝臓と肺に発現する核酸を含むようゲノムを変えるための方法は、当技術分野で周知である。
【0078】
Foxp3+細胞により発現されるポリペプチドをコード化する核酸は、活動可能に調節配列に接合されるだろう。コード配列と調節配列は、コード配列の発現と転写を調節配列の影響下と支配下におく方法で共有結合する場合、「活動可能に接合」されると言われる。コード配列が機能タンパク質に翻訳されることを目的として、コード配列は活動可能に調節配列に接合される。5’調整配列におけるプロモータ遺伝子の誘導がコード配列の転写という結果になる場合、ならびに、2種類のDNA配列間の結合の働きがフレーム-シフト突然変異の導入という結果にならない場合とコード配列の転写を導くプロモータ領域の能力を妨げる結果にならない場合と、タンパク質に翻訳される対応するRNA転写産物の能力を妨げる結果にならない場合に、2種類のDNA配列は活動可能に接合されると言われる。したがって、もしプロモータ遺伝子領域にそのDNA配列の転写を生じさせる機能があるならば、プロモータ遺伝子領域はコード配列に活動可能に接合されるだろう。そして結果として生じる転写産物は、目的とするタンパク質やポリペプチドに翻訳されうる。
【0079】
遺伝子発現に必要とされる調整配列の正確な働きは、種間と細胞間で異なる場合があるが、概して、必要に応じて、それぞれ転写と翻訳の開始に関連のある5’非転写配列と5’非翻訳配列を含み、それらはTATAボックス、キャッピング配列、CAAT配列などである。特に、そのような5’非転写調整配列は、活動可能に接合された遺伝子の転写調節のためのプロモータ遺伝子配列を含むプロモータ遺伝子領域を含むだろう。プロモータ遺伝子は恒常的に形成され、誘導性がある場合がある。調節配列はエンハンサー配列と上流活性化配列も要求どおりに含む場合がある。
【0080】
様々な転写調節配列と翻訳調節配列が、宿主の働き次第で、使用される可能性がある。転写調節配列シグナルと翻訳調節配列シグナルは高い発現レベルを持つ特定の遺伝子配列に関連した調節シグナルがあるアテ゛ノウイルス、ウシ乳頭種、シミアンウイルスなどのウイルス源から誘導されることがある。あるいは、アクチン、コラーゲン、ミオシンなどの哺乳類発現産物のプロモータ遺伝子が使用される場合がる。抑制と活性を可能にする転写開始調節シグナルが選択されうる。その結果、遺伝子配列の発現が調節されうる。温度を変化させることで発現が抑制・開始されうることを目的として温度に敏感で、そして化学的(代謝)調節の影響を受けやすい調節シグナルは興味深い。
【0081】
被験の核酸の発現は真核性調節領域の使用を必要とする。このような領域は、概して、RNA合成開始を導くのに十分なプロモータ遺伝子領域を含むだろう。真核性プロモータ遺伝子は、例えば、マウスメタロチオネインI遺伝子配列(Hamer et al.1982,J.Mol.Appl.Gen.1,273-288)、ヘルペスウイルスのTKプロモータ遺伝子)McKnight,1982 Cell 31,355-365)、ならびにSV40早期プロモータ遺伝子(Benoist et al.1981 Nature(London) 290,304-310)を含むだろう。
【0082】
核酸の発現のための調節要素は問題点(例えば肝臓ならびに肺)における核酸の発現に結びつく調節要素である可能性があるとを認識されることが予想される。したがって、いくつかの実施例において、核酸は肝臓と肺の環境において核酸を発現できるプロモータ遺伝子に活動可能に結合されている。このようなプロモータ遺伝子は、肺細胞において使用される肝細胞とプロモータ遺伝子のためのプロモータ遺伝子を含む。
【0083】
いくつかの実施例において、核酸はベクターに挿入される。本文書では、「ベクター」とは、異なる生成環境間の輸送と宿主細胞内の発現のために制限と連結反応により要求された配列が挿入されうる多数の核酸のうちのどれかでありうる。発現ベクターは、それが活動可能に調節配列に接合され、ならびに、RNA転写物として発現されうるように、要求されたDNA配列が制限と連結反応により挿入されうるベクターである。ベクターは、ベクターを用いて形質転換と核酸導入を施されそしてされなかった細胞の同定に適した1つ以上のマーカー配列を、さらに含む場合がある。マーカーは、例えば、抗生物質と他の化合物に対する抵抗力と感度を増減するタンパク質をコード化する遺伝子、その活動が当技術分野で周知の標準分析により検出可能な酵素(例えばβ-ガラクトシダーゼとアルカリホスファターゼ)をコード化する遺伝子、ならびに形質転換と核酸導入を施された細胞、宿主、コロニーそして血小板の表現型に明らかに影響を与える遺伝子を含む。
【0084】
いくつかの実施例において、要求される遺伝子配列を宿主細胞染色体に統合する能力があるベクターが使用される。導入されたDNAをその染色体に安定して統合した細胞は、発現ベクターを含む宿主細胞の選定を可能にする1つ以上のマーカーを導入することにもより、選定されうる。選択可能なマーカー遺伝子配列は、発現されるDNA遺伝子配列に直接結合されうる、そして相互トランスフェクションにより同じ細胞に導入されうる。追加要素は核酸メッセンジャーRNAの最適合成にとっても必要とされる場合がある。こうした要素は接合シグナル、転写プロモータ、エンハンサー、ならびに終結シグナルを含む場合がある。こうした要素を組み入れるデオキシリボ核酸発現ベクターは岡山により記載されたベクターも含む(1983,Molec.Cell.Biol.3,280)。
【0085】
好ましい真核性フ゜ラスミト゛は、例えば、ウシパピローウイルス、エプスタインバーウイルス、SV40、2-ミクロンサークルなどとそれらの派生物を含む。このようなフ゜ラスミドは当技術分野で周知である(1982,Botstein et al.,Miami Wntr.Symp.19,265-274;Broach,1981,in:The Molecular Biology of the Yeast Saccharomyces:Life Cycle and Inheritance,Cold Spring Harbor Laboratory,Cold Spring Harbor,NY,p.445-470;Broach,1982,Cell 28:203-204; Bollon et al.1980,J.Clin.Hematol.Oncol.10:39-48;Maniatis,1980,in:Cell Biology:A Comprehensive Treatise,Vol.3,Gene Sequence Expression,Academic Press,NY,pp.563-608)。他の好ましい真核性ベクターはウイルスベクターである。例えば、制約のためではなく、ポックスウイルス、ヘルペスウイルス、アデノウイルスならびにさまざまなレトロウイルスが使用される可能性がある。ウイルスベクターはインサートDNAとインサートRNAの発現を引き起こすDNAウイルスとRNAウイルスを含む場合がある。
【0086】
構成物を含むベクターとDNA配列が発現のために一度準備されたら、DNA構成物は、さまざまな適切な方法、すなわち、形質転換、トランスフェクション、接合、原形質融合、エレクトロポレーション、リン酸カルシウム沈殿、直接微量注入法などのうちのいずれかにより、Foxp3+NKT細胞のような適切な宿主細胞に導入される場合がある。ベクターの導入後、受容細胞は選択培地で培養され、これによりベクター含有細胞の成長を選択できる。クローン化した遺伝子配列の発現は核酸の産生という結果になる。これは、それ自体は形質転換細において、分化する細胞の誘導に追随するなかで生じうる(例えば、神経芽腫細胞などへのブロモデオキシウラシルの投与)。
【0087】
物質を細胞に付着させる方法
【0088】
一態様において、本発明は肝臓または肺に物質を送る方法を提供する。一実施例において、薬剤はFoxp3+NKT細胞またはFoxp3+NKT細胞に変換されるNKT細胞に付着させる。物質を付着させる方法は当技術分野において周知であり、当発明はいかなる特定の方法にも限定されない。例えば、物質は、細胞表面に自然に存在する糖やタンパク質などの分子と反応させることによって、細胞に共有結合的に付着させることができる。さらに物質は、細胞表面に存在する分子にその薬剤を非共有的に結合することによって、細胞に付着させることができる。例えば、その物質は表面タンパク質に対抗する抗体に連結することができ、その抗体薬剤は、その後表面タンパク質に結合することができる。物質はまた、受容体リガンドなどのリガンドに連結することができ、そのリガンド物質の組み合わせは、その後その細胞に付着させることができる。すべての実施例において、肝臓または肺の細胞を局在化させる前にその物質が細胞から放出されないように、その物質が細胞に結合させることが望ましい。
【0089】
細胞に付着させることができる物質には、毒素または薬品(すなわち、特に肝臓または肺疾患を治療するため)、肝臓または肺に送られるときに有用な効果を持つポリペプチド製剤(すなわち、リゾソーム蓄積症酵素などのポリペプチド)、そして診断用薬がある。
【0090】
被験
【0091】
一態様において、本発明は、被験の疾患の治療方法を提供する。「被験」とは、本文書で使用するとき、ヒトまたは他の脊椎哺乳動物である。しかし、マウス、ラット、イヌ、ネコ、ウマ、雌ウシ、ブタ、ヒツジ、ヤギ、またはヒト以外の霊長類に限定されない。
【0092】
治療上の有効量
【0093】
いくつかの実施例において、本出願に記載されるすべての化合物、物質および細胞(例、TGF-Β,NKT刺激剤、Foxp3+ナチュラルキラーT細胞、IL-2、サイトカイン、抗サイトカイン抗体)は、治療上効果的な量で使用される。「治療上効果的な量」あるいは「効果的な量」は同じ意味で用いられ、例えば、特定の器官において免疫反応を抑制するなどの望ましい治療上の効果が得られるための必要または十分な量を意味する。本出願で提供されている指導と併用し、さまざまな有効な化合物の中から選択することによって、有効性や生物学的利用能、被験の体重、副作用の程度、望ましい投与の方法などの因子を比較検討して、重大な毒性を引き起こすことなく、しかし特定の被験の治療に有効で、効果的な予防薬または治療計画を選択できる。
【0094】
いずれの特定の応用における効果的な量は、疾病または治療の状態、特定の化合物、本出願に記載され投与される物質および細胞、被験の大きさ、疾病または状態の程度などの因子によって異なる。当業者においては、本出願に記載される特定の化合物、薬剤と細胞、または1つ以上の他の治療薬の効果的な量を、必然的に伴う過度な実験なしに、経験的に決めることができる。一般的には最大投与量が使用されることが望ましく、というのは、最高安全容量は、相当の医学的判断に従っているからである。一日、一週間または一カ月に数回の投与は、当出願に記載される化合物、物質および細胞の全身の適切な水準を達成するために検討される。適切な全身の水準は、例えば、患者のピーク、または本出願に記載される化合物、物質および細胞の血漿中濃度の測定などで決定される。
【0095】
化合物または薬剤の治療上効果的な量は、一般に0.001から1000 mg/kgである。本発明において、有用な化合物は、その範囲内で投与されることが想定されている。いくつかの実施例では、範囲は0.01から100mg/kgである。その他の実施例では、範囲は0.05から50mg/kgである。いくつかの実施例では、治療上効果的な量は50mg/kg未満である。例えば45mg/kg未満、40mg/kg未満、35mg/kg未満、30mg/kg 、未満25mg/kg、未満、20mg/kg未満、または15mg/kg未満である。いくつかの実施例では、治療上効果的な量は10mg/kg未満である。例えば9mg/kg未満、8mg/kg未満、7mg/kg未満、6mg/kg未満、5mg/kg未満、4mg/kg未満、3mg/kgまたは2mg/kg未満である。いくつかの実施例では、治療上効果的な量は1.5mg/kg未満である。例えば1.4mg/kg未満、1.3mg/kg未満、1.2mg/kg未満、1.1mg/kg未満、1mg/kg未満、0.9mg/kg未満、0.8mg/kg未満、0.7mg/kg未満、0.6mg/kg未満、0.5mg/kg未満、0.4mg/kg未満、0.3mg/kg未満、0.2mg/kg未満、または0.1mg/kg未満のTGF-Β, NKT-刺激剤または本出願に記載される他の薬剤あるいは化合物である。
【0096】
T-cellsFoxp3+ナチュラルキラーT細胞の治療上効果的な量は、一般に10から1×108細胞である。いくつかの実施例では、Foxp3+ナチュラルキラーT細胞は、1×102から1×107細胞の範囲で投与される。さらに、いくつかの実施例では、Foxp3+ナチュラルキラー T細胞は、1×103から1×106細胞の範囲で投与される。さらに、いくつかの実施例では、治療上効果的な量は、1×107Foxp3+ナチュラルキラーT細胞未満である。例えば、1×106未満、1×105未満、1×104未満または1×103未満のFoxp3+ナチュラルキラーT細胞である。
【0097】
いくつかの実施例では、治療上効果的な量は、一回の服用で投与される。いくつかの実施例では、治療上効果的な量は、数回の服用で投与される。投与量は本出願に記載される化合物、物質および細胞が、投与の方法によって、局所的にまたは全身的に望ましい水準に達するように、適切に調整される。そのような服用で、被験の反応が十分でない場合、より多い投与量(あるいは異なる、より局所的な到達経路による効果的なより多い投与量)が被験の許容範囲内において採用される場合もある。一日数回の投与は、適切な全身的な化合物の濃度を達成するため検討されるべきである。
【0098】
医薬組成物と投与法
【0099】
本出願に記載されている化合物、物質および細胞は、一般に医薬組成物として、通常医薬的に許容できる濃度の塩分、緩衝剤、保存料、適合するキャリヤ、アジュバントおよびその他の治療用含有物を含んで、被験に投与される。適合するキャリヤとその他の医薬組成物成分の特質は、投与の方法によって決まる。
【0100】
本発明の医薬組成物は、本出願に記載されている治療法を行う上で、熟練の技術者に知られているあらゆる方法と経路で投与されうる。
【0101】
いくつかの実施例において、本出願記載の化合物、物質および細胞は、局所的に投与される。局所的投与の経路は、当技術分野では知られており、標的領域と標的器官によって決まる。局所的投与の経路は、経皮(皮膚の上に塗布)、吸入、直腸(浣腸または座薬によって)、点眼薬(結膜に投与)、点耳薬、鼻腔内経由および膣内を含み、標準の局所性投与法を含む。
【0102】
消化管への局所的投与は、腸内投与で、行われ得る。腸内投与は、経口、経腸栄養管、十二指腸栄養管、胃ろう造設、直腸投与を含む。
【0103】
局所的投与は点滴によっても行われる。特定の器官または門脈など特定の器官と直接接触する特定の血管への点滴は、当初は、注入された実体の局所投与で生じる。特定の血管への点滴に加えて、局所的注入は、骨髄(骨髄内輸液)、腸膜および膀胱(膀胱内輸液)へ送ることが可能となる。
当出願で使用される局所的投与には、当出願記載の化合物、物質および細胞の局所注射も含まれる。局所注射は、ほとんどどの領域または器官でも行われる。局所投与の領域例は、筋肉内、大脳内、脳室内、心臓内、皮下、皮内、髄腔内、腹腔内および陰茎海綿体内などで実施される。
局所投与はまた、遅効性の放出気質としても評価されるべきである。よって、当出願記載の化合物、物質および細胞は、手術によって被験に採用されうる。そして実体の遅効性放出は特定の実体の局所的放出を促進する。
本出願で使用されている局所投与は、局所に送るためのキャリヤの使用をも採用する。そのため、局所的に送られる本出願記載の化合物、物質および細胞は、投与時に、体の特定の領域に集まり、1つのキャリヤに結合する場合がある。
【0104】
経口投与においては、物質および化合物は、当技術分野でよく知られている薬学的に承認されているキャリヤと組み合わせることによって、容易に調剤されうる。そのようなキャリヤは、本発明の化合物を、治療される被験が経口で摂取できるよう錠剤、丸薬、糖衣錠、カプセル、液体、ゲル剤、シロップ、スラリー、懸濁液などに調剤することを可能にする。経口使用のための薬学的調剤は、固形の医薬品添加物として得られる。任意に粉砕すれば、結果として混合となり、顆粒の混合を加工し、必要であれば適した補助物を加え、錠剤または糖衣錠の核を作る。適切な医薬品添加物とは、具体的には砂糖のような増量剤、ラクトース、サクロース、マンニトールまたはソルビトールを含む。セルロース調剤は、例えば、トウモロコシ澱粉、小麦澱粉、米澱粉、ジャガイモ澱粉、ゼラチン、トラガント、メチルセルロース、ヒト゛ロキシプロピルメチルセルロース、ナトリウム、カルボキシメチルセルロースおよびあるいはポリビニルピロリドン(PVP)である。必要であれば、薬剤を分解することも追加される。例えば架橋したポリビニルピロリドン、寒天、またはアルギン酸あるいはアルギン酸ナトリウムのような塩である。任意により、経口調剤は体内の酸の状態を中和するために、生理食塩水または緩衝剤で調剤されることがある。例、EDTA。またはキャリヤなしで投与される。
【0105】
経口で投与する場合は、放出の場所は、胃、小腸(十二指腸、空腸または回腸)または大腸である。当業者は胃の中では分解させず、物質を十二指腸または腸内の他の場所で放出する、利用可能な調剤を所有している。腸内のコーティングとして使用される、より一般的な不活性成分の例としては、セルロースアセテートトリメリテート(CAT)、ヒドロキシプロピルメチル セルロース フタレート(HPMCP)、HPMCP 50、HPMCP 55、ポリビニルアセテートフタレート(PVAP)、Eudragit L30D、Aquateric、セルロースアセテートフタレート(CAP)、Eudragit L、 Eudragit SおよびShellacがある。これらのコーティング剤は、混合膜として使用されうる。コーティング剤またはコーティング剤の混合は、胃に対しての保護を想定されない錠剤としても使われる。これには糖衣または錠剤の嚥下を容易にするためのコーティングが含まれる。カプセルは粉末薬を送るための殻(ゼラチンのような)となりうる。液体では、柔らかいゼラチンの殻が使われる。カシェ剤の殻の材質は、厚い澱粉かまたはその他の食用の紙とする。錠剤ではトローチ、すりこみ錠、粉薬錠剤、湿性マッシング技術が使われる。
【0106】
ここに記載された物質と化合物は、顆粒剤または小丸薬の形状内の複数の微粒子としての態様を含む。カプセル投与用の原料製剤態様として粉剤、軽く圧縮されたプラグ、錠剤になる場合がある。医薬組成物は圧縮により調整できる。不活性物質を使用し、医薬組成物の量を希釈もしくは増量することはもできる。炭水化物、マンニトール、α-ラクトース、無水乳糖、セルロース、ショ糖、調整済デキストラン、調整済デンプンを賦形剤として使用できる。充填剤は、無機塩類をカルシウム三リン酸塩、炭酸マグネシウム、塩化ナトリウムを含んで使用できる。市販の賦形剤としてFast-Flo、Emdex、STA-Rx 1500、Emcompress、Avicellがある。
【0107】
崩壊剤が固形製剤の医薬組成物中に使用される場合がある。崩壊剤として使用される物質にデンプンを元にした市販品のExplotabがあるが、デンプンに限定したものではない。デンプングリコール酸ナトリウム、アンバーライト、ナトリウムカルボキシメチルセルロース、ウルトラアミノペクチン、アルギン酸ナトリウム、ゼラチン、オレンジ果皮、酸カルボキシメチルセルロース、海綿、ベントナイトが使用される場合がある。硬質錠剤を形成し治療薬を保持するために結合剤が使用される場合があり、アカシア、トラガント、デンプン、ゼラチンのような天然物が使用される場合がある。抗摩擦剤を製造過程で物質固着を防止するため、配合組成に含む場合がある。潤滑剤を薬剤とダイ壁間の層に使用する場合があり、以下の物質を使用できるがこれらに限定したものではない、ステアリン酸とそれに含まれるマグネシウム、カルシウム塩、ポリテトラフルオロエチレン(PTFE)、流動パラフィン、植物油、ワックス。製剤中の薬剤流動性の促進および圧縮時の再配列補助のために、流動促進剤が使用される場合がある。流動促進剤としてデンプン、タルク、焼成シリカ、ケイアルミン酸水和物が使用される場合がある。
【0108】
吸入投与のため、ここに記載された物質と化合物は加圧パックによるスプレーもしくは噴霧吸入器の態様でシ゛クロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、炭酸ガスや他の適切なガスを使用し容易に送ることができる。
【0109】
ここに記載された物質と化合物は、肺へ送ることも意図されている。ここに記載された物質と化合物は哺乳類の局所もしくは全身へ送られる場合がある。分子吸入に関する文献には以下を含む。Adjei et al., 1990, Pharmaceutical Research, 7:565-569; Adjei et al., 1990, International Journal of Pharmaceutics, 63:135-144 (leuprolide acetate); Braquet et al., 1989, Journal of Cardiovascular Pharmacology, 13(suppl.5):143-146 (endothelin-1); Hubbard et al., 1989, Annals of Internal Medicine, Vol.III, pp. 206-212 (a1- antitrypsin); Smith et al., 1989, J.Clin.Invest. 84:1145-1146 (α-1-proteinase); Oswein et al., 1990,"Aerosolization of Protein", Proceedings of Symposium on Respiratory Drug Delivery II, Keystone, Colorado, March, (recombinant human growth hormone); Debs et al., 1988, J. Immunol. 140:3482-3488 (interferon-g and tumor necrosis factor alpha) and Platz et al., U.S. Patent No. 5,284,656 (granulocyte colony stimulating factor). A method and composition for pulmonary delivery of drugs for systemic effect is described in U.S. Patent No. 5,451,569, issued September 19, 1995 to Wong et al.
【0110】
ここに記載された物質と化合物を有する医薬組成物を鼻へ送ることが意図されている。鼻に送る場合、本発明の医薬組成物は治療薬を鼻から投与後、肺に物質を堆積させる必要もなく直接血流に通過させる。
【0111】
ここに記載された物質と化合物は、カカオバターやグリセリドのような従来の坐剤基剤を含有する直腸組成物、膣組成物、坐薬、停留浣腸にも形成できる。前述の剤形に加えて、化合物はまた、デポ製剤として形成することができる。さらに長時間作用型製剤に対して高分子基材、疎水性物質(例、許容される油の乳化剤)、イオン交換樹脂、難溶性塩のような難溶性の類似体を使用して形成する場合がある。
【0112】
最適化された医薬組成物を含む細胞の投与方法は当該技術分野で知られている。細胞は関節への点滴、注射や外科的挿入により投与可能である。しかし本発明はこれらの実施例に限定されず他の細胞投与方法も意図している。
【0113】
医薬組成物はまた、適当な固体、ケ゛ル相キャリヤ、賦形剤を使用する場合がある。このようなキャリヤ、賦形剤の例として炭酸カルシウム、リン酸カルシウム、様々な糖類、デンプン、セルロース類似体、ゼラチン、ポリエチレングリコールなどの高分子を含むがこれらに限定しない。
【0114】
適切な液状または固形の製剤形状として例をあげると、吸入用には水溶液もしくは食塩溶液があり、マイクロカプセル化した渦巻状で金の極微小粒子を塗布したリポゾームを含む噴霧剤、エアロゾル剤、皮膚への植え込み用の小丸薬があり、皮膚を切開し鋭利な乾燥物を植え込むものがある。また医薬組成物には顆粒剤、散剤、錠剤、コーティング錠(マイクロ)カプセル、坐薬、シロップ剤、乳化剤、懸濁剤、クリーム剤、滴剤、活性化合物の長期放出を持続する調整剤を含み、これらには賦形剤、添加剤、1つ以上の助剤のすべてか1つとして、崩壊剤、結合剤、塗工剤、膨潤剤、潤滑剤、着香料、甘味料、溶解補助剤が通常使用される。医薬組成物は様々な薬物送達システムに適切である。薬物の注入の方法の概要は以下を参照、Langer, 1990, Science 249, 1527-1533。
【0115】
ここに記載された物質と化合物はそれ自体(原剤)もしくは薬学的に許容される塩類として投与される。薬剤が投与される時、塩類は薬学的に許容されるべき状態であり、非薬学的に許容される塩類は、薬学的に許容される塩類を調剤するために使用することができる。このような塩類として塩酸、臭化水素酸、硫酸、硝酸、リン酸、マレイン酸、酢酸、サリチル酸、p-トルエンスルホン酸塩、酒石酸、クエン酸、メタンスルホン酸、蟻酸、マロン酸、コハク酸、ナフタレン-2 -スルホン酸、ベンゼンスルホン酸があるがこれらに限定はされない。また、このような塩類はアルカリ金属塩、ナトリウム、カリウム、カルボン酸基のカルシウム塩などのアルカリ土類塩として調剤することができる。
【0116】
本発明の医薬組成物は、ここに記載された充分な量の物質、化合物、細胞と薬学的に許容されるキャリヤ内に含有する任意で追加可能な治療物質を含む。長期的薬学的に許容されるキャリヤは、1つ以上の互換性のある固体または液体フィラー、賦形剤、ヒトまたは他の脊椎動物に投与するために適している物質をカプセル化することを表す。キャリヤは薬剤を体表面の接触を容易にするために活性成を結合する有機成分、無機成分または自然物、合成物を表す。医薬組成物の成分は本発明の化合物と混合可能で、それぞれも混合可能であり、つまりは実質的に必要な医薬品の効率を損なう相互作用がないようにする。
【0117】
本発明の化合物を送達する粒子の製造において、非生分解性高分子材料と生分解性高分子材料を使用できる。これらの高分子として天然もしくは合成の場合がある。高分子は計画される放出期間に基づいて選択される。特に有益なのが、Sawhney et. al., 1993, Macromolecules 26, 581-587で発表された生体内分解性ハイドロゲルを含む生体接着性高分子であることをここに記す。ポリヒアルロン酸、カゼイン、ゼラチン、グルチン、ポリ酸無水物、ポリアクリル酸、アルギン酸塩、キトサン、ポリ(メチルメタクリレート)、ポリ(エチルメタクリレート)、ポリ(ブチルメタクリレート)、ポリ(メタクリル酸イソブチル)、ポリ(hexylmethacrylate)、ポリ(イソデシルメタクリル酸)、ポリ(メタクリル酸ラウリル)、ポリ(フェニルメタクリル酸)、ポリ(アクリル酸メチル)、ポリ(イソプロピルアクリレート)、ポリ(アクリル酸イソブチル)、ポリ(オクタデシルアクリル酸)。
【0118】
ここに記載された物質と化合物には放出制御システムが含まれている場合がある。「放出制御」とは、ここに記載された調剤を含み、物質および化合物の種類とプロファイルのなかで、ここに記載されたいかなる物質と化合物が制御された調剤から放出される状態を表すことを意図している。これは即時放出製剤、非即時放出製剤および徐放性製剤と遅延放出製剤を含むが、これらに限らない非即時放出製剤についても言及している。「徐放」(「持続放出」も言及する)は長時間をかけた化合物の漸進的で積極的な放出だが、必ずしも一定の薬剤血中濃度を長時間必要としない製剤の従来の意味を言及するために使用される。「遅延放出」は製剤投与と化合物の放出の間に時間遅延がある製剤の従来の意味を言及するために使用される。「遅延放出」は長期間の化合物放出を含む場合と含まない場合があるので「徐放性」になりえる場合となりえない場合がある。長時間持続放出インフ゜ラントの使用は慢性疾患においてとりわけ適する場合がある。ここで使用される「長時間放出」は治療レベルの活性成分が植えこまれ、最低7日間そして30〜60日間の注入の構築および配置について言及している。長時間持続放出インプラントは当業者に知られており、前述のいくつかの放出システムに含まれている。
【0119】
キット
【0120】
一態様において、本発明は、医薬組成物を有しここで記載された物質と化合物、および医薬組成物の投与方法を有するキットを提供する。本発明のいくつかの態様において、キットは製剤バイアル、製剤バイアルS、ここに記載された化合物と物質を含むことが可能である。賦形バイアルには生理食塩水のような希釈液を含み、本発明の化合物の濃縮液もしくは凍結乾燥粉剤になりえる。いくつかの実施例では、特定量の濃縮製剤と特定量の賦形剤を混合する手順を含めた手順書があり、それによって注射もしくは点滴の最終製剤を調剤する。いくつかの実施例では、シリンジもしくは他の投与機器を使用する手順をふくめた手順書がある。いくつかの実施例では、本発明の特定量の化合物を用いて患者を治療する手順を含めた手順書がある。調剤をふくむ容器がたとえ容器が瓶、中隔のあるバイアル、中隔のあるアンプル、輸液バッグおよびその他であっても調剤が、加圧滅菌済みもしくは他の方法で滅菌済みの際に変色という従来のマーキングの印を有する、という理解がなされているものとする。
【0121】
本発明は以下の例をもって更に説明していくが、その説明にさらに制限が課されると理解すべきではない。本出願の全体を通して引用された参照内容の全内容(文献、交付済特許、公開特許出願、同時係属の特許出願を含む)は、明確に参照によって組み込まれており、特に上文に参照した教授内容に組み込まれている。
【実施例】
【0122】
実施例の材料と方法
【0123】
マウス
【0124】
C57BL/6、Balb/c、TGFβRIIdn、およびFoxP3gfpノックインマウス(A.Y.Rudensky,University of Washington,Seattle,WAより入手)を繁殖させ、Oeiras,PortugalにあるInstituto Gulbenkian de Cienciaにて、特定病原体未感染(specific pathogen-free)の条件で飼育した。実験用マウスは性別が一致し、6〜8週齢であった。すべての実験はAnimal User and Institutional Ethical Committeeのガイドラインに準じて実施した。In vivoにおけるiNKT細胞の変換のために、30μgのα-GalCer(Alexis,San Diego,CA)の胃内強制投与を1日おきに3回実施した。
【0125】
組織処理
【0126】
解析するすべての組織はBDセルストレーナーおよびシリンジのピストンを用いて処理した単一細胞懸濁液とした。膵臓は、更に氷冷したトリス‐塩化アンモニウム赤血球溶解液で5分間インキュベートした。肝臓は処理前にヘパリン入りのPBSで3回洗浄し、10%ウシ胎児血清を添加したRPMIで洗浄した。続いて35%(vol/vol)Percoll(Sigma)溶液(11ml)をかけ、室温で25分間、減速無しの1360gの遠心にかけることで肝細胞を分離した。上清を吸引除去し、氷冷したトリス‐塩化アンモニウム赤血球溶解液でペレットを5分間インキュベートした。
【0127】
ヒト末梢血細胞の単離
【0128】
健康な男性と女性のボランティアから同意を取得し、ヘパリンを添加した静脈血検体を取得した。その手順はEthical Board of the Faculty of Medicine,University of Lisbon, Lisbon,Portugalにより審査され承認されていた。Histopaque-1077 Hybri-Max density gradient(Sigma)で末梢血単核細胞(PBMC)を遠心分離し、下記の通り濃縮T細胞を得た。
【0129】
フローサイトメトリーと細胞ソーティング
【0130】
マウスとヒトのPE結合CD1d-PBS57テトラマーは NIH Tetramer Facilityより入手した。抗マウスCD3 (145-2C11)、CD4 (GK1.5 and RM4-5)、CD8 (53-6.7)、CD25 (PC61.5)、CD27 (LG.7F9)、CD62L (MEL-14)、CD103 (2E7)、CTLA-4 (UC10-4B9)、DX5 (DX5)、Foxp3 (FJK-16s)、GITR (DTΑ-1)、NK1.1 (PK136)、NKG2D (CX5)、TCR-β chain (H57-597)、Thy1.1 (HIS51)、Thy1.2 (53-2.1)の蛍光色素標識モノクローナル抗体(クローン名は括弧内に記載した)はeBioscienceまたはBD Biosciencesより購入した。抗ヒトCD4 (SK3)、CD25 (2A3)、CD127 (eBioRDR5)、CD161 (DX12)、CTLΑ-4 (14D3)、Foxp3 (PCH101)、GITR (eBioAITR)およびTCR Vβ11 (C21)の蛍光色素標識モノクローナル抗体はeBioscience、BD BiosciencesまたはBeckman Coulterより購入した。
【0131】
マウスNKT細胞を濃縮するため、細胞を非結合抗CD16/32(クローン2.4G2)ラット抗体(自家作製)とともにインキュベートし、FcRに対する非特異的結合を阻害し、洗浄せずにPE結合CD1d-PBS57テトラマーで標識した。抗PE磁気ビーズを添加し、磁気標識された細胞分画をautoMACS cell separator(Miltenyi Biotech)で単離した。サンプルをFACSCanto I(Becton Dickinson)で分析、もしくはFACSAria(Becton Dickinson)を用いて分取し、すべての実験でタ゛フ゛レット除去した。ヒトNKT細胞を濃縮させるため、細胞を抗CD14(61D3)、CD19(HIB19)およびCD123(6H6)ビオチン化抗体で標識し、抗ビオチン磁気ビーズに結合させ、autoMACS cell separator(Miltenyi Biotech)で濃縮して磁気標識した細胞を除去した。細胞内フローサイトメトリー染色のため、最初に細胞を表面マーカーで標識して、洗浄し、eBioscienceの透過と固定用バッファー「Foxp3 Staining Buffer Set」で固定した。細胞内抗体染色の前に、非結合マウス細胞を抗CD16/32(クローン2.4G2)ラット抗体(自家作製)および通常のラット血清に添加したヒト細胞(eBioscience)と共にインキュベートした。データはFlowJo(Tree Star)により解析した。
【0132】
細胞培養
【0133】
分取したマウス細胞を3μg/mLの抗CD3抗体(クローン145-2C11、eBioscience)でコーティングした24または96ウェル平底プレートで培養した。培地は10%ウシ胎児血清、1%Hepes、1%ペニシリン/ストレプトマイシン、1%ピルビン酸ナトリウムおよび0.1%β-mercaptoethanol(Invitrogen)を添加したRPMI-1640 with GlutaMAXとした。いくつかの条件では、次のサイトカインおよび抗体を培地に添加した。TGF-β(5ng/mL、R&D Systems)、recombinant IL-1β(10ng/mL、eBioscience)、IL-2(5ng/mL、eBiocience)、IL-4(20ng/mL、eBioscience)、IL-6(20ng/mL、R&D Systems))、IL-15(100ng/mL、eBioscience)、IL-7(5ng/mL、R&D Systems)、および抗CD28抗体(2 μg/mL、eBioscience)。細胞内サイトカインの検出前、50ng/mLの4-α-phorbol 12-mystrate 13-acetate(PMA)および500ng/mLのionomycin(Sigma)により、Brefeldin A(Sigma)存在下において5%のCO2、37°Cで、3時間細胞を刺激した。
【0134】
ヒト細胞は、1μg/mLの抗CD3抗体(クローンOKT3、BD Biosciences)をコーティングした24ウェル平底プレートでインキュベートした。培地は10%ウシ胎児血清、1%Hepes、1%ペニシリン/ストレプトマイシン(Invitrogen)を添加したRPMI-1640 with GlutaMAXとした。いくつかの条件では、次のサイトカインおよび抗体を培地に添加した。TGF-β(10ng/mL、R&D Systems)、recombinant IL-2(20U/mL、Roche)、抗IL12抗体および抗IFN-γ抗体(5 μg/mL、eBioscience)、抗IL-4抗体(5 μg/mL、R&D Systems)、および抗CD28抗体(2 μg/mL、eBioscience)。
【0135】
サイトカイン検出
【0136】
各ウェルから培地の上清を除去し、サイトカインの検出まで-80°Cで冷凍した。ELISAはIL-10(Peprotech)およびIL-4(BD-Pharmingen)キットを用いて実施した。IL-9の検出はcytokine bead-array Mouse IL-9 Flex Set(BD-Pharmingen)を用いて実施した。すべての解析は製造元の指示書に従って実施した。
【0137】
In vitroでの増殖および抑制解析
【0138】
細胞増殖を追跡するため、分取したマウス細胞を培養前に5μMのcarboxyfluorescein succinimidyl ester(CFSE、Invitrogen)標識した。調節性iNKTおよびCD4T細胞の抑制能力を評価するため、各サブセットをmitomycin C(Sigma)処理した脾細胞および新鮮に分取したCD4+CD25−T細胞と共に、2.5μg/mLの可溶性抗CD3抗体(BD Pharmingen)を添加した60ウェルTerasaki plates(Greiner)で、3種または4種の細胞を共培養した。いくつかの条件では、次のサイトカインおよび抗体を培地に添加した。200μg/mLの抗IL10R抗体(1B1.2)、200μg/mLの抗IL-4抗体(11B11)、および100μg/mLの抗GITR抗体(YGITR)22。細胞を37°Cで96時間培養し、最後の12時間は1μCi[3H]thymidine(Amersham)を各ウェルに添加した。細胞をグラスファイバーフィルターで捕獲し、[3H]thymidineの取り込みは Microbeta Trilux scintillation counter(Perkin Elmer)を用いて解析した。すべての培養細胞は三種または4種で解析した。
【0139】
Transwellアッセイ
【0140】
透過性膜の培地において、CFSE標識された「キラー細胞」であるCD4+CD25−T細胞を、平底96ウェルプレートのボトムウェルでmitomycin C処理された脾細胞および1μg/mLの可溶性抗CD3抗体により刺激した。調節細胞集団を、0.2μm Anopore membrane insert(Nunc)のホ゛トムウェルで「キラー」細胞と共に培養、あるいはアッパーウェルでmitomycin C処理した脾細胞だけで共に培養した。72時間後のボトムウェルのCFSE濃度をフローサイトメトリーにより解析した。
【0141】
アレルギー性気道疾患
【0142】
Balb/cマウスを0日齢および14日齢において、予め製造元の指示書に従ってDetoxyGel column(Pierce, Rockford, USA)に通した20μg のovalbumin(OVA, grade V; Sigma, St Louis, USA)またはβ-lactoglobulin(Sigma)を腹腔内注射することで感作させ、2.0 mgのendotoxin-free aluminum hydroxide(Alu-gel-S, Serva, Heidelberg, Germany)で懸濁した。C57/B16マウスは、0日目、7日目、14日目に半分の量のOVAを使い感作された。引き続きすべての動物は、図14に示した日においてパイロジェンフリー生理食塩水に溶解した50μgのOVAを鼻腔内にチャレンジし、最終チャレンジの24時間後に屠殺した。BAL好酸球増加を定量するため、1mlの冷却したPBS 10% BSA(Sigma)をゆっくり3回注入および吸引することにより気管を通して気道を洗浄した。その後BALを遠心し、上清を除去し、ペレットをPBSで再懸濁した。細胞を血球計算板で計数した。分画細胞の計数をGiemsa-Wright(Sigma)で染色したcytospinのアッセイで実施した。各サンプルから少なくとも200細胞を盲検的スライド(blinded slides)で計数し、各細胞種の相対数を明らかにした。組織学のために、肺を4% formalin solution(Sigma)で灌流し、収集し切開した。ヘマトキシリン/エオシンを用いて染色し、periodic acid-Schiff(PAS)染色を用いて粘液を含む細胞を明らかにした。写真は、Leica DM2500顕微鏡およびLeica DFC420カメラを用いて撮影した。
【0143】
実験的自己免疫性脳脊髄炎(EAE)
【0144】
C57BL/6マウスにCFAで乳化したmyelin oligodendrocyte glycoprotein(MOG)35-55 ペプチド(MEVGWYRSPFSRVVH LYRNGK,SEQ ID NO:1)を注射し、百日咳毒(0日齢に200ng、2日齢に400ng)を2回静脈内注射することでEAEを誘発させた。何匹かのマウスについて、0日齢および4日齢(腹腔内)に、2度の4μgのα-GalCer(MOG35-55 CFA混合液で乳化させた)投与で処理した。疾患の重症度を毎日モニタリングし、EAEを次の通りグレード分けした。スコア1:非硬直性の尾(limp tail)、スコア2:後肢不完全麻痺、スコア3:後肢完全麻痺、スコア4:前肢衰弱、スコア5:瀕死状態(moribund)
【0145】
共焦点顕微鏡
【0146】
FACSAria(Becton Dickinson)を用いてFoxp3-GFP+細胞を分取し、coverslips pre-coated with poly-L-lysine(Sigma)に撒いて、接着させるために37℃で1時間インキュベートした。スライドをPE標識CD1d/PBS57テトラマーと4℃で1時間培養し、氷冷したPBSで慎重に洗浄した。細胞をPBS 3% paraformaldehyde(Sigma)中に4℃で15分間固定し、氷冷したPBSで洗浄することで余分な固定液を除去した。スライドをDAPI Fluoromount G(Southern Biotech)封入剤で封入して蛍光染色し、共焦点レーザースキャン顕微鏡(LSM 510 META, Carl Zeiss)で観察した。
【0147】
RNA抽出、RTおよびPCR
【0148】
RLT Bufferに直接分取した細胞以外の1,000〜50,000個のFACS分取細胞から、RNeasy Micro Kit(Qiagen)を用いて製造元の指示書に従ってRNAを抽出した。random primers(Invitrogen)およびSuperscript III reverse transcriptase(Invitrogen)を用いてcDNAを合成した。 転写産物は次のプライマー(Bonsai Technologiesより購入)を用いて検出した。PLZF(Zbtb16)fwd:cagtttgcgactgagaatgc,(SEQ ID NO:2)rev:ttcccacacagcagacagaa(SEQ ID NO:3);Foxp3 fwd:cccaggaaagacagcaacctt;(SEQ ID NO:4)rev:ttctcacaaccaggccacttg(SEQ ID NO:5);EFA1 fwd:acacgtagattccggcaagt(SEQ ID NO:6),rev:aggagccctttcccatctc(SEQ ID NO:7)。Power SYBRGreen PCR Master Mix(Applied Biosystems)およびABI-PRISM 7000 sequence-detection system(Applied Biosystems)を用いてPCRを行った。すべてのPCR産物をアガロースゲルに流し、正確なサイズを確認した。
【0149】
統計解析
【0150】
P値はウェルチの補正を行うノンパラメトリックの対応のないt−検定により計算した。
【0151】
例1 TGF-βの存在下で培養の後iNKT細胞によりFoxp3が発現した例
Foxp3+「誘発された」Tregへいわゆる「普通の」T細胞を分化するとして知られた状態、つまりTGF-βの存在下で活性化された際のアップレギュレートしているFoxp3発現のiNKTの可塑性を調べた(35,36)。未感作マウスC57Bl/6の脾臓より識別されたiNKT細胞は、プレート結合抗CD3に刺激され、そしてIL-2 とTGF-βの存在下に培養された。未感作CD4+CD25−Tリンパ球のパラレル培養は、コントロールとして用いられた。3日後、培養細胞の細胞内染色で、Foxp3発現は、iNKT(29.35%±11.80)とCD4 (53.21%±12.03)T細胞培養(図1a)の両者のかなりの比率で検知可能であることが判明した。GFP-Foxp3融合レポータータンパクノックイン対立遺伝子(Foxp3gfpマウス)(37)をもつマウスと、Balb/cマウス(図1bおよび図2)の両者からのiNKT細胞にて同様の結果が得られた。胸腺から識別されたiNKTリンパ球も、Foxp3+iNKT細胞に分化したが、転換効率が低かった(図1c)。Foxp3+iNKT細胞は転換後ソートされ、個々の細胞は共焦点顕微鏡検査によって識別された。図1dにあるように、PBS57リガンドにある染色されたCD1d四量体は、Foxp3発現細胞が、糖脂質抗原を認識するinvariant TCRを表面で産生すること、つまりiNKT細胞にのみに起因する特徴を確認した。それゆえbona fide iNKT細胞は、特別な状況下において刺激されたとき、Foxp3転写因子をアップレギュレートすることができる能力において従来型CD4 T細胞に類似する。注目するべき点として、この特性は、TGF-β(データは示されていない)の存在下においての活性化で、Foxp3アップレギュレートに失敗したγδ T細胞などの、他の従来型とは異なる(非MHC抑制)のT細胞によって共有されていない。
【0152】
さらにiNKT細胞が、Foxp3エクスプレッサーに変わる最適な条件を確認するため、TCRシグナルの強さ、共刺激、サイトカインの添加の影響の試験を行った。Foxp3+NKT細胞への最適な変化は、3μg/mLのプレート結合抗CD3と5ng/mLのTGF-βとIL-2(図1e)の存在下によってなされた。事前のサイトカイン混合液へのIL-15 or IL-7のさらなる添加は、iNKT細胞変換(図2)においてほとんど影響を持たなかった。IL-2の欠如での変化は可能であったが、Foxp3+細胞の発現頻度は大幅に減少(約5%のレヘ゛ルにまで)し、細胞の増殖が弱まったことによるものと思われる。対照的にFoxp3+ iNKT細胞は、TGF-β(図2)の欠如したIL-2もしくはIL-15での培養で誘発されるものはなかった。実際、TGF-β濃度の滴定は、iNKT細胞(図1f)におけるFoxp3発現誘発のために、このサイトカインが重要であることを明らかにした。異なるTGF-βとウシの胎児血清群を用いて、変化したFoxp3+iNKT細胞(20%から50%の間)の頻度の変動性を観察した。培養へ抗CD28単一クローン抗体添加もテストされ、Foxp3+iNKT細胞(データは示されていない)への変化も増大しなかった。このデータはTGF-βシグナルが、iNKT細胞活性におけるFoxp3発現の誘発を促進することを明らかに示した。
【0153】
例2 Foxp3+ iNKT細胞が示すTregとNKT細胞表現型特性
【0154】
iNKTリンパ球が、Foxp3を発現したと確証した際、変化した細胞の表現型を調べた。Foxp3+iNKT細胞の多くの表現型特性は、in vitro変化のFoxp3+CD4 Treg細胞と共有された。すなわち両集団は、大部分において、CD25+、CTLΑ-4+、GITR+、CD103+、IL-7RA−(図3a)であった。しかし両集団間にいくぶんの差異が認められた。すなわちFoxp3+CD4 T細胞は、大部分がCD27+と異質性のCD62L発現であり、Foxp3+iNKT細胞は、大部分がCD27−とCD62L−であった。CD103の高発現に関しCD62Lの欠如は、in vivoにおいて、Foxp3+iNKT細胞は、リンパ節から除外され、末梢組織に大部分移動することを示す。実際RAG2−/−マウスへFoxp3+iNKT細胞を静脈注射し3週間後、肝臓においてこの細胞の大部分を検出することができた(下記参照)。
【0155】
iNKTリンパ細胞の中で、CD4発現の不均一性は、確証された9。興味深いことに、CD4+とCD4−iNKT細胞(図3b)の両存在下よりも、Foxp3の発現の可能性は、CD4+iNKT細胞サフ゛セットを制限していなかったことを発見した。Foxp3+iNKTリンパ球の大部分は、NK1.1−、DX5−、NKG2D+であることを発見した。加えて、PLZFのための転写産物の存在、すなわちNKT系署名(22)と報告されている転写因子を、識別されたFoxp3+とFoxp3−iNKT細胞(図3c)において検出した。あわせてこの観察は、iNKTリンパ球におけるFoxp3発現の誘発が、T系とNK系の両方からの分子の不規則な発現に基づくNKTの性質を保つことを示唆する。
【0156】
例3 Foxp3+iNKT細胞の肝臓へ移動とin vivoでのFoxp3発現の維持
【0157】
遺伝子発現フ゜ロク゛ラムの誘発の後、考慮するための具体的態様は、安定性である。さらに、はじめ予測されていた(38)よりも、従来のTreg細胞が安定性にかけることによるFoxp3発現は明らかになりつつある。in vivoのiNKT細胞においてFoxp3発現が維持されるかどうかを調べるため、変化したFoxp3gfpiNKTもしくはコントロールとしてin vitroで誘発されたFoxp3gfpCD4細胞をRAG2−/−マウスへ注射した。7から21日後、iNKT細胞の表現型は、脾臓、リンパ節(LN)、肺、消化管、肝臓で評価された。LNへ優先的に移動し、脾臓と肝臓においても認められたCD4 T細胞の対照として、主に肝臓と肺において検知されながらも、iNKT細胞はLNで、しかも早い時点で脾臓においても欠いていた。3週間後、Foxp3の発現(図4)がiNKT細胞の80%以下が維持されていた肝臓において存在しながらも、代わりに脾臓において、Foxp3+iNKT細胞は、検知されなかった。集団的に、この結果、両集団は、特異な生理学的位置にいるが、in vivoにおいてiNKT細胞によって変化したFoxp3発現の安定は、変化したFoxp3+Treg細胞に劣らないことを示唆した。すなわちiNKT細胞が、肝臓のような非リンパ系器官に大部分集まる一方、CD4 Tregは、二次リンパ系器官に大部分は移動した。
【0158】
例4 iNKTreg細胞に示される接触依存性GITR介在性抑制的機能
【0159】
Foxp3は、Treg表現型と抑制的機能へつながる末梢性CD25−CD4+T細胞においての遺伝子プログラムを誘発するとされた転写因子である(39-41)。Foxp3+iNKTd細胞の制御機能を評価するため、APCsと可溶な抗CD3 MAb抗体によって刺激されたCD25−CD4+“responder” 細胞の増殖を抑制する能力をテストした。TGF-βの存在下で変化したFoxp3gfpマウス由来のiNKT細胞、そしてコントロールとして、ナチュラルCD25highCD4+(nTreg)細胞とin vitroにおいて変化したFoxp3+CD4+T細胞(Foxp3gfpマウスからも)を用いた。キラー細胞の比率滴定は、変化したFoxp3+CD4+T細胞へ類似した効率と、nTreg細胞(図5a)のわずかに劣る効率を有するターゲットCD25−CD4+T細胞の増殖を、変化したFoxp3+iNKT細胞が、実際に抑制できることを示した。GITRは、Foxp3+iNKTリンパ球(図5b)により介在された調整機能における優位な役割を担うことを示しながら、抗IL10Rではなく、抗GITR抗体(42)の培養への添加は、抑制を逆にした。この結果に合致してFoxp3+iNKT細胞は、Transwell(図5c)で、キラー細胞から培養分離された際、際だった抑制機能の低下が示された。この結果は、従来型Treg細胞に類似しており、iNKTリンパ球におけるFoxp3の誘発は、GITRにより介在された接触依存メカニズムを通して、これら細胞に発揮された抑制機能を与えることを示唆した。
【0160】
例5 Foxp3+iNKT細胞のIn vivo分化はTGF-β依存性
【0161】
Foxp3gfpマウスが産生されたとき、主たる造血系は、Foxp3の発現のためスクリーニングされた。Tリンパ球およびBリンパ球、NK1.1+細胞、マクロファージ、樹状細胞において、Foxp3発現は、αβ T細胞(37)に対して制限されるか観察された。この研究において、NK1.1+TCRβ+リンパ球およびFoxp3発現として、細胞性サブセットが除外された点で、NKT細胞は確認された。しかしNK1.1レセプターの表現型を欠いたNKT細胞の小サブセットがある。加えて、従来型Tリンパ球のサブセットのいくつかは活性化の際、NK1.1を発現できる。それゆえTCRを特定に認識できる四量体を用いて明瞭なinvariant NKT細胞を認識することによって、この観察を確認することをこころみた。肝臓、脾臓、フ゜ールされたLN、パイエル板(PP)と未感作C57Bl/6マウス(図6a,b)の胸腺から単核細胞を集めた。CD4+T細胞の比率がFoxp3を発現した一方、いずれの組織からのiNKT細胞ゲートにおいて検知できないFoxp3が観察された。Balb/cマウスおよびFoxp3gfpマウス(図7)を用いて同様の結果が得られた。
【0162】
α-GalCerへの消化管暴露は、腸間膜リンパ節(MLN)でのFoxp3+iNKT細胞の認識につながるのか、また同じ方法で、口腔耐性は、MLN(43)でFoxp3+Treg細胞のde novo誘発へつながるのか調べた。α-GalCerが胃内のルートで送られたとき、MLNでのFoxp3+iNKT細胞の集積を観察して、マウス(図6c)ごとの細胞の平均値が1383(±206, SD)になった。注視すべき点として、MLNからのFoxp3+iNKT細胞のほとんどが、CD25低値を発現した。Foxp3+iNKT細胞のin vivo産生がTGF-βを必要とするかを調べるために、T細胞およびNKT細胞がTGF-βシグナル(図6c)(44)を形質導入できないdnTGFβRIIマウスへの胃管栄養法によりα-GalCerが送られるとき、Foxp3+iNKT細胞が誘発されないことを観察した。
【0163】
TGF-β、組織のリモデリングを特徴とする繊維症のキーメディエーターを含むサイトカインを有する環境下で知られているiNKT細胞であるアレルギー性気道疾患のマウスモデルを調べた(45)。水酸化アルミニウム(alum)腹腔投与でオボアルブミン(OVA)をもちいて感作されたBalb/cマウスとC57Bl/6マウスの肺から遊離し、つづいて急性もしくは慢性アレルギー性気道疾患(図8)(45)につうずるとして知られているプロトコルと一致して気道に送られたOVAを用いて接種された、iNKT細胞内でのFoxp3表現型を、コントロールとしてはCD4+Tリンパ球の中も調べた。急性もしくは慢性疾患であるかを問わず、もっともアレルギー性の高いマウスの肺から識別されたiNKT細胞によって発現したFoxp3を、識別されたCD4+T細胞(図6d)より低値ではあるが発見された。注視すべき点として、未感作で、操作されていないコントロールマウスの肺から識別されたiNKT細胞は、CD4T細胞とは異なり、Foxp3発現(図6d)を示さなかった。
【0164】
両者を考慮し、Foxp3+iNKT細胞は、胸腺で通常は産生されておらず、TGF-βが存在する環境の末梢で誘発されていることがこの観察より示唆される。
【0165】
例6 実験的アレルギー脳炎(EAE)の予防とFoxp3+iNKTreg細胞の局所発現に存在する関連
【0166】
iNKT細胞(46)発現が以前の保護効果に起因するかを実証するため、多発性硬化症の実験モデルマウス(MS)を使用し、これはFoxp3+iNKTreg細胞の局所集積に関連する。iNKT細胞間にてFoxp3+iNKT細胞の過剰発現(図9)を呈する頸部リンパ節を補強することが認められた。Foxp3+iNKT細胞の増大は著しく中枢神経系(CNS)に制限されており、全身(すなわち、脾臓やCNSを排出しないリンパ節)では観察されていない。この観察からiNKTreg細胞が全体的な免疫抑制の発現がなく、局所の抗炎症作用に介在できることが示唆された。EAEを誘発されたマウスにα-GalCerを投与した。α--GalCerを投与された全てのマウスにはEAEが発病せず、Foxp3+NKTreg細胞の増加が排出リンパ節で観察された。このことから我々のデータで、NKTreg細胞のin vivo産生にNKT細胞アゴニストの使用が可能であり、免疫介在性疾患の予防が可能であることを確証した。
【0167】
例7 ヒトiNKT細胞のFoxp3+iNKTreg細胞への転換可能
【0168】
Foxp3発現がヒトiNKT細胞を誘導できるかも評価した。ヒト抹消血中(47)のiNKTリンパ球の発現が少ないことを考慮して、全T細胞を磁気分離で濃縮し、TGF-βだけでなくIL-12抗体、IFN-γ、IL-4抗体(ヒトCD4 T細胞をFoxp3+Tregsに変換する前述の好ましい環境(48))に対する抗体の遮断カクテルも含め、偏光環境下にて集団細胞群を培養した。培養5日後に最大40%のヒトiNKT細胞がFoxp3にアップレギュレートした。従来のCD4+T細胞(図10)と比べて変換が効率化した。変換したヒトFoxp3+NKT細胞はCD25+、GITR+、そして大部分はCD161+であったが、CD127は約半数のFoxp3+iNKT細胞を発現した。
【0169】
例8 in situ Foxp3+iNKT産生によるアレルギー性気道疾患(喘息)の予防
【0170】
アレルギー性気道疾患に罹患したマウスモデル(オボアルブミン(OVA)や一般的なアレルゲンであるイエダニ、チリダニ類への感作に基づく)を0日目と14日目にアルミニウム容器に入れ、その後20日目、21日目、22日目に鼻腔内にアレルゲンを入れ感染させた。alpha-GalCer(NKT細胞刺激化合物)の単独鼻腔内投与もしくはTGF-βの追加は、気道のNKTreg細胞集積を導くか、気道疾患の臨床症状の予防を導くかどうかを測定した。NKTregを誘発するレジメンが鼻腔内アレルゲン感染と同日に行われた。疾患重症度の低減は組織切片内の炎症性浸潤の低減;肺ホモジネート内のTh2サイトカイン(IL-4、IL-5、IL-13)減少、気管支肺胞洗浄における好酸球含有量の減少、重要なものは気道過敏症状の低減によって評価し、メタコリン吸入量増加に対する反応(気道抵抗)により判定した。
【0171】
気道へのアレルゲン侵入時間に関連し、以下の異なった投与タイミングで試験した。症状発現は治療を誘発するNKTregの事前曝露によって防止できるか、(2)疾患発現はアレルゲン曝露時に治療を誘発するNKTregの投与によって低減できるか、そして汚染時にマウスは顕性アレルギー性気管支炎を発症するかである。
【0172】
参考文献
1.Kronenberg M.、2005年、Annual review of immunology 23:877-900『NKT細胞の生物学的理解に向けて:進歩とパラドックス』
2.Gumper J.E.、S.Miyake、T.Yamamura、およびM.B.Brenner、2002年、The Journal of experimental medicine 195:625-636『CD1d四量体染色により明らかとなったCD1dに限定された機能的にNKT細胞に特異なサブセット』
3.Miche M.L.、A.C.Keller、C.Paget、M. Fujio、F.Trottein、P.B.Savage、C.H.Wong、E. Schneider、M.Dy、およびM.C.Leite-de-Moraes、2007年、The Journal of experimental medicine 204:995-1001『気道内での好中球の出現に関与するIL-17産生性NK1.1(陰性)iNKT細胞集団の同定』
4.Coquet J.M.、S.Chakravarti、K.Kyparissoudis、F.W.McNab、L.A.Pitt、B.S.McKenzie、S.P.Berzins、M.J.Smyth、およびD.I.Godfrey、2008年、Proceedings of the National Academy of Sciences of the United States of America 105:11287-11292『NKT細胞サブセットによる多様なサイトカイン産生およびIL-17産生性CD4-NK1.1-NKT細胞集団の同定』
5.Rachitskaya A.V.、A.M.Hansen、R.Horai、Z.Li、R.Villasmil、D.Luger、R.B.Nussenblatt、およびR.R.Caspi、2008年、J Immunol 180:5167-5171『最先端科学:NKT細胞がIL-23レセプターおよびRORγtを構成的に発現し、レセプター結紮時にIL-6に依存しない方法により急速にIL-17を産生する。』
6.Lee K.A.、M.H.Kang、Y.S.Lee、Y.J.Kim、D.H.Kim、H.J.Ko、およびC.Y.Kang、2008年、Cellular immunology 251:50-55A『ナチュラルキラーT細胞に特異なサブセットが、気道過敏性の原因とならずに好中球の気道浸潤に寄与してIL-17を産生する。』
7.Niemeyer,M.、A.Darmoise、H.J.Mollenkopf、K.Hahnke、R.Hurwitz、G.S.Besra、U.E.Schaible、およびS.H.Kaufmann、2008年、Immunology 123:45-56『遺伝子発現プロフィールによるナチュラルキラーT細胞の特徴分析:Tヘルパー1型(Th1)、Th2およびTh17免疫反応を橋渡しする多面性の説明』
8.Rafter,M.J.、F.Winau、T.Giese、S.H.Kaufmann、U.E.Schaible、およびG.Schonrich、2008年、European journal of immunology 38:668-679『ウィルス危険信号がCD1dデノボ合成およびNKT細胞活性化を制御する。』
9.Biburger,M.、およびG.Tiegs、2008年、Journal of leukocyte biology 84:264-279『活性化により誘発されるNKT細胞の低応答性はアルファ−ガラクトシルセラミド肝炎を防ぐが、活発な転写調整要因には依存しない。』
10.Moreno,M.、J.W.Molling、S.von Mensdorff-Pouilly、R.H.Verheijen、E.Hooijberg、D.Kramer、A.W.Reurs、A.J.van den Eertwegh、B.M.von Blomberg、R.J.Scheper、およびH.J.Bontkes、2008年、J Immunol 181:2446-2454『IFN-γを産生するヒトiNKT細胞が、腫瘍関連抗原に特有の細胞傷害性T細胞の反応を促進する。』
11.Akbari,O.、P.Stock、E.Meyer、M.Kronenberg、S.Sidobre、T.Nakayama、M.Taniguchi、M.J.Grusby、R.H.DeKruyff、およびD.T.Umetsu、2003年、Nature medicine 9:582-588『アレルゲン誘発性気道過敏症の発現におけるIL-4およびIL-13産生性NKT細胞の重要な役割』
12.Gober,M.D.、R.Fishelevich、Y.Zhao、D.Unutmaz、およびA.A.Gaspari、2008年、The Journal of investigative dermatology 128:1460-1469『ヒトNKT細胞は、アレルギー性接触皮膚炎の誘出点で皮膚に浸潤する。』
13.Mattner,J.、P.B.Savage、P.Leung、S.S.Oertelt、V.Wang、O.Trivedi、S.T.Scanlon、K.Pendem、L.Teyton、J.Hart、W.M.Ridgway、L.S.Wicker、M.E.Gershwin、およびA.Bendelac、2008年、Cell host and microbe 3:304-315『ナチュラルキラーT細胞の微生物の活性化により誘発される肝臓の自己免疫疾患』
14.Jian,X.、T.Shimaoka、S.Kojo、M.Harada、H.Watarai、H.Wakao、N.Ohkohchi、S.Yonehara、M.Taniguchi、およびK.Seino、2005年、J Immunol 175:2051-2055『最先端科学:同種移植寛容性におけるNKT細胞輸送におけるCXCL16/CXCR6の重要な役割』
15.Meyer,E.H.、S.Goya、O.Akbari、G.J.Berry、P.B.Savage、M.Kronenberg、T.Nakayama、R.H.DeKruyff、およびD.T.Umetsu、2006年、Proceedings of the National Academy of Sciences of the United States of America 103:2782-2787『インバリアントT細胞レセフ゜ター+NKT細胞の糖脂質活性化は、従来のCD4+T細胞に依存しない気道過敏症を十分に誘発する。』
16.Hong,S.、M.T.Wilson、I.Serizawa、L.Wu、N.Singh、O.V.Naidenko、T.Miura、T.Haba、D.C.Scherer、J.Wei、M.Kronenberg、Y.Koezuka、およびL.Van Kaer、2001年、Nature medicine 7:1052-1056『ナチュラルキラーT細胞リガンドのα−ガラクトシルセラミドは、非肥満型糖尿病マウスの自己免疫性糖尿病を抑止する。』
17.Singh,A.K.、M.T.Wilson、S.Hong、D.Olivares-Villagomez、C.Du、A.K.Stanic、S.Joyce、S.Sriram、Y.Koezuka、およびL.Van Kae、2001年、The Journal of experimental medicine 194:1801-1811『ナチュラルキラーT細胞が活性化されると、マウスは実験的自己免疫性脳脊髄炎を発症しない。』
18.Kim,E.Y.、J.T.Battaile、A.C.Patel、Y.You、E.Agapov、M.H.Grayson、L.A.Benoit、D.E.Byers、Y.Alevy、J.Tucker、S.Swanson、R.Tidwell、J.W.Tyner、J.D.Morton、M.Castro、D.Polineni、G.A.Patterson、R.A.Schwendener、J.D.Allard、G.Peltz、およびM.J.Holtzman、2008年、Nature medicine 14:633-640『先天性免疫反応の持続的活性化により、呼吸器でのウィルス感染が慢性肺疾患へと変移する。』
19.Bendelac,A.、P.B.Savage、およびL.Teyton、2007年、Annual review of immunology 25:297-336『NKT細胞の生物学』
20.Van Kaer,L、2007年、Current opinion in immunology 19:354-364『NKT細胞:先天的にエフェクター機能を持つTリンパ球』
21.Godfrey,D.I.、およびS.P.Berzins、2007年、Nature reviews 7:505-518『NKT細胞の発達における制御点』
22.Savage,A.K.、他、2008年、Immunity 29,391-403『転写制御因子PLZFはNKT細胞系統のエフェクター・プログラムを管理する。』
23.Matsuda,J.L.、L.Gapin、J.L.Baron、S.Sidobre、D.B.Stetson、M.Mohrs、R.M.Locksley、およびM.Kronenberg、2003年、Proceedings of the National Academy of Sciences of the United States of America 100:8395-8400『マウスVA14iナチュラルキラーT細胞は、生体内サイトカイン分極化に対して耐性がある。』
24.Allan,S.E.、R.Broady、S.Gregori、M.E.Himmel、N.Locke、M.G.Roncarolo、R.Bacchetta、およびM.K.Levings、2008年、Immunological reviews 223:391-421『CD4+T制御性細胞:ヒトの疾患の治療に向けて』
25.Brusko,T.M.、A.L.Putnam、およびJ.A.Bluestone、2008年、Immunological reviews 223:371-390『ヒト調節性T細胞:自己免疫性疾患における役割と治療の機会』
26.Graca,L.、A.Le Moine、S.P.Cobbold、およびH.Waldmann、2003年、Current opinion in immunology 15:499-506『優性移植寛容性についての意見』
27.Annacke,O.、R.Pimenta-Araujo、O. Burlen-Defranoux、T.C.Barbosa、A.Cumano、およびA.Bandeira、2001年、J Immunol 166:3008-3018『CD25+CD4+T細胞はIL-10の産生を通して抹消CD4-T細胞の拡大を抑制する。』
28.Edinger,M.、P.Hoffmann、J.Ermann、K.Drago、C.G.Fathman、S.Strober、およびR.S.Negrin、2003年、Nature medicine 9:1144-1150『CD4+CD25+調節性T細胞は、骨髄移植後の移植片対宿主病を抑制して移植片対腫瘍効果を維持する。』
29.Hoffman,P.、J.Ermann、M.Edinger、C.G.Fathman、およびS.Strober、2002年、The Journal of experimental medicine 196:389-399『ドナータイプのCD4(+)CD25(+)調節性T細胞は、同種間骨髄移植後に起こる致死的急性移植片対宿主病を抑制する。』
30.Cohen,J.L.、A.Trenado、D.Vasey、D.Klatzmann、およびB.L.Salomon、2002年、The Journal of experimental medicine 196:401-406『CD4(+)CD25(+)免疫調節T細胞:移植片対宿主病に対する新しい薬物療法学』
31.Taylor,P.A.、C.J.Lees、およびB.R.Blazar、2002年、Blood 99:3493-3499『体外活性化および増殖されたCD4(+)CD25(+)免疫調節細胞の注入により、移植片対宿主病の致死性を抑止する。』
32.Hoffmann,P.、T.J.Boeld、R.Eder、J.Albrecht、K.Doser、B.Piseshka、A.Dada、C.Niemand、M.Assenmacher、E.Orso、R.Andreesen、E.Holler、およびM.Edinger、2006年、Biol Blood Marrow Transplant 12:267-274『試験のためのCD4+CD25+調節性T細胞の隔離』
33.Graca,L.、A.Le Moine、C.Y.Lin、P.J.Fairchild、S.P.Cobbold、およびH.Waldmann、2004年、Proceedings of the National Academy of Sciences of the United States of America 101:10122-10126『ドナー特異的移植寛容性:CD4+CD25+T細胞の矛盾する行動。』
34.Graca,L.、A.Le Moine、S.P.Cobbold、およびH.Waldmann、2003年、Immunologic research 28:181-191『免疫抗体に誘発される移植寛容性:優性規制の役割』
35.Sakaguchi,S.、T.Yamaguchi、T.Nomura、およびM.Ono、2008年、Cell 133:775-787『調節性T細胞および免疫寛容性』
36.Chen,W.、W.Jin、N.Hardegen、K.J.Lei、L.Li、N.Marinos、G.McGrady、およびS.M.Wahl、2003年、The Journal of experimental medicine 198:1875-1886『転写因子Foxp3のTGFβ誘導による抹消CD4+CD25−ナイーブT細胞のCD4+CD25+調節性T細胞への変換』
37.Fontenot,J.D.、J.P.Rasmussen、L.M.Williams、J.L.Dooley、A.G.Farr、およびA.Y.Rudensky、2005年、Immunity 22:329-341『フォークヘッド転写因子Foxp3別の調節性T細胞系統の仕様』
38.Komatsu,N.、他、2009年、Proceedings of the National Academy of sciences of the United States of America 106,1903-1908『ナチュラルFoxp3+T細胞の多様性:委任調節性T細胞系統と可塑性を保っている非委任少数細胞群』
39.Fontenot,J.D.、Gavin、M.A.およびRudensky、A.Y.、2003年、Nature immunology 4,330-336『Foxp3がCD4+CD25+調節性T細胞の発生と機能とをプログラムする。』
40.Hor,S.、Nomura,T.、およびSakaguchi, S.、2003年、Science(New York,N.Y299,1057-1061『転写因子Foxp3による調節性T細胞の発生制御』
41.Khattri,R.、Cox,T.、Yasayko,S.A.、およびRamsdell,F.、2003年、Nature immunology 4,337-342『CD4+CD25+調節性T細胞におけるスカーフィンの重要な役割』
42.Tone,M.、他、2003年、Proceedings of the National Academy of Sciences of the United States of America 100,15059-15064『マウス糖質ステロイドに誘発される腫瘍壊死因子レセプター・リガンドは、T細胞にとって共刺激となる。』
43.Mucida,D.、他、2005年、The Journal of clinical investigation 115,1923-1933『自然発生的調節性T細胞の欠如下における経口免疫寛容性』
44.Gorelik,L.、およびFlavell,R.A、2000年、Immunity 12,171-181『T細胞内でシグナル伝達を行うTGFβの廃止により、自然発生的T細胞の分化と自己免疫疾患が誘発される。』
45.Kearley,J.、Robinson,D.S.、および Lloyd,C.M.、2008年、The Journal of allergy and clinical immunology 122,617-624 e616『CD4+CD25+調節性T細胞は、慢性アレルギー性気道炎症からの回復を促し、気道理モデリングを抑制する。』
46.Mars,L.T.、他、2009年、Proceedings of the National Academy of Sciences of the United States of America 106,6238-6243『iNKT細胞がTh17系統の発生を抑制する。』
47.Berzins,S.P.、Cochrane,A.D.、Pellicci,D.G.、Smyth,M.J.、およびGodfrey,D.I.、2005年、European journal of immunology 35,1399-1407『対組織サンプルの個体発生研究によって明らかになった、ヒトの胸腺と血液NKT細胞内容との限定相関関係』
48.Mantel,P.Y.、他、2007年、PLoS biology 5,e329『GATA3主導のTh2反応は、TGFβ1の誘発するFoxp3の発現と調節性T細胞の形成を抑制する。』
【0173】
均等物
上記の明細書に基づくと、当業者は本発明を実施できるよう十分明確になる。発明の詳細な説明は具体例であって、例示だけを目的としており、特許請求されている本発明の範囲の限定を意図するものではない。本発明の精神を逸脱しない範囲内において種々の改良変更をなし得ることは、添付されている特許請求の範囲内に含めるものであるのが勿論である。
本出願で引用されたすべての引例、特許、公開特許出願の内容は、全体または一部を問わず、本文書で引用された使用または主題のために、引用により本文書の中に含まれる。
【技術分野】
【0001】
本出願は、「Foxp3+Regulatory natural killer T cells and a method for their generation」という発明の名称で2008年11月13日出願の米国仮出願番号61/114,362の35U.S.C.§119(e)での有用性を請求するものである。
【0002】
本出願は、「New process and use of cells」という発明の名称で2009年9月25日出願のポルトガル仮出願番号104764の有用性を請求するものである。
【0003】
上記の各出願の全体の内容は、参照によって本出願に組み入れられる。
【背景技術】
【0004】
免疫システムを制御するNKT細胞の役割が近年大きな注目を浴びている。NKT細胞の機能は、細胞致死、とりわけサイトカイン放出に依存する。特に、NKT細胞は、Th1型反応、Th2型反応、Th17型反応のサイトカインの特徴を産生することが可能で、適応免疫に影響を及ぼす(1)(2)(3)(4)(5)(6)(7)。通常のT細胞に対する影響とは、NKT細胞によって抑制されるか増幅される免疫病態であると言える(8)(9)(10)(11)(12)(13)。適応免疫に対するこのNKT細胞の影響は、移植(14)、アレルギー(15)、自己免疫(16)(17)、他の炎症病態(18)(19)で報告されている。
【発明の概要】
【0005】
一態様において、本発明は、遊離されたFoxp3+ナチュラルキラーT細胞、およびFoxp3+ナチュラルキラーT細胞を有する細胞集団を提供する。一態様において、本発明は、TGF-βおよび少なくとも1つのNKT刺激剤を使用しFoxp3+ナチュラルキラーT細胞を生成する方法を更に提供する。Foxp3+ナチュラルキラーT細胞は、in vitroで産生され、被験in situも産生される。本文書では、Foxp3+ナチュラルキラーT細胞は、Treg細胞と同様の免疫抑制特性を有することが示されており、そのため、Foxp3+ナチュラルキラーT細胞は、様々な免疫不全や免疫状態を治療するために使用される。
【0006】
Foxp3+ナチュラルキラーT細胞は、全身に投与された場合、肝臓と肺に集まる。一態様において、本発明は、これによりFoxp3+ナチュラルキラーT細胞の全身投与によって肝臓と肺の中で、免疫不全と免疫状態を治療するための方法を提供する。このような免疫不全と免疫状態には、移植片対宿主病や、肝臓移植および膵島細胞移植に関わってかひきおこされた好ましくない副作用、およびぜんそくがある。Foxp3+ナチュラルキラーT細胞の肝臓と肺への分布により、これらの組織への治療用ポリペプチドと他の物質の投与も実現する。
【0007】
さらに本発明では、Foxp3+ナチュラルキラーT細胞は、特定の解剖学的な部位(例、組織)のin situで、TGF-βとNKT刺激剤の局所投与によって生成されうる。さらに、本発明では、特定の解剖学的な部位の中で十分な量を得られる場合には、TGF-βまたはNKT刺激剤の投与の必要はない。そのため、一態様において、本発明は、Foxp3+ナチュラルキラーT細胞の局所のin situでの生成により、ある特定の解剖学的な部位での免疫不全と免疫状態を治療するための方法を提供する。
【0008】
一態様において、本発明は、遊離Foxp3+ナチュラルキラーT細胞を提供する。
【0009】
一態様において、本発明は、(a)0.001%以上のFoxp3+ナチュラルキラーT細胞と、(b)10個以上のFoxp3+ナチュラルキラーT細胞を有する遊離細胞集団を提供する。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の割合は、少なくとも0.001%、少なくとも0.01%、少なくとも0.05%、少なくとも0.1%、少なくとも0.5%、少なくとも1%、少なくとも5%、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%である。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の数は、少なくとも1個、少なくとも10個、少なくとも50個、少なくとも100個、少なくとも500個、少なくとも1,000個、少なくとも5,000個、少なくとも10,000個、少なくとも50,000個、少なくとも100,000個、少なくとも1x106個、少なくとも1×107個、少なくとも1×108である。また、いくつかの実施例において、細胞集団は、血球集団、白血球集団、T細胞集団、またはナチュラルキラーT細胞集団である。また、いくつかの実施例において、細胞群はT細胞集団である。
【0010】
一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を生成する方法、すなわち、TGF-βとFoxp3+ナチュラルキラーT細胞を十分に生成するのに十分な量の1個以上のNKT刺激剤の組み合わせを伴うナチュラルキラーT細胞を有する細胞集団へ接触する方法を提供する。いくつかの実施例において、この方法は、IL-2を伴う細胞集団との接触をさらに有する方法である。また、いくつかの実施例において、IL-7、IL-15、IL-2のいずれか、またはこれらのいずれかの組み合わせを伴う細胞集団との接触をさらに有する方法である。さらに、いくつかの実施例において、抗IFNγ抗体、抗IL-4抗IL-4、抗IL-6抗体、抗IL12抗IL-4、抗IL-27抗体で構成されるグループから選択された中和抗体のいずれか、またはこれらのいずれかの組み合わせを伴う細胞群との接触をさらに有する方法である。さらに、いくつかの実施例において、細胞集団は、血球集団、白血球集団、T細胞集団、またはナチュラルキラーT細胞集団である。また、いくつかの実施例において、細胞集団は被験から採取される。
【0011】
一態様において、本発明は、Foxp3+ナチュラルキラーT細胞の数を増やす方法、すなわち、TGF-βと、NKT刺激剤、サイトカインを誘発する少なくとも1つの増殖や少なくとも1つのFoxp3+ナチュラルキラーT細胞の数の増加に十分な量の中和抗体の組み合わせを伴う少なくとも1つのFoxp3+ナチュラルキラーT細胞を有する細胞集団との接触を有する方法を提供する。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の数が、少なくとも2倍、少なくとも5倍、少なくとも10倍、少なくとも50倍、少なくとも100倍、少なくとも200倍、少なくとも500倍、少なくとも1,000倍、少なくとも10,000倍、少なくとも100,000倍、少なくとも106倍、少なくとも107倍増加する。また、いくつかの実施例において、サイトカインを誘発する増殖は、IL-2、IL-7、IL-15、およびIL-21のいずれか、またはこれらのいずれかの組み合わせである。また、いくつかの実施例において、中和抗体は、抗IFNγ抗体、抗IL-4抗体、抗IL-6抗IL-4、抗IL-12、および抗IL-27抗体のいずれか、またはこれらのいずれかの組み合わせである。
【0012】
一態様において、本発明は、ナチュラルキラーT細胞を被験の肝臓または粘膜組織へ送るための方法、すなわちFoxp3+ナチュラルキラーT細胞の被験への全身投与を有する方法を提供する。さらに一態様において、本発明は、ナチュラルキラーT細胞を被験の肝臓または粘膜組織へ送るための方法、すなわちFoxp3+ナチュラルキラーT細胞の被験への局所的な投与を有する方法を提供する。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は自己細胞である。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、Foxp3+ナチュラルキラーT細胞を生成するために十分な量の1個以上のNKT細胞刺激剤とTGF-βを伴うナチュラルキラーT細胞との接触により生成される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、肝臓または粘膜組織内での免疫反応を抑制する効果的な量が投与される。さらに、いくつかの実施例において、肝臓内における免疫反応の抑制は、移植片対宿主病、膵島移植により引き起こされるかそれに関わる好ましくない免疫反応、または肝臓移植もしくは肝臓への免疫介在性炎症により引き起こされるかそれに関わる好ましくない免疫反応を治療するために投与される。いくつかの実施例においてFoxp3+ナチュラルキラーT細胞は、膵島移植もしくは肝移植と関連して管理される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞のゲノムは、ポリペプチドをコード化する核酸を有し、肝臓におけるポリペプチドの発現を肝臓へのFoxp3+ナチュラルキラーT細胞の送り込みがどこでなされるかに起因する。
【0013】
一態様において、本発明は、被験の組織の中の免疫反応を抑制する方法、すなわち、その組織の中の免疫反応を十分に抑制する1個以上のNKT刺激剤の量の局所的な送り込みを有する方法を提供する。いくつかの実施例において、この方法は、その組織の中の免疫反応を十分に抑制するTGF-βの量の局所的な送り込みをさらに有する。さらにいくつかの実施例において、この免疫反応は、抗原に対する免疫反応である。さらにいくつかの実施例において、この組織とは消化管または肺である。さらにいくつかの実施例において、免疫反応の抑制とは、炎症性腸疾患、クローン病、またはぜんそくである。さらにいくつかの実施例において、組織への局所的な送り込みとは、粘膜組織への送り込みである。
【0014】
一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を有する細胞群を有する医薬組成物を提供する。いくつかの実施例において、細胞群は血球集団である。さらにいくつかの実施例において、細胞群は白血球集団である。さらにいくつかの実施例において、細胞群はT細胞集団である。さらにいくつかの実施例において、細胞集団はNKT細胞集団である。
【0015】
一態様において、本発明は、TGF-βおよび1個以上のNKT刺激剤を有する薬品構成を提供する。
【0016】
本発明の限界はそれぞれ本発明の様々な実施例のすべてに適用しうる。そのため、いずれか1つの要素、または要素の組み合わせを含む本発明の各限界は、本発明の各態様に含まれうる。本発明は、以下の記述で明記する図に記載した要素の構造と配列の詳細な適用に限定されない。本発明は、他の実施例の他、様々な方法で実践または実施されうる。さらに、本文書で使用される表現や用語は説明を目的としており、制限と認識されてはならない。本文書内で使用されている「含む」、「有する」、「持つ」、「内包する」、「関わる」等は、以後列記された項目に適用し、付随項目でも同様であることを意味する。
【図面の簡単な説明】
【0017】
図は図示を目的としており、本文書で公開した発明の使用可能性のために必要なものではない。
【図1】図1は、TGF-βが存在する所でiNKT細胞がFoxp3の発現を増加させる状態を示す図である。(a)C57Bl/6ノックインマウスまたはFoxp3gfpノックインマウスの脾臓からのiNKT細胞およびCD4+CD25−T細胞は、IL-2とIL-15が存在する環境下でTGF-βの添加ありとなしの条件でFACSソートされ3日間培養された。左のフ゜ロットは、iNKTの細胞ソートのために使用されるゲーティング手法、およびエンプティCD1dテトラマーを使い評価した背景対照染色を示す。培養後に分析に使用されたゲーティング手法は、iNKTセル(上のパネル)、およびTCRβ+群(下のパネル)の中のCD4 T細胞に示すことである。Foxp3の発現はiNKT(上の列)の中の細胞内染色とC57G1/6マウスから分離された対照CD4 T細胞培養(下の列)か、Foxp3gfpノックインマウスから分離された細胞内のGFP蛍光によって評価された。示されているドットプロットは、3つの個別の実験のトリプリケート培養の代表例である。(b)C57Bl/6ノックインマウス(上)またはFoxp3gfpノックインマウス(下)からの胸腺のiNKT細胞がソートされ、IL-2、IL-15、およびTGF-βが存在する環境下で培養され、図示するとおりFoxp3発現のために分析された。(c)iNKT細胞によるFoxp3の発現は、共焦点顕微鏡観察により1細胞レベルで確認された。Foxp3gfp細胞は、3日間培養された後FACSソートされ、その不変TCRは、PEでラベルされたCD1d/PBS57テトラマー(赤)で再染色され、核小体はDAPI(青)で対比染色された。Foxp3の発現は緑で蛍光発色した。(d)C57B1/6マウスのiNKT細胞とCD4+CD25−T細胞を脾臓から取り出し、IL-2が5ng/mlありTGF-βの濃度が異なる環境で3日間培養された。培地は同一物を2個用意し、その結果は3種類の個別の実験の代表例である。(e)脾臓のiNKT細胞とCD4+CD25−T細胞(図示せず)は、プレート結束の抗CD3の濃度が異なる環境で3日間培養された。示されているドットプロットは、3つの個別の実験のトリプリケート培養の代表例である。
【図2】図2は、サイトカインの条件が異なる環境下でのBalb/c iNKT細胞の培養を示す図である。iNKT細胞は、Balb/cマウスの脾臓から取り出し、CD1d/PBS57テトラマーとpan TCR-β MAbの両方の発現に従ってFACSソートされ、3μg/mLのプレート結束の抗CD3で3日間指定の条件で刺激された。結果は3種類の個別の実験の代表例である。
【図3】図3は、表現形とFoxp3+iNKT細胞のin vivo安定性を示す図である。ネス゛ミiNKT細胞とCD4+CD25−細胞は、FACSソートされ、TGF-βとIL-2が存在する環境下で3日間培養され、Foxp3と表示分子のために両方が染色された。(aとb)示された動向は、iNKT細胞またはCD4細胞の部位でゲートされた(図6の図に定めたとおり)。結果は、少なくとも2つの個別の実験の代表例である。(c)TGF-βとIL-2が存在する環境下での3日間培養された後のFACSソートされたiNKT細胞またはCD4細胞からのFoxp3とPLZFのためにコード化されたmRNAのRT-PCRである。各遺伝子の発現は、EF1Aの発現と比較して示されている。
【図4】図4は、Foxp3+iNKT細胞のin vivo安定性を示す図である。脾臓iNKT細胞とCD4+CD25− T細胞は、Foxp3gfpノックインマウスから取り出され、TGF-βとIL-2が存在する環境下で3日間培養された。Foxp3-GFP+細胞FACSでソートされ、5´104iNKT細胞(上のパネル)またはCD4+CD25− T細胞(下のパネル)がRAG2−/−受容宿主の静脈内に注入された。これらのマウスは21日後に処分され、iNKT細胞とCD4 T細胞の存在が、複数の組織で評価された。この図に、肝臓とリンパ節の塊の中でのiNKT細胞とCD4 T細胞のFoxp3とCD25の発現を示す。iNKT細胞は肝臓でのみで検出された。
【図5】図5は、GITR介在接触依存機構によるT細胞の増殖を抑制するFoxp3+ iNKT細胞を示す図である。(a)Foxp3+iNKT細胞、Foxp3− iNKT細胞、またはiTreg細胞は、偏光条件下でFoxp3gfpノックインマウスからのiNKT細胞とCD4 T細胞のin vitro培養からソートされ、nTreg細胞は元のC57B1/6マウスから分離された。ソートされた細胞は、可溶性抗CD3 MAbが存在する環境下で96時間、マイトマイシンC処理脾細胞とFACSソートCD4+CD25−(キラー細胞)T細胞と共に、異なる割合において、トリプリケートで相互に培養された。増殖は、培養の最後の12時間での[3H]チミシ゛ン結合により高まった。上のパネルに、キラー細胞のみの増殖に標準化された3つの個別の実験(それぞれトリプリケートで)からの増殖抑制の平均値を示す(平均±SEM)。下のパネルに、2:1の比(調節細胞8000:キラー細胞4000)での代表的な実験でのデータを示す。増殖の抑制は統計的に有意(n=3,*P<0.05)だった。(b)抗IL10Rブロック抗体ではなく、抗GITRの添加は、増殖効果を無くした(n=4,**P<0.01)。(c)Foxp3+iNKT細胞は、(a)の場合のように刺激されたキラー細胞と共に1:1の割合にてTranswellで培養された。黒の柱状グラフは、キラー細胞がFoxp3+iNKT細胞と同じ培地で共に培養された時のキラー細胞の増殖を、ク゛レーの柱状グラフは、キラー細胞がFoxp3+iNKT細胞と別の培地で培養された時のキラー細胞の増殖を、波線の柱状グラフは、調節細胞が存在しない環境下でのキラー細胞の増殖を示す。ハ゜ーセントは、指定ゲート内の3条件でのキラー細胞の頻度を示す。
【図6】図6は、Foxp3+iNKT細胞のin vivo変換がTGF-βに依存しているることを示す図である。(a)肝臓から取り出したリンパ球、リンパ節の塊、パイエル板、未使用C57B1/6マウスの脾臓と胸腺の中でのFoxp3の発現の分析である。iNKT細胞は、リンパ球ゲートの中をPBS57とpan TCR-β抗体で満たされたCD1dテトラマーで共に染色することで見分けられた。iNTK細胞の背景染色は、エンプティCD1dテトラマーを使用した平行染色ですべての組織について評価された(肝臓の場合のみ図示)。(b)Foxp3発現は、細胞内抗体染色で分析した。Foxp3+細胞は、CD1d/PBS57−細胞の中にのみ存在した。Foxp3+細胞が、CD4+ Tリンパ球であることを確認した(右のドットプロットでLNの場合のみ図示)。結果は、2つの個別の実験での3匹のマウスの代表例である。(c)1週間にわたるα-GalCerの胃内投与を実施したC57BL/6マウスまたはdnTGFβRIIマウスのMLNからのiNKT細胞でのFoxp3の発現の分析。(d)Foxp3の発現、および慢性または急性のアレルギー性気道疾患のマウスの肺から遊離したiNKT細胞またはCD4 T細胞内のハウスキーピング遺伝子EF1Aの分析である。各動物の肺から1,000個から5,000個のiNKT細胞が、フローサイトメトリーによりソートされ、個別に帯状に示した。操作を受けていない未使用のマウス5匹からの肺のiNKT細胞とCD4 T細胞が少ないために一緒に集められた。実験は、C57Bl/6マウスとBALB/cマウスで個別に実施された。
【図7】図7は、未使用のBalb/cノックインマウスとFoxp3gfpノックインマウスからのiNKT細胞で、Foxp3発現がないことを示す図である。肝臓から取り出したリンパ球、リンパ節の塊、パイエル板、未使用Balb/cマウスとFoxp3gfp マウスの脾臓と胸腺の中でのFoxp3の発現の分析である。iNKT細胞は、リンパ球ゲートの中をPBS57とpan TCR-β抗体で満たされたCD1dテトラマーで共に染色することで見分けられた。
【図8】図8は、アレルギー性気道疾患のBalb/cマウスとC57Bl/6マウスの肺から採取したiNKT細胞の摘出物を示す図である。Balb/cマウスまたはC57Bl/6マウスの5匹のグループは、アレルギー性気道疾患の慢性または急性の状態を引き起こしたため、OVA-alum i.p.で反応性を高めた指定の日数塩水内の50μgのOVAで鼻内負荷を受けた。(a)慢性または急性のアレルギー性気道疾患を引き起こすための手順を図示した。(b)気管支肺胞洗浄(BAL)における好酸球増加と、肺の細胞内容である。(c)各実験グループの代表的な1匹のマウスの肺の中のiNKT細胞とCD4 T細胞の染色を示すFACSデータで、定量RT-PCR分析前で重複排除(図示せず)後のiNKT細胞(左列)とCD4 T細胞をソートするために使用するゲートを示した。(d)慢性(上のパネル)、急性(中のパネル)、未使用(下のパネル)のマウスからの肺組織の組織切片に、ヘマトキシリン/エオシンを使い染色した。
【図9】図9は、EAEから守られたマウスの頚部リンパ節内にFoxp3+iNKT細胞が蓄積した様子を示す図である。EAEは、CFAと百日咳毒素とMOGペプチドの両方の投与によりC57B1/6マウスで引き起こされた。マウスの一部は、各所で示すとおりα-GalCerを使い同時に治療された26。EAEは臨床記録され、中枢神経系に浸透し、頚部リンパ節(LN)のリンパ球数と脾臓が評価された。(a)左パネルに、頚部リンパ節内のiNKT集団、右パネルにiNKTゲート内のFoxp3発現を示す。(b)iNKT細胞(上のパネル)と、Foxp3+ iNKT細胞(下のパネル)の具体的な数が示され、それぞれの記号は、未使用、MOG介在、MOG+α-GalCer処理実験のグループからの1匹の個別のマウスに対応する。細い横棒は平均、太い横棒はグループ間の統計的優位性を示す(n=4または5,*P<0.05)。
【図10】図10は、Foxp3の発現がヒトiNKT細胞の中で引き起こりうることを示す図である。末梢血からのヒトiNKT細胞とCD4+細胞は、磁気的に強められ、TGF-β、抗IL4抗IL-4、抗IL12抗IL-4、抗IFN-γ抗体、抗CD28 MAbs抗IL-4を含む変換混合液が存在する環境と存在しない環境下で5日間相互に培養された。iNKT細胞は、リンパ球ゲート(上)の中のPBS57と抗TCR-Vβ11 MAbで満たされたヒトCD1dテトラマーの相互の染色によって見分けた。iNKT細胞の背景染色は、エンプティヒトCD1dテトラマーを使い平行染色で評価された(左上)。CD4 T細胞は、CD1d/PBS57ネガティブ区域の中でゲートされた(右上)。下のパネルは、Foxp3、およびiNKT(上の列)とCD4+ T細胞(下の列)の中のCD25、CD127、GITR、またはCD161の同時発現を示す。結果は、条件ごとに少なくとも3つの重複した培養で異なる血液ト゛ナーによる3つの個別の実験の代表例である。
【発明を実施するための形態】
【0018】
一態様において、本発明は遊離されたFoxp3+ナチュラルキラーT細胞とFoxp3+ナチュラルキラーT細胞を有する細胞集団を提供する。一態様において、本発明はTGF-βや少なくとも1つのNKT細胞刺激剤を用いながら、Foxp3+ナチュラルキラーT細胞を産生する方法を提供する。Foxp3+ナチュラルキラーT細胞はin vitroで産生され、被検者(被験?統一されていませんが)においてin situにおいて産生された。Foxp3+ナチュラルキラーT細胞は、Treg細胞に対し免疫抑制力に似た特性をもち、そしてFoxp3+ナチュラルキラーT細胞が様々な免疫疾患や免疫状態を処置するために用いることが可能であることが、この点で、証明された。
【0019】
Foxp3+ナチュラルキラーT細胞
【0020】
一態様において、本発明は遊離されたFoxp3+ナチュラルキラーT細胞とFoxp3+ナチュラルキラーT細胞を有する遊離された集団を提供する。
【0021】
ナチュラルキラーT細胞(以下NKT細胞)は、NK1.1 and NKG2D(19)を含むNK直系からのCD1d分子や受容体によって出現された糖脂質抗原を認識するαβ TCRを発現する胸腺由来のリンパ球である。ナチュラルキラーT細胞はType 1 NKT(invariant)、Type 2 NKT、 NKT様に分類される。最もよく研究されたNKT細胞のサブセットはinvariantなα鎖(マウスではVα14-Jα18,ヒトではVα24-Jα18)と制御されたTCR-β鎖レハ゜ートリー(マウスでは、Vβ8.2,Vβ7,Vβ2,ヒトではVβ11)を有するsemi-invariant TCRを有する。これらの細胞は、タイフ゜I、クラシカルまたはinvariant なNKT(iNKT)細胞として知られ、CD1d分子に関連するMHCクラスIの中にある糖脂質を認識することができる。認識に用いられる特有のTCRを有しながらも、iNKT細胞は、多くの分子表面をT細胞と共有する。すなわちマウスではCD3とCD4そしてヒトではCD8(19)(20)である。T細胞もNKT細胞もともに胸腺で成熟する。invariantなTCRをもとにしたNKT細胞の正の選択は、従来のTリンパ球(21)に関し胸腺上皮細胞にかわって細胞を発現しているCD1d+抗原として働くDP胸腺リンパ球によって伝えられる。NKT細胞は、細胞系マーカーPLZF(22)の発現によって分子レベルで特徴付けられるTリンパ球から分化した系と考えられている。
【0022】
in vivoで確認されているiNKT細胞サブセットは、Th1細胞(IFN-γを産生)、Th2細胞(IL-4とIL-13を産生)で、さらに最近においてはTh17細胞(IL-17を産生)に類似している機能的特徴を示すとされている(1)(2)(3)(4)(5)。興味深いことに、TCR刺激によるiNKT細胞サイトカイン産生は従来のTリンパ球(23)の機能的分化を左右しているのと同じ転写機能によって影響されているわけではないようである。
【0023】
一態様において、本発明は、Foxp3+を発現するために変化しているNKT細胞を提供している。FoxP3を発現しているNKT細胞は、ここではFoxp3+NKT細胞,Foxp3+ナチュラルキラーT細胞,Foxp3+TregNKT細胞、NKTreg細胞、ナチュラルキラーTreg細胞、TregNKT細胞、Foxp3+TregナチュラルキラーT細胞、Foxp3+TregulatoryナチュラルキラーT細胞として言及されている。いくつかの実施例において、本発明はFoxp3+細胞に分化しており、またここではiNKTregとして関係しているinvariantなNKT細胞(iNKT)を提供している。いくつかの実施例において、本発明は、NKT Foxp3+細胞へと分化しているnon-iNKT細胞(タイフ゜2 NKTまたはNKT様細胞)を提供している。Foxp3の発現は一般的にTreg細胞と関連付けられ、かつてはNKT細胞上では見つかっていなかった。Treg細胞は、有力な免疫抑制特性を持ちそして病的な自己反応(すなわち、自己免疫疾患)やそしてアレルギー、炎症性腸疾患、移植片対宿主病、移植拒絶反応などの免疫疾患などを防ぐと考えられている。興味深いことに、Foxp3+NKT細胞は、Foxp3+Tregリンパ球に似ている表現型を提示する。つまりCD25+、CTLA-4+、GITR+であり、そして機能的に、効果的にFoxp3+Treg細胞と比べ、T細胞増殖を抑制することができる。
【0024】
ここで示されているFoxp3+ナチュラルキラーT細胞は、NKT表現型(例えば、マーカー)とTreg表現型(例えば、Foxp3マーカー)の両者を有する。加えて、ここで示されているFoxp3+ナチュラルキラーT細胞は、Treg細胞(T細胞増殖を抑制する能力)と機能的同様を有する。しかしFoxp3+ナチュラルキラーT細胞は、Foxp3ナチュラルキラーT細胞、Treg細胞の両者、そしていずれの他の細胞タイフ゜からも見分けることが可能であることが分かるる。Foxp3+ナチュラルキラーT細胞は、NKT細胞とFoxP3マーカーに特有な少なくとも1つのマーカーとの認識によって少なくとも特徴付けられる。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、α--GalCerのような糖脂質にあるCD1dに結合する能力によって特徴付けられ、またFoxP3マーカーを持つ。さまざまなNKT細胞をCD1dとこの定量に用いられるさまざまなリガンドへの結合決定のための具体的な定量を下に示す。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、CD25+、CTLA-4+、GITR+、CD103+、IL7-Rα-、CD27-、CD62L-、NK1.1-、DX5-、NKGD2+そしてPLZF+のマーカー表現型のいずれかとの組み合わせがある。Foxp3+ナチュラルキラーT細胞は、CD4+もしくはCD4-のいずれかになりうる。これらのマーカーのすべてがFoxp3+NKT細胞として分類される細胞上で発現されなければならないわけではないことが分かる。
【0025】
iNKT細胞上でのFoxp3発現の誘導は、Foxp3+Treg細胞によっても発現される遺伝子パネルのアップレギュレーションと調整される。機能的にFoxp3+NKT細胞は、強力な調節の可能性を示している。しかT細胞特有の表現型選択はいくつかの独自の特徴を持つFoxp3+NKTreg細胞とともに絶対的ではなかった。例えば、Foxp3+iTregはCD62Lの発現のためのへテロ先天性であって、二次リンパ系器官へ高内皮差性細静脈(HEV)を通過して再循環するための能力を持つものもあることを示している。対照的にNKTreg細胞はCD62Lをもたず、それゆえ、その周辺での免疫学の状況において介在が制限されているようである。
【0026】
Foxp3+ナチュラルキラーT細胞は、機能的定量によって特徴付けられることを正しく理解されたい。Foxp3+NKT細胞は、NKT細胞としての同等の量と組成においてサイトカインを分泌する能力を失っている。Foxp3+ナチュラルキラーT細胞は、Treg細胞として同様の免疫抑制力の特性を有する。細胞免疫抑制力の特性は、例えば、活性化されたCD4+CD25−キラー細胞増殖の抑制のための細胞の能力によって測られる。Foxp3+NKT細胞の免疫抑制機能は、免疫抑制特性の抑止となるこの相互作用遮断としてのGITR-GITRL相互作用によって伝えられると考えられている。
本発明は、遊離されたFoxp3+ナチュラルキラーT細胞とFoxp3+ナチュラルキラーT細胞のみより構成される細胞の集団と、Foxp3+ナチュラルキラーT細胞を有する集団を含む。細胞もしくは細胞集団に付属しているときに「遊離」とは、被験以外(すなわち、ヒトもしくはヒト以外の動物)の細胞や細胞集団に関する。いくつかの実施例において、細胞は十分に他の細胞から分離され、もしくは、自己同一性が確認され、ここで述べられた方法に従って特徴が確かめられ活用された他の細胞に対し、細胞の数が増したものである。例えば、遊離された細胞や細胞集団は、被験から採取され、in vitroで増殖されたか、他の細胞より産生された。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞からなる細胞集団は、少なくとも0.001%、少なくとも0.01%、少なくとも0.05%、少なくとも0.1%、少なくとも0.5%、少なくとも1%、少なくとも5%、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%のFoxp3+ナチュラルキラーT細胞を有する。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞を有する細胞集団は、少なくとも1、少なくとも10、少なくとも50、少なくとも100、少なくとも500、少なくとも1,000、少なくとも5,000、少なくとも10,000、少なくとも50,000、少なくとも100,000、少なくとも1x106、少なくとも1x107、少なくとも1x108のFoxp3+ナチュラルキラーT細胞を有する。細胞集団(すなわち、FoxP3細胞以外)の細胞の残余は、他の性質を有することがある。したがって例えば、本発明は、Foxp3+ナチュラルキラーT細胞とFoxP3−ナチュラルキラーT細胞の集団と、Foxp3+ナチュラルキラーT細胞とT細胞(他のサフ゛クラス)の集団とを含む。いくつかの実施例において細胞集団は、Foxp3+ナチュラルキラーT細胞と血球(いずれのサフ゛クラス、例えば赤血球)の組み合わせである。いくつかの実施例において細胞集団は、Foxp3+ナチュラルキラーT細胞と血球以外の細胞の組み合わせである。いくつかの実施例において、細胞集団は、Foxp3+ナチュラルキラーT細胞、血球、血球以外の細胞の組み合わせである。本発明は、Foxp3+ナチュラルキラーT細胞や、いずれの起源(例えば、ヒトやマウスのような動物)もしくは、いずれの組織由来の(例えば、脾臓や胸腺など)のFoxp3+ナチュラルキラーT細胞からなる細胞集団を含む。
【0027】
Foxp3+ナチュラルキラーT細胞の生成
【0028】
一態様において、本発明は、Foxp3+ナチュラルキラーT細胞の生成方法を提供する。いくつかの実施例において、TGF-βとFoxp3+ナチュラルキラーT細胞を十分に生成するのに十分な量の1個以上のNKT刺激剤の組み合わせを伴うナチュラルキラーT細胞を有する細胞集団への接触を有する方法を有する。いくつかの実施例において、細胞集団はIL-2にも接触している。いくつかの実施例において、細胞集団はIL-7、IL-15およびまたはIL-21にも接触している。いくつかの実施例において、中和抗体である抗IFNγ抗体、抗IL-4抗体、抗IL-6抗体、抗IL12抗IL-4およびまたは抗IL-27抗体とも接触している。いくつかの実施例において、細胞群は血球集団、白血球集団、T細胞集団である。いくつかの実施例において、細胞集団は被験から採取される。
【0029】
ここに記載されたFoxp3+ナチュラルキラーT細胞の生成方法はFoxP3−ナチュラルキラーT細胞(すなわち、「正常な」ナチュラルキラーT細胞)によるものを示している。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の生成はin vitroで行われた。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の生成はin vivoで行われた。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の生成はin situである特定の解剖学的な部位(例、臓器)で行われた。Foxp3+細胞から生成されたNKT細胞はいかなる臓器にもなりうる。さらに、いくつかの実施例において、NKT細胞はマウス細胞である。さらに、いくつかの実施例において、NKT細胞はヒト細胞である。さらに、いくつかの実施例において、NKT細胞は肝臓、脾臓、胸腺から採取される。さらに、いくつかの実施例において、NKT細胞は血液から採取される。
【0030】
少なくともFoxp3+ナチュラルキラーT細胞の生成方法は1個以上のNKT刺激剤とTGF-Βの接触により有することを示す。
【0031】
本発明は、刺激されたNKT細胞内でFoxP3を発現させた、いかなるTGF-βの使用もしくはTGF-βアナロク゛の使用を含んでいる。そのため、Foxp3+ナチュラルキラーT細胞を生成するために使用されたとおり、TGF-βには、TGF-βの3つのイソ型(TGF-Β1、TGF-Β2、TGF-Β3)、タンパク質前駆体TGF-β、成熟TGF-βがある。ここで使用されるTGF-βとして、TGF-β変異体およびTGF-β(例、cytomodulin-10)と同様の機能を有するTGF-Β同類物も含まれる。
本発明は、TGF-Βを排出する細胞も含む。加えて、元々臓器にTGF-βが豊富に存在するため、任意でこれら臓器内にin vivoでFoxp3+ナチュラルキラーT細胞を生成するために追加のTGF-Β投与をすることはないことが分かる。腸管、両肺、骨髄、肝臓のように、癌細胞の付着した臓器をふくみ、内臓にはTGF-Βが元々豊富に存在する。TGF-βが豊富な環境を提供するために、1つの臓器内の全細胞がTGF-Βを十分有する必要はなく、豊富でなくともNKT細胞からFoxp3+陽性細胞への転換ができることが分かる。しかしTGF-Βが豊富な臓器内でFoxp3+ナチュラルキラーT細胞を産生するにはやはり1個以上のNKT刺激剤の投与が必要である。いくつかの実施例において、NKT細胞からFoxp3+ナチュラルキラーT細胞を生成する条件として、少なくとも1ng/mlのTGF-β、少なくとも2ng/mlのTGF-β、少なくとも3ng/mlのTGF-β、少なくとも4ng/mlのTGF-β、少なくとも5ng/mlのTGF-β、少なくとも10ng/mlのTGF-β、少なくとも100ng/mlのTGF-β、少なくとも1microg/mlのTGF-β1、少なくとも10microg/mlのTGF-βの細胞への接触を含む。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の産生はin vitroで行われTGF-β濃度は少なくとも10ng/mlである。TGF-β濃度はNKT細胞とNKT細胞の性質を有した細胞集団の組成に最低限しか左右されない。すべての実施例において、NKT細胞内のFoxP3発現に至ったTGF-β濃度は好ましいものである。当業者はFoxP3発現の測定ならびにTGF-β濃度の調整を要求があれば容易に行える。
【0032】
NKT細胞刺激剤は、当技術分野では公知であり、CD1d(α-GalCなど)や、抗CD3抗体などの受容体からの経路の下流で作用するいくつかの物質によって出現するいずれかの糖脂質を含む。NKT刺激剤には、抗CD3抗体と、フィトヘムアグルチニン(PHA)と、コンカナバリンA(ConA)と、ホルボール12-ミリスタート13-アセタート(PMA)と、イオノマイシン、およびリガンド(α-GalCer、PBS57、GSL-1、OCH、その他を含むCD1dリガンド)で満たされたテトラマーのなどのTCRアゴニストとを有する。CD1dによって出現されるすべての糖脂質はNKT刺激剤として機能する。さらに、NKT細胞を刺激する糖脂質の類似体がいくつか存在する。NKT刺激剤はまた、機能的定量においても認められる。例えば、NKT細胞は、細胞と仮想の刺激剤を出現する抗原を用いて培養され、そのNKT細胞がIL-2、IL-4およびIFN-γなどのサイトカインを排出するかを評価することで、そのNKT細胞の刺激に対する分析がなされる。Foxp3+NKT細胞のin vitroでの生成におけるNKT細胞の刺激は、例えば、そのNKT細胞に固定化した抗CD3抗体を接触、またはそのNKT細胞の生育培地にNKT刺激剤を添加することで実施される。加えて、これらのNKT刺激剤のいずれかによって満たされた抗原提供細胞は、そのNKT集団に混合できる。In vivoでのNKT細胞の刺激はα-GalCerのようなNKT刺激剤を被験に投与することで実施される。そのNKT細胞は複数のNKT刺激剤にも接触することが分かる。NKT刺激剤の濃度は、そのNKT刺激剤の本質、そのNKT細胞の本質およびそのNKT細胞を有する細胞集団の組成に最小限に依存する。すべての実施例において、NKT刺激剤の濃度は、そのNKT細胞を刺激して得られることが望ましい。当業者は、必要に応じて、NKT細胞が刺激されたかを直ちに判定し、NKT刺激剤の濃度を調整することができる。
【0033】
いくつかの実施例において、TGF-Βと1個以上のNKT刺激剤に加え、そのNKT細胞はIL-2にも接触される。IL-2は、本文書で使用するとき、IL-2およびIL-2と同様の生物学的機能を持つ変異体のことを指す。IL-2に接触するとは、本文書で使用するとき、特定のIL-2の種や特定のIL-2の変異体に限定されるものではない。したがって、非ヒトIL-2が交差反応性であるならば、ヒトNKT細胞はその非ヒトIL-2に接触できる。さらに、IL-2の機能的変異体(e.g.R38AやF42Kのようなアミノ酸突然変異を含む)の説明とは、これらの変異体と、IL-2の機能的断片とこれらのIL-2の変異体もまた、この発明に含まれる。いくつかの実施例において、その細胞は少なくとも濃度5ng/mlのIL-2に曝される。さらに、いくつかの実施例において、TGF-Βに加えて、1個以上のNKT刺激剤と、任意のIL-2と、1個以上のサイトカインまたはサイトカイン中和抗体が、そのNKT細胞に加えられる。さらに、いくつかの実施例において、そのNKT細胞は、IL-7、IL-15もしくはIL-21またはそれらの機能的変異体および類似体に接触される。いくつかの実施例において、そのNKT細胞は、抗IFNγ抗体、抗IL-4抗体、抗IL-6抗体、抗IL-12抗体、抗IL-27抗体と接触される。サイトカインとサイトカイン中和抗体の濃度と組み合わせは、そのNKT細胞の本質(e.g.ネス゛ミかヒトか)、そのNKT細胞の起源(e.g.胸腺由来か血液由来か)、そのNKT細胞を有する細胞集団の組成、または使用されるサイトカインもしくは中和抗体の本質によって変化することが分かる。例えば、サイトカインと中和抗体の組み合わせと濃度は、主にNKT細胞を有する集団と、主に非NKT血球とわずかな量のみのNKT細胞を有する細胞集団とでは異なることがある。当業者は、本文書に示された方法に従って、サイトカインとサイトカイン中和抗体の組み合わせと濃度を調整して、望ましい程度のFoxp3+NKT細胞を入手できる。いくつかの実施例において、そのNKT細胞はヒト細胞で、そのヒトNKT細胞は少なくとも10ng/mlのTGF-Β、少なくとも5microg/mlの抗IL-12抗体、少なくとも5microg/mlの抗IL-4抗体、少なくとも5microg/mlの抗IFN-γ抗体、少なくとも2microg/mlの抗CD28および20U/mlのIL-2に曝される。
【0034】
Foxp3+NKT細胞は、少なくとも1個のNKT細胞を有するいずれの細胞集団からも生成される。例えば、Foxp3+NKT細胞は、NKT細胞の0.001%から1%を構成する末梢血から生成される。いくつかの実施例において、末梢血は被験から採取される。さらに、いくつかの実施例において、末梢血はNKT刺激剤とTGF-Βに接触しFoxp3+NKT細胞を生成する。血球のわずかな割合のみがNKT細胞であっても、そのNKT刺激剤へ曝すことによるNKT細胞の選択的刺激によって、血球集団中のNKT細胞の数が増加し、したがって産生したFoxp3+NKT細胞集団の数も増加する。いくつかの実施例において、その血球集団は、その細胞をTGF-ΒやNKT刺激剤に曝す前に、精製または洗浄される。精製のそれぞれの段階において、NKT細胞を持たない細胞集団が取り除かれ、したがって残余中のNKT細胞の割合は増加する。例えば、可溶性物質を取り除くために、血液を遠心分離することで、その細胞が洗浄されることがある。同様に、白血球(NKT細胞を有するもの)のみを単離するために血液が精製されることがあり、引き続きその白血球集団中のNKT細胞をFoxp3+NKT細胞に変化させるために、その白血球はTGF-ΒとNKT刺激剤に曝されることがある。同じように、T細胞とそのNKT細胞を有するT細胞集団のみを単離するために、血液はさらに精製されることがある。T細胞は、その後TGF-ΒやNKT刺激剤に接触されることがある。いくつかの実施例において、NKT細胞はその血球集団より精製され、(基本的に)NKT細胞集団のみがTGF-ΒとNKT刺激剤に曝される。NKT細胞とNKT細胞を有する細胞集団(T細胞など)は、非血液源から採取されることがある。いくつかの実施例において、NKT細胞は脾臓または胸腺または他の臓器から採取される。いくつかの実施例において、細胞集団(e.g.T細胞)はそれらの臓器から採取され、その後TGF-ΒとNKT刺激剤に曝される。必要があれば、TGF-ΒとNKT刺激剤に曝露する前に、そのNKT細胞を臓器から採取した細胞集団から精製することができる。
【0035】
Foxp3+NKT細胞の精製と生成の段階は入れ替えられることが分かるる。したがって、血球集団はTGF-ΒとNKT刺激剤に接触され、そのFoxp3+NKT細胞またはすべてのNKT細胞(Foxp3+NKT細胞とFoxP3-NKT細胞)は、その後残りの血球より精製される。
【0036】
本発明は、このFoxp3+NKT細胞の生成の方法の特定の生成率に限定されるものではない。いくつかの実施例において、そのNKT細胞の、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%がFoxp3+NKT細胞に変化する。いくつかの実施例において、少なくともそのNKT細胞の40%がFoxp3+NKT細胞に変化する。これらのFoxp3+NKT細胞の生成率は、少なくともそのNKT細胞の本質(e.g.ヒト対ネス゛ミ、臓器由来対血液由来)とそのNKT細胞を有する細胞集団に依存することが理解される。また、Foxp3+NKT細胞の最終の割合は、細胞集団中のNKT細胞の初期の割合に依存することも理解される。したがって、血球集団は、NKT細胞の0.001%から1%の間であるならば、少数のNKT細胞のみを有することがあり、そのためNKT刺激剤とTGF-Βへの接触が終了した後には、少数のFoxp3+NKT細胞のみを有することがある。しかし、そのNKT細胞のみが刺激され、したがってそのNKT細胞は細胞集団中に存在するいかなる他の細胞よりも速い速度で成長するため、そのNKT細胞の割合は最初の0.001%から1%よりも高くなる。
【0037】
一態様において、本発明は、1個以上のFoxp+3ナチュラルキラーT細胞を有する集団から始め、Foxp3+ナチュラルキラーT細胞の数を増やす方法を提供する。いくつかの実施例において、この方法は、TGF-Βと、1個以上のNKT刺激剤と、サイトカインを誘発する1個以上の増殖と、1個以上のFoxp3+ナチュラルキラーT細胞の数の増加に十分な量の中和抗体の組み合わせを伴う少なくとも1個のFoxp+3ナチュラルキラーT細胞を有する細胞集団との接触を有する。この手順は、Foxp3+ナチュラルキラーT細胞のみの集団、またはFoxp3+ナチュラルキラーT細胞と他の細胞の両者を有する集団の、双方において実践されることが理解される。細胞集団がnon-Foxp3+NKT細胞を有する場合、いくつかのNKT細胞がFoxp3+ナチュラルキラーT細胞中に変化し、後に増加する場合がある。したがって、Foxp3+ナチュラルキラーT細胞とnon-Foxp3+ナチュラルキラーT細胞を含む細胞組成を刺激することは、事実上増殖を通したFoxp3+ナチュラルキラーT細胞の数の増加と、変化の組み合わせである。いくつかの実施例において、サイトカインを誘発する増殖はIL-2、IL-7、IL-15、またはIL-21である。いくつかの実施例において、中和抗体は抗IFN-γ抗体、抗IL-4抗体、抗IL-6抗体、抗IL-12抗体、または抗IL-27抗体である。サイトカインを誘発する増殖と中和抗体の望ましい最適な組み合わせと濃度は、そのFoxp3+ナチュラルキラーT細胞の本質、そのFoxp3+ナチュラルキラーT細胞の割合、そしてその細胞集団中のnon-Foxp3ナチュラルキラーT細胞の本質に依存することが理解される。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の数は、少なくとも2倍、少なくとも5倍、少なくとも10倍、少なくとも50倍、少なくとも100倍、少なくとも200倍、少なくとも500倍、少なくとも1,000倍、少なくとも10,000倍、少なくとも100,000倍、少なくとも106倍、少なくとも107倍増加する。
【0038】
本発明が、NKT細胞の数を増やす方法と、Foxp3+ナチュラルキラーT細胞の数を増やす方法と、NKT細胞をFoxp3+ナチュラルキラーT細胞に変換する方法の組み合わせとを、含むことが分かる。したがって、例えば、Foxp3+ナチュラルキラーT細胞の集団は、NKT細胞の集団を増加し、その後NKT細胞をFoxp3+ナチュラルキラーT細胞に変換し、そのFoxp3+ナチュラルキラーT細胞を増加することで産生される。
【0039】
Foxp3+NKT細胞の免疫反応抑制
【0040】
Foxp3+NKT細胞は、Treg細胞と同様に免疫反応抑制の性質を有する。Treg細胞とは、Foxp3+であるが、移植拒絶、移植片対宿主病(GVHD)、アレルギー性疾患、自己免疫、他の炎症病状に効果的であることが示されている(24)。事実、これらの報告は、現在実施されているFoxp3+Treg細胞の臨床試験のための実例で活用されている(25)。Foxp3+NKTreg細胞とFoxp3+Treg細胞の機能的な特徴を考慮すると、これらは臨床への応用において同じ可能性を有することが理解される。さらに、NKTreg細胞はinvariant TCRを有するため、NKTreg細胞はTreg細胞よりも効果的である。invariant TCRを有する細胞は、不変TCRを有さない細胞(Treg細胞)よりも分離されやすく刺激されやすい。
【0041】
NKTreg細胞の不変の特異性の重要性とは、抗原非特異性免疫調節である。よって、Foxp3+NKTreg細胞は、抗体特有活動に反して、一般的な免疫抑制活動を引き起こしがちで、Treg細胞が適用される治療目的に利用できる。多クローン性Treg細胞の集団は、少なくとも部分的に、同じ非特有免疫抑制効果を持つが、これは、おそらく自己抗原を伴う相互反応による(26)。リンパ球減少による増殖と移植片対宿主病GVHDからの保護において、Treg抑制の基盤として作用するのが、この非特有効果である(27,28)。GVHDとは、Tregに起因する干渉を想定する臨床条件の1つで、Treg臨床試験は、この条件で実施されてきた(29-32)。組織移植は、移植片の拒絶を防止するために明瞭な非特有Tregに基づく調節からの恩恵を受ける。非特有抑制の幾分かの程度を提供することで、自然抗原特有調節機構は、許容限界に向かい免疫反応をリセットする機会を得るころだろう。
【0042】
Foxp3+NKT細胞を肝臓と肺に送る方法
【0043】
一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を肝臓に送る方法と、肝臓の中の免疫反応を抑制するための方法を提供する。また、一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を肺に送る方法と、肺の中の免疫反応を抑制するための方法を提供する。Foxp3+ナチュラルキラーT細胞を肝臓に送る方法と、肝臓の中の免疫反応を抑制するための方法を提供する。さらに、一態様において、本発明は、Foxp3+ナチュラルキラーT細胞を粘膜組織に送る方法と、粘膜組織の中の免疫反応を抑制するための方法を提供する。前述の実施例において、この方法は、Foxp3+ナチュラルキラーT細胞を被験への全身投与を含む。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は自己細胞である。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、Foxp3+ナチュラルキラーT細胞を生成するために十分な量のNKT細胞刺激剤とTGF-Βを伴うナチュラルキラーT細胞との接触により生成される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、肝臓内での免疫反応を抑制する効果的な量が投与される。さらに、いくつかの実施例において、細胞刺激剤またはTGF-βは、粘膜(例、腸や肺)内の免疫反応を抑制するために十分な量のFoxp3+ナチュラルキラーT細胞を生じるために効果的な量が投与される。さらに、いくつかの実施例において、肝臓内における免疫反応の抑制は、移植片対宿主病、膵島移植により引き起こされるかそれに関わる好ましくない免疫反応、または肝臓移植もしくは肝臓への免疫介在性炎症により引き起こされるかそれに関わる好ましくない免疫反応の治療である。さらに、いくつかの実施例において、肝臓の免疫介在炎症は、自己免疫性肝炎、原発性胆汁性肝硬変、または脂肪性肝炎である。いくつかの実施例においてFoxp3+ナチュラルキラーT細胞は、膵島移植もしくは肝移植と関連して投与される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞のゲノムは、ポリペプチドをコード化する核酸を有し、ここで、肝臓へのFoxp3+ナチュラルキラーT細胞の送り込みが肝臓におけるポリペプチドを発現させる。
【0044】
予期しなかった発見として、Foxp3+NKTreg細胞を静脈から被験に送ると、Foxp3+の発現は、リンパ節ではなく、肝臓に蓄積されるiNKT細胞によって安定して維持されることがわかった。Foxp3+NKTreg細胞の一部はさらに、肺の粘膜内で見つかり、投与後は最初に脾臓で見つかった。そのため、1つの実施例において、本発明は、Foxp3+ナチュラルキラーT細胞の全身への投与を含むFoxp3+ナチュラルキラーT細胞を肝臓、肺、または脾臓に送るための方法を提供する。しかし、これは、Foxp3+ナチュラルキラーT細胞が肝臓、肺、脾臓への局所的な投与が可能であることが分かる。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞を肝臓に送る方法には、Foxp3+ナチュラルキラーT細胞を産生するために十分な量の1つ以上のNKT細胞刺激剤とTGF-βを伴うナチュラルキラーT細胞を有する細胞の集団との接触を含む。Foxp3+ナチュラルキラーT細胞は、その結果全身に投与される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞を有する医薬組成物が投与される。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、自己細胞である。そのため、いくつかの実施例において、この方法には、被験から血液の採取、血液細胞の集団とFoxp3+ナチュラルキラーT細胞を産生するために十分な量の1つ以上のNKT細胞刺激剤とTGF-βとの接触、Foxp3+ナチュラルキラーT細胞を有する血液細胞の集団の最終的な被験への投与を含む。細胞集団は、1つ以上のNKT細胞刺激剤とTGF-βに接触する前に純化され濃縮されてNKT細胞の数が増加することが理解されている。さらに、この細胞集団は、Foxp3+ナチュラルキラーT細胞が産生した後も純化されて、Foxp3+ナチュラルキラーT細胞の割合を増加させることができる。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は投与の前に増殖する。
【0045】
Foxp3+ナチュラルキラーT細胞が肝臓と肺に集まることができるため、肝臓と肺の中のFoxp3+ナチュラルキラーT細胞の先天的な特性(すなわち、免疫抑制機能)を利用して治療方法を実践することができる。Foxp3+ナチュラルキラーT細胞は、例えば静脈への投与により、肺と肝臓の両方または一方への免疫反応を抑制することが求められる場合、全身に投与される。さらに、Foxp3+ナチュラルキラーT細胞が肝臓や肺に集まることができるため、この細胞の中で産生するか含まれる組み換えポリペプチドと他の物質の両方または一方を肺と肝臓に送る他の細胞の集合特性を使用できる。そのため、NKTreg細胞は、免疫介在疾患に対する細胞治療を提供するが、それは、肝臓の自己免疫や肝臓移植に限らず、免疫原細胞または分子の蓄積のための免疫優遇部位としての肝臓の利用(すなわち、膵島移植または遺伝子治療)である。さらに、肝臓特有の活動は、全身の免疫の抑制に関わる目標以外の効果を低下させる。iNKT細胞の肝臓特有の蓄積は、肝臓炎症、例えば、移植、自己免疫疾患、ウイルス性炎症性変化、脂肪性肝炎、および肝臓被毒に関わる炎症の処置として治療のために使用される。いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、肝臓内での免疫反応を効果的に抑制できる量を投与されるが、ここで、肝臓内での免疫反応の抑制は、移植片対宿主病や、膵島細胞移植に関わるかこれによってひきおこされた好ましくない免疫反応、肝臓移植または肝臓の免疫介在炎症に関わるかこれによってひきおこされた好ましくない免疫反応である。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、膵島細胞移植または肝臓移植に伴い投与される。
【0046】
いくつかの実施例において、Foxp3+ナチュラルキラーT細胞の集合特性が変わることが分かる。投与するFoxp3+ナチュラルキラーT細胞は、特定の組織にこの細胞が集合しやすくなるように、腎臓マーカーや腸マーカーといった細胞組織マーカー(例、細胞表面タンパク質)を有する。Foxp3+ナチュラルキラーT細胞がマーカーを含むように修正する技術と方法で既知の組織マーカー(例、セルのゲノムにマーカーをコード化する核酸を導入)も同様に知られている。そのため、1つの実施例において、本発明は、細胞表面タンパク質を有するFoxp3+ナチュラルキラーT細胞を提供する。いくつかの実施例において、細胞表面タンパク質を含むFoxp3+ナチュラルキラーT細胞は、細胞表面タンパク質をコード化する核酸をFoxp3+ナチュラルキラーT細胞のゲノムの中に導入することで産生できる。
【0047】
肝臓と肺への物質とポリペプチドの送り出し
【0048】
免疫反応抑制特性を有するFoxp3+ナチュラルキラーT細胞を送ることで、計画的な免疫抑制を伴わない免疫優遇部位(肝臓または肺)が形成される。この発見は、例えば静脈を通した直接投与で、免疫原性の治療薬を肝臓に安全に送るために、他の免疫原性の治療薬との組み合わせにおいて実践されうる。例としていくつかあげられる治療として、糖尿病の治療のための膵島移植(静脈から定期的に投与)や細胞が可溶物を作り出す他の細胞の移植治療(凝固障害の凝固因子、リソソーム蓄積症の治療のための酵素交換治療)である。
【0049】
一態様において、本発明は、物質(例、治療薬、ポリペプチド、診断薬)を肝臓または肺に送る方法を提供する。1つの実施例において、この方法は、肝臓または肺に物質を送ることができるように、Foxp3+ナチュラルキラーT細胞を変化させる方法を含む。変化は、例えば、Foxp3+ナチュラルキラーT細胞の細胞表面タンパク質または細胞表面糖にその物質を付着させることで実現する。それに加えて、Foxp3+ナチュラルキラーT細胞のゲノムは、Foxp3+ナチュラルキラーT細胞が肝臓または肺に移った時に、発現していくポリペプチドをコード化する核酸を含むように変化することができる。そのため、1つの実施例において、本発明は、Foxp3+ナチュラルキラーT細胞のゲノムがポリペプチドをコード化する核酸を含むように変化することと、変化したゲノムを有するFoxp3+ナチュラルキラーT細胞を投与することを含む肝臓または肺にペプチドを送る方法を提供するが、ここで、Foxp3+ナチュラルキラーT細胞の投与は、Foxp3+ナチュラルキラーT細胞を肝臓または肺に結果的に送り、さらに、肝臓または肺の中でポリペプチドを結果的に発現させる。
【0050】
いくつかの実施例において、肝臓に送られたポリペプチドは、代謝酵素である。そのため、1つの実施例において、本発明は、肝臓に機能的代謝酵素を送ることでリソソーム蓄積症を治療してリソソーム蓄積症の被験者に欠損する代謝酵素を補完できるようにする方法を提供する。1つの実施例において、肝臓に送られたポリペプチドは、血液恒常性(例、凝固因子)においてある機能を有するポリペプチドである。そのため、1つの実施例において、本発明は、血液恒常性においてある機能を有する機能性ポリペプチドを肝臓に送ることで、血液疾患を治療するための方法を提供する。
【0051】
いくつかの実施例において、肺に送られるポリペプチドは酵素である。そのため、1つの実施例において、本発明は、治療用ポリペプチドの投与により治療できる肺疾患に対する方法を提供する。例えば、酵素ドルナーゼアルファを嚢胞性線維症の治療のため送ってよい。
【0052】
いくつかの実施例において、ポリペプチドといった物質を自己細胞と共に肝臓または肺に送る。自己細胞は「自身」として体の中で認識され、好ましくない免疫効果を防止する。1つの実施例において、血液細胞は被験から採取し、状況に応じて、純化してNKT細胞の数が増加する。その後、NKT細胞は変えられ、細胞に物質を付着させるか、求めるペプチドを細胞のゲノムにコード化する核酸を含むようになる。NKT細胞の変更の後、この細胞とTGF-ΒとNKT刺激剤と接触し、この細胞がFoxp3+ナチュラルキラーT細胞に変わる。付着物質またはポリペプチドをコード化する核酸を有する変化したFoxp3+ナチュラルキラーT細胞は、その後、被験に投与されて変化した細胞が肝臓または肺に送られる。これらの過程の順序の変更はありえることが分かる。例えば、NKT細胞は、最初Foxp3+ナチュラルキラーT細胞に変わり、その後核酸または物質を含むように変わる。
【0053】
臓器特有の免疫反応
【0054】
一態様において、本発明は、臓器など特定の解剖学的な部位におけるFoxp3+ナチュラルキラーT細胞のin situ生成の方法、およびそれらの部位における免疫反応の抑制方法を提供する。一態様において、本発明は、被験の臓器の中の免疫反応を抑制する方法、すなわち、その臓器の中の免疫反応を十分に抑制する1個以上のNKT刺激剤の量の局所的な送り込みを有する方法を提供する。この方法は、その臓器の中の免疫反応を十分に抑制するTGF-Βの量の局所的な送り込みをさらに有する。さらに、いくつかの実施例において、この免疫反応は、抗原に対する免疫反応である。さらにいくつかの実施例において、この免疫反応は、自己免疫反応である。さらにいくつかの実施例において、この臓器とは消化管である。さらに、いくつかの実施例において、免疫反応の抑制とは、炎症性腸疾患である。さらに、いくつかの実施例において、臓器への局所的な送り込みとは、粘膜組織への送り込みである。さらに、いくつかの実施例において、臓器への局所的な送り込みとは、肺の粘膜組織への送り込みである。さらに、いくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、被験者の体内がそれらの生成に十分な量のTGF-βを内包していれば、1個以上のNKT刺激剤の投与により、体内で生成される。
【0055】
さらにいくつかの実施例において、Foxp3+ナチュラルキラーT細胞は、被験者の体内がそれらの生成に十分な量のNKT細胞を内包していれば、TGF-βの投与により、体内で生成される。
【0056】
一態様において、本発明はその臓器の中の免疫反応を十分に抑制する1個以上のNKT刺激剤の局所的な送り込みにより被験の臓器におけるFoxp3+ナチュラルキラーT細胞のin situ生成の方法を提供する。特定の臓器への部分的な局所的送り込み方法は人工的な方法では既知であり、下記でより詳細に説明する。例えば、消化管のNKTreg細胞を誘発することはTGF-βの豊富な状態でNKT細胞作用薬α-Galactosylceramide(α-GalCer)を胃内投与することにより可能であることが示されている。TGF-βの豊富な臓器の例としては、他に肺、肝臓、骨髄、そしてある種のがん細胞である。これらの臓器のすべての細胞がTNF-βに富んでいるわけではないことが分かる。すべての臓器がTGF-βに豊富というわけではなく、TGF-βが豊富でない臓器におけるFoxp3+ナチュラルキラーT細胞のin situ生成は、TGF-βと1個以上のNKT刺激剤の両方を局所的に投与することにより可能である。TGF-βとNKT刺激剤を組み合わせた送り込みは、TGF-βに富んだ臓器に対してももちろん可能である。元々十分な量のNKT刺激剤が備わっている臓器では、TGF-βのみ投与してFoxp3+ナチュラルキラーT細胞のin situ生成を行う。
【0057】
臓器など、特定の解剖学的な部位におけるNKT細胞からのFoxp3+ナチュラルキラーT細胞in situ生成は、他の臓器における免疫反応を抑制することなく、その臓器における免疫抑制効果を誘発することが見込める。したがって此処に説明する方法は、消化管障害(例、クローン病、炎症性腸疾患、潰瘍性大腸炎)や肝臓障害(例、自己免疫性肝炎,初期の胆汁性肝硬変、非アルコール性およびアルコール性の脂肪性肝炎(NASHおよびASH)、肝硬変、C型肝炎およびB型肝炎ウイルス(HCVおよびHBV))、肺障害(例、ぜんそく)に関連する免疫治療や、中枢神経系の炎症や関節炎にも利用可能である。免疫抑制性Foxp3+ナチュラルキラーT細胞の局所生成は、移植手術が行われるあらゆる臓器や区域において、免疫反応を抑制する能力を見込むことができる。
【0058】
Foxp3+ナチュラルキラーT細胞の検出
【0059】
Foxp3+ナチュラルキラーT細胞はCD1d分子により提供される糖脂質を化学結合する能力により特徴づけられ、マーカーFoxp3+を持つ。TypeI 1NKT細胞は、スルファチト゛を含有したCD1d四量体と細胞を化学結合することにより同定されえる(参照例、J Exp Med.2004 Apr 5;199(7):947-57)。TypeII NKT細胞は、不変NKT細胞とも呼ばれ、以下の化合物の1種類を伴う四量体を含有するCD1dと化学結合することにより同されえる。α‐ガラクトシルセラミド(α-GalCer)、リン酸緩衝生理食塩水-57、OCH、GSL-1、isoglobotrihexosylceramide(iGb3)、α-C-ガラクトシルセラミド、また、下記URL参照
(http://www.bdbiosciences.com/external_files/pm/doc/tds/dimerx/live/web_enabled/557764.pdf)。TypeINKT細胞は、それらの不変マーカーにより同定されることもある。
【0060】
CD1d分子は、非多形で、種間で保存され、所有している狭くて深い疎水性リガンド結合ポケットにより特徴づけられる非古典的要組織適合性遺伝子複合体分子である。こうした結合ポケットは、糖脂質とリン脂質をナチュラルキラーT(NKT)細胞に提供する能力がある。最良に特徴づけられたCD1dリガンドはα‐ガラクトシルセラミド(α-GalCer)で、元は海綿抽出物に由来する。CD1d分子によるα-GalCerの提供は、NKT細胞の認識とIFN-γならびにIL-4の急速な大量生産という結果を生じ、α-GalCerに治療効果を授ける。最近になって、リソソーム酸スフィンゴ脂質isoglobotrihexosylceramide(iGb3)はCD1dリガンドと同定された。この内因性スフィンゴ脂質は、NKT細胞の発達に関与すると考えられている。ProImmuneは便宜上、最初からα-GalCerが組み込まれている蛍光標識されたマウスのCD1d四量体と、最適なリガンドをユーサ゛ーにより含有するために空けてある蛍光標識されたマウスのCD1d四量体を提供する。四分割のCD1dの脂質複合体は(使用された脂質リガンドによる)特定の選択性があるNKT細胞のTCRsと化学結合し、これによりフローサイトメトリーによる抗原特異的CD1d限定のNKT細胞の同定と列挙が可能となる。細胞内サイトカインのためのさらなる相互染色(例、IFN-γ/IL-2)ならびに、もしくは表面マーカー(例、CD69)は、抗原特異的小集団のための機能データを生み出しえる。
【0061】
PBS-57は、ポール・サビジ博士と同僚が開発したα-ガラクトシルセラミドの類似体である。独立した3つの研究所は、PBS-57の活動はα-ガラクトシルセラミドと区別できないと示している。NIH Tetramer FacilityはCD1d分子とCD1d四量体に対しキレート化合物にされたPBS-57リガンドを提供する。
【0062】
OCHは、先端を切った側鎖を伴ったガラクトシルセラミドの類似体で、ナチュラルキラーT細胞内のTh-2バイアスのサイトカイン生産を促す。このリガンドは、動物モデルにおける実験的自己免疫性脳脊髄炎の開始を遅らせることを示した。精製されたOCHリガンドは、体外のNKT細胞の促進と体内動物研究のためにまた、得られる場合がある。
【0063】
最近の研究では、Sphingomonadaceaeバクテリアファイリーからの糖脂質は、CD1d分子にリガンドがあると、ナチュラルキラーT細胞を刺激することが判明した。GSL-1は構造的にPBS-57とα-ガラクトシルセラミドと同じである。純化したGSL-1リガンドは、in vitroでNK T細胞を刺激することで、またはin vivoでの動物実験にて得られる。GSL-1は、ツイーン/サッカロース/ヒスチジンの中和剤に溶解し、滅菌し、圧力瓶に入れられ凍結乾燥される。できたがった粉末は、最終濃度が0.2mg/mLになるように水で戻される。
【0064】
α-ガラクトシルセラミドの同類のα-C-ガラクトシルセラミドは、ナチュラルキラーT細胞を潜在的に刺激し、ある種の感染症と癌から動物を護ることが知られている。
【0065】
NKT細胞のシミュレーション
【0066】
本発明は、NKT細胞を変化させ、NKT細胞(Foxp3+NKT細胞を含む)の数を増加させる方法を提供する。NKT細胞を刺激する方法は、当業者の周知であり、以下の1つ以上のNKT刺激剤との接触を含む。抗CD3抗体(プレートバインドか他の表面、ビーズなど、細胞中に抗原があると溶解)、Phytohemaglutinin(PHA)、Concanavalin A(ConA)、Phorbol 12-ミリスチン塩酸13-アセテート(PMA)+イオミシン、CD1dが存在する特定のリガンドなど、上記と、CD1dヘ゛アリンク゛細胞に添加されたリガンド(またはCD1dコーティングビーズ)。これらには、NKT細胞をシミュレーションできる糖脂質と類似の物質が数多く存在する(アルファ-GalCerなど)。NKT刺激剤の組み合わせががこれらの細胞に接触できることは理解されている。
【0067】
免疫不全
【0068】
1つの実施例において、本発明は免疫抑制性特性により細胞を生成する方法を提供する。1つの実施例において、本発明はこれらの細胞を使用し、免疫不全を治療する方法を提供する。ここで用いられる免疫不全は、自己免疫反応およびアレルゲンへの免疫反応も含め、好ましくない免疫反応を持ついずれの病気または障害をも含む。ここで用いられる免疫不全は、臓器移植や異物実体(細胞やたんぱく質など代償療法で使用されるもの)の導入を含め移植手術に関連、または原因として生じた可能性のある、好ましくない免疫反応も含む。免疫不全は、全身エリテマトーデス(SLE)、シェーグレン症候群、慢性関節リューマチ、若年型糖尿病、ヴェゲナー肉芽腫症、炎症性腸疾患、多発性筋炎、皮膚筋炎、複数の内分泌の失敗、シュミット症候群、自己免疫ブドウ膜炎、アジソン病、副腎炎、グレーブス病、甲状腺炎、橋本病、自己免疫甲状腺の病気、悪性貧血、胃萎縮、慢性肝炎、類狼瘡肝炎、アテローム性動脈硬化症、初老期痴呆、脱髄性病気、多発性硬化症、やや鋭い皮膚紅斑性狼瘡、副甲状腺機能低下症、ドレスラー症候群、重症筋無力症、自己免疫血小板減少、原因不明の血小板減少紫斑病、溶血性貧血、尋常性天疱瘡、天疱瘡、ヘルペス状の皮膚炎、円形脱毛症、類天疱瘡、硬皮症、汎発性強皮症、CREST症候群(石灰沈着症、レイノー現象、食道運動障害、強指症と毛細管拡張症)、成人期発症糖尿病(Type II糖尿病)、男性および女性の自己免疫不妊性、強直性脊椎炎、潰瘍性大腸炎、クローン病、混合結合組織病、結節性動脈炎、全身性壊死性脈管炎、若年性慢性関節リューマチ、糸球体腎炎、アトピー性皮膚炎、アトピー性鼻炎、グッドパスチャー症候群、シャガス病、類肉腫症、リューマチ熱、喘息、再発性流産、抗リン脂質症候群、農夫肺、多形性紅斑、心臓切開後症候群、クッシング症候群、自己免疫慢性活動性肝炎、愛鳥家肺、アレルギー疾患、アレルギー性脳脊髄炎、中毒性表皮の表皮壊死症、脱毛症、アルポート症候群、肺胞炎、アレルギー性肺胞炎、線維化性肺胞炎、間質性肺疾患、結節性紅斑、膿皮症壊疽、輸血反応、ハンセン病、マラリア、リーシュマニア症、トリパノソーマ症、高安動脈炎、リウマチ性多発性筋痛、側頭動脈炎、住血吸虫症、巨細胞動脈炎、回虫症、アスペルギルス症も含むが、これらに限定されない、サンプター症候群、湿疹、リンパ腫肉芽腫症、ベーチェット病、カプラン症候群、川崎病、デング熱、脳脊髄炎、心内膜炎、心内膜心筋線維症、眼内炎、持久性隆起性紅斑、乾癬、胎児赤芽球症、好酸球性筋膜炎、シャルマン症候群、フェルティー症候群、フィラリア症、毛様体炎、慢性毛様体炎、異虹彩色性毛様体炎、フックス毛様体炎、IgAネフロパシー、ヘーノホ‐シェーンライン紫斑病、糸球体腎炎、移植片対宿主病、移植拒否、ヒト免疫不全ウイルス感染症、エコーウイルス感染症、心筋症、アルツハイマー病、パーボウイルス感染症、風疹ウイルス感染症、ポスト予防接種症候群、先天性風疹感染症、ホジキンおよび非ホジキン性リンパ腫、腎臓細胞癌、多発性骨髄腫、イートン‐ランバート症候群、再発性多発軟骨炎、悪性黒色腫、クリオグロブリン血症、ウォルデンシュトルム・マクログロブリン血症、エプスタイン‐バーウイルス感染症、耳下腺炎、エヴァン症候群、自己免疫性腺機能不全。
【0069】
ここで用いられる免疫不全は、特に、ぜんそくを含むと理解される。ここに用いられる「喘息」は、狭くなった気道と吸入した薬品に対する気道の反応の増加による炎症を特徴とする、一時的な呼吸器系障害を指す。ぜんそくはしばしば発症するもので、必ずしもアトヒ゜ー性またはアレルギー性の症状に付随するものではない。ぜんそくの症状は、呼吸困難、咳、喘鳴を含むものと広く認識されており、これら3つの症状すべて表れることが一般的だが、これらの症状が併発することがぜんそくの診断の必要条件ではない。
【0070】
一つの実施例において、喘息を治療する方法は、グルココルチコイド、ベータ・アドレナリン作用作動筋、メチルキサンチン、抗コリン作用薬、クロモリン、ネドクロミル、抗ヒスタミン剤、抗IgE抗体からなるグループから選択された抗ぜんそく剤の投与も含まれる。
【0071】
あらゆる実施例において、抗ぜんそく剤は以下のいずれかである。つまりベクロメタゾン二プロピオン酸塩(VANCERIL(登録商標),Schering)、フルニソリド(AEROBID(登録商標),Forest)、フルチカゾンプロピオン酸エステル(FLOVENT(登録商標),GlaxoSmithKline)、プレドニゾン、メチルプレドニゾロン、トリアムシノロン・アセトニド(AZMACORT(登録商標),Aventis)、硫酸アルブテロール(VENTOLIN(登録商標),GlaxoSmithKline;PROVENTIL(登録商標),Schering)、エピネフリン、塩酸イソプロテレノール、硫酸メタプロテレノール(ALUPENT(登録商標),Boehringer Ingelheim)、テルブタリン(BRETHINE(登録商標),LAMISIL(登録商標), Novartis)、臭化イプラトロピウム(ATROVENT(登録商標),Boehringer Ingelheim)、テオフィリン、クロモリン、ネドクロミル、抗IgE抗体(omalizumab;XOLAIR(登録商標);Genentech/Novartis)である。
【0072】
リソソーム貯蔵障害
【0073】
本発明がリソソーム貯蔵障害を治療する方法を提供する1つの実施例においてリソソーム貯蔵障害は、通常、脂質、グリコプロテイン(タンパク質を含んでいる砂糖)またはいわゆるムコ多糖の代謝のために必要な1つの酵素の欠乏の結果として、リソソーム機能障害に起因する。リソソーム貯蔵障害は、当分野では周知であり、活性化因子欠乏症/GM2ガングリオシド蓄積症、アルファ・マンノース症、アスパルチルグルコサミン尿症、コレステリルエステル蓄積症、慢性ヘキソサミニダーゼA欠乏症、シスチン症、ダノン病、ファブリー病、ファーバー病、フコシド症、遺伝性糖タンパク質蓄積症、ゴーシェ病、GM1ガングリオシド蓄積症、I細胞病/ムコ脂質症II型、乳児シアル酸蓄積症/ISSD、若年性ヘキソサミニダーゼA欠乏症、クラッベ病、異染性白質ジストロフィー、ムコ多糖症障害、偽性ハーラー・ポリジストロフィー/ムコ脂質症III A型、MPS-Iハーラー症候群、MPS-Iシャイエ症候群、MPS-Iハーラー-シャイエ症候群、MPS-IIハンター症候群、サンフィリポ症候群A型/MPS-IIIAサンフィリポ症候群B型/MPS-III B、サンフィリポ症候群C型/MPS-III C、サンフィリポ症候群D型/MPS-III D、モルキオA型/MPS IVA、モルキオB型/MPS IVB、MPS IXヒアルロニダーゼ欠乏症、MPS VIマトローラミー、MPS VIIスライ症候群、ムコ脂質症I/シアリドーシス、ムコ脂質症IIIC、ムコ脂質症IV型、多発性スルファターゼ欠損症、ニーマン・ピック病、神経セロイドリポフスチン症、CLN6病、バッテン・シュピールマイアー・フォークト病/若年性NCL/CLN3病、Finnish Variant Late Infantile CLN5、ジャンスキー・ビルショウスキー病/乳児後期CLN2/TPP1病、Kufs/Adult-onset NCL/NCL病、Northern Epilepsy/異型乳児後期CLN8、Santavuori-Haltia/乳児CLN1/PPT病、Beta-mannosidosis、ポンぺ病/グリコーゲン貯蔵障害II型、Pycnodysostosis、Sandhoff病/成人発病/GM2ガングリオシド蓄積症、Sandhoff病/GM2ガングリオシド蓄積症−乳児、Sandhoff病/G
M2ガングリオシド蓄積症−若年、シンドラー病、Salla病/シアル酸貯蔵障害、Tay-Sachs/GM2ガングリオシド蓄積症、そしてウォルマン病がある。
【0074】
血液疾患
【0075】
1つの実施例において、本発明は血液疾患を治療する方法を提供する。1つの実施例において、血液疾患とは、凝固のように、患者が血液恒常性維持のために必要な十分な量のポリペプチドを持たない遺伝子疾患である。血液疾患には、血友病、von Willebrand 病、Bernard-Soulier症候群、Wiskott-Aldrish症候群、そしてグランツマン血小板無力症があるが、これらに限定されるものではない。
【0076】
Foxp3+NKT細胞におけるポリペプチドの発現
【0077】
一態様において、本発明は、ポリペプチドを肝臓と肺へ送るための方法を提供する。いくつかの実施例において、Foxp3+NKT細胞に分化するFoxp3+NKT細胞のゲノムとNKT細胞のゲノムは、肝臓と肺に発現されるポリペプチドをコード化する核酸を含むよう変えられる。肝臓と肺に発現する核酸を含むようゲノムを変えるための方法は、当技術分野で周知である。
【0078】
Foxp3+細胞により発現されるポリペプチドをコード化する核酸は、活動可能に調節配列に接合されるだろう。コード配列と調節配列は、コード配列の発現と転写を調節配列の影響下と支配下におく方法で共有結合する場合、「活動可能に接合」されると言われる。コード配列が機能タンパク質に翻訳されることを目的として、コード配列は活動可能に調節配列に接合される。5’調整配列におけるプロモータ遺伝子の誘導がコード配列の転写という結果になる場合、ならびに、2種類のDNA配列間の結合の働きがフレーム-シフト突然変異の導入という結果にならない場合とコード配列の転写を導くプロモータ領域の能力を妨げる結果にならない場合と、タンパク質に翻訳される対応するRNA転写産物の能力を妨げる結果にならない場合に、2種類のDNA配列は活動可能に接合されると言われる。したがって、もしプロモータ遺伝子領域にそのDNA配列の転写を生じさせる機能があるならば、プロモータ遺伝子領域はコード配列に活動可能に接合されるだろう。そして結果として生じる転写産物は、目的とするタンパク質やポリペプチドに翻訳されうる。
【0079】
遺伝子発現に必要とされる調整配列の正確な働きは、種間と細胞間で異なる場合があるが、概して、必要に応じて、それぞれ転写と翻訳の開始に関連のある5’非転写配列と5’非翻訳配列を含み、それらはTATAボックス、キャッピング配列、CAAT配列などである。特に、そのような5’非転写調整配列は、活動可能に接合された遺伝子の転写調節のためのプロモータ遺伝子配列を含むプロモータ遺伝子領域を含むだろう。プロモータ遺伝子は恒常的に形成され、誘導性がある場合がある。調節配列はエンハンサー配列と上流活性化配列も要求どおりに含む場合がある。
【0080】
様々な転写調節配列と翻訳調節配列が、宿主の働き次第で、使用される可能性がある。転写調節配列シグナルと翻訳調節配列シグナルは高い発現レベルを持つ特定の遺伝子配列に関連した調節シグナルがあるアテ゛ノウイルス、ウシ乳頭種、シミアンウイルスなどのウイルス源から誘導されることがある。あるいは、アクチン、コラーゲン、ミオシンなどの哺乳類発現産物のプロモータ遺伝子が使用される場合がる。抑制と活性を可能にする転写開始調節シグナルが選択されうる。その結果、遺伝子配列の発現が調節されうる。温度を変化させることで発現が抑制・開始されうることを目的として温度に敏感で、そして化学的(代謝)調節の影響を受けやすい調節シグナルは興味深い。
【0081】
被験の核酸の発現は真核性調節領域の使用を必要とする。このような領域は、概して、RNA合成開始を導くのに十分なプロモータ遺伝子領域を含むだろう。真核性プロモータ遺伝子は、例えば、マウスメタロチオネインI遺伝子配列(Hamer et al.1982,J.Mol.Appl.Gen.1,273-288)、ヘルペスウイルスのTKプロモータ遺伝子)McKnight,1982 Cell 31,355-365)、ならびにSV40早期プロモータ遺伝子(Benoist et al.1981 Nature(London) 290,304-310)を含むだろう。
【0082】
核酸の発現のための調節要素は問題点(例えば肝臓ならびに肺)における核酸の発現に結びつく調節要素である可能性があるとを認識されることが予想される。したがって、いくつかの実施例において、核酸は肝臓と肺の環境において核酸を発現できるプロモータ遺伝子に活動可能に結合されている。このようなプロモータ遺伝子は、肺細胞において使用される肝細胞とプロモータ遺伝子のためのプロモータ遺伝子を含む。
【0083】
いくつかの実施例において、核酸はベクターに挿入される。本文書では、「ベクター」とは、異なる生成環境間の輸送と宿主細胞内の発現のために制限と連結反応により要求された配列が挿入されうる多数の核酸のうちのどれかでありうる。発現ベクターは、それが活動可能に調節配列に接合され、ならびに、RNA転写物として発現されうるように、要求されたDNA配列が制限と連結反応により挿入されうるベクターである。ベクターは、ベクターを用いて形質転換と核酸導入を施されそしてされなかった細胞の同定に適した1つ以上のマーカー配列を、さらに含む場合がある。マーカーは、例えば、抗生物質と他の化合物に対する抵抗力と感度を増減するタンパク質をコード化する遺伝子、その活動が当技術分野で周知の標準分析により検出可能な酵素(例えばβ-ガラクトシダーゼとアルカリホスファターゼ)をコード化する遺伝子、ならびに形質転換と核酸導入を施された細胞、宿主、コロニーそして血小板の表現型に明らかに影響を与える遺伝子を含む。
【0084】
いくつかの実施例において、要求される遺伝子配列を宿主細胞染色体に統合する能力があるベクターが使用される。導入されたDNAをその染色体に安定して統合した細胞は、発現ベクターを含む宿主細胞の選定を可能にする1つ以上のマーカーを導入することにもより、選定されうる。選択可能なマーカー遺伝子配列は、発現されるDNA遺伝子配列に直接結合されうる、そして相互トランスフェクションにより同じ細胞に導入されうる。追加要素は核酸メッセンジャーRNAの最適合成にとっても必要とされる場合がある。こうした要素は接合シグナル、転写プロモータ、エンハンサー、ならびに終結シグナルを含む場合がある。こうした要素を組み入れるデオキシリボ核酸発現ベクターは岡山により記載されたベクターも含む(1983,Molec.Cell.Biol.3,280)。
【0085】
好ましい真核性フ゜ラスミト゛は、例えば、ウシパピローウイルス、エプスタインバーウイルス、SV40、2-ミクロンサークルなどとそれらの派生物を含む。このようなフ゜ラスミドは当技術分野で周知である(1982,Botstein et al.,Miami Wntr.Symp.19,265-274;Broach,1981,in:The Molecular Biology of the Yeast Saccharomyces:Life Cycle and Inheritance,Cold Spring Harbor Laboratory,Cold Spring Harbor,NY,p.445-470;Broach,1982,Cell 28:203-204; Bollon et al.1980,J.Clin.Hematol.Oncol.10:39-48;Maniatis,1980,in:Cell Biology:A Comprehensive Treatise,Vol.3,Gene Sequence Expression,Academic Press,NY,pp.563-608)。他の好ましい真核性ベクターはウイルスベクターである。例えば、制約のためではなく、ポックスウイルス、ヘルペスウイルス、アデノウイルスならびにさまざまなレトロウイルスが使用される可能性がある。ウイルスベクターはインサートDNAとインサートRNAの発現を引き起こすDNAウイルスとRNAウイルスを含む場合がある。
【0086】
構成物を含むベクターとDNA配列が発現のために一度準備されたら、DNA構成物は、さまざまな適切な方法、すなわち、形質転換、トランスフェクション、接合、原形質融合、エレクトロポレーション、リン酸カルシウム沈殿、直接微量注入法などのうちのいずれかにより、Foxp3+NKT細胞のような適切な宿主細胞に導入される場合がある。ベクターの導入後、受容細胞は選択培地で培養され、これによりベクター含有細胞の成長を選択できる。クローン化した遺伝子配列の発現は核酸の産生という結果になる。これは、それ自体は形質転換細において、分化する細胞の誘導に追随するなかで生じうる(例えば、神経芽腫細胞などへのブロモデオキシウラシルの投与)。
【0087】
物質を細胞に付着させる方法
【0088】
一態様において、本発明は肝臓または肺に物質を送る方法を提供する。一実施例において、薬剤はFoxp3+NKT細胞またはFoxp3+NKT細胞に変換されるNKT細胞に付着させる。物質を付着させる方法は当技術分野において周知であり、当発明はいかなる特定の方法にも限定されない。例えば、物質は、細胞表面に自然に存在する糖やタンパク質などの分子と反応させることによって、細胞に共有結合的に付着させることができる。さらに物質は、細胞表面に存在する分子にその薬剤を非共有的に結合することによって、細胞に付着させることができる。例えば、その物質は表面タンパク質に対抗する抗体に連結することができ、その抗体薬剤は、その後表面タンパク質に結合することができる。物質はまた、受容体リガンドなどのリガンドに連結することができ、そのリガンド物質の組み合わせは、その後その細胞に付着させることができる。すべての実施例において、肝臓または肺の細胞を局在化させる前にその物質が細胞から放出されないように、その物質が細胞に結合させることが望ましい。
【0089】
細胞に付着させることができる物質には、毒素または薬品(すなわち、特に肝臓または肺疾患を治療するため)、肝臓または肺に送られるときに有用な効果を持つポリペプチド製剤(すなわち、リゾソーム蓄積症酵素などのポリペプチド)、そして診断用薬がある。
【0090】
被験
【0091】
一態様において、本発明は、被験の疾患の治療方法を提供する。「被験」とは、本文書で使用するとき、ヒトまたは他の脊椎哺乳動物である。しかし、マウス、ラット、イヌ、ネコ、ウマ、雌ウシ、ブタ、ヒツジ、ヤギ、またはヒト以外の霊長類に限定されない。
【0092】
治療上の有効量
【0093】
いくつかの実施例において、本出願に記載されるすべての化合物、物質および細胞(例、TGF-Β,NKT刺激剤、Foxp3+ナチュラルキラーT細胞、IL-2、サイトカイン、抗サイトカイン抗体)は、治療上効果的な量で使用される。「治療上効果的な量」あるいは「効果的な量」は同じ意味で用いられ、例えば、特定の器官において免疫反応を抑制するなどの望ましい治療上の効果が得られるための必要または十分な量を意味する。本出願で提供されている指導と併用し、さまざまな有効な化合物の中から選択することによって、有効性や生物学的利用能、被験の体重、副作用の程度、望ましい投与の方法などの因子を比較検討して、重大な毒性を引き起こすことなく、しかし特定の被験の治療に有効で、効果的な予防薬または治療計画を選択できる。
【0094】
いずれの特定の応用における効果的な量は、疾病または治療の状態、特定の化合物、本出願に記載され投与される物質および細胞、被験の大きさ、疾病または状態の程度などの因子によって異なる。当業者においては、本出願に記載される特定の化合物、薬剤と細胞、または1つ以上の他の治療薬の効果的な量を、必然的に伴う過度な実験なしに、経験的に決めることができる。一般的には最大投与量が使用されることが望ましく、というのは、最高安全容量は、相当の医学的判断に従っているからである。一日、一週間または一カ月に数回の投与は、当出願に記載される化合物、物質および細胞の全身の適切な水準を達成するために検討される。適切な全身の水準は、例えば、患者のピーク、または本出願に記載される化合物、物質および細胞の血漿中濃度の測定などで決定される。
【0095】
化合物または薬剤の治療上効果的な量は、一般に0.001から1000 mg/kgである。本発明において、有用な化合物は、その範囲内で投与されることが想定されている。いくつかの実施例では、範囲は0.01から100mg/kgである。その他の実施例では、範囲は0.05から50mg/kgである。いくつかの実施例では、治療上効果的な量は50mg/kg未満である。例えば45mg/kg未満、40mg/kg未満、35mg/kg未満、30mg/kg 、未満25mg/kg、未満、20mg/kg未満、または15mg/kg未満である。いくつかの実施例では、治療上効果的な量は10mg/kg未満である。例えば9mg/kg未満、8mg/kg未満、7mg/kg未満、6mg/kg未満、5mg/kg未満、4mg/kg未満、3mg/kgまたは2mg/kg未満である。いくつかの実施例では、治療上効果的な量は1.5mg/kg未満である。例えば1.4mg/kg未満、1.3mg/kg未満、1.2mg/kg未満、1.1mg/kg未満、1mg/kg未満、0.9mg/kg未満、0.8mg/kg未満、0.7mg/kg未満、0.6mg/kg未満、0.5mg/kg未満、0.4mg/kg未満、0.3mg/kg未満、0.2mg/kg未満、または0.1mg/kg未満のTGF-Β, NKT-刺激剤または本出願に記載される他の薬剤あるいは化合物である。
【0096】
T-cellsFoxp3+ナチュラルキラーT細胞の治療上効果的な量は、一般に10から1×108細胞である。いくつかの実施例では、Foxp3+ナチュラルキラーT細胞は、1×102から1×107細胞の範囲で投与される。さらに、いくつかの実施例では、Foxp3+ナチュラルキラー T細胞は、1×103から1×106細胞の範囲で投与される。さらに、いくつかの実施例では、治療上効果的な量は、1×107Foxp3+ナチュラルキラーT細胞未満である。例えば、1×106未満、1×105未満、1×104未満または1×103未満のFoxp3+ナチュラルキラーT細胞である。
【0097】
いくつかの実施例では、治療上効果的な量は、一回の服用で投与される。いくつかの実施例では、治療上効果的な量は、数回の服用で投与される。投与量は本出願に記載される化合物、物質および細胞が、投与の方法によって、局所的にまたは全身的に望ましい水準に達するように、適切に調整される。そのような服用で、被験の反応が十分でない場合、より多い投与量(あるいは異なる、より局所的な到達経路による効果的なより多い投与量)が被験の許容範囲内において採用される場合もある。一日数回の投与は、適切な全身的な化合物の濃度を達成するため検討されるべきである。
【0098】
医薬組成物と投与法
【0099】
本出願に記載されている化合物、物質および細胞は、一般に医薬組成物として、通常医薬的に許容できる濃度の塩分、緩衝剤、保存料、適合するキャリヤ、アジュバントおよびその他の治療用含有物を含んで、被験に投与される。適合するキャリヤとその他の医薬組成物成分の特質は、投与の方法によって決まる。
【0100】
本発明の医薬組成物は、本出願に記載されている治療法を行う上で、熟練の技術者に知られているあらゆる方法と経路で投与されうる。
【0101】
いくつかの実施例において、本出願記載の化合物、物質および細胞は、局所的に投与される。局所的投与の経路は、当技術分野では知られており、標的領域と標的器官によって決まる。局所的投与の経路は、経皮(皮膚の上に塗布)、吸入、直腸(浣腸または座薬によって)、点眼薬(結膜に投与)、点耳薬、鼻腔内経由および膣内を含み、標準の局所性投与法を含む。
【0102】
消化管への局所的投与は、腸内投与で、行われ得る。腸内投与は、経口、経腸栄養管、十二指腸栄養管、胃ろう造設、直腸投与を含む。
【0103】
局所的投与は点滴によっても行われる。特定の器官または門脈など特定の器官と直接接触する特定の血管への点滴は、当初は、注入された実体の局所投与で生じる。特定の血管への点滴に加えて、局所的注入は、骨髄(骨髄内輸液)、腸膜および膀胱(膀胱内輸液)へ送ることが可能となる。
当出願で使用される局所的投与には、当出願記載の化合物、物質および細胞の局所注射も含まれる。局所注射は、ほとんどどの領域または器官でも行われる。局所投与の領域例は、筋肉内、大脳内、脳室内、心臓内、皮下、皮内、髄腔内、腹腔内および陰茎海綿体内などで実施される。
局所投与はまた、遅効性の放出気質としても評価されるべきである。よって、当出願記載の化合物、物質および細胞は、手術によって被験に採用されうる。そして実体の遅効性放出は特定の実体の局所的放出を促進する。
本出願で使用されている局所投与は、局所に送るためのキャリヤの使用をも採用する。そのため、局所的に送られる本出願記載の化合物、物質および細胞は、投与時に、体の特定の領域に集まり、1つのキャリヤに結合する場合がある。
【0104】
経口投与においては、物質および化合物は、当技術分野でよく知られている薬学的に承認されているキャリヤと組み合わせることによって、容易に調剤されうる。そのようなキャリヤは、本発明の化合物を、治療される被験が経口で摂取できるよう錠剤、丸薬、糖衣錠、カプセル、液体、ゲル剤、シロップ、スラリー、懸濁液などに調剤することを可能にする。経口使用のための薬学的調剤は、固形の医薬品添加物として得られる。任意に粉砕すれば、結果として混合となり、顆粒の混合を加工し、必要であれば適した補助物を加え、錠剤または糖衣錠の核を作る。適切な医薬品添加物とは、具体的には砂糖のような増量剤、ラクトース、サクロース、マンニトールまたはソルビトールを含む。セルロース調剤は、例えば、トウモロコシ澱粉、小麦澱粉、米澱粉、ジャガイモ澱粉、ゼラチン、トラガント、メチルセルロース、ヒト゛ロキシプロピルメチルセルロース、ナトリウム、カルボキシメチルセルロースおよびあるいはポリビニルピロリドン(PVP)である。必要であれば、薬剤を分解することも追加される。例えば架橋したポリビニルピロリドン、寒天、またはアルギン酸あるいはアルギン酸ナトリウムのような塩である。任意により、経口調剤は体内の酸の状態を中和するために、生理食塩水または緩衝剤で調剤されることがある。例、EDTA。またはキャリヤなしで投与される。
【0105】
経口で投与する場合は、放出の場所は、胃、小腸(十二指腸、空腸または回腸)または大腸である。当業者は胃の中では分解させず、物質を十二指腸または腸内の他の場所で放出する、利用可能な調剤を所有している。腸内のコーティングとして使用される、より一般的な不活性成分の例としては、セルロースアセテートトリメリテート(CAT)、ヒドロキシプロピルメチル セルロース フタレート(HPMCP)、HPMCP 50、HPMCP 55、ポリビニルアセテートフタレート(PVAP)、Eudragit L30D、Aquateric、セルロースアセテートフタレート(CAP)、Eudragit L、 Eudragit SおよびShellacがある。これらのコーティング剤は、混合膜として使用されうる。コーティング剤またはコーティング剤の混合は、胃に対しての保護を想定されない錠剤としても使われる。これには糖衣または錠剤の嚥下を容易にするためのコーティングが含まれる。カプセルは粉末薬を送るための殻(ゼラチンのような)となりうる。液体では、柔らかいゼラチンの殻が使われる。カシェ剤の殻の材質は、厚い澱粉かまたはその他の食用の紙とする。錠剤ではトローチ、すりこみ錠、粉薬錠剤、湿性マッシング技術が使われる。
【0106】
ここに記載された物質と化合物は、顆粒剤または小丸薬の形状内の複数の微粒子としての態様を含む。カプセル投与用の原料製剤態様として粉剤、軽く圧縮されたプラグ、錠剤になる場合がある。医薬組成物は圧縮により調整できる。不活性物質を使用し、医薬組成物の量を希釈もしくは増量することはもできる。炭水化物、マンニトール、α-ラクトース、無水乳糖、セルロース、ショ糖、調整済デキストラン、調整済デンプンを賦形剤として使用できる。充填剤は、無機塩類をカルシウム三リン酸塩、炭酸マグネシウム、塩化ナトリウムを含んで使用できる。市販の賦形剤としてFast-Flo、Emdex、STA-Rx 1500、Emcompress、Avicellがある。
【0107】
崩壊剤が固形製剤の医薬組成物中に使用される場合がある。崩壊剤として使用される物質にデンプンを元にした市販品のExplotabがあるが、デンプンに限定したものではない。デンプングリコール酸ナトリウム、アンバーライト、ナトリウムカルボキシメチルセルロース、ウルトラアミノペクチン、アルギン酸ナトリウム、ゼラチン、オレンジ果皮、酸カルボキシメチルセルロース、海綿、ベントナイトが使用される場合がある。硬質錠剤を形成し治療薬を保持するために結合剤が使用される場合があり、アカシア、トラガント、デンプン、ゼラチンのような天然物が使用される場合がある。抗摩擦剤を製造過程で物質固着を防止するため、配合組成に含む場合がある。潤滑剤を薬剤とダイ壁間の層に使用する場合があり、以下の物質を使用できるがこれらに限定したものではない、ステアリン酸とそれに含まれるマグネシウム、カルシウム塩、ポリテトラフルオロエチレン(PTFE)、流動パラフィン、植物油、ワックス。製剤中の薬剤流動性の促進および圧縮時の再配列補助のために、流動促進剤が使用される場合がある。流動促進剤としてデンプン、タルク、焼成シリカ、ケイアルミン酸水和物が使用される場合がある。
【0108】
吸入投与のため、ここに記載された物質と化合物は加圧パックによるスプレーもしくは噴霧吸入器の態様でシ゛クロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、炭酸ガスや他の適切なガスを使用し容易に送ることができる。
【0109】
ここに記載された物質と化合物は、肺へ送ることも意図されている。ここに記載された物質と化合物は哺乳類の局所もしくは全身へ送られる場合がある。分子吸入に関する文献には以下を含む。Adjei et al., 1990, Pharmaceutical Research, 7:565-569; Adjei et al., 1990, International Journal of Pharmaceutics, 63:135-144 (leuprolide acetate); Braquet et al., 1989, Journal of Cardiovascular Pharmacology, 13(suppl.5):143-146 (endothelin-1); Hubbard et al., 1989, Annals of Internal Medicine, Vol.III, pp. 206-212 (a1- antitrypsin); Smith et al., 1989, J.Clin.Invest. 84:1145-1146 (α-1-proteinase); Oswein et al., 1990,"Aerosolization of Protein", Proceedings of Symposium on Respiratory Drug Delivery II, Keystone, Colorado, March, (recombinant human growth hormone); Debs et al., 1988, J. Immunol. 140:3482-3488 (interferon-g and tumor necrosis factor alpha) and Platz et al., U.S. Patent No. 5,284,656 (granulocyte colony stimulating factor). A method and composition for pulmonary delivery of drugs for systemic effect is described in U.S. Patent No. 5,451,569, issued September 19, 1995 to Wong et al.
【0110】
ここに記載された物質と化合物を有する医薬組成物を鼻へ送ることが意図されている。鼻に送る場合、本発明の医薬組成物は治療薬を鼻から投与後、肺に物質を堆積させる必要もなく直接血流に通過させる。
【0111】
ここに記載された物質と化合物は、カカオバターやグリセリドのような従来の坐剤基剤を含有する直腸組成物、膣組成物、坐薬、停留浣腸にも形成できる。前述の剤形に加えて、化合物はまた、デポ製剤として形成することができる。さらに長時間作用型製剤に対して高分子基材、疎水性物質(例、許容される油の乳化剤)、イオン交換樹脂、難溶性塩のような難溶性の類似体を使用して形成する場合がある。
【0112】
最適化された医薬組成物を含む細胞の投与方法は当該技術分野で知られている。細胞は関節への点滴、注射や外科的挿入により投与可能である。しかし本発明はこれらの実施例に限定されず他の細胞投与方法も意図している。
【0113】
医薬組成物はまた、適当な固体、ケ゛ル相キャリヤ、賦形剤を使用する場合がある。このようなキャリヤ、賦形剤の例として炭酸カルシウム、リン酸カルシウム、様々な糖類、デンプン、セルロース類似体、ゼラチン、ポリエチレングリコールなどの高分子を含むがこれらに限定しない。
【0114】
適切な液状または固形の製剤形状として例をあげると、吸入用には水溶液もしくは食塩溶液があり、マイクロカプセル化した渦巻状で金の極微小粒子を塗布したリポゾームを含む噴霧剤、エアロゾル剤、皮膚への植え込み用の小丸薬があり、皮膚を切開し鋭利な乾燥物を植え込むものがある。また医薬組成物には顆粒剤、散剤、錠剤、コーティング錠(マイクロ)カプセル、坐薬、シロップ剤、乳化剤、懸濁剤、クリーム剤、滴剤、活性化合物の長期放出を持続する調整剤を含み、これらには賦形剤、添加剤、1つ以上の助剤のすべてか1つとして、崩壊剤、結合剤、塗工剤、膨潤剤、潤滑剤、着香料、甘味料、溶解補助剤が通常使用される。医薬組成物は様々な薬物送達システムに適切である。薬物の注入の方法の概要は以下を参照、Langer, 1990, Science 249, 1527-1533。
【0115】
ここに記載された物質と化合物はそれ自体(原剤)もしくは薬学的に許容される塩類として投与される。薬剤が投与される時、塩類は薬学的に許容されるべき状態であり、非薬学的に許容される塩類は、薬学的に許容される塩類を調剤するために使用することができる。このような塩類として塩酸、臭化水素酸、硫酸、硝酸、リン酸、マレイン酸、酢酸、サリチル酸、p-トルエンスルホン酸塩、酒石酸、クエン酸、メタンスルホン酸、蟻酸、マロン酸、コハク酸、ナフタレン-2 -スルホン酸、ベンゼンスルホン酸があるがこれらに限定はされない。また、このような塩類はアルカリ金属塩、ナトリウム、カリウム、カルボン酸基のカルシウム塩などのアルカリ土類塩として調剤することができる。
【0116】
本発明の医薬組成物は、ここに記載された充分な量の物質、化合物、細胞と薬学的に許容されるキャリヤ内に含有する任意で追加可能な治療物質を含む。長期的薬学的に許容されるキャリヤは、1つ以上の互換性のある固体または液体フィラー、賦形剤、ヒトまたは他の脊椎動物に投与するために適している物質をカプセル化することを表す。キャリヤは薬剤を体表面の接触を容易にするために活性成を結合する有機成分、無機成分または自然物、合成物を表す。医薬組成物の成分は本発明の化合物と混合可能で、それぞれも混合可能であり、つまりは実質的に必要な医薬品の効率を損なう相互作用がないようにする。
【0117】
本発明の化合物を送達する粒子の製造において、非生分解性高分子材料と生分解性高分子材料を使用できる。これらの高分子として天然もしくは合成の場合がある。高分子は計画される放出期間に基づいて選択される。特に有益なのが、Sawhney et. al., 1993, Macromolecules 26, 581-587で発表された生体内分解性ハイドロゲルを含む生体接着性高分子であることをここに記す。ポリヒアルロン酸、カゼイン、ゼラチン、グルチン、ポリ酸無水物、ポリアクリル酸、アルギン酸塩、キトサン、ポリ(メチルメタクリレート)、ポリ(エチルメタクリレート)、ポリ(ブチルメタクリレート)、ポリ(メタクリル酸イソブチル)、ポリ(hexylmethacrylate)、ポリ(イソデシルメタクリル酸)、ポリ(メタクリル酸ラウリル)、ポリ(フェニルメタクリル酸)、ポリ(アクリル酸メチル)、ポリ(イソプロピルアクリレート)、ポリ(アクリル酸イソブチル)、ポリ(オクタデシルアクリル酸)。
【0118】
ここに記載された物質と化合物には放出制御システムが含まれている場合がある。「放出制御」とは、ここに記載された調剤を含み、物質および化合物の種類とプロファイルのなかで、ここに記載されたいかなる物質と化合物が制御された調剤から放出される状態を表すことを意図している。これは即時放出製剤、非即時放出製剤および徐放性製剤と遅延放出製剤を含むが、これらに限らない非即時放出製剤についても言及している。「徐放」(「持続放出」も言及する)は長時間をかけた化合物の漸進的で積極的な放出だが、必ずしも一定の薬剤血中濃度を長時間必要としない製剤の従来の意味を言及するために使用される。「遅延放出」は製剤投与と化合物の放出の間に時間遅延がある製剤の従来の意味を言及するために使用される。「遅延放出」は長期間の化合物放出を含む場合と含まない場合があるので「徐放性」になりえる場合となりえない場合がある。長時間持続放出インフ゜ラントの使用は慢性疾患においてとりわけ適する場合がある。ここで使用される「長時間放出」は治療レベルの活性成分が植えこまれ、最低7日間そして30〜60日間の注入の構築および配置について言及している。長時間持続放出インプラントは当業者に知られており、前述のいくつかの放出システムに含まれている。
【0119】
キット
【0120】
一態様において、本発明は、医薬組成物を有しここで記載された物質と化合物、および医薬組成物の投与方法を有するキットを提供する。本発明のいくつかの態様において、キットは製剤バイアル、製剤バイアルS、ここに記載された化合物と物質を含むことが可能である。賦形バイアルには生理食塩水のような希釈液を含み、本発明の化合物の濃縮液もしくは凍結乾燥粉剤になりえる。いくつかの実施例では、特定量の濃縮製剤と特定量の賦形剤を混合する手順を含めた手順書があり、それによって注射もしくは点滴の最終製剤を調剤する。いくつかの実施例では、シリンジもしくは他の投与機器を使用する手順をふくめた手順書がある。いくつかの実施例では、本発明の特定量の化合物を用いて患者を治療する手順を含めた手順書がある。調剤をふくむ容器がたとえ容器が瓶、中隔のあるバイアル、中隔のあるアンプル、輸液バッグおよびその他であっても調剤が、加圧滅菌済みもしくは他の方法で滅菌済みの際に変色という従来のマーキングの印を有する、という理解がなされているものとする。
【0121】
本発明は以下の例をもって更に説明していくが、その説明にさらに制限が課されると理解すべきではない。本出願の全体を通して引用された参照内容の全内容(文献、交付済特許、公開特許出願、同時係属の特許出願を含む)は、明確に参照によって組み込まれており、特に上文に参照した教授内容に組み込まれている。
【実施例】
【0122】
実施例の材料と方法
【0123】
マウス
【0124】
C57BL/6、Balb/c、TGFβRIIdn、およびFoxP3gfpノックインマウス(A.Y.Rudensky,University of Washington,Seattle,WAより入手)を繁殖させ、Oeiras,PortugalにあるInstituto Gulbenkian de Cienciaにて、特定病原体未感染(specific pathogen-free)の条件で飼育した。実験用マウスは性別が一致し、6〜8週齢であった。すべての実験はAnimal User and Institutional Ethical Committeeのガイドラインに準じて実施した。In vivoにおけるiNKT細胞の変換のために、30μgのα-GalCer(Alexis,San Diego,CA)の胃内強制投与を1日おきに3回実施した。
【0125】
組織処理
【0126】
解析するすべての組織はBDセルストレーナーおよびシリンジのピストンを用いて処理した単一細胞懸濁液とした。膵臓は、更に氷冷したトリス‐塩化アンモニウム赤血球溶解液で5分間インキュベートした。肝臓は処理前にヘパリン入りのPBSで3回洗浄し、10%ウシ胎児血清を添加したRPMIで洗浄した。続いて35%(vol/vol)Percoll(Sigma)溶液(11ml)をかけ、室温で25分間、減速無しの1360gの遠心にかけることで肝細胞を分離した。上清を吸引除去し、氷冷したトリス‐塩化アンモニウム赤血球溶解液でペレットを5分間インキュベートした。
【0127】
ヒト末梢血細胞の単離
【0128】
健康な男性と女性のボランティアから同意を取得し、ヘパリンを添加した静脈血検体を取得した。その手順はEthical Board of the Faculty of Medicine,University of Lisbon, Lisbon,Portugalにより審査され承認されていた。Histopaque-1077 Hybri-Max density gradient(Sigma)で末梢血単核細胞(PBMC)を遠心分離し、下記の通り濃縮T細胞を得た。
【0129】
フローサイトメトリーと細胞ソーティング
【0130】
マウスとヒトのPE結合CD1d-PBS57テトラマーは NIH Tetramer Facilityより入手した。抗マウスCD3 (145-2C11)、CD4 (GK1.5 and RM4-5)、CD8 (53-6.7)、CD25 (PC61.5)、CD27 (LG.7F9)、CD62L (MEL-14)、CD103 (2E7)、CTLA-4 (UC10-4B9)、DX5 (DX5)、Foxp3 (FJK-16s)、GITR (DTΑ-1)、NK1.1 (PK136)、NKG2D (CX5)、TCR-β chain (H57-597)、Thy1.1 (HIS51)、Thy1.2 (53-2.1)の蛍光色素標識モノクローナル抗体(クローン名は括弧内に記載した)はeBioscienceまたはBD Biosciencesより購入した。抗ヒトCD4 (SK3)、CD25 (2A3)、CD127 (eBioRDR5)、CD161 (DX12)、CTLΑ-4 (14D3)、Foxp3 (PCH101)、GITR (eBioAITR)およびTCR Vβ11 (C21)の蛍光色素標識モノクローナル抗体はeBioscience、BD BiosciencesまたはBeckman Coulterより購入した。
【0131】
マウスNKT細胞を濃縮するため、細胞を非結合抗CD16/32(クローン2.4G2)ラット抗体(自家作製)とともにインキュベートし、FcRに対する非特異的結合を阻害し、洗浄せずにPE結合CD1d-PBS57テトラマーで標識した。抗PE磁気ビーズを添加し、磁気標識された細胞分画をautoMACS cell separator(Miltenyi Biotech)で単離した。サンプルをFACSCanto I(Becton Dickinson)で分析、もしくはFACSAria(Becton Dickinson)を用いて分取し、すべての実験でタ゛フ゛レット除去した。ヒトNKT細胞を濃縮させるため、細胞を抗CD14(61D3)、CD19(HIB19)およびCD123(6H6)ビオチン化抗体で標識し、抗ビオチン磁気ビーズに結合させ、autoMACS cell separator(Miltenyi Biotech)で濃縮して磁気標識した細胞を除去した。細胞内フローサイトメトリー染色のため、最初に細胞を表面マーカーで標識して、洗浄し、eBioscienceの透過と固定用バッファー「Foxp3 Staining Buffer Set」で固定した。細胞内抗体染色の前に、非結合マウス細胞を抗CD16/32(クローン2.4G2)ラット抗体(自家作製)および通常のラット血清に添加したヒト細胞(eBioscience)と共にインキュベートした。データはFlowJo(Tree Star)により解析した。
【0132】
細胞培養
【0133】
分取したマウス細胞を3μg/mLの抗CD3抗体(クローン145-2C11、eBioscience)でコーティングした24または96ウェル平底プレートで培養した。培地は10%ウシ胎児血清、1%Hepes、1%ペニシリン/ストレプトマイシン、1%ピルビン酸ナトリウムおよび0.1%β-mercaptoethanol(Invitrogen)を添加したRPMI-1640 with GlutaMAXとした。いくつかの条件では、次のサイトカインおよび抗体を培地に添加した。TGF-β(5ng/mL、R&D Systems)、recombinant IL-1β(10ng/mL、eBioscience)、IL-2(5ng/mL、eBiocience)、IL-4(20ng/mL、eBioscience)、IL-6(20ng/mL、R&D Systems))、IL-15(100ng/mL、eBioscience)、IL-7(5ng/mL、R&D Systems)、および抗CD28抗体(2 μg/mL、eBioscience)。細胞内サイトカインの検出前、50ng/mLの4-α-phorbol 12-mystrate 13-acetate(PMA)および500ng/mLのionomycin(Sigma)により、Brefeldin A(Sigma)存在下において5%のCO2、37°Cで、3時間細胞を刺激した。
【0134】
ヒト細胞は、1μg/mLの抗CD3抗体(クローンOKT3、BD Biosciences)をコーティングした24ウェル平底プレートでインキュベートした。培地は10%ウシ胎児血清、1%Hepes、1%ペニシリン/ストレプトマイシン(Invitrogen)を添加したRPMI-1640 with GlutaMAXとした。いくつかの条件では、次のサイトカインおよび抗体を培地に添加した。TGF-β(10ng/mL、R&D Systems)、recombinant IL-2(20U/mL、Roche)、抗IL12抗体および抗IFN-γ抗体(5 μg/mL、eBioscience)、抗IL-4抗体(5 μg/mL、R&D Systems)、および抗CD28抗体(2 μg/mL、eBioscience)。
【0135】
サイトカイン検出
【0136】
各ウェルから培地の上清を除去し、サイトカインの検出まで-80°Cで冷凍した。ELISAはIL-10(Peprotech)およびIL-4(BD-Pharmingen)キットを用いて実施した。IL-9の検出はcytokine bead-array Mouse IL-9 Flex Set(BD-Pharmingen)を用いて実施した。すべての解析は製造元の指示書に従って実施した。
【0137】
In vitroでの増殖および抑制解析
【0138】
細胞増殖を追跡するため、分取したマウス細胞を培養前に5μMのcarboxyfluorescein succinimidyl ester(CFSE、Invitrogen)標識した。調節性iNKTおよびCD4T細胞の抑制能力を評価するため、各サブセットをmitomycin C(Sigma)処理した脾細胞および新鮮に分取したCD4+CD25−T細胞と共に、2.5μg/mLの可溶性抗CD3抗体(BD Pharmingen)を添加した60ウェルTerasaki plates(Greiner)で、3種または4種の細胞を共培養した。いくつかの条件では、次のサイトカインおよび抗体を培地に添加した。200μg/mLの抗IL10R抗体(1B1.2)、200μg/mLの抗IL-4抗体(11B11)、および100μg/mLの抗GITR抗体(YGITR)22。細胞を37°Cで96時間培養し、最後の12時間は1μCi[3H]thymidine(Amersham)を各ウェルに添加した。細胞をグラスファイバーフィルターで捕獲し、[3H]thymidineの取り込みは Microbeta Trilux scintillation counter(Perkin Elmer)を用いて解析した。すべての培養細胞は三種または4種で解析した。
【0139】
Transwellアッセイ
【0140】
透過性膜の培地において、CFSE標識された「キラー細胞」であるCD4+CD25−T細胞を、平底96ウェルプレートのボトムウェルでmitomycin C処理された脾細胞および1μg/mLの可溶性抗CD3抗体により刺激した。調節細胞集団を、0.2μm Anopore membrane insert(Nunc)のホ゛トムウェルで「キラー」細胞と共に培養、あるいはアッパーウェルでmitomycin C処理した脾細胞だけで共に培養した。72時間後のボトムウェルのCFSE濃度をフローサイトメトリーにより解析した。
【0141】
アレルギー性気道疾患
【0142】
Balb/cマウスを0日齢および14日齢において、予め製造元の指示書に従ってDetoxyGel column(Pierce, Rockford, USA)に通した20μg のovalbumin(OVA, grade V; Sigma, St Louis, USA)またはβ-lactoglobulin(Sigma)を腹腔内注射することで感作させ、2.0 mgのendotoxin-free aluminum hydroxide(Alu-gel-S, Serva, Heidelberg, Germany)で懸濁した。C57/B16マウスは、0日目、7日目、14日目に半分の量のOVAを使い感作された。引き続きすべての動物は、図14に示した日においてパイロジェンフリー生理食塩水に溶解した50μgのOVAを鼻腔内にチャレンジし、最終チャレンジの24時間後に屠殺した。BAL好酸球増加を定量するため、1mlの冷却したPBS 10% BSA(Sigma)をゆっくり3回注入および吸引することにより気管を通して気道を洗浄した。その後BALを遠心し、上清を除去し、ペレットをPBSで再懸濁した。細胞を血球計算板で計数した。分画細胞の計数をGiemsa-Wright(Sigma)で染色したcytospinのアッセイで実施した。各サンプルから少なくとも200細胞を盲検的スライド(blinded slides)で計数し、各細胞種の相対数を明らかにした。組織学のために、肺を4% formalin solution(Sigma)で灌流し、収集し切開した。ヘマトキシリン/エオシンを用いて染色し、periodic acid-Schiff(PAS)染色を用いて粘液を含む細胞を明らかにした。写真は、Leica DM2500顕微鏡およびLeica DFC420カメラを用いて撮影した。
【0143】
実験的自己免疫性脳脊髄炎(EAE)
【0144】
C57BL/6マウスにCFAで乳化したmyelin oligodendrocyte glycoprotein(MOG)35-55 ペプチド(MEVGWYRSPFSRVVH LYRNGK,SEQ ID NO:1)を注射し、百日咳毒(0日齢に200ng、2日齢に400ng)を2回静脈内注射することでEAEを誘発させた。何匹かのマウスについて、0日齢および4日齢(腹腔内)に、2度の4μgのα-GalCer(MOG35-55 CFA混合液で乳化させた)投与で処理した。疾患の重症度を毎日モニタリングし、EAEを次の通りグレード分けした。スコア1:非硬直性の尾(limp tail)、スコア2:後肢不完全麻痺、スコア3:後肢完全麻痺、スコア4:前肢衰弱、スコア5:瀕死状態(moribund)
【0145】
共焦点顕微鏡
【0146】
FACSAria(Becton Dickinson)を用いてFoxp3-GFP+細胞を分取し、coverslips pre-coated with poly-L-lysine(Sigma)に撒いて、接着させるために37℃で1時間インキュベートした。スライドをPE標識CD1d/PBS57テトラマーと4℃で1時間培養し、氷冷したPBSで慎重に洗浄した。細胞をPBS 3% paraformaldehyde(Sigma)中に4℃で15分間固定し、氷冷したPBSで洗浄することで余分な固定液を除去した。スライドをDAPI Fluoromount G(Southern Biotech)封入剤で封入して蛍光染色し、共焦点レーザースキャン顕微鏡(LSM 510 META, Carl Zeiss)で観察した。
【0147】
RNA抽出、RTおよびPCR
【0148】
RLT Bufferに直接分取した細胞以外の1,000〜50,000個のFACS分取細胞から、RNeasy Micro Kit(Qiagen)を用いて製造元の指示書に従ってRNAを抽出した。random primers(Invitrogen)およびSuperscript III reverse transcriptase(Invitrogen)を用いてcDNAを合成した。 転写産物は次のプライマー(Bonsai Technologiesより購入)を用いて検出した。PLZF(Zbtb16)fwd:cagtttgcgactgagaatgc,(SEQ ID NO:2)rev:ttcccacacagcagacagaa(SEQ ID NO:3);Foxp3 fwd:cccaggaaagacagcaacctt;(SEQ ID NO:4)rev:ttctcacaaccaggccacttg(SEQ ID NO:5);EFA1 fwd:acacgtagattccggcaagt(SEQ ID NO:6),rev:aggagccctttcccatctc(SEQ ID NO:7)。Power SYBRGreen PCR Master Mix(Applied Biosystems)およびABI-PRISM 7000 sequence-detection system(Applied Biosystems)を用いてPCRを行った。すべてのPCR産物をアガロースゲルに流し、正確なサイズを確認した。
【0149】
統計解析
【0150】
P値はウェルチの補正を行うノンパラメトリックの対応のないt−検定により計算した。
【0151】
例1 TGF-βの存在下で培養の後iNKT細胞によりFoxp3が発現した例
Foxp3+「誘発された」Tregへいわゆる「普通の」T細胞を分化するとして知られた状態、つまりTGF-βの存在下で活性化された際のアップレギュレートしているFoxp3発現のiNKTの可塑性を調べた(35,36)。未感作マウスC57Bl/6の脾臓より識別されたiNKT細胞は、プレート結合抗CD3に刺激され、そしてIL-2 とTGF-βの存在下に培養された。未感作CD4+CD25−Tリンパ球のパラレル培養は、コントロールとして用いられた。3日後、培養細胞の細胞内染色で、Foxp3発現は、iNKT(29.35%±11.80)とCD4 (53.21%±12.03)T細胞培養(図1a)の両者のかなりの比率で検知可能であることが判明した。GFP-Foxp3融合レポータータンパクノックイン対立遺伝子(Foxp3gfpマウス)(37)をもつマウスと、Balb/cマウス(図1bおよび図2)の両者からのiNKT細胞にて同様の結果が得られた。胸腺から識別されたiNKTリンパ球も、Foxp3+iNKT細胞に分化したが、転換効率が低かった(図1c)。Foxp3+iNKT細胞は転換後ソートされ、個々の細胞は共焦点顕微鏡検査によって識別された。図1dにあるように、PBS57リガンドにある染色されたCD1d四量体は、Foxp3発現細胞が、糖脂質抗原を認識するinvariant TCRを表面で産生すること、つまりiNKT細胞にのみに起因する特徴を確認した。それゆえbona fide iNKT細胞は、特別な状況下において刺激されたとき、Foxp3転写因子をアップレギュレートすることができる能力において従来型CD4 T細胞に類似する。注目するべき点として、この特性は、TGF-β(データは示されていない)の存在下においての活性化で、Foxp3アップレギュレートに失敗したγδ T細胞などの、他の従来型とは異なる(非MHC抑制)のT細胞によって共有されていない。
【0152】
さらにiNKT細胞が、Foxp3エクスプレッサーに変わる最適な条件を確認するため、TCRシグナルの強さ、共刺激、サイトカインの添加の影響の試験を行った。Foxp3+NKT細胞への最適な変化は、3μg/mLのプレート結合抗CD3と5ng/mLのTGF-βとIL-2(図1e)の存在下によってなされた。事前のサイトカイン混合液へのIL-15 or IL-7のさらなる添加は、iNKT細胞変換(図2)においてほとんど影響を持たなかった。IL-2の欠如での変化は可能であったが、Foxp3+細胞の発現頻度は大幅に減少(約5%のレヘ゛ルにまで)し、細胞の増殖が弱まったことによるものと思われる。対照的にFoxp3+ iNKT細胞は、TGF-β(図2)の欠如したIL-2もしくはIL-15での培養で誘発されるものはなかった。実際、TGF-β濃度の滴定は、iNKT細胞(図1f)におけるFoxp3発現誘発のために、このサイトカインが重要であることを明らかにした。異なるTGF-βとウシの胎児血清群を用いて、変化したFoxp3+iNKT細胞(20%から50%の間)の頻度の変動性を観察した。培養へ抗CD28単一クローン抗体添加もテストされ、Foxp3+iNKT細胞(データは示されていない)への変化も増大しなかった。このデータはTGF-βシグナルが、iNKT細胞活性におけるFoxp3発現の誘発を促進することを明らかに示した。
【0153】
例2 Foxp3+ iNKT細胞が示すTregとNKT細胞表現型特性
【0154】
iNKTリンパ球が、Foxp3を発現したと確証した際、変化した細胞の表現型を調べた。Foxp3+iNKT細胞の多くの表現型特性は、in vitro変化のFoxp3+CD4 Treg細胞と共有された。すなわち両集団は、大部分において、CD25+、CTLΑ-4+、GITR+、CD103+、IL-7RA−(図3a)であった。しかし両集団間にいくぶんの差異が認められた。すなわちFoxp3+CD4 T細胞は、大部分がCD27+と異質性のCD62L発現であり、Foxp3+iNKT細胞は、大部分がCD27−とCD62L−であった。CD103の高発現に関しCD62Lの欠如は、in vivoにおいて、Foxp3+iNKT細胞は、リンパ節から除外され、末梢組織に大部分移動することを示す。実際RAG2−/−マウスへFoxp3+iNKT細胞を静脈注射し3週間後、肝臓においてこの細胞の大部分を検出することができた(下記参照)。
【0155】
iNKTリンパ細胞の中で、CD4発現の不均一性は、確証された9。興味深いことに、CD4+とCD4−iNKT細胞(図3b)の両存在下よりも、Foxp3の発現の可能性は、CD4+iNKT細胞サフ゛セットを制限していなかったことを発見した。Foxp3+iNKTリンパ球の大部分は、NK1.1−、DX5−、NKG2D+であることを発見した。加えて、PLZFのための転写産物の存在、すなわちNKT系署名(22)と報告されている転写因子を、識別されたFoxp3+とFoxp3−iNKT細胞(図3c)において検出した。あわせてこの観察は、iNKTリンパ球におけるFoxp3発現の誘発が、T系とNK系の両方からの分子の不規則な発現に基づくNKTの性質を保つことを示唆する。
【0156】
例3 Foxp3+iNKT細胞の肝臓へ移動とin vivoでのFoxp3発現の維持
【0157】
遺伝子発現フ゜ロク゛ラムの誘発の後、考慮するための具体的態様は、安定性である。さらに、はじめ予測されていた(38)よりも、従来のTreg細胞が安定性にかけることによるFoxp3発現は明らかになりつつある。in vivoのiNKT細胞においてFoxp3発現が維持されるかどうかを調べるため、変化したFoxp3gfpiNKTもしくはコントロールとしてin vitroで誘発されたFoxp3gfpCD4細胞をRAG2−/−マウスへ注射した。7から21日後、iNKT細胞の表現型は、脾臓、リンパ節(LN)、肺、消化管、肝臓で評価された。LNへ優先的に移動し、脾臓と肝臓においても認められたCD4 T細胞の対照として、主に肝臓と肺において検知されながらも、iNKT細胞はLNで、しかも早い時点で脾臓においても欠いていた。3週間後、Foxp3の発現(図4)がiNKT細胞の80%以下が維持されていた肝臓において存在しながらも、代わりに脾臓において、Foxp3+iNKT細胞は、検知されなかった。集団的に、この結果、両集団は、特異な生理学的位置にいるが、in vivoにおいてiNKT細胞によって変化したFoxp3発現の安定は、変化したFoxp3+Treg細胞に劣らないことを示唆した。すなわちiNKT細胞が、肝臓のような非リンパ系器官に大部分集まる一方、CD4 Tregは、二次リンパ系器官に大部分は移動した。
【0158】
例4 iNKTreg細胞に示される接触依存性GITR介在性抑制的機能
【0159】
Foxp3は、Treg表現型と抑制的機能へつながる末梢性CD25−CD4+T細胞においての遺伝子プログラムを誘発するとされた転写因子である(39-41)。Foxp3+iNKTd細胞の制御機能を評価するため、APCsと可溶な抗CD3 MAb抗体によって刺激されたCD25−CD4+“responder” 細胞の増殖を抑制する能力をテストした。TGF-βの存在下で変化したFoxp3gfpマウス由来のiNKT細胞、そしてコントロールとして、ナチュラルCD25highCD4+(nTreg)細胞とin vitroにおいて変化したFoxp3+CD4+T細胞(Foxp3gfpマウスからも)を用いた。キラー細胞の比率滴定は、変化したFoxp3+CD4+T細胞へ類似した効率と、nTreg細胞(図5a)のわずかに劣る効率を有するターゲットCD25−CD4+T細胞の増殖を、変化したFoxp3+iNKT細胞が、実際に抑制できることを示した。GITRは、Foxp3+iNKTリンパ球(図5b)により介在された調整機能における優位な役割を担うことを示しながら、抗IL10Rではなく、抗GITR抗体(42)の培養への添加は、抑制を逆にした。この結果に合致してFoxp3+iNKT細胞は、Transwell(図5c)で、キラー細胞から培養分離された際、際だった抑制機能の低下が示された。この結果は、従来型Treg細胞に類似しており、iNKTリンパ球におけるFoxp3の誘発は、GITRにより介在された接触依存メカニズムを通して、これら細胞に発揮された抑制機能を与えることを示唆した。
【0160】
例5 Foxp3+iNKT細胞のIn vivo分化はTGF-β依存性
【0161】
Foxp3gfpマウスが産生されたとき、主たる造血系は、Foxp3の発現のためスクリーニングされた。Tリンパ球およびBリンパ球、NK1.1+細胞、マクロファージ、樹状細胞において、Foxp3発現は、αβ T細胞(37)に対して制限されるか観察された。この研究において、NK1.1+TCRβ+リンパ球およびFoxp3発現として、細胞性サブセットが除外された点で、NKT細胞は確認された。しかしNK1.1レセプターの表現型を欠いたNKT細胞の小サブセットがある。加えて、従来型Tリンパ球のサブセットのいくつかは活性化の際、NK1.1を発現できる。それゆえTCRを特定に認識できる四量体を用いて明瞭なinvariant NKT細胞を認識することによって、この観察を確認することをこころみた。肝臓、脾臓、フ゜ールされたLN、パイエル板(PP)と未感作C57Bl/6マウス(図6a,b)の胸腺から単核細胞を集めた。CD4+T細胞の比率がFoxp3を発現した一方、いずれの組織からのiNKT細胞ゲートにおいて検知できないFoxp3が観察された。Balb/cマウスおよびFoxp3gfpマウス(図7)を用いて同様の結果が得られた。
【0162】
α-GalCerへの消化管暴露は、腸間膜リンパ節(MLN)でのFoxp3+iNKT細胞の認識につながるのか、また同じ方法で、口腔耐性は、MLN(43)でFoxp3+Treg細胞のde novo誘発へつながるのか調べた。α-GalCerが胃内のルートで送られたとき、MLNでのFoxp3+iNKT細胞の集積を観察して、マウス(図6c)ごとの細胞の平均値が1383(±206, SD)になった。注視すべき点として、MLNからのFoxp3+iNKT細胞のほとんどが、CD25低値を発現した。Foxp3+iNKT細胞のin vivo産生がTGF-βを必要とするかを調べるために、T細胞およびNKT細胞がTGF-βシグナル(図6c)(44)を形質導入できないdnTGFβRIIマウスへの胃管栄養法によりα-GalCerが送られるとき、Foxp3+iNKT細胞が誘発されないことを観察した。
【0163】
TGF-β、組織のリモデリングを特徴とする繊維症のキーメディエーターを含むサイトカインを有する環境下で知られているiNKT細胞であるアレルギー性気道疾患のマウスモデルを調べた(45)。水酸化アルミニウム(alum)腹腔投与でオボアルブミン(OVA)をもちいて感作されたBalb/cマウスとC57Bl/6マウスの肺から遊離し、つづいて急性もしくは慢性アレルギー性気道疾患(図8)(45)につうずるとして知られているプロトコルと一致して気道に送られたOVAを用いて接種された、iNKT細胞内でのFoxp3表現型を、コントロールとしてはCD4+Tリンパ球の中も調べた。急性もしくは慢性疾患であるかを問わず、もっともアレルギー性の高いマウスの肺から識別されたiNKT細胞によって発現したFoxp3を、識別されたCD4+T細胞(図6d)より低値ではあるが発見された。注視すべき点として、未感作で、操作されていないコントロールマウスの肺から識別されたiNKT細胞は、CD4T細胞とは異なり、Foxp3発現(図6d)を示さなかった。
【0164】
両者を考慮し、Foxp3+iNKT細胞は、胸腺で通常は産生されておらず、TGF-βが存在する環境の末梢で誘発されていることがこの観察より示唆される。
【0165】
例6 実験的アレルギー脳炎(EAE)の予防とFoxp3+iNKTreg細胞の局所発現に存在する関連
【0166】
iNKT細胞(46)発現が以前の保護効果に起因するかを実証するため、多発性硬化症の実験モデルマウス(MS)を使用し、これはFoxp3+iNKTreg細胞の局所集積に関連する。iNKT細胞間にてFoxp3+iNKT細胞の過剰発現(図9)を呈する頸部リンパ節を補強することが認められた。Foxp3+iNKT細胞の増大は著しく中枢神経系(CNS)に制限されており、全身(すなわち、脾臓やCNSを排出しないリンパ節)では観察されていない。この観察からiNKTreg細胞が全体的な免疫抑制の発現がなく、局所の抗炎症作用に介在できることが示唆された。EAEを誘発されたマウスにα-GalCerを投与した。α--GalCerを投与された全てのマウスにはEAEが発病せず、Foxp3+NKTreg細胞の増加が排出リンパ節で観察された。このことから我々のデータで、NKTreg細胞のin vivo産生にNKT細胞アゴニストの使用が可能であり、免疫介在性疾患の予防が可能であることを確証した。
【0167】
例7 ヒトiNKT細胞のFoxp3+iNKTreg細胞への転換可能
【0168】
Foxp3発現がヒトiNKT細胞を誘導できるかも評価した。ヒト抹消血中(47)のiNKTリンパ球の発現が少ないことを考慮して、全T細胞を磁気分離で濃縮し、TGF-βだけでなくIL-12抗体、IFN-γ、IL-4抗体(ヒトCD4 T細胞をFoxp3+Tregsに変換する前述の好ましい環境(48))に対する抗体の遮断カクテルも含め、偏光環境下にて集団細胞群を培養した。培養5日後に最大40%のヒトiNKT細胞がFoxp3にアップレギュレートした。従来のCD4+T細胞(図10)と比べて変換が効率化した。変換したヒトFoxp3+NKT細胞はCD25+、GITR+、そして大部分はCD161+であったが、CD127は約半数のFoxp3+iNKT細胞を発現した。
【0169】
例8 in situ Foxp3+iNKT産生によるアレルギー性気道疾患(喘息)の予防
【0170】
アレルギー性気道疾患に罹患したマウスモデル(オボアルブミン(OVA)や一般的なアレルゲンであるイエダニ、チリダニ類への感作に基づく)を0日目と14日目にアルミニウム容器に入れ、その後20日目、21日目、22日目に鼻腔内にアレルゲンを入れ感染させた。alpha-GalCer(NKT細胞刺激化合物)の単独鼻腔内投与もしくはTGF-βの追加は、気道のNKTreg細胞集積を導くか、気道疾患の臨床症状の予防を導くかどうかを測定した。NKTregを誘発するレジメンが鼻腔内アレルゲン感染と同日に行われた。疾患重症度の低減は組織切片内の炎症性浸潤の低減;肺ホモジネート内のTh2サイトカイン(IL-4、IL-5、IL-13)減少、気管支肺胞洗浄における好酸球含有量の減少、重要なものは気道過敏症状の低減によって評価し、メタコリン吸入量増加に対する反応(気道抵抗)により判定した。
【0171】
気道へのアレルゲン侵入時間に関連し、以下の異なった投与タイミングで試験した。症状発現は治療を誘発するNKTregの事前曝露によって防止できるか、(2)疾患発現はアレルゲン曝露時に治療を誘発するNKTregの投与によって低減できるか、そして汚染時にマウスは顕性アレルギー性気管支炎を発症するかである。
【0172】
参考文献
1.Kronenberg M.、2005年、Annual review of immunology 23:877-900『NKT細胞の生物学的理解に向けて:進歩とパラドックス』
2.Gumper J.E.、S.Miyake、T.Yamamura、およびM.B.Brenner、2002年、The Journal of experimental medicine 195:625-636『CD1d四量体染色により明らかとなったCD1dに限定された機能的にNKT細胞に特異なサブセット』
3.Miche M.L.、A.C.Keller、C.Paget、M. Fujio、F.Trottein、P.B.Savage、C.H.Wong、E. Schneider、M.Dy、およびM.C.Leite-de-Moraes、2007年、The Journal of experimental medicine 204:995-1001『気道内での好中球の出現に関与するIL-17産生性NK1.1(陰性)iNKT細胞集団の同定』
4.Coquet J.M.、S.Chakravarti、K.Kyparissoudis、F.W.McNab、L.A.Pitt、B.S.McKenzie、S.P.Berzins、M.J.Smyth、およびD.I.Godfrey、2008年、Proceedings of the National Academy of Sciences of the United States of America 105:11287-11292『NKT細胞サブセットによる多様なサイトカイン産生およびIL-17産生性CD4-NK1.1-NKT細胞集団の同定』
5.Rachitskaya A.V.、A.M.Hansen、R.Horai、Z.Li、R.Villasmil、D.Luger、R.B.Nussenblatt、およびR.R.Caspi、2008年、J Immunol 180:5167-5171『最先端科学:NKT細胞がIL-23レセプターおよびRORγtを構成的に発現し、レセプター結紮時にIL-6に依存しない方法により急速にIL-17を産生する。』
6.Lee K.A.、M.H.Kang、Y.S.Lee、Y.J.Kim、D.H.Kim、H.J.Ko、およびC.Y.Kang、2008年、Cellular immunology 251:50-55A『ナチュラルキラーT細胞に特異なサブセットが、気道過敏性の原因とならずに好中球の気道浸潤に寄与してIL-17を産生する。』
7.Niemeyer,M.、A.Darmoise、H.J.Mollenkopf、K.Hahnke、R.Hurwitz、G.S.Besra、U.E.Schaible、およびS.H.Kaufmann、2008年、Immunology 123:45-56『遺伝子発現プロフィールによるナチュラルキラーT細胞の特徴分析:Tヘルパー1型(Th1)、Th2およびTh17免疫反応を橋渡しする多面性の説明』
8.Rafter,M.J.、F.Winau、T.Giese、S.H.Kaufmann、U.E.Schaible、およびG.Schonrich、2008年、European journal of immunology 38:668-679『ウィルス危険信号がCD1dデノボ合成およびNKT細胞活性化を制御する。』
9.Biburger,M.、およびG.Tiegs、2008年、Journal of leukocyte biology 84:264-279『活性化により誘発されるNKT細胞の低応答性はアルファ−ガラクトシルセラミド肝炎を防ぐが、活発な転写調整要因には依存しない。』
10.Moreno,M.、J.W.Molling、S.von Mensdorff-Pouilly、R.H.Verheijen、E.Hooijberg、D.Kramer、A.W.Reurs、A.J.van den Eertwegh、B.M.von Blomberg、R.J.Scheper、およびH.J.Bontkes、2008年、J Immunol 181:2446-2454『IFN-γを産生するヒトiNKT細胞が、腫瘍関連抗原に特有の細胞傷害性T細胞の反応を促進する。』
11.Akbari,O.、P.Stock、E.Meyer、M.Kronenberg、S.Sidobre、T.Nakayama、M.Taniguchi、M.J.Grusby、R.H.DeKruyff、およびD.T.Umetsu、2003年、Nature medicine 9:582-588『アレルゲン誘発性気道過敏症の発現におけるIL-4およびIL-13産生性NKT細胞の重要な役割』
12.Gober,M.D.、R.Fishelevich、Y.Zhao、D.Unutmaz、およびA.A.Gaspari、2008年、The Journal of investigative dermatology 128:1460-1469『ヒトNKT細胞は、アレルギー性接触皮膚炎の誘出点で皮膚に浸潤する。』
13.Mattner,J.、P.B.Savage、P.Leung、S.S.Oertelt、V.Wang、O.Trivedi、S.T.Scanlon、K.Pendem、L.Teyton、J.Hart、W.M.Ridgway、L.S.Wicker、M.E.Gershwin、およびA.Bendelac、2008年、Cell host and microbe 3:304-315『ナチュラルキラーT細胞の微生物の活性化により誘発される肝臓の自己免疫疾患』
14.Jian,X.、T.Shimaoka、S.Kojo、M.Harada、H.Watarai、H.Wakao、N.Ohkohchi、S.Yonehara、M.Taniguchi、およびK.Seino、2005年、J Immunol 175:2051-2055『最先端科学:同種移植寛容性におけるNKT細胞輸送におけるCXCL16/CXCR6の重要な役割』
15.Meyer,E.H.、S.Goya、O.Akbari、G.J.Berry、P.B.Savage、M.Kronenberg、T.Nakayama、R.H.DeKruyff、およびD.T.Umetsu、2006年、Proceedings of the National Academy of Sciences of the United States of America 103:2782-2787『インバリアントT細胞レセフ゜ター+NKT細胞の糖脂質活性化は、従来のCD4+T細胞に依存しない気道過敏症を十分に誘発する。』
16.Hong,S.、M.T.Wilson、I.Serizawa、L.Wu、N.Singh、O.V.Naidenko、T.Miura、T.Haba、D.C.Scherer、J.Wei、M.Kronenberg、Y.Koezuka、およびL.Van Kaer、2001年、Nature medicine 7:1052-1056『ナチュラルキラーT細胞リガンドのα−ガラクトシルセラミドは、非肥満型糖尿病マウスの自己免疫性糖尿病を抑止する。』
17.Singh,A.K.、M.T.Wilson、S.Hong、D.Olivares-Villagomez、C.Du、A.K.Stanic、S.Joyce、S.Sriram、Y.Koezuka、およびL.Van Kae、2001年、The Journal of experimental medicine 194:1801-1811『ナチュラルキラーT細胞が活性化されると、マウスは実験的自己免疫性脳脊髄炎を発症しない。』
18.Kim,E.Y.、J.T.Battaile、A.C.Patel、Y.You、E.Agapov、M.H.Grayson、L.A.Benoit、D.E.Byers、Y.Alevy、J.Tucker、S.Swanson、R.Tidwell、J.W.Tyner、J.D.Morton、M.Castro、D.Polineni、G.A.Patterson、R.A.Schwendener、J.D.Allard、G.Peltz、およびM.J.Holtzman、2008年、Nature medicine 14:633-640『先天性免疫反応の持続的活性化により、呼吸器でのウィルス感染が慢性肺疾患へと変移する。』
19.Bendelac,A.、P.B.Savage、およびL.Teyton、2007年、Annual review of immunology 25:297-336『NKT細胞の生物学』
20.Van Kaer,L、2007年、Current opinion in immunology 19:354-364『NKT細胞:先天的にエフェクター機能を持つTリンパ球』
21.Godfrey,D.I.、およびS.P.Berzins、2007年、Nature reviews 7:505-518『NKT細胞の発達における制御点』
22.Savage,A.K.、他、2008年、Immunity 29,391-403『転写制御因子PLZFはNKT細胞系統のエフェクター・プログラムを管理する。』
23.Matsuda,J.L.、L.Gapin、J.L.Baron、S.Sidobre、D.B.Stetson、M.Mohrs、R.M.Locksley、およびM.Kronenberg、2003年、Proceedings of the National Academy of Sciences of the United States of America 100:8395-8400『マウスVA14iナチュラルキラーT細胞は、生体内サイトカイン分極化に対して耐性がある。』
24.Allan,S.E.、R.Broady、S.Gregori、M.E.Himmel、N.Locke、M.G.Roncarolo、R.Bacchetta、およびM.K.Levings、2008年、Immunological reviews 223:391-421『CD4+T制御性細胞:ヒトの疾患の治療に向けて』
25.Brusko,T.M.、A.L.Putnam、およびJ.A.Bluestone、2008年、Immunological reviews 223:371-390『ヒト調節性T細胞:自己免疫性疾患における役割と治療の機会』
26.Graca,L.、A.Le Moine、S.P.Cobbold、およびH.Waldmann、2003年、Current opinion in immunology 15:499-506『優性移植寛容性についての意見』
27.Annacke,O.、R.Pimenta-Araujo、O. Burlen-Defranoux、T.C.Barbosa、A.Cumano、およびA.Bandeira、2001年、J Immunol 166:3008-3018『CD25+CD4+T細胞はIL-10の産生を通して抹消CD4-T細胞の拡大を抑制する。』
28.Edinger,M.、P.Hoffmann、J.Ermann、K.Drago、C.G.Fathman、S.Strober、およびR.S.Negrin、2003年、Nature medicine 9:1144-1150『CD4+CD25+調節性T細胞は、骨髄移植後の移植片対宿主病を抑制して移植片対腫瘍効果を維持する。』
29.Hoffman,P.、J.Ermann、M.Edinger、C.G.Fathman、およびS.Strober、2002年、The Journal of experimental medicine 196:389-399『ドナータイプのCD4(+)CD25(+)調節性T細胞は、同種間骨髄移植後に起こる致死的急性移植片対宿主病を抑制する。』
30.Cohen,J.L.、A.Trenado、D.Vasey、D.Klatzmann、およびB.L.Salomon、2002年、The Journal of experimental medicine 196:401-406『CD4(+)CD25(+)免疫調節T細胞:移植片対宿主病に対する新しい薬物療法学』
31.Taylor,P.A.、C.J.Lees、およびB.R.Blazar、2002年、Blood 99:3493-3499『体外活性化および増殖されたCD4(+)CD25(+)免疫調節細胞の注入により、移植片対宿主病の致死性を抑止する。』
32.Hoffmann,P.、T.J.Boeld、R.Eder、J.Albrecht、K.Doser、B.Piseshka、A.Dada、C.Niemand、M.Assenmacher、E.Orso、R.Andreesen、E.Holler、およびM.Edinger、2006年、Biol Blood Marrow Transplant 12:267-274『試験のためのCD4+CD25+調節性T細胞の隔離』
33.Graca,L.、A.Le Moine、C.Y.Lin、P.J.Fairchild、S.P.Cobbold、およびH.Waldmann、2004年、Proceedings of the National Academy of Sciences of the United States of America 101:10122-10126『ドナー特異的移植寛容性:CD4+CD25+T細胞の矛盾する行動。』
34.Graca,L.、A.Le Moine、S.P.Cobbold、およびH.Waldmann、2003年、Immunologic research 28:181-191『免疫抗体に誘発される移植寛容性:優性規制の役割』
35.Sakaguchi,S.、T.Yamaguchi、T.Nomura、およびM.Ono、2008年、Cell 133:775-787『調節性T細胞および免疫寛容性』
36.Chen,W.、W.Jin、N.Hardegen、K.J.Lei、L.Li、N.Marinos、G.McGrady、およびS.M.Wahl、2003年、The Journal of experimental medicine 198:1875-1886『転写因子Foxp3のTGFβ誘導による抹消CD4+CD25−ナイーブT細胞のCD4+CD25+調節性T細胞への変換』
37.Fontenot,J.D.、J.P.Rasmussen、L.M.Williams、J.L.Dooley、A.G.Farr、およびA.Y.Rudensky、2005年、Immunity 22:329-341『フォークヘッド転写因子Foxp3別の調節性T細胞系統の仕様』
38.Komatsu,N.、他、2009年、Proceedings of the National Academy of sciences of the United States of America 106,1903-1908『ナチュラルFoxp3+T細胞の多様性:委任調節性T細胞系統と可塑性を保っている非委任少数細胞群』
39.Fontenot,J.D.、Gavin、M.A.およびRudensky、A.Y.、2003年、Nature immunology 4,330-336『Foxp3がCD4+CD25+調節性T細胞の発生と機能とをプログラムする。』
40.Hor,S.、Nomura,T.、およびSakaguchi, S.、2003年、Science(New York,N.Y299,1057-1061『転写因子Foxp3による調節性T細胞の発生制御』
41.Khattri,R.、Cox,T.、Yasayko,S.A.、およびRamsdell,F.、2003年、Nature immunology 4,337-342『CD4+CD25+調節性T細胞におけるスカーフィンの重要な役割』
42.Tone,M.、他、2003年、Proceedings of the National Academy of Sciences of the United States of America 100,15059-15064『マウス糖質ステロイドに誘発される腫瘍壊死因子レセプター・リガンドは、T細胞にとって共刺激となる。』
43.Mucida,D.、他、2005年、The Journal of clinical investigation 115,1923-1933『自然発生的調節性T細胞の欠如下における経口免疫寛容性』
44.Gorelik,L.、およびFlavell,R.A、2000年、Immunity 12,171-181『T細胞内でシグナル伝達を行うTGFβの廃止により、自然発生的T細胞の分化と自己免疫疾患が誘発される。』
45.Kearley,J.、Robinson,D.S.、および Lloyd,C.M.、2008年、The Journal of allergy and clinical immunology 122,617-624 e616『CD4+CD25+調節性T細胞は、慢性アレルギー性気道炎症からの回復を促し、気道理モデリングを抑制する。』
46.Mars,L.T.、他、2009年、Proceedings of the National Academy of Sciences of the United States of America 106,6238-6243『iNKT細胞がTh17系統の発生を抑制する。』
47.Berzins,S.P.、Cochrane,A.D.、Pellicci,D.G.、Smyth,M.J.、およびGodfrey,D.I.、2005年、European journal of immunology 35,1399-1407『対組織サンプルの個体発生研究によって明らかになった、ヒトの胸腺と血液NKT細胞内容との限定相関関係』
48.Mantel,P.Y.、他、2007年、PLoS biology 5,e329『GATA3主導のTh2反応は、TGFβ1の誘発するFoxp3の発現と調節性T細胞の形成を抑制する。』
【0173】
均等物
上記の明細書に基づくと、当業者は本発明を実施できるよう十分明確になる。発明の詳細な説明は具体例であって、例示だけを目的としており、特許請求されている本発明の範囲の限定を意図するものではない。本発明の精神を逸脱しない範囲内において種々の改良変更をなし得ることは、添付されている特許請求の範囲内に含めるものであるのが勿論である。
本出願で引用されたすべての引例、特許、公開特許出願の内容は、全体または一部を問わず、本文書で引用された使用または主題のために、引用により本文書の中に含まれる。
【特許請求の範囲】
【請求項1】
遊離Foxp3+ナチュラルキラーT細胞であることを特徴とする遊離Foxp3+ナチュラルキラーT細胞。
【請求項2】
遊離細胞集団であって、
(a)少なくとも0.001%のFoxp3+ナチュラルキラーT細胞、または、
(b)少なくとも10個のFoxp3+ナチュラルキラーT細胞を有することを特徴とする遊離細胞集団。
【請求項3】
Foxp3+ナチュラルキラーT細胞の割合は、少なくとも0.001%、少なくとも0.01%、少なくとも0.05%、少なくとも0.1%、少なくとも0.5%、少なくとも1%、少なくとも5%、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、または、少なくとも90%とすることを特徴とする請求項2に記載の細胞集団。
【請求項4】
Foxp3+ナチュラルキラーT細胞の数は、少なくとも1個、少なくとも10個、少なくとも50個、少なくとも100個、少なくとも500個、少なくとも1,000個、少なくとも5,000個、少なくとも10,000個、少なくとも50,000個、少なくとも100,000個、少なくとも1×106個、少なくとも1×107個、または、少なくとも1×108とすることを特徴とする請求項2に記載の細胞集団。
【請求項5】
細胞群は血球集団、白血球集団、T細胞集団、または、ナチュラルキラーT細胞集団であることを特徴とする請求項2〜4のいずれか1項に記載の細胞集団。
【請求項6】
細胞群はT細胞集団であることを特徴とする請求項2〜4のいずれか1項に記載の細胞集団。
【請求項7】
TGF-βとFoxp3+ナチュラルキラーT細胞を十分に生成するのに十分な量の1個以上のNKT刺激剤の組み合わせを伴うナチュラルキラーT細胞を有する細胞集団への接触方法を有することを特徴とするFoxp3+ナチュラルキラーT細胞を生成する方法。
【請求項8】
IL-2を伴う細胞集団との接触方法をさらに含むことを特徴とする請求項7に記載の方法。
【請求項9】
IL-7、IL-15、IL-2のいずれか、または、これらのいずれかの組み合わせを伴う細胞集団との接触方法をさらに含むことを特徴とする請求項7または8に記載の方法。
【請求項10】
抗IFNγ抗体、抗IL-4、抗IL-6抗体、抗IL12、抗IL-27抗体で構成されるク゛ルーフ゜から選択された中和抗体のいずれか、または、これらのいずれかの組み合わせを伴う細胞群との接触方法をさらに含むことを特徴とする請求項7〜9いずれか1項に記載の方法。
【請求項11】
細胞集団は、血球集団、白血球集団、T細胞集団、または、ナチュラルキラーT細胞集団であることを特徴とする請求項7〜10のいずれか1項に記載の方法。
【請求項12】
細胞集団は被験から採取することを特徴とする請求項7〜10のいずれか1項に記載の方法。
【請求項13】
Foxp3+ナチュラルキラーT細胞の数を増やす方法であって、
TGF-Βと、1個以上のNKT刺激剤と、1個以上の増殖誘発サイトカインと、Foxp3+ナチュラルキラーT細胞の数の増加に十分な量の中和抗体とを組み合わせた少なくとも1つのFoxp3+ナチュラルキラーT細胞を有する細胞集団との接触方法を含むことを特徴とするFoxp3+ナチュラルキラーT細胞の数を増やす方法。
【請求項14】
Foxp3+ナチュラルキラーT細胞の数が、少なくとも2倍、少なくとも5倍、少なくとも10倍、少なくとも50倍、少なくとも100倍、少なくとも200倍、少なくとも500倍、少なくとも1,000倍、少なくとも10,000倍、少なくとも100,000倍、少なくとも106倍、少なくとも107倍増加することを特徴とする請求項13に記載の方法。
【請求項15】
増殖を誘発するサイトカインは、IL-2、IL-7、IL-15、および、IL-21のいずれか、または、これらのいずれかの組み合わせとすることを特徴とする請求項13、または、14に記載の方法。
【請求項16】
中和抗体は、抗IFNγ抗体、抗IL-4抗体、抗IL-6抗体、抗IL12抗体、および、抗IL-27抗体のいずれか、または、これらのいずれかの組み合わせとすることを特徴とする請求項14〜16のいずれか1項に記載の方法。
【請求項17】
ナチュラルキラーT細胞を被験の肝臓、または、粘膜組織へ送るための方法であって、Foxp3+ナチュラルキラーT細胞の被験への全身的な投与方法を有することを特徴とするナチュラルキラーT細胞を被験の肝臓、または、粘膜組織へ送るための方法。
【請求項18】
ナチュラルキラーT細胞を被験の肝臓、または、粘膜組織へ送るための方法であって、Foxp3+ナチュラルキラーT細胞の被験への局所的な投与方法を有することを特徴とするナチュラルキラーT細胞を被験の肝臓、または、粘膜組織へ送るための方法。
【請求項19】
Foxp3+ナチュラルキラーT細胞は自己細胞であることを特徴とする請求項17または18に記載の方法。
【請求項20】
Foxp3+ナチュラルキラーT細胞は、Foxp3+ナチュラルキラーT細胞を生成するために十分な量の1個以上のNKT細胞刺激剤とTGF-Βを伴うナチュラルキラーT細胞との接触により生成することを特徴とする請求項17〜19のいずれか1項に記載の方法。
【請求項21】
Foxp3+ナチュラルキラーT細胞は、肝臓、または、粘膜組織内での免疫反応を抑制する効果的な量が投与することを特徴とする請求項17〜20のいずれか1項に記載の方法。
【請求項22】
肝臓内における免疫反応の抑制は、移植片対宿主病、膵島移植により引き起こされるかそれに関わる好ましくない免疫反応、または、肝臓移植もしくは肝臓への免疫介在性炎症により引き起こされるかそれに関わる好ましくない免疫反応を治療するために投与することを特徴とする請求項17〜21のいずれか1項に記載の方法。
【請求項23】
Foxp3+ナチュラルキラーT細胞は、膵島移植、もしくは、肝移植と併せて投与管理することを特徴とする請求項21に記載の方法。
【請求項24】
Foxp3+ナチュラルキラーT細胞のゲノムは、ポリペプチドをコート゛化する核酸を有し、肝臓におけるポリペプチドの発現を肝臓へのFoxp3+ナチュラルキラーT細胞の送り込みが、肝臓でのポリペプチドの発現に誘因することを特徴とする請求項17〜19のいずれか1項に記載の方法。
【請求項25】
被験の臓器の中の免疫反応を抑制する方法であって、
前記臓器の中の免疫反応を十分に抑制する1個以上のNKT刺激剤の量の局所的な送り込みを有することを特徴とする被験の臓器の中の免疫反応を抑制する方法。
【請求項26】
請求項25の方法であって、前記臓器の中の免疫反応を十分に抑制するTGF-Βの量の局所的な送り込み方法をさらに含むことを特徴とする請求項25に記載の方法。
【請求項27】
前記の免疫反応は、抗原に対する免疫反応であることを特徴とする請求項25または26に記載の方法。
【請求項28】
前記の免疫反応は、自己免疫反応であることを特徴とする請求項25または26に記載の方法。
【請求項29】
臓器とは消化管、または、肺であることを特徴とする請求項25〜28のいずれか1項に記載の方法。
【請求項30】
前記免疫反応の抑制とは、炎症性腸疾患、クローン病、または、ぜんそくであることを特徴とする請求項29に記載の方法。
【請求項31】
組織への局所的な送り込みとは、粘膜組織への送り込みであることを特徴とする請求項25〜28のいずれか1項に記載の方法。
【請求項32】
医薬組成物であって、
Foxp3+ナチュラルキラーT細胞を含む細胞集団を有することを特徴とする医薬組成物。
【請求項33】
前記細胞集団は、血液細胞の集団であることを特徴とする請求項32に記載の医薬組成物。
【請求項34】
前記細胞集団は、白血球集団であることを特徴とする請求項32に記載の医薬組成物。
【請求項35】
前記細胞集団は、T細胞集団であることを特徴とする請求項32に記載の医薬組成物。
【請求項36】
前記細胞集団は、NKT細胞の集団であることを特徴とする請求項32に記載の医薬組成物。
【請求項37】
医薬品組成物であって、
TGF-Β、および、1個以上のNKT刺激剤を有することを特徴とする医薬品組成物。
【請求項1】
遊離Foxp3+ナチュラルキラーT細胞であることを特徴とする遊離Foxp3+ナチュラルキラーT細胞。
【請求項2】
遊離細胞集団であって、
(a)少なくとも0.001%のFoxp3+ナチュラルキラーT細胞、または、
(b)少なくとも10個のFoxp3+ナチュラルキラーT細胞を有することを特徴とする遊離細胞集団。
【請求項3】
Foxp3+ナチュラルキラーT細胞の割合は、少なくとも0.001%、少なくとも0.01%、少なくとも0.05%、少なくとも0.1%、少なくとも0.5%、少なくとも1%、少なくとも5%、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、または、少なくとも90%とすることを特徴とする請求項2に記載の細胞集団。
【請求項4】
Foxp3+ナチュラルキラーT細胞の数は、少なくとも1個、少なくとも10個、少なくとも50個、少なくとも100個、少なくとも500個、少なくとも1,000個、少なくとも5,000個、少なくとも10,000個、少なくとも50,000個、少なくとも100,000個、少なくとも1×106個、少なくとも1×107個、または、少なくとも1×108とすることを特徴とする請求項2に記載の細胞集団。
【請求項5】
細胞群は血球集団、白血球集団、T細胞集団、または、ナチュラルキラーT細胞集団であることを特徴とする請求項2〜4のいずれか1項に記載の細胞集団。
【請求項6】
細胞群はT細胞集団であることを特徴とする請求項2〜4のいずれか1項に記載の細胞集団。
【請求項7】
TGF-βとFoxp3+ナチュラルキラーT細胞を十分に生成するのに十分な量の1個以上のNKT刺激剤の組み合わせを伴うナチュラルキラーT細胞を有する細胞集団への接触方法を有することを特徴とするFoxp3+ナチュラルキラーT細胞を生成する方法。
【請求項8】
IL-2を伴う細胞集団との接触方法をさらに含むことを特徴とする請求項7に記載の方法。
【請求項9】
IL-7、IL-15、IL-2のいずれか、または、これらのいずれかの組み合わせを伴う細胞集団との接触方法をさらに含むことを特徴とする請求項7または8に記載の方法。
【請求項10】
抗IFNγ抗体、抗IL-4、抗IL-6抗体、抗IL12、抗IL-27抗体で構成されるク゛ルーフ゜から選択された中和抗体のいずれか、または、これらのいずれかの組み合わせを伴う細胞群との接触方法をさらに含むことを特徴とする請求項7〜9いずれか1項に記載の方法。
【請求項11】
細胞集団は、血球集団、白血球集団、T細胞集団、または、ナチュラルキラーT細胞集団であることを特徴とする請求項7〜10のいずれか1項に記載の方法。
【請求項12】
細胞集団は被験から採取することを特徴とする請求項7〜10のいずれか1項に記載の方法。
【請求項13】
Foxp3+ナチュラルキラーT細胞の数を増やす方法であって、
TGF-Βと、1個以上のNKT刺激剤と、1個以上の増殖誘発サイトカインと、Foxp3+ナチュラルキラーT細胞の数の増加に十分な量の中和抗体とを組み合わせた少なくとも1つのFoxp3+ナチュラルキラーT細胞を有する細胞集団との接触方法を含むことを特徴とするFoxp3+ナチュラルキラーT細胞の数を増やす方法。
【請求項14】
Foxp3+ナチュラルキラーT細胞の数が、少なくとも2倍、少なくとも5倍、少なくとも10倍、少なくとも50倍、少なくとも100倍、少なくとも200倍、少なくとも500倍、少なくとも1,000倍、少なくとも10,000倍、少なくとも100,000倍、少なくとも106倍、少なくとも107倍増加することを特徴とする請求項13に記載の方法。
【請求項15】
増殖を誘発するサイトカインは、IL-2、IL-7、IL-15、および、IL-21のいずれか、または、これらのいずれかの組み合わせとすることを特徴とする請求項13、または、14に記載の方法。
【請求項16】
中和抗体は、抗IFNγ抗体、抗IL-4抗体、抗IL-6抗体、抗IL12抗体、および、抗IL-27抗体のいずれか、または、これらのいずれかの組み合わせとすることを特徴とする請求項14〜16のいずれか1項に記載の方法。
【請求項17】
ナチュラルキラーT細胞を被験の肝臓、または、粘膜組織へ送るための方法であって、Foxp3+ナチュラルキラーT細胞の被験への全身的な投与方法を有することを特徴とするナチュラルキラーT細胞を被験の肝臓、または、粘膜組織へ送るための方法。
【請求項18】
ナチュラルキラーT細胞を被験の肝臓、または、粘膜組織へ送るための方法であって、Foxp3+ナチュラルキラーT細胞の被験への局所的な投与方法を有することを特徴とするナチュラルキラーT細胞を被験の肝臓、または、粘膜組織へ送るための方法。
【請求項19】
Foxp3+ナチュラルキラーT細胞は自己細胞であることを特徴とする請求項17または18に記載の方法。
【請求項20】
Foxp3+ナチュラルキラーT細胞は、Foxp3+ナチュラルキラーT細胞を生成するために十分な量の1個以上のNKT細胞刺激剤とTGF-Βを伴うナチュラルキラーT細胞との接触により生成することを特徴とする請求項17〜19のいずれか1項に記載の方法。
【請求項21】
Foxp3+ナチュラルキラーT細胞は、肝臓、または、粘膜組織内での免疫反応を抑制する効果的な量が投与することを特徴とする請求項17〜20のいずれか1項に記載の方法。
【請求項22】
肝臓内における免疫反応の抑制は、移植片対宿主病、膵島移植により引き起こされるかそれに関わる好ましくない免疫反応、または、肝臓移植もしくは肝臓への免疫介在性炎症により引き起こされるかそれに関わる好ましくない免疫反応を治療するために投与することを特徴とする請求項17〜21のいずれか1項に記載の方法。
【請求項23】
Foxp3+ナチュラルキラーT細胞は、膵島移植、もしくは、肝移植と併せて投与管理することを特徴とする請求項21に記載の方法。
【請求項24】
Foxp3+ナチュラルキラーT細胞のゲノムは、ポリペプチドをコート゛化する核酸を有し、肝臓におけるポリペプチドの発現を肝臓へのFoxp3+ナチュラルキラーT細胞の送り込みが、肝臓でのポリペプチドの発現に誘因することを特徴とする請求項17〜19のいずれか1項に記載の方法。
【請求項25】
被験の臓器の中の免疫反応を抑制する方法であって、
前記臓器の中の免疫反応を十分に抑制する1個以上のNKT刺激剤の量の局所的な送り込みを有することを特徴とする被験の臓器の中の免疫反応を抑制する方法。
【請求項26】
請求項25の方法であって、前記臓器の中の免疫反応を十分に抑制するTGF-Βの量の局所的な送り込み方法をさらに含むことを特徴とする請求項25に記載の方法。
【請求項27】
前記の免疫反応は、抗原に対する免疫反応であることを特徴とする請求項25または26に記載の方法。
【請求項28】
前記の免疫反応は、自己免疫反応であることを特徴とする請求項25または26に記載の方法。
【請求項29】
臓器とは消化管、または、肺であることを特徴とする請求項25〜28のいずれか1項に記載の方法。
【請求項30】
前記免疫反応の抑制とは、炎症性腸疾患、クローン病、または、ぜんそくであることを特徴とする請求項29に記載の方法。
【請求項31】
組織への局所的な送り込みとは、粘膜組織への送り込みであることを特徴とする請求項25〜28のいずれか1項に記載の方法。
【請求項32】
医薬組成物であって、
Foxp3+ナチュラルキラーT細胞を含む細胞集団を有することを特徴とする医薬組成物。
【請求項33】
前記細胞集団は、血液細胞の集団であることを特徴とする請求項32に記載の医薬組成物。
【請求項34】
前記細胞集団は、白血球集団であることを特徴とする請求項32に記載の医薬組成物。
【請求項35】
前記細胞集団は、T細胞集団であることを特徴とする請求項32に記載の医薬組成物。
【請求項36】
前記細胞集団は、NKT細胞の集団であることを特徴とする請求項32に記載の医薬組成物。
【請求項37】
医薬品組成物であって、
TGF-Β、および、1個以上のNKT刺激剤を有することを特徴とする医薬品組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公表番号】特表2012−508575(P2012−508575A)
【公表日】平成24年4月12日(2012.4.12)
【国際特許分類】
【出願番号】特願2011−536276(P2011−536276)
【出願日】平成21年11月13日(2009.11.13)
【国際出願番号】PCT/PT2009/000060
【国際公開番号】WO2010/056144
【国際公開日】平成22年5月20日(2010.5.20)
【出願人】(511115734)インスティテュート デ メディシナ モレキュラー (1)
【出願人】(511115745)ウニベルシダージ デ リジュボア (1)
【Fターム(参考)】
【公表日】平成24年4月12日(2012.4.12)
【国際特許分類】
【出願日】平成21年11月13日(2009.11.13)
【国際出願番号】PCT/PT2009/000060
【国際公開番号】WO2010/056144
【国際公開日】平成22年5月20日(2010.5.20)
【出願人】(511115734)インスティテュート デ メディシナ モレキュラー (1)
【出願人】(511115745)ウニベルシダージ デ リジュボア (1)
【Fターム(参考)】
[ Back to top ]

