GCPII突然変異体を含有するアルツハイマーの予防及び治療用薬学的組成物
【課題】グルタメート生成阻害及びβアミロイド分解活性を有するGCPII突然変異体(K699S)及び前記GCPII突然変異体(K699S)を有効成分として含有する下記の疾患の予防または治療用薬学的組成物を提供する。
【解決手段】GCPII(グルタメート・カルボキシペプチダーゼII)突然変異体(K699S)が野生型GCPIIに比べてAβ分解活性が優れているのみならず、野生型GCPIIが有していないグルタメート生成を阻害する活性を同時に保有しているので、野生型GCPIIよりその効果が顕著に優れていて安定性も優秀であることを確認することによって、GCPII突然変異体(K699S)を、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防または治療剤に有用に用いることができることが分かる。
【解決手段】GCPII(グルタメート・カルボキシペプチダーゼII)突然変異体(K699S)が野生型GCPIIに比べてAβ分解活性が優れているのみならず、野生型GCPIIが有していないグルタメート生成を阻害する活性を同時に保有しているので、野生型GCPIIよりその効果が顕著に優れていて安定性も優秀であることを確認することによって、GCPII突然変異体(K699S)を、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防または治療剤に有用に用いることができることが分かる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、グルタメート生成阻害及びβアミロイド(β-amyloid)分解活性を有するGCPII(グルタメート・カルボキシペプチダーゼII)突然変異体(K699S)、及び前記GCPII突然変異体(K699S)を有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック(Pick)病及びクロイツフェルト・ヤコブ(Creutzfeid-Jakob)病からなる群から選択された疾患の予防及び治療用薬学的組成物に関するものである。
【背景技術】
【0002】
GCPIIは、脳に存在し94〜100kDaの見かけの分子量を有したタイプII内在性膜タンパク質で、主にグリア内に存在し、NAAG(N−アセチルアスパルチルグルタメートをNAA(N−アセチルアスパルテート)及びグルタメートに加水分解することによって、興奮性神経伝達に影響を及ぼす。NAAG加水分解によって生成されたグルタメートは、中枢神経系で主要な興奮性神経伝達物質として神経系に必須な要素として作用するが、脳内での過多な蓄積は脳細胞の死滅と変性をもたらし、アルツハイマー、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病のような退行性脳疾患を惹起することが知られている(非特許文献1〜3)。
【0003】
GCPIIは、酵素活性及び発現部位によって多様な名前が存在する。前立腺でのGCPIIの強い発現(GCPIIの機能場所は知られていない)からPSMAと命名され、中枢神経系では脳神経伝達物質NAAGを代謝させるので、GCPIIをNAALADaseと命名し、小腸前半部ではポリ−g−グルタメート葉酸(poly-g-glutamated folate)、葉酸加水分解酵素(folate hydrolase)FOLH1及びカルボキシペプチダーゼとしてグルタメート・カルボキシペプチダーゼII(GCPII)からガンマ連結されたグルタメート(gamma-linked glutamate)を除去する役割をする。
【0004】
また、GCPIIの構造は、GCPIIの触媒機序及び基質特異性に対する洞察を提供する。GCPIIは活性部位に二核性Zn2+中心があって、この活性部位で二つの亜鉛原子は結合カルボン酸塩リガンド(bridging carboxylate ligand)を共有する。α−NAAGは、GCPIIのアルギニン部分と相互作用するグルタメートサイドチェーン(glutamate side chain)の種類と結合して、カルボニルが攻撃されることから酸素、及びC−末端は亜鉛イオンと結合する。基質(例えば、α−NAAGでのNAA)の残りは、Arg−210と特異的相互作用する基質−結合空間から収容される。もう少し大きな基質(例えば、最大四つの、γ連結されたグルタメートを伴うポリ−γ−グルタメート葉酸(poly-γ-glutamated folates with up to four γ-linked glutamates))は、ポケットとの立体衝突を避けるために少しの構造的再配列を要し、交差して結合し得る。また、GCPIIは二つの活性部位であるS1'ポケット及びS1ポケットを有する(非特許文献4)。前記S1ポケットはGCPII基質特異性の「微細調整(fine-tuning)」として作用し、前記S1'ポケットはNAAG及びGCPII抑制剤の主な高い親和性結合に寄与する。
【0005】
今までに、GCPIIの主要機能としては、NAAG加水分解作用があることが報告された。したがって、強力で選択的なGCPII抑制剤、すなわち2−PMPA(2−(ホスホノメチル)ペンタン二酸)は、脳卒中、ルー・ゲーリック病及び神経因性疼痛の臨床前のモデルで脳グルタメートを減少させて神経保護効果を提供すると報告されたことがある。
【0006】
以前の研究で、GCPIIがAβ(アミロイドβ)の分解効果を通じて、Aβが脳内に蓄積されることを防止または除くことで、アルツハイマー疾患及びダウン症候群などの疾病治療に用いることができると報告されたことがある(特許文献1)。しかし、GCPIIのNAAG加水分解によって生成されるグルタメートは、神経毒性を誘発するだけでなく、脳内の過多な蓄積は脳細胞の死滅と変性をもたらして、アルツハイマー、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病のような退行性脳疾患を惹起することが知られているので、GCPII使用時の安全性を保障することが難しかった。したがって、これを補うことができる方法が要求された。
【0007】
そこで本発明者等は、これを補うことができる方法を研究した結果、GCPIIの多様な突然変異体を製造してその活性を分析し、GCPII突然変異体であるK699Sが野生型GCPIIよりAβ分解に優れた効果があるのみならず、野生型GCPIIが有していないグルタメート生成阻害効果も有するため、野生型GCPIIより優れた効果があって安定性も優れて、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防または治療剤に有用に用いることができることを明らかにすることによって本発明を完成した。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】韓国特許公開番号:10-2007-0023832
【特許文献2】US 7,846,910
【特許文献3】US 2004/0185487
【非特許文献】
【0009】
【非特許文献1】Choi,W. H.,Oh,Y. S.,Ahn,J. Y.,Kim,S. R. and Ha,T. Y.(2005年)Antioxidative and protective effects of Ulmus davidiana var. japonica extracts on glutamate-induced cytotoxicity in PC12 cells. Korean J. Food Sci. Technol.第37巻,p.479-483
【非特許文献2】Jeon,H. J.,Park,S. W. and Mun,B. S.(2004年)Effects of Gwibitang on glutamate-induced death in rat neonatal astrocytes. J Korean Oriental Med.第25巻,p.184-193
【非特許文献3】Lee,J.,Kim,M. S.,Lee,C.,Kim,H. Y.,Choi,D. H.,Kim,T. Y.,Son,Y. and Park,R.(2003年)Role of morphine in the glutamate-induced oxidative damage of C6 glial cells. Korean J Anesthesiol.第45巻,p.271-277
【非特許文献4】Mlcochova P.,Plechanovova A.,Barinka C.,Mahadevan D.,Saldanha J. W.,Rjlisek L.,Konvalinka J.(2007年)Mapping of the active site of glutamate carboxypeptidase II by site-directed mutagenesis. FEBS J.第274(18)巻,p.4731-41
【非特許文献5】Cyril Barinka et al., Amino acids at the N- and C-termini of human glutamate carboxypeptidase II are required for enzymatic activity and proper folding. Eur. J. Biochem. 271, 2782-2790(2008)
【非特許文献6】HENRY S. SPENO et al., Site-Directed Mutagenesis of Predicted Active Site Residues in Glutamate Carboxypeptidase II. MOLECULAR PHARMACOLOGY, 55:179-185 (1999)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、グルタメート生成阻害及びβアミロイド分解活性を有するGCPII(glutamate carboxypeptidaseII)突然変異体(K699S)を提供することである。
【0011】
本発明の他の目的は、前記GCPII突然変異体(K699S)を用いた、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防または治療剤を提供することである。
【0012】
本発明のまた他の目的は、前記GCPII突然変異体(K699S)を用いた、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防または治療剤のスクリーニング方法を提供することである。
【課題を解決するための手段】
【0013】
前記目的を達成するために、本発明はGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(Lysine,K)をセリン(Serine,S)に変異させたGCPII突然変異体を有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物を提供する。
【0014】
また、本発明は、前記GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を発現する発現ベクターを有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤を提供する。
【0015】
また、本発明は、前記GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の遺伝子を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤のスクリーニング用薬学的組成物を提供する。
【0016】
また、本発明は前記GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物を提供する。
【0017】
また、本発明は、
(1)前記GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の発現細胞を被検物質で処理する工程、
(2)工程(1)の細胞においてGCPII突然変異タンパク質の発現水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べ、工程(2)のGCPII突然変異タンパク質の発現水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法を提供する。
【0018】
同時に、本発明は、
(1)前記GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を被検物質で処理する工程、
(2)工程(1)のGCPII突然変異タンパク質の活性水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べ、工程(2)のGCPII突然変異タンパク質の活性水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法を提供する。
【0019】
本発明1は、GCPII(グルタメート・カルボキシペプチダーゼII)の全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物である。
本発明2は、GCPII突然変異体が、配列番号2で表されるアミノ酸配列を有することを特徴とする、本発明1のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物である。
本発明3は、GCPII突然変異体が、グルタメート生成阻害活性及びβアミロイド分解活性を同時に有することを特徴とする、本発明1のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物である。
本発明4は、前記βアミロイドが、溶解性または不溶性βアミロイドであることを特徴とする、本発明3のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物である。
本発明5は、GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を発現する発現ベクターを有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤である。
本発明6は、発現ベクターが、アデノウイルス、アデノ随伴ウイルス、レトロウイルス及びワクシニアウイルスからなる群から選択されるウイルス性の発現ベクターであることを特徴とする、本発明5のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤である。
本発明7は、GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の遺伝子を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物である。
本発明8は、GCPII突然変異体の遺伝子が、配列番号1の塩基配列を有することを特徴とする、本発明7のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物である。
本発明9は、GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物である。
本発明10は、GCPII突然変異タンパク質が、配列番号2のアミノ酸配列を有することを特徴とする、本発明9のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物である。
本発明11は、
(1)GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の発現細胞を被検物質で処理する工程、
(2)工程(1)の細胞でGCPII突然変異タンパク質の発現水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べて、工程(2)のGCPII突然変異タンパク質の発現水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法である。
本発明12は、工程(2)のタンパク質の発現水準が、免疫蛍光法、酵素免疫分析法(ELISA)、ウエスタンブロット及びRT−PCRからなる群から選択されたいずれか一つで測定することを特徴とする、本発明11のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法である。
本発明13は、
(1)GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を被検物質で処理する工程と、
(2)工程(1)のGCPII突然変異タンパク質の活性水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べて、工程(2)のGCPII突然変異タンパク質の活性水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法である。
本発明14は、工程(2)のタンパク質の活性水準が、免疫蛍光法、酵素免疫分析法(ELISA)、質量分析及びタンパク質チップからなる群から選択されたいずれか一つで測定することを特徴とする、本発明13のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法である。
【発明の効果】
【0020】
本発明では、本発明によるGCPII突然変異体(K699S)が、野生型GCPIIに比べてAβ分解活性が優れているだけでなく、野生型GCPIIが有していないグルタメート生成阻害活性を同時に保有しており、野生型GCPIIよりその効果が顕著に優れていて、安定性も優秀であるので、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防または治療剤に有用に用いることができる。
【図面の簡単な説明】
【0021】
【図1】2−PMPAが、Aβに及ぼす影響を示した図である。rhGCPIIを2−PMPAまたはEDTAがあるかまたはない条件で、Aβ40とともに培養した。Aβ40をELISAまたはNAAG分解分析(cleavage assay)で検出した。
【図2】2−PMPAが、NAAG分解に及ぼす影響を示した図である。rhGCPIIを2−PMPAまたはEDTAがあるかまたはない条件で、NAAGとともに培養した。NAAG水準をELISAまたはNAAG分解分析(cleavage assay)で検出した。
【図3】レンチウイルスGCPII(lentiviral GCPII)をマウス初代星状細胞に感染させた後、単量体のAβ40で細胞を処理した。そして、2−PMPAを多様な投与量で処理した。細胞成長培地で前記Aβ40の濃度をELISA分析で測定した。
【図4】8ヶ月になったAPP Swedish/PS1E9形質転換マウスの腹腔内に、1ヶ月間2−PMPAの10mg/kgまたはPBS 2/wkを注入した(9回)。膜断片をNAAGで分析した。
【図5】8ヶ月になったAPP Swedish/PS1E9形質転換マウスの腹腔内に、1ヶ月間2−PMPAの10mg/kgまたはPBS 2/wkを注入した(9回)。膜断片をELISA分析で分析した。
【図6】GCPIIの位置選択的突然変異を示した図で、プライマーの配列を位置選択的突然変異実験に用いた。
【図7】GCPIIの位置選択的突然変異を示した図で、形質導入されたHEK293細胞で多様な突然変異タンパク質の発現を示した。
【図8】GCPIIのS1'ポケット突然変異体のNAAG分解活性を示した図である。S1'ポケット(R210A,K699S)に置換がある突然変異タンパク質は、NAAGを分解しなかった。しかし、S1ポケット(R536L,R548P)に突然変異がある他のタンパク質は、約40%程度NAAG分解活性を有する。
【図9】GCPIIのS1'ポケット突然変異体のNAAG分解活性を示した図である。GCPIIのNAAG分解活性は、Aβペプチドに影響を受けなかった。
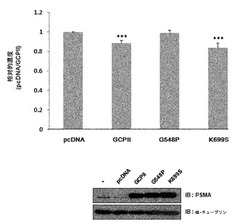
【図10】GCPII突然変異体のAβ分解に及ぼす影響を示した図である。H4細胞で、過剰発現されたS1'突然変異体(K699S)はアミロイド−β40を分解したが、S1突然変異体(G548P)は分解しなかった。
【図11】GCPII突然変異体のAβ分解に及ぼす影響を示した図である。H4細胞で、過剰発現されたS1'突然変異体(K699S)はアミロイド−β40を分解したが、S1突然変異体(G548P)は分解しなかった。
【図12】残ったAβは、G548Pを除いて、K699Sによって減少した。
【発明を実施するための形態】
【0022】
以下、本発明を詳しく説明する。
【0023】
本発明は、GCPII突然変異体(K699S)を提供する。
【0024】
前記GCPII突然変異体(K699S)は、具体的にGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたもので、より詳細には配列番号2で表されるアミノ酸配列を有するものであるが、これに限定されない。
【0025】
前記GCPII突然変異体は、具体的にグルタメート生成阻害活性及びβアミロイド分解活性を同時に有するものであるが、これに限定されない。
【0026】
また、本発明は、GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物を提供する。
【0027】
前記GCPII突然変異体は、具体的に配列番号2で表されるアミノ酸配列を有するものであるが、これに限定されない。
【0028】
前記GCPII突然変異体は、具体的にグルタメート生成阻害活性及びβアミロイド分解活性を同時に有するものであるが、これに限定されない。
【0029】
前記βアミロイドは、具体的に溶解性または不溶性ベータアミロイドであるが、これに限定されない。
【0030】
本発明者等は、GCPIIの特異的抑制剤である2−PMPAのAβペプチドに対する効果を確認するために、組換えヒトGCPII(rhGCPII)をAβ1−40と一緒にインキュベートして多様な投与量で2−PMPAを添加し、ELISAで分析した。その結果、rhGCPIIは、対照群と比べて80%程度Aβ1−40ペプチドを分解させたが、2−PMPAはGCPIIのAβ1−40分解に何らの効果がなかったことを確認した(図1参照)。2−PMPAは、初代マウス星状細胞でレンチウイルスGCPIIのAβ1−40分解を遮断しなかったことを確認した(図3参照)。GCPIIによるNAAGの加水分解は、2−PMPAによって完全に遮断されたことを確認した(図2参照)。また、マウスの脳で2−PMPAの効果を調べるために、2−PMPAで形質転換ADモデルマウスを処理した。本発明者等は、2−PMPA(10mg/kg、腹腔内に、1ヶ月間 2X/wk)を、8ヶ月になったAPP Swedish/PS1Δ9形質転換マウスに対し処理した。皮質膜断片(cortical membrane fraction)におけるAβ1−40及びAβ1−42の水準をELISAで分析し、GCPIIのNAAG分解活性をNAAG分析で測定した。その結果、NAAG分解は、PBS対照群と比べ、2−PMPAで処理したマウスにおいて約90%減少したが(図4参照)、Aβ1−40及びAβ1−42の総水準は2−PMPAの処理によって変化しなかったことを確認した(図5参照)。したがって、GCPIIでNAAGまたはAβ分解部位が異なることを確認した。
【0031】
本発明者等は、GCPIIがS1及びS1'ポケットと命名された二つの活性部位で構成されているということを基に、GCPII[ref]の多様な突然変異体である、GCPIIの7個の突然変異体(R210A、D387N、P388A、R536L、G548P、Y552I、K699S)を製作した(図6参照)。各突然変異がある、二つの相補的オリゴヌクレオチドプライマーを用いて、アミノ酸を位置選択的突然変異で変化させた。突然変異がある多様なGCPIIの発現を確認するために、突然変異プラスミドをHEK293T細胞内に形質導入させた後、ウエスタンブロットでタンパク質の発現変化を確認した。その結果、バンドのパターンは、rhGCPIIと類似し、バンドの一つはGCPIIの予測された大きさである98kDaで顕著に見られることを確認した(図7参照)。
【0032】
本発明者等は、GCPII突然変異体の酵素活性の変化を観察した。多様な突然変異体の酵素活性を分析するために、S1'ポケット(R210A,K699S)及びS1ポケット(R536L,G548P)に置換がある突然変異タンパク質を、H4細胞に形質導入させた。NAAGの加水分解を測定するために、細胞溶解物を[H]3がラベルされたNAAG(20μM)及びGCPIIの特異的基質とともに培養した。その結果、前記S1'ポケット突然変異体(R210A,K699S)は、NAAGを加水分解する活性をまったくなくしてしまったが、前記S1ポケット突然変異体(R536L,G548P)は、野生型GCPIIと比べて40%程度活性を維持するということを確認した(図8参照)。さらに、GCPIIのNAAG分解とAβ分解間の競争的阻害効果を調べるために、rhGCPIIを[H]3がラベルされたNAAG(20μM)及びAβペプチドを濃度別で培養した。その結果、GCPIIのNAAG分解活性は、Aβペプチドに影響を受けなかったことを確認した(図9参照)。したがって、S1'ポケットでのNAAG加水分解は、Aβによって影響されないことを確認し、GCPIIでのNAAG分解とAβ分解機序が異なることを確認した。
【0033】
本発明者等は、突然変異GCPIIのAβクリアランス活性を同定するために、内因性のGCPIIを発現しないことが知られているPC3細胞に、多様な突然変異プラスミドを形質導入した。48時間後、前記細胞溶解物をAβ(2μM)と混合して一晩中培養した。残ったAβペプチドは、6E10抗体を用いてドットブロット及びウエスタンブロットで確認した。その結果、K699S突然変異体は野生型よりもAβをもう少し分解したが、G548P突然変異体はAβ分解活性を失ったことを確認した(図10、11参照)。また、培養培地で外因的に処理されたAβペプチドでGCPIIの分解活性を確認するために、形質導入の翌日、培地内にAβを1ng/mlで処理して37℃で8時間培養しELISA分析を行なった。その結果、ウエスタンブロットと類似し、残ったAβは、G548Pは除外して、K699Sによって減少したことを確認した(図12参照)。したがって、S1ポケットがAβの分解においてS1'ポケットよりもう少し重要であるということを通じて、NAAG加水分解活性及びAβ分解活性の作用は、GCPII酵素によって異なって調節されるということを確認した。
【0034】
ゆえに、本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIに比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患に有用に用いることができる。
【0035】
本発明のGCP−II突然変異タンパク質を有効成分として含有する組成物は、前記有効成分以外に薬剤学的に相応しく、生理学的に許容される補助剤を用いて製造することができ、前記補助剤では、賦形剤、崩解剤、甘味料、結合剤、被剤剤、膨張剤、潤滑剤、滑沢剤または香味料などの可溶化剤を用いることができる。
【0036】
本発明のGCP−II突然変異タンパク質を有効成分として含有する組成物は、投与のために前記記載した有効成分以外に追加で薬剤学的に許容可能な担体を1種以上含んで薬学的組成物として好ましく製剤化することができる。
【0037】
液状溶液で製剤化される組成物において薬学的に許容される担体としては、食塩水、滅菌水、リンゲル液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エチルアルコール及びこれら成分の中で1成分以上を混合して用いることができ、必要によって抗酸化剤、緩衝液、静菌剤など他の通常の添加剤を添加することができる。また、希釈剤、分散剤、界面活性剤、結合剤及び潤滑剤を付加的に添加して水溶液、懸濁液、乳濁液などの注射用剤形、丸薬、カプセル、顆粒または錠剤に製剤化することができる。さらに、当該技術分野の適切な方法としてRemington's Pharmaceutical Science(Mack Publishing Company,Easton PA)に開示されている方法を用いて、各疾患によってまたは成分によって好ましく製剤化することができる。
【0038】
本発明のGCP−II突然変異タンパク質を有効成分として含有する組成物の薬剤の製剤形態としては、顆粒剤、散剤、被覆錠、錠剤、カプセル剤、坐薬、シロップ、溶液、懸濁剤、乳済、点滴液または注射可能な液剤及び活性化合物の徐放出型製剤等を挙げることができる。
【0039】
本発明のGCP−II突然変異タンパク質を有効成分として含有する組成物の投与方法は、特別にこれに制限されるのではないが、目的とする方法によって非経口投与、例えば静脈内、動脈内、腹腔内、筋肉内、胸骨内、経皮、鼻腔内、吸入、局所、直腸または経口投与を通じて一般的な方式で投与することができる。
【0040】
本発明のGCP−II突然変異タンパク質を有効成分として含有する組成物の投与量は、疾患の種類、疾患の重症度、組成物に含有された有効成分及び他の成分の種類及び含量、剤形の種類及び患者の年齢、体重、一般健康状態、性別及び食餌、投与時間、投与経路及び組成物の分泌率、治療期間、同時に用いる薬物を含めた多様な因子にしたがって調節することができる。成人の場合、GCP−II突然変異タンパク質を1日に1回ないし数回投与時、0.1μg/kg〜0.1g/kgの用量で投与することが好ましい。
【0041】
本発明の治療用組成物は、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の治療のために、単独で、またはホルモン治療、薬物治療及び生物学的反応調節剤を用いる方法と併用して用いることができる。
【0042】
また、本発明は本発明によるGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を発現する発現ベクターを有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤を提供する。
【0043】
前記発現ベクターは、詳細にはアデノウイルス、アデノ随伴ウイルス、レトロウイルス及びワクシニアウイルスからなる群から選択されるウイルス性の発現ベクターであるが、これに限定されない。
【0044】
本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIと比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、GCPII突然変異体を発現する発現ベクターを有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤に有用に用いることができる。
【0045】
また、本発明は薬学的に有効な量のGCPII突然変異体を、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患に罹患した個体に投与する工程を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の治療方法を提供する。
【0046】
また、本発明は薬学的に有効な量のGCPII突然変異体を個体に投与する工程を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防方法を提供する。
【0047】
また、本発明は本発明によるGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の遺伝子を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物を提供する。
【0048】
前記GCPII突然変異体の遺伝子は、配列番号1の塩基配列を有することを特徴とするがこれに限定されない。
【0049】
本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIと比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、GCPII突然変異体の遺伝子を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物として有用に用いることができる。
【0050】
また、本発明は本発明によるGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物を提供する。
【0051】
前記GCPII突然変異タンパク質は、配列番号2のアミノ酸配列を有することを特徴とするがこれに限定されない。
【0052】
本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIと比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、GCPII突然変異タンパク質を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物として有用に用いることができる。
【0053】
また、本発明は、
(1)本発明によるGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の発現細胞を被検物質で処理する工程、
(2)工程(1)の細胞においてGCPII突然変異タンパク質の発現水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べ、工程(2)のGCPII突然変異タンパク質の発現水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法を提供する。
【0054】
前記方法において、工程(2)のタンパク質の発現水準は、具体的には免疫蛍光法、酵素免疫分析法(ELISA)、ウエスタンブロット及びRT−PCRからなる群から選択されたいずれか一つで測定するが、これに限定されない。
【0055】
本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIと比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、GCPII突然変異タンパク質の発現変化は、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニングに有用に用いることができる。
【0056】
また、本発明は、
(1)本発明によるGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を被検物質で処理する工程、
(2)工程(1)のGCPII突然変異タンパク質の活性水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べ、工程(2)のGCPII突然変異タンパク質の活性水準を減少させた被検物質を選別する工程を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法を提供する。
【0057】
前記方法において、工程(2)のタンパク質の活性水準は、具体的には免疫蛍光法、酵素免疫分析法(ELISA)、質量分析及びタンパク質チップからなる群から選択されたいずれか一つで測定するが、これに限定されない。
【0058】
本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIに比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、GCPII突然変異タンパク質の活性変化は、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニングに有用に用いることができる。
【0059】
本発明のスクリーニング方法において、GCP−II突然変異体の遺伝子を含有する組成物と試験対象物質間の反応確認は、DNA−DNA、DNA−RNA、DNA−タンパク質及びDNA−化合物間の反応有無を確認するのに用いる一般的な方法を用いることができる。
【0060】
例えば、試験管内(インビトロ)で前記遺伝子と試験対象物質間の結合有無を確認するためのハイブリダイズ試験、哺乳類細胞と試験対象物質を反応させた後のノーザンブロット分析、定量的PCR、定量的リアルタイムPCRなどを通じた前記遺伝子の発現率測定方法、または前記遺伝子にレポーター遺伝子を連結させて細胞内に導入した後、試験対象物質と反応させてレポータータンパク質の発現率を測定する方法などを用いることができる。
【0061】
このような場合、本発明の組成物は、GCP−II突然変異体の遺伝子の他にも核酸の構造を安定に維持させる蒸留水または緩衝液を含有することができる。
【0062】
本発明のスクリーニング方法において、GCP−II突然変異タンパク質を含有する組成物と試験対象物質間の反応確認は、タンパク質−タンパク質及びタンパク質−化合物間の反応有無を確認するのに用いる一般的な方法を用いることができる。
【0063】
例えば、GCP−II突然変異体の遺伝子またはGCP−II突然変異タンパク質と試験対象物質を反応させた後に活性を測定する方法、酵母ツーハイブリッド法、GCP−II突然変異タンパク質に結合するファージディスプレイペプチドクローンの検索、天然物及び化学物質ライブラリなどを用いたHTS(ハイスループット・スクリーニング)、ドラッグヒットHTS(drug hit HTS)、細胞ベースのスクリーニング(cell-based screeing)またはDNAマイクロアレイを使用したスクリーニング方法等を用いることができる。
【0064】
このような場合、本発明の組成物は、GCP−II突然変異体で発現されたタンパク質の他にも、タンパク質の構造または生理活性を安定に維持させる緩衝液または反応液を含むことができる。また、本発明の組成物は、生体内(インビボ)実験のために、前記タンパク質を発現する細胞または転写率を調節することができるプロモーター下で前記タンパク質を発現するプラスミドを含有する細胞等を含むことができる。
【0065】
本発明のスクリーニング方法において試験対象物質は、一般的な選定方式にしたがって、Aβの脳内蓄積またはグルタメートの生成予防及び治療剤としての可能性を有していると推定されるか、または無作為的に選定された個別的な核酸、タンパク質、その他の抽出物または天然物などを挙げることができる。
【実施例】
【0066】
以下、本発明を実施例によって詳しく説明する。ただ、下記の実施例は、本発明を具体的に例示するものであって、本発明の内容が実施例によって限定されるのではない。
【0067】
<実施例1>2−PMPAが、Aβ及びNAAG分解に及ぼす影響の確認
<1−1>細胞培養及び形質導入
HEK293T細胞及びH4細胞(American Type Culture Collection,ATCC,Edinburg,VA,米国)を10%牛胎児血清(FBS;GIBCO)及び1%ペニシリン/ストレプトマイシン(GIBCO)が添加されたDMEM(Dulbecco's modified Eagle's培地)(DMEM;GIBCO)中、PC3細胞を10%牛胎児血清(FBS;GIBCO)及び1%ペニシリン/ストレプトマイシン(GIBCO)が添加されたRPMI培地1640(GIBCO)中、5%CO2を含む湿式培養器で37℃で培養した。製造社の指針書にしたがってリポフェクタミン2000試薬またはリポフェクタミンプラス試薬(インビトロジェン)を用いて、一時的な形質導入を行なった。
【0068】
<1−2>Aβペプチドの準備
Aβ1−40またはAβ1−42(インビトロジェン)ペプチドを最終的に1mM濃度で冷たいヘキサフルオロイソプロパノール(HFIP;Sigma)とともに準備した。室温で40分間振って4℃で20分間放置した後、HFIPを真空状態で除去した。ペプチドペレットを−70℃で保存した。前記ペレットを最終5mM濃度になるようにDMSOで溶解させて、最終1mM濃度になるように蒸留水を添加した。
【0069】
<1−3>ELISA分析を通じた2−PMPAがAβ分解に及ぼす影響の確認
hGCPII及び多様な突然変異体のhGCPII遺伝子をコードするベクターを12ウェルプレートでPC3細胞内に形質導入した。培養培地を約30時間後に2−PMPA((2−(ホスホメチル)ペンタン二酸)があるかまたはない条件で、Aβ1−40またはAβ1−42ペプチドが処理された培地に変えて、細胞を再び8時間培養した。前記培地を回収し、製造社のプロトコールにしたがってELISAキット(インビトロジェン)を用い、残りはAβ1−40またはAβ1−42を分析した。空pcDNA3空ベクターで形質導入された細胞を陰性対照群として用いた。
【0070】
その結果、図1に示されたようにrhGCPIIは、対照群と比べて約80%Aβ1−40を分解したが、2−PMPAはGCPIIのAβ1−40分解に効果がないことを確認した(図1)
【0071】
<1−4>NAAG分解分析を通じた2−PMPAがNAAG分解に及ぼす影響の確認
内因性または過剰発現されたグルタメート・カルボキシペプチダーゼII(GCPII)タンパク質の活性を下記のような方法で測定した。細胞溶解物(50μg)を37℃で一時間50mM HEPES及び150mM NaClを含む総100μlの体積でGCPII特異的抑制剤である2−PMPAの20nMまたはEDTAが一緒にあるかまたはない条件で、NAAG(N−アセチル−L−アスパルチル−L−[3,4−3H]グルタメート;NENコーポレーション)の20μMとともに培養した。反応後に、試料混合物を96ウェルカラム(Havard apparatus)に用意したAG 1−X8陰イオン交換樹脂(Biorad)に用い、5分間2000rpmで遠心分離した。試料混合物と結合した樹脂を0.5mMホルマート(100ml)で溶離し、5分間2000rpmで遠心分離した。溶離したすべての試料を1mlのシンチレーション溶液(Optiphase HiSafe;Wallac)と一緒に混合し、放射能をシンチレーション計数器(Wallac Inc.)で測定した。
【0072】
その結果、図2に示されたように2−PMPAがGCPIIによるNAAG加水分解を完全に遮断したことを確認した(図2)。
【0073】
<1−5>GCPIIプラスミド及びレンチウイルス製作を通じた2−PMPAがレンチウイルスGCPIIのAβ分解に及ぼす影響の確認
hGCPIIプラスミドを下記の記載のように準備した。ヒトのアストロサイトに該当するU87−MG細胞からRNAを分離した後、逆転写酵素を用いてcDNAを合成した。合成されたcDNAで hGCPIIの増幅のために下記のプライマーを用いてPCR方法を用いた。プラスミド生成のためにPCR産物をpcDNA3ベクター内にクローニングした:
正方向:5'−GATGTGGAATCTCCTTCACGAAAC−3'(配列番号3)、及び
逆方向:5'−ATCCTCTTAGGCTACTTCACTCAAAG−3'(配列番号4)。
【0074】
レンチウイルスhGCPIIをMacrogen Inc.(韓国ソウル)で準備した。hGCPIIcDNAをヒトサイトメガロウイルス(CMV)プロモーター及び蛍光タンパク質(GFP)があるIRES配列を含むレンチウイルスコンストラクト(LentiM1.4−hGCPII)内にクローニングした。ウイルス製作のために、hGCPII、VSV−G及びgag−pol発現ベクターを、リポフェクタミンプラス(インビトロジェン,Carlsbad,CA,米国)を用いて293T細胞内に一緒に形質導入した後、細胞を単量体のAβおよび2−PMPAで処理した。細胞成長培地でのAβ1−40の濃度を前記実施例<1−3>の方法で分析した。
【0075】
その結果、図3に示されたように2−PMPAは、レンチウイルスGCPIIのAβ1−40分解を遮断しなかったことを確認した(図3)。
【0076】
<1−6>形質転換動物
二重形質導入APP Swedish/PS1ΔE9マウスをJackson Laboratory(Bar Harbor,ME,米国)から購入し、C57BL/6Jバックグラウンド系統で野生型マウスと交配することによって、ヘミ接合体(hemizygotes)を維持した。すべての動物を標準動物管理プロトコールによって飼育し、韓国食品医薬品安全庁(the Korean Food and Drug Administration)の無菌飼育施設(pathogen-free facility)で維持した。マウス遺伝子型を下記のプライマー(primer)を用いてPCR方法で確認した:
PrP(mouse prion protein):
正方向5'−CCTCTTTGTGACTATGTGGACTGATGTCGG−3'(配列番号5)、
逆方向5'−GTGGATAACCCCTCCCCCAGCCTAGACC−3'(配列番号6)、
ヒト(human)APP:
正方向5'−GACTGACCACTCGACCAGGTTCTG−3'(配列番号7)、及び
逆方向5'−CTTGTAAGTTGGATTCTCATATCCG−3'(配列番号8)。
【0077】
Aβsの脳での水準でGCPII抑制剤の効果を測定するために、処理した群は腹腔内注射で一ヶ月間、PBS 2X/wkで、溶解した2−PMPA(10mg/kg)を注入した。処理しない群は対照群として同じ量のPBSを注入した。マウスが8ヶ月になった時に処理を始めた。
【0078】
<1−7>2−PMPAのマウス脳での効果確認
2−PMPAの効果をマウスの脳で調べるために、前記実施例<1−6>の方法で形質転換された8ヶ月になったAPP Swedish/PS1Δ9マウスの腹腔内に、1ヶ月間、2−PMPAの10mg/kgまたはPBS 2/wkを9回処理した。皮質膜断片でAβ1−40及びAβ1−42の水準を前記実施例<1−3>の方法で分析し、GCPIIのNAAG分解活性を前記実施例<1−4>の方法で測定した。
【0079】
その結果、図4に示されたように2−PMPAで処理したマウスでのNAAG分解は、PBS対照群と比べて約90%減少したことを確認し(図4)、図5に示されたように2−PMPAの処理によってAβ1−40及びAβ1−42の水準は変化しなかったということを確認した(図5)。
【0080】
<実施例2>GCPIIの位置選択的突然変異体の発現の確認
<2−1>GCPIIの位置選択的突然変異(Site-directed mutagenesis)
pcDNA−hGCPIIプラスミド(50ng)を鋳型に用いて、所望する突然変異を産生する二つの相補的オリゴヌクレオチドプライマーで、各突然変異を導入した。Pfu Ultra High−Fidelity DNAポリメラーゼ(stratagene)の2.5Uを用いて延長させ、ニックの入った円形鎖(nicked circular strand)(95℃、5分→(95℃、50秒→55℃、1分→80℃、8分20秒→72℃、1分)22回循環→4℃、無限大(∞))で、結果としてもたらされた突然変異プライマー(125ng)を作った。メチル化されて、突然変異のない母型DNA(nonmutated parental DNA)鋳型を37℃で一時間Dpn I(NEB)の20Uで消化させた。その後、円形(circular)dsDNAでDH5aコンピテント細胞内を形質転換させた。それぞれの突然変異をシークエンシング(Cosmo corporation)で確認した。
【0081】
その結果、図6に示されたようにGCPIIの7個の突然変異体(R210A、D387N、P388A、R536L、G548P、Y552I、K699S)を製作した(図6)。
【0082】
<2−2>ウエスタンブロットを通じたGCPII突然変異体の発現の確認
GCPII突然変異体の発現を確認するために、前記実施例<1−1>の方法にしたがって突然変異体のプラスミドをHEK293T細胞内に形質導入した後、細胞をリン酸緩衝食塩水(PBS;GIBCO)で洗浄し、プロテアーゼ阻害剤カクテル(Sigma)入りのRIPA緩衝溶液(150mM NaCl、1% NP−40、0.5%デオキシコール酸ナトリウム、0.1%SDS、50mM Tris at pH8.0)で溶解させた。ブラッドフォード分析で溶解物のタンパク質の濃度を測定した。同じ濃度のタンパク質にβ−メルカブトエタノールを添加して10分間煮沸し、10%SDS−PAGEで分離した。タンパク質をPVDF(ポリビニリデンジフルオライド)膜(GE Healthcare)で電気泳動させ、一時間室温で5%脱脂粉乳を入れたTBS−Tでブロックした。その後、前記膜を4℃で一晩、5%脱脂粉乳に anti−PSMA(abcam;ab41034,1:1000)、Y−PSMA(Maine Biotech,1:1000)または抗−α−チューブリン抗体(Sigma−Aldrich;T6199,1:50000)とともに培養した。TBS−Tで三回洗浄した後、ブロットを室温で2時間HRP−ヤギ抗マウスコンジュゲートIgG(Jackson IR;115−035−071,1:10000)または、HRP−ヤギ抗ウサギコンジュゲートIgG(Jackson IR;115−035−046,1:10000)とともに培養した。三回洗浄した後、タンパク質を化学発光の基質(Thermo Scientific)を用いて検出した。
【0083】
その結果、図7に示されたようにバンドのパターンは、rhGCPIIと類似し、一つのバンドはGCPIIの予測された大きさである98kDaで明確に見えることを確認した(図7)。
【0084】
<実施例3>GCPII突然変異体のNAAG分解に及ぼす影響の確認
GCPII突然変異体のNAAG分解に及ぼす影響を確認するために、前記実施例<1−1>の方法によって、S1'ポケット(R210A,K699S)及びS1ポケット(R536L,G548P)に置換がある突然変異タンパク質を、H4細胞に形質導入した。NAAGの加水分解を測定するために、前記実施例<1−4>の方法によって、細胞溶解物を[H]3がラベルされたNAAG(20μM)及びGCPIIの特異的基質とともに培養し、前記実施例<2−2>の方法によってタンパク質発現の変化を確認した。
【0085】
その結果、図8に示されたようにS1'ポケット突然変異体(R210A,K699S)はNAAGを加水分解する活性を完全になくしてしまったが、S1ポケット突然変異体(R536L,G548P)は野生型GCPIIと比べて40%程度活性を維持していることを確認した(図8)。
【0086】
GCPIIのNAAG分解でAβの効果を調べるために、前記実施例<1−4>の方法によってrhGCPIIを[H]3がラベルされたNAAG(20μM)及びAβペプチドとともに同時に培養した。
【0087】
その結果、図9に示されたようにGCPIIのNAAG分解活性は、Aβペプチドに影響を受けなかったことを確認した(図9)。
【0088】
<実施例4>GCPII突然変異体のAβ分解に及ぼす影響の確認
<4−1>GCPII/Aβ複合体のモデリング
Aβ−S1及びS1'ポケットの結合のMODEをプログラムO(http://xray.bmc.uu.se/alw yn/A-Z_frameset.html)(PDB file:1z0q(Ab),2oot(GCPII))を用いて制作した。計算的ドッキング(computational docking)をマニュアルドッキング(manual docking)方法を用いて行なった。
【0089】
GCPII突然変異体のAβ分解に及ぼす影響を確認するために、前記実施例<1−5>の方法及び前記実施例<4−1>の方法によって、多様な突然変異体のプラスミドを、内因性のGCPIIを発現しないことが知られているPC3細胞に形質導入した。48時間後、前記細胞溶解物をAβ(2μM)と混合して一晩培養した。
【0090】
<4−2>ドットブロットを通じたGCPII突然変異体のAβ分解に及ぼす影響の確認
発現したGCPIIによって切られないで残ったAβペプチドの量を確認するために、細胞溶解物とAβ(2μM)との混合物を下記のドットブロット方法及び前記実施例<2−2>の方法で確認した。細胞溶解物とAβ(2μM)の混合物1μlをニトロセルロース膜に落とした後、完全に乾燥させた。乾燥した膜を一時間室温で5%脱脂粉乳を入れたTBS−Tでブロックした。その後、前記膜を4℃で一晩、5%脱脂粉乳に抗−Aβ抗体、6E10(SIGNET;SIG−39300,1:2000)とともに培養した。TBS−Tで三回洗浄した後、膜を室温で1時間HRP−ヤギ抗マウスコンジュゲートIgG(Jackson IR;115−035−071,1:10000)とともに培養した。三回洗浄した後、タンパク質を化学発光基質を用いて検出した。
【0091】
その結果、図10、図11に示されたように、K699S突然変異体は野生型よりAβをもう少し分解したが、G548P突然変異体はAβ分解活性を失ったことを確認した(図10、11)。
【0092】
AβペプチドでGCPIIの分解活性を確認するために、前記実施例<1−3>及び前記実施例<4−1>の方法によって、形質導入後の翌日、培地内にAβを1ng/mlで処理し、37℃で8時間培養した。
【0093】
その結果、図12に示されたように残ったAβは、G548Pを除いて、K699Sによって減少したことを確認した(図12)。
【産業上の利用可能性】
【0094】
前記で示されたように、本発明は、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療のための薬剤の開発と、それを用いた予防または治療方法の開発、すなわちタンパク質治療剤、発現及び活性調節物質、遺伝子治療剤または細胞治療剤などに有用に用いることができる。
【技術分野】
【0001】
本発明は、グルタメート生成阻害及びβアミロイド(β-amyloid)分解活性を有するGCPII(グルタメート・カルボキシペプチダーゼII)突然変異体(K699S)、及び前記GCPII突然変異体(K699S)を有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック(Pick)病及びクロイツフェルト・ヤコブ(Creutzfeid-Jakob)病からなる群から選択された疾患の予防及び治療用薬学的組成物に関するものである。
【背景技術】
【0002】
GCPIIは、脳に存在し94〜100kDaの見かけの分子量を有したタイプII内在性膜タンパク質で、主にグリア内に存在し、NAAG(N−アセチルアスパルチルグルタメートをNAA(N−アセチルアスパルテート)及びグルタメートに加水分解することによって、興奮性神経伝達に影響を及ぼす。NAAG加水分解によって生成されたグルタメートは、中枢神経系で主要な興奮性神経伝達物質として神経系に必須な要素として作用するが、脳内での過多な蓄積は脳細胞の死滅と変性をもたらし、アルツハイマー、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病のような退行性脳疾患を惹起することが知られている(非特許文献1〜3)。
【0003】
GCPIIは、酵素活性及び発現部位によって多様な名前が存在する。前立腺でのGCPIIの強い発現(GCPIIの機能場所は知られていない)からPSMAと命名され、中枢神経系では脳神経伝達物質NAAGを代謝させるので、GCPIIをNAALADaseと命名し、小腸前半部ではポリ−g−グルタメート葉酸(poly-g-glutamated folate)、葉酸加水分解酵素(folate hydrolase)FOLH1及びカルボキシペプチダーゼとしてグルタメート・カルボキシペプチダーゼII(GCPII)からガンマ連結されたグルタメート(gamma-linked glutamate)を除去する役割をする。
【0004】
また、GCPIIの構造は、GCPIIの触媒機序及び基質特異性に対する洞察を提供する。GCPIIは活性部位に二核性Zn2+中心があって、この活性部位で二つの亜鉛原子は結合カルボン酸塩リガンド(bridging carboxylate ligand)を共有する。α−NAAGは、GCPIIのアルギニン部分と相互作用するグルタメートサイドチェーン(glutamate side chain)の種類と結合して、カルボニルが攻撃されることから酸素、及びC−末端は亜鉛イオンと結合する。基質(例えば、α−NAAGでのNAA)の残りは、Arg−210と特異的相互作用する基質−結合空間から収容される。もう少し大きな基質(例えば、最大四つの、γ連結されたグルタメートを伴うポリ−γ−グルタメート葉酸(poly-γ-glutamated folates with up to four γ-linked glutamates))は、ポケットとの立体衝突を避けるために少しの構造的再配列を要し、交差して結合し得る。また、GCPIIは二つの活性部位であるS1'ポケット及びS1ポケットを有する(非特許文献4)。前記S1ポケットはGCPII基質特異性の「微細調整(fine-tuning)」として作用し、前記S1'ポケットはNAAG及びGCPII抑制剤の主な高い親和性結合に寄与する。
【0005】
今までに、GCPIIの主要機能としては、NAAG加水分解作用があることが報告された。したがって、強力で選択的なGCPII抑制剤、すなわち2−PMPA(2−(ホスホノメチル)ペンタン二酸)は、脳卒中、ルー・ゲーリック病及び神経因性疼痛の臨床前のモデルで脳グルタメートを減少させて神経保護効果を提供すると報告されたことがある。
【0006】
以前の研究で、GCPIIがAβ(アミロイドβ)の分解効果を通じて、Aβが脳内に蓄積されることを防止または除くことで、アルツハイマー疾患及びダウン症候群などの疾病治療に用いることができると報告されたことがある(特許文献1)。しかし、GCPIIのNAAG加水分解によって生成されるグルタメートは、神経毒性を誘発するだけでなく、脳内の過多な蓄積は脳細胞の死滅と変性をもたらして、アルツハイマー、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病のような退行性脳疾患を惹起することが知られているので、GCPII使用時の安全性を保障することが難しかった。したがって、これを補うことができる方法が要求された。
【0007】
そこで本発明者等は、これを補うことができる方法を研究した結果、GCPIIの多様な突然変異体を製造してその活性を分析し、GCPII突然変異体であるK699Sが野生型GCPIIよりAβ分解に優れた効果があるのみならず、野生型GCPIIが有していないグルタメート生成阻害効果も有するため、野生型GCPIIより優れた効果があって安定性も優れて、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防または治療剤に有用に用いることができることを明らかにすることによって本発明を完成した。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】韓国特許公開番号:10-2007-0023832
【特許文献2】US 7,846,910
【特許文献3】US 2004/0185487
【非特許文献】
【0009】
【非特許文献1】Choi,W. H.,Oh,Y. S.,Ahn,J. Y.,Kim,S. R. and Ha,T. Y.(2005年)Antioxidative and protective effects of Ulmus davidiana var. japonica extracts on glutamate-induced cytotoxicity in PC12 cells. Korean J. Food Sci. Technol.第37巻,p.479-483
【非特許文献2】Jeon,H. J.,Park,S. W. and Mun,B. S.(2004年)Effects of Gwibitang on glutamate-induced death in rat neonatal astrocytes. J Korean Oriental Med.第25巻,p.184-193
【非特許文献3】Lee,J.,Kim,M. S.,Lee,C.,Kim,H. Y.,Choi,D. H.,Kim,T. Y.,Son,Y. and Park,R.(2003年)Role of morphine in the glutamate-induced oxidative damage of C6 glial cells. Korean J Anesthesiol.第45巻,p.271-277
【非特許文献4】Mlcochova P.,Plechanovova A.,Barinka C.,Mahadevan D.,Saldanha J. W.,Rjlisek L.,Konvalinka J.(2007年)Mapping of the active site of glutamate carboxypeptidase II by site-directed mutagenesis. FEBS J.第274(18)巻,p.4731-41
【非特許文献5】Cyril Barinka et al., Amino acids at the N- and C-termini of human glutamate carboxypeptidase II are required for enzymatic activity and proper folding. Eur. J. Biochem. 271, 2782-2790(2008)
【非特許文献6】HENRY S. SPENO et al., Site-Directed Mutagenesis of Predicted Active Site Residues in Glutamate Carboxypeptidase II. MOLECULAR PHARMACOLOGY, 55:179-185 (1999)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、グルタメート生成阻害及びβアミロイド分解活性を有するGCPII(glutamate carboxypeptidaseII)突然変異体(K699S)を提供することである。
【0011】
本発明の他の目的は、前記GCPII突然変異体(K699S)を用いた、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防または治療剤を提供することである。
【0012】
本発明のまた他の目的は、前記GCPII突然変異体(K699S)を用いた、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防または治療剤のスクリーニング方法を提供することである。
【課題を解決するための手段】
【0013】
前記目的を達成するために、本発明はGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(Lysine,K)をセリン(Serine,S)に変異させたGCPII突然変異体を有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物を提供する。
【0014】
また、本発明は、前記GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を発現する発現ベクターを有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤を提供する。
【0015】
また、本発明は、前記GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の遺伝子を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤のスクリーニング用薬学的組成物を提供する。
【0016】
また、本発明は前記GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物を提供する。
【0017】
また、本発明は、
(1)前記GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の発現細胞を被検物質で処理する工程、
(2)工程(1)の細胞においてGCPII突然変異タンパク質の発現水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べ、工程(2)のGCPII突然変異タンパク質の発現水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法を提供する。
【0018】
同時に、本発明は、
(1)前記GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を被検物質で処理する工程、
(2)工程(1)のGCPII突然変異タンパク質の活性水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べ、工程(2)のGCPII突然変異タンパク質の活性水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法を提供する。
【0019】
本発明1は、GCPII(グルタメート・カルボキシペプチダーゼII)の全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物である。
本発明2は、GCPII突然変異体が、配列番号2で表されるアミノ酸配列を有することを特徴とする、本発明1のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物である。
本発明3は、GCPII突然変異体が、グルタメート生成阻害活性及びβアミロイド分解活性を同時に有することを特徴とする、本発明1のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物である。
本発明4は、前記βアミロイドが、溶解性または不溶性βアミロイドであることを特徴とする、本発明3のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物である。
本発明5は、GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を発現する発現ベクターを有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤である。
本発明6は、発現ベクターが、アデノウイルス、アデノ随伴ウイルス、レトロウイルス及びワクシニアウイルスからなる群から選択されるウイルス性の発現ベクターであることを特徴とする、本発明5のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤である。
本発明7は、GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の遺伝子を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物である。
本発明8は、GCPII突然変異体の遺伝子が、配列番号1の塩基配列を有することを特徴とする、本発明7のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物である。
本発明9は、GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物である。
本発明10は、GCPII突然変異タンパク質が、配列番号2のアミノ酸配列を有することを特徴とする、本発明9のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物である。
本発明11は、
(1)GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の発現細胞を被検物質で処理する工程、
(2)工程(1)の細胞でGCPII突然変異タンパク質の発現水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べて、工程(2)のGCPII突然変異タンパク質の発現水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法である。
本発明12は、工程(2)のタンパク質の発現水準が、免疫蛍光法、酵素免疫分析法(ELISA)、ウエスタンブロット及びRT−PCRからなる群から選択されたいずれか一つで測定することを特徴とする、本発明11のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法である。
本発明13は、
(1)GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を被検物質で処理する工程と、
(2)工程(1)のGCPII突然変異タンパク質の活性水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べて、工程(2)のGCPII突然変異タンパク質の活性水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法である。
本発明14は、工程(2)のタンパク質の活性水準が、免疫蛍光法、酵素免疫分析法(ELISA)、質量分析及びタンパク質チップからなる群から選択されたいずれか一つで測定することを特徴とする、本発明13のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法である。
【発明の効果】
【0020】
本発明では、本発明によるGCPII突然変異体(K699S)が、野生型GCPIIに比べてAβ分解活性が優れているだけでなく、野生型GCPIIが有していないグルタメート生成阻害活性を同時に保有しており、野生型GCPIIよりその効果が顕著に優れていて、安定性も優秀であるので、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防または治療剤に有用に用いることができる。
【図面の簡単な説明】
【0021】
【図1】2−PMPAが、Aβに及ぼす影響を示した図である。rhGCPIIを2−PMPAまたはEDTAがあるかまたはない条件で、Aβ40とともに培養した。Aβ40をELISAまたはNAAG分解分析(cleavage assay)で検出した。
【図2】2−PMPAが、NAAG分解に及ぼす影響を示した図である。rhGCPIIを2−PMPAまたはEDTAがあるかまたはない条件で、NAAGとともに培養した。NAAG水準をELISAまたはNAAG分解分析(cleavage assay)で検出した。
【図3】レンチウイルスGCPII(lentiviral GCPII)をマウス初代星状細胞に感染させた後、単量体のAβ40で細胞を処理した。そして、2−PMPAを多様な投与量で処理した。細胞成長培地で前記Aβ40の濃度をELISA分析で測定した。
【図4】8ヶ月になったAPP Swedish/PS1E9形質転換マウスの腹腔内に、1ヶ月間2−PMPAの10mg/kgまたはPBS 2/wkを注入した(9回)。膜断片をNAAGで分析した。
【図5】8ヶ月になったAPP Swedish/PS1E9形質転換マウスの腹腔内に、1ヶ月間2−PMPAの10mg/kgまたはPBS 2/wkを注入した(9回)。膜断片をELISA分析で分析した。
【図6】GCPIIの位置選択的突然変異を示した図で、プライマーの配列を位置選択的突然変異実験に用いた。
【図7】GCPIIの位置選択的突然変異を示した図で、形質導入されたHEK293細胞で多様な突然変異タンパク質の発現を示した。
【図8】GCPIIのS1'ポケット突然変異体のNAAG分解活性を示した図である。S1'ポケット(R210A,K699S)に置換がある突然変異タンパク質は、NAAGを分解しなかった。しかし、S1ポケット(R536L,R548P)に突然変異がある他のタンパク質は、約40%程度NAAG分解活性を有する。
【図9】GCPIIのS1'ポケット突然変異体のNAAG分解活性を示した図である。GCPIIのNAAG分解活性は、Aβペプチドに影響を受けなかった。
【図10】GCPII突然変異体のAβ分解に及ぼす影響を示した図である。H4細胞で、過剰発現されたS1'突然変異体(K699S)はアミロイド−β40を分解したが、S1突然変異体(G548P)は分解しなかった。
【図11】GCPII突然変異体のAβ分解に及ぼす影響を示した図である。H4細胞で、過剰発現されたS1'突然変異体(K699S)はアミロイド−β40を分解したが、S1突然変異体(G548P)は分解しなかった。
【図12】残ったAβは、G548Pを除いて、K699Sによって減少した。
【発明を実施するための形態】
【0022】
以下、本発明を詳しく説明する。
【0023】
本発明は、GCPII突然変異体(K699S)を提供する。
【0024】
前記GCPII突然変異体(K699S)は、具体的にGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたもので、より詳細には配列番号2で表されるアミノ酸配列を有するものであるが、これに限定されない。
【0025】
前記GCPII突然変異体は、具体的にグルタメート生成阻害活性及びβアミロイド分解活性を同時に有するものであるが、これに限定されない。
【0026】
また、本発明は、GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物を提供する。
【0027】
前記GCPII突然変異体は、具体的に配列番号2で表されるアミノ酸配列を有するものであるが、これに限定されない。
【0028】
前記GCPII突然変異体は、具体的にグルタメート生成阻害活性及びβアミロイド分解活性を同時に有するものであるが、これに限定されない。
【0029】
前記βアミロイドは、具体的に溶解性または不溶性ベータアミロイドであるが、これに限定されない。
【0030】
本発明者等は、GCPIIの特異的抑制剤である2−PMPAのAβペプチドに対する効果を確認するために、組換えヒトGCPII(rhGCPII)をAβ1−40と一緒にインキュベートして多様な投与量で2−PMPAを添加し、ELISAで分析した。その結果、rhGCPIIは、対照群と比べて80%程度Aβ1−40ペプチドを分解させたが、2−PMPAはGCPIIのAβ1−40分解に何らの効果がなかったことを確認した(図1参照)。2−PMPAは、初代マウス星状細胞でレンチウイルスGCPIIのAβ1−40分解を遮断しなかったことを確認した(図3参照)。GCPIIによるNAAGの加水分解は、2−PMPAによって完全に遮断されたことを確認した(図2参照)。また、マウスの脳で2−PMPAの効果を調べるために、2−PMPAで形質転換ADモデルマウスを処理した。本発明者等は、2−PMPA(10mg/kg、腹腔内に、1ヶ月間 2X/wk)を、8ヶ月になったAPP Swedish/PS1Δ9形質転換マウスに対し処理した。皮質膜断片(cortical membrane fraction)におけるAβ1−40及びAβ1−42の水準をELISAで分析し、GCPIIのNAAG分解活性をNAAG分析で測定した。その結果、NAAG分解は、PBS対照群と比べ、2−PMPAで処理したマウスにおいて約90%減少したが(図4参照)、Aβ1−40及びAβ1−42の総水準は2−PMPAの処理によって変化しなかったことを確認した(図5参照)。したがって、GCPIIでNAAGまたはAβ分解部位が異なることを確認した。
【0031】
本発明者等は、GCPIIがS1及びS1'ポケットと命名された二つの活性部位で構成されているということを基に、GCPII[ref]の多様な突然変異体である、GCPIIの7個の突然変異体(R210A、D387N、P388A、R536L、G548P、Y552I、K699S)を製作した(図6参照)。各突然変異がある、二つの相補的オリゴヌクレオチドプライマーを用いて、アミノ酸を位置選択的突然変異で変化させた。突然変異がある多様なGCPIIの発現を確認するために、突然変異プラスミドをHEK293T細胞内に形質導入させた後、ウエスタンブロットでタンパク質の発現変化を確認した。その結果、バンドのパターンは、rhGCPIIと類似し、バンドの一つはGCPIIの予測された大きさである98kDaで顕著に見られることを確認した(図7参照)。
【0032】
本発明者等は、GCPII突然変異体の酵素活性の変化を観察した。多様な突然変異体の酵素活性を分析するために、S1'ポケット(R210A,K699S)及びS1ポケット(R536L,G548P)に置換がある突然変異タンパク質を、H4細胞に形質導入させた。NAAGの加水分解を測定するために、細胞溶解物を[H]3がラベルされたNAAG(20μM)及びGCPIIの特異的基質とともに培養した。その結果、前記S1'ポケット突然変異体(R210A,K699S)は、NAAGを加水分解する活性をまったくなくしてしまったが、前記S1ポケット突然変異体(R536L,G548P)は、野生型GCPIIと比べて40%程度活性を維持するということを確認した(図8参照)。さらに、GCPIIのNAAG分解とAβ分解間の競争的阻害効果を調べるために、rhGCPIIを[H]3がラベルされたNAAG(20μM)及びAβペプチドを濃度別で培養した。その結果、GCPIIのNAAG分解活性は、Aβペプチドに影響を受けなかったことを確認した(図9参照)。したがって、S1'ポケットでのNAAG加水分解は、Aβによって影響されないことを確認し、GCPIIでのNAAG分解とAβ分解機序が異なることを確認した。
【0033】
本発明者等は、突然変異GCPIIのAβクリアランス活性を同定するために、内因性のGCPIIを発現しないことが知られているPC3細胞に、多様な突然変異プラスミドを形質導入した。48時間後、前記細胞溶解物をAβ(2μM)と混合して一晩中培養した。残ったAβペプチドは、6E10抗体を用いてドットブロット及びウエスタンブロットで確認した。その結果、K699S突然変異体は野生型よりもAβをもう少し分解したが、G548P突然変異体はAβ分解活性を失ったことを確認した(図10、11参照)。また、培養培地で外因的に処理されたAβペプチドでGCPIIの分解活性を確認するために、形質導入の翌日、培地内にAβを1ng/mlで処理して37℃で8時間培養しELISA分析を行なった。その結果、ウエスタンブロットと類似し、残ったAβは、G548Pは除外して、K699Sによって減少したことを確認した(図12参照)。したがって、S1ポケットがAβの分解においてS1'ポケットよりもう少し重要であるということを通じて、NAAG加水分解活性及びAβ分解活性の作用は、GCPII酵素によって異なって調節されるということを確認した。
【0034】
ゆえに、本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIに比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患に有用に用いることができる。
【0035】
本発明のGCP−II突然変異タンパク質を有効成分として含有する組成物は、前記有効成分以外に薬剤学的に相応しく、生理学的に許容される補助剤を用いて製造することができ、前記補助剤では、賦形剤、崩解剤、甘味料、結合剤、被剤剤、膨張剤、潤滑剤、滑沢剤または香味料などの可溶化剤を用いることができる。
【0036】
本発明のGCP−II突然変異タンパク質を有効成分として含有する組成物は、投与のために前記記載した有効成分以外に追加で薬剤学的に許容可能な担体を1種以上含んで薬学的組成物として好ましく製剤化することができる。
【0037】
液状溶液で製剤化される組成物において薬学的に許容される担体としては、食塩水、滅菌水、リンゲル液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エチルアルコール及びこれら成分の中で1成分以上を混合して用いることができ、必要によって抗酸化剤、緩衝液、静菌剤など他の通常の添加剤を添加することができる。また、希釈剤、分散剤、界面活性剤、結合剤及び潤滑剤を付加的に添加して水溶液、懸濁液、乳濁液などの注射用剤形、丸薬、カプセル、顆粒または錠剤に製剤化することができる。さらに、当該技術分野の適切な方法としてRemington's Pharmaceutical Science(Mack Publishing Company,Easton PA)に開示されている方法を用いて、各疾患によってまたは成分によって好ましく製剤化することができる。
【0038】
本発明のGCP−II突然変異タンパク質を有効成分として含有する組成物の薬剤の製剤形態としては、顆粒剤、散剤、被覆錠、錠剤、カプセル剤、坐薬、シロップ、溶液、懸濁剤、乳済、点滴液または注射可能な液剤及び活性化合物の徐放出型製剤等を挙げることができる。
【0039】
本発明のGCP−II突然変異タンパク質を有効成分として含有する組成物の投与方法は、特別にこれに制限されるのではないが、目的とする方法によって非経口投与、例えば静脈内、動脈内、腹腔内、筋肉内、胸骨内、経皮、鼻腔内、吸入、局所、直腸または経口投与を通じて一般的な方式で投与することができる。
【0040】
本発明のGCP−II突然変異タンパク質を有効成分として含有する組成物の投与量は、疾患の種類、疾患の重症度、組成物に含有された有効成分及び他の成分の種類及び含量、剤形の種類及び患者の年齢、体重、一般健康状態、性別及び食餌、投与時間、投与経路及び組成物の分泌率、治療期間、同時に用いる薬物を含めた多様な因子にしたがって調節することができる。成人の場合、GCP−II突然変異タンパク質を1日に1回ないし数回投与時、0.1μg/kg〜0.1g/kgの用量で投与することが好ましい。
【0041】
本発明の治療用組成物は、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の治療のために、単独で、またはホルモン治療、薬物治療及び生物学的反応調節剤を用いる方法と併用して用いることができる。
【0042】
また、本発明は本発明によるGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を発現する発現ベクターを有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤を提供する。
【0043】
前記発現ベクターは、詳細にはアデノウイルス、アデノ随伴ウイルス、レトロウイルス及びワクシニアウイルスからなる群から選択されるウイルス性の発現ベクターであるが、これに限定されない。
【0044】
本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIと比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、GCPII突然変異体を発現する発現ベクターを有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤に有用に用いることができる。
【0045】
また、本発明は薬学的に有効な量のGCPII突然変異体を、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患に罹患した個体に投与する工程を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の治療方法を提供する。
【0046】
また、本発明は薬学的に有効な量のGCPII突然変異体を個体に投与する工程を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防方法を提供する。
【0047】
また、本発明は本発明によるGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の遺伝子を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物を提供する。
【0048】
前記GCPII突然変異体の遺伝子は、配列番号1の塩基配列を有することを特徴とするがこれに限定されない。
【0049】
本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIと比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、GCPII突然変異体の遺伝子を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物として有用に用いることができる。
【0050】
また、本発明は本発明によるGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物を提供する。
【0051】
前記GCPII突然変異タンパク質は、配列番号2のアミノ酸配列を有することを特徴とするがこれに限定されない。
【0052】
本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIと比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、GCPII突然変異タンパク質を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物として有用に用いることができる。
【0053】
また、本発明は、
(1)本発明によるGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の発現細胞を被検物質で処理する工程、
(2)工程(1)の細胞においてGCPII突然変異タンパク質の発現水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べ、工程(2)のGCPII突然変異タンパク質の発現水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法を提供する。
【0054】
前記方法において、工程(2)のタンパク質の発現水準は、具体的には免疫蛍光法、酵素免疫分析法(ELISA)、ウエスタンブロット及びRT−PCRからなる群から選択されたいずれか一つで測定するが、これに限定されない。
【0055】
本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIと比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、GCPII突然変異タンパク質の発現変化は、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニングに有用に用いることができる。
【0056】
また、本発明は、
(1)本発明によるGCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を被検物質で処理する工程、
(2)工程(1)のGCPII突然変異タンパク質の活性水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べ、工程(2)のGCPII突然変異タンパク質の活性水準を減少させた被検物質を選別する工程を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法を提供する。
【0057】
前記方法において、工程(2)のタンパク質の活性水準は、具体的には免疫蛍光法、酵素免疫分析法(ELISA)、質量分析及びタンパク質チップからなる群から選択されたいずれか一つで測定するが、これに限定されない。
【0058】
本発明によるGCPII突然変異体(K699S)は、既知の野生型GCPIIに比べて、Aβ分解に優れた効果があるのみならず、野生型GCPIIが有している安定性保障の難しさを克服する、NAAG加水分解によって生成されて神経毒性を誘発するグルタメートの生成も同時に阻害する効果まであるので、GCPII突然変異タンパク質の活性変化は、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニングに有用に用いることができる。
【0059】
本発明のスクリーニング方法において、GCP−II突然変異体の遺伝子を含有する組成物と試験対象物質間の反応確認は、DNA−DNA、DNA−RNA、DNA−タンパク質及びDNA−化合物間の反応有無を確認するのに用いる一般的な方法を用いることができる。
【0060】
例えば、試験管内(インビトロ)で前記遺伝子と試験対象物質間の結合有無を確認するためのハイブリダイズ試験、哺乳類細胞と試験対象物質を反応させた後のノーザンブロット分析、定量的PCR、定量的リアルタイムPCRなどを通じた前記遺伝子の発現率測定方法、または前記遺伝子にレポーター遺伝子を連結させて細胞内に導入した後、試験対象物質と反応させてレポータータンパク質の発現率を測定する方法などを用いることができる。
【0061】
このような場合、本発明の組成物は、GCP−II突然変異体の遺伝子の他にも核酸の構造を安定に維持させる蒸留水または緩衝液を含有することができる。
【0062】
本発明のスクリーニング方法において、GCP−II突然変異タンパク質を含有する組成物と試験対象物質間の反応確認は、タンパク質−タンパク質及びタンパク質−化合物間の反応有無を確認するのに用いる一般的な方法を用いることができる。
【0063】
例えば、GCP−II突然変異体の遺伝子またはGCP−II突然変異タンパク質と試験対象物質を反応させた後に活性を測定する方法、酵母ツーハイブリッド法、GCP−II突然変異タンパク質に結合するファージディスプレイペプチドクローンの検索、天然物及び化学物質ライブラリなどを用いたHTS(ハイスループット・スクリーニング)、ドラッグヒットHTS(drug hit HTS)、細胞ベースのスクリーニング(cell-based screeing)またはDNAマイクロアレイを使用したスクリーニング方法等を用いることができる。
【0064】
このような場合、本発明の組成物は、GCP−II突然変異体で発現されたタンパク質の他にも、タンパク質の構造または生理活性を安定に維持させる緩衝液または反応液を含むことができる。また、本発明の組成物は、生体内(インビボ)実験のために、前記タンパク質を発現する細胞または転写率を調節することができるプロモーター下で前記タンパク質を発現するプラスミドを含有する細胞等を含むことができる。
【0065】
本発明のスクリーニング方法において試験対象物質は、一般的な選定方式にしたがって、Aβの脳内蓄積またはグルタメートの生成予防及び治療剤としての可能性を有していると推定されるか、または無作為的に選定された個別的な核酸、タンパク質、その他の抽出物または天然物などを挙げることができる。
【実施例】
【0066】
以下、本発明を実施例によって詳しく説明する。ただ、下記の実施例は、本発明を具体的に例示するものであって、本発明の内容が実施例によって限定されるのではない。
【0067】
<実施例1>2−PMPAが、Aβ及びNAAG分解に及ぼす影響の確認
<1−1>細胞培養及び形質導入
HEK293T細胞及びH4細胞(American Type Culture Collection,ATCC,Edinburg,VA,米国)を10%牛胎児血清(FBS;GIBCO)及び1%ペニシリン/ストレプトマイシン(GIBCO)が添加されたDMEM(Dulbecco's modified Eagle's培地)(DMEM;GIBCO)中、PC3細胞を10%牛胎児血清(FBS;GIBCO)及び1%ペニシリン/ストレプトマイシン(GIBCO)が添加されたRPMI培地1640(GIBCO)中、5%CO2を含む湿式培養器で37℃で培養した。製造社の指針書にしたがってリポフェクタミン2000試薬またはリポフェクタミンプラス試薬(インビトロジェン)を用いて、一時的な形質導入を行なった。
【0068】
<1−2>Aβペプチドの準備
Aβ1−40またはAβ1−42(インビトロジェン)ペプチドを最終的に1mM濃度で冷たいヘキサフルオロイソプロパノール(HFIP;Sigma)とともに準備した。室温で40分間振って4℃で20分間放置した後、HFIPを真空状態で除去した。ペプチドペレットを−70℃で保存した。前記ペレットを最終5mM濃度になるようにDMSOで溶解させて、最終1mM濃度になるように蒸留水を添加した。
【0069】
<1−3>ELISA分析を通じた2−PMPAがAβ分解に及ぼす影響の確認
hGCPII及び多様な突然変異体のhGCPII遺伝子をコードするベクターを12ウェルプレートでPC3細胞内に形質導入した。培養培地を約30時間後に2−PMPA((2−(ホスホメチル)ペンタン二酸)があるかまたはない条件で、Aβ1−40またはAβ1−42ペプチドが処理された培地に変えて、細胞を再び8時間培養した。前記培地を回収し、製造社のプロトコールにしたがってELISAキット(インビトロジェン)を用い、残りはAβ1−40またはAβ1−42を分析した。空pcDNA3空ベクターで形質導入された細胞を陰性対照群として用いた。
【0070】
その結果、図1に示されたようにrhGCPIIは、対照群と比べて約80%Aβ1−40を分解したが、2−PMPAはGCPIIのAβ1−40分解に効果がないことを確認した(図1)
【0071】
<1−4>NAAG分解分析を通じた2−PMPAがNAAG分解に及ぼす影響の確認
内因性または過剰発現されたグルタメート・カルボキシペプチダーゼII(GCPII)タンパク質の活性を下記のような方法で測定した。細胞溶解物(50μg)を37℃で一時間50mM HEPES及び150mM NaClを含む総100μlの体積でGCPII特異的抑制剤である2−PMPAの20nMまたはEDTAが一緒にあるかまたはない条件で、NAAG(N−アセチル−L−アスパルチル−L−[3,4−3H]グルタメート;NENコーポレーション)の20μMとともに培養した。反応後に、試料混合物を96ウェルカラム(Havard apparatus)に用意したAG 1−X8陰イオン交換樹脂(Biorad)に用い、5分間2000rpmで遠心分離した。試料混合物と結合した樹脂を0.5mMホルマート(100ml)で溶離し、5分間2000rpmで遠心分離した。溶離したすべての試料を1mlのシンチレーション溶液(Optiphase HiSafe;Wallac)と一緒に混合し、放射能をシンチレーション計数器(Wallac Inc.)で測定した。
【0072】
その結果、図2に示されたように2−PMPAがGCPIIによるNAAG加水分解を完全に遮断したことを確認した(図2)。
【0073】
<1−5>GCPIIプラスミド及びレンチウイルス製作を通じた2−PMPAがレンチウイルスGCPIIのAβ分解に及ぼす影響の確認
hGCPIIプラスミドを下記の記載のように準備した。ヒトのアストロサイトに該当するU87−MG細胞からRNAを分離した後、逆転写酵素を用いてcDNAを合成した。合成されたcDNAで hGCPIIの増幅のために下記のプライマーを用いてPCR方法を用いた。プラスミド生成のためにPCR産物をpcDNA3ベクター内にクローニングした:
正方向:5'−GATGTGGAATCTCCTTCACGAAAC−3'(配列番号3)、及び
逆方向:5'−ATCCTCTTAGGCTACTTCACTCAAAG−3'(配列番号4)。
【0074】
レンチウイルスhGCPIIをMacrogen Inc.(韓国ソウル)で準備した。hGCPIIcDNAをヒトサイトメガロウイルス(CMV)プロモーター及び蛍光タンパク質(GFP)があるIRES配列を含むレンチウイルスコンストラクト(LentiM1.4−hGCPII)内にクローニングした。ウイルス製作のために、hGCPII、VSV−G及びgag−pol発現ベクターを、リポフェクタミンプラス(インビトロジェン,Carlsbad,CA,米国)を用いて293T細胞内に一緒に形質導入した後、細胞を単量体のAβおよび2−PMPAで処理した。細胞成長培地でのAβ1−40の濃度を前記実施例<1−3>の方法で分析した。
【0075】
その結果、図3に示されたように2−PMPAは、レンチウイルスGCPIIのAβ1−40分解を遮断しなかったことを確認した(図3)。
【0076】
<1−6>形質転換動物
二重形質導入APP Swedish/PS1ΔE9マウスをJackson Laboratory(Bar Harbor,ME,米国)から購入し、C57BL/6Jバックグラウンド系統で野生型マウスと交配することによって、ヘミ接合体(hemizygotes)を維持した。すべての動物を標準動物管理プロトコールによって飼育し、韓国食品医薬品安全庁(the Korean Food and Drug Administration)の無菌飼育施設(pathogen-free facility)で維持した。マウス遺伝子型を下記のプライマー(primer)を用いてPCR方法で確認した:
PrP(mouse prion protein):
正方向5'−CCTCTTTGTGACTATGTGGACTGATGTCGG−3'(配列番号5)、
逆方向5'−GTGGATAACCCCTCCCCCAGCCTAGACC−3'(配列番号6)、
ヒト(human)APP:
正方向5'−GACTGACCACTCGACCAGGTTCTG−3'(配列番号7)、及び
逆方向5'−CTTGTAAGTTGGATTCTCATATCCG−3'(配列番号8)。
【0077】
Aβsの脳での水準でGCPII抑制剤の効果を測定するために、処理した群は腹腔内注射で一ヶ月間、PBS 2X/wkで、溶解した2−PMPA(10mg/kg)を注入した。処理しない群は対照群として同じ量のPBSを注入した。マウスが8ヶ月になった時に処理を始めた。
【0078】
<1−7>2−PMPAのマウス脳での効果確認
2−PMPAの効果をマウスの脳で調べるために、前記実施例<1−6>の方法で形質転換された8ヶ月になったAPP Swedish/PS1Δ9マウスの腹腔内に、1ヶ月間、2−PMPAの10mg/kgまたはPBS 2/wkを9回処理した。皮質膜断片でAβ1−40及びAβ1−42の水準を前記実施例<1−3>の方法で分析し、GCPIIのNAAG分解活性を前記実施例<1−4>の方法で測定した。
【0079】
その結果、図4に示されたように2−PMPAで処理したマウスでのNAAG分解は、PBS対照群と比べて約90%減少したことを確認し(図4)、図5に示されたように2−PMPAの処理によってAβ1−40及びAβ1−42の水準は変化しなかったということを確認した(図5)。
【0080】
<実施例2>GCPIIの位置選択的突然変異体の発現の確認
<2−1>GCPIIの位置選択的突然変異(Site-directed mutagenesis)
pcDNA−hGCPIIプラスミド(50ng)を鋳型に用いて、所望する突然変異を産生する二つの相補的オリゴヌクレオチドプライマーで、各突然変異を導入した。Pfu Ultra High−Fidelity DNAポリメラーゼ(stratagene)の2.5Uを用いて延長させ、ニックの入った円形鎖(nicked circular strand)(95℃、5分→(95℃、50秒→55℃、1分→80℃、8分20秒→72℃、1分)22回循環→4℃、無限大(∞))で、結果としてもたらされた突然変異プライマー(125ng)を作った。メチル化されて、突然変異のない母型DNA(nonmutated parental DNA)鋳型を37℃で一時間Dpn I(NEB)の20Uで消化させた。その後、円形(circular)dsDNAでDH5aコンピテント細胞内を形質転換させた。それぞれの突然変異をシークエンシング(Cosmo corporation)で確認した。
【0081】
その結果、図6に示されたようにGCPIIの7個の突然変異体(R210A、D387N、P388A、R536L、G548P、Y552I、K699S)を製作した(図6)。
【0082】
<2−2>ウエスタンブロットを通じたGCPII突然変異体の発現の確認
GCPII突然変異体の発現を確認するために、前記実施例<1−1>の方法にしたがって突然変異体のプラスミドをHEK293T細胞内に形質導入した後、細胞をリン酸緩衝食塩水(PBS;GIBCO)で洗浄し、プロテアーゼ阻害剤カクテル(Sigma)入りのRIPA緩衝溶液(150mM NaCl、1% NP−40、0.5%デオキシコール酸ナトリウム、0.1%SDS、50mM Tris at pH8.0)で溶解させた。ブラッドフォード分析で溶解物のタンパク質の濃度を測定した。同じ濃度のタンパク質にβ−メルカブトエタノールを添加して10分間煮沸し、10%SDS−PAGEで分離した。タンパク質をPVDF(ポリビニリデンジフルオライド)膜(GE Healthcare)で電気泳動させ、一時間室温で5%脱脂粉乳を入れたTBS−Tでブロックした。その後、前記膜を4℃で一晩、5%脱脂粉乳に anti−PSMA(abcam;ab41034,1:1000)、Y−PSMA(Maine Biotech,1:1000)または抗−α−チューブリン抗体(Sigma−Aldrich;T6199,1:50000)とともに培養した。TBS−Tで三回洗浄した後、ブロットを室温で2時間HRP−ヤギ抗マウスコンジュゲートIgG(Jackson IR;115−035−071,1:10000)または、HRP−ヤギ抗ウサギコンジュゲートIgG(Jackson IR;115−035−046,1:10000)とともに培養した。三回洗浄した後、タンパク質を化学発光の基質(Thermo Scientific)を用いて検出した。
【0083】
その結果、図7に示されたようにバンドのパターンは、rhGCPIIと類似し、一つのバンドはGCPIIの予測された大きさである98kDaで明確に見えることを確認した(図7)。
【0084】
<実施例3>GCPII突然変異体のNAAG分解に及ぼす影響の確認
GCPII突然変異体のNAAG分解に及ぼす影響を確認するために、前記実施例<1−1>の方法によって、S1'ポケット(R210A,K699S)及びS1ポケット(R536L,G548P)に置換がある突然変異タンパク質を、H4細胞に形質導入した。NAAGの加水分解を測定するために、前記実施例<1−4>の方法によって、細胞溶解物を[H]3がラベルされたNAAG(20μM)及びGCPIIの特異的基質とともに培養し、前記実施例<2−2>の方法によってタンパク質発現の変化を確認した。
【0085】
その結果、図8に示されたようにS1'ポケット突然変異体(R210A,K699S)はNAAGを加水分解する活性を完全になくしてしまったが、S1ポケット突然変異体(R536L,G548P)は野生型GCPIIと比べて40%程度活性を維持していることを確認した(図8)。
【0086】
GCPIIのNAAG分解でAβの効果を調べるために、前記実施例<1−4>の方法によってrhGCPIIを[H]3がラベルされたNAAG(20μM)及びAβペプチドとともに同時に培養した。
【0087】
その結果、図9に示されたようにGCPIIのNAAG分解活性は、Aβペプチドに影響を受けなかったことを確認した(図9)。
【0088】
<実施例4>GCPII突然変異体のAβ分解に及ぼす影響の確認
<4−1>GCPII/Aβ複合体のモデリング
Aβ−S1及びS1'ポケットの結合のMODEをプログラムO(http://xray.bmc.uu.se/alw yn/A-Z_frameset.html)(PDB file:1z0q(Ab),2oot(GCPII))を用いて制作した。計算的ドッキング(computational docking)をマニュアルドッキング(manual docking)方法を用いて行なった。
【0089】
GCPII突然変異体のAβ分解に及ぼす影響を確認するために、前記実施例<1−5>の方法及び前記実施例<4−1>の方法によって、多様な突然変異体のプラスミドを、内因性のGCPIIを発現しないことが知られているPC3細胞に形質導入した。48時間後、前記細胞溶解物をAβ(2μM)と混合して一晩培養した。
【0090】
<4−2>ドットブロットを通じたGCPII突然変異体のAβ分解に及ぼす影響の確認
発現したGCPIIによって切られないで残ったAβペプチドの量を確認するために、細胞溶解物とAβ(2μM)との混合物を下記のドットブロット方法及び前記実施例<2−2>の方法で確認した。細胞溶解物とAβ(2μM)の混合物1μlをニトロセルロース膜に落とした後、完全に乾燥させた。乾燥した膜を一時間室温で5%脱脂粉乳を入れたTBS−Tでブロックした。その後、前記膜を4℃で一晩、5%脱脂粉乳に抗−Aβ抗体、6E10(SIGNET;SIG−39300,1:2000)とともに培養した。TBS−Tで三回洗浄した後、膜を室温で1時間HRP−ヤギ抗マウスコンジュゲートIgG(Jackson IR;115−035−071,1:10000)とともに培養した。三回洗浄した後、タンパク質を化学発光基質を用いて検出した。
【0091】
その結果、図10、図11に示されたように、K699S突然変異体は野生型よりAβをもう少し分解したが、G548P突然変異体はAβ分解活性を失ったことを確認した(図10、11)。
【0092】
AβペプチドでGCPIIの分解活性を確認するために、前記実施例<1−3>及び前記実施例<4−1>の方法によって、形質導入後の翌日、培地内にAβを1ng/mlで処理し、37℃で8時間培養した。
【0093】
その結果、図12に示されたように残ったAβは、G548Pを除いて、K699Sによって減少したことを確認した(図12)。
【産業上の利用可能性】
【0094】
前記で示されたように、本発明は、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療のための薬剤の開発と、それを用いた予防または治療方法の開発、すなわちタンパク質治療剤、発現及び活性調節物質、遺伝子治療剤または細胞治療剤などに有用に用いることができる。
【特許請求の範囲】
【請求項1】
GCPII(グルタメート・カルボキシペプチダーゼII)の全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物。
【請求項2】
GCPII突然変異体が、配列番号2で表されるアミノ酸配列を有することを特徴とする、請求項1のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物。
【請求項3】
GCPII突然変異体が、グルタメート生成阻害活性及びβアミロイド分解活性を同時に有することを特徴とする、請求項1のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物。
【請求項4】
前記βアミロイドが、溶解性または不溶性βアミロイドであることを特徴とする、請求項3のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物。
【請求項5】
GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を発現する発現ベクターを有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤。
【請求項6】
発現ベクターが、アデノウイルス、アデノ随伴ウイルス、レトロウイルス及びワクシニアウイルスからなる群から選択されるウイルス性の発現ベクターであることを特徴とする、請求項5のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤。
【請求項7】
GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の遺伝子を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物。
【請求項8】
GCPII突然変異体の遺伝子が、配列番号1の塩基配列を有することを特徴とする、請求項7のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物。
【請求項9】
GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物。
【請求項10】
GCPII突然変異タンパク質が、配列番号2のアミノ酸配列を有することを特徴とする、請求項9のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物。
【請求項11】
(1)GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の発現細胞を被検物質で処理する工程、
(2)工程(1)の細胞でGCPII突然変異タンパク質の発現水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べて、工程(2)のGCPII突然変異タンパク質の発現水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法。
【請求項12】
工程(2)のタンパク質の発現水準が、免疫蛍光法、酵素免疫分析法(ELISA)、ウエスタンブロット及びRT−PCRからなる群から選択されたいずれか一つで測定することを特徴とする、請求項11のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法。
【請求項13】
(1)GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を被検物質で処理する工程と、
(2)工程(1)のGCPII突然変異タンパク質の活性水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べて、工程(2)のGCPII突然変異タンパク質の活性水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法。
【請求項14】
工程(2)のタンパク質の活性水準が、免疫蛍光法、酵素免疫分析法(ELISA)、質量分析及びタンパク質チップからなる群から選択されたいずれか一つで測定することを特徴とする、請求項13のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法。
【請求項1】
GCPII(グルタメート・カルボキシペプチダーゼII)の全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物。
【請求項2】
GCPII突然変異体が、配列番号2で表されるアミノ酸配列を有することを特徴とする、請求項1のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物。
【請求項3】
GCPII突然変異体が、グルタメート生成阻害活性及びβアミロイド分解活性を同時に有することを特徴とする、請求項1のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物。
【請求項4】
前記βアミロイドが、溶解性または不溶性βアミロイドであることを特徴とする、請求項3のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療用薬学的組成物。
【請求項5】
GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体を発現する発現ベクターを有効成分として含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤。
【請求項6】
発現ベクターが、アデノウイルス、アデノ随伴ウイルス、レトロウイルス及びワクシニアウイルスからなる群から選択されるウイルス性の発現ベクターであることを特徴とする、請求項5のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤。
【請求項7】
GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の遺伝子を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物。
【請求項8】
GCPII突然変異体の遺伝子が、配列番号1の塩基配列を有することを特徴とする、請求項7のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物。
【請求項9】
GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を含有する、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物。
【請求項10】
GCPII突然変異タンパク質が、配列番号2のアミノ酸配列を有することを特徴とする、請求項9のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤スクリーニング用薬学的組成物。
【請求項11】
(1)GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異体の発現細胞を被検物質で処理する工程、
(2)工程(1)の細胞でGCPII突然変異タンパク質の発現水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べて、工程(2)のGCPII突然変異タンパク質の発現水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法。
【請求項12】
工程(2)のタンパク質の発現水準が、免疫蛍光法、酵素免疫分析法(ELISA)、ウエスタンブロット及びRT−PCRからなる群から選択されたいずれか一つで測定することを特徴とする、請求項11のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法。
【請求項13】
(1)GCPIIの全体アミノ酸配列のN末端から699番目アミノ酸であるリジン(K)をセリン(S)に変異させたGCPII突然変異タンパク質を被検物質で処理する工程と、
(2)工程(1)のGCPII突然変異タンパク質の活性水準を測定する工程、及び
(3)被検物質で処理しない対照群に比べて、工程(2)のGCPII突然変異タンパク質の活性水準を減少させた被検物質を選別する工程
を含む、アミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法。
【請求項14】
工程(2)のタンパク質の活性水準が、免疫蛍光法、酵素免疫分析法(ELISA)、質量分析及びタンパク質チップからなる群から選択されたいずれか一つで測定することを特徴とする、請求項13のアミロイド症、アルツハイマー疾患、アルツハイマー疾患を伴うダウン症候群、脳卒中、中風、痴ほう、ハンチントン病、ピック病及びクロイツフェルト・ヤコブ病からなる群から選択された疾患の予防及び治療剤候補物質のスクリーニング方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2013−82710(P2013−82710A)
【公開日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願番号】特願2012−222654(P2012−222654)
【出願日】平成24年10月5日(2012.10.5)
【出願人】(512258975)
【Fターム(参考)】
【公開日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願日】平成24年10月5日(2012.10.5)
【出願人】(512258975)

【Fターム(参考)】
[ Back to top ]

