HIV−1交差中和モノクローナル抗体2F5のFab’−エピトープ複合体
【課題】複合体形成していない、ならびに、結合したエピトープを有する双方の、Mab 2F5のFab’フラグメントの三次元構造の提供。
【解決手段】実験室株およびHIV−1のはなはだ多くの同源系統群の初代臨床的分離株の双方に有効な中和剤であるMab 2F5のFab’フラグメントの、ウイルスのエンベロープタンパク質gp41の広範に保存されるペプチド配列ELDKWASとの複合体を形成した、および非複合の両結晶構造が解明され、ペプチド−タンパク質相互作用の特性が決定された。かかる決定に関連して、ペプチド模倣体を、そのエピトープ配列対する増大した抗原性を付与するような三次元構造へと制御がなされる。
【解決手段】実験室株およびHIV−1のはなはだ多くの同源系統群の初代臨床的分離株の双方に有効な中和剤であるMab 2F5のFab’フラグメントの、ウイルスのエンベロープタンパク質gp41の広範に保存されるペプチド配列ELDKWASとの複合体を形成した、および非複合の両結晶構造が解明され、ペプチド−タンパク質相互作用の特性が決定された。かかる決定に関連して、ペプチド模倣体を、そのエピトープ配列対する増大した抗原性を付与するような三次元構造へと制御がなされる。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の分野)
本発明は、結晶学ならびに免疫学、特には、モノクローナル抗体2F5のFab’フラグメントの三次元構造の初めての解明に関する。
【背景技術】
【0002】
(発明の背景)
モノクローナル抗体(Mab)2F5は、HIV−1のはなはだ多くの同源系統群の初代臨床的分離株ならびに実験室株の双方に有効な中和剤であり、時にはKatingerエピトープとも称される、ウイルスのエンベロープタンパク質gp41の、広範に保存されているペプチド配列ELDKWAS(SEQ ID No.1)と反応する(参照文献1〜7:非特許文献1〜7。本出願を通じて、本発明が属する技術分野の現状をより完全に説明するために、様々な文献が括弧中に参照される。各々の引用の完全な文献情報は、明細書の最後にある。これらの参照文献の開示は、参照によって、本開示に組み込む。)このため、Mab 2F5は、HIV−1ワクチンの開発において、より多くの興味がある。抗原性提示(immunogenic presentation)の研究に基づいて、このエピトープ配列の抗原性は、分子的構造に依存するものであると結論された(参照文献8:非特許文献8)。
【非特許文献1】Muster, T., et al., A conserved neutralizing epitope on gp41 of human immunodeficiency virus type 1, J. Virology, 67, 6642-6647 (1993)
【非特許文献2】Muster, T., et al., Cross-neutralizing activity against divergent human immunodeficiency virus type 1 isolates induced by the gp41 sequence ELDKWAS. J. Virology, 68, 4031-4034 (1994)
【非特許文献3】Purtcher, M., et al., A broadly neutralizing human monoclonal antibody against gp41 of human immunodeficiency virus type 1 (HIV-1). AIDS Res. And Human Retroviruses, 10, 1651-1658 (1994)
【非特許文献4】Conley, A.J., et al., Neutralization of divergent human immunodeficiency virus type 1 variants and primary isolates by IAM-41-2F5, an anti-gp41 human monoclonal antibody. Proc. Natl. Acad. Sci. USA, 91, 3348-3352 (1994)
【非特許文献5】Trkola, A., et al., Cross0clade neutralization of primary isolates of human immunodeficiency virus type 1 by human monoclonal antibodies and tetrameric CD4-IGG. J. Virology, 69, 6609-6617 (1995)
【非特許文献6】Burton D.R., A vaccine for HIV type 1: The antibody perspective. Proc. Natl. Acad. Sci. USA, 94, 10018-10023 (1997)
【非特許文献7】Mascola, J.R., et al., Potent and synergistic neutralization of human immunodeficiency virus (HIV) type 1 primary isolates by hyperimmune anti-HIV immunoglobulin combined with monoclonal antibodies 2F5 and 2G12, J. Virology, 71, 7198-7206 (1997)
【非特許文献8】Eckhart, L., et al., Immunogenic presentation of a conserved gp41 epitope of human immunodeficiency virus type 1 on recombinant surface antigens of hepatitis B virus. J. of General Virology, 77, 2001-2008 (1996)
【発明の開示】
【発明が解決しようとする課題】
【0003】
(発明の概要)
本発明によれば、複合体形成していない、ならびに、結合したエピトープを有する双方の、Mab 2F5のFab’フラグメントの三次元構造が提供される。
【課題を解決するための手段】
【0004】
複合体形成した結晶構造において、以下に説明されるように、7個のアミノ酸配列(ELDKWAS)はわずかに歪んだβターンを形成し、タンパク質/ペプチド相互作用の主要部の原因となっている中央のDKWコアを持つ。
【0005】
本明細書中に与えられる詳細な分析から理解されるように、わずかに歪んだβターンは、それぞれ、アスパラギン酸の骨格および側鎖からアラニンおよびトリプトファンのアミドへの水素結合によって安定化されている。三次元構造において、該エピトープのトリプトファンおよびリシンの側鎖は、重なり合い平行となっている。
【0006】
これらの三次元構造の解明は、本明細書に記載されるように、複合体の結晶構造に見られるものと同じβターン様立体配置(configuration)に制御されたペプチド模倣体(mimetics)を構築することを可能にし、それはエピトープ配列の抗原性を増大させると期待される。
【0007】
従って、本発明の1つの態様において、モノクローナル抗体2F5のFab’フラグメントの単離結晶が提供される。結晶形態のFab’2F5フラグメントの単離は、かかる形態のフラグメントの三次元構造を決定することを可能にし、その構造は、以下に記載の図1に示される。以下の表2に記載されるように、結その晶構造に対する、いくらかの特性パラメータが決定された。
【0008】
結晶はそれ自身の独自の格子定数を有する、別の空間群に成長することもできるが、単離される結晶は、格子定数a=63.6Å、b=76.4Å、c=93.4Åの単位格子を持つ、空間群P212121に成長することができる。結晶形態のFab’2F5は、通常、Accession No.2F5Aとして、Protein Data Bankに1999年4月9日に登録された原子座標を有する。
【0009】
本明細書に与えられる、単離結晶を構成しているFab’2F5分子は、以下の表1に見られるように、H鎖98番目〜H鎖120番目のアミノ酸残基を含む重鎖の第3超可変(V3)ループをもち、それは以下に記載される図4に示される三次元構造、および以下の表3に示される原子座標をもつ。
【0010】
本発明のさらなる態様によれば、アミノ酸配列ELDKWAS(SEQ ID No.1)をもつペプチドまたはその機能的類似体(analog)と複合体形成したモノクローナル抗体2F5のFab’フラグメントの単離結晶が提供される。複合体の結晶形態の解明は、この形態の複合体の三次元構造を決定することを可能にし、Fab’フラグメントへのペプチドの結合部位の詳細は以下に記載の図3に示される。以下の表2に記載されるように、複合体の結晶構造に対しても、いくつかの特性パラメータが決定された。
【0011】
結晶は、それ自身の独自の格子定数を持つ別の空間群に成長することもできるが、単離される複合体結晶は、格子定数a=58.0Å、b=65.0Å、c=175.6Åをもつ空間群P212121に成長してもよい。Fab’ 2F5の複合体形成した形態の結晶構造は、Accession No.2F5Bとして、Protein Data Bankに1999年4月9日に登録された原子座標をもつことができる。
【0012】
アミノ酸配列ELDKWASの機能的類似体は、リシンがアルギニンで置換されたもの、および/またはトリプトファンがチロシン、フェニルアラニンまたは荷電していないヒスチジンによって置換されたものでありうる。このような機能性類似体の一例は、ELDRWAS(SEQ ID No.2)である。
【0013】
ペプチドELDKWAS(SEQ ID No.1)と結合している際の、Fab’2F5フラグメントの結晶構造の解明は、かかる抗体へ結合している際の、ペプチド エピトープの現実のコンホメーションの詳細を提供し、それは、解析される結晶の種類に依らず、同じでありえる。
【0014】
ペプチド エピトープのコンホメーションに関して与えられる情報は、抗HIVワクチンの成分として有用であるかもしれない類似ペプチド、ペプチド模倣体および他の抗原の供給の基礎を提供する。
【0015】
従って、本発明の別の態様において、モノクローナル抗体2F5に結合し、また図3に示されるペプチドELDKWAS(SEQ ID No.1)の三次元構造に相当する三次元構造をとるように束縛された合成ペプチドが提供される。
【0016】
この合成ペプチドは通常、アミノ酸配列DKWまたはその機能的類似体を含み、図3に見られまた以下に記載されるように、重なり合い平行であるトリプトファンおよびリシン残基鎖をもつ三次元構造のわずかに歪んだβターン立体配置に束縛されている。
【0017】
エピトープの立体コンホメーション解析は、少なくとも1個のトリプトファンおよびリシンの側鎖が図3に示されるペプチド−タンパク質相互作用を保持し、またMabに結合するアミノ酸によって置換することができるということを示している。例えば、アルギニン(R)はリシン(K)の替りに用いることができ、またチロシン(Y)、フェニルアラニン(F)および荷電していないヒスチジン(H)はトリプトファン(W)の替りに用いることができる。1つまたは複数のこのようなアミノ酸置換が行われたペプチドは、そのペプチドはやはりモノクローナル抗体2F5に結合するという点において、その用語が本明細書において理解されるように、アミノ酸配列DKWの「機能的類似体」を含むペプチドである。
【0018】
本明細書において与えられる合成ペプチドは、どのような便宜的手段によって必要とされるコンホメーションに束縛されてもよい。例えば、アミノ酸配列DKWまたはその類似体を、図3に示される2個のアミノ酸残基の各々の配向に保持するためにジスルフィド架橋を用いてもよい。このようなジスルフィド架橋は合成ペプチドECDKWCS(SEQ ID No.3)のシステイン残基の間に形成することができる。
【0019】
あるいは、アミノ酸配列DKWまたはその機能的類似体を、図3に示されるアミノ酸残基の各々の配向に保持するためにラクタム結合を用いてもよい。このようなラクタム結合は、合成ペプチドEDapDKWES(SEQ ID No.4)またはEEDKWDapS(SEQ ID No.5)のジアミノプロピオン酸(Dap)とグルタミン酸(E)残基の間に形成することができる。
【0020】
ペプチドの抗原性は、ジフテリアトキソイド、破傷風トキソイドまたはHaemophilusの外膜タンパク質を含むタンパク質などの担体分子と複合化することで増大することがよく知られている。このような担体タンパク質をペプチドに結合させてもよい。
【0021】
本発明の付加的な態様において、モノクローナル抗体2F5に結合するペプチドの製造方法も提供され、この方法はモノクローナル抗体2F5のFab’フラグメントとアミノ酸配列ELDKWAS(SEQ ID No.1)をもつペプチドまたはその機能的類似体とを共結晶化し複合体結晶を形成すること、複合体結晶を解析しFab’フラグメントとの関係において結合ペプチドの立体配向を決定すること、および決定された立体配向に束縛され少なくともアミノ酸DKWまたはその機能性類似体を含むペプチドを合成することを含む。
【0022】
少なくともアミノ酸DKWを含むペプチドの機能性類似体は、やはりモノクローナル抗体2F5に結合するものである。機能性類似体はまた、式X1LDKWX2S(X1はE、A、GまたはQであり、X2はAまたはT)で表される類似体を含むELDKWASモチーフの既知の類似体にわたる。
【0023】
本発明の出願ファイルはカラーで製作された図面、すなわち、図1〜4を含む。カラー図面をもつ本特許のコピーは、請求および必要料金の支払により、原出願のPatent and Trademark Officeによって提供される。
【発明を実施するための最良の形態】
【0024】
(発明の全般的説明)
Mab 2F5(IgG)のFab’フラグメントの結晶構造は、分子置換によって2.05Åの分解能で解かれ、標準的免疫グロブリンフォールドを採用する。構造の特徴は、伸びた(22アミノ酸)H鎖の超可変ループ3(V−H3、参照文献9)であり、これはアミノ酸残基H98〜120を含み、図1のリボン表示図から分かるようにタンパク質表面から離れて延びる。V−H3ループは図4に詳細に示されている。V−H3ループの原子座標は表3に与えられている。
【0025】
2.0Åで精密化された結合エピトープをもつFab’2F5複合体の構造において、このループは明瞭な電子密度によってよく限定されたものであった。複合化していない形態においては、V−H3領域はより不明瞭であるが、両方の鎖のC末端を含む、H鎖定常ドメインのC末端領域でのループは、解像度がよりよかった。よりよく限定された電子密度からのコンホメーションは他のモデルを構築するためのテンプレートとして用いた。精密化したモデルは、L鎖の残基L1〜L214およびH鎖のH1〜H146とH151〜H235プラス定序水分子を含む。Fab’2F5のL鎖(SEQ ID No.2)およびH鎖(SEQ ID No.3)のアミノ酸配列が以下の表1に示されている。複合体の構造に対して、P1〜P7はペプチドの残基である。H鎖の定常ドメインのH147〜H150のループはいずれの構造においても明かでなかった。(残基には本明細書において、H鎖に対してH1〜H235またL鎖に対してL1〜L214さらにペプチドに対してP1〜P7と番号をつける。)
前記のループの可動性における差異とともに、複合形態における折曲がり角(elbow angle)は複合していないFab’2F5と異なる(142°対146°)。単位格子が異なっている、すなわち非複合体Fab’2F5は30%小さい単位格子をもっているので、これらの観察のいずれも結晶充填の人工産物の可能性がある。すべてのCα原子のオーバーレイは0.7Åのrmsdを与えが、これらのシフトは抗原結合部位のいかなる変更よりもむしろドメインの一斉運動(すなわち折曲がり角の変化)の結果のように見える。可変領域だけの重ね合わせは0.4Åのrmsdを与える。構造解析の結果は見出されたV−H3の長いループの挿入に対するいかなる明白な説明ももたらさないが、表面残基のその異常な疎水性は、それが抗体メカニズムにおいてある役割を演じていることを示唆する。それは、結合を強めFabの特異性を強化し、gp41のC末端の部分のエピトープ配列に対する相互作用に関与している可能性がある。それは、おそらくgp41のコイルドコイル3量体のコンホメーションを壊して、中和メカニズムの不可欠な部分を形成している可能性さえある。
【0026】
複合体の構造において、ELDKWASペプチドは、P6−Alaのアミド窒素からP3−Aspのカルボニル酸素への3.1Åの水素結合をもち、P4−LysとP5−Trpの間に中心のある僅かに歪んだタイプIβターンを形成する(図2および3に見られる)。この配列は、ターン中の位置2も3もグリシンではなく(参照文献10)、むしろ嵩高い残基リシンおよびトリプトファンであるという点で非典型的である。P5−Trpに対する2面角はラマチャンドラン・プロットの「好ましくない」領域にある(φ=101.7°、ψ=8.7°)。
【0027】
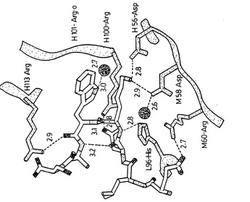
複合体構造の別の興味ある特徴は、約3.8Åの距離でのP4−Lysの伸び切ったアルキル鎖およびP5−Trpの芳香族環の間の疎水性相互作用による、隣接するP5−TrpとP4−Lysの側鎖の重なり合う配置である。疎水性メチレングループがP5−TrpとH54−Trpの間にサンドイッチされているリシンの側鎖は、末端のアミノ基で鋭く曲がり、H56−AspおよびH58−Aspと相互作用している。P5−Trpの主たる疎水性相互作用はP4−Lysのメチレングループであるが、その芳香族環系から4Å以内の他の疎水性残基にはH103−ProおよびH32−PheおよびH113−Argの側鎖のメチレングループが含まれる。ペプチド立体配置の安定性にとっての鍵となる要素はP3−Aspの側鎖の配向であり、これはすべて約2.8Åの距離でL96−His−NεおよびH100−Arg−NH1だけでなくP5−Trpの主鎖アミドと強い水素結合を形成する。3.0Åの距離でP5−Trp−Nε1と会合する水分子もまた、各々2.7Åおよび2.8Åの距離でH33−GlyおよびH101−Argの主鎖カルボニルと強い水素結合を形成する。この解析から、Asp−Lys−Trp(DKW)トリオがタンパク質/ペプチド相互作用の本質的要素であると結論することができる。
【0028】
この結論は、DKWコア以外の変化は結合に劇的な効果を及ぼさず、一方トリオ内の重大な変更は通常中和を妨げるという変異体の研究によって支持される(参照文献5)。LDKWモチーフは、HIV−1エンベロープ糖タンパク質配列の間で83%保存されていると見積もられた(参照文献4)。エピトープの重要部分、DKWに対して、1997 to 1998 Los Alamos HIV Sequence Database(参照文献11)中のすべての同源系統群の配列決定されたHIV−1エンベロープタンパク質206種の間では保存率は86%である。B同源系統群のなかでは、保存率は92%である(91/99配列)。Mab 2F5でのファージライブラリスクリーニングはまた、DRWコアをもつ配列を選択した(参照文献4)。アルギニンでP4−Lysを置換した(すなわち、ペプチドELDRWAS(SEQ ID No.2)複合体の構造は、同一のペプチドコンホーメーションを示し、コンセンサスエピトープをもつここで報告する複合体のように相互作用する。複合体の形成により埋もれた全接触可能面積は1025Å2である(半径1.4Åのプローブを用いて決定された、完全な複合体とペプチドおよび非複合Fab’の表面積の合計との接触可能面積の差として計算される(参照文献12))。複合体Fab’2F5+ELDKWASのペプチド座標は表4に示され、複合体Fab’2F5+ELDRWASのペプチド座標は表5に示される。
【0029】
Fab’2F5との複合体に見出され図3に詳細に見られるgp41エピトープのコンホメーションは予想されなかった。らせんコンホメーションが提案され(参照文献13)、それはgp41のエクトドメインに認められたコイルドコイルの伸長と矛盾がなかった(参照文献14〜19)。2つの報告(参照文献14,19)は部分的配列を含んでいるが、HIV−1(参照文献14〜16)またはSIV(参照文献17〜19)gp41のほとんどの構造解析はエピトープ配列を組込まない。一方では(参照文献14)、結晶化部分のC末端のELDにαらせん構造、長い(37aa)らせんの延長を採用した。他方では、C末端は構造のないコイルである(参照文献19)。
【0030】
全エピトープのコンホメーションは、エピトープを9個のアミノ酸リンカーによってグルタチオン−S−トランスフェラーゼ(GST)のC末端に結合させた融合タンパク質の一部分として決定された(参照文献20)。この環境では、エピトープは一連の窮屈なターンの一部分を形成するが、本明細書に記載される結果に見られるβターンではなかった。GST−融合構造においては、エピトープペプチドは結晶中の隣接する分子と相互作用し、結晶の充填力が観測されるコンホメーションに導いたということがほぼ確実である。この構造のgp41ペプチド部分はまた屈曲性を示す大きな熱パラメータをもっていた。
【0031】
予備的なNMR測定は、ELDKWAS配列はほとんどまたは全く安定な2次構造をとらないということを示唆していた。本明細書で明らかにされるFab’2F5の結晶構造は、このエピトープが赤血球凝集素(参照文献2、21)または組換え体の抗体(参照文献22)のループに導入された場合に観察されるより強い免疫応答を説明し、これらの場合βターンコンホメーションが誘起される可能性があり、エピトープの移植が2F5に似る結合特異性のあるすぐれた体液性応答を示すが生きているウイルスを中和できない肝炎Bウイルスの表面抗原(参照文献8)と対照をなし、正しいエピトープコンホメーションの重要性を際立たせている。
【0032】
本明細書で記載されるgp41エピトープのコンホメーションは、ウイルスエンベロープでの成熟したgp41/gp120の3量体の形成の後、あるいは可能性として融合過程の間に一時的に形成されるかもしれない。中間の「嵌め込まれてない」また融合しない形態だけでなく、本明細書でなされた構造決定において認められた安定な融合する(fusogenic)形態を含むgp41に対するコンホメーションの範囲は、何人かの研究者によって提案されてきた(参照文献14、23)。抗原の短命さは、その低い抗原性およびほとんどの感染患者の抗血清にMab 2F5が結果的に欠如していることと合致している。そのうえ、チンパンジにおけるMab 2F5での受動免疫ではHIV−1を中和できず、感染を遅らせウイルスの数を減少させたが防護にはならなかった(参照文献6)。この結果は、抗体が低濃度であることまたは抗原のコンホメーションの短命さのいずれかのために、おそらく抗体結合の機会が十分でないことによる。gp41に対する唯一の確認された交差中和抗体として、Mab 2F5はHIV−1ワクチンの探求において重要な焦点である。それは今日までに確認された3種の広範に中和するモノクローナル抗体の内の1つであり、短い連続するエピトープをもつ唯一のものである。交差中和Mabとして知られている他の2つは、各々CD4結合部位およびgp120のV3/V4ループのエピトープを定めるb12および2G12であるが(参照文献6)、これらの場合、エピトープは不連続でペプチドと炭水化物相互作用の両方を含む(参照文献5、6)。
【0033】
Fab’2F5の構造中に見出されたgp41配列のコンホメーションをとるように束縛されたペプチド模倣体の開発は、エピトープの低い抗原性を克服し、この化合物を将来のHIV−1ワクチンの有用な成分とするであろう。
【実施例】
【0034】
(実施例)
前記の開示は一般的に本発明を記載する。より完全な理解は以下の具体的実施例を参照することによって得られる。これらの実施例は例示のためにのみ記載され本発明の範囲を限定しようとするものではない。形態の変更および同等物の置換は状況が便法を示唆するかまたはそうなる場合に予想されている。特定の用語が本実施例で使われているが、このような用語は説明のためであり、限定するためではない。
【0035】
用いられるがこの開示および実施例では明示的に記載されていない分子遺伝学、ペプチド模倣体の化学、タンパク質生化学、結晶学および免疫学の方法は、科学的文献に多く報告されており、十分に当分野の技術者の能力の範囲内にある。
【0036】
実施例1
この実施例は、Fab’2F5およびそのエピトープ複合体の調製、精製および結晶化を示す。
【0037】
未処理のヒトIAM 2F5 IgG抗体を、標準的なペプシンプロトコルを用いてF(ab’)2に変換した。F(ab’)2を次に、安定のために溶液に加えられた1%(w/v)臨床用ヒトアルブミンとともに保存した。アルブミンからタンパク質を分離するために、DE52セルロースを20mMトリスpH8.0中で膨潤させ、幅3cmで高さ5cmのカラムに充填し、約30mLのベッドボリュームとした。コラムを2Lの20mMトリスpH8.0で一夜洗浄した。
【0038】
濃度1.1mg/mLのタンパク質55mLを2回4〜5Lの20mMトリスpH8.0で透析し、伝導度および緩衝液のpH、流出およびタンパク質濃度を調べ、タンパク質がカラムに結合したことを確認した。タンパク質を1〜5mL/分でポンプで送ることによってカラムに装填した。アルブミンはカラムに結合し一方F(ab’)2は結合しない。緩衝液A(20mMトリスpH8.0)を、OD280がベースラインに下降するまでカラムに流し、ほぼ7mLのフラクションを得た。
【0039】
アルブミンを、20mMトリスpH8、20mMトリスpH8.0+0.2MNaClの塩勾配で溶出させ、他のタンパク質が存在しないことを確認した。流出タンパク質を濃縮し、23mg/mlで5×500μLのF(ab’)2を得た。k−鎖を標的にするポジティッブ抗原捕捉ELISAアッセイ、それに続くヒト抗体分子のFc部分を標的とするネガティッブアッセイによってだけでなく、還元および非還元nativeおよびSDS−PAGEゲルによって、試料がF(ab’)2であることを確認した。
【0040】
23mg/mLの200μLのFab’を0.1MトリスpH8.0で4mLに希釈した。0.1MトリスpH8.0中の400μL 100mM DTTをその4mLに加え、DTT中10mMの最終濃度を得た。この溶液を1時間室温でインキュベートし、0.1MトリスpH8.0中30μLの500mMのヨードアセトアミド溶液を加えその溶液をさらに30分放置した。Fab’を20mMトリスpH8.0で一夜透析し、結晶化のセットアップに用いるために10mg/mLに濃縮した。
【0041】
複合していないFab’の結晶は、pH5.8の1.0M硫酸アンモニウムを沈殿剤として、5mg/mLタンパク質のハンギングドロップから成長し、針状に成長した。複合体は、3:1の比でペプチドELDKWASをタンパク質に加え、一夜インキュベートし、その後pH7.0の1.6M硫酸アンモニウムを沈殿剤として用い、pH5.8の5mg/mL複合体のハンギングドロップを設置することによって、共結晶化した。結晶は大きな正方両錐体として2日で成長した。
【0042】
H鎖およびL鎖の可変ドメインの配列は最近公表され(参照文献10)、アミノ酸H110、それは当初言われたようなプロリンでなくセリンである、の唯一の訂正以外は本研究で用いられたものと一致する。Fab’フラグメントの可変および定常ドメインの完全なアミノ酸配列は以下の表1に示される(SEQ ID No.6および7)。
【0043】
フリーFab’結晶は空間群P212121(単位格子:a=63.6Å、b=76.4Å、c=94.7Å)に属し、針状結晶に成長する。複合体の結晶も空間群P212121(単位格子:a=59.0Å、b=65.0Å、c=175.6Å)であり、正方両錐体に成長する。結晶をデータ収集のため瞬間凍結した。データを、Molecular Structure Corpのmirror opticsとMar345 image plate detectorとを備えるRigakuFR−C(Fab’2F5)、およびMar30 detectorを用いてブルックヘブンのNational Synchrotron Light Sourceで(複合体)収集した。データをDENZOおよびSCALEPACK(HKL Research)を用いて処理した。
【0044】
実施例2
この実施例はFab’2F5複合および非複合体の構造の解を記載する。
【0045】
Fab’2F5複合体の構造を、PDBエントリ1CLZ(参照文献25)マイナス側鎖および超可変ループをモデルとして用いて分子置換(参照文献24)により解いた。定常および可変領域を独立の探査モデルとして用いた。補正された解は3.3Åまでのデータを用いて相関係数は35.3(R=47.3%)であった。CNSパッケージ(参照文献26)を精密化に用いた。ポリアラニンモデルの剛体の精密化の後生成する2Fo−Fcマップはほとんどの側鎖の位置決定を可能にした。シミュレートされたアニーリングサイクルの後、超可変ループを含めた。ペプチドの密度はこの時点で明かで曖昧さなく当て嵌めることができた。別のアニーリングサイクル、位置およびB−ファクタの精密化の後、水を含め、>3.5のピークを供与または受容原子から適当な距離に差マップに見出した。
【0046】
複合していないFab’2F5の構造を、精密化されたFab’2F5複合体マイナスペプチドを探査モデルとして分子置換によって解いた。相関係数は53.7、R=39.0%であった。精密化は複合体に対するものと同じ手順で行った。データ収集、処理および構造の精密化の統計は以下の表2に与えられる。結晶構造の座標は、非複合構造に対して2F5A、Fab’2F5−エピトープ複合体に対して2F5BのAccession numberでブルックヘブンのProtein Data Bankに登録された。
【0047】
実施例3
この実施例は、束縛されたペプチドベースのワクチンの合理的なデザインにおけるKatingerエピトープ(実施例1および2)の三次元構造の情報の有用性を例示する。
【0048】
1.ECDKWCS CLP−634(SEQ ID No.3)
構造の情報に基づいて、KatingerエピトープをペプチドECDKWCS(CLP−634)の位置2および6の間のジスルフィド架橋によって束縛することが可能である。
【0049】
線状ペプチドECDKWCSは自動的でなく、t−Boc化法とともに標準的な固相ペプチド合成法を用いることによってPAM支持体上で合成される。粗ペプチドを高−HF法によって樹脂から切り離した。粗材料(54mg)をメタノール(500mL)で溶解した。メタノール中50mMヨウ素を、溶液が薄い黄色になるまで、攪拌しながら滴下した。1分間攪拌後、Dowex IX2−200(アセテート)樹脂(約9g)を加えた。溶液が無色になるまで攪拌を続けた。樹脂をフィルタで除去し、50mLの水を加え、混合物を減圧濃縮し、凍結乾燥した。粗環状ペプチドをRP−HPLCによって精製した。
【0050】
2.EdapDKWES CLP−1309(SEQ ID No.4)
構造の情報に基づいて、KatingerエピトープをペプチドEDapDKWES(CLP−1309)の位置2および6の間のラクタム結合によって束縛することも可能である。
【0051】
ペプチド、t−Boc−Glu(OBzl)−Dap(Fmoc)−Asp(OBzl)−Lys(2Cl−Cbz)−Trp(For)−Glu(OFm)−Ser(Bzl)−樹脂をPAM支持固体上で集積した。続いてDap(2)およびGlu(6)の側鎖の保護基を25%ピペラジン処理ではずした。側鎖の環化を4当量のHBTUおよび8当量のDIEAを加え、一夜混合物を振り動かすことによって樹脂上で行った。環状ペプチドを標準のHF法によって切り離し、粗ペプチドをRP−HPLCによって精製した。この実施例で用いられた省略形は、
Dap=ジアミノプロピオン酸
HBTU=O−ベンゾトリアゾリル−N,N,N’,N’−テトラメチルウロニウムヘキサフルオロホスフェート
DIEA=ジ−イソプロピルエチルアミン
PAM=4−ヒドロキシメチル−フェニルアセトアミドメチル樹脂
Bzl=ベンジル
2−Cl−Cbz=2・クロロベンジルオキシカルボニル
For=ホルミル
t−Boc=t−ブトキシカルボニル
Fmoc=フルオレニルメトキシカルボニル
Fm=フルオレニルメチル
である。
【0052】
両ペプチドCLP−634とCLP−1309は、モノクローナル抗体2F5と免疫複合体を形成できることが見出され、次いでFab’フラグメントと共結晶化された。これらの結果は、束縛されたペプチドはKatingerエピトープを模倣でき、ペプチドベースのワクチンとして有用でありうるということを示している。
【0053】
実施例4
この実施例は、抗HIVワクチンとして使用するための、束縛されたペプチド−担体複合体の形成を例示する。
【0054】
束縛されたペプチドCLP−1309(実施例3)と担体タンパク質を複合化するために、4量体ペプチドCys−Gly−Gly−GlyをCLS−1309にN末端で結合し、得られるペプチドをCLP−1491と呼ぶ。同様に、4量体ペプチドGly−Gly−Gly−CysをCLP−1309にC末端で結合し、得られるペプチドをCLP−1492と呼ぶ。
【0055】
50マイクロリットルのm−マレイミドベンゾイル−N−ヒドロキシスクシンイミド(MBS、Pierce、2mg;1mLのテトラヒドロフランまたはメタノール中6.3mmol)をタンパク質溶液(2mLの0.1Mリン酸緩衝液、pH7.5中ほぼ10mgのHin47または破傷風トキソイド)に加えた。反応混合物をアルゴン中室温で30分間攪拌した。反応混合物を、20mM炭酸アンモニウム緩衝液、pH7.2で平衡に達したSephdex G−25カラム(20×300mm)に通し、同じ緩衝液で溶出させた。溶出は230nmの吸光度によってモニタし、ピークの溶出タンパク質を溜めた。担体に組込まれたマレイミド基の数を、過剰の2−メルカプトエタノールを活性化された担体−MBSに加え、改良されたエルマン法を用いて過剰分を逆滴定することによって測定した(参照文献31)。
【0056】
ペプチド−担体複合体に対する一般的なプロトコルは記載されてきた(参照文献32)。簡単に記載すると、脱ガスされたPBS緩衝液、pH7.5中の合成ペプチド(1mg/mL)と担体−MBS(1mg/mL)とを混合した。反応混合物をアルゴン雰囲気下室温で一夜攪拌した。過剰のN−エチル−マレイミド(Aldrich)を加えて反応を終息させ、攪拌をさらに1時間続けた。不溶性の沈殿物を濾別し、濾液をSephadex G−25カラムを用いてゲル濾過クロマトグラフィにかけた。ペプチド−担体複合体を集めた。担体とペプチドのモル比はアミノ酸分析で測定された。
【0057】
(開示の概要)
この開示の概要として、非複合形態の、およびエピトープELDLWASと複合体形成したFab’2F5フラグメントの結晶構造が解明され、そして、ペプチドは、そのペプチド−タンパク質相互作用による束縛された構造に対応するように合成された。改良は本発明の範囲内で可能である。
表1
【0058】
【表1】

【0059】
表2
【0060】
【表2】

【0061】
表3
【0062】
【表3】

【0063】
【表4】

【0064】
【表5】

【0065】
【表6】

【0066】
【表7】

【0067】
【表8】

【0068】
表4
【0069】
【表9】

【0070】
【表10】

【0071】
表5
【0072】
【表11】

【0073】
【表12】

【0074】
参照文献
【0075】
【表13】

【0076】
【表14】

【0077】
【表15】

【図面の簡単な説明】
【0078】
【図1】MOLSCRIPT(参照文献27)およびRaster 3D(参照文献28)により作成された、紫色のH鎖、青色のL鎖およびタンパク質表面から延びる伸びたVH3ループ(金色)を示す、結晶化Fab’2F5のカラーリボン表示図である。
【図2】プログラムO(参照文献29)により作成された、ELDKWASペプチドの密度モデルの着色立体プロット図であり、このFo−Fcマップは、ペプチドに限定して計算され、3σで輪郭を示してあり、輪郭のレベルでのP7−Serの密度のわずかな破れが、結合したエピトープの末端での自由度がわずかに増大していることを示している。
【図3】プログラムSETOR(参照文献30)を用いて作成された、タンパク質−ペプチド相互作用を示す、Fab’2F5の抗原結合部位のカラー表示図である。残基は、原子の種類別に着色され、酸素は赤色、窒素は青色、炭素は灰色およびイオウは黄色であり、明確性のためにエピトープと相互作用する疎水性側鎖のいくつかは省略されており、全ての結合の長さはÅで示される。
【図4】プログラムSETOR(参照文献30)を用いて作成した、アミノ酸残基H98〜H120を含むFab’2F5複合体のH鎖の第3超可変ループのカラー表示図であり、残基は原子の種類別に着色されている。
【技術分野】
【0001】
(発明の分野)
本発明は、結晶学ならびに免疫学、特には、モノクローナル抗体2F5のFab’フラグメントの三次元構造の初めての解明に関する。
【背景技術】
【0002】
(発明の背景)
モノクローナル抗体(Mab)2F5は、HIV−1のはなはだ多くの同源系統群の初代臨床的分離株ならびに実験室株の双方に有効な中和剤であり、時にはKatingerエピトープとも称される、ウイルスのエンベロープタンパク質gp41の、広範に保存されているペプチド配列ELDKWAS(SEQ ID No.1)と反応する(参照文献1〜7:非特許文献1〜7。本出願を通じて、本発明が属する技術分野の現状をより完全に説明するために、様々な文献が括弧中に参照される。各々の引用の完全な文献情報は、明細書の最後にある。これらの参照文献の開示は、参照によって、本開示に組み込む。)このため、Mab 2F5は、HIV−1ワクチンの開発において、より多くの興味がある。抗原性提示(immunogenic presentation)の研究に基づいて、このエピトープ配列の抗原性は、分子的構造に依存するものであると結論された(参照文献8:非特許文献8)。
【非特許文献1】Muster, T., et al., A conserved neutralizing epitope on gp41 of human immunodeficiency virus type 1, J. Virology, 67, 6642-6647 (1993)
【非特許文献2】Muster, T., et al., Cross-neutralizing activity against divergent human immunodeficiency virus type 1 isolates induced by the gp41 sequence ELDKWAS. J. Virology, 68, 4031-4034 (1994)
【非特許文献3】Purtcher, M., et al., A broadly neutralizing human monoclonal antibody against gp41 of human immunodeficiency virus type 1 (HIV-1). AIDS Res. And Human Retroviruses, 10, 1651-1658 (1994)
【非特許文献4】Conley, A.J., et al., Neutralization of divergent human immunodeficiency virus type 1 variants and primary isolates by IAM-41-2F5, an anti-gp41 human monoclonal antibody. Proc. Natl. Acad. Sci. USA, 91, 3348-3352 (1994)
【非特許文献5】Trkola, A., et al., Cross0clade neutralization of primary isolates of human immunodeficiency virus type 1 by human monoclonal antibodies and tetrameric CD4-IGG. J. Virology, 69, 6609-6617 (1995)
【非特許文献6】Burton D.R., A vaccine for HIV type 1: The antibody perspective. Proc. Natl. Acad. Sci. USA, 94, 10018-10023 (1997)
【非特許文献7】Mascola, J.R., et al., Potent and synergistic neutralization of human immunodeficiency virus (HIV) type 1 primary isolates by hyperimmune anti-HIV immunoglobulin combined with monoclonal antibodies 2F5 and 2G12, J. Virology, 71, 7198-7206 (1997)
【非特許文献8】Eckhart, L., et al., Immunogenic presentation of a conserved gp41 epitope of human immunodeficiency virus type 1 on recombinant surface antigens of hepatitis B virus. J. of General Virology, 77, 2001-2008 (1996)
【発明の開示】
【発明が解決しようとする課題】
【0003】
(発明の概要)
本発明によれば、複合体形成していない、ならびに、結合したエピトープを有する双方の、Mab 2F5のFab’フラグメントの三次元構造が提供される。
【課題を解決するための手段】
【0004】
複合体形成した結晶構造において、以下に説明されるように、7個のアミノ酸配列(ELDKWAS)はわずかに歪んだβターンを形成し、タンパク質/ペプチド相互作用の主要部の原因となっている中央のDKWコアを持つ。
【0005】
本明細書中に与えられる詳細な分析から理解されるように、わずかに歪んだβターンは、それぞれ、アスパラギン酸の骨格および側鎖からアラニンおよびトリプトファンのアミドへの水素結合によって安定化されている。三次元構造において、該エピトープのトリプトファンおよびリシンの側鎖は、重なり合い平行となっている。
【0006】
これらの三次元構造の解明は、本明細書に記載されるように、複合体の結晶構造に見られるものと同じβターン様立体配置(configuration)に制御されたペプチド模倣体(mimetics)を構築することを可能にし、それはエピトープ配列の抗原性を増大させると期待される。
【0007】
従って、本発明の1つの態様において、モノクローナル抗体2F5のFab’フラグメントの単離結晶が提供される。結晶形態のFab’2F5フラグメントの単離は、かかる形態のフラグメントの三次元構造を決定することを可能にし、その構造は、以下に記載の図1に示される。以下の表2に記載されるように、結その晶構造に対する、いくらかの特性パラメータが決定された。
【0008】
結晶はそれ自身の独自の格子定数を有する、別の空間群に成長することもできるが、単離される結晶は、格子定数a=63.6Å、b=76.4Å、c=93.4Åの単位格子を持つ、空間群P212121に成長することができる。結晶形態のFab’2F5は、通常、Accession No.2F5Aとして、Protein Data Bankに1999年4月9日に登録された原子座標を有する。
【0009】
本明細書に与えられる、単離結晶を構成しているFab’2F5分子は、以下の表1に見られるように、H鎖98番目〜H鎖120番目のアミノ酸残基を含む重鎖の第3超可変(V3)ループをもち、それは以下に記載される図4に示される三次元構造、および以下の表3に示される原子座標をもつ。
【0010】
本発明のさらなる態様によれば、アミノ酸配列ELDKWAS(SEQ ID No.1)をもつペプチドまたはその機能的類似体(analog)と複合体形成したモノクローナル抗体2F5のFab’フラグメントの単離結晶が提供される。複合体の結晶形態の解明は、この形態の複合体の三次元構造を決定することを可能にし、Fab’フラグメントへのペプチドの結合部位の詳細は以下に記載の図3に示される。以下の表2に記載されるように、複合体の結晶構造に対しても、いくつかの特性パラメータが決定された。
【0011】
結晶は、それ自身の独自の格子定数を持つ別の空間群に成長することもできるが、単離される複合体結晶は、格子定数a=58.0Å、b=65.0Å、c=175.6Åをもつ空間群P212121に成長してもよい。Fab’ 2F5の複合体形成した形態の結晶構造は、Accession No.2F5Bとして、Protein Data Bankに1999年4月9日に登録された原子座標をもつことができる。
【0012】
アミノ酸配列ELDKWASの機能的類似体は、リシンがアルギニンで置換されたもの、および/またはトリプトファンがチロシン、フェニルアラニンまたは荷電していないヒスチジンによって置換されたものでありうる。このような機能性類似体の一例は、ELDRWAS(SEQ ID No.2)である。
【0013】
ペプチドELDKWAS(SEQ ID No.1)と結合している際の、Fab’2F5フラグメントの結晶構造の解明は、かかる抗体へ結合している際の、ペプチド エピトープの現実のコンホメーションの詳細を提供し、それは、解析される結晶の種類に依らず、同じでありえる。
【0014】
ペプチド エピトープのコンホメーションに関して与えられる情報は、抗HIVワクチンの成分として有用であるかもしれない類似ペプチド、ペプチド模倣体および他の抗原の供給の基礎を提供する。
【0015】
従って、本発明の別の態様において、モノクローナル抗体2F5に結合し、また図3に示されるペプチドELDKWAS(SEQ ID No.1)の三次元構造に相当する三次元構造をとるように束縛された合成ペプチドが提供される。
【0016】
この合成ペプチドは通常、アミノ酸配列DKWまたはその機能的類似体を含み、図3に見られまた以下に記載されるように、重なり合い平行であるトリプトファンおよびリシン残基鎖をもつ三次元構造のわずかに歪んだβターン立体配置に束縛されている。
【0017】
エピトープの立体コンホメーション解析は、少なくとも1個のトリプトファンおよびリシンの側鎖が図3に示されるペプチド−タンパク質相互作用を保持し、またMabに結合するアミノ酸によって置換することができるということを示している。例えば、アルギニン(R)はリシン(K)の替りに用いることができ、またチロシン(Y)、フェニルアラニン(F)および荷電していないヒスチジン(H)はトリプトファン(W)の替りに用いることができる。1つまたは複数のこのようなアミノ酸置換が行われたペプチドは、そのペプチドはやはりモノクローナル抗体2F5に結合するという点において、その用語が本明細書において理解されるように、アミノ酸配列DKWの「機能的類似体」を含むペプチドである。
【0018】
本明細書において与えられる合成ペプチドは、どのような便宜的手段によって必要とされるコンホメーションに束縛されてもよい。例えば、アミノ酸配列DKWまたはその類似体を、図3に示される2個のアミノ酸残基の各々の配向に保持するためにジスルフィド架橋を用いてもよい。このようなジスルフィド架橋は合成ペプチドECDKWCS(SEQ ID No.3)のシステイン残基の間に形成することができる。
【0019】
あるいは、アミノ酸配列DKWまたはその機能的類似体を、図3に示されるアミノ酸残基の各々の配向に保持するためにラクタム結合を用いてもよい。このようなラクタム結合は、合成ペプチドEDapDKWES(SEQ ID No.4)またはEEDKWDapS(SEQ ID No.5)のジアミノプロピオン酸(Dap)とグルタミン酸(E)残基の間に形成することができる。
【0020】
ペプチドの抗原性は、ジフテリアトキソイド、破傷風トキソイドまたはHaemophilusの外膜タンパク質を含むタンパク質などの担体分子と複合化することで増大することがよく知られている。このような担体タンパク質をペプチドに結合させてもよい。
【0021】
本発明の付加的な態様において、モノクローナル抗体2F5に結合するペプチドの製造方法も提供され、この方法はモノクローナル抗体2F5のFab’フラグメントとアミノ酸配列ELDKWAS(SEQ ID No.1)をもつペプチドまたはその機能的類似体とを共結晶化し複合体結晶を形成すること、複合体結晶を解析しFab’フラグメントとの関係において結合ペプチドの立体配向を決定すること、および決定された立体配向に束縛され少なくともアミノ酸DKWまたはその機能性類似体を含むペプチドを合成することを含む。
【0022】
少なくともアミノ酸DKWを含むペプチドの機能性類似体は、やはりモノクローナル抗体2F5に結合するものである。機能性類似体はまた、式X1LDKWX2S(X1はE、A、GまたはQであり、X2はAまたはT)で表される類似体を含むELDKWASモチーフの既知の類似体にわたる。
【0023】
本発明の出願ファイルはカラーで製作された図面、すなわち、図1〜4を含む。カラー図面をもつ本特許のコピーは、請求および必要料金の支払により、原出願のPatent and Trademark Officeによって提供される。
【発明を実施するための最良の形態】
【0024】
(発明の全般的説明)
Mab 2F5(IgG)のFab’フラグメントの結晶構造は、分子置換によって2.05Åの分解能で解かれ、標準的免疫グロブリンフォールドを採用する。構造の特徴は、伸びた(22アミノ酸)H鎖の超可変ループ3(V−H3、参照文献9)であり、これはアミノ酸残基H98〜120を含み、図1のリボン表示図から分かるようにタンパク質表面から離れて延びる。V−H3ループは図4に詳細に示されている。V−H3ループの原子座標は表3に与えられている。
【0025】
2.0Åで精密化された結合エピトープをもつFab’2F5複合体の構造において、このループは明瞭な電子密度によってよく限定されたものであった。複合化していない形態においては、V−H3領域はより不明瞭であるが、両方の鎖のC末端を含む、H鎖定常ドメインのC末端領域でのループは、解像度がよりよかった。よりよく限定された電子密度からのコンホメーションは他のモデルを構築するためのテンプレートとして用いた。精密化したモデルは、L鎖の残基L1〜L214およびH鎖のH1〜H146とH151〜H235プラス定序水分子を含む。Fab’2F5のL鎖(SEQ ID No.2)およびH鎖(SEQ ID No.3)のアミノ酸配列が以下の表1に示されている。複合体の構造に対して、P1〜P7はペプチドの残基である。H鎖の定常ドメインのH147〜H150のループはいずれの構造においても明かでなかった。(残基には本明細書において、H鎖に対してH1〜H235またL鎖に対してL1〜L214さらにペプチドに対してP1〜P7と番号をつける。)
前記のループの可動性における差異とともに、複合形態における折曲がり角(elbow angle)は複合していないFab’2F5と異なる(142°対146°)。単位格子が異なっている、すなわち非複合体Fab’2F5は30%小さい単位格子をもっているので、これらの観察のいずれも結晶充填の人工産物の可能性がある。すべてのCα原子のオーバーレイは0.7Åのrmsdを与えが、これらのシフトは抗原結合部位のいかなる変更よりもむしろドメインの一斉運動(すなわち折曲がり角の変化)の結果のように見える。可変領域だけの重ね合わせは0.4Åのrmsdを与える。構造解析の結果は見出されたV−H3の長いループの挿入に対するいかなる明白な説明ももたらさないが、表面残基のその異常な疎水性は、それが抗体メカニズムにおいてある役割を演じていることを示唆する。それは、結合を強めFabの特異性を強化し、gp41のC末端の部分のエピトープ配列に対する相互作用に関与している可能性がある。それは、おそらくgp41のコイルドコイル3量体のコンホメーションを壊して、中和メカニズムの不可欠な部分を形成している可能性さえある。
【0026】
複合体の構造において、ELDKWASペプチドは、P6−Alaのアミド窒素からP3−Aspのカルボニル酸素への3.1Åの水素結合をもち、P4−LysとP5−Trpの間に中心のある僅かに歪んだタイプIβターンを形成する(図2および3に見られる)。この配列は、ターン中の位置2も3もグリシンではなく(参照文献10)、むしろ嵩高い残基リシンおよびトリプトファンであるという点で非典型的である。P5−Trpに対する2面角はラマチャンドラン・プロットの「好ましくない」領域にある(φ=101.7°、ψ=8.7°)。
【0027】
複合体構造の別の興味ある特徴は、約3.8Åの距離でのP4−Lysの伸び切ったアルキル鎖およびP5−Trpの芳香族環の間の疎水性相互作用による、隣接するP5−TrpとP4−Lysの側鎖の重なり合う配置である。疎水性メチレングループがP5−TrpとH54−Trpの間にサンドイッチされているリシンの側鎖は、末端のアミノ基で鋭く曲がり、H56−AspおよびH58−Aspと相互作用している。P5−Trpの主たる疎水性相互作用はP4−Lysのメチレングループであるが、その芳香族環系から4Å以内の他の疎水性残基にはH103−ProおよびH32−PheおよびH113−Argの側鎖のメチレングループが含まれる。ペプチド立体配置の安定性にとっての鍵となる要素はP3−Aspの側鎖の配向であり、これはすべて約2.8Åの距離でL96−His−NεおよびH100−Arg−NH1だけでなくP5−Trpの主鎖アミドと強い水素結合を形成する。3.0Åの距離でP5−Trp−Nε1と会合する水分子もまた、各々2.7Åおよび2.8Åの距離でH33−GlyおよびH101−Argの主鎖カルボニルと強い水素結合を形成する。この解析から、Asp−Lys−Trp(DKW)トリオがタンパク質/ペプチド相互作用の本質的要素であると結論することができる。
【0028】
この結論は、DKWコア以外の変化は結合に劇的な効果を及ぼさず、一方トリオ内の重大な変更は通常中和を妨げるという変異体の研究によって支持される(参照文献5)。LDKWモチーフは、HIV−1エンベロープ糖タンパク質配列の間で83%保存されていると見積もられた(参照文献4)。エピトープの重要部分、DKWに対して、1997 to 1998 Los Alamos HIV Sequence Database(参照文献11)中のすべての同源系統群の配列決定されたHIV−1エンベロープタンパク質206種の間では保存率は86%である。B同源系統群のなかでは、保存率は92%である(91/99配列)。Mab 2F5でのファージライブラリスクリーニングはまた、DRWコアをもつ配列を選択した(参照文献4)。アルギニンでP4−Lysを置換した(すなわち、ペプチドELDRWAS(SEQ ID No.2)複合体の構造は、同一のペプチドコンホーメーションを示し、コンセンサスエピトープをもつここで報告する複合体のように相互作用する。複合体の形成により埋もれた全接触可能面積は1025Å2である(半径1.4Åのプローブを用いて決定された、完全な複合体とペプチドおよび非複合Fab’の表面積の合計との接触可能面積の差として計算される(参照文献12))。複合体Fab’2F5+ELDKWASのペプチド座標は表4に示され、複合体Fab’2F5+ELDRWASのペプチド座標は表5に示される。
【0029】
Fab’2F5との複合体に見出され図3に詳細に見られるgp41エピトープのコンホメーションは予想されなかった。らせんコンホメーションが提案され(参照文献13)、それはgp41のエクトドメインに認められたコイルドコイルの伸長と矛盾がなかった(参照文献14〜19)。2つの報告(参照文献14,19)は部分的配列を含んでいるが、HIV−1(参照文献14〜16)またはSIV(参照文献17〜19)gp41のほとんどの構造解析はエピトープ配列を組込まない。一方では(参照文献14)、結晶化部分のC末端のELDにαらせん構造、長い(37aa)らせんの延長を採用した。他方では、C末端は構造のないコイルである(参照文献19)。
【0030】
全エピトープのコンホメーションは、エピトープを9個のアミノ酸リンカーによってグルタチオン−S−トランスフェラーゼ(GST)のC末端に結合させた融合タンパク質の一部分として決定された(参照文献20)。この環境では、エピトープは一連の窮屈なターンの一部分を形成するが、本明細書に記載される結果に見られるβターンではなかった。GST−融合構造においては、エピトープペプチドは結晶中の隣接する分子と相互作用し、結晶の充填力が観測されるコンホメーションに導いたということがほぼ確実である。この構造のgp41ペプチド部分はまた屈曲性を示す大きな熱パラメータをもっていた。
【0031】
予備的なNMR測定は、ELDKWAS配列はほとんどまたは全く安定な2次構造をとらないということを示唆していた。本明細書で明らかにされるFab’2F5の結晶構造は、このエピトープが赤血球凝集素(参照文献2、21)または組換え体の抗体(参照文献22)のループに導入された場合に観察されるより強い免疫応答を説明し、これらの場合βターンコンホメーションが誘起される可能性があり、エピトープの移植が2F5に似る結合特異性のあるすぐれた体液性応答を示すが生きているウイルスを中和できない肝炎Bウイルスの表面抗原(参照文献8)と対照をなし、正しいエピトープコンホメーションの重要性を際立たせている。
【0032】
本明細書で記載されるgp41エピトープのコンホメーションは、ウイルスエンベロープでの成熟したgp41/gp120の3量体の形成の後、あるいは可能性として融合過程の間に一時的に形成されるかもしれない。中間の「嵌め込まれてない」また融合しない形態だけでなく、本明細書でなされた構造決定において認められた安定な融合する(fusogenic)形態を含むgp41に対するコンホメーションの範囲は、何人かの研究者によって提案されてきた(参照文献14、23)。抗原の短命さは、その低い抗原性およびほとんどの感染患者の抗血清にMab 2F5が結果的に欠如していることと合致している。そのうえ、チンパンジにおけるMab 2F5での受動免疫ではHIV−1を中和できず、感染を遅らせウイルスの数を減少させたが防護にはならなかった(参照文献6)。この結果は、抗体が低濃度であることまたは抗原のコンホメーションの短命さのいずれかのために、おそらく抗体結合の機会が十分でないことによる。gp41に対する唯一の確認された交差中和抗体として、Mab 2F5はHIV−1ワクチンの探求において重要な焦点である。それは今日までに確認された3種の広範に中和するモノクローナル抗体の内の1つであり、短い連続するエピトープをもつ唯一のものである。交差中和Mabとして知られている他の2つは、各々CD4結合部位およびgp120のV3/V4ループのエピトープを定めるb12および2G12であるが(参照文献6)、これらの場合、エピトープは不連続でペプチドと炭水化物相互作用の両方を含む(参照文献5、6)。
【0033】
Fab’2F5の構造中に見出されたgp41配列のコンホメーションをとるように束縛されたペプチド模倣体の開発は、エピトープの低い抗原性を克服し、この化合物を将来のHIV−1ワクチンの有用な成分とするであろう。
【実施例】
【0034】
(実施例)
前記の開示は一般的に本発明を記載する。より完全な理解は以下の具体的実施例を参照することによって得られる。これらの実施例は例示のためにのみ記載され本発明の範囲を限定しようとするものではない。形態の変更および同等物の置換は状況が便法を示唆するかまたはそうなる場合に予想されている。特定の用語が本実施例で使われているが、このような用語は説明のためであり、限定するためではない。
【0035】
用いられるがこの開示および実施例では明示的に記載されていない分子遺伝学、ペプチド模倣体の化学、タンパク質生化学、結晶学および免疫学の方法は、科学的文献に多く報告されており、十分に当分野の技術者の能力の範囲内にある。
【0036】
実施例1
この実施例は、Fab’2F5およびそのエピトープ複合体の調製、精製および結晶化を示す。
【0037】
未処理のヒトIAM 2F5 IgG抗体を、標準的なペプシンプロトコルを用いてF(ab’)2に変換した。F(ab’)2を次に、安定のために溶液に加えられた1%(w/v)臨床用ヒトアルブミンとともに保存した。アルブミンからタンパク質を分離するために、DE52セルロースを20mMトリスpH8.0中で膨潤させ、幅3cmで高さ5cmのカラムに充填し、約30mLのベッドボリュームとした。コラムを2Lの20mMトリスpH8.0で一夜洗浄した。
【0038】
濃度1.1mg/mLのタンパク質55mLを2回4〜5Lの20mMトリスpH8.0で透析し、伝導度および緩衝液のpH、流出およびタンパク質濃度を調べ、タンパク質がカラムに結合したことを確認した。タンパク質を1〜5mL/分でポンプで送ることによってカラムに装填した。アルブミンはカラムに結合し一方F(ab’)2は結合しない。緩衝液A(20mMトリスpH8.0)を、OD280がベースラインに下降するまでカラムに流し、ほぼ7mLのフラクションを得た。
【0039】
アルブミンを、20mMトリスpH8、20mMトリスpH8.0+0.2MNaClの塩勾配で溶出させ、他のタンパク質が存在しないことを確認した。流出タンパク質を濃縮し、23mg/mlで5×500μLのF(ab’)2を得た。k−鎖を標的にするポジティッブ抗原捕捉ELISAアッセイ、それに続くヒト抗体分子のFc部分を標的とするネガティッブアッセイによってだけでなく、還元および非還元nativeおよびSDS−PAGEゲルによって、試料がF(ab’)2であることを確認した。
【0040】
23mg/mLの200μLのFab’を0.1MトリスpH8.0で4mLに希釈した。0.1MトリスpH8.0中の400μL 100mM DTTをその4mLに加え、DTT中10mMの最終濃度を得た。この溶液を1時間室温でインキュベートし、0.1MトリスpH8.0中30μLの500mMのヨードアセトアミド溶液を加えその溶液をさらに30分放置した。Fab’を20mMトリスpH8.0で一夜透析し、結晶化のセットアップに用いるために10mg/mLに濃縮した。
【0041】
複合していないFab’の結晶は、pH5.8の1.0M硫酸アンモニウムを沈殿剤として、5mg/mLタンパク質のハンギングドロップから成長し、針状に成長した。複合体は、3:1の比でペプチドELDKWASをタンパク質に加え、一夜インキュベートし、その後pH7.0の1.6M硫酸アンモニウムを沈殿剤として用い、pH5.8の5mg/mL複合体のハンギングドロップを設置することによって、共結晶化した。結晶は大きな正方両錐体として2日で成長した。
【0042】
H鎖およびL鎖の可変ドメインの配列は最近公表され(参照文献10)、アミノ酸H110、それは当初言われたようなプロリンでなくセリンである、の唯一の訂正以外は本研究で用いられたものと一致する。Fab’フラグメントの可変および定常ドメインの完全なアミノ酸配列は以下の表1に示される(SEQ ID No.6および7)。
【0043】
フリーFab’結晶は空間群P212121(単位格子:a=63.6Å、b=76.4Å、c=94.7Å)に属し、針状結晶に成長する。複合体の結晶も空間群P212121(単位格子:a=59.0Å、b=65.0Å、c=175.6Å)であり、正方両錐体に成長する。結晶をデータ収集のため瞬間凍結した。データを、Molecular Structure Corpのmirror opticsとMar345 image plate detectorとを備えるRigakuFR−C(Fab’2F5)、およびMar30 detectorを用いてブルックヘブンのNational Synchrotron Light Sourceで(複合体)収集した。データをDENZOおよびSCALEPACK(HKL Research)を用いて処理した。
【0044】
実施例2
この実施例はFab’2F5複合および非複合体の構造の解を記載する。
【0045】
Fab’2F5複合体の構造を、PDBエントリ1CLZ(参照文献25)マイナス側鎖および超可変ループをモデルとして用いて分子置換(参照文献24)により解いた。定常および可変領域を独立の探査モデルとして用いた。補正された解は3.3Åまでのデータを用いて相関係数は35.3(R=47.3%)であった。CNSパッケージ(参照文献26)を精密化に用いた。ポリアラニンモデルの剛体の精密化の後生成する2Fo−Fcマップはほとんどの側鎖の位置決定を可能にした。シミュレートされたアニーリングサイクルの後、超可変ループを含めた。ペプチドの密度はこの時点で明かで曖昧さなく当て嵌めることができた。別のアニーリングサイクル、位置およびB−ファクタの精密化の後、水を含め、>3.5のピークを供与または受容原子から適当な距離に差マップに見出した。
【0046】
複合していないFab’2F5の構造を、精密化されたFab’2F5複合体マイナスペプチドを探査モデルとして分子置換によって解いた。相関係数は53.7、R=39.0%であった。精密化は複合体に対するものと同じ手順で行った。データ収集、処理および構造の精密化の統計は以下の表2に与えられる。結晶構造の座標は、非複合構造に対して2F5A、Fab’2F5−エピトープ複合体に対して2F5BのAccession numberでブルックヘブンのProtein Data Bankに登録された。
【0047】
実施例3
この実施例は、束縛されたペプチドベースのワクチンの合理的なデザインにおけるKatingerエピトープ(実施例1および2)の三次元構造の情報の有用性を例示する。
【0048】
1.ECDKWCS CLP−634(SEQ ID No.3)
構造の情報に基づいて、KatingerエピトープをペプチドECDKWCS(CLP−634)の位置2および6の間のジスルフィド架橋によって束縛することが可能である。
【0049】
線状ペプチドECDKWCSは自動的でなく、t−Boc化法とともに標準的な固相ペプチド合成法を用いることによってPAM支持体上で合成される。粗ペプチドを高−HF法によって樹脂から切り離した。粗材料(54mg)をメタノール(500mL)で溶解した。メタノール中50mMヨウ素を、溶液が薄い黄色になるまで、攪拌しながら滴下した。1分間攪拌後、Dowex IX2−200(アセテート)樹脂(約9g)を加えた。溶液が無色になるまで攪拌を続けた。樹脂をフィルタで除去し、50mLの水を加え、混合物を減圧濃縮し、凍結乾燥した。粗環状ペプチドをRP−HPLCによって精製した。
【0050】
2.EdapDKWES CLP−1309(SEQ ID No.4)
構造の情報に基づいて、KatingerエピトープをペプチドEDapDKWES(CLP−1309)の位置2および6の間のラクタム結合によって束縛することも可能である。
【0051】
ペプチド、t−Boc−Glu(OBzl)−Dap(Fmoc)−Asp(OBzl)−Lys(2Cl−Cbz)−Trp(For)−Glu(OFm)−Ser(Bzl)−樹脂をPAM支持固体上で集積した。続いてDap(2)およびGlu(6)の側鎖の保護基を25%ピペラジン処理ではずした。側鎖の環化を4当量のHBTUおよび8当量のDIEAを加え、一夜混合物を振り動かすことによって樹脂上で行った。環状ペプチドを標準のHF法によって切り離し、粗ペプチドをRP−HPLCによって精製した。この実施例で用いられた省略形は、
Dap=ジアミノプロピオン酸
HBTU=O−ベンゾトリアゾリル−N,N,N’,N’−テトラメチルウロニウムヘキサフルオロホスフェート
DIEA=ジ−イソプロピルエチルアミン
PAM=4−ヒドロキシメチル−フェニルアセトアミドメチル樹脂
Bzl=ベンジル
2−Cl−Cbz=2・クロロベンジルオキシカルボニル
For=ホルミル
t−Boc=t−ブトキシカルボニル
Fmoc=フルオレニルメトキシカルボニル
Fm=フルオレニルメチル
である。
【0052】
両ペプチドCLP−634とCLP−1309は、モノクローナル抗体2F5と免疫複合体を形成できることが見出され、次いでFab’フラグメントと共結晶化された。これらの結果は、束縛されたペプチドはKatingerエピトープを模倣でき、ペプチドベースのワクチンとして有用でありうるということを示している。
【0053】
実施例4
この実施例は、抗HIVワクチンとして使用するための、束縛されたペプチド−担体複合体の形成を例示する。
【0054】
束縛されたペプチドCLP−1309(実施例3)と担体タンパク質を複合化するために、4量体ペプチドCys−Gly−Gly−GlyをCLS−1309にN末端で結合し、得られるペプチドをCLP−1491と呼ぶ。同様に、4量体ペプチドGly−Gly−Gly−CysをCLP−1309にC末端で結合し、得られるペプチドをCLP−1492と呼ぶ。
【0055】
50マイクロリットルのm−マレイミドベンゾイル−N−ヒドロキシスクシンイミド(MBS、Pierce、2mg;1mLのテトラヒドロフランまたはメタノール中6.3mmol)をタンパク質溶液(2mLの0.1Mリン酸緩衝液、pH7.5中ほぼ10mgのHin47または破傷風トキソイド)に加えた。反応混合物をアルゴン中室温で30分間攪拌した。反応混合物を、20mM炭酸アンモニウム緩衝液、pH7.2で平衡に達したSephdex G−25カラム(20×300mm)に通し、同じ緩衝液で溶出させた。溶出は230nmの吸光度によってモニタし、ピークの溶出タンパク質を溜めた。担体に組込まれたマレイミド基の数を、過剰の2−メルカプトエタノールを活性化された担体−MBSに加え、改良されたエルマン法を用いて過剰分を逆滴定することによって測定した(参照文献31)。
【0056】
ペプチド−担体複合体に対する一般的なプロトコルは記載されてきた(参照文献32)。簡単に記載すると、脱ガスされたPBS緩衝液、pH7.5中の合成ペプチド(1mg/mL)と担体−MBS(1mg/mL)とを混合した。反応混合物をアルゴン雰囲気下室温で一夜攪拌した。過剰のN−エチル−マレイミド(Aldrich)を加えて反応を終息させ、攪拌をさらに1時間続けた。不溶性の沈殿物を濾別し、濾液をSephadex G−25カラムを用いてゲル濾過クロマトグラフィにかけた。ペプチド−担体複合体を集めた。担体とペプチドのモル比はアミノ酸分析で測定された。
【0057】
(開示の概要)
この開示の概要として、非複合形態の、およびエピトープELDLWASと複合体形成したFab’2F5フラグメントの結晶構造が解明され、そして、ペプチドは、そのペプチド−タンパク質相互作用による束縛された構造に対応するように合成された。改良は本発明の範囲内で可能である。
表1
【0058】
【表1】

【0059】
表2
【0060】
【表2】

【0061】
表3
【0062】
【表3】

【0063】
【表4】

【0064】
【表5】

【0065】
【表6】

【0066】
【表7】

【0067】
【表8】

【0068】
表4
【0069】
【表9】

【0070】
【表10】

【0071】
表5
【0072】
【表11】

【0073】
【表12】

【0074】
参照文献
【0075】
【表13】

【0076】
【表14】

【0077】
【表15】

【図面の簡単な説明】
【0078】
【図1】MOLSCRIPT(参照文献27)およびRaster 3D(参照文献28)により作成された、紫色のH鎖、青色のL鎖およびタンパク質表面から延びる伸びたVH3ループ(金色)を示す、結晶化Fab’2F5のカラーリボン表示図である。
【図2】プログラムO(参照文献29)により作成された、ELDKWASペプチドの密度モデルの着色立体プロット図であり、このFo−Fcマップは、ペプチドに限定して計算され、3σで輪郭を示してあり、輪郭のレベルでのP7−Serの密度のわずかな破れが、結合したエピトープの末端での自由度がわずかに増大していることを示している。
【図3】プログラムSETOR(参照文献30)を用いて作成された、タンパク質−ペプチド相互作用を示す、Fab’2F5の抗原結合部位のカラー表示図である。残基は、原子の種類別に着色され、酸素は赤色、窒素は青色、炭素は灰色およびイオウは黄色であり、明確性のためにエピトープと相互作用する疎水性側鎖のいくつかは省略されており、全ての結合の長さはÅで示される。
【図4】プログラムSETOR(参照文献30)を用いて作成した、アミノ酸残基H98〜H120を含むFab’2F5複合体のH鎖の第3超可変ループのカラー表示図であり、残基は原子の種類別に着色されている。
【特許請求の範囲】
【請求項1】
モノクローナル抗体2F5のFab’フラグメントの単離結晶。
【請求項2】
図1によって表される三次元構造を有する分子からなる請求項1の単離結晶。
【請求項3】
表2中に定められるパラメータを有する分子からなる請求項1の単離結晶。
【請求項4】
格子定数a=63.6Å、b=76.4Åおよびc=93.4Åの単位格子をとり、空間群P212121を有する分子からなる請求項3の単離結晶。
【請求項5】
図4に示される三次元構造を有し、表1に示す、H鎖98番目〜H鎖120番目のアミノ酸残基を含む、重鎖の第3超可変(V3)ループを有する分子からなる請求項1の単離結晶。
【請求項6】
前記のV3ループが、表3中に示される原子座標を有する分子からなる請求項5の単離結晶。
【請求項7】
Protein Data Bankに、Accession number 2F5Aとして登録されている原子座標を有する分子からなる請求項1の単離結晶。
【請求項8】
アミノ酸配列ELDKWAS(SEQ ID No.1)を有するペプチドまたはその機能的類似体と複合体形成したモノクローナル抗体2F5のFab’フラグメントの単離結晶。
【請求項9】
図3に示されるような、Fab’フラグメントに対する該ペプチドの結合部位における構造を有する分子からなる請求項8の単離結晶。
【請求項10】
表2に定められるパラメータを有する分子からなる請求項8の単離結晶。
【請求項11】
格子定数a=58.0Å、b=65.0Åおよびc=175.6Åの単位格子をとり、空間群P212121を有する分子からなる請求項10の単離結晶。
【請求項12】
前記のアミノ酸配列ELDKWASの前記の機能性類似体は、リシンがアルギニンによって置換されたもの、ならびに、トリプトファンがチロシン、フェニルアラニンまたは荷電していないヒスチジンからなる群から選択されるアミノ酸によって置換されたものからなる群から選択される請求項8の単離結晶。
【請求項13】
前記のペプチドがELDKWASである請求項8の単離結晶。
【請求項14】
Fab’2F5:ELDKWAS複合体が表4の原子座標を有する請求項13の単離結晶。
【請求項15】
前記のペプチドがELDRWAS(SEQ ID No.2)である請求項8の単離結晶。
【請求項16】
前記のFab’2F5:ELDRWAS複合体が表5の原子座標を有する請求項15の単離結晶。
【請求項17】
Protein Data Bankに、Accession number 2F5Bとして登録されている原子座標を有する分子からなる請求項8の単離結晶。
【請求項18】
モノクローナル抗体2F5に結合し、図3に示されるペプチドELDKWAS(SEQ ID No.1)に対するものに、相当する三次元構造をもたらすように制御されている合成ペプチド。
【請求項19】
トリプトファンおよびリシンの側鎖が重なり合い、平行となる、前記の三次元構造の僅かに歪んだβターン配置に束縛される、アミノ酸配列DKWあるいはその機能的類似体を含む請求項18の合成ペプチド。
【請求項20】
前記のトリプトファンとリシンの、少なくとも一方のアミノ酸が、図3に示されるペプチド−タンパク質相互作用を維持するアミノ酸によって置換されている請求項19の合成ペプチド。
【請求項21】
前記のリシン残基がアルギニンによって置換されている請求項20の合成ペプチド。
【請求項22】
前記のトリプトファンが、チロシン、フェニルアラニンまたは荷電していないヒスチジンによって置換されている請求項20の合成ペプチド。
【請求項23】
前記のリシン残基がアルギニンによって置換され、かつ、前記のトリプトファンが、チロシン、フェニルアラニンまたは荷電していないヒスチジンによって置換されている請求項20の合成ペプチド。
【請求項24】
前記のペプチドが、前記のアミノ酸配列DKWまたはその機能的類似体を、図3に示されるアミノ酸残基の各々の配向に保持するジスルフィド架橋を含む請求項19の合成ペプチド。
【請求項25】
前記のペプチドは、アミノ酸配列ECDKWCS(SEQ ID No.3)を有し、またジスルフィド架橋が前記のシステイン(C)残基の間で設けられる請求項24の合成ペプチド。
【請求項26】
前記のペプチドが、前記のアミノ酸配列DKWまたはその機能的類似体を、図3に示されるアミノ酸残基の各々の配向に保持するラクタム結合を含む請求項19の合成ペプチド。
【請求項27】
前記のペプチドが、式EDapDKWES(SEQ ID No.5)を有し、かつ、前記のラクタム結合は、Dapとグルタミン酸(E)残基の間に形成されている請求項26の合成ペプチド。
【請求項28】
担体タンパク質と連結されている請求項18の合成ペプチド。
【請求項29】
モノクローナル抗体2F5に結合するペプチドの製造方法であって、
モノクローナル抗体2F5のFab’フラグメントとアミノ酸配列ELDKWAS(SEQ ID No.1)またはその機能性類似体とを共結晶化して、結晶性複合体を形成すること、
結晶性複合体を解析し、Fab’フラグメントに対して相対的に、結合ペプチドの三次元的配向を決定すること、および
決定された立体配向に束縛される、少なくともアミノ酸DKWまたはその機能的類似体を含むペプチドを合成すること
を含む方法。
【請求項30】
アミノ酸配列ELDKWASを有するペプチドの前記の機能性類似体は、アミノ酸配列ELDRWAS(SEQ ID No.2)を有する請求項29の方法。
【特許請求の範囲】
【請求項1】
モノクローナル抗体2F5に結合し、図3に示される、下記の表示:
【化4】

に示されるペプチドELDKWAS(SEQ ID No.1)に対するものに、相当する三次元構造をもたらすように制御されている
ことを特徴とする合成ペプチド。
【請求項2】
トリプトファンおよびリシンの側鎖が重なり合い、平行となる、前記の三次元構造の僅かに歪んだβターン配置に束縛される、アミノ酸配列DKWあるいはその機能的類似体を含む
ことを特徴とする請求項1に記載の合成ペプチド。
【請求項3】
前記のトリプトファンとリシンの、少なくとも一方のアミノ酸が、図3に示される、下記の表示:
【化5】

に示されるペプチド−タンパク質相互作用を維持するアミノ酸によって置換されている
ことを特徴とする請求項2に記載の合成ペプチド。
【請求項4】
前記のリシン残基がアルギニンによって置換されている
ことを特徴とする請求項3に記載の合成ペプチド。
【請求項5】
前記のトリプトファンが、チロシン、フェニルアラニンまたは荷電していないヒスチジンによって置換されている
ことを特徴とする請求項3または4に記載の合成ペプチド。
【請求項6】
前記のペプチドが、前記のアミノ酸配列DKWまたはその機能的類似体を、図3に示される、下記の表示:
【化6】

に示されるアミノ酸残基の各々の配向に保持するジスルフィド架橋を含む
ことを特徴とする請求項2〜5のいずれか1項に記載の合成ペプチド。
【請求項7】
前記のペプチドは、アミノ酸配列ECDKWCS(SEQ ID No.3)を有し、またジスルフィド架橋が前記のシステイン(C)残基の間で設けられる
ことを特徴とする請求項6に記載の合成ペプチド。
【請求項8】
前記のペプチドが、前記のアミノ酸配列DKWまたはその機能的類似体を、図3に示される、下記の表示:
【化7】

に示されるアミノ酸残基の各々の配向に保持するラクタム結合を含む
ことを特徴とする請求項2〜7のいずれか1項に記載の合成ペプチド。
【請求項9】
前記のペプチドが、式EDapDKWES(SEQ ID No.5)を有し、かつ、前記のラクタム結合は、Dapとグルタミン酸(E)残基の間に形成されている
ことを特徴とする請求項8に記載の合成ペプチド。
【請求項10】
担体タンパク質と連結されている
ことを特徴とする請求項1〜9のいずれか1項に記載の合成ペプチド。
【請求項11】
モノクローナル抗体2F5に結合する合成ペプチドの製造方法であって、
モノクローナル抗体2F5のFab’フラグメントとアミノ酸配列ELDKWAS(SEQ ID No.1)またはその機能性類似体とを共結晶化して、X線結晶構造解析に利用可能な結晶性複合体を形成する工程、
結晶性複合体を解析し、Fab’フラグメントに対して相対的に、結合ペプチドの三次元的配向を決定する工程、および
決定された立体配向に束縛される、少なくともアミノ酸DKWまたはその機能的類似体を含むペプチドを合成する工程
を含む
ことを特徴とする合成ペプチドの製造方法。
【請求項12】
アミノ酸配列ELDKWASを有するペプチドの前記の機能性類似体は、アミノ酸配列ELDRWAS(SEQ ID No.2)を有する
ことを特徴とする請求項11に記載の合成ペプチドの製造方法。
【請求項1】
モノクローナル抗体2F5のFab’フラグメントの単離結晶。
【請求項2】
図1によって表される三次元構造を有する分子からなる請求項1の単離結晶。
【請求項3】
表2中に定められるパラメータを有する分子からなる請求項1の単離結晶。
【請求項4】
格子定数a=63.6Å、b=76.4Åおよびc=93.4Åの単位格子をとり、空間群P212121を有する分子からなる請求項3の単離結晶。
【請求項5】
図4に示される三次元構造を有し、表1に示す、H鎖98番目〜H鎖120番目のアミノ酸残基を含む、重鎖の第3超可変(V3)ループを有する分子からなる請求項1の単離結晶。
【請求項6】
前記のV3ループが、表3中に示される原子座標を有する分子からなる請求項5の単離結晶。
【請求項7】
Protein Data Bankに、Accession number 2F5Aとして登録されている原子座標を有する分子からなる請求項1の単離結晶。
【請求項8】
アミノ酸配列ELDKWAS(SEQ ID No.1)を有するペプチドまたはその機能的類似体と複合体形成したモノクローナル抗体2F5のFab’フラグメントの単離結晶。
【請求項9】
図3に示されるような、Fab’フラグメントに対する該ペプチドの結合部位における構造を有する分子からなる請求項8の単離結晶。
【請求項10】
表2に定められるパラメータを有する分子からなる請求項8の単離結晶。
【請求項11】
格子定数a=58.0Å、b=65.0Åおよびc=175.6Åの単位格子をとり、空間群P212121を有する分子からなる請求項10の単離結晶。
【請求項12】
前記のアミノ酸配列ELDKWASの前記の機能性類似体は、リシンがアルギニンによって置換されたもの、ならびに、トリプトファンがチロシン、フェニルアラニンまたは荷電していないヒスチジンからなる群から選択されるアミノ酸によって置換されたものからなる群から選択される請求項8の単離結晶。
【請求項13】
前記のペプチドがELDKWASである請求項8の単離結晶。
【請求項14】
Fab’2F5:ELDKWAS複合体が表4の原子座標を有する請求項13の単離結晶。
【請求項15】
前記のペプチドがELDRWAS(SEQ ID No.2)である請求項8の単離結晶。
【請求項16】
前記のFab’2F5:ELDRWAS複合体が表5の原子座標を有する請求項15の単離結晶。
【請求項17】
Protein Data Bankに、Accession number 2F5Bとして登録されている原子座標を有する分子からなる請求項8の単離結晶。
【請求項18】
モノクローナル抗体2F5に結合し、図3に示されるペプチドELDKWAS(SEQ ID No.1)に対するものに、相当する三次元構造をもたらすように制御されている合成ペプチド。
【請求項19】
トリプトファンおよびリシンの側鎖が重なり合い、平行となる、前記の三次元構造の僅かに歪んだβターン配置に束縛される、アミノ酸配列DKWあるいはその機能的類似体を含む請求項18の合成ペプチド。
【請求項20】
前記のトリプトファンとリシンの、少なくとも一方のアミノ酸が、図3に示されるペプチド−タンパク質相互作用を維持するアミノ酸によって置換されている請求項19の合成ペプチド。
【請求項21】
前記のリシン残基がアルギニンによって置換されている請求項20の合成ペプチド。
【請求項22】
前記のトリプトファンが、チロシン、フェニルアラニンまたは荷電していないヒスチジンによって置換されている請求項20の合成ペプチド。
【請求項23】
前記のリシン残基がアルギニンによって置換され、かつ、前記のトリプトファンが、チロシン、フェニルアラニンまたは荷電していないヒスチジンによって置換されている請求項20の合成ペプチド。
【請求項24】
前記のペプチドが、前記のアミノ酸配列DKWまたはその機能的類似体を、図3に示されるアミノ酸残基の各々の配向に保持するジスルフィド架橋を含む請求項19の合成ペプチド。
【請求項25】
前記のペプチドは、アミノ酸配列ECDKWCS(SEQ ID No.3)を有し、またジスルフィド架橋が前記のシステイン(C)残基の間で設けられる請求項24の合成ペプチド。
【請求項26】
前記のペプチドが、前記のアミノ酸配列DKWまたはその機能的類似体を、図3に示されるアミノ酸残基の各々の配向に保持するラクタム結合を含む請求項19の合成ペプチド。
【請求項27】
前記のペプチドが、式EDapDKWES(SEQ ID No.5)を有し、かつ、前記のラクタム結合は、Dapとグルタミン酸(E)残基の間に形成されている請求項26の合成ペプチド。
【請求項28】
担体タンパク質と連結されている請求項18の合成ペプチド。
【請求項29】
モノクローナル抗体2F5に結合するペプチドの製造方法であって、
モノクローナル抗体2F5のFab’フラグメントとアミノ酸配列ELDKWAS(SEQ ID No.1)またはその機能性類似体とを共結晶化して、結晶性複合体を形成すること、
結晶性複合体を解析し、Fab’フラグメントに対して相対的に、結合ペプチドの三次元的配向を決定すること、および
決定された立体配向に束縛される、少なくともアミノ酸DKWまたはその機能的類似体を含むペプチドを合成すること
を含む方法。
【請求項30】
アミノ酸配列ELDKWASを有するペプチドの前記の機能性類似体は、アミノ酸配列ELDRWAS(SEQ ID No.2)を有する請求項29の方法。
【特許請求の範囲】
【請求項1】
モノクローナル抗体2F5に結合し、図3に示される、下記の表示:
【化4】

に示されるペプチドELDKWAS(SEQ ID No.1)に対するものに、相当する三次元構造をもたらすように制御されている
ことを特徴とする合成ペプチド。
【請求項2】
トリプトファンおよびリシンの側鎖が重なり合い、平行となる、前記の三次元構造の僅かに歪んだβターン配置に束縛される、アミノ酸配列DKWあるいはその機能的類似体を含む
ことを特徴とする請求項1に記載の合成ペプチド。
【請求項3】
前記のトリプトファンとリシンの、少なくとも一方のアミノ酸が、図3に示される、下記の表示:
【化5】

に示されるペプチド−タンパク質相互作用を維持するアミノ酸によって置換されている
ことを特徴とする請求項2に記載の合成ペプチド。
【請求項4】
前記のリシン残基がアルギニンによって置換されている
ことを特徴とする請求項3に記載の合成ペプチド。
【請求項5】
前記のトリプトファンが、チロシン、フェニルアラニンまたは荷電していないヒスチジンによって置換されている
ことを特徴とする請求項3または4に記載の合成ペプチド。
【請求項6】
前記のペプチドが、前記のアミノ酸配列DKWまたはその機能的類似体を、図3に示される、下記の表示:
【化6】

に示されるアミノ酸残基の各々の配向に保持するジスルフィド架橋を含む
ことを特徴とする請求項2〜5のいずれか1項に記載の合成ペプチド。
【請求項7】
前記のペプチドは、アミノ酸配列ECDKWCS(SEQ ID No.3)を有し、またジスルフィド架橋が前記のシステイン(C)残基の間で設けられる
ことを特徴とする請求項6に記載の合成ペプチド。
【請求項8】
前記のペプチドが、前記のアミノ酸配列DKWまたはその機能的類似体を、図3に示される、下記の表示:
【化7】

に示されるアミノ酸残基の各々の配向に保持するラクタム結合を含む
ことを特徴とする請求項2〜7のいずれか1項に記載の合成ペプチド。
【請求項9】
前記のペプチドが、式EDapDKWES(SEQ ID No.5)を有し、かつ、前記のラクタム結合は、Dapとグルタミン酸(E)残基の間に形成されている
ことを特徴とする請求項8に記載の合成ペプチド。
【請求項10】
担体タンパク質と連結されている
ことを特徴とする請求項1〜9のいずれか1項に記載の合成ペプチド。
【請求項11】
モノクローナル抗体2F5に結合する合成ペプチドの製造方法であって、
モノクローナル抗体2F5のFab’フラグメントとアミノ酸配列ELDKWAS(SEQ ID No.1)またはその機能性類似体とを共結晶化して、X線結晶構造解析に利用可能な結晶性複合体を形成する工程、
結晶性複合体を解析し、Fab’フラグメントに対して相対的に、結合ペプチドの三次元的配向を決定する工程、および
決定された立体配向に束縛される、少なくともアミノ酸DKWまたはその機能的類似体を含むペプチドを合成する工程
を含む
ことを特徴とする合成ペプチドの製造方法。
【請求項12】
アミノ酸配列ELDKWASを有するペプチドの前記の機能性類似体は、アミノ酸配列ELDRWAS(SEQ ID No.2)を有する
ことを特徴とする請求項11に記載の合成ペプチドの製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2006−328047(P2006−328047A)
【公開日】平成18年12月7日(2006.12.7)
【国際特許分類】
【出願番号】特願2006−104287(P2006−104287)
【出願日】平成18年4月5日(2006.4.5)
【分割の表示】特願2000−611559(P2000−611559)の分割
【原出願日】平成12年4月5日(2000.4.5)
【出願人】(501401504)ユニバーシティー オブ トロント (1)
【氏名又は名称原語表記】UNIVERSITY OF TORONTO
【出願人】(500096994)サノフィ パスツ−ル リミテッド (12)
【氏名又は名称原語表記】SANOFI PASTEUR LIMITED
【Fターム(参考)】
【公開日】平成18年12月7日(2006.12.7)
【国際特許分類】
【出願日】平成18年4月5日(2006.4.5)
【分割の表示】特願2000−611559(P2000−611559)の分割
【原出願日】平成12年4月5日(2000.4.5)
【出願人】(501401504)ユニバーシティー オブ トロント (1)
【氏名又は名称原語表記】UNIVERSITY OF TORONTO
【出願人】(500096994)サノフィ パスツ−ル リミテッド (12)
【氏名又は名称原語表記】SANOFI PASTEUR LIMITED
【Fターム(参考)】
[ Back to top ]

