HLA−A24拘束性抗原ペプチドおよびその用途
【課題】 HLA−A24拘束性抗原ペプチドの提供。
【解決手段】 CML66由来のペプチドであって、WYQDSVYYIまたはYYIDTLGRIのアミノ酸配列からなるHLA−A24拘束性抗原ペプチドである。前記抗原ペプチドにより活性化されるCML66特異的CD8+T細胞は、細胞上のHLA−A24分子と結合した前記抗原ペプチドを認識し、細胞傷害性を示すため、CML66を発現する悪性腫瘍細胞を攻撃できる。前記ペプチドは、細胞免疫療法、ワクチン療法等の悪性腫瘍に対する医療分野に有用である。
【解決手段】 CML66由来のペプチドであって、WYQDSVYYIまたはYYIDTLGRIのアミノ酸配列からなるHLA−A24拘束性抗原ペプチドである。前記抗原ペプチドにより活性化されるCML66特異的CD8+T細胞は、細胞上のHLA−A24分子と結合した前記抗原ペプチドを認識し、細胞傷害性を示すため、CML66を発現する悪性腫瘍細胞を攻撃できる。前記ペプチドは、細胞免疫療法、ワクチン療法等の悪性腫瘍に対する医療分野に有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、HLA−A24拘束性抗原ペプチドおよびその用途に関する。
【背景技術】
【0002】
癌細胞を排除する機能を有する細胞傷害性T細胞(cytotoxic T lymphocyte;CTL)は、癌細胞表面に発現しているHLAクラスI分子と癌特異的タンパク質由来ペプチドとの複合体を認識して、癌細胞を消滅させる。近年、このメカニズムを利用して、細胞傷害性T細胞が認識する標的ペプチドを同定し、これを抗原ペプチドとして人為的に宿主に与え、特異的な抗腫瘍免疫を誘導する方法が、研究されている。そして、そのメカニズムから、前記抗原ペプチドは、癌ワクチンとも呼ばれている。これまでに、いくつかの癌細胞に特異的な抗原ペプチドの同定が行われ、癌ワクチンの応用が試みられているが、効果が十分ではないため、新たな抗原ペプチドの同定が求められている。
【0003】
CML66は、583アミノ酸からなる分子量66kDのタンパク質であり、移植片対白血病作用(Graft−versus−Leukemia effect:GVL)と関連する白血病関連抗原であることが報告されている。そして、さらなる解析によって、(1)coding遺伝子が、第8番染色体長腕(8q23)に位置していること、(2)タンパク質の機能が依然として不明であること、(3)慢性骨髄性白血病(CML)患者由来の細胞や前立腺がん患者由来の細胞、さらに、ヒト白血病やメラノーマ、肺がん等の患者由来の株化細胞において、CML66タンパク質およびCML66 mRNAの過剰発現が認められるが、正常組織では、HLA分子が発現しない精巣細胞で産生される以外では、わずかに心臓で発現が確認されるのみであること、(4)正常でも2つのsplicing isoform(CML66−L、CML66−S)が見られ、554アミノ酸からなる短縮型isoformであるCML66−Sは、主に精巣細胞で発現し、さらに、担がん患者血清中のCML66特異抗体は、CML66−Lに対するものがほとんどであること等が明らかとなっている(非特許文献1〜3)。
【非特許文献1】Yang X.F. et al. Proc. Natl. Acad. Sci. USA 98: 7492-7497, 2001.
【非特許文献2】Wu C.J. et al. Clin. Cancer Res. 11: 4504-4511, 2005.
【非特許文献3】Yan Y. et al. J. Immunol. 172: 651-660, 2004.
【発明の開示】
【発明が解決しようとする課題】
【0004】
前述の情報は、CML66が、腫瘍細胞の特性に関与しているか否かは不明であるものの、いわゆる、分化抗原としてのがん関連抗原(癌細胞特異的抗原)として、様々な癌に対する免疫療法の標的抗原となり得ることを示していると考えられる。
【0005】
そこで、本発明は、CML66由来のペプチドであって、癌ワクチンとして使用可能な新たな抗原ペプチドの提供を目的とする。
【課題を解決するための手段】
【0006】
前記目的を達成するために、本発明のペプチドは、下記(1)〜(4)のいずれかに記載のペプチドである。
(1)配列番号1のアミノ酸配列からなるペプチド
WYQDSVYYI (配列番号1)
(2)配列番号2のアミノ酸配列からなるペプチド
YYIDTLGRI (配列番号2)
(3)前記(1)または(2)のペプチドとのアミノ酸配列の相同性が80%以上であるペプチドであって、HLA−A24分子と結合することでCD8+T細胞に特異的に認識されうるHLA−A24拘束性抗原ペプチド
(4)前記(1)または(2)のペプチドのアミノ酸配列において、1個または数個のアミノ酸が、欠失、置換もしくは付加されたアミノ酸配列からなるペプチドであって、HLA−A24分子と結合することでCD8+T細胞に特異的に認識されうるHLA−A24拘束性抗原ペプチド。
【0007】
本発明の活性化誘導剤は、CD8+T細胞の細胞傷害性の活性化を誘導する活性化誘導剤であって、以下の第1および第2の活性化誘導剤がある。第1の活性化誘導剤は、前記本発明のペプチドまたはその誘導体を含む活性化誘導剤であり、第2の活性化誘導剤は、前記本発明のペプチドまたはその誘導体をコードするポリヌクレオチドを含む活性化誘導剤である。
【0008】
本発明のCD8+細胞傷害性T細胞の製造方法は、下記工程(A)および(B)を含むことを特徴とする。
(A) 患者のリンパ球を準備する工程
(B) 前記リンパ球と、前記本発明のペプチドまたはその誘導体とをインキュベーションする工程
【0009】
本発明の抗原提示細胞の製造方法は、下記工程(a)および(b)を含むことを特徴とする。
(a) 患者の樹状細胞を準備する工程
(b) 前記樹状細胞と、本発明のペプチドまたはその誘導体とをインキュベーションする工程
【0010】
本発明の医薬組成物は、癌免疫療法に用いる医薬組成物である。本発明の第1の医薬組成物は、抗原ペプチドとして、本発明のペプチドまたはその誘導体を含む。本発明の第2の医薬組成物は、本発明のペプチドまたはその誘導体をコードするポリヌクレオチドを含む。本発明の第3の医薬組成物は、本発明の細胞傷害性T細胞の製造方法により製造されたCD8+細胞傷害性T細胞を含む。また、本発明の第4の医薬組成物は、本発明の抗原提示細胞の製造方法により製造された抗原提示細胞を含む。
【発明の効果】
【0011】
一般的に、抗原ペプチドは、T細胞受容体(TCR)に認識される際、特定のHLAクラスI分子(ヒト組織適合性抗原;ヒト白血球抗原)に結合することにより、初めてTCRに認識される。このため、日本人の約60%が占めているHLA−A24分子のような、頻度が高いHLAクラスI分子に対して結合可能なペプチドであれば、その汎用性を担保できると考えられる。そこで、本発明者らは、鋭意研究の結果、HLA−A24と結合するCML66由来のペプチドを同定し、本発明に到った。本発明のペプチドは、CD8+T細胞に認識され得る、CML66特異的HLA−A24拘束性抗原ペプチドである。
【0012】
本発明のペプチドによれば、CML66特異的CD8+T細胞の活性化・増殖を促進できる。この活性化により、CML66特異的CD8+T細胞は、細胞傷害活性を有する細胞傷害性T細胞となるため、悪性腫瘍の破壊による効果的な治療が可能となる。このため、本発明のペプチドは、例えば、癌ワクチン(悪性腫瘍ワクチン)等として使用でき、白血病を含む悪性腫瘍に対するワクチン療法に有用である。
【0013】
また、本発明のペプチドをリンパ球と共培養することで、CML66特異的CD8+細胞傷害性T細胞を製造できる。このようにして製造した細胞傷害性T細胞を、例えば、患者の体内に戻すことによって、例えば、白血病を含む悪性腫瘍に対する細胞免疫療法が可能となる。
【0014】
また、本発明のペプチドを樹状細胞と共培養することで、本発明のペプチドを抗原提示する抗原提示細胞を製造できる。樹状細胞は、主要組織適合抗原(MHC)や共刺激分子を共発現し、抗原未感作のナイーブT細胞をも刺激できる、極めて強力な抗原提示細胞である。このため、本発明の抗原提示細胞によれば、CML66特異的CD8+T細胞を効果的に活性化して、細胞傷害性T細胞を誘導できる。したがって、このような抗原提示細胞を、例えば、患者の体内に戻すことによって、例えば、白血病等の悪性腫瘍に対して、より効果的な細胞免疫療法が可能となる。
【発明を実施するための最良の形態】
【0015】
ペプチドおよびその用途
(1)ペプチド
本発明のペプチドは、HLA−A24分子上に結合してCD8+T細胞により特異的に認識されうるCML66の抗原ペプチドである。HLA−A24分子のHLA遺伝子型は、A*2402であることが好ましい。
【0016】
本発明において、「抗原ペプチド」とは、抗原決定基(エピトープ)を構成するペプチドをいう。前記抗原ペプチドは、抗原決定基の最小単位である必要はなく、例えば、8〜26個、9〜24個、10〜22個又は11〜20個の範囲のアミノ酸により構成されるペプチドがあげられる。
【0017】
本発明において、「HLA−A24分子上に結合してCD8+T細胞により特異的に認識される」とは、例えば、あるペプチドが、樹状細胞等の抗原提示細胞表面のHLA−A24分子上に提示された場合、適切な補助刺激因子(共刺激因子)とともに、ペプチド抗原特異的にCD8+T細胞を活性化しうること等をいう。
【0018】
本発明のペプチドとHLA−A24分子との結合は、例えば、細胞内部で発現されたペプチド、もしくは、貪食作用により細胞内部に取り込まれたペプチドが、細胞内でHLA−A24分子と結合する場合でもよい。また、既に細胞表面に存在するHLA−A24分子に、細胞外に存在するペプチドが直接結合する場合であってもよい。
【0019】
本発明において、HLAクラスI分子とは、ヒトのMHCクラスI分子に対応する分子であり、HLA−A24型とは、HLAクラスI分子のアロ抗原型がA24型であること、すなわち、HLA−A24遺伝子の遺伝子産物であることをいい、HLA−A*2402型とは、HLA−A24遺伝子の対立遺伝子の遺伝子型がA*2402であることをいう。
【0020】
本発明のペプチドは、配列番号1または配列番号2に記載のアミノ酸配列からなるペプチドを含む。CML66タンパク質(例えば、NCBIアクセッション番号AAK73017)において、配列番号1のアミノ酸配列(WYQDSVYYI)は、70番目〜78番目のアミノ酸配列に相当し、配列番号2のアミノ酸配列(YYIDTLGRI)は、76番目〜84番目のアミノ酸配列に相当する。以下、配列番号1のアミノ酸配列からなるペプチドを、「CML6670−78」ともいい、配列番号2のアミノ酸配列からなるペプチドを、「CML6676−84」ともいう。
【0021】
また、本発明のペプチドは、配列番号1または配列番号2に記載のアミノ酸配列からなるペプチドと相同なペプチドを含む。ここで、アミノ酸配列が「相同」であるとは、その機能を維持できるほど十分に類似していることをいう。また、一般的に、2つ以上のアミノ酸配列において、例えば、80%以上、84%以上、88%以上、92%以上、96%以上の同一性又は類似性を示す場合、これらは相同であるといえる。前記同一性および類似性は、2以上の塩基配列又はアミノ酸配列間で、これらの配列を比較して決定される関係をいう。同一性が、アライメントされた場合の同一残基の割合を示すのに対し、類似性は、同一残基に加え、同類置換された残基も含む。同一性および類似性は、従来公知の様々なコンピュータープログラムにより、容易に決定できる。本発明のペプチドにおいて、「機能」とは、HLA−A24分子と結合することでCD8+T細胞にペプチド抗原特異的に認識されうることを意味する。
【0022】
また、本発明のペプチドは、配列番号1または配列番号2に記載のアミノ酸配列において、1個または数個のアミノ酸が、欠失、置換もしくは付加されたアミノ酸配列からなるペプチドであって、前記機能を有するものも含む。相違するアミノ酸の残基数としては、例えば、1〜6個、1〜5個、1〜4個、1〜3個、1〜2個又は1個である。
【0023】
本発明のペプチドは、例えば、天然のCML66由来のペプチドのような天然物でもよいし、化学合成ペプチドや、遺伝子工学により製造されたペプチドであってもよい。化学合成や遺伝子工学による製造の手法は、特に制限されず、従来公知の方法が採用できる。遺伝子工学を利用する場合、例えば、本発明のペプチドをコードするポリヌクレオチドや、前記ポリヌクレオチドを挿入した発現ベクターを、例えば、大腸菌、酵母、昆虫細胞等の適当な宿主に導入し、生物学的に製造してもよい。
【0024】
本発明のペプチドは、前述のような癌ワクチンとして使用できるたけでなく、例えば、CML66特異的細胞傷害性T細胞を患者体外で増殖させた後、体内に移入(例えば、点滴投与等)する養子免疫療法(受動免疫療法)等に使用することができる。また、この他にも、例えば、体内に存在するCML66特異的細胞傷害性T細胞を、高感度かつ迅速に検出できるペプチド・HLAテトラマー診断法にも応用可能である。
【0025】
(2)第1の活性化誘導剤
本発明の第1の活性化誘導剤は、前述のように、CD8+T細胞の細胞傷害性の活性化を誘導する活性化誘導剤であって、本発明のペプチドおよびその誘導体の少なくとも一方を含むことを特徴とする。本発明の第1の活性化誘導剤を、例えば、目的の細胞や組織、その周辺に投与することによって、CML66特異的CD8+T細胞の活性化・増殖を促進できる。そして、この活性化により、CML66特異的CD8+T細胞を、細胞傷害活性を有する細胞傷害性T細胞とすることができる。
【0026】
本発明の第1の活性化誘導剤は、例えば、本発明のペプチドおよび誘導体のいずれか一方を含むのみでもよいし、両方を含んでもよい。また、本発明のペプチドおよび誘導体は、一種類でもよいし、二種類以上を含んでいてもよい。本発明の第1の活性化誘導剤は、例えば、本発明のペプチドまたは誘導体のみでもよいし、この他に、さらに、各種添加剤を含んでもよい。なお、具体的な使用方法等については、例えば、後述する第1の医薬組成物と同様である。
【0027】
(3)第1の医薬組成物
本発明の第1の医薬組成物は、前述のように、癌免疫療法に用いる医薬組成物であって、本発明のペプチドおよびその誘導体の少なくとも一方を含むことを特徴とする。本発明の第1の医薬組成物は、例えば、前述の第1の活性化誘導剤と同様に、本発明のペプチドまたは誘導体のみでもよいし、この他に、さらに、薬学的に許容できるアジュバンド、キャリア又は賦形剤等の添加剤を含んでもよい。また、本発明のペプチドの誘導体としては、特に制限されず、例えば、従来公知の修飾方法により修飾されたもの、例えば、塩、糖鎖修飾されたもの、脂質修飾されたもの等が含まれる。以下、「本発明のペプチド」とは、本発明のペプチドの誘導体を含む。
【0028】
本発明の第1の医薬組成物は、例えば、ワクチンとして患者に有効量を投与することで、癌(例えば、悪性腫瘍)のワクチン療法に使用できる。前記ワクチンが投与されると、例えば、患者の体内において、本発明のペプチドが樹状細胞等の抗原提示細胞に取り込まれ、HLAクラスI分子に結合して前記抗原提示細胞上に抗原提示される。そして、発現している共刺激分子とともに、CML66特異的CD8+T細胞を刺激、誘導(活性化)する。活性化により細胞傷害性活性を持ったCML66特異的CD8+細胞傷害性T細胞は、前記患者の体内で、CML66を発現する悪性腫瘍細胞を破壊する。これにより、悪性腫瘍の治療が可能になる。なお、HLA−A24のHLA遺伝子頻度は、日本人で約60%を占めるといわれている。したがって、このように高い頻度のHLA−A24に結合できる点からも、本発明のペプチドを含む医薬組成物は、臨床的有用性が極めて高いといえる。
【0029】
本発明の第1の医薬組成物の調製方法は、例えば、従来公知のワクチンの調製方法を使用できる。前記ワクチンは、例えば、注射剤として使用する溶液や懸濁液として、本発明のペプチドと、薬学的に許容できる賦形剤とから調製してもよい。また、前記ワクチンを、固体に調製してもよい。前記賦形剤としては、例えば、水、塩水、デキストロース、グリセロール、エタノール等及びそれらの組み合わせである。また必要に応じて、ワクチンは、少量の補助物質、例えば、湿潤剤又は乳化剤、pH緩衝剤、又はワクチンの有効性を高めるアジュバントを含んでいてもよい。前記アジュバントとしては、特に制限されず、従来公知のものを使用でき、その中でも、患者の体内で、樹状細胞等の抗原提示細胞による本発明のペプチドの取込みを促進するものが好ましい。また、本発明のペプチドは、中性または薬学的に許容できる塩として、ワクチンに製剤化されてもよい。
【0030】
ワクチンの投与方法は、制限されないが、例えば、表皮下、真皮内、真皮下又は筋肉内等への注射によって非経口的に投与される。他の投与方法に適した製剤として、例えば、坐剤や、経口、口腔内、舌下、腹腔内、鞘膜内、肛門及び頭蓋内製剤がある。ワクチンは、患者及び剤形に合わせて、治療に有効な量を投与することが好ましい。
【0031】
本発明において、治療対象となる悪性腫瘍は、制限されない。具体例としては、例えば、CML66を発現する悪性腫瘍があげられ、例えば、各種白血病や各種固形腫瘍等である。前記白血病としては、例えば、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、急性リンパ性白血病(ALL)等があげられ、前記固形腫瘍としては、例えば、肺、前立腺癌、並びに黒色腫等が挙げられるが、これらに限定されない。
【0032】
ポリヌクレオチドおよびベクターならびにその用途
(1)ポリヌクレオチド
本発明のポリヌクレオチドは、本発明のペプチドをコードするポリヌクレオチドである。本発明のポリヌクレオチドを、例えば、目的の細胞に導入し、前記細胞内で本発明のペプチドを発現させれば、CML66特異的CD8+T細胞の活性化・増殖を促進できる。この活性化により、CML66特異的CD8+T細胞は、細胞傷害活性を有する細胞傷害性T細胞とすることができる。
【0033】
前記ポリヌクレオチドとしては、例えば、以下に示す塩基配列またはその相補配列からなるポリヌクレオチドがあげられる。配列番号5に示す塩基配列からなるポリヌクレオチドは、配列番号1のアミノ酸配列からなる本発明のペプチドCML6670−78をコードするポリヌクレオチドの一例である。また、配列番号6に示す塩基配列からなるポリヌクレオチドは、配列番号2のアミノ酸配列からなる本発明のペプチドCML6676−84をコードするポリヌクレオチドの一例である。本発明のポリヌクレオチドは、一本鎖ポリヌクレオチドでも二本鎖ポリヌクレオチドでもよい。
CML6670−78 5’−tggtatcaagacagtgtctactatatt−3’ (配列番号5)
CML6676−84 5’−tactatattgatacccttggaagaatt−3’ (配列番号6)
【0034】
さらに、本発明のポリヌクレオチドは、配列番号1または配列番号2のアミノ酸配列をコードする塩基配列と相同な塩基配列、または、その相補的な塩基配列からなるポリヌクレオチドを含む。ポリヌクレオチドの塩基配列が「相同」であるとは、前記ポリヌクレオチドがコードするペプチドが、本発明のペプチドとしての機能を維持できるほど十分に類似していることをいう。例えば、塩基配列に、点変異、欠失又は付加による相違があるとしても、これらが前記遺伝子の機能に影響を与えないならば、両者は相同であるといえる。相違する塩基数としては、例えば、1〜20個、1〜15個、1〜10個、1〜5個、1〜3個、1〜2個又は1個である。また、2つ以上の配列において、例えば、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%もしくは約99%の同一性を示す場合、これらは相同であるといえる。また、2つのポリヌクレオチドの一方が、他方の相補配列からなるポリヌクレオチドと、ストリンジェントな条件でハイブリダイズする場合には、両者は相同といえる。前記ストリンジェントな条件としては、特に限定されないが、例えば、6×SSC、0.5%SDS、5×デンハルト、0.01%変性サケ精子核酸を含む溶液中、「Tm−25℃」の温度で一晩保温する条件等があげられる。前記Tmは、例えば、下記式により求められる。下記式中、Nはポリヌクレオチドプローブの鎖長であり、%G+Cはポリヌクレオチドプローブプライマー中のグアニン及びシトシン残基の含有量である。
Tm=81.5−16.6(log10[Na+])+0.41(%G+C)−(600/N)
【0035】
本発明のポリヌクレオチドの製造方法は、特に制限されず、例えば、化学合成により製造してもよく、または、公知のCML66遺伝子に基づき設計したプライマーを使用して、各種遺伝子増幅法により製造し、または、適当なベクターにクローニングしてもよい。
【0036】
(2)ベクター
本発明のベクターは、前記本発明のポリヌクレオチドを含むベクターである。本発明のベクターを、例えば、目的の細胞に導入し、前記細胞内で本発明のペプチドを発現させれば、CML66特異的CD8+T細胞の活性化・増殖を促進できる。この活性化により、CML66特異的CD8+T細胞は、細胞傷害活性を有する細胞傷害性T細胞とすることができる。
【0037】
本発明のベクターは、本発明のポリヌクレオチドを含むベクターである。本発明のベクターは、発現ベクターであることが好ましく、本発明のポリヌクレオチドが、本発明のベクターが導入される宿主細胞内で発現可能なように連結されていることが好ましい。本発明のベクターの種類は、特に制限されず、例えば、ウイルスベクターであってよく、非ウイルスベクターであってもよい。前記ウイルスベクターとしては、例えば、レトロウィルスベクター、免疫不全症ウイルス(HIV)等のレンチウィルスベクター、アデノウィルスベクター、アデノ随伴ベクター(AAVベクター;adeno associated virus)、ヘルペスウイルス、ワクシニアウイルス、ポックスウイルス、ポリオウイルス、シンビスウイルス、センダイウイルス、SV40等のDNAウイルスやRNAウイルスがあげられる。非ウイルスベクターとしては、例えば、pcDNA3.1(Invitrogen社)、pZeoSV(Invitrogen社)、pBK−CMV(Stratagene社)、pCAGGS(Gene108,193−200(1991))等の発現ベクターが例示できる。通常、これらのベクターのプロモーターの下流に、発現可能なように前記ポリヌクレオチドを挿入すればよい。
【0038】
(3)第2の活性化誘導剤
本発明の第2の活性化誘導剤は、前述のように、CD8+T細胞の細胞傷害性の活性化を誘導する活性化誘導剤であって、本発明のポリヌクレオチドおよびベクターの少なくとも一方を含むことを特徴とする。本発明の第2の活性化誘導剤を、例えば、目的の細胞に導入して、本発明のポリペプチドや誘導体を発現させることによって、CML66特異的CD8+T細胞の活性化・増殖を促進できる。そして、この活性化により、CML66特異的CD8+T細胞を、細胞傷害活性を有する細胞傷害性T細胞とすることができる。
【0039】
本発明の第2の活性化誘導剤は、例えば、本発明のポリヌクレオチドおよびベクターのいずれか一方を含むのみでもよいし、両方を含んでもよい。また、本発明のポリヌクレオチドおよびベクターは、一種類でもよいし、二種類以上を含んでもよい。本発明の第2の活性化誘導剤は、例えば、本発明のポリヌクレオチドまたはベクターのみでもよいし、この他に、さらに、各種添加剤を含んでもよい。なお、具体的な使用方法等については、例えば、後述する第2の医薬組成物と同様にすることができる。
【0040】
(4)第2の医薬組成物
本発明の第2の医薬組成物は、癌免疫療法に用いる医薬組成物であって、本発明のポリヌクレオチドおよびベクターの少なくとも一方を含むことを特徴とする。第2の医薬組成物は、例えば、患者の体内、好ましくは、皮下組織、リンパ節内、筋肉細胞内に接種し、本発明のペプチドを発現させることで、CML66特異的免疫反応を誘導するDNA(RNA)ワクチン療法に使用できる。第2の医薬組成物の細胞への導入方法は、特に制限されず、ポリヌクレオチドやベクターの種類に応じて適宜決定できる。具体例としては、例えば、ウイルスベクターを利用する方法、リポフェクション法、エレクトロポレーション法、マイクロインジェクション法、細胞融合法、DEAEデキストラン法、リン酸カルシウム法等があげられる。
【0041】
ワクチンとしての調製方法は、特に制限されず、前述の本発明のペプチドを含むワクチン(第1の医薬組成物)と同様に調製できる。また、本発明の第2の医薬組成物において、本発明のポリヌクレオチドは、導入される細胞内で本発明のペプチドを発現できる形態であればよい。この場合、第2の医薬組成物は、例えば、ベクターに連結されていない本発明のポリヌクレオチドを、導入剤とともに含んでもよい。前記導入剤としては、特に制限されないが、例えば、リポソーム等の、非ベクター系遺伝子導入方法に使用されるものがあげられる。また、本発明のポリヌクレオチドを含む第2の医薬組成物を、例えば、パーティクルガン等を用いた直接注入法により、接種することもできる。
【0042】
CD8+細胞傷害性T細胞の製造方法およびその用途
(1)CD8+細胞傷害性T細胞の製造方法
本発明のCD8+細胞傷害性T細胞の製造方法は、前述のように、CD8+細胞傷害性T細胞の製造方法であって、下記工程(A)および(B)を含むことを特徴とする。
(A) 患者のリンパ球を準備する工程
(B) 前記リンパ球と、本発明のペプチドおよびその誘導体の少なくとも一方とをインキュベーションする工程
【0043】
前記工程(B)においては、例えば、前記リンパ球と、本発明のペプチドを提示する抗原提示細胞とをインキュベーションすることが好ましい。前記抗原提示細胞の調製方法は、特に制限されない。具体例としては、前記工程(B)において、例えば、前記リンパ球と、樹状細胞と、本発明のペプチドとをインキュベーションすることによって、抗原提示細胞を調製できる。前記樹状細胞は、例えば、本発明のペプチドをパルスされることによって、本発明のペプチドを提示する抗原提示細胞となる。そして、この抗原提示細胞が、前記リンパ球の増殖および活性化を誘導するため、細胞傷害活性を有するCD8+細胞傷害性T細胞が得られる。
【0044】
前記リンパ球は、通常、患者の血液から採取される。前記抗原提示細胞としては、例えば、リンパ球を採取した患者から採取したものが使用できる。この他にも、例えば、自己、同種同系、および、HLAクラスIについて前記患者と一致する同種異系の抗原提示細胞が使用できる。前記抗原提示細胞としては、本発明のペプチドをCD8+T細胞に対して提示し、これを増殖刺激して活性化し得るHLA−A24分子および補助刺激分子(共刺激分子)を発現するものが好ましく、例えば、樹状細胞があげられる。抗原提示細胞は、例えば、リンパ球を採取した患者から採取または調製することが好ましい。
【0045】
本発明の製造方法により製造されるCML66特異的CD8+細胞傷害性T細胞は、例えば、白血病細胞を含む悪性腫瘍細胞に対してHLA−A24拘束性の細胞傷害性を示すという特徴的機能を有する。このため、CML66特異的CD8+細胞傷害性T細胞は、例えば、前記HLA−A24陽性患者の体内で、CML66を発現する悪性腫瘍細胞を破壊する。
【0046】
(2)第3の医薬組成物
本発明の第3の医薬組成物は、本発明のCD8+傷害性T細胞の製造方法により製造されたCML66特異的CD8+細胞傷害性T細胞を含む。この医薬組成物を、例えば、患者に有効量投与することで、悪性腫瘍を治療する細胞免疫療法が可能となる。
【0047】
抗原提示細胞の製造方法およびその用途
(1)抗原提示細胞の製造方法
本発明の抗原提示細胞の製造方法は、前述のように、下記工程(a)および(b)を含むことを特徴とする。
(a) 患者の樹状細胞を準備する工程
(b) 前記樹状細胞と、本発明のペプチドおよびその誘導体の少なくとも一方とをインキュベーションする工程
【0048】
前記(a)工程において、樹状細胞は、例えば、患者血液に存在する細胞でもよいし、人為的に分化誘導することにより調製した樹状細胞でもよい。前者の場合、例えば、血液成分分離装置を用いて、患者本人の血液から樹状細胞そのものを採取する方法により得られる。また、後者の場合、患者の未成熟樹状細胞は、例えば、末梢血単核球(PBMC)を採取し、例えば、サイトカインの一種であるGM−CSF、IL−4等の存在下で培養することにより得られる。さらに、例えば、TNF−α等で成熟樹状細胞に分化させる。そして、このようにして得られた樹状細胞を本発明のペプチドまたは誘導体とインキュベーションすることにより、例えば、CML66特異的CD8+T細胞に対する免疫誘導力が増強された樹状細胞を製造できる。
【0049】
また、本発明の抗原提示細胞の製造方法において、前記工程(b)に代えて、下記(c)工程を含んでもよい。
(c)前記樹状細胞に、本発明のポリヌクレオチドまたは本発明のベクターを導入する工程
【0050】
このように、樹状細胞に本発明のポリヌクレオチドまたは本発明のベクターを導入することで、樹状細胞内で本発明のペプチドが発現される。その結果、前記樹状細胞内で、発現したペプチドが前記細胞表面に提示されることで、抗原提示細胞が得られる。この抗原提示細胞は、CML66特異的CD8+T細胞に対する免疫誘導力が増強された樹状細胞である。ポリヌクレオチドやベクターの遺伝子導入方法としては、特に制限されず、その種類に応じて適宜決定できる。具体例としては、例えば、ウイルスベクターを利用する方法、リポフェクション法、エレクトロポレーション法、マイクロインジェクション法、細胞融合法、DEAEデキストラン法、リン酸カルシウム法等が挙げられる。
【0051】
本発明の抗原提示細胞の製造方法により製造された細胞は、下記医薬組成物として以外に、例えば、本発明のCML66特異的CD8+T細胞の製造方法における抗原提示細胞としても使用できる。
【0052】
(2)第4の医薬組成物
本発明の第4の医薬組成物は、本発明の抗原提示細胞の製造方法により製造された抗原提示細胞を含む医薬組成物である。本発明の第4の医薬組成物は、CML66特異的に免疫誘導力が向上した樹状細胞を含んでいるため、例えば、悪性腫瘍の樹状細胞療法に利用できる。また、本発明の第4の医薬組成物は、前記樹状細胞に加え、前述のCML66特異的CD8+細胞傷害性T細胞をさらに含んでいてもよい。
【実施例】
【0053】
以下、実施例を用いて本発明をさらに説明する。
【0054】
[実施例1]
本実施例では、HLAクラスI拘束性抗原ペプチドの同定を行った。腫瘍細胞やPBMCにおけるHLAクラスI発現は、FITC標識抗HLA−A24抗体を用いてフローサイトメトリー法で解析した。なお、前記フローサイトメトリー法による解析では、FACScan(BDバイオサイエンス社製)、Cell Questソフトウェア(BDバイオサイエンス社製)を用いた。
【0055】
(1)CML66ペプチドの合成
HLA−A24と結合可能性のあるペプチドとして、CML66のアミノ酸配列由来の複数のペプチドを合成した。
【0056】
(2)CML66ペプチドのHLAクラスI分子に対する結合能の測定
T2細胞は、抗原提示システムにおいて本質的な役割を持つTAP(transporter associated with antigen processing)を欠損した細胞であるため、細胞内在性の抗原を、細胞表面のHLA上にHLA−ペプチド複合体として提示することができない。しかし、細胞に添加したペプチドが、前記細胞表面でHLAと結合する場合には、細胞表面にHLA−ペプチド複合体を形成できる。このため、抗原ペプチドとHLAとの直接の結合を解析するアッセイに用いる細胞として有用であることが知られている。そこで、まず、T2細胞にHLA−A24を発現させたT2−A24細胞を、培地に1×106個となるようにまき、合成した各種CML66ペプチド10μmol/Lを添加した後、28℃で18時間培養を行った。T2−A24細胞の培地としては、Geneticin(終濃度800μg/mL)を添加した10%FCS含有RPMI1640培地を使用した。そして、培養細胞を回収し、これに、FITCで標識した抗HLA−A24抗体を添加した。これらを4℃で20分反応させた後、0.1%FCS含有PBS(−)で、前記細胞を2回洗浄し、フローサイトメーターで蛍光強度を測定した。蛍光指数は、下記式より算出した。
蛍光指数=(S−B)/B
S:各サンプルの平均蛍光強度
B:バックグラウンドの平均蛍光強度
【0057】
各種CML66ペプチドについて、フローサイトメトリー法により、HLAクラスIに対する親和性を調べた結果を下記表1に示す。下記表1に、HLA−A24に対して親和性を示したCML66ペプチドの情報、ならびに、測定結果を示す。なお、一般的に、蛍光指数測定値が1.0以上であれば、結合能が十分高いと判断でき、より高い値であれば、さらに結合能が高いと判断できる(高親和性)。
【0058】
【表1】

【0059】
前記表1に示すように、TAP欠損細胞を用いたフローサイトメトリー法によって、HLA−A24分子(HLA−A*2402)に結合し得るペプチドとして、CML66217−225(KYEIIKRDI;配列番号3)、CML6622−30(GYKLSLEPL;配列番号4)、CML6670−78(WYQDSVYYI:配列番号1)、CML6676−84(YYIDTLGRI;配列番号2)を、それぞれ初めて同定した。CML6670−78およびCML6676−84は、HLA−A24分子に対し、特に高い結合性を示した。なお、ペプチドの名称に付した数字は、CML66タンパク質におけるアミノ酸部位であり、各ペプチドのN末端アミノ酸残基とC末端アミノ酸残基の位置を示す。
【0060】
[実施例2]
本実施例では、実施例1で同定されたペプチドCML6670−78およびCML6676−84を用いて、CML66ペプチド特異的細胞傷害性T細胞を樹立し、その細胞傷害性を確認した。
【0061】
(1)CML66ペプチド特異的細胞傷害性T細胞の樹立
HLA−A24(HLA−A*2402)陽性ドナーから末梢血単核球(PBMC)を採取し、MACSビーズ(ミルテニーバイオテク社製)を用いてCD14陽性細胞を回収した。回収したCD14陽性細胞を、GM−CSF(75ng/mL)およびIL−4(8.3ng/mL)を加えた10%FCS含有RPMI1640培地で、5日培養した。培養5日目に、さらに、TNF−α(100U/mL)を加えて、単球由来成熟樹状細胞を誘導・樹立した。そして、培養8日目に樹状細胞を回収し、これを抗原提示細胞として用いた。
【0062】
同一ドナーのPBMCから、MACSビーズを用いてCD8+T細胞を回収した。そして、前記樹状細胞に10μmol/LのCML66由来ペプチド、すなわち、CML6670−78(WYQDSVYYI)またはCML6676−84(YYIDTLGRI)を添加し、1ウェルあたり100μLの培地に前記樹状細胞1×104個をまき、さらに、回収したCD8+T細胞約1×105個を加えて、これを刺激した。なお、CD8+T細胞は、10%ヒト血清含有RPMI1640培地により培養した。培養開始から8日目、さらに、mitomycin C(MMC)処理したドナーPBMC 1×104個にCML66由来ペプチド(10μmol/L)を添加し、2回目の刺激を行った。その2日後、さらに、IL−2(10U/mL)を加えて継続培養を行い、培養開始から15日目に、mitomycin C(MMC)で処理した自己PBMC 1×105個に前記CML66由来ペプチド(10μmol/L)を添加し、3回目の刺激を行った。3回目の刺激より4〜5日後、細胞傷害度を、51Cr放出試験によって測定し、ペプチド特異的な反応が見られる細胞傷害性T細胞をスクリーニングした。そして、選択した細胞を、前記CML66由来ペプチド(10μmol/L)で繰り返し刺激しながら培養した。前記CML66由来ペプチドに対する特異反応性を示した細胞は、IL−2を添加した培地で継続的に培養した。以後、4回目、5回目の刺激には、MMCで処理した自己PBMCを、6回目の刺激以降は、MMCで処理した自己LCL(リンパ芽球様細胞)を、それぞれ抗原提示細胞として用いた。なお、LCLとは、末梢血Bリンパ球にEBウイルスを感染させ、不死化させることによって樹立した細胞である。
【0063】
(2)細胞傷害性の測定
(2−1)自己LCL細胞に対するCML66由来ペプチド特異的細胞傷害
前記(1)において樹立した細胞傷害性T細胞について、従来公知の51Cr放出試験により細胞傷害活性を確認した。なお、標的抗原特異的細胞傷害活性は、CML66由来ペプチド添加および無添加での比較により検討した。
【0064】
まず、51Cr(Na251CrO4)でラベルされた標的細胞を準備した。96穴丸底プレートに、1ウェルあたり200μLの10%FCS含有RPMI1640培地と前記標的細胞0.5×104個とを加え、さらに、所定の細胞数の細胞傷害性T細胞を添加して、5時間培養を行った。なお、CML66由来ペプチドを添加する場合は、予め、CML66由来ペプチドの存在下で標的細胞を2時間培養した後に、細胞傷害性T細胞を添加した。標的細胞として前述のLCLを使用した。細胞傷害性T細胞(エフェクター;E)と標的細胞(ターゲット;T)との比率(E:T比)は、5:1とした。そして、標的細胞と細胞傷害性T細胞とを反応させた後、培養液の上清を回収して51Cr放出量を測定した。細胞傷害度は、下記式より算出した。
細胞傷害度=(S−N)/(M−N)
S:各サンプル51Cr放出量
N:自然51Cr放出量
M:最大51Cr放出量
【0065】
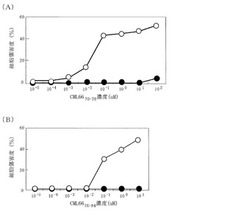
これらの結果を、図1に示す。同図(A)は、CML6670−78で誘導した細胞傷害性T細胞による細胞傷害度を示すグラフであり、同図(B)は、CML6676−84で誘導した細胞傷害性T細胞による細胞傷害度を示すグラフである。両図において、横軸は、各CML66由来ペプチド濃度であり、縦軸は、CML66由来ペプチド特異的細胞傷害性T細胞による細胞傷害度(%)である。また、両図において、○は、自己LCL細胞にCML66由来ペプチドを添加、●は、HLA−A*2402陰性健常者由来LCL細胞にCML66由来ペプチドを添加した、3rd party(第三者陰性対照)に対する細胞傷害性T細胞アッセイの結果をそれぞれ示す。同図(A)に示すように、樹立した細胞傷害性T細胞は、CML6670−78(WYQDSVYYI)を添加された場合に、HLA−A*2402陽性自己LCL細胞に対する傷害性を示した。また、データは示さないが、自己由来LCL細胞を標的とした場合でも、CML66ペプチドの非存在下では、細胞傷害が全く見られないことは確認している。このことから、本実施例で樹立された細胞傷害性T細胞の細胞傷害性は、CML6670−78特異性を示すことが証明された。さらに、この細胞傷害性T細胞は、CML6670−78を添加したHLA−A*2402陰性健常者由来LCL細胞(3rd party)に対して細胞傷害性を示さなかった。また、同図(B)に示すように、CML6676−84を用いた場合も、同様の結果が得られた。以上のことから、樹立された細胞傷害性T細胞は、HLA−A*2402に特異的に結合したCML66由来ペプチドを認識して、標的細胞を傷害すると考えられた。
【0066】
(2−2)HLA−A24(HLA−A*2402)陽性細胞による細胞傷害
CML66由来ペプチド特異的細胞傷害が、HLA−A*2402に拘束されることを確認するために、HLA−A*2402陽性自己LCL細胞、HLA−A*2402陽性非自己LCL、HLA−A*2402陰性非自己LCL、白血病患者由来細胞株であるC1R細胞にHLA−A*2402を発現させたC1R−A*2402細胞を標的細胞として用いた細胞傷害性アッセイを行った。実験の条件は、細胞傷害時のCML6676−84の濃度を10μmol/Lとした以外は、本実施例の(2−1)と同様に行った。また、各種抗体を添加した際の細胞傷害性についても確認した。これは、CML6676−84の濃度を10μmol/Lとし、細胞傷害性T細胞を加える直前30分間に10μg/mLの抗HLAクラスIモノクローナル抗体(w6/32)または抗HLA−DRモノクローナル抗体(L243)を加えた以外は、前記(2−1)と同様に行った。
【0067】
これらの結果を、図2に示す。同図(A)は、CML6676−84ペプチド存在下もしくは非存在下における細胞傷害性T細胞(CTL)による細胞傷害性アッセイの結果であり、同図(B)は、さらに、各種抗体存在下での細胞傷害度を示す結果である。なお、両図において、「*」は、バックグラウンド以下の値であることを示す。同図(A)に示すように、標的細胞のHLA−A*2402の存在下でのみ、CML6676−84による細胞傷害が起こることがわかった。また、同図(B)に示すように、HLA−A*2402を認識する抗HLAクラスI抗体によって細胞傷害が阻害されたのに対し、HLA−A*2402を認識しない抗HLA−DR抗体では全く阻害効果が認められなかった。以上の結果から、CML66由来ペプチド特異的細胞傷害が、HLA−A*2402に拘束されることが確認された。
【0068】
(3)樹立した細胞傷害性T細胞のHLA−A24拘束性のさらなる確認
細胞傷害性T細胞のHLA−A24拘束性をさらに確認するために、各種細胞を標的細胞として用いて、前記(2)と同様にして、細胞傷害性T細胞の細胞傷害性を調べた。標的細胞は、HLA−A24(HLA−A*2402)陽性細胞として、KH88(慢性骨髄性白血病急性転化型ヒト株化細胞)、KCL22(慢性骨髄性白血病急性転化型ヒト株化細胞)、KAZZ(慢性骨髄性白血病急性転化型ヒト株化細胞)、SAS527(慢性骨髄性白血病急性転化型ヒト株化細胞)、OUN−1(慢性骨髄性白血病急性転化型ヒト株化細胞)およびMEG01(慢性骨髄性白血病急性転化型ヒト株化細胞)を使用し、HLA−A24(HLA−A*2402)陰性細胞として、K562(慢性骨髄性白血病急性転化型ヒト株化細胞)、KT−1(慢性骨髄性白血病急性転化型ヒト株化細胞)およびKG−1(急性骨髄性白血病M1型ヒト株化細胞)を使用した。また、健常者由来PBMC(末梢血単核球)、CB(ヒト臍帯血細胞)およびCBMC(ヒト臍帯血単核細胞)を対照として使用した。各種細胞の培養には、10%FCS含有RPMI1640培地を使用した。細胞傷害性T細胞(エフェクター;E)と、標的細胞(ターゲット;T)との比率(E:T比)は、CML6670−78特異的細胞傷害性T細胞を用いた実験では、40:1、20:1、10:1、または、5:1とし、CML6676−84特異的細胞傷害性T細胞を用いた実験では、10:1、5:1、または2.5:1とした。これらの結果を、図3および図4のグラフに示す。両図において、横軸は、CML66特異的な細胞傷害性T細胞(CTL)による細胞傷害度(%)である。
【0069】
また、一部の標的細胞については、各種抗体を添加した際の細胞傷害についても確認した。これは、エフェクターである細胞傷害性T細胞を添加する前、前記標的細胞に対して、抗HLA−クラスI抗体(w6/32)または抗HLA−DR抗体(L243)を終濃度10μg/mLになるように加え、その後1時間培養し、細胞傷害性T細胞を添加した。なお、E:T比は10:1とし、コントロールとしては、抗体に代えてPBSを添加した。これらの結果を、図5のグラフに示す。同図において、横軸は、CML66特異的な細胞傷害性T細胞(CTL)による細胞傷害度(%)である。
【0070】
なお、前記各種標的細胞におけるCML66発現量を、予めリアルタイムPCR法により確認した。まず、各腫瘍細胞よりトータルRNAを抽出し、公知の方法によりcDNAを調製した。そして、このcDNAを鋳型として、市販のキット(TaqMan(商標)Gene Expression assays、CML66 primer、GAPDH primer、Applied Biosystems社製)を用いてリアルタイムPCRを行い、CML66 mRNA copy数を測定した。解析は、ABI Prism 7700(Applied Biosystems社製)により行った。そして、Comparative Ct法を用いて、K562細胞株のCML66発現量を1としたときの、各種細胞における発現の相対値を計算した。その結果を図6の棒グラフに示す。同図において、縦軸は、CML66 mRNAの相対発現量である。図示のとおり、慢性骨髄性白血病(CML)患者由来株化細胞である、K562細胞、KH88細胞、KCL22細胞、KAZZ細胞、SAS527細胞、KT−1細胞、OUN−1細胞、MEG01細胞、および急性骨髄性白血病(AML)患者由来株化細胞であるKG−1細胞のいずれも、CML66のmRNAを発現し、特に、KCL22およびKT−1が、CML66のmRNAを高発現することが確認された。
【0071】
図3は、CML6670−78(WYQDSVYYI)特異的細胞傷害性T細胞による白血病細胞に対する細胞傷害度を示すグラフであり、図4は、CMLCML6676−84(YYIDTLGRI)特異的細胞傷害性T細胞による白血病細胞に対する細胞傷害度を示すグラフである。なお、同図において、「*」は、バックグラウンド以下の値であることを示す。CML6670−78(WYQDSVYYI)特異的細胞傷害性T細胞の場合、同図上段に示すように、CML6670−78特異的細胞傷害性T細胞は、CML66を強く発現しているHLA−A24陽性白血病細胞(KH88、KCL22、KAZZ、SAS527)に対して、CML6670−78無添加であっても、高い細胞傷害性を示すことが確認された。他方、同図中段に示すように、CML66を強く発現している細胞であっても、HLA−A24陰性白血病細胞(KT−1、KG−1、K562)に対しては、細胞傷害性は示さなかった。さらに、同図下段に示すように、HLA−A24陽性健常者由来細胞に対しても、細胞傷害性は示さなかった。また、CMLCML6676−84(YYIDTLGRI)特異的細胞傷害性T細胞の場合、図4に示すように、CML6676−84特異的細胞傷害性T細胞は、HLA−A24陽性白血病細胞(OUN−1、MEG01)に対してのみ、高い細胞傷害性を示すことが確認された。
【0072】
図5は、さらに各種抗体存在下での細胞傷害度を示すグラフであり、同図(A)は、CML6670−78特異的細胞傷害性T細胞の結果であり、同図(B)は、CML6676−84特異的細胞傷害性T細胞の結果であり。両図に示すように、細胞傷害性T細胞の細胞傷害性は、抗HLA−クラスI抗体を添加することによって阻害された。このことから、細胞傷害性T細胞は、HLA−A24拘束性細胞傷害を示すことが確認された。これらの結果は、CML66が、腫瘍細胞内で断片化され、ペプチド抗原CML6670−78およびCML6676−84が腫瘍細胞表面上のHLA−A24分子と結合して提示されていることを意味している。同時に、前記CML66抗原ペプチドを標的として、HLA−A24陽性者に標的特異的細胞傷害性T細胞を誘導できることを意味している。
【0073】
[実施例3]
本実施例では、CML66が、癌免疫療法の標的分子になり得ることをさらに検証する目的で、白血病患者の末梢血中でのCML66特異的細胞傷害性T細胞の存在を調べた。
【0074】
(1)白血病細胞でのCML66発現の定量
HLA−A24陽性の急性骨髄性白血病患者、慢性骨髄性白血病患者(慢性期及び急性転化期)、急性リンパ性白血病患者由来の各種細胞、さらに慢性骨髄性白血病患者骨髄由来CD34陽性細胞について、前述と同様のリアルタイムPCR法により、CML66 mRNAの発現を定量した。なお、CD34陽性細胞の回収には、実施例2と同様に、MACSビーズ(ミルテニーバイオテク社製)を用いた。
【0075】
これらの結果を、図7〜10のグラフに示す。図7は、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、進行期慢性骨髄単球性白血病(CMMoL)、急性リンパ性白血病(ALL)患者由来の細胞、対照としてCML患者由来の細胞であるK562細胞、および健常者由来の末梢血単核球(PBMC)、健常者由来のヒト臍帯血細胞(CB)の結果を示す図である。図8は、急性骨髄性白血病(AML)の各種サブタイプ(M0、M1、M2、M3、M4、M5b)の患者由来の細胞、およびK562についての結果を示す図である。図9は、CMLの臨床病期である急性転化期(CML−BC:Blast Crisis)、慢性期(CML−CP:Chronic Phase)の患者由来の細胞、およびK562についての結果を示す図である。図10は、CML慢性期(CML−CP)の患者または健常者から単離したCD34陽性細胞、およびK562についての結果を示す図である。CML患者のCD34陽性細胞は、CMLの白血病性幹細胞を含むと考えられている。図7〜10において、縦軸は、それぞれ、CML66 mRNAの相対発現量である。図示のとおり、急性骨髄性白血病細胞(AML)、急性転化期の慢性骨髄性白血病細胞(CML−BC)、急性リンパ性白血病細胞(ALL)およびCD34陽性慢性骨髄性白血病細胞(CML−CP CD34+)のいずれにもCML66 mRNAの高発現が確認された。以上の結果は、CML66は、単にAML、CML、CMMoL、ALLの治療の標的として有望であるというだけでなく、Imatinibのような従来の分子標的薬が奏功しにくい、より悪性度の高い急性転化期CMLおよびCMLの白血病性幹細胞に対しても有効である可能性を示している。
【0076】
(2)CML66特異的細胞傷害性T細胞頻度の測定
まず、HLA−A24陽性の急性骨髄性及びリンパ性白血病患者(化学療法後並びに同種骨髄移植後)、ならびに健常者より末梢血単核球(PBMC)を分離し、1×106〜2×106個となるようにまき、さらにCML6670−78またはCML6676−84(10μmol/L)を加えた。前記PBMCは、IL−7(5ng/mL)およびIL−12(100pg/mL)を含有する10%ヒト血清含有RPMI1640培地で培養し、1週間ごとに、CML6670−78またはCML6676−84(10μmol/L)を添加した。培養4日目からは、IL−2(10U/mL)を加えて継続培養し、培養16日目頃に、ELISPOT法によりCML66に特異的な細胞傷害性T細胞の頻度を測定した。なお、CML66由来ペプチド未添加培養群を陰性コントロールとした。
【0077】
ELISPOT法は、以下の通り行った。まず、底がニトロセルロース膜で覆われた96穴MultiScreen−HAプレートに、抗IFN−γモノクローナル抗体(10μg/mL)を添加し、4℃で18時間放置することによって、前記膜に抗体を結合させた。前記膜をPBS(−)で洗浄し、10%FCS・RPMI1640で、37℃、1時間、前記膜をコーティーングした後、前述のT2−A24細胞5×104個をまき、CML6670−78またはCML6676−84(10μmol/L)を添加して、1時間培養を行った。前記T2−24細胞は、10%FCS含有RPMI1640により培養し、その後、各患者のPBMCをまいて、18時間反応させた。0.1%Tween20を含有するPBS(−)で前記プレートを洗浄し、ウサギ抗ヒトIFN−γ抗体を加えて90分、続いて、ヤギ抗ウサギIgG抗体を加えて90分おいた。そして、最後に、混合液(0.1mol/L酢酸ナトリウム(pH5.0)/3−amino−9−Ethylcarbazole/N,N dimethylformamide/0.015% H2O2)100μLを加えて40分反応させて、発色させた。前記プレートを水でよく洗浄し、乾燥させた後、倒立顕微鏡により、スポットを確認し、CML66特異的細胞傷害性T細胞の頻度を測定した。
【0078】
図11に、前記ELISPOT法による、CML6676−84特異的細胞傷害性T細胞頻度の測定結果を示す。同図(A)は、患者末梢血中に存在する、CML6676−84特異的細胞傷害性T細胞の頻度を示すELISPOT法による解析結果を示すグラフであり、同図(B)は、患者二名に関する前記ELISPOT法で得られたスポットの写真である。また、両図において、「+」は、CML6676−84添加の結果、「−」は、CML6676−84無添加の結果である。同図(A)に示すように、健常者(○、△、□)末梢血中にはCML6676−84に応答して増加する細胞傷害性T細胞がほとんど存在しなかった。一方、急性リンパ性白血病(ALL)患者(▲、×、●)および急性骨髄性白血病(AML)患者(◆、■、▼)の末梢血中には、CML6676−84に応答して増加する細胞傷害性T細胞が存在することが確認できた。また、同図(B)に示すように、CML6676−84ペプチド添加の場合、無添加よりもスポットの増加が目視によっても顕著であった。なお、図示していないが、CML6670−78ペプチドを用いた場合にも、ほぼ同様の結果が得られることが確認できた。
【0079】
前述の図7〜10に示すように、白血病患者由来の細胞において、CML66の高発現が確認された。また、前述のように、ELISPOTアッセイにより、それぞれの患者の末梢血中に、CML6670−78またはCML6676−84を特異的に認識する細胞傷害性T細胞が存在することが確認された。この結果は、白血病患者内で前記CML由来66ペプチドが細胞傷害性T細胞の標的抗原として、実際に機能していることを示している。このため、ペプチドワクチンCML6670−78およびCML6676−84によれば、これらの細胞傷害性T細胞を活性化させ、腫瘍細胞を排除できる可能性が非常に高いといえる。以上の結果から、CML6670−78およびCML6676−84が癌ワクチンとして有用であることが臨床的に証明されたといえる。
【0080】
本発明のペプチドは、例えば、骨髄性白血病の他に、慢性骨髄単球性白血病や急性リンパ性白血病等を含む各種白血病患者由来の細胞に対して、腫瘍抗原ペプチドとして機能し、また、その他にも、メラノーマ細胞株や各種固形癌株化細胞、前立腺がん患者由来の細胞に対しても、腫瘍抗原ペプチドとして機能することができる。
【産業上の利用可能性】
【0081】
以上のように、本発明は、例えば、白血病を含む悪性腫瘍の医療分野、特に、細胞免疫療法、ワクチン療法、遺伝子治療等を含む免疫療法の分野で有用である。
【図面の簡単な説明】
【0082】
【図1】図1は、本発明の実施例2において、CML由来ペプチドで誘導した細胞傷害性T細胞による細胞傷害度を示すグラフであり、(A)は、CML6670−78を使用した結果であり、(B)は、CML6676−84を使用した結果である。
【図2】図2(A)は、前記実施例2において、CML6676−84存在下もしくは非存在下での細胞傷害性T細胞(CTL)による細胞傷害度を示すグラフであり、図2(B)は、各種HLA阻害抗体の存在下における細胞傷害度を示すグラフである。
【図3】図3は、前記実施例2における、CML6670−78特異的な細胞傷害性T細胞(CTL)による各種白血病患者由来の細胞に対する細胞傷害度を示すグラフである。
【図4】図4は、前記実施例2における、CML6676−84特異的な細胞傷害性T細胞(CTL)による各種白血病患者由来の細胞に対する細胞傷害度を示すグラフである。
【図5】図5は、前記実施例2における、各種抗体の添加による、CML66由来ペプチドで誘導した細胞傷害性T細胞の細胞傷害度を示すグラフであり、(A)は、CML6670−78で誘導した結果であり、(B)は、CML6676−84で誘導した結果である。
【図6】図6は、前記実施例2における、各種標的細胞のCML66 mRNA発現量を示すグラフである。
【図7】図7は、本発明の実施例3における、各種白血病患者由来の細胞のCML66 mRNA発現量を示すグラフである。
【図8】図8は、前記実施例3における、急性骨髄性白血病(AML)患者の各臨床病型ごとの患者白血病細胞のCML66 mRNA発現量を示すグラフである。
【図9】図9は、前記実施例3における、慢性骨髄性白血病の急性転化期(CML−BC)、および慢性期(CML−CP)の患者骨髄由来白血病細胞のCML66 mRNA発現量を示すグラフである。
【図10】図10は、前記実施例3における、CML慢性期(CML−CP)の患者または健常者から単離したCD34陽性細胞のCML66 mRNA発現量を示すグラフである。
【図11】図11(A)は、前記実施例3における、各種白血病患者の末梢血中に存在するCML6676−84特異的細胞傷害性T細胞の頻度を示すグラフであり、同図(B)は、代表的な陽性例二症例での前記CML6676−84特異的細胞傷害性T細胞のスポットを示す写真である。
【技術分野】
【0001】
本発明は、HLA−A24拘束性抗原ペプチドおよびその用途に関する。
【背景技術】
【0002】
癌細胞を排除する機能を有する細胞傷害性T細胞(cytotoxic T lymphocyte;CTL)は、癌細胞表面に発現しているHLAクラスI分子と癌特異的タンパク質由来ペプチドとの複合体を認識して、癌細胞を消滅させる。近年、このメカニズムを利用して、細胞傷害性T細胞が認識する標的ペプチドを同定し、これを抗原ペプチドとして人為的に宿主に与え、特異的な抗腫瘍免疫を誘導する方法が、研究されている。そして、そのメカニズムから、前記抗原ペプチドは、癌ワクチンとも呼ばれている。これまでに、いくつかの癌細胞に特異的な抗原ペプチドの同定が行われ、癌ワクチンの応用が試みられているが、効果が十分ではないため、新たな抗原ペプチドの同定が求められている。
【0003】
CML66は、583アミノ酸からなる分子量66kDのタンパク質であり、移植片対白血病作用(Graft−versus−Leukemia effect:GVL)と関連する白血病関連抗原であることが報告されている。そして、さらなる解析によって、(1)coding遺伝子が、第8番染色体長腕(8q23)に位置していること、(2)タンパク質の機能が依然として不明であること、(3)慢性骨髄性白血病(CML)患者由来の細胞や前立腺がん患者由来の細胞、さらに、ヒト白血病やメラノーマ、肺がん等の患者由来の株化細胞において、CML66タンパク質およびCML66 mRNAの過剰発現が認められるが、正常組織では、HLA分子が発現しない精巣細胞で産生される以外では、わずかに心臓で発現が確認されるのみであること、(4)正常でも2つのsplicing isoform(CML66−L、CML66−S)が見られ、554アミノ酸からなる短縮型isoformであるCML66−Sは、主に精巣細胞で発現し、さらに、担がん患者血清中のCML66特異抗体は、CML66−Lに対するものがほとんどであること等が明らかとなっている(非特許文献1〜3)。
【非特許文献1】Yang X.F. et al. Proc. Natl. Acad. Sci. USA 98: 7492-7497, 2001.
【非特許文献2】Wu C.J. et al. Clin. Cancer Res. 11: 4504-4511, 2005.
【非特許文献3】Yan Y. et al. J. Immunol. 172: 651-660, 2004.
【発明の開示】
【発明が解決しようとする課題】
【0004】
前述の情報は、CML66が、腫瘍細胞の特性に関与しているか否かは不明であるものの、いわゆる、分化抗原としてのがん関連抗原(癌細胞特異的抗原)として、様々な癌に対する免疫療法の標的抗原となり得ることを示していると考えられる。
【0005】
そこで、本発明は、CML66由来のペプチドであって、癌ワクチンとして使用可能な新たな抗原ペプチドの提供を目的とする。
【課題を解決するための手段】
【0006】
前記目的を達成するために、本発明のペプチドは、下記(1)〜(4)のいずれかに記載のペプチドである。
(1)配列番号1のアミノ酸配列からなるペプチド
WYQDSVYYI (配列番号1)
(2)配列番号2のアミノ酸配列からなるペプチド
YYIDTLGRI (配列番号2)
(3)前記(1)または(2)のペプチドとのアミノ酸配列の相同性が80%以上であるペプチドであって、HLA−A24分子と結合することでCD8+T細胞に特異的に認識されうるHLA−A24拘束性抗原ペプチド
(4)前記(1)または(2)のペプチドのアミノ酸配列において、1個または数個のアミノ酸が、欠失、置換もしくは付加されたアミノ酸配列からなるペプチドであって、HLA−A24分子と結合することでCD8+T細胞に特異的に認識されうるHLA−A24拘束性抗原ペプチド。
【0007】
本発明の活性化誘導剤は、CD8+T細胞の細胞傷害性の活性化を誘導する活性化誘導剤であって、以下の第1および第2の活性化誘導剤がある。第1の活性化誘導剤は、前記本発明のペプチドまたはその誘導体を含む活性化誘導剤であり、第2の活性化誘導剤は、前記本発明のペプチドまたはその誘導体をコードするポリヌクレオチドを含む活性化誘導剤である。
【0008】
本発明のCD8+細胞傷害性T細胞の製造方法は、下記工程(A)および(B)を含むことを特徴とする。
(A) 患者のリンパ球を準備する工程
(B) 前記リンパ球と、前記本発明のペプチドまたはその誘導体とをインキュベーションする工程
【0009】
本発明の抗原提示細胞の製造方法は、下記工程(a)および(b)を含むことを特徴とする。
(a) 患者の樹状細胞を準備する工程
(b) 前記樹状細胞と、本発明のペプチドまたはその誘導体とをインキュベーションする工程
【0010】
本発明の医薬組成物は、癌免疫療法に用いる医薬組成物である。本発明の第1の医薬組成物は、抗原ペプチドとして、本発明のペプチドまたはその誘導体を含む。本発明の第2の医薬組成物は、本発明のペプチドまたはその誘導体をコードするポリヌクレオチドを含む。本発明の第3の医薬組成物は、本発明の細胞傷害性T細胞の製造方法により製造されたCD8+細胞傷害性T細胞を含む。また、本発明の第4の医薬組成物は、本発明の抗原提示細胞の製造方法により製造された抗原提示細胞を含む。
【発明の効果】
【0011】
一般的に、抗原ペプチドは、T細胞受容体(TCR)に認識される際、特定のHLAクラスI分子(ヒト組織適合性抗原;ヒト白血球抗原)に結合することにより、初めてTCRに認識される。このため、日本人の約60%が占めているHLA−A24分子のような、頻度が高いHLAクラスI分子に対して結合可能なペプチドであれば、その汎用性を担保できると考えられる。そこで、本発明者らは、鋭意研究の結果、HLA−A24と結合するCML66由来のペプチドを同定し、本発明に到った。本発明のペプチドは、CD8+T細胞に認識され得る、CML66特異的HLA−A24拘束性抗原ペプチドである。
【0012】
本発明のペプチドによれば、CML66特異的CD8+T細胞の活性化・増殖を促進できる。この活性化により、CML66特異的CD8+T細胞は、細胞傷害活性を有する細胞傷害性T細胞となるため、悪性腫瘍の破壊による効果的な治療が可能となる。このため、本発明のペプチドは、例えば、癌ワクチン(悪性腫瘍ワクチン)等として使用でき、白血病を含む悪性腫瘍に対するワクチン療法に有用である。
【0013】
また、本発明のペプチドをリンパ球と共培養することで、CML66特異的CD8+細胞傷害性T細胞を製造できる。このようにして製造した細胞傷害性T細胞を、例えば、患者の体内に戻すことによって、例えば、白血病を含む悪性腫瘍に対する細胞免疫療法が可能となる。
【0014】
また、本発明のペプチドを樹状細胞と共培養することで、本発明のペプチドを抗原提示する抗原提示細胞を製造できる。樹状細胞は、主要組織適合抗原(MHC)や共刺激分子を共発現し、抗原未感作のナイーブT細胞をも刺激できる、極めて強力な抗原提示細胞である。このため、本発明の抗原提示細胞によれば、CML66特異的CD8+T細胞を効果的に活性化して、細胞傷害性T細胞を誘導できる。したがって、このような抗原提示細胞を、例えば、患者の体内に戻すことによって、例えば、白血病等の悪性腫瘍に対して、より効果的な細胞免疫療法が可能となる。
【発明を実施するための最良の形態】
【0015】
ペプチドおよびその用途
(1)ペプチド
本発明のペプチドは、HLA−A24分子上に結合してCD8+T細胞により特異的に認識されうるCML66の抗原ペプチドである。HLA−A24分子のHLA遺伝子型は、A*2402であることが好ましい。
【0016】
本発明において、「抗原ペプチド」とは、抗原決定基(エピトープ)を構成するペプチドをいう。前記抗原ペプチドは、抗原決定基の最小単位である必要はなく、例えば、8〜26個、9〜24個、10〜22個又は11〜20個の範囲のアミノ酸により構成されるペプチドがあげられる。
【0017】
本発明において、「HLA−A24分子上に結合してCD8+T細胞により特異的に認識される」とは、例えば、あるペプチドが、樹状細胞等の抗原提示細胞表面のHLA−A24分子上に提示された場合、適切な補助刺激因子(共刺激因子)とともに、ペプチド抗原特異的にCD8+T細胞を活性化しうること等をいう。
【0018】
本発明のペプチドとHLA−A24分子との結合は、例えば、細胞内部で発現されたペプチド、もしくは、貪食作用により細胞内部に取り込まれたペプチドが、細胞内でHLA−A24分子と結合する場合でもよい。また、既に細胞表面に存在するHLA−A24分子に、細胞外に存在するペプチドが直接結合する場合であってもよい。
【0019】
本発明において、HLAクラスI分子とは、ヒトのMHCクラスI分子に対応する分子であり、HLA−A24型とは、HLAクラスI分子のアロ抗原型がA24型であること、すなわち、HLA−A24遺伝子の遺伝子産物であることをいい、HLA−A*2402型とは、HLA−A24遺伝子の対立遺伝子の遺伝子型がA*2402であることをいう。
【0020】
本発明のペプチドは、配列番号1または配列番号2に記載のアミノ酸配列からなるペプチドを含む。CML66タンパク質(例えば、NCBIアクセッション番号AAK73017)において、配列番号1のアミノ酸配列(WYQDSVYYI)は、70番目〜78番目のアミノ酸配列に相当し、配列番号2のアミノ酸配列(YYIDTLGRI)は、76番目〜84番目のアミノ酸配列に相当する。以下、配列番号1のアミノ酸配列からなるペプチドを、「CML6670−78」ともいい、配列番号2のアミノ酸配列からなるペプチドを、「CML6676−84」ともいう。
【0021】
また、本発明のペプチドは、配列番号1または配列番号2に記載のアミノ酸配列からなるペプチドと相同なペプチドを含む。ここで、アミノ酸配列が「相同」であるとは、その機能を維持できるほど十分に類似していることをいう。また、一般的に、2つ以上のアミノ酸配列において、例えば、80%以上、84%以上、88%以上、92%以上、96%以上の同一性又は類似性を示す場合、これらは相同であるといえる。前記同一性および類似性は、2以上の塩基配列又はアミノ酸配列間で、これらの配列を比較して決定される関係をいう。同一性が、アライメントされた場合の同一残基の割合を示すのに対し、類似性は、同一残基に加え、同類置換された残基も含む。同一性および類似性は、従来公知の様々なコンピュータープログラムにより、容易に決定できる。本発明のペプチドにおいて、「機能」とは、HLA−A24分子と結合することでCD8+T細胞にペプチド抗原特異的に認識されうることを意味する。
【0022】
また、本発明のペプチドは、配列番号1または配列番号2に記載のアミノ酸配列において、1個または数個のアミノ酸が、欠失、置換もしくは付加されたアミノ酸配列からなるペプチドであって、前記機能を有するものも含む。相違するアミノ酸の残基数としては、例えば、1〜6個、1〜5個、1〜4個、1〜3個、1〜2個又は1個である。
【0023】
本発明のペプチドは、例えば、天然のCML66由来のペプチドのような天然物でもよいし、化学合成ペプチドや、遺伝子工学により製造されたペプチドであってもよい。化学合成や遺伝子工学による製造の手法は、特に制限されず、従来公知の方法が採用できる。遺伝子工学を利用する場合、例えば、本発明のペプチドをコードするポリヌクレオチドや、前記ポリヌクレオチドを挿入した発現ベクターを、例えば、大腸菌、酵母、昆虫細胞等の適当な宿主に導入し、生物学的に製造してもよい。
【0024】
本発明のペプチドは、前述のような癌ワクチンとして使用できるたけでなく、例えば、CML66特異的細胞傷害性T細胞を患者体外で増殖させた後、体内に移入(例えば、点滴投与等)する養子免疫療法(受動免疫療法)等に使用することができる。また、この他にも、例えば、体内に存在するCML66特異的細胞傷害性T細胞を、高感度かつ迅速に検出できるペプチド・HLAテトラマー診断法にも応用可能である。
【0025】
(2)第1の活性化誘導剤
本発明の第1の活性化誘導剤は、前述のように、CD8+T細胞の細胞傷害性の活性化を誘導する活性化誘導剤であって、本発明のペプチドおよびその誘導体の少なくとも一方を含むことを特徴とする。本発明の第1の活性化誘導剤を、例えば、目的の細胞や組織、その周辺に投与することによって、CML66特異的CD8+T細胞の活性化・増殖を促進できる。そして、この活性化により、CML66特異的CD8+T細胞を、細胞傷害活性を有する細胞傷害性T細胞とすることができる。
【0026】
本発明の第1の活性化誘導剤は、例えば、本発明のペプチドおよび誘導体のいずれか一方を含むのみでもよいし、両方を含んでもよい。また、本発明のペプチドおよび誘導体は、一種類でもよいし、二種類以上を含んでいてもよい。本発明の第1の活性化誘導剤は、例えば、本発明のペプチドまたは誘導体のみでもよいし、この他に、さらに、各種添加剤を含んでもよい。なお、具体的な使用方法等については、例えば、後述する第1の医薬組成物と同様である。
【0027】
(3)第1の医薬組成物
本発明の第1の医薬組成物は、前述のように、癌免疫療法に用いる医薬組成物であって、本発明のペプチドおよびその誘導体の少なくとも一方を含むことを特徴とする。本発明の第1の医薬組成物は、例えば、前述の第1の活性化誘導剤と同様に、本発明のペプチドまたは誘導体のみでもよいし、この他に、さらに、薬学的に許容できるアジュバンド、キャリア又は賦形剤等の添加剤を含んでもよい。また、本発明のペプチドの誘導体としては、特に制限されず、例えば、従来公知の修飾方法により修飾されたもの、例えば、塩、糖鎖修飾されたもの、脂質修飾されたもの等が含まれる。以下、「本発明のペプチド」とは、本発明のペプチドの誘導体を含む。
【0028】
本発明の第1の医薬組成物は、例えば、ワクチンとして患者に有効量を投与することで、癌(例えば、悪性腫瘍)のワクチン療法に使用できる。前記ワクチンが投与されると、例えば、患者の体内において、本発明のペプチドが樹状細胞等の抗原提示細胞に取り込まれ、HLAクラスI分子に結合して前記抗原提示細胞上に抗原提示される。そして、発現している共刺激分子とともに、CML66特異的CD8+T細胞を刺激、誘導(活性化)する。活性化により細胞傷害性活性を持ったCML66特異的CD8+細胞傷害性T細胞は、前記患者の体内で、CML66を発現する悪性腫瘍細胞を破壊する。これにより、悪性腫瘍の治療が可能になる。なお、HLA−A24のHLA遺伝子頻度は、日本人で約60%を占めるといわれている。したがって、このように高い頻度のHLA−A24に結合できる点からも、本発明のペプチドを含む医薬組成物は、臨床的有用性が極めて高いといえる。
【0029】
本発明の第1の医薬組成物の調製方法は、例えば、従来公知のワクチンの調製方法を使用できる。前記ワクチンは、例えば、注射剤として使用する溶液や懸濁液として、本発明のペプチドと、薬学的に許容できる賦形剤とから調製してもよい。また、前記ワクチンを、固体に調製してもよい。前記賦形剤としては、例えば、水、塩水、デキストロース、グリセロール、エタノール等及びそれらの組み合わせである。また必要に応じて、ワクチンは、少量の補助物質、例えば、湿潤剤又は乳化剤、pH緩衝剤、又はワクチンの有効性を高めるアジュバントを含んでいてもよい。前記アジュバントとしては、特に制限されず、従来公知のものを使用でき、その中でも、患者の体内で、樹状細胞等の抗原提示細胞による本発明のペプチドの取込みを促進するものが好ましい。また、本発明のペプチドは、中性または薬学的に許容できる塩として、ワクチンに製剤化されてもよい。
【0030】
ワクチンの投与方法は、制限されないが、例えば、表皮下、真皮内、真皮下又は筋肉内等への注射によって非経口的に投与される。他の投与方法に適した製剤として、例えば、坐剤や、経口、口腔内、舌下、腹腔内、鞘膜内、肛門及び頭蓋内製剤がある。ワクチンは、患者及び剤形に合わせて、治療に有効な量を投与することが好ましい。
【0031】
本発明において、治療対象となる悪性腫瘍は、制限されない。具体例としては、例えば、CML66を発現する悪性腫瘍があげられ、例えば、各種白血病や各種固形腫瘍等である。前記白血病としては、例えば、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、急性リンパ性白血病(ALL)等があげられ、前記固形腫瘍としては、例えば、肺、前立腺癌、並びに黒色腫等が挙げられるが、これらに限定されない。
【0032】
ポリヌクレオチドおよびベクターならびにその用途
(1)ポリヌクレオチド
本発明のポリヌクレオチドは、本発明のペプチドをコードするポリヌクレオチドである。本発明のポリヌクレオチドを、例えば、目的の細胞に導入し、前記細胞内で本発明のペプチドを発現させれば、CML66特異的CD8+T細胞の活性化・増殖を促進できる。この活性化により、CML66特異的CD8+T細胞は、細胞傷害活性を有する細胞傷害性T細胞とすることができる。
【0033】
前記ポリヌクレオチドとしては、例えば、以下に示す塩基配列またはその相補配列からなるポリヌクレオチドがあげられる。配列番号5に示す塩基配列からなるポリヌクレオチドは、配列番号1のアミノ酸配列からなる本発明のペプチドCML6670−78をコードするポリヌクレオチドの一例である。また、配列番号6に示す塩基配列からなるポリヌクレオチドは、配列番号2のアミノ酸配列からなる本発明のペプチドCML6676−84をコードするポリヌクレオチドの一例である。本発明のポリヌクレオチドは、一本鎖ポリヌクレオチドでも二本鎖ポリヌクレオチドでもよい。
CML6670−78 5’−tggtatcaagacagtgtctactatatt−3’ (配列番号5)
CML6676−84 5’−tactatattgatacccttggaagaatt−3’ (配列番号6)
【0034】
さらに、本発明のポリヌクレオチドは、配列番号1または配列番号2のアミノ酸配列をコードする塩基配列と相同な塩基配列、または、その相補的な塩基配列からなるポリヌクレオチドを含む。ポリヌクレオチドの塩基配列が「相同」であるとは、前記ポリヌクレオチドがコードするペプチドが、本発明のペプチドとしての機能を維持できるほど十分に類似していることをいう。例えば、塩基配列に、点変異、欠失又は付加による相違があるとしても、これらが前記遺伝子の機能に影響を与えないならば、両者は相同であるといえる。相違する塩基数としては、例えば、1〜20個、1〜15個、1〜10個、1〜5個、1〜3個、1〜2個又は1個である。また、2つ以上の配列において、例えば、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%もしくは約99%の同一性を示す場合、これらは相同であるといえる。また、2つのポリヌクレオチドの一方が、他方の相補配列からなるポリヌクレオチドと、ストリンジェントな条件でハイブリダイズする場合には、両者は相同といえる。前記ストリンジェントな条件としては、特に限定されないが、例えば、6×SSC、0.5%SDS、5×デンハルト、0.01%変性サケ精子核酸を含む溶液中、「Tm−25℃」の温度で一晩保温する条件等があげられる。前記Tmは、例えば、下記式により求められる。下記式中、Nはポリヌクレオチドプローブの鎖長であり、%G+Cはポリヌクレオチドプローブプライマー中のグアニン及びシトシン残基の含有量である。
Tm=81.5−16.6(log10[Na+])+0.41(%G+C)−(600/N)
【0035】
本発明のポリヌクレオチドの製造方法は、特に制限されず、例えば、化学合成により製造してもよく、または、公知のCML66遺伝子に基づき設計したプライマーを使用して、各種遺伝子増幅法により製造し、または、適当なベクターにクローニングしてもよい。
【0036】
(2)ベクター
本発明のベクターは、前記本発明のポリヌクレオチドを含むベクターである。本発明のベクターを、例えば、目的の細胞に導入し、前記細胞内で本発明のペプチドを発現させれば、CML66特異的CD8+T細胞の活性化・増殖を促進できる。この活性化により、CML66特異的CD8+T細胞は、細胞傷害活性を有する細胞傷害性T細胞とすることができる。
【0037】
本発明のベクターは、本発明のポリヌクレオチドを含むベクターである。本発明のベクターは、発現ベクターであることが好ましく、本発明のポリヌクレオチドが、本発明のベクターが導入される宿主細胞内で発現可能なように連結されていることが好ましい。本発明のベクターの種類は、特に制限されず、例えば、ウイルスベクターであってよく、非ウイルスベクターであってもよい。前記ウイルスベクターとしては、例えば、レトロウィルスベクター、免疫不全症ウイルス(HIV)等のレンチウィルスベクター、アデノウィルスベクター、アデノ随伴ベクター(AAVベクター;adeno associated virus)、ヘルペスウイルス、ワクシニアウイルス、ポックスウイルス、ポリオウイルス、シンビスウイルス、センダイウイルス、SV40等のDNAウイルスやRNAウイルスがあげられる。非ウイルスベクターとしては、例えば、pcDNA3.1(Invitrogen社)、pZeoSV(Invitrogen社)、pBK−CMV(Stratagene社)、pCAGGS(Gene108,193−200(1991))等の発現ベクターが例示できる。通常、これらのベクターのプロモーターの下流に、発現可能なように前記ポリヌクレオチドを挿入すればよい。
【0038】
(3)第2の活性化誘導剤
本発明の第2の活性化誘導剤は、前述のように、CD8+T細胞の細胞傷害性の活性化を誘導する活性化誘導剤であって、本発明のポリヌクレオチドおよびベクターの少なくとも一方を含むことを特徴とする。本発明の第2の活性化誘導剤を、例えば、目的の細胞に導入して、本発明のポリペプチドや誘導体を発現させることによって、CML66特異的CD8+T細胞の活性化・増殖を促進できる。そして、この活性化により、CML66特異的CD8+T細胞を、細胞傷害活性を有する細胞傷害性T細胞とすることができる。
【0039】
本発明の第2の活性化誘導剤は、例えば、本発明のポリヌクレオチドおよびベクターのいずれか一方を含むのみでもよいし、両方を含んでもよい。また、本発明のポリヌクレオチドおよびベクターは、一種類でもよいし、二種類以上を含んでもよい。本発明の第2の活性化誘導剤は、例えば、本発明のポリヌクレオチドまたはベクターのみでもよいし、この他に、さらに、各種添加剤を含んでもよい。なお、具体的な使用方法等については、例えば、後述する第2の医薬組成物と同様にすることができる。
【0040】
(4)第2の医薬組成物
本発明の第2の医薬組成物は、癌免疫療法に用いる医薬組成物であって、本発明のポリヌクレオチドおよびベクターの少なくとも一方を含むことを特徴とする。第2の医薬組成物は、例えば、患者の体内、好ましくは、皮下組織、リンパ節内、筋肉細胞内に接種し、本発明のペプチドを発現させることで、CML66特異的免疫反応を誘導するDNA(RNA)ワクチン療法に使用できる。第2の医薬組成物の細胞への導入方法は、特に制限されず、ポリヌクレオチドやベクターの種類に応じて適宜決定できる。具体例としては、例えば、ウイルスベクターを利用する方法、リポフェクション法、エレクトロポレーション法、マイクロインジェクション法、細胞融合法、DEAEデキストラン法、リン酸カルシウム法等があげられる。
【0041】
ワクチンとしての調製方法は、特に制限されず、前述の本発明のペプチドを含むワクチン(第1の医薬組成物)と同様に調製できる。また、本発明の第2の医薬組成物において、本発明のポリヌクレオチドは、導入される細胞内で本発明のペプチドを発現できる形態であればよい。この場合、第2の医薬組成物は、例えば、ベクターに連結されていない本発明のポリヌクレオチドを、導入剤とともに含んでもよい。前記導入剤としては、特に制限されないが、例えば、リポソーム等の、非ベクター系遺伝子導入方法に使用されるものがあげられる。また、本発明のポリヌクレオチドを含む第2の医薬組成物を、例えば、パーティクルガン等を用いた直接注入法により、接種することもできる。
【0042】
CD8+細胞傷害性T細胞の製造方法およびその用途
(1)CD8+細胞傷害性T細胞の製造方法
本発明のCD8+細胞傷害性T細胞の製造方法は、前述のように、CD8+細胞傷害性T細胞の製造方法であって、下記工程(A)および(B)を含むことを特徴とする。
(A) 患者のリンパ球を準備する工程
(B) 前記リンパ球と、本発明のペプチドおよびその誘導体の少なくとも一方とをインキュベーションする工程
【0043】
前記工程(B)においては、例えば、前記リンパ球と、本発明のペプチドを提示する抗原提示細胞とをインキュベーションすることが好ましい。前記抗原提示細胞の調製方法は、特に制限されない。具体例としては、前記工程(B)において、例えば、前記リンパ球と、樹状細胞と、本発明のペプチドとをインキュベーションすることによって、抗原提示細胞を調製できる。前記樹状細胞は、例えば、本発明のペプチドをパルスされることによって、本発明のペプチドを提示する抗原提示細胞となる。そして、この抗原提示細胞が、前記リンパ球の増殖および活性化を誘導するため、細胞傷害活性を有するCD8+細胞傷害性T細胞が得られる。
【0044】
前記リンパ球は、通常、患者の血液から採取される。前記抗原提示細胞としては、例えば、リンパ球を採取した患者から採取したものが使用できる。この他にも、例えば、自己、同種同系、および、HLAクラスIについて前記患者と一致する同種異系の抗原提示細胞が使用できる。前記抗原提示細胞としては、本発明のペプチドをCD8+T細胞に対して提示し、これを増殖刺激して活性化し得るHLA−A24分子および補助刺激分子(共刺激分子)を発現するものが好ましく、例えば、樹状細胞があげられる。抗原提示細胞は、例えば、リンパ球を採取した患者から採取または調製することが好ましい。
【0045】
本発明の製造方法により製造されるCML66特異的CD8+細胞傷害性T細胞は、例えば、白血病細胞を含む悪性腫瘍細胞に対してHLA−A24拘束性の細胞傷害性を示すという特徴的機能を有する。このため、CML66特異的CD8+細胞傷害性T細胞は、例えば、前記HLA−A24陽性患者の体内で、CML66を発現する悪性腫瘍細胞を破壊する。
【0046】
(2)第3の医薬組成物
本発明の第3の医薬組成物は、本発明のCD8+傷害性T細胞の製造方法により製造されたCML66特異的CD8+細胞傷害性T細胞を含む。この医薬組成物を、例えば、患者に有効量投与することで、悪性腫瘍を治療する細胞免疫療法が可能となる。
【0047】
抗原提示細胞の製造方法およびその用途
(1)抗原提示細胞の製造方法
本発明の抗原提示細胞の製造方法は、前述のように、下記工程(a)および(b)を含むことを特徴とする。
(a) 患者の樹状細胞を準備する工程
(b) 前記樹状細胞と、本発明のペプチドおよびその誘導体の少なくとも一方とをインキュベーションする工程
【0048】
前記(a)工程において、樹状細胞は、例えば、患者血液に存在する細胞でもよいし、人為的に分化誘導することにより調製した樹状細胞でもよい。前者の場合、例えば、血液成分分離装置を用いて、患者本人の血液から樹状細胞そのものを採取する方法により得られる。また、後者の場合、患者の未成熟樹状細胞は、例えば、末梢血単核球(PBMC)を採取し、例えば、サイトカインの一種であるGM−CSF、IL−4等の存在下で培養することにより得られる。さらに、例えば、TNF−α等で成熟樹状細胞に分化させる。そして、このようにして得られた樹状細胞を本発明のペプチドまたは誘導体とインキュベーションすることにより、例えば、CML66特異的CD8+T細胞に対する免疫誘導力が増強された樹状細胞を製造できる。
【0049】
また、本発明の抗原提示細胞の製造方法において、前記工程(b)に代えて、下記(c)工程を含んでもよい。
(c)前記樹状細胞に、本発明のポリヌクレオチドまたは本発明のベクターを導入する工程
【0050】
このように、樹状細胞に本発明のポリヌクレオチドまたは本発明のベクターを導入することで、樹状細胞内で本発明のペプチドが発現される。その結果、前記樹状細胞内で、発現したペプチドが前記細胞表面に提示されることで、抗原提示細胞が得られる。この抗原提示細胞は、CML66特異的CD8+T細胞に対する免疫誘導力が増強された樹状細胞である。ポリヌクレオチドやベクターの遺伝子導入方法としては、特に制限されず、その種類に応じて適宜決定できる。具体例としては、例えば、ウイルスベクターを利用する方法、リポフェクション法、エレクトロポレーション法、マイクロインジェクション法、細胞融合法、DEAEデキストラン法、リン酸カルシウム法等が挙げられる。
【0051】
本発明の抗原提示細胞の製造方法により製造された細胞は、下記医薬組成物として以外に、例えば、本発明のCML66特異的CD8+T細胞の製造方法における抗原提示細胞としても使用できる。
【0052】
(2)第4の医薬組成物
本発明の第4の医薬組成物は、本発明の抗原提示細胞の製造方法により製造された抗原提示細胞を含む医薬組成物である。本発明の第4の医薬組成物は、CML66特異的に免疫誘導力が向上した樹状細胞を含んでいるため、例えば、悪性腫瘍の樹状細胞療法に利用できる。また、本発明の第4の医薬組成物は、前記樹状細胞に加え、前述のCML66特異的CD8+細胞傷害性T細胞をさらに含んでいてもよい。
【実施例】
【0053】
以下、実施例を用いて本発明をさらに説明する。
【0054】
[実施例1]
本実施例では、HLAクラスI拘束性抗原ペプチドの同定を行った。腫瘍細胞やPBMCにおけるHLAクラスI発現は、FITC標識抗HLA−A24抗体を用いてフローサイトメトリー法で解析した。なお、前記フローサイトメトリー法による解析では、FACScan(BDバイオサイエンス社製)、Cell Questソフトウェア(BDバイオサイエンス社製)を用いた。
【0055】
(1)CML66ペプチドの合成
HLA−A24と結合可能性のあるペプチドとして、CML66のアミノ酸配列由来の複数のペプチドを合成した。
【0056】
(2)CML66ペプチドのHLAクラスI分子に対する結合能の測定
T2細胞は、抗原提示システムにおいて本質的な役割を持つTAP(transporter associated with antigen processing)を欠損した細胞であるため、細胞内在性の抗原を、細胞表面のHLA上にHLA−ペプチド複合体として提示することができない。しかし、細胞に添加したペプチドが、前記細胞表面でHLAと結合する場合には、細胞表面にHLA−ペプチド複合体を形成できる。このため、抗原ペプチドとHLAとの直接の結合を解析するアッセイに用いる細胞として有用であることが知られている。そこで、まず、T2細胞にHLA−A24を発現させたT2−A24細胞を、培地に1×106個となるようにまき、合成した各種CML66ペプチド10μmol/Lを添加した後、28℃で18時間培養を行った。T2−A24細胞の培地としては、Geneticin(終濃度800μg/mL)を添加した10%FCS含有RPMI1640培地を使用した。そして、培養細胞を回収し、これに、FITCで標識した抗HLA−A24抗体を添加した。これらを4℃で20分反応させた後、0.1%FCS含有PBS(−)で、前記細胞を2回洗浄し、フローサイトメーターで蛍光強度を測定した。蛍光指数は、下記式より算出した。
蛍光指数=(S−B)/B
S:各サンプルの平均蛍光強度
B:バックグラウンドの平均蛍光強度
【0057】
各種CML66ペプチドについて、フローサイトメトリー法により、HLAクラスIに対する親和性を調べた結果を下記表1に示す。下記表1に、HLA−A24に対して親和性を示したCML66ペプチドの情報、ならびに、測定結果を示す。なお、一般的に、蛍光指数測定値が1.0以上であれば、結合能が十分高いと判断でき、より高い値であれば、さらに結合能が高いと判断できる(高親和性)。
【0058】
【表1】

【0059】
前記表1に示すように、TAP欠損細胞を用いたフローサイトメトリー法によって、HLA−A24分子(HLA−A*2402)に結合し得るペプチドとして、CML66217−225(KYEIIKRDI;配列番号3)、CML6622−30(GYKLSLEPL;配列番号4)、CML6670−78(WYQDSVYYI:配列番号1)、CML6676−84(YYIDTLGRI;配列番号2)を、それぞれ初めて同定した。CML6670−78およびCML6676−84は、HLA−A24分子に対し、特に高い結合性を示した。なお、ペプチドの名称に付した数字は、CML66タンパク質におけるアミノ酸部位であり、各ペプチドのN末端アミノ酸残基とC末端アミノ酸残基の位置を示す。
【0060】
[実施例2]
本実施例では、実施例1で同定されたペプチドCML6670−78およびCML6676−84を用いて、CML66ペプチド特異的細胞傷害性T細胞を樹立し、その細胞傷害性を確認した。
【0061】
(1)CML66ペプチド特異的細胞傷害性T細胞の樹立
HLA−A24(HLA−A*2402)陽性ドナーから末梢血単核球(PBMC)を採取し、MACSビーズ(ミルテニーバイオテク社製)を用いてCD14陽性細胞を回収した。回収したCD14陽性細胞を、GM−CSF(75ng/mL)およびIL−4(8.3ng/mL)を加えた10%FCS含有RPMI1640培地で、5日培養した。培養5日目に、さらに、TNF−α(100U/mL)を加えて、単球由来成熟樹状細胞を誘導・樹立した。そして、培養8日目に樹状細胞を回収し、これを抗原提示細胞として用いた。
【0062】
同一ドナーのPBMCから、MACSビーズを用いてCD8+T細胞を回収した。そして、前記樹状細胞に10μmol/LのCML66由来ペプチド、すなわち、CML6670−78(WYQDSVYYI)またはCML6676−84(YYIDTLGRI)を添加し、1ウェルあたり100μLの培地に前記樹状細胞1×104個をまき、さらに、回収したCD8+T細胞約1×105個を加えて、これを刺激した。なお、CD8+T細胞は、10%ヒト血清含有RPMI1640培地により培養した。培養開始から8日目、さらに、mitomycin C(MMC)処理したドナーPBMC 1×104個にCML66由来ペプチド(10μmol/L)を添加し、2回目の刺激を行った。その2日後、さらに、IL−2(10U/mL)を加えて継続培養を行い、培養開始から15日目に、mitomycin C(MMC)で処理した自己PBMC 1×105個に前記CML66由来ペプチド(10μmol/L)を添加し、3回目の刺激を行った。3回目の刺激より4〜5日後、細胞傷害度を、51Cr放出試験によって測定し、ペプチド特異的な反応が見られる細胞傷害性T細胞をスクリーニングした。そして、選択した細胞を、前記CML66由来ペプチド(10μmol/L)で繰り返し刺激しながら培養した。前記CML66由来ペプチドに対する特異反応性を示した細胞は、IL−2を添加した培地で継続的に培養した。以後、4回目、5回目の刺激には、MMCで処理した自己PBMCを、6回目の刺激以降は、MMCで処理した自己LCL(リンパ芽球様細胞)を、それぞれ抗原提示細胞として用いた。なお、LCLとは、末梢血Bリンパ球にEBウイルスを感染させ、不死化させることによって樹立した細胞である。
【0063】
(2)細胞傷害性の測定
(2−1)自己LCL細胞に対するCML66由来ペプチド特異的細胞傷害
前記(1)において樹立した細胞傷害性T細胞について、従来公知の51Cr放出試験により細胞傷害活性を確認した。なお、標的抗原特異的細胞傷害活性は、CML66由来ペプチド添加および無添加での比較により検討した。
【0064】
まず、51Cr(Na251CrO4)でラベルされた標的細胞を準備した。96穴丸底プレートに、1ウェルあたり200μLの10%FCS含有RPMI1640培地と前記標的細胞0.5×104個とを加え、さらに、所定の細胞数の細胞傷害性T細胞を添加して、5時間培養を行った。なお、CML66由来ペプチドを添加する場合は、予め、CML66由来ペプチドの存在下で標的細胞を2時間培養した後に、細胞傷害性T細胞を添加した。標的細胞として前述のLCLを使用した。細胞傷害性T細胞(エフェクター;E)と標的細胞(ターゲット;T)との比率(E:T比)は、5:1とした。そして、標的細胞と細胞傷害性T細胞とを反応させた後、培養液の上清を回収して51Cr放出量を測定した。細胞傷害度は、下記式より算出した。
細胞傷害度=(S−N)/(M−N)
S:各サンプル51Cr放出量
N:自然51Cr放出量
M:最大51Cr放出量
【0065】
これらの結果を、図1に示す。同図(A)は、CML6670−78で誘導した細胞傷害性T細胞による細胞傷害度を示すグラフであり、同図(B)は、CML6676−84で誘導した細胞傷害性T細胞による細胞傷害度を示すグラフである。両図において、横軸は、各CML66由来ペプチド濃度であり、縦軸は、CML66由来ペプチド特異的細胞傷害性T細胞による細胞傷害度(%)である。また、両図において、○は、自己LCL細胞にCML66由来ペプチドを添加、●は、HLA−A*2402陰性健常者由来LCL細胞にCML66由来ペプチドを添加した、3rd party(第三者陰性対照)に対する細胞傷害性T細胞アッセイの結果をそれぞれ示す。同図(A)に示すように、樹立した細胞傷害性T細胞は、CML6670−78(WYQDSVYYI)を添加された場合に、HLA−A*2402陽性自己LCL細胞に対する傷害性を示した。また、データは示さないが、自己由来LCL細胞を標的とした場合でも、CML66ペプチドの非存在下では、細胞傷害が全く見られないことは確認している。このことから、本実施例で樹立された細胞傷害性T細胞の細胞傷害性は、CML6670−78特異性を示すことが証明された。さらに、この細胞傷害性T細胞は、CML6670−78を添加したHLA−A*2402陰性健常者由来LCL細胞(3rd party)に対して細胞傷害性を示さなかった。また、同図(B)に示すように、CML6676−84を用いた場合も、同様の結果が得られた。以上のことから、樹立された細胞傷害性T細胞は、HLA−A*2402に特異的に結合したCML66由来ペプチドを認識して、標的細胞を傷害すると考えられた。
【0066】
(2−2)HLA−A24(HLA−A*2402)陽性細胞による細胞傷害
CML66由来ペプチド特異的細胞傷害が、HLA−A*2402に拘束されることを確認するために、HLA−A*2402陽性自己LCL細胞、HLA−A*2402陽性非自己LCL、HLA−A*2402陰性非自己LCL、白血病患者由来細胞株であるC1R細胞にHLA−A*2402を発現させたC1R−A*2402細胞を標的細胞として用いた細胞傷害性アッセイを行った。実験の条件は、細胞傷害時のCML6676−84の濃度を10μmol/Lとした以外は、本実施例の(2−1)と同様に行った。また、各種抗体を添加した際の細胞傷害性についても確認した。これは、CML6676−84の濃度を10μmol/Lとし、細胞傷害性T細胞を加える直前30分間に10μg/mLの抗HLAクラスIモノクローナル抗体(w6/32)または抗HLA−DRモノクローナル抗体(L243)を加えた以外は、前記(2−1)と同様に行った。
【0067】
これらの結果を、図2に示す。同図(A)は、CML6676−84ペプチド存在下もしくは非存在下における細胞傷害性T細胞(CTL)による細胞傷害性アッセイの結果であり、同図(B)は、さらに、各種抗体存在下での細胞傷害度を示す結果である。なお、両図において、「*」は、バックグラウンド以下の値であることを示す。同図(A)に示すように、標的細胞のHLA−A*2402の存在下でのみ、CML6676−84による細胞傷害が起こることがわかった。また、同図(B)に示すように、HLA−A*2402を認識する抗HLAクラスI抗体によって細胞傷害が阻害されたのに対し、HLA−A*2402を認識しない抗HLA−DR抗体では全く阻害効果が認められなかった。以上の結果から、CML66由来ペプチド特異的細胞傷害が、HLA−A*2402に拘束されることが確認された。
【0068】
(3)樹立した細胞傷害性T細胞のHLA−A24拘束性のさらなる確認
細胞傷害性T細胞のHLA−A24拘束性をさらに確認するために、各種細胞を標的細胞として用いて、前記(2)と同様にして、細胞傷害性T細胞の細胞傷害性を調べた。標的細胞は、HLA−A24(HLA−A*2402)陽性細胞として、KH88(慢性骨髄性白血病急性転化型ヒト株化細胞)、KCL22(慢性骨髄性白血病急性転化型ヒト株化細胞)、KAZZ(慢性骨髄性白血病急性転化型ヒト株化細胞)、SAS527(慢性骨髄性白血病急性転化型ヒト株化細胞)、OUN−1(慢性骨髄性白血病急性転化型ヒト株化細胞)およびMEG01(慢性骨髄性白血病急性転化型ヒト株化細胞)を使用し、HLA−A24(HLA−A*2402)陰性細胞として、K562(慢性骨髄性白血病急性転化型ヒト株化細胞)、KT−1(慢性骨髄性白血病急性転化型ヒト株化細胞)およびKG−1(急性骨髄性白血病M1型ヒト株化細胞)を使用した。また、健常者由来PBMC(末梢血単核球)、CB(ヒト臍帯血細胞)およびCBMC(ヒト臍帯血単核細胞)を対照として使用した。各種細胞の培養には、10%FCS含有RPMI1640培地を使用した。細胞傷害性T細胞(エフェクター;E)と、標的細胞(ターゲット;T)との比率(E:T比)は、CML6670−78特異的細胞傷害性T細胞を用いた実験では、40:1、20:1、10:1、または、5:1とし、CML6676−84特異的細胞傷害性T細胞を用いた実験では、10:1、5:1、または2.5:1とした。これらの結果を、図3および図4のグラフに示す。両図において、横軸は、CML66特異的な細胞傷害性T細胞(CTL)による細胞傷害度(%)である。
【0069】
また、一部の標的細胞については、各種抗体を添加した際の細胞傷害についても確認した。これは、エフェクターである細胞傷害性T細胞を添加する前、前記標的細胞に対して、抗HLA−クラスI抗体(w6/32)または抗HLA−DR抗体(L243)を終濃度10μg/mLになるように加え、その後1時間培養し、細胞傷害性T細胞を添加した。なお、E:T比は10:1とし、コントロールとしては、抗体に代えてPBSを添加した。これらの結果を、図5のグラフに示す。同図において、横軸は、CML66特異的な細胞傷害性T細胞(CTL)による細胞傷害度(%)である。
【0070】
なお、前記各種標的細胞におけるCML66発現量を、予めリアルタイムPCR法により確認した。まず、各腫瘍細胞よりトータルRNAを抽出し、公知の方法によりcDNAを調製した。そして、このcDNAを鋳型として、市販のキット(TaqMan(商標)Gene Expression assays、CML66 primer、GAPDH primer、Applied Biosystems社製)を用いてリアルタイムPCRを行い、CML66 mRNA copy数を測定した。解析は、ABI Prism 7700(Applied Biosystems社製)により行った。そして、Comparative Ct法を用いて、K562細胞株のCML66発現量を1としたときの、各種細胞における発現の相対値を計算した。その結果を図6の棒グラフに示す。同図において、縦軸は、CML66 mRNAの相対発現量である。図示のとおり、慢性骨髄性白血病(CML)患者由来株化細胞である、K562細胞、KH88細胞、KCL22細胞、KAZZ細胞、SAS527細胞、KT−1細胞、OUN−1細胞、MEG01細胞、および急性骨髄性白血病(AML)患者由来株化細胞であるKG−1細胞のいずれも、CML66のmRNAを発現し、特に、KCL22およびKT−1が、CML66のmRNAを高発現することが確認された。
【0071】
図3は、CML6670−78(WYQDSVYYI)特異的細胞傷害性T細胞による白血病細胞に対する細胞傷害度を示すグラフであり、図4は、CMLCML6676−84(YYIDTLGRI)特異的細胞傷害性T細胞による白血病細胞に対する細胞傷害度を示すグラフである。なお、同図において、「*」は、バックグラウンド以下の値であることを示す。CML6670−78(WYQDSVYYI)特異的細胞傷害性T細胞の場合、同図上段に示すように、CML6670−78特異的細胞傷害性T細胞は、CML66を強く発現しているHLA−A24陽性白血病細胞(KH88、KCL22、KAZZ、SAS527)に対して、CML6670−78無添加であっても、高い細胞傷害性を示すことが確認された。他方、同図中段に示すように、CML66を強く発現している細胞であっても、HLA−A24陰性白血病細胞(KT−1、KG−1、K562)に対しては、細胞傷害性は示さなかった。さらに、同図下段に示すように、HLA−A24陽性健常者由来細胞に対しても、細胞傷害性は示さなかった。また、CMLCML6676−84(YYIDTLGRI)特異的細胞傷害性T細胞の場合、図4に示すように、CML6676−84特異的細胞傷害性T細胞は、HLA−A24陽性白血病細胞(OUN−1、MEG01)に対してのみ、高い細胞傷害性を示すことが確認された。
【0072】
図5は、さらに各種抗体存在下での細胞傷害度を示すグラフであり、同図(A)は、CML6670−78特異的細胞傷害性T細胞の結果であり、同図(B)は、CML6676−84特異的細胞傷害性T細胞の結果であり。両図に示すように、細胞傷害性T細胞の細胞傷害性は、抗HLA−クラスI抗体を添加することによって阻害された。このことから、細胞傷害性T細胞は、HLA−A24拘束性細胞傷害を示すことが確認された。これらの結果は、CML66が、腫瘍細胞内で断片化され、ペプチド抗原CML6670−78およびCML6676−84が腫瘍細胞表面上のHLA−A24分子と結合して提示されていることを意味している。同時に、前記CML66抗原ペプチドを標的として、HLA−A24陽性者に標的特異的細胞傷害性T細胞を誘導できることを意味している。
【0073】
[実施例3]
本実施例では、CML66が、癌免疫療法の標的分子になり得ることをさらに検証する目的で、白血病患者の末梢血中でのCML66特異的細胞傷害性T細胞の存在を調べた。
【0074】
(1)白血病細胞でのCML66発現の定量
HLA−A24陽性の急性骨髄性白血病患者、慢性骨髄性白血病患者(慢性期及び急性転化期)、急性リンパ性白血病患者由来の各種細胞、さらに慢性骨髄性白血病患者骨髄由来CD34陽性細胞について、前述と同様のリアルタイムPCR法により、CML66 mRNAの発現を定量した。なお、CD34陽性細胞の回収には、実施例2と同様に、MACSビーズ(ミルテニーバイオテク社製)を用いた。
【0075】
これらの結果を、図7〜10のグラフに示す。図7は、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、進行期慢性骨髄単球性白血病(CMMoL)、急性リンパ性白血病(ALL)患者由来の細胞、対照としてCML患者由来の細胞であるK562細胞、および健常者由来の末梢血単核球(PBMC)、健常者由来のヒト臍帯血細胞(CB)の結果を示す図である。図8は、急性骨髄性白血病(AML)の各種サブタイプ(M0、M1、M2、M3、M4、M5b)の患者由来の細胞、およびK562についての結果を示す図である。図9は、CMLの臨床病期である急性転化期(CML−BC:Blast Crisis)、慢性期(CML−CP:Chronic Phase)の患者由来の細胞、およびK562についての結果を示す図である。図10は、CML慢性期(CML−CP)の患者または健常者から単離したCD34陽性細胞、およびK562についての結果を示す図である。CML患者のCD34陽性細胞は、CMLの白血病性幹細胞を含むと考えられている。図7〜10において、縦軸は、それぞれ、CML66 mRNAの相対発現量である。図示のとおり、急性骨髄性白血病細胞(AML)、急性転化期の慢性骨髄性白血病細胞(CML−BC)、急性リンパ性白血病細胞(ALL)およびCD34陽性慢性骨髄性白血病細胞(CML−CP CD34+)のいずれにもCML66 mRNAの高発現が確認された。以上の結果は、CML66は、単にAML、CML、CMMoL、ALLの治療の標的として有望であるというだけでなく、Imatinibのような従来の分子標的薬が奏功しにくい、より悪性度の高い急性転化期CMLおよびCMLの白血病性幹細胞に対しても有効である可能性を示している。
【0076】
(2)CML66特異的細胞傷害性T細胞頻度の測定
まず、HLA−A24陽性の急性骨髄性及びリンパ性白血病患者(化学療法後並びに同種骨髄移植後)、ならびに健常者より末梢血単核球(PBMC)を分離し、1×106〜2×106個となるようにまき、さらにCML6670−78またはCML6676−84(10μmol/L)を加えた。前記PBMCは、IL−7(5ng/mL)およびIL−12(100pg/mL)を含有する10%ヒト血清含有RPMI1640培地で培養し、1週間ごとに、CML6670−78またはCML6676−84(10μmol/L)を添加した。培養4日目からは、IL−2(10U/mL)を加えて継続培養し、培養16日目頃に、ELISPOT法によりCML66に特異的な細胞傷害性T細胞の頻度を測定した。なお、CML66由来ペプチド未添加培養群を陰性コントロールとした。
【0077】
ELISPOT法は、以下の通り行った。まず、底がニトロセルロース膜で覆われた96穴MultiScreen−HAプレートに、抗IFN−γモノクローナル抗体(10μg/mL)を添加し、4℃で18時間放置することによって、前記膜に抗体を結合させた。前記膜をPBS(−)で洗浄し、10%FCS・RPMI1640で、37℃、1時間、前記膜をコーティーングした後、前述のT2−A24細胞5×104個をまき、CML6670−78またはCML6676−84(10μmol/L)を添加して、1時間培養を行った。前記T2−24細胞は、10%FCS含有RPMI1640により培養し、その後、各患者のPBMCをまいて、18時間反応させた。0.1%Tween20を含有するPBS(−)で前記プレートを洗浄し、ウサギ抗ヒトIFN−γ抗体を加えて90分、続いて、ヤギ抗ウサギIgG抗体を加えて90分おいた。そして、最後に、混合液(0.1mol/L酢酸ナトリウム(pH5.0)/3−amino−9−Ethylcarbazole/N,N dimethylformamide/0.015% H2O2)100μLを加えて40分反応させて、発色させた。前記プレートを水でよく洗浄し、乾燥させた後、倒立顕微鏡により、スポットを確認し、CML66特異的細胞傷害性T細胞の頻度を測定した。
【0078】
図11に、前記ELISPOT法による、CML6676−84特異的細胞傷害性T細胞頻度の測定結果を示す。同図(A)は、患者末梢血中に存在する、CML6676−84特異的細胞傷害性T細胞の頻度を示すELISPOT法による解析結果を示すグラフであり、同図(B)は、患者二名に関する前記ELISPOT法で得られたスポットの写真である。また、両図において、「+」は、CML6676−84添加の結果、「−」は、CML6676−84無添加の結果である。同図(A)に示すように、健常者(○、△、□)末梢血中にはCML6676−84に応答して増加する細胞傷害性T細胞がほとんど存在しなかった。一方、急性リンパ性白血病(ALL)患者(▲、×、●)および急性骨髄性白血病(AML)患者(◆、■、▼)の末梢血中には、CML6676−84に応答して増加する細胞傷害性T細胞が存在することが確認できた。また、同図(B)に示すように、CML6676−84ペプチド添加の場合、無添加よりもスポットの増加が目視によっても顕著であった。なお、図示していないが、CML6670−78ペプチドを用いた場合にも、ほぼ同様の結果が得られることが確認できた。
【0079】
前述の図7〜10に示すように、白血病患者由来の細胞において、CML66の高発現が確認された。また、前述のように、ELISPOTアッセイにより、それぞれの患者の末梢血中に、CML6670−78またはCML6676−84を特異的に認識する細胞傷害性T細胞が存在することが確認された。この結果は、白血病患者内で前記CML由来66ペプチドが細胞傷害性T細胞の標的抗原として、実際に機能していることを示している。このため、ペプチドワクチンCML6670−78およびCML6676−84によれば、これらの細胞傷害性T細胞を活性化させ、腫瘍細胞を排除できる可能性が非常に高いといえる。以上の結果から、CML6670−78およびCML6676−84が癌ワクチンとして有用であることが臨床的に証明されたといえる。
【0080】
本発明のペプチドは、例えば、骨髄性白血病の他に、慢性骨髄単球性白血病や急性リンパ性白血病等を含む各種白血病患者由来の細胞に対して、腫瘍抗原ペプチドとして機能し、また、その他にも、メラノーマ細胞株や各種固形癌株化細胞、前立腺がん患者由来の細胞に対しても、腫瘍抗原ペプチドとして機能することができる。
【産業上の利用可能性】
【0081】
以上のように、本発明は、例えば、白血病を含む悪性腫瘍の医療分野、特に、細胞免疫療法、ワクチン療法、遺伝子治療等を含む免疫療法の分野で有用である。
【図面の簡単な説明】
【0082】
【図1】図1は、本発明の実施例2において、CML由来ペプチドで誘導した細胞傷害性T細胞による細胞傷害度を示すグラフであり、(A)は、CML6670−78を使用した結果であり、(B)は、CML6676−84を使用した結果である。
【図2】図2(A)は、前記実施例2において、CML6676−84存在下もしくは非存在下での細胞傷害性T細胞(CTL)による細胞傷害度を示すグラフであり、図2(B)は、各種HLA阻害抗体の存在下における細胞傷害度を示すグラフである。
【図3】図3は、前記実施例2における、CML6670−78特異的な細胞傷害性T細胞(CTL)による各種白血病患者由来の細胞に対する細胞傷害度を示すグラフである。
【図4】図4は、前記実施例2における、CML6676−84特異的な細胞傷害性T細胞(CTL)による各種白血病患者由来の細胞に対する細胞傷害度を示すグラフである。
【図5】図5は、前記実施例2における、各種抗体の添加による、CML66由来ペプチドで誘導した細胞傷害性T細胞の細胞傷害度を示すグラフであり、(A)は、CML6670−78で誘導した結果であり、(B)は、CML6676−84で誘導した結果である。
【図6】図6は、前記実施例2における、各種標的細胞のCML66 mRNA発現量を示すグラフである。
【図7】図7は、本発明の実施例3における、各種白血病患者由来の細胞のCML66 mRNA発現量を示すグラフである。
【図8】図8は、前記実施例3における、急性骨髄性白血病(AML)患者の各臨床病型ごとの患者白血病細胞のCML66 mRNA発現量を示すグラフである。
【図9】図9は、前記実施例3における、慢性骨髄性白血病の急性転化期(CML−BC)、および慢性期(CML−CP)の患者骨髄由来白血病細胞のCML66 mRNA発現量を示すグラフである。
【図10】図10は、前記実施例3における、CML慢性期(CML−CP)の患者または健常者から単離したCD34陽性細胞のCML66 mRNA発現量を示すグラフである。
【図11】図11(A)は、前記実施例3における、各種白血病患者の末梢血中に存在するCML6676−84特異的細胞傷害性T細胞の頻度を示すグラフであり、同図(B)は、代表的な陽性例二症例での前記CML6676−84特異的細胞傷害性T細胞のスポットを示す写真である。
【特許請求の範囲】
【請求項1】
下記(1)〜(4)のいずれかに記載のペプチド。
(1)配列番号1のアミノ酸配列からなるペプチド
(2)配列番号2のアミノ酸配列からなるペプチド
(3)前記(1)または(2)のペプチドとのアミノ酸配列の相同性が80%以上のペプチドであって、HLA−A24分子と結合することでCD8+T細胞に特異的に認識されうるHLA−A24拘束性抗原ペプチド
(4)前記(1)または(2)のペプチドのアミノ酸配列において、1個または数個のアミノ酸が、欠失、置換もしくは付加されたアミノ酸配列からなるペプチドであって、HLA−A24分子と結合することでCD8+T細胞に特異的に認識されうるHLA−A24拘束性抗原ペプチド。
【請求項2】
前記HLA−A24分子の遺伝子型が、A*2402である、請求項1に記載のペプチド。
【請求項3】
CD8+T細胞の細胞傷害性の活性化を誘導する活性化誘導剤であって、
請求項1および2記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つを含む活性化誘導剤。
【請求項4】
CD8+T細胞の細胞傷害性の活性化を誘導する活性化誘導剤であって、
請求項1および2記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つをコードするポリヌクレオチドを含む活性化誘導剤。
【請求項5】
さらに、ベクターを含み、前記ポリヌクレオチドが前記ベクターに挿入されている、請求項4記載の活性化誘導剤。
【請求項6】
癌免疫療法に用いる医薬組成物であって、
抗原ペプチドとして、請求項1および2記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つを含む医薬組成物。
【請求項7】
癌免疫療法に用いる医薬組成物であって、
請求項1および2記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つをコードするポリヌクレオチドを含む医薬組成物。
【請求項8】
さらに、ベクターを含み、前記ポリヌクレオチドが前記ベクターに挿入されている、請求項7記載の医薬組成物。
【請求項9】
CD8+細胞傷害性T細胞の製造方法であって、
下記工程(A)および(B)を含む細胞傷害性T細胞の製造方法。
(A) 患者のリンパ球を準備する工程
(B) 前記リンパ球と、請求項1および2に記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つとをインキュベーションする工程
【請求項10】
前記工程(B)において、前記リンパ球と、前記ペプチドおよび前記誘導体の少なくとも一方を提示する抗原提示細胞とをインキュベーションする、請求項9記載の細胞傷害性T細胞の製造方法。
【請求項11】
抗原提示細胞の製造方法であって、下記工程(a)および(b)を含む抗原提示細胞の製造方法。
(a) 患者の樹状細胞を準備する工程
(b) 前記樹状細胞と、請求項1および2に記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つとをインキュベーションする工程
【請求項12】
前記工程(a)において、患者の単球を準備し、前記単球を分化誘導することにより、樹状細胞を調製する、請求項11記載の抗原提示細胞の製造方法。
【請求項13】
前記工程(b)に代えて、下記(c)工程を含む、請求項11または12記載の抗原提示細胞の製造方法。
(c) 前記樹状細胞に、請求項1および2に記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つをコードするポリヌクレオチドを導入する工程
【請求項14】
前記(c)工程において、前記樹状細胞に、前記ポリヌクレオチドが挿入されたベクターを導入する、請求項13記載の抗原提示細胞の製造方法。
【請求項15】
癌免疫療法に用いる医薬組成物であって、
請求項9または10に記載の製造方法により製造されたCD8+細胞傷害性T細胞、および、請求項11から14のいずれか一項に記載の製造方法により製造された抗原提示細胞の少なくとも一方を含む医薬組成物。
【請求項1】
下記(1)〜(4)のいずれかに記載のペプチド。
(1)配列番号1のアミノ酸配列からなるペプチド
(2)配列番号2のアミノ酸配列からなるペプチド
(3)前記(1)または(2)のペプチドとのアミノ酸配列の相同性が80%以上のペプチドであって、HLA−A24分子と結合することでCD8+T細胞に特異的に認識されうるHLA−A24拘束性抗原ペプチド
(4)前記(1)または(2)のペプチドのアミノ酸配列において、1個または数個のアミノ酸が、欠失、置換もしくは付加されたアミノ酸配列からなるペプチドであって、HLA−A24分子と結合することでCD8+T細胞に特異的に認識されうるHLA−A24拘束性抗原ペプチド。
【請求項2】
前記HLA−A24分子の遺伝子型が、A*2402である、請求項1に記載のペプチド。
【請求項3】
CD8+T細胞の細胞傷害性の活性化を誘導する活性化誘導剤であって、
請求項1および2記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つを含む活性化誘導剤。
【請求項4】
CD8+T細胞の細胞傷害性の活性化を誘導する活性化誘導剤であって、
請求項1および2記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つをコードするポリヌクレオチドを含む活性化誘導剤。
【請求項5】
さらに、ベクターを含み、前記ポリヌクレオチドが前記ベクターに挿入されている、請求項4記載の活性化誘導剤。
【請求項6】
癌免疫療法に用いる医薬組成物であって、
抗原ペプチドとして、請求項1および2記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つを含む医薬組成物。
【請求項7】
癌免疫療法に用いる医薬組成物であって、
請求項1および2記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つをコードするポリヌクレオチドを含む医薬組成物。
【請求項8】
さらに、ベクターを含み、前記ポリヌクレオチドが前記ベクターに挿入されている、請求項7記載の医薬組成物。
【請求項9】
CD8+細胞傷害性T細胞の製造方法であって、
下記工程(A)および(B)を含む細胞傷害性T細胞の製造方法。
(A) 患者のリンパ球を準備する工程
(B) 前記リンパ球と、請求項1および2に記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つとをインキュベーションする工程
【請求項10】
前記工程(B)において、前記リンパ球と、前記ペプチドおよび前記誘導体の少なくとも一方を提示する抗原提示細胞とをインキュベーションする、請求項9記載の細胞傷害性T細胞の製造方法。
【請求項11】
抗原提示細胞の製造方法であって、下記工程(a)および(b)を含む抗原提示細胞の製造方法。
(a) 患者の樹状細胞を準備する工程
(b) 前記樹状細胞と、請求項1および2に記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つとをインキュベーションする工程
【請求項12】
前記工程(a)において、患者の単球を準備し、前記単球を分化誘導することにより、樹状細胞を調製する、請求項11記載の抗原提示細胞の製造方法。
【請求項13】
前記工程(b)に代えて、下記(c)工程を含む、請求項11または12記載の抗原提示細胞の製造方法。
(c) 前記樹状細胞に、請求項1および2に記載のペプチドならびにその誘導体からなる群から選択された少なくとも1つをコードするポリヌクレオチドを導入する工程
【請求項14】
前記(c)工程において、前記樹状細胞に、前記ポリヌクレオチドが挿入されたベクターを導入する、請求項13記載の抗原提示細胞の製造方法。
【請求項15】
癌免疫療法に用いる医薬組成物であって、
請求項9または10に記載の製造方法により製造されたCD8+細胞傷害性T細胞、および、請求項11から14のいずれか一項に記載の製造方法により製造された抗原提示細胞の少なくとも一方を含む医薬組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2009−35534(P2009−35534A)
【公開日】平成21年2月19日(2009.2.19)
【国際特許分類】
【出願番号】特願2008−163922(P2008−163922)
【出願日】平成20年6月24日(2008.6.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 電気通信回線による発表: 掲載年月日:平成20年4月16日 掲載アドレス1: http://www3.interscience.wiley.com/journal/118489811/home 掲載アドレス2: http://www3.interscience.wiley.com/journal/120091663/abstract?CRETRY=1&SRETRY=0 掲載アドレス3: http://www3.interscience.wiley.com/user/accessdenied?ID=120091663&Act=2138&Code=4717&Page=/cgi−bin/fulltext/120091663/HTMLSTART 掲載アドレス4: http://www3.interscience.wiley.com/user/accessdenied?ID=120091663&Act=2138&Code=4717&Page=/cgi−bin/fulltext/120091663/PDFSTART
【出願人】(504147254)国立大学法人愛媛大学 (214)
【Fターム(参考)】
【公開日】平成21年2月19日(2009.2.19)
【国際特許分類】
【出願日】平成20年6月24日(2008.6.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 電気通信回線による発表: 掲載年月日:平成20年4月16日 掲載アドレス1: http://www3.interscience.wiley.com/journal/118489811/home 掲載アドレス2: http://www3.interscience.wiley.com/journal/120091663/abstract?CRETRY=1&SRETRY=0 掲載アドレス3: http://www3.interscience.wiley.com/user/accessdenied?ID=120091663&Act=2138&Code=4717&Page=/cgi−bin/fulltext/120091663/HTMLSTART 掲載アドレス4: http://www3.interscience.wiley.com/user/accessdenied?ID=120091663&Act=2138&Code=4717&Page=/cgi−bin/fulltext/120091663/PDFSTART
【出願人】(504147254)国立大学法人愛媛大学 (214)
【Fターム(参考)】
[ Back to top ]

