HLA結合性ペプチド、その前駆体、それをコードするDNA断片および組み換えベクター
【課題】HLA−A型分子との結合性に優れるHLA結合性ペプチドを提供する。
【解決手段】HLA−A型分子に結合するHLA結合性ペプチドであって、特定のHLA結合性ペプチドを提供する。
【解決手段】HLA−A型分子に結合するHLA結合性ペプチドであって、特定のHLA結合性ペプチドを提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、HLA結合性ペプチド、その前駆体、それをコードするDNA断片および組み換えベクターに関する。
【背景技術】
【0002】
ヒト主要組織適合抗原(HLA)の遺伝子は、6番目の染色体の短腕に位置しており、HLAは、クラスI分子(HLA−A型、B型、C型)と、クラスII分子(HLA−DP型、DQ型、DR型)に大別される。特異的免疫応答において、細胞傷害性T細胞(CTL)が腫瘍細胞、移植片細胞、ウイルス感染細胞などの細胞表面抗原を認識する時、クラスI分子と一緒に認識することが必須であり、クラスI分子は、ほとんどすべての細胞の膜表面上に存在している。
【0003】
デングウイルスなどのウイルスに感染すると、自然免疫によるウイルス排除反応が起こり、次いで、特異的免疫応答が誘導され、ウイルスの排除反応が起こる。
【0004】
特異的免疫応答では、体液中のウイルスが中和抗体により排除され、細胞内のウイルスが細胞傷害性T細胞(CTL)により排除される。すなわち、CTLは、感染細胞表面のHLAクラスI分子に提示された、8〜11のアミノ酸からなるウイルス抗原(CTLエピトープ)を特異的に認識し、感染細胞を傷害することによりウイルスを排除する。したがって、このようなウイルスに特異的なCTLエピトープを同定することは、ウイルスに対する予防および治療ワクチンを作成する上で重要である。
【0005】
この種の技術として、特許文献1記載のものがある。特許文献1には、特定のアミノ酸配列からなるオリゴペプチドは、HLA結合性を有する旨が記載されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開平8−151396号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、上記文献記載の従来技術は、以下の点で改善の余地を有していた。
【0008】
第一に、上記文献記載のHLA結合性ペプチドは、HLA分子と有効に結合するか否かは不明であり、HLAとの結合性の面でさらなる改善の余地を有していた。
【0009】
第二に、上記文献記載のHLA結合性ペプチドは、HLA−DQ4と結合性がある旨記載されている。しかし、欧米人種に多いHLA−A2分子(HLA−A*0201遺伝子あるいはHLA−A*0206遺伝子などの産物)および日本人種に多いHLA−A24分子(HLA−A*2402遺伝子などの産物)に対して結合するか否かは不明である。
【0010】
本発明は上記事情に鑑みてなされたものであり、特定の型のHLA分子との結合性に優れるHLA結合性ペプチドを提供する。
【課題を解決するための手段】
【0011】
本発明によれば、HLA−A型分子に結合するHLA結合性ペプチドであって、配列番号1から50からなる群より選ばれる1種以上のアミノ酸配列を含み、8以上11以下のアミノ酸残基からなるHLA結合性ペプチドが提供される。
【発明の効果】
【0012】
本発明によれば、特定のアミノ酸配列を含むため、HLA−A型分子との結合性に優れるHLA結合性ペプチドが得られる。
【図面の簡単な説明】
【0013】
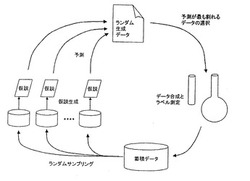
【図1】実施例で用いた能動学習実験計画を説明する模式図である。
【発明を実施するための形態】
【0014】
以下、本発明の実施の形態について、図面を用いて説明する。尚、すべての図面において、同様な構成要素には同様の符号を付し、適宜説明を省略する。
【0015】
<実施形態1>
本実施形態では、能動学習実験法(特開平11−316754号公報)を用いて得られる仮説により予測された、HLA分子との結合性が、−logKd値に換算して3以上であるアミノ酸配列を含み、8以上11以下のアミノ酸残基からなるペプチドを、HLA結合性ペプチド候補とした。そして結合実験を行った結果、実際にこれらのペプチドがHLA結合性ペプチドであることを確認した。
【0016】
その結果、HLA分子との結合性が、−logKd値に換算して3以上であるアミノ酸配列を含むため、HLA−A型分子との結合性に優れる、多数のHLA結合性ペプチドを効率よく得ることができた。
【0017】
具体的には、本実施形態に係るHLA結合性ペプチドは、HLA−A型分子に結合するHLA結合性ペプチドであって、後述する配列番号1から50からなる群より選ばれる1種以上のアミノ酸配列を含み、8以上11以下のアミノ酸残基からなるHLA結合性ペプチドである。
【0018】
ヒトHLA−A型のうち、日本人種の約50%がHLA−A24型をもつ。また、ドイツ人などの欧米人は、HLA−A2型が多い。
【0019】
なお、これらの配列は、いずれもデング熱を起こすデングウイルスの所定のゲノムタンパク質に含まれる9アミノ酸残基からなる配列である。
【0020】
配列番号1から25の配列を、下記の表1に示す。
【0021】
【表1】

【0022】
配列番号1から25の配列は、デングウイルス2型(血清型type2)の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号1から25の配列は、上述の方法により予測された、HLA−A24分子(HLA−A*2402遺伝子の産物)との結合性が上位の配列である。なお、配列番号1から25まで結合性の優れる順に並んでいる。すなわち、配列番号1が、最も結合性が優れると予測される配列である。なお、各配列のHLA−A24分子との結合性の予測スコアおよび結合実験データの項目の単位は、いずれも−logKd値にて示されている。
【0023】
配列番号26から40の配列を、下記の表2に示す。
【0024】
【表2】

【0025】
配列番号26から40の配列は、デングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号26から40の配列は、上述の方法により予測された、HLA−A2分子(HLA−A*0201遺伝子の産物)との結合性が上位の配列である。なお、配列番号26から40まで結合性の優れる順に並んでいる。すなわち、配列番号26が、最も結合性が優れると予測される配列である。なお、各配列のHLA−A2分子との結合性の予測スコアおよび結合実験データの項目の単位は、いずれも−logKd値にて示されている。
【0026】
配列番号41から50の配列を、下記の表3に示す。
【0027】
【表3】

【0028】
配列番号41から50の配列は、デングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号41から50の配列は、上述の方法により予測された、HLA−A2分子(HLA−A*0206遺伝子の産物)との結合性が上位の配列である。なお、配列番号41から50まで結合性の優れる順に並んでいる。すなわち、配列番号41が、最も結合性が優れると予測される配列である。なお、各配列のHLA−A2分子との結合性の予測スコアおよび結合実験データの項目の単位は、いずれも−logKd値にて示されている。
【0029】
なお、詳しくは、後述するが、表1〜表3のいずれにおいても、予測スコアと結合実験データとの間に関連性が存在していることが明らかである。すなわち、多少の誤差はあるが、上述の方法により予測された、HLA−A分子との結合性が高いペプチドは、実験的に確認してもHLA−A分子との結合性が高いといえる。
【0030】
従来は、このように実験計画法を活用してHLA結合性ペプチドを見出す手法は採られていなかったために、実験的にHLA結合性が確認された極少数のHLA結合性ペプチドが知られていたに過ぎなかった。そのため、従来の手法で全くランダムに9アミノ酸残基からなるペプチドを合成し、HLA分子との結合実験を行っても、結合性が−logKd値に換算して6を超えるものは、確率的には約100個に1個しかなかった。
【0031】
本実施形態においては、このように実験計画法を活用してHLA結合性ペプチドを見出す手法を採用したため、上記のような、50配列にも及ぶ多数のHLA結合性ペプチドを見出すことができた。また、得られたHLA結合性ペプチドの一部についてHLA結合性を実験的に確認したところ、実験を行った配列のいずれにおいても予測と同等かそれ以上のHLAとの優れた結合性が確認された。
【0032】
なお、これらの配列の中でも、配列番号1、2、4、5、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49および50からなる群より選ばれる1種以上のアミノ酸配列を含むHLA結合性ペプチドは、実験によりヒトHLA−A型分子との結合性が確認されている。このため、確実にヒトHLA−A型分子との結合性に優れるHLA結合性ペプチドであると言える。
【0033】
ここで、本実施形態に係るHLA結合性ペプチドの、HLA分子との結合性は、−logKd値に換算して3以上とすることができ、特に好ましくは5以上であり、さらに好ましくは5.4以上である。
【0034】
生化学の分野では、−logKd値に換算しておおよそ結合能の3前後が、実際にペプチドがHLAをはじめとするMHCに結合するかしないかのしきい値として知られている。よって、HLA分子との結合性が−logKd値に換算して3以上であれば、HLA結合性ペプチドであると言える。
【0035】
また、HLA−A24分子の場合であれば、HLA−A24分子との結合性が−logKd値に換算して5以上であれば、HLA分子に対する結合性が優れるペプチドが得られるため、免疫疾患などに対する効果的な治療薬、予防薬などの開発に好適に利用できる。
【0036】
また、HLA−A24分子との結合性が−logKd値に換算して5.4以上であれば、HLA分子に対する結合性が特に優れるペプチドが得られるため、免疫疾患などに対してさらに効果的な治療薬、予防薬などの開発に好適に利用できる。
【0037】
また、本実施形態に係るHLA結合性ペプチドは、8以上11以下のアミノ酸残基からなる構成とすることができる。
【0038】
このように、8以上11以下のアミノ酸残基からなるペプチドであれば、HLA分子との結合性に優れる。また、細胞傷害性T細胞(CTL)は、ウイルスなどに感染した細胞表面のHLAクラスI分子に提示された、8〜11のアミノ酸からなるウイルス抗原(CTLエピトープ)を特異的に認識し、感染細胞を傷害することによりウイルスを排除する。そして、このようなウイルスなどに特異的な8〜11のアミノ酸からなるCTLエピトープを作ることは、ウイルスなどに対する治療または予防のためのワクチンを作成する上で重要である。
【0039】
例えば、上記のHLA結合性ペプチドは、アミノ酸残基のみからなるペプチドであってもよいが、特に限定するものではない。例えば、必要に応じて本発明の作用効果を阻害しない範囲で糖鎖または脂肪酸基などの修飾を受けているHLA結合性ペプチド前駆体であってもよい。このような前駆体が、人体の消化器官などのほ乳類の生体内において、消化酵素などにより消化されるなどの変化を受けて、HLA結合性ペプチドとなることによっても、上記のHLA結合性ペプチドにおいて結合性ペプチドと同様の作用効果が得られる。
【0040】
また、上記のHLA結合性ペプチドは、ヒトHLA−A24分子に結合するペプチドであってもよい。
さらに、上記のHLA結合性ペプチドは、ヒトHLA−A2分子に結合するペプチドであってもよい。
【0041】
この構成によれば、日本人種を含むアジア人種に多いHLA−A24分子に対して結合するペプチドが得られるため、日本人種を含むアジア人種に特に効果的な治療薬、予防薬などの開発に利用できる。
【0042】
さらにこの構成によれば、日本人種に加えて欧米人種に多いHLA−A2分子に対して結合するペプチドが得られるため、日本人種に加えて欧米人種に特に効果的な治療薬、予防薬などの開発に利用できる。
【0043】
また、上記のHLA結合性ペプチドに含まれるアミノ酸配列は、デングウイルスの所定のゲノムタンパク質由来のアミノ酸配列としてもよいが、特に限定するわけではない。例えば、HIVのタンパク質由来のアミノ酸配列や、杉花粉のタンパク質由来のアミノ酸配列などであってもよい。また、その他の病原性またはアレルゲン性を有するタンパク質由来のアミノ酸配列を含んでいてもよい。
【0044】
例えばデングウイルス由来のアミノ酸配列を含む場合には、デングウイルスによりもたらされる疾病の予防、治療などに利用可能なHLA結合性ペプチドが得られる。
【0045】
<実施形態2>
本実施形態によれば、HLA−A型分子に結合するHLA結合性ペプチドであって、上記のHLA結合性ペプチドに含まれるアミノ酸配列のうち1若しくは2個のアミノ酸残基が欠失、置換若しくは付加されてなるアミノ酸配列を含み、8以上11以下のアミノ酸残基からなるHLA結合性ペプチドが提供される。
【0046】
後述するように、HLA−A型分子との結合性を有する特定のアミノ酸配列のうち1若しくは数個のアミノ酸残基が欠失、置換若しくは付加されてなるアミノ酸配列を含む構成であっても、上述の実施形態1に係るHLA結合性ペプチドと同様の作用を奏する。
【0047】
また、配列番号1から50に示したHLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは2個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと予測することができる。
【0048】
別の観点から言えば、上述の方法により予測された、HLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは数個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと予測することができる。なお、置換されるアミノ酸残基同士は、ともに疎水性アミノ酸残基などの互いに特性の類似するアミノ酸残基同士とする方がよい。
【0049】
また、実施形態1および実施形態2に記載のHLA結合性ペプチドは、いずれも当業者に公知の手法を用いて製造可能である。例えば、固相法または液相法により人工合成してもよい。また、これらのHLA結合性ペプチドをコードするDNA断片または組み換えベクターから発現することにより、これらのHLA結合性ペプチドを製造してもよい。また、こうして得られたHLA結合性ペプチドは、いずれも当業者に公知の手法を用いて同定可能である。例えば、エドマン分解法や質量分析法などを用いて同定可能である。
【0050】
<実施形態3>
本実施形態によれば、上記のHLA結合性ペプチドをコードするDNA配列を含むDNA断片が提供される。本実施形態に係るDNA断片は、特定のDNA配列を含むため、上記のHLA結合性ペプチドを発現可能である。
【0051】
また、本実施形態に係るDNA断片を用いて上記のHLA結合性ペプチドを発現する場合には、このDNA断片を細胞内に導入して発現させてもよく、市販の人工的なタンパク質発現キットを用いて発現してもよい。
【0052】
さらに、上記のDNA断片は、例えばヒトの細胞内に導入することにより、持続的な発現を行うことができる。そのため、細胞内にHLA結合性ペプチドそのものを導入する場合よりも、細胞内にHLA結合性ペプチドをコードするDNA断片を導入する方が、持続的に細胞内にHLA結合性ペプチドを存在させることができる。HLA結合性ペプチドをワクチンとして用いる場合には、このように持続的に発現可能であることは、ワクチンの有効性を高める上で有利である。
【0053】
また、本実施形態に係るDNA断片は、当業者に公知の手法を用いて製造可能である。例えば、市販のDNAシンセサイザーなどにより、人工的に合成してもよい。あるいは、デングウイルスのゲノムより制限酵素などを用いて切り出してきても良い。あるいは、プライマーを用いてデングウイルスのゲノムよりPCR法で増幅して得てもよい。また、こうして得られたDNA断片は、いずれも当業者に公知の手法を用いて同定可能である。例えば、市販のDNAシークエンサーなどにより同定可能である。
【0054】
<実施形態4>
本実施形態によれば、上記のHLA結合性ペプチドをコードするDNA配列を含む組み換えベクターが得られる。本実施形態に係る組み換えベクターは、特定のDNA配列を含むため、上記のHLA結合性ペプチドを発現可能である。
【0055】
また、本実施形態に係る組み換えベクターを用いて上記のHLA結合性ペプチドを発現する場合には、この組み換えベクターを細胞内に導入して発現させてもよく、市販の人工的なタンパク質発現キットを用いて発現してもよい。
【0056】
さらに、上記の組み換えベクターは、例えばヒトの細胞内に導入することにより、持続的な発現を行うことができる。そのため、細胞内にHLA結合性ペプチドそのものを導入する場合よりも、細胞内にHLA結合性ペプチドをコードする組み換えベクターを導入する方が、持続的に細胞内にHLA結合性ペプチドを存在させることができる。HLA結合性ペプチドをワクチンとして用いる場合には、このように持続的に発現可能であることは、ワクチンの有効性を高める上で有利である。
【0057】
また、上記の組み換えベクターにおいては、上記のHLA結合性ペプチドをコードするDNA配列の上流のプロモーター領域などの転写・発現に関する調節領域を任意の配列とすることにより、HLA結合性ペプチドの発現量を精度よく制御可能である。また、組み換えベクターのオリジン領域などの複製に関する調節領域を任意の配列とすることにより、組み換えベクターの細胞内でのコピー数を精度よく制御可能である。
【0058】
また、上記の組み換えベクターは、上記のHLA結合性ペプチドをコードするDNA配列以外にも任意の配列を含むことができる。例えば、薬剤耐性遺伝子などのマーカー遺伝子の配列を含んでいてもよい。
【0059】
また、本実施形態に係る組み換えベクターは、当業者に公知の手法を用いて製造可能である。例えば、pBR322やpUC19などの市販のベクターのマルチクローニングサイトを任意の制限酵素サイトにて開裂し、そのサイトに上記DNA断片を挿入してライゲーションすることにより得られる。また、こうして得られた組み換えベクターは、いずれも当業者に公知の手法を用いて同定可能である。例えば、任意の制限酵素により切断したDNA断片の長さがpBR322やpUC19などの市販のベクターの開裂地図と対応するか、アガロースゲル電気泳動により確認し、さらにマルチクローニングサイトから切り出したDNA配列中に上記DNA配列が含まれているか、DNAシークエンサーなどにより同定可能である。
【0060】
以上、本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【0061】
例えば、上記実施の形態ではデングウイルスの所定のゲノムタンパク質由来のアミノ酸配列を含むHLA結合性ペプチドとしたが、デングウイルスの他のタンパク質由来のアミノ酸配列を含むHLA結合性ペプチドとしてもよい。このような場合にも、それぞれの由来するタンパク質に関連する各種の免疫疾患の治療に利用することが可能である。
【0062】
また、デングウイルス以外のHIVウイルスなどの病原体に対するHLA結合性ペプチドとしてもよく、杉花粉などのアレルゲン、またはガン細胞などのタンパク質由来のアミノ酸配列を含むHLA結合性ペプチドとしてもよい。
【0063】
なお、このようにしても、上述の方法を用いてHLA結合性に優れると予測されたアミノ配列を含むのであれば、実験的に確認しても同様に優れたHLA結合性を示すと考えられる。このため、これらのHLA結合性ペプチドは、感染症(デング熱、インフルエンザ、SARS、HIV、HCVなど)を中心にして、ガン免疫療法(Wilms Tumor 1,MAGEなど)、アレルギー疾患(花粉症、リウマチ、アトピー、喘息など)、自己免疫疾患などの治療または予防に好適に用い得る。
【実施例】
【0064】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0065】
具体的に、本実施例における予測・実験・評価の手順は、能動学習実験計画に基づいて行い、全体として次のステップを繰り返した。ここで用いた能動学習実験計画の模式図を図1に示す。
【0066】
(1)後述する下位学習アルゴリズムの試行1回分を行う。すなわち、蓄積データのランダムリサンプリングから複数の仮説を発現し、ランダムに発現された質問候補点(ペプチド)に対する予測値の分散が最も大きい点を、実験すべき質問点として選ぶ。
【0067】
(2)選ばれた質問点のペプチドを、後述する合成・精製法により製造し、実際の結合能を後述する実験により測定して蓄積データに加える。
【0068】
本実施例では、下位学習アルゴリズムとして、隠れマルコフモデルの教師付き学習アルゴリズムを用い、223種のペプチドの初期データからスタートし、1回の実験あたり20〜30種のペプチドを予測、選択し、上記手順を4回繰り返し、合計341件のデータを得た。
【0069】
より具体的には、本実施例の能動学習法では、20種類あるアミノ酸を9個ならべたアミノ酸配列からなるペプチドの設計・合成を、1回の実験あたり20〜30種類分行った。そして、それらのHLA分子との結合の強さ(結合能)の計測を行った。そして、実験結果として、結合能(Kd値)を得た。結合能が高ければ、ワクチンの材料として利用可能なHLA結合性ペプチドの候補とした。
【0070】
そして、得られた結果を、数学的アルゴリズムとして隠れマルコフモデルを利用する学習機械を備える学習システムに入力し、ルールを作成した。ここで、学習機械は、それぞれ異なる結果をサンプリングし、ルールを作った。なお、学習機械により、発現されるルールも異なる構成とした。なお、得られたルールや、実験データは、蓄積データとして随時格納される。
【0071】
そして、そのルールにより、209=5000億以上のペプチド配列の中から、次回の実験候補を選び出し、上記のプロセスを繰り返した。この際、異なるルールを実験候補に適用し、実験結果の予測が割れる候補を実験にかけた。このように、実験結果の予測が割れる候補を次回の実験にかけるため、最終的な予測精度が向上した。
【0072】
このように、複数の学習機械が、異なる予測をするサンプルを実験候補に選ぶ選択的サンプリングを行うことで、効率的に情報を獲得し、精度の高い仮説(ルール)を得た。上記のプロセスを、4回繰り返せば、後述する実施例のように優れた結果を得られた。また、7回以上繰り返せば、さらに優れた結果が得られる。
【0073】
このような能動学習法を行うことにより、本来ならば、9アミノ酸残基からなるペプチドについて、HLA結合性ペプチドの全候補物質5000億通り以上について行う必要のある結合実験の数を削減できた。能動学習法においては、実験からルールを作成し、ルールを適用して予測した数十の候補配列について実験を行うことを繰り返した。このため、実験の回数を削減して初期スクリーニングの時間/コストを大きく低減できた。
【0074】
また、このようにして能動学習法により得られるルールによる、ペプチドのHLAとの結合性の予測の的中率は、70〜80%にも達した。一方、アンカー法などの他の公知の技術による的中率は30%程度に過ぎない。
【0075】
<ペプチド合成と精製>
ペプチドは、Fmocアミノ酸を用い、Merrifieldの固相法にて、マニュアル合成をした。脱保護の後、C18カラムを用いて逆相HPLC精製をし、95%以上の純度にした。ペプチドの同定と純度の確認は、MALDI−TOF質量分析にて行った(Voyager DE RP、PerSeptive)。ペプチドの定量は、BSAを標準蛋白質としてMicro BCAアッセイ(Pierce社)にて行った。
【0076】
<ペプチドのHLA−A2402分子への結合実験>
HLA−A*2402遺伝子の産物であるHLA−A24分子へのペプチドの結合能の測定は、HLA−A*2402遺伝子を発現するC1R−A24細胞(熊本大学、滝口雅文教授作成のものを、許可を得て供与いただいた。)を用いて行った。
【0077】
まず、C1R−A24細胞をpH3.3の酸性条件に30秒曝し、HLA−A2402分子に元来結合している内因性ペプチドと、HLAクラスI分子に共通して会合している軽鎖β2mを解離、除去した。中和後、C1R−A24細胞に精製β2mを添加し、ペプチドの希釈列に加えて、氷上4時間インキュベートした。この間に再会合したHLA−A2402分子、ペプチド、β2mの3者の会合体(MHC−pep)を認識する蛍光標識モノクローナル抗体17A12を用いて染色した。
【0078】
その後、個々のC1R−A24細胞当たりのMHC−pep数(上記蛍光抗体の蛍光強度に比例する)を、蛍光細胞解析装置FACScan(Becton−Dickinson社)を用いて定量測定した。1細胞当たりの平均蛍光強度から、論文(Udaka et al.,Immunogenetics,51、816−828、2000)に発表した方法にて、HLA−A24分子とペプチド間の結合解離定数Kd値を算出した。
【0079】
<ペプチドのHLA−A0201分子への結合実験>
HLA−A*0201遺伝子の産物であるHLA−A2分子へのペプチドの結合能の測定は、HLA−A*0201を発現する細胞株JY(ATCC(American Type Culture Collection)より入手)を用いて行った。
【0080】
まずJY細胞をpH3.8の酸性条件に30秒曝し、HLA−A0201分子にそれまで非共有結合的に会合していた内因性ペプチドと軽鎖β2mを解離、除去した。中和後、再会合実験を行った。
【0081】
結合能を測定したいペプチドの段階希釈列に上記JY細胞と精製β2mを加えたのち、氷上で4時間インキュベートした。この時点までに再会合したHLA−A0201分子を、会合型特異的な蛍光標識モノクローナル抗体BB7.2を用いて染色した。
【0082】
その後、1細胞あたりの蛍光量をフローサイトメーターにて測定し、論文(Udaka et al.,Immunogenetics,51、816−828、2000)に発表した方法にて、解離定数Kd値を算出した。
【0083】
<ペプチドのHLA−A0206分子への結合実験>
HLA−A*0206遺伝子の産物であるHLA−A2分子へのペプチドの結合能の測定は、HLA−A*0206を発現する、マウスのTAPペプチドトランスポーター欠損細胞であるRAMS細胞に、HLA−A*0206遺伝子のcDNAを発現させた、RA2.6細胞(高知大学にて新たに作成した細胞株)を用いて行った。
【0084】
まずRA2.6細胞を26℃で一晩培養し、細胞表面にペプチドを結合していないHLA−A0206分子が蓄積したところへペプチドの希釈列を加え、室温で30分結合させた。
【0085】
その後37℃で3.5時間培養することにより、ペプチドを結合していない空のHLA−A0206分子が変性し、立体構造が失われる。
【0086】
そこへ、ペプチド結合型HLA−A0206分子を特異的に認識する蛍光標識モノクローナル抗体17A10もしくは17A12を加え、氷上で20分インキュベートし、細胞を染色した。
【0087】
その後、1細胞あたりの蛍光量をフローサイトメーターにて測定し、論文(Udaka et al.,Immunogenetics,51、816−828、 2000)に発表した方法にて、解離定数Kd値を算出した。
【0088】
<評価結果>
その結果、上記表1〜表3に示した予測結果および実験結果が得られた。
【0089】
表1の配列番号1から25の配列は、GENBANKに登録されているデングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号1から25の配列は、実施形態1で説明した実験計画法により得られる仮説により予測された、HLA−A24分子(HLA−A*2402遺伝子の産物)との結合性が上位の配列である。なお、配列番号1から25まで結合性の優れる順に並んでいる。すなわち、配列番号1が、最も結合性が優れると予測される配列である。なお、デングウイルス2型の代表株AY776328株の全長アミノ酸配列(MNNQRKKARNTPFNMLKRERNRVSTVQQLTKRFSLGMLQGRGPLKLFMALVAFLRFLTIPPTAGILKRWGTIKKSKAINVLRGFRKEIGRMLNILNRRRRTAGVIIMMIPTVVAFHLTTRNGEPHMIVSRQEKGKSLLFKTENGVNMCTLMAMDLGELCEDTITYNCPLLRQNEPEDIDCWCNSTSTWVTYGTCTATGEHRREKRSVALVPHVGMGLETRTETWMSSEGAWKHAQRIETWVLRHPGFTIMAAILAYTIGTTYFQRVLIFILLTAVAPSMTMRCIGISNRDFVEGVSGGSWVDIVLEHGSCVTTMAKNKPTLDFELTKTEAKHPATLRKYCIEAKLTNTTTASRCPTQGEPSLNEEQDKRFVCKHSMVDRGWGNGCGLFGKGGIVTCAMFTCKKNMEGKVVQPENLEYTIVITPHSGEENAVGNDTGKHGKEIKVTPQSSITEAELTGYGTVTMECSPRTGLDFNEMVLLQMEDKAWLVHRQWFLDLPLPWLPGADTQGSNWIQKETLVTFKNPHAKKQDVVVLGSQEGAMHTALTGATEIQMSSGNLLFTGHLKCRLRMDKLQLKGMSYSMCTGKFKVVKEIAETQHGTIVIRVQYEGDGSPCKIPFEIMDLEKRHVLGRLITVNPIVTEKDSPVNIEAEPPFGDSYIIIGVEPGQLKLSWFKKGSSIGQMFETTMRGAKRMAILGDTAWDFGSLGGVFTSIGKALHQVFGAIYGAAFSGVSWTMKILIGVVITWIGMNSRSTSLSVSLVLVGVVTLYLGVMVQADSGCVVSWKNKELKCGSGIFITDNVHTWTEQYKFQPESPSKLASAIQKAHEEGICGIRSVTRLENLMWKQITPELNHILSENEVKLTIMTGDIKGIMQAGKRSLRPQPTELKYSWKAWGKAKMLSTELHNHTFLIDGPETAECPNTNRAWNSLEVEDYGFGVFTTNIWLKLKERQDVFCDSKLMSAAIKDNRAVHADMGYWIESALNDTWKIEKASFIEVKSCHWPKSHTLWSNGVLESEMIIPKNFAGPVSQHNYRPGYHTQTAGPWHLGKLEMDFDFCEGTTVVVTEDCGNRGPSLRTTTASGKLITEWCCRSCTLPPLRYRGEDGCWYGMEIRPLKEKEENLVNSLVTAGHGQIDNFSLGVWGMALFLEEMLRTRVGTKHAILLVAVSFVTLITGNMSFRDLGRVMVMVGATMTDDIGMGVTYLALLAAFKVRPTFAAGLLLRKLTSKELMMTTIGIVLLSQSTIPETILELTDALALGMMVLKIVRNMEKYQLAVTIMAILCVPNAVILQNAWKVSCTILAVVSVSPLLLTSSQQKADWIPLALTIKGLNPTAIFLTTLSRTSKKRSWPLNEAIMAVGMVSILASSLLKNDIPMTGPLVAGGLLTVCYVLTGRSADLELERAADVRWEEQAEISGSSPILSITISEDGSMSIKNEEEEQTLTILIRTGLLVISGLFPVSIPITAAAWYLWEVKKQRAGVLWDVPSPPPVGKAELEDGAYRIKQKGILGYSQIGAGVYKEGTFHTMWHVTRGAVLMHKGKRIEPSWADVKKDLISYGGGWKLEGEWKEGEEVQVLALEPGKNPRAVQTKPGLFKTNTGTIGAVSLDFSPGTSGSPIVDKKGKVVGLYGNGVVTRSGTYVSAIAQTEKSIEDNPEIEDDIFRKKRLTIMDLHPGAGKTKRYLPAIVREAIKRGLRTLILAPTRVVAAEMEEALRGLPIRYQTPAIRAEHTGREIVDLMCHATFTMRLLSPIRVPNYNLIIMDEAHFTDPASIAARGYISTRVEMGEAAGIFMTATPPGSRDPFPQSNAPIMDEEREIPERSWNSGHEWVTDFKGKTVWFVPSIKAGNDIAACLRKNGKKVIQLSRKTFDSEYVKTRTNDWDFVVTTDISEMGANFKAERVIDPRRCMKPVILTDGEERVILAGPMPVTHSSAAQRRGRVGRNPKNENDQYIYMGEPLENDEDCAHWKEAKMLLDNINTPEGIIPSMFEPEREKVDAIDGEYRLRGEARKTFVDLMRRGDLPVWLAYRVAAEGINYADRRWCFDGVKNNQILEENVEVEIWTKEGERKKLKPRWLDARIYSDPLALKEFKEFAAGRKSLTLNLITEMGRLPTFMTQKARNALDNLAVLHTAEAGGRAYNHALSELPETLETLLLLTLLATVTGGIFLFLMSGKGIGKMTLGMCCIITASVLLWYAQIQPHWIAASIILEFFLIVLLIPEPEKQRTPQDNQLTYVVIAILTVVAATMANEMGFLEKTKKDFGLGGIATQQPESNILDIDLRPASAWTLYAVATTFITPMLRHSIENSSVNVSLTAIANQATVLMGLGKGWPLSKMDIGVPLLAIGCYSQVNPITLTAALLLLVAHYAIIGPGLQAKATREAQKRAAAGIMKNPTVDGITVIDLDPIPYDPKFEKQLGQVMLLVLCVTQVLMMRTTWALCEALTLATGPISTLWEGNPGRFWNTTIAVSMANIFRGSYLAGAGLLFSIMKNTANTRRGTGNTGETLGEKWKNRLNALGKSEFQIYKKSGIQEVDRTLAKEGIKRGETDHHAVSRGSAKLRWFVERNLVTPEGKVMDLGCGRGGWSYYCGGLKNVKEVKGLTKGGPGHEEPIPMSTYGWNLVRLQSGVDVFFTPPEKCDTLLCDIGESSPNPTVEAGRTLRVLNLVENWLNNNTQFCIKVLNPYMPSVIEKMEALQRKYGGALVRNPLSRNSTHEMYWVSNASGNIVSSVNMISRMLINRFTMRHKKATYEPDVDLGSGTRNIGIESEIPNLDIIGKRIEKIKQEHETSWHYDQDHPYKTWAYHGSYETKQTGSASSMVNGVVRLLTKPWDVIPMVTQMAMTDTTPFGQQRVFKEKVDTRTQEPKEGTKKLMKITAEWLWKELGKKKTPRMCTREEFTRKVRSNAALGAIFTDENKWKSAREAVEDSGFWELVDKERNLHLEGKCETCVYNMMGKREKKLGEFGKAKGSRAIWYMWLGARFLEFEALGFLNEDHWFSRENSLSGVEREGLHKLGYILRDVSKKEGGAMYADDTAGWDTRITLEDLKNEEMVTNHMEGEHKKLAEAIFKLTYQNKVVRVQRPTPRGTVMDIISRRDQRGSGQVVTYGLNTFTNMEAQLIRQMEGEGVFKSIQQLTATEEIAVKNWLARVGRERLSRMAISGDDCVVKPLDDRFASALTALNDMGKVRKDIQQWEPSRGWNDWTQVPFCSHHFHELIMKDGRVLVVPCRNQDELIGRARISQGAGWSLRETACLGKSYAQMWSLMYFHRRDLRLAANAICSAVPSHWVPTSRTTWSIHATHEWMTTEDMLTVWNRVWIQENPWIEDKTPVESWEEIPYLGKREDQWCGSLIGLTSRATWAKNIQTAINQVRSLIGNEEYTDYMPSMKRFRREEEEAGVLW)を、配列番号51に示す。
【0090】
また、表2の配列番号26から40の配列は、上述のデングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号26から40の配列は、実施形態1で説明した実験計画法により得られる仮説により予測された、HLA−A2分子(HLA−A*0201遺伝子の産物)との結合性が上位の配列である。なお、配列番号26から40まで結合性の優れる順に並んでいる。すなわち、配列番号26が、最も結合性が優れると予測される配列である。
【0091】
また、表3の配列番号41から50の配列は、上述のデングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号41から50の配列は、実施形態1で説明した実験計画法により得られる仮説により予測された、HLA−A2分子(HLA−A*0206遺伝子の産物)との結合性が上位の配列である。なお、配列番号41から50まで結合性の優れる順に並んでいる。すなわち、配列番号41が、最も結合性が優れると予測される配列である。
【0092】
また、表1〜表3には、上述のデングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基について、上述の予測プログラムを用いた予測結果のスコア上位に相当するアミノ酸配列、予測スコア、それに対応する結合実験データが記載されている。なお、結合実験はすべて、9アミノ酸ペプチドを上述の合成方法により人工合成して行った。
【0093】
上記の互いに1または2アミノ酸残基が置換されてなるペプチド配列は、いずれも同様に優れたHLA−A分子との結合性を示すことが予測される。よって、配列番号1から50に示したHLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは数個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと予測することができる。
【0094】
別の観点から言えば、実施形態1で説明した実験計画法により得られる仮説により予測された、HLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは数個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと言える。なお、置換されるアミノ酸残基同士は、ともに疎水性アミノ酸残基などの互いに特性の類似するアミノ酸残基同士とする方がよい。
【0095】
発明者の一人宇高らは、互いに1または2アミノ酸残基が置換されてなるペプチド配列であっても、同様に優れた抗原提示分子との結合性を示すことを既に報告している。
1."Decrypting the structure of MHC−I restricted CTL epitopes with complex peptide libraries."Keiko Udaka,Karl−Heinz Wiesmuller,Stefan Kienle,Gunter Jung and Peter Walden.J.Exp.Med.181,2097−2108.(1995)
2."Tolerance to amino acid varidations in peptides binding to the MHC class I protein H−2Kb."Keiko Udaka,Karl−Heinz Wiesmuller, Stefan Kienle, Gunter Jung and Peter Walden.J.Biol.Chem.270,24130−24134.(1995)
3."Self MHC−restricted peptides recognized by all alloreactive T lymphocyte clone."Keiko Udaka,Karl−Heinz Wiesmuller,Stefan Kienle,Gunter Jung and Peter Walden.J.Immunol.157,670−678.(1996)
したがって、上記の互いに1または2アミノ酸残基が置換されてなるペプチド配列は、いずれも同様に優れたHLA−A分子との結合性を示すことが予測される。よって、配列番号1から50に示したHLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは数個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと予測することができる。
【0096】
別の観点から言えば、実施形態1で説明した実験計画法により得られる仮説により予測された、HLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは数個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと言える。なお、置換されるアミノ酸残基同士は、ともに疎水性アミノ酸残基などの互いに特性の類似するアミノ酸残基同士とする方がよい。
【0097】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【0098】
この出願は、2006年10月12日に出願された日本出願特願2006−279232及び2007年7月20日に出願された日本出願特願2007−189047を基礎とする優先権を主張し、その開示の全てをここに取り込む。
【技術分野】
【0001】
本発明は、HLA結合性ペプチド、その前駆体、それをコードするDNA断片および組み換えベクターに関する。
【背景技術】
【0002】
ヒト主要組織適合抗原(HLA)の遺伝子は、6番目の染色体の短腕に位置しており、HLAは、クラスI分子(HLA−A型、B型、C型)と、クラスII分子(HLA−DP型、DQ型、DR型)に大別される。特異的免疫応答において、細胞傷害性T細胞(CTL)が腫瘍細胞、移植片細胞、ウイルス感染細胞などの細胞表面抗原を認識する時、クラスI分子と一緒に認識することが必須であり、クラスI分子は、ほとんどすべての細胞の膜表面上に存在している。
【0003】
デングウイルスなどのウイルスに感染すると、自然免疫によるウイルス排除反応が起こり、次いで、特異的免疫応答が誘導され、ウイルスの排除反応が起こる。
【0004】
特異的免疫応答では、体液中のウイルスが中和抗体により排除され、細胞内のウイルスが細胞傷害性T細胞(CTL)により排除される。すなわち、CTLは、感染細胞表面のHLAクラスI分子に提示された、8〜11のアミノ酸からなるウイルス抗原(CTLエピトープ)を特異的に認識し、感染細胞を傷害することによりウイルスを排除する。したがって、このようなウイルスに特異的なCTLエピトープを同定することは、ウイルスに対する予防および治療ワクチンを作成する上で重要である。
【0005】
この種の技術として、特許文献1記載のものがある。特許文献1には、特定のアミノ酸配列からなるオリゴペプチドは、HLA結合性を有する旨が記載されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開平8−151396号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、上記文献記載の従来技術は、以下の点で改善の余地を有していた。
【0008】
第一に、上記文献記載のHLA結合性ペプチドは、HLA分子と有効に結合するか否かは不明であり、HLAとの結合性の面でさらなる改善の余地を有していた。
【0009】
第二に、上記文献記載のHLA結合性ペプチドは、HLA−DQ4と結合性がある旨記載されている。しかし、欧米人種に多いHLA−A2分子(HLA−A*0201遺伝子あるいはHLA−A*0206遺伝子などの産物)および日本人種に多いHLA−A24分子(HLA−A*2402遺伝子などの産物)に対して結合するか否かは不明である。
【0010】
本発明は上記事情に鑑みてなされたものであり、特定の型のHLA分子との結合性に優れるHLA結合性ペプチドを提供する。
【課題を解決するための手段】
【0011】
本発明によれば、HLA−A型分子に結合するHLA結合性ペプチドであって、配列番号1から50からなる群より選ばれる1種以上のアミノ酸配列を含み、8以上11以下のアミノ酸残基からなるHLA結合性ペプチドが提供される。
【発明の効果】
【0012】
本発明によれば、特定のアミノ酸配列を含むため、HLA−A型分子との結合性に優れるHLA結合性ペプチドが得られる。
【図面の簡単な説明】
【0013】
【図1】実施例で用いた能動学習実験計画を説明する模式図である。
【発明を実施するための形態】
【0014】
以下、本発明の実施の形態について、図面を用いて説明する。尚、すべての図面において、同様な構成要素には同様の符号を付し、適宜説明を省略する。
【0015】
<実施形態1>
本実施形態では、能動学習実験法(特開平11−316754号公報)を用いて得られる仮説により予測された、HLA分子との結合性が、−logKd値に換算して3以上であるアミノ酸配列を含み、8以上11以下のアミノ酸残基からなるペプチドを、HLA結合性ペプチド候補とした。そして結合実験を行った結果、実際にこれらのペプチドがHLA結合性ペプチドであることを確認した。
【0016】
その結果、HLA分子との結合性が、−logKd値に換算して3以上であるアミノ酸配列を含むため、HLA−A型分子との結合性に優れる、多数のHLA結合性ペプチドを効率よく得ることができた。
【0017】
具体的には、本実施形態に係るHLA結合性ペプチドは、HLA−A型分子に結合するHLA結合性ペプチドであって、後述する配列番号1から50からなる群より選ばれる1種以上のアミノ酸配列を含み、8以上11以下のアミノ酸残基からなるHLA結合性ペプチドである。
【0018】
ヒトHLA−A型のうち、日本人種の約50%がHLA−A24型をもつ。また、ドイツ人などの欧米人は、HLA−A2型が多い。
【0019】
なお、これらの配列は、いずれもデング熱を起こすデングウイルスの所定のゲノムタンパク質に含まれる9アミノ酸残基からなる配列である。
【0020】
配列番号1から25の配列を、下記の表1に示す。
【0021】
【表1】

【0022】
配列番号1から25の配列は、デングウイルス2型(血清型type2)の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号1から25の配列は、上述の方法により予測された、HLA−A24分子(HLA−A*2402遺伝子の産物)との結合性が上位の配列である。なお、配列番号1から25まで結合性の優れる順に並んでいる。すなわち、配列番号1が、最も結合性が優れると予測される配列である。なお、各配列のHLA−A24分子との結合性の予測スコアおよび結合実験データの項目の単位は、いずれも−logKd値にて示されている。
【0023】
配列番号26から40の配列を、下記の表2に示す。
【0024】
【表2】

【0025】
配列番号26から40の配列は、デングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号26から40の配列は、上述の方法により予測された、HLA−A2分子(HLA−A*0201遺伝子の産物)との結合性が上位の配列である。なお、配列番号26から40まで結合性の優れる順に並んでいる。すなわち、配列番号26が、最も結合性が優れると予測される配列である。なお、各配列のHLA−A2分子との結合性の予測スコアおよび結合実験データの項目の単位は、いずれも−logKd値にて示されている。
【0026】
配列番号41から50の配列を、下記の表3に示す。
【0027】
【表3】

【0028】
配列番号41から50の配列は、デングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号41から50の配列は、上述の方法により予測された、HLA−A2分子(HLA−A*0206遺伝子の産物)との結合性が上位の配列である。なお、配列番号41から50まで結合性の優れる順に並んでいる。すなわち、配列番号41が、最も結合性が優れると予測される配列である。なお、各配列のHLA−A2分子との結合性の予測スコアおよび結合実験データの項目の単位は、いずれも−logKd値にて示されている。
【0029】
なお、詳しくは、後述するが、表1〜表3のいずれにおいても、予測スコアと結合実験データとの間に関連性が存在していることが明らかである。すなわち、多少の誤差はあるが、上述の方法により予測された、HLA−A分子との結合性が高いペプチドは、実験的に確認してもHLA−A分子との結合性が高いといえる。
【0030】
従来は、このように実験計画法を活用してHLA結合性ペプチドを見出す手法は採られていなかったために、実験的にHLA結合性が確認された極少数のHLA結合性ペプチドが知られていたに過ぎなかった。そのため、従来の手法で全くランダムに9アミノ酸残基からなるペプチドを合成し、HLA分子との結合実験を行っても、結合性が−logKd値に換算して6を超えるものは、確率的には約100個に1個しかなかった。
【0031】
本実施形態においては、このように実験計画法を活用してHLA結合性ペプチドを見出す手法を採用したため、上記のような、50配列にも及ぶ多数のHLA結合性ペプチドを見出すことができた。また、得られたHLA結合性ペプチドの一部についてHLA結合性を実験的に確認したところ、実験を行った配列のいずれにおいても予測と同等かそれ以上のHLAとの優れた結合性が確認された。
【0032】
なお、これらの配列の中でも、配列番号1、2、4、5、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49および50からなる群より選ばれる1種以上のアミノ酸配列を含むHLA結合性ペプチドは、実験によりヒトHLA−A型分子との結合性が確認されている。このため、確実にヒトHLA−A型分子との結合性に優れるHLA結合性ペプチドであると言える。
【0033】
ここで、本実施形態に係るHLA結合性ペプチドの、HLA分子との結合性は、−logKd値に換算して3以上とすることができ、特に好ましくは5以上であり、さらに好ましくは5.4以上である。
【0034】
生化学の分野では、−logKd値に換算しておおよそ結合能の3前後が、実際にペプチドがHLAをはじめとするMHCに結合するかしないかのしきい値として知られている。よって、HLA分子との結合性が−logKd値に換算して3以上であれば、HLA結合性ペプチドであると言える。
【0035】
また、HLA−A24分子の場合であれば、HLA−A24分子との結合性が−logKd値に換算して5以上であれば、HLA分子に対する結合性が優れるペプチドが得られるため、免疫疾患などに対する効果的な治療薬、予防薬などの開発に好適に利用できる。
【0036】
また、HLA−A24分子との結合性が−logKd値に換算して5.4以上であれば、HLA分子に対する結合性が特に優れるペプチドが得られるため、免疫疾患などに対してさらに効果的な治療薬、予防薬などの開発に好適に利用できる。
【0037】
また、本実施形態に係るHLA結合性ペプチドは、8以上11以下のアミノ酸残基からなる構成とすることができる。
【0038】
このように、8以上11以下のアミノ酸残基からなるペプチドであれば、HLA分子との結合性に優れる。また、細胞傷害性T細胞(CTL)は、ウイルスなどに感染した細胞表面のHLAクラスI分子に提示された、8〜11のアミノ酸からなるウイルス抗原(CTLエピトープ)を特異的に認識し、感染細胞を傷害することによりウイルスを排除する。そして、このようなウイルスなどに特異的な8〜11のアミノ酸からなるCTLエピトープを作ることは、ウイルスなどに対する治療または予防のためのワクチンを作成する上で重要である。
【0039】
例えば、上記のHLA結合性ペプチドは、アミノ酸残基のみからなるペプチドであってもよいが、特に限定するものではない。例えば、必要に応じて本発明の作用効果を阻害しない範囲で糖鎖または脂肪酸基などの修飾を受けているHLA結合性ペプチド前駆体であってもよい。このような前駆体が、人体の消化器官などのほ乳類の生体内において、消化酵素などにより消化されるなどの変化を受けて、HLA結合性ペプチドとなることによっても、上記のHLA結合性ペプチドにおいて結合性ペプチドと同様の作用効果が得られる。
【0040】
また、上記のHLA結合性ペプチドは、ヒトHLA−A24分子に結合するペプチドであってもよい。
さらに、上記のHLA結合性ペプチドは、ヒトHLA−A2分子に結合するペプチドであってもよい。
【0041】
この構成によれば、日本人種を含むアジア人種に多いHLA−A24分子に対して結合するペプチドが得られるため、日本人種を含むアジア人種に特に効果的な治療薬、予防薬などの開発に利用できる。
【0042】
さらにこの構成によれば、日本人種に加えて欧米人種に多いHLA−A2分子に対して結合するペプチドが得られるため、日本人種に加えて欧米人種に特に効果的な治療薬、予防薬などの開発に利用できる。
【0043】
また、上記のHLA結合性ペプチドに含まれるアミノ酸配列は、デングウイルスの所定のゲノムタンパク質由来のアミノ酸配列としてもよいが、特に限定するわけではない。例えば、HIVのタンパク質由来のアミノ酸配列や、杉花粉のタンパク質由来のアミノ酸配列などであってもよい。また、その他の病原性またはアレルゲン性を有するタンパク質由来のアミノ酸配列を含んでいてもよい。
【0044】
例えばデングウイルス由来のアミノ酸配列を含む場合には、デングウイルスによりもたらされる疾病の予防、治療などに利用可能なHLA結合性ペプチドが得られる。
【0045】
<実施形態2>
本実施形態によれば、HLA−A型分子に結合するHLA結合性ペプチドであって、上記のHLA結合性ペプチドに含まれるアミノ酸配列のうち1若しくは2個のアミノ酸残基が欠失、置換若しくは付加されてなるアミノ酸配列を含み、8以上11以下のアミノ酸残基からなるHLA結合性ペプチドが提供される。
【0046】
後述するように、HLA−A型分子との結合性を有する特定のアミノ酸配列のうち1若しくは数個のアミノ酸残基が欠失、置換若しくは付加されてなるアミノ酸配列を含む構成であっても、上述の実施形態1に係るHLA結合性ペプチドと同様の作用を奏する。
【0047】
また、配列番号1から50に示したHLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは2個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと予測することができる。
【0048】
別の観点から言えば、上述の方法により予測された、HLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは数個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと予測することができる。なお、置換されるアミノ酸残基同士は、ともに疎水性アミノ酸残基などの互いに特性の類似するアミノ酸残基同士とする方がよい。
【0049】
また、実施形態1および実施形態2に記載のHLA結合性ペプチドは、いずれも当業者に公知の手法を用いて製造可能である。例えば、固相法または液相法により人工合成してもよい。また、これらのHLA結合性ペプチドをコードするDNA断片または組み換えベクターから発現することにより、これらのHLA結合性ペプチドを製造してもよい。また、こうして得られたHLA結合性ペプチドは、いずれも当業者に公知の手法を用いて同定可能である。例えば、エドマン分解法や質量分析法などを用いて同定可能である。
【0050】
<実施形態3>
本実施形態によれば、上記のHLA結合性ペプチドをコードするDNA配列を含むDNA断片が提供される。本実施形態に係るDNA断片は、特定のDNA配列を含むため、上記のHLA結合性ペプチドを発現可能である。
【0051】
また、本実施形態に係るDNA断片を用いて上記のHLA結合性ペプチドを発現する場合には、このDNA断片を細胞内に導入して発現させてもよく、市販の人工的なタンパク質発現キットを用いて発現してもよい。
【0052】
さらに、上記のDNA断片は、例えばヒトの細胞内に導入することにより、持続的な発現を行うことができる。そのため、細胞内にHLA結合性ペプチドそのものを導入する場合よりも、細胞内にHLA結合性ペプチドをコードするDNA断片を導入する方が、持続的に細胞内にHLA結合性ペプチドを存在させることができる。HLA結合性ペプチドをワクチンとして用いる場合には、このように持続的に発現可能であることは、ワクチンの有効性を高める上で有利である。
【0053】
また、本実施形態に係るDNA断片は、当業者に公知の手法を用いて製造可能である。例えば、市販のDNAシンセサイザーなどにより、人工的に合成してもよい。あるいは、デングウイルスのゲノムより制限酵素などを用いて切り出してきても良い。あるいは、プライマーを用いてデングウイルスのゲノムよりPCR法で増幅して得てもよい。また、こうして得られたDNA断片は、いずれも当業者に公知の手法を用いて同定可能である。例えば、市販のDNAシークエンサーなどにより同定可能である。
【0054】
<実施形態4>
本実施形態によれば、上記のHLA結合性ペプチドをコードするDNA配列を含む組み換えベクターが得られる。本実施形態に係る組み換えベクターは、特定のDNA配列を含むため、上記のHLA結合性ペプチドを発現可能である。
【0055】
また、本実施形態に係る組み換えベクターを用いて上記のHLA結合性ペプチドを発現する場合には、この組み換えベクターを細胞内に導入して発現させてもよく、市販の人工的なタンパク質発現キットを用いて発現してもよい。
【0056】
さらに、上記の組み換えベクターは、例えばヒトの細胞内に導入することにより、持続的な発現を行うことができる。そのため、細胞内にHLA結合性ペプチドそのものを導入する場合よりも、細胞内にHLA結合性ペプチドをコードする組み換えベクターを導入する方が、持続的に細胞内にHLA結合性ペプチドを存在させることができる。HLA結合性ペプチドをワクチンとして用いる場合には、このように持続的に発現可能であることは、ワクチンの有効性を高める上で有利である。
【0057】
また、上記の組み換えベクターにおいては、上記のHLA結合性ペプチドをコードするDNA配列の上流のプロモーター領域などの転写・発現に関する調節領域を任意の配列とすることにより、HLA結合性ペプチドの発現量を精度よく制御可能である。また、組み換えベクターのオリジン領域などの複製に関する調節領域を任意の配列とすることにより、組み換えベクターの細胞内でのコピー数を精度よく制御可能である。
【0058】
また、上記の組み換えベクターは、上記のHLA結合性ペプチドをコードするDNA配列以外にも任意の配列を含むことができる。例えば、薬剤耐性遺伝子などのマーカー遺伝子の配列を含んでいてもよい。
【0059】
また、本実施形態に係る組み換えベクターは、当業者に公知の手法を用いて製造可能である。例えば、pBR322やpUC19などの市販のベクターのマルチクローニングサイトを任意の制限酵素サイトにて開裂し、そのサイトに上記DNA断片を挿入してライゲーションすることにより得られる。また、こうして得られた組み換えベクターは、いずれも当業者に公知の手法を用いて同定可能である。例えば、任意の制限酵素により切断したDNA断片の長さがpBR322やpUC19などの市販のベクターの開裂地図と対応するか、アガロースゲル電気泳動により確認し、さらにマルチクローニングサイトから切り出したDNA配列中に上記DNA配列が含まれているか、DNAシークエンサーなどにより同定可能である。
【0060】
以上、本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【0061】
例えば、上記実施の形態ではデングウイルスの所定のゲノムタンパク質由来のアミノ酸配列を含むHLA結合性ペプチドとしたが、デングウイルスの他のタンパク質由来のアミノ酸配列を含むHLA結合性ペプチドとしてもよい。このような場合にも、それぞれの由来するタンパク質に関連する各種の免疫疾患の治療に利用することが可能である。
【0062】
また、デングウイルス以外のHIVウイルスなどの病原体に対するHLA結合性ペプチドとしてもよく、杉花粉などのアレルゲン、またはガン細胞などのタンパク質由来のアミノ酸配列を含むHLA結合性ペプチドとしてもよい。
【0063】
なお、このようにしても、上述の方法を用いてHLA結合性に優れると予測されたアミノ配列を含むのであれば、実験的に確認しても同様に優れたHLA結合性を示すと考えられる。このため、これらのHLA結合性ペプチドは、感染症(デング熱、インフルエンザ、SARS、HIV、HCVなど)を中心にして、ガン免疫療法(Wilms Tumor 1,MAGEなど)、アレルギー疾患(花粉症、リウマチ、アトピー、喘息など)、自己免疫疾患などの治療または予防に好適に用い得る。
【実施例】
【0064】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0065】
具体的に、本実施例における予測・実験・評価の手順は、能動学習実験計画に基づいて行い、全体として次のステップを繰り返した。ここで用いた能動学習実験計画の模式図を図1に示す。
【0066】
(1)後述する下位学習アルゴリズムの試行1回分を行う。すなわち、蓄積データのランダムリサンプリングから複数の仮説を発現し、ランダムに発現された質問候補点(ペプチド)に対する予測値の分散が最も大きい点を、実験すべき質問点として選ぶ。
【0067】
(2)選ばれた質問点のペプチドを、後述する合成・精製法により製造し、実際の結合能を後述する実験により測定して蓄積データに加える。
【0068】
本実施例では、下位学習アルゴリズムとして、隠れマルコフモデルの教師付き学習アルゴリズムを用い、223種のペプチドの初期データからスタートし、1回の実験あたり20〜30種のペプチドを予測、選択し、上記手順を4回繰り返し、合計341件のデータを得た。
【0069】
より具体的には、本実施例の能動学習法では、20種類あるアミノ酸を9個ならべたアミノ酸配列からなるペプチドの設計・合成を、1回の実験あたり20〜30種類分行った。そして、それらのHLA分子との結合の強さ(結合能)の計測を行った。そして、実験結果として、結合能(Kd値)を得た。結合能が高ければ、ワクチンの材料として利用可能なHLA結合性ペプチドの候補とした。
【0070】
そして、得られた結果を、数学的アルゴリズムとして隠れマルコフモデルを利用する学習機械を備える学習システムに入力し、ルールを作成した。ここで、学習機械は、それぞれ異なる結果をサンプリングし、ルールを作った。なお、学習機械により、発現されるルールも異なる構成とした。なお、得られたルールや、実験データは、蓄積データとして随時格納される。
【0071】
そして、そのルールにより、209=5000億以上のペプチド配列の中から、次回の実験候補を選び出し、上記のプロセスを繰り返した。この際、異なるルールを実験候補に適用し、実験結果の予測が割れる候補を実験にかけた。このように、実験結果の予測が割れる候補を次回の実験にかけるため、最終的な予測精度が向上した。
【0072】
このように、複数の学習機械が、異なる予測をするサンプルを実験候補に選ぶ選択的サンプリングを行うことで、効率的に情報を獲得し、精度の高い仮説(ルール)を得た。上記のプロセスを、4回繰り返せば、後述する実施例のように優れた結果を得られた。また、7回以上繰り返せば、さらに優れた結果が得られる。
【0073】
このような能動学習法を行うことにより、本来ならば、9アミノ酸残基からなるペプチドについて、HLA結合性ペプチドの全候補物質5000億通り以上について行う必要のある結合実験の数を削減できた。能動学習法においては、実験からルールを作成し、ルールを適用して予測した数十の候補配列について実験を行うことを繰り返した。このため、実験の回数を削減して初期スクリーニングの時間/コストを大きく低減できた。
【0074】
また、このようにして能動学習法により得られるルールによる、ペプチドのHLAとの結合性の予測の的中率は、70〜80%にも達した。一方、アンカー法などの他の公知の技術による的中率は30%程度に過ぎない。
【0075】
<ペプチド合成と精製>
ペプチドは、Fmocアミノ酸を用い、Merrifieldの固相法にて、マニュアル合成をした。脱保護の後、C18カラムを用いて逆相HPLC精製をし、95%以上の純度にした。ペプチドの同定と純度の確認は、MALDI−TOF質量分析にて行った(Voyager DE RP、PerSeptive)。ペプチドの定量は、BSAを標準蛋白質としてMicro BCAアッセイ(Pierce社)にて行った。
【0076】
<ペプチドのHLA−A2402分子への結合実験>
HLA−A*2402遺伝子の産物であるHLA−A24分子へのペプチドの結合能の測定は、HLA−A*2402遺伝子を発現するC1R−A24細胞(熊本大学、滝口雅文教授作成のものを、許可を得て供与いただいた。)を用いて行った。
【0077】
まず、C1R−A24細胞をpH3.3の酸性条件に30秒曝し、HLA−A2402分子に元来結合している内因性ペプチドと、HLAクラスI分子に共通して会合している軽鎖β2mを解離、除去した。中和後、C1R−A24細胞に精製β2mを添加し、ペプチドの希釈列に加えて、氷上4時間インキュベートした。この間に再会合したHLA−A2402分子、ペプチド、β2mの3者の会合体(MHC−pep)を認識する蛍光標識モノクローナル抗体17A12を用いて染色した。
【0078】
その後、個々のC1R−A24細胞当たりのMHC−pep数(上記蛍光抗体の蛍光強度に比例する)を、蛍光細胞解析装置FACScan(Becton−Dickinson社)を用いて定量測定した。1細胞当たりの平均蛍光強度から、論文(Udaka et al.,Immunogenetics,51、816−828、2000)に発表した方法にて、HLA−A24分子とペプチド間の結合解離定数Kd値を算出した。
【0079】
<ペプチドのHLA−A0201分子への結合実験>
HLA−A*0201遺伝子の産物であるHLA−A2分子へのペプチドの結合能の測定は、HLA−A*0201を発現する細胞株JY(ATCC(American Type Culture Collection)より入手)を用いて行った。
【0080】
まずJY細胞をpH3.8の酸性条件に30秒曝し、HLA−A0201分子にそれまで非共有結合的に会合していた内因性ペプチドと軽鎖β2mを解離、除去した。中和後、再会合実験を行った。
【0081】
結合能を測定したいペプチドの段階希釈列に上記JY細胞と精製β2mを加えたのち、氷上で4時間インキュベートした。この時点までに再会合したHLA−A0201分子を、会合型特異的な蛍光標識モノクローナル抗体BB7.2を用いて染色した。
【0082】
その後、1細胞あたりの蛍光量をフローサイトメーターにて測定し、論文(Udaka et al.,Immunogenetics,51、816−828、2000)に発表した方法にて、解離定数Kd値を算出した。
【0083】
<ペプチドのHLA−A0206分子への結合実験>
HLA−A*0206遺伝子の産物であるHLA−A2分子へのペプチドの結合能の測定は、HLA−A*0206を発現する、マウスのTAPペプチドトランスポーター欠損細胞であるRAMS細胞に、HLA−A*0206遺伝子のcDNAを発現させた、RA2.6細胞(高知大学にて新たに作成した細胞株)を用いて行った。
【0084】
まずRA2.6細胞を26℃で一晩培養し、細胞表面にペプチドを結合していないHLA−A0206分子が蓄積したところへペプチドの希釈列を加え、室温で30分結合させた。
【0085】
その後37℃で3.5時間培養することにより、ペプチドを結合していない空のHLA−A0206分子が変性し、立体構造が失われる。
【0086】
そこへ、ペプチド結合型HLA−A0206分子を特異的に認識する蛍光標識モノクローナル抗体17A10もしくは17A12を加え、氷上で20分インキュベートし、細胞を染色した。
【0087】
その後、1細胞あたりの蛍光量をフローサイトメーターにて測定し、論文(Udaka et al.,Immunogenetics,51、816−828、 2000)に発表した方法にて、解離定数Kd値を算出した。
【0088】
<評価結果>
その結果、上記表1〜表3に示した予測結果および実験結果が得られた。
【0089】
表1の配列番号1から25の配列は、GENBANKに登録されているデングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号1から25の配列は、実施形態1で説明した実験計画法により得られる仮説により予測された、HLA−A24分子(HLA−A*2402遺伝子の産物)との結合性が上位の配列である。なお、配列番号1から25まで結合性の優れる順に並んでいる。すなわち、配列番号1が、最も結合性が優れると予測される配列である。なお、デングウイルス2型の代表株AY776328株の全長アミノ酸配列(MNNQRKKARNTPFNMLKRERNRVSTVQQLTKRFSLGMLQGRGPLKLFMALVAFLRFLTIPPTAGILKRWGTIKKSKAINVLRGFRKEIGRMLNILNRRRRTAGVIIMMIPTVVAFHLTTRNGEPHMIVSRQEKGKSLLFKTENGVNMCTLMAMDLGELCEDTITYNCPLLRQNEPEDIDCWCNSTSTWVTYGTCTATGEHRREKRSVALVPHVGMGLETRTETWMSSEGAWKHAQRIETWVLRHPGFTIMAAILAYTIGTTYFQRVLIFILLTAVAPSMTMRCIGISNRDFVEGVSGGSWVDIVLEHGSCVTTMAKNKPTLDFELTKTEAKHPATLRKYCIEAKLTNTTTASRCPTQGEPSLNEEQDKRFVCKHSMVDRGWGNGCGLFGKGGIVTCAMFTCKKNMEGKVVQPENLEYTIVITPHSGEENAVGNDTGKHGKEIKVTPQSSITEAELTGYGTVTMECSPRTGLDFNEMVLLQMEDKAWLVHRQWFLDLPLPWLPGADTQGSNWIQKETLVTFKNPHAKKQDVVVLGSQEGAMHTALTGATEIQMSSGNLLFTGHLKCRLRMDKLQLKGMSYSMCTGKFKVVKEIAETQHGTIVIRVQYEGDGSPCKIPFEIMDLEKRHVLGRLITVNPIVTEKDSPVNIEAEPPFGDSYIIIGVEPGQLKLSWFKKGSSIGQMFETTMRGAKRMAILGDTAWDFGSLGGVFTSIGKALHQVFGAIYGAAFSGVSWTMKILIGVVITWIGMNSRSTSLSVSLVLVGVVTLYLGVMVQADSGCVVSWKNKELKCGSGIFITDNVHTWTEQYKFQPESPSKLASAIQKAHEEGICGIRSVTRLENLMWKQITPELNHILSENEVKLTIMTGDIKGIMQAGKRSLRPQPTELKYSWKAWGKAKMLSTELHNHTFLIDGPETAECPNTNRAWNSLEVEDYGFGVFTTNIWLKLKERQDVFCDSKLMSAAIKDNRAVHADMGYWIESALNDTWKIEKASFIEVKSCHWPKSHTLWSNGVLESEMIIPKNFAGPVSQHNYRPGYHTQTAGPWHLGKLEMDFDFCEGTTVVVTEDCGNRGPSLRTTTASGKLITEWCCRSCTLPPLRYRGEDGCWYGMEIRPLKEKEENLVNSLVTAGHGQIDNFSLGVWGMALFLEEMLRTRVGTKHAILLVAVSFVTLITGNMSFRDLGRVMVMVGATMTDDIGMGVTYLALLAAFKVRPTFAAGLLLRKLTSKELMMTTIGIVLLSQSTIPETILELTDALALGMMVLKIVRNMEKYQLAVTIMAILCVPNAVILQNAWKVSCTILAVVSVSPLLLTSSQQKADWIPLALTIKGLNPTAIFLTTLSRTSKKRSWPLNEAIMAVGMVSILASSLLKNDIPMTGPLVAGGLLTVCYVLTGRSADLELERAADVRWEEQAEISGSSPILSITISEDGSMSIKNEEEEQTLTILIRTGLLVISGLFPVSIPITAAAWYLWEVKKQRAGVLWDVPSPPPVGKAELEDGAYRIKQKGILGYSQIGAGVYKEGTFHTMWHVTRGAVLMHKGKRIEPSWADVKKDLISYGGGWKLEGEWKEGEEVQVLALEPGKNPRAVQTKPGLFKTNTGTIGAVSLDFSPGTSGSPIVDKKGKVVGLYGNGVVTRSGTYVSAIAQTEKSIEDNPEIEDDIFRKKRLTIMDLHPGAGKTKRYLPAIVREAIKRGLRTLILAPTRVVAAEMEEALRGLPIRYQTPAIRAEHTGREIVDLMCHATFTMRLLSPIRVPNYNLIIMDEAHFTDPASIAARGYISTRVEMGEAAGIFMTATPPGSRDPFPQSNAPIMDEEREIPERSWNSGHEWVTDFKGKTVWFVPSIKAGNDIAACLRKNGKKVIQLSRKTFDSEYVKTRTNDWDFVVTTDISEMGANFKAERVIDPRRCMKPVILTDGEERVILAGPMPVTHSSAAQRRGRVGRNPKNENDQYIYMGEPLENDEDCAHWKEAKMLLDNINTPEGIIPSMFEPEREKVDAIDGEYRLRGEARKTFVDLMRRGDLPVWLAYRVAAEGINYADRRWCFDGVKNNQILEENVEVEIWTKEGERKKLKPRWLDARIYSDPLALKEFKEFAAGRKSLTLNLITEMGRLPTFMTQKARNALDNLAVLHTAEAGGRAYNHALSELPETLETLLLLTLLATVTGGIFLFLMSGKGIGKMTLGMCCIITASVLLWYAQIQPHWIAASIILEFFLIVLLIPEPEKQRTPQDNQLTYVVIAILTVVAATMANEMGFLEKTKKDFGLGGIATQQPESNILDIDLRPASAWTLYAVATTFITPMLRHSIENSSVNVSLTAIANQATVLMGLGKGWPLSKMDIGVPLLAIGCYSQVNPITLTAALLLLVAHYAIIGPGLQAKATREAQKRAAAGIMKNPTVDGITVIDLDPIPYDPKFEKQLGQVMLLVLCVTQVLMMRTTWALCEALTLATGPISTLWEGNPGRFWNTTIAVSMANIFRGSYLAGAGLLFSIMKNTANTRRGTGNTGETLGEKWKNRLNALGKSEFQIYKKSGIQEVDRTLAKEGIKRGETDHHAVSRGSAKLRWFVERNLVTPEGKVMDLGCGRGGWSYYCGGLKNVKEVKGLTKGGPGHEEPIPMSTYGWNLVRLQSGVDVFFTPPEKCDTLLCDIGESSPNPTVEAGRTLRVLNLVENWLNNNTQFCIKVLNPYMPSVIEKMEALQRKYGGALVRNPLSRNSTHEMYWVSNASGNIVSSVNMISRMLINRFTMRHKKATYEPDVDLGSGTRNIGIESEIPNLDIIGKRIEKIKQEHETSWHYDQDHPYKTWAYHGSYETKQTGSASSMVNGVVRLLTKPWDVIPMVTQMAMTDTTPFGQQRVFKEKVDTRTQEPKEGTKKLMKITAEWLWKELGKKKTPRMCTREEFTRKVRSNAALGAIFTDENKWKSAREAVEDSGFWELVDKERNLHLEGKCETCVYNMMGKREKKLGEFGKAKGSRAIWYMWLGARFLEFEALGFLNEDHWFSRENSLSGVEREGLHKLGYILRDVSKKEGGAMYADDTAGWDTRITLEDLKNEEMVTNHMEGEHKKLAEAIFKLTYQNKVVRVQRPTPRGTVMDIISRRDQRGSGQVVTYGLNTFTNMEAQLIRQMEGEGVFKSIQQLTATEEIAVKNWLARVGRERLSRMAISGDDCVVKPLDDRFASALTALNDMGKVRKDIQQWEPSRGWNDWTQVPFCSHHFHELIMKDGRVLVVPCRNQDELIGRARISQGAGWSLRETACLGKSYAQMWSLMYFHRRDLRLAANAICSAVPSHWVPTSRTTWSIHATHEWMTTEDMLTVWNRVWIQENPWIEDKTPVESWEEIPYLGKREDQWCGSLIGLTSRATWAKNIQTAINQVRSLIGNEEYTDYMPSMKRFRREEEEAGVLW)を、配列番号51に示す。
【0090】
また、表2の配列番号26から40の配列は、上述のデングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号26から40の配列は、実施形態1で説明した実験計画法により得られる仮説により予測された、HLA−A2分子(HLA−A*0201遺伝子の産物)との結合性が上位の配列である。なお、配列番号26から40まで結合性の優れる順に並んでいる。すなわち、配列番号26が、最も結合性が優れると予測される配列である。
【0091】
また、表3の配列番号41から50の配列は、上述のデングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基からなる配列である。また、配列番号41から50の配列は、実施形態1で説明した実験計画法により得られる仮説により予測された、HLA−A2分子(HLA−A*0206遺伝子の産物)との結合性が上位の配列である。なお、配列番号41から50まで結合性の優れる順に並んでいる。すなわち、配列番号41が、最も結合性が優れると予測される配列である。
【0092】
また、表1〜表3には、上述のデングウイルス2型の代表株AY776328株に含まれる9アミノ酸残基について、上述の予測プログラムを用いた予測結果のスコア上位に相当するアミノ酸配列、予測スコア、それに対応する結合実験データが記載されている。なお、結合実験はすべて、9アミノ酸ペプチドを上述の合成方法により人工合成して行った。
【0093】
上記の互いに1または2アミノ酸残基が置換されてなるペプチド配列は、いずれも同様に優れたHLA−A分子との結合性を示すことが予測される。よって、配列番号1から50に示したHLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは数個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと予測することができる。
【0094】
別の観点から言えば、実施形態1で説明した実験計画法により得られる仮説により予測された、HLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは数個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと言える。なお、置換されるアミノ酸残基同士は、ともに疎水性アミノ酸残基などの互いに特性の類似するアミノ酸残基同士とする方がよい。
【0095】
発明者の一人宇高らは、互いに1または2アミノ酸残基が置換されてなるペプチド配列であっても、同様に優れた抗原提示分子との結合性を示すことを既に報告している。
1."Decrypting the structure of MHC−I restricted CTL epitopes with complex peptide libraries."Keiko Udaka,Karl−Heinz Wiesmuller,Stefan Kienle,Gunter Jung and Peter Walden.J.Exp.Med.181,2097−2108.(1995)
2."Tolerance to amino acid varidations in peptides binding to the MHC class I protein H−2Kb."Keiko Udaka,Karl−Heinz Wiesmuller, Stefan Kienle, Gunter Jung and Peter Walden.J.Biol.Chem.270,24130−24134.(1995)
3."Self MHC−restricted peptides recognized by all alloreactive T lymphocyte clone."Keiko Udaka,Karl−Heinz Wiesmuller,Stefan Kienle,Gunter Jung and Peter Walden.J.Immunol.157,670−678.(1996)
したがって、上記の互いに1または2アミノ酸残基が置換されてなるペプチド配列は、いずれも同様に優れたHLA−A分子との結合性を示すことが予測される。よって、配列番号1から50に示したHLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは数個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと予測することができる。
【0096】
別の観点から言えば、実施形態1で説明した実験計画法により得られる仮説により予測された、HLA−A分子との結合性が優れるアミノ酸配列のうち1若しくは数個のアミノ酸残基が置換、欠失、付加されてなるアミノ酸配列であっても、同様に優れたHLA結合性を示すものと言える。なお、置換されるアミノ酸残基同士は、ともに疎水性アミノ酸残基などの互いに特性の類似するアミノ酸残基同士とする方がよい。
【0097】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【0098】
この出願は、2006年10月12日に出願された日本出願特願2006−279232及び2007年7月20日に出願された日本出願特願2007−189047を基礎とする優先権を主張し、その開示の全てをここに取り込む。
【特許請求の範囲】
【請求項1】
HLA−A型分子に結合するHLA結合性ペプチドであって、
配列番号15からなることを特徴とするHLA結合性ペプチド。
【請求項2】
請求項1に記載のHLA結合性ペプチドにおいて、
前記HLA結合性ペプチドは、
HLA−A24分子に結合することを特徴とするHLA結合性ペプチド。
【請求項3】
前記HLA−A24分子がHLA−A2402分子である請求項2に記載のHLA結合性ペプチド。
【請求項4】
請求項1に記載のHLA結合性ペプチドにおいて、
前記HLA結合性ペプチドは、
HLA−A2分子に結合することを特徴とするHLA結合性ペプチド。
【請求項5】
前記HLA−A2分子がHLA−A0201分子である請求項4に記載のHLA結合性ペプチド。
【請求項6】
前記HLA−A2分子がHLA−A0206分子である請求項4に記載のHLA結合性ペプチド。
【請求項7】
請求項1乃至6のいずれかに記載のHLA結合性ペプチドをコードするDNA配列を含むことを特徴とするDNA断片。
【請求項8】
請求項1乃至6のいずれかに記載のHLA結合性ペプチドをコードするDNA配列を含むことを特徴とする組み換えベクター。
【請求項1】
HLA−A型分子に結合するHLA結合性ペプチドであって、
配列番号15からなることを特徴とするHLA結合性ペプチド。
【請求項2】
請求項1に記載のHLA結合性ペプチドにおいて、
前記HLA結合性ペプチドは、
HLA−A24分子に結合することを特徴とするHLA結合性ペプチド。
【請求項3】
前記HLA−A24分子がHLA−A2402分子である請求項2に記載のHLA結合性ペプチド。
【請求項4】
請求項1に記載のHLA結合性ペプチドにおいて、
前記HLA結合性ペプチドは、
HLA−A2分子に結合することを特徴とするHLA結合性ペプチド。
【請求項5】
前記HLA−A2分子がHLA−A0201分子である請求項4に記載のHLA結合性ペプチド。
【請求項6】
前記HLA−A2分子がHLA−A0206分子である請求項4に記載のHLA結合性ペプチド。
【請求項7】
請求項1乃至6のいずれかに記載のHLA結合性ペプチドをコードするDNA配列を含むことを特徴とするDNA断片。
【請求項8】
請求項1乃至6のいずれかに記載のHLA結合性ペプチドをコードするDNA配列を含むことを特徴とする組み換えベクター。
【図1】




【公開番号】特開2013−78325(P2013−78325A)
【公開日】平成25年5月2日(2013.5.2)
【国際特許分類】
【出願番号】特願2012−257249(P2012−257249)
【出願日】平成24年11月26日(2012.11.26)
【分割の表示】特願2008−538674(P2008−538674)の分割
【原出願日】平成19年10月3日(2007.10.3)
【出願人】(000004237)日本電気株式会社 (19,353)
【出願人】(504174180)国立大学法人高知大学 (174)
【Fターム(参考)】
【公開日】平成25年5月2日(2013.5.2)
【国際特許分類】
【出願日】平成24年11月26日(2012.11.26)
【分割の表示】特願2008−538674(P2008−538674)の分割
【原出願日】平成19年10月3日(2007.10.3)
【出願人】(000004237)日本電気株式会社 (19,353)
【出願人】(504174180)国立大学法人高知大学 (174)
【Fターム(参考)】
[ Back to top ]

