HPLCによるビオチン及びビオチン関連物質の測定方法
【課題】HPLCを利用したビオチン及びビオチン関連物質の測定法の提供。
【解決手段】合成樹脂が充填されたオープンクロマト管には塩酸緩衝液が通液される。塩酸緩衝液により希釈されたビオチン及びビオチン関連物質を含んだ試料がオープンクロマト管に通液されて、ビオチン及びビオチン関連物質に代表される分子量1000以上の物質は合成樹脂に吸着する。オープンクロマト管が塩酸緩衝液により洗浄されて、合成樹脂に吸着せずに残留していた尿中成分は洗い流される。エタノールがオープンクロマト管に通液されて、エタノールに溶解する物質の溶出が行われる。溶出液がDMEQ−Hによる蛍光標識反応に供されて、溶出液中のカルボン酸を含む物質は蛍光標識される。溶出液にHPLCが適用されて、蛍光標識されたビオチン及びビオチン関連物質は、蛍光検出器により測定される。
【解決手段】合成樹脂が充填されたオープンクロマト管には塩酸緩衝液が通液される。塩酸緩衝液により希釈されたビオチン及びビオチン関連物質を含んだ試料がオープンクロマト管に通液されて、ビオチン及びビオチン関連物質に代表される分子量1000以上の物質は合成樹脂に吸着する。オープンクロマト管が塩酸緩衝液により洗浄されて、合成樹脂に吸着せずに残留していた尿中成分は洗い流される。エタノールがオープンクロマト管に通液されて、エタノールに溶解する物質の溶出が行われる。溶出液がDMEQ−Hによる蛍光標識反応に供されて、溶出液中のカルボン酸を含む物質は蛍光標識される。溶出液にHPLCが適用されて、蛍光標識されたビオチン及びビオチン関連物質は、蛍光検出器により測定される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、HPLC(高速液体クロマトグラフィー)を利用したビオチンおよびビオチン関連物質の測定方法に関するものである。
【背景技術】
【0002】
ビオチンは食品添加物に認定されていないために、治療用粉ミルクを摂取している乳児の欠乏症状が報告されている。また、近年、妊娠中に尿中ビオチン量が減少することが明らかになりつつある。ビオチンは日本食品標準成分表に収載されていないために、食事記録法などの食事調査が実施できない。このため、血漿や尿中のビオチン及びビオチン関連物質の精度の高い測定が健康管理のために必要とされている。
【0003】
ビオチンの測定法としては、従来より、微生物学的定量法、HPLC法、酵素抗体法、及びガスクロマトグラフィ法が利用されている(非特許文献1)。微生物学的定量法は現在最も汎用されている測定法であり、血液や尿などの生体試料及び食品中のビオチン量の測定に利用されている。HPLC法としては、ADAMにて蛍光誘導体にして検出するプレカラム法(非特許文献2)、及び蛍光標識されたstreptoavidinとの特異的結合を利用したポストカラム法(非特許文献3、4、5)が利用されている。ビオチン関連物質である3−HIAの測定法としては、カルボン酸を標識して、UVによって検出するHPLCシステムが利用されている(非特許文献6)。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Livaniou E et al.: Analytical techniques for determining biotin. J Chromatogr A 881:331-343, 2000.
【非特許文献2】Hayakawa K et al.: Determination of biotin (vitamin H) by the high-performance affinity chromatography with tripsin-treated avidin-bound column. J Chromatogr B 869:93-100, 2008.
【非特許文献3】Chastain JL et al.: High-performance liquid chromatography of biotin and analoques. J Chromatogr 330:153-158, 1985.
【非特許文献4】Lahely S et al.: Determination of biotin in foods by high-performance liquid chromatography with post-column derivatization and fluorimetric detection. Food Chem 65:253-258, 1999.
【非特許文献5】Thompson LB et al.: Determination of biotin by high-performance liquid chromatography in infant formula, medical nutritional products, and vitamin premixes. J AOAC Internat 89:1515-1518, 2006.
【非特許文献6】Watanabe T et al.: Measurement of 3-hydroxyisovaleric acid in urine of biotin-deficient infants and mice by HPLC. J Nutr 135:615-618, 2005.
【発明の概要】
【発明が解決しようとする課題】
【0005】
上述された微生物学的定量法には、発育にビオチンを要求する微生物のうち最もビオチンに特異性の高い乳酸菌株が用いられるため、測定感度が高い。しかし、微生物学的定量法には、活性の安定した乳酸菌の維持管理が煩雑であるという課題が存在する。乳酸菌は、ビオチンの異化代謝物であるビオチンスルフォキシドの存在により発育する一方、ビオチンスルフォンの存在により発育が抑制される。このような特異性の低さ故に、ビオチン代謝物の存在下における生体試料の評価は精度が十分ではない。
【0006】
酵素抗体法とガスクロマトグラフィ法とを組み合わせた方法では、ビオチン及びビオチン代謝物をそれぞれHPLCにより分取し、それぞれを酵素抗体法で測定する方法が採用されている。しかし、酵素抗体法及びガスクロマトグラフィ法には、それぞれ感度や汎用性の低さという課題が存在する。
【0007】
従来より利用されているHPLC法では、ビオチンが溶解しない有機溶媒中における蛍光標識反応が行われるため、測定感度が低い。また、streptoavidinによる結合がビオチンに特異的であるため、ビオチン異化代謝物を測定することはできない。
【0008】
本発明は、前述された事情に鑑みてなされたものであり、その目的は、混在されたビオチン、及びビオチン関連物質を同時に測定する方法を提供することにある。
【課題を解決するための手段】
【0009】
(1) 本発明に係るビオチン及びビオチン関連物質の測定方法は、合成樹脂に塩酸緩衝液を通液する第1ステップと、ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料を塩酸緩衝液により希釈する第2ステップと、上記合成樹脂に希釈された上記試料を通液して、上記合成樹脂に上記試料中の有機物の一部を吸着させる第3ステップと、上記有機物が吸着した上記合成樹脂を、塩酸緩衝液によって洗浄する第4ステップと、上記合成樹脂にエタノールを通液して、上記合成樹脂に吸着していた有機物の溶出を行う第5ステップと、上記溶出により得られた溶出液を蛍光標識反応に供する第6ステップと、蛍光標識された上記溶出液にHPLCを適用することにより、上記溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を測定する第7ステップと、を含む。
【0010】
塩酸緩衝液が通液された合成樹脂には、塩酸緩衝液によって希釈された試料が通液される。これにより、ビオチン及びビオチン関連物質に代表される分子量1000以下の物質が、合成樹脂に吸着する。合成樹脂が塩酸緩衝液によって洗浄されて、合成樹脂に吸着せずに残留していた分子量1000を超える物質が洗い流される。合成樹脂にエタノールが通液されて、ビオチン及びビオチン関連物質に代表されるエタノールに溶解する物質が溶出される。溶出液が蛍光標識反応に供されて、ビオチン及びビオチン関連物質に代表される分子中にカルボン酸を含む物質が蛍光標識される。溶出液にHPLCが適用されて、蛍光標識されたビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種が測定される。
【0011】
(2) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記ビオチン異化代謝物は、ビオチンスルフォキシド、ビオチンスルフォン、及びビスノルビオチンからなる群より選択された少なくとも1種のビオチン異化代謝物であってもよい。
【0012】
(3) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記蛍光標識反応は、DMEQ−Hによって行われてもよい。
【0013】
(4) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記試料は、食品又は動物の飼料の一部を含んだものであってもよい。
【0014】
食品又は動物の飼料に含有されるビオチン及びビオチン関連物質を測定することにより、人、家畜、及びペット等が摂取するビオチン及びビオチン関連物質を知ることが可能となり、健康管理に貢献することができる。
【0015】
(5) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記試料は、哺乳動物の体内から採取された尿又は血液中の成分を含んだものであってもよい。
【0016】
人や他の哺乳動物の尿又は血漿に含有されるビオチン及びビオチン関連物質を測定することにより、ビオチンの欠乏を早期に発見することが可能となり、健康管理に貢献することができる。
【0017】
(6) 本発明に係るビオチン及びビオチン関連物質の測定方法は、ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料を蛍光標識反応に供する第8ステップと、蛍光標識された上記試料を、リン酸緩衝液により希釈する第9ステップと、アビジン樹脂に希釈された上記試料を通液して、上記試料中の有機物の一部を、アビジン樹脂に吸着させる第10ステップと、上記有機物が吸着した上記アビジン樹脂を、リン酸緩衝液によって洗浄する第11ステップと、上記アビジン樹脂にグアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液を通液して、上記アビジン樹脂に吸着していた有機物の溶出を行う第12ステップと、上記溶出により得られた溶出液にHPLCを適用することにより、上記溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を測定する第13ステップと、を含む。
【0018】
試料が蛍光標識反応に供されて、ビオチン及びビオチン関連物質に代表される分子中にカルボン酸を含む物質が蛍光標識される。試料は、リン酸緩衝液により希釈される。試料はアビジン樹脂に通液され、ビオチン及びビオチン関連物質に代表されるウレイド環を有する物質は、アビジンと特異的に結合する。アビジン樹脂がリン酸緩衝液によって洗浄されて、アビジン樹脂に吸着せずに残留していたウレイド環を有さない物質は、洗い流される。アビジン樹脂にグアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液が通液されて、酸性条件下でのグアニジン塩酸塩のタンパク膨潤作用と、アセトニトリルのタンパク立体構造の変性作用により、ウレイド環を有する物質が溶出される。溶出液にHPLCが適用されて、蛍光標識されたビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種が測定される。
【0019】
(7) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記ビオチン異化代謝物は、ビオチンスルフォキシド、ビオチンスルフォン、及びビスノルビオチンからなる群より選択された少なくとも1種のビオチン異化代謝物であってもよい。
【0020】
(8) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記蛍光標識反応は、DMEQ−Hによって行われてもよい。
【0021】
(9) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記試料は、食品又は動物の飼料の一部を含んだものであってもよい。
【0022】
(10) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記試料は、哺乳動物の体内から採取された尿又は血液中の成分を含んだものであってもよい。
【発明の効果】
【0023】
本発明に係るビオチン及びビオチン関連物質の測定方法によると、混在されたビオチン、及びビオチン関連物質を同時に測定することが可能となる。それにより、食品や家畜の飼料のビオチン含有量を測定によって把握し、適切なビオチン摂取量を維持することができる。
【図面の簡単な説明】
【0024】
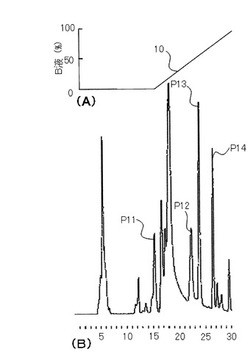
【図1】図1は、本発明の実施例1に係るビオチン及びビオチン関連物質の測定法により、健全者の尿を測定して得られたクロマトグラムである。
【図2】図2は、合成樹脂やアビジン樹脂による前処理を経ずに、ビオチン欠乏症患者におけるビオチン投与前の尿を測定して得られたクロマトグラムである。
【図3】図3は、合成樹脂やアビジン樹脂による前処理を経ずに、ビオチン欠乏症患者におけるビオチン投与後の尿を測定して得られたクロマトグラムである。
【図4】図4は、本発明の実施例1に係るビオチン及びビオチン関連物質の測定法により、ビオチン欠乏症患者におけるビオチン投与前の尿を測定して得られたクロマトグラムである。
【図5】図5は、本発明の実施例1に係るビオチン及びビオチン関連物質の測定法により、ビオチン欠乏症患者におけるビオチン投与後の尿を測定して得られたクロマトグラムである。
【図6】図6は、本発明の実施例2に係るビオチン及びビオチン関連物質の測定法により、ビオチン欠乏症患者におけるビオチン投与前の尿を測定して得られたクロマトグラムである。
【図7】図7は、本発明の実施例2に係るビオチン及びビオチン関連物質の測定法により、ビオチン欠乏症患者におけるビオチン投与後の尿を測定して得られたクロマトグラムである。
【発明を実施するための形態】
【0025】
以下に、適宜図面が参照されて、本発明の好ましい実施形態が説明される。なお、以下に説明される実施形態は、本発明の一例に過ぎず、本発明の要旨を変更しない範囲で、本発明の実施形態が適宜変更できることは言うまでもない。
【0026】
[第1実施形態]
本発明の第1実施形態は、以下の第1から第7ステップを含むものである。第1ステップにおいて、合成樹脂が充填されたオープンクロマト管には、塩酸緩衝液が通液される。第2ステップにおいて、例えば人の尿に代表されるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも一種を含んだ試料が塩酸緩衝液により希釈される。第3ステップにおいて、オープンクロマト管に試料が通液されて、試料中の有機物のうち分子量1000以下の物質が合成樹脂に吸着する。第4ステップにおいて、合成樹脂が塩酸緩衝液によって洗浄されて、樹脂に吸着せずに残留している分子量1000以上の物質が洗い流される。第5ステップにおいて、オープンクロマト管にエタノールが通液されて、合成樹脂に吸着していた有機物のうち、エタノールに溶解する物質の溶出が行われる。第6ステップにおいて、溶出液が蛍光標識反応に供される。第7ステップにおいて、上記溶出液にHPLCが適用されて、上記溶出液に含まれる蛍光標識されたビオチン、ビオチン異化代謝物、及び3−HIAが測定される。以下、第1実施形態の各ステップが詳細に説明される。
【0027】
第1ステップにおいて、合成樹脂が充填されたオープンクロマト管には塩酸緩衝液が通液される。ここで、合成樹脂とは、多孔質構造を有する架橋高分子であり、樹脂内の細孔表面と被吸着物質間の物理的相互作用により特定の有機物を吸着するものである。合成樹脂としては、例えば三菱化学株式会社が販売するセパビーズSP850が使用可能である。また、塩酸緩衝液とは、塩酸と他の物質の水溶液であり、緩衝作用を有するものである。塩酸緩衝液としては、例えば塩酸と、塩化カリウム、グリシン、又はトリスとの混合物が使用可能である。また、通液とは、液体を流し込む操作である。オープンクロマト管の上部には液体の流入口が設けられており、そこから通液された液体は、オープンクロマト管内部に充填された物質を伝い、オープンクロマト管の下部に設けられた液体の流出口から流出する。オープンクロマト管としては、例えばジーエルサイエンス株式会社の販売するものが使用可能である。塩酸緩衝液の通液により、後述される第3ステップにおいて目的物質であるビオチン及びビオチン関連物質の吸着が強められる。
【0028】
第2ステップにおいて、ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料が、塩酸緩衝液により例えば5倍に希釈される。これにより、試料のphは、後述される第3ステップにおいてビオチン及びビオチン関連物質が合成樹脂に吸着するために適切な値となる。ここで、ビオチンとは、ビタミンB群に分類される水溶性ビタミンであり、D−[(+)−cis−ヘキサヒドロ−2−オキソ−1H−チエノ−(3,4)−イミダゾール−4−吉草酸]として表記されるものである。また、ビオチン異化代謝物とは、ビオチンが異化反応された結果としての代謝生成物である。ビオチン異化代謝物としては、例えばビオチンスルフォキシド、ビオチンスルフォン、及びビスノルビオチン等が挙げられる。また、3−HIAとは、3−ヒドロキシイソ吉草酸である。ビオチン、ビオチン異化代謝物、及び3−HIAを含んだ試料としては、例えば人や他の哺乳動物の尿や血液、動物の飼料、又は飲食物などが挙げられる。
【0029】
第3ステップにおいて、合成樹脂が充填されたオープンクロマト管に、試料が通液されて、希釈された試料中のビオチン、ビオチンスルフォキシド、ビオチンスルフォン、ビスノルビオチン、3−HIAなど、分子量1000以下の物質が、合成樹脂に吸着する。ここで、吸着とは、樹脂内の細孔表面と被吸着物質間の物理的相互作用による結合のことである。
【0030】
第4ステップにおいて、オープンカラムの内部、及び有機物が吸着された合成樹脂が、塩酸緩衝液により洗浄される。この操作により、樹脂に吸着せずに残留している分子量1000以上の尿中成分が洗い流される。この尿中成分は、尿と共に排泄されるホルモンなどの体内代謝産物、及び生体内でグルクロン酸や硫酸など抱合された有機物などである。オープンカラム及び合成樹脂の洗浄のために、十分な量の塩酸緩衝液が、オープンクロマト管に通液される。
【0031】
第5ステップにおいて、エタノールにより、合成樹脂からエタノールに溶解する物質の溶出が行われる。ここで、エタノールによる溶出とは、合成樹脂表面の疎水性や、ビオチン、ビオチンスルフォキシド、ビオチンスルフォン、ビスノルビオチン、及び3−HIAの疎水性部分の間のファンデルワールス力(Vander Waales力)による吸着によって、対象となる物質を極性物質であるエタノールに移動させることである。ビオチンはエタノール以外の有機溶剤には溶解しないため、エタノールが溶出剤として用いられる必要がある。エタノールによる溶出のために、オープンクロマト管には、エタノールが通液される。エタノールが合成樹脂を伝うことで、合成樹脂からエタノールに溶解する物質の溶出が行われる。上述された流出口より流出した溶出液は、試験管などによって採取される。
【0032】
第6ステップにおいて、溶出により得られた溶出液は蛍光標識反応に供される。ここで、蛍光標識反応とは、蛍光標識試薬等が用いられて、溶出液中の分子が蛍光標識される反応である。蛍光標識試薬としては、例えば、DMEQ−H(6,7−dimethoxy−1−methy−2(1H)−quinoxalinone−3−propio−nylcarboxylic acid hydrazide)が使用可能である。蛍光標識の方法として、第5ステップで得られた溶出液を、塩酸、ピリジン、及びEDCの各水溶液と、DMEQ−HのN,N−dimethylformamide溶液との混合液の中で静置する方法が挙げられる。溶出液にはビオチン及びビオチン関連物質の他にも分子量1000以下の物質が含まれるが、溶出液中の物質のうち分子中にカルボン酸を含む物質が標識される。蛍光標識された物質は、後述される第7ステップにおいて、蛍光検出器により検出される。
【0033】
第7ステップにおいて、蛍光標識された溶出液にHPLCが適用されて、溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種が測定される。ここで、HPLCとは、カラムクロマトグラフィーの一種であり、HPLCカラム内部に機械的に高い圧力が印加されて、移動相溶媒が高流速でHPLCカラムを通過するものである。これにより、分析物が固定相に留まる時間は短縮され、分離能及び検出感度が高くなる。HPLCとしては、溶媒の組成を連続的に変化させて溶出を行うグラジュエント法が使用可能である。例えば溶出にメタノールが使用される場合、溶媒中のメタノールが少ない初期の状態では極性の高い物質が溶出され、メタノールの割合が増加するに従って極性の低い物質が順次溶出される。HPLCに使用される機材として、送液のためのポンプ、試料を注入するインジェクター、HPLCカラム、HPLCカラムの温度を制御するカラムオーブン、及び蛍光標識された物質を検出する蛍光検出器等が挙げられる。HPLCカラムには、例えば株式会社ワイエムシィが販売するYMC−Pack FA(250×6mm)が使用可能である。上述された他の機材には、例えば株式会社島津製作所が販売するProminenceが使用可能である。
【0034】
[第2実施形態]
続けて、本発明に係る第2実施形態が、各ステップごとに解説される。第2実施形態は、第8から第13ステップを含むものである。第8ステップにおいて、試料を含んだ溶液は、蛍光標識反応に供される。第9ステップにおいて、蛍光標識反応に供された試料は、リン酸緩衝液により希釈される。第10ステップにおいて、アビジン樹脂が充填されたオープンクロマト管内部に試料が通液されて、試料中の有機物のうち、分子構造中にウレイド環を有する物質がアビジン樹脂に吸着する。第11ステップにおいて、有機物が吸着されたアビジン樹脂がリン酸緩衝液によって洗浄されて、樹脂に吸着せずに残留している物質が洗い流される。第12ステップにおいて、グアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液によって、アビジン樹脂に吸着していた分子構造中にウレイド環を有する物質の溶出が行われる。第13ステップにおいて、溶出により得られた溶出液にHPLCが適用されて、上記溶出液に含まれる蛍光標識されたビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種が測定される。
【0035】
即ち、第2実施形態は、合成樹脂に代わってアビジン樹脂が使用される点において、前述の第1実施形態と相違する。また、第1実施形態では、合成樹脂による前処理の後に蛍光標識反応が行われるが、第2実施形態では、蛍光標識反応が行われた後にアビジン樹脂による処理が行われる。以下、第2実施形態の各ステップが詳細に説明される。
【0036】
第8ステップにおいて、ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料が、蛍光標識反応に供される。蛍光標識反応には、第1実施形態と同様にDMEQ−Hを使用した方法が使用可能である。即ち、試料を、塩酸、ピリジン、及びEDCの各水溶液と、DMEQ−HのN,N−dimethylformamide溶液との混合液の中で静置する方法が挙げられる。アビジンとビオチンの結合は強固であり、アビジンと結合したビオチンの溶出は非常に困難である。しかし、事前に蛍光標識反応が行われることで、アビジンとビオチンの結合力は弱まり、後述される第12ステップにおける溶出が容易となる。これは、蛍光標識反応によりビオチンの分子構造が変化するためである。
【0037】
第9ステップにおいて、蛍光標識された試料は、リン酸緩衝液により例えば10倍に希釈される。ここで、リン酸緩衝液とは、リン酸と他の物質との混合液であり、緩衝作用を有するものである。リン酸緩衝液には、例えばリン酸二水素ナトリウムとリン酸水素二ナトリウムとの混合液が使用可能である。リン酸緩衝液により、試料のpHは、後述される第10ステップにおいて、ビオチン及びビオチン関連物質がアビジンとの結合するために最適な値となる。
【0038】
第10ステップにおいて、アビジン樹脂が充填されたオープンクロマト管内部に試料が通液されて、分子構造中にウレイド環を有する物質が、アビジン樹脂に吸着する。ここで、アビジン樹脂とは、アビジンが樹脂に結合されたレジン担体である。アビジン樹脂としては、例えばプロメガ株式会社が販売するTetraLinkTM Tetrameric Avidin Resinが使用可能である。アビジンには、ビオチンおよびビオチン異化代謝物のウレイド環と特異的に結合するという性質があるため、アビジン樹脂により、他の物質からビオチンおよびビオチン異化代謝物を選択的に抽出することが可能である。
【0039】
第11ステップにおいて、アビジン樹脂及びオープンクロマト管が、リン酸緩衝液によって洗浄される。この操作により、分子構造中にウレイド環を有さないことから、アビジン樹脂に吸着せずに残留していた物質が洗い流される。アビジン樹脂及びオープンクロマト管の洗浄には、上述の第1実施形態と同様の方法が使用可能である。即ち、アビジン樹脂が充填されたオープンクロマト管に、リン酸緩衝液を通液する方法が挙げられる。
【0040】
第12ステップにおいて、グアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液が使用されて、ビオチンおよびビオチン異化代謝物に代表されるウレイド環を有した物質がアビジン樹脂から溶出される。この溶出は、酸性条件下でのグアニジン塩酸塩のタンパク膨潤作用と、アセトニトリルのタンパク立体構造の変性作用によって行われる。アビジン樹脂からの溶出には、上述の第1実施形態と同様の方法が使用可能である。即ち、アビジン樹脂が充填されたオープンクロマト管に、グアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液を通液する方法が挙げられる。
【0041】
第13ステップにおいて、溶出により得られた溶出液にHPLCが適用されることにより、上記溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種が測定される。HPLCには、上述の第1実施形態と同様にグラジュエント法に基づく方法が使用可能であり、装置やカラムにも同様の物が使用可能である。
【実施例】
【0042】
[実施例1]
本発明に係る実施例1が以下に解説される。本実施例は上述の第1実施形態に対応するものである。本実施例において、試料として人の尿が使用される。
【0043】
[合成樹脂による前処理]
尿の前処理のために、オープンクロマト管が準備される。オープンクロマト管の内部には、合成樹脂が充填される。本実施形態においては、合成樹脂として、三菱化学株式会社が販売するセパビーズSP850が使用される。
【0044】
オープンクロマト管には、0.2M塩酸緩衝液(pH1.0)が通液される。続けて、0.2Mの塩酸緩衝液によって5倍希釈された尿がオープンクロマト管に通液された後、オープンクロマト管及び合成樹脂は、塩酸緩衝液の通液により洗浄される。純エタノールがオープンクロマト管に通液されて、溶出液は減圧濃縮される。ここで、上述されたオープンクロマト管への塩酸緩衝液の通液、塩酸緩衝液による尿の希釈、オープンクロマト管への尿の通液、オープンクロマト管及び合成樹脂の洗浄、及びエタノールによる溶出が、それぞれ本発明における第1、第2、第3、第4、及び第5ステップに相当するものである。
【0045】
[蛍光標識反応]
上記の手順により得られた標準水溶液1ngに対して塩酸、ピリジン、及びEDCの各水溶液と、DMEQ−HのN,N−dimethylformamide溶液とがそれぞれ0.05M、2.5%、0.25M、100μMとなるように添加されて、室温で2時間以上静置される。ここで、上述された溶液の添加が、本発明における第6ステップに相当するものである。
【0046】
[HPLCによる測定]
HPLCによる測定のために、HPLCカラムが準備される。本実施例においては、HPLCカラムとして、株式会社ワイエムシィが販売するYMC−Pack FA(250×6mm)が使用される。移動相には、水、メタノール、及びアセトニトリルが75:15:10の割合で混合された溶液(以下、I液とする)と、80%メタノール(以下、II液とする)とによるグラジュエント法が用いられる。流速は1.0ml/分とし、測定はEx:360nm、Em:435nmの蛍光測定により行われる。カラムの温度は35℃である。ここで、HPLCカラムを用いた蛍光測定が本発明における第7ステップに相当するものである。
【0047】
[測定結果]
図1(A)の折れ線10は、グラジュエント法の移動相におけるII液濃度の時間変化を示したものである。(B)のクロマトグラムにおいて、横軸は分単位の保持時間、縦軸は蛍光検出器の出力である。検出感度は20pgである。ピークP11、P12、P13、P14は、それぞれビオチンスルフォキシド、ビスノルビオチン、3−HIA、及びビオチンを示している。ビオチンスルフォンを示すピークは、試薬のピークと重なっており確認できなかった。図1の通り、本実施形態に係るビオチン及びビオチン関連物質の測定方法によると、若干の夾雑ピークが残るものの、ビオチンスルフォン以外のビオチン関連物質を測定することが可能であった。
【0048】
[実施例の作用効果]
本実施例に係るビオチン及びビオチン関連物質の測定方法によると、合成樹脂への吸着及び合成樹脂からの溶出により、分子量1000以下の物質が他の尿中成分から分離される。また、蛍光標識反応により、カルボン酸を含む物質が標識されるので、尿中のビオチン及びビオチン関連物質を蛍光検出器によって選択的に検出することができる。
【0049】
人や他の哺乳動物の尿に含有されるビオチン及びビオチン関連物質を測定することにより、ビオチンの欠乏を早期に発見することが可能となり、健康管理に貢献することができる。
【0050】
[実施例2]
続けて、本発明に係る実施例2が以下に解説される。本実施例は、上述された実施形態2に対応するものである。本実施例において、実施形態1と同様に、試料として人の尿が使用される。
【0051】
予め、尿は実施例1と同様の方法によって蛍光標識される。尿の前処理のためにアビジン樹脂が準備される。本変形例においては、アビジン樹脂として、プロメガ株式会社が販売するTetraLinkTM Tetrameric Avidin Resinが使用される。蛍光標識された尿は、2/15Mのリン酸緩衝液(pH7.4)により10倍希釈される。アビジン樹脂への吸着のため、尿はアビジン樹脂が充填されたオープンクロマト管に通液される。リン酸緩衝液がオープンクロマト管に通液されて、オープンクロマト管及びアビジン樹脂は、十分に洗浄される。3Mグアニジン塩酸塩、0.5%トリフルオロ酢酸、及び25%アセトニトリルの混合液がオープンクロマト管に通液される。溶出液に対して上述されたHPLCによる測定が行われる。ここで、尿の蛍光標識、リン酸緩衝液による尿の希釈、アビジン樹脂への吸着、リン酸緩衝液によるアビジン樹脂の洗浄、アビジン樹脂からの溶出、及びHPLCによる蛍光測定が、それぞれ本発明における第8、第9、第10、第11、第12、及び第13ステップに相当するものである。
【0052】
[測定結果]
ビオチン投与前後におけるビオチン欠乏患者の尿の測定結果が以下に解説される。本実施例の測定方法によるクロマトグラムとの比較対象として、合成樹脂やアビジン樹脂による前処理を経ずに得られたクロマトグラム、及び実施例1の方法によるクロマトグラムがそれぞれ示される。図2から図7に示されるクロマトグラムにおいて、図1と同様の測定条件が使用される。即ち、横軸は分単位の保持時間、縦軸は検出器の出力強度を示す。検出感度は20pgである。II液濃度の時間変化は図1(A)と同様である。
【0053】
まずは、合成樹脂やアビジン樹脂による前処理を経ずに得られたクロマトグラムが解説される。これは、試料として採取された尿を上述の蛍光標識反応に供して、HPLCによる測定を行った結果得られたものである。図2及び図3の通り、前処理を経ない尿から得られたクロマトグラムによると、ビオチンの投与前後共に夾雑ピークが多く、ビオチン関連物質のピーク同定は困難である。
【0054】
続けて、実施例1の方法によるクロマトグラムが解説される。図4におけるピークP21は、3−HIAを示すものである。図5におけるピークP31、P32、P33は、それぞれビオチンスルフォキシド、ビスノルビオチン、及びビオチンを示すものである。図4及び図5の通り、ビオチン投与前では、ビオチン及びビオチン異化代謝物は検出されず、ビオチン欠乏の早期指標である3−HIAの大きなピークP21が確認されている。ビオチン投与によって3−HIAのピークは消失し、ビオチンおよびビオチン異化代謝物のピークが検出されている。
【0055】
続けて、実施例2の方法によるクロマトグラムが解説される。図6におけるピークP41は、ビオチンスルフォンを示すものである。図7におけるピークP51、P52、P53、P54は、それぞれビオチンスルフォキシド、ビオチンスルフォン、ビスノルビオチン、及びビオチンを示すものである。図6、図7の通り、ビオチン投与前後共に、実施例1の方法では試薬ピークに隠れていたビオチンスルフォンが確認されている。ビオチン投与後の結果では、前述の実施形態と同様にビオチン及びビオチン異化代謝物が検出されている。
【0056】
[実施例の作用効果]
本実施例に係るビオチン及びビオチン関連物質の測定方法によると、蛍光標識反応により、カルボン酸を含む物質が標識される。また、アビジン樹脂への吸着及びアビジン樹脂からの溶出により、ウレイド環を有する物質が他の尿中成分から分離されるので、尿中のビオチン及びビオチン関連物質を蛍光検出器によって選択的に検出することができる。
【0057】
また、蛍光標識反応によりビオチンの分子構造が変化し、アビジンとの結合力が弱まるため、通常は困難であるアビジン樹脂からの溶出が容易に行われる。
【符号の説明】
【0058】
10・・・ 折れ線
P11・・・ピーク(ビオチンスルフォキシド)
P12・・・ピーク(ビスノルビオチン)
P13・・・ピーク(3−HIA)
P14・・・ピーク(ビオチン)
P21・・・ピーク(3−HIA)
P31・・・ピーク(ビオチンスルフォキシド)
P32・・・ピーク(ビスノルビオチン)
P33・・・ピーク(ビオチン)
P41・・・ピーク(ビオチンスルフォン)
P51・・・ピーク(ビオチンスルフォキシド)
P52・・・ピーク(ビオチンスルフォン)
P53・・・ピーク(ビスノルビオチン)
P54・・・ピーク(ビオチン)
【技術分野】
【0001】
本発明は、HPLC(高速液体クロマトグラフィー)を利用したビオチンおよびビオチン関連物質の測定方法に関するものである。
【背景技術】
【0002】
ビオチンは食品添加物に認定されていないために、治療用粉ミルクを摂取している乳児の欠乏症状が報告されている。また、近年、妊娠中に尿中ビオチン量が減少することが明らかになりつつある。ビオチンは日本食品標準成分表に収載されていないために、食事記録法などの食事調査が実施できない。このため、血漿や尿中のビオチン及びビオチン関連物質の精度の高い測定が健康管理のために必要とされている。
【0003】
ビオチンの測定法としては、従来より、微生物学的定量法、HPLC法、酵素抗体法、及びガスクロマトグラフィ法が利用されている(非特許文献1)。微生物学的定量法は現在最も汎用されている測定法であり、血液や尿などの生体試料及び食品中のビオチン量の測定に利用されている。HPLC法としては、ADAMにて蛍光誘導体にして検出するプレカラム法(非特許文献2)、及び蛍光標識されたstreptoavidinとの特異的結合を利用したポストカラム法(非特許文献3、4、5)が利用されている。ビオチン関連物質である3−HIAの測定法としては、カルボン酸を標識して、UVによって検出するHPLCシステムが利用されている(非特許文献6)。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Livaniou E et al.: Analytical techniques for determining biotin. J Chromatogr A 881:331-343, 2000.
【非特許文献2】Hayakawa K et al.: Determination of biotin (vitamin H) by the high-performance affinity chromatography with tripsin-treated avidin-bound column. J Chromatogr B 869:93-100, 2008.
【非特許文献3】Chastain JL et al.: High-performance liquid chromatography of biotin and analoques. J Chromatogr 330:153-158, 1985.
【非特許文献4】Lahely S et al.: Determination of biotin in foods by high-performance liquid chromatography with post-column derivatization and fluorimetric detection. Food Chem 65:253-258, 1999.
【非特許文献5】Thompson LB et al.: Determination of biotin by high-performance liquid chromatography in infant formula, medical nutritional products, and vitamin premixes. J AOAC Internat 89:1515-1518, 2006.
【非特許文献6】Watanabe T et al.: Measurement of 3-hydroxyisovaleric acid in urine of biotin-deficient infants and mice by HPLC. J Nutr 135:615-618, 2005.
【発明の概要】
【発明が解決しようとする課題】
【0005】
上述された微生物学的定量法には、発育にビオチンを要求する微生物のうち最もビオチンに特異性の高い乳酸菌株が用いられるため、測定感度が高い。しかし、微生物学的定量法には、活性の安定した乳酸菌の維持管理が煩雑であるという課題が存在する。乳酸菌は、ビオチンの異化代謝物であるビオチンスルフォキシドの存在により発育する一方、ビオチンスルフォンの存在により発育が抑制される。このような特異性の低さ故に、ビオチン代謝物の存在下における生体試料の評価は精度が十分ではない。
【0006】
酵素抗体法とガスクロマトグラフィ法とを組み合わせた方法では、ビオチン及びビオチン代謝物をそれぞれHPLCにより分取し、それぞれを酵素抗体法で測定する方法が採用されている。しかし、酵素抗体法及びガスクロマトグラフィ法には、それぞれ感度や汎用性の低さという課題が存在する。
【0007】
従来より利用されているHPLC法では、ビオチンが溶解しない有機溶媒中における蛍光標識反応が行われるため、測定感度が低い。また、streptoavidinによる結合がビオチンに特異的であるため、ビオチン異化代謝物を測定することはできない。
【0008】
本発明は、前述された事情に鑑みてなされたものであり、その目的は、混在されたビオチン、及びビオチン関連物質を同時に測定する方法を提供することにある。
【課題を解決するための手段】
【0009】
(1) 本発明に係るビオチン及びビオチン関連物質の測定方法は、合成樹脂に塩酸緩衝液を通液する第1ステップと、ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料を塩酸緩衝液により希釈する第2ステップと、上記合成樹脂に希釈された上記試料を通液して、上記合成樹脂に上記試料中の有機物の一部を吸着させる第3ステップと、上記有機物が吸着した上記合成樹脂を、塩酸緩衝液によって洗浄する第4ステップと、上記合成樹脂にエタノールを通液して、上記合成樹脂に吸着していた有機物の溶出を行う第5ステップと、上記溶出により得られた溶出液を蛍光標識反応に供する第6ステップと、蛍光標識された上記溶出液にHPLCを適用することにより、上記溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を測定する第7ステップと、を含む。
【0010】
塩酸緩衝液が通液された合成樹脂には、塩酸緩衝液によって希釈された試料が通液される。これにより、ビオチン及びビオチン関連物質に代表される分子量1000以下の物質が、合成樹脂に吸着する。合成樹脂が塩酸緩衝液によって洗浄されて、合成樹脂に吸着せずに残留していた分子量1000を超える物質が洗い流される。合成樹脂にエタノールが通液されて、ビオチン及びビオチン関連物質に代表されるエタノールに溶解する物質が溶出される。溶出液が蛍光標識反応に供されて、ビオチン及びビオチン関連物質に代表される分子中にカルボン酸を含む物質が蛍光標識される。溶出液にHPLCが適用されて、蛍光標識されたビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種が測定される。
【0011】
(2) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記ビオチン異化代謝物は、ビオチンスルフォキシド、ビオチンスルフォン、及びビスノルビオチンからなる群より選択された少なくとも1種のビオチン異化代謝物であってもよい。
【0012】
(3) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記蛍光標識反応は、DMEQ−Hによって行われてもよい。
【0013】
(4) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記試料は、食品又は動物の飼料の一部を含んだものであってもよい。
【0014】
食品又は動物の飼料に含有されるビオチン及びビオチン関連物質を測定することにより、人、家畜、及びペット等が摂取するビオチン及びビオチン関連物質を知ることが可能となり、健康管理に貢献することができる。
【0015】
(5) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記試料は、哺乳動物の体内から採取された尿又は血液中の成分を含んだものであってもよい。
【0016】
人や他の哺乳動物の尿又は血漿に含有されるビオチン及びビオチン関連物質を測定することにより、ビオチンの欠乏を早期に発見することが可能となり、健康管理に貢献することができる。
【0017】
(6) 本発明に係るビオチン及びビオチン関連物質の測定方法は、ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料を蛍光標識反応に供する第8ステップと、蛍光標識された上記試料を、リン酸緩衝液により希釈する第9ステップと、アビジン樹脂に希釈された上記試料を通液して、上記試料中の有機物の一部を、アビジン樹脂に吸着させる第10ステップと、上記有機物が吸着した上記アビジン樹脂を、リン酸緩衝液によって洗浄する第11ステップと、上記アビジン樹脂にグアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液を通液して、上記アビジン樹脂に吸着していた有機物の溶出を行う第12ステップと、上記溶出により得られた溶出液にHPLCを適用することにより、上記溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を測定する第13ステップと、を含む。
【0018】
試料が蛍光標識反応に供されて、ビオチン及びビオチン関連物質に代表される分子中にカルボン酸を含む物質が蛍光標識される。試料は、リン酸緩衝液により希釈される。試料はアビジン樹脂に通液され、ビオチン及びビオチン関連物質に代表されるウレイド環を有する物質は、アビジンと特異的に結合する。アビジン樹脂がリン酸緩衝液によって洗浄されて、アビジン樹脂に吸着せずに残留していたウレイド環を有さない物質は、洗い流される。アビジン樹脂にグアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液が通液されて、酸性条件下でのグアニジン塩酸塩のタンパク膨潤作用と、アセトニトリルのタンパク立体構造の変性作用により、ウレイド環を有する物質が溶出される。溶出液にHPLCが適用されて、蛍光標識されたビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種が測定される。
【0019】
(7) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記ビオチン異化代謝物は、ビオチンスルフォキシド、ビオチンスルフォン、及びビスノルビオチンからなる群より選択された少なくとも1種のビオチン異化代謝物であってもよい。
【0020】
(8) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記蛍光標識反応は、DMEQ−Hによって行われてもよい。
【0021】
(9) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記試料は、食品又は動物の飼料の一部を含んだものであってもよい。
【0022】
(10) 本発明に係るビオチン及びビオチン関連物質の測定方法において、上記試料は、哺乳動物の体内から採取された尿又は血液中の成分を含んだものであってもよい。
【発明の効果】
【0023】
本発明に係るビオチン及びビオチン関連物質の測定方法によると、混在されたビオチン、及びビオチン関連物質を同時に測定することが可能となる。それにより、食品や家畜の飼料のビオチン含有量を測定によって把握し、適切なビオチン摂取量を維持することができる。
【図面の簡単な説明】
【0024】
【図1】図1は、本発明の実施例1に係るビオチン及びビオチン関連物質の測定法により、健全者の尿を測定して得られたクロマトグラムである。
【図2】図2は、合成樹脂やアビジン樹脂による前処理を経ずに、ビオチン欠乏症患者におけるビオチン投与前の尿を測定して得られたクロマトグラムである。
【図3】図3は、合成樹脂やアビジン樹脂による前処理を経ずに、ビオチン欠乏症患者におけるビオチン投与後の尿を測定して得られたクロマトグラムである。
【図4】図4は、本発明の実施例1に係るビオチン及びビオチン関連物質の測定法により、ビオチン欠乏症患者におけるビオチン投与前の尿を測定して得られたクロマトグラムである。
【図5】図5は、本発明の実施例1に係るビオチン及びビオチン関連物質の測定法により、ビオチン欠乏症患者におけるビオチン投与後の尿を測定して得られたクロマトグラムである。
【図6】図6は、本発明の実施例2に係るビオチン及びビオチン関連物質の測定法により、ビオチン欠乏症患者におけるビオチン投与前の尿を測定して得られたクロマトグラムである。
【図7】図7は、本発明の実施例2に係るビオチン及びビオチン関連物質の測定法により、ビオチン欠乏症患者におけるビオチン投与後の尿を測定して得られたクロマトグラムである。
【発明を実施するための形態】
【0025】
以下に、適宜図面が参照されて、本発明の好ましい実施形態が説明される。なお、以下に説明される実施形態は、本発明の一例に過ぎず、本発明の要旨を変更しない範囲で、本発明の実施形態が適宜変更できることは言うまでもない。
【0026】
[第1実施形態]
本発明の第1実施形態は、以下の第1から第7ステップを含むものである。第1ステップにおいて、合成樹脂が充填されたオープンクロマト管には、塩酸緩衝液が通液される。第2ステップにおいて、例えば人の尿に代表されるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも一種を含んだ試料が塩酸緩衝液により希釈される。第3ステップにおいて、オープンクロマト管に試料が通液されて、試料中の有機物のうち分子量1000以下の物質が合成樹脂に吸着する。第4ステップにおいて、合成樹脂が塩酸緩衝液によって洗浄されて、樹脂に吸着せずに残留している分子量1000以上の物質が洗い流される。第5ステップにおいて、オープンクロマト管にエタノールが通液されて、合成樹脂に吸着していた有機物のうち、エタノールに溶解する物質の溶出が行われる。第6ステップにおいて、溶出液が蛍光標識反応に供される。第7ステップにおいて、上記溶出液にHPLCが適用されて、上記溶出液に含まれる蛍光標識されたビオチン、ビオチン異化代謝物、及び3−HIAが測定される。以下、第1実施形態の各ステップが詳細に説明される。
【0027】
第1ステップにおいて、合成樹脂が充填されたオープンクロマト管には塩酸緩衝液が通液される。ここで、合成樹脂とは、多孔質構造を有する架橋高分子であり、樹脂内の細孔表面と被吸着物質間の物理的相互作用により特定の有機物を吸着するものである。合成樹脂としては、例えば三菱化学株式会社が販売するセパビーズSP850が使用可能である。また、塩酸緩衝液とは、塩酸と他の物質の水溶液であり、緩衝作用を有するものである。塩酸緩衝液としては、例えば塩酸と、塩化カリウム、グリシン、又はトリスとの混合物が使用可能である。また、通液とは、液体を流し込む操作である。オープンクロマト管の上部には液体の流入口が設けられており、そこから通液された液体は、オープンクロマト管内部に充填された物質を伝い、オープンクロマト管の下部に設けられた液体の流出口から流出する。オープンクロマト管としては、例えばジーエルサイエンス株式会社の販売するものが使用可能である。塩酸緩衝液の通液により、後述される第3ステップにおいて目的物質であるビオチン及びビオチン関連物質の吸着が強められる。
【0028】
第2ステップにおいて、ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料が、塩酸緩衝液により例えば5倍に希釈される。これにより、試料のphは、後述される第3ステップにおいてビオチン及びビオチン関連物質が合成樹脂に吸着するために適切な値となる。ここで、ビオチンとは、ビタミンB群に分類される水溶性ビタミンであり、D−[(+)−cis−ヘキサヒドロ−2−オキソ−1H−チエノ−(3,4)−イミダゾール−4−吉草酸]として表記されるものである。また、ビオチン異化代謝物とは、ビオチンが異化反応された結果としての代謝生成物である。ビオチン異化代謝物としては、例えばビオチンスルフォキシド、ビオチンスルフォン、及びビスノルビオチン等が挙げられる。また、3−HIAとは、3−ヒドロキシイソ吉草酸である。ビオチン、ビオチン異化代謝物、及び3−HIAを含んだ試料としては、例えば人や他の哺乳動物の尿や血液、動物の飼料、又は飲食物などが挙げられる。
【0029】
第3ステップにおいて、合成樹脂が充填されたオープンクロマト管に、試料が通液されて、希釈された試料中のビオチン、ビオチンスルフォキシド、ビオチンスルフォン、ビスノルビオチン、3−HIAなど、分子量1000以下の物質が、合成樹脂に吸着する。ここで、吸着とは、樹脂内の細孔表面と被吸着物質間の物理的相互作用による結合のことである。
【0030】
第4ステップにおいて、オープンカラムの内部、及び有機物が吸着された合成樹脂が、塩酸緩衝液により洗浄される。この操作により、樹脂に吸着せずに残留している分子量1000以上の尿中成分が洗い流される。この尿中成分は、尿と共に排泄されるホルモンなどの体内代謝産物、及び生体内でグルクロン酸や硫酸など抱合された有機物などである。オープンカラム及び合成樹脂の洗浄のために、十分な量の塩酸緩衝液が、オープンクロマト管に通液される。
【0031】
第5ステップにおいて、エタノールにより、合成樹脂からエタノールに溶解する物質の溶出が行われる。ここで、エタノールによる溶出とは、合成樹脂表面の疎水性や、ビオチン、ビオチンスルフォキシド、ビオチンスルフォン、ビスノルビオチン、及び3−HIAの疎水性部分の間のファンデルワールス力(Vander Waales力)による吸着によって、対象となる物質を極性物質であるエタノールに移動させることである。ビオチンはエタノール以外の有機溶剤には溶解しないため、エタノールが溶出剤として用いられる必要がある。エタノールによる溶出のために、オープンクロマト管には、エタノールが通液される。エタノールが合成樹脂を伝うことで、合成樹脂からエタノールに溶解する物質の溶出が行われる。上述された流出口より流出した溶出液は、試験管などによって採取される。
【0032】
第6ステップにおいて、溶出により得られた溶出液は蛍光標識反応に供される。ここで、蛍光標識反応とは、蛍光標識試薬等が用いられて、溶出液中の分子が蛍光標識される反応である。蛍光標識試薬としては、例えば、DMEQ−H(6,7−dimethoxy−1−methy−2(1H)−quinoxalinone−3−propio−nylcarboxylic acid hydrazide)が使用可能である。蛍光標識の方法として、第5ステップで得られた溶出液を、塩酸、ピリジン、及びEDCの各水溶液と、DMEQ−HのN,N−dimethylformamide溶液との混合液の中で静置する方法が挙げられる。溶出液にはビオチン及びビオチン関連物質の他にも分子量1000以下の物質が含まれるが、溶出液中の物質のうち分子中にカルボン酸を含む物質が標識される。蛍光標識された物質は、後述される第7ステップにおいて、蛍光検出器により検出される。
【0033】
第7ステップにおいて、蛍光標識された溶出液にHPLCが適用されて、溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種が測定される。ここで、HPLCとは、カラムクロマトグラフィーの一種であり、HPLCカラム内部に機械的に高い圧力が印加されて、移動相溶媒が高流速でHPLCカラムを通過するものである。これにより、分析物が固定相に留まる時間は短縮され、分離能及び検出感度が高くなる。HPLCとしては、溶媒の組成を連続的に変化させて溶出を行うグラジュエント法が使用可能である。例えば溶出にメタノールが使用される場合、溶媒中のメタノールが少ない初期の状態では極性の高い物質が溶出され、メタノールの割合が増加するに従って極性の低い物質が順次溶出される。HPLCに使用される機材として、送液のためのポンプ、試料を注入するインジェクター、HPLCカラム、HPLCカラムの温度を制御するカラムオーブン、及び蛍光標識された物質を検出する蛍光検出器等が挙げられる。HPLCカラムには、例えば株式会社ワイエムシィが販売するYMC−Pack FA(250×6mm)が使用可能である。上述された他の機材には、例えば株式会社島津製作所が販売するProminenceが使用可能である。
【0034】
[第2実施形態]
続けて、本発明に係る第2実施形態が、各ステップごとに解説される。第2実施形態は、第8から第13ステップを含むものである。第8ステップにおいて、試料を含んだ溶液は、蛍光標識反応に供される。第9ステップにおいて、蛍光標識反応に供された試料は、リン酸緩衝液により希釈される。第10ステップにおいて、アビジン樹脂が充填されたオープンクロマト管内部に試料が通液されて、試料中の有機物のうち、分子構造中にウレイド環を有する物質がアビジン樹脂に吸着する。第11ステップにおいて、有機物が吸着されたアビジン樹脂がリン酸緩衝液によって洗浄されて、樹脂に吸着せずに残留している物質が洗い流される。第12ステップにおいて、グアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液によって、アビジン樹脂に吸着していた分子構造中にウレイド環を有する物質の溶出が行われる。第13ステップにおいて、溶出により得られた溶出液にHPLCが適用されて、上記溶出液に含まれる蛍光標識されたビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種が測定される。
【0035】
即ち、第2実施形態は、合成樹脂に代わってアビジン樹脂が使用される点において、前述の第1実施形態と相違する。また、第1実施形態では、合成樹脂による前処理の後に蛍光標識反応が行われるが、第2実施形態では、蛍光標識反応が行われた後にアビジン樹脂による処理が行われる。以下、第2実施形態の各ステップが詳細に説明される。
【0036】
第8ステップにおいて、ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料が、蛍光標識反応に供される。蛍光標識反応には、第1実施形態と同様にDMEQ−Hを使用した方法が使用可能である。即ち、試料を、塩酸、ピリジン、及びEDCの各水溶液と、DMEQ−HのN,N−dimethylformamide溶液との混合液の中で静置する方法が挙げられる。アビジンとビオチンの結合は強固であり、アビジンと結合したビオチンの溶出は非常に困難である。しかし、事前に蛍光標識反応が行われることで、アビジンとビオチンの結合力は弱まり、後述される第12ステップにおける溶出が容易となる。これは、蛍光標識反応によりビオチンの分子構造が変化するためである。
【0037】
第9ステップにおいて、蛍光標識された試料は、リン酸緩衝液により例えば10倍に希釈される。ここで、リン酸緩衝液とは、リン酸と他の物質との混合液であり、緩衝作用を有するものである。リン酸緩衝液には、例えばリン酸二水素ナトリウムとリン酸水素二ナトリウムとの混合液が使用可能である。リン酸緩衝液により、試料のpHは、後述される第10ステップにおいて、ビオチン及びビオチン関連物質がアビジンとの結合するために最適な値となる。
【0038】
第10ステップにおいて、アビジン樹脂が充填されたオープンクロマト管内部に試料が通液されて、分子構造中にウレイド環を有する物質が、アビジン樹脂に吸着する。ここで、アビジン樹脂とは、アビジンが樹脂に結合されたレジン担体である。アビジン樹脂としては、例えばプロメガ株式会社が販売するTetraLinkTM Tetrameric Avidin Resinが使用可能である。アビジンには、ビオチンおよびビオチン異化代謝物のウレイド環と特異的に結合するという性質があるため、アビジン樹脂により、他の物質からビオチンおよびビオチン異化代謝物を選択的に抽出することが可能である。
【0039】
第11ステップにおいて、アビジン樹脂及びオープンクロマト管が、リン酸緩衝液によって洗浄される。この操作により、分子構造中にウレイド環を有さないことから、アビジン樹脂に吸着せずに残留していた物質が洗い流される。アビジン樹脂及びオープンクロマト管の洗浄には、上述の第1実施形態と同様の方法が使用可能である。即ち、アビジン樹脂が充填されたオープンクロマト管に、リン酸緩衝液を通液する方法が挙げられる。
【0040】
第12ステップにおいて、グアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液が使用されて、ビオチンおよびビオチン異化代謝物に代表されるウレイド環を有した物質がアビジン樹脂から溶出される。この溶出は、酸性条件下でのグアニジン塩酸塩のタンパク膨潤作用と、アセトニトリルのタンパク立体構造の変性作用によって行われる。アビジン樹脂からの溶出には、上述の第1実施形態と同様の方法が使用可能である。即ち、アビジン樹脂が充填されたオープンクロマト管に、グアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液を通液する方法が挙げられる。
【0041】
第13ステップにおいて、溶出により得られた溶出液にHPLCが適用されることにより、上記溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種が測定される。HPLCには、上述の第1実施形態と同様にグラジュエント法に基づく方法が使用可能であり、装置やカラムにも同様の物が使用可能である。
【実施例】
【0042】
[実施例1]
本発明に係る実施例1が以下に解説される。本実施例は上述の第1実施形態に対応するものである。本実施例において、試料として人の尿が使用される。
【0043】
[合成樹脂による前処理]
尿の前処理のために、オープンクロマト管が準備される。オープンクロマト管の内部には、合成樹脂が充填される。本実施形態においては、合成樹脂として、三菱化学株式会社が販売するセパビーズSP850が使用される。
【0044】
オープンクロマト管には、0.2M塩酸緩衝液(pH1.0)が通液される。続けて、0.2Mの塩酸緩衝液によって5倍希釈された尿がオープンクロマト管に通液された後、オープンクロマト管及び合成樹脂は、塩酸緩衝液の通液により洗浄される。純エタノールがオープンクロマト管に通液されて、溶出液は減圧濃縮される。ここで、上述されたオープンクロマト管への塩酸緩衝液の通液、塩酸緩衝液による尿の希釈、オープンクロマト管への尿の通液、オープンクロマト管及び合成樹脂の洗浄、及びエタノールによる溶出が、それぞれ本発明における第1、第2、第3、第4、及び第5ステップに相当するものである。
【0045】
[蛍光標識反応]
上記の手順により得られた標準水溶液1ngに対して塩酸、ピリジン、及びEDCの各水溶液と、DMEQ−HのN,N−dimethylformamide溶液とがそれぞれ0.05M、2.5%、0.25M、100μMとなるように添加されて、室温で2時間以上静置される。ここで、上述された溶液の添加が、本発明における第6ステップに相当するものである。
【0046】
[HPLCによる測定]
HPLCによる測定のために、HPLCカラムが準備される。本実施例においては、HPLCカラムとして、株式会社ワイエムシィが販売するYMC−Pack FA(250×6mm)が使用される。移動相には、水、メタノール、及びアセトニトリルが75:15:10の割合で混合された溶液(以下、I液とする)と、80%メタノール(以下、II液とする)とによるグラジュエント法が用いられる。流速は1.0ml/分とし、測定はEx:360nm、Em:435nmの蛍光測定により行われる。カラムの温度は35℃である。ここで、HPLCカラムを用いた蛍光測定が本発明における第7ステップに相当するものである。
【0047】
[測定結果]
図1(A)の折れ線10は、グラジュエント法の移動相におけるII液濃度の時間変化を示したものである。(B)のクロマトグラムにおいて、横軸は分単位の保持時間、縦軸は蛍光検出器の出力である。検出感度は20pgである。ピークP11、P12、P13、P14は、それぞれビオチンスルフォキシド、ビスノルビオチン、3−HIA、及びビオチンを示している。ビオチンスルフォンを示すピークは、試薬のピークと重なっており確認できなかった。図1の通り、本実施形態に係るビオチン及びビオチン関連物質の測定方法によると、若干の夾雑ピークが残るものの、ビオチンスルフォン以外のビオチン関連物質を測定することが可能であった。
【0048】
[実施例の作用効果]
本実施例に係るビオチン及びビオチン関連物質の測定方法によると、合成樹脂への吸着及び合成樹脂からの溶出により、分子量1000以下の物質が他の尿中成分から分離される。また、蛍光標識反応により、カルボン酸を含む物質が標識されるので、尿中のビオチン及びビオチン関連物質を蛍光検出器によって選択的に検出することができる。
【0049】
人や他の哺乳動物の尿に含有されるビオチン及びビオチン関連物質を測定することにより、ビオチンの欠乏を早期に発見することが可能となり、健康管理に貢献することができる。
【0050】
[実施例2]
続けて、本発明に係る実施例2が以下に解説される。本実施例は、上述された実施形態2に対応するものである。本実施例において、実施形態1と同様に、試料として人の尿が使用される。
【0051】
予め、尿は実施例1と同様の方法によって蛍光標識される。尿の前処理のためにアビジン樹脂が準備される。本変形例においては、アビジン樹脂として、プロメガ株式会社が販売するTetraLinkTM Tetrameric Avidin Resinが使用される。蛍光標識された尿は、2/15Mのリン酸緩衝液(pH7.4)により10倍希釈される。アビジン樹脂への吸着のため、尿はアビジン樹脂が充填されたオープンクロマト管に通液される。リン酸緩衝液がオープンクロマト管に通液されて、オープンクロマト管及びアビジン樹脂は、十分に洗浄される。3Mグアニジン塩酸塩、0.5%トリフルオロ酢酸、及び25%アセトニトリルの混合液がオープンクロマト管に通液される。溶出液に対して上述されたHPLCによる測定が行われる。ここで、尿の蛍光標識、リン酸緩衝液による尿の希釈、アビジン樹脂への吸着、リン酸緩衝液によるアビジン樹脂の洗浄、アビジン樹脂からの溶出、及びHPLCによる蛍光測定が、それぞれ本発明における第8、第9、第10、第11、第12、及び第13ステップに相当するものである。
【0052】
[測定結果]
ビオチン投与前後におけるビオチン欠乏患者の尿の測定結果が以下に解説される。本実施例の測定方法によるクロマトグラムとの比較対象として、合成樹脂やアビジン樹脂による前処理を経ずに得られたクロマトグラム、及び実施例1の方法によるクロマトグラムがそれぞれ示される。図2から図7に示されるクロマトグラムにおいて、図1と同様の測定条件が使用される。即ち、横軸は分単位の保持時間、縦軸は検出器の出力強度を示す。検出感度は20pgである。II液濃度の時間変化は図1(A)と同様である。
【0053】
まずは、合成樹脂やアビジン樹脂による前処理を経ずに得られたクロマトグラムが解説される。これは、試料として採取された尿を上述の蛍光標識反応に供して、HPLCによる測定を行った結果得られたものである。図2及び図3の通り、前処理を経ない尿から得られたクロマトグラムによると、ビオチンの投与前後共に夾雑ピークが多く、ビオチン関連物質のピーク同定は困難である。
【0054】
続けて、実施例1の方法によるクロマトグラムが解説される。図4におけるピークP21は、3−HIAを示すものである。図5におけるピークP31、P32、P33は、それぞれビオチンスルフォキシド、ビスノルビオチン、及びビオチンを示すものである。図4及び図5の通り、ビオチン投与前では、ビオチン及びビオチン異化代謝物は検出されず、ビオチン欠乏の早期指標である3−HIAの大きなピークP21が確認されている。ビオチン投与によって3−HIAのピークは消失し、ビオチンおよびビオチン異化代謝物のピークが検出されている。
【0055】
続けて、実施例2の方法によるクロマトグラムが解説される。図6におけるピークP41は、ビオチンスルフォンを示すものである。図7におけるピークP51、P52、P53、P54は、それぞれビオチンスルフォキシド、ビオチンスルフォン、ビスノルビオチン、及びビオチンを示すものである。図6、図7の通り、ビオチン投与前後共に、実施例1の方法では試薬ピークに隠れていたビオチンスルフォンが確認されている。ビオチン投与後の結果では、前述の実施形態と同様にビオチン及びビオチン異化代謝物が検出されている。
【0056】
[実施例の作用効果]
本実施例に係るビオチン及びビオチン関連物質の測定方法によると、蛍光標識反応により、カルボン酸を含む物質が標識される。また、アビジン樹脂への吸着及びアビジン樹脂からの溶出により、ウレイド環を有する物質が他の尿中成分から分離されるので、尿中のビオチン及びビオチン関連物質を蛍光検出器によって選択的に検出することができる。
【0057】
また、蛍光標識反応によりビオチンの分子構造が変化し、アビジンとの結合力が弱まるため、通常は困難であるアビジン樹脂からの溶出が容易に行われる。
【符号の説明】
【0058】
10・・・ 折れ線
P11・・・ピーク(ビオチンスルフォキシド)
P12・・・ピーク(ビスノルビオチン)
P13・・・ピーク(3−HIA)
P14・・・ピーク(ビオチン)
P21・・・ピーク(3−HIA)
P31・・・ピーク(ビオチンスルフォキシド)
P32・・・ピーク(ビスノルビオチン)
P33・・・ピーク(ビオチン)
P41・・・ピーク(ビオチンスルフォン)
P51・・・ピーク(ビオチンスルフォキシド)
P52・・・ピーク(ビオチンスルフォン)
P53・・・ピーク(ビスノルビオチン)
P54・・・ピーク(ビオチン)
【特許請求の範囲】
【請求項1】
合成樹脂に塩酸緩衝液を通液する第1ステップと、
ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料を塩酸緩衝液により希釈する第2ステップと、
上記合成樹脂に希釈された上記試料を通液して、上記合成樹脂に上記試料中の有機物の一部を吸着させる第3ステップと、
上記有機物が吸着した上記合成樹脂を、塩酸緩衝液によって洗浄する第4ステップと、
上記合成樹脂にエタノールを通液して、上記合成樹脂に吸着していた有機物の溶出を行う第5ステップと、
上記溶出により得られた溶出液を蛍光標識反応に供する第6ステップと、
蛍光標識された上記溶出液にHPLCを適用することにより、上記溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を測定する第7ステップと、を含んだビオチン及びビオチン関連物質の測定方法。
【請求項2】
上記ビオチン異化代謝物は、ビオチンスルフォキシド、ビオチンスルフォン、及びビスノルビオチンからなる群より選択された少なくとも1種のビオチン異化代謝物である請求項1に記載のビオチン及びビオチン関連物質の測定方法。
【請求項3】
上記蛍光標識反応は、DMEQ−Hによって行われる請求項1又は2に記載のビオチン及びビオチン関連物質の測定方法。
【請求項4】
上記試料は、食品又は動物の飼料の一部を含んだものである請求項1から3の何れかに記載のビオチン及びビオチン関連物質の測定方法。
【請求項5】
上記試料は、哺乳動物の体内から採取された尿又は血液中の成分を含んだものである請求項1から3の何れかに記載のビオチン及びビオチン関連物質の測定方法。
【請求項6】
ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料を蛍光標識反応に供する第8ステップと、
蛍光標識された上記試料を、リン酸緩衝液により希釈する第9ステップと、
アビジン樹脂に希釈された上記試料を通液して、上記試料中の有機物の一部を、アビジン樹脂に吸着させる第10ステップと、
上記有機物が吸着したアビジン樹脂を、リン酸緩衝液によって洗浄する第11ステップと、
上記アビジン樹脂にグアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液を通液して、上記アビジン樹脂に吸着していた有機物の溶出を行う第12ステップと、
上記溶出により得られた溶出液にHPLCを適用することにより、上記溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を測定する第13ステップと、を含んだビオチン及びビオチン関連物質の測定方法。
【請求項7】
上記ビオチン異化代謝物は、ビオチンスルフォキシド、ビオチンスルフォン、及びビスノルビオチンからなる群より選択された少なくとも1種のビオチン異化代謝物である請求項6に記載のビオチン及びビオチン関連物質の測定方法。
【請求項8】
上記蛍光標識反応は、DMEQ−Hによって行われる請求項6又は7に記載のビオチン及びビオチン関連物質の測定方法。
【請求項9】
上記試料は、食品又は動物の飼料の一部を含んだものである請求項6から8の何れかに記載のビオチン及びビオチン関連物質の測定方法。
【請求項10】
上記試料は、哺乳動物の体内から採取された尿又は血液中の成分を含んだものである請求項6から8の何れかに記載のビオチン及びビオチン関連物質の測定方法。
【請求項1】
合成樹脂に塩酸緩衝液を通液する第1ステップと、
ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料を塩酸緩衝液により希釈する第2ステップと、
上記合成樹脂に希釈された上記試料を通液して、上記合成樹脂に上記試料中の有機物の一部を吸着させる第3ステップと、
上記有機物が吸着した上記合成樹脂を、塩酸緩衝液によって洗浄する第4ステップと、
上記合成樹脂にエタノールを通液して、上記合成樹脂に吸着していた有機物の溶出を行う第5ステップと、
上記溶出により得られた溶出液を蛍光標識反応に供する第6ステップと、
蛍光標識された上記溶出液にHPLCを適用することにより、上記溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を測定する第7ステップと、を含んだビオチン及びビオチン関連物質の測定方法。
【請求項2】
上記ビオチン異化代謝物は、ビオチンスルフォキシド、ビオチンスルフォン、及びビスノルビオチンからなる群より選択された少なくとも1種のビオチン異化代謝物である請求項1に記載のビオチン及びビオチン関連物質の測定方法。
【請求項3】
上記蛍光標識反応は、DMEQ−Hによって行われる請求項1又は2に記載のビオチン及びビオチン関連物質の測定方法。
【請求項4】
上記試料は、食品又は動物の飼料の一部を含んだものである請求項1から3の何れかに記載のビオチン及びビオチン関連物質の測定方法。
【請求項5】
上記試料は、哺乳動物の体内から採取された尿又は血液中の成分を含んだものである請求項1から3の何れかに記載のビオチン及びビオチン関連物質の測定方法。
【請求項6】
ビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を含んだ試料を蛍光標識反応に供する第8ステップと、
蛍光標識された上記試料を、リン酸緩衝液により希釈する第9ステップと、
アビジン樹脂に希釈された上記試料を通液して、上記試料中の有機物の一部を、アビジン樹脂に吸着させる第10ステップと、
上記有機物が吸着したアビジン樹脂を、リン酸緩衝液によって洗浄する第11ステップと、
上記アビジン樹脂にグアニジン塩酸塩、トリフルオロ酢酸、及びアセトニトリルを含む混合液を通液して、上記アビジン樹脂に吸着していた有機物の溶出を行う第12ステップと、
上記溶出により得られた溶出液にHPLCを適用することにより、上記溶出液に含まれるビオチン、ビオチン異化代謝物、及び3−HIAのうちの少なくとも1種を測定する第13ステップと、を含んだビオチン及びビオチン関連物質の測定方法。
【請求項7】
上記ビオチン異化代謝物は、ビオチンスルフォキシド、ビオチンスルフォン、及びビスノルビオチンからなる群より選択された少なくとも1種のビオチン異化代謝物である請求項6に記載のビオチン及びビオチン関連物質の測定方法。
【請求項8】
上記蛍光標識反応は、DMEQ−Hによって行われる請求項6又は7に記載のビオチン及びビオチン関連物質の測定方法。
【請求項9】
上記試料は、食品又は動物の飼料の一部を含んだものである請求項6から8の何れかに記載のビオチン及びビオチン関連物質の測定方法。
【請求項10】
上記試料は、哺乳動物の体内から採取された尿又は血液中の成分を含んだものである請求項6から8の何れかに記載のビオチン及びビオチン関連物質の測定方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−122769(P2012−122769A)
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願番号】特願2010−271917(P2010−271917)
【出願日】平成22年12月6日(2010.12.6)
【出願人】(592216384)兵庫県 (258)
【出願人】(510321402)
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願日】平成22年12月6日(2010.12.6)
【出願人】(592216384)兵庫県 (258)
【出願人】(510321402)

[ Back to top ]

