ICEインヒビターを使用した発作の処置
【課題】患者における発作を処置するための方法を提供すること。
【解決手段】上記方法は、ICE/カスパーゼ−1を阻害する化合物を該患者に投与する工程を包含する。一つの局面において、上記化合物は、ICE/カスパーゼ−1および1つ以上の他のカスパーゼ酵素を阻害する。一つの局面において、上記化合物は、選択的なICE/カスパーゼ−1インヒビターである。一つの局面において、上記化合物は、末梢に投与される(すなわち、経口投与または非経口投与され、頭蓋内投与されない)。
【解決手段】上記方法は、ICE/カスパーゼ−1を阻害する化合物を該患者に投与する工程を包含する。一つの局面において、上記化合物は、ICE/カスパーゼ−1および1つ以上の他のカスパーゼ酵素を阻害する。一つの局面において、上記化合物は、選択的なICE/カスパーゼ−1インヒビターである。一つの局面において、上記化合物は、末梢に投与される(すなわち、経口投与または非経口投与され、頭蓋内投与されない)。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の分野)
本発明は、ICEインヒビターを用いて発作を処置または予防するための方法および組成物に関する。
【背景技術】
【0002】
(発明の背景)
サイトカイン(特に、IL−1βおよびTNF−α)は、多くの疾患を開始し得、そして維持し得るので、最適な治療標的である。種々の戦略(例えば、可溶性レセプター、抗体、レセプターアンタゴニストまたはインヒビター)は、サイトカインをブロックするために使用される。これらの特異的なサイトカインベースの治療法は、多くの慢性炎症または自己免疫疾患における炎症を軽減することが示されており、そしてヒトへの使用についてFDAにより認可されている(Bresnihanら、1998;Mohlerら、1993;Nukiら、2002;van Deventerら、1999)。
【0003】
インターロイキン−1β転換酵素(ICE、カスパーゼ−1としても公知)は、IL−1βおよびIL−18の前駆体を活性なサイトカインへと切断する細胞内プロテアーゼである(Akitaら、1997;Kuidaら、1995)。他のプロテアーゼ(細菌のプロテアーゼおよび宿主のプロテアーゼが挙げられる)は、プロIL−1βをプロセッシングし得るが、ICE欠失(ICE−/−)マウスは、内毒素に応答して成熟したIL−1βを放出し得ないことが示されている(Fantuzziら、1997;Liら、1995)。
【0004】
炎症誘導性サイトカインおよび抗炎症性サイトカインの脳における発現は、発作と関連している(非特許文献1;非特許文献2;非特許文献3)。しかしながら、抗痙攣治療法または抗てんかん治療法としての使用のために現在許容可能な抗サイトカイン薬物も抗炎症薬物も存在しない。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】A. Vezzaniら、「Interleukin−1β Immunoreactivity and Microglia Are Enhanced in the Rat Hippocampus by Focal Kainate Application: Functional Evidence for Enhancement of Electrographic Seizures」J.Neurosci.(1999)19,pp.5054−5065
【非特許文献2】DeSimoniら、「Inflammatory cytokines and related genes and are induced in the rat hippocampus by limbic status epilepticus」Eur.J.Neurosci.(2000)12,pp.2623−2633
【非特許文献3】A.Vezzaniら、「Powerful Anticonvulsant Action of IL− Receptor Antagonist on Intracerebral Injection and Astrocytic Overexpression in Mice」 PNAS(2000)97,pp.11534−11539
【発明の概要】
【課題を解決するための手段】
【0006】
(発明の要旨)
本発明は、ICEインヒビターを投与することによって、発作、痙攣、てんかん、および関連する状態を、処置または予防するための方法に関する。
【0007】
本発明はまた、発作、痙攣、てんかん、または関連する状態を処置または予防するための化合物および組成物に関する。
本発明はまた、このような状態を処置または予防するのに有用な薬剤を同定するための方法に関する。
【0008】
本発明はまた、本発明の方法を実施するための組成物およびキットを作製するためのプロセスに関する。
例えば、本発明は、以下の項目を提供する:
(項目1)
患者における発作を処置するための方法であって、該方法は、ICE/カスパーゼ−1を阻害する化合物を該患者に投与する工程を包含する、方法。
(項目2)
患者における痙攣を処置するための方法であって、該方法は、ICE/カスパーゼ−1を阻害する化合物を該患者に投与する工程を包含する、方法。
(項目3)
患者におけるてんかんを処置するための方法であって、該方法は、ICE/カスパーゼ−1を阻害する化合物を該患者に投与する工程を包含する、方法。
(項目4)
患者における発作障害を予防するための方法であって、該方法は、ICE/カスパーゼ−1を阻害する化合物を該患者に投与する工程を包含する、方法。
(項目5)
上記化合物がICE/カスパーゼ−1および1つ以上の他のカスパーゼ酵素を阻害する、項目1〜4のいずれか1項に記載の方法。
(項目6)
上記化合物が選択的なICE/カスパーゼ−1インヒビターである、項目1〜5のいずれか1項に記載の方法。
(項目7)
上記化合物が国際公開パンフレット第95/35308号、同第97/22619号、同第99/47545号、および同第01/90063号のいずれかに従う、項目1〜6のいずれか1項に記載の方法。
(項目8)
項目1〜6のいずれか1項に記載の方法であって、ここで上記化合物が:
【化1】

またはそのいずれかの立体異性体を含み、該立体異性体としては:
【化2】

が挙げられる、方法。
(項目9)
項目1〜6のいずれか1項に記載の方法であって、ここで上記化合物が:
【化3】

またはそのいずれかの立体異性体を含み、該立体異性体としては:
【化4】

が挙げられる、方法。
(項目10)
項目1〜6のいずれか1項に記載の方法であって、ここで上記化合物が:
【化5】

またはそのいずれかの立体異性体を含み:
【化6】

が挙げられる、方法。
(項目11)
項目1〜6のいずれか1項に記載の方法であって、ここで上記化合物が:
【化7】

またはそのいずれかの立体異性体を含み:
【化8】

が挙げられる、方法。
(項目12)
項目1〜11のいずれか1項に記載の方法であって、ここで上記化合物が末梢に投与される(すなわち、経口投与または非経口投与され、頭蓋内投与されない)、方法。
(項目13)
項目1〜12のいずれか1項に記載の方法であって、さらなる化合物を投与する工程をさらに包含し、ここで該さらなる化合物が抗痙攣薬化合物である、方法。
(項目14)
項目13に記載の方法であって、ここで上記さらなる化合物が、メフォバルビタール、ペントバルビタール、ロラゼパム、クロナゼパム、クロラゼペート、ジアゼパム、チアガビン(tiagabin)、ガバペンチン、プレガバリン(pregabalin)、ビガバトリン、ヒダントイン、フェニトイン、ホスフェニトイン、ラモトリジン、メトスクシミド、エトスクシミド、カルバマゼピン、リルゾール、バルプロアート(varproate)、ジバルプロックス、フェルバメート、プリミドン、またはトピラマートである、方法。
(項目15)
患者における発作、痙攣、またはてんかんを回復、処置または予防するための薬学的組成物であって、該組成物は、ICE/カスパーゼ−1を阻害する化合物および薬学的に受容可能なキャリアを含有する、薬学的組成物。
(項目16)
上記組成物が別の抗痙攣薬化合物をさらに含有する、項目15に記載の薬学的組成物。
(項目17)
項目16に記載の薬学的組成物であって、上記さらなる化合物は、メフォバルビタール、ペントバルビタール、ロラゼパム、クロナゼパム、クロラゼペート、ジアゼパム、チアガビン(tiagabin)、ガバペンチン、プレガバリン(pregabalin)、ビガバトリン、ヒダントイン、フェニトイン、ホスフェニトイン、ラモトリジン、メトスクシミド、エトスクシミド、カルバマゼピン、リルゾール、バルプロアート(varproate)、ジバルプロックス、フェルバメート、プリミドン、またはトピラマートである、薬学的組成物。
(項目18)
ICEを阻害する化合物、および該化合物を使用して発作、痙攣またはてんかんを処置するための指示を備える、キット。
(項目19)
上記化合物が国際公開パンフレット第95/35308号、同第97/22619号、同第99/47545号、または同第01/90063号に開示されるとおりであるかまたは項目8〜11に記載のとおりである、項目15〜17のいずれか1項に記載の薬学的組成物、または項目18に記載のキット。
(項目20)
発作、痙攣またはてんかんの処置において使用するための化合物を同定するためのアッセイであって、該アッセイは、該化合物がICE/カスパーゼ−1を阻害する能力を決定する工程を包含する、アッセイ。
(項目21)
抗発作活性、抗痙攣活性または抗てんかん活性を有するICE/カスパーゼ−1インヒビターを同定するためのアッセイであって、該アッセイは、該ICE/カスパーゼ−1インヒビターが発作、痙攣またはてんかんを阻害する能力を決定する工程を包含する、アッセイ。
(項目22)
上記アッセイが、実質的に本明細書中に記載されるとおりの方法によってなされる、項目20または項目21に記載のアッセイ。
【図面の簡単な説明】
【0009】
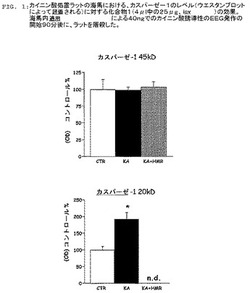
【図1】図1は、カイニン酸処置ラットの海馬における、カスパーゼ−1のレベル(ウエスタンブロットによって評価される)に対する化合物1(4μl中の25μg、icv)の効果を示す。海馬内マイクロインジェクションによる40ngでのカイニン酸誘導性のEEG発作の開始90分後に、ラットを屠殺した(図2Aおよび図2Bもまた参照のこと)。
【図2】図2Aおよび図2Bは、化合物1の処置ありまたは処置なしでの、偽性海馬における、カイニン酸誘導性発作の90分後のICE/カスパーゼ−1レベルおよびIL−1βレベルのウエスタンブロット分析の結果を示す。図2Aおよび図2Bは、ウエスタンブロットデータのヒストグラムの表示であり、4匹のラット由来の平均±SEMとして示す。化合物1(25μg/4μL)またはビヒクルを、カイニン酸(40ng)の海馬内への注入の45分前および10分前に脳室内に注入した。化合物1は、成熟形態のカスパーゼ−1および成熟形態のIL−1βの発作誘導性産生をブロックした(図1も参照のこと)。Turkeyの検定により*p<0.05;**p<0.001。実施例1および実施例6を参照のこと。
【発明を実施するための形態】
【0010】
(発明の詳細な説明)
本発明は、発作を処置または予防するために有効な量でICEインヒビターを投与することによって、発作を処置または予防するための方法を提供する。
【0011】
出願人らは、げっ歯類において発作を処置することにICEインヒビターの使用が有効であることを実証している。特に、出願人らは、ICEインヒビターを用いた処置が発作の発現までの時間を増加させ、そして発作に費やされる時間を低下させることを実証した。ICEインヒビター化合物1は、高用量のフェニトインまたはカルバマゼピン(これらは公知の抗痙攣薬化合物である)のいずれかと同程度に有効であった。
【0012】
従って、本発明の1実施形態は、発作を阻害するための治療ストラテジーを提供する。これらの方法は、発作を調節、改善、処置または予防するために使用され得る。これらの方法はまた発作障害の進行および悪化を改善、処置、防止するために使用され得る。このような方法は、例えば、外傷性脳損傷、感染または発熱性の発作事象の後にICEインヒビターを投与して、恒久的な発作障害の重篤度を阻止するかまたは減少させる工程を包含する。
【0013】
本発明の他の実施形態は、てんかん、痙攣および関連障害を制御、改善、処置または予防するための治療ストラテジーを提供する。
【0014】
出願人らはまた、化合物1および化合物2が、腹腔内経路で投与される場合に、発作を阻害することを示した(表3)。
【0015】
ICEインヒビター化合物は、とりわけ慢性関節リウマチ、皮膚科学的炎症疾患および炎症性腸疾患の動物モデルにおける抗炎症活性について公知である(G.Kuら,「Selective Interleukin−1 Converting Enzyme(ICE/Caspase−1)Inhibition With Pralnacasan(HMR 3480/VX−740)Reduces Inflammation and Joint Destruction in Murine Type−II Collagen−induced Arthritis(CIA)」 American College of Rheumatology,San Francisco,November 12−15,2001;G.Kuら 「Interleukin−1β Converting Enzyme(ICE,Caspase−1)Inhibition with VX−765 Reduces Inflammation and Cytokine Levels in Murine Dermatitis and Arthritis Models」International Congress of Immunology,Stockholm,Sweden,July 22−27,2001;G.Kuら「Interleukin−1β Converting Enzyme(ICE,Caspase−1)Inhibition with VX−765 Reduces Inflammation and Cytokine Levels in Murine Oxazolone−induced Dermatitis」The Society for Investigative Dermatology,May 9−12,2001 アブストラクト856;また、本明細書中に記載したICEインヒビターの資料もまた参照のこと。化合物1はまた、慢性関節リウマチの患者において抗炎症活性を有することを実証されている(K.Pavelkaら「Clinical Effects of Pralnacasan (PRAL),an Orally−active Interleukin−1β Converting Enzyme (ICE) Inhibitor,in a 285 Patient PHII Trial in Rheumatoid Arthritis(RA)」American College of Rheumatology 2002 Conference Late−Breaking Abstract,New Orleans,October 25−29,2002)。ICEインヒビターは、発作または発作障害を処置するためには使用されていない。
【0016】
動物およびヒトにおける抗炎症活性を背景とするこれら化合物の薬物動態学は周知である。さらに、出願人らは、これらの化合物が、血中および特定の末梢組織中よりも明らかに低濃度で脳内へと浸透することが観察した。この後者の特性は、いずれの抗痙攣剤の活性にも抗てんかん剤の活性にも必須であり、そしてこの化合物によって達成される脳内濃度は、脳においてICE/カスパーゼ−1を阻害すること、ならびにIL−1β産生およびそれの発作の発症への寄与を阻害することに十分であるかどうかは明らかでない。それにもかかわらず、出願人らは、末梢性に投与される場合に化合物1および化合物2が抗痙攣薬活性を有することを実証した。
【0017】
発作に対するICEインヒビターの有利な効果は、ICEインヒビターの抗炎症活性と直接には関係しない。イブプロフェンは、公知の抗炎症剤であり、出願人らの発作モデルにおいて試験され、腹腔内経路で投与された。イブプロフェンは、ビヒクルと比較して発作活性を増加させる(表4を参照のこと)。ビヒクルと比較して、イブプロフェンはてんかん重積状態である時間を増加させた。従って、このことは、イブプロフェンが発作活性を増加または誘導することを示唆する。
【0018】
本明細書中に提供される実施例は、ヒトのてんかん障害および痙攣障害の良好なモデルとして理解されるげっ歯類の発作モデルを含む。例えば、公知の抗てんかん剤(例えば、カルバマゼピンおよびフェニトキシン)は、ICEインヒビターと同様に、このモデルにおいて抗痙攣活性を示す。
【0019】
本出願人らは、脳室内投与後および腹腔内投与後のこれらの化合物の抗痙攣活性を研究したが、種々の末梢経路(腹腔内、経口および静脈内が挙げられる)によって投与される化合物1および化合物2を用いた先行の実験は、これら化合物がこれらの代替経路によって投与される場合にも抗痙攣活性を有することを示す。好ましい実施形態において、ICEインヒビターは末梢投与される(すなわち、経口または非経口であって、頭蓋内ではない)。
【0020】
本発明は、ICEのインヒビターである化合物の使用を含む。このような化合物は、ICEに対して選択的であり得る。または、このような化合物は、ICEに対して活性であり得、そして別のカスパーゼに対して活性であり得るか、または他のカスパーゼの範囲(例えば、2〜14)に対して活性であり得る。本明細書中に実証されるように、ICEを抑制することおよびIL−1βの産生を抑制することは、上記の任意の一つ以上または全てに挙げられる、発作の発症の時間を遅延させるか、発作の所要時間量を低下させるか、または発作の頻度を低下させる。実施例1および実施例6において得られたデ−タは、化合物1の抗痙攣性用量がICE/カスパーゼ−1の活性化およびIL−1β産生に対して予想される機構に関連した効果を有することを証明する。
【0021】
本発明の方法において、化合物は、ICEを阻害して、これによって発作(または他の関連障害)を処置するのに効果的な量で投与される。発作(または他の関連障害)を処置することとしては、発作の持続期間を減らすこと、発作の重篤度を軽減すること、発作発症の発生率を軽減すること、発作開始を遅延させること、発作の発生を排除すること、が挙げられる。従って、また、本発明によって発作(または他の関連した障害)を防止するための方法が提供され、この方法は発作を防止するために有効量のICEインヒビターを投与することによる。
【0022】
本発明の方法は、動物、好ましくは哺乳動物(ヒトおよびヒト以外の哺乳類を含む)を処置するために用いられ得る。ICEを阻害するいかなる化合物も、本発明の方法および組成物において使用され得る。このような化合物としては、ICEを選択的に阻害する化合物、およびカスパ−ゼまたはICE/CED−3ファミリーの一つ以上の酵素を阻害する化合物が挙げられる。本発明と関係した使用のための化合物は、可逆性様式または不可逆性様式のいずれかでICEの触媒活性を阻害する。
【0023】
本発明の化合物は、ICEを阻害しておよび/またはIL−1レベル(特にIL−1βレベルおよびIL−18レベル)を低下させる。これらの化合物は、例えば、ICEを阻害すること、IL−1βおよび/またはIL−18の産生を阻害すること、IL−1レベルおよび/またはIL−18レベルの調節を阻害すること、ならびに/あるいはIL−1β活性および/またはIL−18活性に影響を及ぼすことについて、アッセイされ得る。これら各々の活性の試験するためのアッセイは、当該分野で公知である(本明細書の実施例、WO95/35308、WO97/22619、WO99/47545またはWO01/90063を参照のこと)。従って、これらの化合物は、本明細書中に記載されるICE媒介性疾患および/またはIL−1媒介性疾患における事象を標的化および阻害し得る。
【0024】
本発明と関連して使用され得る化合物としては、限定はされないが、以下の文書の化合物が挙げられる:WO04/058718、WO04/002961、WO03/088917、WO03/068242、WO03/042169、WO98/16505、WO93/09135、WO03/106460、WO03/103677、WO03/104231、WO02/085899、WO00/55114、WO00/55127、WO00/61542、WO01/05772、WO01/10383、WO01/16093、WO01/42216、WO01/72707、WO01/90070、WO01/94351、WO02/094263、WO02/42278、米国特許第6,184,210号、米国特許第6,184,244号、米国特許第6,187,771号、米国特許第6,197,750号、米国特許第6,242,422号、April 2001 American Chemical Society(ACS)meeting in San Diego、California、USA、WO02/22611、US2002/0058630、WO02/12638、WO95/35308、5,716,929、WO97/22619、米国特許第6,204,261号、WO99/47545、WO01/90063、米国特許公開第2004/0014753号、米国特許公開第2004/0009966号、米国特許公開第2003/0236296号、米国特許第6,693,096号、米国特許第6,610,683号、米国特許第6,531,467号、米国特許第6,528,506号、米国特許第6,200,969号、WO2003/072528、WO2003/032918、WO01/00658、WO98/10778、米国特許第6,716,818号、米国特許第6,620,782号、米国特許第6,566,338号、米国特許第6,495,522号、米国特許第6,355,618号、6,153,591、WO2005/003100、WO2004/002401、WO00/61542、WO00/55114、WO99/47154、米国特許第6,083,981号、米国特許第5,932,549号、米国特許第5,919,790号、米国特許第5,744,451号、WO2002/089749、WO99/36426、WO98/16505、WO98/16504、WO98/16502、米国特許第6,316,415号、米国特許第5,932,549号、米国特許第5,919,790号、米国特許第5,744,451号、EP1082127、EP1049703、EP0932600、EP0932598、WO99/56765、WO93/05071、EP0600880、およびEP1378573(これらは全て、本明細書中で参考として援用される)。本発明における使用のための好ましい化合物としては、WO04/058718、WO04/002961、WO95/35308、WO97/22619、WO99/47545およびWO01/90063の化合物が挙げられる。本発明における使用のための好ましい他の化合物としては、WO95/35308、WO97/22619、WO99/47545およびWO01/90063の化合物が挙げられる。より好ましい化合物は、本明細書中の特許請求の範囲に記載される化合物である。これらの化合物は、熟練した実務家に公知の方法および本明細書において引用される文書中に開示される方法によって、得られ得る。
【0025】
本発明はまた、本明細書中の方法に従って抗発作活性、抗てんかん活性または抗痙攣活性について化合物を試験するためのアッセイを提供する。このような方法は、例えば、発作、痙攣、てんかんまたは関連した障害の処置に有用な化合物を同定する工程を包含し、これは、化合物がICEを阻害する能力および/または発作、痙攣、てんかんまたは関連した障害を阻害する能力を決定する工程を含む。本発明の他の方法は、抗痙攣活性についてICEインヒビターをアッセイする工程を含む。このような方法およびアッセイは、発作、痙攣、てんかんまたは関連した障害の処置における使用のための化合物を同定することに有用である。他の好ましい実施形態において、アッセイは、実質的に本明細書(例えば、実施例1、2または3を参照のこと)に記載されるような方法によってなされ得る。
【0026】
従って、本発明の薬学的組成物および方法は、インビトロまたはインビボでIL−1レベルおよび/またはIL−1活性を制御するのに有用である。このように、本発明の組成物および方法は、インビボでIL−1レベルを制御するため、そして特定の状態(本明細書において述べられるような疾患、障害または効果が挙げられる)の発達、重篤度または効果を処置するかまたは軽減するために有用である。
【0027】
別の実施形態によれば、本発明は、上記のように、本発明の化合物または薬学的に受容可能なその誘導体(例えば塩)、ならびに薬学的に受容可能なキャリア含む組成物を提供する。
【0028】
別の実施形態によれば、本発明の組成物および方法はさらに、別の治療薬を含み得る。このような薬剤としては、発作、痙攣またはてんかんを処置または阻害するための以下の化合物が挙げられるが、これらに限定されない:例えば、バルビツレート(例えば、メフォバルビタール、ペントバルビタール)、ベンゾダイアゼピン(例えば、ロラゼパム、クロナゼパム、クロラゼペート、ジアゼパム)、GABAアナログ(例えば、チアガビン(tiagabin)、ガバペンチン、プレガバリン、ビガバトリン(vigabatrin))、ヒダントイン(例えば、フェニトイン、フォスフェニトイン(fosphenytoin))フェニルトリアジン(例えば、ラモトリジン)、スクシンイミド(例えば、メトスクシミド、エトスクシミド)、または他の種々の化合物(例えば、カルバマゼピン、リルゾール(riluzole)、バルプロアート、ジバルプロックス(divalproex)、フェルバメート(felbamate)、プリミドンまたはトピラメート(topiramate))、抗炎症剤、マトリックスメタロプロテアーゼインヒビター、リポキシゲナーゼインヒビター、サイトカインアンタゴニスト、免疫抑制剤、抗癌剤、抗ウィルス因子、サイトカイン、増殖因子、免疫調節物質(例えば、ブロピリミン(bropirimine)、抗ヒトαインターフェロン抗体、IL−2、GM−CSF、メチオニンエンケファリン、インターフェロンα、ジエチルジチオカルバメート、腫瘍壊死因子、ナルトレキソンおよびrEPO)、プロスタグランジンまたは抗脈管過増殖化合物。
【0029】
用語「薬学的に受容可能なキャリア」とは、本発明の化合物と共に患者に投与され得、そしてその薬理活性を破壊しない無毒性キャリアをいう。
【0030】
これらの組成物において使用され得る、薬学的に受容可能なキャリアとしては、以下が挙げられるが、これらに限定はされない:イオン交換体、アルミナ、ステアリン酸アルミニウム、レシチン、ヒト血清アルブミンのような血清タンパク質、リン酸塩のような緩衝物質、グリシン、ソルビン酸、ソルビン酸カリウム、飽和植物性脂肪酸の部分的なグリセリド混合物、水、塩または電解質(例えば、硫酸プロタミン、リン酸水素二ナトリウム、リン酸水素カリウム、塩化ナトリウム、亜鉛塩、コロイドシリカ、三ケイ酸マグネシウム、ポリビニルピロリドン、セルロースベースの物質、ポリエチレングリコール、ナトリウムカルボキシメチルセルロ−ス、ポリアクリラート、ワックス、ポリエチレン−ポリオキシプロピレン−ブロックポリマー、ポリエチレングリコールおよび羊毛脂。
【0031】
本発明の化合物のみを活性成分として含む薬学的組成物において、これらの組成物を投与する方法は、被験体にさらなる薬剤を投与する工程をさらに含み得る。このような薬剤としては、発作、痙攣またはてんかんを処置または阻害するための以下の化合物が挙げられるが、これらに限定されない:例えばバルビツレート(例えば、メフォバルビタール、ペントバルビタール)、ベンゾダイアゼピン(例えば、ロラゼパム、クロナゼパム、クロラゼペート、ジアゼパム)、GABAアナログ(例えば、チアガビン、ガバペンチン、プレガバリン、ビガバトリン)、ヒダントイン(例えば、フェニトイン、フォスフェニトイン)、フェニルトリアジン(例えば、ラモトリジン)、スクシンイミド(例えば、メトスクシミド、エトスクシミド)、または他の種々の化合物(例えば、カルバマゼピン、リルゾール、バルプロアート、ジバルプロックス、フェルバメート、プリミドンまたはトピラメート)、抗炎症剤、マトリックスメタロプロテアーゼインヒビター、リポキシゲナーゼインヒビター、サイトカインアンタゴニスト、免疫抑制剤、抗癌剤、抗ウィルス剤、サイトカイン、増殖因子、免疫調節物質(例えば、ブロピリミン、抗ヒトαインターフェロン抗体、IL−2、GM−CSF、メチオニンエンケファリン、インターフェロンα、ジエチルジチオカルバメート、腫瘍壊死因子、ナルトレキソンおよびrEPO)、プロスタグランジン、または抗脈管過増殖化合物。第2の薬剤が使用される場合、この第2の薬剤は別々の剤形として、または本発明の化合物または組成物と共に単一の剤形の一部としてのいずれかで投与され得る。
【0032】
上記の組成物に存在する化合物の量は、疾患の重篤度、ICE阻害レベル、IL−1レベル、またはIL−1活性の検出可能な減少を引き起こすのに十分であるべきである。
【0033】
これらの組成物において、本発明の化合物の薬学的に受容可能な塩が利用される場合、これらの塩は好ましくは無機または有機の酸および塩基に由来する。このような酸性塩の中には、以下のものが挙げられる:酢酸塩、アジピン酸塩、アルギン酸塩、アスパルテート、安息香酸塩、ベンゼンスルホン酸塩、重硫酸塩、酪酸塩、クエン酸塩、樟脳酸塩、樟脳スルホン酸塩、シクロペンタンプロピオン酸塩、ジグルコン酸塩、ドデシル硫酸塩、エタンスルホン酸塩、フマル酸塩、グルコヘプタノエート、グリセロリン酸塩、ヘミスルフェート、ヘプタノエート、ヘキサノエート、塩酸塩、臭化水素酸塩、ヨウ化水素塩、2−ヒドロキシエタンスルホン酸塩、乳酸塩、マレイン酸塩、メタンスルホン酸塩、2−ナフタレンスルホン酸塩、ニコチン酸塩、シュウ酸塩、パモエート、ペクチネート、ペルオキソ硫酸塩、3−フェニルプロピオン酸塩、ピクラート、ピバル酸塩、プロピオン酸塩、スクシナート、酒石酸塩、チオシアン酸塩、トシレートおよびウンデカノエート。塩基性塩としては、以下が挙げられる:アンモニウム塩、アルカリ金属塩(例えばナトリウム塩およびカリウム塩)、アルカリ土類金属塩(例えば、カルシウム塩およびマグネシウム塩)、有機塩基との塩(例えば、ジシクロヘキシルアミン塩)、Nメチル−D−グルカミン、アミノ酸(例えば、アルギニン、リシン)との塩、など。
【0034】
また、塩基性窒素含有基は、以下のような因子と四価にされ得る:ハロゲン化低級アルキル(例えば、メチル、エチル、プロピルおよびブチルの塩化物、臭化物およびヨウ化物);硫酸ジアルキル(例えばジメチル、ジエチル、ジブチルおよびジアミルの硫酸塩)、長鎖ハロゲン化物(例えば、デシル、ラウリル、ミリスチルおよびステアリルの、塩化物、臭化物およびヨウ化物);ハロゲン化アラルキル(例えば、ベンジルおよびフェネチルの臭化物およびその他のもの)。このようにして、水溶性製品または油溶性製品または分散可能な製品が得られる。
【0035】
本発明の組成物および方法で利用される化合物は、選択的な生物学的性質を強化するために適切な官能性を付加することにより改変され得る。このような改変は、当該分野で公知であり、そして所定の生物系(例えば、血液、リンパ系または中枢神経系)に生物学的浸透を増加させる改変、経口のアベイラビリティーを増加させる改変、注入による投与を可能にするために溶解性を増加させる改変、代謝を変更する改変、および/または排泄速度を変更する改変が挙げられる。
【0036】
好ましい実施例によれば、本発明の組成物は、被験体(例えば、哺乳類、好ましくはヒト)への薬学的投与のために処方される。
【0037】
本発明のこのような薬学的組成物は、経口で、非経口で、吸入スプレーによって、局所的に、直腸に、鼻腔内で、口腔内で、経膣的に、または移植されたレザバを介して、投与され得る。本明細書で用いられる場合、用語「非経口」としては、皮下の、静脈内、筋肉内の、関節腔内の、滑液包内の、胸骨内の、クモ膜下の、肝臓内、病巣内および頭蓋内の注射技術および注入技術が挙げられる。好ましくは、組成物は経口投与される。
【0038】
本発明の組成物の滅菌注射剤形態は、水性または油性懸濁物であり得る。これらの懸濁物は、適切な分散剤または湿潤剤および懸濁剤を使用して、当該分野で公知の技術に従って処方され得る。滅菌注射用調製物はまた、非経口的に受容可能な無毒性の希釈剤または溶媒中の、滅菌した注射可能の溶液または懸濁物(例えば、1,3−ブタンジオール中の溶液)であり得る。使用され得る受容可能なビヒクルおよび溶媒の中には、水、リンゲル液および等張食塩水がある。さらに、滅菌した不揮発性油は、溶媒または懸濁媒体として慣用的に使用される。この目的のため、任意の無刺激の不揮発性油(合成モノグリセリドまたは合成ジグリセリドが挙げられる)が使用され得る。脂肪酸(例えば、オレイン酸およびそのグリセリド誘導体)は、注射物の調製に有用であり、天然の薬学的に受容可能な油(例えば、オリーブ油およびヒマシ油、特にそれらのポリオキシエチル化形態)である場合に有用である。また、これらの油溶液または懸濁物は、長鎖アルコ−ル希釈剤または分散剤(例えば、エマルジョンおよび懸濁液を含む薬学的に受容可能な剤形の処方物において通常使用される、カルボキシメチルセルロ−スまたは類似の分散剤)を含み得る。薬学的に受容可能な固体、液体または他の剤形の製造において通常使用される、Tween、Spanおよび他の乳化剤またはバイオアベイラビリティー増強剤のような他の一般的に用いられる界面活性剤もまた、処方目的のために使用され得る。
【0039】
固体キャリアが使用される場合、調製物は、粉末形態もしくはペレット形態での硬質ゼラチンカプセル、またはトロ−チ剤もしくはロゼンジの形態に錠剤化、配置され得る。固体キャリアの量は、例えば、約25mg〜400mgまで変動する。液体キャリアが用いられる場合、調製物は、例えば、シロップ、エマルジョン、ソフトゼラチンカプセル、無菌の注射可能な液体(例えば、アンプルまたは非水系の液体懸濁物)の形態であり得る。組成物がカプセルの形態である場合、例えば硬質ゼラチンカプセルシェル中に上述したキャリアを使用して、任意の慣用的なカプセル化法が適切である。
【0040】
シロップ処方物は、矯味矯臭剤または着色料と共に、液体キャリア(例えば、エタノール、グリセリンまたは水)中の化合物の懸濁物または溶液から構成され得る。エアロゾル調製物は、液体キャリア(例えば水、エタノールまたはグリセリン)中の化合物の溶液または懸濁液から構成され得る;一方、粉末乾燥エアロゾルにおいて、調製物は、例えば湿潤剤を含み得る。
【0041】
本発明の処方物は、活性成分を、一つ以上のその成分の受容可能なキャリアおよび必要に応じて他の任意の治療成分と一緒に含む。キャリアは、処方物の他の成分と互換性を持つという意味において「受容可能で」あるべきであり、そしてそれのレシピエントに有害であってはならない。
【0042】
本発明の薬学的組成物は、カプセル、錠剤、および水性懸濁液または水性溶液を含むがこれに限らない、任意の経口受容可能な剤形においても経口投与され得る。経口使用のための錠剤の場合、通常使用されるキャリアとしては、ラクトースおよびコーンスターチが挙げられる。滑沢剤(例えば、ステアリン酸マグネシウム)も、代表的に添加される。カプセル形態での経口投与のために有用な希釈剤としては、ラクトースおよび乾燥コーンスターチが挙げられる。水性懸濁物が経口使用のために必要とされる場合、活性成分は、乳化剤および懸濁剤と混ぜ合わされる。所望される場合、特定の甘味剤、矯味矯臭剤または着色料が添加され得る。
【0043】
あるいは、本発明の薬学的組成物は、直腸の投与のための坐薬の形態で投与され得る。これらは、室温で固体であるが直腸温で液体である適切な非刺激性賦形剤と薬剤とを混ぜ合わせることにより調製され得、これにより直腸で溶けて薬物を放出する。このような物質としては、ココアバタ−、蜜蝋およびポリエチレングリコ−ルが挙げられる。
【0044】
特に、処置標的が局所適用によって容易に接近可能な領域または器官を含む場合(例えば、頭蓋内の手術の間が挙げられる)、本発明の薬学的組成物はまた、局所投与され得る。適切な局所処方物は、これらの適用の各々のために容易に調製される。
【0045】
下部腸管用の局所適用は、直腸坐剤処方物(上記参照)において、または適切な浣腸処方物において達成され得る。局所経皮パッチもまた用いられ得る。
【0046】
局所適用のため、薬学的組成物は、一つ以上のキャリア中に懸濁または溶解された活性成分を含む、適切な軟膏に処方され得る。本発明の化合物の局所投与のためのキャリアとしては、限定はされないが、鉱油、流動パラフィン、白色ワセリン、プロピレングリコ−ル、ポリオキシエチレン、ポリオキシプロピレン化合物、乳化ろうおよび水が挙げられる。あるいは、薬学的組成物は、一つ以上の薬学的に受容可能なキャリア中に懸濁または溶解された活性成分を含む、適切なロ−ション剤またはクリ−ムに処方され得る。適切なキャリアとしては、鉱油、ソルビタンモノステアレート、ポリソルベート60、セチルエステルワックス、セテアリール(cetearyl)アルコール、2−オクチルドデカノール、ベンジルアルコールおよび水が挙げられるが、これらに限定されない。
【0047】
眼の使用のため、薬学的組成物は、等張のpH調整された滅菌食塩水中の超微粉砕された懸濁物として、または好ましくは等張のpH調整された食塩水中の溶液として、防腐剤(例えば塩化ベンザルコニウム)を含むかまたは含まずに、処方され得る。あるいは、眼の使用のため、薬学的組成物は、軟膏(例えばワセリン)に処方され得る。一実施形態において、組成物は、本明細書において処方されるとおりである。他の眼科用調製物は、例えば、米国特許第6,645,994号および/または米国特許第6,630,473号に見出され得る。
【0048】
本発明の薬学的組成物はまた、鼻エアロゾルまたは吸入により投与され得る。このような組成物は、薬学的処方物の分野で公知の技術に従って調製され、そして食塩水の溶液として、ベンジルアルコ−ルまたは他の適切な防腐剤、バイオアベイラビリティーを強化する吸収促進剤、フッ化炭化水素および/または当該分野において公知の他の従来の可溶化剤または分散剤を使用して、調製され得る。
【0049】
薬学的に受容可能なキャリアまたは希釈剤の形態および特徴は、それが合わされるべき活性成分の量、投与経路および他の周知の変数により指示されることが、当業者により認識される。
【0050】
上記の化合物および組成物はまた、発作または痙攣に関連する特定の疾患に関する治療適用に有用である。
【0051】
本発明の化合物はIL−1βおよび/またはIL−18の放出を阻害し得、これによって本明細書に述べられるような特定の疾患のいくつかの病態生理学作用を阻害するかまたはブロックすることに有用であり得る。
【0052】
本発明はまた、(1)細胞からのIL−1放出を阻害すること、および/または(2)ヒトを含む哺乳類のIL−1の極端に高い組織レベルの厄介な作用、毒性作用または致死作用を防止すること、による特定の疾患を処置するための治療方法に関する。この方法には、一つ以上のICE/CED−3インヒビターの有効なICE阻害量を哺乳類に投与する工程を包含する。この方法はまた、治療可能な(amenable)特定の疾患(発作、痙攣、てんかんまたは関連した障害が挙げられる)の予防処置または防止のために使用され得る。本発明は、この種の化合物の有効量を、これを必要とする哺乳動物(ヒトを含む)に投与することによって、これらの障害を処置するための方法を提供する。
【0053】
化合物は、ICEを阻害して、IL−1の放出を妨害するかまたはIL−1レベルおよびIL−1活性を減少させることによって、そしてこれらの状況の各々における過剰なレベルのIL−1の病態生理学的作用を阻害することによって、特定の疾患の停止または消散を直接的に促進し、そして通常機能の回復を促進する。併せると、これらの作用は、発作および関連した障害を処置する際のそれら化合物の新規な使用を関連させる。
【0054】
ICE阻害は、当該分野において公知の方法、および本明細書でより完全に記載されるような方法によって、測定され得る。
【0055】
化合物は、単核細胞、マクロファージ、神経細胞、内皮細胞、表皮細胞、間葉系細胞(例えば:線維芽細胞、骨格の筋細胞、平滑筋筋細胞、心臓筋細胞)および他の多くの型の細胞によるIL−1放出の開始(release)を阻害するのに有用であり得る。
【0056】
用語「状態(condition)」または「状態(state)」は、被験体において有害な生物学的結果をもたらす任意の疾患、障害または効果をいう。
【0057】
本明細書で用いられる場合、用語「発作」は、一般的に、生体の全部または一部にわたる筋肉の突発的かつ不随意な収縮をいい、この収縮は中枢神経系のニューロンのサブセットの異常な興奮によって引き起こされる。発作は、てんかんの症状である。発作の運動性の徴候は、脳電図(EEG)の変化を伴う。これらの変化は、明らかな運動性の徴候がない場合も起り得る。
【0058】
患者または細胞培養物(すなわち、細胞または細胞培地)の血液または細胞の中のIL−1タンパク質レベルは、例えば、IL−1への免疫特異的結合、または活性IL−1の存在の結果として産生されることが公知の他のタンパク質への免疫特異的結合についてアッセイすることによって決定されることができる。このような方法は、当該分野で公知である。例えば、使用され得るイムノアッセイとしては、標識抗体を用いて、以下が挙げられるが、これに限定されるものではない:競合的アッセイ系および非競合アッセイ系、ウエスタンブロット、ラジオイムノアッセイ、ELISA(酵素結合免疫吸着検定法)、「サンドイッチ」イムノアッセイ、免疫沈降アッセイ、沈降素(precipitin)反応、ゲル内拡散沈降素反応、免疫拡散アッセイ、凝集反応アッセイ、補体結合アッセイ、免疫放射線測定法、蛍光免疫法、プロテインAイムノアッセイおよびFACS分析。このようなアッセイは、当該分野で周知である(例えば、Ausubelら編、1994、Current Protocols in Molecular Biology、第1巻、John Wiely&Sons(New York)(これは、その全体が参考として本明細書中に援用される)。
【0059】
競合結合アッセイはまた、IL−1のレベルを決定するために使用され得る。競合結合アッセイの1つの例はラジオイムノアッセイであり、これは、漸増量の非標識IL−1の存在下での、IL−1を発現している細胞からの標識された(例えば、3Hまたは125I)タンパク質とIL−1抗体とのインキュベーション、および標識されたIL−1と結合したIL−1抗体の検出を含む。特定の抗原に対する目的の抗体のアフィニティーおよび解離速度は、スキャッチャードプロット分析によって、データから決定され得る。二次抗体との競合はまた、ラジオイムノアッセイを使用して決定され得る。この場合、抗原は、漸増量の非標識二次抗体の存在下で、標識された(例えば、3Hまたは125I)化合物に結合した目的の抗体と共にインキュベートされる。
【0060】
IL−1レベルはまた、活性によりアッセイされ得、例えば、IL−1または増殖因子のようなサイトカインの生物活性レベルを検出し得る細胞株によりIL−1レベルがアッセイされ得る。一実施形態によれば、生物学的サンプル中の生物活性のIL−1のレベルは、イソプロピル−b−D−チオガラクトピラノシドと共に、遺伝子操作された細胞株をインキュベートすることによって、検出される。細胞株は試験されるべきサンプルと共にインキュベートされ、そして細胞株における細胞死は青色の強度(これは、試験されるサンプルの生物活性サイトカインまたは増殖因子を示す)を決定することによって、モニタリングされる。また、患者の血清のIL−1活性アッセイについては、例えば、Burns(1994)20(l)40−44を参照のこと。
【0061】
1日あたり体重1kgあたり約0.01mg〜100mgの間の活性成分化合物の投薬レベル、好ましくは1日あたり体重1kgあたり約0.5mg〜約75mgの間の活性成分化合物の投薬レベル、そして最も好ましくは1日あたり体重1kgあたり約1mg〜約50mgの間の活性成分化合物の投薬レベルは、単独療法に有用である。約50mg/kg〜約200mg/kgの投薬量がテストされ、効果的であると見出された(本明細書中の実施例を参照のこと)。頭蓋内投与のため、1ng〜1gの間の活性成分化合物の投薬レベル、好ましくは100ng〜100mgの間の活性成分化合物の投薬レベルが有用である。
【0062】
代表的に、本発明の薬学的組成物は、1日につき約1〜5回、あるいは持続性注入として投与される。このような投与は、長期的な治療法または急性の治療法として使用され得る。単一の剤形を製造するためキャリア物質と組み合わされ得る活性成分の量は、処置される宿主、または特定の投与様式に依存して変動する。代表的な調製物は、約5%〜約95%の活性化合物(w/w)を含む。好ましくは、このような調製物は、約20%〜約80%の活性化合物を含む。
【0063】
本発明の組成物が、本発明の化合物および一つ以上の付加的な治療薬の組合せを含む場合、その化合物および付加的な薬剤の両方は、単独療法レジメンにおける通常投与される投薬量の約10%〜約80%の間の投薬レベルで存在するべきである。
【0064】
必要に応じて、患者の状態の改善の際、本発明の化合物、組成物または組合せの維持用量が、投与され得る。その後、その改善された状態が保持されるレベルに、症状の関数として、投薬量または投与頻度が、あるいはその両方とも、軽減され得る。症状が所望のレベルに緩和される場合、処置を中止することが可能であり得る。しかしながら、患者は、いかなる再発徴候または疾患徴候に対する長期ベースの断続的な処置を必要とし得る。
【0065】
いかなる特定の患者のための特定の投薬量および処置レジメンが様々な要因(使用される特定の化合物の活性、年齢、体重、一般的健康、性別、食事、投与時間、排泄速度、薬物の組み合わせおよび処置医師の判断および処置されている特定の疾患の重篤度が挙げられる)に依存することもまた理解されるべきである。活性成分の量は、組成物中の、特定の化合物および存在する場合、他の治療薬にも依存する。
【0066】
従って、被験体において本発明の疾患を処置または予防するための方法は、本明細書中に記載される任意の化合物、薬学的組成物または組合せを被験体に投与する工程を含む。
【0067】
好ましい実施形態において、本発明は、上述した疾患のうちの1つを有する哺乳動物を処置する方法を提供し、この方法は、上記の薬学的に受容可能な組成物をその哺乳動物に投与する工程を含む。この実施形態において、患者はまた他の治療薬を投与される場合、その治療薬は、単一の剤形または別々の剤形として、本発明の化合物と共に送達され得る。別々の剤形として投与される場合、他の治療薬は、本発明の化合物を含む薬学的に受容可能な組成物の投与の前に、その投与と同時に、またはその投与の後に投与され得る。
【0068】
本発明に従って疾患を処置するための化合物または組成物を同定するための方法は、複数の化合物または組成物が、特定の疾患の作用を改善する能力および/または本発明の特定の疾患を有する患者の状態を改善する能力について、それらの化合物または組成物をスクリーニングするための方法を含む。本発明の1実施形態に従って、ハイスループットのスクリーニングは、マイクロタイタープレートの複数のウェルの培養物中に細胞を有すること、異なる化合物または組成物を各々のウェルに加えること、ならびに各々の細胞培養物中のICE阻害レベルおよび/または活性、ならびにIL−1レベルおよび/または活性を、コントロールウェルの細胞培養物中に存在するレベルまたは活性と比較することによって、達成され得る。この発明に従う比較工程に有用なコントロールとしては、化合物または組成物により処置されていない細胞または被験体、およびICE阻害またはICE活性に効果のないことが公知である化合物または組成物により処置されている細胞または被験体、が挙げられる。本発明の一実施形態に従い、ハイスループットスクリーニングは、細胞をプレートに添加すること〜化合物または組成物の添加の後のデータの収集および分析までを含む工程が機械により行われるように、自動化される。本発明の比較工程において有用な機器(例えば、標識された対象(例えば、放射性標識された対象、蛍光性の対象、または着色された対象)またはそれ自身検出可能である対象を検出し得る機器)は、市販されており、そして/または、当該分野で公知である。従って、本明細書中に開示される特定の疾患を処置するために有用である、この発明に従う化合物および組成物は、迅速かつ効率よくスクリーニングされ得る。
【0069】
本明細書中に開示される全ての出願、特許および参考文献は、参考として援用される。本発明がより完全に理解されるため、以下の調製実施例および試験実施例が記載される。これらの例は、例示目的のためのみであり、本発明の範囲をいかようにも限定しないものとして解釈されるべきである。
【実施例】
【0070】
実施例1
雄性の成体Sprague−Dawleyラットの発作の実験モデルを、長期的に(chronically)埋没されたカニューレおよび電極を用いた、自由に移動可能なラットの背側海馬における、カイニン酸(0.5μl中の40ng)の一側性のマイクロインジェクションにより誘導した。簡潔には、動物を、Equithesin(1%のフェノバルビタールおよび4%の抱水クロラール;3ml/kg、腹腔内注射)を使用して深麻酔した。双極性のニクロム線絶縁電極(60μm)を、背側海馬の歯状回(中隔極)に両側性に埋没し、そしてガイドカニューレ(22ゲージ)を、硬膜の頂部に一側性に配置し、そしてカイニン酸の海馬内注入のための深部電極のうちの1つに接着した。海馬の電極の移植に関するブレグマからの座標は、(ミリメ−トル単位:鼻棒(nose bar)−2.5、AP−3.5、L±2.4、および硬膜の下で3)であった。
【0071】
化合物の脳室内注入のため、さらなるガイドカニューレを、硬膜の頂部に一側性に配置した(ミリメートル単位、鼻棒−2.5;AP−1;L+1.5)。鼻の洞にまたがってアース線を配置し、そして頭頂葉皮質にまたがって2本のネジ電極を両側性に配置した。電極をマルチピンソケット(March Electronics、NY)に接続し、アクリル歯科用セメントによって注入カニューレと一緒に頭蓋に固定した。
【0072】
化合物1(25μg/4μl)または等量のビヒクルを脳室内注入により投与した。以下のパラメ−タに基づいたEEG分析によって、発作を記録し、定量化した:1)初回の発作エピソードの開始までの時間、2)3時間の記録の間の発作のエピソードの数、および3)各々の発作事象の持続期間を合計することによって計算した発作活動の所要時間。化合物1処置は、痙攣の発症までの潜伏期(latency)を大いに増加させ、発作のエピソードの数および全体の発作活動の所要時間を減らした(表1)。
【0073】
ICE/カスパーゼ−1の活性化に対する化合物1の効果を、これらのラットからのサンプルのウエスタンブロットにより検出される活性20kDサブユニットの量に基づいて評価した。図1は、化合物1の処置がカイニン酸発作により誘導されるカスパーゼ−1 20kDサブユニットの増加を打ち消すだけでなく、このサブユニットを極めて低いレベルに引き下げたことを示す。プロ−カスパーゼ−1の不活性45kDサブユニットのレベルは、カイニン酸によっても化合物1によって変わらなかった。
【0074】
表1:ラットに、左の海馬の0.5μlカイニン酸の40ngの注入の45分前および10分前に脳室内に(icv)化合物1(25μg/4μl)を投与した。コントロール(ビヒクル)に、食塩水中の20%のCremophorを投与した。
【0075】
【表1】

**スチューデントのt検定によりビヒクルに対してp<0.01。
【0076】
実施例2
ラットにおける発作の実験モデルを、長期埋没されたカニュ−レを使用して、自由に移動可能なラットの背側海馬においてカイニン酸(0.5μL中40ng)の一側性のマイクロインジェクションにより誘導した。カイニン酸の45分前および10分前に、化合物1(30mg/kg)またはビヒクルを腹腔内注射により投与した。長期埋没された海馬電極を使用して、EEG発作を記録した。以下のパラメ−タに基づいたEEG分析によって、発作の活動および発作間のてんかんの活動を定量化した:1)初回の発作のエピソードの開始までの時間、2)3時間の記録の間の発作のエピソードの数、および3)各々の発作事象の持続期間を合計することによって計算した発作活動の所要時間。化合物1の処置は、痙攣の発症までの潜伏期を大いに増加させ、発作活動の総所要時間を約30%減らした(しかし、この差異は統計学上の有意差には到らなかった)(表2)。これらのデ−タは、より高用量がより大きくかつ統計学的に有意な効果を生じるのに効果的であることを示唆する。より高用量の化合物2が統計学的に有意の効果を生じた実施例4を参照のこと。
【0077】
表2.左海馬における0.5μlのカイニン酸の40ngの適用の45分前および10分前に、ラットに化合物1(30mg/kg)を腹腔内投与した。コントロール動物(ビヒクル)に、食塩水中の20%のCremophorを投与した。
【0078】
【表2】

*スチューデントのt検定によりビヒクルに対してp<0.01。
【0079】
実施例3
(ICE阻害)
当該分野で公知の方法によって、ICEを阻害するそれらの能力について化合物を試験し得る(図2−4に記載される文書を参照のこと)。
【0080】
実施例4
EEG発作を、長期埋没されたカニュ−レを使用する40ngのカイニン酸(KA)の海馬内注入によって、成体雄性Sprague−Dawleyラットにおいて誘導した。長期埋没した海馬の電極を使用して、EEG発作を記録した。以下のパラメ−タに基づいたEEG分析によって、発作および発作間のてんかんの活動を定量化した:1)初回の発作のエピソードの開始までの時間、2)3時間の記録の間の発作のエピソードの数、および3)各々の発作事象の持続期間を合計することによって計算した発作活動の所要時間。化合物2またはそのビヒクルを、連続3日(50mg/kg〜200mg/kg)間、腹腔内注射した。4日目、ラットに、0.5μl中40ngのカイニン酸の海馬内注入の45分前および10分前に、化合物2を投与した。
【0081】
表3.ラットにおけるカイニン誘導性発作に対する化合物2の効果
【0082】
【表3】

データは、平均±SE(N=7〜15匹のラット)
**一方向ANOVA、その後のDunnett検定によりビヒクルに対してp<0.01。
【0083】
実施例5
発作に対するイブプロフェンの効果をまた、実施例4に記載されている方法を使用して試験した。ラットに、0.5μl中40μgのカイニン酸の一側性の海馬内注入の60分前に、イブプロフェン(50mg/kg、腹腔内)を投与した。コントロール(ビヒクル)に、食塩水を投与した。*スチュ−デントのt検定によりビヒクルに対してp<0.05。発作をEEGにより分析し、定量化した。てんかん重積状態は、連続的に30分より長く持続する連続発作活動を表す。
【0084】
【表4】

【0085】
【表5】

【0086】
実施例6
また、カイニン酸により誘導されたIL−1β産生に対する化合物1の効果を実施例1にて説明したように研究した。ICE/カスパーゼ−1活性化のように、IL−1β産生を、海馬内カイニン酸(40ng)マイクロインジェクションの90分後にラットから得た海馬のホモジェネートのウエスタンブロット分析により評価した。海馬のホモジェネ−トからの総タンパク(170μg)を、10% アクリルアミドのSDS PAGEを使用して分離し、そしてエレクトロブロッティングによって、Hybondニトロセルロ−ス膜に移した。ICE/カスパーゼ−1およびIL−1βの免疫反応性を、選択的な抗体を使用して評価し、そして強化された化学発光により検出した。海馬内カイニン酸注入は、ICE/カスパーゼ−1の活性20kDサブユニットの形成および活性17kD IL−1βの形成を誘導した。化合物1(25μg/4μLで脳室内に注入した)は、ICE/カスパーゼ−1の活性20kDサブユニットの形成の打ち消しによって明らかにされるように、ICE/カスパーゼ−1の活性化を阻害し、そしてまた成熟した活性17kD IL−1βの形成を低減した(カスパーゼ−1のデータに関して図1および図2Aを、そしてIL−1βのデータに関して図2Bを参照のこと)。
【0087】
実施例7
(錠剤の形成)
化合物2を、以下および実施例6に記載されるように、経口投与のために処方し得る。錠剤につき300mgの化合物2を提供するため、薬物製品を処方した。
【0088】
【表6】

【0089】
【表7】

本明細書において、引用される全ての文書は、本明細書により参考として援用される。
【0090】
本発明の多くの実施形態が記載されたが、基本的な実施例を変更して、本発明の化合物および方法を利用する他の実施形態を提供し得る。従って、本発明の範囲は、例として示された特定の実施形態よりもむしろ添付の請求の範囲により定義されるべきであることであることが理解される。
【技術分野】
【0001】
(発明の分野)
本発明は、ICEインヒビターを用いて発作を処置または予防するための方法および組成物に関する。
【背景技術】
【0002】
(発明の背景)
サイトカイン(特に、IL−1βおよびTNF−α)は、多くの疾患を開始し得、そして維持し得るので、最適な治療標的である。種々の戦略(例えば、可溶性レセプター、抗体、レセプターアンタゴニストまたはインヒビター)は、サイトカインをブロックするために使用される。これらの特異的なサイトカインベースの治療法は、多くの慢性炎症または自己免疫疾患における炎症を軽減することが示されており、そしてヒトへの使用についてFDAにより認可されている(Bresnihanら、1998;Mohlerら、1993;Nukiら、2002;van Deventerら、1999)。
【0003】
インターロイキン−1β転換酵素(ICE、カスパーゼ−1としても公知)は、IL−1βおよびIL−18の前駆体を活性なサイトカインへと切断する細胞内プロテアーゼである(Akitaら、1997;Kuidaら、1995)。他のプロテアーゼ(細菌のプロテアーゼおよび宿主のプロテアーゼが挙げられる)は、プロIL−1βをプロセッシングし得るが、ICE欠失(ICE−/−)マウスは、内毒素に応答して成熟したIL−1βを放出し得ないことが示されている(Fantuzziら、1997;Liら、1995)。
【0004】
炎症誘導性サイトカインおよび抗炎症性サイトカインの脳における発現は、発作と関連している(非特許文献1;非特許文献2;非特許文献3)。しかしながら、抗痙攣治療法または抗てんかん治療法としての使用のために現在許容可能な抗サイトカイン薬物も抗炎症薬物も存在しない。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】A. Vezzaniら、「Interleukin−1β Immunoreactivity and Microglia Are Enhanced in the Rat Hippocampus by Focal Kainate Application: Functional Evidence for Enhancement of Electrographic Seizures」J.Neurosci.(1999)19,pp.5054−5065
【非特許文献2】DeSimoniら、「Inflammatory cytokines and related genes and are induced in the rat hippocampus by limbic status epilepticus」Eur.J.Neurosci.(2000)12,pp.2623−2633
【非特許文献3】A.Vezzaniら、「Powerful Anticonvulsant Action of IL− Receptor Antagonist on Intracerebral Injection and Astrocytic Overexpression in Mice」 PNAS(2000)97,pp.11534−11539
【発明の概要】
【課題を解決するための手段】
【0006】
(発明の要旨)
本発明は、ICEインヒビターを投与することによって、発作、痙攣、てんかん、および関連する状態を、処置または予防するための方法に関する。
【0007】
本発明はまた、発作、痙攣、てんかん、または関連する状態を処置または予防するための化合物および組成物に関する。
本発明はまた、このような状態を処置または予防するのに有用な薬剤を同定するための方法に関する。
【0008】
本発明はまた、本発明の方法を実施するための組成物およびキットを作製するためのプロセスに関する。
例えば、本発明は、以下の項目を提供する:
(項目1)
患者における発作を処置するための方法であって、該方法は、ICE/カスパーゼ−1を阻害する化合物を該患者に投与する工程を包含する、方法。
(項目2)
患者における痙攣を処置するための方法であって、該方法は、ICE/カスパーゼ−1を阻害する化合物を該患者に投与する工程を包含する、方法。
(項目3)
患者におけるてんかんを処置するための方法であって、該方法は、ICE/カスパーゼ−1を阻害する化合物を該患者に投与する工程を包含する、方法。
(項目4)
患者における発作障害を予防するための方法であって、該方法は、ICE/カスパーゼ−1を阻害する化合物を該患者に投与する工程を包含する、方法。
(項目5)
上記化合物がICE/カスパーゼ−1および1つ以上の他のカスパーゼ酵素を阻害する、項目1〜4のいずれか1項に記載の方法。
(項目6)
上記化合物が選択的なICE/カスパーゼ−1インヒビターである、項目1〜5のいずれか1項に記載の方法。
(項目7)
上記化合物が国際公開パンフレット第95/35308号、同第97/22619号、同第99/47545号、および同第01/90063号のいずれかに従う、項目1〜6のいずれか1項に記載の方法。
(項目8)
項目1〜6のいずれか1項に記載の方法であって、ここで上記化合物が:
【化1】

またはそのいずれかの立体異性体を含み、該立体異性体としては:
【化2】

が挙げられる、方法。
(項目9)
項目1〜6のいずれか1項に記載の方法であって、ここで上記化合物が:
【化3】

またはそのいずれかの立体異性体を含み、該立体異性体としては:
【化4】

が挙げられる、方法。
(項目10)
項目1〜6のいずれか1項に記載の方法であって、ここで上記化合物が:
【化5】

またはそのいずれかの立体異性体を含み:
【化6】

が挙げられる、方法。
(項目11)
項目1〜6のいずれか1項に記載の方法であって、ここで上記化合物が:
【化7】

またはそのいずれかの立体異性体を含み:
【化8】

が挙げられる、方法。
(項目12)
項目1〜11のいずれか1項に記載の方法であって、ここで上記化合物が末梢に投与される(すなわち、経口投与または非経口投与され、頭蓋内投与されない)、方法。
(項目13)
項目1〜12のいずれか1項に記載の方法であって、さらなる化合物を投与する工程をさらに包含し、ここで該さらなる化合物が抗痙攣薬化合物である、方法。
(項目14)
項目13に記載の方法であって、ここで上記さらなる化合物が、メフォバルビタール、ペントバルビタール、ロラゼパム、クロナゼパム、クロラゼペート、ジアゼパム、チアガビン(tiagabin)、ガバペンチン、プレガバリン(pregabalin)、ビガバトリン、ヒダントイン、フェニトイン、ホスフェニトイン、ラモトリジン、メトスクシミド、エトスクシミド、カルバマゼピン、リルゾール、バルプロアート(varproate)、ジバルプロックス、フェルバメート、プリミドン、またはトピラマートである、方法。
(項目15)
患者における発作、痙攣、またはてんかんを回復、処置または予防するための薬学的組成物であって、該組成物は、ICE/カスパーゼ−1を阻害する化合物および薬学的に受容可能なキャリアを含有する、薬学的組成物。
(項目16)
上記組成物が別の抗痙攣薬化合物をさらに含有する、項目15に記載の薬学的組成物。
(項目17)
項目16に記載の薬学的組成物であって、上記さらなる化合物は、メフォバルビタール、ペントバルビタール、ロラゼパム、クロナゼパム、クロラゼペート、ジアゼパム、チアガビン(tiagabin)、ガバペンチン、プレガバリン(pregabalin)、ビガバトリン、ヒダントイン、フェニトイン、ホスフェニトイン、ラモトリジン、メトスクシミド、エトスクシミド、カルバマゼピン、リルゾール、バルプロアート(varproate)、ジバルプロックス、フェルバメート、プリミドン、またはトピラマートである、薬学的組成物。
(項目18)
ICEを阻害する化合物、および該化合物を使用して発作、痙攣またはてんかんを処置するための指示を備える、キット。
(項目19)
上記化合物が国際公開パンフレット第95/35308号、同第97/22619号、同第99/47545号、または同第01/90063号に開示されるとおりであるかまたは項目8〜11に記載のとおりである、項目15〜17のいずれか1項に記載の薬学的組成物、または項目18に記載のキット。
(項目20)
発作、痙攣またはてんかんの処置において使用するための化合物を同定するためのアッセイであって、該アッセイは、該化合物がICE/カスパーゼ−1を阻害する能力を決定する工程を包含する、アッセイ。
(項目21)
抗発作活性、抗痙攣活性または抗てんかん活性を有するICE/カスパーゼ−1インヒビターを同定するためのアッセイであって、該アッセイは、該ICE/カスパーゼ−1インヒビターが発作、痙攣またはてんかんを阻害する能力を決定する工程を包含する、アッセイ。
(項目22)
上記アッセイが、実質的に本明細書中に記載されるとおりの方法によってなされる、項目20または項目21に記載のアッセイ。
【図面の簡単な説明】
【0009】
【図1】図1は、カイニン酸処置ラットの海馬における、カスパーゼ−1のレベル(ウエスタンブロットによって評価される)に対する化合物1(4μl中の25μg、icv)の効果を示す。海馬内マイクロインジェクションによる40ngでのカイニン酸誘導性のEEG発作の開始90分後に、ラットを屠殺した(図2Aおよび図2Bもまた参照のこと)。
【図2】図2Aおよび図2Bは、化合物1の処置ありまたは処置なしでの、偽性海馬における、カイニン酸誘導性発作の90分後のICE/カスパーゼ−1レベルおよびIL−1βレベルのウエスタンブロット分析の結果を示す。図2Aおよび図2Bは、ウエスタンブロットデータのヒストグラムの表示であり、4匹のラット由来の平均±SEMとして示す。化合物1(25μg/4μL)またはビヒクルを、カイニン酸(40ng)の海馬内への注入の45分前および10分前に脳室内に注入した。化合物1は、成熟形態のカスパーゼ−1および成熟形態のIL−1βの発作誘導性産生をブロックした(図1も参照のこと)。Turkeyの検定により*p<0.05;**p<0.001。実施例1および実施例6を参照のこと。
【発明を実施するための形態】
【0010】
(発明の詳細な説明)
本発明は、発作を処置または予防するために有効な量でICEインヒビターを投与することによって、発作を処置または予防するための方法を提供する。
【0011】
出願人らは、げっ歯類において発作を処置することにICEインヒビターの使用が有効であることを実証している。特に、出願人らは、ICEインヒビターを用いた処置が発作の発現までの時間を増加させ、そして発作に費やされる時間を低下させることを実証した。ICEインヒビター化合物1は、高用量のフェニトインまたはカルバマゼピン(これらは公知の抗痙攣薬化合物である)のいずれかと同程度に有効であった。
【0012】
従って、本発明の1実施形態は、発作を阻害するための治療ストラテジーを提供する。これらの方法は、発作を調節、改善、処置または予防するために使用され得る。これらの方法はまた発作障害の進行および悪化を改善、処置、防止するために使用され得る。このような方法は、例えば、外傷性脳損傷、感染または発熱性の発作事象の後にICEインヒビターを投与して、恒久的な発作障害の重篤度を阻止するかまたは減少させる工程を包含する。
【0013】
本発明の他の実施形態は、てんかん、痙攣および関連障害を制御、改善、処置または予防するための治療ストラテジーを提供する。
【0014】
出願人らはまた、化合物1および化合物2が、腹腔内経路で投与される場合に、発作を阻害することを示した(表3)。
【0015】
ICEインヒビター化合物は、とりわけ慢性関節リウマチ、皮膚科学的炎症疾患および炎症性腸疾患の動物モデルにおける抗炎症活性について公知である(G.Kuら,「Selective Interleukin−1 Converting Enzyme(ICE/Caspase−1)Inhibition With Pralnacasan(HMR 3480/VX−740)Reduces Inflammation and Joint Destruction in Murine Type−II Collagen−induced Arthritis(CIA)」 American College of Rheumatology,San Francisco,November 12−15,2001;G.Kuら 「Interleukin−1β Converting Enzyme(ICE,Caspase−1)Inhibition with VX−765 Reduces Inflammation and Cytokine Levels in Murine Dermatitis and Arthritis Models」International Congress of Immunology,Stockholm,Sweden,July 22−27,2001;G.Kuら「Interleukin−1β Converting Enzyme(ICE,Caspase−1)Inhibition with VX−765 Reduces Inflammation and Cytokine Levels in Murine Oxazolone−induced Dermatitis」The Society for Investigative Dermatology,May 9−12,2001 アブストラクト856;また、本明細書中に記載したICEインヒビターの資料もまた参照のこと。化合物1はまた、慢性関節リウマチの患者において抗炎症活性を有することを実証されている(K.Pavelkaら「Clinical Effects of Pralnacasan (PRAL),an Orally−active Interleukin−1β Converting Enzyme (ICE) Inhibitor,in a 285 Patient PHII Trial in Rheumatoid Arthritis(RA)」American College of Rheumatology 2002 Conference Late−Breaking Abstract,New Orleans,October 25−29,2002)。ICEインヒビターは、発作または発作障害を処置するためには使用されていない。
【0016】
動物およびヒトにおける抗炎症活性を背景とするこれら化合物の薬物動態学は周知である。さらに、出願人らは、これらの化合物が、血中および特定の末梢組織中よりも明らかに低濃度で脳内へと浸透することが観察した。この後者の特性は、いずれの抗痙攣剤の活性にも抗てんかん剤の活性にも必須であり、そしてこの化合物によって達成される脳内濃度は、脳においてICE/カスパーゼ−1を阻害すること、ならびにIL−1β産生およびそれの発作の発症への寄与を阻害することに十分であるかどうかは明らかでない。それにもかかわらず、出願人らは、末梢性に投与される場合に化合物1および化合物2が抗痙攣薬活性を有することを実証した。
【0017】
発作に対するICEインヒビターの有利な効果は、ICEインヒビターの抗炎症活性と直接には関係しない。イブプロフェンは、公知の抗炎症剤であり、出願人らの発作モデルにおいて試験され、腹腔内経路で投与された。イブプロフェンは、ビヒクルと比較して発作活性を増加させる(表4を参照のこと)。ビヒクルと比較して、イブプロフェンはてんかん重積状態である時間を増加させた。従って、このことは、イブプロフェンが発作活性を増加または誘導することを示唆する。
【0018】
本明細書中に提供される実施例は、ヒトのてんかん障害および痙攣障害の良好なモデルとして理解されるげっ歯類の発作モデルを含む。例えば、公知の抗てんかん剤(例えば、カルバマゼピンおよびフェニトキシン)は、ICEインヒビターと同様に、このモデルにおいて抗痙攣活性を示す。
【0019】
本出願人らは、脳室内投与後および腹腔内投与後のこれらの化合物の抗痙攣活性を研究したが、種々の末梢経路(腹腔内、経口および静脈内が挙げられる)によって投与される化合物1および化合物2を用いた先行の実験は、これら化合物がこれらの代替経路によって投与される場合にも抗痙攣活性を有することを示す。好ましい実施形態において、ICEインヒビターは末梢投与される(すなわち、経口または非経口であって、頭蓋内ではない)。
【0020】
本発明は、ICEのインヒビターである化合物の使用を含む。このような化合物は、ICEに対して選択的であり得る。または、このような化合物は、ICEに対して活性であり得、そして別のカスパーゼに対して活性であり得るか、または他のカスパーゼの範囲(例えば、2〜14)に対して活性であり得る。本明細書中に実証されるように、ICEを抑制することおよびIL−1βの産生を抑制することは、上記の任意の一つ以上または全てに挙げられる、発作の発症の時間を遅延させるか、発作の所要時間量を低下させるか、または発作の頻度を低下させる。実施例1および実施例6において得られたデ−タは、化合物1の抗痙攣性用量がICE/カスパーゼ−1の活性化およびIL−1β産生に対して予想される機構に関連した効果を有することを証明する。
【0021】
本発明の方法において、化合物は、ICEを阻害して、これによって発作(または他の関連障害)を処置するのに効果的な量で投与される。発作(または他の関連障害)を処置することとしては、発作の持続期間を減らすこと、発作の重篤度を軽減すること、発作発症の発生率を軽減すること、発作開始を遅延させること、発作の発生を排除すること、が挙げられる。従って、また、本発明によって発作(または他の関連した障害)を防止するための方法が提供され、この方法は発作を防止するために有効量のICEインヒビターを投与することによる。
【0022】
本発明の方法は、動物、好ましくは哺乳動物(ヒトおよびヒト以外の哺乳類を含む)を処置するために用いられ得る。ICEを阻害するいかなる化合物も、本発明の方法および組成物において使用され得る。このような化合物としては、ICEを選択的に阻害する化合物、およびカスパ−ゼまたはICE/CED−3ファミリーの一つ以上の酵素を阻害する化合物が挙げられる。本発明と関係した使用のための化合物は、可逆性様式または不可逆性様式のいずれかでICEの触媒活性を阻害する。
【0023】
本発明の化合物は、ICEを阻害しておよび/またはIL−1レベル(特にIL−1βレベルおよびIL−18レベル)を低下させる。これらの化合物は、例えば、ICEを阻害すること、IL−1βおよび/またはIL−18の産生を阻害すること、IL−1レベルおよび/またはIL−18レベルの調節を阻害すること、ならびに/あるいはIL−1β活性および/またはIL−18活性に影響を及ぼすことについて、アッセイされ得る。これら各々の活性の試験するためのアッセイは、当該分野で公知である(本明細書の実施例、WO95/35308、WO97/22619、WO99/47545またはWO01/90063を参照のこと)。従って、これらの化合物は、本明細書中に記載されるICE媒介性疾患および/またはIL−1媒介性疾患における事象を標的化および阻害し得る。
【0024】
本発明と関連して使用され得る化合物としては、限定はされないが、以下の文書の化合物が挙げられる:WO04/058718、WO04/002961、WO03/088917、WO03/068242、WO03/042169、WO98/16505、WO93/09135、WO03/106460、WO03/103677、WO03/104231、WO02/085899、WO00/55114、WO00/55127、WO00/61542、WO01/05772、WO01/10383、WO01/16093、WO01/42216、WO01/72707、WO01/90070、WO01/94351、WO02/094263、WO02/42278、米国特許第6,184,210号、米国特許第6,184,244号、米国特許第6,187,771号、米国特許第6,197,750号、米国特許第6,242,422号、April 2001 American Chemical Society(ACS)meeting in San Diego、California、USA、WO02/22611、US2002/0058630、WO02/12638、WO95/35308、5,716,929、WO97/22619、米国特許第6,204,261号、WO99/47545、WO01/90063、米国特許公開第2004/0014753号、米国特許公開第2004/0009966号、米国特許公開第2003/0236296号、米国特許第6,693,096号、米国特許第6,610,683号、米国特許第6,531,467号、米国特許第6,528,506号、米国特許第6,200,969号、WO2003/072528、WO2003/032918、WO01/00658、WO98/10778、米国特許第6,716,818号、米国特許第6,620,782号、米国特許第6,566,338号、米国特許第6,495,522号、米国特許第6,355,618号、6,153,591、WO2005/003100、WO2004/002401、WO00/61542、WO00/55114、WO99/47154、米国特許第6,083,981号、米国特許第5,932,549号、米国特許第5,919,790号、米国特許第5,744,451号、WO2002/089749、WO99/36426、WO98/16505、WO98/16504、WO98/16502、米国特許第6,316,415号、米国特許第5,932,549号、米国特許第5,919,790号、米国特許第5,744,451号、EP1082127、EP1049703、EP0932600、EP0932598、WO99/56765、WO93/05071、EP0600880、およびEP1378573(これらは全て、本明細書中で参考として援用される)。本発明における使用のための好ましい化合物としては、WO04/058718、WO04/002961、WO95/35308、WO97/22619、WO99/47545およびWO01/90063の化合物が挙げられる。本発明における使用のための好ましい他の化合物としては、WO95/35308、WO97/22619、WO99/47545およびWO01/90063の化合物が挙げられる。より好ましい化合物は、本明細書中の特許請求の範囲に記載される化合物である。これらの化合物は、熟練した実務家に公知の方法および本明細書において引用される文書中に開示される方法によって、得られ得る。
【0025】
本発明はまた、本明細書中の方法に従って抗発作活性、抗てんかん活性または抗痙攣活性について化合物を試験するためのアッセイを提供する。このような方法は、例えば、発作、痙攣、てんかんまたは関連した障害の処置に有用な化合物を同定する工程を包含し、これは、化合物がICEを阻害する能力および/または発作、痙攣、てんかんまたは関連した障害を阻害する能力を決定する工程を含む。本発明の他の方法は、抗痙攣活性についてICEインヒビターをアッセイする工程を含む。このような方法およびアッセイは、発作、痙攣、てんかんまたは関連した障害の処置における使用のための化合物を同定することに有用である。他の好ましい実施形態において、アッセイは、実質的に本明細書(例えば、実施例1、2または3を参照のこと)に記載されるような方法によってなされ得る。
【0026】
従って、本発明の薬学的組成物および方法は、インビトロまたはインビボでIL−1レベルおよび/またはIL−1活性を制御するのに有用である。このように、本発明の組成物および方法は、インビボでIL−1レベルを制御するため、そして特定の状態(本明細書において述べられるような疾患、障害または効果が挙げられる)の発達、重篤度または効果を処置するかまたは軽減するために有用である。
【0027】
別の実施形態によれば、本発明は、上記のように、本発明の化合物または薬学的に受容可能なその誘導体(例えば塩)、ならびに薬学的に受容可能なキャリア含む組成物を提供する。
【0028】
別の実施形態によれば、本発明の組成物および方法はさらに、別の治療薬を含み得る。このような薬剤としては、発作、痙攣またはてんかんを処置または阻害するための以下の化合物が挙げられるが、これらに限定されない:例えば、バルビツレート(例えば、メフォバルビタール、ペントバルビタール)、ベンゾダイアゼピン(例えば、ロラゼパム、クロナゼパム、クロラゼペート、ジアゼパム)、GABAアナログ(例えば、チアガビン(tiagabin)、ガバペンチン、プレガバリン、ビガバトリン(vigabatrin))、ヒダントイン(例えば、フェニトイン、フォスフェニトイン(fosphenytoin))フェニルトリアジン(例えば、ラモトリジン)、スクシンイミド(例えば、メトスクシミド、エトスクシミド)、または他の種々の化合物(例えば、カルバマゼピン、リルゾール(riluzole)、バルプロアート、ジバルプロックス(divalproex)、フェルバメート(felbamate)、プリミドンまたはトピラメート(topiramate))、抗炎症剤、マトリックスメタロプロテアーゼインヒビター、リポキシゲナーゼインヒビター、サイトカインアンタゴニスト、免疫抑制剤、抗癌剤、抗ウィルス因子、サイトカイン、増殖因子、免疫調節物質(例えば、ブロピリミン(bropirimine)、抗ヒトαインターフェロン抗体、IL−2、GM−CSF、メチオニンエンケファリン、インターフェロンα、ジエチルジチオカルバメート、腫瘍壊死因子、ナルトレキソンおよびrEPO)、プロスタグランジンまたは抗脈管過増殖化合物。
【0029】
用語「薬学的に受容可能なキャリア」とは、本発明の化合物と共に患者に投与され得、そしてその薬理活性を破壊しない無毒性キャリアをいう。
【0030】
これらの組成物において使用され得る、薬学的に受容可能なキャリアとしては、以下が挙げられるが、これらに限定はされない:イオン交換体、アルミナ、ステアリン酸アルミニウム、レシチン、ヒト血清アルブミンのような血清タンパク質、リン酸塩のような緩衝物質、グリシン、ソルビン酸、ソルビン酸カリウム、飽和植物性脂肪酸の部分的なグリセリド混合物、水、塩または電解質(例えば、硫酸プロタミン、リン酸水素二ナトリウム、リン酸水素カリウム、塩化ナトリウム、亜鉛塩、コロイドシリカ、三ケイ酸マグネシウム、ポリビニルピロリドン、セルロースベースの物質、ポリエチレングリコール、ナトリウムカルボキシメチルセルロ−ス、ポリアクリラート、ワックス、ポリエチレン−ポリオキシプロピレン−ブロックポリマー、ポリエチレングリコールおよび羊毛脂。
【0031】
本発明の化合物のみを活性成分として含む薬学的組成物において、これらの組成物を投与する方法は、被験体にさらなる薬剤を投与する工程をさらに含み得る。このような薬剤としては、発作、痙攣またはてんかんを処置または阻害するための以下の化合物が挙げられるが、これらに限定されない:例えばバルビツレート(例えば、メフォバルビタール、ペントバルビタール)、ベンゾダイアゼピン(例えば、ロラゼパム、クロナゼパム、クロラゼペート、ジアゼパム)、GABAアナログ(例えば、チアガビン、ガバペンチン、プレガバリン、ビガバトリン)、ヒダントイン(例えば、フェニトイン、フォスフェニトイン)、フェニルトリアジン(例えば、ラモトリジン)、スクシンイミド(例えば、メトスクシミド、エトスクシミド)、または他の種々の化合物(例えば、カルバマゼピン、リルゾール、バルプロアート、ジバルプロックス、フェルバメート、プリミドンまたはトピラメート)、抗炎症剤、マトリックスメタロプロテアーゼインヒビター、リポキシゲナーゼインヒビター、サイトカインアンタゴニスト、免疫抑制剤、抗癌剤、抗ウィルス剤、サイトカイン、増殖因子、免疫調節物質(例えば、ブロピリミン、抗ヒトαインターフェロン抗体、IL−2、GM−CSF、メチオニンエンケファリン、インターフェロンα、ジエチルジチオカルバメート、腫瘍壊死因子、ナルトレキソンおよびrEPO)、プロスタグランジン、または抗脈管過増殖化合物。第2の薬剤が使用される場合、この第2の薬剤は別々の剤形として、または本発明の化合物または組成物と共に単一の剤形の一部としてのいずれかで投与され得る。
【0032】
上記の組成物に存在する化合物の量は、疾患の重篤度、ICE阻害レベル、IL−1レベル、またはIL−1活性の検出可能な減少を引き起こすのに十分であるべきである。
【0033】
これらの組成物において、本発明の化合物の薬学的に受容可能な塩が利用される場合、これらの塩は好ましくは無機または有機の酸および塩基に由来する。このような酸性塩の中には、以下のものが挙げられる:酢酸塩、アジピン酸塩、アルギン酸塩、アスパルテート、安息香酸塩、ベンゼンスルホン酸塩、重硫酸塩、酪酸塩、クエン酸塩、樟脳酸塩、樟脳スルホン酸塩、シクロペンタンプロピオン酸塩、ジグルコン酸塩、ドデシル硫酸塩、エタンスルホン酸塩、フマル酸塩、グルコヘプタノエート、グリセロリン酸塩、ヘミスルフェート、ヘプタノエート、ヘキサノエート、塩酸塩、臭化水素酸塩、ヨウ化水素塩、2−ヒドロキシエタンスルホン酸塩、乳酸塩、マレイン酸塩、メタンスルホン酸塩、2−ナフタレンスルホン酸塩、ニコチン酸塩、シュウ酸塩、パモエート、ペクチネート、ペルオキソ硫酸塩、3−フェニルプロピオン酸塩、ピクラート、ピバル酸塩、プロピオン酸塩、スクシナート、酒石酸塩、チオシアン酸塩、トシレートおよびウンデカノエート。塩基性塩としては、以下が挙げられる:アンモニウム塩、アルカリ金属塩(例えばナトリウム塩およびカリウム塩)、アルカリ土類金属塩(例えば、カルシウム塩およびマグネシウム塩)、有機塩基との塩(例えば、ジシクロヘキシルアミン塩)、Nメチル−D−グルカミン、アミノ酸(例えば、アルギニン、リシン)との塩、など。
【0034】
また、塩基性窒素含有基は、以下のような因子と四価にされ得る:ハロゲン化低級アルキル(例えば、メチル、エチル、プロピルおよびブチルの塩化物、臭化物およびヨウ化物);硫酸ジアルキル(例えばジメチル、ジエチル、ジブチルおよびジアミルの硫酸塩)、長鎖ハロゲン化物(例えば、デシル、ラウリル、ミリスチルおよびステアリルの、塩化物、臭化物およびヨウ化物);ハロゲン化アラルキル(例えば、ベンジルおよびフェネチルの臭化物およびその他のもの)。このようにして、水溶性製品または油溶性製品または分散可能な製品が得られる。
【0035】
本発明の組成物および方法で利用される化合物は、選択的な生物学的性質を強化するために適切な官能性を付加することにより改変され得る。このような改変は、当該分野で公知であり、そして所定の生物系(例えば、血液、リンパ系または中枢神経系)に生物学的浸透を増加させる改変、経口のアベイラビリティーを増加させる改変、注入による投与を可能にするために溶解性を増加させる改変、代謝を変更する改変、および/または排泄速度を変更する改変が挙げられる。
【0036】
好ましい実施例によれば、本発明の組成物は、被験体(例えば、哺乳類、好ましくはヒト)への薬学的投与のために処方される。
【0037】
本発明のこのような薬学的組成物は、経口で、非経口で、吸入スプレーによって、局所的に、直腸に、鼻腔内で、口腔内で、経膣的に、または移植されたレザバを介して、投与され得る。本明細書で用いられる場合、用語「非経口」としては、皮下の、静脈内、筋肉内の、関節腔内の、滑液包内の、胸骨内の、クモ膜下の、肝臓内、病巣内および頭蓋内の注射技術および注入技術が挙げられる。好ましくは、組成物は経口投与される。
【0038】
本発明の組成物の滅菌注射剤形態は、水性または油性懸濁物であり得る。これらの懸濁物は、適切な分散剤または湿潤剤および懸濁剤を使用して、当該分野で公知の技術に従って処方され得る。滅菌注射用調製物はまた、非経口的に受容可能な無毒性の希釈剤または溶媒中の、滅菌した注射可能の溶液または懸濁物(例えば、1,3−ブタンジオール中の溶液)であり得る。使用され得る受容可能なビヒクルおよび溶媒の中には、水、リンゲル液および等張食塩水がある。さらに、滅菌した不揮発性油は、溶媒または懸濁媒体として慣用的に使用される。この目的のため、任意の無刺激の不揮発性油(合成モノグリセリドまたは合成ジグリセリドが挙げられる)が使用され得る。脂肪酸(例えば、オレイン酸およびそのグリセリド誘導体)は、注射物の調製に有用であり、天然の薬学的に受容可能な油(例えば、オリーブ油およびヒマシ油、特にそれらのポリオキシエチル化形態)である場合に有用である。また、これらの油溶液または懸濁物は、長鎖アルコ−ル希釈剤または分散剤(例えば、エマルジョンおよび懸濁液を含む薬学的に受容可能な剤形の処方物において通常使用される、カルボキシメチルセルロ−スまたは類似の分散剤)を含み得る。薬学的に受容可能な固体、液体または他の剤形の製造において通常使用される、Tween、Spanおよび他の乳化剤またはバイオアベイラビリティー増強剤のような他の一般的に用いられる界面活性剤もまた、処方目的のために使用され得る。
【0039】
固体キャリアが使用される場合、調製物は、粉末形態もしくはペレット形態での硬質ゼラチンカプセル、またはトロ−チ剤もしくはロゼンジの形態に錠剤化、配置され得る。固体キャリアの量は、例えば、約25mg〜400mgまで変動する。液体キャリアが用いられる場合、調製物は、例えば、シロップ、エマルジョン、ソフトゼラチンカプセル、無菌の注射可能な液体(例えば、アンプルまたは非水系の液体懸濁物)の形態であり得る。組成物がカプセルの形態である場合、例えば硬質ゼラチンカプセルシェル中に上述したキャリアを使用して、任意の慣用的なカプセル化法が適切である。
【0040】
シロップ処方物は、矯味矯臭剤または着色料と共に、液体キャリア(例えば、エタノール、グリセリンまたは水)中の化合物の懸濁物または溶液から構成され得る。エアロゾル調製物は、液体キャリア(例えば水、エタノールまたはグリセリン)中の化合物の溶液または懸濁液から構成され得る;一方、粉末乾燥エアロゾルにおいて、調製物は、例えば湿潤剤を含み得る。
【0041】
本発明の処方物は、活性成分を、一つ以上のその成分の受容可能なキャリアおよび必要に応じて他の任意の治療成分と一緒に含む。キャリアは、処方物の他の成分と互換性を持つという意味において「受容可能で」あるべきであり、そしてそれのレシピエントに有害であってはならない。
【0042】
本発明の薬学的組成物は、カプセル、錠剤、および水性懸濁液または水性溶液を含むがこれに限らない、任意の経口受容可能な剤形においても経口投与され得る。経口使用のための錠剤の場合、通常使用されるキャリアとしては、ラクトースおよびコーンスターチが挙げられる。滑沢剤(例えば、ステアリン酸マグネシウム)も、代表的に添加される。カプセル形態での経口投与のために有用な希釈剤としては、ラクトースおよび乾燥コーンスターチが挙げられる。水性懸濁物が経口使用のために必要とされる場合、活性成分は、乳化剤および懸濁剤と混ぜ合わされる。所望される場合、特定の甘味剤、矯味矯臭剤または着色料が添加され得る。
【0043】
あるいは、本発明の薬学的組成物は、直腸の投与のための坐薬の形態で投与され得る。これらは、室温で固体であるが直腸温で液体である適切な非刺激性賦形剤と薬剤とを混ぜ合わせることにより調製され得、これにより直腸で溶けて薬物を放出する。このような物質としては、ココアバタ−、蜜蝋およびポリエチレングリコ−ルが挙げられる。
【0044】
特に、処置標的が局所適用によって容易に接近可能な領域または器官を含む場合(例えば、頭蓋内の手術の間が挙げられる)、本発明の薬学的組成物はまた、局所投与され得る。適切な局所処方物は、これらの適用の各々のために容易に調製される。
【0045】
下部腸管用の局所適用は、直腸坐剤処方物(上記参照)において、または適切な浣腸処方物において達成され得る。局所経皮パッチもまた用いられ得る。
【0046】
局所適用のため、薬学的組成物は、一つ以上のキャリア中に懸濁または溶解された活性成分を含む、適切な軟膏に処方され得る。本発明の化合物の局所投与のためのキャリアとしては、限定はされないが、鉱油、流動パラフィン、白色ワセリン、プロピレングリコ−ル、ポリオキシエチレン、ポリオキシプロピレン化合物、乳化ろうおよび水が挙げられる。あるいは、薬学的組成物は、一つ以上の薬学的に受容可能なキャリア中に懸濁または溶解された活性成分を含む、適切なロ−ション剤またはクリ−ムに処方され得る。適切なキャリアとしては、鉱油、ソルビタンモノステアレート、ポリソルベート60、セチルエステルワックス、セテアリール(cetearyl)アルコール、2−オクチルドデカノール、ベンジルアルコールおよび水が挙げられるが、これらに限定されない。
【0047】
眼の使用のため、薬学的組成物は、等張のpH調整された滅菌食塩水中の超微粉砕された懸濁物として、または好ましくは等張のpH調整された食塩水中の溶液として、防腐剤(例えば塩化ベンザルコニウム)を含むかまたは含まずに、処方され得る。あるいは、眼の使用のため、薬学的組成物は、軟膏(例えばワセリン)に処方され得る。一実施形態において、組成物は、本明細書において処方されるとおりである。他の眼科用調製物は、例えば、米国特許第6,645,994号および/または米国特許第6,630,473号に見出され得る。
【0048】
本発明の薬学的組成物はまた、鼻エアロゾルまたは吸入により投与され得る。このような組成物は、薬学的処方物の分野で公知の技術に従って調製され、そして食塩水の溶液として、ベンジルアルコ−ルまたは他の適切な防腐剤、バイオアベイラビリティーを強化する吸収促進剤、フッ化炭化水素および/または当該分野において公知の他の従来の可溶化剤または分散剤を使用して、調製され得る。
【0049】
薬学的に受容可能なキャリアまたは希釈剤の形態および特徴は、それが合わされるべき活性成分の量、投与経路および他の周知の変数により指示されることが、当業者により認識される。
【0050】
上記の化合物および組成物はまた、発作または痙攣に関連する特定の疾患に関する治療適用に有用である。
【0051】
本発明の化合物はIL−1βおよび/またはIL−18の放出を阻害し得、これによって本明細書に述べられるような特定の疾患のいくつかの病態生理学作用を阻害するかまたはブロックすることに有用であり得る。
【0052】
本発明はまた、(1)細胞からのIL−1放出を阻害すること、および/または(2)ヒトを含む哺乳類のIL−1の極端に高い組織レベルの厄介な作用、毒性作用または致死作用を防止すること、による特定の疾患を処置するための治療方法に関する。この方法には、一つ以上のICE/CED−3インヒビターの有効なICE阻害量を哺乳類に投与する工程を包含する。この方法はまた、治療可能な(amenable)特定の疾患(発作、痙攣、てんかんまたは関連した障害が挙げられる)の予防処置または防止のために使用され得る。本発明は、この種の化合物の有効量を、これを必要とする哺乳動物(ヒトを含む)に投与することによって、これらの障害を処置するための方法を提供する。
【0053】
化合物は、ICEを阻害して、IL−1の放出を妨害するかまたはIL−1レベルおよびIL−1活性を減少させることによって、そしてこれらの状況の各々における過剰なレベルのIL−1の病態生理学的作用を阻害することによって、特定の疾患の停止または消散を直接的に促進し、そして通常機能の回復を促進する。併せると、これらの作用は、発作および関連した障害を処置する際のそれら化合物の新規な使用を関連させる。
【0054】
ICE阻害は、当該分野において公知の方法、および本明細書でより完全に記載されるような方法によって、測定され得る。
【0055】
化合物は、単核細胞、マクロファージ、神経細胞、内皮細胞、表皮細胞、間葉系細胞(例えば:線維芽細胞、骨格の筋細胞、平滑筋筋細胞、心臓筋細胞)および他の多くの型の細胞によるIL−1放出の開始(release)を阻害するのに有用であり得る。
【0056】
用語「状態(condition)」または「状態(state)」は、被験体において有害な生物学的結果をもたらす任意の疾患、障害または効果をいう。
【0057】
本明細書で用いられる場合、用語「発作」は、一般的に、生体の全部または一部にわたる筋肉の突発的かつ不随意な収縮をいい、この収縮は中枢神経系のニューロンのサブセットの異常な興奮によって引き起こされる。発作は、てんかんの症状である。発作の運動性の徴候は、脳電図(EEG)の変化を伴う。これらの変化は、明らかな運動性の徴候がない場合も起り得る。
【0058】
患者または細胞培養物(すなわち、細胞または細胞培地)の血液または細胞の中のIL−1タンパク質レベルは、例えば、IL−1への免疫特異的結合、または活性IL−1の存在の結果として産生されることが公知の他のタンパク質への免疫特異的結合についてアッセイすることによって決定されることができる。このような方法は、当該分野で公知である。例えば、使用され得るイムノアッセイとしては、標識抗体を用いて、以下が挙げられるが、これに限定されるものではない:競合的アッセイ系および非競合アッセイ系、ウエスタンブロット、ラジオイムノアッセイ、ELISA(酵素結合免疫吸着検定法)、「サンドイッチ」イムノアッセイ、免疫沈降アッセイ、沈降素(precipitin)反応、ゲル内拡散沈降素反応、免疫拡散アッセイ、凝集反応アッセイ、補体結合アッセイ、免疫放射線測定法、蛍光免疫法、プロテインAイムノアッセイおよびFACS分析。このようなアッセイは、当該分野で周知である(例えば、Ausubelら編、1994、Current Protocols in Molecular Biology、第1巻、John Wiely&Sons(New York)(これは、その全体が参考として本明細書中に援用される)。
【0059】
競合結合アッセイはまた、IL−1のレベルを決定するために使用され得る。競合結合アッセイの1つの例はラジオイムノアッセイであり、これは、漸増量の非標識IL−1の存在下での、IL−1を発現している細胞からの標識された(例えば、3Hまたは125I)タンパク質とIL−1抗体とのインキュベーション、および標識されたIL−1と結合したIL−1抗体の検出を含む。特定の抗原に対する目的の抗体のアフィニティーおよび解離速度は、スキャッチャードプロット分析によって、データから決定され得る。二次抗体との競合はまた、ラジオイムノアッセイを使用して決定され得る。この場合、抗原は、漸増量の非標識二次抗体の存在下で、標識された(例えば、3Hまたは125I)化合物に結合した目的の抗体と共にインキュベートされる。
【0060】
IL−1レベルはまた、活性によりアッセイされ得、例えば、IL−1または増殖因子のようなサイトカインの生物活性レベルを検出し得る細胞株によりIL−1レベルがアッセイされ得る。一実施形態によれば、生物学的サンプル中の生物活性のIL−1のレベルは、イソプロピル−b−D−チオガラクトピラノシドと共に、遺伝子操作された細胞株をインキュベートすることによって、検出される。細胞株は試験されるべきサンプルと共にインキュベートされ、そして細胞株における細胞死は青色の強度(これは、試験されるサンプルの生物活性サイトカインまたは増殖因子を示す)を決定することによって、モニタリングされる。また、患者の血清のIL−1活性アッセイについては、例えば、Burns(1994)20(l)40−44を参照のこと。
【0061】
1日あたり体重1kgあたり約0.01mg〜100mgの間の活性成分化合物の投薬レベル、好ましくは1日あたり体重1kgあたり約0.5mg〜約75mgの間の活性成分化合物の投薬レベル、そして最も好ましくは1日あたり体重1kgあたり約1mg〜約50mgの間の活性成分化合物の投薬レベルは、単独療法に有用である。約50mg/kg〜約200mg/kgの投薬量がテストされ、効果的であると見出された(本明細書中の実施例を参照のこと)。頭蓋内投与のため、1ng〜1gの間の活性成分化合物の投薬レベル、好ましくは100ng〜100mgの間の活性成分化合物の投薬レベルが有用である。
【0062】
代表的に、本発明の薬学的組成物は、1日につき約1〜5回、あるいは持続性注入として投与される。このような投与は、長期的な治療法または急性の治療法として使用され得る。単一の剤形を製造するためキャリア物質と組み合わされ得る活性成分の量は、処置される宿主、または特定の投与様式に依存して変動する。代表的な調製物は、約5%〜約95%の活性化合物(w/w)を含む。好ましくは、このような調製物は、約20%〜約80%の活性化合物を含む。
【0063】
本発明の組成物が、本発明の化合物および一つ以上の付加的な治療薬の組合せを含む場合、その化合物および付加的な薬剤の両方は、単独療法レジメンにおける通常投与される投薬量の約10%〜約80%の間の投薬レベルで存在するべきである。
【0064】
必要に応じて、患者の状態の改善の際、本発明の化合物、組成物または組合せの維持用量が、投与され得る。その後、その改善された状態が保持されるレベルに、症状の関数として、投薬量または投与頻度が、あるいはその両方とも、軽減され得る。症状が所望のレベルに緩和される場合、処置を中止することが可能であり得る。しかしながら、患者は、いかなる再発徴候または疾患徴候に対する長期ベースの断続的な処置を必要とし得る。
【0065】
いかなる特定の患者のための特定の投薬量および処置レジメンが様々な要因(使用される特定の化合物の活性、年齢、体重、一般的健康、性別、食事、投与時間、排泄速度、薬物の組み合わせおよび処置医師の判断および処置されている特定の疾患の重篤度が挙げられる)に依存することもまた理解されるべきである。活性成分の量は、組成物中の、特定の化合物および存在する場合、他の治療薬にも依存する。
【0066】
従って、被験体において本発明の疾患を処置または予防するための方法は、本明細書中に記載される任意の化合物、薬学的組成物または組合せを被験体に投与する工程を含む。
【0067】
好ましい実施形態において、本発明は、上述した疾患のうちの1つを有する哺乳動物を処置する方法を提供し、この方法は、上記の薬学的に受容可能な組成物をその哺乳動物に投与する工程を含む。この実施形態において、患者はまた他の治療薬を投与される場合、その治療薬は、単一の剤形または別々の剤形として、本発明の化合物と共に送達され得る。別々の剤形として投与される場合、他の治療薬は、本発明の化合物を含む薬学的に受容可能な組成物の投与の前に、その投与と同時に、またはその投与の後に投与され得る。
【0068】
本発明に従って疾患を処置するための化合物または組成物を同定するための方法は、複数の化合物または組成物が、特定の疾患の作用を改善する能力および/または本発明の特定の疾患を有する患者の状態を改善する能力について、それらの化合物または組成物をスクリーニングするための方法を含む。本発明の1実施形態に従って、ハイスループットのスクリーニングは、マイクロタイタープレートの複数のウェルの培養物中に細胞を有すること、異なる化合物または組成物を各々のウェルに加えること、ならびに各々の細胞培養物中のICE阻害レベルおよび/または活性、ならびにIL−1レベルおよび/または活性を、コントロールウェルの細胞培養物中に存在するレベルまたは活性と比較することによって、達成され得る。この発明に従う比較工程に有用なコントロールとしては、化合物または組成物により処置されていない細胞または被験体、およびICE阻害またはICE活性に効果のないことが公知である化合物または組成物により処置されている細胞または被験体、が挙げられる。本発明の一実施形態に従い、ハイスループットスクリーニングは、細胞をプレートに添加すること〜化合物または組成物の添加の後のデータの収集および分析までを含む工程が機械により行われるように、自動化される。本発明の比較工程において有用な機器(例えば、標識された対象(例えば、放射性標識された対象、蛍光性の対象、または着色された対象)またはそれ自身検出可能である対象を検出し得る機器)は、市販されており、そして/または、当該分野で公知である。従って、本明細書中に開示される特定の疾患を処置するために有用である、この発明に従う化合物および組成物は、迅速かつ効率よくスクリーニングされ得る。
【0069】
本明細書中に開示される全ての出願、特許および参考文献は、参考として援用される。本発明がより完全に理解されるため、以下の調製実施例および試験実施例が記載される。これらの例は、例示目的のためのみであり、本発明の範囲をいかようにも限定しないものとして解釈されるべきである。
【実施例】
【0070】
実施例1
雄性の成体Sprague−Dawleyラットの発作の実験モデルを、長期的に(chronically)埋没されたカニューレおよび電極を用いた、自由に移動可能なラットの背側海馬における、カイニン酸(0.5μl中の40ng)の一側性のマイクロインジェクションにより誘導した。簡潔には、動物を、Equithesin(1%のフェノバルビタールおよび4%の抱水クロラール;3ml/kg、腹腔内注射)を使用して深麻酔した。双極性のニクロム線絶縁電極(60μm)を、背側海馬の歯状回(中隔極)に両側性に埋没し、そしてガイドカニューレ(22ゲージ)を、硬膜の頂部に一側性に配置し、そしてカイニン酸の海馬内注入のための深部電極のうちの1つに接着した。海馬の電極の移植に関するブレグマからの座標は、(ミリメ−トル単位:鼻棒(nose bar)−2.5、AP−3.5、L±2.4、および硬膜の下で3)であった。
【0071】
化合物の脳室内注入のため、さらなるガイドカニューレを、硬膜の頂部に一側性に配置した(ミリメートル単位、鼻棒−2.5;AP−1;L+1.5)。鼻の洞にまたがってアース線を配置し、そして頭頂葉皮質にまたがって2本のネジ電極を両側性に配置した。電極をマルチピンソケット(March Electronics、NY)に接続し、アクリル歯科用セメントによって注入カニューレと一緒に頭蓋に固定した。
【0072】
化合物1(25μg/4μl)または等量のビヒクルを脳室内注入により投与した。以下のパラメ−タに基づいたEEG分析によって、発作を記録し、定量化した:1)初回の発作エピソードの開始までの時間、2)3時間の記録の間の発作のエピソードの数、および3)各々の発作事象の持続期間を合計することによって計算した発作活動の所要時間。化合物1処置は、痙攣の発症までの潜伏期(latency)を大いに増加させ、発作のエピソードの数および全体の発作活動の所要時間を減らした(表1)。
【0073】
ICE/カスパーゼ−1の活性化に対する化合物1の効果を、これらのラットからのサンプルのウエスタンブロットにより検出される活性20kDサブユニットの量に基づいて評価した。図1は、化合物1の処置がカイニン酸発作により誘導されるカスパーゼ−1 20kDサブユニットの増加を打ち消すだけでなく、このサブユニットを極めて低いレベルに引き下げたことを示す。プロ−カスパーゼ−1の不活性45kDサブユニットのレベルは、カイニン酸によっても化合物1によって変わらなかった。
【0074】
表1:ラットに、左の海馬の0.5μlカイニン酸の40ngの注入の45分前および10分前に脳室内に(icv)化合物1(25μg/4μl)を投与した。コントロール(ビヒクル)に、食塩水中の20%のCremophorを投与した。
【0075】
【表1】

**スチューデントのt検定によりビヒクルに対してp<0.01。
【0076】
実施例2
ラットにおける発作の実験モデルを、長期埋没されたカニュ−レを使用して、自由に移動可能なラットの背側海馬においてカイニン酸(0.5μL中40ng)の一側性のマイクロインジェクションにより誘導した。カイニン酸の45分前および10分前に、化合物1(30mg/kg)またはビヒクルを腹腔内注射により投与した。長期埋没された海馬電極を使用して、EEG発作を記録した。以下のパラメ−タに基づいたEEG分析によって、発作の活動および発作間のてんかんの活動を定量化した:1)初回の発作のエピソードの開始までの時間、2)3時間の記録の間の発作のエピソードの数、および3)各々の発作事象の持続期間を合計することによって計算した発作活動の所要時間。化合物1の処置は、痙攣の発症までの潜伏期を大いに増加させ、発作活動の総所要時間を約30%減らした(しかし、この差異は統計学上の有意差には到らなかった)(表2)。これらのデ−タは、より高用量がより大きくかつ統計学的に有意な効果を生じるのに効果的であることを示唆する。より高用量の化合物2が統計学的に有意の効果を生じた実施例4を参照のこと。
【0077】
表2.左海馬における0.5μlのカイニン酸の40ngの適用の45分前および10分前に、ラットに化合物1(30mg/kg)を腹腔内投与した。コントロール動物(ビヒクル)に、食塩水中の20%のCremophorを投与した。
【0078】
【表2】

*スチューデントのt検定によりビヒクルに対してp<0.01。
【0079】
実施例3
(ICE阻害)
当該分野で公知の方法によって、ICEを阻害するそれらの能力について化合物を試験し得る(図2−4に記載される文書を参照のこと)。
【0080】
実施例4
EEG発作を、長期埋没されたカニュ−レを使用する40ngのカイニン酸(KA)の海馬内注入によって、成体雄性Sprague−Dawleyラットにおいて誘導した。長期埋没した海馬の電極を使用して、EEG発作を記録した。以下のパラメ−タに基づいたEEG分析によって、発作および発作間のてんかんの活動を定量化した:1)初回の発作のエピソードの開始までの時間、2)3時間の記録の間の発作のエピソードの数、および3)各々の発作事象の持続期間を合計することによって計算した発作活動の所要時間。化合物2またはそのビヒクルを、連続3日(50mg/kg〜200mg/kg)間、腹腔内注射した。4日目、ラットに、0.5μl中40ngのカイニン酸の海馬内注入の45分前および10分前に、化合物2を投与した。
【0081】
表3.ラットにおけるカイニン誘導性発作に対する化合物2の効果
【0082】
【表3】

データは、平均±SE(N=7〜15匹のラット)
**一方向ANOVA、その後のDunnett検定によりビヒクルに対してp<0.01。
【0083】
実施例5
発作に対するイブプロフェンの効果をまた、実施例4に記載されている方法を使用して試験した。ラットに、0.5μl中40μgのカイニン酸の一側性の海馬内注入の60分前に、イブプロフェン(50mg/kg、腹腔内)を投与した。コントロール(ビヒクル)に、食塩水を投与した。*スチュ−デントのt検定によりビヒクルに対してp<0.05。発作をEEGにより分析し、定量化した。てんかん重積状態は、連続的に30分より長く持続する連続発作活動を表す。
【0084】
【表4】

【0085】
【表5】

【0086】
実施例6
また、カイニン酸により誘導されたIL−1β産生に対する化合物1の効果を実施例1にて説明したように研究した。ICE/カスパーゼ−1活性化のように、IL−1β産生を、海馬内カイニン酸(40ng)マイクロインジェクションの90分後にラットから得た海馬のホモジェネートのウエスタンブロット分析により評価した。海馬のホモジェネ−トからの総タンパク(170μg)を、10% アクリルアミドのSDS PAGEを使用して分離し、そしてエレクトロブロッティングによって、Hybondニトロセルロ−ス膜に移した。ICE/カスパーゼ−1およびIL−1βの免疫反応性を、選択的な抗体を使用して評価し、そして強化された化学発光により検出した。海馬内カイニン酸注入は、ICE/カスパーゼ−1の活性20kDサブユニットの形成および活性17kD IL−1βの形成を誘導した。化合物1(25μg/4μLで脳室内に注入した)は、ICE/カスパーゼ−1の活性20kDサブユニットの形成の打ち消しによって明らかにされるように、ICE/カスパーゼ−1の活性化を阻害し、そしてまた成熟した活性17kD IL−1βの形成を低減した(カスパーゼ−1のデータに関して図1および図2Aを、そしてIL−1βのデータに関して図2Bを参照のこと)。
【0087】
実施例7
(錠剤の形成)
化合物2を、以下および実施例6に記載されるように、経口投与のために処方し得る。錠剤につき300mgの化合物2を提供するため、薬物製品を処方した。
【0088】
【表6】

【0089】
【表7】

本明細書において、引用される全ての文書は、本明細書により参考として援用される。
【0090】
本発明の多くの実施形態が記載されたが、基本的な実施例を変更して、本発明の化合物および方法を利用する他の実施形態を提供し得る。従って、本発明の範囲は、例として示された特定の実施形態よりもむしろ添付の請求の範囲により定義されるべきであることであることが理解される。
【特許請求の範囲】
【請求項1】
本明細書に記載の方法。
【請求項1】
本明細書に記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開2011−213741(P2011−213741A)
【公開日】平成23年10月27日(2011.10.27)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−169647(P2011−169647)
【出願日】平成23年8月2日(2011.8.2)
【分割の表示】特願2007−513479(P2007−513479)の分割
【原出願日】平成17年5月16日(2005.5.16)
【出願人】(598032106)バーテックス ファーマシューティカルズ インコーポレイテッド (414)
【氏名又は名称原語表記】VERTEX PHARMACEUTICALS INCORPORATED
【住所又は居所原語表記】130 Waverly Street, Camridge, Massachusetts 02139−4242, U.S.A.
【Fターム(参考)】
【公開日】平成23年10月27日(2011.10.27)
【国際特許分類】
【出願番号】特願2011−169647(P2011−169647)
【出願日】平成23年8月2日(2011.8.2)
【分割の表示】特願2007−513479(P2007−513479)の分割
【原出願日】平成17年5月16日(2005.5.16)
【出願人】(598032106)バーテックス ファーマシューティカルズ インコーポレイテッド (414)
【氏名又は名称原語表記】VERTEX PHARMACEUTICALS INCORPORATED
【住所又は居所原語表記】130 Waverly Street, Camridge, Massachusetts 02139−4242, U.S.A.
【Fターム(参考)】
[ Back to top ]

