IGF−1分泌促進剤
【課題】発芽玄米に含有されるステロール配糖体に着目し、その新しい作用機序について、明らかにする。
【解決手段】発芽玄米由来のステロール配糖体を有効成分とするIGF−1分泌促進剤。
【解決手段】発芽玄米由来のステロール配糖体を有効成分とするIGF−1分泌促進剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、糖尿病病態改善及び膵臓細胞保護効果を有する安全なIGF−1分泌促進剤に関する。
【背景技術】
【0002】
戦前、戦後の貧しい食事パターンの時代は、主要な死因は感染症や脳卒中であったが、経済の高度成長期を境に食が豊かになると、総摂取エネルギーに対する脂質エネルギー比率が高くなり、動物性脂質摂取やリノール酸の摂取増加、身体活動量の低下を背景として、内臓脂肪型肥満を基礎とした代謝障害が増加し、主要な死因は悪性新生物、心血管疾患や脳血管疾患が上位を占める構造に変化した。
【0003】
生活習慣病として代表的な糖尿病は先進諸国をはじめとして、世界的に増加している。世界保健機関(WHO)によると、世界には少なくとも 1億7,100万人の糖尿病患者がいるとされ、2030年までにこの数は世界で3億6,600万人が糖尿病を罹患すると推定されている。特に、もっとも増加率の高い地域はアジアとアフリカになるとみられている。発展途上国の糖尿病は、都市化とライフスタイルの変化にともなって増加する傾向があり、食生活の高タンパク質で脂肪の多い欧米化と関連している可能性がある。
内臓脂肪に起因するインスリン抵抗性の増大は、膵臓からのインスリン分泌に負荷をかけ、やがては膵β細胞を疲弊、死滅させ、インスリン分泌の低下をもたらす。インスリン分泌低下により血糖の制御ができなくなり糖尿病が重症化すると、神経障害、網膜症、腎症などの治療が困難な合併症を併発し、最悪の場合は、重い障害を残したり、死亡したりする結果にも繋がることから、早期の予防策が希求されている。
【0004】
IGF−1は中枢神経疾患(アルツハイマー病などの認知症など)、心血管系疾患(心筋梗塞、脳梗塞、高血圧など)、代謝異常疾患(肥満、糖尿病、脂質異常症など)、消化器・内臓疾患(潰瘍、肝機能低下など)、運動器疾患(関節リウマチ、関節炎など)、皮膚化領域疾患(皮膚老化、脱毛など)、免疫賦活作用(NK細胞活性化など)など、多岐に渡り関与することが知られている。例えば、インスリン様成長因子(IGF−I)のレベル上昇による内臓脂肪の低下方法のようにIGF−1のレベルを高める技術(特許文献1)をはじめ、抗老化や疾病予防、治療などへの応用としてのIGF−1の利用が注目されている。
【0005】
ヒトや動物(ウシや豚など)由来や人工的に合成されたIGF−1そのものを経口投与することは、ポリペプチドであるIGF−1の特性から困難であり、注射剤として使用されている。しかしながら、注射剤の場合は、医師の監視下で行われるため、汎用性のある手段とはいえず、製剤に混入する不純物によっては副作用をきたす可能性がある。さらに糖尿病の罹患により肝臓がんやすい臓がんの発症リスクが糖尿病非罹患者よりも高まるという疫学調査の結果から、その病因とIGF−1との関連も示唆されていることから、人為的にIGF−1を投与するような利用法には問題があった。
【0006】
安全性を重視して、生体が本来もっている機能を賦活化してIGF−1レベルを高める技術が公開されている。具体的なIGF−1の有用性に関連した先行技術は、例えば、糖尿病に有効な組成物として食品たんぱく質を利用し、生体内でIGF−1を誘導する技術(特許文献2)、同じく食品たんぱく質を利用するものとして、加齢に伴う諸症状(肌荒れ、肌艶、肌の張りの低下、しみ、そばかすの増加、気力の低下など)の緩和としてサケの卵巣膜をプロテアーゼ処理し抽出したIGF−1値上昇剤(特許文献3)、肌荒れ改良剤(特許文献4)、末梢血液循環を改善する加速度脈波加齢指数上昇剤(特許文献5)がある。また、カルシトニン遺伝子関連ペプチドを介してIGF−1を誘導するカルシトニン遺伝子関連ペプチド産生及び放出促進作用を有する胃粘膜傷害予防・治療用可食性組成物および育毛用可食性組成物(特許文献6)、育毛や美容効果を持った植物由来の苦味配糖体ゲンチオピクリンを含んだIGF−1産生促進剤(特許文献7)、老化による皮膚のしわ、たるみを軽減するα-D-グルコピラノシルグリセロールを含有するIGF−1産生促進剤(特許文献8)が公知となっている。
【0007】
しかしながら、食品たんぱく質をベースとしたものや苦味配糖体、イソフラボノイド類、カプサイシンなどIGF−1産生を促進する従来技術は、におい、苦味、辛味、渋みなどの特徴から利用を継続するにはなお課題を残していた。
また、IGF−1を産生促進するために多量の炭酸ガスナノバブルを発生させる技術として、血流量およびインスリン様成長因子増加装置、並びに血流量およびインスリン様成長因子増加方法(特許文献9)が公知となっているが、コストの面から、汎用性に問題がある。
【0008】
本出願人、本発明者等は、発芽玄米に着目して、研究開発を続けており、発芽玄米そのものの開発及び発芽玄米に含まれている成分の機能に関する発明など多数の提案をしている。
機能成分に着目した提案として、例えば、特許文献10(特開2008−266326号公報)は、発芽玄米全脂質画分を有効成分とする神経障害若しくは糖尿病性神経障害予防若しくは改善剤を提案している。
特許文献11(特開2006−316018号公報)は、発芽玄米の糠から抽出したアリラトースBを含有するグルココルチコイド受容体拮抗剤、アドレナリンβ3受容体作動剤が提案されている。
特許文献12(特開2006−316016号公報)は、発芽玄米の糠から抽出した特定の化学構造のリゾホスファチジルコリンを含有するインスリン受容体作動剤が提案されている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特表2007−502834号公報
【特許文献2】特許3137273号公報
【特許文献3】特許3946238号公報
【特許文献4】特許3899116号公報
【特許文献5】特許3946239号公報
【特許文献6】特許4213617号公報
【特許文献7】特開2009−196989号公報
【特許文献8】特開2009−161475号公報
【特許文献9】特開2008−214207号公報
【特許文献10】特開2008−266326号公報
【特許文献11】特開2006−316018号公報
【特許文献12】特開2006−316016号公報
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明者は、発芽玄米に含有されるステロール配糖体に着目し、その新しい作用機序について、明らかにすることを本発明の課題とする。特に、糖尿病病態改善及び膵臓細胞保護効果を有する安全なIGF−1分泌促進剤を提供することを課題とする。
【課題を解決するための手段】
【0011】
すなわち、本発明の主な構成は、次のとおりである。
1.発芽玄米由来のステロール配糖体を有効成分とするIGF−1分泌促進剤。
2.発芽玄米由来のステロール配糖体が、発芽玄米糠由来のステロールであることを特徴とする1.記載のIGF−1分泌促進剤。
3.1.又は2.に記載されたIGF−1分泌促進剤を含有する飲食品。
4.1.又は2.に記載されたIGF−1分泌促進剤を含有するペットフード。
【発明の効果】
【0012】
本発明は、発芽玄米由来のステロール配糖体にIGF−1を増加させ、糖尿病、特に膵臓が傷害された糖尿病の病態改善効果及び膵β細胞の保護作用があることを明らかにした。さらにin vivo試験において膵臓ランゲルハンス島β細胞が保護されており、その結果インスリン分泌が改善、血糖値上昇が抑制されていることが明らかとなった。
特に、発芽玄米由来のステロール配糖体は、発芽玄米の糠の部分より抽出して利用することができる。
この発芽玄米由来のステロール配糖体を医薬、飲食品等の形態で摂取することにより、糖尿病を改善し、治療の困難な合併症の予防を図ることができる。これは、ペット用としても活用できる。また、発芽玄米由来であるので、安全性が高く、風味にも問題ないことから、IGF−1増加作用を奏することで、膵β細胞保護作用を高め、糖尿病合併症予防に効果を発揮できる。
【図面の簡単な説明】
【0013】
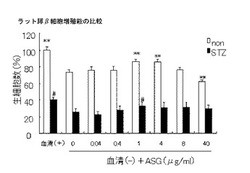
【図1】膵β細胞保護作用(細胞生存率)を示すグラフ。
【図2】膵β細胞のIGF−1のmRNA発現量増加を示す図。
【図3】膵β細胞のIGF−1分泌促進を示す図。
【図4】肥満モデルマウスでのIGF-1分泌促進を示す図。
【図5】糖尿病モデルマウスを用いた血糖値の測定結果を示すグラフ。
【図6】糖尿病モデルマウスを用いた血中インスリン値を示すグラフ。
【発明を実施するための形態】
【0014】
本発明に使用する発芽玄米由来ステロール配糖体画分(以下「ステロール配糖体画分」と称する場合がある)は、発芽玄米から得た糠をヘキサンで中性脂質を除去し、得られた残渣をさらに有機溶媒にて抽出した総脂質画分に含まれ、高速液体クロマトグラフィー(HPLC)で分離・濃縮することが出来る。
本発明は、この発芽玄米由来のステロール配糖体を有効成分とするIGF-1分泌促進剤である。摂取方法は、経口、注射により行うことができ、医薬、飲食品、食品添加剤、ペット用の医薬剤、ペット用飼料の添加剤として活用することができる。通常食用にしている発芽玄米由来の成分であるので、安全性が高い。
ステロール配糖体は、発芽玄米の糠成分から極微量抽出される成分であるので、ステロール配糖体を医薬あるいは飲食品、ペット用医薬や飼料に応用する場合は、抽出されたステロール配糖体そのものを使用するのであって、発芽玄米そのものあるいは発芽玄米の粉末などステロール配糖体 を抽出する前の状態で使用することは想定されていない。
【0015】
本発明は、IGF−1分泌促進のための食品添加物、食品およびペットフード、動物用医薬として利用することができる。剤型は、公知の方法により助剤とともに任意の形態に製剤化して、経口投与することができる。カプセル剤又は錠剤、顆粒剤、細粒剤、散剤、液状として投与できる。
投与量は、投与方法と、患者の年齢、病状や一般状態等によって変化し得るが、動物試験の結果より成人では体重1kg当たり通常、1日当たりの有効成分として0.4〜600mgが妥当である。
【0016】
本発明のIGF−1分泌促進剤は、一般食品や健康食品に配合することができ、また、食品添加物の成分とすることもできる。配合する食品は特に限定されず、例えば食パン、菓子パン、パイ、デニッシュ、ドーナツ、ケーキ等のベーカリー食品、うどん、そば、中華麺、焼きそば、パスタ等の麺類、天ぷら、コロッケ等のフライ類、カレー、シチュー、ドレッシング等のソース類、ふりかけ類、かまぼこ等の練り製品、ジュース等の飲料、スナック菓子、米菓、飴、ガム等の菓子類を挙げることができる。
ペットには、犬、猫、ハムスター、リス等の哺乳類の飼料として適している。本発明のペットフードの形態は特に限定されるものではなく、例えばドライタイプ、ウェットタイプ、セミモイストタイプ、ビスケットタイプ、ソーセージタイプ、ジャーキータイプ、粉末、顆粒、カプセルなどが挙げられる。
【0017】
<発芽玄米由来のステロール配糖体>
1.糠成分を採取する発芽玄米は、公知の方法により調製することができる。本出願人は、発芽玄米について多数の提案をしており、例えば、特許第3423927号公報、特許第3611804号公報、特許第3738025号公報等に開示された発芽玄米の製法によって得ることができる。
試験に用いたステロール配糖体画分の抽出は発芽玄米約2,000kgを搗精して得られた糠200kg(搗精度10%)を用いて行った。
【0018】
2.本出願人は、先に、発芽玄米から抽出したステロール配糖体を国際公開(WO2009/110612)として提案した。本願発明で使用するステロール配糖体画分は、このステロール配糖体を含んでいることが判明している。このステロール配糖体画分は、IGF−1を増加させ、糖尿病、すい臓が傷害された糖尿病の病態改善効果及び膵臓細胞の保護作用があることを解明した。
【0019】
[ラット膵β細胞株INS−1細胞を用いた評価]
膵臓細胞保護作用を明らかにするため、無血清で培養したラット膵β細胞株INS−1細
胞の細胞増殖能とSTZ処理による機能障害について、ステロール配糖体の効果を検討した。無血清培養下におけるINS−1細胞におけるIGF−1 mRNA誘導効果およびIGF−1分泌能を確認した。
【0020】
[肥満モデルマウスを用いた評価]
特許第3738025号公報の技術によって得られた発芽玄米から抽出したステロール配糖体画分をステロール配糖体の供給源として飼料に混ぜて高脂肪食誘導肥満モデルマウスに摂取させ、高脂肪食により惹起される高血糖に対する改善能および肥満マウスに対するIGF-1分泌誘導能を確認した。
【0021】
<ステロール配糖体画分の調製例>
発芽玄米糠をヘキサンで脂質成分中の中性脂質を除去後、それぞれの残渣につき、ヘキサン、クロロホルム及びメタノールを用いてステロール配糖体の粗抽出液を調製した。このステロール配糖体抽出液からクロロホルム:メタノール(2:1)混合液で抽出し、シリカゲル担体カラムクロマトグラフィーによって、ステロール配糖体画分の調製を行った。試験に用いたステロール配糖体画分の抽出は発芽玄米約2,000kgを搗精して得られた糠200kg(搗精度10%)を用いて行った。
米糠(500g)が浸る量のヘキサンを加え十分に撹拌した後ガーゼでろ過を行い、脱脂糠を得た。その後、ヘキサンを揮発させた脱脂糠を1.5 kgに対してクロロホルム:メタノール2:1を(3L)加えて総脂質画分(TL)を抽出し、抽出液をエバポレーターで乾固させ乾固物(ステロール配糖体画分)を得た。
【0022】
乾固物は300mlのクロロホルム:ヘキサン=1:1に溶解し、クロロホルムで膨潤させた直径 10cm×長さ 100cm (メルク社製シリカゲル60を80cm充填)のカラムに全溶解液をアプライした。溶液がイアトロビーズに全てしみ込んだ後、クロロホルム:ヘキサン=1:1(7,840ml)、クロロホルム(20,160ml)、クロロホルム:メタノール=9:1(10,080ml)の順でそれぞれを通液した。クロロホルム:メタノール=9:1の通液により分離した暗緑色の溶液だけを全て採取した。採取した暗緑色の溶液はエバポレーターで乾固させ試験に供した。以下に各ポイントでの収量を示す。
【0023】
【表1】

【0024】
[ASG分析]
抽出したステロール配糖体画分の分析は以下の条件で行った。この分析の結果、最終乾固物には、アシル化ステロール配糖体(以下「ASG」と称する場合がある)が72.6%含まれていることが判明した。
分析条件
検出器 :Crona(TM) CAD(TM) Charged Aerosol Detector
カラム :LiChrospher Si 60(5μm,125×4mm i.d.,Merck)
カラム温度:40度
流 速 :1mL/min.
注入量 :10μL
サンプル溶媒:クロロホルム:メタノール(2:1,vol/vol)
検量線濃度 :10,20,40,60及び80μg/mL
移動相、グラジェント条件(表2参照)
【0025】
【表2】

【0026】
〔細胞試験〕
膵臓β細胞保護作用を明らかにするため、ラット膵臓細胞株INS−1細胞を無血清培養条件及びストレプトゾトシン(STZ)処理を追加した場合のASGの影響を調べた。
最初にINS−1細胞 (5×104cells/well)を96ウェルプレートに播種し10%FBS含有RPMI 1640にて37℃で1日培養を行った。その後、KRB緩衝液で洗浄した後、1mM STZ処理もしくは無処理の条件下、37℃で60分間培養した。そして、細胞をKRB緩衝液で洗浄し、10%FBS含有RPMI 1640もしくは無血清RPMI 1640、0.04、0.4、1.0、4.0、8.0、40μg/ml ASG含有RPMI 1640で2日間培養を行い、生細胞数の評価を行った。また、各ウェルから培養清を採取し、培養上清中のIGF−1濃度を市販のELISA kit(R&D Systems)にて測定した。
【0027】
〔IGF−1のmRNA発現量〕
ASG添加による膵臓β細胞におけるIGF−1発現誘導能を調べた。
INS−1細胞 (2.5×106cells/well)を100mmディッシュに播種し10%FBS含有RPMI 1640にて37℃で1日培養を行った。その後、10% FBS含有RPMIから無血清RPMI 1640に入れ替え、ASGを0、4.0、8.0、40μg/ml の濃度で添加し、2日間培養を行った。その後PBS緩衝液で細胞をリンスし、RNA抽出キットNucleoSpin RNAII(日本ジェネティクス)の方法に従い、RNAを抽出した。得られたTotal RNAサンプルをPrimer(Random Hexamer)、dNTP、逆転写酵素とともに反応させ、cDNAを得た。その後、IGF−1 Primer、βアクチン Primerを用いて目的配列を含むcDNAをPCRで増幅させて、増幅産物をアガロースゲル電気泳動にて分離し、エチジウムブロマイド染色を行い、IGF−1 mRNA発現量の変化を評価した。また、このときの培地中へのIGF−1タンパク質の分泌量をELISA法にて測定した。
【0028】
[統計解析]
統計解析は無血清群と各群との間で対応のないt検定を実施した。各評価項目は、一元配置分散分析後、有意差があった場合には、多重比較検定としてTukey検定を実施した。各群間の有意水準はP<0.05とした。
【0029】
〔測定結果〕
膵臓β細胞保護作用を検討した結果、無血清条件下でのSTZ処理により、非処理群に比較して生細胞率が大きく低下している。これに対してASG添加(1μg/ml)によりこの生細胞率が高く維持され、細胞死が有意に抑制された。(図1)
さらに、ASGの膵臓β細胞におけるIGF−1誘導活性を測定したところ、mRNAレベルおよび、タンパク質レベルでASGはIGF−1を誘導することが明らかとなった。(図2)(図3)
【0030】
[肥満者を対象とした評価]
健常者(n=46名[男24名、女22名]、BMI21.5±1.9,体脂肪率23.1±6.0、年齢44.9±10.1)に比べて肥満者(n=20名[男7名、女13名]、BMI28.9±3.3,体脂肪率34.0±7.7、年齢46.2±8.5)では、IGF−1濃度が低いことがわかっている(表3)。そこで今回は肥満モデルマウスを用いてステロール配糖体画分のIGF-1分泌誘導能を評価した。
【0031】
【表3】

【0032】
[動物試験・飼料]
試験には7週齢の雄性C57BL/6j マウスを用いた。被験飼料は、上述の方法で分取したステロール配糖体画分(ASG含量72.6%)を30%脂肪食に0.079%及び0.794%を添加し、重量調整はいずれもβスターチで行った。
【0033】
【表4】

【0034】
[投与・試料採取]
群分けは、各群の平均体重に差がないよう無作為に3群(高脂肪飼料群、低ステロール配糖体飼料群及び高ステロール配糖体飼料群)に振り分け実施した。飼料は粉末給餌とし、群分け後から、それぞれの被験飼料を66日間自由摂取させた。一般状態は毎日観察した。摂餌量は一週間毎の摂餌量が算出できるよう可能な限り行った。体重は1週間おきに測定した。採血は投与終了翌日に4時間絶食の後、エーテル麻酔下でヘパリンNa加注射筒により実施した。
【0035】
[測定]
糖質、脂質マーカーとして血漿中のグルコース(以下Glu)、総コレステロール(以下T-cho)、中性脂肪 (以下TG)、HDLコレステロール (以下HDL-cho)、LDLコレステロール (以下 LDL-cho)を測定した。GluはグルコースCII−テストワコー(和光純薬工業株式会社)、T-choはコレステロールE−テストワコー(和光純薬工業株式会社)、TGはトリグリセライドE−テストワコー(和光純薬工業株式会社)、HDL-cho及びLDL-choは、それぞれを含む画分を遠心分離法にて分離した後、コレステロールE-テストワコー(和光純薬工業株式会社)にてそれぞれの画分を測定しHDL-choとLDL-choの値とした。IGF-1については、Quantikine Mouse IGF-1(R&DSystems)を用いて血漿中のIGF-1濃度を定量した。
【0036】
〔統計解析〕
評価項目は、一元配置分散分析後、有意差があった場合には、多重比較検定としてTukey検定を実施した。各群間の有意水準はP<0.05とした。
【0037】
〔測定結果〕
血漿Glu、TG及びT-Cho、LDL-choは、高脂肪食群と比較し両ステロール配糖体飼料群で低値を示し、HDL-choは高値を示した(表5)。
【0038】
【表5】

【0039】
血中IGF-1濃度を図4に示した。高脂肪食で飼育したマウスに比較して、高脂肪食にASGを添加した群(低ステロール配糖体群、高ステロール配糖体群)では用量依存的な血中IGF-1濃度の有意な上昇が見られた。
【0040】
[糖尿病モデルマウス試験]
本発明による膵臓保護効果を確認するため糖尿病モデル動物を用いた試験を行った。
試験には週齢の7週齢のC57BLKS/J lar-+Leprdb/+Leprdb 雄性 マウス(糖尿病モデルマウス)を日本エスエルシー株式会社より購入し、予備飼育1週間の後試験に用いた。被験飼料は、上述の方法で分取したステロール配糖体画分(ASG含量 72.9%)をAIN-93G食に0.79質量% 添加し、重量調整はいずれもコーンスターチで行った。試験に用いた飼料の組成を下記表6に示す。
【0041】
【表6】

【0042】
〔投与・試料採取〕
群分けは、各群の平均体重に差がないよう無作為に2群(普通飼料群、ステロール配糖体飼料群)に振り分け実施した。飼料は粉末給餌とし、群分け後から、それぞれの被験飼料を約5週間 自由摂取させた。一般状態は毎日観察した。摂餌量は一週間毎の摂餌量が算出できるよう可能な限り行った。体重は1週間おきに測定した。採血は投与終了翌日に4時間絶食の後、エーテル麻酔下でヘパリンNa加注射筒により実施した。
【0043】
〔測定〕
血漿中のグルコース(以下Glu)、血中インスリンを測定した。Gluは生化学自動分析装置 DRI-CHEM(富士フィルム社製)により、専用のスライドを用いて測定した。血中インスリン値はインスリン測定キット(株式会社 森永生科学研究所)を用いて測定を行った。
【0044】
〔統計解析〕
2群間の比較は、対応のないt検定を実施した。
【0045】
〔測定結果〕
解剖時のGlu測定結果を 図5 に示す。Gluは普通飼料群に比較して、ステロール配糖体飼料群で低値を示した。
【0046】
解剖時の血中インスリン値の測定結果を 図6に示す。
血中インスリン値は普通飼料群に比較して、ステロール配糖体飼料群で高値を示した。また、膵臓の病理所見では対照群に発生するランゲルハンス島の空胞化も発芽玄米ステロール配糖体飼料群で軽微になることが確認でき、普通飼料群に比較して膵臓機能が維持されていることが確認できた。
以上のとおり、本発明品はin vitroの試験により膵細胞からのIGF-1分泌促進を介して膵細胞を保護することを確認した。さらにin vivo試験において本発明品投与動物は、対照の動物に比較して膵臓ランゲルハンス島β細胞が保護されており、その結果インスリン分泌が改善、血糖値上昇が抑制されていることが明らかとなった。
【0047】
以下に本発明のステロール配糖体を用いた処方例を示す。
処方例1
[カプセル剤]
組成
ステロール配糖体画分(乾固物) …100mg
ミツロウ … 10mg
ぶどう種子オイル …110mg
上記成分を混合し、ゼラチンおよびグリセリンを混合したカプセル基剤中に充填し、軟
カプセルを得た。
【0048】
処方例2
[錠剤]
組成
ステロール配糖体画分(乾固物) …150mg
セルロース … 80mg
デンプン … 20mg
ショ糖脂肪酸エステル … 2mg
上記成分を混合、打錠し、錠剤を得た。
【0049】
処方例3
[飲料]
組成 (配合;質量%)
果糖ブトウ糖液糖 5.00
クエン酸 10.4
L−アスコルビン酸 0.20
香料 0.02
色素 0.10
ステロール配糖体画分(乾固物) 1.00
乳化剤 0.30
水 81.98
上記成分を混合して飲料とした。
【技術分野】
【0001】
本発明は、糖尿病病態改善及び膵臓細胞保護効果を有する安全なIGF−1分泌促進剤に関する。
【背景技術】
【0002】
戦前、戦後の貧しい食事パターンの時代は、主要な死因は感染症や脳卒中であったが、経済の高度成長期を境に食が豊かになると、総摂取エネルギーに対する脂質エネルギー比率が高くなり、動物性脂質摂取やリノール酸の摂取増加、身体活動量の低下を背景として、内臓脂肪型肥満を基礎とした代謝障害が増加し、主要な死因は悪性新生物、心血管疾患や脳血管疾患が上位を占める構造に変化した。
【0003】
生活習慣病として代表的な糖尿病は先進諸国をはじめとして、世界的に増加している。世界保健機関(WHO)によると、世界には少なくとも 1億7,100万人の糖尿病患者がいるとされ、2030年までにこの数は世界で3億6,600万人が糖尿病を罹患すると推定されている。特に、もっとも増加率の高い地域はアジアとアフリカになるとみられている。発展途上国の糖尿病は、都市化とライフスタイルの変化にともなって増加する傾向があり、食生活の高タンパク質で脂肪の多い欧米化と関連している可能性がある。
内臓脂肪に起因するインスリン抵抗性の増大は、膵臓からのインスリン分泌に負荷をかけ、やがては膵β細胞を疲弊、死滅させ、インスリン分泌の低下をもたらす。インスリン分泌低下により血糖の制御ができなくなり糖尿病が重症化すると、神経障害、網膜症、腎症などの治療が困難な合併症を併発し、最悪の場合は、重い障害を残したり、死亡したりする結果にも繋がることから、早期の予防策が希求されている。
【0004】
IGF−1は中枢神経疾患(アルツハイマー病などの認知症など)、心血管系疾患(心筋梗塞、脳梗塞、高血圧など)、代謝異常疾患(肥満、糖尿病、脂質異常症など)、消化器・内臓疾患(潰瘍、肝機能低下など)、運動器疾患(関節リウマチ、関節炎など)、皮膚化領域疾患(皮膚老化、脱毛など)、免疫賦活作用(NK細胞活性化など)など、多岐に渡り関与することが知られている。例えば、インスリン様成長因子(IGF−I)のレベル上昇による内臓脂肪の低下方法のようにIGF−1のレベルを高める技術(特許文献1)をはじめ、抗老化や疾病予防、治療などへの応用としてのIGF−1の利用が注目されている。
【0005】
ヒトや動物(ウシや豚など)由来や人工的に合成されたIGF−1そのものを経口投与することは、ポリペプチドであるIGF−1の特性から困難であり、注射剤として使用されている。しかしながら、注射剤の場合は、医師の監視下で行われるため、汎用性のある手段とはいえず、製剤に混入する不純物によっては副作用をきたす可能性がある。さらに糖尿病の罹患により肝臓がんやすい臓がんの発症リスクが糖尿病非罹患者よりも高まるという疫学調査の結果から、その病因とIGF−1との関連も示唆されていることから、人為的にIGF−1を投与するような利用法には問題があった。
【0006】
安全性を重視して、生体が本来もっている機能を賦活化してIGF−1レベルを高める技術が公開されている。具体的なIGF−1の有用性に関連した先行技術は、例えば、糖尿病に有効な組成物として食品たんぱく質を利用し、生体内でIGF−1を誘導する技術(特許文献2)、同じく食品たんぱく質を利用するものとして、加齢に伴う諸症状(肌荒れ、肌艶、肌の張りの低下、しみ、そばかすの増加、気力の低下など)の緩和としてサケの卵巣膜をプロテアーゼ処理し抽出したIGF−1値上昇剤(特許文献3)、肌荒れ改良剤(特許文献4)、末梢血液循環を改善する加速度脈波加齢指数上昇剤(特許文献5)がある。また、カルシトニン遺伝子関連ペプチドを介してIGF−1を誘導するカルシトニン遺伝子関連ペプチド産生及び放出促進作用を有する胃粘膜傷害予防・治療用可食性組成物および育毛用可食性組成物(特許文献6)、育毛や美容効果を持った植物由来の苦味配糖体ゲンチオピクリンを含んだIGF−1産生促進剤(特許文献7)、老化による皮膚のしわ、たるみを軽減するα-D-グルコピラノシルグリセロールを含有するIGF−1産生促進剤(特許文献8)が公知となっている。
【0007】
しかしながら、食品たんぱく質をベースとしたものや苦味配糖体、イソフラボノイド類、カプサイシンなどIGF−1産生を促進する従来技術は、におい、苦味、辛味、渋みなどの特徴から利用を継続するにはなお課題を残していた。
また、IGF−1を産生促進するために多量の炭酸ガスナノバブルを発生させる技術として、血流量およびインスリン様成長因子増加装置、並びに血流量およびインスリン様成長因子増加方法(特許文献9)が公知となっているが、コストの面から、汎用性に問題がある。
【0008】
本出願人、本発明者等は、発芽玄米に着目して、研究開発を続けており、発芽玄米そのものの開発及び発芽玄米に含まれている成分の機能に関する発明など多数の提案をしている。
機能成分に着目した提案として、例えば、特許文献10(特開2008−266326号公報)は、発芽玄米全脂質画分を有効成分とする神経障害若しくは糖尿病性神経障害予防若しくは改善剤を提案している。
特許文献11(特開2006−316018号公報)は、発芽玄米の糠から抽出したアリラトースBを含有するグルココルチコイド受容体拮抗剤、アドレナリンβ3受容体作動剤が提案されている。
特許文献12(特開2006−316016号公報)は、発芽玄米の糠から抽出した特定の化学構造のリゾホスファチジルコリンを含有するインスリン受容体作動剤が提案されている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特表2007−502834号公報
【特許文献2】特許3137273号公報
【特許文献3】特許3946238号公報
【特許文献4】特許3899116号公報
【特許文献5】特許3946239号公報
【特許文献6】特許4213617号公報
【特許文献7】特開2009−196989号公報
【特許文献8】特開2009−161475号公報
【特許文献9】特開2008−214207号公報
【特許文献10】特開2008−266326号公報
【特許文献11】特開2006−316018号公報
【特許文献12】特開2006−316016号公報
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明者は、発芽玄米に含有されるステロール配糖体に着目し、その新しい作用機序について、明らかにすることを本発明の課題とする。特に、糖尿病病態改善及び膵臓細胞保護効果を有する安全なIGF−1分泌促進剤を提供することを課題とする。
【課題を解決するための手段】
【0011】
すなわち、本発明の主な構成は、次のとおりである。
1.発芽玄米由来のステロール配糖体を有効成分とするIGF−1分泌促進剤。
2.発芽玄米由来のステロール配糖体が、発芽玄米糠由来のステロールであることを特徴とする1.記載のIGF−1分泌促進剤。
3.1.又は2.に記載されたIGF−1分泌促進剤を含有する飲食品。
4.1.又は2.に記載されたIGF−1分泌促進剤を含有するペットフード。
【発明の効果】
【0012】
本発明は、発芽玄米由来のステロール配糖体にIGF−1を増加させ、糖尿病、特に膵臓が傷害された糖尿病の病態改善効果及び膵β細胞の保護作用があることを明らかにした。さらにin vivo試験において膵臓ランゲルハンス島β細胞が保護されており、その結果インスリン分泌が改善、血糖値上昇が抑制されていることが明らかとなった。
特に、発芽玄米由来のステロール配糖体は、発芽玄米の糠の部分より抽出して利用することができる。
この発芽玄米由来のステロール配糖体を医薬、飲食品等の形態で摂取することにより、糖尿病を改善し、治療の困難な合併症の予防を図ることができる。これは、ペット用としても活用できる。また、発芽玄米由来であるので、安全性が高く、風味にも問題ないことから、IGF−1増加作用を奏することで、膵β細胞保護作用を高め、糖尿病合併症予防に効果を発揮できる。
【図面の簡単な説明】
【0013】
【図1】膵β細胞保護作用(細胞生存率)を示すグラフ。
【図2】膵β細胞のIGF−1のmRNA発現量増加を示す図。
【図3】膵β細胞のIGF−1分泌促進を示す図。
【図4】肥満モデルマウスでのIGF-1分泌促進を示す図。
【図5】糖尿病モデルマウスを用いた血糖値の測定結果を示すグラフ。
【図6】糖尿病モデルマウスを用いた血中インスリン値を示すグラフ。
【発明を実施するための形態】
【0014】
本発明に使用する発芽玄米由来ステロール配糖体画分(以下「ステロール配糖体画分」と称する場合がある)は、発芽玄米から得た糠をヘキサンで中性脂質を除去し、得られた残渣をさらに有機溶媒にて抽出した総脂質画分に含まれ、高速液体クロマトグラフィー(HPLC)で分離・濃縮することが出来る。
本発明は、この発芽玄米由来のステロール配糖体を有効成分とするIGF-1分泌促進剤である。摂取方法は、経口、注射により行うことができ、医薬、飲食品、食品添加剤、ペット用の医薬剤、ペット用飼料の添加剤として活用することができる。通常食用にしている発芽玄米由来の成分であるので、安全性が高い。
ステロール配糖体は、発芽玄米の糠成分から極微量抽出される成分であるので、ステロール配糖体を医薬あるいは飲食品、ペット用医薬や飼料に応用する場合は、抽出されたステロール配糖体そのものを使用するのであって、発芽玄米そのものあるいは発芽玄米の粉末などステロール配糖体 を抽出する前の状態で使用することは想定されていない。
【0015】
本発明は、IGF−1分泌促進のための食品添加物、食品およびペットフード、動物用医薬として利用することができる。剤型は、公知の方法により助剤とともに任意の形態に製剤化して、経口投与することができる。カプセル剤又は錠剤、顆粒剤、細粒剤、散剤、液状として投与できる。
投与量は、投与方法と、患者の年齢、病状や一般状態等によって変化し得るが、動物試験の結果より成人では体重1kg当たり通常、1日当たりの有効成分として0.4〜600mgが妥当である。
【0016】
本発明のIGF−1分泌促進剤は、一般食品や健康食品に配合することができ、また、食品添加物の成分とすることもできる。配合する食品は特に限定されず、例えば食パン、菓子パン、パイ、デニッシュ、ドーナツ、ケーキ等のベーカリー食品、うどん、そば、中華麺、焼きそば、パスタ等の麺類、天ぷら、コロッケ等のフライ類、カレー、シチュー、ドレッシング等のソース類、ふりかけ類、かまぼこ等の練り製品、ジュース等の飲料、スナック菓子、米菓、飴、ガム等の菓子類を挙げることができる。
ペットには、犬、猫、ハムスター、リス等の哺乳類の飼料として適している。本発明のペットフードの形態は特に限定されるものではなく、例えばドライタイプ、ウェットタイプ、セミモイストタイプ、ビスケットタイプ、ソーセージタイプ、ジャーキータイプ、粉末、顆粒、カプセルなどが挙げられる。
【0017】
<発芽玄米由来のステロール配糖体>
1.糠成分を採取する発芽玄米は、公知の方法により調製することができる。本出願人は、発芽玄米について多数の提案をしており、例えば、特許第3423927号公報、特許第3611804号公報、特許第3738025号公報等に開示された発芽玄米の製法によって得ることができる。
試験に用いたステロール配糖体画分の抽出は発芽玄米約2,000kgを搗精して得られた糠200kg(搗精度10%)を用いて行った。
【0018】
2.本出願人は、先に、発芽玄米から抽出したステロール配糖体を国際公開(WO2009/110612)として提案した。本願発明で使用するステロール配糖体画分は、このステロール配糖体を含んでいることが判明している。このステロール配糖体画分は、IGF−1を増加させ、糖尿病、すい臓が傷害された糖尿病の病態改善効果及び膵臓細胞の保護作用があることを解明した。
【0019】
[ラット膵β細胞株INS−1細胞を用いた評価]
膵臓細胞保護作用を明らかにするため、無血清で培養したラット膵β細胞株INS−1細
胞の細胞増殖能とSTZ処理による機能障害について、ステロール配糖体の効果を検討した。無血清培養下におけるINS−1細胞におけるIGF−1 mRNA誘導効果およびIGF−1分泌能を確認した。
【0020】
[肥満モデルマウスを用いた評価]
特許第3738025号公報の技術によって得られた発芽玄米から抽出したステロール配糖体画分をステロール配糖体の供給源として飼料に混ぜて高脂肪食誘導肥満モデルマウスに摂取させ、高脂肪食により惹起される高血糖に対する改善能および肥満マウスに対するIGF-1分泌誘導能を確認した。
【0021】
<ステロール配糖体画分の調製例>
発芽玄米糠をヘキサンで脂質成分中の中性脂質を除去後、それぞれの残渣につき、ヘキサン、クロロホルム及びメタノールを用いてステロール配糖体の粗抽出液を調製した。このステロール配糖体抽出液からクロロホルム:メタノール(2:1)混合液で抽出し、シリカゲル担体カラムクロマトグラフィーによって、ステロール配糖体画分の調製を行った。試験に用いたステロール配糖体画分の抽出は発芽玄米約2,000kgを搗精して得られた糠200kg(搗精度10%)を用いて行った。
米糠(500g)が浸る量のヘキサンを加え十分に撹拌した後ガーゼでろ過を行い、脱脂糠を得た。その後、ヘキサンを揮発させた脱脂糠を1.5 kgに対してクロロホルム:メタノール2:1を(3L)加えて総脂質画分(TL)を抽出し、抽出液をエバポレーターで乾固させ乾固物(ステロール配糖体画分)を得た。
【0022】
乾固物は300mlのクロロホルム:ヘキサン=1:1に溶解し、クロロホルムで膨潤させた直径 10cm×長さ 100cm (メルク社製シリカゲル60を80cm充填)のカラムに全溶解液をアプライした。溶液がイアトロビーズに全てしみ込んだ後、クロロホルム:ヘキサン=1:1(7,840ml)、クロロホルム(20,160ml)、クロロホルム:メタノール=9:1(10,080ml)の順でそれぞれを通液した。クロロホルム:メタノール=9:1の通液により分離した暗緑色の溶液だけを全て採取した。採取した暗緑色の溶液はエバポレーターで乾固させ試験に供した。以下に各ポイントでの収量を示す。
【0023】
【表1】

【0024】
[ASG分析]
抽出したステロール配糖体画分の分析は以下の条件で行った。この分析の結果、最終乾固物には、アシル化ステロール配糖体(以下「ASG」と称する場合がある)が72.6%含まれていることが判明した。
分析条件
検出器 :Crona(TM) CAD(TM) Charged Aerosol Detector
カラム :LiChrospher Si 60(5μm,125×4mm i.d.,Merck)
カラム温度:40度
流 速 :1mL/min.
注入量 :10μL
サンプル溶媒:クロロホルム:メタノール(2:1,vol/vol)
検量線濃度 :10,20,40,60及び80μg/mL
移動相、グラジェント条件(表2参照)
【0025】
【表2】

【0026】
〔細胞試験〕
膵臓β細胞保護作用を明らかにするため、ラット膵臓細胞株INS−1細胞を無血清培養条件及びストレプトゾトシン(STZ)処理を追加した場合のASGの影響を調べた。
最初にINS−1細胞 (5×104cells/well)を96ウェルプレートに播種し10%FBS含有RPMI 1640にて37℃で1日培養を行った。その後、KRB緩衝液で洗浄した後、1mM STZ処理もしくは無処理の条件下、37℃で60分間培養した。そして、細胞をKRB緩衝液で洗浄し、10%FBS含有RPMI 1640もしくは無血清RPMI 1640、0.04、0.4、1.0、4.0、8.0、40μg/ml ASG含有RPMI 1640で2日間培養を行い、生細胞数の評価を行った。また、各ウェルから培養清を採取し、培養上清中のIGF−1濃度を市販のELISA kit(R&D Systems)にて測定した。
【0027】
〔IGF−1のmRNA発現量〕
ASG添加による膵臓β細胞におけるIGF−1発現誘導能を調べた。
INS−1細胞 (2.5×106cells/well)を100mmディッシュに播種し10%FBS含有RPMI 1640にて37℃で1日培養を行った。その後、10% FBS含有RPMIから無血清RPMI 1640に入れ替え、ASGを0、4.0、8.0、40μg/ml の濃度で添加し、2日間培養を行った。その後PBS緩衝液で細胞をリンスし、RNA抽出キットNucleoSpin RNAII(日本ジェネティクス)の方法に従い、RNAを抽出した。得られたTotal RNAサンプルをPrimer(Random Hexamer)、dNTP、逆転写酵素とともに反応させ、cDNAを得た。その後、IGF−1 Primer、βアクチン Primerを用いて目的配列を含むcDNAをPCRで増幅させて、増幅産物をアガロースゲル電気泳動にて分離し、エチジウムブロマイド染色を行い、IGF−1 mRNA発現量の変化を評価した。また、このときの培地中へのIGF−1タンパク質の分泌量をELISA法にて測定した。
【0028】
[統計解析]
統計解析は無血清群と各群との間で対応のないt検定を実施した。各評価項目は、一元配置分散分析後、有意差があった場合には、多重比較検定としてTukey検定を実施した。各群間の有意水準はP<0.05とした。
【0029】
〔測定結果〕
膵臓β細胞保護作用を検討した結果、無血清条件下でのSTZ処理により、非処理群に比較して生細胞率が大きく低下している。これに対してASG添加(1μg/ml)によりこの生細胞率が高く維持され、細胞死が有意に抑制された。(図1)
さらに、ASGの膵臓β細胞におけるIGF−1誘導活性を測定したところ、mRNAレベルおよび、タンパク質レベルでASGはIGF−1を誘導することが明らかとなった。(図2)(図3)
【0030】
[肥満者を対象とした評価]
健常者(n=46名[男24名、女22名]、BMI21.5±1.9,体脂肪率23.1±6.0、年齢44.9±10.1)に比べて肥満者(n=20名[男7名、女13名]、BMI28.9±3.3,体脂肪率34.0±7.7、年齢46.2±8.5)では、IGF−1濃度が低いことがわかっている(表3)。そこで今回は肥満モデルマウスを用いてステロール配糖体画分のIGF-1分泌誘導能を評価した。
【0031】
【表3】

【0032】
[動物試験・飼料]
試験には7週齢の雄性C57BL/6j マウスを用いた。被験飼料は、上述の方法で分取したステロール配糖体画分(ASG含量72.6%)を30%脂肪食に0.079%及び0.794%を添加し、重量調整はいずれもβスターチで行った。
【0033】
【表4】

【0034】
[投与・試料採取]
群分けは、各群の平均体重に差がないよう無作為に3群(高脂肪飼料群、低ステロール配糖体飼料群及び高ステロール配糖体飼料群)に振り分け実施した。飼料は粉末給餌とし、群分け後から、それぞれの被験飼料を66日間自由摂取させた。一般状態は毎日観察した。摂餌量は一週間毎の摂餌量が算出できるよう可能な限り行った。体重は1週間おきに測定した。採血は投与終了翌日に4時間絶食の後、エーテル麻酔下でヘパリンNa加注射筒により実施した。
【0035】
[測定]
糖質、脂質マーカーとして血漿中のグルコース(以下Glu)、総コレステロール(以下T-cho)、中性脂肪 (以下TG)、HDLコレステロール (以下HDL-cho)、LDLコレステロール (以下 LDL-cho)を測定した。GluはグルコースCII−テストワコー(和光純薬工業株式会社)、T-choはコレステロールE−テストワコー(和光純薬工業株式会社)、TGはトリグリセライドE−テストワコー(和光純薬工業株式会社)、HDL-cho及びLDL-choは、それぞれを含む画分を遠心分離法にて分離した後、コレステロールE-テストワコー(和光純薬工業株式会社)にてそれぞれの画分を測定しHDL-choとLDL-choの値とした。IGF-1については、Quantikine Mouse IGF-1(R&DSystems)を用いて血漿中のIGF-1濃度を定量した。
【0036】
〔統計解析〕
評価項目は、一元配置分散分析後、有意差があった場合には、多重比較検定としてTukey検定を実施した。各群間の有意水準はP<0.05とした。
【0037】
〔測定結果〕
血漿Glu、TG及びT-Cho、LDL-choは、高脂肪食群と比較し両ステロール配糖体飼料群で低値を示し、HDL-choは高値を示した(表5)。
【0038】
【表5】

【0039】
血中IGF-1濃度を図4に示した。高脂肪食で飼育したマウスに比較して、高脂肪食にASGを添加した群(低ステロール配糖体群、高ステロール配糖体群)では用量依存的な血中IGF-1濃度の有意な上昇が見られた。
【0040】
[糖尿病モデルマウス試験]
本発明による膵臓保護効果を確認するため糖尿病モデル動物を用いた試験を行った。
試験には週齢の7週齢のC57BLKS/J lar-+Leprdb/+Leprdb 雄性 マウス(糖尿病モデルマウス)を日本エスエルシー株式会社より購入し、予備飼育1週間の後試験に用いた。被験飼料は、上述の方法で分取したステロール配糖体画分(ASG含量 72.9%)をAIN-93G食に0.79質量% 添加し、重量調整はいずれもコーンスターチで行った。試験に用いた飼料の組成を下記表6に示す。
【0041】
【表6】

【0042】
〔投与・試料採取〕
群分けは、各群の平均体重に差がないよう無作為に2群(普通飼料群、ステロール配糖体飼料群)に振り分け実施した。飼料は粉末給餌とし、群分け後から、それぞれの被験飼料を約5週間 自由摂取させた。一般状態は毎日観察した。摂餌量は一週間毎の摂餌量が算出できるよう可能な限り行った。体重は1週間おきに測定した。採血は投与終了翌日に4時間絶食の後、エーテル麻酔下でヘパリンNa加注射筒により実施した。
【0043】
〔測定〕
血漿中のグルコース(以下Glu)、血中インスリンを測定した。Gluは生化学自動分析装置 DRI-CHEM(富士フィルム社製)により、専用のスライドを用いて測定した。血中インスリン値はインスリン測定キット(株式会社 森永生科学研究所)を用いて測定を行った。
【0044】
〔統計解析〕
2群間の比較は、対応のないt検定を実施した。
【0045】
〔測定結果〕
解剖時のGlu測定結果を 図5 に示す。Gluは普通飼料群に比較して、ステロール配糖体飼料群で低値を示した。
【0046】
解剖時の血中インスリン値の測定結果を 図6に示す。
血中インスリン値は普通飼料群に比較して、ステロール配糖体飼料群で高値を示した。また、膵臓の病理所見では対照群に発生するランゲルハンス島の空胞化も発芽玄米ステロール配糖体飼料群で軽微になることが確認でき、普通飼料群に比較して膵臓機能が維持されていることが確認できた。
以上のとおり、本発明品はin vitroの試験により膵細胞からのIGF-1分泌促進を介して膵細胞を保護することを確認した。さらにin vivo試験において本発明品投与動物は、対照の動物に比較して膵臓ランゲルハンス島β細胞が保護されており、その結果インスリン分泌が改善、血糖値上昇が抑制されていることが明らかとなった。
【0047】
以下に本発明のステロール配糖体を用いた処方例を示す。
処方例1
[カプセル剤]
組成
ステロール配糖体画分(乾固物) …100mg
ミツロウ … 10mg
ぶどう種子オイル …110mg
上記成分を混合し、ゼラチンおよびグリセリンを混合したカプセル基剤中に充填し、軟
カプセルを得た。
【0048】
処方例2
[錠剤]
組成
ステロール配糖体画分(乾固物) …150mg
セルロース … 80mg
デンプン … 20mg
ショ糖脂肪酸エステル … 2mg
上記成分を混合、打錠し、錠剤を得た。
【0049】
処方例3
[飲料]
組成 (配合;質量%)
果糖ブトウ糖液糖 5.00
クエン酸 10.4
L−アスコルビン酸 0.20
香料 0.02
色素 0.10
ステロール配糖体画分(乾固物) 1.00
乳化剤 0.30
水 81.98
上記成分を混合して飲料とした。
【特許請求の範囲】
【請求項1】
発芽玄米由来のステロール配糖体を有効成分とするIGF−1分泌促進剤。
【請求項2】
発芽玄米由来のステロール配糖体が、発芽玄米糠由来のステロールであることを特徴とする請求項1記載のIGF−1分泌促進剤。
【請求項3】
請求項1又は2に記載されたIGF−1分泌促進剤を含有する飲食品。
【請求項4】
請求項1又は2に記載されたIGF−1分泌促進剤を含有するペットフード。
【請求項1】
発芽玄米由来のステロール配糖体を有効成分とするIGF−1分泌促進剤。
【請求項2】
発芽玄米由来のステロール配糖体が、発芽玄米糠由来のステロールであることを特徴とする請求項1記載のIGF−1分泌促進剤。
【請求項3】
請求項1又は2に記載されたIGF−1分泌促進剤を含有する飲食品。
【請求項4】
請求項1又は2に記載されたIGF−1分泌促進剤を含有するペットフード。
【図1】


【図4】


【図5】


【図6】


【図2】


【図3】




【図4】


【図5】


【図6】


【図2】


【図3】


【公開番号】特開2011−157345(P2011−157345A)
【公開日】平成23年8月18日(2011.8.18)
【国際特許分類】
【出願番号】特願2010−244395(P2010−244395)
【出願日】平成22年10月29日(2010.10.29)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
【公開日】平成23年8月18日(2011.8.18)
【国際特許分類】
【出願日】平成22年10月29日(2010.10.29)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
[ Back to top ]

