IL−10産生促進作用を有する免疫賦活組成物
【課題】フコイダンおよび乳酸菌を含有し、高いIL−10産生促進作用を有することを特徴とする免疫賦活組成物を提供する。
【解決手段】テトラジェノコッカス属、ペディオコッカス属、ラクトバチルス属等の乳酸菌の菌体重量1重量部に対して、ワカメ由来のフコイダン0.1〜10重量部を添加、培養することにより、IL−12産生促進作用だけでなく、高いIL−10産生促進作用を有する免疫賦活組成物を得ることができる。当該免疫賦活組成物は、I型アレルギーの症状改善や炎症性疾患である潰瘍性大腸炎等の症状緩和に高い効果を有することが期待される。
【解決手段】テトラジェノコッカス属、ペディオコッカス属、ラクトバチルス属等の乳酸菌の菌体重量1重量部に対して、ワカメ由来のフコイダン0.1〜10重量部を添加、培養することにより、IL−12産生促進作用だけでなく、高いIL−10産生促進作用を有する免疫賦活組成物を得ることができる。当該免疫賦活組成物は、I型アレルギーの症状改善や炎症性疾患である潰瘍性大腸炎等の症状緩和に高い効果を有することが期待される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、特定の乳酸菌にワカメ由来のフコイダンを添加することで乳酸菌の有するIL−10およびIL−12産生促進効果を増強した免疫賦活組成物に関する。
【背景技術】
【0002】
生体内の免疫系は、細菌、酵母、カビ、ウイルスなどによる感染や、腫瘍に対する防御、アレルギーの発症に重要な役割を果たしており、その防御機構の中心はリンパ球と抗原提示細胞である。リンパ球と抗原提示細胞は、抗原特異的または抗原非特異的に活性化され、異物を排除する能力を高める。リンパ球や抗原提示細胞の活性化において、インターロイキン12(以下、「IL−12」という。)は、ナチュラルキラー細胞(以下、「NK細胞」という。)やヘルパーT細胞に作用してインターフェロンγ(以下、「IFN−γ」という。)や腫瘍壊死因子α(以下、「TNF−α」という。)の産生を誘導し、抗原提示細胞を活性化すること、NK細胞およびCD8+T細胞の細胞障害活性を増強すること、インターロイキン2(以下、「IL−2」という。)と相乗的に作用して、細胞障害性リンパ球を活性化するとともにリンホカイン活性化キラー細胞を誘導すること、細胞性免疫を補助するヘルパーT細胞(Th0)のTh1タイプへの分化や、そのバランス(Th1/Th2)の制御にも関与していることが知られている。このようにIL−12は、自然免疫ならびに細胞性免疫の強化による感染防御、抗腫瘍活性またはアレルギー予防など免疫賦活作用を促進する点において重要な役割を担っている。また、インターロイキン10(以下、「IL−10」という。)は、主にTh2細胞や制御性T細胞、活性化B細胞、単球、肥満細胞からも産生される。IL−10は、主に単球系細胞に作用して炎症性サイトカインの産生を始めとする免疫機能を抑制性に制御するため、炎症の抑制に重要な役割を果たしている。
【0003】
一方、乳酸菌は、免疫賦活能を有することが知られており、これを摂取することにより生体の免疫活性を向上する作用が認められる。例えば、テトラジェノコッカス属、ペディオコッカス属またはロイコノストック属に属する乳酸菌を摂取することにより、IL−12の産生が促進される(例えば、特許文献1参照)。また、ビフィドバクテリウム属やラクトバチルス属、ストレプトコッカス属など乳酸菌8種類の合剤の経口摂取により、IL−10産生を促進し、潰瘍性大腸炎を緩和することが知られている。(例えば、非特許文献1参照)。このような乳酸菌の作用から、乳酸菌を摂取することは、生体内の免疫状態を良好に保つうえで有効な手段であるといえる。
【0004】
しかしながら、前記のような効果を発揮するためには、多量の菌体を摂取する必要があり、乳酸菌を含む免疫賦活組成物を提供する際に、煩雑な工程を経なければならず、高いコストを要する欠点がある。この欠点を補うために、カゼイン加水分解物を添加した培地を用いて乳酸菌を培養する方法(例えば、特許文献2参照)や、フコイダン加水分解物を乳酸菌に添加することで、乳酸菌の持つ免疫賦活能を増強させる方法(例えば、特許文献3参照)が提案されている。これらの方法により、ある程度高い免疫賦活能を有する乳酸菌を得ることができ、通年性アレルギー性鼻炎や花粉症、気管支喘息、アトピー性皮膚炎などのI型アレルギーの症状緩和が期待できる免疫賦活組成物を提供することができる。しかしながら、充分な免疫賦活能を有しているとは言えず、特に、IL−10産生が極端に低く、改善がみられないことから、炎症性疾患である潰瘍性大腸炎、クローン病、敗血症などを予防・改善する効果を得ることは難しいのが現状である。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】「医学のあゆみ Vol.228 No.3」2009年 p.227-232
【特許文献】
【0006】
【特許文献1】特開2006−028047号公報
【特許文献2】再表2006/073145号公報
【特許文献3】特開2007−039341号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、乳酸菌含量が低くとも高い免疫賦活能を有し、特に生体のIL−10およびIL−12産生を促進する免疫賦活組成物を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、特定の乳酸菌にワカメ由来のフコイダンを添加し、乳酸菌の有するIL−10およびIL−12産生促進効果を増強し、高い免疫賦活作用を示すことを見出し、本発明を完成した。すなわち本発明は、以下に関する。
1)ワカメ由来フコイダンおよびテトラジェノコッカス属、ペディオコッカス属もしくはラクトバチルス属の乳酸菌のいずれか1種または2種以上を含有することを特徴とする免疫賦活組成物。
2)前記1)記載の乳酸菌が、テトラジェノコッカス・ハロフィラスKK221(受託番号FERM BP−10987)である免疫賦活組成物。
3)前記1)〜2)記載の免疫賦活組成物に含まれる乳酸菌菌体重量1重量部に対し、フコイダン重量が0.1〜10重量部の範囲である免疫賦活組成物。
4)前記1)〜3)記載の免疫賦活組成物を有効成分とするIL−10産生促進剤。
【発明の効果】
【0009】
本発明により、乳酸菌菌体の含有量が低くても、高いIL−10およびIL−12産生促進効果を有する免疫賦活組成物を提供することができる。
【図面の簡単な説明】
【0010】
【図1】マクロファージを各乳酸菌で刺激し、フコイダンを添加した際のIL−12産生量を表す。
【図2】マクロファージをKK221で刺激し、フコイダンを添加した際のIL−10産生量を表す。
【図3】マクロファージをKK221で刺激し、フコイダンを添加した際のIL−12産生量を表す。
【図4】マクロファージをKK221で刺激し、フコイダンを添加した際の各サイトカイン産生量を表す。
【図5】フコイダン添加時のKK221貪食細胞の割合を表す。
【図6】脾臓細胞をKK221で刺激し、フコイダンを添加した際のIL−10産生量を表す。
【図7】脾臓細胞をKK221で刺激し、フコイダンを添加した際のIFN−γ産生量を表す。
【図8】フコイダン、KK221または両方を摂取した際のOVA特異的IgE量を表す。
【図9】フコイダン、KK221または両方を摂取した際の脾臓細胞からのIFN−γ産生量を表す。
【図10】フコイダン、KK221または両方を摂取した際の脾臓細胞からのIL−4産生量を表す。
【発明を実施するための形態】
【0011】
(乳酸菌)
本発明に用いられる乳酸菌は、テトラジェノコッカス属、ペディオコッカス属またはラクトバチルス属の乳酸菌である。その中でも、テトラジェノコッカス・ハロフィラスKK221株(受託番号FERM BP−10987;以下、「KK221」という。)は、後述する免疫賦活組成物の免疫賦活能が特に高いことから好ましい。当該乳酸菌にフコイダンを添加することで、極めて高いIL−10産生促進作用を有する免疫賦活組成物を得ることができる。
【0012】
(フコイダン)
フコイダンとは、コンブ、ワカメまたはモズク等の褐藻類の粘質物に多く含まれる含硫多糖の一種である。本発明に用いられるフコイダンは、ワカメ由来のフコイダンであり、後述する免疫賦活組成物としての効果が高く、安価である特徴を有する。ワカメからフコイダンを抽出する方法は、特に制限されることはないが、例えば、ワカメを酢酸または希塩酸の水溶液に懸濁させ、抽出を行う酸抽出法等、公知の方法を用いることができる。
【0013】
(免疫賦活組成物)
本発明の免疫賦活組成物は、前記乳酸菌および前記フコイダンを有効成分とする。また、免疫賦活組成物に含まれる乳酸菌菌体重量およびフコイダン重量の比率が、免疫賦活組成物の免疫賦活能を左右する大きな要因であり、乳酸菌菌体重量1重量部に対し、フコイダン重量が0.1〜10重量部であることが重要である。フコイダン重量が、当該範囲を下回る場合、IL−10、IL−12産生促進作用が低くなってしまう。一方、フコイダン重量を増やしていくと、IL−10産生促進作用に関しては、フコイダン濃度の増加に比例して高くなるものの、IL−12産生促進作用は、フコイダン濃度が一定濃度を越えるとかえって減少してしまう。また、IL−10の過剰産生によりI型アレルギーの症状改善効果を示さない可能性も考えられるため、IL−10およびIL−12双方の産生促進作用を考慮すると、前記濃度の範囲を上回る量のフコイダンを添加するのは好ましくない。本発明である免疫賦活組成物は、テトラジェノコッカス属、ペディオコッカス属およびラクトバチルス属の乳酸菌、ワカメ由来のフコイダンを一定濃度の範囲で含有することで、IL−10およびIL−12産生促進作用が共に高く、幅広い免疫賦活能を有することを最大の特徴とする。
【0014】
以下に本発明の実施例を記載するが、本発明はこれらに何ら限定されるものではない。
【実施例1】
【0015】
[フコイダンによるIL−12産生促進試験]
1.乳酸菌懸濁液の調製
MRS培地に各種乳酸菌(ペディオコッカス・ペントサセウスNRIC0099、ラクトバチルス・ペントサスNRIC0391、ラクトバチルス・カゼイ・サブスピーシーズ・カゼイNRIC0644、ラクトバチルス・ブレビスNRIC1038、ラクトバチルス・プランタラムNRIC1067、ラクトバチルス・ヘルベティカスNRIC1545、ラクトバチルス・デルブリュッキー・サブスピーシーズ・ラクティスNRIC1683、ラクトバチルス・デルブリュッキー・サブスピーシーズ・ブルガリカスNRIC1688、KK221)を1×107個/mlとなるようMRS培地に接種した。KK221は、食塩10%を含有するMRS培地に1×107個/mlとなるように接種した。それぞれを、30℃で48〜72時間静置培養し、95℃で10分間の煮沸殺菌を行った後、遠心濃縮機によって培地を除去して集菌した。生理食塩水にて菌体を洗浄後、細胞培養用のRPMI完全培地に2×107個/mlとなるように懸濁し、乳酸菌懸濁液を調製した。RPMI完全培地の組成は、25mM HEPES、100U/mL ペニシリン、100μg/mL ストレプトマイシン、50μM 2−メルカプトエタノール、2mM L−グルタミン酸加RPMI1640培地(Gibco社製)に非働化(56℃、30分)したFCS(Invitrogen社製)を10%添加したものである。
【0016】
2.フコイダン溶液の調製
ワカメ由来フコイダンをRPMI完全培地に0.8、4、8または40mg/mlとなるように溶解し、フコイダン溶液を調製した。
【0017】
3.IL−12産生促進試験
フコイダンによる乳酸菌のIL−12産生促進活性の増強作用を、マウス(6〜10週齢BALB/c、雄、チャールズリバー社)より採取・調製した腹腔滲出マクロファージ細胞を用いて評価した。
【0018】
(1)腹腔滲出マクロファージ細胞の採取および調製
チオグリコレート2mlを腹腔内に投与し、刺激したマウスから、投与3日後に無菌的に腹腔滲出マクロファージを採取した。採取したマクロファージを1%FBS溶液(Invitrogen社製)にて洗浄後、細胞数を測定し、RPMI完全培地で、2×106個/mlの濃度になるようマクロファージ細胞溶液を調製した。調製したマクロファージ細胞溶液を用いて、96ウェル組織培養プレートに1ウェル当たり100μl(2×105個/ウェル)播種した。これに、前記の乳酸菌懸濁液を、1ウェル当たりそれぞれ50μl(1×106個/ウェル)加えた。一方、対照群として、乳酸菌菌体を添加していないRPMI完全培地を1ウェル当たり50μl加えた。次に、前記のフコイダン溶液を、実験群、対照群ともに1ウェル当たりそれぞれ50μl(最終濃度0.2、2または10μg/ml)加えた。該プレートを、37℃の5%炭酸ガス培養器内で培養し、培養開始後24時間の培養上清を回収した。
【0019】
(2)IL−12産生促進活性の測定
上記の工程により回収した培養上清中のIL−12濃度を、エンザイムイムノアッセイで測定した。なお、エンザイムイムノアッセイは、下記の工程に従い、測定を行った。
【0020】
ラット抗マウスIL−12抗体(BD Pharmingen社製)が2μg/mlとなるよう、0.2M、pH6.0のリン酸緩衝液を用いて調製した溶液を、96ウェル組織培養プレート1ウェル当たり100μl加え、室温で一晩静置後、ラット抗IL−12抗体を各ウェルに付着させたプレートを調製した。当該プレートに1ウェル当たり100μlの培養上清を加え、室温で90分間静置し、培養上清中のマウスIL−12を、プレートに付着させたラット抗マウスIL−12抗体と結合させた。洗浄後、ラットビオチン化抗マウスIL−12抗体(BD Pharmingen 社製)を加え、前記マウスIL−12に結合させた。洗浄後、ストレプトアビジンで標識したペルオキシダーゼ酵素(Vector 社製)を加え、ラットビオチン化抗マウスIL−12抗体中のビオチンに結合させた。発色は、TMB基質溶液(Moss/コスモバイオ社製)を1ウェル当たり100μl加え、室温で20分間反応させることで行った。反応を、0.5N塩酸で停止後、マイクロプレートリーダー(TECAN社製)を用いて450nmにおける吸光度を測定し、リコンビナントマウスIL−12(BD Pharmingen社製)により作成した標識曲線から、培養上清中のIL−12の濃度を求めた。この結果を図1に示す。
【0021】
図1に示すとおり、各乳酸菌にフコイダンを添加することで、マクロファージのIL−12産生促進が増強されることが確認された。一方、フコイダンの添加量が多くなると、マクロファージのIL−12産生促進が増強された後に、産生量が低下することが確認された。この結果により、乳酸菌にフコイダンを添加することで、マクロファージによる菌体貪食が促進され、IL−12産生促進活性が増強されることが示唆された。
【実施例2】
【0022】
[乳酸菌およびフコイダンの最適な重量比の検討1]
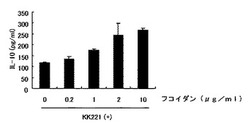
免疫賦活組成物が高い免疫賦活能を有するために乳酸菌およびフコイダンの最適な重量比の検討を行った。実施例1に記載の方法に従い、2×106個/mlマクロファージ細胞溶液を調製し、96ウェル平底プレート(BD FALCON社製)に、1ウェルあたり該マクロファージ細胞溶液を100μl(2×105個/ウェル)播種した。次に、KK221を用いて50μg/mlの濃度となるよう乳酸菌懸濁液を調製し、1ウェルあたり該乳酸菌懸濁液50μl(2.5μg/ウェル)を添加した。さらに、4、8または40μg/mlのフコイダン溶液を調製し、1ウェルあたり50μl(0.2、0.4または2μg/ウェル)を添加した。24時間培養後、培養上清中のIL−10濃度を測定した。IL−10濃度は、マウスIL−10 ELISA KIT(BD Pharmingen社製)を用いて、実施例1に記載の方法に従い測定した。この結果を図2に示す。
【0023】
図2に示すとおり、乳酸菌にフコイダンを添加することにより、マクロファージのIL−10産生が、フコイダンの濃度依存的に促進されることが確認された。なお、IL−10産生促進作用が確認された際の、乳酸菌およびフコイダンの重量比は、乳酸菌菌体重量1重量部に対し、フコイダン重量0.08重量部であった。このことから、フコイダン重量が0.1重量部以上であれば、乳酸菌によるIL−10産生が充分に促進されると考えられる。
【実施例3】
【0024】
[乳酸菌およびフコイダンの最適な重量比の検討2]
実施例1に記載の方法に従い、2×106個/mlマクロファージ細胞溶液を調製し、96ウェル平底プレート(BD FALCON社製)に、1ウェルあたり該マクロファージ細胞溶液を100μl(2×105個/ウェル)播種した。次に、KK221を用いて8μg/mlの濃度となるよう乳酸菌懸濁液を調製し、1ウェルあたり該乳酸菌懸濁液50μl(0.4μg/ウェル)を添加した。さらに、0.8、8、40または80μg/mlのフコイダン溶液を調製し、1ウェルあたり50μl(0.04、0.4、2または4μg/ウェル)を添加した。24時間培養後、培養上清中のIL−12濃度を、実施例1に記載の方法に従い測定した。結果を図3に示す。
【0025】
図3に示すとおり、乳酸菌菌体重量1重量部に対し、フコイダン重量が0.1〜10重量部の範囲において、マクロファージのIL−12産生が促進され、フコイダン重量が1重量部において、IL−12産生促進の効果は最大となった。
実施例2、3の結果により、乳酸菌菌体重量1重量部に対し、フコイダン重量が0.1〜10重量部の範囲である免疫賦活組成物は、IL−12産生およびIL−10産生の双方が促進され、相乗的に作用することにより、I型アレルギーの症状改善や炎症性疾患である潰瘍性大腸炎等の症状緩和に効果を有することが期待される。
【実施例4】
【0026】
[フコイダンによる乳酸菌のサイトカイン産生促進作用]
実施例1に記載の方法と同様に、マクロファージ細胞溶液、KK221の乳酸菌懸濁液、フコイダン溶液を調製し、培養24時間後の培養上清中のTNF−α濃度およびIL−6濃度を測定した。TNF−α濃度およびIL−6濃度は、マウスTNF ELISA KIT(BD Pharmingen社製)、マウスIL−6 ELISA KIT(BD Pharmingen社製)を用いて、実施例1に記載の方法に従い測定した。この結果を図4に示す。
図4に示すとおり、KK221にフコイダンを添加することにより、マクロファージの各サイトカインの産生が促進されることが確認された。この結果は、乳酸菌にフコイダンを添加することにより、乳酸菌の免疫賦活作用が増強されたことを示唆している。
【実施例5】
【0027】
[マウスマクロファージを用いたフコイダンによる乳酸菌の貪食促進作用]
1.乳酸菌懸濁液の調製
実施例1に記載の方法と同様に、菌体を調製後、1mlの菌体懸濁液に10mg/mlのFITC溶液(同仁化学研究所製)を10μl添加し、30℃で1時間インキュベートを行った。その後、生理食塩水にて菌体を3回洗浄し、最後に4×106個/mlとなるようにRPMI完全培地に懸濁した。
【0028】
2.フコイダン溶液の調製
実施例1に記載の方法と同様に調製した。
【0029】
3.菌体貪食促進作用の評価
マウス(6〜10週齢BALB/c、雄、チャールズリバー社)より採取、調製した腹腔滲出マクロファージ細胞を用いて、菌体貪食促進作用を評価した。マクロファージ細胞溶液は実施例1に記載の方法と同様に調製した。24ウェル平底プレート(BD FALCON社製)に、マクロファージ細胞溶液、前記の乳酸菌懸濁液(1×106個/ウェル)、前記のフコイダン溶液(最終濃度0.2、1、2または10μg/ml)を、1ウェル当たりそれぞれ250μl加えた。対照群として、乳酸菌懸濁液(1×106個/ウェル)を添加したRPMI完全培地を、1ウェル当たり250μl加えた。37℃にて、5%炭酸ガス培養器内で培養し、培養開始4時間後に培養上清を除き、生理食塩水にて2回洗浄後、トリプシン処理を行い、細胞を回収した。回収した細胞をFACScan(BD Bioscience社製)により解析し、FITC陽性の細胞を菌体貪食細胞とし、その割合を算出した。この結果を図5に示す。
【0030】
図5に示すとおり、フコイダンの濃度依存的に、マクロファージの菌体貪食率が上昇していることが確認された。この結果により、実施例1〜4において確認された乳酸菌のサイトカイン産生の促進が、フコイダンがマクロファージの菌体貪食作用を促進したことに由来するものであることが示唆された。
【実施例6】
【0031】
[マウス脾臓細胞を用いたフコイダンと乳酸菌によるIL−10産生促進作用およびIL−12を介したインターフェロンγ(IFN−γ)産生促進作用]
マウス(6〜10週齢BALB/c、雄、チャールズリバー社)より脾臓を採取後、400ユニット/mlのタイプ1コラゲナーゼ(シグマ社製)含有RPMI1640培地(Gibco社製)で攪拌、細胞の懸濁を行い、マウス脾臓細胞を回収した。その後、RPMI完全培地に、マウス脾臓細胞の濃度が5×106個/mlとなるように懸濁し、脾臓細胞懸濁液を調製した。乳酸菌懸濁液は、実施例1に記載の方法に従い乳酸菌の濃度が5×106個/mlとなるように調製した。96ウェル平底プレート(BD FALCON社製)に脾臓細胞懸濁液を100μl、乳酸菌懸濁液を100μl、フコイダン溶液を50μl(フコイダンの終濃度0、0.2、1、2または10μg/ml)添加し、37℃の5%炭酸ガス培養器内で48時間培養した(抗体無添加群)。また、IFN−γ産生に対するIL-12の関与について検討するために、培養液中に、IL-12中和抗体添加群として抗マウスIL-12中和抗体(BD Pharmingen社製)を、コントロール抗体添加群として抗ラットIgG2a抗体(BD Pharmingen社製)を、終濃度10μg/mlとなるように加えたものを調製した。
【0032】
培養後、15,00rpmで5分間遠心分離を行い、上清を回収し、抗体無添加群についてはIL−10濃度およびIFN−γ濃度を、抗マウスIL-12中和抗体添加群およびコントロール抗体添加群についてはIFN−γ濃度を、実施例1、2に記載の方法に従い測定した。なお、IFN−γ濃度の測定は、抗マウスIFN−γ抗体(BD Pharmingen社製)を用いたエンザイムイムノアッセイにより実施した。この結果を図6、7に示す。なお、有意差検定(T検定)は、抗マウスIL-12中和抗体添加群をコントロール抗体添加群に対し行なった。
【0033】
図6に示すとおり、IL-10産生は、フコイダン濃度依存的に促進することが確認された。
【0034】
図7に示すとおり、IFN−γ産生は、フコイダン濃度依存的に促進することが確認された。また、抗マウスIL-12中和抗体を添加することにより、IFN−γ産生が抑制されたことから、フコイダンによるIFN−γ産生の促進作用は、IL−12を介した作用であることが示唆された。
【実施例7】
【0035】
[乳酸菌とフコイダンを併用することによるマウスの抗原特異的IgEの上昇抑制効果]
6週齢のBALB/cマウス(雄)を用いて、KK221、フコイダンまたはその両方の連続強制経口投与を行い、KK221とフコイダンを投与することによるマウスの抗原特異的IgEの上昇抑制効果を調べた。オボアルブミン(OVA)感作を行い、アレルギーを誘導することで、乳酸菌摂取が血中OVA特異的IgE量、脾臓細胞のサイトカイン産生能に及ぼす影響を調べた。OVA感作は試験開始0日目、14日目に、下記の方法に従い実施した。
【0036】
1.OVA感作
試験開始0日目から20日目までの21日間、前記マウスに、フコイダン溶液が25mg/mlとなるよう生理食塩水に懸濁した溶液0.2ml(5mg/日)またはKK221が2×109個/mlとなるよう生理食塩水に懸濁した溶液0.2ml(4×108個/日)を摂取させた。また、フコイダン溶液が5mg/ml(1mg/日)およびKK221が2×109個/ml(4×108個/日)となるよう生理食塩水に懸濁した低用量フコイダン・乳酸菌溶液0.2ml、フコイダン溶液が25mg/ml(5mg/日)およびKK221が2×109個/ml(4×108個/日)となるよう生理食塩水に懸濁した高用量フコイダン・乳酸菌溶液0.2mlを、実験群としてマウスに投与した。対照群として、何も添加しない生理食塩水0.2mlを摂取させた。試験開始0日目および14日目に、OVA(GradeV;シグマ社製)20μg/生理食塩水0.2mlとなるように調製した試薬を、または、水酸化アルミニウム(和光純薬工業社製)2mg/生理食塩水0.2mlとなるように調製した試薬を、腹腔内にそれぞれ0.2ml投与した。試験開始21日目にマウスより脾臓および血液を採取し、血清中のOVA特異的IgE量、脾臓由来のIFN−γおよびIL−4産生量を測定した。
【0037】
2.血中のOVA特異的IgE量の測定
試験開始21日目に採血を行い、1500rpmで30分間遠心を行い、血清を得た。血清中のOVA特異的IgE量をエンザイムイムノアッセイにより測定した。詳しくは、OVA(シグマ社製、GradeV)を50μg/mlとなるように1M炭酸水素ナトリウム緩衝液 (pH8.2)に溶解し、96ウェルプレートに50μl/ウェルでコーティングした。その後、血清サンプルを100倍希釈し、プレート上に50μlずつ分注し、1時間インキュベートした。洗浄後、抗マウスIgE抗体(BD Pharmingen社製)を1%BSA加0.05%Tween含有リン酸緩衝液500倍希釈した溶液で1時間インキュベートした。洗浄後、ストレプトアビジンで標識したペルオキシダーゼ酵素(Vector社製)を加え、ビオチンと結合させた。発色は、TMB基質溶液(Moss/コスモバイオ社製)を1ウェル当たり100μl加え、室温で20分間反応させることで行った。反応を0.5N塩酸で停止し、マイクロプレートリーダー(TECAN社製)で、450nmにおける吸光度を測定し、OVA感作を行った対照群の値に対する相対値を算出し、OVA特異的IgE量を定量化した。この結果を、図8に示す。なお、有意差検定は分散分析後、ダンカン法により行なった。
【0038】
図8に示すとおり、マウスにKK221を摂取させると、血中OVA特異的IgE量が低下することが確認された。また、低用量フコイダン・乳酸菌溶液および高用量フコイダン・乳酸菌溶液を摂取させたマウスにおいても、同様の効果が確認された。
【0039】
3.脾臓細胞から産生されるIFN−γの測定
試験開始21日目に脾臓を採取後、メッシュにより脾臓をすり潰し、細胞の懸濁を行い、脾臓細胞を回収した。その後、24ウェル平底プレート(BD FALCON社製)を用い、OVA(シグマ社製、GradeV)を100μg/ml含む10%FBS(JRH)加RPMI1640培地において脾臓細胞を1×107個/mlの濃度で懸濁後、3日間培養を行った。培養後、1,500rpmで5分間遠心を行い、上清を回収し、エンザイムイムノアッセイによりIFN−γ濃度を測定した。エンザイムイムノアッセイは、実施例7と同様の方法で行なった。この結果を、図9に示す。なお、有意差検定は、分散分析後、ダンカン法により行なった。
【0040】
図9に示すとおり、フコイダン・乳酸菌溶液を摂取させることにより、マウスの脾臓細胞由来のIFN−γ産生量が増加し、その効果は低用量フコイダン・乳酸菌溶液において最も高いことが確認された。
4.脾臓細胞から産生されるIL−4の測定
上記の培養上清中に産生されたIL−4濃度をエンザイムイムノアッセイにより測定した。詳しくは抗マウスIL−4抗体(BD Pharmingen社製)を2μg/mlとなるように1M炭酸水素ナトリウム緩衝液(pH9.5)に溶解し、96ウェルプレートに50μl/ウェルでコーティングした。その後、上清サンプルをプレート上に50μlずつ分注し、1時間インキュベートした。洗浄後、ビオチン標識抗IL−4マウス抗体(BD Pharmingen社製)を1%BSA加0.05%Tween含有リン酸緩衝液500倍希釈した溶液で1時間インキュベートした。洗浄後、ストレプトアビジンで標識したペルオキシダーゼ酵素(Vector社製)を加え、ビオチンと結合させた。発色は、TMB基質溶液(Moss/コスモバイオ社製)を1ウェル当たり100μl加え、室温で20分間反応させることで行った。反応を0.5N塩酸で停止し、マイクロプレートリーダー(TECAN社製)を用いて450nmにおける吸光度を測定し、リコンビナントマウスIL−4(BD Pharmingen社製)で作成した標識曲線から、培養上清中のIL−4の濃度を求めた。この結果を、図10に示す。なお、有意差検定は分散分析後、ダンカン法により行なった。
【0041】
図10に示すとおり、低用量フコイダン・乳酸菌溶液を摂取させることにより、マウスの脾臓由来のIL−4産生量が抑制された。
【0042】
上記の結果より、抗原に対する脾臓細胞の応答は、低用量フコイダン・乳酸菌溶液を摂取させたマウスにおいて最も改善されたことが確認された。この結果により、本発明である免疫賦活組成物が、生体においても高い免疫賦活能を有していることを示唆された。
【技術分野】
【0001】
本発明は、特定の乳酸菌にワカメ由来のフコイダンを添加することで乳酸菌の有するIL−10およびIL−12産生促進効果を増強した免疫賦活組成物に関する。
【背景技術】
【0002】
生体内の免疫系は、細菌、酵母、カビ、ウイルスなどによる感染や、腫瘍に対する防御、アレルギーの発症に重要な役割を果たしており、その防御機構の中心はリンパ球と抗原提示細胞である。リンパ球と抗原提示細胞は、抗原特異的または抗原非特異的に活性化され、異物を排除する能力を高める。リンパ球や抗原提示細胞の活性化において、インターロイキン12(以下、「IL−12」という。)は、ナチュラルキラー細胞(以下、「NK細胞」という。)やヘルパーT細胞に作用してインターフェロンγ(以下、「IFN−γ」という。)や腫瘍壊死因子α(以下、「TNF−α」という。)の産生を誘導し、抗原提示細胞を活性化すること、NK細胞およびCD8+T細胞の細胞障害活性を増強すること、インターロイキン2(以下、「IL−2」という。)と相乗的に作用して、細胞障害性リンパ球を活性化するとともにリンホカイン活性化キラー細胞を誘導すること、細胞性免疫を補助するヘルパーT細胞(Th0)のTh1タイプへの分化や、そのバランス(Th1/Th2)の制御にも関与していることが知られている。このようにIL−12は、自然免疫ならびに細胞性免疫の強化による感染防御、抗腫瘍活性またはアレルギー予防など免疫賦活作用を促進する点において重要な役割を担っている。また、インターロイキン10(以下、「IL−10」という。)は、主にTh2細胞や制御性T細胞、活性化B細胞、単球、肥満細胞からも産生される。IL−10は、主に単球系細胞に作用して炎症性サイトカインの産生を始めとする免疫機能を抑制性に制御するため、炎症の抑制に重要な役割を果たしている。
【0003】
一方、乳酸菌は、免疫賦活能を有することが知られており、これを摂取することにより生体の免疫活性を向上する作用が認められる。例えば、テトラジェノコッカス属、ペディオコッカス属またはロイコノストック属に属する乳酸菌を摂取することにより、IL−12の産生が促進される(例えば、特許文献1参照)。また、ビフィドバクテリウム属やラクトバチルス属、ストレプトコッカス属など乳酸菌8種類の合剤の経口摂取により、IL−10産生を促進し、潰瘍性大腸炎を緩和することが知られている。(例えば、非特許文献1参照)。このような乳酸菌の作用から、乳酸菌を摂取することは、生体内の免疫状態を良好に保つうえで有効な手段であるといえる。
【0004】
しかしながら、前記のような効果を発揮するためには、多量の菌体を摂取する必要があり、乳酸菌を含む免疫賦活組成物を提供する際に、煩雑な工程を経なければならず、高いコストを要する欠点がある。この欠点を補うために、カゼイン加水分解物を添加した培地を用いて乳酸菌を培養する方法(例えば、特許文献2参照)や、フコイダン加水分解物を乳酸菌に添加することで、乳酸菌の持つ免疫賦活能を増強させる方法(例えば、特許文献3参照)が提案されている。これらの方法により、ある程度高い免疫賦活能を有する乳酸菌を得ることができ、通年性アレルギー性鼻炎や花粉症、気管支喘息、アトピー性皮膚炎などのI型アレルギーの症状緩和が期待できる免疫賦活組成物を提供することができる。しかしながら、充分な免疫賦活能を有しているとは言えず、特に、IL−10産生が極端に低く、改善がみられないことから、炎症性疾患である潰瘍性大腸炎、クローン病、敗血症などを予防・改善する効果を得ることは難しいのが現状である。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】「医学のあゆみ Vol.228 No.3」2009年 p.227-232
【特許文献】
【0006】
【特許文献1】特開2006−028047号公報
【特許文献2】再表2006/073145号公報
【特許文献3】特開2007−039341号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、乳酸菌含量が低くとも高い免疫賦活能を有し、特に生体のIL−10およびIL−12産生を促進する免疫賦活組成物を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、特定の乳酸菌にワカメ由来のフコイダンを添加し、乳酸菌の有するIL−10およびIL−12産生促進効果を増強し、高い免疫賦活作用を示すことを見出し、本発明を完成した。すなわち本発明は、以下に関する。
1)ワカメ由来フコイダンおよびテトラジェノコッカス属、ペディオコッカス属もしくはラクトバチルス属の乳酸菌のいずれか1種または2種以上を含有することを特徴とする免疫賦活組成物。
2)前記1)記載の乳酸菌が、テトラジェノコッカス・ハロフィラスKK221(受託番号FERM BP−10987)である免疫賦活組成物。
3)前記1)〜2)記載の免疫賦活組成物に含まれる乳酸菌菌体重量1重量部に対し、フコイダン重量が0.1〜10重量部の範囲である免疫賦活組成物。
4)前記1)〜3)記載の免疫賦活組成物を有効成分とするIL−10産生促進剤。
【発明の効果】
【0009】
本発明により、乳酸菌菌体の含有量が低くても、高いIL−10およびIL−12産生促進効果を有する免疫賦活組成物を提供することができる。
【図面の簡単な説明】
【0010】
【図1】マクロファージを各乳酸菌で刺激し、フコイダンを添加した際のIL−12産生量を表す。
【図2】マクロファージをKK221で刺激し、フコイダンを添加した際のIL−10産生量を表す。
【図3】マクロファージをKK221で刺激し、フコイダンを添加した際のIL−12産生量を表す。
【図4】マクロファージをKK221で刺激し、フコイダンを添加した際の各サイトカイン産生量を表す。
【図5】フコイダン添加時のKK221貪食細胞の割合を表す。
【図6】脾臓細胞をKK221で刺激し、フコイダンを添加した際のIL−10産生量を表す。
【図7】脾臓細胞をKK221で刺激し、フコイダンを添加した際のIFN−γ産生量を表す。
【図8】フコイダン、KK221または両方を摂取した際のOVA特異的IgE量を表す。
【図9】フコイダン、KK221または両方を摂取した際の脾臓細胞からのIFN−γ産生量を表す。
【図10】フコイダン、KK221または両方を摂取した際の脾臓細胞からのIL−4産生量を表す。
【発明を実施するための形態】
【0011】
(乳酸菌)
本発明に用いられる乳酸菌は、テトラジェノコッカス属、ペディオコッカス属またはラクトバチルス属の乳酸菌である。その中でも、テトラジェノコッカス・ハロフィラスKK221株(受託番号FERM BP−10987;以下、「KK221」という。)は、後述する免疫賦活組成物の免疫賦活能が特に高いことから好ましい。当該乳酸菌にフコイダンを添加することで、極めて高いIL−10産生促進作用を有する免疫賦活組成物を得ることができる。
【0012】
(フコイダン)
フコイダンとは、コンブ、ワカメまたはモズク等の褐藻類の粘質物に多く含まれる含硫多糖の一種である。本発明に用いられるフコイダンは、ワカメ由来のフコイダンであり、後述する免疫賦活組成物としての効果が高く、安価である特徴を有する。ワカメからフコイダンを抽出する方法は、特に制限されることはないが、例えば、ワカメを酢酸または希塩酸の水溶液に懸濁させ、抽出を行う酸抽出法等、公知の方法を用いることができる。
【0013】
(免疫賦活組成物)
本発明の免疫賦活組成物は、前記乳酸菌および前記フコイダンを有効成分とする。また、免疫賦活組成物に含まれる乳酸菌菌体重量およびフコイダン重量の比率が、免疫賦活組成物の免疫賦活能を左右する大きな要因であり、乳酸菌菌体重量1重量部に対し、フコイダン重量が0.1〜10重量部であることが重要である。フコイダン重量が、当該範囲を下回る場合、IL−10、IL−12産生促進作用が低くなってしまう。一方、フコイダン重量を増やしていくと、IL−10産生促進作用に関しては、フコイダン濃度の増加に比例して高くなるものの、IL−12産生促進作用は、フコイダン濃度が一定濃度を越えるとかえって減少してしまう。また、IL−10の過剰産生によりI型アレルギーの症状改善効果を示さない可能性も考えられるため、IL−10およびIL−12双方の産生促進作用を考慮すると、前記濃度の範囲を上回る量のフコイダンを添加するのは好ましくない。本発明である免疫賦活組成物は、テトラジェノコッカス属、ペディオコッカス属およびラクトバチルス属の乳酸菌、ワカメ由来のフコイダンを一定濃度の範囲で含有することで、IL−10およびIL−12産生促進作用が共に高く、幅広い免疫賦活能を有することを最大の特徴とする。
【0014】
以下に本発明の実施例を記載するが、本発明はこれらに何ら限定されるものではない。
【実施例1】
【0015】
[フコイダンによるIL−12産生促進試験]
1.乳酸菌懸濁液の調製
MRS培地に各種乳酸菌(ペディオコッカス・ペントサセウスNRIC0099、ラクトバチルス・ペントサスNRIC0391、ラクトバチルス・カゼイ・サブスピーシーズ・カゼイNRIC0644、ラクトバチルス・ブレビスNRIC1038、ラクトバチルス・プランタラムNRIC1067、ラクトバチルス・ヘルベティカスNRIC1545、ラクトバチルス・デルブリュッキー・サブスピーシーズ・ラクティスNRIC1683、ラクトバチルス・デルブリュッキー・サブスピーシーズ・ブルガリカスNRIC1688、KK221)を1×107個/mlとなるようMRS培地に接種した。KK221は、食塩10%を含有するMRS培地に1×107個/mlとなるように接種した。それぞれを、30℃で48〜72時間静置培養し、95℃で10分間の煮沸殺菌を行った後、遠心濃縮機によって培地を除去して集菌した。生理食塩水にて菌体を洗浄後、細胞培養用のRPMI完全培地に2×107個/mlとなるように懸濁し、乳酸菌懸濁液を調製した。RPMI完全培地の組成は、25mM HEPES、100U/mL ペニシリン、100μg/mL ストレプトマイシン、50μM 2−メルカプトエタノール、2mM L−グルタミン酸加RPMI1640培地(Gibco社製)に非働化(56℃、30分)したFCS(Invitrogen社製)を10%添加したものである。
【0016】
2.フコイダン溶液の調製
ワカメ由来フコイダンをRPMI完全培地に0.8、4、8または40mg/mlとなるように溶解し、フコイダン溶液を調製した。
【0017】
3.IL−12産生促進試験
フコイダンによる乳酸菌のIL−12産生促進活性の増強作用を、マウス(6〜10週齢BALB/c、雄、チャールズリバー社)より採取・調製した腹腔滲出マクロファージ細胞を用いて評価した。
【0018】
(1)腹腔滲出マクロファージ細胞の採取および調製
チオグリコレート2mlを腹腔内に投与し、刺激したマウスから、投与3日後に無菌的に腹腔滲出マクロファージを採取した。採取したマクロファージを1%FBS溶液(Invitrogen社製)にて洗浄後、細胞数を測定し、RPMI完全培地で、2×106個/mlの濃度になるようマクロファージ細胞溶液を調製した。調製したマクロファージ細胞溶液を用いて、96ウェル組織培養プレートに1ウェル当たり100μl(2×105個/ウェル)播種した。これに、前記の乳酸菌懸濁液を、1ウェル当たりそれぞれ50μl(1×106個/ウェル)加えた。一方、対照群として、乳酸菌菌体を添加していないRPMI完全培地を1ウェル当たり50μl加えた。次に、前記のフコイダン溶液を、実験群、対照群ともに1ウェル当たりそれぞれ50μl(最終濃度0.2、2または10μg/ml)加えた。該プレートを、37℃の5%炭酸ガス培養器内で培養し、培養開始後24時間の培養上清を回収した。
【0019】
(2)IL−12産生促進活性の測定
上記の工程により回収した培養上清中のIL−12濃度を、エンザイムイムノアッセイで測定した。なお、エンザイムイムノアッセイは、下記の工程に従い、測定を行った。
【0020】
ラット抗マウスIL−12抗体(BD Pharmingen社製)が2μg/mlとなるよう、0.2M、pH6.0のリン酸緩衝液を用いて調製した溶液を、96ウェル組織培養プレート1ウェル当たり100μl加え、室温で一晩静置後、ラット抗IL−12抗体を各ウェルに付着させたプレートを調製した。当該プレートに1ウェル当たり100μlの培養上清を加え、室温で90分間静置し、培養上清中のマウスIL−12を、プレートに付着させたラット抗マウスIL−12抗体と結合させた。洗浄後、ラットビオチン化抗マウスIL−12抗体(BD Pharmingen 社製)を加え、前記マウスIL−12に結合させた。洗浄後、ストレプトアビジンで標識したペルオキシダーゼ酵素(Vector 社製)を加え、ラットビオチン化抗マウスIL−12抗体中のビオチンに結合させた。発色は、TMB基質溶液(Moss/コスモバイオ社製)を1ウェル当たり100μl加え、室温で20分間反応させることで行った。反応を、0.5N塩酸で停止後、マイクロプレートリーダー(TECAN社製)を用いて450nmにおける吸光度を測定し、リコンビナントマウスIL−12(BD Pharmingen社製)により作成した標識曲線から、培養上清中のIL−12の濃度を求めた。この結果を図1に示す。
【0021】
図1に示すとおり、各乳酸菌にフコイダンを添加することで、マクロファージのIL−12産生促進が増強されることが確認された。一方、フコイダンの添加量が多くなると、マクロファージのIL−12産生促進が増強された後に、産生量が低下することが確認された。この結果により、乳酸菌にフコイダンを添加することで、マクロファージによる菌体貪食が促進され、IL−12産生促進活性が増強されることが示唆された。
【実施例2】
【0022】
[乳酸菌およびフコイダンの最適な重量比の検討1]
免疫賦活組成物が高い免疫賦活能を有するために乳酸菌およびフコイダンの最適な重量比の検討を行った。実施例1に記載の方法に従い、2×106個/mlマクロファージ細胞溶液を調製し、96ウェル平底プレート(BD FALCON社製)に、1ウェルあたり該マクロファージ細胞溶液を100μl(2×105個/ウェル)播種した。次に、KK221を用いて50μg/mlの濃度となるよう乳酸菌懸濁液を調製し、1ウェルあたり該乳酸菌懸濁液50μl(2.5μg/ウェル)を添加した。さらに、4、8または40μg/mlのフコイダン溶液を調製し、1ウェルあたり50μl(0.2、0.4または2μg/ウェル)を添加した。24時間培養後、培養上清中のIL−10濃度を測定した。IL−10濃度は、マウスIL−10 ELISA KIT(BD Pharmingen社製)を用いて、実施例1に記載の方法に従い測定した。この結果を図2に示す。
【0023】
図2に示すとおり、乳酸菌にフコイダンを添加することにより、マクロファージのIL−10産生が、フコイダンの濃度依存的に促進されることが確認された。なお、IL−10産生促進作用が確認された際の、乳酸菌およびフコイダンの重量比は、乳酸菌菌体重量1重量部に対し、フコイダン重量0.08重量部であった。このことから、フコイダン重量が0.1重量部以上であれば、乳酸菌によるIL−10産生が充分に促進されると考えられる。
【実施例3】
【0024】
[乳酸菌およびフコイダンの最適な重量比の検討2]
実施例1に記載の方法に従い、2×106個/mlマクロファージ細胞溶液を調製し、96ウェル平底プレート(BD FALCON社製)に、1ウェルあたり該マクロファージ細胞溶液を100μl(2×105個/ウェル)播種した。次に、KK221を用いて8μg/mlの濃度となるよう乳酸菌懸濁液を調製し、1ウェルあたり該乳酸菌懸濁液50μl(0.4μg/ウェル)を添加した。さらに、0.8、8、40または80μg/mlのフコイダン溶液を調製し、1ウェルあたり50μl(0.04、0.4、2または4μg/ウェル)を添加した。24時間培養後、培養上清中のIL−12濃度を、実施例1に記載の方法に従い測定した。結果を図3に示す。
【0025】
図3に示すとおり、乳酸菌菌体重量1重量部に対し、フコイダン重量が0.1〜10重量部の範囲において、マクロファージのIL−12産生が促進され、フコイダン重量が1重量部において、IL−12産生促進の効果は最大となった。
実施例2、3の結果により、乳酸菌菌体重量1重量部に対し、フコイダン重量が0.1〜10重量部の範囲である免疫賦活組成物は、IL−12産生およびIL−10産生の双方が促進され、相乗的に作用することにより、I型アレルギーの症状改善や炎症性疾患である潰瘍性大腸炎等の症状緩和に効果を有することが期待される。
【実施例4】
【0026】
[フコイダンによる乳酸菌のサイトカイン産生促進作用]
実施例1に記載の方法と同様に、マクロファージ細胞溶液、KK221の乳酸菌懸濁液、フコイダン溶液を調製し、培養24時間後の培養上清中のTNF−α濃度およびIL−6濃度を測定した。TNF−α濃度およびIL−6濃度は、マウスTNF ELISA KIT(BD Pharmingen社製)、マウスIL−6 ELISA KIT(BD Pharmingen社製)を用いて、実施例1に記載の方法に従い測定した。この結果を図4に示す。
図4に示すとおり、KK221にフコイダンを添加することにより、マクロファージの各サイトカインの産生が促進されることが確認された。この結果は、乳酸菌にフコイダンを添加することにより、乳酸菌の免疫賦活作用が増強されたことを示唆している。
【実施例5】
【0027】
[マウスマクロファージを用いたフコイダンによる乳酸菌の貪食促進作用]
1.乳酸菌懸濁液の調製
実施例1に記載の方法と同様に、菌体を調製後、1mlの菌体懸濁液に10mg/mlのFITC溶液(同仁化学研究所製)を10μl添加し、30℃で1時間インキュベートを行った。その後、生理食塩水にて菌体を3回洗浄し、最後に4×106個/mlとなるようにRPMI完全培地に懸濁した。
【0028】
2.フコイダン溶液の調製
実施例1に記載の方法と同様に調製した。
【0029】
3.菌体貪食促進作用の評価
マウス(6〜10週齢BALB/c、雄、チャールズリバー社)より採取、調製した腹腔滲出マクロファージ細胞を用いて、菌体貪食促進作用を評価した。マクロファージ細胞溶液は実施例1に記載の方法と同様に調製した。24ウェル平底プレート(BD FALCON社製)に、マクロファージ細胞溶液、前記の乳酸菌懸濁液(1×106個/ウェル)、前記のフコイダン溶液(最終濃度0.2、1、2または10μg/ml)を、1ウェル当たりそれぞれ250μl加えた。対照群として、乳酸菌懸濁液(1×106個/ウェル)を添加したRPMI完全培地を、1ウェル当たり250μl加えた。37℃にて、5%炭酸ガス培養器内で培養し、培養開始4時間後に培養上清を除き、生理食塩水にて2回洗浄後、トリプシン処理を行い、細胞を回収した。回収した細胞をFACScan(BD Bioscience社製)により解析し、FITC陽性の細胞を菌体貪食細胞とし、その割合を算出した。この結果を図5に示す。
【0030】
図5に示すとおり、フコイダンの濃度依存的に、マクロファージの菌体貪食率が上昇していることが確認された。この結果により、実施例1〜4において確認された乳酸菌のサイトカイン産生の促進が、フコイダンがマクロファージの菌体貪食作用を促進したことに由来するものであることが示唆された。
【実施例6】
【0031】
[マウス脾臓細胞を用いたフコイダンと乳酸菌によるIL−10産生促進作用およびIL−12を介したインターフェロンγ(IFN−γ)産生促進作用]
マウス(6〜10週齢BALB/c、雄、チャールズリバー社)より脾臓を採取後、400ユニット/mlのタイプ1コラゲナーゼ(シグマ社製)含有RPMI1640培地(Gibco社製)で攪拌、細胞の懸濁を行い、マウス脾臓細胞を回収した。その後、RPMI完全培地に、マウス脾臓細胞の濃度が5×106個/mlとなるように懸濁し、脾臓細胞懸濁液を調製した。乳酸菌懸濁液は、実施例1に記載の方法に従い乳酸菌の濃度が5×106個/mlとなるように調製した。96ウェル平底プレート(BD FALCON社製)に脾臓細胞懸濁液を100μl、乳酸菌懸濁液を100μl、フコイダン溶液を50μl(フコイダンの終濃度0、0.2、1、2または10μg/ml)添加し、37℃の5%炭酸ガス培養器内で48時間培養した(抗体無添加群)。また、IFN−γ産生に対するIL-12の関与について検討するために、培養液中に、IL-12中和抗体添加群として抗マウスIL-12中和抗体(BD Pharmingen社製)を、コントロール抗体添加群として抗ラットIgG2a抗体(BD Pharmingen社製)を、終濃度10μg/mlとなるように加えたものを調製した。
【0032】
培養後、15,00rpmで5分間遠心分離を行い、上清を回収し、抗体無添加群についてはIL−10濃度およびIFN−γ濃度を、抗マウスIL-12中和抗体添加群およびコントロール抗体添加群についてはIFN−γ濃度を、実施例1、2に記載の方法に従い測定した。なお、IFN−γ濃度の測定は、抗マウスIFN−γ抗体(BD Pharmingen社製)を用いたエンザイムイムノアッセイにより実施した。この結果を図6、7に示す。なお、有意差検定(T検定)は、抗マウスIL-12中和抗体添加群をコントロール抗体添加群に対し行なった。
【0033】
図6に示すとおり、IL-10産生は、フコイダン濃度依存的に促進することが確認された。
【0034】
図7に示すとおり、IFN−γ産生は、フコイダン濃度依存的に促進することが確認された。また、抗マウスIL-12中和抗体を添加することにより、IFN−γ産生が抑制されたことから、フコイダンによるIFN−γ産生の促進作用は、IL−12を介した作用であることが示唆された。
【実施例7】
【0035】
[乳酸菌とフコイダンを併用することによるマウスの抗原特異的IgEの上昇抑制効果]
6週齢のBALB/cマウス(雄)を用いて、KK221、フコイダンまたはその両方の連続強制経口投与を行い、KK221とフコイダンを投与することによるマウスの抗原特異的IgEの上昇抑制効果を調べた。オボアルブミン(OVA)感作を行い、アレルギーを誘導することで、乳酸菌摂取が血中OVA特異的IgE量、脾臓細胞のサイトカイン産生能に及ぼす影響を調べた。OVA感作は試験開始0日目、14日目に、下記の方法に従い実施した。
【0036】
1.OVA感作
試験開始0日目から20日目までの21日間、前記マウスに、フコイダン溶液が25mg/mlとなるよう生理食塩水に懸濁した溶液0.2ml(5mg/日)またはKK221が2×109個/mlとなるよう生理食塩水に懸濁した溶液0.2ml(4×108個/日)を摂取させた。また、フコイダン溶液が5mg/ml(1mg/日)およびKK221が2×109個/ml(4×108個/日)となるよう生理食塩水に懸濁した低用量フコイダン・乳酸菌溶液0.2ml、フコイダン溶液が25mg/ml(5mg/日)およびKK221が2×109個/ml(4×108個/日)となるよう生理食塩水に懸濁した高用量フコイダン・乳酸菌溶液0.2mlを、実験群としてマウスに投与した。対照群として、何も添加しない生理食塩水0.2mlを摂取させた。試験開始0日目および14日目に、OVA(GradeV;シグマ社製)20μg/生理食塩水0.2mlとなるように調製した試薬を、または、水酸化アルミニウム(和光純薬工業社製)2mg/生理食塩水0.2mlとなるように調製した試薬を、腹腔内にそれぞれ0.2ml投与した。試験開始21日目にマウスより脾臓および血液を採取し、血清中のOVA特異的IgE量、脾臓由来のIFN−γおよびIL−4産生量を測定した。
【0037】
2.血中のOVA特異的IgE量の測定
試験開始21日目に採血を行い、1500rpmで30分間遠心を行い、血清を得た。血清中のOVA特異的IgE量をエンザイムイムノアッセイにより測定した。詳しくは、OVA(シグマ社製、GradeV)を50μg/mlとなるように1M炭酸水素ナトリウム緩衝液 (pH8.2)に溶解し、96ウェルプレートに50μl/ウェルでコーティングした。その後、血清サンプルを100倍希釈し、プレート上に50μlずつ分注し、1時間インキュベートした。洗浄後、抗マウスIgE抗体(BD Pharmingen社製)を1%BSA加0.05%Tween含有リン酸緩衝液500倍希釈した溶液で1時間インキュベートした。洗浄後、ストレプトアビジンで標識したペルオキシダーゼ酵素(Vector社製)を加え、ビオチンと結合させた。発色は、TMB基質溶液(Moss/コスモバイオ社製)を1ウェル当たり100μl加え、室温で20分間反応させることで行った。反応を0.5N塩酸で停止し、マイクロプレートリーダー(TECAN社製)で、450nmにおける吸光度を測定し、OVA感作を行った対照群の値に対する相対値を算出し、OVA特異的IgE量を定量化した。この結果を、図8に示す。なお、有意差検定は分散分析後、ダンカン法により行なった。
【0038】
図8に示すとおり、マウスにKK221を摂取させると、血中OVA特異的IgE量が低下することが確認された。また、低用量フコイダン・乳酸菌溶液および高用量フコイダン・乳酸菌溶液を摂取させたマウスにおいても、同様の効果が確認された。
【0039】
3.脾臓細胞から産生されるIFN−γの測定
試験開始21日目に脾臓を採取後、メッシュにより脾臓をすり潰し、細胞の懸濁を行い、脾臓細胞を回収した。その後、24ウェル平底プレート(BD FALCON社製)を用い、OVA(シグマ社製、GradeV)を100μg/ml含む10%FBS(JRH)加RPMI1640培地において脾臓細胞を1×107個/mlの濃度で懸濁後、3日間培養を行った。培養後、1,500rpmで5分間遠心を行い、上清を回収し、エンザイムイムノアッセイによりIFN−γ濃度を測定した。エンザイムイムノアッセイは、実施例7と同様の方法で行なった。この結果を、図9に示す。なお、有意差検定は、分散分析後、ダンカン法により行なった。
【0040】
図9に示すとおり、フコイダン・乳酸菌溶液を摂取させることにより、マウスの脾臓細胞由来のIFN−γ産生量が増加し、その効果は低用量フコイダン・乳酸菌溶液において最も高いことが確認された。
4.脾臓細胞から産生されるIL−4の測定
上記の培養上清中に産生されたIL−4濃度をエンザイムイムノアッセイにより測定した。詳しくは抗マウスIL−4抗体(BD Pharmingen社製)を2μg/mlとなるように1M炭酸水素ナトリウム緩衝液(pH9.5)に溶解し、96ウェルプレートに50μl/ウェルでコーティングした。その後、上清サンプルをプレート上に50μlずつ分注し、1時間インキュベートした。洗浄後、ビオチン標識抗IL−4マウス抗体(BD Pharmingen社製)を1%BSA加0.05%Tween含有リン酸緩衝液500倍希釈した溶液で1時間インキュベートした。洗浄後、ストレプトアビジンで標識したペルオキシダーゼ酵素(Vector社製)を加え、ビオチンと結合させた。発色は、TMB基質溶液(Moss/コスモバイオ社製)を1ウェル当たり100μl加え、室温で20分間反応させることで行った。反応を0.5N塩酸で停止し、マイクロプレートリーダー(TECAN社製)を用いて450nmにおける吸光度を測定し、リコンビナントマウスIL−4(BD Pharmingen社製)で作成した標識曲線から、培養上清中のIL−4の濃度を求めた。この結果を、図10に示す。なお、有意差検定は分散分析後、ダンカン法により行なった。
【0041】
図10に示すとおり、低用量フコイダン・乳酸菌溶液を摂取させることにより、マウスの脾臓由来のIL−4産生量が抑制された。
【0042】
上記の結果より、抗原に対する脾臓細胞の応答は、低用量フコイダン・乳酸菌溶液を摂取させたマウスにおいて最も改善されたことが確認された。この結果により、本発明である免疫賦活組成物が、生体においても高い免疫賦活能を有していることを示唆された。
【特許請求の範囲】
【請求項1】
ワカメ由来フコイダンおよびテトラジェノコッカス属、ペディオコッカス属もしくはラクトバチルス属の乳酸菌のいずれか1種または2種以上を含有することを特徴とする免疫賦活組成物。
【請求項2】
請求項1記載の乳酸菌が、テトラジェノコッカス・ハロフィラスKK221(受託番号FERM BP−10987)である免疫賦活組成物。
【請求項3】
請求項1〜2記載の免疫賦活組成物に含まれる乳酸菌菌体重量1重量部に対し、フコイダン重量が0.1〜10重量部の範囲である免疫賦活組成物。
【請求項4】
請求項1〜3記載の免疫賦活組成物を有効成分とするIL−10産生促進剤。
【請求項1】
ワカメ由来フコイダンおよびテトラジェノコッカス属、ペディオコッカス属もしくはラクトバチルス属の乳酸菌のいずれか1種または2種以上を含有することを特徴とする免疫賦活組成物。
【請求項2】
請求項1記載の乳酸菌が、テトラジェノコッカス・ハロフィラスKK221(受託番号FERM BP−10987)である免疫賦活組成物。
【請求項3】
請求項1〜2記載の免疫賦活組成物に含まれる乳酸菌菌体重量1重量部に対し、フコイダン重量が0.1〜10重量部の範囲である免疫賦活組成物。
【請求項4】
請求項1〜3記載の免疫賦活組成物を有効成分とするIL−10産生促進剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2010−235528(P2010−235528A)
【公開日】平成22年10月21日(2010.10.21)
【国際特許分類】
【出願番号】特願2009−86210(P2009−86210)
【出願日】平成21年3月31日(2009.3.31)
【出願人】(000004477)キッコーマン株式会社 (212)
【出願人】(390010674)理研ビタミン株式会社 (236)
【Fターム(参考)】
【公開日】平成22年10月21日(2010.10.21)
【国際特許分類】
【出願日】平成21年3月31日(2009.3.31)
【出願人】(000004477)キッコーマン株式会社 (212)
【出願人】(390010674)理研ビタミン株式会社 (236)
【Fターム(参考)】
[ Back to top ]

