L−リシン生産能が向上した微生物及びこれを用いたL−リシン生産方法
本発明は、内在的活性に比べて弱化されたグルコン酸キナーゼ活性を有するL−リシン生産微生物、前記微生物を製造する方法及び前記微生物を用いてL−リシンを生産する方法に関するものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、高いL−リシン生産能を有する微生物及びこれを用いたL−リシン生産方法に関するものである。
【背景技術】
【0002】
L−リシンは、オキサロ酢酸からリシン生合成経路を介して合成される。L−リシンの生合性に重要な酵素などは、アスパラギン酸セミアルデヒドデヒドロゲナーゼ、ジヒドロジピコリン酸レダクターゼ及びジアミノピメリン酸デヒドロゲナーゼであって、それぞれ遺伝子asd、dapB及びddhによってエンコードされ、リシン生合成経路の部分などを仲裁するNADPH依存的レダクターゼなどである。この経路で1分子のL−リシン生産は、前記酵素などによって3分子のNADPHの消耗を直接的に要求し、1分子のNADPHは間接的に用いられる。コリネバクテリウム・グルタミクム細胞(Corynebacterium glutamicum cell)内でNADPHの再生とL−リシン生合成との間の直接的な連関性は既に報告されたことがある(Wittmann and Heinzle, Microbiol 68:5843−5849, 2002; Marx et al., J Biotechnol 104:185−197, 2003; Ohnishi et al., Microbiol Lett 242:265−274, 2005)。
【0003】
コリネバクテリウムでNADPHの主要供給経路は、TCAサイクルとペントースリン酸経路である。L−リシン生産のために必要な還元力は、ペントースリン酸経路の酸化経路を介して供給されるのが好ましい。ペントースリン酸経路は、2つサイクルの作動が2つのNADPH分子の伴われる生産とともに1つのCO2分子を排出するので、炭素代謝効率面から経済的により有利である一方、1つのTCAサイクル当り1つのNADPH分子の伴われる生産とともに2つのCO2分子が排出される。従って、L−リシンのより高い収率は、NADPHのより多い供給を要求し、これによってペントースリン酸経路に対する依存度が高くなるようになる。
【0004】
全てペントースリン酸経路に関与された、グルコース−6−リン酸デヒドロゲナーゼ(G6PDH)及び6−ホスホグルコン酸デヒドロゲナーゼ(6PGD)がL−リシンの生産と関連されていることが報告された(Marx et al., Biotechnol Bioeng 56:168−180, 1997; Wittmann and Heinzle, Microbiol 68:5843−5849, 2002)。
【0005】
L−アミノ酸生産コリネバクテリウム菌株において、ペントースリン酸経路でNADPH生成を果たす遺伝子発現酵素が強化された際に、または酵素が変異された際にL−アミノ酸生産能が増加されることが報告されたことがあった。例えば、J.Beckerらは、L−リシン生産コリネバクテリウム・グルタミクムでG6PDHをエンコードするzwf遺伝子のさらに強いプローモータの提供がリシン生産量で著しい増加を招くことを報告した(J. Becker et al., J Biotechnol 132: 99−109, 2007)。ヨーロッパ特許第1302537号には、変異型6PGDをコード化する遺伝子が導入されたL−アミノ酸生産コリネバクテリアを培養してL−アミノ酸を生産する方法が開示されている。
【0006】
しかし、コリネバクテリウムの内在的グルコン酸キナーゼ(GntK)活性弱化を介してペントースリン酸経路におけるNADPH生合成が増加されたコリネバクテリア属微生物に対しては、従来の文献などに開示されたところがない。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Wittmann and Heinzle, Microbiol 68:5843−5849, 2002
【非特許文献2】Marx et al., J Biotechnol 104:185−197, 2003
【非特許文献3】Ohnishi et al., Microbiol Lett 242:265−274, 2005
【非特許文献4】Marx et al., Biotechnol Bioeng 56:168−180, 1997
【非特許文献5】J. Becker et al., J Biotechnol 132: 99−109, 2007
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明者らは、L−リシンを高効率、高収率で生産するための方法を見つけるために鋭意努力した結果、酸化的ペントースリン酸経路での遺伝的変形によるNADPH生産の増加がL−リシンの生産量を増加させ得ることを確認した。
【課題を解決するための手段】
【0009】
従って、本発明の目的は、内在的活性に比べて弱化されたグルコン酸キナーゼ(GntK)活性を有するL−リシン生産微生物を提供することである。
【0010】
本発明の他の目的は、全体または部分的にポリヌクレオチドを変異させることによって弱化された活性を有するグルコン酸キナーゼ(GntK)をエンコードするポリヌクレオチド断片を構成する段階;宿主細胞で染色体の相同組換えを行うことができるベクターに前記収得したポリヌクレオチド断片を挿入して組換えベクターを収得する段階;前記収得した組換えベクターをL−リシンを生産することができる宿主細胞に導入して相同組換え体を収得する段階;及び前記相同組換え体から内在的活性に比べて弱化されたGntKの活性を有する菌株を選抜する段階を含む前記L−リシン生産微生物の製造方法を提供することである。
【0011】
本発明のまた他の目的は、本発明の微生物を培養して細胞培養物を収得する段階;及び前記細胞培養物または微生物からL−リシンを回収する段階を含むL−リシンの生産方法を提供することである。
【発明の効果】
【0012】
本発明は、コリネバクテリウム菌株でNADPHの細胞内水準を増加させることによって、生合成のためにNADPHを必要とするL−アミノ酸、特に、L−リシンを高効率及び高収率で生産することができる。
【図面の簡単な説明】
【0013】
本発明の目的、特徴、局面、及び利点は、以下の詳細な説明と添付図面とによって、より明白となる。
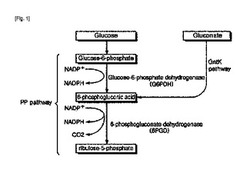
【図1】図1は、コリネバクテリウム・グルタミクムのペントースリン酸経路を示した概略図である。
【図2】図2は、コリネバクテリウムの染色体NCgl2399遺伝子のマーカー−フリー欠損用pDZ−ΔNCgl2399ベクターを示した概略図である。
【図3】図3は、コリネバクテリウムの染色体NCgl2905遺伝子のマーカー−フリー欠損用pDZ−ΔNCgl2905ベクターを示した概略図である。
【発明を実施するための形態】
【0014】
前記目的を達成するための一つの態様として、本発明は、内在的活性に比べて弱化されたグルコン酸キナーゼ(GntK)活性を有するL−リシン生産微生物を提供する。
【0015】
用語“L−リシン”とは、NH2(CH2) 4CH(NH2)COOHの化学式を有する塩基性α−アミノ酸である。体内で合成できない必須アミノ酸である。L−リシンは、オキサロ酢酸から一部がNADPH依存性還元酵素によって触媒されるリシン生合成経路を介して合成される。この経路を介して1分子のL−リシン生合成は、酵素による3分子のNADPHの直接的消耗と、1分子のNADPHの間接的使用を要求する。
【0016】
本発明で使用された用語、“グルコン酸キナーゼ(GntK)”とは、微生物のペントースリン酸経路の酸化過程中間体である6−ホスホグルコン酸を生産するGntK経路に関与する酵素を意味する。コリネバクテリウム属の微生物は、ペントースリン酸経路の酸化過程の中間体である6−ホスホグルコン酸を合成するために、2つの経路、すなわち、G6PDH及びGntK経路の両方を運用し(図1)、これは、コリネバクテリウム属の微生物がGntK経路を介してグルコースを部分的に分解することができるということを意味する。前記GntK経路の遮断が6−ホスホグルコン酸への炭素供給を遮断し、炭素フラックスを6−ホスホグルコン酸からペントースリン酸化過程に転換できるという仮定で、本発明者らはGntK経路の遮断が6−ホスホグルコン酸デヒドロゲナーゼ(6PGD)の活性で特異的増加を生じるから、よって、NADPHの再生が増加することを提示する。そこで、微生物内でグルコン酸キナーゼ(GntK)として作用するものとして推定される酵素の活性を弱化させる。
【0017】
好ましくは、グルコン酸キナーゼ(GntK)活性を有する酵素は、配列番号1のアミノ酸配列で表されるNCgl2399または配列番号2のアミノ酸配列で表されるNCgl2905であり得る。
【0018】
本発明で使用された用語、“内在的活性”とは、自然型微生物における酵素の活性を意味し、特に、GntKと組み合わせて使用される際に、自然型微生物が示すGntKの活性を意味する。
【0019】
用語、“内在的活性弱化”は、前記ポリヌクレオチド配列全体または一部の欠損、前記ポリヌクレオチド配列一部の置換または前記ポリヌクレオチド配列内へ少なくとも一つの塩基対の挿入から構成される群から選択される一つの方法で、微生物で内在的タンパク質をエンコードするポリヌクレオチドを含む染色体上で達成することができる。また、発現調節要素の全体または一部の欠損、置換または挿入によって突然変異がなされる前記ポリヌクレオチド配列に対する調節要素を変異させることによって、内在的活性が弱化され得る。前記発現調節要素は、染色体上のポリヌクレオチド配列の上部または下部に位置することができ、好ましくは、調節要素はプローモーター、 エンハンサーなどであるが、本発明はこれに制限されない。前記ポリヌクレオチドの変異は、相同組換えのように周知の方法を使用して達成することができる。
【0020】
本発明で使用された用語、“内在的活性に比べて弱化されたGntK活性”は、
破裂のような遺伝子変異によってGntK活性が下向調節され、よって、天然型微生物での酵素の内在的活性より低くなることを意味する。本発明の一例において、本発明は図2または図3の開裂地図で表される組換えベクターの導入を介してGntK活性を妨害することにより増加されたL−リシン生産能を有するコリネバクテリウム属の微生物を提供する。
【0021】
グルコン酸キナーゼ活性を有し、互いに異なるアミノ酸配列を有するタンパク質をコードする2つまたはそれ以上の染色体遺伝子が存在する場合、内在的GntK活性は、少なくとも1つの染色体遺伝子上で全体または一部の欠損、置換または挿入によって弱化され得る。また、少なくとも1つの染色体遺伝子に対する調節要素上で全体または一部の欠損、置換または挿入を介して内在的GntK活性が弱化され得る。
【0022】
好ましくは、ヌクレオチドの欠損、置換または挿入による変異がNCgl2399またはNCgl2905をエンコードする遺伝子、または、それぞれNCgl2399とNCgl2905をエンコードする配列番号3と4のヌクレオチド配列を有する遺伝子のうち、1つまたは2つのいずれで、またはそれらの調節要素上で生じるように許容され、GntKが正常的に機能しないこともある。
【0023】
本発明において、グルコン酸キナーゼをエンコードする遺伝子の一部を含む組換えベクターを導入して内在的グルコン酸キナーゼ遺伝子を欠損または突然変異させることによって、内在的活性に比べて弱化されたグルコン酸キナーゼ活性を有する微生物を製造することができる。前記一部遺伝子の染色体内への挿入は、周知の方法、例えば、相同組換えによって達成することができる。
【0024】
このような観点で、本発明は、1)ポリヌクレオチドの全体または一部の配列が変異されて弱化された活性を有するグルコン酸キナーゼ(GntK)をエンコードするポリヌクレオチド断片を構成する段階;2)組換えベクターを提供するために宿主細胞で染色体と相同組換えできるベクターに前記収得したポリヌクレオチド断片を挿入する段階;3)相同組換え体を形成するために前記収得した組換えベクターをL−リシンを生産することができる宿主細胞に導入する段階;及び4)前記相同組換え体の中からGntKの活性が内在的活性に比べて弱化された菌株を選抜する段階を含むL−リシン生産微生物の製造方法を提供する。
【0025】
本発明で使用された用語、“組換えベクター”とは、宿主細胞の染色体から分離されて複製できないベクターであって、一般に、染色体と外部遺伝子との相同組換えを許容する必須的な要素を含む遺伝子構造物を意味する。組換えベクターは、抗生剤耐性遺伝子とレバンスクラーゼ(sacB)遺伝子のような選抜遺伝子を含むことができる。好ましくは、本発明では、図2または図3の開裂地図によって表される組換えベクターが使用され得る。
【0026】
L−リシンが生産できる限り、どのような菌株でも組換えベクターを導入させる宿主細胞として制限なく使用され得る。好ましくは、コリネバクテリウム属またはブレビバクテリウム属の微生物である。本発明において有用な宿主細胞の例としては、コリネバクテリウム・グルタミクムATCC13032、コリネバクテリウム・グルタミクム、コリネバクテリウム・テルモアミノゲネス(thermoaminogenes)FERM BP−1539、ブレビバクテリウム・フラバム(Brevibacterium flavum)ATCC14067、及びブレビバクテリウム・ラクトファーメンタム(lactofermentum)ATCC13869、及びそれらから誘導されたL−アミノ酸生産突然変異体または菌株、例えば、コリネバクテリウム・グルタミクムKFCC10881、コリネバクテリウム・グルタミクムKFCC11001、及びコリネバクテリウム・グルタミクムKCCM10770Pが含まれることができる。好ましくは、コリネバクテリウム・グルタミクムKFCC10881であり得る。本発明の具体的な実施態様では、コリネバクテリウム・グルタミクムKFCC10881が使用されたが、本発明がこれに制限されるのではない。
【0027】
本発明の一実施態様では、コリネバクテリウム・グルタミクム内で複製することなく標的遺伝子のマーカー−フリー欠損を行うことができるpDZベクター(韓国特許第0924065号に開示)を用いて前記遺伝子などを欠損させた。すなわち、前記pDZベクターにそれぞれNCgl2399またはNCgl2905をエンコードする遺伝子などの一部分を有した組換えベクターを構成した後、L−リシンを生産するコリネバクテリウムの菌株に形質転換させ、弱化されたグルコン酸キナーゼ活性を有するL−リシン生産用コリネバクテリウム菌株を製作するためにゲノムと相同組換えを行うように許容した。
【0028】
本発明では、NCgl2399をエンコードする遺伝子の一部をpDZベクターに挿入させて組換えベクター構成し、pDZ−ΔNCgl2399と命名し、これをコリネバクテリウム菌株に形質転換させた。NCgl2399をエンコードする遺伝子が破壊された組換えコリネバクテリウム菌株をKFCC10881−ΔNCgl2399と命名した。別に、pDZ−ΔNCgl2905と命名したNCgl2905をエンコードする遺伝子の一部を含む組換えpDZベクターをコリネバクテリウム菌株に形質転換させた。NCg12905をエンコードする染色体遺伝子が破壊された組換え菌株をKFCC10881−ΔNCgl2905と命名した。さらに、前記KFCC10881−ΔNCgl2399を組換えプラスミドpDZ−ΔNCgl2905を形質転換させてNCgl2399及びNCgl2905遺伝子が同時に欠損された変異菌株を提供した。これをコリネバクテリウム・グルタミクムCA01−0892と命名し、2010年6月24日付で韓国微生物保存センターに寄託して受託番号KCCM11085Pを受けた。
【0029】
さらに、本発明の一実施態様では、前記組換えコリネバクテリウム・グルタミクム菌株を細胞内グルコン酸キナーゼ活性とNADPH水準に対して評価した。NCgl2399遺伝子が欠損された菌株、及びNCgl2399とNCgl2905遺伝子とが同時に欠損された菌株の細胞内GntKの活性は、母菌株に比べて減少していることが観察された。なお、細胞内のNADPH濃度水準及び6PGD活性は、母菌株に比べて増加していることが観察された(表2)。結果的に、前記製作された菌株などのリシン生産量は母菌株に比較して増加していることが観察された(表3)。
【0030】
前記の結果は、内在的活性以下のグルコン酸キナーゼ活性の弱化は、6PGDの活性を増加させ、これは、NADPH生産に肯定的効果を持つことによって、結果的に、L−リシンを高効率及び高収率で生産することができるということを意味する。また、グルコン酸キナーゼ活性を有するタンパク質が2つまたはそれ以上の異なる遺伝子によってエンコードされる場合、2つまたはそれ以上の遺伝子を欠損させることによって、より高いL−リシン生産能を得ることができる。従って、本発明のL−リシン生産微生物は、高効率及び高収率でL−リシンを生産するために使用することができる。
【0031】
また他の一つの態様として、本発明は、1)本発明の微生物を培養して細胞培養物を収得する段階;及び2)前記細胞培養物または微生物からL−リシンを回収する段階を含むL−リシンの生産方法を提供する。
【0032】
本発明で使用された用語、“培養”は、微生物を人工的に調節した条件下で生育させることを意味する。本発明の組換え体を培養することは、当業界の周知の様々な方法を用いて行うことができる。前記細胞は、バッチ工程または注入バッチまたは反復注入バッチ工程などの連続式工程で培養され得るが、本発明がこれに制限されるのではない。
【0033】
培養に使用される培地は、適切な方式で使用される菌株の要件を満たさなければならない。コリネバックテリア菌株培養に使用するための適した培地は当業界で公知されている(例えば、Manual of Methods for General Bacteriology, American Society for Bacteriology, Washington D.C., USA, 1981)。培養培地の炭素源は、例えばグルコース、スクロース、ラクトース、フルクトース、マルトース、澱粉、及びセルロースのような糖類、及び炭水化物;大豆油、ヒマワリ種子油、落花生油、及びヤシ油などのようなオイル及び脂肪;パルミチン酸、ステアリン酸、及びリノール酸のような脂肪酸;グリセロール、及びエタノールのようなアルコール;酢酸のような有機酸であり得る。これらの物質は、個別的にまたは組み合わせて使用され得る。組換え体培養に有用な窒素源の例としては、ペプトン、酵母エキス、肉汁、麦芽エキス、トウモロコシ浸漬液、大豆粕及び尿素または無機化合物、例えば、硫酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、炭酸アンモニウム及び硝酸アンモニウムを含む。これらの窒素源も個別的にまたは組み合わせて使用され得る。培養培地に使用され得るリン源としては、リン酸水素二カリウム、リン酸二水素カリウム及び相応するナトリウム塩がある。また、培養培地は、細胞成長に必要な金属塩を含むことができ、アミノ酸及びビタミンのような必須栄養素で補充することができる。また、培養培地に適切な前駆体などが添加され得る。栄養素または補充物は、培養過程の間に全て合わせて一回または分けて添加され得る。
【0034】
培養培地のpHは、水酸化ナトリウム、水酸化カリウムまたはアンモニアのような塩基性化合物、または、リン酸または硫酸のような酸性化合物で調節することができる。培養培地で気泡の生成は、脂肪酸ポリグリコールエステルのような消泡剤を使用して抑制することができる。培養培地は、酸素または酸素を含有したガス(例えば、空気)を注入することにより好気条件下で維持され得る。培養温度は、普通20℃〜45℃、好ましくは、25℃〜40℃である。培養は、最大量のL−アミノ酸が生産されるまで継続される。これに関連して10から160時間内に達成され得る。生産された後、L−リシンは、培養培地の中に排出されるか、または細胞内に含まれることがあり得る。
【0035】
本発明によるL−リシンを生産する方法は、細胞または細胞培養物からリシンを回収する段階を含む。L−リシンは、公知の方法を使用して細胞培養物または細胞から分離され得る。本発明に有用な分離方法は、例えば、遠心分離、濾過、陰イオン交換クロマトグラフィー、結晶化及びHPLCなどが含まれることができるが、これらの例に限定されるのではない。
【実施例】
【0036】
以下、本発明を下記の実施例によって詳細に説明する。但し、下記実施例は、本発明を例示するものだけであり、本発明の内容が下記実施例によって限定されるのではない。
【0037】
実施例1:サイト(site)特異的遺伝子破壊による変異株の作製
組換え菌株KFCC10881−ΔNCgl2399とKFCC10881−ΔNCgl2905の製造に使用するためにプライマーをデザインした。まず、アメリカ国立保健院の遺伝子銀行(NIH Genbank)からNCgl2399(配列番号1)及びNCgl2905(配列番号2)の配列を確保した。前記配列などに基づいてNCgl2399またはNCgl2905の不活性化断片を構成するのに使用されるプライマー2399F1、2399F2、2399R1、2399R2、2905F1、2905F2、2905R1、及び2905R2を合成した(表1)。本発明で使用されたプライマーなどの塩基配列を配列番号と共に表1に要約した。制限サイトに下線を引いた。
【0038】
【表1】

【0039】
コリネバクテリウム・グルタミクム内で複製が不可能なpDZでサイト特異的遺伝子破壊を実施した。遺伝子破壊変異株を作るのに使用するために、NCgl2399とNCgl2905のそれぞれ内部的に欠損されたオープンリーディングフレームを有するpDZ誘導体を構成した。前記pDZ誘導体は、pDZ−ΔNCgl2399(図2)とpDZ−ΔNCgl2905(図3)である。pDZ−ΔNCgl2399は、XbaI末端と2、267bpの長さNCgl2399のKpnIサイトに内部的遺伝子欠損を含む。前記NCgl2399の内部的遺伝子欠損は、鋳型として使用されるコリネバクテリウム・グルタミクムATCC13032のゲノムDNAを有する2399F1−2399R1プライマー(配列番号5及び6)と2399F2−2399R2プライマー(配列番号7及び8)の存在下でオーバーラップ伸長PCRを使用して生成される。
【0040】
pDZ−ΔNCgl2905は、XbaI末端と2、819bpの長さNCgl2905のSmaIサイトに内部的遺伝子欠損を含む。前記NCgl2905の内部的遺伝子欠損は、鋳型として使用されるコリネバクテリウム・グルタミクムATCC13032のゲノムDNAを有する2905F1−2905R1プライマー(配列番号9及び10)と2905F2−2905R2プライマー(配列番号11及び12)の存在下でオーバーラップ伸長PCRを使用して生成される。
【0041】
前記組換えプラスミドを野生型コリネバクテリウム・グルタミクムに電気穿孔法で形質転換させ(van der Rest et al., Appl Microbiol Biotechnol 52:541−545, 1999)、1次組換え(交叉)によって染色体に組み込ませた。その後、10%のスクロースを含む寒天平板で2次組換え(交叉)によって染色体からプラスミドを切除した。
【0042】
遺伝子特異的プライマー対である2399F1−2399R2(配列番号5及び8)及び2905F1−2905R2(配列番号9及び12)を使用して前記2次組換えが完了したコリネバクテリウム・グルタミクム組換え体のゲノムDNA上で診断(diagnostic)PCRを行ってコリネバクテリウム・グルタミクム組換え体がそれぞれ欠損されたNCgl2399及びNCgl2905遺伝子を有することを確認した。この組換え菌株などをそれぞれKFCC10881−ΔNCgl2399及びKFCC10881−ΔNCgl2905と命名した。前記NCgl2399及びNCgl2905のオープンリーディングフレームDNA配列は、GenBank受託番号NC_003450を参考した。
【0043】
実施例2:NCgl2399及びNCgl2905遺伝子の両方で欠損された変異株の製作
組換え菌株KFCC10881−ΔNCgl2399を電気穿孔法を使用して組換えプラスミドpDZ−ΔNCgl2905と形質転換させ、前記示したものと同様な方法で処理してNCgl2399及びNCgl2905遺伝子の両方に欠損された新規な組換え菌株を得た。前記変異菌株をコリネバクテリウム・グルタミクムCA01−0892と命名し、2010年6月24日付けで受託番号KCCM11085Pで韓国微生物培養センターに寄託した。
【0044】
実施例3:細胞内GntKと6PGDの活性及びNADPHの水準分析
前記実施例1と2で製作されたL−リシン生産菌株であるコリネバクテリウム・グルタミクムKFCC−10881−ΔNCgl2399、KFCC−10881−ΔNCgl2905及びCA01−0892(KFCC−10881−ΔNCgl2399ΔNCgl2905)の細胞内グルコン酸キナーゼ(GntK)活性及びNADPH水準を下記のような方法で分析した。
【0045】
下記の複合培地25mlを含有する250mlコーナーバッフルフラスコに母菌株コリネバクテリウム・グルタミクムKFCC−10881と、前記3種の組換え菌株などをそれぞれ接種し、30℃で、200rpmで振盪培養した。指数成長期の細胞などを遠心分離法を使用して収穫し、100mMトリス/HCl緩衝液(pH7.5)に懸濁した。ガラスビーズを使用して細胞を破壊した後、細胞ライセートを遠心分離して上澄液を確保した。
【0046】
<複合培地(pH7.0)>
グルコース20g、ペプトン10g、酵母エキス5g、尿素1.5g、KH2PO44g、K2HPO48g、MgSO47H2O0.5g、ビオチン100μg、チアミンHCl1000μg、カルシウム−パントテン酸2000μg、ニコチンアミド2000μg(蒸溜水1リットル基準)
【0047】
総タンパク質含量のためにブラッドフォード法によって上澄液を定量的に分析した。6PGD活性は、340nmでNADPHに対する吸光度を使用して測定した(Frunzke et al., Mol Microbiol 67:305−322, 2008)。GntK活性は、6PGDに対する結合酵素アッセイ(coupled enzymatic assay)で測定した(Frunzke et al., Mol Microbiol 67:305−322, 2008)。NADPHの濃度は、EnzyChromTMNADP+/NADPH分析キットを使用した酵素サイクリング反応(enzymatic cycling reaction)で決定した(BioAssay Systems, CA, USA)。
【0048】
表2に示されたように、NCgl2399遺伝子に欠損されたKFCC−10881−ΔNCgl2399の細胞内GntK(EC:2.7.1.12)活性は、母菌株(KFCC10881)と比較して約58.7%減少したが、6PGD活性で2.4倍の増加があった。NCgl2399及びNCgl2905遺伝子が同時に欠損されたCA01−0892のGntK活性は、母菌株と比較して約78.3%減少したが、6PGD活性で5.1倍の増加があった(表2)。
【0049】
また、前記酵素活性変化の結果として、CA01−0892の細胞内NADPH水準は、170%まで増加されたことが観察された。これらのデータは、すべての場合において10%以下の標準偏差を有する少なくとも3つの独立的な培養から測定した平均値である。前記の結果は、内在的活性以下へのグルコン酸キナーゼ活性の弱化が6PGDの活性を増加させ、これは、NADPH生産に肯定的な影響を持つ。
【0050】
【表2】

【0051】
実施例4:NCgl2399及びNCgl2905遺伝子欠損菌株でのリシン生産
L−リシン生産のために、前記実施例1と2で製作されたL−リシン生産菌株であるコリネバクテリウム・グルタミクムKFCC−10881−ΔNCgl2399、KFCC−10881−ΔNCgl2905及びCA01−0892(KFCC−10881−ΔNCgl2399ΔNCgl2905)を次のように培養した。
【0052】
下記の種培地25mlを含有する250mlコーナー−バッフルフラスコに母菌株コリネバクテリウム・グルタミクムKFCC−10881と前記3種の組換え菌株などをそれぞれ接種し、30℃で20時間200rpmで振盪培養した。その後、下記の生産培地24mlを含有する250mlコーナー−バッフルフラスコに前記培養された1mlの種培養液をそれぞれ接種し、30℃で120時間200rpmで振盪培養した。前記鐘培地と生産培地は、次の組成で構成される。
【0053】
<種培地(pH7.0)>
グルコース20g、ペプトン10g、酵母エキス5g、尿素1.5g、KH2PO44g、K2HPO48g、MgSO47H2O0.5g、ビオチン100μg、チアミンHCl1000μg、カルシウム−パントテン酸2000μg、ニコチンアミド2000μg(蒸溜水1リットル基準)
【0054】
<生産培地(pH7.0)>
グルコース100g、(NH4)2SO440g、大豆タンパク質2.5g、トウモロコシ浸漬固形粉5g、尿素3g、KH2PO41g、MgSO47H2O0.5g、ビオチン100μg、チアミンHCl1000μg、カルシウム−パントテン酸2000μg、ニコチンアミド3000μg、CaCO330g(蒸溜水1リットル基準)
【0055】
培養終了後、菌株によって生産されたL−リシンの量を決定するためにHPLC分析を行った。コリネバクテリウム・グルタミクムKFCC−10881、KFCC−10881−ΔNCgl2399、KFCC−10881−ΔNCgl2905及びCA01−0892(KFCC−10881−ΔNCgl2399ΔNCgl2905)の培養液中のL−リシン濃度を表3に要約した。
【0056】
【表3】

【0057】
表3に示されたように、ΔNCgl2399遺伝子またはΔNCgl2905遺伝子に欠損された組換え菌株は、母菌株KFCC−10881と比較してリシン生産でそれぞれ約5.9%及び8.0%増加することを確認した。さらに、ΔNCgl2399遺伝子とΔNCgl2905遺伝子に同時に欠損されたCA01−0892菌株の場合には、リシン生産量で母菌株に対比して約13.1%増加した(表3)。前記の結果は、グルコン酸キナーゼ活性を内在的活性以下への弱化は6PGDの活性を増加させることができ、これは、NADPH生産に肯定的な影響を持ち、よって、L−リシンを高効率及び高収率で生産することができることを示す。
【0058】
本発明の好ましい実施態様が例示的な目的のために開示されたが、当業者は添付された請求項に開示されたような本発明のカテゴリーおよび趣旨を逸脱することなく、様々な変更、付加および代替が可能であることが理解されよう。
【0059】

【技術分野】
【0001】
本発明は、高いL−リシン生産能を有する微生物及びこれを用いたL−リシン生産方法に関するものである。
【背景技術】
【0002】
L−リシンは、オキサロ酢酸からリシン生合成経路を介して合成される。L−リシンの生合性に重要な酵素などは、アスパラギン酸セミアルデヒドデヒドロゲナーゼ、ジヒドロジピコリン酸レダクターゼ及びジアミノピメリン酸デヒドロゲナーゼであって、それぞれ遺伝子asd、dapB及びddhによってエンコードされ、リシン生合成経路の部分などを仲裁するNADPH依存的レダクターゼなどである。この経路で1分子のL−リシン生産は、前記酵素などによって3分子のNADPHの消耗を直接的に要求し、1分子のNADPHは間接的に用いられる。コリネバクテリウム・グルタミクム細胞(Corynebacterium glutamicum cell)内でNADPHの再生とL−リシン生合成との間の直接的な連関性は既に報告されたことがある(Wittmann and Heinzle, Microbiol 68:5843−5849, 2002; Marx et al., J Biotechnol 104:185−197, 2003; Ohnishi et al., Microbiol Lett 242:265−274, 2005)。
【0003】
コリネバクテリウムでNADPHの主要供給経路は、TCAサイクルとペントースリン酸経路である。L−リシン生産のために必要な還元力は、ペントースリン酸経路の酸化経路を介して供給されるのが好ましい。ペントースリン酸経路は、2つサイクルの作動が2つのNADPH分子の伴われる生産とともに1つのCO2分子を排出するので、炭素代謝効率面から経済的により有利である一方、1つのTCAサイクル当り1つのNADPH分子の伴われる生産とともに2つのCO2分子が排出される。従って、L−リシンのより高い収率は、NADPHのより多い供給を要求し、これによってペントースリン酸経路に対する依存度が高くなるようになる。
【0004】
全てペントースリン酸経路に関与された、グルコース−6−リン酸デヒドロゲナーゼ(G6PDH)及び6−ホスホグルコン酸デヒドロゲナーゼ(6PGD)がL−リシンの生産と関連されていることが報告された(Marx et al., Biotechnol Bioeng 56:168−180, 1997; Wittmann and Heinzle, Microbiol 68:5843−5849, 2002)。
【0005】
L−アミノ酸生産コリネバクテリウム菌株において、ペントースリン酸経路でNADPH生成を果たす遺伝子発現酵素が強化された際に、または酵素が変異された際にL−アミノ酸生産能が増加されることが報告されたことがあった。例えば、J.Beckerらは、L−リシン生産コリネバクテリウム・グルタミクムでG6PDHをエンコードするzwf遺伝子のさらに強いプローモータの提供がリシン生産量で著しい増加を招くことを報告した(J. Becker et al., J Biotechnol 132: 99−109, 2007)。ヨーロッパ特許第1302537号には、変異型6PGDをコード化する遺伝子が導入されたL−アミノ酸生産コリネバクテリアを培養してL−アミノ酸を生産する方法が開示されている。
【0006】
しかし、コリネバクテリウムの内在的グルコン酸キナーゼ(GntK)活性弱化を介してペントースリン酸経路におけるNADPH生合成が増加されたコリネバクテリア属微生物に対しては、従来の文献などに開示されたところがない。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Wittmann and Heinzle, Microbiol 68:5843−5849, 2002
【非特許文献2】Marx et al., J Biotechnol 104:185−197, 2003
【非特許文献3】Ohnishi et al., Microbiol Lett 242:265−274, 2005
【非特許文献4】Marx et al., Biotechnol Bioeng 56:168−180, 1997
【非特許文献5】J. Becker et al., J Biotechnol 132: 99−109, 2007
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明者らは、L−リシンを高効率、高収率で生産するための方法を見つけるために鋭意努力した結果、酸化的ペントースリン酸経路での遺伝的変形によるNADPH生産の増加がL−リシンの生産量を増加させ得ることを確認した。
【課題を解決するための手段】
【0009】
従って、本発明の目的は、内在的活性に比べて弱化されたグルコン酸キナーゼ(GntK)活性を有するL−リシン生産微生物を提供することである。
【0010】
本発明の他の目的は、全体または部分的にポリヌクレオチドを変異させることによって弱化された活性を有するグルコン酸キナーゼ(GntK)をエンコードするポリヌクレオチド断片を構成する段階;宿主細胞で染色体の相同組換えを行うことができるベクターに前記収得したポリヌクレオチド断片を挿入して組換えベクターを収得する段階;前記収得した組換えベクターをL−リシンを生産することができる宿主細胞に導入して相同組換え体を収得する段階;及び前記相同組換え体から内在的活性に比べて弱化されたGntKの活性を有する菌株を選抜する段階を含む前記L−リシン生産微生物の製造方法を提供することである。
【0011】
本発明のまた他の目的は、本発明の微生物を培養して細胞培養物を収得する段階;及び前記細胞培養物または微生物からL−リシンを回収する段階を含むL−リシンの生産方法を提供することである。
【発明の効果】
【0012】
本発明は、コリネバクテリウム菌株でNADPHの細胞内水準を増加させることによって、生合成のためにNADPHを必要とするL−アミノ酸、特に、L−リシンを高効率及び高収率で生産することができる。
【図面の簡単な説明】
【0013】
本発明の目的、特徴、局面、及び利点は、以下の詳細な説明と添付図面とによって、より明白となる。
【図1】図1は、コリネバクテリウム・グルタミクムのペントースリン酸経路を示した概略図である。
【図2】図2は、コリネバクテリウムの染色体NCgl2399遺伝子のマーカー−フリー欠損用pDZ−ΔNCgl2399ベクターを示した概略図である。
【図3】図3は、コリネバクテリウムの染色体NCgl2905遺伝子のマーカー−フリー欠損用pDZ−ΔNCgl2905ベクターを示した概略図である。
【発明を実施するための形態】
【0014】
前記目的を達成するための一つの態様として、本発明は、内在的活性に比べて弱化されたグルコン酸キナーゼ(GntK)活性を有するL−リシン生産微生物を提供する。
【0015】
用語“L−リシン”とは、NH2(CH2) 4CH(NH2)COOHの化学式を有する塩基性α−アミノ酸である。体内で合成できない必須アミノ酸である。L−リシンは、オキサロ酢酸から一部がNADPH依存性還元酵素によって触媒されるリシン生合成経路を介して合成される。この経路を介して1分子のL−リシン生合成は、酵素による3分子のNADPHの直接的消耗と、1分子のNADPHの間接的使用を要求する。
【0016】
本発明で使用された用語、“グルコン酸キナーゼ(GntK)”とは、微生物のペントースリン酸経路の酸化過程中間体である6−ホスホグルコン酸を生産するGntK経路に関与する酵素を意味する。コリネバクテリウム属の微生物は、ペントースリン酸経路の酸化過程の中間体である6−ホスホグルコン酸を合成するために、2つの経路、すなわち、G6PDH及びGntK経路の両方を運用し(図1)、これは、コリネバクテリウム属の微生物がGntK経路を介してグルコースを部分的に分解することができるということを意味する。前記GntK経路の遮断が6−ホスホグルコン酸への炭素供給を遮断し、炭素フラックスを6−ホスホグルコン酸からペントースリン酸化過程に転換できるという仮定で、本発明者らはGntK経路の遮断が6−ホスホグルコン酸デヒドロゲナーゼ(6PGD)の活性で特異的増加を生じるから、よって、NADPHの再生が増加することを提示する。そこで、微生物内でグルコン酸キナーゼ(GntK)として作用するものとして推定される酵素の活性を弱化させる。
【0017】
好ましくは、グルコン酸キナーゼ(GntK)活性を有する酵素は、配列番号1のアミノ酸配列で表されるNCgl2399または配列番号2のアミノ酸配列で表されるNCgl2905であり得る。
【0018】
本発明で使用された用語、“内在的活性”とは、自然型微生物における酵素の活性を意味し、特に、GntKと組み合わせて使用される際に、自然型微生物が示すGntKの活性を意味する。
【0019】
用語、“内在的活性弱化”は、前記ポリヌクレオチド配列全体または一部の欠損、前記ポリヌクレオチド配列一部の置換または前記ポリヌクレオチド配列内へ少なくとも一つの塩基対の挿入から構成される群から選択される一つの方法で、微生物で内在的タンパク質をエンコードするポリヌクレオチドを含む染色体上で達成することができる。また、発現調節要素の全体または一部の欠損、置換または挿入によって突然変異がなされる前記ポリヌクレオチド配列に対する調節要素を変異させることによって、内在的活性が弱化され得る。前記発現調節要素は、染色体上のポリヌクレオチド配列の上部または下部に位置することができ、好ましくは、調節要素はプローモーター、 エンハンサーなどであるが、本発明はこれに制限されない。前記ポリヌクレオチドの変異は、相同組換えのように周知の方法を使用して達成することができる。
【0020】
本発明で使用された用語、“内在的活性に比べて弱化されたGntK活性”は、
破裂のような遺伝子変異によってGntK活性が下向調節され、よって、天然型微生物での酵素の内在的活性より低くなることを意味する。本発明の一例において、本発明は図2または図3の開裂地図で表される組換えベクターの導入を介してGntK活性を妨害することにより増加されたL−リシン生産能を有するコリネバクテリウム属の微生物を提供する。
【0021】
グルコン酸キナーゼ活性を有し、互いに異なるアミノ酸配列を有するタンパク質をコードする2つまたはそれ以上の染色体遺伝子が存在する場合、内在的GntK活性は、少なくとも1つの染色体遺伝子上で全体または一部の欠損、置換または挿入によって弱化され得る。また、少なくとも1つの染色体遺伝子に対する調節要素上で全体または一部の欠損、置換または挿入を介して内在的GntK活性が弱化され得る。
【0022】
好ましくは、ヌクレオチドの欠損、置換または挿入による変異がNCgl2399またはNCgl2905をエンコードする遺伝子、または、それぞれNCgl2399とNCgl2905をエンコードする配列番号3と4のヌクレオチド配列を有する遺伝子のうち、1つまたは2つのいずれで、またはそれらの調節要素上で生じるように許容され、GntKが正常的に機能しないこともある。
【0023】
本発明において、グルコン酸キナーゼをエンコードする遺伝子の一部を含む組換えベクターを導入して内在的グルコン酸キナーゼ遺伝子を欠損または突然変異させることによって、内在的活性に比べて弱化されたグルコン酸キナーゼ活性を有する微生物を製造することができる。前記一部遺伝子の染色体内への挿入は、周知の方法、例えば、相同組換えによって達成することができる。
【0024】
このような観点で、本発明は、1)ポリヌクレオチドの全体または一部の配列が変異されて弱化された活性を有するグルコン酸キナーゼ(GntK)をエンコードするポリヌクレオチド断片を構成する段階;2)組換えベクターを提供するために宿主細胞で染色体と相同組換えできるベクターに前記収得したポリヌクレオチド断片を挿入する段階;3)相同組換え体を形成するために前記収得した組換えベクターをL−リシンを生産することができる宿主細胞に導入する段階;及び4)前記相同組換え体の中からGntKの活性が内在的活性に比べて弱化された菌株を選抜する段階を含むL−リシン生産微生物の製造方法を提供する。
【0025】
本発明で使用された用語、“組換えベクター”とは、宿主細胞の染色体から分離されて複製できないベクターであって、一般に、染色体と外部遺伝子との相同組換えを許容する必須的な要素を含む遺伝子構造物を意味する。組換えベクターは、抗生剤耐性遺伝子とレバンスクラーゼ(sacB)遺伝子のような選抜遺伝子を含むことができる。好ましくは、本発明では、図2または図3の開裂地図によって表される組換えベクターが使用され得る。
【0026】
L−リシンが生産できる限り、どのような菌株でも組換えベクターを導入させる宿主細胞として制限なく使用され得る。好ましくは、コリネバクテリウム属またはブレビバクテリウム属の微生物である。本発明において有用な宿主細胞の例としては、コリネバクテリウム・グルタミクムATCC13032、コリネバクテリウム・グルタミクム、コリネバクテリウム・テルモアミノゲネス(thermoaminogenes)FERM BP−1539、ブレビバクテリウム・フラバム(Brevibacterium flavum)ATCC14067、及びブレビバクテリウム・ラクトファーメンタム(lactofermentum)ATCC13869、及びそれらから誘導されたL−アミノ酸生産突然変異体または菌株、例えば、コリネバクテリウム・グルタミクムKFCC10881、コリネバクテリウム・グルタミクムKFCC11001、及びコリネバクテリウム・グルタミクムKCCM10770Pが含まれることができる。好ましくは、コリネバクテリウム・グルタミクムKFCC10881であり得る。本発明の具体的な実施態様では、コリネバクテリウム・グルタミクムKFCC10881が使用されたが、本発明がこれに制限されるのではない。
【0027】
本発明の一実施態様では、コリネバクテリウム・グルタミクム内で複製することなく標的遺伝子のマーカー−フリー欠損を行うことができるpDZベクター(韓国特許第0924065号に開示)を用いて前記遺伝子などを欠損させた。すなわち、前記pDZベクターにそれぞれNCgl2399またはNCgl2905をエンコードする遺伝子などの一部分を有した組換えベクターを構成した後、L−リシンを生産するコリネバクテリウムの菌株に形質転換させ、弱化されたグルコン酸キナーゼ活性を有するL−リシン生産用コリネバクテリウム菌株を製作するためにゲノムと相同組換えを行うように許容した。
【0028】
本発明では、NCgl2399をエンコードする遺伝子の一部をpDZベクターに挿入させて組換えベクター構成し、pDZ−ΔNCgl2399と命名し、これをコリネバクテリウム菌株に形質転換させた。NCgl2399をエンコードする遺伝子が破壊された組換えコリネバクテリウム菌株をKFCC10881−ΔNCgl2399と命名した。別に、pDZ−ΔNCgl2905と命名したNCgl2905をエンコードする遺伝子の一部を含む組換えpDZベクターをコリネバクテリウム菌株に形質転換させた。NCg12905をエンコードする染色体遺伝子が破壊された組換え菌株をKFCC10881−ΔNCgl2905と命名した。さらに、前記KFCC10881−ΔNCgl2399を組換えプラスミドpDZ−ΔNCgl2905を形質転換させてNCgl2399及びNCgl2905遺伝子が同時に欠損された変異菌株を提供した。これをコリネバクテリウム・グルタミクムCA01−0892と命名し、2010年6月24日付で韓国微生物保存センターに寄託して受託番号KCCM11085Pを受けた。
【0029】
さらに、本発明の一実施態様では、前記組換えコリネバクテリウム・グルタミクム菌株を細胞内グルコン酸キナーゼ活性とNADPH水準に対して評価した。NCgl2399遺伝子が欠損された菌株、及びNCgl2399とNCgl2905遺伝子とが同時に欠損された菌株の細胞内GntKの活性は、母菌株に比べて減少していることが観察された。なお、細胞内のNADPH濃度水準及び6PGD活性は、母菌株に比べて増加していることが観察された(表2)。結果的に、前記製作された菌株などのリシン生産量は母菌株に比較して増加していることが観察された(表3)。
【0030】
前記の結果は、内在的活性以下のグルコン酸キナーゼ活性の弱化は、6PGDの活性を増加させ、これは、NADPH生産に肯定的効果を持つことによって、結果的に、L−リシンを高効率及び高収率で生産することができるということを意味する。また、グルコン酸キナーゼ活性を有するタンパク質が2つまたはそれ以上の異なる遺伝子によってエンコードされる場合、2つまたはそれ以上の遺伝子を欠損させることによって、より高いL−リシン生産能を得ることができる。従って、本発明のL−リシン生産微生物は、高効率及び高収率でL−リシンを生産するために使用することができる。
【0031】
また他の一つの態様として、本発明は、1)本発明の微生物を培養して細胞培養物を収得する段階;及び2)前記細胞培養物または微生物からL−リシンを回収する段階を含むL−リシンの生産方法を提供する。
【0032】
本発明で使用された用語、“培養”は、微生物を人工的に調節した条件下で生育させることを意味する。本発明の組換え体を培養することは、当業界の周知の様々な方法を用いて行うことができる。前記細胞は、バッチ工程または注入バッチまたは反復注入バッチ工程などの連続式工程で培養され得るが、本発明がこれに制限されるのではない。
【0033】
培養に使用される培地は、適切な方式で使用される菌株の要件を満たさなければならない。コリネバックテリア菌株培養に使用するための適した培地は当業界で公知されている(例えば、Manual of Methods for General Bacteriology, American Society for Bacteriology, Washington D.C., USA, 1981)。培養培地の炭素源は、例えばグルコース、スクロース、ラクトース、フルクトース、マルトース、澱粉、及びセルロースのような糖類、及び炭水化物;大豆油、ヒマワリ種子油、落花生油、及びヤシ油などのようなオイル及び脂肪;パルミチン酸、ステアリン酸、及びリノール酸のような脂肪酸;グリセロール、及びエタノールのようなアルコール;酢酸のような有機酸であり得る。これらの物質は、個別的にまたは組み合わせて使用され得る。組換え体培養に有用な窒素源の例としては、ペプトン、酵母エキス、肉汁、麦芽エキス、トウモロコシ浸漬液、大豆粕及び尿素または無機化合物、例えば、硫酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、炭酸アンモニウム及び硝酸アンモニウムを含む。これらの窒素源も個別的にまたは組み合わせて使用され得る。培養培地に使用され得るリン源としては、リン酸水素二カリウム、リン酸二水素カリウム及び相応するナトリウム塩がある。また、培養培地は、細胞成長に必要な金属塩を含むことができ、アミノ酸及びビタミンのような必須栄養素で補充することができる。また、培養培地に適切な前駆体などが添加され得る。栄養素または補充物は、培養過程の間に全て合わせて一回または分けて添加され得る。
【0034】
培養培地のpHは、水酸化ナトリウム、水酸化カリウムまたはアンモニアのような塩基性化合物、または、リン酸または硫酸のような酸性化合物で調節することができる。培養培地で気泡の生成は、脂肪酸ポリグリコールエステルのような消泡剤を使用して抑制することができる。培養培地は、酸素または酸素を含有したガス(例えば、空気)を注入することにより好気条件下で維持され得る。培養温度は、普通20℃〜45℃、好ましくは、25℃〜40℃である。培養は、最大量のL−アミノ酸が生産されるまで継続される。これに関連して10から160時間内に達成され得る。生産された後、L−リシンは、培養培地の中に排出されるか、または細胞内に含まれることがあり得る。
【0035】
本発明によるL−リシンを生産する方法は、細胞または細胞培養物からリシンを回収する段階を含む。L−リシンは、公知の方法を使用して細胞培養物または細胞から分離され得る。本発明に有用な分離方法は、例えば、遠心分離、濾過、陰イオン交換クロマトグラフィー、結晶化及びHPLCなどが含まれることができるが、これらの例に限定されるのではない。
【実施例】
【0036】
以下、本発明を下記の実施例によって詳細に説明する。但し、下記実施例は、本発明を例示するものだけであり、本発明の内容が下記実施例によって限定されるのではない。
【0037】
実施例1:サイト(site)特異的遺伝子破壊による変異株の作製
組換え菌株KFCC10881−ΔNCgl2399とKFCC10881−ΔNCgl2905の製造に使用するためにプライマーをデザインした。まず、アメリカ国立保健院の遺伝子銀行(NIH Genbank)からNCgl2399(配列番号1)及びNCgl2905(配列番号2)の配列を確保した。前記配列などに基づいてNCgl2399またはNCgl2905の不活性化断片を構成するのに使用されるプライマー2399F1、2399F2、2399R1、2399R2、2905F1、2905F2、2905R1、及び2905R2を合成した(表1)。本発明で使用されたプライマーなどの塩基配列を配列番号と共に表1に要約した。制限サイトに下線を引いた。
【0038】
【表1】

【0039】
コリネバクテリウム・グルタミクム内で複製が不可能なpDZでサイト特異的遺伝子破壊を実施した。遺伝子破壊変異株を作るのに使用するために、NCgl2399とNCgl2905のそれぞれ内部的に欠損されたオープンリーディングフレームを有するpDZ誘導体を構成した。前記pDZ誘導体は、pDZ−ΔNCgl2399(図2)とpDZ−ΔNCgl2905(図3)である。pDZ−ΔNCgl2399は、XbaI末端と2、267bpの長さNCgl2399のKpnIサイトに内部的遺伝子欠損を含む。前記NCgl2399の内部的遺伝子欠損は、鋳型として使用されるコリネバクテリウム・グルタミクムATCC13032のゲノムDNAを有する2399F1−2399R1プライマー(配列番号5及び6)と2399F2−2399R2プライマー(配列番号7及び8)の存在下でオーバーラップ伸長PCRを使用して生成される。
【0040】
pDZ−ΔNCgl2905は、XbaI末端と2、819bpの長さNCgl2905のSmaIサイトに内部的遺伝子欠損を含む。前記NCgl2905の内部的遺伝子欠損は、鋳型として使用されるコリネバクテリウム・グルタミクムATCC13032のゲノムDNAを有する2905F1−2905R1プライマー(配列番号9及び10)と2905F2−2905R2プライマー(配列番号11及び12)の存在下でオーバーラップ伸長PCRを使用して生成される。
【0041】
前記組換えプラスミドを野生型コリネバクテリウム・グルタミクムに電気穿孔法で形質転換させ(van der Rest et al., Appl Microbiol Biotechnol 52:541−545, 1999)、1次組換え(交叉)によって染色体に組み込ませた。その後、10%のスクロースを含む寒天平板で2次組換え(交叉)によって染色体からプラスミドを切除した。
【0042】
遺伝子特異的プライマー対である2399F1−2399R2(配列番号5及び8)及び2905F1−2905R2(配列番号9及び12)を使用して前記2次組換えが完了したコリネバクテリウム・グルタミクム組換え体のゲノムDNA上で診断(diagnostic)PCRを行ってコリネバクテリウム・グルタミクム組換え体がそれぞれ欠損されたNCgl2399及びNCgl2905遺伝子を有することを確認した。この組換え菌株などをそれぞれKFCC10881−ΔNCgl2399及びKFCC10881−ΔNCgl2905と命名した。前記NCgl2399及びNCgl2905のオープンリーディングフレームDNA配列は、GenBank受託番号NC_003450を参考した。
【0043】
実施例2:NCgl2399及びNCgl2905遺伝子の両方で欠損された変異株の製作
組換え菌株KFCC10881−ΔNCgl2399を電気穿孔法を使用して組換えプラスミドpDZ−ΔNCgl2905と形質転換させ、前記示したものと同様な方法で処理してNCgl2399及びNCgl2905遺伝子の両方に欠損された新規な組換え菌株を得た。前記変異菌株をコリネバクテリウム・グルタミクムCA01−0892と命名し、2010年6月24日付けで受託番号KCCM11085Pで韓国微生物培養センターに寄託した。
【0044】
実施例3:細胞内GntKと6PGDの活性及びNADPHの水準分析
前記実施例1と2で製作されたL−リシン生産菌株であるコリネバクテリウム・グルタミクムKFCC−10881−ΔNCgl2399、KFCC−10881−ΔNCgl2905及びCA01−0892(KFCC−10881−ΔNCgl2399ΔNCgl2905)の細胞内グルコン酸キナーゼ(GntK)活性及びNADPH水準を下記のような方法で分析した。
【0045】
下記の複合培地25mlを含有する250mlコーナーバッフルフラスコに母菌株コリネバクテリウム・グルタミクムKFCC−10881と、前記3種の組換え菌株などをそれぞれ接種し、30℃で、200rpmで振盪培養した。指数成長期の細胞などを遠心分離法を使用して収穫し、100mMトリス/HCl緩衝液(pH7.5)に懸濁した。ガラスビーズを使用して細胞を破壊した後、細胞ライセートを遠心分離して上澄液を確保した。
【0046】
<複合培地(pH7.0)>
グルコース20g、ペプトン10g、酵母エキス5g、尿素1.5g、KH2PO44g、K2HPO48g、MgSO47H2O0.5g、ビオチン100μg、チアミンHCl1000μg、カルシウム−パントテン酸2000μg、ニコチンアミド2000μg(蒸溜水1リットル基準)
【0047】
総タンパク質含量のためにブラッドフォード法によって上澄液を定量的に分析した。6PGD活性は、340nmでNADPHに対する吸光度を使用して測定した(Frunzke et al., Mol Microbiol 67:305−322, 2008)。GntK活性は、6PGDに対する結合酵素アッセイ(coupled enzymatic assay)で測定した(Frunzke et al., Mol Microbiol 67:305−322, 2008)。NADPHの濃度は、EnzyChromTMNADP+/NADPH分析キットを使用した酵素サイクリング反応(enzymatic cycling reaction)で決定した(BioAssay Systems, CA, USA)。
【0048】
表2に示されたように、NCgl2399遺伝子に欠損されたKFCC−10881−ΔNCgl2399の細胞内GntK(EC:2.7.1.12)活性は、母菌株(KFCC10881)と比較して約58.7%減少したが、6PGD活性で2.4倍の増加があった。NCgl2399及びNCgl2905遺伝子が同時に欠損されたCA01−0892のGntK活性は、母菌株と比較して約78.3%減少したが、6PGD活性で5.1倍の増加があった(表2)。
【0049】
また、前記酵素活性変化の結果として、CA01−0892の細胞内NADPH水準は、170%まで増加されたことが観察された。これらのデータは、すべての場合において10%以下の標準偏差を有する少なくとも3つの独立的な培養から測定した平均値である。前記の結果は、内在的活性以下へのグルコン酸キナーゼ活性の弱化が6PGDの活性を増加させ、これは、NADPH生産に肯定的な影響を持つ。
【0050】
【表2】

【0051】
実施例4:NCgl2399及びNCgl2905遺伝子欠損菌株でのリシン生産
L−リシン生産のために、前記実施例1と2で製作されたL−リシン生産菌株であるコリネバクテリウム・グルタミクムKFCC−10881−ΔNCgl2399、KFCC−10881−ΔNCgl2905及びCA01−0892(KFCC−10881−ΔNCgl2399ΔNCgl2905)を次のように培養した。
【0052】
下記の種培地25mlを含有する250mlコーナー−バッフルフラスコに母菌株コリネバクテリウム・グルタミクムKFCC−10881と前記3種の組換え菌株などをそれぞれ接種し、30℃で20時間200rpmで振盪培養した。その後、下記の生産培地24mlを含有する250mlコーナー−バッフルフラスコに前記培養された1mlの種培養液をそれぞれ接種し、30℃で120時間200rpmで振盪培養した。前記鐘培地と生産培地は、次の組成で構成される。
【0053】
<種培地(pH7.0)>
グルコース20g、ペプトン10g、酵母エキス5g、尿素1.5g、KH2PO44g、K2HPO48g、MgSO47H2O0.5g、ビオチン100μg、チアミンHCl1000μg、カルシウム−パントテン酸2000μg、ニコチンアミド2000μg(蒸溜水1リットル基準)
【0054】
<生産培地(pH7.0)>
グルコース100g、(NH4)2SO440g、大豆タンパク質2.5g、トウモロコシ浸漬固形粉5g、尿素3g、KH2PO41g、MgSO47H2O0.5g、ビオチン100μg、チアミンHCl1000μg、カルシウム−パントテン酸2000μg、ニコチンアミド3000μg、CaCO330g(蒸溜水1リットル基準)
【0055】
培養終了後、菌株によって生産されたL−リシンの量を決定するためにHPLC分析を行った。コリネバクテリウム・グルタミクムKFCC−10881、KFCC−10881−ΔNCgl2399、KFCC−10881−ΔNCgl2905及びCA01−0892(KFCC−10881−ΔNCgl2399ΔNCgl2905)の培養液中のL−リシン濃度を表3に要約した。
【0056】
【表3】

【0057】
表3に示されたように、ΔNCgl2399遺伝子またはΔNCgl2905遺伝子に欠損された組換え菌株は、母菌株KFCC−10881と比較してリシン生産でそれぞれ約5.9%及び8.0%増加することを確認した。さらに、ΔNCgl2399遺伝子とΔNCgl2905遺伝子に同時に欠損されたCA01−0892菌株の場合には、リシン生産量で母菌株に対比して約13.1%増加した(表3)。前記の結果は、グルコン酸キナーゼ活性を内在的活性以下への弱化は6PGDの活性を増加させることができ、これは、NADPH生産に肯定的な影響を持ち、よって、L−リシンを高効率及び高収率で生産することができることを示す。
【0058】
本発明の好ましい実施態様が例示的な目的のために開示されたが、当業者は添付された請求項に開示されたような本発明のカテゴリーおよび趣旨を逸脱することなく、様々な変更、付加および代替が可能であることが理解されよう。
【0059】

【特許請求の範囲】
【請求項1】
内在的活性に比べて弱化されたグルコン酸キナーゼ(GntK)活性を有する、L−リシン生産微生物。
【請求項2】
前記グルコン酸キナーゼは、配列番号1または配列番号2のアミノ酸配列を有するものである、請求項1に記載のL−リシン生産微生物。
【請求項3】
前記微生物は、コリネバクテリウム属である、請求項1に記載のL−リシン生産微生物。
【請求項4】
グルコン酸キナーゼをエンコードする染色体遺伝子上の塩基配列全体または一部の欠損、一部の置換または挿入によって内在的グルコン酸キナーゼ活性が弱化されたものである、請求項1に記載のL−リシン生産微生物。
【請求項5】
グルコン酸キナーゼをエンコードする染色体遺伝子の調節要素上で、全体または一部の欠損、一部の置換または挿入によって内在的グルコン酸キナーゼ活性が弱化されたものである、請求項1に記載のL−リシン生産微生物。
【請求項6】
グルコン酸キナーゼ活性を有し、互いに異なるアミノ酸配列を有するタンパク質をコード化する2つまたはそれ以上の染色体遺伝子が存在する場合、少なくとも1つの染色体遺伝子上の全体または一部の欠損、置換または挿入によって;または少なくとも1つの染色体遺伝子の調節要素上で全体または一部が欠損、一部が置換または挿入によって内在的グルコン酸キナーゼ活性が弱化されたものである、請求項1に記載のL−リシン生産微生物。
【請求項7】
前記微生物は、コリネバクテリウム・グルタミクムKFCC10881から由来したものである、請求項1に記載のL−リシン生産微生物。
【請求項8】
前記微生物は、受託番号KCCM11085Pで寄託されたコリネバクテリウム・グルタミクムCA01−0892として識別されるものである、請求項1に記載のL−リシン生産微生物。
【請求項9】
1)全体または一部の配列が変異されて弱化された活性を有するグルコン酸キナーゼ(GntK)をエンコードするポリヌクレオチド断片を構成する段階;
2)組換えベクターを提供するために、宿主細胞で染色体と相同組換えできるベクターに前記収得したポリヌクレオチド断片を挿入する段階;
3)相同組換え体を形成するために、前記収得した組換えベクターをL−リシンを生産することができる宿主細胞へ導入する段階;及び
4)前記相同組換え体の中からGntKの活性が内在的活性に比べて弱化された菌株を選抜する段階を含む、請求項1乃至8のうち、いずれか1項によるL−リシン生産微生物の製造方法。
【請求項10】
1)請求項1乃至8のうち、いずれか1項による微生物を培養して細胞培養物を収得する段階:及び
2)前記細胞培養物または微生物からL−リシンを回収する段階を含む、L−リシンの生産方法。
【請求項1】
内在的活性に比べて弱化されたグルコン酸キナーゼ(GntK)活性を有する、L−リシン生産微生物。
【請求項2】
前記グルコン酸キナーゼは、配列番号1または配列番号2のアミノ酸配列を有するものである、請求項1に記載のL−リシン生産微生物。
【請求項3】
前記微生物は、コリネバクテリウム属である、請求項1に記載のL−リシン生産微生物。
【請求項4】
グルコン酸キナーゼをエンコードする染色体遺伝子上の塩基配列全体または一部の欠損、一部の置換または挿入によって内在的グルコン酸キナーゼ活性が弱化されたものである、請求項1に記載のL−リシン生産微生物。
【請求項5】
グルコン酸キナーゼをエンコードする染色体遺伝子の調節要素上で、全体または一部の欠損、一部の置換または挿入によって内在的グルコン酸キナーゼ活性が弱化されたものである、請求項1に記載のL−リシン生産微生物。
【請求項6】
グルコン酸キナーゼ活性を有し、互いに異なるアミノ酸配列を有するタンパク質をコード化する2つまたはそれ以上の染色体遺伝子が存在する場合、少なくとも1つの染色体遺伝子上の全体または一部の欠損、置換または挿入によって;または少なくとも1つの染色体遺伝子の調節要素上で全体または一部が欠損、一部が置換または挿入によって内在的グルコン酸キナーゼ活性が弱化されたものである、請求項1に記載のL−リシン生産微生物。
【請求項7】
前記微生物は、コリネバクテリウム・グルタミクムKFCC10881から由来したものである、請求項1に記載のL−リシン生産微生物。
【請求項8】
前記微生物は、受託番号KCCM11085Pで寄託されたコリネバクテリウム・グルタミクムCA01−0892として識別されるものである、請求項1に記載のL−リシン生産微生物。
【請求項9】
1)全体または一部の配列が変異されて弱化された活性を有するグルコン酸キナーゼ(GntK)をエンコードするポリヌクレオチド断片を構成する段階;
2)組換えベクターを提供するために、宿主細胞で染色体と相同組換えできるベクターに前記収得したポリヌクレオチド断片を挿入する段階;
3)相同組換え体を形成するために、前記収得した組換えベクターをL−リシンを生産することができる宿主細胞へ導入する段階;及び
4)前記相同組換え体の中からGntKの活性が内在的活性に比べて弱化された菌株を選抜する段階を含む、請求項1乃至8のうち、いずれか1項によるL−リシン生産微生物の製造方法。
【請求項10】
1)請求項1乃至8のうち、いずれか1項による微生物を培養して細胞培養物を収得する段階:及び
2)前記細胞培養物または微生物からL−リシンを回収する段階を含む、L−リシンの生産方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2012−530515(P2012−530515A)
【公表日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−524667(P2012−524667)
【出願日】平成23年7月15日(2011.7.15)
【国際出願番号】PCT/KR2011/005252
【国際公開番号】WO2012/008810
【国際公開日】平成24年1月19日(2012.1.19)
【出願人】(511023598)シージェイ チェイルジェダン コーポレイション (6)
【Fターム(参考)】
【公表日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成23年7月15日(2011.7.15)
【国際出願番号】PCT/KR2011/005252
【国際公開番号】WO2012/008810
【国際公開日】平成24年1月19日(2012.1.19)
【出願人】(511023598)シージェイ チェイルジェダン コーポレイション (6)
【Fターム(参考)】
[ Back to top ]

