LDIプレート、レーザー脱離イオン化質量分析装置、レーザー脱離イオン化質量分析方法及びLDIプレート製造方法
【課題】
汎用性の高いLDIプレート等を提供する。
【解決手段】
本発明の第1の側面は、レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に塗布され、レーザーが照射されることによって分析対象となる試料のイオン化を補助するイオン化補助粒子とを有することを特徴とするLDIプレートにある。本構成によれば、容易に製造でき、汎用性の高いLDIプレートが得られる。本発明の第2の側面は、レーザーが照射されることによって分析対象となる試料のイオン化を補助する白金粒子を有することを特徴とするLDIプレートにある。本構成によれば、広範囲の波長のレーザー光を吸収できる白金粒子が基板上に担持されているため、様々な種類の試料をレーザー脱離イオン化質量分析法の対象とすることができる。
汎用性の高いLDIプレート等を提供する。
【解決手段】
本発明の第1の側面は、レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に塗布され、レーザーが照射されることによって分析対象となる試料のイオン化を補助するイオン化補助粒子とを有することを特徴とするLDIプレートにある。本構成によれば、容易に製造でき、汎用性の高いLDIプレートが得られる。本発明の第2の側面は、レーザーが照射されることによって分析対象となる試料のイオン化を補助する白金粒子を有することを特徴とするLDIプレートにある。本構成によれば、広範囲の波長のレーザー光を吸収できる白金粒子が基板上に担持されているため、様々な種類の試料をレーザー脱離イオン化質量分析法の対象とすることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、イオン化技術、特に、レーザー脱離イオン化質量分析方法及びレーザー脱離イオン化質量分析用基板に関する。
【背景技術】
【0002】
質量分析法は、試料の質量電荷比(質量を電荷の数で割った値)を求めるときに使用される手法である。すなわち、質量分析法では、測定対象をイオン化し、その質量電荷比(m/z)の違いによってイオンを分離し、検出する。
【0003】
物質にレーザー光を照射すると、物質が光を吸収して光電子移動が進行し、イオン化される。この直接的なレーザー照射によるイオン化法をレーザー脱離イオン化法(Laser Desorption / Ionization、LDI)という。しかし、LDIでは物質の種類によっては効率的な電子移動が行われず、試料がレーザーでダメージを受けてしまうという欠点があった。
【0004】
そこで、これまでは、測定試料にイオン化補助剤(マトリックス剤)を混合して、レーザー光(例えば波長:337nm)を当てることにより、マトリックス剤が光を吸収し、照射箇所で急激な温度上昇が生じ、試料分子を分解せずにイオン化(ソフトイオン化)することができるとされている(非特許文献1、2、3参照)。この手法は、マトリック支援レーザー脱離イオン化質量分析法(MALDI(Matrix Assisted Laser Desorption / Ionization)-MS)と呼ばれる技術である。この技術は、タンパク質や合成高分子などの化合物を測定する手段として、医薬、臨床、食品、高分子材料及び環境分野等に広く利用されている。
【0005】
このMALDI法で用いられるマトリックスとしては、(1)二重結合や芳香環を官能基にもつ有機マトリックスと(非特許文献2参照)、(2)無機微粒子を用いる無機マトリックスに大別される(特許文献1、特許文献2、非特許文献3、非特許文献4、非特許文献5参照)。(3)マトリックスを用いないソフトイオン化法の技術として、数10ナノメートルの微細な細孔構造をもつ多孔質シリコン表面に試料に塗布し、レーザー光を照射してイオン化する方法(DIOS法)が提案されている(非特許文献6参照)。
【0006】
【非特許文献1】Rakawa et.al. J. Mass Spectrom. Soc. Jpn 2004, 52, 33.
【非特許文献2】Karas, M.;Hillenkamp, F. Anal. Chem. 1988, 60, 2299.
【非特許文献3】Tanaka, K.; Eaki, H.; Ido, Y.;Akita, S.; Yoshida, Y.;Yoshida, T. Rapid Commun. Mass Spectrm. 1988, 2, 151.
【非特許文献4】John A. McLean, Katherine A. Stumpo, and David H. Russell J. Am. Chem. Soc. 2005, 127, 5304.
【非特許文献5】産総研TODAY2006-05Vol.6No.5
【非特許文献6】Wei, J.; Buriak, J. M.; Siuzdak, G. Nature 1999, 399, 243-6.
【特許文献1】特開昭62-43582
【特許文献2】特開2006-201042
【発明の開示】
【発明が解決しようとする課題】
【0007】
(1)上述の方法での問題点は、まず、有機マトリックスでは最適な条件(試料に加える有機マトリックスと溶媒の種類や混合比、試料とマトリックスの混晶の結晶状態等)を測定ごとに検討しなければならないことである。マトリックスの役目は、レーザーエネルギー伝達の仲介である。質量分析のスペクトルはサンプルとマトリックスの混晶の状態に大きく左右され、サンプルに応じたマトリックスを探さなければならないという課題がある。
【0008】
また、有機マトリックスと試料との間の化学反応や、有機マトリックスのレーザー照射による分解生成物によるピークの発生が問題となる場合がある。
【0009】
加えて、図1に示すように、有機マトリックスに由来する妨害イオンピークが極めて多く発生するため、分子量が1000以下のペプチドや添加剤などの分析が困難であるという課題がある。すなわち、MALDI法では、過剰に加えられたマトリックス剤に由来するピークが強く観測されるため、試料ピークを妨害してしまう。
【0010】
(2)微粒子を用いる無機マトリックスの手法では、グリセリンなどの液体を無機微粒子と混合したサスペンジョンと試料を混合して用いるが、イオン源部が真空中であるためにグリセリンによる装置の汚染が問題となる。また、この手法では、比較的多くの試料を測定に要し、質量分析法では測定試料の回収が困難であるため、貴重な試料を分析対象にし難い場合もある。さらには、プレートの製造過程に大掛かりな装置や量子ドットを利用するなどの困難な工程を含み、汎用性に欠ける場合もある。したがって、これらの手法は殆んど用いられていないのが現状である。
【0011】
(3)多孔質シリコンを用いるDIOS法では、シリコン表面が容易に空気酸化されることによりイオン化効率が著しく下がるという耐久性の課題がある。
【0012】
本発明は、上述の背景技術に鑑みてなされたものであり、汎用性の高いLDIプレート等を提供することを目的とする。
【課題を解決するための手段】
【0013】
この発明によれば、上述の目的を達成するために、特許請求の範囲に記載のとおりの構成を採用している。以下、この発明を詳細に説明する。
【0014】
本発明の第1の側面は、レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に塗布され、レーザーが照射されることによって分析対象となる試料のイオン化を補助するイオン化補助粒子とを有することを特徴とするLDIプレートにある。本構成によれば、容易に製造でき、汎用性の高いLDIプレートが得られる。
【0015】
本発明の第2の側面は、レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に担持され、レーザーが照射されることによって分析対象となる試料のイオン化を補助する白金粒子とを有することを特徴とするLDIプレートにある。本構成によれば、広範囲の波長のレーザー光を吸収できる白金粒子が基板上に担持されているため、様々な種類の試料をレーザー脱離イオン化質量分析法の対象とすることができる。
【0016】
本発明の第3の側面は、請求項1に記載の前記LDIプレートと、前記LDIプレートに支持された測定対象となる試料をイオン化するための装置と、イオン化された試料を検出するための検出器とを有することを特徴とするレーザー脱離イオン化質量分析装置にある。本構成によれば、容易に製造でき、汎用性の高いレーザー脱離イオン化質量分析装置が得られる。
【0017】
本発明の第4の側面は、レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に塗布され、レーザーが照射されることによって分析対象となる試料のイオン化を補助するイオン化補助粒子とを有するLDIプレート上に試料を配置する工程と、前記イオン化補助粒子にレーザーを照射することによって試料をイオン化する工程と、イオン化された前記試料を検出する工程とを有することを特徴とするレーザー脱離イオン化質量分析方法にある。本構成によれば、容易にレーザー脱離イオン化質量分析方法を実現できる。
【0018】
本発明の第5の側面は、レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートを製造する方法であって、塩化白金酸を還元する還元工程と、前記還元工程によって得られる白金粒子を分散させた液体を基板に塗布する塗布工程とを有することを特徴とするLDIプレート製造方法にある。本構成によれば、広範囲の波長のレーザー光を吸収できる白金粒子が基板上に担持されているため、様々な種類の試料をレーザー脱離イオン化質量分析法の対象とすることができるLDIプレートを得ることができる。
【0019】
なお、本明細書において、イオン化補助粒子とは、レーザーが照射されることによって分析対象となる試料のイオン化を補助するための粒子をいい、その目的を達するものであれば大きさを問わない。これには、例えば、微細粉、微粒子、後述する、ナノ粒子及びナノ粉が含まれる。微細粉の1次粒子のサイズ(直径)は、例えば、1nm以上1μm以下、望ましくは5nm以上600nm以下、さらに望ましくは5nm以上300nm以下とするのが好ましい。また、2次凝集しているものも含まれる。さらに、微細粉よりも大きな構造体のうち、上述の大きさの突起部分を有する構造体でもよい。例えば、突起物が3nm以上300nm以下、望ましくは5nm以上200nm以下の大きさのものをもつ構造体が考えられる。
【0020】
また、担持とは、何らかの物質に他の物質が載っているような状態をいい、例えば塗布などの方法によって実現される。
【発明の効果】
【0021】
本発明によれば、汎用性の高いLDIプレート等が得られる。
【0022】
本発明のさらに他の目的、特徴又は利点は、後述する本発明の実施の形態や添付する図面に基づく詳細な説明によって明らかになるであろう。
【発明を実施するための最良の形態】
【0023】
以下、本発明の実施の形態について図面を参照しながら詳細に説明する。
【0024】
[概要]
【0025】
本実施形態の手法では、マトリックスとして、例えば、ナノ粒子(金ナノ粒子、白金ナノ粒子、酸化亜鉛ナノ粒子等)を担持した基板(例えばナノ粒子担持基板)を試料のイオン化に用いる。ここでは、ナノ粒子を用いる場合について説明するが、イオン化を補助するものであれば粒径などの大きさは問わない。金ナノ粒子及び白金ナノ粒子を使用する場合には、粒子表面に保護剤(有機分子、高分子等)が付着していないことが好ましい。
【0026】
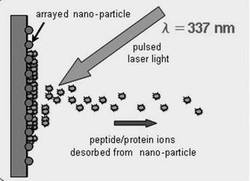
図2は、本実施形態のナノ粒子担持基板を用いたレーザー脱離イオン化質量分析法を示す図である。これらナノ粒子は、レーザー光(例えば波長:337nm)を吸収し、ナノ粒子内で局所的に急激な温度上昇が生じ、試料分子を分解せずにイオン化することができる。
【0027】
本実施形態でマトリックスとして使用するナノ粒子は、これまで必要とされていたグリセリンなどの液体を必ずしも必要としない。また、ナノ粒子の耐久性も極めて高い。ナノ粒子担持基板では、分子量が1000以下のマトリックス由来の妨害ピークの発生を著しく減少させることが可能である。
【0028】
ナノ粒子担持基板の作製は、試料ホルダにナノ粒子が分散した溶液を2μL程度塗布し、乾燥させる。続いて、その上に試料溶液を1μL程度塗布し、一般に減圧下に乾燥させるだけでよい。これによって、MALDI法では不可欠であったマトリックスなどに関する試料調製のノウハウは不要になる。また、本手法では、特別な装置改造などは必ずしも必要とされず、市販のMALDI-MS装置の機種を問わず、多くの機種でそのまま利用することができる。
【0029】
[質量分析方法]
【0030】
具体的な質量分析方法について説明する。
【0031】
まず、分析の対象となる固体試料を、可溶の適当な溶媒で溶かして試料溶液を作る。この際の資料の濃度は、通常1μM程度である。
【0032】
次に、ナノ粒子の分散した水溶液を作る。ナノ粒子の材料は、貴金属、金属、合金、金属酸化物、半導体、金、白金、Rh、Pd、ZuO、CuO、Cu2O、TiO2、RuO2、AlO3等を例として挙げることができる。
【0033】
また、分散媒はプレートに塗布されるまで粒子が沈降しなければよいが、常温・真空下で容易に蒸発してしまう分散媒を用いれば、低分子量領域に分散媒のピークがでないことがのぞましい。分散媒として用いられる代表的なものとしては、水、メタノール、エタノール、プロパノール、イソプロパノール、ブタノールなどのアルコール類、酢酸エチルなどのエステル類、エチルエーテル、THFなどのエーテル類、ヘキサン、石油エーテルなどのアルカン類、クロロホルム、塩化メチレンなどのハロゲン化アルキル類、ベンゼン、トルエンなどの芳香族類等がある。
【0034】
ここで、粒子表面に保護剤(例えば、有機分子、高分子)が付着していないことが好ましい。ただし、当然のことながら、分析の対象となる試料の分析に大きな影響がない程度の微量の保護剤であれば問題ない。同様の理由で、表面に吸着高分子、界面活性剤、有機金属配位子などの有機保護層を持っていない粉末、粒子を使用するのが好ましい。
【0035】
例えば、金ナノ粒子は、溶液に浸された塊状の金にレーザー光を当てて粉砕することによって液中でのレーザーアブレーションが起こり、調製することができる。通常、市販されている金ナノ粒子及び白金ナノ粒子は保護剤が付着した状態で提供されるが、後述するように、これら保護剤の存在は、試料のイオン化において妨げとなる場合がある。また、ナノ粒子の直径は、レーザー照射箇所で急激な温度上昇を起こすためには小さくすることが好都合である。金ナノ粒子及び白金ナノ粒子については200nm以下、酸化亜鉛ナノ粒子については100nm以下が好ましい。但し、これらの粒子が2次凝集していることについては問題がない。
【0036】
次に、市販のLDIプレートに先述のナノ粒子が分散した溶液を2μL程度塗布し、乾燥させる。これによりナノ粒子担持基板を作製する。続いて、その上に試料溶液を1μL程度塗布し、乾燥させる。中性試料分子を分析対象とする場合には、試料を塗布する前に、カチオン化剤としてクエン酸バッファー(クエン酸(0.2M):クエン酸アンモニウム(0.2M)=1.1:5の体積比)をナノ粒子担持基板に塗布する。
【0037】
このようにして作製されたナノ粒子担持基板に10ns程度のパルスレーザー光(波長:337nm、520nm又は1020nm等)を照射すると、レーザー光はナノ粒子に吸収され、これによって局部的に急激な温度上昇が生ずる。この温度上昇によって、その近辺の試料分子がイオン化され、加速電圧によって、質量分析計に引き出される。なお、レーザーイオン化法に用いるため、ナノ粒子はレーザー波長(例えば337nm)付近の吸収の大きなものが望ましいが、その波長近傍に吸収波長極大を有する必要はない。
【0038】
ナノ粒子としては、金ナノ粒子、白金ナノ粒子、及び酸化亜鉛ナノ粒子が好ましい。特に、白金ナノ粒子が優れた特性を示す。
【0039】
なお、レーザー脱離イオン化質量分析装置には、試料導入部、試料をイオン化するためのイオン源、イオン化された試料を分離する分析部、イオン化された試料を検出するためのイオン検出部、データ処理部が備えられている。
【0040】
[分析結果]
【0041】
図3は、酸化亜鉛ナノ粒子担持基板を用いたポリエチレングリコール(PEG)のLDI-MSスペクトルである。比較のために典型的な有機マトリックスであるα-シアノ-4-ヒドロキシけい皮酸(CHCA)を用いた場合も示してある。有機マトリックスを用いた場合、試料500以下にマトリックス由来の妨害ピークが見られた(丸印)。一方、酸化亜鉛ナノ粒子担持基板を用いた場合は、マトリックス由来の妨害ピークが見られず、PEGのモノマー単位に対応する44の繰り返し単位をもつPEG試料のピークのみが観測された。同様の結果は、金ナノ粒子担持基板、及び白金ナノ粒子担持基板においても確認された。
【0042】
図4は、金ナノ粒子担持基板を用いたペプチド及び脂質のLDI-MSスペクトルである。試料は、(a)サブスタンスP、(b)アンジオテンシンI、(c)DPPC(脂質)である。また、図5は、糖の脂質のLDI-MSスペクトルである。試料は、(a)キトサン(6量体)、(b)bーシクロデキストリンである。いずれの場合も、明確な試料ピークが検出された。ピークの拡大図によれば同位体のピークを確認することができることから、分解能でピークが検出されていることがわかる。本実施形態のナノ粒子担持基板は、タンパク質、脂質、ペプチド、糖の同定を行うための有効な解析手段になりうるものであり、新しい医薬品開発の促進に役立つ重要な技術に発展することが期待される。
【0043】
図6は、保護剤有りの場合と保護剤なしの場合との金ナノ粒子担持基板を用いたアンジオテンシンIのLDI-MSスペクトルである。また、図7は、保護剤有りの場合と保護剤なしの場合との白金ナノ粒子担持基板を用いたアンジオテンシンIのLDI-MSスペクトルである。ここで保護剤としては市販されているクエン酸Naを使用した。保護剤が付着した金ナノ粒子担持基板では、ブロードなピークが検出され、分解能が極めて悪い。これに比べて、保護剤がない金ナノ粒子担持基板では、ピーク強度及び分解能ともに優れている。同様に、市販されている高分子(ポリビニールピロリドン(PVP))保護剤が付着した白金ナノ粒子担持基板では、明確なピークが検出されないのに対し、保護剤がない白金ナノ粒子では、明確なピークが検出されている。このように、金ナノ粒子及び白金ナノ粒子については、粒子表面に保護剤(有機分子、高分子)が付着していないことが好ましいことがわかる。また、白金ナノ粒子は、分解能、強度ともに金ナノ粒子よりも優れていることがわかる。
【0044】
なお、図8は、金・白金ナノ粒子担持基板を用いた界面活性剤のLDI-MSスペクトルである。分析対象はアルキルトリメチルアンモニウムブロマイドであり、炭素数比C10:C12:C14:C16を等モル混合(それぞれ1mM)とした。有機マトリックス使用の場合には、炭素数の変化に寄らず、均等に検出されているが、ナノ粒子使用の場合には、C16が他の炭素数の化合物よりも強く検出された。ナノ粒子担持基板では、粒子表面に吸着した分子を選択的にイオン化することが可能であることがわかる。
【0045】
[白金ナノ粉]
【0046】
白金は非常に安定な金属であり、金属そのままでナノ粉として空気中で保存しても容易に酸化したり燃焼したりしない。また、化合物と反応することも少ない。さらに、融点が約1770℃と非常に高く、レーザー照射によるフラグメンテーションが起こりにくい。特に、黒色のため、どの波長のレーザー光も吸収できるという利点がある。
【0047】
そこで、これらの有利な点を持つ白金のナノ粉を以下の要領で製造し、質量分析に使用した。
【0048】
<白金ナノ粉製造方法1>
【0049】
塩化白金(IV)酸(1g)水溶液に水素化ホウ素ナトリウム(380mg)を入れ、これを還元した。得られた粉末をろ過し、純水で洗浄し、雑イオンなどをできるだけ取り除いたあと、乾燥・回収する。これを純水中に入れ、めのう乳鉢でよく摺り合わせた。
【0050】
得られた白金ナノ粉分散液をLDIプレートに塗布し、カチオン化剤としてクエン酸バッファー(クエン酸(0.2M)/クエン酸アンモニウム(0.2M)=1.1/5の体積比)を塗布した後、その上にサンプルを載せて乾燥後、MSスペクトルを測定した。
【0051】
アンジオテンシンI、インスリン、チトクロームCをそれぞれ1pmolで分析した場合、極めて少ない分解ピークで検出可能であった。アンジオテンシンIを使用した分析では同位体ピークも観測された。
【0052】
<白金ナノ粉製造方法2>
【0053】
塩化白金(IV)酸(1g)水溶液に水素化ホウ素ナトリウム(380mg)を入れ、これを還元した。得られた粉末をろ過し、純水で洗浄し、雑イオンなどをできるだけ取り除いたあと、乾燥・回収した。こうして得られた白金ナノ粉(12mg/mL)を純水中にいれ超音波照射(40kHz、45W、5分)によって分散させた。得られた分散液をLDIプレートに塗布し、その上にクエン酸バッファー、サンプルを載せて乾燥後、MSスペクトルを測定した。以下では、この方法で製造された白金ナノ粉を使用した測定結果について説明する。
【0054】
図9、図10及び図11は、アンジオテンシンI(700amol)、インシュリン ヒト(5fmol)、チトクロームC(20fmol)をそれぞれ分析対象とし、白金ナノ粉を使用した場合の測定結果である。この場合、それぞれ極めて低濃度であっても分解ピークも見られず観測できた。アンジオテンシンIを使用した分析では同位体ピークも観測された。
【0055】
図12は、白金ナノ粉を使用した場合のSubstance PのMSスペクトルである。Substance Pは、11個のアミノ酸よりなるポリペプチドであるが、この場合であってもイオン化は適切に行われ、Substance Pがうまく検出されていることがわかる。
【0056】
図13は、白金ナノ粉を使用した場合のアンジオテンシンIのMSスペクトルである。白金ナノ粉を使用した場合は、イオン化は適切に行われ、アンジオテンシンIがうまく検出されていることがわかる。
【0057】
図14は、白金ナノ粉を使用した場合のインスリンのMSスペクトルである。また、図15は、白金ナノ粉を使用した場合のチトクロームCのMSスペクトルである。いずれの場合にも、イオン化は適切に行われ、試料がうまく検出されていることがわかる。
【0058】
図16は、白金ナノ粉のSEM写真である。この写真からわかるように、この白金ナノ粉には突起状の部分又は針状の部分が観察される。白金ナノ粉には、板状に尖った部位があり、幅は100nmぐらい、厚みは数nm程度である。同様の事項はAnal. Chem., 77, 5364 (2005).にも開示されている。このような突起状の部分又は針状の部分が、試料のイオン化効率を向上させるための重要な役割を担っているものと考えられる。
【0059】
[その他]
【0060】
上述の実施形態では、高感度かつ高分解能の分析を実現している。特に、サブフェムトモルの分析を実現しており、これは、市販のDIOS基板の約10倍から100倍の高感度かつ高分解能の分析にあたる。
【0061】
また、上述の実施形態では、分子量一万以上のタンパク質のイオン化も実現している。DIOS基板では、インシュリン(6000Da)までとされている点と比べると本実施形態の分析対象の広さが際立っている。
【0062】
さらに、上述の実施形態では、極めて良い再現性を実現している。これまでの分析技術では、高分子マトリックスを使用した場合、どうしても高分子が部分的に結晶化し、サンプルエリアの一部にレーザービームをあてていたが、そのときによいスペクトルが取れる場所とそうでない場所があった。しかし、特に、上述のように白金ナノ粒子、特殊形態の白金ナノ材料を一様に印刷・塗布すると、部分的な結晶化がほとんどないため、いわゆるスイートスポットがほとんど存在せず、どのサンプルエリアでも、よい感度で測定することができるという利点が存在する。
【0063】
また、極めて高い空気中での表面安定性が実現できる。これは例えば1年以上と考えられ、これまでのDIOS基板が数日、表面処理したものが一カ月程度で感度低下していたものとは大きく異なる。
【0064】
また、市販のほとんどのLDI-MS装置に使用可能であると考えられる。作製が極めて容易であり、DIOS基板がWaters社製のMSのみにしか使用できず、他社装置の場合には改造が必要になる点で異なる。
【0065】
特に、上述の実施形態では、壊れやすい分子をイオン化でき、試料の選択性が広い点できわめて優れている。
【0066】
上述の試料作製法によれば、マトリックスとして、保護剤(有機分子、高分子等)が付着していないナノ粒子(金ナノ粒子、白金ナノ粒子、酸化亜鉛ナノ粒子等)を担持した基板(ナノ粒子担持基板)を試料のイオン化に用いてLDI-MS分析を行っても、分子量が1000以下のマトリックス由来の妨害ピークの発生を著しく減少させつつ試料のイオン化が可能である。
【0067】
金ナノ粒子、白金ナノ粒子、及び酸化亜鉛ナノ粒子は、グリセリンなどの液体を特に必要とせず、かつ極めて耐久性の高い無機マトリックスである。また、特別な装置改造なしでも、市販のLDI-MS装置が機種を問わずそのまま利用することができる。
【0068】
ナノ粒子担持基板の作製は、例えば、LDIプレートにナノ粒子が分散した溶液を2μL程度塗布し、乾燥させた後、その上に試料溶液を1μL程度塗布し、乾燥させるだけでよい。これによって、MALDI法では不可欠であったマトリックスなどに関する試料調製のノウハウは不要となり、試料作製は極めて容易となる。また、マトリックスと試料との間で化学反応が起こるという不具合が解消され、分析対象物が広がる。
【0069】
ナノ粒子表面に吸着した分子が優先的にイオン化することから、望む試料と相互作用する特異的結合分子をナノ粒子表面と結合させることによって、従来技術では困難な特定のターゲットタンパク質やリガンドと特異的な相互作用を持つタンパク質に絞った試料の検出がLDI-MSによって可能となる。
【0070】
上述のように、本実施形態の手法は、LDI-MS測定によりタンパク質や合成高分子などの化合物を分析するにあたり、極めて耐久性の高い、貴金属ナノ粒子又は半導体ナノ粒子等をマトリックスに用いることによって、(1)分子量が1000以下のマトリックス由来の妨害イオンピークの発生を著しく減少させること、(2)マトリックスと試料との化学反応がほぼ起こらないこと、(3)試料とマトリックスの混晶の結晶状態を検討する必要がないこと、及び(4)グリセリンなどの液体を必ずとも必要としないなどの利点を有するLDI-MSの手法である。
【0071】
[用途]
【0072】
プロテオーム解析、メタボロミクス解析への応用が有望視される。特に、サンプルに含まれる低分子化合物を網羅的に解析し、ある条件下で生体内はどのような変化を起こすかを調べるメタボロミクス解析では、低分子領域で妨害イオンピークが少ない上述の技術が有効である。
【0073】
なお、SDS-PAGEや二次元電気泳動による分離操作と組み合わせて使用することも可能である。とくにこのように分離したものを本発明で示すプレート上に塗布もしくは転写することで、分離された物質をマッピングすることができる。本発明のLDIプレートでは、有機マトリックスを使用する場合に見られる、場所による感度の大きな違い(いわゆるスイートスポット)がみられにくいため、こうした物質の位置を知ることのできるマッピング法に極めて有効である。AP-LDI、IR-LDIにも転用することも考えられる。
【0074】
[権利解釈等]
【0075】
以上、特定の実施形態を参照しながら、本発明について説明してきた。しかしながら、本発明の要旨を逸脱しない範囲で当業者が実施形態の修正又は代用を成し得ることは自明である。すなわち、例示という形態で本発明を開示してきたのであり、本明細書の記載内容を限定的に解釈するべきではない。本発明の要旨を判断するためには、冒頭に記載した特許請求の範囲の欄を参酌すべきである。
【0076】
また、この発明の説明用の実施形態が上述の目的を達成することは明らかであるが、多くの変更や他の実施例を当業者が行うことができることも理解されるところである。特許請求の範囲、明細書、図面及び説明用の各実施形態のエレメント又はコンポーネントを他の1つまたは組み合わせとともに採用してもよい。特許請求の範囲は、かかる変更や他の実施形態をも範囲に含むことを意図されており、これらは、この発明の技術思想および技術的範囲に含まれる。
【図面の簡単な説明】
【0077】
【図1】有機マトリックスに由来する妨害イオンピークを示す図である。
【図2】ナノ粒子担持基板を用いたレーザー脱離イオン化質量分析法を示す図である。
【図3】酸化亜鉛ナノ粒子担持基板を用いたポリエチレングリコール(PEG)のLDI-MSスペクトルである。
【図4】金ナノ粒子担持基板を用いたペプチド及び脂質のLDI-MSスペクトルである。
【図5】糖の脂質のLDI-MSスペクトルである。
【図6】保護剤有りの場合と保護剤なしの場合との金ナノ粒子担持基板を用いたアンジオテンシンIのLDI-MSスペクトルである。
【図7】保護剤有りの場合と保護剤なしの場合との白金ナノ粒子担持基板を用いたアンジオテンシンIのLDI-MSスペクトルである。
【図8】金・白金ナノ粒子担持基板を用いた界面活性剤のLDI-MSスペクトルである。
【図9】アンジオテンシンIを分析対象とし、白金ナノ粉を使用した場合の測定結果である。
【図10】インシュリン ヒトを分析対象とし、白金ナノ粉を使用した場合の測定結果である。
【図11】チトクロームCを分析対象とし、白金ナノ粉を使用した場合の測定結果である。
【図12】白金ナノ粉を使用した場合のSubstance PのMSスペクトルである。
【図13】白金ナノ粉を使用した場合のアンジオテンシンIのMSスペクトルである。
【図14】白金ナノ粉を使用した場合のインスリンのMSスペクトルである。
【図15】白金ナノ粉を使用した場合のチトクロームCのMSスペクトルである。
【図16】白金ナノ粉のSEM写真である。
【技術分野】
【0001】
本発明は、イオン化技術、特に、レーザー脱離イオン化質量分析方法及びレーザー脱離イオン化質量分析用基板に関する。
【背景技術】
【0002】
質量分析法は、試料の質量電荷比(質量を電荷の数で割った値)を求めるときに使用される手法である。すなわち、質量分析法では、測定対象をイオン化し、その質量電荷比(m/z)の違いによってイオンを分離し、検出する。
【0003】
物質にレーザー光を照射すると、物質が光を吸収して光電子移動が進行し、イオン化される。この直接的なレーザー照射によるイオン化法をレーザー脱離イオン化法(Laser Desorption / Ionization、LDI)という。しかし、LDIでは物質の種類によっては効率的な電子移動が行われず、試料がレーザーでダメージを受けてしまうという欠点があった。
【0004】
そこで、これまでは、測定試料にイオン化補助剤(マトリックス剤)を混合して、レーザー光(例えば波長:337nm)を当てることにより、マトリックス剤が光を吸収し、照射箇所で急激な温度上昇が生じ、試料分子を分解せずにイオン化(ソフトイオン化)することができるとされている(非特許文献1、2、3参照)。この手法は、マトリック支援レーザー脱離イオン化質量分析法(MALDI(Matrix Assisted Laser Desorption / Ionization)-MS)と呼ばれる技術である。この技術は、タンパク質や合成高分子などの化合物を測定する手段として、医薬、臨床、食品、高分子材料及び環境分野等に広く利用されている。
【0005】
このMALDI法で用いられるマトリックスとしては、(1)二重結合や芳香環を官能基にもつ有機マトリックスと(非特許文献2参照)、(2)無機微粒子を用いる無機マトリックスに大別される(特許文献1、特許文献2、非特許文献3、非特許文献4、非特許文献5参照)。(3)マトリックスを用いないソフトイオン化法の技術として、数10ナノメートルの微細な細孔構造をもつ多孔質シリコン表面に試料に塗布し、レーザー光を照射してイオン化する方法(DIOS法)が提案されている(非特許文献6参照)。
【0006】
【非特許文献1】Rakawa et.al. J. Mass Spectrom. Soc. Jpn 2004, 52, 33.
【非特許文献2】Karas, M.;Hillenkamp, F. Anal. Chem. 1988, 60, 2299.
【非特許文献3】Tanaka, K.; Eaki, H.; Ido, Y.;Akita, S.; Yoshida, Y.;Yoshida, T. Rapid Commun. Mass Spectrm. 1988, 2, 151.
【非特許文献4】John A. McLean, Katherine A. Stumpo, and David H. Russell J. Am. Chem. Soc. 2005, 127, 5304.
【非特許文献5】産総研TODAY2006-05Vol.6No.5
【非特許文献6】Wei, J.; Buriak, J. M.; Siuzdak, G. Nature 1999, 399, 243-6.
【特許文献1】特開昭62-43582
【特許文献2】特開2006-201042
【発明の開示】
【発明が解決しようとする課題】
【0007】
(1)上述の方法での問題点は、まず、有機マトリックスでは最適な条件(試料に加える有機マトリックスと溶媒の種類や混合比、試料とマトリックスの混晶の結晶状態等)を測定ごとに検討しなければならないことである。マトリックスの役目は、レーザーエネルギー伝達の仲介である。質量分析のスペクトルはサンプルとマトリックスの混晶の状態に大きく左右され、サンプルに応じたマトリックスを探さなければならないという課題がある。
【0008】
また、有機マトリックスと試料との間の化学反応や、有機マトリックスのレーザー照射による分解生成物によるピークの発生が問題となる場合がある。
【0009】
加えて、図1に示すように、有機マトリックスに由来する妨害イオンピークが極めて多く発生するため、分子量が1000以下のペプチドや添加剤などの分析が困難であるという課題がある。すなわち、MALDI法では、過剰に加えられたマトリックス剤に由来するピークが強く観測されるため、試料ピークを妨害してしまう。
【0010】
(2)微粒子を用いる無機マトリックスの手法では、グリセリンなどの液体を無機微粒子と混合したサスペンジョンと試料を混合して用いるが、イオン源部が真空中であるためにグリセリンによる装置の汚染が問題となる。また、この手法では、比較的多くの試料を測定に要し、質量分析法では測定試料の回収が困難であるため、貴重な試料を分析対象にし難い場合もある。さらには、プレートの製造過程に大掛かりな装置や量子ドットを利用するなどの困難な工程を含み、汎用性に欠ける場合もある。したがって、これらの手法は殆んど用いられていないのが現状である。
【0011】
(3)多孔質シリコンを用いるDIOS法では、シリコン表面が容易に空気酸化されることによりイオン化効率が著しく下がるという耐久性の課題がある。
【0012】
本発明は、上述の背景技術に鑑みてなされたものであり、汎用性の高いLDIプレート等を提供することを目的とする。
【課題を解決するための手段】
【0013】
この発明によれば、上述の目的を達成するために、特許請求の範囲に記載のとおりの構成を採用している。以下、この発明を詳細に説明する。
【0014】
本発明の第1の側面は、レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に塗布され、レーザーが照射されることによって分析対象となる試料のイオン化を補助するイオン化補助粒子とを有することを特徴とするLDIプレートにある。本構成によれば、容易に製造でき、汎用性の高いLDIプレートが得られる。
【0015】
本発明の第2の側面は、レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に担持され、レーザーが照射されることによって分析対象となる試料のイオン化を補助する白金粒子とを有することを特徴とするLDIプレートにある。本構成によれば、広範囲の波長のレーザー光を吸収できる白金粒子が基板上に担持されているため、様々な種類の試料をレーザー脱離イオン化質量分析法の対象とすることができる。
【0016】
本発明の第3の側面は、請求項1に記載の前記LDIプレートと、前記LDIプレートに支持された測定対象となる試料をイオン化するための装置と、イオン化された試料を検出するための検出器とを有することを特徴とするレーザー脱離イオン化質量分析装置にある。本構成によれば、容易に製造でき、汎用性の高いレーザー脱離イオン化質量分析装置が得られる。
【0017】
本発明の第4の側面は、レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に塗布され、レーザーが照射されることによって分析対象となる試料のイオン化を補助するイオン化補助粒子とを有するLDIプレート上に試料を配置する工程と、前記イオン化補助粒子にレーザーを照射することによって試料をイオン化する工程と、イオン化された前記試料を検出する工程とを有することを特徴とするレーザー脱離イオン化質量分析方法にある。本構成によれば、容易にレーザー脱離イオン化質量分析方法を実現できる。
【0018】
本発明の第5の側面は、レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートを製造する方法であって、塩化白金酸を還元する還元工程と、前記還元工程によって得られる白金粒子を分散させた液体を基板に塗布する塗布工程とを有することを特徴とするLDIプレート製造方法にある。本構成によれば、広範囲の波長のレーザー光を吸収できる白金粒子が基板上に担持されているため、様々な種類の試料をレーザー脱離イオン化質量分析法の対象とすることができるLDIプレートを得ることができる。
【0019】
なお、本明細書において、イオン化補助粒子とは、レーザーが照射されることによって分析対象となる試料のイオン化を補助するための粒子をいい、その目的を達するものであれば大きさを問わない。これには、例えば、微細粉、微粒子、後述する、ナノ粒子及びナノ粉が含まれる。微細粉の1次粒子のサイズ(直径)は、例えば、1nm以上1μm以下、望ましくは5nm以上600nm以下、さらに望ましくは5nm以上300nm以下とするのが好ましい。また、2次凝集しているものも含まれる。さらに、微細粉よりも大きな構造体のうち、上述の大きさの突起部分を有する構造体でもよい。例えば、突起物が3nm以上300nm以下、望ましくは5nm以上200nm以下の大きさのものをもつ構造体が考えられる。
【0020】
また、担持とは、何らかの物質に他の物質が載っているような状態をいい、例えば塗布などの方法によって実現される。
【発明の効果】
【0021】
本発明によれば、汎用性の高いLDIプレート等が得られる。
【0022】
本発明のさらに他の目的、特徴又は利点は、後述する本発明の実施の形態や添付する図面に基づく詳細な説明によって明らかになるであろう。
【発明を実施するための最良の形態】
【0023】
以下、本発明の実施の形態について図面を参照しながら詳細に説明する。
【0024】
[概要]
【0025】
本実施形態の手法では、マトリックスとして、例えば、ナノ粒子(金ナノ粒子、白金ナノ粒子、酸化亜鉛ナノ粒子等)を担持した基板(例えばナノ粒子担持基板)を試料のイオン化に用いる。ここでは、ナノ粒子を用いる場合について説明するが、イオン化を補助するものであれば粒径などの大きさは問わない。金ナノ粒子及び白金ナノ粒子を使用する場合には、粒子表面に保護剤(有機分子、高分子等)が付着していないことが好ましい。
【0026】
図2は、本実施形態のナノ粒子担持基板を用いたレーザー脱離イオン化質量分析法を示す図である。これらナノ粒子は、レーザー光(例えば波長:337nm)を吸収し、ナノ粒子内で局所的に急激な温度上昇が生じ、試料分子を分解せずにイオン化することができる。
【0027】
本実施形態でマトリックスとして使用するナノ粒子は、これまで必要とされていたグリセリンなどの液体を必ずしも必要としない。また、ナノ粒子の耐久性も極めて高い。ナノ粒子担持基板では、分子量が1000以下のマトリックス由来の妨害ピークの発生を著しく減少させることが可能である。
【0028】
ナノ粒子担持基板の作製は、試料ホルダにナノ粒子が分散した溶液を2μL程度塗布し、乾燥させる。続いて、その上に試料溶液を1μL程度塗布し、一般に減圧下に乾燥させるだけでよい。これによって、MALDI法では不可欠であったマトリックスなどに関する試料調製のノウハウは不要になる。また、本手法では、特別な装置改造などは必ずしも必要とされず、市販のMALDI-MS装置の機種を問わず、多くの機種でそのまま利用することができる。
【0029】
[質量分析方法]
【0030】
具体的な質量分析方法について説明する。
【0031】
まず、分析の対象となる固体試料を、可溶の適当な溶媒で溶かして試料溶液を作る。この際の資料の濃度は、通常1μM程度である。
【0032】
次に、ナノ粒子の分散した水溶液を作る。ナノ粒子の材料は、貴金属、金属、合金、金属酸化物、半導体、金、白金、Rh、Pd、ZuO、CuO、Cu2O、TiO2、RuO2、AlO3等を例として挙げることができる。
【0033】
また、分散媒はプレートに塗布されるまで粒子が沈降しなければよいが、常温・真空下で容易に蒸発してしまう分散媒を用いれば、低分子量領域に分散媒のピークがでないことがのぞましい。分散媒として用いられる代表的なものとしては、水、メタノール、エタノール、プロパノール、イソプロパノール、ブタノールなどのアルコール類、酢酸エチルなどのエステル類、エチルエーテル、THFなどのエーテル類、ヘキサン、石油エーテルなどのアルカン類、クロロホルム、塩化メチレンなどのハロゲン化アルキル類、ベンゼン、トルエンなどの芳香族類等がある。
【0034】
ここで、粒子表面に保護剤(例えば、有機分子、高分子)が付着していないことが好ましい。ただし、当然のことながら、分析の対象となる試料の分析に大きな影響がない程度の微量の保護剤であれば問題ない。同様の理由で、表面に吸着高分子、界面活性剤、有機金属配位子などの有機保護層を持っていない粉末、粒子を使用するのが好ましい。
【0035】
例えば、金ナノ粒子は、溶液に浸された塊状の金にレーザー光を当てて粉砕することによって液中でのレーザーアブレーションが起こり、調製することができる。通常、市販されている金ナノ粒子及び白金ナノ粒子は保護剤が付着した状態で提供されるが、後述するように、これら保護剤の存在は、試料のイオン化において妨げとなる場合がある。また、ナノ粒子の直径は、レーザー照射箇所で急激な温度上昇を起こすためには小さくすることが好都合である。金ナノ粒子及び白金ナノ粒子については200nm以下、酸化亜鉛ナノ粒子については100nm以下が好ましい。但し、これらの粒子が2次凝集していることについては問題がない。
【0036】
次に、市販のLDIプレートに先述のナノ粒子が分散した溶液を2μL程度塗布し、乾燥させる。これによりナノ粒子担持基板を作製する。続いて、その上に試料溶液を1μL程度塗布し、乾燥させる。中性試料分子を分析対象とする場合には、試料を塗布する前に、カチオン化剤としてクエン酸バッファー(クエン酸(0.2M):クエン酸アンモニウム(0.2M)=1.1:5の体積比)をナノ粒子担持基板に塗布する。
【0037】
このようにして作製されたナノ粒子担持基板に10ns程度のパルスレーザー光(波長:337nm、520nm又は1020nm等)を照射すると、レーザー光はナノ粒子に吸収され、これによって局部的に急激な温度上昇が生ずる。この温度上昇によって、その近辺の試料分子がイオン化され、加速電圧によって、質量分析計に引き出される。なお、レーザーイオン化法に用いるため、ナノ粒子はレーザー波長(例えば337nm)付近の吸収の大きなものが望ましいが、その波長近傍に吸収波長極大を有する必要はない。
【0038】
ナノ粒子としては、金ナノ粒子、白金ナノ粒子、及び酸化亜鉛ナノ粒子が好ましい。特に、白金ナノ粒子が優れた特性を示す。
【0039】
なお、レーザー脱離イオン化質量分析装置には、試料導入部、試料をイオン化するためのイオン源、イオン化された試料を分離する分析部、イオン化された試料を検出するためのイオン検出部、データ処理部が備えられている。
【0040】
[分析結果]
【0041】
図3は、酸化亜鉛ナノ粒子担持基板を用いたポリエチレングリコール(PEG)のLDI-MSスペクトルである。比較のために典型的な有機マトリックスであるα-シアノ-4-ヒドロキシけい皮酸(CHCA)を用いた場合も示してある。有機マトリックスを用いた場合、試料500以下にマトリックス由来の妨害ピークが見られた(丸印)。一方、酸化亜鉛ナノ粒子担持基板を用いた場合は、マトリックス由来の妨害ピークが見られず、PEGのモノマー単位に対応する44の繰り返し単位をもつPEG試料のピークのみが観測された。同様の結果は、金ナノ粒子担持基板、及び白金ナノ粒子担持基板においても確認された。
【0042】
図4は、金ナノ粒子担持基板を用いたペプチド及び脂質のLDI-MSスペクトルである。試料は、(a)サブスタンスP、(b)アンジオテンシンI、(c)DPPC(脂質)である。また、図5は、糖の脂質のLDI-MSスペクトルである。試料は、(a)キトサン(6量体)、(b)bーシクロデキストリンである。いずれの場合も、明確な試料ピークが検出された。ピークの拡大図によれば同位体のピークを確認することができることから、分解能でピークが検出されていることがわかる。本実施形態のナノ粒子担持基板は、タンパク質、脂質、ペプチド、糖の同定を行うための有効な解析手段になりうるものであり、新しい医薬品開発の促進に役立つ重要な技術に発展することが期待される。
【0043】
図6は、保護剤有りの場合と保護剤なしの場合との金ナノ粒子担持基板を用いたアンジオテンシンIのLDI-MSスペクトルである。また、図7は、保護剤有りの場合と保護剤なしの場合との白金ナノ粒子担持基板を用いたアンジオテンシンIのLDI-MSスペクトルである。ここで保護剤としては市販されているクエン酸Naを使用した。保護剤が付着した金ナノ粒子担持基板では、ブロードなピークが検出され、分解能が極めて悪い。これに比べて、保護剤がない金ナノ粒子担持基板では、ピーク強度及び分解能ともに優れている。同様に、市販されている高分子(ポリビニールピロリドン(PVP))保護剤が付着した白金ナノ粒子担持基板では、明確なピークが検出されないのに対し、保護剤がない白金ナノ粒子では、明確なピークが検出されている。このように、金ナノ粒子及び白金ナノ粒子については、粒子表面に保護剤(有機分子、高分子)が付着していないことが好ましいことがわかる。また、白金ナノ粒子は、分解能、強度ともに金ナノ粒子よりも優れていることがわかる。
【0044】
なお、図8は、金・白金ナノ粒子担持基板を用いた界面活性剤のLDI-MSスペクトルである。分析対象はアルキルトリメチルアンモニウムブロマイドであり、炭素数比C10:C12:C14:C16を等モル混合(それぞれ1mM)とした。有機マトリックス使用の場合には、炭素数の変化に寄らず、均等に検出されているが、ナノ粒子使用の場合には、C16が他の炭素数の化合物よりも強く検出された。ナノ粒子担持基板では、粒子表面に吸着した分子を選択的にイオン化することが可能であることがわかる。
【0045】
[白金ナノ粉]
【0046】
白金は非常に安定な金属であり、金属そのままでナノ粉として空気中で保存しても容易に酸化したり燃焼したりしない。また、化合物と反応することも少ない。さらに、融点が約1770℃と非常に高く、レーザー照射によるフラグメンテーションが起こりにくい。特に、黒色のため、どの波長のレーザー光も吸収できるという利点がある。
【0047】
そこで、これらの有利な点を持つ白金のナノ粉を以下の要領で製造し、質量分析に使用した。
【0048】
<白金ナノ粉製造方法1>
【0049】
塩化白金(IV)酸(1g)水溶液に水素化ホウ素ナトリウム(380mg)を入れ、これを還元した。得られた粉末をろ過し、純水で洗浄し、雑イオンなどをできるだけ取り除いたあと、乾燥・回収する。これを純水中に入れ、めのう乳鉢でよく摺り合わせた。
【0050】
得られた白金ナノ粉分散液をLDIプレートに塗布し、カチオン化剤としてクエン酸バッファー(クエン酸(0.2M)/クエン酸アンモニウム(0.2M)=1.1/5の体積比)を塗布した後、その上にサンプルを載せて乾燥後、MSスペクトルを測定した。
【0051】
アンジオテンシンI、インスリン、チトクロームCをそれぞれ1pmolで分析した場合、極めて少ない分解ピークで検出可能であった。アンジオテンシンIを使用した分析では同位体ピークも観測された。
【0052】
<白金ナノ粉製造方法2>
【0053】
塩化白金(IV)酸(1g)水溶液に水素化ホウ素ナトリウム(380mg)を入れ、これを還元した。得られた粉末をろ過し、純水で洗浄し、雑イオンなどをできるだけ取り除いたあと、乾燥・回収した。こうして得られた白金ナノ粉(12mg/mL)を純水中にいれ超音波照射(40kHz、45W、5分)によって分散させた。得られた分散液をLDIプレートに塗布し、その上にクエン酸バッファー、サンプルを載せて乾燥後、MSスペクトルを測定した。以下では、この方法で製造された白金ナノ粉を使用した測定結果について説明する。
【0054】
図9、図10及び図11は、アンジオテンシンI(700amol)、インシュリン ヒト(5fmol)、チトクロームC(20fmol)をそれぞれ分析対象とし、白金ナノ粉を使用した場合の測定結果である。この場合、それぞれ極めて低濃度であっても分解ピークも見られず観測できた。アンジオテンシンIを使用した分析では同位体ピークも観測された。
【0055】
図12は、白金ナノ粉を使用した場合のSubstance PのMSスペクトルである。Substance Pは、11個のアミノ酸よりなるポリペプチドであるが、この場合であってもイオン化は適切に行われ、Substance Pがうまく検出されていることがわかる。
【0056】
図13は、白金ナノ粉を使用した場合のアンジオテンシンIのMSスペクトルである。白金ナノ粉を使用した場合は、イオン化は適切に行われ、アンジオテンシンIがうまく検出されていることがわかる。
【0057】
図14は、白金ナノ粉を使用した場合のインスリンのMSスペクトルである。また、図15は、白金ナノ粉を使用した場合のチトクロームCのMSスペクトルである。いずれの場合にも、イオン化は適切に行われ、試料がうまく検出されていることがわかる。
【0058】
図16は、白金ナノ粉のSEM写真である。この写真からわかるように、この白金ナノ粉には突起状の部分又は針状の部分が観察される。白金ナノ粉には、板状に尖った部位があり、幅は100nmぐらい、厚みは数nm程度である。同様の事項はAnal. Chem., 77, 5364 (2005).にも開示されている。このような突起状の部分又は針状の部分が、試料のイオン化効率を向上させるための重要な役割を担っているものと考えられる。
【0059】
[その他]
【0060】
上述の実施形態では、高感度かつ高分解能の分析を実現している。特に、サブフェムトモルの分析を実現しており、これは、市販のDIOS基板の約10倍から100倍の高感度かつ高分解能の分析にあたる。
【0061】
また、上述の実施形態では、分子量一万以上のタンパク質のイオン化も実現している。DIOS基板では、インシュリン(6000Da)までとされている点と比べると本実施形態の分析対象の広さが際立っている。
【0062】
さらに、上述の実施形態では、極めて良い再現性を実現している。これまでの分析技術では、高分子マトリックスを使用した場合、どうしても高分子が部分的に結晶化し、サンプルエリアの一部にレーザービームをあてていたが、そのときによいスペクトルが取れる場所とそうでない場所があった。しかし、特に、上述のように白金ナノ粒子、特殊形態の白金ナノ材料を一様に印刷・塗布すると、部分的な結晶化がほとんどないため、いわゆるスイートスポットがほとんど存在せず、どのサンプルエリアでも、よい感度で測定することができるという利点が存在する。
【0063】
また、極めて高い空気中での表面安定性が実現できる。これは例えば1年以上と考えられ、これまでのDIOS基板が数日、表面処理したものが一カ月程度で感度低下していたものとは大きく異なる。
【0064】
また、市販のほとんどのLDI-MS装置に使用可能であると考えられる。作製が極めて容易であり、DIOS基板がWaters社製のMSのみにしか使用できず、他社装置の場合には改造が必要になる点で異なる。
【0065】
特に、上述の実施形態では、壊れやすい分子をイオン化でき、試料の選択性が広い点できわめて優れている。
【0066】
上述の試料作製法によれば、マトリックスとして、保護剤(有機分子、高分子等)が付着していないナノ粒子(金ナノ粒子、白金ナノ粒子、酸化亜鉛ナノ粒子等)を担持した基板(ナノ粒子担持基板)を試料のイオン化に用いてLDI-MS分析を行っても、分子量が1000以下のマトリックス由来の妨害ピークの発生を著しく減少させつつ試料のイオン化が可能である。
【0067】
金ナノ粒子、白金ナノ粒子、及び酸化亜鉛ナノ粒子は、グリセリンなどの液体を特に必要とせず、かつ極めて耐久性の高い無機マトリックスである。また、特別な装置改造なしでも、市販のLDI-MS装置が機種を問わずそのまま利用することができる。
【0068】
ナノ粒子担持基板の作製は、例えば、LDIプレートにナノ粒子が分散した溶液を2μL程度塗布し、乾燥させた後、その上に試料溶液を1μL程度塗布し、乾燥させるだけでよい。これによって、MALDI法では不可欠であったマトリックスなどに関する試料調製のノウハウは不要となり、試料作製は極めて容易となる。また、マトリックスと試料との間で化学反応が起こるという不具合が解消され、分析対象物が広がる。
【0069】
ナノ粒子表面に吸着した分子が優先的にイオン化することから、望む試料と相互作用する特異的結合分子をナノ粒子表面と結合させることによって、従来技術では困難な特定のターゲットタンパク質やリガンドと特異的な相互作用を持つタンパク質に絞った試料の検出がLDI-MSによって可能となる。
【0070】
上述のように、本実施形態の手法は、LDI-MS測定によりタンパク質や合成高分子などの化合物を分析するにあたり、極めて耐久性の高い、貴金属ナノ粒子又は半導体ナノ粒子等をマトリックスに用いることによって、(1)分子量が1000以下のマトリックス由来の妨害イオンピークの発生を著しく減少させること、(2)マトリックスと試料との化学反応がほぼ起こらないこと、(3)試料とマトリックスの混晶の結晶状態を検討する必要がないこと、及び(4)グリセリンなどの液体を必ずとも必要としないなどの利点を有するLDI-MSの手法である。
【0071】
[用途]
【0072】
プロテオーム解析、メタボロミクス解析への応用が有望視される。特に、サンプルに含まれる低分子化合物を網羅的に解析し、ある条件下で生体内はどのような変化を起こすかを調べるメタボロミクス解析では、低分子領域で妨害イオンピークが少ない上述の技術が有効である。
【0073】
なお、SDS-PAGEや二次元電気泳動による分離操作と組み合わせて使用することも可能である。とくにこのように分離したものを本発明で示すプレート上に塗布もしくは転写することで、分離された物質をマッピングすることができる。本発明のLDIプレートでは、有機マトリックスを使用する場合に見られる、場所による感度の大きな違い(いわゆるスイートスポット)がみられにくいため、こうした物質の位置を知ることのできるマッピング法に極めて有効である。AP-LDI、IR-LDIにも転用することも考えられる。
【0074】
[権利解釈等]
【0075】
以上、特定の実施形態を参照しながら、本発明について説明してきた。しかしながら、本発明の要旨を逸脱しない範囲で当業者が実施形態の修正又は代用を成し得ることは自明である。すなわち、例示という形態で本発明を開示してきたのであり、本明細書の記載内容を限定的に解釈するべきではない。本発明の要旨を判断するためには、冒頭に記載した特許請求の範囲の欄を参酌すべきである。
【0076】
また、この発明の説明用の実施形態が上述の目的を達成することは明らかであるが、多くの変更や他の実施例を当業者が行うことができることも理解されるところである。特許請求の範囲、明細書、図面及び説明用の各実施形態のエレメント又はコンポーネントを他の1つまたは組み合わせとともに採用してもよい。特許請求の範囲は、かかる変更や他の実施形態をも範囲に含むことを意図されており、これらは、この発明の技術思想および技術的範囲に含まれる。
【図面の簡単な説明】
【0077】
【図1】有機マトリックスに由来する妨害イオンピークを示す図である。
【図2】ナノ粒子担持基板を用いたレーザー脱離イオン化質量分析法を示す図である。
【図3】酸化亜鉛ナノ粒子担持基板を用いたポリエチレングリコール(PEG)のLDI-MSスペクトルである。
【図4】金ナノ粒子担持基板を用いたペプチド及び脂質のLDI-MSスペクトルである。
【図5】糖の脂質のLDI-MSスペクトルである。
【図6】保護剤有りの場合と保護剤なしの場合との金ナノ粒子担持基板を用いたアンジオテンシンIのLDI-MSスペクトルである。
【図7】保護剤有りの場合と保護剤なしの場合との白金ナノ粒子担持基板を用いたアンジオテンシンIのLDI-MSスペクトルである。
【図8】金・白金ナノ粒子担持基板を用いた界面活性剤のLDI-MSスペクトルである。
【図9】アンジオテンシンIを分析対象とし、白金ナノ粉を使用した場合の測定結果である。
【図10】インシュリン ヒトを分析対象とし、白金ナノ粉を使用した場合の測定結果である。
【図11】チトクロームCを分析対象とし、白金ナノ粉を使用した場合の測定結果である。
【図12】白金ナノ粉を使用した場合のSubstance PのMSスペクトルである。
【図13】白金ナノ粉を使用した場合のアンジオテンシンIのMSスペクトルである。
【図14】白金ナノ粉を使用した場合のインスリンのMSスペクトルである。
【図15】白金ナノ粉を使用した場合のチトクロームCのMSスペクトルである。
【図16】白金ナノ粉のSEM写真である。
【特許請求の範囲】
【請求項1】
レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に塗布され、レーザーが照射されることによって分析対象となる試料のイオン化を補助するイオン化補助粒子とを有することを特徴とするLDIプレート。
【請求項2】
前記イオン化補助粒子の材料は、金属又は金属酸化物であることを特徴とする請求項1に記載のLDIプレート。
【請求項3】
レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に担持され、レーザーが照射されることによって分析対象となる試料のイオン化を補助する白金粒子とを有することを特徴とするLDIプレート。
【請求項4】
前記白金粒子は、突起状の部分又は針状の部分を有することを特徴とする請求項1に記載のLDIプレート。
【請求項5】
請求項1に記載の前記LDIプレートと、前記LDIプレートに支持された測定対象となる試料をイオン化するための装置と、イオン化された試料を検出するための検出器とを有することを特徴とするレーザー脱離イオン化質量分析装置。
【請求項6】
レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に塗布され、レーザーが照射されることによって分析対象となる試料のイオン化を補助するイオン化補助粒子とを有するLDIプレート上に試料を配置する工程と、前記イオン化補助粒子にレーザーを照射することによって試料をイオン化する工程と、
イオン化された前記試料を検出する工程とを有することを特徴とするレーザー脱離イオン化質量分析方法。
【請求項7】
レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートを製造する方法であって、塩化白金酸を還元する還元工程と、前記還元工程によって得られる白金粒子を分散させた液体を基板に塗布する塗布工程とを有することを特徴とするLDIプレート製造方法。
【請求項8】
前記還元工程によって得られる白金粒子は、突起状の部分又は針状の部分を有することを特徴とする請求項7に記載のLDIプレート製造方法。
【請求項1】
レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に塗布され、レーザーが照射されることによって分析対象となる試料のイオン化を補助するイオン化補助粒子とを有することを特徴とするLDIプレート。
【請求項2】
前記イオン化補助粒子の材料は、金属又は金属酸化物であることを特徴とする請求項1に記載のLDIプレート。
【請求項3】
レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に担持され、レーザーが照射されることによって分析対象となる試料のイオン化を補助する白金粒子とを有することを特徴とするLDIプレート。
【請求項4】
前記白金粒子は、突起状の部分又は針状の部分を有することを特徴とする請求項1に記載のLDIプレート。
【請求項5】
請求項1に記載の前記LDIプレートと、前記LDIプレートに支持された測定対象となる試料をイオン化するための装置と、イオン化された試料を検出するための検出器とを有することを特徴とするレーザー脱離イオン化質量分析装置。
【請求項6】
レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートであって、基板と、前記基板上に塗布され、レーザーが照射されることによって分析対象となる試料のイオン化を補助するイオン化補助粒子とを有するLDIプレート上に試料を配置する工程と、前記イオン化補助粒子にレーザーを照射することによって試料をイオン化する工程と、
イオン化された前記試料を検出する工程とを有することを特徴とするレーザー脱離イオン化質量分析方法。
【請求項7】
レーザー脱離イオン化質量分析法の分析対象となる試料を支持するためのLDIプレートを製造する方法であって、塩化白金酸を還元する還元工程と、前記還元工程によって得られる白金粒子を分散させた液体を基板に塗布する塗布工程とを有することを特徴とするLDIプレート製造方法。
【請求項8】
前記還元工程によって得られる白金粒子は、突起状の部分又は針状の部分を有することを特徴とする請求項7に記載のLDIプレート製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2008−204654(P2008−204654A)
【公開日】平成20年9月4日(2008.9.4)
【国際特許分類】
【出願番号】特願2007−36658(P2007−36658)
【出願日】平成19年2月16日(2007.2.16)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(399030060)学校法人 関西大学 (208)
【Fターム(参考)】
【公開日】平成20年9月4日(2008.9.4)
【国際特許分類】
【出願日】平成19年2月16日(2007.2.16)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(399030060)学校法人 関西大学 (208)
【Fターム(参考)】
[ Back to top ]

