LXRアンタゴニスト
【課題】 生活習慣病の処置等に有用な、血清脂質濃度および血糖を効果的に制御することができる物質を提供する。
【解決手段】 LXRのアンタゴニストとして機能可能なコレステロール酸化物を提供する。また、特定の条件で行う薄層クロマトグラフィーにより得られるRf値が0〜0.059であるコレステロール酸化物を提供する。このようなコレステロール酸化物は、例えば、コレステロールの加熱生成物を、内径1cmおよび長さ6cmのシリカゲルカラムを用い、ジエチルエーテル:アセトンの容積比がそれぞれ75:25、50:50、25:75、0:100である4種の混合溶媒各5mlで順に溶出して2.5mlずつ分画し;そして得られる特定の画分を、逆相HPLCでさらに分画することにより、得ることができる。
【解決手段】 LXRのアンタゴニストとして機能可能なコレステロール酸化物を提供する。また、特定の条件で行う薄層クロマトグラフィーにより得られるRf値が0〜0.059であるコレステロール酸化物を提供する。このようなコレステロール酸化物は、例えば、コレステロールの加熱生成物を、内径1cmおよび長さ6cmのシリカゲルカラムを用い、ジエチルエーテル:アセトンの容積比がそれぞれ75:25、50:50、25:75、0:100である4種の混合溶媒各5mlで順に溶出して2.5mlずつ分画し;そして得られる特定の画分を、逆相HPLCでさらに分画することにより、得ることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、LXR(肝臓X受容体;Liver X receptor)のアンタゴニストに関する。LXRアンタゴニストは、生活習慣病の処置のために用いることができ、そのようなアンタゴニストとして、酸化コレステロールのある種のものが機能可能である。
【背景技術】
【0002】
脂質代謝を制御する核内受容体であるLXR(肝臓X受容体;Liver X receptor)を標的としての動脈硬化症に対する創薬が行われてきている。
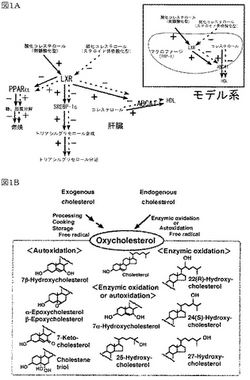
図1Aに示したマクロファージや肝臓といった、動脈硬化発症において重要な臓器ではLXRの活性を上昇させれば、細胞内コレステロールを排出させるATP-binding cassette transporter-1(ABCA1)の発現量が上がり(非特許文献1等参照)、抗動脈硬化作用をもつリポタンパク質である血清HDL濃度が上昇すると期待されてきた。
【0003】
しかしながら、LXRはトリアシルグリセロールの合成を促進するため、血清HDL濃度は上昇するが、それにも増して血清トリアシルグリセロール濃度も上昇させる結果になった(図1A参照。肝臓の部分の実線矢印)。現在、主なLXRのアゴニストとして、22(R)ヒドロキシコレステロール、24(S)ヒドロキシコレステロール(非特許文献2参照)といった、側鎖酸化型の酸化コレステロール(図1B)が発見され、合成薬剤としてはTO-901317が開発されたが、それぞれ、高トリアシルグリセリド血症の可能性が指摘されている。
【0004】
【非特許文献1】Karen Schwartz et al: Biochem, Biophys. Res. Commun. 274, 794-802(2000)
【非特許文献2】Jurgen M. Lehmann et al: J. Biol. Biochem. 272, 3137-3140(1997)
【発明の開示】
【0005】
LXRは脂質代謝亢進として働くので、上記のような副作用が発現したと考えられる。したがって、脂質代謝を抑制気味にするアンタゴニストは効果的に血清脂質濃度および血糖を制御できると考えられる。本発明者らは、ステロイド骨格酸化型のコレステロール酸化物が、LXRのアンタゴニストとして機能する可能性を予想した(図1A。肝臓部分の灰色矢印)。そのような化合物が得られれば、高脂血症、動脈硬化症、糖尿病、肥満等の生活習慣病を処置するための医薬として期待できる。本発明者らは、加熱により生成したコレステロール酸化物をシリカゲルを充填したカラムを用いて分画し、マクロファージからのコレステロールの排出機構をモデル系として(図1A)、コレステロール酸化物の中からLXRのアンタゴニストの探索を試み、本発明を完成するに至った。
【0006】
本発明はすなわち、LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の酸化コレステロールを提供する。
本明細書においては、特別な場合を除き、「アゴニスト」とは、作動薬、作用薬ともいい、受容体に結合して種々の生理作用を示す物質をいい、「アンタゴニスト」とは、拮抗薬、遮断薬ともいい、受容体に結合してアゴニストの効果を阻害するが、それ自体は受容体と結合してもアゴニストの効果を発揮できないものをいう。本明細書において、LXRに関してアンタゴニストというとき(例えば「LXRのアンタゴニスト」というとき)は、特別な場合を除き、LXRに結合して、9-cisレチノイン酸の発揮しうる効果のうち、少なくともマクロファージからのコレステロール排出亢進効果を阻害するように機能可能な物質をいう。より詳細には、本明細書の実施例(1-a)に記載のコレステロール排出試験にしたがって試験したときに、9-cisレチノイン酸のコレステロール排出亢進効果の、少なくとも10%を阻害する(すなわち、9-cisレチノイン酸のみを用いた場合のコレステロール排出亢進効果を100としたとき、9-cisレチノイン酸と同時にその10倍量(モル当量)の候補化合物を用いた場合のコレステロール排出亢進効果を90に抑える)ように機能可能な物質をいい、好ましくは20%以上、より好ましくは40%以上、さらに好ましくは60%以上、それより好ましくは80%以上を阻害するように機能可能な物質をいう。
【0007】
LXRのアンタゴニストとしての機能は、9-cisレチノイン酸によるABCA1の誘導を抑制することによって発揮されるものであってもよい。このような場合は、ある物質がLXRのアンタゴニストであるか否かは、9-cisレチノイン酸によるABCA1の誘導を抑制するか否かを、例えば、本明細書の実施例5にしたがってABCA1 mRNAの転写量を指標として判断することができる。
【0008】
また本明細書において、LXRに関してアンタゴニストというときは、22(R)-ヒドロキシコレステロール、TO901317等のLXRのアゴニストとして機能可能な物質の発揮しうる効果のうち少なくともマクロファージからのコレステロール排出亢進効果を阻害するように機能可能な物質であってもよい。
【0009】
本明細書で「酸化コレステロール」(「オキシコレステロール」ということもある。)というときは、特別な場合を除き、自動酸化により生成したものであるか、酵素的酸化により生成したものであるかを問わず、またステロイド骨格酸化型であるか、側鎖酸化型であるかを問わず、コレステロール酸化型の化合物をいう。酸化コレステロールには、例えば、7β―ヒドロキシコレステロール、α―エポキシコレステロール、β―エポキシコレステロール、7-ケトコレステロール、コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオール、7α―ヒドロキシコレステロール、25-ヒドロキシコレステロール、22(R)-ヒドロキシコレステロール、24(S)-ヒドロキシコレステロール、27-ヒドロキシコレステロール、および本明細書の実施例4で得られたB画分に存在する化合物が含まれる。
【0010】
本明細書で「コレステロール酸化物」というときは、特別な場合を除き、コレステロールを酸化処理することにより得られたものをいい、酸化コレステロールである化合物単体である場合と、数種の酸化コレステロールの混合物である場合とがある。特別な場合を除き、自動酸化により生成したものであるか、酵素的酸化により生成したものであるかを問わず、またステロイド骨格酸化型であるか、側鎖酸化型であるかを問わない。
【0011】
本発明の酸化コレステロールは、LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の化合物でありうる。これには、LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の酸化コレステロールは、例えば、コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオール、本明細書の実施例4で得られたB画分、H2画分および/またはC1画分に存在する化合物が含まれる。
【0012】
本発明の酸化コレステロールは、9-cisレチノイン酸との競合試験により、9-cisレチノイン酸によるマクロファージからのコレステロール排出亢進効果を阻害するか否か、および/または9-cisレチノイン酸によるABCA1の誘導を抑制するか否かにより、LXRのアンタゴニストとしての機能を確認することができるが、本発明の酸化コレステロールは、単独で用いた場合にも、マクロファージからのコレステロール排出抑制効果および/またはABCA1の誘導抑制効果を発揮するものであってもよい。
【0013】
LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の酸化コレステロール、またはそのような酸化コレステロールを含むコレステロール酸化物は、以下のようにして得ることができる:
1)コレステロールの加熱生成物を、内径1cmおよび長さ6cmのシリカゲルカラムを用い、ジエチルエーテル:アセトンの容積比がそれぞれ75:25、50:50、25:75、0:100である4種の混合溶媒各5mlで順に溶出して2.5mlずつ分画して第6番目の画分を得て;そして
2)得られる第6番目の画分を、所望によりさらに分画する工程により特定の画分を得る。したがって、本発明はまた、このような工程により得られるコレステロール酸化物を提供する。工程1)から得られる第6番目の画分には、コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオールおよびそれら以外の物質が含まれうる。この画分は、本明細書の実施例(1-b)からも明らかなように、9-cRAの発揮しうる効果のうち少なくともマクロファージからのコレステロール排出効果を阻害しうる。そのため、続く工程2)として、第6番目の画分に含まれる各々の化合物を単離精製するとよい。
【0014】
工程2)は、好ましくは、工程1)により得られる第6番目の画分を、例えばアルキル基を導入したシリカ担体の逆相分配クロマトグラフィ樹脂を充填したカラムを用いるHPLCによって分画する工程である。
【0015】
詳細には、例えば、Vydac C18を充填した孔径300Å、粒径5μm、内径4.6mm×250mm、メタノール:アセトニトリルの容積比40:60の溶液を移動相とし、流速1.0ml/分、35Pa(3.5bar)および40℃の条件で分画する工程である。このような工程2)から得られる0〜6分20秒の画分には、コレスタン3β,5α,6α-トリオールおよびコレスタン3β,5α,6β-トリオール以外の新規な物質が含まれうる。この画分はLXRのアンタゴニスととしての活性が特に顕著であり、本発明のコレステロール酸化物として特に好ましい。
【0016】
工程2)は、また、Vydac C18を充填した孔径300Å、粒径5μm、内径4.6mm×250mm、メタノール:アセトニトリルの容積比20:80の溶液を移動相とし、流速1.0ml/分、350Pa(35bar)および15〜25℃の条件で分画する工程であってもよい。このような工程2)から得られる6〜19分の画分には新規な物質が含まれうる。この画分はLXRのアンタゴニスととしての活性が特に顕著であり、本発明のコレステロール酸化物として特に好ましい。得られる6〜19分の画分は、さらにVydac C18、粒径5μm、孔径300Åを充填した内径4.6mm×250mmのカラムを用い、メタノール:アセトニトリルの容積比20:80の溶液を移動相とし、流速1.0ml/分、350Pa(35bar)および15〜25℃の条件でさらに分画し、7〜11分の画分を得てもよい。このような画分には新規な物質が含まれうる。この画分はLXRのアンタゴニスととしての活性が特に顕著であり、本発明のコレステロール酸化物として特に好ましい。
【0017】
本発明のコレステロール酸化物が、数種の酸化コレステロールの混合物である場合、例えば、日本生化学会編「新生化学実験講座4 脂質I 中性脂質とリポタンパク質」東京化学同人(1993.6.20)に示された脂溶性物質の単離精製法にしたがって、特定の酸化コレステロールを単離することができる。したがって、本発明はまた、LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の酸化コレステロールを提供する。
【0018】
なお、本発明において「(特定の工程により)得られるコレステロール酸化物」というときは、その特定の工程により得られたコレステロール酸化物、および他の工程により得られたコレステロール酸化物であって、その特定の工程により得られたコレステロール酸化物と同一の成分を含むコレステロール酸化物も含む。
【0019】
本発明はまた、シリカゲル60を固定相とし、ヘプタン:酢酸エチルの容積比1:1の混合液を移動相とし、20〜30℃の条件で行う薄層クロマトグラフィーにより得られるRf値が0〜0.059であるコレステロール酸化物を提供する。なお、本明細書でRf値に関して、「n1〜n2」であるというときは、そのRf値は両端を含むその範囲に含まれる値である。ここでいうRf値が0〜0.059であるコレステロール酸化物には、コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオール、およびそれら以外の化合物が含まれうる。
【0020】
本明細書で、酸化コレステロールおよび本発明のコレステロール酸化物に含まれる化合物について述べるときは、特別な場合を除き、その説明はいずれの立体異性体についても、いずれのコンフォメーション(例えば、イス型コンフォメーション、舟形コンフォメーション)をとっている化合物についても当てはまり、またそれらの混合物についてもあてはまる。例えば、本明細書で「コレスタン3β,5α,6α-トリオール」について述べるときは、特別な場合を除き、その説明は、イス型コンフォメーションのものにも舟形コンフォメーションのものにもあてはまり、またそれらの任意の比の混合物についてもあてはまる。
【0021】
本発明のコレステロール酸化物はLXRのアンタゴニスとして機能可能である。また、本発明者らは、コレスタン3β,5α,6α-トリオールおよびコレスタン3β,5α,6β-トリオール(これらには、実施例(2-b)に記載の方法で合成されたもの、実施例3に記載の、αおよびβ-エポキシコレステロールの加水分解により得られたもの、実施例で用いた市販の純品が含まれる。)がLXRのアンタゴニスととして機能可能であることを初めて見出した。したがって、本発明は、コレスタン3β,5α,6α-トリオールおよびコレスタン3β,5α,6β-トリオールおよびこれまで述べてきたような本発明のコレステロール酸化物からなる群より選択される1種以上を有効成分として含む、LXRの機能に関連した疾患または状態を処置するための組成物を提供する。本発明の組成物は、脂質代謝に関連した疾患または状態を処置するために有用であり、より特定すると、血清脂質濃度および/または血糖値のコントロールに関連した疾患または状態を処置するために有用であり、さらに特定すると、高脂血症、動脈硬化、糖尿病、肥満を含む生活習慣病を処置するために有用である。
【0022】
本明細書において、本発明の組成物に関し、生活習慣病を「処置(する)」というときは、生活習慣病に関連した疾患もしくは状態を予防もしくは治療すること、軽度に抑えること、または進行を抑えることを意味する。「処置」には、根本的な治療が含まれ、また長期的な予防および/または治療とが含まれる。
【0023】
本発明の組成物は、医薬または食品の形態とすることができる。
本発明の組成物を医薬組成物とする場合、有効成分であるコレステロール酸化物の量は、目的、症状、対象者の年齢、体重等に応じて適宜とすることができる。投与経路、剤形も適宜設計することができ、例えば、全身的な投与のため、または局所投与のために製剤化することができ、内服剤、外用剤、固形剤、液状製剤、散剤、顆粒剤、カプセル剤、錠剤、軟膏剤、硬膏剤、ハップ剤、ローション剤、リニメント剤、または坐剤とすることができる。また、除放化製剤、放出制御型製剤とすることもできる。製剤は、従来の方法にしたがって行うことができ、医薬として許容できる種々の添加物、例えば、附形剤、結合剤、崩壊剤、滑沢剤、コーティング剤、懸濁化剤、乳化剤、安定剤、保存剤、緩衝剤を用いることができる。
【0024】
本発明の組成物は、食品または飲料の形態とすることができる。有効成分であるコレステロール酸化物の量は、医薬品である場合に準じて適宜とすることができる。本発明の組成物である食品または飲料は、栄養機能食品、特定保健用食品、健康食品、栄養補助食品、ドリンク剤等とすることができる。
【0025】
本発明の組成物には、その具体的な用途(例えば、生活習慣病予防のため、体質改善のため、長期的な治療のため、等。)、および/またはその具体的な用い方(例えば、量、回数、継続的に使用すべき旨、期間、等。)を表示することができる。
【0026】
LXRのアンタゴニスとが脂質代謝に関連した疾患または状態を処置するのに有用であるとの知見は、本発明者らによりはじめて提供されるものである。したがって、本発明はまた、脂質代謝に関連した疾患または状態を処置するための化合物を選択するための方法であって、用意した候補化合物がLXRのアンタゴニストであるか否かをインビトロでの試験により判定し、そしてLXRのアンタゴニストである化合物を脂質代謝に関連した疾患または状態を処置するための化合物として選択する工程を含む方法を提供する。判定する工程は、LXRを用いる実験系、例えば、それを含んだ細胞を利用する種々のモデル系を適用することができる。本明細書の実施例で用いているような、マクロファージからのコレステロールの排出機構のモデル系は、その好ましい一例である。
【0027】
このような方法によって選択された化合物は、さらに公知の方法や、当業者には良く知られた方法を用いて合成することも可能である。したがって、本発明はさらに、上述の化合物を選択するための方法にしたがって得られた化合物を製造する工程を含む、脂質代謝に関連した疾患または状態を処置するための医薬組成物の製造方法を提供する。
【0028】
実施例:
加熱により生成した酸化コレステロールをシリカゲルで充填したカラムを用いて分画し、LXRのリガンド、あるいはLXRとヘテロダイマーを形成するRetinoid X receptor(RXR)のリガンドによって亢進されたマクロファージからのコレステロールの排出に及ぼす機構をモデル系として、LXRのアンタゴニストの探索を試みた。
【実施例1】
【0029】
<加熱生成した酸化コレステロール混合物がマクロファージからのCholesterol effluxに及ぼす影響>
(1-a)酸化コレステロール混合物のカラム精製(1)およびコレステロール排出活性に及ぼす影響:
コレステロールの加熱・酸化コレステロールの抽出:
コレステロール(ナカライ)100mgを1mlのクロロホルムに溶かして、ビーカーの壁面にコレステロールを薄膜状に作り、150℃で12時間加熱した。ジエチルエーテル(過酸化物フリー)で回収した後、完全にエーテルを飛ばして75℃の熱エタノールを加えて溶解した。-20℃で20分放置し、遠心後、上清を回収した。沈殿物に再び熱エタノールを加えて撹拌後、-20℃で20分放置、遠心後、上清を回収した。この抽出操作をもう一度繰り返した。エタノールを飛ばし、2mlの混合溶媒(ヘキサン:ジエチルエーテル=75:25)に溶解したものを、シリカゲルカラムに供する酸化コレステロール混合物サンプルとした。
【0030】
シリカゲルカラムによる酸化コレステロール混合物の分画:
活性化したシリカゲル60(ナカライ)を20mlヘキサンに加えて混ぜ、カラム(内径:1cm, 長さ:10cm)に6cmまで充填して(Bed Vol:4.7ml)10mlのヘキサンで平衡化した。調製した2mlの酸化コレステロール混合物サンプルをカラムに供した。続いて混合溶媒(ヘキサン:ジエチルエーテル=75:25)を20ml供した後、次の混合溶媒(ヘキサン:ジエチルエーテル=60:40)40mlで未反応のコレステロールを溶出させた。最後にアセトンを溶出溶媒として酸化コレステロールを溶出させ、溶出時間により6つに分画した。画分1, 2には溶出物がなかったため、画分3よりFraction番号をつけ、それぞれFraction 1, 2, 3, 4とした(下表参照)。
【0031】
【表1】

【0032】
各画分中に含まれている加熱によって生成した酸化物のうち、市販されている酸化コレステロール(6種類;7β-ヒドロキシコレステロール、β-エポキシコレステロール、α-エポキシコレステロール、コレスタン3β,5α,6β-トリオール、7-ケトコレステロール、7α-ヒドロキシコレステロール)をGC法により同定した。それ以外のピークを未知の酸化コレステロールとした。4つの画分中で酸化コレステロールの種類と量が互いに異なるFraction 1と4(GC分析結果は図2参照)を用いて、その違いを以下の実験で検討した。また未知の酸化コレステロール混合物の影響を確認するために、画分中に含まれる既知の酸化コレステロールと同じ組成と比率になるように市販されている純品(STERALOIDSから購入、住所:INC.P.O. BOX 689, NEWPORT R.I. 02840 U.S.A.)を用いて混合し、これをOxycont 1, 4として同様に検討した。
【0033】
コレステロール排出実験:
(THP-1細胞のマクロファージへの分化)
ヒト急性単球性白血病由来リンパ球様細胞であるTHP-1細胞(理化学研究所細胞開発銀行から分譲)を、100nM Phorbol 13-Myristate 12-acetateおよび10% Fetal Bovine Serum含有D-MEM/F-12培地(GIBCO)に懸濁し、0.5×106cells/mlになるように12穴ディッシュ(上下8穴を使用)に播いた。
【0034】
([3H]コレステロール添加溶液の調製)
FBS 900μl/dishおよびエタノールに溶かした200μCi/ml[1β, 2β(n)-3H]Cholesterol(以下[3H]コレステロール、Amersham pharmacia biotech)90μl/dishを37℃で30分間、10分毎に混合しながらインキュベートした。30分後、D-MEM/F-12培地を添加して合計9mlとし、添加溶液とした。
【0035】
(コレステロール排出試験)
分化開始からおよそ72時間後の細胞を使用した。細胞を播いた各ウェルをPBS(-)(日水製薬)で2回洗浄後、調製した[3H]コレステロール添加溶液を1mlずつ各ウェルに添加し、CO2インキュベーター内で24時間インキュベートした。24時間後、各ウェルの培地を回収し、PBS(-)で2回洗浄した。その後、細胞に取り込まれた[3H]コレステロールの平衡化のために、2mg/ml Bovine serum albumin(Fatty acid free)(以下BSA、Sigma)含有D-MEM/F-12培地1mlを添加し、CO2インキュベーター内で24時間インキュベートした。10μg/ml human Apo A-Iおよび2mg/ml BSA含有D-MEM/F-12培地に、Frac.1もしくは4、またはOxyocont 1もしくは4を各10μM、またはコントロールとしてVehicleであるエタノールを容積が総培地量の1% (v/v)になるように添加し、添加溶液とした。24時間培養しておいたBSA含有添加培地を回収し、PBS(-)で2回洗浄した後、9-cisレチノイン酸(9-cRA)と同時に、調製した添加溶液を1mlずつ添加した。CO2インキュベーター内で24時間インキュベートした後、培地を回収した。続いて細胞をPBS(-)で2回洗浄した後、0.2N NaOH 1mlを添加し、一晩振とうすることで細胞を溶解した。
【0036】
細胞からの脂質抽出は以下のようにFolch法にて行った。まず、細胞溶解液をメタノール(ナカライ)6.7ml/wellで回収した。次にクロロホルム(ナカライ)13.3mlを添加し、混和後、40℃で30分間インキュベートした。脱イオン水4mlを加え、低温室で1晩放置し、翌日上層を除去した。下層の有機層を窒素ガスによりドライアップした後、ヘキサン(ナカライ)5mlで脂質を溶解した。
【0037】
培養液回収液200μlおよび細胞抽出液500μlにACS-II Scintillation Cocktail 10mlを添加後、液体シンチレーションカウンター(Beckman)を用いて[3H]コレステロール量を測定した。
【0038】
コレステロール排出率は培地に放出された[3H]コレステロール量と細胞に残存した[3H]コレステロール量の和を1とした時の培地に放出された[3H]コレステロール量の割合で表した。
【0039】
その結果、Frac.1は9-cRAにより亢進されたマクロファージからのコレステロールの排出に影響を及ぼさなかったのに対し、Frac.4は排出を抑制した(図3)。このような抑制がOxycont 4で見られなかったことから、Frac.4中の未知酸化コレステロールが細胞からのコレステロールの排出を抑制したと考えられた。
【0040】
また、Frac.4とともに、LXRのリガンドである22(R)-OHまたは合成アゴニストTO-901317(T1317)を同時に添加したときの排出率を算出したところ、Frac.4はLXRのリガンドによるコレステロール排出の亢進作用を阻害した(図4)。この実験結果から、Frac.4の中には、9-cRAおよびLXRのリガンドにより亢進されたコレステロール排出を抑制する未知酸化コレステロールが存在すると考えられた。
【0041】
そこで、Frac.1と4を比較し、Frac.1に存在しないFrac.4中で最も濃度の高い未知酸化コレステロール(以下、「Peak 1」という。図2中にも示した。)を精製することにした。
【0042】
(1-b)酸化コレステロール混合物のカラム精製(2)およびコレステロール排出活性に及ぼす影響:
コレステロールを加熱して得られた酸化コレステロール混合物を細かく分画するためにシリカゲルカラム(内径:1cm, 長さ:10cm, シリカゲルの充填6cm)に供して、ジエチルエーテル:アセトン=75:25, 50:50, 25:75, 0:100の4種類の混合溶媒の各5mlで順次溶出させて2.5mlずつ8分画し、それぞれの番号をFrac.4-1〜4-8とした。Frac.4-6に実験1と同じ物質と考えられるPeak 1(30mol%)およびCholestan-3β,5α,6β-triol(54mol%)、またいくつかの微量な未知の酸化コレステロールが溶出した。Peak 1が細胞からのコレステロールの排出に及ぼす影響を検討するために、Frac.4-6およびそのControlとしてCholestan-3β,5α,6β-triol純品を(1-a)と同様の実験に用いた。
【0043】
その結果、Controlと比較してPeak 1の含まれるFrac.4-6は9-cRAにより亢進されたマクロファージからのコレステロールの排出を強く抑制した(図5)。
【0044】
(1-c)酸化コレステロール混合物のTLC分画およびコレステロール排出活性に及ぼす影響:
TLCによる酸化コレステロール混合物画分の分画:
シリカゲルカラムで分画した酸化コレステロール画分Frac.4-6を更に分画するために、シリカゲル60を用いた薄層プレート(TLC)にアプライしてヘプタン:酢酸エチル=1:1の溶媒で展開した(約80分)。展開後、蛍光指示薬としてプリムリン試薬をTLCプレートに噴霧し、UV照射でバンドを検出した。α-triolあるいはβ-triol(純品)と同じ位置に検出されたバンド(Rf値=0〜0.059;画分名TLC1)、TLC1の上方に検出されたバンド(Rf値=0.059〜0.1;TLC2)、α-eopxyの位置に検出された二つのバンド(Rf値=0.34〜0.37、0.37〜0.38;TLC3、4)、上方に検出された二つのバンド(Rf値=0.82〜0.89, 0.89〜1;TLC5, 6)(図6参照)をそれぞれ剥ぎ取り、5mlのアセトンで5分間抽出後、3,000rpmで5分間遠心して上清を回収した。この操作を3回繰り返した。各抽出液をGCで分析したところ、TLC1にβ-triolおよびPeak1が、TLC2および6に未知酸化コレステロールのピークが検出され、これらの画分について(1-a)と同様にコレステロール排出試験を行った。コレステロール排出試験で添加後の濃度が10μMとなるようにTLC1の濃度を調製し、TLC2および6についてはTLC1と同量をサンプリングすることによって調製した。
【0045】
その結果、TLC1は9-cRAにより亢進されたマクロファージからのコレステロールの排出を強く抑制したのに対して、TLC2および6は抑制しなかった(図7)。この結果より、コレステロールの排出を抑制する物質は、peak-1およびβ-triolと同じ極性を示すTLC1の画分に存在することが示された。
【実施例2】
【0046】
<酸化コレステロール混合物中に含まれるPeak(Peak 1)の同定およびコレステロール排出に及ぼす影響>
(2-a)Peak 1の同定:
Peak 1の物質を同定するために、Frac.4およびFrac.4-6をMSで解析してPeak 1の開裂パターンを確認した(Frac.4:図8、Frac.4-6:図9)。その結果と、文献(Biochemica et Biophysica Acta 1302, 1996, 145-152)のMSチャートとを比較し、Peak 1をCholestan-3β,5α,6α-triolと同定した。
【0047】
(2-b)α-triolの合成およびコレステロール排出に及ぼす影響:
マクロファージからのコレステロールの排出を抑制すると考えられるCholestan-3β,5α,6α-triolを下記の方法で合成した(参照: Steroids/Louis F.Fieser and Mary Fieser (1959, p189))。928mgのコレステロールを20mlのジエチルエーテル(過酸化物フリー)に溶解し、100mlのジエチルエーテルに溶かした四酸化オスミウム605mgを加えた後、ピリジン0.5mlを加えた。これを真空状態で5日間反応させた。反応後に46ml 0.1N KOHに溶かした2.5gのマンニトールを加えて、24時間振とうした。振とう後の反応液からクロロホルムで抽出された物質を、実施例1と同様にシリカゲルカラムに供した。シリカゲルカラム(内径:1cm, 長さ:10cm, シリカゲルの充填6cm)にジエチルエーテル:アセトン=75:25, 50:50, 25:75, 0:100の4種類の混合溶媒の各5mlで順次溶出させて2.5mlずつ8分画し、6画分目に溶出した物質をGC-MSで分析したところ、Cholestan-3β,5α,6α-triol(α-triol)と確認された。
【0048】
6画分目に溶出したα-triol(純度98.6mol%)が細胞からのコレステロールの排出に及ぼす影響を検討するために、実施例1と同様の実験に用い、コレステロールを加熱した後にカラムで精製した画分(Frac.4-6;α-triol 60mol%)の作用と比較した。その結果、α-triolは22(R)-OHおよび9-cRAにより亢進されたマクロファージからのコレステロールの排出をFrac.4-6ほどには抑制しなかった(図10、11)。この結果より、Frac.4-6中には、α-triol以外のコレステロールの排出を抑制する酸化コレステロールが含まれることが示唆された。
【実施例3】
【0049】
<αおよびβ-epoxycholesterolの加水分解反応がコレステロール排出活性に及ぼす影響>
CholestanteriolはEpoxycholesterolの構造を経て生成する経路が知られている(図12)。αおよびβ-triolのコレステロール骨格における立体異性体の生成について検討するために、αおよびβ-epoxycholesterolを下記の方法で加水分解することによってTriolを含む加水分解産物を生成した。2mgのαおよびβ-epoxycholesterol (Steraloids)に1ml Tetrahydrofuran:H2O:Acetone=4:1:0.5および100μlの70% HClO4を添加して4時間振とうした。実施例1の(1-c)と同様の方法でTLCで分画した。α-triolあるいはβ-triol(純品)と同じ位置に検出されたバンド(Rf値=0〜0.059;画分名α-epoxy TLC1およびβ-epoxy TLC1)をGCで分析したところ、88.9mol%(α-epoxy TLC1)および95.6mol%のβ-triol(β-epoxy TLC1)が生成していた。この画分についてコレステロール排出実験で検討し、市販品のβ-triolと比較した。
【0050】
その結果、9-cRAにより亢進されたマクロファージからのコレステロールの排出が、α-epoxy TLC1およびβ-epoxy TLC1によって抑制された(図13、14)。しかし、Frac.4-6が示すような強い抑制作用は見られなかった。
【実施例4】
【0051】
<酸化コレステロール混合物のHPLC分画およびCholesterol efflux活性に及ぼす影響>
(1)Frac.4-6画分を以下の条件でHPLCにより分画した。
HPLC条件:
ポンプ Waters 600E;
カラム VyDAC C18、粒径5μm、孔径300Å、4.6mm×250mm;
移動相 メタノール:アセトニトリル=40:60(v/v);
流速 1.0ml/min;
検出器 蒸発光散乱検出器 SEDEX 75。
【0052】
ELSD条件:
Pressure 3.5bar;
Temperature 40℃。
【0053】
分画は、α-triolおよびβ-triol、またこれらの物質より速く溶出された物質(B画分)の3つに分画した(α-triol、β-triol、B画分)。各分画時間はB画分: 0〜6分20秒、α-triol: 6分20秒〜7分40秒、β-triol: 9分30秒〜12分とし、チャートを確認しながら分画した(図15: HPLCチャート)。これらの画分の純度をGCにより解析したところ、α-triol: 86.4%、β-triol: 91.3%であった。また、B画分には酸化物が多く含まれていた。これらの画分が細胞からのコレステロールの排出に及ぼす影響を検討するために、実験1と同様の実験に用いた。
【0054】
その結果、9-cRAにより亢進されたマクロファージからのコレステロールの排出がα-triol、β-triolそれぞれによって抑制されたが、いずれもFrac.4-6ほどの抑制効果はなく、以前示された市販品α-triol、β-triolによる抑制と同程度であった。対して、B画分はFrac.4-6と同様に排出を抑制した。
【0055】
これより、排出抑制能を有する物質は加熱生成したα-triolおよびβ-triolではなく、B画分中に存在することが示唆された。しかし、B画分には各々が微量ながらも数多くの酸化物が含まれているため、排出抑制能を示す物質を同定するためにはHPLC条件を検討し、更に細かく分画することによって候補物質を絞り込む必要があると思われる。
【0056】
(2)次に、α-triolおよびβ-triol以外の酸化物について検討した。Frac.4-6画分を、メタノール:アセトニトリル[20:80(v/v)]を移動相とし、35bar、15〜25℃、他は(1)と同じ条件でHPLCにより分画した。HPLCチャートを図17に示した。各分画時間は、H1画分:4〜6分、H2画分:6〜19分、H3画分:20〜36分、H4画分:47〜60分であった。
【0057】
これらの未知酸化コレステロール画分がマクロファージからのコレステロールの排出に及ぼす影響を図18に示した。H2画分は、9-cRAによるマクロファージからのコレステロール排出促進を強く抑制した。また、H1画分でも抑制する傾向が見られた。
【0058】
(3)続いて、H2画分を再分画したものについて検討した。H2画分を、メタノール:アセトニトリル[20:80(v/v)]を移動相とし、35bar、15〜25℃、他は(1)と同じ条件でHPLCにより分画した。このHPLCチャートを図19示した。各分画時間は、C1画分:7〜11分、C2画分:11〜13分30秒、C3画分:13分30秒〜16分30秒、C4画分: 16分30秒〜19分30秒であった。
【0059】
また、これらの画分がマクロファージからのコレステロールの排出に及ぼす影響を図20に示した。C1画分は、9-cRAによるマクロファージからのコレステロール排出促進を強く抑制した。
【0060】
(4)合成したα-Triolおよび純品のβ-Triolと同様に、コレステロールを加熱することによって生成したα-triolおよびβ-triolも9-cRAによるコレステロールの排出の促進に対して影響を及ぼさなかった。そこで、Frac.4-6に含まれる未知酸化物の影響を検討したところ、Fig.4-6のようにH2に含まれる酸化物によって抑制された。さらに図20から、H2画分中の物質のうちC2〜4に含まれる化合物ではないことも示された。しかし、C1に含まれる酸化物をGCで分析したところ、この画分にはまだ多数の分子種が存在していた。図18のようにH1でも抑制傾向が見られたことから、C1に含まれていた多数の分子種の中でも早く溶出した化合物が活性を示す物質であると考えられる。また、これらの画分はβ-Triolよりも早く溶出したことから、β-Triolに比べて極性が高い酸化物であると考えられる。
【0061】
今回、移動相について検討したところ、アセトニトリルの割合を高くすることによってβ-Triolと未知酸化物との分離がよくなった。また、未知酸化物は、HPLC-MSのような、分離能の良い長いHPLCカラムを用いて細かく分画する方法、また長いシリカゲルカラムで分離を検討し、その画分をHPLCで分画するなどの方法で単離することができる。
【実施例5】
【0062】
<HPLC画分がABCA1の発現に及ぼす影響>
細胞内コレステロールの排出機構として、細胞膜とHDLのコレステロール濃度勾配を利用した単純拡散、ABCA1を介した脂質に乏しいApoA-Iへの排出、ApoE依存的な排出、SR-BIを介した排出、コレステロールの27-Hydroxylationを介した排出などが報告されている。その中でも、生体内で酵素的に生成される20(S)-Hydroxycholesterolや22(R)-OHのような酸化コレステロールは、LXRのリガンドとしてABCA1の発現を誘導し、細胞内コレステロールの排出を亢進すると考えられている。酵素的生成物に加え、加熱のような自動酸化によって生成される酸化コレステロールの中にも、LXRのリガンドとしてABCA1の発現と、それに続く細胞内コレステロールの排出に影響を及ぼす物質が存在する可能性が考えられる。本発明によって見いだされた細胞内コレステロールの排出を抑制する化合物は、コレステロールを出発物質とした化合物であることから、ABCA1を介した排出機構に関与していると考えられ、ABCA1の発現に及ぼす影響を検討することは重要であると考えられる。
【0063】
そこで、コレステロール排出を抑制したHPLC画分がABCA1の発現に及ぼす影響を調べた。
THP-1細胞からmRNAの抽出:
THP-1細胞を実施例(1-a)と同様の方法でマクロファージに分化させた。分化から72時間後にPBS(-)で2回洗浄し、9-cRA 1μM、9-cRA 1μMおよびHPLCで分画したH2画分 10μMの混合溶液、またはコントロールとしてVehicleであるエタノールを容積が総培地量の1%(v/v)になるように添加し、CO2インキュベーター内でインキュベートした。24時間後、PBS(-)で2回洗浄して、Denaturing solution [Sol. D; 4M Guanidinium thiocyanate(GTC)、25mM Sodium citrate(pH7.0)、0.1M 2-Mercaptoethanol、10% Sodium N-lauroyl sarcosine(以上nacalai tesque)]を300μl/well for 6-well dish添加し、細胞を回収した。一晩以上凍結保存後、Acid-Guanidinium-Phenol-Chloroform法(AGPC法)にてmRNAを抽出した。抽出したmRNAは30μlのRNA水に溶解した後、260nmにおける吸光度を測定し、OD260値が1のときRNA濃度は40μg/mlとしてRNAの濃度を算出した。
【0064】
RT-PCRによるABCA1とβ-actinのcDNAの増幅:
PCRの条件は以下の通りである。RNAを1.5μg分取し、2×Reaction Mix(Invitrogen、USA)12.5μl、5’-primer(5pmol) 0.5μl、3’-primer(5pmol) 0.5μl、Super Scripta IIIRT/Platinum(登録商標)Taq Mix Template 1μl(Invitrogen、USA)、滅菌超純水を加え、全量を25μlに調製した。反応の際にはミネラルオイルを重層し、反応液の蒸発を防いだ。ABCA1の PCR条件は、55°Cで30分間反応させた後、94℃で2分間熱変性を行い、続いて94℃で30秒間、50℃で1分間、72℃ 30秒間のサイクルを20回繰り返した。またβ-actinは55°Cで30分間反応させた後、94℃で2分間熱変性を行い、94℃で30秒間、56℃で1分間、72℃で0.5秒間のサイクルを20回繰り返した。その後、それぞれ72℃で10分間の伸長反応を行った。
【0065】
サザンブロッティング:
PCR産物はミネラルオイル除去後、エチジウムブロマイド無添加の2%アガロースゲル中で電気泳動を行った。この際、バンドの確認のために、クローニングしたヒトABCA1およびヒトβ-actinはEcoRIで制限消化しておいたものと同時に泳動した。泳動終了後、ゲルをバットに移し、加水分解液(0.25M HCl)にゲルを浸して10分間振とうした。脱イオン水で洗浄後、変性溶液(1.5M NaCl、0.5M NaOH)に浸し、30分間振とうした。再び脱イオン水で洗浄後、中和溶液[1.5M NaCl、0.5M Tris(pH7.0)]に浸して30分間振とうした。この後、キャピラリー拡散法を用いて、メンブレン(Hybond NX、Amersham Pharmacia Biotech、USA)に8時間以上ブロッティングした。ブロッティング終了後、トランスイルミネーター上にメンブレンを置き、紫外灯を5分間照射することでCross linkingを行った。
【0066】
プローブ作成:
ヒトABCA1またはヒトβ-actinのプラズミドDNA 5μgをEcoRIで37°C 1時間以上制限消化させた。そしてエチジウムブロマイド添加の2%アガロースゲルにて電気泳動を行った。電気泳動終了後、目的のバンドを切り出し回収した。回収したcDNA(5μg)はMultiprime DNA labeling system(Amersham Pharmacia Biotech)を用いて[α-32P]dCTP(3,000Ci/mmol、Amersham Pharmacia Biotech)2.5μlで標識した。反応は37°Cで30分間行い、G-50カラム(ProbeQuant G-50 Micro Columns、Amersham Pharmacia Biotech)を用いてプローブを調整した。
【0067】
ハイブリダイゼーション:
メンブレンのRNAが固定されている面を内側にしてハイブリボトルに入れ、ガラス棒と10mlのプレハイ液[50%脱イオン化formamide、4×SSC、5×Denhardt’s solution(0.1% Ficoll、0.1% polyvinylpyrrolidone、0.1% BSA)、50mM Na phosphate(pH6.5)、0.1mg/ml yeast tRNA、0.5mg/ml NaPO4、1% SDS]42°Cで3時間プレハイブリダイゼーションを行った。プレハイ終了後、ボトルの中の液を捨て、新しいハイブリ液10mlを加えた。これに作成したプローブを加え、42°Cで18時間以上ハイブリダイゼーションを行った。そして、メンブレンは50°Cにした2×SSC(0.3M NaCl, 0.1M sodium citrate)-0.1% SDSですすいだ後、2×SSC-0.1%SDSで50°C、15分間洗浄した。さらに0.2×SSC(0.03M NaCl, 0.01M sodium citrate)-0.1% SDSで50°C、15分間洗浄した。フィルターにサーベイメーターを当て、洗浄が十分でないと判断した時は50℃にした0.1×SSC(15mM NaCl, 5mM sodium citrate)-0.1% SDSで50℃、15分間洗浄した。メンブレン上のカウントを確認した後、メンブレンをラップに包んでIPカセット(富士写真フィルム、東京)に入れ、Imaging Plate(富士写真フィルム)を当てた。ヒトABCA1は2時間、β-actinは15分間感光させた後、バイオイメージングアナライザー(FLA-5000、富士写真フィルム)を用いて測定した。結果は、a-actinで補正した値を用いて、エタノールを添加したときの発現量を1としたときの相対値で表した。
【0068】
統計解析:
統計解析はFisher's PLSDを用いて行い、p<0.05をもって有意差ありと判定した。
結果:
マクロファージのABCA1 mRNA発現量を図21に示した。9-cRA添加によってABCA1 mRNA発現量が増加した。9-cRAをHPLCにより分画されたH2画分(H2 fraction)と共存させることによってABCA1 mRNA発現量の増加が抑制された。
【0069】
考察:
9-cRA添加により、コントロールに比べてABCA1 mRNA発現量は21倍ほど高くなった。9-cRAと同時にH2画分を添加したとき、9-cRA単独添加の83%減少した。H2画分によるABCA1 mRNA発現量の抑制は、Cholesterol efflux実験の結果を反映していた。このことから、H2画分に含まれる未知の酸化コレステロールは9-cRAによるABCA1の誘導を抑制することによって細胞内コレステロールの排出を抑制していることが示唆された。
【0070】
本実施例においては、H2画分の単独添加による影響について検討していないが、実施例(1-a)で分画されたFraction 4については、Fraction 4の単独添加においてもコントロールと比較して細胞内コレステロールの排出を抑制した(データは示していない。)ことから、H2画分単独の添加によってもFraction 4と同様にコントロールと比較して排出が抑制され、このとき、ABCA1の発現も抑制されていると思われる。
【図面の簡単な説明】
【0071】
【図1】図1Aは、ステロイド骨格酸化型のコレステロール酸化物が、図1A中の点線矢印で示したようなLXRのアンタゴニストとして機能する可能性の予想を示した図である。図1Aに示したマクロファージや肝臓といった、動脈硬化発症において重要な臓器ではLXRの活性を上昇させれば、細胞内コレステロールを排出させるATP-binding cassette transporter-1(ABCA1)の発現量が上がり、抗動脈硬化作用をもつリポタンパク質である血清HDL濃度が上昇すると期待されてきた。しかし、LXRはトリアシルグリセロールの合成を促進するため、血清トリアシルグリセロール濃度も同時に上昇させる結果になった(図1Aの肝臓の部分の実線矢印を参照のこと)。図1Bは、自動酸化および酵素的酸化によって生成する主な酸化コレステロールを表した図である。
【図2】図2Aは、実施例1の(1-a)で得たFraction 1のGCチャートである。図2Bは、実施例1の(1-a)で得たFraction 4のGCチャートである。市販の酸化コレステロール(6種類;7β-ヒドロキシコレステロール、α-エポキシコレステロール、β-エポキシコレステロール、7-ケトコレステロール、コレスタン3β,5α,6β-トリオール、7α-ヒドロキシコレステロール)を同定した。Frac.4中にのみ存在する未知の酸化コレステロールの中で、もっとも濃度の高いものを「Peak 1」とし、精製することにした。
【図3】図3は、マクロファージからのコレステロール排出に及ぼす酸化コレステロール画分の影響を示すグラフである。図中、Frac.1および4は実施例1の(1-a)で得た画分であり、Oxycont 1および4は市販されている純品をそれぞれの画分中に含まれる既知の酸化コレステロールと同じ組成および比率になるように混合したものである。コレステロール排出率(Fold)は、(培地に放出された[3H]コレステロール)/(培地に放出された[3H]コレステロール+細胞に残存した[3H]コレステロール)で表した。Frac.1、は9-cRAにより亢進されたマクロファージからのコレステロールの排出に影響を及ぼさなかったのに対し、Frac.4は排出を抑制した。このような抑制はOxycont 4では見られなかった。n=4、a, b, c, d; p<0.05
【図4】図4は、LXRリガンドにより亢進されたマクロファージからのコレステロール排出に及ぼすFrac.4の影響を示すグラフである。Frac.4とともに、LXRのリガンドである22(R)-OHまたは合成アゴニストTO-901317(T1317)を同時に添加したときの排出率を算出したところ、Frac.4はLXRのリガンドによるコレステロール排出の亢進作用を阻害した。n=4、a, b, c; p<0.05
【図5】図5は、マクロファージからのコレステロール排出に及ぼす未知酸化コレステロール画分の影響を示すグラフである。図中、Peak 1は実施例1の(1-b)で得たFrac.4-6、Triolは純品Cholestan-3β,5α,6β-triolである。Controlと比較してPeak 1の含まれるFrac.4-6は9-cRAにより亢進されたマクロファージからのコレステロールの排出を強く抑制した。n=4、a, b, c, d; p<0.05
【図6】図6は、TLCによるFrac.4-6の分画結果の概略図である。
【図7】図7は、マクロファージからのコレステロール排出に及ぼす各TLC画分の影響を示すグラフである。TLC1は9-cRAにより亢進されたマクロファージからのコレステロールの排出を強く抑制したのに対して、TLC2およびTLC6は抑制しなかった。n=4、a, b; p<0.05
【図8】図8は、Frac.4のMSチャートである。
【図9】図9は、Frac.4-6のMSチャートである。
【図10】図10は、マクロファージからのコレステロール排出に及ぼすFrac.4-6およびCholestan-3β,5α,6α-triolの影響を示すグラフである。α-triolは9-cRAにより亢進されたマクロファージからのコレステロールの排出を抑制しなかった。n=4、a, b; p<0.05
【図11】図11は、マクロファージからのコレステロール排出に及ぼすFrac.4-6およびCholestan-3β,5α,6α-triol(α-triol)の影響を示すグラフである。α-triolは22(R)-OHにより亢進されたマクロファージからのコレステロールの排出を抑制しなかった。n=4、a, b; p<0.05
【図12】図12は、酸性条件下でのβ-epoxycholesterolの加水分解反応によるCholestan-3β,5α,6α-triolの生成経路を示した図である。
【図13】図13は、9-cRAにより亢進されたマクロファージからのコレステロール排出に及ぼすα-epoxycholesterol加水分解産物の影響を示すグラフである。コレステロールの排出はα-epoxy TLC1によって抑制された。n=4、a, b; p<0.05
【図14】図14は、9-cRAにより亢進されたマクロファージからのコレステロール排出に及ぼすβ-epoxycholesterol加水分解産物の影響を示すグラフである。コレステロールの排出はβ-epoxy TLC1によって抑制された。n=4、a, b; p<0.05
【図15】図15は、Frac.4-6画分のHPLCチャートである。移動相はメタノール:アセトニトリル =40:60(v/v)とした。
【図16】図16は、マクロファージからのコレステロール排出に及ぼすHPLC画分の影響を示すグラフである。9-cRAにより亢進されたマクロファージからのコレステロールの排出がα-triol、β-triolそれぞれによって抑制されたが、いずれもFrac.4-6ほどの抑制効果はなかった。B画分はFrac.4-6と同様に排出を抑制した。n=4、a, b, c, d; p<0.05
【図17】図17は、Frac.4-6画分のHPLCチャートである。移動相はメタノール:アセトニトリル=20:80(v/v)とした。
【図18】図18は、マクロファージからのコレステロール排出に及ぼすHPLC画分の影響を示すグラフである。H2画分は、9-cRAによるマクロファージからのコレステロール排出促進を強く抑制した。また、H1画分でも抑制する傾向が見られた。n=4、a, b, c, d, e; p<0.05
【図19】図19は、H2画分のHPLCチャートである。
【図20】図20は、マクロファージからのコレステロール排出に及ぼすHPLC画分の影響を示すグラフである。C1画分は、9-cRAによるマクロファージからのコレステロール排出促進を強く抑制した。n=4、a, b, c; p<0.05
【図21】図21は、マクロファージのABCA1 mRNA発現量を示した写真およびグラフである。9-cRA添加により、ABC1 mRNAの発現量が増加したが、9-cRAをHPLC分画したH2画分(H2 fraction)と共存させることにより、ABC1 mRNAの発現量の増加が抑制された。グラフでは、n=4、*; p<0.05
【技術分野】
【0001】
本発明は、LXR(肝臓X受容体;Liver X receptor)のアンタゴニストに関する。LXRアンタゴニストは、生活習慣病の処置のために用いることができ、そのようなアンタゴニストとして、酸化コレステロールのある種のものが機能可能である。
【背景技術】
【0002】
脂質代謝を制御する核内受容体であるLXR(肝臓X受容体;Liver X receptor)を標的としての動脈硬化症に対する創薬が行われてきている。
図1Aに示したマクロファージや肝臓といった、動脈硬化発症において重要な臓器ではLXRの活性を上昇させれば、細胞内コレステロールを排出させるATP-binding cassette transporter-1(ABCA1)の発現量が上がり(非特許文献1等参照)、抗動脈硬化作用をもつリポタンパク質である血清HDL濃度が上昇すると期待されてきた。
【0003】
しかしながら、LXRはトリアシルグリセロールの合成を促進するため、血清HDL濃度は上昇するが、それにも増して血清トリアシルグリセロール濃度も上昇させる結果になった(図1A参照。肝臓の部分の実線矢印)。現在、主なLXRのアゴニストとして、22(R)ヒドロキシコレステロール、24(S)ヒドロキシコレステロール(非特許文献2参照)といった、側鎖酸化型の酸化コレステロール(図1B)が発見され、合成薬剤としてはTO-901317が開発されたが、それぞれ、高トリアシルグリセリド血症の可能性が指摘されている。
【0004】
【非特許文献1】Karen Schwartz et al: Biochem, Biophys. Res. Commun. 274, 794-802(2000)
【非特許文献2】Jurgen M. Lehmann et al: J. Biol. Biochem. 272, 3137-3140(1997)
【発明の開示】
【0005】
LXRは脂質代謝亢進として働くので、上記のような副作用が発現したと考えられる。したがって、脂質代謝を抑制気味にするアンタゴニストは効果的に血清脂質濃度および血糖を制御できると考えられる。本発明者らは、ステロイド骨格酸化型のコレステロール酸化物が、LXRのアンタゴニストとして機能する可能性を予想した(図1A。肝臓部分の灰色矢印)。そのような化合物が得られれば、高脂血症、動脈硬化症、糖尿病、肥満等の生活習慣病を処置するための医薬として期待できる。本発明者らは、加熱により生成したコレステロール酸化物をシリカゲルを充填したカラムを用いて分画し、マクロファージからのコレステロールの排出機構をモデル系として(図1A)、コレステロール酸化物の中からLXRのアンタゴニストの探索を試み、本発明を完成するに至った。
【0006】
本発明はすなわち、LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の酸化コレステロールを提供する。
本明細書においては、特別な場合を除き、「アゴニスト」とは、作動薬、作用薬ともいい、受容体に結合して種々の生理作用を示す物質をいい、「アンタゴニスト」とは、拮抗薬、遮断薬ともいい、受容体に結合してアゴニストの効果を阻害するが、それ自体は受容体と結合してもアゴニストの効果を発揮できないものをいう。本明細書において、LXRに関してアンタゴニストというとき(例えば「LXRのアンタゴニスト」というとき)は、特別な場合を除き、LXRに結合して、9-cisレチノイン酸の発揮しうる効果のうち、少なくともマクロファージからのコレステロール排出亢進効果を阻害するように機能可能な物質をいう。より詳細には、本明細書の実施例(1-a)に記載のコレステロール排出試験にしたがって試験したときに、9-cisレチノイン酸のコレステロール排出亢進効果の、少なくとも10%を阻害する(すなわち、9-cisレチノイン酸のみを用いた場合のコレステロール排出亢進効果を100としたとき、9-cisレチノイン酸と同時にその10倍量(モル当量)の候補化合物を用いた場合のコレステロール排出亢進効果を90に抑える)ように機能可能な物質をいい、好ましくは20%以上、より好ましくは40%以上、さらに好ましくは60%以上、それより好ましくは80%以上を阻害するように機能可能な物質をいう。
【0007】
LXRのアンタゴニストとしての機能は、9-cisレチノイン酸によるABCA1の誘導を抑制することによって発揮されるものであってもよい。このような場合は、ある物質がLXRのアンタゴニストであるか否かは、9-cisレチノイン酸によるABCA1の誘導を抑制するか否かを、例えば、本明細書の実施例5にしたがってABCA1 mRNAの転写量を指標として判断することができる。
【0008】
また本明細書において、LXRに関してアンタゴニストというときは、22(R)-ヒドロキシコレステロール、TO901317等のLXRのアゴニストとして機能可能な物質の発揮しうる効果のうち少なくともマクロファージからのコレステロール排出亢進効果を阻害するように機能可能な物質であってもよい。
【0009】
本明細書で「酸化コレステロール」(「オキシコレステロール」ということもある。)というときは、特別な場合を除き、自動酸化により生成したものであるか、酵素的酸化により生成したものであるかを問わず、またステロイド骨格酸化型であるか、側鎖酸化型であるかを問わず、コレステロール酸化型の化合物をいう。酸化コレステロールには、例えば、7β―ヒドロキシコレステロール、α―エポキシコレステロール、β―エポキシコレステロール、7-ケトコレステロール、コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオール、7α―ヒドロキシコレステロール、25-ヒドロキシコレステロール、22(R)-ヒドロキシコレステロール、24(S)-ヒドロキシコレステロール、27-ヒドロキシコレステロール、および本明細書の実施例4で得られたB画分に存在する化合物が含まれる。
【0010】
本明細書で「コレステロール酸化物」というときは、特別な場合を除き、コレステロールを酸化処理することにより得られたものをいい、酸化コレステロールである化合物単体である場合と、数種の酸化コレステロールの混合物である場合とがある。特別な場合を除き、自動酸化により生成したものであるか、酵素的酸化により生成したものであるかを問わず、またステロイド骨格酸化型であるか、側鎖酸化型であるかを問わない。
【0011】
本発明の酸化コレステロールは、LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の化合物でありうる。これには、LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の酸化コレステロールは、例えば、コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオール、本明細書の実施例4で得られたB画分、H2画分および/またはC1画分に存在する化合物が含まれる。
【0012】
本発明の酸化コレステロールは、9-cisレチノイン酸との競合試験により、9-cisレチノイン酸によるマクロファージからのコレステロール排出亢進効果を阻害するか否か、および/または9-cisレチノイン酸によるABCA1の誘導を抑制するか否かにより、LXRのアンタゴニストとしての機能を確認することができるが、本発明の酸化コレステロールは、単独で用いた場合にも、マクロファージからのコレステロール排出抑制効果および/またはABCA1の誘導抑制効果を発揮するものであってもよい。
【0013】
LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の酸化コレステロール、またはそのような酸化コレステロールを含むコレステロール酸化物は、以下のようにして得ることができる:
1)コレステロールの加熱生成物を、内径1cmおよび長さ6cmのシリカゲルカラムを用い、ジエチルエーテル:アセトンの容積比がそれぞれ75:25、50:50、25:75、0:100である4種の混合溶媒各5mlで順に溶出して2.5mlずつ分画して第6番目の画分を得て;そして
2)得られる第6番目の画分を、所望によりさらに分画する工程により特定の画分を得る。したがって、本発明はまた、このような工程により得られるコレステロール酸化物を提供する。工程1)から得られる第6番目の画分には、コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオールおよびそれら以外の物質が含まれうる。この画分は、本明細書の実施例(1-b)からも明らかなように、9-cRAの発揮しうる効果のうち少なくともマクロファージからのコレステロール排出効果を阻害しうる。そのため、続く工程2)として、第6番目の画分に含まれる各々の化合物を単離精製するとよい。
【0014】
工程2)は、好ましくは、工程1)により得られる第6番目の画分を、例えばアルキル基を導入したシリカ担体の逆相分配クロマトグラフィ樹脂を充填したカラムを用いるHPLCによって分画する工程である。
【0015】
詳細には、例えば、Vydac C18を充填した孔径300Å、粒径5μm、内径4.6mm×250mm、メタノール:アセトニトリルの容積比40:60の溶液を移動相とし、流速1.0ml/分、35Pa(3.5bar)および40℃の条件で分画する工程である。このような工程2)から得られる0〜6分20秒の画分には、コレスタン3β,5α,6α-トリオールおよびコレスタン3β,5α,6β-トリオール以外の新規な物質が含まれうる。この画分はLXRのアンタゴニスととしての活性が特に顕著であり、本発明のコレステロール酸化物として特に好ましい。
【0016】
工程2)は、また、Vydac C18を充填した孔径300Å、粒径5μm、内径4.6mm×250mm、メタノール:アセトニトリルの容積比20:80の溶液を移動相とし、流速1.0ml/分、350Pa(35bar)および15〜25℃の条件で分画する工程であってもよい。このような工程2)から得られる6〜19分の画分には新規な物質が含まれうる。この画分はLXRのアンタゴニスととしての活性が特に顕著であり、本発明のコレステロール酸化物として特に好ましい。得られる6〜19分の画分は、さらにVydac C18、粒径5μm、孔径300Åを充填した内径4.6mm×250mmのカラムを用い、メタノール:アセトニトリルの容積比20:80の溶液を移動相とし、流速1.0ml/分、350Pa(35bar)および15〜25℃の条件でさらに分画し、7〜11分の画分を得てもよい。このような画分には新規な物質が含まれうる。この画分はLXRのアンタゴニスととしての活性が特に顕著であり、本発明のコレステロール酸化物として特に好ましい。
【0017】
本発明のコレステロール酸化物が、数種の酸化コレステロールの混合物である場合、例えば、日本生化学会編「新生化学実験講座4 脂質I 中性脂質とリポタンパク質」東京化学同人(1993.6.20)に示された脂溶性物質の単離精製法にしたがって、特定の酸化コレステロールを単離することができる。したがって、本発明はまた、LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の酸化コレステロールを提供する。
【0018】
なお、本発明において「(特定の工程により)得られるコレステロール酸化物」というときは、その特定の工程により得られたコレステロール酸化物、および他の工程により得られたコレステロール酸化物であって、その特定の工程により得られたコレステロール酸化物と同一の成分を含むコレステロール酸化物も含む。
【0019】
本発明はまた、シリカゲル60を固定相とし、ヘプタン:酢酸エチルの容積比1:1の混合液を移動相とし、20〜30℃の条件で行う薄層クロマトグラフィーにより得られるRf値が0〜0.059であるコレステロール酸化物を提供する。なお、本明細書でRf値に関して、「n1〜n2」であるというときは、そのRf値は両端を含むその範囲に含まれる値である。ここでいうRf値が0〜0.059であるコレステロール酸化物には、コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオール、およびそれら以外の化合物が含まれうる。
【0020】
本明細書で、酸化コレステロールおよび本発明のコレステロール酸化物に含まれる化合物について述べるときは、特別な場合を除き、その説明はいずれの立体異性体についても、いずれのコンフォメーション(例えば、イス型コンフォメーション、舟形コンフォメーション)をとっている化合物についても当てはまり、またそれらの混合物についてもあてはまる。例えば、本明細書で「コレスタン3β,5α,6α-トリオール」について述べるときは、特別な場合を除き、その説明は、イス型コンフォメーションのものにも舟形コンフォメーションのものにもあてはまり、またそれらの任意の比の混合物についてもあてはまる。
【0021】
本発明のコレステロール酸化物はLXRのアンタゴニスとして機能可能である。また、本発明者らは、コレスタン3β,5α,6α-トリオールおよびコレスタン3β,5α,6β-トリオール(これらには、実施例(2-b)に記載の方法で合成されたもの、実施例3に記載の、αおよびβ-エポキシコレステロールの加水分解により得られたもの、実施例で用いた市販の純品が含まれる。)がLXRのアンタゴニスととして機能可能であることを初めて見出した。したがって、本発明は、コレスタン3β,5α,6α-トリオールおよびコレスタン3β,5α,6β-トリオールおよびこれまで述べてきたような本発明のコレステロール酸化物からなる群より選択される1種以上を有効成分として含む、LXRの機能に関連した疾患または状態を処置するための組成物を提供する。本発明の組成物は、脂質代謝に関連した疾患または状態を処置するために有用であり、より特定すると、血清脂質濃度および/または血糖値のコントロールに関連した疾患または状態を処置するために有用であり、さらに特定すると、高脂血症、動脈硬化、糖尿病、肥満を含む生活習慣病を処置するために有用である。
【0022】
本明細書において、本発明の組成物に関し、生活習慣病を「処置(する)」というときは、生活習慣病に関連した疾患もしくは状態を予防もしくは治療すること、軽度に抑えること、または進行を抑えることを意味する。「処置」には、根本的な治療が含まれ、また長期的な予防および/または治療とが含まれる。
【0023】
本発明の組成物は、医薬または食品の形態とすることができる。
本発明の組成物を医薬組成物とする場合、有効成分であるコレステロール酸化物の量は、目的、症状、対象者の年齢、体重等に応じて適宜とすることができる。投与経路、剤形も適宜設計することができ、例えば、全身的な投与のため、または局所投与のために製剤化することができ、内服剤、外用剤、固形剤、液状製剤、散剤、顆粒剤、カプセル剤、錠剤、軟膏剤、硬膏剤、ハップ剤、ローション剤、リニメント剤、または坐剤とすることができる。また、除放化製剤、放出制御型製剤とすることもできる。製剤は、従来の方法にしたがって行うことができ、医薬として許容できる種々の添加物、例えば、附形剤、結合剤、崩壊剤、滑沢剤、コーティング剤、懸濁化剤、乳化剤、安定剤、保存剤、緩衝剤を用いることができる。
【0024】
本発明の組成物は、食品または飲料の形態とすることができる。有効成分であるコレステロール酸化物の量は、医薬品である場合に準じて適宜とすることができる。本発明の組成物である食品または飲料は、栄養機能食品、特定保健用食品、健康食品、栄養補助食品、ドリンク剤等とすることができる。
【0025】
本発明の組成物には、その具体的な用途(例えば、生活習慣病予防のため、体質改善のため、長期的な治療のため、等。)、および/またはその具体的な用い方(例えば、量、回数、継続的に使用すべき旨、期間、等。)を表示することができる。
【0026】
LXRのアンタゴニスとが脂質代謝に関連した疾患または状態を処置するのに有用であるとの知見は、本発明者らによりはじめて提供されるものである。したがって、本発明はまた、脂質代謝に関連した疾患または状態を処置するための化合物を選択するための方法であって、用意した候補化合物がLXRのアンタゴニストであるか否かをインビトロでの試験により判定し、そしてLXRのアンタゴニストである化合物を脂質代謝に関連した疾患または状態を処置するための化合物として選択する工程を含む方法を提供する。判定する工程は、LXRを用いる実験系、例えば、それを含んだ細胞を利用する種々のモデル系を適用することができる。本明細書の実施例で用いているような、マクロファージからのコレステロールの排出機構のモデル系は、その好ましい一例である。
【0027】
このような方法によって選択された化合物は、さらに公知の方法や、当業者には良く知られた方法を用いて合成することも可能である。したがって、本発明はさらに、上述の化合物を選択するための方法にしたがって得られた化合物を製造する工程を含む、脂質代謝に関連した疾患または状態を処置するための医薬組成物の製造方法を提供する。
【0028】
実施例:
加熱により生成した酸化コレステロールをシリカゲルで充填したカラムを用いて分画し、LXRのリガンド、あるいはLXRとヘテロダイマーを形成するRetinoid X receptor(RXR)のリガンドによって亢進されたマクロファージからのコレステロールの排出に及ぼす機構をモデル系として、LXRのアンタゴニストの探索を試みた。
【実施例1】
【0029】
<加熱生成した酸化コレステロール混合物がマクロファージからのCholesterol effluxに及ぼす影響>
(1-a)酸化コレステロール混合物のカラム精製(1)およびコレステロール排出活性に及ぼす影響:
コレステロールの加熱・酸化コレステロールの抽出:
コレステロール(ナカライ)100mgを1mlのクロロホルムに溶かして、ビーカーの壁面にコレステロールを薄膜状に作り、150℃で12時間加熱した。ジエチルエーテル(過酸化物フリー)で回収した後、完全にエーテルを飛ばして75℃の熱エタノールを加えて溶解した。-20℃で20分放置し、遠心後、上清を回収した。沈殿物に再び熱エタノールを加えて撹拌後、-20℃で20分放置、遠心後、上清を回収した。この抽出操作をもう一度繰り返した。エタノールを飛ばし、2mlの混合溶媒(ヘキサン:ジエチルエーテル=75:25)に溶解したものを、シリカゲルカラムに供する酸化コレステロール混合物サンプルとした。
【0030】
シリカゲルカラムによる酸化コレステロール混合物の分画:
活性化したシリカゲル60(ナカライ)を20mlヘキサンに加えて混ぜ、カラム(内径:1cm, 長さ:10cm)に6cmまで充填して(Bed Vol:4.7ml)10mlのヘキサンで平衡化した。調製した2mlの酸化コレステロール混合物サンプルをカラムに供した。続いて混合溶媒(ヘキサン:ジエチルエーテル=75:25)を20ml供した後、次の混合溶媒(ヘキサン:ジエチルエーテル=60:40)40mlで未反応のコレステロールを溶出させた。最後にアセトンを溶出溶媒として酸化コレステロールを溶出させ、溶出時間により6つに分画した。画分1, 2には溶出物がなかったため、画分3よりFraction番号をつけ、それぞれFraction 1, 2, 3, 4とした(下表参照)。
【0031】
【表1】

【0032】
各画分中に含まれている加熱によって生成した酸化物のうち、市販されている酸化コレステロール(6種類;7β-ヒドロキシコレステロール、β-エポキシコレステロール、α-エポキシコレステロール、コレスタン3β,5α,6β-トリオール、7-ケトコレステロール、7α-ヒドロキシコレステロール)をGC法により同定した。それ以外のピークを未知の酸化コレステロールとした。4つの画分中で酸化コレステロールの種類と量が互いに異なるFraction 1と4(GC分析結果は図2参照)を用いて、その違いを以下の実験で検討した。また未知の酸化コレステロール混合物の影響を確認するために、画分中に含まれる既知の酸化コレステロールと同じ組成と比率になるように市販されている純品(STERALOIDSから購入、住所:INC.P.O. BOX 689, NEWPORT R.I. 02840 U.S.A.)を用いて混合し、これをOxycont 1, 4として同様に検討した。
【0033】
コレステロール排出実験:
(THP-1細胞のマクロファージへの分化)
ヒト急性単球性白血病由来リンパ球様細胞であるTHP-1細胞(理化学研究所細胞開発銀行から分譲)を、100nM Phorbol 13-Myristate 12-acetateおよび10% Fetal Bovine Serum含有D-MEM/F-12培地(GIBCO)に懸濁し、0.5×106cells/mlになるように12穴ディッシュ(上下8穴を使用)に播いた。
【0034】
([3H]コレステロール添加溶液の調製)
FBS 900μl/dishおよびエタノールに溶かした200μCi/ml[1β, 2β(n)-3H]Cholesterol(以下[3H]コレステロール、Amersham pharmacia biotech)90μl/dishを37℃で30分間、10分毎に混合しながらインキュベートした。30分後、D-MEM/F-12培地を添加して合計9mlとし、添加溶液とした。
【0035】
(コレステロール排出試験)
分化開始からおよそ72時間後の細胞を使用した。細胞を播いた各ウェルをPBS(-)(日水製薬)で2回洗浄後、調製した[3H]コレステロール添加溶液を1mlずつ各ウェルに添加し、CO2インキュベーター内で24時間インキュベートした。24時間後、各ウェルの培地を回収し、PBS(-)で2回洗浄した。その後、細胞に取り込まれた[3H]コレステロールの平衡化のために、2mg/ml Bovine serum albumin(Fatty acid free)(以下BSA、Sigma)含有D-MEM/F-12培地1mlを添加し、CO2インキュベーター内で24時間インキュベートした。10μg/ml human Apo A-Iおよび2mg/ml BSA含有D-MEM/F-12培地に、Frac.1もしくは4、またはOxyocont 1もしくは4を各10μM、またはコントロールとしてVehicleであるエタノールを容積が総培地量の1% (v/v)になるように添加し、添加溶液とした。24時間培養しておいたBSA含有添加培地を回収し、PBS(-)で2回洗浄した後、9-cisレチノイン酸(9-cRA)と同時に、調製した添加溶液を1mlずつ添加した。CO2インキュベーター内で24時間インキュベートした後、培地を回収した。続いて細胞をPBS(-)で2回洗浄した後、0.2N NaOH 1mlを添加し、一晩振とうすることで細胞を溶解した。
【0036】
細胞からの脂質抽出は以下のようにFolch法にて行った。まず、細胞溶解液をメタノール(ナカライ)6.7ml/wellで回収した。次にクロロホルム(ナカライ)13.3mlを添加し、混和後、40℃で30分間インキュベートした。脱イオン水4mlを加え、低温室で1晩放置し、翌日上層を除去した。下層の有機層を窒素ガスによりドライアップした後、ヘキサン(ナカライ)5mlで脂質を溶解した。
【0037】
培養液回収液200μlおよび細胞抽出液500μlにACS-II Scintillation Cocktail 10mlを添加後、液体シンチレーションカウンター(Beckman)を用いて[3H]コレステロール量を測定した。
【0038】
コレステロール排出率は培地に放出された[3H]コレステロール量と細胞に残存した[3H]コレステロール量の和を1とした時の培地に放出された[3H]コレステロール量の割合で表した。
【0039】
その結果、Frac.1は9-cRAにより亢進されたマクロファージからのコレステロールの排出に影響を及ぼさなかったのに対し、Frac.4は排出を抑制した(図3)。このような抑制がOxycont 4で見られなかったことから、Frac.4中の未知酸化コレステロールが細胞からのコレステロールの排出を抑制したと考えられた。
【0040】
また、Frac.4とともに、LXRのリガンドである22(R)-OHまたは合成アゴニストTO-901317(T1317)を同時に添加したときの排出率を算出したところ、Frac.4はLXRのリガンドによるコレステロール排出の亢進作用を阻害した(図4)。この実験結果から、Frac.4の中には、9-cRAおよびLXRのリガンドにより亢進されたコレステロール排出を抑制する未知酸化コレステロールが存在すると考えられた。
【0041】
そこで、Frac.1と4を比較し、Frac.1に存在しないFrac.4中で最も濃度の高い未知酸化コレステロール(以下、「Peak 1」という。図2中にも示した。)を精製することにした。
【0042】
(1-b)酸化コレステロール混合物のカラム精製(2)およびコレステロール排出活性に及ぼす影響:
コレステロールを加熱して得られた酸化コレステロール混合物を細かく分画するためにシリカゲルカラム(内径:1cm, 長さ:10cm, シリカゲルの充填6cm)に供して、ジエチルエーテル:アセトン=75:25, 50:50, 25:75, 0:100の4種類の混合溶媒の各5mlで順次溶出させて2.5mlずつ8分画し、それぞれの番号をFrac.4-1〜4-8とした。Frac.4-6に実験1と同じ物質と考えられるPeak 1(30mol%)およびCholestan-3β,5α,6β-triol(54mol%)、またいくつかの微量な未知の酸化コレステロールが溶出した。Peak 1が細胞からのコレステロールの排出に及ぼす影響を検討するために、Frac.4-6およびそのControlとしてCholestan-3β,5α,6β-triol純品を(1-a)と同様の実験に用いた。
【0043】
その結果、Controlと比較してPeak 1の含まれるFrac.4-6は9-cRAにより亢進されたマクロファージからのコレステロールの排出を強く抑制した(図5)。
【0044】
(1-c)酸化コレステロール混合物のTLC分画およびコレステロール排出活性に及ぼす影響:
TLCによる酸化コレステロール混合物画分の分画:
シリカゲルカラムで分画した酸化コレステロール画分Frac.4-6を更に分画するために、シリカゲル60を用いた薄層プレート(TLC)にアプライしてヘプタン:酢酸エチル=1:1の溶媒で展開した(約80分)。展開後、蛍光指示薬としてプリムリン試薬をTLCプレートに噴霧し、UV照射でバンドを検出した。α-triolあるいはβ-triol(純品)と同じ位置に検出されたバンド(Rf値=0〜0.059;画分名TLC1)、TLC1の上方に検出されたバンド(Rf値=0.059〜0.1;TLC2)、α-eopxyの位置に検出された二つのバンド(Rf値=0.34〜0.37、0.37〜0.38;TLC3、4)、上方に検出された二つのバンド(Rf値=0.82〜0.89, 0.89〜1;TLC5, 6)(図6参照)をそれぞれ剥ぎ取り、5mlのアセトンで5分間抽出後、3,000rpmで5分間遠心して上清を回収した。この操作を3回繰り返した。各抽出液をGCで分析したところ、TLC1にβ-triolおよびPeak1が、TLC2および6に未知酸化コレステロールのピークが検出され、これらの画分について(1-a)と同様にコレステロール排出試験を行った。コレステロール排出試験で添加後の濃度が10μMとなるようにTLC1の濃度を調製し、TLC2および6についてはTLC1と同量をサンプリングすることによって調製した。
【0045】
その結果、TLC1は9-cRAにより亢進されたマクロファージからのコレステロールの排出を強く抑制したのに対して、TLC2および6は抑制しなかった(図7)。この結果より、コレステロールの排出を抑制する物質は、peak-1およびβ-triolと同じ極性を示すTLC1の画分に存在することが示された。
【実施例2】
【0046】
<酸化コレステロール混合物中に含まれるPeak(Peak 1)の同定およびコレステロール排出に及ぼす影響>
(2-a)Peak 1の同定:
Peak 1の物質を同定するために、Frac.4およびFrac.4-6をMSで解析してPeak 1の開裂パターンを確認した(Frac.4:図8、Frac.4-6:図9)。その結果と、文献(Biochemica et Biophysica Acta 1302, 1996, 145-152)のMSチャートとを比較し、Peak 1をCholestan-3β,5α,6α-triolと同定した。
【0047】
(2-b)α-triolの合成およびコレステロール排出に及ぼす影響:
マクロファージからのコレステロールの排出を抑制すると考えられるCholestan-3β,5α,6α-triolを下記の方法で合成した(参照: Steroids/Louis F.Fieser and Mary Fieser (1959, p189))。928mgのコレステロールを20mlのジエチルエーテル(過酸化物フリー)に溶解し、100mlのジエチルエーテルに溶かした四酸化オスミウム605mgを加えた後、ピリジン0.5mlを加えた。これを真空状態で5日間反応させた。反応後に46ml 0.1N KOHに溶かした2.5gのマンニトールを加えて、24時間振とうした。振とう後の反応液からクロロホルムで抽出された物質を、実施例1と同様にシリカゲルカラムに供した。シリカゲルカラム(内径:1cm, 長さ:10cm, シリカゲルの充填6cm)にジエチルエーテル:アセトン=75:25, 50:50, 25:75, 0:100の4種類の混合溶媒の各5mlで順次溶出させて2.5mlずつ8分画し、6画分目に溶出した物質をGC-MSで分析したところ、Cholestan-3β,5α,6α-triol(α-triol)と確認された。
【0048】
6画分目に溶出したα-triol(純度98.6mol%)が細胞からのコレステロールの排出に及ぼす影響を検討するために、実施例1と同様の実験に用い、コレステロールを加熱した後にカラムで精製した画分(Frac.4-6;α-triol 60mol%)の作用と比較した。その結果、α-triolは22(R)-OHおよび9-cRAにより亢進されたマクロファージからのコレステロールの排出をFrac.4-6ほどには抑制しなかった(図10、11)。この結果より、Frac.4-6中には、α-triol以外のコレステロールの排出を抑制する酸化コレステロールが含まれることが示唆された。
【実施例3】
【0049】
<αおよびβ-epoxycholesterolの加水分解反応がコレステロール排出活性に及ぼす影響>
CholestanteriolはEpoxycholesterolの構造を経て生成する経路が知られている(図12)。αおよびβ-triolのコレステロール骨格における立体異性体の生成について検討するために、αおよびβ-epoxycholesterolを下記の方法で加水分解することによってTriolを含む加水分解産物を生成した。2mgのαおよびβ-epoxycholesterol (Steraloids)に1ml Tetrahydrofuran:H2O:Acetone=4:1:0.5および100μlの70% HClO4を添加して4時間振とうした。実施例1の(1-c)と同様の方法でTLCで分画した。α-triolあるいはβ-triol(純品)と同じ位置に検出されたバンド(Rf値=0〜0.059;画分名α-epoxy TLC1およびβ-epoxy TLC1)をGCで分析したところ、88.9mol%(α-epoxy TLC1)および95.6mol%のβ-triol(β-epoxy TLC1)が生成していた。この画分についてコレステロール排出実験で検討し、市販品のβ-triolと比較した。
【0050】
その結果、9-cRAにより亢進されたマクロファージからのコレステロールの排出が、α-epoxy TLC1およびβ-epoxy TLC1によって抑制された(図13、14)。しかし、Frac.4-6が示すような強い抑制作用は見られなかった。
【実施例4】
【0051】
<酸化コレステロール混合物のHPLC分画およびCholesterol efflux活性に及ぼす影響>
(1)Frac.4-6画分を以下の条件でHPLCにより分画した。
HPLC条件:
ポンプ Waters 600E;
カラム VyDAC C18、粒径5μm、孔径300Å、4.6mm×250mm;
移動相 メタノール:アセトニトリル=40:60(v/v);
流速 1.0ml/min;
検出器 蒸発光散乱検出器 SEDEX 75。
【0052】
ELSD条件:
Pressure 3.5bar;
Temperature 40℃。
【0053】
分画は、α-triolおよびβ-triol、またこれらの物質より速く溶出された物質(B画分)の3つに分画した(α-triol、β-triol、B画分)。各分画時間はB画分: 0〜6分20秒、α-triol: 6分20秒〜7分40秒、β-triol: 9分30秒〜12分とし、チャートを確認しながら分画した(図15: HPLCチャート)。これらの画分の純度をGCにより解析したところ、α-triol: 86.4%、β-triol: 91.3%であった。また、B画分には酸化物が多く含まれていた。これらの画分が細胞からのコレステロールの排出に及ぼす影響を検討するために、実験1と同様の実験に用いた。
【0054】
その結果、9-cRAにより亢進されたマクロファージからのコレステロールの排出がα-triol、β-triolそれぞれによって抑制されたが、いずれもFrac.4-6ほどの抑制効果はなく、以前示された市販品α-triol、β-triolによる抑制と同程度であった。対して、B画分はFrac.4-6と同様に排出を抑制した。
【0055】
これより、排出抑制能を有する物質は加熱生成したα-triolおよびβ-triolではなく、B画分中に存在することが示唆された。しかし、B画分には各々が微量ながらも数多くの酸化物が含まれているため、排出抑制能を示す物質を同定するためにはHPLC条件を検討し、更に細かく分画することによって候補物質を絞り込む必要があると思われる。
【0056】
(2)次に、α-triolおよびβ-triol以外の酸化物について検討した。Frac.4-6画分を、メタノール:アセトニトリル[20:80(v/v)]を移動相とし、35bar、15〜25℃、他は(1)と同じ条件でHPLCにより分画した。HPLCチャートを図17に示した。各分画時間は、H1画分:4〜6分、H2画分:6〜19分、H3画分:20〜36分、H4画分:47〜60分であった。
【0057】
これらの未知酸化コレステロール画分がマクロファージからのコレステロールの排出に及ぼす影響を図18に示した。H2画分は、9-cRAによるマクロファージからのコレステロール排出促進を強く抑制した。また、H1画分でも抑制する傾向が見られた。
【0058】
(3)続いて、H2画分を再分画したものについて検討した。H2画分を、メタノール:アセトニトリル[20:80(v/v)]を移動相とし、35bar、15〜25℃、他は(1)と同じ条件でHPLCにより分画した。このHPLCチャートを図19示した。各分画時間は、C1画分:7〜11分、C2画分:11〜13分30秒、C3画分:13分30秒〜16分30秒、C4画分: 16分30秒〜19分30秒であった。
【0059】
また、これらの画分がマクロファージからのコレステロールの排出に及ぼす影響を図20に示した。C1画分は、9-cRAによるマクロファージからのコレステロール排出促進を強く抑制した。
【0060】
(4)合成したα-Triolおよび純品のβ-Triolと同様に、コレステロールを加熱することによって生成したα-triolおよびβ-triolも9-cRAによるコレステロールの排出の促進に対して影響を及ぼさなかった。そこで、Frac.4-6に含まれる未知酸化物の影響を検討したところ、Fig.4-6のようにH2に含まれる酸化物によって抑制された。さらに図20から、H2画分中の物質のうちC2〜4に含まれる化合物ではないことも示された。しかし、C1に含まれる酸化物をGCで分析したところ、この画分にはまだ多数の分子種が存在していた。図18のようにH1でも抑制傾向が見られたことから、C1に含まれていた多数の分子種の中でも早く溶出した化合物が活性を示す物質であると考えられる。また、これらの画分はβ-Triolよりも早く溶出したことから、β-Triolに比べて極性が高い酸化物であると考えられる。
【0061】
今回、移動相について検討したところ、アセトニトリルの割合を高くすることによってβ-Triolと未知酸化物との分離がよくなった。また、未知酸化物は、HPLC-MSのような、分離能の良い長いHPLCカラムを用いて細かく分画する方法、また長いシリカゲルカラムで分離を検討し、その画分をHPLCで分画するなどの方法で単離することができる。
【実施例5】
【0062】
<HPLC画分がABCA1の発現に及ぼす影響>
細胞内コレステロールの排出機構として、細胞膜とHDLのコレステロール濃度勾配を利用した単純拡散、ABCA1を介した脂質に乏しいApoA-Iへの排出、ApoE依存的な排出、SR-BIを介した排出、コレステロールの27-Hydroxylationを介した排出などが報告されている。その中でも、生体内で酵素的に生成される20(S)-Hydroxycholesterolや22(R)-OHのような酸化コレステロールは、LXRのリガンドとしてABCA1の発現を誘導し、細胞内コレステロールの排出を亢進すると考えられている。酵素的生成物に加え、加熱のような自動酸化によって生成される酸化コレステロールの中にも、LXRのリガンドとしてABCA1の発現と、それに続く細胞内コレステロールの排出に影響を及ぼす物質が存在する可能性が考えられる。本発明によって見いだされた細胞内コレステロールの排出を抑制する化合物は、コレステロールを出発物質とした化合物であることから、ABCA1を介した排出機構に関与していると考えられ、ABCA1の発現に及ぼす影響を検討することは重要であると考えられる。
【0063】
そこで、コレステロール排出を抑制したHPLC画分がABCA1の発現に及ぼす影響を調べた。
THP-1細胞からmRNAの抽出:
THP-1細胞を実施例(1-a)と同様の方法でマクロファージに分化させた。分化から72時間後にPBS(-)で2回洗浄し、9-cRA 1μM、9-cRA 1μMおよびHPLCで分画したH2画分 10μMの混合溶液、またはコントロールとしてVehicleであるエタノールを容積が総培地量の1%(v/v)になるように添加し、CO2インキュベーター内でインキュベートした。24時間後、PBS(-)で2回洗浄して、Denaturing solution [Sol. D; 4M Guanidinium thiocyanate(GTC)、25mM Sodium citrate(pH7.0)、0.1M 2-Mercaptoethanol、10% Sodium N-lauroyl sarcosine(以上nacalai tesque)]を300μl/well for 6-well dish添加し、細胞を回収した。一晩以上凍結保存後、Acid-Guanidinium-Phenol-Chloroform法(AGPC法)にてmRNAを抽出した。抽出したmRNAは30μlのRNA水に溶解した後、260nmにおける吸光度を測定し、OD260値が1のときRNA濃度は40μg/mlとしてRNAの濃度を算出した。
【0064】
RT-PCRによるABCA1とβ-actinのcDNAの増幅:
PCRの条件は以下の通りである。RNAを1.5μg分取し、2×Reaction Mix(Invitrogen、USA)12.5μl、5’-primer(5pmol) 0.5μl、3’-primer(5pmol) 0.5μl、Super Scripta IIIRT/Platinum(登録商標)Taq Mix Template 1μl(Invitrogen、USA)、滅菌超純水を加え、全量を25μlに調製した。反応の際にはミネラルオイルを重層し、反応液の蒸発を防いだ。ABCA1の PCR条件は、55°Cで30分間反応させた後、94℃で2分間熱変性を行い、続いて94℃で30秒間、50℃で1分間、72℃ 30秒間のサイクルを20回繰り返した。またβ-actinは55°Cで30分間反応させた後、94℃で2分間熱変性を行い、94℃で30秒間、56℃で1分間、72℃で0.5秒間のサイクルを20回繰り返した。その後、それぞれ72℃で10分間の伸長反応を行った。
【0065】
サザンブロッティング:
PCR産物はミネラルオイル除去後、エチジウムブロマイド無添加の2%アガロースゲル中で電気泳動を行った。この際、バンドの確認のために、クローニングしたヒトABCA1およびヒトβ-actinはEcoRIで制限消化しておいたものと同時に泳動した。泳動終了後、ゲルをバットに移し、加水分解液(0.25M HCl)にゲルを浸して10分間振とうした。脱イオン水で洗浄後、変性溶液(1.5M NaCl、0.5M NaOH)に浸し、30分間振とうした。再び脱イオン水で洗浄後、中和溶液[1.5M NaCl、0.5M Tris(pH7.0)]に浸して30分間振とうした。この後、キャピラリー拡散法を用いて、メンブレン(Hybond NX、Amersham Pharmacia Biotech、USA)に8時間以上ブロッティングした。ブロッティング終了後、トランスイルミネーター上にメンブレンを置き、紫外灯を5分間照射することでCross linkingを行った。
【0066】
プローブ作成:
ヒトABCA1またはヒトβ-actinのプラズミドDNA 5μgをEcoRIで37°C 1時間以上制限消化させた。そしてエチジウムブロマイド添加の2%アガロースゲルにて電気泳動を行った。電気泳動終了後、目的のバンドを切り出し回収した。回収したcDNA(5μg)はMultiprime DNA labeling system(Amersham Pharmacia Biotech)を用いて[α-32P]dCTP(3,000Ci/mmol、Amersham Pharmacia Biotech)2.5μlで標識した。反応は37°Cで30分間行い、G-50カラム(ProbeQuant G-50 Micro Columns、Amersham Pharmacia Biotech)を用いてプローブを調整した。
【0067】
ハイブリダイゼーション:
メンブレンのRNAが固定されている面を内側にしてハイブリボトルに入れ、ガラス棒と10mlのプレハイ液[50%脱イオン化formamide、4×SSC、5×Denhardt’s solution(0.1% Ficoll、0.1% polyvinylpyrrolidone、0.1% BSA)、50mM Na phosphate(pH6.5)、0.1mg/ml yeast tRNA、0.5mg/ml NaPO4、1% SDS]42°Cで3時間プレハイブリダイゼーションを行った。プレハイ終了後、ボトルの中の液を捨て、新しいハイブリ液10mlを加えた。これに作成したプローブを加え、42°Cで18時間以上ハイブリダイゼーションを行った。そして、メンブレンは50°Cにした2×SSC(0.3M NaCl, 0.1M sodium citrate)-0.1% SDSですすいだ後、2×SSC-0.1%SDSで50°C、15分間洗浄した。さらに0.2×SSC(0.03M NaCl, 0.01M sodium citrate)-0.1% SDSで50°C、15分間洗浄した。フィルターにサーベイメーターを当て、洗浄が十分でないと判断した時は50℃にした0.1×SSC(15mM NaCl, 5mM sodium citrate)-0.1% SDSで50℃、15分間洗浄した。メンブレン上のカウントを確認した後、メンブレンをラップに包んでIPカセット(富士写真フィルム、東京)に入れ、Imaging Plate(富士写真フィルム)を当てた。ヒトABCA1は2時間、β-actinは15分間感光させた後、バイオイメージングアナライザー(FLA-5000、富士写真フィルム)を用いて測定した。結果は、a-actinで補正した値を用いて、エタノールを添加したときの発現量を1としたときの相対値で表した。
【0068】
統計解析:
統計解析はFisher's PLSDを用いて行い、p<0.05をもって有意差ありと判定した。
結果:
マクロファージのABCA1 mRNA発現量を図21に示した。9-cRA添加によってABCA1 mRNA発現量が増加した。9-cRAをHPLCにより分画されたH2画分(H2 fraction)と共存させることによってABCA1 mRNA発現量の増加が抑制された。
【0069】
考察:
9-cRA添加により、コントロールに比べてABCA1 mRNA発現量は21倍ほど高くなった。9-cRAと同時にH2画分を添加したとき、9-cRA単独添加の83%減少した。H2画分によるABCA1 mRNA発現量の抑制は、Cholesterol efflux実験の結果を反映していた。このことから、H2画分に含まれる未知の酸化コレステロールは9-cRAによるABCA1の誘導を抑制することによって細胞内コレステロールの排出を抑制していることが示唆された。
【0070】
本実施例においては、H2画分の単独添加による影響について検討していないが、実施例(1-a)で分画されたFraction 4については、Fraction 4の単独添加においてもコントロールと比較して細胞内コレステロールの排出を抑制した(データは示していない。)ことから、H2画分単独の添加によってもFraction 4と同様にコントロールと比較して排出が抑制され、このとき、ABCA1の発現も抑制されていると思われる。
【図面の簡単な説明】
【0071】
【図1】図1Aは、ステロイド骨格酸化型のコレステロール酸化物が、図1A中の点線矢印で示したようなLXRのアンタゴニストとして機能する可能性の予想を示した図である。図1Aに示したマクロファージや肝臓といった、動脈硬化発症において重要な臓器ではLXRの活性を上昇させれば、細胞内コレステロールを排出させるATP-binding cassette transporter-1(ABCA1)の発現量が上がり、抗動脈硬化作用をもつリポタンパク質である血清HDL濃度が上昇すると期待されてきた。しかし、LXRはトリアシルグリセロールの合成を促進するため、血清トリアシルグリセロール濃度も同時に上昇させる結果になった(図1Aの肝臓の部分の実線矢印を参照のこと)。図1Bは、自動酸化および酵素的酸化によって生成する主な酸化コレステロールを表した図である。
【図2】図2Aは、実施例1の(1-a)で得たFraction 1のGCチャートである。図2Bは、実施例1の(1-a)で得たFraction 4のGCチャートである。市販の酸化コレステロール(6種類;7β-ヒドロキシコレステロール、α-エポキシコレステロール、β-エポキシコレステロール、7-ケトコレステロール、コレスタン3β,5α,6β-トリオール、7α-ヒドロキシコレステロール)を同定した。Frac.4中にのみ存在する未知の酸化コレステロールの中で、もっとも濃度の高いものを「Peak 1」とし、精製することにした。
【図3】図3は、マクロファージからのコレステロール排出に及ぼす酸化コレステロール画分の影響を示すグラフである。図中、Frac.1および4は実施例1の(1-a)で得た画分であり、Oxycont 1および4は市販されている純品をそれぞれの画分中に含まれる既知の酸化コレステロールと同じ組成および比率になるように混合したものである。コレステロール排出率(Fold)は、(培地に放出された[3H]コレステロール)/(培地に放出された[3H]コレステロール+細胞に残存した[3H]コレステロール)で表した。Frac.1、は9-cRAにより亢進されたマクロファージからのコレステロールの排出に影響を及ぼさなかったのに対し、Frac.4は排出を抑制した。このような抑制はOxycont 4では見られなかった。n=4、a, b, c, d; p<0.05
【図4】図4は、LXRリガンドにより亢進されたマクロファージからのコレステロール排出に及ぼすFrac.4の影響を示すグラフである。Frac.4とともに、LXRのリガンドである22(R)-OHまたは合成アゴニストTO-901317(T1317)を同時に添加したときの排出率を算出したところ、Frac.4はLXRのリガンドによるコレステロール排出の亢進作用を阻害した。n=4、a, b, c; p<0.05
【図5】図5は、マクロファージからのコレステロール排出に及ぼす未知酸化コレステロール画分の影響を示すグラフである。図中、Peak 1は実施例1の(1-b)で得たFrac.4-6、Triolは純品Cholestan-3β,5α,6β-triolである。Controlと比較してPeak 1の含まれるFrac.4-6は9-cRAにより亢進されたマクロファージからのコレステロールの排出を強く抑制した。n=4、a, b, c, d; p<0.05
【図6】図6は、TLCによるFrac.4-6の分画結果の概略図である。
【図7】図7は、マクロファージからのコレステロール排出に及ぼす各TLC画分の影響を示すグラフである。TLC1は9-cRAにより亢進されたマクロファージからのコレステロールの排出を強く抑制したのに対して、TLC2およびTLC6は抑制しなかった。n=4、a, b; p<0.05
【図8】図8は、Frac.4のMSチャートである。
【図9】図9は、Frac.4-6のMSチャートである。
【図10】図10は、マクロファージからのコレステロール排出に及ぼすFrac.4-6およびCholestan-3β,5α,6α-triolの影響を示すグラフである。α-triolは9-cRAにより亢進されたマクロファージからのコレステロールの排出を抑制しなかった。n=4、a, b; p<0.05
【図11】図11は、マクロファージからのコレステロール排出に及ぼすFrac.4-6およびCholestan-3β,5α,6α-triol(α-triol)の影響を示すグラフである。α-triolは22(R)-OHにより亢進されたマクロファージからのコレステロールの排出を抑制しなかった。n=4、a, b; p<0.05
【図12】図12は、酸性条件下でのβ-epoxycholesterolの加水分解反応によるCholestan-3β,5α,6α-triolの生成経路を示した図である。
【図13】図13は、9-cRAにより亢進されたマクロファージからのコレステロール排出に及ぼすα-epoxycholesterol加水分解産物の影響を示すグラフである。コレステロールの排出はα-epoxy TLC1によって抑制された。n=4、a, b; p<0.05
【図14】図14は、9-cRAにより亢進されたマクロファージからのコレステロール排出に及ぼすβ-epoxycholesterol加水分解産物の影響を示すグラフである。コレステロールの排出はβ-epoxy TLC1によって抑制された。n=4、a, b; p<0.05
【図15】図15は、Frac.4-6画分のHPLCチャートである。移動相はメタノール:アセトニトリル =40:60(v/v)とした。
【図16】図16は、マクロファージからのコレステロール排出に及ぼすHPLC画分の影響を示すグラフである。9-cRAにより亢進されたマクロファージからのコレステロールの排出がα-triol、β-triolそれぞれによって抑制されたが、いずれもFrac.4-6ほどの抑制効果はなかった。B画分はFrac.4-6と同様に排出を抑制した。n=4、a, b, c, d; p<0.05
【図17】図17は、Frac.4-6画分のHPLCチャートである。移動相はメタノール:アセトニトリル=20:80(v/v)とした。
【図18】図18は、マクロファージからのコレステロール排出に及ぼすHPLC画分の影響を示すグラフである。H2画分は、9-cRAによるマクロファージからのコレステロール排出促進を強く抑制した。また、H1画分でも抑制する傾向が見られた。n=4、a, b, c, d, e; p<0.05
【図19】図19は、H2画分のHPLCチャートである。
【図20】図20は、マクロファージからのコレステロール排出に及ぼすHPLC画分の影響を示すグラフである。C1画分は、9-cRAによるマクロファージからのコレステロール排出促進を強く抑制した。n=4、a, b, c; p<0.05
【図21】図21は、マクロファージのABCA1 mRNA発現量を示した写真およびグラフである。9-cRA添加により、ABC1 mRNAの発現量が増加したが、9-cRAをHPLC分画したH2画分(H2 fraction)と共存させることにより、ABC1 mRNAの発現量の増加が抑制された。グラフでは、n=4、*; p<0.05
【特許請求の範囲】
【請求項1】
1)コレステロールの加熱生成物を、内径1cmおよび長さ6cmのシリカゲルカラムに供し、ジエチルエーテル:アセトンの容積比がそれぞれ75:25、50:50、25:75、0:100である4種の混合溶媒各5mlで順に溶出し、2.5mlずつ分画して第6番目の画分を得て;そして
2)所望により、第6番目の画分をさらに分画する
工程により得られる、コレステロール酸化物。
【請求項2】
工程2)が、第6番目の画分を分画して、コレスタン3β,5α,6α-トリオールおよびコレスタン3β,5α,6β-トリオールを含まない画分を得る工程である、請求項1に記載のコレステロール酸化物。
【請求項3】
工程2)が、第6番目の画分を、Vydac C18、粒径5μm、孔径300Åを充填した内径4.6mm×250mmのカラムを用い、メタノール:アセトニトリルの容積比40:60の溶液を移動相とし、流速1.0ml/分、3.5barおよび40℃の条件で、さらに分画して0〜6分20秒の画分を得る工程である、請求項2に記載のコレステロール酸化物。
【請求項4】
工程2)が、第6番目の画分を、Vydac C18、粒径5μm、孔径300Åを充填した内径4.6mm×250mmのカラムを用い、メタノール:アセトニトリルの容積比20:80の溶液を移動相とし、流速1.0ml/分、35barおよび15〜25℃の条件で、さらに分画して6〜19分の画分を得る工程である、請求項2に記載のコレステロール酸化物。
【請求項5】
工程2)が、第6番目の画分を、Vydac C18、粒径5μm、孔径300Åを充填した内径4.6mm×250mmのカラムを用い、メタノール:アセトニトリルの容積比20:80の溶液を移動相とし、流速1.0ml/分、350Pa(35bar)および15〜25℃の条件で、さらに分画して6〜19分の画分を得て;そして6〜19分の画分を、Vydac C18、粒径5μm、孔径300Åを充填した内径4.6mm×250mmのカラムを用い、メタノール:アセトニトリルの容積比20:80の溶液を移動相とし、流速1.0ml/分、35barおよび15〜25℃の条件で、さらに分画して7〜11分の画分を得る工程である、請求項2に記載のコレステロール酸化物。
【請求項6】
シリカゲル60を固定相とし、ヘプタン:酢酸エチルの容積比1:1の混合液を移動相として行う薄層クロマトグラフィーにより得られるRf値が0〜0.059であるコレステロール酸化物。
【請求項7】
コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオールではないステロイド骨格酸化型の化合物である、請求項2〜6のいずれか1項に記載のコレステロール酸化物。
【請求項8】
コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオールおよび請求項2、3および7のいずれか1項に記載のコレステロール酸化物からなる群より選択される1種以上を含む、組成物。
【請求項9】
脂質代謝に関連した疾患または状態を処置するための、請求項8に記載の組成物。
【請求項10】
血清脂質濃度および/または血糖値の制御に関連した疾患または状態を処置するための、請求項5または9に記載の組成物。
【請求項11】
高脂血症、動脈硬化、糖尿病、肥満を含む生活習慣病を処置するための請求項8〜10のいずれか1項に記載の組成物。
【請求項12】
脂質代謝に関連した疾患または状態を処置するための化合物を選択するための方法であって、用意した候補化合物が肝臓X受容体(Liver X receptor;LXR)のアンタゴニストであるか否かをインビトロでの試験により判定し、そしてLXRのアンタゴニストである化合物を脂質代謝に関連した疾患または状態を処置するための化合物として選択する工程を含む、前記方法。
【請求項13】
請求項12に記載された方法によって選択された化合物を製造する工程を含む、脂質代謝に関連した疾患または状態を処置するための化合物の製造方法。
【請求項14】
LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の酸化コレステロール。
【請求項1】
1)コレステロールの加熱生成物を、内径1cmおよび長さ6cmのシリカゲルカラムに供し、ジエチルエーテル:アセトンの容積比がそれぞれ75:25、50:50、25:75、0:100である4種の混合溶媒各5mlで順に溶出し、2.5mlずつ分画して第6番目の画分を得て;そして
2)所望により、第6番目の画分をさらに分画する
工程により得られる、コレステロール酸化物。
【請求項2】
工程2)が、第6番目の画分を分画して、コレスタン3β,5α,6α-トリオールおよびコレスタン3β,5α,6β-トリオールを含まない画分を得る工程である、請求項1に記載のコレステロール酸化物。
【請求項3】
工程2)が、第6番目の画分を、Vydac C18、粒径5μm、孔径300Åを充填した内径4.6mm×250mmのカラムを用い、メタノール:アセトニトリルの容積比40:60の溶液を移動相とし、流速1.0ml/分、3.5barおよび40℃の条件で、さらに分画して0〜6分20秒の画分を得る工程である、請求項2に記載のコレステロール酸化物。
【請求項4】
工程2)が、第6番目の画分を、Vydac C18、粒径5μm、孔径300Åを充填した内径4.6mm×250mmのカラムを用い、メタノール:アセトニトリルの容積比20:80の溶液を移動相とし、流速1.0ml/分、35barおよび15〜25℃の条件で、さらに分画して6〜19分の画分を得る工程である、請求項2に記載のコレステロール酸化物。
【請求項5】
工程2)が、第6番目の画分を、Vydac C18、粒径5μm、孔径300Åを充填した内径4.6mm×250mmのカラムを用い、メタノール:アセトニトリルの容積比20:80の溶液を移動相とし、流速1.0ml/分、350Pa(35bar)および15〜25℃の条件で、さらに分画して6〜19分の画分を得て;そして6〜19分の画分を、Vydac C18、粒径5μm、孔径300Åを充填した内径4.6mm×250mmのカラムを用い、メタノール:アセトニトリルの容積比20:80の溶液を移動相とし、流速1.0ml/分、35barおよび15〜25℃の条件で、さらに分画して7〜11分の画分を得る工程である、請求項2に記載のコレステロール酸化物。
【請求項6】
シリカゲル60を固定相とし、ヘプタン:酢酸エチルの容積比1:1の混合液を移動相として行う薄層クロマトグラフィーにより得られるRf値が0〜0.059であるコレステロール酸化物。
【請求項7】
コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオールではないステロイド骨格酸化型の化合物である、請求項2〜6のいずれか1項に記載のコレステロール酸化物。
【請求項8】
コレスタン3β,5α,6α-トリオール、コレスタン3β,5α,6β-トリオールおよび請求項2、3および7のいずれか1項に記載のコレステロール酸化物からなる群より選択される1種以上を含む、組成物。
【請求項9】
脂質代謝に関連した疾患または状態を処置するための、請求項8に記載の組成物。
【請求項10】
血清脂質濃度および/または血糖値の制御に関連した疾患または状態を処置するための、請求項5または9に記載の組成物。
【請求項11】
高脂血症、動脈硬化、糖尿病、肥満を含む生活習慣病を処置するための請求項8〜10のいずれか1項に記載の組成物。
【請求項12】
脂質代謝に関連した疾患または状態を処置するための化合物を選択するための方法であって、用意した候補化合物が肝臓X受容体(Liver X receptor;LXR)のアンタゴニストであるか否かをインビトロでの試験により判定し、そしてLXRのアンタゴニストである化合物を脂質代謝に関連した疾患または状態を処置するための化合物として選択する工程を含む、前記方法。
【請求項13】
請求項12に記載された方法によって選択された化合物を製造する工程を含む、脂質代謝に関連した疾患または状態を処置するための化合物の製造方法。
【請求項14】
LXRのアンタゴニストとして機能可能な、ステロイド骨格酸化型の酸化コレステロール。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【公開番号】特開2006−315997(P2006−315997A)
【公開日】平成18年11月24日(2006.11.24)
【国際特許分類】
【出願番号】特願2005−140097(P2005−140097)
【出願日】平成17年5月12日(2005.5.12)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 日本栄養・食糧学会発行、第59回 日本栄養・食糧学会大会 講演要旨集、平成17年4月1日発行
【出願人】(504145342)国立大学法人九州大学 (960)
【Fターム(参考)】
【公開日】平成18年11月24日(2006.11.24)
【国際特許分類】
【出願日】平成17年5月12日(2005.5.12)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 日本栄養・食糧学会発行、第59回 日本栄養・食糧学会大会 講演要旨集、平成17年4月1日発行
【出願人】(504145342)国立大学法人九州大学 (960)
【Fターム(参考)】
[ Back to top ]

