Li溶液回収装置及びLi溶液回収方法
【課題】リチウムイオン二次電池の正極材料を含む焼成物を水に浸出させて得たリチウムとフッ素、硫酸等の各イオンを含有する溶解液から、連続的にリチウムの精製と濃縮を同時に行うことにより、リチウムを回収できる装置および方法を提供する。
【解決手段】電解槽において不溶性陽極と陰極間を複数の隔膜で仕切ることにより、仕切られた各室で陽イオンと陰イオンの濃度差が保持され、各室で均一な濃度が保持されたまま、陽極側から陰極側へとイオンの濃度勾配を維持できる。中間付近の室へ原液を供給し、リチウムイオン濃度の高い陰極に最寄りの室からリチウムイオン濃縮液を抜き出し、不純物イオン濃度の高い陽極に最も近い室から不純物濃縮液を排出する。
【解決手段】電解槽において不溶性陽極と陰極間を複数の隔膜で仕切ることにより、仕切られた各室で陽イオンと陰イオンの濃度差が保持され、各室で均一な濃度が保持されたまま、陽極側から陰極側へとイオンの濃度勾配を維持できる。中間付近の室へ原液を供給し、リチウムイオン濃度の高い陰極に最寄りの室からリチウムイオン濃縮液を抜き出し、不純物イオン濃度の高い陽極に最も近い室から不純物濃縮液を排出する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、Li溶液回収装置及びLi溶液回収方法であって、液中の陽イオン、陰イオンを電気分解により精製、濃縮し、濃縮されたLiイオン等を効率的に回収する装置及び方法に関する。特に、リチウムイオン二次電池の正極材料を含む焼成物を水又は酸により溶解させた溶液からリチウムを精製及び濃縮して回収する装置及び方法に関する。
【背景技術】
【0002】
リチウムイオン二次電池は、従来の鉛蓄電池、ニッカド二次電池等に比較して軽量、高容量、高起電力の優れた二次電池であり、携帯電話、ノートパソコン等のモバイル機器などに広く使用されている。
このようなリチウムイオン二次電池の正極材料としては、例えばコバルト酸リチウム(LiCoO2)、マンガン酸リチウム(LiMn2O4)などが用いられており、これらには希少有価物質であるリチウムが含まれている。そこで、使用済みのリチウムイオン二次電池からこれらの有価物質を回収し、再びリチウムイオン二次電池の正極材料としてリサイクル利用を図ることが望まれている。
【0003】
ここで、リチウムイオン二次電池の正極材料を焼成すると、リチウムが酸化リチウム(Li2O)となり、この焼成物を水で浸出すると、水酸化リチウム(LiOH)、水中ではリチウムイオンと水酸化物イオンとなって溶出することが知られている。
しかし、リチウムイオン二次電池の廃棄物をリサイクル対象とした場合、上述の水による浸出により、リチウムと同時にフッ素や硫酸が不純物として溶出する。フッ素は電解質として、例えば、LiPF6などが使用されており、これに起因する。硫酸は(CF3SO2)2NLi、(C2F5SO2)2NLiなどの電解質添加剤由来のSが硫酸となって浸出すると考えられる。
また、電池又は正極材の重量に対してリチウムの含有量はそれほど多くはなく、リチウムを浸出した液の濃度も比較的低い。それらの理由から、不純物を除去する精製工程と濃縮工程が必要となり、より低コストで高効率の精製、濃縮方法が求められている。また、工業利用の観点から、連続的に精製、濃縮できる工程が望まれている。
【0004】
不純物の除去や濃縮の方法として、例えば、特許文献1には、電池廃棄物を溶解したリチウム含有溶液をろ過し、可溶性リチウム塩を含有する溶液を、陽極室と陰極室が陽イオン交換膜で仕切られた電解槽を用いて精製する方法が提案されている。この方法は、陽極室中に電池廃棄物を溶解したリチウム含有溶液を供し、多孔性を有する陽イオン交換膜を隔てて陰極室へ選択的にリチウムイオンを電気により泳動させ、陰極室にリチウムを濃縮する手法である。
【0005】
しかし、この提案では、陽極室へリチウムを供給し、陰極室から取り出す工程となっているため、バッチ処理では陽イオン、陰イオンを分離することが可能ではあるが、連続的に液の供給と抜き出しを行う場合には適していない。連続的に給液する場合は、陽極側からの陰イオン濃縮液を連続的に排出し、陰極側から陽イオン濃縮液を連続的に抜き出しする必要がある。しかし、この提案では、リチウム含有液を陽極室へ供給した時点でリチウムが拡散し、陽極室のリチウム濃度が上昇したまま抜き出しを行うこととなり、排出側のリチウム濃度が上昇したまま排出することとなり、リチウムの回収率が低下する。また、滞留時間を十分に長くとることで解決が可能であるが、その分電気エネルギーを多量に使用することとなり経済的でない。また、この提案の槽を複数準備し、数回にわたる繰り返し処理にて実施できる可能性もあるが、電極板や電解槽が複数必要となることから経済的でない。
【0006】
また、この提案では、陽イオン交換膜を利用していることから、運転を繰り返すと陽イオン(カチオン)交換膜の接点が充分に得られなくなり、膜を頻繁に交換する必要があり、消耗した場合もコストがかかるという問題がある。
また、泳動を伴わずに濃縮のみを行う場合、例えば蒸発濃縮などが考えられるが、蒸発に多大なエネルギーを必要とすることに加えて、不純物も同時に濃縮されることから得られる回収物に不純物が多く混入するという問題がある。
精製と濃縮を別々に実施するという方法もあるが、工程が二つになり設備が増大し、各工程でエネルギーを必要とすることから、この場合も当然コストが増大する。
【0007】
したがってリチウムを溶出させた溶液から、リチウムの精製と濃縮を低コストで同時に、連続的に行うことができるリチウムの回収方法の提供が望まれているのが現状である。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特表2001−508925号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、従来における前記諸問題を解決し、以下の目的を達成することを課題とする。即ち、本発明は、リチウムイオン二次電池の正極材料を含む焼成物を水に浸出させて得たリチウムとフッ素、硫酸などを含有する溶解液から、リチウムの精製と濃縮を行うことにより、リチウム溶解液を回収できる装置及び方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
前記課題を解決するための手段としては、以下の通りである。即ち、
本発明のLi溶液回収装置は、電解槽に供給されるLi溶解原液中の陽イオン、陰イオンを該電解槽への直流電流の通電によりそれぞれ陰極側、陽極側へ泳動させてLi濃度の異なる溶液を回収するLi溶液回収装置であって、
前記電解槽は、通液性隔壁により仕切られてLi溶解原液供給室、陽極室及び陰極室を有し、該Li溶解原液供給室は該陽極室と該陰極室の間に位置し、該陽極室、該陰極室にはそれぞれ不溶性陽極、陰極が配置され、
前記Li溶解原液を前記Li溶解原液供給室に供給する供給手段と、前記陽極室、前記陰極室からそれぞれLi濃度の異なる溶液を回収する回収手段と、を有する。
【0011】
また、本発明のLi溶液回収装置の好適形態は、第1に、前記電解槽は通液性隔壁により5室〜10室に仕切られているものである。
第2に、前記陰極室が前記Li溶解原液供給室と該陰極室とを仕切る前記通液性隔壁に略平行な通液性隔壁により複数の陰極室に仕切られるものである。
第3に、前記陽極室が前記Li溶解原液供給室と該陽極室とを仕切る前記通液性隔壁に略平行な通液性隔壁により複数の陽極室に仕切られるものである。
第4に、上記陰イオンが、フッ素イオン、硫酸イオンの少なくとも一種を含む。
第5に、上記Li溶解原液が、廃リチウムイオン電池を焼成し、リチウムをリチウム陽イオンとして溶解させた液である。
第6に、前記通液性隔壁の通気度が10〜1000cm3/cm2・分である。
【0012】
一方、本発明のLi溶液回収方法は、上述のLi溶液回収装置を用い、前記Li溶解原液供給室にLi溶解原液を供給し、前記電解槽へ直流電流を通電して、前記陽極室、前記陰極室からそれぞれLi濃度の異なる溶液を回収することを特徴とする。
好ましくは、Li溶解原液の供給、Li濃度の異なる溶液の回収をいずれも連続的に行うものである。
【0013】
前記課題を解決するための手段の詳細を説明する。液中のイオンを通電による泳動にて分離、精製する場合、リチウムイオンは陰極方向へ泳動され、陰極室で濃縮する。不純物であるフッ素イオン、硫酸イオンは陽極方向へ泳動され、陽極室で濃縮する。これらは当たり前のことであるが、この操作を連続的に実施する場合、単純に通液性隔壁の無い電解槽や、通液性隔壁を隔てて陰極室と陽極室とに2槽に分けた電解槽では連続的に給液と排出を繰り返した場合に、陽イオン、陰イオンの濃度勾配を保つことができずに分離ができなくなる。そのため、連続的に精製と濃縮を実施することができない。
【0014】
これに対し、本発明では、電解槽が通液性隔壁により仕切られてLi溶解原液供給室、陽極室及び陰極室を有し、Li溶解原液供給室は該陽極室と該陰極室の間に位置することにより、仕切られた各室で陽イオンと陰イオンの濃度差が保持され、各室で均一な濃度が保持されたまま、陽極側から陰極側へとイオンの濃度勾配を維持できる。このことにより、通液性隔壁により仕切られた各室のうち、Li溶解液のリチウムイオン濃度に近い中間付近の室へLi溶解原液を供給し、リチウムイオン濃度の高い陰極室からリチウムイオン濃縮液を抜き出し、不純物であるフッ素イオン、硫酸イオン濃度の高い陽極室から不純物濃縮液を排出していくことで、連続的にリチウムの精製と濃縮行い、不純物濃度が低いリチウム濃縮液を回収できる。これにより、リチウムイオン二次電池の正極材料を含む焼成物を水に浸出させて得たリチウム、フッ素、硫酸などを含有する溶液から、リチウムの精製と濃縮を同時に、連続的に行うことができるリチウム回収方法を提供できる。
【発明の効果】
【0015】
本発明によると、従来における問題を解決することができ、リチウムイオン二次電池の正極材料を含む焼成物を水に浸出させて得たリチウム、フッ素、硫酸などを含有する溶解液から、連続的にリチウムの精製と濃縮を同時に行うことにより、リチウムを回収できる方法を提供できる。
【図面の簡単な説明】
【0016】
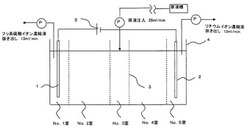
【図1】リチウム溶液の精製と濃縮を行う装置の模式図の例1(縦断面図)。
【図2】リチウム溶液の精製と濃縮を行う装置の模式図の例2(横断面図、平面図)。
【図3】実施例1の試験方法と装置の概要を示す模式図(縦断面図)。
【図4】実施例1の各室のリチウムイオン濃度を示すグラフ。
【図5】実施例1の各室のフッ素イオン濃度を示すグラフ。
【図6】実施例1の各室の硫酸イオン濃度を示すグラフ。
【図7】実施例2の試験方法と装置の概要を示す模式図(縦断面図)。
【図8】実施例2の各室のリチウムイオン濃度を示すグラフ。
【図9】実施例2の各室のフッ素イオン濃度を示すグラフ。
【図10】実施例2の各室の硫酸イオン濃度を示すグラフ。
【図11】実施例3の試験方法と装置の概要を示す模式図(縦断面図)。
【図12】実施例3の各室のリチウムイオン濃度を示すグラフ。
【図13】実施例3の各室のフッ素イオン濃度を示すグラフ。
【図14】実施例3の各室の硫酸イオン濃度を示すグラフ。
【図15】比較例1の試験方法と装置の概要を示す模式図(縦断面図)。
【図16】比較例2の試験方法と装置の概要を示す模式図(縦断面図)。
【図17】比較例2の各室のリチウムイオン濃度を示すグラフ。
【図18】比較例2の各室のフッ素イオン濃度を示すグラフ。
【図19】比較例2の各室の硫酸イオン濃度を示すグラフ。
【図20】比較例3の試験方法と装置の概要を示す模式図(縦断面図)。
【図21】比較例3の各室のリチウムイオン濃度を示すグラフ。
【図22】比較例3の各室のフッ素イオン濃度を示すグラフ。
【図23】比較例3の各室の硫酸イオン濃度を示すグラフ。
【図24】比較例4の試験方法と装置の概要を示す模式図(縦断面図)。
【図25】比較例4の各室のリチウムイオン濃度を示すグラフ。
【図26】比較例4の各室のフッ素イオン濃度を示すグラフ。
【図27】比較例4の各室の硫酸イオン濃度を示すグラフ。
【発明を実施するための形態】
【0017】
本発明のLi溶液回収装置には、リチウムイオン二次電池の正極材料を含む焼成物からリチウムを水で浸出したリチウムイオン溶解液をLi溶解原液として用いることができる。
【0018】
リチウムの精製と濃縮を同時に、連続的に行う方法としては、通液性隔壁により前述のように3室以上に仕切られ陰極と陽極を設けた電解槽を用いて、電極に直流電流を通電することによりリチウムが溶解した溶液中からリチウムの精製と濃縮を同時に、連続的に行うことができれば、特に制限はなく、目的に応じて適宜選択することができる。
例えば、陽極及び陰極を有するリチウムの精製及び濃縮槽が前記陽極及び前記陰極間を3室以上に通液性隔壁で仕切られた槽を用い、前記陽極及び前記陰極間に通電しながら、前記陰極が存在する陰極室でリチウムイオンを濃縮させることが好ましい。
連続的にリチウムの精製と濃縮を行う際の、Li溶解原液の供給は、3室以上に隔壁で仕切られた各室の陽極室、陰極室以外のどこの室に供給しても良いが、通液性隔壁により仕切られた各室のうち、Li溶解原液のリチウムイオン濃度に近い槽へLi溶解原液を供給することが好ましい。
また濃縮、精製された液の抜き出しはリチウムイオン濃度の高い陰極室から抜き出し、不純物であるフッ素イオン、硫酸イオン濃度の高い陽極室から不純物濃縮液を排出していくことが好ましい。これにより、連続的にリチウムの精製と濃縮行い、不純物濃度が低いリチウム濃縮液を回収できる。
【0019】
前記陽極室と前記陰極室とを隔てるのに使用する通液性隔壁の種類は液中のリチウムイオンを通過可能であれば特に制限はなく、目的に応じて適宣選択することができる。陽極側はF-、SO42-が通過可能であることが好ましい。例えば、ろ布、イオン交換膜、RO膜、NF膜、限外ろ過膜、精密ろ過膜、イオン交換樹脂などが挙げられ、ろ布であることが安価な点で好ましい。
【0020】
ろ布の材質は、特に制限はなく、例えばポリプロピレン製、ポリエチレン製などが挙げられるが、液性が酸性、アルカリ性の両方に耐性を持つポリプロピレン製であることが好ましい。
ろ布の織り方は特に制限はなく、例えば二重織、朱子織、綾織などが挙げられる。織り方と繊維の材質、厚さによりろ布の通気度が変化するため、通気度が適切であればよい。
通液性隔壁の好ましい通気度は10〜1000cm3/cm2・分であり、より好ましくは、20〜600cm3/cm2・分である。通気度が10cm3/cm2・分より低いと電解電圧が上昇して精製のコストが増大し、1000cm3/cm2・分より高いと水中のイオンが拡散しやすくなり各室間の濃度差の維持が困難になる。
【0021】
前記リチウムの精製と濃縮を同時に行う装置の形状としては、特に制限はなく、目的に応じて適宣選択することができる。例えば、図1に示すように電解槽に陰極と陽極を有し、陽極と陰極の間を隔壁で分離し、陽極室、陰極室を更に通気性隔壁で仕切ることが好ましい。
また、図2に示すように、陽極又は陰極を槽の中心に位置し、同心円上に通気性隔壁を配置し、槽の内側又は槽そのものが対極となる構造においても実施することができる。
【0022】
電解槽は、前述のように通気性隔壁により3室以上に仕切る。好ましくは3室〜100室、より好ましくは5室〜10室に仕切ることがよい。3室未満となると、連続的に給液と排出を繰り返した場合に、陽イオン、陰イオンの濃度勾配を保つことができずに分離ができなくなる。そのため、連続的に精製と濃縮を実施することができないことがある。100室以上となると、電解電圧が上昇し、精製のコストが増大することがある。
【0023】
前記リチウムの精製と濃縮を同時に行う際の、リチウム及びフッ素、硫酸が溶解した溶液の液性はpH5〜14であることが好ましく、より好ましくはアルカリ性であり、より一層好ましくはpH8〜13.5である。pHが5より低い場合、不純物としてアルミニウムが存在する場合に、アルミニウムは陽イオンとして存在してしまうことから、リチウムイオンと同様に陰極へ泳動されて分離が不十分となることがある。一方、pHが14より高い場合は装置を腐食する可能性がある。
【0024】
−リチウムイオン二次電池の正極材料−
前記リチウムイオン二次電池の正極材料としては、特に制限はなく、目的に応じて適宜選択できるが、例えばコバルト酸リチウム(LiCoO2)、及びマンガン酸リチウム(LiMn2O4)などを用いることができる。
前記正極材料としては、使用済リチウムイオン二次電池より得られたものを用いることが、リチウムをリサイクルできる点から好ましい。
【0025】
−原料として使用するリチウムイオン二次電池の正極材料を含む焼成物−
本発明の精製及び濃縮方法を用いたリチウムイオン二次電池のリチウムリサイクル原料にはリチウムイオン二次電池の正極材を含む焼成物を用いることが好ましい。該焼成物を焼成する雰囲気としては、特に制限はなく、焼成条件などに応じて適宜選択することができ、例えば大気雰囲気、酸化雰囲気、不活性雰囲気、還元性雰囲気、などが挙げられる。なお、前記雰囲気は、焼成中は、通気させておくことが好ましい。
ここで、前記大気雰囲気とは、酸素が21vol%、窒素78vol%の大気(空気)を用いた雰囲気を意味する。
前記酸化雰囲気とは、窒素又はアルゴン等の不活性雰囲気中に酸素を1vol%〜21vol%含む雰囲気を意味し、酸素を1vol%〜5vol%含む雰囲気が好ましい。
前記不活性雰囲気とは、窒素又はアルゴンからなる雰囲気を意味する。
前記還元性雰囲気とは、例えば、窒素又はアルゴン等の不活性雰囲気中にCO、H2、H2S、SO2などを含む雰囲気を意味する。
【0026】
前記焼成は、焼成炉を用いて行うことが好ましい。前記焼成炉としては、特に制限はなく、目的に応じて適宜選択することができ、例えばロータリーキルン、流動床炉、トンネル炉、マッフル等のバッチ式炉、キュウポラ、ストーカー炉などが挙げられる。大気雰囲気下でも焼成できるので、例えばロータリーキルン炉等の普通に用いられている焼成炉を使用することができ、焼成炉の選択幅が広くなる。
前記焼成温度は、特に制限はなく、目的に応じて適宜選択できるが、大気雰囲気下では400℃以上、不活性雰囲気下では600℃以上、酸化雰囲気下では400℃以上であることがより好ましく、上限温度は1200℃以下であることが好ましい。
前記焼成温度が、400℃未満であると、例えばリチウムイオン二次電池の正極の結晶構造を破壊できないために、リチウムを溶出できないことがあり、1,200℃を超えると、多大なエネルギーを必要とすると共に、焼成物が焼結するため、粉砕工程が必要となることがある。
【0027】
前記リチウムの精製と濃縮を同時に行う際の電極間に印加する電流密度は、5A/m2から500A/m2が好ましく、10A/m2から300A/m2がより好ましい。5A/m2より低くなると、リチウムイオンの泳動に時間がかかることがあり、500A/m2以上となると、水素や酸素の発生に多くのエネルギーが使用されてしまうため効率が低下する。
【0028】
前記リチウムの精製と濃縮を同時に行う際の陽極と陰極の電極間の距離は、0.5cmから100cmの間隔であれば任意に設置できる。1cmから50cmがより好ましい。0.5cmより短いと短絡によるショートが起こる危険性があり、100cmより長いと電圧が上昇し、消費電力が高くなることから経済的でない。
【0029】
(炭酸リチウムの回収方法)
炭酸リチウムを回収する際には、本発明の前記リチウムの精製および濃縮を同時に行う方法にて濃縮、精製した液を用いることができる。
前記炭酸リチウムの回収方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば(1)液を自然乾燥する方法、(2)加熱により乾燥固化する方法、(3)炭酸を吹き込みながら晶析させる方法、(4)炭酸塩により沈殿分離する方法、などが挙げられ、炭酸リチウムとして回収できる。
特に、(3)の方法が好ましく、本発明の方法で精製濃縮した液をpHが5〜9の範囲まで炭酸を吹き込み、炭酸リチウムとして析出させることができる。pHが5未満となると析出する炭酸リチウムの量が減少する可能性があり、pH9を超えると、炭酸が不足している可能性がある。また、炭酸リチウムは高温であるほど水への溶解度が低いため、加温することが望ましい。加温の温度は80℃から100℃が好ましい。80℃未満であると炭酸リチウムの収量が低下する。
【0030】
前記リチウムの回収方法は、リチウムイオン二次電池の正極材料を含む焼成物からリチウムを浸出させた液を原液とし、本発明の精製および濃縮方法を用いて溶液中の不純物を分離しつつ、リチウムを濃縮させ、得られた濃縮液を上述の炭酸リチウムを晶析する工程にて効率よくリチウムを回収することができ、リチウムイオン二次電池のリサイクルを図ることができる。
【実施例】
【0031】
以下、本発明の実施例を説明するが、本発明は、これらの実施例に何ら限定されるものではない。
【0032】
<リチウム電池正極材料の分離>
市販のパソコン用リチウムイオン二次電池(正極がコバルト、マンガン、ニッケルの酸化物から成る三元系正極材、負極に黒鉛を使用)を、700℃、空気雰囲気で一時間焼成し、得られた焼成物をハンマークラッシャーで破砕した。破砕物を試験用篩にて篩分けを行い。篩目開き1mm以下の正極材粉を得た。焼成はボックス炉(KOYO LINDBERG社製)にて行った。
【0033】
<リチウム溶解液の作成>
得られた正極材料30kgを100Lの水に浸漬させ、リチウムイオンが溶解した溶液を得た。溶解液の組成を表1に示す。
【0034】
【表1】

【0035】
<溶液中のリチウムの分析>
溶液中のリチウム濃度については、高周波プラズマ発光分光分析装置(日本ジャーレル・アッシュ株式会社製、iCAP−6300)により分析し、リチウム濃度を算出した。
【0036】
<溶液中のフッ素、硫酸の分析>
溶液中のフッ素、硫酸濃度については、イオンクロマトグラフィー(ダイオネクス社製、)により分析し、濃度を算出した。
【0037】
[実施例1]
図3に示すようなリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。
通液性隔壁として陽極と陰極間を隔てる膜はポリプロピレン製のろ布(敷島カンバス株式会社製、P91C)を用いた。膜4枚を用いて、電解槽を5室に仕切り、両端の室をそれぞれ陰極室、陽極室とし、それぞれの電極を配置した。陽極は酸化チタンに白金をコーティングした電極、陰極はチタン電極を用いた。電極間距離は24cmであった。
まず、電解槽のLi溶解原液供給室に25リットル(lと表す。)の原液を注入し、両極間に5Aの直流電流(電圧は8ボルト)を16時間通電し、隔膜で仕切られた各室にリチウムイオンの濃度勾配をつくった。その後、5Aの電流を保持したまま、原液を図3に示すNo.3室に26ml/minで供給し、陰極室であるNo.5室からリチウム濃縮液を13ml/minで回収し、陽極室であるNo.1室からフッ素、硫酸イオンの濃縮液を13ml/minで系外へ排出する操作を連続的に行った。このときの槽内の液滞留時間は16時間であった。
時間経過に伴う各室のリチウム、フッ素、硫酸イオン濃度を記録した。その結果を表2に示す。また、各室のNo.は図3に示したNo.で表記した。
【0038】
【表2】

【0039】
表2の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度をそれぞれ図4から図6に示した。連続通液開始から48時間が経過しても、陽極側のNo.1室と陰極側のNo.5室のイオンの濃度差は維持されていた。このことから、濃縮液を一定の液質で得ることができ、液の供給と抜き出しを連続的に実施できることを示している。
【0040】
[実施例2]
図7に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。通液性隔壁として隔膜を図7のように略平行に6枚用い、隔膜により仕切られた部屋を7つとし、原液供給をNo.4室、リチウム濃縮液の回収をNo.7室(陰極室)とした以外は、実施例1と同様の条件で試験を行った。
その結果を表3に示す。また、各室のNo.は図7に示したNo.で表記した。
【0041】
【表3】

【0042】
表3の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度をそれぞれ図8から図10に示した。連続通液開始から48時間が経過しても、陰極と陽極のイオンの濃度勾配は維持されていた。このことから、濃縮液を一定の液質で得ることができ、液の供給と抜き出しを連続的に実施できることを示している。
【0043】
[実施例3]
図11に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。電解槽の仕切りを通液性隔壁の膜2枚を用いて、電解槽を3室に仕切って行った以外は実施例1と同様の条件で試験した。時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度を記録した。その結果を表4に示す。また、各室のNo.は図11に示したNo.で表記した。
【0044】
【表4】

【0045】
表4の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度を図12から図14に示した。通液初期である8時間通水時点では、No.3室(陰極室)にリチウムが濃縮され、No.1室(陽極室)にフッ素、硫酸イオンが濃縮された状態ではあったが、実施例1および2と比較して濃度差は小さかった。さらに連続通液を継続したところ、形成されていた濃度勾配が時間経過に伴って無くなり、各室ともに原液に近い濃度に徐々に近づく結果となった。これより、濃縮液を一定の液質で得る効果はあるが、実施例1、2よりは効果が少ないことがわかる。
【0046】
[比較例1]
図15に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。通液性隔壁は用いず、隔膜により陰極室と陽極室を仕切らなかった以外は、実施例1と同様の条件で試験を行った。
その結果を表5に示す。
【0047】
【表5】

【0048】
表5の結果から、通液性隔壁により陰極室と陽極室を仕切らなかった場合には、濃度の勾配ができず、濃縮と精製ができないことが確認された。
【0049】
[比較例2]
図16に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。通液性隔壁として隔膜を図16のように1枚用い、隔膜により仕切られた部屋を2つとし、原液供給をNo.1室、リチウム濃縮液の回収をNo.2室(陰極室)とした以外は、実施例1と同様の条件で試験を行った。
その結果を表6に示す。また、各室のNo.は図16に示したNo.で表記した。
【0050】
【表6】

【0051】
表6の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度をそれぞれ図17から図19に示した。連続通液開始から時間が経過するに伴って、陰極室と陽極室のイオンの濃度勾配は減少していた。特に回収対象であるリチウムについては連続通液開始から48時間の時点では陰極室と陽極室の濃度勾配は実施例1から3と比較して大きく減少していた。このことは、濃縮液を連続的に一定の液質で得ることができないことを示している。
【0052】
[比較例3]
図20に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。原液供給をNo.2室とした以外は、比較例2と同様の条件で試験を行った。
その結果を表7に示す。また、各室のNo.は図20に示したNo.で表記した。
【0053】
【表7】

【0054】
表7の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度をそれぞれ図21から図23に示した。連続通液開始から時間が経過するに伴って、陰極室と陽極室のイオンの濃度勾配は減少していた。特に回収対象であるリチウムについては連続通液開始から48時間の時点では陰極室と陽極室の濃度勾配は実施例1から3と比較して大きく減少していた。このことは、濃縮液を連続的に一定の液質で得ることができないことを示している。
【0055】
[比較例4]
図24に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。まず、比較例2、3で用いたものと同様の構造で、容量が半分である電解槽を二槽準備し、直列に配置して連続通水を行える仕様とした。各電解槽のLi溶解原液供給室にそれぞれ12.5lの原液を注入し、両極間に2.5Aの直流電流(電圧は8ボルト)を16時間通電し、隔膜で仕切られた各室にリチウムイオンの濃度勾配をつくった。その後、各電極間で2.5Aの電流を保持したまま、原液を図24に示すNo.1室に26ml/minで供給し、陰極室であるNo.2室からリチウム濃縮液を19.5ml/minで回収した濃縮液を2槽目の陽極室であるNo.3室へ供給し、1槽目の陽極室であるNo.1室からフッ素、硫酸イオンの濃縮液を6.5ml/minで、2槽目の陽極室であるNo.4室からフッ素、硫酸イオンの濃縮液を13ml/min系外へ排出する操作を連続的に行った。このときの槽内の液滞留時間は各槽で8時間であった。この比較例4の装置にかかる消費電力は実施例1とほぼ同じであり、濃縮液の回収量も同じとなるようにした。
時間経過に伴う各室のリチウム、フッ素、硫酸イオン濃度を記録した。その結果を表8に示す。また、各室のNo.は図24に示したNo.で表記した。
【0056】
【表8】

【0057】
表8の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度をそれぞれ図25から図27に示した。連続通液開始から時間が経過するに伴って、陰極室と陽極室のイオンの濃度勾配はともに減少していた。特に回収対象であるリチウムについては連続通液開始から48時間の時点ではNo.1室(陰極室)とNo.4室(陽極室)の濃度勾配は実施例1から3と比較して大きく減少していた。この比較例4で示す装置は、原液を供給する槽とリチウム濃縮液を回収する槽間を仕切る隔壁の数が実施例1と同数であり、消費電力も同じであるが、実施例1の方が、濃縮効率が良いことが分かる。さらに比較例4のような構造では電流を流すための整流器や送液のためのポンプ、電極等の装置が複数必要となることから、経済的でない。
【産業上の利用可能性】
【0058】
本発明のリチウムの精製および濃縮を連続的に行う回収方法は、従来と比較して効率的にリチウムを精製、濃縮でき、従来実現できていなかった連続的な処理を可能とするため、低コストかつ効率的な回収方法でリチウムイオン二次電池の再利用を図ることができる。
【符号の説明】
【0059】
1 陽極
2 陰極
3 隔膜(通液性隔壁)
4 電解槽本体
5 直流電源
【技術分野】
【0001】
本発明は、Li溶液回収装置及びLi溶液回収方法であって、液中の陽イオン、陰イオンを電気分解により精製、濃縮し、濃縮されたLiイオン等を効率的に回収する装置及び方法に関する。特に、リチウムイオン二次電池の正極材料を含む焼成物を水又は酸により溶解させた溶液からリチウムを精製及び濃縮して回収する装置及び方法に関する。
【背景技術】
【0002】
リチウムイオン二次電池は、従来の鉛蓄電池、ニッカド二次電池等に比較して軽量、高容量、高起電力の優れた二次電池であり、携帯電話、ノートパソコン等のモバイル機器などに広く使用されている。
このようなリチウムイオン二次電池の正極材料としては、例えばコバルト酸リチウム(LiCoO2)、マンガン酸リチウム(LiMn2O4)などが用いられており、これらには希少有価物質であるリチウムが含まれている。そこで、使用済みのリチウムイオン二次電池からこれらの有価物質を回収し、再びリチウムイオン二次電池の正極材料としてリサイクル利用を図ることが望まれている。
【0003】
ここで、リチウムイオン二次電池の正極材料を焼成すると、リチウムが酸化リチウム(Li2O)となり、この焼成物を水で浸出すると、水酸化リチウム(LiOH)、水中ではリチウムイオンと水酸化物イオンとなって溶出することが知られている。
しかし、リチウムイオン二次電池の廃棄物をリサイクル対象とした場合、上述の水による浸出により、リチウムと同時にフッ素や硫酸が不純物として溶出する。フッ素は電解質として、例えば、LiPF6などが使用されており、これに起因する。硫酸は(CF3SO2)2NLi、(C2F5SO2)2NLiなどの電解質添加剤由来のSが硫酸となって浸出すると考えられる。
また、電池又は正極材の重量に対してリチウムの含有量はそれほど多くはなく、リチウムを浸出した液の濃度も比較的低い。それらの理由から、不純物を除去する精製工程と濃縮工程が必要となり、より低コストで高効率の精製、濃縮方法が求められている。また、工業利用の観点から、連続的に精製、濃縮できる工程が望まれている。
【0004】
不純物の除去や濃縮の方法として、例えば、特許文献1には、電池廃棄物を溶解したリチウム含有溶液をろ過し、可溶性リチウム塩を含有する溶液を、陽極室と陰極室が陽イオン交換膜で仕切られた電解槽を用いて精製する方法が提案されている。この方法は、陽極室中に電池廃棄物を溶解したリチウム含有溶液を供し、多孔性を有する陽イオン交換膜を隔てて陰極室へ選択的にリチウムイオンを電気により泳動させ、陰極室にリチウムを濃縮する手法である。
【0005】
しかし、この提案では、陽極室へリチウムを供給し、陰極室から取り出す工程となっているため、バッチ処理では陽イオン、陰イオンを分離することが可能ではあるが、連続的に液の供給と抜き出しを行う場合には適していない。連続的に給液する場合は、陽極側からの陰イオン濃縮液を連続的に排出し、陰極側から陽イオン濃縮液を連続的に抜き出しする必要がある。しかし、この提案では、リチウム含有液を陽極室へ供給した時点でリチウムが拡散し、陽極室のリチウム濃度が上昇したまま抜き出しを行うこととなり、排出側のリチウム濃度が上昇したまま排出することとなり、リチウムの回収率が低下する。また、滞留時間を十分に長くとることで解決が可能であるが、その分電気エネルギーを多量に使用することとなり経済的でない。また、この提案の槽を複数準備し、数回にわたる繰り返し処理にて実施できる可能性もあるが、電極板や電解槽が複数必要となることから経済的でない。
【0006】
また、この提案では、陽イオン交換膜を利用していることから、運転を繰り返すと陽イオン(カチオン)交換膜の接点が充分に得られなくなり、膜を頻繁に交換する必要があり、消耗した場合もコストがかかるという問題がある。
また、泳動を伴わずに濃縮のみを行う場合、例えば蒸発濃縮などが考えられるが、蒸発に多大なエネルギーを必要とすることに加えて、不純物も同時に濃縮されることから得られる回収物に不純物が多く混入するという問題がある。
精製と濃縮を別々に実施するという方法もあるが、工程が二つになり設備が増大し、各工程でエネルギーを必要とすることから、この場合も当然コストが増大する。
【0007】
したがってリチウムを溶出させた溶液から、リチウムの精製と濃縮を低コストで同時に、連続的に行うことができるリチウムの回収方法の提供が望まれているのが現状である。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特表2001−508925号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、従来における前記諸問題を解決し、以下の目的を達成することを課題とする。即ち、本発明は、リチウムイオン二次電池の正極材料を含む焼成物を水に浸出させて得たリチウムとフッ素、硫酸などを含有する溶解液から、リチウムの精製と濃縮を行うことにより、リチウム溶解液を回収できる装置及び方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
前記課題を解決するための手段としては、以下の通りである。即ち、
本発明のLi溶液回収装置は、電解槽に供給されるLi溶解原液中の陽イオン、陰イオンを該電解槽への直流電流の通電によりそれぞれ陰極側、陽極側へ泳動させてLi濃度の異なる溶液を回収するLi溶液回収装置であって、
前記電解槽は、通液性隔壁により仕切られてLi溶解原液供給室、陽極室及び陰極室を有し、該Li溶解原液供給室は該陽極室と該陰極室の間に位置し、該陽極室、該陰極室にはそれぞれ不溶性陽極、陰極が配置され、
前記Li溶解原液を前記Li溶解原液供給室に供給する供給手段と、前記陽極室、前記陰極室からそれぞれLi濃度の異なる溶液を回収する回収手段と、を有する。
【0011】
また、本発明のLi溶液回収装置の好適形態は、第1に、前記電解槽は通液性隔壁により5室〜10室に仕切られているものである。
第2に、前記陰極室が前記Li溶解原液供給室と該陰極室とを仕切る前記通液性隔壁に略平行な通液性隔壁により複数の陰極室に仕切られるものである。
第3に、前記陽極室が前記Li溶解原液供給室と該陽極室とを仕切る前記通液性隔壁に略平行な通液性隔壁により複数の陽極室に仕切られるものである。
第4に、上記陰イオンが、フッ素イオン、硫酸イオンの少なくとも一種を含む。
第5に、上記Li溶解原液が、廃リチウムイオン電池を焼成し、リチウムをリチウム陽イオンとして溶解させた液である。
第6に、前記通液性隔壁の通気度が10〜1000cm3/cm2・分である。
【0012】
一方、本発明のLi溶液回収方法は、上述のLi溶液回収装置を用い、前記Li溶解原液供給室にLi溶解原液を供給し、前記電解槽へ直流電流を通電して、前記陽極室、前記陰極室からそれぞれLi濃度の異なる溶液を回収することを特徴とする。
好ましくは、Li溶解原液の供給、Li濃度の異なる溶液の回収をいずれも連続的に行うものである。
【0013】
前記課題を解決するための手段の詳細を説明する。液中のイオンを通電による泳動にて分離、精製する場合、リチウムイオンは陰極方向へ泳動され、陰極室で濃縮する。不純物であるフッ素イオン、硫酸イオンは陽極方向へ泳動され、陽極室で濃縮する。これらは当たり前のことであるが、この操作を連続的に実施する場合、単純に通液性隔壁の無い電解槽や、通液性隔壁を隔てて陰極室と陽極室とに2槽に分けた電解槽では連続的に給液と排出を繰り返した場合に、陽イオン、陰イオンの濃度勾配を保つことができずに分離ができなくなる。そのため、連続的に精製と濃縮を実施することができない。
【0014】
これに対し、本発明では、電解槽が通液性隔壁により仕切られてLi溶解原液供給室、陽極室及び陰極室を有し、Li溶解原液供給室は該陽極室と該陰極室の間に位置することにより、仕切られた各室で陽イオンと陰イオンの濃度差が保持され、各室で均一な濃度が保持されたまま、陽極側から陰極側へとイオンの濃度勾配を維持できる。このことにより、通液性隔壁により仕切られた各室のうち、Li溶解液のリチウムイオン濃度に近い中間付近の室へLi溶解原液を供給し、リチウムイオン濃度の高い陰極室からリチウムイオン濃縮液を抜き出し、不純物であるフッ素イオン、硫酸イオン濃度の高い陽極室から不純物濃縮液を排出していくことで、連続的にリチウムの精製と濃縮行い、不純物濃度が低いリチウム濃縮液を回収できる。これにより、リチウムイオン二次電池の正極材料を含む焼成物を水に浸出させて得たリチウム、フッ素、硫酸などを含有する溶液から、リチウムの精製と濃縮を同時に、連続的に行うことができるリチウム回収方法を提供できる。
【発明の効果】
【0015】
本発明によると、従来における問題を解決することができ、リチウムイオン二次電池の正極材料を含む焼成物を水に浸出させて得たリチウム、フッ素、硫酸などを含有する溶解液から、連続的にリチウムの精製と濃縮を同時に行うことにより、リチウムを回収できる方法を提供できる。
【図面の簡単な説明】
【0016】
【図1】リチウム溶液の精製と濃縮を行う装置の模式図の例1(縦断面図)。
【図2】リチウム溶液の精製と濃縮を行う装置の模式図の例2(横断面図、平面図)。
【図3】実施例1の試験方法と装置の概要を示す模式図(縦断面図)。
【図4】実施例1の各室のリチウムイオン濃度を示すグラフ。
【図5】実施例1の各室のフッ素イオン濃度を示すグラフ。
【図6】実施例1の各室の硫酸イオン濃度を示すグラフ。
【図7】実施例2の試験方法と装置の概要を示す模式図(縦断面図)。
【図8】実施例2の各室のリチウムイオン濃度を示すグラフ。
【図9】実施例2の各室のフッ素イオン濃度を示すグラフ。
【図10】実施例2の各室の硫酸イオン濃度を示すグラフ。
【図11】実施例3の試験方法と装置の概要を示す模式図(縦断面図)。
【図12】実施例3の各室のリチウムイオン濃度を示すグラフ。
【図13】実施例3の各室のフッ素イオン濃度を示すグラフ。
【図14】実施例3の各室の硫酸イオン濃度を示すグラフ。
【図15】比較例1の試験方法と装置の概要を示す模式図(縦断面図)。
【図16】比較例2の試験方法と装置の概要を示す模式図(縦断面図)。
【図17】比較例2の各室のリチウムイオン濃度を示すグラフ。
【図18】比較例2の各室のフッ素イオン濃度を示すグラフ。
【図19】比較例2の各室の硫酸イオン濃度を示すグラフ。
【図20】比較例3の試験方法と装置の概要を示す模式図(縦断面図)。
【図21】比較例3の各室のリチウムイオン濃度を示すグラフ。
【図22】比較例3の各室のフッ素イオン濃度を示すグラフ。
【図23】比較例3の各室の硫酸イオン濃度を示すグラフ。
【図24】比較例4の試験方法と装置の概要を示す模式図(縦断面図)。
【図25】比較例4の各室のリチウムイオン濃度を示すグラフ。
【図26】比較例4の各室のフッ素イオン濃度を示すグラフ。
【図27】比較例4の各室の硫酸イオン濃度を示すグラフ。
【発明を実施するための形態】
【0017】
本発明のLi溶液回収装置には、リチウムイオン二次電池の正極材料を含む焼成物からリチウムを水で浸出したリチウムイオン溶解液をLi溶解原液として用いることができる。
【0018】
リチウムの精製と濃縮を同時に、連続的に行う方法としては、通液性隔壁により前述のように3室以上に仕切られ陰極と陽極を設けた電解槽を用いて、電極に直流電流を通電することによりリチウムが溶解した溶液中からリチウムの精製と濃縮を同時に、連続的に行うことができれば、特に制限はなく、目的に応じて適宜選択することができる。
例えば、陽極及び陰極を有するリチウムの精製及び濃縮槽が前記陽極及び前記陰極間を3室以上に通液性隔壁で仕切られた槽を用い、前記陽極及び前記陰極間に通電しながら、前記陰極が存在する陰極室でリチウムイオンを濃縮させることが好ましい。
連続的にリチウムの精製と濃縮を行う際の、Li溶解原液の供給は、3室以上に隔壁で仕切られた各室の陽極室、陰極室以外のどこの室に供給しても良いが、通液性隔壁により仕切られた各室のうち、Li溶解原液のリチウムイオン濃度に近い槽へLi溶解原液を供給することが好ましい。
また濃縮、精製された液の抜き出しはリチウムイオン濃度の高い陰極室から抜き出し、不純物であるフッ素イオン、硫酸イオン濃度の高い陽極室から不純物濃縮液を排出していくことが好ましい。これにより、連続的にリチウムの精製と濃縮行い、不純物濃度が低いリチウム濃縮液を回収できる。
【0019】
前記陽極室と前記陰極室とを隔てるのに使用する通液性隔壁の種類は液中のリチウムイオンを通過可能であれば特に制限はなく、目的に応じて適宣選択することができる。陽極側はF-、SO42-が通過可能であることが好ましい。例えば、ろ布、イオン交換膜、RO膜、NF膜、限外ろ過膜、精密ろ過膜、イオン交換樹脂などが挙げられ、ろ布であることが安価な点で好ましい。
【0020】
ろ布の材質は、特に制限はなく、例えばポリプロピレン製、ポリエチレン製などが挙げられるが、液性が酸性、アルカリ性の両方に耐性を持つポリプロピレン製であることが好ましい。
ろ布の織り方は特に制限はなく、例えば二重織、朱子織、綾織などが挙げられる。織り方と繊維の材質、厚さによりろ布の通気度が変化するため、通気度が適切であればよい。
通液性隔壁の好ましい通気度は10〜1000cm3/cm2・分であり、より好ましくは、20〜600cm3/cm2・分である。通気度が10cm3/cm2・分より低いと電解電圧が上昇して精製のコストが増大し、1000cm3/cm2・分より高いと水中のイオンが拡散しやすくなり各室間の濃度差の維持が困難になる。
【0021】
前記リチウムの精製と濃縮を同時に行う装置の形状としては、特に制限はなく、目的に応じて適宣選択することができる。例えば、図1に示すように電解槽に陰極と陽極を有し、陽極と陰極の間を隔壁で分離し、陽極室、陰極室を更に通気性隔壁で仕切ることが好ましい。
また、図2に示すように、陽極又は陰極を槽の中心に位置し、同心円上に通気性隔壁を配置し、槽の内側又は槽そのものが対極となる構造においても実施することができる。
【0022】
電解槽は、前述のように通気性隔壁により3室以上に仕切る。好ましくは3室〜100室、より好ましくは5室〜10室に仕切ることがよい。3室未満となると、連続的に給液と排出を繰り返した場合に、陽イオン、陰イオンの濃度勾配を保つことができずに分離ができなくなる。そのため、連続的に精製と濃縮を実施することができないことがある。100室以上となると、電解電圧が上昇し、精製のコストが増大することがある。
【0023】
前記リチウムの精製と濃縮を同時に行う際の、リチウム及びフッ素、硫酸が溶解した溶液の液性はpH5〜14であることが好ましく、より好ましくはアルカリ性であり、より一層好ましくはpH8〜13.5である。pHが5より低い場合、不純物としてアルミニウムが存在する場合に、アルミニウムは陽イオンとして存在してしまうことから、リチウムイオンと同様に陰極へ泳動されて分離が不十分となることがある。一方、pHが14より高い場合は装置を腐食する可能性がある。
【0024】
−リチウムイオン二次電池の正極材料−
前記リチウムイオン二次電池の正極材料としては、特に制限はなく、目的に応じて適宜選択できるが、例えばコバルト酸リチウム(LiCoO2)、及びマンガン酸リチウム(LiMn2O4)などを用いることができる。
前記正極材料としては、使用済リチウムイオン二次電池より得られたものを用いることが、リチウムをリサイクルできる点から好ましい。
【0025】
−原料として使用するリチウムイオン二次電池の正極材料を含む焼成物−
本発明の精製及び濃縮方法を用いたリチウムイオン二次電池のリチウムリサイクル原料にはリチウムイオン二次電池の正極材を含む焼成物を用いることが好ましい。該焼成物を焼成する雰囲気としては、特に制限はなく、焼成条件などに応じて適宜選択することができ、例えば大気雰囲気、酸化雰囲気、不活性雰囲気、還元性雰囲気、などが挙げられる。なお、前記雰囲気は、焼成中は、通気させておくことが好ましい。
ここで、前記大気雰囲気とは、酸素が21vol%、窒素78vol%の大気(空気)を用いた雰囲気を意味する。
前記酸化雰囲気とは、窒素又はアルゴン等の不活性雰囲気中に酸素を1vol%〜21vol%含む雰囲気を意味し、酸素を1vol%〜5vol%含む雰囲気が好ましい。
前記不活性雰囲気とは、窒素又はアルゴンからなる雰囲気を意味する。
前記還元性雰囲気とは、例えば、窒素又はアルゴン等の不活性雰囲気中にCO、H2、H2S、SO2などを含む雰囲気を意味する。
【0026】
前記焼成は、焼成炉を用いて行うことが好ましい。前記焼成炉としては、特に制限はなく、目的に応じて適宜選択することができ、例えばロータリーキルン、流動床炉、トンネル炉、マッフル等のバッチ式炉、キュウポラ、ストーカー炉などが挙げられる。大気雰囲気下でも焼成できるので、例えばロータリーキルン炉等の普通に用いられている焼成炉を使用することができ、焼成炉の選択幅が広くなる。
前記焼成温度は、特に制限はなく、目的に応じて適宜選択できるが、大気雰囲気下では400℃以上、不活性雰囲気下では600℃以上、酸化雰囲気下では400℃以上であることがより好ましく、上限温度は1200℃以下であることが好ましい。
前記焼成温度が、400℃未満であると、例えばリチウムイオン二次電池の正極の結晶構造を破壊できないために、リチウムを溶出できないことがあり、1,200℃を超えると、多大なエネルギーを必要とすると共に、焼成物が焼結するため、粉砕工程が必要となることがある。
【0027】
前記リチウムの精製と濃縮を同時に行う際の電極間に印加する電流密度は、5A/m2から500A/m2が好ましく、10A/m2から300A/m2がより好ましい。5A/m2より低くなると、リチウムイオンの泳動に時間がかかることがあり、500A/m2以上となると、水素や酸素の発生に多くのエネルギーが使用されてしまうため効率が低下する。
【0028】
前記リチウムの精製と濃縮を同時に行う際の陽極と陰極の電極間の距離は、0.5cmから100cmの間隔であれば任意に設置できる。1cmから50cmがより好ましい。0.5cmより短いと短絡によるショートが起こる危険性があり、100cmより長いと電圧が上昇し、消費電力が高くなることから経済的でない。
【0029】
(炭酸リチウムの回収方法)
炭酸リチウムを回収する際には、本発明の前記リチウムの精製および濃縮を同時に行う方法にて濃縮、精製した液を用いることができる。
前記炭酸リチウムの回収方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば(1)液を自然乾燥する方法、(2)加熱により乾燥固化する方法、(3)炭酸を吹き込みながら晶析させる方法、(4)炭酸塩により沈殿分離する方法、などが挙げられ、炭酸リチウムとして回収できる。
特に、(3)の方法が好ましく、本発明の方法で精製濃縮した液をpHが5〜9の範囲まで炭酸を吹き込み、炭酸リチウムとして析出させることができる。pHが5未満となると析出する炭酸リチウムの量が減少する可能性があり、pH9を超えると、炭酸が不足している可能性がある。また、炭酸リチウムは高温であるほど水への溶解度が低いため、加温することが望ましい。加温の温度は80℃から100℃が好ましい。80℃未満であると炭酸リチウムの収量が低下する。
【0030】
前記リチウムの回収方法は、リチウムイオン二次電池の正極材料を含む焼成物からリチウムを浸出させた液を原液とし、本発明の精製および濃縮方法を用いて溶液中の不純物を分離しつつ、リチウムを濃縮させ、得られた濃縮液を上述の炭酸リチウムを晶析する工程にて効率よくリチウムを回収することができ、リチウムイオン二次電池のリサイクルを図ることができる。
【実施例】
【0031】
以下、本発明の実施例を説明するが、本発明は、これらの実施例に何ら限定されるものではない。
【0032】
<リチウム電池正極材料の分離>
市販のパソコン用リチウムイオン二次電池(正極がコバルト、マンガン、ニッケルの酸化物から成る三元系正極材、負極に黒鉛を使用)を、700℃、空気雰囲気で一時間焼成し、得られた焼成物をハンマークラッシャーで破砕した。破砕物を試験用篩にて篩分けを行い。篩目開き1mm以下の正極材粉を得た。焼成はボックス炉(KOYO LINDBERG社製)にて行った。
【0033】
<リチウム溶解液の作成>
得られた正極材料30kgを100Lの水に浸漬させ、リチウムイオンが溶解した溶液を得た。溶解液の組成を表1に示す。
【0034】
【表1】

【0035】
<溶液中のリチウムの分析>
溶液中のリチウム濃度については、高周波プラズマ発光分光分析装置(日本ジャーレル・アッシュ株式会社製、iCAP−6300)により分析し、リチウム濃度を算出した。
【0036】
<溶液中のフッ素、硫酸の分析>
溶液中のフッ素、硫酸濃度については、イオンクロマトグラフィー(ダイオネクス社製、)により分析し、濃度を算出した。
【0037】
[実施例1]
図3に示すようなリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。
通液性隔壁として陽極と陰極間を隔てる膜はポリプロピレン製のろ布(敷島カンバス株式会社製、P91C)を用いた。膜4枚を用いて、電解槽を5室に仕切り、両端の室をそれぞれ陰極室、陽極室とし、それぞれの電極を配置した。陽極は酸化チタンに白金をコーティングした電極、陰極はチタン電極を用いた。電極間距離は24cmであった。
まず、電解槽のLi溶解原液供給室に25リットル(lと表す。)の原液を注入し、両極間に5Aの直流電流(電圧は8ボルト)を16時間通電し、隔膜で仕切られた各室にリチウムイオンの濃度勾配をつくった。その後、5Aの電流を保持したまま、原液を図3に示すNo.3室に26ml/minで供給し、陰極室であるNo.5室からリチウム濃縮液を13ml/minで回収し、陽極室であるNo.1室からフッ素、硫酸イオンの濃縮液を13ml/minで系外へ排出する操作を連続的に行った。このときの槽内の液滞留時間は16時間であった。
時間経過に伴う各室のリチウム、フッ素、硫酸イオン濃度を記録した。その結果を表2に示す。また、各室のNo.は図3に示したNo.で表記した。
【0038】
【表2】

【0039】
表2の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度をそれぞれ図4から図6に示した。連続通液開始から48時間が経過しても、陽極側のNo.1室と陰極側のNo.5室のイオンの濃度差は維持されていた。このことから、濃縮液を一定の液質で得ることができ、液の供給と抜き出しを連続的に実施できることを示している。
【0040】
[実施例2]
図7に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。通液性隔壁として隔膜を図7のように略平行に6枚用い、隔膜により仕切られた部屋を7つとし、原液供給をNo.4室、リチウム濃縮液の回収をNo.7室(陰極室)とした以外は、実施例1と同様の条件で試験を行った。
その結果を表3に示す。また、各室のNo.は図7に示したNo.で表記した。
【0041】
【表3】

【0042】
表3の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度をそれぞれ図8から図10に示した。連続通液開始から48時間が経過しても、陰極と陽極のイオンの濃度勾配は維持されていた。このことから、濃縮液を一定の液質で得ることができ、液の供給と抜き出しを連続的に実施できることを示している。
【0043】
[実施例3]
図11に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。電解槽の仕切りを通液性隔壁の膜2枚を用いて、電解槽を3室に仕切って行った以外は実施例1と同様の条件で試験した。時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度を記録した。その結果を表4に示す。また、各室のNo.は図11に示したNo.で表記した。
【0044】
【表4】

【0045】
表4の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度を図12から図14に示した。通液初期である8時間通水時点では、No.3室(陰極室)にリチウムが濃縮され、No.1室(陽極室)にフッ素、硫酸イオンが濃縮された状態ではあったが、実施例1および2と比較して濃度差は小さかった。さらに連続通液を継続したところ、形成されていた濃度勾配が時間経過に伴って無くなり、各室ともに原液に近い濃度に徐々に近づく結果となった。これより、濃縮液を一定の液質で得る効果はあるが、実施例1、2よりは効果が少ないことがわかる。
【0046】
[比較例1]
図15に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。通液性隔壁は用いず、隔膜により陰極室と陽極室を仕切らなかった以外は、実施例1と同様の条件で試験を行った。
その結果を表5に示す。
【0047】
【表5】

【0048】
表5の結果から、通液性隔壁により陰極室と陽極室を仕切らなかった場合には、濃度の勾配ができず、濃縮と精製ができないことが確認された。
【0049】
[比較例2]
図16に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。通液性隔壁として隔膜を図16のように1枚用い、隔膜により仕切られた部屋を2つとし、原液供給をNo.1室、リチウム濃縮液の回収をNo.2室(陰極室)とした以外は、実施例1と同様の条件で試験を行った。
その結果を表6に示す。また、各室のNo.は図16に示したNo.で表記した。
【0050】
【表6】

【0051】
表6の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度をそれぞれ図17から図19に示した。連続通液開始から時間が経過するに伴って、陰極室と陽極室のイオンの濃度勾配は減少していた。特に回収対象であるリチウムについては連続通液開始から48時間の時点では陰極室と陽極室の濃度勾配は実施例1から3と比較して大きく減少していた。このことは、濃縮液を連続的に一定の液質で得ることができないことを示している。
【0052】
[比較例3]
図20に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。原液供給をNo.2室とした以外は、比較例2と同様の条件で試験を行った。
その結果を表7に示す。また、各室のNo.は図20に示したNo.で表記した。
【0053】
【表7】

【0054】
表7の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度をそれぞれ図21から図23に示した。連続通液開始から時間が経過するに伴って、陰極室と陽極室のイオンの濃度勾配は減少していた。特に回収対象であるリチウムについては連続通液開始から48時間の時点では陰極室と陽極室の濃度勾配は実施例1から3と比較して大きく減少していた。このことは、濃縮液を連続的に一定の液質で得ることができないことを示している。
【0055】
[比較例4]
図24に示すリチウムの精製、濃縮用の試験電解槽を用いて、以下のようにして精製、濃縮を行う連続系の試験を行った。まず、比較例2、3で用いたものと同様の構造で、容量が半分である電解槽を二槽準備し、直列に配置して連続通水を行える仕様とした。各電解槽のLi溶解原液供給室にそれぞれ12.5lの原液を注入し、両極間に2.5Aの直流電流(電圧は8ボルト)を16時間通電し、隔膜で仕切られた各室にリチウムイオンの濃度勾配をつくった。その後、各電極間で2.5Aの電流を保持したまま、原液を図24に示すNo.1室に26ml/minで供給し、陰極室であるNo.2室からリチウム濃縮液を19.5ml/minで回収した濃縮液を2槽目の陽極室であるNo.3室へ供給し、1槽目の陽極室であるNo.1室からフッ素、硫酸イオンの濃縮液を6.5ml/minで、2槽目の陽極室であるNo.4室からフッ素、硫酸イオンの濃縮液を13ml/min系外へ排出する操作を連続的に行った。このときの槽内の液滞留時間は各槽で8時間であった。この比較例4の装置にかかる消費電力は実施例1とほぼ同じであり、濃縮液の回収量も同じとなるようにした。
時間経過に伴う各室のリチウム、フッ素、硫酸イオン濃度を記録した。その結果を表8に示す。また、各室のNo.は図24に示したNo.で表記した。
【0056】
【表8】

【0057】
表8の結果について、時間経過に伴う各室のリチウム、フッ素、硫酸の各イオン濃度をそれぞれ図25から図27に示した。連続通液開始から時間が経過するに伴って、陰極室と陽極室のイオンの濃度勾配はともに減少していた。特に回収対象であるリチウムについては連続通液開始から48時間の時点ではNo.1室(陰極室)とNo.4室(陽極室)の濃度勾配は実施例1から3と比較して大きく減少していた。この比較例4で示す装置は、原液を供給する槽とリチウム濃縮液を回収する槽間を仕切る隔壁の数が実施例1と同数であり、消費電力も同じであるが、実施例1の方が、濃縮効率が良いことが分かる。さらに比較例4のような構造では電流を流すための整流器や送液のためのポンプ、電極等の装置が複数必要となることから、経済的でない。
【産業上の利用可能性】
【0058】
本発明のリチウムの精製および濃縮を連続的に行う回収方法は、従来と比較して効率的にリチウムを精製、濃縮でき、従来実現できていなかった連続的な処理を可能とするため、低コストかつ効率的な回収方法でリチウムイオン二次電池の再利用を図ることができる。
【符号の説明】
【0059】
1 陽極
2 陰極
3 隔膜(通液性隔壁)
4 電解槽本体
5 直流電源
【特許請求の範囲】
【請求項1】
電解槽に供給されるLi溶解原液中の陽イオン、陰イオンを該電解槽への直流電流の通電によりそれぞれ陰極側、陽極側へ泳動させてLi濃度の異なる溶液を回収するLi溶液回収装置であって、
前記電解槽は、通液性隔壁により仕切られてLi溶解原液供給室、陽極室及び陰極室を有し、該Li溶解原液供給室は該陽極室と該陰極室の間に位置し、該陽極室、該陰極室にはそれぞれ不溶性陽極、陰極が配置され、
前記Li溶解原液を前記Li溶解原液供給室に供給する供給手段と、前記陽極室、前記陰極室からそれぞれLi濃度の異なる溶液を回収する回収手段と、を有するLi溶液回収装置。
【請求項2】
前記電解槽は前記通液性隔壁により5室〜10室に仕切られている、請求項1に記載のLi溶液回収装置。
【請求項3】
前記陰極室が前記Li溶解原液供給室と該陰極室とを仕切る前記通液性隔壁に略平行な通液性隔壁により複数の陰極室に仕切られる、請求項1または2に記載のLi溶液回収装置。
【請求項4】
前記陽極室が前記Li溶解原液供給室と該陽極室とを仕切る前記通液性隔壁に略平行な通液性隔壁により複数の陽極室に仕切られる、請求項1〜3のいずれかに記載のLi溶液回収装置。
【請求項5】
前記陰イオンが、フッ素イオン、硫酸イオンの少なくとも一種を含む、請求項1〜4のいずれかに記載のLi溶液回収装置。
【請求項6】
前記Li溶解原液が、廃リチウムイオン電池を焼成し、リチウムをリチウム陽イオンとして溶解させた液である、請求項1〜5のいずれかに記載のLi溶液回収装置。
【請求項7】
前記通液性隔壁の通気度が10〜1000cm3/cm2・分である、請求項1〜6のいずれかに記載のLi溶液回収装置。
【請求項8】
請求項1〜7のいずれかに記載のLi溶液回収装置を用いて、前記Li溶解原液供給室にLi溶解原液を供給し、前記電解槽へ直流電流を通電して、前記陽極室、前記陰極室からそれぞれLi濃度の異なる溶液を回収するLi溶液回収方法。
【請求項9】
請求項1〜7のいずれかに記載のLi溶液回収装置を用いて、前記Li溶解原液供給室にLi溶解原液を連続的に供給し、前記電解槽へ直流電流を通電して、前記陽極室、前記陰極室からそれぞれLi濃度の異なる溶液を連続的に回収するLi溶液回収方法。
【請求項1】
電解槽に供給されるLi溶解原液中の陽イオン、陰イオンを該電解槽への直流電流の通電によりそれぞれ陰極側、陽極側へ泳動させてLi濃度の異なる溶液を回収するLi溶液回収装置であって、
前記電解槽は、通液性隔壁により仕切られてLi溶解原液供給室、陽極室及び陰極室を有し、該Li溶解原液供給室は該陽極室と該陰極室の間に位置し、該陽極室、該陰極室にはそれぞれ不溶性陽極、陰極が配置され、
前記Li溶解原液を前記Li溶解原液供給室に供給する供給手段と、前記陽極室、前記陰極室からそれぞれLi濃度の異なる溶液を回収する回収手段と、を有するLi溶液回収装置。
【請求項2】
前記電解槽は前記通液性隔壁により5室〜10室に仕切られている、請求項1に記載のLi溶液回収装置。
【請求項3】
前記陰極室が前記Li溶解原液供給室と該陰極室とを仕切る前記通液性隔壁に略平行な通液性隔壁により複数の陰極室に仕切られる、請求項1または2に記載のLi溶液回収装置。
【請求項4】
前記陽極室が前記Li溶解原液供給室と該陽極室とを仕切る前記通液性隔壁に略平行な通液性隔壁により複数の陽極室に仕切られる、請求項1〜3のいずれかに記載のLi溶液回収装置。
【請求項5】
前記陰イオンが、フッ素イオン、硫酸イオンの少なくとも一種を含む、請求項1〜4のいずれかに記載のLi溶液回収装置。
【請求項6】
前記Li溶解原液が、廃リチウムイオン電池を焼成し、リチウムをリチウム陽イオンとして溶解させた液である、請求項1〜5のいずれかに記載のLi溶液回収装置。
【請求項7】
前記通液性隔壁の通気度が10〜1000cm3/cm2・分である、請求項1〜6のいずれかに記載のLi溶液回収装置。
【請求項8】
請求項1〜7のいずれかに記載のLi溶液回収装置を用いて、前記Li溶解原液供給室にLi溶解原液を供給し、前記電解槽へ直流電流を通電して、前記陽極室、前記陰極室からそれぞれLi濃度の異なる溶液を回収するLi溶液回収方法。
【請求項9】
請求項1〜7のいずれかに記載のLi溶液回収装置を用いて、前記Li溶解原液供給室にLi溶解原液を連続的に供給し、前記電解槽へ直流電流を通電して、前記陽極室、前記陰極室からそれぞれLi濃度の異なる溶液を連続的に回収するLi溶液回収方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【公開番号】特開2012−200666(P2012−200666A)
【公開日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願番号】特願2011−67060(P2011−67060)
【出願日】平成23年3月25日(2011.3.25)
【出願人】(506347517)DOWAエコシステム株式会社 (83)
【Fターム(参考)】
【公開日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願日】平成23年3月25日(2011.3.25)
【出願人】(506347517)DOWAエコシステム株式会社 (83)
【Fターム(参考)】
[ Back to top ]

