M−CSFに対する抗体
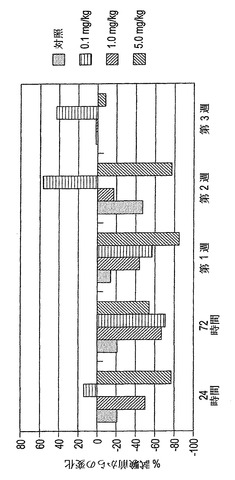
【課題】ヒトM−CSFに特異的に結合し、またM−CSFアンタゴニストとして作用する、単離されたヒト抗体もしくはこの抗原結合部分、およびこのような抗体または抗原結合部分を含む組成物の提供。
【解決手段】M−CSF、好ましくはヒトM−CSFに特異的に結合し、またM−CSFを阻害するように機能する抗体、およびこの抗原結合部分、ヒト抗M−CSF抗体、およびこの抗原結合部分、さらにこのような抗体または抗原結合部分を含む組成物、このような組成物を構成する化合物をコードする核酸分子の提供。ヒト抗M−CSF抗体、このような抗体を含む組成物を作製する方法、ならびに抗体および組成物を診断および治療に使用する方法、該ヒト抗M−CSF抗体を含む、重鎖および/または軽鎖の免疫グロブリン分子をコードする核酸分子を用いる遺伝子治療法等の提供。
【解決手段】M−CSF、好ましくはヒトM−CSFに特異的に結合し、またM−CSFを阻害するように機能する抗体、およびこの抗原結合部分、ヒト抗M−CSF抗体、およびこの抗原結合部分、さらにこのような抗体または抗原結合部分を含む組成物、このような組成物を構成する化合物をコードする核酸分子の提供。ヒト抗M−CSF抗体、このような抗体を含む組成物を作製する方法、ならびに抗体および組成物を診断および治療に使用する方法、該ヒト抗M−CSF抗体を含む、重鎖および/または軽鎖の免疫グロブリン分子をコードする核酸分子を用いる遺伝子治療法等の提供。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
M-CSFに特異的に結合するヒトモノクローナル抗体、またはこの抗原結合部分。
【請求項2】
以下の少なくとも1つの特性を有する、請求項1記載のヒトモノクローナル抗体、または抗原結合部分:
(a)ヒトの分泌型のアイソタイプM-CSF、および膜結合型のアイソタイプM-CSFに結合すること;
(b)GM-CSFもしくはG-CSFに対する選択性より少なくとも100倍大きいM-CSFに対する選択性を有すること;
(c)1.0×10-7 Mもしくはそれ以下のKDでM-CSFに結合すること;
(d)2.0×10-4 s-1もしくはそれ以下のM-CSFに対する解離定数(koff)を有すること;または
(e)ヒトのc-fmsの存在下でヒトM-CSFに結合すること。
【請求項3】
抗体もしくは断片が、c-fmsへの結合をブロックし、かつ1.0×10-7 Mまたはそれ以下のKDでM-CSFに結合する、請求項2記載のヒトのモノクローナル抗体または部分。
【請求項4】
M-CSFに特異的に結合するヒトモノクローナル抗体8.10.3Fまたはこの抗原結合部分。
【請求項5】
M-CSFに特異的に結合するヒトモノクローナル抗体9.14.4Iまたはこの抗原結合部分。
【請求項6】
以下からなる群より選択される少なくとも1つの特性を有する、ヒトM-CSFに特異的に結合してこれを阻害するヒト化抗体、キメラ抗体、もしくはヒトモノクローナル抗体、またはこの抗原結合部分:
(a)M-CSFに対する結合をめぐって、抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、8.10.3-CG2抗体、9.7.2-CG2抗体、9.7.2-CG4抗体、9.14.4-CG2抗体、9.14.4-CG4抗体、9.14.4-Ser抗体、9.7.2-Ser抗体、8.10.3-Ser抗体、8.10.3-CG4抗体、8.10.3FG1抗体、および9.14.4G1抗体からなる群より選択される抗体とクロス競合すること;
(b)M-CSFに対する結合をめぐって、252、88、100、3.8.3、2.7.3、1.120.1、9.14.4I、8.10.3F、9.7.2IF、9.14.4、8.10.3、9.7.2、9.7.2C-Ser、9.14.4C-Ser、8.10.3C-Ser、8.10.3-CG2、9.7.2-CG2、9.7.2-CG4、9.14.4-CG2、9.14.4-CG4、9.14.4-Ser、9.7.2-Ser、8.10.3-Ser、8.10.3-CG4、8.10.3FG1および9.14.4G1からなる群より選択される抗体と競合すること;
(c)抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体と同じM-CSFのエピトープと結合すること;
(d)抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体と実質的に同じKDでM-CSFに結合すること;ならびに
(e)抗体252、抗体88、抗体100、抗体3.8.3、2.7.3、1.120.1、9.14.4I、8.10.3F、9.7.2IF、9.14.4、8.10.3、9.7.2、9.7.2C-Ser、9.14.4C-Ser、8.10.3C-Ser、8.10.3-CG2、9.7.2-CG2、9.7.2-CG4、9.14.4-CG2、9.14.4-CG4、9.14.4-Ser、9.7.2-Ser、8.10.3-Ser、8.10.3-CG4、8.10.3FG1および9.14.4G1からなる群より選択される抗体と実質的に同じ解離速度でM-CSFに結合すること。
【請求項7】
以下からなる群より選択される、M-CSFに特異的に結合するモノクローナル抗体:
(a)シグナル配列を含まない、SEQ ID NO:2に記載された重鎖のアミノ酸配列、およびSEQ ID NO:4に記載された軽鎖のアミノ酸配列を含む抗体;
(b)シグナル配列を含まない、SEQ ID NO:6に記載された重鎖のアミノ酸配列、およびSEQ ID NO:8に記載された軽鎖のアミノ酸配列を含む抗体;
(c)シグナル配列を含まない、SEQ ID NO:10に記載された重鎖のアミノ酸配列、およびSEQ ID NO:12に記載された軽鎖のアミノ酸配列を含む抗体;
(d)シグナル配列を含まない、SEQ ID NO:14に記載された重鎖のアミノ酸配列、およびSEQ ID NO:16に記載された軽鎖のアミノ酸配列を含む抗体;
(e)シグナル配列を含まない、SEQ ID NO:18に記載された重鎖のアミノ酸配列、およびにSEQ ID NO:20記載された軽鎖のアミノ酸配列を含む抗体;
(f)シグナル配列を含まない、SEQ ID NO:22に記載された重鎖のアミノ酸配列、およびSEQ ID NO:24に記載された軽鎖のアミノ酸配列を含む抗体;
(g)シグナル配列を含まない、SEQ ID NO:26に記載された重鎖のアミノ酸配列、およびSEQ ID NO:28に記載された軽鎖のアミノ酸配列を含む抗体;
(h)シグナル配列を含まない、SEQ ID NO:38に記載された重鎖のアミノ酸配列、およびSEQ ID NO:28に記載された軽鎖のアミノ酸配列を含む抗体;
(i)シグナル配列を含まない、SEQ ID NO:54に記載された重鎖のアミノ酸配列、およびSEQ ID NO:56に記載された軽鎖のアミノ酸配列を含む抗体;
(j)シグナル配列を含まない、SEQ ID NO:74に記載された重鎖のアミノ酸配列、およびSEQ ID NO:56に記載された軽鎖のアミノ酸配列を含む抗体;
(k)シグナル配列を含まない、SEQ ID NO:78に記載された重鎖のアミノ酸配列、およびSEQ ID NO:56に記載された軽鎖のアミノ酸配列を含む抗体;
(l)シグナル配列を含まない、SEQ ID NO:82に記載された重鎖のアミノ酸配列、およびSEQ ID NO:28に記載された軽鎖のアミノ酸配列を含む抗体;
(m)シグナル配列を含まない、SEQ ID NO:102に記載された重鎖のアミノ酸配列、およびSEQ ID NO:28に記載された軽鎖のアミノ酸配列を含む抗体;
(n)シグナル配列を含まない、SEQ ID NO:30に記載された重鎖のアミノ酸配列、およびSEQ ID NO:32に記載された軽鎖のアミノ酸配列を含む抗体;
(o)シグナル配列を含まない、SEQ ID NO:30に記載された重鎖のアミノ酸配列、およびSEQ ID NO:44に記載された軽鎖のアミノ酸配列を含む抗体;
(p)シグナル配列を含まない、SEQ ID NO:58に記載された重鎖のアミノ酸配列、およびSEQ ID NO:60に記載された軽鎖のアミノ酸配列を含む抗体;
(q)シグナル配列を含まない、SEQ ID NO:62に記載された重鎖のアミノ酸配列、およびSEQ ID NO:60に記載された軽鎖のアミノ酸配列を含む抗体;
(r)シグナル配列を含まない、SEQ ID NO:90に記載された重鎖のアミノ酸配列、およびSEQ ID NO:44に記載された軽鎖のアミノ酸配列を含む抗体;
(s)シグナル配列を含まない、SEQ ID NO:94に記載された重鎖のアミノ酸配列、およびSEQ ID NO:60に記載された軽鎖のアミノ酸配列を含む抗体;
(t)シグナル配列を含まない、SEQ ID NO:98に記載された重鎖のアミノ酸配列、およびSEQ ID NO:32に記載された軽鎖のアミノ酸配列を含む抗体;
(u)シグナル配列を含まない、SEQ ID NO:34に記載された重鎖のアミノ酸配列、およびSEQ ID NO:36に記載された軽鎖のアミノ酸配列を含む抗体;
(v)シグナル配列を含まない、SEQ ID NO:46に記載された重鎖のアミノ酸配列、およびSEQ ID NO:48に記載された軽鎖のアミノ酸配列を含む抗体;
(w)シグナル配列を含まない、SEQ ID NO:50に記載された重鎖のアミノ酸配列、およびSEQ ID NO:52に記載された軽鎖のアミノ酸配列を含む抗体;
(x)シグナル配列を含まない、SEQ ID NO:66に記載された重鎖のアミノ酸配列、およびSEQ ID NO:52に記載された軽鎖のアミノ酸配列を含む抗体;
(y)シグナル配列を含まない、SEQ ID NO:70に記載された重鎖のアミノ酸配列、およびSEQ ID NO:52に記載された軽鎖のアミノ酸配列を含む抗体;ならびに
(z)シグナル配列を含まない、SEQ ID NO:86に記載された重鎖のアミノ酸配列、およびSEQ ID NO:48に記載された軽鎖のアミノ酸配列を含む抗体。
【請求項8】
以下を含む、請求項1記載のヒトモノクローナル抗体、またはこの抗原結合部分:
(a)モノクローナル抗体252、モノクローナル抗体88、モノクローナル抗体100、モノクローナル抗体3.8.3、モノクローナル抗体2.7.3、モノクローナル抗体1.120.1、モノクローナル抗体9.14.4I、モノクローナル抗体8.10.3F、モノクローナル抗体9.7.2IF、モノクローナル抗体9.14.4、モノクローナル抗体8.10.3、モノクローナル抗体9.7.2、モノクローナル抗体9.7.2C-Ser、モノクローナル抗体9.14.4C-Ser、モノクローナル抗体8.10.3C-Ser、モノクローナル抗体8.10.3-CG2、モノクローナル抗体9.7.2-CG2、モノクローナル抗体9.7.2-CG4、モノクローナル抗体9.14.4-CG2、モノクローナル抗体9.14.4-CG4、モノクローナル抗体9.14.4-Ser、モノクローナル抗体9.7.2-Ser、モノクローナル抗体8.10.3-Ser、モノクローナル抗体8.10.3-CG4、モノクローナル抗体8.10.3FG1、およびモノクローナル抗体9.14.4G1からなる群より選択される抗体の重鎖から独立に選択される重鎖のCDR1、CDR2、およびCDR3;または
(b)モノクローナル抗体252、モノクローナル抗体88、モノクローナル抗体100、モノクローナル抗体3.8.3、モノクローナル抗体2.7.3、モノクローナル抗体1.120.1、モノクローナル抗体9.14.4I、モノクローナル抗体8.10.3F、モノクローナル抗体9.7.2IF、モノクローナル抗体9.14.4、モノクローナル抗体8.10.3、モノクローナル抗体9.7.2、モノクローナル抗体9.7.2C-Ser、モノクローナル抗体9.14.4C-Ser、モノクローナル抗体8.10.3C-Ser、モノクローナル抗体8.10.3-CG2、モノクローナル抗体9.7.2-CG2、モノクローナル抗体9.7.2-CG4、モノクローナル抗体9.14.4-CG2、モノクローナル抗体9.14.4-CG4、モノクローナル抗体9.14.4-Ser、モノクローナル抗体9.7.2-Ser、モノクローナル抗体8.10.3-Ser、モノクローナル抗体8.10.3-CG4、モノクローナル抗体8.10.3FG1、およびモノクローナル抗体9.14.4G1からなる群より選択される抗体の軽鎖から独立に選択される軽鎖のCDR1、CDR2、およびCDR3。
【請求項9】
以下である、M-CSFに特異的に結合するモノクローナル抗体、またはこの抗原結合部分:
(a)重鎖が、抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体の重鎖のCDR1、CDR2、およびCDR3を含み;
(b)軽鎖が、抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体の重鎖のCDR1、CDR2、およびCDR3を含み;
(c)抗体が、(a)の重鎖、および(b)の軽鎖を含み;または
(d)重鎖および軽鎖のCDRのアミノ酸配列が、同じ抗体から選択される、(c)の抗体。
【請求項10】
抗体が以下を含む、M-CSFに特異的に結合するモノクローナル抗体、またはこの抗原結合部分:
(a)抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および9.14.4G1からなる群より選択される抗体の重鎖のCDR1の開始部位〜CDR3の末端のアミノ酸配列を含む重鎖;
(b)抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体のCDR1の開始部位〜CDR3の末端のアミノ酸配列を含む軽鎖;
(c)(a)の重鎖、および(b)の軽鎖;または
(d)同じ抗体から選択される(a)の重鎖、および(b)の軽鎖のアミノ酸配列。
【請求項11】
以下を含む、請求項10記載のモノクローナル抗体または抗原結合部分:
(a)シグナル配列を含まない、抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体の重鎖の可変ドメイン(VH)のアミノ酸配列;
(b)シグナル配列を含まない、抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体の軽鎖の可変ドメイン(VL)のアミノ酸配列;
(c)(a)のVHのアミノ酸配列、および(b)のVLのアミノ酸配列;または
(d)VHとVLが同じ抗体に由来する、(a)のVHのアミノ酸配列、および(b)のVLのアミノ酸配列。
【請求項12】
以下からなる群より選択されるポリペプチド:
(a)シグナル配列を含まない、SEQ ID NO:2のアミノ酸配列を含むポリペプチド;
(b)シグナル配列を含まない、SEQ ID NO:6のアミノ酸配列を含むポリペプチド;
(c)シグナル配列を含まない、SEQ ID NO:10のアミノ酸配列を含むポリペプチド;
(d)シグナル配列を含まない、SEQ ID NO:14のアミノ酸配列を含むポリペプチド;
(e)シグナル配列を含まない、SEQ ID NO:18のアミノ酸配列を含むポリペプチド;
(f)シグナル配列を含まない、SEQ ID NO:22のアミノ酸配列を含むポリペプチド;
(g)シグナル配列を含まない、SEQ ID NO:26のアミノ酸配列を含むポリペプチド;
(h)シグナル配列を含まない、SEQ ID NO:30のアミノ酸配列を含むポリペプチド;
(i)シグナル配列を含まない、SEQ ID NO:34のアミノ酸配列を含むポリペプチド;
(j)シグナル配列を含まない、SEQ ID NO:38のアミノ酸配列を含むポリペプチド;
(k)シグナル配列を含まない、SEQ ID NO:46のアミノ酸配列を含むポリペプチド;
(l)シグナル配列を含まない、SEQ ID NO:50のアミノ酸配列を含むポリペプチド;
(m)シグナル配列を含まない、SEQ ID NO:54のアミノ酸配列を含むポリペプチド;
(n)シグナル配列を含まない、SEQ ID NO:58のアミノ酸配列を含むポリペプチド;
(o)シグナル配列を含まない、SEQ ID NO:62のアミノ酸配列を含むポリペプチド;
(p)シグナル配列を含まない、SEQ ID NO:66のアミノ酸配列を含むポリペプチド;
(q)シグナル配列を含まない、SEQ ID NO:70のアミノ酸配列を含むポリペプチド;
(r)シグナル配列を含まない、SEQ ID NO:74のアミノ酸配列を含むポリペプチド;
(s)シグナル配列を含まない、SEQ ID NO:78のアミノ酸配列を含むポリペプチド;
(t)シグナル配列を含まない、SEQ ID NO:82のアミノ酸配列を含むポリペプチド;
(u)シグナル配列を含まない、SEQ ID NO:86のアミノ酸配列を含むポリペプチド;
(v)シグナル配列を含まない、SEQ ID NO:90のアミノ酸配列を含むポリペプチド;
(w)シグナル配列を含まない、SEQ ID NO:94のアミノ酸配列を含むポリペプチド;
(x)シグナル配列を含まない、SEQ ID NO:98のアミノ酸配列を含むポリペプチド;および
(y)シグナル配列を含まない、SEQ ID NO:102のアミノ酸配列を含むポリペプチド。
【請求項13】
シグナル配列を含まない、SEQ ID NO:30のアミノ酸配列を含む、請求項12記載のポリペプチド。
【請求項14】
シグナル配列を含まない、SEQ ID NO:26のアミノ酸配列を含む、請求項12記載のポリペプチド。
【請求項15】
以下からなる群より選択されるポリペプチド:
(a)シグナル配列を含まない、SEQ ID NO:4のアミノ酸配列を含むポリペプチド;
(b)シグナル配列を含まない、SEQ ID NO:8のアミノ酸配列を含むポリペプチド;
(c)シグナル配列を含まない、SEQ ID NO:12のアミノ酸配列を含むポリペプチド;
(d)シグナル配列を含まない、SEQ ID NO:16のアミノ酸配列を含むポリペプチド;
(e)シグナル配列を含まない、SEQ ID NO:20のアミノ酸配列を含むポリペプチド;
(f)シグナル配列を含まない、SEQ ID NO:24のアミノ酸配列を含むポリペプチド;
(g)シグナル配列を含まない、SEQ ID NO:28のアミノ酸配列を含むポリペプチド;
(h)シグナル配列を含まない、SEQ ID NO:32のアミノ酸配列を含むポリペプチド;
(i)シグナル配列を含まない、SEQ ID NO:36のアミノ酸配列を含むポリペプチド;
(j)シグナル配列を含まない、SEQ ID NO:44のアミノ酸配列を含むポリペプチド;
(k)シグナル配列を含まない、SEQ ID NO:48のアミノ酸配列を含むポリペプチド、
(l)シグナル配列を含まない、SEQ ID NO:52のアミノ酸配列を含むポリペプチド;
(m)シグナル配列を含まない、SEQ ID NO:56のアミノ酸配列を含むポリペプチド;および
(n)シグナル配列を含まない、SEQ ID NO:60のアミノ酸配列を含むポリペプチド。
【請求項16】
シグナル配列を含まない、SEQ ID NO:32のアミノ酸配列を含む、請求項15記載のポリペプチド。
【請求項17】
シグナル配列を含まない、SEQ ID NO:28のアミノ酸配列を含む、請求項15記載のポリペプチド。
【請求項18】
抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体のFR1、FR2、FR3、もしくはF4のアミノ酸配列の1つもしくは複数を含む、M-CSFに特異的に結合するモノクローナル抗体、またはこの抗原結合部分。
【請求項19】
以下を含む、請求項1記載のヒトモノクローナル抗体:
(a)シグナル配列を含まない、モノクローナル抗体252、モノクローナル抗体88、モノクローナル抗体100、モノクローナル抗体3.8.3、モノクローナル抗体2.7.3、モノクローナル抗体1.120.1、モノクローナル抗体9.14.4I、モノクローナル抗体8.10.3F、モノクローナル抗体9.7.2IF、モノクローナル抗体9.14.4、モノクローナル抗体8.10.3、モノクローナル抗体9.7.2、モノクローナル抗体9.7.2C-Ser、モノクローナル抗体9.14.4C-Ser、モノクローナル抗体8.10.3C-Ser、モノクローナル抗体8.10.3-CG2、モノクローナル抗体9.7.2-CG2、モノクローナル抗体9.7.2-CG4、モノクローナル抗体9.14.4-CG2、モノクローナル抗体9.14.4-CG4、モノクローナル抗体9.14.4-Ser、モノクローナル抗体9.7.2-Ser、モノクローナル抗体8.10.3-Ser、モノクローナル抗体8.10.3-CG4、モノクローナル抗体8.10.3FG1、もしくはモノクローナル抗体9.14.4G1の重鎖のアミノ酸配列と少なくとも90%が同一な重鎖のアミノ酸配列;
(b)シグナル配列を含まない、モノクローナル抗体252、モノクローナル抗体88、モノクローナル抗体100、モノクローナル抗体3.8.3、モノクローナル抗体2.7.3、モノクローナル抗体1.120.1、モノクローナル抗体9.14.4I、モノクローナル抗体8.10.3F、モノクローナル抗体9.7.2IF、モノクローナル抗体9.14.4、モノクローナル抗体8.10.3、モノクローナル抗体9.7.2、モノクローナル抗体9.7.2C-Ser、モノクローナル抗体9.14.4C-Ser、モノクローナル抗体8.10.3C-Ser、モノクローナル抗体8.10.3-CG2、モノクローナル抗体9.7.2-CG2、モノクローナル抗体9.7.2-CG4、モノクローナル抗体9.14.4-CG2、モノクローナル抗体9.14.4-CG4、モノクローナル抗体9.14.4-Ser、モノクローナル抗体9.7.2-Ser、モノクローナル抗体8.10.3-Ser、モノクローナル抗体8.10.3-CG4、モノクローナル抗体8.10.3FG1、もしくはモノクローナル抗体9.14.4G1の軽鎖のアミノ酸配列と少なくとも90%が同一な軽鎖のアミノ酸配列;または
(c)(a)の重鎖のアミノ酸配列、および(b)の軽鎖のアミノ酸配列。
【請求項20】
抗体または抗原結合部分の重鎖のC末端のリシンが存在しない、請求項1〜19〜のいずれか一項記載の、モノクローナル抗体または抗原結合部分。
【請求項21】
請求項1〜20のいずれか一項記載の抗体または抗原結合部分、および薬学的に許容される担体を含む薬学的組成物。
【請求項22】
抗体が、モノクローナルの抗M-CSF抗体9.14.4Iまたは8.10.3Fである、請求項21記載の薬学的組成物。
【請求項23】
治療を必要とする被験対象に、請求項1〜20のいずれか一項記載の治療的有効量の抗体もしくはこの抗原結合部分、または抗体もしくは抗体部分がM-CSFを阻害する、請求項21〜22のいずれか一項記載の薬学的組成物を投与する段階を含む、ヒトを含む被験対象における関節炎、乾癬性関節炎、強直性脊椎炎、ライター症候群、慢性関節リウマチ、痛風、外傷性関節炎、風疹性関節炎、および急性滑膜炎、ならびに他の関節炎条件、敗血症、敗血症性ショック、内毒素ショック、グラム陰性菌性敗血症、毒素ショック症候群、アルツハイマー病、卒中、神経外傷、喘息、成人呼吸窮迫症候群、脳性マラリア、慢性肺炎、珪肺症、肺サルコイドーシス、骨吸収疾患、骨粗鬆症、再狭窄、心臓および腎臓の再灌流傷害、血栓症、糸球体腎炎、糖尿病、移植片対宿主反応、同種移植拒絶反応、炎症性腸疾患、クローン病、潰瘍性大腸炎、多発性硬化症、筋肉変性、湿疹、接触皮膚炎、乾癬、日焼け、および結膜炎ショックからなる群より選択される状態を治療する方法。
【請求項24】
状態が慢性関節リウマチである、請求項23記載の方法。
【請求項25】
使用抗体がモノクローナルの抗M-CSF抗体8.10.3Fまたは9.14.4Iである、請求項23または24に記載の記載の方法。
【請求項26】
M-CSFのc-fmsへの結合を阻害する、請求項1〜20のいずれか一項記載の抗体もしくはこの抗原結合部分、または請求項21〜22のいずれか一項記載の薬学的組成物を被験対象に投与する段階を含む、ヒトを含む被験対象の肉腫、癌、またはリンパ腫などの固形腫瘍を治療する方法。
【請求項27】
請求項1〜20のいずれか一項記載の抗体もしくはこの抗原結合部分、または該抗体もしくは該抗原結合部分の重鎖もしくは軽鎖を産生する、単離された細胞系列。
【請求項28】
抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体、ならびに前記の抗体の一つと同じアミノ酸配列を有する抗体を産生する、請求項27記載の細胞系列。
【請求項29】
請求項1〜20のいずれか一項記載の抗体の重鎖もしくはこの抗原結合部分、または軽鎖もしくはこの抗原結合部分をコードするヌクレオチド配列を含む、単離された核酸分子。
【請求項30】
核酸分子に機能的に連結された発現制御配列を任意に含む、請求項29記載の核酸分子を含むベクター。
【請求項31】
請求項30記載のベクターまたは請求項29記載の核酸分子を含む宿主細胞。
【請求項32】
請求項1〜20のいずれか一項記載の抗体または抗原結合部分の重鎖をコードする核酸分子、および軽鎖をコードする核酸分子を含む、請求項31記載の宿主細胞。
【請求項33】
請求項32記載の宿主細胞、または請求項28記載の細胞系列を適切な条件で培養する段階、ならびに抗体または抗原結合部分を回収する段階を含む、抗M-CSF抗体またはこの抗原結合部分を作製する方法。
【請求項34】
以下の段階を含む、M-CSFに特異的に結合するヒトモノクローナル抗体を作製する方法:
(a)ヒト抗体を産生する能力を有する非ヒトトランスジェニック動物を、M-CSF、M-CSFの免疫原性部分、またはM-CSFを発現する細胞もしくは組織で免疫化する段階;
(b)トランスジェニック動物が、M-CSFに対する免疫応答を惹起可能とする段階;および
(c)トランスジェニック動物からBリンパ球を単離する段階。
【請求項1】
M-CSFに特異的に結合するヒトモノクローナル抗体、またはこの抗原結合部分。
【請求項2】
以下の少なくとも1つの特性を有する、請求項1記載のヒトモノクローナル抗体、または抗原結合部分:
(a)ヒトの分泌型のアイソタイプM-CSF、および膜結合型のアイソタイプM-CSFに結合すること;
(b)GM-CSFもしくはG-CSFに対する選択性より少なくとも100倍大きいM-CSFに対する選択性を有すること;
(c)1.0×10-7 Mもしくはそれ以下のKDでM-CSFに結合すること;
(d)2.0×10-4 s-1もしくはそれ以下のM-CSFに対する解離定数(koff)を有すること;または
(e)ヒトのc-fmsの存在下でヒトM-CSFに結合すること。
【請求項3】
抗体もしくは断片が、c-fmsへの結合をブロックし、かつ1.0×10-7 Mまたはそれ以下のKDでM-CSFに結合する、請求項2記載のヒトのモノクローナル抗体または部分。
【請求項4】
M-CSFに特異的に結合するヒトモノクローナル抗体8.10.3Fまたはこの抗原結合部分。
【請求項5】
M-CSFに特異的に結合するヒトモノクローナル抗体9.14.4Iまたはこの抗原結合部分。
【請求項6】
以下からなる群より選択される少なくとも1つの特性を有する、ヒトM-CSFに特異的に結合してこれを阻害するヒト化抗体、キメラ抗体、もしくはヒトモノクローナル抗体、またはこの抗原結合部分:
(a)M-CSFに対する結合をめぐって、抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、8.10.3-CG2抗体、9.7.2-CG2抗体、9.7.2-CG4抗体、9.14.4-CG2抗体、9.14.4-CG4抗体、9.14.4-Ser抗体、9.7.2-Ser抗体、8.10.3-Ser抗体、8.10.3-CG4抗体、8.10.3FG1抗体、および9.14.4G1抗体からなる群より選択される抗体とクロス競合すること;
(b)M-CSFに対する結合をめぐって、252、88、100、3.8.3、2.7.3、1.120.1、9.14.4I、8.10.3F、9.7.2IF、9.14.4、8.10.3、9.7.2、9.7.2C-Ser、9.14.4C-Ser、8.10.3C-Ser、8.10.3-CG2、9.7.2-CG2、9.7.2-CG4、9.14.4-CG2、9.14.4-CG4、9.14.4-Ser、9.7.2-Ser、8.10.3-Ser、8.10.3-CG4、8.10.3FG1および9.14.4G1からなる群より選択される抗体と競合すること;
(c)抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体と同じM-CSFのエピトープと結合すること;
(d)抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体と実質的に同じKDでM-CSFに結合すること;ならびに
(e)抗体252、抗体88、抗体100、抗体3.8.3、2.7.3、1.120.1、9.14.4I、8.10.3F、9.7.2IF、9.14.4、8.10.3、9.7.2、9.7.2C-Ser、9.14.4C-Ser、8.10.3C-Ser、8.10.3-CG2、9.7.2-CG2、9.7.2-CG4、9.14.4-CG2、9.14.4-CG4、9.14.4-Ser、9.7.2-Ser、8.10.3-Ser、8.10.3-CG4、8.10.3FG1および9.14.4G1からなる群より選択される抗体と実質的に同じ解離速度でM-CSFに結合すること。
【請求項7】
以下からなる群より選択される、M-CSFに特異的に結合するモノクローナル抗体:
(a)シグナル配列を含まない、SEQ ID NO:2に記載された重鎖のアミノ酸配列、およびSEQ ID NO:4に記載された軽鎖のアミノ酸配列を含む抗体;
(b)シグナル配列を含まない、SEQ ID NO:6に記載された重鎖のアミノ酸配列、およびSEQ ID NO:8に記載された軽鎖のアミノ酸配列を含む抗体;
(c)シグナル配列を含まない、SEQ ID NO:10に記載された重鎖のアミノ酸配列、およびSEQ ID NO:12に記載された軽鎖のアミノ酸配列を含む抗体;
(d)シグナル配列を含まない、SEQ ID NO:14に記載された重鎖のアミノ酸配列、およびSEQ ID NO:16に記載された軽鎖のアミノ酸配列を含む抗体;
(e)シグナル配列を含まない、SEQ ID NO:18に記載された重鎖のアミノ酸配列、およびにSEQ ID NO:20記載された軽鎖のアミノ酸配列を含む抗体;
(f)シグナル配列を含まない、SEQ ID NO:22に記載された重鎖のアミノ酸配列、およびSEQ ID NO:24に記載された軽鎖のアミノ酸配列を含む抗体;
(g)シグナル配列を含まない、SEQ ID NO:26に記載された重鎖のアミノ酸配列、およびSEQ ID NO:28に記載された軽鎖のアミノ酸配列を含む抗体;
(h)シグナル配列を含まない、SEQ ID NO:38に記載された重鎖のアミノ酸配列、およびSEQ ID NO:28に記載された軽鎖のアミノ酸配列を含む抗体;
(i)シグナル配列を含まない、SEQ ID NO:54に記載された重鎖のアミノ酸配列、およびSEQ ID NO:56に記載された軽鎖のアミノ酸配列を含む抗体;
(j)シグナル配列を含まない、SEQ ID NO:74に記載された重鎖のアミノ酸配列、およびSEQ ID NO:56に記載された軽鎖のアミノ酸配列を含む抗体;
(k)シグナル配列を含まない、SEQ ID NO:78に記載された重鎖のアミノ酸配列、およびSEQ ID NO:56に記載された軽鎖のアミノ酸配列を含む抗体;
(l)シグナル配列を含まない、SEQ ID NO:82に記載された重鎖のアミノ酸配列、およびSEQ ID NO:28に記載された軽鎖のアミノ酸配列を含む抗体;
(m)シグナル配列を含まない、SEQ ID NO:102に記載された重鎖のアミノ酸配列、およびSEQ ID NO:28に記載された軽鎖のアミノ酸配列を含む抗体;
(n)シグナル配列を含まない、SEQ ID NO:30に記載された重鎖のアミノ酸配列、およびSEQ ID NO:32に記載された軽鎖のアミノ酸配列を含む抗体;
(o)シグナル配列を含まない、SEQ ID NO:30に記載された重鎖のアミノ酸配列、およびSEQ ID NO:44に記載された軽鎖のアミノ酸配列を含む抗体;
(p)シグナル配列を含まない、SEQ ID NO:58に記載された重鎖のアミノ酸配列、およびSEQ ID NO:60に記載された軽鎖のアミノ酸配列を含む抗体;
(q)シグナル配列を含まない、SEQ ID NO:62に記載された重鎖のアミノ酸配列、およびSEQ ID NO:60に記載された軽鎖のアミノ酸配列を含む抗体;
(r)シグナル配列を含まない、SEQ ID NO:90に記載された重鎖のアミノ酸配列、およびSEQ ID NO:44に記載された軽鎖のアミノ酸配列を含む抗体;
(s)シグナル配列を含まない、SEQ ID NO:94に記載された重鎖のアミノ酸配列、およびSEQ ID NO:60に記載された軽鎖のアミノ酸配列を含む抗体;
(t)シグナル配列を含まない、SEQ ID NO:98に記載された重鎖のアミノ酸配列、およびSEQ ID NO:32に記載された軽鎖のアミノ酸配列を含む抗体;
(u)シグナル配列を含まない、SEQ ID NO:34に記載された重鎖のアミノ酸配列、およびSEQ ID NO:36に記載された軽鎖のアミノ酸配列を含む抗体;
(v)シグナル配列を含まない、SEQ ID NO:46に記載された重鎖のアミノ酸配列、およびSEQ ID NO:48に記載された軽鎖のアミノ酸配列を含む抗体;
(w)シグナル配列を含まない、SEQ ID NO:50に記載された重鎖のアミノ酸配列、およびSEQ ID NO:52に記載された軽鎖のアミノ酸配列を含む抗体;
(x)シグナル配列を含まない、SEQ ID NO:66に記載された重鎖のアミノ酸配列、およびSEQ ID NO:52に記載された軽鎖のアミノ酸配列を含む抗体;
(y)シグナル配列を含まない、SEQ ID NO:70に記載された重鎖のアミノ酸配列、およびSEQ ID NO:52に記載された軽鎖のアミノ酸配列を含む抗体;ならびに
(z)シグナル配列を含まない、SEQ ID NO:86に記載された重鎖のアミノ酸配列、およびSEQ ID NO:48に記載された軽鎖のアミノ酸配列を含む抗体。
【請求項8】
以下を含む、請求項1記載のヒトモノクローナル抗体、またはこの抗原結合部分:
(a)モノクローナル抗体252、モノクローナル抗体88、モノクローナル抗体100、モノクローナル抗体3.8.3、モノクローナル抗体2.7.3、モノクローナル抗体1.120.1、モノクローナル抗体9.14.4I、モノクローナル抗体8.10.3F、モノクローナル抗体9.7.2IF、モノクローナル抗体9.14.4、モノクローナル抗体8.10.3、モノクローナル抗体9.7.2、モノクローナル抗体9.7.2C-Ser、モノクローナル抗体9.14.4C-Ser、モノクローナル抗体8.10.3C-Ser、モノクローナル抗体8.10.3-CG2、モノクローナル抗体9.7.2-CG2、モノクローナル抗体9.7.2-CG4、モノクローナル抗体9.14.4-CG2、モノクローナル抗体9.14.4-CG4、モノクローナル抗体9.14.4-Ser、モノクローナル抗体9.7.2-Ser、モノクローナル抗体8.10.3-Ser、モノクローナル抗体8.10.3-CG4、モノクローナル抗体8.10.3FG1、およびモノクローナル抗体9.14.4G1からなる群より選択される抗体の重鎖から独立に選択される重鎖のCDR1、CDR2、およびCDR3;または
(b)モノクローナル抗体252、モノクローナル抗体88、モノクローナル抗体100、モノクローナル抗体3.8.3、モノクローナル抗体2.7.3、モノクローナル抗体1.120.1、モノクローナル抗体9.14.4I、モノクローナル抗体8.10.3F、モノクローナル抗体9.7.2IF、モノクローナル抗体9.14.4、モノクローナル抗体8.10.3、モノクローナル抗体9.7.2、モノクローナル抗体9.7.2C-Ser、モノクローナル抗体9.14.4C-Ser、モノクローナル抗体8.10.3C-Ser、モノクローナル抗体8.10.3-CG2、モノクローナル抗体9.7.2-CG2、モノクローナル抗体9.7.2-CG4、モノクローナル抗体9.14.4-CG2、モノクローナル抗体9.14.4-CG4、モノクローナル抗体9.14.4-Ser、モノクローナル抗体9.7.2-Ser、モノクローナル抗体8.10.3-Ser、モノクローナル抗体8.10.3-CG4、モノクローナル抗体8.10.3FG1、およびモノクローナル抗体9.14.4G1からなる群より選択される抗体の軽鎖から独立に選択される軽鎖のCDR1、CDR2、およびCDR3。
【請求項9】
以下である、M-CSFに特異的に結合するモノクローナル抗体、またはこの抗原結合部分:
(a)重鎖が、抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体の重鎖のCDR1、CDR2、およびCDR3を含み;
(b)軽鎖が、抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体の重鎖のCDR1、CDR2、およびCDR3を含み;
(c)抗体が、(a)の重鎖、および(b)の軽鎖を含み;または
(d)重鎖および軽鎖のCDRのアミノ酸配列が、同じ抗体から選択される、(c)の抗体。
【請求項10】
抗体が以下を含む、M-CSFに特異的に結合するモノクローナル抗体、またはこの抗原結合部分:
(a)抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および9.14.4G1からなる群より選択される抗体の重鎖のCDR1の開始部位〜CDR3の末端のアミノ酸配列を含む重鎖;
(b)抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体のCDR1の開始部位〜CDR3の末端のアミノ酸配列を含む軽鎖;
(c)(a)の重鎖、および(b)の軽鎖;または
(d)同じ抗体から選択される(a)の重鎖、および(b)の軽鎖のアミノ酸配列。
【請求項11】
以下を含む、請求項10記載のモノクローナル抗体または抗原結合部分:
(a)シグナル配列を含まない、抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体の重鎖の可変ドメイン(VH)のアミノ酸配列;
(b)シグナル配列を含まない、抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体の軽鎖の可変ドメイン(VL)のアミノ酸配列;
(c)(a)のVHのアミノ酸配列、および(b)のVLのアミノ酸配列;または
(d)VHとVLが同じ抗体に由来する、(a)のVHのアミノ酸配列、および(b)のVLのアミノ酸配列。
【請求項12】
以下からなる群より選択されるポリペプチド:
(a)シグナル配列を含まない、SEQ ID NO:2のアミノ酸配列を含むポリペプチド;
(b)シグナル配列を含まない、SEQ ID NO:6のアミノ酸配列を含むポリペプチド;
(c)シグナル配列を含まない、SEQ ID NO:10のアミノ酸配列を含むポリペプチド;
(d)シグナル配列を含まない、SEQ ID NO:14のアミノ酸配列を含むポリペプチド;
(e)シグナル配列を含まない、SEQ ID NO:18のアミノ酸配列を含むポリペプチド;
(f)シグナル配列を含まない、SEQ ID NO:22のアミノ酸配列を含むポリペプチド;
(g)シグナル配列を含まない、SEQ ID NO:26のアミノ酸配列を含むポリペプチド;
(h)シグナル配列を含まない、SEQ ID NO:30のアミノ酸配列を含むポリペプチド;
(i)シグナル配列を含まない、SEQ ID NO:34のアミノ酸配列を含むポリペプチド;
(j)シグナル配列を含まない、SEQ ID NO:38のアミノ酸配列を含むポリペプチド;
(k)シグナル配列を含まない、SEQ ID NO:46のアミノ酸配列を含むポリペプチド;
(l)シグナル配列を含まない、SEQ ID NO:50のアミノ酸配列を含むポリペプチド;
(m)シグナル配列を含まない、SEQ ID NO:54のアミノ酸配列を含むポリペプチド;
(n)シグナル配列を含まない、SEQ ID NO:58のアミノ酸配列を含むポリペプチド;
(o)シグナル配列を含まない、SEQ ID NO:62のアミノ酸配列を含むポリペプチド;
(p)シグナル配列を含まない、SEQ ID NO:66のアミノ酸配列を含むポリペプチド;
(q)シグナル配列を含まない、SEQ ID NO:70のアミノ酸配列を含むポリペプチド;
(r)シグナル配列を含まない、SEQ ID NO:74のアミノ酸配列を含むポリペプチド;
(s)シグナル配列を含まない、SEQ ID NO:78のアミノ酸配列を含むポリペプチド;
(t)シグナル配列を含まない、SEQ ID NO:82のアミノ酸配列を含むポリペプチド;
(u)シグナル配列を含まない、SEQ ID NO:86のアミノ酸配列を含むポリペプチド;
(v)シグナル配列を含まない、SEQ ID NO:90のアミノ酸配列を含むポリペプチド;
(w)シグナル配列を含まない、SEQ ID NO:94のアミノ酸配列を含むポリペプチド;
(x)シグナル配列を含まない、SEQ ID NO:98のアミノ酸配列を含むポリペプチド;および
(y)シグナル配列を含まない、SEQ ID NO:102のアミノ酸配列を含むポリペプチド。
【請求項13】
シグナル配列を含まない、SEQ ID NO:30のアミノ酸配列を含む、請求項12記載のポリペプチド。
【請求項14】
シグナル配列を含まない、SEQ ID NO:26のアミノ酸配列を含む、請求項12記載のポリペプチド。
【請求項15】
以下からなる群より選択されるポリペプチド:
(a)シグナル配列を含まない、SEQ ID NO:4のアミノ酸配列を含むポリペプチド;
(b)シグナル配列を含まない、SEQ ID NO:8のアミノ酸配列を含むポリペプチド;
(c)シグナル配列を含まない、SEQ ID NO:12のアミノ酸配列を含むポリペプチド;
(d)シグナル配列を含まない、SEQ ID NO:16のアミノ酸配列を含むポリペプチド;
(e)シグナル配列を含まない、SEQ ID NO:20のアミノ酸配列を含むポリペプチド;
(f)シグナル配列を含まない、SEQ ID NO:24のアミノ酸配列を含むポリペプチド;
(g)シグナル配列を含まない、SEQ ID NO:28のアミノ酸配列を含むポリペプチド;
(h)シグナル配列を含まない、SEQ ID NO:32のアミノ酸配列を含むポリペプチド;
(i)シグナル配列を含まない、SEQ ID NO:36のアミノ酸配列を含むポリペプチド;
(j)シグナル配列を含まない、SEQ ID NO:44のアミノ酸配列を含むポリペプチド;
(k)シグナル配列を含まない、SEQ ID NO:48のアミノ酸配列を含むポリペプチド、
(l)シグナル配列を含まない、SEQ ID NO:52のアミノ酸配列を含むポリペプチド;
(m)シグナル配列を含まない、SEQ ID NO:56のアミノ酸配列を含むポリペプチド;および
(n)シグナル配列を含まない、SEQ ID NO:60のアミノ酸配列を含むポリペプチド。
【請求項16】
シグナル配列を含まない、SEQ ID NO:32のアミノ酸配列を含む、請求項15記載のポリペプチド。
【請求項17】
シグナル配列を含まない、SEQ ID NO:28のアミノ酸配列を含む、請求項15記載のポリペプチド。
【請求項18】
抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体のFR1、FR2、FR3、もしくはF4のアミノ酸配列の1つもしくは複数を含む、M-CSFに特異的に結合するモノクローナル抗体、またはこの抗原結合部分。
【請求項19】
以下を含む、請求項1記載のヒトモノクローナル抗体:
(a)シグナル配列を含まない、モノクローナル抗体252、モノクローナル抗体88、モノクローナル抗体100、モノクローナル抗体3.8.3、モノクローナル抗体2.7.3、モノクローナル抗体1.120.1、モノクローナル抗体9.14.4I、モノクローナル抗体8.10.3F、モノクローナル抗体9.7.2IF、モノクローナル抗体9.14.4、モノクローナル抗体8.10.3、モノクローナル抗体9.7.2、モノクローナル抗体9.7.2C-Ser、モノクローナル抗体9.14.4C-Ser、モノクローナル抗体8.10.3C-Ser、モノクローナル抗体8.10.3-CG2、モノクローナル抗体9.7.2-CG2、モノクローナル抗体9.7.2-CG4、モノクローナル抗体9.14.4-CG2、モノクローナル抗体9.14.4-CG4、モノクローナル抗体9.14.4-Ser、モノクローナル抗体9.7.2-Ser、モノクローナル抗体8.10.3-Ser、モノクローナル抗体8.10.3-CG4、モノクローナル抗体8.10.3FG1、もしくはモノクローナル抗体9.14.4G1の重鎖のアミノ酸配列と少なくとも90%が同一な重鎖のアミノ酸配列;
(b)シグナル配列を含まない、モノクローナル抗体252、モノクローナル抗体88、モノクローナル抗体100、モノクローナル抗体3.8.3、モノクローナル抗体2.7.3、モノクローナル抗体1.120.1、モノクローナル抗体9.14.4I、モノクローナル抗体8.10.3F、モノクローナル抗体9.7.2IF、モノクローナル抗体9.14.4、モノクローナル抗体8.10.3、モノクローナル抗体9.7.2、モノクローナル抗体9.7.2C-Ser、モノクローナル抗体9.14.4C-Ser、モノクローナル抗体8.10.3C-Ser、モノクローナル抗体8.10.3-CG2、モノクローナル抗体9.7.2-CG2、モノクローナル抗体9.7.2-CG4、モノクローナル抗体9.14.4-CG2、モノクローナル抗体9.14.4-CG4、モノクローナル抗体9.14.4-Ser、モノクローナル抗体9.7.2-Ser、モノクローナル抗体8.10.3-Ser、モノクローナル抗体8.10.3-CG4、モノクローナル抗体8.10.3FG1、もしくはモノクローナル抗体9.14.4G1の軽鎖のアミノ酸配列と少なくとも90%が同一な軽鎖のアミノ酸配列;または
(c)(a)の重鎖のアミノ酸配列、および(b)の軽鎖のアミノ酸配列。
【請求項20】
抗体または抗原結合部分の重鎖のC末端のリシンが存在しない、請求項1〜19〜のいずれか一項記載の、モノクローナル抗体または抗原結合部分。
【請求項21】
請求項1〜20のいずれか一項記載の抗体または抗原結合部分、および薬学的に許容される担体を含む薬学的組成物。
【請求項22】
抗体が、モノクローナルの抗M-CSF抗体9.14.4Iまたは8.10.3Fである、請求項21記載の薬学的組成物。
【請求項23】
治療を必要とする被験対象に、請求項1〜20のいずれか一項記載の治療的有効量の抗体もしくはこの抗原結合部分、または抗体もしくは抗体部分がM-CSFを阻害する、請求項21〜22のいずれか一項記載の薬学的組成物を投与する段階を含む、ヒトを含む被験対象における関節炎、乾癬性関節炎、強直性脊椎炎、ライター症候群、慢性関節リウマチ、痛風、外傷性関節炎、風疹性関節炎、および急性滑膜炎、ならびに他の関節炎条件、敗血症、敗血症性ショック、内毒素ショック、グラム陰性菌性敗血症、毒素ショック症候群、アルツハイマー病、卒中、神経外傷、喘息、成人呼吸窮迫症候群、脳性マラリア、慢性肺炎、珪肺症、肺サルコイドーシス、骨吸収疾患、骨粗鬆症、再狭窄、心臓および腎臓の再灌流傷害、血栓症、糸球体腎炎、糖尿病、移植片対宿主反応、同種移植拒絶反応、炎症性腸疾患、クローン病、潰瘍性大腸炎、多発性硬化症、筋肉変性、湿疹、接触皮膚炎、乾癬、日焼け、および結膜炎ショックからなる群より選択される状態を治療する方法。
【請求項24】
状態が慢性関節リウマチである、請求項23記載の方法。
【請求項25】
使用抗体がモノクローナルの抗M-CSF抗体8.10.3Fまたは9.14.4Iである、請求項23または24に記載の記載の方法。
【請求項26】
M-CSFのc-fmsへの結合を阻害する、請求項1〜20のいずれか一項記載の抗体もしくはこの抗原結合部分、または請求項21〜22のいずれか一項記載の薬学的組成物を被験対象に投与する段階を含む、ヒトを含む被験対象の肉腫、癌、またはリンパ腫などの固形腫瘍を治療する方法。
【請求項27】
請求項1〜20のいずれか一項記載の抗体もしくはこの抗原結合部分、または該抗体もしくは該抗原結合部分の重鎖もしくは軽鎖を産生する、単離された細胞系列。
【請求項28】
抗体252、抗体88、抗体100、抗体3.8.3、抗体2.7.3、抗体1.120.1、抗体9.14.4I、抗体8.10.3F、抗体9.7.2IF、抗体9.14.4、抗体8.10.3、抗体9.7.2、抗体9.7.2C-Ser、抗体9.14.4C-Ser、抗体8.10.3C-Ser、抗体8.10.3-CG2、抗体9.7.2-CG2、抗体9.7.2-CG4、抗体9.14.4-CG2、抗体9.14.4-CG4、抗体9.14.4-Ser、抗体9.7.2-Ser、抗体8.10.3-Ser、抗体8.10.3-CG4、抗体8.10.3FG1、および抗体9.14.4G1からなる群より選択される抗体、ならびに前記の抗体の一つと同じアミノ酸配列を有する抗体を産生する、請求項27記載の細胞系列。
【請求項29】
請求項1〜20のいずれか一項記載の抗体の重鎖もしくはこの抗原結合部分、または軽鎖もしくはこの抗原結合部分をコードするヌクレオチド配列を含む、単離された核酸分子。
【請求項30】
核酸分子に機能的に連結された発現制御配列を任意に含む、請求項29記載の核酸分子を含むベクター。
【請求項31】
請求項30記載のベクターまたは請求項29記載の核酸分子を含む宿主細胞。
【請求項32】
請求項1〜20のいずれか一項記載の抗体または抗原結合部分の重鎖をコードする核酸分子、および軽鎖をコードする核酸分子を含む、請求項31記載の宿主細胞。
【請求項33】
請求項32記載の宿主細胞、または請求項28記載の細胞系列を適切な条件で培養する段階、ならびに抗体または抗原結合部分を回収する段階を含む、抗M-CSF抗体またはこの抗原結合部分を作製する方法。
【請求項34】
以下の段階を含む、M-CSFに特異的に結合するヒトモノクローナル抗体を作製する方法:
(a)ヒト抗体を産生する能力を有する非ヒトトランスジェニック動物を、M-CSF、M-CSFの免疫原性部分、またはM-CSFを発現する細胞もしくは組織で免疫化する段階;
(b)トランスジェニック動物が、M-CSFに対する免疫応答を惹起可能とする段階;および
(c)トランスジェニック動物からBリンパ球を単離する段階。
【図1A】


【図1B】


【図2A】


【図2B】


【図3A】


【図3B】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図4F】


【図4G】


【図4H】


【図4I】


【図4J】


【図4K】


【図4L】


【図4M】


【図4N】


【図4O】


【図4P】


【図4Q】


【図4R】


【図4S】


【図4T】


【図4U】


【図4V】


【図4W】


【図4X】


【図4Y】


【図4Z】


【図4AA】


【図4BB】


【図4CC】


【図4DD】


【図4EE】


【図4FF】


【図4GG】


【図4HH】


【図4II】


【図4JJ】


【図4KK】


【図4LL】


【図4MM】


【図4NN】


【図4OO】


【図4PP】


【図4QQ】


【図4RR】


【図4SS】


【図4TT】


【図4UU】


【図4VV】


【図4WW】


【図4XX】


【図4YY】


【図4ZZ】




【図1B】


【図2A】


【図2B】


【図3A】


【図3B】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図4F】


【図4G】


【図4H】


【図4I】


【図4J】


【図4K】


【図4L】


【図4M】


【図4N】


【図4O】


【図4P】


【図4Q】


【図4R】


【図4S】


【図4T】


【図4U】


【図4V】


【図4W】


【図4X】


【図4Y】


【図4Z】


【図4AA】


【図4BB】


【図4CC】


【図4DD】


【図4EE】


【図4FF】


【図4GG】


【図4HH】


【図4II】


【図4JJ】


【図4KK】


【図4LL】


【図4MM】


【図4NN】


【図4OO】


【図4PP】


【図4QQ】


【図4RR】


【図4SS】


【図4TT】


【図4UU】


【図4VV】


【図4WW】


【図4XX】


【図4YY】


【図4ZZ】


【公開番号】特開2011−83291(P2011−83291A)
【公開日】平成23年4月28日(2011.4.28)
【国際特許分類】
【出願番号】特願2011−10778(P2011−10778)
【出願日】平成23年1月21日(2011.1.21)
【分割の表示】特願2007−263538(P2007−263538)の分割
【原出願日】平成16年9月9日(2004.9.9)
【出願人】(503181266)ワーナー−ランバート カンパニー リミテッド ライアビリティー カンパニー (167)
【出願人】(398005777)アムジェン フレモント インク. (40)
【Fターム(参考)】
【公開日】平成23年4月28日(2011.4.28)
【国際特許分類】
【出願日】平成23年1月21日(2011.1.21)
【分割の表示】特願2007−263538(P2007−263538)の分割
【原出願日】平成16年9月9日(2004.9.9)
【出願人】(503181266)ワーナー−ランバート カンパニー リミテッド ライアビリティー カンパニー (167)
【出願人】(398005777)アムジェン フレモント インク. (40)
【Fターム(参考)】
[ Back to top ]

