MAGE−A発現の改良された検出
配列番号5、6、7、2、3、4、8、9、11、12、13、14、15、16、17、18、19または25のいずれかに記載のヌクレオチド配列を含むオリゴヌクレオチド、プライマーまたはプローブ。このオリゴヌクレオチドは、遺伝子、特に、MAGE-A3遺伝子のメチル化状態の検出にとって有用である。前記オリゴヌクレオチドは、MAGE-A3遺伝子のメチル化状態を決定するため、ならびに癌を診断するため、療法を指示するため、および治療のための被験者を選択するためのプライマー対、キットおよび方法において有用である。前記プライマーまたはプローブは、ループまたはヘアピン構造を含んでもよく、リアルタイムメチル化特異的PCRにおいて用いることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、MAGE-Aファミリー遺伝子発現の検出に関する。より具体的には、本発明は、メチル化または非メチル化形態のMAGE-A3を検出する方法および関連するオリゴヌクレオチド、プライマー、プローブ、プライマー対ならびにキットに関する。本発明の方法は、増幅技術、特に、蛍光に基づくリアルタイムおよびエンドポイントPCR法を含み、診断的、予測的および治療的に有用である。
【背景技術】
【0002】
MAGE遺伝子は、癌/精巣抗原のファミリーに属する。MAGEファミリーの遺伝子は、20を超えるメンバーを含み、MAGE A、B、CおよびD遺伝子からなる(Scanlanら(2002) Immunol Rev. 188:22-32; Chomezら(2001) Cancer Res. 61(14):5544-51)。それらは染色体X上でクラスター化しており(Lucasら、1998 Cancer Res. 58.743-752; Lucasら、1999 Cancer Res 59:4100-4103; Lucasら、2000 Int J Cancer 87:55-60; Lurquinら、1997 Genomics 46:397-408; Muscatelliら、1995 Proc Natl Acad Sci USA 92:4987-4991; PoIdら、1999 Genomics 59:161-167; Rognerら、1995 Genomics 29:725-731)、依然として不明確な機能を有する(Ohmanら、2001 Exp Cell Res. 265(2): 185-94)。MAGE遺伝子は高度に相同的であり、特に、MAGE-Aファミリーのメンバーは60〜98%の相同性を有する。
【0003】
ヒトMAGE-A3遺伝子は、メラノーマ(Furutaら、2004 Cancer Sci. 95, 962-968)、膀胱癌、肝細胞癌(Qiuら、2006. Clinical Biochemistry 39, 259-266)、胃癌(Hondaら、2004 British Journal of Cancer 90, 838-843)、結腸直腸癌(Kimら、2006 World Journal of Gastroenterology 12, 5651-5657)および肺癌(NSCLC)(Scanlanら、2002 Immunol Rev. 188:22-32; Jangら、2001 Cancer Res. 61, 21: 7959-7963)などの様々な型の腫瘍において発現される。唯一、精巣生殖細胞または胎盤を除いて、正常な成体組織においては発現が観察されていない(Haasら、1988 Am J Reprod Immunol Microbiol 18:47-51; Takahashiら、1995 Cancer Res 55:3478-382)。
【0004】
抗原特異的癌免疫療法剤(ASCI)は、高度に特異的な様式で癌細胞を認識し、排除するように免疫系を訓練するように設計された新しいクラスの薬剤である。そのようなものとして、ASCIは標的化された治療を可能にする。ASCIは2つの主成分を有する:癌細胞に対して免疫応答を特異的に指向させる「腫瘍抗原」および抗腫瘍免疫応答を増加させるために選択された免疫刺激化合物を含む「アジュバント系」。MAGE-A3抗原およびASCIにおける使用にとって好適な構築物は、WO99/40188に記載されており、非小細胞肺癌(NSCLC)を有する患者におけるMAGE-A3 ASCIに関する有望な第II相試験の結果が最近報告されている(J. Clin. Oncol. Vol. 25, No. 18S (June 20 Suppl.) 2007: 7554)。
【0005】
免疫療法から利益を得られるMAGE-A3を発現する患者を特異的に同定し、投与目的でMAGE-A3発現をモニターし、臨床試験においてMAGE-A3発現を同定するか、または単に癌を有する患者を早期段階で同定することができる定量的高効率アッセイを有することが重要である。いくつかの適用可能な診断方法が記載されており、半定量的RT-PCR(De Plaenら、1994 Immunogenetics 40(5):360-9)、他のPCRに基づく技術および低密度マイクロアレイ (Zammatteoら、2002 Clinical Chemistry 48(1) 25-34)が挙げられる。さらに、MAGE-A3 ASCIと共に使用するための改良されたRT-PCR法が、WO2007/147876に考察されている。
【0006】
存在するアッセイの最も大きな欠点は、それらがMAGEA3発現を評価するためにRNAの単離を要することである。ホルマリン固定され、パラフィン包埋された(FFPE)腫瘍組織は、臨床センター内で腫瘍組織を保存するための通常の方法である。ホルマリン中での固定は、組織内でのRNAの分子構造を変化させ、架橋およびまた部分的分解を引き起こす。部分的分解は100〜300塩基対のより小さい断片のRNAの生成を誘導する。RNAに対するこれらの構造的変化は、MAGEA3発現レベルを測定するためにFFPE組織から抽出されたRNAの使用を制限する。
【0007】
本発明の課題は、存在するアッセイの欠点を排除する改良されたアッセイを提供することである。
【0008】
遺伝子メチル化は、遺伝子発現の重要な調節因子である。特に、特定の遺伝子のプロモーター領域中のCpGジヌクレオチド対に認められるシトシン残基でのメチル化は、遺伝子発現の下方調節を介して多くの疾患状態に寄与し得る。例えば、腫瘍抑制遺伝子の異常なメチル化は、これらの遺伝子の上方または下方調節を誘導し、かくして、多くの癌の存在および発達に関連する(Hoffmannら、2005 Biochem Cell Biol 83: 296-321)。異常な遺伝子メチル化のパターンは、起源となる組織に特異的であることが多い。従って、特定の遺伝子のメチル化状態の検出は、予測的および診断的に有用であり、これを用いて、疾患の相対的段階を決定し、また特定の型の療法に対する応答を予測することができる(Laird. 2003 Nat Rev Cancer 3: 253-266)。
【0009】
ゲル上で結果を可視化するメチル化特異的PCR(MSP)(ゲルに基づくMSPアッセイ)は、遺伝子のエピジェネティックなサイレンシングを決定するために広く用いられているが(Esteller Mら、Cancer Res 2001;61:3225-9)、他の技術を用いる定量的試験も開発されている(Laird PW., Nat Rev Cancer 2003;3:253-66; Eadsら、Nucleic Acids Res 2000;28:E32; Mikeska T,ら、J Mol Diagn 2007)。
【0010】
核酸増幅反応をリアルタイムでモニターするためのいくつかの蛍光に基づく技術が利用可能である。1つのそのような技術は、米国特許第6,090,552号およびEP 0912597に記載されており、Amplifluor(登録商標)として商業的に知られている。また、この方法は、核酸増幅反応のエンドポイントモニタリングにとっても好適である。Vlassenbroeckら(Vlassenbroeckら、2008. Journal of Molec. Diagn., V10, No. 4)はさらに、Amplifluor(登録商標)技術を用いた標準化された直接的リアルタイムMSPアッセイを記載している。
【発明の概要】
【0011】
本発明は、MAGE-A3発現を測定するための改良された方法および/またはアッセイに関する。本発明はさらに、特定の型の療法、特に、本明細書に記載のオリゴヌクレオチド、プライマー、プローブ、プライマー対、キットおよび/または方法の使用を介して、MAGE-A3を発現すると同定された患者の治療に基づく抗原特異的癌免疫療法(ASCI)に関する。MAGE-A3タンパク質発現を、MAGE-A3遺伝子自体の発現レベルを測定するよりもむしろ、該遺伝子のメチル化状態を決定することにより検出する。本発明者らは、それらのメチル化試験のメチル化状態の結果が、MAGE-A3免疫療法からの利益のためのNSCLCにおけるMAGE-A3発現の予測値を確立したRT-PCRアッセイに関して得られた結果と良好に一致することを示す。かくして、このアッセイは、治療にとって好適な患者を選択し、患者の治療が成功する可能性を予測するのに有用であり、患者の療法選択を援助するために用いることができる。
【0012】
一態様においては、本発明は、遺伝子のメチル化状態の検出にとって有用である、配列番号2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含むか、もしくは本質的にそれからなるか、またはそれからなるオリゴヌクレオチド、プライマーまたはプローブを提供する。
【0013】
前記オリゴヌクレオチド、プライマーまたはプローブは、好ましくは、5'から3'の順に、以下の連続する配列:
(a)約6〜30個のヌクレオチドの第1のヌクレオチド配列であって、該第1のヌクレオチド配列内のヌクレオチドが、分子エネルギー移動対の供与体部分と受容体部分から選択される第1の部分で標識され、供与体部分が、励起された場合、1個以上の特定の波長で蛍光を放出し、受容体部分が、該供与体部分により放出された蛍光を吸収および/もしくはクエンチする、前記ヌクレオチド配列;
(b)約3〜20個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第2の一本鎖ヌクレオチド配列;
(c)約6〜30個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第3のヌクレオチド配列であって、第3のヌクレオチド配列内のヌクレオチドが、前記供与体部分と受容体部分から選択される第2の部分で標識され、第2の部分が第1のヌクレオチド配列を標識しない前記群のメンバーであり、供与体部分が励起され、蛍光を放出する場合、受容体部分が供与体部分により放出された蛍光を吸収し、クエンチするように、第1の部分と第2の部分が近くなるように、二本鎖が第1のヌクレオチド配列と第3のヌクレオチド配列との間で形成することができるように、第3のヌクレオチド配列が第1のヌクレオチド配列と逆の順序で相補的である、前記ヌクレオチド配列;ならびに
(d)3'末端に配列番号2、4、5、7、8、11、13、14、16、17、19または25のいずれかのヌクレオチド配列を含む約8〜40個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる、プライマーの3'末端の第4の一本鎖ヌクレオチド配列、
を含み、本質的にそれからなるか、またはそれからなり、二本鎖が形成されない場合、第1の部分と第2の部分が、第1および第2の部分の間の分子エネルギー移動を阻害する距離により分離される。
【0014】
3'末端の特定のヌクレオチド配列により、MAGE-A3遺伝子のメチル化状態を決定することができる。これらのプライマーは、好適な試薬(本明細書で考察される)を用いる治療後に、非メチル化形態のMAGEA3遺伝子に優先的に結合する。これらのオリゴヌクレオチドの特性は本明細書で考察されており、その考察は変更すべきところは変更して適用される。特定のヌクレオチド配列は、MAGE Aファミリー遺伝子のメチル化または非メチル化DNAの部分を含む核酸鎖と相補的なヌクレオチド配列の核酸ポリメラーゼによる合成をプライミングすることができる。
【0015】
最も好ましくは、前記オリゴヌクレオチド、プライマーまたはプローブは、配列番号3、6、9、12、15または18のヌクレオチド配列からなり、目的の遺伝子の一部を増幅するのに用いられる。
【0016】
さらに、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含むか、または本質的にそれからなるか、またはそれからなるプライマーを含むプライマー対も提供される。
【0017】
さらなる態様においては、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含むか、または本質的にそれからなるか、またはそれからなる少なくとも1個のプライマー、プライマー対またはプライマーのセットを含むキットが提供される。このキットは、遺伝子、特に、MAGE-A3などのMAGE-Aファミリー遺伝子のメチル化状態を検出するためのものである。
【0018】
さらなる態様においては、本発明は、DNAを含有するサンプル中のMage-A3遺伝子のメチル化状態を検出するための方法であって、
(a)DNAを含有するサンプルと、DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基をもたらすが、メチル化シトシン残基を修飾しない試薬とを接触させること/該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマーが、該試薬で処理した後に、それぞれメチル化または非メチル化DNAの配列にのみ結合するように設計され、少なくとも1対のプライマー中の少なくとも1個のプライマーが、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含み、本質的にそれからなるか、またはそれからなる、前記プライマー対を用いて目的のメチル化または非メチル化遺伝子の少なくとも一部を増幅すること(必要に応じて)、
を含む、前記方法を提供する。
【0019】
さらなる態様においては、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることによりサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、サンプル中の非メチル化MAGE-A3の存在が癌または癌の素因を示す、癌または癌の素因を診断する方法が提供される。
【0020】
さらなる態様においては、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることによりサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、非メチル化MAGE-A3の存在がMAGE-A3陽性腫瘍の存在を示す、MAGE-A3陽性腫瘍の存在を決定するための方法が提供される。「MAGE-A3陽性腫瘍」とは、MAGE-A3抗原を発現する任意の腫瘍または腫瘍細胞(患者から単離されたもの)を意味する。
【0021】
本発明はさらに、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、MAGE-A3遺伝子がメチル化されていない場合、(好ましくは)被験者がMAGE-A3免疫療法剤を用いる治療のために同定および/または選択される、MAGE-A3免疫療法剤を用いる治療にとって好適な患者を同定および/または選択するための方法を提供する。かくして、非メチル化MAGEA3を有する患者は、該遺伝子がメチル化された患者よりも好ましい。
【0022】
あるいは、前記遺伝子が非メチル化されていない場合、被験者を、MAGE-A3免疫療法剤を用いる治療のために同定および/または選択しないのが好ましい。
【0023】
関連する態様においては、本発明は、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、該遺伝子がメチル化されていない場合、MAGE-A3免疫療法剤を用いる治療の成功の可能性が、該遺伝子がメチル化されている場合よりも高い、癌の治療の成功の可能性を予測するための方法を提供する。
【0024】
あるいは、サンプル中の非メチル化MAGE-A3の非存在は、MAGE-A3免疫療法剤を用いる治療に対する耐性の可能性が、該遺伝子がメチル化されていない場合よりも高いことを示す。かくして、メチル化MAGE-A3遺伝子の検出は、免疫療法剤を用いる治療の成功確率が低いことを示す。
【0025】
さらに関連する態様においては、本発明は、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、該遺伝子がメチル化されていない場合、免疫療法剤を治療のために選択する、癌のための好適な治療計画を選択する方法を提供する。
【0026】
あるいは、前記遺伝子が非メチル化されていない場合、免疫療法剤を用いる治療は禁忌である。
【0027】
また、免疫療法剤の投与を含み、被験者を、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて治療のために選択する、被験者における癌を治療する方法も提供される。
【0028】
好ましくは、本明細書に記載の様々な態様の全てについて、非メチル化MAGE-A3遺伝子の検出は、MAGE-A3タンパク質のレベルの増加に対応する。
【0029】
本発明はさらに、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定すること、ならびに次いで、本明細書に記載のMAGE-A3を含む組成物を患者に投与することを含む、患者を治療する方法を提供する。MAGE-A3遺伝子がメチル化されていないことがわかった場合、前記組成物を投与するのが好ましい。
【0030】
さらなる態様においては、腫瘍組織を除去するために治療された患者であって、MAGE-A3を発現する腫瘍の再発が疑われる前記患者を治療する方法であって、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、腫瘍組織中のMAGE-A3遺伝子のメチル化状態を測定すること、ならびに次いで、本明細書に記載のMAGE-A3を含む組成物を該患者に投与することを含む、前記方法が提供される。MAGE-A3遺伝子がメチル化されていないことがわかった場合、前記組成物を投与するのが好ましい。
【0031】
本発明のさらなる態様においては、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択された、腫瘍に罹患する患者の治療のための医薬の製造における、MAGE-A3を含む組成物の使用が提供される。また、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択された、腫瘍に罹患する患者の治療における使用のためのMAGE-A3を含む組成物も提供される。
【0032】
さらなる実施形態においては、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて治療のために選択された、MAGE-A3を発現する腫瘍の再発が疑われる患者の治療のための医薬の製造における、MAGE-A3を含む組成物の使用が提供される。また、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて治療のために選択された、MAGE-A3を発現する腫瘍の再発が疑われる患者の治療における使用のためのMAGE-A3を含む組成物も提供される。
【図面の簡単な説明】
【0033】
【図1】非変換配列(図1a - 配列番号10)および対応する変換配列(図1b - 配列番号41)上のMAGEA3_Uプライマーの位置を示す。MAGEA3_GO1 Uプライマー位置を囲み、MAGEA3_GO2 Uプライマー位置を強調し、MAGEA3_FURUTA Uプライマー位置を太字で示し、MAGEA3_QIU Uプライマー位置に下線を付し、■で示されるG位置は転写開始部位に対応する。
【図2】非変換配列(図2a - 配列番号10)および対応する変換配列(図2b - 配列番号41)上のMAGEA3_GO_2_Uプライマーの位置を示す。下線は転写開始部位で始まる。
【図3】検出グラフの限界を示す。図3a:MAGEA3_GO_2_U:入力U DNA(LNCaP細胞)をCt値に対してプロットしたところ、1.5 ngのU入力DNAが依然として検出可能である。図3b:MAGEA3_Furuta_U:入力U DNA(Gerl細胞)をCt値に対してプロットしたところ、1.5 ngのU入力DNAが依然として検出可能である。
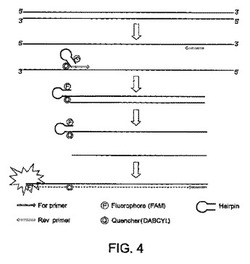
【図4】Amplifluor(登録商標)技術の図式的概観を示す。プライマー対中の少なくとも一方のプライマー(この場合はフォワードプライマー)は、分子エネルギー移動対の供与体(FAM)および受容体部分(DABCYL)を担持する「ヘアピン」構造を含む。増幅の非存在下では、供与体部分により放出される蛍光は、受容体部分により効率的に受容され、蛍光のクエンチングを誘導する。増幅の間に、プライマーは増幅産物中に組込まれる。2周目の増幅の間に、ステムループまたはヘアピン構造が破壊される。受容体部分はもはや供与体部分により放出される蛍光を効率的にクエンチすることができない。かくして、供与体部分は検出可能な蛍光シグナルを産生する。
【図5】サンプル分類のための決定木を示す(メチル化、非メチル化または無効)。
【図6−1】メラノーマサンプル中でのMAGE-A3メチル化状態を示す:受信者動作特性(ROC)曲線を、偽陽性率(100の特異性)の関数において真陽性率(感度)をプロットすることにより、4つのMAGE-A3非メチル化アッセイについて算出した。図6a:GO_1_Uアッセイ:感度91.7%、特異性76.5%、カットオフ214.8、曲線下面積(AUC)は0.912である。95%CI区間は、面積=5について、P=0.0001の有意性で0.781〜0.977であった。図6b:GO_2_Uアッセイ:感度87.5%、特異性100%、カットオフ292.6、曲線下面積(AUC)は0.971である。95%CI区間は、面積=5について、P=0.0001の有意性で0.863〜0.996であった。図6c:Furuta_Uアッセイ:感度66.7%、特異性100%、カットオフ943.1、曲線下面積(AUC)は0.939である。95%CI区間は、面積=5について、P=0.0001の有意性で0.817〜0.989であった。図6d:Qiu_Uアッセイ:感度83.3%、特異性94.1%、カットオフ431.1、曲線下面積(AUC)は0.944である。95%CI区間は、面積=5について、P=0.0001の有意性で0.824〜0.990であった。図6e:4つのアッセイのそれぞれについて得られた結果をまとめた表である。
【図6−2】図6−1の続きである。
【図6−3】図6−2の続きである。
【図7−1】肺生検におけるMAGE-A3メチル化状態を示す:受信者動作特性(ROC)曲線を、偽陽性率(100の特異性)の関数において真陽性率(感度)をプロットすることにより、4つのMAGE-A3非メチル化アッセイについて算出した。図7a:GO_1_Uアッセイ:感度84.6%、特異性91.7%、カットオフ115.8、曲線下面積(AUC)は0.954である。95%CI区間は、面積=5について、P=0.0001の有意性で0.868〜0.990であった。図7b:GO_2_Uアッセイ:感度88.5%、特異性94.4%、カットオフ108.28、曲線下面積(AUC)は0.971である。95%CI区間は、面積=5について、P=0.0001の有意性で0.893〜0.996であった。図7c:Furuta_Uアッセイ:感度84.6%、特異性91.7%、カットオフ296.8、曲線下面積(AUC)は0.949である。95%CI区間は、面積=5について、P=0.0001の有意性で0.861〜0.988であった。図7d:Qiu_Uアッセイ:感度84.6%、特異性91.7%、カットオフ176.71、曲線下面積(AUC)は0.948である。95%CI区間は、面積=5について、P=0.0001の有意性で0.859〜0.988であった。図7e:肺生検上での4つのアッセイのそれぞれについて得られた結果をまとめた表である。
【図7−2】図7−1の続きである。
【図7−3】図7−2の続きである。
【図8−1】肺FFPEサンプル中でのMAGE-A3メチル化状態を示す:受信者動作特性(ROC)曲線を、偽陽性率(100の特異性)の関数において真陽性率(感度)をプロットすることにより、4つのMAGE-A3非メチル化アッセイについて算出した。図8a:GO_1_Uアッセイ:感度84.0%、特異性96.0%、カットオフ21.88、曲線下面積(AUC)は0.933である。95%CI区間は、面積=5について、P=0.0001の有意性で0.825〜0.984であった。図8b:GO_2_Uアッセイ:感度84.0%、特異性96.3%、カットオフ17.75、曲線下面積(AUC)は0.932である。95%CI区間は、面積=5について、P=0.0001の有意性で0.826〜0.983であった。図8c:Furuta_Uアッセイ:感度80.0%、特異性96.2%、カットオフ214.26、曲線下面積(AUC)は0.923である。95%CI区間は、面積=5について、P=0.0001の有意性で0.813〜0.979であった。図8d:Qiu_Uアッセイ:感度72.0%、特異性96.2%、カットオフ68.91、曲線下面積(AUC)は0.912である。95%CI区間は、面積=5について、P=0.0001の有意性で0.799〜0.973であった。図8e:肺FFPEサンプル上での4つのアッセイのそれぞれについて得られた結果をまとめた表である。
【図8−2】図8−1の続きである。
【図8−3】図8−2の続きである。
【図9】反応プロセスの様々な工程で固定した場合のPCR阻害に対するメラニンの効果を示す。図9a:MAGE-A3 UリアルタイムMSPを通して処理された、固定したメラニンを含む、および含まないLNCaP細胞系材料。BT=亜硫酸水素処理。図9b:Gst-Pi MリアルタイムMSPを通して処理された、固定したメラニンを含む、および含まないMCF7細胞系材料。
【図10】プロテインD-MAGE-A3-Hisを示す。一本下線=プロテインDの最初の109個のアミノ酸、二重下線=プロテインDのシグナル配列(18アミノ酸)、囲み=挿入/置換された配列:2-3でのMet-Asp(置換);128-129でのMet-Asp(挿入)および442-443でのGly-Gly(挿入)。太字=MAGE3の断片:MAGE3のアミノ酸3-314(合計312アミノ酸)、灰色部分=7個のhis尾部。
【発明を実施するための形態】
【0034】
本発明は、DNAを含有するサンプル中のメチル化された、またはメチル化されていないMAGE-A3遺伝子の存在および/または量を検出するためのアッセイを提供する。このアッセイを開発するために、MAGE-A3遺伝子中でメチル化を受けやすい領域を同定し、メチル化された形態のMAGE-A3遺伝子からメチル化されていない形態のものを識別することができる特定のオリゴヌクレオチドを開発することが必要であった。
【0035】
従って、第1の態様においては、本発明は、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるオリゴヌクレオチドを提供する。これらのオリゴヌクレオチドは、目的の遺伝子のメチル化状態の検出において有用である。これらのオリゴヌクレオチドは、プライマーおよび/またはプローブとして役立ち得る。特定の実施形態においては、前記オリゴヌクレオチドは前記遺伝子の非メチル化形態を検出する。非メチル化形態を検出するための好適なオリゴヌクレオチドは、配列番号2、4、5、7、8、11、13または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。メチル化形態を検出するための好適なオリゴヌクレオチドは、配列番号14、16、17または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。特定の実施形態においては、これらのオリゴヌクレオチドは、本発明に記載のヘアピン構造を含む。そのような好ましいオリゴヌクレオチドとしては、非メチル化形態の遺伝子を検出するための配列番号3、6、9および12に記載の配列ならびにメチル化形態の遺伝子を検出するための配列番号15および18に記載の配列が挙げられる。
【0036】
本発明の「遺伝子」または「目的の遺伝子」は、好ましくはMAGEA3および/またはMAGEA6遺伝子である。MAGEA3およびMAGEA6は、HUGO Gene Nomenclature Committeeにより認可された遺伝子記号である。MAGEA3遺伝子は、染色体X(位置q28)上に位置し、その遺伝子配列は受託番号NM_005362およびENSG00000197172の下で列挙されている。MAGE-A3遺伝子は、メラノーマ抗原ファミリーA, 3をコードする。MAGEA6遺伝子は、染色体X(位置q28)上に位置する。MAGE-A3は、MAGE-3またはMAGEA3として互換的に言及されることが多い。同様に、MAGE-A6はMAGE-6またはMAGEA6として互換的に言及されることが多い;全て本明細書で用いられる。これらの遺伝子の低メチル化は、例えば、メラノーマまたは肺癌(NSCLCを含む)などの癌の発生率と関連し得る。
【0037】
メチル化を受けやすいCpGジヌクレオチドは、典型的には、ヒト遺伝子のプロモーター領域に集中する。好ましい実施形態においては、前記遺伝子のメチル化状態を、該遺伝子のプロモーター領域中のメチル化のレベルを決定することにより評価する。「プロモーター」は、転写開始部位(TSS)から上流の領域であり、TSSから約10 kb、3 kb、1 kb、500 bpまたは150〜300 bpに伸長する。MAGE-3については、プロモーター領域中のCpGの分布はむしろ珍しい。
【0038】
用語「メチル化状態」とは、DNA配列内の1個または複数個のCpGジヌクレオチドでの5-メチルシトシン(「5-mCyt」)の存在または非存在を指す。「高メチル化」は、正常レベルを超えるメチル化レベルの増加と定義される。かくして、それは、遺伝子、頻繁にはプロモーター領域中の特異的CpG部位でのシトシンの異常なメチル化(5-mCyt)に関する。メチル化の正常レベルを、例えば、非癌細胞中でのメチル化のレベルを決定することにより定義することができる。
【0039】
「低メチル化」とは、「正常な」DNA配列(好適な対照サンプル中に認められる)内の対応するCpGジヌクレオチドに認められる5-mCytの量と比較して、(試験DNAサンプルの)DNA配列内の1個または複数個のCpGジヌクレオチドでの5-mCytの存在の減少を指す。
【0040】
再度、メチル化の「正常な」レベルを、例えば、非癌細胞中のメチル化レベルを決定することにより定義することができる。本発明においては、MAGE-A3および/またはMAGE-A6遺伝子の低メチル化は、癌の信頼できる指示因子を提供するこの腫瘍関連抗原遺伝子の発現の増加を示す。
【0041】
本発明は、第2の態様において、DNAを含有するサンプル中のメチル化または非メチル化遺伝子の存在および/または量を検出する方法であって、DNAを含有するサンプルと、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる少なくとも1個のオリゴヌクレオチドとを接触させる工程を含む、前記方法を提供する。好ましくは、この方法は、前記遺伝子がメチル化されているか、またはメチル化されていないかを評価するさらなる工程を含む。これは、前記オリゴヌクレオチドが、本明細書に考察されるように、DNAを含有するサンプル中のDNAに安定に結合するかどうかに依存し得る。
【0042】
メチル化状態を評価するための技術は、様々な手法に基づく。本発明のオリゴヌクレオチドを適用する任意の好適な技術を用いることができる。一実施形態においては、メチル化CpGジヌクレオチドモチーフを検出するための手法は、DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基をもたらす試薬を使用する。この試薬は、メチル化シトシン残基を修飾せず、かくして、好ましくは、核酸増幅を含んでもよい、下流のプロセスにおいて非メチル化核酸分子とメチル化核酸分子との識別が可能になる。一実施形態においては、前記試薬は、非メチル化シトシン残基を選択的に脱アミノ化するように作用してもよい。かくして、前記試薬への曝露後、非メチル化DNAは、対応するメチル化DNAのものとは異なるヌクレオチド配列を含む。シトシンの脱アミノ化は、チミンと同じ塩基対特性を有するが、シトシン塩基対性質とは異なる、ウラシル残基の存在をもたらす。これはメチル化シトシンと非メチル化シトシンとの識別を可能にする。
【0043】
配列の差異を評価するための有用な従来技術は、オリゴヌクレオチドプライマーを用いる。プライマーを設計するための2つの手法が可能である。第1に、プライマー自体がDNAメチル化の任意の潜在的な部位をカバーしないプライマーを設計することができる。異なるメチル化の部位における配列の変化は、2つのプライマー結合部位の間に位置し、配列変化の可視化にはさらなるアッセイ工程が必要である。第2に、最初に処理された配列のメチル化または非メチル化形態と特異的にハイブリダイズするプライマーを設計することができる。ハイブリダイゼーション後、増幅反応を実施し、当業界で公知の任意の検出系を用いて増幅産物をアッセイすることができる。増幅産物の存在は、プライマーがDNAにハイブリダイズしたことを示す。プライマーの特異性は、DNAが修飾されたか否かを示し、次いで、DNAがメチル化されたか否かを示す。標的に対して相補的な十分な領域、例えば、12、13、14、15、16、17、18、19、20、21または22個のヌクレオチドがある場合、プライマーはハイブリダイゼーションを阻害しないが、他の操作にとって有用であってよい追加のヌクレオチド残基をも含んでもよい。そのような他の残基の例は、制限エンドヌクレアーゼ切断のための部位、リガンド結合のための部位、または因子結合もしくはリンカーもしくはリピートのための部位、または可視化のための残基であってよい。前記オリゴヌクレオチドプライマーは、それらが修飾メチル化残基にとって特異的であるようなものであってもよい。プライマーとしての使用のための好ましいオリゴヌクレオチドは、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。
【0044】
修飾核酸と非修飾核酸とを識別するためのさらなる方法は、オリゴヌクレオチドプローブを用いることである。そのようなプローブは、修飾核酸に、または増幅により得られた産物などの修飾核酸のさらなる産物に直接的にハイブリダイズし得る。プローブに基づくアッセイは、特定の配列へのオリゴヌクレオチドハイブリダイゼーションおよびその後のハイブリッドの検出を生かすものである。また、増幅産物を検出する前にさらなる精製工程、例えば、沈降工程が存在してもよい。オリゴヌクレオチドプローブを、当業界で公知の任意の検出系を用いて標識することができる。これらのものとしては、限定されるものではないが、蛍光部分、放射性アイソトープ標識部分、生物発光部分、発光部分、化学発光部分、酵素、基質、受容体、またはリガンドが挙げられる。プローブとして用いるための好ましいオリゴヌクレオチドは、配列番号2、4、5、7、8、11、13、14、16、17、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。
【0045】
「オリゴヌクレオチドプライマー」を、本明細書では「プライマー」と互換的に言及する。同様に、「オリゴヌクレオチドプローブ」を、本明細書では「プローブ」と互換的に言及する。
【0046】
好ましい実施形態においては、前記遺伝子(またはその一部、特に、CpGアイランド)のメチル化状態を、メチル化特異的PCR(MSP)を用いて決定する。
【0047】
MSP技術は、当業者には知られているであろう。MSP手法においては、亜硫酸水素ナトリウム処理の結果としての配列差異を利用することにより、メチル化DNAから非メチル化DNAを識別するように設計されたプライマー対を用いて、DNAを増幅することができる(Herman JG et al. Proc Natl Acad Sci U S A. 1996 Sep 3;93(18):9821-6およびWO 97/46705)。MSP技術の特定例は、リアルタイム定量的MSP(QMSP)と呼ばれ、リアルタイムにメチル化DNAの信頼性の高い定量化を可能にする。
【0048】
リアルタイム方法は、一般的には増幅手順の連続的な目視モニタリングに基づくものであり、生成物中の取込みを定量化することができ、その量が鋳型中のその配列のコピー数を示す、蛍光標識された試薬を用いる。そのような標識試薬は、二本鎖DNAに優先的に結合し、その蛍光が、二本鎖DNAの結合により大きく増強される蛍光染料であってよい。あるいは、標識されたプライマーおよび/または標識されたプローブを用いることができる。それらは、TAQMAN(登録商標)、MOLECULAR BEACONS(登録商標)、AMPLIFLUOR(登録商標)およびSCORPION(登録商標)DzyNA(登録商標)などのよく知られ、商業的に入手可能なリアルタイム増幅技術の特異的増幅である。これらのリアルタイム方法を、ポリメラーゼ連鎖反応(PCR)と共に用いることが多い。
【0049】
TaqMan技術は、蛍光染料とクエンチング染料を含む、線状の、加水分解オリゴヌクレオチドプローブを用いる。
【0050】
照射された場合、励起された蛍光染料は、蛍光を発するよりもむしろ、近隣のクエンチング染料分子にエネルギーを移動させる(FRET原理)。TaqManプローブは、PCR産物の内部領域にアニーリングし、ポリメラーゼが鋳型を複製する時に、そのエキソヌクレアーゼ活性により切断される。これはクエンチャーの活性を終結させ、リポーター染料は蛍光を放出し始め、プローブ切断の速度と比例して各サイクルにおいて増加する。
【0051】
また、分子ビーコンも蛍光染料およびクエンチング染料を含むが、蛍光共鳴エネルギー移動(FRET)を起こすように両染料を近位に持って行くために溶液中で遊離しながら、ヘアピン構造を取るように設計される。ビーコンがアニーリング工程の間に標的にハイブリダイズする場合、ヘアピンは線状化し、両染料(供与体および受容体/クエンチャー)が分離する。供与体から検出される蛍光の増加は、利用可能なPCR産物の量と相関するであろう。
【0052】
スコーピオンプローブに関しては、単一のオリゴヌクレオチドを用いて、配列特異的プライミングおよびPCR産物検出を達成する。スコーピオンプローブは、ハイブリダイズしていない状態でステムループ配置を維持し、フルオロフォアとクエンチャーの間でFRETが起こる。ステムの3'部分はまた、プライマーの伸長産物と相補的である配列も含む。この配列を、増幅不可能なモノマーを介して特異的プライマーの5'末端に連結する。スコーピオンプライマーの伸長後、特異的プローブ配列は、伸長されたアンプリコン内のその相補体に結合することができ、かくして、ヘアピン構造を開き、フルオロフォアとクエンチャーを分離し、ならびに蛍光シグナルを提供する。
【0053】
重メチルにおいては、プライミングはメチル化特異的であるが、伸長不可能なオリゴヌクレオチドブロッカーはプライマー自身の代わりにこの特異性を提供する。このブロッカーはメチル化特異的様式で亜硫酸水素処理されたDNAに結合し、その結合部位はプライマー結合部位と重複する。ブロッカーが結合した場合、プライマーは結合することができず、従って、アンプリコンは生成されない。重メチルを、リアルタイム検出と共に用いることができる。
【0054】
Plexor(商標)qPCRおよびqRT-PCR系は、2個の修飾ヌクレオチド間の特異的相互作用を利用して、定量的PCR分析を達成するものである。PCRプライマーの一方は、5'末端にイソ-dC残基に隣接する蛍光標識を含む。第2のPCRプライマーは標識されない。反応混合物はデオキシヌクレオチドと、クエンチャーであるダブシルで修飾されたイソ-dGTPを含む。ダブシル-イソ-dGTPは、イソ-dC残基と相補的な位置で優先的に取り込まれる。この位置でのダブシル-イソ-dGTPの取込みは、相補鎖上での蛍光染料のクエンチングおよび蛍光の減少をもたらし、増幅の間に定量化が可能になる。これらの多重反応のために、異なるフルオロフォアを有するプライマー対を、それぞれの標的配列のために用いる。
【0055】
かくして、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるオリゴヌクレオチドを、目的の遺伝子のメチル化状態の検出のための上記方法におけるプライマーまたはプローブとして用いることができる。
【0056】
好ましい実施形態においては、本発明は、DNAを含有するサンプル中の目的のメチル化または非メチル化遺伝子の存在および/または量を検出するリアルタイム方法であって、
(a)DNAを含有するサンプルと、該DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を産生するが、メチル化シトシン残基を修飾しない試薬とを接触させること/該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマー対であって、その少なくとも1個のプライマーが、前記試薬を用いる処理後に、それぞれメチル化または非メチル化DNAの配列にのみ結合するように設計され、該プライマー対中の少なくとも1個のプライマーが、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、前記プライマー対を用いて、目的のメチル化または非メチル化遺伝子の少なくとも一部を増幅すること、
を含む、前記方法を提供する。
【0057】
本発明の方法における目的の遺伝子は、好ましくは、MAGE-A3および/またはMAGEA6遺伝子である。好ましくは、前記プライマー対中の少なくとも1個のプライマーは、増幅の非存在下で、受容体部分が供与体部分により放出される(励起の際に)蛍光をクエンチし、増幅の間に、検出可能な蛍光シグナルを生成するのに十分に供与体部分と受容体部分を分離するようにステムループ構造が破壊されるように配置された、分子エネルギー移動対の供与体部分と受容体部分を担持するステムループ構造を含むプライマーである。これをリアルタイムで検出して、目的のメチル化または非メチル化遺伝子の存在の示唆を提供することができる。配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、前記プライマー対中のプライマーは、ステムループ構造を担持するのが好ましい。
【0058】
特定の実施形態においては、メチル化または非メチル化遺伝子の遺伝子コピー数を決定する。ここで、本明細書に記載の方法は、さらなる工程:
(c)目的のメチル化または非メチル化遺伝子に関する標準曲線に対してリアルタイム検出の結果を定量化して、遺伝子コピー数の出力を得ること、
を含むのが好ましい。
【0059】
好ましくは、工程(c)はさらに、サイクルの閾値が40未満である場合、増幅が正当であると考えられることを特徴とする。
【0060】
MageA3および/またはMageA6遺伝子などの遺伝子については、非メチル化形態の遺伝子の検出が主に関連し得る。
【0061】
本発明の方法により、目的のメチル化または非メチル化遺伝子の存在を、リアルタイムでサンプル中で検出することができる。本発明の方法は定量的方法であるため、目的の遺伝子のメチル化または非メチル化形態の(相対)量を、反応が進行するにつれて決定することもできる。しかしながら、リアルタイム方法を用いる必要はない。標的DNAがサンプル中の存在するか否かを発見するためにのみ、分析を行うことができる。エンドポイント増幅検出技術は、リアルタイムPCRのために広く用いられているものと同じ手法を利用する。従って、本発明の方法は、DNAを含有するサンプル中の目的のメチル化または非メチル化遺伝子の存在および/または量を検出するエンドポイント方法を包含してもよい。
【0062】
かくして、本発明は、DNAを含有するサンプル中の目的のメチル化または非メチル化遺伝子の存在および/または量を検出する(エンドポイント)方法であって、
(a)DNAを含有するサンプルと、該DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を産生するが、メチル化シトシン残基を修飾しない試薬とを接触させることおよび/または該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマー対であって、その少なくとも1個のプライマーが、前記試薬を用いる処理後に、それぞれメチル化または非メチル化DNAの配列にのみ結合するように設計され、該プライマー対中の少なくとも1個のプライマーが、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、前記プライマー対を用いて、目的のメチル化または非メチル化遺伝子の少なくとも一部を増幅すること、
を含む、前記方法を提供する。
【0063】
上記のように、本発明の方法における目的の遺伝子は、好ましくはMAGE-A3および/またはMAGE-A6遺伝子である。好ましくは、前記プライマー対中の少なくとも1個のプライマーは、本明細書に記載の特徴を有する分子エネルギー移動対の供与体部分と受容体部分とを担持するステムループ構造を含むプライマーである。配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマー対中のプライマーは、好ましくはステムループ構造を担持する。
【0064】
MAGE-A3および/またはMAGE-A6遺伝子については、非メチル化形態の遺伝子の検出が主に関連し得る。配列番号2、3、4、5、6、7、8、9、11、12、13または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーを、前記試薬を用いる処理後に非メチル化MAGEA3 DNAを検出するために設計した。
【0065】
非メチル化遺伝子の非存在は、メチル化遺伝子の存在を示すであろう。しかしながら、メチル化遺伝子の検出も、本発明の範囲内にある。配列番号14、15、16、17、18または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーを、前記試薬を用いる処理後にメチル化MAGEA3 DNAを検出するために設計した。
【0066】
メチル化または非メチル化遺伝子の遺伝子コピー数を所望する場合、前記方法は、好ましくは、
(c)目的のメチル化または非メチル化遺伝子に関する標準曲線に対して検出の結果を定量化して、遺伝子コピー数の出力を得る工程、
をさらに含む。
【0067】
本発明の全ての実施形態は、本発明のエンドポイント態様に適用可能であり、かくして、変更すべきところは変更して適用される。エンドポイント分析は、増幅の終わりでの蛍光を決定するための蛍光プレートリーダーまたは他の好適な装置の使用を想定してもよい。
【0068】
本発明の方法は、最も好ましくは、任意の好適な(DNAを含有する)試験サンプル上で実行されるex vivoまたはin vitroでの方法である。しかしながら、一実施形態においては、前記方法はまた、サンプルを取得する工程を含んでもよい。試験サンプルは、DNAを含有するサンプル、特に、目的の遺伝子を含む、DNAを含有するサンプルである。本発明の方法を、特に、目的の遺伝子のメチル化が疾患の発生率と関連する(ことが知られる)場合、疾患の診断において用いることができる。
【0069】
DNAを含有するサンプルは、任意の好適な組織サンプルまたは体液を含んでもよい。好ましくは、試験サンプルをヒト被験者から取得する。癌への適用のためには、前記サンプルは、癌性であると疑われる組織または代表的な体液から取られた組織サンプルを含んでもよい。
【0070】
MAGE-A3遺伝子の低メチル化は、肺癌と関連してきた。かくして、一実施形態においては、MAGE-A3遺伝子を含む本発明の方法において用いられる試験サンプルは、好ましくは、肺細胞または肺細胞から得られる核酸を含む。最も好ましくは、前記サンプルは、ホルマリン固定パラフィン包埋(FFPE)組織である。2つの型の肺癌が存在する:非小細胞肺癌(NSCLC)および小細胞肺癌(SCLC)。この名称は単に、腫瘍中に認められる細胞の型を説明するものである。前記試験サンプルは、好ましくは、非小細胞肺癌(NSCLC)に由来する細胞または核酸を含む。NSCLCとしては、扁平上皮細胞癌、腺癌、および大細胞癌が挙げられ、肺癌の約80%を占める。好ましい実施形態においては、癌がNSCLCである場合、サンプルは肺組織サンプルまたは唾液サンプルである。NSCLCは治癒が困難であり、利用可能な治療はできるだけ長く延命し、疾患の症候を緩和するためのものになる傾向がある。NSCLCは最も一般的な型の肺癌であり、不良転帰と関連する。
【0071】
MAGE-A3遺伝子の低メチル化はまた、膀胱癌とも関連する。かくして、さらなる実施形態においては、本発明の方法において用いられるさらに好ましい試験サンプルは、移行性膀胱細胞または扁平上皮癌膀胱細胞を含む。好ましくは、前記試験サンプルを膀胱組織から取得する。より好ましくは、それは尿由来のものであり、移行性膀胱細胞または扁平上皮癌膀胱細胞に由来する核酸を含む。前記試験サンプルを、液体尿、その沈降物、または尿中の沈降物から誘導することができる。前記組織および体液を、任意の好適な方法を用いて回収することができ、その多くは当業界でよく知られている。
【0072】
MAGE-A3遺伝子の低メチル化はまた、メラノーマとも関連する。メラノーマは組織病理学的用語でよく定義されている、色素沈着した、容易に到達できる病変である。初期の放射状増殖期(RGP)のメラノーマは、表皮および真皮乳頭層に侵入することができるが、転移能力を有さない;この段階での切除はほぼ完全に治癒的である。その後の垂直増殖期(VGP)は、より攻撃的な段階への移行を意味し、転移することができる。かくして、RGP/VGP移行で起こる遺伝子発現の変化は、非常に興味深い。かくして、さらなる実施形態においては、本発明において用いられるさらに好ましい試験サンプルは、メラノーマ細胞を含む。好ましくは、前記試験サンプルを、皮膚病変から取得する。
【0073】
本発明の方法における使用のための他のDNAを含有するサンプルとしては、診断、予後、または個別化された医学的使用のためのサンプルが挙げられる。これらのサンプルを、例えば、生検もしくは微細針吸引物などの外科的サンプルから、パラフィン包埋組織から、凍結腫瘍組織サンプルから、新鮮な腫瘍組織サンプルから、または新鮮な、もしくは凍結された体液から取得することができる。非限定例としては、全血、骨髄、脳脊髄液、腹水、胸膜液、リンパ液、血清、血漿、尿、乳糜、糞便、射精物、痰、乳頭吸引物、唾液、スワブ検体、結腸洗浄標本およびブラシ標本が挙げられる。組織および体液を、任意の好適な方法を用いて回収することができ、多くのそのような方法が当業界でよく知られている。パラフィン包埋標本の評価を、直接的に、または組織切片上で実施することができる。用語「サンプル」、「患者サンプル」および「患者のサンプル」は、互換的に用いられ、上記のような、患者に由来するDNAを含有するサンプルを意味すると意図される。
【0074】
本発明の方法を、精製された、または未精製のDNAを含有するサンプル上で実行することができる。しかしながら、好ましい実施形態においては、工程(a)(試薬処理工程)の前に、または予備工程として、DNAを含有するサンプルからDNAを単離/抽出/精製する。任意の好適なDNA単離技術を用いることができる。精製技術の例を、Molecular Cloning - A Laboratory Manual (第3版)、SambrookおよびRussell(特に、その中の添付物8および第5章を参照)などの標準的な教科書に見出すことができる。1つの好ましい実施形態においては、精製はDNAのアルコール沈降を含む。好ましいアルコールとしては、エタノールおよびイソプロパノールが挙げられる。また、好適な精製技術としては、塩に基づく沈降方法も挙げられる。かくして、1つの特定の実施形態においては、DNA精製技術は、夾雑物を沈降させるための高濃度の塩の使用を含む。その塩は、例えば、酢酸カリウムおよび/または酢酸アンモニウムを含む、本質的にそれからなる、またはそれからなってもよい。前記方法は、沈降させた夾雑物の除去、次いで、アルコール沈降を介するDNAの回収の工程をさらに含んでもよい。
【0075】
代替的な実施形態においては、DNA精製技術は、細胞溶解物から夾雑物を抽出するための有機溶媒の使用に基づく。かくして、一実施形態においては、前記方法は、DNAを抽出するためのフェノール、クロロホルムおよびイソアミルアルコールの使用を含む。好適な条件を用いて、夾雑物が有機相中に分離され、DNAが水相に残留することを確保する。さらなるキットは、磁気ビーズ、シリカ膜などを使用する。そのようなキットは当業界でよく知られており、市販されている。本発明の方法は、PUREGENE(登録商標)DNA精製キットを用いることができる。
【0076】
これらの精製技術の好ましい実施形態においては、抽出されたDNAを、エタノールまたはイソプロパノール沈降などのアルコール沈降を介して回収する。
【0077】
ホルマリン固定パラフィン包埋(FFPE)腫瘍組織は、臨床センター内での腫瘍組織保存のための通常の方法である。そのようなFFPE包埋サンプルは、DNA抽出の前に脱ろう工程を必要とする。好ましい実施形態においては、FFPE組織サンプルまたはスライド上に固定されたサンプル材料を、キシレン処理により最初に脱ろうする。キシレンとの接触期間は、キシレンがサンプルに接触し、それと相互作用するのに十分なものであるべきである。より好ましい実施形態においては、FFPEサンプルを100%キシレン中で約2時間、脱パラフィン化する。この工程を、もう一度繰り返して、完全な脱パラフィン化を確実にする。キシレン処理の後、サンプルを70%エタノールを用いて再水和する。
【0078】
本発明の方法はまた、必要に応じて(工程(a)の前に、または予備工程として)、サンプル中の単離/抽出/精製されたDNAの定量化を含んでもよい。サンプル中のDNAの定量化を、任意の好適な手段を用いて達成することができる。核酸の定量は、例えば、分光光度計、蛍光光度計またはUVトランスイルミネーターの使用に基づくものであってよい。好適な技術の例は、Molecular Cloning - A Laboratory Manual (第3版)、SambrookおよびRussell(特に、その中の添付物8を参照)などの標準的な教科書に記載されている。好ましい実施形態においては、Molecular Probes, Invitrogenから入手可能なPicogreen(登録商標)dsDNA定量キットなどのキットを用いて、DNAを定量することができる。
【0079】
本発明の方法は、DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を生成する試薬に依存する。前記試薬の作用様式は既に説明されている。好ましい実施形態においては、DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を生成するが、メチル化シトシン残基を修飾しない試薬は、亜硫酸水素塩試薬を含む、本質的にそれからなる、またはそれからなる(Frommerら、Proc. Natl. Acad. Sci. USA 1992 89:1827-1831)。いくつかの亜硫酸水素含有試薬が当業界で公知であり、脱アミノ化反応を実行するための好適なキットは市販されている(Zymo Research社製のEZ DNAメチル化キットなど)。本発明の方法における使用のための特に好ましい試薬は、亜硫酸水素ナトリウムを含む、本質的にそれからなる、またはそれからなる。
【0080】
一度、前記サンプル中のDNAを前記試薬で処理したら、該試薬により引き起こされるヌクレオチド配列における差異を検出する必要がある。これを、核酸増幅技術を用いて行う。既に記載のように、機能的に関連するメチル化は、遺伝子のプロモーター領域と最も一般的に関連する。特に、いわゆる「CpGアイランド」は、比較的高い発生率のCpG残基を含み、前記遺伝子のプロモーター領域中に認められることが多い。目的の遺伝子中のCpGアイランドを同定することができる様々なソフトウェアプログラムが存在する。従って、本発明の方法は、少なくとも1個のプライマー対を用いて目的のメチル化または非メチル化遺伝子の少なくとも一部を増幅することを含んでもよい。上記で考察されたように、メチル化状態を調査しようとする目的の残基は、典型的には規定のCpGアイランドおよび/または目的の遺伝子のプロモーター領域中に認められるため、前記プライマー対は、典型的には、全体よりもむしろ、前記遺伝子の一部のみ(この領域中の)を増幅するであろう。前記遺伝子の任意の好適な部分を、増幅産物が目的の遺伝子の存在の信頼できる指示因子として検出可能であるという条件で、本発明の方法に従って増幅することができる。特に容易に検出可能な増幅産物は、約50〜250 bpである。さらにより好ましくは、目的のメチル化または非メチル化遺伝子の増幅のための少なくとも1個のプライマー対を用いる増幅は、約100〜200 bpまたは50〜100 bpの増幅産物をもたらす。典型的には、限定されたDNA量が得られ、より小さいアンプリコンが望ましい場合、これは、組織サンプル、特に、パラフィン包埋サンプルにとって特に関連する。好ましい実施形態においては、検出可能な増幅産物は、配列番号2、4、5、7、8、11、13、14、16、17または19のいずれかの少なくともヌクレオチド配列を含む。好ましくは、(約)100 bp、110 bp、115 bp、120 bp、125 bp、126 bp、130 bp、135 bp、140 bpまたは142 bpの増幅産物が産生される。
【0081】
前記プライマー対中の少なくとも一方のプライマー、および好ましくは、両方のプライマーを、前記試薬を用いる処理後に、メチル化または非メチル化DNAの配列にのみ結合するように設計する。かくして、前記プライマーは、前記方法が行われる用途に応じて、メチル化形態の遺伝子(前記試薬を用いる処理後に未修飾のままである)または非メチル化形態の遺伝子(前記試薬により修飾される)とのみ塩基対を形成することにより、メチル化遺伝子と非メチル化遺伝子とを識別するように作用する。従って、このプライマーは、目的の遺伝子中の少なくとも1個のメチル化部位を包含しなければならない。好ましくは、前記プライマーは、少なくとも1個、2個、3個、4個、5個、6個、7個または8個のメチル化部位を含む遺伝子の領域に結合する。最も好ましくは、前記プライマーを、プライマー結合部位内のCpG対中の全てのシトシン残基がメチル化されるか、または非メチル化された、すなわち、「完全にメチル化された」または「完全に非メチル化された」配列である配列に結合するように設計する。しかしながら、1個または数個のメチル化部位のみが機能的に関連する場合、前記プライマーを、効率的な結合を起こすために、これらの残基のみをメチル化する(シトシンとして残る)か、または非メチル化する(ウラシルに変換する)必要がある標的配列に結合するように設計することができる。他の(機能的に関連しない)潜在的なメチル化部位を、好適なプライマー設計を介して完全に回避するか、またはこれらのあまり関連性のない部位のメチル化状態とは無関係に結合するプライマーを設計することができる(例えば、プライマー配列内の好適な位置にGおよびA残基の混合物を含有させることによる)。従って、メチル化または非メチル化形態の目的の遺伝子が元のDNAを含有するサンプル中に存在する場合にのみ、増幅産物が予想される。さらに、またはあるいは、例えば、遺伝子が、メチル化された機能的に重要な部位および非メチル化された別の機能的に重要な部位を含む場合、前記プライマー対中の少なくとも一方のプライマーが、前記試薬を用いる処理後に非メチル化DNAの配列にのみ結合し、他方のプライマーが、処理後にメチル化DNAにのみ結合することが好適であってよい。
【0082】
好ましくは、前記プライマー対中の少なくとも一方のプライマーは、分子エネルギー移動対の供与体部分と受容体部分を担持するステムループまたは「ヘアピン」構造を含有するプライマーである。このプライマーは、必要に応じてメチル化DNAと非メチル化DNAを識別するプライマーであってもよい。増幅の非存在下で、受容体部分が、励起の際に供与体部分により放出される蛍光をクエンチするように、プライマーを配置する。かくして、前記プライマーにより指示される増幅の前に、または増幅の非存在下では、ステムループまたは「ヘアピン」構造は無傷のままである。供与体部分により放出される蛍光は、蛍光のクエンチングをもたらす受容体部分により効率的に受容される。
【0083】
増幅の間に、プライマーのステムループまたはヘアピン構造の配置を変化させる。特に、一度、プライマーが増幅産物中に、特に、二本鎖DNA中に組込まれたら、(特に2周目の増幅の間に)ステムループまたはヘアピン構造が破壊される。構造におけるこの変化は、受容体部分が、供与体部分により放出される蛍光をもはや効率的にクエンチすることができないほど十分に供与体部分と受容体部分を分離する。かくして、供与体部分は検出可能な蛍光シグナルを産生する。このシグナルをリアルタイムで検出して、目的のメチル化または非メチル化遺伝子の遺伝子コピー数の示唆を提供する。
【0084】
かくして、本発明の方法は、分子エネルギー移動(MET)標識で検出可能に標識された核酸の増幅のためのオリゴヌクレオチドを利用することができる。前記プライマーは、MET対の供与体および/または受容体部分を含み、増幅産物がMET対の供与体および受容体部分の両方を含むように、増幅反応の増幅産物中に組込まれる。
【0085】
増幅産物が二本鎖である場合、増幅産物中に組込まれるMET対は同じ鎖上にあってもよく、増幅が3増幅である場合、反対の鎖上にあってもよい。増幅において用いられるポリメラーゼが5'-3'エキソヌクレアーゼ活性を有する特定の例においては、MET対部分の1つを、このエキソヌクレアーゼ活性により、増副産物の集団の少なくともいくつかから切断することができる。そのようなエキソヌクレアーゼ活性は、本発明の増幅方法にとって有害ではない。
【0086】
本明細書に考察される本発明の方法は、ポリメラーゼ連鎖反応(PCR)、3増幅、および他の増幅系などの核酸配列の増幅のための多くの方法に適合可能である。
【0087】
好ましい実施形態においては、METは、オリゴヌクレオチドを供与体および受容体部分で標識し、供与体部分がフルオロフォアであり、受容体部分がフルオロフォアであってよく、供与体部分により放出される蛍光エネルギーが受容体部分により吸収される、蛍光共鳴エネルギー移動(FRET)である。受容体部分はクエンチャーであってよい。かくして、増幅プライマーは、供与体部分と受容体部分の両方を含むヘアピンプライマーであり、受容体部分が供与体の蛍光をクエンチするように配置される。プライマーを増幅産物中に組込む場合、その配置が変化し、クエンチングが排除され、供与体部分の蛍光を検出することができる。
【0088】
本発明の方法により、組み込まれなかったオリゴヌクレオチドを予め分離することなく増幅産物を検出することができる。さらに、それらにより、標識されたオリゴヌクレオチドを増幅産物に組込むことにより、該産物を直接的に検出することができる。
【0089】
好ましい実施形態においては、本発明の方法は、参照遺伝子の発現を決定することも含む。参照遺伝子は、異なるサンプル間で比較を行うのに重要である。比較しようとするサンプル間で安定かつ信頼性の高い様式で発現されると考えられる好適な遺伝子を選択することにより、目的の遺伝子と共に参照遺伝子の増幅の検出は、入力材料の量、酵素的効率、サンプル分解などの内部サンプル変数を考慮に入れる。参照遺伝子は、理想的には、信頼性の高い入力DNA量の存在下、試験下でサンプル間で定常的に発現されるものである。かくして、目的の遺伝子から得られる結果を、対応するコピー数の参照遺伝子に対して正規化することができる。本発明にとって好適な参照遺伝子としては、β-アクチン、グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDH)、18SリボソームRNAなどのリボソームRNA遺伝子およびRNAポリメラーゼII遺伝子(Radonic A.ら、Biochem Biophys Res Commun. 2004 Jan 23;313(4):856-62)が挙げられる。特に好ましい実施形態においては、参照遺伝子はβ-アクチンである。
【0090】
かくして、本発明の方法はさらに、少なくとも1個のプライマー対を用いて参照遺伝子の少なくとも一部を増幅し、該プライマー対中の少なくとも1個のプライマーが、上記特性を有するステムループ構造を含むプライマーであることを特徴とする。
【0091】
参照遺伝子の任意の好適な部分を、増幅産物が参照遺伝子の存在の信頼できる指示因子として検出可能であるという条件で、本発明の方法に従って増幅することができる。特に容易に検出可能な増幅産物は、約50〜250 bpである。さらにより好ましくは、参照遺伝子の増幅のための少なくとも1個のプライマー対を用いる増幅は、約100〜200 bpの増幅産物を産生する。これは、典型的には、限られたDNA量が得られる、組織サンプル、特に、パラフィン包埋サンプルについては特に関連する。
【0092】
参照遺伝子が本発明の方法に含まれる実施形態においては、該方法はさらに、メチル化された、またはメチル化されていない目的の遺伝子に関する標準曲線に対して(リアルタイム)検出の結果を定量することを含む該方法の工程が、それぞれ、遺伝子コピー数の出力をもたらす参照遺伝子に関する標準曲線に対して参照遺伝子のリアルタイム検出の結果を定量することも含み、必要に応じて、メチル化された、またはメチル化されていない目的の遺伝子の遺伝子コピー数を、参照遺伝子の遺伝子コピー数で除算することにより、結果を正規化することをさらに含むことを特徴とする。
【0093】
再度、前記方法は、サイクル閾値が40未満である場合、増幅が有効であると考えられることを特徴とする。これは、好ましくは目的の遺伝子と参照遺伝子の両方に関する事例である。
【0094】
参照遺伝子の少なくとも一部の増幅は、一般的には少なくとも1個のプライマー対を用いる。好ましくは、前記プライマー対中の少なくとも1個のプライマーは、目的の遺伝子に関して、分子エネルギー移動対の供与体部分と受容体部分を担持するステムループ構造を含むプライマーである。増幅中のそのような構造の作用様式は、本明細書で説明されている。
【0095】
本発明の方法における使用のための「ヘアピン」プライマーは、最も好ましくは、米国特許第6,090,552号およびEP 0912597号(その開示はその全体が本明細書に組み入れられるものとする)に記載されたものである。これらのプライマーは、Amplifluor(登録商標)プライマーとして商業的に公知である。かくして、特に好ましい実施形態においては、目的の遺伝子および/または参照遺伝子の一部を増幅するのに用いられるステムループ構造を含むプライマーは、5'から3'の順に、以下の連続する配列:
(a)第1のヌクレオチド配列を、分子エネルギー移動対の供与体部分と受容体部分から選択される第1の部分で標識し、供与体部分が、励起された場合、1個以上の特定の波長で蛍光を放出し、受容体部分が、該供与体部分により放出された該蛍光を吸収および/もしくはクエンチする、約6〜30個のヌクレオチドの第1のヌクレオチド配列;
(b)約3〜20個のヌクレオチド含む、本質的にそれからなる、もしくはそれからなる第2の一本鎖ヌクレオチド配列;
(c)第3のヌクレオチド配列を、前記供与体部分と前記受容体部分から選択される第2の部分で標識し、第2の部分が第1のヌクレオチド配列を標識しない前記群のメンバーであり、第3のヌクレオチド配列が、二本鎖が第1のヌクレオチド配列と第2のヌクレオチド配列との間で形成することができるように、第1のヌクレオチド配列とは逆向きに相補的であり、第1の部分と第2の部分が近位にあり、供与体部分が励起され、蛍光を放出する場合、受容体部分が供与体部分により放出された蛍光を吸収し、クエンチする、約6〜30個のヌクレオチドを含む、本質的にそれからなる、もしくはそれからなる第3のヌクレオチド配列;ならびに
(d)プライマーの3'末端の、配列番号2、4、5、7、8、11、13、14、16、17、19もしくは25のいずれかの配列をその3'末端に含む(およびかくして、遺伝子のメチル化された、もしくはメチル化されていないDNAの一部を含む核酸鎖と相補的なヌクレオチド配列の核酸ポリメラーゼによる合成をプライミングすることができる)約8〜40個のヌクレオチドを含む、本質的にそれからなる、もしくはそれからなる第4の一本鎖ヌクレオチド配列、
を含む、本質的にそれからなる、またはそれからなり、前記二本鎖が形成されない場合、第1の部分と第2の部分は、該第1および第2の部分の間の分子エネルギー移動を阻害する距離により分離される。
【0096】
特に好ましい実施形態においては、前記供与体部分と受容体部分は、蛍光共鳴エネルギー移動(FRET)対を形成する。分子エネルギー移動(MET)は、供与体分子と受容体分子の間でエネルギーが非放射的に通過するプロセスである。蛍光共鳴エネルギー移動(FRET)は、METの形態である。FRETは特定の化合物の特性から生じる;特定の波長の光への曝露により励起された場合、それらは様々な波長で光を放出する(すなわち、それらは蛍光を発する)。そのような化合物をフルオロフォアと呼ぶ。FRETにおいては、エネルギーは、フルオロフォアである供与体分子と、受容体分子との間で長距離(10〜100Å)に渡って非放射的に通過する。供与体は光子を吸収し、このエネルギーを受容体に非放射的に移動させる(Forster, 1949, Z. Naturforsch. A4: 321-327; Clegg, 1992, Methods Enzymol. 211: 353-388)。励起スペクトルと放出スペクトルが重複する2種のフルオロフォアが近くにある場合、一方のフルオロフォアの励起は第2のフルオロフォアにより吸収され、それを刺激する波長で光を放出する原因となり、順に、蛍光を発する原因となるであろう。換言すれば、第1の(供与体)フルオロフォアの励起状態のエネルギーは、近隣の第2の(受容体)フルオロフォアとの共鳴誘導性双極子-双極子相互作用により移動する。結果として、供与体分子の寿命は低下し、その傾向はクエンチされるが、受容体分子の蛍光強度は増強され、脱分極する。供与体の励起状態のエネルギーが非フルオロフォア受容体に移動する場合、供与体の蛍光は受容体により蛍光をその後放出することなくクエンチされる。この場合、受容体はクエンチャーとして機能する。クエンチャーと受容体の両方を本発明において用いることができる。蛍光共鳴エネルギー移動(FRET)に関与することができる分子対を、FRET対と呼ぶ。エネルギー移動が起こるためには、供与体分子と受容体分子は、典型的には、近い位置になければならない(最大で70〜100Å)(Clegg, 1992, Methods Enzymol. 211: 353-388; Selvin, 1995, Methods Enzymol. 246: 300-334)。エネルギー移動の効率は、供与体分子と受容体分子との距離と共に急速に落ちる。Forster(1949, Z. Naturforsch. A4:321-327)によれば、エネルギー移動の効率は、D x 10-6(Dは供与体と受容体との距離である)に比例する。効率的には、これは、FRETが最大で約70Åの距離で最も効率的に起こり得ることを意味する。FRETにおいて一般的に用いられる分子を、別の節において考察する。フルオロフォアが供与体であるか、または受容体であるかを、その励起および放出スペクトル、およびそれが対形成したフルオロフォアにより定義する。例えば、FAMは488 nmの波長を有する光により最も効率的に励起され、500〜650 nmのスペクトルを有する光を放出し、最大で525 nmの光を放出する。FAMはJOE、TAMRA、およびROX(全て最大514 nmの励起波長を有する)と共に用いるための好適な供与体フルオロフォアである。
【0097】
1つの特に好ましい実施形態においては、前記供与体部分はフルオレセインまたはその誘導体であり、前記受容体部分はDABCYLである。好ましくは、フルオレセイン誘導体は、6-カルボキシフルオレセインを含む、本質的にそれからなる、またはそれからなる。
【0098】
MET標識を、前記プライマー中の任意の好適な点に付着させることができる。特に好ましい実施形態においては、供与体部分と受容体部分を、ステムループが無傷のままでありながら、前記部分が互いに物理的に近位にあるように、ステムループ構造内の相補的ヌクレオチド上に配置する。しかしながら、本発明のプライマーを、一度、プライマーが増幅産物中に組込まれたら、供与体と受容体の増幅および分離の非存在下で、それぞれの供与体と受容体との間でのMET/FRETを可能にするのに有効な任意の位置で前記部分を用いて標識することができる。
【0099】
ステムループまたはヘアピン構造配列は、それが標的遺伝子(目的の遺伝子または参照遺伝子)に結合しないため、そのヌクレオチド配列に依存しない。従って、次いで、目的の配列のリアルタイム検出を容易にする配列特異的プライマーと組合わせることができる「ユニバーサル」ステムループまたはヘアピン配列を設計することができる。主な配列要件は、その配列が増幅の非存在下で安定である(およびかくして、効率的なクエンチングを確保する)ステムループ/ヘアピン構造を形成することである。かくして、前記プライマーの配列特異的部分は、鋳型鎖に結合し、相補鎖の合成を指令する。従って、前記プライマーは、増幅の1周目において増幅産物の一部となる。相補鎖が合成される時、増幅はステムループ/ヘアピン構造を介して起こる。これにより、フルオロフォアとクエンチャー分子が分離し、かくして、増幅が進行するにつれてフルオロフォアの生成を誘導する。ステムループ構造は、増幅において用いられるプライマーの配列特異的部分の5'末端に見出されるのが好ましい。
【0100】
上記のように、この検出配列を、一般的にはFRET対を用いて標識する。ステムループまたはヘアピン構造が無傷のままである場合、FRETが2個の部分間で有効であるように、FRET対中の一方の部分は、前記配列の5'末端に向かって、その近くに、または5'末端に見出され、他方の部分は該配列の3'末端に向かって、その近くに、または3'末端に見出されるのが好ましい。
【0101】
実験の節に詳述するように、プライマーを注意深く選択して、本発明の方法の感度および特異性を確保しなければならない。従って、前記遺伝子のメチル化状態を検出するのに用いるための特に好ましいプライマーとしては、
5'-AGCGATGCGTTCGAGCATCGCU-3'(配列番号1)
5'-ATTTTTGTTTGGAATTTAGGGTAG-3'(配列番号2)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUCCAACATCAAACCATCACTCA-3'(配列番号3)
および/もしくは
5'-CCAACATCAAACCATCACTCA-3'(配列番号4)
および/もしくは
5'-TGGAATTTAGGGTAGTATTGT-3'(配列番号5)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUTGGAATTTAGGGTAGTATTGT-3'(配列番号6)
および/もしくは
5'-CCCTCCACCAACATCAAA-3'(配列番号7)
および/もしくは
5'-TTAGGATGTGATGTTATTGATTTGT-3'(配列番号8)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUTTAGGATGTGATGTTATTGATTTGT-3'(配列番号9)
および/もしくは
5'-TGTTTGGAATTTAGGGTAGTATTGT-3'(配列番号11)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUTGTTTGGAATTTAGGGTAGTATTGT-3'(配列番号12)
および/もしくは
5'-CCATCACTCATTACTCAAAACAAA-3'(配列番号13)
および/もしくは
5'-ATTTTTGTTCGGAATTTAGGGTAG-3'(配列番号14)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUCCGACGTCAAACCGTCGCTCG-3'(配列番号15)
および/もしくは
5'-CCGACGTCAAACCGTCGCTCG-3'(配列番号16)
および/もしくは
5'-CGGAATTTAGGGTAGTATCGT-3'(配列番号17)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUCCCTCCGCCGACGTCAAA-3'(配列番号18)
および/もしくは
5'-CCCTCCGCCGACGTCAAA-3'(配列番号19)
に記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーが挙げられる。
【0102】
配列番号1は、ヘアピン構造の配列である。配列番号2、5、8または11は、Mageプロモーターの亜硫酸水素変換非メチル化配列と相補的なフォワードプライマー配列である。
【0103】
配列番号1は、ヘアピン構造配列である。配列番号6、9および12は、ヘアピン構造配列およびそれぞれ配列番号5、8および11の配列を含む。
【0104】
配列番号4、7および13は、Mageプロモーターの亜硫酸水素変換非メチル化配列と相補的なリバースプライマー配列である。
【0105】
配列番号3は、ヘアピン構造配列および配列番号4の配列を含む。
【0106】
配列番号14および17は、Mageプロモーターの亜硫酸水素変換メチル化配列と相補的なフォワードプライマー配列である。
【0107】
配列番号16および19は、Mageプロモーターの亜硫酸水素変換メチル化配列と相補的なリバースプライマー配列である。
【0108】
配列番号15および18は、ヘアピン構造配列ならびにそれぞれ配列番号16および19の配列を含む。
【0109】
実験の節に詳述するように、MAGE-A3の発現およびメチル化レベルは、配列5’ TGGAATTTAGGGTAG 3’(配列番号25)を含む3種全部のプライマー、配列番号2、5または11を組込んだアッセイにおいて最良の一致を示した。かくして、別の実施形態においては、MAGE-A3のプロモーター領域に結合する好ましいプライマーは、配列番号25を含む。MAGE-A3の亜硫酸水素変換配列と相補的なプライマーの部分は、25 bp未満であるのが好ましい;好ましくは、それは23、22、21、20または19 bpの長さである。かくして、そのような好ましいプライマーのMage-A3特異的部分は、好ましくは24〜19 bpの長さであるか、または23〜19 bpの長さである。好ましくは、それは19 bpの長さである。かくして、前記プライマーは、配列5’-ATTTTTGTTTGGAATTTAGGGTAGTATTGT-3’(配列番号26)に由来する23、22、21、20または19個の連続する塩基の任意の配列を含んでもよい。最も好ましくは、前記プライマーのMage-A3特異的部分は、配列番号2、4、5または7に記載のヌクレオチド配列からなる。
【0110】
配列番号2、3、4、5、6、7、8、9、11、12または13のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーは、低メチル化(非メチル化)MAGE-A3遺伝子の検出にとって特に有用である。好ましいプライマーは、配列番号2、3、4、5、6または7のヌクレオチド配列を有する。
【0111】
配列番号14、15、16、17、18または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーは、高メチル化(メチル化)MAGE-A3遺伝子の検出にとって特に有用である。
【0112】
本発明の方法/キットおよびアッセイにおける使用のための好ましいプライマー対は、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる少なくとも1個のプライマーを含む。好ましいプライマー対は、配列番号2と3;配列番号6と7;配列番号9と4;配列番号12と13;配列番号14と15;または配列番号17と18のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。最も好ましいプライマー対は、配列番号6と7のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。
【0113】
前記プライマーのいずれか一方または両方を、標識するか、または上記で詳細に考察したように、好ましくは5'末端に、供与体部分と受容体部分を担持する好適なステムループまたはヘアピン構造を含むように合成することができる。好ましい実施形態においては、前記プライマーの一方または両方を、標識するか、または好ましくは、5'末端に、
5'-AGCGATGCGTTCGAGCATCGCU-3'(配列番号1)
に記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるステムループ構造を含むように合成する。
【0114】
この検出配列を、一般的には、FRET対を用いて標識する。ステムループまたはヘアピン構造が無傷のままである場合、FRETが2個の部分間で有効であるように、FRET対中の一方の部分は、前記配列の5'末端に向かって、その近くに、または5'末端に見出され、他方の部分は、該配列の3'末端に向かって、その近くに、または3'末端に見出されるのが好ましい。特に好ましい実施形態においては、ステムループまたはヘアピン構造、特に、配列番号1に記載の配列を含む、本質的にそれからなる、またはそれからなる核酸を、その5'末端で、FAMを用いて、その3'末端でDABCYLを用いて標識する。他の好ましい組合せは本明細書で考察されており、その考察は変更すべきところは変更して適用することができる。
【0115】
これらのプライマーは、本発明の別の態様を形成する。これらのプライマーのさらなる特徴を、以下の詳細な説明(実験部分)にまとめる。これらの配列の変異体を本発明において用いることができることに留意されたい。特に、例えば、必要に応じて、結合特異性またはステムループの形成を改善するために、追加のフランキング配列を付加することができる。変異体配列は、配列番号1〜9および11〜19または25に記載のプライマーおよび/またはプローブのヌクレオチド配列と少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%のヌクレオチド配列同一性を有するのが好ましい。前記プライマーおよびヘアピン構造は、必要に応じて合成ヌクレオチド類似体を含んでもよく、または例えば、DNA、RNAもしくはPNAに基づくもの、またはその混合物であってもよい。同様に、代替的な蛍光供与体および受容体部分/FRET対を、必要に応じて用いることができる。蛍光供与体および受容体部分を用いて標識することに加えて、前記プライマーは、本発明の方法におけるプライマーおよび/またはステムループ/ヘアピン構造としての機能が阻害されないという条件で、修飾オリゴヌクレオチドならびに他の付加基および標識を含んでもよい。
【0116】
それぞれのプライマー対について、少なくとも一方のプライマーを、増幅の非存在下では、受容体部分が供与体部分により放出された(励起の際に)蛍光をクエンチし、増幅の間には、リアルタイムで検出されて前記遺伝子の遺伝子コピー数の示唆を提供する検出可能な蛍光シグナルを産生するのに十分な供与体および受容体部分を分離するように、ステムループ構造が破壊されるように配置される分子エネルギー移動対の供与体および受容体部分で標識する。好ましくは、前記供与体部分と受容体部分は、FRET対である。一実施形態においては、前記供与体部分と受容体部分を、5-カルボキシフルオレセインもしくは6-カルボキシフルオレセイン(FAM)、2',7'-ジメトキシ-4',5'-ジクロロ-6-カルボキシフルオレセイン(JOE)、ローダミン、6-カルボキシローダミン(R6G)、N,N,N'-テトラメチル-6-カルボキシローダミン(TAMRA)、6-カルボキシ-X-ローダミン(ROX)、5-(2'-アミノエチル)アミノナフタレン-1-スルホン酸(EDANS)、アントラニラミド、クマリン、テルビウムキレート誘導体、マラカイトグリーン、反応性Red 4、DABCYL、テトラメチルローダミン、ピレンブチラート、エオシンニトロチロシン、エチジウム、およびテキサスレッドから選択する。さらなる実施形態においては、前記供与体部分を、フルオレセイン、5-カルボキシフルオレセインもしくは6-カルボキシフルオレセイン(FAM)、ローダミン、5-(2'-アミノエチル)アミノナフタレン-1-スルホン酸(EDANS)、アントラニラミド、クマリン、テルビウムキレート誘導体、マラカイトグリーン、および反応性Red 4から選択し、前記受容体部分を、DABCYL、ローダミン、テトラメチルローダミン、ピレンブチラート、エオシンニトロチロシン、エチジウム、およびテキサスレッドから選択する。好ましくは、前記供与体部分はフルオレセインまたはその誘導体であり、前記受容体部分はDABCYLであり、最も好ましくは、供与体部分は6-カルボキシフルオレセインである。特に、多重的な内容において、他の好ましい組合せを本明細書で考察し、これらの組合せも本発明のこれらの態様について想定される。
【0117】
本発明はまた、本発明の方法を実行するために用いることができるキットも提供する。このキットは、本明細書に記載の本発明の様々な方法(および使用)に関連して記載された好ましい特徴のいずれかを含んでもよい。かくして、本発明は、少なくとも1個の本発明のプライマー対を含む、DNAを含有するサンプル中のメチル化された、またはメチル化されていない目的の遺伝子の存在および/または量を検出するためのキットを提供する。好ましくは、このキットは、メチル化されていない、および/またはメチル化されたMAGE-A3遺伝子の存在および/または量を検出するための本発明のプライマー対ならびに参照遺伝子、特に、β-アクチンの存在および/または量を検出するためのプライマー対を含む。かくして、前記キットは、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25に記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーを含むプライマー対を含んでもよい。好ましくは、それぞれのプライマー対中の少なくとも一方のプライマーを、好適なステムループまたはヘアピン構造で標識して、上記で考察されたように(この考察は本明細書では変更すべきところは変更して適用することができる)、リアルタイムでの検出を容易にする。最も好ましくは、それぞれのプライマー対中の少なくとも一方のプライマーは、配列番号1に記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるステムループまたはヘアピン構造を含む。ステムループ構造を、本明細書で考察されたように(この考察は本明細書では変更すべきところは変更して適用することができる)、好適な供与体および受容体部分で標識する。
【0118】
上記のように、本発明のプライマーのさらなる特徴を、以下の詳細な説明(実験部分)にまとめる。これらの配列の変異体を、本明細書で考察されたように本発明において用いることができる。代替的な蛍光供与体および受容体部分/FRET対を、本明細書に考察されたように、必要に応じて用いることができる。
【0119】
一実施形態においては、本発明のキットはさらに、本明細書に考察されたように、非メチル化シトシンを修飾する(保護されたメチル化シトシン残基に優先する)試薬を含む。そのような試薬は、非メチル化シトシン残基からメチル化シトシン残基を識別するのに有用である。好ましい実施形態においては、前記試薬は、亜硫酸水素塩、好ましくは、亜硫酸水素ナトリウムを含む。この試薬は、非メチル化シトシン残基をウラシルに変換することができるが、メチル化シトシンは未変換のままである。残基中のこの差異を用いて、シトシンとウラシルとを識別するプライマー(グアニンについてはシトシン対であるが、アデニンについてはウラシル対)を用いるPCRなどの下流のプロセスにおいてメチル化された核酸とメチル化されていない核酸とを識別することができる。
【0120】
本明細書に記載の本発明の方法に関して考察されるように、好適な対照を用いて、該方法のための品質対照として働かせることができる。従って、一実施形態においては、本発明のキットはさらに、メチル化状態が公知である1種以上の対照核酸分子を含む、本質的にそれからなる、またはそれからなる。これらの(1種以上の)対照核酸分子は、メチル化されていることが公知であるか、もしくはそのように処理された核酸および/または非メチル化されていることが公知であるか、もしくはそのように処理された核酸分子の両方を含んでもよい。一般的には非メチル化されているが、メチル化されるように処理することができる好適な内部参照遺伝子の一例は、β-アクチンである。
【0121】
本発明のキットは、本発明の特許請求された方法を実行するための好適なバッファーおよび他の試薬をさらに含んでもよい。かくして、本発明の方法に関して提供される考察は、本明細書では変更すべきところは変更して適用することができ、簡潔さのために繰り返さないものとする。一実施形態においては、本発明のキットはさらに、核酸増幅バッファーを含む、本質的にそれからなる、またはそれからなる。
【0122】
前記キットはまた、核酸増幅を触媒する酵素をさらに含み、本質的にそれからなるか、またはそれからなってもよい。かくして、前記キットはまた、核酸増幅のための好適なポリメラーゼをさらに含み、本質的にそれからなるか、またはそれからなってもよい。その例としては、Taq、Pfu、VentなどのファミリーAおよびファミリーB型のポリメラーゼの両方に由来するものが挙げられる。
【0123】
キットの様々な成分を、個々の区画中に別々に包装するか、または例えば、必要に応じて、一緒に保存してもよい。
【0124】
前記キットはまた、別々のシート上に印刷してもよいか、または例えば、キットの包装中に組み入れてもよい、使用のための好適な説明書を含んでもよい。この説明書は、その多くが市販されている好適なリアルタイム増幅装置と共に本発明のキットを使用するのを容易にすることができる。
【0125】
本発明のリアルタイム方法の最後の工程は、メチル化された、またはメチル化されていない目的の遺伝子、および必要に応じて、参照遺伝子(含有させる場合)に関する標準曲線に対してリアルタイム検出の結果を定量することを含む。標準曲線を、標準物のセットを用いて作製することができる。それぞれの標準物は、必要に応じて、既知のコピー数、または濃度の目的の遺伝子および/または参照遺伝子を含む。典型的には、蛍光の基線値は、バックグラウンド蛍光を考慮して設定されるであろう。例えば、一実施形態においては、配列検出系(SDS)ソフトウェアを用いる。このソフトウェアは、増幅産物を検出する前に、3〜15サイクルの増幅反応のデフォルト基線範囲を設定する。次いで、蛍光の閾値を、この基線を超える統計学的に有意な値で定義する。典型的には、この閾値を、基線蛍光を超える10の標準偏差に設定する。好適なソフトウェアを、リアルタイム増幅反応を実行するための装置と共に提供する。このソフトウェアは、反応に関する基線と閾値を自動的に算出する。次いで、サイクル閾値(Ct)を、各標準物について決定することができる。これは、閾値増幅レベルを達成するのに必要とされるサイクル数である。かくして、反応混合物中の遺伝子標準物の初期濃度が大きいほど、増幅産物の特定の収率を達成するのに必要とされるサイクル数は少なくなる。標準的なDNAのセットの既知の初期コピー数のlog10に対するCtのプロットは、直線になる。これが標準曲線である。かくして、目的の遺伝子および参照遺伝子の増幅に関するCt値を用いる場合、これをそれぞれの標準曲線に対してそれぞれ内挿して、DNAを含有するサンプル中のコピー数を決定することができる。かくして、前記方法の出力は、それぞれの目的の遺伝子および参照遺伝子に関する遺伝子コピー数である。その結果を、メチル化された、またはメチル化されていない目的の遺伝子の遺伝子コピー数を、参照遺伝子の遺伝子コピー数により除算することにより正規化することができる。好ましい実施形態においては、Applied Biosystems 7900 HTファストリアルタイムPCRシステムを用いて、本発明の方法を実行する。好ましくは、個々の検出器のための基線および閾値を自動的に生成するためのAuto CTアルゴリズムなどの好適なアルゴリズムなどのSDSソフトウェアを用いるのが好ましい。
【0126】
本発明の方法を、任意の好適な増幅技術と共に用いることができるが、ポリメラーゼ連鎖反応(PCR)を用いて増幅を実行するのが最も好ましい。かくして、PCRが好ましい増幅方法であるが、ネステッドPCRなどの基本技術に対する変形を含有させるために、等価物を本発明の範囲内に含有させることもできる。例としては、限定されるものではないが、NASBA、3SR、TMAおよび3増幅などの等温増幅技術が挙げられ、その全ては当業界でよく知られており、好適な試薬が市販されている。他の好適な増幅方法としては、限定されるものではないが、リガーゼ連鎖反応(LCR)(Barringerら、1990)、MLPA、標的ポリヌクレオチド配列の選択的増幅(米国特許第6,410,276号)、コンセンサス配列プライムポリメラーゼ連鎖反応(米国特許第4,437,975号)、インベーダー技術(Third Wave Technologies, Madison, WI)、鎖置換技術、任意プライムポリメラーゼ連鎖反応(WO 90/06995)およびニック置換増幅(WO 2004/067726)が挙げられる。
【0127】
本発明のリアルタイムPCR方法は、一般的には、プライマーをアニーリングさせるために温度を低下させる工程、プライマー伸長のために温度を上昇させる工程、変性のために温度を上昇させる工程およびデータ収集のために温度を低下させる工程を含む。1つの特定の実施形態においては、データ収集工程を、約60℃〜64℃、最も好ましくは、約62℃の温度で実行するが、これは実施例の節に考察されるように、最大の感度および特異的結果を与えることが示されたからである。
【0128】
特定の実施形態においては、ポリメラーゼ連鎖反応の温度プロファイリングは、40〜50回反復、好ましくは約45回反復のサイクルを含む:
(a)約50℃で約2分間、
(b)約95℃で約10分間、
(c)約95℃で約15秒間、
(d)約62℃で約1分間。
【0129】
本発明の方法において特異的かつ高感度の結果をもたらすことが示された好ましい反応スキームは、段階1:50℃で2分間、段階2:95℃で10分間、段階3:95℃で15秒間、59℃で30秒間、59℃で30秒間(=プラトーデータ収集)を45回反復。
【0130】
本発明の方法を用いて、同じ反応において2種以上の目的の遺伝子を検出することができる。プライマーのいくつかの特異的セットの使用により、いくつかの核酸標的の増幅を同じ反応混合物において実施することができる。これを「多重化」と呼ぶことができる。好ましい実施形態においては、各標的のための一方または両方のプライマーは、FRET対を形成する蛍光部分およびクエンチング部分で標識されたヘアピンプライマーであってよい。いくつかの核酸標的の増幅には、異なる放出波長を有する、異なる蛍光供与体および/または受容体部分を用いて、各セットのプライマーを標識することが必要である。増幅後の検出および分析の間に、反応混合物に光を当て、反応において用いられるプライマーのセットの各々に関する特定の波長特性のそれぞれにおいて読み取る。かくして、前記混合物中の特定の標的DNAが増幅され、標識されたことを決定することができる。特定の実施形態においては、異なるそれぞれの標的配列の増幅のための2個以上のプライマー対を用いる。かくして、メチル化/非メチル化された目的の遺伝子の一団の存在および/または量を、単一のDNAを含有するサンプル中で検出することができる。
【0131】
また、多重化を、同じ反応中で目的の遺伝子と参照遺伝子の両方を検出する状況で用いることもできる。再度、好適な識別可能な供与体および/または受容体部分で標識されたプライマーにより、目的の遺伝子と参照遺伝子の増幅により生成されたシグナルを、それぞれ識別することができる。
【0132】
一実施形態においては、ユニバーサルクエンチャーを、それぞれ識別可能な放出最大波長を有する好適なフルオロフォア供与体と一緒に用いる。特に好ましいクエンチャーは、DABCYLである。クエンチャーとしてのDABCYLと一緒に、それぞれ、以下のフルオロフォアを用いて多重化を可能にすることができる:クマリン(最大放出475 nm)、EDANS(491 nm)、フルオレセイン(515 nm)、ルシファーイエロー(523 nm)、BODIPY(525 nm)、エオシン(543 nm)、テトラメチルローダミン(575 nm)およびテキサスレッド(615 nm)(Tyagiら、Nature Biotechnology, Vol. 16, Jan 1998; 49-53)。他の好ましい組合せは、本明細書で考察されている。
【0133】
代替的な実施形態においては、DNAを含有するサンプルを分割し、該サンプルの好適な一部に対して本発明の方法を実行して、直接比較可能な結果を得ることができる。かくして、目的の遺伝子と参照遺伝子の両方を検出する場合、サンプルを2つに分割して、一方のサンプル部分においては、リアルタイムでの目的の遺伝子の増幅、他方のサンプル部分においては、リアルタイムでの参照遺伝子の増幅を検出することができる。前記サンプルをさらに分割して、必要に応じて、好適な対照反応を実行することができる。このスキームの利点は、ユニバーサルFRET対を用いて、各プライマー対を標識し、様々な波長での放出を検出するための要件を取り除くことができる。しかしながら、この方法は、好適なサンプルを取得して、最初にサンプルを分割することができるかどうかに依る。任意の好適な反応容量を用いることができるが、1つの特定の実施形態においては、増幅工程のための総反応容量は、約10〜40μl、より好ましくは約10〜30μlおよび最も好ましくは約12μlである。
【0134】
一態様においては、本発明のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を、サンプル中の非メチル化(または低メチル化)MAGE-A3の存在が、癌または癌の素因を示す、癌または癌の素因を診断するために用いる。かくして、本発明は、癌または癌の素因を診断するためのキット、方法およびプライマーを提供する。
【0135】
「診断」を、疾患もしくは疾患の前段階のスクリーニング、疾患もしくは疾患の前段階の同定、疾患の病期および状態および進行のモニタリング、治療後の疾患の再発のチェックならびに特定の治療の成功のモニタリングを含むと本明細書では定義する。また、試験は予測値を有してもよく、これは用語「診断」の定義内に含まれる。試験の予測値を、癌に対する潜在的な罹りやすさのマーカーとして、または癌への進行のマーカーとして用いることができる。かくして、危険性のある患者を、該患者において同定可能な症候に関して、疾患がそれ自体を示す機会を有する前に同定することができる。好ましい実施形態においては、癌を、肺癌、メラノーマまたは膀胱癌から選択する。好ましい実施形態においては、診断のための方法およびアッセイは、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、からなる、本質的にそれからなる、またはそれからなるオリゴヌクレオチドを用いる。好ましい実施形態においては、癌または癌の素因の診断は、配列番号2、3、4、5、6、7、8、9、11、12、13、または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるオリゴヌクレオチドを用い、非メチル化形態の前記遺伝子を検出する。代替的な実施形態においては、診断のための方法およびアッセイは、配列番号14、16、17または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる少なくとも1個のオリゴヌクレオチドを用いる。
【0136】
試験を診断的に、または治療計画と共に実施することができる。上記のように、NSCLCにおけるMAGE-A3発現の予測値を確立するRT-PCRアッセイが記載されている。これらのアッセイは、MAGE-A3免疫療法剤を用いる治療にとって好適な患者の選択においてその用途がある。本発明者らは、本発明のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対またはキットを用いる非メチル化MAGE-A3の検出のために設計されたアッセイが、MAGE-A3を発現するものとしてサンプルを確実に分類することができることを示した。メチル化試験について得られたメチル化状態の結果は、RNAサンプルに対して用いられるMAGE-A3検出のための既存のRT-PCR試験について得られた結果と良好に一致する。従って、前記メチル化試験は臨床用途を有する。
【0137】
さらなる態様において、本発明は、被験者における癌の治療の成功可能性を予測する方法であって、
(a)被験者から得られたDNAを含有する試験サンプルを、該DNA中の非メチル化シトシン残基を選択的に修飾して検出可能な修飾残基をもたらすが、メチル化シトシン残基を修飾しない試薬と接触させること/該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマー対の少なくとも一方のプライマーを、前記試薬を用いる処理後に、対応する非メチル化DNAの配列にのみ結合するように設計し、該プライマー対中の少なくとも一方のプライマーが、配列番号2、3、4、5、6、7、8、9、11、12、13または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、少なくとも1個のプライマー対を用いて非メチル化MAGE A3遺伝子の少なくとも一部を増幅させること、
(c)MAGE-A3遺伝子のメチル化状態を決定すること、
を含み、前記サンプル中の非メチル化MAGE-A3の存在が、非メチル化MAGE-A3遺伝子が検出されないか、またはそのレベルがより低い場合よりも、MAGE-A3免疫療法剤を用いる治療の成功可能性がより高いことを示す、前記方法を提供する。
【0138】
工程(c)は、増幅産物が形成されたかどうかを同定することを含む。増幅産物の同定(本明細書で考察された任意の好適な技術を用いる)は、前記サンプル中の非メチル化または低メチル化MAGEA3の存在を示す。
【0139】
勿論、逆の状況も適用可能であり、従って、本発明の方法を同様に用いて、MAGEA3免疫療法剤に対する耐性、またはそれを用いる治療が成功しない可能性が存在するかどうかを決定することができる。前記サンプル中の非メチル化MAGE-A3の非存在は、治療に対する耐性が存在し、および/または治療が成功しない可能性があることを示す。また、特定の実施形態においては、メチル化DNAに特異的なプライマーを相補的な方法において用いることもできる。
【0140】
また、本発明の方法を用いて、患者のための好適な治療過程を選択することもできる。非メチル化MAGE-A3の存在は、MAGE-A3免疫療法剤を有益に投与することができることを示すが、非メチル化MAGE-A3の非存在または低レベルの非メチル化MAGE-A3は、免疫療法剤が禁忌であることを示す。本発明のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法に関して提供される考察は、本態様にも変更すべきところは変更して適用することができ、従って、全ての実施形態が、本発明のこの態様にとって、必要に応じて想定される。
【0141】
「治療の成功可能性」とは、任意の1種以上の列挙される治療剤、好ましくは、MAGE-A3免疫療法剤またはMAGE-A3を含む組成物を用いる癌の治療が、成功するであろう確率を意味する。
【0142】
「耐性」を、特定の免疫療法剤のいずれか1種を用いる癌の治療が成功する確率が低いこと、および/または治療効果を達成するにはより高い用量が必要とされることと定義する。
【0143】
MageA3の低メチル化を、特定の癌の型と関連付けることができる。従って、特定の実施形態においては、本発明は、サンプル中の膀胱癌、NSCLCなどの肺癌またはメラノーマに対する素因、またはその発生を検出する方法であって、本発明のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いてMAGE-A3遺伝子のメチル化状態を検出することを含み、該サンプル中の非メチル化MAGE-A3の検出が、癌および特にメラノーマ;非小細胞肺癌(NSCLC)などの肺癌;もしくは移行細胞癌などの膀胱癌に対する素因、またはその発生を示す、前記方法を提供する。さらなる実施形態においては、腫瘍または癌を、乳癌;食道癌などの頭部および頸部癌;扁平上皮細胞癌;精上皮腫;肝臓癌;多発性骨髄腫および結腸癌から選択する。
【0144】
さらなる態様においては、MAGE-A3陽性腫瘍の存在を決定するための方法であって、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いて、サンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、非メチル化MAGE-A3の存在が、MAGE-A3陽性腫瘍の存在について示す、前記方法を提供する。
【0145】
試験を、診断的に、または治療計画と共に実施することができる。MAGE-A3特異的免疫療法剤(ASCI)が開発されており、臨床試験において現在評価されている。また、試験を用いて、どの治療計画または予防計画を患者に対して使用するかを決定し、治療計画の効力をモニターすることもできる。
【0146】
従って、本発明はさらに、MAGE-A3免疫療法剤を用いる治療にとって好適な患者を同定および/または選択するための方法であって、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いて、患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、MAGE-A3遺伝子がメチル化されていない場合、被験者を、MAGE-A3免疫療法剤を用いる治療のために同定および/または選択する、前記方法を提供する。
【0147】
あるいは、前記遺伝子が非メチル化されていない場合、前記被験者をMAGE-A3免疫療法剤を用いる治療のために選択しないのが好ましい。
【0148】
関連する態様においては、本発明は、癌の治療の成功可能性を予測するための方法であって、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いて、患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、該遺伝子がメチル化されていない場合、MAGE-A3免疫療法剤を用いる治療の成功可能性が、該遺伝子がメチル化されている場合よりも高い、前記方法を提供する。
【0149】
あるいは、前記サンプル中の非メチル化MAGE-A3の非存在は、MAGE-A3免疫療法剤を用いる治療に対する耐性の可能性が、該遺伝子がメチル化されていない場合よりも高いことを示す。かくして、メチル化MAGE-A3遺伝子の検出(または低メチル化遺伝子の検出の欠如)は、免疫療法剤を用いる治療の成功確率が低いことを示す。
【0150】
かくして、患者集団を、MAGE-A3遺伝子に関してそのメチル化状態に基づいて、治療のために選択することができる。これにより、より多く集中され、個別化された形態の薬剤が得られ、かくして、最も有効であると考えられる薬剤を用いて患者を治療することができるため、成功率の改善がもたらされる。
【0151】
さらに関連する態様においては、本発明は、癌のための好適な治療計画を選択する方法であって、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いて、患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、該遺伝子がメチル化されていない場合、治療のために免疫療法剤(特に、MAGE免疫療法剤)を選択する、前記方法を提供する。
【0152】
あるいは、前記遺伝子が非メチル化されていない場合、免疫療法剤を用いる治療は禁忌である。
【0153】
また、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択された被験者における癌を治療する方法であって、免疫療法剤の投与を含む前記方法も提供される。好ましくは、本明細書に記載の全ての異なる態様について、非メチル化MAGE-A3遺伝子の検出は、MAGE-A3タンパク質レベルの増加に対応する。
【0154】
本発明において有用なMAGE-A3免疫療法剤は、MAGE-A3に基づく組成物を含む。MAGE-A3を含む組成物の例としては、完全長MAGE-A3、実質的に完全長のMAGE-A3およびMAGE-A3の断片、例えば、MAGE-A3のペプチドを含む組成物が挙げられる。
【0155】
本発明において用いることができるペプチドの例としては、以下のMAGE-A3ペプチドが挙げられる:

【0156】
MAGEタンパク質は、完全長MAGE-A3であってもよく、または実質的に完全長のMAGE-A3の断片、例えば、MAGE3のアミノ酸3〜314(合計312個のアミノ酸)、もしくは1〜10個のアミノ酸がMAGE-A3タンパク質のN末端および/もしくはC末端から欠失された他のMAGE-A3断片を含んでもよい。
【0157】
一実施形態においては、MAGE-A3タンパク質、断片またはペプチドを、融合パートナータンパク質に連結することができる。
【0158】
MAGE-A3タンパク質、断片もしくはペプチドおよび融合パートナータンパク質を化学的に結合させるか、または組換え融合タンパク質として発現させることができる。抗原およびパートナーを組換え融合タンパク質として発現させる実施形態においては、これは非融合タンパク質と比較して、発現系において産生されるレベルの増加をもたらし得る。かくして、融合パートナータンパク質は、Tヘルパーエピトープ(免疫学的融合パートナータンパク質)、好ましくは、ヒトにより認識されるTヘルパーエピトープの提供を援助し、および/または天然の組換えタンパク質よりも高い収率での該タンパク質(発現増強タンパク質)の発現を援助することができる。一実施形態においては、融合パートナータンパク質は、免疫学的融合パートナータンパク質および発現増強パートナータンパク質の両方であってよい。
【0159】
本発明の一実施形態においては、用いることができる免疫学的融合パートナータンパク質を、プロテインD、グラム陰性細菌、ヘモフィルス・インフルエンザB(Haemophilus influenza B)の表面タンパク質(WO 91/18926)またはその誘導体から誘導する。プロテインD誘導体は、該タンパク質の最初の1/3、または該タンパク質の最初の約1/3を含んでもよい。一実施形態においては、プロテインDの最初のN末端の109個の残基を、融合パートナーとして用いて、さらなる外因性T細胞エピトープを有するMAGE-A3抗原を提供し、大腸菌中での発現レベルを増加させることができる(かくして、発現エンハンサーとしても作用する)。代替的な実施形態においては、プロテインD誘導体は、最初のN末端の100〜110個のアミノ酸または最初のN末端の約100〜110個のアミノ酸を含んでもよい。一実施形態においては、プロテインDまたはその誘導体を脂質化し、リポプロテインDを用いることができる:脂質尾部は、抗原提示細胞への抗原の最適な提示を確保することができる。代替的な実施形態においては、プロテインDまたはその誘導体を脂質化しない。プロテインDの「分泌配列」または「シグナル配列」とは、天然タンパク質のほぼアミノ酸1〜16、17、18または19を指す。一実施形態においては、プロテインDの分泌またはシグナル配列とは、プロテインDのN末端の19個のアミノ酸を指す。一実施形態においては、分泌またはシグナル配列を、プロテインD融合パートナーのN末端に含有させる。本明細書で用いられる「最初の1/3」、「最初の109個のアミノ酸」および「最初のN末端の100〜110個のアミノ酸」とは、分泌またはシグナル配列の直後のプロテインD配列のアミノ酸を指す。必要に応じて、シグナル配列のアミノ酸2-Kおよび3-Lを、アミノ酸2-Mおよび3-Dと置換することができる。
【0160】
一実施形態においては、MAGE-A3は、プロテインD-MAGE-A3-His、432個のアミノ酸残基の融合タンパク質であってもよい。この融合タンパク質は、プロテインDのシグナル配列、プロテインDのアミノ酸1〜109、MAGE-A3タンパク質に由来する312個のアミノ酸(アミノ酸3〜314)、スペーサーおよび生産プロセスの間の融合タンパク質の精製を容易にすることができるポリヒスチジン尾部(His)、例えば、
i)18残基のシグナル配列およびプロテインDの最初のN末端の109個の残基;
ii)2個の非関連残基(メチオニンおよびアスパラギン酸);
iii)天然のMAGE-A3タンパク質の残基3〜314;
iv)ヒンジ領域として機能する2個のグリシン残基;ならびに
v)7個のヒスチジン残基、
を含む。
【0161】
この分子のアミノ酸配列を、図10(配列番号40)に示す。この抗原および以下にまとめたものは、WO 99/40188により詳細に記載されている。
【0162】
別の実施形態においては、免疫学的融合パートナータンパク質は、LytAとして知られるタンパク質またはそれから誘導されるタンパク質であってよい。LytAは、ペプチドグリカン主鎖中の特定の結合を特異的に分解するオートリシンである、N-アセチル-L-アラニンアミダーゼ、アミダーゼLytA(LytA遺伝子によりコードされる(Gene, 43 (1986) 265-272頁)を合成する肺炎連鎖球菌(Streptococcus pneumoniae)に由来する。LytAタンパク質のC末端ドメインは、コリンまたはDEAEなどのいくつかのコリン類似体への親和性を担う。この特性は、融合タンパク質の発現にとって有用な大腸菌C-LytA発現プラスミドの開発に活用されている。そのアミノ末端にC-LytA断片を含むハイブリッドタンパク質の精製が記載されている(Biotechnology: 10, (1992) 795-798頁)。一実施形態においては、前記分子のC末端部分を用いることができる。C末端中に認められ、残基178で始まるLytA分子の反復部分を用いることができる。一実施形態においては、LytA部分は、残基188〜305を含んでもよい。
【0163】
他の融合パートナーとしては、インフルエンザウイルスに由来する非構造タンパク質、NS1(ヘマグルチニン)を含む。一実施形態においては、NS1のN末端の81個のアミノ酸を用いるが、それらがTヘルパーエピトープを含むという条件で、異なる断片を用いてもよい。
【0164】
本発明の一実施形態においては、MAGE-A3タンパク質は、誘導体化された遊離チオールを含んでもよい。そのような抗原はWO 99/40188に記載されている。特に、カルボキシアミド化またはカルボキシメチル化誘導体を用いることができる。
【0165】
さらなる実施形態においては、MAGE-A3組成物は、MAGE-A3タンパク質、本明細書に記載の断片もしくはペプチドもしくは融合タンパク質をコードする核酸分子を含む。本発明の一実施形態においては、前記配列を好適な発現ベクター中に挿入し、DNA/RNAワクチン接種に用いることができる。前記核酸を発現する微生物ベクターを、ベクター由来免疫療法剤として用いることもできる。
【0166】
好適なウイルスベクターの例としては、レトロウイルス、レンチウイルス、アデノウイルス、アデノ関連ウイルス、単純ヘルペスウイルスなどのヘルペスウイルス、α-ウイルス、カナリポックスなどのポックスウイルスおよびワクシニアウイルスに基づく系が挙げられる。これらのウイルスを用いる遺伝子導入技術は、当業者には公知である。例えば、レトロウイルスベクターを用いて、本発明のポリヌクレオチドを宿主ゲノム中に安定に組込むことができるが、そのような組換えは好ましくない。対照的に、複製欠損アデノウイルスベクターはエピソームのままであり、従って、一過的な発現が可能になる。昆虫細胞(例えば、バキュロウイルスベクター)、ヒト細胞、酵母、細菌における発現を駆動することができるベクターを用いて、例えば、サブユニットワクチンとして、または免疫アッセイにおける使用のための、本発明のポリヌクレオチドによりコードされる、大量のMAGE-A3タンパク質を産生させることができる。
【0167】
好ましい実施形態においては、生ベクターとして用いられるアデノウイルスは、複製欠損サルアデノウイルスである。典型的には、これらのウイルスは、E1欠失を含み、E1遺伝子を用いて形質転換された細胞系上で増殖させることができる。好ましいサルアデノウイルスは、チンパンジーから単離されたウイルスである。特に、C68(Pan 9としても知られる)(米国特許第6,083,716号)ならびにPan 5、6およびPan 7(WO 03/046124)が、本発明における使用にとって好ましい。これらのベクターを操作して、遺伝子産物を発現することができるように、本発明の異種遺伝子を挿入することができる。そのような組換えアデノウイルスの使用、製剤および製造は、WO 03/046142に詳細に記載されている。
【0168】
核酸配列を取得するための従来の組換え技術、および発現ベクターの製造は、Maniatisら、Molecular Cloning - A Laboratory Manual; Cold Spring Harbor, 1982-1989に記載されている。
【0169】
タンパク質に基づく組成物については、本発明のタンパク質を、液体形態中または凍結乾燥形態中で可溶性の形態で提供することができる。
【0170】
各ヒト用量は、1〜1000μgのタンパク質を含んでもよい。一実施形態においては、前記用量は30〜300μgのタンパク質を含んでもよい。
【0171】
本明細書に記載のMAGE-A3含有組成物はさらに、ワクチンアジュバント、および/または免疫刺激サイトカインもしくはケモカインを含んでもよい。
【0172】
本発明における使用のための好適なワクチンアジュバントは、例えば、Freundの不完全アジュバントおよび完全アジュバント(Difco Laboratories, Detroit, MI);Merckアジュバント65(Merck and Company, Inc., Rahway, NJ);AS-2(SmithKline Beecham, Philadelphia, PA);水酸化アルミニウムゲル(ミョウバン)もしくはリン酸アルミニウムなどのアルミニウム塩;カルシウム、鉄もしくは亜鉛の塩;アシル化チロシンの不溶性懸濁液;陽イオンもしくは陰イオン的に誘導体化されたポリサッカリド;ポリホスファゼン;生分解性ミクロスフェア;モノホスホリルリピドAおよびクイルAなどの市販のものである。GM-CSFまたはインターロイキン-2、-7、もしくは-12などのサイトカイン、およびケモカインをアジュバントとして用いることもできる。
【0173】
一実施形態においては、前記アジュバントは、3-デ-O-アシル化モノホスホリルリピドA(3D-MPL)などのモノホスホリルリピドAと、アルミニウム塩との組合せを含んでもよい。あるいは、前記アジュバントは、WO 98/50399、WO 01/34617およびWO 03/065806に開示された、3D-MPLまたはリン酸アミノアルキルグルコサミニドなどの他のtoll様受容体4(TLR4)リガンドを含んでもよい。
【0174】
用いることができる別のアジュバントは、サポニン、例えば、QS21(Aquila Biopharmaceuticals Inc., Framingham, MA)であってよく、単独で、または他のアジュバントと組合わせて用いることができる。例えば、一実施形態においては、WO 94/00153に記載のQS21と3D-MPLの組合せなどのモノホスホリルリピドAとサポニン誘導体の組合せ、またはWO 96/33739に記載のような、QS21がコレステロールでクエンチされた組成物が提供される。他の好適な製剤は、水中油乳濁液およびトコフェロールを含む。一実施形態においては、前記アジュバントは、WO 95/17210に記載のように、水中油乳濁液中にQS21、3D-MPLおよびトコフェロールを含む。
【0175】
本発明における使用のための他のアジュバントは、CpGジヌクレオチドがメチル化されていない、非メチル化CpG含有オリゴヌクレオチドなどのTLR9アンタゴニストを含んでもよい。そのようなオリゴヌクレオチドはよく知られており、例えば、WO 96/02555に記載されている。
【0176】
本発明における使用のための好適なオリゴヌクレオチド(本文脈における)としては、以下のものが挙げられる:

【0177】
CpG含有オリゴヌクレオチドを、単独で、または他のアジュバントと共に用いることもできる。例えば、一実施形態においては、前記アジュバントは、CpG含有オリゴヌクレオチドとサポニン誘導体の組合せ、特に、WO 00/09159およびWO 00/62800に開示されたCpGとQS21の組合せを含む。
【0178】
従って、本明細書に記載のMAGE-A3を含む組成物であって、アジュバントが3D-MPL、QS21、CpGオリゴヌクレオチド、ポリエチレンエーテルもしくはエステルのうちの1種以上またはこれらのアジュバントの2種以上の組合せを含む、前記組成物が提供される。特定の実施形態においては、前記組成物内のMAGE-A3成分を、水中油もしくは油中水乳濁液ビヒクルまたはリポソーム製剤中で提供することができる。
【0179】
一実施形態においては、前記アジュバントは、3D-MPL、QS21および免疫刺激CpGオリゴヌクレオチドのうちの1種以上を含んでもよい。一実施形態においては、3種全部のアジュバント成分が存在する。前記成分を、リポソーム製剤またはWO 95/17210に記載のものなどの水中油乳濁液中で提供することができる。
【0180】
別の実施形態においては、3D-MPLとQs21を、水中油乳濁液中、かつCpGオリゴヌクレオチドの非存在下で提供する。
【0181】
用いられる3D-MPLの量は一般的に少量であるが、製剤に応じて、用量あたり1〜1000μg、好ましくは用量あたり1〜500μg、およびより好ましくは用量あたり1〜100μgの範囲にあってよい。
【0182】
本発明のアジュバント中のCpGまたは免疫刺激オリゴヌクレオチドの量は一般的には少量であるが、製剤に応じて、用量あたり1〜1000μg、好ましくは用量あたり1〜500μg、およびより好ましくは用量あたり1〜100μgの範囲にあってよい。
【0183】
本発明のアジュバントにおける使用のためのサポニンの量は、用量あたり1〜1000μg、好ましくは用量あたり1〜500μg、より好ましくは用量あたり1〜250μg、および最も好ましくは用量あたり1〜100μgの範囲にあってよい。
【0184】
本明細書に記載のアジュバント製剤はさらに、水中油乳濁液および/もしくはトコフェロールを含んでもよく、またはリポソーム組成物中で製剤化してもよい。
【0185】
他の好適なアジュバントとしては、モンタニドISA 720 (Seppic, France)、SAF (Chiron, California, United States)、ISCOMS (CSL)、MF-59 (Chiron)、Ribi Detox、RC-529 (GSK, Hamilton, MT)および他のアミノアルキルグルコサミニド4-リン酸(AGP)が挙げられる。
【0186】
一般的には、各ヒト用量は、0.1〜1000μg、例えば、0.1〜500μg、0.1〜100μg、または0.1〜50μgの抗原を含んでもよい。特定の免疫療法剤の最適量を、ワクチン接種された被験者における好適な免疫応答の観察などの標準的な試験により確認することができる。初回ワクチン接種後に、被験者は十分に間隔を空けた1回または数回の追加免疫を受けてもよい。
【0187】
あるいは、本発明の方法における使用のための組成物は、製薬上許容し得る賦形剤中に本明細書に記載のMAGE-A3を含む医薬組成物を含んでもよい。
【0188】
ここで、本発明を、以下の非限定的な実施例に関して説明する。
【0189】
(実施例)
詳細な説明−実験の節
【実施例1】
【0190】
リアルタイムAmplifluorアッセイ
直接リアルタイム蛍光メチル化特異的PCRアッセイ(リアルタイムMSPアッセイ)を開発して、MGMTプロモーターのメチル化状態を定義した(Vlassenbroeckら、J Mol Diagn 2008, 10:332-337)。この技術を、70頁の図4に関する図面の凡例に例示し、まとめる。
【0191】
Mage-A3に関する分析物の定量を、この技術を用いてうまく実施した。これは、ABI Prism(登録商標)7900HT装置(Applied Biosystems)上でのAmplifluor(登録商標)アッセイ形式を用いて、Mage-A3のための特異的プライマーおよびプライマー/検出対を用いる平行増幅/定量プロセスからなっていた。
【0192】
反応混合物中の最終プライマー濃度は、フォワードプライマー/検出およびリバースプライマーの両方について、100 nMであった。Roxを含む12.5μlのiTaqTM Supermix (BioRad, 2xバッファー)を、PCR反応に用いた。5μlの修飾鋳型DNAを含む、反応あたりの総量は25μlであった。ABI 7900HT SDS装置を、仕様の10分前に開始し、加熱カバーを105℃に到達させた。以下の温度プロファイルを用いた:段階1:50℃で2分間、段階2:95℃で10分間、段階3:95℃で15秒間、62℃で1分間(=プラトー-データ収集)を45回反復。
【0193】
標準曲線として用いられるプラスミド材料を、以下のように作製した:前記プライマーにより定義されるプロモーター配列をPCR増幅し、クローニングする(好適な単離され、亜硫酸水素修飾された細胞系のDNAを用いる)。この配列を配列決定により検証し、公開されたプロモーター配列と比較する。
【0194】
標準曲線(2 x 106 - 20コピー)を含有させて、そのCt値を標準曲線に内挿することにより未知のサンプルのコピー数を決定した。このアッセイにおいては、β-アクチンを参照遺伝子として用いた。
【実施例2】
【0195】
MAGE-A3アッセイおよびプライマー設計
Qiuら、Clinical Biochemistry 39 (2006), 259-2; Jangら、Cancer Research 61 (2001), 7959-7963およびFurutaら、Cancer Sci 95 (2004), 962-968に記載の非メチル化MAGE-A3を検出するのに有用なプライマーを合成し、新規プライマー配列に加えて表1に示す。
【0196】
非メチル化形態またはあるいはメチル化形態のMage A3を検出するためのフォワード(F)およびリバース(R)プライマーのコンピューター内設計を、MSP要件に適合させたPrimer3ソフトウェア(http://fokker.wi.mit.edu/primer3/input.htm)を用いて行った。条件は以下の通りであった:アンプリコンのサイズ:60-120 nt;プライマーのサイズ:18-27 nt;融点:55-65℃;最大3'自己相補性=0;TSS近辺の200 bpのウィンドウ(戻るまでの番号=2000)。
【0197】
U_プライマーを、非メチル化Mage-A3を検出するために設計し、M_プライマーをメチル化Mage-A3を検出するために設計した。最後に、プライマーA MAGE_A3およびMAGEA3_GO_1_U_F、MAGEA3_GO_2_U_R、MAGEA3_GO_1_U_R_AMP、MAGEA3_GO_2_U_F_AMP、MAGEA3_GO_1_M_F、MAGEA3_GO_2_M_F、MAGEA3_GO_1_M_R_AMPおよびMAGEA3_GO_2_M_R_AMPを、さらなる調査のために保持した。転写開始部位(TSS)と比較したU-プライマーの位置を、図1および図2に示す。このプライマーは転写開始部位の近くに位置する。
【0198】
フォワードまたはリバースプライマーのいずれかを合成して、ヌクレオチド配列:5' AGCGATGCGTTCGAGCATCGCU 3'(配列番号1)を5'末端に有する供与体および受容体部分を担持する好適なステムループまたはヘアピン構造を含有させた。
【0199】
様々なMAGEA3プライマーの組合せを試験した。最終的に、4つのU-アッセイと2つのM-アッセイを、さらなる開発のために保持した。各アッセイについて選択されたプライマーの組合せを表1にまとめる。
【表1】

【実施例3】
【0200】
分析アッセイの性能
アッセイの分析性能(検出限界および特異性)を、再構築された基質を用いて証明した。
【0201】
検出限界
非メチル化パターンに関するMSPの感度を決定するために、陽性であると確認された細胞系材料(LNCaPおよびGerl)を連続希釈し、対照(陰性)細胞系のDNA(DU145)と混合した。1/10;1/100および1/500の希釈物を作製した(表2を参照)。総量750 ngのDNA(U DNA + M DNA)を、Zymo Research社製EZ DNA Methylationキットを用いて亜硫酸水素処理した。
【表2】

【0202】
続いて、2.4μlの化学的に処理されたDNAを、非メチル化GO_2_Uアッセイ(LNCaP/DU145 DNA混合物)および非メチル化Furutaアッセイ(Gerl/DU145 DNA混合物)のための特異的プライマーを用いるMAGEA3リアルタイムMSPの鋳型として用いた。結果を図3に提供する。
【0203】
認められるように、MAGEA3 GO_2_UおよびMAGEA3_FurutaリアルタイムMSPのより低い検出限界が、1.5 ng(1/500希釈率)で繰り返し設定されたが、これは全サンプル調製手順を考慮したものである。PCR反応あたり10%のサンプルを用いるため、最終的な分析感度は0.15 ngである。
【0204】
分析特異性
MAGEA3 GO_1_U/GO_2_U/Furuta_UおよびQIU_Uプライマーセットの特異性を、CpGenome(商標)Universal Methylated/Unmethylated DNA(Chemicon International, CA, USA; カタログ番号S7821およびカタログ番号S7822)を用いるMSPならびにその後のアガロースゲル分析により確認した。簡単に述べると、amplifluorリアルタイムMSPを、以下の温度プロフィール:段階1:50℃で2分間、段階2:95℃で10分間、段階3:95℃で15秒間、62℃で1分間(=プラトー-データ収集)を45回反復を用いるI Cycler (Bio-Rad)上で実施した。Amplifluorに基づく検出には高い特異性が必須であるため、温度勾配を段階3で適用して、最良のアニーリング温度(57℃、58.1℃、60.3℃および61.8℃)を選択した。
【0205】
得られたPCR産物を全部、3%アガロースゲル上で泳動した。CpGenome(商標)Universal Methylated DNAを鋳型DNAとして用いた場合(57℃で試験)、バンドは可視化されなかったが、これにより非メチル化DNAに対する特異性が確認された。
【0206】
さらに、MAGEA3アッセイの特異性を、配列アラインメントを用いて、MAGE-Aファミリーの遺伝子数を互いに調査した。MAGEA3 GO_1_U/GO_2_U/Furuta_UおよびQIU_UプライマーセットとMAGE-A2およびMAGE-A12配列(変換配列)の不一致の番号を表3に示す。調査したUプライマーはMAGE-A3 U/MAGE-A6 Uにとって特異的であるようであった。
【表3】

【0207】
MAGE-A3調節配列のクローニングおよび性能標準曲線
364 bpの調節MAGE-A3 U DNA配列を、表4に示されるフランキングプライマーを用いてクローニングした。
【表4】

【0208】
このクローニングされた材料を、リアルタイムMSPのための標準曲線材料として用いた。最初に、6個の標準曲線の2個のプレートをランニング(running)することにより、再現性を確認した(2*106-2*101コピー)(2人の異なる操作者、3個のPCR混合物/操作者/プレート)。スロープ、PCR効率およびR2値をモニターしたところ、許容可能な結果が得られた。
【0209】
性能標準曲線
MAGEA3プラスミド材料の連続希釈液(2 x 106〜2 x 101コピー/5μl)を、表1の特定のプライマーおよびAmplifluor検出配列を用いて、以下の最適化された温度プロフィール:段階1:50℃で2分間、段階2:95℃で10分間、段階3:95℃で15秒間、59℃で30秒間、59℃で30秒間(=プラトー-データ収集)を45回反復を用いて2回ロードした。結果をSDS 2.2ソフトウェア(Applied Biosystems)を用いて生成し、Ct値(増幅曲線がソフトウェアにより自動的に設定された閾値を横断するサイクル数)としてエクスポートした。標準曲線の性能を表5に示す。
【表5】

【実施例4】
【0210】
細胞系材料に対するアッセイの性能
MAGEA3メチル化状態を、19種の細胞系について調査した。MAGEA3 UおよびMアッセイに関する、それぞれ最良のメチル化および非メチル化細胞系を、以下に示す。
【表6】

【0211】
【表7】

【実施例5】
【0212】
中間精度
中間精度を、非メチル化およびメチル化形態のMAGEA3プロモーター配列に関する同じアッセイを繰り返し行うことにより試験した。様々な数の完全に修飾されたMAGEA3 UおよびMAGEA3 MプロモーターDNA分子(標準曲線材料)を、繰り返し測定した。さらに、操作者因子を、2人の異なる技術を有する研究室の人間(操作者AおよびB)が2つの異なる日にアッセイを繰り返し実施することにより試験した(操作者1人、1日あたり、2回、3つの異なる標準曲線希釈を行った)。
【0213】
表8および9は、GO_1およびGO_2 UおよびM MAGEA3アッセイの中間精度を試験するために行った実験をまとめたものである。同じ数の分子に関する全ての結果の標準偏差が0.11〜1.29であることが示された。全ての相関係数の概要(異なる操作者および日)を、表9に示す(平均R2は0.9959〜0.9997である)。
【表8】

【0214】
【表9】

【実施例6】
【0215】
メラニン干渉
メラニンを含むサンプルからのPCRの効率が低いことが以前に報告された。Eckhartら(2000)は、メラノサイトから誘導されたRNAおよびcDNA調製物は両方とも、RT-PCR阻害剤を含み、核酸と共に精製されたことを見出した。候補阻害剤メラニンの調査により、それが熱安定性DNAポリメラーゼに可逆的に結合し、その活性を阻害することが示された。MAGEA3 U amplifluorアッセイを介してメラノーマサンプルを処理する前に、メラニンによる潜在的な阻害を調査した。
【0216】
合成メラニンを、Eckhartらにより記載されたように調製した。簡単に述べると、メラニン(SIGMA M8631)を、2 mg/mlの濃度で蒸留水に溶解し、激しくボルテックスし、室温で10分間、水浴中で超音波処理した。溶解しなかったメラニンを、9000 gの遠心分離により除去した。潜在的な阻害効果を、反応プロセスの様々な段階でメラニンを添加することにより試験した:
1)抽出前:1μgおよび5μgの調製されたメラニンを、250,000個のLNCaP細胞および250,000個のMCF7細胞に添加した、
2)抽出後:1μgおよび5μgの調製されたメラニンを、1μgのLNCapおよびMCF7 DNAに添加した、
3)亜硫酸水素処理後:1μgおよび5μgの調製されたメラニンを、PCR反応中で直接固定した。亜硫酸水素溶出容量を、一定の鋳型濃度(「a」と注釈を付ける、例えば、LNCaP a)またはPCR反応中の一定量の鋳型(「b」と注釈を付ける、例えば、LNCaP b)を有するように適合させた。
【0217】
これらのメラニン含有LNCaPおよびMCF7サンプルを、対応する非固定(non-spiked)メラニンサンプルを用いて同時に処理した。
【0218】
サンプルを、PUREGENE(登録商標)DNA精製キットおよびEZ DNAメチル化キットを用いてさらに処理した。化学的に修飾されたDNAを、MAGEA3 U、Gst-Pi MおよびACTBリアルタイムMSPのための入力材料として用いた。
【0219】
試験した遺伝子プロモーターおよびACTB参照遺伝子の回収されたコピー数を算出し、それぞれの条件について比較した。
【0220】
結果を図9に示す。メラニンを、DNA抽出の前または後に添加した場合、有意なPCR阻害効果は観察されなかった。PCR反応中に直接固定した場合、メラニンのみが明らかな阻害を示した。RT-PCRとは対照的に、高いメラニン含量を有するメラノーマサンプルを、PCR阻害の危険性を有さないリアルタイムMSPを介して処理することができる。
【実施例7】
【0221】
メラノーマ/肺サンプル中でのMAGE-A3メチル化状態およびRNA発現との一致
材料および方法
臨床サンプル:
メラノーマおよび肺癌患者に由来する外科的標本は、GSKBioにより提供されたものである:ゲノムDNAサンプル(gDNA)、RNA later(登録商標)溶液中の生検材料および対応するホルマリン固定パラフィン包埋組織(FFPE)を、GSKBio RNA発現データに基づいてMAGEA3陽性またはMAGEA3陰性と分類した。提供されたサンプルセットの概説を表10に詳述する。
【表10】

【0222】
細胞系:
細胞系を、陽性および陰性対照としてそれぞれの実行(run)に含有させた。臨床サンプルに対してamplifluorリアルタイムMSPアッセイを適用する前に、アッセイの感度および特異性を細胞系材料上で確認した。最良のMAGEA3メチル化および非メチル化細胞系を、表11にまとめる。Gerl、Staq en CRL9609をGSKBioから取得し、細胞系LNCaPおよびDU145をAmerican Type Culture Collectionから購入した。
【表11】

【0223】
DNA単離:
ホルマリン固定パラフィン包埋サンプルを、最初に750μlのキシレン中、2時間、脱パラフィン化した。2回目のキシレン処理を行った(400μlのキシレンで2時間)。次いで、250μlの70%エタノールを添加した後、13000 rpmで15分間遠心分離した。上清を除去し、サンプルを室温で空気乾燥した。
【0224】
RNA later(登録商標)中のサンプルを、カミソリの刃を用いて非常に小さい切片に切断した後、RNA later(登録商標)溶液を除去した。
【0225】
続いて、古典的なフェノール/クロロホルム抽出方法を用いてDNAを抽出し、50μlのLoTE (3 mM TRIS、0.2 mM EDTA、pH 8.0)中に再懸濁した。
【0226】
Picogreen(登録商標)dsDNA定量キット(Molecular Probes, #P7589)を用いて、製造業者の推奨に従ってDNAを定量した。キットと共に提供されたλDNAを用いて、標準曲線を調製した。FluoStar Galaxyプレートリーダー(BMG Lab technologies, Germany)を用いて、データを収集した。
【0227】
DNA修飾:
1.5μgのDNAを、Zymo Research社製EZ DNAメチル化キットを用いて、亜硫酸水素修飾にかけた。
【0228】
簡単に述べると、45μlのアリコートを、5μlのM-Dilution Bufferと混合し、1100 rpmで振とうしながら、37℃で15分間インキュベートした。次いで、100μlの希釈されたCT変換試薬を添加し、サンプルを暗室中、1100 rpmで振とうしながら、70℃で3時間インキュベートした。変換後、サンプルをさらに脱塩し、製造業者の説明書に従って脱スルホン化し、25μlのTris-HCl 1mM pH 8.0中で溶出させた。修飾されたDNAを、さらに処理するまで-80℃で保存した。
【0229】
DNA増幅:
リアルタイムMSPを、Applied Biosystems社製の7900HTファストリアルタイムPCRサイクラー上に印加した。
【0230】
非メチル化形態の遺伝子プロモーター配列を標的化するように設計された、4つのMAGEA3低メチル化アッセイを、例えば、表2のプライマーおよびプローブ、配列番号3、4および13のエクソン3 MAGE-A3特異的プライマーおよびプローブを用いて、WO 2007/147876に記載の方法に従って測定した、提供されたRNA発現データとの一致について試験した。無関係の参照遺伝子β-アクチン(ACTB)も測定した。プライマーおよびamplifluor検出配列を表1に示す。
【0231】
2.4μlの修飾ゲノムDNAサンプルを、Roxを含む6μlのiTaq(商標)Supermix(BioRad, 2 x バッファー)およびフォワードプライマー/ディテクターおよびリバースプライマーの両方について100 nMの最終プライマー濃度を含む、最終的な12μlのPCR反応容量に添加した。それぞれのMAGEA3設計のためのサイクリング条件は、50℃で2分間;95℃で10分間;次いで、95℃で15秒間、59℃で30秒間[ACTBについては62℃]および59℃で30秒間[ACTBについては62℃](=プラトー-データ収集)の45サイクルであった。
【0232】
結果をSDS 2.2.2ソフトウェア(Applied Biosystems)を用いて生成し、Ct値(増幅曲線が、ソフトウェアにより自動的に設定された閾値を横断するサイクル数)としてエクスポートした後、目的の亜硫酸水素修飾配列を含むプラスミドDNAまたは精製されたPCR産物を用いて、20〜2 x 106個の遺伝子コピー等価物の標準曲線に対してプロットされた値の線形回帰に基づいてコピー数を算出した。MAGEA3とACTBとの比を算出して、試験結果を生成させた。データを解釈するために、非盲目RNA発現データに基づいて臨床カットオフ(閾値)を定義した。
【0233】
サンプルを、図5に示された決定木に基づいて、メチル化、非メチル化、または無効と分類した。細胞系を陽性および陰性対照として各実行中に含有させ、DNA抽出工程での手順に入れた。
【0234】
以下の基準:a)両方の標準曲線のPCR効率が80%以上;b)少なくとも4つの関連するデータ点のr2が0.990以上;c)ΔCtが2回の間で1.5未満;d)日常的に含有させたNTCが増幅しない;e)陽性細胞系アッセイ対照の1.5μgの変換反応の10%が検出可能である;およびf)陰性細胞系アッセイ対照の1.5μgの変換反応の10%が標準曲線内で検出されない、を満たす場合、実行は有効であると考えた。
【0235】
結果
メチル化と遺伝子発現との一致:
メラノーマ:
MAGEA3の発現およびメチル化レベルを、同じサンプルセット上で比較した。合計、41個のメラノーマサンプルを、RT-PCRおよびリアルタイムMSPを用いて処理した。いくつかの設計のMAGEA3 U amplifluorアッセイを試験して、どのアッセイがGSKにより提供されたRNA発現データと最もよく一致するかを見た。最大一致および最小の偽陽性率を有するように臨床カットオフを設定した(表12を参照)。これらのサンプルにおけるMAGEA3メチル化状態に関するROC曲線を図6に示す。17個の陰性サンプルのうち、9個は他のMAGE-Aファミリーメンバーについても陽性であった;GO_2_UおよびFuruta Uアッセイはこれらの9個のサンプルを正確に分類した(100%の特異性)。
【0236】
これらのデータを総合すると、MAGEA3_GO_2_Uアッセイが、92.7%の一致率および100%の特異性で最良であった。
【表12】

【0237】
肺サンプル(生検およびFFPE):
上記の同じ設定を、異なるサンプルセットに対して試験した:RNA later(登録商標)中の52個の肺FFPRサンプルと61個の肺組織を、4つのMAGEA3 U amplifluorアッセイを介してスクリーニングし、対応するRNAデータに一致させた。
【0238】
これらの肺生検およびFFPEサンプル中のMAGEA3メチル化状態に関するROC曲線を、それぞれ図7および8に提供する。MAGEA3陰性サンプルのうち、9個は他のMAGE-Aファミリーメンバーについても陽性であった;MAGEA3 Uアッセイは9個全部のサンプルを正確に分類した(100%の特異性)。MAGEA3_GO_2_Uアッセイが、FFPEにおいては90.4%の一致率および生検においては91.8%の一致率で最良の性能のアッセイであり、100%の特異性を維持していた(表13)。
【表13】

【実施例8】
【0239】
MAGEA3アッセイによる肺サンプルの試験
肺癌に由来するDNAを、LNCaP & DU145対照細胞系と平行してMAGEA3(U & Mアッセイバージョン)およびβ-アクチンアッセイを介して処理した。いくつかの設計のMAGEA3 U amplifluorアッセイを試験して、どのアッセイがMAGEA3 GO_2 Uアッセイと最も一致するかを見た。実施例7に記載の実験条件を用いた。標準曲線は80%を超える効率を示した。R2は0.99よりも高かった。MAGEA3 GO_2 Uアッセイについては、カットオフ値を29に、MAGEA3 GO_1 Uアッセイについては22に;MAGEA3 GO_1 Mアッセイについては148に、およびMAGEA3 GO_2 Mアッセイについては167に設定した。MAGEA3のメチル化を同じサンプルセット上で比較した。結果を表14および15に示す。MAGEA3 GO_2 Uアッセイについては(カットオフ=29)、
・3個のサンプルを無効と分類し、これらのサンプルを他のU & Mアッセイとの比較に含ませない;
・9個のサンプルを非メチル化と分類する;
・15個のサンプルをメチル化と分類する。
【0240】
4つのMAGEA3 Uアッセイにより、有効なサンプルに関してMAGEA3 GO_2 Uアッセイと96%一致した同様の結果が得られる。MAGEA3 Mアッセイにより、MAGEA3 GO_2 Uアッセイと71%および75%の一致が得られた。
【表14】

【0241】
【表15】

【0242】
本発明は、本明細書に記載の特定の実施形態によりその範囲を限定されるべきではない。実際、本明細書に記載のものに加えて、本発明の様々な改変が、前記説明および添付の図面から当業者には明らかとなるであろう。そのような改変は、添付の特許請求の範囲内にあると意図される。さらに、本明細書に記載の全ての実施形態は、必要に応じて、幅広く適用可能であり、任意の、および他の全ての一致する実施形態と組合わせることができる。
【0243】
様々な刊行物が本明細書に引用されるが、その開示はその全体が参照により本明細書に組み入れられるものとする。
【技術分野】
【0001】
本発明は、MAGE-Aファミリー遺伝子発現の検出に関する。より具体的には、本発明は、メチル化または非メチル化形態のMAGE-A3を検出する方法および関連するオリゴヌクレオチド、プライマー、プローブ、プライマー対ならびにキットに関する。本発明の方法は、増幅技術、特に、蛍光に基づくリアルタイムおよびエンドポイントPCR法を含み、診断的、予測的および治療的に有用である。
【背景技術】
【0002】
MAGE遺伝子は、癌/精巣抗原のファミリーに属する。MAGEファミリーの遺伝子は、20を超えるメンバーを含み、MAGE A、B、CおよびD遺伝子からなる(Scanlanら(2002) Immunol Rev. 188:22-32; Chomezら(2001) Cancer Res. 61(14):5544-51)。それらは染色体X上でクラスター化しており(Lucasら、1998 Cancer Res. 58.743-752; Lucasら、1999 Cancer Res 59:4100-4103; Lucasら、2000 Int J Cancer 87:55-60; Lurquinら、1997 Genomics 46:397-408; Muscatelliら、1995 Proc Natl Acad Sci USA 92:4987-4991; PoIdら、1999 Genomics 59:161-167; Rognerら、1995 Genomics 29:725-731)、依然として不明確な機能を有する(Ohmanら、2001 Exp Cell Res. 265(2): 185-94)。MAGE遺伝子は高度に相同的であり、特に、MAGE-Aファミリーのメンバーは60〜98%の相同性を有する。
【0003】
ヒトMAGE-A3遺伝子は、メラノーマ(Furutaら、2004 Cancer Sci. 95, 962-968)、膀胱癌、肝細胞癌(Qiuら、2006. Clinical Biochemistry 39, 259-266)、胃癌(Hondaら、2004 British Journal of Cancer 90, 838-843)、結腸直腸癌(Kimら、2006 World Journal of Gastroenterology 12, 5651-5657)および肺癌(NSCLC)(Scanlanら、2002 Immunol Rev. 188:22-32; Jangら、2001 Cancer Res. 61, 21: 7959-7963)などの様々な型の腫瘍において発現される。唯一、精巣生殖細胞または胎盤を除いて、正常な成体組織においては発現が観察されていない(Haasら、1988 Am J Reprod Immunol Microbiol 18:47-51; Takahashiら、1995 Cancer Res 55:3478-382)。
【0004】
抗原特異的癌免疫療法剤(ASCI)は、高度に特異的な様式で癌細胞を認識し、排除するように免疫系を訓練するように設計された新しいクラスの薬剤である。そのようなものとして、ASCIは標的化された治療を可能にする。ASCIは2つの主成分を有する:癌細胞に対して免疫応答を特異的に指向させる「腫瘍抗原」および抗腫瘍免疫応答を増加させるために選択された免疫刺激化合物を含む「アジュバント系」。MAGE-A3抗原およびASCIにおける使用にとって好適な構築物は、WO99/40188に記載されており、非小細胞肺癌(NSCLC)を有する患者におけるMAGE-A3 ASCIに関する有望な第II相試験の結果が最近報告されている(J. Clin. Oncol. Vol. 25, No. 18S (June 20 Suppl.) 2007: 7554)。
【0005】
免疫療法から利益を得られるMAGE-A3を発現する患者を特異的に同定し、投与目的でMAGE-A3発現をモニターし、臨床試験においてMAGE-A3発現を同定するか、または単に癌を有する患者を早期段階で同定することができる定量的高効率アッセイを有することが重要である。いくつかの適用可能な診断方法が記載されており、半定量的RT-PCR(De Plaenら、1994 Immunogenetics 40(5):360-9)、他のPCRに基づく技術および低密度マイクロアレイ (Zammatteoら、2002 Clinical Chemistry 48(1) 25-34)が挙げられる。さらに、MAGE-A3 ASCIと共に使用するための改良されたRT-PCR法が、WO2007/147876に考察されている。
【0006】
存在するアッセイの最も大きな欠点は、それらがMAGEA3発現を評価するためにRNAの単離を要することである。ホルマリン固定され、パラフィン包埋された(FFPE)腫瘍組織は、臨床センター内で腫瘍組織を保存するための通常の方法である。ホルマリン中での固定は、組織内でのRNAの分子構造を変化させ、架橋およびまた部分的分解を引き起こす。部分的分解は100〜300塩基対のより小さい断片のRNAの生成を誘導する。RNAに対するこれらの構造的変化は、MAGEA3発現レベルを測定するためにFFPE組織から抽出されたRNAの使用を制限する。
【0007】
本発明の課題は、存在するアッセイの欠点を排除する改良されたアッセイを提供することである。
【0008】
遺伝子メチル化は、遺伝子発現の重要な調節因子である。特に、特定の遺伝子のプロモーター領域中のCpGジヌクレオチド対に認められるシトシン残基でのメチル化は、遺伝子発現の下方調節を介して多くの疾患状態に寄与し得る。例えば、腫瘍抑制遺伝子の異常なメチル化は、これらの遺伝子の上方または下方調節を誘導し、かくして、多くの癌の存在および発達に関連する(Hoffmannら、2005 Biochem Cell Biol 83: 296-321)。異常な遺伝子メチル化のパターンは、起源となる組織に特異的であることが多い。従って、特定の遺伝子のメチル化状態の検出は、予測的および診断的に有用であり、これを用いて、疾患の相対的段階を決定し、また特定の型の療法に対する応答を予測することができる(Laird. 2003 Nat Rev Cancer 3: 253-266)。
【0009】
ゲル上で結果を可視化するメチル化特異的PCR(MSP)(ゲルに基づくMSPアッセイ)は、遺伝子のエピジェネティックなサイレンシングを決定するために広く用いられているが(Esteller Mら、Cancer Res 2001;61:3225-9)、他の技術を用いる定量的試験も開発されている(Laird PW., Nat Rev Cancer 2003;3:253-66; Eadsら、Nucleic Acids Res 2000;28:E32; Mikeska T,ら、J Mol Diagn 2007)。
【0010】
核酸増幅反応をリアルタイムでモニターするためのいくつかの蛍光に基づく技術が利用可能である。1つのそのような技術は、米国特許第6,090,552号およびEP 0912597に記載されており、Amplifluor(登録商標)として商業的に知られている。また、この方法は、核酸増幅反応のエンドポイントモニタリングにとっても好適である。Vlassenbroeckら(Vlassenbroeckら、2008. Journal of Molec. Diagn., V10, No. 4)はさらに、Amplifluor(登録商標)技術を用いた標準化された直接的リアルタイムMSPアッセイを記載している。
【発明の概要】
【0011】
本発明は、MAGE-A3発現を測定するための改良された方法および/またはアッセイに関する。本発明はさらに、特定の型の療法、特に、本明細書に記載のオリゴヌクレオチド、プライマー、プローブ、プライマー対、キットおよび/または方法の使用を介して、MAGE-A3を発現すると同定された患者の治療に基づく抗原特異的癌免疫療法(ASCI)に関する。MAGE-A3タンパク質発現を、MAGE-A3遺伝子自体の発現レベルを測定するよりもむしろ、該遺伝子のメチル化状態を決定することにより検出する。本発明者らは、それらのメチル化試験のメチル化状態の結果が、MAGE-A3免疫療法からの利益のためのNSCLCにおけるMAGE-A3発現の予測値を確立したRT-PCRアッセイに関して得られた結果と良好に一致することを示す。かくして、このアッセイは、治療にとって好適な患者を選択し、患者の治療が成功する可能性を予測するのに有用であり、患者の療法選択を援助するために用いることができる。
【0012】
一態様においては、本発明は、遺伝子のメチル化状態の検出にとって有用である、配列番号2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含むか、もしくは本質的にそれからなるか、またはそれからなるオリゴヌクレオチド、プライマーまたはプローブを提供する。
【0013】
前記オリゴヌクレオチド、プライマーまたはプローブは、好ましくは、5'から3'の順に、以下の連続する配列:
(a)約6〜30個のヌクレオチドの第1のヌクレオチド配列であって、該第1のヌクレオチド配列内のヌクレオチドが、分子エネルギー移動対の供与体部分と受容体部分から選択される第1の部分で標識され、供与体部分が、励起された場合、1個以上の特定の波長で蛍光を放出し、受容体部分が、該供与体部分により放出された蛍光を吸収および/もしくはクエンチする、前記ヌクレオチド配列;
(b)約3〜20個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第2の一本鎖ヌクレオチド配列;
(c)約6〜30個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第3のヌクレオチド配列であって、第3のヌクレオチド配列内のヌクレオチドが、前記供与体部分と受容体部分から選択される第2の部分で標識され、第2の部分が第1のヌクレオチド配列を標識しない前記群のメンバーであり、供与体部分が励起され、蛍光を放出する場合、受容体部分が供与体部分により放出された蛍光を吸収し、クエンチするように、第1の部分と第2の部分が近くなるように、二本鎖が第1のヌクレオチド配列と第3のヌクレオチド配列との間で形成することができるように、第3のヌクレオチド配列が第1のヌクレオチド配列と逆の順序で相補的である、前記ヌクレオチド配列;ならびに
(d)3'末端に配列番号2、4、5、7、8、11、13、14、16、17、19または25のいずれかのヌクレオチド配列を含む約8〜40個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる、プライマーの3'末端の第4の一本鎖ヌクレオチド配列、
を含み、本質的にそれからなるか、またはそれからなり、二本鎖が形成されない場合、第1の部分と第2の部分が、第1および第2の部分の間の分子エネルギー移動を阻害する距離により分離される。
【0014】
3'末端の特定のヌクレオチド配列により、MAGE-A3遺伝子のメチル化状態を決定することができる。これらのプライマーは、好適な試薬(本明細書で考察される)を用いる治療後に、非メチル化形態のMAGEA3遺伝子に優先的に結合する。これらのオリゴヌクレオチドの特性は本明細書で考察されており、その考察は変更すべきところは変更して適用される。特定のヌクレオチド配列は、MAGE Aファミリー遺伝子のメチル化または非メチル化DNAの部分を含む核酸鎖と相補的なヌクレオチド配列の核酸ポリメラーゼによる合成をプライミングすることができる。
【0015】
最も好ましくは、前記オリゴヌクレオチド、プライマーまたはプローブは、配列番号3、6、9、12、15または18のヌクレオチド配列からなり、目的の遺伝子の一部を増幅するのに用いられる。
【0016】
さらに、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含むか、または本質的にそれからなるか、またはそれからなるプライマーを含むプライマー対も提供される。
【0017】
さらなる態様においては、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含むか、または本質的にそれからなるか、またはそれからなる少なくとも1個のプライマー、プライマー対またはプライマーのセットを含むキットが提供される。このキットは、遺伝子、特に、MAGE-A3などのMAGE-Aファミリー遺伝子のメチル化状態を検出するためのものである。
【0018】
さらなる態様においては、本発明は、DNAを含有するサンプル中のMage-A3遺伝子のメチル化状態を検出するための方法であって、
(a)DNAを含有するサンプルと、DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基をもたらすが、メチル化シトシン残基を修飾しない試薬とを接触させること/該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマーが、該試薬で処理した後に、それぞれメチル化または非メチル化DNAの配列にのみ結合するように設計され、少なくとも1対のプライマー中の少なくとも1個のプライマーが、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含み、本質的にそれからなるか、またはそれからなる、前記プライマー対を用いて目的のメチル化または非メチル化遺伝子の少なくとも一部を増幅すること(必要に応じて)、
を含む、前記方法を提供する。
【0019】
さらなる態様においては、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることによりサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、サンプル中の非メチル化MAGE-A3の存在が癌または癌の素因を示す、癌または癌の素因を診断する方法が提供される。
【0020】
さらなる態様においては、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることによりサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、非メチル化MAGE-A3の存在がMAGE-A3陽性腫瘍の存在を示す、MAGE-A3陽性腫瘍の存在を決定するための方法が提供される。「MAGE-A3陽性腫瘍」とは、MAGE-A3抗原を発現する任意の腫瘍または腫瘍細胞(患者から単離されたもの)を意味する。
【0021】
本発明はさらに、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、MAGE-A3遺伝子がメチル化されていない場合、(好ましくは)被験者がMAGE-A3免疫療法剤を用いる治療のために同定および/または選択される、MAGE-A3免疫療法剤を用いる治療にとって好適な患者を同定および/または選択するための方法を提供する。かくして、非メチル化MAGEA3を有する患者は、該遺伝子がメチル化された患者よりも好ましい。
【0022】
あるいは、前記遺伝子が非メチル化されていない場合、被験者を、MAGE-A3免疫療法剤を用いる治療のために同定および/または選択しないのが好ましい。
【0023】
関連する態様においては、本発明は、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、該遺伝子がメチル化されていない場合、MAGE-A3免疫療法剤を用いる治療の成功の可能性が、該遺伝子がメチル化されている場合よりも高い、癌の治療の成功の可能性を予測するための方法を提供する。
【0024】
あるいは、サンプル中の非メチル化MAGE-A3の非存在は、MAGE-A3免疫療法剤を用いる治療に対する耐性の可能性が、該遺伝子がメチル化されていない場合よりも高いことを示す。かくして、メチル化MAGE-A3遺伝子の検出は、免疫療法剤を用いる治療の成功確率が低いことを示す。
【0025】
さらに関連する態様においては、本発明は、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、該遺伝子がメチル化されていない場合、免疫療法剤を治療のために選択する、癌のための好適な治療計画を選択する方法を提供する。
【0026】
あるいは、前記遺伝子が非メチル化されていない場合、免疫療法剤を用いる治療は禁忌である。
【0027】
また、免疫療法剤の投与を含み、被験者を、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて治療のために選択する、被験者における癌を治療する方法も提供される。
【0028】
好ましくは、本明細書に記載の様々な態様の全てについて、非メチル化MAGE-A3遺伝子の検出は、MAGE-A3タンパク質のレベルの増加に対応する。
【0029】
本発明はさらに、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定すること、ならびに次いで、本明細書に記載のMAGE-A3を含む組成物を患者に投与することを含む、患者を治療する方法を提供する。MAGE-A3遺伝子がメチル化されていないことがわかった場合、前記組成物を投与するのが好ましい。
【0030】
さらなる態様においては、腫瘍組織を除去するために治療された患者であって、MAGE-A3を発現する腫瘍の再発が疑われる前記患者を治療する方法であって、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、腫瘍組織中のMAGE-A3遺伝子のメチル化状態を測定すること、ならびに次いで、本明細書に記載のMAGE-A3を含む組成物を該患者に投与することを含む、前記方法が提供される。MAGE-A3遺伝子がメチル化されていないことがわかった場合、前記組成物を投与するのが好ましい。
【0031】
本発明のさらなる態様においては、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択された、腫瘍に罹患する患者の治療のための医薬の製造における、MAGE-A3を含む組成物の使用が提供される。また、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択された、腫瘍に罹患する患者の治療における使用のためのMAGE-A3を含む組成物も提供される。
【0032】
さらなる実施形態においては、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて治療のために選択された、MAGE-A3を発現する腫瘍の再発が疑われる患者の治療のための医薬の製造における、MAGE-A3を含む組成物の使用が提供される。また、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて治療のために選択された、MAGE-A3を発現する腫瘍の再発が疑われる患者の治療における使用のためのMAGE-A3を含む組成物も提供される。
【図面の簡単な説明】
【0033】
【図1】非変換配列(図1a - 配列番号10)および対応する変換配列(図1b - 配列番号41)上のMAGEA3_Uプライマーの位置を示す。MAGEA3_GO1 Uプライマー位置を囲み、MAGEA3_GO2 Uプライマー位置を強調し、MAGEA3_FURUTA Uプライマー位置を太字で示し、MAGEA3_QIU Uプライマー位置に下線を付し、■で示されるG位置は転写開始部位に対応する。
【図2】非変換配列(図2a - 配列番号10)および対応する変換配列(図2b - 配列番号41)上のMAGEA3_GO_2_Uプライマーの位置を示す。下線は転写開始部位で始まる。
【図3】検出グラフの限界を示す。図3a:MAGEA3_GO_2_U:入力U DNA(LNCaP細胞)をCt値に対してプロットしたところ、1.5 ngのU入力DNAが依然として検出可能である。図3b:MAGEA3_Furuta_U:入力U DNA(Gerl細胞)をCt値に対してプロットしたところ、1.5 ngのU入力DNAが依然として検出可能である。
【図4】Amplifluor(登録商標)技術の図式的概観を示す。プライマー対中の少なくとも一方のプライマー(この場合はフォワードプライマー)は、分子エネルギー移動対の供与体(FAM)および受容体部分(DABCYL)を担持する「ヘアピン」構造を含む。増幅の非存在下では、供与体部分により放出される蛍光は、受容体部分により効率的に受容され、蛍光のクエンチングを誘導する。増幅の間に、プライマーは増幅産物中に組込まれる。2周目の増幅の間に、ステムループまたはヘアピン構造が破壊される。受容体部分はもはや供与体部分により放出される蛍光を効率的にクエンチすることができない。かくして、供与体部分は検出可能な蛍光シグナルを産生する。
【図5】サンプル分類のための決定木を示す(メチル化、非メチル化または無効)。
【図6−1】メラノーマサンプル中でのMAGE-A3メチル化状態を示す:受信者動作特性(ROC)曲線を、偽陽性率(100の特異性)の関数において真陽性率(感度)をプロットすることにより、4つのMAGE-A3非メチル化アッセイについて算出した。図6a:GO_1_Uアッセイ:感度91.7%、特異性76.5%、カットオフ214.8、曲線下面積(AUC)は0.912である。95%CI区間は、面積=5について、P=0.0001の有意性で0.781〜0.977であった。図6b:GO_2_Uアッセイ:感度87.5%、特異性100%、カットオフ292.6、曲線下面積(AUC)は0.971である。95%CI区間は、面積=5について、P=0.0001の有意性で0.863〜0.996であった。図6c:Furuta_Uアッセイ:感度66.7%、特異性100%、カットオフ943.1、曲線下面積(AUC)は0.939である。95%CI区間は、面積=5について、P=0.0001の有意性で0.817〜0.989であった。図6d:Qiu_Uアッセイ:感度83.3%、特異性94.1%、カットオフ431.1、曲線下面積(AUC)は0.944である。95%CI区間は、面積=5について、P=0.0001の有意性で0.824〜0.990であった。図6e:4つのアッセイのそれぞれについて得られた結果をまとめた表である。
【図6−2】図6−1の続きである。
【図6−3】図6−2の続きである。
【図7−1】肺生検におけるMAGE-A3メチル化状態を示す:受信者動作特性(ROC)曲線を、偽陽性率(100の特異性)の関数において真陽性率(感度)をプロットすることにより、4つのMAGE-A3非メチル化アッセイについて算出した。図7a:GO_1_Uアッセイ:感度84.6%、特異性91.7%、カットオフ115.8、曲線下面積(AUC)は0.954である。95%CI区間は、面積=5について、P=0.0001の有意性で0.868〜0.990であった。図7b:GO_2_Uアッセイ:感度88.5%、特異性94.4%、カットオフ108.28、曲線下面積(AUC)は0.971である。95%CI区間は、面積=5について、P=0.0001の有意性で0.893〜0.996であった。図7c:Furuta_Uアッセイ:感度84.6%、特異性91.7%、カットオフ296.8、曲線下面積(AUC)は0.949である。95%CI区間は、面積=5について、P=0.0001の有意性で0.861〜0.988であった。図7d:Qiu_Uアッセイ:感度84.6%、特異性91.7%、カットオフ176.71、曲線下面積(AUC)は0.948である。95%CI区間は、面積=5について、P=0.0001の有意性で0.859〜0.988であった。図7e:肺生検上での4つのアッセイのそれぞれについて得られた結果をまとめた表である。
【図7−2】図7−1の続きである。
【図7−3】図7−2の続きである。
【図8−1】肺FFPEサンプル中でのMAGE-A3メチル化状態を示す:受信者動作特性(ROC)曲線を、偽陽性率(100の特異性)の関数において真陽性率(感度)をプロットすることにより、4つのMAGE-A3非メチル化アッセイについて算出した。図8a:GO_1_Uアッセイ:感度84.0%、特異性96.0%、カットオフ21.88、曲線下面積(AUC)は0.933である。95%CI区間は、面積=5について、P=0.0001の有意性で0.825〜0.984であった。図8b:GO_2_Uアッセイ:感度84.0%、特異性96.3%、カットオフ17.75、曲線下面積(AUC)は0.932である。95%CI区間は、面積=5について、P=0.0001の有意性で0.826〜0.983であった。図8c:Furuta_Uアッセイ:感度80.0%、特異性96.2%、カットオフ214.26、曲線下面積(AUC)は0.923である。95%CI区間は、面積=5について、P=0.0001の有意性で0.813〜0.979であった。図8d:Qiu_Uアッセイ:感度72.0%、特異性96.2%、カットオフ68.91、曲線下面積(AUC)は0.912である。95%CI区間は、面積=5について、P=0.0001の有意性で0.799〜0.973であった。図8e:肺FFPEサンプル上での4つのアッセイのそれぞれについて得られた結果をまとめた表である。
【図8−2】図8−1の続きである。
【図8−3】図8−2の続きである。
【図9】反応プロセスの様々な工程で固定した場合のPCR阻害に対するメラニンの効果を示す。図9a:MAGE-A3 UリアルタイムMSPを通して処理された、固定したメラニンを含む、および含まないLNCaP細胞系材料。BT=亜硫酸水素処理。図9b:Gst-Pi MリアルタイムMSPを通して処理された、固定したメラニンを含む、および含まないMCF7細胞系材料。
【図10】プロテインD-MAGE-A3-Hisを示す。一本下線=プロテインDの最初の109個のアミノ酸、二重下線=プロテインDのシグナル配列(18アミノ酸)、囲み=挿入/置換された配列:2-3でのMet-Asp(置換);128-129でのMet-Asp(挿入)および442-443でのGly-Gly(挿入)。太字=MAGE3の断片:MAGE3のアミノ酸3-314(合計312アミノ酸)、灰色部分=7個のhis尾部。
【発明を実施するための形態】
【0034】
本発明は、DNAを含有するサンプル中のメチル化された、またはメチル化されていないMAGE-A3遺伝子の存在および/または量を検出するためのアッセイを提供する。このアッセイを開発するために、MAGE-A3遺伝子中でメチル化を受けやすい領域を同定し、メチル化された形態のMAGE-A3遺伝子からメチル化されていない形態のものを識別することができる特定のオリゴヌクレオチドを開発することが必要であった。
【0035】
従って、第1の態様においては、本発明は、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるオリゴヌクレオチドを提供する。これらのオリゴヌクレオチドは、目的の遺伝子のメチル化状態の検出において有用である。これらのオリゴヌクレオチドは、プライマーおよび/またはプローブとして役立ち得る。特定の実施形態においては、前記オリゴヌクレオチドは前記遺伝子の非メチル化形態を検出する。非メチル化形態を検出するための好適なオリゴヌクレオチドは、配列番号2、4、5、7、8、11、13または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。メチル化形態を検出するための好適なオリゴヌクレオチドは、配列番号14、16、17または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。特定の実施形態においては、これらのオリゴヌクレオチドは、本発明に記載のヘアピン構造を含む。そのような好ましいオリゴヌクレオチドとしては、非メチル化形態の遺伝子を検出するための配列番号3、6、9および12に記載の配列ならびにメチル化形態の遺伝子を検出するための配列番号15および18に記載の配列が挙げられる。
【0036】
本発明の「遺伝子」または「目的の遺伝子」は、好ましくはMAGEA3および/またはMAGEA6遺伝子である。MAGEA3およびMAGEA6は、HUGO Gene Nomenclature Committeeにより認可された遺伝子記号である。MAGEA3遺伝子は、染色体X(位置q28)上に位置し、その遺伝子配列は受託番号NM_005362およびENSG00000197172の下で列挙されている。MAGE-A3遺伝子は、メラノーマ抗原ファミリーA, 3をコードする。MAGEA6遺伝子は、染色体X(位置q28)上に位置する。MAGE-A3は、MAGE-3またはMAGEA3として互換的に言及されることが多い。同様に、MAGE-A6はMAGE-6またはMAGEA6として互換的に言及されることが多い;全て本明細書で用いられる。これらの遺伝子の低メチル化は、例えば、メラノーマまたは肺癌(NSCLCを含む)などの癌の発生率と関連し得る。
【0037】
メチル化を受けやすいCpGジヌクレオチドは、典型的には、ヒト遺伝子のプロモーター領域に集中する。好ましい実施形態においては、前記遺伝子のメチル化状態を、該遺伝子のプロモーター領域中のメチル化のレベルを決定することにより評価する。「プロモーター」は、転写開始部位(TSS)から上流の領域であり、TSSから約10 kb、3 kb、1 kb、500 bpまたは150〜300 bpに伸長する。MAGE-3については、プロモーター領域中のCpGの分布はむしろ珍しい。
【0038】
用語「メチル化状態」とは、DNA配列内の1個または複数個のCpGジヌクレオチドでの5-メチルシトシン(「5-mCyt」)の存在または非存在を指す。「高メチル化」は、正常レベルを超えるメチル化レベルの増加と定義される。かくして、それは、遺伝子、頻繁にはプロモーター領域中の特異的CpG部位でのシトシンの異常なメチル化(5-mCyt)に関する。メチル化の正常レベルを、例えば、非癌細胞中でのメチル化のレベルを決定することにより定義することができる。
【0039】
「低メチル化」とは、「正常な」DNA配列(好適な対照サンプル中に認められる)内の対応するCpGジヌクレオチドに認められる5-mCytの量と比較して、(試験DNAサンプルの)DNA配列内の1個または複数個のCpGジヌクレオチドでの5-mCytの存在の減少を指す。
【0040】
再度、メチル化の「正常な」レベルを、例えば、非癌細胞中のメチル化レベルを決定することにより定義することができる。本発明においては、MAGE-A3および/またはMAGE-A6遺伝子の低メチル化は、癌の信頼できる指示因子を提供するこの腫瘍関連抗原遺伝子の発現の増加を示す。
【0041】
本発明は、第2の態様において、DNAを含有するサンプル中のメチル化または非メチル化遺伝子の存在および/または量を検出する方法であって、DNAを含有するサンプルと、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる少なくとも1個のオリゴヌクレオチドとを接触させる工程を含む、前記方法を提供する。好ましくは、この方法は、前記遺伝子がメチル化されているか、またはメチル化されていないかを評価するさらなる工程を含む。これは、前記オリゴヌクレオチドが、本明細書に考察されるように、DNAを含有するサンプル中のDNAに安定に結合するかどうかに依存し得る。
【0042】
メチル化状態を評価するための技術は、様々な手法に基づく。本発明のオリゴヌクレオチドを適用する任意の好適な技術を用いることができる。一実施形態においては、メチル化CpGジヌクレオチドモチーフを検出するための手法は、DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基をもたらす試薬を使用する。この試薬は、メチル化シトシン残基を修飾せず、かくして、好ましくは、核酸増幅を含んでもよい、下流のプロセスにおいて非メチル化核酸分子とメチル化核酸分子との識別が可能になる。一実施形態においては、前記試薬は、非メチル化シトシン残基を選択的に脱アミノ化するように作用してもよい。かくして、前記試薬への曝露後、非メチル化DNAは、対応するメチル化DNAのものとは異なるヌクレオチド配列を含む。シトシンの脱アミノ化は、チミンと同じ塩基対特性を有するが、シトシン塩基対性質とは異なる、ウラシル残基の存在をもたらす。これはメチル化シトシンと非メチル化シトシンとの識別を可能にする。
【0043】
配列の差異を評価するための有用な従来技術は、オリゴヌクレオチドプライマーを用いる。プライマーを設計するための2つの手法が可能である。第1に、プライマー自体がDNAメチル化の任意の潜在的な部位をカバーしないプライマーを設計することができる。異なるメチル化の部位における配列の変化は、2つのプライマー結合部位の間に位置し、配列変化の可視化にはさらなるアッセイ工程が必要である。第2に、最初に処理された配列のメチル化または非メチル化形態と特異的にハイブリダイズするプライマーを設計することができる。ハイブリダイゼーション後、増幅反応を実施し、当業界で公知の任意の検出系を用いて増幅産物をアッセイすることができる。増幅産物の存在は、プライマーがDNAにハイブリダイズしたことを示す。プライマーの特異性は、DNAが修飾されたか否かを示し、次いで、DNAがメチル化されたか否かを示す。標的に対して相補的な十分な領域、例えば、12、13、14、15、16、17、18、19、20、21または22個のヌクレオチドがある場合、プライマーはハイブリダイゼーションを阻害しないが、他の操作にとって有用であってよい追加のヌクレオチド残基をも含んでもよい。そのような他の残基の例は、制限エンドヌクレアーゼ切断のための部位、リガンド結合のための部位、または因子結合もしくはリンカーもしくはリピートのための部位、または可視化のための残基であってよい。前記オリゴヌクレオチドプライマーは、それらが修飾メチル化残基にとって特異的であるようなものであってもよい。プライマーとしての使用のための好ましいオリゴヌクレオチドは、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。
【0044】
修飾核酸と非修飾核酸とを識別するためのさらなる方法は、オリゴヌクレオチドプローブを用いることである。そのようなプローブは、修飾核酸に、または増幅により得られた産物などの修飾核酸のさらなる産物に直接的にハイブリダイズし得る。プローブに基づくアッセイは、特定の配列へのオリゴヌクレオチドハイブリダイゼーションおよびその後のハイブリッドの検出を生かすものである。また、増幅産物を検出する前にさらなる精製工程、例えば、沈降工程が存在してもよい。オリゴヌクレオチドプローブを、当業界で公知の任意の検出系を用いて標識することができる。これらのものとしては、限定されるものではないが、蛍光部分、放射性アイソトープ標識部分、生物発光部分、発光部分、化学発光部分、酵素、基質、受容体、またはリガンドが挙げられる。プローブとして用いるための好ましいオリゴヌクレオチドは、配列番号2、4、5、7、8、11、13、14、16、17、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。
【0045】
「オリゴヌクレオチドプライマー」を、本明細書では「プライマー」と互換的に言及する。同様に、「オリゴヌクレオチドプローブ」を、本明細書では「プローブ」と互換的に言及する。
【0046】
好ましい実施形態においては、前記遺伝子(またはその一部、特に、CpGアイランド)のメチル化状態を、メチル化特異的PCR(MSP)を用いて決定する。
【0047】
MSP技術は、当業者には知られているであろう。MSP手法においては、亜硫酸水素ナトリウム処理の結果としての配列差異を利用することにより、メチル化DNAから非メチル化DNAを識別するように設計されたプライマー対を用いて、DNAを増幅することができる(Herman JG et al. Proc Natl Acad Sci U S A. 1996 Sep 3;93(18):9821-6およびWO 97/46705)。MSP技術の特定例は、リアルタイム定量的MSP(QMSP)と呼ばれ、リアルタイムにメチル化DNAの信頼性の高い定量化を可能にする。
【0048】
リアルタイム方法は、一般的には増幅手順の連続的な目視モニタリングに基づくものであり、生成物中の取込みを定量化することができ、その量が鋳型中のその配列のコピー数を示す、蛍光標識された試薬を用いる。そのような標識試薬は、二本鎖DNAに優先的に結合し、その蛍光が、二本鎖DNAの結合により大きく増強される蛍光染料であってよい。あるいは、標識されたプライマーおよび/または標識されたプローブを用いることができる。それらは、TAQMAN(登録商標)、MOLECULAR BEACONS(登録商標)、AMPLIFLUOR(登録商標)およびSCORPION(登録商標)DzyNA(登録商標)などのよく知られ、商業的に入手可能なリアルタイム増幅技術の特異的増幅である。これらのリアルタイム方法を、ポリメラーゼ連鎖反応(PCR)と共に用いることが多い。
【0049】
TaqMan技術は、蛍光染料とクエンチング染料を含む、線状の、加水分解オリゴヌクレオチドプローブを用いる。
【0050】
照射された場合、励起された蛍光染料は、蛍光を発するよりもむしろ、近隣のクエンチング染料分子にエネルギーを移動させる(FRET原理)。TaqManプローブは、PCR産物の内部領域にアニーリングし、ポリメラーゼが鋳型を複製する時に、そのエキソヌクレアーゼ活性により切断される。これはクエンチャーの活性を終結させ、リポーター染料は蛍光を放出し始め、プローブ切断の速度と比例して各サイクルにおいて増加する。
【0051】
また、分子ビーコンも蛍光染料およびクエンチング染料を含むが、蛍光共鳴エネルギー移動(FRET)を起こすように両染料を近位に持って行くために溶液中で遊離しながら、ヘアピン構造を取るように設計される。ビーコンがアニーリング工程の間に標的にハイブリダイズする場合、ヘアピンは線状化し、両染料(供与体および受容体/クエンチャー)が分離する。供与体から検出される蛍光の増加は、利用可能なPCR産物の量と相関するであろう。
【0052】
スコーピオンプローブに関しては、単一のオリゴヌクレオチドを用いて、配列特異的プライミングおよびPCR産物検出を達成する。スコーピオンプローブは、ハイブリダイズしていない状態でステムループ配置を維持し、フルオロフォアとクエンチャーの間でFRETが起こる。ステムの3'部分はまた、プライマーの伸長産物と相補的である配列も含む。この配列を、増幅不可能なモノマーを介して特異的プライマーの5'末端に連結する。スコーピオンプライマーの伸長後、特異的プローブ配列は、伸長されたアンプリコン内のその相補体に結合することができ、かくして、ヘアピン構造を開き、フルオロフォアとクエンチャーを分離し、ならびに蛍光シグナルを提供する。
【0053】
重メチルにおいては、プライミングはメチル化特異的であるが、伸長不可能なオリゴヌクレオチドブロッカーはプライマー自身の代わりにこの特異性を提供する。このブロッカーはメチル化特異的様式で亜硫酸水素処理されたDNAに結合し、その結合部位はプライマー結合部位と重複する。ブロッカーが結合した場合、プライマーは結合することができず、従って、アンプリコンは生成されない。重メチルを、リアルタイム検出と共に用いることができる。
【0054】
Plexor(商標)qPCRおよびqRT-PCR系は、2個の修飾ヌクレオチド間の特異的相互作用を利用して、定量的PCR分析を達成するものである。PCRプライマーの一方は、5'末端にイソ-dC残基に隣接する蛍光標識を含む。第2のPCRプライマーは標識されない。反応混合物はデオキシヌクレオチドと、クエンチャーであるダブシルで修飾されたイソ-dGTPを含む。ダブシル-イソ-dGTPは、イソ-dC残基と相補的な位置で優先的に取り込まれる。この位置でのダブシル-イソ-dGTPの取込みは、相補鎖上での蛍光染料のクエンチングおよび蛍光の減少をもたらし、増幅の間に定量化が可能になる。これらの多重反応のために、異なるフルオロフォアを有するプライマー対を、それぞれの標的配列のために用いる。
【0055】
かくして、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるオリゴヌクレオチドを、目的の遺伝子のメチル化状態の検出のための上記方法におけるプライマーまたはプローブとして用いることができる。
【0056】
好ましい実施形態においては、本発明は、DNAを含有するサンプル中の目的のメチル化または非メチル化遺伝子の存在および/または量を検出するリアルタイム方法であって、
(a)DNAを含有するサンプルと、該DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を産生するが、メチル化シトシン残基を修飾しない試薬とを接触させること/該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマー対であって、その少なくとも1個のプライマーが、前記試薬を用いる処理後に、それぞれメチル化または非メチル化DNAの配列にのみ結合するように設計され、該プライマー対中の少なくとも1個のプライマーが、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、前記プライマー対を用いて、目的のメチル化または非メチル化遺伝子の少なくとも一部を増幅すること、
を含む、前記方法を提供する。
【0057】
本発明の方法における目的の遺伝子は、好ましくは、MAGE-A3および/またはMAGEA6遺伝子である。好ましくは、前記プライマー対中の少なくとも1個のプライマーは、増幅の非存在下で、受容体部分が供与体部分により放出される(励起の際に)蛍光をクエンチし、増幅の間に、検出可能な蛍光シグナルを生成するのに十分に供与体部分と受容体部分を分離するようにステムループ構造が破壊されるように配置された、分子エネルギー移動対の供与体部分と受容体部分を担持するステムループ構造を含むプライマーである。これをリアルタイムで検出して、目的のメチル化または非メチル化遺伝子の存在の示唆を提供することができる。配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、前記プライマー対中のプライマーは、ステムループ構造を担持するのが好ましい。
【0058】
特定の実施形態においては、メチル化または非メチル化遺伝子の遺伝子コピー数を決定する。ここで、本明細書に記載の方法は、さらなる工程:
(c)目的のメチル化または非メチル化遺伝子に関する標準曲線に対してリアルタイム検出の結果を定量化して、遺伝子コピー数の出力を得ること、
を含むのが好ましい。
【0059】
好ましくは、工程(c)はさらに、サイクルの閾値が40未満である場合、増幅が正当であると考えられることを特徴とする。
【0060】
MageA3および/またはMageA6遺伝子などの遺伝子については、非メチル化形態の遺伝子の検出が主に関連し得る。
【0061】
本発明の方法により、目的のメチル化または非メチル化遺伝子の存在を、リアルタイムでサンプル中で検出することができる。本発明の方法は定量的方法であるため、目的の遺伝子のメチル化または非メチル化形態の(相対)量を、反応が進行するにつれて決定することもできる。しかしながら、リアルタイム方法を用いる必要はない。標的DNAがサンプル中の存在するか否かを発見するためにのみ、分析を行うことができる。エンドポイント増幅検出技術は、リアルタイムPCRのために広く用いられているものと同じ手法を利用する。従って、本発明の方法は、DNAを含有するサンプル中の目的のメチル化または非メチル化遺伝子の存在および/または量を検出するエンドポイント方法を包含してもよい。
【0062】
かくして、本発明は、DNAを含有するサンプル中の目的のメチル化または非メチル化遺伝子の存在および/または量を検出する(エンドポイント)方法であって、
(a)DNAを含有するサンプルと、該DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を産生するが、メチル化シトシン残基を修飾しない試薬とを接触させることおよび/または該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマー対であって、その少なくとも1個のプライマーが、前記試薬を用いる処理後に、それぞれメチル化または非メチル化DNAの配列にのみ結合するように設計され、該プライマー対中の少なくとも1個のプライマーが、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、前記プライマー対を用いて、目的のメチル化または非メチル化遺伝子の少なくとも一部を増幅すること、
を含む、前記方法を提供する。
【0063】
上記のように、本発明の方法における目的の遺伝子は、好ましくはMAGE-A3および/またはMAGE-A6遺伝子である。好ましくは、前記プライマー対中の少なくとも1個のプライマーは、本明細書に記載の特徴を有する分子エネルギー移動対の供与体部分と受容体部分とを担持するステムループ構造を含むプライマーである。配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマー対中のプライマーは、好ましくはステムループ構造を担持する。
【0064】
MAGE-A3および/またはMAGE-A6遺伝子については、非メチル化形態の遺伝子の検出が主に関連し得る。配列番号2、3、4、5、6、7、8、9、11、12、13または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーを、前記試薬を用いる処理後に非メチル化MAGEA3 DNAを検出するために設計した。
【0065】
非メチル化遺伝子の非存在は、メチル化遺伝子の存在を示すであろう。しかしながら、メチル化遺伝子の検出も、本発明の範囲内にある。配列番号14、15、16、17、18または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーを、前記試薬を用いる処理後にメチル化MAGEA3 DNAを検出するために設計した。
【0066】
メチル化または非メチル化遺伝子の遺伝子コピー数を所望する場合、前記方法は、好ましくは、
(c)目的のメチル化または非メチル化遺伝子に関する標準曲線に対して検出の結果を定量化して、遺伝子コピー数の出力を得る工程、
をさらに含む。
【0067】
本発明の全ての実施形態は、本発明のエンドポイント態様に適用可能であり、かくして、変更すべきところは変更して適用される。エンドポイント分析は、増幅の終わりでの蛍光を決定するための蛍光プレートリーダーまたは他の好適な装置の使用を想定してもよい。
【0068】
本発明の方法は、最も好ましくは、任意の好適な(DNAを含有する)試験サンプル上で実行されるex vivoまたはin vitroでの方法である。しかしながら、一実施形態においては、前記方法はまた、サンプルを取得する工程を含んでもよい。試験サンプルは、DNAを含有するサンプル、特に、目的の遺伝子を含む、DNAを含有するサンプルである。本発明の方法を、特に、目的の遺伝子のメチル化が疾患の発生率と関連する(ことが知られる)場合、疾患の診断において用いることができる。
【0069】
DNAを含有するサンプルは、任意の好適な組織サンプルまたは体液を含んでもよい。好ましくは、試験サンプルをヒト被験者から取得する。癌への適用のためには、前記サンプルは、癌性であると疑われる組織または代表的な体液から取られた組織サンプルを含んでもよい。
【0070】
MAGE-A3遺伝子の低メチル化は、肺癌と関連してきた。かくして、一実施形態においては、MAGE-A3遺伝子を含む本発明の方法において用いられる試験サンプルは、好ましくは、肺細胞または肺細胞から得られる核酸を含む。最も好ましくは、前記サンプルは、ホルマリン固定パラフィン包埋(FFPE)組織である。2つの型の肺癌が存在する:非小細胞肺癌(NSCLC)および小細胞肺癌(SCLC)。この名称は単に、腫瘍中に認められる細胞の型を説明するものである。前記試験サンプルは、好ましくは、非小細胞肺癌(NSCLC)に由来する細胞または核酸を含む。NSCLCとしては、扁平上皮細胞癌、腺癌、および大細胞癌が挙げられ、肺癌の約80%を占める。好ましい実施形態においては、癌がNSCLCである場合、サンプルは肺組織サンプルまたは唾液サンプルである。NSCLCは治癒が困難であり、利用可能な治療はできるだけ長く延命し、疾患の症候を緩和するためのものになる傾向がある。NSCLCは最も一般的な型の肺癌であり、不良転帰と関連する。
【0071】
MAGE-A3遺伝子の低メチル化はまた、膀胱癌とも関連する。かくして、さらなる実施形態においては、本発明の方法において用いられるさらに好ましい試験サンプルは、移行性膀胱細胞または扁平上皮癌膀胱細胞を含む。好ましくは、前記試験サンプルを膀胱組織から取得する。より好ましくは、それは尿由来のものであり、移行性膀胱細胞または扁平上皮癌膀胱細胞に由来する核酸を含む。前記試験サンプルを、液体尿、その沈降物、または尿中の沈降物から誘導することができる。前記組織および体液を、任意の好適な方法を用いて回収することができ、その多くは当業界でよく知られている。
【0072】
MAGE-A3遺伝子の低メチル化はまた、メラノーマとも関連する。メラノーマは組織病理学的用語でよく定義されている、色素沈着した、容易に到達できる病変である。初期の放射状増殖期(RGP)のメラノーマは、表皮および真皮乳頭層に侵入することができるが、転移能力を有さない;この段階での切除はほぼ完全に治癒的である。その後の垂直増殖期(VGP)は、より攻撃的な段階への移行を意味し、転移することができる。かくして、RGP/VGP移行で起こる遺伝子発現の変化は、非常に興味深い。かくして、さらなる実施形態においては、本発明において用いられるさらに好ましい試験サンプルは、メラノーマ細胞を含む。好ましくは、前記試験サンプルを、皮膚病変から取得する。
【0073】
本発明の方法における使用のための他のDNAを含有するサンプルとしては、診断、予後、または個別化された医学的使用のためのサンプルが挙げられる。これらのサンプルを、例えば、生検もしくは微細針吸引物などの外科的サンプルから、パラフィン包埋組織から、凍結腫瘍組織サンプルから、新鮮な腫瘍組織サンプルから、または新鮮な、もしくは凍結された体液から取得することができる。非限定例としては、全血、骨髄、脳脊髄液、腹水、胸膜液、リンパ液、血清、血漿、尿、乳糜、糞便、射精物、痰、乳頭吸引物、唾液、スワブ検体、結腸洗浄標本およびブラシ標本が挙げられる。組織および体液を、任意の好適な方法を用いて回収することができ、多くのそのような方法が当業界でよく知られている。パラフィン包埋標本の評価を、直接的に、または組織切片上で実施することができる。用語「サンプル」、「患者サンプル」および「患者のサンプル」は、互換的に用いられ、上記のような、患者に由来するDNAを含有するサンプルを意味すると意図される。
【0074】
本発明の方法を、精製された、または未精製のDNAを含有するサンプル上で実行することができる。しかしながら、好ましい実施形態においては、工程(a)(試薬処理工程)の前に、または予備工程として、DNAを含有するサンプルからDNAを単離/抽出/精製する。任意の好適なDNA単離技術を用いることができる。精製技術の例を、Molecular Cloning - A Laboratory Manual (第3版)、SambrookおよびRussell(特に、その中の添付物8および第5章を参照)などの標準的な教科書に見出すことができる。1つの好ましい実施形態においては、精製はDNAのアルコール沈降を含む。好ましいアルコールとしては、エタノールおよびイソプロパノールが挙げられる。また、好適な精製技術としては、塩に基づく沈降方法も挙げられる。かくして、1つの特定の実施形態においては、DNA精製技術は、夾雑物を沈降させるための高濃度の塩の使用を含む。その塩は、例えば、酢酸カリウムおよび/または酢酸アンモニウムを含む、本質的にそれからなる、またはそれからなってもよい。前記方法は、沈降させた夾雑物の除去、次いで、アルコール沈降を介するDNAの回収の工程をさらに含んでもよい。
【0075】
代替的な実施形態においては、DNA精製技術は、細胞溶解物から夾雑物を抽出するための有機溶媒の使用に基づく。かくして、一実施形態においては、前記方法は、DNAを抽出するためのフェノール、クロロホルムおよびイソアミルアルコールの使用を含む。好適な条件を用いて、夾雑物が有機相中に分離され、DNAが水相に残留することを確保する。さらなるキットは、磁気ビーズ、シリカ膜などを使用する。そのようなキットは当業界でよく知られており、市販されている。本発明の方法は、PUREGENE(登録商標)DNA精製キットを用いることができる。
【0076】
これらの精製技術の好ましい実施形態においては、抽出されたDNAを、エタノールまたはイソプロパノール沈降などのアルコール沈降を介して回収する。
【0077】
ホルマリン固定パラフィン包埋(FFPE)腫瘍組織は、臨床センター内での腫瘍組織保存のための通常の方法である。そのようなFFPE包埋サンプルは、DNA抽出の前に脱ろう工程を必要とする。好ましい実施形態においては、FFPE組織サンプルまたはスライド上に固定されたサンプル材料を、キシレン処理により最初に脱ろうする。キシレンとの接触期間は、キシレンがサンプルに接触し、それと相互作用するのに十分なものであるべきである。より好ましい実施形態においては、FFPEサンプルを100%キシレン中で約2時間、脱パラフィン化する。この工程を、もう一度繰り返して、完全な脱パラフィン化を確実にする。キシレン処理の後、サンプルを70%エタノールを用いて再水和する。
【0078】
本発明の方法はまた、必要に応じて(工程(a)の前に、または予備工程として)、サンプル中の単離/抽出/精製されたDNAの定量化を含んでもよい。サンプル中のDNAの定量化を、任意の好適な手段を用いて達成することができる。核酸の定量は、例えば、分光光度計、蛍光光度計またはUVトランスイルミネーターの使用に基づくものであってよい。好適な技術の例は、Molecular Cloning - A Laboratory Manual (第3版)、SambrookおよびRussell(特に、その中の添付物8を参照)などの標準的な教科書に記載されている。好ましい実施形態においては、Molecular Probes, Invitrogenから入手可能なPicogreen(登録商標)dsDNA定量キットなどのキットを用いて、DNAを定量することができる。
【0079】
本発明の方法は、DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を生成する試薬に依存する。前記試薬の作用様式は既に説明されている。好ましい実施形態においては、DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を生成するが、メチル化シトシン残基を修飾しない試薬は、亜硫酸水素塩試薬を含む、本質的にそれからなる、またはそれからなる(Frommerら、Proc. Natl. Acad. Sci. USA 1992 89:1827-1831)。いくつかの亜硫酸水素含有試薬が当業界で公知であり、脱アミノ化反応を実行するための好適なキットは市販されている(Zymo Research社製のEZ DNAメチル化キットなど)。本発明の方法における使用のための特に好ましい試薬は、亜硫酸水素ナトリウムを含む、本質的にそれからなる、またはそれからなる。
【0080】
一度、前記サンプル中のDNAを前記試薬で処理したら、該試薬により引き起こされるヌクレオチド配列における差異を検出する必要がある。これを、核酸増幅技術を用いて行う。既に記載のように、機能的に関連するメチル化は、遺伝子のプロモーター領域と最も一般的に関連する。特に、いわゆる「CpGアイランド」は、比較的高い発生率のCpG残基を含み、前記遺伝子のプロモーター領域中に認められることが多い。目的の遺伝子中のCpGアイランドを同定することができる様々なソフトウェアプログラムが存在する。従って、本発明の方法は、少なくとも1個のプライマー対を用いて目的のメチル化または非メチル化遺伝子の少なくとも一部を増幅することを含んでもよい。上記で考察されたように、メチル化状態を調査しようとする目的の残基は、典型的には規定のCpGアイランドおよび/または目的の遺伝子のプロモーター領域中に認められるため、前記プライマー対は、典型的には、全体よりもむしろ、前記遺伝子の一部のみ(この領域中の)を増幅するであろう。前記遺伝子の任意の好適な部分を、増幅産物が目的の遺伝子の存在の信頼できる指示因子として検出可能であるという条件で、本発明の方法に従って増幅することができる。特に容易に検出可能な増幅産物は、約50〜250 bpである。さらにより好ましくは、目的のメチル化または非メチル化遺伝子の増幅のための少なくとも1個のプライマー対を用いる増幅は、約100〜200 bpまたは50〜100 bpの増幅産物をもたらす。典型的には、限定されたDNA量が得られ、より小さいアンプリコンが望ましい場合、これは、組織サンプル、特に、パラフィン包埋サンプルにとって特に関連する。好ましい実施形態においては、検出可能な増幅産物は、配列番号2、4、5、7、8、11、13、14、16、17または19のいずれかの少なくともヌクレオチド配列を含む。好ましくは、(約)100 bp、110 bp、115 bp、120 bp、125 bp、126 bp、130 bp、135 bp、140 bpまたは142 bpの増幅産物が産生される。
【0081】
前記プライマー対中の少なくとも一方のプライマー、および好ましくは、両方のプライマーを、前記試薬を用いる処理後に、メチル化または非メチル化DNAの配列にのみ結合するように設計する。かくして、前記プライマーは、前記方法が行われる用途に応じて、メチル化形態の遺伝子(前記試薬を用いる処理後に未修飾のままである)または非メチル化形態の遺伝子(前記試薬により修飾される)とのみ塩基対を形成することにより、メチル化遺伝子と非メチル化遺伝子とを識別するように作用する。従って、このプライマーは、目的の遺伝子中の少なくとも1個のメチル化部位を包含しなければならない。好ましくは、前記プライマーは、少なくとも1個、2個、3個、4個、5個、6個、7個または8個のメチル化部位を含む遺伝子の領域に結合する。最も好ましくは、前記プライマーを、プライマー結合部位内のCpG対中の全てのシトシン残基がメチル化されるか、または非メチル化された、すなわち、「完全にメチル化された」または「完全に非メチル化された」配列である配列に結合するように設計する。しかしながら、1個または数個のメチル化部位のみが機能的に関連する場合、前記プライマーを、効率的な結合を起こすために、これらの残基のみをメチル化する(シトシンとして残る)か、または非メチル化する(ウラシルに変換する)必要がある標的配列に結合するように設計することができる。他の(機能的に関連しない)潜在的なメチル化部位を、好適なプライマー設計を介して完全に回避するか、またはこれらのあまり関連性のない部位のメチル化状態とは無関係に結合するプライマーを設計することができる(例えば、プライマー配列内の好適な位置にGおよびA残基の混合物を含有させることによる)。従って、メチル化または非メチル化形態の目的の遺伝子が元のDNAを含有するサンプル中に存在する場合にのみ、増幅産物が予想される。さらに、またはあるいは、例えば、遺伝子が、メチル化された機能的に重要な部位および非メチル化された別の機能的に重要な部位を含む場合、前記プライマー対中の少なくとも一方のプライマーが、前記試薬を用いる処理後に非メチル化DNAの配列にのみ結合し、他方のプライマーが、処理後にメチル化DNAにのみ結合することが好適であってよい。
【0082】
好ましくは、前記プライマー対中の少なくとも一方のプライマーは、分子エネルギー移動対の供与体部分と受容体部分を担持するステムループまたは「ヘアピン」構造を含有するプライマーである。このプライマーは、必要に応じてメチル化DNAと非メチル化DNAを識別するプライマーであってもよい。増幅の非存在下で、受容体部分が、励起の際に供与体部分により放出される蛍光をクエンチするように、プライマーを配置する。かくして、前記プライマーにより指示される増幅の前に、または増幅の非存在下では、ステムループまたは「ヘアピン」構造は無傷のままである。供与体部分により放出される蛍光は、蛍光のクエンチングをもたらす受容体部分により効率的に受容される。
【0083】
増幅の間に、プライマーのステムループまたはヘアピン構造の配置を変化させる。特に、一度、プライマーが増幅産物中に、特に、二本鎖DNA中に組込まれたら、(特に2周目の増幅の間に)ステムループまたはヘアピン構造が破壊される。構造におけるこの変化は、受容体部分が、供与体部分により放出される蛍光をもはや効率的にクエンチすることができないほど十分に供与体部分と受容体部分を分離する。かくして、供与体部分は検出可能な蛍光シグナルを産生する。このシグナルをリアルタイムで検出して、目的のメチル化または非メチル化遺伝子の遺伝子コピー数の示唆を提供する。
【0084】
かくして、本発明の方法は、分子エネルギー移動(MET)標識で検出可能に標識された核酸の増幅のためのオリゴヌクレオチドを利用することができる。前記プライマーは、MET対の供与体および/または受容体部分を含み、増幅産物がMET対の供与体および受容体部分の両方を含むように、増幅反応の増幅産物中に組込まれる。
【0085】
増幅産物が二本鎖である場合、増幅産物中に組込まれるMET対は同じ鎖上にあってもよく、増幅が3増幅である場合、反対の鎖上にあってもよい。増幅において用いられるポリメラーゼが5'-3'エキソヌクレアーゼ活性を有する特定の例においては、MET対部分の1つを、このエキソヌクレアーゼ活性により、増副産物の集団の少なくともいくつかから切断することができる。そのようなエキソヌクレアーゼ活性は、本発明の増幅方法にとって有害ではない。
【0086】
本明細書に考察される本発明の方法は、ポリメラーゼ連鎖反応(PCR)、3増幅、および他の増幅系などの核酸配列の増幅のための多くの方法に適合可能である。
【0087】
好ましい実施形態においては、METは、オリゴヌクレオチドを供与体および受容体部分で標識し、供与体部分がフルオロフォアであり、受容体部分がフルオロフォアであってよく、供与体部分により放出される蛍光エネルギーが受容体部分により吸収される、蛍光共鳴エネルギー移動(FRET)である。受容体部分はクエンチャーであってよい。かくして、増幅プライマーは、供与体部分と受容体部分の両方を含むヘアピンプライマーであり、受容体部分が供与体の蛍光をクエンチするように配置される。プライマーを増幅産物中に組込む場合、その配置が変化し、クエンチングが排除され、供与体部分の蛍光を検出することができる。
【0088】
本発明の方法により、組み込まれなかったオリゴヌクレオチドを予め分離することなく増幅産物を検出することができる。さらに、それらにより、標識されたオリゴヌクレオチドを増幅産物に組込むことにより、該産物を直接的に検出することができる。
【0089】
好ましい実施形態においては、本発明の方法は、参照遺伝子の発現を決定することも含む。参照遺伝子は、異なるサンプル間で比較を行うのに重要である。比較しようとするサンプル間で安定かつ信頼性の高い様式で発現されると考えられる好適な遺伝子を選択することにより、目的の遺伝子と共に参照遺伝子の増幅の検出は、入力材料の量、酵素的効率、サンプル分解などの内部サンプル変数を考慮に入れる。参照遺伝子は、理想的には、信頼性の高い入力DNA量の存在下、試験下でサンプル間で定常的に発現されるものである。かくして、目的の遺伝子から得られる結果を、対応するコピー数の参照遺伝子に対して正規化することができる。本発明にとって好適な参照遺伝子としては、β-アクチン、グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDH)、18SリボソームRNAなどのリボソームRNA遺伝子およびRNAポリメラーゼII遺伝子(Radonic A.ら、Biochem Biophys Res Commun. 2004 Jan 23;313(4):856-62)が挙げられる。特に好ましい実施形態においては、参照遺伝子はβ-アクチンである。
【0090】
かくして、本発明の方法はさらに、少なくとも1個のプライマー対を用いて参照遺伝子の少なくとも一部を増幅し、該プライマー対中の少なくとも1個のプライマーが、上記特性を有するステムループ構造を含むプライマーであることを特徴とする。
【0091】
参照遺伝子の任意の好適な部分を、増幅産物が参照遺伝子の存在の信頼できる指示因子として検出可能であるという条件で、本発明の方法に従って増幅することができる。特に容易に検出可能な増幅産物は、約50〜250 bpである。さらにより好ましくは、参照遺伝子の増幅のための少なくとも1個のプライマー対を用いる増幅は、約100〜200 bpの増幅産物を産生する。これは、典型的には、限られたDNA量が得られる、組織サンプル、特に、パラフィン包埋サンプルについては特に関連する。
【0092】
参照遺伝子が本発明の方法に含まれる実施形態においては、該方法はさらに、メチル化された、またはメチル化されていない目的の遺伝子に関する標準曲線に対して(リアルタイム)検出の結果を定量することを含む該方法の工程が、それぞれ、遺伝子コピー数の出力をもたらす参照遺伝子に関する標準曲線に対して参照遺伝子のリアルタイム検出の結果を定量することも含み、必要に応じて、メチル化された、またはメチル化されていない目的の遺伝子の遺伝子コピー数を、参照遺伝子の遺伝子コピー数で除算することにより、結果を正規化することをさらに含むことを特徴とする。
【0093】
再度、前記方法は、サイクル閾値が40未満である場合、増幅が有効であると考えられることを特徴とする。これは、好ましくは目的の遺伝子と参照遺伝子の両方に関する事例である。
【0094】
参照遺伝子の少なくとも一部の増幅は、一般的には少なくとも1個のプライマー対を用いる。好ましくは、前記プライマー対中の少なくとも1個のプライマーは、目的の遺伝子に関して、分子エネルギー移動対の供与体部分と受容体部分を担持するステムループ構造を含むプライマーである。増幅中のそのような構造の作用様式は、本明細書で説明されている。
【0095】
本発明の方法における使用のための「ヘアピン」プライマーは、最も好ましくは、米国特許第6,090,552号およびEP 0912597号(その開示はその全体が本明細書に組み入れられるものとする)に記載されたものである。これらのプライマーは、Amplifluor(登録商標)プライマーとして商業的に公知である。かくして、特に好ましい実施形態においては、目的の遺伝子および/または参照遺伝子の一部を増幅するのに用いられるステムループ構造を含むプライマーは、5'から3'の順に、以下の連続する配列:
(a)第1のヌクレオチド配列を、分子エネルギー移動対の供与体部分と受容体部分から選択される第1の部分で標識し、供与体部分が、励起された場合、1個以上の特定の波長で蛍光を放出し、受容体部分が、該供与体部分により放出された該蛍光を吸収および/もしくはクエンチする、約6〜30個のヌクレオチドの第1のヌクレオチド配列;
(b)約3〜20個のヌクレオチド含む、本質的にそれからなる、もしくはそれからなる第2の一本鎖ヌクレオチド配列;
(c)第3のヌクレオチド配列を、前記供与体部分と前記受容体部分から選択される第2の部分で標識し、第2の部分が第1のヌクレオチド配列を標識しない前記群のメンバーであり、第3のヌクレオチド配列が、二本鎖が第1のヌクレオチド配列と第2のヌクレオチド配列との間で形成することができるように、第1のヌクレオチド配列とは逆向きに相補的であり、第1の部分と第2の部分が近位にあり、供与体部分が励起され、蛍光を放出する場合、受容体部分が供与体部分により放出された蛍光を吸収し、クエンチする、約6〜30個のヌクレオチドを含む、本質的にそれからなる、もしくはそれからなる第3のヌクレオチド配列;ならびに
(d)プライマーの3'末端の、配列番号2、4、5、7、8、11、13、14、16、17、19もしくは25のいずれかの配列をその3'末端に含む(およびかくして、遺伝子のメチル化された、もしくはメチル化されていないDNAの一部を含む核酸鎖と相補的なヌクレオチド配列の核酸ポリメラーゼによる合成をプライミングすることができる)約8〜40個のヌクレオチドを含む、本質的にそれからなる、もしくはそれからなる第4の一本鎖ヌクレオチド配列、
を含む、本質的にそれからなる、またはそれからなり、前記二本鎖が形成されない場合、第1の部分と第2の部分は、該第1および第2の部分の間の分子エネルギー移動を阻害する距離により分離される。
【0096】
特に好ましい実施形態においては、前記供与体部分と受容体部分は、蛍光共鳴エネルギー移動(FRET)対を形成する。分子エネルギー移動(MET)は、供与体分子と受容体分子の間でエネルギーが非放射的に通過するプロセスである。蛍光共鳴エネルギー移動(FRET)は、METの形態である。FRETは特定の化合物の特性から生じる;特定の波長の光への曝露により励起された場合、それらは様々な波長で光を放出する(すなわち、それらは蛍光を発する)。そのような化合物をフルオロフォアと呼ぶ。FRETにおいては、エネルギーは、フルオロフォアである供与体分子と、受容体分子との間で長距離(10〜100Å)に渡って非放射的に通過する。供与体は光子を吸収し、このエネルギーを受容体に非放射的に移動させる(Forster, 1949, Z. Naturforsch. A4: 321-327; Clegg, 1992, Methods Enzymol. 211: 353-388)。励起スペクトルと放出スペクトルが重複する2種のフルオロフォアが近くにある場合、一方のフルオロフォアの励起は第2のフルオロフォアにより吸収され、それを刺激する波長で光を放出する原因となり、順に、蛍光を発する原因となるであろう。換言すれば、第1の(供与体)フルオロフォアの励起状態のエネルギーは、近隣の第2の(受容体)フルオロフォアとの共鳴誘導性双極子-双極子相互作用により移動する。結果として、供与体分子の寿命は低下し、その傾向はクエンチされるが、受容体分子の蛍光強度は増強され、脱分極する。供与体の励起状態のエネルギーが非フルオロフォア受容体に移動する場合、供与体の蛍光は受容体により蛍光をその後放出することなくクエンチされる。この場合、受容体はクエンチャーとして機能する。クエンチャーと受容体の両方を本発明において用いることができる。蛍光共鳴エネルギー移動(FRET)に関与することができる分子対を、FRET対と呼ぶ。エネルギー移動が起こるためには、供与体分子と受容体分子は、典型的には、近い位置になければならない(最大で70〜100Å)(Clegg, 1992, Methods Enzymol. 211: 353-388; Selvin, 1995, Methods Enzymol. 246: 300-334)。エネルギー移動の効率は、供与体分子と受容体分子との距離と共に急速に落ちる。Forster(1949, Z. Naturforsch. A4:321-327)によれば、エネルギー移動の効率は、D x 10-6(Dは供与体と受容体との距離である)に比例する。効率的には、これは、FRETが最大で約70Åの距離で最も効率的に起こり得ることを意味する。FRETにおいて一般的に用いられる分子を、別の節において考察する。フルオロフォアが供与体であるか、または受容体であるかを、その励起および放出スペクトル、およびそれが対形成したフルオロフォアにより定義する。例えば、FAMは488 nmの波長を有する光により最も効率的に励起され、500〜650 nmのスペクトルを有する光を放出し、最大で525 nmの光を放出する。FAMはJOE、TAMRA、およびROX(全て最大514 nmの励起波長を有する)と共に用いるための好適な供与体フルオロフォアである。
【0097】
1つの特に好ましい実施形態においては、前記供与体部分はフルオレセインまたはその誘導体であり、前記受容体部分はDABCYLである。好ましくは、フルオレセイン誘導体は、6-カルボキシフルオレセインを含む、本質的にそれからなる、またはそれからなる。
【0098】
MET標識を、前記プライマー中の任意の好適な点に付着させることができる。特に好ましい実施形態においては、供与体部分と受容体部分を、ステムループが無傷のままでありながら、前記部分が互いに物理的に近位にあるように、ステムループ構造内の相補的ヌクレオチド上に配置する。しかしながら、本発明のプライマーを、一度、プライマーが増幅産物中に組込まれたら、供与体と受容体の増幅および分離の非存在下で、それぞれの供与体と受容体との間でのMET/FRETを可能にするのに有効な任意の位置で前記部分を用いて標識することができる。
【0099】
ステムループまたはヘアピン構造配列は、それが標的遺伝子(目的の遺伝子または参照遺伝子)に結合しないため、そのヌクレオチド配列に依存しない。従って、次いで、目的の配列のリアルタイム検出を容易にする配列特異的プライマーと組合わせることができる「ユニバーサル」ステムループまたはヘアピン配列を設計することができる。主な配列要件は、その配列が増幅の非存在下で安定である(およびかくして、効率的なクエンチングを確保する)ステムループ/ヘアピン構造を形成することである。かくして、前記プライマーの配列特異的部分は、鋳型鎖に結合し、相補鎖の合成を指令する。従って、前記プライマーは、増幅の1周目において増幅産物の一部となる。相補鎖が合成される時、増幅はステムループ/ヘアピン構造を介して起こる。これにより、フルオロフォアとクエンチャー分子が分離し、かくして、増幅が進行するにつれてフルオロフォアの生成を誘導する。ステムループ構造は、増幅において用いられるプライマーの配列特異的部分の5'末端に見出されるのが好ましい。
【0100】
上記のように、この検出配列を、一般的にはFRET対を用いて標識する。ステムループまたはヘアピン構造が無傷のままである場合、FRETが2個の部分間で有効であるように、FRET対中の一方の部分は、前記配列の5'末端に向かって、その近くに、または5'末端に見出され、他方の部分は該配列の3'末端に向かって、その近くに、または3'末端に見出されるのが好ましい。
【0101】
実験の節に詳述するように、プライマーを注意深く選択して、本発明の方法の感度および特異性を確保しなければならない。従って、前記遺伝子のメチル化状態を検出するのに用いるための特に好ましいプライマーとしては、
5'-AGCGATGCGTTCGAGCATCGCU-3'(配列番号1)
5'-ATTTTTGTTTGGAATTTAGGGTAG-3'(配列番号2)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUCCAACATCAAACCATCACTCA-3'(配列番号3)
および/もしくは
5'-CCAACATCAAACCATCACTCA-3'(配列番号4)
および/もしくは
5'-TGGAATTTAGGGTAGTATTGT-3'(配列番号5)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUTGGAATTTAGGGTAGTATTGT-3'(配列番号6)
および/もしくは
5'-CCCTCCACCAACATCAAA-3'(配列番号7)
および/もしくは
5'-TTAGGATGTGATGTTATTGATTTGT-3'(配列番号8)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUTTAGGATGTGATGTTATTGATTTGT-3'(配列番号9)
および/もしくは
5'-TGTTTGGAATTTAGGGTAGTATTGT-3'(配列番号11)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUTGTTTGGAATTTAGGGTAGTATTGT-3'(配列番号12)
および/もしくは
5'-CCATCACTCATTACTCAAAACAAA-3'(配列番号13)
および/もしくは
5'-ATTTTTGTTCGGAATTTAGGGTAG-3'(配列番号14)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUCCGACGTCAAACCGTCGCTCG-3'(配列番号15)
および/もしくは
5'-CCGACGTCAAACCGTCGCTCG-3'(配列番号16)
および/もしくは
5'-CGGAATTTAGGGTAGTATCGT-3'(配列番号17)
および/もしくは
5'-AGCGATGCGTTCGAGCATCGCUCCCTCCGCCGACGTCAAA-3'(配列番号18)
および/もしくは
5'-CCCTCCGCCGACGTCAAA-3'(配列番号19)
に記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーが挙げられる。
【0102】
配列番号1は、ヘアピン構造の配列である。配列番号2、5、8または11は、Mageプロモーターの亜硫酸水素変換非メチル化配列と相補的なフォワードプライマー配列である。
【0103】
配列番号1は、ヘアピン構造配列である。配列番号6、9および12は、ヘアピン構造配列およびそれぞれ配列番号5、8および11の配列を含む。
【0104】
配列番号4、7および13は、Mageプロモーターの亜硫酸水素変換非メチル化配列と相補的なリバースプライマー配列である。
【0105】
配列番号3は、ヘアピン構造配列および配列番号4の配列を含む。
【0106】
配列番号14および17は、Mageプロモーターの亜硫酸水素変換メチル化配列と相補的なフォワードプライマー配列である。
【0107】
配列番号16および19は、Mageプロモーターの亜硫酸水素変換メチル化配列と相補的なリバースプライマー配列である。
【0108】
配列番号15および18は、ヘアピン構造配列ならびにそれぞれ配列番号16および19の配列を含む。
【0109】
実験の節に詳述するように、MAGE-A3の発現およびメチル化レベルは、配列5’ TGGAATTTAGGGTAG 3’(配列番号25)を含む3種全部のプライマー、配列番号2、5または11を組込んだアッセイにおいて最良の一致を示した。かくして、別の実施形態においては、MAGE-A3のプロモーター領域に結合する好ましいプライマーは、配列番号25を含む。MAGE-A3の亜硫酸水素変換配列と相補的なプライマーの部分は、25 bp未満であるのが好ましい;好ましくは、それは23、22、21、20または19 bpの長さである。かくして、そのような好ましいプライマーのMage-A3特異的部分は、好ましくは24〜19 bpの長さであるか、または23〜19 bpの長さである。好ましくは、それは19 bpの長さである。かくして、前記プライマーは、配列5’-ATTTTTGTTTGGAATTTAGGGTAGTATTGT-3’(配列番号26)に由来する23、22、21、20または19個の連続する塩基の任意の配列を含んでもよい。最も好ましくは、前記プライマーのMage-A3特異的部分は、配列番号2、4、5または7に記載のヌクレオチド配列からなる。
【0110】
配列番号2、3、4、5、6、7、8、9、11、12または13のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーは、低メチル化(非メチル化)MAGE-A3遺伝子の検出にとって特に有用である。好ましいプライマーは、配列番号2、3、4、5、6または7のヌクレオチド配列を有する。
【0111】
配列番号14、15、16、17、18または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーは、高メチル化(メチル化)MAGE-A3遺伝子の検出にとって特に有用である。
【0112】
本発明の方法/キットおよびアッセイにおける使用のための好ましいプライマー対は、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる少なくとも1個のプライマーを含む。好ましいプライマー対は、配列番号2と3;配列番号6と7;配列番号9と4;配列番号12と13;配列番号14と15;または配列番号17と18のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。最も好ましいプライマー対は、配列番号6と7のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる。
【0113】
前記プライマーのいずれか一方または両方を、標識するか、または上記で詳細に考察したように、好ましくは5'末端に、供与体部分と受容体部分を担持する好適なステムループまたはヘアピン構造を含むように合成することができる。好ましい実施形態においては、前記プライマーの一方または両方を、標識するか、または好ましくは、5'末端に、
5'-AGCGATGCGTTCGAGCATCGCU-3'(配列番号1)
に記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるステムループ構造を含むように合成する。
【0114】
この検出配列を、一般的には、FRET対を用いて標識する。ステムループまたはヘアピン構造が無傷のままである場合、FRETが2個の部分間で有効であるように、FRET対中の一方の部分は、前記配列の5'末端に向かって、その近くに、または5'末端に見出され、他方の部分は、該配列の3'末端に向かって、その近くに、または3'末端に見出されるのが好ましい。特に好ましい実施形態においては、ステムループまたはヘアピン構造、特に、配列番号1に記載の配列を含む、本質的にそれからなる、またはそれからなる核酸を、その5'末端で、FAMを用いて、その3'末端でDABCYLを用いて標識する。他の好ましい組合せは本明細書で考察されており、その考察は変更すべきところは変更して適用することができる。
【0115】
これらのプライマーは、本発明の別の態様を形成する。これらのプライマーのさらなる特徴を、以下の詳細な説明(実験部分)にまとめる。これらの配列の変異体を本発明において用いることができることに留意されたい。特に、例えば、必要に応じて、結合特異性またはステムループの形成を改善するために、追加のフランキング配列を付加することができる。変異体配列は、配列番号1〜9および11〜19または25に記載のプライマーおよび/またはプローブのヌクレオチド配列と少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%のヌクレオチド配列同一性を有するのが好ましい。前記プライマーおよびヘアピン構造は、必要に応じて合成ヌクレオチド類似体を含んでもよく、または例えば、DNA、RNAもしくはPNAに基づくもの、またはその混合物であってもよい。同様に、代替的な蛍光供与体および受容体部分/FRET対を、必要に応じて用いることができる。蛍光供与体および受容体部分を用いて標識することに加えて、前記プライマーは、本発明の方法におけるプライマーおよび/またはステムループ/ヘアピン構造としての機能が阻害されないという条件で、修飾オリゴヌクレオチドならびに他の付加基および標識を含んでもよい。
【0116】
それぞれのプライマー対について、少なくとも一方のプライマーを、増幅の非存在下では、受容体部分が供与体部分により放出された(励起の際に)蛍光をクエンチし、増幅の間には、リアルタイムで検出されて前記遺伝子の遺伝子コピー数の示唆を提供する検出可能な蛍光シグナルを産生するのに十分な供与体および受容体部分を分離するように、ステムループ構造が破壊されるように配置される分子エネルギー移動対の供与体および受容体部分で標識する。好ましくは、前記供与体部分と受容体部分は、FRET対である。一実施形態においては、前記供与体部分と受容体部分を、5-カルボキシフルオレセインもしくは6-カルボキシフルオレセイン(FAM)、2',7'-ジメトキシ-4',5'-ジクロロ-6-カルボキシフルオレセイン(JOE)、ローダミン、6-カルボキシローダミン(R6G)、N,N,N'-テトラメチル-6-カルボキシローダミン(TAMRA)、6-カルボキシ-X-ローダミン(ROX)、5-(2'-アミノエチル)アミノナフタレン-1-スルホン酸(EDANS)、アントラニラミド、クマリン、テルビウムキレート誘導体、マラカイトグリーン、反応性Red 4、DABCYL、テトラメチルローダミン、ピレンブチラート、エオシンニトロチロシン、エチジウム、およびテキサスレッドから選択する。さらなる実施形態においては、前記供与体部分を、フルオレセイン、5-カルボキシフルオレセインもしくは6-カルボキシフルオレセイン(FAM)、ローダミン、5-(2'-アミノエチル)アミノナフタレン-1-スルホン酸(EDANS)、アントラニラミド、クマリン、テルビウムキレート誘導体、マラカイトグリーン、および反応性Red 4から選択し、前記受容体部分を、DABCYL、ローダミン、テトラメチルローダミン、ピレンブチラート、エオシンニトロチロシン、エチジウム、およびテキサスレッドから選択する。好ましくは、前記供与体部分はフルオレセインまたはその誘導体であり、前記受容体部分はDABCYLであり、最も好ましくは、供与体部分は6-カルボキシフルオレセインである。特に、多重的な内容において、他の好ましい組合せを本明細書で考察し、これらの組合せも本発明のこれらの態様について想定される。
【0117】
本発明はまた、本発明の方法を実行するために用いることができるキットも提供する。このキットは、本明細書に記載の本発明の様々な方法(および使用)に関連して記載された好ましい特徴のいずれかを含んでもよい。かくして、本発明は、少なくとも1個の本発明のプライマー対を含む、DNAを含有するサンプル中のメチル化された、またはメチル化されていない目的の遺伝子の存在および/または量を検出するためのキットを提供する。好ましくは、このキットは、メチル化されていない、および/またはメチル化されたMAGE-A3遺伝子の存在および/または量を検出するための本発明のプライマー対ならびに参照遺伝子、特に、β-アクチンの存在および/または量を検出するためのプライマー対を含む。かくして、前記キットは、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25に記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるプライマーを含むプライマー対を含んでもよい。好ましくは、それぞれのプライマー対中の少なくとも一方のプライマーを、好適なステムループまたはヘアピン構造で標識して、上記で考察されたように(この考察は本明細書では変更すべきところは変更して適用することができる)、リアルタイムでの検出を容易にする。最も好ましくは、それぞれのプライマー対中の少なくとも一方のプライマーは、配列番号1に記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるステムループまたはヘアピン構造を含む。ステムループ構造を、本明細書で考察されたように(この考察は本明細書では変更すべきところは変更して適用することができる)、好適な供与体および受容体部分で標識する。
【0118】
上記のように、本発明のプライマーのさらなる特徴を、以下の詳細な説明(実験部分)にまとめる。これらの配列の変異体を、本明細書で考察されたように本発明において用いることができる。代替的な蛍光供与体および受容体部分/FRET対を、本明細書に考察されたように、必要に応じて用いることができる。
【0119】
一実施形態においては、本発明のキットはさらに、本明細書に考察されたように、非メチル化シトシンを修飾する(保護されたメチル化シトシン残基に優先する)試薬を含む。そのような試薬は、非メチル化シトシン残基からメチル化シトシン残基を識別するのに有用である。好ましい実施形態においては、前記試薬は、亜硫酸水素塩、好ましくは、亜硫酸水素ナトリウムを含む。この試薬は、非メチル化シトシン残基をウラシルに変換することができるが、メチル化シトシンは未変換のままである。残基中のこの差異を用いて、シトシンとウラシルとを識別するプライマー(グアニンについてはシトシン対であるが、アデニンについてはウラシル対)を用いるPCRなどの下流のプロセスにおいてメチル化された核酸とメチル化されていない核酸とを識別することができる。
【0120】
本明細書に記載の本発明の方法に関して考察されるように、好適な対照を用いて、該方法のための品質対照として働かせることができる。従って、一実施形態においては、本発明のキットはさらに、メチル化状態が公知である1種以上の対照核酸分子を含む、本質的にそれからなる、またはそれからなる。これらの(1種以上の)対照核酸分子は、メチル化されていることが公知であるか、もしくはそのように処理された核酸および/または非メチル化されていることが公知であるか、もしくはそのように処理された核酸分子の両方を含んでもよい。一般的には非メチル化されているが、メチル化されるように処理することができる好適な内部参照遺伝子の一例は、β-アクチンである。
【0121】
本発明のキットは、本発明の特許請求された方法を実行するための好適なバッファーおよび他の試薬をさらに含んでもよい。かくして、本発明の方法に関して提供される考察は、本明細書では変更すべきところは変更して適用することができ、簡潔さのために繰り返さないものとする。一実施形態においては、本発明のキットはさらに、核酸増幅バッファーを含む、本質的にそれからなる、またはそれからなる。
【0122】
前記キットはまた、核酸増幅を触媒する酵素をさらに含み、本質的にそれからなるか、またはそれからなってもよい。かくして、前記キットはまた、核酸増幅のための好適なポリメラーゼをさらに含み、本質的にそれからなるか、またはそれからなってもよい。その例としては、Taq、Pfu、VentなどのファミリーAおよびファミリーB型のポリメラーゼの両方に由来するものが挙げられる。
【0123】
キットの様々な成分を、個々の区画中に別々に包装するか、または例えば、必要に応じて、一緒に保存してもよい。
【0124】
前記キットはまた、別々のシート上に印刷してもよいか、または例えば、キットの包装中に組み入れてもよい、使用のための好適な説明書を含んでもよい。この説明書は、その多くが市販されている好適なリアルタイム増幅装置と共に本発明のキットを使用するのを容易にすることができる。
【0125】
本発明のリアルタイム方法の最後の工程は、メチル化された、またはメチル化されていない目的の遺伝子、および必要に応じて、参照遺伝子(含有させる場合)に関する標準曲線に対してリアルタイム検出の結果を定量することを含む。標準曲線を、標準物のセットを用いて作製することができる。それぞれの標準物は、必要に応じて、既知のコピー数、または濃度の目的の遺伝子および/または参照遺伝子を含む。典型的には、蛍光の基線値は、バックグラウンド蛍光を考慮して設定されるであろう。例えば、一実施形態においては、配列検出系(SDS)ソフトウェアを用いる。このソフトウェアは、増幅産物を検出する前に、3〜15サイクルの増幅反応のデフォルト基線範囲を設定する。次いで、蛍光の閾値を、この基線を超える統計学的に有意な値で定義する。典型的には、この閾値を、基線蛍光を超える10の標準偏差に設定する。好適なソフトウェアを、リアルタイム増幅反応を実行するための装置と共に提供する。このソフトウェアは、反応に関する基線と閾値を自動的に算出する。次いで、サイクル閾値(Ct)を、各標準物について決定することができる。これは、閾値増幅レベルを達成するのに必要とされるサイクル数である。かくして、反応混合物中の遺伝子標準物の初期濃度が大きいほど、増幅産物の特定の収率を達成するのに必要とされるサイクル数は少なくなる。標準的なDNAのセットの既知の初期コピー数のlog10に対するCtのプロットは、直線になる。これが標準曲線である。かくして、目的の遺伝子および参照遺伝子の増幅に関するCt値を用いる場合、これをそれぞれの標準曲線に対してそれぞれ内挿して、DNAを含有するサンプル中のコピー数を決定することができる。かくして、前記方法の出力は、それぞれの目的の遺伝子および参照遺伝子に関する遺伝子コピー数である。その結果を、メチル化された、またはメチル化されていない目的の遺伝子の遺伝子コピー数を、参照遺伝子の遺伝子コピー数により除算することにより正規化することができる。好ましい実施形態においては、Applied Biosystems 7900 HTファストリアルタイムPCRシステムを用いて、本発明の方法を実行する。好ましくは、個々の検出器のための基線および閾値を自動的に生成するためのAuto CTアルゴリズムなどの好適なアルゴリズムなどのSDSソフトウェアを用いるのが好ましい。
【0126】
本発明の方法を、任意の好適な増幅技術と共に用いることができるが、ポリメラーゼ連鎖反応(PCR)を用いて増幅を実行するのが最も好ましい。かくして、PCRが好ましい増幅方法であるが、ネステッドPCRなどの基本技術に対する変形を含有させるために、等価物を本発明の範囲内に含有させることもできる。例としては、限定されるものではないが、NASBA、3SR、TMAおよび3増幅などの等温増幅技術が挙げられ、その全ては当業界でよく知られており、好適な試薬が市販されている。他の好適な増幅方法としては、限定されるものではないが、リガーゼ連鎖反応(LCR)(Barringerら、1990)、MLPA、標的ポリヌクレオチド配列の選択的増幅(米国特許第6,410,276号)、コンセンサス配列プライムポリメラーゼ連鎖反応(米国特許第4,437,975号)、インベーダー技術(Third Wave Technologies, Madison, WI)、鎖置換技術、任意プライムポリメラーゼ連鎖反応(WO 90/06995)およびニック置換増幅(WO 2004/067726)が挙げられる。
【0127】
本発明のリアルタイムPCR方法は、一般的には、プライマーをアニーリングさせるために温度を低下させる工程、プライマー伸長のために温度を上昇させる工程、変性のために温度を上昇させる工程およびデータ収集のために温度を低下させる工程を含む。1つの特定の実施形態においては、データ収集工程を、約60℃〜64℃、最も好ましくは、約62℃の温度で実行するが、これは実施例の節に考察されるように、最大の感度および特異的結果を与えることが示されたからである。
【0128】
特定の実施形態においては、ポリメラーゼ連鎖反応の温度プロファイリングは、40〜50回反復、好ましくは約45回反復のサイクルを含む:
(a)約50℃で約2分間、
(b)約95℃で約10分間、
(c)約95℃で約15秒間、
(d)約62℃で約1分間。
【0129】
本発明の方法において特異的かつ高感度の結果をもたらすことが示された好ましい反応スキームは、段階1:50℃で2分間、段階2:95℃で10分間、段階3:95℃で15秒間、59℃で30秒間、59℃で30秒間(=プラトーデータ収集)を45回反復。
【0130】
本発明の方法を用いて、同じ反応において2種以上の目的の遺伝子を検出することができる。プライマーのいくつかの特異的セットの使用により、いくつかの核酸標的の増幅を同じ反応混合物において実施することができる。これを「多重化」と呼ぶことができる。好ましい実施形態においては、各標的のための一方または両方のプライマーは、FRET対を形成する蛍光部分およびクエンチング部分で標識されたヘアピンプライマーであってよい。いくつかの核酸標的の増幅には、異なる放出波長を有する、異なる蛍光供与体および/または受容体部分を用いて、各セットのプライマーを標識することが必要である。増幅後の検出および分析の間に、反応混合物に光を当て、反応において用いられるプライマーのセットの各々に関する特定の波長特性のそれぞれにおいて読み取る。かくして、前記混合物中の特定の標的DNAが増幅され、標識されたことを決定することができる。特定の実施形態においては、異なるそれぞれの標的配列の増幅のための2個以上のプライマー対を用いる。かくして、メチル化/非メチル化された目的の遺伝子の一団の存在および/または量を、単一のDNAを含有するサンプル中で検出することができる。
【0131】
また、多重化を、同じ反応中で目的の遺伝子と参照遺伝子の両方を検出する状況で用いることもできる。再度、好適な識別可能な供与体および/または受容体部分で標識されたプライマーにより、目的の遺伝子と参照遺伝子の増幅により生成されたシグナルを、それぞれ識別することができる。
【0132】
一実施形態においては、ユニバーサルクエンチャーを、それぞれ識別可能な放出最大波長を有する好適なフルオロフォア供与体と一緒に用いる。特に好ましいクエンチャーは、DABCYLである。クエンチャーとしてのDABCYLと一緒に、それぞれ、以下のフルオロフォアを用いて多重化を可能にすることができる:クマリン(最大放出475 nm)、EDANS(491 nm)、フルオレセイン(515 nm)、ルシファーイエロー(523 nm)、BODIPY(525 nm)、エオシン(543 nm)、テトラメチルローダミン(575 nm)およびテキサスレッド(615 nm)(Tyagiら、Nature Biotechnology, Vol. 16, Jan 1998; 49-53)。他の好ましい組合せは、本明細書で考察されている。
【0133】
代替的な実施形態においては、DNAを含有するサンプルを分割し、該サンプルの好適な一部に対して本発明の方法を実行して、直接比較可能な結果を得ることができる。かくして、目的の遺伝子と参照遺伝子の両方を検出する場合、サンプルを2つに分割して、一方のサンプル部分においては、リアルタイムでの目的の遺伝子の増幅、他方のサンプル部分においては、リアルタイムでの参照遺伝子の増幅を検出することができる。前記サンプルをさらに分割して、必要に応じて、好適な対照反応を実行することができる。このスキームの利点は、ユニバーサルFRET対を用いて、各プライマー対を標識し、様々な波長での放出を検出するための要件を取り除くことができる。しかしながら、この方法は、好適なサンプルを取得して、最初にサンプルを分割することができるかどうかに依る。任意の好適な反応容量を用いることができるが、1つの特定の実施形態においては、増幅工程のための総反応容量は、約10〜40μl、より好ましくは約10〜30μlおよび最も好ましくは約12μlである。
【0134】
一態様においては、本発明のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を、サンプル中の非メチル化(または低メチル化)MAGE-A3の存在が、癌または癌の素因を示す、癌または癌の素因を診断するために用いる。かくして、本発明は、癌または癌の素因を診断するためのキット、方法およびプライマーを提供する。
【0135】
「診断」を、疾患もしくは疾患の前段階のスクリーニング、疾患もしくは疾患の前段階の同定、疾患の病期および状態および進行のモニタリング、治療後の疾患の再発のチェックならびに特定の治療の成功のモニタリングを含むと本明細書では定義する。また、試験は予測値を有してもよく、これは用語「診断」の定義内に含まれる。試験の予測値を、癌に対する潜在的な罹りやすさのマーカーとして、または癌への進行のマーカーとして用いることができる。かくして、危険性のある患者を、該患者において同定可能な症候に関して、疾患がそれ自体を示す機会を有する前に同定することができる。好ましい実施形態においては、癌を、肺癌、メラノーマまたは膀胱癌から選択する。好ましい実施形態においては、診断のための方法およびアッセイは、配列番号2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、からなる、本質的にそれからなる、またはそれからなるオリゴヌクレオチドを用いる。好ましい実施形態においては、癌または癌の素因の診断は、配列番号2、3、4、5、6、7、8、9、11、12、13、または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるオリゴヌクレオチドを用い、非メチル化形態の前記遺伝子を検出する。代替的な実施形態においては、診断のための方法およびアッセイは、配列番号14、16、17または19のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる少なくとも1個のオリゴヌクレオチドを用いる。
【0136】
試験を診断的に、または治療計画と共に実施することができる。上記のように、NSCLCにおけるMAGE-A3発現の予測値を確立するRT-PCRアッセイが記載されている。これらのアッセイは、MAGE-A3免疫療法剤を用いる治療にとって好適な患者の選択においてその用途がある。本発明者らは、本発明のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対またはキットを用いる非メチル化MAGE-A3の検出のために設計されたアッセイが、MAGE-A3を発現するものとしてサンプルを確実に分類することができることを示した。メチル化試験について得られたメチル化状態の結果は、RNAサンプルに対して用いられるMAGE-A3検出のための既存のRT-PCR試験について得られた結果と良好に一致する。従って、前記メチル化試験は臨床用途を有する。
【0137】
さらなる態様において、本発明は、被験者における癌の治療の成功可能性を予測する方法であって、
(a)被験者から得られたDNAを含有する試験サンプルを、該DNA中の非メチル化シトシン残基を選択的に修飾して検出可能な修飾残基をもたらすが、メチル化シトシン残基を修飾しない試薬と接触させること/該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマー対の少なくとも一方のプライマーを、前記試薬を用いる処理後に、対応する非メチル化DNAの配列にのみ結合するように設計し、該プライマー対中の少なくとも一方のプライマーが、配列番号2、3、4、5、6、7、8、9、11、12、13または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、少なくとも1個のプライマー対を用いて非メチル化MAGE A3遺伝子の少なくとも一部を増幅させること、
(c)MAGE-A3遺伝子のメチル化状態を決定すること、
を含み、前記サンプル中の非メチル化MAGE-A3の存在が、非メチル化MAGE-A3遺伝子が検出されないか、またはそのレベルがより低い場合よりも、MAGE-A3免疫療法剤を用いる治療の成功可能性がより高いことを示す、前記方法を提供する。
【0138】
工程(c)は、増幅産物が形成されたかどうかを同定することを含む。増幅産物の同定(本明細書で考察された任意の好適な技術を用いる)は、前記サンプル中の非メチル化または低メチル化MAGEA3の存在を示す。
【0139】
勿論、逆の状況も適用可能であり、従って、本発明の方法を同様に用いて、MAGEA3免疫療法剤に対する耐性、またはそれを用いる治療が成功しない可能性が存在するかどうかを決定することができる。前記サンプル中の非メチル化MAGE-A3の非存在は、治療に対する耐性が存在し、および/または治療が成功しない可能性があることを示す。また、特定の実施形態においては、メチル化DNAに特異的なプライマーを相補的な方法において用いることもできる。
【0140】
また、本発明の方法を用いて、患者のための好適な治療過程を選択することもできる。非メチル化MAGE-A3の存在は、MAGE-A3免疫療法剤を有益に投与することができることを示すが、非メチル化MAGE-A3の非存在または低レベルの非メチル化MAGE-A3は、免疫療法剤が禁忌であることを示す。本発明のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法に関して提供される考察は、本態様にも変更すべきところは変更して適用することができ、従って、全ての実施形態が、本発明のこの態様にとって、必要に応じて想定される。
【0141】
「治療の成功可能性」とは、任意の1種以上の列挙される治療剤、好ましくは、MAGE-A3免疫療法剤またはMAGE-A3を含む組成物を用いる癌の治療が、成功するであろう確率を意味する。
【0142】
「耐性」を、特定の免疫療法剤のいずれか1種を用いる癌の治療が成功する確率が低いこと、および/または治療効果を達成するにはより高い用量が必要とされることと定義する。
【0143】
MageA3の低メチル化を、特定の癌の型と関連付けることができる。従って、特定の実施形態においては、本発明は、サンプル中の膀胱癌、NSCLCなどの肺癌またはメラノーマに対する素因、またはその発生を検出する方法であって、本発明のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いてMAGE-A3遺伝子のメチル化状態を検出することを含み、該サンプル中の非メチル化MAGE-A3の検出が、癌および特にメラノーマ;非小細胞肺癌(NSCLC)などの肺癌;もしくは移行細胞癌などの膀胱癌に対する素因、またはその発生を示す、前記方法を提供する。さらなる実施形態においては、腫瘍または癌を、乳癌;食道癌などの頭部および頸部癌;扁平上皮細胞癌;精上皮腫;肝臓癌;多発性骨髄腫および結腸癌から選択する。
【0144】
さらなる態様においては、MAGE-A3陽性腫瘍の存在を決定するための方法であって、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いて、サンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、非メチル化MAGE-A3の存在が、MAGE-A3陽性腫瘍の存在について示す、前記方法を提供する。
【0145】
試験を、診断的に、または治療計画と共に実施することができる。MAGE-A3特異的免疫療法剤(ASCI)が開発されており、臨床試験において現在評価されている。また、試験を用いて、どの治療計画または予防計画を患者に対して使用するかを決定し、治療計画の効力をモニターすることもできる。
【0146】
従って、本発明はさらに、MAGE-A3免疫療法剤を用いる治療にとって好適な患者を同定および/または選択するための方法であって、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いて、患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、MAGE-A3遺伝子がメチル化されていない場合、被験者を、MAGE-A3免疫療法剤を用いる治療のために同定および/または選択する、前記方法を提供する。
【0147】
あるいは、前記遺伝子が非メチル化されていない場合、前記被験者をMAGE-A3免疫療法剤を用いる治療のために選択しないのが好ましい。
【0148】
関連する態様においては、本発明は、癌の治療の成功可能性を予測するための方法であって、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いて、患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、該遺伝子がメチル化されていない場合、MAGE-A3免疫療法剤を用いる治療の成功可能性が、該遺伝子がメチル化されている場合よりも高い、前記方法を提供する。
【0149】
あるいは、前記サンプル中の非メチル化MAGE-A3の非存在は、MAGE-A3免疫療法剤を用いる治療に対する耐性の可能性が、該遺伝子がメチル化されていない場合よりも高いことを示す。かくして、メチル化MAGE-A3遺伝子の検出(または低メチル化遺伝子の検出の欠如)は、免疫療法剤を用いる治療の成功確率が低いことを示す。
【0150】
かくして、患者集団を、MAGE-A3遺伝子に関してそのメチル化状態に基づいて、治療のために選択することができる。これにより、より多く集中され、個別化された形態の薬剤が得られ、かくして、最も有効であると考えられる薬剤を用いて患者を治療することができるため、成功率の改善がもたらされる。
【0151】
さらに関連する態様においては、本発明は、癌のための好適な治療計画を選択する方法であって、本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いて、患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、該遺伝子がメチル化されていない場合、治療のために免疫療法剤(特に、MAGE免疫療法剤)を選択する、前記方法を提供する。
【0152】
あるいは、前記遺伝子が非メチル化されていない場合、免疫療法剤を用いる治療は禁忌である。
【0153】
また、本発明の方法のいずれかに従って、または本明細書に記載のオリゴヌクレオチド、プライマーもしくはプローブ、プライマー対、キットまたは方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択された被験者における癌を治療する方法であって、免疫療法剤の投与を含む前記方法も提供される。好ましくは、本明細書に記載の全ての異なる態様について、非メチル化MAGE-A3遺伝子の検出は、MAGE-A3タンパク質レベルの増加に対応する。
【0154】
本発明において有用なMAGE-A3免疫療法剤は、MAGE-A3に基づく組成物を含む。MAGE-A3を含む組成物の例としては、完全長MAGE-A3、実質的に完全長のMAGE-A3およびMAGE-A3の断片、例えば、MAGE-A3のペプチドを含む組成物が挙げられる。
【0155】
本発明において用いることができるペプチドの例としては、以下のMAGE-A3ペプチドが挙げられる:

【0156】
MAGEタンパク質は、完全長MAGE-A3であってもよく、または実質的に完全長のMAGE-A3の断片、例えば、MAGE3のアミノ酸3〜314(合計312個のアミノ酸)、もしくは1〜10個のアミノ酸がMAGE-A3タンパク質のN末端および/もしくはC末端から欠失された他のMAGE-A3断片を含んでもよい。
【0157】
一実施形態においては、MAGE-A3タンパク質、断片またはペプチドを、融合パートナータンパク質に連結することができる。
【0158】
MAGE-A3タンパク質、断片もしくはペプチドおよび融合パートナータンパク質を化学的に結合させるか、または組換え融合タンパク質として発現させることができる。抗原およびパートナーを組換え融合タンパク質として発現させる実施形態においては、これは非融合タンパク質と比較して、発現系において産生されるレベルの増加をもたらし得る。かくして、融合パートナータンパク質は、Tヘルパーエピトープ(免疫学的融合パートナータンパク質)、好ましくは、ヒトにより認識されるTヘルパーエピトープの提供を援助し、および/または天然の組換えタンパク質よりも高い収率での該タンパク質(発現増強タンパク質)の発現を援助することができる。一実施形態においては、融合パートナータンパク質は、免疫学的融合パートナータンパク質および発現増強パートナータンパク質の両方であってよい。
【0159】
本発明の一実施形態においては、用いることができる免疫学的融合パートナータンパク質を、プロテインD、グラム陰性細菌、ヘモフィルス・インフルエンザB(Haemophilus influenza B)の表面タンパク質(WO 91/18926)またはその誘導体から誘導する。プロテインD誘導体は、該タンパク質の最初の1/3、または該タンパク質の最初の約1/3を含んでもよい。一実施形態においては、プロテインDの最初のN末端の109個の残基を、融合パートナーとして用いて、さらなる外因性T細胞エピトープを有するMAGE-A3抗原を提供し、大腸菌中での発現レベルを増加させることができる(かくして、発現エンハンサーとしても作用する)。代替的な実施形態においては、プロテインD誘導体は、最初のN末端の100〜110個のアミノ酸または最初のN末端の約100〜110個のアミノ酸を含んでもよい。一実施形態においては、プロテインDまたはその誘導体を脂質化し、リポプロテインDを用いることができる:脂質尾部は、抗原提示細胞への抗原の最適な提示を確保することができる。代替的な実施形態においては、プロテインDまたはその誘導体を脂質化しない。プロテインDの「分泌配列」または「シグナル配列」とは、天然タンパク質のほぼアミノ酸1〜16、17、18または19を指す。一実施形態においては、プロテインDの分泌またはシグナル配列とは、プロテインDのN末端の19個のアミノ酸を指す。一実施形態においては、分泌またはシグナル配列を、プロテインD融合パートナーのN末端に含有させる。本明細書で用いられる「最初の1/3」、「最初の109個のアミノ酸」および「最初のN末端の100〜110個のアミノ酸」とは、分泌またはシグナル配列の直後のプロテインD配列のアミノ酸を指す。必要に応じて、シグナル配列のアミノ酸2-Kおよび3-Lを、アミノ酸2-Mおよび3-Dと置換することができる。
【0160】
一実施形態においては、MAGE-A3は、プロテインD-MAGE-A3-His、432個のアミノ酸残基の融合タンパク質であってもよい。この融合タンパク質は、プロテインDのシグナル配列、プロテインDのアミノ酸1〜109、MAGE-A3タンパク質に由来する312個のアミノ酸(アミノ酸3〜314)、スペーサーおよび生産プロセスの間の融合タンパク質の精製を容易にすることができるポリヒスチジン尾部(His)、例えば、
i)18残基のシグナル配列およびプロテインDの最初のN末端の109個の残基;
ii)2個の非関連残基(メチオニンおよびアスパラギン酸);
iii)天然のMAGE-A3タンパク質の残基3〜314;
iv)ヒンジ領域として機能する2個のグリシン残基;ならびに
v)7個のヒスチジン残基、
を含む。
【0161】
この分子のアミノ酸配列を、図10(配列番号40)に示す。この抗原および以下にまとめたものは、WO 99/40188により詳細に記載されている。
【0162】
別の実施形態においては、免疫学的融合パートナータンパク質は、LytAとして知られるタンパク質またはそれから誘導されるタンパク質であってよい。LytAは、ペプチドグリカン主鎖中の特定の結合を特異的に分解するオートリシンである、N-アセチル-L-アラニンアミダーゼ、アミダーゼLytA(LytA遺伝子によりコードされる(Gene, 43 (1986) 265-272頁)を合成する肺炎連鎖球菌(Streptococcus pneumoniae)に由来する。LytAタンパク質のC末端ドメインは、コリンまたはDEAEなどのいくつかのコリン類似体への親和性を担う。この特性は、融合タンパク質の発現にとって有用な大腸菌C-LytA発現プラスミドの開発に活用されている。そのアミノ末端にC-LytA断片を含むハイブリッドタンパク質の精製が記載されている(Biotechnology: 10, (1992) 795-798頁)。一実施形態においては、前記分子のC末端部分を用いることができる。C末端中に認められ、残基178で始まるLytA分子の反復部分を用いることができる。一実施形態においては、LytA部分は、残基188〜305を含んでもよい。
【0163】
他の融合パートナーとしては、インフルエンザウイルスに由来する非構造タンパク質、NS1(ヘマグルチニン)を含む。一実施形態においては、NS1のN末端の81個のアミノ酸を用いるが、それらがTヘルパーエピトープを含むという条件で、異なる断片を用いてもよい。
【0164】
本発明の一実施形態においては、MAGE-A3タンパク質は、誘導体化された遊離チオールを含んでもよい。そのような抗原はWO 99/40188に記載されている。特に、カルボキシアミド化またはカルボキシメチル化誘導体を用いることができる。
【0165】
さらなる実施形態においては、MAGE-A3組成物は、MAGE-A3タンパク質、本明細書に記載の断片もしくはペプチドもしくは融合タンパク質をコードする核酸分子を含む。本発明の一実施形態においては、前記配列を好適な発現ベクター中に挿入し、DNA/RNAワクチン接種に用いることができる。前記核酸を発現する微生物ベクターを、ベクター由来免疫療法剤として用いることもできる。
【0166】
好適なウイルスベクターの例としては、レトロウイルス、レンチウイルス、アデノウイルス、アデノ関連ウイルス、単純ヘルペスウイルスなどのヘルペスウイルス、α-ウイルス、カナリポックスなどのポックスウイルスおよびワクシニアウイルスに基づく系が挙げられる。これらのウイルスを用いる遺伝子導入技術は、当業者には公知である。例えば、レトロウイルスベクターを用いて、本発明のポリヌクレオチドを宿主ゲノム中に安定に組込むことができるが、そのような組換えは好ましくない。対照的に、複製欠損アデノウイルスベクターはエピソームのままであり、従って、一過的な発現が可能になる。昆虫細胞(例えば、バキュロウイルスベクター)、ヒト細胞、酵母、細菌における発現を駆動することができるベクターを用いて、例えば、サブユニットワクチンとして、または免疫アッセイにおける使用のための、本発明のポリヌクレオチドによりコードされる、大量のMAGE-A3タンパク質を産生させることができる。
【0167】
好ましい実施形態においては、生ベクターとして用いられるアデノウイルスは、複製欠損サルアデノウイルスである。典型的には、これらのウイルスは、E1欠失を含み、E1遺伝子を用いて形質転換された細胞系上で増殖させることができる。好ましいサルアデノウイルスは、チンパンジーから単離されたウイルスである。特に、C68(Pan 9としても知られる)(米国特許第6,083,716号)ならびにPan 5、6およびPan 7(WO 03/046124)が、本発明における使用にとって好ましい。これらのベクターを操作して、遺伝子産物を発現することができるように、本発明の異種遺伝子を挿入することができる。そのような組換えアデノウイルスの使用、製剤および製造は、WO 03/046142に詳細に記載されている。
【0168】
核酸配列を取得するための従来の組換え技術、および発現ベクターの製造は、Maniatisら、Molecular Cloning - A Laboratory Manual; Cold Spring Harbor, 1982-1989に記載されている。
【0169】
タンパク質に基づく組成物については、本発明のタンパク質を、液体形態中または凍結乾燥形態中で可溶性の形態で提供することができる。
【0170】
各ヒト用量は、1〜1000μgのタンパク質を含んでもよい。一実施形態においては、前記用量は30〜300μgのタンパク質を含んでもよい。
【0171】
本明細書に記載のMAGE-A3含有組成物はさらに、ワクチンアジュバント、および/または免疫刺激サイトカインもしくはケモカインを含んでもよい。
【0172】
本発明における使用のための好適なワクチンアジュバントは、例えば、Freundの不完全アジュバントおよび完全アジュバント(Difco Laboratories, Detroit, MI);Merckアジュバント65(Merck and Company, Inc., Rahway, NJ);AS-2(SmithKline Beecham, Philadelphia, PA);水酸化アルミニウムゲル(ミョウバン)もしくはリン酸アルミニウムなどのアルミニウム塩;カルシウム、鉄もしくは亜鉛の塩;アシル化チロシンの不溶性懸濁液;陽イオンもしくは陰イオン的に誘導体化されたポリサッカリド;ポリホスファゼン;生分解性ミクロスフェア;モノホスホリルリピドAおよびクイルAなどの市販のものである。GM-CSFまたはインターロイキン-2、-7、もしくは-12などのサイトカイン、およびケモカインをアジュバントとして用いることもできる。
【0173】
一実施形態においては、前記アジュバントは、3-デ-O-アシル化モノホスホリルリピドA(3D-MPL)などのモノホスホリルリピドAと、アルミニウム塩との組合せを含んでもよい。あるいは、前記アジュバントは、WO 98/50399、WO 01/34617およびWO 03/065806に開示された、3D-MPLまたはリン酸アミノアルキルグルコサミニドなどの他のtoll様受容体4(TLR4)リガンドを含んでもよい。
【0174】
用いることができる別のアジュバントは、サポニン、例えば、QS21(Aquila Biopharmaceuticals Inc., Framingham, MA)であってよく、単独で、または他のアジュバントと組合わせて用いることができる。例えば、一実施形態においては、WO 94/00153に記載のQS21と3D-MPLの組合せなどのモノホスホリルリピドAとサポニン誘導体の組合せ、またはWO 96/33739に記載のような、QS21がコレステロールでクエンチされた組成物が提供される。他の好適な製剤は、水中油乳濁液およびトコフェロールを含む。一実施形態においては、前記アジュバントは、WO 95/17210に記載のように、水中油乳濁液中にQS21、3D-MPLおよびトコフェロールを含む。
【0175】
本発明における使用のための他のアジュバントは、CpGジヌクレオチドがメチル化されていない、非メチル化CpG含有オリゴヌクレオチドなどのTLR9アンタゴニストを含んでもよい。そのようなオリゴヌクレオチドはよく知られており、例えば、WO 96/02555に記載されている。
【0176】
本発明における使用のための好適なオリゴヌクレオチド(本文脈における)としては、以下のものが挙げられる:

【0177】
CpG含有オリゴヌクレオチドを、単独で、または他のアジュバントと共に用いることもできる。例えば、一実施形態においては、前記アジュバントは、CpG含有オリゴヌクレオチドとサポニン誘導体の組合せ、特に、WO 00/09159およびWO 00/62800に開示されたCpGとQS21の組合せを含む。
【0178】
従って、本明細書に記載のMAGE-A3を含む組成物であって、アジュバントが3D-MPL、QS21、CpGオリゴヌクレオチド、ポリエチレンエーテルもしくはエステルのうちの1種以上またはこれらのアジュバントの2種以上の組合せを含む、前記組成物が提供される。特定の実施形態においては、前記組成物内のMAGE-A3成分を、水中油もしくは油中水乳濁液ビヒクルまたはリポソーム製剤中で提供することができる。
【0179】
一実施形態においては、前記アジュバントは、3D-MPL、QS21および免疫刺激CpGオリゴヌクレオチドのうちの1種以上を含んでもよい。一実施形態においては、3種全部のアジュバント成分が存在する。前記成分を、リポソーム製剤またはWO 95/17210に記載のものなどの水中油乳濁液中で提供することができる。
【0180】
別の実施形態においては、3D-MPLとQs21を、水中油乳濁液中、かつCpGオリゴヌクレオチドの非存在下で提供する。
【0181】
用いられる3D-MPLの量は一般的に少量であるが、製剤に応じて、用量あたり1〜1000μg、好ましくは用量あたり1〜500μg、およびより好ましくは用量あたり1〜100μgの範囲にあってよい。
【0182】
本発明のアジュバント中のCpGまたは免疫刺激オリゴヌクレオチドの量は一般的には少量であるが、製剤に応じて、用量あたり1〜1000μg、好ましくは用量あたり1〜500μg、およびより好ましくは用量あたり1〜100μgの範囲にあってよい。
【0183】
本発明のアジュバントにおける使用のためのサポニンの量は、用量あたり1〜1000μg、好ましくは用量あたり1〜500μg、より好ましくは用量あたり1〜250μg、および最も好ましくは用量あたり1〜100μgの範囲にあってよい。
【0184】
本明細書に記載のアジュバント製剤はさらに、水中油乳濁液および/もしくはトコフェロールを含んでもよく、またはリポソーム組成物中で製剤化してもよい。
【0185】
他の好適なアジュバントとしては、モンタニドISA 720 (Seppic, France)、SAF (Chiron, California, United States)、ISCOMS (CSL)、MF-59 (Chiron)、Ribi Detox、RC-529 (GSK, Hamilton, MT)および他のアミノアルキルグルコサミニド4-リン酸(AGP)が挙げられる。
【0186】
一般的には、各ヒト用量は、0.1〜1000μg、例えば、0.1〜500μg、0.1〜100μg、または0.1〜50μgの抗原を含んでもよい。特定の免疫療法剤の最適量を、ワクチン接種された被験者における好適な免疫応答の観察などの標準的な試験により確認することができる。初回ワクチン接種後に、被験者は十分に間隔を空けた1回または数回の追加免疫を受けてもよい。
【0187】
あるいは、本発明の方法における使用のための組成物は、製薬上許容し得る賦形剤中に本明細書に記載のMAGE-A3を含む医薬組成物を含んでもよい。
【0188】
ここで、本発明を、以下の非限定的な実施例に関して説明する。
【0189】
(実施例)
詳細な説明−実験の節
【実施例1】
【0190】
リアルタイムAmplifluorアッセイ
直接リアルタイム蛍光メチル化特異的PCRアッセイ(リアルタイムMSPアッセイ)を開発して、MGMTプロモーターのメチル化状態を定義した(Vlassenbroeckら、J Mol Diagn 2008, 10:332-337)。この技術を、70頁の図4に関する図面の凡例に例示し、まとめる。
【0191】
Mage-A3に関する分析物の定量を、この技術を用いてうまく実施した。これは、ABI Prism(登録商標)7900HT装置(Applied Biosystems)上でのAmplifluor(登録商標)アッセイ形式を用いて、Mage-A3のための特異的プライマーおよびプライマー/検出対を用いる平行増幅/定量プロセスからなっていた。
【0192】
反応混合物中の最終プライマー濃度は、フォワードプライマー/検出およびリバースプライマーの両方について、100 nMであった。Roxを含む12.5μlのiTaqTM Supermix (BioRad, 2xバッファー)を、PCR反応に用いた。5μlの修飾鋳型DNAを含む、反応あたりの総量は25μlであった。ABI 7900HT SDS装置を、仕様の10分前に開始し、加熱カバーを105℃に到達させた。以下の温度プロファイルを用いた:段階1:50℃で2分間、段階2:95℃で10分間、段階3:95℃で15秒間、62℃で1分間(=プラトー-データ収集)を45回反復。
【0193】
標準曲線として用いられるプラスミド材料を、以下のように作製した:前記プライマーにより定義されるプロモーター配列をPCR増幅し、クローニングする(好適な単離され、亜硫酸水素修飾された細胞系のDNAを用いる)。この配列を配列決定により検証し、公開されたプロモーター配列と比較する。
【0194】
標準曲線(2 x 106 - 20コピー)を含有させて、そのCt値を標準曲線に内挿することにより未知のサンプルのコピー数を決定した。このアッセイにおいては、β-アクチンを参照遺伝子として用いた。
【実施例2】
【0195】
MAGE-A3アッセイおよびプライマー設計
Qiuら、Clinical Biochemistry 39 (2006), 259-2; Jangら、Cancer Research 61 (2001), 7959-7963およびFurutaら、Cancer Sci 95 (2004), 962-968に記載の非メチル化MAGE-A3を検出するのに有用なプライマーを合成し、新規プライマー配列に加えて表1に示す。
【0196】
非メチル化形態またはあるいはメチル化形態のMage A3を検出するためのフォワード(F)およびリバース(R)プライマーのコンピューター内設計を、MSP要件に適合させたPrimer3ソフトウェア(http://fokker.wi.mit.edu/primer3/input.htm)を用いて行った。条件は以下の通りであった:アンプリコンのサイズ:60-120 nt;プライマーのサイズ:18-27 nt;融点:55-65℃;最大3'自己相補性=0;TSS近辺の200 bpのウィンドウ(戻るまでの番号=2000)。
【0197】
U_プライマーを、非メチル化Mage-A3を検出するために設計し、M_プライマーをメチル化Mage-A3を検出するために設計した。最後に、プライマーA MAGE_A3およびMAGEA3_GO_1_U_F、MAGEA3_GO_2_U_R、MAGEA3_GO_1_U_R_AMP、MAGEA3_GO_2_U_F_AMP、MAGEA3_GO_1_M_F、MAGEA3_GO_2_M_F、MAGEA3_GO_1_M_R_AMPおよびMAGEA3_GO_2_M_R_AMPを、さらなる調査のために保持した。転写開始部位(TSS)と比較したU-プライマーの位置を、図1および図2に示す。このプライマーは転写開始部位の近くに位置する。
【0198】
フォワードまたはリバースプライマーのいずれかを合成して、ヌクレオチド配列:5' AGCGATGCGTTCGAGCATCGCU 3'(配列番号1)を5'末端に有する供与体および受容体部分を担持する好適なステムループまたはヘアピン構造を含有させた。
【0199】
様々なMAGEA3プライマーの組合せを試験した。最終的に、4つのU-アッセイと2つのM-アッセイを、さらなる開発のために保持した。各アッセイについて選択されたプライマーの組合せを表1にまとめる。
【表1】

【実施例3】
【0200】
分析アッセイの性能
アッセイの分析性能(検出限界および特異性)を、再構築された基質を用いて証明した。
【0201】
検出限界
非メチル化パターンに関するMSPの感度を決定するために、陽性であると確認された細胞系材料(LNCaPおよびGerl)を連続希釈し、対照(陰性)細胞系のDNA(DU145)と混合した。1/10;1/100および1/500の希釈物を作製した(表2を参照)。総量750 ngのDNA(U DNA + M DNA)を、Zymo Research社製EZ DNA Methylationキットを用いて亜硫酸水素処理した。
【表2】

【0202】
続いて、2.4μlの化学的に処理されたDNAを、非メチル化GO_2_Uアッセイ(LNCaP/DU145 DNA混合物)および非メチル化Furutaアッセイ(Gerl/DU145 DNA混合物)のための特異的プライマーを用いるMAGEA3リアルタイムMSPの鋳型として用いた。結果を図3に提供する。
【0203】
認められるように、MAGEA3 GO_2_UおよびMAGEA3_FurutaリアルタイムMSPのより低い検出限界が、1.5 ng(1/500希釈率)で繰り返し設定されたが、これは全サンプル調製手順を考慮したものである。PCR反応あたり10%のサンプルを用いるため、最終的な分析感度は0.15 ngである。
【0204】
分析特異性
MAGEA3 GO_1_U/GO_2_U/Furuta_UおよびQIU_Uプライマーセットの特異性を、CpGenome(商標)Universal Methylated/Unmethylated DNA(Chemicon International, CA, USA; カタログ番号S7821およびカタログ番号S7822)を用いるMSPならびにその後のアガロースゲル分析により確認した。簡単に述べると、amplifluorリアルタイムMSPを、以下の温度プロフィール:段階1:50℃で2分間、段階2:95℃で10分間、段階3:95℃で15秒間、62℃で1分間(=プラトー-データ収集)を45回反復を用いるI Cycler (Bio-Rad)上で実施した。Amplifluorに基づく検出には高い特異性が必須であるため、温度勾配を段階3で適用して、最良のアニーリング温度(57℃、58.1℃、60.3℃および61.8℃)を選択した。
【0205】
得られたPCR産物を全部、3%アガロースゲル上で泳動した。CpGenome(商標)Universal Methylated DNAを鋳型DNAとして用いた場合(57℃で試験)、バンドは可視化されなかったが、これにより非メチル化DNAに対する特異性が確認された。
【0206】
さらに、MAGEA3アッセイの特異性を、配列アラインメントを用いて、MAGE-Aファミリーの遺伝子数を互いに調査した。MAGEA3 GO_1_U/GO_2_U/Furuta_UおよびQIU_UプライマーセットとMAGE-A2およびMAGE-A12配列(変換配列)の不一致の番号を表3に示す。調査したUプライマーはMAGE-A3 U/MAGE-A6 Uにとって特異的であるようであった。
【表3】

【0207】
MAGE-A3調節配列のクローニングおよび性能標準曲線
364 bpの調節MAGE-A3 U DNA配列を、表4に示されるフランキングプライマーを用いてクローニングした。
【表4】

【0208】
このクローニングされた材料を、リアルタイムMSPのための標準曲線材料として用いた。最初に、6個の標準曲線の2個のプレートをランニング(running)することにより、再現性を確認した(2*106-2*101コピー)(2人の異なる操作者、3個のPCR混合物/操作者/プレート)。スロープ、PCR効率およびR2値をモニターしたところ、許容可能な結果が得られた。
【0209】
性能標準曲線
MAGEA3プラスミド材料の連続希釈液(2 x 106〜2 x 101コピー/5μl)を、表1の特定のプライマーおよびAmplifluor検出配列を用いて、以下の最適化された温度プロフィール:段階1:50℃で2分間、段階2:95℃で10分間、段階3:95℃で15秒間、59℃で30秒間、59℃で30秒間(=プラトー-データ収集)を45回反復を用いて2回ロードした。結果をSDS 2.2ソフトウェア(Applied Biosystems)を用いて生成し、Ct値(増幅曲線がソフトウェアにより自動的に設定された閾値を横断するサイクル数)としてエクスポートした。標準曲線の性能を表5に示す。
【表5】

【実施例4】
【0210】
細胞系材料に対するアッセイの性能
MAGEA3メチル化状態を、19種の細胞系について調査した。MAGEA3 UおよびMアッセイに関する、それぞれ最良のメチル化および非メチル化細胞系を、以下に示す。
【表6】

【0211】
【表7】

【実施例5】
【0212】
中間精度
中間精度を、非メチル化およびメチル化形態のMAGEA3プロモーター配列に関する同じアッセイを繰り返し行うことにより試験した。様々な数の完全に修飾されたMAGEA3 UおよびMAGEA3 MプロモーターDNA分子(標準曲線材料)を、繰り返し測定した。さらに、操作者因子を、2人の異なる技術を有する研究室の人間(操作者AおよびB)が2つの異なる日にアッセイを繰り返し実施することにより試験した(操作者1人、1日あたり、2回、3つの異なる標準曲線希釈を行った)。
【0213】
表8および9は、GO_1およびGO_2 UおよびM MAGEA3アッセイの中間精度を試験するために行った実験をまとめたものである。同じ数の分子に関する全ての結果の標準偏差が0.11〜1.29であることが示された。全ての相関係数の概要(異なる操作者および日)を、表9に示す(平均R2は0.9959〜0.9997である)。
【表8】

【0214】
【表9】

【実施例6】
【0215】
メラニン干渉
メラニンを含むサンプルからのPCRの効率が低いことが以前に報告された。Eckhartら(2000)は、メラノサイトから誘導されたRNAおよびcDNA調製物は両方とも、RT-PCR阻害剤を含み、核酸と共に精製されたことを見出した。候補阻害剤メラニンの調査により、それが熱安定性DNAポリメラーゼに可逆的に結合し、その活性を阻害することが示された。MAGEA3 U amplifluorアッセイを介してメラノーマサンプルを処理する前に、メラニンによる潜在的な阻害を調査した。
【0216】
合成メラニンを、Eckhartらにより記載されたように調製した。簡単に述べると、メラニン(SIGMA M8631)を、2 mg/mlの濃度で蒸留水に溶解し、激しくボルテックスし、室温で10分間、水浴中で超音波処理した。溶解しなかったメラニンを、9000 gの遠心分離により除去した。潜在的な阻害効果を、反応プロセスの様々な段階でメラニンを添加することにより試験した:
1)抽出前:1μgおよび5μgの調製されたメラニンを、250,000個のLNCaP細胞および250,000個のMCF7細胞に添加した、
2)抽出後:1μgおよび5μgの調製されたメラニンを、1μgのLNCapおよびMCF7 DNAに添加した、
3)亜硫酸水素処理後:1μgおよび5μgの調製されたメラニンを、PCR反応中で直接固定した。亜硫酸水素溶出容量を、一定の鋳型濃度(「a」と注釈を付ける、例えば、LNCaP a)またはPCR反応中の一定量の鋳型(「b」と注釈を付ける、例えば、LNCaP b)を有するように適合させた。
【0217】
これらのメラニン含有LNCaPおよびMCF7サンプルを、対応する非固定(non-spiked)メラニンサンプルを用いて同時に処理した。
【0218】
サンプルを、PUREGENE(登録商標)DNA精製キットおよびEZ DNAメチル化キットを用いてさらに処理した。化学的に修飾されたDNAを、MAGEA3 U、Gst-Pi MおよびACTBリアルタイムMSPのための入力材料として用いた。
【0219】
試験した遺伝子プロモーターおよびACTB参照遺伝子の回収されたコピー数を算出し、それぞれの条件について比較した。
【0220】
結果を図9に示す。メラニンを、DNA抽出の前または後に添加した場合、有意なPCR阻害効果は観察されなかった。PCR反応中に直接固定した場合、メラニンのみが明らかな阻害を示した。RT-PCRとは対照的に、高いメラニン含量を有するメラノーマサンプルを、PCR阻害の危険性を有さないリアルタイムMSPを介して処理することができる。
【実施例7】
【0221】
メラノーマ/肺サンプル中でのMAGE-A3メチル化状態およびRNA発現との一致
材料および方法
臨床サンプル:
メラノーマおよび肺癌患者に由来する外科的標本は、GSKBioにより提供されたものである:ゲノムDNAサンプル(gDNA)、RNA later(登録商標)溶液中の生検材料および対応するホルマリン固定パラフィン包埋組織(FFPE)を、GSKBio RNA発現データに基づいてMAGEA3陽性またはMAGEA3陰性と分類した。提供されたサンプルセットの概説を表10に詳述する。
【表10】

【0222】
細胞系:
細胞系を、陽性および陰性対照としてそれぞれの実行(run)に含有させた。臨床サンプルに対してamplifluorリアルタイムMSPアッセイを適用する前に、アッセイの感度および特異性を細胞系材料上で確認した。最良のMAGEA3メチル化および非メチル化細胞系を、表11にまとめる。Gerl、Staq en CRL9609をGSKBioから取得し、細胞系LNCaPおよびDU145をAmerican Type Culture Collectionから購入した。
【表11】

【0223】
DNA単離:
ホルマリン固定パラフィン包埋サンプルを、最初に750μlのキシレン中、2時間、脱パラフィン化した。2回目のキシレン処理を行った(400μlのキシレンで2時間)。次いで、250μlの70%エタノールを添加した後、13000 rpmで15分間遠心分離した。上清を除去し、サンプルを室温で空気乾燥した。
【0224】
RNA later(登録商標)中のサンプルを、カミソリの刃を用いて非常に小さい切片に切断した後、RNA later(登録商標)溶液を除去した。
【0225】
続いて、古典的なフェノール/クロロホルム抽出方法を用いてDNAを抽出し、50μlのLoTE (3 mM TRIS、0.2 mM EDTA、pH 8.0)中に再懸濁した。
【0226】
Picogreen(登録商標)dsDNA定量キット(Molecular Probes, #P7589)を用いて、製造業者の推奨に従ってDNAを定量した。キットと共に提供されたλDNAを用いて、標準曲線を調製した。FluoStar Galaxyプレートリーダー(BMG Lab technologies, Germany)を用いて、データを収集した。
【0227】
DNA修飾:
1.5μgのDNAを、Zymo Research社製EZ DNAメチル化キットを用いて、亜硫酸水素修飾にかけた。
【0228】
簡単に述べると、45μlのアリコートを、5μlのM-Dilution Bufferと混合し、1100 rpmで振とうしながら、37℃で15分間インキュベートした。次いで、100μlの希釈されたCT変換試薬を添加し、サンプルを暗室中、1100 rpmで振とうしながら、70℃で3時間インキュベートした。変換後、サンプルをさらに脱塩し、製造業者の説明書に従って脱スルホン化し、25μlのTris-HCl 1mM pH 8.0中で溶出させた。修飾されたDNAを、さらに処理するまで-80℃で保存した。
【0229】
DNA増幅:
リアルタイムMSPを、Applied Biosystems社製の7900HTファストリアルタイムPCRサイクラー上に印加した。
【0230】
非メチル化形態の遺伝子プロモーター配列を標的化するように設計された、4つのMAGEA3低メチル化アッセイを、例えば、表2のプライマーおよびプローブ、配列番号3、4および13のエクソン3 MAGE-A3特異的プライマーおよびプローブを用いて、WO 2007/147876に記載の方法に従って測定した、提供されたRNA発現データとの一致について試験した。無関係の参照遺伝子β-アクチン(ACTB)も測定した。プライマーおよびamplifluor検出配列を表1に示す。
【0231】
2.4μlの修飾ゲノムDNAサンプルを、Roxを含む6μlのiTaq(商標)Supermix(BioRad, 2 x バッファー)およびフォワードプライマー/ディテクターおよびリバースプライマーの両方について100 nMの最終プライマー濃度を含む、最終的な12μlのPCR反応容量に添加した。それぞれのMAGEA3設計のためのサイクリング条件は、50℃で2分間;95℃で10分間;次いで、95℃で15秒間、59℃で30秒間[ACTBについては62℃]および59℃で30秒間[ACTBについては62℃](=プラトー-データ収集)の45サイクルであった。
【0232】
結果をSDS 2.2.2ソフトウェア(Applied Biosystems)を用いて生成し、Ct値(増幅曲線が、ソフトウェアにより自動的に設定された閾値を横断するサイクル数)としてエクスポートした後、目的の亜硫酸水素修飾配列を含むプラスミドDNAまたは精製されたPCR産物を用いて、20〜2 x 106個の遺伝子コピー等価物の標準曲線に対してプロットされた値の線形回帰に基づいてコピー数を算出した。MAGEA3とACTBとの比を算出して、試験結果を生成させた。データを解釈するために、非盲目RNA発現データに基づいて臨床カットオフ(閾値)を定義した。
【0233】
サンプルを、図5に示された決定木に基づいて、メチル化、非メチル化、または無効と分類した。細胞系を陽性および陰性対照として各実行中に含有させ、DNA抽出工程での手順に入れた。
【0234】
以下の基準:a)両方の標準曲線のPCR効率が80%以上;b)少なくとも4つの関連するデータ点のr2が0.990以上;c)ΔCtが2回の間で1.5未満;d)日常的に含有させたNTCが増幅しない;e)陽性細胞系アッセイ対照の1.5μgの変換反応の10%が検出可能である;およびf)陰性細胞系アッセイ対照の1.5μgの変換反応の10%が標準曲線内で検出されない、を満たす場合、実行は有効であると考えた。
【0235】
結果
メチル化と遺伝子発現との一致:
メラノーマ:
MAGEA3の発現およびメチル化レベルを、同じサンプルセット上で比較した。合計、41個のメラノーマサンプルを、RT-PCRおよびリアルタイムMSPを用いて処理した。いくつかの設計のMAGEA3 U amplifluorアッセイを試験して、どのアッセイがGSKにより提供されたRNA発現データと最もよく一致するかを見た。最大一致および最小の偽陽性率を有するように臨床カットオフを設定した(表12を参照)。これらのサンプルにおけるMAGEA3メチル化状態に関するROC曲線を図6に示す。17個の陰性サンプルのうち、9個は他のMAGE-Aファミリーメンバーについても陽性であった;GO_2_UおよびFuruta Uアッセイはこれらの9個のサンプルを正確に分類した(100%の特異性)。
【0236】
これらのデータを総合すると、MAGEA3_GO_2_Uアッセイが、92.7%の一致率および100%の特異性で最良であった。
【表12】

【0237】
肺サンプル(生検およびFFPE):
上記の同じ設定を、異なるサンプルセットに対して試験した:RNA later(登録商標)中の52個の肺FFPRサンプルと61個の肺組織を、4つのMAGEA3 U amplifluorアッセイを介してスクリーニングし、対応するRNAデータに一致させた。
【0238】
これらの肺生検およびFFPEサンプル中のMAGEA3メチル化状態に関するROC曲線を、それぞれ図7および8に提供する。MAGEA3陰性サンプルのうち、9個は他のMAGE-Aファミリーメンバーについても陽性であった;MAGEA3 Uアッセイは9個全部のサンプルを正確に分類した(100%の特異性)。MAGEA3_GO_2_Uアッセイが、FFPEにおいては90.4%の一致率および生検においては91.8%の一致率で最良の性能のアッセイであり、100%の特異性を維持していた(表13)。
【表13】

【実施例8】
【0239】
MAGEA3アッセイによる肺サンプルの試験
肺癌に由来するDNAを、LNCaP & DU145対照細胞系と平行してMAGEA3(U & Mアッセイバージョン)およびβ-アクチンアッセイを介して処理した。いくつかの設計のMAGEA3 U amplifluorアッセイを試験して、どのアッセイがMAGEA3 GO_2 Uアッセイと最も一致するかを見た。実施例7に記載の実験条件を用いた。標準曲線は80%を超える効率を示した。R2は0.99よりも高かった。MAGEA3 GO_2 Uアッセイについては、カットオフ値を29に、MAGEA3 GO_1 Uアッセイについては22に;MAGEA3 GO_1 Mアッセイについては148に、およびMAGEA3 GO_2 Mアッセイについては167に設定した。MAGEA3のメチル化を同じサンプルセット上で比較した。結果を表14および15に示す。MAGEA3 GO_2 Uアッセイについては(カットオフ=29)、
・3個のサンプルを無効と分類し、これらのサンプルを他のU & Mアッセイとの比較に含ませない;
・9個のサンプルを非メチル化と分類する;
・15個のサンプルをメチル化と分類する。
【0240】
4つのMAGEA3 Uアッセイにより、有効なサンプルに関してMAGEA3 GO_2 Uアッセイと96%一致した同様の結果が得られる。MAGEA3 Mアッセイにより、MAGEA3 GO_2 Uアッセイと71%および75%の一致が得られた。
【表14】

【0241】
【表15】

【0242】
本発明は、本明細書に記載の特定の実施形態によりその範囲を限定されるべきではない。実際、本明細書に記載のものに加えて、本発明の様々な改変が、前記説明および添付の図面から当業者には明らかとなるであろう。そのような改変は、添付の特許請求の範囲内にあると意図される。さらに、本明細書に記載の全ての実施形態は、必要に応じて、幅広く適用可能であり、任意の、および他の全ての一致する実施形態と組合わせることができる。
【0243】
様々な刊行物が本明細書に引用されるが、その開示はその全体が参照により本明細書に組み入れられるものとする。
【特許請求の範囲】
【請求項1】
遺伝子のメチル化状態の検出にとって有用である、配列番号5、6、7、2、3、4、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるオリゴヌクレオチド、プライマーまたはプローブ。
【請求項2】
遺伝子のメチル化状態の検出にとって有用である、配列番号5、6、7、2、3、4または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるオリゴヌクレオチド、プライマーまたはプローブ。
【請求項3】
5'から3'の順序に、以下の連続する配列:
(a)約6〜30個のヌクレオチドの第1のヌクレオチド配列であって、該第1のヌクレオチド配列内のヌクレオチドが、分子エネルギー移動対の供与体部分と受容体部分から選択される第1の部分で標識され、供与体部分が、励起された場合、1個以上の特定の波長で蛍光を放出し、受容体部分が、該供与体部分により放出された蛍光を吸収および/もしくはクエンチする、前記ヌクレオチド配列;
(b)約3〜20個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第2の一本鎖ヌクレオチド配列;
(c)約6〜30個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第3のヌクレオチド配列であって、第3のヌクレオチド配列内のヌクレオチドが、前記供与体部分と受容体部分から選択される第2の部分で標識され、第2の部分が第1のヌクレオチド配列を標識しない前記群のメンバーであり、供与体部分が励起され、蛍光を放出する場合、受容体部分が供与体部分により放出された蛍光を吸収し、クエンチするように、第1の部分と第2の部分が近くなるように、二本鎖が第1のヌクレオチド配列と第3のヌクレオチド配列との間で形成することができるように、第3のヌクレオチド配列が第1のヌクレオチド配列と逆の順序で相補的である、前記ヌクレオチド配列;ならびに
(d)3'末端に配列番号5、7、2、4、8、11、13または25のいずれかの配列を含む、本質的にそれからなる、またはそれからなる約8〜40個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる、プライマーの3'末端の第4の一本鎖ヌクレオチド配列(MAGE A3遺伝子の非メチル化DNAの一部を含む核酸鎖と相補的なヌクレオチド配列の核酸ポリメラーゼによる合成をプライミングすることができる)、
を含むか、または本質的にそれかなるか、またはそれからなり、二本鎖が形成されない場合、第1の部分と第2の部分が、第1および第2の部分の間の分子エネルギー移動を阻害する距離により分離される、請求項1に記載のオリゴヌクレオチド、プライマーまたはプローブ。
【請求項4】
5'から3'の順序に、以下の連続する配列:
(a)約6〜30個のヌクレオチドの第1のヌクレオチド配列であって、該第1のヌクレオチド配列内のヌクレオチドが、分子エネルギー移動対の供与体部分と受容体部分から選択される第1の部分で標識され、供与体部分が、励起された場合、1個以上の特定の波長で蛍光を放出し、受容体部分が、該供与体部分により放出された蛍光を吸収および/もしくはクエンチする、前記ヌクレオチド配列;
(b)約3〜20個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第2の一本鎖ヌクレオチド配列;
(c)約6〜30個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第3のヌクレオチド配列であって、第3のヌクレオチド配列内のヌクレオチドが、前記供与体部分と受容体部分から選択される第2の部分で標識され、第2の部分が第1のヌクレオチド配列を標識しない前記群のメンバーであり、供与体部分が励起され、蛍光を放出する場合、受容体部分が供与体部分により放出された蛍光を吸収し、クエンチするように、第1の部分と第2の部分が近くなるように、二本鎖が第1のヌクレオチド配列と第3のヌクレオチド配列との間で形成することができるように、第3のヌクレオチド配列が第1のヌクレオチド配列と逆の順序で相補的である、前記ヌクレオチド配列;ならびに
(d)3'末端に配列番号14、16、17または19のいずれかの配列を含む、本質的にそれからなる、またはそれからなる約8〜40個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる、プライマーの3'末端の第4の一本鎖ヌクレオチド配列(MAGE A3遺伝子のメチル化DNAの一部を含む核酸鎖と相補的なヌクレオチド配列の核酸ポリメラーゼによる合成をプライミングすることができる)、
を含むか、または本質的にそれかなるか、またはそれからなり、二本鎖が形成されない場合、第1の部分と第2の部分が、第1および第2の部分の間の分子エネルギー移動を阻害する距離により分離される、請求項1に記載のオリゴヌクレオチド、プライマーまたはプローブ。
【請求項5】
第4の一本鎖ヌクレオチド配列が、配列番号5、7、2、4または25のいずれかの配列をその3'末端に含む約8〜40ヌクレオチドを含む、本質的にそれからなる、またはそれからなる、請求項3に記載のオリゴヌクレオチド、プライマーまたはプローブ。
【請求項6】
請求項1〜5のいずれか1項に記載のプライマーを含むプライマー対。
【請求項7】
請求項5に記載のプライマーを含む、請求項6に記載のプライマー対。
【請求項8】
配列番号6および7;配列番号2および3;配列番号9および4;配列番号12および13;配列番号14および15;または配列番号17および18のヌクレオチド配列を含むか、または本質的にそれからなるか、またはそれからなるプライマー対。
【請求項9】
配列番号6および7または配列番号2および3のヌクレオチド配列を含むか、または本質的にそれからなるか、またはそれからなる、請求項8に記載のプライマー対。
【請求項10】
請求項1〜5のいずれか1項に定義された少なくとも1個のオリゴヌクレオチド、プライマーもしくはプローブまたは請求項6〜9のいずれか1項に定義されたプライマー対を含む、遺伝子のメチル化状態を検出するためのキット。
【請求項11】
前記遺伝子がMAGE-A3遺伝子である、請求項1〜5のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブまたは請求項6〜9のいずれか1項に定義されたプライマー対または請求項10に定義されたキット。
【請求項12】
DNAを含有するサンプル中の非メチル化Mage-A3遺伝子の存在および/または量を検出する方法であって、
(a)該DNAを含有するサンプルと、該DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を産生するが、メチル化シトシン残基を修飾しない試薬とを接触させること/該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマーを、該試薬を用いる処理後に非メチル化DNAの配列にのみ結合するように設計し、プライマー対中の少なくとも1個のプライマーが、配列番号5、6、7、2、3、4、8、9、11、12、13または25のいずれかに記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、少なくとも1個のプライマー対を用いて、目的の非メチル化遺伝子の少なくとも一部を増幅すること、
を含む前記方法。
【請求項13】
プライマー対中の少なくとも1個のプライマーが、配列番号5、6、7、2、3、4または25のいずれかに記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、請求項13に記載の方法。
【請求項14】
DNAを含有するサンプル中のメチル化Mage-A3遺伝子の存在および/または量を検出する方法であって、
(a)該DNAを含有するサンプルと、該DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を産生するが、メチル化シトシン残基を修飾しない試薬とを接触させること/該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマーを、該試薬を用いる処理後にメチル化DNAの配列にのみ結合するように設計し、プライマー対中の少なくとも1個のプライマーが、配列番号14、15、16、17、18または19のいずれかに記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、少なくとも1個のプライマー対を用いて、目的のメチル化遺伝子の少なくとも一部を増幅すること、
を含む前記方法。
【請求項15】
癌または癌の素因を診断する方法であって、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、サンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、サンプル中の非メチル化MAGE-A3の存在が、癌または癌の素因を示す、前記方法。
【請求項16】
MAGE-A3免疫療法剤を用いる治療にとって好適な患者を同定および/または選択する方法であって、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、該患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、MAGE-A3遺伝子がメチル化されていない場合、被験者をMAGE-A3免疫療法剤を用いる治療のために同定および/または選択する、前記方法。
【請求項17】
癌の治療の成功可能性を予測する方法であって、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、MAGE-A3遺伝子がメチル化されていない場合、MAGE-A3免疫療法剤を用いる治療の成功可能性が、該遺伝子がメチル化されている場合よりも高い、前記方法。
【請求項18】
癌のための好適な治療計画を選択する方法であって、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、MAGE-A3遺伝子がメチル化されていない場合、免疫療法剤を治療のために選択する、前記方法。
【請求項19】
免疫療法剤の投与を含む被験者における癌を治療する方法であって、該被験者を、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択する、前記方法。
【請求項20】
請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定すること、ならびに次いで、MAGE-A3を含む組成物を患者に投与すること(MAGE-A3遺伝子がメチル化されていないことがわかった場合)を含む、患者を治療する方法。
【請求項21】
腫瘍組織を除去するために治療された、MAGE-A3を発現する腫瘍を再発しやすい患者を治療する方法であって、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定すること、ならびに次いで、MAGE-A3を含む組成物を患者に投与すること(MAGE-A3遺伝子がメチル化されていないことがわかった場合)を含む、前記方法。
【請求項22】
腫瘍に罹患する患者の治療のための医薬の製造におけるMAGE-A3を含む組成物の使用であって、該患者が、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択された、前記使用。
【請求項23】
MAGE-A3を発現する腫瘍を再発しやすい患者の治療のための医薬の製造におけるMAGE-A3を含む組成物の使用であって、該患者が、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択された、前記使用。
【請求項24】
MAGE-A3を含む組成物が、完全長MAGE-A3、実質的に完全長のMAGE-A3またはMAGE-A3の断片、例えば、MAGE-A3のペプチドを含む、請求項20〜23のいずれか1項に記載の方法または使用。
【請求項25】
MAGE-A3ペプチドが、

から選択される、請求項24に記載の方法または使用。
【請求項26】
MAGE-A3が、完全長MAGE-A3または1〜10個のアミノ酸がMAGE-A3タンパク質のN末端および/もしくはC末端から欠失された、実質的に完全長のMAGE-A3の断片である、請求項24に記載の方法または使用。
【請求項27】
MAGE-A3がMAGE3のアミノ酸3〜314(合計312個のアミノ酸)である、請求項24に記載の方法または使用。
【請求項28】
MAGE-A3タンパク質、断片またはペプチドを融合パートナータンパク質に連結する、請求項24に記載の方法または使用。
【請求項29】
MAGE-A3タンパク質、断片またはペプチドおよび融合パートナータンパク質を、化学的に結合させるか、または組換え融合タンパク質として発現させる、請求項28に記載の方法または使用。
【請求項30】
融合パートナータンパク質が、グラム陰性細菌ヘモフィルス・インフルエンザBまたはその誘導体の表面タンパク質であるプロテインDである、請求項28または29に記載の方法または使用。
【請求項31】
プロテインD誘導体が、プロテインDの最初の1/3、プロテインDの最初のほぼ1/3、プロテインDの最初のN末端の100〜110残基、プロテインDの最初のN末端の109残基を含む、請求項30に記載の方法または使用。
【請求項32】
分泌またはシグナル配列を、プロテインD融合パートナーのN末端にさらに含有させる、請求項30または31に記載の方法または使用。
【請求項33】
MAGE-A3が、プロテインDのシグナル配列;プロテインDのアミノ酸1〜109;MAGE-A3タンパク質に由来する312個のアミノ酸(アミノ酸3〜314);スペーサー;およびポリヒスチジン尾部を含む融合タンパク質である、請求項26〜32のいずれか1項に記載の方法または使用。
【請求項34】
融合パートナータンパク質が、LytAまたは残基178で始まるC末端中に認められるLytA分子の反復部分を含むか、もしくはそれからなるか、または残基188〜305を含むその誘導体である、請求項28または30に記載の方法または使用。
【請求項35】
融合パートナータンパク質が、NS1(ヘマグルチニン)、またはNS1のN末端の81アミノ酸を含むその誘導体である、請求項28または30に記載の方法または使用。
【請求項36】
MAGE-A3が誘導体化された遊離チオールを含む、請求項20〜35のいずれか1項に記載の方法または使用。
【請求項37】
前記組成物が、MAGE-A3タンパク質、その断片もしくはペプチドまたは融合タンパク質をコードする核酸分子を含む、請求項20〜36のいずれか1項に記載の方法または使用。
【請求項38】
前記核酸分子を発現ベクター内に提供する、請求項37に記載の方法または使用。
【請求項39】
MAGE-A3を含有する組成物が、1種以上のアジュバント、免疫刺激サイトカインおよびケモカインをさらに含む、請求項20〜38のいずれか1項に記載の方法または使用。
【請求項40】
前記アジュバントがモノホスホリルリピドAまたはその誘導体、サポニンまたはその誘導体およびTLR9アンタゴニストのうちの1種以上を含む、請求項39に記載の方法または使用。
【請求項41】
TLR9アゴニストがCpG含有オリゴヌクレオチドである、請求項39または40に記載の方法または使用。
【請求項42】
前記アジュバントを、必要に応じて、コレステロールおよび/もしくはトコフェロールを含有する、水中油乳濁液もしくは油中水乳濁液中で製剤化するか、またはリポソーム組成物中で製剤化する、請求項39〜41のいずれか1項に記載の方法または使用。
【請求項1】
遺伝子のメチル化状態の検出にとって有用である、配列番号5、6、7、2、3、4、8、9、11、12、13、14、15、16、17、18、19または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるオリゴヌクレオチド、プライマーまたはプローブ。
【請求項2】
遺伝子のメチル化状態の検出にとって有用である、配列番号5、6、7、2、3、4または25のいずれかのヌクレオチド配列を含む、本質的にそれからなる、またはそれからなるオリゴヌクレオチド、プライマーまたはプローブ。
【請求項3】
5'から3'の順序に、以下の連続する配列:
(a)約6〜30個のヌクレオチドの第1のヌクレオチド配列であって、該第1のヌクレオチド配列内のヌクレオチドが、分子エネルギー移動対の供与体部分と受容体部分から選択される第1の部分で標識され、供与体部分が、励起された場合、1個以上の特定の波長で蛍光を放出し、受容体部分が、該供与体部分により放出された蛍光を吸収および/もしくはクエンチする、前記ヌクレオチド配列;
(b)約3〜20個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第2の一本鎖ヌクレオチド配列;
(c)約6〜30個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第3のヌクレオチド配列であって、第3のヌクレオチド配列内のヌクレオチドが、前記供与体部分と受容体部分から選択される第2の部分で標識され、第2の部分が第1のヌクレオチド配列を標識しない前記群のメンバーであり、供与体部分が励起され、蛍光を放出する場合、受容体部分が供与体部分により放出された蛍光を吸収し、クエンチするように、第1の部分と第2の部分が近くなるように、二本鎖が第1のヌクレオチド配列と第3のヌクレオチド配列との間で形成することができるように、第3のヌクレオチド配列が第1のヌクレオチド配列と逆の順序で相補的である、前記ヌクレオチド配列;ならびに
(d)3'末端に配列番号5、7、2、4、8、11、13または25のいずれかの配列を含む、本質的にそれからなる、またはそれからなる約8〜40個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる、プライマーの3'末端の第4の一本鎖ヌクレオチド配列(MAGE A3遺伝子の非メチル化DNAの一部を含む核酸鎖と相補的なヌクレオチド配列の核酸ポリメラーゼによる合成をプライミングすることができる)、
を含むか、または本質的にそれかなるか、またはそれからなり、二本鎖が形成されない場合、第1の部分と第2の部分が、第1および第2の部分の間の分子エネルギー移動を阻害する距離により分離される、請求項1に記載のオリゴヌクレオチド、プライマーまたはプローブ。
【請求項4】
5'から3'の順序に、以下の連続する配列:
(a)約6〜30個のヌクレオチドの第1のヌクレオチド配列であって、該第1のヌクレオチド配列内のヌクレオチドが、分子エネルギー移動対の供与体部分と受容体部分から選択される第1の部分で標識され、供与体部分が、励起された場合、1個以上の特定の波長で蛍光を放出し、受容体部分が、該供与体部分により放出された蛍光を吸収および/もしくはクエンチする、前記ヌクレオチド配列;
(b)約3〜20個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第2の一本鎖ヌクレオチド配列;
(c)約6〜30個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる第3のヌクレオチド配列であって、第3のヌクレオチド配列内のヌクレオチドが、前記供与体部分と受容体部分から選択される第2の部分で標識され、第2の部分が第1のヌクレオチド配列を標識しない前記群のメンバーであり、供与体部分が励起され、蛍光を放出する場合、受容体部分が供与体部分により放出された蛍光を吸収し、クエンチするように、第1の部分と第2の部分が近くなるように、二本鎖が第1のヌクレオチド配列と第3のヌクレオチド配列との間で形成することができるように、第3のヌクレオチド配列が第1のヌクレオチド配列と逆の順序で相補的である、前記ヌクレオチド配列;ならびに
(d)3'末端に配列番号14、16、17または19のいずれかの配列を含む、本質的にそれからなる、またはそれからなる約8〜40個のヌクレオチドを含み、本質的にそれからなるか、またはそれからなる、プライマーの3'末端の第4の一本鎖ヌクレオチド配列(MAGE A3遺伝子のメチル化DNAの一部を含む核酸鎖と相補的なヌクレオチド配列の核酸ポリメラーゼによる合成をプライミングすることができる)、
を含むか、または本質的にそれかなるか、またはそれからなり、二本鎖が形成されない場合、第1の部分と第2の部分が、第1および第2の部分の間の分子エネルギー移動を阻害する距離により分離される、請求項1に記載のオリゴヌクレオチド、プライマーまたはプローブ。
【請求項5】
第4の一本鎖ヌクレオチド配列が、配列番号5、7、2、4または25のいずれかの配列をその3'末端に含む約8〜40ヌクレオチドを含む、本質的にそれからなる、またはそれからなる、請求項3に記載のオリゴヌクレオチド、プライマーまたはプローブ。
【請求項6】
請求項1〜5のいずれか1項に記載のプライマーを含むプライマー対。
【請求項7】
請求項5に記載のプライマーを含む、請求項6に記載のプライマー対。
【請求項8】
配列番号6および7;配列番号2および3;配列番号9および4;配列番号12および13;配列番号14および15;または配列番号17および18のヌクレオチド配列を含むか、または本質的にそれからなるか、またはそれからなるプライマー対。
【請求項9】
配列番号6および7または配列番号2および3のヌクレオチド配列を含むか、または本質的にそれからなるか、またはそれからなる、請求項8に記載のプライマー対。
【請求項10】
請求項1〜5のいずれか1項に定義された少なくとも1個のオリゴヌクレオチド、プライマーもしくはプローブまたは請求項6〜9のいずれか1項に定義されたプライマー対を含む、遺伝子のメチル化状態を検出するためのキット。
【請求項11】
前記遺伝子がMAGE-A3遺伝子である、請求項1〜5のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブまたは請求項6〜9のいずれか1項に定義されたプライマー対または請求項10に定義されたキット。
【請求項12】
DNAを含有するサンプル中の非メチル化Mage-A3遺伝子の存在および/または量を検出する方法であって、
(a)該DNAを含有するサンプルと、該DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を産生するが、メチル化シトシン残基を修飾しない試薬とを接触させること/該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマーを、該試薬を用いる処理後に非メチル化DNAの配列にのみ結合するように設計し、プライマー対中の少なくとも1個のプライマーが、配列番号5、6、7、2、3、4、8、9、11、12、13または25のいずれかに記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、少なくとも1個のプライマー対を用いて、目的の非メチル化遺伝子の少なくとも一部を増幅すること、
を含む前記方法。
【請求項13】
プライマー対中の少なくとも1個のプライマーが、配列番号5、6、7、2、3、4または25のいずれかに記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、請求項13に記載の方法。
【請求項14】
DNAを含有するサンプル中のメチル化Mage-A3遺伝子の存在および/または量を検出する方法であって、
(a)該DNAを含有するサンプルと、該DNA中の非メチル化シトシン残基を選択的に修飾して、検出可能な修飾残基を産生するが、メチル化シトシン残基を修飾しない試薬とを接触させること/該サンプルを該試薬で処理すること、
(b)少なくとも1個のプライマーを、該試薬を用いる処理後にメチル化DNAの配列にのみ結合するように設計し、プライマー対中の少なくとも1個のプライマーが、配列番号14、15、16、17、18または19のいずれかに記載のヌクレオチド配列を含む、本質的にそれからなる、またはそれからなる、少なくとも1個のプライマー対を用いて、目的のメチル化遺伝子の少なくとも一部を増幅すること、
を含む前記方法。
【請求項15】
癌または癌の素因を診断する方法であって、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、サンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、サンプル中の非メチル化MAGE-A3の存在が、癌または癌の素因を示す、前記方法。
【請求項16】
MAGE-A3免疫療法剤を用いる治療にとって好適な患者を同定および/または選択する方法であって、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、該患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、MAGE-A3遺伝子がメチル化されていない場合、被験者をMAGE-A3免疫療法剤を用いる治療のために同定および/または選択する、前記方法。
【請求項17】
癌の治療の成功可能性を予測する方法であって、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、MAGE-A3遺伝子がメチル化されていない場合、MAGE-A3免疫療法剤を用いる治療の成功可能性が、該遺伝子がメチル化されている場合よりも高い、前記方法。
【請求項18】
癌のための好適な治療計画を選択する方法であって、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、患者のサンプル中のMAGE-A3遺伝子のメチル化状態を検出することを含み、MAGE-A3遺伝子がメチル化されていない場合、免疫療法剤を治療のために選択する、前記方法。
【請求項19】
免疫療法剤の投与を含む被験者における癌を治療する方法であって、該被験者を、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択する、前記方法。
【請求項20】
請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定すること、ならびに次いで、MAGE-A3を含む組成物を患者に投与すること(MAGE-A3遺伝子がメチル化されていないことがわかった場合)を含む、患者を治療する方法。
【請求項21】
腫瘍組織を除去するために治療された、MAGE-A3を発現する腫瘍を再発しやすい患者を治療する方法であって、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定すること、ならびに次いで、MAGE-A3を含む組成物を患者に投与すること(MAGE-A3遺伝子がメチル化されていないことがわかった場合)を含む、前記方法。
【請求項22】
腫瘍に罹患する患者の治療のための医薬の製造におけるMAGE-A3を含む組成物の使用であって、該患者が、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択された、前記使用。
【請求項23】
MAGE-A3を発現する腫瘍を再発しやすい患者の治療のための医薬の製造におけるMAGE-A3を含む組成物の使用であって、該患者が、請求項1〜5もしくは11のいずれか1項に定義されたオリゴヌクレオチド、プライマーもしくはプローブ、請求項6〜9もしくは11のいずれか1項に定義されたプライマー対、請求項10もしくは11に記載のキットまたは請求項12〜14のいずれか1項に記載の方法を用いることにより、MAGE-A3遺伝子のメチル化状態を測定することに基づいて、治療のために選択された、前記使用。
【請求項24】
MAGE-A3を含む組成物が、完全長MAGE-A3、実質的に完全長のMAGE-A3またはMAGE-A3の断片、例えば、MAGE-A3のペプチドを含む、請求項20〜23のいずれか1項に記載の方法または使用。
【請求項25】
MAGE-A3ペプチドが、

から選択される、請求項24に記載の方法または使用。
【請求項26】
MAGE-A3が、完全長MAGE-A3または1〜10個のアミノ酸がMAGE-A3タンパク質のN末端および/もしくはC末端から欠失された、実質的に完全長のMAGE-A3の断片である、請求項24に記載の方法または使用。
【請求項27】
MAGE-A3がMAGE3のアミノ酸3〜314(合計312個のアミノ酸)である、請求項24に記載の方法または使用。
【請求項28】
MAGE-A3タンパク質、断片またはペプチドを融合パートナータンパク質に連結する、請求項24に記載の方法または使用。
【請求項29】
MAGE-A3タンパク質、断片またはペプチドおよび融合パートナータンパク質を、化学的に結合させるか、または組換え融合タンパク質として発現させる、請求項28に記載の方法または使用。
【請求項30】
融合パートナータンパク質が、グラム陰性細菌ヘモフィルス・インフルエンザBまたはその誘導体の表面タンパク質であるプロテインDである、請求項28または29に記載の方法または使用。
【請求項31】
プロテインD誘導体が、プロテインDの最初の1/3、プロテインDの最初のほぼ1/3、プロテインDの最初のN末端の100〜110残基、プロテインDの最初のN末端の109残基を含む、請求項30に記載の方法または使用。
【請求項32】
分泌またはシグナル配列を、プロテインD融合パートナーのN末端にさらに含有させる、請求項30または31に記載の方法または使用。
【請求項33】
MAGE-A3が、プロテインDのシグナル配列;プロテインDのアミノ酸1〜109;MAGE-A3タンパク質に由来する312個のアミノ酸(アミノ酸3〜314);スペーサー;およびポリヒスチジン尾部を含む融合タンパク質である、請求項26〜32のいずれか1項に記載の方法または使用。
【請求項34】
融合パートナータンパク質が、LytAまたは残基178で始まるC末端中に認められるLytA分子の反復部分を含むか、もしくはそれからなるか、または残基188〜305を含むその誘導体である、請求項28または30に記載の方法または使用。
【請求項35】
融合パートナータンパク質が、NS1(ヘマグルチニン)、またはNS1のN末端の81アミノ酸を含むその誘導体である、請求項28または30に記載の方法または使用。
【請求項36】
MAGE-A3が誘導体化された遊離チオールを含む、請求項20〜35のいずれか1項に記載の方法または使用。
【請求項37】
前記組成物が、MAGE-A3タンパク質、その断片もしくはペプチドまたは融合タンパク質をコードする核酸分子を含む、請求項20〜36のいずれか1項に記載の方法または使用。
【請求項38】
前記核酸分子を発現ベクター内に提供する、請求項37に記載の方法または使用。
【請求項39】
MAGE-A3を含有する組成物が、1種以上のアジュバント、免疫刺激サイトカインおよびケモカインをさらに含む、請求項20〜38のいずれか1項に記載の方法または使用。
【請求項40】
前記アジュバントがモノホスホリルリピドAまたはその誘導体、サポニンまたはその誘導体およびTLR9アンタゴニストのうちの1種以上を含む、請求項39に記載の方法または使用。
【請求項41】
TLR9アゴニストがCpG含有オリゴヌクレオチドである、請求項39または40に記載の方法または使用。
【請求項42】
前記アジュバントを、必要に応じて、コレステロールおよび/もしくはトコフェロールを含有する、水中油乳濁液もしくは油中水乳濁液中で製剤化するか、またはリポソーム組成物中で製剤化する、請求項39〜41のいずれか1項に記載の方法または使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6−1】


【図6−2】


【図6−3】


【図7−1】


【図7−2】


【図7−3】


【図8−1】


【図8−2】


【図8−3】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6−1】


【図6−2】


【図6−3】


【図7−1】


【図7−2】


【図7−3】


【図8−1】


【図8−2】


【図8−3】


【図9】


【図10】


【公表番号】特表2010−538633(P2010−538633A)
【公表日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願番号】特願2010−524578(P2010−524578)
【出願日】平成20年9月17日(2008.9.17)
【国際出願番号】PCT/GB2008/003142
【国際公開番号】WO2009/037438
【国際公開日】平成21年3月26日(2009.3.26)
【出願人】(510071541)オンコメチローム サイエンシズ ソシエテ アノニム (1)
【出願人】(305060279)グラクソスミスクライン バイオロジカルズ ソシエテ アノニム (169)
【Fターム(参考)】
【公表日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願日】平成20年9月17日(2008.9.17)
【国際出願番号】PCT/GB2008/003142
【国際公開番号】WO2009/037438
【国際公開日】平成21年3月26日(2009.3.26)
【出願人】(510071541)オンコメチローム サイエンシズ ソシエテ アノニム (1)
【出願人】(305060279)グラクソスミスクライン バイオロジカルズ ソシエテ アノニム (169)
【Fターム(参考)】
[ Back to top ]

