MALDI質量分析法用測定試料調製方法
【課題】高いイオン生成量を有するMALDI質量分析法用の測定試料を調製し、短時間で効率良く質の高いMSスペクトルが得られるようにし、また、構造同定に必要な高感度MSn(2≦n)解析を可能とし、自動分析への応用を可能にする高スループットのMALDI質量分析法の実現が可能になるMALDI質量分析法用測定試料調製方法を提供すること。
【解決手段】MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させ、該混合結晶のうちの特定の多形構造を利用してイオン化効率を高めることを特徴とするMALDI質量分析法用測定試料調製方法。
【解決手段】MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させ、該混合結晶のうちの特定の多形構造を利用してイオン化効率を高めることを特徴とするMALDI質量分析法用測定試料調製方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、MALDI質量分析法において、イオン化効率を高め、高感度にシグナルを検出できるMALDI質量分析法用測定試料調製方法、及び、該測定試料調製方法を使用して調製されたMALDI質量分析法用測定試料を用いるMALDI質量分析法に関するものである。
【背景技術】
【0002】
「質量分析(mass spectrometry)(以下、「MS」と略記することがある)法」とは、測定対象分子を含む試料をイオン化し、測定対象分子由来のイオンを質量電荷比(質量/電荷(m/z))によって分離し検出することによって、その測定対象分子の化学構造に関する情報を得る方法である。
【0003】
MSにおいて、試料のイオン化は、分析の可否や得られるスペクトルの質を左右する重要な過程であり、試料を効率よくイオンにするためにこれまで多くのイオン化法が開発されてきた。現在のところ、生体高分子のイオン化には、ソフトイオン化であるマトリックス支援レーザー脱離イオン化(matrix−assisted laser desorption/ionization)(以下、「MALDI」と略記することがある)法やエレクトロスプレーイオン化(electrospray ionization)(以下、「ESI」と略記することがある)法が主に用いられている。これらのイオン化法を用いた質量分析計は、NMR等に比べて測定試料量が少なくても測定が可能であることから、バイオ分野でも広く用いられている。
【0004】
MALDIでは、マトリックスと呼ばれる光吸収を持つ物質の中に、測定対象となる分子(例えば、タンパク質、ペプチド、糖類等がある)を分散させ、そこにパルスレーザーを照射することでマトリックスと共に測定対象となる分子をイオン化する技術である。
【0005】
使用するレーザーの波長は紫外領域の波長を有する場合が多く、赤外領域の波長を使用する場合もあるが、マトリックスの光吸収特性に合わせたレーザーを用いるのが一般的である。現在、最も多用されるレーザーは窒素レーザーであり、波長337nmを有する。
【0006】
一方、使用するマトリックスの選択が分析の成否を決めるため、これまでに多くのマトリックスが開発され、実際にMALDIに用いられてきた。一般的に、マトリックスは結晶性の有機分子であり、分析試料との共結晶を生成した上で、上記パルスレーザーを照射しイオン化する。近年は様々な液体マトリックスも開発されてきており、測定対象の試料に応じ様々な選択肢がある。
【0007】
実際に用いられているマトリックスの中でも汎用性があり、標準的なマトリックスは、CHCA(α−cyano−hydroxycinnamic acid)、SA(sinapic acid)、DHBA(2,5−dihydroxybenzoic acid)等であり、特にDHBAは、低分子量有機化合物、ペプチド、糖類、タンパク質等のイオン化に適する優れたマトリックスである。
【0008】
一般に、マトリックスと試料は良く混ざり、混合結晶又は混合物となる必要があると考えられている。この試料とマトリックスの混合結晶又は混合物の善し悪しが感度及びスペクトルの質に影響を与える。更に、一見同質の混合物に見えても実際には不均一で、特に固体結晶の場合には、結晶が生成した場所すべてから測定対象分子由来のイオンが得られるわけではなく、生成した結晶のごく一部分にレーザーを照射した場合のみ測定対象分子由来のイオンが得られる。
【0009】
この部分は、「スイートスポット(sweet spot)」と呼ばれ、MALDI質量分析法により、特に自動分析において質の高いマススペクトルを得るためには、対象の測定試料中にスイートスポットを多数作製することが効果的である。
【0010】
特に、DHBAは0.1〜1.5mm程度の比較的大きな針状の結晶を生成するが、スイートスポットとそうでない場所でのイオン生成量の差が著しく異なる。結晶サイズの不均一性がこの現象の大きな原因であると考えられており、これを示した例として、非特許文献1や非特許文献2がある。
【0011】
例えば、DHBAは2種類の結晶多形を持つことが知られており、それぞれの結晶は異なる融点を持つと報告されている。これを示した例として、非特許文献3及び非特許文献4がある。非特許文献3によると、2種類の多形は、それぞれ異なる溶媒を用いて作製されており、溶媒として水を用いた場合には安定型のOrderedが生成し、アセトンとクロロホルムの体積比1:3の混合溶媒からは準安定型のDisorderedが生成すると報告されている。
【0012】
また、独立行政法人産業技術総合研究所の有機化合物のスペクトルデータベースには、結晶多形については特に指定していないが、DHBAのラマンスペクトルとIRスペクトルが掲載されている。しかしながら、MALDIにおける標準的な試料調製法の条件下で生成するマトリックスの結晶多形については、詳細に研究されたことがなかったばかりでなく、結晶多形とMALDIにおけるシグナル強度の関係、結晶構造とスイートスポットの関係等については全く知られていなかった。
【0013】
更に、DHBAは、糖鎖や糖ペプチドの測定に汎用されるが、糖鎖や比較的親水性の糖ペプチドはイオン化効率が悪いので、質の高い良いマススペクトルを得るには、試料が消費されるプレスキャンや経験によって手動でスイートスポットを探し出し、レーザー照射を行うといった時間のかかる作業が必要となり、特に測定試料全体の自動分析には適さないのが現状であった。
【0014】
この問題の解決には、マトリックス溶液を迅速に乾燥させる等して、強制的に微結晶を生成させ、スイートスポットとなり得る領域を限定する手法や(非特許文献5)、結晶化しない液体マトリックスを使用する手法があるが、イオン生成量の低下を招いたり、夾雑塩等の付加イオンの生成を促進したりする場合があり、測定試料のスイートスポットの高いイオン生成量をそのまま活用できる手法ではなかった。液体マトリックスにおいても、固体マトリックスほどのばらつきはないが、夾雑塩等の影響でスペクトルの再現性が劣る場合もあり、根本的な解決にはならなかった。
【0015】
また、DHBAを結晶化した後、表面を打破することによって物理的な凹凸を軽減する方法が、非特許文献6に記載されている。非特許文献6には、結晶化を冷蔵庫内で行った後、生成した結晶を打破すると、高いシグナルが得られるという記載もあるが、冷蔵庫内でマトリックスを結晶化したことによる効果の詳細は明らかではない。また、結晶を破壊することで、多形構造が変化したり、作製した測定試料中でのスイートスポットが不明確になったりする問題点がある。従って、スイートスポットを結晶の生成時に再現性よく局在化させ、質の良いマススペクトルを効率良く取得することを目的とした本発明とは趣旨が異なる。
【0016】
また、スイートスポットの形成を制御する目的でいくつかの技術が開発されており、例として特許文献1や特許文献2があるが、これらの技術の実行には、専用の装置や試料支持部材が必要である。また、これらの技術は、できるだけ狭小領域に試料を濃縮するという発想に基づいており、マトリックスの結晶化条件を工夫することで、特別な器具、装置、試料支持部材等を使用することなく、スイートスポットとなる結晶をより多く、広範囲に形成させる、又は、再現性良く形成させるという本発明とは根本的に異なるものであった。
【先行技術文献】
【特許文献】
【0017】
【特許文献1】特開2003−098115号公報
【特許文献2】特開2003−098149号公報
【非特許文献】
【0018】
【非特許文献1】Revecca W. et al., Anal. Chem. 72(18), 30-36 (2000)
【非特許文献2】Luxembourg S.L. et al., Anal. Chem. 75(10), 2333-2341 (2003)
【非特許文献3】Haisa M. et al., Acta. Cryst. B38, 1480-1485(1982)
【非特許文献4】Cohen D.E. et al., Crystal Growth & Design 7(3), 492-495(2007)
【非特許文献5】WilliamsT.I. et al., Rapid Commun. Mass Spectrom. 21, 807-811(2007)
【非特許文献6】Allwood D.A. et al., Appl. Surf. Sci.103(3), 231-244 (1996)
【発明の概要】
【発明が解決しようとする課題】
【0019】
本発明は上記背景技術に鑑みてなされたものであり、その課題は、MALDI質量分析法において、高いイオン生成量を有する測定試料を調製することであり、短時間で効率良く質の高いMSスペクトルを得ることのできるMALDI質量分析法用の測定試料を調製する方法を提供することにある。
【0020】
また、構造同定に必要な高感度MSn(2≦n)解析が可能となり、また、自動分析への応用が可能となり、高スループットのMALDI質量分析法の実現が可能になる方法を提供することにある。
【課題を解決するための手段】
【0021】
本発明者は、マトリックス単独の結晶構造について、分光学的手法及び熱分析法を用いて解析するとともに、試料支持部材上の結晶について局所的な分析を行った結果、意外にも、試料支持部材上に作製したDHBAマトリックス結晶には、マトリックスの再結晶精製されたマトリックスの標準品(独立行政法人産業技術総合研究所の有機化合物のスペクトルデータベースにあるもの)とは異なる物理化学的性質を示す結晶構造が混在していることを発見した。
【0022】
更に、測定試料とマトリックスの混合結晶において、高いイオン生成量を有するスイートスポットを創出する該混合結晶の部分とスイートスポットにならない該混合結晶の部分との違いは、マトリックスの結晶構造の違いに依存し、スイートスポットを創出する該混合結晶の部分は、マトリックスの標準品独立行政法人産業技術総合研究所の有機化合物のスペクトルデータベースにあるもの)とは異なる物理化学的性質を示す結晶構造であると同定した。
【0023】
このことから、スイートスポットを創出する、すなわちスイートスポットとなり得る該混合結晶の形成と、スイートスポットにならない該混合結晶の形成を制御するため、マトリックスの結晶化条件を最適化することにより、質の高いMSスペクトルを与える測定試料の作製が可能になるかもしれないと着想して、鋭意検討を重ねた結果、上記の課題を解決できることを見出した。
【0024】
すなわち、マトリックス結晶の多形構造は、測定試料の調製時の溶媒除去の際の、又は結晶を析出させる際の温度条件等の設定で容易に形成することが可能であり、更には、温度条件のみの設定でスイートスポットとなり得る該混合結晶の位置を明確に制御可能であることを初めて見出し、本発明を完成するに至った。そして、マトリックス溶液の調製に常用されるアセトニトリル及び/又は水を溶媒として使用した場合において、特に温度条件の設定で、差別的に特定の多形構造が形成されること見出し、本発明を完成するに至った。なお、非特許文献3において使用しているアセトン及びクロロホルムは、測定対象分子が溶解しない場合が多いため、MALDI質量分析法におけるマトリックス溶液の溶媒としては適当でない。
【0025】
通常、糖ペプチド等の測定対象分子の溶解度は、溶液の温度の低下と共に低下するため、マトリックス溶液や試料支持部材を冷却することは、マトリックス結晶と測定対象分子の混和性を低下させ、混合結晶の不均一性を増大させ、スイートスポットの形成に対しては一見不利であるようにも思われる。
しかし、意外にもマトリックス溶液の冷却によって該混合結晶の不均一性は増大せず、スイートスポットの形成を温度条件のみの設定で制御することが可能であり、スイートスポットの形成を制御することで、プレスキャンをしなくても、マニュアル測定であっても、質の高いマススペクトルを取得することが可能となることを見出して本発明に至った。
【0026】
特に、更に、測定対象分子のイオン化効率を高めるための誘導体化剤及びその洗浄過程を合わせて行うことで、スイートスポットの位置等を温度条件のみの設定で制御することが可能であり、また、スイートスポットの位置等を制御することで、プレスキャンをしなくても、マニュアル測定であっても、容易に質の高いマススペクトルを取得することが可能となることを見出して本発明に至った。
【0027】
すなわち、本発明は、以下のMALDI質量分析法用測定試料調製方法を提供するものである。
[1]MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させ、該混合結晶のうちの特定の多形構造を利用してイオン化効率を高めることを特徴とするMALDI質量分析法用測定試料調製方法。
[2]MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の結晶化条件を制御し、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させ、スイートスポットとなり得る特定の多形構造を利用してイオン化効率を高めることを特徴とする[1]に記載のMALDI質量分析法用測定試料調製方法。
[3]該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)であり、スイートスポットとなり得る多形構造が準安定結晶β晶であることを特徴とする[1]又は[2]に記載のMALDI質量分析法用測定試料調製方法。
[4]MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の温度条件を制御することによって、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させることを特徴とする[1]ないし[3]の何れかに記載のMALDI質量分析法用測定試料調製方法。
[5]MALDI質量分析法において、試料支持部材上に測定対象分子を含む試料を載せた後にマトリックス溶液を載置し、又は試料支持部材上に測定対象分子を含む試料とマトリックス溶液を同時に載置し、該溶液を乾燥させて該試料とマトリックスの混合結晶を析出させる際の温度条件を制御し、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させることを特徴とする[1]ないし[4]の何れかに記載のMALDI質量分析法用測定試料調製方法。
[6]該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)であり、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の温度を、マトリックス溶液の凝固点以上15℃以下の範囲に設定することを特徴とする[1]ないし[5]の何れかに記載のMALDI質量分析法用測定試料調製方法。
[7]MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際、試料支持部材の温度を、マトリックス溶液の凝固点以上15℃以下の範囲に設定することを特徴とする[1]ないし[6]の何れかに記載のMALDI質量分析法用測定試料調製方法。
[8]測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の溶媒が、水及び/又はアセトニトリルであることを特徴とする[1]ないし[7]の何れかに記載のMALDI質量分析法用測定試料調製方法。
[9]試料支持部材上に測定対象分子を含む試料を載せた後であって、マトリックス溶液を載置する前に、測定対象分子と反応することによってイオン化効率を高める誘導体化剤の溶液を該試料支持部材上に滴下して乾燥する工程を挿入することを特徴とする[1]ないし[8]の何れかに記載のMALDI質量分析法用測定試料調製方法。
【0028】
また、本発明は、以下のMALDI質量分析法を提供するものである。
[10][1]ないし[9]の何れかに記載のMALDI質量分析法用測定試料調製方法を使用して調製されたMALDI質量分析法用測定試料を用いてイオン化効率を高めることを特徴とするMALDI質量分析法。
【発明の効果】
【0029】
本発明によれば、前記問題点と課題を解決し、測定試料の善し悪しを判断したり、スイートスポットがMALDI質量分析法用の試料支持部材上のどの部分にあるかを経験によって探し出したりする作業が必要なくなり、誰でも短時間で効率良く質の高いMSスペクトルを得ることができる。それによって、自動分析への応用も可能となり、高スループットのMS分析手法を提供することができる。
【0030】
特に、構造同定に必要な高感度MSn(2≦n)解析を可能にし、測定対象分子を含む試料の量が少ない、測定対象分子のイオン化効率が低い等の理由で従来は測定できなかった試料であっても、誰でも短時間で効率良く化学構造の決定が可能になる。
【図面の簡単な説明】
【0031】
【図1】実施例で用いられた測定対象分子である糖ペプチドの化学構造を示す図である。
【図2】参考例1における、試料支持部材上の析出物の共焦点レーザー顕微鏡写真を示す図である。
【図3】2種類のラマン分光スペクトルを示す図である。 (a)プレート(試料支持部材)上の安定結晶α晶(標準品のDHBA粉末)で測定されたラマン分光スペクトルである。 (b)プレート(試料支持部材)上の準安定結晶β晶で測定されたラマン分光スペクトルである。
【図4】プレート(試料支持部材)上で、1199cm−1付近に強いシグナルをもつ安定結晶α晶を白く表し、1199cm−1付近に強いシグナルをもたない準安定結晶β晶を黒く表したラマンイメージング画像である。
【図5】図4で黒く表された部分(準安定結晶β晶)のマススペクトルを示す図である。
【図6】試料支持部材上をMSシグナルでスキャンした画像であり、イオン化効率が高い部分を示す図である。
【図7】実施例1で測定された顕微ラマンスペクトルを示す図である。
【図8】参考例2で測定された顕微ラマンスペクトルを示す図である。
【図9】参考例2で測定された粉末X線回折を示す図である。
【図10】比較例1で測定された顕微ラマンスペクトルを示す図である。
【図11】比較例1で測定された粉末X線回折を示す図である。
【図12】2種類のMSスペクトルを示す図である。 (a)実施例2の試料支持部材上を測定したMSスペクトルである。 (b)比較例2の試料支持部材上を測定したMSスペクトルである。
【図13】実施例2と比較例2の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像である。 (a)実施例2の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を濃い灰色から黒で示す図である。 (b)比較例2の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を濃い灰色から黒で示す図である。
【図14】比較例3の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を濃い灰色から黒で示す図である。
【図15】2種類のMSスペクトルを示す図である。 (a)実施例3の試料支持部材上を測定したMSスペクトルである。 (b)比較例4の試料支持部材上を測定したMSスペクトルである。
【図16】2種類のMSスペクトルを示す図である。 (c)実施例4の試料支持部材上を測定したMSスペクトルである。 (d)実施例5の試料支持部材上を測定したMSスペクトルである。
【図17】実施例3、比較例4の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像である。 (a)実施例3の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。 (b)比較例4の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。
【図18】実施例4、実施例5の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像である。 (c)実施例4の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。 (d)実施例5の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。
【図19】2種類のMSスペクトルを示す図である。 (a)実施例6の試料支持部材上を測定したMSスペクトルである。 (b)比較例5の試料支持部材上を測定したMSスペクトルである。
【図20】実施例6と比較例5の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像である。 (a)実施例6の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。 (b)比較例5の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。
【図21】2種類のMSスペクトルを示す図である。 (a)実施例7の試料支持部材上を測定したMSスペクトルである。 (b)比較例6の試料支持部材上を測定したMSスペクトルである。
【図22】実施例7と比較例6の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像である。 (a)実施例7の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。 (b)比較例6の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。
【図23】実施例8と比較例7の測定試料の共焦点レーザー顕微鏡写真と4種類のペプチドのMSシグナルスキャン画像である。 (a)実施例8の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。 (b)比較例7の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。
【発明を実施するための形態】
【0032】
以下、本発明について説明するが、本発明は以下の実施の具体的態様に限定されるものではなく、任意に変形して実施することができる。
【0033】
<MALDI質量分析法用測定試料の調製方法>
マトリックスはレーザーの光エネルギーを吸収して、共存する測定対象分子の脱離及びイオン化を達成する物質であれば限定されないが、例えば、以下のものが挙げられる。
【0034】
1,8−ジアミノナフタレン(1,8-Diaminonaphthalene)(1,8−DAN)、2,5−ジヒドロキシ安息香酸(2,5-Dihydroxybenzoic acid)(以下、「DHBA」と略記する場合がある)、1,8−アントラセンジカルボン酸ジメチルエステル(1,8-Anthracenedicarboxylic Acid Dimethyl ester)、ロイコキニザリン(Leucoquinizarin)、アントラロビン(Anthrarobin)、1,5−ジアミノナフタレン(1,5-Diaminonaphthalene)(1,5−DAN)、6−アザ−2−チオチミン(6-Aza-2-thiothymine)、1,5−ジアミノアントラキノン(1,5-Diaminoanthraquinone)、1,6−ジアミノピレン(1,6-Diaminopyrene)、3,6−ジアミノカルバゾール(3,6-Diaminocarbazole)、1,8−アントラセンジカルボン酸(1,8-Anthracenedicarboxylic Acid)、ノルハルマン(Norharmane)、1−ピレンプロピルアミンハイドロクロライド(1-Pyrenepropylamine hydrochloride)、9−アミノフルオレンハイドロクロライド(9-Aminofluorene Hydrochloride)、フェルラ酸(Ferulic acid)、ジトラノール(Dithranol)、2−(4−ヒドロキシフェニルアゾ)安息香酸(2-(4-Hydroxyphenylazo)benzoic acid)(HABA)、trans−2−[3−(4−tert−ブチルフェニル)−2−メチル−2−プロペニリデン]マロンニトリル(trans-2-[3-(4-tert-Butylphenyl)-2-methyl-2-propenylidene]malononitrile)(DCTB)、trans−4−フェニル−3−ブテン−2−オン(trans-4-Phenyl-3-buten-2-one)(TPBO)、trans−3−インドールアクリル酸(trans-3-Indoleacrylic acid)(IAA)、1,10−フェナントロリン(1,10-Phenanthroline)、5−ニトロー1,10−フェナントロリン(5-Nitro-1,10-phenanthroline)、α−シアノ−4−ヒドロキシケイ皮酸(α-Cyano-4-hydroxycinnamic acid)(CHCA)、シナピン酸(Sinapic acid)(SA)、2,4,6−トリヒドロキシアセトフェノン(2,4,6-Trihydroxyacetophenone)(THAP)、3−ヒドロキシピコリン酸(3-Hydroxypicolinic acid)(HPA)、アントラニル酸(Anthranilic acid)、ニコチン酸(Nicotinic
acid)、3−アミノキノリン(3-Aminoquinoline)、2−ヒドロキシ−5−メトキシ安息香酸(2-Hydroxy-5-methoxybenzoic acid)、2,5−ジメトキシ安息香酸(2,5-Dimethoxybenzoic acid)、4,7−フェナントロリン(4,7-Phenanthroline)、p−クマル酸(p-Coumaric acid)、1−イソキノリノール(1-Isoquinolinol)、2−ピコリン酸(2-Picolinic acid)、1−ピレンブタン酸ヒドラジド(1-Pyrenebutanoic acid, hydrazide)(PBH)、1−ピレンブタン酸(1-Pyrenebutyric acid)(PBA)、1−ピレンメチルアミンハイドロクロライド(1-Pyrenemethylamine hydrochloride)(PMA)。
【0035】
上記したマトリックスの中でも、針状に結晶化する性質を有するマトリックスが好ましい。更に、2,5−ジヒドロキシ安息香酸(DHBA)が最も好ましい。
【0036】
<試料とマトリックスの混合結晶の析出又は混合物の生成>
本発明のMALDI質量分析法用測定試料の調製方法において、該測定対象分子を含む試料とマトリックスの混合結晶を作製する方法には、特に限定はないが、例えば、好ましい方法として、以下の(1)法〜(3)法が挙げられる。
(1)試料支持部材上に測定対象分子を含む試料を載せた後に、乾燥後又は乾燥する前にマトリックス溶液を載置し、次いで、該溶液を乾燥させて、該混合結晶を析出させる方法。
(2)試料支持部材上に測定対象分子を含む試料とマトリックス溶液を同時に載置し、次いで、該溶液を乾燥させて、該混合結晶を析出させる方法。
(3)試料支持部材上に該マトリックス溶液を載置し、次いで該溶液を乾燥させ該マトリックスの結晶を析出させた後、同一又は異なる化学構造を有するマトリックスと測定対象分子を含む溶液を重層し、次いで該溶液を乾燥させて混合物を生成させる方法。
【0037】
試料とマトリックスの混合結晶を作製する方法として、特に好ましくは、上記(1)又は(2)である。すなわち、
(1)試料支持部材上に測定対象分子を含む試料を載せた後にマトリックス溶液を載置し、又は、
(2)試料支持部材上に測定対象分子を含む試料とマトリックス溶液を同時に載置し、次いで、該溶液を乾燥させて、該混合結晶を析出させる方法、である。
【0038】
本発明において、「測定対象分子を含む試料とマトリックスの混合結晶」とは、測定対象分子を含む試料の分子とマトリックスの分子とを物質として両方含有する結晶という意味であり、測定対象分子がマトリックス分子に置き換わることによって、マトリックス分子単独の(マトリックス分子独自の)結晶構造とは異なる結晶構造になった結晶を意味しない。通常は、試料支持部材上においては、マトリックスの分子数に比べて測定対象分子の分子数は極めて少ない。
【0039】
<<(1)法>>
上記(1)法は、本発明において特に好適な方法であり、測定対象分子を含む試料を先に試料支持部材上に存在させ、次いで、マトリックス溶液(好ましくは実質的にマトリックスのみを溶解した溶液)を、該試料に重層し、試料を溶解させながら、試料支持部材(以下、「プレート」と略記することがある)上で乾燥させて、結晶を析出させる測定試料の調製方法である。
【0040】
上記(1)法においては、マトリックス溶液をプレート上で乾燥する工程を、プレート上に物質を供給する工程の中では最終の工程とする。一般に、高いイオン生成量を得るためには試料とマトリックスがよく混合されなければならないにもかかわらず、最終の工程でプレートに供給する溶液の中に測定対象分子が溶解(含有)されていなくてもよいことを本発明者は見出した。
【0041】
そして、上記(1)法において、スイートスポットとなる結晶を多数形成させるためには、マトリックス溶液(好ましくは実質的にマトリックスのみを溶解した溶液)の温度は、好ましくは試料支持部材の温度より低い方がよい。
【0042】
マトリックス溶液(好ましくは実質的にマトリックスのみを溶解した溶液)の温度は、具体的には、試料支持部材上に載置する際には、20℃以下が好ましく、15℃以下がより好ましく、4℃以下が特に好ましい。また、結晶析出中に維持するマトリックス溶液の温度は、20℃以下が好ましく、15℃以下がより好ましく、4℃以下が特に好ましい。また、マトリックス溶液の温度は、マトリックス溶液の凝固点以上であることが必要である。マトリックス溶液は、冷蔵庫等で十分に冷却した後に用いることが特に好ましい。
【0043】
更に、試料支持部材についても、あらかじめ冷却した状態にしておくことが好ましい。試料支持部材の温度は、具体的には、マトリックス溶液を試料支持部材上に載置する際には、20℃以下が好ましく、15℃以下が特に好ましい。また、結晶析出中に維持する試料支持部材の温度は、20℃以下が好ましく、15℃以下が特に好ましい。結露を防止できる条件であれば、4℃以下が特に好ましい。従って、試料支持部材を冷却するにあたり、測定試料を調製する場所の湿度によっては、試料支持部材に結露が生じることがあるため、乾燥した環境下で作業することが好ましい。また、試料支持部材の温度は、マトリックス溶液の凝固点以上であることが好ましい。
【0044】
本発明における「測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の結晶化条件」とは、温度、過飽和度(濃度)、溶媒、pH、添加物、界面張力等をいう。温度及び過飽和度(濃度)は、結晶の多形構造生成に影響を与える主要な制御因子であり、溶媒、pH、添加物及び界面張力は補助因子として影響する。従って、本発明における「スイートスポットとなる結晶多形の形成方法」としては、特に限定はないが、温度、過飽和度(濃度)、溶媒、pH、添加物、界面張力等を最適化し、制御する方法が挙げられる。
【0045】
上記の「スイートスポットとなる結晶多形の形成方法」として、マトリックスが2,5−ジヒドロキシ安息香酸(以下、「DHBA」と略記することがある)である場合には、プレート及びマトリックス溶液の温度が、上記した通りの低温となるように冷却する方法が最も簡便で効果的であり、再現性良く測定試料を調製できるという理由等から特に好ましい。溶媒を留去するとき(結晶を析出させるとき)を低温にすることが好ましく、それを確実に達成するために、載置するときに、マトリックス溶液及び/又は試料支持部材を低温にしておくことが好ましい。
【0046】
溶媒を留去するとき(混合結晶を析出させるとき)の試料支持部材を低温にすることが本発明の効果を発揮させるために特に好ましく、それを確実に達成するために、載置するときも、「試料支持部材」又は「試料支持部材とマトリックス溶液の双方」を低温にしておくことが好ましい。
【0047】
物質をプレート上に載置するための実質的な最終工程に、マトリックスのみを溶解した溶液を用いる場合、該溶液の溶媒は、測定対象分子と該マトリックスの何れをも溶解できる溶媒であることが好ましい。下層に既にある測定対象分子を溶解して、マトリックスと混合させることができるからである。
【0048】
上記(1)法は、以下の、工程(A)及び工程(B)を必須の工程として含むことが好ましい。
(A)測定対象分子を含む試料の溶液をプレート上で乾燥する工程と、その後に、
(B)マトリックスのみを溶媒に溶解した溶液を、上記プレートに滴下する工程
【0049】
工程(A)では、測定対象分子を含む試料の溶液をプレート上で乾燥する。このときの溶液は、測定対象分子を含有してさえいればよく、マトリックスは含有されていてもいなくてもよい。ただし、測定対象分子を含む試料が極微量の場合、測定対象分子を含む試料の良溶媒がマトリックスの貧溶媒であり、そのマトリックスや溶媒を用いたい場合、マトリックスが溶解した溶媒に対して試料が不安定でありストック溶液として保管若しくは使用ができない又は取り扱いが難しくなる場合等には、測定試料の調製が容易である点、溶媒の選択幅が広がる点、試料の分解や容器への吸着を抑制できる点等のため、このときの溶液中にはマトリックスを溶解させずに、測定対象分子を含む試料のみを溶解させる方が好ましい。
【0050】
その際の溶媒としては、測定対象分子を含む試料を溶解しさえすれば特に限定はなく、マトリックスを溶解させる性質は有していなくてもよいし、常圧における沸点が高く、蒸発(乾燥)速度は遅くてもよい。測定対象分子又は測定対象分子を含む試料が水溶性であるならば、工程(A)で用いる溶媒は水単独が特に好ましい。測定対象分子を含む試料が糖であるならば、工程(A)で用いる溶媒は水単独が最も好ましい。マトリックスを溶解させないので、マトリックスに対する溶解度は低くてもよく、そのため測定対象分子又は測定対象分子を含む試料に最も好適な溶媒が選択できる。
【0051】
工程(A)における上記溶液中における測定対象分子の濃度は特に限定はないが、1amol/μL〜1μmol/μLが好ましく、100amol/μL〜1nmol/μLが特に好ましい。工程(A)終了後に(乾燥後に)、プレート上に存在する測定対象分子を含有する層の厚さは特に限定はないが、5μm以下が好ましく、1μm以下が特に好ましい。かかる層の厚さが厚すぎると、マトリックス溶液を滴下した場合にマトリックス分子とうまく混和しない可能性があり、MSシグナル強度が低下する場合がある。
【0052】
(1)法は、「測定対象分子を含む試料」の溶液をまずプレートに滴下するので、測定対象分子を含む試料が極めて微量である場合に、別の容器でマトリックス溶液と混合しその一部をプレートに滴下することなく、微量試料のほとんど全量を分析に供することができるため特に有用である。測定対象分子を含む試料が1000fmol以下の場合により有用であり、300fmol以下の場合に特に有用であり、100fmol(例えば、100fmol/μLに溶解した水溶液を1μL滴下する等によりプレート上に100fmol載せる)以下の場合に更に有用である。
【0053】
(1)法においては、工程(A)の後に、(B)マトリックスのみを溶媒に溶解した溶液を上記プレートに滴下する工程を有する。「工程(A)の後に」の意味は、「工程(A)の直後に」には限定されず、工程(A)と工程(B)の間に、他の工程が挿入されていてもよい。「他の工程」としては、例えば、後述する工程(C)が挙げられる。
【0054】
工程(B)では、実質的にマトリックスのみを溶媒に溶解した溶液を上記プレートに滴下するが、測定対象分子と該マトリックスの何れをも溶解できる溶媒を用いることによって、下層の測定対象分子がマトリックス分子と混和し、溶媒の蒸発にともなって混合結晶が現出する。
【0055】
<<<誘導体化>>>
(1)法においては、上記工程(A)と工程(B)の間に、
(C)測定対象分子と反応することによってイオン化効率を高める誘導体化剤の溶液を、上記プレート上に滴下して乾燥する工程
を行なうことが、イオン化効率を更に高めるために好ましい。
【0056】
すなわち、(A)試料支持部材上に測定対象分子を含む試料を載せた後であって、(B)マトリックス溶液を載置する前に、(C)測定対象分子と反応することによってイオン化効率を高める誘導体化剤の溶液を該試料支持部材上に滴下して乾燥する工程を挿入するMALDI質量分析法は、イオン化効率が更に高くなるために好ましい。
【0057】
測定対象分子と反応することによってイオン化効率を高める誘導体化剤(以下、単に「誘導体化剤」と略記する)を、予め測定対象分子と反応させてから、プレートに供給すると、測定試料のロスに繋がる場合がある。従って、糖、糖タンパク質、糖ペプチド等の微量な「生体由来の分子又は生体試料中の分子」に質量分析法を適用する場合、工程(A)と工程(B)の間に工程(C)を挿入することが特に好ましい。
【0058】
誘導体化剤は、誘導体化された測定対象分子すなわち質量分析に供される分子のイオン化効率を高めるものであれば特に限定はない。誘導体化剤は、MALDI質量分析法におけるマトリックスとしての効果を有する化合物、又はそれらに後記する反応性官能基やスペーサ部分を更に有する化合物も好ましい。
【0059】
かかる誘導体化剤の化学構造は上記効果を奏するものであれば特に限定はないが、その分子内にナフタレン、アントラセン、ピレン等の縮合多環を有する縮合多環化合物等が上記効果を好適に奏するので特に好ましい。ここで「縮合多環化合物」とは、窒素、硫黄又は酸素分子を含む複素環を一部に含んでいてもよい縮合多環部分と、測定対象分子とを結合することが可能である反応性官能基と、要すれば、該縮合多環部分と該反応性官能基とを連結するスペーサ部分とを有する化合物をいう。特に、芳香族環を有する化合物であることが好ましい。
【0060】
誘導体化剤は、測定対象分子に反応することによって、誘導体化された分子すなわち質量分析に供される分子の、イオン化切断位置を制御できるようにするものであることが特に好ましい。
【0061】
誘導体化剤は、アミノ基、ヒドラジド基、ジアゾメチル基、スクシニミジルエステル基、塩化スルホニル基、ヨード基(−I)等の反応性官能基を有することが好ましい。特に好ましい誘導体化剤としては、具体的には、ナフタレン環、アントラセン環、ピレン環等の縮合多環に、上記基が直接若しくは他の基(スペーサ部分)を介して結合した縮合多環誘導体化合物;ヨウ化メチル;ジアゾメタン;トリメチルシリルジアゾメタン等が挙げられる。
【0062】
このうち、誘導体化された分子すなわち質量分析に供される分子のイオン化効率を高めたり、イオン化切断位置を制御できるようにしたりする点等で、ピレン環化合物が特に好ましい。ここで「ピレン環化合物」とは、ピレン環と、「測定対象分子」に結合することが可能である反応性官能基と、要すれば該ピレン環と該反応性官能基とを連結するスペーサ部分とを有する化合物をいう。
【0063】
具体的には、1−ピレンブタン酸ヒドラジド(1-pyrenebutanoic acid, hydrazide)(以下、「PBH」と略記する)、1−ピレン酢酸ヒドラジド(1-pyreneacetic acid, hydrazide)、1−ピレンプロピオン酸ヒドラジド(1-pyrenepropionic acid, hydrazide)、1−ピレン酢酸スクシニミジルエステル(1-pyreneacetic acid, succinimidyl ester)、1−ピレンプロピオン酸スクシニミジルエステル(1-pyrenepropionic acid, succinimidyl ester)、1−ピレンブタン酸スクシニミジルエステル(1-pyrenebutanoic acid, succinimidyl ester)、N−(1−ピレンブタノイル)システイン酸スクシニミジルエステル(N-(1-pyrenebutanoyl)cysteic acid, succinimidyl ester)、N−(1−ピレン)ヨードアセトアミド(N-(1-pyrene) iodoacetamide)、N−(1−ピレン)ヨードマレイミド(N-(1-pyrene) maleimide)、N−(1−ピレンメチル)ヨードアセトアミド(N-(1-pyrenemethyl) iodoacetamide)、1−ピレンメチルヨードアセテート(1-pyrenemethyl iodoacetate)、アミノピレン(aminopyrene)、1−ピレンメチルアミン(1-pyrenemethyl amine)、1−ピレンプロピルアミン(3-(1-pyrenyl)propylamine)、1−ピレンブチルアミン(4-(1-pyrenyl)butylamine)、1−ピレンスルホン酸クロリド(1-pyrenesμLfonyl chloride)、1−ピレニルジアゾメタン(1-pyrenyldiazomethane)(以下、「PDAM」と略記する)、1−ピレンカルバルデヒド ヒドラゾン(1-pyrenecarbaldehyde hydrazone)、1−ピレニルチオシアネート(1-pyrenylthiocyanate)、1−ピレニルイソチオシアネート(1-pyrenylisothiocyanate)等が好ましいものとして挙げられる。このうち最も好ましくはPBH又はPDAMである。
【0064】
誘導体化剤としては、上記具体的化合物において、ピレン環を、ナフタレン環又はアントラセン環に代えたものも好ましいものとして挙げられる。また、ヨウ化メチル、ジアゾメタン又はトリメチルシリルジアゾメタンも好ましい。
【0065】
好ましい「測定対象分子と誘導体化剤との組み合わせ」としては、測定対象分子がアルデヒド基を含有する糖鎖を有する分子であり、誘導体化剤がアミノ基又はヒドラジド基等を有するものである場合が挙げられる。また、好ましい組み合わせとしては、測定対象分子が、カルボキシル基、アミノ基又はメルカプト基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤が、アミノ基、ヒドラジド基又はジアゾメチル基等を有するものである場合が挙げられ、更に、測定対象分子が、カルボキシル基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤がヨウ化メチル又はトリメチルシリルジアゾメタンである場合が挙げられる。これらの組み合わせは、測定対象分子及び誘導体化剤を、容易にプレート上で反応させることができる点、イオン化を阻害しない点、反応が選択的である点、一般に微量での分析の必要性が高いので、前記効果を奏し易い点等から好ましい。
【0066】
<<(2)法>>
(2)試料支持部材上に測定対象分子を含む試料とマトリックス溶液を同時に載置し、該溶液を乾燥させて、試料支持部材上に該混合結晶を析出させる方法も好ましい。かかる(2)法の測定試料の調製方法は、「Dried Droplet法」として知られているものである。(1)の調製方法で、試料支持部材上に測定対象分子を含む試料を載せた後に、乾燥する前にマトリックス溶液を載置する方法も同様である。
【0067】
この(2)法においても、マトリックス溶液をあらかじめ冷却しておくことによって、好ましくは、マトリックス溶液及び試料支持部材をあらかじめ冷却しておくことによって、スイートスポットとなり得る結晶構造の形成を促進させることができる。マトリックス溶液の好ましい温度、試料支持部材の好ましい温度、それらと「測定試料を調製する雰囲気温度」との関係、温度設定手段等は、前記した(1)法の場合と同様である。
【0068】
スイートスポットになり得る混合結晶の部分は、MS分析法以外の分析方法を用いて、該混合結晶の局所的な分析をした際に、該マトリックスの標準品とは異なる分析結果を呈する「測定対象分子を含む試料とマトリックスの混合結晶」として検出できる。マトリックスがDHBAである場合は、上記「マトリックスの標準品」とは、大部分がDHBAの安定結晶α晶から成る状態をいい、上記「マトリックスの標準品とは異なる分析結果を呈する『測定対象分子を含む試料とマトリックスの混合結晶』」とは、DHBAの準安定結晶β晶をいう。
【0069】
本発明における「測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の結晶化条件」とは、温度、過飽和度(濃度)、溶媒、pH、添加物、界面張力等をいい、それらの影響、制御方法、好ましい範囲、その理由等は、前記した(1)法と同様である。
【0070】
また、(2)法においても測定対象分子の誘導体化を行ってもよい。誘導体化については、前記した(1)法と同様である。
【0071】
<<試料とマトリックスの混合結晶の析出方法一般>>
本発明のMALDI質量分析法用測定試料の調製方法において、「該測定対象分子を含む試料」とマトリックスとの混合結晶を作製する方法は特に限定はなく、何れの方法においても、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の結晶化条件を制御することによって、スイートスポットとなり得る特定の多形構造を形成させることが好ましい。該混合結晶のうちスイートスポットとなり得る特定の多形構造の形成を促進させる。
【0072】
「測定対象分子を含む試料」とマトリックスの混合結晶を作製する方法にはよらず、前記の(1)法、(2)法及び(3)法の何れの方法においても、該「結晶化条件の制御」は、「析出させる際の温度条件の制御」により行うことが好ましい。
【0073】
本発明においては、溶液を乾燥させて該試料とマトリックスの混合結晶を析出させる際の試料支持部材の温度条件を室温より低い温度に制御することによって、スイートスポットとなり得る特定の多形構造の形成を促進させる。
【0074】
本発明における「室温」とは、試料を調製する場所の気温(雰囲気温度)のことをいう。本発明の効果は、試料支持部材の温度を低温に保つことにより好適に達成されるものであり、試料を調製する場所との温度差を利用したものではない。
【0075】
該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)の場合で、溶媒に水を含む場合は、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の温度は、具体的には、20℃以下が好ましく、15℃以下がより好ましく、10℃以下が特に好ましく、4℃以下が更に好ましい。また、マトリックス溶液の凝固点以上であることが必要である。
「混合結晶を析出させる際の温度」とは、何れの「測定試料の調製方法」においても、プレート上で析出直前及び/又はプレート上で析出中の溶液の温度をいう。
【0076】
本発明の効果が奏される作用原理は以下のように考えられる。ただし、以下に記載の現象が確実に起こる測定試料の調製方法にのみ本発明が限定される訳ではない。
すなわち、上記の温度範囲であると、DHBAの飽和溶解度が温度に依存して低下し、マトリックス結晶化の駆動力となる濃度勾配が大きくなり、DHBA溶液が不安定な高エネルギー状態となって、DHBAの結晶化が速度論的に進行するために、スイートスポットとなり得る準安定型の多形構造の結晶核が数多く形成される。
準安定型の多形構造の結晶核が多数形成されると、生成したDHBA結晶の核と測定対象分子が相互作用することによって、マトリックス結晶中に取り込まれる対象分子が増加する。特に、イオン化効率が低い対象分子の場合には、マトリックス結晶の表面に吸着しているのみではイオン化されず、結晶内部に取り込まれている必要がある。対象分子は、結晶の成長段階では結晶内部に取り込まれ難い。
【0077】
また、温度を低く保つことにより、マトリックス水溶液の粘性が高くなり、試料支持部材上での溶液の流動性が抑制され、試料支持部材上での初期のマトリックス水溶液のぬれ面積を最終的に保持することができるので、スイートスポットが支持部材の一定位置に形成される。
【0078】
測定対象分子を含む試料とマトリックスの混合結晶を析出させる際、試料支持部材の温度は、20℃以下が好ましく、15℃以下がより好ましく、10℃以下が特に好ましく、更に好ましくは4℃以下である。また、下限は、マトリックス溶液の凝固点以上であることが好ましい。
【0079】
測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の溶媒が、水及び/又はアセトニトリルであることが、糖、タンパク質、ペプチド、糖タンパク質、糖ペプチド、核酸、糖脂質等に汎用できる点で好ましい。すなわち、マトリックスの分子数に比べて極めて分子数の少ない測定対象分子である、糖、タンパク質、ペプチド、糖タンパク質、糖ペプチド、核酸、糖脂質等の測定対象分子を十分に溶解する点、同時にスイートスポットとなり得る特定の多形構造を迅速に作製させ、測定対象分子を効率的に結晶中に取り込むことができるという点で特に好ましい。水若しくはアセトニトリル、又は水とアセトニトリルとの混合溶媒の時に、前記した効果を特に発揮する。これらは、特に、マトリックスがDHBAのとき、スイートスポットとなり得る特定の多形構造ができ易い溶媒である。
【0080】
本発明においては、スイートスポットになり得る混合結晶の部分を多く形成させて、該スイートスポットが多数形成された試料を対象としてレーザー脱離イオン化することを特徴とする。
本発明で用いられるマトリックスの種類は特に限定はなく、MALDI質量分析法に用いられるマトリックスならば何れも用いられるが、特に針状に結晶化する物質は、結晶化の際の温度を低温に保つことによって、スイートスポットになり得る特定の結晶構造への測定試料の取り込みが促進されるため、本発明に好適に使用できる。
本発明は、該マトリックスが、針状に結晶化する物質であることを特徴とする上記のMALDI質量分析法用測定試料調製方法でもある。
中でも、マトリックスとして最も好ましくは、2,5−ジヒドロキシ安息香酸(DHBA)である。
【0081】
該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)のとき、スイートスポットとなり得る多形構造は準安定結晶β晶である。「準安定結晶β晶」とは、非特許文献3には、「Disordered」と示され、ケンブリッジデータベースに登録されている(CCDC No.BESKAL01、格子定数a=11.299(2)Å、b=11.830(3)Å、c=4.966(4)Å、β=90.50(3)°)結晶構造である。
【0082】
DHBAの「準安定結晶β晶」のラマンスペクトルは、安定結晶α晶のラマンスペクトル(独立行政法人産業技術総合研究所のスペクトルデータベースに登録されている「参照ラマンスペクトル」で観測される、1199cm−1付近、1307cm−1付近及び376cm−1付近等の強いシグナルがなく、3265cm−1付近にブロードなシグナルがある。
【0083】
「準安定結晶β晶」は、CuKα線による粉末X線回折によれば、2θ=11.0度、16.0度、17.5度、24.8度、28.3度及び31.2度に特徴的な回折ピークを有しているものであり、図9に示した粉末X線回折パターンを与えるものである。
【0084】
該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)のとき、スイートスポットとならない多形構造は安定結晶α晶である。「安定結晶α晶」とは、独立行政法人産業技術総合研究所スペクトルデータベースに登録されているDHBAのラマンスペクトルを与える結晶構造であり、また、非特許文献3には「Ordered」と示され、ケンブリッジデータベースに登録されている(CCDC No.BESKAL、格子定数a=23.945(2)Å、b=4.908(1)Å、c=5.621(1)Å、β=100.98(0)°)結晶構造である。
【0085】
「安定結晶α晶」は、CuKα線による粉末X線回折によれば、2θ=16.3度、19.8度、23.8度、27.3度、31.3度及び37.0度に特徴的な回折ピークを有しているものであり、図11に示した粉末X線回折パターンを与えるものである。
【0086】
<測定対象分子>
本発明のMALDI質量分析法が適用される測定対象分子は特に限定はないが、生体由来の分子又は生体試料中の分子であることが好ましく、具体的には、糖、タンパク質、ペプチド、糖タンパク質、糖ペプチド、核酸、糖脂質等であることが、本発明の効果をより発揮できるので好ましい。「測定対象分子」としては、天然物から調製されるもの、天然物を化学的又は酵素学的に一部改変して調製されるものの他、化学的又は酵素学的に調製されるものも好ましい。また、生体に含まれる分子の部分構造を有するものや生体に含まれる分子を模倣して作製されたものも好ましい。また、プレートに載せる前に、すでに誘導体化がなされていてもよい。
【0087】
また、質量分析法に用いるプレート上に載せる試料、すなわち、測定対象分子を含む試料としては、「測定対象分子」そのものだけでもよいし、「測定対象分子」を含むもの、例えば、生体の組織、細胞、体液や分泌物(例えば、血液、血清、尿、精液、唾液、涙液、汗、糞便等)等でもよい。すなわち、直接生体試料を用いてもよい。また、試料をプレート上に載せ、酵素処理等を行なって、測定対象分子を調製してもよい。
【0088】
上記した分子は、分析に供される試料が少量である場合が多く、また特に、糖、糖タンパク質、糖脂質等の複合糖質等又はそれらから化学的若しくは酵素学的に遊離させて得たものは、分子量や組成が同一の異性体が複数存在するので、スイートスポットが容易に見つからずに測定を断念していた場合も多く、本発明のスイートスポットの予測方法及びMALDI質量分析法は、それら分子の化学構造解析に対して特に上記効果を奏するので好ましい。
【0089】
<質量分析装置>
イオン化に用いられるレーザーとしては、窒素レーザー(337nm)、YAGレーザー3倍波(355nm)、NdYAGレーザー(256nm)、炭酸ガスレーザー(2940nm)等が挙げられるが、窒素レーザーが好ましい。イオンの分離検出方法は特に限定はなく、二重収束法、四重極集束法(四重極(Q)フィルター法)、タンデム型四重極(QQ)法、イオントラップ法、飛行時間(TOF)法等を用いて、イオン化した分子を質量/電荷比(m/z)に従って分離し検出する。好ましくは、QIT−TOFである。
【0090】
糖、タンパク質、ペプチド、糖タンパク質、糖ペプチド、核酸、糖脂質等の分子は、分子量や組成が同じ異性体を多く含むので、イオンの生成効率を向上させ、分子のフラグメント化をn回繰り返す方法(MSn法)が好ましい。本発明は、検出された「測定対象分子を含む試料とマトリックスの混合結晶」の部分に対し、フラグメント化をn回繰り返すMSn法(2≦n)を適用することが好ましい。MSn法により、例えば分子中の結合位置等を決定できる。
【0091】
<作用・原理>
本発明において、準安定結晶β晶の部分に優れたスイートスポットが存在する作用・原理は明確ではないが、以下のようにも考えられる。ただし、本発明は、以下の作用・原理の及ぶ範囲に限定されるものではない。
すなわち、スイートスポットとなる「測定対象分子を含む試料とマトリックスの混合結晶」の中では、測定対象分子が効率的に脱離・イオン化するために好ましい状態で取り込まれていると考えられる。特に、マトリックス結晶化の初期に結晶核ができる際に、マトリックス溶液の温度をより低く設定すると、マトリックス結晶核の生成が促進され、準安定結晶β晶が広範囲に一斉に結晶化し、スイートスポットの形成に好ましい影響を与えるためと考えられる。
【実施例】
【0092】
以下に、実施例及び比較例を挙げて本発明を更に具体的に説明するが、本発明は、その要旨を超えない限りこれらの実施例に限定されるものではない。
【0093】
参考例1
<プレート上で、23℃で乾燥、安定結晶α晶と準安定結晶β晶を検出>
まず、シリコン基板に金を蒸着させた金基板プレート(試料支持部材)に、測定対象分子である糖ペプチド1(化学構造を図1に示す)を水に溶解して、500fmol/μLにした水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。
【0094】
次に、誘導体化剤である標識試薬PDAM(1−pyrenyldiazomethan;Molecular Probes社製)をDMSO(dimethyl sulfoxide;SIGMA社製)に溶解させ、2nmol/μLにした溶液を0.25μL滴下し、ヒートブロック上で、80℃、大気圧下に放置し乾燥させた。プレート上の余剰誘導体化剤を除くため、トルエン(SIGMA社製)に浸し余剰のPDAMを除去し十分に乾燥させた。
【0095】
次に、高純度DHBA(Shimadzu Biotech社製)を水に溶解して10mg/mLにした水溶液を0.75μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。この測定試料析出物の共焦点レーザー顕微鏡写真を図2に示す。
【0096】
このプレート(試料支持部材)上のDHBA結晶のラマンイメージング画像を取得するため、inViaラマンマイクロスコープ(株式会社レニショー社製)を用い、波長532nmの励起レーザー条件下でラマン測定を行った。
【0097】
上記「測定試料析出物」のラマンスペクトルについて、まず、多変量解析によってスペクトルのパターンを比較したところ、プレート(試料支持部材)上で析出したDHBAの結晶ごとに特有のラマンスペクトルが得られた。そして、「測定試料析出物」においては、独立行政法人産業技術総合研究所スペクトルデータベースに登録されているDHBAのラマンスペクトル(以下、「参照ラマンスペクトル」と記載する場合がある)と同一のラマンスペクトルが得られるα晶(「安定結晶α晶」ともいう)と、参照ラマンスペクトルとは異なるラマンスペクトルが得られるβ晶(「準安定結晶β晶」ともいう)の少なくとも2種類に分けられることが判明した。
【0098】
なお、マトリックスの再結晶精製された、測定対象分子が含まれない粉末(マトリックスの標準品)からは、参照ラマンスペクトルと同一のラマンスペクトルが得られる。測定試料析出物の安定結晶α晶と準安定結晶β晶から得られたラマンスペクトルを図3に示す。
【0099】
準安定結晶β晶のラマンスペクトルは、参照ラマンスペクトルで観測されていた1199cm−1付近、1307cm−1付近、376cm−1付近等の強いシグナルが消滅していた。逆に、3265cm−1付近にブロードなシグナルが観察された。
【0100】
上記「測定試料析出物」のDHBA結晶のうち、1199cm−1付近に強いシグナルをもつ安定結晶α晶を白く表し、1199cm−1付近に強いシグナルをもたない準安定結晶β晶を黒く表したラマンイメージング画像を図4に示す。すなわち、図4において、白く表された結晶は、参照ラマンスペクトルと同じラマンスペクトルが得られた安定結晶α晶であり、黒く表された結晶は、参照ラマンスペクトルとは異なるラマンスペクトル(図3(b))が得られた準安定結晶β晶である。
【0101】
上記「測定試料析出物」について、MALDI質量分析法によってマススペクトルを取得した。測定は、質量分析計としてMALDI−QIT−TOF型質量分析計(AXIMA−QIT、Shimadzu Biotech社製)を用いて行った。測定は正イオンモードで行い、上記「測定試料析出物」の全域に対して、レーザーパワーを測定対象分子のイオンのシグナルがではじめる閾値に最適化した後、40μm間隔でレーザー照射を行い、自動で測定した。
【0102】
その結果、図2に示した「結晶があるところ全て」からシグナルが検出できるわけではなく、白く表されず黒く表された(1199cm−1付近に強いシグナルを有しない)準安定結晶β晶からのみから強いシグナルを検出することができた。また、準安定結晶β晶の円周上の根元から特に強いシグナルを検出することができた。
【0103】
一方、白く表された(1199cm−1付近に強いシグナルを有する)安定結晶α晶内のどこからも強いシグナルを検出することができなかった。すなわち、参照ラマンスペクトルと同一のラマンスペクトルを示す安定結晶α晶の部分にはスイートスポットがなかった。
【0104】
準安定結晶β晶の円周上の根元から得られたマススペクトルを図5に示す。図6に示すように、良好なMSシグナルが得られる測定点(スイートスポット)はβ晶に存在することが判明し、この結晶からは、極めて良好なマススペクトルを得ることができた。
【0105】
更に、図4と図6を比較すると、ラマンイメージング画像とスイートスポットの位置の相関がより明白になった。すなわち、図4で黒く表示されている、参照ラマンスペクトルとは異なるラマンスペクトルを生ずる準安定結晶β晶の根元(結晶化の起点部位)では、参照ラマンスペクトルと同じラマンスペクトルを生じる安定結晶α晶(白く表示されている)と比べて格段にイオン生成量が高く、優れたスイートスポットとなっていることが示された。
【0106】
実施例1
<密閉容器内で、4℃で析出、準安定結晶β晶であることを確認>
高純度マトリックスDHBA(LaserBio Labs製)200mgにアセトニトリルを3mL加え、50℃に加熱し溶解させた。不溶物質を熱時濾去した後、溶液を密閉容器に入れ4℃に冷却し、30分間静置した後、析出した針状の白色結晶を濾取し、アセトニトリルにより洗浄した。室温下で乾燥し、結晶性物質を得た。
【0107】
得られた試料の結晶構造を評価するため、針状結晶の複数点について顕微ラマン分光分析を行った。測定には、KAISER SYSTEM社製HoloLab SERIES 5000型顕微ラマン分光分析装置を用い、レーザー波長532nm、レーザー強度50mWで測定を行った。この結晶性試料の顕微ラマンスペクトルを図7に示す。図7に示すように、上記の方法により得られた針状結晶は、参考例1で得られた準安定結晶β晶のラマンスペクトル(図3(b))と非常に良く一致し、C=O及びC=C伸縮振動由来の1325cm−1付近のシグナルが非常に強く観測される特徴があり、また、3261cm−1付近にブロードシグナルを示すことが分かった。このスペクトルは、参照ラマンスペクトルとは異なり、1199cm−1付近の強いシグナルを有していなかった。
【0108】
図7に示すこの結晶のラマンスペクトルは、下記に記述する参考例2の結晶と非常に良い一致が認められた。従って、実施例1において得られた針状結晶の多形は、参考例2で得られた針状結晶と同一の結晶構造を有する準安定結晶β晶である。
なお、試料支持部材上でも、温度条件を同じにすれば、密閉容器内と同様の結晶構造が得られ易いと考えられる。
【0109】
参考例2
<密閉容器内で、4℃で析出、準安定結晶β晶であることを確認>
高純度マトリックスDHBA(LaserBio Labs製)200mgにクロロホルムとアセトンを体積比3:1で混合させた溶媒6mLを加え、50℃に加熱し溶解させた。不溶物質を熱時濾去した後、溶液を密閉容器に入れ4℃に冷却し、30分間静置した後、析出した針状の白色結晶を濾取し、母液と同一の組成の溶媒により洗浄した。室温下で乾燥し、針状の結晶性物質を得た。
【0110】
この結晶性試料が示すラマンスペクトルを評価するため、実施例1と同様の方法により、顕微ラマン分光分析を行った。得られたラマンシフトの測定結果を図8に示す。図8に示すように、上記の方法により得られた針状結晶は、実施例1で得られた結晶と同様に1325cm−1付近のシグナルが非常に強く観測される特徴があり、また、3261cm−1付近にブロードシグナルを示すことがわかった。
【0111】
得られた結晶性試料の結晶構造を評価するため、CuKα線を用いた粉末X線回折を測定した。
粉末X線回折測定装置には、島津製作所製 XRD−6100を使用し、X線源としてはCuKα線を用い、以下の測定条件で実施した。
ステップ幅:0.02deg
スキャンスピード:2.0deg/min
加速電圧:40kV
加速電流:40mA
走査範囲:5〜50deg
【0112】
この結晶性試料の粉末X線回折図を図9に示す。図9に示すように、この結晶の回折角度(2θ)は、特徴的に、約11.0度、16.0度、17.5度、24.8度、28.3度、及び31.2度にピークを有していた。なお、ケンブリッジデータベースには、前記非特許文献3に「Disordered」と示されるDHBA結晶の多形体が登録されており(CCDC No.BESKAL01)、その理論構造より粉末X線をシミュレートした結果と非常に良い一致が認められた。
【0113】
従って、参考例2において得られた針状結晶は、前記非特許文献3に「Disordered」と示される結晶構造であり、この針状結晶は、参照スペクトルにおける1900cm−1付近の強いシグナルを示さないことが判明した。
よって、前記「準安定結晶β晶」は、非特許文献3に「Disordered」と示される結晶構造を有するものである。
【0114】
更に、実施例1において得られたラマンスペクトルは、参考例2において得られたラマンスペクトルと一致したことから、実施例1の手法により得られた針状結晶は、非特許文献3に「Disordered」と示される準安定結晶β晶であることが判明した。
【0115】
比較例1
<密閉容器内で、25℃で析出、安定結晶α晶であることを確認>
高純度マトリックスDHBA(LaserBio Labs製)200mgにアセトニトリルを3mL加え、50℃に加熱し溶解させた。不溶物質を熱時濾去した後、溶液を密閉容器に入れ室温下の25℃にて一昼夜静置し、析出した板状の白色結晶を濾取し、アセトニトリルにより洗浄した。室温下で乾燥し、結晶性物質を得た。
【0116】
次に、実施例1と同様の方法により顕微ラマン分光分析を行った。ラマンシフトの測定結果を図10に示す。図10に示すように、上記の方法により得られた板状結晶は、1199cm−1付近に強いシグナルを示し、参照ラマンスペクトルと良い一致を示し、実施例1及び参考例2で得られた準安定結晶β晶の測定結果とは異なるラマンスペクトルを示した。
【0117】
比較例1で得られた結晶性試料の結晶構造を評価するため、参考例2と同様の方法により粉末X線回折を測定した。この結晶の粉末X線回折図を図11に示す。
【0118】
図11に示すように、この結晶の回折角度(2θ)は、特徴的に約16.3度、19.8度、23.8度、27.3度、31.3度、及び37.0度にピークを有しており、参考例2で得られた結晶の粉末X線回折図(図9)とは異なる特徴を示した。
【0119】
なお、ケンブリッジデータベースに、前記非特許文献1にOrderedと示されるDHBA結晶の多形体が登録されており(CCDC No.BESKAL)、その理論構造より粉末X線をシミュレートした結果と非常に良い一致が認められた。従って、比較例1で得られた結晶は、前記非特許文献1にOrderedと示される結晶構造であることが確認された。
よって、前記「安定結晶α晶」は、非特許文献1に「Ordered」と示される結晶構造を有するものである。
【0120】
実施例1及び比較例1の結果から、溶媒としてアセトニトリルを用いたDHBAの結晶化に関して、冷却を行って短時間で析出させた場合にはDisordered(準安定結晶β晶)の結晶形となり(実施例1)、室温以上の温度で比較的時間をかけて結晶化させた場合にはOrdered(安定結晶α晶)の結晶形が得られる(比較例1)ことが判明した。
試料支持部材上でも、温度条件を同じにすれば、密閉容器内と同様の結晶構造が得られ易いと考えられる。
【0121】
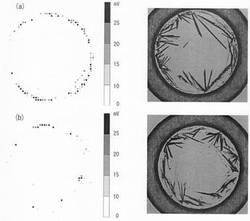
実施例2
<プレート上で、15℃で乾燥、準安定結晶β晶を優先的に調製>
まず、質量分析用プレート(試料支持部材)に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。
【0122】
次に、誘導体化剤である標識試薬PDAM(1−pyrenyldiazomethan;Molecular Probes社製)をDMSO(dimethyl sulfoxide;SIGMA社製)に溶解させ、10nmol/μLにした溶液を0.25μL滴下し、ヒートブロック上で、80℃、大気圧下に放置し乾燥させた。余剰の誘導体化剤を除くため、キシレン(SIGMA社製)に浸し余剰のPDAMを除去し十分に乾燥させた。
【0123】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLにした水溶液を4℃に冷却し、そのうち1.00μLをマトリックスとしてあらかじめ15℃に設定したプレートに滴下した。次に、プレートの温度を15℃に保ちながら大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。すなわちこの条件は、プレートとマトリックス溶液の温度をより低温にすることで、準安定結晶β晶を有利に作製する条件に対応する。乾燥した環境下であれば、より低温に冷却する方がよいが、プレートが結露を起こす温度以下に冷却しないことが好ましい。
【0124】
この測定試料について、MALDI質量分析法によってマススペクトルを取得した。測定は、質量分析計としてMALDI−QIT−TOF型質量分析計(AXIMA−QIT、Shimadzu Biotech社製)を用い、正イオンモードで行った。また、測定試料の全域に対して、レーザーパワーを測定対象分子のイオンのシグナルがではじめる閾値に最適化した後、50μm間隔でレーザー照射を行い、自動測定した。
【0125】
得られたマススペクトルを図12(a)に示し、図13(a)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。更に、図13(a)に示したシグナル強度を5段階で評価し、上位4段階に該当するシグナルの検出ポイント数を集計して表1に示した。
【0126】
【表1】

【0127】
比較例2
<プレート上で、23℃で乾燥、安定結晶α晶と準安定結晶β晶を検出>
実施例2と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、PDAMによる誘導体化を行った後、キシレン(SIGMA社製)に浸し余剰のPDAMを除去し十分に乾燥させた。DHBA溶液を滴下するまでは、実施例2と同様の操作を行った。
【0128】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を1.00μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0129】
この測定試料について、実施例2と同様のMALDI質量分析法によってマススペクトルを取得した。測定は、質量分析計としてMALDI−QIT−TOF型質量分析計(AXIMA−QIT、Shimadzu Biotech社製)を用いて行った。測定は正イオンモードで行った。測定試料の全域に対して、レーザーパワーを測定対象分子のイオンのシグナルが出始める閾値に最適化した後、50μm間隔でレーザー照射を行い、自動測定した。
【0130】
得られたマススペクトルを図12(b)に示し、図13(b)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。更に、図13(b)に示したシグナル強度を5段階で評価し、上位4段階に該当するシグナルの検出ポイント数を集計して表2に示した。
【0131】
【表2】

【0132】
<実施例2と比較例2の結果>
図12(a)と(b)のマススペクトルを比較すると、測定対象分子のシグナル強度は明らかに図12(a)の方が2倍程度高く良好である。更に、図13(a)と(b)を比較すると、何れの場合においても、円周上の根元からシグナルが得られる傾向があるが、明らかに図13(a)の方が検出されたポイント数が多かった。すなわち、実施例2で作製した測定試料は円周上にある大部分の結晶から良好なシグナルが得られるが、比較例2で作製した測定試料は、結晶のごく一部からしかシグナルが生じていなかった。
【0133】
更に、表1と表2を比較すると、測定試料の全体で検出されたポイント数は実施例2(表1)の場合に、比較例2(表2)の場合に比べて約3倍多く、強度の高いシグナルも多くの測定点で得られることも明白である。
【0134】
比較例3
<プレート上で、25℃で乾燥、安定結晶α晶を優先的に調製>
実施例2と同様に測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、PDAMによる誘導体化を行った後、キシレン(SIGMA社製)に浸し余剰のPDAMを除去し十分に乾燥させた。DHBA溶液を滴下するまでは、実施例2と同様の操作を行った。
【0135】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液(40℃)のうち1.00μLをマトリックスとしてプレートに滴下した。次に、プレートを室温(25℃)中、大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。すなわちこの条件は、比較例1の安定結晶α晶を有利に形成する条件に対応する。
【0136】
この測定試料について、実施例2と同様のMALDI質量分析法によってマススペクトルを取得したところ、比較例2と類似の結果であった。測定は、質量分析計としてMALDI−QIT−TOF型質量分析計(AXIMA−QIT、Shimadzu Biotech社製)を用いて行った。測定は正イオンモードで行った。測定試料の全域に対して、レーザーパワーを測定対象分子のイオンのシグナルが出始める閾値に最適化した後、50μm間隔でレーザー照射を行い、自動測定した。
【0137】
図14には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。図14に示すように、40℃程度に加熱したマトリックス溶液をプレート上に滴下した場合、溶媒の蒸発速度が速いために液滴の均一な円形が保持されず、溶媒の蒸発に偏りが生じた。そのため、円周上以外の場所がDHBAの結晶化の起点となり、マトリックス結晶の形に再現性がなかった。
【0138】
更に、得られたマススペクトルのシグナル強度は比較例2と同じであった。図14に示したシグナル強度を実施例2と同様の方法で5段階評価し、上位4段階に該当するシグナルのポイント数を集計した結果についても、比較例2と類似の結果であった。
【0139】
実施例3
<PDAMラベルあり/プレート冷却/マトリックス溶液冷却>
まず、質量分析用プレート(試料支持部材)に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。
【0140】
次に、誘導体化剤である標識試薬PDAM(1−pyrenyldiazomethan;Molecular Probes社製)をDMSO(dimethyl sulfoxide;SIGMA社製)に溶解させ、10nmol/μLにした溶液を0.25μL滴下し、ヒートブロック上で、70℃、大気圧下に放置し乾燥させた。余剰の誘導体化剤を除くため、キシレン(SIGMA社製)に浸し余剰のPDAMを除去し十分に乾燥させた。
【0141】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLにした水溶液を4℃に冷却し、そのうち1μLをマトリックスとしてあらかじめ15℃に設定したプレートに滴下した。次に、プレートの温度を15℃以下に保ちながら大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。すなわちこの条件は、プレートとマトリックス溶液の温度をより低温にすることで、準安定結晶β晶を有利に作製する条件に対応する。乾燥した環境下であれば、より低温に冷却する方がよいが、プレートが結露を起こす温度以下に冷却しないことが好ましい。
【0142】
この測定試料について、実施例1と同様のMALDI質量分析法によってマススペクトルを取得した。
【0143】
得られたマススペクトルを図15(a)に示し、図17(a)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0144】
比較例4
<PDAMラベルあり/プレート室温/マトリックス溶液室温>
実施例2と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、標識試薬PDAMを用いて反応させ、洗浄を行った。DHBA溶液を滴下するまでは、実施例3と同様の操作を行った。
【0145】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0146】
この測定試料について、実施例3と同様のMALDI質量分析法によってマススペクトルを取得した。
【0147】
得られたマススペクトルを図15(b)に示し、図17(b)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0148】
<実施例3と比較例4の結果>
図15(a)と図15(b)のマススペクトルを比較すると、測定対象分子のシグナル強度は明らかに図15(a)の方が3倍程度高く良好である。更に、図17(a)と図17(b)を比較すると、何れの場合においても、試料支持部材の円周に沿って結晶の根元部分からシグナルが得られる傾向があるが、図17(a)の場合には明らかに検出ポイント数が多かった。すなわち、実施例3で作製した測定試料は、良好なシグナルが得られる大半の結晶の根元部分が試料支持部材の円周に沿って形成されており、該結晶部分にレーザー照射することによっても短時間で良好なシグナルが得られたが、比較例4で作製した測定試料の場合には、結晶のふちの部分にレーザー照射しても良好なシグナルを得ることは難しかった。
【0149】
実施例4
<PDAMラベルあり/プレート冷却/マトリックス溶液室温>
実施例3と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、標識試薬PDAMを用いて反応させ、洗浄を行った。DHBA溶液を滴下するまでは、実施例3と同様の操作を行った。
【0150】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLにした室温の水溶液1μLをマトリックスとしてあらかじめ15℃に設定したプレートに滴下した。次に、プレートの温度を15℃以下に保ちながら大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。
【0151】
この測定試料について、実施例3と同様のMALDI質量分析法によってマススペクトルを取得した。
【0152】
得られたマススペクトルを図16(c)に示し、図18(c)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0153】
実施例5
<PDAMラベルあり/プレート室温/マトリックス溶液冷却>
実施例3と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、標識試薬PDAMを用いて反応させ、洗浄を行った。DHBA溶液を滴下するまでは、実施例3と同様の操作を行った。
【0154】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を零下20℃程度に冷却した後、室温に保ったプレートに1μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0155】
この測定試料について、実施例3と同様のMALDI質量分析法によってマススペクトルを取得した。
【0156】
得られたマススペクトルを図16(d)に示し、図18(d)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0157】
<実施例4と実施例5の結果>
図16(c)及び図16(d)のマススペクトルを図15(a)及び図15(b)と比較すると、測定対象分子のシグナル強度は、図15(a)>図16(c)>図16(d)>図15(b)の順に高く良好である。また、図17及び図18の(a)〜(d)を比較すると、スイートスポットの数は、図17(a)>図18(c)>図18(d)>図17(b)の順に多かった。すなわち、実施例4及び5で作製した測定試料は、プレートあるいはマトリックス溶液の一方のみを冷却することによって、双方を冷却したとき程の効果はないが、通常の室温下で試料を調製するときよりは良好なシグナルが得られる。
【0158】
実施例3と比較例4においては、何れも、測定対象分子である糖ペプチドを誘導体化剤であるPDAMにより標識してから測定したが、実施例3と比較例4における温度の違いによる結果の差は、PDAMによる標識の有無には関わらず観測された。すなわち、誘導体化剤(標識試薬)を使用しない場合においても、15℃に設定してDHBAを結晶化させた場合には、23℃に設定してDHBAを結晶化させた場合と比較して、MSシグナル強度は2倍以上に向上した。
【0159】
実施例6
<プレート冷却/マトリックス溶液冷却>
まず、質量分析用プレート(試料支持部材)(島津製作所製、384ウェルサンプルプレート)に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。
【0160】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLにした水溶液を冷蔵庫で4℃に保冷し、そのうち1μLをマトリックスとして、あらかじめ15℃に設定したプレートに滴下した。次に、プレートの温度を15℃以下に保ちながら大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。すなわちこの条件は、プレートとマトリックス溶液の温度をより低温にすることで、準安定結晶β晶を有利に作製する条件に対応する。乾燥した環境下であれば、より低温に冷却する方がよいが、プレートが結露を起こす温度以下に冷却しないことが好ましい。
【0161】
この測定試料について、MALDI質量分析法によってマススペクトルを取得した。測定は、質量分析計としてMALDI−QIT−TOF型質量分析計(AXIMA−QIT、Shimadzu Biotech社製)を用い、正イオンモードで行った。また、測定試料の全域に対して、レーザーパワーを測定対象分子のイオンのシグナルがではじめる閾値に最適化した後、50μm間隔でレーザー照射し、測定試料の全体を自動測定した。
【0162】
得られたマススペクトルを図19(a)に示し、図20(a)には測定試料において糖ペプチドイオンのシグナルが顕著に検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。更に、図20(a)に示したシグナル強度を5段階で評価し、上位4段階に該当するシグナルの検出ポイント数を集計して表3に示した。
【0163】
【表3】

【0164】
比較例5
<プレート室温/マトリックス溶液室温>
実施例6と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させた。DHBA溶液を滴下するまでは、実施例6と同様の操作を行った。
【0165】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0166】
この測定試料について、実施例6と同様のMALDI質量分析法によってマススペクトルを取得した。
【0167】
得られたマススペクトルを図19(b)に示し、図20(b)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。更に、図20(b)に示したシグナル強度を5段階で評価し、上位4段階に該当するシグナルの検出ポイント数を集計して表4に示した。
【0168】
【表4】

【0169】
<実施例6と比較例5の結果>
図19(a)と図19(b)のマススペクトルを比較すると、測定対象分子のシグナル強度は明らかに図19(a)の方が2倍程度高く良好である。更に、図20(a)と図20(b)を比較すると、何れの場合においても、結晶の根元部分から良好なシグナルが得られる傾向があるが、明らかに図20(a)の方が検出されたポイント数が多かった。すなわち、実施例6で作製した測定試料は、大半の結晶の根元部分から良好なシグナルが得られるが、比較例5で作製した測定試料の場合には、一部の結晶の根元部分からしかシグナルが生じていなかった。また自動分析により得られたマススペクトルの検出限界をS/N>3とした場合、実施例6の図20(a)では、10fmolの測定試料まで検出可能であったが、比較例5の図20(b)では50fmolを検出することができなかった。
【0170】
更に、表3と表4を比較すると、測定試料の全体で検出されたポイント数は実施例6(表3)の場合に、比較例5(表4)の場合に比べて約2倍多く、強度の高いシグナルも約2倍多くの測定点で得られることも明白である。
【0171】
実施例7
<ウェル境界のないプレート/PDAMラベルあり/プレート冷却/マトリックス溶液冷却>
まず、質量分析用プレート(試料支持部材)のウェル境界のない平らな面に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、標識試薬PDAMを用いて反応させ、洗浄を行った。DHBA溶液を滴下するまでは、実施例3と同様の操作を行った。
【0172】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLにした水溶液を4℃に冷却し、そのうち1μLをマトリックスとしてあらかじめ15℃に設定したプレートに滴下した。次に、プレートの温度を15℃以下に保ちながら大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。すなわちこの条件は、プレートとマトリックス溶液の温度をより低温にすることで、準安定結晶β晶を有利に作製する条件に対応する。乾燥した環境下であれば、より低温に冷却する方がよいが、プレートが結露を起こす温度以下に冷却しないことが好ましい。
【0173】
この測定試料について、実施例3と同様のMALDI質量分析法によってマススペクトルを取得した。
【0174】
得られたマススペクトルを図21(a)に示し、図22(a)には、自動分析において検出された糖ペプチドイオンのシグナル位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0175】
比較例6
<境界のないプレート/PDAMラベルあり/プレート室温/マトリックス溶液室温>
実施例7と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を質量分析用プレート(試料支持部材)の境界のない平らな面に1μL滴下し、乾燥させ、標識試薬PDAMを用いて反応させ、洗浄を行った。DHBA溶液を滴下するまでは、実施例7と同様の操作を行った。
【0176】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0177】
この測定試料について、実施例1と同様のMALDI質量分析法によってマススペクトルを取得した。
【0178】
得られたマススペクトルを図21(b)に示し、図22(b)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0179】
<実施例7と比較例6の結果>
図21(a)と図21(b)のマススペクトルを比較すると、測定対象分子のシグナル強度は明らかに図21(a)の方が2倍程度高く良好である。更に、図22(a)と図22(b)を比較すると、何れの場合においても、結晶の根元部分からシグナルが得られる傾向があるが、図22(a)の場合には明らかに検出されたスイートスポットの数が多かった。すなわち、実施例7で作製した測定試料は、マトリックスの結晶化の際のプレート温度を15℃に設定することにより、混合結晶の形成位置を制御した結果、結晶のふちの位置でのスイートスポット数が増えた。実施例3と実施例7を比較すると、このマトリックス結晶のスイートスポット形成に対する効果は、支持部材とマトリックス溶液の温度を室温より低い温度に制御したことによるものであり、プレート上の突起などの物理的な境界とは無関係であることが明らかである。
【0180】
実施例8
<ペプチド混合物/プレート冷却/マトリックス溶液冷却>
まず、20μgの牛血清アルブミン(Sigma−Aldrich社製)に、界面活性剤としてSodium 3−{(2−methyl−2−undecyl−1,3−dioxolan−4−yl)methoxy}−1−propanesulfonate(RapiGest SF(waters社製))を最終濃度が0.1%となるように加え、100℃で5分間加熱した。冷却後、10mmol/L重炭酸アンモニウムと10mmol/Lジチオトレイトールを含む水溶液に溶解し、55℃で45分間インキュベートした。
反応後、135mmol/Lのヨードアセトアミドを5μL加え、暗所で45分間静置した。次に、1μgのトリプシンを加え、37℃で一晩反応させた。
【0181】
反応後の溶液にセルロース粉末を加え、吸着、溶出操作を行って濃縮精製した後、得られた溶液を質量分析用プレート(試料支持部材)に1μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。
【0182】
この測定試料について、実施例1と同様の操作により結晶化を行い、MALDI質量分析法によって正イオンモードのマススペクトルを取得した。
【0183】
図23(a)には、自動分析において検出されたペプチドイオンのシグナルのうち、高い値を示した約25点の位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0184】
比較例7
<ペプチド混合物/プレート室温/マトリックス溶液室温>
実施例8と同様に、測定対象分子であるペプチド混合物を水に溶解して、質量分析用プレートに1μL滴下し、乾燥させた。DHBA溶液を滴下するまでは、実施例8と同様の操作を行った。
【0185】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0186】
この測定試料について、実施例8と同様のMALDI質量分析法によってマススペクトルを取得した。
【0187】
図23(b)には、自動分析において検出されたペプチドイオンのシグナルのうち、高い値を示した約25点の位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0188】
<実施例8と比較例7の結果>
図23(a)と図23(b)を比較すると、図23(a)の場合には、明らかに、検出されたスイートスポットはマトリックス結晶のふちにそって分布している。すなわち、実施例8で作製した測定試料は、マトリックスの結晶化の際のプレート温度を15℃に設定することにより、すべてのペプチドのスイートスポットが均一に位置した。従って、マトリックス結晶のふちにそってレーザーを照射すれば、容易にすべてのペプチドのスイートスポットを同時に検出することができ、効率よくMSスペクトルを取得することができる。
一方、比較例7では、各ペプチドのスイートスポットは、必ずしもマトリックス結晶のふちに存在しているとは限らず、またペプチドの種類によって分布が異なるため、スイートスポットをあらかじめ見極めることは難しく、質の高いMSスペクトルを取得するためには測定試料全体を測定する必要がある。
【0189】
<実施例、比較例、参考例のまとめ>
従って、本発明では、MALDI質量分析法の試料調製において、良好なMSスペクトルを得るためには測定試料中に多数のスイートスポットとなるマトリックスの結晶多形を形成させることが効果的であり、マトリックス結晶がスイートスポットとなるかならないかの違いは、マトリックスの結晶多形の違いに依存し、更にマトリックス溶液の溶媒を迅速に乾燥させるよりは、プレートと溶液の温度を低温にする方法が、スイートスポットの形成に関して最も有効であることが明らかとなった。
【産業上の利用可能性】
【0190】
本発明の、測定対象分子を含む試料とマトリックスの混合結晶を析出させ、該混合結晶のうちの特定の多形構造を利用してイオン化効率を高めるMALDI質量分析法用測定試料調製方法は、短時間で効率良く質の高いMSスペクトルを得ることが可能であり、構造同定で必要な高感度MSn(2≦n)解析を可能にし、更には自動分析への応用が可能となるので、MSスペクトルを使用する全ての分析分野に、特に、微量試料しか入手できない場合がある生体分析の分野等に広く利用されるものである。
【技術分野】
【0001】
本発明は、MALDI質量分析法において、イオン化効率を高め、高感度にシグナルを検出できるMALDI質量分析法用測定試料調製方法、及び、該測定試料調製方法を使用して調製されたMALDI質量分析法用測定試料を用いるMALDI質量分析法に関するものである。
【背景技術】
【0002】
「質量分析(mass spectrometry)(以下、「MS」と略記することがある)法」とは、測定対象分子を含む試料をイオン化し、測定対象分子由来のイオンを質量電荷比(質量/電荷(m/z))によって分離し検出することによって、その測定対象分子の化学構造に関する情報を得る方法である。
【0003】
MSにおいて、試料のイオン化は、分析の可否や得られるスペクトルの質を左右する重要な過程であり、試料を効率よくイオンにするためにこれまで多くのイオン化法が開発されてきた。現在のところ、生体高分子のイオン化には、ソフトイオン化であるマトリックス支援レーザー脱離イオン化(matrix−assisted laser desorption/ionization)(以下、「MALDI」と略記することがある)法やエレクトロスプレーイオン化(electrospray ionization)(以下、「ESI」と略記することがある)法が主に用いられている。これらのイオン化法を用いた質量分析計は、NMR等に比べて測定試料量が少なくても測定が可能であることから、バイオ分野でも広く用いられている。
【0004】
MALDIでは、マトリックスと呼ばれる光吸収を持つ物質の中に、測定対象となる分子(例えば、タンパク質、ペプチド、糖類等がある)を分散させ、そこにパルスレーザーを照射することでマトリックスと共に測定対象となる分子をイオン化する技術である。
【0005】
使用するレーザーの波長は紫外領域の波長を有する場合が多く、赤外領域の波長を使用する場合もあるが、マトリックスの光吸収特性に合わせたレーザーを用いるのが一般的である。現在、最も多用されるレーザーは窒素レーザーであり、波長337nmを有する。
【0006】
一方、使用するマトリックスの選択が分析の成否を決めるため、これまでに多くのマトリックスが開発され、実際にMALDIに用いられてきた。一般的に、マトリックスは結晶性の有機分子であり、分析試料との共結晶を生成した上で、上記パルスレーザーを照射しイオン化する。近年は様々な液体マトリックスも開発されてきており、測定対象の試料に応じ様々な選択肢がある。
【0007】
実際に用いられているマトリックスの中でも汎用性があり、標準的なマトリックスは、CHCA(α−cyano−hydroxycinnamic acid)、SA(sinapic acid)、DHBA(2,5−dihydroxybenzoic acid)等であり、特にDHBAは、低分子量有機化合物、ペプチド、糖類、タンパク質等のイオン化に適する優れたマトリックスである。
【0008】
一般に、マトリックスと試料は良く混ざり、混合結晶又は混合物となる必要があると考えられている。この試料とマトリックスの混合結晶又は混合物の善し悪しが感度及びスペクトルの質に影響を与える。更に、一見同質の混合物に見えても実際には不均一で、特に固体結晶の場合には、結晶が生成した場所すべてから測定対象分子由来のイオンが得られるわけではなく、生成した結晶のごく一部分にレーザーを照射した場合のみ測定対象分子由来のイオンが得られる。
【0009】
この部分は、「スイートスポット(sweet spot)」と呼ばれ、MALDI質量分析法により、特に自動分析において質の高いマススペクトルを得るためには、対象の測定試料中にスイートスポットを多数作製することが効果的である。
【0010】
特に、DHBAは0.1〜1.5mm程度の比較的大きな針状の結晶を生成するが、スイートスポットとそうでない場所でのイオン生成量の差が著しく異なる。結晶サイズの不均一性がこの現象の大きな原因であると考えられており、これを示した例として、非特許文献1や非特許文献2がある。
【0011】
例えば、DHBAは2種類の結晶多形を持つことが知られており、それぞれの結晶は異なる融点を持つと報告されている。これを示した例として、非特許文献3及び非特許文献4がある。非特許文献3によると、2種類の多形は、それぞれ異なる溶媒を用いて作製されており、溶媒として水を用いた場合には安定型のOrderedが生成し、アセトンとクロロホルムの体積比1:3の混合溶媒からは準安定型のDisorderedが生成すると報告されている。
【0012】
また、独立行政法人産業技術総合研究所の有機化合物のスペクトルデータベースには、結晶多形については特に指定していないが、DHBAのラマンスペクトルとIRスペクトルが掲載されている。しかしながら、MALDIにおける標準的な試料調製法の条件下で生成するマトリックスの結晶多形については、詳細に研究されたことがなかったばかりでなく、結晶多形とMALDIにおけるシグナル強度の関係、結晶構造とスイートスポットの関係等については全く知られていなかった。
【0013】
更に、DHBAは、糖鎖や糖ペプチドの測定に汎用されるが、糖鎖や比較的親水性の糖ペプチドはイオン化効率が悪いので、質の高い良いマススペクトルを得るには、試料が消費されるプレスキャンや経験によって手動でスイートスポットを探し出し、レーザー照射を行うといった時間のかかる作業が必要となり、特に測定試料全体の自動分析には適さないのが現状であった。
【0014】
この問題の解決には、マトリックス溶液を迅速に乾燥させる等して、強制的に微結晶を生成させ、スイートスポットとなり得る領域を限定する手法や(非特許文献5)、結晶化しない液体マトリックスを使用する手法があるが、イオン生成量の低下を招いたり、夾雑塩等の付加イオンの生成を促進したりする場合があり、測定試料のスイートスポットの高いイオン生成量をそのまま活用できる手法ではなかった。液体マトリックスにおいても、固体マトリックスほどのばらつきはないが、夾雑塩等の影響でスペクトルの再現性が劣る場合もあり、根本的な解決にはならなかった。
【0015】
また、DHBAを結晶化した後、表面を打破することによって物理的な凹凸を軽減する方法が、非特許文献6に記載されている。非特許文献6には、結晶化を冷蔵庫内で行った後、生成した結晶を打破すると、高いシグナルが得られるという記載もあるが、冷蔵庫内でマトリックスを結晶化したことによる効果の詳細は明らかではない。また、結晶を破壊することで、多形構造が変化したり、作製した測定試料中でのスイートスポットが不明確になったりする問題点がある。従って、スイートスポットを結晶の生成時に再現性よく局在化させ、質の良いマススペクトルを効率良く取得することを目的とした本発明とは趣旨が異なる。
【0016】
また、スイートスポットの形成を制御する目的でいくつかの技術が開発されており、例として特許文献1や特許文献2があるが、これらの技術の実行には、専用の装置や試料支持部材が必要である。また、これらの技術は、できるだけ狭小領域に試料を濃縮するという発想に基づいており、マトリックスの結晶化条件を工夫することで、特別な器具、装置、試料支持部材等を使用することなく、スイートスポットとなる結晶をより多く、広範囲に形成させる、又は、再現性良く形成させるという本発明とは根本的に異なるものであった。
【先行技術文献】
【特許文献】
【0017】
【特許文献1】特開2003−098115号公報
【特許文献2】特開2003−098149号公報
【非特許文献】
【0018】
【非特許文献1】Revecca W. et al., Anal. Chem. 72(18), 30-36 (2000)
【非特許文献2】Luxembourg S.L. et al., Anal. Chem. 75(10), 2333-2341 (2003)
【非特許文献3】Haisa M. et al., Acta. Cryst. B38, 1480-1485(1982)
【非特許文献4】Cohen D.E. et al., Crystal Growth & Design 7(3), 492-495(2007)
【非特許文献5】WilliamsT.I. et al., Rapid Commun. Mass Spectrom. 21, 807-811(2007)
【非特許文献6】Allwood D.A. et al., Appl. Surf. Sci.103(3), 231-244 (1996)
【発明の概要】
【発明が解決しようとする課題】
【0019】
本発明は上記背景技術に鑑みてなされたものであり、その課題は、MALDI質量分析法において、高いイオン生成量を有する測定試料を調製することであり、短時間で効率良く質の高いMSスペクトルを得ることのできるMALDI質量分析法用の測定試料を調製する方法を提供することにある。
【0020】
また、構造同定に必要な高感度MSn(2≦n)解析が可能となり、また、自動分析への応用が可能となり、高スループットのMALDI質量分析法の実現が可能になる方法を提供することにある。
【課題を解決するための手段】
【0021】
本発明者は、マトリックス単独の結晶構造について、分光学的手法及び熱分析法を用いて解析するとともに、試料支持部材上の結晶について局所的な分析を行った結果、意外にも、試料支持部材上に作製したDHBAマトリックス結晶には、マトリックスの再結晶精製されたマトリックスの標準品(独立行政法人産業技術総合研究所の有機化合物のスペクトルデータベースにあるもの)とは異なる物理化学的性質を示す結晶構造が混在していることを発見した。
【0022】
更に、測定試料とマトリックスの混合結晶において、高いイオン生成量を有するスイートスポットを創出する該混合結晶の部分とスイートスポットにならない該混合結晶の部分との違いは、マトリックスの結晶構造の違いに依存し、スイートスポットを創出する該混合結晶の部分は、マトリックスの標準品独立行政法人産業技術総合研究所の有機化合物のスペクトルデータベースにあるもの)とは異なる物理化学的性質を示す結晶構造であると同定した。
【0023】
このことから、スイートスポットを創出する、すなわちスイートスポットとなり得る該混合結晶の形成と、スイートスポットにならない該混合結晶の形成を制御するため、マトリックスの結晶化条件を最適化することにより、質の高いMSスペクトルを与える測定試料の作製が可能になるかもしれないと着想して、鋭意検討を重ねた結果、上記の課題を解決できることを見出した。
【0024】
すなわち、マトリックス結晶の多形構造は、測定試料の調製時の溶媒除去の際の、又は結晶を析出させる際の温度条件等の設定で容易に形成することが可能であり、更には、温度条件のみの設定でスイートスポットとなり得る該混合結晶の位置を明確に制御可能であることを初めて見出し、本発明を完成するに至った。そして、マトリックス溶液の調製に常用されるアセトニトリル及び/又は水を溶媒として使用した場合において、特に温度条件の設定で、差別的に特定の多形構造が形成されること見出し、本発明を完成するに至った。なお、非特許文献3において使用しているアセトン及びクロロホルムは、測定対象分子が溶解しない場合が多いため、MALDI質量分析法におけるマトリックス溶液の溶媒としては適当でない。
【0025】
通常、糖ペプチド等の測定対象分子の溶解度は、溶液の温度の低下と共に低下するため、マトリックス溶液や試料支持部材を冷却することは、マトリックス結晶と測定対象分子の混和性を低下させ、混合結晶の不均一性を増大させ、スイートスポットの形成に対しては一見不利であるようにも思われる。
しかし、意外にもマトリックス溶液の冷却によって該混合結晶の不均一性は増大せず、スイートスポットの形成を温度条件のみの設定で制御することが可能であり、スイートスポットの形成を制御することで、プレスキャンをしなくても、マニュアル測定であっても、質の高いマススペクトルを取得することが可能となることを見出して本発明に至った。
【0026】
特に、更に、測定対象分子のイオン化効率を高めるための誘導体化剤及びその洗浄過程を合わせて行うことで、スイートスポットの位置等を温度条件のみの設定で制御することが可能であり、また、スイートスポットの位置等を制御することで、プレスキャンをしなくても、マニュアル測定であっても、容易に質の高いマススペクトルを取得することが可能となることを見出して本発明に至った。
【0027】
すなわち、本発明は、以下のMALDI質量分析法用測定試料調製方法を提供するものである。
[1]MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させ、該混合結晶のうちの特定の多形構造を利用してイオン化効率を高めることを特徴とするMALDI質量分析法用測定試料調製方法。
[2]MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の結晶化条件を制御し、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させ、スイートスポットとなり得る特定の多形構造を利用してイオン化効率を高めることを特徴とする[1]に記載のMALDI質量分析法用測定試料調製方法。
[3]該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)であり、スイートスポットとなり得る多形構造が準安定結晶β晶であることを特徴とする[1]又は[2]に記載のMALDI質量分析法用測定試料調製方法。
[4]MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の温度条件を制御することによって、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させることを特徴とする[1]ないし[3]の何れかに記載のMALDI質量分析法用測定試料調製方法。
[5]MALDI質量分析法において、試料支持部材上に測定対象分子を含む試料を載せた後にマトリックス溶液を載置し、又は試料支持部材上に測定対象分子を含む試料とマトリックス溶液を同時に載置し、該溶液を乾燥させて該試料とマトリックスの混合結晶を析出させる際の温度条件を制御し、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させることを特徴とする[1]ないし[4]の何れかに記載のMALDI質量分析法用測定試料調製方法。
[6]該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)であり、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の温度を、マトリックス溶液の凝固点以上15℃以下の範囲に設定することを特徴とする[1]ないし[5]の何れかに記載のMALDI質量分析法用測定試料調製方法。
[7]MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際、試料支持部材の温度を、マトリックス溶液の凝固点以上15℃以下の範囲に設定することを特徴とする[1]ないし[6]の何れかに記載のMALDI質量分析法用測定試料調製方法。
[8]測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の溶媒が、水及び/又はアセトニトリルであることを特徴とする[1]ないし[7]の何れかに記載のMALDI質量分析法用測定試料調製方法。
[9]試料支持部材上に測定対象分子を含む試料を載せた後であって、マトリックス溶液を載置する前に、測定対象分子と反応することによってイオン化効率を高める誘導体化剤の溶液を該試料支持部材上に滴下して乾燥する工程を挿入することを特徴とする[1]ないし[8]の何れかに記載のMALDI質量分析法用測定試料調製方法。
【0028】
また、本発明は、以下のMALDI質量分析法を提供するものである。
[10][1]ないし[9]の何れかに記載のMALDI質量分析法用測定試料調製方法を使用して調製されたMALDI質量分析法用測定試料を用いてイオン化効率を高めることを特徴とするMALDI質量分析法。
【発明の効果】
【0029】
本発明によれば、前記問題点と課題を解決し、測定試料の善し悪しを判断したり、スイートスポットがMALDI質量分析法用の試料支持部材上のどの部分にあるかを経験によって探し出したりする作業が必要なくなり、誰でも短時間で効率良く質の高いMSスペクトルを得ることができる。それによって、自動分析への応用も可能となり、高スループットのMS分析手法を提供することができる。
【0030】
特に、構造同定に必要な高感度MSn(2≦n)解析を可能にし、測定対象分子を含む試料の量が少ない、測定対象分子のイオン化効率が低い等の理由で従来は測定できなかった試料であっても、誰でも短時間で効率良く化学構造の決定が可能になる。
【図面の簡単な説明】
【0031】
【図1】実施例で用いられた測定対象分子である糖ペプチドの化学構造を示す図である。
【図2】参考例1における、試料支持部材上の析出物の共焦点レーザー顕微鏡写真を示す図である。
【図3】2種類のラマン分光スペクトルを示す図である。 (a)プレート(試料支持部材)上の安定結晶α晶(標準品のDHBA粉末)で測定されたラマン分光スペクトルである。 (b)プレート(試料支持部材)上の準安定結晶β晶で測定されたラマン分光スペクトルである。
【図4】プレート(試料支持部材)上で、1199cm−1付近に強いシグナルをもつ安定結晶α晶を白く表し、1199cm−1付近に強いシグナルをもたない準安定結晶β晶を黒く表したラマンイメージング画像である。
【図5】図4で黒く表された部分(準安定結晶β晶)のマススペクトルを示す図である。
【図6】試料支持部材上をMSシグナルでスキャンした画像であり、イオン化効率が高い部分を示す図である。
【図7】実施例1で測定された顕微ラマンスペクトルを示す図である。
【図8】参考例2で測定された顕微ラマンスペクトルを示す図である。
【図9】参考例2で測定された粉末X線回折を示す図である。
【図10】比較例1で測定された顕微ラマンスペクトルを示す図である。
【図11】比較例1で測定された粉末X線回折を示す図である。
【図12】2種類のMSスペクトルを示す図である。 (a)実施例2の試料支持部材上を測定したMSスペクトルである。 (b)比較例2の試料支持部材上を測定したMSスペクトルである。
【図13】実施例2と比較例2の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像である。 (a)実施例2の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を濃い灰色から黒で示す図である。 (b)比較例2の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を濃い灰色から黒で示す図である。
【図14】比較例3の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を濃い灰色から黒で示す図である。
【図15】2種類のMSスペクトルを示す図である。 (a)実施例3の試料支持部材上を測定したMSスペクトルである。 (b)比較例4の試料支持部材上を測定したMSスペクトルである。
【図16】2種類のMSスペクトルを示す図である。 (c)実施例4の試料支持部材上を測定したMSスペクトルである。 (d)実施例5の試料支持部材上を測定したMSスペクトルである。
【図17】実施例3、比較例4の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像である。 (a)実施例3の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。 (b)比較例4の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。
【図18】実施例4、実施例5の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像である。 (c)実施例4の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。 (d)実施例5の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。
【図19】2種類のMSスペクトルを示す図である。 (a)実施例6の試料支持部材上を測定したMSスペクトルである。 (b)比較例5の試料支持部材上を測定したMSスペクトルである。
【図20】実施例6と比較例5の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像である。 (a)実施例6の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。 (b)比較例5の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。
【図21】2種類のMSスペクトルを示す図である。 (a)実施例7の試料支持部材上を測定したMSスペクトルである。 (b)比較例6の試料支持部材上を測定したMSスペクトルである。
【図22】実施例7と比較例6の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像である。 (a)実施例7の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。 (b)比較例6の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。
【図23】実施例8と比較例7の測定試料の共焦点レーザー顕微鏡写真と4種類のペプチドのMSシグナルスキャン画像である。 (a)実施例8の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。 (b)比較例7の試料支持部材上の共焦点レーザー顕微鏡写真とMSシグナルでスキャンした画像であり、イオン化効率が高い部分を黒で示す図である。
【発明を実施するための形態】
【0032】
以下、本発明について説明するが、本発明は以下の実施の具体的態様に限定されるものではなく、任意に変形して実施することができる。
【0033】
<MALDI質量分析法用測定試料の調製方法>
マトリックスはレーザーの光エネルギーを吸収して、共存する測定対象分子の脱離及びイオン化を達成する物質であれば限定されないが、例えば、以下のものが挙げられる。
【0034】
1,8−ジアミノナフタレン(1,8-Diaminonaphthalene)(1,8−DAN)、2,5−ジヒドロキシ安息香酸(2,5-Dihydroxybenzoic acid)(以下、「DHBA」と略記する場合がある)、1,8−アントラセンジカルボン酸ジメチルエステル(1,8-Anthracenedicarboxylic Acid Dimethyl ester)、ロイコキニザリン(Leucoquinizarin)、アントラロビン(Anthrarobin)、1,5−ジアミノナフタレン(1,5-Diaminonaphthalene)(1,5−DAN)、6−アザ−2−チオチミン(6-Aza-2-thiothymine)、1,5−ジアミノアントラキノン(1,5-Diaminoanthraquinone)、1,6−ジアミノピレン(1,6-Diaminopyrene)、3,6−ジアミノカルバゾール(3,6-Diaminocarbazole)、1,8−アントラセンジカルボン酸(1,8-Anthracenedicarboxylic Acid)、ノルハルマン(Norharmane)、1−ピレンプロピルアミンハイドロクロライド(1-Pyrenepropylamine hydrochloride)、9−アミノフルオレンハイドロクロライド(9-Aminofluorene Hydrochloride)、フェルラ酸(Ferulic acid)、ジトラノール(Dithranol)、2−(4−ヒドロキシフェニルアゾ)安息香酸(2-(4-Hydroxyphenylazo)benzoic acid)(HABA)、trans−2−[3−(4−tert−ブチルフェニル)−2−メチル−2−プロペニリデン]マロンニトリル(trans-2-[3-(4-tert-Butylphenyl)-2-methyl-2-propenylidene]malononitrile)(DCTB)、trans−4−フェニル−3−ブテン−2−オン(trans-4-Phenyl-3-buten-2-one)(TPBO)、trans−3−インドールアクリル酸(trans-3-Indoleacrylic acid)(IAA)、1,10−フェナントロリン(1,10-Phenanthroline)、5−ニトロー1,10−フェナントロリン(5-Nitro-1,10-phenanthroline)、α−シアノ−4−ヒドロキシケイ皮酸(α-Cyano-4-hydroxycinnamic acid)(CHCA)、シナピン酸(Sinapic acid)(SA)、2,4,6−トリヒドロキシアセトフェノン(2,4,6-Trihydroxyacetophenone)(THAP)、3−ヒドロキシピコリン酸(3-Hydroxypicolinic acid)(HPA)、アントラニル酸(Anthranilic acid)、ニコチン酸(Nicotinic
acid)、3−アミノキノリン(3-Aminoquinoline)、2−ヒドロキシ−5−メトキシ安息香酸(2-Hydroxy-5-methoxybenzoic acid)、2,5−ジメトキシ安息香酸(2,5-Dimethoxybenzoic acid)、4,7−フェナントロリン(4,7-Phenanthroline)、p−クマル酸(p-Coumaric acid)、1−イソキノリノール(1-Isoquinolinol)、2−ピコリン酸(2-Picolinic acid)、1−ピレンブタン酸ヒドラジド(1-Pyrenebutanoic acid, hydrazide)(PBH)、1−ピレンブタン酸(1-Pyrenebutyric acid)(PBA)、1−ピレンメチルアミンハイドロクロライド(1-Pyrenemethylamine hydrochloride)(PMA)。
【0035】
上記したマトリックスの中でも、針状に結晶化する性質を有するマトリックスが好ましい。更に、2,5−ジヒドロキシ安息香酸(DHBA)が最も好ましい。
【0036】
<試料とマトリックスの混合結晶の析出又は混合物の生成>
本発明のMALDI質量分析法用測定試料の調製方法において、該測定対象分子を含む試料とマトリックスの混合結晶を作製する方法には、特に限定はないが、例えば、好ましい方法として、以下の(1)法〜(3)法が挙げられる。
(1)試料支持部材上に測定対象分子を含む試料を載せた後に、乾燥後又は乾燥する前にマトリックス溶液を載置し、次いで、該溶液を乾燥させて、該混合結晶を析出させる方法。
(2)試料支持部材上に測定対象分子を含む試料とマトリックス溶液を同時に載置し、次いで、該溶液を乾燥させて、該混合結晶を析出させる方法。
(3)試料支持部材上に該マトリックス溶液を載置し、次いで該溶液を乾燥させ該マトリックスの結晶を析出させた後、同一又は異なる化学構造を有するマトリックスと測定対象分子を含む溶液を重層し、次いで該溶液を乾燥させて混合物を生成させる方法。
【0037】
試料とマトリックスの混合結晶を作製する方法として、特に好ましくは、上記(1)又は(2)である。すなわち、
(1)試料支持部材上に測定対象分子を含む試料を載せた後にマトリックス溶液を載置し、又は、
(2)試料支持部材上に測定対象分子を含む試料とマトリックス溶液を同時に載置し、次いで、該溶液を乾燥させて、該混合結晶を析出させる方法、である。
【0038】
本発明において、「測定対象分子を含む試料とマトリックスの混合結晶」とは、測定対象分子を含む試料の分子とマトリックスの分子とを物質として両方含有する結晶という意味であり、測定対象分子がマトリックス分子に置き換わることによって、マトリックス分子単独の(マトリックス分子独自の)結晶構造とは異なる結晶構造になった結晶を意味しない。通常は、試料支持部材上においては、マトリックスの分子数に比べて測定対象分子の分子数は極めて少ない。
【0039】
<<(1)法>>
上記(1)法は、本発明において特に好適な方法であり、測定対象分子を含む試料を先に試料支持部材上に存在させ、次いで、マトリックス溶液(好ましくは実質的にマトリックスのみを溶解した溶液)を、該試料に重層し、試料を溶解させながら、試料支持部材(以下、「プレート」と略記することがある)上で乾燥させて、結晶を析出させる測定試料の調製方法である。
【0040】
上記(1)法においては、マトリックス溶液をプレート上で乾燥する工程を、プレート上に物質を供給する工程の中では最終の工程とする。一般に、高いイオン生成量を得るためには試料とマトリックスがよく混合されなければならないにもかかわらず、最終の工程でプレートに供給する溶液の中に測定対象分子が溶解(含有)されていなくてもよいことを本発明者は見出した。
【0041】
そして、上記(1)法において、スイートスポットとなる結晶を多数形成させるためには、マトリックス溶液(好ましくは実質的にマトリックスのみを溶解した溶液)の温度は、好ましくは試料支持部材の温度より低い方がよい。
【0042】
マトリックス溶液(好ましくは実質的にマトリックスのみを溶解した溶液)の温度は、具体的には、試料支持部材上に載置する際には、20℃以下が好ましく、15℃以下がより好ましく、4℃以下が特に好ましい。また、結晶析出中に維持するマトリックス溶液の温度は、20℃以下が好ましく、15℃以下がより好ましく、4℃以下が特に好ましい。また、マトリックス溶液の温度は、マトリックス溶液の凝固点以上であることが必要である。マトリックス溶液は、冷蔵庫等で十分に冷却した後に用いることが特に好ましい。
【0043】
更に、試料支持部材についても、あらかじめ冷却した状態にしておくことが好ましい。試料支持部材の温度は、具体的には、マトリックス溶液を試料支持部材上に載置する際には、20℃以下が好ましく、15℃以下が特に好ましい。また、結晶析出中に維持する試料支持部材の温度は、20℃以下が好ましく、15℃以下が特に好ましい。結露を防止できる条件であれば、4℃以下が特に好ましい。従って、試料支持部材を冷却するにあたり、測定試料を調製する場所の湿度によっては、試料支持部材に結露が生じることがあるため、乾燥した環境下で作業することが好ましい。また、試料支持部材の温度は、マトリックス溶液の凝固点以上であることが好ましい。
【0044】
本発明における「測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の結晶化条件」とは、温度、過飽和度(濃度)、溶媒、pH、添加物、界面張力等をいう。温度及び過飽和度(濃度)は、結晶の多形構造生成に影響を与える主要な制御因子であり、溶媒、pH、添加物及び界面張力は補助因子として影響する。従って、本発明における「スイートスポットとなる結晶多形の形成方法」としては、特に限定はないが、温度、過飽和度(濃度)、溶媒、pH、添加物、界面張力等を最適化し、制御する方法が挙げられる。
【0045】
上記の「スイートスポットとなる結晶多形の形成方法」として、マトリックスが2,5−ジヒドロキシ安息香酸(以下、「DHBA」と略記することがある)である場合には、プレート及びマトリックス溶液の温度が、上記した通りの低温となるように冷却する方法が最も簡便で効果的であり、再現性良く測定試料を調製できるという理由等から特に好ましい。溶媒を留去するとき(結晶を析出させるとき)を低温にすることが好ましく、それを確実に達成するために、載置するときに、マトリックス溶液及び/又は試料支持部材を低温にしておくことが好ましい。
【0046】
溶媒を留去するとき(混合結晶を析出させるとき)の試料支持部材を低温にすることが本発明の効果を発揮させるために特に好ましく、それを確実に達成するために、載置するときも、「試料支持部材」又は「試料支持部材とマトリックス溶液の双方」を低温にしておくことが好ましい。
【0047】
物質をプレート上に載置するための実質的な最終工程に、マトリックスのみを溶解した溶液を用いる場合、該溶液の溶媒は、測定対象分子と該マトリックスの何れをも溶解できる溶媒であることが好ましい。下層に既にある測定対象分子を溶解して、マトリックスと混合させることができるからである。
【0048】
上記(1)法は、以下の、工程(A)及び工程(B)を必須の工程として含むことが好ましい。
(A)測定対象分子を含む試料の溶液をプレート上で乾燥する工程と、その後に、
(B)マトリックスのみを溶媒に溶解した溶液を、上記プレートに滴下する工程
【0049】
工程(A)では、測定対象分子を含む試料の溶液をプレート上で乾燥する。このときの溶液は、測定対象分子を含有してさえいればよく、マトリックスは含有されていてもいなくてもよい。ただし、測定対象分子を含む試料が極微量の場合、測定対象分子を含む試料の良溶媒がマトリックスの貧溶媒であり、そのマトリックスや溶媒を用いたい場合、マトリックスが溶解した溶媒に対して試料が不安定でありストック溶液として保管若しくは使用ができない又は取り扱いが難しくなる場合等には、測定試料の調製が容易である点、溶媒の選択幅が広がる点、試料の分解や容器への吸着を抑制できる点等のため、このときの溶液中にはマトリックスを溶解させずに、測定対象分子を含む試料のみを溶解させる方が好ましい。
【0050】
その際の溶媒としては、測定対象分子を含む試料を溶解しさえすれば特に限定はなく、マトリックスを溶解させる性質は有していなくてもよいし、常圧における沸点が高く、蒸発(乾燥)速度は遅くてもよい。測定対象分子又は測定対象分子を含む試料が水溶性であるならば、工程(A)で用いる溶媒は水単独が特に好ましい。測定対象分子を含む試料が糖であるならば、工程(A)で用いる溶媒は水単独が最も好ましい。マトリックスを溶解させないので、マトリックスに対する溶解度は低くてもよく、そのため測定対象分子又は測定対象分子を含む試料に最も好適な溶媒が選択できる。
【0051】
工程(A)における上記溶液中における測定対象分子の濃度は特に限定はないが、1amol/μL〜1μmol/μLが好ましく、100amol/μL〜1nmol/μLが特に好ましい。工程(A)終了後に(乾燥後に)、プレート上に存在する測定対象分子を含有する層の厚さは特に限定はないが、5μm以下が好ましく、1μm以下が特に好ましい。かかる層の厚さが厚すぎると、マトリックス溶液を滴下した場合にマトリックス分子とうまく混和しない可能性があり、MSシグナル強度が低下する場合がある。
【0052】
(1)法は、「測定対象分子を含む試料」の溶液をまずプレートに滴下するので、測定対象分子を含む試料が極めて微量である場合に、別の容器でマトリックス溶液と混合しその一部をプレートに滴下することなく、微量試料のほとんど全量を分析に供することができるため特に有用である。測定対象分子を含む試料が1000fmol以下の場合により有用であり、300fmol以下の場合に特に有用であり、100fmol(例えば、100fmol/μLに溶解した水溶液を1μL滴下する等によりプレート上に100fmol載せる)以下の場合に更に有用である。
【0053】
(1)法においては、工程(A)の後に、(B)マトリックスのみを溶媒に溶解した溶液を上記プレートに滴下する工程を有する。「工程(A)の後に」の意味は、「工程(A)の直後に」には限定されず、工程(A)と工程(B)の間に、他の工程が挿入されていてもよい。「他の工程」としては、例えば、後述する工程(C)が挙げられる。
【0054】
工程(B)では、実質的にマトリックスのみを溶媒に溶解した溶液を上記プレートに滴下するが、測定対象分子と該マトリックスの何れをも溶解できる溶媒を用いることによって、下層の測定対象分子がマトリックス分子と混和し、溶媒の蒸発にともなって混合結晶が現出する。
【0055】
<<<誘導体化>>>
(1)法においては、上記工程(A)と工程(B)の間に、
(C)測定対象分子と反応することによってイオン化効率を高める誘導体化剤の溶液を、上記プレート上に滴下して乾燥する工程
を行なうことが、イオン化効率を更に高めるために好ましい。
【0056】
すなわち、(A)試料支持部材上に測定対象分子を含む試料を載せた後であって、(B)マトリックス溶液を載置する前に、(C)測定対象分子と反応することによってイオン化効率を高める誘導体化剤の溶液を該試料支持部材上に滴下して乾燥する工程を挿入するMALDI質量分析法は、イオン化効率が更に高くなるために好ましい。
【0057】
測定対象分子と反応することによってイオン化効率を高める誘導体化剤(以下、単に「誘導体化剤」と略記する)を、予め測定対象分子と反応させてから、プレートに供給すると、測定試料のロスに繋がる場合がある。従って、糖、糖タンパク質、糖ペプチド等の微量な「生体由来の分子又は生体試料中の分子」に質量分析法を適用する場合、工程(A)と工程(B)の間に工程(C)を挿入することが特に好ましい。
【0058】
誘導体化剤は、誘導体化された測定対象分子すなわち質量分析に供される分子のイオン化効率を高めるものであれば特に限定はない。誘導体化剤は、MALDI質量分析法におけるマトリックスとしての効果を有する化合物、又はそれらに後記する反応性官能基やスペーサ部分を更に有する化合物も好ましい。
【0059】
かかる誘導体化剤の化学構造は上記効果を奏するものであれば特に限定はないが、その分子内にナフタレン、アントラセン、ピレン等の縮合多環を有する縮合多環化合物等が上記効果を好適に奏するので特に好ましい。ここで「縮合多環化合物」とは、窒素、硫黄又は酸素分子を含む複素環を一部に含んでいてもよい縮合多環部分と、測定対象分子とを結合することが可能である反応性官能基と、要すれば、該縮合多環部分と該反応性官能基とを連結するスペーサ部分とを有する化合物をいう。特に、芳香族環を有する化合物であることが好ましい。
【0060】
誘導体化剤は、測定対象分子に反応することによって、誘導体化された分子すなわち質量分析に供される分子の、イオン化切断位置を制御できるようにするものであることが特に好ましい。
【0061】
誘導体化剤は、アミノ基、ヒドラジド基、ジアゾメチル基、スクシニミジルエステル基、塩化スルホニル基、ヨード基(−I)等の反応性官能基を有することが好ましい。特に好ましい誘導体化剤としては、具体的には、ナフタレン環、アントラセン環、ピレン環等の縮合多環に、上記基が直接若しくは他の基(スペーサ部分)を介して結合した縮合多環誘導体化合物;ヨウ化メチル;ジアゾメタン;トリメチルシリルジアゾメタン等が挙げられる。
【0062】
このうち、誘導体化された分子すなわち質量分析に供される分子のイオン化効率を高めたり、イオン化切断位置を制御できるようにしたりする点等で、ピレン環化合物が特に好ましい。ここで「ピレン環化合物」とは、ピレン環と、「測定対象分子」に結合することが可能である反応性官能基と、要すれば該ピレン環と該反応性官能基とを連結するスペーサ部分とを有する化合物をいう。
【0063】
具体的には、1−ピレンブタン酸ヒドラジド(1-pyrenebutanoic acid, hydrazide)(以下、「PBH」と略記する)、1−ピレン酢酸ヒドラジド(1-pyreneacetic acid, hydrazide)、1−ピレンプロピオン酸ヒドラジド(1-pyrenepropionic acid, hydrazide)、1−ピレン酢酸スクシニミジルエステル(1-pyreneacetic acid, succinimidyl ester)、1−ピレンプロピオン酸スクシニミジルエステル(1-pyrenepropionic acid, succinimidyl ester)、1−ピレンブタン酸スクシニミジルエステル(1-pyrenebutanoic acid, succinimidyl ester)、N−(1−ピレンブタノイル)システイン酸スクシニミジルエステル(N-(1-pyrenebutanoyl)cysteic acid, succinimidyl ester)、N−(1−ピレン)ヨードアセトアミド(N-(1-pyrene) iodoacetamide)、N−(1−ピレン)ヨードマレイミド(N-(1-pyrene) maleimide)、N−(1−ピレンメチル)ヨードアセトアミド(N-(1-pyrenemethyl) iodoacetamide)、1−ピレンメチルヨードアセテート(1-pyrenemethyl iodoacetate)、アミノピレン(aminopyrene)、1−ピレンメチルアミン(1-pyrenemethyl amine)、1−ピレンプロピルアミン(3-(1-pyrenyl)propylamine)、1−ピレンブチルアミン(4-(1-pyrenyl)butylamine)、1−ピレンスルホン酸クロリド(1-pyrenesμLfonyl chloride)、1−ピレニルジアゾメタン(1-pyrenyldiazomethane)(以下、「PDAM」と略記する)、1−ピレンカルバルデヒド ヒドラゾン(1-pyrenecarbaldehyde hydrazone)、1−ピレニルチオシアネート(1-pyrenylthiocyanate)、1−ピレニルイソチオシアネート(1-pyrenylisothiocyanate)等が好ましいものとして挙げられる。このうち最も好ましくはPBH又はPDAMである。
【0064】
誘導体化剤としては、上記具体的化合物において、ピレン環を、ナフタレン環又はアントラセン環に代えたものも好ましいものとして挙げられる。また、ヨウ化メチル、ジアゾメタン又はトリメチルシリルジアゾメタンも好ましい。
【0065】
好ましい「測定対象分子と誘導体化剤との組み合わせ」としては、測定対象分子がアルデヒド基を含有する糖鎖を有する分子であり、誘導体化剤がアミノ基又はヒドラジド基等を有するものである場合が挙げられる。また、好ましい組み合わせとしては、測定対象分子が、カルボキシル基、アミノ基又はメルカプト基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤が、アミノ基、ヒドラジド基又はジアゾメチル基等を有するものである場合が挙げられ、更に、測定対象分子が、カルボキシル基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤がヨウ化メチル又はトリメチルシリルジアゾメタンである場合が挙げられる。これらの組み合わせは、測定対象分子及び誘導体化剤を、容易にプレート上で反応させることができる点、イオン化を阻害しない点、反応が選択的である点、一般に微量での分析の必要性が高いので、前記効果を奏し易い点等から好ましい。
【0066】
<<(2)法>>
(2)試料支持部材上に測定対象分子を含む試料とマトリックス溶液を同時に載置し、該溶液を乾燥させて、試料支持部材上に該混合結晶を析出させる方法も好ましい。かかる(2)法の測定試料の調製方法は、「Dried Droplet法」として知られているものである。(1)の調製方法で、試料支持部材上に測定対象分子を含む試料を載せた後に、乾燥する前にマトリックス溶液を載置する方法も同様である。
【0067】
この(2)法においても、マトリックス溶液をあらかじめ冷却しておくことによって、好ましくは、マトリックス溶液及び試料支持部材をあらかじめ冷却しておくことによって、スイートスポットとなり得る結晶構造の形成を促進させることができる。マトリックス溶液の好ましい温度、試料支持部材の好ましい温度、それらと「測定試料を調製する雰囲気温度」との関係、温度設定手段等は、前記した(1)法の場合と同様である。
【0068】
スイートスポットになり得る混合結晶の部分は、MS分析法以外の分析方法を用いて、該混合結晶の局所的な分析をした際に、該マトリックスの標準品とは異なる分析結果を呈する「測定対象分子を含む試料とマトリックスの混合結晶」として検出できる。マトリックスがDHBAである場合は、上記「マトリックスの標準品」とは、大部分がDHBAの安定結晶α晶から成る状態をいい、上記「マトリックスの標準品とは異なる分析結果を呈する『測定対象分子を含む試料とマトリックスの混合結晶』」とは、DHBAの準安定結晶β晶をいう。
【0069】
本発明における「測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の結晶化条件」とは、温度、過飽和度(濃度)、溶媒、pH、添加物、界面張力等をいい、それらの影響、制御方法、好ましい範囲、その理由等は、前記した(1)法と同様である。
【0070】
また、(2)法においても測定対象分子の誘導体化を行ってもよい。誘導体化については、前記した(1)法と同様である。
【0071】
<<試料とマトリックスの混合結晶の析出方法一般>>
本発明のMALDI質量分析法用測定試料の調製方法において、「該測定対象分子を含む試料」とマトリックスとの混合結晶を作製する方法は特に限定はなく、何れの方法においても、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の結晶化条件を制御することによって、スイートスポットとなり得る特定の多形構造を形成させることが好ましい。該混合結晶のうちスイートスポットとなり得る特定の多形構造の形成を促進させる。
【0072】
「測定対象分子を含む試料」とマトリックスの混合結晶を作製する方法にはよらず、前記の(1)法、(2)法及び(3)法の何れの方法においても、該「結晶化条件の制御」は、「析出させる際の温度条件の制御」により行うことが好ましい。
【0073】
本発明においては、溶液を乾燥させて該試料とマトリックスの混合結晶を析出させる際の試料支持部材の温度条件を室温より低い温度に制御することによって、スイートスポットとなり得る特定の多形構造の形成を促進させる。
【0074】
本発明における「室温」とは、試料を調製する場所の気温(雰囲気温度)のことをいう。本発明の効果は、試料支持部材の温度を低温に保つことにより好適に達成されるものであり、試料を調製する場所との温度差を利用したものではない。
【0075】
該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)の場合で、溶媒に水を含む場合は、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の温度は、具体的には、20℃以下が好ましく、15℃以下がより好ましく、10℃以下が特に好ましく、4℃以下が更に好ましい。また、マトリックス溶液の凝固点以上であることが必要である。
「混合結晶を析出させる際の温度」とは、何れの「測定試料の調製方法」においても、プレート上で析出直前及び/又はプレート上で析出中の溶液の温度をいう。
【0076】
本発明の効果が奏される作用原理は以下のように考えられる。ただし、以下に記載の現象が確実に起こる測定試料の調製方法にのみ本発明が限定される訳ではない。
すなわち、上記の温度範囲であると、DHBAの飽和溶解度が温度に依存して低下し、マトリックス結晶化の駆動力となる濃度勾配が大きくなり、DHBA溶液が不安定な高エネルギー状態となって、DHBAの結晶化が速度論的に進行するために、スイートスポットとなり得る準安定型の多形構造の結晶核が数多く形成される。
準安定型の多形構造の結晶核が多数形成されると、生成したDHBA結晶の核と測定対象分子が相互作用することによって、マトリックス結晶中に取り込まれる対象分子が増加する。特に、イオン化効率が低い対象分子の場合には、マトリックス結晶の表面に吸着しているのみではイオン化されず、結晶内部に取り込まれている必要がある。対象分子は、結晶の成長段階では結晶内部に取り込まれ難い。
【0077】
また、温度を低く保つことにより、マトリックス水溶液の粘性が高くなり、試料支持部材上での溶液の流動性が抑制され、試料支持部材上での初期のマトリックス水溶液のぬれ面積を最終的に保持することができるので、スイートスポットが支持部材の一定位置に形成される。
【0078】
測定対象分子を含む試料とマトリックスの混合結晶を析出させる際、試料支持部材の温度は、20℃以下が好ましく、15℃以下がより好ましく、10℃以下が特に好ましく、更に好ましくは4℃以下である。また、下限は、マトリックス溶液の凝固点以上であることが好ましい。
【0079】
測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の溶媒が、水及び/又はアセトニトリルであることが、糖、タンパク質、ペプチド、糖タンパク質、糖ペプチド、核酸、糖脂質等に汎用できる点で好ましい。すなわち、マトリックスの分子数に比べて極めて分子数の少ない測定対象分子である、糖、タンパク質、ペプチド、糖タンパク質、糖ペプチド、核酸、糖脂質等の測定対象分子を十分に溶解する点、同時にスイートスポットとなり得る特定の多形構造を迅速に作製させ、測定対象分子を効率的に結晶中に取り込むことができるという点で特に好ましい。水若しくはアセトニトリル、又は水とアセトニトリルとの混合溶媒の時に、前記した効果を特に発揮する。これらは、特に、マトリックスがDHBAのとき、スイートスポットとなり得る特定の多形構造ができ易い溶媒である。
【0080】
本発明においては、スイートスポットになり得る混合結晶の部分を多く形成させて、該スイートスポットが多数形成された試料を対象としてレーザー脱離イオン化することを特徴とする。
本発明で用いられるマトリックスの種類は特に限定はなく、MALDI質量分析法に用いられるマトリックスならば何れも用いられるが、特に針状に結晶化する物質は、結晶化の際の温度を低温に保つことによって、スイートスポットになり得る特定の結晶構造への測定試料の取り込みが促進されるため、本発明に好適に使用できる。
本発明は、該マトリックスが、針状に結晶化する物質であることを特徴とする上記のMALDI質量分析法用測定試料調製方法でもある。
中でも、マトリックスとして最も好ましくは、2,5−ジヒドロキシ安息香酸(DHBA)である。
【0081】
該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)のとき、スイートスポットとなり得る多形構造は準安定結晶β晶である。「準安定結晶β晶」とは、非特許文献3には、「Disordered」と示され、ケンブリッジデータベースに登録されている(CCDC No.BESKAL01、格子定数a=11.299(2)Å、b=11.830(3)Å、c=4.966(4)Å、β=90.50(3)°)結晶構造である。
【0082】
DHBAの「準安定結晶β晶」のラマンスペクトルは、安定結晶α晶のラマンスペクトル(独立行政法人産業技術総合研究所のスペクトルデータベースに登録されている「参照ラマンスペクトル」で観測される、1199cm−1付近、1307cm−1付近及び376cm−1付近等の強いシグナルがなく、3265cm−1付近にブロードなシグナルがある。
【0083】
「準安定結晶β晶」は、CuKα線による粉末X線回折によれば、2θ=11.0度、16.0度、17.5度、24.8度、28.3度及び31.2度に特徴的な回折ピークを有しているものであり、図9に示した粉末X線回折パターンを与えるものである。
【0084】
該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)のとき、スイートスポットとならない多形構造は安定結晶α晶である。「安定結晶α晶」とは、独立行政法人産業技術総合研究所スペクトルデータベースに登録されているDHBAのラマンスペクトルを与える結晶構造であり、また、非特許文献3には「Ordered」と示され、ケンブリッジデータベースに登録されている(CCDC No.BESKAL、格子定数a=23.945(2)Å、b=4.908(1)Å、c=5.621(1)Å、β=100.98(0)°)結晶構造である。
【0085】
「安定結晶α晶」は、CuKα線による粉末X線回折によれば、2θ=16.3度、19.8度、23.8度、27.3度、31.3度及び37.0度に特徴的な回折ピークを有しているものであり、図11に示した粉末X線回折パターンを与えるものである。
【0086】
<測定対象分子>
本発明のMALDI質量分析法が適用される測定対象分子は特に限定はないが、生体由来の分子又は生体試料中の分子であることが好ましく、具体的には、糖、タンパク質、ペプチド、糖タンパク質、糖ペプチド、核酸、糖脂質等であることが、本発明の効果をより発揮できるので好ましい。「測定対象分子」としては、天然物から調製されるもの、天然物を化学的又は酵素学的に一部改変して調製されるものの他、化学的又は酵素学的に調製されるものも好ましい。また、生体に含まれる分子の部分構造を有するものや生体に含まれる分子を模倣して作製されたものも好ましい。また、プレートに載せる前に、すでに誘導体化がなされていてもよい。
【0087】
また、質量分析法に用いるプレート上に載せる試料、すなわち、測定対象分子を含む試料としては、「測定対象分子」そのものだけでもよいし、「測定対象分子」を含むもの、例えば、生体の組織、細胞、体液や分泌物(例えば、血液、血清、尿、精液、唾液、涙液、汗、糞便等)等でもよい。すなわち、直接生体試料を用いてもよい。また、試料をプレート上に載せ、酵素処理等を行なって、測定対象分子を調製してもよい。
【0088】
上記した分子は、分析に供される試料が少量である場合が多く、また特に、糖、糖タンパク質、糖脂質等の複合糖質等又はそれらから化学的若しくは酵素学的に遊離させて得たものは、分子量や組成が同一の異性体が複数存在するので、スイートスポットが容易に見つからずに測定を断念していた場合も多く、本発明のスイートスポットの予測方法及びMALDI質量分析法は、それら分子の化学構造解析に対して特に上記効果を奏するので好ましい。
【0089】
<質量分析装置>
イオン化に用いられるレーザーとしては、窒素レーザー(337nm)、YAGレーザー3倍波(355nm)、NdYAGレーザー(256nm)、炭酸ガスレーザー(2940nm)等が挙げられるが、窒素レーザーが好ましい。イオンの分離検出方法は特に限定はなく、二重収束法、四重極集束法(四重極(Q)フィルター法)、タンデム型四重極(QQ)法、イオントラップ法、飛行時間(TOF)法等を用いて、イオン化した分子を質量/電荷比(m/z)に従って分離し検出する。好ましくは、QIT−TOFである。
【0090】
糖、タンパク質、ペプチド、糖タンパク質、糖ペプチド、核酸、糖脂質等の分子は、分子量や組成が同じ異性体を多く含むので、イオンの生成効率を向上させ、分子のフラグメント化をn回繰り返す方法(MSn法)が好ましい。本発明は、検出された「測定対象分子を含む試料とマトリックスの混合結晶」の部分に対し、フラグメント化をn回繰り返すMSn法(2≦n)を適用することが好ましい。MSn法により、例えば分子中の結合位置等を決定できる。
【0091】
<作用・原理>
本発明において、準安定結晶β晶の部分に優れたスイートスポットが存在する作用・原理は明確ではないが、以下のようにも考えられる。ただし、本発明は、以下の作用・原理の及ぶ範囲に限定されるものではない。
すなわち、スイートスポットとなる「測定対象分子を含む試料とマトリックスの混合結晶」の中では、測定対象分子が効率的に脱離・イオン化するために好ましい状態で取り込まれていると考えられる。特に、マトリックス結晶化の初期に結晶核ができる際に、マトリックス溶液の温度をより低く設定すると、マトリックス結晶核の生成が促進され、準安定結晶β晶が広範囲に一斉に結晶化し、スイートスポットの形成に好ましい影響を与えるためと考えられる。
【実施例】
【0092】
以下に、実施例及び比較例を挙げて本発明を更に具体的に説明するが、本発明は、その要旨を超えない限りこれらの実施例に限定されるものではない。
【0093】
参考例1
<プレート上で、23℃で乾燥、安定結晶α晶と準安定結晶β晶を検出>
まず、シリコン基板に金を蒸着させた金基板プレート(試料支持部材)に、測定対象分子である糖ペプチド1(化学構造を図1に示す)を水に溶解して、500fmol/μLにした水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。
【0094】
次に、誘導体化剤である標識試薬PDAM(1−pyrenyldiazomethan;Molecular Probes社製)をDMSO(dimethyl sulfoxide;SIGMA社製)に溶解させ、2nmol/μLにした溶液を0.25μL滴下し、ヒートブロック上で、80℃、大気圧下に放置し乾燥させた。プレート上の余剰誘導体化剤を除くため、トルエン(SIGMA社製)に浸し余剰のPDAMを除去し十分に乾燥させた。
【0095】
次に、高純度DHBA(Shimadzu Biotech社製)を水に溶解して10mg/mLにした水溶液を0.75μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。この測定試料析出物の共焦点レーザー顕微鏡写真を図2に示す。
【0096】
このプレート(試料支持部材)上のDHBA結晶のラマンイメージング画像を取得するため、inViaラマンマイクロスコープ(株式会社レニショー社製)を用い、波長532nmの励起レーザー条件下でラマン測定を行った。
【0097】
上記「測定試料析出物」のラマンスペクトルについて、まず、多変量解析によってスペクトルのパターンを比較したところ、プレート(試料支持部材)上で析出したDHBAの結晶ごとに特有のラマンスペクトルが得られた。そして、「測定試料析出物」においては、独立行政法人産業技術総合研究所スペクトルデータベースに登録されているDHBAのラマンスペクトル(以下、「参照ラマンスペクトル」と記載する場合がある)と同一のラマンスペクトルが得られるα晶(「安定結晶α晶」ともいう)と、参照ラマンスペクトルとは異なるラマンスペクトルが得られるβ晶(「準安定結晶β晶」ともいう)の少なくとも2種類に分けられることが判明した。
【0098】
なお、マトリックスの再結晶精製された、測定対象分子が含まれない粉末(マトリックスの標準品)からは、参照ラマンスペクトルと同一のラマンスペクトルが得られる。測定試料析出物の安定結晶α晶と準安定結晶β晶から得られたラマンスペクトルを図3に示す。
【0099】
準安定結晶β晶のラマンスペクトルは、参照ラマンスペクトルで観測されていた1199cm−1付近、1307cm−1付近、376cm−1付近等の強いシグナルが消滅していた。逆に、3265cm−1付近にブロードなシグナルが観察された。
【0100】
上記「測定試料析出物」のDHBA結晶のうち、1199cm−1付近に強いシグナルをもつ安定結晶α晶を白く表し、1199cm−1付近に強いシグナルをもたない準安定結晶β晶を黒く表したラマンイメージング画像を図4に示す。すなわち、図4において、白く表された結晶は、参照ラマンスペクトルと同じラマンスペクトルが得られた安定結晶α晶であり、黒く表された結晶は、参照ラマンスペクトルとは異なるラマンスペクトル(図3(b))が得られた準安定結晶β晶である。
【0101】
上記「測定試料析出物」について、MALDI質量分析法によってマススペクトルを取得した。測定は、質量分析計としてMALDI−QIT−TOF型質量分析計(AXIMA−QIT、Shimadzu Biotech社製)を用いて行った。測定は正イオンモードで行い、上記「測定試料析出物」の全域に対して、レーザーパワーを測定対象分子のイオンのシグナルがではじめる閾値に最適化した後、40μm間隔でレーザー照射を行い、自動で測定した。
【0102】
その結果、図2に示した「結晶があるところ全て」からシグナルが検出できるわけではなく、白く表されず黒く表された(1199cm−1付近に強いシグナルを有しない)準安定結晶β晶からのみから強いシグナルを検出することができた。また、準安定結晶β晶の円周上の根元から特に強いシグナルを検出することができた。
【0103】
一方、白く表された(1199cm−1付近に強いシグナルを有する)安定結晶α晶内のどこからも強いシグナルを検出することができなかった。すなわち、参照ラマンスペクトルと同一のラマンスペクトルを示す安定結晶α晶の部分にはスイートスポットがなかった。
【0104】
準安定結晶β晶の円周上の根元から得られたマススペクトルを図5に示す。図6に示すように、良好なMSシグナルが得られる測定点(スイートスポット)はβ晶に存在することが判明し、この結晶からは、極めて良好なマススペクトルを得ることができた。
【0105】
更に、図4と図6を比較すると、ラマンイメージング画像とスイートスポットの位置の相関がより明白になった。すなわち、図4で黒く表示されている、参照ラマンスペクトルとは異なるラマンスペクトルを生ずる準安定結晶β晶の根元(結晶化の起点部位)では、参照ラマンスペクトルと同じラマンスペクトルを生じる安定結晶α晶(白く表示されている)と比べて格段にイオン生成量が高く、優れたスイートスポットとなっていることが示された。
【0106】
実施例1
<密閉容器内で、4℃で析出、準安定結晶β晶であることを確認>
高純度マトリックスDHBA(LaserBio Labs製)200mgにアセトニトリルを3mL加え、50℃に加熱し溶解させた。不溶物質を熱時濾去した後、溶液を密閉容器に入れ4℃に冷却し、30分間静置した後、析出した針状の白色結晶を濾取し、アセトニトリルにより洗浄した。室温下で乾燥し、結晶性物質を得た。
【0107】
得られた試料の結晶構造を評価するため、針状結晶の複数点について顕微ラマン分光分析を行った。測定には、KAISER SYSTEM社製HoloLab SERIES 5000型顕微ラマン分光分析装置を用い、レーザー波長532nm、レーザー強度50mWで測定を行った。この結晶性試料の顕微ラマンスペクトルを図7に示す。図7に示すように、上記の方法により得られた針状結晶は、参考例1で得られた準安定結晶β晶のラマンスペクトル(図3(b))と非常に良く一致し、C=O及びC=C伸縮振動由来の1325cm−1付近のシグナルが非常に強く観測される特徴があり、また、3261cm−1付近にブロードシグナルを示すことが分かった。このスペクトルは、参照ラマンスペクトルとは異なり、1199cm−1付近の強いシグナルを有していなかった。
【0108】
図7に示すこの結晶のラマンスペクトルは、下記に記述する参考例2の結晶と非常に良い一致が認められた。従って、実施例1において得られた針状結晶の多形は、参考例2で得られた針状結晶と同一の結晶構造を有する準安定結晶β晶である。
なお、試料支持部材上でも、温度条件を同じにすれば、密閉容器内と同様の結晶構造が得られ易いと考えられる。
【0109】
参考例2
<密閉容器内で、4℃で析出、準安定結晶β晶であることを確認>
高純度マトリックスDHBA(LaserBio Labs製)200mgにクロロホルムとアセトンを体積比3:1で混合させた溶媒6mLを加え、50℃に加熱し溶解させた。不溶物質を熱時濾去した後、溶液を密閉容器に入れ4℃に冷却し、30分間静置した後、析出した針状の白色結晶を濾取し、母液と同一の組成の溶媒により洗浄した。室温下で乾燥し、針状の結晶性物質を得た。
【0110】
この結晶性試料が示すラマンスペクトルを評価するため、実施例1と同様の方法により、顕微ラマン分光分析を行った。得られたラマンシフトの測定結果を図8に示す。図8に示すように、上記の方法により得られた針状結晶は、実施例1で得られた結晶と同様に1325cm−1付近のシグナルが非常に強く観測される特徴があり、また、3261cm−1付近にブロードシグナルを示すことがわかった。
【0111】
得られた結晶性試料の結晶構造を評価するため、CuKα線を用いた粉末X線回折を測定した。
粉末X線回折測定装置には、島津製作所製 XRD−6100を使用し、X線源としてはCuKα線を用い、以下の測定条件で実施した。
ステップ幅:0.02deg
スキャンスピード:2.0deg/min
加速電圧:40kV
加速電流:40mA
走査範囲:5〜50deg
【0112】
この結晶性試料の粉末X線回折図を図9に示す。図9に示すように、この結晶の回折角度(2θ)は、特徴的に、約11.0度、16.0度、17.5度、24.8度、28.3度、及び31.2度にピークを有していた。なお、ケンブリッジデータベースには、前記非特許文献3に「Disordered」と示されるDHBA結晶の多形体が登録されており(CCDC No.BESKAL01)、その理論構造より粉末X線をシミュレートした結果と非常に良い一致が認められた。
【0113】
従って、参考例2において得られた針状結晶は、前記非特許文献3に「Disordered」と示される結晶構造であり、この針状結晶は、参照スペクトルにおける1900cm−1付近の強いシグナルを示さないことが判明した。
よって、前記「準安定結晶β晶」は、非特許文献3に「Disordered」と示される結晶構造を有するものである。
【0114】
更に、実施例1において得られたラマンスペクトルは、参考例2において得られたラマンスペクトルと一致したことから、実施例1の手法により得られた針状結晶は、非特許文献3に「Disordered」と示される準安定結晶β晶であることが判明した。
【0115】
比較例1
<密閉容器内で、25℃で析出、安定結晶α晶であることを確認>
高純度マトリックスDHBA(LaserBio Labs製)200mgにアセトニトリルを3mL加え、50℃に加熱し溶解させた。不溶物質を熱時濾去した後、溶液を密閉容器に入れ室温下の25℃にて一昼夜静置し、析出した板状の白色結晶を濾取し、アセトニトリルにより洗浄した。室温下で乾燥し、結晶性物質を得た。
【0116】
次に、実施例1と同様の方法により顕微ラマン分光分析を行った。ラマンシフトの測定結果を図10に示す。図10に示すように、上記の方法により得られた板状結晶は、1199cm−1付近に強いシグナルを示し、参照ラマンスペクトルと良い一致を示し、実施例1及び参考例2で得られた準安定結晶β晶の測定結果とは異なるラマンスペクトルを示した。
【0117】
比較例1で得られた結晶性試料の結晶構造を評価するため、参考例2と同様の方法により粉末X線回折を測定した。この結晶の粉末X線回折図を図11に示す。
【0118】
図11に示すように、この結晶の回折角度(2θ)は、特徴的に約16.3度、19.8度、23.8度、27.3度、31.3度、及び37.0度にピークを有しており、参考例2で得られた結晶の粉末X線回折図(図9)とは異なる特徴を示した。
【0119】
なお、ケンブリッジデータベースに、前記非特許文献1にOrderedと示されるDHBA結晶の多形体が登録されており(CCDC No.BESKAL)、その理論構造より粉末X線をシミュレートした結果と非常に良い一致が認められた。従って、比較例1で得られた結晶は、前記非特許文献1にOrderedと示される結晶構造であることが確認された。
よって、前記「安定結晶α晶」は、非特許文献1に「Ordered」と示される結晶構造を有するものである。
【0120】
実施例1及び比較例1の結果から、溶媒としてアセトニトリルを用いたDHBAの結晶化に関して、冷却を行って短時間で析出させた場合にはDisordered(準安定結晶β晶)の結晶形となり(実施例1)、室温以上の温度で比較的時間をかけて結晶化させた場合にはOrdered(安定結晶α晶)の結晶形が得られる(比較例1)ことが判明した。
試料支持部材上でも、温度条件を同じにすれば、密閉容器内と同様の結晶構造が得られ易いと考えられる。
【0121】
実施例2
<プレート上で、15℃で乾燥、準安定結晶β晶を優先的に調製>
まず、質量分析用プレート(試料支持部材)に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。
【0122】
次に、誘導体化剤である標識試薬PDAM(1−pyrenyldiazomethan;Molecular Probes社製)をDMSO(dimethyl sulfoxide;SIGMA社製)に溶解させ、10nmol/μLにした溶液を0.25μL滴下し、ヒートブロック上で、80℃、大気圧下に放置し乾燥させた。余剰の誘導体化剤を除くため、キシレン(SIGMA社製)に浸し余剰のPDAMを除去し十分に乾燥させた。
【0123】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLにした水溶液を4℃に冷却し、そのうち1.00μLをマトリックスとしてあらかじめ15℃に設定したプレートに滴下した。次に、プレートの温度を15℃に保ちながら大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。すなわちこの条件は、プレートとマトリックス溶液の温度をより低温にすることで、準安定結晶β晶を有利に作製する条件に対応する。乾燥した環境下であれば、より低温に冷却する方がよいが、プレートが結露を起こす温度以下に冷却しないことが好ましい。
【0124】
この測定試料について、MALDI質量分析法によってマススペクトルを取得した。測定は、質量分析計としてMALDI−QIT−TOF型質量分析計(AXIMA−QIT、Shimadzu Biotech社製)を用い、正イオンモードで行った。また、測定試料の全域に対して、レーザーパワーを測定対象分子のイオンのシグナルがではじめる閾値に最適化した後、50μm間隔でレーザー照射を行い、自動測定した。
【0125】
得られたマススペクトルを図12(a)に示し、図13(a)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。更に、図13(a)に示したシグナル強度を5段階で評価し、上位4段階に該当するシグナルの検出ポイント数を集計して表1に示した。
【0126】
【表1】

【0127】
比較例2
<プレート上で、23℃で乾燥、安定結晶α晶と準安定結晶β晶を検出>
実施例2と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、PDAMによる誘導体化を行った後、キシレン(SIGMA社製)に浸し余剰のPDAMを除去し十分に乾燥させた。DHBA溶液を滴下するまでは、実施例2と同様の操作を行った。
【0128】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を1.00μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0129】
この測定試料について、実施例2と同様のMALDI質量分析法によってマススペクトルを取得した。測定は、質量分析計としてMALDI−QIT−TOF型質量分析計(AXIMA−QIT、Shimadzu Biotech社製)を用いて行った。測定は正イオンモードで行った。測定試料の全域に対して、レーザーパワーを測定対象分子のイオンのシグナルが出始める閾値に最適化した後、50μm間隔でレーザー照射を行い、自動測定した。
【0130】
得られたマススペクトルを図12(b)に示し、図13(b)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。更に、図13(b)に示したシグナル強度を5段階で評価し、上位4段階に該当するシグナルの検出ポイント数を集計して表2に示した。
【0131】
【表2】

【0132】
<実施例2と比較例2の結果>
図12(a)と(b)のマススペクトルを比較すると、測定対象分子のシグナル強度は明らかに図12(a)の方が2倍程度高く良好である。更に、図13(a)と(b)を比較すると、何れの場合においても、円周上の根元からシグナルが得られる傾向があるが、明らかに図13(a)の方が検出されたポイント数が多かった。すなわち、実施例2で作製した測定試料は円周上にある大部分の結晶から良好なシグナルが得られるが、比較例2で作製した測定試料は、結晶のごく一部からしかシグナルが生じていなかった。
【0133】
更に、表1と表2を比較すると、測定試料の全体で検出されたポイント数は実施例2(表1)の場合に、比較例2(表2)の場合に比べて約3倍多く、強度の高いシグナルも多くの測定点で得られることも明白である。
【0134】
比較例3
<プレート上で、25℃で乾燥、安定結晶α晶を優先的に調製>
実施例2と同様に測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、PDAMによる誘導体化を行った後、キシレン(SIGMA社製)に浸し余剰のPDAMを除去し十分に乾燥させた。DHBA溶液を滴下するまでは、実施例2と同様の操作を行った。
【0135】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液(40℃)のうち1.00μLをマトリックスとしてプレートに滴下した。次に、プレートを室温(25℃)中、大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。すなわちこの条件は、比較例1の安定結晶α晶を有利に形成する条件に対応する。
【0136】
この測定試料について、実施例2と同様のMALDI質量分析法によってマススペクトルを取得したところ、比較例2と類似の結果であった。測定は、質量分析計としてMALDI−QIT−TOF型質量分析計(AXIMA−QIT、Shimadzu Biotech社製)を用いて行った。測定は正イオンモードで行った。測定試料の全域に対して、レーザーパワーを測定対象分子のイオンのシグナルが出始める閾値に最適化した後、50μm間隔でレーザー照射を行い、自動測定した。
【0137】
図14には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。図14に示すように、40℃程度に加熱したマトリックス溶液をプレート上に滴下した場合、溶媒の蒸発速度が速いために液滴の均一な円形が保持されず、溶媒の蒸発に偏りが生じた。そのため、円周上以外の場所がDHBAの結晶化の起点となり、マトリックス結晶の形に再現性がなかった。
【0138】
更に、得られたマススペクトルのシグナル強度は比較例2と同じであった。図14に示したシグナル強度を実施例2と同様の方法で5段階評価し、上位4段階に該当するシグナルのポイント数を集計した結果についても、比較例2と類似の結果であった。
【0139】
実施例3
<PDAMラベルあり/プレート冷却/マトリックス溶液冷却>
まず、質量分析用プレート(試料支持部材)に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。
【0140】
次に、誘導体化剤である標識試薬PDAM(1−pyrenyldiazomethan;Molecular Probes社製)をDMSO(dimethyl sulfoxide;SIGMA社製)に溶解させ、10nmol/μLにした溶液を0.25μL滴下し、ヒートブロック上で、70℃、大気圧下に放置し乾燥させた。余剰の誘導体化剤を除くため、キシレン(SIGMA社製)に浸し余剰のPDAMを除去し十分に乾燥させた。
【0141】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLにした水溶液を4℃に冷却し、そのうち1μLをマトリックスとしてあらかじめ15℃に設定したプレートに滴下した。次に、プレートの温度を15℃以下に保ちながら大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。すなわちこの条件は、プレートとマトリックス溶液の温度をより低温にすることで、準安定結晶β晶を有利に作製する条件に対応する。乾燥した環境下であれば、より低温に冷却する方がよいが、プレートが結露を起こす温度以下に冷却しないことが好ましい。
【0142】
この測定試料について、実施例1と同様のMALDI質量分析法によってマススペクトルを取得した。
【0143】
得られたマススペクトルを図15(a)に示し、図17(a)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0144】
比較例4
<PDAMラベルあり/プレート室温/マトリックス溶液室温>
実施例2と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、標識試薬PDAMを用いて反応させ、洗浄を行った。DHBA溶液を滴下するまでは、実施例3と同様の操作を行った。
【0145】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0146】
この測定試料について、実施例3と同様のMALDI質量分析法によってマススペクトルを取得した。
【0147】
得られたマススペクトルを図15(b)に示し、図17(b)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0148】
<実施例3と比較例4の結果>
図15(a)と図15(b)のマススペクトルを比較すると、測定対象分子のシグナル強度は明らかに図15(a)の方が3倍程度高く良好である。更に、図17(a)と図17(b)を比較すると、何れの場合においても、試料支持部材の円周に沿って結晶の根元部分からシグナルが得られる傾向があるが、図17(a)の場合には明らかに検出ポイント数が多かった。すなわち、実施例3で作製した測定試料は、良好なシグナルが得られる大半の結晶の根元部分が試料支持部材の円周に沿って形成されており、該結晶部分にレーザー照射することによっても短時間で良好なシグナルが得られたが、比較例4で作製した測定試料の場合には、結晶のふちの部分にレーザー照射しても良好なシグナルを得ることは難しかった。
【0149】
実施例4
<PDAMラベルあり/プレート冷却/マトリックス溶液室温>
実施例3と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、標識試薬PDAMを用いて反応させ、洗浄を行った。DHBA溶液を滴下するまでは、実施例3と同様の操作を行った。
【0150】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLにした室温の水溶液1μLをマトリックスとしてあらかじめ15℃に設定したプレートに滴下した。次に、プレートの温度を15℃以下に保ちながら大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。
【0151】
この測定試料について、実施例3と同様のMALDI質量分析法によってマススペクトルを取得した。
【0152】
得られたマススペクトルを図16(c)に示し、図18(c)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0153】
実施例5
<PDAMラベルあり/プレート室温/マトリックス溶液冷却>
実施例3と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、標識試薬PDAMを用いて反応させ、洗浄を行った。DHBA溶液を滴下するまでは、実施例3と同様の操作を行った。
【0154】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を零下20℃程度に冷却した後、室温に保ったプレートに1μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0155】
この測定試料について、実施例3と同様のMALDI質量分析法によってマススペクトルを取得した。
【0156】
得られたマススペクトルを図16(d)に示し、図18(d)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0157】
<実施例4と実施例5の結果>
図16(c)及び図16(d)のマススペクトルを図15(a)及び図15(b)と比較すると、測定対象分子のシグナル強度は、図15(a)>図16(c)>図16(d)>図15(b)の順に高く良好である。また、図17及び図18の(a)〜(d)を比較すると、スイートスポットの数は、図17(a)>図18(c)>図18(d)>図17(b)の順に多かった。すなわち、実施例4及び5で作製した測定試料は、プレートあるいはマトリックス溶液の一方のみを冷却することによって、双方を冷却したとき程の効果はないが、通常の室温下で試料を調製するときよりは良好なシグナルが得られる。
【0158】
実施例3と比較例4においては、何れも、測定対象分子である糖ペプチドを誘導体化剤であるPDAMにより標識してから測定したが、実施例3と比較例4における温度の違いによる結果の差は、PDAMによる標識の有無には関わらず観測された。すなわち、誘導体化剤(標識試薬)を使用しない場合においても、15℃に設定してDHBAを結晶化させた場合には、23℃に設定してDHBAを結晶化させた場合と比較して、MSシグナル強度は2倍以上に向上した。
【0159】
実施例6
<プレート冷却/マトリックス溶液冷却>
まず、質量分析用プレート(試料支持部材)(島津製作所製、384ウェルサンプルプレート)に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。
【0160】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLにした水溶液を冷蔵庫で4℃に保冷し、そのうち1μLをマトリックスとして、あらかじめ15℃に設定したプレートに滴下した。次に、プレートの温度を15℃以下に保ちながら大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。すなわちこの条件は、プレートとマトリックス溶液の温度をより低温にすることで、準安定結晶β晶を有利に作製する条件に対応する。乾燥した環境下であれば、より低温に冷却する方がよいが、プレートが結露を起こす温度以下に冷却しないことが好ましい。
【0161】
この測定試料について、MALDI質量分析法によってマススペクトルを取得した。測定は、質量分析計としてMALDI−QIT−TOF型質量分析計(AXIMA−QIT、Shimadzu Biotech社製)を用い、正イオンモードで行った。また、測定試料の全域に対して、レーザーパワーを測定対象分子のイオンのシグナルがではじめる閾値に最適化した後、50μm間隔でレーザー照射し、測定試料の全体を自動測定した。
【0162】
得られたマススペクトルを図19(a)に示し、図20(a)には測定試料において糖ペプチドイオンのシグナルが顕著に検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。更に、図20(a)に示したシグナル強度を5段階で評価し、上位4段階に該当するシグナルの検出ポイント数を集計して表3に示した。
【0163】
【表3】

【0164】
比較例5
<プレート室温/マトリックス溶液室温>
実施例6と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させた。DHBA溶液を滴下するまでは、実施例6と同様の操作を行った。
【0165】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0166】
この測定試料について、実施例6と同様のMALDI質量分析法によってマススペクトルを取得した。
【0167】
得られたマススペクトルを図19(b)に示し、図20(b)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。更に、図20(b)に示したシグナル強度を5段階で評価し、上位4段階に該当するシグナルの検出ポイント数を集計して表4に示した。
【0168】
【表4】

【0169】
<実施例6と比較例5の結果>
図19(a)と図19(b)のマススペクトルを比較すると、測定対象分子のシグナル強度は明らかに図19(a)の方が2倍程度高く良好である。更に、図20(a)と図20(b)を比較すると、何れの場合においても、結晶の根元部分から良好なシグナルが得られる傾向があるが、明らかに図20(a)の方が検出されたポイント数が多かった。すなわち、実施例6で作製した測定試料は、大半の結晶の根元部分から良好なシグナルが得られるが、比較例5で作製した測定試料の場合には、一部の結晶の根元部分からしかシグナルが生じていなかった。また自動分析により得られたマススペクトルの検出限界をS/N>3とした場合、実施例6の図20(a)では、10fmolの測定試料まで検出可能であったが、比較例5の図20(b)では50fmolを検出することができなかった。
【0170】
更に、表3と表4を比較すると、測定試料の全体で検出されたポイント数は実施例6(表3)の場合に、比較例5(表4)の場合に比べて約2倍多く、強度の高いシグナルも約2倍多くの測定点で得られることも明白である。
【0171】
実施例7
<ウェル境界のないプレート/PDAMラベルあり/プレート冷却/マトリックス溶液冷却>
まず、質量分析用プレート(試料支持部材)のウェル境界のない平らな面に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を1μL滴下し、乾燥させ、標識試薬PDAMを用いて反応させ、洗浄を行った。DHBA溶液を滴下するまでは、実施例3と同様の操作を行った。
【0172】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLにした水溶液を4℃に冷却し、そのうち1μLをマトリックスとしてあらかじめ15℃に設定したプレートに滴下した。次に、プレートの温度を15℃以下に保ちながら大気圧下で溶媒を乾燥させ、マトリックスの結晶化を行った。すなわちこの条件は、プレートとマトリックス溶液の温度をより低温にすることで、準安定結晶β晶を有利に作製する条件に対応する。乾燥した環境下であれば、より低温に冷却する方がよいが、プレートが結露を起こす温度以下に冷却しないことが好ましい。
【0173】
この測定試料について、実施例3と同様のMALDI質量分析法によってマススペクトルを取得した。
【0174】
得られたマススペクトルを図21(a)に示し、図22(a)には、自動分析において検出された糖ペプチドイオンのシグナル位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0175】
比較例6
<境界のないプレート/PDAMラベルあり/プレート室温/マトリックス溶液室温>
実施例7と同様に、測定対象分子である糖ペプチド(化学構造を図1に示す)を水に溶解して、100fmol/μLにした水溶液を質量分析用プレート(試料支持部材)の境界のない平らな面に1μL滴下し、乾燥させ、標識試薬PDAMを用いて反応させ、洗浄を行った。DHBA溶液を滴下するまでは、実施例7と同様の操作を行った。
【0176】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0177】
この測定試料について、実施例1と同様のMALDI質量分析法によってマススペクトルを取得した。
【0178】
得られたマススペクトルを図21(b)に示し、図22(b)には測定試料において糖ペプチドイオンのシグナルが検出された位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0179】
<実施例7と比較例6の結果>
図21(a)と図21(b)のマススペクトルを比較すると、測定対象分子のシグナル強度は明らかに図21(a)の方が2倍程度高く良好である。更に、図22(a)と図22(b)を比較すると、何れの場合においても、結晶の根元部分からシグナルが得られる傾向があるが、図22(a)の場合には明らかに検出されたスイートスポットの数が多かった。すなわち、実施例7で作製した測定試料は、マトリックスの結晶化の際のプレート温度を15℃に設定することにより、混合結晶の形成位置を制御した結果、結晶のふちの位置でのスイートスポット数が増えた。実施例3と実施例7を比較すると、このマトリックス結晶のスイートスポット形成に対する効果は、支持部材とマトリックス溶液の温度を室温より低い温度に制御したことによるものであり、プレート上の突起などの物理的な境界とは無関係であることが明らかである。
【0180】
実施例8
<ペプチド混合物/プレート冷却/マトリックス溶液冷却>
まず、20μgの牛血清アルブミン(Sigma−Aldrich社製)に、界面活性剤としてSodium 3−{(2−methyl−2−undecyl−1,3−dioxolan−4−yl)methoxy}−1−propanesulfonate(RapiGest SF(waters社製))を最終濃度が0.1%となるように加え、100℃で5分間加熱した。冷却後、10mmol/L重炭酸アンモニウムと10mmol/Lジチオトレイトールを含む水溶液に溶解し、55℃で45分間インキュベートした。
反応後、135mmol/Lのヨードアセトアミドを5μL加え、暗所で45分間静置した。次に、1μgのトリプシンを加え、37℃で一晩反応させた。
【0181】
反応後の溶液にセルロース粉末を加え、吸着、溶出操作を行って濃縮精製した後、得られた溶液を質量分析用プレート(試料支持部材)に1μL滴下し、室温(23℃)、大気圧下で放置し乾燥させた。
【0182】
この測定試料について、実施例1と同様の操作により結晶化を行い、MALDI質量分析法によって正イオンモードのマススペクトルを取得した。
【0183】
図23(a)には、自動分析において検出されたペプチドイオンのシグナルのうち、高い値を示した約25点の位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0184】
比較例7
<ペプチド混合物/プレート室温/マトリックス溶液室温>
実施例8と同様に、測定対象分子であるペプチド混合物を水に溶解して、質量分析用プレートに1μL滴下し、乾燥させた。DHBA溶液を滴下するまでは、実施例8と同様の操作を行った。
【0185】
次に、高純度DHBA(Shimadzu Biotech社製)を60%アセトニトリル水溶液に溶解して10mg/mLに調製した水溶液を1μL滴下し、室温(23℃)、大気圧下で放置し、溶媒を乾燥させた。
【0186】
この測定試料について、実施例8と同様のMALDI質量分析法によってマススペクトルを取得した。
【0187】
図23(b)には、自動分析において検出されたペプチドイオンのシグナルのうち、高い値を示した約25点の位置及び測定試料の共焦点レーザー顕微鏡写真を示した。
【0188】
<実施例8と比較例7の結果>
図23(a)と図23(b)を比較すると、図23(a)の場合には、明らかに、検出されたスイートスポットはマトリックス結晶のふちにそって分布している。すなわち、実施例8で作製した測定試料は、マトリックスの結晶化の際のプレート温度を15℃に設定することにより、すべてのペプチドのスイートスポットが均一に位置した。従って、マトリックス結晶のふちにそってレーザーを照射すれば、容易にすべてのペプチドのスイートスポットを同時に検出することができ、効率よくMSスペクトルを取得することができる。
一方、比較例7では、各ペプチドのスイートスポットは、必ずしもマトリックス結晶のふちに存在しているとは限らず、またペプチドの種類によって分布が異なるため、スイートスポットをあらかじめ見極めることは難しく、質の高いMSスペクトルを取得するためには測定試料全体を測定する必要がある。
【0189】
<実施例、比較例、参考例のまとめ>
従って、本発明では、MALDI質量分析法の試料調製において、良好なMSスペクトルを得るためには測定試料中に多数のスイートスポットとなるマトリックスの結晶多形を形成させることが効果的であり、マトリックス結晶がスイートスポットとなるかならないかの違いは、マトリックスの結晶多形の違いに依存し、更にマトリックス溶液の溶媒を迅速に乾燥させるよりは、プレートと溶液の温度を低温にする方法が、スイートスポットの形成に関して最も有効であることが明らかとなった。
【産業上の利用可能性】
【0190】
本発明の、測定対象分子を含む試料とマトリックスの混合結晶を析出させ、該混合結晶のうちの特定の多形構造を利用してイオン化効率を高めるMALDI質量分析法用測定試料調製方法は、短時間で効率良く質の高いMSスペクトルを得ることが可能であり、構造同定で必要な高感度MSn(2≦n)解析を可能にし、更には自動分析への応用が可能となるので、MSスペクトルを使用する全ての分析分野に、特に、微量試料しか入手できない場合がある生体分析の分野等に広く利用されるものである。
【特許請求の範囲】
【請求項1】
MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させ、該混合結晶のうちの特定の多形構造を利用してイオン化効率を高めることを特徴とするMALDI質量分析法用測定試料調製方法。
【請求項2】
MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の結晶化条件を制御し、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させ、スイートスポットとなり得る特定の多形構造を利用してイオン化効率を高めることを特徴とする請求項1に記載のMALDI質量分析法用測定試料調製方法。
【請求項3】
該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)であり、スイートスポットとなり得る多形構造が準安定結晶β晶であることを特徴とする請求項1又は請求項2に記載のMALDI質量分析法用測定試料調製方法。
【請求項4】
MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の温度条件を制御することによって、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させることを特徴とする請求項1ないし請求項3の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項5】
MALDI質量分析法において、試料支持部材上に測定対象分子を含む試料を載せた後にマトリックス溶液を載置し、又は試料支持部材上に測定対象分子を含む試料とマトリックス溶液を同時に載置し、該溶液を乾燥させて該試料とマトリックスの混合結晶を析出させる際の温度条件を制御し、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させることを特徴とする請求項1ないし請求項4の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項6】
該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)であり、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の温度を、マトリックス溶液の凝固点以上15℃以下の範囲に設定することを特徴とする請求項1ないし請求項5の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項7】
MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際、試料支持部材の温度を、マトリックス溶液の凝固点以上15℃以下の範囲に設定することを特徴とする請求項1ないし請求項6の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項8】
測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の溶媒が、水及び/又はアセトニトリルであることを特徴とする請求項1ないし請求項7の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項9】
試料支持部材上に測定対象分子を含む試料を載せた後であって、マトリックス溶液を載置する前に、測定対象分子と反応することによってイオン化効率を高める誘導体化剤の溶液を該試料支持部材上に滴下して乾燥する工程を挿入することを特徴とする請求項1ないし請求項8の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項10】
請求項1ないし請求項9の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法を使用して調製されたMALDI質量分析法用測定試料を用いてイオン化効率を高めることを特徴とするMALDI質量分析法。
【請求項1】
MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させ、該混合結晶のうちの特定の多形構造を利用してイオン化効率を高めることを特徴とするMALDI質量分析法用測定試料調製方法。
【請求項2】
MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の結晶化条件を制御し、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させ、スイートスポットとなり得る特定の多形構造を利用してイオン化効率を高めることを特徴とする請求項1に記載のMALDI質量分析法用測定試料調製方法。
【請求項3】
該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)であり、スイートスポットとなり得る多形構造が準安定結晶β晶であることを特徴とする請求項1又は請求項2に記載のMALDI質量分析法用測定試料調製方法。
【請求項4】
MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の温度条件を制御することによって、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させることを特徴とする請求項1ないし請求項3の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項5】
MALDI質量分析法において、試料支持部材上に測定対象分子を含む試料を載せた後にマトリックス溶液を載置し、又は試料支持部材上に測定対象分子を含む試料とマトリックス溶液を同時に載置し、該溶液を乾燥させて該試料とマトリックスの混合結晶を析出させる際の温度条件を制御し、該混合結晶のうちスイートスポットとなり得る特定の多形構造を形成させることを特徴とする請求項1ないし請求項4の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項6】
該マトリックスが、2,5−ジヒドロキシ安息香酸(DHBA)であり、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の温度を、マトリックス溶液の凝固点以上15℃以下の範囲に設定することを特徴とする請求項1ないし請求項5の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項7】
MALDI質量分析法において、測定対象分子を含む試料とマトリックスの混合結晶を析出させる際、試料支持部材の温度を、マトリックス溶液の凝固点以上15℃以下の範囲に設定することを特徴とする請求項1ないし請求項6の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項8】
測定対象分子を含む試料とマトリックスの混合結晶を析出させる際の溶媒が、水及び/又はアセトニトリルであることを特徴とする請求項1ないし請求項7の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項9】
試料支持部材上に測定対象分子を含む試料を載せた後であって、マトリックス溶液を載置する前に、測定対象分子と反応することによってイオン化効率を高める誘導体化剤の溶液を該試料支持部材上に滴下して乾燥する工程を挿入することを特徴とする請求項1ないし請求項8の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法。
【請求項10】
請求項1ないし請求項9の何れかの請求項に記載のMALDI質量分析法用測定試料調製方法を使用して調製されたMALDI質量分析法用測定試料を用いてイオン化効率を高めることを特徴とするMALDI質量分析法。
【図1】


【図3】


【図5】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図15】


【図16】


【図19】


【図21】


【図2】


【図4】


【図6】


【図13】


【図14】


【図17】


【図18】


【図20】


【図22】


【図23】




【図3】


【図5】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図15】


【図16】


【図19】


【図21】


【図2】


【図4】


【図6】


【図13】


【図14】


【図17】


【図18】


【図20】


【図22】


【図23】


【公開番号】特開2012−177689(P2012−177689A)
【公開日】平成24年9月13日(2012.9.13)
【国際特許分類】
【出願番号】特願2012−18854(P2012−18854)
【出願日】平成24年1月31日(2012.1.31)
【出願人】(000173924)公益財団法人野口研究所 (108)
【Fターム(参考)】
【公開日】平成24年9月13日(2012.9.13)
【国際特許分類】
【出願日】平成24年1月31日(2012.1.31)
【出願人】(000173924)公益財団法人野口研究所 (108)
【Fターム(参考)】
[ Back to top ]

