MHC分子に結合する腫瘍関連ペプチド
【課題】ヒト主要組織適合複合体(MHC)クラスI分子に結合することができる特定のアミノ酸配列を含む腫瘍関連ペプチドを提供する。
【解決手段】特定配列番号からなる群より選択されるアミノ酸配列を有し、ヒト主要組織適合複合体(MHC)クラスI分子に結合することができる腫瘍関連ペプチド。また、腫瘍疾患の治療薬製造および腫瘍疾患治療のための上記ペプチドの使用。更に、上記ペプチドの少なくとも1つを含む医薬組成物。
【解決手段】特定配列番号からなる群より選択されるアミノ酸配列を有し、ヒト主要組織適合複合体(MHC)クラスI分子に結合することができる腫瘍関連ペプチド。また、腫瘍疾患の治療薬製造および腫瘍疾患治療のための上記ペプチドの使用。更に、上記ペプチドの少なくとも1つを含む医薬組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒト主要組織適合複合体(MHC)クラスI分子に結合することができる腫瘍関連ペプチド(tumor−associated peptide)に関する。
このようなペプチドは、例えば、腫瘍関連疾患(tumor−associated diseases)の免疫療法に用いられる。
【背景技術】
【0002】
腫瘍細胞が免疫機構により排除されるとき、免疫機構の構成要素による腫瘍関連抗原(tumor−associated antigens:TAA)の同定は中心的な役割を果たしている。この機構は、腫瘍細胞と正常細胞との間に、質的又は量的な違いが存在することに基づく。抗腫瘍反応を引き起こすためには、腫瘍細胞は、腫瘍を排除するのに充分な免疫反応を引き起こす抗原を発現する必要がある。
【0003】
特に、CD8を発現している細胞傷害性Tリンパ球(以下、CTLという)は、腫瘍の排除に関わっている。このような細胞傷害性T細胞による免疫反応を引き起こすためには、T細胞に対して外来性のタンパク質やペプチドが提示されなければならない。抗原は、それらがMHC分子によって細胞表面に提示されたときにのみ、T細胞によりペプチド断片として認識される。これらのMHC(“主要組織適合複合体”)分子は、通常細胞内でペプチドと結合し、それらを細胞表面に輸送するペプチド受容体である。ペプチドとMHC分子とのこの複合体は、T細胞により認識される。ヒトMHC分子は、ヒト白血球抗原(HLA)とも呼ばれる。
【0004】
MHC分子には2つのクラスがある:MHCクラスI分子は、ほとんどの有核細胞に存在し、細胞内タンパク質の分解によって生じるペプチドを提示する。
MHCクラスII分子は、専門的な抗原提示細胞(APC)にのみ存在し、エンドサイト−シスの間に取り込まれて加工される外来性タンパク質のペプチドを提示する。ペプチド/MHCクラスI分子複合体は、CD8陽性の細胞傷害性Tリンパ球によって認識され、ペプチド/MHCクラスII分子複合体は、CD4ヘルパーT細胞によって認識される。
【0005】
細胞の免疫反応を引き起こすためには、ペプチドはMHC分子に結合しなければならない。この反応は、MHC分子の対立遺伝子とそのペプチドのアミノ酸配列に依存する。MHCクラスI結合ペプチドは、一般的には8から10残基の長さで、配列中に2つの保存された残基(「アンカー」)を含み、これらがMHC分子中に存在する相補的なくぼみ(ポケット)と結合する。
【0006】
免疫系が腫瘍関連ペプチドに対して効果的なCTL反応を引き起こすためには、これらのペプチドは、腫瘍細胞に発現される特異的なMHCクラスI分子に結合することができるだけでなく、特異的なT細胞受容体(TCR)を有するT細胞によって認識される必要がある。
【0007】
腫瘍ワクチンを開発する際の主な目的は、CD8+CTLによって認識される腫瘍関連抗原の同定と特定である。
【0008】
腫瘍特異的細胞傷害性Tリンパ球によって認識される抗原又はそれらのエピトープは、それぞれ、酵素、受容体、転写因子等の全てのクラスのタンパク質分子でありうる。腫瘍関連抗原の別の重要なクラスは、様々な種類の腫瘍や健康な精巣組織において発現される癌精巣抗原のような、組織特異的な構造である。
【0009】
Tリンパ球がタンパク質を腫瘍特異的抗原として認識するためには、そしてそれらを治療に用いるためには、以下の要件が満たされている必要がある:抗原は、腫瘍細胞によって主に発現されており、正常細胞では発現されていないか又は腫瘍におけるように、少なくとも少量が発現している必要がある。更に、特異的な抗原が一種の腫瘍中に存在するだけでなく、他の種類の腫瘍にも高濃度で存在していることが好ましい。更に、抗原のアミノ酸配列中のエピトープの存在が不可欠である。これらの腫瘍関連抗原由来のペプチドは、試験管内(in vitro)又は生体内(in vivo)のいずれにおいてもT細胞反応を誘導すると考えられているためである。
【0010】
このように、TAAは、腫瘍ワクチン開発の出発点である。TAAの同定方法及び特定方法は、患者由来のCTLの利用、又は腫瘍組織と正常組織との間に異なる転写プロファイルが生じることに基づく。
【0011】
腫瘍組織で過剰発現された、又は、このような組織において選択的に発現された遺伝子の同定は、これらの遺伝子から翻訳された抗原の、免疫療法への利用について正確な情報を与えない。これは、T細胞反応は、MHCの提示を媒介として、抗原全体ではなく抗原のエピトープのみによって引き起こされるので、これらの抗原のいくつかのエピトープのみがこのような利用に適当であるという事実に基づく。このように、過剰発現された、又は、選択的に発現されたタンパク質からMHC分子によって提示されるこれらのペプチドを選択することは重要であり、それにより細胞傷害性Tリンパ球による特異的な腫瘍の認識に対する取り組みの着手点となる。
【発明の概要】
【発明が解決しようとする課題】
【0012】
上記観点から、本発明は、ヒト主要組織適合複合体(MHC)クラスI分子に結合することができる、このようなペプチドの少なくとも一つの新規なアミノ酸配列を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明によれば、添付した配列プロトコルの配列番号1〜配列番号79からなる群より選択されるアミノ酸配列を含む腫瘍関連ペプチドであって、上記ペプチドは、ヒト主要組織適合複合体(MHC)クラスI分子に結合することができるペプチドを提供することにより上記課題は達成される。
本発明の基礎をなす課題は、これにより、完全に達成される。
【0014】
言うまでもなく、腫瘍から同定されるペプチドは、量産するため、そして以下に述べる目的に使うため、合成されてもよく又は細胞中で発現されてもよい。
【0015】
本発明者らは、上述したペプチドを、MHCクラスI分子に特異的なリガンドとして腫瘍関連組織から同定することができた。これに関連して、「腫瘍関連」ペプチド(“tumor−associated” peptide)の用語は、ここでは腫瘍材料から単離され、同定されたペプチドを意味する。真性(一次)腫瘍に提示されるこれらのペプチドは、腫瘍細胞中で抗原処理を受ける。
【0016】
例えば、上記ペプチドが由来する対応する抗原を発現する腫瘍細胞に対する免疫反応を引き起こすため、癌の治療において特異的なリガンドを用いることができる。
【0017】
一方では、このようなCTLの誘導による免疫反応は、生体内で達成しうる。この目的のため、ペプチドは、例えば、医薬組成物の形態で、TAAに関連する腫瘍疾患に苦しむ患者に投与される。
【0018】
他方では、ペプチドが由来する抗原を発現する腫瘍に対するCTL反応は、生体外(ex vivo)で誘導しうる。この目的のため、CTL前駆体細胞は、抗原提示細胞及びペプチドと共にインキュベートされる。これによって刺激されたCTLは次いで培養され、そしてこれらの活性化されたCTLが患者に投与される。
【0019】
更なる可能性は、生体外でペプチドをAPCにロード(load)しそしてこれらのロードされたAPCを、腫瘍組織においてこのペプチドが由来する抗原を発現している患者に投与することである。上記APCは生体内で次々にCTLにペプチドを提示し、それらを活性化する。
【0020】
本発明のペプチドは、診断試薬として利用することもできる。
ここでは、ペプチドは、CTL集団中に特異的にそのペプチドに向かうCTLが存在するかどうか、又は、CTLが治療により誘導されたかどうかを知るために用いることができる。
【0021】
更に、そのペプチドに対して反応性を示すT細胞前駆体の増加が、そのペプチドを用いて調べられる。
【0022】
更に、そのペプチドは、ペプチドが由来する抗原を発現する腫瘍の病気の経過を評価するマーカーとして用いることができる。
【0023】
添付した表1に、同定されたペプチドが示されている。これらペプチドは、それが結合するそれぞれのHLAタイプに従って配列されている。更に、表にはペプチドが由来するタンパク質と、そのタンパク質中のペプチドの各位置が配列されている。ここに、翻訳上の誤解を避けるためタンパク質の英語表記を残した。更に、National Instisute of Healthの“National Center for Biotechnology Information”の遺伝子バンクに載せられているAcc番号が引用されている(http://www.ncbi.nlm.nih.gov参照)。
【0024】
本発明者らは、2人の患者、RCC01とRCC13の腎臓細胞の悪性腫瘍からペプチド(又はリガンド)を分離することができた。ここで、患者RCC01の腫瘍組織から68のリガンドが単離され、患者RCC13の腫瘍組織から13のリガンドが単離された。両患者において同定されたリガンドのうち2つのリガンドは、同一であった。これらは、配列番号1と3を有するペプチドであった(met−プロトオンコジーン(C−Met)のYVDPVITSIとケラチン18のALLNIKVKL)。
【0025】
79のリガンドが患者の腫瘍から同定され、それらのうちの30はHLAサブタイプのHLA−A*02と結合し、13はHLA−A*68と結合し、34はHLA−B*18又はHLA−B*44と結合し、2つはHLA*24と結合した。
【0026】
HLA−A*02リガンドは、全て対立遺伝子特異的ペプチドモチーフを提示していた(ポジション2にロイシン/バリン、イソロイシン、アラニン又はメチオニン;C末端にロイシン/バリン、イソロイシン又はアラニン)。
【0027】
上記リガンドの中には、多量に発現される、ほとんどの組織で等しく発現されるいわゆるハウスキーピング遺伝子に由来するものもあったが、多くは腫瘍との結合により区別された。
【0028】
例えば、配列番号1 YVDPVITSIを有するペプチドは、リガンド、特に腫瘍と結合しmet−プロトオンコジーン(c−Met)(ポジション654−662)に由来するリガンドに関連する。配列番号2、22及び23を有するペプチドは、アディポフィリン(adipophilin)( “脂肪細胞分化関連”タンパク質とも呼ばれる)に由来し、このタンパク質のポジション129−137、62−71及び349−358を構成し、最後の2つのペプチドはHLA−A*68が提示するペプチドの中に包含される。配列番号3を有するリガンドは、ケラチン18由来のリガンドで、ポジション365−373に位置する。
【0029】
上記リガンドの大部分は、ポジション2にグルタミン酸(E)を有しており、このグルタミン酸は、HLA−B*44サブタイプのアンカーアミノ酸である。このように、ペプチドが初期の研究で免疫原性であると証明されたタンパク質由来であることを確認できた。例えば、配列番号5を有するペプチドは、タンパク質アネキシンII(Annexin II)(アネキシンII中のポジション:55−63)に由来する。このタンパク質は、メラノーマ患者に存在するMHCクラスII分子に関する免疫原性であることが証明されている(Heinzel et al., The self peptide annexin II(208-223)presented by dendritic cells sentisizes autologous CD4+ T-lymphocytes torecognize melanoma cells, 2001,Cancer Immunol. Immunother. 49:671-678参照)。
【0030】
更に、タンパク質、特に腫瘍組織で過剰発現されるタンパク質由来のいくつかのペプチドも同定できた。このように、ビメンチン(Vimentin)のフラグメント(EEIAFLKKL、ポジション229−237)及びカルデスモン(Caldesmon)のフラグメント(DEAAFLERL、ポジション92−100)を同定できた。Yangらは、これらのタンパク質が、腎臓細胞の癌組織で過剰発現されることを開示している(Expression profiling of renalepithelial neoplasms: a method for tumor classification and discovery ofdiagnostic molecular markers, 2001, Am. J. Pathol.,158:1639-1651)。
【0031】
本発明者らは更に、中でも特に、est−1由来のリガンド(NEFSLKGVDF、ポジション86−95)、アルファ−カテニン(Alpha−Catenin)由来のリガンド(NEQDLGIQY、ポジション169−177)及びガレクチン2(Galectin 2)由来のペプチド(SEVKFTVTF、ポジション80−88)を同定することができた。
【0032】
本発明者らは更に、酵素ニコチンアミド−N−メチル−トランスフェラーゼ由来のフラグメントYYMIGEQKF(配列番号79)を単離した。高橋らは、この酵素が腎臓細胞癌において過剰発現されることを開示している(Gene expression profiling of clearcell renal cell carcinoma: gene identification and prognostic classification,2001, Proc. Natl. Acad. Sci. USA,98:9754-9749)。
【0033】
驚くべきことに、本発明者らは提供者の血液中の同定されたペプチドの中の1つに特異的な細胞傷害性Tリンパ球を検出することができた。このように、腫瘍に特異的なCTL反応を誘導することが可能となる。
【0034】
本発明者らは、本研究において、2つの具体例として選択されたペプチドを用いることによって、配列番号1(c−met−プロトオンコジーンフラグメント又はc−Metペプチド)を有するペプチド又は配列番号2(アディポフィリンフラグメント又はアディポフィリンペプチド)を有するペプチドに特異的なTリンパ球(CTL)が生体内で発生することを明らかにすることができた。これらのCTLは、それぞれのタンパク質を発現した、異なる患者の異なる腫瘍細胞株由来の腫瘍細胞を特異的に死滅させることができた。本発明者らはまた、上述したCTLについて、例えば、予め対応するペプチドを用いてパルスされた樹状細胞が溶解されることを明らかにした。本発明者らはまた、本発明のペプチドをエピトープとして用いると、ヒトT細胞が試験管内で活性化されることを、これらの研究から明らかにした。本発明者らは、患者の末梢血単核細胞(PBMNC)から得られ、ある種のペプチドに特異的なCTLが、別の患者の同種の腫瘍細胞を死滅させることができるという点についてのみ、証明できなかった。本発明者らは更に、他種の腫瘍細胞であってもこれらのCTLにより溶解することを明らかにした。
【0035】
好ましい具体例として、配列番号1〜配列番号79からなるペプチド及びこれらの配列の少なくとも1つのアミノ酸が、類似する化学的性質を有する他のアミノ酸によって置換されているペプチドは、免疫反応の活性化にも用いられる。
【0036】
それぞれのMHC−サブタイプに関しては、例えば、これらのアンカーアミノ酸は類似する化学的性質を有する他のアミノ酸によって置換されていてもよい。例えば、MHCサブタイプHLA−A*02と結合するペプチドにおいて、ポジション2のロイシンは、イソロイシン、バリン又はメチオニンで置換されていても良く、逆もまた同じである。C末端のロイシンは、バリン、イソロイシン及びアラニンで置換されていても良く、これらは全て非極性側鎖を有する。
【0037】
更に、配列番号1〜79を有するペプチドが、N末端又はC末端に少なくとも1つの付加的なアミノ酸を含むものであるか、又は、配列中の少なくとも1つのアミノ酸が欠損しているものであっても用いることができる。
【0038】
更に、配列番号1〜79を有するペプチドが、少なくとも1つのアミノ酸が化学的に修飾されているものであっても用いることができる。
【0039】
(1又は2以上の)アミノ酸の変異は、その変異がペプチドの免疫原性に影響を与えないように、言い換えると、ペプチドが、MHC分子に対する同程度の結合能及びT細胞刺激能を示すように選択される。
【0040】
本発明において、上記ペプチドは、腫瘍疾患及び/又はアデノーマ(腺種)性疾患の治療に用いることができる。
【0041】
治療される腫瘍疾患としては、例えば、腎臓、乳房、膵臓、胃、膀胱、精巣、及び/又は、皮膚のがんがあげられる。腫瘍疾患の一覧は、単なる例示にすぎず、利用範囲を特に限定するものではない。
【0042】
本発明者らはまた、研究により本発明のペプチドがこのような用途に適していることを明らかにした。このように、ある種のペプチドに特異的な、特異的に生成したCTLによって、腫瘍細胞は効果的に、かつ選択的に死滅させられることが明らかになった。
【0043】
腫瘍関連抗原を腫瘍のワクチンに用いるためには、その適用には一般的にいくつかの可能な形態がある。Tigheらは、抗原を、組換えタンパク質として適当なアジュバント(補助剤)又は運搬系と共に、又は、プラスミドベクター中で抗原をコードしているcDNAとして投与しうることを明らかにした(1998, Gene vaccination:plasmid DNAis more than just a blueprint, Immunol. Today 19(2):89-97)。後者の場合、免疫反応を誘導するためには、患者の体内において抗原が処理され、抗原提示細胞(APC)に提示されなければならない。
【0044】
Meliefらは、更なる可能性、すなわち合成ペプチドをワクチンとして用いる可能性について明らかにしている(1996,Peptide-based cancervaccines, Curr. Opin. Immunol. 8:651-657)。
【0045】
好ましい形態として、上記ペプチドは、アジュバントを加えて、又は、それ自体で用いることができる。
【0046】
アジュバントとしては、例えば、顆粒球マクロファージ刺激因子(granulocate-macrophage-colony-stimulating-factor)(GM−CSF)を用いることができる。
【0047】
また、このようなアジュバントの例としては、水酸化アルミニウム、フロイントアジュバント等のミネラルオイルのエマルジョン、サポニン又はシリコン化合物があげられる。
【0048】
アジュバントを用いることは、上記ペプチドにより誘導される免疫反応が高められ、及び/又は、ペプチドが安定化されるため、有用である。
【0049】
別の好ましい形態として、抗原提示細胞上(表面)に結合されたペプチドが投与される。
【0050】
この方法は、ペプチドが免疫系、特に細胞傷害性T細胞(CTL)に提示されるため、有効である。これによって、CTLは腫瘍細胞を認識でき、特異的に死滅させることができる。例えば、樹状細胞、単球又はBリンパ球は、この目的における抗原提示細胞として適している。
【0051】
ここで、上記細胞は、例えば、生体外でペプチドをロードされる。一方、細胞で上記ペプチドを発現させるため、ペプチドをコードしているDNA又は対応するRNAを用いて細胞をトランスフェクションすることもできる。
【0052】
本発明者らは、研究によって、樹状細胞(DC)が、特異的なペプチドをロードできること、そして、これらのペプチドをロードされた樹状細胞がペプチドに特異的なCTLを活性化することを見いだした。このことは、免疫系が、各ペプチドを発現する腫瘍を標的とするCTLを生成するように刺激されうることを意味する。
【0053】
上記ペプチドを載せている抗原提示細胞は、そのまま用いることもでき、又は、使用に先立って熱ショックタンパク質gp96を用いて活性化することもできる。この熱ショックタンパク質は、MHCクラスI分子や、B7のような共刺激分子の発現を誘導し、更にサイトカインの生産を刺激する。このため、免疫反応の誘導は、すべてにおいて高められる。
【0054】
別の好ましい形態として、上記ペプチドは、白血球、特にTリンパ球をラベルするために用いられる。
【0055】
この使用方法の利点として、上記ペプチドを用いると、CTL群において上記ペプチドに特異的なCTLを検出することができることである。
【0056】
上記ペプチドはまた、腫瘍疾患の治療経過を評価するためのマーカーとして用いることもできる。
【0057】
上記ペプチドは、他の免疫処置や治療における治療のモニターするために用いることもできる。ここで、上記ペプチドは、治療に用いることができるだけでなく、診断においても用いることができる。
【0058】
更なる具体例として、上記ペプチドは、抗体を生成するために用いられる。
【0059】
一般的にポリクローナル抗体は、ペプチドの注入により動物を免疫処置し、次いで免疫グロブリンを精製することにより得ることができる。
【0060】
モノクローナル抗体は、例えば、Methods Enzymol.(1986), 121, Hybridomatechnology and monoclonal antibodiesに記載されているような一般的手順により生成する。
【0061】
更に、本発明は、ペプチドを1又は2以上含む医薬組成物に関する。
【0062】
この組成物は、例えば、非経口的に、例えば、皮下、皮内又は筋内に適用することができ、又は、経口投与することもできる。この場合、上記ペプチドは、薬学的に利用可能なキャリアー、好ましくは水性キャリアーに溶解又は懸濁される。上記組成物は更に、添加物、例えば、緩衝液、バインダー、希釈液等を含んでいても良い。
【0063】
上記ペプチドは、免疫刺激物質、例えば、サイトカインと共に投与することもできる。このような性質の組成物に用いることができる多くの添加剤についての記述があり、例えば、A. Kibbe, Handbook ofPharmaceutical Excipients, 3.ed,2000,American Pharmaceutical Association andpharmaceutical pressに記載されている。
【0064】
上記組成物は、腫瘍疾患及び/又はアデノーマ性疾患の防止、予防及び/又は治療に用いることができる。
【0065】
配列番号1〜79を有するペプチドを少なくとも1つ含む上記医薬組成物は、それぞれのペプチド又は抗原が関連する腫瘍疾患の患者に投与される。それゆえ、腫瘍特異的免疫反応が腫瘍特異的CTLを基にして誘導される。
【0066】
上記医薬組成物中に存在する1又は2以上のペプチドの量としては、治療学的に効果がある量である。これに関して、上記組成物に含まれるペプチドは、少なくとも2つの異なるHLAタイプに結合することができる。
【0067】
本発明は更に、配列番号1〜79のペプチドをコードしている核酸分子に関する。
【0068】
上記核酸分子は、DNA−又はRNA−分子を意味し、がんの免疫治療にも用いることができる。これにより、核酸分子により発現したペプチドは、そのペプチドを発現する腫瘍細胞に対する免疫反応を誘導する。
【0069】
本発明において、上記核酸分子は、ベクター中に供給されてもよい。
【0070】
本発明は更に、配列番号1〜79のペプチドを生産するように、上記核酸分子により遺伝子的に修飾されている細胞に関する。
【0071】
この目的のため、上記細胞は、上記ペプチドをコードしているDNA又は対応するRNAを用いてトランスフェクションされ、それにより細胞上にペプチドを発現する。この目的のため、例えば、樹状細胞、単球又はBリンパ球が、抗原提示細胞として好適である。
【0072】
上述した特性や以下に説明する特性は、明記された例の組み合わせにおいて用いることができるだけでなく、他の組み合わせ又は本発明の範囲を逸脱することなく、それら自体でも使用することができることは、言うまでもない。
【図面の簡単な説明】
【0073】
本発明の具体例が以下に図示し、説明されている。
【0074】
【図1】ケラチン18に特異的なCD8+Tリンパ球の検出を示す。
【図2a】c−Metペプチド(配列番号1)に特異的な、試験管系(in vitro)におけるCTL反応の誘導を示す。
【図2b】c−Metペプチド(配列番号1)に特異的な、試験管系(in vitro)におけるCTL反応の誘導を示す。
【図2c】アディポフィリン(adipophilin)ペプチド(配列番号2)に特異的な、試験管系(in vitro)におけるCTL反応の誘導を示す。
【図2d】アディポフィリン(adipophilin)ペプチド(配列番号2)に特異的な、試験管系(in vitro)におけるCTL反応の誘導を示す。
【図3a】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。c−Metペプチド(配列番号1)に誘導されるCTLにより媒介される溶解を示す。
【図3b】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。c−Metペプチド(配列番号1)に誘導されるCTLにより媒介される溶解を示す。
【図3c】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。c−Metペプチド(配列番号1)に誘導されるCTLにより媒介される溶解を示す。
【図3d】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。c−Metペプチド(配列番号1)に誘導されるCTLにより媒介される溶解を示す。
【図3e】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。アディポフィリンペプチド(配列番号2)に誘導されるCTLにより媒介される溶解を示す。
【図3f】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。アディポフィリンペプチド(配列番号2)に誘導されるCTLにより媒介される溶解を示す。
【図4a】誘導されたCTLに媒介される51Crでラベルした腫瘍細胞とラベルしていないパルスされたT2細胞を用いた溶解阻害アッセイを示す。c−Metペプチド(配列番号1)に誘導されたCTLに媒介されている。
【図4b】誘導されたCTLに媒介される51Crでラベルした腫瘍細胞とラベルしていないパルスされたT2細胞を用いた溶解阻害アッセイを示す。c−Metペプチド(配列番号1)に誘導されたCTLに媒介されている。
【図4c】誘導されたCTLに媒介される51Crでラベルした腫瘍細胞とラベルしていないパルスされたT2細胞を用いた溶解阻害アッセイを示す。アディポフィリンペプチド(配列番号2)に誘導されたCTLに媒介されている。
【図5a】誘導されたCTLに媒介される、腫瘍RNAを用いてトランスフェクションされた自己由来の樹状細胞の溶解を示す。c−Metペプチド(配列番号1)に誘導されたCTLにより媒介されている。
【図5b】誘導されたCTLに媒介される、腫瘍RNAを用いてトランスフェクションされた自己由来の樹状細胞の溶解を示す。アディポフィリンペプチド(配列番号2)に誘導されたCTLにより媒介されている。
【図6】試験管内(in vitro)で誘導されたアディポフィリン特異的自己由来CTLが、慢性白血病患者の自己由来腫瘍細胞を認識するが、自己由来樹状細胞又はB細胞を認識しないことを示す。
【発明を実施するための形態】
【0075】
実施例1
1.1 患者サンプル
組織学的に確認された腎臓細胞の悪性腫瘍を有する患者のサンプルは、ティュービンゲン大学の泌尿器科から入手した。患者はいずれも術前治療を受けていない。患者番号1(以下、RCC01と記す)は、以下のHLA型を有していた:HLA−A*02 A*68 B*18 B*44;患者番号2(以下、RCC13と記す):HLA−A*02 A*24 B*07 B*40。
【0076】
1.2 MHCクラスI分子結合ペプチドの単離
ショック冷凍(shock−frozen)した腫瘍サンプルは、Schirle,M.らの記載「新規T細胞−非依存アプローチによる、腫瘍関連MHCクラスIリガンドの同定(Identification of tumor-associated MHC-class I ligands by a novel Tcell-independent approach)」2000,European Journal ofImmunology,30:2216-2225に従い処理した。ペプチドは、クラスIHLAに特異的なモノクローナル抗体W6/32、又は、HLA−A2に特異的なモノクローナル抗体BB7.2を用いて標準的な手順により単離された。これらの抗体の生産方法と使用方法は、Barnstable, C.J.らの「グループA赤血球、HLAおよび他のヒト細胞表面抗原に対するモノクローナル抗体の生産−遺伝的解析のための新規ツール(Production of monoclonal antibodies to group A erythrocytes,HLA andother human cell surface antigens-New tools for genetic analysis.)」1978,Cell,14:9-20、及び、Parham, P.及びBrodsky F.M.の「BB7.2の部分精製および特性。HLA−A2およびHLA−A28の変異体に対する特異性を持つ細胞傷害性モノクローナル抗体(Partial purification and some properties of BB7.2.A cytotoxicmonoclonal antibody with specificity for HLA-A2 and a variant of HLA-A28)」1981,Hum.Immunol.,3:277-299による。
【0077】
1.3 質量分析
患者RCC01の腫瘍組織由来のペプチドは、逆相HPLC(SMART−system, μRPC C2/C18 SC 2.1/19, Amersham Pharmacia Biotech)により分離され、フラクションはnanoESI MSを用いて分析された。これに際し、手順はSchirle,M.等の報告に記載されている方法で実施した(Identification of tumor-associatedMHC-class I ligand by a novel T cell-independent approach, 2000,EuropeanJournal of Immunology, 30:2216-2225)。
【0078】
患者RCC13の腫瘍組織由来のペプチドは、上述したオンラインのキャピュラリーLC−MSに少し変更を加えて同定した。100 μl量のサンプルを注入し、300μm*5mm C18カラム(LC−packing)で脱塩し、予め濃縮した。気密性100μlシリンジ(1710 RNR、Hamilton)を備えたシリンジポンプ(PHD 2000, Harvard Apparatus, Inc.)は、溶媒とサンプルを2μl/分で流した。ペプチドの分離のため、予め濃縮するためのカラムは、75μm×250mm C18(LCパッキング)カラムに一列で切り替えた。その後TEEピース(ZT1C, Valco)及び300μm×150mm C18カラムのプレカラムを用いて、流速12μl/分を約300nl/分に減少して、70分間のB液濃度25%−60%の二液グラジエントを実施した。
【0079】
ブランクランを常時実施して、確実に本系に残余ペプチドを含めないようにした。オンライン断片化を上述のように実施して、断片スペクトルを手動で解析した。データベースサーチ(NCBInr, EST)は、MASCOT(http://www.matrixscience.com)を用いて行った。
【0080】
1.4 患者RCC01の腫瘍組織の77のMHCクラスIリガンドの同定
添付した表1に、HLA−A*02、HLA−A*68、HLA−B*18、又は、HLA−B*44に結合したリガンドを示した。HLA−A*02に結合したペプチドは、対立遺伝子に特異的なペプチドモチーフを示した:ポジション2がロイシン、バリン、イソロイシン、アラニン又はメチオニンで、C末端がロイシン、バリン、イソロイシン又はアラニンである。多くのリガンドは、いわゆるハウスキーピングタンパク質由来であるが、腫瘍関連グループと報告されているタンパク質由来のリガンドも検出された。
【0081】
HLA−A*68リガンドは、アンカーアミノ酸であるポジション2のスレオニン、イソロイシン、バリン、アラニン又はロイシンと、C末端のアルギニン又はリジンによって同定された。これは、HLA−A*6801サブタイプを示す。アディポフィリン由来の別の2つのリガンド、すなわちMTSALPEIQK及びMAGDIYSVFRが、HLA−A*68が提示するペプチド中に発見された。更に腫瘍関連サイクリンD1由来のETIPLTAEKLが見つかった。ペプチドTIVNILTNRは、アネキシンI(Annexin II)由来であり、このタンパク質はメラノーマ患者のMHCクラスIIと関連する免疫原であることが分かっている(Heinzel et al., The self peptideannexin II(208-223) presented by dendritic cells sentisizes autologous CD4+T-lymphocytes to recognize melanoma cells, 2001,Cancer Immunol. Immunother.49:671-678参照)。更に、リガンドは、HLA−B*44サブタイプのアンカーアミノ酸であるグルタミン酸をポジション2に有していた。HLA−B*18のペプチドモチーフは知られていないので、これらの2つのHLA−B分子間の区別は不可能であった。
【0082】
1.5 患者RCC13の腫瘍組織のMHCクラスIリガンド
患者RCC13の腫瘍組織にも、患者RCC01において確認された同じリガンドが同定された、プロトオンコジーン(c−Met)とケラチン18由来のリガンドと同じリガンドが確認された:配列番号1と3を有するペプチドである。更に、この腫瘍組織からは、別のリガンドが得られ、ニコチンアミド−N−メチルトランスフェラーゼ(NNMT)に由来するリガンドが確認された;この遺伝子は、全ての腎臓悪性腫瘍の95%以上において過剰発現される。更に、その他のリガンドのいくつかは、RCC01のペプチドのレパートリーと共通している。
【0083】
1.6 正常CD8+T細胞レパートリー中のケラチン18特異的T細胞の検出
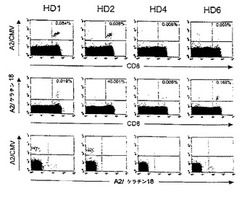
健康な患者由来の末梢血単核細胞を、アディポフィリン−、ケラチン18−又はmet−プロトオンコジーン(c−Met)ペプチドと共に折り畳まれたHLA−A*0201四量体で染色した:四量体の生成のため、組換えHLA−A*0201分子は、試験管内(インビトロ)でSVASTITGV(配列番号2、アディポフィリン),ALLNIKVKL(配列番号3、ケラチン18)又はYVDPVITSI(配列番号1、met−プロトオンコジーン、c−Met)と共に折り畳まれ、ゲルろ過により精製され、単量体を連結するためにビオチン化され、ストレプトアビジンと混合された。
【0084】
健康な22の個体のうち4個体において、予想外に、ケラチン18特異的CD8+T細胞の有意な個体群が見られた。ダブル染色の結果を、図1にドットプロットで示す。中段にケラチン18で染色した結果を示す。CD8+陽性T細胞の0.02〜0.2%がケラチン18特異的であった。ドットプロットの下段から分かるように、ケラチン18四量体の結合は特異的であった。
【0085】
実施例2
腫瘍細胞による配列番号1(YVDPVITSI)(c−Metオンコジーンのペプチド断片)及び配列番号2(アディポフィリンのペプチド断片)のペプチドの提示、及び、CTLによるそれらの認識について分析するため、c−Metペプチド(配列番号1のペプチド)に特異的なCTLとアディポフィリンペプチド(配列番号2のペプチド)に特異的なCTLが、試験管内で誘導された。この操作において、健康なHLA−A*02陽性ドナー由来の樹状細胞(DC)が用いられた。
【0086】
2.1 DCの生成
末梢血単核細胞(PBMNC)は、テュービンゲン大学の血液バンクの健康なボランティアの軟膜層(buffy coat)の調製物から得られたヘパリン化された血液を、Ficoll/Paque(Biochrom, Berlin, Germany)を用いて、密度勾配遠心分離することにより単離された。細胞は、RP10培地(RPMI 1640、熱で不活化したウシ胎児の血清10%と抗生物質を添加した)を使用した6穴のプレート(Falcon, Heidelberg, Germany)に植えられた(1穴あたり1×107細胞/3ml)。37℃、5%CO2で2時間インキュベーションしたあと、非粘着性の細胞を除去し、以下のサイトカインを添加したRP10培地で粘着性の血液の単球を培養した:ヒト組換えGM−CSF(顆粒球マクロファージコロニー刺激因子;Leukomax, Novartis; 100ng/ml)、インターロイキン IL−4(R&D Systems, Wiesbaden, Germany, 1000 IU/ml)及びTNF−α(腫瘍壊死因子α)(R&D Systems, Wiesbaden, Germany, 10ng/ml)。
【0087】
2.2 ペプチド合成
典型的な、2つのHLA−A*02結合ペプチド(上述したように同定されたc−Met (配列番号1、YVDPVITSI)又はアディポフィリン(配列番号2,SVASTITGV))は、標準F−moc試薬を用いてペプチド合成機(432A, Applied Biosystems,Weiterstadt, Germany)で合成され、逆相HPLCと質量分析により分析された。この方法で、同定されたペプチドの充分量を得ることができる。
【0088】
2.3 HLA−A*02により限定される合成ペプチドを用いた抗原特異的CTL反応の誘導
CTL誘導のため、ステップ2.1で得られたDC(5×105)を、ステップ2.2で得られた配列番号1又は配列番号2のペプチド各50μl/mlと共に2時間パルスし、洗浄し、自己由来の2.5×106のPBMNCとRP10培地中でインキュベートした。
【0089】
7日間培養した後、細胞を、ペプチドと共にパルス刺激された自己由来のPBMNCにより再刺激した。その過程において、1ng/mlのヒト組換えインターロイキンIL−2(R&D Systems)を1、3、5日に添加した。それにより誘導されたCTLの細胞溶解活性は、最終の再刺激の後5日目に標準51Cr放出アッセイ(以下の項目2.4を参照:CTLアッセイ)により分析した。
【0090】
2.4 CTLアッセイ
CTLアッセイにおいて、腫瘍細胞、異なる細胞株のペプチド−パルス細胞及び自己由来のDCが標的細胞として用いられた。ペプチド−パルス細胞は、50μg/mlのペプチド(配列番号1又は配列番号2)と共に2時間パルスされた。全ての標的細胞は、RP10培地(RPMI 1640、熱で不活化したウシ胎児の血清10%と抗生物質を添加した)中で〔51Cr〕クロム酸ナトリウムを用いて、1時間の間37℃でラベルされた。その後、1穴あたり104の細胞を96穴の丸底プレートに移した。最終体積が200μlとなるようにCTLの数を変化させて加えて、4時間37℃でインキュベートした。アッセイの終わりに、上澄み(1穴あたり50μl)を採取して、ベータ−プレートカウンターで数えた。特異的な溶解の割合は、次のように計算した:100×((実験に基づく放出数)−(自然放出数))/((最大放出数)−(自然放出数))。自然放出数及び最大放出数は、それぞれ培地又は2%Triron X−100いずれかの存在下で決定した。
【0091】
2.5 CTL誘導の結果
a) ペプチド−パルスDCに対するCTL細胞傷害活性
図2には、T2−又はDC−細胞に対する誘導されたCTL(項目2.3参照)の細胞傷害活性に関する51Cr放出アッセイの結果を示す。T2−細胞株はHLA−A*02陽性で、TAP(抗原処理に関連する輸送体)欠損である;(TAPペプチド輸送体は、タンパク質性のペプチド断片を細胞質ゾルから小胞体に輸送し、そこでそれらはMHC分子と結合する)。
【0092】
図2の2a及び2bに、配列番号1のペプチドにより誘導されたCTLのT2−又はDC−細胞に対する細胞傷害活性を示す。どちらの細胞型も、配列番号1の(c−Met)ペプチド(黒く塗られた四角)、又は、関係のないペプチド(Survivin(=“Sv”;ELTLGEFLKL;配列番号80)又はHIV(ILKEPVHGV;Pol.HIV−1逆転写酵素ペプチド、ポジション476−484;配列番号81)と共に予めパルスされている。図2c及び2dに、配列番号2のペプチドにより誘導されたCTLのT2−又はDC−細胞に対する細胞傷害活性を示す。T2−又はDC−細胞どちらの細胞型も、配列番号2のアディポフィリンペプチドと共に予めパルスされている。
【0093】
51Crの放出により証明される特異的な溶解を、図2a−2dのグラフに、同様に図3−5のCTL溶解のグラフに、標的細胞(溶解する51Crでラベルされた細胞)に対するエフェクター細胞(CTL)の細胞の割合を変化させて示す。
【0094】
図2a−2dに示されるように、抗原特異的な細胞殺傷能が、CTL細胞株(この細胞株は2週間ごとの再刺激で生成されたものである)について証明された。配列番号1のc−Metペプチド(図2a及び2b)又は配列番号2のアディポフィリンペプチド(図2c及び2d)を与えられた細胞のみがCTLの増加により溶解した(図2a−2d中の黒塗り四角の曲線参照);一方、関係のないペプチドとパルス処理したコントロール細胞は、溶解しなかった(塗りつぶされていない四角で示す曲線)。これゆえ、溶解活性の特異性が証明された。
【0095】
b) 腫瘍細胞株に対するCTL細胞傷害活性
次いで、再び標準的な腫瘍51Cr放出アッセイにおいて、配列番号1のc−Metペプチド又は配列番号2のアディポフィリンペプチドに特異的なCTLが、細胞内でc−Met−プロトオンコジーン又はアディポフィリンを発現している腫瘍細胞を認識し、溶解するかどうかを調べた。
【0096】
その実験において、以下に示す51CrでラベルされたHLA−A*02陽性細胞株が用いられた:HCT166(大腸がん;G.Pawelec教授(テュービンゲン、ドイツ)から入手)、A 498、MZ 1257及びMZ 1774(腎臓細胞がん、A. Knuth教授(フランクフルト、ドイツ)から入手)、MCF−7(乳がん;ATCC American Type Culture Collectionから入手)、Mel 1479(悪性メラノーマ;G.Pawelec教授(テュービンゲン、ドイツ)から入手)、U 266(多発性骨髄腫;G.Pawelec教授(テュービンゲン、ドイツ)から入手)。これらの細胞株は、標的構造(ターゲット)としてc−Met−プロトオンコジーン及びアディポフィリンを発現する。
【0097】
この実験において、CEBV(エプスタイン・バールウイルス)で不死化したB細胞株Croft、HLA−A*01陽性(O.J.Finn(ピッツバーグ、米国)から入手、)、SK−OV−3(卵巣がん;HLA−A*03陽性;O.J.Finn(ピッツバーグ、米国)から入手)、がネガティブコントロールとして用いられた。K 562細胞(例えば、the German Collection of MikroOrganism and Cell Cultures DSMZから入手可能;ACC 10)は、ナチュラルキラー細胞(NK)の活性を決定するために用いられた。この細胞株は、これらのキラー細胞に対する感受性が高いためである。
【0098】
すべての細胞株は、RP10培地(RPMI 1640、熱で不活化したウシ胎児の血清10%と抗生物質を添加した)中で培養された。
【0099】
上述した腫瘍細胞株と誘導されたCTLを用いて、上述した方法により51Cr放出アッセイ(項目2.4.参照)を行った。
【0100】
図3a−3fに、これらのCTLアッセイの結果を示す。図3a−3dにおいては、配列番号1のc−Metペプチドを用いて誘導されたCTLが用いられ、図3e−3fにおいては、配列番号2のアディポフィリンペプチドを用いて誘導されたCTLが用いられた。
【0101】
図3a−3fに示されるように、配列番号1を有するc−Metペプチドに特異的なCTL(図3a−3d)又は配列番号2を有するアディポフィリンペプチドに特異的なCTL(図3e及び3f)は、HLA−A*02及びc−Met又はアディポフィリンの両方を発現している腫瘍細胞を効果的に溶解した(図3aは細胞株HCT 116、図3bは細胞株A 498、図3cは細胞株MZ 1257及びMEL 1479、図3dは細胞株MCF−7及びU 266;図3eは細胞株A 494、U 266及びMCF−7、図3fは細胞株MZ 1774、Mel 1479及びMZ 1257)。特異的溶解は、項目2.4に記載したように、51Cr放出により測定した。配列番号1のペプチドにより誘導されたCTLによっても、配列番号2のペプチドにより誘導されたCTLによっても、コントロールの細胞株SK−OV−3(HLA−A*02陰性)の溶解はなかった。このように、ターゲット細胞を効果的に溶解するためには、HLA−A*02分子と共に腫瘍細胞に両ペプチドが提示される必要があることが明らかとなった。更に、CTLの抗原特異性及びMHC制限がこの方法により明らかになった。
【0102】
配列番号1を有するペプチドにより試験管内で誘導されたCTL細胞は、K562細胞株(図3a、3b及び3d参照)を認識せず、細胞傷害活性はナチュラルキラー(NK)細胞によっては媒介されないことを示した。
【0103】
c)阻害アッセイ
試験管内で誘導されたCTLの抗原特異性とMHC制限を更に確かめるため、51Crでラベルしていない(“cold”)阻害細胞株を用いて阻害アッセイを行った。
【0104】
ペプチド−パルス細胞株の能力は、腫瘍細胞の溶解を阻害することで分析した(競合アッセイ)。このため、過剰量の阻害剤(過剰量のラベルしていないパルス細胞)が用いられた。阻害剤(ペプチド−パルス細胞)の標的細胞(腫瘍細胞)に対する比率は、20:1であった。阻害細胞株はラベルされていないので、阻害細胞株が溶解するときには51Crは放出されなかった。
【0105】
細胞株T2(HLA−A*02;TAP欠損;項目2.5.a)参照)が阻害剤として用いられた。アッセイの前に、この細胞株T2は関連するペプチド(配列番号1又は2)又は関係のないペプチド(Survivin(=Sv)、配列番号80)それぞれを用いてパルスされた。
【0106】
これらの試験結果を図4a−4cに示す。それによれば、図4a及び4bでは、c−Metペプチド(配列番号1)に誘導されたCTLが用いられ、図4cでは、アディポフィリンペプチド(配列番号2)に誘導されたCTLが用いられた。
【0107】
図4a及び4bにおいて、51Crでラベルした細胞株U 266及びA 498の溶解は、阻害剤細胞株無しでテストした(黒く塗られた四角の曲線参照);関係のないペプチド(Survivin(=Sv)、配列番号80;ネガティブコントロール、塗りつぶされた三角)と共にパルスした阻害剤細胞株T2を用いた溶解;配列番号1のc−Metペプチドと共にパルスした阻害細胞株T2を用いた溶解(塗りつぶされていない菱形の曲線)。
【0108】
阻害剤細胞の存在なしで、CTLによる腫瘍細胞の溶解が証明された(図4a−dにおいて黒く塗られた四角の曲線をそれぞれ参照)。更に、図4a及び4bに示されるように、阻害剤標的が配列番号1のc−Metペプチドを用いてパルスされていれば(塗りつぶされていない菱形の曲線それぞれ参照)、過剰量の阻害剤を用いた場合には標的腫瘍細胞は溶解しなかった(そして51Crが放出されなかった)。CTL活性は、過剰量のラベルされていないT細胞に向けられ、それゆえこれらの細胞が溶解し、腫瘍細胞は溶解しなかった。関係のないペプチド(Survivin(=Sv)、配列番号80)を用いてパルスしたT2細胞は、CTLによる腫瘍細胞の溶解を阻害しなかったので、放出された51Crが測定された(図4a及び4bの黒塗り三角の曲線参照)。
【0109】
配列番号2のアディポフィリンペプチドを用いて誘導されたCTLを用いた場合も、同様の結果が示された。
【0110】
アディポフィリンにより誘導されたCTLの細胞傷害活性のMHC制限と抗原特異性は、HLA−A*02特異的モノクローナル抗体を用いて,ラベルしていない(“cold”)阻害剤を用いた阻害アッセイによって確認された:この実験結果を図4cに示す。HLA−A*02特異的抗体(モノクローナル抗体BB7.2、IgG2b、S.Stefanovic、ティュービンゲンから入手)を添加したとき、A 498腫瘍細胞はブロックされ、そのためそれらは添加したCTLによって溶解されず、51Crは放出されなかった(図4cの塗られた三角印の曲線参照)。コントロールとしてHLA−A*02をブロックしない非特異的抗体(ChromPure Maus IgG、Dianova、ドイツ;図4cの塗られた四角の曲線参照)が用いられた。これらの阻害アッセイにおいて、細胞は、96穴のプレート上に播種する前に、10μg/mlの抗体と共に30分間インキュベートされた。
【0111】
更に、関係のないペプチドSurvivin(配列番号80)(T2/SV)を用いてパルスされたT2競合細胞株は、CTLに誘導される腫瘍細胞株A 498の溶解を阻害できないが(図4cの黒く塗られた丸の曲線参照)、配列番号2のアディポフィリンペプチドを用いてパルスされたCTLT2阻害細胞株(T2/AD)は腫瘍細胞株の溶解を阻害することができ、このため−後者を言い換えると−51Crの放出は観察されなかった(図4cのx印の曲線参照)。
【0112】
d) トランスフェクションされたDCの特異的溶解
次の実験では、自己セッティング(autologous setting) CTL細胞傷害活性について分析した。そこでは、CTL誘導のために用いられた(項目2.2.参照)のと同じPBMNCから生成した自己由来のDCが標的細胞として用いられた。CTLアッセイに先立って、DCは、腫瘍細胞株から予め単離されたRNA又はコントロールRNAに相当するRNA(試験管内で転写されたEGFP−RNA、強化緑色蛍光タンパク質RNA;プラスミド:pSP64 Poly(A) EGFPII、Van Tendeloo、アントワープ、ベルギーより入手)を用いてエレクトロポレートされた。腫瘍細胞の全RNAはQIAGEN Rneasy Mini Kit(QIAGEN、Hilden、ドイツ)を用いて、製造者の手順に従って単離された。RNA量と純度は、分光学的手法により決定し、等分して−80℃で貯蔵した。
【0113】
6日目のエレクトロポレーションに先立って、未成熟なDCは血清を含まないX−VIVO 20培地(BioWhittaker、Walkersville、米国)で2回洗浄され、最終濃度2×107細胞/mlに再懸濁された。次いで、細胞懸濁液200μlを総量10μgのRNAと混合し、4mmキュベット中でEasyject PlusTM(Peglab,Erlangen、ドイツ)を用いてエレクトロポレーションした(パラメーター:300V、150μF、1540Ω、パルス時間231ms)。エレクトロポレーションの後、細胞はすぐにRP10培地に移され、インキュベーターに戻された。80%以上の細胞が、エレクトロポレーション後に生存していることが分かった。
【0114】
これらの試験結果を図5a及び5bに示す。図5aにおいては、配列番号1のc−Metペプチドで誘導されたCTLが用いられ、図5bにおいては、配列番号2のアディポフィリンペプチドで誘導されたCTLが用いられた。
【0115】
c−Metペプチド(配列番号1)で誘導されたCTL(項目2.4.参照)を用いたCTLアッセイを行った後、c−Metペプチド発現腫瘍細胞株(A 498及びMCF−7)のRNAを用いてエレクトロポレーションしたDCの特異的溶解が証明された(図5a中の黒く塗られたシンボルの曲線参照)。c−Metペプチド非発現腫瘍細胞株CroftのRNAを用いてエレクトロポレーションしたDCは、溶解しなかった(塗りつぶしていない菱形の曲線参照)。
【0116】
配列番号2のアディポフィリンペプチドによって誘導されたCTLは、アディポフィリン発現腫瘍細胞株A 498(図5bの黒く塗られた三角の曲線参照)のRNAを用いてエレクトロポレーションしたDCを溶解した。更に、アディポフィリンペプチド配列番号2と共にパルスされたDCは、溶解した(図5bの黒塗り菱形の曲線参照)。一方、コントロール(EGFP)RNAを用いてエレクトロポレーションしたDCは、溶解しなかった(図5bの塗りつぶしていない三角の曲線参照)。
【0117】
このように、配列番号1のc−Metペプチド又は配列番号2のアディポフィリンペプチド陽性腫瘍細胞のRNAを用いてDCをトランスフェクションした後、同定されたペプチド、すなわち配列番号1のc−Metペプチド又は配列番号2のアディポフィリンペプチドは処理され、提示されたことが証明された。
【0118】
e) 慢性リンパ性白血病患者におけるアディポフィリン特異的CTLの誘導
更なる研究において、HLA−A*0201陽性の慢性リンパ性白血病(CLL)患者のPBMNCからCTLが生じ、これは配列番号2のアディポフィリンペプチドに特異的であった。この患者は、フルダラビンで治療後、症状が軽減した。更に、この患者由来のCLL細胞及びDCが、51Crでラベルされる標的としてアッセイで用いられた。このアッセイでは、ペプチドに誘導されるCTLにより51Crの放出が媒介される。
【0119】
図6に示すように、ペプチドに誘導されるCTLは、自己由来のCLL細胞(“CLL cells”)と同様に、配列番号2のアディポフィリンペプチドと共にパルスされたこの患者由来のDC(“DC+AD”)を効果的に溶解した。一方、関係のないペプチド配列番号80のSurvivinを用いてパルスしたDC(“DC+SV”)は、溶解しなかった。悪性でないB細胞及び細胞株K 562も、CTLによって溶解しなかった。
【0120】
CTL反応の特異性は、配列番号2のアディポフィリンペプチド又は関係ないペプチド配列番号80のSurvivinと共にパルスされた細胞株T2(上記参照)を阻害細胞として用いた標的阻害アッセイによって更に確認された。配列番号2のアディポフィリンペプチドによって誘導されたCTLは、対応する配列番号2のペプチドと共にパルスされた過剰量の阻害剤細胞株を溶解し、そのため、51Crでラベルされた腫瘍細胞はこの場合には溶解されなかった(図6中の塗りつぶされていない四角の曲線参照)。
【0121】
結論として、本発明者らは、同定されたペプチドが、多くの(腫瘍)疾患の免疫療法の分野において、将来有望な物質であることを示した。
【表1】




【技術分野】
【0001】
本発明は、ヒト主要組織適合複合体(MHC)クラスI分子に結合することができる腫瘍関連ペプチド(tumor−associated peptide)に関する。
このようなペプチドは、例えば、腫瘍関連疾患(tumor−associated diseases)の免疫療法に用いられる。
【背景技術】
【0002】
腫瘍細胞が免疫機構により排除されるとき、免疫機構の構成要素による腫瘍関連抗原(tumor−associated antigens:TAA)の同定は中心的な役割を果たしている。この機構は、腫瘍細胞と正常細胞との間に、質的又は量的な違いが存在することに基づく。抗腫瘍反応を引き起こすためには、腫瘍細胞は、腫瘍を排除するのに充分な免疫反応を引き起こす抗原を発現する必要がある。
【0003】
特に、CD8を発現している細胞傷害性Tリンパ球(以下、CTLという)は、腫瘍の排除に関わっている。このような細胞傷害性T細胞による免疫反応を引き起こすためには、T細胞に対して外来性のタンパク質やペプチドが提示されなければならない。抗原は、それらがMHC分子によって細胞表面に提示されたときにのみ、T細胞によりペプチド断片として認識される。これらのMHC(“主要組織適合複合体”)分子は、通常細胞内でペプチドと結合し、それらを細胞表面に輸送するペプチド受容体である。ペプチドとMHC分子とのこの複合体は、T細胞により認識される。ヒトMHC分子は、ヒト白血球抗原(HLA)とも呼ばれる。
【0004】
MHC分子には2つのクラスがある:MHCクラスI分子は、ほとんどの有核細胞に存在し、細胞内タンパク質の分解によって生じるペプチドを提示する。
MHCクラスII分子は、専門的な抗原提示細胞(APC)にのみ存在し、エンドサイト−シスの間に取り込まれて加工される外来性タンパク質のペプチドを提示する。ペプチド/MHCクラスI分子複合体は、CD8陽性の細胞傷害性Tリンパ球によって認識され、ペプチド/MHCクラスII分子複合体は、CD4ヘルパーT細胞によって認識される。
【0005】
細胞の免疫反応を引き起こすためには、ペプチドはMHC分子に結合しなければならない。この反応は、MHC分子の対立遺伝子とそのペプチドのアミノ酸配列に依存する。MHCクラスI結合ペプチドは、一般的には8から10残基の長さで、配列中に2つの保存された残基(「アンカー」)を含み、これらがMHC分子中に存在する相補的なくぼみ(ポケット)と結合する。
【0006】
免疫系が腫瘍関連ペプチドに対して効果的なCTL反応を引き起こすためには、これらのペプチドは、腫瘍細胞に発現される特異的なMHCクラスI分子に結合することができるだけでなく、特異的なT細胞受容体(TCR)を有するT細胞によって認識される必要がある。
【0007】
腫瘍ワクチンを開発する際の主な目的は、CD8+CTLによって認識される腫瘍関連抗原の同定と特定である。
【0008】
腫瘍特異的細胞傷害性Tリンパ球によって認識される抗原又はそれらのエピトープは、それぞれ、酵素、受容体、転写因子等の全てのクラスのタンパク質分子でありうる。腫瘍関連抗原の別の重要なクラスは、様々な種類の腫瘍や健康な精巣組織において発現される癌精巣抗原のような、組織特異的な構造である。
【0009】
Tリンパ球がタンパク質を腫瘍特異的抗原として認識するためには、そしてそれらを治療に用いるためには、以下の要件が満たされている必要がある:抗原は、腫瘍細胞によって主に発現されており、正常細胞では発現されていないか又は腫瘍におけるように、少なくとも少量が発現している必要がある。更に、特異的な抗原が一種の腫瘍中に存在するだけでなく、他の種類の腫瘍にも高濃度で存在していることが好ましい。更に、抗原のアミノ酸配列中のエピトープの存在が不可欠である。これらの腫瘍関連抗原由来のペプチドは、試験管内(in vitro)又は生体内(in vivo)のいずれにおいてもT細胞反応を誘導すると考えられているためである。
【0010】
このように、TAAは、腫瘍ワクチン開発の出発点である。TAAの同定方法及び特定方法は、患者由来のCTLの利用、又は腫瘍組織と正常組織との間に異なる転写プロファイルが生じることに基づく。
【0011】
腫瘍組織で過剰発現された、又は、このような組織において選択的に発現された遺伝子の同定は、これらの遺伝子から翻訳された抗原の、免疫療法への利用について正確な情報を与えない。これは、T細胞反応は、MHCの提示を媒介として、抗原全体ではなく抗原のエピトープのみによって引き起こされるので、これらの抗原のいくつかのエピトープのみがこのような利用に適当であるという事実に基づく。このように、過剰発現された、又は、選択的に発現されたタンパク質からMHC分子によって提示されるこれらのペプチドを選択することは重要であり、それにより細胞傷害性Tリンパ球による特異的な腫瘍の認識に対する取り組みの着手点となる。
【発明の概要】
【発明が解決しようとする課題】
【0012】
上記観点から、本発明は、ヒト主要組織適合複合体(MHC)クラスI分子に結合することができる、このようなペプチドの少なくとも一つの新規なアミノ酸配列を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明によれば、添付した配列プロトコルの配列番号1〜配列番号79からなる群より選択されるアミノ酸配列を含む腫瘍関連ペプチドであって、上記ペプチドは、ヒト主要組織適合複合体(MHC)クラスI分子に結合することができるペプチドを提供することにより上記課題は達成される。
本発明の基礎をなす課題は、これにより、完全に達成される。
【0014】
言うまでもなく、腫瘍から同定されるペプチドは、量産するため、そして以下に述べる目的に使うため、合成されてもよく又は細胞中で発現されてもよい。
【0015】
本発明者らは、上述したペプチドを、MHCクラスI分子に特異的なリガンドとして腫瘍関連組織から同定することができた。これに関連して、「腫瘍関連」ペプチド(“tumor−associated” peptide)の用語は、ここでは腫瘍材料から単離され、同定されたペプチドを意味する。真性(一次)腫瘍に提示されるこれらのペプチドは、腫瘍細胞中で抗原処理を受ける。
【0016】
例えば、上記ペプチドが由来する対応する抗原を発現する腫瘍細胞に対する免疫反応を引き起こすため、癌の治療において特異的なリガンドを用いることができる。
【0017】
一方では、このようなCTLの誘導による免疫反応は、生体内で達成しうる。この目的のため、ペプチドは、例えば、医薬組成物の形態で、TAAに関連する腫瘍疾患に苦しむ患者に投与される。
【0018】
他方では、ペプチドが由来する抗原を発現する腫瘍に対するCTL反応は、生体外(ex vivo)で誘導しうる。この目的のため、CTL前駆体細胞は、抗原提示細胞及びペプチドと共にインキュベートされる。これによって刺激されたCTLは次いで培養され、そしてこれらの活性化されたCTLが患者に投与される。
【0019】
更なる可能性は、生体外でペプチドをAPCにロード(load)しそしてこれらのロードされたAPCを、腫瘍組織においてこのペプチドが由来する抗原を発現している患者に投与することである。上記APCは生体内で次々にCTLにペプチドを提示し、それらを活性化する。
【0020】
本発明のペプチドは、診断試薬として利用することもできる。
ここでは、ペプチドは、CTL集団中に特異的にそのペプチドに向かうCTLが存在するかどうか、又は、CTLが治療により誘導されたかどうかを知るために用いることができる。
【0021】
更に、そのペプチドに対して反応性を示すT細胞前駆体の増加が、そのペプチドを用いて調べられる。
【0022】
更に、そのペプチドは、ペプチドが由来する抗原を発現する腫瘍の病気の経過を評価するマーカーとして用いることができる。
【0023】
添付した表1に、同定されたペプチドが示されている。これらペプチドは、それが結合するそれぞれのHLAタイプに従って配列されている。更に、表にはペプチドが由来するタンパク質と、そのタンパク質中のペプチドの各位置が配列されている。ここに、翻訳上の誤解を避けるためタンパク質の英語表記を残した。更に、National Instisute of Healthの“National Center for Biotechnology Information”の遺伝子バンクに載せられているAcc番号が引用されている(http://www.ncbi.nlm.nih.gov参照)。
【0024】
本発明者らは、2人の患者、RCC01とRCC13の腎臓細胞の悪性腫瘍からペプチド(又はリガンド)を分離することができた。ここで、患者RCC01の腫瘍組織から68のリガンドが単離され、患者RCC13の腫瘍組織から13のリガンドが単離された。両患者において同定されたリガンドのうち2つのリガンドは、同一であった。これらは、配列番号1と3を有するペプチドであった(met−プロトオンコジーン(C−Met)のYVDPVITSIとケラチン18のALLNIKVKL)。
【0025】
79のリガンドが患者の腫瘍から同定され、それらのうちの30はHLAサブタイプのHLA−A*02と結合し、13はHLA−A*68と結合し、34はHLA−B*18又はHLA−B*44と結合し、2つはHLA*24と結合した。
【0026】
HLA−A*02リガンドは、全て対立遺伝子特異的ペプチドモチーフを提示していた(ポジション2にロイシン/バリン、イソロイシン、アラニン又はメチオニン;C末端にロイシン/バリン、イソロイシン又はアラニン)。
【0027】
上記リガンドの中には、多量に発現される、ほとんどの組織で等しく発現されるいわゆるハウスキーピング遺伝子に由来するものもあったが、多くは腫瘍との結合により区別された。
【0028】
例えば、配列番号1 YVDPVITSIを有するペプチドは、リガンド、特に腫瘍と結合しmet−プロトオンコジーン(c−Met)(ポジション654−662)に由来するリガンドに関連する。配列番号2、22及び23を有するペプチドは、アディポフィリン(adipophilin)( “脂肪細胞分化関連”タンパク質とも呼ばれる)に由来し、このタンパク質のポジション129−137、62−71及び349−358を構成し、最後の2つのペプチドはHLA−A*68が提示するペプチドの中に包含される。配列番号3を有するリガンドは、ケラチン18由来のリガンドで、ポジション365−373に位置する。
【0029】
上記リガンドの大部分は、ポジション2にグルタミン酸(E)を有しており、このグルタミン酸は、HLA−B*44サブタイプのアンカーアミノ酸である。このように、ペプチドが初期の研究で免疫原性であると証明されたタンパク質由来であることを確認できた。例えば、配列番号5を有するペプチドは、タンパク質アネキシンII(Annexin II)(アネキシンII中のポジション:55−63)に由来する。このタンパク質は、メラノーマ患者に存在するMHCクラスII分子に関する免疫原性であることが証明されている(Heinzel et al., The self peptide annexin II(208-223)presented by dendritic cells sentisizes autologous CD4+ T-lymphocytes torecognize melanoma cells, 2001,Cancer Immunol. Immunother. 49:671-678参照)。
【0030】
更に、タンパク質、特に腫瘍組織で過剰発現されるタンパク質由来のいくつかのペプチドも同定できた。このように、ビメンチン(Vimentin)のフラグメント(EEIAFLKKL、ポジション229−237)及びカルデスモン(Caldesmon)のフラグメント(DEAAFLERL、ポジション92−100)を同定できた。Yangらは、これらのタンパク質が、腎臓細胞の癌組織で過剰発現されることを開示している(Expression profiling of renalepithelial neoplasms: a method for tumor classification and discovery ofdiagnostic molecular markers, 2001, Am. J. Pathol.,158:1639-1651)。
【0031】
本発明者らは更に、中でも特に、est−1由来のリガンド(NEFSLKGVDF、ポジション86−95)、アルファ−カテニン(Alpha−Catenin)由来のリガンド(NEQDLGIQY、ポジション169−177)及びガレクチン2(Galectin 2)由来のペプチド(SEVKFTVTF、ポジション80−88)を同定することができた。
【0032】
本発明者らは更に、酵素ニコチンアミド−N−メチル−トランスフェラーゼ由来のフラグメントYYMIGEQKF(配列番号79)を単離した。高橋らは、この酵素が腎臓細胞癌において過剰発現されることを開示している(Gene expression profiling of clearcell renal cell carcinoma: gene identification and prognostic classification,2001, Proc. Natl. Acad. Sci. USA,98:9754-9749)。
【0033】
驚くべきことに、本発明者らは提供者の血液中の同定されたペプチドの中の1つに特異的な細胞傷害性Tリンパ球を検出することができた。このように、腫瘍に特異的なCTL反応を誘導することが可能となる。
【0034】
本発明者らは、本研究において、2つの具体例として選択されたペプチドを用いることによって、配列番号1(c−met−プロトオンコジーンフラグメント又はc−Metペプチド)を有するペプチド又は配列番号2(アディポフィリンフラグメント又はアディポフィリンペプチド)を有するペプチドに特異的なTリンパ球(CTL)が生体内で発生することを明らかにすることができた。これらのCTLは、それぞれのタンパク質を発現した、異なる患者の異なる腫瘍細胞株由来の腫瘍細胞を特異的に死滅させることができた。本発明者らはまた、上述したCTLについて、例えば、予め対応するペプチドを用いてパルスされた樹状細胞が溶解されることを明らかにした。本発明者らはまた、本発明のペプチドをエピトープとして用いると、ヒトT細胞が試験管内で活性化されることを、これらの研究から明らかにした。本発明者らは、患者の末梢血単核細胞(PBMNC)から得られ、ある種のペプチドに特異的なCTLが、別の患者の同種の腫瘍細胞を死滅させることができるという点についてのみ、証明できなかった。本発明者らは更に、他種の腫瘍細胞であってもこれらのCTLにより溶解することを明らかにした。
【0035】
好ましい具体例として、配列番号1〜配列番号79からなるペプチド及びこれらの配列の少なくとも1つのアミノ酸が、類似する化学的性質を有する他のアミノ酸によって置換されているペプチドは、免疫反応の活性化にも用いられる。
【0036】
それぞれのMHC−サブタイプに関しては、例えば、これらのアンカーアミノ酸は類似する化学的性質を有する他のアミノ酸によって置換されていてもよい。例えば、MHCサブタイプHLA−A*02と結合するペプチドにおいて、ポジション2のロイシンは、イソロイシン、バリン又はメチオニンで置換されていても良く、逆もまた同じである。C末端のロイシンは、バリン、イソロイシン及びアラニンで置換されていても良く、これらは全て非極性側鎖を有する。
【0037】
更に、配列番号1〜79を有するペプチドが、N末端又はC末端に少なくとも1つの付加的なアミノ酸を含むものであるか、又は、配列中の少なくとも1つのアミノ酸が欠損しているものであっても用いることができる。
【0038】
更に、配列番号1〜79を有するペプチドが、少なくとも1つのアミノ酸が化学的に修飾されているものであっても用いることができる。
【0039】
(1又は2以上の)アミノ酸の変異は、その変異がペプチドの免疫原性に影響を与えないように、言い換えると、ペプチドが、MHC分子に対する同程度の結合能及びT細胞刺激能を示すように選択される。
【0040】
本発明において、上記ペプチドは、腫瘍疾患及び/又はアデノーマ(腺種)性疾患の治療に用いることができる。
【0041】
治療される腫瘍疾患としては、例えば、腎臓、乳房、膵臓、胃、膀胱、精巣、及び/又は、皮膚のがんがあげられる。腫瘍疾患の一覧は、単なる例示にすぎず、利用範囲を特に限定するものではない。
【0042】
本発明者らはまた、研究により本発明のペプチドがこのような用途に適していることを明らかにした。このように、ある種のペプチドに特異的な、特異的に生成したCTLによって、腫瘍細胞は効果的に、かつ選択的に死滅させられることが明らかになった。
【0043】
腫瘍関連抗原を腫瘍のワクチンに用いるためには、その適用には一般的にいくつかの可能な形態がある。Tigheらは、抗原を、組換えタンパク質として適当なアジュバント(補助剤)又は運搬系と共に、又は、プラスミドベクター中で抗原をコードしているcDNAとして投与しうることを明らかにした(1998, Gene vaccination:plasmid DNAis more than just a blueprint, Immunol. Today 19(2):89-97)。後者の場合、免疫反応を誘導するためには、患者の体内において抗原が処理され、抗原提示細胞(APC)に提示されなければならない。
【0044】
Meliefらは、更なる可能性、すなわち合成ペプチドをワクチンとして用いる可能性について明らかにしている(1996,Peptide-based cancervaccines, Curr. Opin. Immunol. 8:651-657)。
【0045】
好ましい形態として、上記ペプチドは、アジュバントを加えて、又は、それ自体で用いることができる。
【0046】
アジュバントとしては、例えば、顆粒球マクロファージ刺激因子(granulocate-macrophage-colony-stimulating-factor)(GM−CSF)を用いることができる。
【0047】
また、このようなアジュバントの例としては、水酸化アルミニウム、フロイントアジュバント等のミネラルオイルのエマルジョン、サポニン又はシリコン化合物があげられる。
【0048】
アジュバントを用いることは、上記ペプチドにより誘導される免疫反応が高められ、及び/又は、ペプチドが安定化されるため、有用である。
【0049】
別の好ましい形態として、抗原提示細胞上(表面)に結合されたペプチドが投与される。
【0050】
この方法は、ペプチドが免疫系、特に細胞傷害性T細胞(CTL)に提示されるため、有効である。これによって、CTLは腫瘍細胞を認識でき、特異的に死滅させることができる。例えば、樹状細胞、単球又はBリンパ球は、この目的における抗原提示細胞として適している。
【0051】
ここで、上記細胞は、例えば、生体外でペプチドをロードされる。一方、細胞で上記ペプチドを発現させるため、ペプチドをコードしているDNA又は対応するRNAを用いて細胞をトランスフェクションすることもできる。
【0052】
本発明者らは、研究によって、樹状細胞(DC)が、特異的なペプチドをロードできること、そして、これらのペプチドをロードされた樹状細胞がペプチドに特異的なCTLを活性化することを見いだした。このことは、免疫系が、各ペプチドを発現する腫瘍を標的とするCTLを生成するように刺激されうることを意味する。
【0053】
上記ペプチドを載せている抗原提示細胞は、そのまま用いることもでき、又は、使用に先立って熱ショックタンパク質gp96を用いて活性化することもできる。この熱ショックタンパク質は、MHCクラスI分子や、B7のような共刺激分子の発現を誘導し、更にサイトカインの生産を刺激する。このため、免疫反応の誘導は、すべてにおいて高められる。
【0054】
別の好ましい形態として、上記ペプチドは、白血球、特にTリンパ球をラベルするために用いられる。
【0055】
この使用方法の利点として、上記ペプチドを用いると、CTL群において上記ペプチドに特異的なCTLを検出することができることである。
【0056】
上記ペプチドはまた、腫瘍疾患の治療経過を評価するためのマーカーとして用いることもできる。
【0057】
上記ペプチドは、他の免疫処置や治療における治療のモニターするために用いることもできる。ここで、上記ペプチドは、治療に用いることができるだけでなく、診断においても用いることができる。
【0058】
更なる具体例として、上記ペプチドは、抗体を生成するために用いられる。
【0059】
一般的にポリクローナル抗体は、ペプチドの注入により動物を免疫処置し、次いで免疫グロブリンを精製することにより得ることができる。
【0060】
モノクローナル抗体は、例えば、Methods Enzymol.(1986), 121, Hybridomatechnology and monoclonal antibodiesに記載されているような一般的手順により生成する。
【0061】
更に、本発明は、ペプチドを1又は2以上含む医薬組成物に関する。
【0062】
この組成物は、例えば、非経口的に、例えば、皮下、皮内又は筋内に適用することができ、又は、経口投与することもできる。この場合、上記ペプチドは、薬学的に利用可能なキャリアー、好ましくは水性キャリアーに溶解又は懸濁される。上記組成物は更に、添加物、例えば、緩衝液、バインダー、希釈液等を含んでいても良い。
【0063】
上記ペプチドは、免疫刺激物質、例えば、サイトカインと共に投与することもできる。このような性質の組成物に用いることができる多くの添加剤についての記述があり、例えば、A. Kibbe, Handbook ofPharmaceutical Excipients, 3.ed,2000,American Pharmaceutical Association andpharmaceutical pressに記載されている。
【0064】
上記組成物は、腫瘍疾患及び/又はアデノーマ性疾患の防止、予防及び/又は治療に用いることができる。
【0065】
配列番号1〜79を有するペプチドを少なくとも1つ含む上記医薬組成物は、それぞれのペプチド又は抗原が関連する腫瘍疾患の患者に投与される。それゆえ、腫瘍特異的免疫反応が腫瘍特異的CTLを基にして誘導される。
【0066】
上記医薬組成物中に存在する1又は2以上のペプチドの量としては、治療学的に効果がある量である。これに関して、上記組成物に含まれるペプチドは、少なくとも2つの異なるHLAタイプに結合することができる。
【0067】
本発明は更に、配列番号1〜79のペプチドをコードしている核酸分子に関する。
【0068】
上記核酸分子は、DNA−又はRNA−分子を意味し、がんの免疫治療にも用いることができる。これにより、核酸分子により発現したペプチドは、そのペプチドを発現する腫瘍細胞に対する免疫反応を誘導する。
【0069】
本発明において、上記核酸分子は、ベクター中に供給されてもよい。
【0070】
本発明は更に、配列番号1〜79のペプチドを生産するように、上記核酸分子により遺伝子的に修飾されている細胞に関する。
【0071】
この目的のため、上記細胞は、上記ペプチドをコードしているDNA又は対応するRNAを用いてトランスフェクションされ、それにより細胞上にペプチドを発現する。この目的のため、例えば、樹状細胞、単球又はBリンパ球が、抗原提示細胞として好適である。
【0072】
上述した特性や以下に説明する特性は、明記された例の組み合わせにおいて用いることができるだけでなく、他の組み合わせ又は本発明の範囲を逸脱することなく、それら自体でも使用することができることは、言うまでもない。
【図面の簡単な説明】
【0073】
本発明の具体例が以下に図示し、説明されている。
【0074】
【図1】ケラチン18に特異的なCD8+Tリンパ球の検出を示す。
【図2a】c−Metペプチド(配列番号1)に特異的な、試験管系(in vitro)におけるCTL反応の誘導を示す。
【図2b】c−Metペプチド(配列番号1)に特異的な、試験管系(in vitro)におけるCTL反応の誘導を示す。
【図2c】アディポフィリン(adipophilin)ペプチド(配列番号2)に特異的な、試験管系(in vitro)におけるCTL反応の誘導を示す。
【図2d】アディポフィリン(adipophilin)ペプチド(配列番号2)に特異的な、試験管系(in vitro)におけるCTL反応の誘導を示す。
【図3a】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。c−Metペプチド(配列番号1)に誘導されるCTLにより媒介される溶解を示す。
【図3b】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。c−Metペプチド(配列番号1)に誘導されるCTLにより媒介される溶解を示す。
【図3c】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。c−Metペプチド(配列番号1)に誘導されるCTLにより媒介される溶解を示す。
【図3d】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。c−Metペプチド(配列番号1)に誘導されるCTLにより媒介される溶解を示す。
【図3e】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。アディポフィリンペプチド(配列番号2)に誘導されるCTLにより媒介される溶解を示す。
【図3f】c−Met又はアディポフィリンを発現している腫瘍細胞株の抗原特異的溶解を示す。アディポフィリンペプチド(配列番号2)に誘導されるCTLにより媒介される溶解を示す。
【図4a】誘導されたCTLに媒介される51Crでラベルした腫瘍細胞とラベルしていないパルスされたT2細胞を用いた溶解阻害アッセイを示す。c−Metペプチド(配列番号1)に誘導されたCTLに媒介されている。
【図4b】誘導されたCTLに媒介される51Crでラベルした腫瘍細胞とラベルしていないパルスされたT2細胞を用いた溶解阻害アッセイを示す。c−Metペプチド(配列番号1)に誘導されたCTLに媒介されている。
【図4c】誘導されたCTLに媒介される51Crでラベルした腫瘍細胞とラベルしていないパルスされたT2細胞を用いた溶解阻害アッセイを示す。アディポフィリンペプチド(配列番号2)に誘導されたCTLに媒介されている。
【図5a】誘導されたCTLに媒介される、腫瘍RNAを用いてトランスフェクションされた自己由来の樹状細胞の溶解を示す。c−Metペプチド(配列番号1)に誘導されたCTLにより媒介されている。
【図5b】誘導されたCTLに媒介される、腫瘍RNAを用いてトランスフェクションされた自己由来の樹状細胞の溶解を示す。アディポフィリンペプチド(配列番号2)に誘導されたCTLにより媒介されている。
【図6】試験管内(in vitro)で誘導されたアディポフィリン特異的自己由来CTLが、慢性白血病患者の自己由来腫瘍細胞を認識するが、自己由来樹状細胞又はB細胞を認識しないことを示す。
【発明を実施するための形態】
【0075】
実施例1
1.1 患者サンプル
組織学的に確認された腎臓細胞の悪性腫瘍を有する患者のサンプルは、ティュービンゲン大学の泌尿器科から入手した。患者はいずれも術前治療を受けていない。患者番号1(以下、RCC01と記す)は、以下のHLA型を有していた:HLA−A*02 A*68 B*18 B*44;患者番号2(以下、RCC13と記す):HLA−A*02 A*24 B*07 B*40。
【0076】
1.2 MHCクラスI分子結合ペプチドの単離
ショック冷凍(shock−frozen)した腫瘍サンプルは、Schirle,M.らの記載「新規T細胞−非依存アプローチによる、腫瘍関連MHCクラスIリガンドの同定(Identification of tumor-associated MHC-class I ligands by a novel Tcell-independent approach)」2000,European Journal ofImmunology,30:2216-2225に従い処理した。ペプチドは、クラスIHLAに特異的なモノクローナル抗体W6/32、又は、HLA−A2に特異的なモノクローナル抗体BB7.2を用いて標準的な手順により単離された。これらの抗体の生産方法と使用方法は、Barnstable, C.J.らの「グループA赤血球、HLAおよび他のヒト細胞表面抗原に対するモノクローナル抗体の生産−遺伝的解析のための新規ツール(Production of monoclonal antibodies to group A erythrocytes,HLA andother human cell surface antigens-New tools for genetic analysis.)」1978,Cell,14:9-20、及び、Parham, P.及びBrodsky F.M.の「BB7.2の部分精製および特性。HLA−A2およびHLA−A28の変異体に対する特異性を持つ細胞傷害性モノクローナル抗体(Partial purification and some properties of BB7.2.A cytotoxicmonoclonal antibody with specificity for HLA-A2 and a variant of HLA-A28)」1981,Hum.Immunol.,3:277-299による。
【0077】
1.3 質量分析
患者RCC01の腫瘍組織由来のペプチドは、逆相HPLC(SMART−system, μRPC C2/C18 SC 2.1/19, Amersham Pharmacia Biotech)により分離され、フラクションはnanoESI MSを用いて分析された。これに際し、手順はSchirle,M.等の報告に記載されている方法で実施した(Identification of tumor-associatedMHC-class I ligand by a novel T cell-independent approach, 2000,EuropeanJournal of Immunology, 30:2216-2225)。
【0078】
患者RCC13の腫瘍組織由来のペプチドは、上述したオンラインのキャピュラリーLC−MSに少し変更を加えて同定した。100 μl量のサンプルを注入し、300μm*5mm C18カラム(LC−packing)で脱塩し、予め濃縮した。気密性100μlシリンジ(1710 RNR、Hamilton)を備えたシリンジポンプ(PHD 2000, Harvard Apparatus, Inc.)は、溶媒とサンプルを2μl/分で流した。ペプチドの分離のため、予め濃縮するためのカラムは、75μm×250mm C18(LCパッキング)カラムに一列で切り替えた。その後TEEピース(ZT1C, Valco)及び300μm×150mm C18カラムのプレカラムを用いて、流速12μl/分を約300nl/分に減少して、70分間のB液濃度25%−60%の二液グラジエントを実施した。
【0079】
ブランクランを常時実施して、確実に本系に残余ペプチドを含めないようにした。オンライン断片化を上述のように実施して、断片スペクトルを手動で解析した。データベースサーチ(NCBInr, EST)は、MASCOT(http://www.matrixscience.com)を用いて行った。
【0080】
1.4 患者RCC01の腫瘍組織の77のMHCクラスIリガンドの同定
添付した表1に、HLA−A*02、HLA−A*68、HLA−B*18、又は、HLA−B*44に結合したリガンドを示した。HLA−A*02に結合したペプチドは、対立遺伝子に特異的なペプチドモチーフを示した:ポジション2がロイシン、バリン、イソロイシン、アラニン又はメチオニンで、C末端がロイシン、バリン、イソロイシン又はアラニンである。多くのリガンドは、いわゆるハウスキーピングタンパク質由来であるが、腫瘍関連グループと報告されているタンパク質由来のリガンドも検出された。
【0081】
HLA−A*68リガンドは、アンカーアミノ酸であるポジション2のスレオニン、イソロイシン、バリン、アラニン又はロイシンと、C末端のアルギニン又はリジンによって同定された。これは、HLA−A*6801サブタイプを示す。アディポフィリン由来の別の2つのリガンド、すなわちMTSALPEIQK及びMAGDIYSVFRが、HLA−A*68が提示するペプチド中に発見された。更に腫瘍関連サイクリンD1由来のETIPLTAEKLが見つかった。ペプチドTIVNILTNRは、アネキシンI(Annexin II)由来であり、このタンパク質はメラノーマ患者のMHCクラスIIと関連する免疫原であることが分かっている(Heinzel et al., The self peptideannexin II(208-223) presented by dendritic cells sentisizes autologous CD4+T-lymphocytes to recognize melanoma cells, 2001,Cancer Immunol. Immunother.49:671-678参照)。更に、リガンドは、HLA−B*44サブタイプのアンカーアミノ酸であるグルタミン酸をポジション2に有していた。HLA−B*18のペプチドモチーフは知られていないので、これらの2つのHLA−B分子間の区別は不可能であった。
【0082】
1.5 患者RCC13の腫瘍組織のMHCクラスIリガンド
患者RCC13の腫瘍組織にも、患者RCC01において確認された同じリガンドが同定された、プロトオンコジーン(c−Met)とケラチン18由来のリガンドと同じリガンドが確認された:配列番号1と3を有するペプチドである。更に、この腫瘍組織からは、別のリガンドが得られ、ニコチンアミド−N−メチルトランスフェラーゼ(NNMT)に由来するリガンドが確認された;この遺伝子は、全ての腎臓悪性腫瘍の95%以上において過剰発現される。更に、その他のリガンドのいくつかは、RCC01のペプチドのレパートリーと共通している。
【0083】
1.6 正常CD8+T細胞レパートリー中のケラチン18特異的T細胞の検出
健康な患者由来の末梢血単核細胞を、アディポフィリン−、ケラチン18−又はmet−プロトオンコジーン(c−Met)ペプチドと共に折り畳まれたHLA−A*0201四量体で染色した:四量体の生成のため、組換えHLA−A*0201分子は、試験管内(インビトロ)でSVASTITGV(配列番号2、アディポフィリン),ALLNIKVKL(配列番号3、ケラチン18)又はYVDPVITSI(配列番号1、met−プロトオンコジーン、c−Met)と共に折り畳まれ、ゲルろ過により精製され、単量体を連結するためにビオチン化され、ストレプトアビジンと混合された。
【0084】
健康な22の個体のうち4個体において、予想外に、ケラチン18特異的CD8+T細胞の有意な個体群が見られた。ダブル染色の結果を、図1にドットプロットで示す。中段にケラチン18で染色した結果を示す。CD8+陽性T細胞の0.02〜0.2%がケラチン18特異的であった。ドットプロットの下段から分かるように、ケラチン18四量体の結合は特異的であった。
【0085】
実施例2
腫瘍細胞による配列番号1(YVDPVITSI)(c−Metオンコジーンのペプチド断片)及び配列番号2(アディポフィリンのペプチド断片)のペプチドの提示、及び、CTLによるそれらの認識について分析するため、c−Metペプチド(配列番号1のペプチド)に特異的なCTLとアディポフィリンペプチド(配列番号2のペプチド)に特異的なCTLが、試験管内で誘導された。この操作において、健康なHLA−A*02陽性ドナー由来の樹状細胞(DC)が用いられた。
【0086】
2.1 DCの生成
末梢血単核細胞(PBMNC)は、テュービンゲン大学の血液バンクの健康なボランティアの軟膜層(buffy coat)の調製物から得られたヘパリン化された血液を、Ficoll/Paque(Biochrom, Berlin, Germany)を用いて、密度勾配遠心分離することにより単離された。細胞は、RP10培地(RPMI 1640、熱で不活化したウシ胎児の血清10%と抗生物質を添加した)を使用した6穴のプレート(Falcon, Heidelberg, Germany)に植えられた(1穴あたり1×107細胞/3ml)。37℃、5%CO2で2時間インキュベーションしたあと、非粘着性の細胞を除去し、以下のサイトカインを添加したRP10培地で粘着性の血液の単球を培養した:ヒト組換えGM−CSF(顆粒球マクロファージコロニー刺激因子;Leukomax, Novartis; 100ng/ml)、インターロイキン IL−4(R&D Systems, Wiesbaden, Germany, 1000 IU/ml)及びTNF−α(腫瘍壊死因子α)(R&D Systems, Wiesbaden, Germany, 10ng/ml)。
【0087】
2.2 ペプチド合成
典型的な、2つのHLA−A*02結合ペプチド(上述したように同定されたc−Met (配列番号1、YVDPVITSI)又はアディポフィリン(配列番号2,SVASTITGV))は、標準F−moc試薬を用いてペプチド合成機(432A, Applied Biosystems,Weiterstadt, Germany)で合成され、逆相HPLCと質量分析により分析された。この方法で、同定されたペプチドの充分量を得ることができる。
【0088】
2.3 HLA−A*02により限定される合成ペプチドを用いた抗原特異的CTL反応の誘導
CTL誘導のため、ステップ2.1で得られたDC(5×105)を、ステップ2.2で得られた配列番号1又は配列番号2のペプチド各50μl/mlと共に2時間パルスし、洗浄し、自己由来の2.5×106のPBMNCとRP10培地中でインキュベートした。
【0089】
7日間培養した後、細胞を、ペプチドと共にパルス刺激された自己由来のPBMNCにより再刺激した。その過程において、1ng/mlのヒト組換えインターロイキンIL−2(R&D Systems)を1、3、5日に添加した。それにより誘導されたCTLの細胞溶解活性は、最終の再刺激の後5日目に標準51Cr放出アッセイ(以下の項目2.4を参照:CTLアッセイ)により分析した。
【0090】
2.4 CTLアッセイ
CTLアッセイにおいて、腫瘍細胞、異なる細胞株のペプチド−パルス細胞及び自己由来のDCが標的細胞として用いられた。ペプチド−パルス細胞は、50μg/mlのペプチド(配列番号1又は配列番号2)と共に2時間パルスされた。全ての標的細胞は、RP10培地(RPMI 1640、熱で不活化したウシ胎児の血清10%と抗生物質を添加した)中で〔51Cr〕クロム酸ナトリウムを用いて、1時間の間37℃でラベルされた。その後、1穴あたり104の細胞を96穴の丸底プレートに移した。最終体積が200μlとなるようにCTLの数を変化させて加えて、4時間37℃でインキュベートした。アッセイの終わりに、上澄み(1穴あたり50μl)を採取して、ベータ−プレートカウンターで数えた。特異的な溶解の割合は、次のように計算した:100×((実験に基づく放出数)−(自然放出数))/((最大放出数)−(自然放出数))。自然放出数及び最大放出数は、それぞれ培地又は2%Triron X−100いずれかの存在下で決定した。
【0091】
2.5 CTL誘導の結果
a) ペプチド−パルスDCに対するCTL細胞傷害活性
図2には、T2−又はDC−細胞に対する誘導されたCTL(項目2.3参照)の細胞傷害活性に関する51Cr放出アッセイの結果を示す。T2−細胞株はHLA−A*02陽性で、TAP(抗原処理に関連する輸送体)欠損である;(TAPペプチド輸送体は、タンパク質性のペプチド断片を細胞質ゾルから小胞体に輸送し、そこでそれらはMHC分子と結合する)。
【0092】
図2の2a及び2bに、配列番号1のペプチドにより誘導されたCTLのT2−又はDC−細胞に対する細胞傷害活性を示す。どちらの細胞型も、配列番号1の(c−Met)ペプチド(黒く塗られた四角)、又は、関係のないペプチド(Survivin(=“Sv”;ELTLGEFLKL;配列番号80)又はHIV(ILKEPVHGV;Pol.HIV−1逆転写酵素ペプチド、ポジション476−484;配列番号81)と共に予めパルスされている。図2c及び2dに、配列番号2のペプチドにより誘導されたCTLのT2−又はDC−細胞に対する細胞傷害活性を示す。T2−又はDC−細胞どちらの細胞型も、配列番号2のアディポフィリンペプチドと共に予めパルスされている。
【0093】
51Crの放出により証明される特異的な溶解を、図2a−2dのグラフに、同様に図3−5のCTL溶解のグラフに、標的細胞(溶解する51Crでラベルされた細胞)に対するエフェクター細胞(CTL)の細胞の割合を変化させて示す。
【0094】
図2a−2dに示されるように、抗原特異的な細胞殺傷能が、CTL細胞株(この細胞株は2週間ごとの再刺激で生成されたものである)について証明された。配列番号1のc−Metペプチド(図2a及び2b)又は配列番号2のアディポフィリンペプチド(図2c及び2d)を与えられた細胞のみがCTLの増加により溶解した(図2a−2d中の黒塗り四角の曲線参照);一方、関係のないペプチドとパルス処理したコントロール細胞は、溶解しなかった(塗りつぶされていない四角で示す曲線)。これゆえ、溶解活性の特異性が証明された。
【0095】
b) 腫瘍細胞株に対するCTL細胞傷害活性
次いで、再び標準的な腫瘍51Cr放出アッセイにおいて、配列番号1のc−Metペプチド又は配列番号2のアディポフィリンペプチドに特異的なCTLが、細胞内でc−Met−プロトオンコジーン又はアディポフィリンを発現している腫瘍細胞を認識し、溶解するかどうかを調べた。
【0096】
その実験において、以下に示す51CrでラベルされたHLA−A*02陽性細胞株が用いられた:HCT166(大腸がん;G.Pawelec教授(テュービンゲン、ドイツ)から入手)、A 498、MZ 1257及びMZ 1774(腎臓細胞がん、A. Knuth教授(フランクフルト、ドイツ)から入手)、MCF−7(乳がん;ATCC American Type Culture Collectionから入手)、Mel 1479(悪性メラノーマ;G.Pawelec教授(テュービンゲン、ドイツ)から入手)、U 266(多発性骨髄腫;G.Pawelec教授(テュービンゲン、ドイツ)から入手)。これらの細胞株は、標的構造(ターゲット)としてc−Met−プロトオンコジーン及びアディポフィリンを発現する。
【0097】
この実験において、CEBV(エプスタイン・バールウイルス)で不死化したB細胞株Croft、HLA−A*01陽性(O.J.Finn(ピッツバーグ、米国)から入手、)、SK−OV−3(卵巣がん;HLA−A*03陽性;O.J.Finn(ピッツバーグ、米国)から入手)、がネガティブコントロールとして用いられた。K 562細胞(例えば、the German Collection of MikroOrganism and Cell Cultures DSMZから入手可能;ACC 10)は、ナチュラルキラー細胞(NK)の活性を決定するために用いられた。この細胞株は、これらのキラー細胞に対する感受性が高いためである。
【0098】
すべての細胞株は、RP10培地(RPMI 1640、熱で不活化したウシ胎児の血清10%と抗生物質を添加した)中で培養された。
【0099】
上述した腫瘍細胞株と誘導されたCTLを用いて、上述した方法により51Cr放出アッセイ(項目2.4.参照)を行った。
【0100】
図3a−3fに、これらのCTLアッセイの結果を示す。図3a−3dにおいては、配列番号1のc−Metペプチドを用いて誘導されたCTLが用いられ、図3e−3fにおいては、配列番号2のアディポフィリンペプチドを用いて誘導されたCTLが用いられた。
【0101】
図3a−3fに示されるように、配列番号1を有するc−Metペプチドに特異的なCTL(図3a−3d)又は配列番号2を有するアディポフィリンペプチドに特異的なCTL(図3e及び3f)は、HLA−A*02及びc−Met又はアディポフィリンの両方を発現している腫瘍細胞を効果的に溶解した(図3aは細胞株HCT 116、図3bは細胞株A 498、図3cは細胞株MZ 1257及びMEL 1479、図3dは細胞株MCF−7及びU 266;図3eは細胞株A 494、U 266及びMCF−7、図3fは細胞株MZ 1774、Mel 1479及びMZ 1257)。特異的溶解は、項目2.4に記載したように、51Cr放出により測定した。配列番号1のペプチドにより誘導されたCTLによっても、配列番号2のペプチドにより誘導されたCTLによっても、コントロールの細胞株SK−OV−3(HLA−A*02陰性)の溶解はなかった。このように、ターゲット細胞を効果的に溶解するためには、HLA−A*02分子と共に腫瘍細胞に両ペプチドが提示される必要があることが明らかとなった。更に、CTLの抗原特異性及びMHC制限がこの方法により明らかになった。
【0102】
配列番号1を有するペプチドにより試験管内で誘導されたCTL細胞は、K562細胞株(図3a、3b及び3d参照)を認識せず、細胞傷害活性はナチュラルキラー(NK)細胞によっては媒介されないことを示した。
【0103】
c)阻害アッセイ
試験管内で誘導されたCTLの抗原特異性とMHC制限を更に確かめるため、51Crでラベルしていない(“cold”)阻害細胞株を用いて阻害アッセイを行った。
【0104】
ペプチド−パルス細胞株の能力は、腫瘍細胞の溶解を阻害することで分析した(競合アッセイ)。このため、過剰量の阻害剤(過剰量のラベルしていないパルス細胞)が用いられた。阻害剤(ペプチド−パルス細胞)の標的細胞(腫瘍細胞)に対する比率は、20:1であった。阻害細胞株はラベルされていないので、阻害細胞株が溶解するときには51Crは放出されなかった。
【0105】
細胞株T2(HLA−A*02;TAP欠損;項目2.5.a)参照)が阻害剤として用いられた。アッセイの前に、この細胞株T2は関連するペプチド(配列番号1又は2)又は関係のないペプチド(Survivin(=Sv)、配列番号80)それぞれを用いてパルスされた。
【0106】
これらの試験結果を図4a−4cに示す。それによれば、図4a及び4bでは、c−Metペプチド(配列番号1)に誘導されたCTLが用いられ、図4cでは、アディポフィリンペプチド(配列番号2)に誘導されたCTLが用いられた。
【0107】
図4a及び4bにおいて、51Crでラベルした細胞株U 266及びA 498の溶解は、阻害剤細胞株無しでテストした(黒く塗られた四角の曲線参照);関係のないペプチド(Survivin(=Sv)、配列番号80;ネガティブコントロール、塗りつぶされた三角)と共にパルスした阻害剤細胞株T2を用いた溶解;配列番号1のc−Metペプチドと共にパルスした阻害細胞株T2を用いた溶解(塗りつぶされていない菱形の曲線)。
【0108】
阻害剤細胞の存在なしで、CTLによる腫瘍細胞の溶解が証明された(図4a−dにおいて黒く塗られた四角の曲線をそれぞれ参照)。更に、図4a及び4bに示されるように、阻害剤標的が配列番号1のc−Metペプチドを用いてパルスされていれば(塗りつぶされていない菱形の曲線それぞれ参照)、過剰量の阻害剤を用いた場合には標的腫瘍細胞は溶解しなかった(そして51Crが放出されなかった)。CTL活性は、過剰量のラベルされていないT細胞に向けられ、それゆえこれらの細胞が溶解し、腫瘍細胞は溶解しなかった。関係のないペプチド(Survivin(=Sv)、配列番号80)を用いてパルスしたT2細胞は、CTLによる腫瘍細胞の溶解を阻害しなかったので、放出された51Crが測定された(図4a及び4bの黒塗り三角の曲線参照)。
【0109】
配列番号2のアディポフィリンペプチドを用いて誘導されたCTLを用いた場合も、同様の結果が示された。
【0110】
アディポフィリンにより誘導されたCTLの細胞傷害活性のMHC制限と抗原特異性は、HLA−A*02特異的モノクローナル抗体を用いて,ラベルしていない(“cold”)阻害剤を用いた阻害アッセイによって確認された:この実験結果を図4cに示す。HLA−A*02特異的抗体(モノクローナル抗体BB7.2、IgG2b、S.Stefanovic、ティュービンゲンから入手)を添加したとき、A 498腫瘍細胞はブロックされ、そのためそれらは添加したCTLによって溶解されず、51Crは放出されなかった(図4cの塗られた三角印の曲線参照)。コントロールとしてHLA−A*02をブロックしない非特異的抗体(ChromPure Maus IgG、Dianova、ドイツ;図4cの塗られた四角の曲線参照)が用いられた。これらの阻害アッセイにおいて、細胞は、96穴のプレート上に播種する前に、10μg/mlの抗体と共に30分間インキュベートされた。
【0111】
更に、関係のないペプチドSurvivin(配列番号80)(T2/SV)を用いてパルスされたT2競合細胞株は、CTLに誘導される腫瘍細胞株A 498の溶解を阻害できないが(図4cの黒く塗られた丸の曲線参照)、配列番号2のアディポフィリンペプチドを用いてパルスされたCTLT2阻害細胞株(T2/AD)は腫瘍細胞株の溶解を阻害することができ、このため−後者を言い換えると−51Crの放出は観察されなかった(図4cのx印の曲線参照)。
【0112】
d) トランスフェクションされたDCの特異的溶解
次の実験では、自己セッティング(autologous setting) CTL細胞傷害活性について分析した。そこでは、CTL誘導のために用いられた(項目2.2.参照)のと同じPBMNCから生成した自己由来のDCが標的細胞として用いられた。CTLアッセイに先立って、DCは、腫瘍細胞株から予め単離されたRNA又はコントロールRNAに相当するRNA(試験管内で転写されたEGFP−RNA、強化緑色蛍光タンパク質RNA;プラスミド:pSP64 Poly(A) EGFPII、Van Tendeloo、アントワープ、ベルギーより入手)を用いてエレクトロポレートされた。腫瘍細胞の全RNAはQIAGEN Rneasy Mini Kit(QIAGEN、Hilden、ドイツ)を用いて、製造者の手順に従って単離された。RNA量と純度は、分光学的手法により決定し、等分して−80℃で貯蔵した。
【0113】
6日目のエレクトロポレーションに先立って、未成熟なDCは血清を含まないX−VIVO 20培地(BioWhittaker、Walkersville、米国)で2回洗浄され、最終濃度2×107細胞/mlに再懸濁された。次いで、細胞懸濁液200μlを総量10μgのRNAと混合し、4mmキュベット中でEasyject PlusTM(Peglab,Erlangen、ドイツ)を用いてエレクトロポレーションした(パラメーター:300V、150μF、1540Ω、パルス時間231ms)。エレクトロポレーションの後、細胞はすぐにRP10培地に移され、インキュベーターに戻された。80%以上の細胞が、エレクトロポレーション後に生存していることが分かった。
【0114】
これらの試験結果を図5a及び5bに示す。図5aにおいては、配列番号1のc−Metペプチドで誘導されたCTLが用いられ、図5bにおいては、配列番号2のアディポフィリンペプチドで誘導されたCTLが用いられた。
【0115】
c−Metペプチド(配列番号1)で誘導されたCTL(項目2.4.参照)を用いたCTLアッセイを行った後、c−Metペプチド発現腫瘍細胞株(A 498及びMCF−7)のRNAを用いてエレクトロポレーションしたDCの特異的溶解が証明された(図5a中の黒く塗られたシンボルの曲線参照)。c−Metペプチド非発現腫瘍細胞株CroftのRNAを用いてエレクトロポレーションしたDCは、溶解しなかった(塗りつぶしていない菱形の曲線参照)。
【0116】
配列番号2のアディポフィリンペプチドによって誘導されたCTLは、アディポフィリン発現腫瘍細胞株A 498(図5bの黒く塗られた三角の曲線参照)のRNAを用いてエレクトロポレーションしたDCを溶解した。更に、アディポフィリンペプチド配列番号2と共にパルスされたDCは、溶解した(図5bの黒塗り菱形の曲線参照)。一方、コントロール(EGFP)RNAを用いてエレクトロポレーションしたDCは、溶解しなかった(図5bの塗りつぶしていない三角の曲線参照)。
【0117】
このように、配列番号1のc−Metペプチド又は配列番号2のアディポフィリンペプチド陽性腫瘍細胞のRNAを用いてDCをトランスフェクションした後、同定されたペプチド、すなわち配列番号1のc−Metペプチド又は配列番号2のアディポフィリンペプチドは処理され、提示されたことが証明された。
【0118】
e) 慢性リンパ性白血病患者におけるアディポフィリン特異的CTLの誘導
更なる研究において、HLA−A*0201陽性の慢性リンパ性白血病(CLL)患者のPBMNCからCTLが生じ、これは配列番号2のアディポフィリンペプチドに特異的であった。この患者は、フルダラビンで治療後、症状が軽減した。更に、この患者由来のCLL細胞及びDCが、51Crでラベルされる標的としてアッセイで用いられた。このアッセイでは、ペプチドに誘導されるCTLにより51Crの放出が媒介される。
【0119】
図6に示すように、ペプチドに誘導されるCTLは、自己由来のCLL細胞(“CLL cells”)と同様に、配列番号2のアディポフィリンペプチドと共にパルスされたこの患者由来のDC(“DC+AD”)を効果的に溶解した。一方、関係のないペプチド配列番号80のSurvivinを用いてパルスしたDC(“DC+SV”)は、溶解しなかった。悪性でないB細胞及び細胞株K 562も、CTLによって溶解しなかった。
【0120】
CTL反応の特異性は、配列番号2のアディポフィリンペプチド又は関係ないペプチド配列番号80のSurvivinと共にパルスされた細胞株T2(上記参照)を阻害細胞として用いた標的阻害アッセイによって更に確認された。配列番号2のアディポフィリンペプチドによって誘導されたCTLは、対応する配列番号2のペプチドと共にパルスされた過剰量の阻害剤細胞株を溶解し、そのため、51Crでラベルされた腫瘍細胞はこの場合には溶解されなかった(図6中の塗りつぶされていない四角の曲線参照)。
【0121】
結論として、本発明者らは、同定されたペプチドが、多くの(腫瘍)疾患の免疫療法の分野において、将来有望な物質であることを示した。
【表1】




【特許請求の範囲】
【請求項1】
添付した配列プロトコルの配列番号4のアミノ酸配列を含み、ヒト主要組織適合複合体(MHC)クラスI分子に結合することができることを特徴とする腫瘍関連ペプチド。
【請求項2】
N末端又はC末端に1つの付加的なアミノ酸を含むことを特徴とする請求項1に記載のペプチド。
【請求項3】
1つのアミノ酸が欠損していることを特徴とする請求項1又は2に記載のペプチド。
【請求項4】
腫瘍疾患及び/又はアデノーマ疾患の治療薬の製造のための、請求項1〜3のいずれかに記載の1又は2以上のペプチドの使用。
【請求項5】
疾患が、腎臓、乳房、膵臓、胃、膀胱、及び/又は精巣のがんであることを特徴とする請求項4記載のペプチドの使用。
【請求項6】
請求項1〜3のいずれかに記載のペプチドを1又は2以上含むことを特徴とする腫瘍疾患及び/又はアデノーマ疾患の治療のための医薬組成物。
【請求項7】
疾患が、腎臓、乳房、膵臓、胃、膀胱、及び/又は精巣のがんであることを特徴とする請求項6記載の医薬組成物。
【請求項8】
さらに、アジュバントを含むことを特徴とする請求項6又は7記載の医薬組成物。
【請求項9】
抗原提示細胞上に結合されたペプチドが使用されることを特徴とする請求項6〜8のいずれかに記載の医薬組成物。
【請求項10】
白血球をラベルするために用いられることを特徴とする請求項1〜3のいずれかに記載のペプチドの使用。
【請求項11】
請求項1〜3のいずれかに記載のペプチドを1又は2以上含むことを特徴とする診断試薬。
【請求項12】
抗体を製造するための、請求項1〜3のいずれかに記載のペプチドの使用。
【請求項13】
請求項1〜3のいずれかに記載のペプチドを1つ又は2以上含むことを特徴とする医薬組成物。
【請求項14】
請求項1〜3のいずれかに記載のペプチドをコードしていることを特徴とする核酸分子。
【請求項15】
請求項14に記載の核酸分子を含むことを特徴とするベクター。
【請求項16】
請求項14に記載の核酸分子又は請求項15に記載のベクターにより遺伝子的に修飾されていることを特徴とする、請求項1〜3のいずれかに記載のペプチドを製造するための細胞。
【請求項1】
添付した配列プロトコルの配列番号4のアミノ酸配列を含み、ヒト主要組織適合複合体(MHC)クラスI分子に結合することができることを特徴とする腫瘍関連ペプチド。
【請求項2】
N末端又はC末端に1つの付加的なアミノ酸を含むことを特徴とする請求項1に記載のペプチド。
【請求項3】
1つのアミノ酸が欠損していることを特徴とする請求項1又は2に記載のペプチド。
【請求項4】
腫瘍疾患及び/又はアデノーマ疾患の治療薬の製造のための、請求項1〜3のいずれかに記載の1又は2以上のペプチドの使用。
【請求項5】
疾患が、腎臓、乳房、膵臓、胃、膀胱、及び/又は精巣のがんであることを特徴とする請求項4記載のペプチドの使用。
【請求項6】
請求項1〜3のいずれかに記載のペプチドを1又は2以上含むことを特徴とする腫瘍疾患及び/又はアデノーマ疾患の治療のための医薬組成物。
【請求項7】
疾患が、腎臓、乳房、膵臓、胃、膀胱、及び/又は精巣のがんであることを特徴とする請求項6記載の医薬組成物。
【請求項8】
さらに、アジュバントを含むことを特徴とする請求項6又は7記載の医薬組成物。
【請求項9】
抗原提示細胞上に結合されたペプチドが使用されることを特徴とする請求項6〜8のいずれかに記載の医薬組成物。
【請求項10】
白血球をラベルするために用いられることを特徴とする請求項1〜3のいずれかに記載のペプチドの使用。
【請求項11】
請求項1〜3のいずれかに記載のペプチドを1又は2以上含むことを特徴とする診断試薬。
【請求項12】
抗体を製造するための、請求項1〜3のいずれかに記載のペプチドの使用。
【請求項13】
請求項1〜3のいずれかに記載のペプチドを1つ又は2以上含むことを特徴とする医薬組成物。
【請求項14】
請求項1〜3のいずれかに記載のペプチドをコードしていることを特徴とする核酸分子。
【請求項15】
請求項14に記載の核酸分子を含むことを特徴とするベクター。
【請求項16】
請求項14に記載の核酸分子又は請求項15に記載のベクターにより遺伝子的に修飾されていることを特徴とする、請求項1〜3のいずれかに記載のペプチドを製造するための細胞。
【図1】


【図2a】


【図2b】


【図2c】


【図2d】


【図3a】


【図3b】


【図3c】


【図3d】


【図3e】


【図3f】


【図4a】


【図4b】


【図4c】


【図5a】


【図5b】


【図6】




【図2a】


【図2b】


【図2c】


【図2d】


【図3a】


【図3b】


【図3c】


【図3d】


【図3e】


【図3f】


【図4a】


【図4b】


【図4c】


【図5a】


【図5b】


【図6】


【公開番号】特開2010−99078(P2010−99078A)
【公開日】平成22年5月6日(2010.5.6)
【国際特許分類】
【出願番号】特願2009−283584(P2009−283584)
【出願日】平成21年12月15日(2009.12.15)
【分割の表示】特願2004−509714(P2004−509714)の分割
【原出願日】平成15年3月27日(2003.3.27)
【出願人】(506258073)イマティクス バイオテクノロジーズ ゲーエムベーハー (24)
【Fターム(参考)】
【公開日】平成22年5月6日(2010.5.6)
【国際特許分類】
【出願日】平成21年12月15日(2009.12.15)
【分割の表示】特願2004−509714(P2004−509714)の分割
【原出願日】平成15年3月27日(2003.3.27)
【出願人】(506258073)イマティクス バイオテクノロジーズ ゲーエムベーハー (24)
【Fターム(参考)】
[ Back to top ]

