MRI造影剤用ナノダイヤモンド粒子
【課題】高い生体適合性と特異的体内貯留挙動を有するMRI造影剤用ナノダイヤモンド粒子の提供。
【解決手段】ナノダイヤモンド粒子がキレート機能を有する有機分子で化学修飾されることにより形成された前駆体が、ガドリニウムイオンで錯形成されていることを特徴とするMRI造影剤用ナノダイヤモンドであって、従来MRI造影剤用のナノダイヤモンド粒子の製造方法に用いられてきたイオン注入及びアニールを施すことなく、簡便にナノダイヤモンド粒子にキレート機能を有する有機分子を化学修飾し、さらに、MRI造影能を有するガドリニウムイオンを錯形成させる。
【解決手段】ナノダイヤモンド粒子がキレート機能を有する有機分子で化学修飾されることにより形成された前駆体が、ガドリニウムイオンで錯形成されていることを特徴とするMRI造影剤用ナノダイヤモンドであって、従来MRI造影剤用のナノダイヤモンド粒子の製造方法に用いられてきたイオン注入及びアニールを施すことなく、簡便にナノダイヤモンド粒子にキレート機能を有する有機分子を化学修飾し、さらに、MRI造影能を有するガドリニウムイオンを錯形成させる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、MRI造影剤用ナノダイヤモンド粒子及びその製造方法に関する。
【背景技術】
【0002】
粒径がナノメートル・オーダーのダイヤモンド粒子(以下、ナノダイヤモンド粒子と称する。)は、高い生体適合性を有しており、また、特異的な体内貯留挙動を示すことから、MRI(Magnetic Resonance Imaging:核磁気共鳴画像法)造影剤への適用が、検討されている。
【0003】
従来技術として、ナノダイヤモンドに金属イオンをイオン注入して、磁気ナノダイヤモンド粒子を作成し、さらに磁気ナノダイヤモンド表面に親水性を付与する官能基と、媒質中への分散性を高める官能基を含有させることにより、MR(磁気共鳴)画像診断用標識剤として使用する技術が開示されている(特許文献1)。
【0004】
また、特許文献2には、ナノダイヤモンド分散液をシリコン基板に塗布した後、塗布層に含まれるナノダイヤモンドにイオン注入を行い、その後、イオン注入したナノダイヤモンドをシリコン基板表面から剥離し、剥離したナノダイヤモンドを真空中アニール及び空気酸化することにより、ナノダイヤモンドに官能基を化学修飾させ、これにより、MR造影剤に用いられる、磁性ナノダイヤモンドの製造方法が開示されている。
【0005】
しかし、これらの技術はともに、イオン注入(100keV)を行うこと、さらには、真空中においてアニール(700度〜800度)を行うことが必須の要件となっていることから、これらの処理を行うための大型の専用装置(イオン注入装置など)が必要となり、これら大型装置の設備費用や管理維持といった面で問題がある。
【0006】
また、非特許文献1は、合成したキレート分子にガドリニウムイオンを錯形成し、その後、錯体をナノダイヤモンド粒子とリンカー鎖を通して化学結合させることにより、MRI造影剤用ナノダイヤモンド粒子を作成する技術に関するものである。
【0007】
しかし、下記に説明する本願発明の内容である、ナノダイヤモンド粒子とカドリニウム錯体とが直接結合していること、そして、カドリニウムイオン錯形成前にナノダイヤモンド粒子にキレート分子化学修飾反応を行うことによって、カドリニウムイオンの脱離を防止できることについては、非特許文献1に一切開示がない。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2008−79824号公報
【特許文献2】特開2010−13718号公報
【非特許文献】
【0009】
【非特許文献1】L. M. Manus, D. J. Mastarone, E. A. Waters, X. Q. Zhang, E. A. Schultz-Sikma, K. W. MacRenaris, D. Ho, T. J. Maeda, Nano Lett. 10, 484-489 (2010)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、従来MRI造影剤用のナノダイヤモンド粒子の製造方法に用いられてきたイオン注入及びアニールを施すことなく、簡便にナノダイヤモンド粒子にキレート機能を有する有機分子を化学修飾し、さらに、MRI造影能を有するガドリニウムイオンを錯形成させた、MRI造影剤用ナノダイヤモンド粒子を提供することにある。
【課題を解決するための手段】
【0011】
すなわち、本発明は、
1)ナノダイヤモンド粒子がキレート機能を有する有機分子で化学修飾されることにより形成された前駆体が、ガドリニウムイオンで錯形成されていることを特徴とするMRI造影剤用ナノダイヤモンド。
2)前記キレート機能を有する有機分子が、ジエチレントリアミン五酢酸、1,4,7,10−テトラアザシクロドデカン−1,4,7,10−四酢酸又はこれらの誘導体であることを特徴とする上記1)記載のMRI造影剤用ナノダイヤモンド粒子。
3)前記ナノダイヤモンド粒子が、粒径2nm〜100nmであることを特徴とする上記1)又は2)記載のMRI造影剤用ナノダイヤモンド粒子。
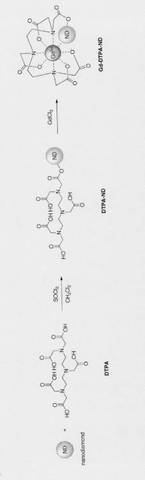
4)前記前駆体が、下記の模式図[化1]で表されることを特徴とする上記1)〜3)のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子。
【0012】
【化1】

【0013】
5)下記の模式図[化2]で表されることを特徴とする請求項1〜4のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子。
【0014】
【化2】

【0015】
6)請求項1〜5のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子を成分とするMRI造影剤、を提供する。
【0016】
また、本発明は、
7)ナノダイヤモンド粒子にキレート機能を有する有機分子を化学修飾させて前駆体を形成した後、前記前駆体をガドリニウムイオンで錯形成させることを特徴とするMRI造影剤用ナノダイヤモンド粒子の製造方法。
8)前記キレート機能を有する有機分子が、ジエチレントリアミン五酢酸、1,4,7,10−テトラアザシクロドデカン−1,4,7,10−四酢酸又はこれらの誘導体であることを特徴とする上記7)記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
9)前記ナノダイヤモンド粒子が、粒径2nm〜100nmであることを特徴とする上記7)又は8)記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
10)ナノダイヤモンド粒子及びジエチレントリアミン五酢酸の塩化メチレン懸濁液に塩化チオニルの塩化メチレン溶液を加えて、ナノダイヤモンド粒子にジエチレントリアミン五酢酸を化学修飾させ、その後、ジエチレントリアミン五酢酸を化学修飾させたナノダイヤモンドの水懸濁液に塩化カドリニウム水溶液を加えて、ガドリニウムイオンを錯形成させることを特徴とする上記7)〜9)のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
11)前記前駆体が、下記の模式図[化3]で表されることを特徴とする上記7)〜10)のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
【0017】
【化3】

【0018】
12)下記の模式図[化4]で表されることを特徴とする上記7)〜11)のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法
【化4】

【0019】
13)上記7)〜12)のいずれか一項に記載の製造方法により製造されたMRI造影剤用ナノダイヤモンド粒子を成分とするMRI造影剤、を提供する。
【発明の効果】
【0020】
本発明は、ナノダイヤモンド粒子の高い生体適合性及び特異的な体内貯留挙動を利用することより、従来の短時間で体外へ排出されるMRI造影剤と比較して、経時診断の利用に適したMRI造影剤を提供でき、さらに、イオン注入やアニール処理などの煩雑な操作を施すことなく、簡便にMRI造影剤用ナノダイヤモンド粒子を提供することができるという優れた効果を有する。
【図面の簡単な説明】
【0021】
【図1】化学反応の概略図である。
【図2】XPSスペクトルである。同図(a)は、DTPA反応前のナノダイヤモンド粒子(5nm)のXPSスペクトルである。同図(b)は、DTPA反応後のナノダイヤモンド粒子(5nm)のXPSスペクトルである。
【図3】IRスペクトルである。同図(a)は、DTPA反応前のナノダイヤモンド粒子(5nm)のIRスペクトルである。同図(b)は、DTPAのIRスペクトルである。同図(c)は、DTPA反応前のナノダイヤモンド粒子(5nm)のIRスペクトルである。
【図4】DTPA反応後のナノダイヤモンド粒子(5nm)のMSスペクトルである。
【図5】錯形成反応後のナノダイヤモンド粒子(5nm)のXPSスペクトルである。
【図6】XPSスペクトルである。同図(a)は、DTPA反応前のナノダイヤモンド粒子(50nm)のXPSスペクトルである。同図(b)は、DTPA反応後のナノダイヤモンド粒子(50nm)のXPSスペクトルである。
【図7】錯形成反応後のナノダイヤモンド粒子(50nm)のXPSスペクトルである。
【図8】XPSスペクトルである。同図(a)は、DTPA反応前のナノダイヤモンド粒子(100nm)のXPSスペクトルである。同図(b)は、DTPA反応後のナノダイヤモンド粒子(100nm)のXPSスペクトルである。
【図9】錯形成反応後のナノダイヤモンド粒子(100nm)のXPSスペクトルである。
【図10】PBS及び注射用水のT1強調画像である。
【発明を実施するための形態】
【0022】
本発明のMRI造影剤用ナノダイヤモンド粒子は、ナノダイヤモンド粒子がキレート機能を有する有機分子で化学修飾され、さらにガドリニウムイオンで錯形成されていることが大きな特徴である。これによって、イオン注入やアニール処理などの煩雑な操作を施すことなく、簡便にMRI造影剤用ナノダイヤモンド粒子を作製することができる。
【0023】
通常、ナノダイヤモンド粒子は、粒径2nm〜100nmのナノナノダイヤモンド粒子を使用する。ナノナノダイヤモンド粒子の粒径については、粒径が2nm未満であると高度に凝集するために下限値を2nmとする。一方、粒径が100nmを越えると分散性の低下という問題があるので、上限値を100nmとする。
【0024】
前記キレート機能を有する有機分子としては、ジエチレントリアミン五酢酸、1,4,7,10−テトラアザシクロドデカン−1,4,7,10−四酢酸又はこれらの誘導体を使用することができる。このキレート剤として、市販品を使用することができる。
この錯形成反応は化学反応のみであり、室温で行うことができ、したがって特別な加熱装置やアニーリング装置は必要としない。また、キレート分子化学修飾反応を、先に行うことにより、ガドリニウムイオンの脱離を防止することができる効果を有する。
【0025】
前記のように、ナノダイヤモンド粒子に、キレート機能を有する有機分子を化学修飾させて、前記模式図[化3]に示すような構造の前駆体を得た後、該前駆体にガドリニウムイオンを錯形成させる。このガドリニウム錯体とナノダイヤモンド間は直接結合し、ナノダイヤモンド表面上の酸素系官能基で、カドリニウムイオン錯形成を補助している可能性がある。
【0026】
上記の代表例を示すと、次のようになる。すなわち、ナノダイヤモンド粒子及びジエチレントリアミン五酢酸の塩化メチレン懸濁液に塩化チオニルの塩化メチレン溶液を加えて、ナノダイヤモンド粒子にジエチレントリアミン五酢酸を化学修飾させる。
【0027】
前記塩化メチレン懸濁液中に含まれるジエチレントリアミン五酢酸は、ナノダイヤモンド粒子0.5gに対して、0.1〜5gとするのが好ましい。0.1g未満であると懸濁液での反応が進まないため0.1g以上とする。一方、5gを越えると未反応ジエチレントリアミン五酢酸が増加するため5g以下とする。より好ましくは0.5〜2gとする。また、このとき、塩化チオニルの塩化メチレン溶液は好ましくは1〜30mlとし、より好ましくは2〜20mlとする。
【0028】
その後、ジエチレントリアミン五酢酸を化学修飾させたナノダイヤモンドの水懸濁液に塩化カドリニウム水溶液を加えて、ガドリニウムイオンを錯形成させることで、MRI造影剤用ナノダイヤモンド粒子を製造することができる。すなわち、模式図[化5]に示す構造の物質を得ることができる。
【0029】
【化5】

【0030】
上記用量で作製したジエチレントリアミン五酢酸を化学修飾させたナノダイヤモンドの水懸濁液に対して、塩化カドリニウムは、0.1〜0.5gとするのが好ましい。0.1g未満であると反応が進まないため0.1g以上とする。一方、0.5gを越えると反応処理後の未反応塩化ガドリニウムの除去が難しくなることから0.5gとする。より好ましくは0.2〜0.3gとする。
【0031】
以上から、下記模式図[化6]に示す特徴のMRI造影剤用ナノダイヤモンド粒子を得ることができる。
【0032】
【化6】

【0033】
この工程の概略を図1に示す。なお、詳細は実施例で説明する。この図1の工程から明らかなように、出発物質から僅か2ステップ(工程)で、MRI造影剤用ナノダイヤモンド粒子を製造することができる。しかも、低温で製造でき、大型の設備や特殊な反応法を使用しなければならないという制限は、一切ないという、優れた効果を有する。
【実施例】
【0034】
実施例を具体的に説明するが、以下の説明は理解し易くするものであり、発明の本質を制限されるものではない。すなわち、発明に含まれる他の態様または変形を含有するものである。
【0035】
(実施例1)
(キレート機能を有する有機分子の化学修飾)
粒径が5nmのナノダイヤモンド粒子とジエチレントリアミン五酢酸(DTPA)の塩化メチレン懸濁液を作成した。次に、この懸濁液に塩化チオニルの塩化メチレン溶液を加えて、約7時間還流させた。これにより、ナノダイヤモンド粒子にジエチレントリアミン五酢酸が化学修飾された。化学反応の概略を図1に示す。
【0036】
当該化学修飾したナノダイヤモンド粒子を塩化メチレンで洗浄した。その後、微量に残る塩化チオニルを除去するために真空乾燥を行った。次に、水酸化ナトリウム水溶液、水、メタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)、IR(赤外分光法)、MS(質量分析法)、を測定した。その結果を図2〜図4に示す。
【0037】
図2(a)は、化学修飾前のナノダイヤモンド粒子のXPSスペクトルである。また、図2(b)は、化学修飾後のナノダイヤモンド粒子のXPSスペクトルである。図2(b)において、窒素に由来するピークが観察されたことから、ナノダイヤモンド粒子表面上にジエチレントリアミン五酢酸(DTPA)に由来する官能基が化学修飾されたことが確認できた。
【0038】
図3(a)は、化学修飾前のナノダイヤモンド粒子のIRスペクトルである。また、図3(b)は、ジエチレントリアミン五酢酸(DTPA)のIRスペクトルである。また、図3(c)は、化学修飾後のナノダイヤモンド粒子のIRスペクトルである。
図3(c)において、ジエチレントリアミン五酢酸(DTPA)に由来するピークが観察されたことから、ナノダイヤモンド粒子表面上にジエチレントリアミン五酢酸(DTPA)に由来する官能基が化学修飾されたことが確認できた。
【0039】
図4は、化学修飾後のナノダイヤモンド粒子のMSスペクトルである。図4において、ジエチレントリアミン五酢酸(DTPA)に由来するピークが観察されたことから、ナノダイヤモンド粒子表面上にジエチレントリアミン五酢酸(DTPA)に由来する官能基が化学修飾されたことが確認できた。すなわち、模式図[化7]に示す構造の物質を得ることができたと考えられる。
【0040】
【化7】

【0041】
(ガドリニウムイオンの錯形成)
ジエチレントリアミン五酢酸(DTPA)を化学修飾させたナノダイヤモンド粒子の水懸濁液を作成した。次に、この懸濁液に塩化カドリニウム水溶液を滴下した。その後、水酸化ナトリウム水溶液にてpH値を6程度に調整し、室温において、2時間攪拌した。
これにより、ガドリニウムイオンを錯形成した。化学反応の概略を図1に示す。
【0042】
当該錯形成したナノダイヤモンド粒子を水及びメタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)を測定した。その結果を図5に示す。
【0043】
図5は、錯形成後のナノダイヤモンド粒子のXPSスペクトルである。図5において、カドリニウムに由来するピークが観察されたことから、ガドリニウムイオンが錯形成されたことが確認できた。すなわち、下記模式図[化8]に示す構造のMRI造影剤用ナノダイヤモンド粒子を得ることができたと考えられる。
【0044】
【化8】

【0045】
(実施例2)
(キレート機能を有する有機分子の化学修飾)
粒径が50nmのナノダイヤモンド粒子とジエチレントリアミン五酢酸(DTPA)の塩化メチレン懸濁液を作成した。次に、この懸濁液に塩化チオニルの塩化メチレン溶液を加えて、約7時間還流させた。これにより、ナノダイヤモンド粒子にジエチレントリアミン五酢酸が化学修飾された。化学反応は、実施例1と同様である。
【0046】
当該化学修飾したナノダイヤモンド粒子を塩化メチレンで洗浄した。その後、微量に残る塩化チオニルを除去するために真空乾燥を行った。次に、水酸化ナトリウム水溶液、水、メタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)を測定した。その結果を図6に示す。
【0047】
図6(a)は、化学修飾前のナノダイヤモンド粒子のXPSスペクトルである。また、図6(b)は、化学修飾後のナノダイヤモンド粒子のXPSスペクトルである。図6(b)において、窒素に由来するピークが観察されたことから、ナノダイヤモンド粒子表面上にジエチレントリアミン五酢酸(DTPA)に由来する官能基が化学修飾されたことが確認できた。すなわち、実施例1と同様に、模式図[化7]に示す構造の物質を得ることができたと考えられる。
【0048】
(ガドリニウムイオンの錯形成)
ジエチレントリアミン五酢酸(DTPA)を化学修飾させたナノダイヤモンド粒子の水懸濁液を作成した。次に、この懸濁液に塩化カドリニウム水溶液を滴下した。その後、水酸化ナトリウム水溶液にてpH値を6程度に調整し、室温において、2時間攪拌した。
これにより、ガドリニウムイオンを錯形成した。化学反応は、実施例1と同様である。
【0049】
当該錯形成したナノダイヤモンド粒子を水及びメタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)を測定した。その結果を図7に示す。
【0050】
図7は、錯形成後のナノダイヤモンド粒子のXPSスペクトルである。図7において、カドリニウムに由来するピークが観察されたことから、ガドリニウムイオンが錯形成されたことが確認できた。すなわち、実施例1と同様に、模式図[化8]に示す構造のMRI造影剤用ナノダイヤモンド粒子を得ることができた。
【0051】
(実施例3)
(キレート機能を有する有機分子の化学修飾)
粒径が100nmのナノダイヤモンド粒子とジエチレントリアミン五酢酸(DTPA)の塩化メチレン懸濁液を作成した。次に、この懸濁液に塩化チオニルの塩化メチレン溶液を加えて、約7時間還流させた。これにより、ナノダイヤモンド粒子にジエチレントリアミン五酢酸が化学修飾された。化学反応は、実施例1と同様である。
【0052】
当該化学修飾したナノダイヤモンド粒子を塩化メチレンで洗浄した。その後、微量に残る塩化チオニルを除去するために真空乾燥を行った。次に、水酸化ナトリウム水溶液、水、メタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)を測定した。その結果を図8に示す。
【0053】
図8(a)は、化学修飾前のナノダイヤモンド粒子のXPSスペクトルである。また、図8(b)は、化学修飾後のナノダイヤモンド粒子のXPSスペクトルである。図8(b)において、窒素に由来するピークが観察されたことから、ナノダイヤモンド粒子表面上にジエチレントリアミン五酢酸(DTPA)に由来する官能基が化学修飾されたことが確認できた。すなわち、実施例1と同様に、模式図[化7]に示す構造の物質を得ることができた。
【0054】
(ガドリニウムイオンの錯形成)
ジエチレントリアミン五酢酸(DTPA)を化学修飾させたナノダイヤモンド粒子の水懸濁液を作成した。次に、この懸濁液に塩化カドリニウム水溶液を滴下した。その後、水酸化ナトリウム水溶液にてpH値を6程度に調整し、室温において、2時間攪拌した。
これにより、ガドリニウムイオンを錯形成した。化学反応は、実施例1と同様である。
【0055】
当該錯形成したナノダイヤモンド粒子を水及びメタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)を測定した。その結果を図9に示す。
【0056】
図9は、錯形成後のナノダイヤモンド粒子のXPSスペクトルである。図9において、カドリニウムに由来するピークが観察されたことから、ガドリニウムイオンが錯形成されたことが確認できた。すなわち、実施例1と同様に、模式図[化8]に示す構造のMRI造影剤用ナノダイヤモンド粒子を得ることができた。
【0057】
(MRI造影能の評価)
実施例1として、ジエチレントリアミン五酢酸(DTPA)を化学修飾し、さらに、ガドリニウムを錯形成したナノダイヤモンド粒子(以下、Gd−DTPA−ナノダイヤモンド粒子と称する。)を添加したPBS及び注射用水分散液(0.1w/v%)を作成した。
【0058】
(比較例)
比較例1として、未処理のナノダイヤモンド粒子(以下、未処理−ナノダイヤモンド粒子と称する。)を添加したPBS及び注射用水分散液(0.1w/v%)を作成した。
比較例2として、何も添加しないPBS及び注射用水分散液(0.1w/v%)を用意した。
【0059】
これらを、1.5テスラMRI装置でT1強調画像を撮像した。その結果を、図10に示す。図10から、実施例のGd−DTPA−ナノダイヤモンド粒子は、比較例に比べて、高信号が示されたことから、高いMRI造影能を有することを確認できた。
【産業上の利用可能性】
【0060】
本発明は、キレート機能を有する有機分子で化学修飾し、さらに、ガドリニウムイオンで錯形成することによって、イオン注入やアニール処理などの煩雑な操作を施すことなく、簡便に、MRI造影能を有するナノダイヤモンド粒子を提供することができるという優れた効果を有するので、MRI造影剤等へ適用することができる。
【技術分野】
【0001】
本発明は、MRI造影剤用ナノダイヤモンド粒子及びその製造方法に関する。
【背景技術】
【0002】
粒径がナノメートル・オーダーのダイヤモンド粒子(以下、ナノダイヤモンド粒子と称する。)は、高い生体適合性を有しており、また、特異的な体内貯留挙動を示すことから、MRI(Magnetic Resonance Imaging:核磁気共鳴画像法)造影剤への適用が、検討されている。
【0003】
従来技術として、ナノダイヤモンドに金属イオンをイオン注入して、磁気ナノダイヤモンド粒子を作成し、さらに磁気ナノダイヤモンド表面に親水性を付与する官能基と、媒質中への分散性を高める官能基を含有させることにより、MR(磁気共鳴)画像診断用標識剤として使用する技術が開示されている(特許文献1)。
【0004】
また、特許文献2には、ナノダイヤモンド分散液をシリコン基板に塗布した後、塗布層に含まれるナノダイヤモンドにイオン注入を行い、その後、イオン注入したナノダイヤモンドをシリコン基板表面から剥離し、剥離したナノダイヤモンドを真空中アニール及び空気酸化することにより、ナノダイヤモンドに官能基を化学修飾させ、これにより、MR造影剤に用いられる、磁性ナノダイヤモンドの製造方法が開示されている。
【0005】
しかし、これらの技術はともに、イオン注入(100keV)を行うこと、さらには、真空中においてアニール(700度〜800度)を行うことが必須の要件となっていることから、これらの処理を行うための大型の専用装置(イオン注入装置など)が必要となり、これら大型装置の設備費用や管理維持といった面で問題がある。
【0006】
また、非特許文献1は、合成したキレート分子にガドリニウムイオンを錯形成し、その後、錯体をナノダイヤモンド粒子とリンカー鎖を通して化学結合させることにより、MRI造影剤用ナノダイヤモンド粒子を作成する技術に関するものである。
【0007】
しかし、下記に説明する本願発明の内容である、ナノダイヤモンド粒子とカドリニウム錯体とが直接結合していること、そして、カドリニウムイオン錯形成前にナノダイヤモンド粒子にキレート分子化学修飾反応を行うことによって、カドリニウムイオンの脱離を防止できることについては、非特許文献1に一切開示がない。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2008−79824号公報
【特許文献2】特開2010−13718号公報
【非特許文献】
【0009】
【非特許文献1】L. M. Manus, D. J. Mastarone, E. A. Waters, X. Q. Zhang, E. A. Schultz-Sikma, K. W. MacRenaris, D. Ho, T. J. Maeda, Nano Lett. 10, 484-489 (2010)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、従来MRI造影剤用のナノダイヤモンド粒子の製造方法に用いられてきたイオン注入及びアニールを施すことなく、簡便にナノダイヤモンド粒子にキレート機能を有する有機分子を化学修飾し、さらに、MRI造影能を有するガドリニウムイオンを錯形成させた、MRI造影剤用ナノダイヤモンド粒子を提供することにある。
【課題を解決するための手段】
【0011】
すなわち、本発明は、
1)ナノダイヤモンド粒子がキレート機能を有する有機分子で化学修飾されることにより形成された前駆体が、ガドリニウムイオンで錯形成されていることを特徴とするMRI造影剤用ナノダイヤモンド。
2)前記キレート機能を有する有機分子が、ジエチレントリアミン五酢酸、1,4,7,10−テトラアザシクロドデカン−1,4,7,10−四酢酸又はこれらの誘導体であることを特徴とする上記1)記載のMRI造影剤用ナノダイヤモンド粒子。
3)前記ナノダイヤモンド粒子が、粒径2nm〜100nmであることを特徴とする上記1)又は2)記載のMRI造影剤用ナノダイヤモンド粒子。
4)前記前駆体が、下記の模式図[化1]で表されることを特徴とする上記1)〜3)のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子。
【0012】
【化1】

【0013】
5)下記の模式図[化2]で表されることを特徴とする請求項1〜4のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子。
【0014】
【化2】

【0015】
6)請求項1〜5のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子を成分とするMRI造影剤、を提供する。
【0016】
また、本発明は、
7)ナノダイヤモンド粒子にキレート機能を有する有機分子を化学修飾させて前駆体を形成した後、前記前駆体をガドリニウムイオンで錯形成させることを特徴とするMRI造影剤用ナノダイヤモンド粒子の製造方法。
8)前記キレート機能を有する有機分子が、ジエチレントリアミン五酢酸、1,4,7,10−テトラアザシクロドデカン−1,4,7,10−四酢酸又はこれらの誘導体であることを特徴とする上記7)記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
9)前記ナノダイヤモンド粒子が、粒径2nm〜100nmであることを特徴とする上記7)又は8)記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
10)ナノダイヤモンド粒子及びジエチレントリアミン五酢酸の塩化メチレン懸濁液に塩化チオニルの塩化メチレン溶液を加えて、ナノダイヤモンド粒子にジエチレントリアミン五酢酸を化学修飾させ、その後、ジエチレントリアミン五酢酸を化学修飾させたナノダイヤモンドの水懸濁液に塩化カドリニウム水溶液を加えて、ガドリニウムイオンを錯形成させることを特徴とする上記7)〜9)のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
11)前記前駆体が、下記の模式図[化3]で表されることを特徴とする上記7)〜10)のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
【0017】
【化3】

【0018】
12)下記の模式図[化4]で表されることを特徴とする上記7)〜11)のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法
【化4】

【0019】
13)上記7)〜12)のいずれか一項に記載の製造方法により製造されたMRI造影剤用ナノダイヤモンド粒子を成分とするMRI造影剤、を提供する。
【発明の効果】
【0020】
本発明は、ナノダイヤモンド粒子の高い生体適合性及び特異的な体内貯留挙動を利用することより、従来の短時間で体外へ排出されるMRI造影剤と比較して、経時診断の利用に適したMRI造影剤を提供でき、さらに、イオン注入やアニール処理などの煩雑な操作を施すことなく、簡便にMRI造影剤用ナノダイヤモンド粒子を提供することができるという優れた効果を有する。
【図面の簡単な説明】
【0021】
【図1】化学反応の概略図である。
【図2】XPSスペクトルである。同図(a)は、DTPA反応前のナノダイヤモンド粒子(5nm)のXPSスペクトルである。同図(b)は、DTPA反応後のナノダイヤモンド粒子(5nm)のXPSスペクトルである。
【図3】IRスペクトルである。同図(a)は、DTPA反応前のナノダイヤモンド粒子(5nm)のIRスペクトルである。同図(b)は、DTPAのIRスペクトルである。同図(c)は、DTPA反応前のナノダイヤモンド粒子(5nm)のIRスペクトルである。
【図4】DTPA反応後のナノダイヤモンド粒子(5nm)のMSスペクトルである。
【図5】錯形成反応後のナノダイヤモンド粒子(5nm)のXPSスペクトルである。
【図6】XPSスペクトルである。同図(a)は、DTPA反応前のナノダイヤモンド粒子(50nm)のXPSスペクトルである。同図(b)は、DTPA反応後のナノダイヤモンド粒子(50nm)のXPSスペクトルである。
【図7】錯形成反応後のナノダイヤモンド粒子(50nm)のXPSスペクトルである。
【図8】XPSスペクトルである。同図(a)は、DTPA反応前のナノダイヤモンド粒子(100nm)のXPSスペクトルである。同図(b)は、DTPA反応後のナノダイヤモンド粒子(100nm)のXPSスペクトルである。
【図9】錯形成反応後のナノダイヤモンド粒子(100nm)のXPSスペクトルである。
【図10】PBS及び注射用水のT1強調画像である。
【発明を実施するための形態】
【0022】
本発明のMRI造影剤用ナノダイヤモンド粒子は、ナノダイヤモンド粒子がキレート機能を有する有機分子で化学修飾され、さらにガドリニウムイオンで錯形成されていることが大きな特徴である。これによって、イオン注入やアニール処理などの煩雑な操作を施すことなく、簡便にMRI造影剤用ナノダイヤモンド粒子を作製することができる。
【0023】
通常、ナノダイヤモンド粒子は、粒径2nm〜100nmのナノナノダイヤモンド粒子を使用する。ナノナノダイヤモンド粒子の粒径については、粒径が2nm未満であると高度に凝集するために下限値を2nmとする。一方、粒径が100nmを越えると分散性の低下という問題があるので、上限値を100nmとする。
【0024】
前記キレート機能を有する有機分子としては、ジエチレントリアミン五酢酸、1,4,7,10−テトラアザシクロドデカン−1,4,7,10−四酢酸又はこれらの誘導体を使用することができる。このキレート剤として、市販品を使用することができる。
この錯形成反応は化学反応のみであり、室温で行うことができ、したがって特別な加熱装置やアニーリング装置は必要としない。また、キレート分子化学修飾反応を、先に行うことにより、ガドリニウムイオンの脱離を防止することができる効果を有する。
【0025】
前記のように、ナノダイヤモンド粒子に、キレート機能を有する有機分子を化学修飾させて、前記模式図[化3]に示すような構造の前駆体を得た後、該前駆体にガドリニウムイオンを錯形成させる。このガドリニウム錯体とナノダイヤモンド間は直接結合し、ナノダイヤモンド表面上の酸素系官能基で、カドリニウムイオン錯形成を補助している可能性がある。
【0026】
上記の代表例を示すと、次のようになる。すなわち、ナノダイヤモンド粒子及びジエチレントリアミン五酢酸の塩化メチレン懸濁液に塩化チオニルの塩化メチレン溶液を加えて、ナノダイヤモンド粒子にジエチレントリアミン五酢酸を化学修飾させる。
【0027】
前記塩化メチレン懸濁液中に含まれるジエチレントリアミン五酢酸は、ナノダイヤモンド粒子0.5gに対して、0.1〜5gとするのが好ましい。0.1g未満であると懸濁液での反応が進まないため0.1g以上とする。一方、5gを越えると未反応ジエチレントリアミン五酢酸が増加するため5g以下とする。より好ましくは0.5〜2gとする。また、このとき、塩化チオニルの塩化メチレン溶液は好ましくは1〜30mlとし、より好ましくは2〜20mlとする。
【0028】
その後、ジエチレントリアミン五酢酸を化学修飾させたナノダイヤモンドの水懸濁液に塩化カドリニウム水溶液を加えて、ガドリニウムイオンを錯形成させることで、MRI造影剤用ナノダイヤモンド粒子を製造することができる。すなわち、模式図[化5]に示す構造の物質を得ることができる。
【0029】
【化5】

【0030】
上記用量で作製したジエチレントリアミン五酢酸を化学修飾させたナノダイヤモンドの水懸濁液に対して、塩化カドリニウムは、0.1〜0.5gとするのが好ましい。0.1g未満であると反応が進まないため0.1g以上とする。一方、0.5gを越えると反応処理後の未反応塩化ガドリニウムの除去が難しくなることから0.5gとする。より好ましくは0.2〜0.3gとする。
【0031】
以上から、下記模式図[化6]に示す特徴のMRI造影剤用ナノダイヤモンド粒子を得ることができる。
【0032】
【化6】

【0033】
この工程の概略を図1に示す。なお、詳細は実施例で説明する。この図1の工程から明らかなように、出発物質から僅か2ステップ(工程)で、MRI造影剤用ナノダイヤモンド粒子を製造することができる。しかも、低温で製造でき、大型の設備や特殊な反応法を使用しなければならないという制限は、一切ないという、優れた効果を有する。
【実施例】
【0034】
実施例を具体的に説明するが、以下の説明は理解し易くするものであり、発明の本質を制限されるものではない。すなわち、発明に含まれる他の態様または変形を含有するものである。
【0035】
(実施例1)
(キレート機能を有する有機分子の化学修飾)
粒径が5nmのナノダイヤモンド粒子とジエチレントリアミン五酢酸(DTPA)の塩化メチレン懸濁液を作成した。次に、この懸濁液に塩化チオニルの塩化メチレン溶液を加えて、約7時間還流させた。これにより、ナノダイヤモンド粒子にジエチレントリアミン五酢酸が化学修飾された。化学反応の概略を図1に示す。
【0036】
当該化学修飾したナノダイヤモンド粒子を塩化メチレンで洗浄した。その後、微量に残る塩化チオニルを除去するために真空乾燥を行った。次に、水酸化ナトリウム水溶液、水、メタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)、IR(赤外分光法)、MS(質量分析法)、を測定した。その結果を図2〜図4に示す。
【0037】
図2(a)は、化学修飾前のナノダイヤモンド粒子のXPSスペクトルである。また、図2(b)は、化学修飾後のナノダイヤモンド粒子のXPSスペクトルである。図2(b)において、窒素に由来するピークが観察されたことから、ナノダイヤモンド粒子表面上にジエチレントリアミン五酢酸(DTPA)に由来する官能基が化学修飾されたことが確認できた。
【0038】
図3(a)は、化学修飾前のナノダイヤモンド粒子のIRスペクトルである。また、図3(b)は、ジエチレントリアミン五酢酸(DTPA)のIRスペクトルである。また、図3(c)は、化学修飾後のナノダイヤモンド粒子のIRスペクトルである。
図3(c)において、ジエチレントリアミン五酢酸(DTPA)に由来するピークが観察されたことから、ナノダイヤモンド粒子表面上にジエチレントリアミン五酢酸(DTPA)に由来する官能基が化学修飾されたことが確認できた。
【0039】
図4は、化学修飾後のナノダイヤモンド粒子のMSスペクトルである。図4において、ジエチレントリアミン五酢酸(DTPA)に由来するピークが観察されたことから、ナノダイヤモンド粒子表面上にジエチレントリアミン五酢酸(DTPA)に由来する官能基が化学修飾されたことが確認できた。すなわち、模式図[化7]に示す構造の物質を得ることができたと考えられる。
【0040】
【化7】

【0041】
(ガドリニウムイオンの錯形成)
ジエチレントリアミン五酢酸(DTPA)を化学修飾させたナノダイヤモンド粒子の水懸濁液を作成した。次に、この懸濁液に塩化カドリニウム水溶液を滴下した。その後、水酸化ナトリウム水溶液にてpH値を6程度に調整し、室温において、2時間攪拌した。
これにより、ガドリニウムイオンを錯形成した。化学反応の概略を図1に示す。
【0042】
当該錯形成したナノダイヤモンド粒子を水及びメタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)を測定した。その結果を図5に示す。
【0043】
図5は、錯形成後のナノダイヤモンド粒子のXPSスペクトルである。図5において、カドリニウムに由来するピークが観察されたことから、ガドリニウムイオンが錯形成されたことが確認できた。すなわち、下記模式図[化8]に示す構造のMRI造影剤用ナノダイヤモンド粒子を得ることができたと考えられる。
【0044】
【化8】

【0045】
(実施例2)
(キレート機能を有する有機分子の化学修飾)
粒径が50nmのナノダイヤモンド粒子とジエチレントリアミン五酢酸(DTPA)の塩化メチレン懸濁液を作成した。次に、この懸濁液に塩化チオニルの塩化メチレン溶液を加えて、約7時間還流させた。これにより、ナノダイヤモンド粒子にジエチレントリアミン五酢酸が化学修飾された。化学反応は、実施例1と同様である。
【0046】
当該化学修飾したナノダイヤモンド粒子を塩化メチレンで洗浄した。その後、微量に残る塩化チオニルを除去するために真空乾燥を行った。次に、水酸化ナトリウム水溶液、水、メタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)を測定した。その結果を図6に示す。
【0047】
図6(a)は、化学修飾前のナノダイヤモンド粒子のXPSスペクトルである。また、図6(b)は、化学修飾後のナノダイヤモンド粒子のXPSスペクトルである。図6(b)において、窒素に由来するピークが観察されたことから、ナノダイヤモンド粒子表面上にジエチレントリアミン五酢酸(DTPA)に由来する官能基が化学修飾されたことが確認できた。すなわち、実施例1と同様に、模式図[化7]に示す構造の物質を得ることができたと考えられる。
【0048】
(ガドリニウムイオンの錯形成)
ジエチレントリアミン五酢酸(DTPA)を化学修飾させたナノダイヤモンド粒子の水懸濁液を作成した。次に、この懸濁液に塩化カドリニウム水溶液を滴下した。その後、水酸化ナトリウム水溶液にてpH値を6程度に調整し、室温において、2時間攪拌した。
これにより、ガドリニウムイオンを錯形成した。化学反応は、実施例1と同様である。
【0049】
当該錯形成したナノダイヤモンド粒子を水及びメタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)を測定した。その結果を図7に示す。
【0050】
図7は、錯形成後のナノダイヤモンド粒子のXPSスペクトルである。図7において、カドリニウムに由来するピークが観察されたことから、ガドリニウムイオンが錯形成されたことが確認できた。すなわち、実施例1と同様に、模式図[化8]に示す構造のMRI造影剤用ナノダイヤモンド粒子を得ることができた。
【0051】
(実施例3)
(キレート機能を有する有機分子の化学修飾)
粒径が100nmのナノダイヤモンド粒子とジエチレントリアミン五酢酸(DTPA)の塩化メチレン懸濁液を作成した。次に、この懸濁液に塩化チオニルの塩化メチレン溶液を加えて、約7時間還流させた。これにより、ナノダイヤモンド粒子にジエチレントリアミン五酢酸が化学修飾された。化学反応は、実施例1と同様である。
【0052】
当該化学修飾したナノダイヤモンド粒子を塩化メチレンで洗浄した。その後、微量に残る塩化チオニルを除去するために真空乾燥を行った。次に、水酸化ナトリウム水溶液、水、メタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)を測定した。その結果を図8に示す。
【0053】
図8(a)は、化学修飾前のナノダイヤモンド粒子のXPSスペクトルである。また、図8(b)は、化学修飾後のナノダイヤモンド粒子のXPSスペクトルである。図8(b)において、窒素に由来するピークが観察されたことから、ナノダイヤモンド粒子表面上にジエチレントリアミン五酢酸(DTPA)に由来する官能基が化学修飾されたことが確認できた。すなわち、実施例1と同様に、模式図[化7]に示す構造の物質を得ることができた。
【0054】
(ガドリニウムイオンの錯形成)
ジエチレントリアミン五酢酸(DTPA)を化学修飾させたナノダイヤモンド粒子の水懸濁液を作成した。次に、この懸濁液に塩化カドリニウム水溶液を滴下した。その後、水酸化ナトリウム水溶液にてpH値を6程度に調整し、室温において、2時間攪拌した。
これにより、ガドリニウムイオンを錯形成した。化学反応は、実施例1と同様である。
【0055】
当該錯形成したナノダイヤモンド粒子を水及びメタノールによる洗浄を行い、減圧下で乾燥を行った。その後、当該ナノダイヤモンド粒子について、XPS(X線光電子分光法)を測定した。その結果を図9に示す。
【0056】
図9は、錯形成後のナノダイヤモンド粒子のXPSスペクトルである。図9において、カドリニウムに由来するピークが観察されたことから、ガドリニウムイオンが錯形成されたことが確認できた。すなわち、実施例1と同様に、模式図[化8]に示す構造のMRI造影剤用ナノダイヤモンド粒子を得ることができた。
【0057】
(MRI造影能の評価)
実施例1として、ジエチレントリアミン五酢酸(DTPA)を化学修飾し、さらに、ガドリニウムを錯形成したナノダイヤモンド粒子(以下、Gd−DTPA−ナノダイヤモンド粒子と称する。)を添加したPBS及び注射用水分散液(0.1w/v%)を作成した。
【0058】
(比較例)
比較例1として、未処理のナノダイヤモンド粒子(以下、未処理−ナノダイヤモンド粒子と称する。)を添加したPBS及び注射用水分散液(0.1w/v%)を作成した。
比較例2として、何も添加しないPBS及び注射用水分散液(0.1w/v%)を用意した。
【0059】
これらを、1.5テスラMRI装置でT1強調画像を撮像した。その結果を、図10に示す。図10から、実施例のGd−DTPA−ナノダイヤモンド粒子は、比較例に比べて、高信号が示されたことから、高いMRI造影能を有することを確認できた。
【産業上の利用可能性】
【0060】
本発明は、キレート機能を有する有機分子で化学修飾し、さらに、ガドリニウムイオンで錯形成することによって、イオン注入やアニール処理などの煩雑な操作を施すことなく、簡便に、MRI造影能を有するナノダイヤモンド粒子を提供することができるという優れた効果を有するので、MRI造影剤等へ適用することができる。
【特許請求の範囲】
【請求項1】
ナノダイヤモンド粒子がキレート機能を有する有機分子で化学修飾されることにより形成された前駆体が、ガドリニウムイオンで錯形成されていることを特徴とするMRI造影剤用ナノダイヤモンド。
【請求項2】
前記キレート機能を有する有機分子が、ジエチレントリアミン五酢酸、1,4,7,10−テトラアザシクロドデカン−1,4,7,10−四酢酸又はこれらの誘導体であることを特徴とする請求項1記載のMRI造影剤用ナノダイヤモンド粒子。
【請求項3】
前記ナノダイヤモンド粒子が、粒径2nm〜100nmであることを特徴とする請求項1又は2記載のMRI造影剤用ナノダイヤモンド粒子。
【請求項4】
前記前駆体が、下記の模式図[化9]で表されることを特徴とする請求項1〜3のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子。
【化9】

【請求項5】
下記の模式図[化10]で表されることを特徴とする請求項1〜4のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子。
【化10】

【請求項6】
請求項1〜5のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子を成分とするMRI造影剤。
【請求項7】
ナノダイヤモンド粒子にキレート機能を有する有機分子を化学修飾させて前駆体を形成した後、前記前駆体をガドリニウムイオンで錯形成させることを特徴とするMRI造影剤用ナノダイヤモンド粒子の製造方法。
【請求項8】
前記キレート機能を有する有機分子が、ジエチレントリアミン五酢酸、1,4,7,10−テトラアザシクロドデカン−1,4,7,10−四酢酸又はこれらの誘導体であることを特徴とする請求項7記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
【請求項9】
前記ナノダイヤモンド粒子が、粒径2nm〜100nmであることを特徴とする請求項7又は8記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
【請求項10】
ナノダイヤモンド粒子及びジエチレントリアミン五酢酸の塩化メチレン懸濁液に塩化チオニルの塩化メチレン溶液を加えて、ナノダイヤモンド粒子にジエチレントリアミン五酢酸を化学修飾させ、その後、ジエチレントリアミン五酢酸を化学修飾させたナノダイヤモンドの水懸濁液に塩化カドリニウム水溶液を加えて、ガドリニウムイオンを錯形成させることを特徴とする請求項7〜9のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
【請求項11】
前記前駆体が、下記の模式図[化11]で表されることを特徴とする請求項7〜10のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
【化11】

【請求項12】
下記の模式図[化12]で表されることを特徴とする請求項7〜11のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法
【化12】

【請求項13】
請求項7〜12のいずれか一項に記載の製造方法により製造されたMRI造影剤用ナノダイヤモンド粒子を成分とするMRI造影剤。
【請求項1】
ナノダイヤモンド粒子がキレート機能を有する有機分子で化学修飾されることにより形成された前駆体が、ガドリニウムイオンで錯形成されていることを特徴とするMRI造影剤用ナノダイヤモンド。
【請求項2】
前記キレート機能を有する有機分子が、ジエチレントリアミン五酢酸、1,4,7,10−テトラアザシクロドデカン−1,4,7,10−四酢酸又はこれらの誘導体であることを特徴とする請求項1記載のMRI造影剤用ナノダイヤモンド粒子。
【請求項3】
前記ナノダイヤモンド粒子が、粒径2nm〜100nmであることを特徴とする請求項1又は2記載のMRI造影剤用ナノダイヤモンド粒子。
【請求項4】
前記前駆体が、下記の模式図[化9]で表されることを特徴とする請求項1〜3のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子。
【化9】

【請求項5】
下記の模式図[化10]で表されることを特徴とする請求項1〜4のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子。
【化10】

【請求項6】
請求項1〜5のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子を成分とするMRI造影剤。
【請求項7】
ナノダイヤモンド粒子にキレート機能を有する有機分子を化学修飾させて前駆体を形成した後、前記前駆体をガドリニウムイオンで錯形成させることを特徴とするMRI造影剤用ナノダイヤモンド粒子の製造方法。
【請求項8】
前記キレート機能を有する有機分子が、ジエチレントリアミン五酢酸、1,4,7,10−テトラアザシクロドデカン−1,4,7,10−四酢酸又はこれらの誘導体であることを特徴とする請求項7記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
【請求項9】
前記ナノダイヤモンド粒子が、粒径2nm〜100nmであることを特徴とする請求項7又は8記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
【請求項10】
ナノダイヤモンド粒子及びジエチレントリアミン五酢酸の塩化メチレン懸濁液に塩化チオニルの塩化メチレン溶液を加えて、ナノダイヤモンド粒子にジエチレントリアミン五酢酸を化学修飾させ、その後、ジエチレントリアミン五酢酸を化学修飾させたナノダイヤモンドの水懸濁液に塩化カドリニウム水溶液を加えて、ガドリニウムイオンを錯形成させることを特徴とする請求項7〜9のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
【請求項11】
前記前駆体が、下記の模式図[化11]で表されることを特徴とする請求項7〜10のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法。
【化11】

【請求項12】
下記の模式図[化12]で表されることを特徴とする請求項7〜11のいずれか一項に記載のMRI造影剤用ナノダイヤモンド粒子の製造方法
【化12】

【請求項13】
請求項7〜12のいずれか一項に記載の製造方法により製造されたMRI造影剤用ナノダイヤモンド粒子を成分とするMRI造影剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2013−39216(P2013−39216A)
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願番号】特願2011−177695(P2011−177695)
【出願日】平成23年8月15日(2011.8.15)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(599055382)学校法人東邦大学 (18)
【Fターム(参考)】
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願日】平成23年8月15日(2011.8.15)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(599055382)学校法人東邦大学 (18)
【Fターム(参考)】
[ Back to top ]

