Mg2Si微粒子及びその製造方法
【課題】結晶性が高く、微細であり、しかも不純物量の少ないMg2Si微粒子及びその製造方法を提供すること。
【解決手段】比表面積が30m2/g以上であり、Mg2SiのXRD最強線強度(IMg2Si)に対するSiのXRD最強線強度(ISi)の比(=ISi×100/IMg2Si)が5.0%以下であるMg2Si微粒子。このようなMg2Si微粒子は、Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを、Mg/Si比(モル比)が2以下となり、かつ、Na/Si比(モル比)が1以上9以下となるように配合し、配合物を、0.7Tmin以上Tmin未満の温度(但し、Tminは、前記Na−Si系化合物の融点、共晶点、及び分解温度の内の最も低い温度)で加熱し、反応物を溶媒で洗浄し、未反応原料及び副生成物を除去することにより得られる。
【解決手段】比表面積が30m2/g以上であり、Mg2SiのXRD最強線強度(IMg2Si)に対するSiのXRD最強線強度(ISi)の比(=ISi×100/IMg2Si)が5.0%以下であるMg2Si微粒子。このようなMg2Si微粒子は、Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを、Mg/Si比(モル比)が2以下となり、かつ、Na/Si比(モル比)が1以上9以下となるように配合し、配合物を、0.7Tmin以上Tmin未満の温度(但し、Tminは、前記Na−Si系化合物の融点、共晶点、及び分解温度の内の最も低い温度)で加熱し、反応物を溶媒で洗浄し、未反応原料及び副生成物を除去することにより得られる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、Mg2Si微粒子及びその製造方法に関し、さらに詳しくは、熱電材料、Li二次電池の負極材料などに使用することが可能なMg2Si微粒子及びその製造方法に関する。
【背景技術】
【0002】
金属シリサイドは、Siを多量に含んでいるため、一般に、耐酸化性や耐食性に優れている。また、金属シリサイドの中には、半導体特性や高温における機械的特性に優れたものも知られている。そのため、金属シリサイドは、熱電材料、発熱体、耐酸化コーティング材料、高温構造材料、半導体などへの応用が期待されている。特に、Mg2Siは、熱電特性やLiイオンの吸蔵放出特性に優れているだけでなく、低密度であり、資源が豊富でコストが安く、環境負荷も小さいという特徴がある。
【0003】
このようなMg2Siの製造方法に関しては、従来から種々の提案がなされている。
例えば、非特許文献1には、2:1の割合でMgとSiとを混合粉砕し、混合粉砕物を成形し、成形体にマイクロ波を照射するMg2Si粉末の製造方法が開示されている。
同文献には、このような方法により、アンチ蛍石型のMg2Siと少量のSiとを含む粉末が得られると記載されている。
なお、同文献の図2には、125〜200Wのマイクロ波を照射した試料B1のX線回折パターンが記載されている。同図には、Mg2Siの回折ピークに加えて、相対的に大きなSiの回折ピークが認められており、Mg2Siの最強線(2θ=〜40°)の強度に対するSiの最強線(2θ=〜28°)の強度の比は、12.0%と見積もられる。
【0004】
また、非特許文献2には、
(1)NaSi粉末の成形体及びMg粉末をBNルツボに入れ、
(2)BNルツボをステンレス鋼チューブに入れて密封し、973K(>Mgの融点)で24h加熱し、
(3)加熱後に残留しているNaを2−プロパノール及びエタノールで除去する
Mg2Siの製造方法が開示されている。
同文献には、
(a)加熱により、表面にMg金属が付着し、内部がNaで満たされたバルク試料が得られる点、
(b)バルク試料をアルコールと反応させると、中空構造が得られる点、及び、
(c)中空構造の外表面は、Mg及びMg2Siに加えて、MgOのXRDピークが認められるのに対し、中空構造の内面は、Mg2Siの単相である点、
が記載されている。
【0005】
また、特許文献1には、Mg2Siではないが、
(1)Fe粉末、Si粉末及びNa片をBNルツボに入れ、
(2)BNルツボをステンレス鋼チューブに入れて密封し、673〜1073Kで1.5〜24時間加熱し、
(3)生成物に含まれるNaやNa−Si化合物を2−プロパノール、エタノール混合溶液で除去する
β−FeSi2粉末の製造方法が開示されている。
【0006】
さらに、非特許文献3には、Mg2Siではないが、
(1)無水NiCl2とSiCl4とNaとをステンレス鋼製オートクレーブに入れ、
(2)オートクレーブを密封した後、600℃で16h保持し、
(3)生成物を無水アルコールに浸漬した後、析出物をろ過し、蒸留水、希塩酸及び無水アルコールで洗浄する
δ−Ni2Siナノワイヤーの製造方法が開示されている。
【0007】
非特許文献1に記載されているように、MgとSiの混合粉砕物からなる成形体にマイクロ波を照射すると、Mg2Siを含む微結晶が得られる。しかしながら、この方法では、高比表面積を有する高純度のMg2Si粉末を合成するのは困難である。
【0008】
一方、非特許文献2に記載されているように、NaSiとMg融液とを反応させると、大きさが50〜200μmであるMg2Si結晶粒が密に充填しており、ボイドや隙間のない中空構造が得られる。しかしながら、この方法では、Mg2Siからなる微粉末は得られない。これは、合成過程でNa−Mg融液が形成され、Mg2Si粒子を粒成長させるためと考えられる。
【0009】
さらに、単相で、かつ微細なMg2Si粉末を得るために、Mg2Si合金インゴットをボールミルで粉砕する方法も考えられる。しかしながら、通常の粉砕法では、一般に1μm以下の粒子を効率よく製造するのは困難である。また、ボールの削りカスなどの不純物の混入が避けられない。さらに、粉砕された粒子の最表面はアモルファス化するため、結晶性の高い粒子を得ることは困難である。
また、MgとSiとをメカニカルアロイングにより合金化する方法も考えられるが、メカニカルアロイング法により単相のMg2Siを得るのは困難である。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2009−046381号公報
【非特許文献】
【0011】
【非特許文献1】Dalton Trans., vol.39, 11074(2010)
【非特許文献2】J.Mater.Sci., vol.44, 5688(2009)
【非特許文献3】Chem.Lett., vol.34, 326(2005)
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明が解決しようとする課題は、結晶性が高く、微細であり、しかも不純物量の少ないMg2Si微粒子及びその製造方法を提供することにある。
【課題を解決するための手段】
【0013】
上記課題を解決するために本発明に係るMg2Si微粒子の製造方法は、
Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを、Mg/Si比(モル比)が2以下となり、かつ、Na/Si比(モル比)が1以上9以下となるように配合する配合工程と、
前記配合工程で得られた配合物を、0.7Tmin以上Tmin未満の温度(但し、Tminは、前記Na−Si系化合物の融点、共晶点、及び分解温度の内の最も低い温度)で加熱し、得られた反応物を冷却する反応工程と、
前記反応物を溶媒で洗浄し、未反応原料及び副生成物を除去する洗浄工程と
を備えていることを要旨とする。
【0014】
また、本発明に係るMg2Si微粒子は、
本発明に係る方法により得られ、
比表面積が30m2/g以上であり、
Mg2SiのXRD最強線強度(IMg2Si)に対するSiのXRD最強線強度(ISi)の比(=ISi×100/IMg2Si)が5.0%以下である
ことを要旨とする。
【発明の効果】
【0015】
Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを所定の比率で混合し、混合物を所定の温度で加熱すると、結晶性が高く、微細であり、しかも不純物量の少ないMg2Si微粉末が得られる。これは、
(1)生成反応の際、Na−Si系化合物中のNaとMgのハロゲン化物中のMgとが交換することでNa−Si系化合物が微細化され、かつ、SiとMgが反応することでMg2Si微粒子が生成するため、及び、
(2)Mg2Siを粒成長させる融液が発生しない条件下で合成されるため、
と考えられる。
【図面の簡単な説明】
【0016】
【図1】試料の合成方法を示すフロー図である。
【図2】合成装置の概略構成図である。
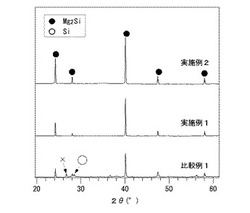
【図3】実施例1、2及び比較例1で得られた粉末のXRDパターンである。
【図4】実施例2で得られた粉末のSEM像(2視野)である。
【図5】Na−Si二元系の相図である。
【発明を実施するための形態】
【0017】
以下に本発明の一実施の形態について詳細に説明する。
[1. Mg2Si微粒子]
本発明に係るMg2Si微粒子は、
本発明に係る方法により得られ、
比表面積が30m2/g以上であり、
Mg2SiのXRD最強線強度(IMg2Si)に対するSiのXRD最強線強度(ISi)の比(=ISi×100/IMg2Si)が5.0%以下である
ことを特徴とする。
【0018】
[1.1. 比表面積]
本発明において、「比表面積」とは、BET法により算出される値をいう。
本発明に係るMg2Si微粒子の比表面積は、30m2/g以上である。比表面積が高いMg2Si微粒子は、後述する方法により得られる。しかも、このような高比表面積を得るために、粉砕を必要としない。製造条件を最適化すると、比表面積が35m2/g以上であるMg2Si微粒子が得られる。
【0019】
[1.2. 最強線強度比]
本発明において、「最強線強度比」とは、Mg2SiのXRD最強線強度(IMg2Si)に対するSiのXRD最強線強度(ISi)の比(=ISi×100/IMg2Si(%))をいう。
本発明に係るMg2Si微粒子の最強線強度比は、5.0%以下である。最強線強度比が小さいMg2Si微粒子は、後述する方法により得られる。製造条件を最適化すると、最強線強度比が4.0%以下、あるいは、3.0%以下であるMg2Si微粒子が得られる。
【0020】
[1.3. 平均粒径]
本発明において、「粒径」とは、SEM像から測定される1次粒子の最大長さをいう。
「平均粒径」とは、無作為に選んだ50個以上の1次粒子の粒径の平均値をいう。
本発明に係るMg2Si微粒子は、平均粒径が200nm以下である。Mg2Si微粒子は、大部分が粒径200nm以下の微粒子であるが、一部、粒径が数百nmの1次粒子も含まれている。また、合成直後のMg2Si微粒子は、このような1次粒子の凝集体又は集合体になっている。
なお、微粒子を完全な球と仮定し、比表面積から球の直径(平均粒径)を算出することができる。本発明に係るMg2Si微粒子の場合、比表面積から算出される平均粒径は、100nm未満となる。
【0021】
[1.4. Mg/Si比]
本発明において、「Mg/Si比」とは、Mg2Si微粒子全体に含まれるSiに対するMgの比(モル比)をいう。Mg/Si比は、無作為に選んだ10箇所以上の地点においてSEM−EDXにより元素分析を行い、各地点におけるMg/Si比の平均値を算出することにより得られる。
後述する方法を用いると、Mg/Si比が1.90〜2.10であるMg2Si微粒子が得られる。
【0022】
[1.5. 不純物]
本発明に係るMg2Si微粒子は、Mg2Si相のみからなるのが好ましいが、不純物が含まれていても良い。但し、Mg2Si微粒子の特性を低下させる不純物は、少ないほど良い。
不純物としては、例えば、
(1)出発原料の残留物、
(2)Si、MgO、Mg(OH)2などの副生成物、
などがある。
【0023】
本発明において、「不純物量」とは、粉末全体に含まれる元素の数に対するMg2Si以外の元素の数の割合をいう。不純物量は、無作為に選んだ10箇所以上の地点においてSEM−EDXにより元素分析を行い、各地点における不純物量の平均値を算出することにより得られる。
後述する方法を用いると、不純物量が5at%以下であるMg2Si微粒子が得られる。製造条件を最適化すると、不純物量が4at%以下、あるいは、3at%以下であるMg2Si微粒子が得られる。
【0024】
[2. Mg2Si微粒子の製造方法]
本発明に係るMg2Si微粒子の製造方法は、配合工程と、反応工程と、洗浄工程とを備えている。
【0025】
[2.1. 配合工程]
配合工程は、Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを、Mg/Si比(モル比)が2以下となり、かつ、Na/Si比(モル比)が1以上9以下となるように配合する工程である。
【0026】
[2.1.1. 原料]
「Na−Si系化合物」とは、NaとSiから構成される化合物をいう。Na−Si系化合物としては、NaSi、Naクラスレート(Na8Si46、NaxSi136(1.5<x<24))などがある。
Mgのハロゲン化物としては、MgCl2、MgBr2、MgI2などがある。特に、MgCl2は、溶媒に対する溶解性が高く、副生成物(NaCl)も溶媒に対する溶解性が高いので、原料として好適である。
Naは、Mgのハロゲン化物からMgを生成させるための還元剤として機能する。Na−Si系化合物に含まれるNaもまた、還元剤として機能するので、Naは、必要に応じて添加することができる。Na−Si系化合物とMgのハロゲン化物だけで後述するNa/Si比を満足させることができる場合には、Naの添加を省略することができる。
【0027】
[2.1.2. Mg/Si比]
原料中のMg/Si比(モル比)は、合成された微粒子に含まれる不純物量に影響を与える。
Mgのハロゲン化物は、ある種の溶媒に溶解する。そのため、Mg/Si比が化学量論比を超えた場合であっても、過剰に加えたMgのハロゲン化物がそのままの形で残留しているときには、反応物からMgのハロゲン化物を比較的容易に除去することができる。しかしながら、過剰のMgは、難溶性のMgOやMg(OH)2となって残留する場合がある。
一方、Na−Si系化合物もまた、ある種の溶媒に溶解する。また、Mg/Si比が化学量論比より小さい場合であっても、Na/Si比が後述の範囲にある場合には、過剰のSiが不純物相として残留するおそれは少ない。
従って、高純度のMg2Siを合成するためには、Mg/Si比は、2以下とする必要がある。
一方、Mg/Si比が小さくなりすぎると、Mg2Siの収量が低下する。従って、Mg/Si比は、1.8以上が好ましい。Mg/Si比は、さらに好ましくは、1.9以上である。
【0028】
[2.1.3. Na/Si比]
Na/Si比(モル比)は、合成された微粒子に含まれる不純物量に影響を与える。
Naに対してSiが過剰である場合、反応物中にSiが残留する場合がある。従って、Na/Si比は、1以上である必要がある。Na/Si比は、さらに好ましくは、1.5以上である。
一方、Siに対してNaが過剰であっても、Naを含む不純物は、比較的容易に除去することができる。しかしながら、Naが大過剰になると、Mgを含む不純物量が増大する。これは、Naが大過剰になると反応中に液相が生成し、Siと反応できなかったMgが冷却、洗浄の過程で酸化又は水酸化されるためと考えられる。従って、Na/Si比は、9以下である必要がある。Na/Si比は、さらに好ましくは、8以下である。
【0029】
[2.2. 反応工程]
反応工程は、前記配合工程で得られた配合物を、0.7Tmin以上Tmin未満の温度(但し、Tminは、前記Na−Si系化合物の融点、共晶点、及び分解温度の内の最も低い温度)で加熱し、得られた反応物を冷却する工程である。
【0030】
加熱温度が低すぎると、副生成物としてSiが生成する場合がある。従って、加熱温度は、0.7Tmin以上である必要がある。ここで、「Tmin」は、前記Na−Si系化合物の融点、共晶点、及び分解温度の内の最も低い温度である。例えば、NaSiの場合、融点:798℃、共晶点:680℃、分解温度:なし、であるので、Tminは680℃となる。加熱温度は、さらに好ましくは0.8Tmin以上である。
一方、加熱温度が高すぎると、液相が生成し、Mg2Si粒子が粗大化する。従って、加熱温度は、Tmin未満である必要がある。加熱温度は、さらに好ましくは0.97Tmin以下である。
加熱時間は、特に限定されるものではなく、加熱温度に応じて最適な時間を選択する。一般に、加熱温度が高くなるほど、短時間で反応を完了させることができる。反応終了後、反応物を冷却する。
【0031】
[2.3. 洗浄工程]
洗浄工程は、前記反応物を溶媒で洗浄し、未反応原料及び副生成物を除去する工程である。
出発原料であるNa−Si系化合物、Mgのハロゲン化物及びNaは、いずれも溶媒に可溶である。また、反応が理想的に進行した場合、副生成物は、可溶性のハロゲン塩(NaClなど)のみからなる。そのため、得られた反応物を適当な溶媒で洗浄すれば、本発明に係るMg2Si微粒子が得られる。
溶媒が未反応原料及び副生成物のすべてを溶解可能である場合、洗浄は、一段階で行うことができる。一方、溶媒が未反応原料又は副生成物の一部のみを溶解可能である場合、洗浄は、各成分を溶解可能な溶媒を用いて複数段階で行うか、あるいは、混合溶媒を用いて一段階で行うのが好ましい。
【0032】
[3. Mg2Si微粒子及びその製造方法の作用]
Mg2Si微粒子を合成する方法としては、例えば、非特許文献1に記載されているように、MgとSiとを混合粉砕し、混合粉砕物を成形し、成形体にマイクロ波を照射する方法が知られている。
しかしながら、同文献に記載の方法は、基本的には固相反応により目的とする相を生成させる方法である。そのため、マイクロ波照射が不十分であるときには、生成した一次粒子の粒成長や凝集は生じにくいが、同文献の図2に示されているように、未反応のSiが多量(最強線強度比で12%に相当する)に残留する。
一方、これを避けるためにマイクロ波照射時間を長くすると、原料間の固相反応が進行すると同時に、生成した粒子の粒成長や凝集が著しく進行する。さらに、過剰のマイクロ波照射は、生成したMg2Siの熱分解及び分解生成物であるMgの蒸発を引き起こし(同文献の第11077頁右欄第4行〜8行参照)、粉末中のSi量を増大させる原因となる。
そのため、同文献に記載の方法では、高純度と高比表面積とを兼ね備えたMg2Si粒子を合成するのは困難である。
【0033】
これに対し、Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを所定の比率で混合し、混合物を所定の温度で加熱すると、結晶性が高く、微細であり、しかも不純物量の少ないMg2Si微粉末が得られる。しかも、高比表面積を得るために、粉砕を必要としない。
これは、
(1)生成反応の際、Na−Si系化合物中のNaとMgのハロゲン化物中のMgとが交換することでNa−Si系化合物が微細化され、かつ、SiとMgが反応することでMg2Si微粒子が生成するため、及び、
(2)Mg2Siを粒成長させる融液が発生しない条件下で合成されるため、
と考えられる。
【実施例】
【0034】
(実施例1〜2、比較例1〜2)
[1. 試料の作製]
図1に示す手順に従い、粉末を合成した。すなわち、まず、所定量のNaSi粉末、MgCl2粉末、及びNaを秤量した。Mg/Si比は、2.0とした。また、Na/Si比は、4又は15とした(表1参照)。本実施例の場合、Tminは、680℃(NaSiの共晶点)である。
図2に示すように、原料をBNルツボに入れ、さらにBNルツボをSUS容器に入れた。SUS容器内をAr雰囲気とした後、SUS容器を密封した。このSUS容器を所定温度で加熱した。加熱条件は、450℃(0.66Tmin)×5h、550℃(0.81Tmin)×5h、又は、650℃(0.96Tmin)×5hとした。
室温に冷却後、BNルツボ内の加熱物を取り出し、乳鉢で粉砕した。粉砕物をアルコールに分散させ、攪拌することで洗浄した。さらに、粉末を分離・回収し、乾燥させた。
【0035】
【表1】

【0036】
[2. 試験方法]
[2.1. X線回折]
合成された粉末についてX線回折を行い、生成相を同定した。
[2.2. SEM観察及びSEM−EDX分析]
合成された粉末について、SEM観察を行った。また、SEM−EDX分析は、加速電圧:10keV、スポット径:約1μmの条件下で行った。
[2.3. 比表面積]
BET法により比表面積を測定した。
【0037】
[3. 結果]
[3.1. X線回折]
図3に、実施例1〜2及び比較例1で得られた粉末のXRDパターンを示す。なお、図3中、「×」は、BN(るつぼが割れて試料に紛れ込んだもの)を表す。
いずれの条件においても、Mg2Siが主相と考えられる粉末が合成された。仕込み量が同じ場合、比較例1(加熱温度:450℃)ではSiを含有しているのに対し、実施例1(加熱温度:550℃)及び実施例2(加熱温度:650℃)では、XRDパターン中においてほぼ不純物が観測されなかった(図3参照)。ここで、比較例1において、ISi×100/IMg2Si=5.6%と算出された。
【0038】
[3.2. SEM観察及び比表面積]
図4に、実施例2で得られた粉末のSEM像(2視野)を示す。図4より、得られた粉末は、粒径200nm以下の多数の粒子が凝集、又は集合した粉末であることがわかった。一部、数百nm以上の粒子も含んでいるが、平均粒径は、少なくとも200nm以下であると考えられる。
観察視野内でEDX分析を行ったところ、図4(a)ではMg/Si比=1.95、図4(b)ではMg/Si比=2.04であった。さらに、実施例2で得られた粉末の比表面積は、38m2/gであった。
【0039】
仕込み組成が異なり、加熱条件が同じ試料(実施例2、比較例2)については、不純物量が異なった。すなわち、SEM−EDX分析では、実施例2ではMg/Si比〜2であったのに対し、比較例2では図4と同等の〜20μm×〜20μmの領域のEDX分析ではMg/Si比〜3であった。
これにより、比較例2においては、MgO、Mg(OH)2などの不純物が含有されているものと推定される。また、Mg/Si比〜3より、含有不純物量は5%より多いことは明らかであると考えられる。
【0040】
Mg2Siの生成過程は次のように考えられる。NaSi中のNa及び/又は添加したNaは、還元剤として作用し、MgCl2からMgを生成させる。生成したMgは、NaSi中のSiと反応することでMg2Siを生成させると共に、副生成物としてNaClを生成させる。後者の反応の過程で、NaSi粒子が解砕しながらMgと反応するために、Mg2Si微粒子が生成するものと推定される。原料のNaSi、MgCl2の粒子径、両者の混合状態、加熱条件(急速加熱)などの条件を変えることにより、生成したMg2Si粒子の粒径を変化させることも可能と考えられる。
未反応の原料(Na、NaSi、MgCl2)や副生成物(NaCl)は、いずれも溶媒に可溶であるので、反応生成物を溶媒で洗浄することにより、Mg2Si微粒子を得ることができる。
【0041】
図5に、Na−Si二元系の相図(出典:H.Morito et al., Journal of Alloys and Compounds 480(2009)723-726)を示す。
比較例1、実施例1〜2で示されるように、適切な加熱条件(温度など)を選択すれば、不純物のないMg2Si粒子が得られる。また、同じ温度において実施例2と比較例2で不純物量が大きく異なるのは、図5に示されるように、後者は前者よりも液相が多く存在する条件であるために、Siと反応できなかったMgが、冷却、洗浄の過程で酸化又は水酸化されて、アモルファスの不純物として残存したものと推察される。
【0042】
以上、本発明の実施の形態について詳細に説明したが、本発明は上記実施の形態に何ら限定されるものではなく、本発明の要旨を逸脱しない範囲で種々の改変が可能である。
【産業上の利用可能性】
【0043】
本発明に係るMg2Si微粒子及びその製造方法は、熱電材料やLi二次電池の負極材料及びその製造方法として使用することができる。
【技術分野】
【0001】
本発明は、Mg2Si微粒子及びその製造方法に関し、さらに詳しくは、熱電材料、Li二次電池の負極材料などに使用することが可能なMg2Si微粒子及びその製造方法に関する。
【背景技術】
【0002】
金属シリサイドは、Siを多量に含んでいるため、一般に、耐酸化性や耐食性に優れている。また、金属シリサイドの中には、半導体特性や高温における機械的特性に優れたものも知られている。そのため、金属シリサイドは、熱電材料、発熱体、耐酸化コーティング材料、高温構造材料、半導体などへの応用が期待されている。特に、Mg2Siは、熱電特性やLiイオンの吸蔵放出特性に優れているだけでなく、低密度であり、資源が豊富でコストが安く、環境負荷も小さいという特徴がある。
【0003】
このようなMg2Siの製造方法に関しては、従来から種々の提案がなされている。
例えば、非特許文献1には、2:1の割合でMgとSiとを混合粉砕し、混合粉砕物を成形し、成形体にマイクロ波を照射するMg2Si粉末の製造方法が開示されている。
同文献には、このような方法により、アンチ蛍石型のMg2Siと少量のSiとを含む粉末が得られると記載されている。
なお、同文献の図2には、125〜200Wのマイクロ波を照射した試料B1のX線回折パターンが記載されている。同図には、Mg2Siの回折ピークに加えて、相対的に大きなSiの回折ピークが認められており、Mg2Siの最強線(2θ=〜40°)の強度に対するSiの最強線(2θ=〜28°)の強度の比は、12.0%と見積もられる。
【0004】
また、非特許文献2には、
(1)NaSi粉末の成形体及びMg粉末をBNルツボに入れ、
(2)BNルツボをステンレス鋼チューブに入れて密封し、973K(>Mgの融点)で24h加熱し、
(3)加熱後に残留しているNaを2−プロパノール及びエタノールで除去する
Mg2Siの製造方法が開示されている。
同文献には、
(a)加熱により、表面にMg金属が付着し、内部がNaで満たされたバルク試料が得られる点、
(b)バルク試料をアルコールと反応させると、中空構造が得られる点、及び、
(c)中空構造の外表面は、Mg及びMg2Siに加えて、MgOのXRDピークが認められるのに対し、中空構造の内面は、Mg2Siの単相である点、
が記載されている。
【0005】
また、特許文献1には、Mg2Siではないが、
(1)Fe粉末、Si粉末及びNa片をBNルツボに入れ、
(2)BNルツボをステンレス鋼チューブに入れて密封し、673〜1073Kで1.5〜24時間加熱し、
(3)生成物に含まれるNaやNa−Si化合物を2−プロパノール、エタノール混合溶液で除去する
β−FeSi2粉末の製造方法が開示されている。
【0006】
さらに、非特許文献3には、Mg2Siではないが、
(1)無水NiCl2とSiCl4とNaとをステンレス鋼製オートクレーブに入れ、
(2)オートクレーブを密封した後、600℃で16h保持し、
(3)生成物を無水アルコールに浸漬した後、析出物をろ過し、蒸留水、希塩酸及び無水アルコールで洗浄する
δ−Ni2Siナノワイヤーの製造方法が開示されている。
【0007】
非特許文献1に記載されているように、MgとSiの混合粉砕物からなる成形体にマイクロ波を照射すると、Mg2Siを含む微結晶が得られる。しかしながら、この方法では、高比表面積を有する高純度のMg2Si粉末を合成するのは困難である。
【0008】
一方、非特許文献2に記載されているように、NaSiとMg融液とを反応させると、大きさが50〜200μmであるMg2Si結晶粒が密に充填しており、ボイドや隙間のない中空構造が得られる。しかしながら、この方法では、Mg2Siからなる微粉末は得られない。これは、合成過程でNa−Mg融液が形成され、Mg2Si粒子を粒成長させるためと考えられる。
【0009】
さらに、単相で、かつ微細なMg2Si粉末を得るために、Mg2Si合金インゴットをボールミルで粉砕する方法も考えられる。しかしながら、通常の粉砕法では、一般に1μm以下の粒子を効率よく製造するのは困難である。また、ボールの削りカスなどの不純物の混入が避けられない。さらに、粉砕された粒子の最表面はアモルファス化するため、結晶性の高い粒子を得ることは困難である。
また、MgとSiとをメカニカルアロイングにより合金化する方法も考えられるが、メカニカルアロイング法により単相のMg2Siを得るのは困難である。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2009−046381号公報
【非特許文献】
【0011】
【非特許文献1】Dalton Trans., vol.39, 11074(2010)
【非特許文献2】J.Mater.Sci., vol.44, 5688(2009)
【非特許文献3】Chem.Lett., vol.34, 326(2005)
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明が解決しようとする課題は、結晶性が高く、微細であり、しかも不純物量の少ないMg2Si微粒子及びその製造方法を提供することにある。
【課題を解決するための手段】
【0013】
上記課題を解決するために本発明に係るMg2Si微粒子の製造方法は、
Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを、Mg/Si比(モル比)が2以下となり、かつ、Na/Si比(モル比)が1以上9以下となるように配合する配合工程と、
前記配合工程で得られた配合物を、0.7Tmin以上Tmin未満の温度(但し、Tminは、前記Na−Si系化合物の融点、共晶点、及び分解温度の内の最も低い温度)で加熱し、得られた反応物を冷却する反応工程と、
前記反応物を溶媒で洗浄し、未反応原料及び副生成物を除去する洗浄工程と
を備えていることを要旨とする。
【0014】
また、本発明に係るMg2Si微粒子は、
本発明に係る方法により得られ、
比表面積が30m2/g以上であり、
Mg2SiのXRD最強線強度(IMg2Si)に対するSiのXRD最強線強度(ISi)の比(=ISi×100/IMg2Si)が5.0%以下である
ことを要旨とする。
【発明の効果】
【0015】
Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを所定の比率で混合し、混合物を所定の温度で加熱すると、結晶性が高く、微細であり、しかも不純物量の少ないMg2Si微粉末が得られる。これは、
(1)生成反応の際、Na−Si系化合物中のNaとMgのハロゲン化物中のMgとが交換することでNa−Si系化合物が微細化され、かつ、SiとMgが反応することでMg2Si微粒子が生成するため、及び、
(2)Mg2Siを粒成長させる融液が発生しない条件下で合成されるため、
と考えられる。
【図面の簡単な説明】
【0016】
【図1】試料の合成方法を示すフロー図である。
【図2】合成装置の概略構成図である。
【図3】実施例1、2及び比較例1で得られた粉末のXRDパターンである。
【図4】実施例2で得られた粉末のSEM像(2視野)である。
【図5】Na−Si二元系の相図である。
【発明を実施するための形態】
【0017】
以下に本発明の一実施の形態について詳細に説明する。
[1. Mg2Si微粒子]
本発明に係るMg2Si微粒子は、
本発明に係る方法により得られ、
比表面積が30m2/g以上であり、
Mg2SiのXRD最強線強度(IMg2Si)に対するSiのXRD最強線強度(ISi)の比(=ISi×100/IMg2Si)が5.0%以下である
ことを特徴とする。
【0018】
[1.1. 比表面積]
本発明において、「比表面積」とは、BET法により算出される値をいう。
本発明に係るMg2Si微粒子の比表面積は、30m2/g以上である。比表面積が高いMg2Si微粒子は、後述する方法により得られる。しかも、このような高比表面積を得るために、粉砕を必要としない。製造条件を最適化すると、比表面積が35m2/g以上であるMg2Si微粒子が得られる。
【0019】
[1.2. 最強線強度比]
本発明において、「最強線強度比」とは、Mg2SiのXRD最強線強度(IMg2Si)に対するSiのXRD最強線強度(ISi)の比(=ISi×100/IMg2Si(%))をいう。
本発明に係るMg2Si微粒子の最強線強度比は、5.0%以下である。最強線強度比が小さいMg2Si微粒子は、後述する方法により得られる。製造条件を最適化すると、最強線強度比が4.0%以下、あるいは、3.0%以下であるMg2Si微粒子が得られる。
【0020】
[1.3. 平均粒径]
本発明において、「粒径」とは、SEM像から測定される1次粒子の最大長さをいう。
「平均粒径」とは、無作為に選んだ50個以上の1次粒子の粒径の平均値をいう。
本発明に係るMg2Si微粒子は、平均粒径が200nm以下である。Mg2Si微粒子は、大部分が粒径200nm以下の微粒子であるが、一部、粒径が数百nmの1次粒子も含まれている。また、合成直後のMg2Si微粒子は、このような1次粒子の凝集体又は集合体になっている。
なお、微粒子を完全な球と仮定し、比表面積から球の直径(平均粒径)を算出することができる。本発明に係るMg2Si微粒子の場合、比表面積から算出される平均粒径は、100nm未満となる。
【0021】
[1.4. Mg/Si比]
本発明において、「Mg/Si比」とは、Mg2Si微粒子全体に含まれるSiに対するMgの比(モル比)をいう。Mg/Si比は、無作為に選んだ10箇所以上の地点においてSEM−EDXにより元素分析を行い、各地点におけるMg/Si比の平均値を算出することにより得られる。
後述する方法を用いると、Mg/Si比が1.90〜2.10であるMg2Si微粒子が得られる。
【0022】
[1.5. 不純物]
本発明に係るMg2Si微粒子は、Mg2Si相のみからなるのが好ましいが、不純物が含まれていても良い。但し、Mg2Si微粒子の特性を低下させる不純物は、少ないほど良い。
不純物としては、例えば、
(1)出発原料の残留物、
(2)Si、MgO、Mg(OH)2などの副生成物、
などがある。
【0023】
本発明において、「不純物量」とは、粉末全体に含まれる元素の数に対するMg2Si以外の元素の数の割合をいう。不純物量は、無作為に選んだ10箇所以上の地点においてSEM−EDXにより元素分析を行い、各地点における不純物量の平均値を算出することにより得られる。
後述する方法を用いると、不純物量が5at%以下であるMg2Si微粒子が得られる。製造条件を最適化すると、不純物量が4at%以下、あるいは、3at%以下であるMg2Si微粒子が得られる。
【0024】
[2. Mg2Si微粒子の製造方法]
本発明に係るMg2Si微粒子の製造方法は、配合工程と、反応工程と、洗浄工程とを備えている。
【0025】
[2.1. 配合工程]
配合工程は、Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを、Mg/Si比(モル比)が2以下となり、かつ、Na/Si比(モル比)が1以上9以下となるように配合する工程である。
【0026】
[2.1.1. 原料]
「Na−Si系化合物」とは、NaとSiから構成される化合物をいう。Na−Si系化合物としては、NaSi、Naクラスレート(Na8Si46、NaxSi136(1.5<x<24))などがある。
Mgのハロゲン化物としては、MgCl2、MgBr2、MgI2などがある。特に、MgCl2は、溶媒に対する溶解性が高く、副生成物(NaCl)も溶媒に対する溶解性が高いので、原料として好適である。
Naは、Mgのハロゲン化物からMgを生成させるための還元剤として機能する。Na−Si系化合物に含まれるNaもまた、還元剤として機能するので、Naは、必要に応じて添加することができる。Na−Si系化合物とMgのハロゲン化物だけで後述するNa/Si比を満足させることができる場合には、Naの添加を省略することができる。
【0027】
[2.1.2. Mg/Si比]
原料中のMg/Si比(モル比)は、合成された微粒子に含まれる不純物量に影響を与える。
Mgのハロゲン化物は、ある種の溶媒に溶解する。そのため、Mg/Si比が化学量論比を超えた場合であっても、過剰に加えたMgのハロゲン化物がそのままの形で残留しているときには、反応物からMgのハロゲン化物を比較的容易に除去することができる。しかしながら、過剰のMgは、難溶性のMgOやMg(OH)2となって残留する場合がある。
一方、Na−Si系化合物もまた、ある種の溶媒に溶解する。また、Mg/Si比が化学量論比より小さい場合であっても、Na/Si比が後述の範囲にある場合には、過剰のSiが不純物相として残留するおそれは少ない。
従って、高純度のMg2Siを合成するためには、Mg/Si比は、2以下とする必要がある。
一方、Mg/Si比が小さくなりすぎると、Mg2Siの収量が低下する。従って、Mg/Si比は、1.8以上が好ましい。Mg/Si比は、さらに好ましくは、1.9以上である。
【0028】
[2.1.3. Na/Si比]
Na/Si比(モル比)は、合成された微粒子に含まれる不純物量に影響を与える。
Naに対してSiが過剰である場合、反応物中にSiが残留する場合がある。従って、Na/Si比は、1以上である必要がある。Na/Si比は、さらに好ましくは、1.5以上である。
一方、Siに対してNaが過剰であっても、Naを含む不純物は、比較的容易に除去することができる。しかしながら、Naが大過剰になると、Mgを含む不純物量が増大する。これは、Naが大過剰になると反応中に液相が生成し、Siと反応できなかったMgが冷却、洗浄の過程で酸化又は水酸化されるためと考えられる。従って、Na/Si比は、9以下である必要がある。Na/Si比は、さらに好ましくは、8以下である。
【0029】
[2.2. 反応工程]
反応工程は、前記配合工程で得られた配合物を、0.7Tmin以上Tmin未満の温度(但し、Tminは、前記Na−Si系化合物の融点、共晶点、及び分解温度の内の最も低い温度)で加熱し、得られた反応物を冷却する工程である。
【0030】
加熱温度が低すぎると、副生成物としてSiが生成する場合がある。従って、加熱温度は、0.7Tmin以上である必要がある。ここで、「Tmin」は、前記Na−Si系化合物の融点、共晶点、及び分解温度の内の最も低い温度である。例えば、NaSiの場合、融点:798℃、共晶点:680℃、分解温度:なし、であるので、Tminは680℃となる。加熱温度は、さらに好ましくは0.8Tmin以上である。
一方、加熱温度が高すぎると、液相が生成し、Mg2Si粒子が粗大化する。従って、加熱温度は、Tmin未満である必要がある。加熱温度は、さらに好ましくは0.97Tmin以下である。
加熱時間は、特に限定されるものではなく、加熱温度に応じて最適な時間を選択する。一般に、加熱温度が高くなるほど、短時間で反応を完了させることができる。反応終了後、反応物を冷却する。
【0031】
[2.3. 洗浄工程]
洗浄工程は、前記反応物を溶媒で洗浄し、未反応原料及び副生成物を除去する工程である。
出発原料であるNa−Si系化合物、Mgのハロゲン化物及びNaは、いずれも溶媒に可溶である。また、反応が理想的に進行した場合、副生成物は、可溶性のハロゲン塩(NaClなど)のみからなる。そのため、得られた反応物を適当な溶媒で洗浄すれば、本発明に係るMg2Si微粒子が得られる。
溶媒が未反応原料及び副生成物のすべてを溶解可能である場合、洗浄は、一段階で行うことができる。一方、溶媒が未反応原料又は副生成物の一部のみを溶解可能である場合、洗浄は、各成分を溶解可能な溶媒を用いて複数段階で行うか、あるいは、混合溶媒を用いて一段階で行うのが好ましい。
【0032】
[3. Mg2Si微粒子及びその製造方法の作用]
Mg2Si微粒子を合成する方法としては、例えば、非特許文献1に記載されているように、MgとSiとを混合粉砕し、混合粉砕物を成形し、成形体にマイクロ波を照射する方法が知られている。
しかしながら、同文献に記載の方法は、基本的には固相反応により目的とする相を生成させる方法である。そのため、マイクロ波照射が不十分であるときには、生成した一次粒子の粒成長や凝集は生じにくいが、同文献の図2に示されているように、未反応のSiが多量(最強線強度比で12%に相当する)に残留する。
一方、これを避けるためにマイクロ波照射時間を長くすると、原料間の固相反応が進行すると同時に、生成した粒子の粒成長や凝集が著しく進行する。さらに、過剰のマイクロ波照射は、生成したMg2Siの熱分解及び分解生成物であるMgの蒸発を引き起こし(同文献の第11077頁右欄第4行〜8行参照)、粉末中のSi量を増大させる原因となる。
そのため、同文献に記載の方法では、高純度と高比表面積とを兼ね備えたMg2Si粒子を合成するのは困難である。
【0033】
これに対し、Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを所定の比率で混合し、混合物を所定の温度で加熱すると、結晶性が高く、微細であり、しかも不純物量の少ないMg2Si微粉末が得られる。しかも、高比表面積を得るために、粉砕を必要としない。
これは、
(1)生成反応の際、Na−Si系化合物中のNaとMgのハロゲン化物中のMgとが交換することでNa−Si系化合物が微細化され、かつ、SiとMgが反応することでMg2Si微粒子が生成するため、及び、
(2)Mg2Siを粒成長させる融液が発生しない条件下で合成されるため、
と考えられる。
【実施例】
【0034】
(実施例1〜2、比較例1〜2)
[1. 試料の作製]
図1に示す手順に従い、粉末を合成した。すなわち、まず、所定量のNaSi粉末、MgCl2粉末、及びNaを秤量した。Mg/Si比は、2.0とした。また、Na/Si比は、4又は15とした(表1参照)。本実施例の場合、Tminは、680℃(NaSiの共晶点)である。
図2に示すように、原料をBNルツボに入れ、さらにBNルツボをSUS容器に入れた。SUS容器内をAr雰囲気とした後、SUS容器を密封した。このSUS容器を所定温度で加熱した。加熱条件は、450℃(0.66Tmin)×5h、550℃(0.81Tmin)×5h、又は、650℃(0.96Tmin)×5hとした。
室温に冷却後、BNルツボ内の加熱物を取り出し、乳鉢で粉砕した。粉砕物をアルコールに分散させ、攪拌することで洗浄した。さらに、粉末を分離・回収し、乾燥させた。
【0035】
【表1】

【0036】
[2. 試験方法]
[2.1. X線回折]
合成された粉末についてX線回折を行い、生成相を同定した。
[2.2. SEM観察及びSEM−EDX分析]
合成された粉末について、SEM観察を行った。また、SEM−EDX分析は、加速電圧:10keV、スポット径:約1μmの条件下で行った。
[2.3. 比表面積]
BET法により比表面積を測定した。
【0037】
[3. 結果]
[3.1. X線回折]
図3に、実施例1〜2及び比較例1で得られた粉末のXRDパターンを示す。なお、図3中、「×」は、BN(るつぼが割れて試料に紛れ込んだもの)を表す。
いずれの条件においても、Mg2Siが主相と考えられる粉末が合成された。仕込み量が同じ場合、比較例1(加熱温度:450℃)ではSiを含有しているのに対し、実施例1(加熱温度:550℃)及び実施例2(加熱温度:650℃)では、XRDパターン中においてほぼ不純物が観測されなかった(図3参照)。ここで、比較例1において、ISi×100/IMg2Si=5.6%と算出された。
【0038】
[3.2. SEM観察及び比表面積]
図4に、実施例2で得られた粉末のSEM像(2視野)を示す。図4より、得られた粉末は、粒径200nm以下の多数の粒子が凝集、又は集合した粉末であることがわかった。一部、数百nm以上の粒子も含んでいるが、平均粒径は、少なくとも200nm以下であると考えられる。
観察視野内でEDX分析を行ったところ、図4(a)ではMg/Si比=1.95、図4(b)ではMg/Si比=2.04であった。さらに、実施例2で得られた粉末の比表面積は、38m2/gであった。
【0039】
仕込み組成が異なり、加熱条件が同じ試料(実施例2、比較例2)については、不純物量が異なった。すなわち、SEM−EDX分析では、実施例2ではMg/Si比〜2であったのに対し、比較例2では図4と同等の〜20μm×〜20μmの領域のEDX分析ではMg/Si比〜3であった。
これにより、比較例2においては、MgO、Mg(OH)2などの不純物が含有されているものと推定される。また、Mg/Si比〜3より、含有不純物量は5%より多いことは明らかであると考えられる。
【0040】
Mg2Siの生成過程は次のように考えられる。NaSi中のNa及び/又は添加したNaは、還元剤として作用し、MgCl2からMgを生成させる。生成したMgは、NaSi中のSiと反応することでMg2Siを生成させると共に、副生成物としてNaClを生成させる。後者の反応の過程で、NaSi粒子が解砕しながらMgと反応するために、Mg2Si微粒子が生成するものと推定される。原料のNaSi、MgCl2の粒子径、両者の混合状態、加熱条件(急速加熱)などの条件を変えることにより、生成したMg2Si粒子の粒径を変化させることも可能と考えられる。
未反応の原料(Na、NaSi、MgCl2)や副生成物(NaCl)は、いずれも溶媒に可溶であるので、反応生成物を溶媒で洗浄することにより、Mg2Si微粒子を得ることができる。
【0041】
図5に、Na−Si二元系の相図(出典:H.Morito et al., Journal of Alloys and Compounds 480(2009)723-726)を示す。
比較例1、実施例1〜2で示されるように、適切な加熱条件(温度など)を選択すれば、不純物のないMg2Si粒子が得られる。また、同じ温度において実施例2と比較例2で不純物量が大きく異なるのは、図5に示されるように、後者は前者よりも液相が多く存在する条件であるために、Siと反応できなかったMgが、冷却、洗浄の過程で酸化又は水酸化されて、アモルファスの不純物として残存したものと推察される。
【0042】
以上、本発明の実施の形態について詳細に説明したが、本発明は上記実施の形態に何ら限定されるものではなく、本発明の要旨を逸脱しない範囲で種々の改変が可能である。
【産業上の利用可能性】
【0043】
本発明に係るMg2Si微粒子及びその製造方法は、熱電材料やLi二次電池の負極材料及びその製造方法として使用することができる。
【特許請求の範囲】
【請求項1】
Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを、Mg/Si比(モル比)が2以下となり、かつ、Na/Si比(モル比)が1以上9以下となるように配合する配合工程と、
前記配合工程で得られた配合物を、0.7Tmin以上Tmin未満の温度(但し、Tminは、前記Na−Si系化合物の融点、共晶点、及び分解温度の内の最も低い温度)で加熱し、得られた反応物を冷却する反応工程と、
前記反応物を溶媒で洗浄し、未反応原料及び副生成物を除去する洗浄工程と
を備えたMg2Si微粒子の製造方法。
【請求項2】
前記Na−Si系化合物は、NaSiであり、
前記Mgのハロゲン化物は、MgCl2である
請求項1に記載のMg2Si微粒子の製造方法。
【請求項3】
請求項1又は2に記載の方法により得られ、
比表面積が30m2/g以上であり、
Mg2SiのXRD最強線強度(IMg2Si)に対するSiのXRD最強線強度(ISi)の比(=ISi×100/IMg2Si)が5.0%以下である
Mg2Si微粒子。
【請求項1】
Na−Si系化合物及びMgのハロゲン化物、並びに、必要に応じてNaを、Mg/Si比(モル比)が2以下となり、かつ、Na/Si比(モル比)が1以上9以下となるように配合する配合工程と、
前記配合工程で得られた配合物を、0.7Tmin以上Tmin未満の温度(但し、Tminは、前記Na−Si系化合物の融点、共晶点、及び分解温度の内の最も低い温度)で加熱し、得られた反応物を冷却する反応工程と、
前記反応物を溶媒で洗浄し、未反応原料及び副生成物を除去する洗浄工程と
を備えたMg2Si微粒子の製造方法。
【請求項2】
前記Na−Si系化合物は、NaSiであり、
前記Mgのハロゲン化物は、MgCl2である
請求項1に記載のMg2Si微粒子の製造方法。
【請求項3】
請求項1又は2に記載の方法により得られ、
比表面積が30m2/g以上であり、
Mg2SiのXRD最強線強度(IMg2Si)に対するSiのXRD最強線強度(ISi)の比(=ISi×100/IMg2Si)が5.0%以下である
Mg2Si微粒子。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−35735(P2013−35735A)
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願番号】特願2011−175014(P2011−175014)
【出願日】平成23年8月10日(2011.8.10)
【出願人】(000003609)株式会社豊田中央研究所 (4,200)
【Fターム(参考)】
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願日】平成23年8月10日(2011.8.10)
【出願人】(000003609)株式会社豊田中央研究所 (4,200)
【Fターム(参考)】
[ Back to top ]

