N−アセチルトランスフェラーゼ2(NAT2)の遺伝子型を検出するための核酸プライマーセット及び核酸プローブ
【課題】NAT2遺伝子の一塩基多型を短時間で簡便、且つ安価に検出できる方法を提供するために、該検出に用いる核酸プライマー及び検出用プローブを提供することを目的とする。
【解決手段】NAT2遺伝子の一塩基多型G590A、G857A及びT341Cにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットを提供する。また、本発明に従ったプライマーセットによって増幅された増幅産物を検出するための核酸プローブを提供する。また、本発明に従ったプライマーセットを用いたNAT2遺伝子の一塩基多型G590A、G857A及びT341Cにおける遺伝子型の検出方法を提供する。
【解決手段】NAT2遺伝子の一塩基多型G590A、G857A及びT341Cにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットを提供する。また、本発明に従ったプライマーセットによって増幅された増幅産物を検出するための核酸プローブを提供する。また、本発明に従ったプライマーセットを用いたNAT2遺伝子の一塩基多型G590A、G857A及びT341Cにおける遺伝子型の検出方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、N-アセチルトランスフェラーゼ2(NAT2)遺伝子の一塩基多型における遺伝子型を検出するために用いられる核酸プライマーセット及び検出用プローブに関する。
【背景技術】
【0002】
N-アセチルトランスフェラーゼ2(NAT2)は、結核治療薬イソニアジド(INH)やサラゾスルファピリジン等の臨床的に重要な薬物の代謝に関与している。サラゾスルファピリジンは、潰瘍性大腸炎や関節リウマチ等の治療薬である。
【0003】
NAT2をコードする遺伝子には遺伝子多型が存在することが知られている。NAT2の活性が高い表現型はRapid Acetylator(RA)と呼ばれ、活性が低い表現型はSlow Acetylator(SA)と呼ばれている。日本人では、野生型NAT2*4を含む4種類の多型(NAT2*4、NAT2*5、NAT*6、NAT2*7)が存在すると言われている。変異アレルNAT2*5、NAT*6、NAT2*7は、各々、一塩基多型T341C、G590A、G857Aにおける遺伝子型を検査することにより判別することができる。この変異アレルのホモ接合体、または複合ヘテロ接合体を有する人はSAの可能性が高く、副作用の発生確率が高くなる。
【0004】
このように、NAT2遺伝子の変異を検査することは、薬物の副作用を回避するために有用である。また、NAT2遺伝子の遺伝子型を明らかにすることにより、個々人に適した薬物投与や治療を選択することが出来る。
【0005】
一塩基多型の検出は、一般に、PCR(Polymerase chain reaction)法によって標的核酸を増幅し、特異的なプローブで野生型及び変異型のそれぞれの増幅産物を検出することによって行われる(非特許文献1)。しかしながら、PCR法は核酸抽出などの前処理が煩雑である。また、サーマルサイクラーのような複雑な温度制御が必須であり、さらに反応時間に2時間以上を要するなどの不都合がある。また、PCR法による増幅産物は2本鎖であるため、相補鎖が、検出の際にプローブに対するコンペティターとなり、検出感度を低下させるという問題があった。そこで、増幅産物を1本鎖にするため、酵素や磁気ビーズを用いて、相補鎖を分解又は分離する方法がとられているが、いずれも操作が煩雑であり、また費用がかかるという問題がある。
【非特許文献1】Jain K.K., Application of Amplicip CYP450, Mol Diagn 9,119-27 (2005)
【発明の開示】
【発明が解決しようとする課題】
【0006】
上記問題に鑑み、本発明は、NAT2遺伝子の一塩基多型を短時間で簡便、且つ安価に検出できる方法を提供するために、該検出に用いる核酸プライマー及び検出用プローブを提供することを目的とする。
【課題を解決するための手段】
【0007】
上記目的を達成するため、本発明は、NAT2遺伝子の一塩基多型G590Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、表2及び3に記載されたプライマーセット1〜16から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する核酸プライマーセットが提供される。
【0008】
ここにおいて、表2及び3に記載されたプライマーセット1〜16は、次のプライマーから成る:
プライマーセット1:配列番号1のFIPプライマー及び配列番号7のBIPプライマー、
プライマーセット2:配列番号2のFIPプライマー及び配列番号7のBIPプライマー、
プライマーセット3:配列番号5のFIPプライマー及び配列番号7のBIPプライマー、
プライマーセット4:配列番号6のFIPプライマー及び配列番号7のBIPプライマー、
プライマーセット5:配列番号10のFIPプライマー及び配列番号13のBIPプライマー、
プライマーセット6:配列番号10のFIPプライマー及び配列番号14のBIPプライマー、
プライマーセット7:配列番号15のFIPプライマー及び配列番号11のBIPプライマー、
プライマーセット8:配列番号15のFIPプライマー及び配列番号12のBIPプライマー、
プライマーセット9:配列番号15のFIPプライマー及び配列番号13のBIPプライマー、
プライマーセット10:配列番号15のFIPプライマー及び配列番号14のBIPプライマー、
プライマーセット11:配列番号16のFIPプライマー及び配列番号11のBIPプライマー、
プライマーセット12:配列番号16のFIPプライマー及び配列番号12のBIPプライマー、
プライマーセット13:配列番号16のFIPプライマー及び配列番号13のBIPプライマー、
プライマーセット14:配列番号16のFIPプライマー及び配列番号14のBIPプライマー、
プライマーセット15:配列番号17のFIPプライマー及び配列番号13のBIPプライマー、
プライマーセット16:配列番号17のFIPプライマー及び配列番号14のBIPプライマー。
【0009】
他の態様において、NAT2遺伝子の一塩基多型G857Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、表4に記載されたプライマーセット1〜5から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する核酸プライマーセットが提供される。
【0010】
ここにおいて、表4に記載されたプライマーセット1〜5は、次のプライマーから成る:
プライマーセット1:配列番号20のFIPプライマー及び配列番号21のBIPプライマー、
プライマーセット2:配列番号20のFIPプライマー及び配列番号22のBIPプライマー、
プライマーセット3:配列番号20のFIPプライマー及び配列番号23のBIPプライマー、
プライマーセット4:配列番号20のFIPプライマー及び配列番号25のBIPプライマー、
プライマーセット5:配列番号20のFIPプライマー及び配列番号26のBIPプライマー。
【0011】
他の態様において、NAT2遺伝子の一塩基多型T341Cにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、表5に記載されたプライマーセット1〜10から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する核酸プライマーセットが提供される。
【0012】
ここにおいて、表5に記載されたプライマーセット1〜10は、次のプライマーから成る:
プライマーセット1:配列番号33のFIPプライマー及び配列番号30のBIPプライマー、
プライマーセット2:配列番号33のFIPプライマー及び配列番号31のBIPプライマー、
プライマーセット3:配列番号33のFIPプライマー及び配列番号32のBIPプライマー、
プライマーセット4:配列番号34のFIPプライマー及び配列番号30のBIPプライマー、
プライマーセット5:配列番号34のFIPプライマー及び配列番号31のBIPプライマー、
プライマーセット6:配列番号34のFIPプライマー及び配列番号32のBIPプライマー、
プライマーセット7:配列番号35のFIPプライマー及び配列番号32のBIPプライマー、
プライマーセット8:配列番号36のFIPプライマー及び配列番号32のBIPプライマー、
プライマーセット9:配列番号37のFIPプライマー及び配列番号32のBIPプライマー、
プライマーセット10:配列番号38のFIPプライマー及び配列番号32のBIPプライマー。
【0013】
他の態様において、NAT2遺伝子の一塩基多型G590A及びG857Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、表6に記載されたプライマーセット1〜8から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する核酸プライマーセットが提供される。
【0014】
ここにおいて、表6に記載されたプライマーセット1〜8は、次のプライマーから成る:
プライマーセット1:配列番号42のFIPプライマー及び配列番号43のBIPプライマー、
プライマーセット2:配列番号42のFIPプライマー及び配列番号44のBIPプライマー、
プライマーセット3:配列番号45のFIPプライマー及び配列番号43のBIPプライマー、
プライマーセット4:配列番号45のFIPプライマー及び配列番号46のBIPプライマー、
プライマーセット5:配列番号47のFIPプライマー及び配列番号43のBIPプライマー、
プライマーセット6:配列番号48のFIPプライマー及び配列番号43のBIPプライマー、
プライマーセット7:配列番号48のFIPプライマー及び配列番号46のBIPプライマー、
プライマーセット8:配列番号48のFIPプライマー及び配列番号44のBIPプライマー。
【0015】
他の側面に従って、上記核酸プライマーセットを使用して標的核酸を増幅する工程と、得られた増幅産物に含まれる、野生型の増幅産物と変異型の増幅産物のそれぞれの量を測定し、比較する工程とを具備する、NAT2遺伝子の一塩基多型G590A、G857A又はT341Cにおける遺伝子型の検出方法が提供される。
【0016】
また他の側面から、上記核酸プライマーセットを用いて標的核酸を増幅し、得られた増幅産物を検出するために用いられる核酸プローブが提供される。一つの態様において、該核酸プローブは、野性型核酸プローブが野生型の増幅産物と相補的であり、62〜70℃のTm値を有し、変異型核酸プローブが変異型の増幅産物と相補的であり、61〜69℃のTm値を有し、且つ、前記一塩基多型G590A部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする。他の態様において、該核酸プローブは、野生型核酸プローブが59〜68℃のTm値を有し、変異型核酸プローブが58〜68℃のTm値を有し、且つ、前記一塩基多型G857A部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする。他の態様において、該核酸プローブは、野生型核酸プローブが61〜69℃のTm値を有し、変異型核酸プローブが58〜70℃のTm値を有し、且つ、前記一塩基多型T341C部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする。
【0017】
また他の側面から、NAT2遺伝子の一塩基多型G590A、G857A及びT341Cにおける遺伝子型を同時に検出する方法が提供される。
【発明の効果】
【0018】
本発明によれば、NAT2遺伝子の一塩基多型における遺伝子型を検出するための核酸プライマー及び検出用プローブが提供される。これにより、NAT2遺伝子の一塩基多型T341C、G590A、G857Aにおける遺伝子型を、安価で簡便に検出することが可能である。
【発明を実施するための最良の形態】
【0019】
一塩基多型の検出にはPCR法が用いられることが多いが、PCR法には上記したような不都合な点がある。よって、本発明では、PCR法に替わってLAMP(Loop-mediated isothermal amplification)法を利用して一塩基多型を検出する。LAMP法とは、核酸を等温条件下60〜65℃で増幅する技術である。LAMP法はPCR法と比較して、短時間で多量の増幅産物が得られるという利点を有する。また、サンプル中の不純物の影響を受けにくいとも報告されている。LAMP法を用いることによって、簡便に標的核酸を増幅することが可能である。
【0020】
本発明の検出方法では、LAMP法によって標的核酸を増幅し、得られた増幅産物中の、野生型の増幅産物と変異型の増幅産物の量をそれぞれ測定する。野生型の増幅産物が多い場合は、試験に供された標的核酸の遺伝子型は野性型であると判定できる。反対に、変異型の増幅産物が多い場合は、該標的核酸は変異型であると判定できる。また、野生型と変異型の増幅産物がほぼ等量である場合は、ヘテロ型の遺伝子であると判定できる。
【0021】
増幅産物の量は、これに限定されないが、例えば核酸プローブを用いて測定することができる。核酸プローブは、野生型の増幅産物と相補的な核酸プローブと、変異型の増幅産物と相補的な核酸プローブを用いる。増幅産物とそれぞれの核酸プローブとをハイブリダイゼーションさせ、それぞれの核酸プローブに結合した増幅産物の量を測定する。野生型の核酸プローブに結合した増幅産物の量と、変異型の核酸プローブに結合した増幅産物の量を比較することによって、標的核酸の遺伝子型を判定することができる。
【0022】
<LAMP法の概要>
以下にLAMP法の概要を説明する。なお、本明細書では、一塩基多型の検出に供される核酸(ゲノムDNA等を含む)を検体核酸と称する。また、LAMP法によって増幅されるNAT2遺伝子内の領域を標的核酸と称する。また、LAMP法によって得られた産物を増幅産物と称する。また、ヒトゲノムDNAを含む溶液を試料溶液と称する。
【0023】
LAMP法では、標的核酸に対してその5’末端側から順にF3領域、F2領域、F1領域を設定し、3’末端側から順にB3c領域、B2c領域、及びB1c領域を設定する。そして、図1に示すような4種のプライマーを用いて標的核酸を増幅する。なお、F1c、F2c、F3c、B1、B2、及びB3領域はそれぞれ、F1、F2、F3、B1c、B2c、及びB3c領域の相補鎖における領域を示している。
【0024】
LAMP法において核酸を増幅するために使用される4種のプライマーとは、(1)3’末端側に前記F2領域と同じ配列を有し、且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー;(2)前記F3領域と同じ配列から成るF3プライマー;(3)3’末端側に前記B2c領域と相補的な配列を有し、且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー;及び、(4)前記B3c領域と相補的な配列から成るB3プライマーである。一般に、FIPプライマー及びBIPプライマーはインナープライマーと呼ばれ、F3プライマー及びB3プライマーはアウタープライマーと呼ばれる。
【0025】
上記4種のプライマーを用いてLAMP増幅を行うと、図2に示すようなダンベル構造を有する中間産物が生成される。一本鎖ループ内のF2c及びB2c領域にFIP及びBIPプライマーが結合し、該プライマーの3’末端及び中間産物自体の3’末端から伸長反応が進行する。詳細には、特許第3313358号を参照されたい。
【0026】
LAMP法ではさらに、ループプライマーと呼ばれるさらなるプライマーを任意に用いることによって、増幅時間を短縮させることができる。この場合、図3に示すように、前記F2領域からF1領域にかけての部分においてLF領域を設定し、前記B2c領域からB1c領域にかけての部分においてLBc領域を設定する。これらはループプライマー領域と称する。そして、上記の4種のプライマーに加えて、LF領域と相補的な配列から成るループプライマーLFc、及び上記LBc領域と同じ配列から成るループプライマーLBcを用いる。詳細には、WO2002/0249028号を参照されたい。これらのループプライマーLFc及びLBcは、同時に用いてもよいが、何れか一方のみを用いてもよい。ループプライマーは、図4に示すように、FIP及びBIPプライマーがアニールするループとは別のループにアニールし、さらなる合成起点を与えることによって増幅を促進させる。
【0027】
<LAMP増幅産物の検出;核酸プローブ>
一塩基多型を検出する場合は、検出される多型部位を図5に示すFP領域又はBPc領域に位置させる。或いは、FP領域及びBPc領域のそれぞれに異なる多型を位置させてもよい。図5に記載したように、F2領域からF1領域にかけての部分は、増幅産物中で一本鎖となる部分である。同様に、B2c領域からB1c領域にかけての部分も増幅産物中で一本鎖となる部分である。一本鎖である部分に検出すべき多型部位を位置させることによって、核酸プローブによる検出を簡便にすることができる。
【0028】
核酸プローブは、多型部位を含むFP領域又はBPc領域と結合するように設計する。即ち、核酸プローブは、FP領域又はBPc領域のうち、多型部位を含む領域の配列と相補的な配列を有する。
【0029】
なお、増幅産物中には、FP領域及びBPc領域とそれぞれ相補的なFPc領域及びBP領域も存在する。よって、これらのFPc領域及びBP領域を検出に利用することも可能である。
【0030】
本明細書においては、野生型の増幅産物と相補的な配列を含む核酸プローブを野性型核酸プローブと称し、変異型の増幅産物と相補的な配列を含む核酸プローブを変異型核酸プローブと称する。
【0031】
核酸プローブは、特に限定されないが、DNA、RNA、PNA、LNA、メチルホスホネート骨格の核酸、その他の人工核酸鎖から構成されて良い。基体に固定化するために、末端をアミノ基、カルボキシル基、ヒドロシル基、チオール基、スルホン基などの反応性官能基で修飾してもよい。該官能基とヌクレオチドの間にスペーサーを導入することも可能である。スペーサーには、例えばアルカン骨格、エチレングリコール骨格などを用いることができる。
【0032】
<核酸プローブ固定化基体>
核酸プローブは、これに限定されないが、基体上に固定化して用いることができる。核酸プローブ固定化基体は、DNAチップ、DNAマイクロアレイと称されるそれ自身公知の装置を利用しても良い。
【0033】
プローブ固定化基体の一実施態様の模式図を図6に示した。プローブは、基体1上の固定化領域2に固定化される。基体1は例えばシリコン基板などから製造することができるが、これに限定されない。プローブの固定化は、公知の手段によって行えばよい。1つの基体1に固定化されるプローブは1種でも複数種類であってもよく、その配置や数は当業者が必要に応じて適宜設計変更することが可能である。後述するように、プローブを蛍光検出する場合には、本実施態様のようなプローブ固定化基体を用いることができる。
【0034】
プローブ固定化基体の他の実施態様の模式図を図7に示した。本実施態様においては、基体11に電極12が備えられる。プローブは電極12に固定化される。電極12は、電気的情報を取り出すためのパット13に接続される。基体11は例えばシリコン基板などから製造することができるが、これに限定されない。電極の製造及びプローブの固定化は、公知の手段によって行えばよい。電極は、特に限定されるものではないが、金、金の合金、銀、プラチナ、水銀、ニッケル、パラジウム、シリコン、ゲルマニウム、ガリウム及びタングステン等の金属単体及びそれらの合金、あるいはグラファイト、グラシーカーボンのような炭素、及びこれらの酸化物又は化合物で製造することができる。
【0035】
図7の固定化基体は10個の電極を備えるが、これに限定されず、1つの基体に配置される電極の数は任意に変更できる。また電極の配置パターンも図に示したものに限定されず、当業者が必要に応じて適宜設計変更することが可能である。基体1には、必要に応じて、参照電極および対極を設けても良い。後述するように、プローブを電気化学的に検出する場合には、本実施態様のようなプローブ固定化基体を用いることができる。
【0036】
<核酸プローブと増幅産物とのハイブリダイゼーション>
核酸プローブと増幅産物とのハイブリダイゼーションは適切な条件下で行う。適切な条件は、増幅産物の種類や構造、検出配列に含まれる塩基の種類、核酸プローブの種類によって異なる。例えば、イオン強度0.01〜5の範囲で、pH5〜10の範囲の緩衝液中で行う。反応溶液中には、ハイブリダーゼション促進剤である硫酸デキストラン、並びにサケ精子DNA、牛胸腺DNAやEDTAおよび界面活性剤などを添加しても良い。反応温度は、例えば10℃〜90℃の範囲で行い、攪拌や振盪などで反応効率を高めても良い。反応後の洗浄には、例えばイオン強度0.01〜5の範囲で、pH5〜10の範囲の緩衝液を用いればよい。
【0037】
<検出方法>
前記基体に固定化されたプローブと増幅産物とがハイブリダイズすると2本鎖核酸が生じる。この2本鎖核酸は、電気化学的に又は蛍光により検出することができる。
【0038】
(a)電流検出方式
電気化学的に2本鎖核酸を検出する方法を説明する。この方法では、2本鎖核酸を特異的に認識する2本鎖認識体を用いる。2本鎖認識体の例には、例えば、ヘキスト33258、アクリジンオレンジ、キナクリン、ドウノマイシン、メタロインターカレーター、ビスアクリジン等のビスインターカレーター、トリスインターカレーター、ポリインターカレーターなどが含まれるが、これらに限定されない。更に、これらの物質を電気化学的に活性な金属錯体、例えばフェロセン、ビオロゲンなどで修飾することも可能である。
【0039】
2本鎖認識体の濃度はその種類によって異なるが、一般的には1ng/mL〜1mg/mLの範囲で使用する。この際には、イオン強度0.001〜5の範囲でpH5〜10の範囲の緩衝液を用いればよい。
【0040】
ハイブリダイゼーション反応中又は反応後、反応溶液中に2本鎖認識体を添加する。ハイブリダイズによって2本鎖核酸が生じている場合は、2本鎖認識体がこれに結合する。そこで、例えば2本鎖認識体が電気化学的に反応する電位以上の電位を印加して、2本鎖認識体に由来する反応電流値を測定することができる。この際、電位は定速で印加するか、あるいは、パルスで印加するかあるいな定電位を印加してもよい。測定の際に、例えばポテンショスタット、デジタルマルチメーター、およびファンクションジェネレーターなどの装置を用いて電流、電圧を制御してもよい。例えば特開平10-146183号公報に記載された公知の電気化学的検出手段が好適に用いられる。
【0041】
(b)蛍光検出法
蛍光によって2本鎖核酸を検出する方法を説明する。予め、プライマーを蛍光学的に活性な物質で標識しておく。又は、蛍光学的に活性な物質で標識した2次プローブを用いて検出する。或いは、複数の標識を使用してもよい。蛍光学的に活性な物質は、これらに限定されないが、FITC、Cy3、Cy5、もしくはローダミンなどの蛍光色素を含む。蛍光物質は、例えば蛍光検出器を用いて検出される。標識の種類に応じた適宜の検出装置を用い、標識された検出配列又は2次プローブを検出する。
【0042】
<核酸プライマーの選択>
図8に一塩基多型G590AをF2とF1の間、すなわちFP領域に位置させた場合の模式図を示した。FIPプライマーは、F2領域と同じ配列、及び、F1領域と相補的な配列を有するプライマーである。このF2領域とF1領域とが、G590Aを挟んで位置する限り、様々な種類のプライマーを設計することが可能である。
【0043】
しかしながら、プライマーの種類によってLAMP法の増幅効率が異なることが、本発明者らの研究によって明らかとなった。例えば、図8に4種のプライマーを例示する。その他の3種のプライマー(BIP、F3、及びB3プライマー)は共通のものを使用してそれぞれ増幅する。その結果、プライマー1は、十分な増幅時間、例えば2時間かけても増幅しない。プライマー2は、約1時間で増幅するが、プライマー同士の非特異的な増幅が起きる。プライマー3はプライマー同士の非特異的な増幅はないが、増幅に1.5〜2時間要する。プライマー4は、プライマー同士の非特異的な増幅もみられず、増幅も1時間以内で終了する。このような場合、増幅のために良好なプライマーは3または4であり、最良のプライマーは4である。即ち、優れたプライマーとは、増幅効率が高く短時間で増幅し、且つ非特異的な増幅が見られないプライマーである。
【0044】
さらに、増幅産物を核酸プローブを用いて検出する場合には、増幅産物と核酸プローブとのハイブリダイゼーションが、高効率で生じることが望ましい。よって、ハイブリダイゼーションの効率が優れた増幅産物であるかどうかも、上記プライマーを評価する際に考慮される。
【0045】
さらに、ヒトNAT2遺伝子はヒトNAT1と非常に高い相同性を示す。図9A及びBに、NAT2遺伝子及びNAT1遺伝子の配列を示した。NAT2遺伝子はNAT1遺伝子と相同性が高いため、NAT2を特異的に増幅するためには、NAT2とNAT1とで配列が異なる領域にプライマーを設計する必要がある。
【0046】
よって、何れかのプライマーは、NAT2とNAT1で配列が異なる領域に設計する。好ましくは、F1領域、F2領域、B1領域、B2領域の少なくとも一つがNAT2とNAT1で配列が異なる領域に設計する。また、図9に示したように変異が報告されている箇所にはプライマーを設計しない。場合によって、変異箇所にプライマーを設計せざるを得ない場合には、mixの塩基またはdeoxyinosine(dI)などのユニバーサルな塩基を導入する。一塩基多型を間に挟まないもう一方のインナープライマーについては、F2からB2までの長さが450bp以下、より好ましくは350bp以下となる領域に設計することが好ましい。また、1本鎖ループの長さは、100bp以下、より好ましくは70bp以下となるように両インナープライマーを設計することが好ましい。
【0047】
プライマー同士の非特異的な増幅はLAMP反応でしばしば見られる現象である。FIPプライマーはF1c領域とF2領域を含むため、長鎖の核酸となる。同じくBIPプライマーもB1c領域とB2領域を含むため、長鎖の核酸となる。よって、FIPプライマー同士、BIPプライマー同士、またはFIPプライマーとBIPプライマーが互いに絡み合い、プライマーを鋳型として増幅してしまう確率が高くなる。また、LAMP反応は、F3プライマー、B3プライマー、さらに場合によってはLFcプライマー、LBcプライマーも反応液中に存在するため、PCR反応と比較して非特異反応の確率はさらに高くなる。このような非特異反応が発生すると、検体核酸を鋳型とする所望のLAMP産物の量が低下する。
【0048】
また、検体核酸を添加していないネガティブコントロール反応液において非特異反応が発生すると、増幅に伴い放出されるピロリン酸とMgの白色沈殿が、非特異的な増幅によるものなのか、コンタミネーションによって生じたものなのか区別することができない。従って、非特異増幅が発生するプライマーを排除することは重要である。
【0049】
そこで本発明者らはNAT2遺伝子の一塩基多型G590Aについて、そしてさらにG857A及びT341Cについて、該一塩基多型部分を増幅するために最適な核酸プライマーを選択するための試験を行った。
【0050】
[試験1−1:G590A用プライマー;FP領域]
NAT2 G590Aの多型部位をFP領域に設計した6種類の核酸プライマーセットを用い、63℃で1時間及び2時間、増幅反応させた。反応は表1に記載した組成で行った。鋳型DNAにはヒトゲノムを用いた。コンタミネーションの有無、及び非特異的な増幅の有無を確認するため、全てのセットでヒトゲノムの代わりに滅菌超純水を添加したネガティブコントロールを作製した。増幅反応後、3%アガロース電気泳動により増幅産物を確認した。
【0051】
用いた核酸プライマーセットを表2に示す。
【表1】

【0052】
【表2】

【0053】
F3プライマーは配列番号8、B3プライマーは配列番号9を用い、全てのセットに共通で使用した。
【0054】
[試験1−1:結果]
表2の6種類のプライマーセットを用いて得られた増幅産物を電気泳動に供した。その結果を図10に示す。1時間増幅した場合、プライマーセット3および4で十分量の増幅産物が得られた(レーン5,6)。2時間増幅した場合、プライマーセット1、2、3及び4で十分量の増幅産物が得られた(レーン1,2,5及び6)。プライマーセット18、19(レーン3及び4)では、増幅産物が少ないか、または増幅が確認されなかった。また、全てのセットにおいて、非特異増幅は見られなかった。以上から、良好なプライマーセットは1、2、3、4であり、最良のプライマーセットは3、4であることが明らかになった。上記の結果を表2にまとめた。
【0055】
[試験1−2:G590A用プライマー;BP領域]
NAT2 G590Aの多型部位をBP領域に設計した16種類のプライマーセットを用い、63℃で1時間及び2時間、増幅反応させた。反応は表1に記載した組成で行った。鋳型DNAにはヒトゲノムを用いた。コンタミネーションの有無、及び非特異的な増幅の有無を確認するため、全てのセットでヒトゲノムの代わりに滅菌超純水を添加したネガティブコントロールを作製した。増幅反応後、3%アガロース電気泳動により増幅産物を確認した。
【0056】
用いた核酸プライマーセットを表3に示す。
【表3】

【0057】
F3プライマーは配列番号18、B3プライマーは配列番号19を用い、全てのセットに共通で使用した。
【0058】
[試験1−2:結果]
表3の16種類のプライマーセットを用いて得られた増幅産物を電気泳動に供した。その結果を図11に示す。1時間増幅した場合、プライマーセット9で十分量の増幅産物が得られた(レーン7)。2時間増幅した場合、プライマーセット5、6、7、8、9、10、11、12、13、14、15、20、21で十分量の増幅産物が得られた。プライマーセット22、23では、増幅が見られなかった。プライマーセット20、21においては、図12に示すような非特異増幅が見られた。以上から、良好なプライマーセットは5、6、7、8、9、10、11、12、13、14、15及び16であり、最良のプライマーセットは9であることが明らかになった。上記の結果を表3にまとめた。
【0059】
[試験2:G857A用プライマー;BP領域]
NAT2 G857Aの多型部位をBP領域に設計した6種類のプライマーセットを用い、63℃で1時間及び2時間、増幅反応させた。反応は表1に記載した組成で行った。鋳型DNAにはヒトゲノムを用いた。コンタミネーションの有無、及び非特異的な増幅の有無を確認するため、全てのセットでヒトゲノムの代わりに滅菌超純水を添加したネガティブコントロールを作製した。増幅反応後、3%アガロース電気泳動により増幅産物を確認した。
【0060】
用いた核酸プライマーセットを表4に示す。
【表4】

【0061】
F3プライマーは配列番号27、B3プライマーは配列番号28を用い、全てのセットに共通で使用した。
【0062】
[試験2:結果]
表4の6種類のプライマーセットを用いて得られた増幅産物を電気泳動に供した。1時間増幅した場合、プライマーセット1、2、3、4及び5で十分量の増幅産物が得られた。2時間増幅した場合にも、同様にプライマーセット1、2、3、4及び5で十分量の増幅産物が得られた。プライマーセット6では、2時間増幅した場合でも増幅は見られなかった。また、全てのセットにおいて、非特異増幅は見られなかった。以上から、最良のプライマーセットは1、2、3、4、及び5であることが明らかになった。上記の結果を表4にまとめた。
【0063】
[試験3:T341C用プライマー;BP領域]
NAT2 T341Cの多型部位をBP領域に設計した13種類の核酸プライマーセットを用い、63℃で1時間及び2時間、増幅反応させた。反応は表1に記載した組成で行った。鋳型DNAにはヒトゲノムを用いた。コンタミネーションの有無、及び非特異的な増幅の有無を確認するため、全てのセットでヒトゲノムの代わりに滅菌超純水を添加したネガティブコントロールを作製した。増幅反応後、3%アガロース電気泳動により増幅産物を確認した。
【0064】
用いた核酸プライマーセットを表5に示す。
【表5】

【0065】
F3プライマーは、プライマーセット1、2、3、4、5、11、12、13および14については、配列番号39を用いた。プライマーセット6、7、8および9については、配列番号41を用いた。B3プライマーは配列番号40を用い、全てのセットに共通で使用した。
【0066】
[試験3:結果]
表5の13種類のプライマーセットを用いて得られた増幅産物を電気泳動に供した。1時間増幅した場合、プライマーセット3、6、9、10で十分量の増幅産物が得られた。2時間増幅した場合には、プライマーセット1、2、3、4、5、6、7、8、9、10及び11で十分量の増幅産物が得られた。プライマーセット12、13では、2時間増幅した場合でも増幅は見られなかった。プライマーセットセット11においては、非特異増幅が見られた。プライマーセット1、2、3、4、5、6、7、8、9、10においては、非特異増幅が見られなかった。このことから、良好なプライマーセットは1、2、3、4、5、6、7、8、9及び10であり、最良のプライマーセットは3、6、9、10であることが明らかになった。上記の結果を表5にまとめた。
【0067】
<G590A及びG857Aの多型部位を同時に増幅するための核酸プライマーの選択>
多型部位は、FP領域とBP領域の各々に配置することもできる。これにより、1つの増幅産物で、2箇所以上の一塩基多型を測定することができる。例えば、G590AとG857Aの場合、G590AをFP領域に設計し、G857AをFPc領域に設計することができる。G590AとG857Aは少し離れて位置するため、ターゲット長(F2からB2までの長さ)は350bp程度となり、若干増幅効率は低下するものの、ループプライマーの導入などにより、1時間以内で増幅することができる。G590AとG857Aを同時に増幅する方法として、1つの反応チューブで各々の産物をマルチ増幅する方法もあるが、マルチ増幅は、条件設定を厳密に制御しなくてはならない。また、厳密に制御しても片方の産物のみが優先的に増幅し、もう一方の産物が増幅しない場合もありうる。よって、上述の方法により1つの増幅産物で2箇所以上の一塩基多型を測定できることは、大きな利点となる。
【0068】
[試験4:G590A用プライマー(FP領域)、G857A用プライマー(BP領域)]
NAT2 G590Aの多型部位をFP領域に設計し、NAT2 G857Aの多型部位をBPc領域に設計した11種類の核酸プライマーセットを用い、63℃で1時間、1.5時間及び2時間、増幅反応させた。反応は表1に記載した組成で行った。鋳型DNAにはヒトゲノムを用いた。コンタミネーションの有無、及び非特異的な増幅の有無を確認するため、全てのセットでヒトゲノムの代わりに滅菌超純水を添加したネガティブコントロールを作製した。増幅反応後、3%アガロース電気泳動により増幅産物を確認した。
【0069】
用いた核酸プライマーセットを表6に示す。
【表6】

【0070】
F3プライマーは配列番号49、B3プライマーは配列番号50を用いて全てのセットに共通で使用した。
【0071】
[試験4:結果]
表6の11種類のプライマーセットを用いて得られた増幅産物を電気泳動に供した。1時間増幅した場合、いずれのプライマーセットにおいても増幅は見られなかった。1.5時間増幅した場合、プライマーセット1、6、7、8で十分量の増幅産物が得られた。2時間増幅した場合には、プライマーセット1、2、3、4、5、6、7、8及び10で十分量の増幅産物が得られた。プライマーセット9、11では、2時間増幅した場合でも増幅は見られなかった。プライマーセットセット10においては、非特異増幅が見られた。1、2、3、4、5、6、7、8においては、非特異増幅が見られなかった。このことから、良好なプライマーセットは1、2、3、4、5、6、7及び8であり、最良のプライマーセットは1、6、7、8であることが明らかになった。上記の結果を表6にまとめた。
【0072】
以上の試験から、本発明で提供される好ましいインナープライマーが決定された。当業者には明らかなように、LAMP反応において最も重要なプライマーはインナープライマーである。増幅反応にインナープライマーは必須であるが、アウタープライマー、ループプライマーは必須ではない。アウタープライマー、ループプライマーを増幅反応液に入れることで、増幅効率は高まるが、位置による増幅効率の変化はインナープライマーと比較して少ない。よって、アウタープライマー(F3及びB3プライマー)は、任意の配列を用いてよい。例えば、F2領域の5’末端から60塩基以内の領域及びB2c領域の3’末端から60塩基以内の領域に結合するように設計されることが好ましい。即ち、F3プライマーと同じ配列であるF3領域が、F2領域の5’末端から60塩基以内に位置し、B3プライマーと相補的な配列であるB3c領域が、B2c領域の3’末端から60塩基以内に位置することが好ましい。また、ループプライマーはインナープライマーが結合するループとは別のループに結合するように設計し、インナープライマー領域と重ならない領域に設計されていればよい。
【0073】
<核酸プローブの選択>
核酸プローブの鎖長は、短すぎても長すぎても好ましくない。塩基の種類により結合力に差はあるが、一般的に鎖長は長くなれば長くなるほど結合力は増加する。核酸プローブの鎖長が短すぎる場合、核酸プローブと増幅産物とハイブリ効率は低くなる。一方、核酸プローブの鎖長が長すぎる場合、野生型核酸プローブと変異型核酸プローブとの1塩基の差が小さくなる。そのため、野生型増幅産物と変異型核酸プローブとの非特異的な結合、また、変異型増幅産物と野生型核酸プローブとの非特異的な結合が増加する。よって、一塩基多型を検出するためには、例えば10〜35塩基のような、適切な鎖長の核酸プローブを用いることが好ましい。
【0074】
上記結合力は、2本鎖核酸が解離する温度Tm値によって表すことができる。Tm値を計算する手法としては、例えば、最近接塩基対法、Wallance法、GC%法などがある。本発明では、最近接塩基対法(Breslauer et. al. 1986、Freier et.al. 1986, Schildkraut et.al. 1965)を採用する。本発明においては、Na+濃度:50mM、核酸プローブ(オリゴヌクレオチド)の濃度:0.5μMという条件下で算出した。
【0075】
以下、本発明に従って得られた増幅産物の検出に好適に用いられる核酸プローブを選択するための試験を行った。
【0076】
[試験5−1:G590A検出用プローブ]
PCR-RFLP(Polymerase chain reaction-restriction fragment length polymorphism)解析によってヘテロ型であると判明したヒトゲノムを鋳型に用い、G590A検出用プライマーセット9を用いて、63℃で1時間LAMP増幅を行った。G590A検出用プライマーセット9は上記試験1−2の結果、最良のプライマーであることが判明したセットである。得られた増幅産物を、電流検出型のDNAチップで検出した。
【0077】
核酸プローブ:
試験した核酸プローブの塩基配列を表7に示した。核酸プローブは、プラス鎖のものを用いた。核酸プローブは、電極に固定化するために3’末端をチオール修飾した。ネガティブコントロールプローブについては、NAT2遺伝子配列とは全く無関係な配列を示すものを使用した。
【表7】

【0078】
核酸プローブ固定化基体:
DNAチップ上に金電極を作製し、これに核酸プローブを固定化した。固定化は、チオールと金との強い結合性を利用して行った。末端をチオール修飾した核酸プローブを含むプローブ溶液を金電極上にスポットし、1時間静置後、1mMメルカプトヘキサノール溶液に浸し、その後、0.2×SSC溶液で洗浄した。同一プローブは2電極ずつスポットした。洗浄後、超純水で洗浄、風乾し、核酸プローブ固定化基体とした。
【0079】
核酸プローブは以下の通りに各電極に割り当てた:
1−2電極 ネガティブプローブ(配列番号51)
3−4電極 野生型核酸プローブ 17mer (配列番号52)
5−6電極 野生型核酸プローブ 21mer (配列番号53)
7−8電極 野生型核酸プローブ 26mer (配列番号54)
9−10電極 野生型核酸プローブ 29mer (配列番号55)
11−12電極 変異型核酸プローブ 19mer (配列番号56)
13−14電極 変異型核酸プローブ 21mer (配列番号57)
15−16電極 変異型核酸プローブ 23mer (配列番号58)
17−18電極 変異型核酸プローブ 27mer (配列番号59)
19−20電極 変異型核酸プローブ 30mer (配列番号60)
増幅産物と核酸プローブのハイブリダイゼーション及び検出:
上記増幅によって得られた増幅産物に終濃度2×SSCの塩を添加し、電極に固定化された核酸プローブとハイブリダイゼーション反応させた。反応温度は、35℃、45℃、50℃、55℃、60℃とし、60分間反応させた。その後、超純水で軽く洗浄した。電極を挿入剤であるヘキスト33258溶液を50μM含むリン酸緩衝液中に10分間浸漬した後、洗浄し、ヘキスト33258分子の酸化電流応答を測定した。
【0080】
[試験5−1:結果]
結果を図13に示す。反応温度が上昇すると共に、得られる信号が増加した。よって、反応温度が高い程、ハイブリダイゼーションの効率が上昇することが示された。反応温度55℃と60℃では、ほぼ同じ結果であった。
【0081】
[試験5−2:G590A検出用プローブ]
次に、反応温度を55℃とし、反応時間を10分、20分、40分、60分、120分間として、試験5−1と同様に行った。
【0082】
[試験5−2:結果]
結果を図14に示す。反応時間10分と120分により得られた結果は、ほぼ同じであった。このことから、反応時間10分でハイブリダイゼーション反応が飽和状態に達することが明らかになった。
【0083】
鎖長が比較的短い野生型核酸プローブ(17G:配列番号52)及び変異型核酸プローブ(19A:配列番号56、21A:配列番号57、23A:配列番号58)は、得られた信号が比較的低かった。野生型核酸プローブ(21G:配列番号53、26G:配列番号54、29G:配列番号55)及び変異型核酸プローブ(27A:配列番号59、30A:配列番号60)はほぼ同程度の高い信号が得られた。
【0084】
[試験5−3:G590A検出用プローブ]
次に、反応温度55℃、反応時間20分で、試験5−1と同様にハイブリダイゼーションを行った。その後、核酸プローブ固定化基体を40℃、45℃、50℃の0.2×SSC洗浄バッファーに20分間浸漬して洗浄した。なお、本試験で増幅に用いた検体核酸は、PCR-RFLP解析により、野生ホモ型、変異ホモ型、ヘテロ型であると判明している3種類のヒトゲノムを用いた。
【0085】
[試験5−3:結果]
結果を図15A〜Cに示す。洗浄なし(超純粋で軽く洗浄しただけのもの)の場合、野生型の増幅産物が変異型核酸プローブによって検出され、同様に変異型の増幅産物が野生型核酸プローブから検出され、非特異的なハイブリダイゼーションが確認された。洗浄温度40℃の結果は、洗浄なしとほぼ同一であった。
【0086】
洗浄温度45℃では、野生型増幅産物では、野生型核酸プローブ(21G、26G)によって高い信号値が検出され、変異型核酸プローブ(27A)によってはほとんど信号値が検出されなかった。同様に、変異型増幅産物では、変異型核酸プローブ(27A)によって高い信号値が検出され、野生型核酸プローブ(21G、26G)によってはほとんど信号値が検出されなかった。よって、45℃の洗浄により、非特異的なハイブリダイゼーションによる結合が剥離されたことが示された。また、ヘテロ型の増幅産物では、野生型核酸プローブ(21G、26G)および変異型核酸プローブ(27A)の双方により高い信号値が検出された。
【0087】
洗浄温度50℃では、検出される電流値が低く、洗浄によって増幅産物が核酸プローブから剥離することが確認された。洗浄温度50℃において、野生型核酸プローブ(29G)は、野生型の増幅産物の信号値が減少したにも関わらず、変異型の増幅産物の信号値が残り、非特異的な結合が依然としてあることが示された。同様に、変異型核酸プローブ(30A)も、変異型の増幅産物の信号値が減少したにも関わらず、野生型の増幅産物の信号値が残った。
【0088】
以上の結果、野生型核酸プローブ(21G、26G)及び変異型核酸プローブ(27A)によって理想的な検出パターンが得られることが判明した。よって、本発明に従って用いられる最適な核酸プローブは、野生型核酸プローブ(21G:配列番号53、26G:配列番号54)及び変異型核酸プローブ(27A:配列番号59)である。
【0089】
表7に、試験に用いた核酸プローブのTm値を併せて示した。表7から分かるように、本発明において好適に用いられる核酸プローブは、Tm値が62〜70℃、好ましくは62〜66℃である野生型核酸プローブであり、Tm値が61〜69℃、好ましくは66〜67℃である変異型核酸プローブである。
【0090】
[試験6−1:G857A検出用プローブ]
PCR-RFLP解析によってヘテロ型であると判明したヒトゲノムを鋳型に用い、G857A検出用プライマーセット1及び5を用いて、63℃で1時間LAMP増幅を行った。G857A検出用プライマーセット1及び5は上記試験2の結果、最良のプライマーであることが判明したセットである。得られた増幅産物を、電流検出型のDNAチップで検出した。
【0091】
核酸プローブ:
試験した核酸プローブの塩基配列を表8に示した。核酸プローブは、プラス鎖のものを用いた。核酸プローブは、電極に固定化するために3’末端をチオール修飾した。ネガティブコントロールプローブについては、NAT2遺伝子配列とは全く無関係な配列を示すものを使用した。
【表8】

【0092】
核酸プローブ固定化基体:
核酸プローブ固定化基体は試験5−1と同様に作製した。
【0093】
核酸プローブは以下の通りに各電極に割り当てた:
1−2電極 ネガティブプローブ(配列番号51)
3−4電極 野生型核酸プローブ 20mer (配列番号61)
5−6電極 野生型核酸プローブ 23mer (配列番号62)
7−8電極 野生型核酸プローブ 24mer (配列番号63)
9−10電極 野生型核酸プローブ 25mer (配列番号64)
11−12電極 野生型核酸プローブ 30mer (配列番号65)
13−14電極 変異型核酸プローブ 24mer (配列番号66)
15−16電極 変異型核酸プローブ 26mer (配列番号67)
17−18電極 変異型核酸プローブ 28mer (配列番号68)
19−20電極 変異型核酸プローブ 29mer (配列番号69)
21−22電極 変異型核酸プローブ 31mer (配列番号70)
増幅産物と核酸プローブのハイブリダイゼーション及び検出:
上記増幅によって得られた増幅産物に終濃度2×SSCの塩を添加し、電極に固定化された核酸プローブとハイブリダイゼーション反応させた。反応温度は、35℃、45℃、50℃、55℃、60℃とし、20分間反応させた。その後、超純水で軽く洗浄した。電極を挿入剤であるヘキスト33258溶液を50μM含むリン酸緩衝液中に10分間浸漬した後、洗浄し、ヘキスト33258分子の酸化電流応答を測定した。
【0094】
[試験6−1:結果]
結果を図16に示す。図16Aはプライマーセット1の結果であり、図16Bはプライマーセット5の結果である。反応温度が上昇すると共に、得られる信号が増加した。よって、反応温度が高い程、ハイブリダイゼーションの効率が上昇することが示された。反応温度55℃と60℃では、ほぼ同じ結果であった。
G857A検出用プライマーセット1および5を用いて増幅したLAMP産物を検出した結果、G857A検出用プライマーセット1と比較して5の方がよりハイブリに伴う信号増加が高かった。プライマーセット1と5で、信号増加量が異なる理由は不明である。原因の一つとして、増幅産物中の一本鎖部分の長さや、核酸プローブと結合する位置によって、ハイブリダイゼーションの効率が変化することが考えられる。或いは、増幅産物中に挿入されるヘキスト33258の量が若干異なる可能性も考えられる。
【0095】
[試験6−2:G857A検出用プローブ]
次に、プライマーセット5を用いて増幅した産物について、反応温度55℃、反応時間20分で、試験5−3と同様にハイブリダイゼーションを行った。その後、核酸プローブ固定化基体を45℃の0.2×SSC洗浄バッファーに20分間浸漬して洗浄した。なお、本試験で増幅に用いた検体核酸は、PCR-RFLP解析により、野生ホモ型、変異ホモ型、ヘテロ型であると判明している3種類のヒトゲノムを用いた。
【0096】
[試験6−2:結果]
結果を図17に示す。野生型増幅産物では、野生型核酸プローブ(23G、24G、25G)によって高い信号値が検出され、変異型核酸プローブ(26A、28A、29A)によってはほとんど信号値が検出されなかった。同様に、変異型増幅産物では、変異型核酸プローブ(26A、28A、29A)によって高い信号値が検出され、野生型核酸プローブ(23G、24G、25G)によってはほとんど信号値が検出されなかった。また、ヘテロ型の増幅産物では、野生型核酸プローブ(23G、24G、25G)および変異型核酸プローブ(26A、28A、29A)の双方により高い信号値が検出された。
【0097】
以上の結果、野生型核酸プローブ(23G、24G、25G)及び変異型核酸プローブ(26A、28A、29A)によって理想的な検出パターンが得られることが判明した。よって、本発明に従って用いられる最適な核酸プローブは、野生型核酸プローブ(23G:配列番号62、24G:配列番号63、25G:配列番号64)及び変異型核酸プローブ(26A:配列番号67、28A:配列番号68、29A:配列番号69)である。
【0098】
表8には、試験に用いた核酸プローブのTm値を併せて示した。表8から分かるように、本発明において好適に用いられる核酸プローブは、Tm値が59〜68℃、好ましくは64〜65℃である野生型核酸プローブであり、Tm値が58〜68℃、好ましくは64〜66℃である変異型核酸プローブである。
【0099】
[試験7−1:T341C検出用プローブ]
シークエンス解析によって野生ホモ型、変異ホモ型、ヘテロ型であると判明したヒトゲノムを鋳型に用い、T341C検出用プライマーセット6及び10を用いて、63℃で1時間LAMP増幅を行った。T341C検出用プライマーセット6及び10は上記試験3の結果、最良のプライマーであることが判明したセットである。得られた増幅産物を、電流検出型のDNAチップで検出した。
【0100】
核酸プローブ:
試験した核酸プローブの塩基配列を表9に示した。核酸プローブは、プラス鎖のものを用いた。核酸プローブは、電極に固定化するために3’末端をチオール修飾した。ネガティブコントロールプローブについては、NAT2遺伝子配列とは全く無関係な配列を示すものを使用した。
【表9】

【0101】
核酸プローブ固定化基体:
核酸プローブ固定化基体は試験5−1と同様に作製した。
【0102】
核酸プローブは以下の通りに各電極に割り当てた:
1−2電極 ネガティブプローブ(配列番号51)
3−4電極 野生型核酸プローブ 16mer (配列番号71)
5−6電極 野生型核酸プローブ 18mer (配列番号72)
7−8電極 野生型核酸プローブ 19mer (配列番号73)
9−10電極 野生型核酸プローブ 20mer (配列番号74)
11−12電極 変異型核酸プローブ 16mer (配列番号75)
13−14電極 変異型核酸プローブ 17mer (配列番号76)
15−16電極 変異型核酸プローブ 18mer (配列番号77)
17−18電極 変異型核酸プローブ 19mer (配列番号78)
19−20電極 変異型核酸プローブ 20mer (配列番号79)
増幅産物と核酸プローブのハイブリダイゼーション及び検出:
上記増幅によって得られた増幅産物に終濃度2×SSCの塩を添加し、電極に固定化された核酸プローブとハイブリダイゼーション反応させた。反応温度は、55℃で20分間反応させた。その後、45℃で20分洗浄した。この電極を挿入剤であるヘキスト33258溶液を50μM含むリン酸緩衝液中に10分間浸漬した後、洗浄し、ヘキスト33258分子の酸化電流応答を測定した。
【0103】
[試験7−1:結果]
結果を図18に示す。図18Aはプライマーセット6の結果であり、図18Bはプライマーセット10の結果である。野生型検出用核酸プローブ(18T、19T)及び、変異型検出用核酸プローブ(17C、18C、19C)で理想的な検出パターンを示した。野生型増幅産物においては、野生型検出用核酸プローブ(18T、19T)から高い信号増加が検出され、変異型検出用核酸プローブ(17C、18C、19C)では非特異的なハイブリが剥離され、信号増加はほとんど見られなかった。同様に、変異型増幅産物においては、変異型検出用核酸プローブ(17C、18C、19C)から高い信号増加が検出され、野生型検出用核酸プローブ(18T、19T)では非特異的なハイブリが剥離され、信号増加はほとんど見られなかった。また、ヘテロ型の増幅産物においては、野生型検出用核酸プローブ(18T、19T)および変異型検出用核酸プローブ(17C、18C、19C)から高い信号増加が検出された。また、T341C検出用プライマーセット6及び10のそれぞれを用いて得られた増幅産物は、ほぼ同一の検出パターンを示した。
【0104】
以上の結果、本発明に従って用いられる最適な核酸プローブは、野生型検出用核酸プローブ(18T:配列番号72、19T:配列番号73)及び変異型検出用核酸プローブ(17C:配列番号76、18C:配列番号77、19C:配列番号78)である。
【0105】
表9には、試験に用いた核酸プローブのTm値を併せて示した。表9から分かるように、本発明において好適に用いられる核酸プローブは、Tm値が61〜69℃、好ましくは66〜68℃である野生型核酸プローブであり、Tm値が58〜70℃、好ましくは63〜69℃である変異型核酸プローブである。
【0106】
[試験8−1:G590A及びG857A検出用プローブ]
PCR-RFLP解析によって野生ホモ型、変異ホモ型、ヘテロ型であると判明したヒトゲノムを鋳型に用い、G590AおよびG857A検出用プライマーセット6を用いて、63℃でLAMP増幅を行った。G590AおよびG857A検出用プライマーセット6は上記試験4の結果、最良のプライマーであることが判明したセットである。得られた増幅産物を、電流検出型のDNAチップで検出した。
【0107】
ループプライマーによる増幅時間の短縮:
G590A及びG857A検出用プライマーセットは、増幅に1.5時間近くかかる。よって、ループプライマーを導入し、増幅時間の短縮を検証した。ループプライマーは表6に記載のLBプライマー(配列番号80)を用い、25μl反応液中、40pmol添加した。増幅の結果、ループプライマーの導入により1時間以内で増幅することが明らかになった。
【0108】
DNAチップ検出結果:
ループプライマーを導入して増幅したG590A及びG857A検出用プライマーセット6の増幅産物について、試験5及び6における検討の結果、最適な核酸プローブであることが判明している以下の核酸プローブを用いて検出した。
【0109】
核酸プローブ:
G590Aについては、表7に示す野生型検出用プローブ(配列番号54)、変異型検出用プローブ(配列番号59)を用い、G857Aについては、表8に示す野生型検出用プローブ(配列番号62)、変異型検出用プローブ(配列番号67)を用いた。G590A検出用核酸プローブはマイナス鎖のもの、G857A検出用核酸プローブはプラス鎖のものを用いた。核酸プローブは、電極に固定化するために3’末端をチオール修飾した。
【0110】
核酸プローブ固定化基体:
核酸プローブ固定化基体は試験5−1と同様に作製した。
【0111】
核酸プローブは以下の通りに各電極に割り当てた:
1−2電極 ネガティブプローブ(配列番号51)
3−4電極 野生型核酸プローブ 26mer (配列番号54)
5−6電極 変異型核酸プローブ 27mer (配列番号59)
7−8電極 野生型核酸プローブ 23mer (配列番号62)
9−10電極 変異型核酸プローブ 26mer (配列番号67)
増幅産物と核酸プローブのハイブリダイゼーション及び検出:
上記試験7と同様の方法で行った。
【0112】
[試験8−1:結果]
結果を図19に示す。G590A野生型検出用プローブ(配列番号54)、変異型検出用プローブ(配列番号59)、G857A野生型検出用プローブ(配列番号62)、変異型検出用プローブ(配列番号67)を用いることで、理想的な検出結果が得られた。
【0113】
<検体試料>
本発明が対象とする検体は特に限定される物ではなく、例えば、ヒトから採取した血液、血清、白血球、毛根、口腔粘膜などを用いることができる。これら検体試料から核酸成分の抽出を行い、標的核酸の検出試験に供される試料溶液を調製する。抽出方法は特に限定されないが、例えば、市販の核酸抽出方法QIAamp(QIAGEN社製)、スマイテスト(住友金属社製)等を利用することも可能である。
【0114】
<キット>
本発明の他の側面から、本発明の検出方法に用いるための、LAMP法のための上記プライマーセットを具備するキットが提供される。該キットは、任意に、鎖置換型DNA合成酵素、合成基質、及び緩衝溶液などを具備することができる。
【0115】
他の側面から、LAMP法のための上記プライマーセットによって増幅された増幅産物を検出するための核酸プローブが提供される。さらに、該核酸プローブが固定化された核酸プローブ固定化基体が提供される。該プローブ固定化基体は、好ましくはDNAチップ又はDNAマイクロアレイとして提供される。
また、該核酸プローブ又は核酸プローブ固定化基体をさらに具備する上記キットも提供される。
【0116】
また、本発明の他の態様において、NAT2の一塩基多型G590A、G857A及びT341Cを同時に検出する方法が提供される。本態様においては、上記の通りにG590A、G857A及びT341Cについて別々に増幅工程を行い、その後、増幅産物を混合して混合液を調製する。この混合液を上記と同様の検出方法に供する。本態様に従えば、G590A、G857A及びT341Cについての遺伝子型を同時に検出することができる。
【実施例】
【0117】
[G590A、G857A、T341Cの同時検出]
G590A、G857A、T341Cを同時に検出する試験を行った。G590A検出用核酸プライマーセット9(試験1−2)、G857A検出用核酸プライマーセット5(試験2)、又はT341C検出用核酸プライマーセット6及び10(試験3)のそれぞれを用いて、ヒトゲノムを63℃で1時間増幅した。ヒトゲノムは、PCR-RFLP解析またはシークエンス解析により、野生ホモ型、変異ホモ型、ヘテロ型であると判明している3種類のヒトゲノムを用いた。増幅反応後、3つの増幅産物を混合し、混合反応液を調製した。
【0118】
核酸プローブ:
この混合反応液を、G590A用の核酸プローブ、G857A用の核酸プローブ、及びT341C用の核酸プローブを用いる検出に供した。用いた核酸プローブは、次の通りである:
G590A 野生型核酸プローブ(配列番号54)、変異型核酸プローブ(配列番号59)、
G857A 野生型核酸プローブ(配列番号62)、変異型核酸プローブ(配列番号67)
T341C 野生型核酸プローブ(配列番号72)、変異型核酸プローブ(配列番号76)
核酸プローブは全てプラス鎖のものを用い、3’末端をチオール修飾した。
【0119】
プローブ核酸固定化電極の作製:
上記試験5−1に記載の方法と同様にプローブ核酸固定化電極を作製した。
【0120】
核酸プローブは以下の通りに各電極に割り当てた:
1−2電極 ネガティブプローブ(配列番号51)
3−4電極 G590A野生型核酸プローブ 26mer (配列番号54)
5−6電極 G590A 変異型核酸プローブ 27mer (配列番号59)
7−8電極 G857A 野生型核酸プローブ 23mer (配列番号62)
9−10電極 G857A 変異型核酸プローブ 26mer (配列番号67)
11−12電極 T341C 野生型核酸プローブ 18mer (配列番号72)
13−14電極 T341C 変異型核酸プローブ 17mer (配列番号76)
増幅産物と核酸プローブのハイブリダイゼーション及び検出:
上記試験7と同様に行った。
【0121】
[結果]
結果を図20に示す。図20Aはプライマーセット9,5,6を用いた結果であり、図20Bはプライマーセット9,5,10を用いた結果である。G590A、G857A、T341Cの各型において、理想的な検出パターンを示した。このことから、DNAチップを用いてG590A、G857A、T341Cを同時検出できることが示された。
【図面の簡単な説明】
【0122】
【図1】LAMP法の概要図。
【図2】LAMP法の中間産物及びインナープライマー(FIP、BIP)のアニール位置を示す模式図。
【図3】ループプライマーの配置を示す概要図。
【図4】LAMP法の中間産物及びループプライマー(LFc、LBc)のアニール位置を示す模式図。
【図5】増幅産物の検出位置を示す模式図。
【図6】プローブ固定化基体の一実施形態の平面模式図。
【図7】プローブ固定化基体の一実施形態の平面模式図。
【図8】FIPプライマーの配置を示す模式図。
【図9A】NAT1及びNAT2遺伝子の配列。
【図9B】図9Aに続くNAT1及びNAT2遺伝子の配列。
【図10】本発明のプライマーセットによる増幅の電気泳動図。
【図11】本発明のプライマーセットによる増幅の電気泳動図。
【図12】非特異的増幅を示す電気泳動図。
【図13】G590A検出用プローブについての試験結果1。
【図14】G590A検出用プローブについての試験結果2。
【図15A】G590A検出用プローブについての試験結果3(野性型)。
【図15B】G590A検出用プローブについての試験結果3(変異型)。
【図15C】G590A検出用プローブについての試験結果3(ヘテロ型)。
【図16A】G857A検出用プローブについての試験結果1(プライマーセット1)。
【図16B】G857A検出用プローブについての試験結果1(プライマーセット5)。
【図17】G857A検出用プローブについての試験結果2。
【図18A】T341C検出用プローブについての試験結果1(プライマーセット6)。
【図18B】T341C検出用プローブについての試験結果1(プライマーセット10)。
【図19】G590A、G857Aの同時増幅の結果。
【図20A】G590A、G857A、T341Aの同時検出結果(T341C用プライマーセット6)。
【図20B】G590A、G857A、T341Aの同時検出結果(T341C用プライマーセット10)。
【符号の説明】
【0123】
1…基体、2…固定化領域、11…基体、12…電極、13…パット
【技術分野】
【0001】
本発明は、N-アセチルトランスフェラーゼ2(NAT2)遺伝子の一塩基多型における遺伝子型を検出するために用いられる核酸プライマーセット及び検出用プローブに関する。
【背景技術】
【0002】
N-アセチルトランスフェラーゼ2(NAT2)は、結核治療薬イソニアジド(INH)やサラゾスルファピリジン等の臨床的に重要な薬物の代謝に関与している。サラゾスルファピリジンは、潰瘍性大腸炎や関節リウマチ等の治療薬である。
【0003】
NAT2をコードする遺伝子には遺伝子多型が存在することが知られている。NAT2の活性が高い表現型はRapid Acetylator(RA)と呼ばれ、活性が低い表現型はSlow Acetylator(SA)と呼ばれている。日本人では、野生型NAT2*4を含む4種類の多型(NAT2*4、NAT2*5、NAT*6、NAT2*7)が存在すると言われている。変異アレルNAT2*5、NAT*6、NAT2*7は、各々、一塩基多型T341C、G590A、G857Aにおける遺伝子型を検査することにより判別することができる。この変異アレルのホモ接合体、または複合ヘテロ接合体を有する人はSAの可能性が高く、副作用の発生確率が高くなる。
【0004】
このように、NAT2遺伝子の変異を検査することは、薬物の副作用を回避するために有用である。また、NAT2遺伝子の遺伝子型を明らかにすることにより、個々人に適した薬物投与や治療を選択することが出来る。
【0005】
一塩基多型の検出は、一般に、PCR(Polymerase chain reaction)法によって標的核酸を増幅し、特異的なプローブで野生型及び変異型のそれぞれの増幅産物を検出することによって行われる(非特許文献1)。しかしながら、PCR法は核酸抽出などの前処理が煩雑である。また、サーマルサイクラーのような複雑な温度制御が必須であり、さらに反応時間に2時間以上を要するなどの不都合がある。また、PCR法による増幅産物は2本鎖であるため、相補鎖が、検出の際にプローブに対するコンペティターとなり、検出感度を低下させるという問題があった。そこで、増幅産物を1本鎖にするため、酵素や磁気ビーズを用いて、相補鎖を分解又は分離する方法がとられているが、いずれも操作が煩雑であり、また費用がかかるという問題がある。
【非特許文献1】Jain K.K., Application of Amplicip CYP450, Mol Diagn 9,119-27 (2005)
【発明の開示】
【発明が解決しようとする課題】
【0006】
上記問題に鑑み、本発明は、NAT2遺伝子の一塩基多型を短時間で簡便、且つ安価に検出できる方法を提供するために、該検出に用いる核酸プライマー及び検出用プローブを提供することを目的とする。
【課題を解決するための手段】
【0007】
上記目的を達成するため、本発明は、NAT2遺伝子の一塩基多型G590Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、表2及び3に記載されたプライマーセット1〜16から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する核酸プライマーセットが提供される。
【0008】
ここにおいて、表2及び3に記載されたプライマーセット1〜16は、次のプライマーから成る:
プライマーセット1:配列番号1のFIPプライマー及び配列番号7のBIPプライマー、
プライマーセット2:配列番号2のFIPプライマー及び配列番号7のBIPプライマー、
プライマーセット3:配列番号5のFIPプライマー及び配列番号7のBIPプライマー、
プライマーセット4:配列番号6のFIPプライマー及び配列番号7のBIPプライマー、
プライマーセット5:配列番号10のFIPプライマー及び配列番号13のBIPプライマー、
プライマーセット6:配列番号10のFIPプライマー及び配列番号14のBIPプライマー、
プライマーセット7:配列番号15のFIPプライマー及び配列番号11のBIPプライマー、
プライマーセット8:配列番号15のFIPプライマー及び配列番号12のBIPプライマー、
プライマーセット9:配列番号15のFIPプライマー及び配列番号13のBIPプライマー、
プライマーセット10:配列番号15のFIPプライマー及び配列番号14のBIPプライマー、
プライマーセット11:配列番号16のFIPプライマー及び配列番号11のBIPプライマー、
プライマーセット12:配列番号16のFIPプライマー及び配列番号12のBIPプライマー、
プライマーセット13:配列番号16のFIPプライマー及び配列番号13のBIPプライマー、
プライマーセット14:配列番号16のFIPプライマー及び配列番号14のBIPプライマー、
プライマーセット15:配列番号17のFIPプライマー及び配列番号13のBIPプライマー、
プライマーセット16:配列番号17のFIPプライマー及び配列番号14のBIPプライマー。
【0009】
他の態様において、NAT2遺伝子の一塩基多型G857Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、表4に記載されたプライマーセット1〜5から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する核酸プライマーセットが提供される。
【0010】
ここにおいて、表4に記載されたプライマーセット1〜5は、次のプライマーから成る:
プライマーセット1:配列番号20のFIPプライマー及び配列番号21のBIPプライマー、
プライマーセット2:配列番号20のFIPプライマー及び配列番号22のBIPプライマー、
プライマーセット3:配列番号20のFIPプライマー及び配列番号23のBIPプライマー、
プライマーセット4:配列番号20のFIPプライマー及び配列番号25のBIPプライマー、
プライマーセット5:配列番号20のFIPプライマー及び配列番号26のBIPプライマー。
【0011】
他の態様において、NAT2遺伝子の一塩基多型T341Cにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、表5に記載されたプライマーセット1〜10から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する核酸プライマーセットが提供される。
【0012】
ここにおいて、表5に記載されたプライマーセット1〜10は、次のプライマーから成る:
プライマーセット1:配列番号33のFIPプライマー及び配列番号30のBIPプライマー、
プライマーセット2:配列番号33のFIPプライマー及び配列番号31のBIPプライマー、
プライマーセット3:配列番号33のFIPプライマー及び配列番号32のBIPプライマー、
プライマーセット4:配列番号34のFIPプライマー及び配列番号30のBIPプライマー、
プライマーセット5:配列番号34のFIPプライマー及び配列番号31のBIPプライマー、
プライマーセット6:配列番号34のFIPプライマー及び配列番号32のBIPプライマー、
プライマーセット7:配列番号35のFIPプライマー及び配列番号32のBIPプライマー、
プライマーセット8:配列番号36のFIPプライマー及び配列番号32のBIPプライマー、
プライマーセット9:配列番号37のFIPプライマー及び配列番号32のBIPプライマー、
プライマーセット10:配列番号38のFIPプライマー及び配列番号32のBIPプライマー。
【0013】
他の態様において、NAT2遺伝子の一塩基多型G590A及びG857Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、表6に記載されたプライマーセット1〜8から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する核酸プライマーセットが提供される。
【0014】
ここにおいて、表6に記載されたプライマーセット1〜8は、次のプライマーから成る:
プライマーセット1:配列番号42のFIPプライマー及び配列番号43のBIPプライマー、
プライマーセット2:配列番号42のFIPプライマー及び配列番号44のBIPプライマー、
プライマーセット3:配列番号45のFIPプライマー及び配列番号43のBIPプライマー、
プライマーセット4:配列番号45のFIPプライマー及び配列番号46のBIPプライマー、
プライマーセット5:配列番号47のFIPプライマー及び配列番号43のBIPプライマー、
プライマーセット6:配列番号48のFIPプライマー及び配列番号43のBIPプライマー、
プライマーセット7:配列番号48のFIPプライマー及び配列番号46のBIPプライマー、
プライマーセット8:配列番号48のFIPプライマー及び配列番号44のBIPプライマー。
【0015】
他の側面に従って、上記核酸プライマーセットを使用して標的核酸を増幅する工程と、得られた増幅産物に含まれる、野生型の増幅産物と変異型の増幅産物のそれぞれの量を測定し、比較する工程とを具備する、NAT2遺伝子の一塩基多型G590A、G857A又はT341Cにおける遺伝子型の検出方法が提供される。
【0016】
また他の側面から、上記核酸プライマーセットを用いて標的核酸を増幅し、得られた増幅産物を検出するために用いられる核酸プローブが提供される。一つの態様において、該核酸プローブは、野性型核酸プローブが野生型の増幅産物と相補的であり、62〜70℃のTm値を有し、変異型核酸プローブが変異型の増幅産物と相補的であり、61〜69℃のTm値を有し、且つ、前記一塩基多型G590A部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする。他の態様において、該核酸プローブは、野生型核酸プローブが59〜68℃のTm値を有し、変異型核酸プローブが58〜68℃のTm値を有し、且つ、前記一塩基多型G857A部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする。他の態様において、該核酸プローブは、野生型核酸プローブが61〜69℃のTm値を有し、変異型核酸プローブが58〜70℃のTm値を有し、且つ、前記一塩基多型T341C部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする。
【0017】
また他の側面から、NAT2遺伝子の一塩基多型G590A、G857A及びT341Cにおける遺伝子型を同時に検出する方法が提供される。
【発明の効果】
【0018】
本発明によれば、NAT2遺伝子の一塩基多型における遺伝子型を検出するための核酸プライマー及び検出用プローブが提供される。これにより、NAT2遺伝子の一塩基多型T341C、G590A、G857Aにおける遺伝子型を、安価で簡便に検出することが可能である。
【発明を実施するための最良の形態】
【0019】
一塩基多型の検出にはPCR法が用いられることが多いが、PCR法には上記したような不都合な点がある。よって、本発明では、PCR法に替わってLAMP(Loop-mediated isothermal amplification)法を利用して一塩基多型を検出する。LAMP法とは、核酸を等温条件下60〜65℃で増幅する技術である。LAMP法はPCR法と比較して、短時間で多量の増幅産物が得られるという利点を有する。また、サンプル中の不純物の影響を受けにくいとも報告されている。LAMP法を用いることによって、簡便に標的核酸を増幅することが可能である。
【0020】
本発明の検出方法では、LAMP法によって標的核酸を増幅し、得られた増幅産物中の、野生型の増幅産物と変異型の増幅産物の量をそれぞれ測定する。野生型の増幅産物が多い場合は、試験に供された標的核酸の遺伝子型は野性型であると判定できる。反対に、変異型の増幅産物が多い場合は、該標的核酸は変異型であると判定できる。また、野生型と変異型の増幅産物がほぼ等量である場合は、ヘテロ型の遺伝子であると判定できる。
【0021】
増幅産物の量は、これに限定されないが、例えば核酸プローブを用いて測定することができる。核酸プローブは、野生型の増幅産物と相補的な核酸プローブと、変異型の増幅産物と相補的な核酸プローブを用いる。増幅産物とそれぞれの核酸プローブとをハイブリダイゼーションさせ、それぞれの核酸プローブに結合した増幅産物の量を測定する。野生型の核酸プローブに結合した増幅産物の量と、変異型の核酸プローブに結合した増幅産物の量を比較することによって、標的核酸の遺伝子型を判定することができる。
【0022】
<LAMP法の概要>
以下にLAMP法の概要を説明する。なお、本明細書では、一塩基多型の検出に供される核酸(ゲノムDNA等を含む)を検体核酸と称する。また、LAMP法によって増幅されるNAT2遺伝子内の領域を標的核酸と称する。また、LAMP法によって得られた産物を増幅産物と称する。また、ヒトゲノムDNAを含む溶液を試料溶液と称する。
【0023】
LAMP法では、標的核酸に対してその5’末端側から順にF3領域、F2領域、F1領域を設定し、3’末端側から順にB3c領域、B2c領域、及びB1c領域を設定する。そして、図1に示すような4種のプライマーを用いて標的核酸を増幅する。なお、F1c、F2c、F3c、B1、B2、及びB3領域はそれぞれ、F1、F2、F3、B1c、B2c、及びB3c領域の相補鎖における領域を示している。
【0024】
LAMP法において核酸を増幅するために使用される4種のプライマーとは、(1)3’末端側に前記F2領域と同じ配列を有し、且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー;(2)前記F3領域と同じ配列から成るF3プライマー;(3)3’末端側に前記B2c領域と相補的な配列を有し、且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー;及び、(4)前記B3c領域と相補的な配列から成るB3プライマーである。一般に、FIPプライマー及びBIPプライマーはインナープライマーと呼ばれ、F3プライマー及びB3プライマーはアウタープライマーと呼ばれる。
【0025】
上記4種のプライマーを用いてLAMP増幅を行うと、図2に示すようなダンベル構造を有する中間産物が生成される。一本鎖ループ内のF2c及びB2c領域にFIP及びBIPプライマーが結合し、該プライマーの3’末端及び中間産物自体の3’末端から伸長反応が進行する。詳細には、特許第3313358号を参照されたい。
【0026】
LAMP法ではさらに、ループプライマーと呼ばれるさらなるプライマーを任意に用いることによって、増幅時間を短縮させることができる。この場合、図3に示すように、前記F2領域からF1領域にかけての部分においてLF領域を設定し、前記B2c領域からB1c領域にかけての部分においてLBc領域を設定する。これらはループプライマー領域と称する。そして、上記の4種のプライマーに加えて、LF領域と相補的な配列から成るループプライマーLFc、及び上記LBc領域と同じ配列から成るループプライマーLBcを用いる。詳細には、WO2002/0249028号を参照されたい。これらのループプライマーLFc及びLBcは、同時に用いてもよいが、何れか一方のみを用いてもよい。ループプライマーは、図4に示すように、FIP及びBIPプライマーがアニールするループとは別のループにアニールし、さらなる合成起点を与えることによって増幅を促進させる。
【0027】
<LAMP増幅産物の検出;核酸プローブ>
一塩基多型を検出する場合は、検出される多型部位を図5に示すFP領域又はBPc領域に位置させる。或いは、FP領域及びBPc領域のそれぞれに異なる多型を位置させてもよい。図5に記載したように、F2領域からF1領域にかけての部分は、増幅産物中で一本鎖となる部分である。同様に、B2c領域からB1c領域にかけての部分も増幅産物中で一本鎖となる部分である。一本鎖である部分に検出すべき多型部位を位置させることによって、核酸プローブによる検出を簡便にすることができる。
【0028】
核酸プローブは、多型部位を含むFP領域又はBPc領域と結合するように設計する。即ち、核酸プローブは、FP領域又はBPc領域のうち、多型部位を含む領域の配列と相補的な配列を有する。
【0029】
なお、増幅産物中には、FP領域及びBPc領域とそれぞれ相補的なFPc領域及びBP領域も存在する。よって、これらのFPc領域及びBP領域を検出に利用することも可能である。
【0030】
本明細書においては、野生型の増幅産物と相補的な配列を含む核酸プローブを野性型核酸プローブと称し、変異型の増幅産物と相補的な配列を含む核酸プローブを変異型核酸プローブと称する。
【0031】
核酸プローブは、特に限定されないが、DNA、RNA、PNA、LNA、メチルホスホネート骨格の核酸、その他の人工核酸鎖から構成されて良い。基体に固定化するために、末端をアミノ基、カルボキシル基、ヒドロシル基、チオール基、スルホン基などの反応性官能基で修飾してもよい。該官能基とヌクレオチドの間にスペーサーを導入することも可能である。スペーサーには、例えばアルカン骨格、エチレングリコール骨格などを用いることができる。
【0032】
<核酸プローブ固定化基体>
核酸プローブは、これに限定されないが、基体上に固定化して用いることができる。核酸プローブ固定化基体は、DNAチップ、DNAマイクロアレイと称されるそれ自身公知の装置を利用しても良い。
【0033】
プローブ固定化基体の一実施態様の模式図を図6に示した。プローブは、基体1上の固定化領域2に固定化される。基体1は例えばシリコン基板などから製造することができるが、これに限定されない。プローブの固定化は、公知の手段によって行えばよい。1つの基体1に固定化されるプローブは1種でも複数種類であってもよく、その配置や数は当業者が必要に応じて適宜設計変更することが可能である。後述するように、プローブを蛍光検出する場合には、本実施態様のようなプローブ固定化基体を用いることができる。
【0034】
プローブ固定化基体の他の実施態様の模式図を図7に示した。本実施態様においては、基体11に電極12が備えられる。プローブは電極12に固定化される。電極12は、電気的情報を取り出すためのパット13に接続される。基体11は例えばシリコン基板などから製造することができるが、これに限定されない。電極の製造及びプローブの固定化は、公知の手段によって行えばよい。電極は、特に限定されるものではないが、金、金の合金、銀、プラチナ、水銀、ニッケル、パラジウム、シリコン、ゲルマニウム、ガリウム及びタングステン等の金属単体及びそれらの合金、あるいはグラファイト、グラシーカーボンのような炭素、及びこれらの酸化物又は化合物で製造することができる。
【0035】
図7の固定化基体は10個の電極を備えるが、これに限定されず、1つの基体に配置される電極の数は任意に変更できる。また電極の配置パターンも図に示したものに限定されず、当業者が必要に応じて適宜設計変更することが可能である。基体1には、必要に応じて、参照電極および対極を設けても良い。後述するように、プローブを電気化学的に検出する場合には、本実施態様のようなプローブ固定化基体を用いることができる。
【0036】
<核酸プローブと増幅産物とのハイブリダイゼーション>
核酸プローブと増幅産物とのハイブリダイゼーションは適切な条件下で行う。適切な条件は、増幅産物の種類や構造、検出配列に含まれる塩基の種類、核酸プローブの種類によって異なる。例えば、イオン強度0.01〜5の範囲で、pH5〜10の範囲の緩衝液中で行う。反応溶液中には、ハイブリダーゼション促進剤である硫酸デキストラン、並びにサケ精子DNA、牛胸腺DNAやEDTAおよび界面活性剤などを添加しても良い。反応温度は、例えば10℃〜90℃の範囲で行い、攪拌や振盪などで反応効率を高めても良い。反応後の洗浄には、例えばイオン強度0.01〜5の範囲で、pH5〜10の範囲の緩衝液を用いればよい。
【0037】
<検出方法>
前記基体に固定化されたプローブと増幅産物とがハイブリダイズすると2本鎖核酸が生じる。この2本鎖核酸は、電気化学的に又は蛍光により検出することができる。
【0038】
(a)電流検出方式
電気化学的に2本鎖核酸を検出する方法を説明する。この方法では、2本鎖核酸を特異的に認識する2本鎖認識体を用いる。2本鎖認識体の例には、例えば、ヘキスト33258、アクリジンオレンジ、キナクリン、ドウノマイシン、メタロインターカレーター、ビスアクリジン等のビスインターカレーター、トリスインターカレーター、ポリインターカレーターなどが含まれるが、これらに限定されない。更に、これらの物質を電気化学的に活性な金属錯体、例えばフェロセン、ビオロゲンなどで修飾することも可能である。
【0039】
2本鎖認識体の濃度はその種類によって異なるが、一般的には1ng/mL〜1mg/mLの範囲で使用する。この際には、イオン強度0.001〜5の範囲でpH5〜10の範囲の緩衝液を用いればよい。
【0040】
ハイブリダイゼーション反応中又は反応後、反応溶液中に2本鎖認識体を添加する。ハイブリダイズによって2本鎖核酸が生じている場合は、2本鎖認識体がこれに結合する。そこで、例えば2本鎖認識体が電気化学的に反応する電位以上の電位を印加して、2本鎖認識体に由来する反応電流値を測定することができる。この際、電位は定速で印加するか、あるいは、パルスで印加するかあるいな定電位を印加してもよい。測定の際に、例えばポテンショスタット、デジタルマルチメーター、およびファンクションジェネレーターなどの装置を用いて電流、電圧を制御してもよい。例えば特開平10-146183号公報に記載された公知の電気化学的検出手段が好適に用いられる。
【0041】
(b)蛍光検出法
蛍光によって2本鎖核酸を検出する方法を説明する。予め、プライマーを蛍光学的に活性な物質で標識しておく。又は、蛍光学的に活性な物質で標識した2次プローブを用いて検出する。或いは、複数の標識を使用してもよい。蛍光学的に活性な物質は、これらに限定されないが、FITC、Cy3、Cy5、もしくはローダミンなどの蛍光色素を含む。蛍光物質は、例えば蛍光検出器を用いて検出される。標識の種類に応じた適宜の検出装置を用い、標識された検出配列又は2次プローブを検出する。
【0042】
<核酸プライマーの選択>
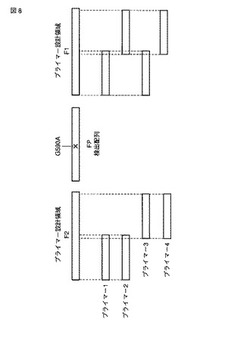
図8に一塩基多型G590AをF2とF1の間、すなわちFP領域に位置させた場合の模式図を示した。FIPプライマーは、F2領域と同じ配列、及び、F1領域と相補的な配列を有するプライマーである。このF2領域とF1領域とが、G590Aを挟んで位置する限り、様々な種類のプライマーを設計することが可能である。
【0043】
しかしながら、プライマーの種類によってLAMP法の増幅効率が異なることが、本発明者らの研究によって明らかとなった。例えば、図8に4種のプライマーを例示する。その他の3種のプライマー(BIP、F3、及びB3プライマー)は共通のものを使用してそれぞれ増幅する。その結果、プライマー1は、十分な増幅時間、例えば2時間かけても増幅しない。プライマー2は、約1時間で増幅するが、プライマー同士の非特異的な増幅が起きる。プライマー3はプライマー同士の非特異的な増幅はないが、増幅に1.5〜2時間要する。プライマー4は、プライマー同士の非特異的な増幅もみられず、増幅も1時間以内で終了する。このような場合、増幅のために良好なプライマーは3または4であり、最良のプライマーは4である。即ち、優れたプライマーとは、増幅効率が高く短時間で増幅し、且つ非特異的な増幅が見られないプライマーである。
【0044】
さらに、増幅産物を核酸プローブを用いて検出する場合には、増幅産物と核酸プローブとのハイブリダイゼーションが、高効率で生じることが望ましい。よって、ハイブリダイゼーションの効率が優れた増幅産物であるかどうかも、上記プライマーを評価する際に考慮される。
【0045】
さらに、ヒトNAT2遺伝子はヒトNAT1と非常に高い相同性を示す。図9A及びBに、NAT2遺伝子及びNAT1遺伝子の配列を示した。NAT2遺伝子はNAT1遺伝子と相同性が高いため、NAT2を特異的に増幅するためには、NAT2とNAT1とで配列が異なる領域にプライマーを設計する必要がある。
【0046】
よって、何れかのプライマーは、NAT2とNAT1で配列が異なる領域に設計する。好ましくは、F1領域、F2領域、B1領域、B2領域の少なくとも一つがNAT2とNAT1で配列が異なる領域に設計する。また、図9に示したように変異が報告されている箇所にはプライマーを設計しない。場合によって、変異箇所にプライマーを設計せざるを得ない場合には、mixの塩基またはdeoxyinosine(dI)などのユニバーサルな塩基を導入する。一塩基多型を間に挟まないもう一方のインナープライマーについては、F2からB2までの長さが450bp以下、より好ましくは350bp以下となる領域に設計することが好ましい。また、1本鎖ループの長さは、100bp以下、より好ましくは70bp以下となるように両インナープライマーを設計することが好ましい。
【0047】
プライマー同士の非特異的な増幅はLAMP反応でしばしば見られる現象である。FIPプライマーはF1c領域とF2領域を含むため、長鎖の核酸となる。同じくBIPプライマーもB1c領域とB2領域を含むため、長鎖の核酸となる。よって、FIPプライマー同士、BIPプライマー同士、またはFIPプライマーとBIPプライマーが互いに絡み合い、プライマーを鋳型として増幅してしまう確率が高くなる。また、LAMP反応は、F3プライマー、B3プライマー、さらに場合によってはLFcプライマー、LBcプライマーも反応液中に存在するため、PCR反応と比較して非特異反応の確率はさらに高くなる。このような非特異反応が発生すると、検体核酸を鋳型とする所望のLAMP産物の量が低下する。
【0048】
また、検体核酸を添加していないネガティブコントロール反応液において非特異反応が発生すると、増幅に伴い放出されるピロリン酸とMgの白色沈殿が、非特異的な増幅によるものなのか、コンタミネーションによって生じたものなのか区別することができない。従って、非特異増幅が発生するプライマーを排除することは重要である。
【0049】
そこで本発明者らはNAT2遺伝子の一塩基多型G590Aについて、そしてさらにG857A及びT341Cについて、該一塩基多型部分を増幅するために最適な核酸プライマーを選択するための試験を行った。
【0050】
[試験1−1:G590A用プライマー;FP領域]
NAT2 G590Aの多型部位をFP領域に設計した6種類の核酸プライマーセットを用い、63℃で1時間及び2時間、増幅反応させた。反応は表1に記載した組成で行った。鋳型DNAにはヒトゲノムを用いた。コンタミネーションの有無、及び非特異的な増幅の有無を確認するため、全てのセットでヒトゲノムの代わりに滅菌超純水を添加したネガティブコントロールを作製した。増幅反応後、3%アガロース電気泳動により増幅産物を確認した。
【0051】
用いた核酸プライマーセットを表2に示す。
【表1】

【0052】
【表2】

【0053】
F3プライマーは配列番号8、B3プライマーは配列番号9を用い、全てのセットに共通で使用した。
【0054】
[試験1−1:結果]
表2の6種類のプライマーセットを用いて得られた増幅産物を電気泳動に供した。その結果を図10に示す。1時間増幅した場合、プライマーセット3および4で十分量の増幅産物が得られた(レーン5,6)。2時間増幅した場合、プライマーセット1、2、3及び4で十分量の増幅産物が得られた(レーン1,2,5及び6)。プライマーセット18、19(レーン3及び4)では、増幅産物が少ないか、または増幅が確認されなかった。また、全てのセットにおいて、非特異増幅は見られなかった。以上から、良好なプライマーセットは1、2、3、4であり、最良のプライマーセットは3、4であることが明らかになった。上記の結果を表2にまとめた。
【0055】
[試験1−2:G590A用プライマー;BP領域]
NAT2 G590Aの多型部位をBP領域に設計した16種類のプライマーセットを用い、63℃で1時間及び2時間、増幅反応させた。反応は表1に記載した組成で行った。鋳型DNAにはヒトゲノムを用いた。コンタミネーションの有無、及び非特異的な増幅の有無を確認するため、全てのセットでヒトゲノムの代わりに滅菌超純水を添加したネガティブコントロールを作製した。増幅反応後、3%アガロース電気泳動により増幅産物を確認した。
【0056】
用いた核酸プライマーセットを表3に示す。
【表3】

【0057】
F3プライマーは配列番号18、B3プライマーは配列番号19を用い、全てのセットに共通で使用した。
【0058】
[試験1−2:結果]
表3の16種類のプライマーセットを用いて得られた増幅産物を電気泳動に供した。その結果を図11に示す。1時間増幅した場合、プライマーセット9で十分量の増幅産物が得られた(レーン7)。2時間増幅した場合、プライマーセット5、6、7、8、9、10、11、12、13、14、15、20、21で十分量の増幅産物が得られた。プライマーセット22、23では、増幅が見られなかった。プライマーセット20、21においては、図12に示すような非特異増幅が見られた。以上から、良好なプライマーセットは5、6、7、8、9、10、11、12、13、14、15及び16であり、最良のプライマーセットは9であることが明らかになった。上記の結果を表3にまとめた。
【0059】
[試験2:G857A用プライマー;BP領域]
NAT2 G857Aの多型部位をBP領域に設計した6種類のプライマーセットを用い、63℃で1時間及び2時間、増幅反応させた。反応は表1に記載した組成で行った。鋳型DNAにはヒトゲノムを用いた。コンタミネーションの有無、及び非特異的な増幅の有無を確認するため、全てのセットでヒトゲノムの代わりに滅菌超純水を添加したネガティブコントロールを作製した。増幅反応後、3%アガロース電気泳動により増幅産物を確認した。
【0060】
用いた核酸プライマーセットを表4に示す。
【表4】

【0061】
F3プライマーは配列番号27、B3プライマーは配列番号28を用い、全てのセットに共通で使用した。
【0062】
[試験2:結果]
表4の6種類のプライマーセットを用いて得られた増幅産物を電気泳動に供した。1時間増幅した場合、プライマーセット1、2、3、4及び5で十分量の増幅産物が得られた。2時間増幅した場合にも、同様にプライマーセット1、2、3、4及び5で十分量の増幅産物が得られた。プライマーセット6では、2時間増幅した場合でも増幅は見られなかった。また、全てのセットにおいて、非特異増幅は見られなかった。以上から、最良のプライマーセットは1、2、3、4、及び5であることが明らかになった。上記の結果を表4にまとめた。
【0063】
[試験3:T341C用プライマー;BP領域]
NAT2 T341Cの多型部位をBP領域に設計した13種類の核酸プライマーセットを用い、63℃で1時間及び2時間、増幅反応させた。反応は表1に記載した組成で行った。鋳型DNAにはヒトゲノムを用いた。コンタミネーションの有無、及び非特異的な増幅の有無を確認するため、全てのセットでヒトゲノムの代わりに滅菌超純水を添加したネガティブコントロールを作製した。増幅反応後、3%アガロース電気泳動により増幅産物を確認した。
【0064】
用いた核酸プライマーセットを表5に示す。
【表5】

【0065】
F3プライマーは、プライマーセット1、2、3、4、5、11、12、13および14については、配列番号39を用いた。プライマーセット6、7、8および9については、配列番号41を用いた。B3プライマーは配列番号40を用い、全てのセットに共通で使用した。
【0066】
[試験3:結果]
表5の13種類のプライマーセットを用いて得られた増幅産物を電気泳動に供した。1時間増幅した場合、プライマーセット3、6、9、10で十分量の増幅産物が得られた。2時間増幅した場合には、プライマーセット1、2、3、4、5、6、7、8、9、10及び11で十分量の増幅産物が得られた。プライマーセット12、13では、2時間増幅した場合でも増幅は見られなかった。プライマーセットセット11においては、非特異増幅が見られた。プライマーセット1、2、3、4、5、6、7、8、9、10においては、非特異増幅が見られなかった。このことから、良好なプライマーセットは1、2、3、4、5、6、7、8、9及び10であり、最良のプライマーセットは3、6、9、10であることが明らかになった。上記の結果を表5にまとめた。
【0067】
<G590A及びG857Aの多型部位を同時に増幅するための核酸プライマーの選択>
多型部位は、FP領域とBP領域の各々に配置することもできる。これにより、1つの増幅産物で、2箇所以上の一塩基多型を測定することができる。例えば、G590AとG857Aの場合、G590AをFP領域に設計し、G857AをFPc領域に設計することができる。G590AとG857Aは少し離れて位置するため、ターゲット長(F2からB2までの長さ)は350bp程度となり、若干増幅効率は低下するものの、ループプライマーの導入などにより、1時間以内で増幅することができる。G590AとG857Aを同時に増幅する方法として、1つの反応チューブで各々の産物をマルチ増幅する方法もあるが、マルチ増幅は、条件設定を厳密に制御しなくてはならない。また、厳密に制御しても片方の産物のみが優先的に増幅し、もう一方の産物が増幅しない場合もありうる。よって、上述の方法により1つの増幅産物で2箇所以上の一塩基多型を測定できることは、大きな利点となる。
【0068】
[試験4:G590A用プライマー(FP領域)、G857A用プライマー(BP領域)]
NAT2 G590Aの多型部位をFP領域に設計し、NAT2 G857Aの多型部位をBPc領域に設計した11種類の核酸プライマーセットを用い、63℃で1時間、1.5時間及び2時間、増幅反応させた。反応は表1に記載した組成で行った。鋳型DNAにはヒトゲノムを用いた。コンタミネーションの有無、及び非特異的な増幅の有無を確認するため、全てのセットでヒトゲノムの代わりに滅菌超純水を添加したネガティブコントロールを作製した。増幅反応後、3%アガロース電気泳動により増幅産物を確認した。
【0069】
用いた核酸プライマーセットを表6に示す。
【表6】

【0070】
F3プライマーは配列番号49、B3プライマーは配列番号50を用いて全てのセットに共通で使用した。
【0071】
[試験4:結果]
表6の11種類のプライマーセットを用いて得られた増幅産物を電気泳動に供した。1時間増幅した場合、いずれのプライマーセットにおいても増幅は見られなかった。1.5時間増幅した場合、プライマーセット1、6、7、8で十分量の増幅産物が得られた。2時間増幅した場合には、プライマーセット1、2、3、4、5、6、7、8及び10で十分量の増幅産物が得られた。プライマーセット9、11では、2時間増幅した場合でも増幅は見られなかった。プライマーセットセット10においては、非特異増幅が見られた。1、2、3、4、5、6、7、8においては、非特異増幅が見られなかった。このことから、良好なプライマーセットは1、2、3、4、5、6、7及び8であり、最良のプライマーセットは1、6、7、8であることが明らかになった。上記の結果を表6にまとめた。
【0072】
以上の試験から、本発明で提供される好ましいインナープライマーが決定された。当業者には明らかなように、LAMP反応において最も重要なプライマーはインナープライマーである。増幅反応にインナープライマーは必須であるが、アウタープライマー、ループプライマーは必須ではない。アウタープライマー、ループプライマーを増幅反応液に入れることで、増幅効率は高まるが、位置による増幅効率の変化はインナープライマーと比較して少ない。よって、アウタープライマー(F3及びB3プライマー)は、任意の配列を用いてよい。例えば、F2領域の5’末端から60塩基以内の領域及びB2c領域の3’末端から60塩基以内の領域に結合するように設計されることが好ましい。即ち、F3プライマーと同じ配列であるF3領域が、F2領域の5’末端から60塩基以内に位置し、B3プライマーと相補的な配列であるB3c領域が、B2c領域の3’末端から60塩基以内に位置することが好ましい。また、ループプライマーはインナープライマーが結合するループとは別のループに結合するように設計し、インナープライマー領域と重ならない領域に設計されていればよい。
【0073】
<核酸プローブの選択>
核酸プローブの鎖長は、短すぎても長すぎても好ましくない。塩基の種類により結合力に差はあるが、一般的に鎖長は長くなれば長くなるほど結合力は増加する。核酸プローブの鎖長が短すぎる場合、核酸プローブと増幅産物とハイブリ効率は低くなる。一方、核酸プローブの鎖長が長すぎる場合、野生型核酸プローブと変異型核酸プローブとの1塩基の差が小さくなる。そのため、野生型増幅産物と変異型核酸プローブとの非特異的な結合、また、変異型増幅産物と野生型核酸プローブとの非特異的な結合が増加する。よって、一塩基多型を検出するためには、例えば10〜35塩基のような、適切な鎖長の核酸プローブを用いることが好ましい。
【0074】
上記結合力は、2本鎖核酸が解離する温度Tm値によって表すことができる。Tm値を計算する手法としては、例えば、最近接塩基対法、Wallance法、GC%法などがある。本発明では、最近接塩基対法(Breslauer et. al. 1986、Freier et.al. 1986, Schildkraut et.al. 1965)を採用する。本発明においては、Na+濃度:50mM、核酸プローブ(オリゴヌクレオチド)の濃度:0.5μMという条件下で算出した。
【0075】
以下、本発明に従って得られた増幅産物の検出に好適に用いられる核酸プローブを選択するための試験を行った。
【0076】
[試験5−1:G590A検出用プローブ]
PCR-RFLP(Polymerase chain reaction-restriction fragment length polymorphism)解析によってヘテロ型であると判明したヒトゲノムを鋳型に用い、G590A検出用プライマーセット9を用いて、63℃で1時間LAMP増幅を行った。G590A検出用プライマーセット9は上記試験1−2の結果、最良のプライマーであることが判明したセットである。得られた増幅産物を、電流検出型のDNAチップで検出した。
【0077】
核酸プローブ:
試験した核酸プローブの塩基配列を表7に示した。核酸プローブは、プラス鎖のものを用いた。核酸プローブは、電極に固定化するために3’末端をチオール修飾した。ネガティブコントロールプローブについては、NAT2遺伝子配列とは全く無関係な配列を示すものを使用した。
【表7】

【0078】
核酸プローブ固定化基体:
DNAチップ上に金電極を作製し、これに核酸プローブを固定化した。固定化は、チオールと金との強い結合性を利用して行った。末端をチオール修飾した核酸プローブを含むプローブ溶液を金電極上にスポットし、1時間静置後、1mMメルカプトヘキサノール溶液に浸し、その後、0.2×SSC溶液で洗浄した。同一プローブは2電極ずつスポットした。洗浄後、超純水で洗浄、風乾し、核酸プローブ固定化基体とした。
【0079】
核酸プローブは以下の通りに各電極に割り当てた:
1−2電極 ネガティブプローブ(配列番号51)
3−4電極 野生型核酸プローブ 17mer (配列番号52)
5−6電極 野生型核酸プローブ 21mer (配列番号53)
7−8電極 野生型核酸プローブ 26mer (配列番号54)
9−10電極 野生型核酸プローブ 29mer (配列番号55)
11−12電極 変異型核酸プローブ 19mer (配列番号56)
13−14電極 変異型核酸プローブ 21mer (配列番号57)
15−16電極 変異型核酸プローブ 23mer (配列番号58)
17−18電極 変異型核酸プローブ 27mer (配列番号59)
19−20電極 変異型核酸プローブ 30mer (配列番号60)
増幅産物と核酸プローブのハイブリダイゼーション及び検出:
上記増幅によって得られた増幅産物に終濃度2×SSCの塩を添加し、電極に固定化された核酸プローブとハイブリダイゼーション反応させた。反応温度は、35℃、45℃、50℃、55℃、60℃とし、60分間反応させた。その後、超純水で軽く洗浄した。電極を挿入剤であるヘキスト33258溶液を50μM含むリン酸緩衝液中に10分間浸漬した後、洗浄し、ヘキスト33258分子の酸化電流応答を測定した。
【0080】
[試験5−1:結果]
結果を図13に示す。反応温度が上昇すると共に、得られる信号が増加した。よって、反応温度が高い程、ハイブリダイゼーションの効率が上昇することが示された。反応温度55℃と60℃では、ほぼ同じ結果であった。
【0081】
[試験5−2:G590A検出用プローブ]
次に、反応温度を55℃とし、反応時間を10分、20分、40分、60分、120分間として、試験5−1と同様に行った。
【0082】
[試験5−2:結果]
結果を図14に示す。反応時間10分と120分により得られた結果は、ほぼ同じであった。このことから、反応時間10分でハイブリダイゼーション反応が飽和状態に達することが明らかになった。
【0083】
鎖長が比較的短い野生型核酸プローブ(17G:配列番号52)及び変異型核酸プローブ(19A:配列番号56、21A:配列番号57、23A:配列番号58)は、得られた信号が比較的低かった。野生型核酸プローブ(21G:配列番号53、26G:配列番号54、29G:配列番号55)及び変異型核酸プローブ(27A:配列番号59、30A:配列番号60)はほぼ同程度の高い信号が得られた。
【0084】
[試験5−3:G590A検出用プローブ]
次に、反応温度55℃、反応時間20分で、試験5−1と同様にハイブリダイゼーションを行った。その後、核酸プローブ固定化基体を40℃、45℃、50℃の0.2×SSC洗浄バッファーに20分間浸漬して洗浄した。なお、本試験で増幅に用いた検体核酸は、PCR-RFLP解析により、野生ホモ型、変異ホモ型、ヘテロ型であると判明している3種類のヒトゲノムを用いた。
【0085】
[試験5−3:結果]
結果を図15A〜Cに示す。洗浄なし(超純粋で軽く洗浄しただけのもの)の場合、野生型の増幅産物が変異型核酸プローブによって検出され、同様に変異型の増幅産物が野生型核酸プローブから検出され、非特異的なハイブリダイゼーションが確認された。洗浄温度40℃の結果は、洗浄なしとほぼ同一であった。
【0086】
洗浄温度45℃では、野生型増幅産物では、野生型核酸プローブ(21G、26G)によって高い信号値が検出され、変異型核酸プローブ(27A)によってはほとんど信号値が検出されなかった。同様に、変異型増幅産物では、変異型核酸プローブ(27A)によって高い信号値が検出され、野生型核酸プローブ(21G、26G)によってはほとんど信号値が検出されなかった。よって、45℃の洗浄により、非特異的なハイブリダイゼーションによる結合が剥離されたことが示された。また、ヘテロ型の増幅産物では、野生型核酸プローブ(21G、26G)および変異型核酸プローブ(27A)の双方により高い信号値が検出された。
【0087】
洗浄温度50℃では、検出される電流値が低く、洗浄によって増幅産物が核酸プローブから剥離することが確認された。洗浄温度50℃において、野生型核酸プローブ(29G)は、野生型の増幅産物の信号値が減少したにも関わらず、変異型の増幅産物の信号値が残り、非特異的な結合が依然としてあることが示された。同様に、変異型核酸プローブ(30A)も、変異型の増幅産物の信号値が減少したにも関わらず、野生型の増幅産物の信号値が残った。
【0088】
以上の結果、野生型核酸プローブ(21G、26G)及び変異型核酸プローブ(27A)によって理想的な検出パターンが得られることが判明した。よって、本発明に従って用いられる最適な核酸プローブは、野生型核酸プローブ(21G:配列番号53、26G:配列番号54)及び変異型核酸プローブ(27A:配列番号59)である。
【0089】
表7に、試験に用いた核酸プローブのTm値を併せて示した。表7から分かるように、本発明において好適に用いられる核酸プローブは、Tm値が62〜70℃、好ましくは62〜66℃である野生型核酸プローブであり、Tm値が61〜69℃、好ましくは66〜67℃である変異型核酸プローブである。
【0090】
[試験6−1:G857A検出用プローブ]
PCR-RFLP解析によってヘテロ型であると判明したヒトゲノムを鋳型に用い、G857A検出用プライマーセット1及び5を用いて、63℃で1時間LAMP増幅を行った。G857A検出用プライマーセット1及び5は上記試験2の結果、最良のプライマーであることが判明したセットである。得られた増幅産物を、電流検出型のDNAチップで検出した。
【0091】
核酸プローブ:
試験した核酸プローブの塩基配列を表8に示した。核酸プローブは、プラス鎖のものを用いた。核酸プローブは、電極に固定化するために3’末端をチオール修飾した。ネガティブコントロールプローブについては、NAT2遺伝子配列とは全く無関係な配列を示すものを使用した。
【表8】

【0092】
核酸プローブ固定化基体:
核酸プローブ固定化基体は試験5−1と同様に作製した。
【0093】
核酸プローブは以下の通りに各電極に割り当てた:
1−2電極 ネガティブプローブ(配列番号51)
3−4電極 野生型核酸プローブ 20mer (配列番号61)
5−6電極 野生型核酸プローブ 23mer (配列番号62)
7−8電極 野生型核酸プローブ 24mer (配列番号63)
9−10電極 野生型核酸プローブ 25mer (配列番号64)
11−12電極 野生型核酸プローブ 30mer (配列番号65)
13−14電極 変異型核酸プローブ 24mer (配列番号66)
15−16電極 変異型核酸プローブ 26mer (配列番号67)
17−18電極 変異型核酸プローブ 28mer (配列番号68)
19−20電極 変異型核酸プローブ 29mer (配列番号69)
21−22電極 変異型核酸プローブ 31mer (配列番号70)
増幅産物と核酸プローブのハイブリダイゼーション及び検出:
上記増幅によって得られた増幅産物に終濃度2×SSCの塩を添加し、電極に固定化された核酸プローブとハイブリダイゼーション反応させた。反応温度は、35℃、45℃、50℃、55℃、60℃とし、20分間反応させた。その後、超純水で軽く洗浄した。電極を挿入剤であるヘキスト33258溶液を50μM含むリン酸緩衝液中に10分間浸漬した後、洗浄し、ヘキスト33258分子の酸化電流応答を測定した。
【0094】
[試験6−1:結果]
結果を図16に示す。図16Aはプライマーセット1の結果であり、図16Bはプライマーセット5の結果である。反応温度が上昇すると共に、得られる信号が増加した。よって、反応温度が高い程、ハイブリダイゼーションの効率が上昇することが示された。反応温度55℃と60℃では、ほぼ同じ結果であった。
G857A検出用プライマーセット1および5を用いて増幅したLAMP産物を検出した結果、G857A検出用プライマーセット1と比較して5の方がよりハイブリに伴う信号増加が高かった。プライマーセット1と5で、信号増加量が異なる理由は不明である。原因の一つとして、増幅産物中の一本鎖部分の長さや、核酸プローブと結合する位置によって、ハイブリダイゼーションの効率が変化することが考えられる。或いは、増幅産物中に挿入されるヘキスト33258の量が若干異なる可能性も考えられる。
【0095】
[試験6−2:G857A検出用プローブ]
次に、プライマーセット5を用いて増幅した産物について、反応温度55℃、反応時間20分で、試験5−3と同様にハイブリダイゼーションを行った。その後、核酸プローブ固定化基体を45℃の0.2×SSC洗浄バッファーに20分間浸漬して洗浄した。なお、本試験で増幅に用いた検体核酸は、PCR-RFLP解析により、野生ホモ型、変異ホモ型、ヘテロ型であると判明している3種類のヒトゲノムを用いた。
【0096】
[試験6−2:結果]
結果を図17に示す。野生型増幅産物では、野生型核酸プローブ(23G、24G、25G)によって高い信号値が検出され、変異型核酸プローブ(26A、28A、29A)によってはほとんど信号値が検出されなかった。同様に、変異型増幅産物では、変異型核酸プローブ(26A、28A、29A)によって高い信号値が検出され、野生型核酸プローブ(23G、24G、25G)によってはほとんど信号値が検出されなかった。また、ヘテロ型の増幅産物では、野生型核酸プローブ(23G、24G、25G)および変異型核酸プローブ(26A、28A、29A)の双方により高い信号値が検出された。
【0097】
以上の結果、野生型核酸プローブ(23G、24G、25G)及び変異型核酸プローブ(26A、28A、29A)によって理想的な検出パターンが得られることが判明した。よって、本発明に従って用いられる最適な核酸プローブは、野生型核酸プローブ(23G:配列番号62、24G:配列番号63、25G:配列番号64)及び変異型核酸プローブ(26A:配列番号67、28A:配列番号68、29A:配列番号69)である。
【0098】
表8には、試験に用いた核酸プローブのTm値を併せて示した。表8から分かるように、本発明において好適に用いられる核酸プローブは、Tm値が59〜68℃、好ましくは64〜65℃である野生型核酸プローブであり、Tm値が58〜68℃、好ましくは64〜66℃である変異型核酸プローブである。
【0099】
[試験7−1:T341C検出用プローブ]
シークエンス解析によって野生ホモ型、変異ホモ型、ヘテロ型であると判明したヒトゲノムを鋳型に用い、T341C検出用プライマーセット6及び10を用いて、63℃で1時間LAMP増幅を行った。T341C検出用プライマーセット6及び10は上記試験3の結果、最良のプライマーであることが判明したセットである。得られた増幅産物を、電流検出型のDNAチップで検出した。
【0100】
核酸プローブ:
試験した核酸プローブの塩基配列を表9に示した。核酸プローブは、プラス鎖のものを用いた。核酸プローブは、電極に固定化するために3’末端をチオール修飾した。ネガティブコントロールプローブについては、NAT2遺伝子配列とは全く無関係な配列を示すものを使用した。
【表9】

【0101】
核酸プローブ固定化基体:
核酸プローブ固定化基体は試験5−1と同様に作製した。
【0102】
核酸プローブは以下の通りに各電極に割り当てた:
1−2電極 ネガティブプローブ(配列番号51)
3−4電極 野生型核酸プローブ 16mer (配列番号71)
5−6電極 野生型核酸プローブ 18mer (配列番号72)
7−8電極 野生型核酸プローブ 19mer (配列番号73)
9−10電極 野生型核酸プローブ 20mer (配列番号74)
11−12電極 変異型核酸プローブ 16mer (配列番号75)
13−14電極 変異型核酸プローブ 17mer (配列番号76)
15−16電極 変異型核酸プローブ 18mer (配列番号77)
17−18電極 変異型核酸プローブ 19mer (配列番号78)
19−20電極 変異型核酸プローブ 20mer (配列番号79)
増幅産物と核酸プローブのハイブリダイゼーション及び検出:
上記増幅によって得られた増幅産物に終濃度2×SSCの塩を添加し、電極に固定化された核酸プローブとハイブリダイゼーション反応させた。反応温度は、55℃で20分間反応させた。その後、45℃で20分洗浄した。この電極を挿入剤であるヘキスト33258溶液を50μM含むリン酸緩衝液中に10分間浸漬した後、洗浄し、ヘキスト33258分子の酸化電流応答を測定した。
【0103】
[試験7−1:結果]
結果を図18に示す。図18Aはプライマーセット6の結果であり、図18Bはプライマーセット10の結果である。野生型検出用核酸プローブ(18T、19T)及び、変異型検出用核酸プローブ(17C、18C、19C)で理想的な検出パターンを示した。野生型増幅産物においては、野生型検出用核酸プローブ(18T、19T)から高い信号増加が検出され、変異型検出用核酸プローブ(17C、18C、19C)では非特異的なハイブリが剥離され、信号増加はほとんど見られなかった。同様に、変異型増幅産物においては、変異型検出用核酸プローブ(17C、18C、19C)から高い信号増加が検出され、野生型検出用核酸プローブ(18T、19T)では非特異的なハイブリが剥離され、信号増加はほとんど見られなかった。また、ヘテロ型の増幅産物においては、野生型検出用核酸プローブ(18T、19T)および変異型検出用核酸プローブ(17C、18C、19C)から高い信号増加が検出された。また、T341C検出用プライマーセット6及び10のそれぞれを用いて得られた増幅産物は、ほぼ同一の検出パターンを示した。
【0104】
以上の結果、本発明に従って用いられる最適な核酸プローブは、野生型検出用核酸プローブ(18T:配列番号72、19T:配列番号73)及び変異型検出用核酸プローブ(17C:配列番号76、18C:配列番号77、19C:配列番号78)である。
【0105】
表9には、試験に用いた核酸プローブのTm値を併せて示した。表9から分かるように、本発明において好適に用いられる核酸プローブは、Tm値が61〜69℃、好ましくは66〜68℃である野生型核酸プローブであり、Tm値が58〜70℃、好ましくは63〜69℃である変異型核酸プローブである。
【0106】
[試験8−1:G590A及びG857A検出用プローブ]
PCR-RFLP解析によって野生ホモ型、変異ホモ型、ヘテロ型であると判明したヒトゲノムを鋳型に用い、G590AおよびG857A検出用プライマーセット6を用いて、63℃でLAMP増幅を行った。G590AおよびG857A検出用プライマーセット6は上記試験4の結果、最良のプライマーであることが判明したセットである。得られた増幅産物を、電流検出型のDNAチップで検出した。
【0107】
ループプライマーによる増幅時間の短縮:
G590A及びG857A検出用プライマーセットは、増幅に1.5時間近くかかる。よって、ループプライマーを導入し、増幅時間の短縮を検証した。ループプライマーは表6に記載のLBプライマー(配列番号80)を用い、25μl反応液中、40pmol添加した。増幅の結果、ループプライマーの導入により1時間以内で増幅することが明らかになった。
【0108】
DNAチップ検出結果:
ループプライマーを導入して増幅したG590A及びG857A検出用プライマーセット6の増幅産物について、試験5及び6における検討の結果、最適な核酸プローブであることが判明している以下の核酸プローブを用いて検出した。
【0109】
核酸プローブ:
G590Aについては、表7に示す野生型検出用プローブ(配列番号54)、変異型検出用プローブ(配列番号59)を用い、G857Aについては、表8に示す野生型検出用プローブ(配列番号62)、変異型検出用プローブ(配列番号67)を用いた。G590A検出用核酸プローブはマイナス鎖のもの、G857A検出用核酸プローブはプラス鎖のものを用いた。核酸プローブは、電極に固定化するために3’末端をチオール修飾した。
【0110】
核酸プローブ固定化基体:
核酸プローブ固定化基体は試験5−1と同様に作製した。
【0111】
核酸プローブは以下の通りに各電極に割り当てた:
1−2電極 ネガティブプローブ(配列番号51)
3−4電極 野生型核酸プローブ 26mer (配列番号54)
5−6電極 変異型核酸プローブ 27mer (配列番号59)
7−8電極 野生型核酸プローブ 23mer (配列番号62)
9−10電極 変異型核酸プローブ 26mer (配列番号67)
増幅産物と核酸プローブのハイブリダイゼーション及び検出:
上記試験7と同様の方法で行った。
【0112】
[試験8−1:結果]
結果を図19に示す。G590A野生型検出用プローブ(配列番号54)、変異型検出用プローブ(配列番号59)、G857A野生型検出用プローブ(配列番号62)、変異型検出用プローブ(配列番号67)を用いることで、理想的な検出結果が得られた。
【0113】
<検体試料>
本発明が対象とする検体は特に限定される物ではなく、例えば、ヒトから採取した血液、血清、白血球、毛根、口腔粘膜などを用いることができる。これら検体試料から核酸成分の抽出を行い、標的核酸の検出試験に供される試料溶液を調製する。抽出方法は特に限定されないが、例えば、市販の核酸抽出方法QIAamp(QIAGEN社製)、スマイテスト(住友金属社製)等を利用することも可能である。
【0114】
<キット>
本発明の他の側面から、本発明の検出方法に用いるための、LAMP法のための上記プライマーセットを具備するキットが提供される。該キットは、任意に、鎖置換型DNA合成酵素、合成基質、及び緩衝溶液などを具備することができる。
【0115】
他の側面から、LAMP法のための上記プライマーセットによって増幅された増幅産物を検出するための核酸プローブが提供される。さらに、該核酸プローブが固定化された核酸プローブ固定化基体が提供される。該プローブ固定化基体は、好ましくはDNAチップ又はDNAマイクロアレイとして提供される。
また、該核酸プローブ又は核酸プローブ固定化基体をさらに具備する上記キットも提供される。
【0116】
また、本発明の他の態様において、NAT2の一塩基多型G590A、G857A及びT341Cを同時に検出する方法が提供される。本態様においては、上記の通りにG590A、G857A及びT341Cについて別々に増幅工程を行い、その後、増幅産物を混合して混合液を調製する。この混合液を上記と同様の検出方法に供する。本態様に従えば、G590A、G857A及びT341Cについての遺伝子型を同時に検出することができる。
【実施例】
【0117】
[G590A、G857A、T341Cの同時検出]
G590A、G857A、T341Cを同時に検出する試験を行った。G590A検出用核酸プライマーセット9(試験1−2)、G857A検出用核酸プライマーセット5(試験2)、又はT341C検出用核酸プライマーセット6及び10(試験3)のそれぞれを用いて、ヒトゲノムを63℃で1時間増幅した。ヒトゲノムは、PCR-RFLP解析またはシークエンス解析により、野生ホモ型、変異ホモ型、ヘテロ型であると判明している3種類のヒトゲノムを用いた。増幅反応後、3つの増幅産物を混合し、混合反応液を調製した。
【0118】
核酸プローブ:
この混合反応液を、G590A用の核酸プローブ、G857A用の核酸プローブ、及びT341C用の核酸プローブを用いる検出に供した。用いた核酸プローブは、次の通りである:
G590A 野生型核酸プローブ(配列番号54)、変異型核酸プローブ(配列番号59)、
G857A 野生型核酸プローブ(配列番号62)、変異型核酸プローブ(配列番号67)
T341C 野生型核酸プローブ(配列番号72)、変異型核酸プローブ(配列番号76)
核酸プローブは全てプラス鎖のものを用い、3’末端をチオール修飾した。
【0119】
プローブ核酸固定化電極の作製:
上記試験5−1に記載の方法と同様にプローブ核酸固定化電極を作製した。
【0120】
核酸プローブは以下の通りに各電極に割り当てた:
1−2電極 ネガティブプローブ(配列番号51)
3−4電極 G590A野生型核酸プローブ 26mer (配列番号54)
5−6電極 G590A 変異型核酸プローブ 27mer (配列番号59)
7−8電極 G857A 野生型核酸プローブ 23mer (配列番号62)
9−10電極 G857A 変異型核酸プローブ 26mer (配列番号67)
11−12電極 T341C 野生型核酸プローブ 18mer (配列番号72)
13−14電極 T341C 変異型核酸プローブ 17mer (配列番号76)
増幅産物と核酸プローブのハイブリダイゼーション及び検出:
上記試験7と同様に行った。
【0121】
[結果]
結果を図20に示す。図20Aはプライマーセット9,5,6を用いた結果であり、図20Bはプライマーセット9,5,10を用いた結果である。G590A、G857A、T341Cの各型において、理想的な検出パターンを示した。このことから、DNAチップを用いてG590A、G857A、T341Cを同時検出できることが示された。
【図面の簡単な説明】
【0122】
【図1】LAMP法の概要図。
【図2】LAMP法の中間産物及びインナープライマー(FIP、BIP)のアニール位置を示す模式図。
【図3】ループプライマーの配置を示す概要図。
【図4】LAMP法の中間産物及びループプライマー(LFc、LBc)のアニール位置を示す模式図。
【図5】増幅産物の検出位置を示す模式図。
【図6】プローブ固定化基体の一実施形態の平面模式図。
【図7】プローブ固定化基体の一実施形態の平面模式図。
【図8】FIPプライマーの配置を示す模式図。
【図9A】NAT1及びNAT2遺伝子の配列。
【図9B】図9Aに続くNAT1及びNAT2遺伝子の配列。
【図10】本発明のプライマーセットによる増幅の電気泳動図。
【図11】本発明のプライマーセットによる増幅の電気泳動図。
【図12】非特異的増幅を示す電気泳動図。
【図13】G590A検出用プローブについての試験結果1。
【図14】G590A検出用プローブについての試験結果2。
【図15A】G590A検出用プローブについての試験結果3(野性型)。
【図15B】G590A検出用プローブについての試験結果3(変異型)。
【図15C】G590A検出用プローブについての試験結果3(ヘテロ型)。
【図16A】G857A検出用プローブについての試験結果1(プライマーセット1)。
【図16B】G857A検出用プローブについての試験結果1(プライマーセット5)。
【図17】G857A検出用プローブについての試験結果2。
【図18A】T341C検出用プローブについての試験結果1(プライマーセット6)。
【図18B】T341C検出用プローブについての試験結果1(プライマーセット10)。
【図19】G590A、G857Aの同時増幅の結果。
【図20A】G590A、G857A、T341Aの同時検出結果(T341C用プライマーセット6)。
【図20B】G590A、G857A、T341Aの同時検出結果(T341C用プライマーセット10)。
【符号の説明】
【0123】
1…基体、2…固定化領域、11…基体、12…電極、13…パット
【特許請求の範囲】
【請求項1】
NAT2遺伝子の一塩基多型G590Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表2及び3に記載されたプライマーセット1〜16から選択されるFIPプライマー及びBIPプライマー、
前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、
前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する、核酸プライマーセット。
【請求項2】
前記FIPプライマー及びBIPプライマーが、表2及び3に記載されたプライマーセット3、4、及び9から選択される、請求項1に記載の核酸プライマーセット。
【請求項3】
前記FIPプライマー及びBIPプライマーが、表3に記載されたプライマーセット9のプライマーである、請求項1に記載の核酸プライマーセット。
【請求項4】
NAT2遺伝子の一塩基多型G590Aにおける遺伝子型を検出するための、請求項1〜3の何れか一項に記載の核酸プライマーセットを具備するキット。
【請求項5】
請求項1〜3の何れか一項に記載の核酸プライマーセットを使用して標的核酸を増幅する工程と、
得られた増幅産物に含まれる、野生型の増幅産物と変異型の増幅産物のそれぞれの量を測定し、比較する工程と
を具備する、NAT2遺伝子の一塩基多型G590Aにおける遺伝子型の検出方法。
【請求項6】
前記増幅産物の測定が、基体に固定化された核酸プローブと該増幅産物とをハイブリダイゼーションさせ、該核酸プローブに結合した増幅産物の量を測定することによって行われ、
該核酸プローブが、前記野生型の増幅産物と相補的な野性型核酸プローブ、及び、前記変異型の増幅産物と相補的な変異型核酸プローブであることを特徴とする、請求項5に記載の検出方法。
【請求項7】
前記野生型核酸プローブが62〜70℃のTm値を有し、前記変異型核酸プローブが61〜69℃のTm値を有し、且つ、前記一塩基多型G590A部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする、請求項6に記載の検出方法。
【請求項8】
前記野生型核酸プローブが62〜66℃のTm値を有し、前記変異型核酸プローブが66〜67℃のTm値を有することを特徴とする、請求項7に記載の検出方法。
【請求項9】
前記野生型核酸プローブが配列番号53又は54の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号59の配列又はその相補配列から成る、請求項6に記載の検出方法。
【請求項10】
前記野生型核酸プローブが配列番号54の配列又はその相補配列から成り、前記変異型核酸プローブが配列番号59の配列又はその相補配列から成る、請求項9に記載の検出方法。
【請求項11】
NAT2遺伝子の一塩基多型G590Aにおける遺伝子型を検出するための野性型及び変異型の核酸プローブであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表2及び3に記載されたプライマーセット1〜16から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーから成る核酸プライマーセットを用いて標的核酸を増幅し、得られた増幅産物を検出するために用いられ、
前記野性型核酸プローブが、野生型の増幅産物と相補的であり、62〜70℃のTm値を有し、且つ、前記一塩基多型G590A部位がその末端から3塩基以上内側に位置することを特徴とし、
前記変異型核酸プローブが、変異型の増幅産物と相補的であり、61〜69℃のTm値を有し、且つ、前記一塩基多型G590A部位がその末端から3塩基以上内側に位置することを特徴とする、野性型及び変異型の核酸プローブ。
【請求項12】
前記野生型核酸プローブが配列番号53又は54の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号59の配列又はその相補配列から成る、請求項11に記載の野性型及び変異型の核酸プローブ。
【請求項13】
請求項11又は12に記載の野性型及び変異型の核酸プローブを固定化した核酸プローブ固定化基体。
【請求項14】
NAT2遺伝子の一塩基多型G857Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表4に記載されたプライマーセット1〜5から選択されるFIPプライマー及びBIPプライマー、
前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、
前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する、核酸プライマーセット。
【請求項15】
前記FIPプライマー及びBIPプライマーが、表4に記載されたプライマーセット5のプライマーである、請求項14に記載の核酸プライマーセット。
【請求項16】
NAT2遺伝子の一塩基多型G857Aにおける遺伝子型を検出するための、請求項14又は15に記載の核酸プライマーセットを具備するキット。
【請求項17】
請求項14又は15に記載の核酸プライマーセットを使用して標的核酸を増幅する工程と、
得られた増幅産物に含まれる、野生型の増幅産物と変異型の増幅産物のそれぞれの量を測定し、比較する工程と
を具備する、NAT2遺伝子の一塩基多型G857Aにおける遺伝子型の検出方法。
【請求項18】
前記増幅産物の測定が、基体に固定化された核酸プローブと該増幅産物とをハイブリダイゼーションさせ、該核酸プローブに結合した増幅産物の量を測定することによって行われ、
該核酸プローブが、前記野生型の増幅産物と相補的な野性型核酸プローブ、及び、前記変異型の増幅産物と相補的な変異型核酸プローブであることを特徴とする、請求項17に記載の検出方法。
【請求項19】
前記野生型核酸プローブが59〜68℃のTm値を有し、前記変異型核酸プローブが58〜68℃のTm値を有し、且つ、前記一塩基多型G857A部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする、請求項18に記載の検出方法。
【請求項20】
前記野生型核酸プローブが64〜65℃のTm値を有し、前記変異型核酸プローブが64〜66℃のTm値を有することを特徴とする、請求項19に記載の検出方法。
【請求項21】
前記野生型核酸プローブが配列番号62、63又は64の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号67、68又は69の配列又はそれらの相補配列から成る、請求項20に記載の検出方法。
【請求項22】
前記野生型核酸プローブが配列番号62の配列又はその相補配列から成り、前記変異型核酸プローブが配列番号67の配列又はその相補配列から成る、請求項21に記載の検出方法。
【請求項23】
NAT2遺伝子の一塩基多型G857Aにおける遺伝子型を検出するための野性型及び変異型の核酸プローブであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表4に記載されたプライマーセット1〜5から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーから成る核酸プライマーセットを用いて標的核酸を増幅し、得られた増幅産物を検出するために用いられ、
前記野性型核酸プローブが、野生型の増幅産物と相補的であり、59〜68℃のTm値を有し、且つ、前記一塩基多型G857A部位がその末端から3塩基以上内側に位置することを特徴とし、
前記変異型核酸プローブが、変異型の増幅産物と相補的であり、58〜68℃のTm値を有し、且つ、前記一塩基多型G857A部位がその末端から3塩基以上内側に位置することを特徴とする、野性型及び変異型の核酸プローブ。
【請求項24】
前記野生型核酸プローブが配列番号62、63又は64の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号67、68又は69の配列又はそれらの相補配列から成る、請求項23に記載の野性型及び変異型の核酸プローブ。
【請求項25】
請求項23又は24に記載の野性型及び変異型の核酸プローブを固定化した核酸プローブ固定化基体。
【請求項26】
NAT2遺伝子の一塩基多型T341Cにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表5に記載されたプライマーセット1〜10から選択されるFIPプライマー及びBIPプライマー、
前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、
前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する、核酸プライマーセット。
【請求項27】
前記FIPプライマー及びBIPプライマーが、表5に記載されたプライマーセット3、69及び10から選択される、請求項26に記載の核酸プライマーセット。
【請求項28】
前記FIPプライマー及びBIPプライマーが、表5に記載されたプライマーセット6又は10のプライマーである、請求項26に記載の核酸プライマーセット。
【請求項29】
NAT2遺伝子の一塩基多型T341Cにおける遺伝子型を検出するための、請求項26〜28の何れか一項に記載の核酸プライマーセットを具備するキット。
【請求項30】
請求項26〜28の何れか一項に記載の核酸プライマーセットを使用して標的核酸を増幅する工程と、
得られた増幅産物に含まれる、野生型の増幅産物と変異型の増幅産物のそれぞれの量を測定し、比較する工程と
を具備する、NAT2遺伝子の一塩基多型T341Cにおける遺伝子型の検出方法。
【請求項31】
前記増幅産物の測定が、基体に固定化された核酸プローブと該増幅産物とをハイブリダイゼーションさせ、該核酸プローブに結合した増幅産物の量を測定することによって行われ、
該核酸プローブが、前記野生型の増幅産物と相補的な野性型核酸プローブ、及び、前記変異型の増幅産物と相補的な変異型核酸プローブであることを特徴とする、請求項30に記載の検出方法。
【請求項32】
前記野生型核酸プローブが61〜69℃のTm値を有し、前記変異型核酸プローブが58〜70℃のTm値を有し、且つ、前記一塩基多型T341C部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする、請求項31に記載の検出方法。
【請求項33】
前記野生型核酸プローブが66〜68℃のTm値を有し、前記変異型核酸プローブが63〜69℃のTm値を有することを特徴とする、請求項32に記載の検出方法。
【請求項34】
前記野生型核酸プローブが配列番号72又は73の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号76、77又は78の配列又はそれらの相補配列から成る、請求項33に記載の検出方法。
【請求項35】
前記野生型核酸プローブが配列番号72の配列又はその相補配列から成り、前記変異型核酸プローブが配列番号76の配列又はその相補配列から成る、請求項34に記載の検出方法。
【請求項36】
NAT2遺伝子の一塩基多型T341Cにおける遺伝子型を検出するための野性型及び変異型の核酸プローブであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表5に記載されたプライマーセット1〜10から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーから成る核酸プライマーセットを用いて標的核酸を増幅し、得られた増幅産物を検出するために用いられ、
前記野性型核酸プローブが、野生型の増幅産物と相補的であり、61〜69℃のTm値を有し、且つ、前記一塩基多型T341C部位がその末端から3塩基以上内側に位置することを特徴とし、
前記変異型核酸プローブが、変異型の増幅産物と相補的であり、58〜70℃のTm値を有し、且つ、前記一塩基多型T341C部位がその末端から3塩基以上内側に位置することを特徴とする、野性型及び変異型の核酸プローブ。
【請求項37】
前記野生型核酸プローブが配列番号72又は73の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号76、77又は78の配列又はそれらの相補配列から成る、請求項36に記載の野性型及び変異型の核酸プローブ。
【請求項38】
請求項36又は37に記載の野性型及び変異型の核酸プローブを固定化した核酸プローブ固定化基体。
【請求項39】
NAT2遺伝子の一塩基多型G590A及びG857Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表6に記載されたプライマーセット1〜8から選択されるFIPプライマー及びBIPプライマー、
前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、
前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する、核酸プライマーセット。
【請求項40】
前記FIPプライマー及びBIPプライマーが、表6に記載されたプライマーセット1、6、7及び8から選択される、請求項39に記載の核酸プライマーセット。
【請求項41】
前記FIPプライマー及びBIPプライマーが、表6に記載されたプライマーセット6のプライマーである、請求項40に記載の核酸プライマーセット。
【請求項42】
NAT2遺伝子の一塩基多型G590A及びG857Aにおける遺伝子型を検出するための、請求項39〜41の何れか一項に記載の核酸プライマーセットを具備するキット。
【請求項43】
請求項39〜41の何れか一項に記載の核酸プライマーセットを使用して標的核酸を増幅する工程と、
得られた増幅産物に含まれる、野生型の増幅産物と変異型の増幅産物のそれぞれの量を測定し、比較する工程と
を具備する、NAT2遺伝子の一塩基多型G590A及びG857Aにおける遺伝子型の検出方法。
【請求項44】
前記増幅産物の測定が、基体に固定化された核酸プローブと該増幅産物とをハイブリダイゼーションさせ、該核酸プローブに結合した増幅産物の量を測定することによって行われ、
該核酸プローブが、前記野生型の増幅産物と相補的な野性型核酸プローブ、及び、前記変異型の増幅産物と相補的な変異型核酸プローブであることを特徴とする、請求項43に記載の検出方法。
【請求項45】
前記野生型核酸プローブが配列番号54の配列又はその相補配列から成るG590A用の野性型核酸プローブ、及び、配列番号62の配列又はその相補配列から成るG857A用の野性型核酸プローブであり、前記変異型核酸プローブが配列番号59の配列又はその相補配列から成るG590A用の変異型核酸プローブ、及び、配列番号67の配列又はその相補配列から成るG857A用の変異型核酸プローブである、請求項44に記載の検出方法。
【請求項46】
NAT2遺伝子の一塩基多型G590A、G857A及びT341Cにおける遺伝子型を同時に検出する方法であって、
表3に記載されたプライマーセット9を使用して標的核酸を増幅する工程と、
表4に記載されたプライマーセット5を使用して標的核酸を増幅する工程と、
表5に記載されたプライマーセット6又は10を使用して標的核酸を増幅する工程と、
得られた増幅産物を混合して混合液を調製する工程と、
配列番号54の配列又はその相補配列から成るG590A用野生型核酸プローブ、配列番号59の配列又はその相補配列から成るG590A用変異型核酸プローブ、配列番号62の配列又はその相補配列から成るG857A用野生型核酸プローブ、配列番号67の配列又はその相補配列から成るG857A用変異型核酸プローブ、配列番号72の配列又はその相補配列から成るT341C用野生型核酸プローブ、及び、配列番号76の配列又はその相補配列から成るT341C用変異型核酸プローブが固定された核酸プローブ固定化基体と前記混合液を接触させ、前記増幅産物と前記核酸プローブとをハイブリダイゼーションさせる工程と、
前記それぞれの核酸プローブに結合した増幅産物の量を測定する工程と
前記G590A用野生型核酸プローブ及びG590A用変異型核酸プローブに結合した増幅産物の量を測定して比較する工程と、
前記G857A用野生型核酸プローブ及びG857A用変異型核酸プローブに結合した増幅産物の量を測定して比較する工程と、
前記T341C用野生型核酸プローブ及びT341C用変異型核酸プローブに結合した増幅産物の量を測定して比較する工程と、
を具備する、NAT2遺伝子の一塩基多型G590A、G857A及びT341Cにおける遺伝子型の同時検出方法。
【請求項1】
NAT2遺伝子の一塩基多型G590Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表2及び3に記載されたプライマーセット1〜16から選択されるFIPプライマー及びBIPプライマー、
前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、
前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する、核酸プライマーセット。
【請求項2】
前記FIPプライマー及びBIPプライマーが、表2及び3に記載されたプライマーセット3、4、及び9から選択される、請求項1に記載の核酸プライマーセット。
【請求項3】
前記FIPプライマー及びBIPプライマーが、表3に記載されたプライマーセット9のプライマーである、請求項1に記載の核酸プライマーセット。
【請求項4】
NAT2遺伝子の一塩基多型G590Aにおける遺伝子型を検出するための、請求項1〜3の何れか一項に記載の核酸プライマーセットを具備するキット。
【請求項5】
請求項1〜3の何れか一項に記載の核酸プライマーセットを使用して標的核酸を増幅する工程と、
得られた増幅産物に含まれる、野生型の増幅産物と変異型の増幅産物のそれぞれの量を測定し、比較する工程と
を具備する、NAT2遺伝子の一塩基多型G590Aにおける遺伝子型の検出方法。
【請求項6】
前記増幅産物の測定が、基体に固定化された核酸プローブと該増幅産物とをハイブリダイゼーションさせ、該核酸プローブに結合した増幅産物の量を測定することによって行われ、
該核酸プローブが、前記野生型の増幅産物と相補的な野性型核酸プローブ、及び、前記変異型の増幅産物と相補的な変異型核酸プローブであることを特徴とする、請求項5に記載の検出方法。
【請求項7】
前記野生型核酸プローブが62〜70℃のTm値を有し、前記変異型核酸プローブが61〜69℃のTm値を有し、且つ、前記一塩基多型G590A部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする、請求項6に記載の検出方法。
【請求項8】
前記野生型核酸プローブが62〜66℃のTm値を有し、前記変異型核酸プローブが66〜67℃のTm値を有することを特徴とする、請求項7に記載の検出方法。
【請求項9】
前記野生型核酸プローブが配列番号53又は54の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号59の配列又はその相補配列から成る、請求項6に記載の検出方法。
【請求項10】
前記野生型核酸プローブが配列番号54の配列又はその相補配列から成り、前記変異型核酸プローブが配列番号59の配列又はその相補配列から成る、請求項9に記載の検出方法。
【請求項11】
NAT2遺伝子の一塩基多型G590Aにおける遺伝子型を検出するための野性型及び変異型の核酸プローブであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表2及び3に記載されたプライマーセット1〜16から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーから成る核酸プライマーセットを用いて標的核酸を増幅し、得られた増幅産物を検出するために用いられ、
前記野性型核酸プローブが、野生型の増幅産物と相補的であり、62〜70℃のTm値を有し、且つ、前記一塩基多型G590A部位がその末端から3塩基以上内側に位置することを特徴とし、
前記変異型核酸プローブが、変異型の増幅産物と相補的であり、61〜69℃のTm値を有し、且つ、前記一塩基多型G590A部位がその末端から3塩基以上内側に位置することを特徴とする、野性型及び変異型の核酸プローブ。
【請求項12】
前記野生型核酸プローブが配列番号53又は54の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号59の配列又はその相補配列から成る、請求項11に記載の野性型及び変異型の核酸プローブ。
【請求項13】
請求項11又は12に記載の野性型及び変異型の核酸プローブを固定化した核酸プローブ固定化基体。
【請求項14】
NAT2遺伝子の一塩基多型G857Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表4に記載されたプライマーセット1〜5から選択されるFIPプライマー及びBIPプライマー、
前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、
前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する、核酸プライマーセット。
【請求項15】
前記FIPプライマー及びBIPプライマーが、表4に記載されたプライマーセット5のプライマーである、請求項14に記載の核酸プライマーセット。
【請求項16】
NAT2遺伝子の一塩基多型G857Aにおける遺伝子型を検出するための、請求項14又は15に記載の核酸プライマーセットを具備するキット。
【請求項17】
請求項14又は15に記載の核酸プライマーセットを使用して標的核酸を増幅する工程と、
得られた増幅産物に含まれる、野生型の増幅産物と変異型の増幅産物のそれぞれの量を測定し、比較する工程と
を具備する、NAT2遺伝子の一塩基多型G857Aにおける遺伝子型の検出方法。
【請求項18】
前記増幅産物の測定が、基体に固定化された核酸プローブと該増幅産物とをハイブリダイゼーションさせ、該核酸プローブに結合した増幅産物の量を測定することによって行われ、
該核酸プローブが、前記野生型の増幅産物と相補的な野性型核酸プローブ、及び、前記変異型の増幅産物と相補的な変異型核酸プローブであることを特徴とする、請求項17に記載の検出方法。
【請求項19】
前記野生型核酸プローブが59〜68℃のTm値を有し、前記変異型核酸プローブが58〜68℃のTm値を有し、且つ、前記一塩基多型G857A部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする、請求項18に記載の検出方法。
【請求項20】
前記野生型核酸プローブが64〜65℃のTm値を有し、前記変異型核酸プローブが64〜66℃のTm値を有することを特徴とする、請求項19に記載の検出方法。
【請求項21】
前記野生型核酸プローブが配列番号62、63又は64の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号67、68又は69の配列又はそれらの相補配列から成る、請求項20に記載の検出方法。
【請求項22】
前記野生型核酸プローブが配列番号62の配列又はその相補配列から成り、前記変異型核酸プローブが配列番号67の配列又はその相補配列から成る、請求項21に記載の検出方法。
【請求項23】
NAT2遺伝子の一塩基多型G857Aにおける遺伝子型を検出するための野性型及び変異型の核酸プローブであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表4に記載されたプライマーセット1〜5から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーから成る核酸プライマーセットを用いて標的核酸を増幅し、得られた増幅産物を検出するために用いられ、
前記野性型核酸プローブが、野生型の増幅産物と相補的であり、59〜68℃のTm値を有し、且つ、前記一塩基多型G857A部位がその末端から3塩基以上内側に位置することを特徴とし、
前記変異型核酸プローブが、変異型の増幅産物と相補的であり、58〜68℃のTm値を有し、且つ、前記一塩基多型G857A部位がその末端から3塩基以上内側に位置することを特徴とする、野性型及び変異型の核酸プローブ。
【請求項24】
前記野生型核酸プローブが配列番号62、63又は64の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号67、68又は69の配列又はそれらの相補配列から成る、請求項23に記載の野性型及び変異型の核酸プローブ。
【請求項25】
請求項23又は24に記載の野性型及び変異型の核酸プローブを固定化した核酸プローブ固定化基体。
【請求項26】
NAT2遺伝子の一塩基多型T341Cにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表5に記載されたプライマーセット1〜10から選択されるFIPプライマー及びBIPプライマー、
前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、
前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する、核酸プライマーセット。
【請求項27】
前記FIPプライマー及びBIPプライマーが、表5に記載されたプライマーセット3、69及び10から選択される、請求項26に記載の核酸プライマーセット。
【請求項28】
前記FIPプライマー及びBIPプライマーが、表5に記載されたプライマーセット6又は10のプライマーである、請求項26に記載の核酸プライマーセット。
【請求項29】
NAT2遺伝子の一塩基多型T341Cにおける遺伝子型を検出するための、請求項26〜28の何れか一項に記載の核酸プライマーセットを具備するキット。
【請求項30】
請求項26〜28の何れか一項に記載の核酸プライマーセットを使用して標的核酸を増幅する工程と、
得られた増幅産物に含まれる、野生型の増幅産物と変異型の増幅産物のそれぞれの量を測定し、比較する工程と
を具備する、NAT2遺伝子の一塩基多型T341Cにおける遺伝子型の検出方法。
【請求項31】
前記増幅産物の測定が、基体に固定化された核酸プローブと該増幅産物とをハイブリダイゼーションさせ、該核酸プローブに結合した増幅産物の量を測定することによって行われ、
該核酸プローブが、前記野生型の増幅産物と相補的な野性型核酸プローブ、及び、前記変異型の増幅産物と相補的な変異型核酸プローブであることを特徴とする、請求項30に記載の検出方法。
【請求項32】
前記野生型核酸プローブが61〜69℃のTm値を有し、前記変異型核酸プローブが58〜70℃のTm値を有し、且つ、前記一塩基多型T341C部位がそれぞれの核酸プローブの末端から3塩基以上内側に位置することを特徴とする、請求項31に記載の検出方法。
【請求項33】
前記野生型核酸プローブが66〜68℃のTm値を有し、前記変異型核酸プローブが63〜69℃のTm値を有することを特徴とする、請求項32に記載の検出方法。
【請求項34】
前記野生型核酸プローブが配列番号72又は73の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号76、77又は78の配列又はそれらの相補配列から成る、請求項33に記載の検出方法。
【請求項35】
前記野生型核酸プローブが配列番号72の配列又はその相補配列から成り、前記変異型核酸プローブが配列番号76の配列又はその相補配列から成る、請求項34に記載の検出方法。
【請求項36】
NAT2遺伝子の一塩基多型T341Cにおける遺伝子型を検出するための野性型及び変異型の核酸プローブであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表5に記載されたプライマーセット1〜10から選択されるFIPプライマー及びBIPプライマー、前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーから成る核酸プライマーセットを用いて標的核酸を増幅し、得られた増幅産物を検出するために用いられ、
前記野性型核酸プローブが、野生型の増幅産物と相補的であり、61〜69℃のTm値を有し、且つ、前記一塩基多型T341C部位がその末端から3塩基以上内側に位置することを特徴とし、
前記変異型核酸プローブが、変異型の増幅産物と相補的であり、58〜70℃のTm値を有し、且つ、前記一塩基多型T341C部位がその末端から3塩基以上内側に位置することを特徴とする、野性型及び変異型の核酸プローブ。
【請求項37】
前記野生型核酸プローブが配列番号72又は73の配列又はそれらの相補配列から成り、前記変異型核酸プローブが配列番号76、77又は78の配列又はそれらの相補配列から成る、請求項36に記載の野性型及び変異型の核酸プローブ。
【請求項38】
請求項36又は37に記載の野性型及び変異型の核酸プローブを固定化した核酸プローブ固定化基体。
【請求項39】
NAT2遺伝子の一塩基多型G590A及びG857Aにおける遺伝子型を検出するための、LAMP増幅用核酸プライマーセットであって、
標的核酸の5’末端側から順にF3領域、F2領域及びF1領域、及び3’末端側から順にB3c領域、B2c領域及びB1c領域とし、
核酸プライマーが3’末端側に前記F2領域と同じ配列を有し且つ5’末端側に前記F1領域と相補的な配列を有するFIPプライマー、前記F3領域と同じ配列から成るF3プライマー、3’末端側に前記B2c領域と相補的な配列を有し且つ5’末端側に前記B1c領域と同じ配列を有するBIPプライマー、及び、前記B3c領域と相補的な配列から成るB3プライマーである場合に、
表6に記載されたプライマーセット1〜8から選択されるFIPプライマー及びBIPプライマー、
前記標的核酸のF2領域の5’末端から60塩基以内の領域に結合するF3プライマー、及び、
前記標的核酸のB2c領域の3’末端から60塩基以内の領域に結合するB3プライマーを具備する、核酸プライマーセット。
【請求項40】
前記FIPプライマー及びBIPプライマーが、表6に記載されたプライマーセット1、6、7及び8から選択される、請求項39に記載の核酸プライマーセット。
【請求項41】
前記FIPプライマー及びBIPプライマーが、表6に記載されたプライマーセット6のプライマーである、請求項40に記載の核酸プライマーセット。
【請求項42】
NAT2遺伝子の一塩基多型G590A及びG857Aにおける遺伝子型を検出するための、請求項39〜41の何れか一項に記載の核酸プライマーセットを具備するキット。
【請求項43】
請求項39〜41の何れか一項に記載の核酸プライマーセットを使用して標的核酸を増幅する工程と、
得られた増幅産物に含まれる、野生型の増幅産物と変異型の増幅産物のそれぞれの量を測定し、比較する工程と
を具備する、NAT2遺伝子の一塩基多型G590A及びG857Aにおける遺伝子型の検出方法。
【請求項44】
前記増幅産物の測定が、基体に固定化された核酸プローブと該増幅産物とをハイブリダイゼーションさせ、該核酸プローブに結合した増幅産物の量を測定することによって行われ、
該核酸プローブが、前記野生型の増幅産物と相補的な野性型核酸プローブ、及び、前記変異型の増幅産物と相補的な変異型核酸プローブであることを特徴とする、請求項43に記載の検出方法。
【請求項45】
前記野生型核酸プローブが配列番号54の配列又はその相補配列から成るG590A用の野性型核酸プローブ、及び、配列番号62の配列又はその相補配列から成るG857A用の野性型核酸プローブであり、前記変異型核酸プローブが配列番号59の配列又はその相補配列から成るG590A用の変異型核酸プローブ、及び、配列番号67の配列又はその相補配列から成るG857A用の変異型核酸プローブである、請求項44に記載の検出方法。
【請求項46】
NAT2遺伝子の一塩基多型G590A、G857A及びT341Cにおける遺伝子型を同時に検出する方法であって、
表3に記載されたプライマーセット9を使用して標的核酸を増幅する工程と、
表4に記載されたプライマーセット5を使用して標的核酸を増幅する工程と、
表5に記載されたプライマーセット6又は10を使用して標的核酸を増幅する工程と、
得られた増幅産物を混合して混合液を調製する工程と、
配列番号54の配列又はその相補配列から成るG590A用野生型核酸プローブ、配列番号59の配列又はその相補配列から成るG590A用変異型核酸プローブ、配列番号62の配列又はその相補配列から成るG857A用野生型核酸プローブ、配列番号67の配列又はその相補配列から成るG857A用変異型核酸プローブ、配列番号72の配列又はその相補配列から成るT341C用野生型核酸プローブ、及び、配列番号76の配列又はその相補配列から成るT341C用変異型核酸プローブが固定された核酸プローブ固定化基体と前記混合液を接触させ、前記増幅産物と前記核酸プローブとをハイブリダイゼーションさせる工程と、
前記それぞれの核酸プローブに結合した増幅産物の量を測定する工程と
前記G590A用野生型核酸プローブ及びG590A用変異型核酸プローブに結合した増幅産物の量を測定して比較する工程と、
前記G857A用野生型核酸プローブ及びG857A用変異型核酸プローブに結合した増幅産物の量を測定して比較する工程と、
前記T341C用野生型核酸プローブ及びT341C用変異型核酸プローブに結合した増幅産物の量を測定して比較する工程と、
を具備する、NAT2遺伝子の一塩基多型G590A、G857A及びT341Cにおける遺伝子型の同時検出方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A】


【図9B】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15A】


【図15B】


【図15C】


【図16A】


【図16B】


【図17】


【図18A】


【図18B】


【図19】


【図20A】


【図20B】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A】


【図9B】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15A】


【図15B】


【図15C】


【図16A】


【図16B】


【図17】


【図18A】


【図18B】


【図19】


【図20A】


【図20B】


【公開番号】特開2008−237140(P2008−237140A)
【公開日】平成20年10月9日(2008.10.9)
【国際特許分類】
【出願番号】特願2007−84289(P2007−84289)
【出願日】平成19年3月28日(2007.3.28)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
【公開日】平成20年10月9日(2008.10.9)
【国際特許分類】
【出願日】平成19年3月28日(2007.3.28)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
[ Back to top ]

