N−メチルアミノ酸およびその他の特殊アミノ酸を含む特殊ペプチド化合物ライブラリーの翻訳構築と活性種探索法
【課題】無細胞(in vitro)翻訳系を利用して特殊ペプチドライブラリーを構築し、標的タンパク質に結合する特殊ペプチドをスクリーニングするための技術を確立すること。
【解決手段】(i)特殊アミノ酸でアシル化されたtRNAを含む無細胞翻訳系によって、特殊アミノ酸がペプチド配列にランダムに導入された特殊ペプチドライブラリーを調製し;(ii)得られた特殊ペプチドライブラリーを標的物質に接触させ;そして、(iii)標的物質に結合する特殊ペプチドを活性ペプチドとして選択することを特徴とする、ペプチドライブラリーから標的物質に結合する特殊ペプチド化合物をスクリーニングする方法。
【解決手段】(i)特殊アミノ酸でアシル化されたtRNAを含む無細胞翻訳系によって、特殊アミノ酸がペプチド配列にランダムに導入された特殊ペプチドライブラリーを調製し;(ii)得られた特殊ペプチドライブラリーを標的物質に接触させ;そして、(iii)標的物質に結合する特殊ペプチドを活性ペプチドとして選択することを特徴とする、ペプチドライブラリーから標的物質に結合する特殊ペプチド化合物をスクリーニングする方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、環状構造や特殊アミノ酸を有するペプチドである特殊ペプチド、特に環状N-メチルペプチドを用いた創薬に関する。より具体的には、N-メチルアミノ酸あるいはその他の特殊アミノ酸を含んだ特殊ペプチド化合物のライブラリーを構築する方法、化合物ライブラリー、該ライブラリーから薬剤候補を探索する手段、及び探索の結果見出された化合物に関する。
【背景技術】
【0002】
1.特殊ペプチドの位置づけ
現在市販されている医薬品の多くは、分子量がおおよそ500 Da以下の有機低分子化合物である。これは、低分子化合物であるため体内への吸収や拡散が早く、細胞膜透過性に優れ、免疫原性を示さないことに起因する。副作用としては、選択性の低さによる副作用が考えられる。これとは対照的に、近年注目されている抗体医薬は、高い選択性を持つが、免疫原性を生じる可能性があること、また標的が細胞外や細胞表面に制限されることが問題となり、薬剤としての応用が限られる。
【0003】
その一方で、特殊ペプチドは、低分子化合物と抗体の利点を併せ持つ分子群であると考えられている。一般的に、ペプチドは有機低分子化合物より分子量が大きい(1,000〜3,000 Da)ために膜透過性が悪く、かつプロテアーゼによって生体内で速やかに分解されることから、医薬品にならないと言われてきた。しかし、天然由来のペプチドであるサイクロスポリンは、細胞膜を透過し、標的に結合することで免疫抑制作用を発揮する。この生理活性や薬物動態は、ペプチド中の大環状構造及び特殊アミノ酸が、標的結合力や膜透過性、生体内安定性を向上させることに起因している。このことから、特殊ペプチドは、細胞膜外だけでなく細胞質内の標的にもアプローチできる可能性を秘めている。一方、疾患の多くは、タンパク質間相互作用の異常によって惹起されており、そのような相互作用を阻害する薬剤開発が盛んに行われている。通常、タンパク質間相互作用は、明確な疎水性ポケットが存在せず、互いに広い表面積(750〜1,500Å)を介して結合するため、低分子化合物ベースの阻害剤を創製することは困難である。しかしながら、特殊ペプチドは分子自身がある程度大きく、静電的及び疎水的相互作用、水素結合を形成する官能基が数多く存在する。そのため、タンパク質の浅くて広い結合部位に対して効果的に結合しうる可能性を有している。つまり、特殊ペプチドは、細胞内外そしてタンパク質間相互作用まで幅広く対応可能であり、新たな創薬シーズとして非常に魅力的な化合物群であるといえる。
【0004】
2.大環状構造とN-メチルアミノ酸がペプチドに与える影響
大環状構造は、ペプチドに対して薬剤としての利点を与える。1)大環状構造は、分子のconformational spaceを制限することで、標的との結合時におけるエントロピーロスが減少し、直鎖構造よりも強固な結合能力を示す。また、環状化することによって、標的に対する選択性が向上するとの報告もある。2)生体内のプロテアーゼは、天然のポリペプチドを切断するために、直鎖ペプチドに結合、切断する。そのため、環状ペプチドに対する結合及び切断能力が低いために、生体内での安定性が向上する。3)膜透過性が向上すると考えられている。これは、ペプチドが環状化することにより、分子内水素結合を形成するアミド結合の数が増加し、細胞膜中での疎水的環境下における、アミドN-Hの脱溶媒のエネルギー損失が減らすことができる。
【0005】
一方、特殊アミノ酸としてN-メチルアミノ酸を利用すると、ペプチド鎖のバックボーンにN-メチルペプチド結合を導入することができる。1)この構造は、環状化の時と同じようにプロテアーゼに認識されにくく、切断されにくい。2)N-メチルペプチド結合を導入することで、細胞膜透過性や腸管吸収を高め、bioavailabilityが改善された例がある。3)ペプチド結合は、二重結合性を持っているため、cis型及びtrans型の構造を与えるが、通常は、cis型の高いallylic strainを回避するために、trans型の構造をとる。しかしながら、N-メチルペプチド結合におけるcis型及びtrans型のallylic strainの差は、通常のペプチド結合のそれよりも低くなるために、cis型の構造をとる場合がある。それゆえ、ペプチド全体の構造は、1つまたはそれ以上のN-メチルペプチド結合によって構造変換を誘起し、通常のペプチドでは形成できない特殊な構造を形成する可能性が高い。そのため、通常のペプチドで十分な結合能力を得ることのできない標的タンパク質表面に対して、有効なライブラリーを提供できると考えられる。
【0006】
3.翻訳系を利用したN-メチルペプチドの合成およびそれを用いたライブラリーの構築と薬剤候補探索法
天然由来のN-メチルペプチドは、非リボソームペプチド合成酵素(NRPS, non-ribosomal peptide sythetases)と呼ばれる酵素群によって合成される。これらの酵素群は非常に複雑で、人工的に改変してペプチドライブラリーを作製できる技術は現在確立されていない。
【0007】
一方、N-メチルペプチドを自由に作製するため、これまでに翻訳系を利用したN-メチルペプチドの合成方法がいくつか報告されている。翻訳系はリボソーム型ペプチド合成酵素によりmRNAを鋳型としてペプチドを合成する系であるため、原理的には(決して容易ではないが)、鋳型となるmRNAの配列を変えることで様々な配列を持つペプチドを合成できる。既存の遺伝暗号を書き換え、N-メチルアミノ酸を人為的に割り当てた改変遺伝暗号を利用し、N-メチルペプチド翻訳合成を試みたこれまでの研究について概説する。
【0008】
UAG(終止)コドンを利用して、N-メチルフェニルアラニン(Bain et al., Tehtahedron, 1991, 47, 2389-2400. Rabbit reticulocyte lysate)、N-メチルアラニン(Ellman et al., Science, 1992, 255, 197-200. E.coli lysate)、N-メチルグリシン(Chaung et al., Science, 1993, 259, 806-809. E.coli lysate)、N-メチルアスパラギン酸(Karginov et al. JACS, 1997, 119, 8166-8176. Short et al., Biochemistry, 2000, 39, 8768-8781. Rabbit reticulocyte lysate)がタンパク質の1箇所に導入されている。
【0009】
また、センスコドンを利用した方法も報告されている。天然アミノ酸との競合を避けるため、ペプチド発現系として再構成型の無細胞翻訳系(reconstituted cell-free translation system;Y. Shimizu et al., Nature Biotechnology, 2001, vol. 19, p.751-755、その他)を用いた例が多い。
【0010】
Greenらは、20種類のN-メチルアミノ酸を用いた、ジペプチドの翻訳合成を行った(Merryman et al., Chem. Biol., 2004, 11, 575-582. Reconstituted cell-free translation system. E. coli)。N-メチルアミノアシルtRNAは、以下の3段階で調製した。1)アミノアシルtRNA合成酵素(ARS)によるアミノアシル-tRNAを基質とし、2-ニトロベンズアルデヒドでアミノ基を保護する。2)ホルムアルデヒドでアミノ基をメチル化する。3)UV照射によって2-ニトロベンジル基を脱保護する。4年後、この方法を利用して、Szostakらは、N-メチルバリン、N-メチルロイシン、N-メチルスレオニンの3種類が含まれたN-メチルペプチドの合成に成功している(Subtelny et al., JACS, 2008, 130, 6131-6136, Reconstituted cell-free translation system. E. coli)。
【0011】
Cornishらは、N-メチルアラニンまたはN-メチルフェニルアラニンをGUUコドン(バリン)に指定し、トリペプチドの翻訳合成に成功している(Tan et al., JACS, 2004, 126, 12752-12753, Reconstituted cell-free translation system. E. coli)。
【0012】
川上らは、アシルtRNA合成酵素様活性を持つRNA触媒(ARSリボザイム)であるフレキシザイムを利用して種々のN-メチルアミノ酸の導入に成功している(Kawakami et al., Chem. Biol., 2008, 15, 32-42. Reconstituted cell-free translation system. E. coli)。また3種類のN-メチルアミノ酸を10残基連続したN-メチルペプチドの合成に成功している。さらにN-メチルアミノ酸が4つ導入された環状ペプチドの合成も行っている。
【0013】
代表的なARSリボザイムについて、次の文献に記載されている(H. Murakami, H. Saito, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 655-662;H. Murakami, D. Kourouklis, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 1077-1084;H. Murakami, A. Ohta, H. Ashigai, H. Suga (2006) Nature Methods 3, 357-359 "A highly flexible tRNA acylation method for non-natural polypeptide synthesis"; N. Niwa, Y. Yamagishi, H. Murakami, H. Suga (2009) Bioorganic & Medicinal Chemistry Letters 19, 3892-3894 "A flexizyme that selectively charges amino acids activated by a water-friendly leaving group"; 及びWO2007/066627「多目的アシル化触媒とその用途」)。
【0014】
一方、翻訳系を用いたN-メチルアミノ酸をコードしたペプチドライブラリーの構築およびそれを応用した薬剤候補探索については、これまで1例しか知られていない。Robertsらは、N-メチルフェニルアラニンをGUAコドン(バリン)に指定し、2及び5、10残基のN-メチルペプチドを翻訳合成し、mRNAディスプレイ法と互換性があることを確かめている(Frankel et al., Chem. Biol., 2003, 10, 1043-1050. tRNA-depleted rabbit reticulocyte lysate)。また同グループは、架橋剤(disuccinimidyl glutarate, DSG)を利用したペプチド環状化方法と、N-メチルフェニルアラニンをランダムNNS(NはA、U、CまたはGのいずれかであり、SはCまたはG)領域のUAGコドンに指定したmRNAディスプレイ法を報告した(Millward et al., ACS Chem. Biol. 2007, 2, 625-634. Rabbit reticulocyte lysate)。その結果、標的タンパク質に結合する環状ペプチドが得られたものの、N-メチルフェニルアラニンはペプチド中に見いだされなかった。この結果は、Robertsらが構築したライブラリーそのもの品質(すなわち、N-メチルフェニルアラニンが導入されたペプチドがライブラリー化されているかの品質保証)が低いのか、活性ペプチドにN-メチルフェニルアラニンが含まれない結果なのかは明確でないが、本技術の成熟度では目的としたN-メチルアミノ酸含有特殊ペプチドの生理活性種を獲得するのが困難であることを示唆しているのは自明である。
【0015】
上記の例に代表されるように、N-メチルアミノ酸含有ペプチドのライブラリー化はこれまでの技術では達成されておらず、またそれを用いた薬剤候補探索の成功例は一例もない。
【0016】
4.In vitroディスプレイによるペプチドライブラリーの調製
In vitroディスプレイとは、表現型(phynotype)とその配列をコードした遺伝型(genotype)を非共有結合あるいは共有結合で連結することで表現型を遺伝型にディスプレイし、試験管に再構築された複製システムを用いて活性種を濃縮、増幅(セレクション)することを可能にするシステムを指す。本システムの最大の利点は、原核・真核生命体を媒体としないため、非常に大きな多様性をもったライブラリーを探索することができるため、高活性の生理物質(本特許に関してはペプチド)をセレクションすることができる。その典型的な比較例としては、大腸菌を複製媒体とするファージディスプレイでは10の7乗の多様性ライブラリーのセレクションが可能であるが、 In vitroディスプレイでは10の13乗に及ぶ多様性ライブラリーの探索が可能となる。In vitroディスプレイには、ribosomeディスプレイ、mRNAディスプレイ、RAPIDディスプレイ(未公開特許出願である特願2009-243240)等がある。その一例として、mRNAディスプレイを例に挙げ下記に説明するが、本明細書で開示される特殊ペプチド化合物のライブラリーは全てのIn vitroディスプレイに適応可能である。
【0017】
mRNAディスプレイは、ペプチドとその鋳型であるmRNAを結合させることにより、ペプチドのアミノ酸配列と核酸配列を対応付ける技術である。そのために、アシル化tRNAの末端アナログであるピューロマイシンを適当なリンカーを介してmRNAの3’末端に結合させ、これを翻訳反応に加えることで、ピューロマイシンがリボソームのA部位に入り込み、伸長中のペプチドと共有結合を形成し、結果として翻訳産物であるペプチド分子がピューロマイシンを介してmRNAと連結する(Roberts et al., Proc. Natl. Acd. Sci. USA, 1997, 94, 12297-12302、Nemoto et al., FEBS Lett., 1997, 414, 405-408、特許第3683282号広報(国際公開WO98/16636)、特許第3683902号広報、特許第3692542号広報(国際公開WO98/31700))。
【0018】
In vitroディスプレイでは、10の13乗の多様性を持つペプチドライブラリーの調製が可能であるが、これまで報告されたものではペプチドはタンパク質性アミノ酸のみから構成されている。複数種の特殊アミノ酸(N-メチルアミノ酸を含む)及び環状化構造を含むペプチドがその遺伝子型に提示されたライブラリーを作製し、セレクションに成功した実績は知られていない。
【0019】
5.HPVと子宮頸癌
子宮頸癌は、女性の癌では乳がんに次いで多く、世界では年間47万人の発症と23万人の死亡が、日本では年間1万人以上の発症と3千人以上の死亡が報告されている。子宮頸癌の発症には、ヒトパピローマウイルス(Human papillomavirus, HPV)感染、特に高リスク型(16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68, 73型)HPVの感染が必須である。その後、10〜30年の潜伏感染を経て、細胞が悪性形質を獲得することで子宮頸癌を発症する。一方、子宮頸癌は、HPV感染を予防することでほぼ100%予防可能な癌であり、実際にHPVワクチンであるCervarix(GlaxoSmithKline)とGardasil(Merck)が世界100カ国以上で使用され、2009年9月に日本でも承認された。しかし、これらのワクチンは感染者には無効であり、16型、18型HPVのキャプシドタンパク質を抗原としているため、それ以外の型のHPV感染には効果が無い。そのため、子宮頸癌治療薬の開発が望まれている。
【0020】
HPV感染細胞では、HPVゲノムが複製され、娘細胞に分配され、潜伏感染が拡大する。その過程の中で、HPVゲノムが宿主ゲノムに組み込まれることで、HPV初期遺伝子群がコードするタンパク質が高発現し、ウイルスゲノムの複製に有利な細胞内環境へと導く。特に、ウイルスタンパク質E6及びE7による細胞の不死化、増殖促進、がん抑制遺伝子の不活性化が重要であると考えられている。
【0021】
E7は、約100アミノ酸残基からなるタンパク質で、N末端にCR1(conserved region 1)、及びCR2、1つのジンクフィンガードメインから成る。CR2のLXCXEモチーフを介してRbファミリータンパク質(pRb, p107, p130)に結合する。Rbは、転写因子E2Fと複合体を形成して、E2F を不活性化し、細胞をG0期に停止させる。ところが、E7がRbと結合すると、E2Fは遊離し、活性化され、細胞周期が回転する。また、E7は、pRb及びμ-カルパインと相互に結合することで、pRbの分解も促進する。
【0022】
E6は、宿主細胞内のユビキチンリガーゼE6APとE6中のLXXLLモチーフを介して結合し、がん抑制因子p53のユビキチン化と分解を促進する。p53は、細胞周期をG1期に停止させ、また、DNA損傷時にはその修復を誘導し、損傷が高度な場合はアポトーシスを誘導する。そして、E7によるRbファミリータンパク質の不活性化を介した細胞周期の進行は、p53を介したアポトーシスを誘導する。E6は、これらのp53の役割を阻害することで、アポトーシスを回避し、ウイルスの増殖を促進していると考えられる。その他にも、E6-E6AP複合体は、細胞極性の維持や細胞増殖の制御を担っているPDZドメインを有するタンパク質群やテロメアーゼ抑制因子NFX1のユビキチン化と分解を促進し、多方面からガン化を誘導している。現在、入手可能な子宮頸癌細胞であるHeLa細胞、及び、SiHa細胞、Caski細胞の染色体には、それぞれHPV18、HPV16、HPV16のゲノムが組み込まれており、E6を高発現している。そして、siRNAによりE6またはE6APをノックダウンすることで、p53の蓄積及びアポトーシスの誘導が観測されており、E6の作用はE6APに依存していると考えられている。
【0023】
6.ユビキチンリガーゼE6AP
ユビキチンリガーゼE6AP(E6 Associated Protein、852アミノ酸残基)は、UBE3A遺伝子にコードされており、E6を介してがん抑制因子p53と結合し、そのユビキチン化と26Sプロテアソームによる分解を促進することで、1990年に発見された。E6APの約350アミノ酸残基からなるC末端ドメインはHECT(Homologous to E6AP Carboxyl-Terminus)ドメインと呼ばれ、ユビキチンリガーゼE3の大きなファミリーを形成している。ヒトにおいては約50種類、酵母においては5種類のHECTドメインを有するユビキチンリガーゼが確認されている。HECTドメインは、大きなN末端ローブ(約250アミノ酸残基)とC末端ローブ(約100アミノ酸残基)が短いヒンジ部分で連結されており、C末端ローブ中に活性化システインが存在する。ユビキチン化された活性化E2タンパク質は、HECTドメイン中のN末端ローブに結合し、ユビキチンをC末端ローブ中のシステインに転移し、ユビキチンチオエステル中間体を形成する。その後、HECTドメイン上流のドメインによってリクルートされた標的タンパク質のリシン側鎖のアミノ基とHECT上のユビキチンがイソペプチド結合することによって、標的のユビキチン化が起こる。これまでの研究において、E6は、E6AP中のHECTドメインより約120アミノ酸残基上流の18アミノ酸からなるα-ヘリックスに結合し、E6-E6AP複合体を形成する。この複合体は、p53と結合することで、p53のポリユビキチン化を行い、分解へと誘導する。
【0024】
これまでの研究において、子宮頸癌治療薬を目標にしたユビキチンライゲースE6APの阻害剤は存在しない。さらに、HECTドメインを有するユビキチンライゲースE3の阻害剤も存在しない。またヒト由来のE6APを標的にすることで、様々な高リスク型HPV由来の子宮頸癌に対して効用が見込める。
【先行技術文献】
【特許文献】
【0025】
【特許文献1】WO2007/066627
【特許文献2】特許第3683282号広報
【特許文献3】特許第3683902号広報
【特許文献4】特許第3692542号広報
【非特許文献】
【0026】
【非特許文献1】Bain et al., Tehtahedron, 1991, 47, 2389-2400.
【非特許文献2】Ellman et al., Science, 1992, 255, 197-200.
【非特許文献3】Chaung et al., Science, 1993, 259, 806-809.
【非特許文献4】Karginov et al. JACS, 1997, 119, 8166-8176.
【非特許文献5】Short et al., Biochemistry, 2000, 39, 8768-8781.
【非特許文献6】Merryman et al., Chem. Biol., 2004, 11, 575-582.
【非特許文献7】Subtelny et al., JACS, 2008, 130, 6131-6136.
【非特許文献8】Tan et al., JACS, 2004, 126, 12752-12753.
【非特許文献9】Frankel et al., Chem. Biol., 2003, 10, 1043-1050.
【非特許文献10】Millward et al., ACS Chem. Biol. 2007, 2, 625-634.
【非特許文献11】Kawakami et al., Chem. Biol., 2008, 15, 32-42.
【非特許文献12】Y. Shimizu et al., Nature Biotechnology, 2001, vol. 19, p.751-755
【非特許文献13】H. Murakami, H. Saito, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 655-662
【非特許文献14】H. Murakami, D. Kourouklis, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 1077-1084
【非特許文献15】H. Murakami, A. Ohta, H. Ashigai, H. Suga (2006) Nature Methods 3, 357-359
【非特許文献16】N. Niwa, Y. Yamagishi, H. Murakami, H. Suga (2009) Bioorganic & Medicinal Chemistry Letters 19, 3892-3894
【非特許文献17】Roberts et al., Proc. Natl. Acd. Sci. USA, 1997, 94, 12297-12302、
【非特許文献18】Nemoto et al., FEBS Lett., 1997, 414, 405-408
【発明の概要】
【発明が解決しようとする課題】
【0027】
大環状構造や特殊なアミノ酸を含む特殊ペプチドは、膜透過性や標的結合能力、生体内安定性に優れているため、新しい創薬シーズとして注目されている。現在、特殊ペプチドのライブラリーの供給は、天然物やペプチド固相合成に制限され、多様性や簡便性に乏しく、十分な薬剤探索が行われていない。
【0028】
本発明者らは、特殊ペプチドを翻訳合成により構築する技術を保有している。さらに、本発明者らは、翻訳合成された非環状の特殊ペプチドの分子内特異的反応を利用して、ペプチドを環状化する技術を保有している。
【0029】
本発明の課題は、上記の2つの技術をそれぞれ単独で、あるいは組み合わせて利用することにより、無細胞(in vitro)翻訳系を利用して特殊ペプチド化合物のペプチドライブラリーを構築すること、そしてin vitroディスプレイ法を利用して標的タンパク質に結合する特殊ペプチド化合物をスクリーニングするための技術を確立することである。
【課題を解決するための手段】
【0030】
本発明者らは、遺伝暗号リプログラミング技術を利用して、複数の特殊アミノ酸を含む特殊ペプチドのライブラリー(特殊ペプチドライブラリーと称する)を構築し、これをディスプレイ系と組み合わせることで、標的物質に高い結合能を有する特殊ペプチドアプタマーのスクリーニングを行う技術を確立した。
【0031】
具体的には、特殊ペプチドライブラリーのランダム配列に導入される特殊アミノ酸の例としてN-メチルアミノ酸を使用し、複数のN-メチルアミノ酸を含む環状特殊ペプチドライブラリーを構築した。標的の例としてユビキチンリガーゼE6APを使用し、標的に高い特異性を持つ環状N-メチルペプチドを獲得することに成功した。
【0032】
本発明の要旨は以下の通りである。
(1)次の工程を含む、ペプチドライブラリーから標的物質に結合する特殊ペプチドを選択する方法:
(i)特殊アミノ酸でアシル化されたtRNAを含む無細胞翻訳系によって、特殊アミノ酸がペプチド配列にランダムに導入された特殊ペプチドを含むライブラリーを調製する工程;
(ii)ペプチドライブラリーを標的物質に接触させる工程;及び
(iii)標的物質に結合する特殊ペプチドを選択する工程
であって、
前記(i)の工程において、ライブラリーを構成する各ペプチドが当該ペプチドをコードする核酸配列から翻訳され、核酸配列とその翻訳産物であるペプチドが連結され、
核酸配列において、ペプチドをコードする領域が、異なる複数のトリプレットの繰り返しからなるランダム配列を含み、ランダム配列中のトリプレットの少なくとも一部が特殊アミノ酸を指定する人為的なコドンに対応する配列である、前記方法。
【0033】
(2)前記(i)の工程が、アシルtRNA合成酵素様活性を持つRNA触媒を用いて特殊アミノ酸でtRNAをアシル化することを含む、(1)の方法。
(3)特殊アミノ酸でアシル化されるtRNAが、in vitro転写反応で調製されたtRNAである、前記方法。
【0034】
(4)前記(i)の工程が、ペプチドをコードする領域を含むmRNAのライブラリーを調製し、これを翻訳することを含む、(1)の方法。
(5)ペプチドをコードする領域が、さらに、
官能基1を持つアミノ酸を指定するコドン、及び
官能基2を持つアミノ酸を指定するコドン
に対応する配列を含み、
官能基1及び官能基2は結合形成反応が可能な一組の官能基であり、
前記(i)の工程において、特殊アミノ酸でアシル化されたtRNAのアンチコドンと特殊アミノ酸を指定する人為的なコドンの対合により特殊アミノ酸がペプチド配列に導入され、翻訳産物であるペプチドが官能基1と官能基2の間の結合形成反応によって環状化されることにより、ライブラリーが環状特殊ペプチドを含む、(1)の方法。
【0035】
(6)ランダム配列を構成するトリプレットが以下の配列からなるコドン:
N1N2Uコドン{N1及びN2はそれぞれ独立して、A、U、CまたはGのいずれかである}
N1N2Kコドン{N1及びN2はそれぞれ独立して、A、U、CまたはGのいずれかであり、Kは、CまたはGのいずれかである}、及び
N1N2N3コドン{N1、N2及びN3はそれぞれ独立して、A、U、CまたはGのいずれかである}、から選択される(1)の方法。
【0036】
(7)ランダム配列が、N1N2Uコドン、N1N2Kコドン、N1N2N3コドンのいずれかの2回以上の繰り返しからなる(6)の方法。
(8)官能基1及び官能基2が、以下の官能基の組(A)から(C):
【0037】
【化1】

(式中、X1はClまたはBrであり、そして、Arは置換基を有していてもよい芳香環である)のいずれか一組である、(5)の方法。
【0038】
(9)官能基1を持つアミノ酸がクロロアセチル基を持つアミノ酸であり、官能基2を持つアミノ酸がシステインである、(5)の方法。
(10)ペプチドをコードする領域が、以下の(a)〜(c):
(a)クロロアセチル基を持つアミノ酸を指定する開始コドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、NNU{Nは、A、U、CまたはGのいずれかのリボヌクレオチドである}コドンの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
を含み、開始コドンと、クロロアセチル基を持つアミノ酸でアシル化された開始tRNAのアンチコドンの対合により、クロロアセチル基を持つアミノ酸がペプチドN末端に導入され、ランダム配列中の特殊アミノ酸を指定する人為的なコドンと、特殊アミノ酸でアシル化された伸長用tRNAのアンチコドンとの対合により、特殊アミノ酸がペプチドに導入され、翻訳産物であるペプチドがクロロアセチル基とシステインのスルフィドリル基との間の結合形成反応によって環状化される、前記方法。
【0039】
(11)ライブラリーがリボソームディスプレイライブラリー、mRNAディスプレイライブラリー、及びRAPIDディスプレイライブラリーからなる群から選択されるいずれかである、前記方法。
【0040】
(12)前記(iii)の工程が、標的物質に結合した環状特殊ペプチドをコードする核酸配列を決定することを含む、(1)の方法。
(13)mRNAとその翻訳産物である環状特殊ペプチドの複合体からなるin vitroディスプレイライブラリーであって、ペプチドをコードする領域が、以下の(a)〜(c):
(a)クロロアセチル基を持つアミノ酸を指定する人為的なコドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、異なる複数のトリプレットの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
を含むmRNAライブラリーを、以下の(d)及び(e)のアミノアシルtRNA:
(d)前記(a)のコドンと相補的なアンチコドンを有する、クロロアセチル基を持つアミノ酸でアシル化された人工tRNA
(e)1種以上の特殊アミノ酸でアシル化された人工tRNA
並びに
(f)システイン、システインtRNA、及びシステイニルRS(CysRS)
を少なくとも含む再構成型の無細胞翻訳系で翻訳することにより得られる、前記in vitroディスプレイライブラリー。
【0041】
(14)環状特殊ペプチドと当該ペプチドをコードする核酸配列の複合体からなるin vitroディスプレイライブラリーを調製するためのキットであって、
(i)ペプチドをコードする領域が、以下の(a)〜(c)を含むmRNA:
(a)クロロアセチル基を持つアミノ酸を指定する人為的なコドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、異なる複数のトリプレットの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
及び
(ii)以下の(d)及び(e)のアミノアシルtRNA:
(d)前記(a)のコドンと相補的なアンチコドンを有する、クロロアセチル基を持つアミノ酸を持つアミノ酸でアシル化された人工開始tRNA、
(e)前記(b)の人為的なコドンと相補的なアンチコドンをそれぞれ有する、異なる特殊アミノ酸でそれぞれアシル化された人工伸長tRNA、
及び
(iii)システイン及びシステインでアシル化され得るtRNA、及び
(iv)単離されたリボソーム
を少なくとも含む、前記キット。
【0042】
(15)特殊アミノ酸が、N-メチルアミノ酸である、前記方法。
(16)標的物質が、ユビキチンリガーゼE6APである、(1)の方法。
(17)前記(16)の方法により得られた、Cyclo(-Ac-DWCDVMeSGRMeFMeGYMeFPC)G-OHである化合物MCP11。
【発明の効果】
【0043】
特殊ペプチドを翻訳合成により構築する技術及び/又はペプチドの環状化技術を利用して、特殊ペプチドライブラリーを構築することができる。さらに、これら2つの技術の特性を組み合わせる事で、Nメチルアミノ酸のような特殊アミノ酸を含んだ環状特殊ペプチドライブラリーを構築できる。
【0044】
特殊アミノ酸を含んだ環状特殊ペプチドライブラリーの翻訳合成技術及び当該技術をディスプレイ系と組み合わせる技術の確立により、プロテアーゼ耐性をもった高活性環状特殊ペプチドを短時間で且つ安価に探索・発見することが可能となった。
【図面の簡単な説明】
【0045】
【図1】(NNU)n(nは2以上の数)の長さを持つランダムmRNAの調製を示す。(実施例1)
【図2−1】N-メチルアミノ酸-tRNAの調製を示す。(実施例2)
【図2−2】D-ClAcW-tRNAの調製を示す。(実施例2)
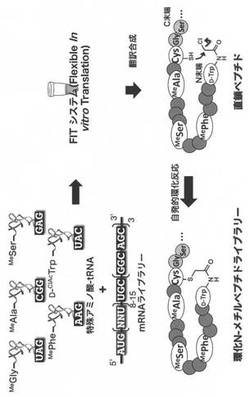
【図3】環状N-メチルペプチドの翻訳合成を示す。(実施例3)
【図4】環状N-メチルペプチドライブラリーとmRNAディスプレイを組み合わせたセレクションを説明する図である。(実施例4)
【図5−1】セレクションの進行度(実施例4)を示す。
【図5−2】:DNA配列からのペプチド配列の解析を示す。(実施例5)
【図5−3】MCP11の翻訳合成及び結合確認を示す。(実施例5)
【図5−4】表面プラズモン共鳴法によるMCP11及び誘導体の親和性解析結果を示す。ビオチン化E6AP-HECTをストレプトアビジンチップに固定化し、各ペプチドを用いて親和性解析を行った。(実施例7)
【発明を実施するための形態】
【0046】
本発明は、次の工程を含む、ペプチドライブラリーから標的物質に結合する特殊ペプチド化合物をスクリーニングする方法に関する。
(i)特殊アミノ酸でアシル化されたtRNAを含む無細胞翻訳系によって、特殊アミノ酸がペプチド配列にランダムに導入された特殊ペプチドを含むライブラリーを調製し;(ii)得られたペプチドライブラリーを標的物質に接触させ;そして、(iii)標的物質に結合する特殊ペプチドを選択する。
【0047】
ペプチドライブラリーとは、多種類のペプチドで構成された集合体であり、スクリーニングとは、集合体から目的とする機能を備えたペプチドを選択する行為である。本発明においては、遺伝暗号リプログラミング技術を利用して、複数の特殊アミノ酸を含む特殊ペプチドの集合体からなるライブラリーを構築し、これをin vitroディスプレイ系と組み合わせることで、標的タンパク質に高い結合能を有するペプチドアプタマーのスクリーニングを行う。したがって、前記(i)の工程は、各ペプチドをコードする核酸からなるライブラリーを調製して、これを翻訳すること、及び核酸とその翻訳産物であるペプチドを連結し、これにより表現型(ペプチドのアミノ酸配列)が遺伝型(核酸配列)にディスプレイされたライブラリーを構築することを含む。
【0048】
遺伝暗号のリプログラミング
遺伝暗号のリプログラミングとは、既存コドンに特殊アミノ酸を人為的に割り当てることである。特殊アミノ酸とは、天然の翻訳で使用される20種類のタンパク質性アミノ酸とは構造の異なるアミノ酸全般を指し、人工的に合成したものであっても、自然界に存在するものであってもよい。つまり、タンパク質性アミノ酸の側鎖構造の一部が化学的に変更・修飾された非タンパク質性アミノ酸や人工アミノ酸、D体アミノ酸、N-メチルアミノ酸、N-アシルアミノ酸、β-アミノ酸、アミノ酸骨格上のアミノ基やカルボキシル基が置換された構造を有する誘導体等が全て含まれる。N-メチルアミノ酸は、アミノ酸のα位アミノ基にメチル基が一つ導入された特殊アミノ酸である。
【0049】
天然の翻訳では、mRNAの3つの塩基の並び(トリプレット)が一つのコドンとして一つのタンパク質性アミノ酸を指定しており、その並びに対応するペプチドが合成される。このとき、コドンとアミノ酸との対応付けは、以下の2段階で行われる。(i)tRNAの末端にアミノアシルtRNA合成酵素(ARS)が対応するアミノ酸を連結する。(ii)tRNAのアンチコドンが対応するmRNAのコドンと対合することにより、mRNAの情報に沿ってtRNA上のアミノ酸が重合されペプチドが合成される。
【0050】
こうしたコドンとアンチコドンとの対応関係は、ほとんど普遍的に決定されており、64種類のコドンそれぞれに、20種類のタンパク質性アミノ酸のいずれか一つが割り当てられている。しかしながら、再構成型の翻訳系と人工アミノアシル化RNA触媒フレキシザイムを利用することで、この遺伝暗号をリプログラミングすることができる。
【0051】
再構成型の翻訳系とは、リボソーム、翻訳因子、tRNA、アミノ酸、及びATPやGTP等のエネルギーソースなど、タンパク質やペプチドの翻訳合成に関わる因子をそれぞれ単離・精製し、混ぜ合わせた翻訳系である。例えば、大腸菌のリボソームを用いる系として次の文献に記載された技術が公知である:H. F. Kung, B. Redfield, B. V. Treadwell, B. Eskin, C. Spears and H. Weissbach (1977) “DNA-directed in vitrosynthesis of beta-galactosidase. Studies with purified factors” The Journal of Biological Chemistry Vol. 252, No. 19, 6889-6894 ; M. C. Gonza, C. Cunningham and R. M. Green (1985) “Isolation and point of action of a factor from Escherichia coli required to reconstruct translation” Proceeding of National Academy of Sciences of the United States of America Vol. 82, 1648-1652 ; M. Y. Pavlov and M. Ehrenberg (1996) “Rate of translation of natural mRNAs in an optimized in Vitro system” Archives of Biochemistry and Biophysics Vol. 328, No. 1, 9-16 ; Y. Shimizu, A. Inoue, Y. Tomari, T. Suzuki, T. Yokogawa, K. Nishikawa and T. Ueda (2001) “Cell-free translation reconstituted with purified components” Nature Biotechnology Vol. 19, No. 8, 751-755;H. Ohashi, Y. Shimizu, B. W. Ying, and T. Ueda (2007) “Efficient protein selection based on ribosome display system with purified components”Biochemical and Biophysical Research Communications Vol. 352, No. 1, 270-276。
【0052】
一方、フレキシザイム(flexizyme)は、任意のtRNAに任意のアミノ酸またはヒドロキシ酸を連結することのできる人工RNA触媒である。例えば、以下の文献に記載されたものが公知である:H. Murakami, H. Saito, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 655-662; H. Murakami, D. Kourouklis, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 1077-1084; H. Murakami, A. Ohta, H. Ashigai, H. Suga (2006) Nature Methods 3, 357-359 "The flexizyme system: a highly flexible tRNA aminoacylation tool for the synthesis of nonnatural peptides"; N. Niwa, Y. Yamagishi, H. Murakami, H. Suga (2009) Bioorganic & Medicinal Chemistry Letters 19, 3892-3894 "A flexizyme that selectively charges amino acids activated by a water-friendly leaving group";及びWO2007/066627「多目的化アシル化触媒とその用途」。フレキシザイムは、原型のフレキシザイム(Fx)、及び、これから改変されたジニトロベンジルフレキシザイム(dFx)、エンハンスドフレキシザイム(eFx)、アミノフレキシザイム(aFx)等の呼称でも知られる。
【0053】
遺伝暗号のリプログラミングには、翻訳系の構成因子を目的に合わせて自由に取り除き、必要な成分だけを再構成してできる翻訳系を利用する。例えば、特定のアミノ酸を除去した翻訳系を再構成すると、当該アミノ酸に対応するコドンが空きコドンになる。続いて、フレキシザイムを利用して、その空きコドンに相補的なアンチコドンを有するtRNAに特殊アミノ酸を連結し、これを加えて翻訳を行う。これによって、特殊アミノ酸がそのコドンでコードされることになり、除去したアミノ酸の代わりに特殊アミノ酸が導入されたペプチドが翻訳される。
【0054】
あるいは、特定のアミノ酸に対応する天然由来のtRNAを使用しないことによっても、その特定のアミノ酸に対応するコドンを空きコドンにできる場合がある。例えば、複数個のコドンに対応する天然由来のtRNAの代わりに、修飾塩基を含まない、in vitro合成されたサプレッサーtRNAに特殊なアミノ酸を連結したものを用いることで、そのサプレッサーtRNAに対応するコドンが特殊アミノ酸のための人為的なコドンとしてリプログラミングされる。本明細書において、tRNAは天然のtRNAと人工的に構築したtRNA(人工tRNA)の両方を指す。人工tRNAの典型的な例は、T7ポリメラーゼのような適当なRNAポリメラーゼを用いてin vitro転写により調製されたtRNAである。
【0055】
遺伝暗号のリプログラミングにより、適当な配列の鋳型mRNAに基づくin vitro翻訳産物として、様々な特殊ペプチドを翻訳合成することができる。特殊ペプチドは、フレキシザイムと再構成型翻訳系を組み合わせた系で合成可能なあらゆる翻訳産物を含む。フレキシザイムを利用して、天然の20種類のタンパク質性アミノ酸以外に、様々な側鎖を有するアミノ酸、β-アミノ酸、γ-アミノ酸及びδ-アミノ酸、D-アミノ酸、アミノ酸骨格上のアミノ基やカルボキシル基が置換された構造を有する誘導体でtRNAをアシル化することができる。したがって、特殊ペプチドの意味には、これらの様々な基質を構成要素とする重合体が含まれる。さらに、特殊ペプチドは、主鎖骨格として通常のアミド結合とは異なる構造も有し得るものである。例えば、アミノ酸とヒドロキシ酸から構成されるデプシペプチド、ヒドロキシ酸が連続して縮合したポリエステル、N-メチルペプチド、N-末端に様々なアシル基(アセチル基、ピログルタミン酸、脂肪酸など)を有するペプチドも、特殊ペプチドに含まれる。
【0056】
本願の実施例では、特殊ペプチドの例として、遺伝暗号リプログラミング技術を利用して、人為的なコドンでN-メチルアミノ酸を指定することにより得られるN-メチルペプチドを具体的に示している。N-メチルペプチドとは、N-メチルアミノ酸を一つ以上含むペプチドの総称である。N-メチルペプチドには、α-アミノ基がメチル化されたアミノ酸(N-メチルアミノ酸)を含むことにより、ペプチド主鎖のペプチド結合(-NHCO-)の窒素部分がメチル化されたN-メチルペプチド結合が導入されている。
【0057】
従来技術の項で述べた川上らの論文では、遺伝暗号のリプログラミングにより、既存コドンにN−メチルアミノ酸を割り当てることで、N-メチルアミノ酸として、N-メチルグリシン、N-メチルアラニン、N-メチルセリン、N-メチルスレオニン、N-メチルシステイン、N-メチルメチオニン、N-メチルグルタミン、N-メチルヒスチジン、N-メチルフェニルアラニン、N-メチルチロシン、N-メチルトリプトファン、N-メチルノルバリン、N-メチルノルロイシン、N-メチル-p-ニトロフェニルアラニン、N-メチル-p-メトキシフェニルアラニンをペプチドに導入できることが示された。同様のN-メチルアミノ酸を、本発明においても使用可能である。
【0058】
人為的なコドン
天然の翻訳では、以下に示す普遍暗号表に従って、64種類のコドンそれぞれに、20種類のタンパク質性アミノ酸及び翻訳の終止が割り当てられている。
【0059】
【表1】

これに対し、本発明においては、遺伝暗号のリプログラミングにより書き換えられ、普遍暗号表の既存の遺伝暗号とは異なる特殊アミノ酸をコードするコドンを人為的なコドンと称する。
【0060】
コドンとアンチコドンの対応は、相補的な塩基の対合に依存する。リボソーム上の翻訳反応において、特殊アミノ酸を連結したtRNAのアンチコドンと、特殊アミノ酸を指定するmRNA上の人為的なコドンが対合することにより、特殊アミノ酸がペプチド鎖に導入される。
【0061】
塩基の対合とは核酸の塩基のうち定まった組み合わせの2個が互いに水素結合により塩基対形成することをいう。塩基対を形成し得る塩基の組み合わせは互いに「相補的」であるという。DNAではアデニン(A)とチミン(T)、及び、グアニン(G)とシトシン(C)、RNAではAとウラシル(U)、及び、GとCが対合する。さらに、RNAではG−A、G−Uのようないわゆる非ワトソン−クリック塩基対も熱力学的に安定な塩基対として存在するので、本明細書においてはこれらの組み合わせも相補的であるという。
【0062】
本願実施例で用いた人為的なコドンとアンチコドンの対応の例で説明する。例えば、MeAlaのコドンは5’-GCU-3’であり、完全に相補鎖を組むtRNAのアンチコドンは、3’-CGA-5’である。一般的には5’側の塩基から記述するので、これを5’-AGC-3’と書く。さらに、コドンの3’側第三塩基とアンチコドンの5’側第一塩基の相補鎖形成は、Wobble則により、ワトソン−クリック型の塩基対合以外にUとGのペアなどが許容される場合がある。したがって、MeAlaのコドン5’-GCU-3’は、tRNAのアンチコドン5’-GGC-3’で正しく読み取ることができる。
【0063】
本発明では、ペプチド鎖伸長反応で使用されるコドンに加えて、開始コドンも書き換えることができる。開始コドンは、翻訳の開始を指定するコドンであり、mRNA上でペプチドのN末端となる開始アミノ酸をコードする。mRNAの翻訳の開始には、開始tRNAと呼ばれる特定のtRNAが必要である。翻訳が始まるには、アミノアシル化された開始tRNAが、開始因子(IF)とともにリボソームの小サブユニットに結合し、リボソームの小サブユニットがmRNA上の開始コドンに結合する。開始tRNAは開始コドンに対応するアンチコドンを有し、開始コドンを認識する。普遍暗号表においては、開始コドンとしては一般的にはメチオニンのコドンであるAUGが用いられるため、開始tRNAはメチオニンに対応するアンチコドンを有し、開始tRNAは必ずメチオニン(原核細胞ではホルミルメチオニン)を運ぶ。しかしながら、遺伝暗号のリプログラミングを利用すると、開始アミノ酸がメチオニンに限定されない。つまり、開始tRNAにメチオニン以外の任意のアミノ酸を結合して翻訳を開始させることができる。また、フレキシザイムを用いることにより、任意のアンチコドンで置換された開始tRNAに任意の開始アミノ酸を結合することにより、開始コドンもAUGに限定されない。つまり、開始コドンとして他の人為的なコドンを割り当てることも可能である。
【0064】
ペプチドの環状化
本発明においては、翻訳合成された非環状の特殊ペプチドの分子内特異的反応を利用して、ペプチドが環状化される。ペプチドの環状化は、以下の工程(i)及び(ii)により実施される。
(i)結合形成反応が可能な一組の官能基である官能基1及び官能基2を分子内に有する非環状ペプチド化合物を翻訳合成によって合成する工程;及び
(ii)前記官能基1及び官能基2の結合形成反応によって前記非環状ペプチド化合物を環状化する工程。
【0065】
結合形成反応が可能な一組の官能基とは、当該一組の官能基間、すなわち官能基1と官能基2との間で結合形成反応が可能であり、そして、その反応の結果として、非環状ペプチド化合物を環状ペプチド化合物とする官能基の組のことである。そのような一組の官能基としては、結合形成反応が可能な官能基の組み合わせであれば、特に制限はない。また、官能基間の反応の形式についても特に制限はなく、置換反応、付加反応、縮合反応及び環状化付加反応等、様々な反応形式であることができ、また、反応によって形成される結合の形式(単結合、二重結合及び三重結合等)及びその数についても特に制限はない。
【0066】
一組の官能基としては、例えば、−CH2−L(Lは−Cl、−Br及び−OSO2CH3等の脱離基を表す)と求核性官能基(−OH、−NH2及び−SH等)の組が挙げられる。官能基1及び官能基2の結合形成反応の一例は二つのシステイン残基によるジスルフィド結合により環状構造の形成である。しかしながらジスルフィド結合は生体中で容易に還元されてしまう。したがって、安定な環状構造を形成するためには、官能基1及び官能基2の結合は、非還元性の結合であることが好ましい。本発明者らは以前に、翻訳された直鎖状のペプチドを非還元性の結合形成によって環状化させる手法を開発し、報告した(Goto et al., ACS Chem. Biol., 2008, 3, 120-129、WO2008/117833「環状ペプチド化合物の合成方法」)。同様の方法を本願でも利用可能である。非環状ペプチド化合物とは、上述の特殊ペプチドに包含される非環状の化合物であり、直鎖状のペプチドと同義である。
【0067】
本発明で利用可能な、好ましい一組の官能基1及び官能基2の例を以下に示す。
【0068】
【化2】

(式中、X1はClまたはBrであり、そして、Arは置換基を有していてもよい芳香環である)
Arの置換基は特に制限はないが、例えば、水酸基、ハロゲン原子、炭素原子数1から6のアルキル基、炭素原子数1から6のアルコキシ基、フェニル基、フェノキシ基、シアノ基及びニトロ基等が挙げられる。
【0069】
(A)の組の場合、官能基間での置換反応により式(A−3)の構造を与えることができる。また(B)及び(C)の場合は、官能基間での環状化反応により、それぞれ(B−3)及び(C−3)の構造を与えることができる。
【0070】
【化3】

非環状ペプチド化合物に存在する一組の官能基間での結合形成によって環が形成されるため、非環状ペプチド化合物を構成する要素(典型的には、アミノ酸)を一つの単位として、そのような一組の官能基は、異なった構成要素の単位上に存在することが必要である。説明の便宜のため、そのような構成要素をアミノ酸化合物、構成要素の単位をアミノ酸化合物単位と称する。すなわち、非環状ペプチド化合物は、一組の官能基を異なったアミノ酸単位上に有する化合物である。非環状ペプチド化合物において、一方の官能基を有するアミノ酸化合物単位と他方の官能基を有するアミノ酸化合物単位との間に少なくとも一つのアミノ酸化合物単位が存在することが好ましく、例えば、一乃至二十、または二乃至十、または三乃至五のアミノ酸化合物の単位が存在することが好ましい。
【0071】
本発明では、このような一組の官能基を有する非環状ペプチド化合物が無細胞翻訳系での翻訳合成によって合成される。環状化のためのこれらの官能基を有するアミノ酸がタンパク質性アミノ酸ではなく、特殊アミノ酸である場合は、遺伝暗号リプログラミング技術を利用してペプチド鎖に導入する。
【0072】
第一の態様において、非環状ペプチド化合物の翻訳合成は、(a)官能基1を有するアミノ酸でアミノアシル化された開始tRNA、(b)官能基2を有するアミノ酸及び該アミノ酸でアミノアシル化されるtRNAとを少なくとも含む無細胞翻訳系、(c)前記開始tRNAのアンチコドンに対応するコドン、及び前記官能基2を有するアミノ酸でアミノアシル化されるtRNAのアンチコドンに対応するコドン、とを所望の位置に有するmRNAを提供し、前記(a)のアミノアシル化された開始tRNA、及び前記(c)のmRNAを前記(b)の無細胞翻訳系に加えて非環状ペプチド化合物を合成する工程、を含む方法によって行われる。
【0073】
第一の態様の方法によって得られる非環状ペプチド化合物では、官能基1を有する特殊アミノ酸で翻訳が開始し、官能基2は、ペプチド鎖伸長反応において導入されるタンパク質性アミノ酸残基上に存在することになる。
【0074】
官能基1はアミノ酸のα−炭素及びβ−炭素等の炭素原子上の置換基として存在することができ、またはそのような炭素原子上の置換基上に存在することができる。また、官能基1は、アミノ基窒素原子上の置換基として存在することができ、またはそのようなアミノ基窒素原子上の置換基上に存在することができる。官能基1は官能基2と結合形成反応できることが必要である。後述するように、官能基2は、基本的に、システイン及びチロシン等に含まれる求核性官能基(−SH、−COOH及び−OH等)であるため、官能基1としては適切な脱離基を有する官能基、例えば−CH2−L(Lは−Cl、−Br及び−OSO2CH3等の脱離基を表す)の基を有する官能基であることが好ましい。
【0075】
官能基1を有する特殊アミノ酸は、具体的には、例えば、アミノ基窒素原子上に前記(A−1)の基を有するアミノ酸化合物であることが好ましい。アミノ酸化合物の具体例としては、例えば、式(1)の化合物
【0076】
【化4】

が挙げられる。式(1)中、R1及びR2は水素原子またはα位の炭素原子に炭素で連結した任意の置換基を表す。R1及びR2は、具体的には、例えば、20種類のタンパク質性アミノ酸のα−炭素上の置換基のいずれかであることが好ましい。そして、R1及びR2は、タンパク質性アミノ酸のα−炭素上の置換基の組み合わせのいずれかであることが好ましい。式(1)の化合物の具体例としては、例えば、式(1−1):
【0077】
【化5】

が挙げられる。
【0078】
官能基2を有するアミノ酸は、例えば、システイン、アスパラギン酸、グルタミン及びチロシン等である。すなわち、官能基2としては−OH、−SH、−C(=O)NH2及び−COOH等である。官能基2を有するアミノ酸としては、システインが好ましい。官能基2を有するアミノ酸は、該アミノ酸及び対応するtRNAを少なくとも含む再構成型の翻訳系でぺプチド鎖伸長反応において導入される。
【0079】
別の方法として、環状ペプチド化合物合成のための第2の態様においては、官能基1を有するアミノ酸及び官能基2を有するアミノ酸の両方が特殊アミノ酸である。官能基1及び官能基2は、アミノ基窒素原子上の置換基に、または、α−炭素及びβ−炭素等の炭素原子上の置換基に存在することができる。
【0080】
窒素原子上に存在する場合、例えば、式(20)乃至式(24):
【0081】
【化6】

(式中、nは、1以上の整数、例えば1乃至10の数を表し、X1は前記と同義である)のようなアシル置換基、またはアシル置換基の一部として、アミノ酸アミノ基の窒素原子上に導入することができる。
【0082】
α−炭素及びβ−炭素等の炭素原子上に存在する場合、例えば、式(25)乃至式(30):
【0083】
【化7】

(式中、nは、1以上の整数、例えば1乃至10の数を表し、X1は前記と同義である)のような基として導入することができる。
【0084】
官能基1を有するアミノ酸化合物の具体例としては、例えば、式(2)の化合物が挙げられ、官能基2を有するアミノ酸化合物の具体例としては、例えば、式(3)の化合物を挙げることができる。
【0085】
【化8】

式(2)中、R1及びR2は前記と同様であり、Z1は任意の置換基を表す。Z1としては、例えば、水酸基、ハロゲン原子、炭素原子数1乃至6のアルキル基、炭素原子数1乃至6のアルコキシ基、フェニル基、フェノキシ基、シアノ基及びニトロ基等が挙げられる。式(2)の化合物の具体例としては、例えば、式(31):
【0086】
【化9】

が挙げられる。
【0087】
さらに別の方法として、環状ペプチド化合物合成のための第3の態様においては、官能基1及び官能基2の両方が、ペプチド鎖伸長反応において導入されるアミノ酸残基上に存在する。官能基1を有するアミノ酸は特殊アミノ酸であり、遺伝子リプログラミング技術を用いて、ペプチド鎖伸長反応において導入される。第一の態様と同様に、官能基2を有するアミノ酸はタンパク質性アミノ酸であり、官能基2は、基本的に、システイン及びチロシン等に含まれる求核性官能基(−SH、−COOH及び−OH等)であるため、官能基1としては適切な脱離基を有する官能基、例えば−CH2−L(Lは−Cl、−Br及び−OSO2CH3等の脱離基を表す)の基を有する官能基であることが好ましい。
【0088】
官能基1を有するアミノ酸化合物の具体例としては、例えば、式(4)の化合物が挙げられる。
【0089】
【化10】

式(4)中、mは1乃至10の整数を表す。式(4)の化合物の具体例としては、mが2の化合物を挙げることができ、この化合物は、例えば、2,4−ジアミノ酪酸から製造することができる。官能基2を有するアミノ酸化合物としては、システインが好ましい。
【0090】
さらに別の方法として、環状ペプチド化合物合成のための第4の態様においては、官能基1及び官能基2の両方が、ペプチド鎖伸長反応において導入されるアミノ酸残基上に存在する。官能基1を有するアミノ酸と官能基2を有するアミノ酸の両方が特殊アミノ酸であり、遺伝子リプログラミング技術を用いて、ペプチド鎖に導入される。
【0091】
官能基1及び官能基2は、アミノ基窒素原子上の置換基に、または、α−炭素及びβ−炭素等の炭素原子上の置換基に存在することができる。官能基1及び官能基2は、α−炭素及びβ−炭素等の炭素原子上の置換基に存在することが好ましい。官能基1及び官能基2としては、例えば、第2の態様において例示した基を挙げることができる。
【0092】
官能基1を有するアミノ酸の具体例としては、例えば、式(5)または式(7)の化合物が挙げられる。
【0093】
【化11】

これらの式中、Z1及びmは前記と同義である。式(7)の化合物の具体例としては、例えば、式(32):
【0094】
【化12】

が挙げられる。
【0095】
官能基2を有するアミノ酸の具体例としては、例えば、式(6)または式(8)の化合物を挙げることができる。
【0096】
【化13】

式(6)中、mは前記と同義である。
【0097】
また、官能基1を有するアミノ酸化合物としては(A−1)の官能基を有する化合物(例えば、前記式(4)の化合物)、官能基2を有するアミノ酸化合物としてはホモシステインやメルカプトノルバリン等の−SH基を有する特殊アミノ酸、という組み合わせを挙げることもできる。
【0098】
上述のようにして合成された非環状ペプチド化合物を環状化することによって環状ペプチド化合物が合成される。官能基1及び官能基2の結合形成反応の条件は官能基の組の種類に応じて、設定される。
【0099】
非環状ペプチド化合物の環状化は、非環状ペプチド化合物を単離した後、適切な反応条件にさらすことによって行うことができる。または、非環状ペプチド化合物を単離することなく、無細胞翻訳系を適切な反応条件に調整することによって環状化を行うことができる。また、一組の官能基の種類によっては、非環状ペプチド化合物を合成するための無細胞翻訳系の条件下において環状化することがあり、この場合は、特段の反応条件の調整を行うことなく、環状ペプチド化合物を得ることができる。
【0100】
非環状ペプチド化合物の環状化のための反応条件は、例えば、一組の官能基が、−CH2−L(Lは−Cl及び−Br等の脱離基を表す)と求核性官能基−SH、の組である場合、例えば、非環状ペプチド化合物を単離した後、適当な溶媒中で加熱する(例えば40から100℃)ことによって、または、単離することなく無細胞翻訳系を例えば35から40℃で数時間(例えば、37℃で3時間)保つことによって、行うことができる。
【0101】
一組の官能基が前記組(A)の場合、例えば、非環状ペプチド化合物を単離した後、適当な溶媒中で加熱する(例えば40から100℃)ことによって、または、単離することなく無細胞翻訳系を例えば35から40℃で数時間(例えば、37℃で3時間)保つことによって、環状化することができる。また、官能基(A−1)と(A−2)との反応性は比較的高いため、一組の官能基が前記組(A)の場合、非環状ペプチド化合物合成のための無細胞翻訳系内において当該官能基の反応が進行し、無細胞翻訳系より環状ペプチド化合物として単離されることがある。
【0102】
一組の官能基が前記組(B)の場合、無細胞翻訳系より単離した非環状ペプチド化合物を、適当な溶媒中、一価の銅塩(硫酸銅(II)をアスコルベイトで系内で還元しながら生産する)で処理することによって環状化(ヒュースゲン(Huisgen)環化)して(B−3)とすることができる。
【0103】
一組の官能基が前記組(C)の場合、非環状ペプチド化合物を単離した後、適当な溶媒中、フェリシアン化カリウム(K3[Fe(CN)6])で処理することによって反応させ(C−3)とすることができる。
【0104】
後述の実施例においては、無細胞翻訳系の条件下において環状化することが可能な例として、両端にそれぞれクロロアセチル基とシステインを配置したペプチド配列を翻訳合成して得られる環状ペプチドが記載されている。この場合、遺伝暗号リプログラミング技術を利用して官能基1としてクロロアセチル基を有するペプチドを合成する。このとき、ペプチド中にシステイン残基を配置しておくと、翻訳後に自発的にチオール基がクロロアセチル基に求核攻撃し、ペプチドがチオエーテル結合により環状化する。ペプチドのN末端にクロロアセチル基を導入する場合は、クロロアセチル基を持つアミノ酸でアシル化された開始tRNAを翻訳系に加えてペプチドを合成する。あるいは、クロロアセチル基をN末端以外の場所に配置することもでき、その場合は、クロロアセチル基を持つアミノ酸で伸長tRNAをアシル化したものを使用する。
【0105】
無細胞翻訳系
翻訳系とは、ペプチド翻訳合成のための方法及びキット(物)の両方を含む概念である。本発明において、特殊ペプチドライブラリーの調製に使用される無細胞翻訳系は、公知の再構成型の翻訳系をさらに細分化し、より不純物の少ない系を構築して利用することが好ましい。従来の系と対比させながら、本発明で利用可能なキット(物)としての翻訳系の具体的な構成成分について説明する。
【0106】
翻訳系の構成成分の具体例としては、リボソーム、IF群、EF群、RF群、RRF、目的のペプチド合成に最低限必要となる天然アミノ酸・tRNA・特異的なARSタンパク質質酵素のセット、翻訳反応のためのエネルギーソース、などがある。
【0107】
リボソームとしては、大腸菌から単離され、精製されたリボソームが好適に利用される。
蛋白質類では、翻訳開始因子(例えば、IF1、IF2、IF3)、翻訳伸長因子(例えばEF-Tu、EF-Ts、EF-G)、翻訳終結因子(例えば、RF1、RF2、RF3、RRF)、エネルギーソース再生のための酵素(例えばcreatine kinase, myokinase, pyrophosphatase, nucleotide-diphosphatase kinase)を使用する。この中で、翻訳終結因子・エネルギーソース再生のための酵素の添加は任意である。鋳型DNAからの転写を行うためにT7 RNA polymeraseを加えることもあるが、あらかじめ転写したmRNAを翻訳系に加える場合、RNA polymeraseの添加は不要である。
【0108】
その他、従来の系と同様、適当な緩衝溶液、翻訳反応のエネルギーソースとしてのNTP類、Creatine phosphate、リボソーム活性化、RNA安定化、タンパク質安定化のために必要な因子等を適宜使用することができる。また、通常の翻訳反応では、開始コドンAUGには、開始tRNAにより、N-ホルミルメチオニンが規定されるため、10-formyl-5,6,7,8-tetrahydroforlic acid(Baggott et al., 1995)のようなホルミルドナーが必須であるが、本発明において特殊アミノ酸で翻訳反応を開始する場合は、ホルミルドナーは任意である。同様の理由で、methionyl-tRNA formyltransferase(MTF)も必須でない。
【0109】
本発明で利用される翻訳系において、天然のタンパク質性アミノ酸に対しては、従来の系と同様に、対応する天然のtRNA及びARSを利用することができる。天然tRNAの例は、大腸菌を集め、破砕し、そこからtRNA画分を精製した混合物であり、市販品も入手可能である。天然tRNA中の特定のA、U、C、Gは、酵素によって化学修飾を受けている。あるいは、試験管内で転写した天然配列をもつtRNAの使用も可能である。一方、特殊アミノ酸に対しては、天然tRNAではなく、オルソゴナルtRNAとしてtRNA転写産物である人工tRNAを利用することが好ましい。人工tRNAは、DNAを鋳型として適当なRNAポリメラーゼを用いたin vitro転写反応で調製可能である。このような人工tRNAには、化学修飾は全く存在しない。翻訳産物がタンパク質性アミノ酸を含まない特殊ペプチドである場合、タンパク質性アミノ酸用の天然tRNA及びARSは不要であり、人工tRNAのみで特殊ペプチドの合成を実施することができる。
【0110】
翻訳産物であるペプチドに特殊アミノ酸を導入するためには、予め特殊アミノ酸でアシル化されたオルソゴナルtRNAを翻訳系に加える。好ましい態様において、特殊アミノ酸でアシル化されたtRNAは、他のtRNAやARSが存在しない条件で、フレキシザイムを用いて、単離されたオルソゴナルtRNAの3’末端に特殊アミノ酸を結合することにより調製される。あるいは、化学的あるいは酵素的に特殊アミノ酸をtRNAにチャージしたものも、原理的には使用可能である。
【0111】
特殊ペプチドをコードする鋳型核酸
本発明では、無細胞翻訳系において、ペプチドをコードする領域にランダム配列を持つ鋳型核酸(mRNAもしくは対応するDNA)から翻訳合成を行うことで、ランダムなアミノ酸配列を持つペプチドライブラリーを合成する。さらに、翻訳系をin vitro ディスプレイ技術と組み合わせる事で、ライブラリーを構成するペプチドが当該ペプチドをコードする核酸配列を伴った状態でスクリーニングを行う。言い換えると、遺伝情報が、その翻訳産物であるペプチドとして提示(ディスプレイ)されているディスプレイライブラリーから、ペプチドアプタマーの選択を行う。これにより、ライブラリー中のそれぞれのランダムペプチド分子に、分子生物学的手法により増幅及び読み取りが可能なタグが付加されている事になる。
【0112】
in vitro ディスプレイとは、無細胞翻訳系(in vitro翻訳系ともいう)を用いて合成されたペプチドが遺伝情報と対応付けて提示されたものであり、リボソームディスプレイ、mRNAディスプレイ、DNAディスプレイ、RAPIDディスプレイ等が公知である。いずれのディスプレイも、mRNAもしくはDNAに記録された遺伝情報と、その遺伝情報によってコードされるペプチドを連結することにより、[遺伝情報]−[翻訳産物]の複合体として対応付けるメカニズムを有する。リボソームディスプレイにおいては、mRNA−リボソーム−ペプチドの3者が複合体を形成する。mRNAディスプレイ及びRAPIDディスプレイにおいては、mRNA−ペプチドの複合体が形成される。DNAディスプレイにおいては、DNA−ペプチドの複合体が形成される。本発明においては任意のin vitro ディスプレイライブラリーの利用が可能である。
【0113】
本発明では、ペプチドのアミノ酸配列に対応する鋳型であるRNAもしくはDNAの配列が、特殊ペプチドのランダムなライブラリーをコードするように設計される。具体的には、塩基配列においてペプチドをコードする領域が、異なる複数のトリプレットの繰り返しからなるランダム配列を含み、ランダム配列中のトリプレットの少なくとも一部が特殊アミノ酸を指定する人為的なコドンに対応する配列である。
【0114】
本発明の別の態様では、RNAもしくはDNAの配列が、環状特殊ペプチドをコードするように設計される。具体的には、塩基配列においてペプチドをコードする領域が、mRNA配列の5’から3’の向きに沿って、次の(a)から(c)に対応するような塩基配列を順に含む:
(a)官能基1を持つアミノ酸を指定するコドン;
(b)異なる複数のトリプレットの繰り返しからなるランダム配列、及び
(c)官能基2を持つアミノ酸を指定するコドン。
【0115】
ランダムなmRNA配列は、その翻訳産物であるランダムなアミノ酸配列中に特殊アミノ酸が一定の確率で現れるように設計される。すなわち、上記(b)のランダム配列中のトリプレットの少なくとも一部が特殊アミノ酸を指定する人為的なコドンとなることにより、翻訳産物であるランダムペプチドのアミノ酸配列の一部に特殊アミノ酸が導入される。特殊アミノ酸の導入は、リボソーム上のペプチド鎖伸長反応において、特殊アミノ酸を連結した伸長反応用tRNAのアンチコドンと、特殊アミノ酸を指定する人為的なコドンが対合することにより達成される。さらに、結合形成反応が可能な一組の官能基である官能基1及び官能基2の間の結合形成反応によって、翻訳産物であるペプチドが環状化される。上述したように、特殊アミノ酸の導入のために使用されるtRNAは、in vitro転写反応で調製された人工tRNAであることが好ましい。
【0116】
本発明では、目的に合わせて最適化された成分からなる無細胞翻訳系に、翻訳の鋳型となる塩基配列に対応するDNAまたはRNA分子を加えて利用する。核酸配列には、生細胞を利用したタンパク質発現系と同様に、目的のアミノ酸配列をコードする領域に加えて、使用する翻訳系に合わせて、翻訳に有利な塩基配列を付加的に含むことができる。例えば、大腸菌由来のリボソームを利用する系の場合は、開始コドンの上流にShine-Dalgarno(SD)配列やイプシロン配列などを含むことにより翻訳反応の効率が上昇する。
【0117】
ペプチドをコードする領域のN末端には、開始コドンが配置される。開始コドンは通常はトリプレット配列AUGである。しかしながら、本発明においては、in vitro転写反応により合成された開始tRNAにおいてアンチコドン配列を任意の配列とすることで、開始コドンのリプログラミングが可能であるので、AUGコドンに加えて、他の塩基配列も開始コドンとして利用できる。
【0118】
C末端側には、in vitroディスプレイ用に、核酸分子とその翻訳産物であるペプチドを連結するための配列が含まれる。例えば、ピューロマイシンリンカーを用いたmRNAディスプレイ法を利用する場合、mRNAライブラリーにピューロマイシンリンカーが予め連結されたものを翻訳系に加えることにより、mRNA−ペプチドの複合体ライブラリーが形成される。ピューロマイシンをリボソームのAサイトに効率良く取り込ませるために、通常、mRNAの3’末端側とピューロマイシンの間にリンカーが挿入される。ピューロマイシンはリボソーム上でペプチド転移反応の基質(アミノアシルtRNA類似体)として機能し、伸長ペプチドのC末端に結合することにより、mRNAとペプチドを連結する。mRNAディスプレイ法は、in vitro翻訳系でmRNAとペプチドを適当なリンカーを介して連結することにより遺伝子型と表現型を一体化させる技術であり、このような目的が達成される限り、ピューロマイシンに代えて他の同様の機能を有する物質を含むリンカーも利用可能であることは当業者の認識の範囲内である。
【0119】
また別の方法として、リンカーを予め連結したmRNAを用いるのではなく、in vitro翻訳系内でのリンカーとmRNAのハイブリダイゼーションにより、mRNA-ペプチドの複合体ライブラリーを形成する方法も利用可能である。例えば、フレキシザイムを利用して調製したフェニルアラニンリンカー(3’-フェニルアラニン-ACCA-PEG-[mRNAライブラリーの3’末端領域と相補的な塩基配列]-5’)をmRNAライブラリーと相補鎖を組ませることで、mRNA-ペプチドの複合体ライブラリーが形成される(未公開出願である特願2009-243240に記載される「RAPIDディスプレイ法」)。この場合、mRNAのペプチドをコードする領域の下流(3’末端領域)に、リンカーとハイブリダイゼーションするための塩基配列が含まれる。
【0120】
後述の具体的な実施例においては、ペプチドのN末端に開始コドンAUGが、C末端に、官能基2を持つアミノ酸としてシステイン(Cys)をコードするコドンUGCが配置され、その直後にリンカーとなるGlySerGlySerGlySerをコードするコドンが続いており、AUGとUGCの間がランダム配列となっている。
【0121】
ランダム配列は、任意の配列のトリプレットからなるコドンの繰り返しで構成され、一部がN-メチルアミノ酸のような特殊アミノ酸を指定する人為的なコドンとなるように設計される。
【0122】
ランダム配列を構成するトリプレットをN1N2N3コドンで表して、可能な配列について説明する。N1とN2は、それぞれ独立して、A、U、CまたはGのいずれか1つであることができる。さらに、N3もA、U、CまたはGのいずれか1つであることができる。あるいは、N3は、A、U、C及びGの4種の塩基のうちの任意の3種から選択されるいずれか1つであることができる。あるいは、N3は、A、U、C及びGの4種の塩基のうちの任意の2種から選択されるいずれか1つであることができる。あるいは、N3を、A、U、CまたはGの1つに定めることができる。
【0123】
例えば、ランダム配列を構成するmRNA配列上のトリプレットの例として、NNUコドンまたはNNKコドン{Nは、A、U、CまたはGのいずれかのリボヌクレオチドであり、Kは、CまたはGのいずれかのリボヌクレオチドである}が挙げられる。
【0124】
以下、実施例に沿って、ランダムmRNAライブラリーとしてNNU(NはAまたはU、C、G)をコドンとしたmRNAを利用し、環状化反応用にNα-クロロアセチル-D-トリプトファンとシステインが配置され、4種類のN-メチルアミノ酸が導入されたペプチド配列の例で説明するが、本発明がこれに限定される意図ではない。
【0125】
例えば、NNUトリプレットによって発生するコドンの数は、16種類(4 x 4 x 1 = 16)であり、4コドンが4種類のN-メチルアミノ酸(N-メチルグリシン[AUU]、N-メチルアラニン[GCU]、N-メチルセリン[CUU]、N-メチルフェニルアラニン[UUU])に割り当てられた。また残り12コドンが11種類のタンパク質性アミノ酸(セリン[UCU及びAGU]、チロシン[UAU]、システイン[UGU]、プロリン[CCU]、ヒスチジン[CAU]、アルギニン[CGU]、トレオニン[ACU]、アスパラギン[AAU]、バリン[GUU]、アスパラギン酸[GAU]、グリシン[GGU])に割り当てられた。そして、mRNA上の環状N-メチルペプチドをコードするオープンリーディングフレームは、5’-AUG(NNU)8〜15UGC-3’とした。AUGにNα-クロロアセチル-D-トリプトファンが、UGCにシステインが規定され、必ず環状化ペプチドが形成されるように設計した。その実施例として、様々な大きさの環状ペプチドを調製するためにNNUコドンを8から15回繰り返した。
【0126】
【表2】

NNUライブラリーの利点としては、ランダム領域でUAA及びUAG、UGAで規定されるストップコドンが出現しないため、確度の高いライブラリーを構築することができる。また16コドン中、4コドンがN-メチルアミノ酸を規定するため、ペプチド中にN-メチルアミノ酸の導入確率を理論上では25%にまで高めることができる。今回は、NNUライブラリーを用いたが、NNK(KはCまたはG)ライブラリーや他の塩基を3番目に位置させ組み合わせたライブラリー等を利用し、32コドン(4 x 4 x 2 = 32)を使用する方法もある。その際、4種類のN-メチルアミノ酸を導入する場合、N-メチルアミノ酸の出現確率は半減する。
【0127】
mRNA上のコドンは対応するtRNAのアンチコドンと対合する。コドン3文字目とアンチコドン1文字目はwobble塩基対が許容されるので、ワトソン-クリック型の塩基対に加えてそれ以外の組み合わせが可能である。例えば、NNUコドンの第三塩基Uに対してはG又はA、NNKコドンの第三塩基Cに対してはG、NNKコドンの第三塩基Gに対してはU又はCの対合が可能である。本願発明においてN-メチルアミノ酸を導入するためにNNUコドンを用いる場合、GNNアンチコドンは好ましい組み合わせの一例である。
【0128】
フレキシザイムによるアミノアシル化反応
フレキシザイムは、所望の構造を持つアミノ酸基質を任意のtRNAにアシル化する機能を有するRNA触媒(ARSリボザイム)である。フレキシザイムは、天然のARSタンパク質酵素とは異なり、各アミノ酸及び各tRNAに対して特異性を持たず、本来チャージすべきアミノ酸以外の任意のアミノ酸を用いたアミノアシル化が可能である。本発明では、フレキシザイムを用いて特殊アミノ酸でアシル化された直交性(オルソゴナル)tRNAを、無細胞翻訳系に添加することにより、ペプチド配列に特殊アミノ酸が導入される。
【0129】
オルソゴナルtRNAとは、翻訳系に内在する天然由来のARS(例えば大腸菌由来のARSタンパク質酵素)によって認識されないので、翻訳系内でアミノアシル化されることはないが、リボソーム上のペプチド合成反応では効率よくmRNAのコドンと対合して指定されたアミノ酸を発現させ得るtRNAである。オルソゴナルtRNAとして、例えば、異なる種に由来する天然のサプレッサーtRNA、あるいは、人工的に構築したtRNAが使用される。上述のように、本発明において特殊アミノ酸の導入のために好適に使用されるものは、人工的な転写産物であるオルソゴナルtRNAである。
【0130】
フレキシザイムは、活性化アミノ酸エステルを基質として、アミノ酸の反応点であるカルボニル基、及びアミノ酸側鎖あるいは脱離基である芳香環、並びにtRNAの3’末端に存在する5'-RCC-3'配列部分(R = A or G)を認識して、3’末端のアデノシンにアシル化する触媒能を有する。フレキシザイムは、tRNAのアンチコドン部分に対して特異性がない。つまり、tRNAのアンチコドン部分をどのような配列に変えても、アミノアシル化の効率には影響がない。フレキシザイムにより、任意の特殊アミノ酸を任意のアンチコドン配列を持つtRNAに連結することができるので、任意の特殊アミノ酸を任意のコドンに対応させることができる。従って、任意の特殊アミノ酸を導入したライブラリーの調製が可能である。
【0131】
公知のフレキシザイムの構造(RNA配列)を以下に示す。
原型のフレキシザイム Fx
[GGAUCGAAAGAUUUCCGCAGGCCCGAAAGGGUAUUGGCGUUAGGU-3’, 45nt]
ジニトロベンジルフレキシザイム dFx
[5'-GGAUCGAAAGAUUUCCGCAUCCCCGAAAGGGUACAUGGCGUUAGGU-3’, 46nt]
エンハンスドフレキシザイム eFx
[5'-GGAUCGAAAGAUUUCCGCGGCCCCGAAAGGGGAUUAGCGUUAGGU-3’, 45nt])
アミノフレキシザイム aFx
[5'-GGAUCGAAAGAUUUCCGCACCCCCGAAAGGGGUAAGUGGCGUUAGGU-3’, 47nt])
フレキシザイムは、天然のARSタンパク質酵素とは異なり、アミノアシル化反応の第1段階目である高エネルギー中間体(アミノアシルAMP)の生成の過程をスキップしてアミノ酸基質のtRNAへの結合の過程のみを触媒するため、アミノ酸基質としてはあらかじめ弱活性化されたアミノ酸を用いる必要がある。つまり、アミノ酸のアデニル化をスキップする代わりに、アシル化が進行するカルボニル基において弱活性化されたエステル結合を持つアミノ酸誘導体を使用する。一般にアシル基の活性化は電子吸引性をもつ脱離基をエステル結合させることで達成できるが、あまり強力な電子吸引性脱離基を有するエステルでは水中で加水分解が起きるばかりか、ランダムなRNAへのアシル化が併発してしまう。したがって、アミノ酸基質としては無触媒状態でこのような副反応が起きにくいように弱活性化したものを用いる必要がある。このような弱活性化は、例えば、AMP、シアノメチルエステル、チオエステル、又はニトロ基やフッ素その他の電子吸引性の官能基をもったベンジルエステル等を使用して行うことができる。好適なアミノ酸基質の例としては、アミノアシル-シアノメチルエステル(CME:cyanomethyl ester)、アミノアシル-ジニトロベンジルエステル(DNB:3,5-dinitrobenzyl ester)、又はアミノアシル-4-クロロベンジルチオエステル(CBT:p-chloro-benzyl thioester)等が挙げられるが、これらに限定されない。
【0132】
また、アミノ酸基質は、フレキシザイムで認識されるように、アミノ酸側鎖または脱離基内に芳香環を有していなければならない。本明細書中では、フレキシザイムの基質として、このような適当な脱離基を有するアミノ酸基質を、活性化アミノ酸エステルということもある。例えば、N-メチルフェニルアラニンの場合、N-メチルフェニルアラニンCMEを基質として用いることで、eFxとtRNAを混合し、N-メチルフェニルアラニン結合tRNAを調製することができる。eFxは、芳香族を側鎖に有するアミノ酸の活性化アミノ酸を基質とすることができ、活性基に芳香族は必要ない。例えば、N-メチルグリシン、N-メチルアラニン、N-メチルセリンは、それぞれのDNB誘導体を基質とし、dFxとtRNAを混合することで、N-メチルアミノ酸結合tRNAを調製することができる。dFxは、活性基の芳香族を認識するため、アミノ酸の側鎖に限定されない。
【0133】
フレキシザイムによるアシル化反応は、溶液中で行ってもよいし、担体に固定化したARSリボザイムを用いたカラムを用いて反応させてもよい。例えば、もし翻訳の反応スケールが100μl以下の少ない量であれば、溶液中でフレキシザイムによるtRNAのアシル化を行い、反応溶液をエタノール沈殿したペレットを適当な緩衝液(例えば1mMの酢酸カリウム、pH5等)に溶解し、翻訳系に添加すれば良い。反応の条件は適宜好適な条件を選べばよいが、少量スケールの反応条件の一例としては、最終濃度で0.5〜20μMのtRNA、0.5〜20μMのフレキシザイム、2〜10mMのアミノ酸基質、0.6MのMgCl2を含むpH7.5、0.1Mの反応緩衝液を、0度(℃)で1時間〜24時間、反応させるとよい。
【0134】
翻訳の反応スケールが100μlを超える場合は、フレキシザイムの再利用を考慮し、担体に固定化したフレキシザイムを用いたほうが好都合である。担体として、例えば、樹脂、アガロース、セファロース、磁気ビーズなどを用いることもできるが、特に限定されない。フレキシザイムを担体に固定化して反応を行わせる場合は、例えば、Murakami, H., Bonzagni, N. J. and Suga, H. (2002). "Aminoacyl-tRNA synthesis by a resin-immobilized ribozyme." J. Am. Chem. Soc. 124(24): 6834-6835に記載の方法に従って行うことができる。反応産物であるアミノアシル化tRNAの分離は、様々な方法で行える。一例としては、10mM程度のEDTAを含有する緩衝液でカラムから溶出する方法がある。ARSリボザイムを固定化した樹脂は、例えば反応バッファーで平衡化することにより、十数回リサイクルすることができる。
【0135】
後述の実施例においては、Kawakamiら(非特許文献11)の記載に従い、フレキシザイムを用いて、4種類のN-メチルアミノ酸(N-メチルグリシン、N-メチルアラニン、N-メチルセリン、N-メチルフェニルアラニン)をtRNAAsn-E2に連結して、アミノ酸配列に導入した例を説明する。tRNAAsn-E2NNNは、大腸菌由来の伸長反応用tRNAであるtRNAAsnを改変して作成された人工tRNAであり、アンチコドン配列(NNN、Nは任意の塩基を表す)を様々に変化させて用いることができる。この人工tRNAは天然のARSに対して直交性を持つため、翻訳系中で天然のアミノ酸によってチャージされることがないが、リボソーム上のペプチド鎖伸長反応に際しては問題なく受け入れられる。つまり、この人工tRNAに特殊アミノ酸が連結されたアミノアシルtRNAは、伸長因子(EF-Tu)と結合して、リボソームのA部位に運ばれて、ペプチド鎖伸長過程で使用される。tRNAAsn-E2は、特殊アミノ酸をアシル化するための伸長用tRNAとしての一つの例示であり、実施例で使用された具体的な無細胞翻訳系において実際に使用可能であることが確認されている。しかしながら、本発明で使用可能な伸長反応用tRNAはこれに限定されない。当業者であれば、本発明においてペプチド鎖伸長反応で特殊アミノ酸を導入するために利用可能なtRNAは、使用する無細胞翻訳系の成分に合わせて適宜に選択可能であることが理解できるであろう。
【0136】
また、本発明では、環状化のための官能基を有するアミノ酸が特殊アミノ酸である場合にも、フレキシザイムを用いてそのような特殊アミノ酸を任意のアンチコドンを持つ直交性(オルソゴナル)tRNAに結合させる。本発明の一態様では、開始アミノ酸残基として官能基1を有するアミノ酸を配置する。その場合、開始tRNAに環状化反応用の官能基を有するアミノ酸をチャージすることにより、ペプチドN末端に環状化反応用の官能基が導入される。
【0137】
例えば、後述の実施例では、クロロアセチル基を有するD体のトリプトファンであるNα-クロロアセチル-D-トリプトファンを開始tRNAであるtRNAfMetに連結し、ペプチドN末端に導入を行った。ペプチドに導入されたクロロアセチル基は、ペプチド内部のシステイン残基のチオール基と自発的なSN2反応を引き起こし、チオエーテル結合によってペプチドが環状化する(Goto et al., ACS Chem. Biol., 2008, 3, 120-129)。この例では、D体のトリプトファンを母核としているが、L体のトリプトファンはもちろん、他の19種類のタンパク質性アミノ酸のL体及びD体でも問題なくペプチドライブラリーを作製することができる。
【0138】
なお、4つのN-メチルアミノ酸及びクロロアセチル基を有するフェニルアラニンを導入した特定の配列をもつモデル環状N-メチルペプチドの翻訳合成はKawakamiらによって達成されている(非特許文献11)。しかしながら、ライブラリーの構築については本願で初めて開示される。
【0139】
開始tRNAと伸長tRNA
天然の翻訳反応において、開始tRNAは翻訳開始のみに用いられ、伸長反応では使用されず、反対に、伸長用tRNAは開始反応には使用されないことは重要である。このような開始tRNAと伸長用tRNAの区別は本願発明においても同様である。
【0140】
本願では、特殊アミノ酸をアシル化するために人工tRNAが好適に用いられる。伸長tRNAである人工tRNAの非限定的な一例がtRNAAsn-E2である。このtRNAの塩基配列は、大腸菌の天然tRNAAsn
(5’-UCCUCUGs4UAGUUCAGDCGGDAGAACGGCGGACUQUUt6AAYCCGUAUm7GUCACUGGTYCGAGUCCAGUCAGAGGAGCCA-3’) がベースになっている(s4U:4-チオウリジン、D:ジヒドロウリジン、Q:キューオシン、t6A:6-スレオニルカルバモイルアデニン、Y:ワイブシン、m7G:7-メチルグアノシン、T:リボチミジン)。本発明者らは、この天然tRNAに対して、修飾塩基を無くし、かつ変異を導入することで、大腸菌の20種類のアミノアシル化酵素によってアミノアシル化を受けない伸長反応用のtRNAであるtRNAAsn-E2をin vitro転写によって作製した。NNNの箇所がアンチコドンに相当し、コドンに対応するように変化させる。
(tRNAAsn-E2: 5’-GGCUCUGUAGUUCAGUCGGUAGAACGGCGGACUNNNAAUCCGUAUGUCACUGGUUCGAGUCCAGUCAGAGCCGCCA-3’、[修飾を無くした箇所、合計8カ所。s4U8U、D16U、D20U、t6A37A、Y39U、m7G46G、T54U、Y55U。34番目のQに関しては、アンチコドンなので、コドンに対応して変化させる。][変異の箇所 、合計4カ所。U1G、C2G、G71C、G72C])
開始tRNAである人工tRNAの非限定的な一例が、tRNAfMetである。このtRNAの塩基配列は、大腸菌の天然tRNAfMet
(5’-CGCGGGGs4UGGAGCAGCCUGGDAGCUCGUCGGGCmUCAUAACCCGAAGAUCGUCGGTYCAAAUCCGGCCCCCGCAACCA-3’ )がベースになっている。(Cm:2’-O-メチルシチジン)。本発明者らは、この天然tRNAに対して、修飾塩基を無くし、5’末端最初のCをGに変化させた開始反応用のtRNAであるtRNAfMetをin vitro転写によって作製した。CAUの箇所がアンチコドンに相当し、AUG開始コドンに対応する。(本願で使用したtRNAfMet: 5’-GGCGGGGUGGAGCAGCCUGGUAGCUCGUCGGGCUCAUAACCCGAAGAUCGUCGGUUCAAAUCCGGCCCCCGCAACCA-3’、[修飾を無くした箇所、合計6カ所。s4U8U、D20U、Cm32C、T54U、Y55U。][変異の箇所 、合計1カ所。C1G])開始tRNAにおいて重要な箇所は5’末端の最初の塩基(天然tRNAfMetではC、本願のtRNAfMetではG)が、72番目の塩基(天然tRNAfMet及び本願のtRNAfMetではA)と相補鎖を組まないことである。この非相補鎖によって、メチオニルホルミルトランスフェラーゼ(MTF)によりMet-tRNAfMetにホルミル基が転移されたり(但し、この部分にクロロアセチルトリプトファンのような開始用特殊アミノ酸を利用する場合は、意味は無い)、またEF-Tuとの結合が抑制されたりする。
【0141】
in vitroセレクション
本発明において、無細胞翻訳系で構築される特殊ペプチドライブラリーは、mRNAディスプレイを始めとするin vitroディスプレイ技術と完全に適合可能であるため、1013種類以上の高い多様性からなる特殊ペプチドライブラリーから、標的に結合するペプチド分子の創出が可能である。
【0142】
in vitroディスプレイ技術は、進化分子工学のツールとして利用される。進化分子工学では、所望の機能や性質を持つタンパク質やペプチドを創製することを目的として、可能性のある遺伝子を大規模に準備し、その中から狙った表現型を有するクローンを選択する。基本的には、最初にDNA集団(DNAライブラリー)を調製し、in vitro転写産物としてRNA集団(RNAライブラリー)を得て、in vitro翻訳産物としてペプチド集団(ペプチドライブラリー)を得る。このペプチドライブラリーから、所望の機能や性質を持つものを何らかのスクリーニング系で選択することになる。例えば、特定のタンパク質に結合するペプチド分子を得たい場合は、標的タンパク質を固相化したカラムにペプチド集団を流し込み、カラムに結合したペプチド分子の混合物を回収することができる。このとき、in vitroディスプレイ技術により、各ペプチド分子には、その鋳型である核酸分子がタグのように付加されている。mRNAディスプレイライブラリーであれば、各ペプチド分子にはmRNAが付加されている。そこで、回収したペプチド−mRNA複合体の集団から逆転写酵素でDNAに戻し、PCRで増幅して狙った表現型を有するクローンが多く含まれるバイアスのかかったライブラリーを得た後に、再度同じような選択実験を行う。あるいは、RNAアプタマーを回収してしまう可能性を回避するため、核酸部分を2本鎖(DNA/RNAハイブリッド)にする目的で、選択前に逆転写反応を行うことも可能である。この操作を繰り返すことで、世代の経過とともに所望の表現型を有するクローンが集団中で濃縮されていく。
【0143】
ペプチドアプタマーを同定する場合、in vitro ディスプレイライブラリーと標的物質を混合し、標的物質に結合したペプチドを提示する対応付け分子(活性種)を選択し、選択された対応付け分子の核酸部分からPCRにより核酸ライブラリーを調製する工程を繰り返すことで、標的物質に結合するペプチドアプタマーの遺伝子をクローニングできる。
【0144】
標的物質としては、一般的には、タンパク質、核酸、糖質、脂質、その他どのような化合物でもよい。
活性種を選択するためには、[遺伝情報]−[ペプチド]複合体を標的物質と接触させ、標的物質に結合したペプチドを提示する複合体を、標的物質に結合していない他の多数の複合体から適当な方法で分離して回収する必要がある。このような回収の方法としては多くの技術が公知である。
【0145】
例えば、標的物質に、固相への結合により回収可能な修飾を施しておくと便利である。例えば、後述の実施例では、標的物質をビオチン修飾しておき、固相化されたビオチン結合タンパク質への特異的な結合を利用して回収している。このような特異的な結合としては、ビオチン結合タンパク質(アビジン、ストレプトアビジンなど)/ビオチンの組み合わせの他にも、マルトース結合タンパク質/マルトース、ポリヒスチジンペプチド/金属イオン(ニッケル、コバルトなど)、グルタチオン-S-トランスフェラーゼ/グルタチオン、抗体/抗原(エピトープ)などが、利用可能であるが、これらに限定されるものではない。
【0146】
本発明は、ペプチドライブラリーを標的物質と接触させ、標的物質に結合したぺプチドを提示する活性種を選択し、選択された活性種の核酸配列を増幅し、増幅された核酸配列を鋳型として無細胞翻訳系で再び合成されたペプチドのライブラリーから活性種を選択するというin vitroセレクションを繰り返すことにより、標的物質に結合する特殊ペプチドを創製することを含む。
【0147】
標的物質に結合する特殊ペプチド化合物の創製は、標的物質に結合したぺプチドを提示する活性種を回収して核酸配列を解析し、核酸配列からペプチド配列を決定し、得られたペプチド配列に基づき適当な特殊ペプチドを選択することにより、標的物質に結合する特殊ペプチドのアミノ酸配列及び核酸配列を得ることを含む。さらに、得られた配列情報に基づき、任意の方法を用いて、特殊ペプチドを合成、精製及び単離することが可能である。得られたペプチドを用いて、標的タンパク質の結合評価や阻害活性の確認を行い、活性の高い特殊ペプチドを得ることができる。
【0148】
後述の実施例では、標的物質としてユビキチンリガーゼE6APに着目し、そのC末端ドメインであるE6AP-HECTに対して特異的に結合する環状N-メチルペプチドを得た。
これまでの説明に加えて、本発明の実施のための材料及び方法は、特に断らないかぎり、化学及び分子生物学の技術分野でよく知られる慣用の方法に従って、様々な一般的な教科書や専門的な参考文献に記載されている方法を用いる。
【0149】
以下では、本発明を実施例によって具体的に説明する。なお、これらの実施例は、本発明を説明するためのものであって、本発明の範囲を限定するものではない。
【実施例】
【0150】
実施例1.NNU mRNAライブラリーの作製(図1)
環状N-メチルペプチドライブラリーを構築するためのmRNAライブラリーは、以下のように調製した。
【0151】
NNA(N = A or T or C or G)が8〜15個連続したランダム領域を有する8本のDNAプライマー(NNUpool8.R69 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool9.R72 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool10.R75 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool11.R78 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool12.R81 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool13.R84 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool14.R87 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool15.R90 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’])
及び
T7g10M.F48 (5’- TAATACGACTCACTATAGGGTTAACTTTAAGAAGGAGATATACATATG-3’)
CGS3an13.R39 (5’-TTTCCGCCCCCCGTCCTAGCTGCCGCTGCCGCTGCCGCA-3’)
は、オペロンバイオテクノロジーから購入した。
【0152】
T7g10M.F48と各NNU poolプライマーを利用し、Taqポリメラーゼによる伸長反応を行った(94°C, 1 min→[50°C, 1 min→72°C, 1 min]x10cycles→72°C, 5 min)。次にこの伸長反応産物を鋳型として、T7g10M.F48及びCGS3an13.R39を利用し、Taqポリメラーゼを用いてPCRを行った(94°C, 1 min→[94°C, 40 sec→61°C, 40 sec→72°C, 40sec]x4cycles→72°C, 5 min)。
【0153】
次にPCR産物を利用して、T7RNAポリメラーゼを利用した転写反応を行い、8M尿素を含む8%ポリアクリルアミドゲルで分離精製を行い、各々20 μM mRNAとした。
このmRNAは、5’末端側から
T7プロモーター3’末端のG、
イプシロン配列(5’-UUAACUUUAA-3’)、
Shine-Dalgarno配列(5’-AAGGAGA-3’)、
翻訳領域(5’-AUG[NNU]8-15UGC-3’)、
ペプチドリンカー領域(5’-GGCAGCGGCAGCGGCAGC-3’)、
ピューロマイシンリンカー相補鎖形成領域(5’-UAGGACGGGGGGCGGAAA-3’)
という構成になっている。
【0154】
NNU8からNNU15のランダム配列を有する各mRNAを、モル比で1/163、1/162、1/16、1、1.4、1.4、1.4、1.4の割合で混合し、10 uM mRNAライブラリーとした。
実施例2.アミノアシル-tRNAの調製(図2)
N-メチルアミノ酸として、N-メチルグリシン(MeGly)、N-メチルアラニン(MeAla)、N-メチルセリン(MeSer)、N-メチルフェニルアラニン(MePhe)の4種類を選んだ。そして、これらの活性化エステル誘導体、ジニトロベンジルエステル(DBE)またはシアノメチルエステル(CME)として、N-メチルグリシンジニトロベンジルエステル(MeGly-DBE)、N-メチルアラニンジニトロベンジルエステル(MeAla-DBE)、N-メチルセリンジニトロベンジルエステル(MeSer-DBE)、N-メチルフェニルアラニンシアノメチルエステル(MePhe-CME)を調製した。
【0155】
MeGly-DBE、MeAla-DBE及びMeSer-DBEとtRNAを連結するために、ARSリボザイムとしてジニトロベンジルフレキシザイムdFxを用いた。MePhe-CMEに対しては、エンハンスドフレキシザイムeFxを用いた。
【0156】
その際、各N-メチルアミノ酸MeGly、MeAla、MeSer、MePheをそれぞれAUU、GCU、CUU、UUUのコドンに割り当てるため、アンチコドン部分にGAU、GGC、GAG、GAAを有するtRNAAsnE2を使用した。
【0157】
各アミノ酸活性化エステル(5 mM)と対応するARSリボザイム(25 μM)、tRNAAsnE2 (25 μM)、100 mM HEPES(pH7.5)、600 mM MgCl2を加え、0 °C、2時間(MeGly-DBE、MeAla-DBE)または6時間(MeSer-DBE、MePhe-CME)、アミノアシル化反応させ、エタノール沈殿後、翻訳反応に利用した。
【0158】
ペプチドライブラリーへの環状構造の導入は、クロロアセチル基及びペプチド内部に配置したシステインのスルフィドリル基間の分子内SN2反応を利用する。そこで、N-クロロアセチル-D-トリプトファン(D-ClAcTrp)をペプチドN末端に導入した。本アミノ酸のシアノメチルエステル(D-ClAcTrp -CME)及びeFxを利用することで、CAUのアンチコドンを有する開始tRNAfMetにD-ClAcTrpを連結したアミノアシルtRNAを上述した反応条件により調製した。当アミノ酸における反応時間は2時間とした。
【0159】
実施例3.環状N-メチルペプチドライブラリーの構築
mRNAライブラリーの3’末端にピューロマイシンリンカーPu-CC-linker (5’-pCTCCCGCCCCCCGTCC-(SPC18)5CC-puromycin, bex株式会社)を連結するため、10x Ligation buffer (TAKARA) 20 uL、H2O 70 uL, DMSO 40 uL, 7.5 uM Pu-CC-linker 40 uL, 10 uM mRNA 20 uL、T4 RNA ligase (ホームメイド) 10 uLを混合し、室温、30分間反応させた。その後、0.6 M NaCl、10 mM EDTA 200 uLを加え、反応を停止した。この溶液をフェノール/クロロホルム溶液で処理した後、エタノール沈殿し、乾燥後、H2O 30 uLに溶解し、6 uM mRNA-ピューロマイシンリンカーとした。
【0160】
ペプチドライブラリーの翻訳反応は、最適化された無細胞翻訳系で行った。無細胞翻訳系の構成は以下に記載する。50 mM Hepes-KOH [pH7.6], 100 mM KOAc, 20 mM Creatine phosphate, 12 mM Mg(OAc)2, 2 mM GTP, 2 mM ATP, 1 mM CTP, 1 mM UTP, 2 mM Spermidine, 2 mM DTT, 100 uM 10-formyl-5,6,7,8-tetrahydroforlic acid (Baggott et al., 1995), 1.5 mg/mL E. coli total tRNA (Roche), 1.2 uM ribosome, 2.7 uM IF1, 0.4 uM IF2, 1.5 uM IF3, 30 uM EF-Tu, 30 uM EF-Ts, 0.26 uM EF-G, 0.25 uM RF2, 0.17 uM RF3, 0.5 uM RRF, 0.6 uM methionine transformylase, 4 ug/mL creatine kinase(Roche), 3 ug/mL myokinase (Sigma), 0.1 uM pyrophosphatase, 0.1 uM nucleotide-diphosphatase kinase, 0.1 uM T7 RNA polymerase。
【0161】
またこの翻訳系には、12種類のアミノアシルtRNA合成酵素(0.03 uM ArgRS, 0.38 uM AsnRS, 0.13 uM AspRS, 0.02 uM CysRS, 0.09 uM GlyRS, 0.02 uM HisRS, 0.11uM LysRS (Flag配列用), 0.16 uM ProRS, 0.04 uM SerRS, 0.09 uM ThrRS, 0.02 uM TyrRS, 0.02 uM ValRS)及び11種のアミノ酸(アルジニン、アスパラギン、アスパラギン酸、システイン、グリシン、ヒスチジン、プロリン、セリン、トレオニン、チロシン、バリン、各0.2 mM)が含まれている。
【0162】
なお上述の最適化された無細胞翻訳は、自由にタンパク因子やアミノ酸を除くことができるので、Flexible In vitro Translation system (FIT system)と呼ぶことにする(同一出願人の未公開特許出願である特願2010-190315に記載)。FIT systeme150 uLに対して、1.2 uM mRNA-ピューロマイシンリンカー及び5つのアミノアシルtRNA(D-ClAcTrp-tRNAfMetUAC, MeGly-tRNAAsnE2GAU, MeAla-tRNAAsnE2GGC, MeSer-tRNAAsnE2GAG, MePhe-tRNAAsnE2GAA,各25 uM)を加え、37°C、30分間、翻訳反応を行い、環状N-メチルペプチドライブラリーを構築した。
【0163】
上述した環状N-メチルペプチドの翻訳合成を図3に示す。
反応後、室温で12分間放置し、mRNA-ピューロマイシンとペプチドの連結を行った。その後、200 mM EDTA(pH 8.0) 15 uLを加え、37°C、30分間放置し、リボソームをmRNAから取り除いた。この溶液をmRNA-ペプチド複合体溶液として、1ラウンド目のin vitroセレクションに利用した。
【0164】
一方、2ラウンド目のライブラリーの構築には、5uLの翻訳溶液を使用した。また3ラウンド目以降は、2.5uLの翻訳溶液を使用した。
実施例4.In vitroセレクション
標的として、ビオチン化されたAvi-His-GB1-E6AP-HECTドメイン(Avi: ビオチン化タグ配列、His: His6タグ配列、GB1: Protein G B1 domain、可溶化タグ配列、Zhou et al. 2001)をストレプトアビジン-磁性担体(Invitrogen)に固定化し、in vitroセレクションに利用した。(図4)
1ラウンド目のmRNA-ペプチド複合体溶液及びE6AP-HECT固定化担体(200 nM)を混合し、4°C、30分間インキュベートした(ポジティブセレクション)。上澄みを除き、氷冷したTBST(100 mM Tris-HCl[pH 7.5], 300 mM NaCl, 0.05%(v/v) tween20) 300 uLを加え、洗浄した。固定化担体を回収後、40 uL の逆転写反応溶液(5xRT buffer (Promega), 0.5 uM dNTPs, 2 uM CGS3an13R39, 5 U/uL MLV Reverse transcriptase (Promega), 0.2 U/uLRNase Inhibitor (Promega))を加え、42°C、1時間混合し、逆転写反応を行った。この逆転写反応溶液に、360 uLのPCR溶液(10 mM Tris-HCl[pH7.5], 50 mM KCl, 0.1%(v/v) Triton X-100, 2.5 mM MgCl2, 0.25 mM dNTPs, 0.25 uM T7g10M.F48, 0.25 uM CGS3an13R39)を加え、95°C、5分間加熱し、上清を回収した。回収した溶液にTaq polymeraseを添加し、PCRによって回収したcDNAの増幅を行った。増幅したDNAは、転写反応によって次のラウンドのmRNAとした。また回収したcDNA量は、リアルタイムPCRにより算出した。
【0165】
一方、2ラウンド目以降は、MLV reverse transcriptase (RNase H minus)を使用し、逆転写反応を行いcDNA及びmRNA-ペプチドの複合体を形成してから、in vitroセレクションを行った。さらに2ラウンド目では、ネガティブセレクションとして、ストレプトアビジン磁性担体、及び、ビオチン固定化担体、Avi-His-GB1固定化担体(200 nM)を体積比1:1:1で混合した担体とmRNA-ペプチド複合体溶液を4°C、30分間混合し、その上清を利用して上述のポジティブセレクションを行った。その後、固定化担体とPCR溶液を混合、加熱し、上澄みを回収し、cDNAを増幅した。また3及び4ラウンド目では、ネガティブセレクションを3回実行後、37°Cでポジティブセレクションを行った。続けて、5及び6ラウンド目では、ネガティブセレクションを9回実行後、37°Cでポジティブセレクションを行った。
【0166】
セレクションのラウンドを繰り返し行い、6ラウンド後に0.9%までcDNAの回収率が上昇したため、cDNAライブラリーの配列解析を行った。図5−1にセレクションの進行度を示す。
【0167】
実施例5.MCP11の翻訳合成及び結合の確認
シークエンスの解析を行ったところ、5つのペプチド配列が得られ、MCP11〜15という名前をつけた(図2:DNA配列からのペプチド配列の解析)。
【0168】
MCP11、12、13、14は保存されたアミノ酸残基が存在し、N-メチルアミノ酸が3〜4つ導入されている。MCP15は、N-メチルアミノ酸が3つ含まれており、疎水性残基が多く、他のクローンとの保存された配列が存在していない。これらのシークエンス解析で最も多く検出されたMCP11について、さらなる実験を行った。
【0169】
MCP11のランダム配列は、アミノ酸配列CDVSGRFGYFP(下線を付けたS、F、GはN-メチル体である)からなる配列を有していた。D体のClAcWとCの間の結合形成により環状化された構造を以下に図示する。
【0170】
【化14】

MCP11がFIT systemにより正確に翻訳合成されているかを確かめるため、MALDI-TOF analysisによる質量分析を行った。MCP11のcDNAを含むプラスミドから、
フォワードプライマーとして
T7g10M.F48(5’- TAATACGACTCACTATAGGGTTAACTTTAAGAAGGAGATATACATATG-3’)、
リバースプライマーとして
CGS3an13TAA.R39(5’-TTTCCGCCCCCCGTCTTAGCTGCCGCTGCCGCTGCCGCA-3’)
を用いたPCRにより、直鎖DNAを増幅した。
【0171】
終止コドンをUAGからUAAに変化させることにより、FIT system中に含まれるRF2(release factor 2、翻訳終結因子2)によって、ペプチド翻訳反応が終結するためにペプチドの収量増加が見込める。
【0172】
この直鎖cDNA及び5つのアミノアシルtRNA(D-ClAcTrp-tRNAfMetUAC, MeGly-tRNAAsnE2GAU, MeAla-tRNAAsnE2GGC, MeSer-tRNAAsnE2GAG, MePhe-tRNAAsnE2GAA,各25 uM)をFIT systemに加え、37°C、30分翻訳反応を行った。翻訳溶液をC18チップカラムで脱塩した後、MALDI-TOFによって分析した。得られたExact massは、2064.87であり、目的のペプチド(Calculated exact mass=2064.85)の翻訳合成を確認することができた。図5−3の左パネルを参照されたい。
【0173】
次に、MCP11の単一cDNA(UAGを含む)を利用して、mRNAディスプレイ法(転写、ピューロマイシンリンカーの連結、逆転写反応、標的への結合、cDNAの回収、リアルタイムPCRでの評価)によるE6AP-HECTへの結合評価を試みた。翻訳反応は2.5uLスケールで行い、ネガティブセレクション(E6AP-HECT無しの担体)は、4°Cで3回、ポジティブセレクション(E6AP-HECT有りの担体)は37°Cで行った。その結果、ポジティブセレクション時にcDNAの回収が見られ、MCP11がE6AP-HECT特異的に結合をすることを確認した。図5−3の右パネルを参照されたい。
【0174】
実施例6.ペプチド合成と精製
セレクションで得られた配列情報をもとに、Fmocペプチド固相合成法により、対応するMCP11を合成した。レジン上のペプチドは、トリフルオロ酢酸:トリイソプロピルシラン: H2O (87.5: 10: 2.5)溶液で切り出した後、エーテル沈殿を行った。沈殿を50%アセトニトリル(1% トリフルオロ酢酸)溶液に溶かし、トリエチルアミンを加え、塩基性条件下で環状化反応を行った。その後、C18逆相カラムを利用したHPLCによって精製した。精製したペプチドは、凍結乾燥後、DMSOに溶解した。得られたペプチドの分子量は、MALDI-TOF MSで測定した。
【0175】
実施例7.SPRによる結合定数の決定
BIACORE T100を用いた表面プラズモン共鳴によるE6AP-HECTに対するMCP11の結合定数の解析を行った。
【0176】
センサーチップとしてストレプトアビジンセンサーチップ(SA chip certified)、リガンドとしてAvi-His-GB1-E6AP-HECT、アナライトとしてMCP11を用いた。センサーチップにE6AP-HECTを固定化した後、MCP11を用いてシングルサイクルカイネティクスによる解析の結果、MCP11のKDは、0.5 nMであった。また直鎖N-メチルペプチドMLP11のKDは、100〜1000 nMで、結合能力に200倍以上の差が見られた。またNメチルアミノ酸を含まない環状ペプチドCP11及び直鎖ペプチドLP11は、1000 nMでは結合が見られなかった。この結果より、MCP11のN-メチル骨格及び大環状骨格は、E6AP-HECTへの強固な結合に必須であることがわかった(図5−4:表面プラズモン共鳴法によるMCP11及び誘導体の親和性解析)。
【配列表フリーテキスト】
【0177】
配列番号1 フレキシザイム Fx
配列番号2 ジニトロベンジルフレキシザイム dFx
配列番号3 エンハンスドフレキシザイム eFx
配列番号4 アミノフレキシザイム aFx
配列番号5 tRNAAsn-E2
配列番号6 tRNAfMet
配列番号7 T7g10M.F48
配列番号8 CGS3an13.R39
【技術分野】
【0001】
本発明は、環状構造や特殊アミノ酸を有するペプチドである特殊ペプチド、特に環状N-メチルペプチドを用いた創薬に関する。より具体的には、N-メチルアミノ酸あるいはその他の特殊アミノ酸を含んだ特殊ペプチド化合物のライブラリーを構築する方法、化合物ライブラリー、該ライブラリーから薬剤候補を探索する手段、及び探索の結果見出された化合物に関する。
【背景技術】
【0002】
1.特殊ペプチドの位置づけ
現在市販されている医薬品の多くは、分子量がおおよそ500 Da以下の有機低分子化合物である。これは、低分子化合物であるため体内への吸収や拡散が早く、細胞膜透過性に優れ、免疫原性を示さないことに起因する。副作用としては、選択性の低さによる副作用が考えられる。これとは対照的に、近年注目されている抗体医薬は、高い選択性を持つが、免疫原性を生じる可能性があること、また標的が細胞外や細胞表面に制限されることが問題となり、薬剤としての応用が限られる。
【0003】
その一方で、特殊ペプチドは、低分子化合物と抗体の利点を併せ持つ分子群であると考えられている。一般的に、ペプチドは有機低分子化合物より分子量が大きい(1,000〜3,000 Da)ために膜透過性が悪く、かつプロテアーゼによって生体内で速やかに分解されることから、医薬品にならないと言われてきた。しかし、天然由来のペプチドであるサイクロスポリンは、細胞膜を透過し、標的に結合することで免疫抑制作用を発揮する。この生理活性や薬物動態は、ペプチド中の大環状構造及び特殊アミノ酸が、標的結合力や膜透過性、生体内安定性を向上させることに起因している。このことから、特殊ペプチドは、細胞膜外だけでなく細胞質内の標的にもアプローチできる可能性を秘めている。一方、疾患の多くは、タンパク質間相互作用の異常によって惹起されており、そのような相互作用を阻害する薬剤開発が盛んに行われている。通常、タンパク質間相互作用は、明確な疎水性ポケットが存在せず、互いに広い表面積(750〜1,500Å)を介して結合するため、低分子化合物ベースの阻害剤を創製することは困難である。しかしながら、特殊ペプチドは分子自身がある程度大きく、静電的及び疎水的相互作用、水素結合を形成する官能基が数多く存在する。そのため、タンパク質の浅くて広い結合部位に対して効果的に結合しうる可能性を有している。つまり、特殊ペプチドは、細胞内外そしてタンパク質間相互作用まで幅広く対応可能であり、新たな創薬シーズとして非常に魅力的な化合物群であるといえる。
【0004】
2.大環状構造とN-メチルアミノ酸がペプチドに与える影響
大環状構造は、ペプチドに対して薬剤としての利点を与える。1)大環状構造は、分子のconformational spaceを制限することで、標的との結合時におけるエントロピーロスが減少し、直鎖構造よりも強固な結合能力を示す。また、環状化することによって、標的に対する選択性が向上するとの報告もある。2)生体内のプロテアーゼは、天然のポリペプチドを切断するために、直鎖ペプチドに結合、切断する。そのため、環状ペプチドに対する結合及び切断能力が低いために、生体内での安定性が向上する。3)膜透過性が向上すると考えられている。これは、ペプチドが環状化することにより、分子内水素結合を形成するアミド結合の数が増加し、細胞膜中での疎水的環境下における、アミドN-Hの脱溶媒のエネルギー損失が減らすことができる。
【0005】
一方、特殊アミノ酸としてN-メチルアミノ酸を利用すると、ペプチド鎖のバックボーンにN-メチルペプチド結合を導入することができる。1)この構造は、環状化の時と同じようにプロテアーゼに認識されにくく、切断されにくい。2)N-メチルペプチド結合を導入することで、細胞膜透過性や腸管吸収を高め、bioavailabilityが改善された例がある。3)ペプチド結合は、二重結合性を持っているため、cis型及びtrans型の構造を与えるが、通常は、cis型の高いallylic strainを回避するために、trans型の構造をとる。しかしながら、N-メチルペプチド結合におけるcis型及びtrans型のallylic strainの差は、通常のペプチド結合のそれよりも低くなるために、cis型の構造をとる場合がある。それゆえ、ペプチド全体の構造は、1つまたはそれ以上のN-メチルペプチド結合によって構造変換を誘起し、通常のペプチドでは形成できない特殊な構造を形成する可能性が高い。そのため、通常のペプチドで十分な結合能力を得ることのできない標的タンパク質表面に対して、有効なライブラリーを提供できると考えられる。
【0006】
3.翻訳系を利用したN-メチルペプチドの合成およびそれを用いたライブラリーの構築と薬剤候補探索法
天然由来のN-メチルペプチドは、非リボソームペプチド合成酵素(NRPS, non-ribosomal peptide sythetases)と呼ばれる酵素群によって合成される。これらの酵素群は非常に複雑で、人工的に改変してペプチドライブラリーを作製できる技術は現在確立されていない。
【0007】
一方、N-メチルペプチドを自由に作製するため、これまでに翻訳系を利用したN-メチルペプチドの合成方法がいくつか報告されている。翻訳系はリボソーム型ペプチド合成酵素によりmRNAを鋳型としてペプチドを合成する系であるため、原理的には(決して容易ではないが)、鋳型となるmRNAの配列を変えることで様々な配列を持つペプチドを合成できる。既存の遺伝暗号を書き換え、N-メチルアミノ酸を人為的に割り当てた改変遺伝暗号を利用し、N-メチルペプチド翻訳合成を試みたこれまでの研究について概説する。
【0008】
UAG(終止)コドンを利用して、N-メチルフェニルアラニン(Bain et al., Tehtahedron, 1991, 47, 2389-2400. Rabbit reticulocyte lysate)、N-メチルアラニン(Ellman et al., Science, 1992, 255, 197-200. E.coli lysate)、N-メチルグリシン(Chaung et al., Science, 1993, 259, 806-809. E.coli lysate)、N-メチルアスパラギン酸(Karginov et al. JACS, 1997, 119, 8166-8176. Short et al., Biochemistry, 2000, 39, 8768-8781. Rabbit reticulocyte lysate)がタンパク質の1箇所に導入されている。
【0009】
また、センスコドンを利用した方法も報告されている。天然アミノ酸との競合を避けるため、ペプチド発現系として再構成型の無細胞翻訳系(reconstituted cell-free translation system;Y. Shimizu et al., Nature Biotechnology, 2001, vol. 19, p.751-755、その他)を用いた例が多い。
【0010】
Greenらは、20種類のN-メチルアミノ酸を用いた、ジペプチドの翻訳合成を行った(Merryman et al., Chem. Biol., 2004, 11, 575-582. Reconstituted cell-free translation system. E. coli)。N-メチルアミノアシルtRNAは、以下の3段階で調製した。1)アミノアシルtRNA合成酵素(ARS)によるアミノアシル-tRNAを基質とし、2-ニトロベンズアルデヒドでアミノ基を保護する。2)ホルムアルデヒドでアミノ基をメチル化する。3)UV照射によって2-ニトロベンジル基を脱保護する。4年後、この方法を利用して、Szostakらは、N-メチルバリン、N-メチルロイシン、N-メチルスレオニンの3種類が含まれたN-メチルペプチドの合成に成功している(Subtelny et al., JACS, 2008, 130, 6131-6136, Reconstituted cell-free translation system. E. coli)。
【0011】
Cornishらは、N-メチルアラニンまたはN-メチルフェニルアラニンをGUUコドン(バリン)に指定し、トリペプチドの翻訳合成に成功している(Tan et al., JACS, 2004, 126, 12752-12753, Reconstituted cell-free translation system. E. coli)。
【0012】
川上らは、アシルtRNA合成酵素様活性を持つRNA触媒(ARSリボザイム)であるフレキシザイムを利用して種々のN-メチルアミノ酸の導入に成功している(Kawakami et al., Chem. Biol., 2008, 15, 32-42. Reconstituted cell-free translation system. E. coli)。また3種類のN-メチルアミノ酸を10残基連続したN-メチルペプチドの合成に成功している。さらにN-メチルアミノ酸が4つ導入された環状ペプチドの合成も行っている。
【0013】
代表的なARSリボザイムについて、次の文献に記載されている(H. Murakami, H. Saito, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 655-662;H. Murakami, D. Kourouklis, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 1077-1084;H. Murakami, A. Ohta, H. Ashigai, H. Suga (2006) Nature Methods 3, 357-359 "A highly flexible tRNA acylation method for non-natural polypeptide synthesis"; N. Niwa, Y. Yamagishi, H. Murakami, H. Suga (2009) Bioorganic & Medicinal Chemistry Letters 19, 3892-3894 "A flexizyme that selectively charges amino acids activated by a water-friendly leaving group"; 及びWO2007/066627「多目的アシル化触媒とその用途」)。
【0014】
一方、翻訳系を用いたN-メチルアミノ酸をコードしたペプチドライブラリーの構築およびそれを応用した薬剤候補探索については、これまで1例しか知られていない。Robertsらは、N-メチルフェニルアラニンをGUAコドン(バリン)に指定し、2及び5、10残基のN-メチルペプチドを翻訳合成し、mRNAディスプレイ法と互換性があることを確かめている(Frankel et al., Chem. Biol., 2003, 10, 1043-1050. tRNA-depleted rabbit reticulocyte lysate)。また同グループは、架橋剤(disuccinimidyl glutarate, DSG)を利用したペプチド環状化方法と、N-メチルフェニルアラニンをランダムNNS(NはA、U、CまたはGのいずれかであり、SはCまたはG)領域のUAGコドンに指定したmRNAディスプレイ法を報告した(Millward et al., ACS Chem. Biol. 2007, 2, 625-634. Rabbit reticulocyte lysate)。その結果、標的タンパク質に結合する環状ペプチドが得られたものの、N-メチルフェニルアラニンはペプチド中に見いだされなかった。この結果は、Robertsらが構築したライブラリーそのもの品質(すなわち、N-メチルフェニルアラニンが導入されたペプチドがライブラリー化されているかの品質保証)が低いのか、活性ペプチドにN-メチルフェニルアラニンが含まれない結果なのかは明確でないが、本技術の成熟度では目的としたN-メチルアミノ酸含有特殊ペプチドの生理活性種を獲得するのが困難であることを示唆しているのは自明である。
【0015】
上記の例に代表されるように、N-メチルアミノ酸含有ペプチドのライブラリー化はこれまでの技術では達成されておらず、またそれを用いた薬剤候補探索の成功例は一例もない。
【0016】
4.In vitroディスプレイによるペプチドライブラリーの調製
In vitroディスプレイとは、表現型(phynotype)とその配列をコードした遺伝型(genotype)を非共有結合あるいは共有結合で連結することで表現型を遺伝型にディスプレイし、試験管に再構築された複製システムを用いて活性種を濃縮、増幅(セレクション)することを可能にするシステムを指す。本システムの最大の利点は、原核・真核生命体を媒体としないため、非常に大きな多様性をもったライブラリーを探索することができるため、高活性の生理物質(本特許に関してはペプチド)をセレクションすることができる。その典型的な比較例としては、大腸菌を複製媒体とするファージディスプレイでは10の7乗の多様性ライブラリーのセレクションが可能であるが、 In vitroディスプレイでは10の13乗に及ぶ多様性ライブラリーの探索が可能となる。In vitroディスプレイには、ribosomeディスプレイ、mRNAディスプレイ、RAPIDディスプレイ(未公開特許出願である特願2009-243240)等がある。その一例として、mRNAディスプレイを例に挙げ下記に説明するが、本明細書で開示される特殊ペプチド化合物のライブラリーは全てのIn vitroディスプレイに適応可能である。
【0017】
mRNAディスプレイは、ペプチドとその鋳型であるmRNAを結合させることにより、ペプチドのアミノ酸配列と核酸配列を対応付ける技術である。そのために、アシル化tRNAの末端アナログであるピューロマイシンを適当なリンカーを介してmRNAの3’末端に結合させ、これを翻訳反応に加えることで、ピューロマイシンがリボソームのA部位に入り込み、伸長中のペプチドと共有結合を形成し、結果として翻訳産物であるペプチド分子がピューロマイシンを介してmRNAと連結する(Roberts et al., Proc. Natl. Acd. Sci. USA, 1997, 94, 12297-12302、Nemoto et al., FEBS Lett., 1997, 414, 405-408、特許第3683282号広報(国際公開WO98/16636)、特許第3683902号広報、特許第3692542号広報(国際公開WO98/31700))。
【0018】
In vitroディスプレイでは、10の13乗の多様性を持つペプチドライブラリーの調製が可能であるが、これまで報告されたものではペプチドはタンパク質性アミノ酸のみから構成されている。複数種の特殊アミノ酸(N-メチルアミノ酸を含む)及び環状化構造を含むペプチドがその遺伝子型に提示されたライブラリーを作製し、セレクションに成功した実績は知られていない。
【0019】
5.HPVと子宮頸癌
子宮頸癌は、女性の癌では乳がんに次いで多く、世界では年間47万人の発症と23万人の死亡が、日本では年間1万人以上の発症と3千人以上の死亡が報告されている。子宮頸癌の発症には、ヒトパピローマウイルス(Human papillomavirus, HPV)感染、特に高リスク型(16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68, 73型)HPVの感染が必須である。その後、10〜30年の潜伏感染を経て、細胞が悪性形質を獲得することで子宮頸癌を発症する。一方、子宮頸癌は、HPV感染を予防することでほぼ100%予防可能な癌であり、実際にHPVワクチンであるCervarix(GlaxoSmithKline)とGardasil(Merck)が世界100カ国以上で使用され、2009年9月に日本でも承認された。しかし、これらのワクチンは感染者には無効であり、16型、18型HPVのキャプシドタンパク質を抗原としているため、それ以外の型のHPV感染には効果が無い。そのため、子宮頸癌治療薬の開発が望まれている。
【0020】
HPV感染細胞では、HPVゲノムが複製され、娘細胞に分配され、潜伏感染が拡大する。その過程の中で、HPVゲノムが宿主ゲノムに組み込まれることで、HPV初期遺伝子群がコードするタンパク質が高発現し、ウイルスゲノムの複製に有利な細胞内環境へと導く。特に、ウイルスタンパク質E6及びE7による細胞の不死化、増殖促進、がん抑制遺伝子の不活性化が重要であると考えられている。
【0021】
E7は、約100アミノ酸残基からなるタンパク質で、N末端にCR1(conserved region 1)、及びCR2、1つのジンクフィンガードメインから成る。CR2のLXCXEモチーフを介してRbファミリータンパク質(pRb, p107, p130)に結合する。Rbは、転写因子E2Fと複合体を形成して、E2F を不活性化し、細胞をG0期に停止させる。ところが、E7がRbと結合すると、E2Fは遊離し、活性化され、細胞周期が回転する。また、E7は、pRb及びμ-カルパインと相互に結合することで、pRbの分解も促進する。
【0022】
E6は、宿主細胞内のユビキチンリガーゼE6APとE6中のLXXLLモチーフを介して結合し、がん抑制因子p53のユビキチン化と分解を促進する。p53は、細胞周期をG1期に停止させ、また、DNA損傷時にはその修復を誘導し、損傷が高度な場合はアポトーシスを誘導する。そして、E7によるRbファミリータンパク質の不活性化を介した細胞周期の進行は、p53を介したアポトーシスを誘導する。E6は、これらのp53の役割を阻害することで、アポトーシスを回避し、ウイルスの増殖を促進していると考えられる。その他にも、E6-E6AP複合体は、細胞極性の維持や細胞増殖の制御を担っているPDZドメインを有するタンパク質群やテロメアーゼ抑制因子NFX1のユビキチン化と分解を促進し、多方面からガン化を誘導している。現在、入手可能な子宮頸癌細胞であるHeLa細胞、及び、SiHa細胞、Caski細胞の染色体には、それぞれHPV18、HPV16、HPV16のゲノムが組み込まれており、E6を高発現している。そして、siRNAによりE6またはE6APをノックダウンすることで、p53の蓄積及びアポトーシスの誘導が観測されており、E6の作用はE6APに依存していると考えられている。
【0023】
6.ユビキチンリガーゼE6AP
ユビキチンリガーゼE6AP(E6 Associated Protein、852アミノ酸残基)は、UBE3A遺伝子にコードされており、E6を介してがん抑制因子p53と結合し、そのユビキチン化と26Sプロテアソームによる分解を促進することで、1990年に発見された。E6APの約350アミノ酸残基からなるC末端ドメインはHECT(Homologous to E6AP Carboxyl-Terminus)ドメインと呼ばれ、ユビキチンリガーゼE3の大きなファミリーを形成している。ヒトにおいては約50種類、酵母においては5種類のHECTドメインを有するユビキチンリガーゼが確認されている。HECTドメインは、大きなN末端ローブ(約250アミノ酸残基)とC末端ローブ(約100アミノ酸残基)が短いヒンジ部分で連結されており、C末端ローブ中に活性化システインが存在する。ユビキチン化された活性化E2タンパク質は、HECTドメイン中のN末端ローブに結合し、ユビキチンをC末端ローブ中のシステインに転移し、ユビキチンチオエステル中間体を形成する。その後、HECTドメイン上流のドメインによってリクルートされた標的タンパク質のリシン側鎖のアミノ基とHECT上のユビキチンがイソペプチド結合することによって、標的のユビキチン化が起こる。これまでの研究において、E6は、E6AP中のHECTドメインより約120アミノ酸残基上流の18アミノ酸からなるα-ヘリックスに結合し、E6-E6AP複合体を形成する。この複合体は、p53と結合することで、p53のポリユビキチン化を行い、分解へと誘導する。
【0024】
これまでの研究において、子宮頸癌治療薬を目標にしたユビキチンライゲースE6APの阻害剤は存在しない。さらに、HECTドメインを有するユビキチンライゲースE3の阻害剤も存在しない。またヒト由来のE6APを標的にすることで、様々な高リスク型HPV由来の子宮頸癌に対して効用が見込める。
【先行技術文献】
【特許文献】
【0025】
【特許文献1】WO2007/066627
【特許文献2】特許第3683282号広報
【特許文献3】特許第3683902号広報
【特許文献4】特許第3692542号広報
【非特許文献】
【0026】
【非特許文献1】Bain et al., Tehtahedron, 1991, 47, 2389-2400.
【非特許文献2】Ellman et al., Science, 1992, 255, 197-200.
【非特許文献3】Chaung et al., Science, 1993, 259, 806-809.
【非特許文献4】Karginov et al. JACS, 1997, 119, 8166-8176.
【非特許文献5】Short et al., Biochemistry, 2000, 39, 8768-8781.
【非特許文献6】Merryman et al., Chem. Biol., 2004, 11, 575-582.
【非特許文献7】Subtelny et al., JACS, 2008, 130, 6131-6136.
【非特許文献8】Tan et al., JACS, 2004, 126, 12752-12753.
【非特許文献9】Frankel et al., Chem. Biol., 2003, 10, 1043-1050.
【非特許文献10】Millward et al., ACS Chem. Biol. 2007, 2, 625-634.
【非特許文献11】Kawakami et al., Chem. Biol., 2008, 15, 32-42.
【非特許文献12】Y. Shimizu et al., Nature Biotechnology, 2001, vol. 19, p.751-755
【非特許文献13】H. Murakami, H. Saito, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 655-662
【非特許文献14】H. Murakami, D. Kourouklis, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 1077-1084
【非特許文献15】H. Murakami, A. Ohta, H. Ashigai, H. Suga (2006) Nature Methods 3, 357-359
【非特許文献16】N. Niwa, Y. Yamagishi, H. Murakami, H. Suga (2009) Bioorganic & Medicinal Chemistry Letters 19, 3892-3894
【非特許文献17】Roberts et al., Proc. Natl. Acd. Sci. USA, 1997, 94, 12297-12302、
【非特許文献18】Nemoto et al., FEBS Lett., 1997, 414, 405-408
【発明の概要】
【発明が解決しようとする課題】
【0027】
大環状構造や特殊なアミノ酸を含む特殊ペプチドは、膜透過性や標的結合能力、生体内安定性に優れているため、新しい創薬シーズとして注目されている。現在、特殊ペプチドのライブラリーの供給は、天然物やペプチド固相合成に制限され、多様性や簡便性に乏しく、十分な薬剤探索が行われていない。
【0028】
本発明者らは、特殊ペプチドを翻訳合成により構築する技術を保有している。さらに、本発明者らは、翻訳合成された非環状の特殊ペプチドの分子内特異的反応を利用して、ペプチドを環状化する技術を保有している。
【0029】
本発明の課題は、上記の2つの技術をそれぞれ単独で、あるいは組み合わせて利用することにより、無細胞(in vitro)翻訳系を利用して特殊ペプチド化合物のペプチドライブラリーを構築すること、そしてin vitroディスプレイ法を利用して標的タンパク質に結合する特殊ペプチド化合物をスクリーニングするための技術を確立することである。
【課題を解決するための手段】
【0030】
本発明者らは、遺伝暗号リプログラミング技術を利用して、複数の特殊アミノ酸を含む特殊ペプチドのライブラリー(特殊ペプチドライブラリーと称する)を構築し、これをディスプレイ系と組み合わせることで、標的物質に高い結合能を有する特殊ペプチドアプタマーのスクリーニングを行う技術を確立した。
【0031】
具体的には、特殊ペプチドライブラリーのランダム配列に導入される特殊アミノ酸の例としてN-メチルアミノ酸を使用し、複数のN-メチルアミノ酸を含む環状特殊ペプチドライブラリーを構築した。標的の例としてユビキチンリガーゼE6APを使用し、標的に高い特異性を持つ環状N-メチルペプチドを獲得することに成功した。
【0032】
本発明の要旨は以下の通りである。
(1)次の工程を含む、ペプチドライブラリーから標的物質に結合する特殊ペプチドを選択する方法:
(i)特殊アミノ酸でアシル化されたtRNAを含む無細胞翻訳系によって、特殊アミノ酸がペプチド配列にランダムに導入された特殊ペプチドを含むライブラリーを調製する工程;
(ii)ペプチドライブラリーを標的物質に接触させる工程;及び
(iii)標的物質に結合する特殊ペプチドを選択する工程
であって、
前記(i)の工程において、ライブラリーを構成する各ペプチドが当該ペプチドをコードする核酸配列から翻訳され、核酸配列とその翻訳産物であるペプチドが連結され、
核酸配列において、ペプチドをコードする領域が、異なる複数のトリプレットの繰り返しからなるランダム配列を含み、ランダム配列中のトリプレットの少なくとも一部が特殊アミノ酸を指定する人為的なコドンに対応する配列である、前記方法。
【0033】
(2)前記(i)の工程が、アシルtRNA合成酵素様活性を持つRNA触媒を用いて特殊アミノ酸でtRNAをアシル化することを含む、(1)の方法。
(3)特殊アミノ酸でアシル化されるtRNAが、in vitro転写反応で調製されたtRNAである、前記方法。
【0034】
(4)前記(i)の工程が、ペプチドをコードする領域を含むmRNAのライブラリーを調製し、これを翻訳することを含む、(1)の方法。
(5)ペプチドをコードする領域が、さらに、
官能基1を持つアミノ酸を指定するコドン、及び
官能基2を持つアミノ酸を指定するコドン
に対応する配列を含み、
官能基1及び官能基2は結合形成反応が可能な一組の官能基であり、
前記(i)の工程において、特殊アミノ酸でアシル化されたtRNAのアンチコドンと特殊アミノ酸を指定する人為的なコドンの対合により特殊アミノ酸がペプチド配列に導入され、翻訳産物であるペプチドが官能基1と官能基2の間の結合形成反応によって環状化されることにより、ライブラリーが環状特殊ペプチドを含む、(1)の方法。
【0035】
(6)ランダム配列を構成するトリプレットが以下の配列からなるコドン:
N1N2Uコドン{N1及びN2はそれぞれ独立して、A、U、CまたはGのいずれかである}
N1N2Kコドン{N1及びN2はそれぞれ独立して、A、U、CまたはGのいずれかであり、Kは、CまたはGのいずれかである}、及び
N1N2N3コドン{N1、N2及びN3はそれぞれ独立して、A、U、CまたはGのいずれかである}、から選択される(1)の方法。
【0036】
(7)ランダム配列が、N1N2Uコドン、N1N2Kコドン、N1N2N3コドンのいずれかの2回以上の繰り返しからなる(6)の方法。
(8)官能基1及び官能基2が、以下の官能基の組(A)から(C):
【0037】
【化1】

(式中、X1はClまたはBrであり、そして、Arは置換基を有していてもよい芳香環である)のいずれか一組である、(5)の方法。
【0038】
(9)官能基1を持つアミノ酸がクロロアセチル基を持つアミノ酸であり、官能基2を持つアミノ酸がシステインである、(5)の方法。
(10)ペプチドをコードする領域が、以下の(a)〜(c):
(a)クロロアセチル基を持つアミノ酸を指定する開始コドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、NNU{Nは、A、U、CまたはGのいずれかのリボヌクレオチドである}コドンの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
を含み、開始コドンと、クロロアセチル基を持つアミノ酸でアシル化された開始tRNAのアンチコドンの対合により、クロロアセチル基を持つアミノ酸がペプチドN末端に導入され、ランダム配列中の特殊アミノ酸を指定する人為的なコドンと、特殊アミノ酸でアシル化された伸長用tRNAのアンチコドンとの対合により、特殊アミノ酸がペプチドに導入され、翻訳産物であるペプチドがクロロアセチル基とシステインのスルフィドリル基との間の結合形成反応によって環状化される、前記方法。
【0039】
(11)ライブラリーがリボソームディスプレイライブラリー、mRNAディスプレイライブラリー、及びRAPIDディスプレイライブラリーからなる群から選択されるいずれかである、前記方法。
【0040】
(12)前記(iii)の工程が、標的物質に結合した環状特殊ペプチドをコードする核酸配列を決定することを含む、(1)の方法。
(13)mRNAとその翻訳産物である環状特殊ペプチドの複合体からなるin vitroディスプレイライブラリーであって、ペプチドをコードする領域が、以下の(a)〜(c):
(a)クロロアセチル基を持つアミノ酸を指定する人為的なコドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、異なる複数のトリプレットの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
を含むmRNAライブラリーを、以下の(d)及び(e)のアミノアシルtRNA:
(d)前記(a)のコドンと相補的なアンチコドンを有する、クロロアセチル基を持つアミノ酸でアシル化された人工tRNA
(e)1種以上の特殊アミノ酸でアシル化された人工tRNA
並びに
(f)システイン、システインtRNA、及びシステイニルRS(CysRS)
を少なくとも含む再構成型の無細胞翻訳系で翻訳することにより得られる、前記in vitroディスプレイライブラリー。
【0041】
(14)環状特殊ペプチドと当該ペプチドをコードする核酸配列の複合体からなるin vitroディスプレイライブラリーを調製するためのキットであって、
(i)ペプチドをコードする領域が、以下の(a)〜(c)を含むmRNA:
(a)クロロアセチル基を持つアミノ酸を指定する人為的なコドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、異なる複数のトリプレットの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
及び
(ii)以下の(d)及び(e)のアミノアシルtRNA:
(d)前記(a)のコドンと相補的なアンチコドンを有する、クロロアセチル基を持つアミノ酸を持つアミノ酸でアシル化された人工開始tRNA、
(e)前記(b)の人為的なコドンと相補的なアンチコドンをそれぞれ有する、異なる特殊アミノ酸でそれぞれアシル化された人工伸長tRNA、
及び
(iii)システイン及びシステインでアシル化され得るtRNA、及び
(iv)単離されたリボソーム
を少なくとも含む、前記キット。
【0042】
(15)特殊アミノ酸が、N-メチルアミノ酸である、前記方法。
(16)標的物質が、ユビキチンリガーゼE6APである、(1)の方法。
(17)前記(16)の方法により得られた、Cyclo(-Ac-DWCDVMeSGRMeFMeGYMeFPC)G-OHである化合物MCP11。
【発明の効果】
【0043】
特殊ペプチドを翻訳合成により構築する技術及び/又はペプチドの環状化技術を利用して、特殊ペプチドライブラリーを構築することができる。さらに、これら2つの技術の特性を組み合わせる事で、Nメチルアミノ酸のような特殊アミノ酸を含んだ環状特殊ペプチドライブラリーを構築できる。
【0044】
特殊アミノ酸を含んだ環状特殊ペプチドライブラリーの翻訳合成技術及び当該技術をディスプレイ系と組み合わせる技術の確立により、プロテアーゼ耐性をもった高活性環状特殊ペプチドを短時間で且つ安価に探索・発見することが可能となった。
【図面の簡単な説明】
【0045】
【図1】(NNU)n(nは2以上の数)の長さを持つランダムmRNAの調製を示す。(実施例1)
【図2−1】N-メチルアミノ酸-tRNAの調製を示す。(実施例2)
【図2−2】D-ClAcW-tRNAの調製を示す。(実施例2)
【図3】環状N-メチルペプチドの翻訳合成を示す。(実施例3)
【図4】環状N-メチルペプチドライブラリーとmRNAディスプレイを組み合わせたセレクションを説明する図である。(実施例4)
【図5−1】セレクションの進行度(実施例4)を示す。
【図5−2】:DNA配列からのペプチド配列の解析を示す。(実施例5)
【図5−3】MCP11の翻訳合成及び結合確認を示す。(実施例5)
【図5−4】表面プラズモン共鳴法によるMCP11及び誘導体の親和性解析結果を示す。ビオチン化E6AP-HECTをストレプトアビジンチップに固定化し、各ペプチドを用いて親和性解析を行った。(実施例7)
【発明を実施するための形態】
【0046】
本発明は、次の工程を含む、ペプチドライブラリーから標的物質に結合する特殊ペプチド化合物をスクリーニングする方法に関する。
(i)特殊アミノ酸でアシル化されたtRNAを含む無細胞翻訳系によって、特殊アミノ酸がペプチド配列にランダムに導入された特殊ペプチドを含むライブラリーを調製し;(ii)得られたペプチドライブラリーを標的物質に接触させ;そして、(iii)標的物質に結合する特殊ペプチドを選択する。
【0047】
ペプチドライブラリーとは、多種類のペプチドで構成された集合体であり、スクリーニングとは、集合体から目的とする機能を備えたペプチドを選択する行為である。本発明においては、遺伝暗号リプログラミング技術を利用して、複数の特殊アミノ酸を含む特殊ペプチドの集合体からなるライブラリーを構築し、これをin vitroディスプレイ系と組み合わせることで、標的タンパク質に高い結合能を有するペプチドアプタマーのスクリーニングを行う。したがって、前記(i)の工程は、各ペプチドをコードする核酸からなるライブラリーを調製して、これを翻訳すること、及び核酸とその翻訳産物であるペプチドを連結し、これにより表現型(ペプチドのアミノ酸配列)が遺伝型(核酸配列)にディスプレイされたライブラリーを構築することを含む。
【0048】
遺伝暗号のリプログラミング
遺伝暗号のリプログラミングとは、既存コドンに特殊アミノ酸を人為的に割り当てることである。特殊アミノ酸とは、天然の翻訳で使用される20種類のタンパク質性アミノ酸とは構造の異なるアミノ酸全般を指し、人工的に合成したものであっても、自然界に存在するものであってもよい。つまり、タンパク質性アミノ酸の側鎖構造の一部が化学的に変更・修飾された非タンパク質性アミノ酸や人工アミノ酸、D体アミノ酸、N-メチルアミノ酸、N-アシルアミノ酸、β-アミノ酸、アミノ酸骨格上のアミノ基やカルボキシル基が置換された構造を有する誘導体等が全て含まれる。N-メチルアミノ酸は、アミノ酸のα位アミノ基にメチル基が一つ導入された特殊アミノ酸である。
【0049】
天然の翻訳では、mRNAの3つの塩基の並び(トリプレット)が一つのコドンとして一つのタンパク質性アミノ酸を指定しており、その並びに対応するペプチドが合成される。このとき、コドンとアミノ酸との対応付けは、以下の2段階で行われる。(i)tRNAの末端にアミノアシルtRNA合成酵素(ARS)が対応するアミノ酸を連結する。(ii)tRNAのアンチコドンが対応するmRNAのコドンと対合することにより、mRNAの情報に沿ってtRNA上のアミノ酸が重合されペプチドが合成される。
【0050】
こうしたコドンとアンチコドンとの対応関係は、ほとんど普遍的に決定されており、64種類のコドンそれぞれに、20種類のタンパク質性アミノ酸のいずれか一つが割り当てられている。しかしながら、再構成型の翻訳系と人工アミノアシル化RNA触媒フレキシザイムを利用することで、この遺伝暗号をリプログラミングすることができる。
【0051】
再構成型の翻訳系とは、リボソーム、翻訳因子、tRNA、アミノ酸、及びATPやGTP等のエネルギーソースなど、タンパク質やペプチドの翻訳合成に関わる因子をそれぞれ単離・精製し、混ぜ合わせた翻訳系である。例えば、大腸菌のリボソームを用いる系として次の文献に記載された技術が公知である:H. F. Kung, B. Redfield, B. V. Treadwell, B. Eskin, C. Spears and H. Weissbach (1977) “DNA-directed in vitrosynthesis of beta-galactosidase. Studies with purified factors” The Journal of Biological Chemistry Vol. 252, No. 19, 6889-6894 ; M. C. Gonza, C. Cunningham and R. M. Green (1985) “Isolation and point of action of a factor from Escherichia coli required to reconstruct translation” Proceeding of National Academy of Sciences of the United States of America Vol. 82, 1648-1652 ; M. Y. Pavlov and M. Ehrenberg (1996) “Rate of translation of natural mRNAs in an optimized in Vitro system” Archives of Biochemistry and Biophysics Vol. 328, No. 1, 9-16 ; Y. Shimizu, A. Inoue, Y. Tomari, T. Suzuki, T. Yokogawa, K. Nishikawa and T. Ueda (2001) “Cell-free translation reconstituted with purified components” Nature Biotechnology Vol. 19, No. 8, 751-755;H. Ohashi, Y. Shimizu, B. W. Ying, and T. Ueda (2007) “Efficient protein selection based on ribosome display system with purified components”Biochemical and Biophysical Research Communications Vol. 352, No. 1, 270-276。
【0052】
一方、フレキシザイム(flexizyme)は、任意のtRNAに任意のアミノ酸またはヒドロキシ酸を連結することのできる人工RNA触媒である。例えば、以下の文献に記載されたものが公知である:H. Murakami, H. Saito, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 655-662; H. Murakami, D. Kourouklis, and H. Suga, (2003), Chemistry & Biology, Vol. 10, 1077-1084; H. Murakami, A. Ohta, H. Ashigai, H. Suga (2006) Nature Methods 3, 357-359 "The flexizyme system: a highly flexible tRNA aminoacylation tool for the synthesis of nonnatural peptides"; N. Niwa, Y. Yamagishi, H. Murakami, H. Suga (2009) Bioorganic & Medicinal Chemistry Letters 19, 3892-3894 "A flexizyme that selectively charges amino acids activated by a water-friendly leaving group";及びWO2007/066627「多目的化アシル化触媒とその用途」。フレキシザイムは、原型のフレキシザイム(Fx)、及び、これから改変されたジニトロベンジルフレキシザイム(dFx)、エンハンスドフレキシザイム(eFx)、アミノフレキシザイム(aFx)等の呼称でも知られる。
【0053】
遺伝暗号のリプログラミングには、翻訳系の構成因子を目的に合わせて自由に取り除き、必要な成分だけを再構成してできる翻訳系を利用する。例えば、特定のアミノ酸を除去した翻訳系を再構成すると、当該アミノ酸に対応するコドンが空きコドンになる。続いて、フレキシザイムを利用して、その空きコドンに相補的なアンチコドンを有するtRNAに特殊アミノ酸を連結し、これを加えて翻訳を行う。これによって、特殊アミノ酸がそのコドンでコードされることになり、除去したアミノ酸の代わりに特殊アミノ酸が導入されたペプチドが翻訳される。
【0054】
あるいは、特定のアミノ酸に対応する天然由来のtRNAを使用しないことによっても、その特定のアミノ酸に対応するコドンを空きコドンにできる場合がある。例えば、複数個のコドンに対応する天然由来のtRNAの代わりに、修飾塩基を含まない、in vitro合成されたサプレッサーtRNAに特殊なアミノ酸を連結したものを用いることで、そのサプレッサーtRNAに対応するコドンが特殊アミノ酸のための人為的なコドンとしてリプログラミングされる。本明細書において、tRNAは天然のtRNAと人工的に構築したtRNA(人工tRNA)の両方を指す。人工tRNAの典型的な例は、T7ポリメラーゼのような適当なRNAポリメラーゼを用いてin vitro転写により調製されたtRNAである。
【0055】
遺伝暗号のリプログラミングにより、適当な配列の鋳型mRNAに基づくin vitro翻訳産物として、様々な特殊ペプチドを翻訳合成することができる。特殊ペプチドは、フレキシザイムと再構成型翻訳系を組み合わせた系で合成可能なあらゆる翻訳産物を含む。フレキシザイムを利用して、天然の20種類のタンパク質性アミノ酸以外に、様々な側鎖を有するアミノ酸、β-アミノ酸、γ-アミノ酸及びδ-アミノ酸、D-アミノ酸、アミノ酸骨格上のアミノ基やカルボキシル基が置換された構造を有する誘導体でtRNAをアシル化することができる。したがって、特殊ペプチドの意味には、これらの様々な基質を構成要素とする重合体が含まれる。さらに、特殊ペプチドは、主鎖骨格として通常のアミド結合とは異なる構造も有し得るものである。例えば、アミノ酸とヒドロキシ酸から構成されるデプシペプチド、ヒドロキシ酸が連続して縮合したポリエステル、N-メチルペプチド、N-末端に様々なアシル基(アセチル基、ピログルタミン酸、脂肪酸など)を有するペプチドも、特殊ペプチドに含まれる。
【0056】
本願の実施例では、特殊ペプチドの例として、遺伝暗号リプログラミング技術を利用して、人為的なコドンでN-メチルアミノ酸を指定することにより得られるN-メチルペプチドを具体的に示している。N-メチルペプチドとは、N-メチルアミノ酸を一つ以上含むペプチドの総称である。N-メチルペプチドには、α-アミノ基がメチル化されたアミノ酸(N-メチルアミノ酸)を含むことにより、ペプチド主鎖のペプチド結合(-NHCO-)の窒素部分がメチル化されたN-メチルペプチド結合が導入されている。
【0057】
従来技術の項で述べた川上らの論文では、遺伝暗号のリプログラミングにより、既存コドンにN−メチルアミノ酸を割り当てることで、N-メチルアミノ酸として、N-メチルグリシン、N-メチルアラニン、N-メチルセリン、N-メチルスレオニン、N-メチルシステイン、N-メチルメチオニン、N-メチルグルタミン、N-メチルヒスチジン、N-メチルフェニルアラニン、N-メチルチロシン、N-メチルトリプトファン、N-メチルノルバリン、N-メチルノルロイシン、N-メチル-p-ニトロフェニルアラニン、N-メチル-p-メトキシフェニルアラニンをペプチドに導入できることが示された。同様のN-メチルアミノ酸を、本発明においても使用可能である。
【0058】
人為的なコドン
天然の翻訳では、以下に示す普遍暗号表に従って、64種類のコドンそれぞれに、20種類のタンパク質性アミノ酸及び翻訳の終止が割り当てられている。
【0059】
【表1】

これに対し、本発明においては、遺伝暗号のリプログラミングにより書き換えられ、普遍暗号表の既存の遺伝暗号とは異なる特殊アミノ酸をコードするコドンを人為的なコドンと称する。
【0060】
コドンとアンチコドンの対応は、相補的な塩基の対合に依存する。リボソーム上の翻訳反応において、特殊アミノ酸を連結したtRNAのアンチコドンと、特殊アミノ酸を指定するmRNA上の人為的なコドンが対合することにより、特殊アミノ酸がペプチド鎖に導入される。
【0061】
塩基の対合とは核酸の塩基のうち定まった組み合わせの2個が互いに水素結合により塩基対形成することをいう。塩基対を形成し得る塩基の組み合わせは互いに「相補的」であるという。DNAではアデニン(A)とチミン(T)、及び、グアニン(G)とシトシン(C)、RNAではAとウラシル(U)、及び、GとCが対合する。さらに、RNAではG−A、G−Uのようないわゆる非ワトソン−クリック塩基対も熱力学的に安定な塩基対として存在するので、本明細書においてはこれらの組み合わせも相補的であるという。
【0062】
本願実施例で用いた人為的なコドンとアンチコドンの対応の例で説明する。例えば、MeAlaのコドンは5’-GCU-3’であり、完全に相補鎖を組むtRNAのアンチコドンは、3’-CGA-5’である。一般的には5’側の塩基から記述するので、これを5’-AGC-3’と書く。さらに、コドンの3’側第三塩基とアンチコドンの5’側第一塩基の相補鎖形成は、Wobble則により、ワトソン−クリック型の塩基対合以外にUとGのペアなどが許容される場合がある。したがって、MeAlaのコドン5’-GCU-3’は、tRNAのアンチコドン5’-GGC-3’で正しく読み取ることができる。
【0063】
本発明では、ペプチド鎖伸長反応で使用されるコドンに加えて、開始コドンも書き換えることができる。開始コドンは、翻訳の開始を指定するコドンであり、mRNA上でペプチドのN末端となる開始アミノ酸をコードする。mRNAの翻訳の開始には、開始tRNAと呼ばれる特定のtRNAが必要である。翻訳が始まるには、アミノアシル化された開始tRNAが、開始因子(IF)とともにリボソームの小サブユニットに結合し、リボソームの小サブユニットがmRNA上の開始コドンに結合する。開始tRNAは開始コドンに対応するアンチコドンを有し、開始コドンを認識する。普遍暗号表においては、開始コドンとしては一般的にはメチオニンのコドンであるAUGが用いられるため、開始tRNAはメチオニンに対応するアンチコドンを有し、開始tRNAは必ずメチオニン(原核細胞ではホルミルメチオニン)を運ぶ。しかしながら、遺伝暗号のリプログラミングを利用すると、開始アミノ酸がメチオニンに限定されない。つまり、開始tRNAにメチオニン以外の任意のアミノ酸を結合して翻訳を開始させることができる。また、フレキシザイムを用いることにより、任意のアンチコドンで置換された開始tRNAに任意の開始アミノ酸を結合することにより、開始コドンもAUGに限定されない。つまり、開始コドンとして他の人為的なコドンを割り当てることも可能である。
【0064】
ペプチドの環状化
本発明においては、翻訳合成された非環状の特殊ペプチドの分子内特異的反応を利用して、ペプチドが環状化される。ペプチドの環状化は、以下の工程(i)及び(ii)により実施される。
(i)結合形成反応が可能な一組の官能基である官能基1及び官能基2を分子内に有する非環状ペプチド化合物を翻訳合成によって合成する工程;及び
(ii)前記官能基1及び官能基2の結合形成反応によって前記非環状ペプチド化合物を環状化する工程。
【0065】
結合形成反応が可能な一組の官能基とは、当該一組の官能基間、すなわち官能基1と官能基2との間で結合形成反応が可能であり、そして、その反応の結果として、非環状ペプチド化合物を環状ペプチド化合物とする官能基の組のことである。そのような一組の官能基としては、結合形成反応が可能な官能基の組み合わせであれば、特に制限はない。また、官能基間の反応の形式についても特に制限はなく、置換反応、付加反応、縮合反応及び環状化付加反応等、様々な反応形式であることができ、また、反応によって形成される結合の形式(単結合、二重結合及び三重結合等)及びその数についても特に制限はない。
【0066】
一組の官能基としては、例えば、−CH2−L(Lは−Cl、−Br及び−OSO2CH3等の脱離基を表す)と求核性官能基(−OH、−NH2及び−SH等)の組が挙げられる。官能基1及び官能基2の結合形成反応の一例は二つのシステイン残基によるジスルフィド結合により環状構造の形成である。しかしながらジスルフィド結合は生体中で容易に還元されてしまう。したがって、安定な環状構造を形成するためには、官能基1及び官能基2の結合は、非還元性の結合であることが好ましい。本発明者らは以前に、翻訳された直鎖状のペプチドを非還元性の結合形成によって環状化させる手法を開発し、報告した(Goto et al., ACS Chem. Biol., 2008, 3, 120-129、WO2008/117833「環状ペプチド化合物の合成方法」)。同様の方法を本願でも利用可能である。非環状ペプチド化合物とは、上述の特殊ペプチドに包含される非環状の化合物であり、直鎖状のペプチドと同義である。
【0067】
本発明で利用可能な、好ましい一組の官能基1及び官能基2の例を以下に示す。
【0068】
【化2】

(式中、X1はClまたはBrであり、そして、Arは置換基を有していてもよい芳香環である)
Arの置換基は特に制限はないが、例えば、水酸基、ハロゲン原子、炭素原子数1から6のアルキル基、炭素原子数1から6のアルコキシ基、フェニル基、フェノキシ基、シアノ基及びニトロ基等が挙げられる。
【0069】
(A)の組の場合、官能基間での置換反応により式(A−3)の構造を与えることができる。また(B)及び(C)の場合は、官能基間での環状化反応により、それぞれ(B−3)及び(C−3)の構造を与えることができる。
【0070】
【化3】

非環状ペプチド化合物に存在する一組の官能基間での結合形成によって環が形成されるため、非環状ペプチド化合物を構成する要素(典型的には、アミノ酸)を一つの単位として、そのような一組の官能基は、異なった構成要素の単位上に存在することが必要である。説明の便宜のため、そのような構成要素をアミノ酸化合物、構成要素の単位をアミノ酸化合物単位と称する。すなわち、非環状ペプチド化合物は、一組の官能基を異なったアミノ酸単位上に有する化合物である。非環状ペプチド化合物において、一方の官能基を有するアミノ酸化合物単位と他方の官能基を有するアミノ酸化合物単位との間に少なくとも一つのアミノ酸化合物単位が存在することが好ましく、例えば、一乃至二十、または二乃至十、または三乃至五のアミノ酸化合物の単位が存在することが好ましい。
【0071】
本発明では、このような一組の官能基を有する非環状ペプチド化合物が無細胞翻訳系での翻訳合成によって合成される。環状化のためのこれらの官能基を有するアミノ酸がタンパク質性アミノ酸ではなく、特殊アミノ酸である場合は、遺伝暗号リプログラミング技術を利用してペプチド鎖に導入する。
【0072】
第一の態様において、非環状ペプチド化合物の翻訳合成は、(a)官能基1を有するアミノ酸でアミノアシル化された開始tRNA、(b)官能基2を有するアミノ酸及び該アミノ酸でアミノアシル化されるtRNAとを少なくとも含む無細胞翻訳系、(c)前記開始tRNAのアンチコドンに対応するコドン、及び前記官能基2を有するアミノ酸でアミノアシル化されるtRNAのアンチコドンに対応するコドン、とを所望の位置に有するmRNAを提供し、前記(a)のアミノアシル化された開始tRNA、及び前記(c)のmRNAを前記(b)の無細胞翻訳系に加えて非環状ペプチド化合物を合成する工程、を含む方法によって行われる。
【0073】
第一の態様の方法によって得られる非環状ペプチド化合物では、官能基1を有する特殊アミノ酸で翻訳が開始し、官能基2は、ペプチド鎖伸長反応において導入されるタンパク質性アミノ酸残基上に存在することになる。
【0074】
官能基1はアミノ酸のα−炭素及びβ−炭素等の炭素原子上の置換基として存在することができ、またはそのような炭素原子上の置換基上に存在することができる。また、官能基1は、アミノ基窒素原子上の置換基として存在することができ、またはそのようなアミノ基窒素原子上の置換基上に存在することができる。官能基1は官能基2と結合形成反応できることが必要である。後述するように、官能基2は、基本的に、システイン及びチロシン等に含まれる求核性官能基(−SH、−COOH及び−OH等)であるため、官能基1としては適切な脱離基を有する官能基、例えば−CH2−L(Lは−Cl、−Br及び−OSO2CH3等の脱離基を表す)の基を有する官能基であることが好ましい。
【0075】
官能基1を有する特殊アミノ酸は、具体的には、例えば、アミノ基窒素原子上に前記(A−1)の基を有するアミノ酸化合物であることが好ましい。アミノ酸化合物の具体例としては、例えば、式(1)の化合物
【0076】
【化4】

が挙げられる。式(1)中、R1及びR2は水素原子またはα位の炭素原子に炭素で連結した任意の置換基を表す。R1及びR2は、具体的には、例えば、20種類のタンパク質性アミノ酸のα−炭素上の置換基のいずれかであることが好ましい。そして、R1及びR2は、タンパク質性アミノ酸のα−炭素上の置換基の組み合わせのいずれかであることが好ましい。式(1)の化合物の具体例としては、例えば、式(1−1):
【0077】
【化5】

が挙げられる。
【0078】
官能基2を有するアミノ酸は、例えば、システイン、アスパラギン酸、グルタミン及びチロシン等である。すなわち、官能基2としては−OH、−SH、−C(=O)NH2及び−COOH等である。官能基2を有するアミノ酸としては、システインが好ましい。官能基2を有するアミノ酸は、該アミノ酸及び対応するtRNAを少なくとも含む再構成型の翻訳系でぺプチド鎖伸長反応において導入される。
【0079】
別の方法として、環状ペプチド化合物合成のための第2の態様においては、官能基1を有するアミノ酸及び官能基2を有するアミノ酸の両方が特殊アミノ酸である。官能基1及び官能基2は、アミノ基窒素原子上の置換基に、または、α−炭素及びβ−炭素等の炭素原子上の置換基に存在することができる。
【0080】
窒素原子上に存在する場合、例えば、式(20)乃至式(24):
【0081】
【化6】

(式中、nは、1以上の整数、例えば1乃至10の数を表し、X1は前記と同義である)のようなアシル置換基、またはアシル置換基の一部として、アミノ酸アミノ基の窒素原子上に導入することができる。
【0082】
α−炭素及びβ−炭素等の炭素原子上に存在する場合、例えば、式(25)乃至式(30):
【0083】
【化7】

(式中、nは、1以上の整数、例えば1乃至10の数を表し、X1は前記と同義である)のような基として導入することができる。
【0084】
官能基1を有するアミノ酸化合物の具体例としては、例えば、式(2)の化合物が挙げられ、官能基2を有するアミノ酸化合物の具体例としては、例えば、式(3)の化合物を挙げることができる。
【0085】
【化8】

式(2)中、R1及びR2は前記と同様であり、Z1は任意の置換基を表す。Z1としては、例えば、水酸基、ハロゲン原子、炭素原子数1乃至6のアルキル基、炭素原子数1乃至6のアルコキシ基、フェニル基、フェノキシ基、シアノ基及びニトロ基等が挙げられる。式(2)の化合物の具体例としては、例えば、式(31):
【0086】
【化9】

が挙げられる。
【0087】
さらに別の方法として、環状ペプチド化合物合成のための第3の態様においては、官能基1及び官能基2の両方が、ペプチド鎖伸長反応において導入されるアミノ酸残基上に存在する。官能基1を有するアミノ酸は特殊アミノ酸であり、遺伝子リプログラミング技術を用いて、ペプチド鎖伸長反応において導入される。第一の態様と同様に、官能基2を有するアミノ酸はタンパク質性アミノ酸であり、官能基2は、基本的に、システイン及びチロシン等に含まれる求核性官能基(−SH、−COOH及び−OH等)であるため、官能基1としては適切な脱離基を有する官能基、例えば−CH2−L(Lは−Cl、−Br及び−OSO2CH3等の脱離基を表す)の基を有する官能基であることが好ましい。
【0088】
官能基1を有するアミノ酸化合物の具体例としては、例えば、式(4)の化合物が挙げられる。
【0089】
【化10】

式(4)中、mは1乃至10の整数を表す。式(4)の化合物の具体例としては、mが2の化合物を挙げることができ、この化合物は、例えば、2,4−ジアミノ酪酸から製造することができる。官能基2を有するアミノ酸化合物としては、システインが好ましい。
【0090】
さらに別の方法として、環状ペプチド化合物合成のための第4の態様においては、官能基1及び官能基2の両方が、ペプチド鎖伸長反応において導入されるアミノ酸残基上に存在する。官能基1を有するアミノ酸と官能基2を有するアミノ酸の両方が特殊アミノ酸であり、遺伝子リプログラミング技術を用いて、ペプチド鎖に導入される。
【0091】
官能基1及び官能基2は、アミノ基窒素原子上の置換基に、または、α−炭素及びβ−炭素等の炭素原子上の置換基に存在することができる。官能基1及び官能基2は、α−炭素及びβ−炭素等の炭素原子上の置換基に存在することが好ましい。官能基1及び官能基2としては、例えば、第2の態様において例示した基を挙げることができる。
【0092】
官能基1を有するアミノ酸の具体例としては、例えば、式(5)または式(7)の化合物が挙げられる。
【0093】
【化11】

これらの式中、Z1及びmは前記と同義である。式(7)の化合物の具体例としては、例えば、式(32):
【0094】
【化12】

が挙げられる。
【0095】
官能基2を有するアミノ酸の具体例としては、例えば、式(6)または式(8)の化合物を挙げることができる。
【0096】
【化13】

式(6)中、mは前記と同義である。
【0097】
また、官能基1を有するアミノ酸化合物としては(A−1)の官能基を有する化合物(例えば、前記式(4)の化合物)、官能基2を有するアミノ酸化合物としてはホモシステインやメルカプトノルバリン等の−SH基を有する特殊アミノ酸、という組み合わせを挙げることもできる。
【0098】
上述のようにして合成された非環状ペプチド化合物を環状化することによって環状ペプチド化合物が合成される。官能基1及び官能基2の結合形成反応の条件は官能基の組の種類に応じて、設定される。
【0099】
非環状ペプチド化合物の環状化は、非環状ペプチド化合物を単離した後、適切な反応条件にさらすことによって行うことができる。または、非環状ペプチド化合物を単離することなく、無細胞翻訳系を適切な反応条件に調整することによって環状化を行うことができる。また、一組の官能基の種類によっては、非環状ペプチド化合物を合成するための無細胞翻訳系の条件下において環状化することがあり、この場合は、特段の反応条件の調整を行うことなく、環状ペプチド化合物を得ることができる。
【0100】
非環状ペプチド化合物の環状化のための反応条件は、例えば、一組の官能基が、−CH2−L(Lは−Cl及び−Br等の脱離基を表す)と求核性官能基−SH、の組である場合、例えば、非環状ペプチド化合物を単離した後、適当な溶媒中で加熱する(例えば40から100℃)ことによって、または、単離することなく無細胞翻訳系を例えば35から40℃で数時間(例えば、37℃で3時間)保つことによって、行うことができる。
【0101】
一組の官能基が前記組(A)の場合、例えば、非環状ペプチド化合物を単離した後、適当な溶媒中で加熱する(例えば40から100℃)ことによって、または、単離することなく無細胞翻訳系を例えば35から40℃で数時間(例えば、37℃で3時間)保つことによって、環状化することができる。また、官能基(A−1)と(A−2)との反応性は比較的高いため、一組の官能基が前記組(A)の場合、非環状ペプチド化合物合成のための無細胞翻訳系内において当該官能基の反応が進行し、無細胞翻訳系より環状ペプチド化合物として単離されることがある。
【0102】
一組の官能基が前記組(B)の場合、無細胞翻訳系より単離した非環状ペプチド化合物を、適当な溶媒中、一価の銅塩(硫酸銅(II)をアスコルベイトで系内で還元しながら生産する)で処理することによって環状化(ヒュースゲン(Huisgen)環化)して(B−3)とすることができる。
【0103】
一組の官能基が前記組(C)の場合、非環状ペプチド化合物を単離した後、適当な溶媒中、フェリシアン化カリウム(K3[Fe(CN)6])で処理することによって反応させ(C−3)とすることができる。
【0104】
後述の実施例においては、無細胞翻訳系の条件下において環状化することが可能な例として、両端にそれぞれクロロアセチル基とシステインを配置したペプチド配列を翻訳合成して得られる環状ペプチドが記載されている。この場合、遺伝暗号リプログラミング技術を利用して官能基1としてクロロアセチル基を有するペプチドを合成する。このとき、ペプチド中にシステイン残基を配置しておくと、翻訳後に自発的にチオール基がクロロアセチル基に求核攻撃し、ペプチドがチオエーテル結合により環状化する。ペプチドのN末端にクロロアセチル基を導入する場合は、クロロアセチル基を持つアミノ酸でアシル化された開始tRNAを翻訳系に加えてペプチドを合成する。あるいは、クロロアセチル基をN末端以外の場所に配置することもでき、その場合は、クロロアセチル基を持つアミノ酸で伸長tRNAをアシル化したものを使用する。
【0105】
無細胞翻訳系
翻訳系とは、ペプチド翻訳合成のための方法及びキット(物)の両方を含む概念である。本発明において、特殊ペプチドライブラリーの調製に使用される無細胞翻訳系は、公知の再構成型の翻訳系をさらに細分化し、より不純物の少ない系を構築して利用することが好ましい。従来の系と対比させながら、本発明で利用可能なキット(物)としての翻訳系の具体的な構成成分について説明する。
【0106】
翻訳系の構成成分の具体例としては、リボソーム、IF群、EF群、RF群、RRF、目的のペプチド合成に最低限必要となる天然アミノ酸・tRNA・特異的なARSタンパク質質酵素のセット、翻訳反応のためのエネルギーソース、などがある。
【0107】
リボソームとしては、大腸菌から単離され、精製されたリボソームが好適に利用される。
蛋白質類では、翻訳開始因子(例えば、IF1、IF2、IF3)、翻訳伸長因子(例えばEF-Tu、EF-Ts、EF-G)、翻訳終結因子(例えば、RF1、RF2、RF3、RRF)、エネルギーソース再生のための酵素(例えばcreatine kinase, myokinase, pyrophosphatase, nucleotide-diphosphatase kinase)を使用する。この中で、翻訳終結因子・エネルギーソース再生のための酵素の添加は任意である。鋳型DNAからの転写を行うためにT7 RNA polymeraseを加えることもあるが、あらかじめ転写したmRNAを翻訳系に加える場合、RNA polymeraseの添加は不要である。
【0108】
その他、従来の系と同様、適当な緩衝溶液、翻訳反応のエネルギーソースとしてのNTP類、Creatine phosphate、リボソーム活性化、RNA安定化、タンパク質安定化のために必要な因子等を適宜使用することができる。また、通常の翻訳反応では、開始コドンAUGには、開始tRNAにより、N-ホルミルメチオニンが規定されるため、10-formyl-5,6,7,8-tetrahydroforlic acid(Baggott et al., 1995)のようなホルミルドナーが必須であるが、本発明において特殊アミノ酸で翻訳反応を開始する場合は、ホルミルドナーは任意である。同様の理由で、methionyl-tRNA formyltransferase(MTF)も必須でない。
【0109】
本発明で利用される翻訳系において、天然のタンパク質性アミノ酸に対しては、従来の系と同様に、対応する天然のtRNA及びARSを利用することができる。天然tRNAの例は、大腸菌を集め、破砕し、そこからtRNA画分を精製した混合物であり、市販品も入手可能である。天然tRNA中の特定のA、U、C、Gは、酵素によって化学修飾を受けている。あるいは、試験管内で転写した天然配列をもつtRNAの使用も可能である。一方、特殊アミノ酸に対しては、天然tRNAではなく、オルソゴナルtRNAとしてtRNA転写産物である人工tRNAを利用することが好ましい。人工tRNAは、DNAを鋳型として適当なRNAポリメラーゼを用いたin vitro転写反応で調製可能である。このような人工tRNAには、化学修飾は全く存在しない。翻訳産物がタンパク質性アミノ酸を含まない特殊ペプチドである場合、タンパク質性アミノ酸用の天然tRNA及びARSは不要であり、人工tRNAのみで特殊ペプチドの合成を実施することができる。
【0110】
翻訳産物であるペプチドに特殊アミノ酸を導入するためには、予め特殊アミノ酸でアシル化されたオルソゴナルtRNAを翻訳系に加える。好ましい態様において、特殊アミノ酸でアシル化されたtRNAは、他のtRNAやARSが存在しない条件で、フレキシザイムを用いて、単離されたオルソゴナルtRNAの3’末端に特殊アミノ酸を結合することにより調製される。あるいは、化学的あるいは酵素的に特殊アミノ酸をtRNAにチャージしたものも、原理的には使用可能である。
【0111】
特殊ペプチドをコードする鋳型核酸
本発明では、無細胞翻訳系において、ペプチドをコードする領域にランダム配列を持つ鋳型核酸(mRNAもしくは対応するDNA)から翻訳合成を行うことで、ランダムなアミノ酸配列を持つペプチドライブラリーを合成する。さらに、翻訳系をin vitro ディスプレイ技術と組み合わせる事で、ライブラリーを構成するペプチドが当該ペプチドをコードする核酸配列を伴った状態でスクリーニングを行う。言い換えると、遺伝情報が、その翻訳産物であるペプチドとして提示(ディスプレイ)されているディスプレイライブラリーから、ペプチドアプタマーの選択を行う。これにより、ライブラリー中のそれぞれのランダムペプチド分子に、分子生物学的手法により増幅及び読み取りが可能なタグが付加されている事になる。
【0112】
in vitro ディスプレイとは、無細胞翻訳系(in vitro翻訳系ともいう)を用いて合成されたペプチドが遺伝情報と対応付けて提示されたものであり、リボソームディスプレイ、mRNAディスプレイ、DNAディスプレイ、RAPIDディスプレイ等が公知である。いずれのディスプレイも、mRNAもしくはDNAに記録された遺伝情報と、その遺伝情報によってコードされるペプチドを連結することにより、[遺伝情報]−[翻訳産物]の複合体として対応付けるメカニズムを有する。リボソームディスプレイにおいては、mRNA−リボソーム−ペプチドの3者が複合体を形成する。mRNAディスプレイ及びRAPIDディスプレイにおいては、mRNA−ペプチドの複合体が形成される。DNAディスプレイにおいては、DNA−ペプチドの複合体が形成される。本発明においては任意のin vitro ディスプレイライブラリーの利用が可能である。
【0113】
本発明では、ペプチドのアミノ酸配列に対応する鋳型であるRNAもしくはDNAの配列が、特殊ペプチドのランダムなライブラリーをコードするように設計される。具体的には、塩基配列においてペプチドをコードする領域が、異なる複数のトリプレットの繰り返しからなるランダム配列を含み、ランダム配列中のトリプレットの少なくとも一部が特殊アミノ酸を指定する人為的なコドンに対応する配列である。
【0114】
本発明の別の態様では、RNAもしくはDNAの配列が、環状特殊ペプチドをコードするように設計される。具体的には、塩基配列においてペプチドをコードする領域が、mRNA配列の5’から3’の向きに沿って、次の(a)から(c)に対応するような塩基配列を順に含む:
(a)官能基1を持つアミノ酸を指定するコドン;
(b)異なる複数のトリプレットの繰り返しからなるランダム配列、及び
(c)官能基2を持つアミノ酸を指定するコドン。
【0115】
ランダムなmRNA配列は、その翻訳産物であるランダムなアミノ酸配列中に特殊アミノ酸が一定の確率で現れるように設計される。すなわち、上記(b)のランダム配列中のトリプレットの少なくとも一部が特殊アミノ酸を指定する人為的なコドンとなることにより、翻訳産物であるランダムペプチドのアミノ酸配列の一部に特殊アミノ酸が導入される。特殊アミノ酸の導入は、リボソーム上のペプチド鎖伸長反応において、特殊アミノ酸を連結した伸長反応用tRNAのアンチコドンと、特殊アミノ酸を指定する人為的なコドンが対合することにより達成される。さらに、結合形成反応が可能な一組の官能基である官能基1及び官能基2の間の結合形成反応によって、翻訳産物であるペプチドが環状化される。上述したように、特殊アミノ酸の導入のために使用されるtRNAは、in vitro転写反応で調製された人工tRNAであることが好ましい。
【0116】
本発明では、目的に合わせて最適化された成分からなる無細胞翻訳系に、翻訳の鋳型となる塩基配列に対応するDNAまたはRNA分子を加えて利用する。核酸配列には、生細胞を利用したタンパク質発現系と同様に、目的のアミノ酸配列をコードする領域に加えて、使用する翻訳系に合わせて、翻訳に有利な塩基配列を付加的に含むことができる。例えば、大腸菌由来のリボソームを利用する系の場合は、開始コドンの上流にShine-Dalgarno(SD)配列やイプシロン配列などを含むことにより翻訳反応の効率が上昇する。
【0117】
ペプチドをコードする領域のN末端には、開始コドンが配置される。開始コドンは通常はトリプレット配列AUGである。しかしながら、本発明においては、in vitro転写反応により合成された開始tRNAにおいてアンチコドン配列を任意の配列とすることで、開始コドンのリプログラミングが可能であるので、AUGコドンに加えて、他の塩基配列も開始コドンとして利用できる。
【0118】
C末端側には、in vitroディスプレイ用に、核酸分子とその翻訳産物であるペプチドを連結するための配列が含まれる。例えば、ピューロマイシンリンカーを用いたmRNAディスプレイ法を利用する場合、mRNAライブラリーにピューロマイシンリンカーが予め連結されたものを翻訳系に加えることにより、mRNA−ペプチドの複合体ライブラリーが形成される。ピューロマイシンをリボソームのAサイトに効率良く取り込ませるために、通常、mRNAの3’末端側とピューロマイシンの間にリンカーが挿入される。ピューロマイシンはリボソーム上でペプチド転移反応の基質(アミノアシルtRNA類似体)として機能し、伸長ペプチドのC末端に結合することにより、mRNAとペプチドを連結する。mRNAディスプレイ法は、in vitro翻訳系でmRNAとペプチドを適当なリンカーを介して連結することにより遺伝子型と表現型を一体化させる技術であり、このような目的が達成される限り、ピューロマイシンに代えて他の同様の機能を有する物質を含むリンカーも利用可能であることは当業者の認識の範囲内である。
【0119】
また別の方法として、リンカーを予め連結したmRNAを用いるのではなく、in vitro翻訳系内でのリンカーとmRNAのハイブリダイゼーションにより、mRNA-ペプチドの複合体ライブラリーを形成する方法も利用可能である。例えば、フレキシザイムを利用して調製したフェニルアラニンリンカー(3’-フェニルアラニン-ACCA-PEG-[mRNAライブラリーの3’末端領域と相補的な塩基配列]-5’)をmRNAライブラリーと相補鎖を組ませることで、mRNA-ペプチドの複合体ライブラリーが形成される(未公開出願である特願2009-243240に記載される「RAPIDディスプレイ法」)。この場合、mRNAのペプチドをコードする領域の下流(3’末端領域)に、リンカーとハイブリダイゼーションするための塩基配列が含まれる。
【0120】
後述の具体的な実施例においては、ペプチドのN末端に開始コドンAUGが、C末端に、官能基2を持つアミノ酸としてシステイン(Cys)をコードするコドンUGCが配置され、その直後にリンカーとなるGlySerGlySerGlySerをコードするコドンが続いており、AUGとUGCの間がランダム配列となっている。
【0121】
ランダム配列は、任意の配列のトリプレットからなるコドンの繰り返しで構成され、一部がN-メチルアミノ酸のような特殊アミノ酸を指定する人為的なコドンとなるように設計される。
【0122】
ランダム配列を構成するトリプレットをN1N2N3コドンで表して、可能な配列について説明する。N1とN2は、それぞれ独立して、A、U、CまたはGのいずれか1つであることができる。さらに、N3もA、U、CまたはGのいずれか1つであることができる。あるいは、N3は、A、U、C及びGの4種の塩基のうちの任意の3種から選択されるいずれか1つであることができる。あるいは、N3は、A、U、C及びGの4種の塩基のうちの任意の2種から選択されるいずれか1つであることができる。あるいは、N3を、A、U、CまたはGの1つに定めることができる。
【0123】
例えば、ランダム配列を構成するmRNA配列上のトリプレットの例として、NNUコドンまたはNNKコドン{Nは、A、U、CまたはGのいずれかのリボヌクレオチドであり、Kは、CまたはGのいずれかのリボヌクレオチドである}が挙げられる。
【0124】
以下、実施例に沿って、ランダムmRNAライブラリーとしてNNU(NはAまたはU、C、G)をコドンとしたmRNAを利用し、環状化反応用にNα-クロロアセチル-D-トリプトファンとシステインが配置され、4種類のN-メチルアミノ酸が導入されたペプチド配列の例で説明するが、本発明がこれに限定される意図ではない。
【0125】
例えば、NNUトリプレットによって発生するコドンの数は、16種類(4 x 4 x 1 = 16)であり、4コドンが4種類のN-メチルアミノ酸(N-メチルグリシン[AUU]、N-メチルアラニン[GCU]、N-メチルセリン[CUU]、N-メチルフェニルアラニン[UUU])に割り当てられた。また残り12コドンが11種類のタンパク質性アミノ酸(セリン[UCU及びAGU]、チロシン[UAU]、システイン[UGU]、プロリン[CCU]、ヒスチジン[CAU]、アルギニン[CGU]、トレオニン[ACU]、アスパラギン[AAU]、バリン[GUU]、アスパラギン酸[GAU]、グリシン[GGU])に割り当てられた。そして、mRNA上の環状N-メチルペプチドをコードするオープンリーディングフレームは、5’-AUG(NNU)8〜15UGC-3’とした。AUGにNα-クロロアセチル-D-トリプトファンが、UGCにシステインが規定され、必ず環状化ペプチドが形成されるように設計した。その実施例として、様々な大きさの環状ペプチドを調製するためにNNUコドンを8から15回繰り返した。
【0126】
【表2】

NNUライブラリーの利点としては、ランダム領域でUAA及びUAG、UGAで規定されるストップコドンが出現しないため、確度の高いライブラリーを構築することができる。また16コドン中、4コドンがN-メチルアミノ酸を規定するため、ペプチド中にN-メチルアミノ酸の導入確率を理論上では25%にまで高めることができる。今回は、NNUライブラリーを用いたが、NNK(KはCまたはG)ライブラリーや他の塩基を3番目に位置させ組み合わせたライブラリー等を利用し、32コドン(4 x 4 x 2 = 32)を使用する方法もある。その際、4種類のN-メチルアミノ酸を導入する場合、N-メチルアミノ酸の出現確率は半減する。
【0127】
mRNA上のコドンは対応するtRNAのアンチコドンと対合する。コドン3文字目とアンチコドン1文字目はwobble塩基対が許容されるので、ワトソン-クリック型の塩基対に加えてそれ以外の組み合わせが可能である。例えば、NNUコドンの第三塩基Uに対してはG又はA、NNKコドンの第三塩基Cに対してはG、NNKコドンの第三塩基Gに対してはU又はCの対合が可能である。本願発明においてN-メチルアミノ酸を導入するためにNNUコドンを用いる場合、GNNアンチコドンは好ましい組み合わせの一例である。
【0128】
フレキシザイムによるアミノアシル化反応
フレキシザイムは、所望の構造を持つアミノ酸基質を任意のtRNAにアシル化する機能を有するRNA触媒(ARSリボザイム)である。フレキシザイムは、天然のARSタンパク質酵素とは異なり、各アミノ酸及び各tRNAに対して特異性を持たず、本来チャージすべきアミノ酸以外の任意のアミノ酸を用いたアミノアシル化が可能である。本発明では、フレキシザイムを用いて特殊アミノ酸でアシル化された直交性(オルソゴナル)tRNAを、無細胞翻訳系に添加することにより、ペプチド配列に特殊アミノ酸が導入される。
【0129】
オルソゴナルtRNAとは、翻訳系に内在する天然由来のARS(例えば大腸菌由来のARSタンパク質酵素)によって認識されないので、翻訳系内でアミノアシル化されることはないが、リボソーム上のペプチド合成反応では効率よくmRNAのコドンと対合して指定されたアミノ酸を発現させ得るtRNAである。オルソゴナルtRNAとして、例えば、異なる種に由来する天然のサプレッサーtRNA、あるいは、人工的に構築したtRNAが使用される。上述のように、本発明において特殊アミノ酸の導入のために好適に使用されるものは、人工的な転写産物であるオルソゴナルtRNAである。
【0130】
フレキシザイムは、活性化アミノ酸エステルを基質として、アミノ酸の反応点であるカルボニル基、及びアミノ酸側鎖あるいは脱離基である芳香環、並びにtRNAの3’末端に存在する5'-RCC-3'配列部分(R = A or G)を認識して、3’末端のアデノシンにアシル化する触媒能を有する。フレキシザイムは、tRNAのアンチコドン部分に対して特異性がない。つまり、tRNAのアンチコドン部分をどのような配列に変えても、アミノアシル化の効率には影響がない。フレキシザイムにより、任意の特殊アミノ酸を任意のアンチコドン配列を持つtRNAに連結することができるので、任意の特殊アミノ酸を任意のコドンに対応させることができる。従って、任意の特殊アミノ酸を導入したライブラリーの調製が可能である。
【0131】
公知のフレキシザイムの構造(RNA配列)を以下に示す。
原型のフレキシザイム Fx
[GGAUCGAAAGAUUUCCGCAGGCCCGAAAGGGUAUUGGCGUUAGGU-3’, 45nt]
ジニトロベンジルフレキシザイム dFx
[5'-GGAUCGAAAGAUUUCCGCAUCCCCGAAAGGGUACAUGGCGUUAGGU-3’, 46nt]
エンハンスドフレキシザイム eFx
[5'-GGAUCGAAAGAUUUCCGCGGCCCCGAAAGGGGAUUAGCGUUAGGU-3’, 45nt])
アミノフレキシザイム aFx
[5'-GGAUCGAAAGAUUUCCGCACCCCCGAAAGGGGUAAGUGGCGUUAGGU-3’, 47nt])
フレキシザイムは、天然のARSタンパク質酵素とは異なり、アミノアシル化反応の第1段階目である高エネルギー中間体(アミノアシルAMP)の生成の過程をスキップしてアミノ酸基質のtRNAへの結合の過程のみを触媒するため、アミノ酸基質としてはあらかじめ弱活性化されたアミノ酸を用いる必要がある。つまり、アミノ酸のアデニル化をスキップする代わりに、アシル化が進行するカルボニル基において弱活性化されたエステル結合を持つアミノ酸誘導体を使用する。一般にアシル基の活性化は電子吸引性をもつ脱離基をエステル結合させることで達成できるが、あまり強力な電子吸引性脱離基を有するエステルでは水中で加水分解が起きるばかりか、ランダムなRNAへのアシル化が併発してしまう。したがって、アミノ酸基質としては無触媒状態でこのような副反応が起きにくいように弱活性化したものを用いる必要がある。このような弱活性化は、例えば、AMP、シアノメチルエステル、チオエステル、又はニトロ基やフッ素その他の電子吸引性の官能基をもったベンジルエステル等を使用して行うことができる。好適なアミノ酸基質の例としては、アミノアシル-シアノメチルエステル(CME:cyanomethyl ester)、アミノアシル-ジニトロベンジルエステル(DNB:3,5-dinitrobenzyl ester)、又はアミノアシル-4-クロロベンジルチオエステル(CBT:p-chloro-benzyl thioester)等が挙げられるが、これらに限定されない。
【0132】
また、アミノ酸基質は、フレキシザイムで認識されるように、アミノ酸側鎖または脱離基内に芳香環を有していなければならない。本明細書中では、フレキシザイムの基質として、このような適当な脱離基を有するアミノ酸基質を、活性化アミノ酸エステルということもある。例えば、N-メチルフェニルアラニンの場合、N-メチルフェニルアラニンCMEを基質として用いることで、eFxとtRNAを混合し、N-メチルフェニルアラニン結合tRNAを調製することができる。eFxは、芳香族を側鎖に有するアミノ酸の活性化アミノ酸を基質とすることができ、活性基に芳香族は必要ない。例えば、N-メチルグリシン、N-メチルアラニン、N-メチルセリンは、それぞれのDNB誘導体を基質とし、dFxとtRNAを混合することで、N-メチルアミノ酸結合tRNAを調製することができる。dFxは、活性基の芳香族を認識するため、アミノ酸の側鎖に限定されない。
【0133】
フレキシザイムによるアシル化反応は、溶液中で行ってもよいし、担体に固定化したARSリボザイムを用いたカラムを用いて反応させてもよい。例えば、もし翻訳の反応スケールが100μl以下の少ない量であれば、溶液中でフレキシザイムによるtRNAのアシル化を行い、反応溶液をエタノール沈殿したペレットを適当な緩衝液(例えば1mMの酢酸カリウム、pH5等)に溶解し、翻訳系に添加すれば良い。反応の条件は適宜好適な条件を選べばよいが、少量スケールの反応条件の一例としては、最終濃度で0.5〜20μMのtRNA、0.5〜20μMのフレキシザイム、2〜10mMのアミノ酸基質、0.6MのMgCl2を含むpH7.5、0.1Mの反応緩衝液を、0度(℃)で1時間〜24時間、反応させるとよい。
【0134】
翻訳の反応スケールが100μlを超える場合は、フレキシザイムの再利用を考慮し、担体に固定化したフレキシザイムを用いたほうが好都合である。担体として、例えば、樹脂、アガロース、セファロース、磁気ビーズなどを用いることもできるが、特に限定されない。フレキシザイムを担体に固定化して反応を行わせる場合は、例えば、Murakami, H., Bonzagni, N. J. and Suga, H. (2002). "Aminoacyl-tRNA synthesis by a resin-immobilized ribozyme." J. Am. Chem. Soc. 124(24): 6834-6835に記載の方法に従って行うことができる。反応産物であるアミノアシル化tRNAの分離は、様々な方法で行える。一例としては、10mM程度のEDTAを含有する緩衝液でカラムから溶出する方法がある。ARSリボザイムを固定化した樹脂は、例えば反応バッファーで平衡化することにより、十数回リサイクルすることができる。
【0135】
後述の実施例においては、Kawakamiら(非特許文献11)の記載に従い、フレキシザイムを用いて、4種類のN-メチルアミノ酸(N-メチルグリシン、N-メチルアラニン、N-メチルセリン、N-メチルフェニルアラニン)をtRNAAsn-E2に連結して、アミノ酸配列に導入した例を説明する。tRNAAsn-E2NNNは、大腸菌由来の伸長反応用tRNAであるtRNAAsnを改変して作成された人工tRNAであり、アンチコドン配列(NNN、Nは任意の塩基を表す)を様々に変化させて用いることができる。この人工tRNAは天然のARSに対して直交性を持つため、翻訳系中で天然のアミノ酸によってチャージされることがないが、リボソーム上のペプチド鎖伸長反応に際しては問題なく受け入れられる。つまり、この人工tRNAに特殊アミノ酸が連結されたアミノアシルtRNAは、伸長因子(EF-Tu)と結合して、リボソームのA部位に運ばれて、ペプチド鎖伸長過程で使用される。tRNAAsn-E2は、特殊アミノ酸をアシル化するための伸長用tRNAとしての一つの例示であり、実施例で使用された具体的な無細胞翻訳系において実際に使用可能であることが確認されている。しかしながら、本発明で使用可能な伸長反応用tRNAはこれに限定されない。当業者であれば、本発明においてペプチド鎖伸長反応で特殊アミノ酸を導入するために利用可能なtRNAは、使用する無細胞翻訳系の成分に合わせて適宜に選択可能であることが理解できるであろう。
【0136】
また、本発明では、環状化のための官能基を有するアミノ酸が特殊アミノ酸である場合にも、フレキシザイムを用いてそのような特殊アミノ酸を任意のアンチコドンを持つ直交性(オルソゴナル)tRNAに結合させる。本発明の一態様では、開始アミノ酸残基として官能基1を有するアミノ酸を配置する。その場合、開始tRNAに環状化反応用の官能基を有するアミノ酸をチャージすることにより、ペプチドN末端に環状化反応用の官能基が導入される。
【0137】
例えば、後述の実施例では、クロロアセチル基を有するD体のトリプトファンであるNα-クロロアセチル-D-トリプトファンを開始tRNAであるtRNAfMetに連結し、ペプチドN末端に導入を行った。ペプチドに導入されたクロロアセチル基は、ペプチド内部のシステイン残基のチオール基と自発的なSN2反応を引き起こし、チオエーテル結合によってペプチドが環状化する(Goto et al., ACS Chem. Biol., 2008, 3, 120-129)。この例では、D体のトリプトファンを母核としているが、L体のトリプトファンはもちろん、他の19種類のタンパク質性アミノ酸のL体及びD体でも問題なくペプチドライブラリーを作製することができる。
【0138】
なお、4つのN-メチルアミノ酸及びクロロアセチル基を有するフェニルアラニンを導入した特定の配列をもつモデル環状N-メチルペプチドの翻訳合成はKawakamiらによって達成されている(非特許文献11)。しかしながら、ライブラリーの構築については本願で初めて開示される。
【0139】
開始tRNAと伸長tRNA
天然の翻訳反応において、開始tRNAは翻訳開始のみに用いられ、伸長反応では使用されず、反対に、伸長用tRNAは開始反応には使用されないことは重要である。このような開始tRNAと伸長用tRNAの区別は本願発明においても同様である。
【0140】
本願では、特殊アミノ酸をアシル化するために人工tRNAが好適に用いられる。伸長tRNAである人工tRNAの非限定的な一例がtRNAAsn-E2である。このtRNAの塩基配列は、大腸菌の天然tRNAAsn
(5’-UCCUCUGs4UAGUUCAGDCGGDAGAACGGCGGACUQUUt6AAYCCGUAUm7GUCACUGGTYCGAGUCCAGUCAGAGGAGCCA-3’) がベースになっている(s4U:4-チオウリジン、D:ジヒドロウリジン、Q:キューオシン、t6A:6-スレオニルカルバモイルアデニン、Y:ワイブシン、m7G:7-メチルグアノシン、T:リボチミジン)。本発明者らは、この天然tRNAに対して、修飾塩基を無くし、かつ変異を導入することで、大腸菌の20種類のアミノアシル化酵素によってアミノアシル化を受けない伸長反応用のtRNAであるtRNAAsn-E2をin vitro転写によって作製した。NNNの箇所がアンチコドンに相当し、コドンに対応するように変化させる。
(tRNAAsn-E2: 5’-GGCUCUGUAGUUCAGUCGGUAGAACGGCGGACUNNNAAUCCGUAUGUCACUGGUUCGAGUCCAGUCAGAGCCGCCA-3’、[修飾を無くした箇所、合計8カ所。s4U8U、D16U、D20U、t6A37A、Y39U、m7G46G、T54U、Y55U。34番目のQに関しては、アンチコドンなので、コドンに対応して変化させる。][変異の箇所 、合計4カ所。U1G、C2G、G71C、G72C])
開始tRNAである人工tRNAの非限定的な一例が、tRNAfMetである。このtRNAの塩基配列は、大腸菌の天然tRNAfMet
(5’-CGCGGGGs4UGGAGCAGCCUGGDAGCUCGUCGGGCmUCAUAACCCGAAGAUCGUCGGTYCAAAUCCGGCCCCCGCAACCA-3’ )がベースになっている。(Cm:2’-O-メチルシチジン)。本発明者らは、この天然tRNAに対して、修飾塩基を無くし、5’末端最初のCをGに変化させた開始反応用のtRNAであるtRNAfMetをin vitro転写によって作製した。CAUの箇所がアンチコドンに相当し、AUG開始コドンに対応する。(本願で使用したtRNAfMet: 5’-GGCGGGGUGGAGCAGCCUGGUAGCUCGUCGGGCUCAUAACCCGAAGAUCGUCGGUUCAAAUCCGGCCCCCGCAACCA-3’、[修飾を無くした箇所、合計6カ所。s4U8U、D20U、Cm32C、T54U、Y55U。][変異の箇所 、合計1カ所。C1G])開始tRNAにおいて重要な箇所は5’末端の最初の塩基(天然tRNAfMetではC、本願のtRNAfMetではG)が、72番目の塩基(天然tRNAfMet及び本願のtRNAfMetではA)と相補鎖を組まないことである。この非相補鎖によって、メチオニルホルミルトランスフェラーゼ(MTF)によりMet-tRNAfMetにホルミル基が転移されたり(但し、この部分にクロロアセチルトリプトファンのような開始用特殊アミノ酸を利用する場合は、意味は無い)、またEF-Tuとの結合が抑制されたりする。
【0141】
in vitroセレクション
本発明において、無細胞翻訳系で構築される特殊ペプチドライブラリーは、mRNAディスプレイを始めとするin vitroディスプレイ技術と完全に適合可能であるため、1013種類以上の高い多様性からなる特殊ペプチドライブラリーから、標的に結合するペプチド分子の創出が可能である。
【0142】
in vitroディスプレイ技術は、進化分子工学のツールとして利用される。進化分子工学では、所望の機能や性質を持つタンパク質やペプチドを創製することを目的として、可能性のある遺伝子を大規模に準備し、その中から狙った表現型を有するクローンを選択する。基本的には、最初にDNA集団(DNAライブラリー)を調製し、in vitro転写産物としてRNA集団(RNAライブラリー)を得て、in vitro翻訳産物としてペプチド集団(ペプチドライブラリー)を得る。このペプチドライブラリーから、所望の機能や性質を持つものを何らかのスクリーニング系で選択することになる。例えば、特定のタンパク質に結合するペプチド分子を得たい場合は、標的タンパク質を固相化したカラムにペプチド集団を流し込み、カラムに結合したペプチド分子の混合物を回収することができる。このとき、in vitroディスプレイ技術により、各ペプチド分子には、その鋳型である核酸分子がタグのように付加されている。mRNAディスプレイライブラリーであれば、各ペプチド分子にはmRNAが付加されている。そこで、回収したペプチド−mRNA複合体の集団から逆転写酵素でDNAに戻し、PCRで増幅して狙った表現型を有するクローンが多く含まれるバイアスのかかったライブラリーを得た後に、再度同じような選択実験を行う。あるいは、RNAアプタマーを回収してしまう可能性を回避するため、核酸部分を2本鎖(DNA/RNAハイブリッド)にする目的で、選択前に逆転写反応を行うことも可能である。この操作を繰り返すことで、世代の経過とともに所望の表現型を有するクローンが集団中で濃縮されていく。
【0143】
ペプチドアプタマーを同定する場合、in vitro ディスプレイライブラリーと標的物質を混合し、標的物質に結合したペプチドを提示する対応付け分子(活性種)を選択し、選択された対応付け分子の核酸部分からPCRにより核酸ライブラリーを調製する工程を繰り返すことで、標的物質に結合するペプチドアプタマーの遺伝子をクローニングできる。
【0144】
標的物質としては、一般的には、タンパク質、核酸、糖質、脂質、その他どのような化合物でもよい。
活性種を選択するためには、[遺伝情報]−[ペプチド]複合体を標的物質と接触させ、標的物質に結合したペプチドを提示する複合体を、標的物質に結合していない他の多数の複合体から適当な方法で分離して回収する必要がある。このような回収の方法としては多くの技術が公知である。
【0145】
例えば、標的物質に、固相への結合により回収可能な修飾を施しておくと便利である。例えば、後述の実施例では、標的物質をビオチン修飾しておき、固相化されたビオチン結合タンパク質への特異的な結合を利用して回収している。このような特異的な結合としては、ビオチン結合タンパク質(アビジン、ストレプトアビジンなど)/ビオチンの組み合わせの他にも、マルトース結合タンパク質/マルトース、ポリヒスチジンペプチド/金属イオン(ニッケル、コバルトなど)、グルタチオン-S-トランスフェラーゼ/グルタチオン、抗体/抗原(エピトープ)などが、利用可能であるが、これらに限定されるものではない。
【0146】
本発明は、ペプチドライブラリーを標的物質と接触させ、標的物質に結合したぺプチドを提示する活性種を選択し、選択された活性種の核酸配列を増幅し、増幅された核酸配列を鋳型として無細胞翻訳系で再び合成されたペプチドのライブラリーから活性種を選択するというin vitroセレクションを繰り返すことにより、標的物質に結合する特殊ペプチドを創製することを含む。
【0147】
標的物質に結合する特殊ペプチド化合物の創製は、標的物質に結合したぺプチドを提示する活性種を回収して核酸配列を解析し、核酸配列からペプチド配列を決定し、得られたペプチド配列に基づき適当な特殊ペプチドを選択することにより、標的物質に結合する特殊ペプチドのアミノ酸配列及び核酸配列を得ることを含む。さらに、得られた配列情報に基づき、任意の方法を用いて、特殊ペプチドを合成、精製及び単離することが可能である。得られたペプチドを用いて、標的タンパク質の結合評価や阻害活性の確認を行い、活性の高い特殊ペプチドを得ることができる。
【0148】
後述の実施例では、標的物質としてユビキチンリガーゼE6APに着目し、そのC末端ドメインであるE6AP-HECTに対して特異的に結合する環状N-メチルペプチドを得た。
これまでの説明に加えて、本発明の実施のための材料及び方法は、特に断らないかぎり、化学及び分子生物学の技術分野でよく知られる慣用の方法に従って、様々な一般的な教科書や専門的な参考文献に記載されている方法を用いる。
【0149】
以下では、本発明を実施例によって具体的に説明する。なお、これらの実施例は、本発明を説明するためのものであって、本発明の範囲を限定するものではない。
【実施例】
【0150】
実施例1.NNU mRNAライブラリーの作製(図1)
環状N-メチルペプチドライブラリーを構築するためのmRNAライブラリーは、以下のように調製した。
【0151】
NNA(N = A or T or C or G)が8〜15個連続したランダム領域を有する8本のDNAプライマー(NNUpool8.R69 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool9.R72 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool10.R75 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool11.R78 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool12.R81 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool13.R84 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool14.R87 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’]、
NNUpool15.R90 [5’-GCTGCCGCTGCCGCTGCCGCAANNANNANNANNANNANNANNANNANNANNANNANNANNANNANNCATATGTATATCTCCTTCTTAAAG-3’])
及び
T7g10M.F48 (5’- TAATACGACTCACTATAGGGTTAACTTTAAGAAGGAGATATACATATG-3’)
CGS3an13.R39 (5’-TTTCCGCCCCCCGTCCTAGCTGCCGCTGCCGCTGCCGCA-3’)
は、オペロンバイオテクノロジーから購入した。
【0152】
T7g10M.F48と各NNU poolプライマーを利用し、Taqポリメラーゼによる伸長反応を行った(94°C, 1 min→[50°C, 1 min→72°C, 1 min]x10cycles→72°C, 5 min)。次にこの伸長反応産物を鋳型として、T7g10M.F48及びCGS3an13.R39を利用し、Taqポリメラーゼを用いてPCRを行った(94°C, 1 min→[94°C, 40 sec→61°C, 40 sec→72°C, 40sec]x4cycles→72°C, 5 min)。
【0153】
次にPCR産物を利用して、T7RNAポリメラーゼを利用した転写反応を行い、8M尿素を含む8%ポリアクリルアミドゲルで分離精製を行い、各々20 μM mRNAとした。
このmRNAは、5’末端側から
T7プロモーター3’末端のG、
イプシロン配列(5’-UUAACUUUAA-3’)、
Shine-Dalgarno配列(5’-AAGGAGA-3’)、
翻訳領域(5’-AUG[NNU]8-15UGC-3’)、
ペプチドリンカー領域(5’-GGCAGCGGCAGCGGCAGC-3’)、
ピューロマイシンリンカー相補鎖形成領域(5’-UAGGACGGGGGGCGGAAA-3’)
という構成になっている。
【0154】
NNU8からNNU15のランダム配列を有する各mRNAを、モル比で1/163、1/162、1/16、1、1.4、1.4、1.4、1.4の割合で混合し、10 uM mRNAライブラリーとした。
実施例2.アミノアシル-tRNAの調製(図2)
N-メチルアミノ酸として、N-メチルグリシン(MeGly)、N-メチルアラニン(MeAla)、N-メチルセリン(MeSer)、N-メチルフェニルアラニン(MePhe)の4種類を選んだ。そして、これらの活性化エステル誘導体、ジニトロベンジルエステル(DBE)またはシアノメチルエステル(CME)として、N-メチルグリシンジニトロベンジルエステル(MeGly-DBE)、N-メチルアラニンジニトロベンジルエステル(MeAla-DBE)、N-メチルセリンジニトロベンジルエステル(MeSer-DBE)、N-メチルフェニルアラニンシアノメチルエステル(MePhe-CME)を調製した。
【0155】
MeGly-DBE、MeAla-DBE及びMeSer-DBEとtRNAを連結するために、ARSリボザイムとしてジニトロベンジルフレキシザイムdFxを用いた。MePhe-CMEに対しては、エンハンスドフレキシザイムeFxを用いた。
【0156】
その際、各N-メチルアミノ酸MeGly、MeAla、MeSer、MePheをそれぞれAUU、GCU、CUU、UUUのコドンに割り当てるため、アンチコドン部分にGAU、GGC、GAG、GAAを有するtRNAAsnE2を使用した。
【0157】
各アミノ酸活性化エステル(5 mM)と対応するARSリボザイム(25 μM)、tRNAAsnE2 (25 μM)、100 mM HEPES(pH7.5)、600 mM MgCl2を加え、0 °C、2時間(MeGly-DBE、MeAla-DBE)または6時間(MeSer-DBE、MePhe-CME)、アミノアシル化反応させ、エタノール沈殿後、翻訳反応に利用した。
【0158】
ペプチドライブラリーへの環状構造の導入は、クロロアセチル基及びペプチド内部に配置したシステインのスルフィドリル基間の分子内SN2反応を利用する。そこで、N-クロロアセチル-D-トリプトファン(D-ClAcTrp)をペプチドN末端に導入した。本アミノ酸のシアノメチルエステル(D-ClAcTrp -CME)及びeFxを利用することで、CAUのアンチコドンを有する開始tRNAfMetにD-ClAcTrpを連結したアミノアシルtRNAを上述した反応条件により調製した。当アミノ酸における反応時間は2時間とした。
【0159】
実施例3.環状N-メチルペプチドライブラリーの構築
mRNAライブラリーの3’末端にピューロマイシンリンカーPu-CC-linker (5’-pCTCCCGCCCCCCGTCC-(SPC18)5CC-puromycin, bex株式会社)を連結するため、10x Ligation buffer (TAKARA) 20 uL、H2O 70 uL, DMSO 40 uL, 7.5 uM Pu-CC-linker 40 uL, 10 uM mRNA 20 uL、T4 RNA ligase (ホームメイド) 10 uLを混合し、室温、30分間反応させた。その後、0.6 M NaCl、10 mM EDTA 200 uLを加え、反応を停止した。この溶液をフェノール/クロロホルム溶液で処理した後、エタノール沈殿し、乾燥後、H2O 30 uLに溶解し、6 uM mRNA-ピューロマイシンリンカーとした。
【0160】
ペプチドライブラリーの翻訳反応は、最適化された無細胞翻訳系で行った。無細胞翻訳系の構成は以下に記載する。50 mM Hepes-KOH [pH7.6], 100 mM KOAc, 20 mM Creatine phosphate, 12 mM Mg(OAc)2, 2 mM GTP, 2 mM ATP, 1 mM CTP, 1 mM UTP, 2 mM Spermidine, 2 mM DTT, 100 uM 10-formyl-5,6,7,8-tetrahydroforlic acid (Baggott et al., 1995), 1.5 mg/mL E. coli total tRNA (Roche), 1.2 uM ribosome, 2.7 uM IF1, 0.4 uM IF2, 1.5 uM IF3, 30 uM EF-Tu, 30 uM EF-Ts, 0.26 uM EF-G, 0.25 uM RF2, 0.17 uM RF3, 0.5 uM RRF, 0.6 uM methionine transformylase, 4 ug/mL creatine kinase(Roche), 3 ug/mL myokinase (Sigma), 0.1 uM pyrophosphatase, 0.1 uM nucleotide-diphosphatase kinase, 0.1 uM T7 RNA polymerase。
【0161】
またこの翻訳系には、12種類のアミノアシルtRNA合成酵素(0.03 uM ArgRS, 0.38 uM AsnRS, 0.13 uM AspRS, 0.02 uM CysRS, 0.09 uM GlyRS, 0.02 uM HisRS, 0.11uM LysRS (Flag配列用), 0.16 uM ProRS, 0.04 uM SerRS, 0.09 uM ThrRS, 0.02 uM TyrRS, 0.02 uM ValRS)及び11種のアミノ酸(アルジニン、アスパラギン、アスパラギン酸、システイン、グリシン、ヒスチジン、プロリン、セリン、トレオニン、チロシン、バリン、各0.2 mM)が含まれている。
【0162】
なお上述の最適化された無細胞翻訳は、自由にタンパク因子やアミノ酸を除くことができるので、Flexible In vitro Translation system (FIT system)と呼ぶことにする(同一出願人の未公開特許出願である特願2010-190315に記載)。FIT systeme150 uLに対して、1.2 uM mRNA-ピューロマイシンリンカー及び5つのアミノアシルtRNA(D-ClAcTrp-tRNAfMetUAC, MeGly-tRNAAsnE2GAU, MeAla-tRNAAsnE2GGC, MeSer-tRNAAsnE2GAG, MePhe-tRNAAsnE2GAA,各25 uM)を加え、37°C、30分間、翻訳反応を行い、環状N-メチルペプチドライブラリーを構築した。
【0163】
上述した環状N-メチルペプチドの翻訳合成を図3に示す。
反応後、室温で12分間放置し、mRNA-ピューロマイシンとペプチドの連結を行った。その後、200 mM EDTA(pH 8.0) 15 uLを加え、37°C、30分間放置し、リボソームをmRNAから取り除いた。この溶液をmRNA-ペプチド複合体溶液として、1ラウンド目のin vitroセレクションに利用した。
【0164】
一方、2ラウンド目のライブラリーの構築には、5uLの翻訳溶液を使用した。また3ラウンド目以降は、2.5uLの翻訳溶液を使用した。
実施例4.In vitroセレクション
標的として、ビオチン化されたAvi-His-GB1-E6AP-HECTドメイン(Avi: ビオチン化タグ配列、His: His6タグ配列、GB1: Protein G B1 domain、可溶化タグ配列、Zhou et al. 2001)をストレプトアビジン-磁性担体(Invitrogen)に固定化し、in vitroセレクションに利用した。(図4)
1ラウンド目のmRNA-ペプチド複合体溶液及びE6AP-HECT固定化担体(200 nM)を混合し、4°C、30分間インキュベートした(ポジティブセレクション)。上澄みを除き、氷冷したTBST(100 mM Tris-HCl[pH 7.5], 300 mM NaCl, 0.05%(v/v) tween20) 300 uLを加え、洗浄した。固定化担体を回収後、40 uL の逆転写反応溶液(5xRT buffer (Promega), 0.5 uM dNTPs, 2 uM CGS3an13R39, 5 U/uL MLV Reverse transcriptase (Promega), 0.2 U/uLRNase Inhibitor (Promega))を加え、42°C、1時間混合し、逆転写反応を行った。この逆転写反応溶液に、360 uLのPCR溶液(10 mM Tris-HCl[pH7.5], 50 mM KCl, 0.1%(v/v) Triton X-100, 2.5 mM MgCl2, 0.25 mM dNTPs, 0.25 uM T7g10M.F48, 0.25 uM CGS3an13R39)を加え、95°C、5分間加熱し、上清を回収した。回収した溶液にTaq polymeraseを添加し、PCRによって回収したcDNAの増幅を行った。増幅したDNAは、転写反応によって次のラウンドのmRNAとした。また回収したcDNA量は、リアルタイムPCRにより算出した。
【0165】
一方、2ラウンド目以降は、MLV reverse transcriptase (RNase H minus)を使用し、逆転写反応を行いcDNA及びmRNA-ペプチドの複合体を形成してから、in vitroセレクションを行った。さらに2ラウンド目では、ネガティブセレクションとして、ストレプトアビジン磁性担体、及び、ビオチン固定化担体、Avi-His-GB1固定化担体(200 nM)を体積比1:1:1で混合した担体とmRNA-ペプチド複合体溶液を4°C、30分間混合し、その上清を利用して上述のポジティブセレクションを行った。その後、固定化担体とPCR溶液を混合、加熱し、上澄みを回収し、cDNAを増幅した。また3及び4ラウンド目では、ネガティブセレクションを3回実行後、37°Cでポジティブセレクションを行った。続けて、5及び6ラウンド目では、ネガティブセレクションを9回実行後、37°Cでポジティブセレクションを行った。
【0166】
セレクションのラウンドを繰り返し行い、6ラウンド後に0.9%までcDNAの回収率が上昇したため、cDNAライブラリーの配列解析を行った。図5−1にセレクションの進行度を示す。
【0167】
実施例5.MCP11の翻訳合成及び結合の確認
シークエンスの解析を行ったところ、5つのペプチド配列が得られ、MCP11〜15という名前をつけた(図2:DNA配列からのペプチド配列の解析)。
【0168】
MCP11、12、13、14は保存されたアミノ酸残基が存在し、N-メチルアミノ酸が3〜4つ導入されている。MCP15は、N-メチルアミノ酸が3つ含まれており、疎水性残基が多く、他のクローンとの保存された配列が存在していない。これらのシークエンス解析で最も多く検出されたMCP11について、さらなる実験を行った。
【0169】
MCP11のランダム配列は、アミノ酸配列CDVSGRFGYFP(下線を付けたS、F、GはN-メチル体である)からなる配列を有していた。D体のClAcWとCの間の結合形成により環状化された構造を以下に図示する。
【0170】
【化14】

MCP11がFIT systemにより正確に翻訳合成されているかを確かめるため、MALDI-TOF analysisによる質量分析を行った。MCP11のcDNAを含むプラスミドから、
フォワードプライマーとして
T7g10M.F48(5’- TAATACGACTCACTATAGGGTTAACTTTAAGAAGGAGATATACATATG-3’)、
リバースプライマーとして
CGS3an13TAA.R39(5’-TTTCCGCCCCCCGTCTTAGCTGCCGCTGCCGCTGCCGCA-3’)
を用いたPCRにより、直鎖DNAを増幅した。
【0171】
終止コドンをUAGからUAAに変化させることにより、FIT system中に含まれるRF2(release factor 2、翻訳終結因子2)によって、ペプチド翻訳反応が終結するためにペプチドの収量増加が見込める。
【0172】
この直鎖cDNA及び5つのアミノアシルtRNA(D-ClAcTrp-tRNAfMetUAC, MeGly-tRNAAsnE2GAU, MeAla-tRNAAsnE2GGC, MeSer-tRNAAsnE2GAG, MePhe-tRNAAsnE2GAA,各25 uM)をFIT systemに加え、37°C、30分翻訳反応を行った。翻訳溶液をC18チップカラムで脱塩した後、MALDI-TOFによって分析した。得られたExact massは、2064.87であり、目的のペプチド(Calculated exact mass=2064.85)の翻訳合成を確認することができた。図5−3の左パネルを参照されたい。
【0173】
次に、MCP11の単一cDNA(UAGを含む)を利用して、mRNAディスプレイ法(転写、ピューロマイシンリンカーの連結、逆転写反応、標的への結合、cDNAの回収、リアルタイムPCRでの評価)によるE6AP-HECTへの結合評価を試みた。翻訳反応は2.5uLスケールで行い、ネガティブセレクション(E6AP-HECT無しの担体)は、4°Cで3回、ポジティブセレクション(E6AP-HECT有りの担体)は37°Cで行った。その結果、ポジティブセレクション時にcDNAの回収が見られ、MCP11がE6AP-HECT特異的に結合をすることを確認した。図5−3の右パネルを参照されたい。
【0174】
実施例6.ペプチド合成と精製
セレクションで得られた配列情報をもとに、Fmocペプチド固相合成法により、対応するMCP11を合成した。レジン上のペプチドは、トリフルオロ酢酸:トリイソプロピルシラン: H2O (87.5: 10: 2.5)溶液で切り出した後、エーテル沈殿を行った。沈殿を50%アセトニトリル(1% トリフルオロ酢酸)溶液に溶かし、トリエチルアミンを加え、塩基性条件下で環状化反応を行った。その後、C18逆相カラムを利用したHPLCによって精製した。精製したペプチドは、凍結乾燥後、DMSOに溶解した。得られたペプチドの分子量は、MALDI-TOF MSで測定した。
【0175】
実施例7.SPRによる結合定数の決定
BIACORE T100を用いた表面プラズモン共鳴によるE6AP-HECTに対するMCP11の結合定数の解析を行った。
【0176】
センサーチップとしてストレプトアビジンセンサーチップ(SA chip certified)、リガンドとしてAvi-His-GB1-E6AP-HECT、アナライトとしてMCP11を用いた。センサーチップにE6AP-HECTを固定化した後、MCP11を用いてシングルサイクルカイネティクスによる解析の結果、MCP11のKDは、0.5 nMであった。また直鎖N-メチルペプチドMLP11のKDは、100〜1000 nMで、結合能力に200倍以上の差が見られた。またNメチルアミノ酸を含まない環状ペプチドCP11及び直鎖ペプチドLP11は、1000 nMでは結合が見られなかった。この結果より、MCP11のN-メチル骨格及び大環状骨格は、E6AP-HECTへの強固な結合に必須であることがわかった(図5−4:表面プラズモン共鳴法によるMCP11及び誘導体の親和性解析)。
【配列表フリーテキスト】
【0177】
配列番号1 フレキシザイム Fx
配列番号2 ジニトロベンジルフレキシザイム dFx
配列番号3 エンハンスドフレキシザイム eFx
配列番号4 アミノフレキシザイム aFx
配列番号5 tRNAAsn-E2
配列番号6 tRNAfMet
配列番号7 T7g10M.F48
配列番号8 CGS3an13.R39
【特許請求の範囲】
【請求項1】
次の工程を含む、ペプチドライブラリーから標的物質に結合する特殊ペプチドを選択する方法:
(i)特殊アミノ酸でアシル化されたtRNAを含む無細胞翻訳系によって、特殊アミノ酸がペプチド配列にランダムに導入された特殊ペプチドを含むライブラリーを調製する工程;
(ii)ペプチドライブラリーを標的物質に接触させる工程;及び
(iii)標的物質に結合する特殊ペプチドを選択する工程
であって、
前記(i)の工程において、ライブラリーを構成する各ペプチドが当該ペプチドをコードする核酸配列から翻訳され、核酸配列とその翻訳産物であるペプチドが連結され、
核酸配列において、ペプチドをコードする領域が、異なる複数のトリプレットの繰り返しからなるランダム配列を含み、ランダム配列中のトリプレットの少なくとも一部が特殊アミノ酸を指定する人為的なコドンに対応する配列である、前記方法。
【請求項2】
前記(i)の工程が、アシルtRNA合成酵素様活性を持つRNA触媒を用いて特殊アミノ酸でtRNAをアシル化することを含む、請求項1の方法。
【請求項3】
特殊アミノ酸でアシル化されるtRNAが、in vitro転写反応で調製されたtRNAである、請求項1または2に記載の方法。
【請求項4】
前記(i)の工程が、ペプチドをコードする領域を含むmRNAのライブラリーを調製し、これを翻訳することを含む、請求項1の方法。
【請求項5】
ペプチドをコードする領域が、さらに、
官能基1を持つアミノ酸を指定するコドン、及び
官能基2を持つアミノ酸を指定するコドン
に対応する配列を含み、
官能基1及び官能基2は結合形成反応が可能な一組の官能基であり、
前記(i)の工程において、特殊アミノ酸でアシル化されたtRNAのアンチコドンと特殊アミノ酸を指定する人為的なコドンの対合により特殊アミノ酸がペプチド配列に導入され、翻訳産物であるペプチドが官能基1と官能基2の間の結合形成反応によって環状化されることにより、ライブラリーが環状特殊ペプチドを含む、請求項1の方法。
【請求項6】
ランダム配列を構成するトリプレットが、以下の配列からなるコドン:
N1N2Uコドン{N1及びN2はそれぞれ独立して、A、U、CまたはGのいずれかである}
N1N2Kコドン{N1及びN2はそれぞれ独立して、A、U、CまたはGのいずれかであり、Kは、CまたはGのいずれかである}、及び
N1N2N3コドン{N1、N2及びN3はそれぞれ独立して、A、U、CまたはGのいずれかである}、から選択される、請求項1の方法。
【請求項7】
ランダム配列が、N1N2Uコドン、N1N2Kコドン、N1N2N3コドンのいずれかの2回以上の繰り返しからなる、請求項6の方法。
【請求項8】
官能基1及び官能基2が、以下の官能基の組(A)から(C):
【化1】

(式中、X1はClまたはBrであり、そして、Arは置換基を有していてもよい芳香環である)のいずれか一組である、請求項5の方法。
【請求項9】
官能基1を持つアミノ酸がクロロアセチル基を持つアミノ酸であり、官能基2を持つアミノ酸がシステインである、請求項5の方法。
【請求項10】
ペプチドをコードする領域が、以下の(a)〜(c):
(a)クロロアセチル基を持つアミノ酸を指定する開始コドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、NNU{Nは、A、U、CまたはGのいずれかのリボヌクレオチドである}コドンの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
を含み、開始コドンと、クロロアセチル基を持つアミノ酸でアシル化された開始tRNAのアンチコドンの対合により、クロロアセチル基を持つアミノ酸がペプチドN末端に導入され、ランダム配列中の特殊アミノ酸を指定する人為的なコドンと、特殊アミノ酸でアシル化された伸長用tRNAのアンチコドンとの対合により、特殊アミノ酸がペプチドに導入され、翻訳産物であるペプチドがクロロアセチル基とシステインのスルフィドリル基との間の結合形成反応によって環状化される、請求項1〜9のいずれかに記載の方法。
【請求項11】
ライブラリーがリボソームディスプレイライブラリー、mRNAディスプレイライブラリー、及びRAPIDディスプレイライブラリーからなる群から選択されるいずれかである、請求項1〜10のいずれかに記載の方法。
【請求項12】
前記(iii)の工程が、標的物質に結合した環状特殊ペプチドをコードする核酸配列を決定することを含む、請求項1に記載の方法。
【請求項13】
mRNAとその翻訳産物である環状特殊ペプチドの複合体からなるin vitroディスプレイライブラリーであって、ペプチドをコードする領域が、以下の(a)〜(c):
(a)クロロアセチル基を持つアミノ酸を指定する人為的なコドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、異なる複数のトリプレットの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
を含むmRNAライブラリーを、以下の(d)及び(e)のアミノアシルtRNA:
(d)前記(a)のコドンと相補的なアンチコドンを有する、クロロアセチル基を持つアミノ酸でアシル化された人工tRNA
(e)1種以上の特殊アミノ酸でアシル化された人工tRNA
並びに
(f)システイン、システインtRNA、及びシステイニルRS(CysRS)
を少なくとも含む再構成型の無細胞翻訳系で翻訳することにより得られる、前記in vitroディスプレイライブラリー。
【請求項14】
環状特殊ペプチドと当該ペプチドをコードする核酸配列の複合体からなるin vitroディスプレイライブラリーを調製するためのキットであって、
(i)ペプチドをコードする領域が、以下の(a)〜(c)を含むmRNA:
(a)クロロアセチル基を持つアミノ酸を指定する人為的なコドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、異なる複数のトリプレットの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
及び
(ii)以下の(d)及び(e)のアミノアシルtRNA:
(d)前記(a)のコドンと相補的なアンチコドンを有する、クロロアセチル基を持つアミノ酸を持つアミノ酸でアシル化された人工開始tRNA、
(e)前記(b)の人為的なコドンと相補的なアンチコドンをそれぞれ有する、異なる特殊アミノ酸でそれぞれアシル化された人工伸長tRNA、
及び
(iii)システイン及びシステインでアシル化され得るtRNA、及び
(iv)単離されたリボソーム
を少なくとも含む、前記キット。
【請求項15】
特殊アミノ酸が、N-メチルアミノ酸である、請求項1〜12のいずれかに記載の方法。
【請求項1】
次の工程を含む、ペプチドライブラリーから標的物質に結合する特殊ペプチドを選択する方法:
(i)特殊アミノ酸でアシル化されたtRNAを含む無細胞翻訳系によって、特殊アミノ酸がペプチド配列にランダムに導入された特殊ペプチドを含むライブラリーを調製する工程;
(ii)ペプチドライブラリーを標的物質に接触させる工程;及び
(iii)標的物質に結合する特殊ペプチドを選択する工程
であって、
前記(i)の工程において、ライブラリーを構成する各ペプチドが当該ペプチドをコードする核酸配列から翻訳され、核酸配列とその翻訳産物であるペプチドが連結され、
核酸配列において、ペプチドをコードする領域が、異なる複数のトリプレットの繰り返しからなるランダム配列を含み、ランダム配列中のトリプレットの少なくとも一部が特殊アミノ酸を指定する人為的なコドンに対応する配列である、前記方法。
【請求項2】
前記(i)の工程が、アシルtRNA合成酵素様活性を持つRNA触媒を用いて特殊アミノ酸でtRNAをアシル化することを含む、請求項1の方法。
【請求項3】
特殊アミノ酸でアシル化されるtRNAが、in vitro転写反応で調製されたtRNAである、請求項1または2に記載の方法。
【請求項4】
前記(i)の工程が、ペプチドをコードする領域を含むmRNAのライブラリーを調製し、これを翻訳することを含む、請求項1の方法。
【請求項5】
ペプチドをコードする領域が、さらに、
官能基1を持つアミノ酸を指定するコドン、及び
官能基2を持つアミノ酸を指定するコドン
に対応する配列を含み、
官能基1及び官能基2は結合形成反応が可能な一組の官能基であり、
前記(i)の工程において、特殊アミノ酸でアシル化されたtRNAのアンチコドンと特殊アミノ酸を指定する人為的なコドンの対合により特殊アミノ酸がペプチド配列に導入され、翻訳産物であるペプチドが官能基1と官能基2の間の結合形成反応によって環状化されることにより、ライブラリーが環状特殊ペプチドを含む、請求項1の方法。
【請求項6】
ランダム配列を構成するトリプレットが、以下の配列からなるコドン:
N1N2Uコドン{N1及びN2はそれぞれ独立して、A、U、CまたはGのいずれかである}
N1N2Kコドン{N1及びN2はそれぞれ独立して、A、U、CまたはGのいずれかであり、Kは、CまたはGのいずれかである}、及び
N1N2N3コドン{N1、N2及びN3はそれぞれ独立して、A、U、CまたはGのいずれかである}、から選択される、請求項1の方法。
【請求項7】
ランダム配列が、N1N2Uコドン、N1N2Kコドン、N1N2N3コドンのいずれかの2回以上の繰り返しからなる、請求項6の方法。
【請求項8】
官能基1及び官能基2が、以下の官能基の組(A)から(C):
【化1】

(式中、X1はClまたはBrであり、そして、Arは置換基を有していてもよい芳香環である)のいずれか一組である、請求項5の方法。
【請求項9】
官能基1を持つアミノ酸がクロロアセチル基を持つアミノ酸であり、官能基2を持つアミノ酸がシステインである、請求項5の方法。
【請求項10】
ペプチドをコードする領域が、以下の(a)〜(c):
(a)クロロアセチル基を持つアミノ酸を指定する開始コドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、NNU{Nは、A、U、CまたはGのいずれかのリボヌクレオチドである}コドンの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
を含み、開始コドンと、クロロアセチル基を持つアミノ酸でアシル化された開始tRNAのアンチコドンの対合により、クロロアセチル基を持つアミノ酸がペプチドN末端に導入され、ランダム配列中の特殊アミノ酸を指定する人為的なコドンと、特殊アミノ酸でアシル化された伸長用tRNAのアンチコドンとの対合により、特殊アミノ酸がペプチドに導入され、翻訳産物であるペプチドがクロロアセチル基とシステインのスルフィドリル基との間の結合形成反応によって環状化される、請求項1〜9のいずれかに記載の方法。
【請求項11】
ライブラリーがリボソームディスプレイライブラリー、mRNAディスプレイライブラリー、及びRAPIDディスプレイライブラリーからなる群から選択されるいずれかである、請求項1〜10のいずれかに記載の方法。
【請求項12】
前記(iii)の工程が、標的物質に結合した環状特殊ペプチドをコードする核酸配列を決定することを含む、請求項1に記載の方法。
【請求項13】
mRNAとその翻訳産物である環状特殊ペプチドの複合体からなるin vitroディスプレイライブラリーであって、ペプチドをコードする領域が、以下の(a)〜(c):
(a)クロロアセチル基を持つアミノ酸を指定する人為的なコドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、異なる複数のトリプレットの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
を含むmRNAライブラリーを、以下の(d)及び(e)のアミノアシルtRNA:
(d)前記(a)のコドンと相補的なアンチコドンを有する、クロロアセチル基を持つアミノ酸でアシル化された人工tRNA
(e)1種以上の特殊アミノ酸でアシル化された人工tRNA
並びに
(f)システイン、システインtRNA、及びシステイニルRS(CysRS)
を少なくとも含む再構成型の無細胞翻訳系で翻訳することにより得られる、前記in vitroディスプレイライブラリー。
【請求項14】
環状特殊ペプチドと当該ペプチドをコードする核酸配列の複合体からなるin vitroディスプレイライブラリーを調製するためのキットであって、
(i)ペプチドをコードする領域が、以下の(a)〜(c)を含むmRNA:
(a)クロロアセチル基を持つアミノ酸を指定する人為的なコドン、
(b)特殊アミノ酸を指定する人為的なコドンを含む、異なる複数のトリプレットの繰り返しからなるランダム配列、及び
(c)システインを指定するコドン
及び
(ii)以下の(d)及び(e)のアミノアシルtRNA:
(d)前記(a)のコドンと相補的なアンチコドンを有する、クロロアセチル基を持つアミノ酸を持つアミノ酸でアシル化された人工開始tRNA、
(e)前記(b)の人為的なコドンと相補的なアンチコドンをそれぞれ有する、異なる特殊アミノ酸でそれぞれアシル化された人工伸長tRNA、
及び
(iii)システイン及びシステインでアシル化され得るtRNA、及び
(iv)単離されたリボソーム
を少なくとも含む、前記キット。
【請求項15】
特殊アミノ酸が、N-メチルアミノ酸である、請求項1〜12のいずれかに記載の方法。
【図1】


【図2−1】


【図2−2】


【図3】


【図4】


【図5−1】


【図5−2】


【図5−3】


【図5−4】




【図2−1】


【図2−2】


【図3】


【図4】


【図5−1】


【図5−2】


【図5−3】


【図5−4】


【公開番号】特開2012−58092(P2012−58092A)
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願番号】特願2010−202012(P2010−202012)
【出願日】平成22年9月9日(2010.9.9)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願日】平成22年9月9日(2010.9.9)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

