N−及びO−置換型の4−[2−(ジフェニルメトキシ)−エチル]−1−[(フェニル)メチル]ピペリジンアナログ、及びそれを用いたCNS障害を治療する方法
N−及びO−置換型の[2−ジアロマティックメトキシ及びメチルアミノ)アルキル]ピペリジンは、ドーパミン輸送体(DAT)及びセロトニン輸送体(SERT)に対し高いCNS活性を示す。好適な化合物は、DATとSERTとの間で、及びDAT及びノルエピネフリン輸送体(NET)との間で大きく異なる行動を示す。化合物はCNS障害を治療する場合に有用性があり、限定しないがコカイン中毒、抑うつ状態、及びパーキンソン病を含む。
【発明の詳細な説明】
【技術分野】
【0001】
[関連出願の相互参照]
本出願は、2004年12月8日提出の米国特許出願第11/007,484号の一部継続出願であり、2003年3月28日提出の米国特許出願第10/311,796号の継続出願であり、2001年6月14日提出のPCT出願PCT/US01/40964の利益を主張し、2000年6月20日の米国仮特許出願第60/212,921号の利益を主張する。これによって、これらの出願の開示全体は引用によって組み込まれる。
【0002】
[技術分野]
本発明はモノアミン輸送系、特にドーパミン輸送体(DAT)、セロトニン輸送体(SERT)、及びノルエピネフリン輸送体(NET)に対し活性を示す、薬理学的に能動的な化合物に関する。新規の化合物はSERTと比較して、DATに対する活性で大きな差異を示す。
【背景技術】
【0003】
ドーパミン輸送体は中枢神経系(CNS)中の病態生理学的(pathophysiocological)プロセスで重要な役割を果たすシナプス前性に配置される高分子である。DATは放出されたドーパミンのシナプス前ニューロンへの再蓄積によって、ドーパミン作動性の神経伝達を終結する。M.J.Kuhar,“Neurotransmitter Uptake:A Tool in Identifying Neurotransmitter Specific Pathways”,LIFE SCI.,13,1623−34,1973。コカイン中毒において、コカインのDATへの結合、ドーパミンの取り込みの結果的な遮断は、薬物の強化特性と関連するように思われる。M.E.A.Reithら,“Structural Requirements for Cocaine Congeners to Interact With Dopamine and Serotonin Uptake Sites in Mouse Brain and to Induced Stereotyped Behavior”,BIOCHEM.PHARMACOL.,1986,35,1123−1129;M.C.Ritzら,“Cocaine Inhibition of Ligand Binding At Dopamine,Norpinephrine and Serotonin Transporters:A Structure−Activity Study”,LIFE.SCI.,1990,46,635−645;M.C.Ritzら,“Cocaine Receptors On Dopamine Transporters Are Related to Self−Administration of Cocaine”,SCIENCE,1987,237.1219−1223;B.Girosら,“Hyperlocomotion and Indifference to Cocaine and Amphetamine in Mice Lacking the Dopamine Transporter”,NATURE,1996,379,606−612。輸送機能と更に関連づけられるのは、パーキンソン病に関連するドーパミン作動性ニューロン中の神経毒性物質の濃度である。輸送体高分子は、パーキンソン病の被殻の組織部分に輸送体高分子がないことによって明らかなように、パーキンソン病用のマーカ:H.Shoemakerら,NAUNYN SCHMIEDEBERGS ARCH.PHARMACOL.,1985,329,227−235、及びJ.−M.Maloteauxら,EUR.J.PHARM.,1988,156,331−340;となりうる。H.B.Niznikら,ARCH.BIOCHEM.BIOPHYS.,1990,276,424−432及びM.J.Kaufmanら,SYNAPSE,1991,9,43−49。従って、DATに対し強力で、かつ選択的な結合基は、脳内のコカインの主標的の生体内モニタリングと、コカイン結合部位の特徴づけと、コカイン中毒の治療のための薬物療法薬と、パーキンソン病のモニタリンに対し有望である。
【0004】
コカインは脳内の様々な神経細胞輸送系に結合することが知られる:M.E.A.Reithら,前掲;が、コカイン中毒での因子であるコカインの増強作用は、DATへの結合によって開始すると考えられ、ドーパミン輸送の阻害を引き起こす。不正使用の向精神薬であるフェンシクリジン(PCP)は更に、DATへの結合を通じてその行動的影響の少なくとも一部を示すと知られている。K.M.Johnson,“Phencyclidine:Behavioral and Biochemical Evidence Supporting a Role For Dopamine”,FED.PROC,1983,42,2579−2583;E.D.Frenchら,“Phencyclidine Binding Sites in the Nucleus Accumbens and Phencyclidine−Induced Hyperactivity are Decreased Following Lesions of the Mesolimbic Dopamine System”,EUR.J.PHARMACOL.,1985,116,1−9。DATは更に、ヒトで突発性パーキンソン症候群を誘発する、1−メチル−4−フェニル−1,2,3,6−テトラヒドロピリジン(MPTP)の神経毒性作用に決定的な役割を果たす。J.Langstonら,“MPTP:Current Concepts and Controversies”,CLIN.NEUROPHARMAC,1986,9,485−507;H.Kinemuchiら,“The Neurotoxicity of 1−methyl−4−phenyl−1,2,3,6−tetrahydropyridine(MPTP)and its Relevance to Parkinson’s Disease”,NEUROCHEM.INT.,1987,11,359−373。セロトニン輸送体(SERT)は更に、多数の神経学的プロセスと関連する。例えば、SERTは抑うつ状態及び薬物中毒と強く関連する。
【発明の概要】
【0005】
いくつかのクラスの化合物は、DATでのコカイン及びPCP結合部位を特徴づけるために開発されてきた。M.E.A.Reithら,前掲;F.I.Carrollら,“Cocaine Receptor:Biochemical Characterization and Structure−Activity Relationship of Cocaine Analogues at the Dopamine Transporter”,J.MED.CHEM.,1992,35,969−981;R.A.Milliusら,“Synthesis and Receptor Binding of N−substituted Tropane Derivatives”,“High Affinity Ligands For Cocaine Receptor”,J.MED.CHEM.,1991,34,1728−1731;I.Chaudieuら,“Role of the Aromatic Group in the Inhibition of Phencyclidine Binding and Dopamine Uptake by PCP Analogs”,PHARMACOL.BIOCHEM.BEHAV.,1989,32,699−705。コカインアナログの広範な構造活性相関(SAR)の研究が、DATに結合する強力かつ選択的なトロパン誘導体の開発となった。このクラスのいくつかの周知の化合物はCFT(Win35,428)及びRTI−55を含む。これらのトロパン誘導体及びコカインの構造の類似性は容易に明らかである。
【0006】

【0007】
更に最近の報告は、更により強力かつ選択的なトロパンについて述べている:P.C.Meltzerら,“Substituted 3−phenyltropane Analogs of Cocaine:Synthesis,Inhibition of Binding At Cocaine Recognition Sites,and Positron Emission Tomography Imaging”,J.MED.CHEM.,1993,36,855−862;F.I.Carrollら,“Cocaine and 3β−(4’−substituted phenyl)tropane−2β−carboxylic acid ester and amide analogues.New High−affinity and Selective Compounds for the Dopamine Transporter”,J.MED.CHEM.,1995,38,379−388。同様の方法で、PCPの修飾はより強力なアナログの開発に導いた:I.Chaudieuら,“Role of the Aromatic Group in the Inhibition of Phencyclidine Binding and Dopamine Uptake By PCP Analogs”,PHARMACOL.BIOCHEM.BEHAV.,1989,32,699−705;J.Vignonら,“[3H]N−[1−(2−Benzo(b)thienyl)cyclohexyl]piperidine([3H]BTCP):A New Phencyclidine Analog Selective for the Dopamine Uptake Complex”,EUR.J.PHARMACOL.,1988,148,427−436。
【0008】

【0009】
「GBR」クラスの化合物:P.Van der Zeeら,“Aryl 1,4−dialk(en)ylpiperazines as Selective and Very Potent Inhibitors of Dopamine Uptake”,EUR.J.MED.CHEM,1980,15,363−370;は、DATに対する選択性及び効能が著しく高いことで知られている。
【0010】

【0011】
これらの2つは、R=F及びR=Hであり、低ナノモルの範囲で高親和性を有する。P.H.Anderson,“Biochemical and Pharmacological Characterization of [3H]GBR12935 Binding in Vitro to Rat Striatal Membranes:Labeling of the Dopamine Uptake Complex”,J.NEUROCHEM.,1987,48,1887−1896;P.H.Anderson,“The Dopamine Uptake Inhibitor GBR12909:Selectivity and Molecular Mechanism of Action”,EUR.J.PHARMACOL.,1989,166,493−504。広範な構造/活性相関(SAR)の研究によって、DATに対する、非常に強力ないくつかの化合物が生成された。C.DeVriesら,“Heteroaromatic Analogs of 1−[2−(diphenylmethoxy)ethyl]− and 1−[2−[bis(4−fluorophenyl)methoxy]ethyl]−4−(3−phenylpropyl)piperazines(GBR12935 and GBR12909)as High−Affinity Dopamine Reuptake Inhibitors”,J.MED.CHEM.,1997,40,705−716;D.Mateckaら,“Development of Novel,Potent,and Selective Dopamine Reuptake Inhibitors Through Alteration of the Piperazine Ring of 1−[2−(diphenylmethoxy)ethyl]− and 1−[2−[Bis(4−fluorophenyl)methoxy]ethyl]−4−(3−phenylpropyl)piperazines(GBR12935 and GBR12909)”,J.MED.CHEM.,1996 39,4704−4716。これらの化合物の放射標識は神経薬理学的活性の解明を促進してきた。R=FであるGBRはDATから非常にゆっくりと解離し:R.B.Rothman,“Tight Binding Dopamine Reuptake Inhibitors as Cocaine Antagonists”,FEBS LETT.,1989,257.341−344、微小透析によって測定されるように、コカインによって誘発される、細胞外ドーパミンレベルの増加を減衰させる。R.B.Rothman,前掲;U.Sogaardら,“A Tolerance Study of Single and Multiple Dosing of the Selective Dopamine Uptake Inhibitor GBR12909 in Healthy Subjects”,INT.CLIN.PSYCHOPHARM.,1990,5,237−251。この化合物はヒトで非刺激性であり:J.R.Glowaら,“The Effects of GBR12909 on Responding of Rhesus Monkeys Maintained Under Schedules of Cocaine− and Food−Delivery”,NIDA.RES.MONOGR.,1994,141.12、アカゲザルでコカインの自己投与行動を遮断することを近頃示してきた。A.K.Duttaら,“Positional Importance of the Nitrogen Atom in Novel Piperidine Analogs of GBR12909:Affinity and Selectivity for the Dopamine Transporter”,MED.CHEM.RES.,1993,3,209−222。このような研究は、好適な化合物が常習性なくコカイン拮抗薬として作用しうる可能性を上昇させる。
【課題を解決するための手段】
【0012】
本発明はDAT、SERT、及び/又はNETに対して神経薬理学的活性を示すN−及びO−型の4−[2−ジアリールアミノ又はオキソアルキル]ピペリジンの誘導体に関する。このクラスの好適な化合物は、DATに対して低ナノモルの活性を、かつ、SERT及びNETと比較して、DATに対して差異の大きな結合活性を示す。
【図面の簡単な説明】
【0013】
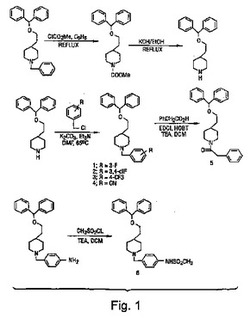
【図1】図1は、一の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図2】図2は、更なる合成スキームと、本発明の化合物に特有の構造とを例示する。
【図3】図3は、更なる合成スキームと、本発明の化合物に特有の構造とを例示する。
【図4】図4は、更なる合成スキームと、本発明の化合物に特有の構造とを例示する。
【図5A】図5Aは、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図5B】図5Bは、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図6】図6は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図7】図7は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図8】図8は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図9】図9は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図10】図10は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図11】図11は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図12】図12は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図13】図13は、表6の表示に供する。
【図14】図14は、本発明の実施形態に適切な化合物の化学構造を提供する。
【図15】図15は、表7の表示に供する。
【図16】図16は、表8の表示に供する。
【図17】図17は、表9の表示に供する。
【発明を実施するための形態】
【0014】
本発明の化合物は、式

に対応し、Aは

であり、Bは

であり、Xは−NH−、−NR4−、−S−、及び−O−からなる群から選択され、R4はC1−4アルキル、NH2、C1−4ヒドロキシアルキル、ハロゲン化されたC1−4アルキル、C2−4アルケニル、C2−4ヒドロキシアルケニル、ハロゲン化されたC2−4アルケニル、C2−4アルキニル、及びハロゲン化されたC2−4アルキニルであり、
Yは−H、−NH2、−OH、=O、又は−O−C(O)−R5であり、
lは0、1、又は2、好ましくは0又は1、より好ましくは0であり、
nは1又は2、好ましくは2であり、
mは1、2、3、又は4、好ましくは1であり、
oは0、1、2、3、又は4、好ましくは0、1、又は2、最も好ましくは0又は1であり、
pは0、1、2、3、又は4、好ましくは0、1、又は2、最も好ましくは0又は1であり、
qは0、1、2、又は3、好ましくは0又は1であり、
R、R1、及びR2はH、F、Cl、Br、I、CN、COOEt、OH、NO2、NH2、OR5からなる群から選択され、R5はC1−8アルキル、C5−6シクロアルキル、又はC2−8アルケニルであるか、あるいは、R2は5又は6員環のヘテロ環、好適には、

からなる群から選択されるヘテロ環であり、R6はC1−4アルキル、あるいは置換型又は非置換型のフェニル又はナフチルであってもよく、ヒドロキシル基はエチレン炭素で置換されないと理解すべきであり、
−(CH2)m−の1又はそれ以上のCH2基は、CR7R’7によって選択的に置換され、
R7はH、−OR11、又は−NR11であり、
R’7はH、又は−C1−8アルキルであるか、あるいはR7R’7は=Oとして相互に結合され、
R11はH、C1−8アルキル、C2−8アルキレン、C6−18アルキルアリール、又は−COOR12であり、
R12はC1−8アルキル、C2−8アルキレン、又はC6−18アルキルアリールであり、あるいはその薬学的に許容可能な塩又は誘導体である。
【0015】
本発明の化合物は更に、式:

の化合物を含む。ここで、A、B、R、及びoは上述のように規定される。
【0016】
上式において、A及びBは、

であることが好ましい。ここでpは1又は2である。上式において、mが2又は3である場合、メチレン水素のうちの1つはOR7によって置換されてもよく、R7はアルキル、好ましくはC1−16アルキル、より好ましくはC1−4低級アルキル、又はC2−18アルキレン、又は

であり、R8はC1−18アルキル、又はC2−18アルキレンである。
【0017】
好適には、式(A)の化合物は、

に対応する。
【0018】
変形物において、本発明は、以下の条件に合致する場合に、構造式I又はその好適なサブセット内の化合物を含まない:
Aがフェニルであり、XがOであり、YがHであり、lが0であり、m=1であり、nが1である場合、
Bがフェニルである場合、R、R1、及びR2の総てがHではない;
Bがフェニルである場合、R及びR1は双方がFではない化合物;
Aがフェニルであり、XがOであり、YがHであり、lが0であり、m=1であり、n=zである場合、
R2及びR1が双方ともHでBがフェニルである場合、R2は、
qが1である場合にハロ、メトキシ、メチル、ニトロ、又はアミノではなく、
qが2である場合に3−クロロ−4−フルオロではなく;
R及びR1が4−フルオロである場合、Bは非置換型のフェニルではなく;
Rが4−ハロであり、Bがフェニルであり、qが1である場合、R2はFではない化合物;
Aがフェニルであり、XがOであり、YがHであり、lが0であり、nが2であり、mが2であり、Bが非置換型のフェニルである場合、
o及びpが双方とも1である場合、R及びR1は双方がハロではなく;
Aがフェニルであり、lが0であり、nが2であり、mが2である場合、R、R1、及びR2のうちの少なくとも1つがH以外である化合物;
Aがフェニルであり、Bがフェニルであり、XがOであり、YがHであり、lが0であり、mが2であり、lが2であり、qが0である場合、R及びR1が双方ともメチルではない化合物;
Aがフェニルであり、XがOであり、YがHであり、Bがフェニルであり、lが0であり、mが2であり、nが1である場合、
R、R1、及びR2がHであり;
rが0であり、o及びpが1である場合、R及びR1が双方とも4−フルオロではない化合物;
Aがフェニルであり、XがOであり、YがHであり、lが0であり、mが3であり、nが2である場合、
Bがフェニルであり、qが1であり、R2がHである場合、o及びpは双方とも0ではなく;
Bがフェニルである場合、o及びpは、R及びR1が双方とも4−ハロであるか、あるいは双方ともメトキシである場合に、双方とも1ではない化合物;
XがOであり、YがHであり、oが0であり、Aが非置換型のフェニルであり、lが0であり、mが3であり、nが2である場合、Bが4−フルオロフェニル、あるいは、環の3位で(CH2)mに結合される6員環のヘテロアリール環ではない化合物;
XがOであり、YがHであり、Aが非置換型のチオフェニルであり、lが0であり、mが3であり、nが2であり、YがHであり、Bが非置換型のフェニルである場合、oはRが4−フルオロである場合に、0以外であるが1ではない化合物;
XがOであり、YがHであり、Aが非置換型のチオフェニルであり、oが0であり、lがOであり、mが1であり、lが2である場合、Bはフェニル、3−ピリジル、又は4−(フルオロフェニル)ではない化合物;
XがOであり、YがHであり、Aが非置換型のフェニルであり、lが0であり、mが1であり、nが2である場合、Bは非置換型のチオフェニル、又は非置換型の2,3−ベンゾチオフェニルではない化合物;
XがNHであり、YがHであり、Aがフェニルであり、lが0であり、mが1であり、nが2である場合、
qが0であり、oが1であり、pが1である場合、R及びR1は双方とも4−フルオロではなく、
qが1であり、oが0であり、pが0である場合、Bは4−(フルオロフェニル)ではない化合物。
【0019】
本発明の化合物は更に、構造:

を有する化合物を含み、Aは前述のように規定され、COOCH3、=O、CH3、F、又はOHであってもよく、XはO、S、NH、NR9、又はN−であり、Zを有するNの残りの原子価は環構造を形成し、rは0ないし8、好ましくは0ないし4、より好ましくは0、1、又は2であり、ZはH又はC1−4アルキレン、好ましくはH又はC1−2アルキレンであり、アルキレン基が存在する場合で、XがN−である場合にXと環構造を形成し、Bは前に規定したとおり、あるいはH、CH3、−CH=CH2であり、R9は、

であり、R10はC6−20アルキルである。この構造の好適な化合物は、Aが置換型のフェニルであり、XがNHであり、ZがHであり、Bが置換型のフェニルである化合物と、XがN−であり、rが0であり、Zが−CH2CH2−、又は−CH2CH2CH2−である化合物とを含み、双方が窒素を含む6又は7員環を形成する。
【0020】
本発明の化合物は更に、構造:

を有する化合物を含み、総ての記号は異なることを明確に述べられない限り、上で説明したものと同一である。例えば、R、R2、X、Y、l、m、o、及びqは上に規定されたものである。wは1又はそれ以上のメチレン基の1又はそれ以上の水素原子がZ1によって置換されることを表わす数値である。Z1は−H、−NH2、−OH、=O、−O−アルキル(例えば、C1−8)、−O−アリール(例えば、C6−16)、又は−O−C(O)−R5である。上式において、ZはCH2基の少なくとも1の水素を置換すると理解すべきである。この変形物において、上に説明した条件は更に、この構造に適用可能である。特に有用な変形物は、式:

によって提供される。特に有用な変形物において、Z1はH又はOHである。
【0021】
上述の定義によって包含される構造式の例は、


であり、示されたR2基は1又はそれ以上のR2、好ましくは1又は2のR2基を示し、任意の環位置を占有してもよい。後方の2の化合物においては、XはNH又はOであることが好ましい。
【0022】
好適な化合物は、N−アリールアルキル部分の置換基が電気陰性及び電子吸引性の官能基である化合物である。特に、構造式:

を有する化合物は、ナノモル範囲で予想外の低活性、ならびにDAT及びSERTに対する結合親和性の差異によって示されるような高選択性を提供することを示してきた。前述の式において、各々の変形物は別個に規定されるとみなされる。X及びRないしR5に対する様々な置換基は、このような置換のうちのいずれか1つ又はそれ以上の排除に用いてもよい。
【0023】
更に好適なクラスの活性化合物は、Bが4−シアノ、4−ヨード、又は3,4−ジフルオロの官能基を有するフェニル基である構造式Iの化合物、特に構造式I又はその好適な亜種の一般式の範囲内にあり、構造:

に対応する化合物を含む。
【0024】
最も好適には、本発明の活性化合物は式:

の化合物に対応し、B1は4−シアノフェニル、3,4−ジフルオロフェニル、又は4−ヨードフェニルである。−(CH2)m−基を有する、上の更に一般的な構造の各々において、mが2又は3である場合、−(CH2)m−部分の炭素のうちのいずれかは上に規定したように、−OR7によって置換してもよい。
【0025】
好適な化合物の更なる例は、

を含み、R’’’はH、OH、NH2、OR9、又はNHR9であり、R9は、

であり、R10はC6−20アルキル、及び、

である。更に有用な化合物は式D−84、D−225、D−232、D−233、及びD−276:


によって提供される。
【0026】
式D−84、D−225、D−232、D−233、及びD−276を有する化合物は、図5A、5B、6、7、8、及び9に説明される合成スキームを介して生成する。
【0027】
本発明の更に別の変形物において、式:

を有する化合物が提供され、総ての記号は異なることを明確に述べられない限り、上で説明したものと同一である。特に、Aは、

であり、Bは、

であり、
lは0、1、又は2、好ましくは0又は1、より好ましくは0であり、
mは1又は2、好ましくは1であり、
oは0、1、2、3、又は4、好ましくは0、1、又は2、最も好ましくは0又は1であり、
pは0、1、2、3、又は4、好ましくは0、1、又は2、最も好ましくは0又は1であり、
qは0、1、2、又は3、好ましくは0又は1であり、
Z1は−H、−NH2、−OH、=O、−O−アルキル(例えば、C1−8)、−O−アリール(例えば、C6−16)、又は−O−C(O)−R5であり、
wは1又はそれ以上のメチレン基の1又はそれ以上の水素原子がZ1によって置換されることを表わす数値である。上式において、ZはCH2基の少なくとも1の水素を置換すると理解すべきである。R、R1、及びR2はH、F、Cl、Br、I、CN、COOEt、OH、NO2、NH2、OR5からなる群から選択され、R5はC1−8アルキル、C5−6シクロアルキル、又はC2−8アルケニルであるか、あるいは、R2は5又は6員環のヘテロ環、好適には、

からなる群から選択されるヘテロ環であり、R6はC1−4アルキル、あるいは置換型又は非置換型のフェニル又はナフチルであってもよく、ヒドロキシル基はエチレン炭素で置換されないと理解すべきであり、
−(CH2)m−の1又はそれ以上のCH2基は、CR7R’7によって選択的に置換され、
R7はH、−OR11、又は−NR11であり、
R’7はH、又は−C1−8アルキルであるか、あるいはR7R’7は=Oとして相互に結合され、
R11はH、C1−8アルキル、C2−8アルキレン、C6−18アルキルアリール、又は−COOR12であり、
R12はC1−8アルキル、C2−8アルキレン、又はC6−18アルキルアリールであり、R20及びR21はそれぞれ独立に、水素又はC1−10アルキルといった置換型又は非置換型の炭化水素基である。あるいはその薬学的に許容可能な塩又は誘導体である。変形物において、R20及びR21は、例えば式:

に記載のような環を形成するように結合され、uは1、2、又は3、好ましくは2である。本実施形態の更に特異的な化合物は、式:

によって表わされる化合物を含む。
【0028】
本実施形態の標的化合物の合成は、図10、11、及び12に示される。図10は標的4aないし4dの合成について記載する。既出の刊行物に記載のように、光学活性のシス型のアミンは、アミンをジアステレオマの中間体に変換し、その後に、所望の異性体を対応するアミンであるシス−(−)−3に分離及び加水分解することによって、ラセミ1から合成される(Kolhatkar,R.B.;Ghorai,S.K.;George,C;Reith,M.E.;Dutta,A.K. Interaction of cis−(6−benzhydrylpiperidin−3−yl)benzylamine analogues with monoamine transporters:structure−activity relationship study of structurally constrained 3,6−disubstituted piperidine analogues of (2,2−diphenylethyl)−[1−(4−fluorobenzyl)piperidine−4−ylmethyl]amine.J Med Chem 2003,46,2205−15)。光学活性のエポキシドを有する(−)−3の処理によって、良好な収量で最終的なヒドロキシ標的4aないし4dが得られた。光学活性のエポキシドは、公表されている手順によって合成された(Schaus,S.E.;Brandes,B.D.;Larrow,J.F.;Tokunaga,M.;Hansen,K.B.;Gould,A.E.;Furrow,M.E.;Jacobsen,E.N.Highly selective hydrolytic kinetic resolution of terminal epoxides catalyzed by chiral(salen)Co(III) complexes.Practical synthesis of enantioenriched terminal epoxides and 1,2−diols.J Am Chem Soc 2002,124,1307−15)。
【0029】
図11は標的7aないし7dの合成について記載する。光学活性のアミンである(−)−5は以下の既存の手順によって合成された(Kolhatkar,R.;Cook,C.D.;Ghorai,S.K.;Deschamps,J.;Beardsley,P.M.;Reith,M.E.;Dutta,A.K. Further structurally constrained analogues of cis−(6−benzhydrylpiperidin−3−yl)benzylamine with elucidation of bioactive conformation:discovery of 1,4−diazabicyclo[3.3.1]nonane derivatives and evaluation of their biological properties for the monoamine transporters.J Med Chem 2004,47,5101−13)。このアミンはラセミの2,3−エポキシプロピルベンゼンとともに処理され、2のジアステレオマ6a及び6bを生成し、カラムクロマトグラフィによって分離された。アミンのシス−(−)−5は更に、エタノール中で別々に、エナンチオマ(R及びS型の)2−フェニルオキシラン及び2−(4−フルオロフェニル)オキシランで処理されて、適度に良好な収量で標的化合物7aないし7dを提供した。
【0030】
図12は標的11a及び11bの合成について説明する。塩基性条件下における、アミンのシス−(−)−5の、3−クロロ−4’−フルオロプロピオフェノンでのN−アルキル化は、水素化ホウ素ナトリウムによって還元される符号8を生成して、R型及びS型のアルコール9の双方の混合物を生成した。アルコール9は次いで、ジアステレオマのカンファン酸エステルに変換され、半調製用HPLC(semi−preparative HPLC)プロセスによって分離された。最終的な標的11a及び11bは、エステルを加水分解した後に生成された。
【0031】
本発明の化合物の様々な幾何及び立体異性体は総て有用である。しかしながら、一部の幾何及び立体異性体は予想外の高活性又は差異のある活性を有する。後者の一例は2−ジフェニルメチル−5−(4−フルオロベンジルアミノ)ピペリジンのシス異性体及びトランス異性体によって表わされ、ラセミ体に調製される。シス異性体はDATに対し93.7のSERTの選択率を示す一方、トランス異性体は6.28の選択率を示した。個々の鏡像異性体は更に高い活性及び選択性を示すことが期待される。
【0032】
本発明について一般的に記載されてきたように、更なる理解が、特に明記されない限り、例示目的でのみ本明細書中に提供され、かつ、限定することを意図しない、特定の特異的な実施例によって得ることができる。
【0033】
標的化合物は、遊離塩基、あるいは例えば、塩酸塩、臭化水素酸塩、シュウ酸塩、酒石酸塩といった塩として調製される。化合物の特徴は、標準的な高磁場NMR、質量スペクトル、旋光度等を用いて得られる。化合物の純度は元素分析、TLC、又はHPLCによって測定される。98%より高い純度は、これらの化合物の生物学的分析に好適である。
【0034】
ラットのDATは[3H]Win35,428で標識され、ラットのSERTは[3H]シタロプラムで標識される。双方の結合アッセイは、M.E.A.Reithら,“Structural Requirements for Cocaine Congeners to Interact With Dopamine and Serotonin Uptake Sites in Mouse Brain and to Induced Stereotyped Behavior”,BIOCHEM.PHARMACOL.,1986,35,1123−1129、及び、A.K.Duttaら,“Structure−Activity Relationship Studies of Novel 4−[2−[Bis(4−fluorophenyl)methoxy]ethyl]−1−(3−phenylpropyl)piperidine Analogs:Synthesis and Biological Evaluation at the Dopamine and Serotonin Transporter Sites”,J.MED.CHEM.,1996,39,749−756に記載のように、オスの若成体期のスプラーグドーリーラットからの線条体組織を用いて同一条件下で実行された。簡単に言うと、ラットの線条体膜は、室温で30nMの最終Na+濃度、pH7.4のリン酸ナトリウムバッファ中で、氷上で2時間、放射性リガンド及び阻害剤とともにインキュベートされた。アッセイはガラス繊維のフィルタマット(メリーランド州ゲーサーズバーグのWallac社)を通した濾過によって終結し、MACH3−96 Tomtecハーベスタ(Wallac社)で0.05%(v/v)のポリエチレンイミンに予浸された。フィルタはMicrobeta Plus液体シンチレーションカウンタ(Wallac社)中で放射活性についてアッセイされた。
【0035】
[3H]ドーパミンのHEK−293−hDAT細胞への取り込みは、前述の一般的な技術によって懸濁された無傷細胞中で測定された。M.C.Ritzら,“Cocaine Inhibition of Ligand Binding at Dopamine,Norpinephrine and Serotonin Transporters:A Structure−Activity Study”,LIFE.SCI,1990,46,635−645;MJ.Kaufmanら,SYNAPSE,1991,9,43−49。簡単に言うと、細胞は上述と同一のトロポロン含有バッファで、室温で15分間、阻害剤とともにプレインキュベートされ、[3H]ドーパミンが添加され、インキュベーションは更に8分間継続した。アッセイの終結は低温バッファの添加と、Whatman GF/Cガラス繊維フィルタを通した急速濾過とからなり、Brandel 24ピンハーベスタ(メリーランド州ゲーサーズバーグのBrandel社)を用いて0.05%(w/v)のポリ−L−リジンに予浸された。フィルタ上の放射活性は液体シンチレーション計数(Beckman LS6000IC、カリフォルニア州フラートンのBeckman Instruments社)によって測定された。
【0036】
総ての化合物はジメチルスルホキシド(DMSO)に溶解され、10%(v/v)のDMSOに希釈された。後者のストックからの添加により、DMSOの最終濃度0.5%を得て、それ自体により、放射性リガンドの結合又は取り込みを妨げなかった。初期の距離測定実験後に、試験化合物の少なくとも5の濃度が調査され、IC50値前後に均等に分布された。後者は前述のように非線形計算機の曲線適合手順によって測定された。
【0037】
これらの化合物に対するDAT、SERT、及びNETの活性は、多数の手段において有用になりうる。例えば、放射性リガンド型のこれらの開示された化合物は、SPECT及びPETの造影研究用に、CNS中でのDAT用の造影剤としての適用を見出すであろう。このような造影はパーキンソン病を診断するのに有用となりうる。
【0038】
更に化合物は、新しい候補のCNS作用薬を試験する場合に、比較リガンド又は塩基リガンド用途の、DAT、SERT、及びNET用のリガンドとして作用しうる。しかしながら、最も重要なことには、本発明の化合物は低濃度での結合親和性によって示されるように、薬物中毒のようなCNS障害、特にコカイン及びPCPの投与の影響、場合によっては、合法及び違法の双方の、他の向精神薬の投与の影響を治療する場合に有用性がある。化合物は例えば、コカイン中毒を治療するのに用いてもよい。本発明の化合物は更に、本明細書中に記載のインビトロ研究に基づき、パーキンソン病及び他の関連する障害を罹患した患者への投与に対する有用性を示す。化合物は更に抗うつ剤として、及び上述に関連する他の神経障害を治療する場合に、有用性がある。
【0039】
従って、今日までに実行され、本明細書中に開示された研究は、哺乳類種、特にヒトでのCNS障害の治療にける、本発明で主張される化合物の使用を支持する。有効用量は治療中の特定の障害に依存して変化する。一般的に、投与は、脳組織及び/又は体液がDAT、SERT、又はNETへの測定可能な結合を引き起こす場合に存在する濃度の程度となる。この結合は、本発明の放射標識された化合物を用いるステップを具える従来技術によって、あるいは、他の放射標識されたリガンドを置換するように本発明の化合物を用いることによって評価できる。SPECT及びPETといった従来技術は結合を評価するのに用いてもよい。
【0040】
一般的に、血液又は血漿中の化合物の濃度は、本明細書中で測定されるように、各々の輸送体について約1%ないし約1000%のIC50濃度、より好適には5%ないし400%、更により好適には10%ないし200%の範囲にすべきである。
【0041】
投与は、例えば、好適な溶媒中に溶解、又は液体中に分散若しくは乳化される活性化合物を含む液体として、静脈内に、錠剤又はカプセル形状の固体として、注入される液体として非経口的に、あるいは経皮貼布によって経皮的に、といった薬学的に許容可能な形態にしてもよい。各々の製剤は通常の薬学的に許容可能な添加剤を含んでもよく、限定しないが、香味剤、臭気剤、錠剤化助剤(tabletting aid)、溶解度賦活剤(solubility enhancer)、透過性賦活剤(permeability enhancer)、界面活性剤、賦形剤等を含んでもよい。更に化合物は、薬学的に許容可能な塩の好適な塩形成剤と反応させてもよく、限定しないが酢酸塩、ギ酸塩、シュウ酸塩、酒石酸塩、塩酸塩、臭化水素酸塩、硫酸水素塩等を含んでもよい。
【0042】
経口投与の場合の推定される有用な用量は、体重1kgにつき0.01mgないし100mg、より好適には0.1mgないし50mg、更により好適には0.2mgないし30mgである。平均的な成体の全用量は5mgないし500mg、好適には10mgないし250mg、最も好適には10mgないし150mgの範囲であってもよい。実際の用量は従来の方法論によって簡単に定量できる。
【0043】
標的化合物は、遊離塩基、あるいは例えば、塩酸塩、臭化水素酸塩、又はシュウ酸塩といった塩として調製される。化合物の特徴は、標準的な高磁場NMR、質量スペクトル、旋光度等を用いて得られる。化合物の純度は元素分析、TLC、又はHPLCによって測定される。98%より高い純度は、これらの化合物の生物学的分析に好適である。いくつかの一般的な合成経路は本明細書中で用いられてきた。合成有機化学者に周知の他の合成方法は、本発明の化合物を調製するのに、あるいはこれらの化合物を誘導体化するのに用いてもよい。
【0044】
[I.中間体の合成]
《1−(メトキシカルボニル)−4−[(2−ジフェニルメトキシ)エチル]ピペリジン》
ベンゼン(60ml)中の、4−[2−(ジフェニルメトキシ)エチル]−1−(フェニルメチル)ピペリジン(4.62g、11.82mmol)及びクロロギ酸メチル(2.60g、23.53mmol)の溶液は6時間還流された。T.L.C.が反応の完了を示した後に、溶媒は減圧下で除去されて、粘稠液体の1−(メトキシカルボニル)−4−[(2−ジフェニルメトキシ)エチル]ピペリジン4.17g(99%の収率)を提供した。1H NMR(CD3Cl)δ7.34−7.18(10H、m、Ar−H)、5.30(1H、s、Ph2CHO)、3.67(3H、s、OCH3)、3.50−3.46(2H、t、J=6.0Hz、OCH2)、2.77−2.68(2H、t、J=12.3Hz、N(CH)2)、2.62−2.54(2H、t、J−12.0Hz、N(CH)2)、1.67−1.57(5H、m)、1.26−1.07(2H、m)。
【0045】
《4−[(2−ジフェニルメトキシ)エチル]ピペリジン》
1−(メトキシカルボニル)−4−[(2−ジフェニルメトキシ)エチル]ピペリジン(4.17g、11.81mmol)はエタノール(100ml)中に溶解され、KOH(2.5g)は溶液中に添加された。反応溶液は3日間還流された。溶媒は蒸発させ、EtOAcが添加された。EtOAc溶液は鹹水によって洗浄され、Na2SO4で乾燥させ、蒸発させて粗生成物を提供し、粗生成物はクロマトグラフィ(EtOAc/MeOH/Et3N=100/5/2)によって精製されて、白色固体の4−[(2−ジフェニルメトキシ)エチル]ピペリジン2.80g(80%の収率)を提供した。1H NMR(CD3Cl)δ7.35−7.19(10H、m、Ar−H)、5.31(1H、s、Ph2CHO)、3.50−3,46(2H、t、J=6.0Hz、OCH2)、3.08−3.04(2H、bd、J=2.3Hz、N(CH)2)、2.77−2.68(2H、t、J=12.6Hz)、2.62−2.54(2H、t、J=12.3Hz、N(CH)2)、1.82−1.57(5H、m)、1.14−1.02(2H、m)。分析:[C20H25NO・2.0H2O]、計算値:C 79.90;H 8.58;N 4.66、実測値:C 79.86;H 8.59;N 4.70。
【0046】
《N−ベンズヒドリルオキシフタルイミド》
DMF(50ml)中の、1−クロロ−1,1−ジフェニルメタン(3.42g、16.93mmol)、N−ヒドロキシフタルイミド(2.30g、14.11mmol)、及びEt3N(3.0ml)の溶液は、N2下で8時間、60℃で攪拌された。反応混合物が室温に冷却された後に、水(100ml)が添加された。混合物はEt2Oで抽出された。混合有機相はNa2SO4で乾燥させた。溶媒の蒸発後、粗生成物はクロマトグラフィ(ヘキサン/ベンゼン/EtOAc=20/10/3)によって精製されて、白色固体3.95g(85%の収率)を提供した。1H NMR(CD3Cl)δ7.72−7.63(1H、m)、7.56−7.53(1H、m)、7.40−7.24(12H、m)、5.85(1H、s、Ph2CH)。
【0047】
《O−ベンズヒドリルヒドロキシルアミン》
N−ベンズヒドリルオキシフタルイミド(1.03g、3.14mmol)はEtOH(20ml)に溶解された。NH2NH2(0.3ml)はEtOH溶液に添加された。反応混合物が0.5時間室温で攪拌された後、EtOHは減圧下で除去され、EtOAc(60ml)が添加された。混合物は濾過された。溶液は収集され、Na2SO4で乾燥させた。溶媒の蒸発後、粗生成物はクロマトグラフィ(ヘキサン/EtOAc=5/1)によって調製されて、粘性油0.31g(50%の収率)を提供した。1H NMR(CD3Cl)δ7.34−7.26(10H、m、AR−H)、5.65(1H、s、Ph2CH)。
【0048】
《1−[(4−フルオロフェニル)メチル]−4−ピペリジンメタノール》
乾燥THF(50ml)は、氷浴中のN2下の水素化アルミニウムリチウム(0.7g)に液滴添加された。乾燥THF(10ml)中の1−[(4−フルオロフェニル)メチル]−4−(エトキシカルボニル)ピペリジン(1.21g、4.57mmol)はLAH懸濁溶液に液滴添加された。反応混合物は2時間還流された。飽和NaOH/H2O(3ml)は液滴添加され、反応は氷浴によって冷却した。混合物は濾過された。溶液はNa2SO4で乾燥させ、0.98g(98%の収率)の符号11を生成するように蒸発させた。1H NMR(CD3Cl)δ7.36−7.26(2H、m、Ar−H)、7.07−6.96(2H、m、Ar−H)、4.66(1H、s、OH)、3.50−3.48(2H、d、J=6.0Hz、CH2OH)、3.46(2H、s、F−PhCH2)、2.90−2.87(2H、bd、J=11.1Hz、N(CH)2)、1.99−1.91(2H、dt、J=1.8、11.8Hz、N(CH)2)、1.73−1.68(3H、m)、1.34−1.22(2H、m)。
【0049】
《1−[(4−フルオロフェニル)メチル]−4−ピペリジンカルボアルデヒド》
CH2Cl2(20ml)中の、オキシリルクロリド(oxylyl chloride:0.59ml、3.95mmol)の溶液は−78℃に冷却された。DMSO(0.95ml、13.38mmol)は、オキシリルクロリド溶液に液滴添加された。反応混合物は5分間攪拌され、CH2Cl2(20ml)中の1−[(4−フルオロフェニル)メチル]−4−ピペリジンメタノール(0.99g、4.46mmol)は反応溶液に液滴添加された。攪拌は更に20分間継続された。Et3N8.0mlが添加され、反応混合物は10分間攪拌され、その後室温に温められた。水(50ml)が添加され、混合物はCH2Cl2で抽出された。混合したCH2Cl2溶液はNa2SO4で乾燥させた。溶媒の蒸発によって油0.77g(79%の収率)が提供された。1H NMR(CD3Cl)δ9.65(1H、s、CHO)、7.30−7.24(2H、m、Ar−H)、7.00−6.97(2H、m、Ar−H)、3.46(2H、s、p−FPhCH2)、2.81−2.76(2H、m、N(CH)2)、2.30−2.20(1H、m、CHCHO)、2.14−2.06(2H、dt、J=2.1、11.3Hz、N(CH)2)、1.92−1.86(2H、dd、J=3.5、13.5Hz)、1.74−1.62(2H、m)。
【0050】
《4−[(2−ジフェニルエチル)アミノカルボニル]−1−[(4−フルオロフェニル)メチル]ピペリジン》
1−[(4−フルオロフェニル)メチル]−4−(エトキシカルボニル)ピペリジン(0.68g、2.72mmol)はカルボン酸に変換され、次いで、2,2−ジフェニルエチルアミン(0.67g、3.40mmol)、EDCI(0.76g、3.95mmol)、及びHOBT(0.62g、4.59mmol)と反応させて、4−[(2−ジフェニルエチル)アミノカルボニル]−1−[(4−フルオロフェニル)メチル]ピペリジン0.84g(75%の収率)を生成した(手順D)。1H NMR(CD3Cl)δ7.36−7.20(12H、m、Ar−H)、7.01−6.95(2H、m、Ar−H)、5.39(1H、bs、NH)、4.21−4.15(1H、t、J=7.8Hz、Ph2CH)、3.91−3.86(2H、t、J=7.5Hz、CH2NH)、3.41(2H、s、p−FPhCH2)、2.84−2.80(2H、d、J=11.4Hz、N(CH)2)、1.96−1.87(3H、m、NHCOCH、NH(CH)2)、1.65−1.58(4H、m)。
【0051】
《4−[(ビス(4−フルオロフェニル)エチルアミノ)カルボニル−1−(フェニルエチル)ピペリジン》
1−(フェニルエチル)−4−(エトキシカルボニル)ピペリジン(0.25g、0.95mmol)はカルボン酸に変換され、次いで、Et3N(1.5ml)及びCH2Cl2(20ml)中のビス(4−フルオロフェニル)メチルアミン(0.25g、1.14mmol)、EDCI(0.25g、1.27mmol)、HOBT(0.20g、1.48mmol)と反応させて、4−[(ビス(4−フルオロフェニル)エチルアミノ)カルボニル−1−(フェニルエチル)ピペリジン0.32g(74%の収率)を生成した(手順E)。1H NMR(CD3Cl)δ7.29−7.03(10H、m、Ar−H)、7.05−6.99(3H、m、Ar−H)、6.22−6.20(1H、d、J=7.8Hz)、p−FPh2CH)、6.00−5.97(1H、d、J=7.5Hz、NH)、3.08−3.04(2H、bd、J=11.4Hz、N(CH)2)、2.83−2.78(2H、d)、2.62−2.57(2H、m)、2.25−2.15(1H、m、NCOCH)、2.10−2.03(2H、t、J=11.4Hz、N(CH)2)、1.96−1.81(4H、m)。
【0052】
《4−[(1−フェニルエチル)アミノカルボニル]メチル−1−[(4−フルオロフェニル)メチル]ピペリジン》
1−[(4−フルオロフェニル)メチル]−4−[(エトキシカルボニル)メチル]ピペリジン(0.55g、1.97mmol)は、CF3CO2H/HCl/H2O(1:1:1)10mlに還流されて、対応する酸を提供し、次いで、CH2Cl2(10ml)中の1−フェニルエチルアミン(0.29g、2.40mmol)、EDCI(0.56g、2.97mmol)、及びHOBT(0.40g、2.96mmol)と反応させて、固体0.33g(50%の収率)を生成した(手順D)。1H NMR(CD3Cl)δ7.35−7.23(7H、m、Ar−H)、7.00−6.94(2H、t、J=8.4Hz、Ar−H)、5.83−5.80(1H、bd、J=7.5Hz、NH)、5.15−5.10(m、1H、PhCHMe)、3.42(s、2H、p−PhCH2N)、2.83−2.78(m、2H、N(CH)2)、2.07−2.05(2H、d、J=7.2Hz、CH2CO)、1.99−1.89(2H、m)、1.86−1.78(1H、m)、1.71−1.61(2H、t、J=15Hz)、1.48−1.45(3H、d、J=6.9Hz、Me)、1.33−1.21(2H、m)。
【0053】
《2−(ジフェニルシアノメチル)−5−ニトロピリジンの合成》
3mLのトルエン中の、1.0gの2−クロロ−5−ニトロピリジン(6.3mmol)、1.33gのジフェニルアセトニトリル(6.9mmol、1.1当量)及び700mgのフッ化テトラブチルアンモニウム(3.15mmol、0.5当量)の混合物に対し、1.5mLの50%のNaOH水溶液が液滴添加された。30分後、TLC(ヘキサン/EtOAc)は出発物質を残さなかった。混合物はタールを除去するために、シリカのショートプラグを通して濾過され、蒸発させ、色相分析された(SiO2;ヘキサン/EtOAc)。粗生成物はMeOHから再結晶化されたわずかに黄色い油であり、融点94ないし99℃の呈色のないプレートとして表題の化合物(1.7g、86%)を提供した。1H NMR(CDCl3:300MHz)7.20−7.29(5H、m)、7.35−7.42(5H、m)、7.54(1H、d、J=8.7Hz、H−3)、8.49(1H、dd、J=3及び9Hz、H−4)、9.60(1H、d、J=2.4Hz、H−6)。13C NMR(CDCl3;300MHz)60.19、121.65、123.77、128.87、129.09、129.33、132.52、138.46、143.49、145.31、164.99。元素分析はC19H13N3O2について計算された:C 72.38;H 4.13;N 13.33。実測値:C 72.35;H 4.08;N 13.25。
【0054】
《2−(ジフェニルアセトアミドメチル)−5−ニトロピリジンの合成》
5.0gの2−(ジフェニルシアノメチル)−5−ニトロピリジン(15.8mmol)の混合物は、10mLのH2Oで希釈された、40mLの濃H2SO4の磁気攪拌された室温溶液に添加された。混合物は次いで、総ての出発物質がTLC(〜2時間)によって消費されるまで、90℃に加熱された。濃い溶液は更に、粉砕した氷及び水に注入され、1時間攪拌され、表題の未精製の化合物が沈殿する。混合物はEtOAcで三回抽出され、貯蔵され、乾燥させ(MgSO4、セライトのショートプラグを通した濾過を伴う)、蒸発させた。乾式カラムクロマトグラフィ(シリカ;ヘキサン/EtOAc/MeOH)は、融点160ないし164℃の非結晶型の黄褐色の固体として、表題の化合物(4.74g、90%)を提供した。1H NMR(CDCl3;300MHz)5.9(1H、bs、NH)、7.05−7.1(4H、m、ArH)、7.26(1H、d、J=2.4及び6.3Hz、H−4)、9.43(1H、d、J=1.8Hz、H−6)。13C NMR(CDCl3;400MHz)126.78、128.02、128.64、130.25、131.68、142.09、143.43、169.44、173.99。元素分析はC19H15N3O3について計算された:C 68.47;H 4.50;N 12.61。実測値:C 68.49;H 4.55;N 12.60。
【0055】
《ジフェニル−(5−アミノ−2−ピリジル)アセトアミドの合成》
50%のEtOH/氷AcOH中の8.86gのジフェニル−(5−ニトロ−2−ピリジル)アセトアミド(26.5mmol)の、100mgの酸化白金(IV)との混合物は、Parr社の水素化装置(Parr hydrogenator:30psi H2)で3時間振盪された。混合物はセライト層を通して濾過され、エタノールは減圧下で蒸発させた。混合物は次いでK2CO3で塩基性にされ、EtOAc(4倍)で抽出され、乾燥させ(MgSO4)、再度セライトを通して濾過され、蒸発させた。残りの固体はヘキサン/EtOAc/MeOHから再結晶化させて、黄褐色結晶としての表題の化合物(7.9g、98%)を提供した。融点は215ないし220℃であった。1H NMR(CDCl3;300MHz)δ3.85(2H、bs、NH)、5.88(1H、bs、CONH)、6.54(1H、d、J=8.4Hz)、6.84(1H、dd、J=3及び8.7Hz)、7.01−7.06(4H、m)、7.24−7.32(6H、m)、8.11(1H、d、J=2.4Hz、H−6)、9.57(1H、bs、CONH)。元素分析はC19H17N3O・0.25H2Oについて計算された:C 74.15;H 5.69;N 13.67。実測値:C 74.06;N 5.69;H 13.78。
【0056】
《2−ジフェニルメチル−5−アミノピリジンの合成》
N2雰囲気下で5.28gのジフェニルメチル−(5−アミノ−2−ピリジル)アセトアミド(17.4mmol)と150mLの37%HClとの混合物は、総ての出発物質がTLC(〜18時間)によって消費されるまで還流された。混合物は次いで300gの氷及びH2Oで冷却及び注入され、K2CO3で塩基性にされた。混合物はEtOAc(150mL)で3回抽出され、乾燥させ(MgSO4)、凝固したグリーンオイルに蒸発させた。これは色相分析され(SiO2;ヘキサン/EtOAc)、融点130ないし134℃の黄褐色結晶性固体としての表題の化合物(4.09g、90%)を得た。1H NMR(CDCl3;300MHz)δ3.52(2H、bs、NH)、5.61(1H、s、CH(C6H5)2)、6.83−6.91(2H、m、ArH)、7.15−7.32(10H、m、ArH)、8.08(1H、d、J=2.4Hz、H−6)。13C NMR(CDCl3;300MHz)58.61、122.38、123.98、126.55、128.57、129.56、137.31、140.77、143.64、153.39。元素分析はC18H16N2について計算された:C 83.08;H 6.15;N 10.77。実測値:C 82.82;H 6.30;N 10.81。
【0057】
《ラセミのシス−及びトランス−2−ジフェニルメチル−5−アミノピペリジンの合成》
454mgの2−ジフェニルメチル−5−アミノピリジンの二塩化水素化物の塩(3.83mmol)と20mLのMeOHの溶液に、50mgの酸化白金(IV)が添加され、混合物はH2雰囲気(60psi)下で10時間、室温で振盪された。混合物は次いでセライトを通して濾過され、MeOHは蒸発させた。残りの残留物は飽和K2CO3で希釈され、CH2Cl2(5倍)で抽出された。抽出物は貯蔵され、乾燥させ(MgSO4)、無色油に蒸発させた。油は色相分析され(SiO2;CH2Cl2/MeOH/トリエチルアミン)、無色油として300mg(82%)の表題の化合物を得た。油はEtO2の添加で凝固された。ジアステレオマのこの混合物のサンプルはPTLC(SiO2;ヘキサン/EtOAc/MeOH)によって分離された。第1の溶出:ラセミのシス−2−ジフェニルメチル−5−アミノピペリジン;1H NMR(CDCl3;400MHz)δ1.35−1.45(2H、m、H−3)、1.55−1.65(2H、m、H−4)、2.08(3H、bs、NH)、2.77−2.82(2H、s、H−6)3.0(1H、m、Σ3J=13Hz、H−5eq)、3.25(1H、dt、3J=4.0及び8.8Hz、H−2ax)、3.81(1H、d、3J=10.4Hz、CH(C6H5)2)、7.1−7.4(10H、m、ArH)。第2の溶出:ラセミのトランス−2−ジフェニルメチル−5−アミノピペリジン;1H NMR(CDCl3;400MHz)δ1.1−1.25(2H、m、H−3ax、H−4ax)、1.55−1.6(1H、m、H−3eq)、1.9−1.96(1H、m、H−4eq)、2.13(3H、bs、NH)、2.35(1H、t、2J及び3J=10.8Hz、H−6ax)、2.85(1H、m、Σ3J=38Hz、H−5ax)、3.11(1H、d、2J=9.2Hz、H−6eq)、3.19(1H、t、3J=10.8Hz、H−2ax)、3.69(1H、d、3J=10Hz、CH(C6H5)2)、7.15−7.4(10H、m、ArH)。表題の化合物の精製され、分離されない混合物の1H NMR(CDCl3;400MHz)は、複合化により60のシス型:40のトランス型の比率を示した(CH(C6H5)2)。
【実施例1】
【0058】
[II.図1ないし4の実施例]
《4−[2−(ジフェニルメトキシ)エチル]−1−[(3−フルオロフェニル)メチル]ピペリジン》
DMF(10ml)中の、4−[(2−ジフェニルメトキシ)エチル]ピペリジン4(58mg、0.19mmol)、3−フルオロベンジルクロリド(51mg、0.35mmol)、Et3N(0.5ml)、及び無水K2CO3の混合物は、65℃で一晩攪拌された。反応混合物は30mlの水で希釈され、Et2Oで抽出された。混合有機相はNa2SO4で乾燥させ、蒸発させて粗生成物を提供し、粗生成物はクロマトグラフィ(EtOAc/ヘキサン=1/3)によって精製されて、4−[2−(ジフェニルメトキシエチル]−1−[(3−フルオロフェニル)メチル]ピペリジンの粘稠液体62mg(79%の収率)を提供した(手順A)。1H NMR(CD3Cl)δ7.34−7.20(10H、m、2Ph)、7.11−7.03(3H、m、m−FPh)、6.95(1H、m、m−FPh)、5.31(1H、s、Ph2CH)、3.45−3.44(2H、t、J=6.6Hz、OCH2)、3.44(2H、s、m−FPhCH2)、2.84−2.80(2H、bd、J=11.1Hz、N(CH)2)、1.97−1.89(2H、t、J=11.4Hz、N(CH)2)、1.63−1.51(4H、m)、1.49−1.44(1H、m)、1.29−1.21(2H、m)。遊離塩基は融点=150ないし151℃のシュウ酸塩に変換された。分析:[C27H30NOF・(COOH)2・0.3H2O]、計算値:C 69.79;H 6.58;N 2.80、実測値:C 69.87;H 6.80;N 2.76。
【実施例2】
【0059】
《4−[2−(ジフェニルメトキシ)エチル]−1−[(3,4−ジフルオロフェニル)メチル]ピペリジン》
4−[(2−ジフェニルメトキシ)エチル]ピペリジン4(0.12g、0.42mmol)は乾燥DMF(10ml)中で(3,4−ジフルオロ)ベンジルブロミド(bromode)(0.17g、0.82mmol)、Et3N(0.5ml)、及びK2CO3(0.6g)と反応させて、粘稠液体として4−[2−(ジフェニルメトキシ)エチル]−1−[(3,4−ジフルオロフェニル)メチル]ピペリジン0.15g(86%の収率)を提供した(手順A)。1H NMR(CD3Cl)δ7.34−6.99(13H、m、Ar−H)、5.31(1H、s、Ph2CH)、3.49−3.45(2H、t、J=6.3Hz、OCH2)、3.85(s、2H、NCH2Ph)、2.80−2.77(2H、d、J=11.4Hz、N(CH)2)、1.95−1.87(2H、t、J=11.4Hz、N(CH)2)、1.63−1.55(4H、m)、1.50−1.42(1H、m)、1.28−1.15(2H、m)。遊離塩基は融点=158ないし159℃のシュウ酸塩に変換された。分析:[C27H29NOF2・(COOH)2]、計算値:C 68.07;H 6.11;N 2.73、実測値:C 68.18;H 6.13;N 2.73。
【実施例3】
【0060】
《4−[2−(ジフェニルメトキシ)エチル]−1−[((4−トリフルオロメチル)フェニル)メチル]ピペリジン》
4−[(2−ジフェニルメトキシ)エチル]ピペリジン4(0.11g、0.37mmol)は、DMF(10ml)中で(4−トリフルオロメチル)ベンジルクロリド(0.14g、0.72mmol)、Et3N(0.5ml)、及びK2CO3(0.5g)と反応させて、粘稠液体として4−[(ジフェニルメトキシ)エチル]−1−[((4−トリフルオロメチル)フェニル)メチル]ピペリジン0.15g(92%の収率)を提供した(手順A)。1H NMR(CD3Cl)δ7.64−7.47(4H、m、CF3Ph)、7.34−7.23(10H、m、2Ph)、5.31(s、Ph2CH)、3.52(2H、s、p−FPhCH2)、3.49−3.45(2H、t、J=6.3Hz、OCH2)、2.84−2.80(2H、d、J=11.1Hz、N(CH)2)、2.00−1.92(2H、t、J−11.1Hz、N(CH)2)、1.63−1.55(4H、m)、1.49−1.42(1H、m)、1.27−1.15(2H、m)。遊離塩基は融点=149ないし150℃のシュウ酸塩に変換された。分析:[C27H30NOF3・(COOH)2・0.70H2O]、計算値:C 64.77;H 6.05;N 2.51、実測値:C 65.15;H 6.46;N 2.40。
【実施例4】
【0061】
《4−[2−(ジフェニルメトキシ)エチル]−1−[(4−シアノフェニル)メチル]ピペリジン》
4−[(2−ジフェニルメトキシ)エチル]ピペリジン4(0.15g、0.52mmol)は、DMF10ml中で4−シアノベンジルブロミド(0.18g、0.92mmol)、Et3N(0.5ml)、及びK2CO3(0.7g)と反応させて、白色固体として4−[2−(ジフェニルメトキシ)エチル−1−[(4−シアノフェニル)メチル]ピペリジン0.17g(84%の収率)を提供した(手順A)。1H NMR(CD3Cl)δ7.61=7.58(2H、d、J=7.5Hz、Ar−H)、7.45−7.42(2H、d、J=7.5Hz、Ar−H)、7.33−7.22(10H、m、Ar−H)、5.31(1H、s、Ph2CHO)、351(2H、s、P−CNPhCH2)、3.50−3.46(2H、t、J=6.0Hz、OCH2CH2)、2.81−2.77(2H、bd、J=10.8Hz、N(CH)2)、2.00−1.93(2H、t、J=11.1Hz、N(CH)2)、1.65−1.56(4H、m)、1.52−1.46(1H、m、OCH2CH2CH)、1.30−1.18(2H、m)。遊離塩基は融点=120ないし121℃のシュウ酸塩に変換された。分析:[C28H30N2O)・(CO2H)2・0.26H2O]、計算値:C 71.32;H 6.48;N 5.54、実測値:C 71.32;H 6.69;N 5.39。
【実施例5】
【0062】
《4−[2−(ジフェニルメトキシ)エチル]−1−[(フェニルメチル)カルボニル]ピペリジン》
Et3N(1ml)及び乾燥CH2Cl2(10ml)中で、フェニル酢酸(0.11g、0.82mmol)、1−[3−(ジメチルアミノ)プロピル]−3−エチルカルボジイミドヒドロクロリド(EDCI)(0.17g、0.88mmol)、及び1−ヒドロキシベンゾトリアゾール(HOBT)(0.11g、0.88mmol)の溶液が1時間室温で攪拌された。CH2Cl2(5ml)中で4−[(2−ジフェニルメトキシ)エチル]ピペリジン4(0.12g、0.41mmol)が添加された。溶液は室温で一晩攪拌された。溶媒は減圧中で除去され、残留物はEtOAcに溶解された。有機相は5%のクエン酸水溶液、その後飽和NaHCO3溶液で洗浄され、Na2SO4で乾燥させた。有機抽出物は蒸発させて粗生成物を提供し、粗生成物はクロマトグラフィ(EtOAc/ヘキサン=1/3)によって精製されて、粘稠液体である4−[2−(ジフェニルメトキシ)エチル]−1−[(フェニルメチル)カルボニル]ピペリジン(5e)0.27g(96%の収率)を収集した(手順B)。1H NMR(CD3Cl)δ7.32−7.25(15H、m、Ar−H)、5.29(1H、s、Ph2CHO)、4.62−4.58(1H、d、J=12.6Hz、NCH)、3.84−3.79(1H、d、J=13.2Hz、NCH)、3.72(2H、s、PhCH2)、3.47−3.43(2H、t、J=6.2Hz、OCH2)、2.96−2.88(1H、t、J=12.6Hz、NCH)、2.58−2.50(1H、t、J=12.3Hz、NCH)、1.68−1.52(3H、m)、1.27−1.19(2H、m)、1.10−1.03(1H、m)、0.89−0.081(1H、m)。分析:[C28H31O2N・0.12H2O]、計算値:C 80.90;H 7.51;N 3.37、実測値:C 80.87;H 7.50;N 3.27。
【実施例6】
【0063】
《4−[2−(ジフェニルメトキシ)エチル]−1−[((4−メチルスルホニルアミノ)フェニル)メチル]ピペリジン》
4−[(2−ジフェニルメトキシ)エチル]−1−[((4−アミノ)フェニル)メチル]ピペリジン(0.11g、0.29mmol)はCH2Cl2(5ml)に溶解させた。CH3SO2Cl(0.04g)及びEt3N(0.1ml)が添加された。反応混合物は室温で一晩攪拌された。溶媒は蒸発させ、EtOAc60mlが添加された。有機相は飽和NaHCO3/H2O及び鹹水によって洗浄され、Na2SO4で乾燥させた。蒸発後、粗生成物がクロマトグラフィ(EtOAc/MeOH=100/1)によって精製されて、純粋化合物である、4−[(2−ジフェニルメトキシ)エチル]−1−[((4−メチルスルホニルアミノ)フェニル)メチル]ピペリジン26mg(20%の収率)を提供した。1H NMR(CD3Cl)δ7.41−7.14(14H、m、Ar−H)、5.31(1H、s、Ph2CHO)、3.49−3.34(4H、m、OCH2CH2、NCH2Ph)、3.40(1H、s、NH)、2.98(3H、s、CH3SO2)、2.85−2.81(2H、bd、J=10.8Hz、N(CH)2)、1.97−1.90(2H、t、J=10.8Hz、N(CH)2)、1.64−1.51(4H、m)、1.50−1.45(1H、m、O(CH2)2CH)、1.28−1.17(2H、m)。遊離塩基は融点=122ないし124℃のシュウ酸塩に変換された。分析:[C28H34N2O3S・(COOH)・1.15H2O]、計算値:C 61.14;H 6.55;N 4.75、実測値:C 61.14;H 6.42;N 4.71。
【実施例7】
【0064】
《4−[((2−ジフェニルメトキシ)アミノ)メチル]−1−[(4−フルオロフェニル)メチル]ピペリジン》
ClCH2CH2Cl(20ml)中の、O−ベンズヒドリルヒドロキシルアミン9(0.25g、1.27mmol)及びアルデヒドの1−[(4−フルオロフェニル)メチル]−4−ピペリジンカルボアルデヒド(0.28g、1.27mmol)の溶液に、Na(OAc)3BH(0.54g、2.55mmol)が添加された。反応混合物は室温で一晩攪拌された。EtOAc80mlが添加され、溶液は飽和NaHCO3/H2O及び鹹水によって洗浄された。有機相はNa2SO4で乾燥させ、蒸発させて粗生成物を提供し、粗生成物はクロマトグラフィ(EtOAc/ヘキサン=1/2)によって精製されて、無色油0.43g(84%の収率)を提供した。1H NMR(CD3Cl)δ7.36−7.23(12H、m、Ar−H)、7.01−6.95(2H、t、J=7.4Hz、Ar−H)、3.41(2H、s、p−F−PhCH2)、2.82−2.78(2H、bd、J=11.1Hz、N(CH)2)、2.25−2.21(1H、m、NH)、2.00−1.93(2H、t、J=10.8Hz、N(CH)2)、1.71−1.47(7H、m)。遊離塩基は融点=154ないし155℃のシュウ酸塩に変換された。分析:[C26H29FN2O・(COOH)・0.10H2O]、計算値:C 67.88;H 6.32;N 5.65、実測値:C 67.62;H 5.90;N 5.51。
【実施例8】
【0065】
《4−[2−((ジフェニルメチル)アミノ)エチル]−1−[(3,4−ジフルオロフェニル)メチル]ピペリジン》
乾燥THF20ml中の、4−[2−ジフェニルメチル)アミノカルボニル]メチル−1−[(3,4−ジフルオロフェニル)メチル]ピペリジン(0.12g、0.28mmol)の溶液に、1MのBH3/THF(1.0ml)が添加された。反応溶液は6時間還流された。溶液が室温まで冷却された後に、MeOH(5ml)がゆっくりと添加された。溶媒は減圧下で除去された。10%のHCl/MeOH(10ml)が残留物に添加され、溶液は1時間還流された。固体のNaHCO3は、MeOHが蒸発された後に添加させた。混合物はEtOAcで抽出された。混合有機相はNa2SO4で乾燥させ、蒸発させて粗生成物を提供し、クロマトグラフィ(ヘキサン/EtOAc/Et3N=1/2/1%)によって、白色固体0.11g(90%の収率)に精製された(手順E)。1H NMR(CD3Cl)δ7.39−6.99(13H、m、Ar−H)、4.79(1H、s、Ph2CH)、3.39(2H、s、F2PhCH2)、2.80−2.76(2H、d、J=11.1Hz、N(CH)2)、2.60−2.55(2H、t、J=7.0Hz、NCH2)、1.93−1.86(2H、t、J=11.1Hz、N(CH)2)、1.62−1.58(2H、d、J=12Hz)、1.49−1.42(2H、q、J=6.3Hz、NCH2CH2)、1.35−1.31(1H、m、NCH2CH2CH(CH2)2)、1.26−1.19(2H、t、J=12.0Hz)。遊離塩基は融点=280ないし281℃のHCl塩に変換された。分析:(C27H30N2F2・2HCl・0.25H2O)、計算値:C 65.12;H 6.85;N 5.62、実測値:C 65.13;H 6.80;N 5.28。
【実施例9】
【0066】
《4−[2−((ジフェニルメチル)アミノ)エチル]−1−(フェニルメチルピペリジン》
化合物4−[2−(ジフェニルメチル)アミノカルボニル)メチル−1−(フェニルメチル)ピペリジン(0.54g、1.31mmol)はTHF(10ml)中で1MのBH3/THF(5.0ml)と反応させて、4−[2−(ジフェニルメチル)アミノ]エチル−1−(フェニルメチルピペリジン0.44g(84%の収率)を生成した(手順E)。1H NMR(CD3Cl)δ7.39−7.19(15H、m、Ar−H)、4.79(1H、s、PhCH)、3.47(2H、s、PhCH2)、2.86−2.82(2H、d、J=11.1Hz、N(CH)2)、2.59−2.55(2H、t、J=7.2Hz、NCH2)、1.94−1.87(2H、t、J=11.1Hz、N(CH)2)、1.61−1.58(2H、m)、1.48−1.42(2H、m)、1.34−1.20(3H、m)。遊離塩基は融点−172ないし174℃のHCl塩に変換された。分析:(C27H32N2・2HCl・106H2O)、計算値:C 68.05;H 7.64;N 5.88、実測値:C 68.06;H 7.82;N 5.90。
【実施例10】
【0067】
《4−[2−((ジフェニルメチル)−N−メチルアミノ)エチル]−1−(4−フェニルメチル)ピペリジン》
4−[(2−ジフェニルエチル)アミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン(0.23g、0.59mmol)、ホルムアルデヒド(1.0g、37%/H2O)、及びギ酸(2.0g、88%/H2O)の溶液は3時間還流された。反応溶液が室温まで冷却された後、溶媒は減圧下で除去された。粗生成物はクロマトグラフィ(EtOAc/ヘキサン=l/2)によって精製されて、白色固体0.17g(71%の収率)を提供した。1H NMR(CD3Cl)δ7.40−7.16(12H、m、Ar−H)、7.05−6.95(2H、t、J=7.4Hz、Ar−H)、4.31(1H、s、Ph2CHN)、3.41(2H、s、p−FPhCH2N)、2.80−2.76(2H、d、J=11.8Hz、N(CH)2)、2.36−2.30(2H、t、J=7.5Hz、NCH2)、2.11(3H、s、NCH3)、1.91−1.83(2H、t、J=11.4Hz、N(CH)2)、1.54−1.50(2H、d、J=11.4Hz)、1.47−1.40(3H、m、NCH2CH2CH)、1.32−1.10(2H、m)。遊離塩基は融点=260ないし261℃のHCl塩に変換された。分析:[C28H33N2F・2HCl・0.50H2O]]、計算値:C 67.46;H 7.29;N 5.61、実測値:C 67.33;H 7.19;N 5.56。
【実施例11】
【0068】
《4−[[2−(ジフェニル)エチル]アミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン》
化合物4−[(2−ジフェニルエチル)アミノカルボニル]−1−[(4−フルオロフェニル)メチル]ピペリジン(0.32g、13mmol)はTHF(20ml)中で1MのBH3/THF(4.0ml)と反応させて、4−[(2−ジフェニルエチル)アミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン0.25g(81%の収率)を生成した(手順E)。1H NMR(CD3Cl)δ7.32−7.19(12H、m、Ar−H)、7.00−695(2H、m、Ar−H)、4.21−4.17(1H、t、J−7.7Hz、(Ph2CH)、3.67(1H、s、NH)、3.41(2H、s、p−FPhCH2)、3.22−3.19(2H、d、J=7.8Hz、NHCH2CH(Ph)2)、2.83−2.79(2H、bd、J=11.1Hz、N(CH)2)、2.52−2.50(2H、d、J=6.6Hz、NHCH2CH)、1.91−1.84(2H、t、J=11.1Hz、1.58−1.54(2H、d、J−12Hz)、1.45−1.39(1H、m、NHCH2CH)、1.21−1.14(2H、t、J=12Hz)。遊離塩基は融点=126ないし127℃のHCl塩に変換された。分析:[C27H31FN2O・2HCl]、計算値:C 62.96;H 7.31;N 5.43、実測値:C 62.93;H 7.19;N 5.41。
【実施例12】
【0069】
《4−[(ビス(4−フルオロフェニル)メチルアミノ)メチル]−1−[2−(フェニル)エチル]ピペリジン》
化合物4−[(2−ジフェニルエチル)アミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン(0.30g、0.71mmol)はNMR(25ml)中で1MのBH3/THF(4.ml)と反応させて、白色固体である4−[(ビス(4−フルオロフェニル)メチルアミノ)メチル]−1−(フェニルエチル)ピペリジン0.28g(96%の収率)を生成した(手順E)。1H NMR(CD3Cl)δ7.35−7.18(10H、m、Ar−H0、7.00−6.95(3H、m、Ar−H)、4.74(1H、S、P−FPh)2CH)、3.02−2.99(2H、d、J=10.8Hz、N(CH)2)、2.83−2.78(2H、M)、2.60−2.55(2H、m)、2.45−2.43(2H、d、J=6.2Hz、NHCH2CH)、2.04−1.96(2H、t、J=11.4Hz、N(CH)2)、1.78−1.26(5H、m)。遊離塩基は融点=214ないし215℃のHCl塩に変換された。分析:(C27H30F2N2・2HCl・0.50H2O)、計算値:C 64.58;H 6.61;N 5.57、実測値:C 64.61;H 6.65;N 5.43。
【実施例13】
【0070】
《[[(2−(ジフェニル)エチル]−N−メチルアミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン》
4−[(2−ジフェニルエチル)アミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン(45mg、0.11mmol)は、ホルムアルデヒド(1.0g)及びギ酸(2.0g、37%/H2O)中に還流されて、4−[(2−ジフェニルエチル)−N=メチルアミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン44mg(88%の収率)を生成した(手順F)。1H NMR(CD3Cl)δ7.28−7.13(12H、m、Ar−H)、7.02−6.96(2H、t、J=8.4Hz、Ar−H)、4.15−410(1H、t、J=7.5Hz、Ph2CH)、3.46(2H、s、F−PhCH2)、2.91−2.88(2H、d、J=7.5Hz、Ph2CHCH2N)、2.81−2.77(2H、d、J=11.1Hz、N(CH)2)、2.20(3H、s、CH3)、2.20−2.17(2H、d、J=7.5Hz、NCH2CH)、1.90−1.83(2H、t、J=11.4Hz、N(CH)2)、1.52−1.47(2H、d、J=12.9Hz)、1.54−1.28(1H、m、NCH2CH)、1.14−1.06(2H、t、J=12.4Hz)。遊離塩基は融点=144ないし145℃のシュウ酸塩に変換された。分析:[C28H33N2F・2(COOH)2・1.47H2O]]、計算値:C 61.68;H 5.99;N 4.49、実測値:C 61.65;H 5.99;N 4.35。
【実施例14】
【0071】
《4[2−[(1−(フェニル)エチル)アミノ]エチル]−1−[(4−フルオロフェニル)メチル]ピペリジン》
化合物4−[(1−フェニルエチル)アミノカルボニル]メチル−1−[(4−フルオロフェニル)メチル]ピペリジン(0.33g、0.93mmol)は1MのBH3/THF(5.0ml)と反応させて、粘性油0.23g(95%の収率)を生成した(手順E)。1H NMR(CD3Cl)δ7.34−=7.21(5H、m、Ar−H)、7.01−6.95(2H、t、J=8.4Hz、Ar−H)、4.09−4.07(1H、d、J=6.0Hz、NH)、3.77−3.71(1H、q、J=6.3Hz、PhCHMe)、3.42(2H、s、p−FPhCH2)、2.82−2.78(2H、d、J=10.8Hz、N(CH)2)、2.55−2.37(2H、m、NCH2)、1.91−1.83(2H、t、J=11.4Hz、N(CH)2)、1.59−1.53(4H、m)、1.44−1.38(1H、m)、1.36−1.34(3H、d、J=6.0Hz、CH3)、1.25−1.14(2H、m)。遊離塩基は融点=172ないし173℃のシュウ酸塩に変換された。分析:[C22H29FN2・2(COOH)2]、計算値:C 59.99;H 6.39;N 5.38、実測値:C 59.84;H 6.46;N 5.29。
【実施例15】
【0072】
《ラセミのシス−及びトランス−2−ジフェニルメチル−5−(4−フルオロベンジルアミノ)ピペリジンの合成》
30mLの1,2−ジクロロエタン中の、420mgのラセミのシス−及びトランス−2−ジフェニルメチル−5−アミノピペリジン(1.58mmol)、156mgの4−フルオロベンズアルデヒド(0.8当量)、94mgの氷HOAc(1当量)の室温溶液に、一部ずつ119mgのシアノ水素化ホウ素ナトリウム(1.2当量)が添加された。混合物は18時間攪拌された。次いで、H2Oが添加され、混合物は30分間攪拌され、その後濃HClで酸性にし、更に30分攪拌した。その後混合物は濃NaOHで塩基性にされ、3回CH2Cl2で抽出された。有機相は収集され、乾燥させ(MgSO4)、蒸発させた。残留物は色相分析されて(SiO2;CH2Cl2;MeOH)、双方のジアステレオマの組合せの混合物(240mg、40%)を精製した。次いで、この混合物は更に色相分析されて(SiO2;1のヘキサン;1のEtOAc:0.06のトリエチルアミン)、ジアステレオマを分離した。第1の溶出:1H、NMR、(CDCl3;400MHz)δ1.3−1.4(2H、m、H−3)、1.49(1H、tt、2J及び3J3a=13.6Hz、3J3e及び3J5e=4.0Hz、H−4ax)、1.65−1.85(3H、m、H−4ax 2NH)、2.65−2.72(2H、m、H−5eq、H−6ax)、2.99(1H、d、2J=10.4Hz、H−6eq)、3.28(1H、dt、3J=4.4及び10.8Hz、H−2ax)、3.71(2H、s、CH2C6H4F)、3.81(1H、d、3J=9.6Hz、CH(C6H5)2)、6.99(2H、t、3J=8.4Hz、ArH オルト位のF)、7.12−7.39(12H、m、ArH)。ビス−塩酸塩として沈殿された。融点60ないし105℃。元素分析はC25H29N2FCl2・0.5H2Oについて計算された:C 65.93;H 6.59;N 6.15。実測値:C 65.26;H 6.78;N 6.49。
【0073】
第2の溶出:ラセミのトランス−2−ジフェニルメチル−5−(4−フルオロベンジルアミノ)ピペリジン(96mg、38.5%)、1H NMR(CDCl3;400MHz)δ1.17(2H、qm、3J=10Hz、H−3ax及びH−4ax)、1.57−1.65(1H、m、H−3eq)、1.4−1.7(bs、NH)、1.9−1.96(1H、m、H−4eq)、2.33(1H、t、2J及び3J=10.4Hz、H−6ax)、2.65(1H、m、Σ3J=36Hz、H−5ax)、3.15−3.25(2H、m、H−2ax、H−6eq)、3.68(1H、d、2J=0.6Hz、CH(C6H5)2)、3.75(2H、s、CH2C6H4F)、6.97(2H、t、3J=8.8Hz、ArH オルト位のF)、7.1−7.3(10H、m、ArH)、7.36(2H、d、3J=7.6Hz、ArH メタ位のF)。ビス−塩酸塩として沈殿された。元素分析はC25H29N2FCl2・0.5H2Oについて計算された:C 65.93;H 6.59;N 6.15。実測値:C 65.56;H 6.89;N 6.14。
【実施例16】
【0074】
《ラセミのトランス−3−ヒドロキシ−4−[2−ジフェニルメトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジンの合成》
0℃に冷却されたTHF(10mL)中の、

(0.92g、1.9mmol)の攪拌された懸濁液に、液滴で1MのBH3テトラヒドロフラン錯体(7.7mL、7.7mmol、4当量)が添加された。その後、冷浴は除去され、溶液はRTに温められた。混合物はその後、12時間還流された。0℃に冷却後、H2O(5.76mL)、EtOH(5.76mL)、及び3NのNaOH(15mL)が添加され、その後、30%のH2O2(18mL)が液滴添加された。反応物は55℃で12時間攪拌され、その後RTに冷却され、CH2Cl2で3回抽出された。抽出物は貯蔵され、乾燥させ(MgSO4)、透明な油に蒸発させた。粗生成物は色相分析されて(SiO2;5%のMeOH/CH2Cl2)、遊離塩基(0.553mg、71%)を得た。1H NMR(CDCl3)∂1.34−1.39(2H、m)、1.59−1.55(2H、m)、1.81−1.95(3H、m)、2.72(1H、d、J=9.9Hz)、2.98(1H、d、J=10.5Hz)、3.42−3.63(5H、m)、5.37(1H、s)、6.98(2H、t、J=9.3Hz)、7.22−7.35(12H、m)。その後、EtOH(5mL)中でシュウ酸二水和物(0.169g、1.1当量)と反応させて、表題の化合物(468mg、77%)を得た。融点143ないし150℃。元素分析はC28H31NO6Fについて計算された:C 68.37;H 6.29;N 2.75。実測値:C 67.96;H 6.43;N 2.63。
【実施例17】
【0075】
《ラセミのトランス−3−プロピオニル−4−[2−(ジフェニルメトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジンの合成》
氷浴で冷却された2mLのCH2Cl2中の61mgの3−ヒドロキシ−4−[2−(ジフェニルメトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジン(0.15mmol)と、21mgのトリエチルアミン(0.23mmol、1.5当量)との溶液に、18mgのプロピオン酸クロリド(0.19mmol、1.3当量)が液滴添加され、反応はRTに温められた。1時間後、同量のトリエチルアミン及びプロピオン酸クロリドが添加された。1時間後、H2Oが添加され、有機層は分離され、乾燥させ(MgSO4)、蒸発させた。残りの残留物は色相分析されて(SiO2;CH2Cl2/MeOH)、遊離塩基(53mg、77%)として表題の化合物を得た。1H NMR(CDCl3∂1.1(3H、t、J=8.1Hz)、1.26−1.95(7H、m)、2.26(2H、q、J=7.2及び7.5Hz)、2.71(1H、d、J=11.7Hz)、3.02(1H、d、J=10.5Hz)、3.41−3.52(4H、m)、4.67(1H、t、J=9.6Hz)、5.31(1H、s)、6.98(2H、t、J=9.3Hz)、7.2−7.4(12H、m)。その後、2mLの50%EtOH/Et2Oの混合物中でシュウ酸二水和物(15.4mg、1.1当量)と反応させて、融点 ℃の表題の化合物を得た。元素分析はC32H36NO7F・0.5H2Oについて計算された:C 67.43;H 6.41;N 2.46。実測値:C 67.34;H 6.43;N 2.44。
【実施例18】
【0076】
《ラセミの3−ケト−4−[2−(ジフェニルメトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジンの合成》
−78℃に冷却されたCH2Cl2(3mL)中の塩化オキサリル(0.4mmol、0.87当量)の溶液に、108mgのジメチルスルホキシド(1.38mmol、3当量)が液滴添加された。混合物は10分間攪拌され、CH2Cl2(1mL)中の、236mgのラセミのトランス−3−ヒドロキシ−4−[2−(ジフェニルメトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジン(0.46mmol)が液滴添加された。15分の攪拌後、トリエチルアミン(825mg、17.6当量)が添加され、混合物は室温まで温められた。総ての揮発性物質は室温で蒸発させ、残りの残留物は色相分析されて(SiO2;ヘキサン:EtOAc:MeOH)、遊離塩基(116mg、60%)を得たが、これは室温で分解し、冷気中で保存されなれけばならない。1H NMR(CdCl3)∂1.45−1.65(2H、m)、2.0−2.1(1H、m)、2.2−2.3(1H、m)、2.38−2.6(2H、m)、2.77(1H、d、J=13.6Hz)、2.9(1H、bd、J=13.6Hz)、3.45−3.55(4H、m)、5.30(1H、s)、6.99(2H、t、J=11.2Hz)、7.19−7.39(12H、m)。表題の化合物(125mg、50%)は遊離塩基(205mg)をシュウ酸二水和物(62mg、1当量)と反応させることによって得られた。融点104ないし109℃。元素分析はC29H30NO6Fについて計算された:C 68.64;H 5.92;N 2.76。実測値:C 68.34;H 5.93; N 2.68。
【実施例19】
【0077】
《4−[2−(ジフェニルメトキシ)エチル]−1−[(4−ヨードフェニル)メチル]ピペリジンの合成》
4−[2−(ジフェニルメトキシ)エチル]ピペリジン(0.23g、0.77mmol)は、EtOH(10mL)中で4−ヨードベンジルブロミド(0.76g、2.5mmol)及びK2CO3(1.00g、7mmol)と反応させて、濃い油0.17g(%)を提供した。1H NMR(300MHz、CDCl3):1.21−1.63(7H、m)、1.87−1.93(t、J=11Hz、2H、N(CH2)−)、2.79−2.83(bd、J=12Hz、2H、N(CH2)−)、3.41−3.49(4H、m)、5.31(s、1H、Ph2CHO−)、7.05−7.63(14H、m、ArH)。遊離塩基は融点=160ないし161℃のシュウ酸塩に変換された。分析:C27H30INO.(COOH)2。
【0078】
[生物学的試験]
我々は意外にも、ピペリジン誘導体中の長い芳香族アルキル鎖がセロトニン輸送体(SERT)との更なる相互作用、ひいては低い選択性を生じることを発見した(参照、A.K.Duttaら,“Structure−Activity Relationship Studies of Novel 4−[2−[Bis(4−fluorophenyl)methoxy]ethyl]−1−(3−phenylpropyl)piperidine Analogs:Synthesis and Biological Evaluation at the Dopamine and Serotonin Transporter Sites”,J.MED.CHEM.,1996,39,749−756;A.K.Duttaら,“Highly Selective,Novel Analogs of 4−[2−(diphenylmethoxy)ethyl]−1−benzylpiperidine For The Dopamine Transporter:Effect of Different Aromatic Substitutions on Their Affinity and Selectivity”,J.MED.CHEM.,1997,40,35−43;A.K.Duttaら,Potent and Selective Ligands for the Dopamine Transporter(DAT):Structure−Activity Relationship Studies of Novel 4−[2−(diphenylmethoxy)ethyl]−1−(3−phenylpropyl)piperidine Analogs”,J.MED.CHEM.,1998,41,699−705)。電気陰性のフッ素原子、及び強い電子吸引性の官能基CNの効果を調査するために、実施例1ないし4の化合物が設計及び合成された。電気陰性及び電子吸引性の官能基の存在が、これらのアナログの活性及び選択性を向上させた。これらの新規の化合物は、ピペリジンのN原子とアリール環との間にメチレン基のみを有し、かつ、電気陰性のアリール置換基を有し、ドーパミン輸送体(DAT)に対し完全な選択性及び効能を呈した。従って、フェニル環中にある強い電子吸引性のシアノ基を有する実施例4の化合物は、ドーパミン輸送体に対し顕著な効能及び選択性を示した(IC50、3.7nM、SERT/DAT=615、表1)。これは、標準的な基準化合物GBR12909(IC50、14nM、SERT/DAT=6)を超える顕著な改善である。実施例2の化合物は更に、DATについてGBR12909よりも良好な効能及び大きな選択性を示した(SERT/DAT=122)。
【0079】
実施例8、9、11、及び12の化合物(表1)は、オキシアルキル結合ではなく、ピペリジン環と、分子のビス芳香族メタン部分との間の4−(アミノアルキル)結合を用いる。実施例8及び9の双方が標準的なGBR12909分子よりも更に強力及び選択的である(それぞれ、IC50、7.0及び4.5nM、SERT/DAT=227及び347)。化合物4−[2−(ジフェニルメトキシ)エチル]−1−[(4−ヨードフェニル)メチル]ピペリジンは、新規の標準的な活性を設定する。
【0080】
N原子が隣接する位置へ再配置される実施例11の化合物において、DATに対する強い親和性と、SERTに対する中程度の親和性とからなる、興味深い効果が観察された。このような二重の活性を有する化合物は、薬物乱用に対する、及び、他の神経障害における薬剤の開発において、特有の適用を見出すことができ、それは抑うつ状態の治療を含んでいる。
【0081】
本発明の系で開発されたこれらの化合物のいずれも、ノルエピネフリン輸送体(NET)に対して感知可能な活性を示さず、DATに対する選択性を示す。
【0082】
本発明の新規化合物は更に、これらの新規化合物による細胞質ゾル中のドーパミン再取り込みの阻害を測定する、ドーパミン再取り込みの阻害アッセイで評価された。この点で、コカイン及びGBR12909は強力なDA取り込み阻害剤である。理想的には、薬物中毒の治療用の所望の薬剤は、わずかなドーパミン取り込み阻害効能しか有するべきではなく、その点でGBR12909より低い効能にすべきであり、このことがコカイン拮抗薬として作用する薬剤の確率を増加させる。表2の本発明の化合物系において、総ての列挙された結果は、コカイン拮抗薬として作用するこれらの新規化合物の潜在力の増加を、GBR12909よりも反映する。
【0083】
【表1】

1 4−[((1−フェニルエトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジン
2 4−[2−(ジフェニルメトキシ)エチル]−1−[(3−ヒドロキシフェニル)メチル]ピペリジン
3 4−[2−(ジフェニルメトキシ)エチル]−1−[(4−ヨードフェニル)メチル]ピペリジン
【0084】
【表2】

【0085】
実施例15の化合物のラセミのシス異性体及びトランス異性体の活性が測定された。結果は以下の表3に示される。SERT/DAT、NET/DAT、及び[3H]DA/DTの結合比率に対する選択性は、コカイン及び本発明の実施例11に対する同様のデータとともに、表4に示される。示されるように、シス異性体とトランス異性体との間で選択性の顕著な変化がある。幾何異性体の各対の個々の立体異性体は更に、まったく異なる活性を示す。
【0086】
【表3】

【0087】
【表4】

【0088】
【表5】

【0089】
[III.図7ないし9の実施例]
試薬及び溶媒は民間の納入業者から得られ、他に示されない限りにおいては元のままで用いられた。乾燥溶媒は標準的な手順によって得られた。総ての反応は、他に断りのない限りにおいては不活性雰囲気(N2)下で行われた。分析用のシリカゲル60F254でコーティングされたTLCプレートは、EMD Chemical社から購入され、UV光で、又はリンモリブデン酸(PMA)での処理によって可視化された。フラッシュクロマトグラフィはBaker Silica Gel 40mmで行われた。1H NMRスペクトルは、Varian 400MHz FT NMRで常に得られた。用いられたNMRの溶媒は、示されるようにCDCl3であった。TMSは内部標準として用いられた。元素分析はAtlantic Microlab社で行われ、理論値の±0.4%内であった。
【0090】
《4−(2−(ベンズヒドリルオキシ)エチル)ピリジン(3)の合成》
図7について、4−ビニルピリジン1(10g、95.1mmol)と、ベンズヒドロール2(35.04g、190mmol)との攪拌溶液に、ナトリウムメトキシド(1.541g、28.5mmol)が添加された。反応混合物は130ないし140℃で20時間加熱され、RTに冷却され、1NのHCl(150ml)で酸性にされた。溶液は酢酸エチル(3×30ml)で抽出されて、未反応のベンズヒドロールと副生成物のジベンズヒドリルエーテルとを除去した。水溶液は更に、10%のNaOH溶液(pH10)で塩基性にされ、ジクロロメタン(3×30ml)で抽出された。混合有機層は水(2×20ml)で洗浄され、無水硫酸ナトリウムで乾燥させ、溶媒は減圧中で蒸発させた。油性残留物は減圧蒸留を受けて、未反応の4−ビニルピリジン(3.9g)を除去した。生成物は減圧下で乾燥させて、微量の4−ビニルピリジンを除去して、8.7g(52%)の表題の化合物3を得た。1H−NMR(CDCl3;400MHz):2.90−2.93(t、2H、J=6.4Hz、OCH2CH2)、3.66−3.67(t、2H、J=6.8Hz、OCH2CH2)、5.32(s、1H、PhCH(O)Ph)、7.13−7.14(d、2H、J=5.6Hz、3,5−Pyr−H)、7.17−7.33(m、10H、ArH)、8.47−8.48(d、2H、J=6.0Hz、2,6−Pyr−H)。
【0091】
《4−(2−(ベンズヒドリルオキシ)エチル)−1−ベンジル−1,2,3,6−テトラヒドロピリジン(4)の合成》
図7について、4−(2−(ベンズヒドリルオキシ)エチル)ピリジン3(4.0g、13.82mmol)及びベンジルブロミド(2.86g、16.73mmol)は20mlの乾燥アセトニトリルに溶解され、6時間還流された。溶媒は減圧下で除去された。高減圧下で2時間、残留物を乾燥させた後に、30mlの乾燥メタノールで溶解され、氷浴中で冷却された。水素化ホウ素ナトリウム(0.76g、20.05mmol)は次いで、1.5時間の期間にわたって非常にゆっくりと一部ずつ添加され、溶液は徐々に室温に戻された。反応は4時間の攪拌後、水で急冷され、メタノールは減圧下で除去された。残留生成物は酢酸エチルで溶解され、水で洗浄され、乾燥させ(Na2SO4)、かつ濃縮された。粗生成物はシリカゲルでのカラムクロマトグラフィ(ヘキサン:酢酸エチル 5:1)によって精製されて、無色油として符号4(5.0g、94%)を生成した。1H−NMR(CDCl3;400MHz):2.086(brs、2H、H−3)、2.32−2.35(t、2H、J=6.8Hz、OCH2CH2)、2.52−2.54(t、2H、J=5.6Hz、H−2)、2.94−2.94(brm、2H、H−6)3.52−3.55(m、4H、NCH2Ph、OCH2CH2)、5.34(s、1H、PhCH(O)Ph)、5.41−5.42(brs、1H、CH=C)、7.12−7.37(m、15H、ArH)。
【0092】
《4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロピリジン(5)の合成》
図7について、ベンゼン(40ml)中の4−(2−(ベンズヒドリルオキシ)エチル)−1−ベンジル−1,2,3,6−テトラヒドロピリジン4(12.44g、0.0324mol)と、クロロギ酸メチル(5.0ml、0.0648mol)との溶液は6時間還流された。反応の完了後(TLCによってモニタリングされる)、溶媒は減圧下で除去されて、粘性油の形態で4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−カルボン酸メチルを提供した。カラムクロマトグラフィ(ヘキサン:EtOAc 9:1)によって精製されて、6.7g(59%)の純生成物を得た。
【0093】
エタノール(25ml)中の4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−カルボン酸メチル(6.5g、18.49mmol)の攪拌溶液に、クライゼンアルカリ液(5mlの水及び20mlのメタノールに溶解された6.457gのKOH)が添加された。溶液は一晩還流され、減圧下で濃縮され、水(40ml)で冷却及び希釈され、エーテル(3×30ml)で抽出された。混合されたエーテル抽出物は乾燥(Na2SO4)及び蒸発させて、粘稠液体を提供した。生成物はシリカゲルでのカラムクロマトグラフィ(酢酸エチル:メタノール:トリエチルアミン 20:10:2.5)によって精製されて、黄色を帯びた粘稠液体として化合物5を得た(4.8g、88%)。1H−NMR(CDCl3;400MHz):2.03(brm、2H、H−3)、2.29−2.32(t、2H、J=6.4Hz、OCH2CH2)、2.92−2.95(t、2H、J=5.6Hz、H−2)、3.31(brs、2H、H−6)、3.49−3.53(t、2H、OCH2CH2)、5.32(s、1H、PhCH(O)Ph)、5.41(brs、1H、CH=C)、5.76(brs、1H、−NH)、7.17−7.33(m、10H、ArH)。
【0094】
[通常手順I]
図8について、エタノール中の4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロ−ピリジン5(1当量)と、スチレンオキシド6(1当量)との溶液は一晩還流された。反応混合物はRTに冷却され、溶媒は減圧下で蒸発させた。茶色を帯びた油性残留物は、任意の未反応の出発物質が存在する場合に除去するためにシリカゲルでのカラムクロマトグラフィ(ヘキサン:酢酸エチル 1:1)によって精製されて、ピリジン及び無水酢酸を用いてアセチル化を後に受ける位置異性体(化合物7aの場合においては、(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−フェニル−エタノール、所望の生成物、及び(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロ−ピリジン−1(2H)−イル)−2−フェニルエタノール)の混合物であると知られる無色油を得た。反応混合物はRTに維持し、時折振盪した。4時間後、溶媒は減圧下で除去され、残留物はジクロロメタン(15ml)に吸収され、水(10ml)で洗浄され、Na2SO4で乾燥させ、溶媒は減圧下で除去された。シリカゲルでの粗生成物のカラムクロマトグラフィ(ヘキサン:酢酸エチル 8:2)は、アセチル化生成物を提供した。
【0095】
《(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−フェニルエチルアセタート(7a)》
図8について、4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロピリジン5(0.5g、1.704mmol)、R−スチレンオキシド6a(0.205g、1.704mmol)、エタノール(20ml)。収量(精製後)=0.7g。アセチル化については、位置異性体(0.7g、1.693mmol)と、ピリジン(10ml)と、無水酢酸(0.208ml、2.2mmol、1.3当量)との混合物。収量(精製後)=0.26g。1H−NMR(CDCl3;400MHz):2.03−2.07(brs、5H、H−3、COCH3)、2.31−2.34(t、2H、J=6.4Hz、OCH2CH2)、2.54−2.71(m、3H、H−2、NCHHCHOAc)、2.91−2.97(dd、1H、J=8.8Hz、NCHHCHOAc)、3.04(brs、2H、H−6)、3.51−3.54(t、2H、OCH2CH2)、5.34(s、1H、PhCH(O)Ph)、5.39(brs、1H、CH=C)、5.95−5.98(dd、1H、CHOAc)、7.03−7.34(m、15H、ArH)。[a]25D=−20.22°(c=1.05、CHCl3)。
【0096】
《(S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−フェニルエチルアセタート(7b)》
図8について、4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロピリジン5(0.5g、1.704mmol)、S−スチレンオキシド6b(0.205g、1.704mmol)、エタノール(20ml)。収量(精製後)=0.65g。アセチル化については、位置異性体(0.5g、1.209mmol)と、ピリジン(10ml)と、無水酢酸(0.148ml、1.571mmol、1.3当量)との混合物。収量(精製後)=0.2g。1H−NMR(CDCl3;400MHz):2.03−2.07(brs、5H、H−3、COCH3)、2.31−2.34(t、2H、J=6.4Hz、OCH2CH2)、2.59−2.74(m、3H、H−2、NCHHCHOAc)、2.95−2.30(dd、1H、J=9.2Hz、NCHHCHOAc)、3.04(brs、2H、H−6)、3.51−3.54(t、2H、OCH2CH2)、5.33(s、1H、PhCH(O)Ph)、5.39(brs、1H、CH=C)、5.96−6.00(dd、1H、CHOAc)、7.21−7.37(m、15H、ArH)。[a]25D=+21.17°(c=1.02、CHCl3)。
【0097】
《(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−(4−フルオロフェニル)−エチルアセタート(7c)》
図8について、4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロピリジン5(0.493g、1.68mmol)、R−4−フルオロスチレンオキシド6c(0.232g、1.68mmol)、エタノール(20ml)。収量(精製後)=0.380g。アセチル化については、位置異性体(0.38g、0.881mmol)と、ピリジン(10ml)と、無水酢酸(0.110ml、1.145mmol、1.3当量)との混合物。収量(精製後)=0.18g。1H−NMR(CDCl3;400MHz):2.02−2.06(brs、5H、H−3、COCH3)、2.30−2.38(t、2H、J=6.4Hz、OCH2CH2)、2.52−2.69(m、3H、H−2、NCHHCHOAc)、2.91−2.96(dd、1H、J=8.8Hz、NCHHCHOAc)、3.04(brs、2H、H−6)、3.51−3.55(t、2H、OCH2CH2)、5.37(s、1H、PhCH(O)Ph)、5.39(brs、1H、CH=C)、5.95−5.98(dd、1H、CHOAc)、6.99−7.04(t、2H、ArH)、7.21−7.33(m、12H、ArH)。[a]25D=−24.240(c=0.77、CHCl3)。
【0098】
《(S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−(4−フルオロフェニル)−エチルアセタート(7d)》
図8について、4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロピリジン5(0.477g、1.62mmol)、S−4−フルオロスチレンオキシド6d(0.225g、1.62mmol)、エタノール(20ml)。収量(精製後)=0.42g。アセチル化については、位置異性体(0.42g、0.973mmol)と、ピリジン(10ml)と、無水酢酸(0.119ml、1.265mmol、1.3当量)との混合物。収量(精製後)=0.25g。1H−NMR(CDCl3;400MHz):2.03−2.06(brs、5H、H−3、COCH3)、2.305−2.338(t、2H、J=6.4Hz、OCH2CH2)、2.579−2.73(m、3H、H−2、NCHHCHOAc)、2.95−3.00(dd、1H、J=8.8Hz、NCHHCHOAc)、3.04(brs、2H、H−6)、3.51−3.54(t、2H、OCH2CH2)、5.33(s、1H、PhCH(O)Ph)、5.39(brs、1H、CH=C)、5.96−5.99(dd、1H、CHOAc)、6.99−7.03(t、2H、ArH)、7.23−7.33(m、12H、ArH)。[a]25D=+24.89°(c=0.83、CHCl3)。
【0099】
[通常手順II]
《符号8Aないし8Dの合成》
図8について、0℃、N2下で、乾燥THF中のNaBH4の攪拌溶液に、48%の質量濃度(w/w)のBF3−エーテル錯体が液滴添加された。氷浴は除去され、溶液は1時間室温(RT)で攪拌された。混合物は次いで氷浴中で冷却された。冷却溶液内に、THF(10ml)中の符号8の溶液が液滴添加された。溶液はRTに戻されて、更に2時間攪拌された。溶液は再度0℃に冷却され、水、エタノール、及び3NのNaOH溶液が添加され、その後30%のH2O2が液滴添加された。反応混合物は55℃で一晩攪拌され、RTに冷却され、溶媒は減圧下で蒸発させた。生成物は水と酢酸エチルとの間に分割された。水層は酢酸エチルで抽出され、混合有機層はNa2SO4で乾燥させ、濃縮されて、シリカゲルで色相分析される未精製のジアステレオマ混合物を提供し、淡黄色の粘性油を提供した。
【0100】
《ジアステレオマ8Aないし8Dの分離》
ジアステレオマ混合物8Aないし8Dは、順相カラム(Nova−Pack Silica 6mM)を用いて、半調製用HPLCによって分離された。用いられた移動相は15ml/分の流速でのヘキサン中の4又は5%のいずれかの2−プロパノールであった。分離されたジアステレオマの最終純度は、1ml/分の流速で同一の移動層を用いて分析用順相カラム(Nova−Pack Silica 60Å 4mM)によって点検された。
【0101】
《(1R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニル−エチルアセタート(8A)の合成》
図8について、通常手順IIが用いられた。化学物質の量は添加の順に下記の通りである:NaBH4(0.116g、3.08mmol)、THF(20ml)、BF3−エーテル錯体(0.4ml、3.265mmol)、(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−フェニルエチルアセタート7a(0.7g、1.536mmol)、水(2ml)、エタノール(2ml)、3NのNaOH(1.1ml)、及び30%のH2O2(0.8ml、7.68mmol)。
【0102】
《ジアステレオマ8Aの分離》
半調製用HPLCの実行時に、移動相として4%の2−プロパノールを用いた場合、符号8a及び8a’の保持時間がそれぞれ、14.31及び17.96分であることが観察された。分析用HPLCの場合においては、符号8a及び8a’に対する各保持時間は4.71及び5.52分であった。符号8aの収量=0.183g。符号8a’の収量=0.12g。
【0103】
《(R)−2−((3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニルエチルアセタート(8a)》
図8について、1H−NMR(CDCl3;400MHz):1.34−1.39(2H、m、H−4、H−5ax)、1.55−1.66(2H、m、H−5eq、CH2CH2O)、1.85−1.91(m、1H、H−6ax)、1.98−2.03(t、1H、J=9.6Hz、H−2ax)、2.08(s、3H、OCOCH3)、2.13−2.19(t、1H、J=10.8Hz、CHHCH2O)、2.56−2.61(dd、1H、J=13.6、4.4Hz、NCHHCHAr)、2.71−2.73(brd、1H、J=11.2Hz、H−6eq)、2.82−2.88(m、1H、NCHHCHAr)、3.05−3.08(dd、1H、J=10.4、3.2Hz、H−2eq)、3.33−3.38(m、1H、H−3ax)、3.48−3.54(m、1H、CH2CHHO)、3.55−3.60(m、1H、CH2CHHO)、5.36(s、1H、PhCH(O)Ph)、5.91−5.95(dd、1H、J=8.8、4.4Hz、CHOCOCH3)、7.22−7.35(15H、m、ArH)。[a]25D=−12.72°(c=0.99、MeOH)。
【0104】
《(R)−2−((3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニルエチルアセタート(8a’)》
図8について、1H−NMR(CDCl3;400MHz):1.34−1.40(m、2H、H−4、H−5ax)、1.54−1.66(m、2H、H−5eq、CH2CH2O)、1.82−1.91(m、1H、H−6ax)、2.02−2.13(m、5H、H−2ax、OCOCH3、CHHCH2O)、2.53−2.58(dd、1H、J=13.6、4Hz NCHHCHAr)、2.80−2.87(m、2H、H−6eq、NCHHCHAr)、2.97−3.01(dd、1H、J=10.8、3.6Hz、H−2eq)、3.37−3.42(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.56−3.60(m、1H、CH2CHHO)、5.37(s、1H、PhCH(O)Ph)、5.93−5.96(dd、1H、J=8.8、4Hz、CHOCOCH3)、7.22−7.35(m、15H、ArH)。[a]25D=−48.76°(c=1.05、MeOH)。
【0105】
《(1S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニル−エチルアセタート(8B)の合成》
図8について、通常手順IIが用いられた。化学物質の量は添加の順に以下の通りである:NaBH4(0.0191g、0.505mmol)、THF(10ml)、BF3−エーテル錯体(0.066ml、0.536mmol)、(S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−フェニルエチルアセタート7b(0.115g、0.252mmol)、水(0.3ml)、エタノール(0.5ml)、3NのNaOH(0.2ml)、及び30%のH2O2(0.2ml、1.26mmol)。
【0106】
《ジアステレオマ8Bの分離》
半調製用HPLCの実行時に、移動相としてヘキサン中の5%の2−プロパノールを用いる場合、符号8b’及び8bの保持時間がそれぞれ、13.57及び18.15分であることが観察された。分析用HPLCの場合においては、符号8b’及び8bに対する各保持時間は3.71及び4.37分であった。符号8b’の収量=0.03g。符号8bの収量=0.03g。(S)−2−((3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニルエチルアセタート(8b’)。1H−NMR(CDCl3;400MHz):1.30−1.38(m、2H、H−4、H−5ax)、1.54−1.66(m、2H、H−5eq、CH2CH2O)、1.84−1.91(m、1H、H−6ax)、1.98−2.03(t、1H、J=9.6Hz、H−2ax)、2.08(s、3H、OCOCH3)、2.13−2.19(t、1H、J=10.8Hz、CHHCH2O)、2.56−2.61(dd、1H、J=13.2、4Hz NCHHCHAr)、2.71−2.74(brd、1H、J=11.6Hz、H−6eq)、2.82−2.88(m、1H、NCHHCHAr)、3.05−3.08(dd、1H、J=10.4、2.8Hz、H−2eq)、3.33−3.38(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.55−3.60(m、1H、CH2CHHO)、5.36(s、1H、PhCH(O)Ph)、5.91−5.95(dd、1H、J=8.8、4.4Hz、CHOCOCH3)、7.22−7.35(m、15H、ArH)。[a]25D=+12.98°(c=1.47、CHCl3)。
【0107】
《(S)−2−((3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニルエチルアセタート(8b)》
この調製は図8によって実行された:1H−NMR(CDCl3;400MHz):1.30−1.39(m、2H、H−4、H−5ax)、1.55−1.66(m、2H、H−5eq、CH2CH2O)、1.82−1.92(m、1H、H−6ax)、2.02−2.13(m、5H、H−2ax、OCOCH3、CHHCH2O)、2.54−2.58(dd、1H、J=13.6、4Hz NCHHCHAr)、2.80−2.87(m、2H、H−6eq、NCHHCHAr)、2.97−3.01(dd、1H、J=10.8、3.2Hz、H−2eq)、3.37−3.42(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.56−3.61(m、1H、CH2CHHO)、5.37(s、1H、PhCH(O)Ph)、5.93−5.96(dd、1H、J=8.8、4Hz、CHOCOCH3)、7.22−7.35(m、15H、ArH)。[a]25D=−48.76°(c=1.05、MeOH)。
【0108】
《(1R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8C)の合成》
図8について、通常手順IIが用いられた。化学物質の量は添加の順に以下の通りである:NaBH4(0.029g、0.762mmol)、THF(10ml)、BF3−エーテル錯体(0.1ml、0.81mmol)、(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−(4−フルオロフェニル)エチルアセタート7c(0.180g、0.38mmol)、水(0.3ml)、エタノール(0.4ml)、3NのNaOH(0.3ml)、及び30%のH2O2(0.2ml、1.9mmol)。
【0109】
《ジアステレオマ8Cの分離》
図8について、半調製用HPLCの実行時に、移動相としてヘキサン中の5%の2−プロパノールを用いる場合、符号8c及び8c’の保持時間がそれぞれ、13.35及び18.49分であることが観察された。分析用HPLCの場合においては、符号8c及び8c’に対する各保持時間は3.92及び4.41分であった。符号8cの収量=0.026g。符号8c’の収量=0.023g。
【0110】
《(R)−2−((3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8c)》
1H−NMR(CDCl3;400MHz):1.28−1.38(m、2H、H−4、H−5ax)、1.54−1.65(2H、m、H−5eq、CH2CH2O)、1.83−1.92(m、1H、H−6ax)、1.97−2.0(t、1H、J=10Hz、H−2ax)、2.07(s、3H、OCOCH3)、2.12−2.17(t、1H、J=9.2Hz、CHHCH2O)、2.54−2.58(dd、1H、J=13.6、4.4Hz、NCHHCHAr)、2.71−2.73(brd、1H、J=11.6Hz、H−6eq)、2.80−2.85(m、1H、NCHHCHAr)、3.01−3.05(dd、1H、J=10.4、3.6Hz、H−2eq)、3.31−3.37(m、1H、H−3ax)、3.48−3.54(m、1H、CH2CHHO)、3.57−3.61(m、1H、CH2CHHO)、5.37(s、1H、PhCH(O)Ph)、5.87−5.90(dd、1H、J=8.4、4.8Hz、CHOCOCH3)、7.00−7.04(t、2H、ArH)、7.23−7.33(m、12H、ArH)。[a]25D=−12.95°(c=1.0、CHCl3)。
【0111】
《(R)−2−((3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8c’)》
1H−NMR(CDCl3;400MHz):1.31−1.40(m、2H、H−4、H−5ax)、1.55−1.65(m、2H、H−5eq、CH2CH2O)、1.82−1.91(m、1H、H−6ax)、2.01−2.14(m、5H、H−2ax、OCOCH3、CHHCH2O)、2.51−2.56(dd、1H、J=13.6、3.6Hz、NCHHCHAr)、2.76−2.84(m、2H、H−6eq、NCHHCHAr)、2.98−3.01(dd、1H、J=10.8、3.2Hz、H−2eq)、3.36−3.41(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.56−3.61(m、1H、CH2CHHO)、5.37(s、1H、PhCH(O)Ph)、5.89−5.92(dd、1H、J=8.8、4.4Hz、CHOCOCH3)、6.97−7.05(t、2H、ArH)、7.23−7.33(m、12H、ArH)。[?]25D=−36.33°(c=0.9、CHCl3)。
【0112】
《(1S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8D)の合成》
図8について、通常手順IIが用いられた。化学物質の量は添加の順に以下の通りである:NaBH4(0.04g、1.06mmol)、THF(10ml)、BF3−エーテル錯体(0.14ml、1.12mmol)、(S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−(4−フルオロフェニル)エチルアセタート7d(0.25g、0.53mmol)、水(0.4ml)、エタノール(0.6ml)、3NのNaOH(0.4ml)、及び30%のH2O2(0.4ml、4.11mmol)。
【0113】
《ジアステレオマ8Dの分離》
半調製用HPLCの実行時に、移動相としてヘキサン中の5%の2−プロパノールを用いる場合、符号8d’及び8dの保持時間がそれぞれ、13.4及び17.69であることが観察された。分析用HPLCの場合においては、符号8d’及び8bに対する各保持時間は3.41及び4.23分であった。符号8d’の収量=0.02g。符号8dの収量=0.02g。
【0114】
《(S)−2−((3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8d’)》
1H−NMR(CDCl3;400MHz):1.28−1.38(m、2H、H−4、H−5ax)、1.54−1.65(2H、m、H−5eq、CH2CH2O)、1.83−1.92(m、1H、H−6ax)、1.97−1.99(t、1H、J=13.2Hz、H−2ax)、2.07(s、3H、OCOCH3)、2.11−2.14(t、1H、J=8.8Hz、CHHCH2O)、2.54−2.58(dd、J=13.6、4.8Hz、1H、NCHHCHAr)、2.70−2.73(brd、1H、J=11.2Hz、H−6eq)、2.79−2.85(m、1H、NCHHCHAr)、3.01−3.05(dd、1H、J=10.4、2.8Hz、H−2eq)、3.31−3.36(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.55−3.60(m、1H、CH2CHHO)、5.36(s、1H、PhCH(O)Ph)、5.87−5.90(dd、1H、J=8.4、4.8Hz、CHOCOCH3)、6.99−7.04(t、2H、ArH)、7.22−7.33(m、12H、ArH)。[a]25D=+13.30°(c=1.0、CHCl3)。
【0115】
《(S)−2−((3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8d)》
1H−NMR(CDCl3;400MHz):1.31−1.40(m、2H、H−4、H−5ax)、1.54−1.64(2H、m、H−5eq、CH2CH2O)、1.82−1.91(m、1H、H−6ax)、2.01−2.12(m、5H、H−2ax、OCOCH3、CHHCH2O)、2.51−2.56(dd、1H、J=13.2、4.4Hz、NCHHCHAr)、2.76−2.84(m、2H、H−6eq、NCHHCHAr)、2.97−3.01(dd、1H、J=10.8、3.2Hz、H−2eq)、3.35−3.40(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.56−3.61(m、1H、CH2CHHO)、5.37(s、1H、PhCH(O)Ph)、5.89−5.92(dd、1H、J=8.8、4.4Hz、CHOCOCH3)、6.99−7.03(t、2H、ArH)、7.22−7.33(m、12H、ArH)。[a]25D=+36.5°(c=1.0、CHCl3)。
【0116】
[通常手順III]
《符号9aないし9d、9a’ないし9d’の合成》
図9について、HPLC分離で得られる留分I及びIIは、室温で4時間、メタノール(15ml)中の無水K2CO3(0.56当量)で別個に脱アセチル化された。メタノールは減圧下で除去され、残留物はジクロロメタンと水との間に分割された。有機層は分離され、水層は更にジクロロメタン(2×20ml)で抽出された。混合有機層は、無水Na2CO3で乾燥させ、濃縮された。粗生成物はシリカゲルで色相分析された(酢酸エチル、酢酸エチル:メタノール 9:1、メタノール)。
【0117】
《(3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((R)−2−ヒドロキシ−2−フェニルエチル)−ピペリジン−3−オール(9a)(D−225)の合成》
図9について、留分I、すなわち、ジアステレオマ混合物8AのHPLC分離による符号8a(0.183g、0.386mmol)は、メタノール中の無水K2CO3(30mg、0.216mmol)で処理されて、符号9aを生成した(0.15g)。1H−NMR(CDCl3;400MHz):1.39−1.46(m、2H、H−4、H−5ax)、1.59−1.66(m、2H、H−5eq、CHHCH2O)、1.87−1.94(m、2H、H−2ax、CHHCH2O)、2.22−2.31(t、1H、J=10.8Hz、H6−ax)、2.44−2.53(m、2H、NCH2CHAr)、2.70−2.73(brd、1H、J=11.2Hz、H−6eq)、3.30−3.34(dd、1H、J=10.8、3.2Hz、H−2eq)、3.40−3.46(m、1H、H−3ax)、3.51−3.57(m、1H、CH2CHHO)、3.60−3.65(m、1H、CH2CHHO)、4.72−4.76(dd、1H、J=10,4Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.24−7.35(m、15H、ArH)。[a]25D=−12.48°(c=1.0、CHCl3)。遊離塩基は融点154ないし156℃のシュウ酸塩に変換された。分析はC28H33NO3・(COOH)2・0.9H2O)のC、H、Nについて計算された。
【0118】
《(3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((R)−2−ヒドロキシ−2−フェニルエチル)−ピペリジン−3−オール(9a’)(D−226)の合成》
図9について、留分II、すなわち、ジアステレオマ混合物8AのHPLC分離による符号8a’(0.12g、0.253mmol)は、メタノール中の無水K2CO3(20mg、0.142mmol)で処理されて、符号9a’を生成した(0.08g)。1H−NMR(CDCl3;400MHz):1.32−1.43(m、2H、H−4、H−5ax)、1.60−1.71(m、2H、H−5eq、CHHCH2O)、1.88−2.01(m、2H、H−2ax、CHHCH2O)、2.12−2.18(t、1H、J=10.4Hz、H6−ax)、2.43−2.55(m、2H、NCH2CHAr)、2.98−3.01(dd、1H、J=11.2、3.2Hz、H−2eq)、3.04−3.07(brd、1H、J=10.8Hz、H−6eq)、3.43−3.48(m、1H、H−3ax)、3.52−3.57(m、1H、CH2CHHO)、3.60−3.65(m、1H、CH2CHHO)、4.70−4.73(dd、1H、J=10.4、3.6Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.24−7.36(m、15H、ArH)。[a]25D=−50.73°(c=0.95、CHCl3)。遊離塩基は融点84ないし86℃のシュウ酸塩に変換された。分析は(C28H33NO3・(COOH)2・0.4H2O)のC、H、Nについて計算された。
【0119】
《(3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((S)−2−ヒドロキシ−2−フェニルエチル)−ピペリジン−3−オール(9b’)(D−275)の合成》
図9について、留分I、すなわち、ジアステレオマ混合物8BのHPLC分離による符号8b’(0.03g、0.063mmol)は、メタノール中の無水K2CO3(5mg、0.035mmol)で処理されて、符号9b’を生成した(0.025g)。1H−NMR(CDCl3;400MHz):1.38−1.44(m、2H、H−4、H−5ax)、1.60−1.67(m、2H、H−5eq、CHHCH2O)、1.87−1.94(m、2H、H−2ax、CHHCH2O)、2.22−2.27(dt、1H、J=11.2Hz、H6−ax)、2.43−2.53(m、2H、NCH2CHAr)、2.69−2.72(brd、1H、J=10.8Hz、H−6eq)、3.30−3.34(dd、1H、J=10.8、3.2Hz、H−2eq)、3.40−3.46(m、1H、H−3ax)、3.51−3.57(m、1H、CH2CHHO)、3.60−3.64(m、1H、CH2CHHO)、4.72−4.75(dd、1H、J=9.6、4Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.24−7.34(m、15H、ArH)。[a]25D=+13.33°(c=0.96、CHCl3)。遊離塩基は融点152ないし154℃のシュウ酸塩に変換された。分析は(C28H33NO3・(COOH)2)のC、H、Nについて計算された。
【0120】
《(3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((S)−2−ヒドロキシ−2−フェニルエチル)−ピペリジン−3−オール(9b)(D−276)の合成》
図9について、留分II、すなわち、ジアステレオマ混合物8BのHPLC分離による符号8b(0.03g、0.063mmol)は、メタノール中の無水K2CO3(5mg、0.035mmol)で処理されて、符号9bを生成した(0.025g)。1H−NMR(CDCl3;400MHz):1.32−1.43(m、2H、H−4、H−5ax)、1.60−1.71(m、2H、H−5eq、CHHCH2O)、1.87−2.01(m、2H、H−2ax、CHHCH2O)、2.12−2.17(t、1H、J=10.4Hz、H6−ax)、2.43−2.54(m、2H、NCH2CHAr)、2.98−3.01(dd、1H、J=10.8、3.2Hz、H−2eq)、3.04−3.07(brd、1H、J=10.4Hz、H−6eq)、3.43−3.48(m、1H、H−3ax)、3.51−3.57(m、1H、CH2CHHO)、3.60−3.64(m、1H、CH2CHHO)、4.70−4.73(dd、1H、J=10.4、3.6Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.23−7.37(m、15H、ArH)。[a]25D=+50.64°(c=0.95、CHCl3)。遊離塩基は融点82ないし84℃のシュウ酸塩に変換された。分析は(C28H33NO3・(COOH)2・0.7H2O)のC、H、Nについて計算された。
【0121】
《(3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((R)−2−(4−フルオロフェニル)−2−ヒドロキシエチル)ピペリジン−3−オール(9c)(D−231)の合成》
図9について、留分I、すなわち、ジアステレオマ混合物8CのHPLC分離による符号8c(0.026g、0.053mmol)は、メタノール中の無水K2CO3(4.1mg、0.03mmol)で処理されて、符号9aを生成した(0.02g)。1H−NMR(CDCl3;400MHz):1.39−1.42(m、2H、H−4、H−5ax)、1.61−1.67(m、2H、H−5eq、CHHCH2O)、1.87−1.95(m、2H、H−2ax、CHHCH2O)、2.23−2.28(t、1H、J=11.2Hz、H6−ax)、2.40−2.50(m、2H、NCH2CHAr)、2.70−2.73(brd、1H、J=11.2Hz、H−6eq)、3.29−3.33(dd、1H、J=10.4、3.2Hz、H−2eq)、3.40−3.46(m、1H、H−3ax)、3.52−3.57(m、1H、Hz、CH2CHHO)、3.60−3.65(m、1H、CH2CHHO)、4.70−4.73(dd、1H、J=10.4、3.6Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.00−7.04(t、2H、ArH)、7.23−7.34(m、12H、ArH)。[a]25D=−13.84°(c=0.65、CHCl3)。遊離塩基は融点160ないし162℃のシュウ酸塩に変換された。分析はC28H32FNO3・(COOH)2・0.1H2O)のC、H、Nについて計算された。
【0122】
《(3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((R)−2−(4−フルオロフェニル)−2−ヒドロキシエチル)ピペリジン−3−オール(9c’)(D−230)の合成》
図9について、留分II、すなわち、ジアステレオマ混合物8CのHPLC分離による符号8c’(0.023g、0.047mmol)は、メタノール中の無水K2CO3(3.6mg、0.026mmol)で処理されて、符号9c’を生成した(0.02g)。1H−NMR(CDCl3;400MHz):1.34−1.41(m、2H、H−4、H−5ax)、1.61−1.71(m、2H、H−5eq、CHHCH2O)、1.88−2.00(m、2H、H−2ax、CHHCH2O)、2.13−2.18(t、1H、J=10Hz、H6−ax)、2.38−2.52(m、2H、NCH2CHAr)、2.97−3.01(dd、1H、J=12、3.6Hz、H−2eq)、3.02−3.05(brd、1H、J=10.8Hz、H−6eq)、3.43−3.49(m、1H、H−3ax)、3.52−3.57(m、1H、CH2CHHO)、3.60−3.65(m、1H、CH2CHHO)、4.67−4.71(dd、1H、J=10.4、3.2Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.00−7.04(t、2H、ArH)、7.24−7.36(m、12H、ArH)。[a]25D=−45.78°(c=0.95、CHCl3)。遊離塩基は融点82ないし84℃のシュウ酸塩に変換された。分析はC28H32FNO3・(COOH)2・0.7H2O)のC、H、Nについて計算された。
【0123】
《(3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((S)−2−(4−フルオロフェニル)−2−ヒドロキシエチル)ピペリジン−3−オール(9d’)(D−233)の合成》
図9について、留分I、すなわち、ジアステレオマ混合物8DのHPLC分離による符号8d’(0.02g、0.04mmol)はメタノール中の無水K2CO3(3.1mg、0.022mmol)で処理されて、符号9d’を生成した(0.017g)。1H−NMR(CDCl3;400MHz):1.40−1.51(m、2H、H−4、H−5ax)、1.60−1.70(m、2H、H−5eq、CHHCH2O)、1.87−1.98(m、2H、H−2ax、CHHCH2O)、2.26−2.31(t、1H、J=11.2Hz、H6−ax)、2.46−2.51(m、2H、NCH2CHAr)、2.77−2.80(brd、1H、J=12Hz、H−6eq)、3.33−3.37(dd、1H、J=10.4、3.2Hz、H−2eq)、3.44−3.50(m、1H、H−3ax)、3.52−3.57(m、1H、CH2CHHO)、3.61−3.65(m、1H、CH2CHHO)、4.74−4.78(t、1H、J=6.8Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.00−7.04(t、2H、ArH)、7.24−7.35(m、12H、ArH)。[a]25D=+14.3(c=0.65、CHCl3)。遊離塩基は融点164ないし166℃のシュウ酸塩に変換された。分析はC28H32FNO3・(COOH)2・0.1H2O)のC、H、Nについて計算された。
【0124】
《(3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((S)−2−(4−フルオロフェニル)−2−ヒドロキシエチル)ピペリジン−3−オール(9d)(D−232)の合成》
図9について、留分II、すなわち、ジアステレオマ混合物8DのHPLC分離による符号8d(0.02g、0.04)は、メタノール中の無水K2CO3(3.1mg、0.022mmol)で処理されて、符号9c’を生成した(0.017g)。1H−NMR(CDCl3;400MHz):1.33−1.39(m、2H、H−4、H−5ax)、1.61−1.71(m、2H、H−5eq、CHHCH2O)、1.88−2.00(m、2H、H−2ax、CHHCH2O)、2.12−2.17(t、1H、J=10.4Hz、H6−ax)、2.38−2.51(m、2H、NCH2CHAr)、2.97−3.00(dd、1H、J=11.2、4Hz、H−2eq)、3.02−3.05(brd、1H、J=11.2Hz、H−6eq)、3.42−3.48(m、1H、H−3ax)、3.52−3.57(m、1H、CH2CHHO)、3.60−3.65(m、1H、CH2CHHO)、4.67−4.70(dd、1H、J=10.4、3.2Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.00−7.04(t、2H、ArH)、7.23−7.34(m、12H、ArH)。[a]25D=+43.13°(c=0.8、CHCl3)。遊離塩基は融点84ないし86℃のシュウ酸塩に変換された。分析はC28H32FNO3・(COOH)2・0.7H2O)のC、H、Nについて計算された。
【0125】
表6(図13)は、ラットの脳の中のDAT、SERT、及びNETでの、図7、8、及び9で記載されるヒドロキシピペリジン誘導体の親和性を提供する。図14はGBR12909の構造を提供する。
【0126】
[IV.図10ないし12の化合物の合成]
分析用のシリカゲルでコーティングされたTLCプレート(Si 250F)はBaker社から購入され、UV光で、あるいはリンモリブデン酸(PMA)での処理によって可視化された。フラッシュクロマトグラフィはBaker Silica Gel 40mMで行われた。1H NMRスペクトルはVarian 400 MHz FT NMRで常に得られた。用いられたNMRの溶媒は、示されるようにCDCl3であった。TMSは内部標準として用いられた。元素分析はAtlantic Microlab社で行われ、理論値の±0.4%内であった。旋光度はPerkin−Elmer241旋光計で測定された。
【0127】
[3H]WIN35,428(83.6Ci/mmol)、[3H]ドーパミン(55.1Ci/mmol)、[3H]セロトニン(30.0Ci/mmol)、及び[3H]ノルエピネフリン(54.6Ci/mmol)は、Dupont−New England Nuclear社(米国マサチューセッツ州ボストン)から入手された。WIN35,428のナフタレンスルホン酸は、Biochemicals社(米国マサチューセッツ州ネーティック)から購入された。(−)−コカインHClは国立薬物乱用研究所から入手した。GBR12909のジヒドロクロリド(1−[2−[ビス(4−フルオロフェニル)メトキシ]エチル]−4−[3−フェニルプロピル]ピペラジン)はSIGMA−ALDRICH社(品番D−052;ミズーリ州セントルイス)から購入された。
【0128】
《N−(6−ベンズヒドリルピペリジン−3−イル)−4,7,7−トリメチル−3−オキソ−2−オキサビシクロ[2.2.1]ヘプタン−1−カルボキサミド(2a及び2b)の合成》
無水CH2Cl2(50ml)中のラセミのシス−6−ベンズヒドリルピペリジン−3−イルアミン1(1.10g、4.12mmol)及びトリエチルアミン(2.08g、20.64mmol)の攪拌溶液に、10mlの無水CH2Cl2に溶解された(1S)−(−)−カンファン酸クロリド(1.07g、4.95mmol)が窒素下で液滴添加された。反応混合物は0℃で30分間、窒素雰囲気下、室温で更に3時間、攪拌された。反応混合物は次いでCH2Cl2(50ml)で希釈され、水(20ml)で洗浄され、Na2SO4で乾燥させ、溶媒は減圧下で蒸発させて、2のジアステレオマ2a及び2bの混合物を提供した。各ジアステレオマは移動相としてヘキサン/ジエチルエーテル(12:88)を用いてシリカゲルでフラッシュカラムクロマトグラフィによって分離された。
【0129】
第1の溶出は符号2a(0.51g、55%)であった。1H NMR(400MHz、CDCl3):δ0.89(3H、s、CH3)、1.09(3H、s、CH3)、1.11(3H、s、CH3)、1.37−1.41(1H、m、H−5)、1.48−1.56(1H、m、H−5)、1.65−1.72(2H、m、CCH2C)、1.82−1.97(3H、m、CCH2C及びH−4)、2.48−2.56(1H、m、H−4)、2.78−2.84(2H、m、H−2)、3.23(1H、dt、J=2.4Hz、J=10.4Hz、H−6)、3.79(1H、d、J=10.0Hz、(Ph)2CH)、4.09−4.12(1H、m、H−3)、7.13−7.37(8H、m、ArH)、7.39−7.41(2H、m、ArH)。
【0130】
第2の溶出は符号2b(0.45g、49%)であった。1H NMR(400MHz、CDCl3):δ0.82(3H、s、CH3)、1.02(3H、s、CH3)、1.05(3H、s、CH3)、1.32−1.35(1H、m、H−5)、1.43−1.52(1H、m、H−5)、1.57−1.64(2H、m、CCH2C)、1.71−1.90(3H、m、CCH2C及びH−4)、2.41−2.50(1H、m、H−4)、2.71−2.80(2H、m、H−2)、3.16(1H、dt、J=2.0Hz、J=10.4Hz、H−6)、3.71(1H、d、J=10.0Hz、(Ph)2CH)、4.01−4.07(1H、m、H−3)、7.07−7.30(8H、m、ArH)、7.33−7.35(2H、m、ArH)。
【0131】
《(−)−シス−6−ベンズヒドリルピペリジン−3−イルアミン(3)の合成》
濃HCl/MeOH(50ml、体積/体積の比率 1:4)中の符号2b(0.55g、1.23mmol)が72時間還流された。メタノールは次いで減圧下で50℃で乾燥され、残りの水溶液は飽和NaHCO3溶液によって中和された。溶液はCH2Cl2(3×50ml)で抽出された。総ての有機層は結合され、鹹水(50ml)で洗浄され、Na2SO4で乾燥させ、酢酸エチル/MeOH/Et3N(80:15:5)を用いて、シリカゲルでフラッシュカラムクロマトグラフィによって濃縮及び精製されて、白色固体(0.26g、79%)として符号3を提供した。1H NMR(400MHz、CDCl3):δ1.35−1.43(2H、m、H−5)、1.59−1.64(2H、m、H−4)、2.18(2H、広範な一重線、NH)、2.79−2.81(2H、m、H−2)、2.98−3.04(1H、m、H−3)、3.25(1H、dt、J=4Hz、J=10Hz、H−6ax)、3.80(1H、d、J=10.2Hz、(Ph)2CH)、7.12−7.40(10H、m、ArH)。[α]25D=(−)41.9°(c1、MeOH)。
【0132】
[手順A]
《(R)−2−[(3S,6S)−6−ベンズヒドリルピペリジン−3−イルアミノ)−1−(4−フルオロフェニル)エタノール(4a)の合成》
乾燥エタノール(20ml)中の(−)−シス−6−ベンズヒドリルピペリジン−3−イルアミン3(0.058g、0.217mmol)の攪拌溶液に、R−(−)−4−フルオロスチレンオキシド(0.045g、0.326mmol)が添加された。反応混合物は窒素雰囲気下で一晩還流された。溶媒は蒸発させて、生成物はジエチルエーテル/MeOH/Et3N(92:8:0.2)を用いて、シリカゲルでフラッシュカラムクロマトグラフィによって精製されて、符号4a(0.023g、26%)を提供した。1H NMR(400MHz、CDCl3):δ1.30−1.38(2H、m、H−5)、1.48−1.55(1H、m、H−4ax)、1.75−1.79(1H、m、H−4eq)、2.44−2.54(1H、dd、J=2.0Hz、J=10.0Hz、NHCH2)、2.71−2.78(2H、m、H−2)、2.86−2.90(1H、dd、J=3.2Hz、J=12.4Hz、NHCH2)、2.97−3.00(1H、m、H−3eq)、3.25(1H、dt、J=3.2Hz、J=9.6Hz、H−6ax)、3.75(1H、d、J=10Hz、(Ph)2CH)、4.60−4.64(1H、dd、J=3.2Hz、J=9.6Hz、CH−OH)、7.01(2H、t、J=8.4Hz、ArH)、7.13−7.37(12H、m、ArH)。遊離塩基は融点202ないし204℃のシュウ酸塩に変換された。[α]25D(シュウ酸塩)=(−)21.5°(c0.26、MeOH)。分析は(C26H29FN2O.2(COOH)2、0.5H2O)のC、H、Nについて計算された。
【0133】
《(S)−2−[(3S,6S)−6−ベンズヒドリルピペリジン−3−イルアミノ)−1−(4−フルオロフェニル)エタノール(4b)の合成》
化合物3(0.076g、0.285mmol)はS−(+)−4−フルオロスチレンオキシド(0.059g、0.427mmol)で還流されて(手順A)、符号4b(0.029g、25%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.38(2H、m、H−5)、1.47−1.53(1H、m、H−4ax)、1.79−1.83(1H、m、H−4eq)、2.43−2.53(1H、dd、J=2.8Hz、J=12.0Hz、NHCH2)、2.71−2.74(2H、m、H−2)、2.87−2.97(2H、m、NHCH2及びH−3eq)、3.25(1H、dt、J=3.2Hz、J=9.6Hz、H−6ax)、3.74(1H、d、J=10Hz、(Ph)2CH)、4.60−4.63(1H、dd、J=2.8Hz、J=8.8Hz、CH−OH)、7.01(2H、t、J=8.8Hz、ArH)、7.16−7.37(12H、m、ArH)。[α]25D(シュウ酸塩)=(+)19.2°(c0.38、MeOH)。遊離塩基は203ないし205℃のシュウ酸塩に変換された。分析は(C26H29FN2O.2(COOH)2、0.9H2O)のC、H、Nについて計算された。
【0134】
《(R)−1−[(3S,6S)−6−ベンズヒドリルピペリジン−3−イルアミノ)−3−フェニルプロパン−2−オール(4c)の合成》
化合物3(0.076g、0.285mmol)はR−(+)−2,3−エポキシプロピルベンゼン(0.057g、0.427mmol)と反応させた(手順A)。粗生成物はジエチルエーテル/MeOH/Et3N(90:10:0.2)を用いてフラッシュカラムクロマトグラフィによって精製され、符号4c(0.035g、30%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.34(2H、m、H−5)、1.44−1.52(1H、m、H−4ax)、1.72−1.75(1H、m、H−4eq)、2.32−2.38(1H、dd、J=2.8Hz、J=9.6Hz、NHCH2)、2.64−2.83(5H、m、H−2、NHCH2、Ph−CH2)、2.90−2.93(1H、m、H−3eq)、3.23(1H、dt、J=3.2Hz、J=10.0Hz、H−6ax)、3.73−3.83(2H、m、(Ph)2CH及びCH−OH)、7.12−7.31(13H、m、ArH)、7.35−7.36(2H、m、ArH)。遊離塩基の旋光度[α]25D=(−)38.9°(c0.57、MeOH)。遊離塩基は205ないし207℃のシュウ酸塩に変換された。分析は(C27H32N2O.2(COOH)2、0.5H2O)のC、H、Nについて計算された。
【0135】
《(S)−1−[(3S,6S)−6−ベンズヒドリルピペリジン−3−イルアミノ)−3−フェニルプロパン−2−オール(4d)の合成》
化合物3(0.075g、0.281mmol)はS−(−)−2,3−エポキシプロピルベンゼン(0.056g、0.422mmol)と反応させ(手順A)、ジエチルエーテル/MeOH/Et3N(90:10:0.2)を用いてシリカゲルでフラッシュカラムクロマトグラフィによって精製されて、符号4d(0.037g、33%)を提供した。1H NMR(400MHz、CDCl3):δ1.23−1.35(2H、m、H−5)、1.41−1.49(1H、m、H−4ax)、1.75−1.78(1H、m、H−4eq)、2.36−2.41(1H、dd、J=3.2Hz、J=8.8Hz、NHCH2)、2.66−2.84(5H、m、H−2、NHCH2、Ph−CH2)、2.89−2.92(1H、m、H−3eq)、3.23(1H、dt、J=2.4Hz、J=10.0Hz、H−6ax)、3.75(1H、d、J=10.0Hz、(Ph)2CH)3.78−3.85(1H、m、及びCH−OH)、7.12−7.31(13H、m、ArH)、7.35−7.36(2H、m、ArH)。旋光度[α]25D=(−)49.3°(c0.96、MeOH)。遊離塩基は206ないし209℃のシュウ酸塩に変換された。分析は(C27H32N2O.2(COOH)2、0.3H2O)のC、H、Nについて計算された。
【0136】
《1−((5S,8S)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン−2−イル)−3−フェニルプロパン−2−オール(6a及び6b)の合成》
乾燥エタノール中のシス−(−)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン5(0.100g、0.341mmol)の攪拌溶液に、2,3−エポキシプロピルベンゼン(0.068g、0.512mmol)が添加された。反応混合物は65℃で一晩攪拌された(手順A)。ジアステレオマは移動相としてアセトン/ジエチルエーテル(20:80)を用いて、調製用TLCによって分離されて、符号6a及び6bを提供した。上方の留分は符号6a(0.026g、18%)を提供した。1H NMR(400MHz、CDCl3):δ1.24−1.43(2H、m、H−7)、1.54−1.66(1H、m、H−6ax)、2.03−2.06(1H、m、H−6eq)、2.28(1H、t、J=12.4Hz、NCH2CH)、2.39(1H、bs、H−5)、2.57−2.87(6H、m、NCH2CH、NCH2CH2N、Ph−CH2)、2.98−3.01(1H、m、H−9ax)、3.10(1H、bd、J=11.8Hz、NCH2CH2N)、3.22−3.25(1H、m、H−9eq)3.77(1H、dt、J=4.8Hz、J=11.2Hz、H−8ax)、3.84−3.91(2H、m、CH−OH、(Ph)2CH)、7.11−7.15(2H、m、ArH)、7.19−7.31(11H、m、ArH)、7.35−7.38(2H、m、ArH)。[α]25D(シュウ酸塩)=(−)24.7°(c0.42、MeOH)。分析は(C29H34N2O.2(COOH)2)のC、H、Nについて計算された。
【0137】
下方の留分は符号6b(0.024g、16%)を提供した。1H NMR(400MHz、CDCl3):δ1.22−1.29(1H、m、H−7ax)、1.34−1.42(1H、m、H−7eq)、1.47−1.56(1H、m、H−6ax)、2.02−2.07(1H、m、H−6eq)、2.20(1H、dd、J=10.8Hz、J=2.4Hz、NCH2CH)、2.48(1H、bm、H−5)、2.67(1H、dd、J=8.0Hz、J=5.6Hz、NCH2CH)、2.75−3.10(7H、m、NCH2CH2N、Ph−CH2、H−9ax)、3.17−3.20(1H、m、H−9eq)3.75(1H、dt、J=4.8Hz、J=11.3Hz、H−8ax)、3.83−3.90(2H、m、CH−OH、(Ph)2CH)、7.12−7.15(2H、m、ArH)、7.19−7.30(11H、m、ArH)、7.33−7.38(2H、m、ArH)。[α]25D(シュウ酸塩)=(−)31.2°(c0.40、MeOH)。分析は(C29H34N2O.2(COOH)2)のC、H、Nについて計算された。
【0138】
《(R)−2−((5S,8S)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−フェニルエタノール(7a)の合成》
乾燥エタノール中のシス−(−)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン5(0.065g、0.222mmol)の攪拌溶液に、R−(+)−2−フェニルオキシラン(0.04g、0.333mmol)が添加された(手順A)。化合物はジエチルエーテル/MeOH(9:1)を用いることによってフラッシュカラムクロマトグラフィによって精製されて、符号7a(0.051g、56%)を提供した。1H NMR(400MHz、CDCl3):δ1.26−1.33(1H、m、H−7ax)、1.38−1.47(1H、m、H−7eq)、1.54−1.63(1H、m、H−6ax)、2.00−2.03(1H、m、H−6eq)、2.38−2.47(2H、m、NCH2CH、H−5)、2.77(1H、dd、J=3.6Hz、J=12.4Hz、NCH2CH)、2.82−2.99(3H、m、NCH2CH2N)3.03−3.06(1H、m、H−9ax)、3.17−3.19(1H、m、NCH2CH2N)、3.29−3.33(1H、m、H−9eq)3.80(1H、dt、J=4.4Hz、J=10.8Hz、H−8ax)、3.91(1H、d、J=11.6Hz、(Ph)2CH)、4.69(1H、dd、J=3.2Hz、J=11.2Hz、CHOH)、7.10−7.38(15H、m、ArH)。[α]25D=(−)52.3°(c0.52、MeOH)。遊離塩基は194ないし197℃のシュウ酸塩に変換された。分析は(C28H32N2O.2(COOH)2)のC、H、Nについて計算された。
【0139】
《(S)−2−((5S,8S)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−フェニルエタノール(7b)の合成》
化合物5(0.060g、0.205mmol)はS−(−)−2−フェニルオキシラン(0.036g、0.307mmol)と反応させて(手順A)、符号7b(0.045g、53%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.34(1H、m、H−7ax)、1.38−1.49(1H、m、H−7eq)、1.54−1.65(1H、m、H−6ax)、2.22−2.27(1H、m、H−6eq)、2.34(1H、dd、J=2.8Hz、J=10.4Hz、NCH2CH)、2.46−2.49(1H、m、NCH2CH2N)、2.64(1H、bs、H−5)、2.91−3.11(6H、m、NCH2CH2N、NCH2CH、H−9ax)、3.24−3.27(1H、m、H−9eq)3.72−3.83(1H、m、H−8ax)、3.88(1H、d、J=11.6Hz、(Ph)2CH)、4.67(1H、dd、J=3.6Hz、J=10.0Hz、CHOH)、7.10−7.37(15H、m、ArH)。[α]25D=(−)45.8°(c0.52、MeOH)。遊離塩基は193ないし195℃のシュウ酸塩に変換された。分析は(C28H32N2O.2(COOH)2、0.3H2O)のC、H、Nについて計算された。
【0140】
《(R)−2−((5S,8S)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−4−フルオロフェニル)エタノール(7c)の合成》
化合物5(0.060g、0.205mmol)はR−(−)−2−(4−フルオロフェニル)オキシラン(0.042g、0.307mmol)(手順A)と反応させて、符号7c(0.034g、39%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.32(1H、m、H−7ax)、1.35−1.47(1H、m、H−7eq)、1.54−1.64(1H、m、H−6ax)、2.00−2.03(2H、m、H−6eq)、2.32−2.38(1H、dd、J=11.2Hz、J=0.8Hz、NCH2CH)、2.44(1H、bs、H−5)、2.73(1H、dd、J=3.6Hz、J=12.8Hz、NCH2CH)、2.79−2.96(3H、m、NCH2CH2N)、3.02−3.06(1H、m、H−9ax)、3.16−3.19(1H、bm、NCH2CH2N)、3.27−3.31(1H、m、H−9eq)、3.75−3.86(1H、m、H−8ax)、3.90(1H、d、J=11.2Hz、(Ph)2CH)、4.66(1H、dd、J=3.2Hz、J=10.8Hz、CHOH)、7.03(2H、t、J=8.4Hz、ArH)、7.10−7.38(12H、m、ArH)。[α]25D(遊離塩基)=(−)45.5°(c0.57、MeOH)。遊離塩基は189ないし191℃のシュウ酸塩に変換された。分析は(C28H31FN2O.2(COOH)2、0.2H2O)のC、H、Nについて計算された。
【0141】
《(S)−2−((5S,8S)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−4−フルオロフェニル)エタノール(7d)の合成》
化合物5(0.070g、0.239mmol)はS−(+)−2−(4−フルオロフェニル)オキシラン(0.049g、0.358mmol)と反応させて(手順A)、符号7d(0.040g、39%)を提供した。1H NMR(400MHz、CDCl3):δ1.27−1.34(1H、m、H−7ax)、1.37−1.49(1H、m、H−7eq)、1.59−1.68(1H、m、H−6ax)、2.20−2.32(2H、m、H−6eq、NCH2CH)、2.45−2.49(1H、m、NCH2CH2N)、2.62(1H、bs、H−5)、2.91−3.11(5H、m、NCH2CH2N、NCH2CH、H−9ax)、3.23−3.28(1H、m、H−9eq)、3.75−3.82(1H、m、H−8ax)、3.88(1H、d、J=11.2Hz、(Ph)2CH)、4.64(1H、dd、J=3.2Hz、J=10.0Hz、CHOH)、6.99−7.04(2H、m、ArH)、7.10−7.37(12H、m、ArH)。[α]25D(遊離塩基)=(−)44.0°(c0.56、MeOH)。遊離塩基は191−193℃のシュウ酸塩に変換された。分析は(C28H31FN2O.2(COOH)2、0.3H2O)のC、H、Nについて計算された。
【0142】
《3−((1S,6S)−6−ベンズヒドリル−2,5−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−(4−フルオロフェニル)プロパン−1−オン(8)の合成》
乾燥アセトニトリル中のシス−(−)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン5(0.250g、0.854mmol)の攪拌溶液に、K2CO3(0.354g、2.56mmol)、次いで3−クロロ−4’−フルオロプロピオフェノン(0.207g、1.11mmol)が添加された。触媒量のヨウ化カリウムが添加され、反応混合物は窒素雰囲気下で3時間還流された。溶媒の蒸発後、残留物は水に溶解され、CH2Cl2(2×100ml)で抽出され、Na2SO4で乾燥させ、蒸発させた。化合物はジエチルエーテル/MeOH/Et3N(93:7:0.2)を用いてフラッシュカラムクロマトグラフィによって精製されて、符号8(0.260g、68%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.34(1H、m、H−7ax)、1.34−1.45(1H、m、H−7eq)、1.48−1.58(1H、m、H−6ax)、2.20−2.23(1H、m、H−6eq)、2.52(1H、bs、H−5)、2.62−2.65(1H、m、NCH2CH2)、2.80−3.16(8H、m、NCH2CH2N、NCH2CH2、CH2CO、H−9ax)、3.20−3.23(1H、m、H−9eq)3.77(1H、dt、J=4.4Hz、J=11.2Hz、H−8ax)、3.89(1H、d、J=11.8Hz、(Ph)2CH)、7.08−7.15(2H、m、ArH)、7.20−7.28(6H、m、ArH)、7.36(2H、d、J=7.2Hz、ArH)、7.95−7.99(2H、dt、J=2.0Hz、J=5.2Hz、ArH)。
【0143】
《3−((1S,6S)−6−ベンズヒドリル−2,5−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−(4−フルオロフェニル)プロパン−1(R及びS)−オール(9)の合成》
25mlのTHFに溶解された化合物8(0.250g、0.564mmol)の攪拌溶液に、NaBH4(0.025g、0.677mmol)が添加され、次いで0.5mlの水が添加された。反応混合物はRTで3時間、窒素雰囲気下で攪拌された。水(5ml)は次いで反応混合物に添加された。溶媒は蒸発させ、残留物は水で溶解され、CH2Cl2(2×50ml)で抽出され、Na2SO4で乾燥させ、減圧下で蒸発させた。粗生成物はジエチルエーテル/MeOH/Et3N(93:8:0.2)を用いてフラッシュカラムクロマトグラフィによって精製されて、符号9(0.195g、79%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.41(2H、m、H−7ax、H−7eq)、1.47−1.95(3H、m、CH2CHOH、H−6ax)、2.09−2.18(1H、m、H−6eq)、2.59−2.96(6H、m、H−5、NCH2CH2、NCH2CH2N)、3.04(1H、d、J=13.2Hz、H−9ax)、3.12−3.25(2H、m、NCH2CH2N、H−9eq)、3.73−3.82(1H、m、H−8ax)、3.88(1H、dd、J=1.6Hz、J=11.6Hz、(Ph)2CH)、4.84−4.95(1H、m、CHOH)、7.00(2H、dt、J=1.6Hz、J=8.4Hz、ArH)、7.10−7.16(2H、m、ArH)、7.19−7.37(10H、m、ArH)。
【0144】
《3−((1S,6S)−6−ベンズヒドリル−2,5−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−(4−フルオロフェニル)プロピル−4,7,7−トリメチル−3−オキソ−2−オキサビシクロ[2.2.1]ヘプタン−1−カルボキシラート(10a及び10b)の合成》
0℃、窒素雰囲気下で、100mlの乾燥CH2Cl2中の3−((1S,6S)−6−ベンズヒドリル−2,5−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−(4−フルオロフェニル)プロパン−1(R及びS)−オール9(0.195g、0.438mmol)、Et3N(0.088g、0.876mmol)、及びDMAP(10mg)の攪拌溶液に、10mlの乾燥CH2Cl2に溶解された(1S)−(−)−カンファン酸クロリド(0.123g、0.569mmol)が添加された。反応混合物は0℃で30分間、室温で3時間、窒素下で攪拌された。反応混合物は水(20ml)で急冷され、次いでCH2Cl2(50ml)で希釈された。有機層は分離されて、水層はCH2Cl2(2×50ml)で抽出され、Na2SO4で乾燥させ、減圧下で蒸発させた。粗生成物はジエチルエーテル/MeOH(95:5)を用いて、シリカゲルでフラッシュカラムクロマトグラフィによって精製されて、2のジアステレオマ10a及び10bの混合物(0.250g、91%)を提供した。ジアステレオマは順相カラム(Nova−pack Silica 6μm)を用いて半調製用HPLCによって分離された。ヘキサン/2−プロパノール/Et3N(92:8:0.3)は、12mL/分の流速を有する移動相として用いられた。2の留分は符号10a及び10bについてそれぞれ、保持時間2.83分及び3.30分で溶出された。
【0145】
第1の溶出は符号10a(0.115g、42%)であった。1H NMR(400MHz、CDCl3):δ0.79(3H、s、CH3)、0.97(3H、s、CH3)、1.07(3H、s、CH3)、1.24−1.49(2H、m、H−7ax、H−7eq)、1.62−1.68(1H、m、H−6ax)、1.84−2.07(3H、m、CH2CHO、H−6eq)、2.16−2.49(5H、m、H−5、CCH2C、NCH2CH2N)、2.59−2.63(1H、m、NCH2CH2N)、2.68−2.75(1H、m、NCH2CH2)、2.86−2.98(2H、m、NCH2CH2、H−9ax)、3.09−3.12(1H、m、NCH2CH2N)、3.18−3.21(1H、m、H−9eq)、3.75(1H、dt、J=4.4Hz、J=11.2Hz、H−8ax)、3.87(1H、d、J=11.2Hz、(Ph)2CH)、5.94(1H、t、J=7.2Hz、CHOCO)、6.97−7.03(2H、m、ArH)、7.09−7.14(2H、m、ArH)、7.19−7.27(6H、m、ArH)、7.30−7.37(4H、m、ArH)。第2の溶出は符号10b(0.105g、38%)であった。1H NMR(400MHz、CDCl3):δ0.88(3H、s、CH3)、0.98(3H、s、CH3)、1.09(3H、s、CH3)、1.23−1.52(2H、m、H−7ax、H−7eq)、1.62−1.68(1H、m、H−6ax)、1.84−1.99(2H、m、CH2CHO)、2.04−2.07(1H、m、H−6eq)、2.12−2.52(5H、m、H−5、CCH2C、NCH2CH2N)、2.68−2.75(1H、m、NCH2CH2)、2.84−2.92(1H、m、NCH2CH2)、2.95−2.99(1H、m、H−9ax)、3.08−3.11(1H、m、NCH2CH2N)、3.18−3.22(1H、m、H−9eq)、3.76(1H、dt、J=4.8Hz、J=11.2Hz、H−8ax)、3.87(1H、d、J=11.6Hz、(Ph)2CH)、5.92(1H、t、J=6.8Hz、CHOCO)、6.98−7.03(2H、m、ArH)、7.09−7.15(2H、m、ArH)、7.19−7.37(10H、m、ArH)。
【0146】
[手順B]
《(−)11aの合成》
第1の溶出するカンファン酸エステルの留分10a(0.075g、0.120mmol)は、室温で12時間、メタノール(20ml)中でK2CO3(20mg)で加水分解された。メタノールは蒸発させ、水(20ml)は添加され、生成物は酢酸エチル(2×50ml)で抽出された。有機層はNa2SO4で乾燥させ、減圧下で蒸発させた。粗生成物はジエチルエーテル/MeOH/Et3N(93:8:0.2)を用いて、シリカでフラッシュカラムクロマトグラフィによって精製されて、符号11a(0.048g、90%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.44(2H、m、H−7ax、H−7eq)、1.54−1.69(2H、m、CH2CHOH、H−6ax)、1.80−1.90(1H、m、CH2CHOH)、2.15−2.18(1H、m、H−6eq)、2.63(1H、bs、H−5)、2.67−2.974(1H、m、NCH2CH2)、2.79−2.95(4H、m、NCH2CH2、NCH2CH2N)、3.04(1H、d、J=13.2Hz、H−9ax)、3.13−3.18(1H、m、NCH2CH2N)、3.22−3.25(1H、m、H−9eq)、3.79(1H、dt、J=4.8Hz、J=11.6Hz、H−8ax)、3.88(1H、d、J=11.6Hz、(Ph)2CH)、4.86(1H、dd、J=2.4Hz、J=9.6Hz、CHOH)、7.00(2H、t、J=8.8Hz、ArH)、7.11−7.16(2H、m、ArH)、7.19−7.37(10H、m、ArH)。[α]25D=(−)38.7°(c1.08、MeOH)。遊離塩基は191ないし193℃のシュウ酸塩に変換された。分析は(C29H33FN2O.2(COOH)2、1.5H2O)のC、H、Nについて計算された。
【0147】
《(−)11bの合成》
第2の溶出する留分10b(0.105g、0.168mmol)はメタノール(20ml)中でK2CO3(20mg)で加水分解されて、符号11b(0.071g、94%)を提供した(手順B)。1H NMR(400MHz、CDCl3):δ1.24−1.43(2H、m、H−7ax、H−7eq)、1.48−1.54(1H、m、H−6ax)、1.71−1.79(1H、m、CH2CHOH)、1.88−1.95(1H、m、CH2CHOH)、2.09−2.12(1H、m、H−6eq)、2.60−2.66(2H、m、H−5、NCH2CH2)、2.76−2.97(4H、m、NCH2CH2、NCH2CH2N)、3.04(1H、d、J=13.2Hz、H−9ax)、3.12−3.15(1H、m、NCH2CH2N)、3.21−3.24(1H、m、H−9eq)、3.78(1H、dt、J=4.8Hz、J=11.6Hz、H−8ax)、3.88(1H、d、J=11.6Hz、(Ph)2CH)、4.94(1H、dd、J=3.2Hz、J=7.6Hz、CHOH)、7.00(2H、t、J=8.4Hz、ArH)、7.10−7.16(2H、m、ArH)、7.20−7.37(10H、m、ArH)。[α]25D=(−)56.8°(c1.0、MeOH)。遊離塩基は193−195℃のシュウ酸塩に変換された。分析は(C29H33FN2O.2(COOH)2、0.5H2O)のC、H、Nについて計算された。
【0148】
[輸送体アッセイ]
ラットDATへの結合における、及びモノアミンの取り込みの阻害における試験化合物の親和性は、既述のようにモニタリングされた。簡潔に言うと、ラット線条体はDATによる[3H]WIN35,428の結合と、DATによる[3H]DAの取り込みとを測定するのに用いられた。ラットの大脳皮質は、SERTによる[3H]セロトニンの取り込みを評価するために用いられ、海馬はNETによる[3H]NEの取り込みを評価するために用いられた。DATでの非特異的な結合は100uMのコカインで規定され、DAT、SERT、及びNETでの非特異的な取り込みは、それぞれ100uMのコカイン、10uMのシタロプラム、及び10uMのデシプラミンで規定された。試験化合物はジメチルスルホキシド(DMSO)に溶解され、10%(v/v)のDMSOに希釈され、それ自身によってアッセイと干渉されない、0.5%の最終DMSO濃度を得てアッセイに添加された。各試験化合物の少なくとも5の三組の濃度が調査され、IC50値前後に均等に分布された。後者は非線形計算機の曲線適合手順によって測定され、チェン−プルソフ(Cheng−Prusoff)の式でKiに変換された。
【0149】
[図10ないし12の化合物に対する結果及び考察]
化合物4aないしb及び4cないしdの設計は、環外ヒドロキシル基の、3,6−二置換型の鋳型に導入することに関連した。化合物4aと4bとの間で、化合物4bはS−エポキシドから合成されるため、S型立体構造内にヒドロキシル基を有する。化合物4bは4aと比較して、DAT及びNETそれぞれによる、放射標識されるDA及びNEの取り込みの阻害についてより強力であった(符号4a及び4bについて、それぞれKi(DAT)=236nM、152nM、及び符号4a及び4bについて、それぞれKi(NET)=1435、306nM)。従って、2の化合物間のNE取り込みの阻害活性における差異は、DA取り込みの阻害活性よりも大きかった。
【0150】
更なる化合物の設計において、更なるメチレン単位がフェニル部分と、ヒドロキシルの中心との間に導入された。この変換によって、符号4cないしdは、符号4aないしbと比較して、より強力なDAT取り込み阻害剤となった(図15中の表7)。符号4c及び4dの双方は、DA取り込み活性の阻害に対し低いナノモル活性を示し(符号4c及び4dについてそれぞれ、Ki(DAT)=25nM、25.3nM)、更に、同一の相対効能が、放射標識されるトロパンリガンドであるCFTを有する結合アッセイで示された。双方の化合物が互角の阻害活性を示し、ヒドロキシルの中心のキラリティためのいかなる選択も示さないことに留意すべきことは興味深いことである。このように、分子構造中の微小な変化によって、符号4aないしbと比較して、符号4cないしdにおいてDAT阻害の効能のほぼ10倍の増加が得られた。
【0151】
更なるアナログの設計において、二環式の(−)−ジアミンの鋳型が環外ヒドロキシル基の導入用に選択された。このように化合物6a及び6bにおいて、符号4c及び4dの二環型を表わし、ヒドロキシル官能基はR型及びS型の立体中心とともに導入された。これらの分子はDA取り込みの阻害のための異なる効能を示し、ヒドロキシルのS型の立体中心はR型の立体中心よりも大きな効能を示した(符号6b、6aについて、それぞれKi(DAT)=16.8nM、82.9nM)。このように、この結果は、その3,6−二置換型の対応物4cないしdと比較して、ある程度異なっていた。化合物6bは6aよりもDA取り込みの阻害において5倍強力であった(表7)。このことによって、より限定的な二環構造の、DATに対するより大きな選択性及び親和性による効果が示された。次の系列の化合物7aないしdは、符号4aないしbのより限定的な二環型を表わし、DATに対し弱い効能から強い効能までの結果を提供した。しかしながら、環外ヒドロキシル基はR型の立体中心であり、これらの分子は先の誘導体とは逆に、DATと優先的な相互作用を生じた。符号7の系列で同定される最も強力な化合物は、フルオロ誘導体7cであり、DATに対し最大の効能を示した(Ki=66.5nM)。一般的に、フルオロ誘導体は、非置換型と比較して強力であった。一般的には、化合物7aないしdは6aないしbよりも効能が更に小さく、輸送体の相互作用におけるN−アルキル鎖の長さの重要性を示した。
【0152】
更なる2の二環式のアミンアナログ11a及び11bにおいて、ヒドロキシル基はベンジル位にプロピル鎖の終端で導入された。従って、これらの2の化合物において、ヒドロキシル基は先のアナログと比較すると、N原子から最も離れて配置された。ヒドロキシル基のこのような配置によって、ジアステレオマ11bのうちの1つにおけるDA取り込みの最大の阻害が生じたことは、取り込み阻害のデータから明らかである(Ki=8.63nM)。従って、化合物11bはセロトニン及びノルエピネフリンの双方の阻害と比較して、ドーパミン取り込みの阻害に対し最大の効能及び選択性を示した(SERT/DAT及びNET/DAT;172及び48.4、図16の表8)。実際に、化合物11bは、この分子の系の中で最も強力かつ選択的な化合物となった。他方、ジアステレオマ11aは、効能が系中の3番目に最良の化合物4dに匹敵するが(符号11a及び4dについてそれぞれ、Ki(DAT)=41.8nM及び25.3nM)、11bと比較して効能が小さかった。芳香環及びN原子に対するヒドロキシル基の位置が取り込み阻害活性に重要な役割を果たすことはこの結果から明らかである。図17は、図10ないし12の化合物に対する元素分析を提供する。
【0153】
本実施形態の化合物は、DATとの相互作用に最適なN−プロピルリンカの長さを含む。N−プロピル終端のベンジル位における環外のヒドロキシル基の位置は、本発明の系において最も能動的かつ選択的なDAT化合物11bを生成する。多くの場合においては、立体化学的な選択はヒドロキシルの立体中心で示された。一般的に、より制限的な二環式アミンから得られたヒドロキシル化合物は、3,6−二置換型のアミン誘導体よりもDATに対し大きな選択性を生じた。
【0154】
本発明の実施形態は例示及び記載されてきたが、これらの実施形態は本発明の総ての可能な形態を例示及び記載することを意図していない。逆に、本明細書中で用いられた用語は、限定ではなく説明の用語であり、様々な変更が本発明の精神及び範囲を逸脱することなくなされうることは理解されよう。
【技術分野】
【0001】
[関連出願の相互参照]
本出願は、2004年12月8日提出の米国特許出願第11/007,484号の一部継続出願であり、2003年3月28日提出の米国特許出願第10/311,796号の継続出願であり、2001年6月14日提出のPCT出願PCT/US01/40964の利益を主張し、2000年6月20日の米国仮特許出願第60/212,921号の利益を主張する。これによって、これらの出願の開示全体は引用によって組み込まれる。
【0002】
[技術分野]
本発明はモノアミン輸送系、特にドーパミン輸送体(DAT)、セロトニン輸送体(SERT)、及びノルエピネフリン輸送体(NET)に対し活性を示す、薬理学的に能動的な化合物に関する。新規の化合物はSERTと比較して、DATに対する活性で大きな差異を示す。
【背景技術】
【0003】
ドーパミン輸送体は中枢神経系(CNS)中の病態生理学的(pathophysiocological)プロセスで重要な役割を果たすシナプス前性に配置される高分子である。DATは放出されたドーパミンのシナプス前ニューロンへの再蓄積によって、ドーパミン作動性の神経伝達を終結する。M.J.Kuhar,“Neurotransmitter Uptake:A Tool in Identifying Neurotransmitter Specific Pathways”,LIFE SCI.,13,1623−34,1973。コカイン中毒において、コカインのDATへの結合、ドーパミンの取り込みの結果的な遮断は、薬物の強化特性と関連するように思われる。M.E.A.Reithら,“Structural Requirements for Cocaine Congeners to Interact With Dopamine and Serotonin Uptake Sites in Mouse Brain and to Induced Stereotyped Behavior”,BIOCHEM.PHARMACOL.,1986,35,1123−1129;M.C.Ritzら,“Cocaine Inhibition of Ligand Binding At Dopamine,Norpinephrine and Serotonin Transporters:A Structure−Activity Study”,LIFE.SCI.,1990,46,635−645;M.C.Ritzら,“Cocaine Receptors On Dopamine Transporters Are Related to Self−Administration of Cocaine”,SCIENCE,1987,237.1219−1223;B.Girosら,“Hyperlocomotion and Indifference to Cocaine and Amphetamine in Mice Lacking the Dopamine Transporter”,NATURE,1996,379,606−612。輸送機能と更に関連づけられるのは、パーキンソン病に関連するドーパミン作動性ニューロン中の神経毒性物質の濃度である。輸送体高分子は、パーキンソン病の被殻の組織部分に輸送体高分子がないことによって明らかなように、パーキンソン病用のマーカ:H.Shoemakerら,NAUNYN SCHMIEDEBERGS ARCH.PHARMACOL.,1985,329,227−235、及びJ.−M.Maloteauxら,EUR.J.PHARM.,1988,156,331−340;となりうる。H.B.Niznikら,ARCH.BIOCHEM.BIOPHYS.,1990,276,424−432及びM.J.Kaufmanら,SYNAPSE,1991,9,43−49。従って、DATに対し強力で、かつ選択的な結合基は、脳内のコカインの主標的の生体内モニタリングと、コカイン結合部位の特徴づけと、コカイン中毒の治療のための薬物療法薬と、パーキンソン病のモニタリンに対し有望である。
【0004】
コカインは脳内の様々な神経細胞輸送系に結合することが知られる:M.E.A.Reithら,前掲;が、コカイン中毒での因子であるコカインの増強作用は、DATへの結合によって開始すると考えられ、ドーパミン輸送の阻害を引き起こす。不正使用の向精神薬であるフェンシクリジン(PCP)は更に、DATへの結合を通じてその行動的影響の少なくとも一部を示すと知られている。K.M.Johnson,“Phencyclidine:Behavioral and Biochemical Evidence Supporting a Role For Dopamine”,FED.PROC,1983,42,2579−2583;E.D.Frenchら,“Phencyclidine Binding Sites in the Nucleus Accumbens and Phencyclidine−Induced Hyperactivity are Decreased Following Lesions of the Mesolimbic Dopamine System”,EUR.J.PHARMACOL.,1985,116,1−9。DATは更に、ヒトで突発性パーキンソン症候群を誘発する、1−メチル−4−フェニル−1,2,3,6−テトラヒドロピリジン(MPTP)の神経毒性作用に決定的な役割を果たす。J.Langstonら,“MPTP:Current Concepts and Controversies”,CLIN.NEUROPHARMAC,1986,9,485−507;H.Kinemuchiら,“The Neurotoxicity of 1−methyl−4−phenyl−1,2,3,6−tetrahydropyridine(MPTP)and its Relevance to Parkinson’s Disease”,NEUROCHEM.INT.,1987,11,359−373。セロトニン輸送体(SERT)は更に、多数の神経学的プロセスと関連する。例えば、SERTは抑うつ状態及び薬物中毒と強く関連する。
【発明の概要】
【0005】
いくつかのクラスの化合物は、DATでのコカイン及びPCP結合部位を特徴づけるために開発されてきた。M.E.A.Reithら,前掲;F.I.Carrollら,“Cocaine Receptor:Biochemical Characterization and Structure−Activity Relationship of Cocaine Analogues at the Dopamine Transporter”,J.MED.CHEM.,1992,35,969−981;R.A.Milliusら,“Synthesis and Receptor Binding of N−substituted Tropane Derivatives”,“High Affinity Ligands For Cocaine Receptor”,J.MED.CHEM.,1991,34,1728−1731;I.Chaudieuら,“Role of the Aromatic Group in the Inhibition of Phencyclidine Binding and Dopamine Uptake by PCP Analogs”,PHARMACOL.BIOCHEM.BEHAV.,1989,32,699−705。コカインアナログの広範な構造活性相関(SAR)の研究が、DATに結合する強力かつ選択的なトロパン誘導体の開発となった。このクラスのいくつかの周知の化合物はCFT(Win35,428)及びRTI−55を含む。これらのトロパン誘導体及びコカインの構造の類似性は容易に明らかである。
【0006】

【0007】
更に最近の報告は、更により強力かつ選択的なトロパンについて述べている:P.C.Meltzerら,“Substituted 3−phenyltropane Analogs of Cocaine:Synthesis,Inhibition of Binding At Cocaine Recognition Sites,and Positron Emission Tomography Imaging”,J.MED.CHEM.,1993,36,855−862;F.I.Carrollら,“Cocaine and 3β−(4’−substituted phenyl)tropane−2β−carboxylic acid ester and amide analogues.New High−affinity and Selective Compounds for the Dopamine Transporter”,J.MED.CHEM.,1995,38,379−388。同様の方法で、PCPの修飾はより強力なアナログの開発に導いた:I.Chaudieuら,“Role of the Aromatic Group in the Inhibition of Phencyclidine Binding and Dopamine Uptake By PCP Analogs”,PHARMACOL.BIOCHEM.BEHAV.,1989,32,699−705;J.Vignonら,“[3H]N−[1−(2−Benzo(b)thienyl)cyclohexyl]piperidine([3H]BTCP):A New Phencyclidine Analog Selective for the Dopamine Uptake Complex”,EUR.J.PHARMACOL.,1988,148,427−436。
【0008】

【0009】
「GBR」クラスの化合物:P.Van der Zeeら,“Aryl 1,4−dialk(en)ylpiperazines as Selective and Very Potent Inhibitors of Dopamine Uptake”,EUR.J.MED.CHEM,1980,15,363−370;は、DATに対する選択性及び効能が著しく高いことで知られている。
【0010】

【0011】
これらの2つは、R=F及びR=Hであり、低ナノモルの範囲で高親和性を有する。P.H.Anderson,“Biochemical and Pharmacological Characterization of [3H]GBR12935 Binding in Vitro to Rat Striatal Membranes:Labeling of the Dopamine Uptake Complex”,J.NEUROCHEM.,1987,48,1887−1896;P.H.Anderson,“The Dopamine Uptake Inhibitor GBR12909:Selectivity and Molecular Mechanism of Action”,EUR.J.PHARMACOL.,1989,166,493−504。広範な構造/活性相関(SAR)の研究によって、DATに対する、非常に強力ないくつかの化合物が生成された。C.DeVriesら,“Heteroaromatic Analogs of 1−[2−(diphenylmethoxy)ethyl]− and 1−[2−[bis(4−fluorophenyl)methoxy]ethyl]−4−(3−phenylpropyl)piperazines(GBR12935 and GBR12909)as High−Affinity Dopamine Reuptake Inhibitors”,J.MED.CHEM.,1997,40,705−716;D.Mateckaら,“Development of Novel,Potent,and Selective Dopamine Reuptake Inhibitors Through Alteration of the Piperazine Ring of 1−[2−(diphenylmethoxy)ethyl]− and 1−[2−[Bis(4−fluorophenyl)methoxy]ethyl]−4−(3−phenylpropyl)piperazines(GBR12935 and GBR12909)”,J.MED.CHEM.,1996 39,4704−4716。これらの化合物の放射標識は神経薬理学的活性の解明を促進してきた。R=FであるGBRはDATから非常にゆっくりと解離し:R.B.Rothman,“Tight Binding Dopamine Reuptake Inhibitors as Cocaine Antagonists”,FEBS LETT.,1989,257.341−344、微小透析によって測定されるように、コカインによって誘発される、細胞外ドーパミンレベルの増加を減衰させる。R.B.Rothman,前掲;U.Sogaardら,“A Tolerance Study of Single and Multiple Dosing of the Selective Dopamine Uptake Inhibitor GBR12909 in Healthy Subjects”,INT.CLIN.PSYCHOPHARM.,1990,5,237−251。この化合物はヒトで非刺激性であり:J.R.Glowaら,“The Effects of GBR12909 on Responding of Rhesus Monkeys Maintained Under Schedules of Cocaine− and Food−Delivery”,NIDA.RES.MONOGR.,1994,141.12、アカゲザルでコカインの自己投与行動を遮断することを近頃示してきた。A.K.Duttaら,“Positional Importance of the Nitrogen Atom in Novel Piperidine Analogs of GBR12909:Affinity and Selectivity for the Dopamine Transporter”,MED.CHEM.RES.,1993,3,209−222。このような研究は、好適な化合物が常習性なくコカイン拮抗薬として作用しうる可能性を上昇させる。
【課題を解決するための手段】
【0012】
本発明はDAT、SERT、及び/又はNETに対して神経薬理学的活性を示すN−及びO−型の4−[2−ジアリールアミノ又はオキソアルキル]ピペリジンの誘導体に関する。このクラスの好適な化合物は、DATに対して低ナノモルの活性を、かつ、SERT及びNETと比較して、DATに対して差異の大きな結合活性を示す。
【図面の簡単な説明】
【0013】
【図1】図1は、一の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図2】図2は、更なる合成スキームと、本発明の化合物に特有の構造とを例示する。
【図3】図3は、更なる合成スキームと、本発明の化合物に特有の構造とを例示する。
【図4】図4は、更なる合成スキームと、本発明の化合物に特有の構造とを例示する。
【図5A】図5Aは、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図5B】図5Bは、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図6】図6は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図7】図7は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図8】図8は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図9】図9は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図10】図10は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図11】図11は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図12】図12は、別の合成スキームと、本発明の化合物に特有の構造とを例示する。
【図13】図13は、表6の表示に供する。
【図14】図14は、本発明の実施形態に適切な化合物の化学構造を提供する。
【図15】図15は、表7の表示に供する。
【図16】図16は、表8の表示に供する。
【図17】図17は、表9の表示に供する。
【発明を実施するための形態】
【0014】
本発明の化合物は、式

に対応し、Aは

であり、Bは

であり、Xは−NH−、−NR4−、−S−、及び−O−からなる群から選択され、R4はC1−4アルキル、NH2、C1−4ヒドロキシアルキル、ハロゲン化されたC1−4アルキル、C2−4アルケニル、C2−4ヒドロキシアルケニル、ハロゲン化されたC2−4アルケニル、C2−4アルキニル、及びハロゲン化されたC2−4アルキニルであり、
Yは−H、−NH2、−OH、=O、又は−O−C(O)−R5であり、
lは0、1、又は2、好ましくは0又は1、より好ましくは0であり、
nは1又は2、好ましくは2であり、
mは1、2、3、又は4、好ましくは1であり、
oは0、1、2、3、又は4、好ましくは0、1、又は2、最も好ましくは0又は1であり、
pは0、1、2、3、又は4、好ましくは0、1、又は2、最も好ましくは0又は1であり、
qは0、1、2、又は3、好ましくは0又は1であり、
R、R1、及びR2はH、F、Cl、Br、I、CN、COOEt、OH、NO2、NH2、OR5からなる群から選択され、R5はC1−8アルキル、C5−6シクロアルキル、又はC2−8アルケニルであるか、あるいは、R2は5又は6員環のヘテロ環、好適には、

からなる群から選択されるヘテロ環であり、R6はC1−4アルキル、あるいは置換型又は非置換型のフェニル又はナフチルであってもよく、ヒドロキシル基はエチレン炭素で置換されないと理解すべきであり、
−(CH2)m−の1又はそれ以上のCH2基は、CR7R’7によって選択的に置換され、
R7はH、−OR11、又は−NR11であり、
R’7はH、又は−C1−8アルキルであるか、あるいはR7R’7は=Oとして相互に結合され、
R11はH、C1−8アルキル、C2−8アルキレン、C6−18アルキルアリール、又は−COOR12であり、
R12はC1−8アルキル、C2−8アルキレン、又はC6−18アルキルアリールであり、あるいはその薬学的に許容可能な塩又は誘導体である。
【0015】
本発明の化合物は更に、式:

の化合物を含む。ここで、A、B、R、及びoは上述のように規定される。
【0016】
上式において、A及びBは、

であることが好ましい。ここでpは1又は2である。上式において、mが2又は3である場合、メチレン水素のうちの1つはOR7によって置換されてもよく、R7はアルキル、好ましくはC1−16アルキル、より好ましくはC1−4低級アルキル、又はC2−18アルキレン、又は

であり、R8はC1−18アルキル、又はC2−18アルキレンである。
【0017】
好適には、式(A)の化合物は、

に対応する。
【0018】
変形物において、本発明は、以下の条件に合致する場合に、構造式I又はその好適なサブセット内の化合物を含まない:
Aがフェニルであり、XがOであり、YがHであり、lが0であり、m=1であり、nが1である場合、
Bがフェニルである場合、R、R1、及びR2の総てがHではない;
Bがフェニルである場合、R及びR1は双方がFではない化合物;
Aがフェニルであり、XがOであり、YがHであり、lが0であり、m=1であり、n=zである場合、
R2及びR1が双方ともHでBがフェニルである場合、R2は、
qが1である場合にハロ、メトキシ、メチル、ニトロ、又はアミノではなく、
qが2である場合に3−クロロ−4−フルオロではなく;
R及びR1が4−フルオロである場合、Bは非置換型のフェニルではなく;
Rが4−ハロであり、Bがフェニルであり、qが1である場合、R2はFではない化合物;
Aがフェニルであり、XがOであり、YがHであり、lが0であり、nが2であり、mが2であり、Bが非置換型のフェニルである場合、
o及びpが双方とも1である場合、R及びR1は双方がハロではなく;
Aがフェニルであり、lが0であり、nが2であり、mが2である場合、R、R1、及びR2のうちの少なくとも1つがH以外である化合物;
Aがフェニルであり、Bがフェニルであり、XがOであり、YがHであり、lが0であり、mが2であり、lが2であり、qが0である場合、R及びR1が双方ともメチルではない化合物;
Aがフェニルであり、XがOであり、YがHであり、Bがフェニルであり、lが0であり、mが2であり、nが1である場合、
R、R1、及びR2がHであり;
rが0であり、o及びpが1である場合、R及びR1が双方とも4−フルオロではない化合物;
Aがフェニルであり、XがOであり、YがHであり、lが0であり、mが3であり、nが2である場合、
Bがフェニルであり、qが1であり、R2がHである場合、o及びpは双方とも0ではなく;
Bがフェニルである場合、o及びpは、R及びR1が双方とも4−ハロであるか、あるいは双方ともメトキシである場合に、双方とも1ではない化合物;
XがOであり、YがHであり、oが0であり、Aが非置換型のフェニルであり、lが0であり、mが3であり、nが2である場合、Bが4−フルオロフェニル、あるいは、環の3位で(CH2)mに結合される6員環のヘテロアリール環ではない化合物;
XがOであり、YがHであり、Aが非置換型のチオフェニルであり、lが0であり、mが3であり、nが2であり、YがHであり、Bが非置換型のフェニルである場合、oはRが4−フルオロである場合に、0以外であるが1ではない化合物;
XがOであり、YがHであり、Aが非置換型のチオフェニルであり、oが0であり、lがOであり、mが1であり、lが2である場合、Bはフェニル、3−ピリジル、又は4−(フルオロフェニル)ではない化合物;
XがOであり、YがHであり、Aが非置換型のフェニルであり、lが0であり、mが1であり、nが2である場合、Bは非置換型のチオフェニル、又は非置換型の2,3−ベンゾチオフェニルではない化合物;
XがNHであり、YがHであり、Aがフェニルであり、lが0であり、mが1であり、nが2である場合、
qが0であり、oが1であり、pが1である場合、R及びR1は双方とも4−フルオロではなく、
qが1であり、oが0であり、pが0である場合、Bは4−(フルオロフェニル)ではない化合物。
【0019】
本発明の化合物は更に、構造:

を有する化合物を含み、Aは前述のように規定され、COOCH3、=O、CH3、F、又はOHであってもよく、XはO、S、NH、NR9、又はN−であり、Zを有するNの残りの原子価は環構造を形成し、rは0ないし8、好ましくは0ないし4、より好ましくは0、1、又は2であり、ZはH又はC1−4アルキレン、好ましくはH又はC1−2アルキレンであり、アルキレン基が存在する場合で、XがN−である場合にXと環構造を形成し、Bは前に規定したとおり、あるいはH、CH3、−CH=CH2であり、R9は、

であり、R10はC6−20アルキルである。この構造の好適な化合物は、Aが置換型のフェニルであり、XがNHであり、ZがHであり、Bが置換型のフェニルである化合物と、XがN−であり、rが0であり、Zが−CH2CH2−、又は−CH2CH2CH2−である化合物とを含み、双方が窒素を含む6又は7員環を形成する。
【0020】
本発明の化合物は更に、構造:

を有する化合物を含み、総ての記号は異なることを明確に述べられない限り、上で説明したものと同一である。例えば、R、R2、X、Y、l、m、o、及びqは上に規定されたものである。wは1又はそれ以上のメチレン基の1又はそれ以上の水素原子がZ1によって置換されることを表わす数値である。Z1は−H、−NH2、−OH、=O、−O−アルキル(例えば、C1−8)、−O−アリール(例えば、C6−16)、又は−O−C(O)−R5である。上式において、ZはCH2基の少なくとも1の水素を置換すると理解すべきである。この変形物において、上に説明した条件は更に、この構造に適用可能である。特に有用な変形物は、式:

によって提供される。特に有用な変形物において、Z1はH又はOHである。
【0021】
上述の定義によって包含される構造式の例は、


であり、示されたR2基は1又はそれ以上のR2、好ましくは1又は2のR2基を示し、任意の環位置を占有してもよい。後方の2の化合物においては、XはNH又はOであることが好ましい。
【0022】
好適な化合物は、N−アリールアルキル部分の置換基が電気陰性及び電子吸引性の官能基である化合物である。特に、構造式:

を有する化合物は、ナノモル範囲で予想外の低活性、ならびにDAT及びSERTに対する結合親和性の差異によって示されるような高選択性を提供することを示してきた。前述の式において、各々の変形物は別個に規定されるとみなされる。X及びRないしR5に対する様々な置換基は、このような置換のうちのいずれか1つ又はそれ以上の排除に用いてもよい。
【0023】
更に好適なクラスの活性化合物は、Bが4−シアノ、4−ヨード、又は3,4−ジフルオロの官能基を有するフェニル基である構造式Iの化合物、特に構造式I又はその好適な亜種の一般式の範囲内にあり、構造:

に対応する化合物を含む。
【0024】
最も好適には、本発明の活性化合物は式:

の化合物に対応し、B1は4−シアノフェニル、3,4−ジフルオロフェニル、又は4−ヨードフェニルである。−(CH2)m−基を有する、上の更に一般的な構造の各々において、mが2又は3である場合、−(CH2)m−部分の炭素のうちのいずれかは上に規定したように、−OR7によって置換してもよい。
【0025】
好適な化合物の更なる例は、

を含み、R’’’はH、OH、NH2、OR9、又はNHR9であり、R9は、

であり、R10はC6−20アルキル、及び、

である。更に有用な化合物は式D−84、D−225、D−232、D−233、及びD−276:


によって提供される。
【0026】
式D−84、D−225、D−232、D−233、及びD−276を有する化合物は、図5A、5B、6、7、8、及び9に説明される合成スキームを介して生成する。
【0027】
本発明の更に別の変形物において、式:

を有する化合物が提供され、総ての記号は異なることを明確に述べられない限り、上で説明したものと同一である。特に、Aは、

であり、Bは、

であり、
lは0、1、又は2、好ましくは0又は1、より好ましくは0であり、
mは1又は2、好ましくは1であり、
oは0、1、2、3、又は4、好ましくは0、1、又は2、最も好ましくは0又は1であり、
pは0、1、2、3、又は4、好ましくは0、1、又は2、最も好ましくは0又は1であり、
qは0、1、2、又は3、好ましくは0又は1であり、
Z1は−H、−NH2、−OH、=O、−O−アルキル(例えば、C1−8)、−O−アリール(例えば、C6−16)、又は−O−C(O)−R5であり、
wは1又はそれ以上のメチレン基の1又はそれ以上の水素原子がZ1によって置換されることを表わす数値である。上式において、ZはCH2基の少なくとも1の水素を置換すると理解すべきである。R、R1、及びR2はH、F、Cl、Br、I、CN、COOEt、OH、NO2、NH2、OR5からなる群から選択され、R5はC1−8アルキル、C5−6シクロアルキル、又はC2−8アルケニルであるか、あるいは、R2は5又は6員環のヘテロ環、好適には、

からなる群から選択されるヘテロ環であり、R6はC1−4アルキル、あるいは置換型又は非置換型のフェニル又はナフチルであってもよく、ヒドロキシル基はエチレン炭素で置換されないと理解すべきであり、
−(CH2)m−の1又はそれ以上のCH2基は、CR7R’7によって選択的に置換され、
R7はH、−OR11、又は−NR11であり、
R’7はH、又は−C1−8アルキルであるか、あるいはR7R’7は=Oとして相互に結合され、
R11はH、C1−8アルキル、C2−8アルキレン、C6−18アルキルアリール、又は−COOR12であり、
R12はC1−8アルキル、C2−8アルキレン、又はC6−18アルキルアリールであり、R20及びR21はそれぞれ独立に、水素又はC1−10アルキルといった置換型又は非置換型の炭化水素基である。あるいはその薬学的に許容可能な塩又は誘導体である。変形物において、R20及びR21は、例えば式:

に記載のような環を形成するように結合され、uは1、2、又は3、好ましくは2である。本実施形態の更に特異的な化合物は、式:

によって表わされる化合物を含む。
【0028】
本実施形態の標的化合物の合成は、図10、11、及び12に示される。図10は標的4aないし4dの合成について記載する。既出の刊行物に記載のように、光学活性のシス型のアミンは、アミンをジアステレオマの中間体に変換し、その後に、所望の異性体を対応するアミンであるシス−(−)−3に分離及び加水分解することによって、ラセミ1から合成される(Kolhatkar,R.B.;Ghorai,S.K.;George,C;Reith,M.E.;Dutta,A.K. Interaction of cis−(6−benzhydrylpiperidin−3−yl)benzylamine analogues with monoamine transporters:structure−activity relationship study of structurally constrained 3,6−disubstituted piperidine analogues of (2,2−diphenylethyl)−[1−(4−fluorobenzyl)piperidine−4−ylmethyl]amine.J Med Chem 2003,46,2205−15)。光学活性のエポキシドを有する(−)−3の処理によって、良好な収量で最終的なヒドロキシ標的4aないし4dが得られた。光学活性のエポキシドは、公表されている手順によって合成された(Schaus,S.E.;Brandes,B.D.;Larrow,J.F.;Tokunaga,M.;Hansen,K.B.;Gould,A.E.;Furrow,M.E.;Jacobsen,E.N.Highly selective hydrolytic kinetic resolution of terminal epoxides catalyzed by chiral(salen)Co(III) complexes.Practical synthesis of enantioenriched terminal epoxides and 1,2−diols.J Am Chem Soc 2002,124,1307−15)。
【0029】
図11は標的7aないし7dの合成について記載する。光学活性のアミンである(−)−5は以下の既存の手順によって合成された(Kolhatkar,R.;Cook,C.D.;Ghorai,S.K.;Deschamps,J.;Beardsley,P.M.;Reith,M.E.;Dutta,A.K. Further structurally constrained analogues of cis−(6−benzhydrylpiperidin−3−yl)benzylamine with elucidation of bioactive conformation:discovery of 1,4−diazabicyclo[3.3.1]nonane derivatives and evaluation of their biological properties for the monoamine transporters.J Med Chem 2004,47,5101−13)。このアミンはラセミの2,3−エポキシプロピルベンゼンとともに処理され、2のジアステレオマ6a及び6bを生成し、カラムクロマトグラフィによって分離された。アミンのシス−(−)−5は更に、エタノール中で別々に、エナンチオマ(R及びS型の)2−フェニルオキシラン及び2−(4−フルオロフェニル)オキシランで処理されて、適度に良好な収量で標的化合物7aないし7dを提供した。
【0030】
図12は標的11a及び11bの合成について説明する。塩基性条件下における、アミンのシス−(−)−5の、3−クロロ−4’−フルオロプロピオフェノンでのN−アルキル化は、水素化ホウ素ナトリウムによって還元される符号8を生成して、R型及びS型のアルコール9の双方の混合物を生成した。アルコール9は次いで、ジアステレオマのカンファン酸エステルに変換され、半調製用HPLC(semi−preparative HPLC)プロセスによって分離された。最終的な標的11a及び11bは、エステルを加水分解した後に生成された。
【0031】
本発明の化合物の様々な幾何及び立体異性体は総て有用である。しかしながら、一部の幾何及び立体異性体は予想外の高活性又は差異のある活性を有する。後者の一例は2−ジフェニルメチル−5−(4−フルオロベンジルアミノ)ピペリジンのシス異性体及びトランス異性体によって表わされ、ラセミ体に調製される。シス異性体はDATに対し93.7のSERTの選択率を示す一方、トランス異性体は6.28の選択率を示した。個々の鏡像異性体は更に高い活性及び選択性を示すことが期待される。
【0032】
本発明について一般的に記載されてきたように、更なる理解が、特に明記されない限り、例示目的でのみ本明細書中に提供され、かつ、限定することを意図しない、特定の特異的な実施例によって得ることができる。
【0033】
標的化合物は、遊離塩基、あるいは例えば、塩酸塩、臭化水素酸塩、シュウ酸塩、酒石酸塩といった塩として調製される。化合物の特徴は、標準的な高磁場NMR、質量スペクトル、旋光度等を用いて得られる。化合物の純度は元素分析、TLC、又はHPLCによって測定される。98%より高い純度は、これらの化合物の生物学的分析に好適である。
【0034】
ラットのDATは[3H]Win35,428で標識され、ラットのSERTは[3H]シタロプラムで標識される。双方の結合アッセイは、M.E.A.Reithら,“Structural Requirements for Cocaine Congeners to Interact With Dopamine and Serotonin Uptake Sites in Mouse Brain and to Induced Stereotyped Behavior”,BIOCHEM.PHARMACOL.,1986,35,1123−1129、及び、A.K.Duttaら,“Structure−Activity Relationship Studies of Novel 4−[2−[Bis(4−fluorophenyl)methoxy]ethyl]−1−(3−phenylpropyl)piperidine Analogs:Synthesis and Biological Evaluation at the Dopamine and Serotonin Transporter Sites”,J.MED.CHEM.,1996,39,749−756に記載のように、オスの若成体期のスプラーグドーリーラットからの線条体組織を用いて同一条件下で実行された。簡単に言うと、ラットの線条体膜は、室温で30nMの最終Na+濃度、pH7.4のリン酸ナトリウムバッファ中で、氷上で2時間、放射性リガンド及び阻害剤とともにインキュベートされた。アッセイはガラス繊維のフィルタマット(メリーランド州ゲーサーズバーグのWallac社)を通した濾過によって終結し、MACH3−96 Tomtecハーベスタ(Wallac社)で0.05%(v/v)のポリエチレンイミンに予浸された。フィルタはMicrobeta Plus液体シンチレーションカウンタ(Wallac社)中で放射活性についてアッセイされた。
【0035】
[3H]ドーパミンのHEK−293−hDAT細胞への取り込みは、前述の一般的な技術によって懸濁された無傷細胞中で測定された。M.C.Ritzら,“Cocaine Inhibition of Ligand Binding at Dopamine,Norpinephrine and Serotonin Transporters:A Structure−Activity Study”,LIFE.SCI,1990,46,635−645;MJ.Kaufmanら,SYNAPSE,1991,9,43−49。簡単に言うと、細胞は上述と同一のトロポロン含有バッファで、室温で15分間、阻害剤とともにプレインキュベートされ、[3H]ドーパミンが添加され、インキュベーションは更に8分間継続した。アッセイの終結は低温バッファの添加と、Whatman GF/Cガラス繊維フィルタを通した急速濾過とからなり、Brandel 24ピンハーベスタ(メリーランド州ゲーサーズバーグのBrandel社)を用いて0.05%(w/v)のポリ−L−リジンに予浸された。フィルタ上の放射活性は液体シンチレーション計数(Beckman LS6000IC、カリフォルニア州フラートンのBeckman Instruments社)によって測定された。
【0036】
総ての化合物はジメチルスルホキシド(DMSO)に溶解され、10%(v/v)のDMSOに希釈された。後者のストックからの添加により、DMSOの最終濃度0.5%を得て、それ自体により、放射性リガンドの結合又は取り込みを妨げなかった。初期の距離測定実験後に、試験化合物の少なくとも5の濃度が調査され、IC50値前後に均等に分布された。後者は前述のように非線形計算機の曲線適合手順によって測定された。
【0037】
これらの化合物に対するDAT、SERT、及びNETの活性は、多数の手段において有用になりうる。例えば、放射性リガンド型のこれらの開示された化合物は、SPECT及びPETの造影研究用に、CNS中でのDAT用の造影剤としての適用を見出すであろう。このような造影はパーキンソン病を診断するのに有用となりうる。
【0038】
更に化合物は、新しい候補のCNS作用薬を試験する場合に、比較リガンド又は塩基リガンド用途の、DAT、SERT、及びNET用のリガンドとして作用しうる。しかしながら、最も重要なことには、本発明の化合物は低濃度での結合親和性によって示されるように、薬物中毒のようなCNS障害、特にコカイン及びPCPの投与の影響、場合によっては、合法及び違法の双方の、他の向精神薬の投与の影響を治療する場合に有用性がある。化合物は例えば、コカイン中毒を治療するのに用いてもよい。本発明の化合物は更に、本明細書中に記載のインビトロ研究に基づき、パーキンソン病及び他の関連する障害を罹患した患者への投与に対する有用性を示す。化合物は更に抗うつ剤として、及び上述に関連する他の神経障害を治療する場合に、有用性がある。
【0039】
従って、今日までに実行され、本明細書中に開示された研究は、哺乳類種、特にヒトでのCNS障害の治療にける、本発明で主張される化合物の使用を支持する。有効用量は治療中の特定の障害に依存して変化する。一般的に、投与は、脳組織及び/又は体液がDAT、SERT、又はNETへの測定可能な結合を引き起こす場合に存在する濃度の程度となる。この結合は、本発明の放射標識された化合物を用いるステップを具える従来技術によって、あるいは、他の放射標識されたリガンドを置換するように本発明の化合物を用いることによって評価できる。SPECT及びPETといった従来技術は結合を評価するのに用いてもよい。
【0040】
一般的に、血液又は血漿中の化合物の濃度は、本明細書中で測定されるように、各々の輸送体について約1%ないし約1000%のIC50濃度、より好適には5%ないし400%、更により好適には10%ないし200%の範囲にすべきである。
【0041】
投与は、例えば、好適な溶媒中に溶解、又は液体中に分散若しくは乳化される活性化合物を含む液体として、静脈内に、錠剤又はカプセル形状の固体として、注入される液体として非経口的に、あるいは経皮貼布によって経皮的に、といった薬学的に許容可能な形態にしてもよい。各々の製剤は通常の薬学的に許容可能な添加剤を含んでもよく、限定しないが、香味剤、臭気剤、錠剤化助剤(tabletting aid)、溶解度賦活剤(solubility enhancer)、透過性賦活剤(permeability enhancer)、界面活性剤、賦形剤等を含んでもよい。更に化合物は、薬学的に許容可能な塩の好適な塩形成剤と反応させてもよく、限定しないが酢酸塩、ギ酸塩、シュウ酸塩、酒石酸塩、塩酸塩、臭化水素酸塩、硫酸水素塩等を含んでもよい。
【0042】
経口投与の場合の推定される有用な用量は、体重1kgにつき0.01mgないし100mg、より好適には0.1mgないし50mg、更により好適には0.2mgないし30mgである。平均的な成体の全用量は5mgないし500mg、好適には10mgないし250mg、最も好適には10mgないし150mgの範囲であってもよい。実際の用量は従来の方法論によって簡単に定量できる。
【0043】
標的化合物は、遊離塩基、あるいは例えば、塩酸塩、臭化水素酸塩、又はシュウ酸塩といった塩として調製される。化合物の特徴は、標準的な高磁場NMR、質量スペクトル、旋光度等を用いて得られる。化合物の純度は元素分析、TLC、又はHPLCによって測定される。98%より高い純度は、これらの化合物の生物学的分析に好適である。いくつかの一般的な合成経路は本明細書中で用いられてきた。合成有機化学者に周知の他の合成方法は、本発明の化合物を調製するのに、あるいはこれらの化合物を誘導体化するのに用いてもよい。
【0044】
[I.中間体の合成]
《1−(メトキシカルボニル)−4−[(2−ジフェニルメトキシ)エチル]ピペリジン》
ベンゼン(60ml)中の、4−[2−(ジフェニルメトキシ)エチル]−1−(フェニルメチル)ピペリジン(4.62g、11.82mmol)及びクロロギ酸メチル(2.60g、23.53mmol)の溶液は6時間還流された。T.L.C.が反応の完了を示した後に、溶媒は減圧下で除去されて、粘稠液体の1−(メトキシカルボニル)−4−[(2−ジフェニルメトキシ)エチル]ピペリジン4.17g(99%の収率)を提供した。1H NMR(CD3Cl)δ7.34−7.18(10H、m、Ar−H)、5.30(1H、s、Ph2CHO)、3.67(3H、s、OCH3)、3.50−3.46(2H、t、J=6.0Hz、OCH2)、2.77−2.68(2H、t、J=12.3Hz、N(CH)2)、2.62−2.54(2H、t、J−12.0Hz、N(CH)2)、1.67−1.57(5H、m)、1.26−1.07(2H、m)。
【0045】
《4−[(2−ジフェニルメトキシ)エチル]ピペリジン》
1−(メトキシカルボニル)−4−[(2−ジフェニルメトキシ)エチル]ピペリジン(4.17g、11.81mmol)はエタノール(100ml)中に溶解され、KOH(2.5g)は溶液中に添加された。反応溶液は3日間還流された。溶媒は蒸発させ、EtOAcが添加された。EtOAc溶液は鹹水によって洗浄され、Na2SO4で乾燥させ、蒸発させて粗生成物を提供し、粗生成物はクロマトグラフィ(EtOAc/MeOH/Et3N=100/5/2)によって精製されて、白色固体の4−[(2−ジフェニルメトキシ)エチル]ピペリジン2.80g(80%の収率)を提供した。1H NMR(CD3Cl)δ7.35−7.19(10H、m、Ar−H)、5.31(1H、s、Ph2CHO)、3.50−3,46(2H、t、J=6.0Hz、OCH2)、3.08−3.04(2H、bd、J=2.3Hz、N(CH)2)、2.77−2.68(2H、t、J=12.6Hz)、2.62−2.54(2H、t、J=12.3Hz、N(CH)2)、1.82−1.57(5H、m)、1.14−1.02(2H、m)。分析:[C20H25NO・2.0H2O]、計算値:C 79.90;H 8.58;N 4.66、実測値:C 79.86;H 8.59;N 4.70。
【0046】
《N−ベンズヒドリルオキシフタルイミド》
DMF(50ml)中の、1−クロロ−1,1−ジフェニルメタン(3.42g、16.93mmol)、N−ヒドロキシフタルイミド(2.30g、14.11mmol)、及びEt3N(3.0ml)の溶液は、N2下で8時間、60℃で攪拌された。反応混合物が室温に冷却された後に、水(100ml)が添加された。混合物はEt2Oで抽出された。混合有機相はNa2SO4で乾燥させた。溶媒の蒸発後、粗生成物はクロマトグラフィ(ヘキサン/ベンゼン/EtOAc=20/10/3)によって精製されて、白色固体3.95g(85%の収率)を提供した。1H NMR(CD3Cl)δ7.72−7.63(1H、m)、7.56−7.53(1H、m)、7.40−7.24(12H、m)、5.85(1H、s、Ph2CH)。
【0047】
《O−ベンズヒドリルヒドロキシルアミン》
N−ベンズヒドリルオキシフタルイミド(1.03g、3.14mmol)はEtOH(20ml)に溶解された。NH2NH2(0.3ml)はEtOH溶液に添加された。反応混合物が0.5時間室温で攪拌された後、EtOHは減圧下で除去され、EtOAc(60ml)が添加された。混合物は濾過された。溶液は収集され、Na2SO4で乾燥させた。溶媒の蒸発後、粗生成物はクロマトグラフィ(ヘキサン/EtOAc=5/1)によって調製されて、粘性油0.31g(50%の収率)を提供した。1H NMR(CD3Cl)δ7.34−7.26(10H、m、AR−H)、5.65(1H、s、Ph2CH)。
【0048】
《1−[(4−フルオロフェニル)メチル]−4−ピペリジンメタノール》
乾燥THF(50ml)は、氷浴中のN2下の水素化アルミニウムリチウム(0.7g)に液滴添加された。乾燥THF(10ml)中の1−[(4−フルオロフェニル)メチル]−4−(エトキシカルボニル)ピペリジン(1.21g、4.57mmol)はLAH懸濁溶液に液滴添加された。反応混合物は2時間還流された。飽和NaOH/H2O(3ml)は液滴添加され、反応は氷浴によって冷却した。混合物は濾過された。溶液はNa2SO4で乾燥させ、0.98g(98%の収率)の符号11を生成するように蒸発させた。1H NMR(CD3Cl)δ7.36−7.26(2H、m、Ar−H)、7.07−6.96(2H、m、Ar−H)、4.66(1H、s、OH)、3.50−3.48(2H、d、J=6.0Hz、CH2OH)、3.46(2H、s、F−PhCH2)、2.90−2.87(2H、bd、J=11.1Hz、N(CH)2)、1.99−1.91(2H、dt、J=1.8、11.8Hz、N(CH)2)、1.73−1.68(3H、m)、1.34−1.22(2H、m)。
【0049】
《1−[(4−フルオロフェニル)メチル]−4−ピペリジンカルボアルデヒド》
CH2Cl2(20ml)中の、オキシリルクロリド(oxylyl chloride:0.59ml、3.95mmol)の溶液は−78℃に冷却された。DMSO(0.95ml、13.38mmol)は、オキシリルクロリド溶液に液滴添加された。反応混合物は5分間攪拌され、CH2Cl2(20ml)中の1−[(4−フルオロフェニル)メチル]−4−ピペリジンメタノール(0.99g、4.46mmol)は反応溶液に液滴添加された。攪拌は更に20分間継続された。Et3N8.0mlが添加され、反応混合物は10分間攪拌され、その後室温に温められた。水(50ml)が添加され、混合物はCH2Cl2で抽出された。混合したCH2Cl2溶液はNa2SO4で乾燥させた。溶媒の蒸発によって油0.77g(79%の収率)が提供された。1H NMR(CD3Cl)δ9.65(1H、s、CHO)、7.30−7.24(2H、m、Ar−H)、7.00−6.97(2H、m、Ar−H)、3.46(2H、s、p−FPhCH2)、2.81−2.76(2H、m、N(CH)2)、2.30−2.20(1H、m、CHCHO)、2.14−2.06(2H、dt、J=2.1、11.3Hz、N(CH)2)、1.92−1.86(2H、dd、J=3.5、13.5Hz)、1.74−1.62(2H、m)。
【0050】
《4−[(2−ジフェニルエチル)アミノカルボニル]−1−[(4−フルオロフェニル)メチル]ピペリジン》
1−[(4−フルオロフェニル)メチル]−4−(エトキシカルボニル)ピペリジン(0.68g、2.72mmol)はカルボン酸に変換され、次いで、2,2−ジフェニルエチルアミン(0.67g、3.40mmol)、EDCI(0.76g、3.95mmol)、及びHOBT(0.62g、4.59mmol)と反応させて、4−[(2−ジフェニルエチル)アミノカルボニル]−1−[(4−フルオロフェニル)メチル]ピペリジン0.84g(75%の収率)を生成した(手順D)。1H NMR(CD3Cl)δ7.36−7.20(12H、m、Ar−H)、7.01−6.95(2H、m、Ar−H)、5.39(1H、bs、NH)、4.21−4.15(1H、t、J=7.8Hz、Ph2CH)、3.91−3.86(2H、t、J=7.5Hz、CH2NH)、3.41(2H、s、p−FPhCH2)、2.84−2.80(2H、d、J=11.4Hz、N(CH)2)、1.96−1.87(3H、m、NHCOCH、NH(CH)2)、1.65−1.58(4H、m)。
【0051】
《4−[(ビス(4−フルオロフェニル)エチルアミノ)カルボニル−1−(フェニルエチル)ピペリジン》
1−(フェニルエチル)−4−(エトキシカルボニル)ピペリジン(0.25g、0.95mmol)はカルボン酸に変換され、次いで、Et3N(1.5ml)及びCH2Cl2(20ml)中のビス(4−フルオロフェニル)メチルアミン(0.25g、1.14mmol)、EDCI(0.25g、1.27mmol)、HOBT(0.20g、1.48mmol)と反応させて、4−[(ビス(4−フルオロフェニル)エチルアミノ)カルボニル−1−(フェニルエチル)ピペリジン0.32g(74%の収率)を生成した(手順E)。1H NMR(CD3Cl)δ7.29−7.03(10H、m、Ar−H)、7.05−6.99(3H、m、Ar−H)、6.22−6.20(1H、d、J=7.8Hz)、p−FPh2CH)、6.00−5.97(1H、d、J=7.5Hz、NH)、3.08−3.04(2H、bd、J=11.4Hz、N(CH)2)、2.83−2.78(2H、d)、2.62−2.57(2H、m)、2.25−2.15(1H、m、NCOCH)、2.10−2.03(2H、t、J=11.4Hz、N(CH)2)、1.96−1.81(4H、m)。
【0052】
《4−[(1−フェニルエチル)アミノカルボニル]メチル−1−[(4−フルオロフェニル)メチル]ピペリジン》
1−[(4−フルオロフェニル)メチル]−4−[(エトキシカルボニル)メチル]ピペリジン(0.55g、1.97mmol)は、CF3CO2H/HCl/H2O(1:1:1)10mlに還流されて、対応する酸を提供し、次いで、CH2Cl2(10ml)中の1−フェニルエチルアミン(0.29g、2.40mmol)、EDCI(0.56g、2.97mmol)、及びHOBT(0.40g、2.96mmol)と反応させて、固体0.33g(50%の収率)を生成した(手順D)。1H NMR(CD3Cl)δ7.35−7.23(7H、m、Ar−H)、7.00−6.94(2H、t、J=8.4Hz、Ar−H)、5.83−5.80(1H、bd、J=7.5Hz、NH)、5.15−5.10(m、1H、PhCHMe)、3.42(s、2H、p−PhCH2N)、2.83−2.78(m、2H、N(CH)2)、2.07−2.05(2H、d、J=7.2Hz、CH2CO)、1.99−1.89(2H、m)、1.86−1.78(1H、m)、1.71−1.61(2H、t、J=15Hz)、1.48−1.45(3H、d、J=6.9Hz、Me)、1.33−1.21(2H、m)。
【0053】
《2−(ジフェニルシアノメチル)−5−ニトロピリジンの合成》
3mLのトルエン中の、1.0gの2−クロロ−5−ニトロピリジン(6.3mmol)、1.33gのジフェニルアセトニトリル(6.9mmol、1.1当量)及び700mgのフッ化テトラブチルアンモニウム(3.15mmol、0.5当量)の混合物に対し、1.5mLの50%のNaOH水溶液が液滴添加された。30分後、TLC(ヘキサン/EtOAc)は出発物質を残さなかった。混合物はタールを除去するために、シリカのショートプラグを通して濾過され、蒸発させ、色相分析された(SiO2;ヘキサン/EtOAc)。粗生成物はMeOHから再結晶化されたわずかに黄色い油であり、融点94ないし99℃の呈色のないプレートとして表題の化合物(1.7g、86%)を提供した。1H NMR(CDCl3:300MHz)7.20−7.29(5H、m)、7.35−7.42(5H、m)、7.54(1H、d、J=8.7Hz、H−3)、8.49(1H、dd、J=3及び9Hz、H−4)、9.60(1H、d、J=2.4Hz、H−6)。13C NMR(CDCl3;300MHz)60.19、121.65、123.77、128.87、129.09、129.33、132.52、138.46、143.49、145.31、164.99。元素分析はC19H13N3O2について計算された:C 72.38;H 4.13;N 13.33。実測値:C 72.35;H 4.08;N 13.25。
【0054】
《2−(ジフェニルアセトアミドメチル)−5−ニトロピリジンの合成》
5.0gの2−(ジフェニルシアノメチル)−5−ニトロピリジン(15.8mmol)の混合物は、10mLのH2Oで希釈された、40mLの濃H2SO4の磁気攪拌された室温溶液に添加された。混合物は次いで、総ての出発物質がTLC(〜2時間)によって消費されるまで、90℃に加熱された。濃い溶液は更に、粉砕した氷及び水に注入され、1時間攪拌され、表題の未精製の化合物が沈殿する。混合物はEtOAcで三回抽出され、貯蔵され、乾燥させ(MgSO4、セライトのショートプラグを通した濾過を伴う)、蒸発させた。乾式カラムクロマトグラフィ(シリカ;ヘキサン/EtOAc/MeOH)は、融点160ないし164℃の非結晶型の黄褐色の固体として、表題の化合物(4.74g、90%)を提供した。1H NMR(CDCl3;300MHz)5.9(1H、bs、NH)、7.05−7.1(4H、m、ArH)、7.26(1H、d、J=2.4及び6.3Hz、H−4)、9.43(1H、d、J=1.8Hz、H−6)。13C NMR(CDCl3;400MHz)126.78、128.02、128.64、130.25、131.68、142.09、143.43、169.44、173.99。元素分析はC19H15N3O3について計算された:C 68.47;H 4.50;N 12.61。実測値:C 68.49;H 4.55;N 12.60。
【0055】
《ジフェニル−(5−アミノ−2−ピリジル)アセトアミドの合成》
50%のEtOH/氷AcOH中の8.86gのジフェニル−(5−ニトロ−2−ピリジル)アセトアミド(26.5mmol)の、100mgの酸化白金(IV)との混合物は、Parr社の水素化装置(Parr hydrogenator:30psi H2)で3時間振盪された。混合物はセライト層を通して濾過され、エタノールは減圧下で蒸発させた。混合物は次いでK2CO3で塩基性にされ、EtOAc(4倍)で抽出され、乾燥させ(MgSO4)、再度セライトを通して濾過され、蒸発させた。残りの固体はヘキサン/EtOAc/MeOHから再結晶化させて、黄褐色結晶としての表題の化合物(7.9g、98%)を提供した。融点は215ないし220℃であった。1H NMR(CDCl3;300MHz)δ3.85(2H、bs、NH)、5.88(1H、bs、CONH)、6.54(1H、d、J=8.4Hz)、6.84(1H、dd、J=3及び8.7Hz)、7.01−7.06(4H、m)、7.24−7.32(6H、m)、8.11(1H、d、J=2.4Hz、H−6)、9.57(1H、bs、CONH)。元素分析はC19H17N3O・0.25H2Oについて計算された:C 74.15;H 5.69;N 13.67。実測値:C 74.06;N 5.69;H 13.78。
【0056】
《2−ジフェニルメチル−5−アミノピリジンの合成》
N2雰囲気下で5.28gのジフェニルメチル−(5−アミノ−2−ピリジル)アセトアミド(17.4mmol)と150mLの37%HClとの混合物は、総ての出発物質がTLC(〜18時間)によって消費されるまで還流された。混合物は次いで300gの氷及びH2Oで冷却及び注入され、K2CO3で塩基性にされた。混合物はEtOAc(150mL)で3回抽出され、乾燥させ(MgSO4)、凝固したグリーンオイルに蒸発させた。これは色相分析され(SiO2;ヘキサン/EtOAc)、融点130ないし134℃の黄褐色結晶性固体としての表題の化合物(4.09g、90%)を得た。1H NMR(CDCl3;300MHz)δ3.52(2H、bs、NH)、5.61(1H、s、CH(C6H5)2)、6.83−6.91(2H、m、ArH)、7.15−7.32(10H、m、ArH)、8.08(1H、d、J=2.4Hz、H−6)。13C NMR(CDCl3;300MHz)58.61、122.38、123.98、126.55、128.57、129.56、137.31、140.77、143.64、153.39。元素分析はC18H16N2について計算された:C 83.08;H 6.15;N 10.77。実測値:C 82.82;H 6.30;N 10.81。
【0057】
《ラセミのシス−及びトランス−2−ジフェニルメチル−5−アミノピペリジンの合成》
454mgの2−ジフェニルメチル−5−アミノピリジンの二塩化水素化物の塩(3.83mmol)と20mLのMeOHの溶液に、50mgの酸化白金(IV)が添加され、混合物はH2雰囲気(60psi)下で10時間、室温で振盪された。混合物は次いでセライトを通して濾過され、MeOHは蒸発させた。残りの残留物は飽和K2CO3で希釈され、CH2Cl2(5倍)で抽出された。抽出物は貯蔵され、乾燥させ(MgSO4)、無色油に蒸発させた。油は色相分析され(SiO2;CH2Cl2/MeOH/トリエチルアミン)、無色油として300mg(82%)の表題の化合物を得た。油はEtO2の添加で凝固された。ジアステレオマのこの混合物のサンプルはPTLC(SiO2;ヘキサン/EtOAc/MeOH)によって分離された。第1の溶出:ラセミのシス−2−ジフェニルメチル−5−アミノピペリジン;1H NMR(CDCl3;400MHz)δ1.35−1.45(2H、m、H−3)、1.55−1.65(2H、m、H−4)、2.08(3H、bs、NH)、2.77−2.82(2H、s、H−6)3.0(1H、m、Σ3J=13Hz、H−5eq)、3.25(1H、dt、3J=4.0及び8.8Hz、H−2ax)、3.81(1H、d、3J=10.4Hz、CH(C6H5)2)、7.1−7.4(10H、m、ArH)。第2の溶出:ラセミのトランス−2−ジフェニルメチル−5−アミノピペリジン;1H NMR(CDCl3;400MHz)δ1.1−1.25(2H、m、H−3ax、H−4ax)、1.55−1.6(1H、m、H−3eq)、1.9−1.96(1H、m、H−4eq)、2.13(3H、bs、NH)、2.35(1H、t、2J及び3J=10.8Hz、H−6ax)、2.85(1H、m、Σ3J=38Hz、H−5ax)、3.11(1H、d、2J=9.2Hz、H−6eq)、3.19(1H、t、3J=10.8Hz、H−2ax)、3.69(1H、d、3J=10Hz、CH(C6H5)2)、7.15−7.4(10H、m、ArH)。表題の化合物の精製され、分離されない混合物の1H NMR(CDCl3;400MHz)は、複合化により60のシス型:40のトランス型の比率を示した(CH(C6H5)2)。
【実施例1】
【0058】
[II.図1ないし4の実施例]
《4−[2−(ジフェニルメトキシ)エチル]−1−[(3−フルオロフェニル)メチル]ピペリジン》
DMF(10ml)中の、4−[(2−ジフェニルメトキシ)エチル]ピペリジン4(58mg、0.19mmol)、3−フルオロベンジルクロリド(51mg、0.35mmol)、Et3N(0.5ml)、及び無水K2CO3の混合物は、65℃で一晩攪拌された。反応混合物は30mlの水で希釈され、Et2Oで抽出された。混合有機相はNa2SO4で乾燥させ、蒸発させて粗生成物を提供し、粗生成物はクロマトグラフィ(EtOAc/ヘキサン=1/3)によって精製されて、4−[2−(ジフェニルメトキシエチル]−1−[(3−フルオロフェニル)メチル]ピペリジンの粘稠液体62mg(79%の収率)を提供した(手順A)。1H NMR(CD3Cl)δ7.34−7.20(10H、m、2Ph)、7.11−7.03(3H、m、m−FPh)、6.95(1H、m、m−FPh)、5.31(1H、s、Ph2CH)、3.45−3.44(2H、t、J=6.6Hz、OCH2)、3.44(2H、s、m−FPhCH2)、2.84−2.80(2H、bd、J=11.1Hz、N(CH)2)、1.97−1.89(2H、t、J=11.4Hz、N(CH)2)、1.63−1.51(4H、m)、1.49−1.44(1H、m)、1.29−1.21(2H、m)。遊離塩基は融点=150ないし151℃のシュウ酸塩に変換された。分析:[C27H30NOF・(COOH)2・0.3H2O]、計算値:C 69.79;H 6.58;N 2.80、実測値:C 69.87;H 6.80;N 2.76。
【実施例2】
【0059】
《4−[2−(ジフェニルメトキシ)エチル]−1−[(3,4−ジフルオロフェニル)メチル]ピペリジン》
4−[(2−ジフェニルメトキシ)エチル]ピペリジン4(0.12g、0.42mmol)は乾燥DMF(10ml)中で(3,4−ジフルオロ)ベンジルブロミド(bromode)(0.17g、0.82mmol)、Et3N(0.5ml)、及びK2CO3(0.6g)と反応させて、粘稠液体として4−[2−(ジフェニルメトキシ)エチル]−1−[(3,4−ジフルオロフェニル)メチル]ピペリジン0.15g(86%の収率)を提供した(手順A)。1H NMR(CD3Cl)δ7.34−6.99(13H、m、Ar−H)、5.31(1H、s、Ph2CH)、3.49−3.45(2H、t、J=6.3Hz、OCH2)、3.85(s、2H、NCH2Ph)、2.80−2.77(2H、d、J=11.4Hz、N(CH)2)、1.95−1.87(2H、t、J=11.4Hz、N(CH)2)、1.63−1.55(4H、m)、1.50−1.42(1H、m)、1.28−1.15(2H、m)。遊離塩基は融点=158ないし159℃のシュウ酸塩に変換された。分析:[C27H29NOF2・(COOH)2]、計算値:C 68.07;H 6.11;N 2.73、実測値:C 68.18;H 6.13;N 2.73。
【実施例3】
【0060】
《4−[2−(ジフェニルメトキシ)エチル]−1−[((4−トリフルオロメチル)フェニル)メチル]ピペリジン》
4−[(2−ジフェニルメトキシ)エチル]ピペリジン4(0.11g、0.37mmol)は、DMF(10ml)中で(4−トリフルオロメチル)ベンジルクロリド(0.14g、0.72mmol)、Et3N(0.5ml)、及びK2CO3(0.5g)と反応させて、粘稠液体として4−[(ジフェニルメトキシ)エチル]−1−[((4−トリフルオロメチル)フェニル)メチル]ピペリジン0.15g(92%の収率)を提供した(手順A)。1H NMR(CD3Cl)δ7.64−7.47(4H、m、CF3Ph)、7.34−7.23(10H、m、2Ph)、5.31(s、Ph2CH)、3.52(2H、s、p−FPhCH2)、3.49−3.45(2H、t、J=6.3Hz、OCH2)、2.84−2.80(2H、d、J=11.1Hz、N(CH)2)、2.00−1.92(2H、t、J−11.1Hz、N(CH)2)、1.63−1.55(4H、m)、1.49−1.42(1H、m)、1.27−1.15(2H、m)。遊離塩基は融点=149ないし150℃のシュウ酸塩に変換された。分析:[C27H30NOF3・(COOH)2・0.70H2O]、計算値:C 64.77;H 6.05;N 2.51、実測値:C 65.15;H 6.46;N 2.40。
【実施例4】
【0061】
《4−[2−(ジフェニルメトキシ)エチル]−1−[(4−シアノフェニル)メチル]ピペリジン》
4−[(2−ジフェニルメトキシ)エチル]ピペリジン4(0.15g、0.52mmol)は、DMF10ml中で4−シアノベンジルブロミド(0.18g、0.92mmol)、Et3N(0.5ml)、及びK2CO3(0.7g)と反応させて、白色固体として4−[2−(ジフェニルメトキシ)エチル−1−[(4−シアノフェニル)メチル]ピペリジン0.17g(84%の収率)を提供した(手順A)。1H NMR(CD3Cl)δ7.61=7.58(2H、d、J=7.5Hz、Ar−H)、7.45−7.42(2H、d、J=7.5Hz、Ar−H)、7.33−7.22(10H、m、Ar−H)、5.31(1H、s、Ph2CHO)、351(2H、s、P−CNPhCH2)、3.50−3.46(2H、t、J=6.0Hz、OCH2CH2)、2.81−2.77(2H、bd、J=10.8Hz、N(CH)2)、2.00−1.93(2H、t、J=11.1Hz、N(CH)2)、1.65−1.56(4H、m)、1.52−1.46(1H、m、OCH2CH2CH)、1.30−1.18(2H、m)。遊離塩基は融点=120ないし121℃のシュウ酸塩に変換された。分析:[C28H30N2O)・(CO2H)2・0.26H2O]、計算値:C 71.32;H 6.48;N 5.54、実測値:C 71.32;H 6.69;N 5.39。
【実施例5】
【0062】
《4−[2−(ジフェニルメトキシ)エチル]−1−[(フェニルメチル)カルボニル]ピペリジン》
Et3N(1ml)及び乾燥CH2Cl2(10ml)中で、フェニル酢酸(0.11g、0.82mmol)、1−[3−(ジメチルアミノ)プロピル]−3−エチルカルボジイミドヒドロクロリド(EDCI)(0.17g、0.88mmol)、及び1−ヒドロキシベンゾトリアゾール(HOBT)(0.11g、0.88mmol)の溶液が1時間室温で攪拌された。CH2Cl2(5ml)中で4−[(2−ジフェニルメトキシ)エチル]ピペリジン4(0.12g、0.41mmol)が添加された。溶液は室温で一晩攪拌された。溶媒は減圧中で除去され、残留物はEtOAcに溶解された。有機相は5%のクエン酸水溶液、その後飽和NaHCO3溶液で洗浄され、Na2SO4で乾燥させた。有機抽出物は蒸発させて粗生成物を提供し、粗生成物はクロマトグラフィ(EtOAc/ヘキサン=1/3)によって精製されて、粘稠液体である4−[2−(ジフェニルメトキシ)エチル]−1−[(フェニルメチル)カルボニル]ピペリジン(5e)0.27g(96%の収率)を収集した(手順B)。1H NMR(CD3Cl)δ7.32−7.25(15H、m、Ar−H)、5.29(1H、s、Ph2CHO)、4.62−4.58(1H、d、J=12.6Hz、NCH)、3.84−3.79(1H、d、J=13.2Hz、NCH)、3.72(2H、s、PhCH2)、3.47−3.43(2H、t、J=6.2Hz、OCH2)、2.96−2.88(1H、t、J=12.6Hz、NCH)、2.58−2.50(1H、t、J=12.3Hz、NCH)、1.68−1.52(3H、m)、1.27−1.19(2H、m)、1.10−1.03(1H、m)、0.89−0.081(1H、m)。分析:[C28H31O2N・0.12H2O]、計算値:C 80.90;H 7.51;N 3.37、実測値:C 80.87;H 7.50;N 3.27。
【実施例6】
【0063】
《4−[2−(ジフェニルメトキシ)エチル]−1−[((4−メチルスルホニルアミノ)フェニル)メチル]ピペリジン》
4−[(2−ジフェニルメトキシ)エチル]−1−[((4−アミノ)フェニル)メチル]ピペリジン(0.11g、0.29mmol)はCH2Cl2(5ml)に溶解させた。CH3SO2Cl(0.04g)及びEt3N(0.1ml)が添加された。反応混合物は室温で一晩攪拌された。溶媒は蒸発させ、EtOAc60mlが添加された。有機相は飽和NaHCO3/H2O及び鹹水によって洗浄され、Na2SO4で乾燥させた。蒸発後、粗生成物がクロマトグラフィ(EtOAc/MeOH=100/1)によって精製されて、純粋化合物である、4−[(2−ジフェニルメトキシ)エチル]−1−[((4−メチルスルホニルアミノ)フェニル)メチル]ピペリジン26mg(20%の収率)を提供した。1H NMR(CD3Cl)δ7.41−7.14(14H、m、Ar−H)、5.31(1H、s、Ph2CHO)、3.49−3.34(4H、m、OCH2CH2、NCH2Ph)、3.40(1H、s、NH)、2.98(3H、s、CH3SO2)、2.85−2.81(2H、bd、J=10.8Hz、N(CH)2)、1.97−1.90(2H、t、J=10.8Hz、N(CH)2)、1.64−1.51(4H、m)、1.50−1.45(1H、m、O(CH2)2CH)、1.28−1.17(2H、m)。遊離塩基は融点=122ないし124℃のシュウ酸塩に変換された。分析:[C28H34N2O3S・(COOH)・1.15H2O]、計算値:C 61.14;H 6.55;N 4.75、実測値:C 61.14;H 6.42;N 4.71。
【実施例7】
【0064】
《4−[((2−ジフェニルメトキシ)アミノ)メチル]−1−[(4−フルオロフェニル)メチル]ピペリジン》
ClCH2CH2Cl(20ml)中の、O−ベンズヒドリルヒドロキシルアミン9(0.25g、1.27mmol)及びアルデヒドの1−[(4−フルオロフェニル)メチル]−4−ピペリジンカルボアルデヒド(0.28g、1.27mmol)の溶液に、Na(OAc)3BH(0.54g、2.55mmol)が添加された。反応混合物は室温で一晩攪拌された。EtOAc80mlが添加され、溶液は飽和NaHCO3/H2O及び鹹水によって洗浄された。有機相はNa2SO4で乾燥させ、蒸発させて粗生成物を提供し、粗生成物はクロマトグラフィ(EtOAc/ヘキサン=1/2)によって精製されて、無色油0.43g(84%の収率)を提供した。1H NMR(CD3Cl)δ7.36−7.23(12H、m、Ar−H)、7.01−6.95(2H、t、J=7.4Hz、Ar−H)、3.41(2H、s、p−F−PhCH2)、2.82−2.78(2H、bd、J=11.1Hz、N(CH)2)、2.25−2.21(1H、m、NH)、2.00−1.93(2H、t、J=10.8Hz、N(CH)2)、1.71−1.47(7H、m)。遊離塩基は融点=154ないし155℃のシュウ酸塩に変換された。分析:[C26H29FN2O・(COOH)・0.10H2O]、計算値:C 67.88;H 6.32;N 5.65、実測値:C 67.62;H 5.90;N 5.51。
【実施例8】
【0065】
《4−[2−((ジフェニルメチル)アミノ)エチル]−1−[(3,4−ジフルオロフェニル)メチル]ピペリジン》
乾燥THF20ml中の、4−[2−ジフェニルメチル)アミノカルボニル]メチル−1−[(3,4−ジフルオロフェニル)メチル]ピペリジン(0.12g、0.28mmol)の溶液に、1MのBH3/THF(1.0ml)が添加された。反応溶液は6時間還流された。溶液が室温まで冷却された後に、MeOH(5ml)がゆっくりと添加された。溶媒は減圧下で除去された。10%のHCl/MeOH(10ml)が残留物に添加され、溶液は1時間還流された。固体のNaHCO3は、MeOHが蒸発された後に添加させた。混合物はEtOAcで抽出された。混合有機相はNa2SO4で乾燥させ、蒸発させて粗生成物を提供し、クロマトグラフィ(ヘキサン/EtOAc/Et3N=1/2/1%)によって、白色固体0.11g(90%の収率)に精製された(手順E)。1H NMR(CD3Cl)δ7.39−6.99(13H、m、Ar−H)、4.79(1H、s、Ph2CH)、3.39(2H、s、F2PhCH2)、2.80−2.76(2H、d、J=11.1Hz、N(CH)2)、2.60−2.55(2H、t、J=7.0Hz、NCH2)、1.93−1.86(2H、t、J=11.1Hz、N(CH)2)、1.62−1.58(2H、d、J=12Hz)、1.49−1.42(2H、q、J=6.3Hz、NCH2CH2)、1.35−1.31(1H、m、NCH2CH2CH(CH2)2)、1.26−1.19(2H、t、J=12.0Hz)。遊離塩基は融点=280ないし281℃のHCl塩に変換された。分析:(C27H30N2F2・2HCl・0.25H2O)、計算値:C 65.12;H 6.85;N 5.62、実測値:C 65.13;H 6.80;N 5.28。
【実施例9】
【0066】
《4−[2−((ジフェニルメチル)アミノ)エチル]−1−(フェニルメチルピペリジン》
化合物4−[2−(ジフェニルメチル)アミノカルボニル)メチル−1−(フェニルメチル)ピペリジン(0.54g、1.31mmol)はTHF(10ml)中で1MのBH3/THF(5.0ml)と反応させて、4−[2−(ジフェニルメチル)アミノ]エチル−1−(フェニルメチルピペリジン0.44g(84%の収率)を生成した(手順E)。1H NMR(CD3Cl)δ7.39−7.19(15H、m、Ar−H)、4.79(1H、s、PhCH)、3.47(2H、s、PhCH2)、2.86−2.82(2H、d、J=11.1Hz、N(CH)2)、2.59−2.55(2H、t、J=7.2Hz、NCH2)、1.94−1.87(2H、t、J=11.1Hz、N(CH)2)、1.61−1.58(2H、m)、1.48−1.42(2H、m)、1.34−1.20(3H、m)。遊離塩基は融点−172ないし174℃のHCl塩に変換された。分析:(C27H32N2・2HCl・106H2O)、計算値:C 68.05;H 7.64;N 5.88、実測値:C 68.06;H 7.82;N 5.90。
【実施例10】
【0067】
《4−[2−((ジフェニルメチル)−N−メチルアミノ)エチル]−1−(4−フェニルメチル)ピペリジン》
4−[(2−ジフェニルエチル)アミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン(0.23g、0.59mmol)、ホルムアルデヒド(1.0g、37%/H2O)、及びギ酸(2.0g、88%/H2O)の溶液は3時間還流された。反応溶液が室温まで冷却された後、溶媒は減圧下で除去された。粗生成物はクロマトグラフィ(EtOAc/ヘキサン=l/2)によって精製されて、白色固体0.17g(71%の収率)を提供した。1H NMR(CD3Cl)δ7.40−7.16(12H、m、Ar−H)、7.05−6.95(2H、t、J=7.4Hz、Ar−H)、4.31(1H、s、Ph2CHN)、3.41(2H、s、p−FPhCH2N)、2.80−2.76(2H、d、J=11.8Hz、N(CH)2)、2.36−2.30(2H、t、J=7.5Hz、NCH2)、2.11(3H、s、NCH3)、1.91−1.83(2H、t、J=11.4Hz、N(CH)2)、1.54−1.50(2H、d、J=11.4Hz)、1.47−1.40(3H、m、NCH2CH2CH)、1.32−1.10(2H、m)。遊離塩基は融点=260ないし261℃のHCl塩に変換された。分析:[C28H33N2F・2HCl・0.50H2O]]、計算値:C 67.46;H 7.29;N 5.61、実測値:C 67.33;H 7.19;N 5.56。
【実施例11】
【0068】
《4−[[2−(ジフェニル)エチル]アミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン》
化合物4−[(2−ジフェニルエチル)アミノカルボニル]−1−[(4−フルオロフェニル)メチル]ピペリジン(0.32g、13mmol)はTHF(20ml)中で1MのBH3/THF(4.0ml)と反応させて、4−[(2−ジフェニルエチル)アミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン0.25g(81%の収率)を生成した(手順E)。1H NMR(CD3Cl)δ7.32−7.19(12H、m、Ar−H)、7.00−695(2H、m、Ar−H)、4.21−4.17(1H、t、J−7.7Hz、(Ph2CH)、3.67(1H、s、NH)、3.41(2H、s、p−FPhCH2)、3.22−3.19(2H、d、J=7.8Hz、NHCH2CH(Ph)2)、2.83−2.79(2H、bd、J=11.1Hz、N(CH)2)、2.52−2.50(2H、d、J=6.6Hz、NHCH2CH)、1.91−1.84(2H、t、J=11.1Hz、1.58−1.54(2H、d、J−12Hz)、1.45−1.39(1H、m、NHCH2CH)、1.21−1.14(2H、t、J=12Hz)。遊離塩基は融点=126ないし127℃のHCl塩に変換された。分析:[C27H31FN2O・2HCl]、計算値:C 62.96;H 7.31;N 5.43、実測値:C 62.93;H 7.19;N 5.41。
【実施例12】
【0069】
《4−[(ビス(4−フルオロフェニル)メチルアミノ)メチル]−1−[2−(フェニル)エチル]ピペリジン》
化合物4−[(2−ジフェニルエチル)アミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン(0.30g、0.71mmol)はNMR(25ml)中で1MのBH3/THF(4.ml)と反応させて、白色固体である4−[(ビス(4−フルオロフェニル)メチルアミノ)メチル]−1−(フェニルエチル)ピペリジン0.28g(96%の収率)を生成した(手順E)。1H NMR(CD3Cl)δ7.35−7.18(10H、m、Ar−H0、7.00−6.95(3H、m、Ar−H)、4.74(1H、S、P−FPh)2CH)、3.02−2.99(2H、d、J=10.8Hz、N(CH)2)、2.83−2.78(2H、M)、2.60−2.55(2H、m)、2.45−2.43(2H、d、J=6.2Hz、NHCH2CH)、2.04−1.96(2H、t、J=11.4Hz、N(CH)2)、1.78−1.26(5H、m)。遊離塩基は融点=214ないし215℃のHCl塩に変換された。分析:(C27H30F2N2・2HCl・0.50H2O)、計算値:C 64.58;H 6.61;N 5.57、実測値:C 64.61;H 6.65;N 5.43。
【実施例13】
【0070】
《[[(2−(ジフェニル)エチル]−N−メチルアミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン》
4−[(2−ジフェニルエチル)アミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン(45mg、0.11mmol)は、ホルムアルデヒド(1.0g)及びギ酸(2.0g、37%/H2O)中に還流されて、4−[(2−ジフェニルエチル)−N=メチルアミノメチル]−1−[(4−フルオロフェニル)メチル]ピペリジン44mg(88%の収率)を生成した(手順F)。1H NMR(CD3Cl)δ7.28−7.13(12H、m、Ar−H)、7.02−6.96(2H、t、J=8.4Hz、Ar−H)、4.15−410(1H、t、J=7.5Hz、Ph2CH)、3.46(2H、s、F−PhCH2)、2.91−2.88(2H、d、J=7.5Hz、Ph2CHCH2N)、2.81−2.77(2H、d、J=11.1Hz、N(CH)2)、2.20(3H、s、CH3)、2.20−2.17(2H、d、J=7.5Hz、NCH2CH)、1.90−1.83(2H、t、J=11.4Hz、N(CH)2)、1.52−1.47(2H、d、J=12.9Hz)、1.54−1.28(1H、m、NCH2CH)、1.14−1.06(2H、t、J=12.4Hz)。遊離塩基は融点=144ないし145℃のシュウ酸塩に変換された。分析:[C28H33N2F・2(COOH)2・1.47H2O]]、計算値:C 61.68;H 5.99;N 4.49、実測値:C 61.65;H 5.99;N 4.35。
【実施例14】
【0071】
《4[2−[(1−(フェニル)エチル)アミノ]エチル]−1−[(4−フルオロフェニル)メチル]ピペリジン》
化合物4−[(1−フェニルエチル)アミノカルボニル]メチル−1−[(4−フルオロフェニル)メチル]ピペリジン(0.33g、0.93mmol)は1MのBH3/THF(5.0ml)と反応させて、粘性油0.23g(95%の収率)を生成した(手順E)。1H NMR(CD3Cl)δ7.34−=7.21(5H、m、Ar−H)、7.01−6.95(2H、t、J=8.4Hz、Ar−H)、4.09−4.07(1H、d、J=6.0Hz、NH)、3.77−3.71(1H、q、J=6.3Hz、PhCHMe)、3.42(2H、s、p−FPhCH2)、2.82−2.78(2H、d、J=10.8Hz、N(CH)2)、2.55−2.37(2H、m、NCH2)、1.91−1.83(2H、t、J=11.4Hz、N(CH)2)、1.59−1.53(4H、m)、1.44−1.38(1H、m)、1.36−1.34(3H、d、J=6.0Hz、CH3)、1.25−1.14(2H、m)。遊離塩基は融点=172ないし173℃のシュウ酸塩に変換された。分析:[C22H29FN2・2(COOH)2]、計算値:C 59.99;H 6.39;N 5.38、実測値:C 59.84;H 6.46;N 5.29。
【実施例15】
【0072】
《ラセミのシス−及びトランス−2−ジフェニルメチル−5−(4−フルオロベンジルアミノ)ピペリジンの合成》
30mLの1,2−ジクロロエタン中の、420mgのラセミのシス−及びトランス−2−ジフェニルメチル−5−アミノピペリジン(1.58mmol)、156mgの4−フルオロベンズアルデヒド(0.8当量)、94mgの氷HOAc(1当量)の室温溶液に、一部ずつ119mgのシアノ水素化ホウ素ナトリウム(1.2当量)が添加された。混合物は18時間攪拌された。次いで、H2Oが添加され、混合物は30分間攪拌され、その後濃HClで酸性にし、更に30分攪拌した。その後混合物は濃NaOHで塩基性にされ、3回CH2Cl2で抽出された。有機相は収集され、乾燥させ(MgSO4)、蒸発させた。残留物は色相分析されて(SiO2;CH2Cl2;MeOH)、双方のジアステレオマの組合せの混合物(240mg、40%)を精製した。次いで、この混合物は更に色相分析されて(SiO2;1のヘキサン;1のEtOAc:0.06のトリエチルアミン)、ジアステレオマを分離した。第1の溶出:1H、NMR、(CDCl3;400MHz)δ1.3−1.4(2H、m、H−3)、1.49(1H、tt、2J及び3J3a=13.6Hz、3J3e及び3J5e=4.0Hz、H−4ax)、1.65−1.85(3H、m、H−4ax 2NH)、2.65−2.72(2H、m、H−5eq、H−6ax)、2.99(1H、d、2J=10.4Hz、H−6eq)、3.28(1H、dt、3J=4.4及び10.8Hz、H−2ax)、3.71(2H、s、CH2C6H4F)、3.81(1H、d、3J=9.6Hz、CH(C6H5)2)、6.99(2H、t、3J=8.4Hz、ArH オルト位のF)、7.12−7.39(12H、m、ArH)。ビス−塩酸塩として沈殿された。融点60ないし105℃。元素分析はC25H29N2FCl2・0.5H2Oについて計算された:C 65.93;H 6.59;N 6.15。実測値:C 65.26;H 6.78;N 6.49。
【0073】
第2の溶出:ラセミのトランス−2−ジフェニルメチル−5−(4−フルオロベンジルアミノ)ピペリジン(96mg、38.5%)、1H NMR(CDCl3;400MHz)δ1.17(2H、qm、3J=10Hz、H−3ax及びH−4ax)、1.57−1.65(1H、m、H−3eq)、1.4−1.7(bs、NH)、1.9−1.96(1H、m、H−4eq)、2.33(1H、t、2J及び3J=10.4Hz、H−6ax)、2.65(1H、m、Σ3J=36Hz、H−5ax)、3.15−3.25(2H、m、H−2ax、H−6eq)、3.68(1H、d、2J=0.6Hz、CH(C6H5)2)、3.75(2H、s、CH2C6H4F)、6.97(2H、t、3J=8.8Hz、ArH オルト位のF)、7.1−7.3(10H、m、ArH)、7.36(2H、d、3J=7.6Hz、ArH メタ位のF)。ビス−塩酸塩として沈殿された。元素分析はC25H29N2FCl2・0.5H2Oについて計算された:C 65.93;H 6.59;N 6.15。実測値:C 65.56;H 6.89;N 6.14。
【実施例16】
【0074】
《ラセミのトランス−3−ヒドロキシ−4−[2−ジフェニルメトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジンの合成》
0℃に冷却されたTHF(10mL)中の、

(0.92g、1.9mmol)の攪拌された懸濁液に、液滴で1MのBH3テトラヒドロフラン錯体(7.7mL、7.7mmol、4当量)が添加された。その後、冷浴は除去され、溶液はRTに温められた。混合物はその後、12時間還流された。0℃に冷却後、H2O(5.76mL)、EtOH(5.76mL)、及び3NのNaOH(15mL)が添加され、その後、30%のH2O2(18mL)が液滴添加された。反応物は55℃で12時間攪拌され、その後RTに冷却され、CH2Cl2で3回抽出された。抽出物は貯蔵され、乾燥させ(MgSO4)、透明な油に蒸発させた。粗生成物は色相分析されて(SiO2;5%のMeOH/CH2Cl2)、遊離塩基(0.553mg、71%)を得た。1H NMR(CDCl3)∂1.34−1.39(2H、m)、1.59−1.55(2H、m)、1.81−1.95(3H、m)、2.72(1H、d、J=9.9Hz)、2.98(1H、d、J=10.5Hz)、3.42−3.63(5H、m)、5.37(1H、s)、6.98(2H、t、J=9.3Hz)、7.22−7.35(12H、m)。その後、EtOH(5mL)中でシュウ酸二水和物(0.169g、1.1当量)と反応させて、表題の化合物(468mg、77%)を得た。融点143ないし150℃。元素分析はC28H31NO6Fについて計算された:C 68.37;H 6.29;N 2.75。実測値:C 67.96;H 6.43;N 2.63。
【実施例17】
【0075】
《ラセミのトランス−3−プロピオニル−4−[2−(ジフェニルメトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジンの合成》
氷浴で冷却された2mLのCH2Cl2中の61mgの3−ヒドロキシ−4−[2−(ジフェニルメトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジン(0.15mmol)と、21mgのトリエチルアミン(0.23mmol、1.5当量)との溶液に、18mgのプロピオン酸クロリド(0.19mmol、1.3当量)が液滴添加され、反応はRTに温められた。1時間後、同量のトリエチルアミン及びプロピオン酸クロリドが添加された。1時間後、H2Oが添加され、有機層は分離され、乾燥させ(MgSO4)、蒸発させた。残りの残留物は色相分析されて(SiO2;CH2Cl2/MeOH)、遊離塩基(53mg、77%)として表題の化合物を得た。1H NMR(CDCl3∂1.1(3H、t、J=8.1Hz)、1.26−1.95(7H、m)、2.26(2H、q、J=7.2及び7.5Hz)、2.71(1H、d、J=11.7Hz)、3.02(1H、d、J=10.5Hz)、3.41−3.52(4H、m)、4.67(1H、t、J=9.6Hz)、5.31(1H、s)、6.98(2H、t、J=9.3Hz)、7.2−7.4(12H、m)。その後、2mLの50%EtOH/Et2Oの混合物中でシュウ酸二水和物(15.4mg、1.1当量)と反応させて、融点 ℃の表題の化合物を得た。元素分析はC32H36NO7F・0.5H2Oについて計算された:C 67.43;H 6.41;N 2.46。実測値:C 67.34;H 6.43;N 2.44。
【実施例18】
【0076】
《ラセミの3−ケト−4−[2−(ジフェニルメトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジンの合成》
−78℃に冷却されたCH2Cl2(3mL)中の塩化オキサリル(0.4mmol、0.87当量)の溶液に、108mgのジメチルスルホキシド(1.38mmol、3当量)が液滴添加された。混合物は10分間攪拌され、CH2Cl2(1mL)中の、236mgのラセミのトランス−3−ヒドロキシ−4−[2−(ジフェニルメトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジン(0.46mmol)が液滴添加された。15分の攪拌後、トリエチルアミン(825mg、17.6当量)が添加され、混合物は室温まで温められた。総ての揮発性物質は室温で蒸発させ、残りの残留物は色相分析されて(SiO2;ヘキサン:EtOAc:MeOH)、遊離塩基(116mg、60%)を得たが、これは室温で分解し、冷気中で保存されなれけばならない。1H NMR(CdCl3)∂1.45−1.65(2H、m)、2.0−2.1(1H、m)、2.2−2.3(1H、m)、2.38−2.6(2H、m)、2.77(1H、d、J=13.6Hz)、2.9(1H、bd、J=13.6Hz)、3.45−3.55(4H、m)、5.30(1H、s)、6.99(2H、t、J=11.2Hz)、7.19−7.39(12H、m)。表題の化合物(125mg、50%)は遊離塩基(205mg)をシュウ酸二水和物(62mg、1当量)と反応させることによって得られた。融点104ないし109℃。元素分析はC29H30NO6Fについて計算された:C 68.64;H 5.92;N 2.76。実測値:C 68.34;H 5.93; N 2.68。
【実施例19】
【0077】
《4−[2−(ジフェニルメトキシ)エチル]−1−[(4−ヨードフェニル)メチル]ピペリジンの合成》
4−[2−(ジフェニルメトキシ)エチル]ピペリジン(0.23g、0.77mmol)は、EtOH(10mL)中で4−ヨードベンジルブロミド(0.76g、2.5mmol)及びK2CO3(1.00g、7mmol)と反応させて、濃い油0.17g(%)を提供した。1H NMR(300MHz、CDCl3):1.21−1.63(7H、m)、1.87−1.93(t、J=11Hz、2H、N(CH2)−)、2.79−2.83(bd、J=12Hz、2H、N(CH2)−)、3.41−3.49(4H、m)、5.31(s、1H、Ph2CHO−)、7.05−7.63(14H、m、ArH)。遊離塩基は融点=160ないし161℃のシュウ酸塩に変換された。分析:C27H30INO.(COOH)2。
【0078】
[生物学的試験]
我々は意外にも、ピペリジン誘導体中の長い芳香族アルキル鎖がセロトニン輸送体(SERT)との更なる相互作用、ひいては低い選択性を生じることを発見した(参照、A.K.Duttaら,“Structure−Activity Relationship Studies of Novel 4−[2−[Bis(4−fluorophenyl)methoxy]ethyl]−1−(3−phenylpropyl)piperidine Analogs:Synthesis and Biological Evaluation at the Dopamine and Serotonin Transporter Sites”,J.MED.CHEM.,1996,39,749−756;A.K.Duttaら,“Highly Selective,Novel Analogs of 4−[2−(diphenylmethoxy)ethyl]−1−benzylpiperidine For The Dopamine Transporter:Effect of Different Aromatic Substitutions on Their Affinity and Selectivity”,J.MED.CHEM.,1997,40,35−43;A.K.Duttaら,Potent and Selective Ligands for the Dopamine Transporter(DAT):Structure−Activity Relationship Studies of Novel 4−[2−(diphenylmethoxy)ethyl]−1−(3−phenylpropyl)piperidine Analogs”,J.MED.CHEM.,1998,41,699−705)。電気陰性のフッ素原子、及び強い電子吸引性の官能基CNの効果を調査するために、実施例1ないし4の化合物が設計及び合成された。電気陰性及び電子吸引性の官能基の存在が、これらのアナログの活性及び選択性を向上させた。これらの新規の化合物は、ピペリジンのN原子とアリール環との間にメチレン基のみを有し、かつ、電気陰性のアリール置換基を有し、ドーパミン輸送体(DAT)に対し完全な選択性及び効能を呈した。従って、フェニル環中にある強い電子吸引性のシアノ基を有する実施例4の化合物は、ドーパミン輸送体に対し顕著な効能及び選択性を示した(IC50、3.7nM、SERT/DAT=615、表1)。これは、標準的な基準化合物GBR12909(IC50、14nM、SERT/DAT=6)を超える顕著な改善である。実施例2の化合物は更に、DATについてGBR12909よりも良好な効能及び大きな選択性を示した(SERT/DAT=122)。
【0079】
実施例8、9、11、及び12の化合物(表1)は、オキシアルキル結合ではなく、ピペリジン環と、分子のビス芳香族メタン部分との間の4−(アミノアルキル)結合を用いる。実施例8及び9の双方が標準的なGBR12909分子よりも更に強力及び選択的である(それぞれ、IC50、7.0及び4.5nM、SERT/DAT=227及び347)。化合物4−[2−(ジフェニルメトキシ)エチル]−1−[(4−ヨードフェニル)メチル]ピペリジンは、新規の標準的な活性を設定する。
【0080】
N原子が隣接する位置へ再配置される実施例11の化合物において、DATに対する強い親和性と、SERTに対する中程度の親和性とからなる、興味深い効果が観察された。このような二重の活性を有する化合物は、薬物乱用に対する、及び、他の神経障害における薬剤の開発において、特有の適用を見出すことができ、それは抑うつ状態の治療を含んでいる。
【0081】
本発明の系で開発されたこれらの化合物のいずれも、ノルエピネフリン輸送体(NET)に対して感知可能な活性を示さず、DATに対する選択性を示す。
【0082】
本発明の新規化合物は更に、これらの新規化合物による細胞質ゾル中のドーパミン再取り込みの阻害を測定する、ドーパミン再取り込みの阻害アッセイで評価された。この点で、コカイン及びGBR12909は強力なDA取り込み阻害剤である。理想的には、薬物中毒の治療用の所望の薬剤は、わずかなドーパミン取り込み阻害効能しか有するべきではなく、その点でGBR12909より低い効能にすべきであり、このことがコカイン拮抗薬として作用する薬剤の確率を増加させる。表2の本発明の化合物系において、総ての列挙された結果は、コカイン拮抗薬として作用するこれらの新規化合物の潜在力の増加を、GBR12909よりも反映する。
【0083】
【表1】

1 4−[((1−フェニルエトキシ)エチル]−1−[(4−フルオロフェニル)メチル]ピペリジン
2 4−[2−(ジフェニルメトキシ)エチル]−1−[(3−ヒドロキシフェニル)メチル]ピペリジン
3 4−[2−(ジフェニルメトキシ)エチル]−1−[(4−ヨードフェニル)メチル]ピペリジン
【0084】
【表2】

【0085】
実施例15の化合物のラセミのシス異性体及びトランス異性体の活性が測定された。結果は以下の表3に示される。SERT/DAT、NET/DAT、及び[3H]DA/DTの結合比率に対する選択性は、コカイン及び本発明の実施例11に対する同様のデータとともに、表4に示される。示されるように、シス異性体とトランス異性体との間で選択性の顕著な変化がある。幾何異性体の各対の個々の立体異性体は更に、まったく異なる活性を示す。
【0086】
【表3】

【0087】
【表4】

【0088】
【表5】

【0089】
[III.図7ないし9の実施例]
試薬及び溶媒は民間の納入業者から得られ、他に示されない限りにおいては元のままで用いられた。乾燥溶媒は標準的な手順によって得られた。総ての反応は、他に断りのない限りにおいては不活性雰囲気(N2)下で行われた。分析用のシリカゲル60F254でコーティングされたTLCプレートは、EMD Chemical社から購入され、UV光で、又はリンモリブデン酸(PMA)での処理によって可視化された。フラッシュクロマトグラフィはBaker Silica Gel 40mmで行われた。1H NMRスペクトルは、Varian 400MHz FT NMRで常に得られた。用いられたNMRの溶媒は、示されるようにCDCl3であった。TMSは内部標準として用いられた。元素分析はAtlantic Microlab社で行われ、理論値の±0.4%内であった。
【0090】
《4−(2−(ベンズヒドリルオキシ)エチル)ピリジン(3)の合成》
図7について、4−ビニルピリジン1(10g、95.1mmol)と、ベンズヒドロール2(35.04g、190mmol)との攪拌溶液に、ナトリウムメトキシド(1.541g、28.5mmol)が添加された。反応混合物は130ないし140℃で20時間加熱され、RTに冷却され、1NのHCl(150ml)で酸性にされた。溶液は酢酸エチル(3×30ml)で抽出されて、未反応のベンズヒドロールと副生成物のジベンズヒドリルエーテルとを除去した。水溶液は更に、10%のNaOH溶液(pH10)で塩基性にされ、ジクロロメタン(3×30ml)で抽出された。混合有機層は水(2×20ml)で洗浄され、無水硫酸ナトリウムで乾燥させ、溶媒は減圧中で蒸発させた。油性残留物は減圧蒸留を受けて、未反応の4−ビニルピリジン(3.9g)を除去した。生成物は減圧下で乾燥させて、微量の4−ビニルピリジンを除去して、8.7g(52%)の表題の化合物3を得た。1H−NMR(CDCl3;400MHz):2.90−2.93(t、2H、J=6.4Hz、OCH2CH2)、3.66−3.67(t、2H、J=6.8Hz、OCH2CH2)、5.32(s、1H、PhCH(O)Ph)、7.13−7.14(d、2H、J=5.6Hz、3,5−Pyr−H)、7.17−7.33(m、10H、ArH)、8.47−8.48(d、2H、J=6.0Hz、2,6−Pyr−H)。
【0091】
《4−(2−(ベンズヒドリルオキシ)エチル)−1−ベンジル−1,2,3,6−テトラヒドロピリジン(4)の合成》
図7について、4−(2−(ベンズヒドリルオキシ)エチル)ピリジン3(4.0g、13.82mmol)及びベンジルブロミド(2.86g、16.73mmol)は20mlの乾燥アセトニトリルに溶解され、6時間還流された。溶媒は減圧下で除去された。高減圧下で2時間、残留物を乾燥させた後に、30mlの乾燥メタノールで溶解され、氷浴中で冷却された。水素化ホウ素ナトリウム(0.76g、20.05mmol)は次いで、1.5時間の期間にわたって非常にゆっくりと一部ずつ添加され、溶液は徐々に室温に戻された。反応は4時間の攪拌後、水で急冷され、メタノールは減圧下で除去された。残留生成物は酢酸エチルで溶解され、水で洗浄され、乾燥させ(Na2SO4)、かつ濃縮された。粗生成物はシリカゲルでのカラムクロマトグラフィ(ヘキサン:酢酸エチル 5:1)によって精製されて、無色油として符号4(5.0g、94%)を生成した。1H−NMR(CDCl3;400MHz):2.086(brs、2H、H−3)、2.32−2.35(t、2H、J=6.8Hz、OCH2CH2)、2.52−2.54(t、2H、J=5.6Hz、H−2)、2.94−2.94(brm、2H、H−6)3.52−3.55(m、4H、NCH2Ph、OCH2CH2)、5.34(s、1H、PhCH(O)Ph)、5.41−5.42(brs、1H、CH=C)、7.12−7.37(m、15H、ArH)。
【0092】
《4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロピリジン(5)の合成》
図7について、ベンゼン(40ml)中の4−(2−(ベンズヒドリルオキシ)エチル)−1−ベンジル−1,2,3,6−テトラヒドロピリジン4(12.44g、0.0324mol)と、クロロギ酸メチル(5.0ml、0.0648mol)との溶液は6時間還流された。反応の完了後(TLCによってモニタリングされる)、溶媒は減圧下で除去されて、粘性油の形態で4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−カルボン酸メチルを提供した。カラムクロマトグラフィ(ヘキサン:EtOAc 9:1)によって精製されて、6.7g(59%)の純生成物を得た。
【0093】
エタノール(25ml)中の4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−カルボン酸メチル(6.5g、18.49mmol)の攪拌溶液に、クライゼンアルカリ液(5mlの水及び20mlのメタノールに溶解された6.457gのKOH)が添加された。溶液は一晩還流され、減圧下で濃縮され、水(40ml)で冷却及び希釈され、エーテル(3×30ml)で抽出された。混合されたエーテル抽出物は乾燥(Na2SO4)及び蒸発させて、粘稠液体を提供した。生成物はシリカゲルでのカラムクロマトグラフィ(酢酸エチル:メタノール:トリエチルアミン 20:10:2.5)によって精製されて、黄色を帯びた粘稠液体として化合物5を得た(4.8g、88%)。1H−NMR(CDCl3;400MHz):2.03(brm、2H、H−3)、2.29−2.32(t、2H、J=6.4Hz、OCH2CH2)、2.92−2.95(t、2H、J=5.6Hz、H−2)、3.31(brs、2H、H−6)、3.49−3.53(t、2H、OCH2CH2)、5.32(s、1H、PhCH(O)Ph)、5.41(brs、1H、CH=C)、5.76(brs、1H、−NH)、7.17−7.33(m、10H、ArH)。
【0094】
[通常手順I]
図8について、エタノール中の4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロ−ピリジン5(1当量)と、スチレンオキシド6(1当量)との溶液は一晩還流された。反応混合物はRTに冷却され、溶媒は減圧下で蒸発させた。茶色を帯びた油性残留物は、任意の未反応の出発物質が存在する場合に除去するためにシリカゲルでのカラムクロマトグラフィ(ヘキサン:酢酸エチル 1:1)によって精製されて、ピリジン及び無水酢酸を用いてアセチル化を後に受ける位置異性体(化合物7aの場合においては、(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−フェニル−エタノール、所望の生成物、及び(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロ−ピリジン−1(2H)−イル)−2−フェニルエタノール)の混合物であると知られる無色油を得た。反応混合物はRTに維持し、時折振盪した。4時間後、溶媒は減圧下で除去され、残留物はジクロロメタン(15ml)に吸収され、水(10ml)で洗浄され、Na2SO4で乾燥させ、溶媒は減圧下で除去された。シリカゲルでの粗生成物のカラムクロマトグラフィ(ヘキサン:酢酸エチル 8:2)は、アセチル化生成物を提供した。
【0095】
《(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−フェニルエチルアセタート(7a)》
図8について、4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロピリジン5(0.5g、1.704mmol)、R−スチレンオキシド6a(0.205g、1.704mmol)、エタノール(20ml)。収量(精製後)=0.7g。アセチル化については、位置異性体(0.7g、1.693mmol)と、ピリジン(10ml)と、無水酢酸(0.208ml、2.2mmol、1.3当量)との混合物。収量(精製後)=0.26g。1H−NMR(CDCl3;400MHz):2.03−2.07(brs、5H、H−3、COCH3)、2.31−2.34(t、2H、J=6.4Hz、OCH2CH2)、2.54−2.71(m、3H、H−2、NCHHCHOAc)、2.91−2.97(dd、1H、J=8.8Hz、NCHHCHOAc)、3.04(brs、2H、H−6)、3.51−3.54(t、2H、OCH2CH2)、5.34(s、1H、PhCH(O)Ph)、5.39(brs、1H、CH=C)、5.95−5.98(dd、1H、CHOAc)、7.03−7.34(m、15H、ArH)。[a]25D=−20.22°(c=1.05、CHCl3)。
【0096】
《(S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−フェニルエチルアセタート(7b)》
図8について、4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロピリジン5(0.5g、1.704mmol)、S−スチレンオキシド6b(0.205g、1.704mmol)、エタノール(20ml)。収量(精製後)=0.65g。アセチル化については、位置異性体(0.5g、1.209mmol)と、ピリジン(10ml)と、無水酢酸(0.148ml、1.571mmol、1.3当量)との混合物。収量(精製後)=0.2g。1H−NMR(CDCl3;400MHz):2.03−2.07(brs、5H、H−3、COCH3)、2.31−2.34(t、2H、J=6.4Hz、OCH2CH2)、2.59−2.74(m、3H、H−2、NCHHCHOAc)、2.95−2.30(dd、1H、J=9.2Hz、NCHHCHOAc)、3.04(brs、2H、H−6)、3.51−3.54(t、2H、OCH2CH2)、5.33(s、1H、PhCH(O)Ph)、5.39(brs、1H、CH=C)、5.96−6.00(dd、1H、CHOAc)、7.21−7.37(m、15H、ArH)。[a]25D=+21.17°(c=1.02、CHCl3)。
【0097】
《(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−(4−フルオロフェニル)−エチルアセタート(7c)》
図8について、4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロピリジン5(0.493g、1.68mmol)、R−4−フルオロスチレンオキシド6c(0.232g、1.68mmol)、エタノール(20ml)。収量(精製後)=0.380g。アセチル化については、位置異性体(0.38g、0.881mmol)と、ピリジン(10ml)と、無水酢酸(0.110ml、1.145mmol、1.3当量)との混合物。収量(精製後)=0.18g。1H−NMR(CDCl3;400MHz):2.02−2.06(brs、5H、H−3、COCH3)、2.30−2.38(t、2H、J=6.4Hz、OCH2CH2)、2.52−2.69(m、3H、H−2、NCHHCHOAc)、2.91−2.96(dd、1H、J=8.8Hz、NCHHCHOAc)、3.04(brs、2H、H−6)、3.51−3.55(t、2H、OCH2CH2)、5.37(s、1H、PhCH(O)Ph)、5.39(brs、1H、CH=C)、5.95−5.98(dd、1H、CHOAc)、6.99−7.04(t、2H、ArH)、7.21−7.33(m、12H、ArH)。[a]25D=−24.240(c=0.77、CHCl3)。
【0098】
《(S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−(4−フルオロフェニル)−エチルアセタート(7d)》
図8について、4−(2−(ベンズヒドリルオキシ)エチル)−1,2,3,6−テトラヒドロピリジン5(0.477g、1.62mmol)、S−4−フルオロスチレンオキシド6d(0.225g、1.62mmol)、エタノール(20ml)。収量(精製後)=0.42g。アセチル化については、位置異性体(0.42g、0.973mmol)と、ピリジン(10ml)と、無水酢酸(0.119ml、1.265mmol、1.3当量)との混合物。収量(精製後)=0.25g。1H−NMR(CDCl3;400MHz):2.03−2.06(brs、5H、H−3、COCH3)、2.305−2.338(t、2H、J=6.4Hz、OCH2CH2)、2.579−2.73(m、3H、H−2、NCHHCHOAc)、2.95−3.00(dd、1H、J=8.8Hz、NCHHCHOAc)、3.04(brs、2H、H−6)、3.51−3.54(t、2H、OCH2CH2)、5.33(s、1H、PhCH(O)Ph)、5.39(brs、1H、CH=C)、5.96−5.99(dd、1H、CHOAc)、6.99−7.03(t、2H、ArH)、7.23−7.33(m、12H、ArH)。[a]25D=+24.89°(c=0.83、CHCl3)。
【0099】
[通常手順II]
《符号8Aないし8Dの合成》
図8について、0℃、N2下で、乾燥THF中のNaBH4の攪拌溶液に、48%の質量濃度(w/w)のBF3−エーテル錯体が液滴添加された。氷浴は除去され、溶液は1時間室温(RT)で攪拌された。混合物は次いで氷浴中で冷却された。冷却溶液内に、THF(10ml)中の符号8の溶液が液滴添加された。溶液はRTに戻されて、更に2時間攪拌された。溶液は再度0℃に冷却され、水、エタノール、及び3NのNaOH溶液が添加され、その後30%のH2O2が液滴添加された。反応混合物は55℃で一晩攪拌され、RTに冷却され、溶媒は減圧下で蒸発させた。生成物は水と酢酸エチルとの間に分割された。水層は酢酸エチルで抽出され、混合有機層はNa2SO4で乾燥させ、濃縮されて、シリカゲルで色相分析される未精製のジアステレオマ混合物を提供し、淡黄色の粘性油を提供した。
【0100】
《ジアステレオマ8Aないし8Dの分離》
ジアステレオマ混合物8Aないし8Dは、順相カラム(Nova−Pack Silica 6mM)を用いて、半調製用HPLCによって分離された。用いられた移動相は15ml/分の流速でのヘキサン中の4又は5%のいずれかの2−プロパノールであった。分離されたジアステレオマの最終純度は、1ml/分の流速で同一の移動層を用いて分析用順相カラム(Nova−Pack Silica 60Å 4mM)によって点検された。
【0101】
《(1R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニル−エチルアセタート(8A)の合成》
図8について、通常手順IIが用いられた。化学物質の量は添加の順に下記の通りである:NaBH4(0.116g、3.08mmol)、THF(20ml)、BF3−エーテル錯体(0.4ml、3.265mmol)、(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−フェニルエチルアセタート7a(0.7g、1.536mmol)、水(2ml)、エタノール(2ml)、3NのNaOH(1.1ml)、及び30%のH2O2(0.8ml、7.68mmol)。
【0102】
《ジアステレオマ8Aの分離》
半調製用HPLCの実行時に、移動相として4%の2−プロパノールを用いた場合、符号8a及び8a’の保持時間がそれぞれ、14.31及び17.96分であることが観察された。分析用HPLCの場合においては、符号8a及び8a’に対する各保持時間は4.71及び5.52分であった。符号8aの収量=0.183g。符号8a’の収量=0.12g。
【0103】
《(R)−2−((3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニルエチルアセタート(8a)》
図8について、1H−NMR(CDCl3;400MHz):1.34−1.39(2H、m、H−4、H−5ax)、1.55−1.66(2H、m、H−5eq、CH2CH2O)、1.85−1.91(m、1H、H−6ax)、1.98−2.03(t、1H、J=9.6Hz、H−2ax)、2.08(s、3H、OCOCH3)、2.13−2.19(t、1H、J=10.8Hz、CHHCH2O)、2.56−2.61(dd、1H、J=13.6、4.4Hz、NCHHCHAr)、2.71−2.73(brd、1H、J=11.2Hz、H−6eq)、2.82−2.88(m、1H、NCHHCHAr)、3.05−3.08(dd、1H、J=10.4、3.2Hz、H−2eq)、3.33−3.38(m、1H、H−3ax)、3.48−3.54(m、1H、CH2CHHO)、3.55−3.60(m、1H、CH2CHHO)、5.36(s、1H、PhCH(O)Ph)、5.91−5.95(dd、1H、J=8.8、4.4Hz、CHOCOCH3)、7.22−7.35(15H、m、ArH)。[a]25D=−12.72°(c=0.99、MeOH)。
【0104】
《(R)−2−((3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニルエチルアセタート(8a’)》
図8について、1H−NMR(CDCl3;400MHz):1.34−1.40(m、2H、H−4、H−5ax)、1.54−1.66(m、2H、H−5eq、CH2CH2O)、1.82−1.91(m、1H、H−6ax)、2.02−2.13(m、5H、H−2ax、OCOCH3、CHHCH2O)、2.53−2.58(dd、1H、J=13.6、4Hz NCHHCHAr)、2.80−2.87(m、2H、H−6eq、NCHHCHAr)、2.97−3.01(dd、1H、J=10.8、3.6Hz、H−2eq)、3.37−3.42(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.56−3.60(m、1H、CH2CHHO)、5.37(s、1H、PhCH(O)Ph)、5.93−5.96(dd、1H、J=8.8、4Hz、CHOCOCH3)、7.22−7.35(m、15H、ArH)。[a]25D=−48.76°(c=1.05、MeOH)。
【0105】
《(1S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニル−エチルアセタート(8B)の合成》
図8について、通常手順IIが用いられた。化学物質の量は添加の順に以下の通りである:NaBH4(0.0191g、0.505mmol)、THF(10ml)、BF3−エーテル錯体(0.066ml、0.536mmol)、(S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−フェニルエチルアセタート7b(0.115g、0.252mmol)、水(0.3ml)、エタノール(0.5ml)、3NのNaOH(0.2ml)、及び30%のH2O2(0.2ml、1.26mmol)。
【0106】
《ジアステレオマ8Bの分離》
半調製用HPLCの実行時に、移動相としてヘキサン中の5%の2−プロパノールを用いる場合、符号8b’及び8bの保持時間がそれぞれ、13.57及び18.15分であることが観察された。分析用HPLCの場合においては、符号8b’及び8bに対する各保持時間は3.71及び4.37分であった。符号8b’の収量=0.03g。符号8bの収量=0.03g。(S)−2−((3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニルエチルアセタート(8b’)。1H−NMR(CDCl3;400MHz):1.30−1.38(m、2H、H−4、H−5ax)、1.54−1.66(m、2H、H−5eq、CH2CH2O)、1.84−1.91(m、1H、H−6ax)、1.98−2.03(t、1H、J=9.6Hz、H−2ax)、2.08(s、3H、OCOCH3)、2.13−2.19(t、1H、J=10.8Hz、CHHCH2O)、2.56−2.61(dd、1H、J=13.2、4Hz NCHHCHAr)、2.71−2.74(brd、1H、J=11.6Hz、H−6eq)、2.82−2.88(m、1H、NCHHCHAr)、3.05−3.08(dd、1H、J=10.4、2.8Hz、H−2eq)、3.33−3.38(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.55−3.60(m、1H、CH2CHHO)、5.36(s、1H、PhCH(O)Ph)、5.91−5.95(dd、1H、J=8.8、4.4Hz、CHOCOCH3)、7.22−7.35(m、15H、ArH)。[a]25D=+12.98°(c=1.47、CHCl3)。
【0107】
《(S)−2−((3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−フェニルエチルアセタート(8b)》
この調製は図8によって実行された:1H−NMR(CDCl3;400MHz):1.30−1.39(m、2H、H−4、H−5ax)、1.55−1.66(m、2H、H−5eq、CH2CH2O)、1.82−1.92(m、1H、H−6ax)、2.02−2.13(m、5H、H−2ax、OCOCH3、CHHCH2O)、2.54−2.58(dd、1H、J=13.6、4Hz NCHHCHAr)、2.80−2.87(m、2H、H−6eq、NCHHCHAr)、2.97−3.01(dd、1H、J=10.8、3.2Hz、H−2eq)、3.37−3.42(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.56−3.61(m、1H、CH2CHHO)、5.37(s、1H、PhCH(O)Ph)、5.93−5.96(dd、1H、J=8.8、4Hz、CHOCOCH3)、7.22−7.35(m、15H、ArH)。[a]25D=−48.76°(c=1.05、MeOH)。
【0108】
《(1R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8C)の合成》
図8について、通常手順IIが用いられた。化学物質の量は添加の順に以下の通りである:NaBH4(0.029g、0.762mmol)、THF(10ml)、BF3−エーテル錯体(0.1ml、0.81mmol)、(R)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−(4−フルオロフェニル)エチルアセタート7c(0.180g、0.38mmol)、水(0.3ml)、エタノール(0.4ml)、3NのNaOH(0.3ml)、及び30%のH2O2(0.2ml、1.9mmol)。
【0109】
《ジアステレオマ8Cの分離》
図8について、半調製用HPLCの実行時に、移動相としてヘキサン中の5%の2−プロパノールを用いる場合、符号8c及び8c’の保持時間がそれぞれ、13.35及び18.49分であることが観察された。分析用HPLCの場合においては、符号8c及び8c’に対する各保持時間は3.92及び4.41分であった。符号8cの収量=0.026g。符号8c’の収量=0.023g。
【0110】
《(R)−2−((3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8c)》
1H−NMR(CDCl3;400MHz):1.28−1.38(m、2H、H−4、H−5ax)、1.54−1.65(2H、m、H−5eq、CH2CH2O)、1.83−1.92(m、1H、H−6ax)、1.97−2.0(t、1H、J=10Hz、H−2ax)、2.07(s、3H、OCOCH3)、2.12−2.17(t、1H、J=9.2Hz、CHHCH2O)、2.54−2.58(dd、1H、J=13.6、4.4Hz、NCHHCHAr)、2.71−2.73(brd、1H、J=11.6Hz、H−6eq)、2.80−2.85(m、1H、NCHHCHAr)、3.01−3.05(dd、1H、J=10.4、3.6Hz、H−2eq)、3.31−3.37(m、1H、H−3ax)、3.48−3.54(m、1H、CH2CHHO)、3.57−3.61(m、1H、CH2CHHO)、5.37(s、1H、PhCH(O)Ph)、5.87−5.90(dd、1H、J=8.4、4.8Hz、CHOCOCH3)、7.00−7.04(t、2H、ArH)、7.23−7.33(m、12H、ArH)。[a]25D=−12.95°(c=1.0、CHCl3)。
【0111】
《(R)−2−((3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8c’)》
1H−NMR(CDCl3;400MHz):1.31−1.40(m、2H、H−4、H−5ax)、1.55−1.65(m、2H、H−5eq、CH2CH2O)、1.82−1.91(m、1H、H−6ax)、2.01−2.14(m、5H、H−2ax、OCOCH3、CHHCH2O)、2.51−2.56(dd、1H、J=13.6、3.6Hz、NCHHCHAr)、2.76−2.84(m、2H、H−6eq、NCHHCHAr)、2.98−3.01(dd、1H、J=10.8、3.2Hz、H−2eq)、3.36−3.41(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.56−3.61(m、1H、CH2CHHO)、5.37(s、1H、PhCH(O)Ph)、5.89−5.92(dd、1H、J=8.8、4.4Hz、CHOCOCH3)、6.97−7.05(t、2H、ArH)、7.23−7.33(m、12H、ArH)。[?]25D=−36.33°(c=0.9、CHCl3)。
【0112】
《(1S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8D)の合成》
図8について、通常手順IIが用いられた。化学物質の量は添加の順に以下の通りである:NaBH4(0.04g、1.06mmol)、THF(10ml)、BF3−エーテル錯体(0.14ml、1.12mmol)、(S)−2−(4−(2−(ベンズヒドリルオキシ)エチル)−5,6−ジヒドロピリジン−1(2H)−イル)−1−(4−フルオロフェニル)エチルアセタート7d(0.25g、0.53mmol)、水(0.4ml)、エタノール(0.6ml)、3NのNaOH(0.4ml)、及び30%のH2O2(0.4ml、4.11mmol)。
【0113】
《ジアステレオマ8Dの分離》
半調製用HPLCの実行時に、移動相としてヘキサン中の5%の2−プロパノールを用いる場合、符号8d’及び8dの保持時間がそれぞれ、13.4及び17.69であることが観察された。分析用HPLCの場合においては、符号8d’及び8bに対する各保持時間は3.41及び4.23分であった。符号8d’の収量=0.02g。符号8dの収量=0.02g。
【0114】
《(S)−2−((3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8d’)》
1H−NMR(CDCl3;400MHz):1.28−1.38(m、2H、H−4、H−5ax)、1.54−1.65(2H、m、H−5eq、CH2CH2O)、1.83−1.92(m、1H、H−6ax)、1.97−1.99(t、1H、J=13.2Hz、H−2ax)、2.07(s、3H、OCOCH3)、2.11−2.14(t、1H、J=8.8Hz、CHHCH2O)、2.54−2.58(dd、J=13.6、4.8Hz、1H、NCHHCHAr)、2.70−2.73(brd、1H、J=11.2Hz、H−6eq)、2.79−2.85(m、1H、NCHHCHAr)、3.01−3.05(dd、1H、J=10.4、2.8Hz、H−2eq)、3.31−3.36(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.55−3.60(m、1H、CH2CHHO)、5.36(s、1H、PhCH(O)Ph)、5.87−5.90(dd、1H、J=8.4、4.8Hz、CHOCOCH3)、6.99−7.04(t、2H、ArH)、7.22−7.33(m、12H、ArH)。[a]25D=+13.30°(c=1.0、CHCl3)。
【0115】
《(S)−2−((3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−3−ヒドロキシピペリジン−1−イル)−1−(4−フルオロフェニル)エチルアセタート(8d)》
1H−NMR(CDCl3;400MHz):1.31−1.40(m、2H、H−4、H−5ax)、1.54−1.64(2H、m、H−5eq、CH2CH2O)、1.82−1.91(m、1H、H−6ax)、2.01−2.12(m、5H、H−2ax、OCOCH3、CHHCH2O)、2.51−2.56(dd、1H、J=13.2、4.4Hz、NCHHCHAr)、2.76−2.84(m、2H、H−6eq、NCHHCHAr)、2.97−3.01(dd、1H、J=10.8、3.2Hz、H−2eq)、3.35−3.40(m、1H、H−3ax)、3.48−3.53(m、1H、CH2CHHO)、3.56−3.61(m、1H、CH2CHHO)、5.37(s、1H、PhCH(O)Ph)、5.89−5.92(dd、1H、J=8.8、4.4Hz、CHOCOCH3)、6.99−7.03(t、2H、ArH)、7.22−7.33(m、12H、ArH)。[a]25D=+36.5°(c=1.0、CHCl3)。
【0116】
[通常手順III]
《符号9aないし9d、9a’ないし9d’の合成》
図9について、HPLC分離で得られる留分I及びIIは、室温で4時間、メタノール(15ml)中の無水K2CO3(0.56当量)で別個に脱アセチル化された。メタノールは減圧下で除去され、残留物はジクロロメタンと水との間に分割された。有機層は分離され、水層は更にジクロロメタン(2×20ml)で抽出された。混合有機層は、無水Na2CO3で乾燥させ、濃縮された。粗生成物はシリカゲルで色相分析された(酢酸エチル、酢酸エチル:メタノール 9:1、メタノール)。
【0117】
《(3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((R)−2−ヒドロキシ−2−フェニルエチル)−ピペリジン−3−オール(9a)(D−225)の合成》
図9について、留分I、すなわち、ジアステレオマ混合物8AのHPLC分離による符号8a(0.183g、0.386mmol)は、メタノール中の無水K2CO3(30mg、0.216mmol)で処理されて、符号9aを生成した(0.15g)。1H−NMR(CDCl3;400MHz):1.39−1.46(m、2H、H−4、H−5ax)、1.59−1.66(m、2H、H−5eq、CHHCH2O)、1.87−1.94(m、2H、H−2ax、CHHCH2O)、2.22−2.31(t、1H、J=10.8Hz、H6−ax)、2.44−2.53(m、2H、NCH2CHAr)、2.70−2.73(brd、1H、J=11.2Hz、H−6eq)、3.30−3.34(dd、1H、J=10.8、3.2Hz、H−2eq)、3.40−3.46(m、1H、H−3ax)、3.51−3.57(m、1H、CH2CHHO)、3.60−3.65(m、1H、CH2CHHO)、4.72−4.76(dd、1H、J=10,4Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.24−7.35(m、15H、ArH)。[a]25D=−12.48°(c=1.0、CHCl3)。遊離塩基は融点154ないし156℃のシュウ酸塩に変換された。分析はC28H33NO3・(COOH)2・0.9H2O)のC、H、Nについて計算された。
【0118】
《(3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((R)−2−ヒドロキシ−2−フェニルエチル)−ピペリジン−3−オール(9a’)(D−226)の合成》
図9について、留分II、すなわち、ジアステレオマ混合物8AのHPLC分離による符号8a’(0.12g、0.253mmol)は、メタノール中の無水K2CO3(20mg、0.142mmol)で処理されて、符号9a’を生成した(0.08g)。1H−NMR(CDCl3;400MHz):1.32−1.43(m、2H、H−4、H−5ax)、1.60−1.71(m、2H、H−5eq、CHHCH2O)、1.88−2.01(m、2H、H−2ax、CHHCH2O)、2.12−2.18(t、1H、J=10.4Hz、H6−ax)、2.43−2.55(m、2H、NCH2CHAr)、2.98−3.01(dd、1H、J=11.2、3.2Hz、H−2eq)、3.04−3.07(brd、1H、J=10.8Hz、H−6eq)、3.43−3.48(m、1H、H−3ax)、3.52−3.57(m、1H、CH2CHHO)、3.60−3.65(m、1H、CH2CHHO)、4.70−4.73(dd、1H、J=10.4、3.6Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.24−7.36(m、15H、ArH)。[a]25D=−50.73°(c=0.95、CHCl3)。遊離塩基は融点84ないし86℃のシュウ酸塩に変換された。分析は(C28H33NO3・(COOH)2・0.4H2O)のC、H、Nについて計算された。
【0119】
《(3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((S)−2−ヒドロキシ−2−フェニルエチル)−ピペリジン−3−オール(9b’)(D−275)の合成》
図9について、留分I、すなわち、ジアステレオマ混合物8BのHPLC分離による符号8b’(0.03g、0.063mmol)は、メタノール中の無水K2CO3(5mg、0.035mmol)で処理されて、符号9b’を生成した(0.025g)。1H−NMR(CDCl3;400MHz):1.38−1.44(m、2H、H−4、H−5ax)、1.60−1.67(m、2H、H−5eq、CHHCH2O)、1.87−1.94(m、2H、H−2ax、CHHCH2O)、2.22−2.27(dt、1H、J=11.2Hz、H6−ax)、2.43−2.53(m、2H、NCH2CHAr)、2.69−2.72(brd、1H、J=10.8Hz、H−6eq)、3.30−3.34(dd、1H、J=10.8、3.2Hz、H−2eq)、3.40−3.46(m、1H、H−3ax)、3.51−3.57(m、1H、CH2CHHO)、3.60−3.64(m、1H、CH2CHHO)、4.72−4.75(dd、1H、J=9.6、4Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.24−7.34(m、15H、ArH)。[a]25D=+13.33°(c=0.96、CHCl3)。遊離塩基は融点152ないし154℃のシュウ酸塩に変換された。分析は(C28H33NO3・(COOH)2)のC、H、Nについて計算された。
【0120】
《(3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((S)−2−ヒドロキシ−2−フェニルエチル)−ピペリジン−3−オール(9b)(D−276)の合成》
図9について、留分II、すなわち、ジアステレオマ混合物8BのHPLC分離による符号8b(0.03g、0.063mmol)は、メタノール中の無水K2CO3(5mg、0.035mmol)で処理されて、符号9bを生成した(0.025g)。1H−NMR(CDCl3;400MHz):1.32−1.43(m、2H、H−4、H−5ax)、1.60−1.71(m、2H、H−5eq、CHHCH2O)、1.87−2.01(m、2H、H−2ax、CHHCH2O)、2.12−2.17(t、1H、J=10.4Hz、H6−ax)、2.43−2.54(m、2H、NCH2CHAr)、2.98−3.01(dd、1H、J=10.8、3.2Hz、H−2eq)、3.04−3.07(brd、1H、J=10.4Hz、H−6eq)、3.43−3.48(m、1H、H−3ax)、3.51−3.57(m、1H、CH2CHHO)、3.60−3.64(m、1H、CH2CHHO)、4.70−4.73(dd、1H、J=10.4、3.6Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.23−7.37(m、15H、ArH)。[a]25D=+50.64°(c=0.95、CHCl3)。遊離塩基は融点82ないし84℃のシュウ酸塩に変換された。分析は(C28H33NO3・(COOH)2・0.7H2O)のC、H、Nについて計算された。
【0121】
《(3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((R)−2−(4−フルオロフェニル)−2−ヒドロキシエチル)ピペリジン−3−オール(9c)(D−231)の合成》
図9について、留分I、すなわち、ジアステレオマ混合物8CのHPLC分離による符号8c(0.026g、0.053mmol)は、メタノール中の無水K2CO3(4.1mg、0.03mmol)で処理されて、符号9aを生成した(0.02g)。1H−NMR(CDCl3;400MHz):1.39−1.42(m、2H、H−4、H−5ax)、1.61−1.67(m、2H、H−5eq、CHHCH2O)、1.87−1.95(m、2H、H−2ax、CHHCH2O)、2.23−2.28(t、1H、J=11.2Hz、H6−ax)、2.40−2.50(m、2H、NCH2CHAr)、2.70−2.73(brd、1H、J=11.2Hz、H−6eq)、3.29−3.33(dd、1H、J=10.4、3.2Hz、H−2eq)、3.40−3.46(m、1H、H−3ax)、3.52−3.57(m、1H、Hz、CH2CHHO)、3.60−3.65(m、1H、CH2CHHO)、4.70−4.73(dd、1H、J=10.4、3.6Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.00−7.04(t、2H、ArH)、7.23−7.34(m、12H、ArH)。[a]25D=−13.84°(c=0.65、CHCl3)。遊離塩基は融点160ないし162℃のシュウ酸塩に変換された。分析はC28H32FNO3・(COOH)2・0.1H2O)のC、H、Nについて計算された。
【0122】
《(3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((R)−2−(4−フルオロフェニル)−2−ヒドロキシエチル)ピペリジン−3−オール(9c’)(D−230)の合成》
図9について、留分II、すなわち、ジアステレオマ混合物8CのHPLC分離による符号8c’(0.023g、0.047mmol)は、メタノール中の無水K2CO3(3.6mg、0.026mmol)で処理されて、符号9c’を生成した(0.02g)。1H−NMR(CDCl3;400MHz):1.34−1.41(m、2H、H−4、H−5ax)、1.61−1.71(m、2H、H−5eq、CHHCH2O)、1.88−2.00(m、2H、H−2ax、CHHCH2O)、2.13−2.18(t、1H、J=10Hz、H6−ax)、2.38−2.52(m、2H、NCH2CHAr)、2.97−3.01(dd、1H、J=12、3.6Hz、H−2eq)、3.02−3.05(brd、1H、J=10.8Hz、H−6eq)、3.43−3.49(m、1H、H−3ax)、3.52−3.57(m、1H、CH2CHHO)、3.60−3.65(m、1H、CH2CHHO)、4.67−4.71(dd、1H、J=10.4、3.2Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.00−7.04(t、2H、ArH)、7.24−7.36(m、12H、ArH)。[a]25D=−45.78°(c=0.95、CHCl3)。遊離塩基は融点82ないし84℃のシュウ酸塩に変換された。分析はC28H32FNO3・(COOH)2・0.7H2O)のC、H、Nについて計算された。
【0123】
《(3S,4S)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((S)−2−(4−フルオロフェニル)−2−ヒドロキシエチル)ピペリジン−3−オール(9d’)(D−233)の合成》
図9について、留分I、すなわち、ジアステレオマ混合物8DのHPLC分離による符号8d’(0.02g、0.04mmol)はメタノール中の無水K2CO3(3.1mg、0.022mmol)で処理されて、符号9d’を生成した(0.017g)。1H−NMR(CDCl3;400MHz):1.40−1.51(m、2H、H−4、H−5ax)、1.60−1.70(m、2H、H−5eq、CHHCH2O)、1.87−1.98(m、2H、H−2ax、CHHCH2O)、2.26−2.31(t、1H、J=11.2Hz、H6−ax)、2.46−2.51(m、2H、NCH2CHAr)、2.77−2.80(brd、1H、J=12Hz、H−6eq)、3.33−3.37(dd、1H、J=10.4、3.2Hz、H−2eq)、3.44−3.50(m、1H、H−3ax)、3.52−3.57(m、1H、CH2CHHO)、3.61−3.65(m、1H、CH2CHHO)、4.74−4.78(t、1H、J=6.8Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.00−7.04(t、2H、ArH)、7.24−7.35(m、12H、ArH)。[a]25D=+14.3(c=0.65、CHCl3)。遊離塩基は融点164ないし166℃のシュウ酸塩に変換された。分析はC28H32FNO3・(COOH)2・0.1H2O)のC、H、Nについて計算された。
【0124】
《(3R,4R)−4−(2−(ベンズヒドリルオキシ)エチル)−1−((S)−2−(4−フルオロフェニル)−2−ヒドロキシエチル)ピペリジン−3−オール(9d)(D−232)の合成》
図9について、留分II、すなわち、ジアステレオマ混合物8DのHPLC分離による符号8d(0.02g、0.04)は、メタノール中の無水K2CO3(3.1mg、0.022mmol)で処理されて、符号9c’を生成した(0.017g)。1H−NMR(CDCl3;400MHz):1.33−1.39(m、2H、H−4、H−5ax)、1.61−1.71(m、2H、H−5eq、CHHCH2O)、1.88−2.00(m、2H、H−2ax、CHHCH2O)、2.12−2.17(t、1H、J=10.4Hz、H6−ax)、2.38−2.51(m、2H、NCH2CHAr)、2.97−3.00(dd、1H、J=11.2、4Hz、H−2eq)、3.02−3.05(brd、1H、J=11.2Hz、H−6eq)、3.42−3.48(m、1H、H−3ax)、3.52−3.57(m、1H、CH2CHHO)、3.60−3.65(m、1H、CH2CHHO)、4.67−4.70(dd、1H、J=10.4、3.2Hz、CH2CH(OH)Ar)、5.39(s、1H、PhCH(O)Ph)、7.00−7.04(t、2H、ArH)、7.23−7.34(m、12H、ArH)。[a]25D=+43.13°(c=0.8、CHCl3)。遊離塩基は融点84ないし86℃のシュウ酸塩に変換された。分析はC28H32FNO3・(COOH)2・0.7H2O)のC、H、Nについて計算された。
【0125】
表6(図13)は、ラットの脳の中のDAT、SERT、及びNETでの、図7、8、及び9で記載されるヒドロキシピペリジン誘導体の親和性を提供する。図14はGBR12909の構造を提供する。
【0126】
[IV.図10ないし12の化合物の合成]
分析用のシリカゲルでコーティングされたTLCプレート(Si 250F)はBaker社から購入され、UV光で、あるいはリンモリブデン酸(PMA)での処理によって可視化された。フラッシュクロマトグラフィはBaker Silica Gel 40mMで行われた。1H NMRスペクトルはVarian 400 MHz FT NMRで常に得られた。用いられたNMRの溶媒は、示されるようにCDCl3であった。TMSは内部標準として用いられた。元素分析はAtlantic Microlab社で行われ、理論値の±0.4%内であった。旋光度はPerkin−Elmer241旋光計で測定された。
【0127】
[3H]WIN35,428(83.6Ci/mmol)、[3H]ドーパミン(55.1Ci/mmol)、[3H]セロトニン(30.0Ci/mmol)、及び[3H]ノルエピネフリン(54.6Ci/mmol)は、Dupont−New England Nuclear社(米国マサチューセッツ州ボストン)から入手された。WIN35,428のナフタレンスルホン酸は、Biochemicals社(米国マサチューセッツ州ネーティック)から購入された。(−)−コカインHClは国立薬物乱用研究所から入手した。GBR12909のジヒドロクロリド(1−[2−[ビス(4−フルオロフェニル)メトキシ]エチル]−4−[3−フェニルプロピル]ピペラジン)はSIGMA−ALDRICH社(品番D−052;ミズーリ州セントルイス)から購入された。
【0128】
《N−(6−ベンズヒドリルピペリジン−3−イル)−4,7,7−トリメチル−3−オキソ−2−オキサビシクロ[2.2.1]ヘプタン−1−カルボキサミド(2a及び2b)の合成》
無水CH2Cl2(50ml)中のラセミのシス−6−ベンズヒドリルピペリジン−3−イルアミン1(1.10g、4.12mmol)及びトリエチルアミン(2.08g、20.64mmol)の攪拌溶液に、10mlの無水CH2Cl2に溶解された(1S)−(−)−カンファン酸クロリド(1.07g、4.95mmol)が窒素下で液滴添加された。反応混合物は0℃で30分間、窒素雰囲気下、室温で更に3時間、攪拌された。反応混合物は次いでCH2Cl2(50ml)で希釈され、水(20ml)で洗浄され、Na2SO4で乾燥させ、溶媒は減圧下で蒸発させて、2のジアステレオマ2a及び2bの混合物を提供した。各ジアステレオマは移動相としてヘキサン/ジエチルエーテル(12:88)を用いてシリカゲルでフラッシュカラムクロマトグラフィによって分離された。
【0129】
第1の溶出は符号2a(0.51g、55%)であった。1H NMR(400MHz、CDCl3):δ0.89(3H、s、CH3)、1.09(3H、s、CH3)、1.11(3H、s、CH3)、1.37−1.41(1H、m、H−5)、1.48−1.56(1H、m、H−5)、1.65−1.72(2H、m、CCH2C)、1.82−1.97(3H、m、CCH2C及びH−4)、2.48−2.56(1H、m、H−4)、2.78−2.84(2H、m、H−2)、3.23(1H、dt、J=2.4Hz、J=10.4Hz、H−6)、3.79(1H、d、J=10.0Hz、(Ph)2CH)、4.09−4.12(1H、m、H−3)、7.13−7.37(8H、m、ArH)、7.39−7.41(2H、m、ArH)。
【0130】
第2の溶出は符号2b(0.45g、49%)であった。1H NMR(400MHz、CDCl3):δ0.82(3H、s、CH3)、1.02(3H、s、CH3)、1.05(3H、s、CH3)、1.32−1.35(1H、m、H−5)、1.43−1.52(1H、m、H−5)、1.57−1.64(2H、m、CCH2C)、1.71−1.90(3H、m、CCH2C及びH−4)、2.41−2.50(1H、m、H−4)、2.71−2.80(2H、m、H−2)、3.16(1H、dt、J=2.0Hz、J=10.4Hz、H−6)、3.71(1H、d、J=10.0Hz、(Ph)2CH)、4.01−4.07(1H、m、H−3)、7.07−7.30(8H、m、ArH)、7.33−7.35(2H、m、ArH)。
【0131】
《(−)−シス−6−ベンズヒドリルピペリジン−3−イルアミン(3)の合成》
濃HCl/MeOH(50ml、体積/体積の比率 1:4)中の符号2b(0.55g、1.23mmol)が72時間還流された。メタノールは次いで減圧下で50℃で乾燥され、残りの水溶液は飽和NaHCO3溶液によって中和された。溶液はCH2Cl2(3×50ml)で抽出された。総ての有機層は結合され、鹹水(50ml)で洗浄され、Na2SO4で乾燥させ、酢酸エチル/MeOH/Et3N(80:15:5)を用いて、シリカゲルでフラッシュカラムクロマトグラフィによって濃縮及び精製されて、白色固体(0.26g、79%)として符号3を提供した。1H NMR(400MHz、CDCl3):δ1.35−1.43(2H、m、H−5)、1.59−1.64(2H、m、H−4)、2.18(2H、広範な一重線、NH)、2.79−2.81(2H、m、H−2)、2.98−3.04(1H、m、H−3)、3.25(1H、dt、J=4Hz、J=10Hz、H−6ax)、3.80(1H、d、J=10.2Hz、(Ph)2CH)、7.12−7.40(10H、m、ArH)。[α]25D=(−)41.9°(c1、MeOH)。
【0132】
[手順A]
《(R)−2−[(3S,6S)−6−ベンズヒドリルピペリジン−3−イルアミノ)−1−(4−フルオロフェニル)エタノール(4a)の合成》
乾燥エタノール(20ml)中の(−)−シス−6−ベンズヒドリルピペリジン−3−イルアミン3(0.058g、0.217mmol)の攪拌溶液に、R−(−)−4−フルオロスチレンオキシド(0.045g、0.326mmol)が添加された。反応混合物は窒素雰囲気下で一晩還流された。溶媒は蒸発させて、生成物はジエチルエーテル/MeOH/Et3N(92:8:0.2)を用いて、シリカゲルでフラッシュカラムクロマトグラフィによって精製されて、符号4a(0.023g、26%)を提供した。1H NMR(400MHz、CDCl3):δ1.30−1.38(2H、m、H−5)、1.48−1.55(1H、m、H−4ax)、1.75−1.79(1H、m、H−4eq)、2.44−2.54(1H、dd、J=2.0Hz、J=10.0Hz、NHCH2)、2.71−2.78(2H、m、H−2)、2.86−2.90(1H、dd、J=3.2Hz、J=12.4Hz、NHCH2)、2.97−3.00(1H、m、H−3eq)、3.25(1H、dt、J=3.2Hz、J=9.6Hz、H−6ax)、3.75(1H、d、J=10Hz、(Ph)2CH)、4.60−4.64(1H、dd、J=3.2Hz、J=9.6Hz、CH−OH)、7.01(2H、t、J=8.4Hz、ArH)、7.13−7.37(12H、m、ArH)。遊離塩基は融点202ないし204℃のシュウ酸塩に変換された。[α]25D(シュウ酸塩)=(−)21.5°(c0.26、MeOH)。分析は(C26H29FN2O.2(COOH)2、0.5H2O)のC、H、Nについて計算された。
【0133】
《(S)−2−[(3S,6S)−6−ベンズヒドリルピペリジン−3−イルアミノ)−1−(4−フルオロフェニル)エタノール(4b)の合成》
化合物3(0.076g、0.285mmol)はS−(+)−4−フルオロスチレンオキシド(0.059g、0.427mmol)で還流されて(手順A)、符号4b(0.029g、25%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.38(2H、m、H−5)、1.47−1.53(1H、m、H−4ax)、1.79−1.83(1H、m、H−4eq)、2.43−2.53(1H、dd、J=2.8Hz、J=12.0Hz、NHCH2)、2.71−2.74(2H、m、H−2)、2.87−2.97(2H、m、NHCH2及びH−3eq)、3.25(1H、dt、J=3.2Hz、J=9.6Hz、H−6ax)、3.74(1H、d、J=10Hz、(Ph)2CH)、4.60−4.63(1H、dd、J=2.8Hz、J=8.8Hz、CH−OH)、7.01(2H、t、J=8.8Hz、ArH)、7.16−7.37(12H、m、ArH)。[α]25D(シュウ酸塩)=(+)19.2°(c0.38、MeOH)。遊離塩基は203ないし205℃のシュウ酸塩に変換された。分析は(C26H29FN2O.2(COOH)2、0.9H2O)のC、H、Nについて計算された。
【0134】
《(R)−1−[(3S,6S)−6−ベンズヒドリルピペリジン−3−イルアミノ)−3−フェニルプロパン−2−オール(4c)の合成》
化合物3(0.076g、0.285mmol)はR−(+)−2,3−エポキシプロピルベンゼン(0.057g、0.427mmol)と反応させた(手順A)。粗生成物はジエチルエーテル/MeOH/Et3N(90:10:0.2)を用いてフラッシュカラムクロマトグラフィによって精製され、符号4c(0.035g、30%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.34(2H、m、H−5)、1.44−1.52(1H、m、H−4ax)、1.72−1.75(1H、m、H−4eq)、2.32−2.38(1H、dd、J=2.8Hz、J=9.6Hz、NHCH2)、2.64−2.83(5H、m、H−2、NHCH2、Ph−CH2)、2.90−2.93(1H、m、H−3eq)、3.23(1H、dt、J=3.2Hz、J=10.0Hz、H−6ax)、3.73−3.83(2H、m、(Ph)2CH及びCH−OH)、7.12−7.31(13H、m、ArH)、7.35−7.36(2H、m、ArH)。遊離塩基の旋光度[α]25D=(−)38.9°(c0.57、MeOH)。遊離塩基は205ないし207℃のシュウ酸塩に変換された。分析は(C27H32N2O.2(COOH)2、0.5H2O)のC、H、Nについて計算された。
【0135】
《(S)−1−[(3S,6S)−6−ベンズヒドリルピペリジン−3−イルアミノ)−3−フェニルプロパン−2−オール(4d)の合成》
化合物3(0.075g、0.281mmol)はS−(−)−2,3−エポキシプロピルベンゼン(0.056g、0.422mmol)と反応させ(手順A)、ジエチルエーテル/MeOH/Et3N(90:10:0.2)を用いてシリカゲルでフラッシュカラムクロマトグラフィによって精製されて、符号4d(0.037g、33%)を提供した。1H NMR(400MHz、CDCl3):δ1.23−1.35(2H、m、H−5)、1.41−1.49(1H、m、H−4ax)、1.75−1.78(1H、m、H−4eq)、2.36−2.41(1H、dd、J=3.2Hz、J=8.8Hz、NHCH2)、2.66−2.84(5H、m、H−2、NHCH2、Ph−CH2)、2.89−2.92(1H、m、H−3eq)、3.23(1H、dt、J=2.4Hz、J=10.0Hz、H−6ax)、3.75(1H、d、J=10.0Hz、(Ph)2CH)3.78−3.85(1H、m、及びCH−OH)、7.12−7.31(13H、m、ArH)、7.35−7.36(2H、m、ArH)。旋光度[α]25D=(−)49.3°(c0.96、MeOH)。遊離塩基は206ないし209℃のシュウ酸塩に変換された。分析は(C27H32N2O.2(COOH)2、0.3H2O)のC、H、Nについて計算された。
【0136】
《1−((5S,8S)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン−2−イル)−3−フェニルプロパン−2−オール(6a及び6b)の合成》
乾燥エタノール中のシス−(−)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン5(0.100g、0.341mmol)の攪拌溶液に、2,3−エポキシプロピルベンゼン(0.068g、0.512mmol)が添加された。反応混合物は65℃で一晩攪拌された(手順A)。ジアステレオマは移動相としてアセトン/ジエチルエーテル(20:80)を用いて、調製用TLCによって分離されて、符号6a及び6bを提供した。上方の留分は符号6a(0.026g、18%)を提供した。1H NMR(400MHz、CDCl3):δ1.24−1.43(2H、m、H−7)、1.54−1.66(1H、m、H−6ax)、2.03−2.06(1H、m、H−6eq)、2.28(1H、t、J=12.4Hz、NCH2CH)、2.39(1H、bs、H−5)、2.57−2.87(6H、m、NCH2CH、NCH2CH2N、Ph−CH2)、2.98−3.01(1H、m、H−9ax)、3.10(1H、bd、J=11.8Hz、NCH2CH2N)、3.22−3.25(1H、m、H−9eq)3.77(1H、dt、J=4.8Hz、J=11.2Hz、H−8ax)、3.84−3.91(2H、m、CH−OH、(Ph)2CH)、7.11−7.15(2H、m、ArH)、7.19−7.31(11H、m、ArH)、7.35−7.38(2H、m、ArH)。[α]25D(シュウ酸塩)=(−)24.7°(c0.42、MeOH)。分析は(C29H34N2O.2(COOH)2)のC、H、Nについて計算された。
【0137】
下方の留分は符号6b(0.024g、16%)を提供した。1H NMR(400MHz、CDCl3):δ1.22−1.29(1H、m、H−7ax)、1.34−1.42(1H、m、H−7eq)、1.47−1.56(1H、m、H−6ax)、2.02−2.07(1H、m、H−6eq)、2.20(1H、dd、J=10.8Hz、J=2.4Hz、NCH2CH)、2.48(1H、bm、H−5)、2.67(1H、dd、J=8.0Hz、J=5.6Hz、NCH2CH)、2.75−3.10(7H、m、NCH2CH2N、Ph−CH2、H−9ax)、3.17−3.20(1H、m、H−9eq)3.75(1H、dt、J=4.8Hz、J=11.3Hz、H−8ax)、3.83−3.90(2H、m、CH−OH、(Ph)2CH)、7.12−7.15(2H、m、ArH)、7.19−7.30(11H、m、ArH)、7.33−7.38(2H、m、ArH)。[α]25D(シュウ酸塩)=(−)31.2°(c0.40、MeOH)。分析は(C29H34N2O.2(COOH)2)のC、H、Nについて計算された。
【0138】
《(R)−2−((5S,8S)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−フェニルエタノール(7a)の合成》
乾燥エタノール中のシス−(−)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン5(0.065g、0.222mmol)の攪拌溶液に、R−(+)−2−フェニルオキシラン(0.04g、0.333mmol)が添加された(手順A)。化合物はジエチルエーテル/MeOH(9:1)を用いることによってフラッシュカラムクロマトグラフィによって精製されて、符号7a(0.051g、56%)を提供した。1H NMR(400MHz、CDCl3):δ1.26−1.33(1H、m、H−7ax)、1.38−1.47(1H、m、H−7eq)、1.54−1.63(1H、m、H−6ax)、2.00−2.03(1H、m、H−6eq)、2.38−2.47(2H、m、NCH2CH、H−5)、2.77(1H、dd、J=3.6Hz、J=12.4Hz、NCH2CH)、2.82−2.99(3H、m、NCH2CH2N)3.03−3.06(1H、m、H−9ax)、3.17−3.19(1H、m、NCH2CH2N)、3.29−3.33(1H、m、H−9eq)3.80(1H、dt、J=4.4Hz、J=10.8Hz、H−8ax)、3.91(1H、d、J=11.6Hz、(Ph)2CH)、4.69(1H、dd、J=3.2Hz、J=11.2Hz、CHOH)、7.10−7.38(15H、m、ArH)。[α]25D=(−)52.3°(c0.52、MeOH)。遊離塩基は194ないし197℃のシュウ酸塩に変換された。分析は(C28H32N2O.2(COOH)2)のC、H、Nについて計算された。
【0139】
《(S)−2−((5S,8S)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−フェニルエタノール(7b)の合成》
化合物5(0.060g、0.205mmol)はS−(−)−2−フェニルオキシラン(0.036g、0.307mmol)と反応させて(手順A)、符号7b(0.045g、53%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.34(1H、m、H−7ax)、1.38−1.49(1H、m、H−7eq)、1.54−1.65(1H、m、H−6ax)、2.22−2.27(1H、m、H−6eq)、2.34(1H、dd、J=2.8Hz、J=10.4Hz、NCH2CH)、2.46−2.49(1H、m、NCH2CH2N)、2.64(1H、bs、H−5)、2.91−3.11(6H、m、NCH2CH2N、NCH2CH、H−9ax)、3.24−3.27(1H、m、H−9eq)3.72−3.83(1H、m、H−8ax)、3.88(1H、d、J=11.6Hz、(Ph)2CH)、4.67(1H、dd、J=3.6Hz、J=10.0Hz、CHOH)、7.10−7.37(15H、m、ArH)。[α]25D=(−)45.8°(c0.52、MeOH)。遊離塩基は193ないし195℃のシュウ酸塩に変換された。分析は(C28H32N2O.2(COOH)2、0.3H2O)のC、H、Nについて計算された。
【0140】
《(R)−2−((5S,8S)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−4−フルオロフェニル)エタノール(7c)の合成》
化合物5(0.060g、0.205mmol)はR−(−)−2−(4−フルオロフェニル)オキシラン(0.042g、0.307mmol)(手順A)と反応させて、符号7c(0.034g、39%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.32(1H、m、H−7ax)、1.35−1.47(1H、m、H−7eq)、1.54−1.64(1H、m、H−6ax)、2.00−2.03(2H、m、H−6eq)、2.32−2.38(1H、dd、J=11.2Hz、J=0.8Hz、NCH2CH)、2.44(1H、bs、H−5)、2.73(1H、dd、J=3.6Hz、J=12.8Hz、NCH2CH)、2.79−2.96(3H、m、NCH2CH2N)、3.02−3.06(1H、m、H−9ax)、3.16−3.19(1H、bm、NCH2CH2N)、3.27−3.31(1H、m、H−9eq)、3.75−3.86(1H、m、H−8ax)、3.90(1H、d、J=11.2Hz、(Ph)2CH)、4.66(1H、dd、J=3.2Hz、J=10.8Hz、CHOH)、7.03(2H、t、J=8.4Hz、ArH)、7.10−7.38(12H、m、ArH)。[α]25D(遊離塩基)=(−)45.5°(c0.57、MeOH)。遊離塩基は189ないし191℃のシュウ酸塩に変換された。分析は(C28H31FN2O.2(COOH)2、0.2H2O)のC、H、Nについて計算された。
【0141】
《(S)−2−((5S,8S)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−4−フルオロフェニル)エタノール(7d)の合成》
化合物5(0.070g、0.239mmol)はS−(+)−2−(4−フルオロフェニル)オキシラン(0.049g、0.358mmol)と反応させて(手順A)、符号7d(0.040g、39%)を提供した。1H NMR(400MHz、CDCl3):δ1.27−1.34(1H、m、H−7ax)、1.37−1.49(1H、m、H−7eq)、1.59−1.68(1H、m、H−6ax)、2.20−2.32(2H、m、H−6eq、NCH2CH)、2.45−2.49(1H、m、NCH2CH2N)、2.62(1H、bs、H−5)、2.91−3.11(5H、m、NCH2CH2N、NCH2CH、H−9ax)、3.23−3.28(1H、m、H−9eq)、3.75−3.82(1H、m、H−8ax)、3.88(1H、d、J=11.2Hz、(Ph)2CH)、4.64(1H、dd、J=3.2Hz、J=10.0Hz、CHOH)、6.99−7.04(2H、m、ArH)、7.10−7.37(12H、m、ArH)。[α]25D(遊離塩基)=(−)44.0°(c0.56、MeOH)。遊離塩基は191−193℃のシュウ酸塩に変換された。分析は(C28H31FN2O.2(COOH)2、0.3H2O)のC、H、Nについて計算された。
【0142】
《3−((1S,6S)−6−ベンズヒドリル−2,5−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−(4−フルオロフェニル)プロパン−1−オン(8)の合成》
乾燥アセトニトリル中のシス−(−)−8−ベンズヒドリル−1,4−ジアザビシクロ[3.3.1]ノナン5(0.250g、0.854mmol)の攪拌溶液に、K2CO3(0.354g、2.56mmol)、次いで3−クロロ−4’−フルオロプロピオフェノン(0.207g、1.11mmol)が添加された。触媒量のヨウ化カリウムが添加され、反応混合物は窒素雰囲気下で3時間還流された。溶媒の蒸発後、残留物は水に溶解され、CH2Cl2(2×100ml)で抽出され、Na2SO4で乾燥させ、蒸発させた。化合物はジエチルエーテル/MeOH/Et3N(93:7:0.2)を用いてフラッシュカラムクロマトグラフィによって精製されて、符号8(0.260g、68%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.34(1H、m、H−7ax)、1.34−1.45(1H、m、H−7eq)、1.48−1.58(1H、m、H−6ax)、2.20−2.23(1H、m、H−6eq)、2.52(1H、bs、H−5)、2.62−2.65(1H、m、NCH2CH2)、2.80−3.16(8H、m、NCH2CH2N、NCH2CH2、CH2CO、H−9ax)、3.20−3.23(1H、m、H−9eq)3.77(1H、dt、J=4.4Hz、J=11.2Hz、H−8ax)、3.89(1H、d、J=11.8Hz、(Ph)2CH)、7.08−7.15(2H、m、ArH)、7.20−7.28(6H、m、ArH)、7.36(2H、d、J=7.2Hz、ArH)、7.95−7.99(2H、dt、J=2.0Hz、J=5.2Hz、ArH)。
【0143】
《3−((1S,6S)−6−ベンズヒドリル−2,5−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−(4−フルオロフェニル)プロパン−1(R及びS)−オール(9)の合成》
25mlのTHFに溶解された化合物8(0.250g、0.564mmol)の攪拌溶液に、NaBH4(0.025g、0.677mmol)が添加され、次いで0.5mlの水が添加された。反応混合物はRTで3時間、窒素雰囲気下で攪拌された。水(5ml)は次いで反応混合物に添加された。溶媒は蒸発させ、残留物は水で溶解され、CH2Cl2(2×50ml)で抽出され、Na2SO4で乾燥させ、減圧下で蒸発させた。粗生成物はジエチルエーテル/MeOH/Et3N(93:8:0.2)を用いてフラッシュカラムクロマトグラフィによって精製されて、符号9(0.195g、79%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.41(2H、m、H−7ax、H−7eq)、1.47−1.95(3H、m、CH2CHOH、H−6ax)、2.09−2.18(1H、m、H−6eq)、2.59−2.96(6H、m、H−5、NCH2CH2、NCH2CH2N)、3.04(1H、d、J=13.2Hz、H−9ax)、3.12−3.25(2H、m、NCH2CH2N、H−9eq)、3.73−3.82(1H、m、H−8ax)、3.88(1H、dd、J=1.6Hz、J=11.6Hz、(Ph)2CH)、4.84−4.95(1H、m、CHOH)、7.00(2H、dt、J=1.6Hz、J=8.4Hz、ArH)、7.10−7.16(2H、m、ArH)、7.19−7.37(10H、m、ArH)。
【0144】
《3−((1S,6S)−6−ベンズヒドリル−2,5−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−(4−フルオロフェニル)プロピル−4,7,7−トリメチル−3−オキソ−2−オキサビシクロ[2.2.1]ヘプタン−1−カルボキシラート(10a及び10b)の合成》
0℃、窒素雰囲気下で、100mlの乾燥CH2Cl2中の3−((1S,6S)−6−ベンズヒドリル−2,5−ジアザビシクロ[3.3.1]ノナン−2−イル)−1−(4−フルオロフェニル)プロパン−1(R及びS)−オール9(0.195g、0.438mmol)、Et3N(0.088g、0.876mmol)、及びDMAP(10mg)の攪拌溶液に、10mlの乾燥CH2Cl2に溶解された(1S)−(−)−カンファン酸クロリド(0.123g、0.569mmol)が添加された。反応混合物は0℃で30分間、室温で3時間、窒素下で攪拌された。反応混合物は水(20ml)で急冷され、次いでCH2Cl2(50ml)で希釈された。有機層は分離されて、水層はCH2Cl2(2×50ml)で抽出され、Na2SO4で乾燥させ、減圧下で蒸発させた。粗生成物はジエチルエーテル/MeOH(95:5)を用いて、シリカゲルでフラッシュカラムクロマトグラフィによって精製されて、2のジアステレオマ10a及び10bの混合物(0.250g、91%)を提供した。ジアステレオマは順相カラム(Nova−pack Silica 6μm)を用いて半調製用HPLCによって分離された。ヘキサン/2−プロパノール/Et3N(92:8:0.3)は、12mL/分の流速を有する移動相として用いられた。2の留分は符号10a及び10bについてそれぞれ、保持時間2.83分及び3.30分で溶出された。
【0145】
第1の溶出は符号10a(0.115g、42%)であった。1H NMR(400MHz、CDCl3):δ0.79(3H、s、CH3)、0.97(3H、s、CH3)、1.07(3H、s、CH3)、1.24−1.49(2H、m、H−7ax、H−7eq)、1.62−1.68(1H、m、H−6ax)、1.84−2.07(3H、m、CH2CHO、H−6eq)、2.16−2.49(5H、m、H−5、CCH2C、NCH2CH2N)、2.59−2.63(1H、m、NCH2CH2N)、2.68−2.75(1H、m、NCH2CH2)、2.86−2.98(2H、m、NCH2CH2、H−9ax)、3.09−3.12(1H、m、NCH2CH2N)、3.18−3.21(1H、m、H−9eq)、3.75(1H、dt、J=4.4Hz、J=11.2Hz、H−8ax)、3.87(1H、d、J=11.2Hz、(Ph)2CH)、5.94(1H、t、J=7.2Hz、CHOCO)、6.97−7.03(2H、m、ArH)、7.09−7.14(2H、m、ArH)、7.19−7.27(6H、m、ArH)、7.30−7.37(4H、m、ArH)。第2の溶出は符号10b(0.105g、38%)であった。1H NMR(400MHz、CDCl3):δ0.88(3H、s、CH3)、0.98(3H、s、CH3)、1.09(3H、s、CH3)、1.23−1.52(2H、m、H−7ax、H−7eq)、1.62−1.68(1H、m、H−6ax)、1.84−1.99(2H、m、CH2CHO)、2.04−2.07(1H、m、H−6eq)、2.12−2.52(5H、m、H−5、CCH2C、NCH2CH2N)、2.68−2.75(1H、m、NCH2CH2)、2.84−2.92(1H、m、NCH2CH2)、2.95−2.99(1H、m、H−9ax)、3.08−3.11(1H、m、NCH2CH2N)、3.18−3.22(1H、m、H−9eq)、3.76(1H、dt、J=4.8Hz、J=11.2Hz、H−8ax)、3.87(1H、d、J=11.6Hz、(Ph)2CH)、5.92(1H、t、J=6.8Hz、CHOCO)、6.98−7.03(2H、m、ArH)、7.09−7.15(2H、m、ArH)、7.19−7.37(10H、m、ArH)。
【0146】
[手順B]
《(−)11aの合成》
第1の溶出するカンファン酸エステルの留分10a(0.075g、0.120mmol)は、室温で12時間、メタノール(20ml)中でK2CO3(20mg)で加水分解された。メタノールは蒸発させ、水(20ml)は添加され、生成物は酢酸エチル(2×50ml)で抽出された。有機層はNa2SO4で乾燥させ、減圧下で蒸発させた。粗生成物はジエチルエーテル/MeOH/Et3N(93:8:0.2)を用いて、シリカでフラッシュカラムクロマトグラフィによって精製されて、符号11a(0.048g、90%)を提供した。1H NMR(400MHz、CDCl3):δ1.25−1.44(2H、m、H−7ax、H−7eq)、1.54−1.69(2H、m、CH2CHOH、H−6ax)、1.80−1.90(1H、m、CH2CHOH)、2.15−2.18(1H、m、H−6eq)、2.63(1H、bs、H−5)、2.67−2.974(1H、m、NCH2CH2)、2.79−2.95(4H、m、NCH2CH2、NCH2CH2N)、3.04(1H、d、J=13.2Hz、H−9ax)、3.13−3.18(1H、m、NCH2CH2N)、3.22−3.25(1H、m、H−9eq)、3.79(1H、dt、J=4.8Hz、J=11.6Hz、H−8ax)、3.88(1H、d、J=11.6Hz、(Ph)2CH)、4.86(1H、dd、J=2.4Hz、J=9.6Hz、CHOH)、7.00(2H、t、J=8.8Hz、ArH)、7.11−7.16(2H、m、ArH)、7.19−7.37(10H、m、ArH)。[α]25D=(−)38.7°(c1.08、MeOH)。遊離塩基は191ないし193℃のシュウ酸塩に変換された。分析は(C29H33FN2O.2(COOH)2、1.5H2O)のC、H、Nについて計算された。
【0147】
《(−)11bの合成》
第2の溶出する留分10b(0.105g、0.168mmol)はメタノール(20ml)中でK2CO3(20mg)で加水分解されて、符号11b(0.071g、94%)を提供した(手順B)。1H NMR(400MHz、CDCl3):δ1.24−1.43(2H、m、H−7ax、H−7eq)、1.48−1.54(1H、m、H−6ax)、1.71−1.79(1H、m、CH2CHOH)、1.88−1.95(1H、m、CH2CHOH)、2.09−2.12(1H、m、H−6eq)、2.60−2.66(2H、m、H−5、NCH2CH2)、2.76−2.97(4H、m、NCH2CH2、NCH2CH2N)、3.04(1H、d、J=13.2Hz、H−9ax)、3.12−3.15(1H、m、NCH2CH2N)、3.21−3.24(1H、m、H−9eq)、3.78(1H、dt、J=4.8Hz、J=11.6Hz、H−8ax)、3.88(1H、d、J=11.6Hz、(Ph)2CH)、4.94(1H、dd、J=3.2Hz、J=7.6Hz、CHOH)、7.00(2H、t、J=8.4Hz、ArH)、7.10−7.16(2H、m、ArH)、7.20−7.37(10H、m、ArH)。[α]25D=(−)56.8°(c1.0、MeOH)。遊離塩基は193−195℃のシュウ酸塩に変換された。分析は(C29H33FN2O.2(COOH)2、0.5H2O)のC、H、Nについて計算された。
【0148】
[輸送体アッセイ]
ラットDATへの結合における、及びモノアミンの取り込みの阻害における試験化合物の親和性は、既述のようにモニタリングされた。簡潔に言うと、ラット線条体はDATによる[3H]WIN35,428の結合と、DATによる[3H]DAの取り込みとを測定するのに用いられた。ラットの大脳皮質は、SERTによる[3H]セロトニンの取り込みを評価するために用いられ、海馬はNETによる[3H]NEの取り込みを評価するために用いられた。DATでの非特異的な結合は100uMのコカインで規定され、DAT、SERT、及びNETでの非特異的な取り込みは、それぞれ100uMのコカイン、10uMのシタロプラム、及び10uMのデシプラミンで規定された。試験化合物はジメチルスルホキシド(DMSO)に溶解され、10%(v/v)のDMSOに希釈され、それ自身によってアッセイと干渉されない、0.5%の最終DMSO濃度を得てアッセイに添加された。各試験化合物の少なくとも5の三組の濃度が調査され、IC50値前後に均等に分布された。後者は非線形計算機の曲線適合手順によって測定され、チェン−プルソフ(Cheng−Prusoff)の式でKiに変換された。
【0149】
[図10ないし12の化合物に対する結果及び考察]
化合物4aないしb及び4cないしdの設計は、環外ヒドロキシル基の、3,6−二置換型の鋳型に導入することに関連した。化合物4aと4bとの間で、化合物4bはS−エポキシドから合成されるため、S型立体構造内にヒドロキシル基を有する。化合物4bは4aと比較して、DAT及びNETそれぞれによる、放射標識されるDA及びNEの取り込みの阻害についてより強力であった(符号4a及び4bについて、それぞれKi(DAT)=236nM、152nM、及び符号4a及び4bについて、それぞれKi(NET)=1435、306nM)。従って、2の化合物間のNE取り込みの阻害活性における差異は、DA取り込みの阻害活性よりも大きかった。
【0150】
更なる化合物の設計において、更なるメチレン単位がフェニル部分と、ヒドロキシルの中心との間に導入された。この変換によって、符号4cないしdは、符号4aないしbと比較して、より強力なDAT取り込み阻害剤となった(図15中の表7)。符号4c及び4dの双方は、DA取り込み活性の阻害に対し低いナノモル活性を示し(符号4c及び4dについてそれぞれ、Ki(DAT)=25nM、25.3nM)、更に、同一の相対効能が、放射標識されるトロパンリガンドであるCFTを有する結合アッセイで示された。双方の化合物が互角の阻害活性を示し、ヒドロキシルの中心のキラリティためのいかなる選択も示さないことに留意すべきことは興味深いことである。このように、分子構造中の微小な変化によって、符号4aないしbと比較して、符号4cないしdにおいてDAT阻害の効能のほぼ10倍の増加が得られた。
【0151】
更なるアナログの設計において、二環式の(−)−ジアミンの鋳型が環外ヒドロキシル基の導入用に選択された。このように化合物6a及び6bにおいて、符号4c及び4dの二環型を表わし、ヒドロキシル官能基はR型及びS型の立体中心とともに導入された。これらの分子はDA取り込みの阻害のための異なる効能を示し、ヒドロキシルのS型の立体中心はR型の立体中心よりも大きな効能を示した(符号6b、6aについて、それぞれKi(DAT)=16.8nM、82.9nM)。このように、この結果は、その3,6−二置換型の対応物4cないしdと比較して、ある程度異なっていた。化合物6bは6aよりもDA取り込みの阻害において5倍強力であった(表7)。このことによって、より限定的な二環構造の、DATに対するより大きな選択性及び親和性による効果が示された。次の系列の化合物7aないしdは、符号4aないしbのより限定的な二環型を表わし、DATに対し弱い効能から強い効能までの結果を提供した。しかしながら、環外ヒドロキシル基はR型の立体中心であり、これらの分子は先の誘導体とは逆に、DATと優先的な相互作用を生じた。符号7の系列で同定される最も強力な化合物は、フルオロ誘導体7cであり、DATに対し最大の効能を示した(Ki=66.5nM)。一般的に、フルオロ誘導体は、非置換型と比較して強力であった。一般的には、化合物7aないしdは6aないしbよりも効能が更に小さく、輸送体の相互作用におけるN−アルキル鎖の長さの重要性を示した。
【0152】
更なる2の二環式のアミンアナログ11a及び11bにおいて、ヒドロキシル基はベンジル位にプロピル鎖の終端で導入された。従って、これらの2の化合物において、ヒドロキシル基は先のアナログと比較すると、N原子から最も離れて配置された。ヒドロキシル基のこのような配置によって、ジアステレオマ11bのうちの1つにおけるDA取り込みの最大の阻害が生じたことは、取り込み阻害のデータから明らかである(Ki=8.63nM)。従って、化合物11bはセロトニン及びノルエピネフリンの双方の阻害と比較して、ドーパミン取り込みの阻害に対し最大の効能及び選択性を示した(SERT/DAT及びNET/DAT;172及び48.4、図16の表8)。実際に、化合物11bは、この分子の系の中で最も強力かつ選択的な化合物となった。他方、ジアステレオマ11aは、効能が系中の3番目に最良の化合物4dに匹敵するが(符号11a及び4dについてそれぞれ、Ki(DAT)=41.8nM及び25.3nM)、11bと比較して効能が小さかった。芳香環及びN原子に対するヒドロキシル基の位置が取り込み阻害活性に重要な役割を果たすことはこの結果から明らかである。図17は、図10ないし12の化合物に対する元素分析を提供する。
【0153】
本実施形態の化合物は、DATとの相互作用に最適なN−プロピルリンカの長さを含む。N−プロピル終端のベンジル位における環外のヒドロキシル基の位置は、本発明の系において最も能動的かつ選択的なDAT化合物11bを生成する。多くの場合においては、立体化学的な選択はヒドロキシルの立体中心で示された。一般的に、より制限的な二環式アミンから得られたヒドロキシル化合物は、3,6−二置換型のアミン誘導体よりもDATに対し大きな選択性を生じた。
【0154】
本発明の実施形態は例示及び記載されてきたが、これらの実施形態は本発明の総ての可能な形態を例示及び記載することを意図していない。逆に、本明細書中で用いられた用語は、限定ではなく説明の用語であり、様々な変更が本発明の精神及び範囲を逸脱することなくなされうることは理解されよう。
【特許請求の範囲】
【請求項1】
式:

を有する化合物であって、Aが、

であり、Bが、

であり、Xが−NH−、−NR4−及び−O−からなる群から選択され、
R4がC1−4アルキル、NH2、C1−4ヒドロキシアルキル、ハロゲン化されたC1−4アルキル、C2−4アルケニル、C2−4ヒドロキシアルケニル、ハロゲン化されたC2−4アルケニル、C2−4アルキニル、及びハロゲン化されたC2−4アルキニルであり、
Yが−H、−NH2、−OH、=O、又は−O−C(O)−R5であり、
lが0、1、又は2であり、
nが1又は2であり、
mが1、2、3、又は4であり、
oが0、1、2、3、又は4であり、
pが0、1、2、3、又は4であり、
qは0、1、2、又は3であり、
R、R1、及びR2がH、F、Cl、Br、I、CN、COOEt、OH、NO2、NH2、OR5からなる群から選択され、R5がC1−8アルキル、C5−6シクロアルキル、又はC2−8アルケニルであるか、あるいは、R2が5又は6員環のヘテロ環であり、
−(CH2)m−の1又はそれ以上のCH2基が、CR7R’7によって選択的に置換され、
R7がH、−OR11、又は−NR11であり、
R’7がH、又は−C1−8アルキルであるか、あるいはR7R’7が=Oとして相互に結合され、
R11がH、C1−8アルキル、C2−8アルキレン、C6−18アルキルアリール、又は−COOR12であり、
R12がC1−8アルキル、C2−8アルキレン、又はC6−18アルキルアリールであり;あるいは、
その薬学的に許容可能な塩又は誘導体であることを特徴とする化合物。
【請求項2】
請求項1に記載の化合物が、式:

を有し、Z1が−H、−NH2、−OH、=O、−O−アルキル、−O−アリール、又は−O−C(O)−R5であり、wが1又はそれ以上のメチレン基の1又はそれ以上の水素原子がZ1によって置換されることを表わす数値であることを特徴とする化合物。
【請求項3】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項4】
請求項1に記載の化合物において、Bが、

であることを特徴とする化合物。
【請求項5】
請求項2に記載の化合物において、Z1がHであることを特徴とする化合物。
【請求項6】
請求項2に記載の化合物において、Z1がOHであることを特徴とする化合物。
【請求項7】
請求項1に記載の化合物において、mが2であることを特徴とする化合物。
【請求項8】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項9】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項10】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項11】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項12】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項13】
請求項1に記載の化合物において、R2が、

からなる群から選択されるヘテロ環であり、R6はC1−4アルキル、あるいは置換型又は非置換型のフェニル又はナフチルであることを特徴とする化合物。
【請求項14】
式:

を有する化合物であって、Aが、

であり、Bが、

であり、
lが0、1、又は2であり、
mが1、2、3、又は4であり、
oが0、1、2、3、又は4であり、
pが0、1、2、3、又は4であり、
qが0、1、2、又は3であり、
R、R1、及びR2がH、F、Cl、CN、COOEt、OH、NO2、NH2、OR5からなる群から選択され、R5がC1−8アルキル、C5−6シクロアルキル、又はC2−8アルケニルであるか、あるいは、R2が5又は6員環のヘテロ環であり、
−(CH2)m−の1又はそれ以上のCH2基が、CR7R’7によって選択的に置換され、
R7がH、−OR11、又は−NR11であり、
R’7がH、又は−C1−8アルキルであるか、あるいはR7R’7が=Oとして相互に結合され、
R11がH、C1−8アルキル、C2−8アルキレン、C6−18アルキルアリール、又は−COOR12であり、
R12がC1−8アルキル、C2−8アルキレン、又はC6−18アルキルアリールであり、
R20及びR21がそれぞれ独立に、水素又は置換型又は非置換型の炭化水素基であるか、あるいは環を形成するように相互に結合されることを特徴とする化合物。
【請求項15】
請求項14に記載の化合物が、式:

を有し、uが1、2、又は3であることを特徴とする化合物。
【請求項16】
請求項14に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項17】
請求項14に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項18】
請求項14に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項19】
請求項14に記載の化合物において、前記(CH2)mの1又はそれ以上の水素原子がZ1によって置換され、Z1が−H、−NH2、−OH、=O、−O−アルキル、−O−アリール、又は−O−C(O)−R5であることを特徴とする化合物。
【請求項20】
請求項14に記載の化合物において、R2が、

からなる群から選択されるヘテロ環であり、R6はC1−4アルキル、あるいは置換型又は非置換型のフェニル又はナフチルであることを特徴とする化合物。
【請求項1】
式:

を有する化合物であって、Aが、

であり、Bが、

であり、Xが−NH−、−NR4−及び−O−からなる群から選択され、
R4がC1−4アルキル、NH2、C1−4ヒドロキシアルキル、ハロゲン化されたC1−4アルキル、C2−4アルケニル、C2−4ヒドロキシアルケニル、ハロゲン化されたC2−4アルケニル、C2−4アルキニル、及びハロゲン化されたC2−4アルキニルであり、
Yが−H、−NH2、−OH、=O、又は−O−C(O)−R5であり、
lが0、1、又は2であり、
nが1又は2であり、
mが1、2、3、又は4であり、
oが0、1、2、3、又は4であり、
pが0、1、2、3、又は4であり、
qは0、1、2、又は3であり、
R、R1、及びR2がH、F、Cl、Br、I、CN、COOEt、OH、NO2、NH2、OR5からなる群から選択され、R5がC1−8アルキル、C5−6シクロアルキル、又はC2−8アルケニルであるか、あるいは、R2が5又は6員環のヘテロ環であり、
−(CH2)m−の1又はそれ以上のCH2基が、CR7R’7によって選択的に置換され、
R7がH、−OR11、又は−NR11であり、
R’7がH、又は−C1−8アルキルであるか、あるいはR7R’7が=Oとして相互に結合され、
R11がH、C1−8アルキル、C2−8アルキレン、C6−18アルキルアリール、又は−COOR12であり、
R12がC1−8アルキル、C2−8アルキレン、又はC6−18アルキルアリールであり;あるいは、
その薬学的に許容可能な塩又は誘導体であることを特徴とする化合物。
【請求項2】
請求項1に記載の化合物が、式:

を有し、Z1が−H、−NH2、−OH、=O、−O−アルキル、−O−アリール、又は−O−C(O)−R5であり、wが1又はそれ以上のメチレン基の1又はそれ以上の水素原子がZ1によって置換されることを表わす数値であることを特徴とする化合物。
【請求項3】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項4】
請求項1に記載の化合物において、Bが、

であることを特徴とする化合物。
【請求項5】
請求項2に記載の化合物において、Z1がHであることを特徴とする化合物。
【請求項6】
請求項2に記載の化合物において、Z1がOHであることを特徴とする化合物。
【請求項7】
請求項1に記載の化合物において、mが2であることを特徴とする化合物。
【請求項8】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項9】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項10】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項11】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項12】
請求項1に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項13】
請求項1に記載の化合物において、R2が、

からなる群から選択されるヘテロ環であり、R6はC1−4アルキル、あるいは置換型又は非置換型のフェニル又はナフチルであることを特徴とする化合物。
【請求項14】
式:

を有する化合物であって、Aが、

であり、Bが、

であり、
lが0、1、又は2であり、
mが1、2、3、又は4であり、
oが0、1、2、3、又は4であり、
pが0、1、2、3、又は4であり、
qが0、1、2、又は3であり、
R、R1、及びR2がH、F、Cl、CN、COOEt、OH、NO2、NH2、OR5からなる群から選択され、R5がC1−8アルキル、C5−6シクロアルキル、又はC2−8アルケニルであるか、あるいは、R2が5又は6員環のヘテロ環であり、
−(CH2)m−の1又はそれ以上のCH2基が、CR7R’7によって選択的に置換され、
R7がH、−OR11、又は−NR11であり、
R’7がH、又は−C1−8アルキルであるか、あるいはR7R’7が=Oとして相互に結合され、
R11がH、C1−8アルキル、C2−8アルキレン、C6−18アルキルアリール、又は−COOR12であり、
R12がC1−8アルキル、C2−8アルキレン、又はC6−18アルキルアリールであり、
R20及びR21がそれぞれ独立に、水素又は置換型又は非置換型の炭化水素基であるか、あるいは環を形成するように相互に結合されることを特徴とする化合物。
【請求項15】
請求項14に記載の化合物が、式:

を有し、uが1、2、又は3であることを特徴とする化合物。
【請求項16】
請求項14に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項17】
請求項14に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項18】
請求項14に記載の化合物が、式:

を有することを特徴とする化合物。
【請求項19】
請求項14に記載の化合物において、前記(CH2)mの1又はそれ以上の水素原子がZ1によって置換され、Z1が−H、−NH2、−OH、=O、−O−アルキル、−O−アリール、又は−O−C(O)−R5であることを特徴とする化合物。
【請求項20】
請求項14に記載の化合物において、R2が、

からなる群から選択されるヘテロ環であり、R6はC1−4アルキル、あるいは置換型又は非置換型のフェニル又はナフチルであることを特徴とする化合物。
【図1】


【図2】


【図3】


【図4】


【図5A】


【図5B】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5A】


【図5B】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公表番号】特表2011−510022(P2011−510022A)
【公表日】平成23年3月31日(2011.3.31)
【国際特許分類】
【出願番号】特願2010−543316(P2010−543316)
【出願日】平成21年1月22日(2009.1.22)
【国際出願番号】PCT/US2009/031666
【国際公開番号】WO2009/094428
【国際公開日】平成21年7月30日(2009.7.30)
【出願人】(508205671)ウェイン ステイト ユニバーシティー (2)
【Fターム(参考)】
【公表日】平成23年3月31日(2011.3.31)
【国際特許分類】
【出願日】平成21年1月22日(2009.1.22)
【国際出願番号】PCT/US2009/031666
【国際公開番号】WO2009/094428
【国際公開日】平成21年7月30日(2009.7.30)
【出願人】(508205671)ウェイン ステイト ユニバーシティー (2)
【Fターム(参考)】
[ Back to top ]

