N−(ジヒドロキシアルキル)ジエチレントリアミン類、その組成物、及びそれを用いた2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法
【課題】 安価で工業的に安定的に得られる原料を用いて、発火の危険性が高い還元剤を用いることなく、簡便且つ安全に少ない工程数で2−ヒドロキシ(アルキル)トリエチレンジアミン類を効率的に合成する方法を提供するとともに、そのための原料として、新規なN−(ジヒドロキシアルキル)ジエチレントリアミン類又はその組成物、ジ置換ヒドロキシアルキルピペラジン類又はその組成物を提供する。
【解決手段】 ジ置換ヒドロキシアルキルピペラジン類を、酸触媒の存在下で分子内脱水縮合反応させて2−ヒドロキシ(アルキル)トリエチレンジアミン類を製造する。ジ置換ヒドロキシアルキルピペラジン類はN−(ジヒドロキシアルキル)ジエチレントリアミン類を、酸触媒、ラネー金属触媒、又はそれら両方の存在下で分子内脱水縮合反応させて得られる。N−(ジヒドロキシアルキル)ジエチレントリアミン類はハロゲン化ジオールと、N−(2−アミノエチル)ジエチレトリアミンとを反応させて得られる。
【解決手段】 ジ置換ヒドロキシアルキルピペラジン類を、酸触媒の存在下で分子内脱水縮合反応させて2−ヒドロキシ(アルキル)トリエチレンジアミン類を製造する。ジ置換ヒドロキシアルキルピペラジン類はN−(ジヒドロキシアルキル)ジエチレントリアミン類を、酸触媒、ラネー金属触媒、又はそれら両方の存在下で分子内脱水縮合反応させて得られる。N−(ジヒドロキシアルキル)ジエチレントリアミン類はハロゲン化ジオールと、N−(2−アミノエチル)ジエチレトリアミンとを反応させて得られる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はN−(ジヒドロキシアルキル)ジエチレントリアミン類、その組成物、及びそれを用いた2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法に関する。
【0002】
本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類、及びその組成物は、2−ヒドロキシ(アルキル)トリエチレンジアミン類の原料として有用である。
【背景技術】
【0003】
2−ヒドロキシ(アルキル)トリエチレンジアミン類は、医農薬中間体、有機合成用触媒、ウレタン樹脂化触媒、化学吸着剤、抗菌剤等に有用であることが知られている(例えば、特許文献1参照)。
【0004】
従来の2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法としては、例えば、N−(ジヒドロキシアルキル)エチレンジアミン類から中間体となるヒドロキシアルキルピペラジン類を合成し(例えば、特許文献1、特許文献2参照)、次いで、得られたヒドロキシアルキルピペラジン類を、アルキレンオキサイドとの反応でジ置換ヒドロキシアルキルピペラジン類として、更に酸触媒の存在下で分子内縮合反応させる製法が報告されている(例えば、特許文献1参照)。
【0005】
しかしながら、上記の製造法は反応の工程数が多く、更に簡略化した製法が求められていた。
【0006】
また他の合成法として、ピペラジンと2,3−ジブロモプロピオン酸エチルとをトルエン又はベンゼンのような不活性溶媒中で反応させて1,4−ジアザビシクロ[2.2.2]オクタン−2−カルボン酸エチルを調製し、次いで得られたエステルを、例えば水素化リチウムアルミニウムを用いて還元する二段階での合成方法が知られている(例えば、特許文献3参照)。
【0007】
しかしながら、この製造方法では、ピペラジンと2,3−ジブロモプロピオン酸エチルとを低い基質濃度で反応させる必要があるため生産性に劣るという欠点を有する。また次反応を効率良く行うため、第一工程で得られる生成物は単離、精製する必要があった。次に第二工程では、還元剤として発火の危険性が高い水素化リチウムアルミニウムを使用するため、工業的にも好ましいとは言えない。更にまた、原料として用いるピペラジンが高価であり、特に2,3−ジブロモプロピオン酸エチルが非常に高価であるため、実用的とは言い難い。
【0008】
以上のように、安価で工業的に安定的に得られる原料を用いて、発火の危険性が高い還元剤を用いることなく、簡便且つ安全に少ない工程数でヒドロキシ(アルキル)トリエチレンジアミン類を効率的に合成することは極めて困難であった。
【0009】
一方、粗2−ヒドロキシエチルジエチレントリアミンの20%水溶液からリン酸担持触媒を用いて分子内で脱水環化するとトリエチレンジアミンが得られることが報告されている(例えば、特許文献4参照)。
【0010】
しかしながら、2−ヒドロキシ(アルキル)トリエチレンジアミン類の合成に有用と考えられる、N−(ジヒドロキシアルキル)ジエチレントリアミン類の生成を確認した例は、これまで報告されていなかった。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】国際公開第2009/145320号パンフレット
【特許文献2】オーストリア国特許第227,268号明細書
【特許文献3】特開2001−504855号公報
【特許文献4】米国特許第4,757,143号明細書
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、上記の背景技術に鑑みてなされたものであり、その目的は、安価で工業的に安定的に得られる原料を用いて、発火の危険性が高い還元剤を用いることなく、簡便且つ安全に少ない工程数でヒドロキシ(アルキル)トリエチレンジアミンを製造する方法を提供すること、及びこのような原料として、新規なN−(ジヒドロキシアルキル)ジエチレントリアミン類、及びその組成物を提供することである。
【課題を解決するための手段】
【0013】
本発明者らは、上記課題を解決すべく、鋭意検討を重ねた結果、本発明を完成するに至った。
【0014】
すなわち、本発明は以下に示すとおり、N−(ジヒドロキシアルキル)ジエチレントリアミン類、その組成物、及びそれを用いた2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法に関するものである。
【0015】
[1]下記式(1)
【0016】
【化1】

【0017】
(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示されるN−(ジヒドロキシアルキル)ジエチレントリアミン類。
【0018】
[2]下記式(2)
【0019】
【化2】

【0020】
(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示されるN−(ジヒドロキシアルキル)ジエチレントリアミン類。
【0021】
[3]下記式(1)
【0022】
【化3】

【0023】
(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示される化合物と下記式(2)
【0024】
【化4】

【0025】
(式中、R、nは上記と同じ定義である。)
で示される化合物とを含有することを特徴とするN−(ジヒドロキシアルキル)ジエチレントリアミン組成物。
【0026】
[4]式(1)で示される化合物に対し、式(2)で示される化合物を、97:3〜80:20(モル比)の割合で含有することを特徴とする上記[3]に記載のN−(ジヒドロキシアルキル)ジエチレントリアミン組成物。
【0027】
[5]下記式(3)
【0028】
【化5】

【0029】
(上記式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、Xはハロゲン原子を表し、nは0〜6の整数を表す。)
で示されるハロゲン化ジオールと、N−(2−アミノエチル)ジエチレトリアミンとを反応させることを特徴とする上記[1]乃至[4]のいずれかに記載のN−(ジヒドロキシアルキル)ジエチレントリアミンの製造方法。
【0030】
[6]下記式(4)
【0031】
【化6】

【0032】
(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示されるジ置換ヒドロキシアルキルピペラジン類。
【0033】
[7]下記式(5)
【0034】
【化7】

【0035】
(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示されるジ置換ヒドロキシアルキルピペラジン類。
【0036】
[8]下記式(4)
【0037】
【化8】

【0038】
(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される化合物と、下記式(5)
【0039】
【化9】

【0040】
(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される化合物とを含有することを特徴とするジ置換ヒドロキシアルキルピペラジン類組成物。
【0041】
[9]上記[1]乃至[4]のいずれかに記載のN−(ジヒドロキシアルキル)ジエチレントリアミンを、酸触媒、ラネー金属触媒、又はそれら両方の存在下で分子内脱水縮合反応させることを特徴とする上記[6]乃至[8]のいずれかに記載のジ置換ヒドロキシアルキルピペラジン類の製造方法。
【0042】
[10]ラネー金属触媒が、ラネー銅触媒を含むことを特徴とする上記[9]に記載の製造方法。
【0043】
[11]酸触媒が、無機リン化合物、該無機リン化合物の金属塩、及び有機リン化合物からなる群より選択される化合物を含むことを特徴とする上記[9]又は[10]に記載の製造方法。
【0044】
[12]上記[6]乃至[8]のいずれかに記載のジ置換ヒドロキシアルキルピペラジン類を、酸触媒の存在下で分子内脱水縮合反応させることを特徴とする下記式(6)
【0045】
【化10】

【0046】
(式中、Rは水素原子又は直鎖状若しくは分枝状の炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法。
【0047】
[13]酸触媒が、無機リン化合物、該無機リン化合物の金属塩、及び有機リン化合物からなる群より選択される化合物を含むことを特徴とする上記[12]に記載の製造方法。
【発明の効果】
【0048】
本発明により、安価で工業的に安定的に得られる原料を用いて、発火の危険性が高い還元剤を用いることなく、簡便且つ安全に少ない工程数でヒドロキシ(アルキル)トリエチレンジアミンを製造する方法を提供することができる。
【0049】
また、本発明は、このような原料として、新規なN−(ジヒドロキシアルキル)ジエチレントリアミン類又はその組成物、ジ置換ヒドロキシアルキルピペラジン類又はその組成物を提供するものであり、産業上極めて有用である。
【図面の簡単な説明】
【0050】
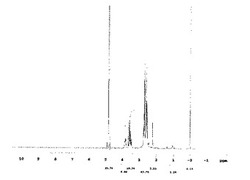
【図1】実施例1で得られたN−(2,3−ジヒドロキシプロピル)ジエチレントリアミン(ピーク1化合物)の1H−NMR(溶媒D2O、酢酸含有品)ピークを示す図である。
【図2】実施例1で得られたN−(2,3−ジヒドロキシプロピル)ジエチレントリアミン(ピーク2化合物)の1H−NMR(溶媒D2O、酢酸含有品)ピークを示す図である。
【図3】実施例1で得られたN−(2,3−ジヒドロキシプロピル)ジエチレントリアミン(ピーク1化合物)の13C−NMR(溶媒D2O、酢酸含有品)ピークを示す図である。
【図4】実施例1で得られたN−(2,3−ジヒドロキシプロピル)ジエチレントリアミン(ピーク2化合物)13C−NMR(溶媒D2O、酢酸含有品)ピークを示す図である。
【発明を実施するための形態】
【0051】
以下、本発明を詳細に説明する。
【0052】
まず、本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類、及びその組成物について説明する。
【0053】
本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類は上記式(1)又は上記式(2)で示される化合物である。
【0054】
また、本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類組成物は、上記式(1)で示される化合物と、上記式(2)で示される化合物とを含有することをその特徴とする。
【0055】
上記式(1)及び式(2)中、置換基Rは水素原子又は炭素数1〜4のアルキル基を表す。炭素数1〜4のアルキル基としては、具体的には、メチル基、エチル基、プロピル基、イソプロピル基、n−ブチル基、イソブチル基、t−ブチル基等が例示される。これらのうち、水素原子、メチル基、エチル基が好ましい。
【0056】
また、上記式(1)及び式(2)中、nは0〜6の整数を表し、0〜2の整数がより好ましい。
【0057】
上記式(1)又は式(2)で示されるN−(ジヒドロキシアルキル)ジエチレントリアミン類としては、特に限定するものではないが、例えば、N−(ジヒドロキシプロピル)ジエチレントリアミン、N−(ジヒドロキシブチル)ジエチレントリアミン、N−(ジヒドロキシヘキシル)ジエチレントリアミン等が挙げられる。
【0058】
本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類、又はその組成物は、例えば、ジエチレントリアミンとグリシドールの付加反応により得られるし、ジエチレントリアミンとグリセリンを酸触媒存在下で脱水縮合反応することによっても得られる。また、ジエチレントリアミンと上記式(3)で示されるハロゲン化ジオールとを反応することによっても得ることができる。これらのうち、コスト面及び反応収率を考慮すると、ジエチレントリアミンと上記式(3)で示されるハロゲン化ジオールとを反応させる方法がより好ましい。
【0059】
上記の方法により、本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類は、上記式(1)で示される化合物と、上記式(2)で示される化合物とを、通常97:3〜80:20(モル比)の割合で含有する組成物として得られる。
【0060】
次に本発明のジ置換ヒドロキシアルキルピペラジン類、及びその組成物について説明する。
【0061】
本発明のジ置換ヒドロキシアルキルピペラジン類は上記式(4)又は式(5)で示される化合物である。
【0062】
また、本発明のジ置換ヒドロキシアルキルピペラジン類組成物は、上記式(4)で示される化合物と上記式(5)で示される化合物とを含有することをその特徴とする。
【0063】
上記式(4)及び式(5)中、置換基Rは水素原子又は炭素数1〜4のアルキル基を表す。炭素数1〜4のアルキル基としては、具体的には、メチル基、エチル基、プロピル基、イソプロピル基、n−ブチル基、イソブチル基、t−ブチル基等が例示される。これらのうち、水素原子、メチル基、エチル基が好ましい。
【0064】
また、上記式(4)及び式(5)中、nは0〜6の整数を表し、0〜2の整数がより好ましい。
【0065】
次に本発明のジ置換ヒドロキシアルキルピペラジン類、又はその組成物は、例えば、本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類、又はその組成物を、酸触媒、ラネー金属触媒又はそれらの両方の存在下で分子内脱水縮合反応させることにより得ることができる。
【0066】
上記の方法において、酸触媒としては、特に限定するものではないが、例えば、金属リン酸塩、有機リン化合物等のリン含有物質、窒素含有物質、硫黄含有物質、ニオブ含有物質、シリカ、アルミナ、シリカ−アルミナ、シリカ−チタニア、ゼオライト、ヘテロポリ酸、第4B族金属酸化物縮合触媒、第6B族金属含有縮合触媒、ブレンステッド酸、ルイス酸等が挙げられる。これらのうち、金属リン酸塩、有機リン化合物等のリン含有物質が特に好ましい。
【0067】
金属リン酸塩としては、特に限定するものではないが、例えば、リン酸、亜リン酸、次亜リン酸等の金属塩が挙げられる。リン酸と塩を形成する金属としては、特に限定するものではないが、例えば、ナトリウム、カリウム、リチウム、カルシウム、バリウム、マグネシウム、アルミニウム、チタン、鉄、コバルト、ニッケル、銅、亜鉛、ジルコニウム、パラジウム、銀、スズ、鉛等が挙げられる。
【0068】
有機リン化合物としては、特に限定するものではないが、例えば、リン酸メチル等のリン酸エステル、リン酸ジメチル等のリン酸ジエステル、リン酸トリフェニル等のリン酸トリエステル、亜リン酸、亜リン酸メチル、亜リン酸フェニル等の亜リン酸エステル、亜リン酸ジフェニル等の亜リン酸ジエステル、亜リントリフェニル等の亜リン酸トリエステル、フェニルホスホン酸等のアリールホスホン酸、メチルホスホン酸等のアルキルホスホン酸、メチル亜ホスホン酸等のアルキル亜ホスホン酸、フェニル亜ホスホン酸等のアリール亜ホスホン酸、ジメチルホスフィン酸等のアルキルホスフィン酸、ジフェニルホスフィン酸等のアリールホスフィン酸、フェニルメチルホスフィン酸等のアルキルアリールホスフィン酸、ジメチル亜ホスフィン酸等のアルキル亜ホスフィン酸、ジフェニル亜ホスフィン酸等のアリール亜ホスフィン酸、フェニルメチル亜ホスフィン酸等のアルキルアリール亜ホスフィン酸、ラウリルアシッドホスフェイト、トリデシルアシッドホスフェイト、ステアリルアシッドホスフェイト等の酸性リン酸エステル、酸性リン酸エステルの塩類等が挙げられる。
【0069】
上記した方法においては、これらの酸触媒から選ばれる一種又は二種以上を用いることができる。
【0070】
酸触媒の使用量は、特に限定するものではないが、原料である、本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類の使用量[すなわち、上記式(1)で示される化合物と上記式(2)で示される化合物の合計の使用量]に対し、通常0.01〜20重量%の範囲、好ましくは0.1〜10重量%の範囲である。0.01重量%よりも少ない場合、反応が著しく遅くなるおそれがあり、20重量%を超えて使用しても経済的に不利となるおそれがある。
【0071】
一方、上記した方法において、ラネー金属触媒としては、特に限定するものではないが、例えば、ラネー銅、金属銅、銅クロム触媒、銅リン酸塩等が挙げられる。これらのうち、ラネー銅を含むことが特に好ましい。
【0072】
ラネー金属触媒の使用量は、特に限定するものではないが、原料である、上記式(1)で示される化合物と上記式(2)で示される化合物の合計の使用量に対し、通常0.01〜20重量%の範囲、好ましくは0.1〜10重量%の範囲である。0.01重量%よりも少ない場合、反応の効率が著しく低下するおそれがあり、50重量%を超えて使用しても経済的に不利となるおそれがある。
【0073】
なお、上記した方法において、酸触媒とラネー金属触媒とを併用して、分子内脱水縮合反応させてもよい。
【0074】
上記した方法において、反応は、通常、水素雰囲気下で行われる。かかるガスの使用量は、上記式(1)で示される化合物と上記式(2)で示される化合物の合計の使用量に対し、通常1〜20倍モル、好ましくは2〜10倍モルの範囲である。
【0075】
上記した方法において、反応圧力は、通常1〜200気圧、好ましくは30〜100気圧の範囲である。200気圧以下とすることで、原料及び生成物の分解が抑制されるため、ジ置換ヒドロキシアルキルピペラジン類の選択率が向上し、30気圧以上とすることで十分な反応速度が得られる。
【0076】
上記した方法において、反応温度は、通常150〜500℃、好ましくは100〜400℃の範囲である。500℃以下とすることで、原料及び生成物の分解が抑制されるため、ジ置換ヒドロキシアルキルピペラジン類の選択率が向上し、130℃以上とすることで十分な反応速度が得られる。
【0077】
上記した方法により得られるジ置換ヒドロキシアルキルピペラジン類は、上記式(4)で示される化合物、又は上記式(5)で示される化合物を、それぞれ3〜20モル比%、97〜80モル比%の範囲で通常含む[ただし、上記式(4)で示される化合物、上記式(5)で示される化合物の合計量が100モル比%を超えることはない。]。
【0078】
次に、本発明の上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法について説明する。
【0079】
本発明の上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法は、本発明のジ置換ヒドロキシアルキルピペラジン類、又はその組成物を、酸触媒の存在下で分子内脱水縮合反応させることをその特徴とする。
【0080】
なお、本発明において、上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類とは、2−ヒドロキシトリエチレンジアミン(n=0の場合)又は2−ヒドロキシアルキルトリエチレンジアミン類(n=1〜6の場合)を意味する。このような2−ヒドロキシ(アルキル)トリエチレンジアミン類としては、特に限定するものではないが、例えば、2−ヒドロキシメチルトリエチレンジアミン、2−ヒドロキシエチルトリエチレンジアミン、2−ヒドロキシプロピルトリエチレンジアミン、2−ヒドロキシブチルトリエチレンジアミン等が挙げられる。
【0081】
上記した方法において、酸触媒としては、特に限定するものではないが、例えば、金属リン酸塩、有機リン化合物等のリン含有物質、窒素含有物質、硫黄含有物質、ニオブ含有物質、シリカ、アルミナ、シリカ−アルミナ、シリカ−チタニア、ゼオライト、ヘテロポリ酸、第4B族金属酸化物縮合触媒、第6B族金属含有縮合触媒、ブレンステッド酸、ルイス酸等が挙げられる。これらのうち、金属リン酸塩、有機リン化合物等のリン含有物質が特に好ましい。
【0082】
金属リン酸塩としては、特に限定するものではないが、例えば、リン酸、亜リン酸、次亜リン酸等の金属塩が挙げられる。リン酸と塩を形成する金属としては、特に限定するものではないが、例えば、ナトリウム、カリウム、リチウム、カルシウム、バリウム、マグネシウム、アルミニウム、チタン、鉄、コバルト、ニッケル、銅、亜鉛、ジルコニウム、パラジウム、銀、スズ、鉛等が挙げられる。
【0083】
有機リン化合物としては、特に限定するものではないが、例えば、リン酸メチル等のリン酸エステル、リン酸ジメチル等のリン酸ジエステル、リン酸トリフェニル等のリン酸トリエステル、亜リン酸、亜リン酸メチル、亜リン酸フェニル等の亜リン酸エステル、亜リン酸ジフェニル等の亜リン酸ジエステル、亜リントリフェニル等の亜リン酸トリエステル、フェニルホスホン酸等のアリールホスホン酸、メチルホスホン酸等のアルキルホスホン酸、メチル亜ホスホン酸等のアルキル亜ホスホン酸、フェニル亜ホスホン酸等のアリール亜ホスホン酸、ジメチルホスフィン酸等のアルキルホスフィン酸、ジフェニルホスフィン酸等のアリールホスフィン酸、フェニルメチルホスフィン酸等のアルキルアリールホスフィン酸、ジメチル亜ホスフィン酸等のアルキル亜ホスフィン酸、ジフェニル亜ホスフィン酸等のアリール亜ホスフィン酸、フェニルメチル亜ホスフィン酸等のアルキルアリール亜ホスフィン酸、ラウリルアシッドホスフェイト、トリデシルアシッドホスフェイト、ステアリルアシッドホスフェイト等の酸性リン酸エステル、酸性リン酸エステルの塩類等が挙げられる。
【0084】
上記した方法においては、これらの酸触媒から選ばれる一種又は二種以上を用いることができる。
【0085】
酸触媒の使用量は、特に限定するものではないが、原料である、本発明のジ置換ヒドロキシアルキルピペラジン類の単位重量当たりでの使用量[すなわち、上記式(4)で示される化合物と上記式(5)で示される化合物との合計の単位重量当たりでの使用量]に対し、通常0.01〜100重量%の範囲、好ましくは0.1〜50重量%の範囲である。0.01重量%よりも少ない場合、反応効率が著しく低下するおそれがあり、100重量%を超えて使用しても経済的に不利となるおそれがある。
【0086】
上記した方法において、反応は気相で行っても液相で行っても良い。また、反応は懸濁床による回分、半回分、連続式でも、また固定床流通式でも実施できるが、工業的には、固定床流通式が操作、装置、経済性の面から有利である。
【0087】
上記した反応においては、希釈剤として、窒素ガス、水素ガス、アンモニアガス、水蒸気、炭化水素等の不活性ガスや、水、不活性な炭化水素等の不活性溶媒を用いて、原料である、上記したジ置換ヒドロキシアルキルピペラジン類を希釈し、反応を進行させることができる。これらの希釈剤は任意の量で使用でき、その使用量としては特に限定するものではないが、[上記式(4)で示される化合物と上記式(5)で示される化合物との合計の使用量]/[希釈剤の使用量](モル比)は、0.01〜1の範囲とすることが好ましく、0.05〜0.5の範囲とすることがさらに好ましい。モル比を0.01以上とすると、上記式(6)で示されるヒドロキシ(アルキル)トリエチレンジアミン類の生産性が向上する。また、モル比を1以下とすると、上記式(6)で示されるヒドロキシ(アルキル)トリエチレンジアミン類の選択性が向上する。
【0088】
上記した反応において、希釈剤は、上記したジ置換ヒドロキシアルキルピペラジン類と同時に反応器内に導入してもよいし、上記したジ置換ヒドロキシアルキルピペラジン類を予め希釈剤に溶解させた後に、原料溶液として反応器に導入してもよい。
【0089】
上記した反応において、反応が気相で行われる場合、通常は、窒素ガス、アルゴンガス等の反応に不活性なガスの共存下で行われる。このようなガスの使用量は、特に限定するものではないが、上記式(4)で示される化合物と上記式(5)で示される化合物との合計の使用量に対して、通常1〜20倍モル、好ましくは2〜10倍モルの範囲である。
【0090】
上記した反応において、反応温度は、特に限定するものではないが、通常150〜500℃、好ましくは200〜400℃の範囲である。500℃以下とすることで、原料及び生成物の分解が抑制されるため、上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類の選択率が向上し、150℃以上とすることで十分な反応速度が得られる。
【0091】
上記した反応において、反応が気相で行われる場合、反応終了後、上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類を含有する反応混合ガスを、水又は酸性水溶液に通じて溶解させ、上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類を含有する反応混合液を得る。そして、得られた反応混合液から、抽出、濃縮等の所望の分離精製操作により、上記式(6)で示されるヒドロキシ(アルキル)トリエチレンジアミン類を得ることができる。また、ハロゲン化水素酸を用いて、ハロゲン化水素酸塩として得ることもできる。
【実施例】
【0092】
本発明を以下の実施例により更に詳細に説明するが、本発明はこれらに限定して解釈されるものではない。なお、本実施例における生成物の収率は、ガスクロマトグラフィーで確認した。
【0093】
分析装置:島津製作所社製、GC−17A,
カラム:J&W Scientific社製キャピラリーカラム、NB−5,
検出器:水素炎イオン化検出器(FID),
カラム温度条件:昇温。
【0094】
また、分子量の確認はガスクロマトグラフ−質量分析計(GC−MS、日本電子社製、GC−MSJMS−K9)を用い、カラムはJ&W Scientific社製キャピラリーカラム、DB−1を用い、昇温条件で測定を行った。
【0095】
更に、化合物の1H−NMR及び13C−NMRの測定には、Varian社製VXR−300Sを使用した。
【0096】
実施例1 N−(2,3−ジヒドロキシプロピル)ジエチレントリアミン類の合成.
1000mlの四つ口フラスコに、ジエチレントリアミン680.9g(6.60モル)を仕込み、窒素雰囲気下で3−クロロ−1,2−プロパンジオール221.1g(2.00モル)を3時間かけて滴下した。四つ口フラスコをオイルバス中に保持することで、反応液の温度は60〜72℃に保たれた。3−クロロ−1,2−プロパンジオール滴下終了後、更に反応温度を72℃に保ち2時間反応を継続した。反応後、30%の水酸化ナトリウム水溶液265.3g(2.00モル)を加えて中和し、単蒸留により反応液中の未反応のジエチレントリアミンを留去した。得られた粘調物にイソプロパノールを加えてろ過後、再濃縮して粗製N−(ジヒドロキシプロピル)ジエチレントリアミン332.5gを得た。濃縮品のガスクロマトグラフィー分析を行ったところ、2本の特徴的なピークが観察された。ピーク1/ピーク2の組成比(モル比)は、15/85であった。これらをGC−MS測定したところ、それぞれの分子量はいずれも177であり、生成物が2種のN−(ジヒドロキシプロピル)エチレンジアミン類であることが判明した。
【0097】
更に、粗製N−(ジヒドロキシプロピル)エチレンジアミンの混合物のうち、119.0gを用いて蒸留精製したところ、ピーク1の化合物2.3gとピーク2の化合物8.0gをそれぞれ単離することができた。各化合物の1H−NMR及び13C−NMRについて測定した結果を図1と図2、図3、及び図4に示す。
【0098】
これらの結果より、ピーク1の化合物は、下記式(7)
【0099】
【化11】

【0100】
で示されるN−(2−アミノエチル)−N−(2,3−ジヒドロキシプロピル)エチレンジアミン(以下、表現を簡潔にするため、「DETA−2PD」と略す。)であることが確認された。これは上記式(2)で示される化合物に該当する。
【0101】
また、ピーク2の化合物は、下記式(8)
【0102】
【化12】

【0103】
で示されるN−(2,3−ジヒドロキシプロピル)ジエチレントリアミン(以下、表現を簡潔にするため、「DETA−1PD」と略す。)であることが確認された。これは上記式(1)で示される化合物に該当する。
【0104】
なお、濃縮液のガスクロマトグラフィーでの測定から、これら2種のDETA−PD合計の収率は92%であった。
【0105】
実施例2 N−(2,3−ジヒドロキシプロピル)ジエチレントリアミン類の合成.
200mlの四つ口フラスコに、ジエチレントリアミン74.5g(0.70モル)、溶媒としてメタノール61.7gを仕込み、窒素雰囲気下で3−クロロ−1,2−プロパンジオール23.7g(0.21モル)を3時間かけて滴下た。四つ口フラスコを冷却バス中に保持することで、反応液の温度は30〜32℃に保たれた。3−クロロ−1,2−プロパンジオール滴下終了後、更に反応温度を30℃以下に保ち2時間反応を継続し実施例1と同様に処理した。反応液のガスクロマトグラフィーでの測定からDETA−1PD/DETA−2PDの組成比(モル比)はそれぞれ9/91であり、合計の収率は92%であった。
【0106】
実施例3 N−(2,3−ジヒドロキシプロピル)ジエチレントリアミン類の合成.
200mlの四つ口フラスコに、ジエチレントリアミン74.5g(0.70モル)、溶媒としてメタノール61.7gを仕込み、窒素雰囲気下、冷却状態で95%グリシドール16.4g(0.21モル)を3時間かけて滴下した。四つ口フラスコを冷却バス中に保持することで、反応液の温度は28〜30℃に保たれた。グリシドール滴下終了後、更に反応温度を30℃以下に保ち2時間反応を継続した。反応液のガスクロマトグラフィーでの測定からDETA−1PD/DETA−2PDの組成比(モル比)はそれぞれ7/93であり、合計の収率は93%であった。
【0107】
実施例4 N−(アミノエチル)−ヒドロキシメチルピペラジン類の合成.
実施例3と同様にして得られたDETA−1PDとDETA−2PDの混合物80.0g(0.50モル)、溶媒として水510.0g、触媒としてラネー銅(商品名CDT−60:川研ファインケミカル社製)9.0gを1000mlオートクレーブに充填し、窒素パージ後、水素雰囲気下で165℃に加熱した。この時の反応容器圧力は8.0MPaであった。反応時間は6時間であった。
【0108】
反応液をガスクロマトグラフィーで分析した結果、DETA−1PDとDETA−2PDの転化率はそれぞれ87%と36%であり、生成物は2本の特徴的なピーク(ピーク3、ピーク4)であることが観察された。ピーク3/ピーク4の組成比(モル比)はそれぞれ3/97であった。これらをGC−MS測定したところ、それぞれの分子量はいずれも159であり、GC−MSのスペクトルパターンから生成物が2種のジ置換ヒドロキシプロピルピペラジン類であることが判明した。
【0109】
すなわち、ピーク3、ピーク4の化合物は、下記式(9)
【0110】
【化13】

【0111】
又は下記式(10)
【0112】
【化14】

【0113】
で示されるN−(アミノエチル)−ヒドロキシメチルピペラジン(以下、表現を簡潔にするため、「4−AE−PIPOH」又は「1−AE−PIPOH」と略す。)であることが確認された。これは、上記式(4)または(5)に該当する化合物である。
【0114】
なお、ガスクロマトグラフィーでの測定から2種のジ置換ヒドロキシプロピルピペラジン類の合計の収率は70%であった。
【0115】
実施例5 N−(アミノエチル)−ヒドロキシメチルピペラジン類の合成.
実施例3と同様にして得られたDETA−1PDとDETA−2PDの混合物75.0g(0.42モル)、溶媒として水425.0g、触媒としてラネー銅の添加量を7.5g添加した以外は実施例4と同様にして、1000mlオートクレーブに充填し、窒素パージ後、水素雰囲気下で165℃に加熱した。この時の反応容器圧力は8.0MPaであった。反応時間は8時間であった。
【0116】
生成物をガスクロマトグラフィーで分析した結果、DETA−1PDとDETA−2PDの転化率はそれぞれ88%と49%であった。ピーク3/ピーク4の組成比(モル比)はそれぞれ4/96であり、2種のジ置換ヒドロキシプロピルピペラジン類の合計の収率は69%であった。
【0117】
実施例6 2−ヒドロキシ(メチル)トリエチレンジアミンの合成.
実施例4と同様にして得られた1−AE−PIPOHと4−AE−PIPOHの混合物
を含む反応液から、ラネー銅触媒をろ過し除去して、濃縮後、トップ温130〜150℃減圧度0.5Torrで単蒸留してピーク3/ピーク4の組成比(モル比)はそれぞれ2/98である粗1−AE−PIPOHと4−AE−PIPOHの混合物を83.0g得た(GC純度67.4面積%)。この混合物に水を添加して、濃度(基質濃度)を25重量%に調製した。
【0118】
市販のリン酸アルミニウム(和光純薬工業社製、化学用)をリン酸処理した触媒20mlを充填した石英管(内径23mm、長さ590mm)を固定床反応器とし、窒素を60ml/minの流量で流しながら320℃に昇温後、水を30ml/hr−1で1時間流通させた。環化反応は、固定床反応器に上記の調製液を、同温度でガス空間速度(GHSV:溶液がガス化した際の供給速度を見かけ触媒体積で除した値)2,313hr−1の流量で流通させて、反応器から留出する溶液をフラスコで受けた。
【0119】
生成物をガスクロマトグラフィーで分析した結果、4−AE−PIPOH、及び1−AE−PIPOHの混合物の転化率は30%であり、分子内脱水縮合反応が進行して、対応する2−ヒドロキシ(メチル)トリエチレンジアミンが5モル%得られた。
【0120】
実施例7 2−ヒドロキシ(メチル)トリエチレンジアミンの合成.
実施例6で調製した粗1−AE−PIPOHと4−AE−PIPOHとの混合水溶液を反応に用いた(ピーク3/ピーク4の組成比(モル比)がそれぞれ2/98であり、GC純度67.4面積%、基質濃度25重量%)。
【0121】
市販のリン酸アルミニウム(和光純薬工業社製、化学用)をリン酸処理した触媒20mlを充填した石英管(内径23mm、長さ590mm)を固定床反応器とし、窒素を60ml/minの流量で流しながら350℃に昇温後、水を30ml/hr−1で1時間流通させた。環化反応は、固定床反応器に上記の調製液を、同温度でガス空間速度(GHSV:溶液がガス化した際の供給速度を見かけ触媒体積で除した値)2,313hr−1の流量で実施例6と同様に流通させて、反応器から留出する溶液をフラスコで受けた。
【0122】
生成物をガスクロマトグラフィーで分析した結果、4−AE−PIPOH、及び1−AE−PIPOHの混合物の転化率は95%であり、分子内脱水縮合反応が進行して、対応する2−ヒドロキシ(メチル)トリエチレンジアミンが6モル%得られた。
【0123】
比較例1.
実施例2で得られたDETA−1PDとDETA−2PDの混合物18.7g(0.11モル)、溶媒として水106.3gを触媒を加えずに200mlオートクレーブに充填し、水素雰囲気下で実施例1と同様にして、反応を実施した。この時の反応容器圧力は8.0MPaであった。反応時間は6時間であった。
【0124】
生成物をガスクロマトグラフィーで分析した結果、DETA−1PDとDETA−2PDの転化率は0%であった。
【0125】
比較例2.
実施例2で得られたDETA−1PDとDETA−2PDの混合物18.7g(0.11モル)、溶媒として水106.3g、ラネーニッケル触媒10.0g(乾燥重量5.0g)を200mlオートクレーブに充填し、窒素パージ後、水素加圧した状態で165℃に加熱した。この時の反応容器圧力は8.0MPaであった。反応時間は6時間であった。
生成物をガスクロマトグラフィーで分析した結果、DETA−1PDとDETA−2PDの転化率は0%であった。
【技術分野】
【0001】
本発明はN−(ジヒドロキシアルキル)ジエチレントリアミン類、その組成物、及びそれを用いた2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法に関する。
【0002】
本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類、及びその組成物は、2−ヒドロキシ(アルキル)トリエチレンジアミン類の原料として有用である。
【背景技術】
【0003】
2−ヒドロキシ(アルキル)トリエチレンジアミン類は、医農薬中間体、有機合成用触媒、ウレタン樹脂化触媒、化学吸着剤、抗菌剤等に有用であることが知られている(例えば、特許文献1参照)。
【0004】
従来の2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法としては、例えば、N−(ジヒドロキシアルキル)エチレンジアミン類から中間体となるヒドロキシアルキルピペラジン類を合成し(例えば、特許文献1、特許文献2参照)、次いで、得られたヒドロキシアルキルピペラジン類を、アルキレンオキサイドとの反応でジ置換ヒドロキシアルキルピペラジン類として、更に酸触媒の存在下で分子内縮合反応させる製法が報告されている(例えば、特許文献1参照)。
【0005】
しかしながら、上記の製造法は反応の工程数が多く、更に簡略化した製法が求められていた。
【0006】
また他の合成法として、ピペラジンと2,3−ジブロモプロピオン酸エチルとをトルエン又はベンゼンのような不活性溶媒中で反応させて1,4−ジアザビシクロ[2.2.2]オクタン−2−カルボン酸エチルを調製し、次いで得られたエステルを、例えば水素化リチウムアルミニウムを用いて還元する二段階での合成方法が知られている(例えば、特許文献3参照)。
【0007】
しかしながら、この製造方法では、ピペラジンと2,3−ジブロモプロピオン酸エチルとを低い基質濃度で反応させる必要があるため生産性に劣るという欠点を有する。また次反応を効率良く行うため、第一工程で得られる生成物は単離、精製する必要があった。次に第二工程では、還元剤として発火の危険性が高い水素化リチウムアルミニウムを使用するため、工業的にも好ましいとは言えない。更にまた、原料として用いるピペラジンが高価であり、特に2,3−ジブロモプロピオン酸エチルが非常に高価であるため、実用的とは言い難い。
【0008】
以上のように、安価で工業的に安定的に得られる原料を用いて、発火の危険性が高い還元剤を用いることなく、簡便且つ安全に少ない工程数でヒドロキシ(アルキル)トリエチレンジアミン類を効率的に合成することは極めて困難であった。
【0009】
一方、粗2−ヒドロキシエチルジエチレントリアミンの20%水溶液からリン酸担持触媒を用いて分子内で脱水環化するとトリエチレンジアミンが得られることが報告されている(例えば、特許文献4参照)。
【0010】
しかしながら、2−ヒドロキシ(アルキル)トリエチレンジアミン類の合成に有用と考えられる、N−(ジヒドロキシアルキル)ジエチレントリアミン類の生成を確認した例は、これまで報告されていなかった。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】国際公開第2009/145320号パンフレット
【特許文献2】オーストリア国特許第227,268号明細書
【特許文献3】特開2001−504855号公報
【特許文献4】米国特許第4,757,143号明細書
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、上記の背景技術に鑑みてなされたものであり、その目的は、安価で工業的に安定的に得られる原料を用いて、発火の危険性が高い還元剤を用いることなく、簡便且つ安全に少ない工程数でヒドロキシ(アルキル)トリエチレンジアミンを製造する方法を提供すること、及びこのような原料として、新規なN−(ジヒドロキシアルキル)ジエチレントリアミン類、及びその組成物を提供することである。
【課題を解決するための手段】
【0013】
本発明者らは、上記課題を解決すべく、鋭意検討を重ねた結果、本発明を完成するに至った。
【0014】
すなわち、本発明は以下に示すとおり、N−(ジヒドロキシアルキル)ジエチレントリアミン類、その組成物、及びそれを用いた2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法に関するものである。
【0015】
[1]下記式(1)
【0016】
【化1】

【0017】
(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示されるN−(ジヒドロキシアルキル)ジエチレントリアミン類。
【0018】
[2]下記式(2)
【0019】
【化2】

【0020】
(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示されるN−(ジヒドロキシアルキル)ジエチレントリアミン類。
【0021】
[3]下記式(1)
【0022】
【化3】

【0023】
(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示される化合物と下記式(2)
【0024】
【化4】

【0025】
(式中、R、nは上記と同じ定義である。)
で示される化合物とを含有することを特徴とするN−(ジヒドロキシアルキル)ジエチレントリアミン組成物。
【0026】
[4]式(1)で示される化合物に対し、式(2)で示される化合物を、97:3〜80:20(モル比)の割合で含有することを特徴とする上記[3]に記載のN−(ジヒドロキシアルキル)ジエチレントリアミン組成物。
【0027】
[5]下記式(3)
【0028】
【化5】

【0029】
(上記式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、Xはハロゲン原子を表し、nは0〜6の整数を表す。)
で示されるハロゲン化ジオールと、N−(2−アミノエチル)ジエチレトリアミンとを反応させることを特徴とする上記[1]乃至[4]のいずれかに記載のN−(ジヒドロキシアルキル)ジエチレントリアミンの製造方法。
【0030】
[6]下記式(4)
【0031】
【化6】

【0032】
(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示されるジ置換ヒドロキシアルキルピペラジン類。
【0033】
[7]下記式(5)
【0034】
【化7】

【0035】
(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示されるジ置換ヒドロキシアルキルピペラジン類。
【0036】
[8]下記式(4)
【0037】
【化8】

【0038】
(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される化合物と、下記式(5)
【0039】
【化9】

【0040】
(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される化合物とを含有することを特徴とするジ置換ヒドロキシアルキルピペラジン類組成物。
【0041】
[9]上記[1]乃至[4]のいずれかに記載のN−(ジヒドロキシアルキル)ジエチレントリアミンを、酸触媒、ラネー金属触媒、又はそれら両方の存在下で分子内脱水縮合反応させることを特徴とする上記[6]乃至[8]のいずれかに記載のジ置換ヒドロキシアルキルピペラジン類の製造方法。
【0042】
[10]ラネー金属触媒が、ラネー銅触媒を含むことを特徴とする上記[9]に記載の製造方法。
【0043】
[11]酸触媒が、無機リン化合物、該無機リン化合物の金属塩、及び有機リン化合物からなる群より選択される化合物を含むことを特徴とする上記[9]又は[10]に記載の製造方法。
【0044】
[12]上記[6]乃至[8]のいずれかに記載のジ置換ヒドロキシアルキルピペラジン類を、酸触媒の存在下で分子内脱水縮合反応させることを特徴とする下記式(6)
【0045】
【化10】

【0046】
(式中、Rは水素原子又は直鎖状若しくは分枝状の炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法。
【0047】
[13]酸触媒が、無機リン化合物、該無機リン化合物の金属塩、及び有機リン化合物からなる群より選択される化合物を含むことを特徴とする上記[12]に記載の製造方法。
【発明の効果】
【0048】
本発明により、安価で工業的に安定的に得られる原料を用いて、発火の危険性が高い還元剤を用いることなく、簡便且つ安全に少ない工程数でヒドロキシ(アルキル)トリエチレンジアミンを製造する方法を提供することができる。
【0049】
また、本発明は、このような原料として、新規なN−(ジヒドロキシアルキル)ジエチレントリアミン類又はその組成物、ジ置換ヒドロキシアルキルピペラジン類又はその組成物を提供するものであり、産業上極めて有用である。
【図面の簡単な説明】
【0050】
【図1】実施例1で得られたN−(2,3−ジヒドロキシプロピル)ジエチレントリアミン(ピーク1化合物)の1H−NMR(溶媒D2O、酢酸含有品)ピークを示す図である。
【図2】実施例1で得られたN−(2,3−ジヒドロキシプロピル)ジエチレントリアミン(ピーク2化合物)の1H−NMR(溶媒D2O、酢酸含有品)ピークを示す図である。
【図3】実施例1で得られたN−(2,3−ジヒドロキシプロピル)ジエチレントリアミン(ピーク1化合物)の13C−NMR(溶媒D2O、酢酸含有品)ピークを示す図である。
【図4】実施例1で得られたN−(2,3−ジヒドロキシプロピル)ジエチレントリアミン(ピーク2化合物)13C−NMR(溶媒D2O、酢酸含有品)ピークを示す図である。
【発明を実施するための形態】
【0051】
以下、本発明を詳細に説明する。
【0052】
まず、本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類、及びその組成物について説明する。
【0053】
本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類は上記式(1)又は上記式(2)で示される化合物である。
【0054】
また、本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類組成物は、上記式(1)で示される化合物と、上記式(2)で示される化合物とを含有することをその特徴とする。
【0055】
上記式(1)及び式(2)中、置換基Rは水素原子又は炭素数1〜4のアルキル基を表す。炭素数1〜4のアルキル基としては、具体的には、メチル基、エチル基、プロピル基、イソプロピル基、n−ブチル基、イソブチル基、t−ブチル基等が例示される。これらのうち、水素原子、メチル基、エチル基が好ましい。
【0056】
また、上記式(1)及び式(2)中、nは0〜6の整数を表し、0〜2の整数がより好ましい。
【0057】
上記式(1)又は式(2)で示されるN−(ジヒドロキシアルキル)ジエチレントリアミン類としては、特に限定するものではないが、例えば、N−(ジヒドロキシプロピル)ジエチレントリアミン、N−(ジヒドロキシブチル)ジエチレントリアミン、N−(ジヒドロキシヘキシル)ジエチレントリアミン等が挙げられる。
【0058】
本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類、又はその組成物は、例えば、ジエチレントリアミンとグリシドールの付加反応により得られるし、ジエチレントリアミンとグリセリンを酸触媒存在下で脱水縮合反応することによっても得られる。また、ジエチレントリアミンと上記式(3)で示されるハロゲン化ジオールとを反応することによっても得ることができる。これらのうち、コスト面及び反応収率を考慮すると、ジエチレントリアミンと上記式(3)で示されるハロゲン化ジオールとを反応させる方法がより好ましい。
【0059】
上記の方法により、本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類は、上記式(1)で示される化合物と、上記式(2)で示される化合物とを、通常97:3〜80:20(モル比)の割合で含有する組成物として得られる。
【0060】
次に本発明のジ置換ヒドロキシアルキルピペラジン類、及びその組成物について説明する。
【0061】
本発明のジ置換ヒドロキシアルキルピペラジン類は上記式(4)又は式(5)で示される化合物である。
【0062】
また、本発明のジ置換ヒドロキシアルキルピペラジン類組成物は、上記式(4)で示される化合物と上記式(5)で示される化合物とを含有することをその特徴とする。
【0063】
上記式(4)及び式(5)中、置換基Rは水素原子又は炭素数1〜4のアルキル基を表す。炭素数1〜4のアルキル基としては、具体的には、メチル基、エチル基、プロピル基、イソプロピル基、n−ブチル基、イソブチル基、t−ブチル基等が例示される。これらのうち、水素原子、メチル基、エチル基が好ましい。
【0064】
また、上記式(4)及び式(5)中、nは0〜6の整数を表し、0〜2の整数がより好ましい。
【0065】
次に本発明のジ置換ヒドロキシアルキルピペラジン類、又はその組成物は、例えば、本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類、又はその組成物を、酸触媒、ラネー金属触媒又はそれらの両方の存在下で分子内脱水縮合反応させることにより得ることができる。
【0066】
上記の方法において、酸触媒としては、特に限定するものではないが、例えば、金属リン酸塩、有機リン化合物等のリン含有物質、窒素含有物質、硫黄含有物質、ニオブ含有物質、シリカ、アルミナ、シリカ−アルミナ、シリカ−チタニア、ゼオライト、ヘテロポリ酸、第4B族金属酸化物縮合触媒、第6B族金属含有縮合触媒、ブレンステッド酸、ルイス酸等が挙げられる。これらのうち、金属リン酸塩、有機リン化合物等のリン含有物質が特に好ましい。
【0067】
金属リン酸塩としては、特に限定するものではないが、例えば、リン酸、亜リン酸、次亜リン酸等の金属塩が挙げられる。リン酸と塩を形成する金属としては、特に限定するものではないが、例えば、ナトリウム、カリウム、リチウム、カルシウム、バリウム、マグネシウム、アルミニウム、チタン、鉄、コバルト、ニッケル、銅、亜鉛、ジルコニウム、パラジウム、銀、スズ、鉛等が挙げられる。
【0068】
有機リン化合物としては、特に限定するものではないが、例えば、リン酸メチル等のリン酸エステル、リン酸ジメチル等のリン酸ジエステル、リン酸トリフェニル等のリン酸トリエステル、亜リン酸、亜リン酸メチル、亜リン酸フェニル等の亜リン酸エステル、亜リン酸ジフェニル等の亜リン酸ジエステル、亜リントリフェニル等の亜リン酸トリエステル、フェニルホスホン酸等のアリールホスホン酸、メチルホスホン酸等のアルキルホスホン酸、メチル亜ホスホン酸等のアルキル亜ホスホン酸、フェニル亜ホスホン酸等のアリール亜ホスホン酸、ジメチルホスフィン酸等のアルキルホスフィン酸、ジフェニルホスフィン酸等のアリールホスフィン酸、フェニルメチルホスフィン酸等のアルキルアリールホスフィン酸、ジメチル亜ホスフィン酸等のアルキル亜ホスフィン酸、ジフェニル亜ホスフィン酸等のアリール亜ホスフィン酸、フェニルメチル亜ホスフィン酸等のアルキルアリール亜ホスフィン酸、ラウリルアシッドホスフェイト、トリデシルアシッドホスフェイト、ステアリルアシッドホスフェイト等の酸性リン酸エステル、酸性リン酸エステルの塩類等が挙げられる。
【0069】
上記した方法においては、これらの酸触媒から選ばれる一種又は二種以上を用いることができる。
【0070】
酸触媒の使用量は、特に限定するものではないが、原料である、本発明のN−(ジヒドロキシアルキル)ジエチレントリアミン類の使用量[すなわち、上記式(1)で示される化合物と上記式(2)で示される化合物の合計の使用量]に対し、通常0.01〜20重量%の範囲、好ましくは0.1〜10重量%の範囲である。0.01重量%よりも少ない場合、反応が著しく遅くなるおそれがあり、20重量%を超えて使用しても経済的に不利となるおそれがある。
【0071】
一方、上記した方法において、ラネー金属触媒としては、特に限定するものではないが、例えば、ラネー銅、金属銅、銅クロム触媒、銅リン酸塩等が挙げられる。これらのうち、ラネー銅を含むことが特に好ましい。
【0072】
ラネー金属触媒の使用量は、特に限定するものではないが、原料である、上記式(1)で示される化合物と上記式(2)で示される化合物の合計の使用量に対し、通常0.01〜20重量%の範囲、好ましくは0.1〜10重量%の範囲である。0.01重量%よりも少ない場合、反応の効率が著しく低下するおそれがあり、50重量%を超えて使用しても経済的に不利となるおそれがある。
【0073】
なお、上記した方法において、酸触媒とラネー金属触媒とを併用して、分子内脱水縮合反応させてもよい。
【0074】
上記した方法において、反応は、通常、水素雰囲気下で行われる。かかるガスの使用量は、上記式(1)で示される化合物と上記式(2)で示される化合物の合計の使用量に対し、通常1〜20倍モル、好ましくは2〜10倍モルの範囲である。
【0075】
上記した方法において、反応圧力は、通常1〜200気圧、好ましくは30〜100気圧の範囲である。200気圧以下とすることで、原料及び生成物の分解が抑制されるため、ジ置換ヒドロキシアルキルピペラジン類の選択率が向上し、30気圧以上とすることで十分な反応速度が得られる。
【0076】
上記した方法において、反応温度は、通常150〜500℃、好ましくは100〜400℃の範囲である。500℃以下とすることで、原料及び生成物の分解が抑制されるため、ジ置換ヒドロキシアルキルピペラジン類の選択率が向上し、130℃以上とすることで十分な反応速度が得られる。
【0077】
上記した方法により得られるジ置換ヒドロキシアルキルピペラジン類は、上記式(4)で示される化合物、又は上記式(5)で示される化合物を、それぞれ3〜20モル比%、97〜80モル比%の範囲で通常含む[ただし、上記式(4)で示される化合物、上記式(5)で示される化合物の合計量が100モル比%を超えることはない。]。
【0078】
次に、本発明の上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法について説明する。
【0079】
本発明の上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法は、本発明のジ置換ヒドロキシアルキルピペラジン類、又はその組成物を、酸触媒の存在下で分子内脱水縮合反応させることをその特徴とする。
【0080】
なお、本発明において、上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類とは、2−ヒドロキシトリエチレンジアミン(n=0の場合)又は2−ヒドロキシアルキルトリエチレンジアミン類(n=1〜6の場合)を意味する。このような2−ヒドロキシ(アルキル)トリエチレンジアミン類としては、特に限定するものではないが、例えば、2−ヒドロキシメチルトリエチレンジアミン、2−ヒドロキシエチルトリエチレンジアミン、2−ヒドロキシプロピルトリエチレンジアミン、2−ヒドロキシブチルトリエチレンジアミン等が挙げられる。
【0081】
上記した方法において、酸触媒としては、特に限定するものではないが、例えば、金属リン酸塩、有機リン化合物等のリン含有物質、窒素含有物質、硫黄含有物質、ニオブ含有物質、シリカ、アルミナ、シリカ−アルミナ、シリカ−チタニア、ゼオライト、ヘテロポリ酸、第4B族金属酸化物縮合触媒、第6B族金属含有縮合触媒、ブレンステッド酸、ルイス酸等が挙げられる。これらのうち、金属リン酸塩、有機リン化合物等のリン含有物質が特に好ましい。
【0082】
金属リン酸塩としては、特に限定するものではないが、例えば、リン酸、亜リン酸、次亜リン酸等の金属塩が挙げられる。リン酸と塩を形成する金属としては、特に限定するものではないが、例えば、ナトリウム、カリウム、リチウム、カルシウム、バリウム、マグネシウム、アルミニウム、チタン、鉄、コバルト、ニッケル、銅、亜鉛、ジルコニウム、パラジウム、銀、スズ、鉛等が挙げられる。
【0083】
有機リン化合物としては、特に限定するものではないが、例えば、リン酸メチル等のリン酸エステル、リン酸ジメチル等のリン酸ジエステル、リン酸トリフェニル等のリン酸トリエステル、亜リン酸、亜リン酸メチル、亜リン酸フェニル等の亜リン酸エステル、亜リン酸ジフェニル等の亜リン酸ジエステル、亜リントリフェニル等の亜リン酸トリエステル、フェニルホスホン酸等のアリールホスホン酸、メチルホスホン酸等のアルキルホスホン酸、メチル亜ホスホン酸等のアルキル亜ホスホン酸、フェニル亜ホスホン酸等のアリール亜ホスホン酸、ジメチルホスフィン酸等のアルキルホスフィン酸、ジフェニルホスフィン酸等のアリールホスフィン酸、フェニルメチルホスフィン酸等のアルキルアリールホスフィン酸、ジメチル亜ホスフィン酸等のアルキル亜ホスフィン酸、ジフェニル亜ホスフィン酸等のアリール亜ホスフィン酸、フェニルメチル亜ホスフィン酸等のアルキルアリール亜ホスフィン酸、ラウリルアシッドホスフェイト、トリデシルアシッドホスフェイト、ステアリルアシッドホスフェイト等の酸性リン酸エステル、酸性リン酸エステルの塩類等が挙げられる。
【0084】
上記した方法においては、これらの酸触媒から選ばれる一種又は二種以上を用いることができる。
【0085】
酸触媒の使用量は、特に限定するものではないが、原料である、本発明のジ置換ヒドロキシアルキルピペラジン類の単位重量当たりでの使用量[すなわち、上記式(4)で示される化合物と上記式(5)で示される化合物との合計の単位重量当たりでの使用量]に対し、通常0.01〜100重量%の範囲、好ましくは0.1〜50重量%の範囲である。0.01重量%よりも少ない場合、反応効率が著しく低下するおそれがあり、100重量%を超えて使用しても経済的に不利となるおそれがある。
【0086】
上記した方法において、反応は気相で行っても液相で行っても良い。また、反応は懸濁床による回分、半回分、連続式でも、また固定床流通式でも実施できるが、工業的には、固定床流通式が操作、装置、経済性の面から有利である。
【0087】
上記した反応においては、希釈剤として、窒素ガス、水素ガス、アンモニアガス、水蒸気、炭化水素等の不活性ガスや、水、不活性な炭化水素等の不活性溶媒を用いて、原料である、上記したジ置換ヒドロキシアルキルピペラジン類を希釈し、反応を進行させることができる。これらの希釈剤は任意の量で使用でき、その使用量としては特に限定するものではないが、[上記式(4)で示される化合物と上記式(5)で示される化合物との合計の使用量]/[希釈剤の使用量](モル比)は、0.01〜1の範囲とすることが好ましく、0.05〜0.5の範囲とすることがさらに好ましい。モル比を0.01以上とすると、上記式(6)で示されるヒドロキシ(アルキル)トリエチレンジアミン類の生産性が向上する。また、モル比を1以下とすると、上記式(6)で示されるヒドロキシ(アルキル)トリエチレンジアミン類の選択性が向上する。
【0088】
上記した反応において、希釈剤は、上記したジ置換ヒドロキシアルキルピペラジン類と同時に反応器内に導入してもよいし、上記したジ置換ヒドロキシアルキルピペラジン類を予め希釈剤に溶解させた後に、原料溶液として反応器に導入してもよい。
【0089】
上記した反応において、反応が気相で行われる場合、通常は、窒素ガス、アルゴンガス等の反応に不活性なガスの共存下で行われる。このようなガスの使用量は、特に限定するものではないが、上記式(4)で示される化合物と上記式(5)で示される化合物との合計の使用量に対して、通常1〜20倍モル、好ましくは2〜10倍モルの範囲である。
【0090】
上記した反応において、反応温度は、特に限定するものではないが、通常150〜500℃、好ましくは200〜400℃の範囲である。500℃以下とすることで、原料及び生成物の分解が抑制されるため、上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類の選択率が向上し、150℃以上とすることで十分な反応速度が得られる。
【0091】
上記した反応において、反応が気相で行われる場合、反応終了後、上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類を含有する反応混合ガスを、水又は酸性水溶液に通じて溶解させ、上記式(6)で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類を含有する反応混合液を得る。そして、得られた反応混合液から、抽出、濃縮等の所望の分離精製操作により、上記式(6)で示されるヒドロキシ(アルキル)トリエチレンジアミン類を得ることができる。また、ハロゲン化水素酸を用いて、ハロゲン化水素酸塩として得ることもできる。
【実施例】
【0092】
本発明を以下の実施例により更に詳細に説明するが、本発明はこれらに限定して解釈されるものではない。なお、本実施例における生成物の収率は、ガスクロマトグラフィーで確認した。
【0093】
分析装置:島津製作所社製、GC−17A,
カラム:J&W Scientific社製キャピラリーカラム、NB−5,
検出器:水素炎イオン化検出器(FID),
カラム温度条件:昇温。
【0094】
また、分子量の確認はガスクロマトグラフ−質量分析計(GC−MS、日本電子社製、GC−MSJMS−K9)を用い、カラムはJ&W Scientific社製キャピラリーカラム、DB−1を用い、昇温条件で測定を行った。
【0095】
更に、化合物の1H−NMR及び13C−NMRの測定には、Varian社製VXR−300Sを使用した。
【0096】
実施例1 N−(2,3−ジヒドロキシプロピル)ジエチレントリアミン類の合成.
1000mlの四つ口フラスコに、ジエチレントリアミン680.9g(6.60モル)を仕込み、窒素雰囲気下で3−クロロ−1,2−プロパンジオール221.1g(2.00モル)を3時間かけて滴下した。四つ口フラスコをオイルバス中に保持することで、反応液の温度は60〜72℃に保たれた。3−クロロ−1,2−プロパンジオール滴下終了後、更に反応温度を72℃に保ち2時間反応を継続した。反応後、30%の水酸化ナトリウム水溶液265.3g(2.00モル)を加えて中和し、単蒸留により反応液中の未反応のジエチレントリアミンを留去した。得られた粘調物にイソプロパノールを加えてろ過後、再濃縮して粗製N−(ジヒドロキシプロピル)ジエチレントリアミン332.5gを得た。濃縮品のガスクロマトグラフィー分析を行ったところ、2本の特徴的なピークが観察された。ピーク1/ピーク2の組成比(モル比)は、15/85であった。これらをGC−MS測定したところ、それぞれの分子量はいずれも177であり、生成物が2種のN−(ジヒドロキシプロピル)エチレンジアミン類であることが判明した。
【0097】
更に、粗製N−(ジヒドロキシプロピル)エチレンジアミンの混合物のうち、119.0gを用いて蒸留精製したところ、ピーク1の化合物2.3gとピーク2の化合物8.0gをそれぞれ単離することができた。各化合物の1H−NMR及び13C−NMRについて測定した結果を図1と図2、図3、及び図4に示す。
【0098】
これらの結果より、ピーク1の化合物は、下記式(7)
【0099】
【化11】

【0100】
で示されるN−(2−アミノエチル)−N−(2,3−ジヒドロキシプロピル)エチレンジアミン(以下、表現を簡潔にするため、「DETA−2PD」と略す。)であることが確認された。これは上記式(2)で示される化合物に該当する。
【0101】
また、ピーク2の化合物は、下記式(8)
【0102】
【化12】

【0103】
で示されるN−(2,3−ジヒドロキシプロピル)ジエチレントリアミン(以下、表現を簡潔にするため、「DETA−1PD」と略す。)であることが確認された。これは上記式(1)で示される化合物に該当する。
【0104】
なお、濃縮液のガスクロマトグラフィーでの測定から、これら2種のDETA−PD合計の収率は92%であった。
【0105】
実施例2 N−(2,3−ジヒドロキシプロピル)ジエチレントリアミン類の合成.
200mlの四つ口フラスコに、ジエチレントリアミン74.5g(0.70モル)、溶媒としてメタノール61.7gを仕込み、窒素雰囲気下で3−クロロ−1,2−プロパンジオール23.7g(0.21モル)を3時間かけて滴下た。四つ口フラスコを冷却バス中に保持することで、反応液の温度は30〜32℃に保たれた。3−クロロ−1,2−プロパンジオール滴下終了後、更に反応温度を30℃以下に保ち2時間反応を継続し実施例1と同様に処理した。反応液のガスクロマトグラフィーでの測定からDETA−1PD/DETA−2PDの組成比(モル比)はそれぞれ9/91であり、合計の収率は92%であった。
【0106】
実施例3 N−(2,3−ジヒドロキシプロピル)ジエチレントリアミン類の合成.
200mlの四つ口フラスコに、ジエチレントリアミン74.5g(0.70モル)、溶媒としてメタノール61.7gを仕込み、窒素雰囲気下、冷却状態で95%グリシドール16.4g(0.21モル)を3時間かけて滴下した。四つ口フラスコを冷却バス中に保持することで、反応液の温度は28〜30℃に保たれた。グリシドール滴下終了後、更に反応温度を30℃以下に保ち2時間反応を継続した。反応液のガスクロマトグラフィーでの測定からDETA−1PD/DETA−2PDの組成比(モル比)はそれぞれ7/93であり、合計の収率は93%であった。
【0107】
実施例4 N−(アミノエチル)−ヒドロキシメチルピペラジン類の合成.
実施例3と同様にして得られたDETA−1PDとDETA−2PDの混合物80.0g(0.50モル)、溶媒として水510.0g、触媒としてラネー銅(商品名CDT−60:川研ファインケミカル社製)9.0gを1000mlオートクレーブに充填し、窒素パージ後、水素雰囲気下で165℃に加熱した。この時の反応容器圧力は8.0MPaであった。反応時間は6時間であった。
【0108】
反応液をガスクロマトグラフィーで分析した結果、DETA−1PDとDETA−2PDの転化率はそれぞれ87%と36%であり、生成物は2本の特徴的なピーク(ピーク3、ピーク4)であることが観察された。ピーク3/ピーク4の組成比(モル比)はそれぞれ3/97であった。これらをGC−MS測定したところ、それぞれの分子量はいずれも159であり、GC−MSのスペクトルパターンから生成物が2種のジ置換ヒドロキシプロピルピペラジン類であることが判明した。
【0109】
すなわち、ピーク3、ピーク4の化合物は、下記式(9)
【0110】
【化13】

【0111】
又は下記式(10)
【0112】
【化14】

【0113】
で示されるN−(アミノエチル)−ヒドロキシメチルピペラジン(以下、表現を簡潔にするため、「4−AE−PIPOH」又は「1−AE−PIPOH」と略す。)であることが確認された。これは、上記式(4)または(5)に該当する化合物である。
【0114】
なお、ガスクロマトグラフィーでの測定から2種のジ置換ヒドロキシプロピルピペラジン類の合計の収率は70%であった。
【0115】
実施例5 N−(アミノエチル)−ヒドロキシメチルピペラジン類の合成.
実施例3と同様にして得られたDETA−1PDとDETA−2PDの混合物75.0g(0.42モル)、溶媒として水425.0g、触媒としてラネー銅の添加量を7.5g添加した以外は実施例4と同様にして、1000mlオートクレーブに充填し、窒素パージ後、水素雰囲気下で165℃に加熱した。この時の反応容器圧力は8.0MPaであった。反応時間は8時間であった。
【0116】
生成物をガスクロマトグラフィーで分析した結果、DETA−1PDとDETA−2PDの転化率はそれぞれ88%と49%であった。ピーク3/ピーク4の組成比(モル比)はそれぞれ4/96であり、2種のジ置換ヒドロキシプロピルピペラジン類の合計の収率は69%であった。
【0117】
実施例6 2−ヒドロキシ(メチル)トリエチレンジアミンの合成.
実施例4と同様にして得られた1−AE−PIPOHと4−AE−PIPOHの混合物
を含む反応液から、ラネー銅触媒をろ過し除去して、濃縮後、トップ温130〜150℃減圧度0.5Torrで単蒸留してピーク3/ピーク4の組成比(モル比)はそれぞれ2/98である粗1−AE−PIPOHと4−AE−PIPOHの混合物を83.0g得た(GC純度67.4面積%)。この混合物に水を添加して、濃度(基質濃度)を25重量%に調製した。
【0118】
市販のリン酸アルミニウム(和光純薬工業社製、化学用)をリン酸処理した触媒20mlを充填した石英管(内径23mm、長さ590mm)を固定床反応器とし、窒素を60ml/minの流量で流しながら320℃に昇温後、水を30ml/hr−1で1時間流通させた。環化反応は、固定床反応器に上記の調製液を、同温度でガス空間速度(GHSV:溶液がガス化した際の供給速度を見かけ触媒体積で除した値)2,313hr−1の流量で流通させて、反応器から留出する溶液をフラスコで受けた。
【0119】
生成物をガスクロマトグラフィーで分析した結果、4−AE−PIPOH、及び1−AE−PIPOHの混合物の転化率は30%であり、分子内脱水縮合反応が進行して、対応する2−ヒドロキシ(メチル)トリエチレンジアミンが5モル%得られた。
【0120】
実施例7 2−ヒドロキシ(メチル)トリエチレンジアミンの合成.
実施例6で調製した粗1−AE−PIPOHと4−AE−PIPOHとの混合水溶液を反応に用いた(ピーク3/ピーク4の組成比(モル比)がそれぞれ2/98であり、GC純度67.4面積%、基質濃度25重量%)。
【0121】
市販のリン酸アルミニウム(和光純薬工業社製、化学用)をリン酸処理した触媒20mlを充填した石英管(内径23mm、長さ590mm)を固定床反応器とし、窒素を60ml/minの流量で流しながら350℃に昇温後、水を30ml/hr−1で1時間流通させた。環化反応は、固定床反応器に上記の調製液を、同温度でガス空間速度(GHSV:溶液がガス化した際の供給速度を見かけ触媒体積で除した値)2,313hr−1の流量で実施例6と同様に流通させて、反応器から留出する溶液をフラスコで受けた。
【0122】
生成物をガスクロマトグラフィーで分析した結果、4−AE−PIPOH、及び1−AE−PIPOHの混合物の転化率は95%であり、分子内脱水縮合反応が進行して、対応する2−ヒドロキシ(メチル)トリエチレンジアミンが6モル%得られた。
【0123】
比較例1.
実施例2で得られたDETA−1PDとDETA−2PDの混合物18.7g(0.11モル)、溶媒として水106.3gを触媒を加えずに200mlオートクレーブに充填し、水素雰囲気下で実施例1と同様にして、反応を実施した。この時の反応容器圧力は8.0MPaであった。反応時間は6時間であった。
【0124】
生成物をガスクロマトグラフィーで分析した結果、DETA−1PDとDETA−2PDの転化率は0%であった。
【0125】
比較例2.
実施例2で得られたDETA−1PDとDETA−2PDの混合物18.7g(0.11モル)、溶媒として水106.3g、ラネーニッケル触媒10.0g(乾燥重量5.0g)を200mlオートクレーブに充填し、窒素パージ後、水素加圧した状態で165℃に加熱した。この時の反応容器圧力は8.0MPaであった。反応時間は6時間であった。
生成物をガスクロマトグラフィーで分析した結果、DETA−1PDとDETA−2PDの転化率は0%であった。
【特許請求の範囲】
【請求項1】
下記式(1)
【化1】

(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示されるN−(ジヒドロキシアルキル)ジエチレントリアミン類。
【請求項2】
下記式(2)
【化2】

(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示されるN−(ジヒドロキシアルキル)ジエチレントリアミン類。
【請求項3】
下記式(1)
【化3】

(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示される化合物と下記式(2)
【化4】

(式中、R、nは上記と同じ定義である。)
で示される化合物とを含有することを特徴とするN−(ジヒドロキシアルキル)ジエチレントリアミン組成物。
【請求項4】
式(1)で示される化合物に対し、式(2)で示される化合物を、97:3〜80:20(モル比)の割合で含有することを特徴とする請求項3に記載のN−(ジヒドロキシアルキル)ジエチレントリアミン組成物。
【請求項5】
下記式(3)
【化5】

(上記式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、Xはハロゲン原子を表し、nは0〜6の整数を表す。)
で示されるハロゲン化ジオールと、N−(2−アミノエチル)ジエチレトリアミンとを反応させることを特徴とする請求項1乃至請求項4のいずれかに記載のN−(ジヒドロキシアルキル)ジエチレントリアミンの製造方法。
【請求項6】
下記式(4)
【化6】

(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示されるジ置換ヒドロキシアルキルピペラジン類。
【請求項7】
下記式(5)
【化7】

(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示されるジ置換ヒドロキシアルキルピペラジン類。
【請求項8】
下記式(4)
【化8】

(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される化合物と、下記式(5)
【化9】

(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される化合物とを含有することを特徴とするジ置換ヒドロキシアルキルピペラジン類組成物。
【請求項9】
請求項1乃至請求項4のいずれかに記載のN−(ジヒドロキシアルキル)ジエチレントリアミンを、酸触媒、ラネー金属触媒、又はそれら両方の存在下で分子内脱水縮合反応させることを特徴とする請求項6乃至請求項8のいずれかに記載のジ置換ヒドロキシアルキルピペラジン類の製造方法。
【請求項10】
ラネー金属触媒が、ラネー銅触媒を含むことを特徴とする請求項9に記載の製造方法。
【請求項11】
酸触媒が、無機リン化合物、該無機リン化合物の金属塩、及び有機リン化合物からなる群より選択される化合物を含むことを特徴とする請求項9又は請求項10に記載の製造方法。
【請求項12】
請求項6乃至請求項8のいずれかに記載のジ置換ヒドロキシアルキルピペラジン類を、酸触媒の存在下で分子内脱水縮合反応させることを特徴とする下記式(6)
【化10】

(式中、Rは水素原子又は直鎖状若しくは分枝状の炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法。
【請求項13】
酸触媒が、無機リン化合物、該無機リン化合物の金属塩、及び有機リン化合物からなる群より選択される化合物を含むことを特徴とする請求項12に記載の製造方法。
【請求項1】
下記式(1)
【化1】

(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示されるN−(ジヒドロキシアルキル)ジエチレントリアミン類。
【請求項2】
下記式(2)
【化2】

(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示されるN−(ジヒドロキシアルキル)ジエチレントリアミン類。
【請求項3】
下記式(1)
【化3】

(式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、nは0〜6の整数を表す。)
で示される化合物と下記式(2)
【化4】

(式中、R、nは上記と同じ定義である。)
で示される化合物とを含有することを特徴とするN−(ジヒドロキシアルキル)ジエチレントリアミン組成物。
【請求項4】
式(1)で示される化合物に対し、式(2)で示される化合物を、97:3〜80:20(モル比)の割合で含有することを特徴とする請求項3に記載のN−(ジヒドロキシアルキル)ジエチレントリアミン組成物。
【請求項5】
下記式(3)
【化5】

(上記式中、Rは水素原子又は炭素数1〜4のアルキル基を表し、Xはハロゲン原子を表し、nは0〜6の整数を表す。)
で示されるハロゲン化ジオールと、N−(2−アミノエチル)ジエチレトリアミンとを反応させることを特徴とする請求項1乃至請求項4のいずれかに記載のN−(ジヒドロキシアルキル)ジエチレントリアミンの製造方法。
【請求項6】
下記式(4)
【化6】

(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示されるジ置換ヒドロキシアルキルピペラジン類。
【請求項7】
下記式(5)
【化7】

(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示されるジ置換ヒドロキシアルキルピペラジン類。
【請求項8】
下記式(4)
【化8】

(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される化合物と、下記式(5)
【化9】

(式中、Rは水素原子又は炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される化合物とを含有することを特徴とするジ置換ヒドロキシアルキルピペラジン類組成物。
【請求項9】
請求項1乃至請求項4のいずれかに記載のN−(ジヒドロキシアルキル)ジエチレントリアミンを、酸触媒、ラネー金属触媒、又はそれら両方の存在下で分子内脱水縮合反応させることを特徴とする請求項6乃至請求項8のいずれかに記載のジ置換ヒドロキシアルキルピペラジン類の製造方法。
【請求項10】
ラネー金属触媒が、ラネー銅触媒を含むことを特徴とする請求項9に記載の製造方法。
【請求項11】
酸触媒が、無機リン化合物、該無機リン化合物の金属塩、及び有機リン化合物からなる群より選択される化合物を含むことを特徴とする請求項9又は請求項10に記載の製造方法。
【請求項12】
請求項6乃至請求項8のいずれかに記載のジ置換ヒドロキシアルキルピペラジン類を、酸触媒の存在下で分子内脱水縮合反応させることを特徴とする下記式(6)
【化10】

(式中、Rは水素原子又は直鎖状若しくは分枝状の炭素数1〜4のアルキル基、nは0〜6の整数を表す。)
で示される2−ヒドロキシ(アルキル)トリエチレンジアミン類の製造方法。
【請求項13】
酸触媒が、無機リン化合物、該無機リン化合物の金属塩、及び有機リン化合物からなる群より選択される化合物を含むことを特徴とする請求項12に記載の製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−121837(P2012−121837A)
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願番号】特願2010−274031(P2010−274031)
【出願日】平成22年12月8日(2010.12.8)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願日】平成22年12月8日(2010.12.8)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

