N−myc下流制御遺伝子1タンパク質を標的とした卵巣明細胞腺癌の治療薬
【課題】 卵巣明細胞腺癌に特異的に発現しているタンパク質を標的とした本疾患の新しい治療薬を提供すること。
【解決手段】 明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の治療及び/又は予防剤。明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の抗癌剤耐性を低下させる薬剤。
【解決手段】 明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の治療及び/又は予防剤。明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の抗癌剤耐性を低下させる薬剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、卵巣明細胞腺癌に特異的に発現しているN-myc下流制御遺伝子1タンパク質を標的とした卵巣明細胞腺癌の治療薬、並びにN-myc下流制御遺伝子1タンパク質を診断マーカー及び創薬ターゲットとして使用する技術に関する。
【背景技術】
【0002】
上皮性卵巣癌に対する標準的化学療法はタキサン製剤とプラチナ製剤であり、その代表的なものはパクリタキセルとカルボプラチンの併用療法である(非特許文献1)。
【0003】
N-myc下流制御遺伝子1(N-myc downstream regulated gene 1, NDRG1, Cap43)の詳細な機能については未だ不明なままであるが、生体内において諸種の刺激によって発現変動をすることが報告されており、多様な機能を持つことが示唆されている。癌細胞との関連においては大腸癌細胞株などを用いた実験で転移抑制機能を有する遺伝子として注目されている。またp53やPTEN (phosphatase and tensin homologue)などの腫瘍抑制能を示す遺伝子との関連についての報告もなされている(非特許文献2)。
【0004】
上皮性卵巣癌の組織型の中で、明細胞腺癌は特に薬剤抵抗性が高く、臨床病期初期であっても予後不良例が存在する悪性度の高い組織型である。現在、卵巣癌の化学療法として主に使用されているプラチナ製剤とタキサン製剤の併用療法に対して、明細胞腺癌は著しく高い抵抗性を示すことから、現在本組織型に対する新しい抗悪性腫瘍薬の開発が喫緊の課題となっている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】産科と婦人科. 診断と治療社. 2005. vol.72
【非特許文献2】Ellen TPら Carcinogenesis, 2008, 29, 2-8
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明は、卵巣明細胞腺癌に特異的に発現しているタンパク質を標的とした本疾患の新しい治療薬を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、プロテオミクス手法を用いて、NDRG1が明細胞腺癌の細胞株および組織にて発現上昇していることを明らかにした。また本タンパク質の発現をRNA干渉法により抑制すると、明細胞腺癌細胞のアポトーシスを誘導し死滅させることができる可能性が示された。すなわち、この結果はNDRG1が卵巣明細胞腺癌の新しい分子標的治療薬の標的となることを示すものである。現在のところ、卵巣明細胞腺癌においてのNDRG1発現に関する報告はなく、また卵巣明細胞腺癌における分子標的治療薬は開発されていない。本発明は、これらの知見に基づいて完成されたものである。
【0008】
本発明の要旨は以下の通りである。
【0009】
(1)明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の治療及び/又は予防剤。
(2)明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の抗癌剤耐性を低下させる薬剤。
(3)明細胞腺癌の治療及び/又は予防に効果のある物質を同定する方法であって、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果を評価する工程
を含む前記方法。
(4)さらに、明細胞腺癌細胞増殖に対する被験物質の効果を調べる工程を含む(3)記載の方法。
(5)明細胞腺癌の抗癌剤耐性を低下させる物質を同定する方法であって、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果を評価する工程
を含む前記方法。
(6)さらに、明細胞腺癌細胞の抗癌剤耐性に対する被験物質の効果を調べる工程を含む(5)記載の方法。
(7)生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することを含む、明細胞腺癌の評価及び/又は鑑別方法。
(8)生体試料におけるN-myc下流制御遺伝子1タンパク質の発現をタンパク質レベルで測定する(7)記載の方法。
(9)生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を核酸レベルで測定する(7)記載の方法。
(10)生体試料が、被験者から得た細胞、組織又は体液である(7)〜(9)のいずれかに記載の方法。
(11)体液が血液である(10)記載の方法。
(12)血液が、全血、血清、血漿又は血漿交換外液である(11)記載の方法。
(13)被験者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現が、健常者又は非明細胞線癌患者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現と比較して、タンパク質レベルで2倍以上の上昇が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する(7)〜(12)のいずれかに記載の方法。
(14)被験者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現が、健常者由来又は非明細胞線癌患者の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現と比較して、核酸レベルで2倍以上の上昇が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する(7)〜(12)のいずれかに記載の方法。
(15)生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することができる試薬を含む、明細胞腺癌の評価及び/又は鑑別のためのキット。
(16)生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することができる試薬が、下記(i)、(ii)又は(iii)のいずれかである(15)記載のキット。
(i) N-myc下流制御遺伝子1タンパク質を特異的に認識できる抗体
(ii) N-myc下流制御遺伝子1タンパク質をコードするmRNAと特異的にハイブリダイズできる核酸プローブ
(iii) N-myc下流制御遺伝子1タンパク質をコードするmRNAを鋳型として合成されるcDNAを特異的に増幅できる少なくとも1対の核酸プライマー
【発明の効果】
【0010】
NDRG1タンパク質の機能を阻害もしくは発現を抑制するような薬剤を使用することで、卵巣明細胞腺癌の治療が可能になる。
【図面の簡単な説明】
【0011】
【図1】培養明細胞腺癌細胞におけるNDRG1の発現上昇。種々の卵巣癌細胞株におけるNDRG1の発現量をウエスタンブロット解析(上図)およびリアルタイムPCR解析(下図)にて比較した。リアルタイムPCRは内部標準として18S RNAを用いた。
【図2】明細胞腺癌組織におけるNDRG1 mRNAの発現解析。内部標準としてβアクチンmRNAを用いた。非明細胞腺癌4例には粘液性2例、漿液性2例が含まれる。発現量を対数表記したものを右図に示した。
【図3】明細胞腺癌組織におけるNDRG1の免疫組織染色。健常卵巣組織、良性腫瘍組織、漿液性腺癌組織、類内膜腺癌組織、粘液性腺癌組織、および明細胞腺癌組織におけるNDRG1を免疫組織染色法にて比較した。
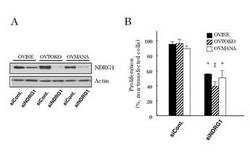
【図4】NDRG1の発現抑制による明細胞腺癌細胞の増殖阻害。(A) NDRG1 siRNA導入細胞におけるNDRG1タンパク質のウエスタンブロット解析。(B)NDRG1 siRNA導入による細胞増殖の変化。‡はP<0.01、*はP<0.05を示す。
【図5】NDRG1の発現抑制による明細胞腺癌のアポトーシス誘導。(A) NDRG1 siRNA導入細胞におけるNDRG1タンパク質の免疫蛍光染色。緑はAlexa488(NDRG1)、赤はローダミン(アクチン)を示す。スケールバーは100 μmを示す。(B)OVISE細胞におけるNDRG1 siRNA導入によるカスパーゼ活性の影響。(C)OVISE細胞におけるNDRG1の発現抑制によるp53およびBax発現量への影響。ウエスタンブロット法により比較した。
【発明を実施するための最良の形態】
【0012】
以下、本発明の実施の形態についてより詳細に説明する。
【0013】
本発明は、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の治療及び/又は予防剤を提供する。
【0014】
また、本発明は、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の抗癌剤耐性を低下させる薬剤を提供する。
【0015】
本発明の薬剤(明細胞腺癌の治療及び/又は予防剤、並びに明細胞腺癌の抗癌剤耐性を低下させる薬剤)において、N-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質としては、核酸(例えば、N-myc下流制御遺伝子1タンパク質を標的とするsiRNA、リボザイム、アンチセンス核酸、デコイ、アプタマー、それらをコードするDNA、それらを発現するベクターなど)、タンパク質(例えば、N-myc下流制御遺伝子1タンパク質に対する抗体、N-myc下流制御遺伝子1タンパク質と相互作用するタンパク質など)、ペプチド、アミノ酸、糖、糖タンパク質、糖脂質、脂質、低分子化合物などを例示することができる。
【0016】
後述の実施例においては、N-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質としては、以下のヌクレオチド配列を標的とする二本鎖オリゴを用いた。CCUUCAAGUACUUCGUGCAGGGCAU(配列番号1)
【0017】
N-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質は、必要により、医薬的に許容される賦形剤又は担体と混合し、錠剤、カプセル剤、散剤、顆粒剤、液剤、シロップ、エアロゾル、坐剤、注射剤等に製剤化するとよい。賦形剤又は担体は、当分野で常套的に使用され、医薬的に許容されるものであればよく、その種類及び組成は適宜変更される。N-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質は、経口、経鼻、直腸、経皮、皮下、静脈内、筋肉内、腹腔内などの種々の経路によって投与できる。投与量は、期待する予防及び/又は治療効果が確認できる量であればよく、剤型、投与経路、患者の年齢、体重、疾患の種類や重篤度などにより適宜決定すればよい。
【0018】
例えば、N-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質がN-myc下流制御遺伝子1タンパク質を標的とするsiRNAである場合には、プラスミドベクター、ウイルスベクターなどのベクターにsiRNAのテンプレートDNAを導入したものをリポソームなどのキャリアーに封入し、生理食塩水、緩衝液などの担体と混合して、製剤化するとよい。この製剤を皮下、静脈内、筋肉内又は腹腔内への注射により被験者に投与するとよい。投与は、疾病の状態の重篤度や生体の応答性によるが、治療の有効性が認められるまで、あるいは疾病状態の軽減が達成されるまでの期間にわたり、適当な用量、投与方法、頻度で行えばよい。例えば、通常、成人一人当たり1〜100mg、好ましくは、1〜10mgの投与量で、少なくとも1回、所望の効果が持続する頻度で投与するとよい。ベクターがウイルスの場合には、例えば、成人一人当たり109〜1012pfu、好ましくは1011〜1012pfuの投与量で少なくとも1回、所望の効果が持続する頻度で投与するとよい。
【0019】
本発明は、明細胞腺癌の治療及び/又は予防に効果のある物質を同定する方法も提供する。この方法は、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果を評価する工程
を含む。
【0020】
被験物質は、いかなる物質であってもよく、タンパク質、ペプチド、アミノ酸、ビタミン、ホルモン、多糖、オリゴ糖、単糖、低分子化合物、核酸(DNA、RNA、オリゴヌクレオチド、モノヌクレオチド等)、脂質、上記以外の天然化合物、合成化合物、植物抽出物、植物抽出物の分画物、それらの混合物などを挙げることができる。
【0021】
本発明の方法に用いられる明細胞腺癌細胞は、N-myc下流制御遺伝子1タンパク質の発現がタンパク質レベル又は核酸レベルで観察されるものであれば、いかなる生物に由来するものであってもよく、ヒト、ブタ、サル、チンパンジー、イヌ、ウシ、ウサギ、ラット、マウスなどの哺乳動物などに由来するものを挙げることができるが、ヒト由来の明細胞腺癌細胞(特に、株化されている細胞、具体的には、OVTOKO、OVISE、OVMANA、OVSAYO、RMG-I、RMG-II(JCRBから入手可能))を使用することが好ましい。
【0022】
被験物質と明細胞腺癌細胞との接触は、いかなる方法によってもよく、例えば、被験物質を明細胞腺癌細胞に添加する方法などを挙げることができる。また、ヒト以外の哺乳動物(例えば、マウス、ラット、モルモット、ウサギ、ブタなど)などの生体に明細胞腺癌細胞を移植してから、被験物質を投与してもよい。
【0023】
被験物質と接触後の明細胞腺癌細胞の培養時間は特に限定されず、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果の有無が確認できる程度の時間であればよい。
【0024】
比較の対照となる被験物質に接触させなかった対照細胞は、被験物質を接触させる前の明細胞腺癌細胞であってもよいし、被験物質を接触させないこと以外は同様の処理を行った明細胞腺癌細胞であってもよい。
【0025】
本発明の一つの例として、被験物質を接触させた明細胞腺癌細胞において、N-myc下流制御遺伝子1タンパク質の発現量がタンパク質レベル又は核酸レベルで対照細胞と比較して減少しており、被験物質がN-myc下流制御遺伝子1タンパク質の発現をタンパク質レベル又は核酸レベルで減少させる効果があると評価できた場合には、この被験物質は、明細胞腺癌の治療及び/又は予防に効果がある物質と同定することができる。
【0026】
さらに、明細胞腺癌細胞増殖に対する被験物質の効果を調べる工程を含んでもよい。明細胞腺癌細胞増殖に対する被験物質の効果は、例えば、明細胞腺癌細胞に被験物質を接触させ、所定時間培養した後に生細胞数を測定することにより調べることができる。
【0027】
本発明の一つの例として、被験物質を接触させた明細胞腺癌細胞において、明細胞腺癌細胞の増殖が対照細胞と比較して阻害されている場合には、この被験物質が明細胞腺癌の治療及び/又は予防に効果がある確実性が増すと考えられる。
【0028】
本発明は、明細胞腺癌の抗癌剤耐性を低下させる物質を同定する方法も提供する。この方法は、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞における発現に対する被験物質の効果を評価する工程
を含む。
【0029】
被験物質は、いかなる物質であってもよく、タンパク質、ペプチド、アミノ酸、ビタミン、ホルモン、多糖、オリゴ糖、単糖、低分子化合物、核酸(DNA、RNA、オリゴヌクレオチド、モノヌクレオチド等)、脂質、上記以外の天然化合物、合成化合物、植物抽出物、植物抽出物の分画物、それらの混合物などを挙げることができる。
【0030】
本発明の方法に用いられる明細胞腺癌細胞は、N-myc下流制御遺伝子1タンパク質の発現がタンパク質レベル又は核酸レベルで観察されるものであれば、いかなる生物に由来するものであってもよく、ヒト、ブタ、サル、チンパンジー、イヌ、ウシ、ウサギ、ラット、マウスなどの哺乳動物などに由来するものを挙げることができるが、ヒト由来の明細胞腺癌細胞(特に、株化されている細胞、具体的には、OVTOKO、OVISE、OVMANA、OVSAYO、RMG-I、RMG-II(JCRBから入手可能))を使用することが好ましい。
【0031】
被験物質と明細胞腺癌細胞との接触は、いかなる方法によってもよく、例えば、被験物質を明細胞腺癌細胞に添加する方法などを挙げることができる。また、ヒト以外の哺乳動物(例えば、マウス、ラット、モルモット、ウサギ、ブタなど)などの生体に明細胞腺癌細胞を移植してから、被験物質を投与してもよい。
【0032】
被験物質と接触後の明細胞腺癌細胞の培養時間は特に限定されず、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果の有無が確認できる程度の時間であればよい。
【0033】
比較の対照となる被験物質に接触させなかった対照細胞は、被験物質を接触させる前の明細胞腺癌細胞であってもよいし、被験物質を接触させないこと以外は同様の処理を行った明細胞腺癌細胞であってもよい。
【0034】
本発明の一つの例として、被験物質を接触させた明細胞腺癌細胞において、N-myc下流制御遺伝子1タンパク質の発現量がタンパク質レベル又は核酸レベルで対照細胞と比較して減少しており、被験物質がN-myc下流制御遺伝子1タンパク質の発現をタンパク質レベル又は核酸レベルで減少させる効果があると評価できた場合には、この被験物質は、明細胞腺癌の抗癌剤耐性を低下させる物質と同定することができる。
【0035】
さらに、明細胞腺癌細胞の抗癌剤耐性に対する被験物質の効果を調べる工程を含んでもよい。明細胞腺癌細胞の抗癌剤耐性に対する被験物質の効果は、例えば、明細胞腺癌細胞を被験物質と接触させる前、後又は同時に、抗癌剤を添加し、適当な時間培養した後に生細胞数を測定することにより調べることができる。被験物質を接触させた明細胞腺癌細胞の生細胞数が、対照細胞の生細胞数と比較して、少なければ、明細胞腺癌細胞の抗癌剤耐性が低下していると看做すことができる。
【0036】
本発明の一つの例として、被験物質を接触させた明細胞腺癌細胞において、明細胞腺癌細胞の抗癌剤耐性が対照細胞と比較して低下している場合には、この被験物質が明細胞腺癌の抗癌剤耐性を低下させる確実性が増すと考えられる。
【0037】
本発明は、生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することを含む、明細胞腺癌の評価及び/又は鑑別方法を提供する。本発明者らは、N-myc下流制御遺伝子1タンパク質は、非明細胞線癌の細胞株(OVCAR-3、OVSAHO、OVKATE、RMUG-SまたはMCAS)や組織と比較して、卵巣明細胞腺癌細胞由来の細胞株(OVTOKO、OVISE、RMG-I、RMG-II、OVMANAまたはOVSAYO)や組織にて2倍以上発現上昇していることを確認した(後述の実施例1、2、3)。
【0038】
N-myc下流制御遺伝子1タンパク質(N-Myc downstream regulated gene 1 protein):分子量42835、機能は不明。種々の組織にて広範囲に発現する。SwissProt登録番号Q92597 (NDRG1_HUMAN)。
【0039】
本発明において、生体試料は、被験者に由来する試料であればよく、被験者から得た細胞、組織、体液など、具体的には、被験者の卵巣から採取又は切除した組織、被験者の血液(例えば、全血、血清、血漿、血漿交換外液など)などを例示することができる。通常の血液検査(臨床検査)で得られる全血、血清あるいは血漿を血液サンプルとして使用するとよい。
【0040】
本発明の方法において、生体試料におけるN-myc下流制御遺伝子1タンパク質の発現はタンパク質レベルで測定してもよいし、核酸レベルで測定してもよい。例えば、ノーザンブロット法、RT-PCR法、ウェスタンブロット法、免疫組織化学分析法などで測定することができる。あるいはまた、cDNAマイクロアレイ、ELISA法などを利用して測定してもよい。
【0041】
N-myc下流制御遺伝子1タンパク質の発現をタンパク質レベルで測定するためには、N-myc下流制御遺伝子1タンパク質を特異的に認識する抗体を用いるとよい。抗体は、モノクローナル抗体、ポリクローナル抗体のいずれであってもよい。これらの抗体は公知の方法で製造することができる。ウェスタンブロット法で測定する場合には、抗体は、125I標識プロテインA、ペルオキシダーゼ結合IgGなどを用いて二次的に検出される。免疫組織化学分析法で測定する場合には、抗体は、蛍光色素、フェリチン、酵素などで標識するとよい。
【0042】
N-myc下流制御遺伝子1タンパク質の発現を核酸レベルで測定するためには、N-myc下流制御遺伝子1のmRNAと特異的にハイブリダイズできる核酸プローブを用いるとよい(ノーザンブロット法で測定する場合)。あるいはまた、N-myc下流制御遺伝子1のmRNAを鋳型として合成されるcDNAを特異的に増幅できる少なくとも1対の核酸プライマーを用いてもよい(RT-PCR法で測定する場合)。核酸プローブ及び核酸プライマーは、N-myc下流制御遺伝子1の遺伝子情報(NM_001135242.1)に基づいて設計することができる。核酸プローブは、通常、約15〜1500塩基のものが適当である。核酸プローブは、放射性元素、蛍光色素、酵素などで標識するとよい。核酸プライマーは、通常、約15〜30塩基のものが適当である。核酸プライマーを放射性元素、蛍光色素、酵素などで標識してもよい。
【0043】
本発明において、生体試料におけるN-myc下流制御遺伝子1タンパク質の発現(タンパク質レベル又は核酸レベル)の有無を検出してもよいし、発現量を測定してもよい。N-myc下流制御遺伝子1タンパク質及び/又はそのmRNAの発現の有無は所定の位置におけるスポットやバンドの出現の有無により確認できる。N-myc下流制御遺伝子1タンパク質及び/又はそのmRNAの発現量はスポットやバンドの染色強度により測定できる。あるいはまた、N-myc下流制御遺伝子1タンパク質及び/又はそのmRNAを定量してもよい。
【0044】
発現を測定するタンパク質又は遺伝子はN-myc下流制御遺伝子1タンパク質(1種類)のみでもよいし、その他のタンパク質又は遺伝子を含む複数種類であってもよい。複数の遺伝子発現や複数のタンパク発現データを参照することにより、より正確な評価が可能となりうる。複数の遺伝子発現や複数のタンパク発現を同時に検出するためには、DNAアレイ(プローブを基板に固定)(NATURE REVIEWS, DRUG DISCOVERY, VOLUME 1, DECEMBER 2002, 951-960)、プロテインチップ(抗体を基板に固定)(NATURE REVIEWS, DRUG DISCOVERY, VOLUME 1, SEPTEMBER 2002, 683-695)、ルミネックス(NATURE REVIEWS, DRUG DISCOVERY, VOLUME 1, JUNE 2002, 447-456)等の検出法を用いることが好ましい。
【0045】
被験者は、明細胞腺癌(特に、卵巣明細胞腺癌)への罹患が疑われる患者であるが、発病危険性が考えられるすべてのヒトを対象としてもよい。
【0046】
本発明の一つの例として、明細胞腺癌(特に、卵巣明細胞腺癌)の評価・鑑別は、以下のような基準で行うことができる。
【0047】
被験者から得た細胞、組織又は体液におけるN-myc下流制御遺伝子1タンパク質の少なくとも1個の発現を測定し、健常者から得た細胞、組織又は体液におけるそれと比較した結果、タンパク質レベルで2倍以上の増加が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する。タンパク質レベルで2倍以上の発現の増加が確認されたタンパク質の数が多いほど、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であるという評価の確実性が増すと考えられる。
【0048】
また、本発明の別の例として、明細胞腺癌(特に、卵巣明細胞腺癌)の評価・鑑別は、以下のような基準で行うことができる。
【0049】
被験者から得た細胞、組織又は体液におけるN-myc下流制御遺伝子1タンパク質の発現を測定し、健常者から得た細胞、組織又は体液におけるそれと比較した結果、核酸レベルで2倍以上の増加が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する。核酸レベルで2倍以上の発現の増加が確認されたタンパク質の数が多いほど、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であるという評価の確実性が増すと考えられる。
【0050】
本発明は、生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することができる試薬を含む、明細胞腺癌の評価及び/又は鑑別のためのキットも提供する。
【0051】
一つの例として、本発明のキットは、N-myc下流制御遺伝子1タンパク質を特異的に認識できる抗体を試薬として含む。抗体は基板に固定されていてもよい(プロテインチップの場合)。キットには、さらに、生体試料を採取するための器具、抗凝固剤、N-myc下流制御遺伝子1タンパク質を検出するための試薬一式、取扱説明書などが含まれてもよい。取扱説明書には、キットの使用方法の他、明細胞腺癌の評価及び/又は鑑別基準なども記載しておくとよい。
【0052】
別の一例として、本発明のキットは、N-myc下流制御遺伝子1タンパク質のmRNAと特異的にハイブリダイズできる核酸プローブを試薬として含む。核酸プローブは基板に固定されていてもよい(DNAアレイの場合)。キットには、さらに、生体試料を採取するための器具、抗凝固剤、生体試料からRNAを抽出するための試薬類、RNAを検出するための試薬類、取扱説明書などが含まれてもよい。取扱説明書には、キットの使用方法の他、明細胞腺癌の評価及び/又は鑑別基準なども記載しておくとよい。
【0053】
さらに別の一例として、本発明のキットはN-myc下流制御遺伝子1タンパク質のmRNAを鋳型として合成されるcDNAを特異的に増幅できる少なくとも1対の核酸プライマーを試薬として含む。キットには、さらに、生体試料を採取するための器具、抗凝固剤、生体試料からRNAを抽出するための試薬類、RNAを検出するための試薬類、取扱説明書などが含まれるとよい。取扱説明書には、キットの使用方法の他、明細胞腺癌の評価及び/又は鑑別基準なども記載しておくとよい。
【実施例】
【0054】
以下、実施例に基づいて本発明を詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【0055】
〔実施例1〕培養明細胞腺癌細胞におけるNDRG1の発現解析
培養明細胞腺癌細胞におけるNDRG1の発現
種々の卵巣癌細胞株におけるNDRG1のmRNA発現量およびタンパク質量を定量的RT-PCR解析およびウエスタンブロットにより比較した。漿液性3種(OVCAR-3、OVSAHO、OVKATE)、粘液性2種(RMUG-S、MCAS)、明細胞6種(OVTOKO、OVISE、RMG-I、RMG-II、OVMANA、OVSAYO)の卵巣癌細胞株を使用した。MCAS、RMUG-S、RMG-I、RMG-IIはJCRB細胞バンクから、OVCAR-3はRIKENバイオリソースセンターから購入した。OVSAHO、OVKATE、OVMANA、OVSAYO、OVTOKO、OVISEは横浜市立大学医学部産婦人科で樹立されたものを供与された(Yanagibashiら British journal of cancer, 76(7) 829-835, 1997)。これらの細胞株からRNeasyスピンカラム(キアゲン)を用いて全RNAを抽出した。そして1.0 μgの全RNAをプライムスクリプト・ファーストストランドcDNA合成キット(タカラバイオ)を用いてランダムヘキサマープライマーとともに逆転写反応を行い、得られたcDNAをSYBR premix ExTaq II試薬(タカラバイオ)を用いて増幅反応した。定量にはリアルタイムPCR解析装置(アジレントP3000)を用いた。使用したプライマー配列は、センスプライマー:5’-GTGGAGGGCCTTGTCCTTATC-3’ (配列番号2)、アンチセンスプライマー:5’-TTGATGAACAGGTGCAGGTTG-3’ (配列番号3)である。またNDRG1タンパク質量を調べるためにウエスタンブロット解析を行った。抗NDRG1ウサギポリクローナル抗体はZymed Lab社から購入した。
【0056】
結果を図1に示す。NDRG1 mRNAおよびタンパク質は、漿液性および粘液性腺癌細胞株と比較して、明細胞腺癌細胞株群にて高く発現していることがわかった。
【0057】
〔実施例2〕明細胞腺癌組織におけるNDRG1 mRNAの発現解析
明細胞腺癌5症例、非明細胞線癌4症例、良性腫瘍4症例の組織検体からRNeasyスピンカラム(キアゲン)を用いて全RNAを抽出した。また健常者卵巣組織2例からの全RNAは、アンビオン社およびザイアゲン社から購入した。そして1.0 μgの全RNAをプライムスクリプト・ファーストストランドcDNA合成キット(タカラバイオ)を用いてランダムヘキサマープライマーとともに逆転写反応を行い、得られたcDNAをSYBR premix ExTaq II試薬(タカラバイオ)を用いて増幅反応した。定量にはリアルタイムPCR解析装置(アジレントP3000)を用いた。実施例1にて用いたプライマーを使用した。
【0058】
結果を図2に示す。卵巣癌組織においても、明細胞腺癌患者の組織にて、NDRG1 mRNA発現量が有意に増加していることが示された。
【0059】
〔実施例3〕明細胞腺癌組織におけるNDRG1の免疫組織染色
明細胞腺癌組織に特徴的にNDRG1発現が認められるかどうか調べるために、明細胞腺癌患者のホルマリン固定パラフィン包埋組織切片を用いてNDRG1の免疫染色を行った。10 mMクエン酸緩衝液(pH6.0)中にて90℃加熱することで賦活化処理を行い、実施例1で使ったNDRG1抗体で染色した。
【0060】
結果を図3に示す。健常卵巣組織、良性腫瘍組織、漿液性腺癌患者組織、類内膜腺癌患者組織、粘液性腺癌患者組織、および明細胞腺癌患者組織と比較した結果、NDRG1の発現が明細胞腺癌患者組織にて強いことがわかった。
【0061】
〔実施例4〕NDRG1の発現抑制による明細胞腺癌細胞の増殖阻害
明細胞腺癌細胞株OVTOKO、OVISE、OVMANAに発現しているNDRG1をRNA干渉により抑制した。NDRG1に対するsiRNA(CCUUCAAGUACUUCGUGCAGGGCAU(配列番号1))および Control siRNA(Invitrogen)をリポフェクトアミンRNAi MAX 試薬を用いてこれら細胞に導入し、2日間培養後のNDRG1タンパク質の発現量をウエスタンブロットにて調べた。またこの時の細胞増殖をCell Titer 96 Aqueous One Solution Cell Proliferation Assay kit(Promega)のMTSアッセイキットにより比較した。
【0062】
結果を図4に示す。OVTOKO、OVISE、OVMANA細胞におけるNDRG1タンパク質の発現は、NDRG1 siRNAの導入により抑制されていることが確認できた(図4A)。この時の細胞増殖能は、3種の細胞株ともに60%以下にまで低下した(図4B)。
【0063】
〔実施例5〕NDRG1の発現抑制による明細胞腺癌のアポトーシス誘導
NDRG1を発現抑制した細胞がアポトーシスを起こしているのかどうかを検証するために、細胞形態、カスパーゼ活性、p53およびBaxのタンパク質量を調べた。siRNAは実施例4と同じ方法でOVTOKOおよびOVISE細胞に導入した。免疫蛍光染色法にて細胞形態を観察するために、siRNA導入細胞をLab-Tekチャンバースライド(Nunc)上で培養した。2日後、細胞を2%パラホルムアルデヒドで固定し、NDRG1およびアクチンを蛍光染色し、Radiance2000共焦点レーザー顕微鏡(BioRad)にて観察した。NDRG1は実施例1で用いたNDRG1抗体とAlexa488標識抗ウサギ抗体(Molecular Probes)、アクチンはローダミン・ファロイジン(Chemicon社)を用いて検出した。またsiRNA導入細胞のカスパーゼ活性の測定は、Caspase-Glo3/7、8、および9 Assayキット(Promega)を用いた。p53およびBaxタンパク質のウエスタンブロットには、それぞれ抗p53マウスモノクローナル抗体DO-1(Calbiochem)および抗Baxウサギポリクローナル抗体N-20(Santa Curz)を用いた。
【0064】
結果を図5に示す。免疫蛍光染色の結果、Control siRNA(siControl)を導入したOVTOKOおよびOVISE細胞においては、NDRG1のシグナルとともに均一な細胞形態が観察されるが、NDRG1 siRNA(siNDRG1)によりNDRG1の発現が抑制された細胞は、細胞形態が崩れていることが認められた(図5A)。さらに、このNDRG1 siRNA導入細胞は、アポトーシスの指標であるカスパーゼ活性の上昇(図5B)、およびp53とBaxタンパク質量の増加(図5C)が認められた。従って、NDRG1の発現抑制は卵巣明細胞腺癌細胞のアポトーシスを誘発できることが分かった。
【産業上の利用可能性】
【0065】
本発明は、卵巣明細胞腺癌の治療に利用できる。
【配列表フリーテキスト】
【0066】
<配列番号1>
配列番号1は、NDRG1に対するsiRNAのヌクレオチド配列を示す。
<配列番号2>
配列番号2は、実施例1で用いたセンスプライマーのヌクレオチド配列を示す。
<配列番号3>
配列番号3は、実施例1で用いたアンチセンスプライマーのヌクレオチド配列を示す。
【技術分野】
【0001】
本発明は、卵巣明細胞腺癌に特異的に発現しているN-myc下流制御遺伝子1タンパク質を標的とした卵巣明細胞腺癌の治療薬、並びにN-myc下流制御遺伝子1タンパク質を診断マーカー及び創薬ターゲットとして使用する技術に関する。
【背景技術】
【0002】
上皮性卵巣癌に対する標準的化学療法はタキサン製剤とプラチナ製剤であり、その代表的なものはパクリタキセルとカルボプラチンの併用療法である(非特許文献1)。
【0003】
N-myc下流制御遺伝子1(N-myc downstream regulated gene 1, NDRG1, Cap43)の詳細な機能については未だ不明なままであるが、生体内において諸種の刺激によって発現変動をすることが報告されており、多様な機能を持つことが示唆されている。癌細胞との関連においては大腸癌細胞株などを用いた実験で転移抑制機能を有する遺伝子として注目されている。またp53やPTEN (phosphatase and tensin homologue)などの腫瘍抑制能を示す遺伝子との関連についての報告もなされている(非特許文献2)。
【0004】
上皮性卵巣癌の組織型の中で、明細胞腺癌は特に薬剤抵抗性が高く、臨床病期初期であっても予後不良例が存在する悪性度の高い組織型である。現在、卵巣癌の化学療法として主に使用されているプラチナ製剤とタキサン製剤の併用療法に対して、明細胞腺癌は著しく高い抵抗性を示すことから、現在本組織型に対する新しい抗悪性腫瘍薬の開発が喫緊の課題となっている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】産科と婦人科. 診断と治療社. 2005. vol.72
【非特許文献2】Ellen TPら Carcinogenesis, 2008, 29, 2-8
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明は、卵巣明細胞腺癌に特異的に発現しているタンパク質を標的とした本疾患の新しい治療薬を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、プロテオミクス手法を用いて、NDRG1が明細胞腺癌の細胞株および組織にて発現上昇していることを明らかにした。また本タンパク質の発現をRNA干渉法により抑制すると、明細胞腺癌細胞のアポトーシスを誘導し死滅させることができる可能性が示された。すなわち、この結果はNDRG1が卵巣明細胞腺癌の新しい分子標的治療薬の標的となることを示すものである。現在のところ、卵巣明細胞腺癌においてのNDRG1発現に関する報告はなく、また卵巣明細胞腺癌における分子標的治療薬は開発されていない。本発明は、これらの知見に基づいて完成されたものである。
【0008】
本発明の要旨は以下の通りである。
【0009】
(1)明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の治療及び/又は予防剤。
(2)明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の抗癌剤耐性を低下させる薬剤。
(3)明細胞腺癌の治療及び/又は予防に効果のある物質を同定する方法であって、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果を評価する工程
を含む前記方法。
(4)さらに、明細胞腺癌細胞増殖に対する被験物質の効果を調べる工程を含む(3)記載の方法。
(5)明細胞腺癌の抗癌剤耐性を低下させる物質を同定する方法であって、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果を評価する工程
を含む前記方法。
(6)さらに、明細胞腺癌細胞の抗癌剤耐性に対する被験物質の効果を調べる工程を含む(5)記載の方法。
(7)生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することを含む、明細胞腺癌の評価及び/又は鑑別方法。
(8)生体試料におけるN-myc下流制御遺伝子1タンパク質の発現をタンパク質レベルで測定する(7)記載の方法。
(9)生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を核酸レベルで測定する(7)記載の方法。
(10)生体試料が、被験者から得た細胞、組織又は体液である(7)〜(9)のいずれかに記載の方法。
(11)体液が血液である(10)記載の方法。
(12)血液が、全血、血清、血漿又は血漿交換外液である(11)記載の方法。
(13)被験者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現が、健常者又は非明細胞線癌患者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現と比較して、タンパク質レベルで2倍以上の上昇が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する(7)〜(12)のいずれかに記載の方法。
(14)被験者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現が、健常者由来又は非明細胞線癌患者の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現と比較して、核酸レベルで2倍以上の上昇が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する(7)〜(12)のいずれかに記載の方法。
(15)生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することができる試薬を含む、明細胞腺癌の評価及び/又は鑑別のためのキット。
(16)生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することができる試薬が、下記(i)、(ii)又は(iii)のいずれかである(15)記載のキット。
(i) N-myc下流制御遺伝子1タンパク質を特異的に認識できる抗体
(ii) N-myc下流制御遺伝子1タンパク質をコードするmRNAと特異的にハイブリダイズできる核酸プローブ
(iii) N-myc下流制御遺伝子1タンパク質をコードするmRNAを鋳型として合成されるcDNAを特異的に増幅できる少なくとも1対の核酸プライマー
【発明の効果】
【0010】
NDRG1タンパク質の機能を阻害もしくは発現を抑制するような薬剤を使用することで、卵巣明細胞腺癌の治療が可能になる。
【図面の簡単な説明】
【0011】
【図1】培養明細胞腺癌細胞におけるNDRG1の発現上昇。種々の卵巣癌細胞株におけるNDRG1の発現量をウエスタンブロット解析(上図)およびリアルタイムPCR解析(下図)にて比較した。リアルタイムPCRは内部標準として18S RNAを用いた。
【図2】明細胞腺癌組織におけるNDRG1 mRNAの発現解析。内部標準としてβアクチンmRNAを用いた。非明細胞腺癌4例には粘液性2例、漿液性2例が含まれる。発現量を対数表記したものを右図に示した。
【図3】明細胞腺癌組織におけるNDRG1の免疫組織染色。健常卵巣組織、良性腫瘍組織、漿液性腺癌組織、類内膜腺癌組織、粘液性腺癌組織、および明細胞腺癌組織におけるNDRG1を免疫組織染色法にて比較した。
【図4】NDRG1の発現抑制による明細胞腺癌細胞の増殖阻害。(A) NDRG1 siRNA導入細胞におけるNDRG1タンパク質のウエスタンブロット解析。(B)NDRG1 siRNA導入による細胞増殖の変化。‡はP<0.01、*はP<0.05を示す。
【図5】NDRG1の発現抑制による明細胞腺癌のアポトーシス誘導。(A) NDRG1 siRNA導入細胞におけるNDRG1タンパク質の免疫蛍光染色。緑はAlexa488(NDRG1)、赤はローダミン(アクチン)を示す。スケールバーは100 μmを示す。(B)OVISE細胞におけるNDRG1 siRNA導入によるカスパーゼ活性の影響。(C)OVISE細胞におけるNDRG1の発現抑制によるp53およびBax発現量への影響。ウエスタンブロット法により比較した。
【発明を実施するための最良の形態】
【0012】
以下、本発明の実施の形態についてより詳細に説明する。
【0013】
本発明は、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の治療及び/又は予防剤を提供する。
【0014】
また、本発明は、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の抗癌剤耐性を低下させる薬剤を提供する。
【0015】
本発明の薬剤(明細胞腺癌の治療及び/又は予防剤、並びに明細胞腺癌の抗癌剤耐性を低下させる薬剤)において、N-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質としては、核酸(例えば、N-myc下流制御遺伝子1タンパク質を標的とするsiRNA、リボザイム、アンチセンス核酸、デコイ、アプタマー、それらをコードするDNA、それらを発現するベクターなど)、タンパク質(例えば、N-myc下流制御遺伝子1タンパク質に対する抗体、N-myc下流制御遺伝子1タンパク質と相互作用するタンパク質など)、ペプチド、アミノ酸、糖、糖タンパク質、糖脂質、脂質、低分子化合物などを例示することができる。
【0016】
後述の実施例においては、N-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質としては、以下のヌクレオチド配列を標的とする二本鎖オリゴを用いた。CCUUCAAGUACUUCGUGCAGGGCAU(配列番号1)
【0017】
N-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質は、必要により、医薬的に許容される賦形剤又は担体と混合し、錠剤、カプセル剤、散剤、顆粒剤、液剤、シロップ、エアロゾル、坐剤、注射剤等に製剤化するとよい。賦形剤又は担体は、当分野で常套的に使用され、医薬的に許容されるものであればよく、その種類及び組成は適宜変更される。N-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質は、経口、経鼻、直腸、経皮、皮下、静脈内、筋肉内、腹腔内などの種々の経路によって投与できる。投与量は、期待する予防及び/又は治療効果が確認できる量であればよく、剤型、投与経路、患者の年齢、体重、疾患の種類や重篤度などにより適宜決定すればよい。
【0018】
例えば、N-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質がN-myc下流制御遺伝子1タンパク質を標的とするsiRNAである場合には、プラスミドベクター、ウイルスベクターなどのベクターにsiRNAのテンプレートDNAを導入したものをリポソームなどのキャリアーに封入し、生理食塩水、緩衝液などの担体と混合して、製剤化するとよい。この製剤を皮下、静脈内、筋肉内又は腹腔内への注射により被験者に投与するとよい。投与は、疾病の状態の重篤度や生体の応答性によるが、治療の有効性が認められるまで、あるいは疾病状態の軽減が達成されるまでの期間にわたり、適当な用量、投与方法、頻度で行えばよい。例えば、通常、成人一人当たり1〜100mg、好ましくは、1〜10mgの投与量で、少なくとも1回、所望の効果が持続する頻度で投与するとよい。ベクターがウイルスの場合には、例えば、成人一人当たり109〜1012pfu、好ましくは1011〜1012pfuの投与量で少なくとも1回、所望の効果が持続する頻度で投与するとよい。
【0019】
本発明は、明細胞腺癌の治療及び/又は予防に効果のある物質を同定する方法も提供する。この方法は、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果を評価する工程
を含む。
【0020】
被験物質は、いかなる物質であってもよく、タンパク質、ペプチド、アミノ酸、ビタミン、ホルモン、多糖、オリゴ糖、単糖、低分子化合物、核酸(DNA、RNA、オリゴヌクレオチド、モノヌクレオチド等)、脂質、上記以外の天然化合物、合成化合物、植物抽出物、植物抽出物の分画物、それらの混合物などを挙げることができる。
【0021】
本発明の方法に用いられる明細胞腺癌細胞は、N-myc下流制御遺伝子1タンパク質の発現がタンパク質レベル又は核酸レベルで観察されるものであれば、いかなる生物に由来するものであってもよく、ヒト、ブタ、サル、チンパンジー、イヌ、ウシ、ウサギ、ラット、マウスなどの哺乳動物などに由来するものを挙げることができるが、ヒト由来の明細胞腺癌細胞(特に、株化されている細胞、具体的には、OVTOKO、OVISE、OVMANA、OVSAYO、RMG-I、RMG-II(JCRBから入手可能))を使用することが好ましい。
【0022】
被験物質と明細胞腺癌細胞との接触は、いかなる方法によってもよく、例えば、被験物質を明細胞腺癌細胞に添加する方法などを挙げることができる。また、ヒト以外の哺乳動物(例えば、マウス、ラット、モルモット、ウサギ、ブタなど)などの生体に明細胞腺癌細胞を移植してから、被験物質を投与してもよい。
【0023】
被験物質と接触後の明細胞腺癌細胞の培養時間は特に限定されず、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果の有無が確認できる程度の時間であればよい。
【0024】
比較の対照となる被験物質に接触させなかった対照細胞は、被験物質を接触させる前の明細胞腺癌細胞であってもよいし、被験物質を接触させないこと以外は同様の処理を行った明細胞腺癌細胞であってもよい。
【0025】
本発明の一つの例として、被験物質を接触させた明細胞腺癌細胞において、N-myc下流制御遺伝子1タンパク質の発現量がタンパク質レベル又は核酸レベルで対照細胞と比較して減少しており、被験物質がN-myc下流制御遺伝子1タンパク質の発現をタンパク質レベル又は核酸レベルで減少させる効果があると評価できた場合には、この被験物質は、明細胞腺癌の治療及び/又は予防に効果がある物質と同定することができる。
【0026】
さらに、明細胞腺癌細胞増殖に対する被験物質の効果を調べる工程を含んでもよい。明細胞腺癌細胞増殖に対する被験物質の効果は、例えば、明細胞腺癌細胞に被験物質を接触させ、所定時間培養した後に生細胞数を測定することにより調べることができる。
【0027】
本発明の一つの例として、被験物質を接触させた明細胞腺癌細胞において、明細胞腺癌細胞の増殖が対照細胞と比較して阻害されている場合には、この被験物質が明細胞腺癌の治療及び/又は予防に効果がある確実性が増すと考えられる。
【0028】
本発明は、明細胞腺癌の抗癌剤耐性を低下させる物質を同定する方法も提供する。この方法は、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞における発現に対する被験物質の効果を評価する工程
を含む。
【0029】
被験物質は、いかなる物質であってもよく、タンパク質、ペプチド、アミノ酸、ビタミン、ホルモン、多糖、オリゴ糖、単糖、低分子化合物、核酸(DNA、RNA、オリゴヌクレオチド、モノヌクレオチド等)、脂質、上記以外の天然化合物、合成化合物、植物抽出物、植物抽出物の分画物、それらの混合物などを挙げることができる。
【0030】
本発明の方法に用いられる明細胞腺癌細胞は、N-myc下流制御遺伝子1タンパク質の発現がタンパク質レベル又は核酸レベルで観察されるものであれば、いかなる生物に由来するものであってもよく、ヒト、ブタ、サル、チンパンジー、イヌ、ウシ、ウサギ、ラット、マウスなどの哺乳動物などに由来するものを挙げることができるが、ヒト由来の明細胞腺癌細胞(特に、株化されている細胞、具体的には、OVTOKO、OVISE、OVMANA、OVSAYO、RMG-I、RMG-II(JCRBから入手可能))を使用することが好ましい。
【0031】
被験物質と明細胞腺癌細胞との接触は、いかなる方法によってもよく、例えば、被験物質を明細胞腺癌細胞に添加する方法などを挙げることができる。また、ヒト以外の哺乳動物(例えば、マウス、ラット、モルモット、ウサギ、ブタなど)などの生体に明細胞腺癌細胞を移植してから、被験物質を投与してもよい。
【0032】
被験物質と接触後の明細胞腺癌細胞の培養時間は特に限定されず、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果の有無が確認できる程度の時間であればよい。
【0033】
比較の対照となる被験物質に接触させなかった対照細胞は、被験物質を接触させる前の明細胞腺癌細胞であってもよいし、被験物質を接触させないこと以外は同様の処理を行った明細胞腺癌細胞であってもよい。
【0034】
本発明の一つの例として、被験物質を接触させた明細胞腺癌細胞において、N-myc下流制御遺伝子1タンパク質の発現量がタンパク質レベル又は核酸レベルで対照細胞と比較して減少しており、被験物質がN-myc下流制御遺伝子1タンパク質の発現をタンパク質レベル又は核酸レベルで減少させる効果があると評価できた場合には、この被験物質は、明細胞腺癌の抗癌剤耐性を低下させる物質と同定することができる。
【0035】
さらに、明細胞腺癌細胞の抗癌剤耐性に対する被験物質の効果を調べる工程を含んでもよい。明細胞腺癌細胞の抗癌剤耐性に対する被験物質の効果は、例えば、明細胞腺癌細胞を被験物質と接触させる前、後又は同時に、抗癌剤を添加し、適当な時間培養した後に生細胞数を測定することにより調べることができる。被験物質を接触させた明細胞腺癌細胞の生細胞数が、対照細胞の生細胞数と比較して、少なければ、明細胞腺癌細胞の抗癌剤耐性が低下していると看做すことができる。
【0036】
本発明の一つの例として、被験物質を接触させた明細胞腺癌細胞において、明細胞腺癌細胞の抗癌剤耐性が対照細胞と比較して低下している場合には、この被験物質が明細胞腺癌の抗癌剤耐性を低下させる確実性が増すと考えられる。
【0037】
本発明は、生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することを含む、明細胞腺癌の評価及び/又は鑑別方法を提供する。本発明者らは、N-myc下流制御遺伝子1タンパク質は、非明細胞線癌の細胞株(OVCAR-3、OVSAHO、OVKATE、RMUG-SまたはMCAS)や組織と比較して、卵巣明細胞腺癌細胞由来の細胞株(OVTOKO、OVISE、RMG-I、RMG-II、OVMANAまたはOVSAYO)や組織にて2倍以上発現上昇していることを確認した(後述の実施例1、2、3)。
【0038】
N-myc下流制御遺伝子1タンパク質(N-Myc downstream regulated gene 1 protein):分子量42835、機能は不明。種々の組織にて広範囲に発現する。SwissProt登録番号Q92597 (NDRG1_HUMAN)。
【0039】
本発明において、生体試料は、被験者に由来する試料であればよく、被験者から得た細胞、組織、体液など、具体的には、被験者の卵巣から採取又は切除した組織、被験者の血液(例えば、全血、血清、血漿、血漿交換外液など)などを例示することができる。通常の血液検査(臨床検査)で得られる全血、血清あるいは血漿を血液サンプルとして使用するとよい。
【0040】
本発明の方法において、生体試料におけるN-myc下流制御遺伝子1タンパク質の発現はタンパク質レベルで測定してもよいし、核酸レベルで測定してもよい。例えば、ノーザンブロット法、RT-PCR法、ウェスタンブロット法、免疫組織化学分析法などで測定することができる。あるいはまた、cDNAマイクロアレイ、ELISA法などを利用して測定してもよい。
【0041】
N-myc下流制御遺伝子1タンパク質の発現をタンパク質レベルで測定するためには、N-myc下流制御遺伝子1タンパク質を特異的に認識する抗体を用いるとよい。抗体は、モノクローナル抗体、ポリクローナル抗体のいずれであってもよい。これらの抗体は公知の方法で製造することができる。ウェスタンブロット法で測定する場合には、抗体は、125I標識プロテインA、ペルオキシダーゼ結合IgGなどを用いて二次的に検出される。免疫組織化学分析法で測定する場合には、抗体は、蛍光色素、フェリチン、酵素などで標識するとよい。
【0042】
N-myc下流制御遺伝子1タンパク質の発現を核酸レベルで測定するためには、N-myc下流制御遺伝子1のmRNAと特異的にハイブリダイズできる核酸プローブを用いるとよい(ノーザンブロット法で測定する場合)。あるいはまた、N-myc下流制御遺伝子1のmRNAを鋳型として合成されるcDNAを特異的に増幅できる少なくとも1対の核酸プライマーを用いてもよい(RT-PCR法で測定する場合)。核酸プローブ及び核酸プライマーは、N-myc下流制御遺伝子1の遺伝子情報(NM_001135242.1)に基づいて設計することができる。核酸プローブは、通常、約15〜1500塩基のものが適当である。核酸プローブは、放射性元素、蛍光色素、酵素などで標識するとよい。核酸プライマーは、通常、約15〜30塩基のものが適当である。核酸プライマーを放射性元素、蛍光色素、酵素などで標識してもよい。
【0043】
本発明において、生体試料におけるN-myc下流制御遺伝子1タンパク質の発現(タンパク質レベル又は核酸レベル)の有無を検出してもよいし、発現量を測定してもよい。N-myc下流制御遺伝子1タンパク質及び/又はそのmRNAの発現の有無は所定の位置におけるスポットやバンドの出現の有無により確認できる。N-myc下流制御遺伝子1タンパク質及び/又はそのmRNAの発現量はスポットやバンドの染色強度により測定できる。あるいはまた、N-myc下流制御遺伝子1タンパク質及び/又はそのmRNAを定量してもよい。
【0044】
発現を測定するタンパク質又は遺伝子はN-myc下流制御遺伝子1タンパク質(1種類)のみでもよいし、その他のタンパク質又は遺伝子を含む複数種類であってもよい。複数の遺伝子発現や複数のタンパク発現データを参照することにより、より正確な評価が可能となりうる。複数の遺伝子発現や複数のタンパク発現を同時に検出するためには、DNAアレイ(プローブを基板に固定)(NATURE REVIEWS, DRUG DISCOVERY, VOLUME 1, DECEMBER 2002, 951-960)、プロテインチップ(抗体を基板に固定)(NATURE REVIEWS, DRUG DISCOVERY, VOLUME 1, SEPTEMBER 2002, 683-695)、ルミネックス(NATURE REVIEWS, DRUG DISCOVERY, VOLUME 1, JUNE 2002, 447-456)等の検出法を用いることが好ましい。
【0045】
被験者は、明細胞腺癌(特に、卵巣明細胞腺癌)への罹患が疑われる患者であるが、発病危険性が考えられるすべてのヒトを対象としてもよい。
【0046】
本発明の一つの例として、明細胞腺癌(特に、卵巣明細胞腺癌)の評価・鑑別は、以下のような基準で行うことができる。
【0047】
被験者から得た細胞、組織又は体液におけるN-myc下流制御遺伝子1タンパク質の少なくとも1個の発現を測定し、健常者から得た細胞、組織又は体液におけるそれと比較した結果、タンパク質レベルで2倍以上の増加が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する。タンパク質レベルで2倍以上の発現の増加が確認されたタンパク質の数が多いほど、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であるという評価の確実性が増すと考えられる。
【0048】
また、本発明の別の例として、明細胞腺癌(特に、卵巣明細胞腺癌)の評価・鑑別は、以下のような基準で行うことができる。
【0049】
被験者から得た細胞、組織又は体液におけるN-myc下流制御遺伝子1タンパク質の発現を測定し、健常者から得た細胞、組織又は体液におけるそれと比較した結果、核酸レベルで2倍以上の増加が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する。核酸レベルで2倍以上の発現の増加が確認されたタンパク質の数が多いほど、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であるという評価の確実性が増すと考えられる。
【0050】
本発明は、生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することができる試薬を含む、明細胞腺癌の評価及び/又は鑑別のためのキットも提供する。
【0051】
一つの例として、本発明のキットは、N-myc下流制御遺伝子1タンパク質を特異的に認識できる抗体を試薬として含む。抗体は基板に固定されていてもよい(プロテインチップの場合)。キットには、さらに、生体試料を採取するための器具、抗凝固剤、N-myc下流制御遺伝子1タンパク質を検出するための試薬一式、取扱説明書などが含まれてもよい。取扱説明書には、キットの使用方法の他、明細胞腺癌の評価及び/又は鑑別基準なども記載しておくとよい。
【0052】
別の一例として、本発明のキットは、N-myc下流制御遺伝子1タンパク質のmRNAと特異的にハイブリダイズできる核酸プローブを試薬として含む。核酸プローブは基板に固定されていてもよい(DNAアレイの場合)。キットには、さらに、生体試料を採取するための器具、抗凝固剤、生体試料からRNAを抽出するための試薬類、RNAを検出するための試薬類、取扱説明書などが含まれてもよい。取扱説明書には、キットの使用方法の他、明細胞腺癌の評価及び/又は鑑別基準なども記載しておくとよい。
【0053】
さらに別の一例として、本発明のキットはN-myc下流制御遺伝子1タンパク質のmRNAを鋳型として合成されるcDNAを特異的に増幅できる少なくとも1対の核酸プライマーを試薬として含む。キットには、さらに、生体試料を採取するための器具、抗凝固剤、生体試料からRNAを抽出するための試薬類、RNAを検出するための試薬類、取扱説明書などが含まれるとよい。取扱説明書には、キットの使用方法の他、明細胞腺癌の評価及び/又は鑑別基準なども記載しておくとよい。
【実施例】
【0054】
以下、実施例に基づいて本発明を詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【0055】
〔実施例1〕培養明細胞腺癌細胞におけるNDRG1の発現解析
培養明細胞腺癌細胞におけるNDRG1の発現
種々の卵巣癌細胞株におけるNDRG1のmRNA発現量およびタンパク質量を定量的RT-PCR解析およびウエスタンブロットにより比較した。漿液性3種(OVCAR-3、OVSAHO、OVKATE)、粘液性2種(RMUG-S、MCAS)、明細胞6種(OVTOKO、OVISE、RMG-I、RMG-II、OVMANA、OVSAYO)の卵巣癌細胞株を使用した。MCAS、RMUG-S、RMG-I、RMG-IIはJCRB細胞バンクから、OVCAR-3はRIKENバイオリソースセンターから購入した。OVSAHO、OVKATE、OVMANA、OVSAYO、OVTOKO、OVISEは横浜市立大学医学部産婦人科で樹立されたものを供与された(Yanagibashiら British journal of cancer, 76(7) 829-835, 1997)。これらの細胞株からRNeasyスピンカラム(キアゲン)を用いて全RNAを抽出した。そして1.0 μgの全RNAをプライムスクリプト・ファーストストランドcDNA合成キット(タカラバイオ)を用いてランダムヘキサマープライマーとともに逆転写反応を行い、得られたcDNAをSYBR premix ExTaq II試薬(タカラバイオ)を用いて増幅反応した。定量にはリアルタイムPCR解析装置(アジレントP3000)を用いた。使用したプライマー配列は、センスプライマー:5’-GTGGAGGGCCTTGTCCTTATC-3’ (配列番号2)、アンチセンスプライマー:5’-TTGATGAACAGGTGCAGGTTG-3’ (配列番号3)である。またNDRG1タンパク質量を調べるためにウエスタンブロット解析を行った。抗NDRG1ウサギポリクローナル抗体はZymed Lab社から購入した。
【0056】
結果を図1に示す。NDRG1 mRNAおよびタンパク質は、漿液性および粘液性腺癌細胞株と比較して、明細胞腺癌細胞株群にて高く発現していることがわかった。
【0057】
〔実施例2〕明細胞腺癌組織におけるNDRG1 mRNAの発現解析
明細胞腺癌5症例、非明細胞線癌4症例、良性腫瘍4症例の組織検体からRNeasyスピンカラム(キアゲン)を用いて全RNAを抽出した。また健常者卵巣組織2例からの全RNAは、アンビオン社およびザイアゲン社から購入した。そして1.0 μgの全RNAをプライムスクリプト・ファーストストランドcDNA合成キット(タカラバイオ)を用いてランダムヘキサマープライマーとともに逆転写反応を行い、得られたcDNAをSYBR premix ExTaq II試薬(タカラバイオ)を用いて増幅反応した。定量にはリアルタイムPCR解析装置(アジレントP3000)を用いた。実施例1にて用いたプライマーを使用した。
【0058】
結果を図2に示す。卵巣癌組織においても、明細胞腺癌患者の組織にて、NDRG1 mRNA発現量が有意に増加していることが示された。
【0059】
〔実施例3〕明細胞腺癌組織におけるNDRG1の免疫組織染色
明細胞腺癌組織に特徴的にNDRG1発現が認められるかどうか調べるために、明細胞腺癌患者のホルマリン固定パラフィン包埋組織切片を用いてNDRG1の免疫染色を行った。10 mMクエン酸緩衝液(pH6.0)中にて90℃加熱することで賦活化処理を行い、実施例1で使ったNDRG1抗体で染色した。
【0060】
結果を図3に示す。健常卵巣組織、良性腫瘍組織、漿液性腺癌患者組織、類内膜腺癌患者組織、粘液性腺癌患者組織、および明細胞腺癌患者組織と比較した結果、NDRG1の発現が明細胞腺癌患者組織にて強いことがわかった。
【0061】
〔実施例4〕NDRG1の発現抑制による明細胞腺癌細胞の増殖阻害
明細胞腺癌細胞株OVTOKO、OVISE、OVMANAに発現しているNDRG1をRNA干渉により抑制した。NDRG1に対するsiRNA(CCUUCAAGUACUUCGUGCAGGGCAU(配列番号1))および Control siRNA(Invitrogen)をリポフェクトアミンRNAi MAX 試薬を用いてこれら細胞に導入し、2日間培養後のNDRG1タンパク質の発現量をウエスタンブロットにて調べた。またこの時の細胞増殖をCell Titer 96 Aqueous One Solution Cell Proliferation Assay kit(Promega)のMTSアッセイキットにより比較した。
【0062】
結果を図4に示す。OVTOKO、OVISE、OVMANA細胞におけるNDRG1タンパク質の発現は、NDRG1 siRNAの導入により抑制されていることが確認できた(図4A)。この時の細胞増殖能は、3種の細胞株ともに60%以下にまで低下した(図4B)。
【0063】
〔実施例5〕NDRG1の発現抑制による明細胞腺癌のアポトーシス誘導
NDRG1を発現抑制した細胞がアポトーシスを起こしているのかどうかを検証するために、細胞形態、カスパーゼ活性、p53およびBaxのタンパク質量を調べた。siRNAは実施例4と同じ方法でOVTOKOおよびOVISE細胞に導入した。免疫蛍光染色法にて細胞形態を観察するために、siRNA導入細胞をLab-Tekチャンバースライド(Nunc)上で培養した。2日後、細胞を2%パラホルムアルデヒドで固定し、NDRG1およびアクチンを蛍光染色し、Radiance2000共焦点レーザー顕微鏡(BioRad)にて観察した。NDRG1は実施例1で用いたNDRG1抗体とAlexa488標識抗ウサギ抗体(Molecular Probes)、アクチンはローダミン・ファロイジン(Chemicon社)を用いて検出した。またsiRNA導入細胞のカスパーゼ活性の測定は、Caspase-Glo3/7、8、および9 Assayキット(Promega)を用いた。p53およびBaxタンパク質のウエスタンブロットには、それぞれ抗p53マウスモノクローナル抗体DO-1(Calbiochem)および抗Baxウサギポリクローナル抗体N-20(Santa Curz)を用いた。
【0064】
結果を図5に示す。免疫蛍光染色の結果、Control siRNA(siControl)を導入したOVTOKOおよびOVISE細胞においては、NDRG1のシグナルとともに均一な細胞形態が観察されるが、NDRG1 siRNA(siNDRG1)によりNDRG1の発現が抑制された細胞は、細胞形態が崩れていることが認められた(図5A)。さらに、このNDRG1 siRNA導入細胞は、アポトーシスの指標であるカスパーゼ活性の上昇(図5B)、およびp53とBaxタンパク質量の増加(図5C)が認められた。従って、NDRG1の発現抑制は卵巣明細胞腺癌細胞のアポトーシスを誘発できることが分かった。
【産業上の利用可能性】
【0065】
本発明は、卵巣明細胞腺癌の治療に利用できる。
【配列表フリーテキスト】
【0066】
<配列番号1>
配列番号1は、NDRG1に対するsiRNAのヌクレオチド配列を示す。
<配列番号2>
配列番号2は、実施例1で用いたセンスプライマーのヌクレオチド配列を示す。
<配列番号3>
配列番号3は、実施例1で用いたアンチセンスプライマーのヌクレオチド配列を示す。
【特許請求の範囲】
【請求項1】
明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の治療及び/又は予防剤。
【請求項2】
明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の抗癌剤耐性を低下させる薬剤。
【請求項3】
明細胞腺癌の治療及び/又は予防に効果のある物質を同定する方法であって、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果を評価する工程
を含む前記方法。
【請求項4】
さらに、明細胞腺癌細胞増殖に対する被験物質の効果を調べる工程を含む請求項3記載の方法。
【請求項5】
明細胞腺癌の抗癌剤耐性を低下させる物質を同定する方法であって、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果を評価する工程
を含む前記方法。
【請求項6】
さらに、明細胞腺癌細胞の抗癌剤耐性に対する被験物質の効果を調べる工程を含む請求項5記載の方法。
【請求項7】
生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することを含む、明細胞腺癌の評価及び/又は鑑別方法。
【請求項8】
生体試料におけるN-myc下流制御遺伝子1タンパク質の発現をタンパク質レベルで測定する請求項7記載の方法。
【請求項9】
生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を核酸レベルで測定する請求項7記載の方法。
【請求項10】
生体試料が、被験者から得た細胞、組織又は体液である請求項7〜9のいずれかに記載の方法。
【請求項11】
体液が血液である請求項10記載の方法。
【請求項12】
血液が、全血、血清、血漿又は血漿交換外液である請求項11記載の方法。
【請求項13】
被験者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現が、健常者又は非明細胞線癌患者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現と比較して、タンパク質レベルで2倍以上の上昇が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する請求項7〜12のいずれかに記載の方法。
【請求項14】
被験者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現が、健常者由来又は非明細胞線癌患者の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現と比較して、核酸レベルで2倍以上の上昇が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する請求項7〜12のいずれかに記載の方法。
【請求項15】
生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することができる試薬を含む、明細胞腺癌の評価及び/又は鑑別のためのキット。
【請求項16】
生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することができる試薬が、下記(i)、(ii)又は(iii)のいずれかである請求項15記載のキット。
(i) N-myc下流制御遺伝子1タンパク質を特異的に認識できる抗体
(ii) N-myc下流制御遺伝子1タンパク質をコードするmRNAと特異的にハイブリダイズできる核酸プローブ
(iii) N-myc下流制御遺伝子1タンパク質をコードするmRNAを鋳型として合成されるcDNAを特異的に増幅できる少なくとも1対の核酸プライマー
【請求項1】
明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の治療及び/又は予防剤。
【請求項2】
明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の機能を阻害若しくは発現を抑制することができる物質を含む、明細胞腺癌の抗癌剤耐性を低下させる薬剤。
【請求項3】
明細胞腺癌の治療及び/又は予防に効果のある物質を同定する方法であって、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果を評価する工程
を含む前記方法。
【請求項4】
さらに、明細胞腺癌細胞増殖に対する被験物質の効果を調べる工程を含む請求項3記載の方法。
【請求項5】
明細胞腺癌の抗癌剤耐性を低下させる物質を同定する方法であって、以下の工程:
(a)被験物質を明細胞腺癌細胞に接触させる工程、
(b)工程(a)で被験物質に接触させた明細胞腺癌細胞を所定時間培養する工程、
(c)工程(b)で培養した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を測定する工程、及び
(d)工程(c)で測定した明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現を被験物質に接触させなかった対照細胞におけるN-myc下流制御遺伝子1タンパク質の発現と比較することにより、明細胞腺癌細胞におけるN-myc下流制御遺伝子1タンパク質の発現に対する被験物質の効果を評価する工程
を含む前記方法。
【請求項6】
さらに、明細胞腺癌細胞の抗癌剤耐性に対する被験物質の効果を調べる工程を含む請求項5記載の方法。
【請求項7】
生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することを含む、明細胞腺癌の評価及び/又は鑑別方法。
【請求項8】
生体試料におけるN-myc下流制御遺伝子1タンパク質の発現をタンパク質レベルで測定する請求項7記載の方法。
【請求項9】
生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を核酸レベルで測定する請求項7記載の方法。
【請求項10】
生体試料が、被験者から得た細胞、組織又は体液である請求項7〜9のいずれかに記載の方法。
【請求項11】
体液が血液である請求項10記載の方法。
【請求項12】
血液が、全血、血清、血漿又は血漿交換外液である請求項11記載の方法。
【請求項13】
被験者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現が、健常者又は非明細胞線癌患者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現と比較して、タンパク質レベルで2倍以上の上昇が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する請求項7〜12のいずれかに記載の方法。
【請求項14】
被験者由来の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現が、健常者由来又は非明細胞線癌患者の生体試料におけるN-myc下流制御遺伝子1タンパク質の発現と比較して、核酸レベルで2倍以上の上昇が確認された場合には、明細胞腺癌に罹患している、あるいは癌の組織型が明細胞腺癌であると評価する請求項7〜12のいずれかに記載の方法。
【請求項15】
生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することができる試薬を含む、明細胞腺癌の評価及び/又は鑑別のためのキット。
【請求項16】
生体試料におけるN-myc下流制御遺伝子1タンパク質の発現を測定することができる試薬が、下記(i)、(ii)又は(iii)のいずれかである請求項15記載のキット。
(i) N-myc下流制御遺伝子1タンパク質を特異的に認識できる抗体
(ii) N-myc下流制御遺伝子1タンパク質をコードするmRNAと特異的にハイブリダイズできる核酸プローブ
(iii) N-myc下流制御遺伝子1タンパク質をコードするmRNAを鋳型として合成されるcDNAを特異的に増幅できる少なくとも1対の核酸プライマー
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−40139(P2013−40139A)
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願番号】特願2011−178684(P2011−178684)
【出願日】平成23年8月18日(2011.8.18)
【出願人】(505155528)公立大学法人横浜市立大学 (101)
【Fターム(参考)】
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願日】平成23年8月18日(2011.8.18)
【出願人】(505155528)公立大学法人横浜市立大学 (101)
【Fターム(参考)】
[ Back to top ]

