NF−κB経路活性化の選択的モジュレーターのスクリーニング方法
本発明は、NF-κB経路活性化の選択的モジュレーターをスクリーニングする方法に関する。本発明は、NEMOと他のタンパク質との相互作用を調節する分子を同定及び選択することにより、NF-κB経路活性化を調節(活性化又は阻害)する可能性がある分子を1次スクリーニングする方法に関する。本発明は、NF-κB経路活性化のモジュレーター(活性化物質又は阻害物質)の2次スクリーニング方法にも関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、NEMOと他のタンパク質との相互作用を調節することによりNF-κB経路の活性化を調節(活性化又は阻害)する分子を同定及び選択するための方法に関する。
【背景技術】
【0002】
核内因子κB (NF-κB)シグナル伝達は、炎症性応答、腫瘍発生、ウイルス感染、細胞増殖の調整、アポトーシス、並びにB及びTリンパ球の抗原性刺激を含む種々の必須の細胞プロセスに関与するシグナル伝達経路である(Ghosh, 1998, Annu. Rev. Immunol.; Karin, 1999, J. Biol. Chem.; Israel, 2000, Trends Cell Biol.; Santoro, 2003, EMBO J.)。哺乳動物細胞において、二量体を形成する5つのNF-κBファミリーメンバーが存在する:RelA、RelB、c-Rel、NF-κB2/p100/p52及びNF-κB1/p105/p50。その主な形態がp50サブユニットとRelAサブユニットとで構成されるヘテロ二量体転写因子であるNF-κBは、休止細胞において、IκBとして知られるタンパク質の阻害ファミリーのメンバーと会合することにより、細胞質に隔離される。サイトカインTNF-α及びインターロイキン-1、エンドトキシン(LPS)、細菌及びウイルスの感染を含むいくつかの因子による刺激の際に、炎症誘発性シグナルは、2つのキナーゼサブユニットIKKα/IKK-1及びIKKβ/IKK-2並びに構造/調整サブユニットNEMO/IKK-γで構成されるタンパク質複合体である標準のIκBキナーゼ複合体(IKK)上に集まる。一旦活性化されると、IKK複合体はIκBタンパク質をリン酸化し、それらのユビキチン化及びその後のプロテアソームによる分解を引き起こす。放出されたNF-κB転写因子は、次いで、核に移動して、遺伝子発現を開始又はアップレギュレートする。IKKαとIKKβは著しい構造類似性を示すが(52%)、遺伝子研究は、これらが、NF-κBの活性化について2つの経路に関与することを示している(Pomerantz, 2002, Mol Cell)。IKKβは、伝統的なNF-κB複合体の活性化を担う炎症誘発性キナーゼであり、NF-κB誘発キナーゼ(NIK)と会合したIKKαは、非標準的なNF-κBシグナル伝達経路において必須の役割を演じる(Senftleben, 2001, Science)。IKKαは、ケラチノサイト分化においても役割を演じるが、このプロセスはそのキナーゼ活性から独立している(Hu, 2001, Nature)。
【0003】
NEMOタンパク質(NF-κB 必須モジュレーター(NF-κB essential modulator))は、NF-κB経路活性化において重要な役割を演じる。NEMOタンパク質は、IKKα及びIKKβタンパク質キナーゼとIKK複合体において会合する。IKKキナーゼは、未知の機構によるリン酸化により活性化されるが、これは、NEMOオリゴマー形成の結果であると考えられている(Agouら, 2004, J. Biol. Chem.)。NEMOタンパク質の存在は、IKK活性化の根底にある。なぜなら、NEMO欠損細胞は、多くの刺激に応答してNF-κBを活性化できないからである。
【0004】
炎症誘発性刺激に応答してIKKの活性化を引き起こす生化学的機構は、まだ不明確なままである。活性化T-ループ中の2つのセリン残基に対するリン酸化が、IKKβの活性化を誘発することが示されている。しかし、このリン酸化事象に導く機構は、まだわかっていない。1つの可能性のある機構は、NEMOオリゴマー形成により誘発されるキナーゼの立体配座変化である(Agouら, 2004, J. Biol. Chem.)。オリゴマー状態のこの変化は、トランス-自己リン酸化の機構によりT-ループの活性化を誘発し得る(Zandi, 1997, Cell; Tang, 2003, J. Biol. Chem.)。
【0005】
IKK活性化におけるNEMOオリゴマー形成の役割と矛盾することなく、最小オリゴマー形成ドメイン内の変異は、多くの刺激に応答するNEMO欠損細胞活性化において、遺伝子的な補完によりNF-κBを救うことができなかった。さらに、NEMOの強制的なオリゴマー形成は、IKK複合体の完全な活性化を導く(Inohara, 2000, J. Biol. Chem.; Poyet, 2000, J. Biol. Chem.; Poyet, 2001, J. Biol. Chem.)。最近、TNF-αに応答してのNEMOのリン酸化及びユビキチン化が報告されている(Carter, 2001, J. Biol. Chem.; Trompouky, 2003, Nature; Kovalenko, 2003, Nature)。しかし、これらのNEMOの修飾は、いくつかの炎症誘発性刺激に応答するIKK複合体の活性化において非常に重要な工程であるとは証明されていない。
【0006】
NF-κB活性化の阻害は、新しい抗炎症性薬剤及び抗癌剤の開発のために、特別な標的を構成する(May, 2000, Science; Poulaki, 2002, Am J Pathol)。NF-κBシグナル伝達経路における多くのタンパク質作用物質のうち、IKK複合体は、新しい特異的NF-κB阻害物質の発見のために最も見込みがある分子標的の1つである。インビボでの可能性のある毒性の影響を最小限にするために、治療上の成功は、NF-κB阻害物質が、NF-κB活性の基底レベルを改変することなく活性化シグナルを遮断する能力に大きく依存する。Mayらは、NEMOとIKKキナーゼとの構成的な相互作用を破壊することによる炎症誘発性NF-κB活性化を特異的に遮断する細胞透過性ペプチド阻害物質について記載した(May, 2000, Science; May, 2002, J. Biol. Chem.)。タンパク質の機能を変更するペプチドの合理的な設計によるタンパク質-タンパク質相互作用の調節は、特に、柔軟で活動的な結合特性を示すシグナル伝達タンパク質を用いる(Pawson, 2003, Science)、基礎研究及び治療薬の新しいクラスの開発(Souroujon, 1998, Nat Biotechnol.)の両方のために重要なツールを提供する。
【0007】
ペプチドモジュレーターの多くの研究が文献に記載され、ここで、ペプチドは、局在化(移動) (Lin, 1995, J. Biol. Chem.)、受容体の補充(Chang, 2000, J. Biol. Chem.)、分子間相互作用(Souroujon, 1998, Nat Biotechnol.)及びオリゴマー形成(Judice, 1997, P.N.A.S.)に干渉することによりタンパク質の機能を媒介する。後者において、HIV-1 gp41融合タンパク質が種々のペプチドを用いて阻害されることは、概念の明確な証明である(概説として、Chan, 1998, Cell及びEckert, 2001, Ann. Rev. Biochem.を参照されたい)。
【0008】
よって、NEMOタンパク質は、NF-κB経路を阻害する新しい薬剤の開発のための見込みのある標的である。なぜなら、これはNF-κB刺激のほとんどを統合し(integrate)、整合し(coordinate)、かつこれはIκBキナーゼ複合体(IKK)の重複しない成分であるからである。
【0009】
NEMOタンパク質のアミノ酸配列は、このタンパク質がいくつかのドメインからなることを示唆する(Agouら, J. Biol. Chem., 2004b)。簡単に、ポリペプチドのN-末端部分は、大きいコイルドコイルモチーフ(CC1)と、タンパク質とIKKキナーゼとの相互作用に含まれる全ての残基(IKK-結合ドメイン)とを含有する。C-末端半分(残基250〜412)は、2つの連続するコイルドコイルモチーフであるCC2 (残基253〜285)及びLZ (残基301〜337)と、タンパク質の最もC-末端側のジンクフィンガーモチーフ(ZF)とで構成され、タンパク質の調整部分として機能し、これは、多くの上流のシグナル分子又はウイルスタンパク質を連結するための結合鋳型としてしばしば報告されている(Ghosh, 1998, Annu. Rev. Immunol.; Santoro, 2003, EMBO J.)。
【0010】
興味深いことに、色素失調症(IP)及び免疫不全を伴う外胚葉性異形成症(EDA-ID)の原因である変異は、分子のこの部分で主に見出された(Doffinger, 2001, Nature Gen.; Zonana, 2000, Am. J. Hum. Genet)。NEMOの最小オリゴマー形成ドメイン(MOD)は、CC2及びLZコイルドコイルモチーフからなる(Agouら, J. Biol. Chem., 2004a)。MODドメインは、NLMモチーフも含む(Nemo様モチーフ(Nemo Like Motif)) (293〜322) (Agouら, 2004b)。上記の残基の番号付けは、配列番号1の配列のマウスNEMOタンパク質に関する。ヒトNEMOタンパク質に関して、CC2、LZ及びNLMドメインはそれぞれ、配列番号2の配列の残基260〜292、残基301〜344及び残基300〜329に対応する。
【0011】
本発明者らは、以前に、NEMOのMODドメインに由来し、NEMOオリゴマー形成を阻害することによりNF-κB経路を阻害できるペプチドを合成した(特許出願WO 2005/027959)。実際に、それぞれマウス及びヒトのNEMOタンパク質のLZドメインに相当する配列番号6及び配列番号7の配列のspLZペプチド、並びにそれぞれマウス及びヒトのNEMOタンパク質のCC2ドメインに相当する配列番号8及び配列番号9の配列のspCC2ペプチドは、NF-κB活性化を、μMの範囲のIC50で阻害する(WO2005/027959、Agouら, 2004b)。
【0012】
NEMOのLZモチーフのN-末端配列に由来する他のペプチドNLM及びDR-NLMも、NF-κB活性化を阻害する。それらのIC50値は、国際PCT出願WO 2005/027959に報告された。DR-NLMペプチドは、LZペプチドの長さの半分である(国際PCT出願WO 2005/027959)。ペプチドNLM (配列番号10)及びDR NLM (配列番号11)は、配列番号1の残基294〜314に相当し、DR NLMにおいて、配列番号1の304位のAspがArg残基に置換されている。ヒトNEMOタンパク質に由来するNLM及びDR NLMは、それぞれ配列番号18及び配列番号12により定義される。
【0013】
WO 2005/027959及びAgouら, 2004bの方法はともに、インビボの細胞に基づくアッセイ系を用いて、特定の物質が核内因子-κB経路に影響するかを決定する。特に、彼らは、内在性NF-κB-lacZレポーター遺伝子を用いるNF-κB阻害アッセイを用いて、NF-κB経路に対するCC2又はLZドメインのような種々のペプチドの影響を決定する。このようなインビボの細胞に基づくアッセイは、特に、適切な株化細胞を維持すること及びアッセイに影響する全ての関連する因子が必要なパラメーター内にあることを確実にすることの複雑さにより、いくつかの問題点を有することが知られている。このようなインビボアッセイを用いる化合物の大規模スクリーニングは、よって、インビトロスクリーニング技術と比較して時間がかかるとともに、複雑で高価である。
【発明の概要】
【発明が解決しようとする課題】
【0014】
予期せぬことに、本発明者らは、今回、MODドメインがオリゴマー形成ドメイン及びポリユビキチン鎖結合ドメインとして作用することを見出した。NEMOドメインのこれらの二重の特性は、NEMOオリゴマー形成を調節(増強又は破壊)することによるか、又はNEMOとポリユビキチン鎖との間の相互作用を調節(増強又は破壊)することによりNF-κBシグナル伝達経路を特異的に調節する新しい化合物の探索を可能にする。実際に、LZはNF-κB活性化を、NEMOオリゴマー形成を破壊することにより阻害するが、DR NLMは、ポリユビキチン鎖とNEMOタンパク質との間の相互作用を遮断することによりNF-κB阻害物質として作用する。これらの結果は、NEMO機能のために必要な、新しく重要なユビキチン結合ドメインに相当するNEMOのNLMドメインについての新しい見識も提供する。より重要なことには、これらの結果は、実際のスクリーニングのための標的として用い得るNEMOの「ホットスポット」領域を規定することを可能にする。
【0015】
NEMO-ポリユビキチン相互作用は、以前に記載されている;Godhaら(2007)は、ヒトT細胞白血病ウイルス(Human T-cell Leukaemia Virus) 1型(HTLV-1)がどのようにしてNF-κB経路を活性化するかとの機構についてのインビボ研究について記載している。著者らは、MAPキナーゼTAK1が、NEMOのK63ポリユビキチン化を誘導することを示し、彼らは、これが、HTLV-1が用いてNF-κB経路に提供を与える機構の少なくとも1つであると考えている。
【0016】
Zhouら(2004)も、NF-κB経路に対するBcl10過剰発現の影響についての研究を記載している。特に、彼らは、Bcl10過剰発現が、K63ポリユビキチン化のためにNEMOを標的にすることを示し、このことを証明するためにインビボユビキチン化アッセイを用いている。
Godhaら(2007)及びZhouら(2004)はともに、ポリユビキチン化の標的として、全長NEMOを用いている。
【0017】
本発明者らは、しかし、研究の過程で、NEMOの必須CC2及びLZドメインだけを含むペプチドを方法において用いて、NEMO活性のモジュレーターを同定できることを見出した。NEMOのこの必須部分のみを用いることにより、より感度が高いアッセイを行って、いずれの特定の機能も有さないであろうNEMOの他の部分とのより全般的な相互作用よりもむしろNEMOのこれらの最も重要な部分及びユビキチンとに相互作用するモジュレーターを見出すことが可能になる。
【0018】
炎症応答、腫瘍発生及びウイルス感染におけるNEMOの役割、並びにNF-κBシグナル伝達経路の複雑さを考慮して、他のタンパク質とのいずれのNEMO相互作用(すなわち、オリゴマー形成又はNEMOとポリユビキチン鎖との相互作用)も破壊することにより作用できる物質を1次スクリーニングする必要性がある。
【0019】
よって、本発明の目的は、他のタンパク質とのNEMOの相互作用を特異的に調節(活性化又は阻害)する分子を選択するためのスクリーニング方法を提供することである。より具体的には、該スクリーニングアッセイは、NF-κB経路活性化の新しく効果的で特異的なモジュレーターを検出するために、NEMOのMODドメインを用いる。
【課題を解決するための手段】
【0020】
よって、本発明の第1の目的は、以下の工程:
(a) (i) NEMOのCC2領域とLZ領域とからなるペプチドP1であって、標識されているか又はされていないペプチドP1と、(ii) NEMOのLZ領域の少なくとも10アミノ酸残基、好ましくはNEMOのLZ領域の少なくとも36アミノ酸残基を含むペプチド、NEMOのNLM領域の少なくとも10アミノ酸残基、好ましくはNEMOのNLM領域の少なくとも21アミノ酸残基を含むペプチド、DR-NLMを含むペプチド、NEMOの領域CC2及びLZを含むペプチド、NEMOのCC2領域の少なくとも10アミノ酸残基を含むペプチド、及びK63-連結ポリユビキチン化鎖を含むペプチドからなる群より選択される、標識されているか又はされていないペプチドP2とを、試験される物質Sの非存在下で接触させ;
(b) 標識されているか又はされていない前記ペプチドP1と、標識されているか又はされていない前記ペプチドP2とを、試験される物質Sの存在下で接触させ;
(c) 工程(a)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(d) 工程(b)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する
を含むことを特徴とする、NF-κB経路活性化の可能性のある(potential)モジュレーターのインビトロ1次スクリーニング方法である。
【図面の簡単な説明】
【0021】
【図1】ペプチドDR NLMによるNF-κB活性化の阻害。
【図2】ペプチドspCC2-LZへのペプチドBA-DR NLMのインビトロ結合。
【図3】ペプチドDR NLMは、他のシグナル伝達経路に影響しない。
【図4】ペプチドDR NLMは、内在性NEMOと相互作用する。
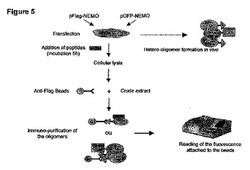
【図5】NEMOオリゴマー形成に対する異なるペプチドの効果を調べるための細胞に基づくアッセイ(細胞ベースアッセイ)の概略図。
【図6】DR NLMペプチドは、細胞においてNEMOオリゴマー形成を阻害しない。
【図7】DR NLMは、細胞のポリユビキチン化タンパク質と、NEMOのCC2ドメイン及びLZドメインを含むペプチドCC2-LZとの相互作用を妨げる。
【図8】HTRFアッセイの最適化。
【発明を実施するための形態】
【0022】
本発明によると、用語「領域」と「ドメイン」は交換可能である。NEMOのCC2及びLZ領域(又はドメイン)は、上記のとおりである。
【0023】
好ましくは、P1は、配列番号17のペプチドsp CC2-LZ、配列番号19のペプチドspCC2-LZ、配列番号1のマウスNEMOタンパク質、配列番号2のヒトNEMOタンパク質、配列番号28のビオチン標識CC2-LZペプチド、配列番号29のビオチン標識ヒト化CC2-LZペプチド、配列番号30の6 his-タグ付加CC2-LZペプチド、及び配列番号31の6 his-タグ付加ヒト化CC2-LZペプチドからなる群より選択される。
好ましくは、P2は、配列番号1、配列番号2、配列番号6〜12、配列番号17〜19、配列番号28〜31の配列のペプチドからなる群より選択される。
本発明による方法で用いられるペプチドは、特許出願WO 2005/027959及びAgouら, 2004bに記載されるようにして合成できる。
【0024】
接頭辞「sp」(合成ポリペプチド)とは、該ペプチドが合成であり、例えばペプチド(例えばspCC2)を、NEMOタンパク質の対応する領域(例えばCC2領域)と区別するために用い得る。しかし、ペプチドとspペプチドとは同じ物質のことをいう。
さらに、正確さを欠いて、異なるペプチドは、マウスNEMOタンパク質とヒトNEMOタンパク質に関係なく関連する。
【0025】
好ましくは、上記のK63-連結ポリユビキチン化分子は、K63-連結ポリユビキチン鎖、例えばK63Ub2-7 (Boston Biochem, Inc)、K63-連結ポリユビキチン鎖に結合したタンパク質、例えばポリユビキチン化タンパク質RIP1 (受容体共役タンパク質キナーゼ1) (Eaら, 2006)、及びK63-連結ポリユビキチン化タンパク質を含む細胞抽出物、例えばTNF-αで予め刺激されたJM4.5.2細胞からの細胞抽出物からなる群より選択される。
【0026】
上記の方法の好ましい実施形態において、上記のペプチドP1は、固体担体上に固定化される。好ましくは、上記の固体担体は、磁気ビーズからなる。有利には、ペプチドP1はビオチニル基に結合し、ストレプトアビジン磁気ビーズ上に固定化される。
【0027】
好ましくは、工程(c)及び(d)のシグナルは、ウェスタンブロット、蛍光異方性、蛍光共鳴エネルギー転移(FRET)、又は均一系時間分解蛍光(HTRF)により測定される。
【0028】
上記の方法の好ましい実施形態において、上記のペプチドP1は標識されず、上記のペプチドP2は蛍光マーカーM1で標識される。
好ましくは、上記のマーカーM1は、緑色蛍光タンパク質(GFP)、シアン蛍光タンパク質、黄色蛍光タンパク質、及びマレイミド基を含む蛍光団からなる群より選択される。蛍光マーカーのその他の例は、Shanerら(Nat. Biotech., 2004, 22, 1567)に記載される。用い得るその他の蛍光団は、CFP/ds Red及び/又はGFP/ds Red (Ericksonら, Biophys J., 2003, 85, 599〜611)、並びにオレンジタイプのシアン変異形(Karawawaら, Biochem J., 2004, 381(Pt1), 307〜12)を含む。マレイミド基を含む蛍光マーカーの例は、Bodipy (登録商標) FL N-(2-アミノエチル)マレイミド蛍光団(Molecular Probe)である。
【0029】
好ましくは、上記の標識ペプチドP2は、配列番号4、5及び13〜16の配列のペプチドからなる群より選択される。
【0030】
上記の方法のさらに別の好ましい実施形態において、上記のペプチドP1はマーカーM2で標識され、上記のペプチドP2はマーカーM3で標識され、M2とM3は蛍光団供与体と蛍光団受容体の対である。
蛍光団供与体-蛍光団受容体の対の例は、ユーロピウムクリプテート-XL665 (Cis-Bio)の対、及びCy5/5 (GE Healthcare)-BHQ3 (Biosearch Technologies)の対である。
【0031】
好ましくは、ハイブリッド構築物は、ペプチドP1及び/又はP2が直接、又はリンカー分子(例えば短いペプチド)を介して蛍光タンパク質に連結されるように用いられる。連結は、好ましくは付加された連結がP1とP2との結合に干渉しないことを条件として、ペプチドのN-末端又はC-末端で生じ得る。
【0032】
P1と、P2へのその結合を調節(活性化又は阻害)する物質との相互作用は、例えば、FRET法を用いて、2つの異なるマーカー(蛍光団供与体及び蛍光団受容体)の近接に起因する蛍光団受容体の蛍光発光の直接測定により検出できる。物質Sの非存在下での蛍光団受容体の蛍光発光と比較した物質Sの存在下での蛍光団受容体の蛍光発光の減少は、該物質SがP2へのP1の結合に干渉することを示す。よって、上記の蛍光発光の減少は、上記の物質SがP2へのP1の結合に干渉することを示し、上記の蛍光発光の増加は、上記の物質SがP2へのP1の結合を増強することを示す。
【0033】
有利には、M2は、第1タグと、第1タグに対して指向されかつ蛍光団供与体で標識された抗体とからなり、M3は、第2タグと、第2タグに対して指向されかつ蛍光団受容体で標識された抗体とからなり、これらの2つのタグは異なる。
好ましくは、マーカーM2の上記のタグはポリHis配列であり、マーカーM3の上記のタグはビオチンである。
【0034】
上記の方法のさらにより好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある活性化物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含む。
【0035】
上記の方法の別の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある阻害物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含む。
【0036】
ペプチドP2がK63-連結ポリユビキチン鎖を含むペプチドである場合、ペプチドP1は、有利には、NEMOのNLM領域の少なくとも10アミノ酸残基、好ましくは少なくとも21アミノ酸残基を含むペプチド、及びDR NLMを含むペプチドからなる群より選択される。好ましくは、上記のペプチドP1は、配列番号1、2、10、17〜19及び28〜31の配列のペプチドからなる群より選択される。
【0037】
よって、このような場合において、NF- κB経路活性化の可能性のあるモジュレーターの1次スクリーニングの方法は、以下の工程を含むことを特徴とする:
(a) (i) NEMOのNLM領域の少なくとも10アミノ酸残基、好ましくは少なくとも21アミノ酸残基を含むペプチド、及びDR NLMを含むペプチドからなる群より選択されるペプチドP1であって、標識されているか又はされていないペプチドP1と、(ii) K63-連結ポリユビキチン化鎖を含むペプチドP2であって、標識されているか又はされていないペプチドP2とを、試験される物質Sの非存在下で接触させ;
(b) 標識されているか又はされていない前記ペプチドP1と、標識されているか又はされていない前記ペプチドP2とを、試験される物質Sの存在下で接触させ;
(c) 工程(a)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(d) 工程(b)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する。
【0038】
好ましくは、上記のペプチドP1は、配列番号1、2、10、17〜19及び28〜31の配列のペプチドからなる群より選択される。
好ましくは、K63-連結ポリユビキチン化鎖を含むペプチドP2は、上記のように、固体担体に固定化される。
好ましくは、上記のペプチドP2は、上記のように蛍光マーカーM1で標識され、工程(c)及び(d)のシグナルは、上記のようにして測定される。
【0039】
上記の方法の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある活性化物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含む。
上記の方法の別の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある阻害物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含む。
【0040】
或いは、NF-κB経路活性化の可能性のあるモジュレーターの1次スクリーニング方法は、以下の工程を含む:
(a) NEMOのCC2領域とLZ領域とを含むペプチドP1を、試験される物質Sと接触させ、ここで上記のペプチドP1は蛍光団供与体であるマーカーM2と蛍光団受容体であるマーカーM3とで標識され、すなわち蛍光団供与体と蛍光団受容体との両方と結合し;
(b) 試験される物質Sの非存在下で蛍光発光を測定し;
(c) 試験される物質Sの存在下で蛍光発光を測定し;
(d) (b)で測定されたシグナルと、(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1ではない物質Sを選択する。
【0041】
好ましくは、工程(c)及び(d)における上記のシグナルは、上記のように、FRET又はHTRFにより測定される。
有利には、上記の蛍光団供与体はCC2領域のN-末端に結合し、蛍光団受容体はLZ領域のC-末端に結合する。
【0042】
上記の代替の方法の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある活性化物質であり、工程(d)は、(b)で測定されたシグナルと(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1未満の物質Sを選択することを含む。
上記の代替の方法の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある阻害物質であり、工程(d)は、(b)で測定されたシグナルと(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1より大きい物質Sを選択することを含む。
【0043】
或いは、NF-κB経路活性化の可能性のあるモジュレーターの1次スクリーニング方法は、以下の工程を含むことを特徴とする:
a) 本発明の第1の目的において定義されるペプチドP1とペプチドP2とを少なくとも発現する1又は複数のポリヌクレオチドで形質転換された、少なくとも1つの内在性NEMO欠損細胞を提供し;
b) 物質Sを、少なくとも1つの上記細胞に供し(apply);
c) P1とP2との複合体の形成を、物質Sの非存在下で適切なシグナルを測定することにより測定し;
d) P1とP2との複合体の形成を、物質Sの存在下で適切なシグナルを測定することにより測定し;
e) (c)で測定されたシグナル及び(d)で測定されたシグナル、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する。
【0044】
この代替法の好ましい実施形態において、P1は融合タンパク質GFP-NEMOであり、P2は融合タンパク質Flag-NEMOであり、ここで、Flagは親水性の8アミノ酸残基のペプチド(配列番号23)である。好ましくは、P1は配列番号27の配列で規定され、P2は配列番号25の配列で規定される。
【0045】
この代替法の別の好ましい実施形態において、工程(c)及びd)は:
c1) (又はd1)) 細胞を溶解させ、
c2) (又はd2)) GFP-NEMOに結合したか又はしていないFlag-NEMOを、Flag-NEMOのFlag部分に対して指向された抗体を用いて免疫沈降させ、
c3) (又はd3)) 免疫沈降されたFlag-NEMOに結合したGFP-NEMOのGFP部分の蛍光発光を検出する
ことを含む。
【0046】
上記の代替法の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある活性化物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含む。
上記の代替方法の別の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある阻害物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含む。
【0047】
本発明の別の目的は:
a) 上記の本発明による可能性のある阻害物質の1次スクリーニングのいずれかの方法により、NF-κB経路活性化を阻害できる可能性がある物質Sを選択し;
b) NF-κB経路の活性化物質を、a)で選択した物質Sの非存在下又は存在下で、NF-κBにより誘導可能なプロモーターの制御下にレポーター遺伝子を含む細胞に供し;
c) レポーター遺伝子の発現を、物質Sの非存在下で適切なシグナルを測定することにより検出し;
d) レポーター遺伝子の発現を、物質Sの存在下で適切なシグナルを測定することにより検出し;
e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質を選択する
ことを含む、NF-κB経路活性化の阻害物質の2次スクリーニング方法である。
【0048】
好ましくは、工程c)で用いられるNF-κB経路の上記の活性化物質は、TNF-α、IL-1β、PMA、イオノマイシン及びサルモネラ・アボルタス(Salmonella abortus)からのLPSからなる群より選択される。
【0049】
レポーター遺伝子は、好ましくは、β-ガラクトシダーゼ酵素をコードするlacZ遺伝子、及びルシフェラーゼをコードするluc遺伝子からなる群より選択される。レポーター遺伝子は、好ましくは、SRE配列(血清応答配列;Serum Response Element)を含むプロモーターの制御下にある。このような構築物は、特許出願WO2005/027959及びAgouら, 2004bに記載される。
【0050】
2次スクリーニングについてのこの方法の好ましい実施形態において、上記の細胞は、Collection Nationale de Cultures de Microorganismes (C.N.C.M.)に2003年4月1日に番号I-3004の下で寄託された70Z/3-C3細胞である。
別の好ましい実施形態において、上記の細胞は、NF-κB経路についてのレポーター系を含むTリンパ球又はMEF細胞(マウス胚性繊維芽細胞;Murine embryonic Fibroblast)である。
【0051】
本発明による方法により選択されたNF-κB経路活性化の上記の阻害物質は、ERK及びp38経路活性化、NF-AT経路活性化及びAP1経路活性化を阻害しないNF-κB経路の特異的阻害物質であることが好ましい。
よって、2次スクリーニングの方法は、有利には、選択された阻害物質がERK及びp38経路、NF-AT経路並びにAP1経路に対して作用するかどうかを決定するさらなる工程を含む。上記の方法により選択される阻害物質は、ERK、p38、NF-AT及びAP1経路活性化を阻害しないものである。
【0052】
ERK及びp38経路、NF-AT経路並びにAP1経路の阻害をアッセイすることは、例えば、対応する経路により誘導可能なプロモーターの制御下に置かれたレポーター遺伝子を用いて行うことができる。レポーター遺伝子の例は、上記のとおりである。ERK及びp38経路、NFAT経路並びにAP1経路により誘導可能な構築物の例は、それぞれSRE-luc (Courtoisら, 1997, Mol. Cell. Biol, 17:1441〜1449)、NF-AT-luc及びAP1-luc (Northropら, 1993, J.Biol.Cell., 268:2917〜2923)である。レポーター遺伝子の発現は、例えば、PMA及びイオノマイシンにより刺激された、対応する構築物を含むような形質転換細胞を用いることによりアッセイされる。
【0053】
本発明の別の目的は:
a) 上記の本発明による可能性のある活性化物質の1次スクリーニングの方法により、NF-κB経路活性化を活性化できる可能性がある物質Sを選択し;
b) NF-κBにより誘導可能なプロモーターの制御下にレポーター遺伝子を含む細胞を提供し;
c) レポーター遺伝子の発現を、物質Sの非存在下で適切なシグナルを測定することにより検出し;
d) レポーター遺伝子の発現を、物質Sの存在下で適切なシグナルを測定することにより検出し;
e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質を選択する
ことを含む、NF-κB経路活性化の活性化物質の2次スクリーニング方法である。
【0054】
レポーター遺伝子は、好ましくは、β-ガラクトシダーゼ酵素をコードするlacZ遺伝子、及びルシフェラーゼをコードするluc遺伝子からなる群より選択される。レポーター遺伝子は、好ましくは、上記のSRE配列(血清応答配列)を含むプロモーターの制御下にある。
【0055】
この2次スクリーニング方法の好ましい実施形態において、上記の細胞は、Collection Nationale de Cultures de Microorganismes (C.N.C.M.)に2003年4月1日に番号I-3004の下で寄託された70Z/3-C3細胞である。
【0056】
本発明及びその多くの付随する利点は、以下の詳細な説明に関連する以下の図面を参照してより理解が深まるので、容易により完全に理解することができる。
【0057】
図1:ペプチドDR NLMによるNF-κB活性化の阻害。安定的にトランスフェクションされた70Z/3-C3細胞を、bodipyタグ付加アンテナペディア(BA) (黒三角)、BA-NLM (塗りつぶした丸)及びBA-DR NLM (塗りつぶした四角) (0〜10μM)と2時間インキュベートした後に、15μg/mlのLPSで4時間活性化した。NF-κB活性は、β-ガラクトシダーゼ(β-Gal)アッセイを用いて測定した。挿入図、LPS活性化あり(+)又はなし(-)で10μMのBA-NLM又はBA-DR NLMペプチドとともに又はなしで(w/o)のインキュベーションの後のNF-κB活性。B、70Z/C3細胞を、2時間、10μMのBA-NLM又はBA-DR NLMペプチドとともにインキュベートした。細胞を5時間、PMA又はIL-1とともに(+)又はなしで(-)処理した。NF-κB活性は、β-ガラクトシダーゼアッセイを用いて測定した。
【0058】
図2:ペプチドspCC2-LZへのペプチドBA-DR NLMのインビトロ結合。A、蛍光異方性を用いたBA-DR NLM:spCC2-LZ複合体の形成の分析。挿入図:蛍光異方性を用いたBR7-DR NLMとspCC2-LZとの複合体の形成の分析。B、蛍光異方性を用いる競合アッセイによるspCC2-LZへのBA-DR NLMの結合部位の決定。蛍光BA-DR NLM (10μM)をspCC2-LZ (30μM)とインキュベートして、BA-DR NLM:spCC2-LZ複合体を形成した。次いで、漸増濃度のA-NLM (白抜きの丸)及びアンテナペディア配列と融合したLZのC-末端部分(A-Cterm-LZ) (塗りつぶした四角)を加え、spCC2-LZと結合したBA-DR NLMを置き換えた。点線は、遊離のBA-DR NLMの異方性レベルを表す。
【0059】
図3:ペプチドDR NLMは、他のシグナル伝達経路に影響しない。AP1、Erk及びP38 MAPK経路並びにNFAT経路に対するBA-NLM及びBA-DR NLMの阻害効果。異なるレポータープラスミド(SRE-luc、AP1-luc、NFAT-luc)で一過的にトランスフェクションしたJurkat細胞を、5μMのBA-NLM又はBA-DR NLMとともに又はなしで(w/o) 2時間インキュベートし、次いで、5時間、擬似刺激(-)又はPMA (100 ng/ml)及びイオノマイシン(1μg/ml)で(+)刺激した。
【0060】
図4:ペプチドDR NLMは、内在性NEMOと相互作用する。A、DR NLMペプチドのタンパク質標的を同定する方法の概要。B、Flag-NEMO被覆ビーズの蛍光測定。Flag-NEMOを用いて安定的に再構成されたTリンパ球(JM4.5.2/Flag-NEMO)を、記載される蛍光ペプチドの非存在下(w/o)又はその存在下で2時間処理して、ペプチドの内部移行を可能にした。対照ペプチド(BA-LZ L322P/L329P)は、野生型NLMの配列を含む。いずれの過剰のペプチドを除去するための数回の細胞洗浄の後に、細胞を溶解させ、内在性Flag-NEMOを、抗Flag抗体を用いて沈降させた。NEMOに結合したペプチドの量は、次いで、蛍光により調べた(左上)。全ての試料を標準化するために、ビーズを被覆するNEMOの量を、抗NEMO抗体を用いてウェスタンブロッティングにより決定し(右上)、全ての試料を標準化するために用いた(下)。
【0061】
図5:NEMOオリゴマー形成に対する異なるペプチドの効果を調べるための細胞に基づくアッセイ(細胞ベースアッセイ)の概略図。
図6:DR NLMペプチドは、細胞においてNEMOオリゴマー形成を阻害しない。A、GFP-NEMOとFLAG-NEMOとのヘテロオリゴマー形成。B、C、GFP-NEMOとFlag-NEMOとで同時トランスフェクションされた293T細胞を、20μMのペプチドA-LZ、A-LZ L322P/L329P (B)、A-NLM又はA-DR NLM(C)を用いて2時間処理した。NEMOヘテロオリゴマーを、次いで、免疫精製し、ヘテロオリゴマーに結合した蛍光NEMOサブユニットの量を、実施例1.Iに記載されるようにして蛍光により調べた。
【0062】
図7:DR NLMは、細胞のポリユビキチン化タンパク質と、NEMOのCC2ドメイン及びLZドメインを含むペプチドCC2-LZとの相互作用を妨げる。A、ポリユビキチン化タンパク質のペプチドspCC2-LZへの相互作用を調べるための方法の概要。B、TNF-αによる刺激あり又はなしで、そしてペプチドBA-NLM又はBA-DR NLMあり(+)又はなし(-)での、ペプチドspCC2-LZに結合するポリユビキチン化タンパク質のウェスタンブロッティング。
【0063】
図8:HTRFアッセイの最適化。A、GST-Ub4の最適量の決定。Biot-CC2-LZ及びHis-CC2-LZ (それぞれ50 nM)を、結合バッファー(20 mM KPO4、100 mM KF及び0.1% BSA、pH 7)中で互いに混合し、次いで、抗-His-XL665 (7 nM)及びストレプトアビジン-EuK (2 nM)とインキュベートした。5分間のインキュベーションの後に、GST-Ub4を異なる濃度で加えた。FRETシグナルは、1時間のインキュベーションの後にモニターした。B、His-CC2-LZ及びBiot-CC2-LZの最適量の決定。化学量論比1対1のBiot-CC2-LZ及びHis-CC2-LZの合計量を結合バッファー中で一緒にインキュベートし、次いで、抗-His-XL665 (7 nM)、ストレプトアビジン-EuK (2nM)及びGST-Ub4 (250 nM)と混合した。FRETシグナルを、1時間のインキュベーションの後に記録した。C、蛍光シグナルに対するDMSOの影響。実験は、結合バッファー中のDMSOの異なる濃度を用いた以外は、250 nMのGST-UB4濃度を用いて、Aと同様であった。
【0064】
ここで、本発明者らにより企図される具体的な形態を実施例により記載する。以下の記載において、多数の具体的な詳細を、充分に理解するために記載する。しかし、本発明はこれらの具体的な詳細に限定されることなく行うことができることが、当業者に認識される。別の場合においては、記載を不要に不明瞭にしないように、公知の方法及び構造は記載しない。
【実施例】
【0065】
実施例1-材料及び方法
A.- 細胞培養、生物学的反応物及び抗体
エンドトキシン混入がないことを、細胞培養に用いたRPMI 1640培地(Invitrogen)及び胎児ウシ血清(Biowest)において確認した。Jurkat (クローン20)細胞を、10%胎児ウシ血清を補ったRPMI 1640中で維持した。安定な株化細胞(70Z/3-C3, C.N.C.M. I-3004)を、Agouら, 2004bに記載されるような、lacZレポーター遺伝子の上流のインターロイキン-2プロモーター中にNF-κB結合部位の3つのタンデムコピーを含有するcx12lacZ-κBプラスミドの存在下で70Z/3細胞をエレクトロポレーションした後に得た。これらは、10%胎児ウシ血清及び50μMのβ-メルカプトエタノール(Sigma)を補ったRPMI 1640で維持した。安定な株化細胞(JM4.5.2/Flag-NEMO)を、マウスFlag-NEMOの配列を含有するpcDNA3プラスミドの存在下でNEMO欠損Tリンパ球(JM4.5.2, Harhajら2000)をエレクトロポレーションした後に得た(Flagは、Sigmaにより提供される配列番号23の配列の親水性8アミノ酸ペプチドである)。これらのヒトJurkat白血病T細胞を、10%胎児ウシ血清を補ったRPMI 1640中で維持した。
【0066】
ヒト胚性腎臓株化細胞293T (American Type Culture Collection; Manassas, VA)を、100単位/mlのペニシリン及びストレプトマイシン(Invitrogen)並びに10%ウシ胎児血清を補ったDMEM培地(Invitrogen)で成長させた。サルモネラ・アボルタスからのLPS、ホルボール12-ミリステート13-アセテート(PMA)及びイオノマイシンはSigmaから購入し、組換えマウスIL-1βはBD Pharmingenから購入した。ポリクローナルウサギ抗-NEMO血清は、R.Weilから寄贈され、特異的抗体は免疫親和性により精製した。抗-GFPポリクローナル抗体はOncogeneからであった。抗-Flag M2モノクローナル抗体、及び抗-ユビキチン抗体は、Sigmaからであった。
【0067】
B.- ペプチド合成及び精製
ペプチドは、以前に記載されたようにして合成する(Agouら, 2004b)。ペプチドの配列は、国際特許W02005027959において既に報告され、それらのいくつかを以下の表Iに示す。
【0068】
【表1−1】

【0069】
【表1−2】

【0070】
【表1−3】

【0071】
【表1−4】

【0072】
C.- FACS分析の条件
ペプチドの内部移行は、国際出願WO 2005/027959に記載されるようにしてFACSにより分析する。
【0073】
D.- NF-κB阻害アッセイ
450μlの10% FCS-RPMI (Invitrogen)中の4.5×105個の70Z/3-C3細胞を、0〜20μMのペプチドBA-DR NLM又はBA-NLMとインキュベートした。37℃にて2時間の後に、200μlの細胞試料を、96ウェルマイクロタイタープレートに2重で移した。1つのウェルを4時間、15μg/ml LPS、20 ng/ml IL1-β又は100 ng/ml PMAのいずれかで処理した。対照のウェルは未処理のまま放置した。37℃にて4時間の後に、細胞を400×gにて5分間、室温にて遠心分離し、ペレットを冷PBS (200μl)で3回洗浄し、細胞を100μlの溶解バッファー(8 mM MgCl2、1 mMジチオエリスリトール、1% Triton X-100、15%グリセロール及びプロテアーゼ阻害物質混合物(Roche Applied Science, ref. 1836145)を含有する25 mM Tris-リン酸バッファーpH7.8)中で溶解した。溶解物を1000×gにて20分間、4℃にて遠心分離し、上清を氷上に保持した後に、β-ガラクトシダーゼアッセイを行った。β-ガラクトシダーゼアッセイは、50μlの上清に対して、4μlのGalacton-star化学発光基質及び196μlの反応バッファー(Clonetech)を含有するアッセイ混合物中で行った。活性は、プレートルミノメータ(Berthold)を用いて測定した。
【0074】
E.- その他のシグナル伝達経路の阻害アッセイ
Jurkat T細胞(クローン20)を、DEAE-デキストラン法により、ERK及びp38経路(SRE-luc; Courtoisら, 1997, Mol. Cell. Biol, 17:1441〜1449)、NF-AT経路又はAP1経路(それぞれNF-AT-luc及びAP1-luc; Northropら, 1993, J.Biol.Cell., 268:2917〜2923)により誘導可能なプロモーターの制御下のルシフェラーゼを含有するレポータープラスミドを用いて、一過的にトランスフェクションした。簡単に、細胞を洗浄し、107細胞/mlにて0.5 mg/mlのDEAE-デキストラン(Pharmacia)を含有するTBS中に再懸濁した。2.106細胞あたり1μgのレポータープラスミドを加えた。室温にて45分間の後に、細胞を10容量のTBSで希釈し、遠心分離し、106細胞/mlにて10% FCS-RPMI中に再懸濁した。24時間後に、細胞を、5μMのNEMO-由来ペプチド(BA-NLM又はBA-DR NLM)とともに又はなしで2時間インキュベートした。これらを、100 ng/ml PMA及び1μg/mlイオノマイシンを用いて5時間刺激したか又は擬似刺激し、最終的に、ルシフェラーゼバッファー(8 mM MgCl2、1 mM DTE、1% Triton X100、15%グリセロールを含有する25 mM Tris-リン酸pH 7.8)に溶解した。ルシフェラーゼ測定は、Bertholdルミノメータで行った。
【0075】
F.- 蛍光異方性
異方性測定は、励起及び発光のための偏光フィルタを備え、L形(L-configuration)の光電子増倍管を用いるQuantaMaster (登録商標)蛍光計(PTI)を用いて行った。全ての実験は、マイクロキュベット(60μl)内で22℃にて、495及び513 nmの励起及び発光波長で行った。励起及び発光波長の帯域は、それぞれ2及び4 nmであった。ミリ異方性(millianisotropy)単位として表される定常状態蛍光異方性を、Agouら, 2004aに記載されるようにして測定した。全ての測定は、20 mM KClを含有する20 mM等イオンバッファーpH 8 (10 mM酢酸、10 mM MES、20 mM Tris)中で行った。それぞれのデータ点は、2分間行った20記録(recording)の結果である。
【0076】
G.- 円偏光二色性分光法
遠-UV円偏光二色性(CD)測定を、Aviv 215分光偏光計を用いて、10 mM NaPO4、pH 7で希釈した試料を用いて行った。
【0077】
H.- Bodipy-コンジュゲートペプチドに結合したタンパク質の同定
5.106個のJM4.5.2/Flag-NEMO細胞を、6ウェルプレートに播種し(3 ml/ウェル)、20μMのBodipy-コンジュゲートペプチド(BA-NLM又はBA-DR NLM)とともに、37℃にて4時間インキュベートした。細胞を、400×gにて5分間遠心分離し、200μlの低張バッファー(10 mM TrisHCl pH 7.9、1.5 mM MgCl2、10 mM KCl)中に再懸濁し、氷上に20分間放置し、26Gの針を数回通過させることにより溶解した。溶解物を、15000×gにて20分間で澄明にし、合計で80μgのタンパク質を、40μlのアガロース抗-Flag M2ビーズと4℃にて1時間インキュベートした。Flag-NEMOタンパク質を、アガロース抗-Flag M2ビーズを用いて、1分間の遠心分離により沈降させた。ビーズを100μlの低張バッファーに再懸濁し、NEMO連結ペプチドの蛍光を、SAFASからのマイクロプレートリーダで読み取った。NEMO被覆ビーズを、ウェスタンブロッティングにより、抗-Flag M2モノクローナル抗体を用いて分析して、UN-SCAN-ITソフトウェアを用いて試料を標準化した。
【0078】
I.- 細胞でのNEMOオリゴマー形成の阻害
293T細胞に、FLAG-NEMOの配列を含有する2μgのプラスミドpcDNA3 (Invitrogen) (配列番号24の配列のpcDNA3-Flag-NEMO)と、GFP-NEMOの配列を含有する0.7μgのプラスミドpcDNA3(配列番号26の配列のpcDNA3-GFP-NEMO)とを、カルシウム-ホスフェート-DNA沈降法により一過的に同時トランスフェクションさせた。空のベクターを、6 cmのディッシュあたり4μgのDNAの合計量まで加える。トランスフェクションの24時間後に、細胞を再懸濁し、20μMのペプチド(A-NLM又はA-DR NLM)とともに又はなしで、37℃にて7時間インキュベートした。細胞を再懸濁し、PBSで2回洗浄して、過剰のペプチドを除去し、上記のプロテアーゼ阻害物質混合物(実施例1.D)を含有する150μlの溶解バッファー中で溶解した。溶解物は、15000×gで4℃にて20分間澄明にした。澄明にした溶解物中のタンパク質の量は、Bradford法により、キットDC Bioradを用いて測定する。100μgの合計タンパク質を、200μlの相互作用バッファー(50 mM TrisHCl pH 7.5、1% triton X100、1 mM DTE、300 mM NaCl)で希釈して、40μlのアガロース抗-Flag M2ビーズ(Sigma)とともに4℃にて1時間インキュベートした。オリゴマーFlag-NEMO/GFP-NEMOを、抗-Flag M2ビーズを用いて沈降させ、相互作用バッファーで2回洗浄した。GFP-NEMOの蛍光を、ビーズ上で直接、蛍光マイクロプレートリーダSAFASを用いて読み取り、澄明にした溶解物を、ウェスタンブロッティングにより、抗-Flag、抗-GFP及び抗-NDPK-B抗体を用いて分析して(Kraeftら, 1996; Exp Cell Res;227:63〜69)、結果を標準化した。
【0079】
J.- NEMOのCC2及びLZドメインを含むペプチドspCC2-LZに結合するポリユビキチン化タンパク質の同定
24.107個のJM4.5.2細胞を、10 ng/mlのTNFαで37℃にて10分間刺激するか又はせずに、冷PBSで2回洗浄し、実施例1.Dに記載されるプロテアーゼ阻害物質混合物を含有する900μlの溶解バッファー中で溶解した。溶解物を、15000×gで4℃にて30分間澄明にした。150μlのタンパク質を、20μMのペプチド(BA-NLM又はBA-DR NLM)とともに又はこれを用いずに10μgのビオチン化-CC2-LZと4℃にて1時間プレインキュベートした150μlのストレプトアビジン磁気ビーズ(MagPrep (登録商標), Novagen)と、4℃にて2時間インキュベートした。ビーズをバッファーA (10 mM Hepes pH 7.5、150 mM NaCl、8 mM MgCl2、10%グリセロール、0.1 mM DDM及び1 mM DTE)で4回洗浄し、6M尿素を含有する30μlのlaemmliバッファーに再懸濁した。試料を、ウェスタンブロッティングにより、抗ユビキチン抗体(Sigma)及びローディング対照について抗-NDPK-B抗体を用いて分析した。
【0080】
K.- ポリユビキチン化鎖との相互作用により誘導されるCC2-LZの二量体形成について競合する化合物の探索
均一系時間分解蛍光(HTRF (登録商標))アッセイ試薬、XL665で標識された抗-(His)6モノクローナル抗体(MABHis6-XL)、及びストレプトアビジン-ユーロピウムクリプテート(ストレプトアビジン-EuK)は、CIS-Bioから購入した。His-CC2-LZペプチド(配列番号30及び31)は、Agouら, 2004aに記載されるようにして精製し、ビオチンタグ付加CC2-LZペプチド(配列番号28及び29)は、Wylerら, 2007に記載されるようにして化学合成した。
【0081】
モノユビキチン鎖及びK63-連結ポリユビキチン鎖は、Boston Biochemから購入した。その末端でGSTタンパク質と融合する直鎖状テトラユビキチンをコードするcDNA は、Y. Dikicから寄贈された。GST-Ub4は、グルタチオンSepharose 4 Fast Flowを製造業者の使用説明(GE Healthcare)に従って用いて精製した。蛍光共鳴エネルギー転移(FRET)の全ての測定は、マイクロプレートリーダMithras LB 940 (Berthold Technologies)を用いて行った。
【0082】
HTRF (登録商標)の原理
HTRF実験において、純粋なHis-CC2-LZタンパク質を、抗-His-XL665 mAbにより標識し、biot-CC2-LZをストレプトアビジン-EuKにより標識した。His-CC2-LZ及びBiot-CC2-LZの二量体形成は、供与体(ストレプトアビジン-EuK)と受容体(抗-His-XL665)との近接を導く。ユーロピウムクリプテートを320 nmにて励起する際に、FRETが、これらの2つの蛍光団の間で発生し、XL665は、665 nmにて特異的長寿命蛍光を再び発光する。
【0083】
全ての実験は、黒色マイクロプレートGreiner (200μl)中で25℃にて行った。励起波長は320 nmであり、蛍光発光は620 nm及び665 nmにて測定して、特異的シグナルを標準化した。蛍光発光は、両方の波長で、50μsの遅延の後に記録し、これは、媒体及び遊離の受容体分子により導入されるバックグラウンドノイズを低減させる。FRETシグナルは、以下の等式を用いて算出される:
(1) ΔF = [(R−Rneg)/Rneg]* 100
式中、Rは、それぞれのアッセイについて算出された比([665 nmでの発光/620 nmでの発光]*10000)であり、Rnegは、陰性対照についての同じ比である(すなわち、His-CC2-LZの非存在下)。
【0084】
簡単に、His-CC2-LZ及びbiot-CC2-LZ (それぞれ50 nM)タンパク質を、100 mMフッ化カリウム及び0.1% BSAを含有する結合バッファー20 mMリン酸カリウムpH 7.0中で互いに混合した。インキュベーションの後に、ストレプトアビジン-EuK (供与体)及び抗体抗-His-XL665 (受容体)を、混合物にそれぞれ2 nM及び7 nMの濃度で加えた。陰性対照は、His-CC2-LZ (結合バッファーで置き換える)以外の上記の全ての成分が存在する混合物であった。これらの条件下で、バックグラウンドを超えるFRETシグナルは検出されなかった。
【0085】
実施例2 - DR NLMペプチドは、NEMOのオリゴマー形成ドメインにインビトロで結合する
円偏光二色性及びゲルろ過による以前の研究は、NLM及びDR NLMペプチドがオリゴマーのコイルドコイル構造を形成せず、100μMまでのペプチド濃度にて単量体として挙動することを示している(データ示さず)。そして、LZペプチドとは異なって、DR NLMペプチド及びNLMペプチドは、自己会合できない。LZペプチドの自己会合は、Agouら, 2004bに記載されている。
ここで、本発明者らは、プレ-B 70Z3リンパ球をホルボールエステル(PMA)、炎症誘発性サイトカイン(IL-1)及びエンドトキシン(LPS)で活性化した後に、DR NLMがNF-κB経路を阻害することを確認している(図1A及び1B)。これらの種々の刺激について測定されたIC50は、同様である(0.9μM +/- 0.1)。さらに、種々の内部移行ペプチド(Tat、アンテナペディア、R7、R9)を用いることにより、同様のIC50値が得られ、このことは、内部移行が、制限する工程でないことを示唆する。
【0086】
DR NLMがNEMOのMODに結合するかを分析するために、蛍光標識BA-DR NLM (10μM)を、漸増濃度のspCC2-LZとインキュベートし、複合体の形成を、蛍光偏光(P)によりモニターし、結果を、式A=2P/(3-P)に従う異方性(A)で表した。spCC2-LZの濃度は、アミノ酸分析により決定した(Vinoloら; 2006)。データ点は、結合等温式に適合させ、これは17μMの解離定数を与えた。挿入図、同じ実験をBR7-DR NLM (10μM)を用いて行い、これは同様の解離定数を与えた(KD = 21μM)。
【0087】
DR NLMは、17μMの親和性及び3:1の化学量論比の安定なMOD/ペプチド複合体を形成する(図2A)。このことは、DR NLMペプチドが、MODの三量体と優先的に相互作用することを示唆する。この相互作用は、細胞の透過性配列に依存しない。なぜなら、そのN-末端にアンテナペディアペプチド(BA-DR NLM)又はポリR7ペプチド(BR7-DR NLM)が融合したDR NLMは、同様の解離定数を示すからである(挿入図、図2A)。結合部位は、MODのいくつかの領域を模倣する種々のペプチドを用いて、蛍光偏光により位置決めされる(図2B)。この部位は、NEMOのLZサブドメインのC-末端部分(残基315〜336)に相当する。この部位は、以前に、点突然変異分析によりNEMO機能に必須であると決定された(Agouら, 2004a)。
【0088】
種々の型の細胞におけるDR NLMにより誘導されるNF-κB阻害の選択性を調べるこれらの研究は、ペプチドの最も魅力的な特性をとらえる。
実施例1.Eに記載される阻害アッセイの結果を、図3に示す。これらの結果は、NLM-DRが、PMAとイオノマイシンに応答して、Tリンパ球におけるAP1、ERK、p38及びNF-ATを含む少なくとも4つのその他の経路を妨げないことを示し、このことは、NLMペプチドではなくDR NLMペプチドが、NF-κB経路を特異的に阻害することを示す(図3)。
【0089】
実施例3 - DR NLMは、細胞においてNEMOと直接相互作用する。
DR NLMペプチドにより観察された阻害がNEMOとの直接の相互作用によるのかという疑問に対処するために、Flag-NEMOタンパク質の遺伝子を用いて(JM4.5.2/Flag-NEMO)実施例1.Aに記載されるようにして安定的に再構築されたNEMO欠損Tリンパ球(JM4.5.2株化細胞)を用いた。細胞を、BA-NLM-DR蛍光標識ペプチド(20μM)又は蛍光標識NLM対照(BA-LZ L322P/L329P)とともに4時間インキュベートした後に、細胞を溶解し、粗抽出物を、実施例1.Hに記載されるようなアガロースビーズと共有結合した抗-Flag抗体とインキュベートした(方法の概略について図4Aを参照)。ビーズの沈降の後に、ビーズに付着した蛍光を測定して(実施例1.H)、NEMOに結合したペプチドの量を分析した(図4A及び4B)。この分析結果を、抗-Flag M2モノクローナル抗体を用いるウェスタンブロッティングにより、それぞれの試料中のFlag-NEMOタンパク質の発現レベルに関して標準化した。図4Bは、DR NLMがNEMOに特異的に結合することを示し、このことは、経路の活性化を阻害する所定のペプチドの効果と、NEMOと相互作用するその能力との完全な相関関係を示す。
【0090】
実施例4 -DR NLMは、NEMOオリゴマー形成に干渉しない。
DR NLMペプチドによるNF-κB経路の阻害の分子的機構をよりよく分析するために、本発明者らは、実施例1.Iに記載されるような細胞内のNEMOオリゴマー形成を調べるアッセイを開発した(細胞ベースアッセイの概要について図5を参照)。このために、GFP-NEMO及びFlag-NEMO融合タンパク質をそれぞれ発現する2つのプラスミドを用いた。プラスミドをヒト293T細胞に同時トランスフェクションして、外在性GFP-NEMO及びFlag-NEMO融合タンパク質を過剰発現させ、NEMOオリゴマー形成を強制した。細胞を、次いで、洗剤での溶解に供し、Flag-NEMOタンパク質を、抗-Flagアガロースビーズ及びFlagペプチドを用いて実施例1.Iに記載されるようにして免疫精製した。ヘテロオリゴマー内のFlag-NEMOサブユニットとGFP-NEMOサブユニットとの会合に起因するビーズに付随する蛍光は、細胞抽出物中に存在するオリゴマーの量の評価を可能にする。GFP-NEMO単独の発現又はFlag-NEMO及びGFPタンパク質の同時発現を含む対照は、抗-Flagビーズに付随する蛍光を示さない(図6A)。
【0091】
BA-LZペプチドは、インビトロのNEMOオリゴマー形成を阻害する(Agouら, 2004b)。次いで、BA-LZを陽性対照として用いて、上記の蛍光細胞ベースアッセイの妥当性を確認した。このアッセイの条件下で、Bodipyの蛍光発光は、GFPの蛍光発光の測定に干渉しない。図6Bに示すように、BA-LZペプチド(20μM)とのインキュベーションは、蛍光NEMOサブユニットの量を大きく低減させ、このことは、BA-LZペプチドが細胞でのNEMOオリゴマー形成を阻害することを示す。これとは対照的に、コイルドコイル界面において二重変異を有する相同ペプチド(BA-LZ L322P/L329P)を用いるか、又は細胞をペプチドなしで処理する場合、より多量の蛍光NEMOサブユニットが回収された。興味深いことに、NEMOオリゴマーの形成は、変異ペプチド(BA-LZ L322P/L329P)の存否で等しく、このことは、NEMOオリゴマーの解離が、この変異ペプチドを用いて観察されなかったことを示す。
【0092】
この細胞に基づくアッセイを用いて、本発明者らは、ペプチドBA-DR NLMがNEMOオリゴマー形成を変化させる能力を調べた。図6Cは、BA-DR NLMがNEMOタンパク質に結合できる能力にもかかわらず、BA-DR NLM又はBA-NLMペプチド(20μM)の存在下又は非存在下で、NEMOオリゴマーが同じ量であることを示す。結論として、細胞での実験は、そのオリゴマー形成の状態に依存しないNEMO阻害の新しい機構を示す。
【0093】
実施例5 - DR NLMは、細胞において、CC2-LZタンパク質とポリユビキチン化タンパク質との相互作用を阻害する。
最近の報告は、NEMOがLys 63-連結ポリユビキチン化のセンサとしても作用することを示した(Eaら, 2006; Wuら, 2006)。よって、本発明者らは、DR NLMが、NEMOとK63ポリユビキチン鎖との相互作用を妨げるかについて調べた。このために、実施例1.Jに記載され、図7Aに示される、NEMOのCC2ドメイン及びLZドメインを含むペプチドを誘引として用いてポリユビキチン化タンパク質を沈降させる沈降アッセイを開発した。磁気ビーズを被覆するビオチン化-CC2-LZ (Bio-CC2-LZ)は、A-NLMペプチド又はA-DR NLM ペプチドの存在下又は非存在下で、TNFαで刺激したか又はしていないNEMO欠損Tリンパ球(JM4.5.2株化細胞)と同時インキュベートした。ビーズを充分に洗浄した後に、CC2-LZに結合した全てのモノユビキチン化タンパク質及びポリユビキチン化タンパク質を、ウェスタンブロットにより、抗ユビキチン抗体(Sigma)を用いて分析した。図7Bに示すように、DR NLMペプチドは、TNF-α依存的な様式で、細胞のポリユビキチン化タンパク質とのCC2-LZ相互作用をなくすが、NLMペプチドの存在下又は非存在下では阻害が観察されなかった。これらの結果は、ポリユビキチン化タンパク質とCC2-LZとの間の相互作用の著しい損失を示し、このことは、DRNLMペプチドがNF-κB経路を、NEMOとポリユビキチン化タンパク質との相互作用を遮断することにより阻害することを示す。相対的に、蛍光偏光を用いるインビトロ結合アッセイは、Lys63-連結ポリユビキチン鎖についてのタグフリーDR NLM の解離定数及び協同性指標(Hill係数) (KD= 250μM、n = 1)が、タグフリーNLM (KD = 180μM、n = 8)のものよりも低いことを示す。このことは、NEMOのNLMペプチドが、新しいユビキチン結合モチーフであり、モチーフでの単純な変異D→Rが、NEMOとポリユビキチン鎖との相互作用の完全な損失を導くことを示す。
【0094】
上記の、及び国際特許出願WO2005027959で以前に報告されたものと組み合わせた結果は、CC2ドメイン及びLZドメインを含むNEMOの領域が、オリゴマー形成ドメインとして、及びポリユビキチン鎖結合ドメインとして作用することを示す。NEMOドメインのこれらの二重の特性は、NEMOオリゴマー形成を破壊し、実施例1.11a)、b)及びc)に記載されるスクリーニングアッセイを用いるか、又はNEMOとポリユビキチン鎖との相互作用を破壊し、実施例1.12に記載されるスクリーニングアッセイを用いることにより、NF-κBシグナル伝達経路を阻害する新しい化合物を探索することを可能にする。
【0095】
実施例6 - CC2-LZオリゴマー形成に基づくスクリーニングアッセイ
A.- LZペプチド結合についてNEMOのCC2ドメイン及びLZドメインを含むペプチドCC2-LZと競合する化合物の探索
異方性測定は、SAFAS Xenius蛍光計を用いて行う。全ての実験は、黒色マイクロプレートGreiner (100μl)中で20℃にて、495及び515 nmの励起及び発光波長で行う。励起及び発光波長の帯域は8 nmである。R7-LZ Bodipy標識(BR7-LZ)及びR7-LZペプチドは表Iに示し、組換えHis-CC2-LZタンパク質は、Agouら, 2004bに記載されるようにして精製する。
【0096】
BR7-LZ (5μM)及びR7-LZ (20μM)を、25℃にて、標的His-CC2-LZ (10μM)とインキュベートして、50 mM KClを含有する100μlのTris/MESバッファー(10 mM酢酸、10 mM MES)、pH 8中で安定な複合体の形成を誘導する。蛍光ペプチドと同じ親和性を示す非蛍光ペプチドは、標的に連結されたペプチドの量を増大させる。これらの実験条件の下で、His-CC2-LZの添加は、遊離のR7-NLM-LZ*BR7-LZペプチド(77 mA)の異方性シグナルに関して20%の異方性の増大を導き、このことは、複合体His-CC2-LZ:BR7-LZの形成を示す。His-CC2-LZ/R7-LZ/BR7-LZ混合物を、次いで、薬剤候補化合物を含有する96ウェルプラスチックプレートに播種する。His-タグCC2-LZ標的からのペプチドの解離を反映する蛍光異方性を低減させるその能力についてヒットを選択する。
【0097】
B.- NEMOのCC2ドメイン及びLZドメインを含むペプチドCC2-LZ の不活性立体配座への立体配座転換を誘導する化合物の探索
このスクリーニングアッセイを開発するために、蛍光共鳴エネルギー転移法(FRET)を用いる。CC2-LZペプチドを、そのN-末端でCy5/5 (GE Healthcare)のような蛍光団供与体と、そしてそのC-末端でBHQ3 (Biosearch Technologies)のような蛍光団受容体とコンジュゲートさせる。二重にコンジュゲートされたCC2-LZを、試験される分子と接触させ、蛍光を測定する。蛍光発光の増大を誘導するヒットを選択する。
【0098】
C.- CC2-LZオリゴマー形成を阻害する化合物の探索
均一系時間分解蛍光(HTRF)に依拠するスクリーニングアッセイも、より高いスループットのために準備する。それぞれビオチン及び(His)6タグを認識するユーロピウム-クリプテート(蛍光団供与体)及びXL665 (蛍光団受容体)をコンジュゲートした抗体は、商業的に入手可能である(Cis-Bio inc.)。His-タグCC2-LZペプチドの精製は、Agouら, 2004bに記載される。ビオチンタグ付加CC2-LZペプチドは、化学的に合成するか、又はAviTag (Avidity, inc)のような組換え大腸菌(E.coli)株から精製する。この方法の主な利点は、手ごろであり、擬陽性の危険性が低減されることである。
【0099】
実施例7 - CC2ドメイン及びLZドメインのポリユビキチン結合特性に基づくスクリーニングアッセイ
A.- 1次スクリーニングアッセイ
第1工程において、K63連結ポリユビキチン鎖(K63Ub 2-7, Boston Biochem, Inc.)を、Ni-NTA HisSordプレート(96ウェルプレート、Qiagen, Inc)に固定化する。蛍光標識CC2-LZ (例えばB-CC2-LZ)又は蛍光NLMペプチド(例えばB-DR NLM)を加えて、K63ポリユビキチン鎖と蛍光タンパク質複合体を形成する。K63ポリユビキチン鎖に結合するCC2-LZ又はNLMと競合するヒットを陽性とみなして選択する。
【0100】
B.- 2次スクリーニングアッセイ
第2工程において、上記の1次スクリーニングに由来する全ての陽性ヒットを2次スクリーニングに供して、NF-κB阻害に対するそれらの影響を、WO2005027959特許に記載される細胞ベースアッセイを用いて調べる。
【0101】
用いた略称: BA-ペプチド、そのN-末端で細胞透過性配列アンテナペディアと融合し、かつbodipy蛍光団とコンジュゲートしたペプチド;A-ペプチド、アンテナペディアタグ付加ペプチド;R7-ペプチド、その末端で細胞透過性ポリカチオンペプチドRRRRRRRと融合したペプチド;Tat、配列YGRKKRRQRRRを含有する細胞透過性ペプチド;R9、9つのアルギニン残基を含有する細胞透過性カチオンペプチド;spCC2-LZ、合成ポリペプチドサブドメインCC2-LZ;DDM、ドデシルマルトシド;MES、モルホリノエタンスルホン酸;DTE、ジチオエリスリトール。
【0102】
実施例8 - ポリユビキチン鎖との相互作用により誘導されるCC2-LZ二量体形成について競合する化合物の探索
本発明者らは、設計されたアンキリン反復タンパク質(Designed Ankyrin Repeat Proteins;DARPins)に結合したCC2-LZ二量体(Wylerら, 2007)のよく特徴決定された複合体も用いた。これらの複合体は、CC2-LZ二量体に対してnMの親和性を示し、陽性タンパク質として用いた。このアッセイにおいて、His-タグ付加タンパク質CC2-LZを、His-タグ付加DARPin 1D5 (KD = 22 nM)又はHis-タグ付加DARPin 2F6 (KD = 8 nM)のいずれかで置き換えた。表IIに示すように、FRETシグナルは、1D5 (290%)及び2F6 (2749%) DARPinsを用いて観察され、このことは、nMタンパク質複合体を同定するためのFRETアッセイの効力を示す。
【0103】
【表2】

【0104】
(+)及び(-)で示すタンパク質試料の異なる組み合わせを用いて、アッセイにおいて蛍光共鳴エネルギー転移(FRET)を測定した。FRETのパーセンテージは、実施例1に記載するようにして算出した。
【0105】
CC2-LZ二量体形成の親和性は、DARPin:CC2-LZ複合体のものと比較して低い(KD = 22μM)ので、CC2-LZの各サブユニットをnM濃度でインキュベートしたときにFRETシグナルは観察されなかった(表IIを参照)。しかし、同じ混合物をGST-テトラユビキチンの存在下でインキュベートしたときに、FRETの特異的シグナルがモニターされ、このことは、テトラユビキチンの結合がCC2-LZ二量体の形成を誘導することを示唆する。同様の実験を、モノユビキチン又はGST単独を用いて行った。しかし、GST単独又はモノユビキチンのいずれを用いてもFRETシグナルは検出されず(図8及び表III)、このことは、FRETシグナルがCC2-LZ二量体とGST-テトラユビキチン鎖との特異的相互作用に起因することを示す。
【0106】
【表3】

【0107】
HTRFアッセイを最適化するために、本発明者らは、His-CC2-LZ、Biot-CC2-LZ及びGST-Ub4の種々の濃度も用いた。図8A及び8Bに示す結果は、HTRF実験における堅固で著しいFRETシグナルのための最適条件が、40 nM Biot-CC2-LZ、40 nM His-CC2-LZ及び250 nM GST- Ub4に相当することを示す。さらに、本発明者らは、5%までのDMSOの存在は、蛍光シグナルを妨げないことを示した(図8C)。
【0108】
結論として、本発明者らは、CC2-LZ二量体形成及び/又はCC2-LZ二量体のポリユビキチン鎖への特異的結合について競合する小分子を探索することを可能にする強力で堅固なFRETアッセイを開発した。
【0109】
【表4】

【0110】
【表5】

【0111】
【表6】

【0112】
【表7】

【0113】
【表8】

【技術分野】
【0001】
本発明は、NEMOと他のタンパク質との相互作用を調節することによりNF-κB経路の活性化を調節(活性化又は阻害)する分子を同定及び選択するための方法に関する。
【背景技術】
【0002】
核内因子κB (NF-κB)シグナル伝達は、炎症性応答、腫瘍発生、ウイルス感染、細胞増殖の調整、アポトーシス、並びにB及びTリンパ球の抗原性刺激を含む種々の必須の細胞プロセスに関与するシグナル伝達経路である(Ghosh, 1998, Annu. Rev. Immunol.; Karin, 1999, J. Biol. Chem.; Israel, 2000, Trends Cell Biol.; Santoro, 2003, EMBO J.)。哺乳動物細胞において、二量体を形成する5つのNF-κBファミリーメンバーが存在する:RelA、RelB、c-Rel、NF-κB2/p100/p52及びNF-κB1/p105/p50。その主な形態がp50サブユニットとRelAサブユニットとで構成されるヘテロ二量体転写因子であるNF-κBは、休止細胞において、IκBとして知られるタンパク質の阻害ファミリーのメンバーと会合することにより、細胞質に隔離される。サイトカインTNF-α及びインターロイキン-1、エンドトキシン(LPS)、細菌及びウイルスの感染を含むいくつかの因子による刺激の際に、炎症誘発性シグナルは、2つのキナーゼサブユニットIKKα/IKK-1及びIKKβ/IKK-2並びに構造/調整サブユニットNEMO/IKK-γで構成されるタンパク質複合体である標準のIκBキナーゼ複合体(IKK)上に集まる。一旦活性化されると、IKK複合体はIκBタンパク質をリン酸化し、それらのユビキチン化及びその後のプロテアソームによる分解を引き起こす。放出されたNF-κB転写因子は、次いで、核に移動して、遺伝子発現を開始又はアップレギュレートする。IKKαとIKKβは著しい構造類似性を示すが(52%)、遺伝子研究は、これらが、NF-κBの活性化について2つの経路に関与することを示している(Pomerantz, 2002, Mol Cell)。IKKβは、伝統的なNF-κB複合体の活性化を担う炎症誘発性キナーゼであり、NF-κB誘発キナーゼ(NIK)と会合したIKKαは、非標準的なNF-κBシグナル伝達経路において必須の役割を演じる(Senftleben, 2001, Science)。IKKαは、ケラチノサイト分化においても役割を演じるが、このプロセスはそのキナーゼ活性から独立している(Hu, 2001, Nature)。
【0003】
NEMOタンパク質(NF-κB 必須モジュレーター(NF-κB essential modulator))は、NF-κB経路活性化において重要な役割を演じる。NEMOタンパク質は、IKKα及びIKKβタンパク質キナーゼとIKK複合体において会合する。IKKキナーゼは、未知の機構によるリン酸化により活性化されるが、これは、NEMOオリゴマー形成の結果であると考えられている(Agouら, 2004, J. Biol. Chem.)。NEMOタンパク質の存在は、IKK活性化の根底にある。なぜなら、NEMO欠損細胞は、多くの刺激に応答してNF-κBを活性化できないからである。
【0004】
炎症誘発性刺激に応答してIKKの活性化を引き起こす生化学的機構は、まだ不明確なままである。活性化T-ループ中の2つのセリン残基に対するリン酸化が、IKKβの活性化を誘発することが示されている。しかし、このリン酸化事象に導く機構は、まだわかっていない。1つの可能性のある機構は、NEMOオリゴマー形成により誘発されるキナーゼの立体配座変化である(Agouら, 2004, J. Biol. Chem.)。オリゴマー状態のこの変化は、トランス-自己リン酸化の機構によりT-ループの活性化を誘発し得る(Zandi, 1997, Cell; Tang, 2003, J. Biol. Chem.)。
【0005】
IKK活性化におけるNEMOオリゴマー形成の役割と矛盾することなく、最小オリゴマー形成ドメイン内の変異は、多くの刺激に応答するNEMO欠損細胞活性化において、遺伝子的な補完によりNF-κBを救うことができなかった。さらに、NEMOの強制的なオリゴマー形成は、IKK複合体の完全な活性化を導く(Inohara, 2000, J. Biol. Chem.; Poyet, 2000, J. Biol. Chem.; Poyet, 2001, J. Biol. Chem.)。最近、TNF-αに応答してのNEMOのリン酸化及びユビキチン化が報告されている(Carter, 2001, J. Biol. Chem.; Trompouky, 2003, Nature; Kovalenko, 2003, Nature)。しかし、これらのNEMOの修飾は、いくつかの炎症誘発性刺激に応答するIKK複合体の活性化において非常に重要な工程であるとは証明されていない。
【0006】
NF-κB活性化の阻害は、新しい抗炎症性薬剤及び抗癌剤の開発のために、特別な標的を構成する(May, 2000, Science; Poulaki, 2002, Am J Pathol)。NF-κBシグナル伝達経路における多くのタンパク質作用物質のうち、IKK複合体は、新しい特異的NF-κB阻害物質の発見のために最も見込みがある分子標的の1つである。インビボでの可能性のある毒性の影響を最小限にするために、治療上の成功は、NF-κB阻害物質が、NF-κB活性の基底レベルを改変することなく活性化シグナルを遮断する能力に大きく依存する。Mayらは、NEMOとIKKキナーゼとの構成的な相互作用を破壊することによる炎症誘発性NF-κB活性化を特異的に遮断する細胞透過性ペプチド阻害物質について記載した(May, 2000, Science; May, 2002, J. Biol. Chem.)。タンパク質の機能を変更するペプチドの合理的な設計によるタンパク質-タンパク質相互作用の調節は、特に、柔軟で活動的な結合特性を示すシグナル伝達タンパク質を用いる(Pawson, 2003, Science)、基礎研究及び治療薬の新しいクラスの開発(Souroujon, 1998, Nat Biotechnol.)の両方のために重要なツールを提供する。
【0007】
ペプチドモジュレーターの多くの研究が文献に記載され、ここで、ペプチドは、局在化(移動) (Lin, 1995, J. Biol. Chem.)、受容体の補充(Chang, 2000, J. Biol. Chem.)、分子間相互作用(Souroujon, 1998, Nat Biotechnol.)及びオリゴマー形成(Judice, 1997, P.N.A.S.)に干渉することによりタンパク質の機能を媒介する。後者において、HIV-1 gp41融合タンパク質が種々のペプチドを用いて阻害されることは、概念の明確な証明である(概説として、Chan, 1998, Cell及びEckert, 2001, Ann. Rev. Biochem.を参照されたい)。
【0008】
よって、NEMOタンパク質は、NF-κB経路を阻害する新しい薬剤の開発のための見込みのある標的である。なぜなら、これはNF-κB刺激のほとんどを統合し(integrate)、整合し(coordinate)、かつこれはIκBキナーゼ複合体(IKK)の重複しない成分であるからである。
【0009】
NEMOタンパク質のアミノ酸配列は、このタンパク質がいくつかのドメインからなることを示唆する(Agouら, J. Biol. Chem., 2004b)。簡単に、ポリペプチドのN-末端部分は、大きいコイルドコイルモチーフ(CC1)と、タンパク質とIKKキナーゼとの相互作用に含まれる全ての残基(IKK-結合ドメイン)とを含有する。C-末端半分(残基250〜412)は、2つの連続するコイルドコイルモチーフであるCC2 (残基253〜285)及びLZ (残基301〜337)と、タンパク質の最もC-末端側のジンクフィンガーモチーフ(ZF)とで構成され、タンパク質の調整部分として機能し、これは、多くの上流のシグナル分子又はウイルスタンパク質を連結するための結合鋳型としてしばしば報告されている(Ghosh, 1998, Annu. Rev. Immunol.; Santoro, 2003, EMBO J.)。
【0010】
興味深いことに、色素失調症(IP)及び免疫不全を伴う外胚葉性異形成症(EDA-ID)の原因である変異は、分子のこの部分で主に見出された(Doffinger, 2001, Nature Gen.; Zonana, 2000, Am. J. Hum. Genet)。NEMOの最小オリゴマー形成ドメイン(MOD)は、CC2及びLZコイルドコイルモチーフからなる(Agouら, J. Biol. Chem., 2004a)。MODドメインは、NLMモチーフも含む(Nemo様モチーフ(Nemo Like Motif)) (293〜322) (Agouら, 2004b)。上記の残基の番号付けは、配列番号1の配列のマウスNEMOタンパク質に関する。ヒトNEMOタンパク質に関して、CC2、LZ及びNLMドメインはそれぞれ、配列番号2の配列の残基260〜292、残基301〜344及び残基300〜329に対応する。
【0011】
本発明者らは、以前に、NEMOのMODドメインに由来し、NEMOオリゴマー形成を阻害することによりNF-κB経路を阻害できるペプチドを合成した(特許出願WO 2005/027959)。実際に、それぞれマウス及びヒトのNEMOタンパク質のLZドメインに相当する配列番号6及び配列番号7の配列のspLZペプチド、並びにそれぞれマウス及びヒトのNEMOタンパク質のCC2ドメインに相当する配列番号8及び配列番号9の配列のspCC2ペプチドは、NF-κB活性化を、μMの範囲のIC50で阻害する(WO2005/027959、Agouら, 2004b)。
【0012】
NEMOのLZモチーフのN-末端配列に由来する他のペプチドNLM及びDR-NLMも、NF-κB活性化を阻害する。それらのIC50値は、国際PCT出願WO 2005/027959に報告された。DR-NLMペプチドは、LZペプチドの長さの半分である(国際PCT出願WO 2005/027959)。ペプチドNLM (配列番号10)及びDR NLM (配列番号11)は、配列番号1の残基294〜314に相当し、DR NLMにおいて、配列番号1の304位のAspがArg残基に置換されている。ヒトNEMOタンパク質に由来するNLM及びDR NLMは、それぞれ配列番号18及び配列番号12により定義される。
【0013】
WO 2005/027959及びAgouら, 2004bの方法はともに、インビボの細胞に基づくアッセイ系を用いて、特定の物質が核内因子-κB経路に影響するかを決定する。特に、彼らは、内在性NF-κB-lacZレポーター遺伝子を用いるNF-κB阻害アッセイを用いて、NF-κB経路に対するCC2又はLZドメインのような種々のペプチドの影響を決定する。このようなインビボの細胞に基づくアッセイは、特に、適切な株化細胞を維持すること及びアッセイに影響する全ての関連する因子が必要なパラメーター内にあることを確実にすることの複雑さにより、いくつかの問題点を有することが知られている。このようなインビボアッセイを用いる化合物の大規模スクリーニングは、よって、インビトロスクリーニング技術と比較して時間がかかるとともに、複雑で高価である。
【発明の概要】
【発明が解決しようとする課題】
【0014】
予期せぬことに、本発明者らは、今回、MODドメインがオリゴマー形成ドメイン及びポリユビキチン鎖結合ドメインとして作用することを見出した。NEMOドメインのこれらの二重の特性は、NEMOオリゴマー形成を調節(増強又は破壊)することによるか、又はNEMOとポリユビキチン鎖との間の相互作用を調節(増強又は破壊)することによりNF-κBシグナル伝達経路を特異的に調節する新しい化合物の探索を可能にする。実際に、LZはNF-κB活性化を、NEMOオリゴマー形成を破壊することにより阻害するが、DR NLMは、ポリユビキチン鎖とNEMOタンパク質との間の相互作用を遮断することによりNF-κB阻害物質として作用する。これらの結果は、NEMO機能のために必要な、新しく重要なユビキチン結合ドメインに相当するNEMOのNLMドメインについての新しい見識も提供する。より重要なことには、これらの結果は、実際のスクリーニングのための標的として用い得るNEMOの「ホットスポット」領域を規定することを可能にする。
【0015】
NEMO-ポリユビキチン相互作用は、以前に記載されている;Godhaら(2007)は、ヒトT細胞白血病ウイルス(Human T-cell Leukaemia Virus) 1型(HTLV-1)がどのようにしてNF-κB経路を活性化するかとの機構についてのインビボ研究について記載している。著者らは、MAPキナーゼTAK1が、NEMOのK63ポリユビキチン化を誘導することを示し、彼らは、これが、HTLV-1が用いてNF-κB経路に提供を与える機構の少なくとも1つであると考えている。
【0016】
Zhouら(2004)も、NF-κB経路に対するBcl10過剰発現の影響についての研究を記載している。特に、彼らは、Bcl10過剰発現が、K63ポリユビキチン化のためにNEMOを標的にすることを示し、このことを証明するためにインビボユビキチン化アッセイを用いている。
Godhaら(2007)及びZhouら(2004)はともに、ポリユビキチン化の標的として、全長NEMOを用いている。
【0017】
本発明者らは、しかし、研究の過程で、NEMOの必須CC2及びLZドメインだけを含むペプチドを方法において用いて、NEMO活性のモジュレーターを同定できることを見出した。NEMOのこの必須部分のみを用いることにより、より感度が高いアッセイを行って、いずれの特定の機能も有さないであろうNEMOの他の部分とのより全般的な相互作用よりもむしろNEMOのこれらの最も重要な部分及びユビキチンとに相互作用するモジュレーターを見出すことが可能になる。
【0018】
炎症応答、腫瘍発生及びウイルス感染におけるNEMOの役割、並びにNF-κBシグナル伝達経路の複雑さを考慮して、他のタンパク質とのいずれのNEMO相互作用(すなわち、オリゴマー形成又はNEMOとポリユビキチン鎖との相互作用)も破壊することにより作用できる物質を1次スクリーニングする必要性がある。
【0019】
よって、本発明の目的は、他のタンパク質とのNEMOの相互作用を特異的に調節(活性化又は阻害)する分子を選択するためのスクリーニング方法を提供することである。より具体的には、該スクリーニングアッセイは、NF-κB経路活性化の新しく効果的で特異的なモジュレーターを検出するために、NEMOのMODドメインを用いる。
【課題を解決するための手段】
【0020】
よって、本発明の第1の目的は、以下の工程:
(a) (i) NEMOのCC2領域とLZ領域とからなるペプチドP1であって、標識されているか又はされていないペプチドP1と、(ii) NEMOのLZ領域の少なくとも10アミノ酸残基、好ましくはNEMOのLZ領域の少なくとも36アミノ酸残基を含むペプチド、NEMOのNLM領域の少なくとも10アミノ酸残基、好ましくはNEMOのNLM領域の少なくとも21アミノ酸残基を含むペプチド、DR-NLMを含むペプチド、NEMOの領域CC2及びLZを含むペプチド、NEMOのCC2領域の少なくとも10アミノ酸残基を含むペプチド、及びK63-連結ポリユビキチン化鎖を含むペプチドからなる群より選択される、標識されているか又はされていないペプチドP2とを、試験される物質Sの非存在下で接触させ;
(b) 標識されているか又はされていない前記ペプチドP1と、標識されているか又はされていない前記ペプチドP2とを、試験される物質Sの存在下で接触させ;
(c) 工程(a)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(d) 工程(b)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する
を含むことを特徴とする、NF-κB経路活性化の可能性のある(potential)モジュレーターのインビトロ1次スクリーニング方法である。
【図面の簡単な説明】
【0021】
【図1】ペプチドDR NLMによるNF-κB活性化の阻害。
【図2】ペプチドspCC2-LZへのペプチドBA-DR NLMのインビトロ結合。
【図3】ペプチドDR NLMは、他のシグナル伝達経路に影響しない。
【図4】ペプチドDR NLMは、内在性NEMOと相互作用する。
【図5】NEMOオリゴマー形成に対する異なるペプチドの効果を調べるための細胞に基づくアッセイ(細胞ベースアッセイ)の概略図。
【図6】DR NLMペプチドは、細胞においてNEMOオリゴマー形成を阻害しない。
【図7】DR NLMは、細胞のポリユビキチン化タンパク質と、NEMOのCC2ドメイン及びLZドメインを含むペプチドCC2-LZとの相互作用を妨げる。
【図8】HTRFアッセイの最適化。
【発明を実施するための形態】
【0022】
本発明によると、用語「領域」と「ドメイン」は交換可能である。NEMOのCC2及びLZ領域(又はドメイン)は、上記のとおりである。
【0023】
好ましくは、P1は、配列番号17のペプチドsp CC2-LZ、配列番号19のペプチドspCC2-LZ、配列番号1のマウスNEMOタンパク質、配列番号2のヒトNEMOタンパク質、配列番号28のビオチン標識CC2-LZペプチド、配列番号29のビオチン標識ヒト化CC2-LZペプチド、配列番号30の6 his-タグ付加CC2-LZペプチド、及び配列番号31の6 his-タグ付加ヒト化CC2-LZペプチドからなる群より選択される。
好ましくは、P2は、配列番号1、配列番号2、配列番号6〜12、配列番号17〜19、配列番号28〜31の配列のペプチドからなる群より選択される。
本発明による方法で用いられるペプチドは、特許出願WO 2005/027959及びAgouら, 2004bに記載されるようにして合成できる。
【0024】
接頭辞「sp」(合成ポリペプチド)とは、該ペプチドが合成であり、例えばペプチド(例えばspCC2)を、NEMOタンパク質の対応する領域(例えばCC2領域)と区別するために用い得る。しかし、ペプチドとspペプチドとは同じ物質のことをいう。
さらに、正確さを欠いて、異なるペプチドは、マウスNEMOタンパク質とヒトNEMOタンパク質に関係なく関連する。
【0025】
好ましくは、上記のK63-連結ポリユビキチン化分子は、K63-連結ポリユビキチン鎖、例えばK63Ub2-7 (Boston Biochem, Inc)、K63-連結ポリユビキチン鎖に結合したタンパク質、例えばポリユビキチン化タンパク質RIP1 (受容体共役タンパク質キナーゼ1) (Eaら, 2006)、及びK63-連結ポリユビキチン化タンパク質を含む細胞抽出物、例えばTNF-αで予め刺激されたJM4.5.2細胞からの細胞抽出物からなる群より選択される。
【0026】
上記の方法の好ましい実施形態において、上記のペプチドP1は、固体担体上に固定化される。好ましくは、上記の固体担体は、磁気ビーズからなる。有利には、ペプチドP1はビオチニル基に結合し、ストレプトアビジン磁気ビーズ上に固定化される。
【0027】
好ましくは、工程(c)及び(d)のシグナルは、ウェスタンブロット、蛍光異方性、蛍光共鳴エネルギー転移(FRET)、又は均一系時間分解蛍光(HTRF)により測定される。
【0028】
上記の方法の好ましい実施形態において、上記のペプチドP1は標識されず、上記のペプチドP2は蛍光マーカーM1で標識される。
好ましくは、上記のマーカーM1は、緑色蛍光タンパク質(GFP)、シアン蛍光タンパク質、黄色蛍光タンパク質、及びマレイミド基を含む蛍光団からなる群より選択される。蛍光マーカーのその他の例は、Shanerら(Nat. Biotech., 2004, 22, 1567)に記載される。用い得るその他の蛍光団は、CFP/ds Red及び/又はGFP/ds Red (Ericksonら, Biophys J., 2003, 85, 599〜611)、並びにオレンジタイプのシアン変異形(Karawawaら, Biochem J., 2004, 381(Pt1), 307〜12)を含む。マレイミド基を含む蛍光マーカーの例は、Bodipy (登録商標) FL N-(2-アミノエチル)マレイミド蛍光団(Molecular Probe)である。
【0029】
好ましくは、上記の標識ペプチドP2は、配列番号4、5及び13〜16の配列のペプチドからなる群より選択される。
【0030】
上記の方法のさらに別の好ましい実施形態において、上記のペプチドP1はマーカーM2で標識され、上記のペプチドP2はマーカーM3で標識され、M2とM3は蛍光団供与体と蛍光団受容体の対である。
蛍光団供与体-蛍光団受容体の対の例は、ユーロピウムクリプテート-XL665 (Cis-Bio)の対、及びCy5/5 (GE Healthcare)-BHQ3 (Biosearch Technologies)の対である。
【0031】
好ましくは、ハイブリッド構築物は、ペプチドP1及び/又はP2が直接、又はリンカー分子(例えば短いペプチド)を介して蛍光タンパク質に連結されるように用いられる。連結は、好ましくは付加された連結がP1とP2との結合に干渉しないことを条件として、ペプチドのN-末端又はC-末端で生じ得る。
【0032】
P1と、P2へのその結合を調節(活性化又は阻害)する物質との相互作用は、例えば、FRET法を用いて、2つの異なるマーカー(蛍光団供与体及び蛍光団受容体)の近接に起因する蛍光団受容体の蛍光発光の直接測定により検出できる。物質Sの非存在下での蛍光団受容体の蛍光発光と比較した物質Sの存在下での蛍光団受容体の蛍光発光の減少は、該物質SがP2へのP1の結合に干渉することを示す。よって、上記の蛍光発光の減少は、上記の物質SがP2へのP1の結合に干渉することを示し、上記の蛍光発光の増加は、上記の物質SがP2へのP1の結合を増強することを示す。
【0033】
有利には、M2は、第1タグと、第1タグに対して指向されかつ蛍光団供与体で標識された抗体とからなり、M3は、第2タグと、第2タグに対して指向されかつ蛍光団受容体で標識された抗体とからなり、これらの2つのタグは異なる。
好ましくは、マーカーM2の上記のタグはポリHis配列であり、マーカーM3の上記のタグはビオチンである。
【0034】
上記の方法のさらにより好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある活性化物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含む。
【0035】
上記の方法の別の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある阻害物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含む。
【0036】
ペプチドP2がK63-連結ポリユビキチン鎖を含むペプチドである場合、ペプチドP1は、有利には、NEMOのNLM領域の少なくとも10アミノ酸残基、好ましくは少なくとも21アミノ酸残基を含むペプチド、及びDR NLMを含むペプチドからなる群より選択される。好ましくは、上記のペプチドP1は、配列番号1、2、10、17〜19及び28〜31の配列のペプチドからなる群より選択される。
【0037】
よって、このような場合において、NF- κB経路活性化の可能性のあるモジュレーターの1次スクリーニングの方法は、以下の工程を含むことを特徴とする:
(a) (i) NEMOのNLM領域の少なくとも10アミノ酸残基、好ましくは少なくとも21アミノ酸残基を含むペプチド、及びDR NLMを含むペプチドからなる群より選択されるペプチドP1であって、標識されているか又はされていないペプチドP1と、(ii) K63-連結ポリユビキチン化鎖を含むペプチドP2であって、標識されているか又はされていないペプチドP2とを、試験される物質Sの非存在下で接触させ;
(b) 標識されているか又はされていない前記ペプチドP1と、標識されているか又はされていない前記ペプチドP2とを、試験される物質Sの存在下で接触させ;
(c) 工程(a)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(d) 工程(b)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する。
【0038】
好ましくは、上記のペプチドP1は、配列番号1、2、10、17〜19及び28〜31の配列のペプチドからなる群より選択される。
好ましくは、K63-連結ポリユビキチン化鎖を含むペプチドP2は、上記のように、固体担体に固定化される。
好ましくは、上記のペプチドP2は、上記のように蛍光マーカーM1で標識され、工程(c)及び(d)のシグナルは、上記のようにして測定される。
【0039】
上記の方法の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある活性化物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含む。
上記の方法の別の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある阻害物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含む。
【0040】
或いは、NF-κB経路活性化の可能性のあるモジュレーターの1次スクリーニング方法は、以下の工程を含む:
(a) NEMOのCC2領域とLZ領域とを含むペプチドP1を、試験される物質Sと接触させ、ここで上記のペプチドP1は蛍光団供与体であるマーカーM2と蛍光団受容体であるマーカーM3とで標識され、すなわち蛍光団供与体と蛍光団受容体との両方と結合し;
(b) 試験される物質Sの非存在下で蛍光発光を測定し;
(c) 試験される物質Sの存在下で蛍光発光を測定し;
(d) (b)で測定されたシグナルと、(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1ではない物質Sを選択する。
【0041】
好ましくは、工程(c)及び(d)における上記のシグナルは、上記のように、FRET又はHTRFにより測定される。
有利には、上記の蛍光団供与体はCC2領域のN-末端に結合し、蛍光団受容体はLZ領域のC-末端に結合する。
【0042】
上記の代替の方法の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある活性化物質であり、工程(d)は、(b)で測定されたシグナルと(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1未満の物質Sを選択することを含む。
上記の代替の方法の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある阻害物質であり、工程(d)は、(b)で測定されたシグナルと(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1より大きい物質Sを選択することを含む。
【0043】
或いは、NF-κB経路活性化の可能性のあるモジュレーターの1次スクリーニング方法は、以下の工程を含むことを特徴とする:
a) 本発明の第1の目的において定義されるペプチドP1とペプチドP2とを少なくとも発現する1又は複数のポリヌクレオチドで形質転換された、少なくとも1つの内在性NEMO欠損細胞を提供し;
b) 物質Sを、少なくとも1つの上記細胞に供し(apply);
c) P1とP2との複合体の形成を、物質Sの非存在下で適切なシグナルを測定することにより測定し;
d) P1とP2との複合体の形成を、物質Sの存在下で適切なシグナルを測定することにより測定し;
e) (c)で測定されたシグナル及び(d)で測定されたシグナル、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する。
【0044】
この代替法の好ましい実施形態において、P1は融合タンパク質GFP-NEMOであり、P2は融合タンパク質Flag-NEMOであり、ここで、Flagは親水性の8アミノ酸残基のペプチド(配列番号23)である。好ましくは、P1は配列番号27の配列で規定され、P2は配列番号25の配列で規定される。
【0045】
この代替法の別の好ましい実施形態において、工程(c)及びd)は:
c1) (又はd1)) 細胞を溶解させ、
c2) (又はd2)) GFP-NEMOに結合したか又はしていないFlag-NEMOを、Flag-NEMOのFlag部分に対して指向された抗体を用いて免疫沈降させ、
c3) (又はd3)) 免疫沈降されたFlag-NEMOに結合したGFP-NEMOのGFP部分の蛍光発光を検出する
ことを含む。
【0046】
上記の代替法の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある活性化物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含む。
上記の代替方法の別の好ましい実施形態において、上記の可能性のあるモジュレーターは、可能性のある阻害物質であり、工程(e)は、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含む。
【0047】
本発明の別の目的は:
a) 上記の本発明による可能性のある阻害物質の1次スクリーニングのいずれかの方法により、NF-κB経路活性化を阻害できる可能性がある物質Sを選択し;
b) NF-κB経路の活性化物質を、a)で選択した物質Sの非存在下又は存在下で、NF-κBにより誘導可能なプロモーターの制御下にレポーター遺伝子を含む細胞に供し;
c) レポーター遺伝子の発現を、物質Sの非存在下で適切なシグナルを測定することにより検出し;
d) レポーター遺伝子の発現を、物質Sの存在下で適切なシグナルを測定することにより検出し;
e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質を選択する
ことを含む、NF-κB経路活性化の阻害物質の2次スクリーニング方法である。
【0048】
好ましくは、工程c)で用いられるNF-κB経路の上記の活性化物質は、TNF-α、IL-1β、PMA、イオノマイシン及びサルモネラ・アボルタス(Salmonella abortus)からのLPSからなる群より選択される。
【0049】
レポーター遺伝子は、好ましくは、β-ガラクトシダーゼ酵素をコードするlacZ遺伝子、及びルシフェラーゼをコードするluc遺伝子からなる群より選択される。レポーター遺伝子は、好ましくは、SRE配列(血清応答配列;Serum Response Element)を含むプロモーターの制御下にある。このような構築物は、特許出願WO2005/027959及びAgouら, 2004bに記載される。
【0050】
2次スクリーニングについてのこの方法の好ましい実施形態において、上記の細胞は、Collection Nationale de Cultures de Microorganismes (C.N.C.M.)に2003年4月1日に番号I-3004の下で寄託された70Z/3-C3細胞である。
別の好ましい実施形態において、上記の細胞は、NF-κB経路についてのレポーター系を含むTリンパ球又はMEF細胞(マウス胚性繊維芽細胞;Murine embryonic Fibroblast)である。
【0051】
本発明による方法により選択されたNF-κB経路活性化の上記の阻害物質は、ERK及びp38経路活性化、NF-AT経路活性化及びAP1経路活性化を阻害しないNF-κB経路の特異的阻害物質であることが好ましい。
よって、2次スクリーニングの方法は、有利には、選択された阻害物質がERK及びp38経路、NF-AT経路並びにAP1経路に対して作用するかどうかを決定するさらなる工程を含む。上記の方法により選択される阻害物質は、ERK、p38、NF-AT及びAP1経路活性化を阻害しないものである。
【0052】
ERK及びp38経路、NF-AT経路並びにAP1経路の阻害をアッセイすることは、例えば、対応する経路により誘導可能なプロモーターの制御下に置かれたレポーター遺伝子を用いて行うことができる。レポーター遺伝子の例は、上記のとおりである。ERK及びp38経路、NFAT経路並びにAP1経路により誘導可能な構築物の例は、それぞれSRE-luc (Courtoisら, 1997, Mol. Cell. Biol, 17:1441〜1449)、NF-AT-luc及びAP1-luc (Northropら, 1993, J.Biol.Cell., 268:2917〜2923)である。レポーター遺伝子の発現は、例えば、PMA及びイオノマイシンにより刺激された、対応する構築物を含むような形質転換細胞を用いることによりアッセイされる。
【0053】
本発明の別の目的は:
a) 上記の本発明による可能性のある活性化物質の1次スクリーニングの方法により、NF-κB経路活性化を活性化できる可能性がある物質Sを選択し;
b) NF-κBにより誘導可能なプロモーターの制御下にレポーター遺伝子を含む細胞を提供し;
c) レポーター遺伝子の発現を、物質Sの非存在下で適切なシグナルを測定することにより検出し;
d) レポーター遺伝子の発現を、物質Sの存在下で適切なシグナルを測定することにより検出し;
e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質を選択する
ことを含む、NF-κB経路活性化の活性化物質の2次スクリーニング方法である。
【0054】
レポーター遺伝子は、好ましくは、β-ガラクトシダーゼ酵素をコードするlacZ遺伝子、及びルシフェラーゼをコードするluc遺伝子からなる群より選択される。レポーター遺伝子は、好ましくは、上記のSRE配列(血清応答配列)を含むプロモーターの制御下にある。
【0055】
この2次スクリーニング方法の好ましい実施形態において、上記の細胞は、Collection Nationale de Cultures de Microorganismes (C.N.C.M.)に2003年4月1日に番号I-3004の下で寄託された70Z/3-C3細胞である。
【0056】
本発明及びその多くの付随する利点は、以下の詳細な説明に関連する以下の図面を参照してより理解が深まるので、容易により完全に理解することができる。
【0057】
図1:ペプチドDR NLMによるNF-κB活性化の阻害。安定的にトランスフェクションされた70Z/3-C3細胞を、bodipyタグ付加アンテナペディア(BA) (黒三角)、BA-NLM (塗りつぶした丸)及びBA-DR NLM (塗りつぶした四角) (0〜10μM)と2時間インキュベートした後に、15μg/mlのLPSで4時間活性化した。NF-κB活性は、β-ガラクトシダーゼ(β-Gal)アッセイを用いて測定した。挿入図、LPS活性化あり(+)又はなし(-)で10μMのBA-NLM又はBA-DR NLMペプチドとともに又はなしで(w/o)のインキュベーションの後のNF-κB活性。B、70Z/C3細胞を、2時間、10μMのBA-NLM又はBA-DR NLMペプチドとともにインキュベートした。細胞を5時間、PMA又はIL-1とともに(+)又はなしで(-)処理した。NF-κB活性は、β-ガラクトシダーゼアッセイを用いて測定した。
【0058】
図2:ペプチドspCC2-LZへのペプチドBA-DR NLMのインビトロ結合。A、蛍光異方性を用いたBA-DR NLM:spCC2-LZ複合体の形成の分析。挿入図:蛍光異方性を用いたBR7-DR NLMとspCC2-LZとの複合体の形成の分析。B、蛍光異方性を用いる競合アッセイによるspCC2-LZへのBA-DR NLMの結合部位の決定。蛍光BA-DR NLM (10μM)をspCC2-LZ (30μM)とインキュベートして、BA-DR NLM:spCC2-LZ複合体を形成した。次いで、漸増濃度のA-NLM (白抜きの丸)及びアンテナペディア配列と融合したLZのC-末端部分(A-Cterm-LZ) (塗りつぶした四角)を加え、spCC2-LZと結合したBA-DR NLMを置き換えた。点線は、遊離のBA-DR NLMの異方性レベルを表す。
【0059】
図3:ペプチドDR NLMは、他のシグナル伝達経路に影響しない。AP1、Erk及びP38 MAPK経路並びにNFAT経路に対するBA-NLM及びBA-DR NLMの阻害効果。異なるレポータープラスミド(SRE-luc、AP1-luc、NFAT-luc)で一過的にトランスフェクションしたJurkat細胞を、5μMのBA-NLM又はBA-DR NLMとともに又はなしで(w/o) 2時間インキュベートし、次いで、5時間、擬似刺激(-)又はPMA (100 ng/ml)及びイオノマイシン(1μg/ml)で(+)刺激した。
【0060】
図4:ペプチドDR NLMは、内在性NEMOと相互作用する。A、DR NLMペプチドのタンパク質標的を同定する方法の概要。B、Flag-NEMO被覆ビーズの蛍光測定。Flag-NEMOを用いて安定的に再構成されたTリンパ球(JM4.5.2/Flag-NEMO)を、記載される蛍光ペプチドの非存在下(w/o)又はその存在下で2時間処理して、ペプチドの内部移行を可能にした。対照ペプチド(BA-LZ L322P/L329P)は、野生型NLMの配列を含む。いずれの過剰のペプチドを除去するための数回の細胞洗浄の後に、細胞を溶解させ、内在性Flag-NEMOを、抗Flag抗体を用いて沈降させた。NEMOに結合したペプチドの量は、次いで、蛍光により調べた(左上)。全ての試料を標準化するために、ビーズを被覆するNEMOの量を、抗NEMO抗体を用いてウェスタンブロッティングにより決定し(右上)、全ての試料を標準化するために用いた(下)。
【0061】
図5:NEMOオリゴマー形成に対する異なるペプチドの効果を調べるための細胞に基づくアッセイ(細胞ベースアッセイ)の概略図。
図6:DR NLMペプチドは、細胞においてNEMOオリゴマー形成を阻害しない。A、GFP-NEMOとFLAG-NEMOとのヘテロオリゴマー形成。B、C、GFP-NEMOとFlag-NEMOとで同時トランスフェクションされた293T細胞を、20μMのペプチドA-LZ、A-LZ L322P/L329P (B)、A-NLM又はA-DR NLM(C)を用いて2時間処理した。NEMOヘテロオリゴマーを、次いで、免疫精製し、ヘテロオリゴマーに結合した蛍光NEMOサブユニットの量を、実施例1.Iに記載されるようにして蛍光により調べた。
【0062】
図7:DR NLMは、細胞のポリユビキチン化タンパク質と、NEMOのCC2ドメイン及びLZドメインを含むペプチドCC2-LZとの相互作用を妨げる。A、ポリユビキチン化タンパク質のペプチドspCC2-LZへの相互作用を調べるための方法の概要。B、TNF-αによる刺激あり又はなしで、そしてペプチドBA-NLM又はBA-DR NLMあり(+)又はなし(-)での、ペプチドspCC2-LZに結合するポリユビキチン化タンパク質のウェスタンブロッティング。
【0063】
図8:HTRFアッセイの最適化。A、GST-Ub4の最適量の決定。Biot-CC2-LZ及びHis-CC2-LZ (それぞれ50 nM)を、結合バッファー(20 mM KPO4、100 mM KF及び0.1% BSA、pH 7)中で互いに混合し、次いで、抗-His-XL665 (7 nM)及びストレプトアビジン-EuK (2 nM)とインキュベートした。5分間のインキュベーションの後に、GST-Ub4を異なる濃度で加えた。FRETシグナルは、1時間のインキュベーションの後にモニターした。B、His-CC2-LZ及びBiot-CC2-LZの最適量の決定。化学量論比1対1のBiot-CC2-LZ及びHis-CC2-LZの合計量を結合バッファー中で一緒にインキュベートし、次いで、抗-His-XL665 (7 nM)、ストレプトアビジン-EuK (2nM)及びGST-Ub4 (250 nM)と混合した。FRETシグナルを、1時間のインキュベーションの後に記録した。C、蛍光シグナルに対するDMSOの影響。実験は、結合バッファー中のDMSOの異なる濃度を用いた以外は、250 nMのGST-UB4濃度を用いて、Aと同様であった。
【0064】
ここで、本発明者らにより企図される具体的な形態を実施例により記載する。以下の記載において、多数の具体的な詳細を、充分に理解するために記載する。しかし、本発明はこれらの具体的な詳細に限定されることなく行うことができることが、当業者に認識される。別の場合においては、記載を不要に不明瞭にしないように、公知の方法及び構造は記載しない。
【実施例】
【0065】
実施例1-材料及び方法
A.- 細胞培養、生物学的反応物及び抗体
エンドトキシン混入がないことを、細胞培養に用いたRPMI 1640培地(Invitrogen)及び胎児ウシ血清(Biowest)において確認した。Jurkat (クローン20)細胞を、10%胎児ウシ血清を補ったRPMI 1640中で維持した。安定な株化細胞(70Z/3-C3, C.N.C.M. I-3004)を、Agouら, 2004bに記載されるような、lacZレポーター遺伝子の上流のインターロイキン-2プロモーター中にNF-κB結合部位の3つのタンデムコピーを含有するcx12lacZ-κBプラスミドの存在下で70Z/3細胞をエレクトロポレーションした後に得た。これらは、10%胎児ウシ血清及び50μMのβ-メルカプトエタノール(Sigma)を補ったRPMI 1640で維持した。安定な株化細胞(JM4.5.2/Flag-NEMO)を、マウスFlag-NEMOの配列を含有するpcDNA3プラスミドの存在下でNEMO欠損Tリンパ球(JM4.5.2, Harhajら2000)をエレクトロポレーションした後に得た(Flagは、Sigmaにより提供される配列番号23の配列の親水性8アミノ酸ペプチドである)。これらのヒトJurkat白血病T細胞を、10%胎児ウシ血清を補ったRPMI 1640中で維持した。
【0066】
ヒト胚性腎臓株化細胞293T (American Type Culture Collection; Manassas, VA)を、100単位/mlのペニシリン及びストレプトマイシン(Invitrogen)並びに10%ウシ胎児血清を補ったDMEM培地(Invitrogen)で成長させた。サルモネラ・アボルタスからのLPS、ホルボール12-ミリステート13-アセテート(PMA)及びイオノマイシンはSigmaから購入し、組換えマウスIL-1βはBD Pharmingenから購入した。ポリクローナルウサギ抗-NEMO血清は、R.Weilから寄贈され、特異的抗体は免疫親和性により精製した。抗-GFPポリクローナル抗体はOncogeneからであった。抗-Flag M2モノクローナル抗体、及び抗-ユビキチン抗体は、Sigmaからであった。
【0067】
B.- ペプチド合成及び精製
ペプチドは、以前に記載されたようにして合成する(Agouら, 2004b)。ペプチドの配列は、国際特許W02005027959において既に報告され、それらのいくつかを以下の表Iに示す。
【0068】
【表1−1】

【0069】
【表1−2】

【0070】
【表1−3】

【0071】
【表1−4】

【0072】
C.- FACS分析の条件
ペプチドの内部移行は、国際出願WO 2005/027959に記載されるようにしてFACSにより分析する。
【0073】
D.- NF-κB阻害アッセイ
450μlの10% FCS-RPMI (Invitrogen)中の4.5×105個の70Z/3-C3細胞を、0〜20μMのペプチドBA-DR NLM又はBA-NLMとインキュベートした。37℃にて2時間の後に、200μlの細胞試料を、96ウェルマイクロタイタープレートに2重で移した。1つのウェルを4時間、15μg/ml LPS、20 ng/ml IL1-β又は100 ng/ml PMAのいずれかで処理した。対照のウェルは未処理のまま放置した。37℃にて4時間の後に、細胞を400×gにて5分間、室温にて遠心分離し、ペレットを冷PBS (200μl)で3回洗浄し、細胞を100μlの溶解バッファー(8 mM MgCl2、1 mMジチオエリスリトール、1% Triton X-100、15%グリセロール及びプロテアーゼ阻害物質混合物(Roche Applied Science, ref. 1836145)を含有する25 mM Tris-リン酸バッファーpH7.8)中で溶解した。溶解物を1000×gにて20分間、4℃にて遠心分離し、上清を氷上に保持した後に、β-ガラクトシダーゼアッセイを行った。β-ガラクトシダーゼアッセイは、50μlの上清に対して、4μlのGalacton-star化学発光基質及び196μlの反応バッファー(Clonetech)を含有するアッセイ混合物中で行った。活性は、プレートルミノメータ(Berthold)を用いて測定した。
【0074】
E.- その他のシグナル伝達経路の阻害アッセイ
Jurkat T細胞(クローン20)を、DEAE-デキストラン法により、ERK及びp38経路(SRE-luc; Courtoisら, 1997, Mol. Cell. Biol, 17:1441〜1449)、NF-AT経路又はAP1経路(それぞれNF-AT-luc及びAP1-luc; Northropら, 1993, J.Biol.Cell., 268:2917〜2923)により誘導可能なプロモーターの制御下のルシフェラーゼを含有するレポータープラスミドを用いて、一過的にトランスフェクションした。簡単に、細胞を洗浄し、107細胞/mlにて0.5 mg/mlのDEAE-デキストラン(Pharmacia)を含有するTBS中に再懸濁した。2.106細胞あたり1μgのレポータープラスミドを加えた。室温にて45分間の後に、細胞を10容量のTBSで希釈し、遠心分離し、106細胞/mlにて10% FCS-RPMI中に再懸濁した。24時間後に、細胞を、5μMのNEMO-由来ペプチド(BA-NLM又はBA-DR NLM)とともに又はなしで2時間インキュベートした。これらを、100 ng/ml PMA及び1μg/mlイオノマイシンを用いて5時間刺激したか又は擬似刺激し、最終的に、ルシフェラーゼバッファー(8 mM MgCl2、1 mM DTE、1% Triton X100、15%グリセロールを含有する25 mM Tris-リン酸pH 7.8)に溶解した。ルシフェラーゼ測定は、Bertholdルミノメータで行った。
【0075】
F.- 蛍光異方性
異方性測定は、励起及び発光のための偏光フィルタを備え、L形(L-configuration)の光電子増倍管を用いるQuantaMaster (登録商標)蛍光計(PTI)を用いて行った。全ての実験は、マイクロキュベット(60μl)内で22℃にて、495及び513 nmの励起及び発光波長で行った。励起及び発光波長の帯域は、それぞれ2及び4 nmであった。ミリ異方性(millianisotropy)単位として表される定常状態蛍光異方性を、Agouら, 2004aに記載されるようにして測定した。全ての測定は、20 mM KClを含有する20 mM等イオンバッファーpH 8 (10 mM酢酸、10 mM MES、20 mM Tris)中で行った。それぞれのデータ点は、2分間行った20記録(recording)の結果である。
【0076】
G.- 円偏光二色性分光法
遠-UV円偏光二色性(CD)測定を、Aviv 215分光偏光計を用いて、10 mM NaPO4、pH 7で希釈した試料を用いて行った。
【0077】
H.- Bodipy-コンジュゲートペプチドに結合したタンパク質の同定
5.106個のJM4.5.2/Flag-NEMO細胞を、6ウェルプレートに播種し(3 ml/ウェル)、20μMのBodipy-コンジュゲートペプチド(BA-NLM又はBA-DR NLM)とともに、37℃にて4時間インキュベートした。細胞を、400×gにて5分間遠心分離し、200μlの低張バッファー(10 mM TrisHCl pH 7.9、1.5 mM MgCl2、10 mM KCl)中に再懸濁し、氷上に20分間放置し、26Gの針を数回通過させることにより溶解した。溶解物を、15000×gにて20分間で澄明にし、合計で80μgのタンパク質を、40μlのアガロース抗-Flag M2ビーズと4℃にて1時間インキュベートした。Flag-NEMOタンパク質を、アガロース抗-Flag M2ビーズを用いて、1分間の遠心分離により沈降させた。ビーズを100μlの低張バッファーに再懸濁し、NEMO連結ペプチドの蛍光を、SAFASからのマイクロプレートリーダで読み取った。NEMO被覆ビーズを、ウェスタンブロッティングにより、抗-Flag M2モノクローナル抗体を用いて分析して、UN-SCAN-ITソフトウェアを用いて試料を標準化した。
【0078】
I.- 細胞でのNEMOオリゴマー形成の阻害
293T細胞に、FLAG-NEMOの配列を含有する2μgのプラスミドpcDNA3 (Invitrogen) (配列番号24の配列のpcDNA3-Flag-NEMO)と、GFP-NEMOの配列を含有する0.7μgのプラスミドpcDNA3(配列番号26の配列のpcDNA3-GFP-NEMO)とを、カルシウム-ホスフェート-DNA沈降法により一過的に同時トランスフェクションさせた。空のベクターを、6 cmのディッシュあたり4μgのDNAの合計量まで加える。トランスフェクションの24時間後に、細胞を再懸濁し、20μMのペプチド(A-NLM又はA-DR NLM)とともに又はなしで、37℃にて7時間インキュベートした。細胞を再懸濁し、PBSで2回洗浄して、過剰のペプチドを除去し、上記のプロテアーゼ阻害物質混合物(実施例1.D)を含有する150μlの溶解バッファー中で溶解した。溶解物は、15000×gで4℃にて20分間澄明にした。澄明にした溶解物中のタンパク質の量は、Bradford法により、キットDC Bioradを用いて測定する。100μgの合計タンパク質を、200μlの相互作用バッファー(50 mM TrisHCl pH 7.5、1% triton X100、1 mM DTE、300 mM NaCl)で希釈して、40μlのアガロース抗-Flag M2ビーズ(Sigma)とともに4℃にて1時間インキュベートした。オリゴマーFlag-NEMO/GFP-NEMOを、抗-Flag M2ビーズを用いて沈降させ、相互作用バッファーで2回洗浄した。GFP-NEMOの蛍光を、ビーズ上で直接、蛍光マイクロプレートリーダSAFASを用いて読み取り、澄明にした溶解物を、ウェスタンブロッティングにより、抗-Flag、抗-GFP及び抗-NDPK-B抗体を用いて分析して(Kraeftら, 1996; Exp Cell Res;227:63〜69)、結果を標準化した。
【0079】
J.- NEMOのCC2及びLZドメインを含むペプチドspCC2-LZに結合するポリユビキチン化タンパク質の同定
24.107個のJM4.5.2細胞を、10 ng/mlのTNFαで37℃にて10分間刺激するか又はせずに、冷PBSで2回洗浄し、実施例1.Dに記載されるプロテアーゼ阻害物質混合物を含有する900μlの溶解バッファー中で溶解した。溶解物を、15000×gで4℃にて30分間澄明にした。150μlのタンパク質を、20μMのペプチド(BA-NLM又はBA-DR NLM)とともに又はこれを用いずに10μgのビオチン化-CC2-LZと4℃にて1時間プレインキュベートした150μlのストレプトアビジン磁気ビーズ(MagPrep (登録商標), Novagen)と、4℃にて2時間インキュベートした。ビーズをバッファーA (10 mM Hepes pH 7.5、150 mM NaCl、8 mM MgCl2、10%グリセロール、0.1 mM DDM及び1 mM DTE)で4回洗浄し、6M尿素を含有する30μlのlaemmliバッファーに再懸濁した。試料を、ウェスタンブロッティングにより、抗ユビキチン抗体(Sigma)及びローディング対照について抗-NDPK-B抗体を用いて分析した。
【0080】
K.- ポリユビキチン化鎖との相互作用により誘導されるCC2-LZの二量体形成について競合する化合物の探索
均一系時間分解蛍光(HTRF (登録商標))アッセイ試薬、XL665で標識された抗-(His)6モノクローナル抗体(MABHis6-XL)、及びストレプトアビジン-ユーロピウムクリプテート(ストレプトアビジン-EuK)は、CIS-Bioから購入した。His-CC2-LZペプチド(配列番号30及び31)は、Agouら, 2004aに記載されるようにして精製し、ビオチンタグ付加CC2-LZペプチド(配列番号28及び29)は、Wylerら, 2007に記載されるようにして化学合成した。
【0081】
モノユビキチン鎖及びK63-連結ポリユビキチン鎖は、Boston Biochemから購入した。その末端でGSTタンパク質と融合する直鎖状テトラユビキチンをコードするcDNA は、Y. Dikicから寄贈された。GST-Ub4は、グルタチオンSepharose 4 Fast Flowを製造業者の使用説明(GE Healthcare)に従って用いて精製した。蛍光共鳴エネルギー転移(FRET)の全ての測定は、マイクロプレートリーダMithras LB 940 (Berthold Technologies)を用いて行った。
【0082】
HTRF (登録商標)の原理
HTRF実験において、純粋なHis-CC2-LZタンパク質を、抗-His-XL665 mAbにより標識し、biot-CC2-LZをストレプトアビジン-EuKにより標識した。His-CC2-LZ及びBiot-CC2-LZの二量体形成は、供与体(ストレプトアビジン-EuK)と受容体(抗-His-XL665)との近接を導く。ユーロピウムクリプテートを320 nmにて励起する際に、FRETが、これらの2つの蛍光団の間で発生し、XL665は、665 nmにて特異的長寿命蛍光を再び発光する。
【0083】
全ての実験は、黒色マイクロプレートGreiner (200μl)中で25℃にて行った。励起波長は320 nmであり、蛍光発光は620 nm及び665 nmにて測定して、特異的シグナルを標準化した。蛍光発光は、両方の波長で、50μsの遅延の後に記録し、これは、媒体及び遊離の受容体分子により導入されるバックグラウンドノイズを低減させる。FRETシグナルは、以下の等式を用いて算出される:
(1) ΔF = [(R−Rneg)/Rneg]* 100
式中、Rは、それぞれのアッセイについて算出された比([665 nmでの発光/620 nmでの発光]*10000)であり、Rnegは、陰性対照についての同じ比である(すなわち、His-CC2-LZの非存在下)。
【0084】
簡単に、His-CC2-LZ及びbiot-CC2-LZ (それぞれ50 nM)タンパク質を、100 mMフッ化カリウム及び0.1% BSAを含有する結合バッファー20 mMリン酸カリウムpH 7.0中で互いに混合した。インキュベーションの後に、ストレプトアビジン-EuK (供与体)及び抗体抗-His-XL665 (受容体)を、混合物にそれぞれ2 nM及び7 nMの濃度で加えた。陰性対照は、His-CC2-LZ (結合バッファーで置き換える)以外の上記の全ての成分が存在する混合物であった。これらの条件下で、バックグラウンドを超えるFRETシグナルは検出されなかった。
【0085】
実施例2 - DR NLMペプチドは、NEMOのオリゴマー形成ドメインにインビトロで結合する
円偏光二色性及びゲルろ過による以前の研究は、NLM及びDR NLMペプチドがオリゴマーのコイルドコイル構造を形成せず、100μMまでのペプチド濃度にて単量体として挙動することを示している(データ示さず)。そして、LZペプチドとは異なって、DR NLMペプチド及びNLMペプチドは、自己会合できない。LZペプチドの自己会合は、Agouら, 2004bに記載されている。
ここで、本発明者らは、プレ-B 70Z3リンパ球をホルボールエステル(PMA)、炎症誘発性サイトカイン(IL-1)及びエンドトキシン(LPS)で活性化した後に、DR NLMがNF-κB経路を阻害することを確認している(図1A及び1B)。これらの種々の刺激について測定されたIC50は、同様である(0.9μM +/- 0.1)。さらに、種々の内部移行ペプチド(Tat、アンテナペディア、R7、R9)を用いることにより、同様のIC50値が得られ、このことは、内部移行が、制限する工程でないことを示唆する。
【0086】
DR NLMがNEMOのMODに結合するかを分析するために、蛍光標識BA-DR NLM (10μM)を、漸増濃度のspCC2-LZとインキュベートし、複合体の形成を、蛍光偏光(P)によりモニターし、結果を、式A=2P/(3-P)に従う異方性(A)で表した。spCC2-LZの濃度は、アミノ酸分析により決定した(Vinoloら; 2006)。データ点は、結合等温式に適合させ、これは17μMの解離定数を与えた。挿入図、同じ実験をBR7-DR NLM (10μM)を用いて行い、これは同様の解離定数を与えた(KD = 21μM)。
【0087】
DR NLMは、17μMの親和性及び3:1の化学量論比の安定なMOD/ペプチド複合体を形成する(図2A)。このことは、DR NLMペプチドが、MODの三量体と優先的に相互作用することを示唆する。この相互作用は、細胞の透過性配列に依存しない。なぜなら、そのN-末端にアンテナペディアペプチド(BA-DR NLM)又はポリR7ペプチド(BR7-DR NLM)が融合したDR NLMは、同様の解離定数を示すからである(挿入図、図2A)。結合部位は、MODのいくつかの領域を模倣する種々のペプチドを用いて、蛍光偏光により位置決めされる(図2B)。この部位は、NEMOのLZサブドメインのC-末端部分(残基315〜336)に相当する。この部位は、以前に、点突然変異分析によりNEMO機能に必須であると決定された(Agouら, 2004a)。
【0088】
種々の型の細胞におけるDR NLMにより誘導されるNF-κB阻害の選択性を調べるこれらの研究は、ペプチドの最も魅力的な特性をとらえる。
実施例1.Eに記載される阻害アッセイの結果を、図3に示す。これらの結果は、NLM-DRが、PMAとイオノマイシンに応答して、Tリンパ球におけるAP1、ERK、p38及びNF-ATを含む少なくとも4つのその他の経路を妨げないことを示し、このことは、NLMペプチドではなくDR NLMペプチドが、NF-κB経路を特異的に阻害することを示す(図3)。
【0089】
実施例3 - DR NLMは、細胞においてNEMOと直接相互作用する。
DR NLMペプチドにより観察された阻害がNEMOとの直接の相互作用によるのかという疑問に対処するために、Flag-NEMOタンパク質の遺伝子を用いて(JM4.5.2/Flag-NEMO)実施例1.Aに記載されるようにして安定的に再構築されたNEMO欠損Tリンパ球(JM4.5.2株化細胞)を用いた。細胞を、BA-NLM-DR蛍光標識ペプチド(20μM)又は蛍光標識NLM対照(BA-LZ L322P/L329P)とともに4時間インキュベートした後に、細胞を溶解し、粗抽出物を、実施例1.Hに記載されるようなアガロースビーズと共有結合した抗-Flag抗体とインキュベートした(方法の概略について図4Aを参照)。ビーズの沈降の後に、ビーズに付着した蛍光を測定して(実施例1.H)、NEMOに結合したペプチドの量を分析した(図4A及び4B)。この分析結果を、抗-Flag M2モノクローナル抗体を用いるウェスタンブロッティングにより、それぞれの試料中のFlag-NEMOタンパク質の発現レベルに関して標準化した。図4Bは、DR NLMがNEMOに特異的に結合することを示し、このことは、経路の活性化を阻害する所定のペプチドの効果と、NEMOと相互作用するその能力との完全な相関関係を示す。
【0090】
実施例4 -DR NLMは、NEMOオリゴマー形成に干渉しない。
DR NLMペプチドによるNF-κB経路の阻害の分子的機構をよりよく分析するために、本発明者らは、実施例1.Iに記載されるような細胞内のNEMOオリゴマー形成を調べるアッセイを開発した(細胞ベースアッセイの概要について図5を参照)。このために、GFP-NEMO及びFlag-NEMO融合タンパク質をそれぞれ発現する2つのプラスミドを用いた。プラスミドをヒト293T細胞に同時トランスフェクションして、外在性GFP-NEMO及びFlag-NEMO融合タンパク質を過剰発現させ、NEMOオリゴマー形成を強制した。細胞を、次いで、洗剤での溶解に供し、Flag-NEMOタンパク質を、抗-Flagアガロースビーズ及びFlagペプチドを用いて実施例1.Iに記載されるようにして免疫精製した。ヘテロオリゴマー内のFlag-NEMOサブユニットとGFP-NEMOサブユニットとの会合に起因するビーズに付随する蛍光は、細胞抽出物中に存在するオリゴマーの量の評価を可能にする。GFP-NEMO単独の発現又はFlag-NEMO及びGFPタンパク質の同時発現を含む対照は、抗-Flagビーズに付随する蛍光を示さない(図6A)。
【0091】
BA-LZペプチドは、インビトロのNEMOオリゴマー形成を阻害する(Agouら, 2004b)。次いで、BA-LZを陽性対照として用いて、上記の蛍光細胞ベースアッセイの妥当性を確認した。このアッセイの条件下で、Bodipyの蛍光発光は、GFPの蛍光発光の測定に干渉しない。図6Bに示すように、BA-LZペプチド(20μM)とのインキュベーションは、蛍光NEMOサブユニットの量を大きく低減させ、このことは、BA-LZペプチドが細胞でのNEMOオリゴマー形成を阻害することを示す。これとは対照的に、コイルドコイル界面において二重変異を有する相同ペプチド(BA-LZ L322P/L329P)を用いるか、又は細胞をペプチドなしで処理する場合、より多量の蛍光NEMOサブユニットが回収された。興味深いことに、NEMOオリゴマーの形成は、変異ペプチド(BA-LZ L322P/L329P)の存否で等しく、このことは、NEMOオリゴマーの解離が、この変異ペプチドを用いて観察されなかったことを示す。
【0092】
この細胞に基づくアッセイを用いて、本発明者らは、ペプチドBA-DR NLMがNEMOオリゴマー形成を変化させる能力を調べた。図6Cは、BA-DR NLMがNEMOタンパク質に結合できる能力にもかかわらず、BA-DR NLM又はBA-NLMペプチド(20μM)の存在下又は非存在下で、NEMOオリゴマーが同じ量であることを示す。結論として、細胞での実験は、そのオリゴマー形成の状態に依存しないNEMO阻害の新しい機構を示す。
【0093】
実施例5 - DR NLMは、細胞において、CC2-LZタンパク質とポリユビキチン化タンパク質との相互作用を阻害する。
最近の報告は、NEMOがLys 63-連結ポリユビキチン化のセンサとしても作用することを示した(Eaら, 2006; Wuら, 2006)。よって、本発明者らは、DR NLMが、NEMOとK63ポリユビキチン鎖との相互作用を妨げるかについて調べた。このために、実施例1.Jに記載され、図7Aに示される、NEMOのCC2ドメイン及びLZドメインを含むペプチドを誘引として用いてポリユビキチン化タンパク質を沈降させる沈降アッセイを開発した。磁気ビーズを被覆するビオチン化-CC2-LZ (Bio-CC2-LZ)は、A-NLMペプチド又はA-DR NLM ペプチドの存在下又は非存在下で、TNFαで刺激したか又はしていないNEMO欠損Tリンパ球(JM4.5.2株化細胞)と同時インキュベートした。ビーズを充分に洗浄した後に、CC2-LZに結合した全てのモノユビキチン化タンパク質及びポリユビキチン化タンパク質を、ウェスタンブロットにより、抗ユビキチン抗体(Sigma)を用いて分析した。図7Bに示すように、DR NLMペプチドは、TNF-α依存的な様式で、細胞のポリユビキチン化タンパク質とのCC2-LZ相互作用をなくすが、NLMペプチドの存在下又は非存在下では阻害が観察されなかった。これらの結果は、ポリユビキチン化タンパク質とCC2-LZとの間の相互作用の著しい損失を示し、このことは、DRNLMペプチドがNF-κB経路を、NEMOとポリユビキチン化タンパク質との相互作用を遮断することにより阻害することを示す。相対的に、蛍光偏光を用いるインビトロ結合アッセイは、Lys63-連結ポリユビキチン鎖についてのタグフリーDR NLM の解離定数及び協同性指標(Hill係数) (KD= 250μM、n = 1)が、タグフリーNLM (KD = 180μM、n = 8)のものよりも低いことを示す。このことは、NEMOのNLMペプチドが、新しいユビキチン結合モチーフであり、モチーフでの単純な変異D→Rが、NEMOとポリユビキチン鎖との相互作用の完全な損失を導くことを示す。
【0094】
上記の、及び国際特許出願WO2005027959で以前に報告されたものと組み合わせた結果は、CC2ドメイン及びLZドメインを含むNEMOの領域が、オリゴマー形成ドメインとして、及びポリユビキチン鎖結合ドメインとして作用することを示す。NEMOドメインのこれらの二重の特性は、NEMOオリゴマー形成を破壊し、実施例1.11a)、b)及びc)に記載されるスクリーニングアッセイを用いるか、又はNEMOとポリユビキチン鎖との相互作用を破壊し、実施例1.12に記載されるスクリーニングアッセイを用いることにより、NF-κBシグナル伝達経路を阻害する新しい化合物を探索することを可能にする。
【0095】
実施例6 - CC2-LZオリゴマー形成に基づくスクリーニングアッセイ
A.- LZペプチド結合についてNEMOのCC2ドメイン及びLZドメインを含むペプチドCC2-LZと競合する化合物の探索
異方性測定は、SAFAS Xenius蛍光計を用いて行う。全ての実験は、黒色マイクロプレートGreiner (100μl)中で20℃にて、495及び515 nmの励起及び発光波長で行う。励起及び発光波長の帯域は8 nmである。R7-LZ Bodipy標識(BR7-LZ)及びR7-LZペプチドは表Iに示し、組換えHis-CC2-LZタンパク質は、Agouら, 2004bに記載されるようにして精製する。
【0096】
BR7-LZ (5μM)及びR7-LZ (20μM)を、25℃にて、標的His-CC2-LZ (10μM)とインキュベートして、50 mM KClを含有する100μlのTris/MESバッファー(10 mM酢酸、10 mM MES)、pH 8中で安定な複合体の形成を誘導する。蛍光ペプチドと同じ親和性を示す非蛍光ペプチドは、標的に連結されたペプチドの量を増大させる。これらの実験条件の下で、His-CC2-LZの添加は、遊離のR7-NLM-LZ*BR7-LZペプチド(77 mA)の異方性シグナルに関して20%の異方性の増大を導き、このことは、複合体His-CC2-LZ:BR7-LZの形成を示す。His-CC2-LZ/R7-LZ/BR7-LZ混合物を、次いで、薬剤候補化合物を含有する96ウェルプラスチックプレートに播種する。His-タグCC2-LZ標的からのペプチドの解離を反映する蛍光異方性を低減させるその能力についてヒットを選択する。
【0097】
B.- NEMOのCC2ドメイン及びLZドメインを含むペプチドCC2-LZ の不活性立体配座への立体配座転換を誘導する化合物の探索
このスクリーニングアッセイを開発するために、蛍光共鳴エネルギー転移法(FRET)を用いる。CC2-LZペプチドを、そのN-末端でCy5/5 (GE Healthcare)のような蛍光団供与体と、そしてそのC-末端でBHQ3 (Biosearch Technologies)のような蛍光団受容体とコンジュゲートさせる。二重にコンジュゲートされたCC2-LZを、試験される分子と接触させ、蛍光を測定する。蛍光発光の増大を誘導するヒットを選択する。
【0098】
C.- CC2-LZオリゴマー形成を阻害する化合物の探索
均一系時間分解蛍光(HTRF)に依拠するスクリーニングアッセイも、より高いスループットのために準備する。それぞれビオチン及び(His)6タグを認識するユーロピウム-クリプテート(蛍光団供与体)及びXL665 (蛍光団受容体)をコンジュゲートした抗体は、商業的に入手可能である(Cis-Bio inc.)。His-タグCC2-LZペプチドの精製は、Agouら, 2004bに記載される。ビオチンタグ付加CC2-LZペプチドは、化学的に合成するか、又はAviTag (Avidity, inc)のような組換え大腸菌(E.coli)株から精製する。この方法の主な利点は、手ごろであり、擬陽性の危険性が低減されることである。
【0099】
実施例7 - CC2ドメイン及びLZドメインのポリユビキチン結合特性に基づくスクリーニングアッセイ
A.- 1次スクリーニングアッセイ
第1工程において、K63連結ポリユビキチン鎖(K63Ub 2-7, Boston Biochem, Inc.)を、Ni-NTA HisSordプレート(96ウェルプレート、Qiagen, Inc)に固定化する。蛍光標識CC2-LZ (例えばB-CC2-LZ)又は蛍光NLMペプチド(例えばB-DR NLM)を加えて、K63ポリユビキチン鎖と蛍光タンパク質複合体を形成する。K63ポリユビキチン鎖に結合するCC2-LZ又はNLMと競合するヒットを陽性とみなして選択する。
【0100】
B.- 2次スクリーニングアッセイ
第2工程において、上記の1次スクリーニングに由来する全ての陽性ヒットを2次スクリーニングに供して、NF-κB阻害に対するそれらの影響を、WO2005027959特許に記載される細胞ベースアッセイを用いて調べる。
【0101】
用いた略称: BA-ペプチド、そのN-末端で細胞透過性配列アンテナペディアと融合し、かつbodipy蛍光団とコンジュゲートしたペプチド;A-ペプチド、アンテナペディアタグ付加ペプチド;R7-ペプチド、その末端で細胞透過性ポリカチオンペプチドRRRRRRRと融合したペプチド;Tat、配列YGRKKRRQRRRを含有する細胞透過性ペプチド;R9、9つのアルギニン残基を含有する細胞透過性カチオンペプチド;spCC2-LZ、合成ポリペプチドサブドメインCC2-LZ;DDM、ドデシルマルトシド;MES、モルホリノエタンスルホン酸;DTE、ジチオエリスリトール。
【0102】
実施例8 - ポリユビキチン鎖との相互作用により誘導されるCC2-LZ二量体形成について競合する化合物の探索
本発明者らは、設計されたアンキリン反復タンパク質(Designed Ankyrin Repeat Proteins;DARPins)に結合したCC2-LZ二量体(Wylerら, 2007)のよく特徴決定された複合体も用いた。これらの複合体は、CC2-LZ二量体に対してnMの親和性を示し、陽性タンパク質として用いた。このアッセイにおいて、His-タグ付加タンパク質CC2-LZを、His-タグ付加DARPin 1D5 (KD = 22 nM)又はHis-タグ付加DARPin 2F6 (KD = 8 nM)のいずれかで置き換えた。表IIに示すように、FRETシグナルは、1D5 (290%)及び2F6 (2749%) DARPinsを用いて観察され、このことは、nMタンパク質複合体を同定するためのFRETアッセイの効力を示す。
【0103】
【表2】

【0104】
(+)及び(-)で示すタンパク質試料の異なる組み合わせを用いて、アッセイにおいて蛍光共鳴エネルギー転移(FRET)を測定した。FRETのパーセンテージは、実施例1に記載するようにして算出した。
【0105】
CC2-LZ二量体形成の親和性は、DARPin:CC2-LZ複合体のものと比較して低い(KD = 22μM)ので、CC2-LZの各サブユニットをnM濃度でインキュベートしたときにFRETシグナルは観察されなかった(表IIを参照)。しかし、同じ混合物をGST-テトラユビキチンの存在下でインキュベートしたときに、FRETの特異的シグナルがモニターされ、このことは、テトラユビキチンの結合がCC2-LZ二量体の形成を誘導することを示唆する。同様の実験を、モノユビキチン又はGST単独を用いて行った。しかし、GST単独又はモノユビキチンのいずれを用いてもFRETシグナルは検出されず(図8及び表III)、このことは、FRETシグナルがCC2-LZ二量体とGST-テトラユビキチン鎖との特異的相互作用に起因することを示す。
【0106】
【表3】

【0107】
HTRFアッセイを最適化するために、本発明者らは、His-CC2-LZ、Biot-CC2-LZ及びGST-Ub4の種々の濃度も用いた。図8A及び8Bに示す結果は、HTRF実験における堅固で著しいFRETシグナルのための最適条件が、40 nM Biot-CC2-LZ、40 nM His-CC2-LZ及び250 nM GST- Ub4に相当することを示す。さらに、本発明者らは、5%までのDMSOの存在は、蛍光シグナルを妨げないことを示した(図8C)。
【0108】
結論として、本発明者らは、CC2-LZ二量体形成及び/又はCC2-LZ二量体のポリユビキチン鎖への特異的結合について競合する小分子を探索することを可能にする強力で堅固なFRETアッセイを開発した。
【0109】
【表4】

【0110】
【表5】

【0111】
【表6】

【0112】
【表7】

【0113】
【表8】

【特許請求の範囲】
【請求項1】
以下の工程:
(a) (i) NEMOのCC2領域とLZ領域とからなるペプチドP1であって、標識されているか又はされていないペプチドP1と、(ii) NEMOのLZ領域の少なくとも10アミノ酸残基を含むペプチド、NEMOのNLM領域の少なくとも10アミノ酸残基を含むペプチド、DR-NLMを含むペプチド、NEMOのCC2領域及びLZ領域を含むペプチド、NEMOのCC2領域の少なくとも10アミノ酸残基を含むペプチド、及びK63-連結ポリユビキチン化鎖を含むペプチドからなる群より選択される、標識されているか又はされていないペプチドP2とを、試験される物質Sの非存在下で接触させ;
(b) 標識されているか又はされていない前記ペプチドP1と、標識されているか又はされていない前記ペプチドP2とを、試験される物質Sの存在下で接触させ;
(c) 工程(a)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(d) 工程(b)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する
を含むことを特徴とする、NF-κB経路活性化の可能性のあるモジュレーターのインビトロ1次スクリーニング方法。
【請求項2】
P1が、配列番号1、2、17、19、28、29、30、31の配列のペプチドからなる群より選択されることを特徴とする請求項1に記載の方法。
【請求項3】
P2が、配列番号1、配列番号2、配列番号6〜12、配列番号17〜19、配列番号28〜31の配列のペプチドからなる群より選択されることを特徴とする請求項1又は2に記載の方法。
【請求項4】
前記ペプチドP1が、固体担体上に固定化されていることを特徴とする請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記ペプチドP1がビオチン基と結合し、前記固体担体がストレプトアビジンビーズからなることを特徴とする請求項4に記載の方法。
【請求項6】
工程(c)及び(d)のシグナルが、ウェスタンブロット、蛍光異方性、蛍光共鳴エネルギー転移(FRET)、又は均一系時間分解蛍光(HTRF)により測定されることを特徴とする請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記ペプチドP1が標識されておらず、前記ペプチドP2が蛍光マーカーM1で標識されていることを特徴とする請求項1〜6のいずれか1項に記載の方法。
【請求項8】
前記マーカーM1が、緑色蛍光タンパク質(GFP)、シアン蛍光タンパク質、黄色蛍光タンパク質及びマレイミド基を含む蛍光団からなる群より選択されることを特徴とする請求項7に記載の方法。
【請求項9】
前記マーカーM1で標識された前記ペプチドP2が、配列番号4、5及び13〜16の配列のペプチドからなる群より選択されることを特徴とする請求項7又は8に記載の方法。
【請求項10】
前記ペプチドP1がマーカーM2で標識され、前記ペプチドP2がマーカーM3で標識され、M2及びM3が蛍光団供与体及び蛍光団受容体の対であることを特徴とする請求項1〜6のいずれか1項に記載の方法。
【請求項11】
前記マーカーM2が、第1タグと、前記第1タグに対して指向されかつ蛍光団供与体で標識された抗体とからなり、前記マーカーM3が、第2タグと、前記第2タグに対して指向されかつ蛍光団受容体で標識された抗体とからなり、前記2つのタグが異なることを特徴とする請求項10に記載の方法。
【請求項12】
マーカーM2の前記タグがポリHis配列であり、マーカーM3の前記タグがビオチンであることを特徴とする請求項11に記載の方法。
【請求項13】
前記可能性のあるモジュレーターが、可能性のある活性化物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含むことを特徴とする請求項1〜12のいずれか1項に記載の方法。
【請求項14】
前記可能性のあるモジュレーターが、可能性のある阻害物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含むことを特徴とする請求項1〜12のいずれか1項に記載の方法。
【請求項15】
以下の工程:
(a) (i) NEMOのNLM領域の少なくとも10アミノ酸残基を含むペプチド、及びDR NLMを含むペプチドからなる群より選択されるペプチドP1であって、標識されているか又はされていないペプチドP1と、(ii) K63-連結ポリユビキチン鎖を含むペプチドP2であって、標識されているか又はされていないペプチドP2とを、試験される物質Sの非存在下で接触させ;
(b) 標識されているか又はされていない前記ペプチドP1と、標識されているか又はされていない前記ペプチドP2とを、試験される物質Sの存在下で接触させ;
(c) 工程(a)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(d) 工程(b)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する
を含むことを特徴とする、NF- κB経路活性化の可能性のあるモジュレーターの1次スクリーニング方法。
【請求項16】
前記ペプチドP1が、配列番号1、2、10及び17〜19の配列のペプチドからなる群より選択されることを特徴とする請求項15に記載の方法。
【請求項17】
K63-連結ポリユビキチン化鎖を含む前記ペプチドP2が、固体担体上に固定化されていることを特徴とする請求項1、15及び16のいずれか1項に記載の方法。
【請求項18】
前記可能性のあるモジュレーターが、可能性のある活性化物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含むことを特徴とする請求項15〜17のいずれか1項に記載の方法。
【請求項19】
前記可能性のあるモジュレーターが、可能性のある阻害物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含むことを特徴とする請求項15〜17のいずれか1項に記載の方法。
【請求項20】
以下の工程:
(a) NEMOのCC2領域とLZ領域とを含むペプチドP1を、試験される物質Sと接触させ、ここで前記ペプチドP1は蛍光団供与体であるマーカーM2と蛍光団受容体であるマーカーM3とで標識され;
(b) 試験される物質Sの非存在下で蛍光発光を測定し;
(c) 試験される物質Sの存在下で蛍光発光を測定し;
(d) (b)で測定されたシグナルと、(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1ではない物質Sを選択する
を含む、NF-κB経路活性化の可能性のあるモジュレーターの1次スクリーニング方法。
【請求項21】
前記ペプチドP1が、配列番号1、2、17、19、28、29、30、31の配列のペプチドからなる群より選択されることを特徴とする請求項20に記載の方法。
【請求項22】
前記蛍光団供与体M2がCC2ドメインのN-末端に結合し、前記蛍光団受容体M3がLZドメインのC-末端に結合することを特徴とする請求項20又は21に記載の方法。
【請求項23】
前記可能性のあるモジュレーターが、可能性のある活性化物質であり、工程(d)が、(b)で測定されたシグナルと(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1未満の物質Sを選択することを含むことを特徴とする請求項20〜22のいずれか1項に記載の方法。
【請求項24】
前記可能性のあるモジュレーターが、可能性のある阻害物質であり、工程(d)が、(b)で測定されたシグナルと(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1より大きい物質Sを選択することを含むことを特徴とする請求項20〜22のいずれか1項に記載の方法。
【請求項25】
以下の工程:
a) 請求項1〜3のいずれか1項で定義されるペプチドP1とペプチドP2とを少なくとも発現する1又は複数のポリヌクレオチドで形質転換された、少なくとも1つの内在性NEMO欠損細胞を提供し;
b) 物質Sを、少なくとも1つの前記細胞に供し;
c) P1とP2との複合体の形成を、物質Sの非存在下で測定し;
d) P1とP2との複合体の形成を、物質Sの存在下で測定し;
e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する
を含むことを特徴とする、NF-κB経路活性化の可能性のあるモジュレーターの1次スクリーニング方法。
【請求項26】
前記ペプチドP1が融合タンパク質GFP-NEMOであり、前記ペプチドP2が融合タンパク質Flag-NEMOであることを特徴とする請求項25に記載の方法。
【請求項27】
工程(c)及び(d)が:
c1) (又はd1)) 細胞を溶解させ、
c2) (又はd2)) GFP-NEMOに結合したか又はしていないFlag-NEMOを、Flag-NEMOのFlag部分に対して指向された抗体を用いて免疫沈降させ、
c3) (又はd3)) 免疫沈降されたFlag-NEMOに結合したGFP-NEMOのGFP部分の蛍光発光を検出する
ことを含むことを特徴とする請求項26に記載の方法。
【請求項28】
前記可能性のあるモジュレーターが、可能性のある活性化物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含むことを特徴とする請求項25〜27のいずれか1項に記載の方法。
【請求項29】
前記可能性のあるモジュレーターが、可能性のある阻害物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含むことを特徴とする請求項25〜27のいずれか1項に記載の方法。
【請求項30】
a) 請求項14、19、24及び29のいずれか1項に記載の方法により、NF-κB経路活性化を阻害できる可能性がある物質Sを選択し;
b) NF-κB経路の活性化物質を、a)で選択した物質Sの非存在下又は存在下で、NF-κBにより誘導可能なプロモーターの制御下にレポーター遺伝子を含む細胞に供し;
c) レポーター遺伝子の発現を、物質Sの非存在下で適切なシグナルを測定することにより検出し;
d) レポーター遺伝子の発現を、物質Sの存在下で適切なシグナルを測定することにより検出し;
e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(e)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質を選択する
ことを含む、NF-κB経路活性化の阻害物質の2次スクリーニング方法。
【請求項31】
a) 請求項13、18、23及び28のいずれか1項に記載の方法により、NF-κB経路活性化を活性化できる可能性がある物質Sを選択し;
b) NF-κBにより誘導可能なプロモーターの制御下にレポーター遺伝子を含む細胞を提供し;
c) レポーター遺伝子の発現を、物質Sの非存在下で適切なシグナルを測定することにより検出し;
d) レポーター遺伝子の発現を、物質Sの存在下で適切なシグナルを測定することにより検出し;
e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質を選択する
ことを含む、NF-κB経路活性化の活性化物質の2次スクリーニング方法。
【請求項32】
NF-κBの前記活性化物質が、TNF-α、IL-1β、PMA、イオノマイシン及びサルモネラ・アボルタスからのLPSからなる群より選択されることを特徴とする請求項30に記載の方法。
【請求項33】
前記レポーター遺伝子が、β-ガラクトシダーゼをコードするlacZ遺伝子、又はルシフェラーゼをコードするluc遺伝子であることを特徴とする請求項30〜32のいずれか1項に記載の方法。
【請求項34】
前記細胞が、Collection Nationale de Cultures de Microorganismes (C.N.C.M.)に2003年4月1日に番号I-3004の下で寄託された70Z/3-C3細胞であることを特徴とする請求項30〜33のいずれか1項に記載の方法。
【請求項1】
以下の工程:
(a) (i) NEMOのCC2領域とLZ領域とからなるペプチドP1であって、標識されているか又はされていないペプチドP1と、(ii) NEMOのLZ領域の少なくとも10アミノ酸残基を含むペプチド、NEMOのNLM領域の少なくとも10アミノ酸残基を含むペプチド、DR-NLMを含むペプチド、NEMOのCC2領域及びLZ領域を含むペプチド、NEMOのCC2領域の少なくとも10アミノ酸残基を含むペプチド、及びK63-連結ポリユビキチン化鎖を含むペプチドからなる群より選択される、標識されているか又はされていないペプチドP2とを、試験される物質Sの非存在下で接触させ;
(b) 標識されているか又はされていない前記ペプチドP1と、標識されているか又はされていない前記ペプチドP2とを、試験される物質Sの存在下で接触させ;
(c) 工程(a)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(d) 工程(b)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する
を含むことを特徴とする、NF-κB経路活性化の可能性のあるモジュレーターのインビトロ1次スクリーニング方法。
【請求項2】
P1が、配列番号1、2、17、19、28、29、30、31の配列のペプチドからなる群より選択されることを特徴とする請求項1に記載の方法。
【請求項3】
P2が、配列番号1、配列番号2、配列番号6〜12、配列番号17〜19、配列番号28〜31の配列のペプチドからなる群より選択されることを特徴とする請求項1又は2に記載の方法。
【請求項4】
前記ペプチドP1が、固体担体上に固定化されていることを特徴とする請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記ペプチドP1がビオチン基と結合し、前記固体担体がストレプトアビジンビーズからなることを特徴とする請求項4に記載の方法。
【請求項6】
工程(c)及び(d)のシグナルが、ウェスタンブロット、蛍光異方性、蛍光共鳴エネルギー転移(FRET)、又は均一系時間分解蛍光(HTRF)により測定されることを特徴とする請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記ペプチドP1が標識されておらず、前記ペプチドP2が蛍光マーカーM1で標識されていることを特徴とする請求項1〜6のいずれか1項に記載の方法。
【請求項8】
前記マーカーM1が、緑色蛍光タンパク質(GFP)、シアン蛍光タンパク質、黄色蛍光タンパク質及びマレイミド基を含む蛍光団からなる群より選択されることを特徴とする請求項7に記載の方法。
【請求項9】
前記マーカーM1で標識された前記ペプチドP2が、配列番号4、5及び13〜16の配列のペプチドからなる群より選択されることを特徴とする請求項7又は8に記載の方法。
【請求項10】
前記ペプチドP1がマーカーM2で標識され、前記ペプチドP2がマーカーM3で標識され、M2及びM3が蛍光団供与体及び蛍光団受容体の対であることを特徴とする請求項1〜6のいずれか1項に記載の方法。
【請求項11】
前記マーカーM2が、第1タグと、前記第1タグに対して指向されかつ蛍光団供与体で標識された抗体とからなり、前記マーカーM3が、第2タグと、前記第2タグに対して指向されかつ蛍光団受容体で標識された抗体とからなり、前記2つのタグが異なることを特徴とする請求項10に記載の方法。
【請求項12】
マーカーM2の前記タグがポリHis配列であり、マーカーM3の前記タグがビオチンであることを特徴とする請求項11に記載の方法。
【請求項13】
前記可能性のあるモジュレーターが、可能性のある活性化物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含むことを特徴とする請求項1〜12のいずれか1項に記載の方法。
【請求項14】
前記可能性のあるモジュレーターが、可能性のある阻害物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含むことを特徴とする請求項1〜12のいずれか1項に記載の方法。
【請求項15】
以下の工程:
(a) (i) NEMOのNLM領域の少なくとも10アミノ酸残基を含むペプチド、及びDR NLMを含むペプチドからなる群より選択されるペプチドP1であって、標識されているか又はされていないペプチドP1と、(ii) K63-連結ポリユビキチン鎖を含むペプチドP2であって、標識されているか又はされていないペプチドP2とを、試験される物質Sの非存在下で接触させ;
(b) 標識されているか又はされていない前記ペプチドP1と、標識されているか又はされていない前記ペプチドP2とを、試験される物質Sの存在下で接触させ;
(c) 工程(a)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(d) 工程(b)で得られたP1とP2との複合体を、適切なシグナルを測定することにより検出し;
(e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する
を含むことを特徴とする、NF- κB経路活性化の可能性のあるモジュレーターの1次スクリーニング方法。
【請求項16】
前記ペプチドP1が、配列番号1、2、10及び17〜19の配列のペプチドからなる群より選択されることを特徴とする請求項15に記載の方法。
【請求項17】
K63-連結ポリユビキチン化鎖を含む前記ペプチドP2が、固体担体上に固定化されていることを特徴とする請求項1、15及び16のいずれか1項に記載の方法。
【請求項18】
前記可能性のあるモジュレーターが、可能性のある活性化物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含むことを特徴とする請求項15〜17のいずれか1項に記載の方法。
【請求項19】
前記可能性のあるモジュレーターが、可能性のある阻害物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含むことを特徴とする請求項15〜17のいずれか1項に記載の方法。
【請求項20】
以下の工程:
(a) NEMOのCC2領域とLZ領域とを含むペプチドP1を、試験される物質Sと接触させ、ここで前記ペプチドP1は蛍光団供与体であるマーカーM2と蛍光団受容体であるマーカーM3とで標識され;
(b) 試験される物質Sの非存在下で蛍光発光を測定し;
(c) 試験される物質Sの存在下で蛍光発光を測定し;
(d) (b)で測定されたシグナルと、(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1ではない物質Sを選択する
を含む、NF-κB経路活性化の可能性のあるモジュレーターの1次スクリーニング方法。
【請求項21】
前記ペプチドP1が、配列番号1、2、17、19、28、29、30、31の配列のペプチドからなる群より選択されることを特徴とする請求項20に記載の方法。
【請求項22】
前記蛍光団供与体M2がCC2ドメインのN-末端に結合し、前記蛍光団受容体M3がLZドメインのC-末端に結合することを特徴とする請求項20又は21に記載の方法。
【請求項23】
前記可能性のあるモジュレーターが、可能性のある活性化物質であり、工程(d)が、(b)で測定されたシグナルと(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1未満の物質Sを選択することを含むことを特徴とする請求項20〜22のいずれか1項に記載の方法。
【請求項24】
前記可能性のあるモジュレーターが、可能性のある阻害物質であり、工程(d)が、(b)で測定されたシグナルと(c)で測定されたシグナルとを比較し、(b)で測定されたシグナル/(c)で測定されたシグナルの比が1より大きい物質Sを選択することを含むことを特徴とする請求項20〜22のいずれか1項に記載の方法。
【請求項25】
以下の工程:
a) 請求項1〜3のいずれか1項で定義されるペプチドP1とペプチドP2とを少なくとも発現する1又は複数のポリヌクレオチドで形質転換された、少なくとも1つの内在性NEMO欠損細胞を提供し;
b) 物質Sを、少なくとも1つの前記細胞に供し;
c) P1とP2との複合体の形成を、物質Sの非存在下で測定し;
d) P1とP2との複合体の形成を、物質Sの存在下で測定し;
e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1ではない物質Sを選択する
を含むことを特徴とする、NF-κB経路活性化の可能性のあるモジュレーターの1次スクリーニング方法。
【請求項26】
前記ペプチドP1が融合タンパク質GFP-NEMOであり、前記ペプチドP2が融合タンパク質Flag-NEMOであることを特徴とする請求項25に記載の方法。
【請求項27】
工程(c)及び(d)が:
c1) (又はd1)) 細胞を溶解させ、
c2) (又はd2)) GFP-NEMOに結合したか又はしていないFlag-NEMOを、Flag-NEMOのFlag部分に対して指向された抗体を用いて免疫沈降させ、
c3) (又はd3)) 免疫沈降されたFlag-NEMOに結合したGFP-NEMOのGFP部分の蛍光発光を検出する
ことを含むことを特徴とする請求項26に記載の方法。
【請求項28】
前記可能性のあるモジュレーターが、可能性のある活性化物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質Sを選択することを含むことを特徴とする請求項25〜27のいずれか1項に記載の方法。
【請求項29】
前記可能性のあるモジュレーターが、可能性のある阻害物質であり、工程(e)が、(c)で測定されたシグナルと(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質Sを選択することを含むことを特徴とする請求項25〜27のいずれか1項に記載の方法。
【請求項30】
a) 請求項14、19、24及び29のいずれか1項に記載の方法により、NF-κB経路活性化を阻害できる可能性がある物質Sを選択し;
b) NF-κB経路の活性化物質を、a)で選択した物質Sの非存在下又は存在下で、NF-κBにより誘導可能なプロモーターの制御下にレポーター遺伝子を含む細胞に供し;
c) レポーター遺伝子の発現を、物質Sの非存在下で適切なシグナルを測定することにより検出し;
d) レポーター遺伝子の発現を、物質Sの存在下で適切なシグナルを測定することにより検出し;
e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(e)で測定されたシグナル/(d)で測定されたシグナルの比が1より大きい物質を選択する
ことを含む、NF-κB経路活性化の阻害物質の2次スクリーニング方法。
【請求項31】
a) 請求項13、18、23及び28のいずれか1項に記載の方法により、NF-κB経路活性化を活性化できる可能性がある物質Sを選択し;
b) NF-κBにより誘導可能なプロモーターの制御下にレポーター遺伝子を含む細胞を提供し;
c) レポーター遺伝子の発現を、物質Sの非存在下で適切なシグナルを測定することにより検出し;
d) レポーター遺伝子の発現を、物質Sの存在下で適切なシグナルを測定することにより検出し;
e) (c)で測定されたシグナルと、(d)で測定されたシグナルとを比較し、(c)で測定されたシグナル/(d)で測定されたシグナルの比が1未満の物質を選択する
ことを含む、NF-κB経路活性化の活性化物質の2次スクリーニング方法。
【請求項32】
NF-κBの前記活性化物質が、TNF-α、IL-1β、PMA、イオノマイシン及びサルモネラ・アボルタスからのLPSからなる群より選択されることを特徴とする請求項30に記載の方法。
【請求項33】
前記レポーター遺伝子が、β-ガラクトシダーゼをコードするlacZ遺伝子、又はルシフェラーゼをコードするluc遺伝子であることを特徴とする請求項30〜32のいずれか1項に記載の方法。
【請求項34】
前記細胞が、Collection Nationale de Cultures de Microorganismes (C.N.C.M.)に2003年4月1日に番号I-3004の下で寄託された70Z/3-C3細胞であることを特徴とする請求項30〜33のいずれか1項に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2010−530970(P2010−530970A)
【公表日】平成22年9月16日(2010.9.16)
【国際特許分類】
【出願番号】特願2010−512810(P2010−512810)
【出願日】平成20年6月20日(2008.6.20)
【国際出願番号】PCT/IB2008/002633
【国際公開番号】WO2009/001222
【国際公開日】平成20年12月31日(2008.12.31)
【出願人】(501474748)インスティティ・パスツール (27)
【氏名又は名称原語表記】INSTITUT PASTEUR
【住所又は居所原語表記】28,rue du Docteur Roux,F−75724 Paris Cedex 15 FRANCE
【出願人】(502205846)サントル ナショナル ドゥ ラ ルシェルシュ シアンティフィク (154)
【Fターム(参考)】
【公表日】平成22年9月16日(2010.9.16)
【国際特許分類】
【出願日】平成20年6月20日(2008.6.20)
【国際出願番号】PCT/IB2008/002633
【国際公開番号】WO2009/001222
【国際公開日】平成20年12月31日(2008.12.31)
【出願人】(501474748)インスティティ・パスツール (27)
【氏名又は名称原語表記】INSTITUT PASTEUR
【住所又は居所原語表記】28,rue du Docteur Roux,F−75724 Paris Cedex 15 FRANCE
【出願人】(502205846)サントル ナショナル ドゥ ラ ルシェルシュ シアンティフィク (154)
【Fターム(参考)】
[ Back to top ]

