NK細胞増強化合物を使用する治療抗体の有効性を増大させる方法および組成物
【課題】 治療抗体の有効性を増大させるための方法および組成物を提供すること。
【解決手段】 有効性は、ADCC機序の増大により増強されることを見いだした。
【解決手段】 有効性は、ADCC機序の増大により増強されることを見いだした。
【発明の詳細な説明】
【技術分野】
【0001】
技術分野
本発明は、一般に、治療抗体の有効性を増大させるための方法および組成物に関し、より詳しくは、本発明は、阻害性受容体を遮断し、またはナチュラルキラー細胞の活性化受容体を刺激し、それによって哺乳動物対象におけるナチュラルキラー細胞の細胞毒性の増強を可能にし、ヒト対象における治療の有効性を、特にADCC機序の増大を通じて増強する化合物と組合わせた治療抗体の使用に関する。
【背景技術】
【0002】
背景技術
ヒトにおけるさまざまな治療法は治療抗体の使用に基づく。これらには、例えば、標的細胞、特にウイルス感染細胞、腫瘍細胞、または他の病原細胞など疾患細胞を枯渇させるように開発された治療抗体の使用を含む。かかる抗体は通常、ヒトIgG1またはIgG3Fc部分を伴うIgG種のモノクローナル抗体である。これらの抗体は、天然または組換え抗体でありうるが、しばしば「ヒト化」マウス抗体である(すなわち、さまざまな種の機能的ドメイン、通常、ヒトまたはヒト以外の霊長類起源のFcタンパク質、およびマウス起源の可変領域または相補性決定領域(CDR)を含んで成る)。あるいは、モノクローナル抗体は、ヒトIg遺伝子座を有するトランスジェニックマウスにおける免疫付与による、またはヒト細胞由来のcDNAライブラリーにより得られる完全にヒトのものでありうる。
【0003】
かかる治療抗体の特定の例がリツキシマブ(rituximab)(マブテラ(Mabthera)(登録商標)、リツキサン(Rituxan)(登録商標))であり、これはCD20を特異的に与えるマウス可変ドメインにつながっているヒトγ1およびκ定常領域により(したがって、ヒトIgG1Fcタンパク質により)生成されるキメラ抗CD20モノクローナル抗体である。過去数年間に、リツキシマブは、Bリンパ球増殖性悪性腫瘍、特に非ホジキンリンパ腫(NHL)に対する治療法を大幅に変えた。ヒト化IgG1抗体の他の例としては、B細胞悪性腫瘍の治療に使用されるアレムツズマブ(alemtuzumab)(キャンパス(Campath)−1H(登録商標))、および乳癌の治療に使用されるトラスツズマブ(trastuzumab)(ヘルセプチン(Herceptin)(登録商標))が挙げられる。開発中の治療抗体のさらなる例は、当該分野において開示されている。
【0004】
治療抗体の作用機序は依然として議論の余地がある。抗体の注入は、抗体によって特異的に認識される抗原を有する細胞の枯渇をもたらす。この枯渇は、少なくとも3つの機序、すなわち、抗体介在細胞の細胞毒性(ADCC)、補体依存性溶解、および抗体によって標的化される抗原を介して示されるシグナルによる腫瘍成長の直接抗腫瘍阻害によって介在されうる。
【0005】
これらの抗体は、特に腫瘍の治療のために、ヒト治療の新たなかつ有効な方法を示すが、つねに強力な効果を示すわけではない。例えば、リツキシマブは、単独または化学療法と併用して、低〜中間悪性度と高悪性度NHLの治療において有効であることが示されたが、低悪性度NHL患者の30%〜50%はリツキシマブに対する臨床反応を示さない。リンパ種細胞でのCD20発現のレベル、治療時の高い全身腫瘍組織量の存在、または低い血清リツキシマブ濃度により、一部の患者におけるリツキシマブの有効性の欠如が説明されうることが示されている。それでもなお、治療の失敗の実際の原因は、大部分が未知のままである。
【0006】
さらに、治療抗体の使用は、その投与が原因の副作用によって制限されうる。例えば、発熱、頭痛、悪心、低血圧、喘鳴、発疹、感染、およびその他多くのものなど副作用が患者には出現し、抗体が投与されうる可能な量または頻度を潜在的に制限しうる。
【0007】
したがって、治療抗体の有効性を増大させ、または副作用を誘発しにくい抗体の削減量を用いて治療効果を達成できることがきわめて興味深いと言える。本発明はこれらおよび他の必要に対処する。
【発明の概要】
【0008】
発明の開示
本発明は、治療抗体の有効性を増強する新たな方法を開示する。以下の理論によって限定されることなく、本方法を用いて達成された驚くべき結果は、治療抗体が注入されるとインビボでADCC機序を増強するその能力に由来すると考えられる。実際に、本発明は、治療抗体の有効性に関係した現在の問題を克服する新たな組成物および方法を提供する。本発明において、個体からのNK細胞は、例えば、NK細胞での阻害性受容体の阻害によって、NK細胞の活性化の欠如による乏しい治療mAb(モノクローナル抗体)介在ADCCを有することが示されている。好ましくは、ADCC機序の増大が、ナチュラルキラー細胞での阻害性受容体を遮断し、または活性化受容体を刺激する化合物の投与によって達成され、それによって哺乳動物対象におけるナチュラルキラー細胞の細胞毒性の増強を促進する。好ましくは、化合物は抗体またはそのフラグメントである。
【0009】
前記抗体または他の化合物は、NK細胞の阻害性受容体、例えば、キラー阻害性受容体(KIRまたはNKG2A/C)分子、または活性化受容体、例えば、NK細胞でのNKp30、NKp44、またはNKp46などNCRと反応し、それによって細胞の阻害を中和し、かつそのADCC活性を増大させうる。
【0010】
より具体的には、本発明は、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物、好ましくは、抗体、またはそのフラグメントが治療抗体とともに対象に同時投与される対象の治療方法を開示する。本発明者らは、ここで治療抗体の有効性が、かかる化合物、好ましくは、例えば、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激することによって、NK細胞の阻害を克服する抗体またはそのフラグメントの同時投与、例えば、同時注入によって大幅に増強されうることを明らかにする。
【0011】
本発明は、治療抗体および化合物、好ましくは、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する抗体またはそのフラグメントを含んで成る医薬組成物にも関する。本発明は、治療抗体および化合物、好ましくは、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する抗体またはそのフラグメントを含んで成るキットにも関する。
【0012】
本発明は、治療抗体による治療の有効性を増大させ、または治療抗体による治療にかけられる対象におけるADCCを増大させるために、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物、好ましくは、抗体またはそのフラグメントの使用にも関する。
【0013】
本発明は、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物、好ましくは、抗体またはそのフラグメント、および疾患を治療するための薬剤の調製のための治療抗体の使用にも関する。より詳しくは、疾患の治療は、標的細胞、好ましくは、ウイルス感染細胞、腫瘍細胞、または他の病原細胞など疾患細胞の枯渇を必要とする。好ましくは、疾患は癌、感染性または免疫疾患である。より好ましくは、疾患は、癌、自己免疫疾患、炎症性疾患、およびウイルス疾患より成る群から選択される。疾患は、移植片拒絶、より詳しくは、同種移植片拒絶、および移植片対宿主疾患(GVHD)にも関する。
【0014】
本発明は、治療抗体、例えば、Fcγ受容体、好ましくは、CD16(FcγRIIIa)によって結合される抗体の投与量を削減する方法をも含んで成る。例えば、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する治療抗体および化合物の同時投与は、使用される治療抗体の低い用量を可能にする。かかる抗体は、化合物の非存在下の推奨量の20%、30%、40%、50%、60%、70%、80%、90%、もしくはより低い用量で使用されうる。
【0015】
また、本発明は、治療抗体、例えば、CD16によって結合される抗体の治療有効削減量を決定するための方法を提供し、この方法は、i)第1の濃度の治療抗体を、標的細胞およびNK細胞と、かつNK細胞での阻害性受容体を遮断し、または活性化受容体を刺激する化合物の非存在下に同時インキュベートする工程と、ii)第2の低濃度の治療抗体を標的細胞、NK細胞と、NK細胞で阻害性受容体を遮断し、または活性化受容体を刺激する化合物の存在下に同時インキュベートする工程と、iii)工程ii)において確認された標的細胞の枯渇が、工程i)において確認された枯渇と同程度であるか決定する工程とを含んで成る。工程ii)が工程i)と同じく有効であることが確認される場合は、化合物および治療抗体の相対濃度が変動され、枯渇が確認され、所定の患者における使用に適する異なる条件、例えば、標的細胞枯渇の最大化、治療抗体の削減量、または化合物の削減量を、患者の特定の必要に応じて特定することができる。
【0016】
特定の態様においては、本発明はそれを必要とするヒト対象における疾患の治療方法を提供し、これはa)NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物を前記対象に投与する工程と、b)CD16によって結合されうる治療抗体を前記対象に投与する工程とを含んで成る。
【0017】
一実施形態においては、治療抗体および化合物は同時に対象に投与される。別の実施形態においては、化合物は治療抗体の投与の1週間以内、4日以内、3日以内、または同日(例えば、約24時間以内)に対象に投与される。別の実施形態においては、疾患は癌、感染性または免疫疾患である。
【0018】
一実施形態においては、方法はさらに、対象におけるNK細胞の活性または数が化合物の投与の前後に評価されるさらなる工程を含んで成る。別の実施形態においては、さらなる工程は、i)投与前に対象からNK細胞を得る工程と、ii)化合物の存在または非存在下に治療抗体によって認識される1つもしくはそれ以上の標的細胞の存在下にNK細胞をインキュベートする工程と、iii)標的細胞を枯渇させるNK細胞の能力に対する化合物の効果を評価する工程とを含み、化合物が標的細胞を枯渇させるNK細胞の能力を増強させる検出が、化合物が方法における使用に適切であり、方法が対象との使用に適切であることを示す。
【0019】
別の態様においては、本発明は、例えば、CD16によって結合されうる治療抗体、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物、および医薬的に許容可能な担体を含んで成る医薬組成物を提供する。別の態様においては、本発明は、例えば、CD16によって結合されうる治療抗体、およびNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する1つもしくはそれ以上の化合物を含んで成るキットを提供する。
【0020】
上記の方法、組成物、またはキットのいずれかについて、一実施形態においては、治療抗体はヒトIgG1またはIgG3Fc部分を有する。別の実施形態においては、化合物は抗体またはそのフラグメントである。別の実施形態においては、化合物はモノクローナル抗体またはそのフラグメントである。別の実施形態においては、治療抗体は放射性または毒性部分と抱合されていない。別の実施形態においては、化合物はNK細胞の阻害性受容体を阻害する。別の実施形態においては、化合物はNK細胞の活性化受容体を刺激する。別の実施形態においては、化合物はヒト、ヒト化、もしくはキメラ抗体、またはそのフラグメントである。一実施形態においては、治療抗体または化合物は、とりわけ、Fabフラグメント、Fab’2フラグメント、CDR、およびScFvなど抗体フラグメントまたはその誘導体でありうる。
【0021】
一実施形態においては、治療抗体はヒト、ヒト化もしくはキメラ抗体、またはそのフラグメントである。別の実施形態においては、治療抗体はリツキシマブまたはキャンパスである。別の実施形態においては、抗体はリツキシマブであり、前記抗体は1週間に375mg/m2未満の投与量で投与される。別の実施形態においては、抗体はキャンパスであり、抗体は1週間に90mg未満の投与量で投与される。
【0022】
一実施形態においては、化合物は、NKG2、KIR2DL、またはKIR3DLヒト受容体の少なくとも1つに結合し、NK細胞の細胞毒性の関連NKG2、KIR2DL−、またはKIR3DL介在阻害を阻害する。別の実施形態においては、化合物は、KIR2DL1、KIR2DL2/3、KIR2DL4、KIR2DL5A、KIR2DL5B、KIR3DL1、KIR3DL2、KIR3DL3、LILRB1、NKG2A、NKG2C NKG2E、およびLILRB5より成る群から選択されるNK細胞の阻害性受容体を遮断する。別の実施形態においては、化合物は、KIR2DLヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL介在阻害を阻害する。別の実施形態においては、化合物は、KIR2DL1、KIR2DL2、およびKIR2DL3ヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、およびKIR2DL3介在阻害を阻害する。別の実施形態においては、化合物は、80位でLys残基を有するHLA−C対立遺伝子分子のヒトKIR2DL1受容体への結合、および80位にAsn残基を有するHLA−C対立遺伝子分子のヒトKIR2DL2およびKIR2DL3受容体への結合を阻害する。別の実施形態においては、化合物は、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200と同じエピトープに結合する。別の実施形態においては、化合物は、ヒトNK細胞の表面でKIR受容体に結合するために、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200と競合する。別の実施形態においては、化合物は、ハイブリドーマDF200またはそのフラグメントによって生成されるモノクローナル抗体DF200である。
【0023】
一実施形態においては、化合物は、NKp30、NKp44、NKp46、およびNKG2Dより成る群から選択される受容体に結合する。別の実施形態においては、化合物は、AZ20、A76、Z25、Z231、およびBAB281より成る群から選択されるモノクローナル抗体に由来するかまたはモノクローナル抗体に競合する。
【0024】
別の態様においては、本発明は、治療抗体とともに投与するための化合物を選択する方法を提供し、前記方法は、i)NK細胞の阻害性受容体を阻害し、または活性化受容体を刺激する試験化合物を提供する工程と、ii)NK細胞の存在下、および試験化合物の存在または非存在下に、治療抗体によって特異的に認識される標的細胞で治療抗体をインキュベートする工程と、iii)標的細胞を枯渇させるNK細胞の能力に対する化合物の効果を評価する工程とを含んで成り、化合物が標的細胞を枯渇させるNK細胞の能力を増強させるという検出が、方法における使用に適切であることを示す。
【0025】
一実施形態においては、化合物は、標的細胞を50%、60%、70%、80%、90%、100%、200%、300%、400%、500%もしくはそれ以上破壊する治療抗体の能力を増強する。別の実施形態においては、化合物は、抗体、抗体フラグメント、モノクローナル抗体、モノクローナル抗体のフラグメント、ヒト化抗体、キメラ抗体、およびヒト抗体より成る群から選択される。別の実施形態においては、標的細胞は、癌細胞、ウイルス感染細胞、または自己免疫疾患の基礎を成す細胞である。別の実施形態においては、治療抗体はリツキシマブまたはキャンパスである。
【0026】
別の態様においては、本発明は、対象におけるCD16によって結合されうる治療抗体の投与を含む治療の有効性を増大させる方法を提供し、前記方法は、前記治療抗体の投与前、投与と同時、または投与後に、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物の治療有効量を前記対象に投与する工程を含んで成る。一実施形態においては、化合物は、前記対象におけるADCCを増強させることによって治療の有効性を増大させる。
【0027】
本発明は、治療抗体の有効性を増大させるための方法を提供する。本発明は、より具体的には、化合物、好ましくは、NK細胞の阻害性受容体を遮断し、または活性化受容体を活性化することによって、NK細胞を増強しうる、好ましくは、抗体またはそのフラグメントの使用が、治療抗体の有効性を顕著に増大させうることを開示する。実際に、本発明者らは、複数の治療抗体の有効性が、NK細胞受容体、例えば、阻害性受容体に対する抗体の同時投与によって大きく増強されうることを明らかにする。
【0028】
したがって、本発明は、それを必要とする対象における疾患の治療方法に関し、
a)化合物、好ましくは、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する抗体またはそのフラグメントを前記対象に投与する工程と、
b)前記対象に治療抗体を投与する工程と
を含んで成る。
【0029】
前記治療抗体は、NK細胞のCD16によって、好ましくは、そのFc領域により結合されうる。
【0030】
好ましくは、前記治療抗体は、ヒトIgG1またはIgG3Fc部分、特にモノクローナル抗体またはそのフラグメント、さらに好ましくは、ヒト化、ヒトもしくはキメラ抗体またはそのフラグメント、例えばリツキシマブを有する。
【0031】
NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントは、治療抗体の投与の前、投与と同時に、または投与の後に対象に投与されうることが意図されている。異なる抗体の投与の方法は、そのバイオアベイラビリティおよび薬物動態によって決まる。好ましくは、治療抗体は、NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントの投与の1週間以内、より好ましくは、5もしくは2日間以内に投与される。好ましくは、治療抗体は、NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントの前またはこれと同時に投与される。
【0032】
別の態様においては、本発明は、治療抗体治療を受ける対象におけるADCCを増大させる方法に関し、前記方法は、NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントのADCCを増大させるのに十分な量を前記治療抗体の投与の前、投与と同時に、または投与の後に前記対象に投与する工程を含んで成る。前記治療抗体は、NK細胞でCD16によって、好ましくは、そのFc領域によって結合されうる。好ましくは、前記治療抗体は、ヒトIgG1またはIgG3Fc部分、特にモノクローナル抗体またはそのフラグメント、さらに好ましくは、ヒト、ヒト化もしくはキメラ抗体またはそのフラグメント、例えばリツキシマブを有する。
【0033】
別の態様においては、本発明は、対象における治療抗体治療の有効性を増大させる方法に関し、前記方法は、前記治療抗体の有効性を増大させるのに十分なNK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントの量を前記治療抗体の投与の前、投与と同時に、または投与の後に前記対象に投与する工程を含んで成る。前記治療抗体は、CD16によって、好ましくは、そのFc領域によって結合されうる。好ましくは、前記治療抗体は、ヒトIgG1またはIgG3Fc部分、特にモノクローナル抗体またはそのフラグメント、さらに好ましくは、ヒト、ヒト化もしくはキメラ抗体またはそのフラグメント、例えばリツキシマブを有する。
【0034】
定義
本明細書で使用される以下の用語は、別段の規定がない限り、それらに割り当てられた意味を有する。
【0035】
本明細書で使用される、「NK」細胞は、非従来的な免疫に関与するリンパ球の下位集団を指す。NK細胞は、CD16、CD56および/またはCD57を含む特異的表面抗原の発現、細胞表面でのアルファ/ベータまたはガンマ/デルタTCR複合体の非存在、特異的細胞溶解酵素の活性化によって「自己」MHC/HLA抗原を発現できない細胞に結合し、かつこれを殺傷する能力、NK活性化受容体のリガンドを発現する腫瘍細胞または他の疾患を殺傷する能力、および免疫応答を刺激または阻害するサイトカインと呼ばれるタンパク質分子を放出する能力など一部の特性および生物学的特性に基づいて同定されうる。これらの特性および活性のいずれかを使用し、当該分野において公知の方法を使用してNK細胞を同定することができる。
【0036】
本明細書で使用される「抗体」という用語は、ポリクローナルおよびモノクローナル抗体を指す。重鎖における定常ドメインの種類によって、抗体は5つの主要なクラス、すなわち、IgA、IgD、IgE、IgG、およびIgMの1つに割り当てられる。これらの一部はさらに、IgG1、IgG2、IgG3、IgG4などのサブクラスまたはアイソタイプに分割される。典型的な免疫グロブリン(抗体)の構造単位は四量体を含んで成る。四量体は、2つの同一ペアのポリペプチド鎖から成り、各ペアは1つの「軽」鎖(約25kDa)および1つの「重」鎖(約50−70kDa)を有する。各鎖のN末端は、主に抗原認識に関与する約100〜110もしくはそれ以上のアミノ酸の可変領域を規定する。可変軽鎖(VL)および可変重鎖(VH)という用語は、それぞれこれらの軽鎖および重鎖を指す。免疫グロブリンの異なるクラスに対応する重鎖定常ドメインは、それぞれ「アルファ」、「デルタ」、「エプシロン」、「ガンマ」、および「ミュー」と呼ばれる。免疫グロブリンの異なるクラスのサブユニット構造および三次元構成は公知である。IgGおよび/またはIgMは本発明において使用される抗体の好ましいクラスであり、IgGが特に好ましいが、これらそれらが生理学的状況下に最も共通の抗体であるためであり、それらは実験室状況下で最も容易に作られるためであり、かつIgGはFcガンマ受容体によって特異的に認識されるためである。好ましくは、本発明の抗体はモノクローナル抗体である。特に好ましいのは、ヒト化、キメラ、ヒト、または他のヒトに適切な抗体である。
【0037】
本発明の枠内で、「治療抗体または抗体」という用語は、より具体的には、患者における標的細胞を枯渇させる働きをする抗体を指す。特に、治療抗体は、標的細胞の表面上に存在する抗原、例えば、腫瘍細胞上に主に、またはのみに存在する腫瘍特異的抗原に特異的に結合する。好ましくは、治療抗体はヒトFcタンパク質を含み、またはヒトFc受容体と相互作用する能力がある。治療抗体は、例えば、ADCCまたはその他の手段によって細胞を標的にすることができ、かつ「ネイキッド」すなわち抱合部分なしであり、または放射性ラベルまたは毒素などの化合物と抱合されうる。
【0038】
「特異的に結合する」という用語は、抗体が、好ましくは、競合結合アッセイにおいて、結合パートナー、例えば、NKp30、NKp44、またはNKp46など活性化NK受容体、もしくはヒトFcガンマ受容体に結合しうることを意味するが、これはタンパク質の組換え形態、その中のエピトープ、または単離NKもしくは関連標的細胞の表面上に存在する天然タンパク質のいずれかを使用して評価される。特異的結合を測定するための競合結合アッセイおよび他の方法は、さらに以下に記載されており、当該分野において公知である。
【0039】
「ヒトに適切な」抗体は、例えば、本明細書に記載された治療方法のためにヒトにおいて安全に使用されうる抗体、誘導体化抗体、または抗体フラグメントを指す。ヒトに適切な抗体としては、抗体の少なくとも一部がヒト由来であり、またはその他の場合に天然のヒト以外の抗体が使用される場合に誘発される免疫応答を回避するために修飾される、すべての種類のヒト化、キメラ、もしくは完全にヒト抗体、または任意の抗体が挙げられる。
【0040】
「免疫原性フラグメント」によって、本明細書では、(i)前記フラグメントに結合する抗体および/または膜結合受容体およびそれに由来する突然変異体を含む前記フラグメントを含んで成る分子の形態に結合する抗体の生成、(ii)MHC分子および前記フラグメント由来のペプチドを含んで成る二分子複合体に反応するT細胞を含むT細胞反応の刺激、(iii)哺乳動物の免疫グロブリンをコード化する遺伝子を発現するバクテリオファージまたは細菌などトランスフェクト媒体の結合などの免疫応答を引き出すポリペプチドまたはペプチドフラグメントが意味される。あるいは、免疫原性フラグメントは、共有結合によって担体タンパク質に抱合されたペプチドフラグメント、そのアミノ酸配列に前記ペプチドフラグメントを含んで成るキメラ組換えポリペプチド構成物など上記の免疫応答を引き出す能力がある構成物も指し、かつ具体的には、その配列が前記フラグメントをコード化するタンパク質を含んで成るcDNAでトランスフェクトされた細胞を含む。
【0041】
本発明において、「ヒト化」抗体は、1つもしくはそれ以上のヒト免疫グロブリンの定常および可変枠組み領域が結合領域、例えば、動物の免疫グロブリンのCDRと融合される抗体を指す。かかるヒト化抗体は、結合領域がそれに由来するヒト以外の抗体の結合特異性を維持するが、ヒト以外の抗体に対する免疫反応を回避するようにデザインされている。
【0042】
「キメラ抗体」は、(a)定常領域、またはそのタンパク質が変化、置換、または交換され、抗原結合部位(可変領域)が異なるまたは変化クラスの定常領域、エフェクター機能および/または種、またはキメラ抗体に新しい特性を与える完全に異なる分子、例えば、酵素、毒素、ホルモン、成長因子、薬剤等につながり、または(b)可変領域、またはそのタンパク質が、異なるまたは変化抗原特異性を有する可変領域で変化、置換、または交換されている抗体分子である。本発明の好ましい実施形態においては、キメラ抗体は、いずれにせよ免疫グロブリンのFc領域、好ましくはヒトFc領域を維持し、それによって標的細胞の表面上でヒトFc受容体との相互作用を可能にする。
【0043】
本発明の枠内で、「増強」、「活性」、または「活性化」NK細胞は、生物学的に活性のNK細胞、より詳しくは、標的細胞を溶解する能力を有するNK細胞を指す。例えば、「活性」NK細胞は、NK活性化受容体リガンドを発現し、「自己」MHC/HLA抗原(KIR不適合細胞)を発現できない細胞を殺傷することができる。リダイレクト・キリング・アッセイ(redirected killing assay)における使用に適した標的細胞の例は、P815細胞およびK562細胞であるが、多くの細胞型のいずれかを使用することができ、これらは当該分野において公知である(例えば、シボリ(Sivori)ら(1997年)、J.Exp.Med.186、p.1129−1136、ビターレ(Vitale)ら(1998年)、J.Exp.Med.187、p.2065−2072、ペッシーノ(Pessino)ら(1998年)、J.Exp.Med.188、p.953−960、ネリ(Neri)ら(2001年)、Clin.Diag.Lab.Immun.8、p.1131−1135を参照)。「増強」、「活性」、または「活性化」細胞は、遊離細胞内カルシウムレベルにおけるサイトカイン(例えば、INF−γおよびTNF−α)産生など、NK活性と関係がある当該分野において周知の他の特性または活性によっても同定されうる。本発明において、「増強」、「活性」、または「活性化」NK細胞は、特に、阻害性受容体の刺激によって阻害されない、またはかかる阻害が、例えば、活性化受容体の刺激によって克服されているインビボでのNK細胞を指す。
【0044】
本明細書で使用される、「活性化NK受容体」という用語は、刺激されると、遊離細胞内カルシウムレベルにおけるサイトカイン(例えば、INF−γおよびTNF−α)産生などNK活性と関係がある当該分野において周知の他の特性または活性の測定可能な増大を引き起こし、かつ遊離細胞内カルシウムレベル、例えば、本明細書で別記されているリダイレクト・キリング・アッセイにおいて細胞に標的する能力、またはNK細胞増殖を刺激する能力を上げるNK細胞の表面上の分子を指す。「活性化KIR受容体」という用語は、NKp30、NKp44、NKp46、NKG2D、IL−12R、IL−15R、IL−18R、およびIL−21Rを含むが、これらに限定されない。本明細書で使用される「活性化NK受容体」という用語は、IL−2受容体(IL−2R)を除外する。NK細胞が活性か、または増殖性であるかどうかを判定する方法は、以下にさらに詳しく述べられており、当業者には公知である。
【0045】
本明細書で使用される、「阻害する」または「阻害」NK受容体」という用語は、刺激されると、サイトカイン(例えば、INF−γおよびTNF−α)産生などNK活性と関係がある当該分野において周知の他の特性または活性の測定可能な減少を引き起こし、かつ遊離細胞内カルシウムレベル、または例えば、本明細書で別記されているリダイレクト・キリング・アッセイにおいて標的細胞を溶解する能力を上げるNK細胞の表面上の分子を指す。かかる受容体の例としては、KIR2DL1、KIR2DL2/3、KIR2DL4、KIR2DL5A、KIR2DL5B、KIR3DL1、KIR3DL2、KIR3DL3、LILRB1、NKG2A、NKG2C NKG2E、およびLILRB5が挙げられる。NK細胞が活性かどうかを判定する方法は、以下にさらに詳しく述べられており、当業者には公知である。
【0046】
本発明において「NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する」という用語は、好ましくは、少なくとも1つの阻害または活性化NK細胞受容体、例えば、KIR、NKG2A/C、NKp30、NKp44、NKp46、および本明細書でリストアップされている他のものと直接相互作用し、かつ受容体の阻害シグナルを中和し(阻害性受容体の場合)、または受容体からのシグナル伝達を刺激する(活性化受容体の場合)一部の化合物、好ましくは、抗体、そのフラグメント、または誘導体の能力を指す。阻害性受容体により、好ましくは化合物、好ましくは抗体またはそのフラグメントが、HLAと受容体との間の相互作用を遮断することができる。化合物が抗体である場合、抗体はポリクローナル、または、好ましくは、モノクローナルでありうる。それらは、ハイブリドーマによって、または所望の可変または定常ドメインを発現するように改変された組換え細胞によって生成されうる。抗体は単鎖抗体、または抗原特異性および低ヒンジ領域またはその変形、例えばFabフラグメント、Fab’2フラグメント、CDR、およびScFvなどを保持する他の抗体誘導体でありうる。これらは、多機能抗体、組換え抗体、ヒト化抗体、またはその変形でありうる。
【0047】
本発明の枠内で、「共通の決定基」は、関連受容体の群、例えば、ヒトKIR2DL受容体群の一部のメンバーによって共有される決定基またはエピトープを指す。決定基またはエピトープは、前記メンバーによって共有されるペプチドフラグメントまたは立体構造エピトープを示しうる。特定の実施形態において、共通の決定基は、モノクローナル抗体DF200、NKVSF1、またはEB6によって認識されるエピトープを含んで成る。
【0048】
本発明の枠内で、共通の決定基に「結合する」抗体という用語は、特異性および/または親和性を有する前記決定基に結合し、例えば、実質的に、高い親和性または特異性で、ヒトNK細胞の表面において他の無関係のモチーフもしくは決定基または構造には結合することはない抗体を指す。より詳しくは、本発明によるモノクローナル抗体の前記決定基への結合は、前記抗体の別のエピトープまたは決定基への結合と区別されうる。
【0049】
NK細胞阻害性受容体に結合し、その刺激を防ぐことが可能な化合物、好ましくは抗体は、したがって「中和」または「阻害」化合物、好ましくは、それらが、少なくとも部分的に、NK細胞阻害性受容体、すなわち、KIRまたはNKG2A/C受容体によって介在される阻害シグナル伝達経路を遮断するという意味で、好ましくは抗体である。さらに重要なことには、この阻害活性は一部の種類のKIRまたはNKG2A/C受容体に関して表示されうるため、これらの化合物、好ましくは抗体は、さまざまな対象において高い効果とともに使用されうる。
【0050】
例えば、細胞、もしくは核酸、タンパク質、またはベクターに関連して使用される場合の「組換え」という用語は、細胞、核酸、タンパク質、またはベクターが異種の核酸もしくはタンパク質の導入、または天然の核酸またはタンパク質の変化によって修飾されていること、または細胞がこうして修飾された細胞由来であることを示す。したがって、例えば、組換え細胞は、細胞の天然の(非組換え)形態内には存在しない遺伝子を発現し、または、その他の場合には異常に発現し、過少発現し、またはまったく発現しない天然の遺伝子を発現する。
【0051】
本発明の枠内で、対象または患者は、哺乳動物の対象または患者、より好ましくは、ヒトの対象または患者を含む。
【0052】
治療抗体
本発明は、治療抗体とともにNK細胞増強化合物の使用に関する。多種多様の治療抗体を本発明において使用することができる。基本的に、「ネイキッド」または放射標識、毒素、もしくは他の部分で抱合されているかどうか、フラグメントか完全長であるかどうか、あるいは天然の抗体もしくは抗体の修飾誘導体であるかどうかに関係なくいかなる治療抗体も使用されうる。好ましくは、方法は、NK細胞活性が―必ずしも限定的ではないが―投与される治療抗体の有効性において役割を果たす治療の有効性を増強するために使用され、かつ好ましくは、抗体またはフラグメントは当然、ヒトFc領域、または、ヒトFc受容体、例えば、Fcガンマ受容体によって抗体の特異的認識を可能にする他のドメインを含み、または含むように修飾もされる。
【0053】
本化合物を使用し、治療抗体によって特異的に認識される抗原を発現する標的細胞を枯渇させる治療抗体の能力を増強させることができる。したがって、治療抗体によって標的されうる細胞によって少なくとも部分的に引き起こされ、または悪化される疾患または状態は、本明細書に記載された方法を使用することによって治療されうる。標的細胞の具体的な例としては、アレルギー、自己免疫疾患、同種反応等に関与する腫瘍細胞、ウイルス感染細胞、同種細胞、病的免疫担当細胞(例えば、Bリンパ球、Tリンパ球、抗原提示細胞等)、あるいは健康な細胞(例えば、抗血管新生治療法における内皮細胞)が挙げられる。本発明の枠内での最も好ましい標的細胞は、腫瘍細胞およびウイルス感染細胞である。治療抗体は、例えば、細胞毒性効果または細胞溶解を、特に抗体依存細胞介在細胞毒性(ADCC)によって介在しうる。
【0054】
ADCCは、その機能が、IgG感作抗原をFcγR保有細胞毒性細胞につなげ、かつ細胞活性化機構を始動させるIgGのFcタンパク質(FcγR)のための白血球受容体を必要とする。したがって、治療抗体は免疫複合体を形成する能力がある。例えば、免疫複合体は、治療抗体によってカバーされる腫瘍標的でありうる。より詳しくは、抗体はCD16によって、好ましくは、そのFc領域により結合されうる。治療抗体がCD16などFcγ受容体に結合するかどうかの判定は、適切なやり方によって、例えば、場合により支持体に固定される、組換え(recombantly)に生成されるCD16ポリペプチドまたはそのフラグメントへの結合を判定することによって、または例えば、CD16を発現することが知られ、または疑われる細胞への治療抗体の結合を判定することによって評価されうる。
【0055】
治療抗体はポリクローナル、または、好ましくは、モノクローナルでありうる。それらはハイブリドーマによって、または所望の可変およびは定常ドメインを発現するように改変された組換え細胞によって生成されうる。抗体は単鎖抗体、または抗原特異性および低ヒンジ領域またはその変形を保持する他の抗体誘導体でありうる。これらは多機能抗体、組換え抗体、ヒト化抗体、そのフラグメントまたは変形でありうる。前記フラグメントまたはその誘導体は、好ましくは、Fabフラグメント、Fab’2フラグメント、CDR、およびScFvから選択される。好ましくは、フラグメントは抗原結合フラグメントである。抗体フラグメントを含んで成る治療抗体としては、二重特異性抗体も挙げられるがこれに限定されず、適切な二重特異性抗体の一例は、CD16に特異的な抗原結合領域および腫瘍抗原に特異的な抗原結合領域を含んで成る。フラグメントを含んで成る他の抗体フォーマットとしては、単一ポリペプチド鎖上の2つの異なる抗体の結合領域を結合する組換え二重特異的抗体誘導体が挙げられ、これはBiTE(商標)とも呼ばれる(クファー(Kufer)Pら、TRENDS in Biotechnology 2004年、22(5)、p.238−244、およびボイエル(Baeuerle)ら、Current Opinion in Molecular Therpeitcs 2003年、5(4)、p.413−419、その開示は参照することにより本明細書に組込まれる)。
【0056】
治療抗体は一般に表面抗原、例えば、膜抗原に特異的である。最も好ましい治療抗体は、CD20、CD52、ErbB2(またはHER2/Neu)、CD33、CD22、CD25、MUC−1、CEA、KDR、αVβ3等、特にリンパ腫抗原(例えば、CD20)など腫瘍抗原(例えば、腫瘍細胞によって特異的に発現される分子)に特異的である。治療抗体は、好ましくは、ヒトまたはヒト以外の霊長類のIgG1またはIgG3Fc部分を有し、より好ましくは、ヒトIgG1部分を有する。
【0057】
一実施形態においては、抗体はADCC中にNK細胞と抗体の相互作用を増強するそのFcタンパク質における修飾を含みうる。かかる修飾治療抗体(「改変抗体」)は一般に、好ましくは、1つもしくはそれ以上のFcγRとの抗体の結合親和性を修飾するFc領域における修飾を含んで成る。1つもしくはそれ以上のFcγRとの修飾結合による抗体を修飾するための方法は当該分野において周知であり、例えば、その各々が参照することにより本明細書にその全体が組込まれる、PCT公開国際公開第2004/016750号パンフレット(国際出願PCT/US2003/025399号明細書)、国際公開第99/158572号パンフレット、国際公開第99/151642号パンフレット、国際公開第98/123289号パンフレット、国際公開第89/107142号パンフレット、国際公開第88/107089号パンフレット、および米国特許第5,843,597号明細書、および同第5,642,821号明細書を参照。
【0058】
関節リウマチを治療するために使用される、D2E7(ケンブリッジ・アンティボディ・テクノロジー・グループ(Cambridge Antibody Technology Group)、plc(英国(UK)、ケンブリッジ/BASF(ドイツ、ルートビヒスハーフェン(Ludwigshafen))、またはインフリキシマブ(Infliximab)(セントコール社(Centocor,Inc.)、ペンシルバニア州(PA)、マルバーン(Malvern)、クローン病および関節リウマチの治療に使用)など本明細書で識別された治療抗体、または国際特許出願PCT/US2003/025399号明細書(参照することにより本明細書にその全体が組込まれる)に開示された抗体は、上記および下記の出願において開示されているように修飾され、かかる抗体が通常使用される疾患の治療に使用されうる。一部の実施形態においては、本発明は、活性化FcγR、例えば、FcγRIIIに対する改変親和性、高低いずれかの親和性を有する改変抗体を提供する。一部の好ましい実施形態においては、FcγRに対する高い親和性を有する改変抗体が提供される。好ましくは、かかる修飾は改変Fc介在エフェクター機能も有する。
【0059】
Fc介在エフェクター機能に影響を及ぼす修飾は当該分野において公知である(例えば、参照することにより本明細書にその全体が組込まれる、米国特許第6,194,351号明細書を参照)。修飾されうるアミノ酸としては、プロリン329、プロリン331、およびリジン322が挙げられるが、これらに限定されない。プロリン329および/または331およびリジン322は、好ましくは、アラニンで差し替えられうるが、他のアミノ酸による代替も考えられる。参照することにより本明細書にその全体が組込まれる、国際公開第00/142072号パンフレットおよび米国特許第6,194,551号明細書を参照。
【0060】
したがって、Fc領域の修飾は、抗体Fc領域に存在するアミノ酸への1つもしくはそれ以上の改変を含んで成りうる。かかる改変は結果として改変抗体介在エフェクター機能、他のFc受容体(例えば、Fc活性化受容体)への改変結合、改変ADCC活性、改変Clq結合活性、改変補体依存細胞毒性活性、またはその組合せを有する抗体が生じうる。
【0061】
一実施形態においては、抗体は、FCGR3A(CD16、FCGR3、免疫グロブリンG Fc受容体III;IGFR3、IgGのFcフラグメントの受容体、低親和性IIIaとも呼ばれる;例えば、OMIM146740を参照)、FCGR2A(CD32、CDw32、IgGのFcフラグメントの受容体、低親和性IIa、FCG2、免疫グロブリンG Fc受容体IIとも呼ばれる;例えば、OMIM146790を参照);FCGR2B(CD32、IgGのFcフラグメントの受容体、低親和性IIb;FCGR2B、FC−γ−RIIBとも呼ばれる;例えば、OMIM604590を参照)、FCG1RA(CD64;IgGのFcフラグメントの受容体、高親和性Ia;IGFR1とも呼ばれる;例えば、OMIM146760を参照);IgGのFCGR1フラグメント、高親和性Ic、免疫グロブリンG Fc受容体IC、IGFRC;例えば、OMIM601503を参照);またはFCGR1B(CD64、IgGのFcフラグメントの受容体、高親和性Ib;免疫グロブリンG Fc受容体IB;IGFRBとも呼ばれる;例えば、OMIM601502を参照)などのFcガンマ受容体によって特異的に認識される。
【0062】
本発明の治療抗体の代表的な例は、リツキシマブ、アレムツズマブ、およびトラスツズマブである。かかる抗体は、ヒト対象における使用に承認されている臨床プロトコールに従って使用されうる。治療抗体のさらなる具体例としては、例えば、エプラツズマブ、バシリキシマブ、ダクリズマブ、セツキシマブ、ラベッツズマブ、セビルマブ、ツブリマブ、パリビズマブ、インフリキシマブ、オマリズマブ、エファリズマブ、ナタリズマブ、クレノリキシマブ等が挙げられる。場合により、NK細胞活性化受容体を刺激する化合物がサイトカインである場合、治療抗体はリツキシマブまたはヘルセプチン以外の抗体であり、または場合により抗CD20もしくは抗HER2/neu抗体以外の抗体である。本発明による使用に好ましい治療抗体の他の例としては、抗フェリティン抗体(米国特許公開第2002/0106324号明細書)、抗p140および抗sc5抗体(国際公開第02/50122号パンフレット)、および抗KIR(キラー阻害性受容体)抗体が挙げられ(KIR受容体は、キャリントン(Carrington)およびノーマン(Norman)、KIR遺伝子クラスター(The KIR Gene Cluster)、2003年5月3日、http://www.ncbi.nlm.nih.gov/booksで入手可能)、上記の文献の各々の開示は参照することにより本明細書に組込まれている。治療抗体の他の例は以下の表にリストアップされており、そのいずれか(およびその他)を本方法において使用されうる。それらが以下の表にリストアップされているか、本明細書で別記されているかどうかに関係なく、好ましくは、ADCCによって標的細胞を枯渇させうる抗体は、本方法から恩恵を受けることができ、以下の表1は、表中にリストアップされた抗体に関しても、リストアップされている抗体の標的または適応に関しても非網羅的であることが理解されるであろう。
【0063】
【表1】

【0064】
【表2】

【0065】
【表3】

【0066】
【表4】

【0067】
【表5】

【0068】
NK細胞活性調節化合物
NK細胞活性は、刺激および阻害シグナルを含む複雑な機序によって調節される。したがって、有効なNK細胞介在療法は、これらの細胞の刺激または阻害シグナルの中和によって達成されうる。NK細胞の阻害性受容体を遮断し、阻害し、または減少させる効果、またはNK細胞の活性化受容体の活性または発現を活性化し、または刺激し、またはさもなければ促進する効果を有する化合物が使用されうることが理解されるであろう。これにはNK細胞受容体に結合し、それらを直接阻害し、または刺激しうるサイトカインのほか、小分子、ポリペプチド、および抗体などの化合物が含まれる。受容体が遮断され、または刺激される機序は、本発明によって提供される利点には重要ではないことも理解されるであろう。例えば、化合物は活性化受容体の発現を増大させ、または阻害性受容体の発現を阻害し、化合物はリガンドと阻害性受容体との相互作用を阻止し、またはリガンドと活性化受容体との相互作用を増強し、または化合物は受容体に直接結合し、それらを阻害し(阻害性受容体の場合)、またはそれらを活性化し(活性化受容体の場合)うる。重要なパラメータは、化合物がインビボでその標的細胞を枯渇させる治療抗体の能力に対して有する効果である。
【0069】
NK細胞の表面上の阻害性受容体は、本化合物によって標的されうる。NK細胞は主要組織適合複合体(MHC)クラスI特異的阻害性受容体によってネガティブに調節される(ケレ(Kaerre)ら、1986年、エーレン(Oehlen)ら、1989年、その開示は参照することにより本明細書に組込まれる)。これら特異的な受容体は、主要組織適合複合体(MHC)クラスI分子またはHLAの多形決定基に結合し、ナチュラルキラー(NK)細胞溶解を阻害する。ヒトにおいては、キラーIg様受容体(KIR)と呼ばれる受容体のファミリーがHLAクラスI対立遺伝子を認識する。
【0070】
KIR2DL、KIR2DS、KIR3DL、およびKIR3DSを含むKIR受容体のいくつかの群がある。2つのIgドメイン(KIR2D)を有するKIR受容体は、HLA−Cアロタイプを識別する。すなわち、KIR2DL2(以前はp58.1と呼ばれる)または密接に関係した遺伝子産物KIR2DL3は群2HLA−Cアロタイプ(Cw1、3、7、および8)によって共有されるエピトープを認識するが、KIR2DL1(p58.2)は相互群1HLA−Cアロタイプ(Cw2、4、5、および6)によって共有されるエピトープを認識する。KIR2DL1による認識は、HLA−C対立遺伝子の80位でのLys残基の存在によって決定される。KIR2DL2およびKIR2DL3認識は、80位でのAsn残基の存在によって決定される。重要なことには、HLA−C対立遺伝子の大多数は、80位でAsnまたはLys残基のいずれかを有する。3つのIgドメイン、KIR3DL1(p70)を有する1つのKIRは、HLA−Bw4対立遺伝子によって共有されるエピトープを認識する。結局、3つのIgドメインKIR3DL2(p140)を有する分子のホモ二量体は、HLA−A3および−A11を認識する。
【0071】
KIRおよび他のクラスI阻害性受容体(モレッタ(Moretta)ら、1997年、バリアンテ(Valiante)ら、1997年、ラニエール(Lanier)、1998年、その開示は参照することにより本明細書に組込まれる)はNK細胞によって、所定の個別のNKレパートリーにおいて同時発現されうるが、単一のKIRを発現する細胞があり、したがって、対応するNK細胞は特異的クラスI対立遺伝子群を発現する細胞によってのみ遮断される。したがって、下記のとおり、阻害性受容体が標的される場合、本方法はしばしば複数の阻害性受容体を標的する化合物の投与を含み、それによって最大範囲のNK細胞に達する広範囲にわたる効果を確実にする。
【0072】
一部の実施形態においては、化合物、好ましくは、抗体またはそのフラグメントがNK細胞の阻害性受容体を遮断し、KIR2DL2、KIR2DL3、KIR2DL1、KIR3DL1、KIR3DL2、NKG2A、およびNKG2Cより成る群から選択される少なくとも1つの阻害性受容体の阻害シグナルを中和する。より好ましくは、NK細胞の阻害性受容体を遮断する化合物、抗体またはそのフラグメントは、好ましくは、KIR2DL2、KIR2DL3、および/またはKIR2DL1の阻害シグナルを中和する化合物、好ましくは、抗体またはそのフラグメントである。
【0073】
本発明は、NK細胞の異なる阻害性受容体を遮断する一部の化合物、好ましくは、抗体またはそのフラグメントの組合せの使用にも関する。好ましくは、NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントは、KIR2DL1、KIR2DL2、KIR2DL3、KIR3DL1、KIR3DL2、NKG2A、およびNKG2Cから選択される阻害性受容体に特異的であり、NK細胞の細胞毒性の関連KIR−またはNKG2A/C介在阻害を阻害することができる。例えば、NK細胞の阻害性受容体を遮断する化合物は、KIR2DL1に特異性を有する抗体、およびKIR2DL2および/またはKIR2DL3に特異性を有する別の抗体を含んで成りうる。より好ましくは、NK細胞の阻害性受容体を遮断する化合物の組合せは、NK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、およびKIR2DL3介在阻害を阻害することができる。他の実施形態においては、1つもしくはそれ以上の阻害性受容体を標的する1つもしくはそれ以上の化合物、および1つもしくはそれ以上の活性化受容体を標的する1つもしくはそれ以上の化合物の混合物を投与する。
【0074】
例えば、KIR2DL1に特異的なモノクローナル抗体は、KIR2DL1Cw4(または同様のもの)対立遺伝子を遮断することが示されている(モレッタら、1993年、その開示は参照することにより本明細書に組込まれる)。他の例では、KIR2DL2/3に対するモノクローナル抗体もKIR2DL2/3HLACw3(または同様のもの)対立遺伝子を遮断することが記載されている(モレッタら、1993年)。抗NKG2A抗体は、NKG2AとHLA−Eとの阻害相互作用を遮断することが示されている。
【0075】
所望により、抗体は、GL183(KIR2DL2、L3、イムノテック(Immunotech)(フランス)、およびベクトン・ディッキンソン(Beckton Dickinson)(米国)から入手可能)、EB6(KIR2DL1、イムノテック(フランス)、およびベクトン・ディッキンソン(米国)から入手可能)、AZ138(KIR3DL1、モレッタら、ジェノバ大学(Univ.Genova)(イタリア)から入手可能)、Q66(KIR3DL2、イムノテック(フランス)から入手可能)、Z270(NKG2A、イムノテック(フランス)から入手可能)、P25(NKG2A/C、モレッタら、ジェノバ大学(イタリア)から入手可能)、およびDX9、Z27(KIR3DL1、イムノテック(フランス)、およびベクトン・ディッキンソン(米国)から入手可能)より成る群から選択されうる。
【0076】
好ましい態様においては、本発明は、モノクローナル抗体、ならびにそのフラグメントおよび誘導体を使用し、前記抗体、フラグメント、または誘導体は、NK細胞の表面で一部のKIRまたはNKG2A/C受容体と交差反応し、その阻害シグナルを中和する。
【0077】
一実施形態においては、本発明は、ヒトKIR2DL受容体の共通の決定基に結合し、かつ対応する阻害経路を阻害するモノクローナル抗体を使用する。好ましくは、本発明は、ヒトNK細胞の表面でKIR2DL1およびKIR2DL2/3受容体に結合し、かつNK細胞の細胞毒性のKIR2DL1−およびKIR2DL2/3介在阻害を阻害するモノクローナル抗体を使用する。抗体は、HLA−c分子のKIR2DL1およびKIR2DL2/3受容体への結合を特異的に阻害する。より好ましくは、抗体は、インビボでNK細胞活性を促進する。KIR2DL1およびKID2DL3(またはKIR2DL2)は、HLA−Cアロタイプ、それぞれ群1HLA−Cアロタイプおよび群2HLA−Cアロタイプの大部分をカバーするために十分であるため、かかる抗体を使用し、大部分のヒト個体、通常、ヒト個体の約90%もしくはそれ以上において治療抗体の有効性を増大させることができる。かかる実施形態においては、2004年7月1日出願の「NK細胞活性を調節するための組成物および方法(Compositions and methods for regulating NK cell activity)」という名称のPCT特許出願第PCT/FR04/01702号明細書に記載された抗体のいずれかを本発明に従って使用されうるが、その開示は参照することにより本明細書に組込まれる。
【0078】
本発明の特定の目的において、NK細胞の阻害性受容体を遮断する抗体はモノクローナル抗体であり、ここで前記抗体はKIR2DLヒト受容体の共通の決定基に結合し、NK細胞の細胞毒性のKIR2DL介在阻害を阻害する。抗体は、より具体的には、それぞれハイブリドーマDF200およびNKVSF1によって生成されるモノクローナル抗体DF200またはNKVSF1と同じエピトープに結合し、かつ/またはヒトNK細胞の表面でKIR受容体に結合するために、それぞれハイブリドーマDF200およびNKVSF1によって生成されるモノクローナル抗体DF200またはNKVSF1と競合する。先に述べたように、抗体が前記抗体と結合のために競合するかどうかを判定する抗体、機能的アッセイ、およびアッセイの例は、PCT特許出願第PCT/FR04/01702号明細書に記載されている。
【0079】
具体的な実施形態において、モノクローナル抗体はハイブリドーマDF200によって生成されるモノクローナル抗体DF200である。別の実施形態においては、モノクローナル抗体はEB6であり、または抗体はモノクローナルEB6と同じエピトープに結合し、またはモノクローナル抗体EB6と結合のために競合する。他の実施形態においては、抗体は、抗体DF200またはEB6のいずれかのフラグメントまたは誘導体である。抗体DF200を生成するハイブリドーマは、識別番号「DF200」、登録番号CNCMI−3224、登録日2004年6月10日(Collection Nationale de Cultures de Microorganismes、パスツール研究所(Institut Pasteur)、25、Rue du Docteur Roux、F−75724 Paris Cedex 15(フランス))のCNCM菌株保存機関で寄託されている。抗体NKVSF1は、セロテック(Serotec)(セルジー・サン・クリストフ(Cergy Sainte−Christophe)(フランス))(カタログ参照番号MCA2243)から入手可能である。
【0080】
本発明の別の実施形態においては、治療抗体の有効性を増強するために使用される化合物は、NK細胞の活性化受容体を刺激する。任意の活性化受容体、例えば、NKp30(例えば、その開示が参照することによりその全体が本明細書に組込まれる、PCT国際公開第01/36630号パンフレットを参照)、NKp44(例えば、その開示が参照することによりその全体が本明細書に組込まれる、ビターレら(1998年)、J.Exp.Med.187、p.2065−2072を参照)、NKp46(例えば、その開示が参照することによりその全体が本明細書に組込まれる、シボリら(1997年)、J.Exp.Med.186、p.1129−1136、ペッシーノら(1998年)、J.Exp.Med.188、p.953−960を参照)、NKG2D(例えば、OMIM602893を参照)、IL−12R、IL−15R、IL−18R、IL−21R、または活性化KIR受容体、例えば、KIR2DS4受容体(キャリントンおよびノーマン、KIR遺伝子クラスター(The KIR Gene Cluster)、2003年5月3日、http://www.ncbi.nlm.nih.gov/booksで入手可能)、またはNK細胞の実質的なフラクションに存在する他の受容体を使用することができ、その活性化は、好ましくは、細胞が以前に阻害KIR受容体など阻害性受容体によって阻害されている場合でも、細胞の活性化または増殖をもたらす。化合物は、ポリペプチド、小分子、および抗体を含む分子的実体でありうる。典型的な化合物としては、活性化受容体と相互作用する天然、組換え、または合成リガンドを含むリガンドが挙げられる。例えば、NK細胞の活性化受容体を刺激する化合物は、IL−12受容体(IL−12R)と相互作用するIL−12、IL−15受容体(IL−15R)と相互作用するIL−15、IL−18受容体(IL−18R)と相互作用するIL−18、IL−21受容体(IL−21R)と相互作用するIL−21などのサイトカインでありうる。かかる化合物は、例えば、IL−12(リサーチ・ダイアグノスティックス(Research Diagnostics)、ニュージャージー州(NJ)、DI−212)、IL−15(リサーチ・ダイアグノスティックス、ニュージャージー州(NJ)、RDI−215)、IL−21(アサノ(Asano)ら、FEBS Lett.2002年、528、p.70−76)から周知である。好ましくは、NK細胞の活性化受容体を刺激する化合物は、IL−2以外の化合物である。NK細胞の活性化受容体を刺激する他の典型的な化合物は、NKp30、NKp44、NKp46、NKG2D、KIR2DS4、および他の活性化KIR受容体より成る群から選択されるNK細胞受容体に結合する抗体を含む。
【0081】
一部の好ましい実施形態においては、活性化受容体は、NK細胞に存在する天然細胞毒性受容体(NCR)、好ましくは、NKp30、NKp44、またはNKp46より成る群から選択されるNCRであり、かつ活性化受容体を刺激する化合物は、同じエピトープに結合し、またはAZ20、A76、Z25、Z231、およびBAB281より成る群から選択されるモノクローナル抗体のいずれかと結合のために競合する。
【0082】
本明細書に記載されたNK細胞受容体のいずれかへの化合物の結合は、さまざまな標準方法のいずれかを使用して検出されうる。例えば、比色ELISA型アッセイを、免疫沈降およびラジオイムノアッセイと同様に使用することができる。競合アッセイは、例えば、試験化合物をNK細胞受容体に結合することが周知の化合物と比較するために使用されうるが、ここで対照(例えば、NKp46に特異的に結合するBAB281)および試験化合物は混合(または予備吸着)され、エピトープ含有タンパク質、例えば、BAB28の場合には、NKp46を含有する試料に適用される。ELISA、ラジオイムノアッセイ、ウェスタンブロット法、およびBIACOREの使用に基づくプロトコールが、かかる単純な競合における使用に適しており、当該分野において公知である。
【0083】
NK細胞の細胞毒性のKIR−またはNKG2A/C介在阻害の阻害、またはNK細胞のNKp30、NKp44、NKp46、またはNKG2D介在活性化の刺激は、さまざまなアッセイまたは試験、例えば結合、細胞毒性、もしくは他の分子または細胞アッセイによって評価されうる。
【0084】
具体的な変形においては、阻害活性は、前記化合物、好ましくは、抗体の、それぞれHLA−CまたはHLA−E陽性標的でのKIRまたはNKG2A/C陽性NKクローンの溶解を再構成する能力によって示される。別の具体的な実施形態においては、化合物、好ましくは、抗体は、HLA−C分子のKIR2DL1およびKIR2DL3(または密接に関係したKIR2DL2)受容体への結合を阻害するものとして、さらに好ましくは、Cw1、Cw3、Cw7、およびCw8から選択されるHLA−C分子(または80位でAsn残基を有するHLA−c分子)のKIRSDL2/3への結合、およびCw2、Cw4、Cw5、およびCw6から選択されるHLA−C分子(または80位でLys残基を有するHLA−c分子)のKIR2DL1への結合を変化させるその能力として規定される。
【0085】
本発明の化合物、好ましくは、抗体の阻害または増強活性は、例えば、その開示が参照することにより本明細書に組込まれる、シボリら(1997年)、J.Exp.Med.186、p.1129−1136において記載されている細胞内遊離カルシウムに対するその効果によって、多くの方法のいずれかにおいて評価されうる。NK細胞活性も細胞ベースの細胞毒性アッセイ、例えば、その各々の全体の開示が参照することにより本明細書に組込まれる、シボリら(1997年)、J.Exp.Med.186、p.1129−1136、ビターレら(1998年)、J.Exp.Med.187、p.2065−2072、ペッシーノら(1998年)、J.Exp.Med.188、p.953−960、ネリら(2001年)、Clin.Diag.Lab.Immun.8、p.1131−1135、ペンデ(Pende)ら(1999年)、J.Exp.Med.190、p.1505−1516)に開示されている、P815、K562細胞、または適切な腫瘍細胞など標的細胞を殺傷するNK細胞を刺激する抗体の能力を評価するなど、クロム遊離の測定によって評価されうる。適切な細胞毒性アッセイは、本明細書の実施例の部でも示される。好ましい実施形態においては、抗体はNK細胞毒性における少なくとも10%の増強、好ましくは、NK細胞毒性における少なくとも40%または50%の増強、またはより好ましくは、NK細胞毒性における少なくとも70%の増強を引き起こす。
【0086】
NK細胞活性もサイトカイン放出アッセイを用いて検討されうるが、ここでNK細胞はNK細胞のサイトカイン産生(例えば、IFN−γおよびTNF−α産生)を刺激する抗体でインキュベートされる。典型的なプロトコールにおいては、PBMCからのIFN−γ産生は、細胞表面および細胞質内染色、および培養の4日後のフローサイトメトリーによる分析によって評価される。手短に言えば、ブレフェルジン(Brefeldin)A)(シグマ・アルドリッチ(Sigma Aldrich)が培養の最後の4時間に最終濃度5μg/mlで添加される。次いで、細胞は透過化前に抗CD3および抗CD56mAbでインキュベートし(IntraPrep)(商標)、ベックマン・コールター(Beckman Coulter)、PE抗IFN−γまたはPE−IgG1(ファルミンゲン(Pharmingen))で染色する。ポリクローナル活性化NK細胞からのGM−CSFおよびIFN−γ産生はELISAを使用して上清において測定される(GM−CSF:DuoSet ELISA、R&Dシステムズ(Systems)、ミネソタ州(MN)、ミネアポリス(Minneapolis)、IFN−γ:OptE1Aセット、ファルミンゲン)。
【0087】
好ましい実施形態においては、ヒトNK細胞を活性化する抗体の能力が評価されるが、ここで少なくともヒトNK細胞ならびにヒト以外のNK細胞を活性化する能力は、化合物が本発明における使用に適切であることを示す。特に、インビトロまたはインビボでNK細胞による適切な標的細胞の枯渇を方向づける治療抗体の能力を増強する化合物の能力が評価されうる。
【0088】
本発明の化合物、好ましくは、抗体は、部分的な阻害または刺激活性を示し、例えば、NK細胞の細胞毒性のKIR2DL介在阻害を部分的に削減し、またはNCRまたは他の受容体の任意の刺激レベルによりNK細胞を部分的に活性化しうる。最も好ましい化合物は、例えば、化合物の非存在下に細胞との比較において、細胞毒性アッセイで測定されるように、NK細胞の活性の少なくとも20%、好ましくは、少なくとも30%、40%、または50%、もしくはそれ以上、阻害(または、活性化受容体の場合には、刺激)することが可能である。化合物の非存在下に枯渇レベルに対して10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、400%、500%、1000%、もしくはそれ以上、標的細胞の枯渇の増大を提供しうる化合物も好ましい。あるいは、本発明の好ましい化合物、好ましくは、抗体は、適合もしくはHLA適合性または自己標的細胞集団、すなわち、前記抗原の非存在下にNK細胞によって有効に溶解される細胞集団の溶解を引き起こすことができる。したがって、本発明の化合物は、インビボでNK細胞活性を促進するものとしても規定されうる。
【0089】
本発明は、NK細胞の活性化受容体を刺激し、または好ましくは、その阻害性受容体を遮断する化合物が、Fabフラグメント、Fab’2フラグメント、CDR、およびScFvを含むがこれらに限定されない、実質的に同じ抗原特異性を有するかかるモノクローナル抗体のフラグメントである実施形態にも関する。さらに、モノクローナル抗体は、ヒト化、ヒト、またはキメラ(例えば、二重特異的または機能化抗体)でありうる。活性化受容体を刺激する抗体もフラグメントでありうるが、それらは完全長であることが好ましい。例えば、修飾配列もしくは抱合異種官能基または他の化合物を有する誘導体は、本明細書に記載された抗体のいずれかのために使用されうる。
【0090】
本発明によるNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する抗体は、当該分野において周知のさまざまな技術によって生成されうる。通常、それらはKIR、NKG2A/C、NCR(例えば、NKp30、NKp44、NKp46)、またはNKG2Dポリペプチド、またはポリペプチドのいずれかの免疫原性フラグメント、および脾細胞の(適切な細胞系との融合によってハイブリドーマを産生する)コレクションを含んで成る免疫原によるヒト以外の動物の免疫付与によって産生される。さまざまな種からモノクローナル抗体を生成する方法は当該分野において公知である(例えば、その開示が参照することにより本明細書に組込まれる、ハーロー(Harlow)ら、「抗体:実験室マニュアル(Antibodies:A laboratory Manual)」、CSHプレス(Press)、1998年、ゴーディング(Goding)、「モノクローナル抗体:原理と実践(Monoclonal Antibodies:Principles and Practice)」、アカデミック・プレス(Academic Press)、1986年を参照)。より具体的には、これらの方法は、ヒト以外の動物を抗原で免疫付与した後、脾細胞を回収し、次いでこれを骨髄腫細胞など不死化細胞と融合する工程を含んで成る。結果として生じるハイブリドーマは、モノクローナル抗体を産生し、限界希釈によって選択され、個々のクローンを単離することができる。抗体は、例えば、その開示が参照することにより本明細書に組込まれる、ワード(Ward)ら(1989年)に開示されている免疫グロブリンのコンビナトリアルライブラリーの選択によっても生成されうる。
【0091】
本発明によるNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する好ましい抗体は、活性化または抑制性NK細胞受容体、例えば、KIR2DLポリペプチド、より好ましくは、ヒトKIR2DLポリペプチドを含んで成る免疫原による免疫付与によって調製される。KIR2DLポリペプチドは、ヒトKIR2DLポリペプチド、またはそのフラグメントもしくは誘導体、通常、免疫原性フラグメント、すなわち、エピトープ、好ましくは、TまたはB細胞エピトープを含んで成るポリペプチドの一部の完全長配列を含んで成りうる。かかるフラグメントは通常、成熟ポリペプチド配列の少なくとも7連続アミノ酸、より好ましくは、その少なくとも10連続アミノ酸を含む。それらは実質的に受容体の細胞外ドメイン由来である。好ましい実施形態においては、免疫原は、脂質膜、通常、細胞の表面において野生型のヒトKIR2DL、NCR、または他のポリペプチドを含んで成る。具体的な実施形態においては、免疫原は、場合により処置または溶解された無傷NK細胞、特に無傷ヒトNK細胞を含んで成る。
【0092】
治療抗体は、CD16など受容体によるその結合を増大させるために修飾されたFc領域を有しうるが、一部の実施形態においては、NK細胞増強抗体はFc受容体のためにその親和性を削減するために改変されたFc領域を有し、そのことによって抗体により結合されたNK細胞自体が結合され、かつ溶解される可能性を削減することになる。
【0093】
NK細胞のKIR2DL受容体を遮断する抗体は、i)KIR2DLポリペプチドを含んで成る免疫原でヒト以外の哺乳動物を免疫付与する工程と、ii)前記免疫付与動物からモノクローナル抗体を調製し、ここで前記モノクローナル抗体が前記KIR2DLポリぺプチドに結合する工程と、iii)KIR2DLポリペプチドの少なくとも2つの異なる血清型と交差反応する工程ii)からモノクローナル抗体を選択する工程と、iv)NK細胞のKIR2DL介在阻害を阻害する(c)のモノクローナル抗体を選択する工程とを含んで成る方法によって生成されうる。
【0094】
工程(iii)と(iv)の順序は変更されうる。場合により、方法はさらに、以下で述べるように、モノクローナル抗体のフラグメントまたは誘導体を作るさらなる工程含んで成りうる。
【0095】
他の変形においては、方法は、i)ライブラリーまたはレパートリーから、KIR2DLポリペプチドの少なくとも2つの異なる血清型と交差反応するモノクローナル抗体またはそのフラグメントもしくは誘導体を選択する工程と、NK細胞のKIR2DL介在阻害を阻害する工程i)からの抗体を選択する工程とを含んで成る。
【0096】
これらの方法のいずれかを使用し、1つもしくはそれ以上のエピトープを共有する(阻害または活性化)NK細胞受容体のいずれかの群に特異的である任意の抗体または抗体フラグメントを選択することができる。例えば、NK細胞のKIR3DLまたはNKG2A/C受容体を遮断し、またはNK細胞の活性化受容体を刺激する抗体の調製のために同様の方法を使用することができる。
【0097】
好ましい実施形態においては、これらの方法で使用され、または本明細書に記載された抗体のいずれかの生成に使用されるヒト以外の動物は、齧歯動物(例えば、マウス、ラット等)、ウシ、ブタ、ウマ、ウサギ、ヤギ、ヒツジ等など哺乳動物である。
【0098】
また、本明細書に記載された抗体のいずれかは遺伝子組換えされ、またはヒトに適切であるように、例えば、ヒト化、キメラ、またはヒト抗体に改変されうる。抗体をヒト化する方法は当該分野において公知である。一般に、本発明によるヒト化抗体は、元の抗体からそれに導入される1つもしくはそれ以上のアミノ酸残基を有する。これらのマウスまたは他のヒト以外のアミノ酸残基はしばしば「輸入」残基と呼ばれ、通常、「輸入」可変ドメインから取られる。ヒト化は本質的に、ウィンター(Winter)と同僚らの方法に従って実施されうる(ジョーンズ(Jones)ら(1986年)ネイチャー(Nature) 321、p.522、リーヒマン(Riechmann)ら(1988年)ネイチャー(Nature) 332、p.323、ベルホイエン(Verhoeyen)ら(1988年)サイエンス(Science) 239、p.1534(1988年))。場合によっては、かかる「ヒト化」抗体はキメラ抗体であり(キャビリー(Cabilly)ら、米国特許第4,816,567号明細書)、実質的に決して無傷とはいえないヒト可変ドメインが元の抗体からの対応する配列によって置換されている。実際には、本発明によるヒト化抗体は通常、一部のCDR残基およびおそらく一部のFR残基が元の抗体における類似の部位からの残基によって置換されているヒト抗体である。
【0099】
「ヒト化」モノクローナル抗体を作る別の方法は、免疫付与に使用されるマウスとしてクセノマウス(XenoMouse)(登録商標)(アブゲニックス(Abgenix)、カリフォルニア州(CA)、フレモント(Fremont))の使用である。クセノマウスは、その免疫グロブリン遺伝子が機能的ヒト免疫グロブリン遺伝子によって置換されたマウス宿主である。したがって、このマウスによって、またはこのマウスのB細胞から作られたハイブリドーマにおいて生成された抗体は、すでにヒト化されている。クセノマウスは、米国特許第6,162,963号明細書に記載されており、これは参照することによりその全体が本明細書に組込まれる。類似の方法はHuMAb−マウス(HuMAb−Mouse)(商標)(メダレックス(Medarex))を使用して得られうる。
【0100】
ヒト抗体は、免疫付与のために、さまざまな他の方法に従って、例えば、ヒト抗体レパートリーを発現するように改変されている他のトランスジェニック動物を使用することによって(ヤコボビッツ(Jakobovitz)ら、ネイチャー(Nature) 362(1993年)、p.255)、またはファージディスプレイ法を使用するアリの体レパートリーの選択によっても生成されうる。かかる方法は等業者には周知であり、本出願で開示されているモノクローナル抗体から始めて使用されうる。
【0101】
本発明の抗体は「キメラ」抗体(免疫グロブリン)にも誘導化されうるが、ここで重鎖および/または軽鎖のタンパク質は元の抗体における対応する配列と同一または同種であると同時に、残りの鎖は別の種由来の抗体における対応する配列と同一または同種であり、またはそれらが所望の生物学的活性を示す限り、別の抗体クラスまたはサブクラス、ならびにかかる抗体のフラグメントに属する(キャビリーら、上記を参照、モリソン(Morrison)ら(1984年)Proc.Natl.Acad.Sci.81、p.6851)。
【0102】
NK細胞の阻害性受容体を遮断し、またはNK細胞の活性化受容体を刺激する化合物が抗体である場合、かかる抗体がポリクローナル、または好ましくは、モノクローナルでありうることも理解されるであろう。抗体は、ハイブリドーマによって、または所望の可変および定常ドメインを発現するように改変された組換え細胞によって生成されうる。抗体は単鎖抗体または抗原特異性および低ヒンジ領域またはその変形を保持する他の抗体誘導体でありうる。抗体は、多機能抗体、組換え抗体、ヒト化抗体、またはそのフラグメントもしくは誘導体でありうる。前記フラグメントまたはその誘導体は、好ましくは、Fabフラグメント、Fab’2フラグメント、CDR、およびScFvから選択される。好ましくは、フラグメントは抗原結合フラグメントである。抗体フラグメントを含んで成る抗体は、二重特異的抗体も含むがこれに限定されない。一例は、活性化受容体に特異的な抗原結合領域および腫瘍抗原に特異的な抗原結合領域を含んで成る二重特異的抗体である(その開示が参照することにより本明細書に組込まれる、PCT公開国際公開第01/71005号パンフレットを参照)。
【0103】
組成物および投与
本発明は、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する少なくとも1つの化合物、好ましくは、抗体またはそのフラグメントを含んで成る組成物、および治療抗体、治療抗体により治療される対象におけるADCCを増大させるため、または疾患、より詳しくは、標的細胞の枯渇を必要とする疾患、好ましくは、ウイルス感染細胞、腫瘍細胞、または他の病的細胞など疾患細胞を有する対象を治療するための治療抗体の有効性を増大させるための前記組成物の使用に関する。好ましくは、疾患は、癌、自己免疫疾患、炎症性疾患、ウイルス疾患より成る群から選択される。疾患は、移植片拒絶、より詳しくは同種移植拒絶、および移植片対宿主疾患(GVHD)にも関する。
【0104】
より詳しくは、疾患の治療は、標的細胞、好ましくは、ウイルス感染細胞、腫瘍細胞、または他の病原細胞など疾患細胞の枯渇を必要とする。好ましくは、疾患は、癌、感染性または免疫疾患である。より好ましくは、疾患は、癌、自己免疫疾患、炎症性疾患、ウイルス疾患より成る群から選択される。疾患は、移植片拒絶、より詳しくは同種移植拒絶、および移植片対宿主疾患(GVHD)にも関する。
【0105】
前記疾患は、造血細胞の腫瘍性増殖を含む。場合により、前記疾患は、リンパ芽球性白血病、急性または慢性骨髄性白血病、ホジキンリンパ腫、非ホジキンリンパ腫、骨髄異形成症候群、多発性骨髄腫、および慢性リンパ球性白血病より成る群から選択される。前記疾患は、ENT癌、結腸直腸癌、乳癌、上皮癌も含む。前記疾患は、CMV感染、およびB型肝炎を含む。前記疾患は、クローン病、関節リウマチ、喘息、乾癬、多発性硬化症、または糖尿病を含む。特に、上記の表にリストアップされた疾患が治療されうる。
【0106】
前記治療抗体は、CD16によって、好ましくは、そのFc領域により結合されうる。好ましくは、前記治療抗体は、ヒトIgG1またはIgG3Fc部分、特にモノクローナル抗体またはそのフラグメント、さらに好ましくは、ヒト、ヒト化もしくはキメラ抗体またはそのフラグメント、例えばリツキシマブを有する。
【0107】
NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する前記化合物、好ましくは、抗体またはそのフラグメントは、KIR、NKG2A/C、NCR、またはNKG2Dヒト受容体の少なくとも1つに結合し、NK細胞の細胞毒性の関連KIR2DL、KIR3DL、および/またはNKG2A/C介在阻害を阻害し、またはNK細胞の細胞毒性の関連NCRまたはNKG2D介在活性化を刺激する。1つの好ましい実施形態においては、KIR2DLヒト受容体、例えば、KIR2DL1、KIR2DL2、KIR2DL3ヒト受容体より成る群から選択される受容体が使用されるか、またはKIR3DLヒト受容体、例えば、KIR3DL1およびKIR3DL2より成る群から選択される受容体が使用される。
【0108】
1つの好ましい実施形態においては、NK細胞増強化合物はKIR2DLヒト受容体の少なくとも1つに結合し、NK細胞の細胞毒性の関連KIR2DL介在阻害を阻害する。好ましくは、KIR2DLヒト受容体は、KIR2DL1、KIR2DL2、KIR2DL3ヒト受容体より成る群から選択される。好ましい実施形態においては、化合物、好ましくは、抗体またはそのフラグメントは、KIR2DLヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL介在阻害を阻害する。より好ましくは、前記化合物、好ましくは、抗体は、KIR2DL1、KIR2DL2、KIR2DL3ヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、KIR2DL3介在阻害を阻害する。特定の実施形態においては、前記化合物、好ましくは、抗体は、80位でLys残基を有するHLA−C対立遺伝子分子のヒトKIR2DL1受容体への結合、および80位でAsn残基を有するHLA−C対立遺伝子分子のヒトKIR2DL2およびKIR2DL3受容体への結合を阻害する。別の特定の実施形態においては、この抗体は、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200と同じエピトープに結合する。場合により、この抗体は、ヒトNK細胞の表面でKIR受容体への結合のためにハイブリドーマDF200によって生成されるモノクローナル抗体DF200と競合する。1つの好ましい実施形態においては、抗体はハイブリドーマDF200によって生成されるモノクローナル抗体DF200である。別の実施形態においては、抗体は、モノクローナル抗体EB6と同じエピトープと競合し、またはこれに結合する。
【0109】
本発明による組成物は、NK細胞の異なる阻害性受容体を遮断し、および/またはNK細胞の1つもしくはそれ以上の活性化受容体を刺激する一部の化合物、好ましくは、抗体またはそのフラグメントの組合せを含んで成りうる。好ましくは、NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントは、KIR2DL1、KIR2DL2、KIR2DL3、KIR3DL1、KIR3DL2、NKG2A、およびNKG2Cから選択される阻害性受容体に特異的であり、NK細胞の細胞毒性の関連KIR−またはNKG2A/C介在阻害を阻害することができる。より好ましくは、「中和」化合物の組合せは、NK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、およびKIR2DL3介在阻害を阻害することができる。化合物の組合せを提供することによって、最大数の異なる阻害性受容体が最大数の患者において遮断されるであろう。また、異なる活性化化合物(または、阻害性受容体と同様に、単一受容体内の異なるエピトープに結合する)を刺激する化合物、例えば、NKp30、NKp44、NKp46、およびNKG2Dより成る群から選択される2つもしくはそれ以上の受容体の任意の組合せの活性化を同時にもたらす化合物の組合せも使用することができる。また、阻害性受容体を遮断する1つもしくはそれ以上の化合物、および活性化受容体を刺激する1つもしくはそれ以上の化合物を含んで成る組合せも使用できる。以下で述べるように、好ましい実施形態においては、NK細胞の試料を本方法の適用前に患者から得ることができ、かつ化合物の異なる組合せに対するNK細胞の応答性を、例えば、標的細胞および治療抗体の存在下に評価することができる。
【0110】
本発明の組成物は、医薬的に許容可能な担体または賦形剤、通常、緩衝液、等張液、水性懸濁液を含んで成り、場合により、安定剤、保存剤等が補充されうる。一般的な剤形としては、食塩液、場合により、高分子量タンパク質(例えば、ヒト血清アルブミン)など保護または安定化分子を含む。
【0111】
1つもしくはそれ以上の治療抗体、1つもしくはそれ以上のNK細胞増強化合物、および、好ましくは、その使用説明書の組合せを含んで成るキットも提供される。
【0112】
本発明の方法および組成物によれば、NK細胞の阻害性受容体を遮断し、またはNK細胞の活性化受容体を刺激する化合物、好ましくは、抗体またはそのフラグメントおよび治療抗体は、「十分」または「治療有効」量で投与される。
【0113】
レシピエントに投与される治療抗体の有効量は、約0.1mg/kg〜約20mg/kgでありうる。しかし、抗体の有効量は、抗体の形態(全Ig、またはフラグメント)、mAbの親和性、および各特定の抗体のために測定されるべき薬物動態パラメータによって決まる。
【0114】
レシピエントに投与されるNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物、好ましくは、抗体またはそのフラグメントの有効量は、約0.1mg/kg〜約20mg/kgでありうる。しかし、抗体の有効量は、抗体の形態(全Ig、またはフラグメント)、mAbの親和性、および各特定の抗体のために測定されるべき薬物動態パラメータによって決まる。
【0115】
本発明の重要な実施形態においては、本化合物の使用が、治療抗体の削減量で達成される治療効果を可能にしうる。治療抗体の使用(例えば、投与量、投与計画)は、副作用、例えば、リツキシマブの場合、発熱、頭痛、喘鳴、血圧低下、およびその他によって制限されうる。したがって、多くの患者における治療抗体の標準用量は、本明細書に記載されたNK細胞増強化合物(すなわち、他の化合物の非存在下に推奨量)とともに投与され、それによってさらに大きな治療効果を必要とする患者における標準用量の有効性を増強するが、例えば、副作用を重篤に受けた他の患者においては、本化合物の投与は治療抗体の削減量で達成される治療効果を可能にし、それによって副作用を回避する。実際に、熟練した医師は、所定の患者のための治療抗体およびNK細胞増強化合物の理想的な用量および投与計画、例えば、患者の特定のニーズおよび全体的な状態に照らして最も適切であろう治療法を決定する能力がある。治療抗体およびNK細胞増強化合物のための適切な投与量の決定における指針の多くの文献、例えば、レミントン(Remington):薬学の科学と実際(The Science and Practice of Pharmacy)、ジェナロ(Gennaro)編(2003年)、ISBN:0781750253、グッドマン(Goodman)およびジルマンス(Gilmans)、治療薬の薬学的基礎(The Pharmacological Basis of Therapeutics)、ハードマン(Hardman)編、リンバード・アンド・ジルマン(Limbird & Gilman)(2001年)、ISBN:0071354697、ローリンス(Rawlins)E.A.編「ベントリー薬剤学教科書(Bentley´」s Textbook of Pharmaceutics)」、ロンドン(London):ベイリール(Bailliere)、チンダル・アンド・コックス(Tindall and Cox)、(1977年)、およびその他が入手可能である。
【0116】
一実施形態においては、医師は、本NK細胞増強化合物のいずれかの投与とともに投与される治療抗体の量を徐々に削減することができ、投与量または投与頻度のいずれかの点で、治療抗体の有効性をモニタリングし、例えば、NK細胞活性をモニタリングする、患者における標的細胞の存在をモニタリングする、さまざまな臨床指標をモニタリングする、またはほかの手段によるなど、かつ、モニタリングの結果に照らして、治療抗体および/またはNK増強化合物の相対濃度または投与方法を調節し、治療効果および副作用の制限を最適化することができる。
【0117】
別の一連の実施形態においては、NK細胞は治療抗体およびNK細胞増強化合物の投与前に(および、必要に応じて、治療中に)患者から得られ、かつ評価され、最大の効果のために使用される理想的な化合物または一式の化合物を判定する。例えば、NK細胞に存在する阻害または活性化受容体の識別が判定されうるとともに、最も顕著な受容体を特異的に標的した化合物が投与されうる。あるいは、得られたNK細胞は治療抗体および標的細胞とともにインキュベートされ、標的細胞枯渇を増強する1つもしくはそれ以上の化合物の能力が評価されうる。いずれか、1つもしくはそれ以上の化合物がインビトロで枯渇の増強において最も有効であるものが、本治療方法用に選択される。
【0118】
化合物および/または治療抗体の適切な用量は、インビトロまたは動物モデルで、例えば、インビトロでは、標的細胞、NK細胞(好ましくは、ヒトNK細胞)、場合により、他の免疫細胞の存在下にさまざまな濃度の治療抗体、およびさまざまな濃度の1つもしくはそれ以上のNK細胞増強化合物をインキュベートし、かつ標準のアッセイ(例えば、実施例の部で述べる)を使用し、さまざまな条件下に標的細胞枯渇の程度または速度を評価することによっても徐々に判定されうる。あるいは、治療抗体の各種投与量を抗体で治療可能な疾患用の動物モデル(例えば、リツキシマブの場合にはNHL用の動物モデル)に、本明細書に記載された化合物の各種投与量とともに投与し、動物の治療における抗体の有効性(例えば、適切な臨床、細胞、もしくは分子アッセイ、または基準によって判定)を評価することができる。
【0119】
本発明による組成物は、対象に直接、通常、静脈内、腹腔内、動脈内、筋内、または経皮経路によって注入されうる。一部のモノクローナル抗体は、リツキサン(リツキシマブ)またはゾレア(Xolair)(オマリズマブ)など臨床状況で有効であることが示されており、同様の投与計画(すなわち、剤形および/または用量および/または投与プロトコール)を本発明の組成物とともに使用することができる。
【0120】
さらに、本発明の組成物は、他の活性剤、または化学療法もしくは他の免疫療法など治療プログラムをさらに含んで成り、またはこれらと組合わせて、同時もしくは連続的に使用されうる。
【0121】
一部の好ましい実施例においては、本発明の方法はさらに、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する2つもしくはそれ以上の化合物の1つもしくはいくつかの注入を含んで成り、これら2つもしくはそれ以上の化合物は組合わせて使用されうる。これは、ADCCのさらに大幅な増強および治療抗体の有効性をもたらすために役立ち、かつ/またはNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する特定の化合物の投与量を削減するために役立ちうる。例えば、IL−2などの化合物は、増加した用量では毒性であることが知られている。したがって、本発明は、好ましくは、それを必要とする対象における疾患の治療方法であって、a)NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する少なくとも2つの化合物、好ましくは、抗体またはそのフラグメントを前記対象に投与する工程と、b)前記対象に治療抗体を投与する工程とを含んで成る方法を提供する。例えば、好ましい計画は、前記2つの化合物が、(i)NCRもしくはNKG2D受容体または活性化KIR受容体を刺激する抗体、および阻害KIR受容体またはNKG2Aを遮断する抗体より成る群から選択される第1の化合物と、(ii)IL−12、IL−15、IL−18、およびIL−21より成る群から選択される第2の化合物である。したがって、本発明はさらに、それを必要とする対象における疾患の治療方法であって、a)NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する本発明による化合物、好ましくは、抗体またはそのフラグメントを前記対象に投与する工程と、b)前記対象に治療抗体を投与する工程と、(c)前記対象にIL−2を投与する工程を含んで成る方法を提供する。IL2は、リサーチ・ダイアグノスティックス、ニュージャージー州(NJ)、RDI−212)、またはカイロン社(Chiron Corp.)、カリフォルニア州(CA)、エメリービル(Emeryville)から入手可能である。
【0122】
サイトカインは、適切な投与計画のいずれかに従って投与されうるとともに、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物の投与の前、投与と同時に、および/または投与の後に、あるいは治療抗体の投与の前、投与と同時に、および/または投与の後に投与されうる。代表的な実施例においては、サイトカインは5−10日間毎日投与され、サイトカインは最初にNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物の第1回目の注入と同じ日に注入される。前記方法は、好ましくは、皮下経路によってサイトカインの1回もしくは2回の注入/日を含んで成る。
【0123】
サイトカインの投与量は、治療される患者の状態によって選択される。好ましい実施例では、比較的低い用量のサイトカインが使用されうる。例えば、有効量は通常、サイトカイン含有医薬組成物が毎日の皮下注入用に使用される場合、100万単位/平方メートル/日サイトカイン未満である。好ましい実施例においては、IL−2は5〜10日間、毎日100万単位/m2未満の用量で皮下注入される。さらにサイトカインの使用の詳細は、その開示が参照することにより本明細書に組込まれる、「NK細胞の増殖に対する効果を有する医薬組成物およびその使用の方法(Pharmaceutical compositions having an effect on the proliferation of NK cells and a method using the same)」という名称の国際特許公開第PCT/EP/0314716号明細書および米国特許出願第60/435,344号明細書に記載されている。
【0124】
治療抗体およびNK細胞増強化合物が同時投与、例えば、同時注入され、または同時であるが異なる剤形で投与され、または独立して投与されうること、例えば、化合物が化合物の投与の数時間、数日、または数週間前または後に投与されることも理解されるであろう。
【0125】
さらに本発明の態様および利点が以下の実験の部で開示されているが、これらは例示としてみなすべきであり、本出願の範囲を限定するものとしてみなしてはならない。
【実施例】
【0126】
実施例1:pan KIR2DL抗体の生成
PBLの精製およびポリクローナルまたはクローナルNK細胞系の生成。
PBLをフィコール・ハイパック(Ficoll Hypaque)勾配遠心法および形成接着細胞の枯渇によって健常ドナーから誘導した。強化NK細胞を得るために、PBLを抗CD3、抗CD4、および抗HLA−DRmAb(4℃下に30mns)の後、ヤギ抗マウス電磁ビーズ(ダイナル(Dynal)(4℃下に30mns)でインキュベートし、当該分野において周知の方法(ペンデら、1999年)によって免疫磁気選択を行った。CD3マイナス、CD4マイナスDRマイナス細胞を照射支持細胞および100U/mlインターロイキン2(プロロイキン(Proleukin)、カイロン社(Chiron Corporation))および1.5ng/mlフィトヘムアグルチニンA(ジブコ(Gibco)BRL)で培養し、ポリクローナルNK細胞集団を得る。NK細胞を限界希釈によってクローン化し、NK細胞のクローンを細胞表面受容体の発現についてフローサイトメトリーによって特徴づける。
【0127】
以下のクローンをこの試験で使用した。
【0128】
CP11、CN5、およびCN505はKIR2DL1陽性クローンであり、EB6またはXA−141抗体によって染色される。CN12およびCP502は、KIR2DL3陽性クローンであり、GL183抗体によって染色される。
【0129】
フローサイトメトリー分析
使用したmAbを実験室のJT3A(IgG2a、抗CD3)、EB6およびGL183(それぞれ、IgG1抗KIR2DL1およびKIR2DL3)、XA−141 IgM抗KIR2DL1(EB6、抗CD4(HP2.6)、抗DR(D1.12、IgG2a)と比べて同じ特異性)で生成した。JT3A、HP2.6、およびDR1.12の代わりに、同じ特異性の市販のmAbが、例えば、ベックマン・コールター社(Beckman coulter Inc)、カリフォルニア州(CA)、フラートン(Fullerton)から使用されうる。EB6およびGL183は、ベックマン・コールター社、カリフォルニア州(CA)、フラートン(Fullerton)で市販されている。XA−141は市販されていないが、EB6を(モレッタら、1993年)に記載されている溶解の対照再構成のために使用することができる。
【0130】
フローサイトメトリー
細胞を適切な抗体(4℃下に30mns)で染色した後、PEまたはFITC抱合ポリクローナル抗マウス抗体(サザン・バイオテクノロジー・アソシエーツ社(Southern Biotechnology Associates Inc))で染色した。試料をFACSAM装置(ベクトン・ディキンソン(Becton Dickinson)、カリフォリニア州(CA)、マウンテンビュー(Mountain View))で細胞蛍光分析によって分析した。
【0131】
細胞毒性実験
NKクローンの細胞溶解活性を標準4時間51Cr放出アッセイによって評価した。エフェクターNK細胞をNK細胞溶解に対するその感受性について周知のCw3またはCw4陽性細胞系で試験した。すべての標的をマイクロ滴定プレートのウェル当り5000の細胞で使用したが、標的比でのエフェクターは数字(通常、標的細胞当り4エフェクター)で示されている。細胞溶解アッセイは、1/2希釈で指示モノクローナル抗体の上清の有無により行われる。手順は実質的に(モレッタら、1993年)に記載されているものと同じである。
【0132】
新しいmAbの生成
mAbは、5週齢バルブ(Balb)Cマウスを活性化ポリクローナルまたはモノクローナルNK細胞系で(モレッタら、1990年、その開示は参照することにより本明細書に組込まれる)に記載されているように免疫付与することによって生成されている。異なる細胞融合の後、mAbを最初にEB6およびGL183陽性NK細胞系およびクローンと交差反応するその能力について選択した。陽性モノクローナル抗体をさらに、それぞれCw4またはCw3陽性標的のEB6陽性またはGL183陽性NKクローンによる溶解を再構成するその能力について検査した。
【0133】
DF200、KIR2DLヒトNK受容体の共通の決定基に対する新たなモノクローナル抗体
モノクローナル抗体の1つであるDF200mAbは、KIR2DL1、KIR2DL2/3を含むKIRファミリーのさまざまなメンバーと反応することがわかった。DF200mAbによるNK細胞の染色に関して、KIR2DL1+細胞およびKIR2DL2/3+細胞は明るく染色された(図1)。
【0134】
これらHLAクラスI特異的阻害性受容体の一方または他方(または両方)を発現するNKクローンを、1つもしくはそれ以上のHLA−C対立遺伝子を発現する標的細胞に対するエフェクター細胞として使用した。予想通り、KIR2DL1+NKクローンは、Cw3陽性標的上でほとんどまたはまったく活性を示さなかったHLA−Cw4およびKIR2DL3+NKクローンを発現する標的細胞に対する細胞溶解活性を、たとえあったとしても、ほとんど示さなかった。しかし、DF200mAb(そのKIR2DL受容体を隠すために使用)の存在下には、NKクローンはそのHLA−Cリガンドを認識できなくなり、Cw3またはCw4標的上で強い細胞溶解活性を示した。
【0135】
例えば、C1R細胞系(CW4+EBV細胞系、ATCC番号CRL1993)はKIR2DL1+NKクローン(CN5/CN505)によって殺傷されなかったが、阻害はDF200または従来の抗KIR2DL1mAbのいずれかの使用によって有効に戻されえた。他方、KIR2DL2/3+KIR2DL1−表現型を発現するNKクローン(CN12)はC1Rを有効に殺傷し、この殺傷はDF200mAbによって左右されなかった(図2)。同様の結果はCw3陽性標的上でKIR2DL2−またはKIR2DL3陽性NKクローンで得られうる。
【0136】
DF200mAb/KIR2DL1およびDF200mAb/KIR2DL3相互作用のビアコア分析。
材料と方法
組換えタンパク質の生成と精製。KIR2DL1およびKIR2DL3組換えタンパク質を大腸菌(E.coli)で生成した。KIR2DL1およびKIR2DL3の全細胞外ドメインをコード化するcDNAを、それぞれ、pCDM8クローン(ビアッソーニ(Biassoni)ら、1993年、その開示は参照することにより本明細書に組込まれる)およびRSVS(gpt)183クローン6ベクター(ワグトマン(Wagtman)ら、1995年、その開示は参照することにより本明細書に組込まれる)から以下のプライマーを使用してPCRによって増幅した。
センス:5’−GGAATTCCAGGAGGAATTTAAAATGCATGAGGGAGTCCACAG−3’
抗センス:5’−CCCAAGCTTGGGTTATGTGACAGAAACAAGCAGTGG−3’
【0137】
それらをビオチン化シグナルをコード化する配列を有するフレームのpML1発現ベクターへクローン化した(サウルキン(Saulquin)ら、2003年、その開示は参照することにより本明細書に組込まれる)。
【0138】
タンパク質発現をBL21(DE3)細菌株(インビトロジェン(Invitrogen))へ行った。トランスフェクト細菌をアンピシリン(100μg/ml)を補充し、1mM IPTGを誘導した培地中、37℃下にOD600=0.6に成長させた。
【0139】
変性状態(8M尿素)下に封入体からタンパク質を回収した。組換えタンパク質の再折畳みを、6工程透析で尿素濃度を低下(それぞれ、4、3、2、1、0.5、および0M尿素)させることによって、室温(RT)下、L−アルギニン(400mM、シグマ)およびβ−メルカプトエタノール(1mM)を含有する、トリス20mM、pH7.8、NaCl 150mM緩衝液中で行った。還元および酸化グルタチオン(それぞれ、5mMおよび0.5mM、シグマ)を0.5および0Mの尿素透析工程中に添加した。最後に、タンパク質をトリス10mM、pH7.5、NaCl 150mM緩衝液に対して広範囲に透析した。溶解再折畳みタンパク質を濃縮させ、次いでスーパーデックス(Superdex)200サイズ排除カラム(ファルマシア(Pharmacia)、AKTAシステム(system))で精製した。
【0140】
ビアコア分析。表面プラスモン共鳴測定をビアコア装置(ビアコア)で行った。すべてのビアコア実験において、0.05%サーファクタントP20を補充したHBS緩衝液をランニングバッファーとして使用した。
【0141】
タンパク質の固定化。組換えKIR2DL1およびKIR2DL3タンパク質をセンサーチップ(Sensor Chip)CM5(ビアコア)上のデキストラン層におけるカルボキシル基に共有結合で固定化した。センサーチップ表面をEDC/NHS(N−エチル−N’−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩およびN−ヒドロキシスクシニミド、ビアコア)で活性化した。カップリングバッファー(10mM酢酸塩pH4.5)中のタンパク質を注入した。残りの活性化基の不活性化を100mMエタノールアミンpH8(ビアコア)を使用して行った。
【0142】
親和性測定。動態測定のために、さまざまな濃度の可溶性抗体(10−7〜4×10−10M)を固定化試料上に加えた。測定を20μl/分の連続流量で行った。各サイクルで、センサーチップの表面を10mM NaOH pH11の5μl注入によって再生した。
【0143】
ビアローグ(BIAlogue)動態評価(Kinetics Evaluation)プログラム(BIAevaluation3.1、ビアコア)をデータ分析のために使用した。
【0144】
結果
DF200mAbの固定化KIR2DL1およびKIR2DL3への結合のビアコア分析
【0145】
【表6】

【0146】
可溶性分析物(さまざまな濃度で40μl)をHBS緩衝液中20μl/分の流量で500または540反射率単位(RU)、および1000または700RUのKIR2DL1およびKIR2DL3をそれぞれ含有するデキストラン層上に注入した。データは6つの独立した実験を代表する。
【0147】
実施例2:リツキサンと抗KIRmAbの組合わせを使用することによるADCCの増強
ヒトNKクローンの調製。陰性抗CD3免疫磁性選択(ミルテンイ(Miltenyi)によるT細胞の枯渇血液単核細胞を限外希釈条件下にプレーティングし、フィトヘムアグルチニン(PHA)(バイオクロムKG、ドイツ、ベルリン(Berlin))で活性化し、インターロイキン(IL)−2(カイロンB.V.、オランダ、アムステルダム(Amsterdam))および照射支持細胞で培養した。クローニング効率はすべてのドナーにおいて同等であり、プレーティングしたNK細胞5個中1個〜10個中1個の範囲である。クローン化NK細胞を同種反応性について、エフェクター対標的比10:1で機知のHLA型のエプスタイン・バー(Epstein−Bar)ウイルス形質転換Bリンパ芽細胞系に対する標準51Cr放出細胞毒性によって検査した。30%以上の溶解を示すクローンを同種反応性と評価した。一般に、クローンは、<5%または>40%のいずれかの溶解を示す。
【0148】
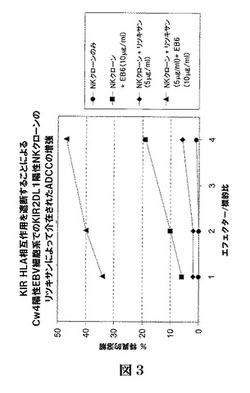
KIR2DL1陽性NK細胞クローンによるリツキサンによって介在されるADCCの増強
NKクローンの細胞溶解活性を標準4時間51Cr放出アッセイによって評価するが、ここでエフェクターNK細胞が、NK細胞溶解に対する感受性で知られるCw4またはCw3陽性EBV細胞系(CD20陽性)で試験された。すべての標的をマイクロ滴定プレートのウェル当り5000の細胞で使用したが、標的に対するエフェクター(NK細胞クローン)の比は図3に示されている。一部の実験においては、治療キメラ抗CDリツキシマブ(リツキサン、アイデック(Idec))を5μg/mlでエフェクター標的混合物に添加する。一部の実験においては、EB6抗体(抗KIR2DL1)を10μg/mlでエフェクター標的混合物に添加する。
【0149】
この実験は、リツキサン単独では実質的にCw4陽性標的上にKIR2DL1陽性NKクローンによるADCCを介在しないことを示した。KIR2DL1陽性クローンのADCCは、抗KIR2DL1抗体の存在下に大きく増強される。
【0150】
実施例3−KIR2DL1陽性NK細胞クローンによるキャンパスによって介在されるADCCの増強
実施例2に記載されたものと同様の実験において、自己Cw4+PHAブラストをNK細胞+アルムツズマブ(キャンパス、ベルレックス(Berlex))、EB6抗体(100μg/ml)、またはキャンパスおよびEB6の存在下にインキュベートした。図4に示されている結果は、EB6の存在が自己細胞を枯渇させるNK細胞の能力を劇的に増強させることを示し、標的細胞の約4%がキャンパスのみの存在下に溶解したのに対し、30%を超える細胞がキャンパス+EB6の存在下に溶解した。
【0151】
文献
ビアソーニR、ベルジアーニ(Verdiani)S、カムビアッジ(Cambiaggi)A、ロメオ(Romeo)PH、フェリーニ(Ferrini)S、モレッタL。ヒトCD3−CD16+ナチュラルキラー細胞はhGATA−3T細胞転写因子および非転位2.3−kbTcRデルタ転写を発現する(Human CD3−CD16+ natural killer cells express the hGATA−3 T cell transcription factor and an unrearranged 2.3−kb TcR delta transcript)。Eur J Immunol.、1993年5月、23(5)、p.1083−1087
カッレ(Karre)K、リュングレン(Ljunggren)HG、ピオンテック(Piontek)G、キースリング(Kiessling)R、(1986年)「H−2不全リンパ腫変形は代替の免疫防御法を示唆する(Selective rejection of H−2−deficient lymphoma variants suggests alternative immune defence strategy)」ネイチャー(Nature) 319、p.675−678
ラニールLL(1998年)「NK細胞受容体(NK cell receptors)」Annu Rev Immunol 16、p.359−393
モレッタA.、ボッチーノ(Bottino)C.、ペンデ(Pende,D.、トリポディ(Tripodi)G.、タムブッシ(Tambussi)G.、ビアール(Viale)O.、オレンゴ(Orengo)A.、バルバレッシ(Barbaresi)M.、メルリ(Merli)A.、シコーン(Ciccone)E.ら(1990年)。「クローン分布された機能的表面分子の発現によるヒトCD3−CD16+ナチュラルキラー(NK)細胞の4つのサブセットの同定:NKクローンのサブセット配置間の相関および特異的アロ抗原認識を介在する能力(Identification of four subsets of human CD3−CD16+ natural killer (NK) cells by the expression of clonally distributed functional surface molecules: correlation between subset assignment of NK clones and ability to mediate specific alloantigen recognition)」。J Exp Med 172、p.1589−1598
モレッタ,A.、ビターレ,M.、ボッチーノ,C.、オレンゴ,A.M.、モレーリ(Morelli),L.、アウググリアーロ(Augugliaro),R.、バルバレッシ,M.、シコーン,E.、およびモレッタ,L.(1993年)。ヒトナチュラルキラー(NK)細胞における主要組織適合複合体(MHC)クラスI分子の推定上の受容体としてのP58分子。異なる特異性を示すNKクローンにおけるMHCクラスI保護細胞の抗p58抗体再構成溶解(P58 molecules as putative receptors for major histocompatibility complex (MHC) class I molecules in human natural killer (NK) cells. Anti−p58 antibodies reconstitute lysis of MHC class I−protected cells in NK clones displaying different specificities)。J Exp Med 178、p.597−604
モレッタA、モレッタL(1997年)「HLAクラスI特異的阻害性受容体(HLA class I specific inhibitory receptors)」Curr Opin Immunol 9、p.694−701
オーレン(Ohlen)C、クリング(Kling)G、ホグルンド(Hoglund)P、ハンソン(Hansson)M、スカンゴス(Scangos)G、ビエベリッヒ(Bieberich)C、ジェイ(Jay)G、カッレK(1989年)「ドナーマウスにおけるH−2導入遺伝子による同種骨髄移植片拒絶の予防(Prevention of allogeneic bone marrow graft rejection by H−2 transgene in donor mice)」サイエンス(Science) 246、p.666−668
ペンデ,D.、パロリーニ(Parolini),S.、ペッシーノ,A.、シボリ,S.、アウググリアーロ(Augugliaro),R.、モレーリ(Morelli),L.、マルセナーロ(Marcenaro),E.、アカメ(Accame),L.、マラスピーナ(Malaspina),A.、ビアッソーニ,R.ら(1999年)。ヒトナチュラルキラー細胞によって介在されるナチュラル細胞毒性に関与する新たなトリガー受容体、NKp30の同定および分子の特徴(Identification and molecular characterization of NKp30, a novel triggering receptor involved in natural cytotoxicity mediated by human natural killer cells)。J Exp Med 190、p.1505−1516
ルッゲリ(Ruggeri),L.、カパーニ(Capanni),M.、ウルバーニ(Urbani),E.、ペルッシオ(Perruccio),K.、スロムチク(Shlomchik),W.D.、トスチ(Tosti),A.、ポサチ(Posati),S.、ロガイア(Rogaia),D.、フラッソーニ(Frassoni),F.、アベルサ(Aversa),F.ら(2002年)。不適合造血移植におけるドナーナチュラルキラー細胞同種反応性の有効性(Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants)。サイエンス(Science) 295、p.2097−2100
サウルキンX、ガスチネル(Gastinel)LN、ビビエル(Vivier)E.ヒトナチュラルキラー細胞活性化受容体KIR2DS2(CD158j)の結晶構造(Crystal structure of the human natural killer cell activating receptor KIR2DS2 (CD158j))J Exp Med.2003年4月7、197(7)、p.933−938
バリアンテ(Valiante)NM、リネルト(Lienert)K、シリング(Shilling)HG、スミッツ(Smits)BJ、パルハム(Parham)P(1997年)「キラー細胞受容体:MHCクラスI発生に対応(Killer cell receptors:keeping pace with MHC class I evolution)Immunol Rev 155、p.155−164
ワグトマン(Wagtmann)N、ビアッソーニR、カントーニ(Cantoni)C、ベルジアーニ(Verdiani)S、マルナチ(Malnati)MS、ビターレM、ボッチーノC、モレッタL、モレッタA、ロング(Long)EO.、p58細胞受容体の分子クローンは細胞外および細胞内ドメインにおける多様性による免疫グロブリン関連分子を示す(Molecular clones of the p58 NK cell receptor reveal immunoglobulin−related molecules with diversity in both the extra− and intracellular domains)。Immunity.1995年5月、2(5)、p.439−449
ワードら、ネイチャー(Nature) 341(1989年)、p.544
【0152】
本明細書で引用されたすべての刊行物および特許出願は、各個の刊行物または特許出願が具体的かつ個別に参照することにより組込まれることが示されているように、その全体が参照することにより本明細書に組込まれる。
【0153】
前記発明は理解の明確さのために説明図および実施例によって詳細に記載されているが、本発明の開示に照らして、添付の特許請求の範囲の精神または範囲を逸脱することなく一部の変更および修正がなされうることが当業者には容易に理解されるであろう。
【0154】
そのすべて可能な変形における上記要素の組合わせが、本明細書で別段の規定がなく、またはその他の場合に文脈によって明らかに否定されない限り、本発明によって包含される。
【0155】
冠詞の「a」と「an」と「the」と本発明を記載する文脈において使用される同様の指示対象は、本明細書で別段の規定がなく、または文脈によって明らかに否定されない限り、単数と複数の両方をカバーすると解釈される。
【0156】
本明細書での値の範囲の列挙は、本明細書で別段の規定がない限り、範囲内に収まる個々の値に個別に言及する簡便な方法として役立つように意図されているにすぎず、個々の値は、それが個別に本明細書で引用されるように明細書に組込まれる。特に指定のない限り、本明細書で示されたすべての正確な値は、対応する近似値を代表する(例えば、特定の因子または測定に関して示されたすべての正確な典型的な値は、必要に応じて「約」で一部変更される対応する近似測定値も示すと考えられうる)。
【0157】
本明細書に記載されたすべての方法は、本明細書で別段の規定がなく、または文脈によって明らかに否定されない限り、任意の適切な順序で実施されうる。
【0158】
いずれかおよびすべての実施例の使用、または本明細書で示されている典型的な言葉(例えば「など(such as)」は、本発明をより良く照らし出すことが意図されているにすぎず、別段の規定がない限り、本発明の範囲に対する制限をもたらすことはない。明細書における言葉は、明確に述べられていない限り、いずれかの要素が本発明の実施にとって絶対必要であることを示していると解釈されるべきではない。
【0159】
本明細書での特許文書の引用および組込みは、便宜上行われているだけであり、かかる文書の妥当性、特許可能性および/または権利行使可能性の観点を反映することはない。
【0160】
1つの要素もしくは複数の要素に関して「含んで成る」、「有する」、「含む」、または「含有する」などの用語を使用する本発明の態様または実施形態の本明細書での記述は、別段の規定がなく、または文脈によって明らかに否定されない限り、特定の1つの要素もしくは複数の要素「から成る」、「から本質的に成る」、または「を実質的に含んで成る」、本発明の同様の態様または実施形態の裏づけを提供することが意図されている(例えば、特定の要素を含んで成るとして本明細書に記載された組成物は、別段の規定がなく、または文脈によって明らかに否定されない限り、その要素から成る組成物も述べていると理解すべきである)。
【0161】
本発明は、適用法によって許容される最大範囲まで本明細書に示された態様または特許請求の範囲で開示された主題のすべての変更例および均等物を含む。
【図面の簡単な説明】
【0162】
【図1】モノクローナル抗体DF200はさまざまなヒトKIR2DL受容体の共通の決定基に結合する。
【図2】エフェクター/標的比4/1でのC1RCw4標的での抗KIR2DLmAb(モノクローナル抗体)による溶解の再構成。モノクローナル抗体DF200は、Cw4陽性標的細胞でのKIR2DL1陽性NK細胞の細胞毒性(再構成溶解)のKIR2DL介在阻害を阻害する。
【図3】KIR/HLA相互作用を遮断することによるCw4陽性EBV細胞系でのKIR2DL1陽性NKクローンのリツキサンによって介在されたADCCの増強。KIR2DL1を有するNKクローン細胞融解が、5μg/mlの抗CD20抗体(ルチキサン(Rutixan))および10μg/mlのEB6抗体(抗KIR2DL1)、リツキサンのみ、EB6のみ、またはいずれの抗体なしの存在下に、さまざまなエフェクター/標的比(1〜4)でCw4陽性EBV形質転換(CD20陽性)標的細胞系に対して試験される。ADCCは、抗KIR2DL1抗体(EB6)の存在下に大きく増強される。
【図4】KIR/HLA相互作用を遮断することによるCw4陽性EBV細胞系でのKIR2DL1陽性NKクローンのキャンパスによって介在されたADCCの増強。KIR2DL1を有するNKクローン細胞融解が、キャンパスおよび100μg/mlのEB6抗体(抗KIR2DL1)、キャンパスのみ、EB6のみ、またはいずれの抗体なしの存在下にCw4陽性EBV形質転換(CD20陽性)標的細胞系に対して試験される。ADCCは、抗KIR2DL1抗体(EB6)の存在下に大きく増強される。
【技術分野】
【0001】
技術分野
本発明は、一般に、治療抗体の有効性を増大させるための方法および組成物に関し、より詳しくは、本発明は、阻害性受容体を遮断し、またはナチュラルキラー細胞の活性化受容体を刺激し、それによって哺乳動物対象におけるナチュラルキラー細胞の細胞毒性の増強を可能にし、ヒト対象における治療の有効性を、特にADCC機序の増大を通じて増強する化合物と組合わせた治療抗体の使用に関する。
【背景技術】
【0002】
背景技術
ヒトにおけるさまざまな治療法は治療抗体の使用に基づく。これらには、例えば、標的細胞、特にウイルス感染細胞、腫瘍細胞、または他の病原細胞など疾患細胞を枯渇させるように開発された治療抗体の使用を含む。かかる抗体は通常、ヒトIgG1またはIgG3Fc部分を伴うIgG種のモノクローナル抗体である。これらの抗体は、天然または組換え抗体でありうるが、しばしば「ヒト化」マウス抗体である(すなわち、さまざまな種の機能的ドメイン、通常、ヒトまたはヒト以外の霊長類起源のFcタンパク質、およびマウス起源の可変領域または相補性決定領域(CDR)を含んで成る)。あるいは、モノクローナル抗体は、ヒトIg遺伝子座を有するトランスジェニックマウスにおける免疫付与による、またはヒト細胞由来のcDNAライブラリーにより得られる完全にヒトのものでありうる。
【0003】
かかる治療抗体の特定の例がリツキシマブ(rituximab)(マブテラ(Mabthera)(登録商標)、リツキサン(Rituxan)(登録商標))であり、これはCD20を特異的に与えるマウス可変ドメインにつながっているヒトγ1およびκ定常領域により(したがって、ヒトIgG1Fcタンパク質により)生成されるキメラ抗CD20モノクローナル抗体である。過去数年間に、リツキシマブは、Bリンパ球増殖性悪性腫瘍、特に非ホジキンリンパ腫(NHL)に対する治療法を大幅に変えた。ヒト化IgG1抗体の他の例としては、B細胞悪性腫瘍の治療に使用されるアレムツズマブ(alemtuzumab)(キャンパス(Campath)−1H(登録商標))、および乳癌の治療に使用されるトラスツズマブ(trastuzumab)(ヘルセプチン(Herceptin)(登録商標))が挙げられる。開発中の治療抗体のさらなる例は、当該分野において開示されている。
【0004】
治療抗体の作用機序は依然として議論の余地がある。抗体の注入は、抗体によって特異的に認識される抗原を有する細胞の枯渇をもたらす。この枯渇は、少なくとも3つの機序、すなわち、抗体介在細胞の細胞毒性(ADCC)、補体依存性溶解、および抗体によって標的化される抗原を介して示されるシグナルによる腫瘍成長の直接抗腫瘍阻害によって介在されうる。
【0005】
これらの抗体は、特に腫瘍の治療のために、ヒト治療の新たなかつ有効な方法を示すが、つねに強力な効果を示すわけではない。例えば、リツキシマブは、単独または化学療法と併用して、低〜中間悪性度と高悪性度NHLの治療において有効であることが示されたが、低悪性度NHL患者の30%〜50%はリツキシマブに対する臨床反応を示さない。リンパ種細胞でのCD20発現のレベル、治療時の高い全身腫瘍組織量の存在、または低い血清リツキシマブ濃度により、一部の患者におけるリツキシマブの有効性の欠如が説明されうることが示されている。それでもなお、治療の失敗の実際の原因は、大部分が未知のままである。
【0006】
さらに、治療抗体の使用は、その投与が原因の副作用によって制限されうる。例えば、発熱、頭痛、悪心、低血圧、喘鳴、発疹、感染、およびその他多くのものなど副作用が患者には出現し、抗体が投与されうる可能な量または頻度を潜在的に制限しうる。
【0007】
したがって、治療抗体の有効性を増大させ、または副作用を誘発しにくい抗体の削減量を用いて治療効果を達成できることがきわめて興味深いと言える。本発明はこれらおよび他の必要に対処する。
【発明の概要】
【0008】
発明の開示
本発明は、治療抗体の有効性を増強する新たな方法を開示する。以下の理論によって限定されることなく、本方法を用いて達成された驚くべき結果は、治療抗体が注入されるとインビボでADCC機序を増強するその能力に由来すると考えられる。実際に、本発明は、治療抗体の有効性に関係した現在の問題を克服する新たな組成物および方法を提供する。本発明において、個体からのNK細胞は、例えば、NK細胞での阻害性受容体の阻害によって、NK細胞の活性化の欠如による乏しい治療mAb(モノクローナル抗体)介在ADCCを有することが示されている。好ましくは、ADCC機序の増大が、ナチュラルキラー細胞での阻害性受容体を遮断し、または活性化受容体を刺激する化合物の投与によって達成され、それによって哺乳動物対象におけるナチュラルキラー細胞の細胞毒性の増強を促進する。好ましくは、化合物は抗体またはそのフラグメントである。
【0009】
前記抗体または他の化合物は、NK細胞の阻害性受容体、例えば、キラー阻害性受容体(KIRまたはNKG2A/C)分子、または活性化受容体、例えば、NK細胞でのNKp30、NKp44、またはNKp46などNCRと反応し、それによって細胞の阻害を中和し、かつそのADCC活性を増大させうる。
【0010】
より具体的には、本発明は、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物、好ましくは、抗体、またはそのフラグメントが治療抗体とともに対象に同時投与される対象の治療方法を開示する。本発明者らは、ここで治療抗体の有効性が、かかる化合物、好ましくは、例えば、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激することによって、NK細胞の阻害を克服する抗体またはそのフラグメントの同時投与、例えば、同時注入によって大幅に増強されうることを明らかにする。
【0011】
本発明は、治療抗体および化合物、好ましくは、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する抗体またはそのフラグメントを含んで成る医薬組成物にも関する。本発明は、治療抗体および化合物、好ましくは、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する抗体またはそのフラグメントを含んで成るキットにも関する。
【0012】
本発明は、治療抗体による治療の有効性を増大させ、または治療抗体による治療にかけられる対象におけるADCCを増大させるために、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物、好ましくは、抗体またはそのフラグメントの使用にも関する。
【0013】
本発明は、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物、好ましくは、抗体またはそのフラグメント、および疾患を治療するための薬剤の調製のための治療抗体の使用にも関する。より詳しくは、疾患の治療は、標的細胞、好ましくは、ウイルス感染細胞、腫瘍細胞、または他の病原細胞など疾患細胞の枯渇を必要とする。好ましくは、疾患は癌、感染性または免疫疾患である。より好ましくは、疾患は、癌、自己免疫疾患、炎症性疾患、およびウイルス疾患より成る群から選択される。疾患は、移植片拒絶、より詳しくは、同種移植片拒絶、および移植片対宿主疾患(GVHD)にも関する。
【0014】
本発明は、治療抗体、例えば、Fcγ受容体、好ましくは、CD16(FcγRIIIa)によって結合される抗体の投与量を削減する方法をも含んで成る。例えば、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する治療抗体および化合物の同時投与は、使用される治療抗体の低い用量を可能にする。かかる抗体は、化合物の非存在下の推奨量の20%、30%、40%、50%、60%、70%、80%、90%、もしくはより低い用量で使用されうる。
【0015】
また、本発明は、治療抗体、例えば、CD16によって結合される抗体の治療有効削減量を決定するための方法を提供し、この方法は、i)第1の濃度の治療抗体を、標的細胞およびNK細胞と、かつNK細胞での阻害性受容体を遮断し、または活性化受容体を刺激する化合物の非存在下に同時インキュベートする工程と、ii)第2の低濃度の治療抗体を標的細胞、NK細胞と、NK細胞で阻害性受容体を遮断し、または活性化受容体を刺激する化合物の存在下に同時インキュベートする工程と、iii)工程ii)において確認された標的細胞の枯渇が、工程i)において確認された枯渇と同程度であるか決定する工程とを含んで成る。工程ii)が工程i)と同じく有効であることが確認される場合は、化合物および治療抗体の相対濃度が変動され、枯渇が確認され、所定の患者における使用に適する異なる条件、例えば、標的細胞枯渇の最大化、治療抗体の削減量、または化合物の削減量を、患者の特定の必要に応じて特定することができる。
【0016】
特定の態様においては、本発明はそれを必要とするヒト対象における疾患の治療方法を提供し、これはa)NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物を前記対象に投与する工程と、b)CD16によって結合されうる治療抗体を前記対象に投与する工程とを含んで成る。
【0017】
一実施形態においては、治療抗体および化合物は同時に対象に投与される。別の実施形態においては、化合物は治療抗体の投与の1週間以内、4日以内、3日以内、または同日(例えば、約24時間以内)に対象に投与される。別の実施形態においては、疾患は癌、感染性または免疫疾患である。
【0018】
一実施形態においては、方法はさらに、対象におけるNK細胞の活性または数が化合物の投与の前後に評価されるさらなる工程を含んで成る。別の実施形態においては、さらなる工程は、i)投与前に対象からNK細胞を得る工程と、ii)化合物の存在または非存在下に治療抗体によって認識される1つもしくはそれ以上の標的細胞の存在下にNK細胞をインキュベートする工程と、iii)標的細胞を枯渇させるNK細胞の能力に対する化合物の効果を評価する工程とを含み、化合物が標的細胞を枯渇させるNK細胞の能力を増強させる検出が、化合物が方法における使用に適切であり、方法が対象との使用に適切であることを示す。
【0019】
別の態様においては、本発明は、例えば、CD16によって結合されうる治療抗体、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物、および医薬的に許容可能な担体を含んで成る医薬組成物を提供する。別の態様においては、本発明は、例えば、CD16によって結合されうる治療抗体、およびNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する1つもしくはそれ以上の化合物を含んで成るキットを提供する。
【0020】
上記の方法、組成物、またはキットのいずれかについて、一実施形態においては、治療抗体はヒトIgG1またはIgG3Fc部分を有する。別の実施形態においては、化合物は抗体またはそのフラグメントである。別の実施形態においては、化合物はモノクローナル抗体またはそのフラグメントである。別の実施形態においては、治療抗体は放射性または毒性部分と抱合されていない。別の実施形態においては、化合物はNK細胞の阻害性受容体を阻害する。別の実施形態においては、化合物はNK細胞の活性化受容体を刺激する。別の実施形態においては、化合物はヒト、ヒト化、もしくはキメラ抗体、またはそのフラグメントである。一実施形態においては、治療抗体または化合物は、とりわけ、Fabフラグメント、Fab’2フラグメント、CDR、およびScFvなど抗体フラグメントまたはその誘導体でありうる。
【0021】
一実施形態においては、治療抗体はヒト、ヒト化もしくはキメラ抗体、またはそのフラグメントである。別の実施形態においては、治療抗体はリツキシマブまたはキャンパスである。別の実施形態においては、抗体はリツキシマブであり、前記抗体は1週間に375mg/m2未満の投与量で投与される。別の実施形態においては、抗体はキャンパスであり、抗体は1週間に90mg未満の投与量で投与される。
【0022】
一実施形態においては、化合物は、NKG2、KIR2DL、またはKIR3DLヒト受容体の少なくとも1つに結合し、NK細胞の細胞毒性の関連NKG2、KIR2DL−、またはKIR3DL介在阻害を阻害する。別の実施形態においては、化合物は、KIR2DL1、KIR2DL2/3、KIR2DL4、KIR2DL5A、KIR2DL5B、KIR3DL1、KIR3DL2、KIR3DL3、LILRB1、NKG2A、NKG2C NKG2E、およびLILRB5より成る群から選択されるNK細胞の阻害性受容体を遮断する。別の実施形態においては、化合物は、KIR2DLヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL介在阻害を阻害する。別の実施形態においては、化合物は、KIR2DL1、KIR2DL2、およびKIR2DL3ヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、およびKIR2DL3介在阻害を阻害する。別の実施形態においては、化合物は、80位でLys残基を有するHLA−C対立遺伝子分子のヒトKIR2DL1受容体への結合、および80位にAsn残基を有するHLA−C対立遺伝子分子のヒトKIR2DL2およびKIR2DL3受容体への結合を阻害する。別の実施形態においては、化合物は、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200と同じエピトープに結合する。別の実施形態においては、化合物は、ヒトNK細胞の表面でKIR受容体に結合するために、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200と競合する。別の実施形態においては、化合物は、ハイブリドーマDF200またはそのフラグメントによって生成されるモノクローナル抗体DF200である。
【0023】
一実施形態においては、化合物は、NKp30、NKp44、NKp46、およびNKG2Dより成る群から選択される受容体に結合する。別の実施形態においては、化合物は、AZ20、A76、Z25、Z231、およびBAB281より成る群から選択されるモノクローナル抗体に由来するかまたはモノクローナル抗体に競合する。
【0024】
別の態様においては、本発明は、治療抗体とともに投与するための化合物を選択する方法を提供し、前記方法は、i)NK細胞の阻害性受容体を阻害し、または活性化受容体を刺激する試験化合物を提供する工程と、ii)NK細胞の存在下、および試験化合物の存在または非存在下に、治療抗体によって特異的に認識される標的細胞で治療抗体をインキュベートする工程と、iii)標的細胞を枯渇させるNK細胞の能力に対する化合物の効果を評価する工程とを含んで成り、化合物が標的細胞を枯渇させるNK細胞の能力を増強させるという検出が、方法における使用に適切であることを示す。
【0025】
一実施形態においては、化合物は、標的細胞を50%、60%、70%、80%、90%、100%、200%、300%、400%、500%もしくはそれ以上破壊する治療抗体の能力を増強する。別の実施形態においては、化合物は、抗体、抗体フラグメント、モノクローナル抗体、モノクローナル抗体のフラグメント、ヒト化抗体、キメラ抗体、およびヒト抗体より成る群から選択される。別の実施形態においては、標的細胞は、癌細胞、ウイルス感染細胞、または自己免疫疾患の基礎を成す細胞である。別の実施形態においては、治療抗体はリツキシマブまたはキャンパスである。
【0026】
別の態様においては、本発明は、対象におけるCD16によって結合されうる治療抗体の投与を含む治療の有効性を増大させる方法を提供し、前記方法は、前記治療抗体の投与前、投与と同時、または投与後に、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物の治療有効量を前記対象に投与する工程を含んで成る。一実施形態においては、化合物は、前記対象におけるADCCを増強させることによって治療の有効性を増大させる。
【0027】
本発明は、治療抗体の有効性を増大させるための方法を提供する。本発明は、より具体的には、化合物、好ましくは、NK細胞の阻害性受容体を遮断し、または活性化受容体を活性化することによって、NK細胞を増強しうる、好ましくは、抗体またはそのフラグメントの使用が、治療抗体の有効性を顕著に増大させうることを開示する。実際に、本発明者らは、複数の治療抗体の有効性が、NK細胞受容体、例えば、阻害性受容体に対する抗体の同時投与によって大きく増強されうることを明らかにする。
【0028】
したがって、本発明は、それを必要とする対象における疾患の治療方法に関し、
a)化合物、好ましくは、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する抗体またはそのフラグメントを前記対象に投与する工程と、
b)前記対象に治療抗体を投与する工程と
を含んで成る。
【0029】
前記治療抗体は、NK細胞のCD16によって、好ましくは、そのFc領域により結合されうる。
【0030】
好ましくは、前記治療抗体は、ヒトIgG1またはIgG3Fc部分、特にモノクローナル抗体またはそのフラグメント、さらに好ましくは、ヒト化、ヒトもしくはキメラ抗体またはそのフラグメント、例えばリツキシマブを有する。
【0031】
NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントは、治療抗体の投与の前、投与と同時に、または投与の後に対象に投与されうることが意図されている。異なる抗体の投与の方法は、そのバイオアベイラビリティおよび薬物動態によって決まる。好ましくは、治療抗体は、NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントの投与の1週間以内、より好ましくは、5もしくは2日間以内に投与される。好ましくは、治療抗体は、NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントの前またはこれと同時に投与される。
【0032】
別の態様においては、本発明は、治療抗体治療を受ける対象におけるADCCを増大させる方法に関し、前記方法は、NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントのADCCを増大させるのに十分な量を前記治療抗体の投与の前、投与と同時に、または投与の後に前記対象に投与する工程を含んで成る。前記治療抗体は、NK細胞でCD16によって、好ましくは、そのFc領域によって結合されうる。好ましくは、前記治療抗体は、ヒトIgG1またはIgG3Fc部分、特にモノクローナル抗体またはそのフラグメント、さらに好ましくは、ヒト、ヒト化もしくはキメラ抗体またはそのフラグメント、例えばリツキシマブを有する。
【0033】
別の態様においては、本発明は、対象における治療抗体治療の有効性を増大させる方法に関し、前記方法は、前記治療抗体の有効性を増大させるのに十分なNK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントの量を前記治療抗体の投与の前、投与と同時に、または投与の後に前記対象に投与する工程を含んで成る。前記治療抗体は、CD16によって、好ましくは、そのFc領域によって結合されうる。好ましくは、前記治療抗体は、ヒトIgG1またはIgG3Fc部分、特にモノクローナル抗体またはそのフラグメント、さらに好ましくは、ヒト、ヒト化もしくはキメラ抗体またはそのフラグメント、例えばリツキシマブを有する。
【0034】
定義
本明細書で使用される以下の用語は、別段の規定がない限り、それらに割り当てられた意味を有する。
【0035】
本明細書で使用される、「NK」細胞は、非従来的な免疫に関与するリンパ球の下位集団を指す。NK細胞は、CD16、CD56および/またはCD57を含む特異的表面抗原の発現、細胞表面でのアルファ/ベータまたはガンマ/デルタTCR複合体の非存在、特異的細胞溶解酵素の活性化によって「自己」MHC/HLA抗原を発現できない細胞に結合し、かつこれを殺傷する能力、NK活性化受容体のリガンドを発現する腫瘍細胞または他の疾患を殺傷する能力、および免疫応答を刺激または阻害するサイトカインと呼ばれるタンパク質分子を放出する能力など一部の特性および生物学的特性に基づいて同定されうる。これらの特性および活性のいずれかを使用し、当該分野において公知の方法を使用してNK細胞を同定することができる。
【0036】
本明細書で使用される「抗体」という用語は、ポリクローナルおよびモノクローナル抗体を指す。重鎖における定常ドメインの種類によって、抗体は5つの主要なクラス、すなわち、IgA、IgD、IgE、IgG、およびIgMの1つに割り当てられる。これらの一部はさらに、IgG1、IgG2、IgG3、IgG4などのサブクラスまたはアイソタイプに分割される。典型的な免疫グロブリン(抗体)の構造単位は四量体を含んで成る。四量体は、2つの同一ペアのポリペプチド鎖から成り、各ペアは1つの「軽」鎖(約25kDa)および1つの「重」鎖(約50−70kDa)を有する。各鎖のN末端は、主に抗原認識に関与する約100〜110もしくはそれ以上のアミノ酸の可変領域を規定する。可変軽鎖(VL)および可変重鎖(VH)という用語は、それぞれこれらの軽鎖および重鎖を指す。免疫グロブリンの異なるクラスに対応する重鎖定常ドメインは、それぞれ「アルファ」、「デルタ」、「エプシロン」、「ガンマ」、および「ミュー」と呼ばれる。免疫グロブリンの異なるクラスのサブユニット構造および三次元構成は公知である。IgGおよび/またはIgMは本発明において使用される抗体の好ましいクラスであり、IgGが特に好ましいが、これらそれらが生理学的状況下に最も共通の抗体であるためであり、それらは実験室状況下で最も容易に作られるためであり、かつIgGはFcガンマ受容体によって特異的に認識されるためである。好ましくは、本発明の抗体はモノクローナル抗体である。特に好ましいのは、ヒト化、キメラ、ヒト、または他のヒトに適切な抗体である。
【0037】
本発明の枠内で、「治療抗体または抗体」という用語は、より具体的には、患者における標的細胞を枯渇させる働きをする抗体を指す。特に、治療抗体は、標的細胞の表面上に存在する抗原、例えば、腫瘍細胞上に主に、またはのみに存在する腫瘍特異的抗原に特異的に結合する。好ましくは、治療抗体はヒトFcタンパク質を含み、またはヒトFc受容体と相互作用する能力がある。治療抗体は、例えば、ADCCまたはその他の手段によって細胞を標的にすることができ、かつ「ネイキッド」すなわち抱合部分なしであり、または放射性ラベルまたは毒素などの化合物と抱合されうる。
【0038】
「特異的に結合する」という用語は、抗体が、好ましくは、競合結合アッセイにおいて、結合パートナー、例えば、NKp30、NKp44、またはNKp46など活性化NK受容体、もしくはヒトFcガンマ受容体に結合しうることを意味するが、これはタンパク質の組換え形態、その中のエピトープ、または単離NKもしくは関連標的細胞の表面上に存在する天然タンパク質のいずれかを使用して評価される。特異的結合を測定するための競合結合アッセイおよび他の方法は、さらに以下に記載されており、当該分野において公知である。
【0039】
「ヒトに適切な」抗体は、例えば、本明細書に記載された治療方法のためにヒトにおいて安全に使用されうる抗体、誘導体化抗体、または抗体フラグメントを指す。ヒトに適切な抗体としては、抗体の少なくとも一部がヒト由来であり、またはその他の場合に天然のヒト以外の抗体が使用される場合に誘発される免疫応答を回避するために修飾される、すべての種類のヒト化、キメラ、もしくは完全にヒト抗体、または任意の抗体が挙げられる。
【0040】
「免疫原性フラグメント」によって、本明細書では、(i)前記フラグメントに結合する抗体および/または膜結合受容体およびそれに由来する突然変異体を含む前記フラグメントを含んで成る分子の形態に結合する抗体の生成、(ii)MHC分子および前記フラグメント由来のペプチドを含んで成る二分子複合体に反応するT細胞を含むT細胞反応の刺激、(iii)哺乳動物の免疫グロブリンをコード化する遺伝子を発現するバクテリオファージまたは細菌などトランスフェクト媒体の結合などの免疫応答を引き出すポリペプチドまたはペプチドフラグメントが意味される。あるいは、免疫原性フラグメントは、共有結合によって担体タンパク質に抱合されたペプチドフラグメント、そのアミノ酸配列に前記ペプチドフラグメントを含んで成るキメラ組換えポリペプチド構成物など上記の免疫応答を引き出す能力がある構成物も指し、かつ具体的には、その配列が前記フラグメントをコード化するタンパク質を含んで成るcDNAでトランスフェクトされた細胞を含む。
【0041】
本発明において、「ヒト化」抗体は、1つもしくはそれ以上のヒト免疫グロブリンの定常および可変枠組み領域が結合領域、例えば、動物の免疫グロブリンのCDRと融合される抗体を指す。かかるヒト化抗体は、結合領域がそれに由来するヒト以外の抗体の結合特異性を維持するが、ヒト以外の抗体に対する免疫反応を回避するようにデザインされている。
【0042】
「キメラ抗体」は、(a)定常領域、またはそのタンパク質が変化、置換、または交換され、抗原結合部位(可変領域)が異なるまたは変化クラスの定常領域、エフェクター機能および/または種、またはキメラ抗体に新しい特性を与える完全に異なる分子、例えば、酵素、毒素、ホルモン、成長因子、薬剤等につながり、または(b)可変領域、またはそのタンパク質が、異なるまたは変化抗原特異性を有する可変領域で変化、置換、または交換されている抗体分子である。本発明の好ましい実施形態においては、キメラ抗体は、いずれにせよ免疫グロブリンのFc領域、好ましくはヒトFc領域を維持し、それによって標的細胞の表面上でヒトFc受容体との相互作用を可能にする。
【0043】
本発明の枠内で、「増強」、「活性」、または「活性化」NK細胞は、生物学的に活性のNK細胞、より詳しくは、標的細胞を溶解する能力を有するNK細胞を指す。例えば、「活性」NK細胞は、NK活性化受容体リガンドを発現し、「自己」MHC/HLA抗原(KIR不適合細胞)を発現できない細胞を殺傷することができる。リダイレクト・キリング・アッセイ(redirected killing assay)における使用に適した標的細胞の例は、P815細胞およびK562細胞であるが、多くの細胞型のいずれかを使用することができ、これらは当該分野において公知である(例えば、シボリ(Sivori)ら(1997年)、J.Exp.Med.186、p.1129−1136、ビターレ(Vitale)ら(1998年)、J.Exp.Med.187、p.2065−2072、ペッシーノ(Pessino)ら(1998年)、J.Exp.Med.188、p.953−960、ネリ(Neri)ら(2001年)、Clin.Diag.Lab.Immun.8、p.1131−1135を参照)。「増強」、「活性」、または「活性化」細胞は、遊離細胞内カルシウムレベルにおけるサイトカイン(例えば、INF−γおよびTNF−α)産生など、NK活性と関係がある当該分野において周知の他の特性または活性によっても同定されうる。本発明において、「増強」、「活性」、または「活性化」NK細胞は、特に、阻害性受容体の刺激によって阻害されない、またはかかる阻害が、例えば、活性化受容体の刺激によって克服されているインビボでのNK細胞を指す。
【0044】
本明細書で使用される、「活性化NK受容体」という用語は、刺激されると、遊離細胞内カルシウムレベルにおけるサイトカイン(例えば、INF−γおよびTNF−α)産生などNK活性と関係がある当該分野において周知の他の特性または活性の測定可能な増大を引き起こし、かつ遊離細胞内カルシウムレベル、例えば、本明細書で別記されているリダイレクト・キリング・アッセイにおいて細胞に標的する能力、またはNK細胞増殖を刺激する能力を上げるNK細胞の表面上の分子を指す。「活性化KIR受容体」という用語は、NKp30、NKp44、NKp46、NKG2D、IL−12R、IL−15R、IL−18R、およびIL−21Rを含むが、これらに限定されない。本明細書で使用される「活性化NK受容体」という用語は、IL−2受容体(IL−2R)を除外する。NK細胞が活性か、または増殖性であるかどうかを判定する方法は、以下にさらに詳しく述べられており、当業者には公知である。
【0045】
本明細書で使用される、「阻害する」または「阻害」NK受容体」という用語は、刺激されると、サイトカイン(例えば、INF−γおよびTNF−α)産生などNK活性と関係がある当該分野において周知の他の特性または活性の測定可能な減少を引き起こし、かつ遊離細胞内カルシウムレベル、または例えば、本明細書で別記されているリダイレクト・キリング・アッセイにおいて標的細胞を溶解する能力を上げるNK細胞の表面上の分子を指す。かかる受容体の例としては、KIR2DL1、KIR2DL2/3、KIR2DL4、KIR2DL5A、KIR2DL5B、KIR3DL1、KIR3DL2、KIR3DL3、LILRB1、NKG2A、NKG2C NKG2E、およびLILRB5が挙げられる。NK細胞が活性かどうかを判定する方法は、以下にさらに詳しく述べられており、当業者には公知である。
【0046】
本発明において「NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する」という用語は、好ましくは、少なくとも1つの阻害または活性化NK細胞受容体、例えば、KIR、NKG2A/C、NKp30、NKp44、NKp46、および本明細書でリストアップされている他のものと直接相互作用し、かつ受容体の阻害シグナルを中和し(阻害性受容体の場合)、または受容体からのシグナル伝達を刺激する(活性化受容体の場合)一部の化合物、好ましくは、抗体、そのフラグメント、または誘導体の能力を指す。阻害性受容体により、好ましくは化合物、好ましくは抗体またはそのフラグメントが、HLAと受容体との間の相互作用を遮断することができる。化合物が抗体である場合、抗体はポリクローナル、または、好ましくは、モノクローナルでありうる。それらは、ハイブリドーマによって、または所望の可変または定常ドメインを発現するように改変された組換え細胞によって生成されうる。抗体は単鎖抗体、または抗原特異性および低ヒンジ領域またはその変形、例えばFabフラグメント、Fab’2フラグメント、CDR、およびScFvなどを保持する他の抗体誘導体でありうる。これらは、多機能抗体、組換え抗体、ヒト化抗体、またはその変形でありうる。
【0047】
本発明の枠内で、「共通の決定基」は、関連受容体の群、例えば、ヒトKIR2DL受容体群の一部のメンバーによって共有される決定基またはエピトープを指す。決定基またはエピトープは、前記メンバーによって共有されるペプチドフラグメントまたは立体構造エピトープを示しうる。特定の実施形態において、共通の決定基は、モノクローナル抗体DF200、NKVSF1、またはEB6によって認識されるエピトープを含んで成る。
【0048】
本発明の枠内で、共通の決定基に「結合する」抗体という用語は、特異性および/または親和性を有する前記決定基に結合し、例えば、実質的に、高い親和性または特異性で、ヒトNK細胞の表面において他の無関係のモチーフもしくは決定基または構造には結合することはない抗体を指す。より詳しくは、本発明によるモノクローナル抗体の前記決定基への結合は、前記抗体の別のエピトープまたは決定基への結合と区別されうる。
【0049】
NK細胞阻害性受容体に結合し、その刺激を防ぐことが可能な化合物、好ましくは抗体は、したがって「中和」または「阻害」化合物、好ましくは、それらが、少なくとも部分的に、NK細胞阻害性受容体、すなわち、KIRまたはNKG2A/C受容体によって介在される阻害シグナル伝達経路を遮断するという意味で、好ましくは抗体である。さらに重要なことには、この阻害活性は一部の種類のKIRまたはNKG2A/C受容体に関して表示されうるため、これらの化合物、好ましくは抗体は、さまざまな対象において高い効果とともに使用されうる。
【0050】
例えば、細胞、もしくは核酸、タンパク質、またはベクターに関連して使用される場合の「組換え」という用語は、細胞、核酸、タンパク質、またはベクターが異種の核酸もしくはタンパク質の導入、または天然の核酸またはタンパク質の変化によって修飾されていること、または細胞がこうして修飾された細胞由来であることを示す。したがって、例えば、組換え細胞は、細胞の天然の(非組換え)形態内には存在しない遺伝子を発現し、または、その他の場合には異常に発現し、過少発現し、またはまったく発現しない天然の遺伝子を発現する。
【0051】
本発明の枠内で、対象または患者は、哺乳動物の対象または患者、より好ましくは、ヒトの対象または患者を含む。
【0052】
治療抗体
本発明は、治療抗体とともにNK細胞増強化合物の使用に関する。多種多様の治療抗体を本発明において使用することができる。基本的に、「ネイキッド」または放射標識、毒素、もしくは他の部分で抱合されているかどうか、フラグメントか完全長であるかどうか、あるいは天然の抗体もしくは抗体の修飾誘導体であるかどうかに関係なくいかなる治療抗体も使用されうる。好ましくは、方法は、NK細胞活性が―必ずしも限定的ではないが―投与される治療抗体の有効性において役割を果たす治療の有効性を増強するために使用され、かつ好ましくは、抗体またはフラグメントは当然、ヒトFc領域、または、ヒトFc受容体、例えば、Fcガンマ受容体によって抗体の特異的認識を可能にする他のドメインを含み、または含むように修飾もされる。
【0053】
本化合物を使用し、治療抗体によって特異的に認識される抗原を発現する標的細胞を枯渇させる治療抗体の能力を増強させることができる。したがって、治療抗体によって標的されうる細胞によって少なくとも部分的に引き起こされ、または悪化される疾患または状態は、本明細書に記載された方法を使用することによって治療されうる。標的細胞の具体的な例としては、アレルギー、自己免疫疾患、同種反応等に関与する腫瘍細胞、ウイルス感染細胞、同種細胞、病的免疫担当細胞(例えば、Bリンパ球、Tリンパ球、抗原提示細胞等)、あるいは健康な細胞(例えば、抗血管新生治療法における内皮細胞)が挙げられる。本発明の枠内での最も好ましい標的細胞は、腫瘍細胞およびウイルス感染細胞である。治療抗体は、例えば、細胞毒性効果または細胞溶解を、特に抗体依存細胞介在細胞毒性(ADCC)によって介在しうる。
【0054】
ADCCは、その機能が、IgG感作抗原をFcγR保有細胞毒性細胞につなげ、かつ細胞活性化機構を始動させるIgGのFcタンパク質(FcγR)のための白血球受容体を必要とする。したがって、治療抗体は免疫複合体を形成する能力がある。例えば、免疫複合体は、治療抗体によってカバーされる腫瘍標的でありうる。より詳しくは、抗体はCD16によって、好ましくは、そのFc領域により結合されうる。治療抗体がCD16などFcγ受容体に結合するかどうかの判定は、適切なやり方によって、例えば、場合により支持体に固定される、組換え(recombantly)に生成されるCD16ポリペプチドまたはそのフラグメントへの結合を判定することによって、または例えば、CD16を発現することが知られ、または疑われる細胞への治療抗体の結合を判定することによって評価されうる。
【0055】
治療抗体はポリクローナル、または、好ましくは、モノクローナルでありうる。それらはハイブリドーマによって、または所望の可変およびは定常ドメインを発現するように改変された組換え細胞によって生成されうる。抗体は単鎖抗体、または抗原特異性および低ヒンジ領域またはその変形を保持する他の抗体誘導体でありうる。これらは多機能抗体、組換え抗体、ヒト化抗体、そのフラグメントまたは変形でありうる。前記フラグメントまたはその誘導体は、好ましくは、Fabフラグメント、Fab’2フラグメント、CDR、およびScFvから選択される。好ましくは、フラグメントは抗原結合フラグメントである。抗体フラグメントを含んで成る治療抗体としては、二重特異性抗体も挙げられるがこれに限定されず、適切な二重特異性抗体の一例は、CD16に特異的な抗原結合領域および腫瘍抗原に特異的な抗原結合領域を含んで成る。フラグメントを含んで成る他の抗体フォーマットとしては、単一ポリペプチド鎖上の2つの異なる抗体の結合領域を結合する組換え二重特異的抗体誘導体が挙げられ、これはBiTE(商標)とも呼ばれる(クファー(Kufer)Pら、TRENDS in Biotechnology 2004年、22(5)、p.238−244、およびボイエル(Baeuerle)ら、Current Opinion in Molecular Therpeitcs 2003年、5(4)、p.413−419、その開示は参照することにより本明細書に組込まれる)。
【0056】
治療抗体は一般に表面抗原、例えば、膜抗原に特異的である。最も好ましい治療抗体は、CD20、CD52、ErbB2(またはHER2/Neu)、CD33、CD22、CD25、MUC−1、CEA、KDR、αVβ3等、特にリンパ腫抗原(例えば、CD20)など腫瘍抗原(例えば、腫瘍細胞によって特異的に発現される分子)に特異的である。治療抗体は、好ましくは、ヒトまたはヒト以外の霊長類のIgG1またはIgG3Fc部分を有し、より好ましくは、ヒトIgG1部分を有する。
【0057】
一実施形態においては、抗体はADCC中にNK細胞と抗体の相互作用を増強するそのFcタンパク質における修飾を含みうる。かかる修飾治療抗体(「改変抗体」)は一般に、好ましくは、1つもしくはそれ以上のFcγRとの抗体の結合親和性を修飾するFc領域における修飾を含んで成る。1つもしくはそれ以上のFcγRとの修飾結合による抗体を修飾するための方法は当該分野において周知であり、例えば、その各々が参照することにより本明細書にその全体が組込まれる、PCT公開国際公開第2004/016750号パンフレット(国際出願PCT/US2003/025399号明細書)、国際公開第99/158572号パンフレット、国際公開第99/151642号パンフレット、国際公開第98/123289号パンフレット、国際公開第89/107142号パンフレット、国際公開第88/107089号パンフレット、および米国特許第5,843,597号明細書、および同第5,642,821号明細書を参照。
【0058】
関節リウマチを治療するために使用される、D2E7(ケンブリッジ・アンティボディ・テクノロジー・グループ(Cambridge Antibody Technology Group)、plc(英国(UK)、ケンブリッジ/BASF(ドイツ、ルートビヒスハーフェン(Ludwigshafen))、またはインフリキシマブ(Infliximab)(セントコール社(Centocor,Inc.)、ペンシルバニア州(PA)、マルバーン(Malvern)、クローン病および関節リウマチの治療に使用)など本明細書で識別された治療抗体、または国際特許出願PCT/US2003/025399号明細書(参照することにより本明細書にその全体が組込まれる)に開示された抗体は、上記および下記の出願において開示されているように修飾され、かかる抗体が通常使用される疾患の治療に使用されうる。一部の実施形態においては、本発明は、活性化FcγR、例えば、FcγRIIIに対する改変親和性、高低いずれかの親和性を有する改変抗体を提供する。一部の好ましい実施形態においては、FcγRに対する高い親和性を有する改変抗体が提供される。好ましくは、かかる修飾は改変Fc介在エフェクター機能も有する。
【0059】
Fc介在エフェクター機能に影響を及ぼす修飾は当該分野において公知である(例えば、参照することにより本明細書にその全体が組込まれる、米国特許第6,194,351号明細書を参照)。修飾されうるアミノ酸としては、プロリン329、プロリン331、およびリジン322が挙げられるが、これらに限定されない。プロリン329および/または331およびリジン322は、好ましくは、アラニンで差し替えられうるが、他のアミノ酸による代替も考えられる。参照することにより本明細書にその全体が組込まれる、国際公開第00/142072号パンフレットおよび米国特許第6,194,551号明細書を参照。
【0060】
したがって、Fc領域の修飾は、抗体Fc領域に存在するアミノ酸への1つもしくはそれ以上の改変を含んで成りうる。かかる改変は結果として改変抗体介在エフェクター機能、他のFc受容体(例えば、Fc活性化受容体)への改変結合、改変ADCC活性、改変Clq結合活性、改変補体依存細胞毒性活性、またはその組合せを有する抗体が生じうる。
【0061】
一実施形態においては、抗体は、FCGR3A(CD16、FCGR3、免疫グロブリンG Fc受容体III;IGFR3、IgGのFcフラグメントの受容体、低親和性IIIaとも呼ばれる;例えば、OMIM146740を参照)、FCGR2A(CD32、CDw32、IgGのFcフラグメントの受容体、低親和性IIa、FCG2、免疫グロブリンG Fc受容体IIとも呼ばれる;例えば、OMIM146790を参照);FCGR2B(CD32、IgGのFcフラグメントの受容体、低親和性IIb;FCGR2B、FC−γ−RIIBとも呼ばれる;例えば、OMIM604590を参照)、FCG1RA(CD64;IgGのFcフラグメントの受容体、高親和性Ia;IGFR1とも呼ばれる;例えば、OMIM146760を参照);IgGのFCGR1フラグメント、高親和性Ic、免疫グロブリンG Fc受容体IC、IGFRC;例えば、OMIM601503を参照);またはFCGR1B(CD64、IgGのFcフラグメントの受容体、高親和性Ib;免疫グロブリンG Fc受容体IB;IGFRBとも呼ばれる;例えば、OMIM601502を参照)などのFcガンマ受容体によって特異的に認識される。
【0062】
本発明の治療抗体の代表的な例は、リツキシマブ、アレムツズマブ、およびトラスツズマブである。かかる抗体は、ヒト対象における使用に承認されている臨床プロトコールに従って使用されうる。治療抗体のさらなる具体例としては、例えば、エプラツズマブ、バシリキシマブ、ダクリズマブ、セツキシマブ、ラベッツズマブ、セビルマブ、ツブリマブ、パリビズマブ、インフリキシマブ、オマリズマブ、エファリズマブ、ナタリズマブ、クレノリキシマブ等が挙げられる。場合により、NK細胞活性化受容体を刺激する化合物がサイトカインである場合、治療抗体はリツキシマブまたはヘルセプチン以外の抗体であり、または場合により抗CD20もしくは抗HER2/neu抗体以外の抗体である。本発明による使用に好ましい治療抗体の他の例としては、抗フェリティン抗体(米国特許公開第2002/0106324号明細書)、抗p140および抗sc5抗体(国際公開第02/50122号パンフレット)、および抗KIR(キラー阻害性受容体)抗体が挙げられ(KIR受容体は、キャリントン(Carrington)およびノーマン(Norman)、KIR遺伝子クラスター(The KIR Gene Cluster)、2003年5月3日、http://www.ncbi.nlm.nih.gov/booksで入手可能)、上記の文献の各々の開示は参照することにより本明細書に組込まれている。治療抗体の他の例は以下の表にリストアップされており、そのいずれか(およびその他)を本方法において使用されうる。それらが以下の表にリストアップされているか、本明細書で別記されているかどうかに関係なく、好ましくは、ADCCによって標的細胞を枯渇させうる抗体は、本方法から恩恵を受けることができ、以下の表1は、表中にリストアップされた抗体に関しても、リストアップされている抗体の標的または適応に関しても非網羅的であることが理解されるであろう。
【0063】
【表1】

【0064】
【表2】

【0065】
【表3】

【0066】
【表4】

【0067】
【表5】

【0068】
NK細胞活性調節化合物
NK細胞活性は、刺激および阻害シグナルを含む複雑な機序によって調節される。したがって、有効なNK細胞介在療法は、これらの細胞の刺激または阻害シグナルの中和によって達成されうる。NK細胞の阻害性受容体を遮断し、阻害し、または減少させる効果、またはNK細胞の活性化受容体の活性または発現を活性化し、または刺激し、またはさもなければ促進する効果を有する化合物が使用されうることが理解されるであろう。これにはNK細胞受容体に結合し、それらを直接阻害し、または刺激しうるサイトカインのほか、小分子、ポリペプチド、および抗体などの化合物が含まれる。受容体が遮断され、または刺激される機序は、本発明によって提供される利点には重要ではないことも理解されるであろう。例えば、化合物は活性化受容体の発現を増大させ、または阻害性受容体の発現を阻害し、化合物はリガンドと阻害性受容体との相互作用を阻止し、またはリガンドと活性化受容体との相互作用を増強し、または化合物は受容体に直接結合し、それらを阻害し(阻害性受容体の場合)、またはそれらを活性化し(活性化受容体の場合)うる。重要なパラメータは、化合物がインビボでその標的細胞を枯渇させる治療抗体の能力に対して有する効果である。
【0069】
NK細胞の表面上の阻害性受容体は、本化合物によって標的されうる。NK細胞は主要組織適合複合体(MHC)クラスI特異的阻害性受容体によってネガティブに調節される(ケレ(Kaerre)ら、1986年、エーレン(Oehlen)ら、1989年、その開示は参照することにより本明細書に組込まれる)。これら特異的な受容体は、主要組織適合複合体(MHC)クラスI分子またはHLAの多形決定基に結合し、ナチュラルキラー(NK)細胞溶解を阻害する。ヒトにおいては、キラーIg様受容体(KIR)と呼ばれる受容体のファミリーがHLAクラスI対立遺伝子を認識する。
【0070】
KIR2DL、KIR2DS、KIR3DL、およびKIR3DSを含むKIR受容体のいくつかの群がある。2つのIgドメイン(KIR2D)を有するKIR受容体は、HLA−Cアロタイプを識別する。すなわち、KIR2DL2(以前はp58.1と呼ばれる)または密接に関係した遺伝子産物KIR2DL3は群2HLA−Cアロタイプ(Cw1、3、7、および8)によって共有されるエピトープを認識するが、KIR2DL1(p58.2)は相互群1HLA−Cアロタイプ(Cw2、4、5、および6)によって共有されるエピトープを認識する。KIR2DL1による認識は、HLA−C対立遺伝子の80位でのLys残基の存在によって決定される。KIR2DL2およびKIR2DL3認識は、80位でのAsn残基の存在によって決定される。重要なことには、HLA−C対立遺伝子の大多数は、80位でAsnまたはLys残基のいずれかを有する。3つのIgドメイン、KIR3DL1(p70)を有する1つのKIRは、HLA−Bw4対立遺伝子によって共有されるエピトープを認識する。結局、3つのIgドメインKIR3DL2(p140)を有する分子のホモ二量体は、HLA−A3および−A11を認識する。
【0071】
KIRおよび他のクラスI阻害性受容体(モレッタ(Moretta)ら、1997年、バリアンテ(Valiante)ら、1997年、ラニエール(Lanier)、1998年、その開示は参照することにより本明細書に組込まれる)はNK細胞によって、所定の個別のNKレパートリーにおいて同時発現されうるが、単一のKIRを発現する細胞があり、したがって、対応するNK細胞は特異的クラスI対立遺伝子群を発現する細胞によってのみ遮断される。したがって、下記のとおり、阻害性受容体が標的される場合、本方法はしばしば複数の阻害性受容体を標的する化合物の投与を含み、それによって最大範囲のNK細胞に達する広範囲にわたる効果を確実にする。
【0072】
一部の実施形態においては、化合物、好ましくは、抗体またはそのフラグメントがNK細胞の阻害性受容体を遮断し、KIR2DL2、KIR2DL3、KIR2DL1、KIR3DL1、KIR3DL2、NKG2A、およびNKG2Cより成る群から選択される少なくとも1つの阻害性受容体の阻害シグナルを中和する。より好ましくは、NK細胞の阻害性受容体を遮断する化合物、抗体またはそのフラグメントは、好ましくは、KIR2DL2、KIR2DL3、および/またはKIR2DL1の阻害シグナルを中和する化合物、好ましくは、抗体またはそのフラグメントである。
【0073】
本発明は、NK細胞の異なる阻害性受容体を遮断する一部の化合物、好ましくは、抗体またはそのフラグメントの組合せの使用にも関する。好ましくは、NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントは、KIR2DL1、KIR2DL2、KIR2DL3、KIR3DL1、KIR3DL2、NKG2A、およびNKG2Cから選択される阻害性受容体に特異的であり、NK細胞の細胞毒性の関連KIR−またはNKG2A/C介在阻害を阻害することができる。例えば、NK細胞の阻害性受容体を遮断する化合物は、KIR2DL1に特異性を有する抗体、およびKIR2DL2および/またはKIR2DL3に特異性を有する別の抗体を含んで成りうる。より好ましくは、NK細胞の阻害性受容体を遮断する化合物の組合せは、NK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、およびKIR2DL3介在阻害を阻害することができる。他の実施形態においては、1つもしくはそれ以上の阻害性受容体を標的する1つもしくはそれ以上の化合物、および1つもしくはそれ以上の活性化受容体を標的する1つもしくはそれ以上の化合物の混合物を投与する。
【0074】
例えば、KIR2DL1に特異的なモノクローナル抗体は、KIR2DL1Cw4(または同様のもの)対立遺伝子を遮断することが示されている(モレッタら、1993年、その開示は参照することにより本明細書に組込まれる)。他の例では、KIR2DL2/3に対するモノクローナル抗体もKIR2DL2/3HLACw3(または同様のもの)対立遺伝子を遮断することが記載されている(モレッタら、1993年)。抗NKG2A抗体は、NKG2AとHLA−Eとの阻害相互作用を遮断することが示されている。
【0075】
所望により、抗体は、GL183(KIR2DL2、L3、イムノテック(Immunotech)(フランス)、およびベクトン・ディッキンソン(Beckton Dickinson)(米国)から入手可能)、EB6(KIR2DL1、イムノテック(フランス)、およびベクトン・ディッキンソン(米国)から入手可能)、AZ138(KIR3DL1、モレッタら、ジェノバ大学(Univ.Genova)(イタリア)から入手可能)、Q66(KIR3DL2、イムノテック(フランス)から入手可能)、Z270(NKG2A、イムノテック(フランス)から入手可能)、P25(NKG2A/C、モレッタら、ジェノバ大学(イタリア)から入手可能)、およびDX9、Z27(KIR3DL1、イムノテック(フランス)、およびベクトン・ディッキンソン(米国)から入手可能)より成る群から選択されうる。
【0076】
好ましい態様においては、本発明は、モノクローナル抗体、ならびにそのフラグメントおよび誘導体を使用し、前記抗体、フラグメント、または誘導体は、NK細胞の表面で一部のKIRまたはNKG2A/C受容体と交差反応し、その阻害シグナルを中和する。
【0077】
一実施形態においては、本発明は、ヒトKIR2DL受容体の共通の決定基に結合し、かつ対応する阻害経路を阻害するモノクローナル抗体を使用する。好ましくは、本発明は、ヒトNK細胞の表面でKIR2DL1およびKIR2DL2/3受容体に結合し、かつNK細胞の細胞毒性のKIR2DL1−およびKIR2DL2/3介在阻害を阻害するモノクローナル抗体を使用する。抗体は、HLA−c分子のKIR2DL1およびKIR2DL2/3受容体への結合を特異的に阻害する。より好ましくは、抗体は、インビボでNK細胞活性を促進する。KIR2DL1およびKID2DL3(またはKIR2DL2)は、HLA−Cアロタイプ、それぞれ群1HLA−Cアロタイプおよび群2HLA−Cアロタイプの大部分をカバーするために十分であるため、かかる抗体を使用し、大部分のヒト個体、通常、ヒト個体の約90%もしくはそれ以上において治療抗体の有効性を増大させることができる。かかる実施形態においては、2004年7月1日出願の「NK細胞活性を調節するための組成物および方法(Compositions and methods for regulating NK cell activity)」という名称のPCT特許出願第PCT/FR04/01702号明細書に記載された抗体のいずれかを本発明に従って使用されうるが、その開示は参照することにより本明細書に組込まれる。
【0078】
本発明の特定の目的において、NK細胞の阻害性受容体を遮断する抗体はモノクローナル抗体であり、ここで前記抗体はKIR2DLヒト受容体の共通の決定基に結合し、NK細胞の細胞毒性のKIR2DL介在阻害を阻害する。抗体は、より具体的には、それぞれハイブリドーマDF200およびNKVSF1によって生成されるモノクローナル抗体DF200またはNKVSF1と同じエピトープに結合し、かつ/またはヒトNK細胞の表面でKIR受容体に結合するために、それぞれハイブリドーマDF200およびNKVSF1によって生成されるモノクローナル抗体DF200またはNKVSF1と競合する。先に述べたように、抗体が前記抗体と結合のために競合するかどうかを判定する抗体、機能的アッセイ、およびアッセイの例は、PCT特許出願第PCT/FR04/01702号明細書に記載されている。
【0079】
具体的な実施形態において、モノクローナル抗体はハイブリドーマDF200によって生成されるモノクローナル抗体DF200である。別の実施形態においては、モノクローナル抗体はEB6であり、または抗体はモノクローナルEB6と同じエピトープに結合し、またはモノクローナル抗体EB6と結合のために競合する。他の実施形態においては、抗体は、抗体DF200またはEB6のいずれかのフラグメントまたは誘導体である。抗体DF200を生成するハイブリドーマは、識別番号「DF200」、登録番号CNCMI−3224、登録日2004年6月10日(Collection Nationale de Cultures de Microorganismes、パスツール研究所(Institut Pasteur)、25、Rue du Docteur Roux、F−75724 Paris Cedex 15(フランス))のCNCM菌株保存機関で寄託されている。抗体NKVSF1は、セロテック(Serotec)(セルジー・サン・クリストフ(Cergy Sainte−Christophe)(フランス))(カタログ参照番号MCA2243)から入手可能である。
【0080】
本発明の別の実施形態においては、治療抗体の有効性を増強するために使用される化合物は、NK細胞の活性化受容体を刺激する。任意の活性化受容体、例えば、NKp30(例えば、その開示が参照することによりその全体が本明細書に組込まれる、PCT国際公開第01/36630号パンフレットを参照)、NKp44(例えば、その開示が参照することによりその全体が本明細書に組込まれる、ビターレら(1998年)、J.Exp.Med.187、p.2065−2072を参照)、NKp46(例えば、その開示が参照することによりその全体が本明細書に組込まれる、シボリら(1997年)、J.Exp.Med.186、p.1129−1136、ペッシーノら(1998年)、J.Exp.Med.188、p.953−960を参照)、NKG2D(例えば、OMIM602893を参照)、IL−12R、IL−15R、IL−18R、IL−21R、または活性化KIR受容体、例えば、KIR2DS4受容体(キャリントンおよびノーマン、KIR遺伝子クラスター(The KIR Gene Cluster)、2003年5月3日、http://www.ncbi.nlm.nih.gov/booksで入手可能)、またはNK細胞の実質的なフラクションに存在する他の受容体を使用することができ、その活性化は、好ましくは、細胞が以前に阻害KIR受容体など阻害性受容体によって阻害されている場合でも、細胞の活性化または増殖をもたらす。化合物は、ポリペプチド、小分子、および抗体を含む分子的実体でありうる。典型的な化合物としては、活性化受容体と相互作用する天然、組換え、または合成リガンドを含むリガンドが挙げられる。例えば、NK細胞の活性化受容体を刺激する化合物は、IL−12受容体(IL−12R)と相互作用するIL−12、IL−15受容体(IL−15R)と相互作用するIL−15、IL−18受容体(IL−18R)と相互作用するIL−18、IL−21受容体(IL−21R)と相互作用するIL−21などのサイトカインでありうる。かかる化合物は、例えば、IL−12(リサーチ・ダイアグノスティックス(Research Diagnostics)、ニュージャージー州(NJ)、DI−212)、IL−15(リサーチ・ダイアグノスティックス、ニュージャージー州(NJ)、RDI−215)、IL−21(アサノ(Asano)ら、FEBS Lett.2002年、528、p.70−76)から周知である。好ましくは、NK細胞の活性化受容体を刺激する化合物は、IL−2以外の化合物である。NK細胞の活性化受容体を刺激する他の典型的な化合物は、NKp30、NKp44、NKp46、NKG2D、KIR2DS4、および他の活性化KIR受容体より成る群から選択されるNK細胞受容体に結合する抗体を含む。
【0081】
一部の好ましい実施形態においては、活性化受容体は、NK細胞に存在する天然細胞毒性受容体(NCR)、好ましくは、NKp30、NKp44、またはNKp46より成る群から選択されるNCRであり、かつ活性化受容体を刺激する化合物は、同じエピトープに結合し、またはAZ20、A76、Z25、Z231、およびBAB281より成る群から選択されるモノクローナル抗体のいずれかと結合のために競合する。
【0082】
本明細書に記載されたNK細胞受容体のいずれかへの化合物の結合は、さまざまな標準方法のいずれかを使用して検出されうる。例えば、比色ELISA型アッセイを、免疫沈降およびラジオイムノアッセイと同様に使用することができる。競合アッセイは、例えば、試験化合物をNK細胞受容体に結合することが周知の化合物と比較するために使用されうるが、ここで対照(例えば、NKp46に特異的に結合するBAB281)および試験化合物は混合(または予備吸着)され、エピトープ含有タンパク質、例えば、BAB28の場合には、NKp46を含有する試料に適用される。ELISA、ラジオイムノアッセイ、ウェスタンブロット法、およびBIACOREの使用に基づくプロトコールが、かかる単純な競合における使用に適しており、当該分野において公知である。
【0083】
NK細胞の細胞毒性のKIR−またはNKG2A/C介在阻害の阻害、またはNK細胞のNKp30、NKp44、NKp46、またはNKG2D介在活性化の刺激は、さまざまなアッセイまたは試験、例えば結合、細胞毒性、もしくは他の分子または細胞アッセイによって評価されうる。
【0084】
具体的な変形においては、阻害活性は、前記化合物、好ましくは、抗体の、それぞれHLA−CまたはHLA−E陽性標的でのKIRまたはNKG2A/C陽性NKクローンの溶解を再構成する能力によって示される。別の具体的な実施形態においては、化合物、好ましくは、抗体は、HLA−C分子のKIR2DL1およびKIR2DL3(または密接に関係したKIR2DL2)受容体への結合を阻害するものとして、さらに好ましくは、Cw1、Cw3、Cw7、およびCw8から選択されるHLA−C分子(または80位でAsn残基を有するHLA−c分子)のKIRSDL2/3への結合、およびCw2、Cw4、Cw5、およびCw6から選択されるHLA−C分子(または80位でLys残基を有するHLA−c分子)のKIR2DL1への結合を変化させるその能力として規定される。
【0085】
本発明の化合物、好ましくは、抗体の阻害または増強活性は、例えば、その開示が参照することにより本明細書に組込まれる、シボリら(1997年)、J.Exp.Med.186、p.1129−1136において記載されている細胞内遊離カルシウムに対するその効果によって、多くの方法のいずれかにおいて評価されうる。NK細胞活性も細胞ベースの細胞毒性アッセイ、例えば、その各々の全体の開示が参照することにより本明細書に組込まれる、シボリら(1997年)、J.Exp.Med.186、p.1129−1136、ビターレら(1998年)、J.Exp.Med.187、p.2065−2072、ペッシーノら(1998年)、J.Exp.Med.188、p.953−960、ネリら(2001年)、Clin.Diag.Lab.Immun.8、p.1131−1135、ペンデ(Pende)ら(1999年)、J.Exp.Med.190、p.1505−1516)に開示されている、P815、K562細胞、または適切な腫瘍細胞など標的細胞を殺傷するNK細胞を刺激する抗体の能力を評価するなど、クロム遊離の測定によって評価されうる。適切な細胞毒性アッセイは、本明細書の実施例の部でも示される。好ましい実施形態においては、抗体はNK細胞毒性における少なくとも10%の増強、好ましくは、NK細胞毒性における少なくとも40%または50%の増強、またはより好ましくは、NK細胞毒性における少なくとも70%の増強を引き起こす。
【0086】
NK細胞活性もサイトカイン放出アッセイを用いて検討されうるが、ここでNK細胞はNK細胞のサイトカイン産生(例えば、IFN−γおよびTNF−α産生)を刺激する抗体でインキュベートされる。典型的なプロトコールにおいては、PBMCからのIFN−γ産生は、細胞表面および細胞質内染色、および培養の4日後のフローサイトメトリーによる分析によって評価される。手短に言えば、ブレフェルジン(Brefeldin)A)(シグマ・アルドリッチ(Sigma Aldrich)が培養の最後の4時間に最終濃度5μg/mlで添加される。次いで、細胞は透過化前に抗CD3および抗CD56mAbでインキュベートし(IntraPrep)(商標)、ベックマン・コールター(Beckman Coulter)、PE抗IFN−γまたはPE−IgG1(ファルミンゲン(Pharmingen))で染色する。ポリクローナル活性化NK細胞からのGM−CSFおよびIFN−γ産生はELISAを使用して上清において測定される(GM−CSF:DuoSet ELISA、R&Dシステムズ(Systems)、ミネソタ州(MN)、ミネアポリス(Minneapolis)、IFN−γ:OptE1Aセット、ファルミンゲン)。
【0087】
好ましい実施形態においては、ヒトNK細胞を活性化する抗体の能力が評価されるが、ここで少なくともヒトNK細胞ならびにヒト以外のNK細胞を活性化する能力は、化合物が本発明における使用に適切であることを示す。特に、インビトロまたはインビボでNK細胞による適切な標的細胞の枯渇を方向づける治療抗体の能力を増強する化合物の能力が評価されうる。
【0088】
本発明の化合物、好ましくは、抗体は、部分的な阻害または刺激活性を示し、例えば、NK細胞の細胞毒性のKIR2DL介在阻害を部分的に削減し、またはNCRまたは他の受容体の任意の刺激レベルによりNK細胞を部分的に活性化しうる。最も好ましい化合物は、例えば、化合物の非存在下に細胞との比較において、細胞毒性アッセイで測定されるように、NK細胞の活性の少なくとも20%、好ましくは、少なくとも30%、40%、または50%、もしくはそれ以上、阻害(または、活性化受容体の場合には、刺激)することが可能である。化合物の非存在下に枯渇レベルに対して10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、400%、500%、1000%、もしくはそれ以上、標的細胞の枯渇の増大を提供しうる化合物も好ましい。あるいは、本発明の好ましい化合物、好ましくは、抗体は、適合もしくはHLA適合性または自己標的細胞集団、すなわち、前記抗原の非存在下にNK細胞によって有効に溶解される細胞集団の溶解を引き起こすことができる。したがって、本発明の化合物は、インビボでNK細胞活性を促進するものとしても規定されうる。
【0089】
本発明は、NK細胞の活性化受容体を刺激し、または好ましくは、その阻害性受容体を遮断する化合物が、Fabフラグメント、Fab’2フラグメント、CDR、およびScFvを含むがこれらに限定されない、実質的に同じ抗原特異性を有するかかるモノクローナル抗体のフラグメントである実施形態にも関する。さらに、モノクローナル抗体は、ヒト化、ヒト、またはキメラ(例えば、二重特異的または機能化抗体)でありうる。活性化受容体を刺激する抗体もフラグメントでありうるが、それらは完全長であることが好ましい。例えば、修飾配列もしくは抱合異種官能基または他の化合物を有する誘導体は、本明細書に記載された抗体のいずれかのために使用されうる。
【0090】
本発明によるNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する抗体は、当該分野において周知のさまざまな技術によって生成されうる。通常、それらはKIR、NKG2A/C、NCR(例えば、NKp30、NKp44、NKp46)、またはNKG2Dポリペプチド、またはポリペプチドのいずれかの免疫原性フラグメント、および脾細胞の(適切な細胞系との融合によってハイブリドーマを産生する)コレクションを含んで成る免疫原によるヒト以外の動物の免疫付与によって産生される。さまざまな種からモノクローナル抗体を生成する方法は当該分野において公知である(例えば、その開示が参照することにより本明細書に組込まれる、ハーロー(Harlow)ら、「抗体:実験室マニュアル(Antibodies:A laboratory Manual)」、CSHプレス(Press)、1998年、ゴーディング(Goding)、「モノクローナル抗体:原理と実践(Monoclonal Antibodies:Principles and Practice)」、アカデミック・プレス(Academic Press)、1986年を参照)。より具体的には、これらの方法は、ヒト以外の動物を抗原で免疫付与した後、脾細胞を回収し、次いでこれを骨髄腫細胞など不死化細胞と融合する工程を含んで成る。結果として生じるハイブリドーマは、モノクローナル抗体を産生し、限界希釈によって選択され、個々のクローンを単離することができる。抗体は、例えば、その開示が参照することにより本明細書に組込まれる、ワード(Ward)ら(1989年)に開示されている免疫グロブリンのコンビナトリアルライブラリーの選択によっても生成されうる。
【0091】
本発明によるNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する好ましい抗体は、活性化または抑制性NK細胞受容体、例えば、KIR2DLポリペプチド、より好ましくは、ヒトKIR2DLポリペプチドを含んで成る免疫原による免疫付与によって調製される。KIR2DLポリペプチドは、ヒトKIR2DLポリペプチド、またはそのフラグメントもしくは誘導体、通常、免疫原性フラグメント、すなわち、エピトープ、好ましくは、TまたはB細胞エピトープを含んで成るポリペプチドの一部の完全長配列を含んで成りうる。かかるフラグメントは通常、成熟ポリペプチド配列の少なくとも7連続アミノ酸、より好ましくは、その少なくとも10連続アミノ酸を含む。それらは実質的に受容体の細胞外ドメイン由来である。好ましい実施形態においては、免疫原は、脂質膜、通常、細胞の表面において野生型のヒトKIR2DL、NCR、または他のポリペプチドを含んで成る。具体的な実施形態においては、免疫原は、場合により処置または溶解された無傷NK細胞、特に無傷ヒトNK細胞を含んで成る。
【0092】
治療抗体は、CD16など受容体によるその結合を増大させるために修飾されたFc領域を有しうるが、一部の実施形態においては、NK細胞増強抗体はFc受容体のためにその親和性を削減するために改変されたFc領域を有し、そのことによって抗体により結合されたNK細胞自体が結合され、かつ溶解される可能性を削減することになる。
【0093】
NK細胞のKIR2DL受容体を遮断する抗体は、i)KIR2DLポリペプチドを含んで成る免疫原でヒト以外の哺乳動物を免疫付与する工程と、ii)前記免疫付与動物からモノクローナル抗体を調製し、ここで前記モノクローナル抗体が前記KIR2DLポリぺプチドに結合する工程と、iii)KIR2DLポリペプチドの少なくとも2つの異なる血清型と交差反応する工程ii)からモノクローナル抗体を選択する工程と、iv)NK細胞のKIR2DL介在阻害を阻害する(c)のモノクローナル抗体を選択する工程とを含んで成る方法によって生成されうる。
【0094】
工程(iii)と(iv)の順序は変更されうる。場合により、方法はさらに、以下で述べるように、モノクローナル抗体のフラグメントまたは誘導体を作るさらなる工程含んで成りうる。
【0095】
他の変形においては、方法は、i)ライブラリーまたはレパートリーから、KIR2DLポリペプチドの少なくとも2つの異なる血清型と交差反応するモノクローナル抗体またはそのフラグメントもしくは誘導体を選択する工程と、NK細胞のKIR2DL介在阻害を阻害する工程i)からの抗体を選択する工程とを含んで成る。
【0096】
これらの方法のいずれかを使用し、1つもしくはそれ以上のエピトープを共有する(阻害または活性化)NK細胞受容体のいずれかの群に特異的である任意の抗体または抗体フラグメントを選択することができる。例えば、NK細胞のKIR3DLまたはNKG2A/C受容体を遮断し、またはNK細胞の活性化受容体を刺激する抗体の調製のために同様の方法を使用することができる。
【0097】
好ましい実施形態においては、これらの方法で使用され、または本明細書に記載された抗体のいずれかの生成に使用されるヒト以外の動物は、齧歯動物(例えば、マウス、ラット等)、ウシ、ブタ、ウマ、ウサギ、ヤギ、ヒツジ等など哺乳動物である。
【0098】
また、本明細書に記載された抗体のいずれかは遺伝子組換えされ、またはヒトに適切であるように、例えば、ヒト化、キメラ、またはヒト抗体に改変されうる。抗体をヒト化する方法は当該分野において公知である。一般に、本発明によるヒト化抗体は、元の抗体からそれに導入される1つもしくはそれ以上のアミノ酸残基を有する。これらのマウスまたは他のヒト以外のアミノ酸残基はしばしば「輸入」残基と呼ばれ、通常、「輸入」可変ドメインから取られる。ヒト化は本質的に、ウィンター(Winter)と同僚らの方法に従って実施されうる(ジョーンズ(Jones)ら(1986年)ネイチャー(Nature) 321、p.522、リーヒマン(Riechmann)ら(1988年)ネイチャー(Nature) 332、p.323、ベルホイエン(Verhoeyen)ら(1988年)サイエンス(Science) 239、p.1534(1988年))。場合によっては、かかる「ヒト化」抗体はキメラ抗体であり(キャビリー(Cabilly)ら、米国特許第4,816,567号明細書)、実質的に決して無傷とはいえないヒト可変ドメインが元の抗体からの対応する配列によって置換されている。実際には、本発明によるヒト化抗体は通常、一部のCDR残基およびおそらく一部のFR残基が元の抗体における類似の部位からの残基によって置換されているヒト抗体である。
【0099】
「ヒト化」モノクローナル抗体を作る別の方法は、免疫付与に使用されるマウスとしてクセノマウス(XenoMouse)(登録商標)(アブゲニックス(Abgenix)、カリフォルニア州(CA)、フレモント(Fremont))の使用である。クセノマウスは、その免疫グロブリン遺伝子が機能的ヒト免疫グロブリン遺伝子によって置換されたマウス宿主である。したがって、このマウスによって、またはこのマウスのB細胞から作られたハイブリドーマにおいて生成された抗体は、すでにヒト化されている。クセノマウスは、米国特許第6,162,963号明細書に記載されており、これは参照することによりその全体が本明細書に組込まれる。類似の方法はHuMAb−マウス(HuMAb−Mouse)(商標)(メダレックス(Medarex))を使用して得られうる。
【0100】
ヒト抗体は、免疫付与のために、さまざまな他の方法に従って、例えば、ヒト抗体レパートリーを発現するように改変されている他のトランスジェニック動物を使用することによって(ヤコボビッツ(Jakobovitz)ら、ネイチャー(Nature) 362(1993年)、p.255)、またはファージディスプレイ法を使用するアリの体レパートリーの選択によっても生成されうる。かかる方法は等業者には周知であり、本出願で開示されているモノクローナル抗体から始めて使用されうる。
【0101】
本発明の抗体は「キメラ」抗体(免疫グロブリン)にも誘導化されうるが、ここで重鎖および/または軽鎖のタンパク質は元の抗体における対応する配列と同一または同種であると同時に、残りの鎖は別の種由来の抗体における対応する配列と同一または同種であり、またはそれらが所望の生物学的活性を示す限り、別の抗体クラスまたはサブクラス、ならびにかかる抗体のフラグメントに属する(キャビリーら、上記を参照、モリソン(Morrison)ら(1984年)Proc.Natl.Acad.Sci.81、p.6851)。
【0102】
NK細胞の阻害性受容体を遮断し、またはNK細胞の活性化受容体を刺激する化合物が抗体である場合、かかる抗体がポリクローナル、または好ましくは、モノクローナルでありうることも理解されるであろう。抗体は、ハイブリドーマによって、または所望の可変および定常ドメインを発現するように改変された組換え細胞によって生成されうる。抗体は単鎖抗体または抗原特異性および低ヒンジ領域またはその変形を保持する他の抗体誘導体でありうる。抗体は、多機能抗体、組換え抗体、ヒト化抗体、またはそのフラグメントもしくは誘導体でありうる。前記フラグメントまたはその誘導体は、好ましくは、Fabフラグメント、Fab’2フラグメント、CDR、およびScFvから選択される。好ましくは、フラグメントは抗原結合フラグメントである。抗体フラグメントを含んで成る抗体は、二重特異的抗体も含むがこれに限定されない。一例は、活性化受容体に特異的な抗原結合領域および腫瘍抗原に特異的な抗原結合領域を含んで成る二重特異的抗体である(その開示が参照することにより本明細書に組込まれる、PCT公開国際公開第01/71005号パンフレットを参照)。
【0103】
組成物および投与
本発明は、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する少なくとも1つの化合物、好ましくは、抗体またはそのフラグメントを含んで成る組成物、および治療抗体、治療抗体により治療される対象におけるADCCを増大させるため、または疾患、より詳しくは、標的細胞の枯渇を必要とする疾患、好ましくは、ウイルス感染細胞、腫瘍細胞、または他の病的細胞など疾患細胞を有する対象を治療するための治療抗体の有効性を増大させるための前記組成物の使用に関する。好ましくは、疾患は、癌、自己免疫疾患、炎症性疾患、ウイルス疾患より成る群から選択される。疾患は、移植片拒絶、より詳しくは同種移植拒絶、および移植片対宿主疾患(GVHD)にも関する。
【0104】
より詳しくは、疾患の治療は、標的細胞、好ましくは、ウイルス感染細胞、腫瘍細胞、または他の病原細胞など疾患細胞の枯渇を必要とする。好ましくは、疾患は、癌、感染性または免疫疾患である。より好ましくは、疾患は、癌、自己免疫疾患、炎症性疾患、ウイルス疾患より成る群から選択される。疾患は、移植片拒絶、より詳しくは同種移植拒絶、および移植片対宿主疾患(GVHD)にも関する。
【0105】
前記疾患は、造血細胞の腫瘍性増殖を含む。場合により、前記疾患は、リンパ芽球性白血病、急性または慢性骨髄性白血病、ホジキンリンパ腫、非ホジキンリンパ腫、骨髄異形成症候群、多発性骨髄腫、および慢性リンパ球性白血病より成る群から選択される。前記疾患は、ENT癌、結腸直腸癌、乳癌、上皮癌も含む。前記疾患は、CMV感染、およびB型肝炎を含む。前記疾患は、クローン病、関節リウマチ、喘息、乾癬、多発性硬化症、または糖尿病を含む。特に、上記の表にリストアップされた疾患が治療されうる。
【0106】
前記治療抗体は、CD16によって、好ましくは、そのFc領域により結合されうる。好ましくは、前記治療抗体は、ヒトIgG1またはIgG3Fc部分、特にモノクローナル抗体またはそのフラグメント、さらに好ましくは、ヒト、ヒト化もしくはキメラ抗体またはそのフラグメント、例えばリツキシマブを有する。
【0107】
NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する前記化合物、好ましくは、抗体またはそのフラグメントは、KIR、NKG2A/C、NCR、またはNKG2Dヒト受容体の少なくとも1つに結合し、NK細胞の細胞毒性の関連KIR2DL、KIR3DL、および/またはNKG2A/C介在阻害を阻害し、またはNK細胞の細胞毒性の関連NCRまたはNKG2D介在活性化を刺激する。1つの好ましい実施形態においては、KIR2DLヒト受容体、例えば、KIR2DL1、KIR2DL2、KIR2DL3ヒト受容体より成る群から選択される受容体が使用されるか、またはKIR3DLヒト受容体、例えば、KIR3DL1およびKIR3DL2より成る群から選択される受容体が使用される。
【0108】
1つの好ましい実施形態においては、NK細胞増強化合物はKIR2DLヒト受容体の少なくとも1つに結合し、NK細胞の細胞毒性の関連KIR2DL介在阻害を阻害する。好ましくは、KIR2DLヒト受容体は、KIR2DL1、KIR2DL2、KIR2DL3ヒト受容体より成る群から選択される。好ましい実施形態においては、化合物、好ましくは、抗体またはそのフラグメントは、KIR2DLヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL介在阻害を阻害する。より好ましくは、前記化合物、好ましくは、抗体は、KIR2DL1、KIR2DL2、KIR2DL3ヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、KIR2DL3介在阻害を阻害する。特定の実施形態においては、前記化合物、好ましくは、抗体は、80位でLys残基を有するHLA−C対立遺伝子分子のヒトKIR2DL1受容体への結合、および80位でAsn残基を有するHLA−C対立遺伝子分子のヒトKIR2DL2およびKIR2DL3受容体への結合を阻害する。別の特定の実施形態においては、この抗体は、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200と同じエピトープに結合する。場合により、この抗体は、ヒトNK細胞の表面でKIR受容体への結合のためにハイブリドーマDF200によって生成されるモノクローナル抗体DF200と競合する。1つの好ましい実施形態においては、抗体はハイブリドーマDF200によって生成されるモノクローナル抗体DF200である。別の実施形態においては、抗体は、モノクローナル抗体EB6と同じエピトープと競合し、またはこれに結合する。
【0109】
本発明による組成物は、NK細胞の異なる阻害性受容体を遮断し、および/またはNK細胞の1つもしくはそれ以上の活性化受容体を刺激する一部の化合物、好ましくは、抗体またはそのフラグメントの組合せを含んで成りうる。好ましくは、NK細胞の阻害性受容体を遮断する化合物、好ましくは、抗体またはそのフラグメントは、KIR2DL1、KIR2DL2、KIR2DL3、KIR3DL1、KIR3DL2、NKG2A、およびNKG2Cから選択される阻害性受容体に特異的であり、NK細胞の細胞毒性の関連KIR−またはNKG2A/C介在阻害を阻害することができる。より好ましくは、「中和」化合物の組合せは、NK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、およびKIR2DL3介在阻害を阻害することができる。化合物の組合せを提供することによって、最大数の異なる阻害性受容体が最大数の患者において遮断されるであろう。また、異なる活性化化合物(または、阻害性受容体と同様に、単一受容体内の異なるエピトープに結合する)を刺激する化合物、例えば、NKp30、NKp44、NKp46、およびNKG2Dより成る群から選択される2つもしくはそれ以上の受容体の任意の組合せの活性化を同時にもたらす化合物の組合せも使用することができる。また、阻害性受容体を遮断する1つもしくはそれ以上の化合物、および活性化受容体を刺激する1つもしくはそれ以上の化合物を含んで成る組合せも使用できる。以下で述べるように、好ましい実施形態においては、NK細胞の試料を本方法の適用前に患者から得ることができ、かつ化合物の異なる組合せに対するNK細胞の応答性を、例えば、標的細胞および治療抗体の存在下に評価することができる。
【0110】
本発明の組成物は、医薬的に許容可能な担体または賦形剤、通常、緩衝液、等張液、水性懸濁液を含んで成り、場合により、安定剤、保存剤等が補充されうる。一般的な剤形としては、食塩液、場合により、高分子量タンパク質(例えば、ヒト血清アルブミン)など保護または安定化分子を含む。
【0111】
1つもしくはそれ以上の治療抗体、1つもしくはそれ以上のNK細胞増強化合物、および、好ましくは、その使用説明書の組合せを含んで成るキットも提供される。
【0112】
本発明の方法および組成物によれば、NK細胞の阻害性受容体を遮断し、またはNK細胞の活性化受容体を刺激する化合物、好ましくは、抗体またはそのフラグメントおよび治療抗体は、「十分」または「治療有効」量で投与される。
【0113】
レシピエントに投与される治療抗体の有効量は、約0.1mg/kg〜約20mg/kgでありうる。しかし、抗体の有効量は、抗体の形態(全Ig、またはフラグメント)、mAbの親和性、および各特定の抗体のために測定されるべき薬物動態パラメータによって決まる。
【0114】
レシピエントに投与されるNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物、好ましくは、抗体またはそのフラグメントの有効量は、約0.1mg/kg〜約20mg/kgでありうる。しかし、抗体の有効量は、抗体の形態(全Ig、またはフラグメント)、mAbの親和性、および各特定の抗体のために測定されるべき薬物動態パラメータによって決まる。
【0115】
本発明の重要な実施形態においては、本化合物の使用が、治療抗体の削減量で達成される治療効果を可能にしうる。治療抗体の使用(例えば、投与量、投与計画)は、副作用、例えば、リツキシマブの場合、発熱、頭痛、喘鳴、血圧低下、およびその他によって制限されうる。したがって、多くの患者における治療抗体の標準用量は、本明細書に記載されたNK細胞増強化合物(すなわち、他の化合物の非存在下に推奨量)とともに投与され、それによってさらに大きな治療効果を必要とする患者における標準用量の有効性を増強するが、例えば、副作用を重篤に受けた他の患者においては、本化合物の投与は治療抗体の削減量で達成される治療効果を可能にし、それによって副作用を回避する。実際に、熟練した医師は、所定の患者のための治療抗体およびNK細胞増強化合物の理想的な用量および投与計画、例えば、患者の特定のニーズおよび全体的な状態に照らして最も適切であろう治療法を決定する能力がある。治療抗体およびNK細胞増強化合物のための適切な投与量の決定における指針の多くの文献、例えば、レミントン(Remington):薬学の科学と実際(The Science and Practice of Pharmacy)、ジェナロ(Gennaro)編(2003年)、ISBN:0781750253、グッドマン(Goodman)およびジルマンス(Gilmans)、治療薬の薬学的基礎(The Pharmacological Basis of Therapeutics)、ハードマン(Hardman)編、リンバード・アンド・ジルマン(Limbird & Gilman)(2001年)、ISBN:0071354697、ローリンス(Rawlins)E.A.編「ベントリー薬剤学教科書(Bentley´」s Textbook of Pharmaceutics)」、ロンドン(London):ベイリール(Bailliere)、チンダル・アンド・コックス(Tindall and Cox)、(1977年)、およびその他が入手可能である。
【0116】
一実施形態においては、医師は、本NK細胞増強化合物のいずれかの投与とともに投与される治療抗体の量を徐々に削減することができ、投与量または投与頻度のいずれかの点で、治療抗体の有効性をモニタリングし、例えば、NK細胞活性をモニタリングする、患者における標的細胞の存在をモニタリングする、さまざまな臨床指標をモニタリングする、またはほかの手段によるなど、かつ、モニタリングの結果に照らして、治療抗体および/またはNK増強化合物の相対濃度または投与方法を調節し、治療効果および副作用の制限を最適化することができる。
【0117】
別の一連の実施形態においては、NK細胞は治療抗体およびNK細胞増強化合物の投与前に(および、必要に応じて、治療中に)患者から得られ、かつ評価され、最大の効果のために使用される理想的な化合物または一式の化合物を判定する。例えば、NK細胞に存在する阻害または活性化受容体の識別が判定されうるとともに、最も顕著な受容体を特異的に標的した化合物が投与されうる。あるいは、得られたNK細胞は治療抗体および標的細胞とともにインキュベートされ、標的細胞枯渇を増強する1つもしくはそれ以上の化合物の能力が評価されうる。いずれか、1つもしくはそれ以上の化合物がインビトロで枯渇の増強において最も有効であるものが、本治療方法用に選択される。
【0118】
化合物および/または治療抗体の適切な用量は、インビトロまたは動物モデルで、例えば、インビトロでは、標的細胞、NK細胞(好ましくは、ヒトNK細胞)、場合により、他の免疫細胞の存在下にさまざまな濃度の治療抗体、およびさまざまな濃度の1つもしくはそれ以上のNK細胞増強化合物をインキュベートし、かつ標準のアッセイ(例えば、実施例の部で述べる)を使用し、さまざまな条件下に標的細胞枯渇の程度または速度を評価することによっても徐々に判定されうる。あるいは、治療抗体の各種投与量を抗体で治療可能な疾患用の動物モデル(例えば、リツキシマブの場合にはNHL用の動物モデル)に、本明細書に記載された化合物の各種投与量とともに投与し、動物の治療における抗体の有効性(例えば、適切な臨床、細胞、もしくは分子アッセイ、または基準によって判定)を評価することができる。
【0119】
本発明による組成物は、対象に直接、通常、静脈内、腹腔内、動脈内、筋内、または経皮経路によって注入されうる。一部のモノクローナル抗体は、リツキサン(リツキシマブ)またはゾレア(Xolair)(オマリズマブ)など臨床状況で有効であることが示されており、同様の投与計画(すなわち、剤形および/または用量および/または投与プロトコール)を本発明の組成物とともに使用することができる。
【0120】
さらに、本発明の組成物は、他の活性剤、または化学療法もしくは他の免疫療法など治療プログラムをさらに含んで成り、またはこれらと組合わせて、同時もしくは連続的に使用されうる。
【0121】
一部の好ましい実施例においては、本発明の方法はさらに、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する2つもしくはそれ以上の化合物の1つもしくはいくつかの注入を含んで成り、これら2つもしくはそれ以上の化合物は組合わせて使用されうる。これは、ADCCのさらに大幅な増強および治療抗体の有効性をもたらすために役立ち、かつ/またはNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する特定の化合物の投与量を削減するために役立ちうる。例えば、IL−2などの化合物は、増加した用量では毒性であることが知られている。したがって、本発明は、好ましくは、それを必要とする対象における疾患の治療方法であって、a)NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する少なくとも2つの化合物、好ましくは、抗体またはそのフラグメントを前記対象に投与する工程と、b)前記対象に治療抗体を投与する工程とを含んで成る方法を提供する。例えば、好ましい計画は、前記2つの化合物が、(i)NCRもしくはNKG2D受容体または活性化KIR受容体を刺激する抗体、および阻害KIR受容体またはNKG2Aを遮断する抗体より成る群から選択される第1の化合物と、(ii)IL−12、IL−15、IL−18、およびIL−21より成る群から選択される第2の化合物である。したがって、本発明はさらに、それを必要とする対象における疾患の治療方法であって、a)NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する本発明による化合物、好ましくは、抗体またはそのフラグメントを前記対象に投与する工程と、b)前記対象に治療抗体を投与する工程と、(c)前記対象にIL−2を投与する工程を含んで成る方法を提供する。IL2は、リサーチ・ダイアグノスティックス、ニュージャージー州(NJ)、RDI−212)、またはカイロン社(Chiron Corp.)、カリフォルニア州(CA)、エメリービル(Emeryville)から入手可能である。
【0122】
サイトカインは、適切な投与計画のいずれかに従って投与されうるとともに、NK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物の投与の前、投与と同時に、および/または投与の後に、あるいは治療抗体の投与の前、投与と同時に、および/または投与の後に投与されうる。代表的な実施例においては、サイトカインは5−10日間毎日投与され、サイトカインは最初にNK細胞の阻害性受容体を遮断し、または活性化受容体を刺激する化合物の第1回目の注入と同じ日に注入される。前記方法は、好ましくは、皮下経路によってサイトカインの1回もしくは2回の注入/日を含んで成る。
【0123】
サイトカインの投与量は、治療される患者の状態によって選択される。好ましい実施例では、比較的低い用量のサイトカインが使用されうる。例えば、有効量は通常、サイトカイン含有医薬組成物が毎日の皮下注入用に使用される場合、100万単位/平方メートル/日サイトカイン未満である。好ましい実施例においては、IL−2は5〜10日間、毎日100万単位/m2未満の用量で皮下注入される。さらにサイトカインの使用の詳細は、その開示が参照することにより本明細書に組込まれる、「NK細胞の増殖に対する効果を有する医薬組成物およびその使用の方法(Pharmaceutical compositions having an effect on the proliferation of NK cells and a method using the same)」という名称の国際特許公開第PCT/EP/0314716号明細書および米国特許出願第60/435,344号明細書に記載されている。
【0124】
治療抗体およびNK細胞増強化合物が同時投与、例えば、同時注入され、または同時であるが異なる剤形で投与され、または独立して投与されうること、例えば、化合物が化合物の投与の数時間、数日、または数週間前または後に投与されることも理解されるであろう。
【0125】
さらに本発明の態様および利点が以下の実験の部で開示されているが、これらは例示としてみなすべきであり、本出願の範囲を限定するものとしてみなしてはならない。
【実施例】
【0126】
実施例1:pan KIR2DL抗体の生成
PBLの精製およびポリクローナルまたはクローナルNK細胞系の生成。
PBLをフィコール・ハイパック(Ficoll Hypaque)勾配遠心法および形成接着細胞の枯渇によって健常ドナーから誘導した。強化NK細胞を得るために、PBLを抗CD3、抗CD4、および抗HLA−DRmAb(4℃下に30mns)の後、ヤギ抗マウス電磁ビーズ(ダイナル(Dynal)(4℃下に30mns)でインキュベートし、当該分野において周知の方法(ペンデら、1999年)によって免疫磁気選択を行った。CD3マイナス、CD4マイナスDRマイナス細胞を照射支持細胞および100U/mlインターロイキン2(プロロイキン(Proleukin)、カイロン社(Chiron Corporation))および1.5ng/mlフィトヘムアグルチニンA(ジブコ(Gibco)BRL)で培養し、ポリクローナルNK細胞集団を得る。NK細胞を限界希釈によってクローン化し、NK細胞のクローンを細胞表面受容体の発現についてフローサイトメトリーによって特徴づける。
【0127】
以下のクローンをこの試験で使用した。
【0128】
CP11、CN5、およびCN505はKIR2DL1陽性クローンであり、EB6またはXA−141抗体によって染色される。CN12およびCP502は、KIR2DL3陽性クローンであり、GL183抗体によって染色される。
【0129】
フローサイトメトリー分析
使用したmAbを実験室のJT3A(IgG2a、抗CD3)、EB6およびGL183(それぞれ、IgG1抗KIR2DL1およびKIR2DL3)、XA−141 IgM抗KIR2DL1(EB6、抗CD4(HP2.6)、抗DR(D1.12、IgG2a)と比べて同じ特異性)で生成した。JT3A、HP2.6、およびDR1.12の代わりに、同じ特異性の市販のmAbが、例えば、ベックマン・コールター社(Beckman coulter Inc)、カリフォルニア州(CA)、フラートン(Fullerton)から使用されうる。EB6およびGL183は、ベックマン・コールター社、カリフォルニア州(CA)、フラートン(Fullerton)で市販されている。XA−141は市販されていないが、EB6を(モレッタら、1993年)に記載されている溶解の対照再構成のために使用することができる。
【0130】
フローサイトメトリー
細胞を適切な抗体(4℃下に30mns)で染色した後、PEまたはFITC抱合ポリクローナル抗マウス抗体(サザン・バイオテクノロジー・アソシエーツ社(Southern Biotechnology Associates Inc))で染色した。試料をFACSAM装置(ベクトン・ディキンソン(Becton Dickinson)、カリフォリニア州(CA)、マウンテンビュー(Mountain View))で細胞蛍光分析によって分析した。
【0131】
細胞毒性実験
NKクローンの細胞溶解活性を標準4時間51Cr放出アッセイによって評価した。エフェクターNK細胞をNK細胞溶解に対するその感受性について周知のCw3またはCw4陽性細胞系で試験した。すべての標的をマイクロ滴定プレートのウェル当り5000の細胞で使用したが、標的比でのエフェクターは数字(通常、標的細胞当り4エフェクター)で示されている。細胞溶解アッセイは、1/2希釈で指示モノクローナル抗体の上清の有無により行われる。手順は実質的に(モレッタら、1993年)に記載されているものと同じである。
【0132】
新しいmAbの生成
mAbは、5週齢バルブ(Balb)Cマウスを活性化ポリクローナルまたはモノクローナルNK細胞系で(モレッタら、1990年、その開示は参照することにより本明細書に組込まれる)に記載されているように免疫付与することによって生成されている。異なる細胞融合の後、mAbを最初にEB6およびGL183陽性NK細胞系およびクローンと交差反応するその能力について選択した。陽性モノクローナル抗体をさらに、それぞれCw4またはCw3陽性標的のEB6陽性またはGL183陽性NKクローンによる溶解を再構成するその能力について検査した。
【0133】
DF200、KIR2DLヒトNK受容体の共通の決定基に対する新たなモノクローナル抗体
モノクローナル抗体の1つであるDF200mAbは、KIR2DL1、KIR2DL2/3を含むKIRファミリーのさまざまなメンバーと反応することがわかった。DF200mAbによるNK細胞の染色に関して、KIR2DL1+細胞およびKIR2DL2/3+細胞は明るく染色された(図1)。
【0134】
これらHLAクラスI特異的阻害性受容体の一方または他方(または両方)を発現するNKクローンを、1つもしくはそれ以上のHLA−C対立遺伝子を発現する標的細胞に対するエフェクター細胞として使用した。予想通り、KIR2DL1+NKクローンは、Cw3陽性標的上でほとんどまたはまったく活性を示さなかったHLA−Cw4およびKIR2DL3+NKクローンを発現する標的細胞に対する細胞溶解活性を、たとえあったとしても、ほとんど示さなかった。しかし、DF200mAb(そのKIR2DL受容体を隠すために使用)の存在下には、NKクローンはそのHLA−Cリガンドを認識できなくなり、Cw3またはCw4標的上で強い細胞溶解活性を示した。
【0135】
例えば、C1R細胞系(CW4+EBV細胞系、ATCC番号CRL1993)はKIR2DL1+NKクローン(CN5/CN505)によって殺傷されなかったが、阻害はDF200または従来の抗KIR2DL1mAbのいずれかの使用によって有効に戻されえた。他方、KIR2DL2/3+KIR2DL1−表現型を発現するNKクローン(CN12)はC1Rを有効に殺傷し、この殺傷はDF200mAbによって左右されなかった(図2)。同様の結果はCw3陽性標的上でKIR2DL2−またはKIR2DL3陽性NKクローンで得られうる。
【0136】
DF200mAb/KIR2DL1およびDF200mAb/KIR2DL3相互作用のビアコア分析。
材料と方法
組換えタンパク質の生成と精製。KIR2DL1およびKIR2DL3組換えタンパク質を大腸菌(E.coli)で生成した。KIR2DL1およびKIR2DL3の全細胞外ドメインをコード化するcDNAを、それぞれ、pCDM8クローン(ビアッソーニ(Biassoni)ら、1993年、その開示は参照することにより本明細書に組込まれる)およびRSVS(gpt)183クローン6ベクター(ワグトマン(Wagtman)ら、1995年、その開示は参照することにより本明細書に組込まれる)から以下のプライマーを使用してPCRによって増幅した。
センス:5’−GGAATTCCAGGAGGAATTTAAAATGCATGAGGGAGTCCACAG−3’
抗センス:5’−CCCAAGCTTGGGTTATGTGACAGAAACAAGCAGTGG−3’
【0137】
それらをビオチン化シグナルをコード化する配列を有するフレームのpML1発現ベクターへクローン化した(サウルキン(Saulquin)ら、2003年、その開示は参照することにより本明細書に組込まれる)。
【0138】
タンパク質発現をBL21(DE3)細菌株(インビトロジェン(Invitrogen))へ行った。トランスフェクト細菌をアンピシリン(100μg/ml)を補充し、1mM IPTGを誘導した培地中、37℃下にOD600=0.6に成長させた。
【0139】
変性状態(8M尿素)下に封入体からタンパク質を回収した。組換えタンパク質の再折畳みを、6工程透析で尿素濃度を低下(それぞれ、4、3、2、1、0.5、および0M尿素)させることによって、室温(RT)下、L−アルギニン(400mM、シグマ)およびβ−メルカプトエタノール(1mM)を含有する、トリス20mM、pH7.8、NaCl 150mM緩衝液中で行った。還元および酸化グルタチオン(それぞれ、5mMおよび0.5mM、シグマ)を0.5および0Mの尿素透析工程中に添加した。最後に、タンパク質をトリス10mM、pH7.5、NaCl 150mM緩衝液に対して広範囲に透析した。溶解再折畳みタンパク質を濃縮させ、次いでスーパーデックス(Superdex)200サイズ排除カラム(ファルマシア(Pharmacia)、AKTAシステム(system))で精製した。
【0140】
ビアコア分析。表面プラスモン共鳴測定をビアコア装置(ビアコア)で行った。すべてのビアコア実験において、0.05%サーファクタントP20を補充したHBS緩衝液をランニングバッファーとして使用した。
【0141】
タンパク質の固定化。組換えKIR2DL1およびKIR2DL3タンパク質をセンサーチップ(Sensor Chip)CM5(ビアコア)上のデキストラン層におけるカルボキシル基に共有結合で固定化した。センサーチップ表面をEDC/NHS(N−エチル−N’−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩およびN−ヒドロキシスクシニミド、ビアコア)で活性化した。カップリングバッファー(10mM酢酸塩pH4.5)中のタンパク質を注入した。残りの活性化基の不活性化を100mMエタノールアミンpH8(ビアコア)を使用して行った。
【0142】
親和性測定。動態測定のために、さまざまな濃度の可溶性抗体(10−7〜4×10−10M)を固定化試料上に加えた。測定を20μl/分の連続流量で行った。各サイクルで、センサーチップの表面を10mM NaOH pH11の5μl注入によって再生した。
【0143】
ビアローグ(BIAlogue)動態評価(Kinetics Evaluation)プログラム(BIAevaluation3.1、ビアコア)をデータ分析のために使用した。
【0144】
結果
DF200mAbの固定化KIR2DL1およびKIR2DL3への結合のビアコア分析
【0145】
【表6】

【0146】
可溶性分析物(さまざまな濃度で40μl)をHBS緩衝液中20μl/分の流量で500または540反射率単位(RU)、および1000または700RUのKIR2DL1およびKIR2DL3をそれぞれ含有するデキストラン層上に注入した。データは6つの独立した実験を代表する。
【0147】
実施例2:リツキサンと抗KIRmAbの組合わせを使用することによるADCCの増強
ヒトNKクローンの調製。陰性抗CD3免疫磁性選択(ミルテンイ(Miltenyi)によるT細胞の枯渇血液単核細胞を限外希釈条件下にプレーティングし、フィトヘムアグルチニン(PHA)(バイオクロムKG、ドイツ、ベルリン(Berlin))で活性化し、インターロイキン(IL)−2(カイロンB.V.、オランダ、アムステルダム(Amsterdam))および照射支持細胞で培養した。クローニング効率はすべてのドナーにおいて同等であり、プレーティングしたNK細胞5個中1個〜10個中1個の範囲である。クローン化NK細胞を同種反応性について、エフェクター対標的比10:1で機知のHLA型のエプスタイン・バー(Epstein−Bar)ウイルス形質転換Bリンパ芽細胞系に対する標準51Cr放出細胞毒性によって検査した。30%以上の溶解を示すクローンを同種反応性と評価した。一般に、クローンは、<5%または>40%のいずれかの溶解を示す。
【0148】
KIR2DL1陽性NK細胞クローンによるリツキサンによって介在されるADCCの増強
NKクローンの細胞溶解活性を標準4時間51Cr放出アッセイによって評価するが、ここでエフェクターNK細胞が、NK細胞溶解に対する感受性で知られるCw4またはCw3陽性EBV細胞系(CD20陽性)で試験された。すべての標的をマイクロ滴定プレートのウェル当り5000の細胞で使用したが、標的に対するエフェクター(NK細胞クローン)の比は図3に示されている。一部の実験においては、治療キメラ抗CDリツキシマブ(リツキサン、アイデック(Idec))を5μg/mlでエフェクター標的混合物に添加する。一部の実験においては、EB6抗体(抗KIR2DL1)を10μg/mlでエフェクター標的混合物に添加する。
【0149】
この実験は、リツキサン単独では実質的にCw4陽性標的上にKIR2DL1陽性NKクローンによるADCCを介在しないことを示した。KIR2DL1陽性クローンのADCCは、抗KIR2DL1抗体の存在下に大きく増強される。
【0150】
実施例3−KIR2DL1陽性NK細胞クローンによるキャンパスによって介在されるADCCの増強
実施例2に記載されたものと同様の実験において、自己Cw4+PHAブラストをNK細胞+アルムツズマブ(キャンパス、ベルレックス(Berlex))、EB6抗体(100μg/ml)、またはキャンパスおよびEB6の存在下にインキュベートした。図4に示されている結果は、EB6の存在が自己細胞を枯渇させるNK細胞の能力を劇的に増強させることを示し、標的細胞の約4%がキャンパスのみの存在下に溶解したのに対し、30%を超える細胞がキャンパス+EB6の存在下に溶解した。
【0151】
文献
ビアソーニR、ベルジアーニ(Verdiani)S、カムビアッジ(Cambiaggi)A、ロメオ(Romeo)PH、フェリーニ(Ferrini)S、モレッタL。ヒトCD3−CD16+ナチュラルキラー細胞はhGATA−3T細胞転写因子および非転位2.3−kbTcRデルタ転写を発現する(Human CD3−CD16+ natural killer cells express the hGATA−3 T cell transcription factor and an unrearranged 2.3−kb TcR delta transcript)。Eur J Immunol.、1993年5月、23(5)、p.1083−1087
カッレ(Karre)K、リュングレン(Ljunggren)HG、ピオンテック(Piontek)G、キースリング(Kiessling)R、(1986年)「H−2不全リンパ腫変形は代替の免疫防御法を示唆する(Selective rejection of H−2−deficient lymphoma variants suggests alternative immune defence strategy)」ネイチャー(Nature) 319、p.675−678
ラニールLL(1998年)「NK細胞受容体(NK cell receptors)」Annu Rev Immunol 16、p.359−393
モレッタA.、ボッチーノ(Bottino)C.、ペンデ(Pende,D.、トリポディ(Tripodi)G.、タムブッシ(Tambussi)G.、ビアール(Viale)O.、オレンゴ(Orengo)A.、バルバレッシ(Barbaresi)M.、メルリ(Merli)A.、シコーン(Ciccone)E.ら(1990年)。「クローン分布された機能的表面分子の発現によるヒトCD3−CD16+ナチュラルキラー(NK)細胞の4つのサブセットの同定:NKクローンのサブセット配置間の相関および特異的アロ抗原認識を介在する能力(Identification of four subsets of human CD3−CD16+ natural killer (NK) cells by the expression of clonally distributed functional surface molecules: correlation between subset assignment of NK clones and ability to mediate specific alloantigen recognition)」。J Exp Med 172、p.1589−1598
モレッタ,A.、ビターレ,M.、ボッチーノ,C.、オレンゴ,A.M.、モレーリ(Morelli),L.、アウググリアーロ(Augugliaro),R.、バルバレッシ,M.、シコーン,E.、およびモレッタ,L.(1993年)。ヒトナチュラルキラー(NK)細胞における主要組織適合複合体(MHC)クラスI分子の推定上の受容体としてのP58分子。異なる特異性を示すNKクローンにおけるMHCクラスI保護細胞の抗p58抗体再構成溶解(P58 molecules as putative receptors for major histocompatibility complex (MHC) class I molecules in human natural killer (NK) cells. Anti−p58 antibodies reconstitute lysis of MHC class I−protected cells in NK clones displaying different specificities)。J Exp Med 178、p.597−604
モレッタA、モレッタL(1997年)「HLAクラスI特異的阻害性受容体(HLA class I specific inhibitory receptors)」Curr Opin Immunol 9、p.694−701
オーレン(Ohlen)C、クリング(Kling)G、ホグルンド(Hoglund)P、ハンソン(Hansson)M、スカンゴス(Scangos)G、ビエベリッヒ(Bieberich)C、ジェイ(Jay)G、カッレK(1989年)「ドナーマウスにおけるH−2導入遺伝子による同種骨髄移植片拒絶の予防(Prevention of allogeneic bone marrow graft rejection by H−2 transgene in donor mice)」サイエンス(Science) 246、p.666−668
ペンデ,D.、パロリーニ(Parolini),S.、ペッシーノ,A.、シボリ,S.、アウググリアーロ(Augugliaro),R.、モレーリ(Morelli),L.、マルセナーロ(Marcenaro),E.、アカメ(Accame),L.、マラスピーナ(Malaspina),A.、ビアッソーニ,R.ら(1999年)。ヒトナチュラルキラー細胞によって介在されるナチュラル細胞毒性に関与する新たなトリガー受容体、NKp30の同定および分子の特徴(Identification and molecular characterization of NKp30, a novel triggering receptor involved in natural cytotoxicity mediated by human natural killer cells)。J Exp Med 190、p.1505−1516
ルッゲリ(Ruggeri),L.、カパーニ(Capanni),M.、ウルバーニ(Urbani),E.、ペルッシオ(Perruccio),K.、スロムチク(Shlomchik),W.D.、トスチ(Tosti),A.、ポサチ(Posati),S.、ロガイア(Rogaia),D.、フラッソーニ(Frassoni),F.、アベルサ(Aversa),F.ら(2002年)。不適合造血移植におけるドナーナチュラルキラー細胞同種反応性の有効性(Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants)。サイエンス(Science) 295、p.2097−2100
サウルキンX、ガスチネル(Gastinel)LN、ビビエル(Vivier)E.ヒトナチュラルキラー細胞活性化受容体KIR2DS2(CD158j)の結晶構造(Crystal structure of the human natural killer cell activating receptor KIR2DS2 (CD158j))J Exp Med.2003年4月7、197(7)、p.933−938
バリアンテ(Valiante)NM、リネルト(Lienert)K、シリング(Shilling)HG、スミッツ(Smits)BJ、パルハム(Parham)P(1997年)「キラー細胞受容体:MHCクラスI発生に対応(Killer cell receptors:keeping pace with MHC class I evolution)Immunol Rev 155、p.155−164
ワグトマン(Wagtmann)N、ビアッソーニR、カントーニ(Cantoni)C、ベルジアーニ(Verdiani)S、マルナチ(Malnati)MS、ビターレM、ボッチーノC、モレッタL、モレッタA、ロング(Long)EO.、p58細胞受容体の分子クローンは細胞外および細胞内ドメインにおける多様性による免疫グロブリン関連分子を示す(Molecular clones of the p58 NK cell receptor reveal immunoglobulin−related molecules with diversity in both the extra− and intracellular domains)。Immunity.1995年5月、2(5)、p.439−449
ワードら、ネイチャー(Nature) 341(1989年)、p.544
【0152】
本明細書で引用されたすべての刊行物および特許出願は、各個の刊行物または特許出願が具体的かつ個別に参照することにより組込まれることが示されているように、その全体が参照することにより本明細書に組込まれる。
【0153】
前記発明は理解の明確さのために説明図および実施例によって詳細に記載されているが、本発明の開示に照らして、添付の特許請求の範囲の精神または範囲を逸脱することなく一部の変更および修正がなされうることが当業者には容易に理解されるであろう。
【0154】
そのすべて可能な変形における上記要素の組合わせが、本明細書で別段の規定がなく、またはその他の場合に文脈によって明らかに否定されない限り、本発明によって包含される。
【0155】
冠詞の「a」と「an」と「the」と本発明を記載する文脈において使用される同様の指示対象は、本明細書で別段の規定がなく、または文脈によって明らかに否定されない限り、単数と複数の両方をカバーすると解釈される。
【0156】
本明細書での値の範囲の列挙は、本明細書で別段の規定がない限り、範囲内に収まる個々の値に個別に言及する簡便な方法として役立つように意図されているにすぎず、個々の値は、それが個別に本明細書で引用されるように明細書に組込まれる。特に指定のない限り、本明細書で示されたすべての正確な値は、対応する近似値を代表する(例えば、特定の因子または測定に関して示されたすべての正確な典型的な値は、必要に応じて「約」で一部変更される対応する近似測定値も示すと考えられうる)。
【0157】
本明細書に記載されたすべての方法は、本明細書で別段の規定がなく、または文脈によって明らかに否定されない限り、任意の適切な順序で実施されうる。
【0158】
いずれかおよびすべての実施例の使用、または本明細書で示されている典型的な言葉(例えば「など(such as)」は、本発明をより良く照らし出すことが意図されているにすぎず、別段の規定がない限り、本発明の範囲に対する制限をもたらすことはない。明細書における言葉は、明確に述べられていない限り、いずれかの要素が本発明の実施にとって絶対必要であることを示していると解釈されるべきではない。
【0159】
本明細書での特許文書の引用および組込みは、便宜上行われているだけであり、かかる文書の妥当性、特許可能性および/または権利行使可能性の観点を反映することはない。
【0160】
1つの要素もしくは複数の要素に関して「含んで成る」、「有する」、「含む」、または「含有する」などの用語を使用する本発明の態様または実施形態の本明細書での記述は、別段の規定がなく、または文脈によって明らかに否定されない限り、特定の1つの要素もしくは複数の要素「から成る」、「から本質的に成る」、または「を実質的に含んで成る」、本発明の同様の態様または実施形態の裏づけを提供することが意図されている(例えば、特定の要素を含んで成るとして本明細書に記載された組成物は、別段の規定がなく、または文脈によって明らかに否定されない限り、その要素から成る組成物も述べていると理解すべきである)。
【0161】
本発明は、適用法によって許容される最大範囲まで本明細書に示された態様または特許請求の範囲で開示された主題のすべての変更例および均等物を含む。
【図面の簡単な説明】
【0162】
【図1】モノクローナル抗体DF200はさまざまなヒトKIR2DL受容体の共通の決定基に結合する。
【図2】エフェクター/標的比4/1でのC1RCw4標的での抗KIR2DLmAb(モノクローナル抗体)による溶解の再構成。モノクローナル抗体DF200は、Cw4陽性標的細胞でのKIR2DL1陽性NK細胞の細胞毒性(再構成溶解)のKIR2DL介在阻害を阻害する。
【図3】KIR/HLA相互作用を遮断することによるCw4陽性EBV細胞系でのKIR2DL1陽性NKクローンのリツキサンによって介在されたADCCの増強。KIR2DL1を有するNKクローン細胞融解が、5μg/mlの抗CD20抗体(ルチキサン(Rutixan))および10μg/mlのEB6抗体(抗KIR2DL1)、リツキサンのみ、EB6のみ、またはいずれの抗体なしの存在下に、さまざまなエフェクター/標的比(1〜4)でCw4陽性EBV形質転換(CD20陽性)標的細胞系に対して試験される。ADCCは、抗KIR2DL1抗体(EB6)の存在下に大きく増強される。
【図4】KIR/HLA相互作用を遮断することによるCw4陽性EBV細胞系でのKIR2DL1陽性NKクローンのキャンパスによって介在されたADCCの増強。KIR2DL1を有するNKクローン細胞融解が、キャンパスおよび100μg/mlのEB6抗体(抗KIR2DL1)、キャンパスのみ、EB6のみ、またはいずれの抗体なしの存在下にCw4陽性EBV形質転換(CD20陽性)標的細胞系に対して試験される。ADCCは、抗KIR2DL1抗体(EB6)の存在下に大きく増強される。
【特許請求の範囲】
【請求項1】
それを必要とするヒト対象における疾患の治療方法であって、
a)阻害性受容体を遮断し、またはNK細胞の活性化受容体を刺激する化合物を前記対象に投与する工程と、
b)CD16によって結合されうる治療抗体を前記対象に投与する工程と
を含んで成る方法。
【請求項2】
前記治療抗体がヒトIgG1またはIgG3Fc部分を有する、請求項1に記載の方法。
【請求項3】
前記化合物が抗体であり、またはその抗原結合フラグメントを含んで成る、請求項1または2に記載の方法。
【請求項4】
前記治療抗体がモノクローナル抗体であり、またはその抗原結合フラグメントを含んで成る、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記治療抗体が放射性または毒性部分と抱合していない、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記化合物がNK細胞の阻害性受容体を阻害する、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記化合物がNK細胞の活性化受容体を刺激する、請求項1〜5のいずれか一項に記載の方法。
【請求項8】
前記化合物がヒト、ヒト化、またはキメラ抗体であり、またはその抗原結合フラグメントを含んで成る、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
前記治療抗体がヒト、ヒト化、またはキメラ抗体であり、またはその抗原結合フラグメントを含んで成る、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
前記治療抗体がリツキシマブまたはキャンパスである、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
前記抗体がリツキシマブであり、かつ前記抗体が1週間に375mg/m2未満の用量で投与される、請求項10に記載の方法。
【請求項12】
前記抗体がキャンパスであり、かつ前記抗体が1週間に90mg未満の用量で投与される、請求項10に記載の方法。
【請求項13】
前記化合物が、NKG2、KIR2DL、またはKIR3DLヒト受容体の少なくとも1つに結合し、かつNK細胞の細胞毒の関連性NKG2、KIR2DL−、またはKIR3DL介在阻害を阻害する、請求項1〜12のいずれか一項に記載の方法。
【請求項14】
前記化合物が、KIR2DL1、KIR2DL2/3、KIR2DL4、KIR2DL5A、KIR2DL5B、KIR3DL1、KIR3DL2、KIR3DL3、LILRB1、NKG2A、NKG2CNKG2E、およびLILRB5より成る群から選択されるNK細胞の阻害性受容体を遮断する、請求項1〜13のいずれか一項に記載の方法。
【請求項15】
前記化合物が、KIR2DLヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL介在阻害を阻害する、請求項1〜14のいずれか一項に記載の方法。
【請求項16】
前記化合物が、KIR2DL1、KIR2DL2、およびKIR2DL3ヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、およびKIR2DL3介在阻害を阻害する、請求項15に記載の方法。
【請求項17】
前記化合物が、80位にLys残基を有するHLA−C対立遺伝子分子のヒトKIR2DL1への結合、および80位でAsn残基を有するHLA−C対立遺伝子分子のヒトKIR2DL2、およびKIR2DL3受容体への結合を阻害する、請求項16に記載の方法。
【請求項18】
前記化合物が、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200、またはモノクローナル抗体EB6と同じエピトープに結合する、請求項13に記載の方法。
【請求項19】
前記化合物が、ヒトNK細胞の表面でKIR受容体に結合するために、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200、またはモノクローナル抗体EB6と競合する、請求項13〜17のいずれか一項に記載の方法。
【請求項20】
前記化合物が、ハイブリドーマDF200もしくはそのフラグメントまたは誘導体、あるいはモノクローナル抗体EB6もしくはそのフラグメントまたは誘導体である、請求項13〜17のいずれか一項に記載の方法。
【請求項21】
前記化合物が抗体であり、またはその抗原結合フラグメントを含んで成る、請求項7に記載の方法。
【請求項22】
前記化合物が、NKp30、NKp44、NKp46、およびNKG2Dより成る群から選択される受容体に結合する、請求項7または21に記載の方法。
【請求項23】
前記化合物が、AZ20、A76、Z25、Z231、およびBAB281より成る群から選択されるモノクローナル抗体から誘導され、またはこれらと競合する、請求項22に記載の方法。
【請求項24】
前記治療抗体および前記化合物が、前記対象へ同時に投与される、請求項1〜23のいずれか一項に記載の方法。
【請求項25】
前記化合物が、前記治療抗体の投与の1週間以内に前記対象に投与される、請求項1〜24のいずれか一項に記載の方法。
【請求項26】
前記疾患が癌、感染性または免疫疾患である、請求項1〜25のいずれか一項に記載の方法。
【請求項27】
前記患者におけるNK細胞の活性または数が前記化合物の投与の前またはその後に評価されるさらなる工程を含んで成る、請求項1〜26のいずれか一項に記載の方法。
【請求項28】
前記さらなる工程が、
i)前記投与の前に前記対象からNK細胞を得る工程と、
ii)前記化合物の存在または非存在下に、前記治療抗体によって認識される1つもしくはそれ以上の標的細胞の存在下に前記NK細胞をインキュベートする工程と、
iii)前記標的細胞を枯渇させる前記NK細胞の能力に対する前記化合物の効果を評価する工程を含み、前記化合物が前記標的細胞を枯渇させる前記NK細胞の能力を増強させるという検出が、前記化合物が前記方法における使用に適切であり、前記方法が前記対象との使用に適切であることを示す、請求項27に記載の方法。
【請求項29】
(a)CD16によって結合されうる治療抗体と、(b)阻害性受容体を遮断し、またはNK細胞の活性化受容体を刺激する化合物と、(c)医薬的に許容可能な担体と
を含んで成る医薬組成物。
【請求項30】
前記治療抗体がヒトIgG1またはIgG3Fc部分を有する、請求項29に記載の組成物。
【請求項31】
前記化合物が抗体であり、またはその抗原結合フラグメントを含んで成る、請求項29または30に記載の組成物。
【請求項32】
前記化合物がモノクローナル抗体であり、またはその抗原結合フラグメントを含んで成る、請求項29または30に記載の組成物。
【請求項33】
前記化合物がヒト、ヒト化、またはキメラ抗体であり、またはその抗原結合フラグメントを含んで成る、請求項29〜32のいずれか一項に記載の組成物。
【請求項34】
前記治療抗体がモノクローナル抗体であり、またはその抗原結合フラグメントを含んで成る、請求項29〜33のいずれか一項に記載の組成物。
【請求項35】
前記治療抗体がヒト、ヒト化、またはキメラ抗体であり、またはその抗原結合フラグメントを含んで成る、請求項34に記載の組成物。
【請求項36】
前記抗体が放射性または毒性部分と抱合していない、請求項34または35に記載の組成物。
【請求項37】
前記化合物がNK細胞の阻害性受容体を阻害する、請求項29〜36のいずれか一項に記載の組成物。
【請求項38】
前記化合物がNK細胞の活性化受容体を刺激する、請求項29〜36のいずれか一項に記載の組成物。
【請求項39】
前記治療抗体がリツキシマブまたはキャンパスである、請求項29〜38のいずれか一項に記載の組成物。
【請求項40】
前記化合物が、KIR2DL1、KIR2DL2/3、KIR2DL4、KIR2DL5A、KIR2DL5B、KIR3DL1、KIR3DL2、KIR3DL3、LILRB1、NKG2A、NKG2CNKG2E、およびLILRB5より成る群から選択されるNK細胞の阻害性受容体を遮断する、請求項29〜37または39に記載の組成物。
【請求項41】
前記化合物が、KIR2DLヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL介在阻害を阻害する、請求項29に記載の組成物。
【請求項42】
前記化合物が、KIR2DL1、KIR2DL2、およびKIR2DL3ヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、およびKIR2DL3介在阻害を阻害する、請求項41に記載の組成物。
【請求項43】
前記化合物が、80位にLys残基を有するHLA−C対立遺伝子分子のヒトKIR2DL1への結合、および80位でAsn残基を有するHLA−C対立遺伝子分子のヒトKIR2DL2およびKIR2DL3受容体への結合を阻害する、請求項41に記載の方法。
【請求項44】
前記化合物が、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200、モノクローナル抗体NKVSF1、またはモノクローナル抗体EB6と同じエピトープに結合する、請求項29または40〜43に記載の組成物。
【請求項45】
前記化合物が、ヒトNK細胞の表面でKIR受容体に結合するために、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200、モノクローナル抗体NKVSF1、またはモノクローナル抗体EB6と競合する、請求項29または40〜43のいずれか一項に記載の組成物。
【請求項46】
前記化合物が、ハイブリドーマDF200もしくはそのフラグメントまたは誘導体によって生成されるモノクローナル抗体DF200、モノクローナル抗体NKVSF1もしくはそのフラグメントまたは誘導体、あるいはモノクローナル抗体EB6もしくはそのフラグメントまたは誘導体である、請求項29または40〜43のいずれか一項に記載の組成物。
【請求項47】
前記化合物が、NKp30、NKp44、NKp46、およびNKG2Dより成る群から選択される受容体に結合する、請求項38に記載の組成物。
【請求項48】
治療抗体とともに投与するための化合物を選択する方法であって、前記方法が、
i)阻害性受容体を阻害し、またはNK細胞上の活性化受容体を刺激する試験化合物を提供する工程と、
ii)NK細胞の存在下、および前記試験化合物の存在または非存在下に、前記治療抗体によって特異的に認識される標的細胞で前記治療抗体をインキュベートする工程と、
iii)前記標的細胞を枯渇させる前記NK細胞の能力に対する前記化合物の効果を評価する工程を含み、前記化合物が前記標的細胞を枯渇させる前記NK細胞の能力を増強させるという検出が、前記方法における使用に適切であることを示す方法。
【請求項49】
前記化合物が前記標的細胞を破壊する前記治療抗体の能力を30%増強する、請求項48に記載の方法。
【請求項50】
前記化合物が前記標的細胞を破壊する前記治療抗体の能力を50%増強する、請求項48に記載の方法。
【請求項51】
前記化合物が、抗体、抗体フラグメント、モノクローナル抗体、モノクローナル抗体のフラグメント、ヒト化抗体、キメラ抗体、およびヒト化抗体より成る群から選択される、請求項48〜50のいずれか一項に記載の方法。
【請求項52】
前記標的細胞が、癌細胞、ウイルス感染細胞、または自己免疫疾患の基礎を成す細胞である、請求項48〜51のいずれか一項に記載の方法。
【請求項53】
前記治療抗体がリツキシマブまたはキャンパスである、請求項48〜52のいずれか一項に記載の方法。
【請求項54】
対象におけるCD16によって結合されうる治療抗体の投与を含む治療の有効性を増大させる方法であって、前記方法が、前記治療抗体の投与前、投与と同時に、または投与後に、阻害性受容体を遮断し、またはNK細胞の活性化受容体を刺激する化合物の治療有効量を前記対象に投与する工程を含んで成る方法。
【請求項55】
前記化合物が前記対象におけるADCCを増強することによって前記治療の有効性を増大させることを特徴とする請求項54に記載の方法。
【請求項1】
それを必要とするヒト対象における疾患の治療方法であって、
a)阻害性受容体を遮断し、またはNK細胞の活性化受容体を刺激する化合物を前記対象に投与する工程と、
b)CD16によって結合されうる治療抗体を前記対象に投与する工程と
を含んで成る方法。
【請求項2】
前記治療抗体がヒトIgG1またはIgG3Fc部分を有する、請求項1に記載の方法。
【請求項3】
前記化合物が抗体であり、またはその抗原結合フラグメントを含んで成る、請求項1または2に記載の方法。
【請求項4】
前記治療抗体がモノクローナル抗体であり、またはその抗原結合フラグメントを含んで成る、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記治療抗体が放射性または毒性部分と抱合していない、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記化合物がNK細胞の阻害性受容体を阻害する、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記化合物がNK細胞の活性化受容体を刺激する、請求項1〜5のいずれか一項に記載の方法。
【請求項8】
前記化合物がヒト、ヒト化、またはキメラ抗体であり、またはその抗原結合フラグメントを含んで成る、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
前記治療抗体がヒト、ヒト化、またはキメラ抗体であり、またはその抗原結合フラグメントを含んで成る、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
前記治療抗体がリツキシマブまたはキャンパスである、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
前記抗体がリツキシマブであり、かつ前記抗体が1週間に375mg/m2未満の用量で投与される、請求項10に記載の方法。
【請求項12】
前記抗体がキャンパスであり、かつ前記抗体が1週間に90mg未満の用量で投与される、請求項10に記載の方法。
【請求項13】
前記化合物が、NKG2、KIR2DL、またはKIR3DLヒト受容体の少なくとも1つに結合し、かつNK細胞の細胞毒の関連性NKG2、KIR2DL−、またはKIR3DL介在阻害を阻害する、請求項1〜12のいずれか一項に記載の方法。
【請求項14】
前記化合物が、KIR2DL1、KIR2DL2/3、KIR2DL4、KIR2DL5A、KIR2DL5B、KIR3DL1、KIR3DL2、KIR3DL3、LILRB1、NKG2A、NKG2CNKG2E、およびLILRB5より成る群から選択されるNK細胞の阻害性受容体を遮断する、請求項1〜13のいずれか一項に記載の方法。
【請求項15】
前記化合物が、KIR2DLヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL介在阻害を阻害する、請求項1〜14のいずれか一項に記載の方法。
【請求項16】
前記化合物が、KIR2DL1、KIR2DL2、およびKIR2DL3ヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、およびKIR2DL3介在阻害を阻害する、請求項15に記載の方法。
【請求項17】
前記化合物が、80位にLys残基を有するHLA−C対立遺伝子分子のヒトKIR2DL1への結合、および80位でAsn残基を有するHLA−C対立遺伝子分子のヒトKIR2DL2、およびKIR2DL3受容体への結合を阻害する、請求項16に記載の方法。
【請求項18】
前記化合物が、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200、またはモノクローナル抗体EB6と同じエピトープに結合する、請求項13に記載の方法。
【請求項19】
前記化合物が、ヒトNK細胞の表面でKIR受容体に結合するために、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200、またはモノクローナル抗体EB6と競合する、請求項13〜17のいずれか一項に記載の方法。
【請求項20】
前記化合物が、ハイブリドーマDF200もしくはそのフラグメントまたは誘導体、あるいはモノクローナル抗体EB6もしくはそのフラグメントまたは誘導体である、請求項13〜17のいずれか一項に記載の方法。
【請求項21】
前記化合物が抗体であり、またはその抗原結合フラグメントを含んで成る、請求項7に記載の方法。
【請求項22】
前記化合物が、NKp30、NKp44、NKp46、およびNKG2Dより成る群から選択される受容体に結合する、請求項7または21に記載の方法。
【請求項23】
前記化合物が、AZ20、A76、Z25、Z231、およびBAB281より成る群から選択されるモノクローナル抗体から誘導され、またはこれらと競合する、請求項22に記載の方法。
【請求項24】
前記治療抗体および前記化合物が、前記対象へ同時に投与される、請求項1〜23のいずれか一項に記載の方法。
【請求項25】
前記化合物が、前記治療抗体の投与の1週間以内に前記対象に投与される、請求項1〜24のいずれか一項に記載の方法。
【請求項26】
前記疾患が癌、感染性または免疫疾患である、請求項1〜25のいずれか一項に記載の方法。
【請求項27】
前記患者におけるNK細胞の活性または数が前記化合物の投与の前またはその後に評価されるさらなる工程を含んで成る、請求項1〜26のいずれか一項に記載の方法。
【請求項28】
前記さらなる工程が、
i)前記投与の前に前記対象からNK細胞を得る工程と、
ii)前記化合物の存在または非存在下に、前記治療抗体によって認識される1つもしくはそれ以上の標的細胞の存在下に前記NK細胞をインキュベートする工程と、
iii)前記標的細胞を枯渇させる前記NK細胞の能力に対する前記化合物の効果を評価する工程を含み、前記化合物が前記標的細胞を枯渇させる前記NK細胞の能力を増強させるという検出が、前記化合物が前記方法における使用に適切であり、前記方法が前記対象との使用に適切であることを示す、請求項27に記載の方法。
【請求項29】
(a)CD16によって結合されうる治療抗体と、(b)阻害性受容体を遮断し、またはNK細胞の活性化受容体を刺激する化合物と、(c)医薬的に許容可能な担体と
を含んで成る医薬組成物。
【請求項30】
前記治療抗体がヒトIgG1またはIgG3Fc部分を有する、請求項29に記載の組成物。
【請求項31】
前記化合物が抗体であり、またはその抗原結合フラグメントを含んで成る、請求項29または30に記載の組成物。
【請求項32】
前記化合物がモノクローナル抗体であり、またはその抗原結合フラグメントを含んで成る、請求項29または30に記載の組成物。
【請求項33】
前記化合物がヒト、ヒト化、またはキメラ抗体であり、またはその抗原結合フラグメントを含んで成る、請求項29〜32のいずれか一項に記載の組成物。
【請求項34】
前記治療抗体がモノクローナル抗体であり、またはその抗原結合フラグメントを含んで成る、請求項29〜33のいずれか一項に記載の組成物。
【請求項35】
前記治療抗体がヒト、ヒト化、またはキメラ抗体であり、またはその抗原結合フラグメントを含んで成る、請求項34に記載の組成物。
【請求項36】
前記抗体が放射性または毒性部分と抱合していない、請求項34または35に記載の組成物。
【請求項37】
前記化合物がNK細胞の阻害性受容体を阻害する、請求項29〜36のいずれか一項に記載の組成物。
【請求項38】
前記化合物がNK細胞の活性化受容体を刺激する、請求項29〜36のいずれか一項に記載の組成物。
【請求項39】
前記治療抗体がリツキシマブまたはキャンパスである、請求項29〜38のいずれか一項に記載の組成物。
【請求項40】
前記化合物が、KIR2DL1、KIR2DL2/3、KIR2DL4、KIR2DL5A、KIR2DL5B、KIR3DL1、KIR3DL2、KIR3DL3、LILRB1、NKG2A、NKG2CNKG2E、およびLILRB5より成る群から選択されるNK細胞の阻害性受容体を遮断する、請求項29〜37または39に記載の組成物。
【請求項41】
前記化合物が、KIR2DLヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL介在阻害を阻害する、請求項29に記載の組成物。
【請求項42】
前記化合物が、KIR2DL1、KIR2DL2、およびKIR2DL3ヒト受容体の共通の決定基に結合し、かつNK細胞の細胞毒性のKIR2DL1−、KIR2DL2−、およびKIR2DL3介在阻害を阻害する、請求項41に記載の組成物。
【請求項43】
前記化合物が、80位にLys残基を有するHLA−C対立遺伝子分子のヒトKIR2DL1への結合、および80位でAsn残基を有するHLA−C対立遺伝子分子のヒトKIR2DL2およびKIR2DL3受容体への結合を阻害する、請求項41に記載の方法。
【請求項44】
前記化合物が、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200、モノクローナル抗体NKVSF1、またはモノクローナル抗体EB6と同じエピトープに結合する、請求項29または40〜43に記載の組成物。
【請求項45】
前記化合物が、ヒトNK細胞の表面でKIR受容体に結合するために、ハイブリドーマDF200によって生成されるモノクローナル抗体DF200、モノクローナル抗体NKVSF1、またはモノクローナル抗体EB6と競合する、請求項29または40〜43のいずれか一項に記載の組成物。
【請求項46】
前記化合物が、ハイブリドーマDF200もしくはそのフラグメントまたは誘導体によって生成されるモノクローナル抗体DF200、モノクローナル抗体NKVSF1もしくはそのフラグメントまたは誘導体、あるいはモノクローナル抗体EB6もしくはそのフラグメントまたは誘導体である、請求項29または40〜43のいずれか一項に記載の組成物。
【請求項47】
前記化合物が、NKp30、NKp44、NKp46、およびNKG2Dより成る群から選択される受容体に結合する、請求項38に記載の組成物。
【請求項48】
治療抗体とともに投与するための化合物を選択する方法であって、前記方法が、
i)阻害性受容体を阻害し、またはNK細胞上の活性化受容体を刺激する試験化合物を提供する工程と、
ii)NK細胞の存在下、および前記試験化合物の存在または非存在下に、前記治療抗体によって特異的に認識される標的細胞で前記治療抗体をインキュベートする工程と、
iii)前記標的細胞を枯渇させる前記NK細胞の能力に対する前記化合物の効果を評価する工程を含み、前記化合物が前記標的細胞を枯渇させる前記NK細胞の能力を増強させるという検出が、前記方法における使用に適切であることを示す方法。
【請求項49】
前記化合物が前記標的細胞を破壊する前記治療抗体の能力を30%増強する、請求項48に記載の方法。
【請求項50】
前記化合物が前記標的細胞を破壊する前記治療抗体の能力を50%増強する、請求項48に記載の方法。
【請求項51】
前記化合物が、抗体、抗体フラグメント、モノクローナル抗体、モノクローナル抗体のフラグメント、ヒト化抗体、キメラ抗体、およびヒト化抗体より成る群から選択される、請求項48〜50のいずれか一項に記載の方法。
【請求項52】
前記標的細胞が、癌細胞、ウイルス感染細胞、または自己免疫疾患の基礎を成す細胞である、請求項48〜51のいずれか一項に記載の方法。
【請求項53】
前記治療抗体がリツキシマブまたはキャンパスである、請求項48〜52のいずれか一項に記載の方法。
【請求項54】
対象におけるCD16によって結合されうる治療抗体の投与を含む治療の有効性を増大させる方法であって、前記方法が、前記治療抗体の投与前、投与と同時に、または投与後に、阻害性受容体を遮断し、またはNK細胞の活性化受容体を刺激する化合物の治療有効量を前記対象に投与する工程を含んで成る方法。
【請求項55】
前記化合物が前記対象におけるADCCを増強することによって前記治療の有効性を増大させることを特徴とする請求項54に記載の方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−51889(P2012−51889A)
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願番号】特願2011−201631(P2011−201631)
【出願日】平成23年9月15日(2011.9.15)
【分割の表示】特願2006−520938(P2006−520938)の分割
【原出願日】平成16年7月23日(2004.7.23)
【出願人】(506000184)イナート・ファルマ (15)
【氏名又は名称原語表記】INNATE PHARMA
【出願人】(506027099)ウニヴェルシタ・デッリ・ストゥーディ・ディ・ペルージャ (3)
【氏名又は名称原語表記】UNIVERSITA DEGLI STUDI DI PERUGIA
【Fターム(参考)】
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願日】平成23年9月15日(2011.9.15)
【分割の表示】特願2006−520938(P2006−520938)の分割
【原出願日】平成16年7月23日(2004.7.23)
【出願人】(506000184)イナート・ファルマ (15)
【氏名又は名称原語表記】INNATE PHARMA
【出願人】(506027099)ウニヴェルシタ・デッリ・ストゥーディ・ディ・ペルージャ (3)
【氏名又は名称原語表記】UNIVERSITA DEGLI STUDI DI PERUGIA
【Fターム(参考)】
[ Back to top ]

