NPM1遺伝子のexon12変異の検出用プローブおよびその用途
【課題】NPM1遺伝子のexon12変異を検出するのに有効なプローブを特定し、NPM1遺伝子のexon12変異を検出する方法、およびそのためのキットを提供する。
【解決手段】NPM1遺伝子のexon12の変異を検出するためのプローブであって、特定の塩基配列における特定部位の12〜50塩基長の配列に相補的な配列またはそれに相同な配列、および前記配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、前記特定部位の第1塩基に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチドから選択される、少なくとも1種の蛍光標識オリゴヌクレオチドからなることを特徴とする多型検出用プローブ。
【解決手段】NPM1遺伝子のexon12の変異を検出するためのプローブであって、特定の塩基配列における特定部位の12〜50塩基長の配列に相補的な配列またはそれに相同な配列、および前記配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、前記特定部位の第1塩基に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチドから選択される、少なくとも1種の蛍光標識オリゴヌクレオチドからなることを特徴とする多型検出用プローブ。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、NPM1遺伝子のexon12変異を検出する方法、ならびにそのための核酸プローブおよびキットに関する。
【0002】
急性骨髄性白血病(AML)の病因に関連する DNA 変異は多数発見されている。NPM1遺伝子変異は成人の急性骨髄性白血病患者に見つかり、FLT3-ITD遺伝子変異の結果と組み合わせて考えることで予後予測に関連することが報告されている(非特許文献1)。NPM1遺伝子の変異タイプとしては、例えば、非特許文献2−7に記載されており、報告症例数の多さや変異が起こる塩基配列箇所から代表的な変異としては、タイプA、タイプB、タイプD、タイプ7、タイプQ、タイプ10、タイプE、タイプ6などが挙げられる。
【0003】
塩基の多型を検出する方法としては、以下の方法が知られている。
非特許文献7には、PCRで増幅した後に電気泳動で分離し、そこから切出したゲルから増幅産物を精製し、ダイレクトシークエンスする方法が記載されている。非特許文献8には、DHPLC法とシークエンス法により検出する方法が記載されている。
しかしながら、これらの方法は、(1)増幅産物を取り出すので、コンタミネーションの危険性があり、(2)操作が自動化されておらず、また各項目それぞれについて操作が必要であることから、手間とコストを必要とし、(3)結果解析に専門知識や専門スキルを必要とし、そして、(4)シークエンス解析の検出特異性は20%程度と低いため、正常細胞の割合が多い癌細胞では、検出が難しいという問題があった。
【0004】
一方、変異を含む領域をPCRで増幅した後、蛍光色素で標識された核酸プローブを用いて融解曲線分析を行い、融解曲線分析の結果に基づいて変異を解析する方法が知られている(特許文献1,2)。これらの文献においては、プローブの設計に関し、末端部が蛍光色素により標識された消光プローブが標的核酸にハイブリダイゼーションしたとき、末端部分においてプローブ−核酸ハイブリッドの複数塩基対が少なくとも一つのGとCのペアを形成するように設計するという教示はある。しかしながら、これらの方法は実施する上で全ての任意配列で実施可能ではないという問題があった。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2001−286300号公報
【特許文献2】特開2002−119291号公報
【非特許文献】
【0006】
【非特許文献1】Blood. 2007;109 : 874-885
【非特許文献2】New Eng J Med 352: 254-266, 2005
【非特許文献3】Blood. 2005;106:1419-1422
【非特許文献4】Blood. 2005;106:3740-3746
【非特許文献5】Blood. 2005;106:3733-3739
【非特許文献6】Blood. 2006;108:1999-2005
【非特許文献7】Blood. 2005;106:2854-2861
【非特許文献8】Haematologica 2007; 92 : 1268-1269
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、NPM1遺伝子のexon12変異を検出するのに有効なプローブを特定し、NPM1遺伝
子のexon12変異を検出する方法、およびそのためのキットを提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者は、NPM1遺伝子のexon12変異を含む特定の領域に基づいてプローブを設計し、該プローブを用いる融解曲線分析を行うことにより当該変異を検出できることを見出し、本発明を完成させるに至った。
【0009】
すなわち、本発明は以下の通りである。
(1)NPM1遺伝子のexon12の変異を検出するためのプローブであって、下記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2およびP2'から選択される少なくとも1種の蛍光標識オリゴヌクレオチドからなることを特徴とする多型検出用プローブ。
(P5)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P5')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1)配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列であり、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1')配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P2)配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列であり、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、および
(P2')配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド。
(2)P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号145に対応する塩基を3'末端から数えて1〜3番目の位置に有し、
P1およびP1'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号135に対応する塩基を3'末端から数えて1〜3番目の位置に有し、
P2およびP2'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号182に対応する塩基を5'末端から数えて1〜3番目の位置に有する、(1)記載のプローブ。
(3)P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号145に対応する塩基を3'末端に有し、
P1およびP1'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、(1)記載のプローブ。
(4)P1およびP1'のオリゴヌクレオチドは、塩基番号153-156のいずれかの塩基に対応する塩基を5'末端とし、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、塩基番号153-156のいずれかの塩基に対応する塩基を3'末端とし、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、(1)記載のプローブ。
(5)P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、塩基番号162を5'末端とし、蛍光色素で標識された塩基番号145に対応する塩基を3'末端に有し、
P1およびP1'のオリゴヌクレオチドは、塩基番号155を5'末端とし、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、塩基番号156を3'末端とし、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、(1)記載のプローブ。
(6)前記オリゴヌクレオチドは、標的配列にハイブリダイズしないときに蛍光を発し、且つ標的配列にハイブリダイズしたときに蛍光強度が減少するかまたは増加する、(1)〜(5)のいずれか1項記載のプローブ。
(7)前記オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、標的配列にハイブリダイズしたときに蛍光強度が減少する、(6)記載のプローブ。
(8)前記プローブが、融解曲線分析用のプローブである、(1)〜(7)のいずれか1項に記載のプローブ。
(9)P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドの塩基長が12〜35で、P1およびP1'のオリゴヌクレオチドの塩基長が16〜35で、P2およびP2'のオリゴヌクレオチドが19〜35である、(1)〜(8)のいずれか1項記載の多型検出用プローブ。
(10)NPM1遺伝子のexon12における多型の検出方法であって、(1)〜(9)のいずれか1項に記載のプローブを少なくとも1種用いることを特徴とする方法。
(11)NPM1遺伝子のexon12における多型の検出方法であって、下記工程(I)〜(IV)を含むことを特徴とする方法。
(I)核酸を含有する試料に、(1)〜(9)のいずれか1項に記載のプローブを添加して前記核酸に前記プローブをハイブリダイズさせる工程、
(II)温度を変化させて前記核酸と前記プローブとのハイブリッド形成体を解離させ、ハイブリッド形成体の解離に基づくシグナルの変動を測定する工程、
(III)前記シグナルの変動を解析して前記試料中の一本鎖核酸におけるTm値を検出する工程、および
(IV)前記Tm値から前記試料中の一本鎖核酸における、目的の多型の有無または多型を有する一本鎖核酸の存在比を検出する工程。
(12)さらに、(I)の工程の前または(I)の工程と同時にDNAを増幅することを含む、(11)に記載の方法。
(13)(10)〜(12)のいずれか1項に記載の方法により、NPM1遺伝子のexon12における多型を検出する工程、および多型の有無を決定する工程を含む、急性骨髄性白血病のかかりやすさ、病態および/または予後を分析する方法。
(14)(1)〜(9)のいずれか1項に記載のプローブを含む、NPM1遺伝子における多型を検出するための試薬キット。
(15)さらに、NPM1遺伝子の配列番号1に示す塩基配列におけるP5、P5'、P6、P6'、P7
、P7'、P1、P1'、P2、P2'のオリゴヌクレオチドがハイブリダイズする配列を含む領域を増幅するためのプライマーを含む、(14)に記載の試薬キット。
(16)前記プライマーが、下記P3およびP4並びにP3'およびP4'から選択される多型検出用プライマーである、(14)または(15)に記載の試薬キット。
(P3)106番目の塩基Tを3'末端とし配列番号1に相同的な10〜50塩基のオリゴヌクレオチド、および
(P4)205番目の塩基Tを3'末端とし配列番号1の相補鎖に相同性を有する10〜50塩基のオリゴヌクレオチド並びに
(P3')106番目の塩基Tを3'末端とし配列番号1の相補鎖に対してストリンジェントな条件下でハイブリダイズする塩基配列を有する10〜50塩基のオリゴヌクレオチド、および
(P4')205番目の塩基Tを3'末端とし配列番号1の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有する10〜50塩基のオリゴヌクレオチド。
【発明の効果】
【0010】
本発明のプローブを添加して融解曲線分析(Tm解析)を行うだけでNPM1遺伝子のexon12の変異の検出が可能となる。本発明のプローブは、特異性が高く、検出感度が高い。本発明の方法を用いることにより、PCRを行う場合であっても、増幅産物を取り出す必要がないため、コンタミネーションの危険性がほぼ無い。また、本発明の方法は、操作が簡単なので自動化が容易である。本発明のプローブを使用すれば、現在報告されている変異の中の代表的な8つの変異タイプの内、7つの変異が識別可能である。また代表的な2つの変異タイプ(タイプA,E)については、野生型に含まれる変異が10%であっても検出可能である。
【図面の簡単な説明】
【0011】
【図1】(A)核酸混合物の融解曲線、及び(B)微分融解曲線の一例を示す図である。
【図2】検量線の一例を示す図である。
【図3】本発明のプローブの設計概略図を示す。実施例において使用される本発明のプローブの位置を示す。また、比較例において使用されるプローブの位置を示す。
【図4】実施例1のWT(相補鎖オリゴヌクレオチド)についてのTm解析における単位時間当たりのTAMRA(3T−NPM1−e12−R1)の蛍光強度の変化量(d蛍光強度増加量/t)を縦軸とし、温度を横軸とし、これらの関係を示す。以下の図においても、縦軸と横軸の関係は同様である。
【図5】実施例1のmt type A(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R1)を用いた。
【図6】実施例1のmt type B(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R1)を用いた。
【図7】実施例1のmt type D(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R1)を用いた。
【図8】実施例1のmt type 7(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R1)を用いた。
【図9】実施例1のWT(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(5T−NPM1−e12−R2)を用いた。
【図10】実施例1のmt type Q(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(5T−NPM1−e12−R2)を用いた。
【図11】実施例1のmt type 10(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(5T−NPM1−e12−R2)を用いた。
【図12】実施例1のmt type E(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(5T−NPM1−e12−R2)を用いた。
【図13】実施例1のmt type 6(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(5T−NPM1−e12−R2)を用いた。
【図14】比較例1のWT(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図15】比較例1のmt type A(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図16】比較例1のmt type B(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図17】比較例1のmt type D(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図18】比較例1のmt type 7(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図19】比較例1のmt type Q(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図20】比較例1のmt type 10(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図21】比較例1のmt type E(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図22】比較例1のmt type 6(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図23】実施例2の血液検体についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図24】実施例2のWT 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図25】実施例2のmt type A 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図26】実施例2のmt type A 30%、Wt 70%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図27】実施例2のmt type A 20%、Wt 80%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図28】実施例2のmt type A 10%、Wt 90%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図29】実施例2のmt type E 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図30】実施例2のmt type E 30%、Wt 70%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図31】実施例2のmt type E 20%、Wt 80%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図32】実施例2のmt type E 10%、Wt 90%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図33】比較例2の血液検体についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図34】比較例2のWt 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図35】比較例2のmt type A 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図36】比較例2のmt type A 20%、Wt 80%(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図37】比較例2のmt type E 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図38】比較例2のmt type E 20%、Wt 80%(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図39】実施例4のmt type A(プラスミド)についてのPCR反応後のTm解析において、プローブにPacific Blue(mtA-R4)を用いた。
【図40】実施例4のmt type A(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(mtB-R5)を用いた。
【図41】実施例4のmt type A(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(mtD-R6)を用いた。
【発明を実施するための形態】
【0012】
<1>本発明プローブおよび本発明検出方法
本発明プローブは、NPM1遺伝子のexon12の変異を検出するためのプローブであって、下記(P5)、(P5')、(P6)、(P6')、(P7)、(P7')、(P1), (P1'), (P2), および(P2')から選択される少なくとも1種の蛍光標識オリゴヌクレオチドからなることを特徴とする多型検出用プローブである。
(P5)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P5')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1)配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配
列に相補的な配列またはそれに相同な配列であり、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1')配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P2)配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列であり、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、および
(P2')配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド。
【0013】
本発明プローブは、配列番号2に示す塩基配列(NPM1遺伝子のexon12の変異タイプAの塩基を有する配列)において上記(P5)、(P5')、(P6)、(P6')、(P7)、(P7')に特定された配列を有し、(P6)、(P6')については、塩基番号153番目に対応する塩基がグアニンであり、(P7)、(P7')については、さらに塩基番号154番目に対応する塩基がチミンである他は、特許文献1,2に記載された消光プローブと同様にして作製できる。また、本発明プローブは、配列番号1に示す塩基配列(NPM1遺伝子のexon12の野生型の塩基を有する配列)において上記(P1), (P1'), (P2)および(P2')に特定された配列を有する他は、特許文献1,2に記載された消光プローブと同様にして作製できる。なお、本発明の配列番号1に示す配列は、GenBankのアクセッションナンバーNG_016018の27689番目から28278番目である。また、配列番号2に示す配列は、塩基番号153〜157番目の4塩基が付加されている点でのみ配列番号1に示す配列と異なる。
【0014】
本発明のプローブの長さとしては、P5、P5'、P6、P6'、P7、P7'については、例えば、12〜50塩基長、12〜35塩基長、または12〜30塩基長である。P1, P1'については、例えば、16〜50塩基長、16〜35塩基長、または16〜30塩基長である。P2, P2'については、例えば、19〜50塩基長、19〜35塩基長、または19〜30塩基長である。
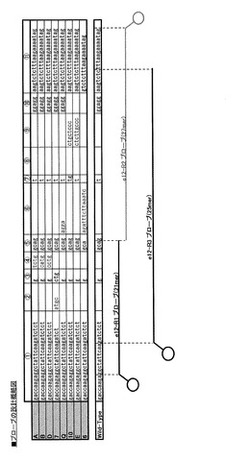
本発明プローブは、例えば、配列番号1に示す塩基配列において、塩基番号153-156(下記表1のgcag)のいずれかの塩基に対応する塩基を末端とするプローブであり、P1, P1'については、塩基番号153-156のいずれかの塩基を5'末端とし、P2, P2'については、塩基番号153-156のいずれかの塩基を3'末端とする。本発明のプローブは、例えば、配列番号1に示す塩基配列において、P1, P1'については、塩基番号155の塩基を5'末端とし、P2, P2'については、塩基番号156の塩基を3'末端とする。
【0015】
本願における「相同性」とは、特定の塩基配列において、塩基配列の相補鎖に例えば、80%、85%、90%、95%、96%、97%、98%、99%以上の同一性を有する配列を有している塩基配列をさす。本願においては、100%の同一性を有していてもよい。
本願におけるハイブリダイゼーションは、公知の方法あるいはそれに準じる方法、例えば、Molecular Cloning 3rd(J. Sambrook et al., Cold Spring Harbor Lab. Press, 2001)
に記載の方法等に従って行うことができる。この文献は、参照により本明細書に組み入れられるものとする。
ストリンジェントな条件とは、特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。典型的なストリンジェントな条件とは、例えば、カリウム濃度は約25mM〜約50mM、及びマグネシウム濃度は約1.0mM〜約5.0mM中において、ハイブリダイゼーションを行う条件があげられる。本発明の条件の1例としてTris−HCl(pH8.6)、25mMのKCl、及び1.5mMのMgCl2中においてハイブリダイゼーションを行う条件が、挙げられるが、これに限定されるものではない。その他、ストリンジェントな条件としては、Molecular Cloning 3rd(J. Sambrook et al., Cold Spring Harbor Lab. Press, 2001)に記載されている。この文献は、参照により本明細書に組み入れられるものとする。当業者は、ハイブリダイゼーション反応や、ハイブリダイゼーション反応液の塩濃度等を変化させることによって、このような条件を容易に選択することができる。
【0016】
さらに、本発明における前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドには、それぞれ前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドに塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。
当該塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数としては1塩基又は2塩基以上が挙げられ、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば1塩基〜10塩基又は1塩基〜5塩基が挙げられる。
【0017】
挿入、欠失又は置換の中でも、本発明における前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドとしては、それぞれ前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドが挙げられる。置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号2で示される配列のうち152番目〜166番目の塩基以外の位置、または配列番号1で示される配列のうち152番目〜162番目の塩基以外の位置の塩基が置換されることが挙げられる。置換される塩基の数としては1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0018】
前記蛍光標識オリゴヌクレオチドにおける、オリゴヌクレオチドとしては、オリゴヌクレオチドの他、修飾されたオリゴヌクレオチドも含まれる。
前記オリゴヌクレオチドの構成単位としては、リボヌクレオチド、デオキシリボヌクレオチド、人工核酸等が挙げられる。前記人工核酸としては、DNA、RNA、RNAアナログであるLNA(Locked Nucleic Acid);ペプチド核酸であるPNA(Peptide Nucleic Acid);架橋化核酸であるBNA(Bridged Nucleic Acid)等が挙げられる。
前記オリゴヌクレオチドは、前記構成単位のうち、一種類から構成されてもよいし、複数種類から構成されてもよい。
【0019】
本発明において使用されるNPM1遺伝子のexon12の変異を検出するためのプローブの塩基配列の例としては、P5としては、5'-cactgcCAGAcagagatc-3'(配列番号56)が挙げられ、P6としては、5'-cactgcCATGcagagatc-3'(配列番号57)が挙げられ、P7としては、5'-cactgcCAGGcagagatc-3'(配列番号58)が挙げられ、P1としては、5'-tgccagagatcttgaatagcc-3'(配列番号4)が挙げられ、P2としては、5'-ctattttcttaaagagacttcctccac-3'(配列番号5)が挙げられる。
蛍光色素としては、特許文献1,2に記載されたものが使用できるが、具体例としては、Pacific Blue(商標)、FAM(商標)、TAMRA(商標)、BODIPY FL(商標)等が挙げられる。蛍光色素のオリゴヌクレオチドへの結合方法は、通常の方法、例えば特許文献1,2に記載の方法に従って行うことができる。
【0020】
本発明の(P5),(P5'),(P6),(P6'),(P7),(P7'),(P1), (P1'), (P2)または(P2')のいずれか1つのオリゴヌクレオチドを用いることにより、例えば、(P5),(P6),(P7)または(P5'),(P6'),(P7')の3つのオリゴヌクレオチドを用いることにより、例えば、(P1)および(P2)または(P1')および(P2')の2つのオリゴヌクレオチドを用いることにより、本実施例3,4に示される配列番号56−58に示すプローブを用いることにより、または、本実施例1,2に示される配列番号4,5に示すプローブを用いることにより、NPM1遺伝子のexon12の変異を検出することができる(図3)。
【0021】
本発明プローブは、標的配列にハイブリダイゼーションしないときに蛍光色素の蛍光が発光し、標的配列にハイブリダイゼーションしたときに蛍光色素の蛍光が減少または増加することが好ましい。本発明プローブは、例えば、ハイブリダイゼーションしないときに蛍光色素の蛍光が発光し、ハイブリダイゼーションしたときに蛍光色素の蛍光が消光する、消光プローブである。
また、本発明プローブは、5’または3’末端から数えて1〜3番目の塩基が蛍光色素により標識化されていることが好ましく、3’末端が蛍光色素により標識されていることがより好ましい。なお、本明細書において、「5’末端から数えて1〜3番目」という場合は、5’末端を1番目として数え、「3’末端から数えて1〜3番目」という場合は、3’末端を1番目として数える。
なお、本発明プローブにおいて蛍光色素により標識されている塩基は、P5,P5',P6,P6',P7,P7'については、配列番号2における145番目の塩基であり、P1, P1'については、配列番号1における135番目の塩基であり、P2, P2'については、配列番号1における182番目の塩基である。
【0022】
本発明のオリゴヌクレオチドにより検出することのできるNPM1遺伝子のexon12の変異は、例えば、以下の表1に記載されており、タイプA、タイプB、タイプD、タイプC、タイプE、タイプGm、タイプKm、タイプNm、タイプOm、タイプQm、タイプ3、タイプ4、タイプ6、タイプ7、タイプ13、タイプ10、タイプG+、タイプH+、タイプI+、タイプJ+、およびタイプIからなる群より選択される少なくとも1つ以上の変異を検出できる。
【0023】
【表1】

【0024】
(P5),(P5'),(P6),(P6'),(P7),(P7')のオリゴヌクレオチドを用いる場合には、タイプA、タイプB、タイプD、タイプC、タイプGm、タイプKm、タイプNm、タイプOm、タイプQm、タイプ3、タイプ4、タイプ13、タイプG+、タイプH+、タイプI+、タイプJ+、およびタイプIなどを検出することができる。
配列番号1に示す塩基配列において塩基番号153-156の領域より5’側の配列のプローブ、例えば、(P1),(P1')のオリゴヌクレオチドを用いる場合には、タイプA、タイプB、タイプD、およびタイプ7などを検出することができる。
配列番号1に示す塩基配列において塩基番号153-156の領域より3’側の配列のプローブ、例えば、(P2),(P2')のオリゴヌクレオチドを用いる場合には、タイプ10、タイプE、およびタイプ6などを検出することができる。
また、本発明の(P5),(P5'),(P6),(P6'),(P7),(P7')のいずれか1つのオリゴヌクレオチド、または(P1)もしくは(P1')および(P2)もしくは(P2')のオリゴヌクレオチドを用いることにより、NPM1遺伝子のexon12の変異の有無を検出することができ、急性骨髄性白血病のかかりやすさ、病態および/または予後の診断が可能となる。
【0025】
本実施例に示される配列番号56,57,58,4,5のプローブを用いることにより、NPM1遺伝子のexon12の変異を検出することができる。配列番号56−58,4に示すプローブについては、3’末端が蛍光色素で標識され、配列番号5に示すプローブについては、5’末端が蛍光色素で標識されている。
【0026】
本発明の検出方法は、上記のような本発明のプローブを用いることを特徴とする。すなわち、本発明の検出方法は、配列番号2に示す塩基配列において、塩基番号157-160の領域(配列番号1の塩基番号153-156に対応)を含む1つ以上のプローブを用いることもできるし、上記P5,P5',P6,P6',P7,P7'の1つ以上のプローブを用いることもできる。また、本発明の検出方法は、配列番号1に示す塩基配列において、塩基番号153-156の領域を末端とする1つ以上のプローブを用いることもできるし、上記P1, P1', P2およびP2'の1つ以上のプローブを用いることもできる。
【0027】
本発明の検出方法は、例えば、本発明のプローブを使用し、以下の工程を含むことを特徴とする。
(I)核酸を含有する試料に、本発明のプローブを添加して前記核酸に前記プローブをハイブリダイズさせる工程、
(II)温度を変化させて前記核酸と前記プローブとのハイブリッド形成体を解離させ、ハイブリッド形成体の解離に基づくシグナルの変動を測定する工程、
(III)前記シグナルの変動を解析して前記試料中の一本鎖核酸におけるTm値を検出する工程、および
(IV)前記Tm値から前記試料中の一本鎖核酸における、目的の多型の有無または多型を有する一本鎖核酸の存在比を検出する工程。
【0028】
本発明検出方法は、本発明プローブを用いることの他は、通常の核酸増幅および融解曲線分析(Tm解析)の方法に従って行うことができる。また、本発明の検出方法は、前記工程(I)の前または工程(I)と同時に核酸を増幅することを含んでいてもよい。
【0029】
核酸増幅の方法としては、ポリメラーゼを用いる方法が好ましく、その例としては、PCR、ICAN、LAMP等が挙げられる。ポリメラーゼを用いる方法により増幅する場合は、本発明プローブの存在下で増幅を行うことが好ましい。用いるプローブに応じて、増幅の反応条件等を調整することは当業者であれば容易である。これにより、核酸の増幅後にプローブのTm値を解析するだけなので、反応終了後増幅産物を取り扱う必要がない。よって、増幅産物による汚染の心配がない。また、増幅に必要な機器と同じ機器で検出することが可能なので、容器を移動する必要すらない。よって、自動化も容易である。
【0030】
なお、工程(III)でTm値を決定することには、Tmの温度を決定することだけでなく、Tmのピークの高さを決定することを含む。ピークの高さにより、多型を有する塩基配列の存在比を決定することができる。なお、多型を有する塩基配列の存在比をより定量的に決定するには、下記に示すような検量線を作成し、それに基づいて存在比を決定することが好ましい。
【0031】
多型を有する塩基配列の存在比を定量的に決定する方法について、野生型と特定の変異型の存在比の決定を例に挙げて以下に示す。ただし、この方法は一例にすぎず、多型を有する塩基配列の存在比の決定の仕方はこれに限定されない。
【0032】
まず、野生型の核酸Wtと変異型の核酸Mtとの2種類の核酸の存在比を各々異ならせた複数の核酸混合物を作製し、複数の核酸混合物の各々について、融解曲線解析装置等を用いて融解曲線を得る。
図1(A)に、ある1つの核酸混合物の温度と蛍光強度との関係で表された融解曲線、
及び図1(B)に温度と蛍光強度の微分値との関係で表された融解曲線(微分融解曲線ともいう)を示す。この微分融解曲線からピークを検出することにより、核酸Wtの融解温度TmW及び核酸Mtの融解温度TmMを検出して、TmW及びTmMを含む温度範囲の各々を設定する。TmWを含む温度範囲ΔTWとしては、例えば、TmWとTmMとの間で蛍光強度の微分値が最小となる温度を下限、蛍光強度のピークの裾野に対応する温度を上限とする温度範囲を設定することができる。また、TmMを含む温度範囲ΔTMとしては、例えば、TmWとTmMとの間で蛍光強度の微分値が最小となる温度を上限、蛍光強度のピークの裾野に対応する温度を下限とする温度範囲を設定することができる。なお、温度範囲ΔTW及び温度範囲ΔTMは、同一の幅(例えば、10℃)または異なる幅(例えば、温度範囲ΔTWが10℃、温度範囲ΔTMが7℃)となるように設定することができる。また、温度範囲ΔTW及び温度範囲ΔTMは、それぞれの融解温度TmからプラスX℃、マイナスX℃の幅(X℃は例えば15℃以内、望ましくは10℃以内)というように設定することができる。
【0033】
次に、温度範囲ΔTW及び温度範囲ΔTMの各々について、微分融解曲線の温度範囲の下限に対応する点と上限に対応する点とを通る直線と微分融解曲線とで囲まれた面積(図1(B)の斜線部分)を求める。面積の求め方の一例として、具体的に以下のように求めることができる。温度Tにおける蛍光強度の微分値をf(T)とし、温度Tにおけるベース値をB(T)として、下記(1)式により求める。
面積S={f(Ts+1)−B(Ts+1)}+{f(Ts+2)−B(Ts+2)}
+・・・+{f(Te-1)−B(Te-1)} ・・・(1)
ただし、Tsは各温度範囲における下限値、Teは上限値である。また、各温度Tにおけるベース値B(T)は、下記(2)式により求まる値であり、蛍光強度の検出信号に含まれるバックグラウンドレベルを表すものである。このベース値を蛍光強度の微分値から減算することにより、蛍光強度の検出信号に含まれるバックグラウンドの影響を除去する。
B(T)=a×(T−Ts)+f(Ts) ・・・(2)
ただし、a={f(Te)−f(Ts)}/(Te−Ts) である。
【0034】
上記(1)式及び(2)式に従って、各核酸混合物について、温度範囲ΔTWにおける面積SW及び温度範囲ΔTWにおける面積SMを求め、面積比と各核酸混合物の存在比との関係を表す検量線を作成する。図2に、横軸に存在比(核酸混合物の総量に対する核酸Mtの割合)をとり、縦軸に面積比(SM/SW)をとった検量線の一例を示す。なお、面積比はSW/SMで定めてもよい。
実際の試料を用いて得られた融解曲線と微分融解曲線から面積比を算出し、上記のようにしてあらかじめ作成した検量線に基づいて、実際の試料中に含まれる多型を有する塩基配列の存在比を決定することができる。
【0035】
本発明において、試料中のDNAは、一本鎖DNAでもよいし二本鎖DNAであってもよい。前記DNAが二本鎖DNAの場合は、例えば、前記ハイブリダイズ工程に先立って、加熱により前記試料中の二本鎖DNAを解離させる工程を含むことが好ましい。二本鎖DNAを一本鎖DNAに解離することによって、次のハイブリダイズ工程において、検出用プローブとのハイブリダイズが可能となる。
【0036】
本発明において、前記試料中のDNAに対する、本発明のプローブの添加割合(モル比)は、制限されないが、検出シグナルを十分に確保できることから、試料中のDNAに対して1倍以下が好ましく、0.1倍以下がより好ましい。この際、試料中のDNAとは、例えば、検出目的の多型が発生している検出対象DNAと前記多型が発生していない非検出対象DNAとの合計でもよいし、検出目的の多型が発生している検出対象配列を含む増幅産物と前記多型が発生していない非検出対象配列を含む増幅産物との合計でもよい。なお、試料中のDNAにおける前記検出対象DNAの割合は、通常、不明であるが、結果的に、前記プローブの添加割合(モル比)は、検出対象DNA(検出対象配列を含む増幅産物)に対して例えば、10倍以下、5倍以下、または3倍以下である。また、その下限は特に制限されないが、例えば、0.001倍以上、0.01倍以上であり、または0.1倍以上である。
【0037】
前記DNAに対する本発明のプローブの添加割合は、例えば、二本鎖DNAに対するモル比でもよいし、一本鎖DNAに対するモル比でもよい。
【0038】
Tm値について説明する。二本鎖DNAを含む溶液を加熱していくと、260nmにおける吸光度が上昇する。これは、二本鎖DNAにおける両鎖間の水素結合が加熱によってほどけ、一本鎖DNAに解離(DNAの融解)することが原因である。この現象に基づき、融解温度Tmとは、一般に、吸光度が、吸光度全上昇分の50%に達した時の温度と定義される。
【0039】
本発明において、前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドが相補的な塩基配列を有するDNAとハイブリダイズした場合のTm値と、非相補的なDNAとハイブリダイズした場合のTm値との差は、例えば5℃以上が挙げられる。前記Tm値の差が5℃以上であることで、上述の変異をより高感度に検出することができる。
また、前記Tm値の差としては、5℃以上、又は7℃以上等が挙げられる。
前記Tm値の差を大きくする方法としては、プローブ配列においてそのハイブリダイズする塩基配列に対してミスマッチとなる塩基を含める方法や、例えばNatureBiotech(1997)vol15 p.331−335に記載の方法などが挙げられる。
【0040】
本発明において、Tm値を決定するための温度変化に伴うシグナル変動の測定は、前述のような原理から260nmの吸光度測定により行うこともできるが、本発明のプローブに付加した標識のシグナルに基づくシグナルであってDNAとプローブとのハイブリッド形成の状態に応じて変動するシグナルを測定することが好ましい。このため、本発明のプローブとして、前述の標識化プローブを使用することが好ましい。前記標識化プローブとしては、例えば、標的配列にハイブリダイズしないときに蛍光を発し、且つ標的配列にハイブリダイズしたときに蛍光強度が減少(消光)する蛍光標識オリゴヌクレオチドプローブ、または標的配列にハイブリダイズしないときに蛍光を発し、且つ標的配列にハイブリダイズしたときに蛍光強度が増加する蛍光標識オリゴヌクレオチドプローブが挙げられる。前者のようなプローブであれば、検出対象配列とハイブリッド(二本鎖DNA)を形成している際にはシグナルを示さないか、シグナルが弱いが、加熱によりプローブが遊離するとシグナルを示すようになるか、シグナルが増加する。また、後者のプローブであれば、検出対象配列とハイブリッド(二本鎖DNA)を形成することによってシグナルを示し、加熱によりプローブが遊離するとシグナルが減少(消失)する。したがって、この標識に基づくシグナルの変化をシグナル特有の条件(吸光度等)で検出することによって、前記260nmの吸光度測定と同様に、融解の進行ならびにTm値の決定を行うことができる。標識化プローブにおける標識化物質は、例えば、前述のとおりであるが蛍光色素標識化プローブが好ましい。
【0041】
核酸増幅を行う際の鋳型となる核酸としては、核酸を含んでいればよく、特に制限されないが、例えば、血液、口腔粘膜懸濁液、爪や毛髪等の体細胞、生殖細胞、乳、腹水液、パラフィン包埋組織、胃液、胃洗浄液、腹膜液、羊水、細胞培養などの任意の生物学的起源に由来する又は由来しうるものである。鋳型となる核酸は、該起源から得られたままで直接的に、または該サンプルの特性を改変するために前処理した後で使用することができる。
【0042】
以下、PCRを用いる場合を例として、さらに説明する。PCRに用いるプライマー対は、本発明プローブがハイブリダイゼーションできる領域が増幅されるようにする他は、通常のPCRにおけるプライマー対の設定方法と同様にして設定することができる。プライマーの長さおよびTm値は、通常には、12mer〜40merで40〜70℃、または16mer〜30merで55〜60℃である。プライマー対の各プライマーの長さは同一でなくてもよいが、両プライマーのTmはほぼ同一(通常には、相違が2℃以内)であることが好ましい。なお、Tm値は最近接塩基対(Nearest Neighbor)法により算出した値である。プライマー対の例としては、配列番号16,17に示す塩基配列を有するプライマーからなるものが挙げられる。
【0043】
PCRは、本発明で使用される本発明プローブの存在下で行うことが好ましい。これにより、増幅反応終了後に増幅産物を精製などすることなくTm解析を行うことができる。用いるプローブに応じて、プライマーのTm値やPCRの反応条件を調整することは当業者であれば容易である。
【0044】
Tm解析の結果に基づくNPM1遺伝子のexon12の変異の検出は通常の方法に従って行うことができる。本発明における検出とは、変異の有無の検出および多型を有する核酸の存在比の決定を包含する。
【0045】
なお、本発明のプローブおよび多型検出方法により、NPM1遺伝子のexon12の変異を検出することができ、検出された変異の有無に基づいて、急性骨髄性白血病のなりやすさ、病態および/または予後を診断することができる。
【0046】
<2>本発明キット
本発明キットは、本発明の検出方法に用いるためのキットである。このキットは、本発明の多型検出用プローブを含むことを特徴とする。なお、本発明のキットは、急性骨髄性白血病のかかりやすさ、病態および/予後を判断するのにも使用できる。
プローブについては、本発明プローブに関し、上記に説明した通りである。
【0047】
本発明検出キットは、プローブの他に、本発明の検出方法における核酸増幅を行うのに必要とされる試薬類、特にDNAポリメラーゼを用いる増幅のための上述のプライマーをさらに含んでいてもよい。
本発明検出キットにおいてプローブ、プライマーおよびその他の試薬類は、別個に収容されていてもよいし、それらの一部が混合物とされていてもよい。
【0048】
本発明において、検出対象となる試料中の試料核酸、多型検出用プローブ又はプライマーの個々の配列に関して、これら互いの相補的な関係に基づいて記述された事項は、特に断らない限り、それぞれの配列と、各配列に対して相補的な配列とについても適用される。各配列に対して相補的な当該配列について本発明の事項を適用する際には、当該相補的な配列が認識する配列は、当業者にとっての技術常識の範囲内で、対応する本明細書に記載された配列に相補的な配列に、明細書全体を読み替えるものとする。
【0049】
以下に、本発明を実施例により具体的に説明する。だだし、これらの実施例は例示であり、これらに限定されない。
【実施例】
【0050】
実施例1(相補鎖オリゴヌクレオチドを検出対象とし、P1,P2プローブを用いる場合)
NPM1遺伝子のexon12の塩基配列(配列番号1(野生型))に基づき、表2に示す、末端部にCを有するプローブを設計した。表2中、プローブの位置は、配列番号1に示す塩基配列における塩基番号を示す。3’末端のPは、リン酸化されていることを示す。TAMRAによる標識は、常法に従って行った。
また、検出対象として使用した相補鎖オリゴヌクレオチドの配列を表2に示す。表2中、オリゴヌクレオチドの位置は、配列番号1に示す塩基配列における塩基番号を示す。
【0051】
【表2】

【0052】
NPM1遺伝子のExon12領域の変異を2つのプローブで検出するために設計したプローブの性能を確認するため、NPM1 exon12領域の野生型配列と各種変異配列の相補鎖を準備し、プローブと相補鎖オリゴヌクレオチドを含む以下の試薬溶液を調製した。
プローブ3T-NPM1-e12-R1に対して相補鎖オリゴヌクレオチドは WT、mt type A、B、D、または7を、プローブ5T-NPM1-e12-R2に対して相補鎖オリゴヌクレオチドは WT、mt type Q、10、E、または6を添加した。
【0053】
【表3】

【0054】
Tm解析の条件は下記の通りである。Tm解析における励起波長および検出波長は、それぞれ520〜555 nmおよび585〜700 nm(TAMRA)であった。
調製した試薬溶液をi-densy 反応チューブに添加し、試薬が蒸発しないようにミネラルオイル30μLを重層し、以下の反応条件でTm解析を実施してTAMRAの蛍光値の変化量を解析した。
【0055】
【表4】

【0056】
表2のプローブを用いてTm解析を行った結果、3T-NPM1-e12-R1(配列番号4)については、TAMRAのピークが、65℃(WT)、59℃(タイプA)、60℃(タイプB)、60℃(タイプD)、55℃(タイプ7)付近で見られた(図4〜8)。
このように、WT、各変異で検出ピークが確認できた。また、WTと各変異のTm値の差(ΔTm)は5〜10℃であり、変異を検出するために十分なTm値の差があることが分かり、変異を検出することに適したプローブであることが分かった。
結果を表5に示す。
【0057】
【表5】

【0058】
また、5T-NPM1-e12-R2(配列番号5)については、TAMRAのピークが、64℃(WT)、62℃(タイプQ)、52℃(タイプ10)、52℃(タイプE)、49℃(タイプ6)付近で見られた(図9〜13)。
このように、WT、各変異で検出ピークが確認できた。また、WTと変異タイプQのTm値の差(ΔTm)は2℃であったが、他の変異タイプでは十分なTm値の差があることが分かり、変異を検出することに適したプローブであることが分かった。
結果を表6に示す。
【0059】
【表6】

【0060】
実施例1の結果より、P1(配列番号4)およびP2(配列番号5)のプローブを用いたとき、NPM1遺伝子のexon12変異の多型(タイプA、タイプB、タイプD、タイプ7、タイプ10、タイプE、タイプ6)について、Tm解析で分析可能な蛍光強度の変化が認められた。すなわち、変異型は、野生型のピークに加えて、他のピークを有するものであり、固有の蛍光強度の変化量のパターンの変化が存在する。従って、P1(配列番号4)およびP2(配列番号5)のプローブを用いることにより、NPM1遺伝子のexon12変異の多型を検出することができる。
【0061】
比較例1(相補鎖オリゴヌクレオチドを検出対象とする場合)
NPM1遺伝子のExon12領域の変異を1つのプローブで検出するために設計したプローブの性能を確認するため、NPM1 exon12領域の野生型配列と各種変異配列の相補鎖を準備し、プローブと相補鎖を含む以下の試薬溶液を調製した。
試薬溶液は実施例1と同様とし、プローブのみ以下のプローブを用いた。またTm解析も実施例1と同様に実施した。
また、変異の検出のために使用したプローブの配列を表7に示す。表7中、プローブの位置は、配列番号1に示す塩基配列における塩基番号を示す。
【0062】
【表7】

【0063】
WTやいくつかの変異タイプでは問題なく検出できたが、変異タイプA、D、7では検出ピークが確認できず、様々な変異の検出に適していないプローブであることが分かった(図14−22)。
結果を表8に示す。
【0064】
【表8】

【0065】
実施例2(血液検体または人工核酸プラスミドを検出対象として用いる場合)
核酸増幅した後、Tm解析による検出が可能であるかを検討するため、血液検体を用いて反応を行った。また、NPM1遺伝子のexon12変異がどの程度混ざった検体まで検出が可能であるか、野生型配列と変異配列(AタイプとEタイプ)の人工核酸プラスミドの混合比率を振り、その検出波形を確認した。人工核酸はpUCプラスミドベクターにNPM1遺伝子のexon12周辺配列の野生型配列(590bp、配列番号1)、変異タイプA(594bp、配列番号2)、変異タイプE(594bp、配列番号3)を挿入したプラスミドを用いた。
全自動SNPs検査装置(商品名i-densy IS-5310、アークレイ社製)を用いてPCR及びTm解析を行った。PCRおよびTm解析の条件は下記の表11の通りである。
また、変異の検出に使用したプローブおよびプライマーの配列を表12に示す。表12中、プローブおよびプライマーの位置は、配列番号1に示す塩基配列における塩基番号を示す。
Tm解析における励起波長および検出波長は、それぞれ420〜485 nmおよび520〜555 nm(BODIPY FL)、または、それぞれ520〜555 nmおよび585〜700 nm(TAMRA)とした。
試薬溶液は以下の通りであった。
【0066】
【表9】

【0067】
<全血の調製>
全血10μlを希釈液(1) 70μlに加え、よく混合した後、この混合液10μlを希釈液(2)
70μlに加えた。この混合液17μlを95℃で10分加熱して4μlの前処理済全血を得た。これを1 testあたりのtemplateとして使用した。
【0068】
【表10】

【0069】
<人工核酸プラスミド>
任意の割合で野生型と変異型を混合した500コピー/μlの人工核酸プラスミドを4μl使用した。
【0070】
【表11】

【0071】
【表12】

【0072】
血液検体を用いてi-densyで測定した結果、問題なく検出ピークが確認できた(図23)。
人工核酸プラスミドを用いた検出波形を確認したところ、BODIPY FLは63℃、TAMRAも63℃に野生型の検出ピークが確認できた(図24)。
変異タイプAの場合、BODIPY FLの56-57℃に検出ピークが確認され(図25の左図)、変異タイプEの場合、TAMRAの50-51℃に検出ピークが確認できた(図29の右図)。任意に割合で混合させたプラスミドの場合、変異タイプAとEの両方で10%の変異配列が混合された状態でも変異の検出ピークが確認できた(図28の左図、図32の右図)。
【0073】
実施例2の結果より、P1(配列番号4)およびP2(配列番号5)のプローブを用いたとき、血液検体を用いた場合、そして、10%の変異配列が混合される場合でも、NPM1遺伝子のexon12変異の多型(タイプA、タイプE)について、Tm解析で解析の可能な蛍光強度の変化が認められた。従って、P1(配列番号4)およびP2(配列番号5)のプローブを用いることにより、NPM1遺伝子のexon12変異の多型を検出することができる。
【0074】
比較例2
比較例として、3T-NPM1-e12-R3プローブを用いた。以下の溶液を用いて核酸増幅した後、Tm解析による検出が可能であるかを検討した。プライマー配列や反応条件は実施例2と同様とした。プラスミド溶液(500コピー/μL)を4μL反応チューブに添加して、以下の反応条件でi-densyで反応した。Tm解析ではTAMRAの蛍光値の変化量を解析した。
【0075】
【表13】

【0076】
【表14】

【0077】
血液を用いた場合と人工核酸プラスミドの野生型と変異タイプEを検体として用いた場合は、問題なく検出ピークが得られた(図33,34,37)。しかしながら、変異タイプA100%を検体とした場合は検出ピークが確認できなかった(図35)。さらに、変異タイプAまたはEを20%混合させた人工核酸を反応させた場合、変異タイプの検出ピークが確認できず、野生型の検出ピークしか確認できなかった(図36,38)。これらの結果から、実施例2の結果と比較して、3T-NPM1-e12-R3のプローブはNPM1のexon12の変異の検出に適していないと判断される。
【0078】
実施例3(相補鎖オリゴヌクレオチドを検出対象とし、P5,P6,P7プローブを用いる場合)
NPM1遺伝子のexon12変異は多種の配列が報告されているが、そのほとんどはタイプA、B、Dである(表1参照)。そのためタイプA、B、Dが明確に検出することが、NPM1遺伝子のexon12変異検出用プローブとして有用である。
NPM1遺伝子のexon12の塩基配列(配列番号2(変異タイプA))に基づき、表15に示す、末端部にCを有するプローブを設計した。表15中、プローブの位置は、配列番号2に示す塩基配列における塩基番号を示す。Pacific Blue, TAMRAおよびPODIPY FLによる標識は、常法に従って行った。
試薬溶液は実施例1と同様とし、プローブのみ以下のプローブを用いた。またTm解析も実施例1と同様に実施した。
また、検出対象として使用した相補鎖オリゴヌクレオチドの配列を表1に記載されており、表1に記載の4の部分に挿入変異を持つ配列である。
【0079】
【表15】

【0080】
Tm解析における励起波長および検出波長は、それぞれ365〜415 nmおよび445〜480 nm(Pacific Blue)、520〜555 nmおよび585〜700 nm(TAMRA)、420〜485 nmおよび520〜555 nm(BODIPY FL)であった。
【0081】
上記に示したプローブを用いて、実施例1と同様にTm解析による検出ピーク(Tm値)の確認を行った。また、野生型の相補鎖に対するTm値と各変異配列に対するTm値の差を確認した。
3PB-NPM1-mtA-R4(配列番号56)については、WTと変異タイプM、N、Gm、12、IとのTm値の差(ΔTm)は4℃以下であったが、他の変異タイプでは十分なTm値の差があることが分かり、変異を検出することに適したプローブであることが分かった。
3T-NPM1-mtB-R5(配列番号57)については、WTと変異タイプM、N、12とのTm値の差(ΔTm)は4℃以下であったが、他の変異タイプでは十分なTm値の差があることが分かり、変異を検出することに適したプローブであることが分かった。
3FL-NPM1-mtD-R6(配列番号58)については、WTと変異タイプM、N、3、12、IとのTm値の差(ΔTm)は4℃以下であったが、他の変異タイプでは十分なTm値の差があることが分かり、変異を検出することに適したプローブであることが分かった。
結果を表16に示す。
【0082】
【表16】

【0083】
mtA-R4プローブは、WT配列(14mer)に加えてタイプAに特有の「tctg」配列を4mer挿入した塩基配列に相補的なプローブである。mtA-R4プローブは、タイプA配列と18mer一致、タイプB配列と16mer一致、タイプDと配列17mer一致するため、WT相補鎖の(14mer一致)よりも高いTm値(高い親和性)が得られ、これら変異配列を検出することができる。
同様に、タイプB配列に相補的なmtB-R5プローブは、タイプA配列と16mer一致、タイプB配列と18mer一致、タイプD配列と17mer一致し、WT相補鎖よりも高いTm値が得られる。
同様に、タイプD配列に相補的なmtD-R6プローブは、タイプA配列と17mer一致、タイプB配列と17mer一致、タイプD配列と18mer一致し、WT相補鎖よりも高いTm値が得られる。
【0084】
実施例4(相補鎖オリゴヌクレオチドを検出対象として検出感度を確認する場合)
NPM1遺伝子のexon12変異のタイプAがどの程度混ざった検体まで検出が可能であるか、野生型配列と変異配列の人工核酸プラスミドの混合比率を振り、その検出波形を確認した。人工核酸はpUCプラスミドベクターにNPM1遺伝子のexon12周辺配列の野生型配列(590bp、配列番号1)、変異タイプA(594bp、配列番号2)を挿入したプラスミドを用いた。
【0085】
【表17】

【0086】
PCRおよびTm解析の条件は実施例2の表11と同様とした。Tm解析における励起波長および検出波長は、それぞれ365〜415 nmおよび445〜480 nm(Pacific Blue)、520〜555 nmおよび585〜700 nm(TAMRA)、420〜485 nmおよび520〜555 nm(BODIPY FL)であった。
【0087】
表15のプローブを用いてTm解析を行った結果、mtA-R4プローブは、mtA 10%や3%の時に61-62℃に(図39)、mtB-R5プローブは、mtA 10%の時に53℃に(図40)、mtD-R6プローブは、mtA 10%や3%の時に59-60℃に(図41)、変異タイプAと考えられる検出ピークが確認できた。
【0088】
実施例4の結果より、mtA-R4(配列番号56)、mtB-R5(配列番号57)、mtD-R6(配列番号58)のプローブを用いたとき、NPM1遺伝子のexon12変異の多型(タイプA)について、Tm解析で分析可能な蛍光強度の変化が認められた。すなわち、変異型は、野生型のピークに加えて、他のピークを有するものであり、固有の蛍光強度の変化量のパターンの変化が存在する。従って、mtA-R4(配列番号56)、mtB-R5(配列番号57)、mtD-R6(配列番号58)のプローブを用いることにより、NPM1遺伝子のexon12変異の多型(タイプA)が少量混在する検体から当該変異を高い感度で検出可能であることが理解される。
【産業上の利用可能性】
【0089】
本発明のプローブを用いることより、急性骨髄性白血病のかかりやすさ、病態および/または予後を診断することができる。
【技術分野】
【0001】
本発明は、NPM1遺伝子のexon12変異を検出する方法、ならびにそのための核酸プローブおよびキットに関する。
【0002】
急性骨髄性白血病(AML)の病因に関連する DNA 変異は多数発見されている。NPM1遺伝子変異は成人の急性骨髄性白血病患者に見つかり、FLT3-ITD遺伝子変異の結果と組み合わせて考えることで予後予測に関連することが報告されている(非特許文献1)。NPM1遺伝子の変異タイプとしては、例えば、非特許文献2−7に記載されており、報告症例数の多さや変異が起こる塩基配列箇所から代表的な変異としては、タイプA、タイプB、タイプD、タイプ7、タイプQ、タイプ10、タイプE、タイプ6などが挙げられる。
【0003】
塩基の多型を検出する方法としては、以下の方法が知られている。
非特許文献7には、PCRで増幅した後に電気泳動で分離し、そこから切出したゲルから増幅産物を精製し、ダイレクトシークエンスする方法が記載されている。非特許文献8には、DHPLC法とシークエンス法により検出する方法が記載されている。
しかしながら、これらの方法は、(1)増幅産物を取り出すので、コンタミネーションの危険性があり、(2)操作が自動化されておらず、また各項目それぞれについて操作が必要であることから、手間とコストを必要とし、(3)結果解析に専門知識や専門スキルを必要とし、そして、(4)シークエンス解析の検出特異性は20%程度と低いため、正常細胞の割合が多い癌細胞では、検出が難しいという問題があった。
【0004】
一方、変異を含む領域をPCRで増幅した後、蛍光色素で標識された核酸プローブを用いて融解曲線分析を行い、融解曲線分析の結果に基づいて変異を解析する方法が知られている(特許文献1,2)。これらの文献においては、プローブの設計に関し、末端部が蛍光色素により標識された消光プローブが標的核酸にハイブリダイゼーションしたとき、末端部分においてプローブ−核酸ハイブリッドの複数塩基対が少なくとも一つのGとCのペアを形成するように設計するという教示はある。しかしながら、これらの方法は実施する上で全ての任意配列で実施可能ではないという問題があった。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2001−286300号公報
【特許文献2】特開2002−119291号公報
【非特許文献】
【0006】
【非特許文献1】Blood. 2007;109 : 874-885
【非特許文献2】New Eng J Med 352: 254-266, 2005
【非特許文献3】Blood. 2005;106:1419-1422
【非特許文献4】Blood. 2005;106:3740-3746
【非特許文献5】Blood. 2005;106:3733-3739
【非特許文献6】Blood. 2006;108:1999-2005
【非特許文献7】Blood. 2005;106:2854-2861
【非特許文献8】Haematologica 2007; 92 : 1268-1269
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、NPM1遺伝子のexon12変異を検出するのに有効なプローブを特定し、NPM1遺伝
子のexon12変異を検出する方法、およびそのためのキットを提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者は、NPM1遺伝子のexon12変異を含む特定の領域に基づいてプローブを設計し、該プローブを用いる融解曲線分析を行うことにより当該変異を検出できることを見出し、本発明を完成させるに至った。
【0009】
すなわち、本発明は以下の通りである。
(1)NPM1遺伝子のexon12の変異を検出するためのプローブであって、下記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2およびP2'から選択される少なくとも1種の蛍光標識オリゴヌクレオチドからなることを特徴とする多型検出用プローブ。
(P5)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P5')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1)配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列であり、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1')配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P2)配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列であり、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、および
(P2')配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド。
(2)P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号145に対応する塩基を3'末端から数えて1〜3番目の位置に有し、
P1およびP1'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号135に対応する塩基を3'末端から数えて1〜3番目の位置に有し、
P2およびP2'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号182に対応する塩基を5'末端から数えて1〜3番目の位置に有する、(1)記載のプローブ。
(3)P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号145に対応する塩基を3'末端に有し、
P1およびP1'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、(1)記載のプローブ。
(4)P1およびP1'のオリゴヌクレオチドは、塩基番号153-156のいずれかの塩基に対応する塩基を5'末端とし、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、塩基番号153-156のいずれかの塩基に対応する塩基を3'末端とし、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、(1)記載のプローブ。
(5)P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、塩基番号162を5'末端とし、蛍光色素で標識された塩基番号145に対応する塩基を3'末端に有し、
P1およびP1'のオリゴヌクレオチドは、塩基番号155を5'末端とし、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、塩基番号156を3'末端とし、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、(1)記載のプローブ。
(6)前記オリゴヌクレオチドは、標的配列にハイブリダイズしないときに蛍光を発し、且つ標的配列にハイブリダイズしたときに蛍光強度が減少するかまたは増加する、(1)〜(5)のいずれか1項記載のプローブ。
(7)前記オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、標的配列にハイブリダイズしたときに蛍光強度が減少する、(6)記載のプローブ。
(8)前記プローブが、融解曲線分析用のプローブである、(1)〜(7)のいずれか1項に記載のプローブ。
(9)P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドの塩基長が12〜35で、P1およびP1'のオリゴヌクレオチドの塩基長が16〜35で、P2およびP2'のオリゴヌクレオチドが19〜35である、(1)〜(8)のいずれか1項記載の多型検出用プローブ。
(10)NPM1遺伝子のexon12における多型の検出方法であって、(1)〜(9)のいずれか1項に記載のプローブを少なくとも1種用いることを特徴とする方法。
(11)NPM1遺伝子のexon12における多型の検出方法であって、下記工程(I)〜(IV)を含むことを特徴とする方法。
(I)核酸を含有する試料に、(1)〜(9)のいずれか1項に記載のプローブを添加して前記核酸に前記プローブをハイブリダイズさせる工程、
(II)温度を変化させて前記核酸と前記プローブとのハイブリッド形成体を解離させ、ハイブリッド形成体の解離に基づくシグナルの変動を測定する工程、
(III)前記シグナルの変動を解析して前記試料中の一本鎖核酸におけるTm値を検出する工程、および
(IV)前記Tm値から前記試料中の一本鎖核酸における、目的の多型の有無または多型を有する一本鎖核酸の存在比を検出する工程。
(12)さらに、(I)の工程の前または(I)の工程と同時にDNAを増幅することを含む、(11)に記載の方法。
(13)(10)〜(12)のいずれか1項に記載の方法により、NPM1遺伝子のexon12における多型を検出する工程、および多型の有無を決定する工程を含む、急性骨髄性白血病のかかりやすさ、病態および/または予後を分析する方法。
(14)(1)〜(9)のいずれか1項に記載のプローブを含む、NPM1遺伝子における多型を検出するための試薬キット。
(15)さらに、NPM1遺伝子の配列番号1に示す塩基配列におけるP5、P5'、P6、P6'、P7
、P7'、P1、P1'、P2、P2'のオリゴヌクレオチドがハイブリダイズする配列を含む領域を増幅するためのプライマーを含む、(14)に記載の試薬キット。
(16)前記プライマーが、下記P3およびP4並びにP3'およびP4'から選択される多型検出用プライマーである、(14)または(15)に記載の試薬キット。
(P3)106番目の塩基Tを3'末端とし配列番号1に相同的な10〜50塩基のオリゴヌクレオチド、および
(P4)205番目の塩基Tを3'末端とし配列番号1の相補鎖に相同性を有する10〜50塩基のオリゴヌクレオチド並びに
(P3')106番目の塩基Tを3'末端とし配列番号1の相補鎖に対してストリンジェントな条件下でハイブリダイズする塩基配列を有する10〜50塩基のオリゴヌクレオチド、および
(P4')205番目の塩基Tを3'末端とし配列番号1の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有する10〜50塩基のオリゴヌクレオチド。
【発明の効果】
【0010】
本発明のプローブを添加して融解曲線分析(Tm解析)を行うだけでNPM1遺伝子のexon12の変異の検出が可能となる。本発明のプローブは、特異性が高く、検出感度が高い。本発明の方法を用いることにより、PCRを行う場合であっても、増幅産物を取り出す必要がないため、コンタミネーションの危険性がほぼ無い。また、本発明の方法は、操作が簡単なので自動化が容易である。本発明のプローブを使用すれば、現在報告されている変異の中の代表的な8つの変異タイプの内、7つの変異が識別可能である。また代表的な2つの変異タイプ(タイプA,E)については、野生型に含まれる変異が10%であっても検出可能である。
【図面の簡単な説明】
【0011】
【図1】(A)核酸混合物の融解曲線、及び(B)微分融解曲線の一例を示す図である。
【図2】検量線の一例を示す図である。
【図3】本発明のプローブの設計概略図を示す。実施例において使用される本発明のプローブの位置を示す。また、比較例において使用されるプローブの位置を示す。
【図4】実施例1のWT(相補鎖オリゴヌクレオチド)についてのTm解析における単位時間当たりのTAMRA(3T−NPM1−e12−R1)の蛍光強度の変化量(d蛍光強度増加量/t)を縦軸とし、温度を横軸とし、これらの関係を示す。以下の図においても、縦軸と横軸の関係は同様である。
【図5】実施例1のmt type A(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R1)を用いた。
【図6】実施例1のmt type B(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R1)を用いた。
【図7】実施例1のmt type D(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R1)を用いた。
【図8】実施例1のmt type 7(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R1)を用いた。
【図9】実施例1のWT(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(5T−NPM1−e12−R2)を用いた。
【図10】実施例1のmt type Q(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(5T−NPM1−e12−R2)を用いた。
【図11】実施例1のmt type 10(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(5T−NPM1−e12−R2)を用いた。
【図12】実施例1のmt type E(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(5T−NPM1−e12−R2)を用いた。
【図13】実施例1のmt type 6(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(5T−NPM1−e12−R2)を用いた。
【図14】比較例1のWT(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図15】比較例1のmt type A(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図16】比較例1のmt type B(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図17】比較例1のmt type D(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図18】比較例1のmt type 7(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図19】比較例1のmt type Q(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図20】比較例1のmt type 10(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図21】比較例1のmt type E(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図22】比較例1のmt type 6(相補鎖オリゴヌクレオチド)についてのTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図23】実施例2の血液検体についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図24】実施例2のWT 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図25】実施例2のmt type A 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図26】実施例2のmt type A 30%、Wt 70%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図27】実施例2のmt type A 20%、Wt 80%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図28】実施例2のmt type A 10%、Wt 90%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図29】実施例2のmt type E 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図30】実施例2のmt type E 30%、Wt 70%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図31】実施例2のmt type E 20%、Wt 80%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図32】実施例2のmt type E 10%、Wt 90%(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(3FL−NPM1−e12−R1)(左図)とTAMRA(5T−NPM1−e12−R2)(右図)を用いた。
【図33】比較例2の血液検体についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図34】比較例2のWt 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図35】比較例2のmt type A 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図36】比較例2のmt type A 20%、Wt 80%(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図37】比較例2のmt type E 100%(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図38】比較例2のmt type E 20%、Wt 80%(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(3T−NPM1−e12−R3)を用いた。
【図39】実施例4のmt type A(プラスミド)についてのPCR反応後のTm解析において、プローブにPacific Blue(mtA-R4)を用いた。
【図40】実施例4のmt type A(プラスミド)についてのPCR反応後のTm解析において、プローブにTAMRA(mtB-R5)を用いた。
【図41】実施例4のmt type A(プラスミド)についてのPCR反応後のTm解析において、プローブにBODIPY FL(mtD-R6)を用いた。
【発明を実施するための形態】
【0012】
<1>本発明プローブおよび本発明検出方法
本発明プローブは、NPM1遺伝子のexon12の変異を検出するためのプローブであって、下記(P5)、(P5')、(P6)、(P6')、(P7)、(P7')、(P1), (P1'), (P2), および(P2')から選択される少なくとも1種の蛍光標識オリゴヌクレオチドからなることを特徴とする多型検出用プローブである。
(P5)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P5')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1)配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配
列に相補的な配列またはそれに相同な配列であり、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1')配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P2)配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列であり、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、および
(P2')配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド。
【0013】
本発明プローブは、配列番号2に示す塩基配列(NPM1遺伝子のexon12の変異タイプAの塩基を有する配列)において上記(P5)、(P5')、(P6)、(P6')、(P7)、(P7')に特定された配列を有し、(P6)、(P6')については、塩基番号153番目に対応する塩基がグアニンであり、(P7)、(P7')については、さらに塩基番号154番目に対応する塩基がチミンである他は、特許文献1,2に記載された消光プローブと同様にして作製できる。また、本発明プローブは、配列番号1に示す塩基配列(NPM1遺伝子のexon12の野生型の塩基を有する配列)において上記(P1), (P1'), (P2)および(P2')に特定された配列を有する他は、特許文献1,2に記載された消光プローブと同様にして作製できる。なお、本発明の配列番号1に示す配列は、GenBankのアクセッションナンバーNG_016018の27689番目から28278番目である。また、配列番号2に示す配列は、塩基番号153〜157番目の4塩基が付加されている点でのみ配列番号1に示す配列と異なる。
【0014】
本発明のプローブの長さとしては、P5、P5'、P6、P6'、P7、P7'については、例えば、12〜50塩基長、12〜35塩基長、または12〜30塩基長である。P1, P1'については、例えば、16〜50塩基長、16〜35塩基長、または16〜30塩基長である。P2, P2'については、例えば、19〜50塩基長、19〜35塩基長、または19〜30塩基長である。
本発明プローブは、例えば、配列番号1に示す塩基配列において、塩基番号153-156(下記表1のgcag)のいずれかの塩基に対応する塩基を末端とするプローブであり、P1, P1'については、塩基番号153-156のいずれかの塩基を5'末端とし、P2, P2'については、塩基番号153-156のいずれかの塩基を3'末端とする。本発明のプローブは、例えば、配列番号1に示す塩基配列において、P1, P1'については、塩基番号155の塩基を5'末端とし、P2, P2'については、塩基番号156の塩基を3'末端とする。
【0015】
本願における「相同性」とは、特定の塩基配列において、塩基配列の相補鎖に例えば、80%、85%、90%、95%、96%、97%、98%、99%以上の同一性を有する配列を有している塩基配列をさす。本願においては、100%の同一性を有していてもよい。
本願におけるハイブリダイゼーションは、公知の方法あるいはそれに準じる方法、例えば、Molecular Cloning 3rd(J. Sambrook et al., Cold Spring Harbor Lab. Press, 2001)
に記載の方法等に従って行うことができる。この文献は、参照により本明細書に組み入れられるものとする。
ストリンジェントな条件とは、特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。典型的なストリンジェントな条件とは、例えば、カリウム濃度は約25mM〜約50mM、及びマグネシウム濃度は約1.0mM〜約5.0mM中において、ハイブリダイゼーションを行う条件があげられる。本発明の条件の1例としてTris−HCl(pH8.6)、25mMのKCl、及び1.5mMのMgCl2中においてハイブリダイゼーションを行う条件が、挙げられるが、これに限定されるものではない。その他、ストリンジェントな条件としては、Molecular Cloning 3rd(J. Sambrook et al., Cold Spring Harbor Lab. Press, 2001)に記載されている。この文献は、参照により本明細書に組み入れられるものとする。当業者は、ハイブリダイゼーション反応や、ハイブリダイゼーション反応液の塩濃度等を変化させることによって、このような条件を容易に選択することができる。
【0016】
さらに、本発明における前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドには、それぞれ前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドに塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。
当該塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数としては1塩基又は2塩基以上が挙げられ、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば1塩基〜10塩基又は1塩基〜5塩基が挙げられる。
【0017】
挿入、欠失又は置換の中でも、本発明における前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドとしては、それぞれ前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドが挙げられる。置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号2で示される配列のうち152番目〜166番目の塩基以外の位置、または配列番号1で示される配列のうち152番目〜162番目の塩基以外の位置の塩基が置換されることが挙げられる。置換される塩基の数としては1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0018】
前記蛍光標識オリゴヌクレオチドにおける、オリゴヌクレオチドとしては、オリゴヌクレオチドの他、修飾されたオリゴヌクレオチドも含まれる。
前記オリゴヌクレオチドの構成単位としては、リボヌクレオチド、デオキシリボヌクレオチド、人工核酸等が挙げられる。前記人工核酸としては、DNA、RNA、RNAアナログであるLNA(Locked Nucleic Acid);ペプチド核酸であるPNA(Peptide Nucleic Acid);架橋化核酸であるBNA(Bridged Nucleic Acid)等が挙げられる。
前記オリゴヌクレオチドは、前記構成単位のうち、一種類から構成されてもよいし、複数種類から構成されてもよい。
【0019】
本発明において使用されるNPM1遺伝子のexon12の変異を検出するためのプローブの塩基配列の例としては、P5としては、5'-cactgcCAGAcagagatc-3'(配列番号56)が挙げられ、P6としては、5'-cactgcCATGcagagatc-3'(配列番号57)が挙げられ、P7としては、5'-cactgcCAGGcagagatc-3'(配列番号58)が挙げられ、P1としては、5'-tgccagagatcttgaatagcc-3'(配列番号4)が挙げられ、P2としては、5'-ctattttcttaaagagacttcctccac-3'(配列番号5)が挙げられる。
蛍光色素としては、特許文献1,2に記載されたものが使用できるが、具体例としては、Pacific Blue(商標)、FAM(商標)、TAMRA(商標)、BODIPY FL(商標)等が挙げられる。蛍光色素のオリゴヌクレオチドへの結合方法は、通常の方法、例えば特許文献1,2に記載の方法に従って行うことができる。
【0020】
本発明の(P5),(P5'),(P6),(P6'),(P7),(P7'),(P1), (P1'), (P2)または(P2')のいずれか1つのオリゴヌクレオチドを用いることにより、例えば、(P5),(P6),(P7)または(P5'),(P6'),(P7')の3つのオリゴヌクレオチドを用いることにより、例えば、(P1)および(P2)または(P1')および(P2')の2つのオリゴヌクレオチドを用いることにより、本実施例3,4に示される配列番号56−58に示すプローブを用いることにより、または、本実施例1,2に示される配列番号4,5に示すプローブを用いることにより、NPM1遺伝子のexon12の変異を検出することができる(図3)。
【0021】
本発明プローブは、標的配列にハイブリダイゼーションしないときに蛍光色素の蛍光が発光し、標的配列にハイブリダイゼーションしたときに蛍光色素の蛍光が減少または増加することが好ましい。本発明プローブは、例えば、ハイブリダイゼーションしないときに蛍光色素の蛍光が発光し、ハイブリダイゼーションしたときに蛍光色素の蛍光が消光する、消光プローブである。
また、本発明プローブは、5’または3’末端から数えて1〜3番目の塩基が蛍光色素により標識化されていることが好ましく、3’末端が蛍光色素により標識されていることがより好ましい。なお、本明細書において、「5’末端から数えて1〜3番目」という場合は、5’末端を1番目として数え、「3’末端から数えて1〜3番目」という場合は、3’末端を1番目として数える。
なお、本発明プローブにおいて蛍光色素により標識されている塩基は、P5,P5',P6,P6',P7,P7'については、配列番号2における145番目の塩基であり、P1, P1'については、配列番号1における135番目の塩基であり、P2, P2'については、配列番号1における182番目の塩基である。
【0022】
本発明のオリゴヌクレオチドにより検出することのできるNPM1遺伝子のexon12の変異は、例えば、以下の表1に記載されており、タイプA、タイプB、タイプD、タイプC、タイプE、タイプGm、タイプKm、タイプNm、タイプOm、タイプQm、タイプ3、タイプ4、タイプ6、タイプ7、タイプ13、タイプ10、タイプG+、タイプH+、タイプI+、タイプJ+、およびタイプIからなる群より選択される少なくとも1つ以上の変異を検出できる。
【0023】
【表1】

【0024】
(P5),(P5'),(P6),(P6'),(P7),(P7')のオリゴヌクレオチドを用いる場合には、タイプA、タイプB、タイプD、タイプC、タイプGm、タイプKm、タイプNm、タイプOm、タイプQm、タイプ3、タイプ4、タイプ13、タイプG+、タイプH+、タイプI+、タイプJ+、およびタイプIなどを検出することができる。
配列番号1に示す塩基配列において塩基番号153-156の領域より5’側の配列のプローブ、例えば、(P1),(P1')のオリゴヌクレオチドを用いる場合には、タイプA、タイプB、タイプD、およびタイプ7などを検出することができる。
配列番号1に示す塩基配列において塩基番号153-156の領域より3’側の配列のプローブ、例えば、(P2),(P2')のオリゴヌクレオチドを用いる場合には、タイプ10、タイプE、およびタイプ6などを検出することができる。
また、本発明の(P5),(P5'),(P6),(P6'),(P7),(P7')のいずれか1つのオリゴヌクレオチド、または(P1)もしくは(P1')および(P2)もしくは(P2')のオリゴヌクレオチドを用いることにより、NPM1遺伝子のexon12の変異の有無を検出することができ、急性骨髄性白血病のかかりやすさ、病態および/または予後の診断が可能となる。
【0025】
本実施例に示される配列番号56,57,58,4,5のプローブを用いることにより、NPM1遺伝子のexon12の変異を検出することができる。配列番号56−58,4に示すプローブについては、3’末端が蛍光色素で標識され、配列番号5に示すプローブについては、5’末端が蛍光色素で標識されている。
【0026】
本発明の検出方法は、上記のような本発明のプローブを用いることを特徴とする。すなわち、本発明の検出方法は、配列番号2に示す塩基配列において、塩基番号157-160の領域(配列番号1の塩基番号153-156に対応)を含む1つ以上のプローブを用いることもできるし、上記P5,P5',P6,P6',P7,P7'の1つ以上のプローブを用いることもできる。また、本発明の検出方法は、配列番号1に示す塩基配列において、塩基番号153-156の領域を末端とする1つ以上のプローブを用いることもできるし、上記P1, P1', P2およびP2'の1つ以上のプローブを用いることもできる。
【0027】
本発明の検出方法は、例えば、本発明のプローブを使用し、以下の工程を含むことを特徴とする。
(I)核酸を含有する試料に、本発明のプローブを添加して前記核酸に前記プローブをハイブリダイズさせる工程、
(II)温度を変化させて前記核酸と前記プローブとのハイブリッド形成体を解離させ、ハイブリッド形成体の解離に基づくシグナルの変動を測定する工程、
(III)前記シグナルの変動を解析して前記試料中の一本鎖核酸におけるTm値を検出する工程、および
(IV)前記Tm値から前記試料中の一本鎖核酸における、目的の多型の有無または多型を有する一本鎖核酸の存在比を検出する工程。
【0028】
本発明検出方法は、本発明プローブを用いることの他は、通常の核酸増幅および融解曲線分析(Tm解析)の方法に従って行うことができる。また、本発明の検出方法は、前記工程(I)の前または工程(I)と同時に核酸を増幅することを含んでいてもよい。
【0029】
核酸増幅の方法としては、ポリメラーゼを用いる方法が好ましく、その例としては、PCR、ICAN、LAMP等が挙げられる。ポリメラーゼを用いる方法により増幅する場合は、本発明プローブの存在下で増幅を行うことが好ましい。用いるプローブに応じて、増幅の反応条件等を調整することは当業者であれば容易である。これにより、核酸の増幅後にプローブのTm値を解析するだけなので、反応終了後増幅産物を取り扱う必要がない。よって、増幅産物による汚染の心配がない。また、増幅に必要な機器と同じ機器で検出することが可能なので、容器を移動する必要すらない。よって、自動化も容易である。
【0030】
なお、工程(III)でTm値を決定することには、Tmの温度を決定することだけでなく、Tmのピークの高さを決定することを含む。ピークの高さにより、多型を有する塩基配列の存在比を決定することができる。なお、多型を有する塩基配列の存在比をより定量的に決定するには、下記に示すような検量線を作成し、それに基づいて存在比を決定することが好ましい。
【0031】
多型を有する塩基配列の存在比を定量的に決定する方法について、野生型と特定の変異型の存在比の決定を例に挙げて以下に示す。ただし、この方法は一例にすぎず、多型を有する塩基配列の存在比の決定の仕方はこれに限定されない。
【0032】
まず、野生型の核酸Wtと変異型の核酸Mtとの2種類の核酸の存在比を各々異ならせた複数の核酸混合物を作製し、複数の核酸混合物の各々について、融解曲線解析装置等を用いて融解曲線を得る。
図1(A)に、ある1つの核酸混合物の温度と蛍光強度との関係で表された融解曲線、
及び図1(B)に温度と蛍光強度の微分値との関係で表された融解曲線(微分融解曲線ともいう)を示す。この微分融解曲線からピークを検出することにより、核酸Wtの融解温度TmW及び核酸Mtの融解温度TmMを検出して、TmW及びTmMを含む温度範囲の各々を設定する。TmWを含む温度範囲ΔTWとしては、例えば、TmWとTmMとの間で蛍光強度の微分値が最小となる温度を下限、蛍光強度のピークの裾野に対応する温度を上限とする温度範囲を設定することができる。また、TmMを含む温度範囲ΔTMとしては、例えば、TmWとTmMとの間で蛍光強度の微分値が最小となる温度を上限、蛍光強度のピークの裾野に対応する温度を下限とする温度範囲を設定することができる。なお、温度範囲ΔTW及び温度範囲ΔTMは、同一の幅(例えば、10℃)または異なる幅(例えば、温度範囲ΔTWが10℃、温度範囲ΔTMが7℃)となるように設定することができる。また、温度範囲ΔTW及び温度範囲ΔTMは、それぞれの融解温度TmからプラスX℃、マイナスX℃の幅(X℃は例えば15℃以内、望ましくは10℃以内)というように設定することができる。
【0033】
次に、温度範囲ΔTW及び温度範囲ΔTMの各々について、微分融解曲線の温度範囲の下限に対応する点と上限に対応する点とを通る直線と微分融解曲線とで囲まれた面積(図1(B)の斜線部分)を求める。面積の求め方の一例として、具体的に以下のように求めることができる。温度Tにおける蛍光強度の微分値をf(T)とし、温度Tにおけるベース値をB(T)として、下記(1)式により求める。
面積S={f(Ts+1)−B(Ts+1)}+{f(Ts+2)−B(Ts+2)}
+・・・+{f(Te-1)−B(Te-1)} ・・・(1)
ただし、Tsは各温度範囲における下限値、Teは上限値である。また、各温度Tにおけるベース値B(T)は、下記(2)式により求まる値であり、蛍光強度の検出信号に含まれるバックグラウンドレベルを表すものである。このベース値を蛍光強度の微分値から減算することにより、蛍光強度の検出信号に含まれるバックグラウンドの影響を除去する。
B(T)=a×(T−Ts)+f(Ts) ・・・(2)
ただし、a={f(Te)−f(Ts)}/(Te−Ts) である。
【0034】
上記(1)式及び(2)式に従って、各核酸混合物について、温度範囲ΔTWにおける面積SW及び温度範囲ΔTWにおける面積SMを求め、面積比と各核酸混合物の存在比との関係を表す検量線を作成する。図2に、横軸に存在比(核酸混合物の総量に対する核酸Mtの割合)をとり、縦軸に面積比(SM/SW)をとった検量線の一例を示す。なお、面積比はSW/SMで定めてもよい。
実際の試料を用いて得られた融解曲線と微分融解曲線から面積比を算出し、上記のようにしてあらかじめ作成した検量線に基づいて、実際の試料中に含まれる多型を有する塩基配列の存在比を決定することができる。
【0035】
本発明において、試料中のDNAは、一本鎖DNAでもよいし二本鎖DNAであってもよい。前記DNAが二本鎖DNAの場合は、例えば、前記ハイブリダイズ工程に先立って、加熱により前記試料中の二本鎖DNAを解離させる工程を含むことが好ましい。二本鎖DNAを一本鎖DNAに解離することによって、次のハイブリダイズ工程において、検出用プローブとのハイブリダイズが可能となる。
【0036】
本発明において、前記試料中のDNAに対する、本発明のプローブの添加割合(モル比)は、制限されないが、検出シグナルを十分に確保できることから、試料中のDNAに対して1倍以下が好ましく、0.1倍以下がより好ましい。この際、試料中のDNAとは、例えば、検出目的の多型が発生している検出対象DNAと前記多型が発生していない非検出対象DNAとの合計でもよいし、検出目的の多型が発生している検出対象配列を含む増幅産物と前記多型が発生していない非検出対象配列を含む増幅産物との合計でもよい。なお、試料中のDNAにおける前記検出対象DNAの割合は、通常、不明であるが、結果的に、前記プローブの添加割合(モル比)は、検出対象DNA(検出対象配列を含む増幅産物)に対して例えば、10倍以下、5倍以下、または3倍以下である。また、その下限は特に制限されないが、例えば、0.001倍以上、0.01倍以上であり、または0.1倍以上である。
【0037】
前記DNAに対する本発明のプローブの添加割合は、例えば、二本鎖DNAに対するモル比でもよいし、一本鎖DNAに対するモル比でもよい。
【0038】
Tm値について説明する。二本鎖DNAを含む溶液を加熱していくと、260nmにおける吸光度が上昇する。これは、二本鎖DNAにおける両鎖間の水素結合が加熱によってほどけ、一本鎖DNAに解離(DNAの融解)することが原因である。この現象に基づき、融解温度Tmとは、一般に、吸光度が、吸光度全上昇分の50%に達した時の温度と定義される。
【0039】
本発明において、前記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2、P2'の蛍光標識オリゴヌクレオチドが相補的な塩基配列を有するDNAとハイブリダイズした場合のTm値と、非相補的なDNAとハイブリダイズした場合のTm値との差は、例えば5℃以上が挙げられる。前記Tm値の差が5℃以上であることで、上述の変異をより高感度に検出することができる。
また、前記Tm値の差としては、5℃以上、又は7℃以上等が挙げられる。
前記Tm値の差を大きくする方法としては、プローブ配列においてそのハイブリダイズする塩基配列に対してミスマッチとなる塩基を含める方法や、例えばNatureBiotech(1997)vol15 p.331−335に記載の方法などが挙げられる。
【0040】
本発明において、Tm値を決定するための温度変化に伴うシグナル変動の測定は、前述のような原理から260nmの吸光度測定により行うこともできるが、本発明のプローブに付加した標識のシグナルに基づくシグナルであってDNAとプローブとのハイブリッド形成の状態に応じて変動するシグナルを測定することが好ましい。このため、本発明のプローブとして、前述の標識化プローブを使用することが好ましい。前記標識化プローブとしては、例えば、標的配列にハイブリダイズしないときに蛍光を発し、且つ標的配列にハイブリダイズしたときに蛍光強度が減少(消光)する蛍光標識オリゴヌクレオチドプローブ、または標的配列にハイブリダイズしないときに蛍光を発し、且つ標的配列にハイブリダイズしたときに蛍光強度が増加する蛍光標識オリゴヌクレオチドプローブが挙げられる。前者のようなプローブであれば、検出対象配列とハイブリッド(二本鎖DNA)を形成している際にはシグナルを示さないか、シグナルが弱いが、加熱によりプローブが遊離するとシグナルを示すようになるか、シグナルが増加する。また、後者のプローブであれば、検出対象配列とハイブリッド(二本鎖DNA)を形成することによってシグナルを示し、加熱によりプローブが遊離するとシグナルが減少(消失)する。したがって、この標識に基づくシグナルの変化をシグナル特有の条件(吸光度等)で検出することによって、前記260nmの吸光度測定と同様に、融解の進行ならびにTm値の決定を行うことができる。標識化プローブにおける標識化物質は、例えば、前述のとおりであるが蛍光色素標識化プローブが好ましい。
【0041】
核酸増幅を行う際の鋳型となる核酸としては、核酸を含んでいればよく、特に制限されないが、例えば、血液、口腔粘膜懸濁液、爪や毛髪等の体細胞、生殖細胞、乳、腹水液、パラフィン包埋組織、胃液、胃洗浄液、腹膜液、羊水、細胞培養などの任意の生物学的起源に由来する又は由来しうるものである。鋳型となる核酸は、該起源から得られたままで直接的に、または該サンプルの特性を改変するために前処理した後で使用することができる。
【0042】
以下、PCRを用いる場合を例として、さらに説明する。PCRに用いるプライマー対は、本発明プローブがハイブリダイゼーションできる領域が増幅されるようにする他は、通常のPCRにおけるプライマー対の設定方法と同様にして設定することができる。プライマーの長さおよびTm値は、通常には、12mer〜40merで40〜70℃、または16mer〜30merで55〜60℃である。プライマー対の各プライマーの長さは同一でなくてもよいが、両プライマーのTmはほぼ同一(通常には、相違が2℃以内)であることが好ましい。なお、Tm値は最近接塩基対(Nearest Neighbor)法により算出した値である。プライマー対の例としては、配列番号16,17に示す塩基配列を有するプライマーからなるものが挙げられる。
【0043】
PCRは、本発明で使用される本発明プローブの存在下で行うことが好ましい。これにより、増幅反応終了後に増幅産物を精製などすることなくTm解析を行うことができる。用いるプローブに応じて、プライマーのTm値やPCRの反応条件を調整することは当業者であれば容易である。
【0044】
Tm解析の結果に基づくNPM1遺伝子のexon12の変異の検出は通常の方法に従って行うことができる。本発明における検出とは、変異の有無の検出および多型を有する核酸の存在比の決定を包含する。
【0045】
なお、本発明のプローブおよび多型検出方法により、NPM1遺伝子のexon12の変異を検出することができ、検出された変異の有無に基づいて、急性骨髄性白血病のなりやすさ、病態および/または予後を診断することができる。
【0046】
<2>本発明キット
本発明キットは、本発明の検出方法に用いるためのキットである。このキットは、本発明の多型検出用プローブを含むことを特徴とする。なお、本発明のキットは、急性骨髄性白血病のかかりやすさ、病態および/予後を判断するのにも使用できる。
プローブについては、本発明プローブに関し、上記に説明した通りである。
【0047】
本発明検出キットは、プローブの他に、本発明の検出方法における核酸増幅を行うのに必要とされる試薬類、特にDNAポリメラーゼを用いる増幅のための上述のプライマーをさらに含んでいてもよい。
本発明検出キットにおいてプローブ、プライマーおよびその他の試薬類は、別個に収容されていてもよいし、それらの一部が混合物とされていてもよい。
【0048】
本発明において、検出対象となる試料中の試料核酸、多型検出用プローブ又はプライマーの個々の配列に関して、これら互いの相補的な関係に基づいて記述された事項は、特に断らない限り、それぞれの配列と、各配列に対して相補的な配列とについても適用される。各配列に対して相補的な当該配列について本発明の事項を適用する際には、当該相補的な配列が認識する配列は、当業者にとっての技術常識の範囲内で、対応する本明細書に記載された配列に相補的な配列に、明細書全体を読み替えるものとする。
【0049】
以下に、本発明を実施例により具体的に説明する。だだし、これらの実施例は例示であり、これらに限定されない。
【実施例】
【0050】
実施例1(相補鎖オリゴヌクレオチドを検出対象とし、P1,P2プローブを用いる場合)
NPM1遺伝子のexon12の塩基配列(配列番号1(野生型))に基づき、表2に示す、末端部にCを有するプローブを設計した。表2中、プローブの位置は、配列番号1に示す塩基配列における塩基番号を示す。3’末端のPは、リン酸化されていることを示す。TAMRAによる標識は、常法に従って行った。
また、検出対象として使用した相補鎖オリゴヌクレオチドの配列を表2に示す。表2中、オリゴヌクレオチドの位置は、配列番号1に示す塩基配列における塩基番号を示す。
【0051】
【表2】

【0052】
NPM1遺伝子のExon12領域の変異を2つのプローブで検出するために設計したプローブの性能を確認するため、NPM1 exon12領域の野生型配列と各種変異配列の相補鎖を準備し、プローブと相補鎖オリゴヌクレオチドを含む以下の試薬溶液を調製した。
プローブ3T-NPM1-e12-R1に対して相補鎖オリゴヌクレオチドは WT、mt type A、B、D、または7を、プローブ5T-NPM1-e12-R2に対して相補鎖オリゴヌクレオチドは WT、mt type Q、10、E、または6を添加した。
【0053】
【表3】

【0054】
Tm解析の条件は下記の通りである。Tm解析における励起波長および検出波長は、それぞれ520〜555 nmおよび585〜700 nm(TAMRA)であった。
調製した試薬溶液をi-densy 反応チューブに添加し、試薬が蒸発しないようにミネラルオイル30μLを重層し、以下の反応条件でTm解析を実施してTAMRAの蛍光値の変化量を解析した。
【0055】
【表4】

【0056】
表2のプローブを用いてTm解析を行った結果、3T-NPM1-e12-R1(配列番号4)については、TAMRAのピークが、65℃(WT)、59℃(タイプA)、60℃(タイプB)、60℃(タイプD)、55℃(タイプ7)付近で見られた(図4〜8)。
このように、WT、各変異で検出ピークが確認できた。また、WTと各変異のTm値の差(ΔTm)は5〜10℃であり、変異を検出するために十分なTm値の差があることが分かり、変異を検出することに適したプローブであることが分かった。
結果を表5に示す。
【0057】
【表5】

【0058】
また、5T-NPM1-e12-R2(配列番号5)については、TAMRAのピークが、64℃(WT)、62℃(タイプQ)、52℃(タイプ10)、52℃(タイプE)、49℃(タイプ6)付近で見られた(図9〜13)。
このように、WT、各変異で検出ピークが確認できた。また、WTと変異タイプQのTm値の差(ΔTm)は2℃であったが、他の変異タイプでは十分なTm値の差があることが分かり、変異を検出することに適したプローブであることが分かった。
結果を表6に示す。
【0059】
【表6】

【0060】
実施例1の結果より、P1(配列番号4)およびP2(配列番号5)のプローブを用いたとき、NPM1遺伝子のexon12変異の多型(タイプA、タイプB、タイプD、タイプ7、タイプ10、タイプE、タイプ6)について、Tm解析で分析可能な蛍光強度の変化が認められた。すなわち、変異型は、野生型のピークに加えて、他のピークを有するものであり、固有の蛍光強度の変化量のパターンの変化が存在する。従って、P1(配列番号4)およびP2(配列番号5)のプローブを用いることにより、NPM1遺伝子のexon12変異の多型を検出することができる。
【0061】
比較例1(相補鎖オリゴヌクレオチドを検出対象とする場合)
NPM1遺伝子のExon12領域の変異を1つのプローブで検出するために設計したプローブの性能を確認するため、NPM1 exon12領域の野生型配列と各種変異配列の相補鎖を準備し、プローブと相補鎖を含む以下の試薬溶液を調製した。
試薬溶液は実施例1と同様とし、プローブのみ以下のプローブを用いた。またTm解析も実施例1と同様に実施した。
また、変異の検出のために使用したプローブの配列を表7に示す。表7中、プローブの位置は、配列番号1に示す塩基配列における塩基番号を示す。
【0062】
【表7】

【0063】
WTやいくつかの変異タイプでは問題なく検出できたが、変異タイプA、D、7では検出ピークが確認できず、様々な変異の検出に適していないプローブであることが分かった(図14−22)。
結果を表8に示す。
【0064】
【表8】

【0065】
実施例2(血液検体または人工核酸プラスミドを検出対象として用いる場合)
核酸増幅した後、Tm解析による検出が可能であるかを検討するため、血液検体を用いて反応を行った。また、NPM1遺伝子のexon12変異がどの程度混ざった検体まで検出が可能であるか、野生型配列と変異配列(AタイプとEタイプ)の人工核酸プラスミドの混合比率を振り、その検出波形を確認した。人工核酸はpUCプラスミドベクターにNPM1遺伝子のexon12周辺配列の野生型配列(590bp、配列番号1)、変異タイプA(594bp、配列番号2)、変異タイプE(594bp、配列番号3)を挿入したプラスミドを用いた。
全自動SNPs検査装置(商品名i-densy IS-5310、アークレイ社製)を用いてPCR及びTm解析を行った。PCRおよびTm解析の条件は下記の表11の通りである。
また、変異の検出に使用したプローブおよびプライマーの配列を表12に示す。表12中、プローブおよびプライマーの位置は、配列番号1に示す塩基配列における塩基番号を示す。
Tm解析における励起波長および検出波長は、それぞれ420〜485 nmおよび520〜555 nm(BODIPY FL)、または、それぞれ520〜555 nmおよび585〜700 nm(TAMRA)とした。
試薬溶液は以下の通りであった。
【0066】
【表9】

【0067】
<全血の調製>
全血10μlを希釈液(1) 70μlに加え、よく混合した後、この混合液10μlを希釈液(2)
70μlに加えた。この混合液17μlを95℃で10分加熱して4μlの前処理済全血を得た。これを1 testあたりのtemplateとして使用した。
【0068】
【表10】

【0069】
<人工核酸プラスミド>
任意の割合で野生型と変異型を混合した500コピー/μlの人工核酸プラスミドを4μl使用した。
【0070】
【表11】

【0071】
【表12】

【0072】
血液検体を用いてi-densyで測定した結果、問題なく検出ピークが確認できた(図23)。
人工核酸プラスミドを用いた検出波形を確認したところ、BODIPY FLは63℃、TAMRAも63℃に野生型の検出ピークが確認できた(図24)。
変異タイプAの場合、BODIPY FLの56-57℃に検出ピークが確認され(図25の左図)、変異タイプEの場合、TAMRAの50-51℃に検出ピークが確認できた(図29の右図)。任意に割合で混合させたプラスミドの場合、変異タイプAとEの両方で10%の変異配列が混合された状態でも変異の検出ピークが確認できた(図28の左図、図32の右図)。
【0073】
実施例2の結果より、P1(配列番号4)およびP2(配列番号5)のプローブを用いたとき、血液検体を用いた場合、そして、10%の変異配列が混合される場合でも、NPM1遺伝子のexon12変異の多型(タイプA、タイプE)について、Tm解析で解析の可能な蛍光強度の変化が認められた。従って、P1(配列番号4)およびP2(配列番号5)のプローブを用いることにより、NPM1遺伝子のexon12変異の多型を検出することができる。
【0074】
比較例2
比較例として、3T-NPM1-e12-R3プローブを用いた。以下の溶液を用いて核酸増幅した後、Tm解析による検出が可能であるかを検討した。プライマー配列や反応条件は実施例2と同様とした。プラスミド溶液(500コピー/μL)を4μL反応チューブに添加して、以下の反応条件でi-densyで反応した。Tm解析ではTAMRAの蛍光値の変化量を解析した。
【0075】
【表13】

【0076】
【表14】

【0077】
血液を用いた場合と人工核酸プラスミドの野生型と変異タイプEを検体として用いた場合は、問題なく検出ピークが得られた(図33,34,37)。しかしながら、変異タイプA100%を検体とした場合は検出ピークが確認できなかった(図35)。さらに、変異タイプAまたはEを20%混合させた人工核酸を反応させた場合、変異タイプの検出ピークが確認できず、野生型の検出ピークしか確認できなかった(図36,38)。これらの結果から、実施例2の結果と比較して、3T-NPM1-e12-R3のプローブはNPM1のexon12の変異の検出に適していないと判断される。
【0078】
実施例3(相補鎖オリゴヌクレオチドを検出対象とし、P5,P6,P7プローブを用いる場合)
NPM1遺伝子のexon12変異は多種の配列が報告されているが、そのほとんどはタイプA、B、Dである(表1参照)。そのためタイプA、B、Dが明確に検出することが、NPM1遺伝子のexon12変異検出用プローブとして有用である。
NPM1遺伝子のexon12の塩基配列(配列番号2(変異タイプA))に基づき、表15に示す、末端部にCを有するプローブを設計した。表15中、プローブの位置は、配列番号2に示す塩基配列における塩基番号を示す。Pacific Blue, TAMRAおよびPODIPY FLによる標識は、常法に従って行った。
試薬溶液は実施例1と同様とし、プローブのみ以下のプローブを用いた。またTm解析も実施例1と同様に実施した。
また、検出対象として使用した相補鎖オリゴヌクレオチドの配列を表1に記載されており、表1に記載の4の部分に挿入変異を持つ配列である。
【0079】
【表15】

【0080】
Tm解析における励起波長および検出波長は、それぞれ365〜415 nmおよび445〜480 nm(Pacific Blue)、520〜555 nmおよび585〜700 nm(TAMRA)、420〜485 nmおよび520〜555 nm(BODIPY FL)であった。
【0081】
上記に示したプローブを用いて、実施例1と同様にTm解析による検出ピーク(Tm値)の確認を行った。また、野生型の相補鎖に対するTm値と各変異配列に対するTm値の差を確認した。
3PB-NPM1-mtA-R4(配列番号56)については、WTと変異タイプM、N、Gm、12、IとのTm値の差(ΔTm)は4℃以下であったが、他の変異タイプでは十分なTm値の差があることが分かり、変異を検出することに適したプローブであることが分かった。
3T-NPM1-mtB-R5(配列番号57)については、WTと変異タイプM、N、12とのTm値の差(ΔTm)は4℃以下であったが、他の変異タイプでは十分なTm値の差があることが分かり、変異を検出することに適したプローブであることが分かった。
3FL-NPM1-mtD-R6(配列番号58)については、WTと変異タイプM、N、3、12、IとのTm値の差(ΔTm)は4℃以下であったが、他の変異タイプでは十分なTm値の差があることが分かり、変異を検出することに適したプローブであることが分かった。
結果を表16に示す。
【0082】
【表16】

【0083】
mtA-R4プローブは、WT配列(14mer)に加えてタイプAに特有の「tctg」配列を4mer挿入した塩基配列に相補的なプローブである。mtA-R4プローブは、タイプA配列と18mer一致、タイプB配列と16mer一致、タイプDと配列17mer一致するため、WT相補鎖の(14mer一致)よりも高いTm値(高い親和性)が得られ、これら変異配列を検出することができる。
同様に、タイプB配列に相補的なmtB-R5プローブは、タイプA配列と16mer一致、タイプB配列と18mer一致、タイプD配列と17mer一致し、WT相補鎖よりも高いTm値が得られる。
同様に、タイプD配列に相補的なmtD-R6プローブは、タイプA配列と17mer一致、タイプB配列と17mer一致、タイプD配列と18mer一致し、WT相補鎖よりも高いTm値が得られる。
【0084】
実施例4(相補鎖オリゴヌクレオチドを検出対象として検出感度を確認する場合)
NPM1遺伝子のexon12変異のタイプAがどの程度混ざった検体まで検出が可能であるか、野生型配列と変異配列の人工核酸プラスミドの混合比率を振り、その検出波形を確認した。人工核酸はpUCプラスミドベクターにNPM1遺伝子のexon12周辺配列の野生型配列(590bp、配列番号1)、変異タイプA(594bp、配列番号2)を挿入したプラスミドを用いた。
【0085】
【表17】

【0086】
PCRおよびTm解析の条件は実施例2の表11と同様とした。Tm解析における励起波長および検出波長は、それぞれ365〜415 nmおよび445〜480 nm(Pacific Blue)、520〜555 nmおよび585〜700 nm(TAMRA)、420〜485 nmおよび520〜555 nm(BODIPY FL)であった。
【0087】
表15のプローブを用いてTm解析を行った結果、mtA-R4プローブは、mtA 10%や3%の時に61-62℃に(図39)、mtB-R5プローブは、mtA 10%の時に53℃に(図40)、mtD-R6プローブは、mtA 10%や3%の時に59-60℃に(図41)、変異タイプAと考えられる検出ピークが確認できた。
【0088】
実施例4の結果より、mtA-R4(配列番号56)、mtB-R5(配列番号57)、mtD-R6(配列番号58)のプローブを用いたとき、NPM1遺伝子のexon12変異の多型(タイプA)について、Tm解析で分析可能な蛍光強度の変化が認められた。すなわち、変異型は、野生型のピークに加えて、他のピークを有するものであり、固有の蛍光強度の変化量のパターンの変化が存在する。従って、mtA-R4(配列番号56)、mtB-R5(配列番号57)、mtD-R6(配列番号58)のプローブを用いることにより、NPM1遺伝子のexon12変異の多型(タイプA)が少量混在する検体から当該変異を高い感度で検出可能であることが理解される。
【産業上の利用可能性】
【0089】
本発明のプローブを用いることより、急性骨髄性白血病のかかりやすさ、病態および/または予後を診断することができる。
【特許請求の範囲】
【請求項1】
NPM1遺伝子のexon12の変異を検出するためのプローブであって、下記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2およびP2'から選択される少なくとも1種の蛍光標識オリゴヌクレオチドからなることを特徴とする多型検出用プローブ。
(P5)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P5')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1)配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列であり、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1')配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P2)配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列であり、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、および
(P2')配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド。
【請求項2】
P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号145に対応する塩基を3'末端から数えて1〜3番目の位置に有し、
P1およびP1'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号135に対応する塩基を3'末端から数えて1〜3番目の位置に有し、
P2およびP2'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号182に対応する塩基を5'末端から数えて1〜3番目の位置に有する、請求項1記載のプローブ。
【請求項3】
P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号145に対応する塩基を3'末端に有し、
P1およびP1'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、請求項1記載のプローブ。
【請求項4】
P1およびP1'のオリゴヌクレオチドは、塩基番号153-156のいずれかの塩基に対応する塩基を5'末端とし、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、塩基番号153-156のいずれかの塩基に対応する塩基を3'末端とし、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、請求項1記載のプローブ。
【請求項5】
P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、塩基番号162を5'末端とし、蛍光色素で標識された塩基番号145に対応する塩基を3'末端に有し、
P1およびP1'のオリゴヌクレオチドは、塩基番号155を5'末端とし、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、塩基番号156を3'末端とし、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、請求項1記載のプローブ。
【請求項6】
前記オリゴヌクレオチドは、標的配列にハイブリダイズしないときに蛍光を発し、且つ標的配列にハイブリダイズしたときに蛍光強度が減少するかまたは増加する、請求項1〜5のいずれか1項記載のプローブ。
【請求項7】
前記オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、標的配列にハイブリダイズしたときに蛍光強度が減少する、請求項6記載のプローブ。
【請求項8】
前記プローブが、融解曲線分析用のプローブである、請求項1〜7のいずれか1項に記載のプローブ。
【請求項9】
P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドの塩基長が12〜35で、P1およびP1'のオリゴヌクレオチドの塩基長が16〜35で、P2およびP2'のオリゴヌクレオチドが19〜35である、請求項1〜8のいずれか1項記載の多型検出用プローブ。
【請求項10】
NPM1遺伝子のexon12における多型の検出方法であって、請求項1〜9のいずれか1項に記載のプローブを少なくとも1種用いることを特徴とする方法。
【請求項11】
NPM1遺伝子のexon12における多型の検出方法であって、下記工程(I)〜(IV)を含むことを特徴とする方法。
(I)核酸を含有する試料に、請求項1〜9のいずれか1項に記載のプローブを添加して前記核酸に前記プローブをハイブリダイズさせる工程、
(II)温度を変化させて前記核酸と前記プローブとのハイブリッド形成体を解離させ、ハイブリッド形成体の解離に基づくシグナルの変動を測定する工程、
(III)前記シグナルの変動を解析して前記試料中の一本鎖核酸におけるTm値を検出する工程、および
(IV)前記Tm値から前記試料中の一本鎖核酸における、目的の多型の有無または多型を有する一本鎖核酸の存在比を決定する工程。
【請求項12】
さらに、(I)の工程の前または(I)の工程と同時にDNAを増幅することを含む、請求項11に記載の方法。
【請求項13】
請求項10〜12のいずれか1項に記載の方法により、NPM1遺伝子のexon12における多型を検
出する工程、および多型の有無を決定する工程を含む、急性骨髄性白血病のかかりやすさ、病態および/または予後を分析する方法。
【請求項14】
請求項1〜9のいずれか1項に記載のプローブを含む、NPM1遺伝子における多型を検出するための試薬キット。
【請求項15】
さらに、NPM1遺伝子の配列番号1に示す塩基配列におけるP5、P5'、P6、P6'、P7、P7'P1、P1'、P2、P2'のオリゴヌクレオチドがハイブリダイズする配列を含む領域を増幅するためのプライマーを含む、請求項14に記載の試薬キット。
【請求項16】
前記プライマーが、下記P3およびP4またはP3'およびP4'から選択される多型検出用プライマーである、請求項14または15に記載の試薬キット。
(P3)106番目の塩基Tを3'末端とし配列番号1に相同的な10〜50塩基のオリゴヌクレオチド、および
(P4)205番目の塩基Tを3'末端とし配列番号1の相補鎖に相同性を有する10〜50塩基のオリゴヌクレオチド、ならびに
(P3')106番目の塩基Tを3'末端とし配列番号1の相補鎖に対してストリンジェントな条件下でハイブリダイズする塩基配列を有する10〜50塩基のオリゴヌクレオチド、および
(P4')205番目の塩基Tを3'末端とし配列番号1の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有する10〜50塩基のオリゴヌクレオチド。
【請求項1】
NPM1遺伝子のexon12の変異を検出するためのプローブであって、下記P5、P5'、P6、P6'、P7、P7'、P1、P1'、P2およびP2'から選択される少なくとも1種の蛍光標識オリゴヌクレオチドからなることを特徴とする多型検出用プローブ。
(P5)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P5')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P6')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7)配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P7')配列番号2に示す塩基配列において、塩基番号145〜156を含む12〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号153番目に対応する塩基がグアニンであり、塩基番号154番目に対応する塩基がチミンであり、塩基番号145に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1)配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列であり、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P1')配列番号1に示す塩基配列において、塩基番号135〜150を含む16〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号135に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、
(P2)配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に相補的な配列またはそれに相同な配列であり、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド、および
(P2')配列番号1に示す塩基配列において、塩基番号164〜182を含む19〜50塩基長の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有し、塩基番号182に対応する塩基がシトシンであり蛍光色素で標識されているオリゴヌクレオチド。
【請求項2】
P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号145に対応する塩基を3'末端から数えて1〜3番目の位置に有し、
P1およびP1'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号135に対応する塩基を3'末端から数えて1〜3番目の位置に有し、
P2およびP2'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号182に対応する塩基を5'末端から数えて1〜3番目の位置に有する、請求項1記載のプローブ。
【請求項3】
P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号145に対応する塩基を3'末端に有し、
P1およびP1'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、請求項1記載のプローブ。
【請求項4】
P1およびP1'のオリゴヌクレオチドは、塩基番号153-156のいずれかの塩基に対応する塩基を5'末端とし、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、塩基番号153-156のいずれかの塩基に対応する塩基を3'末端とし、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、請求項1記載のプローブ。
【請求項5】
P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドは、塩基番号162を5'末端とし、蛍光色素で標識された塩基番号145に対応する塩基を3'末端に有し、
P1およびP1'のオリゴヌクレオチドは、塩基番号155を5'末端とし、蛍光色素で標識された塩基番号135に対応する塩基を3'末端に有し、
P2およびP2'のオリゴヌクレオチドは、塩基番号156を3'末端とし、蛍光色素で標識された塩基番号182に対応する塩基を5'末端に有する、請求項1記載のプローブ。
【請求項6】
前記オリゴヌクレオチドは、標的配列にハイブリダイズしないときに蛍光を発し、且つ標的配列にハイブリダイズしたときに蛍光強度が減少するかまたは増加する、請求項1〜5のいずれか1項記載のプローブ。
【請求項7】
前記オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、標的配列にハイブリダイズしたときに蛍光強度が減少する、請求項6記載のプローブ。
【請求項8】
前記プローブが、融解曲線分析用のプローブである、請求項1〜7のいずれか1項に記載のプローブ。
【請求項9】
P5、P5'、P6、P6'、P7およびP7'のオリゴヌクレオチドの塩基長が12〜35で、P1およびP1'のオリゴヌクレオチドの塩基長が16〜35で、P2およびP2'のオリゴヌクレオチドが19〜35である、請求項1〜8のいずれか1項記載の多型検出用プローブ。
【請求項10】
NPM1遺伝子のexon12における多型の検出方法であって、請求項1〜9のいずれか1項に記載のプローブを少なくとも1種用いることを特徴とする方法。
【請求項11】
NPM1遺伝子のexon12における多型の検出方法であって、下記工程(I)〜(IV)を含むことを特徴とする方法。
(I)核酸を含有する試料に、請求項1〜9のいずれか1項に記載のプローブを添加して前記核酸に前記プローブをハイブリダイズさせる工程、
(II)温度を変化させて前記核酸と前記プローブとのハイブリッド形成体を解離させ、ハイブリッド形成体の解離に基づくシグナルの変動を測定する工程、
(III)前記シグナルの変動を解析して前記試料中の一本鎖核酸におけるTm値を検出する工程、および
(IV)前記Tm値から前記試料中の一本鎖核酸における、目的の多型の有無または多型を有する一本鎖核酸の存在比を決定する工程。
【請求項12】
さらに、(I)の工程の前または(I)の工程と同時にDNAを増幅することを含む、請求項11に記載の方法。
【請求項13】
請求項10〜12のいずれか1項に記載の方法により、NPM1遺伝子のexon12における多型を検
出する工程、および多型の有無を決定する工程を含む、急性骨髄性白血病のかかりやすさ、病態および/または予後を分析する方法。
【請求項14】
請求項1〜9のいずれか1項に記載のプローブを含む、NPM1遺伝子における多型を検出するための試薬キット。
【請求項15】
さらに、NPM1遺伝子の配列番号1に示す塩基配列におけるP5、P5'、P6、P6'、P7、P7'P1、P1'、P2、P2'のオリゴヌクレオチドがハイブリダイズする配列を含む領域を増幅するためのプライマーを含む、請求項14に記載の試薬キット。
【請求項16】
前記プライマーが、下記P3およびP4またはP3'およびP4'から選択される多型検出用プライマーである、請求項14または15に記載の試薬キット。
(P3)106番目の塩基Tを3'末端とし配列番号1に相同的な10〜50塩基のオリゴヌクレオチド、および
(P4)205番目の塩基Tを3'末端とし配列番号1の相補鎖に相同性を有する10〜50塩基のオリゴヌクレオチド、ならびに
(P3')106番目の塩基Tを3'末端とし配列番号1の相補鎖に対してストリンジェントな条件下でハイブリダイズする塩基配列を有する10〜50塩基のオリゴヌクレオチド、および
(P4')205番目の塩基Tを3'末端とし配列番号1の塩基配列に対してストリンジェントな条件下でハイブリダイズする塩基配列を有する10〜50塩基のオリゴヌクレオチド。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】


【公開番号】特開2012−235777(P2012−235777A)
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−102626(P2012−102626)
【出願日】平成24年4月27日(2012.4.27)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成24年4月27日(2012.4.27)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
[ Back to top ]

