Nrf2活性増強剤、Nrf2活性増強用食品及びNrf2活性増強用化粧品
【課題】Nrf2に発現制御される様々な抗酸化酵素・タンパク質の発現を増強することにより生体に酸化ストレス抵抗性を付与できる製剤及び食品の提供。
【解決手段】ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強剤、Nrf2活性増強用食品、Nrf2活性増強用化粧品、抗ストレス剤、抗ストレス用食品、抗ストレス用化粧品、Nrf2により発現を制御される抗酸化タンパク質の発現増強剤、Nrf2により発現を制御される抗酸化タンパク質の発現増強用食品、酸化ストレス性疾患の予防又は治療剤、酸化ストレス性疾患の予防用食品。
【解決手段】ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強剤、Nrf2活性増強用食品、Nrf2活性増強用化粧品、抗ストレス剤、抗ストレス用食品、抗ストレス用化粧品、Nrf2により発現を制御される抗酸化タンパク質の発現増強剤、Nrf2により発現を制御される抗酸化タンパク質の発現増強用食品、酸化ストレス性疾患の予防又は治療剤、酸化ストレス性疾患の予防用食品。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、Nrf2活性増強剤、Nrf2活性増強用食品、Nrf2活性増強用化粧品、抗ストレス剤、抗ストレス用食品及び抗ストレス用化粧品に関する。より詳細には、ホスファチジルイノシトール及びホスファチジルセリンの少なくとも1種を含有するNrf2活性増強剤などに関する。
【背景技術】
【0002】
生体内のフリーラジカルや活性酸素(ROS)(以下、酸化ストレス因子という。)が増加すると、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害、糖尿病などを引き起こすことが知られている。酸化ストレス因子としては、ヒドロキシラジカル、スーパーオキシド、過酸化水素、ヒドロペルオキシルラジカル、アルコキシルラジカル、アルキルペルオキシルラジカル、一酸化窒素、ペルオキシナイトライト、脂質ペルオキシド、次亜塩素酸、オゾンなどが知られている。酸化ストレス因子は、タンパク質、核酸、脂質などと反応しやすく、これらと反応すると、タンパク質の変性、酵素の不活性化、DNAの翻訳異常、DNAの分解、過酸化脂質の生成、不飽和脂肪酸の酸化変性などを引き起こし、これにより上記の疾患が引き起こされる。
【0003】
このような酸化ストレス因子に対し生体は生来的に防御機構を備えており、近年、転写因子としてのNrf2(NF-E2 related factor-2)が主要な役割を果たすことが判明している(特許文献1、特許文献2、特許文献3参照)。Nrf2は通常、Keap1(Kelch like ECH associated protein 1)を介してアクチンと結合した状態で細胞質に存在する。一方、核内には、第二相異物代謝酵素や抗酸化タンパク質などをコードした抗酸化遺伝子が存在する。細胞が酸化ストレスにさらされると、Keap1が感知し、Nrf2が核内に移行する。核内に移行したNrf2はsmall Mafと複合体を形成し、抗酸化遺伝子のARE領域(抗酸化剤応答配列;Antioxidant response element)に結合し、各種の第二相異物代謝酵素や抗酸化タンパク質の発現を亢進する。
【0004】
Nrf2により発現が増強される抗酸化タンパク質としては、グルタチオン-S-トランスフェラーゼ(GST)、ヘムオキシゲナーゼ(HO-1)、NAD(P)H:キノンオキシドレダクターゼ-1(NQO1)、チオレドキシン還元酵素1(TXNRD1)、グルタメート−システインリガーゼ(GCL-c;グルタチオン合成酵素)、スーパーオキシドジスムターゼ(SOD)、グルタチオン還元酵素、カタラーゼなどが知られている。これらの抗酸化タンパク質は酸化ストレス因子を直接低減するか、低減するタンパク質を生成し、酸化ストレス因子による障害から細胞を保護する。例えば、SODはスーパーオキシドを過酸化水素と酸素に分解し、カタラーゼやグルタチオン還元酵素は過酸化水素を分解する。また、NQO1はキノンの2電子還元反応に関与し、キノンの1電子還元に伴って生ずる酸化障害を回避することができる。さらに、TXNRD1はチオレドキシンの酸化型から還元型への転換を促進し、還元型チオレドキシンによってROS消去や細胞内レドックス制御に関わる。また、NQO1は、GST、UDP-グルコノシルトランスフェラーゼ、エポキシドヒドロラーゼ、γ-グルタミルシステイン合成酵素などの抗酸化/解毒関連酵素とフリーラジカル損傷、酸化ストレスなどに対して細胞を保護すること(非特許文献1参照)、膜結合型coenzyme Qを還元型に維持し、膜脂質の過酸化を阻害すること(非特許文献1参照)、α-トコフェロールの誘導体であるα-トコフェロールキノンをα−トコフェロールヒドロキノンに還元することによって抗酸化作用を得ること(非特許文献2参照)が報告されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2008−208038号公報
【特許文献2】特開2006−188444号公報
【特許文献3】特開2009−126801号公報
【非特許文献】
【0006】
【非特許文献1】R. E. Beyer etal. (1996) Proc. Natl. Acad. Sci. USA 93: 2528-2532
【非特許文献2】D. Siegel et al.(1997) Mol. Pharmacol. 52: 300-305
【発明の概要】
【発明が解決しようとする課題】
【0007】
以上のことから、Nrf2によるAREへの結合を活性化することにより、様々な抗酸化酵素・タンパク質の発現が増強され、抗酸化作用を誘導し、酸化ストレスから細胞を保護することができる。本発明は、酸化ストレスから細胞を保護し、上記の各種疾患の予防又は治療に有用なNrf2の活性を増強するNrf2活性増強剤、Nrf2活性増強用食品、Nrf2活性増強用化粧品等の提供を課題とする。
【課題を解決するための手段】
【0008】
本発明者は、上記課題を解決するために研究を重ね、ホスファチジルイノシトール及びホスファチジルセリンの少なくとも1種が、Nrf2を活性化すること、Nrf2に発現制御される第二相酵素であるHO-1、GCL-cの発現を増加すること、グルタチオンを増加すること、酸化ストレスから細胞を保護することなどを見出した。本発明においてNrf2の活性化とHO-1、GCL-cの発現増加が確認されていることから、これら両酵素だけでなく、Nrf2-ARE系で発現制御されている他の抗酸化酵素(グルタミルシステイン合成酵素、細胞内の主要な還元力であるNADPHを合成するグルコース-6-リン酸デヒドロゲナーゼなど)、抗酸化タンパク質などの発現も当然に増加しているであろうことは本発明の開示から当業者に自明である。
【0009】
本発明は、これらの知見に基づき完成されたものであり、以下のNrf2活性増強剤などを提供する。
項1.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強剤。
項2.ホスファチジルセリン及びホスファチジルイノシトールを含有する項1に記載のNrf2活性増強剤。
項3.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強用食品。
項4.ホスファチジルセリン及びホスファチジルイノシトールを含有する項3に記載のNrf2活性増強用食品。
項5.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強用化粧品。
項6.ホスファチジルセリン及びホスファチジルイノシトールを含有する項5に記載のNrf2活性増強用化粧品。
項7.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス剤。
項8.ホスファチジルセリン及びホスファチジルイノシトールを含有する項7に記載の抗ストレス剤。
項9.酸化ストレス性疾患の予防又は治療用である項7又は8に記載の抗ストレス剤。
項10.酸化ストレス性疾患が、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害及び糖尿病からなる群から選択される少なくとも1種である項7に記載の抗ストレス剤。
項11.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス用食品。
項12.ホスファチジルセリン及びホスファチジルイノシトールを含有する項11に記載の抗ストレス用食品。
項13.酸化ストレス性疾患の予防用である項11又は12に記載の抗ストレス用食品。
項14.酸化ストレス性疾患が、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害及び糖尿病からなる群から選択される少なくとも1種である項13に記載の抗ストレス用食品。
項15.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス用化粧品。
項16.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強剤。
項17.ホスファチジルセリン及びホスファチジルイノシトールを含有する項16に記載の抗酸化タンパク質の発現増強剤。
項18.Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である項16又は17に記載の抗酸化タンパク質の発現増強剤。
項19.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強用食品。
項20.ホスファチジルセリン及びホスファチジルイノシトールを含有する項19に記載の抗酸化タンパク質の発現増強用食品。
項21.Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である項19又は20に記載の抗酸化タンパク質の発現増強用食品。
項22.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強用化粧品。
項23.ホスファチジルセリン及びホスファチジルイノシトールを含有する項22に記載の抗酸化タンパク質の発現増強用化粧品。
項24.Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である項22又は23に記載の抗酸化タンパク質の発現増強用化粧品。
【発明の効果】
【0010】
本発明によれば、ホスファチジルイノシトール及びホスファチジルセリンの少なくとも1種によってNrf2が活性化され、Nrf2に発現制御される第二相酵素であるHO-1、GCL-cの発現が増加され、グルタチオンが増加され、酸化ストレスから細胞が保護される。また、本発明では、Nrf2の活性化とHO-1、GCL-cの発現が増加することから、これら両酵素だけでなく、Nrf2-ARE系で発現制御されている他の抗酸化酵素(グルタミルシステイン合成酵素,細胞内の主要な還元力であるNADPHを合成するグルコース-6-リン酸デヒドロゲナーゼなど)、抗酸化タンパク質などの発現も増加しているであろうことが当然に期待される。したがって、本発明によれば、酸化ストレスに起因する疾患、例えば、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害、糖尿病などの予防又は治療が可能である。
【図面の簡単な説明】
【0011】
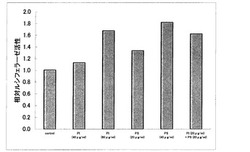
【図1】実施例1において、被検物質としてPIリポソーム、PSリポソーム、PIリポソームとPSリポソームの混合物を用いた場合の、相対ルシフェラーゼ活性を表すグラフである。縦軸の単位は「倍」である。
【図2】実施例2において、被検物質としてPIリポソーム、PSリポソーム、PIPSリポソームを用いた場合の、HO-1遺伝子の相対発現量を表すグラフである。縦軸の単位は「倍」である。
【図3】実施例2において、被検物質としてPIリポソーム、PSリポソーム、PIPSリポソームを用いた場合の、GCL-c遺伝子の相対発現量を表すグラフである。縦軸の単位は「倍」である。
【図4】実施例3において、被検物質として、PIPSリポソームを用いた場合の、グルタチオン量を表すグラフである。
【図5】実施例4において、被検物質としてPIリポソーム、PSリポソームを用いた場合の過酸化水素傷害条件下での神経細胞生存率を表すグラフである。
【図6】実施例5において、被検物質として、PIPSリポソームを用いた場合の過酸化水素傷害条件下での繊維芽細胞生存率を表すグラフである。
【発明を実施するための形態】
【0012】
以下、本発明を詳しく説明する。
本発明のNrf2活性増強剤は、ホスファチジルセリン(以下、PSと略称することがある)及びホスファチジルイノシトール(以下、PIと略称することがある)の少なくとも1種を有効成分として含む。PS、PIは各々単独で、又は組み合わせて使用できるが、好ましくはPS及びPIを併用することである。PSとPIを併用する場合、その比率は、乾燥重量に換算して、PS:PIが約0.5〜20:1であることが好ましく、約1〜10:1であることがより好ましく、約1〜4:1であることがさらにより好ましい。
【0013】
PSは、SIGMA社、BIOMOL社、日油株式会社などから市販されている。PIは、BIOMOL社などから市販されている。また、PIは、大豆、菜種、ひまわり、パームなどの植物由来のレシチンから単離することができる。また、SLP-WHITE(ホスファチジルコリン(以下、「PC」と略称することもある。)25.6%、ホスファチジルエタノールアミン(以下、「PE」と略称することもある。)24.1%、ホスファチジン酸(以下、「PA」と略称することもある。)8%、PI12%、その他約30%)、SLP-PIパウダー(PC18%、PE22%、PA8%、PI17%、その他約35%)(いずれも辻製油製)などの市販レシチンから単離することもできる。PIの単離は、各種のクロマトグラフィーで行うことができる。
【0014】
また、上記植物由来レシチン及び上記市販レシチンはPC及びPEを含むため、これらのレシチンにセリン及びホスフォリパーゼD(以下、「PLD」と略称することもある。)を作用させ塩基交換をさせることにより、PSを含むリン脂質混合物を得ることができ、このリン脂質をPS源として使用することもできる。さらに、この混合物から、各種のクロマトグラフィーでPSを単離することができる。なお、PI及びPSは、それぞれ、その他のリン脂質などの夾雑物質が含まれた状態で製剤化することもできる。
また、上記植物由来レシチン及び上記市販レシチンはPI、PC、及びPEを含むものもあるため、これらのレシチンにセリン及びPLDを作用させ塩基交換をさせることにより、PS及びPIを含むリン脂質混合物を得ることができ、このリン脂質混合物を有効成分として使用することもできる。必要に応じて、この混合物からPSとPIとの混合物を単離すればよい。PIとPSとの混合物は、その他のリン脂質などの夾雑物質が含まれた状態であってもよい。
【0015】
PSとPIとの重量比率(乾燥重量換算)がPS:PI=約0.5〜20:1であるリン脂質混合物は、出発原料となるレシチンとして、PCとPEとの合計重量に対するPI重量 の比率(PI/(PC+PE))が、乾燥重量に換算して、約20〜45重量%、好ましくは約25〜40重量%であるものを用いて、上記塩基交換反応を行うことにより得ることができる。上記植物由来レシチン及び上記市販レシチンは、通常この範囲でPC、PE、及びPIを含むが、PC及びPEの含有量が少ない場合は、例えばSLPC55(辻製油製)のような高純度リン脂質を添加することにより、レシチン中のPCとPEとの合計重量に対するPI重量 の比率(PI/(PC+PE))(乾燥重量換算)を上記範囲内に調整すればよい。
【0016】
レシチンの塩基交換反応は、例えば、特開2007-014270号公報に記載の方法で行うことができる。
即ち、塩基交換反応を行う前に、レシチンを有機溶媒相と水相からなる二相系中で攪拌すればよい。有機溶媒は特に限定されないが、脂肪族炭化水素、環状脂肪族炭化水素、ハロゲン化炭化水素、エステル類、エーテル類、ケトン類等の公知のものを使用すればよい。水相としては緩衝液が好ましい。緩衝液の酸、塩基及び塩の合計濃度は約0.1〜2Mが好ましい。上記二相系において、水は有機溶媒に対して20重量%以下であることが好ましい。二相系中での攪拌は約10〜40℃の温度で、約30分〜2時間行えばよい。これにより、通常、グリセロリン脂質と有機溶媒と水とのエマルジョンが形成される。
次いで、この混合物にセリン及びPLDを添加するが、塩基交換反応系中のグリセロリン脂質の濃度は約5〜40重量%であることが好ましい。また、本反応系中のセリンの濃度は約20〜40重量%が好ましい。
また、後述の製造例に示すように、レシチンを含む有機溶媒相に、セリン及びPLDを含有する緩衝液を加えて攪拌することによって塩基交換反応させることもできる。
【0017】
PLDは、特に限定されず、ナガセケムテックス社製のホスフォリパーゼD、Sigma社製のStreptomyces chromofuscus由来のホスフォリパーゼD、Streptomyces sp.由来のホスフォリパーゼDなどを利用できる。本反応系中におけるPLDの濃度は、グリセロリン脂質1gに対して約5〜200Uとすればよい。なお、1Uは、95%大豆ホスファチジルコリンを基質とし、基質濃度0.16%の0.2M酢酸緩衝液(pH4.0、10mMのCaCl2、1.3%のTriton X-100を含む)を37℃にて反応させた時、1分間に1μmolのコリンを遊離する酵素量である。
塩基交換反応は、約3.5〜10のpH条件で、約10〜40℃の温度で、約1〜72時間行えばよい。
【0018】
上記塩基交換反応により、リン脂質中のPC、PE等とセリンとが反応してPSが生成する。PIは、上記塩基交換反応においてヒドロキシル基含有化合物と反応し難いので、原料のリン脂質に含まれるPIはほぼそのまま塩基交換反応後のリン脂質混合物中に含まれる。
塩基交換反応は、PLDを加熱失活させることにより、終了させればよい。さらに、遠心分離法等により有機溶媒相を得た後、有機溶媒を減圧除去することによって反応混合物を濃縮すればよい。次いで、アセトン又はエタノールで晶析を行い、固液分離によって固形物を得、乾燥することにより、PS及びPIを含むリン脂質混合物を単離することができる。
【0019】
(2)製剤
本発明のNrf2活性増強剤には、化粧品、医薬部外品、医薬品、食品などが含まれる。
皮膚外用剤
本発明のNrf2活性増強剤は各種の皮膚外用剤とすることができる。皮膚外用剤の形態は、特に限定されず、化粧品であれば、例えば、化粧水、化粧用乳液、化粧用クリーム、化粧用ゲル、美容液、パック剤、ファンデーション、口紅、リップクリーム、リップグロス、洗顔剤、ボディソープ、ハンドクリーム、シャンプー、リンス、整髪料等のスキンケア用品又はメイクアップ用品の形態が挙げられる。中でも、広範囲の部位に適用できる点で、化粧水、化粧用ゲル、化粧用乳液、化粧用クリーム、美容液が好ましく、化粧水、化粧用乳液、化粧用クリームがより好ましい。
【0020】
これらは、有効成分であるPI及びPSの少なくとも1種(以下、単に有効成分と略称することがある。)に加えて、通常化粧品に用いられる成分、例えば、精製水、アルコール類(低級アルコール、多価アルコールなど)、油脂類、ロウ類、炭化水素類のような基剤と、必要に応じて、界面活性剤、増粘剤、紫外線吸収剤、紫外線散乱剤、安定剤、防腐剤、着色剤、香料のような添加剤とを配合して調製することができる。
医薬又は医薬部外品としての皮膚外用剤であれば、軟膏剤、ゲル剤、リニメント剤、ローション剤、乳剤、粉剤、懸濁剤、エアゾール剤、液剤などや、基剤を支持体上に支持させた硬膏剤、パップ剤、テープ剤、プラスター剤などの剤型が挙げられる。中でも、ベトツキ感なく均一に塗布することができる点で、ゲル剤、ローション剤、乳剤が好ましく、ゲル剤がより好ましい。
【0021】
医薬又は医薬部外品としての皮膚外用剤は、有効成分を適当な基剤に配合して調製することができる。基剤としては、アルギン酸ナトリウム、ゼラチン、コーンスターチ、トラガントガム、メチルセルロース、ヒドロキシエチルセルロース、カルボキシメチルセルロース、キサンタンガム、カラギーナン、マンナン、アガロース、デキストリン、カルボキシメチルデンプン、ポリビニルアルコール、ポリアクリル酸ナトリウム、メトキシエチレン−無水マレイン酸共重合体、ポリビニルエーテル、ポリビニルピロリドン、カルボキシビニルポリマー、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、プルラン等のポリマー類;白色ワセリン、黄色ワセリン、パラフィン、セレシンワックス、マイクロクリスタリンワックス等の炭化水素類;ゲル化炭化水素(例えば、商品名プラスチベース、ブリストルマイヤーズスクイブ社製);ステアリン酸等の高級脂肪酸;セタノール、オクチルドデカノール、ステアリルアルコール等の高級アルコール;ポリエチレングリコール(例えば、マクロゴール4000等);プロピレングリコール、グリセリン、ジプロピレングリコール、1,3-ブチレングリコール、濃グリセリン等の多価アルコール;モノオレイン酸エステル、ステアリン酸グリセリド等の脂肪酸エステル類;リン酸緩衝液などが挙げられる。さらに、溶解補助剤、無機充填剤、pH調節剤、保湿剤、防腐剤、粘稠剤、酸化防止剤、清涼化剤などの添加剤が添加されていてもよい。
【0022】
皮膚外用剤中の有効成分の含有量は、乾燥重量に換算して、製剤全体に対して、約0.001〜10重量%であることが好ましく、約0.01〜5重量%であることがより好ましく、約0.1〜2重量%であることがさらにより好ましい。上記範囲であれば、適量の使用によって十分なNrf2活性増強作用が得られる。
【0023】
経口投与剤
また、本発明のNrf2活性増強剤は、各種の経口投与製剤とすることができる。固形製剤としては、例えば、散剤、顆粒剤、錠剤、タブレット剤、丸剤、カプセル剤、チュアブル剤などが挙げられ、液体製剤としては、乳剤、液剤、シロップ剤などが挙げられる。中でも、服用し易く味がよい点で、顆粒剤、錠剤、タブレット剤、カプセル剤が好ましく、顆粒剤がより好ましい。
固形製剤は、有効成分に薬学的に許容される担体や添加剤を配合して調製される。例えば、白糖、乳糖、ブドウ糖、でんぷん、マンニットのような賦形剤;アラビアゴム、ゼラチン、結晶セルロース、ヒドロキシプロピルセルロース、メチルセルロースのような結合剤;カルメロース、デンプンのような崩壊剤;無水クエン酸、ラウリン酸ナトリウム、グリセロールのような安定剤などが配合される。さらに、ゼラチン、白糖、アラビアゴム、カルナバロウなどでコーティングしたり、カプセル化したりしてもよい。また、液体製剤は、例えば、上記の有効成分を、水、エタノール、グリセリン、単シロップ、又はこれらの混液などに、溶解又は分散させることにより調製される。これらの製剤には、甘味料、防腐剤、粘滑剤、滑沢剤、希釈剤、緩衝剤、着香剤、着色剤のような添加剤が添加されていてもよい。
【0024】
経口投与剤中の有効成分の含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜50重量%であることが好ましく、約0.05〜30重量%であることがより好ましく、約0.1〜25重量%であることがさらにより好ましい。上記範囲であれば、適量の使用によって十分なNrf2活性増強作用が得られる。
【0025】
その他の剤型
また、本発明のNrf2活性増強剤が医薬品である場合、注射剤や座剤などの剤型にすることもできる。
注射剤は、有効成分を、注射用蒸留水または生理用食塩水などに溶解又は分散させることにより得ることができる。注射剤には、pH調整剤等として水溶性無機酸又はその塩、水溶性有機酸又はその塩、中性アミノ酸、酸性アミノ酸又はその塩、塩基性アミノ酸の塩などが含まれていてもよい。また、緩衝剤、安定化剤、無痛化剤、防腐剤などが含まれていてもよい。
注射剤中の有効成分の含有量は、乾燥重量に換算して、製剤全体に対して、約0.001〜5重量%であることが好ましく、約0.01〜1重量%であることがより好ましく、約0.05〜0.5重量%であることがさらにより好ましい。上記範囲であれば、適量の使用によって十分なNrf2活性増強作用が得られる。
【0026】
座剤は、有効成分を、カルボポール及びポリカルボフィルのようなアクリル性高分子;ヒドロキシプロピルセルロース及びヒドロキシプロピルメチルセルロースのようなセルロース性高分子;アルギン酸ナトリウム及びキトサンのような天然高分子;脂肪酸ワックスなどの基剤に配合することにより調製できる。また、安息香酸ナトリウム、ソルビン酸カリウム、パラベンのような防腐剤;塩酸、クエン酸、水酸化ナトリウムのようなpH調節剤;メチオニンのような安定化剤を配合してもよい。
座剤中の有効成分の含有量は、乾燥重量に換算して、製剤全体に対して、約0.02〜5重量%であることが好ましく、約0.05〜3重量%であることがより好ましく、約0.1〜2重量%であることがさらにより好ましい。上記範囲であれば、適量の使用によって十分なNrf2活性増強作用が得られる。
【0027】
食品
本発明のNrf2活性増強剤が食品である場合の有効成分の含有量は、乾燥重量に換算して、組成物全体に対して、約0.01〜50重量%であることが好ましく、約0.05〜30重量%であることがより好ましく、約0.1〜25重量%であることがさらにより好ましい。上記範囲であれば、無理なく摂取できる食品量中に、十分なNrf2活性増強作用が得られるだけの有効成分が含まれることになる。
【0028】
この食品は、健康食品、栄養補助食品(バランス栄養食、サプリメントなどを含む)として好適に用いることができる。また、保健機能食品(特定保健用食品(疾病リスク低減表示、規格基準型を含む)、条件付き特定保健用食品、栄養機能食品を含む)に好適である。
この食品は、食品に通常用いられる賦形剤または添加剤を配合して、錠剤、タブレット剤、丸剤、顆粒剤、散剤、粉剤、カプセル剤、水和剤、乳剤、液剤、エキス剤、またはエリキシル剤等の剤型に調製することができる。中でも、服用しやすく味が良い点で、錠剤、タブレット剤、顆粒剤が好ましく、顆粒剤がより好ましい。
食品に通常用いられる賦形剤としては、シロップ、アラビアゴム、ショ糖、乳糖、粉末還元麦芽糖、セルロース糖、マンニトール、マルチトール、デキストラン、デンプン類、ゼラチン、ソルビット、トラガント、ポリビニルピロリドンのような結合剤;ショ糖脂肪酸エステル、グリセリン脂肪酸エステル、ステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、ポリエチレングリコールのような潤沢剤;ジャガイモ澱粉のような崩壊剤;ラウリル硫酸ナトリウムのような湿潤剤等が挙げられる。添加剤としては、香料、緩衝剤、増粘剤、着色剤、安定剤、乳化剤、分散剤、懸濁化剤、防腐剤などが挙げられる。
【0029】
また、この食品は、飲料(スポーツ飲料、ドリンク剤、乳飲料、乳酸菌飲料、果汁飲料、炭酸飲料、野菜飲料、茶飲料等)、菓子類(クッキー等の焼き菓子、ゼリー、ガム、グミ、飴等)を含むものであってもよい。中でも、製剤化の点で、リン脂質との相性がよく、処方の調整が容易である点で、乳飲料が好ましい。
【0030】
(3)使用方法
投与量
本発明のNrf2活性増強剤の使用量は、医薬品である場合、対象の年齢、症状、体重などにより異なるが、概ね以下の通りである。
即ち、経口投与剤である場合は、有効成分の投与量が、乾燥重量に換算して、1日当たり、約0.1〜10gであることが好ましく、約0.5〜5gであることがより好ましい。
また、注射剤である場合は、有効成分の投与量が、乾燥重量に換算して、1日当たり、約0.005〜100mgであることが好ましい。
【0031】
また、座剤である場合は、有効成分の投与量が、乾燥重量に換算して、1日当たり、約0.005〜100mgであることが好ましい。
皮膚外用剤である場合は、製剤の使用量が、1日あたり、通常使用量である約0.1〜1mLであればよい。
また、本発明のNrf2活性増強剤が食品である場合、この食品の摂取量は、摂取者の年齢、症状、体重などによって異なるが、有効成分の摂取量が、乾燥重量に換算して、1日当たり、約0.1〜10gであることが好ましく、約0.5〜5gであることがより好ましい。
【0032】
対象
使用対象は特に限定されないが、酸化ストレスを受けやすい人、酸化ストレス抵抗性が低い人、酸化ストレス抵抗性タンパク質の発現量が低い人などが好適な対象となる。また、酸化ストレスに起因する疾患、例えば癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害、糖尿病などの予防又は治療を必要とする人も好適な対象となる。
【0033】
(4)その他
本発明は、PI及びPSの少なくとも1種の有効量を哺乳動物、特に人に投与する、生体内のNrf2活性増強方法、又はNrf2により発現を制御される抗酸化タンパク質の発現増強方法をも包含しうる。
【0034】
以上、Nrf2活性増強剤について詳述したが、他の本発明であるNrf2活性増強用食品、Nrf2活性増強用化粧品、抗ストレス剤、抗ストレス用食品、抗ストレス用化粧品、Nrf2により発現を制御される抗酸化タンパク質の発現増強剤、Nrf2により発現を制御される抗酸化タンパク質の発現増強用食品、Nrf2により発現を制御される抗酸化タンパク質の発現増強用化粧品、酸化ストレス性疾患の予防又は治療剤、酸化ストレス性疾患の予防用食品についても同様である。
なお、Nrf2により発現を制御される抗酸化タンパク質としては、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NQO1、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ、グルタチオンなどが挙げられ、好ましくはヘムオキシゲナーゼ、グルタメート−システインリガーゼ、NQO1である。
【実施例】
【0035】
以下に、実施例を挙げて本発明をより具体的に説明するが、本発明はこれらに限定されるものではない。
製造例1:PI・PS含有リン脂質混合物の製造
大豆レシチン(UltralecP(ADM社);PC=24重量%, PE=17重量%, PI=14重量%含有)7gをヘプタン・アセトン混合液(ヘプタン:アセトン=4:1)70mLと混合し、溶解させ、レシチン溶液を得た。これとは別に、セリン20g及びPLD(ナガセケムテックス社製)500Uを1M酢酸緩衝液(pH4.5)67mL中に含む酵素含有セリン溶液を調製した。
上記レシチン溶液に酵素含有セリン溶液を加え、30℃にて5時間攪拌した。次いで、この混合液に、上記ヘプタン・アセトン混合液75mL及び塩化ナトリウム20gを加え、1時間攪拌し、これを静置して、水相と有機溶媒相とを分離した後、有機相を回収し、PI及びPS含有有機溶媒溶液を得た。この有機溶媒溶液は固形分7gを含有していた。その固形分の組成を下記条件のHPLCで調べたところ、次の通りであった。PS 32重量%、PI 21重量%、PC 2重量%、PE 9重量%、PA 13重量%。これをPI及びPSの混合物(本明細書においてPIPSと称することがある)として以下の試験に使用した。
<HPLC条件>
使用カラム:ジーエルサイエンス社製 Unisil Q NH2 (4.6mm I.D.×250mm)
移動相:アセトニトリル/メタノール/10mMリン酸二水素アンモニウム
=1856/874/270
流速:1.3mL/分
検出:UV 205nm
【0036】
製造例2:PI・PS含有リポソームの製造
製造例1の固形分をクロロホルムで溶解し、エバポレートした。Milli-Q水で分散液を調製し、氷水中で超音波処理を行い、PI及びPSを含有するリポソーム(本明細書においてPIPSリポソームとする)を調製した。
【0037】
製造例3:PI含有リポソームの製造
BIOMOL社のL-α-phosphatidylinositol Naをクロロホルム/メタノール(容量比:9/1)混液で溶解し、エバポレートした。Milli-Q水で分散液を調製し、氷水中で超音波処理を行い、PIを含有するリポソーム(本明細書においてPIリポソームとする)を調製した。
【0038】
製造例4:PS含有リポソームの製造
SIGMA社のL-α-phosphatidylserineをクロロホルム/メタノール(容量比:9/1)混液で溶解し、エバポレートした。Milli-Q水で分散液を調製し、氷水中で超音波処理を行い、PS含有リポソーム(本明細書においてPSリポソームとする)を調製した。
【0039】
実施例1:レポーターアッセイ系におけるNrf2の活性化
被験物質として、PIリポソーム、PSリポソーム、PIリポソームとPSリポソームの混合物を使用した。レポータープラスミドであるpGL3-hNQO1プロモーターは、ヒト由来NQO1由来ARE (antioxidant response element)領域をPCRで増幅し、これをホタルルシフェラーゼレポーターベクターであるpGL3-プロモーター-ベクター(プロメガ社)のMluI-HindIII部位に挿入することによって構築した。
PCRのプライマーはForwardプライマー: 5’-GGA CGC GTG CAG TCA CAG TGA CTC AGC AGA-3’(配列番号1)とReverseプライマー:5’-GGA AGC TTT TTA TAT ATC CTG TCC GGC CCG-3’(配列番号2)を用いた。
次に、10%ウシ胎児血清含有Dulbecco’s modified Eagle’s medium(DMEM)を入れた24穴プレートに4×105 cells/wellの神経細胞(Neuro2a)を播種し、5% CO2下、37℃で一晩培養した。
別途、1.0μgのpGL3-hNQO1プロモーターと1.0μgのpSV-β-ガラクトシダーゼ(プロメガ社)とTransFast試薬(プロメガ社)を含有する無血清DMEMを用意し、この培地を24穴プレートの各ウェルに添加することでトランスフェクションを行った。無血清DMEMの添加量は、各ウェルが1.0μgのpGL3-hNQO1プロモーターと1.0μgのpSV-β-ガラクトシダーゼ(プロメガ社)を含有する量である。
1時間かけてトランスフェクションを行った後、培地を新しいDMEM(10%ウシ胎児血清含有)1mlに交換した。5% CO2下、37℃で一晩培養した後、所定量の被験物質を含有するDMEM 1ml(10%ウシ胎児血清含有)に交換し、さらに24時間培養した。
培地を除去して細胞のみが残った状態のウェルに、Passive Lysis Buffer(プロメガ社)0.125mlを添加し、室温でゆるやかに振とうし、凍結融解を行い、細胞破砕液を得た。
細胞破砕液中のホタルルシフェラーゼ活性を化学発光検出器により測定した。また、β-ガラクトシダーゼ活性は吸光度計で測定した。ホタルルシフェラーゼ活性をβガラクトシダーゼ活性で除した値を相対ルシフェラーゼ活性とした。結果を図1に示す。
PI、PS、両リン脂質を添加した培養液については、コントロールに対して、相対ルシフェラーゼ活性の増強が認められ、すなわち、Nrf2活性化を示した。
【0040】
実施例2:Nrf2によって制御される各種遺伝子の発現解析
被験物質として、PIPSリポソーム、PIリポソーム、PSリポソームを使用した。10%ウシ胎児血清含有DMEMを入れた6穴プレートに5×105 cells/wellの神経細胞(Neuro2a)を播種し、5% CO2下、37℃で一晩培養した。所定量の被験物質を含有するDMEMに交換し、さらに24時間培養した。培養後、培養上清を除去し、各ウェルにISOGEN(ニッポンジーン社)1mlを添加し、細胞抽出液を得た。以下、ISOGEN添付の操作方法に準じてmRNAを分取した。
cDNAの分取にはSuperScriptIII First-Strand Synthesis System for RT-PCR(Invitrogen社)を使用し、本キットに添付の操作手順に準じて行った。
以下に、cDNAの分取に使用したプライマーを示す。
ヘムオキシゲナーゼ(HO-1):
Forwardプライマー:CACGCATATACCCGCTACCT(配列番号3)
Reverseプライマー:TCCTCTGTCAGCATCACCTG(配列番号4)
グルタメートシステインリガーゼ(GCL-c):
Forwardプライマー:ACTGAATGGAGGCGATGTTC(配列番号5)
Reverseプライマー:CTGGGTTGGGTCTGTGTTCT(配列番号6)
βアクチン:
Forwardプライマー:ACTGGGACGACATGGAGAAG(配列番号7)
Reverse プライマー:TCTCAGCTGTGGTGGTGAAG(配列番号8)
結果を図2(HO-1)及び図3(GCL-c)に示す。βアクチンとの比を取ることによって、コントロールに対する相対発現量として示す。Nrf2によって発現増加することが知られている標的遺伝子HO-1、GCL-cの発現量が、PI、PSの添加によってコントロールに対して増加した。この結果から、PI、PS、PIPSはNrf2を活性化し、第2相酵素と呼ばれる一連の遺伝子群の発現を増加させることが明らかとなった。
【0041】
実施例3:細胞内グルタチオン量
10%ウシ胎児血清含有DMEMを入れた6穴プレートに5×105 cells/wellの神経細胞(Neuro2a)を播種し、5% CO2下、37℃で一晩培養した。所定量の被験物質(PIPSリポソーム)を含有するDMEMに交換し、さらに48時間培養した。培養上清を除去して細胞を回収し、凍結融解により細胞を破砕した後、遠心して上清を得た。上清中のグルタチオン量を総グルタチオン定量キット(同仁化学)を用いて定量した。また、上清中のタンパク質量をBradford法で定量した。
結果を図4に示す。PIPSの添加によって、細胞内の総グルタチオン量を増加させた。グルタチオンには活性酸素や生体異物から細胞を防御する機能があり、PIPSはこの機能を増強すると考えられた。
【0042】
実施例4:過酸化水素による細胞死の抑制作用1(神経細胞保護作用)
10%ウシ胎児血清含有DMEMを入れた96穴プレートに1×104 cells/wellの神経細胞(Neuro2a)を播種し、5% CO2下、37℃で24時間培養した。所定量の被験物質(PIリポソーム、PSリポソーム)を含有する10%ウシ胎児血清含有DMEMに交換し、さらに24時間培養した。ここに過酸化水素(和光純薬工業)を最終濃度が0.8mMとなるように添加してさらに24時間培養した。その後、Cell Counting kit-8(同仁化学)を用いて450nmの吸光度を測定した。細胞生存率は、被験物質非含有かつ過酸化水素非添加条件を100%として算出した。
結果を図5に示す。PI、PSの添加によって、過酸化水素による細胞死を抑制できることが確認できた。なお、コントロールは被験物質非含有かつ過酸化水素添加条件である。
【0043】
実施例5:過酸化水素による細胞死の抑制作用2(皮膚細胞保護作用)
10%ウシ胎児血清含有DMEMを入れた96穴プレートに1×104 cells/wellの皮膚繊維芽細胞(NHDF)を播種し、5% CO2下、37℃で48時間培養した。所定量の被験物質(PIPSリポソーム)を含有するDMEMに交換し、さらに24時間培養した。ここに過酸化水素(和光純薬工業)を最終濃度が0.25mMとなるように添加してさらに4時間培養した。その後、Cell Counting kit-8(同仁化学)を用いて450nmの吸光度を測定した。細胞生存率は、被験物質非含有かつ過酸化水素非添加条件を100%として算出した。
結果を図6に示す。PIPSの添加によって、過酸化水素による細胞死を抑制できることが確認できた。なお、コントロールは被験物質非含有かつ過酸化水素添加条件である。
【0044】
処方例1−3(ローション)
各成分の配合量を表1に示した(単位は重量%)。各成分を所定量計量し、室温で撹拌してローションを作製した。ローションのpHはクエン酸水溶液で5.5に調整した。
【表1】

処方例4(牛乳飲料)
各成分の配合量を表2に示した(単位は重量%)。牛乳にPIPSを混合し、室温で2分間、5000rpmでTKホモミクサーで攪拌した。乳化後、100℃、10分加熱処理した。
【表2】

処方例5(豆乳飲料)
各成分の配合量を表3に示した(単位は重量%)。豆乳に他の成分を混合し、室温で2分間、5000rpmでTKホモミクサーで攪拌した。乳化後、100℃、10分加熱処理した。
【表3】

処方例6(ヨーグルト飲料)
各成分の配合量を表4に示した(単位は重量%)。全ての成分を室温にて混合および撹拌して均一な溶液として、飲料を作製した。
【表4】

処方例7(錠剤)
各成分の配合量を表5に示した(単位は重量%)。PIPS、乳糖、ジャガイモデンプンを均一に混合した。混合物にポリビニルアルコールの水溶液を加え、湿式顆粒造粒法により顆粒を調製した。顆粒を乾燥し、ステアリン酸マグネシウムを混合し、圧縮打錠して重量300mgの錠剤を作製した。
【表5】

【産業上の利用分野】
【0045】
本発明は、Nrf2の活性化作用、酸化ストレス抵抗性の改善、予防、治療を要する分野で有用である。
【技術分野】
【0001】
本発明は、Nrf2活性増強剤、Nrf2活性増強用食品、Nrf2活性増強用化粧品、抗ストレス剤、抗ストレス用食品及び抗ストレス用化粧品に関する。より詳細には、ホスファチジルイノシトール及びホスファチジルセリンの少なくとも1種を含有するNrf2活性増強剤などに関する。
【背景技術】
【0002】
生体内のフリーラジカルや活性酸素(ROS)(以下、酸化ストレス因子という。)が増加すると、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害、糖尿病などを引き起こすことが知られている。酸化ストレス因子としては、ヒドロキシラジカル、スーパーオキシド、過酸化水素、ヒドロペルオキシルラジカル、アルコキシルラジカル、アルキルペルオキシルラジカル、一酸化窒素、ペルオキシナイトライト、脂質ペルオキシド、次亜塩素酸、オゾンなどが知られている。酸化ストレス因子は、タンパク質、核酸、脂質などと反応しやすく、これらと反応すると、タンパク質の変性、酵素の不活性化、DNAの翻訳異常、DNAの分解、過酸化脂質の生成、不飽和脂肪酸の酸化変性などを引き起こし、これにより上記の疾患が引き起こされる。
【0003】
このような酸化ストレス因子に対し生体は生来的に防御機構を備えており、近年、転写因子としてのNrf2(NF-E2 related factor-2)が主要な役割を果たすことが判明している(特許文献1、特許文献2、特許文献3参照)。Nrf2は通常、Keap1(Kelch like ECH associated protein 1)を介してアクチンと結合した状態で細胞質に存在する。一方、核内には、第二相異物代謝酵素や抗酸化タンパク質などをコードした抗酸化遺伝子が存在する。細胞が酸化ストレスにさらされると、Keap1が感知し、Nrf2が核内に移行する。核内に移行したNrf2はsmall Mafと複合体を形成し、抗酸化遺伝子のARE領域(抗酸化剤応答配列;Antioxidant response element)に結合し、各種の第二相異物代謝酵素や抗酸化タンパク質の発現を亢進する。
【0004】
Nrf2により発現が増強される抗酸化タンパク質としては、グルタチオン-S-トランスフェラーゼ(GST)、ヘムオキシゲナーゼ(HO-1)、NAD(P)H:キノンオキシドレダクターゼ-1(NQO1)、チオレドキシン還元酵素1(TXNRD1)、グルタメート−システインリガーゼ(GCL-c;グルタチオン合成酵素)、スーパーオキシドジスムターゼ(SOD)、グルタチオン還元酵素、カタラーゼなどが知られている。これらの抗酸化タンパク質は酸化ストレス因子を直接低減するか、低減するタンパク質を生成し、酸化ストレス因子による障害から細胞を保護する。例えば、SODはスーパーオキシドを過酸化水素と酸素に分解し、カタラーゼやグルタチオン還元酵素は過酸化水素を分解する。また、NQO1はキノンの2電子還元反応に関与し、キノンの1電子還元に伴って生ずる酸化障害を回避することができる。さらに、TXNRD1はチオレドキシンの酸化型から還元型への転換を促進し、還元型チオレドキシンによってROS消去や細胞内レドックス制御に関わる。また、NQO1は、GST、UDP-グルコノシルトランスフェラーゼ、エポキシドヒドロラーゼ、γ-グルタミルシステイン合成酵素などの抗酸化/解毒関連酵素とフリーラジカル損傷、酸化ストレスなどに対して細胞を保護すること(非特許文献1参照)、膜結合型coenzyme Qを還元型に維持し、膜脂質の過酸化を阻害すること(非特許文献1参照)、α-トコフェロールの誘導体であるα-トコフェロールキノンをα−トコフェロールヒドロキノンに還元することによって抗酸化作用を得ること(非特許文献2参照)が報告されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2008−208038号公報
【特許文献2】特開2006−188444号公報
【特許文献3】特開2009−126801号公報
【非特許文献】
【0006】
【非特許文献1】R. E. Beyer etal. (1996) Proc. Natl. Acad. Sci. USA 93: 2528-2532
【非特許文献2】D. Siegel et al.(1997) Mol. Pharmacol. 52: 300-305
【発明の概要】
【発明が解決しようとする課題】
【0007】
以上のことから、Nrf2によるAREへの結合を活性化することにより、様々な抗酸化酵素・タンパク質の発現が増強され、抗酸化作用を誘導し、酸化ストレスから細胞を保護することができる。本発明は、酸化ストレスから細胞を保護し、上記の各種疾患の予防又は治療に有用なNrf2の活性を増強するNrf2活性増強剤、Nrf2活性増強用食品、Nrf2活性増強用化粧品等の提供を課題とする。
【課題を解決するための手段】
【0008】
本発明者は、上記課題を解決するために研究を重ね、ホスファチジルイノシトール及びホスファチジルセリンの少なくとも1種が、Nrf2を活性化すること、Nrf2に発現制御される第二相酵素であるHO-1、GCL-cの発現を増加すること、グルタチオンを増加すること、酸化ストレスから細胞を保護することなどを見出した。本発明においてNrf2の活性化とHO-1、GCL-cの発現増加が確認されていることから、これら両酵素だけでなく、Nrf2-ARE系で発現制御されている他の抗酸化酵素(グルタミルシステイン合成酵素、細胞内の主要な還元力であるNADPHを合成するグルコース-6-リン酸デヒドロゲナーゼなど)、抗酸化タンパク質などの発現も当然に増加しているであろうことは本発明の開示から当業者に自明である。
【0009】
本発明は、これらの知見に基づき完成されたものであり、以下のNrf2活性増強剤などを提供する。
項1.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強剤。
項2.ホスファチジルセリン及びホスファチジルイノシトールを含有する項1に記載のNrf2活性増強剤。
項3.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強用食品。
項4.ホスファチジルセリン及びホスファチジルイノシトールを含有する項3に記載のNrf2活性増強用食品。
項5.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強用化粧品。
項6.ホスファチジルセリン及びホスファチジルイノシトールを含有する項5に記載のNrf2活性増強用化粧品。
項7.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス剤。
項8.ホスファチジルセリン及びホスファチジルイノシトールを含有する項7に記載の抗ストレス剤。
項9.酸化ストレス性疾患の予防又は治療用である項7又は8に記載の抗ストレス剤。
項10.酸化ストレス性疾患が、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害及び糖尿病からなる群から選択される少なくとも1種である項7に記載の抗ストレス剤。
項11.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス用食品。
項12.ホスファチジルセリン及びホスファチジルイノシトールを含有する項11に記載の抗ストレス用食品。
項13.酸化ストレス性疾患の予防用である項11又は12に記載の抗ストレス用食品。
項14.酸化ストレス性疾患が、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害及び糖尿病からなる群から選択される少なくとも1種である項13に記載の抗ストレス用食品。
項15.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス用化粧品。
項16.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強剤。
項17.ホスファチジルセリン及びホスファチジルイノシトールを含有する項16に記載の抗酸化タンパク質の発現増強剤。
項18.Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である項16又は17に記載の抗酸化タンパク質の発現増強剤。
項19.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強用食品。
項20.ホスファチジルセリン及びホスファチジルイノシトールを含有する項19に記載の抗酸化タンパク質の発現増強用食品。
項21.Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である項19又は20に記載の抗酸化タンパク質の発現増強用食品。
項22.ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強用化粧品。
項23.ホスファチジルセリン及びホスファチジルイノシトールを含有する項22に記載の抗酸化タンパク質の発現増強用化粧品。
項24.Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である項22又は23に記載の抗酸化タンパク質の発現増強用化粧品。
【発明の効果】
【0010】
本発明によれば、ホスファチジルイノシトール及びホスファチジルセリンの少なくとも1種によってNrf2が活性化され、Nrf2に発現制御される第二相酵素であるHO-1、GCL-cの発現が増加され、グルタチオンが増加され、酸化ストレスから細胞が保護される。また、本発明では、Nrf2の活性化とHO-1、GCL-cの発現が増加することから、これら両酵素だけでなく、Nrf2-ARE系で発現制御されている他の抗酸化酵素(グルタミルシステイン合成酵素,細胞内の主要な還元力であるNADPHを合成するグルコース-6-リン酸デヒドロゲナーゼなど)、抗酸化タンパク質などの発現も増加しているであろうことが当然に期待される。したがって、本発明によれば、酸化ストレスに起因する疾患、例えば、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害、糖尿病などの予防又は治療が可能である。
【図面の簡単な説明】
【0011】
【図1】実施例1において、被検物質としてPIリポソーム、PSリポソーム、PIリポソームとPSリポソームの混合物を用いた場合の、相対ルシフェラーゼ活性を表すグラフである。縦軸の単位は「倍」である。
【図2】実施例2において、被検物質としてPIリポソーム、PSリポソーム、PIPSリポソームを用いた場合の、HO-1遺伝子の相対発現量を表すグラフである。縦軸の単位は「倍」である。
【図3】実施例2において、被検物質としてPIリポソーム、PSリポソーム、PIPSリポソームを用いた場合の、GCL-c遺伝子の相対発現量を表すグラフである。縦軸の単位は「倍」である。
【図4】実施例3において、被検物質として、PIPSリポソームを用いた場合の、グルタチオン量を表すグラフである。
【図5】実施例4において、被検物質としてPIリポソーム、PSリポソームを用いた場合の過酸化水素傷害条件下での神経細胞生存率を表すグラフである。
【図6】実施例5において、被検物質として、PIPSリポソームを用いた場合の過酸化水素傷害条件下での繊維芽細胞生存率を表すグラフである。
【発明を実施するための形態】
【0012】
以下、本発明を詳しく説明する。
本発明のNrf2活性増強剤は、ホスファチジルセリン(以下、PSと略称することがある)及びホスファチジルイノシトール(以下、PIと略称することがある)の少なくとも1種を有効成分として含む。PS、PIは各々単独で、又は組み合わせて使用できるが、好ましくはPS及びPIを併用することである。PSとPIを併用する場合、その比率は、乾燥重量に換算して、PS:PIが約0.5〜20:1であることが好ましく、約1〜10:1であることがより好ましく、約1〜4:1であることがさらにより好ましい。
【0013】
PSは、SIGMA社、BIOMOL社、日油株式会社などから市販されている。PIは、BIOMOL社などから市販されている。また、PIは、大豆、菜種、ひまわり、パームなどの植物由来のレシチンから単離することができる。また、SLP-WHITE(ホスファチジルコリン(以下、「PC」と略称することもある。)25.6%、ホスファチジルエタノールアミン(以下、「PE」と略称することもある。)24.1%、ホスファチジン酸(以下、「PA」と略称することもある。)8%、PI12%、その他約30%)、SLP-PIパウダー(PC18%、PE22%、PA8%、PI17%、その他約35%)(いずれも辻製油製)などの市販レシチンから単離することもできる。PIの単離は、各種のクロマトグラフィーで行うことができる。
【0014】
また、上記植物由来レシチン及び上記市販レシチンはPC及びPEを含むため、これらのレシチンにセリン及びホスフォリパーゼD(以下、「PLD」と略称することもある。)を作用させ塩基交換をさせることにより、PSを含むリン脂質混合物を得ることができ、このリン脂質をPS源として使用することもできる。さらに、この混合物から、各種のクロマトグラフィーでPSを単離することができる。なお、PI及びPSは、それぞれ、その他のリン脂質などの夾雑物質が含まれた状態で製剤化することもできる。
また、上記植物由来レシチン及び上記市販レシチンはPI、PC、及びPEを含むものもあるため、これらのレシチンにセリン及びPLDを作用させ塩基交換をさせることにより、PS及びPIを含むリン脂質混合物を得ることができ、このリン脂質混合物を有効成分として使用することもできる。必要に応じて、この混合物からPSとPIとの混合物を単離すればよい。PIとPSとの混合物は、その他のリン脂質などの夾雑物質が含まれた状態であってもよい。
【0015】
PSとPIとの重量比率(乾燥重量換算)がPS:PI=約0.5〜20:1であるリン脂質混合物は、出発原料となるレシチンとして、PCとPEとの合計重量に対するPI重量 の比率(PI/(PC+PE))が、乾燥重量に換算して、約20〜45重量%、好ましくは約25〜40重量%であるものを用いて、上記塩基交換反応を行うことにより得ることができる。上記植物由来レシチン及び上記市販レシチンは、通常この範囲でPC、PE、及びPIを含むが、PC及びPEの含有量が少ない場合は、例えばSLPC55(辻製油製)のような高純度リン脂質を添加することにより、レシチン中のPCとPEとの合計重量に対するPI重量 の比率(PI/(PC+PE))(乾燥重量換算)を上記範囲内に調整すればよい。
【0016】
レシチンの塩基交換反応は、例えば、特開2007-014270号公報に記載の方法で行うことができる。
即ち、塩基交換反応を行う前に、レシチンを有機溶媒相と水相からなる二相系中で攪拌すればよい。有機溶媒は特に限定されないが、脂肪族炭化水素、環状脂肪族炭化水素、ハロゲン化炭化水素、エステル類、エーテル類、ケトン類等の公知のものを使用すればよい。水相としては緩衝液が好ましい。緩衝液の酸、塩基及び塩の合計濃度は約0.1〜2Mが好ましい。上記二相系において、水は有機溶媒に対して20重量%以下であることが好ましい。二相系中での攪拌は約10〜40℃の温度で、約30分〜2時間行えばよい。これにより、通常、グリセロリン脂質と有機溶媒と水とのエマルジョンが形成される。
次いで、この混合物にセリン及びPLDを添加するが、塩基交換反応系中のグリセロリン脂質の濃度は約5〜40重量%であることが好ましい。また、本反応系中のセリンの濃度は約20〜40重量%が好ましい。
また、後述の製造例に示すように、レシチンを含む有機溶媒相に、セリン及びPLDを含有する緩衝液を加えて攪拌することによって塩基交換反応させることもできる。
【0017】
PLDは、特に限定されず、ナガセケムテックス社製のホスフォリパーゼD、Sigma社製のStreptomyces chromofuscus由来のホスフォリパーゼD、Streptomyces sp.由来のホスフォリパーゼDなどを利用できる。本反応系中におけるPLDの濃度は、グリセロリン脂質1gに対して約5〜200Uとすればよい。なお、1Uは、95%大豆ホスファチジルコリンを基質とし、基質濃度0.16%の0.2M酢酸緩衝液(pH4.0、10mMのCaCl2、1.3%のTriton X-100を含む)を37℃にて反応させた時、1分間に1μmolのコリンを遊離する酵素量である。
塩基交換反応は、約3.5〜10のpH条件で、約10〜40℃の温度で、約1〜72時間行えばよい。
【0018】
上記塩基交換反応により、リン脂質中のPC、PE等とセリンとが反応してPSが生成する。PIは、上記塩基交換反応においてヒドロキシル基含有化合物と反応し難いので、原料のリン脂質に含まれるPIはほぼそのまま塩基交換反応後のリン脂質混合物中に含まれる。
塩基交換反応は、PLDを加熱失活させることにより、終了させればよい。さらに、遠心分離法等により有機溶媒相を得た後、有機溶媒を減圧除去することによって反応混合物を濃縮すればよい。次いで、アセトン又はエタノールで晶析を行い、固液分離によって固形物を得、乾燥することにより、PS及びPIを含むリン脂質混合物を単離することができる。
【0019】
(2)製剤
本発明のNrf2活性増強剤には、化粧品、医薬部外品、医薬品、食品などが含まれる。
皮膚外用剤
本発明のNrf2活性増強剤は各種の皮膚外用剤とすることができる。皮膚外用剤の形態は、特に限定されず、化粧品であれば、例えば、化粧水、化粧用乳液、化粧用クリーム、化粧用ゲル、美容液、パック剤、ファンデーション、口紅、リップクリーム、リップグロス、洗顔剤、ボディソープ、ハンドクリーム、シャンプー、リンス、整髪料等のスキンケア用品又はメイクアップ用品の形態が挙げられる。中でも、広範囲の部位に適用できる点で、化粧水、化粧用ゲル、化粧用乳液、化粧用クリーム、美容液が好ましく、化粧水、化粧用乳液、化粧用クリームがより好ましい。
【0020】
これらは、有効成分であるPI及びPSの少なくとも1種(以下、単に有効成分と略称することがある。)に加えて、通常化粧品に用いられる成分、例えば、精製水、アルコール類(低級アルコール、多価アルコールなど)、油脂類、ロウ類、炭化水素類のような基剤と、必要に応じて、界面活性剤、増粘剤、紫外線吸収剤、紫外線散乱剤、安定剤、防腐剤、着色剤、香料のような添加剤とを配合して調製することができる。
医薬又は医薬部外品としての皮膚外用剤であれば、軟膏剤、ゲル剤、リニメント剤、ローション剤、乳剤、粉剤、懸濁剤、エアゾール剤、液剤などや、基剤を支持体上に支持させた硬膏剤、パップ剤、テープ剤、プラスター剤などの剤型が挙げられる。中でも、ベトツキ感なく均一に塗布することができる点で、ゲル剤、ローション剤、乳剤が好ましく、ゲル剤がより好ましい。
【0021】
医薬又は医薬部外品としての皮膚外用剤は、有効成分を適当な基剤に配合して調製することができる。基剤としては、アルギン酸ナトリウム、ゼラチン、コーンスターチ、トラガントガム、メチルセルロース、ヒドロキシエチルセルロース、カルボキシメチルセルロース、キサンタンガム、カラギーナン、マンナン、アガロース、デキストリン、カルボキシメチルデンプン、ポリビニルアルコール、ポリアクリル酸ナトリウム、メトキシエチレン−無水マレイン酸共重合体、ポリビニルエーテル、ポリビニルピロリドン、カルボキシビニルポリマー、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、プルラン等のポリマー類;白色ワセリン、黄色ワセリン、パラフィン、セレシンワックス、マイクロクリスタリンワックス等の炭化水素類;ゲル化炭化水素(例えば、商品名プラスチベース、ブリストルマイヤーズスクイブ社製);ステアリン酸等の高級脂肪酸;セタノール、オクチルドデカノール、ステアリルアルコール等の高級アルコール;ポリエチレングリコール(例えば、マクロゴール4000等);プロピレングリコール、グリセリン、ジプロピレングリコール、1,3-ブチレングリコール、濃グリセリン等の多価アルコール;モノオレイン酸エステル、ステアリン酸グリセリド等の脂肪酸エステル類;リン酸緩衝液などが挙げられる。さらに、溶解補助剤、無機充填剤、pH調節剤、保湿剤、防腐剤、粘稠剤、酸化防止剤、清涼化剤などの添加剤が添加されていてもよい。
【0022】
皮膚外用剤中の有効成分の含有量は、乾燥重量に換算して、製剤全体に対して、約0.001〜10重量%であることが好ましく、約0.01〜5重量%であることがより好ましく、約0.1〜2重量%であることがさらにより好ましい。上記範囲であれば、適量の使用によって十分なNrf2活性増強作用が得られる。
【0023】
経口投与剤
また、本発明のNrf2活性増強剤は、各種の経口投与製剤とすることができる。固形製剤としては、例えば、散剤、顆粒剤、錠剤、タブレット剤、丸剤、カプセル剤、チュアブル剤などが挙げられ、液体製剤としては、乳剤、液剤、シロップ剤などが挙げられる。中でも、服用し易く味がよい点で、顆粒剤、錠剤、タブレット剤、カプセル剤が好ましく、顆粒剤がより好ましい。
固形製剤は、有効成分に薬学的に許容される担体や添加剤を配合して調製される。例えば、白糖、乳糖、ブドウ糖、でんぷん、マンニットのような賦形剤;アラビアゴム、ゼラチン、結晶セルロース、ヒドロキシプロピルセルロース、メチルセルロースのような結合剤;カルメロース、デンプンのような崩壊剤;無水クエン酸、ラウリン酸ナトリウム、グリセロールのような安定剤などが配合される。さらに、ゼラチン、白糖、アラビアゴム、カルナバロウなどでコーティングしたり、カプセル化したりしてもよい。また、液体製剤は、例えば、上記の有効成分を、水、エタノール、グリセリン、単シロップ、又はこれらの混液などに、溶解又は分散させることにより調製される。これらの製剤には、甘味料、防腐剤、粘滑剤、滑沢剤、希釈剤、緩衝剤、着香剤、着色剤のような添加剤が添加されていてもよい。
【0024】
経口投与剤中の有効成分の含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜50重量%であることが好ましく、約0.05〜30重量%であることがより好ましく、約0.1〜25重量%であることがさらにより好ましい。上記範囲であれば、適量の使用によって十分なNrf2活性増強作用が得られる。
【0025】
その他の剤型
また、本発明のNrf2活性増強剤が医薬品である場合、注射剤や座剤などの剤型にすることもできる。
注射剤は、有効成分を、注射用蒸留水または生理用食塩水などに溶解又は分散させることにより得ることができる。注射剤には、pH調整剤等として水溶性無機酸又はその塩、水溶性有機酸又はその塩、中性アミノ酸、酸性アミノ酸又はその塩、塩基性アミノ酸の塩などが含まれていてもよい。また、緩衝剤、安定化剤、無痛化剤、防腐剤などが含まれていてもよい。
注射剤中の有効成分の含有量は、乾燥重量に換算して、製剤全体に対して、約0.001〜5重量%であることが好ましく、約0.01〜1重量%であることがより好ましく、約0.05〜0.5重量%であることがさらにより好ましい。上記範囲であれば、適量の使用によって十分なNrf2活性増強作用が得られる。
【0026】
座剤は、有効成分を、カルボポール及びポリカルボフィルのようなアクリル性高分子;ヒドロキシプロピルセルロース及びヒドロキシプロピルメチルセルロースのようなセルロース性高分子;アルギン酸ナトリウム及びキトサンのような天然高分子;脂肪酸ワックスなどの基剤に配合することにより調製できる。また、安息香酸ナトリウム、ソルビン酸カリウム、パラベンのような防腐剤;塩酸、クエン酸、水酸化ナトリウムのようなpH調節剤;メチオニンのような安定化剤を配合してもよい。
座剤中の有効成分の含有量は、乾燥重量に換算して、製剤全体に対して、約0.02〜5重量%であることが好ましく、約0.05〜3重量%であることがより好ましく、約0.1〜2重量%であることがさらにより好ましい。上記範囲であれば、適量の使用によって十分なNrf2活性増強作用が得られる。
【0027】
食品
本発明のNrf2活性増強剤が食品である場合の有効成分の含有量は、乾燥重量に換算して、組成物全体に対して、約0.01〜50重量%であることが好ましく、約0.05〜30重量%であることがより好ましく、約0.1〜25重量%であることがさらにより好ましい。上記範囲であれば、無理なく摂取できる食品量中に、十分なNrf2活性増強作用が得られるだけの有効成分が含まれることになる。
【0028】
この食品は、健康食品、栄養補助食品(バランス栄養食、サプリメントなどを含む)として好適に用いることができる。また、保健機能食品(特定保健用食品(疾病リスク低減表示、規格基準型を含む)、条件付き特定保健用食品、栄養機能食品を含む)に好適である。
この食品は、食品に通常用いられる賦形剤または添加剤を配合して、錠剤、タブレット剤、丸剤、顆粒剤、散剤、粉剤、カプセル剤、水和剤、乳剤、液剤、エキス剤、またはエリキシル剤等の剤型に調製することができる。中でも、服用しやすく味が良い点で、錠剤、タブレット剤、顆粒剤が好ましく、顆粒剤がより好ましい。
食品に通常用いられる賦形剤としては、シロップ、アラビアゴム、ショ糖、乳糖、粉末還元麦芽糖、セルロース糖、マンニトール、マルチトール、デキストラン、デンプン類、ゼラチン、ソルビット、トラガント、ポリビニルピロリドンのような結合剤;ショ糖脂肪酸エステル、グリセリン脂肪酸エステル、ステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、ポリエチレングリコールのような潤沢剤;ジャガイモ澱粉のような崩壊剤;ラウリル硫酸ナトリウムのような湿潤剤等が挙げられる。添加剤としては、香料、緩衝剤、増粘剤、着色剤、安定剤、乳化剤、分散剤、懸濁化剤、防腐剤などが挙げられる。
【0029】
また、この食品は、飲料(スポーツ飲料、ドリンク剤、乳飲料、乳酸菌飲料、果汁飲料、炭酸飲料、野菜飲料、茶飲料等)、菓子類(クッキー等の焼き菓子、ゼリー、ガム、グミ、飴等)を含むものであってもよい。中でも、製剤化の点で、リン脂質との相性がよく、処方の調整が容易である点で、乳飲料が好ましい。
【0030】
(3)使用方法
投与量
本発明のNrf2活性増強剤の使用量は、医薬品である場合、対象の年齢、症状、体重などにより異なるが、概ね以下の通りである。
即ち、経口投与剤である場合は、有効成分の投与量が、乾燥重量に換算して、1日当たり、約0.1〜10gであることが好ましく、約0.5〜5gであることがより好ましい。
また、注射剤である場合は、有効成分の投与量が、乾燥重量に換算して、1日当たり、約0.005〜100mgであることが好ましい。
【0031】
また、座剤である場合は、有効成分の投与量が、乾燥重量に換算して、1日当たり、約0.005〜100mgであることが好ましい。
皮膚外用剤である場合は、製剤の使用量が、1日あたり、通常使用量である約0.1〜1mLであればよい。
また、本発明のNrf2活性増強剤が食品である場合、この食品の摂取量は、摂取者の年齢、症状、体重などによって異なるが、有効成分の摂取量が、乾燥重量に換算して、1日当たり、約0.1〜10gであることが好ましく、約0.5〜5gであることがより好ましい。
【0032】
対象
使用対象は特に限定されないが、酸化ストレスを受けやすい人、酸化ストレス抵抗性が低い人、酸化ストレス抵抗性タンパク質の発現量が低い人などが好適な対象となる。また、酸化ストレスに起因する疾患、例えば癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害、糖尿病などの予防又は治療を必要とする人も好適な対象となる。
【0033】
(4)その他
本発明は、PI及びPSの少なくとも1種の有効量を哺乳動物、特に人に投与する、生体内のNrf2活性増強方法、又はNrf2により発現を制御される抗酸化タンパク質の発現増強方法をも包含しうる。
【0034】
以上、Nrf2活性増強剤について詳述したが、他の本発明であるNrf2活性増強用食品、Nrf2活性増強用化粧品、抗ストレス剤、抗ストレス用食品、抗ストレス用化粧品、Nrf2により発現を制御される抗酸化タンパク質の発現増強剤、Nrf2により発現を制御される抗酸化タンパク質の発現増強用食品、Nrf2により発現を制御される抗酸化タンパク質の発現増強用化粧品、酸化ストレス性疾患の予防又は治療剤、酸化ストレス性疾患の予防用食品についても同様である。
なお、Nrf2により発現を制御される抗酸化タンパク質としては、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NQO1、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ、グルタチオンなどが挙げられ、好ましくはヘムオキシゲナーゼ、グルタメート−システインリガーゼ、NQO1である。
【実施例】
【0035】
以下に、実施例を挙げて本発明をより具体的に説明するが、本発明はこれらに限定されるものではない。
製造例1:PI・PS含有リン脂質混合物の製造
大豆レシチン(UltralecP(ADM社);PC=24重量%, PE=17重量%, PI=14重量%含有)7gをヘプタン・アセトン混合液(ヘプタン:アセトン=4:1)70mLと混合し、溶解させ、レシチン溶液を得た。これとは別に、セリン20g及びPLD(ナガセケムテックス社製)500Uを1M酢酸緩衝液(pH4.5)67mL中に含む酵素含有セリン溶液を調製した。
上記レシチン溶液に酵素含有セリン溶液を加え、30℃にて5時間攪拌した。次いで、この混合液に、上記ヘプタン・アセトン混合液75mL及び塩化ナトリウム20gを加え、1時間攪拌し、これを静置して、水相と有機溶媒相とを分離した後、有機相を回収し、PI及びPS含有有機溶媒溶液を得た。この有機溶媒溶液は固形分7gを含有していた。その固形分の組成を下記条件のHPLCで調べたところ、次の通りであった。PS 32重量%、PI 21重量%、PC 2重量%、PE 9重量%、PA 13重量%。これをPI及びPSの混合物(本明細書においてPIPSと称することがある)として以下の試験に使用した。
<HPLC条件>
使用カラム:ジーエルサイエンス社製 Unisil Q NH2 (4.6mm I.D.×250mm)
移動相:アセトニトリル/メタノール/10mMリン酸二水素アンモニウム
=1856/874/270
流速:1.3mL/分
検出:UV 205nm
【0036】
製造例2:PI・PS含有リポソームの製造
製造例1の固形分をクロロホルムで溶解し、エバポレートした。Milli-Q水で分散液を調製し、氷水中で超音波処理を行い、PI及びPSを含有するリポソーム(本明細書においてPIPSリポソームとする)を調製した。
【0037】
製造例3:PI含有リポソームの製造
BIOMOL社のL-α-phosphatidylinositol Naをクロロホルム/メタノール(容量比:9/1)混液で溶解し、エバポレートした。Milli-Q水で分散液を調製し、氷水中で超音波処理を行い、PIを含有するリポソーム(本明細書においてPIリポソームとする)を調製した。
【0038】
製造例4:PS含有リポソームの製造
SIGMA社のL-α-phosphatidylserineをクロロホルム/メタノール(容量比:9/1)混液で溶解し、エバポレートした。Milli-Q水で分散液を調製し、氷水中で超音波処理を行い、PS含有リポソーム(本明細書においてPSリポソームとする)を調製した。
【0039】
実施例1:レポーターアッセイ系におけるNrf2の活性化
被験物質として、PIリポソーム、PSリポソーム、PIリポソームとPSリポソームの混合物を使用した。レポータープラスミドであるpGL3-hNQO1プロモーターは、ヒト由来NQO1由来ARE (antioxidant response element)領域をPCRで増幅し、これをホタルルシフェラーゼレポーターベクターであるpGL3-プロモーター-ベクター(プロメガ社)のMluI-HindIII部位に挿入することによって構築した。
PCRのプライマーはForwardプライマー: 5’-GGA CGC GTG CAG TCA CAG TGA CTC AGC AGA-3’(配列番号1)とReverseプライマー:5’-GGA AGC TTT TTA TAT ATC CTG TCC GGC CCG-3’(配列番号2)を用いた。
次に、10%ウシ胎児血清含有Dulbecco’s modified Eagle’s medium(DMEM)を入れた24穴プレートに4×105 cells/wellの神経細胞(Neuro2a)を播種し、5% CO2下、37℃で一晩培養した。
別途、1.0μgのpGL3-hNQO1プロモーターと1.0μgのpSV-β-ガラクトシダーゼ(プロメガ社)とTransFast試薬(プロメガ社)を含有する無血清DMEMを用意し、この培地を24穴プレートの各ウェルに添加することでトランスフェクションを行った。無血清DMEMの添加量は、各ウェルが1.0μgのpGL3-hNQO1プロモーターと1.0μgのpSV-β-ガラクトシダーゼ(プロメガ社)を含有する量である。
1時間かけてトランスフェクションを行った後、培地を新しいDMEM(10%ウシ胎児血清含有)1mlに交換した。5% CO2下、37℃で一晩培養した後、所定量の被験物質を含有するDMEM 1ml(10%ウシ胎児血清含有)に交換し、さらに24時間培養した。
培地を除去して細胞のみが残った状態のウェルに、Passive Lysis Buffer(プロメガ社)0.125mlを添加し、室温でゆるやかに振とうし、凍結融解を行い、細胞破砕液を得た。
細胞破砕液中のホタルルシフェラーゼ活性を化学発光検出器により測定した。また、β-ガラクトシダーゼ活性は吸光度計で測定した。ホタルルシフェラーゼ活性をβガラクトシダーゼ活性で除した値を相対ルシフェラーゼ活性とした。結果を図1に示す。
PI、PS、両リン脂質を添加した培養液については、コントロールに対して、相対ルシフェラーゼ活性の増強が認められ、すなわち、Nrf2活性化を示した。
【0040】
実施例2:Nrf2によって制御される各種遺伝子の発現解析
被験物質として、PIPSリポソーム、PIリポソーム、PSリポソームを使用した。10%ウシ胎児血清含有DMEMを入れた6穴プレートに5×105 cells/wellの神経細胞(Neuro2a)を播種し、5% CO2下、37℃で一晩培養した。所定量の被験物質を含有するDMEMに交換し、さらに24時間培養した。培養後、培養上清を除去し、各ウェルにISOGEN(ニッポンジーン社)1mlを添加し、細胞抽出液を得た。以下、ISOGEN添付の操作方法に準じてmRNAを分取した。
cDNAの分取にはSuperScriptIII First-Strand Synthesis System for RT-PCR(Invitrogen社)を使用し、本キットに添付の操作手順に準じて行った。
以下に、cDNAの分取に使用したプライマーを示す。
ヘムオキシゲナーゼ(HO-1):
Forwardプライマー:CACGCATATACCCGCTACCT(配列番号3)
Reverseプライマー:TCCTCTGTCAGCATCACCTG(配列番号4)
グルタメートシステインリガーゼ(GCL-c):
Forwardプライマー:ACTGAATGGAGGCGATGTTC(配列番号5)
Reverseプライマー:CTGGGTTGGGTCTGTGTTCT(配列番号6)
βアクチン:
Forwardプライマー:ACTGGGACGACATGGAGAAG(配列番号7)
Reverse プライマー:TCTCAGCTGTGGTGGTGAAG(配列番号8)
結果を図2(HO-1)及び図3(GCL-c)に示す。βアクチンとの比を取ることによって、コントロールに対する相対発現量として示す。Nrf2によって発現増加することが知られている標的遺伝子HO-1、GCL-cの発現量が、PI、PSの添加によってコントロールに対して増加した。この結果から、PI、PS、PIPSはNrf2を活性化し、第2相酵素と呼ばれる一連の遺伝子群の発現を増加させることが明らかとなった。
【0041】
実施例3:細胞内グルタチオン量
10%ウシ胎児血清含有DMEMを入れた6穴プレートに5×105 cells/wellの神経細胞(Neuro2a)を播種し、5% CO2下、37℃で一晩培養した。所定量の被験物質(PIPSリポソーム)を含有するDMEMに交換し、さらに48時間培養した。培養上清を除去して細胞を回収し、凍結融解により細胞を破砕した後、遠心して上清を得た。上清中のグルタチオン量を総グルタチオン定量キット(同仁化学)を用いて定量した。また、上清中のタンパク質量をBradford法で定量した。
結果を図4に示す。PIPSの添加によって、細胞内の総グルタチオン量を増加させた。グルタチオンには活性酸素や生体異物から細胞を防御する機能があり、PIPSはこの機能を増強すると考えられた。
【0042】
実施例4:過酸化水素による細胞死の抑制作用1(神経細胞保護作用)
10%ウシ胎児血清含有DMEMを入れた96穴プレートに1×104 cells/wellの神経細胞(Neuro2a)を播種し、5% CO2下、37℃で24時間培養した。所定量の被験物質(PIリポソーム、PSリポソーム)を含有する10%ウシ胎児血清含有DMEMに交換し、さらに24時間培養した。ここに過酸化水素(和光純薬工業)を最終濃度が0.8mMとなるように添加してさらに24時間培養した。その後、Cell Counting kit-8(同仁化学)を用いて450nmの吸光度を測定した。細胞生存率は、被験物質非含有かつ過酸化水素非添加条件を100%として算出した。
結果を図5に示す。PI、PSの添加によって、過酸化水素による細胞死を抑制できることが確認できた。なお、コントロールは被験物質非含有かつ過酸化水素添加条件である。
【0043】
実施例5:過酸化水素による細胞死の抑制作用2(皮膚細胞保護作用)
10%ウシ胎児血清含有DMEMを入れた96穴プレートに1×104 cells/wellの皮膚繊維芽細胞(NHDF)を播種し、5% CO2下、37℃で48時間培養した。所定量の被験物質(PIPSリポソーム)を含有するDMEMに交換し、さらに24時間培養した。ここに過酸化水素(和光純薬工業)を最終濃度が0.25mMとなるように添加してさらに4時間培養した。その後、Cell Counting kit-8(同仁化学)を用いて450nmの吸光度を測定した。細胞生存率は、被験物質非含有かつ過酸化水素非添加条件を100%として算出した。
結果を図6に示す。PIPSの添加によって、過酸化水素による細胞死を抑制できることが確認できた。なお、コントロールは被験物質非含有かつ過酸化水素添加条件である。
【0044】
処方例1−3(ローション)
各成分の配合量を表1に示した(単位は重量%)。各成分を所定量計量し、室温で撹拌してローションを作製した。ローションのpHはクエン酸水溶液で5.5に調整した。
【表1】

処方例4(牛乳飲料)
各成分の配合量を表2に示した(単位は重量%)。牛乳にPIPSを混合し、室温で2分間、5000rpmでTKホモミクサーで攪拌した。乳化後、100℃、10分加熱処理した。
【表2】

処方例5(豆乳飲料)
各成分の配合量を表3に示した(単位は重量%)。豆乳に他の成分を混合し、室温で2分間、5000rpmでTKホモミクサーで攪拌した。乳化後、100℃、10分加熱処理した。
【表3】

処方例6(ヨーグルト飲料)
各成分の配合量を表4に示した(単位は重量%)。全ての成分を室温にて混合および撹拌して均一な溶液として、飲料を作製した。
【表4】

処方例7(錠剤)
各成分の配合量を表5に示した(単位は重量%)。PIPS、乳糖、ジャガイモデンプンを均一に混合した。混合物にポリビニルアルコールの水溶液を加え、湿式顆粒造粒法により顆粒を調製した。顆粒を乾燥し、ステアリン酸マグネシウムを混合し、圧縮打錠して重量300mgの錠剤を作製した。
【表5】

【産業上の利用分野】
【0045】
本発明は、Nrf2の活性化作用、酸化ストレス抵抗性の改善、予防、治療を要する分野で有用である。
【特許請求の範囲】
【請求項1】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強剤。
【請求項2】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項1に記載のNrf2活性増強剤。
【請求項3】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強用食品。
【請求項4】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項3に記載のNrf2活性増強用食品。
【請求項5】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強用化粧品。
【請求項6】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項5に記載のNrf2活性増強用化粧品。
【請求項7】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス剤。
【請求項8】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項7に記載の抗ストレス剤。
【請求項9】
酸化ストレス性疾患の予防又は治療用である請求項7又は8に記載の抗ストレス剤。
【請求項10】
酸化ストレス性疾患が、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害及び糖尿病からなる群から選択される少なくとも1種である請求項7に記載の抗ストレス剤。
【請求項11】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス用食品。
【請求項12】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項11に記載の抗ストレス用食品。
【請求項13】
酸化ストレス性疾患の予防用である請求項11又は12に記載の抗ストレス用食品。
【請求項14】
酸化ストレス性疾患が、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害及び糖尿病からなる群から選択される少なくとも1種である請求項13に記載の抗ストレス用食品。
【請求項15】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス用化粧品。
【請求項16】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強剤。
【請求項17】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項16に記載の抗酸化タンパク質の発現増強剤。
【請求項18】
Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である請求項16又は17に記載の抗酸化タンパク質の発現増強剤。
【請求項19】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強用食品。
【請求項20】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項19に記載の抗酸化タンパク質の発現増強用食品。
【請求項21】
Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である請求項19又は20に記載の抗酸化タンパク質の発現増強用食品。
【請求項22】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強用化粧品。
【請求項23】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項22に記載の抗酸化タンパク質の発現増強用化粧品。
【請求項24】
Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である請求項22又は23に記載の抗酸化タンパク質の発現増強用化粧品。
【請求項1】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強剤。
【請求項2】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項1に記載のNrf2活性増強剤。
【請求項3】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強用食品。
【請求項4】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項3に記載のNrf2活性増強用食品。
【請求項5】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2活性増強用化粧品。
【請求項6】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項5に記載のNrf2活性増強用化粧品。
【請求項7】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス剤。
【請求項8】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項7に記載の抗ストレス剤。
【請求項9】
酸化ストレス性疾患の予防又は治療用である請求項7又は8に記載の抗ストレス剤。
【請求項10】
酸化ストレス性疾患が、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害及び糖尿病からなる群から選択される少なくとも1種である請求項7に記載の抗ストレス剤。
【請求項11】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス用食品。
【請求項12】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項11に記載の抗ストレス用食品。
【請求項13】
酸化ストレス性疾患の予防用である請求項11又は12に記載の抗ストレス用食品。
【請求項14】
酸化ストレス性疾患が、癌、動脈硬化、心筋梗塞、脳梗塞、肝機能障害及び糖尿病からなる群から選択される少なくとも1種である請求項13に記載の抗ストレス用食品。
【請求項15】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有する抗ストレス用化粧品。
【請求項16】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強剤。
【請求項17】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項16に記載の抗酸化タンパク質の発現増強剤。
【請求項18】
Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である請求項16又は17に記載の抗酸化タンパク質の発現増強剤。
【請求項19】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強用食品。
【請求項20】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項19に記載の抗酸化タンパク質の発現増強用食品。
【請求項21】
Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である請求項19又は20に記載の抗酸化タンパク質の発現増強用食品。
【請求項22】
ホスファチジルセリン及びホスファチジルイノシトールの少なくとも1種を含有するNrf2により発現を制御される抗酸化タンパク質の発現増強用化粧品。
【請求項23】
ホスファチジルセリン及びホスファチジルイノシトールを含有する請求項22に記載の抗酸化タンパク質の発現増強用化粧品。
【請求項24】
Nrf2により発現を制御される抗酸化タンパク質が、グルタチオン-S-トランスフェラーゼ、ヘムオキシゲナーゼ、NAD(P)H:キノンオキシドレダクターゼ、チオレドキシン還元酵素1、グルタメート−システインリガーゼ、スーパーオキシドジスムターゼ、グルタチオン還元酵素、カタラーゼ及びグルタチオンからなる群から選択される少なくとも1種の酵素である請求項22又は23に記載の抗酸化タンパク質の発現増強用化粧品。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−168541(P2011−168541A)
【公開日】平成23年9月1日(2011.9.1)
【国際特許分類】
【出願番号】特願2010−34195(P2010−34195)
【出願日】平成22年2月19日(2010.2.19)
【出願人】(000214250)ナガセケムテックス株式会社 (173)
【Fターム(参考)】
【公開日】平成23年9月1日(2011.9.1)
【国際特許分類】
【出願日】平成22年2月19日(2010.2.19)
【出願人】(000214250)ナガセケムテックス株式会社 (173)
【Fターム(参考)】
[ Back to top ]

