OATP1B3mRNAの新規な選択的スプライシングバリアント
【課題】新規ながんマーカーおよびその用途を提供する。より詳細には、新規ながんマーカー、当該がんマーカーの測定方法および測定用キット、これを用いたがんの検出方法、がんの検出用キット、がんの予防および/または治療剤のスクリーニング方法、並びに、がんワクチン等の医薬を提供する。
【解決手段】被検試料中のOATP1B3 mRNAの選択的スプライシングバリアントの測定方法。当該測定方法は、生体から分離した被検試料中の、特定の塩基配列を含むmRNAを、他の塩基配列を含むmRNAと識別して測定することを含む。当該測定方法は、がんの検出やがんの予防および/または治療剤のスクリーニングに有用である。
【解決手段】被検試料中のOATP1B3 mRNAの選択的スプライシングバリアントの測定方法。当該測定方法は、生体から分離した被検試料中の、特定の塩基配列を含むmRNAを、他の塩基配列を含むmRNAと識別して測定することを含む。当該測定方法は、がんの検出やがんの予防および/または治療剤のスクリーニングに有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規ながんマーカーに関する。より詳細には、本発明は、OATP1B3 mRNAの新規な選択的スプライシングバリアント、およびその用途に関する。
【背景技術】
【0002】
最近の医療技術の進歩により、がんの治療技術も大幅に改善されており、ある種のがんについては、死亡率の減少傾向を示すものもある。しかしながら、がんの発症を早期に発見することは、その治療効果に影響を与えるものであるため、がんの早期発見を可能にする方法の確立が望まれている。
【0003】
がんの診断には、がん組織を超音波またはX線検査などにより視覚的に捉える方法のほか、患者から採取した組織を免疫組織学的手法により細胞形態等の異常を発見する方法、並びに、特定のがんの発症に伴い発現に変化が生じるタンパク質または遺伝子などのいわゆるがんマーカーの動態を検出する生化学的、免疫化学的方法などが知られている。
【0004】
これらの方法において、組織を免疫組織学的手法によりその形態を観察する方法は、組織の標本化が必要であるため、がんの発症の有無の確認に時間を要し、また、観察された形態からがんの発症の有無を見極めるためにはかなりの熟練が必要となる。
【0005】
したがって、比較的簡便でかつ客観的にがん発症の有無を判断することができるがんマーカーを用いる方法の適用が、しばしばおこなわれるようになってきた。しかしながら、ヒトのがんの診断において使用されるがんマーカーの多くは、正常組織細胞にもある程度発現していることから、当該がんマーカーの発現の変動をがん化の指標として用いなくてはならないことが多く、誤診断の可能性が常に存在している。
【0006】
したがって、がん発症の有無を客観的により正確に検出するために、非がん細胞にはその存在が認められず、がん化した細胞だけが産生する物質をがんマーカーとして用いることが望ましい。例えば膵臓がんを例に挙げると、現時点において膵臓がんには有効なスクリーニング検査法が存在しないため、がん症状が表れた時には手遅れになっていることが多く、膵臓がんの早期発見のためには膵臓がん特異的ながんマーカーの使用が必要とされている。
【0007】
ところで、有機アニオン輸送ポリペプチド1B3(OATP1B3;Organic Anion Transporting Polypeptide 1B3、遺伝子名SLCO1B3)は、細胞膜上に発現するトランスポーターであり、幅広い基質認識性を示し、抗がん剤を含む多くの化合物の細胞内取り込みを担っている。OATP1B3は通常肝細胞に特異的に発現するが、他の臓器でもがん化に伴い発現が認められるようになる。これまで、乳がんおよび前立腺がんにおいてOATP1B3の発現や機能が患者の生存率に影響を及ぼすことが報告されている(非特許文献1および2を参照)。また、大腸がん細胞を用いた解析では、OATP1B3の発現が細胞にアポトーシス抵抗性を付与するとの報告がある(非特許文献3を参照)。
【0008】
以上のことから、OATP1B3はがん細胞においてなんらかの役割を担っていると考えられる。このため、OATP1B3の検出はがん治療における予後の診断や抗がん剤有効性診断に有用ながんマーカーとして期待されている。例えば、特許文献1には、LST−2(OATP1B3の別名である)のC末端側細胞内ドメインを認識する抗LST−2モノクローナル抗体を用いて女性大腸がん患者のがん組織におけるLST−2の発現を測定し、この測定値に基づいて当該患者の予後を予測する技術が開示されている。
【0009】
しかしながら、がん細胞におけるOATP1B3の発現・機能については依然として不明な点が多く、がんマーカーとしての利用形態が十分に確立しているとはいえないのが現状である。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2007−119390号公報
【非特許文献】
【0011】
【非特許文献1】Muto et al. Human liver-specific organic anion transporter-2 is a potent prognostic factor for human breast carcinoma. (2007) Cancer Sci. 98:1570-6
【非特許文献2】Hamada et al. Effect of SLCO1B3 Haplotype on Testosterone Transport and Clinical Outcome in Caucasian Patients with Androgen-Independent Prostatic Cancer. (2008) Clin. Cancer Res. 14:3312-8
【非特許文献3】Lee et al. Overexpression of OATP1B3 confers apoptotic resistance in colon cancer. (2008) Cancer Res. 68:10315-23
【発明の概要】
【発明が解決しようとする課題】
【0012】
上述したような従来技術に鑑み、本発明は、新規ながんマーカーおよびその用途を提供することを目的とする。より詳細には、本発明は、新規ながんマーカー、当該がんマーカーの測定方法および測定用キット、これを用いたがんの検出方法、がんの検出用キット、がんの予防および/または治療剤のスクリーニング方法、並びに、がんワクチン等の医薬を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明者らは、上述した従来技術に鑑み、OATP1B3の発現・機能のさらなる探索を目的として、鋭意研究をおこなった。その過程で、驚くべきことに:
(1)従来報告されているOATP1B3 mRNA(本明細書中、「OATP1B3/wt」とも称する;「wt」とは野生型(Wild Type)の意である)の選択的スプライシングバリアントが存在すること、
(2)この新たな選択的スプライシングバリアントが、がん細胞・組織において特異的に強く発現すること;および、
(3)この新たな選択的スプライシングバリアントから、いくつかのペプチドまたはタンパク質が発現しうること、
の3つの知見を得て(本明細書中、この選択的スプライシングバリアントを「OATP1B3/ct」とも称する;「ct」とはがん型(Cancer Type)の意である)、これらの知見に基づき、本発明を完成させるに至った。
【0014】
すなわち、本発明の第1の形態によれば、被検試料中のOATP1B3 mRNAの選択的スプライシングバリアントの測定方法が提供される。当該測定方法は、生体から分離した被検試料中の、配列表の配列番号:1で表される塩基配列を含むmRNAを、配列番号:2で表される塩基配列を含むmRNAと識別して測定することを含む。
【0015】
この際、OATP1B3/ctは、配列番号:1で表される塩基配列におけるエキソンSVの存在を指標として測定されることが好ましい(「エキソンSV」についての詳細は後述する)。また、この測定は、例えば、エキソンSVを含む領域に設定したプライマーを一方のプライマーとして用いる核酸増幅法により、OATP1B3/ctまたはそのcDNAの部分領域を特異的に増幅し、増幅産物を測定することを含む。なお、前記プライマーの塩基数は、好ましくは15〜35程度である。また、前記核酸増幅法は、好ましくはRT−PCR法である。
【0016】
また、本発明の第2の形態によれば、以下の条件を満足する核酸を提供する:
(1)配列番号:1で表される塩基配列を含む核酸とストリンジェントな条件下でハイブリダイズする;
(2)配列番号:2で表される塩基配列を含む核酸が共存する場合に、ストリンジェントな条件下で、当該核酸とはハイブリダイズしないか、または、当該核酸とハイブリダイズした場合であってもその3’末端がミスマッチとなる。
【0017】
この際、当該核酸は、エキソンSVを含む領域とハイブリダイズすることが好ましい。また、当該核酸の塩基数は、好ましくは10程度以上であり、より好ましくは15〜35程度である。さらに、当該核酸は、配列番号:1で表される塩基配列または当該塩基配列の部分領域と同じ塩基配列またはこれらの塩基配列のうち10%以下の塩基が置換されてなる塩基配列からなることが好ましい。当該核酸は、OATP1B3 mRNAの選択的スプライシングバリアントの測定に好適に用いられる。この際、当該核酸は、好ましくは核酸増幅用のプライマー、またはプローブである。
【0018】
さらに、本発明の第3の形態によれば、本発明の第2の形態により提供される核酸を含む、OATP1B3 mRNAの選択的スプライシングバリアントの測定用キットが提供される。
【0019】
また、本発明の第4の形態によれば、がんの検出方法も提供される。当該検出方法は、本発明の第1の形態により提供される測定方法により、または、本発明の第3の形態により提供される測定用キットを用いて、生体から分離した被検試料中のOATP1B3 mRNAの選択的スプライシングバリアントを測定することを含む。この際、配列番号:1で表される塩基配列を含むOATP1B3 mRNAの選択的スプライシングバリアントを測定することが好ましい。また、当該検出方法において、がんは、大腸がんまたは膵臓がんであることが好ましい。
【0020】
さらに、本発明の第5の形態によれば、がんの予防および/または治療剤のスクリーニング方法もまた、提供される。当該スクリーニング方法は、本発明の第1の形態により提供される測定方法により、または、本発明の第3の形態により提供される測定用キットを用いて、がん細胞を被検物質の存在下で培養して得られる培養細胞中のOATP1B3 mRNAの選択的スプライシングバリアントを測定する工程と、得られた測定結果を、前記被検物質の非存在下における場合と比較および/または評価する工程とを含む。
【0021】
そして、本発明の第6の形態によれば、配列番号:1で表される塩基配列を含む、OATP1B3 mRNAの選択的スプライシングバリアント自体もまた、提供される。本選択的スプライシングバリアントは、例えば、該バリアントを培養細胞等に導入し強制発現させることにより、がん化培養細胞等を作成し、本発明の第5の形態のスクリーニング方法にも利用できる。
【0022】
また、本発明の第7の形態によれば、
(1)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド、あるいは、
(2)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列において、10%以下のアミノ酸が置換、欠失、および/または挿入されたアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチドが提供される。当該ポリペプチドは、好ましくは、配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列からなるポリペプチドである。
【0023】
さらに、本発明の第8の形態によれば、第7の形態のポリペプチドをコードする核酸や、当該核酸を含む発現ベクター、当該発現ベクターで形質転換された細胞もまた、提供される。
【0024】
また、本発明の第9の形態によれば、第7の形態のポリペプチドに結合する抗体や、配列番号:4、配列番号:6、配列番号:8、または配列番号:10で表される塩基配列を含む核酸とストリンジェントな条件下でハイブリダイズし、少なくとも15塩基を有する核酸もまた、提供される。
【0025】
そして、本発明の第10の形態によれば、生体から分離した被検試料中の、上記第7の形態のポリペプチドの量を測定することを含む、がんの検出方法が提供される。この際、上記第9の形態の抗体を測定に用いることが好ましい。また、当該抗体を含む、がんの検出用キットも提供されうる。
【0026】
本発明の第11の形態では、医薬が提供される。当該医薬は、第7の形態のポリペプチドまたはその断片や、第8の形態の核酸またはその断片を含み、特異的な細胞傷害性T細胞を誘導するためのものである。当該医薬は、好ましくはがんワクチンである。
【発明の効果】
【0027】
本発明によれば、新規ながんマーカーとしてヒトOATP1B3 mRNAの新規な選択的スプライシングバリアントが提供され、その測定方法、当該測定に利用可能な核酸、および当該測定方法を実施するための手段(測定用キット)が提供される。また、本発明によれば、新規ながんの検出方法も提供され、さらには、がんの予防および/または治療剤の新規なスクリーニング方法も提供される。そして、がんの検出に用いられうるポリペプチドやこれに結合する抗体、当該ポリペプチドの量を指標としたがんの検出方法、当該抗体を含むがんの検出用キット、がんワクチン等としての医薬などもまた、提供される。
【図面の簡単な説明】
【0028】
【図1】OATP1B3/ctのcDNAの塩基配列(配列番号:1)およびOATP1B3/wtのcDNAの塩基配列(配列番号:2)をアライメントした結果を示す図である。図1において、アステリスク(*)は、2つの塩基配列間でヌクレオチドが一致していることを意味する。
【図2】OATP1B3/wtによりコードされるタンパク質のアミノ酸配列を示す図である。
【図3】実施例の「5.SLCO1B3遺伝子の転写開始点の決定」において、ヒト大腸がん由来total RNAまたは白人種肝由来total RNAをテンプレートとしてRLM−5’−RACE法をおこなった結果を可視化するためのアガロースゲル電気泳動の結果を示す写真である。
【図4】ヒトSLCO1B3遺伝子の構造を示す模式図である。図4には、既知および新規の転写開始点の位置が示されている。また、実施例においてRT−PCRをおこなった際に用いたプライマーセットがハイブリダイズする位置もそれぞれ矢印で示されている。
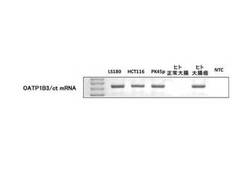
【図5】実施例の「6.cDNAの作製およびRT−PCR法によるmRNA発現解析」において、LS180細胞total RNA、PK45p細胞、ヒト大腸がん/正常大腸ペアRNAおよび白人種肝由来のtotal RNAをテンプレートとしてRT−PCRをおこなった結果を可視化するためのアガロースゲル電気泳動の結果を示す写真である。
【図6】実施例の「8.定量的リアルタイムPCRによるmRNA発現解析」の結果(mRNA発現プロファイル)を示すグラフである。図6のAは、各組織・細胞におけるOATP1B3/ctの発現レベルを示す。また、図6のBは、各組織・細胞におけるOATP1B3/wtの発現レベルを示す。さらに、図6のCは、発現レベルの比(OATP1B3/ctのコピー数/OATP1B3/wtのコピー数)を示す。
【図7】OATP1B3/ct上に存在する4つのオープンリーディングフレーム(ORF)を表す図である。cDNAの塩基配列を上列に示し、下列にコードされるアミノ酸配列を示す。また、下線がORFを示し、太字ATGはORFの上流にある推定翻訳開始コドンを示す。コードされるアミノ酸配列において「GFP」とあるのは、実施例で発現プラスミドを作製した際に緑色蛍光タンパク質(GFP)をコードする塩基配列を挿入した部位を示す。なお、フレーム2については、N末端20アミノ酸をコードする領域の後にGFPをコードする塩基配列を挿入して発現プラスミドを作製した。
【図8】実施例の「10.リバーストランスフェクション」の結果を示すグラフである。なお、緑色はGFP由来の蛍光であり、赤色はトランスフェクションコントロールであるmCherry由来の蛍光である。また、両蛍光の重ね合わせをMergeとして示し、微分干渉像をPhaseとして示す。
【発明を実施するための形態】
【0029】
ヒトSLCO1B3遺伝子は、染色体12p12上に位置する約106kbpの遺伝子であり、この遺伝子から、2712bp(15エキソン)からなるOATP1B3 mRNA(OATP1B3/wt;Refseq Accession No.NM_019844)が転写される。既に報告されているこのOATP1B3/wtのcDNAの塩基配列を配列番号:2および図1に示す。このOATP1B3/wtは、702アミノ酸からなるタンパク質(OATP1B3タンパク質;RefSeq Accession No.NP_062818)をコードしている。このOATP1B3/wtによりコードされるタンパク質のアミノ酸配列を配列番号:3および図2に示す。なお、配列番号:2で表される塩基配列において、5’末端から1番目の塩基(本明細書中、「1nt」のように称する。他の位置の塩基も同様に5’末端から何番目に位置するかの数字にntを付けて称する)から61ntまでがエキソン1、62nt〜210ntがエキソン2、211nt〜1991ntがエキソン3〜エキソン14であり、1992nt〜2712ntがエキソン15である。なお、OATP1B3/wtのコード領域(CDS;Coding Sequence)は、エキソン2〜エキソン15に跨る127〜2235nt(終止コドンTAAを含む)であり、図1において大文字で表記されている。一方、OATP1B3/wtの非コード領域は、図1において小文字で表記されている。
【0030】
後述する実施例に記載するように、本発明者らは、ヒトSLCO1B3遺伝子の転写開始点を決定する目的で、ヒト大腸がん組織由来のtotal RNAをテンプレートとしてRLM−5’−RACE法をおこなったところ、既に報告されている転写開始点(図1に示す「TSS」)の情報から予想されるサイズよりも分子量の小さい増幅産物が検出されることを見出した。そして、SLCO1B3遺伝子の新規転写開始点付近の塩基配列をヒトゲノムDNAのデータベースと照合したところ、新規転写開始点はSLCO1B3遺伝子のイントロン2の領域内に存在し、さらにここに新たなエキソンが存在することが明らかとなった(この新たなエキソンを「エキソンSV」と称する)。また、このエキソンSVはOATP1B3/wtでいうエキソン3へとスプライシングされていた(後述する図4を参照)。このようにして発見されたOATP1B3 mRNAの新規な選択的スプライシングバリアント(OATP1B3/ct)のcDNAの塩基配列を配列番号:1および図1に示す。
【0031】
上述したように、OATP1B3/ctのエキソンSVはOATP1B3/wtのエキソン3へとスプライシングされていた。すなわち、配列番号:1で表される塩基配列において、1nt〜139ntがエキソンSVである。また、配列番号:1で表される塩基配列における140nt〜1920ntは、OATP1B3/wtのエキソン3〜エキソン14と実質的に同一の塩基配列を有する。そして、配列番号:1で表される塩基配列における1921nt〜2170ntは、OATP1B3/wtのエキソン15の対応部分と同一の塩基配列を有する。
【0032】
本発明において見出された選択的スプライシングバリアント(例えば、OATP1B3/ct)は、後述する実施例に記載のように、がん細胞においてその発現量が増大していることが確認された。したがって、生体から分離した被検試料中の当該選択的スプライシングバリアントを測定することにより、がんの検出が可能である。
【0033】
以下、本発明の具体的な好ましい実施形態についてより詳細に説明するが、本発明の技術的範囲は特許請求の範囲の記載に基づいて定められるべきであり、以下の具体的な実施形態や実施例によって限定されるべきではない。
【0034】
本発明の第1の形態により提供されるOATP1B3 mRNAの選択的スプライシングバリアントの測定方法では、生体から分離した被検試料中の、配列番号:1で表される塩基配列を含むmRNA(例えば、配列番号:1で表される塩基配列からなるmRNA)を、配列番号:2で表される塩基配列を含むmRNA(例えば、配列番号:2で表される塩基配列からなるmRNA)と識別して測定することを含む。なお、配列番号:1の塩基配列は、mRNAおよびこれをテンプレートとして得られるcDNAの塩基配列を兼用して示すものであり、mRNAを示す場合には、当然ながら、チミン(t)に代えてウラシル(u)が含まれるため、tをuに読み替える。また、「測定」には、定量、半定量および検出のいずれの概念も包含される。さらに、「mRNAを測定する」ことには、mRNAを直接的に測定する場合のほか、mRNAを一旦cDNAへと変換した後に当該cDNAを測定する場合(後述するRT−PCR等)や、mRNAの翻訳産物を測定する場合のように、mRNAを間接的に測定する場合も包含される。また、以下の説明では、配列番号:1で表される塩基配列を含むmRNA、cDNA、核酸等を、「配列番号:1のmRNA、cDNA、核酸等」と称することがある。
【0035】
なお、配列表には、規則により、二本鎖核酸であってもそのうちの一本鎖(ポリペプチドをコードする核酸ではセンス鎖)のみを記載することになっている。このため、二本鎖核酸の場合には、配列表に現実に記載されている配列は一本鎖であっても、実際にはその相補鎖も配列表に記載されていると解することができる。したがって、本願明細書においても、ある配列番号で表される塩基配列を含むもしくはこれからなる核酸が二本鎖核酸である場合または二本鎖核酸であってもよい場合には、その配列番号で表される塩基配列は、文脈上そうでないことが明らかな場合を除き、その相補鎖をも包含するものとする。例えば、「配列番号:1で表される塩基配列を含む核酸とハイブリダイズする核酸」とは、配列番号:1に現実に記載されているセンス鎖にハイブリダイズする核酸のほか、当該センス鎖に相補的な塩基配列からなるアンチセンス鎖にハイブリダイズする核酸をも意味するのである。
【0036】
配列番号:1のmRNAを配列番号:2のmRNAと識別して測定することは、当業者にとって容易であり、種々の方法により可能である。例えば、エキソンSV内とエキソン3以降の領域にプライマーを設定して逆転写PCR(RT−PCR)をおこない、増幅産物の分子量に基づいて、そのmRNAがOATP1B3/wtか選択的スプライシングバリアント(例えば、OATP1B3/ct)かを識別してmRNAを測定することができる。また、得られた増幅産物について塩基配列を決定してもよい(ダイレクトシークエンス)。
【0037】
配列番号:1のmRNAには、上述したように、OATP1B3/wtには存在しないエキソンであるエキソンSVが存在する。このため、このエキソンSVの存在を指標として選択的スプライシングバリアントを測定することができる。すなわち、配列番号:1で表される塩基配列におけるエキソンSVの存在を指標として、配列番号:1で表される塩基配列を含む選択的スプライシングバリアントを測定することができる。
【0038】
エキソンSVの存在を指標として選択的スプライシングバリアントを測定する好ましい方法としては、エキソンSVを含む領域にハイブリダイズするプライマーを用いた核酸増幅法を用いる方法や、エキソンSVを含む領域にハイブリダイズするプローブを用いる方法を挙げることができる。
【0039】
核酸増幅法を用いる方法には、エキソンSVを含む領域に設定したプライマーを一方のプライマーとして用いる核酸増幅法により配列番号:1で表される塩基配列を含むmRNAまたはそのcDNAの部分領域を特異的に増幅し、増幅産物を測定することを含む。ここで、「領域に設定した」とは、その領域とハイブリダイズするという意味であり、また、PCRのような核酸増幅法により増幅される核酸は二本鎖であるから、上述したように、配列表に現実に記載されているセンス鎖にハイブリダイズするプライマー(リバース側プライマー)を用いる場合と、当該センス鎖に相補的なアンチセンス鎖にハイブリダイズするプライマー(フォワード側プライマー)を用いる場合の両者が包含される。したがって、例えば、「エキソンSVを含む領域に設定したプライマー」とは、配列番号:1に現実に記載されたセンス鎖のエキソンSVを含む領域(つまり、1nt〜139nt)にハイブリダイズするプライマー(リバース側プライマー)または当該プライマーに相補的な塩基配列を有するプライマー(フォワード側プライマー)を意味する。また、「特異的に増幅する」とは、配列番号:1で表される塩基配列を含むmRNAまたはそのcDNAの部分領域は増幅されるが、配列番号:2で表される塩基配列を含むmRNAまたはそのcDNAの部分領域は増幅されないことを意味する。なお、配列番号:1で表される塩基配列において、1nt〜139ntがエキソンSVであり、エキソン3は140ntから始まる。したがって、配列番号:1で表される塩基配列において、139ntと140ntとの融合点は、OATP1B3/wtには存在しないエキソンSVとエキソン3との特異的融合点である。ただし、図1からも明らかなように、上記特異的融合点の上流側2塩基は、OATP1B3/wtとOATP1B3/ctとで共通している。したがって、配列番号:1で表される塩基配列における139ntと140ntとの融合点よりも、これに最も近接した他の特異的融合点である137ntと138ntとの融合点が、エキソンSVとエキソン3との特異的融合点としてより適切である。このことから、本明細書において、「エキソンSVを含む領域」としては、1nt〜137ntがより好ましい。
【0040】
テンプレートとなるmRNAの部分領域と同じ塩基配列(ただしuはtになる)を有するDNAを増幅する核酸増幅法の好ましい例として、逆転写PCR(RT−PCR)が挙げられる。RT−PCRでは、細胞からmRNAを常法により抽出し、逆転写酵素の作用によりmRNAをテンプレートとして第一鎖cDNAを生成させ、さらにこの第一鎖cDNAをテンプレートとして相補鎖を生成させて、二本鎖cDNAを得る。次いで、得られた二本鎖cDNAをテンプレートとしてPCRをおこない、該cDNAまたはその部分領域を増幅する。RT−PCR自体は周知の技術であり、そのためのキットや装置も市販されているため、容易に実施することができる。選択的スプライシングバリアント由来のcDNAを特異的に増幅するために、上述した特異的融合点を含む領域に設定したプライマーを一方のプライマーとして用いる。他方のプライマーは、増幅すべきスプライシングバリアントの任意の領域に設定することができる。なお、プライマーのサイズは特に限定されないが、通常15〜35塩基程度であり、好ましくは15〜25塩基程度である。
【0041】
例えば、配列番号:1のmRNAをRT−PCRにより測定する場合、配列番号:1で表される塩基配列中のエクソンSVを含む領域に設定したプライマーを一方のプライマー(フォワード側プライマーでもリバース側プライマーでもよい)として用いる。ここで、選択的スプライシングバリアント由来のcDNAを特異的に増幅するためには、プライマーとして、ストリンジェントな条件下で、配列番号:1のcDNAにはハイブリダイズするが、配列番号:2のcDNAにはハイブリダイズしないものを用いることが好ましい。ここで「ストリンジェントな条件」とは、プライマーがcDNAに対して特異的にハイブリダイゼーションする条件をいい、例えば成書に記載の条件(サムブルック(Sambrook)ら編、「モレキュラークローニング,ア ラボラトリーマニュアル 第2版」、1989年、コールドスプリングハーバーラボラトリー、特に11.45節“Conditions for Hybridization of Oligonucleotide probes”等)にしたがって決定でき、特に制限されない。ストリンジェントな条件は、塩濃度、温度、およびその他の条件によって決まり、例えば、塩濃度が低いほど、温度が高いほど、ストリンジェンシーは高くなり、プライマーとcDNAとがハイブリダイゼーションしにくくなる。塩濃度は、一般に、SSC溶液(NaCl+クエン酸三ナトリウム)の濃度を調節することによって調節され、ストリンジェントな塩濃度は、例えば、NaCl約250mM以下およびクエン酸三ナトリウム約25mM以下である。ストリンジェントな温度は、一般に、完全ハイブリッドの融解温度(Tm)より15〜25℃低い温度であり、例えば、約30℃以上である。溶液に有機溶媒(例えばホルムアミド)を加えることにより、温度を下げることができる。その他の条件としては、ハイブリダイゼーション時間、洗浄剤(例えば、SDS)の濃度、およびキャリアーDNAの存否等であり、これらの条件を組み合わせることによって、様々なストリンジェンシーを設定することができる。好ましい例として、250mM NaCl、25mM クエン酸三ナトリウム、1% SDS、50% ホルムアミド、200μg/mLの変性サケ精子DNAの条件で、42℃の温度によりハイブリダイゼーションをおこなう。また、ハイブリダイゼーション後の洗浄の条件もストリンジェンシーに影響する。この洗浄条件もまた、塩濃度および温度によって定義され、塩濃度の減少と温度の上昇によって洗浄のストリンジェンシーは増加する。好ましい例として、15mM NaCl、1.5mM クエン酸三ナトリウムおよび0.1% SDSの条件で、68℃の温度にて洗浄をおこなう。
【0042】
配列番号:1のcDNAにはハイブリダイズするが、配列番号:2のcDNAにはハイブリダイズしないことを確保するために、ストリンジェントな条件下で、プライマーの20%以上がエキソンSVを含む領域とハイブリダイズするものであることが好ましい。あるいは、ストリンジェントな条件下でも配列番号:2のcDNAとハイブリダイズした場合には、プライマーの3’末端がミスマッチとなるプライマーを用いることが好ましい。たとえストリンジェントな条件下で配列番号:2のcDNAとハイブリダイズしても、プライマーの3’末端がミスマッチであれば増幅は実質的に起きない。さらには、その少なくとも20%以上がエキソンSV内の領域とストリンジェントな条件下でハイブリダイズするものであって、かつ、その3’末端が配列番号:2のcDNAとはミスマッチになるプライマーを用いることが特に好ましい。以上のようなプライマーを一方のプライマーとして用いることにより、配列番号:2のcDNAの共存下であっても、配列番号:1のcDNAのみを特異的に増幅することができる。なお、プライマーとしては、プライマーがハイブリダイズする配列番号:1の塩基配列中の領域と完全に相補的なものが好ましいが、通常、10%以下程度のミスマッチがあってもプライマーとして利用できる場合が多い(ただし、上述したようにプライマーの3’末端がミスマッチとなるものは除く)。
【0043】
PCR自体は常法に従っておこなうことができる。そして、PCRによる増幅後に、増幅産物を測定する。かような増幅産物の測定も、常法によりおこなうことができる。上述したように、本発明における「測定」には、検出および定量の両者が包含される。さらに、増幅産物の電気泳動バンドの蛍光強度測定や、太さの目視判定のような、簡易定量または半定量も「測定」の概念に包含される。増幅産物の測定は、例えば増幅産物を電気泳動にかけ、増幅バンドを検出することによりおこなうことができる。また、蛍光標識したヌクレオチド三リン酸の存在下にPCRをおこなうことによって増幅産物を蛍光標識し、増幅バンドの蛍光強度を測定することによっても、増幅産物の測定をおこなうことができる。さらに、電気泳動パターンをナイロンやニトロセルロースからなるメンブレンに転写し、増幅産物にハイブリダイズする標識プローブをハイブリダイズさせて、標識を検出または定量する(PCR−サザン(Southern)法)によってもおこなうことができる。さらには、増幅産物にハイブリダイズするプローブを固相化し、上記増幅工程を標識ヌクレオチド三リン酸の存在下におこない、固相化プローブに増幅産物を結合させ、固相に結合された増幅産物を測定することによってもおこなうことができる。これらはいずれも常法であり、周知の知見が適宜参照されうる。
【0044】
あるいは、上述したRT−PCRのPCRを、リアルタイム検出PCRによりおこなうと、より正確に増幅産物を定量することができるため、好ましい。リアルタイム検出PCRでは、通常のPCRを、増幅産物にハイブリダイズする2種類の蛍光色素を結合したプローブの存在下でおこなう。2種類の蛍光色素の一方は、他方の蛍光色素からの蛍光発光を打ち消すクエンチャー色素であり、2種類の蛍光色素が同一のプローブ分子に結合されている状態では蛍光は測定されない。これに対し、PCRにより増幅が起きると、まず、プローブが増幅産物にハイブリダイズする。そして、増幅に用いられるDNAポリメラーゼのエキソヌクレアーゼ活性によりプローブが消化されて2種類の蛍光色素がバラバラになると、クエンチャー色素による消光が起きないので蛍光が測定されるようになるのである。測定される蛍光強度が急激に大きくなるサイクル数が、試料中の核酸テンプレートの濃度に依存して変化することから、連続的に反応溶液の蛍光を測定することにより試料中の鋳型核酸の濃度を定量することができる。なお、リアルタイム検出PCR自体は周知の技術であり、そのためのキットも市販されているため、この市販のキットを用いて容易に実施することができる。
【0045】
なお、RT−PCRをおこなう場合、最初のmRNAの抽出時に混入するゲノムDNAに含まれる偽遺伝子を鋳型とする増幅が起きる場合がある。従って、用いるプライマーセットは、このような偽遺伝子に起因する増幅が起きないプライマーを選択したセットであることが好ましい。偽遺伝子に起因する増幅が起きるか否かは、例えば、そのプライマーセットを用い、ゲノムDNAをテンプレートとしてPCRをおこなった場合に、cDNAを鋳型としてPCRをおこなった場合と同じサイズの増幅産物のみが生成するか否かにより判定することができる。後述する実施例で具体的に用いられているプライマーセット(表3)は、このような偽遺伝子による増幅が起きないものである。また、場合によっては、RT−PCRをおこなう前に、用いる予定のRNAをテンプレートとして、ヒトグリセルアルデヒド−3−デヒドロゲナーゼ(GAPDH)などのハウスキーピング遺伝子を増幅するプライマーセット(例えば、表1に記載のもの)を用いたPCRをおこない、増幅産物が得られないことを確認することによっても、ゲノムDNAの混入がないことが保証されうる。
【0046】
以上、本発明の測定方法をRT−PCR法によりおこなう場合を例に挙げて詳細に説明したが、本発明の測定方法は、上述したプライマーを用いて選択的スプライシングバリアントのmRNAもしくはcDNAまたはその部分領域の増幅をおこなう方法であれば、RT−PCR法によりおこなわれるものに限定されず、他のいずれの核酸増幅法を利用するものであってもよい。例えば、NASBA法(3SR法、TMA法)によりmRNAを増幅することもできる。NASBA法では、リバース側プライマーの5’末端にT7プロモーター配列を付加したものをリバース側プライマーとして、AMT−RT等の逆転写酵素の存在下で、mRNAをテンプレートとしてcDNA鎖(アンチセンス鎖)を形成する。得られたRNA/DNA二本鎖ハイブリッドのRNA鎖をRNaseHにより分解して一本鎖cDNA(アンチセンス鎖)とする。次に、この一本鎖cDNAをテンプレートとし、フォワード側プライマーを用いてDNAポリメラーゼ(逆転写酵素としてAMT−RTを用いる場合には、AMT−RTがDNAポリメラーゼ活性を有するため、これで兼用する)の存在下で相補鎖を形成して、二本鎖cDNAとする。この二本鎖cDNAは、T7プロモーター配列を含んでいることから、これにT7 RNAポリメラーゼを作用させると、転写によりRNA(アンチセンス鎖)が次々に形成される。さらに、形成された二本鎖cDNAについて、変性工程、上記フォワード側プライマー及びリバース側プライマーとのアニーリング工程、相補鎖の伸長工程を繰り返すことにより、二本鎖cDNAが増幅され、これを鋳型とした転写によってさらにRNA(アンチセンス鎖)が形成される。このようなNASBA法においても、一方のプライマーとして、上記したプライマーを用いることにより、選択的スプライシングバリアントのみを増幅することができる(ただし、生成物は上記の通りアンチセンス鎖である)。なお、NASBA法自体は周知の技術であり、このためのキットも市販されているため、この市販のキットを用いて容易に実施することができる。
【0047】
エキソンSVの存在を指標として選択的スプライシングバリアントを測定する他の好ましい方法としては、このエキソンSVを含む領域にストリンジェントな条件下でハイブリダイズするプローブを用いる方法がある(in situハイブリダイゼーション法)。プローブとしては、ストリンジェントな条件下で、配列番号:1で表される塩基配列を有する核酸中のエキソンSVの領域にハイブリダイズするが、配列番号:2で表される塩基配列を有する核酸にはハイブリダイズしないものが用いられる。このような特異性を確保するために、プローブの全長の20〜80%、より好ましくは40〜60%がエキソンSV領域にストリンジェントな条件下でハイブリダイズし、残りが隣接するエキソン3領域にストリンジェントな条件下でハイブリダイズするものであることが好ましい。プローブのサイズは、特に限定されないが、オリゴヌクレオチドの場合、通常、10塩基〜全長であり、10塩基〜100塩基程度が好ましく、さらに好ましくは15塩基〜35塩基程度であり、cRNAやcDNAの場合、通常、300塩基〜800塩基程度である。また、プライマーの場合と同様、プローブがハイブリダイズする領域と完全に同一の塩基配列を有することが最も好ましいが、プローブ全長の10%以下の塩基が置換していてもよい。
【0048】
プローブは、上記核酸に蛍光標識、ビオチン標識、放射標識、酵素標識等の周知の標識を結合して標識プローブとすることもできる。また、プローブは、例えば固相化プローブとして用いる場合に、固相に結合させる領域や、分枝プローブにおける標識を結合させるための分枝のような、被検核酸とは無関係な任意の核酸が結合されたものであってもよい。
【0049】
プローブは、被検試料中に含まれる選択的スプライシングバリアントのmRNAの直接的な測定に用いることもできるし、mRNAをRT−PCR等の核酸増幅法で増幅した後、増幅された増幅核酸を測定する目的にも用いることができる。増幅産物をプローブで特異的に測定する場合、核酸増幅には、エキソンSVが増幅産物中に含まれるようにプライマーを設定する。この場合のプライマーは、選択的スプライシングバリアントに特異的なものである必要はなく、測定の特異性はプローブにより確保される。
【0050】
本発明はまた、配列番号:1で表される塩基配列を含む核酸とはハイブリダイズするが、配列番号:2で表される塩基配列を含む核酸が共存していても当該核酸とはハイブリダイズしない核酸、または、配列番号:2で表される塩基配列を含む核酸とハイブリダイズした場合にその3’末端がミスマッチとなる核酸をも提供する。このような核酸は、上述したプライマーやプローブとして用いることができる。このような核酸としては、配列番号:1で表される塩基配列におけるエキソンSVを含む領域とハイブリダイズするが、配列番号:2で表される塩基配列を含む核酸が共存していても当該核酸とはハイブリダイズしない核酸、または、配列番号:2で表される塩基配列を含む核酸とハイブリダイズした場合にその3’末端がミスマッチとなる核酸が、選択的スプライシングバリアントの特異的な測定のためには好ましい。このような本発明の核酸は、塩基数が10以上であることが好ましく、特に塩基数が15〜35であることが好ましい。また、本発明の核酸は、配列番号:1で表される塩基配列またはその部分領域と同じ塩基配列または当該塩基配列のうち10%以下の塩基が置換した塩基配列を有することが好ましく、特に配列番号:1で表される塩基配列またはその部分領域と同じ塩基配列をからなることが好ましい。
【0051】
このような本発明の核酸は、核酸増幅法のプライマーやプローブ等の、選択的スプライシングバリアントの測定用核酸として用いられうる。
【0052】
さらに、本発明は、上述した本発明の測定用核酸を含む、OATP1B3 mRNAの選択的スプライシングバリアントの測定用キットをも提供する。キットに含まれる試薬類は、本発明の測定用核酸以外は周知のものであってよく、例えば、プライマーセットのほか、逆転写酵素、Taq DNAポリメラーゼ、dNTP、ランダムプライマー、RNase阻害剤、緩衝液等を含めて測定用キットにすることができる。あるいは、キットは、フォワード側プライマーおよびリバース側プライマーのみからなるプライマーセットとし、他の試薬類は、市販のRT−PCR用キット等を利用するようにしてもよい。
【0053】
上述した選択的スプライシングバリアントは、がんマーカーとして利用することができる。すなわち、本発明により提供される選択的スプライシングバリアントは、がん細胞・組織において特異的に強く発現することが判明している。よって、本発明により提供される測定方法や測定用キットは、がんの検出に利用することができる。この際、検出対象とされるがんの種類は特に制限されず、例えば、大腸がん、膵臓がん、乳がん、肺がん、前立腺がん、食道がん、胃がん、肝臓がん、胆道がん、脾臓がん、腎がん、膀胱がん、子宮がん、卵巣がん、精巣がん、甲状腺がん、脳腫瘍、造血器腫瘍などの検出に利用されうる。特に、後述する実施例に記載のように、OATP1B3/ctは、ヒト大腸がん組織に加えて、ヒトの大腸がん由来の細胞(LS180、HCT116)およびヒトの膵臓がん由来の細胞(PK45p)にも強く発現していることが確認されている。これに対し、ヒト正常大腸由来の組織にはOATP1B3/ctの発現が確認されなかったことから、本発明により提供される選択的スプライシングバリアントは、大腸がんおよび膵臓がんのマーカーとして特に有用である。
【0054】
本発明の他の形態によれば、がんの予防および/または治療剤のスクリーニング方法が提供される。このスクリーニング方法は、まず、がん細胞を被検物質の存在下で培養する。そして、得られる培養細胞において、上述した本発明の選択的スプライシングバリアントを測定する。次いで、得られた測定結果を、上記被検物質の非存在下における場合と比較および/または評価する。
【0055】
具体的には、上述した各種がん由来のがん細胞株を、抗がん剤、抗がん候補物質、低分子化合物、天然有機高分子物質、天然の動植物の抽出物、ペプチドなどの被検物質の存在下で培養し、当該培養細胞における本発明の選択的スプライシングバリアントを測定(検出、半定量、または定量)し、選択的スプライシングバリアントの形態が、被検物質の非存在下における場合と比べて有意に減少しているときに、被検物質は上記細胞株が由来とするがんの予防および/または治療剤として有用である可能性があると判断する。
【0056】
本発明のスクリーニング方法において、ヒト大腸がん由来の細胞株(例えば、LS180やHCT116)を用いることで、ヒト大腸がんの予防および/または治療剤のスクリーニングをおこなうことができる。同様に、ヒト膵臓がん由来の細胞株(例えば、PK45p)を用いることで、ヒト膵臓がんの予防および/または治療剤のスクリーニングをおこなうことができる。その他の周知のがん・腫瘍由来の細胞株についても、同様に用いることで各種がん・腫瘍の予防および/または治療剤のスクリーニングをおこなうことが可能である。
【0057】
また、本発明のスクリーニング方法において、選択的スプライシングバリアントを測定する方法としては、上述した本発明の測定方法や測定用キットが同様に用いられうる。よって、ここでは詳細な説明を省略する。
【0058】
本発明者らの検討によれば、OATP1B3/ct mRNAから少なくとも4種のポリペプチドが発現しうることが判明した。具体的には、配列番号:5、配列番号:7、配列番号:9、および配列番号:11のそれぞれで表されるアミノ酸配列からなるポリペプチドが、OATP1B3/ct mRNAから発現しうることが確認された。これらのポリペプチドは、OATP1B3/wt mRNAからは理論上発現できず、OATP1B3/ct mRNAに特異的なものである。このため、これらのポリペプチドは、OATP1B3/ct mRNAと同様にがんマーカーとしての有用性を有するものである。
【0059】
上記の観点から、本発明の他の形態によれば、
(1)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列からなるポリペプチド;および、
(2)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド、あるいは、配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列において、10%以下のアミノ酸が置換、欠失、および/または挿入されたアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド(以下、「機能的等価改変体」とも称する);および、
が提供される。
【0060】
「(2)機能的等価改変体」としては、「配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド」、あるいは、「配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列において、0〜10%、好ましくは0〜7%、さらに好ましくは0〜5%、特に好ましくは0〜2%のアミノ酸が置換、欠失、および/または挿入されたアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド」が含まれる。
【0061】
「がん細胞またはがん組織において発現が増強する」とは、非がん細胞または非がん組織と比較してがん細胞またはがん組織において発現が2倍以上増強することを意味する。
【0062】
以上、本形態のポリペプチドについて説明したが、配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列からなるポリペプチド、および上記機能的等価改変体を総称して、以下、「本発明のポリペプチド」とも称する。また、「本発明のポリペプチド」のうち、配列番号:5で表されるアミノ酸配列からなるポリペプチドを「f1−1」、配列番号:7で表されるアミノ酸配列からなるポリペプチドを「f1−2」、配列番号:9で表されるアミノ酸配列からなるポリペプチドを「f2」、配列番号:11で表されるアミノ酸配列からなるポリペプチドを「f3」とそれぞれ称する。
【0063】
本発明のポリペプチドとしては、f1−1またはf3が特に好ましい。
【0064】
本発明のさらに他の形態によれば、本発明のポリペプチドをコードする核酸もまた、提供される。
【0065】
ここで、本発明のポリペプチドであるf1−1をコードする塩基配列からなる核酸は、配列番号:5で表されるアミノ酸配列からなるf1−1、またはその機能的等価改変体をコードする塩基配列であれば特に制限はない。好ましくは、配列番号:5で表されるアミノ酸配列をコードする塩基配列からなる核酸であり、さらに好ましくは、配列番号:4で表される塩基配列からなる核酸である。
【0066】
同様に、本発明のポリペプチドであるf1−2をコードする塩基配列からなる核酸は、配列番号:7で表されるアミノ酸配列からなるf1−2、またはその機能的等価改変体をコードする塩基配列であれば特に制限はない。好ましくは、配列番号:7で表されるアミノ酸配列をコードする塩基配列からなる核酸であり、さらに好ましくは、配列番号:6で表される塩基配列からなる核酸である。
【0067】
また、本発明のポリペプチドであるf2をコードする塩基配列からなる核酸は、配列番号:9で表されるアミノ酸配列からなるf2、またはその機能的等価改変体をコードする塩基配列であれば特に制限はない。好ましくは、配列番号:9で表されるアミノ酸配列をコードする塩基配列からなる核酸であり、さらに好ましくは、配列番号:8で表される塩基配列からなる核酸である。
【0068】
さらに、本発明のポリペプチドであるf3をコードする塩基配列からなる核酸は、配列番号:11で表されるアミノ酸配列からなるf3、またはその機能的等価改変体をコードする塩基配列であれば特に制限はない。好ましくは、配列番号:11で表されるアミノ酸配列をコードする塩基配列からなる核酸であり、さらに好ましくは、配列番号:10で表される塩基配列からなる核酸である。
【0069】
また、本発明のさらに他の形態によれば、上記核酸を含む発現ベクター、当該発現ベクターで形質転換された細胞もまた、提供される。
【0070】
本発明の発現ベクターや細胞は、従来公知の知見を参照することにより作製することができる。例えば、単離された本発明の核酸を、適当なベクターDNAに再び組込むことにより、真核生物または原核生物の宿主細胞を形質転換させることができる。また、これらのベクターに適当なプロモーターおよび形質発現に関連する配列を導入することにより、それぞれの宿主細胞において核酸を発現させることが可能である。
【0071】
本発明の発現ベクターは、本発明の核酸を含む限り、特に限定されるものではなく、例えば、用いる宿主細胞に応じて適宜選択した公知の発現ベクターに、本発明の核酸を挿入することにより得られる発現ベクターを挙げることができる。
【0072】
また、本発明の細胞も、本発明の発現ベクターでトランスフェクションされ、本発明の核酸を含む限り、特に限定されるものではなく、例えば、本発明の核酸が、宿主細胞の染色体に組み込まれた細胞であってもよいし、あるいは、本発明の核酸を含む発現ベクターの形で含有する細胞であってもよい。また、本発明のポリペプチドを発現している細胞であってもよいし、あるいは、本発明のポリペプチドを発現していない細胞であってもよい。本発明の細胞は、例えば、本発明の発現ベクターにより、所望の宿主細胞をトランスフェクションすることにより得ることができる。
【0073】
上記で得られる所望の細胞は、常法に従い培養することができ、該培養により本発明のポリペプチドが生産される。該培養に用いられる培地としては、採用した宿主細胞に応じて慣用される各種のものが適宜選択されうる。
【0074】
上記により、形質転換細胞に生産される本発明のポリペプチドは、その物理的性質や生化学的性質等を利用した各種の公知の分離操作法により、分離・精製することができる。
【0075】
本発明のポリペプチドは、マーカー配列とインフレームで融合して発現させることで、その発現の確認、精製等が可能になる。マーカー配列としては、例えば、FLAG epitope、Hexa−Histidine tag、Hemagglutinin tag、myc epitopeなどがある。また、マーカー配列とポリペプチドとの間にエンテロキナーゼ、ファクターXa、トロンビンなどのプロテアーゼが認識する特異的なアミノ酸配列を挿入することにより、マーカー配列部分をこれらのプロテアーゼにより切断除去することも可能である。
【0076】
本発明の核酸は、それ自体、またはその一部をがんの検出方法においてハイブリダイズプローブとして用いることができ、がんの検出に有用である。また、本発明のポリペプチドは、本発明のポリペプチドを特異的に認識する抗体の作製や、発現レベルを検出・定量する際のコントロールとして用いることができる。
【0077】
本発明によれば、本発明のポリペプチドに結合する抗体(以下、「本発明の抗体」とも称する)もまた、提供されうる。本発明の抗体の製造方法は、特に限定されるものではない。本発明の抗体(例えば、ポリクローナル抗体、モノクローナル抗体)は、例えば、各種動物に配列番号:5で表されるアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド、配列番号:5で表されるアミノ酸配列において1または数個のアミノ酸が置換、欠失、および/または挿入されたアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド、あるいは、配列番号:5で表されるアミノ酸配列からなるポリペプチドの全部またはその断片を直接投与することにより、得ることができる。また、前記ポリペプチドをコードする遺伝子を導入したプラスミドを用いてDNAワクチン法(Raz,E.et al.,Proc.Natl.Acad.Sci.USA,91,9519−9523,1994;Donnelly,J.J.et al.,J.Infect.Dis.,173,314−320,1996)によっても得ることができる。
【0078】
ポリクローナル抗体は前記ポリペプチドまたはその断片をフロイント完全アジュバントなどの適当なアジュバントに乳濁し、腹腔、皮下または静脈等に免疫して感作した動物、例えばウサギ、ラット、ヤギ、またはニワトリ等の血清または卵から製造される。このように製造されたポリクローナル抗体は常法のタンパク質単離精製法により、分離精製することができ、常法のタンパク質単離精製法としては例えば、遠心分離、透析、硫酸アンモニウムによる塩析、DEAE−セルロース、ハイドロキシアパタイト、プロテインAアガロース等によるクロマトグラフィー法が挙げられる。
【0079】
モノクローナル抗体は、ケーラーとミルスタインの細胞融合法(Kohler,G.and Milstein,C.,Nature,256,495−497,1975)により当業者が容易に製造することが可能である。
【0080】
本発明のさらに他の形態によれば、配列番号4、配列番号6、配列番号8、または配列番号10で表される塩基配列を含む核酸とストリンジェントな条件下でハイブリダイズし、少なくとも15塩基を有する核酸もまた、提供される。なお、「ストリンジェントな条件」については上述した通りである。このような核酸は、本発明の核酸を検出、単離するためのプローブとして、また、本発明の核酸を増幅するためのプライマーとして利用することが可能である。プライマーとして用いる場合には、通常、15bp〜100bp、好ましくは15bp〜40bpの鎖長を有する。プライマーとして好ましい塩基配列は、後述する実施例の「9.緑色蛍光タンパク質(GFP)融合ctOATP1B3ペプチド発現プラスミドの作製」においてf1−1、f1−2、f2およびf3のそれぞれを増幅するのに用いられているプライマーの塩基配列が挙げられる。また、プローブとして用いる場合には、本発明の核酸の一部もしくは全部の配列(またはその相補配列)を有し、少なくとも15bpの鎖長のDNAが用いられる。
【0081】
上記核酸を用いたプローブやプライマーは、がんの検出に利用することができる。
【0082】
なお、本発明に基づいて、本発明の核酸の塩基配列またはその断片を含むオリゴヌクレオチドプローブのアレイを構築することもできる。アレイ技法は公知で、遺伝子発現を解析するために用いられている(Chee,M.et al.(1996)Science,.274,610−613)。
【0083】
本発明のポリペプチドは、がんの検出方法にも適用されうる。すなわち、本発明の他の形態によれば、生体から分離した被検試料中の、本発明のポリペプチドの量を測定することを含む、がんの検出方法が提供される。この際、上述した本発明の抗体を測定に用いることが好ましい。また、当該抗体を含む、がんの検出用キットも提供されうる。以下、この形態について、より詳細に説明する。
【0084】
被検試料中の、本発明のポリペプチドの検出は、例えば、被検試料を各種の分子量測定法、例えば、ゲル電気泳動や、各種の分離精製法(例:イオン交換クロマトグラフィー、疎水性クロマトグラフィー、アフィニティークロマトグラフィー、逆相クロマトグラフィーなど)、イオン化法(例:電子衝撃イオン化法、フィールドディソープション法、二次イオン化法、高速原子衝突法、マトリックス支援レーザー脱離イオン化(MALDI)法、エレクトロスプレーイオン化法など)、質量分析計(例:二重収束質量分析計、四重極型分析計、飛行時間型質量分析計、フーリエ変換質量分析計、イオンサイクロトロン質量分析計など)を組み合わせる方法等に供し、本発明のポリペプチドの分子量と一致するバンドもしくはスポット、またはピークを検出することによりおこなうことができるが、これらに限定されない。本発明のポリペプチドはアミノ酸配列が既知であることから、当該アミノ酸配列を認識する抗体を作製して、ウエスタンブロッティングや各種イムノアッセイにより本発明のポリペプチドを検出する方法が、より好ましく用いられうる。なお、当該抗体の作製方法については、上述した通りである。本発明の抗体を用いて本発明のポリペプチドを検出する方法は、最適化されたイムノアッセイ系を構築してこれをキット化すれば、質量分析装置のような特殊な装置を使用することなく、高感度かつ高精度に本発明のポリペプチドを検出することができる点で、特に有用である。
【0085】
本発明の抗体を用いる本発明のがんの検出方法は、特に制限されないが、被検試料中の抗原量に対応した抗体、抗原または抗体−抗原複合体の量を化学的または物理的手段により検出し、これを既知量の抗原を含む標準液を用いて作製した標準曲線より算出する測定法であれば、いずれの測定法を用いてもよい。例えば、ネフロメトリー、競合法、イムノメトリック法およびサンドイッチ法等が好適に用いられる。
【0086】
標識物質を用いる測定法に用いられる標識剤としては、例えば、放射性同位元素、酵素、蛍光物質、発光物質などが用いられる。放射性同位元素としては、例えば、〔125I〕、〔131I〕、〔3H〕、〔14C〕などが用いられる。上記酵素としては、安定で比活性の大きなものが好ましく、例えば、β-ガラクトシダーゼ、β-グルコシダーゼ、アルカリフォスファターゼ、パーオキシダーゼ、リンゴ酸脱水素酵素などが用いられる。蛍光物質としては、例えば、フルオレスカミン、フルオレセインイソチオシアネートなどが用いられる。発光物質としては、例えば、ルミノール、ルミノール誘導体、ルシフェリン、ルシゲニンなどが用いられる。さらに、抗体あるいは抗原と標識剤との結合にビオチン-アビジン系を用いることもできる。
【0087】
抗原または抗体の不溶化に当っては、物理吸着を用いてもよく、また通常タンパク質あるいは酵素等を不溶化、固定化するのに用いられる化学結合を用いる方法でもよい。担体としては、アガロース、デキストラン、セルロースなどの不溶性多糖類、ポリスチレン、ポリアクリルアミド、シリコン等の合成樹脂、またはガラス等が挙げられる。
【0088】
サンドイッチ法においては、不溶化した本発明の抗体に被検試料を反応させ(1次反応)、さらに標識化した別の本発明の抗体を反応させ(2次反応)た後、不溶化担体上の標識剤の量(活性)を測定することにより、被検試料中の本発明のペプチド量を定量することができる。1次反応と2次反応は逆の順序におこなっても、また、同時におこなってもよいし時間をずらしておこなってもよい。
【0089】
本発明のポリペプチドに対するモノクローナル抗体を、サンドイッチ法以外の測定システム、例えば、競合法、イムノメトリック法あるいはネフロメトリーなどに用いることもできる。
【0090】
競合法では、被検試料中の抗原と標識抗原とを抗体に対して競合的に反応させた後、未反応の標識抗原(F)と、抗体と結合した標識抗原(B)とを分離し(B/F分離)、B/Fいずれかの標識量を測定し、被検試料中の抗原量を定量する。本反応法には、抗体として可溶性抗体を用い、B/F分離をポリエチレングリコール、前記抗体に対する第2抗体などを用いる液相法、および、第1抗体として固相化抗体を用いるか、あるいは、第1抗体は可溶性のものを用い第2抗体として固相化抗体を用いる固相化法とが用いられる。
【0091】
イムノメトリック法では、被検試料の抗原と固相化抗原とを一定量の標識化抗体に対して競合反応させた後固相と液相を分離するか、または、被検試料中の抗原と過剰量の標識化抗体とを反応させ、次に固相化抗原を加え未反応の標識化抗体を固相に結合させた後、固相と液相を分離する。次に、いずれかの相の標識量を測定し被検試料中の抗原量を定量する。
【0092】
また、ネフロメトリーでは、ゲル内または溶液中で抗原抗体反応の結果生じた不溶性の沈降物の量を測定する。被検試料中の抗原量が僅かであり、少量の沈降物しか得られない場合にもレーザーの散乱を利用するレーザーネフロメトリーなどが好適に用いられる。
【0093】
これら個々の免疫学的測定法を本発明の検出方法に適用するにあたっては、特別の条件、操作等の設定は必要とされない。それぞれの方法における通常の条件、操作法に当業者の通常の技術的配慮を加えて本発明のポリペプチドの測定系を構築すればよい。これらの一般的な技術手段の詳細については、総説、成書などを参照することができる。
例えば、入江 寛編「ラジオイムノアッセイ」(講談社、昭和49年発行)、入江 寛編「続ラジオイムノアッセイ」(講談社、昭和54年発行)、石川栄治ら編「酵素免疫測定法」(医学書院、昭和53年発行)、石川栄治ら編「酵素免疫測定法」(第2版)(医学書院、昭和57年発行)、石川栄治ら編「酵素免疫測定法」(第3版)(医学書院、昭和62年発行)、「Methods in ENZYMOLOGY」 Vol. 70 (Immunochemical Techniques (Part A))、同書 Vol. 73 (Immunochemical Techniques (Part B))、同書 Vol. 74 (Immunochemical Techniques (Part C))、同書 Vol. 84 (Immunochemical Techniques (Part D: Selected Immunoassays))、同書 Vol. 92 (Immunochemical Techniques (Part E: Monoclonal Antibodies and General Immunoassay Methods))、同書 Vol. 121 (Immunochemical Techniques (Part I: HybridomaTechnology and Monoclonal Antibodies))(以上、アカデミックプレス社発行)などを参照することができる。
【0094】
あるいは、本発明の抗体を用いる別の本発明の検出方法として、当該抗体を上述したような質量分析計に適合しうるプローブの表面上に固定化し、当該プローブ上の当該抗体に被検試料を接触させ、当該抗体に捕捉された生体試料成分を質量分析にかけ、当該抗体が認識するマーカーペプチドの分子量に相当するピークを検出する方法が挙げられる。
【0095】
上記のいずれかの方法により、被検試料において、本発明のポリペプチドが、コントロール試料におけるレベルと統計学的に有意な差をもって検出された場合には、被検試料中にがん細胞またはがん組織が含まれている可能性が高いと診断することができる。
【0096】
本発明のさらに他の形態では、医薬が提供される。当該医薬は、上述した本発明のポリペプチドもしくはその断片、または本発明の核酸もしくはその断片を含み、特異的な細胞傷害性T細胞(CTL)を誘導するためのものである。当該医薬は、好ましくはがんワクチンである。以下、この形態について、より詳細に説明する。
【0097】
本発明の医薬が本発明のポリペプチドまたはその断片を含む場合、当該ポリペプチドまたはその断片は、HLAと結合して特異的な細胞傷害性T細胞(CTL)を誘導しうるものである必要がある。この観点から、当該ポリペプチドまたはその断片は、本発明のポリペプチドにおける連続する8〜11個のアミノ酸残基からなることが好ましい。なお、特異的なCTLを誘導するポリペプチドの断片は、本技術分野における公知の知見を参照して容易に作製することができる。
【0098】
「HLAと結合して特異的なCTLを誘導しうる」とは、本発明のポリペプチドもしくはその断片、または本発明の核酸もしくはその断片がHLAと結合して複合体を形成し、かかる複合体をCTLが認識できることをいう。換言すれば、本発明のポリペプチドもしくはその断片、または本発明の核酸もしくはその断片が、HLAとの結合活性を有し、かつ、HLAとの複合体の形で、特異的なCTLを誘導する活性を有することを意味する。
【0099】
一方、本発明の医薬が本発明の核酸またはその断片を含む場合、当該核酸がコードするアミノ酸配列を有するポリペプチドは、それ自体がCTLにより認識され、当該CTLを活性化するか、そのような活性を有するポリペプチド断片を与えることができ、腫瘍抗原として機能しうる。本形態において用いられる核酸またはその断片は、本発明のポリペプチドをコードする領域に対応する少なくとも24個以上の塩基からなるポリヌクレオチドまたはその相補鎖であることが好ましい。このようなポリヌクレオチドは、例えば公知のタンパク質発現系を利用して発現ペプチドを確認することにより選択されうる。
【0100】
本発明の医薬は、例えば、がんワクチンとして使用することができる。1種類のポリペプチドもしくはその断片または核酸もしくはその断片のみでもがんワクチンとして有効であるが、複数種類のものを組み合わせて使用するのが好ましい。これは、がん患者のCTLが複数の異なる種類の腫瘍抗原を認識する細胞の集団であることから、複数種類の腫瘍抗原を組み合わせてがんワクチンとして使用する方がより効果的であると期待されるためである。また、本発明のポリペプチドや本発明の核酸は、これら以外のポリペプチドや核酸と併用されてもよい。
【0101】
本発明により提供されるがんワクチンは、適当なアジュバントの存在または非存在下で、単独で、または製薬的に許容される担体と結合して使用することができる。担体は、人体に有害な作用を起こさなければ特に制限はなく、例えば、セルロース、重合アミノ酸、アルブミン等が使用できる。剤形は、ペプチド製剤について周知の剤形が選択可能である。投与量は、CTLによる認識性、治療すべき疾患、患者の年齢、体重等により変化するが、ペプチドの場合、活性本体として、通常、0.0001mg〜1000mg、好ましくは0.001mg〜1000mg、より好ましくは0.1mg〜100mg、さらに好ましくは0.1〜10mg/日/成人ヒトである。これを数日、数週、または数ヶ月に1回投与すればよい。
【0102】
本発明の医薬はまた、本発明のポリペプチドまたはその断片をコードする核酸またはその断片を適当なベクターに組み込み、in vivoまたはex vivoで導入するのに利用することができる。ベクターとしては、例えばレトロウイルス、アデノウイルス、ワクシニアウイルス等が挙げられるが、レトロウイルス系が好ましい。投与量は、CTLによる認識性により変化するが、DNA含量として0.1μg〜100mg/日/成人ヒト、好ましくは1μg〜50mg/日/成人ヒトである。これを数日、数週、または数ヶ月に1回投与すればよい。
【実施例】
【0103】
以下、実施例および参考例により本発明をより具体的に説明するが、本発明の技術的範囲はこれらに限定されない。
【0104】
1.プライマー
ゲノムDNAコンタミネーションチェック、5’cDNA末端のRNAリガーゼ媒介迅速増幅(RLM-RACE;RNA ligase-mediated rapid amplification of 5’cDNA)、逆転写PCR(RT-PCR;Reverse Transcription-Polymeraze Chain Reaction)、cDNAクローニング、定量的リアルタイムPCR(Quantitative real-time PCR)、およびGFP融合ペプチド発現プラスミドからのペプチド発現に用いたプライマーは、インビトロジェン(カールスバッド,カリフォルニア州,アメリカ)またはグライナー−バイオ−ワン(タウフキルヒェン,ドイツ)に依頼して合成したものであり、それぞれ下記の表1〜表6に示す塩基配列を有する。
【0105】
【表1】

【0106】
【表2】

【0107】
【表3】

【0108】
【表4】

【0109】
【表5】

【0110】
【表6】

【0111】
2.細胞培養法
ヒト結腸がん由来細胞株であるLS180細胞は大日本住友製薬(大阪)より購入した。ヒト大腸がん由来細胞株であるHCT116細胞はボーゲルシュタイン博士(Dr.Vogelstein)(ジョンズホプキンス大学、ボルチモア、メリーランド州)よりご恵与いただいた。ヒト膵臓がん由来細胞株であるPK45p細胞は東北大学加齢医学研究所付属医用細胞資源センター(仙台)より入手した。LS180細胞およびPK45p細胞は、それぞれ10%非働化ウシ胎児血清(FBS)(ジェミニ バイオ−プロダクツ,カリフォルニア州)および50単位/mLペニシリン−50μg/mLストレプトマイシン(インビトロジェン)を加えた最小必須培地(MEM;Minimum Essential Medium)(インビトロジェン)またはRPMI(Roswell Park Memorial Institute)1640培地(インビトロジェン)を培地とし、5%CO2/95%Airを気相とした37℃のCO2インキュベーター内にて培養した。
【0112】
3.実験検体
白人種肝検体は、HAB(Human and Animal Bridging)協議会(東京)より入手した。上記検体は、米国立疾病研究互助組織(NDRI;National Disease Research Interchange)(フィラデルフィア,ペンシルバニア州)を介して米国から輸入された移植不適合のヒト肝組織である。なお、上記肝組織は肝炎等の感染症のないものを用いた。なお、本研究におけるこれら検体の研究利用は、千葉大学大学院薬学研究院倫理委員会において事前に承認されている。
【0113】
4.Total RNAの抽出
細胞からのtotal RNA抽出は、FastPureTMRNA Isolation Kit(タカラバイオ株式会社,滋賀)を用いてプロトコールに従いおこなった。抽出したtotal RNAにゲノムDNAの混入がないことを、20μL中にGoTaq Green Master Mix(プロメガ,マディソン,ワイオミング州)10μL、並びに、プライマー(上記表1に記載のヒトグリセルアルデヒド−3−デヒドロゲナーゼ(GAPDH) FおよびGAPDH R)各0.5μL、RNA 1μLを含む反応溶液を用いたPCRにより確認した。PCR反応は、95℃にて30秒間加熱した後、95℃10秒、50℃10秒および72℃30秒のサイクルを40回おこなった。白人種肝からのtotal RNA抽出についても、FastPureTM RNA Isolation Kitを用いてプロトコールに従いおこなった。ヒト大腸がん/正常大腸ペアtotal RNAは、アプライドバイオシステムズ(フォスターシティ,マサチューセッツ州)より購入した。
【0114】
5.SLCO1B3遺伝子の転写開始点の決定
GeneRacerTMKit(インビトロジェン)を用いたRLM−5’−RACE法により、SLCO1B3遺伝子の転写開始点を決定した。テンプレートとしてヒト大腸がん由来total RNAまたは白人種肝由来total RNAを用い、手順はプロトコールに従いおこなった。PCR反応は、20μL中にGoTaq Green Master Mix 10μL、Reverse transcriptionテンプレート 1μL、10μM GeneRacerTM5’プライマーおよびReverse gene specificプライマー(上記表2に記載の「SLCO1B3 648R」)各0.5μLを含むPCR反応溶液を調製し、これを94℃にて2分間加熱した後、94℃30秒、68℃30秒、72℃1分のサイクルを5回、94℃30秒、66℃30秒、72℃1分のサイクルを5回、94℃30秒、65℃30秒、72℃1分のサイクルを30回繰り返したTouch−downPCRをおこなった。このTouch−downPCRの後、PCR反応溶液を滅菌水で5倍希釈したものをテンプレートとして、Nested−PCRをおこなった。Nested−PCRは、20μL中にGoTaq Green Master Mix 10μL、テンプレート1μL、10μM GeneRacerTM5’ NestedプライマーおよびReverse Nested gene specificプライマー(上記表2に記載の「SLCO1B3 424Rnest」)各0.5μLを含むPCR反応溶液を調製し、これを95℃にて30秒間加熱した後、95℃10秒、53℃10秒および72℃30秒のサイクルを40回繰り返した。PCR産物は3%アガロースゲル電気泳動をおこない、エチジウムブロマイド染色により可視化した。電気泳動の結果を図3に示す。図3に示すように、白人種肝由来total RNAをテンプレートとして用いたサンプルでは、既報の転写開始点(図1に示す「TSS」)由来のバンドが確認された。これに対し、ヒト大腸がん由来total RNAをテンプレートとして用いたサンプルでは、既報の転写開始点由来のバンドよりも塩基長の短いバンドが確認された。この結果から、ヒト大腸がん由来OATP1B3 mRNAにおいては、既報とは異なる(既報のものよりも下流(3’)側に位置する)転写開始点が存在することが示唆された。なお、図3に示す「Non-template control」とは、テンプレートを含まない陰性コントロールである(後述する図5における「NTC」も同旨である)。
【0115】
続いて、上記で得られたNested−PCR産物を含むDNA断片を分離精製した後、DynaExpress TA PCR Cloning Kit(株式会社バイオダイナミクス研究所、東京)を用いてpTAC−1ベクターに挿入し、アンピシリンを用いて選択した。プラスミドDNAはPlasmid Miniprep Kit(バイオ−ラッド ラボラトリーズ)を用いて精製した。得られたプラスミドDNAの塩基配列は、CEQTM DTCS-Quick Start Mix(ベックマン コールター、フラートン、カリフォルニア州)を用いてサイクルシークエンス反応をおこない、CEQ 2000 XL DNA analysis system(ベックマン コールター)により解析し、SLCO1B3遺伝子の新規な転写開始点を同定した。
【0116】
SLCO1B3遺伝子の新規転写開始点付近の塩基配列をヒトゲノムDNAのデータベースと照合したところ、新規転写開始点はSLCO1B3遺伝子のイントロン2の領域内に存在し、さらにここに新たなエキソン(エキソンSV)が存在することが明らかとなった。また、このエキソンSVはOATP1B3/wtのエキソン3へとスプライシングされていた(図4を参照)。
【0117】
6.cDNAの作製およびRT−PCR法によるmRNA発現解析
上記4.に記載の手法により抽出したLS180細胞total RNA、PK45p細胞、ヒト大腸がん/正常大腸ペアRNAおよび白人種肝由来のtotal RNAをテンプレートとして用い、High Capacity cDNA Reverse Transcription kit(アプライド バイオシステムズ)を用いて逆転写反応をおこない、cDNAを作製した。このcDNAをテンプレートとしてRT−PCRをおこない、新規OATP1B3 mRNAの発現量を解析した。PCRは、20μL中にGoTaq Green Master Mix 10μL、テンプレートcDNA 1μL、10μM ForwardおよびReverseプライマー(上記表3に記載の「SLCO1B3 TSS in cancer 33F」および「SLCO1B3 TSS in cancer 145R」)各0.5μLを含むPCR反応溶液を調製し、これを95℃にて30秒間加熱した後、95℃10秒、各プライマーに適したアニーリング温度(上記表3に記載の「アニーリング温度」)10秒および72℃15〜20秒のサイクルを38回おこなった。PCR産物は3%アガロースゲル電気泳動をおこない、エチジウムブロマイド染色により可視化した。電気泳動の結果を図5に示す。図5に示すように、ヒト大腸がん組織に加え、大腸がん由来LS180細胞およびHCT116細胞、膵臓がん由来PK45p細胞においても新規OATP1B3 mRNAの発現が認められた。一方、正常ヒト大腸組織においてはこのmRNAの発現は認められなかった。これらの結果より、新規OATP1B3 mRNAはがん細胞/組織に高く発現する分子種であると考えられることから、これを「OATP1B3/ct」とした。
【0118】
7.OATP1B3/ctのcDNAクローニング
OATP1B3/ctのcDNAクローニングは、ヒト大腸がん由来のcDNAをテンプレートとして、上記表4に記載のプライマーセット(ctSLCO1B3 cloning F33およびctSLCO1B3 cloning 2149R)並びにPrimeSTAR HS DNA polymerase(タカラバイオ株式会社,滋賀)を用いたPCRによりおこなった。なお、表4に示すように、OATP1B3/ctのcDNAクローニングに用いたフォワードプライマーは、上記「6.cDNAの作製およびRT−PCR法によるmRNA発現解析」のRT−PCRに用いた「SLCO1B3 TSS in cancer 33F」と同一である。PCRは94℃3分の後、98℃10分、58℃5秒、72℃2分30秒を40サイクル繰り返し、72℃3分を最終ステップとした条件でおこなった。得られたPCR産物は1%アガロースゲル電気泳動により分離し、抽出精製した後、pCR Blunt-II TOPO vector(インビトロジェン)に挿入した。得られた構築物をXbaI(ニッポンジーン、東京)およびBamHI(ニッポンジーン)で処理することにより、OATP1B3/ct cDNAを切り出し、これを同様に処理したpcDNA3.1(-) Neo vector(インビトロジェン)とライゲーションすることにより、OATP1B3/ct/pcDNA3.1(-)を作製した。
【0119】
なお、同様の手法により、OATP1B3/wtのcDNAクローニングもおこなった。具体的には、白人種肝由来のcDNAをテンプレートとして、上記表4に記載のプライマーセット(SLCO1B3 F27およびSLCO1B3 2184R)並びにKOD-plus-Polymerase (TOYOBO、大阪)を用いたPCRによりおこなった。PCR反応は94℃3分の後、94℃30秒、48℃30秒、68℃2分30秒を35サイクル繰り返し、68℃5分を最終ステップとした条件でおこなった。得られたPCR産物は1%アガロースゲル電気泳動により分離し、抽出精製した後、pCR Blunt-II TOPO vector(インビトロジェン)に挿入した。得られた構築物をApaI(ニッポンジーン)およびBamHIで処理することによってOATP1B3/wt cDNAを切り出し、これを同様に処理したpcDNA3.1(-) Neo vectorとライゲーションすることにより、OATP1B3/wt/pcDNA3.1(-)を作製した。
【0120】
上記で作製した2つのプラスミド中のOATP1B3/ctまたはOATP1B3/wtの塩基配列を、CEQ 2000 Dye terminator Cycle Sequencing with Quick Start Kit(ベックマン コールター)およびCEQ 2000 XL DNA analysis system(ベックマン コールター)を用いて解析した。図1には、これにより配列決定されたOATP1B3/ctのcDNA配列(配列番号:1)が、OATP1B3/wtのcDNA配列(Refseq Accession No.NM_019844、配列番号:2)とともに示されている。また、図1および図4に示すように、OATP1B3/ctでは、OATP1B3/wtのエキソン1およびエキソン2が欠失しており、これに代えてエキソンSVが存在し、OATP1B3/wtのエキソン3へとスプライシングされていることが確認される。
【0121】
8.定量的リアルタイムPCRによるmRNA発現解析
上記6.に記載の手法により作製したGHL pool(5つの日本人肝サンプルから調製したcDNAプール)、HHL pool(5つの白人種肝サンプルから調製したcDNAプール)、ヒト大腸がん組織、LS180細胞、PK45p細胞、およびHCT116細胞のそれぞれのcDNA、並びに、上記7.に記載の手法により作製したプラスミドを用いて定量的リアルタイムPCRをおこない、検量線法を用いてOATP1B3/ctおよびOATP1B3/wtのそれぞれのmRNAの定量をおこなった。PCRおよびDNA増幅の検出には、ABI PRISM(登録商標) 7000(アプライド バイオシステムズ)を用いた。
【0122】
OATP1B3/ct mRNAの検出は、20μL中にcDNAテンプレート 1μL、2×FastStart Universal Probe Master (ROX)(ロシュ、ペンツバーグ、ドイツ)10μL、Universal Probe #59 (ロシュ) 0.2μL、および上記表5に記載のプライマーセット(ctSLCO1B3 Left 59-76、およびctSLCO1B3Right 130-151)各0.4μLを含むPCR反応溶液を調製し、これを95℃5分の後、95℃15秒、60℃1分のサイクルを45回繰り返した2 step PCRでおこなった。
【0123】
一方、OATP1B3/wt mRNAの検出は、20μL中にcDNAテンプレート 1 μL、2×SYBER Premix Ex Taq II(タカラバイオ)10μL、50×ROX Reference Dye(タカラバイオ)0.4μLおよび上記表5に記載のプライマーセット(SLCO1B3 F153 for real-time、およびSLCO1B3R194 for real-time)各0.8μLを含むPCR反応溶液を調製し、これを95℃20秒の後、95℃5秒、60℃33秒のサイクルを40回繰り返した2 step PCRでおこなった。
【0124】
検量線用サンプルは、OATP1B3/ct mRNA測定には上記7.に記載の手法により作製したOATP1B3/pTOPOをテンプレートとし、1ウェルあたりのモル数が2.86×10−23〜1.43×10−17モル内の5点を用いて作製した。一方、OATP1B3/wt mRNA測定には上記7.に記載の手法により作製したOATP1B3/pcDNA3.1(−)をテンプレートとし、1ウェルあたりのモル数が1.09×10−23〜1.09×10−17モル内の5点を用いて作製した。PCRおよびDNA増幅の検出はcDNAサンプルと同様におこなった。また、検量線は最小二乗法により直線回帰して得た。
【0125】
定量的リアルタイムPCRの結果得られたmRNA発現プロファイルを図6に示す。図6のAは、各組織・細胞におけるOATP1B3/ctの発現レベルを示す。また、図6のBは、各組織・細胞におけるOATP1B3/wtの発現レベルを示す。なお、図6に示す棒グラフは、OATP1B3 mRNAのコピー数を、3回の独立した実験における平均値±標準偏差として示したものである。さらに、図6のCは、発現レベルの比(OATP1B3/ctのコピー数/OATP1B3/wtのコピー数)を示す。
【0126】
図6のAに示すように、total RNA 1ng中に存在するOATP1B3/ct mRNAコピー数はGHL pool(日本人肝)では8であり、HHL pool(白人種肝)では4であった。これに対し、ヒト大腸がん組織h colon Tu #1 および #2ではそれぞれ1812、89であり、また、LS180細胞では2411、PK45p細胞では289、HCT116細胞では644であった。一方、OATP1B3/wt mRNAコピー数はGHL poolでは12187、HHL poolでは7473であり、h colon Tu #1および#2ではそれぞれ30、3であり、また、LS180細胞では865、PK45p細胞では2、HCT116細胞では172であった。したがって、OATP1B3/ct mRNA発現量はOATP1B3/wt mRNA発現量に対して、ヒト大腸がん組織であるh colon Tu #1および #2 でそれぞれ60倍、30倍、ヒト大腸がん由来細胞であるLS180細胞で2.8倍、PK45p細胞で144.5倍、HCT116細胞で3.7倍と高かった(図6のC)。一方、GHL poolおよびHHL poolでは、OATP1B3/ct mRNAの発現量はOATP1B3/wt発現量のそれぞれ約1/1500、約1/1700であった。以上のことから、ヒト大腸がん組織ではOATP1B3/ct mRNAがほぼ特異的に発現しており、また、ヒト大腸がん由来細胞においても、OATP1B3/ct mRNAが非常に優位に発現していることが示される。つまり、本願の発明者らによって、がん細胞・組織で発現しているのは既報のOATP1B3/wtではなく、今回新たに発見された選択的スプライシングバリアントであるということが明らかとされたのである。
【0127】
9.緑色蛍光タンパク質(GFP)融合ctOATP1B3ペプチド発現プラスミドの作製
図7に示すように、OATP1B3/ct mRNAの各フレームには推定オープンリーディングフレーム(ORF;Open reading frame)が存在する。フレーム1の2つのORFはそれぞれ10アミノ酸からなるペプチドおよび27アミノ酸からなるペプチドをコードすると推定される(f1−1、f1−2)。また、フレーム2のORFはOATP1B3/wtのフレームの途中を開始コドンとしてそのままOATP1B3/wtの終止コドンを共有する655アミノ酸からなるタンパク質をコードすると推定される(f2)。さらに、フレーム3のORFは43アミノ酸からなるペプチドをコードすると推定される(f3)。これら翻訳産物の発現を解析するため、OATP1B3/ct mRNAのフレーム1およびフレーム3に存在するペプチドコード領域(f1−1、f1−2、f3)並びに、フレーム2に存在するタンパク質コード領域のN末端領域20アミノ酸(f2)のC末端側のそれぞれにGFPを融合したタンパク質(f1−1/GFP、f1−2/GFP、f2/GFP、f3/GFP)を発現させるプラスミドを作製した。
【0128】
OATP1B3/ct/pcDNA3.1(-)をテンプレートとして、f1−2領域、f2領域およびf3領域を表6に示すプライマーを用いてPCR(95℃30秒の後、95℃10秒、60℃10秒、72℃20秒を40回繰り返し、72℃10秒を最終ステップ)により増幅した。また、GFPおよびf1−1/GFPについては、pAcGFP-c1をテンプレートとして表6に示すプライマーを用いてPCR(94℃3分の後、98℃10秒、59℃5秒、72℃50秒を40回繰り返し、72℃3分を最終ステップ)により増幅した。GFPのPCR産物をBamHI処理し、同様にBamHI処理したf1−2、f2およびf3のそれぞれのPCR産物とライゲーションした。これをテンプレートとして表6に示すプライマーを用いてPCR(94℃2分の後、94℃10秒、60℃30秒、72℃60秒を35回繰り返し、72℃30秒を最終ステップ)により増幅した。得られたf1−2/GFP、f3/GFPはDynaExpress TA PCR Cloning Kit (BioDynamics Laboratory Inc., 東京) を用いてpTAC-1vectorに挿入した。また、得られたf1−1/GFP、f2/GFPはpCR Blunt-II TOPO vector(インビトロジェン)に挿入した。これらプラスミドをXbaIおよびKpnIで処理し、同様に処理したpcDNA3.1(-)Neoとライゲーションして、f1-1/GFP/pcDNA3.1、f1-2/GFP/pcDNA3.1、f2/GFP/pcDNA3.1、f3/GFP/pcDNA3.1を作製した。
【0129】
10.リバーストランスフェクション
mCherry/pcDNA3.1(-) 320ng/ウェルと、各GFP融合ペプチド発現プラスミドまたはempty pcDNA3.1 (-)Neo(mock) 320ng/ウェルとの混合物にOPTI-MEM(登録商標)(インビトロジェン)100μL/ウェル、およびPlus Reagent(インビトロジェン)0.5μL/ウェルを混合し、Lipofectamin LTX(インビトロジェン)1.6μL/ウェルを加え293FT細胞3.5×105細胞/ウェルとともに24ウェルプレートに播種した。播種から24時間後、GFP由来の緑色蛍光およびmCherry由来の赤色蛍光をOlympus Fluoview ver2.3(オリンパス、東京)を用いて観察した。結果を図8に示す。ここで、図8において、緑色はGFP由来の蛍光であり、赤色はトランスフェクションコントロールであるmCherry由来の蛍光である。また、両蛍光の重ね合わせをMergeとして示し、微分干渉像をPhaseとして示す。なお、解析に用いたレーザー強度・照射時間は全て等しくした。
【0130】
図8に示すように、トランスフェクションした293FT細胞においてf1−1/GFPおよびf3/GFP由来と考えられる強い蛍光が認められた(図8(b)および(e))。また、f2/GFP(図8(d))由来の蛍光も認められた。一方、f1−2/GFPについては、非常に弱い蛍光が認められた(図8(c))。また、同時におこなったmockを用いた実験では緑色蛍光は認められなかった(図8(a))。なお、いずれの実験においてもmCherry由来の赤色蛍光は同等の発色レベルを示した。
【配列表フリーテキスト】
【0131】
〔配列番号:1〕
OATP1B3/ctのcDNAの塩基配列を表す。
〔配列番号:2〕
OATP1B3/wtのcDNAの塩基配列を表す。
〔配列番号:3〕
OATP1B3/wtによりコードされるタンパク質のアミノ酸配列を表す。
〔配列番号:4〕
OATP1B3/ctのフレーム1−1(終止コドン含む)の塩基配列を表す。
〔配列番号:5〕
OATP1B3/ctのフレーム1−1によりコードされるペプチド(f1−1)のアミノ酸配列を表す。
〔配列番号:6〕
OATP1B3/ctのフレーム1−2(終止コドン含む)の塩基配列を表す。
〔配列番号:7〕
OATP1B3/ctのフレーム1−2によりコードされるペプチド(f1−2)のアミノ酸配列を表す。
〔配列番号:8〕
OATP1B3/ctのフレーム2(終止コドン含む)の塩基配列を表す。
〔配列番号:9〕
OATP1B3/ctのフレーム2によりコードされるポリペプチド(f2)のアミノ酸配列を表す。
〔配列番号:10〕
OATP1B3/ctのフレーム3(終止コドン含む)の塩基配列を表す。
〔配列番号:11〕
OATP1B3/ctのフレーム3によりコードされるペプチド(f3)のアミノ酸配列を表す。
〔配列番号:12〕
ヒトGAPDH遺伝子の増幅に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:13〕
ヒトGAPDH遺伝子の増幅に用いたリバースプライマーの塩基配列を表す。
〔配列番号:14〕
RLM−5’−RACEのTouch-down PCRに用いたリバースプライマーの塩基配列を表す。
〔配列番号:15〕
RLM−5’−RACEのNested-PCRに用いたリバースプライマーの塩基配列を表す。
〔配列番号:16〕
RT−PCRおよびOATP1B3/ctのcDNAクローニングに用いたフォワード
プライマーの塩基配列を表す。
〔配列番号:17〕
RT−PCRに用いたリバースプライマーの塩基配列を表す。
〔配列番号:18〕
OATP1B3/ctのcDNAクローニングに用いたリバースプライマーの塩基配列を表す。
〔配列番号:19〕
OATP1B3/wtのcDNAクローニングに用いたフォワードプライマーの塩基配列を表す。
〔配列番号:20〕
OATP1B3/wtのcDNAクローニングに用いたリバースプライマーの塩基配列を表す。
〔配列番号:21〕
定量的リアルタイムPCRにおいてOATP1B3/ctの検出に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:22〕
定量的リアルタイムPCRにおいてOATP1B3/ctの検出に用いたリバースプライマーの塩基配列を表す。
〔配列番号:23〕
定量的リアルタイムPCRにおいてOATP1B3/wtの検出に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:24〕
定量的リアルタイムPCRにおいてOATP1B3/wtの検出に用いたリバースプライマーの塩基配列を表す。
〔配列番号:25〕
f1-1/GFP/pcDNA3.1からの配列番号:5のアミノ酸配列からなるペプチドの発現に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:26〕
f1-1/GFP/pcDNA3.1からの配列番号:5のアミノ酸配列からなるペプチドの発現に用いたリバースプライマーの塩基配列を表す。
〔配列番号:27〕
f1-2/GFP/pcDNA3.1からの配列番号:7のアミノ酸配列からなるペプチドの発現、f2/GFP/pcDNA3.1からの配列番号:9のアミノ酸配列からなるタンパク質の発現、およびf3/GFP/pcDNA3.1からの配列番号:11のアミノ酸配列からなるペプチドの発現に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:28〕
f1-2/GFP/pcDNA3.1からの配列番号:7のアミノ酸配列からなるペプチドの発現に用いたリバースプライマーの塩基配列を表す。
〔配列番号:29〕
f2/GFP/pcDNA3.1からの配列番号:9のアミノ酸配列からなるタンパク質の発現に用いたリバースプライマーの塩基配列を表す。
〔配列番号:30〕
F3/GFP/pcDNA3.1からの配列番号:11のアミノ酸配列からなるペプチドの発現に用いたリバースプライマーの塩基配列を表す。
〔配列番号:31〕
F1-1/GFP/pcDNA3.1、f1-2/GFP/pcDNA3.1、f2/GFP/pcDNA3.1、およびf3/GFP/pcDNA3.1からのGFPタンパク質の発現に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:32〕
F1-1/GFP/pcDNA3.1、f1-2/GFP/pcDNA3.1、f2/GFP/pcDNA3.1、およびf3/GFP/pcDNA3.1からのGFPタンパク質の発現に用いたリバースプライマーの塩基配列を表す。
【技術分野】
【0001】
本発明は、新規ながんマーカーに関する。より詳細には、本発明は、OATP1B3 mRNAの新規な選択的スプライシングバリアント、およびその用途に関する。
【背景技術】
【0002】
最近の医療技術の進歩により、がんの治療技術も大幅に改善されており、ある種のがんについては、死亡率の減少傾向を示すものもある。しかしながら、がんの発症を早期に発見することは、その治療効果に影響を与えるものであるため、がんの早期発見を可能にする方法の確立が望まれている。
【0003】
がんの診断には、がん組織を超音波またはX線検査などにより視覚的に捉える方法のほか、患者から採取した組織を免疫組織学的手法により細胞形態等の異常を発見する方法、並びに、特定のがんの発症に伴い発現に変化が生じるタンパク質または遺伝子などのいわゆるがんマーカーの動態を検出する生化学的、免疫化学的方法などが知られている。
【0004】
これらの方法において、組織を免疫組織学的手法によりその形態を観察する方法は、組織の標本化が必要であるため、がんの発症の有無の確認に時間を要し、また、観察された形態からがんの発症の有無を見極めるためにはかなりの熟練が必要となる。
【0005】
したがって、比較的簡便でかつ客観的にがん発症の有無を判断することができるがんマーカーを用いる方法の適用が、しばしばおこなわれるようになってきた。しかしながら、ヒトのがんの診断において使用されるがんマーカーの多くは、正常組織細胞にもある程度発現していることから、当該がんマーカーの発現の変動をがん化の指標として用いなくてはならないことが多く、誤診断の可能性が常に存在している。
【0006】
したがって、がん発症の有無を客観的により正確に検出するために、非がん細胞にはその存在が認められず、がん化した細胞だけが産生する物質をがんマーカーとして用いることが望ましい。例えば膵臓がんを例に挙げると、現時点において膵臓がんには有効なスクリーニング検査法が存在しないため、がん症状が表れた時には手遅れになっていることが多く、膵臓がんの早期発見のためには膵臓がん特異的ながんマーカーの使用が必要とされている。
【0007】
ところで、有機アニオン輸送ポリペプチド1B3(OATP1B3;Organic Anion Transporting Polypeptide 1B3、遺伝子名SLCO1B3)は、細胞膜上に発現するトランスポーターであり、幅広い基質認識性を示し、抗がん剤を含む多くの化合物の細胞内取り込みを担っている。OATP1B3は通常肝細胞に特異的に発現するが、他の臓器でもがん化に伴い発現が認められるようになる。これまで、乳がんおよび前立腺がんにおいてOATP1B3の発現や機能が患者の生存率に影響を及ぼすことが報告されている(非特許文献1および2を参照)。また、大腸がん細胞を用いた解析では、OATP1B3の発現が細胞にアポトーシス抵抗性を付与するとの報告がある(非特許文献3を参照)。
【0008】
以上のことから、OATP1B3はがん細胞においてなんらかの役割を担っていると考えられる。このため、OATP1B3の検出はがん治療における予後の診断や抗がん剤有効性診断に有用ながんマーカーとして期待されている。例えば、特許文献1には、LST−2(OATP1B3の別名である)のC末端側細胞内ドメインを認識する抗LST−2モノクローナル抗体を用いて女性大腸がん患者のがん組織におけるLST−2の発現を測定し、この測定値に基づいて当該患者の予後を予測する技術が開示されている。
【0009】
しかしながら、がん細胞におけるOATP1B3の発現・機能については依然として不明な点が多く、がんマーカーとしての利用形態が十分に確立しているとはいえないのが現状である。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2007−119390号公報
【非特許文献】
【0011】
【非特許文献1】Muto et al. Human liver-specific organic anion transporter-2 is a potent prognostic factor for human breast carcinoma. (2007) Cancer Sci. 98:1570-6
【非特許文献2】Hamada et al. Effect of SLCO1B3 Haplotype on Testosterone Transport and Clinical Outcome in Caucasian Patients with Androgen-Independent Prostatic Cancer. (2008) Clin. Cancer Res. 14:3312-8
【非特許文献3】Lee et al. Overexpression of OATP1B3 confers apoptotic resistance in colon cancer. (2008) Cancer Res. 68:10315-23
【発明の概要】
【発明が解決しようとする課題】
【0012】
上述したような従来技術に鑑み、本発明は、新規ながんマーカーおよびその用途を提供することを目的とする。より詳細には、本発明は、新規ながんマーカー、当該がんマーカーの測定方法および測定用キット、これを用いたがんの検出方法、がんの検出用キット、がんの予防および/または治療剤のスクリーニング方法、並びに、がんワクチン等の医薬を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明者らは、上述した従来技術に鑑み、OATP1B3の発現・機能のさらなる探索を目的として、鋭意研究をおこなった。その過程で、驚くべきことに:
(1)従来報告されているOATP1B3 mRNA(本明細書中、「OATP1B3/wt」とも称する;「wt」とは野生型(Wild Type)の意である)の選択的スプライシングバリアントが存在すること、
(2)この新たな選択的スプライシングバリアントが、がん細胞・組織において特異的に強く発現すること;および、
(3)この新たな選択的スプライシングバリアントから、いくつかのペプチドまたはタンパク質が発現しうること、
の3つの知見を得て(本明細書中、この選択的スプライシングバリアントを「OATP1B3/ct」とも称する;「ct」とはがん型(Cancer Type)の意である)、これらの知見に基づき、本発明を完成させるに至った。
【0014】
すなわち、本発明の第1の形態によれば、被検試料中のOATP1B3 mRNAの選択的スプライシングバリアントの測定方法が提供される。当該測定方法は、生体から分離した被検試料中の、配列表の配列番号:1で表される塩基配列を含むmRNAを、配列番号:2で表される塩基配列を含むmRNAと識別して測定することを含む。
【0015】
この際、OATP1B3/ctは、配列番号:1で表される塩基配列におけるエキソンSVの存在を指標として測定されることが好ましい(「エキソンSV」についての詳細は後述する)。また、この測定は、例えば、エキソンSVを含む領域に設定したプライマーを一方のプライマーとして用いる核酸増幅法により、OATP1B3/ctまたはそのcDNAの部分領域を特異的に増幅し、増幅産物を測定することを含む。なお、前記プライマーの塩基数は、好ましくは15〜35程度である。また、前記核酸増幅法は、好ましくはRT−PCR法である。
【0016】
また、本発明の第2の形態によれば、以下の条件を満足する核酸を提供する:
(1)配列番号:1で表される塩基配列を含む核酸とストリンジェントな条件下でハイブリダイズする;
(2)配列番号:2で表される塩基配列を含む核酸が共存する場合に、ストリンジェントな条件下で、当該核酸とはハイブリダイズしないか、または、当該核酸とハイブリダイズした場合であってもその3’末端がミスマッチとなる。
【0017】
この際、当該核酸は、エキソンSVを含む領域とハイブリダイズすることが好ましい。また、当該核酸の塩基数は、好ましくは10程度以上であり、より好ましくは15〜35程度である。さらに、当該核酸は、配列番号:1で表される塩基配列または当該塩基配列の部分領域と同じ塩基配列またはこれらの塩基配列のうち10%以下の塩基が置換されてなる塩基配列からなることが好ましい。当該核酸は、OATP1B3 mRNAの選択的スプライシングバリアントの測定に好適に用いられる。この際、当該核酸は、好ましくは核酸増幅用のプライマー、またはプローブである。
【0018】
さらに、本発明の第3の形態によれば、本発明の第2の形態により提供される核酸を含む、OATP1B3 mRNAの選択的スプライシングバリアントの測定用キットが提供される。
【0019】
また、本発明の第4の形態によれば、がんの検出方法も提供される。当該検出方法は、本発明の第1の形態により提供される測定方法により、または、本発明の第3の形態により提供される測定用キットを用いて、生体から分離した被検試料中のOATP1B3 mRNAの選択的スプライシングバリアントを測定することを含む。この際、配列番号:1で表される塩基配列を含むOATP1B3 mRNAの選択的スプライシングバリアントを測定することが好ましい。また、当該検出方法において、がんは、大腸がんまたは膵臓がんであることが好ましい。
【0020】
さらに、本発明の第5の形態によれば、がんの予防および/または治療剤のスクリーニング方法もまた、提供される。当該スクリーニング方法は、本発明の第1の形態により提供される測定方法により、または、本発明の第3の形態により提供される測定用キットを用いて、がん細胞を被検物質の存在下で培養して得られる培養細胞中のOATP1B3 mRNAの選択的スプライシングバリアントを測定する工程と、得られた測定結果を、前記被検物質の非存在下における場合と比較および/または評価する工程とを含む。
【0021】
そして、本発明の第6の形態によれば、配列番号:1で表される塩基配列を含む、OATP1B3 mRNAの選択的スプライシングバリアント自体もまた、提供される。本選択的スプライシングバリアントは、例えば、該バリアントを培養細胞等に導入し強制発現させることにより、がん化培養細胞等を作成し、本発明の第5の形態のスクリーニング方法にも利用できる。
【0022】
また、本発明の第7の形態によれば、
(1)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド、あるいは、
(2)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列において、10%以下のアミノ酸が置換、欠失、および/または挿入されたアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチドが提供される。当該ポリペプチドは、好ましくは、配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列からなるポリペプチドである。
【0023】
さらに、本発明の第8の形態によれば、第7の形態のポリペプチドをコードする核酸や、当該核酸を含む発現ベクター、当該発現ベクターで形質転換された細胞もまた、提供される。
【0024】
また、本発明の第9の形態によれば、第7の形態のポリペプチドに結合する抗体や、配列番号:4、配列番号:6、配列番号:8、または配列番号:10で表される塩基配列を含む核酸とストリンジェントな条件下でハイブリダイズし、少なくとも15塩基を有する核酸もまた、提供される。
【0025】
そして、本発明の第10の形態によれば、生体から分離した被検試料中の、上記第7の形態のポリペプチドの量を測定することを含む、がんの検出方法が提供される。この際、上記第9の形態の抗体を測定に用いることが好ましい。また、当該抗体を含む、がんの検出用キットも提供されうる。
【0026】
本発明の第11の形態では、医薬が提供される。当該医薬は、第7の形態のポリペプチドまたはその断片や、第8の形態の核酸またはその断片を含み、特異的な細胞傷害性T細胞を誘導するためのものである。当該医薬は、好ましくはがんワクチンである。
【発明の効果】
【0027】
本発明によれば、新規ながんマーカーとしてヒトOATP1B3 mRNAの新規な選択的スプライシングバリアントが提供され、その測定方法、当該測定に利用可能な核酸、および当該測定方法を実施するための手段(測定用キット)が提供される。また、本発明によれば、新規ながんの検出方法も提供され、さらには、がんの予防および/または治療剤の新規なスクリーニング方法も提供される。そして、がんの検出に用いられうるポリペプチドやこれに結合する抗体、当該ポリペプチドの量を指標としたがんの検出方法、当該抗体を含むがんの検出用キット、がんワクチン等としての医薬などもまた、提供される。
【図面の簡単な説明】
【0028】
【図1】OATP1B3/ctのcDNAの塩基配列(配列番号:1)およびOATP1B3/wtのcDNAの塩基配列(配列番号:2)をアライメントした結果を示す図である。図1において、アステリスク(*)は、2つの塩基配列間でヌクレオチドが一致していることを意味する。
【図2】OATP1B3/wtによりコードされるタンパク質のアミノ酸配列を示す図である。
【図3】実施例の「5.SLCO1B3遺伝子の転写開始点の決定」において、ヒト大腸がん由来total RNAまたは白人種肝由来total RNAをテンプレートとしてRLM−5’−RACE法をおこなった結果を可視化するためのアガロースゲル電気泳動の結果を示す写真である。
【図4】ヒトSLCO1B3遺伝子の構造を示す模式図である。図4には、既知および新規の転写開始点の位置が示されている。また、実施例においてRT−PCRをおこなった際に用いたプライマーセットがハイブリダイズする位置もそれぞれ矢印で示されている。
【図5】実施例の「6.cDNAの作製およびRT−PCR法によるmRNA発現解析」において、LS180細胞total RNA、PK45p細胞、ヒト大腸がん/正常大腸ペアRNAおよび白人種肝由来のtotal RNAをテンプレートとしてRT−PCRをおこなった結果を可視化するためのアガロースゲル電気泳動の結果を示す写真である。
【図6】実施例の「8.定量的リアルタイムPCRによるmRNA発現解析」の結果(mRNA発現プロファイル)を示すグラフである。図6のAは、各組織・細胞におけるOATP1B3/ctの発現レベルを示す。また、図6のBは、各組織・細胞におけるOATP1B3/wtの発現レベルを示す。さらに、図6のCは、発現レベルの比(OATP1B3/ctのコピー数/OATP1B3/wtのコピー数)を示す。
【図7】OATP1B3/ct上に存在する4つのオープンリーディングフレーム(ORF)を表す図である。cDNAの塩基配列を上列に示し、下列にコードされるアミノ酸配列を示す。また、下線がORFを示し、太字ATGはORFの上流にある推定翻訳開始コドンを示す。コードされるアミノ酸配列において「GFP」とあるのは、実施例で発現プラスミドを作製した際に緑色蛍光タンパク質(GFP)をコードする塩基配列を挿入した部位を示す。なお、フレーム2については、N末端20アミノ酸をコードする領域の後にGFPをコードする塩基配列を挿入して発現プラスミドを作製した。
【図8】実施例の「10.リバーストランスフェクション」の結果を示すグラフである。なお、緑色はGFP由来の蛍光であり、赤色はトランスフェクションコントロールであるmCherry由来の蛍光である。また、両蛍光の重ね合わせをMergeとして示し、微分干渉像をPhaseとして示す。
【発明を実施するための形態】
【0029】
ヒトSLCO1B3遺伝子は、染色体12p12上に位置する約106kbpの遺伝子であり、この遺伝子から、2712bp(15エキソン)からなるOATP1B3 mRNA(OATP1B3/wt;Refseq Accession No.NM_019844)が転写される。既に報告されているこのOATP1B3/wtのcDNAの塩基配列を配列番号:2および図1に示す。このOATP1B3/wtは、702アミノ酸からなるタンパク質(OATP1B3タンパク質;RefSeq Accession No.NP_062818)をコードしている。このOATP1B3/wtによりコードされるタンパク質のアミノ酸配列を配列番号:3および図2に示す。なお、配列番号:2で表される塩基配列において、5’末端から1番目の塩基(本明細書中、「1nt」のように称する。他の位置の塩基も同様に5’末端から何番目に位置するかの数字にntを付けて称する)から61ntまでがエキソン1、62nt〜210ntがエキソン2、211nt〜1991ntがエキソン3〜エキソン14であり、1992nt〜2712ntがエキソン15である。なお、OATP1B3/wtのコード領域(CDS;Coding Sequence)は、エキソン2〜エキソン15に跨る127〜2235nt(終止コドンTAAを含む)であり、図1において大文字で表記されている。一方、OATP1B3/wtの非コード領域は、図1において小文字で表記されている。
【0030】
後述する実施例に記載するように、本発明者らは、ヒトSLCO1B3遺伝子の転写開始点を決定する目的で、ヒト大腸がん組織由来のtotal RNAをテンプレートとしてRLM−5’−RACE法をおこなったところ、既に報告されている転写開始点(図1に示す「TSS」)の情報から予想されるサイズよりも分子量の小さい増幅産物が検出されることを見出した。そして、SLCO1B3遺伝子の新規転写開始点付近の塩基配列をヒトゲノムDNAのデータベースと照合したところ、新規転写開始点はSLCO1B3遺伝子のイントロン2の領域内に存在し、さらにここに新たなエキソンが存在することが明らかとなった(この新たなエキソンを「エキソンSV」と称する)。また、このエキソンSVはOATP1B3/wtでいうエキソン3へとスプライシングされていた(後述する図4を参照)。このようにして発見されたOATP1B3 mRNAの新規な選択的スプライシングバリアント(OATP1B3/ct)のcDNAの塩基配列を配列番号:1および図1に示す。
【0031】
上述したように、OATP1B3/ctのエキソンSVはOATP1B3/wtのエキソン3へとスプライシングされていた。すなわち、配列番号:1で表される塩基配列において、1nt〜139ntがエキソンSVである。また、配列番号:1で表される塩基配列における140nt〜1920ntは、OATP1B3/wtのエキソン3〜エキソン14と実質的に同一の塩基配列を有する。そして、配列番号:1で表される塩基配列における1921nt〜2170ntは、OATP1B3/wtのエキソン15の対応部分と同一の塩基配列を有する。
【0032】
本発明において見出された選択的スプライシングバリアント(例えば、OATP1B3/ct)は、後述する実施例に記載のように、がん細胞においてその発現量が増大していることが確認された。したがって、生体から分離した被検試料中の当該選択的スプライシングバリアントを測定することにより、がんの検出が可能である。
【0033】
以下、本発明の具体的な好ましい実施形態についてより詳細に説明するが、本発明の技術的範囲は特許請求の範囲の記載に基づいて定められるべきであり、以下の具体的な実施形態や実施例によって限定されるべきではない。
【0034】
本発明の第1の形態により提供されるOATP1B3 mRNAの選択的スプライシングバリアントの測定方法では、生体から分離した被検試料中の、配列番号:1で表される塩基配列を含むmRNA(例えば、配列番号:1で表される塩基配列からなるmRNA)を、配列番号:2で表される塩基配列を含むmRNA(例えば、配列番号:2で表される塩基配列からなるmRNA)と識別して測定することを含む。なお、配列番号:1の塩基配列は、mRNAおよびこれをテンプレートとして得られるcDNAの塩基配列を兼用して示すものであり、mRNAを示す場合には、当然ながら、チミン(t)に代えてウラシル(u)が含まれるため、tをuに読み替える。また、「測定」には、定量、半定量および検出のいずれの概念も包含される。さらに、「mRNAを測定する」ことには、mRNAを直接的に測定する場合のほか、mRNAを一旦cDNAへと変換した後に当該cDNAを測定する場合(後述するRT−PCR等)や、mRNAの翻訳産物を測定する場合のように、mRNAを間接的に測定する場合も包含される。また、以下の説明では、配列番号:1で表される塩基配列を含むmRNA、cDNA、核酸等を、「配列番号:1のmRNA、cDNA、核酸等」と称することがある。
【0035】
なお、配列表には、規則により、二本鎖核酸であってもそのうちの一本鎖(ポリペプチドをコードする核酸ではセンス鎖)のみを記載することになっている。このため、二本鎖核酸の場合には、配列表に現実に記載されている配列は一本鎖であっても、実際にはその相補鎖も配列表に記載されていると解することができる。したがって、本願明細書においても、ある配列番号で表される塩基配列を含むもしくはこれからなる核酸が二本鎖核酸である場合または二本鎖核酸であってもよい場合には、その配列番号で表される塩基配列は、文脈上そうでないことが明らかな場合を除き、その相補鎖をも包含するものとする。例えば、「配列番号:1で表される塩基配列を含む核酸とハイブリダイズする核酸」とは、配列番号:1に現実に記載されているセンス鎖にハイブリダイズする核酸のほか、当該センス鎖に相補的な塩基配列からなるアンチセンス鎖にハイブリダイズする核酸をも意味するのである。
【0036】
配列番号:1のmRNAを配列番号:2のmRNAと識別して測定することは、当業者にとって容易であり、種々の方法により可能である。例えば、エキソンSV内とエキソン3以降の領域にプライマーを設定して逆転写PCR(RT−PCR)をおこない、増幅産物の分子量に基づいて、そのmRNAがOATP1B3/wtか選択的スプライシングバリアント(例えば、OATP1B3/ct)かを識別してmRNAを測定することができる。また、得られた増幅産物について塩基配列を決定してもよい(ダイレクトシークエンス)。
【0037】
配列番号:1のmRNAには、上述したように、OATP1B3/wtには存在しないエキソンであるエキソンSVが存在する。このため、このエキソンSVの存在を指標として選択的スプライシングバリアントを測定することができる。すなわち、配列番号:1で表される塩基配列におけるエキソンSVの存在を指標として、配列番号:1で表される塩基配列を含む選択的スプライシングバリアントを測定することができる。
【0038】
エキソンSVの存在を指標として選択的スプライシングバリアントを測定する好ましい方法としては、エキソンSVを含む領域にハイブリダイズするプライマーを用いた核酸増幅法を用いる方法や、エキソンSVを含む領域にハイブリダイズするプローブを用いる方法を挙げることができる。
【0039】
核酸増幅法を用いる方法には、エキソンSVを含む領域に設定したプライマーを一方のプライマーとして用いる核酸増幅法により配列番号:1で表される塩基配列を含むmRNAまたはそのcDNAの部分領域を特異的に増幅し、増幅産物を測定することを含む。ここで、「領域に設定した」とは、その領域とハイブリダイズするという意味であり、また、PCRのような核酸増幅法により増幅される核酸は二本鎖であるから、上述したように、配列表に現実に記載されているセンス鎖にハイブリダイズするプライマー(リバース側プライマー)を用いる場合と、当該センス鎖に相補的なアンチセンス鎖にハイブリダイズするプライマー(フォワード側プライマー)を用いる場合の両者が包含される。したがって、例えば、「エキソンSVを含む領域に設定したプライマー」とは、配列番号:1に現実に記載されたセンス鎖のエキソンSVを含む領域(つまり、1nt〜139nt)にハイブリダイズするプライマー(リバース側プライマー)または当該プライマーに相補的な塩基配列を有するプライマー(フォワード側プライマー)を意味する。また、「特異的に増幅する」とは、配列番号:1で表される塩基配列を含むmRNAまたはそのcDNAの部分領域は増幅されるが、配列番号:2で表される塩基配列を含むmRNAまたはそのcDNAの部分領域は増幅されないことを意味する。なお、配列番号:1で表される塩基配列において、1nt〜139ntがエキソンSVであり、エキソン3は140ntから始まる。したがって、配列番号:1で表される塩基配列において、139ntと140ntとの融合点は、OATP1B3/wtには存在しないエキソンSVとエキソン3との特異的融合点である。ただし、図1からも明らかなように、上記特異的融合点の上流側2塩基は、OATP1B3/wtとOATP1B3/ctとで共通している。したがって、配列番号:1で表される塩基配列における139ntと140ntとの融合点よりも、これに最も近接した他の特異的融合点である137ntと138ntとの融合点が、エキソンSVとエキソン3との特異的融合点としてより適切である。このことから、本明細書において、「エキソンSVを含む領域」としては、1nt〜137ntがより好ましい。
【0040】
テンプレートとなるmRNAの部分領域と同じ塩基配列(ただしuはtになる)を有するDNAを増幅する核酸増幅法の好ましい例として、逆転写PCR(RT−PCR)が挙げられる。RT−PCRでは、細胞からmRNAを常法により抽出し、逆転写酵素の作用によりmRNAをテンプレートとして第一鎖cDNAを生成させ、さらにこの第一鎖cDNAをテンプレートとして相補鎖を生成させて、二本鎖cDNAを得る。次いで、得られた二本鎖cDNAをテンプレートとしてPCRをおこない、該cDNAまたはその部分領域を増幅する。RT−PCR自体は周知の技術であり、そのためのキットや装置も市販されているため、容易に実施することができる。選択的スプライシングバリアント由来のcDNAを特異的に増幅するために、上述した特異的融合点を含む領域に設定したプライマーを一方のプライマーとして用いる。他方のプライマーは、増幅すべきスプライシングバリアントの任意の領域に設定することができる。なお、プライマーのサイズは特に限定されないが、通常15〜35塩基程度であり、好ましくは15〜25塩基程度である。
【0041】
例えば、配列番号:1のmRNAをRT−PCRにより測定する場合、配列番号:1で表される塩基配列中のエクソンSVを含む領域に設定したプライマーを一方のプライマー(フォワード側プライマーでもリバース側プライマーでもよい)として用いる。ここで、選択的スプライシングバリアント由来のcDNAを特異的に増幅するためには、プライマーとして、ストリンジェントな条件下で、配列番号:1のcDNAにはハイブリダイズするが、配列番号:2のcDNAにはハイブリダイズしないものを用いることが好ましい。ここで「ストリンジェントな条件」とは、プライマーがcDNAに対して特異的にハイブリダイゼーションする条件をいい、例えば成書に記載の条件(サムブルック(Sambrook)ら編、「モレキュラークローニング,ア ラボラトリーマニュアル 第2版」、1989年、コールドスプリングハーバーラボラトリー、特に11.45節“Conditions for Hybridization of Oligonucleotide probes”等)にしたがって決定でき、特に制限されない。ストリンジェントな条件は、塩濃度、温度、およびその他の条件によって決まり、例えば、塩濃度が低いほど、温度が高いほど、ストリンジェンシーは高くなり、プライマーとcDNAとがハイブリダイゼーションしにくくなる。塩濃度は、一般に、SSC溶液(NaCl+クエン酸三ナトリウム)の濃度を調節することによって調節され、ストリンジェントな塩濃度は、例えば、NaCl約250mM以下およびクエン酸三ナトリウム約25mM以下である。ストリンジェントな温度は、一般に、完全ハイブリッドの融解温度(Tm)より15〜25℃低い温度であり、例えば、約30℃以上である。溶液に有機溶媒(例えばホルムアミド)を加えることにより、温度を下げることができる。その他の条件としては、ハイブリダイゼーション時間、洗浄剤(例えば、SDS)の濃度、およびキャリアーDNAの存否等であり、これらの条件を組み合わせることによって、様々なストリンジェンシーを設定することができる。好ましい例として、250mM NaCl、25mM クエン酸三ナトリウム、1% SDS、50% ホルムアミド、200μg/mLの変性サケ精子DNAの条件で、42℃の温度によりハイブリダイゼーションをおこなう。また、ハイブリダイゼーション後の洗浄の条件もストリンジェンシーに影響する。この洗浄条件もまた、塩濃度および温度によって定義され、塩濃度の減少と温度の上昇によって洗浄のストリンジェンシーは増加する。好ましい例として、15mM NaCl、1.5mM クエン酸三ナトリウムおよび0.1% SDSの条件で、68℃の温度にて洗浄をおこなう。
【0042】
配列番号:1のcDNAにはハイブリダイズするが、配列番号:2のcDNAにはハイブリダイズしないことを確保するために、ストリンジェントな条件下で、プライマーの20%以上がエキソンSVを含む領域とハイブリダイズするものであることが好ましい。あるいは、ストリンジェントな条件下でも配列番号:2のcDNAとハイブリダイズした場合には、プライマーの3’末端がミスマッチとなるプライマーを用いることが好ましい。たとえストリンジェントな条件下で配列番号:2のcDNAとハイブリダイズしても、プライマーの3’末端がミスマッチであれば増幅は実質的に起きない。さらには、その少なくとも20%以上がエキソンSV内の領域とストリンジェントな条件下でハイブリダイズするものであって、かつ、その3’末端が配列番号:2のcDNAとはミスマッチになるプライマーを用いることが特に好ましい。以上のようなプライマーを一方のプライマーとして用いることにより、配列番号:2のcDNAの共存下であっても、配列番号:1のcDNAのみを特異的に増幅することができる。なお、プライマーとしては、プライマーがハイブリダイズする配列番号:1の塩基配列中の領域と完全に相補的なものが好ましいが、通常、10%以下程度のミスマッチがあってもプライマーとして利用できる場合が多い(ただし、上述したようにプライマーの3’末端がミスマッチとなるものは除く)。
【0043】
PCR自体は常法に従っておこなうことができる。そして、PCRによる増幅後に、増幅産物を測定する。かような増幅産物の測定も、常法によりおこなうことができる。上述したように、本発明における「測定」には、検出および定量の両者が包含される。さらに、増幅産物の電気泳動バンドの蛍光強度測定や、太さの目視判定のような、簡易定量または半定量も「測定」の概念に包含される。増幅産物の測定は、例えば増幅産物を電気泳動にかけ、増幅バンドを検出することによりおこなうことができる。また、蛍光標識したヌクレオチド三リン酸の存在下にPCRをおこなうことによって増幅産物を蛍光標識し、増幅バンドの蛍光強度を測定することによっても、増幅産物の測定をおこなうことができる。さらに、電気泳動パターンをナイロンやニトロセルロースからなるメンブレンに転写し、増幅産物にハイブリダイズする標識プローブをハイブリダイズさせて、標識を検出または定量する(PCR−サザン(Southern)法)によってもおこなうことができる。さらには、増幅産物にハイブリダイズするプローブを固相化し、上記増幅工程を標識ヌクレオチド三リン酸の存在下におこない、固相化プローブに増幅産物を結合させ、固相に結合された増幅産物を測定することによってもおこなうことができる。これらはいずれも常法であり、周知の知見が適宜参照されうる。
【0044】
あるいは、上述したRT−PCRのPCRを、リアルタイム検出PCRによりおこなうと、より正確に増幅産物を定量することができるため、好ましい。リアルタイム検出PCRでは、通常のPCRを、増幅産物にハイブリダイズする2種類の蛍光色素を結合したプローブの存在下でおこなう。2種類の蛍光色素の一方は、他方の蛍光色素からの蛍光発光を打ち消すクエンチャー色素であり、2種類の蛍光色素が同一のプローブ分子に結合されている状態では蛍光は測定されない。これに対し、PCRにより増幅が起きると、まず、プローブが増幅産物にハイブリダイズする。そして、増幅に用いられるDNAポリメラーゼのエキソヌクレアーゼ活性によりプローブが消化されて2種類の蛍光色素がバラバラになると、クエンチャー色素による消光が起きないので蛍光が測定されるようになるのである。測定される蛍光強度が急激に大きくなるサイクル数が、試料中の核酸テンプレートの濃度に依存して変化することから、連続的に反応溶液の蛍光を測定することにより試料中の鋳型核酸の濃度を定量することができる。なお、リアルタイム検出PCR自体は周知の技術であり、そのためのキットも市販されているため、この市販のキットを用いて容易に実施することができる。
【0045】
なお、RT−PCRをおこなう場合、最初のmRNAの抽出時に混入するゲノムDNAに含まれる偽遺伝子を鋳型とする増幅が起きる場合がある。従って、用いるプライマーセットは、このような偽遺伝子に起因する増幅が起きないプライマーを選択したセットであることが好ましい。偽遺伝子に起因する増幅が起きるか否かは、例えば、そのプライマーセットを用い、ゲノムDNAをテンプレートとしてPCRをおこなった場合に、cDNAを鋳型としてPCRをおこなった場合と同じサイズの増幅産物のみが生成するか否かにより判定することができる。後述する実施例で具体的に用いられているプライマーセット(表3)は、このような偽遺伝子による増幅が起きないものである。また、場合によっては、RT−PCRをおこなう前に、用いる予定のRNAをテンプレートとして、ヒトグリセルアルデヒド−3−デヒドロゲナーゼ(GAPDH)などのハウスキーピング遺伝子を増幅するプライマーセット(例えば、表1に記載のもの)を用いたPCRをおこない、増幅産物が得られないことを確認することによっても、ゲノムDNAの混入がないことが保証されうる。
【0046】
以上、本発明の測定方法をRT−PCR法によりおこなう場合を例に挙げて詳細に説明したが、本発明の測定方法は、上述したプライマーを用いて選択的スプライシングバリアントのmRNAもしくはcDNAまたはその部分領域の増幅をおこなう方法であれば、RT−PCR法によりおこなわれるものに限定されず、他のいずれの核酸増幅法を利用するものであってもよい。例えば、NASBA法(3SR法、TMA法)によりmRNAを増幅することもできる。NASBA法では、リバース側プライマーの5’末端にT7プロモーター配列を付加したものをリバース側プライマーとして、AMT−RT等の逆転写酵素の存在下で、mRNAをテンプレートとしてcDNA鎖(アンチセンス鎖)を形成する。得られたRNA/DNA二本鎖ハイブリッドのRNA鎖をRNaseHにより分解して一本鎖cDNA(アンチセンス鎖)とする。次に、この一本鎖cDNAをテンプレートとし、フォワード側プライマーを用いてDNAポリメラーゼ(逆転写酵素としてAMT−RTを用いる場合には、AMT−RTがDNAポリメラーゼ活性を有するため、これで兼用する)の存在下で相補鎖を形成して、二本鎖cDNAとする。この二本鎖cDNAは、T7プロモーター配列を含んでいることから、これにT7 RNAポリメラーゼを作用させると、転写によりRNA(アンチセンス鎖)が次々に形成される。さらに、形成された二本鎖cDNAについて、変性工程、上記フォワード側プライマー及びリバース側プライマーとのアニーリング工程、相補鎖の伸長工程を繰り返すことにより、二本鎖cDNAが増幅され、これを鋳型とした転写によってさらにRNA(アンチセンス鎖)が形成される。このようなNASBA法においても、一方のプライマーとして、上記したプライマーを用いることにより、選択的スプライシングバリアントのみを増幅することができる(ただし、生成物は上記の通りアンチセンス鎖である)。なお、NASBA法自体は周知の技術であり、このためのキットも市販されているため、この市販のキットを用いて容易に実施することができる。
【0047】
エキソンSVの存在を指標として選択的スプライシングバリアントを測定する他の好ましい方法としては、このエキソンSVを含む領域にストリンジェントな条件下でハイブリダイズするプローブを用いる方法がある(in situハイブリダイゼーション法)。プローブとしては、ストリンジェントな条件下で、配列番号:1で表される塩基配列を有する核酸中のエキソンSVの領域にハイブリダイズするが、配列番号:2で表される塩基配列を有する核酸にはハイブリダイズしないものが用いられる。このような特異性を確保するために、プローブの全長の20〜80%、より好ましくは40〜60%がエキソンSV領域にストリンジェントな条件下でハイブリダイズし、残りが隣接するエキソン3領域にストリンジェントな条件下でハイブリダイズするものであることが好ましい。プローブのサイズは、特に限定されないが、オリゴヌクレオチドの場合、通常、10塩基〜全長であり、10塩基〜100塩基程度が好ましく、さらに好ましくは15塩基〜35塩基程度であり、cRNAやcDNAの場合、通常、300塩基〜800塩基程度である。また、プライマーの場合と同様、プローブがハイブリダイズする領域と完全に同一の塩基配列を有することが最も好ましいが、プローブ全長の10%以下の塩基が置換していてもよい。
【0048】
プローブは、上記核酸に蛍光標識、ビオチン標識、放射標識、酵素標識等の周知の標識を結合して標識プローブとすることもできる。また、プローブは、例えば固相化プローブとして用いる場合に、固相に結合させる領域や、分枝プローブにおける標識を結合させるための分枝のような、被検核酸とは無関係な任意の核酸が結合されたものであってもよい。
【0049】
プローブは、被検試料中に含まれる選択的スプライシングバリアントのmRNAの直接的な測定に用いることもできるし、mRNAをRT−PCR等の核酸増幅法で増幅した後、増幅された増幅核酸を測定する目的にも用いることができる。増幅産物をプローブで特異的に測定する場合、核酸増幅には、エキソンSVが増幅産物中に含まれるようにプライマーを設定する。この場合のプライマーは、選択的スプライシングバリアントに特異的なものである必要はなく、測定の特異性はプローブにより確保される。
【0050】
本発明はまた、配列番号:1で表される塩基配列を含む核酸とはハイブリダイズするが、配列番号:2で表される塩基配列を含む核酸が共存していても当該核酸とはハイブリダイズしない核酸、または、配列番号:2で表される塩基配列を含む核酸とハイブリダイズした場合にその3’末端がミスマッチとなる核酸をも提供する。このような核酸は、上述したプライマーやプローブとして用いることができる。このような核酸としては、配列番号:1で表される塩基配列におけるエキソンSVを含む領域とハイブリダイズするが、配列番号:2で表される塩基配列を含む核酸が共存していても当該核酸とはハイブリダイズしない核酸、または、配列番号:2で表される塩基配列を含む核酸とハイブリダイズした場合にその3’末端がミスマッチとなる核酸が、選択的スプライシングバリアントの特異的な測定のためには好ましい。このような本発明の核酸は、塩基数が10以上であることが好ましく、特に塩基数が15〜35であることが好ましい。また、本発明の核酸は、配列番号:1で表される塩基配列またはその部分領域と同じ塩基配列または当該塩基配列のうち10%以下の塩基が置換した塩基配列を有することが好ましく、特に配列番号:1で表される塩基配列またはその部分領域と同じ塩基配列をからなることが好ましい。
【0051】
このような本発明の核酸は、核酸増幅法のプライマーやプローブ等の、選択的スプライシングバリアントの測定用核酸として用いられうる。
【0052】
さらに、本発明は、上述した本発明の測定用核酸を含む、OATP1B3 mRNAの選択的スプライシングバリアントの測定用キットをも提供する。キットに含まれる試薬類は、本発明の測定用核酸以外は周知のものであってよく、例えば、プライマーセットのほか、逆転写酵素、Taq DNAポリメラーゼ、dNTP、ランダムプライマー、RNase阻害剤、緩衝液等を含めて測定用キットにすることができる。あるいは、キットは、フォワード側プライマーおよびリバース側プライマーのみからなるプライマーセットとし、他の試薬類は、市販のRT−PCR用キット等を利用するようにしてもよい。
【0053】
上述した選択的スプライシングバリアントは、がんマーカーとして利用することができる。すなわち、本発明により提供される選択的スプライシングバリアントは、がん細胞・組織において特異的に強く発現することが判明している。よって、本発明により提供される測定方法や測定用キットは、がんの検出に利用することができる。この際、検出対象とされるがんの種類は特に制限されず、例えば、大腸がん、膵臓がん、乳がん、肺がん、前立腺がん、食道がん、胃がん、肝臓がん、胆道がん、脾臓がん、腎がん、膀胱がん、子宮がん、卵巣がん、精巣がん、甲状腺がん、脳腫瘍、造血器腫瘍などの検出に利用されうる。特に、後述する実施例に記載のように、OATP1B3/ctは、ヒト大腸がん組織に加えて、ヒトの大腸がん由来の細胞(LS180、HCT116)およびヒトの膵臓がん由来の細胞(PK45p)にも強く発現していることが確認されている。これに対し、ヒト正常大腸由来の組織にはOATP1B3/ctの発現が確認されなかったことから、本発明により提供される選択的スプライシングバリアントは、大腸がんおよび膵臓がんのマーカーとして特に有用である。
【0054】
本発明の他の形態によれば、がんの予防および/または治療剤のスクリーニング方法が提供される。このスクリーニング方法は、まず、がん細胞を被検物質の存在下で培養する。そして、得られる培養細胞において、上述した本発明の選択的スプライシングバリアントを測定する。次いで、得られた測定結果を、上記被検物質の非存在下における場合と比較および/または評価する。
【0055】
具体的には、上述した各種がん由来のがん細胞株を、抗がん剤、抗がん候補物質、低分子化合物、天然有機高分子物質、天然の動植物の抽出物、ペプチドなどの被検物質の存在下で培養し、当該培養細胞における本発明の選択的スプライシングバリアントを測定(検出、半定量、または定量)し、選択的スプライシングバリアントの形態が、被検物質の非存在下における場合と比べて有意に減少しているときに、被検物質は上記細胞株が由来とするがんの予防および/または治療剤として有用である可能性があると判断する。
【0056】
本発明のスクリーニング方法において、ヒト大腸がん由来の細胞株(例えば、LS180やHCT116)を用いることで、ヒト大腸がんの予防および/または治療剤のスクリーニングをおこなうことができる。同様に、ヒト膵臓がん由来の細胞株(例えば、PK45p)を用いることで、ヒト膵臓がんの予防および/または治療剤のスクリーニングをおこなうことができる。その他の周知のがん・腫瘍由来の細胞株についても、同様に用いることで各種がん・腫瘍の予防および/または治療剤のスクリーニングをおこなうことが可能である。
【0057】
また、本発明のスクリーニング方法において、選択的スプライシングバリアントを測定する方法としては、上述した本発明の測定方法や測定用キットが同様に用いられうる。よって、ここでは詳細な説明を省略する。
【0058】
本発明者らの検討によれば、OATP1B3/ct mRNAから少なくとも4種のポリペプチドが発現しうることが判明した。具体的には、配列番号:5、配列番号:7、配列番号:9、および配列番号:11のそれぞれで表されるアミノ酸配列からなるポリペプチドが、OATP1B3/ct mRNAから発現しうることが確認された。これらのポリペプチドは、OATP1B3/wt mRNAからは理論上発現できず、OATP1B3/ct mRNAに特異的なものである。このため、これらのポリペプチドは、OATP1B3/ct mRNAと同様にがんマーカーとしての有用性を有するものである。
【0059】
上記の観点から、本発明の他の形態によれば、
(1)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列からなるポリペプチド;および、
(2)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド、あるいは、配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列において、10%以下のアミノ酸が置換、欠失、および/または挿入されたアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド(以下、「機能的等価改変体」とも称する);および、
が提供される。
【0060】
「(2)機能的等価改変体」としては、「配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド」、あるいは、「配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列において、0〜10%、好ましくは0〜7%、さらに好ましくは0〜5%、特に好ましくは0〜2%のアミノ酸が置換、欠失、および/または挿入されたアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド」が含まれる。
【0061】
「がん細胞またはがん組織において発現が増強する」とは、非がん細胞または非がん組織と比較してがん細胞またはがん組織において発現が2倍以上増強することを意味する。
【0062】
以上、本形態のポリペプチドについて説明したが、配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列からなるポリペプチド、および上記機能的等価改変体を総称して、以下、「本発明のポリペプチド」とも称する。また、「本発明のポリペプチド」のうち、配列番号:5で表されるアミノ酸配列からなるポリペプチドを「f1−1」、配列番号:7で表されるアミノ酸配列からなるポリペプチドを「f1−2」、配列番号:9で表されるアミノ酸配列からなるポリペプチドを「f2」、配列番号:11で表されるアミノ酸配列からなるポリペプチドを「f3」とそれぞれ称する。
【0063】
本発明のポリペプチドとしては、f1−1またはf3が特に好ましい。
【0064】
本発明のさらに他の形態によれば、本発明のポリペプチドをコードする核酸もまた、提供される。
【0065】
ここで、本発明のポリペプチドであるf1−1をコードする塩基配列からなる核酸は、配列番号:5で表されるアミノ酸配列からなるf1−1、またはその機能的等価改変体をコードする塩基配列であれば特に制限はない。好ましくは、配列番号:5で表されるアミノ酸配列をコードする塩基配列からなる核酸であり、さらに好ましくは、配列番号:4で表される塩基配列からなる核酸である。
【0066】
同様に、本発明のポリペプチドであるf1−2をコードする塩基配列からなる核酸は、配列番号:7で表されるアミノ酸配列からなるf1−2、またはその機能的等価改変体をコードする塩基配列であれば特に制限はない。好ましくは、配列番号:7で表されるアミノ酸配列をコードする塩基配列からなる核酸であり、さらに好ましくは、配列番号:6で表される塩基配列からなる核酸である。
【0067】
また、本発明のポリペプチドであるf2をコードする塩基配列からなる核酸は、配列番号:9で表されるアミノ酸配列からなるf2、またはその機能的等価改変体をコードする塩基配列であれば特に制限はない。好ましくは、配列番号:9で表されるアミノ酸配列をコードする塩基配列からなる核酸であり、さらに好ましくは、配列番号:8で表される塩基配列からなる核酸である。
【0068】
さらに、本発明のポリペプチドであるf3をコードする塩基配列からなる核酸は、配列番号:11で表されるアミノ酸配列からなるf3、またはその機能的等価改変体をコードする塩基配列であれば特に制限はない。好ましくは、配列番号:11で表されるアミノ酸配列をコードする塩基配列からなる核酸であり、さらに好ましくは、配列番号:10で表される塩基配列からなる核酸である。
【0069】
また、本発明のさらに他の形態によれば、上記核酸を含む発現ベクター、当該発現ベクターで形質転換された細胞もまた、提供される。
【0070】
本発明の発現ベクターや細胞は、従来公知の知見を参照することにより作製することができる。例えば、単離された本発明の核酸を、適当なベクターDNAに再び組込むことにより、真核生物または原核生物の宿主細胞を形質転換させることができる。また、これらのベクターに適当なプロモーターおよび形質発現に関連する配列を導入することにより、それぞれの宿主細胞において核酸を発現させることが可能である。
【0071】
本発明の発現ベクターは、本発明の核酸を含む限り、特に限定されるものではなく、例えば、用いる宿主細胞に応じて適宜選択した公知の発現ベクターに、本発明の核酸を挿入することにより得られる発現ベクターを挙げることができる。
【0072】
また、本発明の細胞も、本発明の発現ベクターでトランスフェクションされ、本発明の核酸を含む限り、特に限定されるものではなく、例えば、本発明の核酸が、宿主細胞の染色体に組み込まれた細胞であってもよいし、あるいは、本発明の核酸を含む発現ベクターの形で含有する細胞であってもよい。また、本発明のポリペプチドを発現している細胞であってもよいし、あるいは、本発明のポリペプチドを発現していない細胞であってもよい。本発明の細胞は、例えば、本発明の発現ベクターにより、所望の宿主細胞をトランスフェクションすることにより得ることができる。
【0073】
上記で得られる所望の細胞は、常法に従い培養することができ、該培養により本発明のポリペプチドが生産される。該培養に用いられる培地としては、採用した宿主細胞に応じて慣用される各種のものが適宜選択されうる。
【0074】
上記により、形質転換細胞に生産される本発明のポリペプチドは、その物理的性質や生化学的性質等を利用した各種の公知の分離操作法により、分離・精製することができる。
【0075】
本発明のポリペプチドは、マーカー配列とインフレームで融合して発現させることで、その発現の確認、精製等が可能になる。マーカー配列としては、例えば、FLAG epitope、Hexa−Histidine tag、Hemagglutinin tag、myc epitopeなどがある。また、マーカー配列とポリペプチドとの間にエンテロキナーゼ、ファクターXa、トロンビンなどのプロテアーゼが認識する特異的なアミノ酸配列を挿入することにより、マーカー配列部分をこれらのプロテアーゼにより切断除去することも可能である。
【0076】
本発明の核酸は、それ自体、またはその一部をがんの検出方法においてハイブリダイズプローブとして用いることができ、がんの検出に有用である。また、本発明のポリペプチドは、本発明のポリペプチドを特異的に認識する抗体の作製や、発現レベルを検出・定量する際のコントロールとして用いることができる。
【0077】
本発明によれば、本発明のポリペプチドに結合する抗体(以下、「本発明の抗体」とも称する)もまた、提供されうる。本発明の抗体の製造方法は、特に限定されるものではない。本発明の抗体(例えば、ポリクローナル抗体、モノクローナル抗体)は、例えば、各種動物に配列番号:5で表されるアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド、配列番号:5で表されるアミノ酸配列において1または数個のアミノ酸が置換、欠失、および/または挿入されたアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド、あるいは、配列番号:5で表されるアミノ酸配列からなるポリペプチドの全部またはその断片を直接投与することにより、得ることができる。また、前記ポリペプチドをコードする遺伝子を導入したプラスミドを用いてDNAワクチン法(Raz,E.et al.,Proc.Natl.Acad.Sci.USA,91,9519−9523,1994;Donnelly,J.J.et al.,J.Infect.Dis.,173,314−320,1996)によっても得ることができる。
【0078】
ポリクローナル抗体は前記ポリペプチドまたはその断片をフロイント完全アジュバントなどの適当なアジュバントに乳濁し、腹腔、皮下または静脈等に免疫して感作した動物、例えばウサギ、ラット、ヤギ、またはニワトリ等の血清または卵から製造される。このように製造されたポリクローナル抗体は常法のタンパク質単離精製法により、分離精製することができ、常法のタンパク質単離精製法としては例えば、遠心分離、透析、硫酸アンモニウムによる塩析、DEAE−セルロース、ハイドロキシアパタイト、プロテインAアガロース等によるクロマトグラフィー法が挙げられる。
【0079】
モノクローナル抗体は、ケーラーとミルスタインの細胞融合法(Kohler,G.and Milstein,C.,Nature,256,495−497,1975)により当業者が容易に製造することが可能である。
【0080】
本発明のさらに他の形態によれば、配列番号4、配列番号6、配列番号8、または配列番号10で表される塩基配列を含む核酸とストリンジェントな条件下でハイブリダイズし、少なくとも15塩基を有する核酸もまた、提供される。なお、「ストリンジェントな条件」については上述した通りである。このような核酸は、本発明の核酸を検出、単離するためのプローブとして、また、本発明の核酸を増幅するためのプライマーとして利用することが可能である。プライマーとして用いる場合には、通常、15bp〜100bp、好ましくは15bp〜40bpの鎖長を有する。プライマーとして好ましい塩基配列は、後述する実施例の「9.緑色蛍光タンパク質(GFP)融合ctOATP1B3ペプチド発現プラスミドの作製」においてf1−1、f1−2、f2およびf3のそれぞれを増幅するのに用いられているプライマーの塩基配列が挙げられる。また、プローブとして用いる場合には、本発明の核酸の一部もしくは全部の配列(またはその相補配列)を有し、少なくとも15bpの鎖長のDNAが用いられる。
【0081】
上記核酸を用いたプローブやプライマーは、がんの検出に利用することができる。
【0082】
なお、本発明に基づいて、本発明の核酸の塩基配列またはその断片を含むオリゴヌクレオチドプローブのアレイを構築することもできる。アレイ技法は公知で、遺伝子発現を解析するために用いられている(Chee,M.et al.(1996)Science,.274,610−613)。
【0083】
本発明のポリペプチドは、がんの検出方法にも適用されうる。すなわち、本発明の他の形態によれば、生体から分離した被検試料中の、本発明のポリペプチドの量を測定することを含む、がんの検出方法が提供される。この際、上述した本発明の抗体を測定に用いることが好ましい。また、当該抗体を含む、がんの検出用キットも提供されうる。以下、この形態について、より詳細に説明する。
【0084】
被検試料中の、本発明のポリペプチドの検出は、例えば、被検試料を各種の分子量測定法、例えば、ゲル電気泳動や、各種の分離精製法(例:イオン交換クロマトグラフィー、疎水性クロマトグラフィー、アフィニティークロマトグラフィー、逆相クロマトグラフィーなど)、イオン化法(例:電子衝撃イオン化法、フィールドディソープション法、二次イオン化法、高速原子衝突法、マトリックス支援レーザー脱離イオン化(MALDI)法、エレクトロスプレーイオン化法など)、質量分析計(例:二重収束質量分析計、四重極型分析計、飛行時間型質量分析計、フーリエ変換質量分析計、イオンサイクロトロン質量分析計など)を組み合わせる方法等に供し、本発明のポリペプチドの分子量と一致するバンドもしくはスポット、またはピークを検出することによりおこなうことができるが、これらに限定されない。本発明のポリペプチドはアミノ酸配列が既知であることから、当該アミノ酸配列を認識する抗体を作製して、ウエスタンブロッティングや各種イムノアッセイにより本発明のポリペプチドを検出する方法が、より好ましく用いられうる。なお、当該抗体の作製方法については、上述した通りである。本発明の抗体を用いて本発明のポリペプチドを検出する方法は、最適化されたイムノアッセイ系を構築してこれをキット化すれば、質量分析装置のような特殊な装置を使用することなく、高感度かつ高精度に本発明のポリペプチドを検出することができる点で、特に有用である。
【0085】
本発明の抗体を用いる本発明のがんの検出方法は、特に制限されないが、被検試料中の抗原量に対応した抗体、抗原または抗体−抗原複合体の量を化学的または物理的手段により検出し、これを既知量の抗原を含む標準液を用いて作製した標準曲線より算出する測定法であれば、いずれの測定法を用いてもよい。例えば、ネフロメトリー、競合法、イムノメトリック法およびサンドイッチ法等が好適に用いられる。
【0086】
標識物質を用いる測定法に用いられる標識剤としては、例えば、放射性同位元素、酵素、蛍光物質、発光物質などが用いられる。放射性同位元素としては、例えば、〔125I〕、〔131I〕、〔3H〕、〔14C〕などが用いられる。上記酵素としては、安定で比活性の大きなものが好ましく、例えば、β-ガラクトシダーゼ、β-グルコシダーゼ、アルカリフォスファターゼ、パーオキシダーゼ、リンゴ酸脱水素酵素などが用いられる。蛍光物質としては、例えば、フルオレスカミン、フルオレセインイソチオシアネートなどが用いられる。発光物質としては、例えば、ルミノール、ルミノール誘導体、ルシフェリン、ルシゲニンなどが用いられる。さらに、抗体あるいは抗原と標識剤との結合にビオチン-アビジン系を用いることもできる。
【0087】
抗原または抗体の不溶化に当っては、物理吸着を用いてもよく、また通常タンパク質あるいは酵素等を不溶化、固定化するのに用いられる化学結合を用いる方法でもよい。担体としては、アガロース、デキストラン、セルロースなどの不溶性多糖類、ポリスチレン、ポリアクリルアミド、シリコン等の合成樹脂、またはガラス等が挙げられる。
【0088】
サンドイッチ法においては、不溶化した本発明の抗体に被検試料を反応させ(1次反応)、さらに標識化した別の本発明の抗体を反応させ(2次反応)た後、不溶化担体上の標識剤の量(活性)を測定することにより、被検試料中の本発明のペプチド量を定量することができる。1次反応と2次反応は逆の順序におこなっても、また、同時におこなってもよいし時間をずらしておこなってもよい。
【0089】
本発明のポリペプチドに対するモノクローナル抗体を、サンドイッチ法以外の測定システム、例えば、競合法、イムノメトリック法あるいはネフロメトリーなどに用いることもできる。
【0090】
競合法では、被検試料中の抗原と標識抗原とを抗体に対して競合的に反応させた後、未反応の標識抗原(F)と、抗体と結合した標識抗原(B)とを分離し(B/F分離)、B/Fいずれかの標識量を測定し、被検試料中の抗原量を定量する。本反応法には、抗体として可溶性抗体を用い、B/F分離をポリエチレングリコール、前記抗体に対する第2抗体などを用いる液相法、および、第1抗体として固相化抗体を用いるか、あるいは、第1抗体は可溶性のものを用い第2抗体として固相化抗体を用いる固相化法とが用いられる。
【0091】
イムノメトリック法では、被検試料の抗原と固相化抗原とを一定量の標識化抗体に対して競合反応させた後固相と液相を分離するか、または、被検試料中の抗原と過剰量の標識化抗体とを反応させ、次に固相化抗原を加え未反応の標識化抗体を固相に結合させた後、固相と液相を分離する。次に、いずれかの相の標識量を測定し被検試料中の抗原量を定量する。
【0092】
また、ネフロメトリーでは、ゲル内または溶液中で抗原抗体反応の結果生じた不溶性の沈降物の量を測定する。被検試料中の抗原量が僅かであり、少量の沈降物しか得られない場合にもレーザーの散乱を利用するレーザーネフロメトリーなどが好適に用いられる。
【0093】
これら個々の免疫学的測定法を本発明の検出方法に適用するにあたっては、特別の条件、操作等の設定は必要とされない。それぞれの方法における通常の条件、操作法に当業者の通常の技術的配慮を加えて本発明のポリペプチドの測定系を構築すればよい。これらの一般的な技術手段の詳細については、総説、成書などを参照することができる。
例えば、入江 寛編「ラジオイムノアッセイ」(講談社、昭和49年発行)、入江 寛編「続ラジオイムノアッセイ」(講談社、昭和54年発行)、石川栄治ら編「酵素免疫測定法」(医学書院、昭和53年発行)、石川栄治ら編「酵素免疫測定法」(第2版)(医学書院、昭和57年発行)、石川栄治ら編「酵素免疫測定法」(第3版)(医学書院、昭和62年発行)、「Methods in ENZYMOLOGY」 Vol. 70 (Immunochemical Techniques (Part A))、同書 Vol. 73 (Immunochemical Techniques (Part B))、同書 Vol. 74 (Immunochemical Techniques (Part C))、同書 Vol. 84 (Immunochemical Techniques (Part D: Selected Immunoassays))、同書 Vol. 92 (Immunochemical Techniques (Part E: Monoclonal Antibodies and General Immunoassay Methods))、同書 Vol. 121 (Immunochemical Techniques (Part I: HybridomaTechnology and Monoclonal Antibodies))(以上、アカデミックプレス社発行)などを参照することができる。
【0094】
あるいは、本発明の抗体を用いる別の本発明の検出方法として、当該抗体を上述したような質量分析計に適合しうるプローブの表面上に固定化し、当該プローブ上の当該抗体に被検試料を接触させ、当該抗体に捕捉された生体試料成分を質量分析にかけ、当該抗体が認識するマーカーペプチドの分子量に相当するピークを検出する方法が挙げられる。
【0095】
上記のいずれかの方法により、被検試料において、本発明のポリペプチドが、コントロール試料におけるレベルと統計学的に有意な差をもって検出された場合には、被検試料中にがん細胞またはがん組織が含まれている可能性が高いと診断することができる。
【0096】
本発明のさらに他の形態では、医薬が提供される。当該医薬は、上述した本発明のポリペプチドもしくはその断片、または本発明の核酸もしくはその断片を含み、特異的な細胞傷害性T細胞(CTL)を誘導するためのものである。当該医薬は、好ましくはがんワクチンである。以下、この形態について、より詳細に説明する。
【0097】
本発明の医薬が本発明のポリペプチドまたはその断片を含む場合、当該ポリペプチドまたはその断片は、HLAと結合して特異的な細胞傷害性T細胞(CTL)を誘導しうるものである必要がある。この観点から、当該ポリペプチドまたはその断片は、本発明のポリペプチドにおける連続する8〜11個のアミノ酸残基からなることが好ましい。なお、特異的なCTLを誘導するポリペプチドの断片は、本技術分野における公知の知見を参照して容易に作製することができる。
【0098】
「HLAと結合して特異的なCTLを誘導しうる」とは、本発明のポリペプチドもしくはその断片、または本発明の核酸もしくはその断片がHLAと結合して複合体を形成し、かかる複合体をCTLが認識できることをいう。換言すれば、本発明のポリペプチドもしくはその断片、または本発明の核酸もしくはその断片が、HLAとの結合活性を有し、かつ、HLAとの複合体の形で、特異的なCTLを誘導する活性を有することを意味する。
【0099】
一方、本発明の医薬が本発明の核酸またはその断片を含む場合、当該核酸がコードするアミノ酸配列を有するポリペプチドは、それ自体がCTLにより認識され、当該CTLを活性化するか、そのような活性を有するポリペプチド断片を与えることができ、腫瘍抗原として機能しうる。本形態において用いられる核酸またはその断片は、本発明のポリペプチドをコードする領域に対応する少なくとも24個以上の塩基からなるポリヌクレオチドまたはその相補鎖であることが好ましい。このようなポリヌクレオチドは、例えば公知のタンパク質発現系を利用して発現ペプチドを確認することにより選択されうる。
【0100】
本発明の医薬は、例えば、がんワクチンとして使用することができる。1種類のポリペプチドもしくはその断片または核酸もしくはその断片のみでもがんワクチンとして有効であるが、複数種類のものを組み合わせて使用するのが好ましい。これは、がん患者のCTLが複数の異なる種類の腫瘍抗原を認識する細胞の集団であることから、複数種類の腫瘍抗原を組み合わせてがんワクチンとして使用する方がより効果的であると期待されるためである。また、本発明のポリペプチドや本発明の核酸は、これら以外のポリペプチドや核酸と併用されてもよい。
【0101】
本発明により提供されるがんワクチンは、適当なアジュバントの存在または非存在下で、単独で、または製薬的に許容される担体と結合して使用することができる。担体は、人体に有害な作用を起こさなければ特に制限はなく、例えば、セルロース、重合アミノ酸、アルブミン等が使用できる。剤形は、ペプチド製剤について周知の剤形が選択可能である。投与量は、CTLによる認識性、治療すべき疾患、患者の年齢、体重等により変化するが、ペプチドの場合、活性本体として、通常、0.0001mg〜1000mg、好ましくは0.001mg〜1000mg、より好ましくは0.1mg〜100mg、さらに好ましくは0.1〜10mg/日/成人ヒトである。これを数日、数週、または数ヶ月に1回投与すればよい。
【0102】
本発明の医薬はまた、本発明のポリペプチドまたはその断片をコードする核酸またはその断片を適当なベクターに組み込み、in vivoまたはex vivoで導入するのに利用することができる。ベクターとしては、例えばレトロウイルス、アデノウイルス、ワクシニアウイルス等が挙げられるが、レトロウイルス系が好ましい。投与量は、CTLによる認識性により変化するが、DNA含量として0.1μg〜100mg/日/成人ヒト、好ましくは1μg〜50mg/日/成人ヒトである。これを数日、数週、または数ヶ月に1回投与すればよい。
【実施例】
【0103】
以下、実施例および参考例により本発明をより具体的に説明するが、本発明の技術的範囲はこれらに限定されない。
【0104】
1.プライマー
ゲノムDNAコンタミネーションチェック、5’cDNA末端のRNAリガーゼ媒介迅速増幅(RLM-RACE;RNA ligase-mediated rapid amplification of 5’cDNA)、逆転写PCR(RT-PCR;Reverse Transcription-Polymeraze Chain Reaction)、cDNAクローニング、定量的リアルタイムPCR(Quantitative real-time PCR)、およびGFP融合ペプチド発現プラスミドからのペプチド発現に用いたプライマーは、インビトロジェン(カールスバッド,カリフォルニア州,アメリカ)またはグライナー−バイオ−ワン(タウフキルヒェン,ドイツ)に依頼して合成したものであり、それぞれ下記の表1〜表6に示す塩基配列を有する。
【0105】
【表1】

【0106】
【表2】

【0107】
【表3】

【0108】
【表4】

【0109】
【表5】

【0110】
【表6】

【0111】
2.細胞培養法
ヒト結腸がん由来細胞株であるLS180細胞は大日本住友製薬(大阪)より購入した。ヒト大腸がん由来細胞株であるHCT116細胞はボーゲルシュタイン博士(Dr.Vogelstein)(ジョンズホプキンス大学、ボルチモア、メリーランド州)よりご恵与いただいた。ヒト膵臓がん由来細胞株であるPK45p細胞は東北大学加齢医学研究所付属医用細胞資源センター(仙台)より入手した。LS180細胞およびPK45p細胞は、それぞれ10%非働化ウシ胎児血清(FBS)(ジェミニ バイオ−プロダクツ,カリフォルニア州)および50単位/mLペニシリン−50μg/mLストレプトマイシン(インビトロジェン)を加えた最小必須培地(MEM;Minimum Essential Medium)(インビトロジェン)またはRPMI(Roswell Park Memorial Institute)1640培地(インビトロジェン)を培地とし、5%CO2/95%Airを気相とした37℃のCO2インキュベーター内にて培養した。
【0112】
3.実験検体
白人種肝検体は、HAB(Human and Animal Bridging)協議会(東京)より入手した。上記検体は、米国立疾病研究互助組織(NDRI;National Disease Research Interchange)(フィラデルフィア,ペンシルバニア州)を介して米国から輸入された移植不適合のヒト肝組織である。なお、上記肝組織は肝炎等の感染症のないものを用いた。なお、本研究におけるこれら検体の研究利用は、千葉大学大学院薬学研究院倫理委員会において事前に承認されている。
【0113】
4.Total RNAの抽出
細胞からのtotal RNA抽出は、FastPureTMRNA Isolation Kit(タカラバイオ株式会社,滋賀)を用いてプロトコールに従いおこなった。抽出したtotal RNAにゲノムDNAの混入がないことを、20μL中にGoTaq Green Master Mix(プロメガ,マディソン,ワイオミング州)10μL、並びに、プライマー(上記表1に記載のヒトグリセルアルデヒド−3−デヒドロゲナーゼ(GAPDH) FおよびGAPDH R)各0.5μL、RNA 1μLを含む反応溶液を用いたPCRにより確認した。PCR反応は、95℃にて30秒間加熱した後、95℃10秒、50℃10秒および72℃30秒のサイクルを40回おこなった。白人種肝からのtotal RNA抽出についても、FastPureTM RNA Isolation Kitを用いてプロトコールに従いおこなった。ヒト大腸がん/正常大腸ペアtotal RNAは、アプライドバイオシステムズ(フォスターシティ,マサチューセッツ州)より購入した。
【0114】
5.SLCO1B3遺伝子の転写開始点の決定
GeneRacerTMKit(インビトロジェン)を用いたRLM−5’−RACE法により、SLCO1B3遺伝子の転写開始点を決定した。テンプレートとしてヒト大腸がん由来total RNAまたは白人種肝由来total RNAを用い、手順はプロトコールに従いおこなった。PCR反応は、20μL中にGoTaq Green Master Mix 10μL、Reverse transcriptionテンプレート 1μL、10μM GeneRacerTM5’プライマーおよびReverse gene specificプライマー(上記表2に記載の「SLCO1B3 648R」)各0.5μLを含むPCR反応溶液を調製し、これを94℃にて2分間加熱した後、94℃30秒、68℃30秒、72℃1分のサイクルを5回、94℃30秒、66℃30秒、72℃1分のサイクルを5回、94℃30秒、65℃30秒、72℃1分のサイクルを30回繰り返したTouch−downPCRをおこなった。このTouch−downPCRの後、PCR反応溶液を滅菌水で5倍希釈したものをテンプレートとして、Nested−PCRをおこなった。Nested−PCRは、20μL中にGoTaq Green Master Mix 10μL、テンプレート1μL、10μM GeneRacerTM5’ NestedプライマーおよびReverse Nested gene specificプライマー(上記表2に記載の「SLCO1B3 424Rnest」)各0.5μLを含むPCR反応溶液を調製し、これを95℃にて30秒間加熱した後、95℃10秒、53℃10秒および72℃30秒のサイクルを40回繰り返した。PCR産物は3%アガロースゲル電気泳動をおこない、エチジウムブロマイド染色により可視化した。電気泳動の結果を図3に示す。図3に示すように、白人種肝由来total RNAをテンプレートとして用いたサンプルでは、既報の転写開始点(図1に示す「TSS」)由来のバンドが確認された。これに対し、ヒト大腸がん由来total RNAをテンプレートとして用いたサンプルでは、既報の転写開始点由来のバンドよりも塩基長の短いバンドが確認された。この結果から、ヒト大腸がん由来OATP1B3 mRNAにおいては、既報とは異なる(既報のものよりも下流(3’)側に位置する)転写開始点が存在することが示唆された。なお、図3に示す「Non-template control」とは、テンプレートを含まない陰性コントロールである(後述する図5における「NTC」も同旨である)。
【0115】
続いて、上記で得られたNested−PCR産物を含むDNA断片を分離精製した後、DynaExpress TA PCR Cloning Kit(株式会社バイオダイナミクス研究所、東京)を用いてpTAC−1ベクターに挿入し、アンピシリンを用いて選択した。プラスミドDNAはPlasmid Miniprep Kit(バイオ−ラッド ラボラトリーズ)を用いて精製した。得られたプラスミドDNAの塩基配列は、CEQTM DTCS-Quick Start Mix(ベックマン コールター、フラートン、カリフォルニア州)を用いてサイクルシークエンス反応をおこない、CEQ 2000 XL DNA analysis system(ベックマン コールター)により解析し、SLCO1B3遺伝子の新規な転写開始点を同定した。
【0116】
SLCO1B3遺伝子の新規転写開始点付近の塩基配列をヒトゲノムDNAのデータベースと照合したところ、新規転写開始点はSLCO1B3遺伝子のイントロン2の領域内に存在し、さらにここに新たなエキソン(エキソンSV)が存在することが明らかとなった。また、このエキソンSVはOATP1B3/wtのエキソン3へとスプライシングされていた(図4を参照)。
【0117】
6.cDNAの作製およびRT−PCR法によるmRNA発現解析
上記4.に記載の手法により抽出したLS180細胞total RNA、PK45p細胞、ヒト大腸がん/正常大腸ペアRNAおよび白人種肝由来のtotal RNAをテンプレートとして用い、High Capacity cDNA Reverse Transcription kit(アプライド バイオシステムズ)を用いて逆転写反応をおこない、cDNAを作製した。このcDNAをテンプレートとしてRT−PCRをおこない、新規OATP1B3 mRNAの発現量を解析した。PCRは、20μL中にGoTaq Green Master Mix 10μL、テンプレートcDNA 1μL、10μM ForwardおよびReverseプライマー(上記表3に記載の「SLCO1B3 TSS in cancer 33F」および「SLCO1B3 TSS in cancer 145R」)各0.5μLを含むPCR反応溶液を調製し、これを95℃にて30秒間加熱した後、95℃10秒、各プライマーに適したアニーリング温度(上記表3に記載の「アニーリング温度」)10秒および72℃15〜20秒のサイクルを38回おこなった。PCR産物は3%アガロースゲル電気泳動をおこない、エチジウムブロマイド染色により可視化した。電気泳動の結果を図5に示す。図5に示すように、ヒト大腸がん組織に加え、大腸がん由来LS180細胞およびHCT116細胞、膵臓がん由来PK45p細胞においても新規OATP1B3 mRNAの発現が認められた。一方、正常ヒト大腸組織においてはこのmRNAの発現は認められなかった。これらの結果より、新規OATP1B3 mRNAはがん細胞/組織に高く発現する分子種であると考えられることから、これを「OATP1B3/ct」とした。
【0118】
7.OATP1B3/ctのcDNAクローニング
OATP1B3/ctのcDNAクローニングは、ヒト大腸がん由来のcDNAをテンプレートとして、上記表4に記載のプライマーセット(ctSLCO1B3 cloning F33およびctSLCO1B3 cloning 2149R)並びにPrimeSTAR HS DNA polymerase(タカラバイオ株式会社,滋賀)を用いたPCRによりおこなった。なお、表4に示すように、OATP1B3/ctのcDNAクローニングに用いたフォワードプライマーは、上記「6.cDNAの作製およびRT−PCR法によるmRNA発現解析」のRT−PCRに用いた「SLCO1B3 TSS in cancer 33F」と同一である。PCRは94℃3分の後、98℃10分、58℃5秒、72℃2分30秒を40サイクル繰り返し、72℃3分を最終ステップとした条件でおこなった。得られたPCR産物は1%アガロースゲル電気泳動により分離し、抽出精製した後、pCR Blunt-II TOPO vector(インビトロジェン)に挿入した。得られた構築物をXbaI(ニッポンジーン、東京)およびBamHI(ニッポンジーン)で処理することにより、OATP1B3/ct cDNAを切り出し、これを同様に処理したpcDNA3.1(-) Neo vector(インビトロジェン)とライゲーションすることにより、OATP1B3/ct/pcDNA3.1(-)を作製した。
【0119】
なお、同様の手法により、OATP1B3/wtのcDNAクローニングもおこなった。具体的には、白人種肝由来のcDNAをテンプレートとして、上記表4に記載のプライマーセット(SLCO1B3 F27およびSLCO1B3 2184R)並びにKOD-plus-Polymerase (TOYOBO、大阪)を用いたPCRによりおこなった。PCR反応は94℃3分の後、94℃30秒、48℃30秒、68℃2分30秒を35サイクル繰り返し、68℃5分を最終ステップとした条件でおこなった。得られたPCR産物は1%アガロースゲル電気泳動により分離し、抽出精製した後、pCR Blunt-II TOPO vector(インビトロジェン)に挿入した。得られた構築物をApaI(ニッポンジーン)およびBamHIで処理することによってOATP1B3/wt cDNAを切り出し、これを同様に処理したpcDNA3.1(-) Neo vectorとライゲーションすることにより、OATP1B3/wt/pcDNA3.1(-)を作製した。
【0120】
上記で作製した2つのプラスミド中のOATP1B3/ctまたはOATP1B3/wtの塩基配列を、CEQ 2000 Dye terminator Cycle Sequencing with Quick Start Kit(ベックマン コールター)およびCEQ 2000 XL DNA analysis system(ベックマン コールター)を用いて解析した。図1には、これにより配列決定されたOATP1B3/ctのcDNA配列(配列番号:1)が、OATP1B3/wtのcDNA配列(Refseq Accession No.NM_019844、配列番号:2)とともに示されている。また、図1および図4に示すように、OATP1B3/ctでは、OATP1B3/wtのエキソン1およびエキソン2が欠失しており、これに代えてエキソンSVが存在し、OATP1B3/wtのエキソン3へとスプライシングされていることが確認される。
【0121】
8.定量的リアルタイムPCRによるmRNA発現解析
上記6.に記載の手法により作製したGHL pool(5つの日本人肝サンプルから調製したcDNAプール)、HHL pool(5つの白人種肝サンプルから調製したcDNAプール)、ヒト大腸がん組織、LS180細胞、PK45p細胞、およびHCT116細胞のそれぞれのcDNA、並びに、上記7.に記載の手法により作製したプラスミドを用いて定量的リアルタイムPCRをおこない、検量線法を用いてOATP1B3/ctおよびOATP1B3/wtのそれぞれのmRNAの定量をおこなった。PCRおよびDNA増幅の検出には、ABI PRISM(登録商標) 7000(アプライド バイオシステムズ)を用いた。
【0122】
OATP1B3/ct mRNAの検出は、20μL中にcDNAテンプレート 1μL、2×FastStart Universal Probe Master (ROX)(ロシュ、ペンツバーグ、ドイツ)10μL、Universal Probe #59 (ロシュ) 0.2μL、および上記表5に記載のプライマーセット(ctSLCO1B3 Left 59-76、およびctSLCO1B3Right 130-151)各0.4μLを含むPCR反応溶液を調製し、これを95℃5分の後、95℃15秒、60℃1分のサイクルを45回繰り返した2 step PCRでおこなった。
【0123】
一方、OATP1B3/wt mRNAの検出は、20μL中にcDNAテンプレート 1 μL、2×SYBER Premix Ex Taq II(タカラバイオ)10μL、50×ROX Reference Dye(タカラバイオ)0.4μLおよび上記表5に記載のプライマーセット(SLCO1B3 F153 for real-time、およびSLCO1B3R194 for real-time)各0.8μLを含むPCR反応溶液を調製し、これを95℃20秒の後、95℃5秒、60℃33秒のサイクルを40回繰り返した2 step PCRでおこなった。
【0124】
検量線用サンプルは、OATP1B3/ct mRNA測定には上記7.に記載の手法により作製したOATP1B3/pTOPOをテンプレートとし、1ウェルあたりのモル数が2.86×10−23〜1.43×10−17モル内の5点を用いて作製した。一方、OATP1B3/wt mRNA測定には上記7.に記載の手法により作製したOATP1B3/pcDNA3.1(−)をテンプレートとし、1ウェルあたりのモル数が1.09×10−23〜1.09×10−17モル内の5点を用いて作製した。PCRおよびDNA増幅の検出はcDNAサンプルと同様におこなった。また、検量線は最小二乗法により直線回帰して得た。
【0125】
定量的リアルタイムPCRの結果得られたmRNA発現プロファイルを図6に示す。図6のAは、各組織・細胞におけるOATP1B3/ctの発現レベルを示す。また、図6のBは、各組織・細胞におけるOATP1B3/wtの発現レベルを示す。なお、図6に示す棒グラフは、OATP1B3 mRNAのコピー数を、3回の独立した実験における平均値±標準偏差として示したものである。さらに、図6のCは、発現レベルの比(OATP1B3/ctのコピー数/OATP1B3/wtのコピー数)を示す。
【0126】
図6のAに示すように、total RNA 1ng中に存在するOATP1B3/ct mRNAコピー数はGHL pool(日本人肝)では8であり、HHL pool(白人種肝)では4であった。これに対し、ヒト大腸がん組織h colon Tu #1 および #2ではそれぞれ1812、89であり、また、LS180細胞では2411、PK45p細胞では289、HCT116細胞では644であった。一方、OATP1B3/wt mRNAコピー数はGHL poolでは12187、HHL poolでは7473であり、h colon Tu #1および#2ではそれぞれ30、3であり、また、LS180細胞では865、PK45p細胞では2、HCT116細胞では172であった。したがって、OATP1B3/ct mRNA発現量はOATP1B3/wt mRNA発現量に対して、ヒト大腸がん組織であるh colon Tu #1および #2 でそれぞれ60倍、30倍、ヒト大腸がん由来細胞であるLS180細胞で2.8倍、PK45p細胞で144.5倍、HCT116細胞で3.7倍と高かった(図6のC)。一方、GHL poolおよびHHL poolでは、OATP1B3/ct mRNAの発現量はOATP1B3/wt発現量のそれぞれ約1/1500、約1/1700であった。以上のことから、ヒト大腸がん組織ではOATP1B3/ct mRNAがほぼ特異的に発現しており、また、ヒト大腸がん由来細胞においても、OATP1B3/ct mRNAが非常に優位に発現していることが示される。つまり、本願の発明者らによって、がん細胞・組織で発現しているのは既報のOATP1B3/wtではなく、今回新たに発見された選択的スプライシングバリアントであるということが明らかとされたのである。
【0127】
9.緑色蛍光タンパク質(GFP)融合ctOATP1B3ペプチド発現プラスミドの作製
図7に示すように、OATP1B3/ct mRNAの各フレームには推定オープンリーディングフレーム(ORF;Open reading frame)が存在する。フレーム1の2つのORFはそれぞれ10アミノ酸からなるペプチドおよび27アミノ酸からなるペプチドをコードすると推定される(f1−1、f1−2)。また、フレーム2のORFはOATP1B3/wtのフレームの途中を開始コドンとしてそのままOATP1B3/wtの終止コドンを共有する655アミノ酸からなるタンパク質をコードすると推定される(f2)。さらに、フレーム3のORFは43アミノ酸からなるペプチドをコードすると推定される(f3)。これら翻訳産物の発現を解析するため、OATP1B3/ct mRNAのフレーム1およびフレーム3に存在するペプチドコード領域(f1−1、f1−2、f3)並びに、フレーム2に存在するタンパク質コード領域のN末端領域20アミノ酸(f2)のC末端側のそれぞれにGFPを融合したタンパク質(f1−1/GFP、f1−2/GFP、f2/GFP、f3/GFP)を発現させるプラスミドを作製した。
【0128】
OATP1B3/ct/pcDNA3.1(-)をテンプレートとして、f1−2領域、f2領域およびf3領域を表6に示すプライマーを用いてPCR(95℃30秒の後、95℃10秒、60℃10秒、72℃20秒を40回繰り返し、72℃10秒を最終ステップ)により増幅した。また、GFPおよびf1−1/GFPについては、pAcGFP-c1をテンプレートとして表6に示すプライマーを用いてPCR(94℃3分の後、98℃10秒、59℃5秒、72℃50秒を40回繰り返し、72℃3分を最終ステップ)により増幅した。GFPのPCR産物をBamHI処理し、同様にBamHI処理したf1−2、f2およびf3のそれぞれのPCR産物とライゲーションした。これをテンプレートとして表6に示すプライマーを用いてPCR(94℃2分の後、94℃10秒、60℃30秒、72℃60秒を35回繰り返し、72℃30秒を最終ステップ)により増幅した。得られたf1−2/GFP、f3/GFPはDynaExpress TA PCR Cloning Kit (BioDynamics Laboratory Inc., 東京) を用いてpTAC-1vectorに挿入した。また、得られたf1−1/GFP、f2/GFPはpCR Blunt-II TOPO vector(インビトロジェン)に挿入した。これらプラスミドをXbaIおよびKpnIで処理し、同様に処理したpcDNA3.1(-)Neoとライゲーションして、f1-1/GFP/pcDNA3.1、f1-2/GFP/pcDNA3.1、f2/GFP/pcDNA3.1、f3/GFP/pcDNA3.1を作製した。
【0129】
10.リバーストランスフェクション
mCherry/pcDNA3.1(-) 320ng/ウェルと、各GFP融合ペプチド発現プラスミドまたはempty pcDNA3.1 (-)Neo(mock) 320ng/ウェルとの混合物にOPTI-MEM(登録商標)(インビトロジェン)100μL/ウェル、およびPlus Reagent(インビトロジェン)0.5μL/ウェルを混合し、Lipofectamin LTX(インビトロジェン)1.6μL/ウェルを加え293FT細胞3.5×105細胞/ウェルとともに24ウェルプレートに播種した。播種から24時間後、GFP由来の緑色蛍光およびmCherry由来の赤色蛍光をOlympus Fluoview ver2.3(オリンパス、東京)を用いて観察した。結果を図8に示す。ここで、図8において、緑色はGFP由来の蛍光であり、赤色はトランスフェクションコントロールであるmCherry由来の蛍光である。また、両蛍光の重ね合わせをMergeとして示し、微分干渉像をPhaseとして示す。なお、解析に用いたレーザー強度・照射時間は全て等しくした。
【0130】
図8に示すように、トランスフェクションした293FT細胞においてf1−1/GFPおよびf3/GFP由来と考えられる強い蛍光が認められた(図8(b)および(e))。また、f2/GFP(図8(d))由来の蛍光も認められた。一方、f1−2/GFPについては、非常に弱い蛍光が認められた(図8(c))。また、同時におこなったmockを用いた実験では緑色蛍光は認められなかった(図8(a))。なお、いずれの実験においてもmCherry由来の赤色蛍光は同等の発色レベルを示した。
【配列表フリーテキスト】
【0131】
〔配列番号:1〕
OATP1B3/ctのcDNAの塩基配列を表す。
〔配列番号:2〕
OATP1B3/wtのcDNAの塩基配列を表す。
〔配列番号:3〕
OATP1B3/wtによりコードされるタンパク質のアミノ酸配列を表す。
〔配列番号:4〕
OATP1B3/ctのフレーム1−1(終止コドン含む)の塩基配列を表す。
〔配列番号:5〕
OATP1B3/ctのフレーム1−1によりコードされるペプチド(f1−1)のアミノ酸配列を表す。
〔配列番号:6〕
OATP1B3/ctのフレーム1−2(終止コドン含む)の塩基配列を表す。
〔配列番号:7〕
OATP1B3/ctのフレーム1−2によりコードされるペプチド(f1−2)のアミノ酸配列を表す。
〔配列番号:8〕
OATP1B3/ctのフレーム2(終止コドン含む)の塩基配列を表す。
〔配列番号:9〕
OATP1B3/ctのフレーム2によりコードされるポリペプチド(f2)のアミノ酸配列を表す。
〔配列番号:10〕
OATP1B3/ctのフレーム3(終止コドン含む)の塩基配列を表す。
〔配列番号:11〕
OATP1B3/ctのフレーム3によりコードされるペプチド(f3)のアミノ酸配列を表す。
〔配列番号:12〕
ヒトGAPDH遺伝子の増幅に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:13〕
ヒトGAPDH遺伝子の増幅に用いたリバースプライマーの塩基配列を表す。
〔配列番号:14〕
RLM−5’−RACEのTouch-down PCRに用いたリバースプライマーの塩基配列を表す。
〔配列番号:15〕
RLM−5’−RACEのNested-PCRに用いたリバースプライマーの塩基配列を表す。
〔配列番号:16〕
RT−PCRおよびOATP1B3/ctのcDNAクローニングに用いたフォワード
プライマーの塩基配列を表す。
〔配列番号:17〕
RT−PCRに用いたリバースプライマーの塩基配列を表す。
〔配列番号:18〕
OATP1B3/ctのcDNAクローニングに用いたリバースプライマーの塩基配列を表す。
〔配列番号:19〕
OATP1B3/wtのcDNAクローニングに用いたフォワードプライマーの塩基配列を表す。
〔配列番号:20〕
OATP1B3/wtのcDNAクローニングに用いたリバースプライマーの塩基配列を表す。
〔配列番号:21〕
定量的リアルタイムPCRにおいてOATP1B3/ctの検出に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:22〕
定量的リアルタイムPCRにおいてOATP1B3/ctの検出に用いたリバースプライマーの塩基配列を表す。
〔配列番号:23〕
定量的リアルタイムPCRにおいてOATP1B3/wtの検出に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:24〕
定量的リアルタイムPCRにおいてOATP1B3/wtの検出に用いたリバースプライマーの塩基配列を表す。
〔配列番号:25〕
f1-1/GFP/pcDNA3.1からの配列番号:5のアミノ酸配列からなるペプチドの発現に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:26〕
f1-1/GFP/pcDNA3.1からの配列番号:5のアミノ酸配列からなるペプチドの発現に用いたリバースプライマーの塩基配列を表す。
〔配列番号:27〕
f1-2/GFP/pcDNA3.1からの配列番号:7のアミノ酸配列からなるペプチドの発現、f2/GFP/pcDNA3.1からの配列番号:9のアミノ酸配列からなるタンパク質の発現、およびf3/GFP/pcDNA3.1からの配列番号:11のアミノ酸配列からなるペプチドの発現に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:28〕
f1-2/GFP/pcDNA3.1からの配列番号:7のアミノ酸配列からなるペプチドの発現に用いたリバースプライマーの塩基配列を表す。
〔配列番号:29〕
f2/GFP/pcDNA3.1からの配列番号:9のアミノ酸配列からなるタンパク質の発現に用いたリバースプライマーの塩基配列を表す。
〔配列番号:30〕
F3/GFP/pcDNA3.1からの配列番号:11のアミノ酸配列からなるペプチドの発現に用いたリバースプライマーの塩基配列を表す。
〔配列番号:31〕
F1-1/GFP/pcDNA3.1、f1-2/GFP/pcDNA3.1、f2/GFP/pcDNA3.1、およびf3/GFP/pcDNA3.1からのGFPタンパク質の発現に用いたフォワードプライマーの塩基配列を表す。
〔配列番号:32〕
F1-1/GFP/pcDNA3.1、f1-2/GFP/pcDNA3.1、f2/GFP/pcDNA3.1、およびf3/GFP/pcDNA3.1からのGFPタンパク質の発現に用いたリバースプライマーの塩基配列を表す。
【特許請求の範囲】
【請求項1】
生体から分離した被検試料中のOATP1B3(Organic Anion Transporting Polypeptide 1B3)mRNAの選択的スプライシングバリアントの測定方法であって、
前記被検試料中の、配列番号:1で表される塩基配列を含むmRNAを、配列番号:2で表される塩基配列を含むmRNAと識別して測定することを含む、測定方法。
【請求項2】
配列番号:1で表される塩基配列におけるエキソンSVの存在を指標として、配列番号:1で表される塩基配列を含むmRNAを測定する、請求項1に記載の測定方法。
【請求項3】
前記エキソンSVを含む領域に設定したプライマーを一方のプライマーとして用いる核酸増幅法により、配列表の配列番号:1で表される塩基配列を含むmRNAまたはそのcDNAの部分領域を特異的に増幅し、増幅産物を測定することを含む、請求項2に記載の測定方法。
【請求項4】
前記プライマーの塩基数が15〜35である、請求項3に記載の測定方法。
【請求項5】
前記核酸増幅法がRT−PCR法である、請求項3または4に記載の測定方法。
【請求項6】
以下の条件を満足する核酸:
(1)配列番号:1で表される塩基配列を含む核酸とストリンジェントな条件下でハイブリダイズする;
(2)配列番号:2で表される塩基配列を含む核酸が共存する場合に、ストリンジェントな条件下で、当該核酸とハイブリダイズしないか、または、当該核酸とハイブリダイズした場合であってもその3’末端がミスマッチとなる。
【請求項7】
配列番号:1で表される塩基配列におけるエキソンSVを含む領域とハイブリダイズする、請求項6に記載の核酸。
【請求項8】
塩基数が10以上である、請求項6または7に記載の核酸。
【請求項9】
塩基数が15〜35である、請求項8に記載の核酸。
【請求項10】
配列番号:1で表される塩基配列または当該塩基配列の部分領域と同じ塩基配列またはこれらの塩基配列のうち10%以下の塩基が置換されてなる塩基配列からなる、請求項6〜9のいずれか1項に記載の核酸。
【請求項11】
OATP1B3 mRNAの選択的スプライシングバリアントの測定に用いられる、請求項6〜10のいずれか1項に記載の核酸。
【請求項12】
核酸増幅用のプライマー、またはプローブである、請求項11に記載の核酸。
【請求項13】
請求項11または12に記載の核酸を含む、OATP1B3 mRNAの選択的スプライシングバリアントの測定用キット。
【請求項14】
請求項1〜5のいずれか1項に記載の測定方法により、または、請求項13に記載の測定用キットを用いて、生体から分離した被検試料中のOATP1B3 mRNAの選択的スプライシングバリアントを測定することを含む、がんの検出方法。
【請求項15】
配列番号:1で表される塩基配列を含むOATP1B3 mRNAの選択的スプライシングバリアントを測定する、請求項14に記載の検出方法。
【請求項16】
前記がんが大腸がんまたは膵臓がんである、請求項14または15に記載の検出方法。
【請求項17】
請求項1〜5のいずれか1項に記載の測定方法により、または、請求項13に記載の測定用キットを用いて、がん細胞を被検物質の存在下で培養して得られる培養細胞中のOATP1B3 mRNAの選択的スプライシングバリアントを測定する工程と、
得られた測定結果を、前記被検物質の非存在下における場合と比較および/または評価する工程と、
を含む、がんの予防および/または治療剤のスクリーニング方法。
【請求項18】
配列番号:1で表される塩基配列を含む、OATP1B3(Organic Anion Transporting Polypeptide 1B3)mRNAの選択的スプライシングバリアント。
【請求項19】
(1)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド、あるいは、
(2)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列において、10%以下のアミノ酸が置換、欠失、および/または挿入されたアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド。
【請求項20】
配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列からなるポリペプチド。
【請求項21】
請求項19または20に記載のポリペプチドをコードする核酸。
【請求項22】
請求項21に記載の核酸を含む発現ベクター。
【請求項23】
請求項22に記載の発現ベクターで形質転換された細胞。
【請求項24】
請求項19または20に記載のポリペプチドに結合する抗体。
【請求項25】
配列番号4、配列番号6、配列番号8、または配列番号10で表される塩基配列を含む核酸とストリンジェントな条件下でハイブリダイズし、少なくとも15塩基を有する核酸。
【請求項26】
生体から分離した被検試料中の、請求項19または20に記載のポリペプチドの量を測定することを含む、がんの検出方法。
【請求項27】
請求項24に記載の抗体を測定に用いる、請求項26に記載の検出方法。
【請求項28】
請求項24に記載の抗体を含む、がんの検出用キット。
【請求項29】
請求項19または20に記載のポリペプチドもしくはその断片、または、請求項21に記載の核酸もしくはその断片を含む、特異的な細胞傷害性T細胞を誘導するための医薬。
【請求項30】
がんワクチンである、請求項29に記載の医薬。
【請求項1】
生体から分離した被検試料中のOATP1B3(Organic Anion Transporting Polypeptide 1B3)mRNAの選択的スプライシングバリアントの測定方法であって、
前記被検試料中の、配列番号:1で表される塩基配列を含むmRNAを、配列番号:2で表される塩基配列を含むmRNAと識別して測定することを含む、測定方法。
【請求項2】
配列番号:1で表される塩基配列におけるエキソンSVの存在を指標として、配列番号:1で表される塩基配列を含むmRNAを測定する、請求項1に記載の測定方法。
【請求項3】
前記エキソンSVを含む領域に設定したプライマーを一方のプライマーとして用いる核酸増幅法により、配列表の配列番号:1で表される塩基配列を含むmRNAまたはそのcDNAの部分領域を特異的に増幅し、増幅産物を測定することを含む、請求項2に記載の測定方法。
【請求項4】
前記プライマーの塩基数が15〜35である、請求項3に記載の測定方法。
【請求項5】
前記核酸増幅法がRT−PCR法である、請求項3または4に記載の測定方法。
【請求項6】
以下の条件を満足する核酸:
(1)配列番号:1で表される塩基配列を含む核酸とストリンジェントな条件下でハイブリダイズする;
(2)配列番号:2で表される塩基配列を含む核酸が共存する場合に、ストリンジェントな条件下で、当該核酸とハイブリダイズしないか、または、当該核酸とハイブリダイズした場合であってもその3’末端がミスマッチとなる。
【請求項7】
配列番号:1で表される塩基配列におけるエキソンSVを含む領域とハイブリダイズする、請求項6に記載の核酸。
【請求項8】
塩基数が10以上である、請求項6または7に記載の核酸。
【請求項9】
塩基数が15〜35である、請求項8に記載の核酸。
【請求項10】
配列番号:1で表される塩基配列または当該塩基配列の部分領域と同じ塩基配列またはこれらの塩基配列のうち10%以下の塩基が置換されてなる塩基配列からなる、請求項6〜9のいずれか1項に記載の核酸。
【請求項11】
OATP1B3 mRNAの選択的スプライシングバリアントの測定に用いられる、請求項6〜10のいずれか1項に記載の核酸。
【請求項12】
核酸増幅用のプライマー、またはプローブである、請求項11に記載の核酸。
【請求項13】
請求項11または12に記載の核酸を含む、OATP1B3 mRNAの選択的スプライシングバリアントの測定用キット。
【請求項14】
請求項1〜5のいずれか1項に記載の測定方法により、または、請求項13に記載の測定用キットを用いて、生体から分離した被検試料中のOATP1B3 mRNAの選択的スプライシングバリアントを測定することを含む、がんの検出方法。
【請求項15】
配列番号:1で表される塩基配列を含むOATP1B3 mRNAの選択的スプライシングバリアントを測定する、請求項14に記載の検出方法。
【請求項16】
前記がんが大腸がんまたは膵臓がんである、請求項14または15に記載の検出方法。
【請求項17】
請求項1〜5のいずれか1項に記載の測定方法により、または、請求項13に記載の測定用キットを用いて、がん細胞を被検物質の存在下で培養して得られる培養細胞中のOATP1B3 mRNAの選択的スプライシングバリアントを測定する工程と、
得られた測定結果を、前記被検物質の非存在下における場合と比較および/または評価する工程と、
を含む、がんの予防および/または治療剤のスクリーニング方法。
【請求項18】
配列番号:1で表される塩基配列を含む、OATP1B3(Organic Anion Transporting Polypeptide 1B3)mRNAの選択的スプライシングバリアント。
【請求項19】
(1)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド、あるいは、
(2)配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列において、10%以下のアミノ酸が置換、欠失、および/または挿入されたアミノ酸配列を含み、かつ、がん細胞またはがん組織において発現が増強するポリペプチド。
【請求項20】
配列番号:5、配列番号:7、配列番号:9、または配列番号:11で表されるアミノ酸配列からなるポリペプチド。
【請求項21】
請求項19または20に記載のポリペプチドをコードする核酸。
【請求項22】
請求項21に記載の核酸を含む発現ベクター。
【請求項23】
請求項22に記載の発現ベクターで形質転換された細胞。
【請求項24】
請求項19または20に記載のポリペプチドに結合する抗体。
【請求項25】
配列番号4、配列番号6、配列番号8、または配列番号10で表される塩基配列を含む核酸とストリンジェントな条件下でハイブリダイズし、少なくとも15塩基を有する核酸。
【請求項26】
生体から分離した被検試料中の、請求項19または20に記載のポリペプチドの量を測定することを含む、がんの検出方法。
【請求項27】
請求項24に記載の抗体を測定に用いる、請求項26に記載の検出方法。
【請求項28】
請求項24に記載の抗体を含む、がんの検出用キット。
【請求項29】
請求項19または20に記載のポリペプチドもしくはその断片、または、請求項21に記載の核酸もしくはその断片を含む、特異的な細胞傷害性T細胞を誘導するための医薬。
【請求項30】
がんワクチンである、請求項29に記載の医薬。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2011−188853(P2011−188853A)
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願番号】特願2011−32501(P2011−32501)
【出願日】平成23年2月17日(2011.2.17)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【Fターム(参考)】
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願日】平成23年2月17日(2011.2.17)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【Fターム(参考)】
[ Back to top ]

