PEG化されたG−CSFポリペプチドおよびその製造方法
【課題】PEG化顆粒球コロニー刺激因子の安定性および均一性を増加させる方法を提供する。
【解決手段】水酸基に結合したPEG部分を取り除くために十分な時間、ポリペプチドを8.0を超える高められたpHとし、そして、pHを約8.0またはそれ以下に低下させることを含む、リジン残基のイプシロンアミノ基またはN末端アミノ基に結合した少なくとも1つのPEG部分、および水酸基に結合した少なくとも1つのPEG部分を有するPEG化G−CSFポリペプチドの安定性および均一性を増加させる方法。
【解決手段】水酸基に結合したPEG部分を取り除くために十分な時間、ポリペプチドを8.0を超える高められたpHとし、そして、pHを約8.0またはそれ以下に低下させることを含む、リジン残基のイプシロンアミノ基またはN末端アミノ基に結合した少なくとも1つのPEG部分、および水酸基に結合した少なくとも1つのPEG部分を有するPEG化G−CSFポリペプチドの安定性および均一性を増加させる方法。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
本発明は、不安定なPEG部分(PEG moiety)をPEG化(PEGylated)G−CSF蛋白質から除去し、安定性および均一性を増加させる方法、およびその結果得られるPEG化G−CSF蛋白質に関する。本発明は、また、該PEG化蛋白質を含む医薬組成物および該医薬組成物を投与することによる治療方法に関する。
【背景技術】
【0002】
発明の背景
蛋白質またはポリペプチドへのポリエチレングリコール(PEG)の共有結合(「PEG化」)は、蛋白質またはポリペプチド、とりわけ医薬蛋白質の性質を改善するための、例えば、循環半減期を改善するため、および/または蛋白質エピトープを隠し、よって、望まれない免疫応答の可能性を低減するためのよく知られた技術である。活性化されたPEGに基づく数多くの技術が、蛋白質上の1以上の基にPEG部分を結合させるために利用できる。たとえば、mPEG―スクシンイミジルプロピオネート(mPEG-SPA、Nektar Therapeuticsより入手可能)は、通常、アミド結合を介して、N末端およびリジン残基のイプシロン−アミノ基に特異的に結合するものとして考えられている。しかしながら、実際には、mPEG-SPAは、必ずしも排他的にこれらの基に結合しないだけでなく、エステル結合を介して、セリン、チロシンまたはスレオニン残基の水酸基にも結合し得る。この技術を用いて調製されたPEG化蛋白質は十分な程度の均一性を有しない可能性があり、意図したもの以外の数多くの異なるPEG異性体を含み得る。このことは、かかる蛋白質の特徴づけをより複雑にするという事実を含む、さまざまな理由により望まれない。さらに、意図したもの以外の基に結合したPEG部分は、相対的に不安定であり得る。例えば、mPEG-SPAのようなアミン特異的PEGの場合、エステル結合を介して水酸基に結合したPEG部分は、アミド結合を介してN末端またはリジン残基に結合した部分に比較して相対的に不安定である傾向がある。製剤化および貯蔵条件によって、このことは、これらの不安定なPEG基の望まれない損失を導き得、よって、時間経過と共にPEG化蛋白質の性質が変化する可能性がある。さらに、1以上のPEG部分が、患者に投与された後に体内で蛋白質から離れる危険があり、PEG化蛋白質医薬の潜在的な制度上または安全上の問題であり得る。
本発明は、かかる不安定なPEG基を簡単に除き、それによって、より均一で安定なPEG化蛋白質生産物となる方法を提供することにより、これらの問題を解決する。
【発明の概要】
【0003】
発明の簡単な開示
本発明は、一般的に、リジン残基またはN末端に結合した少なくとも1つのPEG部分および水酸基に結合した少なくとも1つのPEG部分を有するPEGかポリペプチドの安定性および均一性を増加させる方法であって、水酸基に結合したPEG部分を除去するために好適な時間、変化されたpHに該ポリペプチドを置き、その後pHを本件ポリペプチドの長期間保管に好適なpHに調整することを含む方法に関する。
【0004】
ある態様において、本発明は、リジン残基のイプシロンアミノ基またはN末端アミノ基に結合した少なくとも1つのPEG部分および水酸基に結合した少なくとも1つのPEG部分を有するPEG化顆粒球コロニー刺激因子(G−CSF)ポリペプチドの安定性および均一性を増加させる方法であって、水酸基に結合したPEG部分を取り除くために適した時間8.0を超える上昇されたpHにポリペプチドを置き、そのpHを約8.0またはそれ以下に低下させることを含む方法に関する。
【0005】
本発明の他の態様は、G−CSFポリペプチドをアミン特異的活性化ポリエチレングリコール(PEG)とPEG化反応させ、PEG化G−CSFポリペプチド中間体を製造し、その後、該PEG化ポリペプチド中間体を水酸基に結合したPEG部分を取り除くために好適な時間、少なくとも約9.0の高められたpHとし、PEG化G−CSFポリペプチドを製造することを含む、PEG化G−CSFポリペプチドを製造する方法に関する。
【0006】
本発明の他の態様は、PEG化G−CSFポリペプチドのPEG位置異性体(positional PEG isomer)の均質な混合物を含む組成物に関し、ここで、混合物のPEG位置異性体の少なくとも約80%は、2つのPEG位置異性体からなり、それぞれは、リシンのイプシロンアミノ基に結合した2つのPEG部分およびN末端アミノ基に結合した1つのPEG部分からなるPEG部分を有する。
【0007】
更なる本発明の態様は、PEG化G−CSFポリペプチドのPEG位置異性体の混合物を含む組成物に関し、ここで、該ポリペプチドは、野生型ヒトG−CSF(配列番号:1)に比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含み、該ポリペプチドのPEG位置異性体の少なくとも約80%が、3つの結合されたPEG部分を有するリジン/N末端PEG異性体である。
【0008】
更なる態様において、本発明は、野生型ヒトG−CSF(配列番号:1)に比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含む組換えG−CSFポリペプチドのリジン/N末端PEG位置異性体(lysine/N-terminal positional PEG isomer)の混合物を製造する方法であって、a)宿主細胞において組換えG−CSFポリペプチドを発現し;b)組換えG−CSFポリペプチドを単離し;c)単離された組換えG−CSFポリペプチドをアミン特異的活性化PEGと反応させ、組換えG−CSFポリペプチドの複数のPEG位置異性体を製造し;d)複数のPEG位置異性体をpH8.5から10.5で反応させ、組換えG−CSFポリペプチドの部分的に脱PEG化(dePEGylated)された複数のリジン/N末端PEG位置異性体を製造することを含む、方法に関する。
【0009】
本発明の更なる態様は、本明細書で記載される方法を使用して製造されるPEG化G−CSFポリペプチド、並びに、それらのPEG位置異性体分布により特徴付けられるPEG化G−CSFポリペプチド、そして、係るPEG化G−CSFポリペプチドを含む組成物、そして、不十分な好中球のレベルを患っている、またはそのリスクのある患者において、PEG化G−CSFポリペプチドまたは本発明の組成物の投与により、好中球のレベルを増加させる方法に関する。本発明の更なる態様および好ましい態様は、以下の記載および特許請求の範囲から明らかである。
【図面の簡単な説明】
【0010】
【図1】本明細書で記載されているPEG化、部分的脱PEG化、そして精製されたG−CSF改変体のSDS−PAGE分析のスキャンを示す。
【図2】本明細書で記載されているPEG化、そして部分的脱PEG化されたG−CSFのSDS−PAGE分析のスキャンを示す。
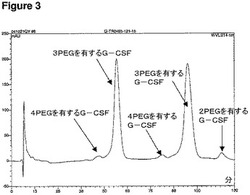
【図3】本発明によって調製された部分的脱PEG化生成物プールのカチオン交換クロマトグラムを示す。
【図4】本発明による脱PEG化されなかった精製されたPEG化G−CSF改変体のカチオン交換クロマトグラムを示す。
【0011】
説明
定義
本明細書および特許請求の範囲の文脈において、以下の定義が適用される:
用語「ポリペプチド」または「蛋白質」は、本明細書において互換して用いられ得、いずれの特定の長さのアミノ酸配列に限定されないで、アミノ酸のポリマーをいう。これらの用語は、完全長の蛋白質だけでなく、いずれの与えられた蛋白質またはポリペプチドの、例えば、断片、短縮バージョン、改変体、ドメインも含むことが意図される。
【0012】
G−CSFポリペプチドは、配列番号:1で示されるヒト顆粒球コロニー刺激因子(hG−CSF)の配列を有するポリペプチド、またはG−CSF活性を示すhG−CSFの改変体である。「G−CSF活性」は、G−CSF受容体(Fukunaga et al., J. Bio. Chem., 265:14008, 1990)に結合する能力であり得るが、好ましくは、とりわけ、マウス細胞株NFS-60 (ATCC Number: CRL-1838)を用いたインビトロ活性試験で測定されるG−CSF細胞増殖活性である。NFS-60細胞株を用いた好適なインビトロG−CSF活性の試験は、Hammerling等により、J. Pharm. Biomed. Anal. 13(1):9-20, 1995に記載されている。G−CSF活性を「示す」ポリペプチドは、測定可能な機能、例えばインビトロ試験における測定可能な増殖活性を示すとき、かかる活性を有すると考えられる。
【0013】
「改変体」は、親(parent)ポリペプチドから1またはそれ以上のアミノ酸残基が相違するポリペプチドであり、ここで、親ポリペプチドは、一般的に、天然の、野生型のアミノ酸配列を有するものであり、典型的には、天然の哺乳類ポリペプチドであり、そして、より典型的には、天然のヒトポリペプチドである。よって、改変体は、天然のポリペプチドに比較して1またはそれ以上の置換、挿入または欠失を含む。例えば、これらには、1またはそれ以上のアミノ酸残基短くなった、Nおよび/またはC末端の欠失体、または、Nおよび/またはC末端で、1またはそれ以上の余分な残基の付加体、例えばN末端でのメチオニン残基の付加体を含む。改変体は、ほとんどの場合には、親ポリペプチドより15アミノ酸残基までで相違し、例えば、12、10、8または6アミノ酸残基である。
【0014】
「アミン特異的活性化PEG(amine-specific activated PEG)」は、N末端アミノ基またはリジン残基のε-アミノ基に、アミド結合を介して、好ましく結合する、活性化PEG誘導体である。アミン特異的活性化PEG誘導体の例には以下を含む:
mPEG-スクシンイミジルプロピオネート(mPEG-SPA):
【0015】
【化1】

mPEG-スクシンイミジルブタノネート(mPEG-SBA):
【0016】
【化2】

mPEG-スクシンイミジルα-メチルブタノネート(mPEG-SMB):
【0017】
【化3】

【0018】
mPEG-SPA、mPEG-SBAおよびmPEG-SMBは、Nektar Therapeuticsから入手可能である;「the Nektar Advanced PEGylation Catalogs 2004 and 2005-2006, 「Polyethylene and Derivatives for Advanced PEGylation」参照。他のアミン特異的活性化PEG誘導体には、SunBio Corporationから入手可能な、PEG-SS (スクシンイミジルスクシネート)、PEG-SG (スクシンイミジルグルタレート), PEG-NPC (p-ニトロフェニルカルボネート)、およびPEG-イソシアネート;およびNOF Corporation から入手可能なPEG-SCMを含む。
【0019】
「不安定な」PEG部分は、本明細書において、ポリペプチドの水酸基、とりわけ、セリン、チロシンまたはスレオニン残基の水酸基にエステル結合を介して結合したPRG部分をいう。上記に説明されるように、水酸基を介するかかるPEG部分の結合は不安定な傾向があり、これらのPEG部分は、エステル結合の加水分解を介して、例えばかかる部分を含むポリペプチドが水溶液形態で保存されるとき、時間と共に、ポリペプチドから脱離する傾向がある。
【0020】
本明細書で使用される「安定性」は、ポリペプチドに結合するPEG部分の結合の安定性、例えば、かかるPEG部分が長期、例えば水溶液中の保存の間、ポリペプチドに結合しているか否か、またはそれらが、例えばエステル結合の加水分解の結果として脱離する傾向があるか否か、を言う。
【0021】
本明細書で使用される、蛋白質の「PEG位置異性体」なる用語は、蛋白質の相違するPEG化形態であって、ここで、PEG基は、蛋白質の相違するアミノ酸位置で存在する。蛋白質の「リジン/N末端PEG異性体」なる用語は、PEG基が、蛋白質のアミノ末端および/または蛋白質におけるリジン残基のイプシロンアミノ基に結合されることを意味する。例えば、「3つの結合されたPEG部分を有するリジン/N末端PEG位置異性体」は、G−CSFに適用されるとき、3つのPEG基が、リジン残基のイプシロンアミノ基および/または蛋白質のN末端に結合するG−CSFPEG位置異性体の混合物を意味する。典型的には、「3つの結合されたPEG部分を有するリジン/N末端PEG位置異性体」は、リジン残基に結合した2つのPEG部分とN末端に結合した1つのPEG部分を有し得る。PEG位置異性体の分析は、以下の実施例に記載されるようなカチオン交換HPLCを用いて実施され得る。
【0022】
ポリペプチドの「リジン/N末端のPEG位置異性体の実質的に精製された混合物」とは、例えばリジン/N末端でないPEG位置異性体等の不純物を排除するためにクロマトグラフィーまたは他の精製手段にかけられた、リジン/N末端PEG位置異性体の混合物をいう。「リジン/N末端のPEG位置異性体の実質的に精製された混合物」は、例えば、もし、本明細書で記載されるような部分的な脱PEG化工程およびそれに続く精製がなければ、存在したであろう水酸基に結合した不安定なPEG部分のほとんどが存在しなく、そして、典型的には、水酸基に結合した不安定なPEG部分を含むポリペプチドを約20%未満、より典型的には、約15%未満含み得る。好ましくは、水酸基に結合した不安定なPEG部分を、約10%未満、例えば、約5%未満含み得る。
【0023】
用語「ポリペプチド改変体のPEG位置異性体の均質な混合物」は、相違するPEG位置異性体のポリペプチド部分が同じであることを意味する。これは、混合物の相違するPEG位置異性体が、全て単一のポリペプチド改変体配列に基づくことを意味する。例えば、PEG化G−CSFポリペプチド改変体のPEG位置異性体の均質な混合物は、相違する混合物のPEG位置異性体が単一のG−CSFポリペプチド改変体に基づくことを意味する。
【0024】
本明細書で使用される「均一性」は、相違する位置異性体、つまり相違する位置で結合した相違する数のPEG部分を含む相違する位置異性体、の数、並びに、これら位置異性体の相対的な分布の観点からの、PEG化ポリペプチドの均質性を言う。例えば、ヒトまたは動物における治療的用途を意図した医薬ポリペプチドに対しては、異なるPEG位置異性体の数は最小であることが一般的に望まれる。
【0025】
「部分的脱PEG化」は、本発明の方法が、水酸基に結合した不安定なPEG部分を取り除き、N末端またはリジン残基のアミノ基により安定に結合したPEG部分はそのまま残るという事実を言う。以下に説明されるように、脱PEG化工程の進行は、特定の高められたpH値および高められたpH値での持続時間に依存する。したがって、特定の場合に選択された状況によって、脱PEG化の工程の最後で、ポリペプチドの小部分が、依然として、水酸基に結合したPEG部分を有し得る可能性がある。しかしながら、本明細書および蛋白質解析の分野での技術常識に基づいて、当業者は、実質的に全ての不安定なPEG部分が除かれ、いずれの残ったPEG部分が、最終産物の所望の性質に重要であるように、方法を調整することができる。本明細書において「脱PEG化」の言及は、「部分的脱PEG化」の言及と理解でき得る。
【0026】
詳細な説明
上記のように、本発明の一態様は、リジン残基のイプシロンアミノ基またはN末端アミノ基に結合した少なくとも1つのPEG部分および水酸基に結合した少なくとも1つのPEG部分を有するPEG化G−CSFポリペプチドの安定性および均質性を高める方法であって、該ポリペプチドを、約8.0を超える高められたpHに、水酸基に結合したPEG部分を取り除くために好適な時間置き、そして、約8.0またはそれ以下にpHを低下させることを含む方法に関する。本発明の方法は、いずれの哺乳類G−CSFポリペプチドにも適しているが、ポリペプチドは、好ましくは、ヒトG−CSFポリペプチド、つまり、配列番号:1のアミノ酸配列を有するポリペプチド、場合によりN末端にメチオニン残基を有するもの、またはそれらの改変体である。G−CSF改変体の場合、これらは、天然、野生型のG−CSFポリペプチド、典型的には、ヒトG−CSF(配列番号:1)に比較して、1またはそれ以上の置換、挿入または欠損、および/または、1またはそれ以上のアミノ酸残基のN末端および/またはC末端の欠失体、例えば1から15の置換、例えば6、8、10または12までの置換を有し得る。好ましいG−CSF改変体は、WO 01/51510およびWO 03/006501に開示されるものを含む。
【0027】
例えばWO 03/006501に記載されるように、hG−CSFは、16、23、34および40の位置に4つのリジン残基を含み、G−CSFをリジン残基またはN末端により好んで結合する活性化PEGを用いたPEG化するときは、これらのリジン残基の少なくとも1つ、例えばこれらの残基の2、3または全てを、例えば欠失、好ましくは置換により、除くことが、しばしば望ましいこともある。本発明の方法で使用されるG−CSFポリペプチドは、したがって、K16、K23、K34およびK40から選択される少なくとも1つのアミノ酸残基が欠失された、または他のアミノ酸残基に置換された改変体であり得る。典型的には、リジン残基の除去は、置換、一般的にはRまたはQ残基、好ましくはR残基での置換、によることができる。したがって、G−CSFポリペプチドは、K16R/Q、K23R/Q、K34R/Q、K40R/Q(ここで、例えば、「K16R/Q」は、位置16のリジンがアルギニンまたはグルタミン残基で置換されることを意味する)からなる群から選択される、1、2、3または4つの置換であり得る。好ましくは、ポリペプチドは、置換K16R+K34R+K40Rを含むが、位置23のリジンを変わらず残している。
【0028】
PEG化が望まれないリジン残基を取り除くことと共に、WO 03/006501は、また、PEG化部位を作成するためのリジン残基の付加を記載する。これらは挿入により付加され得るが、好ましくは、置換により付加され得る。PEG化部位を導入するための好ましいアミノ酸置換の例には、Q70K、Q90K、T105K、Q120K、T133K、S159KおよびH170Kの1またはそれ以上、例えばこれらの置換の2、3、4、または5を含み、好ましい置換は、T105K+S159Kである。好ましい実施態様において、G−CSFポリペプチドは、置換K16R、K34R、K40R、T105KおよびS159Kを含む。ある実施態様において、G−CSFポリペプチドは、hG−CSFに比較して、これら5つの置換のみを含む。
【0029】
G−CSFポリペプチドの産生
本発明によるPEG化されたG−CSFポリペプチドは、本分野で知られた、例えば、WO 03/006501(引用により本明細書に組み込まれる)に記載されたような、いずれの好適な方法によっても製造され得る。かかる方法は、該ポリペプチドをコードする核酸配列の構築および好適な形質転換された、または遺伝子導入された宿主における該配列の発現を含む。しかしながら、本発明のポリペプチドは、相対的に非効率ではあるが、化学合成または化学合成および組換えDNA技術によって製造され得る。本発明のポリペプチドまたは本発明の結合体のポリペプチド部分をコードする核酸配列は、配列番号:1で示されるアミノ酸配列を有するhG−CSF等の、親G−CSFをコードする核酸配列を単離し、または合成し、そして、核酸配列を変化させ、関連アミノ酸残基の導入(つまり、挿入または置換)または欠失(つまり、削除または置換)に影響させる、ことによって構築され得る。
【0030】
核酸配列は、従来法に従った、部位特異的突然変異により従来通りに修飾される。あるいは、核酸配列は、化学合成、例えばオリゴヌクレオチド合成機を用いて製造され、ここで、オリゴヌクレオチドは、所望のポリペプチドのアミノ酸配列に基づいて設計され、そして、好ましくは、組換えポリペプチドが生成される宿主細胞に好まれるコドンを選択する。例えば、所望のポリペプチドの部分をコードするいくつかの小オリゴヌクレオチドは、PCR、ライゲーションまたはライゲーションチェインリアクション(LCR)(Barany, PNAS 88:189-193, 1991)によって、合成され、集められ得る。個々のオリゴヌクレオチドは、典型的には、相補的な集合のために5’または3’オーバーハングを含む。
【0031】
一度集められると(合成、部位特異的突然変異または他の方法により)、ポリペプチドをコードする核酸配列は、組換えベクターに組み込まれ、所望の形質転換された宿主細胞において、G−CSFの発現に必要なコントロール配列に操作可能に結合される。
【0032】
当業者は、好適なベクター、発現コントロール配列およびポリペプチドの発現するための宿主を選択することができる。組換えベクターは、自己複製ベクター、例えば、染色体外の実体として存在するベクターで、その複製が染色体の複製より独立しているもの、例えば、プラスミド、であり得る。あるいは、ベクターは、宿主細胞に導入されると、宿主細胞ゲノムに組み込まれ、組み込まれた染色体と共に複製するものである。
【0033】
ベクターは、好ましくは、本発明のポリペプチドをコードする核酸配列が、核酸配列の転写に必要な付加部分と操作可能に結合した、発現ベクターである。ベクターは、典型的には、プラスミドまたはウイルスDNA由来である。本明細書で述べられる、宿主細胞での発現用の多くの好適な発現ベクターは、商業的に入手可能か、または文献に記載されている。G−CSFを発現する好適なベクターについての詳細な情報は、WO 03/006501に見出され得る。
【0034】
用語「コントロール配列(control sequence)」は、本明細書では、本発明のポリペプチドの発現に対して必要または有利である全ての成分を含むものと定義される。各コントロール配列は、ポリペプチドをコードする核酸配列に対して生来の、または外来のものであってよい。かかるコントロール配列には、限定はされないが、リーダー配列、ポリアデニル化配列、シグナルペプチド配列、合成イントロン、および転写ターミネーターを含む。最小限で、コントロール配列は、プロモーターを含む。多様な発現コントロール配列、例えば、WO 03/006501で記載されたコントロール配列のいずれかが、本発明に使用され得る。
【0035】
G−CSF活性を示すポリペプチドをコードする本発明の核酸配列は、部位特異的突然変異、合成、PCRまたは他の方法で製造され得、所望により、また、シグナルペプチドをコードする核酸配列を含み得る。シグナルペプチドは、ポリペプチドが、発現する細胞から分泌されるときに存在する。かかるシグナルペプチドは、もし存在すれば、ポリペプチドの発現のために選択された細胞によって、認識されるものであるべきである。シグナルペプチドは、ポリペプチドに対し、同種(例えば、通常hG−CSFと結びつけられ)、または異種(hG−CSF以外の他の起源に由来する)であり得、または、宿主細胞に対して同種または異種、つまり、シグナルペプチドは、宿主細胞から通常発現されるか、または、宿主細胞からは通常発現されない、であり得る。したがって、シグナルペプチドは、原核生物、例えば、E.coliのような細菌由来の、または、真核生物、例えば、哺乳動物、または、昆虫または酵母由来であり得る。好適なシグナルペプチドについての更なる情報は、WO 03/006501を参照。
【0036】
いずれの好適な宿主も、G−CSFポリペプチドを製造するために使用され得、細菌(特に好ましくはないが)、真菌(酵母を含む)、植物、昆虫、哺乳類、または他の適当な動物細胞または細胞株、並びにトランスジェニック動物または植物が含まれる。哺乳類の細胞が好ましい。細菌宿主細胞の例には、バチラス(Bacillus)、例えば、B.ブレビス(B. brevis)またはB.ズブチリス(B. subtilis)、シュードモナス(Pseudomonas)またはストレプトマイセス(Streptomyces)種等のグラム陽性細菌、または、E.coli種等のグラム陰性細菌を含む。好適な糸状菌宿主細胞の例には、アスペルギウス(Aspergillus)、例えば、A.オリザエ(A. oryzae)、A.ニガー(A. niger)、またはA.ニデュランス(A. nidulans)、フサリウム(Fusarium)またはトリコダーマ(Trichoderma)種を含む。好適な酵母宿主細胞の例には、サッカロマイセス(Saccharomyces)、例えば、S.セレビシエ(S. cerevisiae)、スキゾサッカロマイセス(Schizosaccharomyces)、クリベロマイセス(Klyveromyces)、ピチア(Pichia)、例えば、P.パストリス(P. pastoris)またはP.メタノリカ(P. methanolica)、ハンセニューラ(Hansenula)、例えば、H.ポリモルファ(H. Polymorpha)またはヤロウィア(Yarrowia)種を含む。好適な昆虫宿主細胞の例には、鱗翅目細胞株、例えば、Spodoptera frugiperda (Sf9またはSf21)またはTrichoplusioa ni細胞(High Five) (US 5,077,214)を含む。好適な哺乳類宿主細胞には、チャイニーズハムスター卵巣(CHO)細胞株 (例えば、CHO-K1; ATCC CCL-61)、グリーンモンキー細胞株 (COS) (例えば、COS 1 (ATCC CRL-1650)、COS 7 (ATCC CRL-1651));マウス細胞 (例えば、NS/O)、新生児ハムスター腎臓(BHK)細胞株(例えば、ATCC CRL-1632またはATCC CCL-10)、およびヒト細胞(例えば、HEK 293 (ATCC CRL-1573))を含む。更なる好適な細胞株は、本分野で知られ、American Type Culture Collection(ロックビル、メリーランド)のような公的寄託機関から入手可能である。
【0037】
本発明の製造方法において、細胞は、本分野で知られている方法を使用して、ポリペプチドを製造するために適した栄養培地で培養される。例えば、細胞は、実験室または工業的培養機の中で、ポリペプチドが発現され、および/または単離されるに好適な培地中および条件下で実施される、震盪フラスコ培養、小スケールまたは大スケールの培養(連続、バッチ、フェドバッチ、または固体状態培養を含む)によって、培養される。培養は、本分野で知られた手法を用いて、炭素および窒素源を含む好適な栄養培地で実施される。好適な培地は、商業的供給者により入手可能であり、または、刊行された組成(例えば、American Type Culture Collectionカタログ)に従って調製され得る。ポリペプチドが栄養培地へ分泌されるとき、ポリペプチドは培地から直接回収され得る。ポリペプチドが分泌されないとき、それは、細胞溶解物から回収され得る。
【0038】
得られるポリペプチドは、本分野で知られる方法によって回収され得る。例えば、ポリペプチドは、栄養培地より、限定はされないが、遠心、ろ過、抽出、噴霧乾燥、エバポレーション、または沈殿を含む従来の手段により回収され得る。
【0039】
ポリペプチドは、本分野で知られている多様な手段で精製され得、これらの手段には、限定はされないが、クロマトグラフィー(例えば、イオン交換、アフィニティー、疎水性、クロマトフォーカシング、およびサイズ排除)、電気泳動の手段(例えば、分取等電点電気泳動法)、相違する溶解性(例えば、硫酸アンモニウム沈殿)、SDS−PAGE、または抽出(例えば、Protein Purification, J.-C. Janson and Lars Ryden, editors, VCH Publishers, New York, 1989参照)を含む。G−CSF活性を示すポリペプチドを生成する特有の方法は、D. MetcalfおよびN. A. Nicolaにより、The hemopoietic colony-stimulating factors, p. 50 51, Cambridge University Press (1995)に、C. S. Bae等により、Appl. Microbiol. Biotechnol, 52:338-344 (1999) and in US 4,810,643に記載されている。
【0040】
PEG化
生成されたG−CSFポリペプチドは、それから、当業者に知られた様々な方法によりPEG化され得る。例えば、G−CSFポリペプチドは、アミン特異的活性化ポリエチレングリコール(PEG)でPEG化されることができる。
【0041】
アミン特異的活性化ポリエチレングリコールは、上述したいずれでもよいが、例えば、mPEG-スクシンイミジルプロピオネート(mPEG-SPA)、mPEG-スクシンイミジルブタノエート(mPEG-SBA)、またはmPEG-スクシンイミジルα-メチルブタノエート(mPEG-SMB)である。PEG部分の分子量は、例えば、ポリペプチドに結合するPEG部分の数に基づいて、選択されることができ、しばしば、約1kDaから約20kDaの範囲、例えば、約1kDaから約12kDa、例えば、約2kDaから約10kDa、例えば、約4kDaから約6kDa、例えば、約5kDaであり得る。例えば、活性化PEGは、分子量約5kDaのmPEG-SPAであり得る。例えば、PEG化は、約7.5−9.0、例えば約8.0−8.5のpHで実施され得る。本明細書において、PEG部分について用いられるとき、用語「約」は、およその平均分子量を示し、通常、ポリマーの調製にある分子量分布が存在するという事実を反映する。更なるPEG化方法の一般情報のために、例えば、Nektar Advanced PEGylation Catalogs 2004および2005-2006、並びにそれらに引用されている参考文献を参照できる。G−CSFポリペプチドのためのより詳細なPEG化方法の記載は、また、WO 03/006501にある。
【0042】
部分的脱PEG化
脱PEG化工程のための高められたpHの選択は、脱PEG化が起こる温度、脱PEG化工程の時間、およびPEG化工程が実施されたpHを含む、PEG化に用いられた条件等の因子に基づく。一般的に、脱PEG化の間に使用されたpHが高いほど、脱PEG化工程は早い。したがって、当業者は、pH、時間および温度等の脱PEG化条件が、与えられ等状況で所望の結果を得るように各々調整され得ることを認識できる。例えば、比較的低い、高められたpH、例えば8および9の間を使用することが可能であるが、例えば、9および11の間、例えば9および10の間のより高いpHの使用は、早い脱PEG化をもたらす。典型的には、したがって、高められたpHは、約8.5から約11.0、例えば、約8.5から約10.5、例えば、約9.0から約10.0の範囲であり得る。高められたpHは、例えば、約9.2から約9.8、例えば約9.5の範囲であり得る。
【0043】
通常、脱PEG化工程は、一般的に最も効率的で、より処理時間が短く、より高い収率なので、PEG化の直ぐ後に行われる。したがって、発明は、この基本的なやり方において、PEG化バルク中間体の部分的脱PEG化工程化、それに続く、以下に記載するような、例えば、クロマトグラフィー精製のような従来の分離により特徴付けられる。しかしながら、いくつかの理由により望まれるのであれば、PEG化工程は、脱PEG化の前に、中間精製工程が続き得る。中間精製工程は、例えば、限外ろ過および/またはジアフィルトレーション(diafiltration)が続く、下記に記載するようなクロマトグラフィー精製を含む。かかる中間精製工程から得られる中間体生産物は、所望ならば、脱PEG化およびその後の生成段階の前に貯蔵され得る。この場合、中間PEG化工程化生産物は、例えば、当業者に一般的に知られる方法を用いて、凍結または凍結乾燥によって、例えば、貯蔵され得る。
【0044】
脱PEG化は、他の面では、対象となるポリペプチドに好適な温度で実施され、例えば、約5℃から約40℃、例えば、約10℃から約35℃で実施される。脱PEG化は、しばしば、約15℃から約25℃、例えば、約20−22℃の大気温度で実施され得る。
【0045】
上記で説明したように、所望の結果を得るために高められたpHでの脱PEG化工程の時間は、pHおよび温度等の他の因子に依存し得るが、一般的に、約2時間から約100時間、典型的には、約4時間から約72時間、より典型的には、約8時間から約48時間の範囲であり得る。通常、脱PEG化の工程を可能な限り短い時間で実施することが望まれるので、ポリペプチドは、しばしば、約24時間を超えない期間で、例えば、約12時間から約30時間、例えば、約18時間から約24時間、高められたpHで置かれ得る。上記に示したように、高められたpHでの相対的に短い時間は、一般的に、相対的に高いpH、例えば、約9−10を伴い得る。
【0046】
高められたpHでの脱PEG化に続いて、pHは、約8.0またはそれ以下、とりわけ、ポリペプチドに対して意図された貯蔵条件に従って、選択されたpHに低下される。例えば、G−CSFに対して、長期貯蔵のための好適なpHは、しばしば、約2.0から約5.0の間、例えば、約2.5から約4.5、例えば約4.0であり得る。いくつかの場合において、例えば、使用される特定の製剤に依存して、幾分高いpH、例えば、約5.0−8.0、例えば、約6.0−7.5、例えば、約7.0−7.5が選択され得る。G−CSFの多様な医薬製剤が、例えば、US 5,104,651、US 5,919,757、US 6,497,869およびUS 6,776,983に記載されている。
【0047】
本発明におけるpHの調整のために、いずれの好適な酸または塩基、有機または無機酸および塩基が使用され得る。同様に、いずれの好適な緩衝液が、pHを所望のレベルに維持するために使用され得る。当業者は、例えば、対象となるポリペプチド及び所望のpHに依存して、いずれの与えられた状況に適する、酸、塩基および緩衝液をよく知っている。
【0048】
pHの低下に引き続き、所望の数のPEG基が結合したポリペプチドを分離するために、ポリペプチドは、通常、少なくとも1つのクロマトグラフィー精製工程、例えば、イオン交換クロマトグラフィーまたはゲルろ過クロマトグラフィーにかけられる。クロマトグラフィー精製は、当業者に一般的に知られた方法を用いて実施され得る。例えば、脱PEG化に続く低下されたpHが約7.0より下の場合、カチオン交換クロマトグラフィーが使用され得る。あるいは、または付け加えて、高められたpH値で、pHの低下の前に、アニオン交換クロマトグラフィーを用いて、クロマトグラフィーが実施され得る。生成物の更なる精製並びに分析は、同様に、当業者に知られた標準的な方法を用いて実施され得る。例えば、クロマトグラフィー精製工程に続く更なる精製は、例えば、限外ろ過またはジアフィルトレーションを用いて、実施され得る。
【0049】
上記したように、本発明の更なる態様は、G−CSFポリペプチドを、アミン特異的活性化ポリエチレングリコール(PEG)を用いてPEG化し、その後、水酸基に結合したPEG部分を取り除くために好適な時間、PEG化ポリペプチドを、少なくとも約9.0の高められたpHに置くことを含む、PEG化G−CSFポリペプチドの製造方法に関する。
この方法は、リジン残基のイプシロンアミノ基またはN末端のアミノ基に結合した少なくとも1つのPEG部分を有し、そして、水酸基に結合したPEG部分が実質的にないPEG化G−CSFポリペプチドをもたらす。ある実施態様において、本発明のこの実施態様は、約7.0−9.0のpHでのPEG化、その後、pHを不安定なPEG部分を取り除くために高めることを用いて、実施される。他の実施態様において、PEG化は、9.0以上、例えば、9−11の範囲のpH、例えば、9.2から10.0で、例えば、約9.5の比較的高いpHで実施され得る。この場合、PEG化および脱PEG化は、単一工程で、単一pH値で、N末端およびリジン残基で所望のPEG化が起こり、一方、望まれない水酸基へのPEG部分の結合を回避するために十分な時間実施され得る。
【0050】
アミン特異的活性化PEGは、上記したいずれでもよく、例えば、mPEG-スクシンイミジルプロピオネート(mPEG-SPA)、mPEG-スクシンイミジルブタノエート(mPEG-SBA)またはmPEG-スクシンイミジルα-メチルブタノエート(mPEG-SMB)であり得る。PEG部分の分子量は、同様に上記した通りであり、例えば、約1kDaから約20kDaの範囲、例えば、約1kDaから約12kDa、例えば、約2kDaから約10kDa、例えば、約4kDaから約6kDa、例えば約5kDaであり得る。例えば、活性化されたPEGは、約5kDaの分子量を有するmPEG−SPAであり得る。例えば、PEG化は、約7.5−9.0、例えば、約8.0−8.5のpHで実施され得る。PEG化の間に使用されるpHに基づいて、選択される高められたpHは、また、一般的に上記された範囲と同様であり得、例えば、約9.2から11.0の範囲、約9.2から10.0の範囲であり得る。同様に、高められたpHでの時間は、また、上記のように選択され得、そして、同じことが、その後の精製等にも当てはまる。
【0051】
本明細書で記載される方法は、均質な、および安定なPEG化蛋白質を製造することを目的とした製造方法に対して、多くの利点を与え、それらには、それが、単純および迅速で、限定された時間の間、変化されたpHの余分な1つの工程のみを要求するものであり、そして、他に、製造方法に使用されるPEG化または精製方法を変化させる必要が無い、という事実を含むものである。この理由のために、不安定なPEG基を取り除くために十分な時間、pHを変化させる同じ一般的な手法は、いずれのPEG化蛋白質の製造に使用され得る。一般的に、塩基性または酸性pHが、水酸基に結合した不安定なPEG部分を取り除くために使用され得、不安定PEG部分の脱離が、pHがより酸性(酸性pH)またはより塩基性(塩基性pH)のとき起こる。不安定なPEGの脱離を得るための条件の選択は、例えば、PEG部分の結合部位の微視的環境を含む、特定蛋白質の構造特性に基づいてなされ得る。
【0052】
PEG化G−CSFポリペプチド
上記に示したように、本発明の方法は、相違するPEG位置異性体の数の観点から、PEG化ポリペプチドの均一性が高められることに利点がある。結合基の数および使用される特定のPEG化化学に依存して、本発明は、別なやり方で可能である以上に、より均質で、より安定なPEG化G−CSFの単離を可能にする。例えば、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを有するPEG化G−CSFポリペプチドが見出されてきており、少なくとも約90−95%のポリペプチドのPEG位置異性体が、3つの結合されたPEG部分を有する、生産物を得ることが可能である。
【0053】
本発明の他の実施態様は、PEG化G−CSFポリペプチド改変体のPEG位置異性体の均質な混合物を含む組成物に関し、ここで、混合物の少なくとも約80%、より好ましくは少なくとも約85%、さらにより好ましくは少なくとも約90%、例えば少なくとも約95%のPEG位置異性体が、2つのPEG位置異性体からなり、各々は、リジン残基のイプシロンアミノ基に結合した2つのPEG部分およびN末端アミノ基に結合した1つのPEG部分を有する。
【0054】
したがって、本発明の他の実施態様は、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含む、PEG化G−CSFポリペプチドに関し、ここで、ポリペプチドの少なくとも約80%のPEG位置異性体が、3つの結合されたPEG部分を有する。典型的には、3つの結合されたPEG部分を有するPEG位置異性体の割合は、80%より大きく、例えば少なくとも約85%または少なくとも約90%であり得、そして、より高く、例えば、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%、または少なくとも約95%であり得る。更なる他の実施態様において、本発明は、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kのみを含むPEG化G−CSFポリペプチドに関し、ここで、ポリペプチドのPEG位置異性体の少なくとも約80%が、3つの結合されたPEG部分を有する。典型的には、3つの結合されたPEG部分を有するPEG位置異性体の割合は、80%より大きく、例えば、少なくとも約85%または少なくとも約90%であり得、そして、それより高く、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%または少なくとも約95%であり得る。
【0055】
更なる実施態様において、本発明は、野生型ヒトG−CSFに比較して置換K16R、K34R、K40R、T105KおよびS159Kを含むPEG化G−CSFポリペプチドの混合物を含む組成物に関し、ここで、混合物中のPEG化G−CSFポリペプチドの少なくとも約80%、好ましくは少なくとも約85%、より好ましくは少なくとも約90%、少なくとも約95%が、2つのPEG位置異性体からなり、各々は3つのPEG基を含み、異性体の1つは、N末端、Lys23およびLys159で結合したPEG基を有し、他の異性体は、N末端、Lys105およびLys159で結合したPEG基を有する。他の実施態様において、本発明は、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kのみを含むPEG化G−CSFポリペプチドの混合物を含む組成物に関し、ここで、混合物中のPEG化G−CSFポリペプチドの少なくとも約80%、好ましくは少なくとも約85%、より好ましくは少なくとも約90%、例えば少なくとも約95%は、各々が3つのPEG基を含む、2つのPEGG−CSF異性体からなり、ここで、異性体の1つは、N末端、Lys23およびLys159で結合したPEG基を有し、そして、他の異性体は、N末端、Lys105およびLys159で結合したPEG基を有する。
【0056】
本発明により製造されるPEG化G−CSFポリペプチドは、PEG化の程度において高度に貯蔵安定的であることが見出されてきた。下記の実施例に示されるように、かかるPEG化G−CSFポリペプチドの水性製剤は、PEG化パターンの大きな変更がなく、長期間貯蔵可能である。このことは、とりわけ、組成物が5℃で貯蔵されたときに事実であるが、驚くことに、組成物が25℃または35℃の高い温度で貯蔵されるときにさえ、比較的に安定であることが見出されてきた。
【0057】
したがって、本発明の更なる態様は、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含む、貯蔵安定なPEG化G−CSFポリペプチドに関し、ここで、ポリペプチドのPEG位置異性体の少なくとも約80%が、5℃の温度で、3月間、水性の参照組成物(aqueous reference composition)中で貯蔵した後、3つの付加PEG部分を有する。典型的には、5℃の温度で3月間貯蔵後の3つの結合されたPEG部分を有するPEG位置異性体の割合は、80%より大きく、例えば、少なくとも約85%または少なくとも約90%であり得る。いくつかの場合に置いて、この割合はさらに高く、例えば、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%または少なくとも約95%であり得る。本発明に従って製造されるPEG化G−CSFポリペプチドの安定性の測定の目的のために、安定性は実施例4に記載されたように、例えば、参照組成物としてそこで記載されているA、B、CまたはD製剤の一つ、とりわけ製剤Dを用いて、試験され得る。
【0058】
医薬的組成物
本発明の他の態様は、本発明に従ったPEG化G−CSFポリペプチドを含む医薬組成物に関する。したがって、本発明の一実施態様は、医薬的に許容される担体およびPEG化G−CSFポリペプチドを含む組成物に関し、ここで、ポリペプチドは、野生型ヒトG−CSF(配列番号:1)に比較して置換K16R、K34R、K40R、T105KおよびS159Kを含み、そして、ここで、ポリペプチドのPEG位置異性体の少なくとも80%は、3つの結合されたPEG部分を有する。典型的には、3つの結合されたPEG部分を有するPEG位置異性体の割合は、少なくとも約85%、好ましくは少なくとも約90%、であり得、そして、さらに高く、例えば少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%、または少なくとも約95%であり得る。更なる他の実施態様において、本発明は、医薬的に許容され得る担体およびPEG化G−CSFポリペプチドを含む医薬組成物に関し、ここで、ポリペプチドは、野生型ヒトG−CSF(配列番号:1)に比較して、置換K16R、K34R、K40R、T105KおよびS159Kのみを含み、ポリペプチドの少なくとも約80%のPEG位置異性体は、3つの付加PEG部分を有する。典型的には、3つの付加PEG部分を有するPEG位置異性体の割合は、少なくとも約85%、好ましくは約90%、であり得、そして、さらに高く、例えば、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%、または少なくとも約95%であり得る。
【0059】
本発明の他の実施態様は、PEG化G−CSFポリペプチド改変体のPEG位置異性体の均一な混合物を含む医薬組成物に関し、ここで、混合物のPEG位置異性体の少なくとも80%、好ましくは少なくとも85%、より好ましくは少なくとも約90%、例えば、少なくとも約95%が、2つのPEG位置異性体からなり、それぞれは、リジン残基のイプシロンアミノ基に結合した2つのPEG部分およびN末端アミノ基に結合した1つのPEG部分からなるPEG部分を有する。
【0060】
更なる実施態様において、本発明は、医薬的に許容可能な担体および野生型ヒトG−CSFに比較して置換K16R、K34R、K40R、T105KおよびS159Kを含むPEG化G−CSFポリペプチドの混合物を含む、医薬組成物に関し、ここで、混合物中のPEG化G−CSFポリペプチドの少なくとも約80%、好ましくは少なくとも85%、より好ましくは少なくとも約90%、例えば、少なくとも約95%が、2つのPEG位置異性体からなり、それぞれは、3つのPEG基を有し、ここで、異性体の一つは、N末端、Lys23およびLys159で結合したPEG基を有し、他の異性体は、N末端、Lys105およびLys159に結合するPEG基を有する。更なる実施態様において、本発明は、医薬的に許容可能な担体および野生型ヒトG−CSFに比較して置換K16R、K34R、K40R、T105KおよびS159Kのみを含むPEG化G−CSFポリペプチドの混合物を含む、医薬組成物に関し、ここで、混合物中のPEG化G−CSFポリペプチドの少なくとも約80%、好ましくは少なくとも85%、より好ましくは少なくとも約90%、例えば、少なくとも約95%が、2つのPEG位置異性体からなり、それぞれは、3つのPEG基を有し、ここで、異性体の一つは、N末端、Lys23およびLys159で結合したPEG基を有し、他の異性体は、N末端、Lys105およびLys159に結合するPEG基を有する。
【0061】
本発明のG−CSFポリペプチドを含む医薬組成物は、あらゆる形態で、例えば、凍結乾燥形態、または、好ましくは、安定な液体製剤で、典型的には水性製剤として、製剤化され得る。かかる組成物は、典型的には、緩衝剤、防腐剤、等張剤(isotonicifier)、安定化剤、非イオン性界面活性剤または洗剤、および増量剤または充填剤、キレート剤、抗酸化剤および共溶媒のような付加的な種々の賦形剤から選択される、1またはそれ以上の成分を含む。G−CSFの好適な製剤の一例は、pH4.0の水溶液中で供給され、0.6ml当たり、0.35mg酢酸、30.0mgソルビトール、0.02mgポリソルベート20、および0.02mgナトリウムを含む、ニューラスタ(登録商標)(ペグフィルグラスチム)のために用いられているものである。
【0062】
医薬組成物の一例は、非経腸投与のために設計された溶液である。多くの場合で、医薬液体製剤は、直ぐに使用するのに適した。液体形態で提供されるが、かかる非経腸製剤は、また、凍結または凍結乾燥形態で提供され得る。前者の場合、組成物は、使用前に解凍されなければならない。後者の形態は、凍結乾燥製剤が一般的に対応する液体よりもより安定であると、当業者により認識されているので、多様な貯蔵条件下で、組成物中に含まれる活性化合物の安定性を増強するために、しばしば用いられる。かかる凍結乾燥製剤は、使用前に、注射用滅菌水または滅菌生理食塩水等の1またはそれ以上の好適な医薬的に許容可能な希釈剤の添加により、再構成される。しかしながら、本発明の組成物は、好ましくは、水溶液の形態である。
【0063】
非経口剤において、それらは、適切なときは、所望の純度を有するポリペプチドと、1以上の医薬的に許容可能な担体、典型的に本分野で採用される賦形剤または安定化剤(それら全てが「賦形剤」と呼ばれ得る)、例えば、緩衝剤、安定化剤、防腐剤、等張剤、非イオン性界面活性剤、抗酸化剤および/または他の多様な添加剤と混合して、凍結乾燥製剤または水溶液としての貯蔵のために製造される。
【0064】
緩衝剤は、所望の範囲でpHを維持するのを助ける。それらは、典型的には、約2mMから約50mMの範囲の濃度で存在する。好適な緩衝剤は、クエン酸緩衝液(例えば、クエン酸1ナトリウム−クエン酸2ナトリウム混合物、クエン酸−クエン酸3ナトリウム混合物、クエン酸−クエン酸1ナトリウム混合物等)、コハク酸緩衝液(例えば、コハク酸−コハク酸1ナトリウム混合物、コハク酸−水酸化ナトリウム混合物、コハク酸−コハク酸2ナトリウム混合物等)、酒石酸緩衝液(例えば、酒石酸−酒石酸ナトリウム混合物、酒石酸−酒石酸カリウム混合物、酒石酸−水酸化ナトリウム混合物等)、フマル酸緩衝液(例えば、フマル酸−フマル酸1ナトリウム混合物、フマル酸−フマル酸2ナトリウム混合物、フマル酸1ナトリウム−フマル酸2ナトリウム混合物等)、グルコン酸緩衝液(例えば、グルコン酸−グルコン酸ナトリウム混合物、グルコン酸−水酸化ナトリウム混合物、グルコン酸−グルコン酸カリウム混合物等)、シュウ酸緩衝液(例えば、シュウ酸−シュウ酸ナトリウム混合物、シュウ酸−水酸化ナトリウム混合物、シュウ酸−シュウ酸カリウム混合物等)、乳酸緩衝液(例えば、乳酸−乳酸ナトリウム混合物、乳酸−水酸化ナトリウム混合物、乳酸−乳酸カリウム混合物等)および酢酸緩衝液(例えば、酢酸−酢酸ナトリウム混合物、酢酸−水酸化ナトリウム混合物等)のような、有機および無機の酸およびそれらの塩の両方を含む。更なる可能性は、リン酸緩衝液、ヒスチジン緩衝液およびトリスのようなトリメチルアミン塩である。
【0065】
防腐剤は、微生物の成長を遅らせるために添加され、存在するときは、約0.2%−1%(w/v)の量で、典型的に添加される。好適な保存剤には、フェノール、ベンジルアルコール、メタクレゾール、メチルパラベン、プロピルパラベン、オクタデシルジメチルベンジルアンモニウムクロライド、ベンザルコニウムハライド類(例えば、塩化、臭化またはヨウ化ベンザルコニウム)、塩化ヘキサメトニウム、メチルまたはプロピルパラベン等のアルキルパラベン類、カテコール、レゾルシノール、シクロヘキサノールおよび3−ペンタノールを含む。
【0066】
等張剤は、液体組成物の等張性を確保するために添加され、多価糖アルコール類、好ましくは3価またはそれ以上の価の糖アルコール類、例えば、グリセリン、エリトリトール、アラビトール、キシリトール、ソルビトールおよびマンニトール等を含む。多価アルコールは、他の成分の相対量を考慮し、0.1重量%および25重量%の間の量で、典型的には、1%から5%で存在することができる。
【0067】
安定化剤は、増量剤から、治療成分を溶解させ、または、変性や容器壁への吸着を防ぐことを助ける添加剤までの機能であり得る、広範なカテゴリーの賦形剤を言う。典型的な安定化剤は、多価糖アルコール類(上記で列挙した);アミノ酸、例えば、アルギニン、リジン、グリシン、グルタミン、アスパラギン、ヒスチジン、アラニン、オルニチン(omithine)、L−ロイシン、2−フェニルアラニン、グルタミン酸、スレオニン等;有機糖類または糖アルコール類、例えば、ラクトース、トレハロース、スタキオース、マンニトール、ソルビトール、キシリトール、リビトール、ミオイノシトール(myoinisitol)、ガラクチトール、グリセロール等、イノシトール等のシクリトールを含む;ポリエチレン グリコール;アミノ酸ポリマー類;硫黄含有還元剤、例えば、尿素、グルタチオン、チオクト酸、チオグリコール酸ナトリウム、チオグリセロール、α−モノチオグリセロールおよびチオ硫酸ナトリウム;低分子量ポリペプチド(つまり、<10残基);蛋白質、例えば、ヒト血清アルブミン、ウシ血清アルブミン、ゼラチンまたは免疫グロブリン類;親水性ポリマー類、例えば、ポリビニルピロリドン;単糖類、例えば、キシロース、マンノース、フルクトースおよびグルコース;二糖類、例えば、ラクトース、マルトースおよびスクロース;3糖類、例えば、ラフィノース、および多糖類、例えば、デキストランであり得る。安定化剤は、例えば、活性な蛋白質重量に基づいて、0.1から10000重量部の範囲で存在し得る。
【0068】
非イオン性界面活性剤または洗剤(または、湿潤剤として知られる)は、治療的成分の溶解を助け、並びに、治療的ポリペプチドを、攪拌惹起凝集から保護するために存在し得、それは、また、ポリペプチドを変性させることなく、表面応力をそぎ取るために、製剤に暴露させられることができる。好適な非イオン性界面活性剤は、ポリソルベート類(20、80等)、ポリオキサマー類(184、188等)、プルロニック(登録商標)ポリオール類、ポリオキシエチレンソルビタンモノエステル類(トゥイーン(Tween)(登録商標)−20、トゥイーン−80等)を含む。
【0069】
添加され得る様々な付加的な賦形剤には、増量剤または充填剤(例えば、デンプン)、キレート剤(例えば、EDTA)、抗酸化剤(例えば、アスコルビン酸、メチオニン、ビタミンE)および共溶媒が含まれる。
【0070】
活性成分は、また、例えば、コアサーべーション(coascervation)技術、または界面重合によって、例えば、コロイド薬物デリバリーシステム(例えば、リポソーム類、アルブミンミクロスフェア類、ミクロエマルジョン類、ナノ粒子類およびナノカプセル類)またはマクロエマルジョンにおける、ヒドロキシメチルセルロース、ゼラチンまたはポリ−メチルメタシレートマイクロカプセルによって、調製されたミクロカプセルに取り込まれ得る。
【0071】
インビボ投与に使用される非経腸製剤は、滅菌であるべきである。これは、当分野でよく知られた方法、例えば、滅菌ろ過膜を通したろ過により、容易になされる。
【0072】
治療方法
本発明の他の態様は、治療方法および本発明のPEG化G−CSFポリペプチドを用いた医薬の製造方法に関する。白血球減少症(白血球の低下したレベル)および好中球減少症(好中球の低下したレベル)は、あらゆるタイプの感染症に罹患しやすくなる。好中球減少症は、例えば、HIVに罹患した患者で慢性であり、化学療法または放射線療法を受ける癌患者で急性である。重篤な好中球減少症の患者にとっては、例えば、化学療法の結果として、相対的に少ない感染症でさえも重大であり得、好中球減少症は、しばしば、化学療法プロトコールの中断を要求する。本発明のPEG化G−CSFポリペプチドは、ある種の化学療法、放射線治療および骨髄移植を受ける癌患者の感染症の予防または治療、末梢血液前駆細胞移植のための前駆細胞銀行のための輸送、重篤で慢性的な、または相対的な白血球減少症の治療、急性骨髄性白血病を有する患者の治療、AIDSまたは他の免疫不全疾患の治療、および抗真菌治療、とりわけ全身性または侵襲性カンジダ症にとりわけ好適である。本発明の目的のための「患者」は、本発明の治療方法がヒト患者の治療を主たる目的としているが、ヒトおよび他の哺乳類の両方を含む。
【0073】
したがって、本発明の態様は、不十分な好中球レベルに罹患したまたはその危険のある患者における、好中球レベルを増加する方法に関し、該患者に、上記PEG化G−CSFポリペプチドの有効量またはPEG化G−CSFポリペプチドを含む上記医薬組成物を投与することを含む。本発明のこの実施態様において、不十分な好中球レベルに罹患またはその危険のある患者は癌患者であり、とりわけ化学療法または放射線療法、特に化学療法で処置される癌患者である。
【0074】
本発明のPEG化G−CSFポリペプチドは、乳癌、非小細胞肺癌、小細胞肺癌、結腸直腸癌、子宮癌、卵巣癌、非ホジキンリンパ腫 (NHL)およびホジキン病を含む、あらゆる相違するタイプの癌に罹患した患者において、好中球の生産を刺激するのに有用であることが意図される。同様に、本発明のポリペプチドは、以下を含むあらゆる相違する化学療法剤を受ける患者に投与することが意図される:
・アルキル化剤、例えばマスタードガス誘導体、例えば、シクロホスファミド、クロラムブシル、イホスファミド、メクロレタミンまたはメルファラン;エチレンイミン類、例えば、ヘキサメチルメラミンまたはチオテパ;アルキルスルホネート類、例えば、ブスルファン;ヒドラジン類およびトリアジン類、例えば、アルトレタミン、デカルバジン、プロカルバジンまたはテモゾロミド;ニトロソウレア類、例えば、カルムスチン、ロムスチンまたはストレプトゾシン;および無機金属錯体試薬、例えば、シスプラチン、カルボプラチンまたはオキサリプラチン;
・植物アルカロイド類、例えば、タキサン類(例えば、ドセタキセルまたはパクリタキセル)、ビンカ・アルカロイド(例えば、ビンブラスチン、ビンクリスチンまたはビノレルビン)、カンプトテカン(camptothecan)誘導体(例えば、イリノテカンまたはトポテカン)およびポドフィロトキシン類(エトポシドまたはテニソピド);
・抗腫瘍抗生物質、例えば、アンスラサイクリン類、例えば、ダウノルビシン、ドキソルビシン、エピルビシン、イダルビシン、またはミトキサントロン;クロモマイシン類、例えば、ダクチノマイシンまたはプリカマイシン;および他の抗腫瘍抗生物質、例えば、ブレオマイシンまたはマイトマイシン;
・代謝拮抗物質、例えば、葉酸拮抗剤、例えば、メトトレキサート;ピリミジン拮抗剤、例えば、カペシタビン、シタラビン、5−フルオロウラシル(5−FU)、ホキシウリジン(Foxuridine)またはゲムシタビン;プリン拮抗薬、例えば、6−メルカプトプリンまたは6−チオグアニン;アデノシンデアミナーゼ阻害剤、例えば、クラドリビン(Cladribine)、フルダラビン、ネララビンまたはペントスタチン;およびリボヌクレアーゼレダクターゼ阻害剤、例えばヒドロキシウレア;
・トポイソメラーゼ阻害剤、例えば、トポイソメラーゼI阻害剤、例えば、イロノテカン(Ironotecan)またはトポテカン;およびトポイソメラーゼII阻害剤、例えば、アムサクリン、エトポシド、エトポシドホスフェートまたはテニポシド。
【0075】
本発明のPEG化G−CSFポリペプチドは、有効または治療有効量、例えば、投与される状態に関連した所望の効果を奏するのに十分な量、とりわけ、与えられた状況下で、好中球の所望の刺激を得るのに十分な量で、投与され得る。正確な用量は、例えば、個人患者および処置される疾患等の因子に依存し得、当業者、典型的には医者により決定され得る。PEG化G−CSFポリペプチドの用量は、例えば、ペグフィルグラスチン(pegfilgrastim)(Neulasta(登録商標))で現在推奨されている用量、成人患者当たり6mg、とほぼ同じ規模であり得る。したがって、本発明のPEG化G−CSFポリペプチドの適切な用量は、約1mgから約15mgの範囲、例えば、約2mgから約15mg、例えば、約3mgから約12mgであることが意図される。したがって、好適な用量は、例えば、約3mg、約6mg、または約9mgであり得る。それぞれの場合、投与量は、患者当たりの標準用量として表され、ここで、患者は成人またはさもなければ少なくとも45kgの体重の患者である。場合により、用量は、患者の体重によって決定され得、本発明のG−CSFポリペプチドの適切な用量は、約10μg/kgから約200μg/kgの範囲、例えば、約25μg/kgから約150μg/kg、例えば、約30μg/kgから約120μg/kgである。したがって、好適な用量は、約30μg/kg、約60μg/kg、約90μg/kgまたは約120μg/kgである。
【0076】
本発明はさらに以下の非限定的な実施例によって記載される。
【実施例】
【0077】
実施例1
部分的に脱PEG化されたG−CSF改変体の製造および分析
サンプルの調製および脱PEG化
野生型ヒトG−CSF(配列番号:1)に比較した置換K16R、K34R、K40R、T105KおよびS159Kを有するG−CSFを、WO 03/006501に実質的に記載されたCHO−K1細胞より製造した。4.5mg/mlのG−CSF改変体200ml(900mgG−CSF)を、mPEG−SPA5000(Nektar Therapeutics)を用いてPEG化した。簡単には、mPEG−SPA5000の13.2%(w/w)溶液100mLを、G−CSF溶液の200mLに10分に渡って添加し、ゆっくり攪拌し十分な混合を確保した。サンプルを21±3℃、pH8.5で44分インキュベートし、ゆっくり攪拌した。サンプル混合物を、その後、800mMホウ酸、pH10.0のストック溶液を用いてpH9.5に調整した。そして、サンプルを21±3℃で24時間、攪拌せずにインキュベーションした。その後、サンプルを100 mmol/kg クエン酸、20 mmol/kg NaOH、pH 2.5を用いて、約2.5倍に濃縮し、最終pHを3.5とした。
【0078】
部分的に脱PEG化されたG−CSFの単離
pHを3.5に低下させた後、直ぐに、サンプルを、20 mmol/kg クエン酸、15 mmol/kg NaOH、pH 3.4で平衡化させた約225 mLのSP-Sepharose HP (Amersham, GE Healthcare)を充填したVL44(Millipore)カラムに載せた。物質を載せた後、遊離のmPEG−酸等の非結合物質を取り除くために、カラムを洗浄した。25−100%溶出緩衝液(20 mmol/kg クエン酸、20 mmol/kg NaOH、200 mmol/kg NaCl、pH 3.5)の直線グラジエントを用い、カラムよりPEG化G−CSFを溶出した。グラジエントを25 CV(カラム体積)に対して展開した。カラム工程を21±3℃で実施し。使用した全ての緩衝液を同じ温度に調整した。カラムの搭載は4.1mg蛋白質/mlレジンであり、流速は8CV/時間であった。
【0079】
40mLのサンプルサイズを有するフラクションを集め、SDS−PAGEで解析した。SDS−PAGE分析に基づいて、約6.5CVに対応し、G−SCF分子当たり主に3つの結合されたPEG基を有する単離されたG−CSFを含む、1440mLの生成物プールを作成した。生成物プールの体積は、溶出グラジエントの傾斜を増加させることにより減らすことができることが、予想される。
【0080】
生成物プールをジアフィルトレーションして、約200mLとし、その後、10 mM 酢酸ナトリウム、43 mg/mL、pH 4.0でジアフィルトレーション
し、30kDaの分子量カットオフ(MWCO)の2つの50 cm2 Millipore Pellicon XL membraneを備えたMillipore LabScale TFF系を用いて、4.9 mg/mLに濃縮した。
【0081】
結果
生成物プールを10 mM 酢酸ナトリウム、43 mg/ml マンニトール、pH 4.0中で限外ろ過およびジアフィルトレーションを行い、物理化学的特徴付けを行った。図1は、上記したPEG化、部分的脱PEG化、および精製したG−CSF改変体のSDS−PAGE分析のスキャンを示し、7つのレーンは、以下を示す:
1.分子量マーカー
2.PEG化後
3.pH9.5、T=0h
4.pH9.5、T=24h
5.カチオン交換カラムへの添加物
6.カチオン交換カラムからの流出物
7.精製産物
【0082】
レーン7に、ポリペプチド分子当たり3つのmPEG−SPA5000基を有するG−CSF改変体に相当する、単一の大きなバンドが認められる。さらに、4つのmPEG−SPA5000基を有するG−CSF改変体に相当する小さいバンドが、また、レーン7で見られる。所望により、本分野で一般的に知られる方法により、精製手段の最適化または調整を行うことにより、要求される純度により収量が僅かに減り得るが、4PEG基に相当する小さなバンドを、減少させ、または実質的に取り除くことができる。
この手順の収量は、精製、ポリペプチド分子当たり主に3PEG基を有する部分的脱PEG化G−CSFの450mgであり、これは、全体の50%の収量であった。
【0083】
実施例2
部分的脱PEG化G−CSFの製造および解析
サンプル調製、脱PEG化および精製
野生型ヒトG−CSF(配列番号:1)に比較した、置換K16R、K34R、K40R、T105KおよびS159Kを有するG−CSF改変体を、CHO−K1細胞から製造し、その後、実質的に上記実施例1に記載したように、mPEG−SPA5000を用いてPEG化した。これを、10 kDa MWCOフィルターを備えたVivaspinろ過装置を用い、150mMホウ酸ナトリウム、pH9.5にジアフィルトレーションした。最終サンプルの濃度は4.7mg/mLであった。そして、サンプルを21±3℃、42時間インキュベーションした。
【0084】
インキュベーション後、サンプルを30 mM クエン酸、10 mM NaOH、pH 2.9で希釈することによって、カチオン交換クロマトグラフィーのために調製した。そして、サンプルを28mLのSP-Sepharose HP resinで充填されたXK16/20カラム(Amersham Biosciences)上に置いた。カラムを、サンプルを載せる前に、20 mM クエン酸、15 mM NaCl、pH 3.5の平衡化緩衝液で平衡化した。カラムに載せた後、カラムを同じ緩衝液で洗浄し、20 mM クエン酸、pH 3.5中、15 mMから200 mM NaClの直線グラジエントを用いて溶出し、相違するPEG化種を分離した。
【0085】
フラクションを集め、SDS−PAGE分析で分析した。3個のPEG部分を主に含むPEG化G−CSF改変体を含む生成物プールを、SDS−PAGEに基づき作成した。この生成物プールを、10kDaのMWCOを有するVivaspinろ過装置を用いてジアフィルトレーションし、緩衝液を交換した。サンプルを10mMコハク酸ナトリウム、43 mg/mL、pH 4.0にジアフィルトレーションし、最終的に3.0mg/mlに濃縮した。
【0086】
位置異性体解析
シアリダーゼ前処理と組み合わせたカチオン交換HPLC(CIEX-HPLC)を用いて、多様なPEG化種を含む生成物プール中の異なる位置異性体の組成について、データを得た。相違する位置異性体の存在によるPEG化後の不均一性に加えて、PEG化G−CSFは、また、0、1または2個のシアル酸基を有する、1つのO-グリコシレーション部位(Thr133)を含むという点で、不均一である。シアル酸基の相違する数の結果として、クロマトグラムにおけるピークの数を減少させるために、分析前に、シアリダーゼ酵素前処理工程が含まれる。シアリダーゼ処理は、最初に、必要であれば、50 mM 酢酸ナトリウム緩衝液、pH 5.0で1mg/mlに希釈し、その後、μg蛋白質当たり0.05μl(0.25m単位)のシアリダーゼを添加し、サンプルを37℃で18時間インキュベーションし、シアル酸を除くことによって、実施される。そして、サンプルを同日に解析するか、または解析の日まで4℃で保存する。HPLCを、PolySULFOETHYL A(登録商標)カチオン交換HPLCカラム(PolyLC Inc.)を用いて、214nmのUV検出で実施する。異なるピークの特徴付けをPolySULFOETHYL A(登録商標)CIEXカラムから手動のコレクションの後、SDS−PAGE分析により実施した。
【0087】
結果−PEG損失
緩衝液を交換したサンプルをSDS−PAGE分析により解析し、時間の関数としての、PEG損失の程度を評価した。結果(図2参照)は、実施例1に対する図1に示されるものと同様であり、24または42時間インキュベーションしたサンプル間に認められた全体的なPEG化の程度における僅かな変化のみが存在した(図2、レーン4および5)。
【0088】
結果−生成物プール中の位置異性体の評価
図3は、上記に記載されたような、SDS−PAGE分析により判断される主に3個のPEG5000基を含む、本発明の部分的脱PEG化G−CSF化生成物プールのカチオン交換クロマトグラムを示す。2つの大きなピークは、それぞれ、3個のPEG500基を有するメジャーな位置異性体を示す。3つの小さなピークは、4個のPEG基を有する2つの位置異性体および2個のPEG基を有する1つの位置異性体を示す。
【0089】
2つの大きなピークを回収し、PEG基が結合された位置を決定するためにネイティブペプチドマップ解析を行った。2つのメジャーな位置異性体は、以下のアミノ酸残基上でPEG化されていることが見出された:
異性体A:N末端、Lys23およびLys159
異性体B:N末端、Lys105およびLys159
これら2つのメジャーな異性体は、サンプルに存在する位置異性体の95%より多いことが示された。
【0090】
実施例3
比較例
比較する目的のために、図4は、本発明の脱PEG化を行わなかった精製、PEG化G−CSF改変体のカチオン交換クロマトグラムの結果を示す。この場合、G−CSF改変体は、実施例1および2で上記に示されたのと同じ、天然ヒトG−CSFに比較した5つの置換、つまり、K16R、K34R、K40R、T105KおよびS159Kを有した。それは、製造され、不安定なPEG部分を取り除くためにpH9.5でインキュベーションしたことを除いて、実施例1で実質的に記載されたようにmPEG−SPA5000でPEG化された。結果として、PEG化改変体は、2−6付加PEG部分を有する多くの相違するPEG異性体の混合物を含んだ。この位置異性体の混合物を、実施例1に実質的に記載されたようなカチオン交換クロマトグラフィーを用いて精製した。主に4−5付加PEG部分を含むフラクションを単離し、実質的に実施例1に記載されたような限外ろ過およびジアフィルトレーションの後、上記に記載したようなCIEX-HPLC分析にかけた。このフラクションは、実施例1および2に記載した3−PEGフラクションに相当するが、部分的に脱PEG化された3−PEG生成物に比較して1または2の位置で付加された(不安定な)PEG基が結合されており、つまり、この場合は、精製産物は、主として4−5付加PEG基を含む。
【0091】
図3に組成が示されている、本発明により調製された部分的に脱PEG化された生成物に比較して、図4に示された生成物は、明らかに、より複雑で、不均一な混合物である。図3に示された本発明により調製された生成物は、それぞれが3つのPEG部分を含む2つのメジャーな位置異性体を95%より多く含むが、図4に示された生成物は、それぞれ4または5の結合されたPEG部分を有する6つのメジャーな位置異性体を含む。これらの6つの4−5PEG位置異性体は、N末端および位置K23、K105およびK159の1または2で安定なPEG部分を、そして、Ser66またはTyr165(データは示さず)の1または両方で不安定なPEG部分を含む。立体的障害のために、単一のG−CSFポリペプチドのこれらの位置の全てが、PEG部分によって占められるわけではない。したがって、図4に示される生成物は、以下の6つのメジャーなPEG位置異性体の不均一な混合物を含む:
N末端、K23、S66、K159、Y165 (5-PEG)
N末端、S66、K105、K159、Y165 (5-PEG)
N末端、K23、S66、K159 (4-PEG)
N末端、K23、S66、Y165 (4-PEG)
N末端、S66、K105、K159 (4-PEG)
N末端、S66、K105、Y165 (4-PEG)。
【0092】
実施例4
安定性データ
結合されたPEG部分の安定性を、4つの相違する温度で保存された相違する水性製剤において試験した。ポリペプチドは、実施例1で記載されたように、製造された後、PEG化され、部分的に脱PEG化され、そしてまた精製された、実施例1で挙げられた5つの置換を有するG−CSF改変体であった。試験された製剤は以下のようである:
【0093】
【表1】

【0094】
各製剤のpHは4.0であった。
CIEX-HPLCを用いて、各サンプルのPEG異性体の分布を、26日、56日および89日後測定し、PEG化の安定性を検討した。結果を以下の表に示す。
【0095】
【表2】

【0096】
【表3】

【0097】
上記結果は、製剤および貯蔵温度にかかわらず、PEG化が高度の安定であり、3PEG異性体の割合は、26、56または89日でサンプリングしたとき、全ての温度で95%に大変近似する。表から容易に見受けられる違いは、-80℃のデータを対照に用いて、その他/特徴付けされないの割合において、主に25℃または35℃で貯蔵されたサンプルでの、時間に渡る僅かな相違であり、対応する、これらのサンプルの2PEG異性体の割合の増加である。
【0098】
比較して、下記の表は、上記に記載されたのと同様の製剤における同じG−CSF改変体、ただし、本発明の脱PEG化工程をしないで製造された、つまり、上記比較実施例3に記載された生成物に対応するものに対する、20、83日の貯蔵後に測定されたデータを示す。この場合の製剤は4.0のpHを有し、15 mM 酢酸ナトリウム、45 mg/mlマンニトール、および5 mg/mlPEG化G−CSF改変体からなり、ここで、PEG化G−CSF改変体は、実験の開始時には、主に(98-99%)4−5個の結合されたPEG部分を含む。下記の表は、示された4つの温度での83日後、並びにそれらの温度のうち2つの20日後に測定されたPEG異性体の分布を示す。5℃で貯蔵されたとき、83日後、4−5PEG部分を含むG−CSFポリペプチドの割合が、わずかにだけ減少する一方、25℃で貯蔵されたとき、4−5PEG異性体の実質的な損失とそれに応じた3PEG異性体の増加、そして、35℃での4−5PEG異性体の更なる大きな損失と、それに応じた3PEG異性体の増加が認められる。これは、本発明の脱PEG化方法がなければ、上記に記載されたように製造されたPEG化G−CSFポリペプチドは、水性製剤で貯蔵されるとき、時間に渡り、そして温度に依存して、ポリペプチドから脱離する、不安定なPEG基を含むことを示す。
【0099】
【表4】

【0100】
上記発明は、明確性および理解の目的で、いくらか詳しく記載されているが、当業者は、この開示を読むことにより、形態および詳細の多様な変化を、本発明の真の範囲から離れないで、することができることは明確である。本明細書で記載された実施例および実施態様が例示的な目的のみであること、そして、その観点から、多様な調整または変化が当業者に示唆され、そして、本出願の精神および範囲および添付する特許請求の範囲に含まれることは、理解される。本明細書で引用した、全ての刊行物、特許、特許出願および/または他の書類は、それぞれ個々の刊行物、特許、特許出願、および/または他の書類が、それぞれ、全ての目的で、その全体が、引用により本明細書に組み込まれることが示されているかのように、同じ程度に全ての目的に、その全体が、引用により、本明細書に組み込まれる。
【0101】
【表5】

【技術分野】
【0001】
発明の分野
本発明は、不安定なPEG部分(PEG moiety)をPEG化(PEGylated)G−CSF蛋白質から除去し、安定性および均一性を増加させる方法、およびその結果得られるPEG化G−CSF蛋白質に関する。本発明は、また、該PEG化蛋白質を含む医薬組成物および該医薬組成物を投与することによる治療方法に関する。
【背景技術】
【0002】
発明の背景
蛋白質またはポリペプチドへのポリエチレングリコール(PEG)の共有結合(「PEG化」)は、蛋白質またはポリペプチド、とりわけ医薬蛋白質の性質を改善するための、例えば、循環半減期を改善するため、および/または蛋白質エピトープを隠し、よって、望まれない免疫応答の可能性を低減するためのよく知られた技術である。活性化されたPEGに基づく数多くの技術が、蛋白質上の1以上の基にPEG部分を結合させるために利用できる。たとえば、mPEG―スクシンイミジルプロピオネート(mPEG-SPA、Nektar Therapeuticsより入手可能)は、通常、アミド結合を介して、N末端およびリジン残基のイプシロン−アミノ基に特異的に結合するものとして考えられている。しかしながら、実際には、mPEG-SPAは、必ずしも排他的にこれらの基に結合しないだけでなく、エステル結合を介して、セリン、チロシンまたはスレオニン残基の水酸基にも結合し得る。この技術を用いて調製されたPEG化蛋白質は十分な程度の均一性を有しない可能性があり、意図したもの以外の数多くの異なるPEG異性体を含み得る。このことは、かかる蛋白質の特徴づけをより複雑にするという事実を含む、さまざまな理由により望まれない。さらに、意図したもの以外の基に結合したPEG部分は、相対的に不安定であり得る。例えば、mPEG-SPAのようなアミン特異的PEGの場合、エステル結合を介して水酸基に結合したPEG部分は、アミド結合を介してN末端またはリジン残基に結合した部分に比較して相対的に不安定である傾向がある。製剤化および貯蔵条件によって、このことは、これらの不安定なPEG基の望まれない損失を導き得、よって、時間経過と共にPEG化蛋白質の性質が変化する可能性がある。さらに、1以上のPEG部分が、患者に投与された後に体内で蛋白質から離れる危険があり、PEG化蛋白質医薬の潜在的な制度上または安全上の問題であり得る。
本発明は、かかる不安定なPEG基を簡単に除き、それによって、より均一で安定なPEG化蛋白質生産物となる方法を提供することにより、これらの問題を解決する。
【発明の概要】
【0003】
発明の簡単な開示
本発明は、一般的に、リジン残基またはN末端に結合した少なくとも1つのPEG部分および水酸基に結合した少なくとも1つのPEG部分を有するPEGかポリペプチドの安定性および均一性を増加させる方法であって、水酸基に結合したPEG部分を除去するために好適な時間、変化されたpHに該ポリペプチドを置き、その後pHを本件ポリペプチドの長期間保管に好適なpHに調整することを含む方法に関する。
【0004】
ある態様において、本発明は、リジン残基のイプシロンアミノ基またはN末端アミノ基に結合した少なくとも1つのPEG部分および水酸基に結合した少なくとも1つのPEG部分を有するPEG化顆粒球コロニー刺激因子(G−CSF)ポリペプチドの安定性および均一性を増加させる方法であって、水酸基に結合したPEG部分を取り除くために適した時間8.0を超える上昇されたpHにポリペプチドを置き、そのpHを約8.0またはそれ以下に低下させることを含む方法に関する。
【0005】
本発明の他の態様は、G−CSFポリペプチドをアミン特異的活性化ポリエチレングリコール(PEG)とPEG化反応させ、PEG化G−CSFポリペプチド中間体を製造し、その後、該PEG化ポリペプチド中間体を水酸基に結合したPEG部分を取り除くために好適な時間、少なくとも約9.0の高められたpHとし、PEG化G−CSFポリペプチドを製造することを含む、PEG化G−CSFポリペプチドを製造する方法に関する。
【0006】
本発明の他の態様は、PEG化G−CSFポリペプチドのPEG位置異性体(positional PEG isomer)の均質な混合物を含む組成物に関し、ここで、混合物のPEG位置異性体の少なくとも約80%は、2つのPEG位置異性体からなり、それぞれは、リシンのイプシロンアミノ基に結合した2つのPEG部分およびN末端アミノ基に結合した1つのPEG部分からなるPEG部分を有する。
【0007】
更なる本発明の態様は、PEG化G−CSFポリペプチドのPEG位置異性体の混合物を含む組成物に関し、ここで、該ポリペプチドは、野生型ヒトG−CSF(配列番号:1)に比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含み、該ポリペプチドのPEG位置異性体の少なくとも約80%が、3つの結合されたPEG部分を有するリジン/N末端PEG異性体である。
【0008】
更なる態様において、本発明は、野生型ヒトG−CSF(配列番号:1)に比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含む組換えG−CSFポリペプチドのリジン/N末端PEG位置異性体(lysine/N-terminal positional PEG isomer)の混合物を製造する方法であって、a)宿主細胞において組換えG−CSFポリペプチドを発現し;b)組換えG−CSFポリペプチドを単離し;c)単離された組換えG−CSFポリペプチドをアミン特異的活性化PEGと反応させ、組換えG−CSFポリペプチドの複数のPEG位置異性体を製造し;d)複数のPEG位置異性体をpH8.5から10.5で反応させ、組換えG−CSFポリペプチドの部分的に脱PEG化(dePEGylated)された複数のリジン/N末端PEG位置異性体を製造することを含む、方法に関する。
【0009】
本発明の更なる態様は、本明細書で記載される方法を使用して製造されるPEG化G−CSFポリペプチド、並びに、それらのPEG位置異性体分布により特徴付けられるPEG化G−CSFポリペプチド、そして、係るPEG化G−CSFポリペプチドを含む組成物、そして、不十分な好中球のレベルを患っている、またはそのリスクのある患者において、PEG化G−CSFポリペプチドまたは本発明の組成物の投与により、好中球のレベルを増加させる方法に関する。本発明の更なる態様および好ましい態様は、以下の記載および特許請求の範囲から明らかである。
【図面の簡単な説明】
【0010】
【図1】本明細書で記載されているPEG化、部分的脱PEG化、そして精製されたG−CSF改変体のSDS−PAGE分析のスキャンを示す。
【図2】本明細書で記載されているPEG化、そして部分的脱PEG化されたG−CSFのSDS−PAGE分析のスキャンを示す。
【図3】本発明によって調製された部分的脱PEG化生成物プールのカチオン交換クロマトグラムを示す。
【図4】本発明による脱PEG化されなかった精製されたPEG化G−CSF改変体のカチオン交換クロマトグラムを示す。
【0011】
説明
定義
本明細書および特許請求の範囲の文脈において、以下の定義が適用される:
用語「ポリペプチド」または「蛋白質」は、本明細書において互換して用いられ得、いずれの特定の長さのアミノ酸配列に限定されないで、アミノ酸のポリマーをいう。これらの用語は、完全長の蛋白質だけでなく、いずれの与えられた蛋白質またはポリペプチドの、例えば、断片、短縮バージョン、改変体、ドメインも含むことが意図される。
【0012】
G−CSFポリペプチドは、配列番号:1で示されるヒト顆粒球コロニー刺激因子(hG−CSF)の配列を有するポリペプチド、またはG−CSF活性を示すhG−CSFの改変体である。「G−CSF活性」は、G−CSF受容体(Fukunaga et al., J. Bio. Chem., 265:14008, 1990)に結合する能力であり得るが、好ましくは、とりわけ、マウス細胞株NFS-60 (ATCC Number: CRL-1838)を用いたインビトロ活性試験で測定されるG−CSF細胞増殖活性である。NFS-60細胞株を用いた好適なインビトロG−CSF活性の試験は、Hammerling等により、J. Pharm. Biomed. Anal. 13(1):9-20, 1995に記載されている。G−CSF活性を「示す」ポリペプチドは、測定可能な機能、例えばインビトロ試験における測定可能な増殖活性を示すとき、かかる活性を有すると考えられる。
【0013】
「改変体」は、親(parent)ポリペプチドから1またはそれ以上のアミノ酸残基が相違するポリペプチドであり、ここで、親ポリペプチドは、一般的に、天然の、野生型のアミノ酸配列を有するものであり、典型的には、天然の哺乳類ポリペプチドであり、そして、より典型的には、天然のヒトポリペプチドである。よって、改変体は、天然のポリペプチドに比較して1またはそれ以上の置換、挿入または欠失を含む。例えば、これらには、1またはそれ以上のアミノ酸残基短くなった、Nおよび/またはC末端の欠失体、または、Nおよび/またはC末端で、1またはそれ以上の余分な残基の付加体、例えばN末端でのメチオニン残基の付加体を含む。改変体は、ほとんどの場合には、親ポリペプチドより15アミノ酸残基までで相違し、例えば、12、10、8または6アミノ酸残基である。
【0014】
「アミン特異的活性化PEG(amine-specific activated PEG)」は、N末端アミノ基またはリジン残基のε-アミノ基に、アミド結合を介して、好ましく結合する、活性化PEG誘導体である。アミン特異的活性化PEG誘導体の例には以下を含む:
mPEG-スクシンイミジルプロピオネート(mPEG-SPA):
【0015】
【化1】

mPEG-スクシンイミジルブタノネート(mPEG-SBA):
【0016】
【化2】

mPEG-スクシンイミジルα-メチルブタノネート(mPEG-SMB):
【0017】
【化3】

【0018】
mPEG-SPA、mPEG-SBAおよびmPEG-SMBは、Nektar Therapeuticsから入手可能である;「the Nektar Advanced PEGylation Catalogs 2004 and 2005-2006, 「Polyethylene and Derivatives for Advanced PEGylation」参照。他のアミン特異的活性化PEG誘導体には、SunBio Corporationから入手可能な、PEG-SS (スクシンイミジルスクシネート)、PEG-SG (スクシンイミジルグルタレート), PEG-NPC (p-ニトロフェニルカルボネート)、およびPEG-イソシアネート;およびNOF Corporation から入手可能なPEG-SCMを含む。
【0019】
「不安定な」PEG部分は、本明細書において、ポリペプチドの水酸基、とりわけ、セリン、チロシンまたはスレオニン残基の水酸基にエステル結合を介して結合したPRG部分をいう。上記に説明されるように、水酸基を介するかかるPEG部分の結合は不安定な傾向があり、これらのPEG部分は、エステル結合の加水分解を介して、例えばかかる部分を含むポリペプチドが水溶液形態で保存されるとき、時間と共に、ポリペプチドから脱離する傾向がある。
【0020】
本明細書で使用される「安定性」は、ポリペプチドに結合するPEG部分の結合の安定性、例えば、かかるPEG部分が長期、例えば水溶液中の保存の間、ポリペプチドに結合しているか否か、またはそれらが、例えばエステル結合の加水分解の結果として脱離する傾向があるか否か、を言う。
【0021】
本明細書で使用される、蛋白質の「PEG位置異性体」なる用語は、蛋白質の相違するPEG化形態であって、ここで、PEG基は、蛋白質の相違するアミノ酸位置で存在する。蛋白質の「リジン/N末端PEG異性体」なる用語は、PEG基が、蛋白質のアミノ末端および/または蛋白質におけるリジン残基のイプシロンアミノ基に結合されることを意味する。例えば、「3つの結合されたPEG部分を有するリジン/N末端PEG位置異性体」は、G−CSFに適用されるとき、3つのPEG基が、リジン残基のイプシロンアミノ基および/または蛋白質のN末端に結合するG−CSFPEG位置異性体の混合物を意味する。典型的には、「3つの結合されたPEG部分を有するリジン/N末端PEG位置異性体」は、リジン残基に結合した2つのPEG部分とN末端に結合した1つのPEG部分を有し得る。PEG位置異性体の分析は、以下の実施例に記載されるようなカチオン交換HPLCを用いて実施され得る。
【0022】
ポリペプチドの「リジン/N末端のPEG位置異性体の実質的に精製された混合物」とは、例えばリジン/N末端でないPEG位置異性体等の不純物を排除するためにクロマトグラフィーまたは他の精製手段にかけられた、リジン/N末端PEG位置異性体の混合物をいう。「リジン/N末端のPEG位置異性体の実質的に精製された混合物」は、例えば、もし、本明細書で記載されるような部分的な脱PEG化工程およびそれに続く精製がなければ、存在したであろう水酸基に結合した不安定なPEG部分のほとんどが存在しなく、そして、典型的には、水酸基に結合した不安定なPEG部分を含むポリペプチドを約20%未満、より典型的には、約15%未満含み得る。好ましくは、水酸基に結合した不安定なPEG部分を、約10%未満、例えば、約5%未満含み得る。
【0023】
用語「ポリペプチド改変体のPEG位置異性体の均質な混合物」は、相違するPEG位置異性体のポリペプチド部分が同じであることを意味する。これは、混合物の相違するPEG位置異性体が、全て単一のポリペプチド改変体配列に基づくことを意味する。例えば、PEG化G−CSFポリペプチド改変体のPEG位置異性体の均質な混合物は、相違する混合物のPEG位置異性体が単一のG−CSFポリペプチド改変体に基づくことを意味する。
【0024】
本明細書で使用される「均一性」は、相違する位置異性体、つまり相違する位置で結合した相違する数のPEG部分を含む相違する位置異性体、の数、並びに、これら位置異性体の相対的な分布の観点からの、PEG化ポリペプチドの均質性を言う。例えば、ヒトまたは動物における治療的用途を意図した医薬ポリペプチドに対しては、異なるPEG位置異性体の数は最小であることが一般的に望まれる。
【0025】
「部分的脱PEG化」は、本発明の方法が、水酸基に結合した不安定なPEG部分を取り除き、N末端またはリジン残基のアミノ基により安定に結合したPEG部分はそのまま残るという事実を言う。以下に説明されるように、脱PEG化工程の進行は、特定の高められたpH値および高められたpH値での持続時間に依存する。したがって、特定の場合に選択された状況によって、脱PEG化の工程の最後で、ポリペプチドの小部分が、依然として、水酸基に結合したPEG部分を有し得る可能性がある。しかしながら、本明細書および蛋白質解析の分野での技術常識に基づいて、当業者は、実質的に全ての不安定なPEG部分が除かれ、いずれの残ったPEG部分が、最終産物の所望の性質に重要であるように、方法を調整することができる。本明細書において「脱PEG化」の言及は、「部分的脱PEG化」の言及と理解でき得る。
【0026】
詳細な説明
上記のように、本発明の一態様は、リジン残基のイプシロンアミノ基またはN末端アミノ基に結合した少なくとも1つのPEG部分および水酸基に結合した少なくとも1つのPEG部分を有するPEG化G−CSFポリペプチドの安定性および均質性を高める方法であって、該ポリペプチドを、約8.0を超える高められたpHに、水酸基に結合したPEG部分を取り除くために好適な時間置き、そして、約8.0またはそれ以下にpHを低下させることを含む方法に関する。本発明の方法は、いずれの哺乳類G−CSFポリペプチドにも適しているが、ポリペプチドは、好ましくは、ヒトG−CSFポリペプチド、つまり、配列番号:1のアミノ酸配列を有するポリペプチド、場合によりN末端にメチオニン残基を有するもの、またはそれらの改変体である。G−CSF改変体の場合、これらは、天然、野生型のG−CSFポリペプチド、典型的には、ヒトG−CSF(配列番号:1)に比較して、1またはそれ以上の置換、挿入または欠損、および/または、1またはそれ以上のアミノ酸残基のN末端および/またはC末端の欠失体、例えば1から15の置換、例えば6、8、10または12までの置換を有し得る。好ましいG−CSF改変体は、WO 01/51510およびWO 03/006501に開示されるものを含む。
【0027】
例えばWO 03/006501に記載されるように、hG−CSFは、16、23、34および40の位置に4つのリジン残基を含み、G−CSFをリジン残基またはN末端により好んで結合する活性化PEGを用いたPEG化するときは、これらのリジン残基の少なくとも1つ、例えばこれらの残基の2、3または全てを、例えば欠失、好ましくは置換により、除くことが、しばしば望ましいこともある。本発明の方法で使用されるG−CSFポリペプチドは、したがって、K16、K23、K34およびK40から選択される少なくとも1つのアミノ酸残基が欠失された、または他のアミノ酸残基に置換された改変体であり得る。典型的には、リジン残基の除去は、置換、一般的にはRまたはQ残基、好ましくはR残基での置換、によることができる。したがって、G−CSFポリペプチドは、K16R/Q、K23R/Q、K34R/Q、K40R/Q(ここで、例えば、「K16R/Q」は、位置16のリジンがアルギニンまたはグルタミン残基で置換されることを意味する)からなる群から選択される、1、2、3または4つの置換であり得る。好ましくは、ポリペプチドは、置換K16R+K34R+K40Rを含むが、位置23のリジンを変わらず残している。
【0028】
PEG化が望まれないリジン残基を取り除くことと共に、WO 03/006501は、また、PEG化部位を作成するためのリジン残基の付加を記載する。これらは挿入により付加され得るが、好ましくは、置換により付加され得る。PEG化部位を導入するための好ましいアミノ酸置換の例には、Q70K、Q90K、T105K、Q120K、T133K、S159KおよびH170Kの1またはそれ以上、例えばこれらの置換の2、3、4、または5を含み、好ましい置換は、T105K+S159Kである。好ましい実施態様において、G−CSFポリペプチドは、置換K16R、K34R、K40R、T105KおよびS159Kを含む。ある実施態様において、G−CSFポリペプチドは、hG−CSFに比較して、これら5つの置換のみを含む。
【0029】
G−CSFポリペプチドの産生
本発明によるPEG化されたG−CSFポリペプチドは、本分野で知られた、例えば、WO 03/006501(引用により本明細書に組み込まれる)に記載されたような、いずれの好適な方法によっても製造され得る。かかる方法は、該ポリペプチドをコードする核酸配列の構築および好適な形質転換された、または遺伝子導入された宿主における該配列の発現を含む。しかしながら、本発明のポリペプチドは、相対的に非効率ではあるが、化学合成または化学合成および組換えDNA技術によって製造され得る。本発明のポリペプチドまたは本発明の結合体のポリペプチド部分をコードする核酸配列は、配列番号:1で示されるアミノ酸配列を有するhG−CSF等の、親G−CSFをコードする核酸配列を単離し、または合成し、そして、核酸配列を変化させ、関連アミノ酸残基の導入(つまり、挿入または置換)または欠失(つまり、削除または置換)に影響させる、ことによって構築され得る。
【0030】
核酸配列は、従来法に従った、部位特異的突然変異により従来通りに修飾される。あるいは、核酸配列は、化学合成、例えばオリゴヌクレオチド合成機を用いて製造され、ここで、オリゴヌクレオチドは、所望のポリペプチドのアミノ酸配列に基づいて設計され、そして、好ましくは、組換えポリペプチドが生成される宿主細胞に好まれるコドンを選択する。例えば、所望のポリペプチドの部分をコードするいくつかの小オリゴヌクレオチドは、PCR、ライゲーションまたはライゲーションチェインリアクション(LCR)(Barany, PNAS 88:189-193, 1991)によって、合成され、集められ得る。個々のオリゴヌクレオチドは、典型的には、相補的な集合のために5’または3’オーバーハングを含む。
【0031】
一度集められると(合成、部位特異的突然変異または他の方法により)、ポリペプチドをコードする核酸配列は、組換えベクターに組み込まれ、所望の形質転換された宿主細胞において、G−CSFの発現に必要なコントロール配列に操作可能に結合される。
【0032】
当業者は、好適なベクター、発現コントロール配列およびポリペプチドの発現するための宿主を選択することができる。組換えベクターは、自己複製ベクター、例えば、染色体外の実体として存在するベクターで、その複製が染色体の複製より独立しているもの、例えば、プラスミド、であり得る。あるいは、ベクターは、宿主細胞に導入されると、宿主細胞ゲノムに組み込まれ、組み込まれた染色体と共に複製するものである。
【0033】
ベクターは、好ましくは、本発明のポリペプチドをコードする核酸配列が、核酸配列の転写に必要な付加部分と操作可能に結合した、発現ベクターである。ベクターは、典型的には、プラスミドまたはウイルスDNA由来である。本明細書で述べられる、宿主細胞での発現用の多くの好適な発現ベクターは、商業的に入手可能か、または文献に記載されている。G−CSFを発現する好適なベクターについての詳細な情報は、WO 03/006501に見出され得る。
【0034】
用語「コントロール配列(control sequence)」は、本明細書では、本発明のポリペプチドの発現に対して必要または有利である全ての成分を含むものと定義される。各コントロール配列は、ポリペプチドをコードする核酸配列に対して生来の、または外来のものであってよい。かかるコントロール配列には、限定はされないが、リーダー配列、ポリアデニル化配列、シグナルペプチド配列、合成イントロン、および転写ターミネーターを含む。最小限で、コントロール配列は、プロモーターを含む。多様な発現コントロール配列、例えば、WO 03/006501で記載されたコントロール配列のいずれかが、本発明に使用され得る。
【0035】
G−CSF活性を示すポリペプチドをコードする本発明の核酸配列は、部位特異的突然変異、合成、PCRまたは他の方法で製造され得、所望により、また、シグナルペプチドをコードする核酸配列を含み得る。シグナルペプチドは、ポリペプチドが、発現する細胞から分泌されるときに存在する。かかるシグナルペプチドは、もし存在すれば、ポリペプチドの発現のために選択された細胞によって、認識されるものであるべきである。シグナルペプチドは、ポリペプチドに対し、同種(例えば、通常hG−CSFと結びつけられ)、または異種(hG−CSF以外の他の起源に由来する)であり得、または、宿主細胞に対して同種または異種、つまり、シグナルペプチドは、宿主細胞から通常発現されるか、または、宿主細胞からは通常発現されない、であり得る。したがって、シグナルペプチドは、原核生物、例えば、E.coliのような細菌由来の、または、真核生物、例えば、哺乳動物、または、昆虫または酵母由来であり得る。好適なシグナルペプチドについての更なる情報は、WO 03/006501を参照。
【0036】
いずれの好適な宿主も、G−CSFポリペプチドを製造するために使用され得、細菌(特に好ましくはないが)、真菌(酵母を含む)、植物、昆虫、哺乳類、または他の適当な動物細胞または細胞株、並びにトランスジェニック動物または植物が含まれる。哺乳類の細胞が好ましい。細菌宿主細胞の例には、バチラス(Bacillus)、例えば、B.ブレビス(B. brevis)またはB.ズブチリス(B. subtilis)、シュードモナス(Pseudomonas)またはストレプトマイセス(Streptomyces)種等のグラム陽性細菌、または、E.coli種等のグラム陰性細菌を含む。好適な糸状菌宿主細胞の例には、アスペルギウス(Aspergillus)、例えば、A.オリザエ(A. oryzae)、A.ニガー(A. niger)、またはA.ニデュランス(A. nidulans)、フサリウム(Fusarium)またはトリコダーマ(Trichoderma)種を含む。好適な酵母宿主細胞の例には、サッカロマイセス(Saccharomyces)、例えば、S.セレビシエ(S. cerevisiae)、スキゾサッカロマイセス(Schizosaccharomyces)、クリベロマイセス(Klyveromyces)、ピチア(Pichia)、例えば、P.パストリス(P. pastoris)またはP.メタノリカ(P. methanolica)、ハンセニューラ(Hansenula)、例えば、H.ポリモルファ(H. Polymorpha)またはヤロウィア(Yarrowia)種を含む。好適な昆虫宿主細胞の例には、鱗翅目細胞株、例えば、Spodoptera frugiperda (Sf9またはSf21)またはTrichoplusioa ni細胞(High Five) (US 5,077,214)を含む。好適な哺乳類宿主細胞には、チャイニーズハムスター卵巣(CHO)細胞株 (例えば、CHO-K1; ATCC CCL-61)、グリーンモンキー細胞株 (COS) (例えば、COS 1 (ATCC CRL-1650)、COS 7 (ATCC CRL-1651));マウス細胞 (例えば、NS/O)、新生児ハムスター腎臓(BHK)細胞株(例えば、ATCC CRL-1632またはATCC CCL-10)、およびヒト細胞(例えば、HEK 293 (ATCC CRL-1573))を含む。更なる好適な細胞株は、本分野で知られ、American Type Culture Collection(ロックビル、メリーランド)のような公的寄託機関から入手可能である。
【0037】
本発明の製造方法において、細胞は、本分野で知られている方法を使用して、ポリペプチドを製造するために適した栄養培地で培養される。例えば、細胞は、実験室または工業的培養機の中で、ポリペプチドが発現され、および/または単離されるに好適な培地中および条件下で実施される、震盪フラスコ培養、小スケールまたは大スケールの培養(連続、バッチ、フェドバッチ、または固体状態培養を含む)によって、培養される。培養は、本分野で知られた手法を用いて、炭素および窒素源を含む好適な栄養培地で実施される。好適な培地は、商業的供給者により入手可能であり、または、刊行された組成(例えば、American Type Culture Collectionカタログ)に従って調製され得る。ポリペプチドが栄養培地へ分泌されるとき、ポリペプチドは培地から直接回収され得る。ポリペプチドが分泌されないとき、それは、細胞溶解物から回収され得る。
【0038】
得られるポリペプチドは、本分野で知られる方法によって回収され得る。例えば、ポリペプチドは、栄養培地より、限定はされないが、遠心、ろ過、抽出、噴霧乾燥、エバポレーション、または沈殿を含む従来の手段により回収され得る。
【0039】
ポリペプチドは、本分野で知られている多様な手段で精製され得、これらの手段には、限定はされないが、クロマトグラフィー(例えば、イオン交換、アフィニティー、疎水性、クロマトフォーカシング、およびサイズ排除)、電気泳動の手段(例えば、分取等電点電気泳動法)、相違する溶解性(例えば、硫酸アンモニウム沈殿)、SDS−PAGE、または抽出(例えば、Protein Purification, J.-C. Janson and Lars Ryden, editors, VCH Publishers, New York, 1989参照)を含む。G−CSF活性を示すポリペプチドを生成する特有の方法は、D. MetcalfおよびN. A. Nicolaにより、The hemopoietic colony-stimulating factors, p. 50 51, Cambridge University Press (1995)に、C. S. Bae等により、Appl. Microbiol. Biotechnol, 52:338-344 (1999) and in US 4,810,643に記載されている。
【0040】
PEG化
生成されたG−CSFポリペプチドは、それから、当業者に知られた様々な方法によりPEG化され得る。例えば、G−CSFポリペプチドは、アミン特異的活性化ポリエチレングリコール(PEG)でPEG化されることができる。
【0041】
アミン特異的活性化ポリエチレングリコールは、上述したいずれでもよいが、例えば、mPEG-スクシンイミジルプロピオネート(mPEG-SPA)、mPEG-スクシンイミジルブタノエート(mPEG-SBA)、またはmPEG-スクシンイミジルα-メチルブタノエート(mPEG-SMB)である。PEG部分の分子量は、例えば、ポリペプチドに結合するPEG部分の数に基づいて、選択されることができ、しばしば、約1kDaから約20kDaの範囲、例えば、約1kDaから約12kDa、例えば、約2kDaから約10kDa、例えば、約4kDaから約6kDa、例えば、約5kDaであり得る。例えば、活性化PEGは、分子量約5kDaのmPEG-SPAであり得る。例えば、PEG化は、約7.5−9.0、例えば約8.0−8.5のpHで実施され得る。本明細書において、PEG部分について用いられるとき、用語「約」は、およその平均分子量を示し、通常、ポリマーの調製にある分子量分布が存在するという事実を反映する。更なるPEG化方法の一般情報のために、例えば、Nektar Advanced PEGylation Catalogs 2004および2005-2006、並びにそれらに引用されている参考文献を参照できる。G−CSFポリペプチドのためのより詳細なPEG化方法の記載は、また、WO 03/006501にある。
【0042】
部分的脱PEG化
脱PEG化工程のための高められたpHの選択は、脱PEG化が起こる温度、脱PEG化工程の時間、およびPEG化工程が実施されたpHを含む、PEG化に用いられた条件等の因子に基づく。一般的に、脱PEG化の間に使用されたpHが高いほど、脱PEG化工程は早い。したがって、当業者は、pH、時間および温度等の脱PEG化条件が、与えられ等状況で所望の結果を得るように各々調整され得ることを認識できる。例えば、比較的低い、高められたpH、例えば8および9の間を使用することが可能であるが、例えば、9および11の間、例えば9および10の間のより高いpHの使用は、早い脱PEG化をもたらす。典型的には、したがって、高められたpHは、約8.5から約11.0、例えば、約8.5から約10.5、例えば、約9.0から約10.0の範囲であり得る。高められたpHは、例えば、約9.2から約9.8、例えば約9.5の範囲であり得る。
【0043】
通常、脱PEG化工程は、一般的に最も効率的で、より処理時間が短く、より高い収率なので、PEG化の直ぐ後に行われる。したがって、発明は、この基本的なやり方において、PEG化バルク中間体の部分的脱PEG化工程化、それに続く、以下に記載するような、例えば、クロマトグラフィー精製のような従来の分離により特徴付けられる。しかしながら、いくつかの理由により望まれるのであれば、PEG化工程は、脱PEG化の前に、中間精製工程が続き得る。中間精製工程は、例えば、限外ろ過および/またはジアフィルトレーション(diafiltration)が続く、下記に記載するようなクロマトグラフィー精製を含む。かかる中間精製工程から得られる中間体生産物は、所望ならば、脱PEG化およびその後の生成段階の前に貯蔵され得る。この場合、中間PEG化工程化生産物は、例えば、当業者に一般的に知られる方法を用いて、凍結または凍結乾燥によって、例えば、貯蔵され得る。
【0044】
脱PEG化は、他の面では、対象となるポリペプチドに好適な温度で実施され、例えば、約5℃から約40℃、例えば、約10℃から約35℃で実施される。脱PEG化は、しばしば、約15℃から約25℃、例えば、約20−22℃の大気温度で実施され得る。
【0045】
上記で説明したように、所望の結果を得るために高められたpHでの脱PEG化工程の時間は、pHおよび温度等の他の因子に依存し得るが、一般的に、約2時間から約100時間、典型的には、約4時間から約72時間、より典型的には、約8時間から約48時間の範囲であり得る。通常、脱PEG化の工程を可能な限り短い時間で実施することが望まれるので、ポリペプチドは、しばしば、約24時間を超えない期間で、例えば、約12時間から約30時間、例えば、約18時間から約24時間、高められたpHで置かれ得る。上記に示したように、高められたpHでの相対的に短い時間は、一般的に、相対的に高いpH、例えば、約9−10を伴い得る。
【0046】
高められたpHでの脱PEG化に続いて、pHは、約8.0またはそれ以下、とりわけ、ポリペプチドに対して意図された貯蔵条件に従って、選択されたpHに低下される。例えば、G−CSFに対して、長期貯蔵のための好適なpHは、しばしば、約2.0から約5.0の間、例えば、約2.5から約4.5、例えば約4.0であり得る。いくつかの場合において、例えば、使用される特定の製剤に依存して、幾分高いpH、例えば、約5.0−8.0、例えば、約6.0−7.5、例えば、約7.0−7.5が選択され得る。G−CSFの多様な医薬製剤が、例えば、US 5,104,651、US 5,919,757、US 6,497,869およびUS 6,776,983に記載されている。
【0047】
本発明におけるpHの調整のために、いずれの好適な酸または塩基、有機または無機酸および塩基が使用され得る。同様に、いずれの好適な緩衝液が、pHを所望のレベルに維持するために使用され得る。当業者は、例えば、対象となるポリペプチド及び所望のpHに依存して、いずれの与えられた状況に適する、酸、塩基および緩衝液をよく知っている。
【0048】
pHの低下に引き続き、所望の数のPEG基が結合したポリペプチドを分離するために、ポリペプチドは、通常、少なくとも1つのクロマトグラフィー精製工程、例えば、イオン交換クロマトグラフィーまたはゲルろ過クロマトグラフィーにかけられる。クロマトグラフィー精製は、当業者に一般的に知られた方法を用いて実施され得る。例えば、脱PEG化に続く低下されたpHが約7.0より下の場合、カチオン交換クロマトグラフィーが使用され得る。あるいは、または付け加えて、高められたpH値で、pHの低下の前に、アニオン交換クロマトグラフィーを用いて、クロマトグラフィーが実施され得る。生成物の更なる精製並びに分析は、同様に、当業者に知られた標準的な方法を用いて実施され得る。例えば、クロマトグラフィー精製工程に続く更なる精製は、例えば、限外ろ過またはジアフィルトレーションを用いて、実施され得る。
【0049】
上記したように、本発明の更なる態様は、G−CSFポリペプチドを、アミン特異的活性化ポリエチレングリコール(PEG)を用いてPEG化し、その後、水酸基に結合したPEG部分を取り除くために好適な時間、PEG化ポリペプチドを、少なくとも約9.0の高められたpHに置くことを含む、PEG化G−CSFポリペプチドの製造方法に関する。
この方法は、リジン残基のイプシロンアミノ基またはN末端のアミノ基に結合した少なくとも1つのPEG部分を有し、そして、水酸基に結合したPEG部分が実質的にないPEG化G−CSFポリペプチドをもたらす。ある実施態様において、本発明のこの実施態様は、約7.0−9.0のpHでのPEG化、その後、pHを不安定なPEG部分を取り除くために高めることを用いて、実施される。他の実施態様において、PEG化は、9.0以上、例えば、9−11の範囲のpH、例えば、9.2から10.0で、例えば、約9.5の比較的高いpHで実施され得る。この場合、PEG化および脱PEG化は、単一工程で、単一pH値で、N末端およびリジン残基で所望のPEG化が起こり、一方、望まれない水酸基へのPEG部分の結合を回避するために十分な時間実施され得る。
【0050】
アミン特異的活性化PEGは、上記したいずれでもよく、例えば、mPEG-スクシンイミジルプロピオネート(mPEG-SPA)、mPEG-スクシンイミジルブタノエート(mPEG-SBA)またはmPEG-スクシンイミジルα-メチルブタノエート(mPEG-SMB)であり得る。PEG部分の分子量は、同様に上記した通りであり、例えば、約1kDaから約20kDaの範囲、例えば、約1kDaから約12kDa、例えば、約2kDaから約10kDa、例えば、約4kDaから約6kDa、例えば約5kDaであり得る。例えば、活性化されたPEGは、約5kDaの分子量を有するmPEG−SPAであり得る。例えば、PEG化は、約7.5−9.0、例えば、約8.0−8.5のpHで実施され得る。PEG化の間に使用されるpHに基づいて、選択される高められたpHは、また、一般的に上記された範囲と同様であり得、例えば、約9.2から11.0の範囲、約9.2から10.0の範囲であり得る。同様に、高められたpHでの時間は、また、上記のように選択され得、そして、同じことが、その後の精製等にも当てはまる。
【0051】
本明細書で記載される方法は、均質な、および安定なPEG化蛋白質を製造することを目的とした製造方法に対して、多くの利点を与え、それらには、それが、単純および迅速で、限定された時間の間、変化されたpHの余分な1つの工程のみを要求するものであり、そして、他に、製造方法に使用されるPEG化または精製方法を変化させる必要が無い、という事実を含むものである。この理由のために、不安定なPEG基を取り除くために十分な時間、pHを変化させる同じ一般的な手法は、いずれのPEG化蛋白質の製造に使用され得る。一般的に、塩基性または酸性pHが、水酸基に結合した不安定なPEG部分を取り除くために使用され得、不安定PEG部分の脱離が、pHがより酸性(酸性pH)またはより塩基性(塩基性pH)のとき起こる。不安定なPEGの脱離を得るための条件の選択は、例えば、PEG部分の結合部位の微視的環境を含む、特定蛋白質の構造特性に基づいてなされ得る。
【0052】
PEG化G−CSFポリペプチド
上記に示したように、本発明の方法は、相違するPEG位置異性体の数の観点から、PEG化ポリペプチドの均一性が高められることに利点がある。結合基の数および使用される特定のPEG化化学に依存して、本発明は、別なやり方で可能である以上に、より均質で、より安定なPEG化G−CSFの単離を可能にする。例えば、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを有するPEG化G−CSFポリペプチドが見出されてきており、少なくとも約90−95%のポリペプチドのPEG位置異性体が、3つの結合されたPEG部分を有する、生産物を得ることが可能である。
【0053】
本発明の他の実施態様は、PEG化G−CSFポリペプチド改変体のPEG位置異性体の均質な混合物を含む組成物に関し、ここで、混合物の少なくとも約80%、より好ましくは少なくとも約85%、さらにより好ましくは少なくとも約90%、例えば少なくとも約95%のPEG位置異性体が、2つのPEG位置異性体からなり、各々は、リジン残基のイプシロンアミノ基に結合した2つのPEG部分およびN末端アミノ基に結合した1つのPEG部分を有する。
【0054】
したがって、本発明の他の実施態様は、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含む、PEG化G−CSFポリペプチドに関し、ここで、ポリペプチドの少なくとも約80%のPEG位置異性体が、3つの結合されたPEG部分を有する。典型的には、3つの結合されたPEG部分を有するPEG位置異性体の割合は、80%より大きく、例えば少なくとも約85%または少なくとも約90%であり得、そして、より高く、例えば、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%、または少なくとも約95%であり得る。更なる他の実施態様において、本発明は、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kのみを含むPEG化G−CSFポリペプチドに関し、ここで、ポリペプチドのPEG位置異性体の少なくとも約80%が、3つの結合されたPEG部分を有する。典型的には、3つの結合されたPEG部分を有するPEG位置異性体の割合は、80%より大きく、例えば、少なくとも約85%または少なくとも約90%であり得、そして、それより高く、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%または少なくとも約95%であり得る。
【0055】
更なる実施態様において、本発明は、野生型ヒトG−CSFに比較して置換K16R、K34R、K40R、T105KおよびS159Kを含むPEG化G−CSFポリペプチドの混合物を含む組成物に関し、ここで、混合物中のPEG化G−CSFポリペプチドの少なくとも約80%、好ましくは少なくとも約85%、より好ましくは少なくとも約90%、少なくとも約95%が、2つのPEG位置異性体からなり、各々は3つのPEG基を含み、異性体の1つは、N末端、Lys23およびLys159で結合したPEG基を有し、他の異性体は、N末端、Lys105およびLys159で結合したPEG基を有する。他の実施態様において、本発明は、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kのみを含むPEG化G−CSFポリペプチドの混合物を含む組成物に関し、ここで、混合物中のPEG化G−CSFポリペプチドの少なくとも約80%、好ましくは少なくとも約85%、より好ましくは少なくとも約90%、例えば少なくとも約95%は、各々が3つのPEG基を含む、2つのPEGG−CSF異性体からなり、ここで、異性体の1つは、N末端、Lys23およびLys159で結合したPEG基を有し、そして、他の異性体は、N末端、Lys105およびLys159で結合したPEG基を有する。
【0056】
本発明により製造されるPEG化G−CSFポリペプチドは、PEG化の程度において高度に貯蔵安定的であることが見出されてきた。下記の実施例に示されるように、かかるPEG化G−CSFポリペプチドの水性製剤は、PEG化パターンの大きな変更がなく、長期間貯蔵可能である。このことは、とりわけ、組成物が5℃で貯蔵されたときに事実であるが、驚くことに、組成物が25℃または35℃の高い温度で貯蔵されるときにさえ、比較的に安定であることが見出されてきた。
【0057】
したがって、本発明の更なる態様は、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含む、貯蔵安定なPEG化G−CSFポリペプチドに関し、ここで、ポリペプチドのPEG位置異性体の少なくとも約80%が、5℃の温度で、3月間、水性の参照組成物(aqueous reference composition)中で貯蔵した後、3つの付加PEG部分を有する。典型的には、5℃の温度で3月間貯蔵後の3つの結合されたPEG部分を有するPEG位置異性体の割合は、80%より大きく、例えば、少なくとも約85%または少なくとも約90%であり得る。いくつかの場合に置いて、この割合はさらに高く、例えば、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%または少なくとも約95%であり得る。本発明に従って製造されるPEG化G−CSFポリペプチドの安定性の測定の目的のために、安定性は実施例4に記載されたように、例えば、参照組成物としてそこで記載されているA、B、CまたはD製剤の一つ、とりわけ製剤Dを用いて、試験され得る。
【0058】
医薬的組成物
本発明の他の態様は、本発明に従ったPEG化G−CSFポリペプチドを含む医薬組成物に関する。したがって、本発明の一実施態様は、医薬的に許容される担体およびPEG化G−CSFポリペプチドを含む組成物に関し、ここで、ポリペプチドは、野生型ヒトG−CSF(配列番号:1)に比較して置換K16R、K34R、K40R、T105KおよびS159Kを含み、そして、ここで、ポリペプチドのPEG位置異性体の少なくとも80%は、3つの結合されたPEG部分を有する。典型的には、3つの結合されたPEG部分を有するPEG位置異性体の割合は、少なくとも約85%、好ましくは少なくとも約90%、であり得、そして、さらに高く、例えば少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%、または少なくとも約95%であり得る。更なる他の実施態様において、本発明は、医薬的に許容され得る担体およびPEG化G−CSFポリペプチドを含む医薬組成物に関し、ここで、ポリペプチドは、野生型ヒトG−CSF(配列番号:1)に比較して、置換K16R、K34R、K40R、T105KおよびS159Kのみを含み、ポリペプチドの少なくとも約80%のPEG位置異性体は、3つの付加PEG部分を有する。典型的には、3つの付加PEG部分を有するPEG位置異性体の割合は、少なくとも約85%、好ましくは約90%、であり得、そして、さらに高く、例えば、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%、または少なくとも約95%であり得る。
【0059】
本発明の他の実施態様は、PEG化G−CSFポリペプチド改変体のPEG位置異性体の均一な混合物を含む医薬組成物に関し、ここで、混合物のPEG位置異性体の少なくとも80%、好ましくは少なくとも85%、より好ましくは少なくとも約90%、例えば、少なくとも約95%が、2つのPEG位置異性体からなり、それぞれは、リジン残基のイプシロンアミノ基に結合した2つのPEG部分およびN末端アミノ基に結合した1つのPEG部分からなるPEG部分を有する。
【0060】
更なる実施態様において、本発明は、医薬的に許容可能な担体および野生型ヒトG−CSFに比較して置換K16R、K34R、K40R、T105KおよびS159Kを含むPEG化G−CSFポリペプチドの混合物を含む、医薬組成物に関し、ここで、混合物中のPEG化G−CSFポリペプチドの少なくとも約80%、好ましくは少なくとも85%、より好ましくは少なくとも約90%、例えば、少なくとも約95%が、2つのPEG位置異性体からなり、それぞれは、3つのPEG基を有し、ここで、異性体の一つは、N末端、Lys23およびLys159で結合したPEG基を有し、他の異性体は、N末端、Lys105およびLys159に結合するPEG基を有する。更なる実施態様において、本発明は、医薬的に許容可能な担体および野生型ヒトG−CSFに比較して置換K16R、K34R、K40R、T105KおよびS159Kのみを含むPEG化G−CSFポリペプチドの混合物を含む、医薬組成物に関し、ここで、混合物中のPEG化G−CSFポリペプチドの少なくとも約80%、好ましくは少なくとも85%、より好ましくは少なくとも約90%、例えば、少なくとも約95%が、2つのPEG位置異性体からなり、それぞれは、3つのPEG基を有し、ここで、異性体の一つは、N末端、Lys23およびLys159で結合したPEG基を有し、他の異性体は、N末端、Lys105およびLys159に結合するPEG基を有する。
【0061】
本発明のG−CSFポリペプチドを含む医薬組成物は、あらゆる形態で、例えば、凍結乾燥形態、または、好ましくは、安定な液体製剤で、典型的には水性製剤として、製剤化され得る。かかる組成物は、典型的には、緩衝剤、防腐剤、等張剤(isotonicifier)、安定化剤、非イオン性界面活性剤または洗剤、および増量剤または充填剤、キレート剤、抗酸化剤および共溶媒のような付加的な種々の賦形剤から選択される、1またはそれ以上の成分を含む。G−CSFの好適な製剤の一例は、pH4.0の水溶液中で供給され、0.6ml当たり、0.35mg酢酸、30.0mgソルビトール、0.02mgポリソルベート20、および0.02mgナトリウムを含む、ニューラスタ(登録商標)(ペグフィルグラスチム)のために用いられているものである。
【0062】
医薬組成物の一例は、非経腸投与のために設計された溶液である。多くの場合で、医薬液体製剤は、直ぐに使用するのに適した。液体形態で提供されるが、かかる非経腸製剤は、また、凍結または凍結乾燥形態で提供され得る。前者の場合、組成物は、使用前に解凍されなければならない。後者の形態は、凍結乾燥製剤が一般的に対応する液体よりもより安定であると、当業者により認識されているので、多様な貯蔵条件下で、組成物中に含まれる活性化合物の安定性を増強するために、しばしば用いられる。かかる凍結乾燥製剤は、使用前に、注射用滅菌水または滅菌生理食塩水等の1またはそれ以上の好適な医薬的に許容可能な希釈剤の添加により、再構成される。しかしながら、本発明の組成物は、好ましくは、水溶液の形態である。
【0063】
非経口剤において、それらは、適切なときは、所望の純度を有するポリペプチドと、1以上の医薬的に許容可能な担体、典型的に本分野で採用される賦形剤または安定化剤(それら全てが「賦形剤」と呼ばれ得る)、例えば、緩衝剤、安定化剤、防腐剤、等張剤、非イオン性界面活性剤、抗酸化剤および/または他の多様な添加剤と混合して、凍結乾燥製剤または水溶液としての貯蔵のために製造される。
【0064】
緩衝剤は、所望の範囲でpHを維持するのを助ける。それらは、典型的には、約2mMから約50mMの範囲の濃度で存在する。好適な緩衝剤は、クエン酸緩衝液(例えば、クエン酸1ナトリウム−クエン酸2ナトリウム混合物、クエン酸−クエン酸3ナトリウム混合物、クエン酸−クエン酸1ナトリウム混合物等)、コハク酸緩衝液(例えば、コハク酸−コハク酸1ナトリウム混合物、コハク酸−水酸化ナトリウム混合物、コハク酸−コハク酸2ナトリウム混合物等)、酒石酸緩衝液(例えば、酒石酸−酒石酸ナトリウム混合物、酒石酸−酒石酸カリウム混合物、酒石酸−水酸化ナトリウム混合物等)、フマル酸緩衝液(例えば、フマル酸−フマル酸1ナトリウム混合物、フマル酸−フマル酸2ナトリウム混合物、フマル酸1ナトリウム−フマル酸2ナトリウム混合物等)、グルコン酸緩衝液(例えば、グルコン酸−グルコン酸ナトリウム混合物、グルコン酸−水酸化ナトリウム混合物、グルコン酸−グルコン酸カリウム混合物等)、シュウ酸緩衝液(例えば、シュウ酸−シュウ酸ナトリウム混合物、シュウ酸−水酸化ナトリウム混合物、シュウ酸−シュウ酸カリウム混合物等)、乳酸緩衝液(例えば、乳酸−乳酸ナトリウム混合物、乳酸−水酸化ナトリウム混合物、乳酸−乳酸カリウム混合物等)および酢酸緩衝液(例えば、酢酸−酢酸ナトリウム混合物、酢酸−水酸化ナトリウム混合物等)のような、有機および無機の酸およびそれらの塩の両方を含む。更なる可能性は、リン酸緩衝液、ヒスチジン緩衝液およびトリスのようなトリメチルアミン塩である。
【0065】
防腐剤は、微生物の成長を遅らせるために添加され、存在するときは、約0.2%−1%(w/v)の量で、典型的に添加される。好適な保存剤には、フェノール、ベンジルアルコール、メタクレゾール、メチルパラベン、プロピルパラベン、オクタデシルジメチルベンジルアンモニウムクロライド、ベンザルコニウムハライド類(例えば、塩化、臭化またはヨウ化ベンザルコニウム)、塩化ヘキサメトニウム、メチルまたはプロピルパラベン等のアルキルパラベン類、カテコール、レゾルシノール、シクロヘキサノールおよび3−ペンタノールを含む。
【0066】
等張剤は、液体組成物の等張性を確保するために添加され、多価糖アルコール類、好ましくは3価またはそれ以上の価の糖アルコール類、例えば、グリセリン、エリトリトール、アラビトール、キシリトール、ソルビトールおよびマンニトール等を含む。多価アルコールは、他の成分の相対量を考慮し、0.1重量%および25重量%の間の量で、典型的には、1%から5%で存在することができる。
【0067】
安定化剤は、増量剤から、治療成分を溶解させ、または、変性や容器壁への吸着を防ぐことを助ける添加剤までの機能であり得る、広範なカテゴリーの賦形剤を言う。典型的な安定化剤は、多価糖アルコール類(上記で列挙した);アミノ酸、例えば、アルギニン、リジン、グリシン、グルタミン、アスパラギン、ヒスチジン、アラニン、オルニチン(omithine)、L−ロイシン、2−フェニルアラニン、グルタミン酸、スレオニン等;有機糖類または糖アルコール類、例えば、ラクトース、トレハロース、スタキオース、マンニトール、ソルビトール、キシリトール、リビトール、ミオイノシトール(myoinisitol)、ガラクチトール、グリセロール等、イノシトール等のシクリトールを含む;ポリエチレン グリコール;アミノ酸ポリマー類;硫黄含有還元剤、例えば、尿素、グルタチオン、チオクト酸、チオグリコール酸ナトリウム、チオグリセロール、α−モノチオグリセロールおよびチオ硫酸ナトリウム;低分子量ポリペプチド(つまり、<10残基);蛋白質、例えば、ヒト血清アルブミン、ウシ血清アルブミン、ゼラチンまたは免疫グロブリン類;親水性ポリマー類、例えば、ポリビニルピロリドン;単糖類、例えば、キシロース、マンノース、フルクトースおよびグルコース;二糖類、例えば、ラクトース、マルトースおよびスクロース;3糖類、例えば、ラフィノース、および多糖類、例えば、デキストランであり得る。安定化剤は、例えば、活性な蛋白質重量に基づいて、0.1から10000重量部の範囲で存在し得る。
【0068】
非イオン性界面活性剤または洗剤(または、湿潤剤として知られる)は、治療的成分の溶解を助け、並びに、治療的ポリペプチドを、攪拌惹起凝集から保護するために存在し得、それは、また、ポリペプチドを変性させることなく、表面応力をそぎ取るために、製剤に暴露させられることができる。好適な非イオン性界面活性剤は、ポリソルベート類(20、80等)、ポリオキサマー類(184、188等)、プルロニック(登録商標)ポリオール類、ポリオキシエチレンソルビタンモノエステル類(トゥイーン(Tween)(登録商標)−20、トゥイーン−80等)を含む。
【0069】
添加され得る様々な付加的な賦形剤には、増量剤または充填剤(例えば、デンプン)、キレート剤(例えば、EDTA)、抗酸化剤(例えば、アスコルビン酸、メチオニン、ビタミンE)および共溶媒が含まれる。
【0070】
活性成分は、また、例えば、コアサーべーション(coascervation)技術、または界面重合によって、例えば、コロイド薬物デリバリーシステム(例えば、リポソーム類、アルブミンミクロスフェア類、ミクロエマルジョン類、ナノ粒子類およびナノカプセル類)またはマクロエマルジョンにおける、ヒドロキシメチルセルロース、ゼラチンまたはポリ−メチルメタシレートマイクロカプセルによって、調製されたミクロカプセルに取り込まれ得る。
【0071】
インビボ投与に使用される非経腸製剤は、滅菌であるべきである。これは、当分野でよく知られた方法、例えば、滅菌ろ過膜を通したろ過により、容易になされる。
【0072】
治療方法
本発明の他の態様は、治療方法および本発明のPEG化G−CSFポリペプチドを用いた医薬の製造方法に関する。白血球減少症(白血球の低下したレベル)および好中球減少症(好中球の低下したレベル)は、あらゆるタイプの感染症に罹患しやすくなる。好中球減少症は、例えば、HIVに罹患した患者で慢性であり、化学療法または放射線療法を受ける癌患者で急性である。重篤な好中球減少症の患者にとっては、例えば、化学療法の結果として、相対的に少ない感染症でさえも重大であり得、好中球減少症は、しばしば、化学療法プロトコールの中断を要求する。本発明のPEG化G−CSFポリペプチドは、ある種の化学療法、放射線治療および骨髄移植を受ける癌患者の感染症の予防または治療、末梢血液前駆細胞移植のための前駆細胞銀行のための輸送、重篤で慢性的な、または相対的な白血球減少症の治療、急性骨髄性白血病を有する患者の治療、AIDSまたは他の免疫不全疾患の治療、および抗真菌治療、とりわけ全身性または侵襲性カンジダ症にとりわけ好適である。本発明の目的のための「患者」は、本発明の治療方法がヒト患者の治療を主たる目的としているが、ヒトおよび他の哺乳類の両方を含む。
【0073】
したがって、本発明の態様は、不十分な好中球レベルに罹患したまたはその危険のある患者における、好中球レベルを増加する方法に関し、該患者に、上記PEG化G−CSFポリペプチドの有効量またはPEG化G−CSFポリペプチドを含む上記医薬組成物を投与することを含む。本発明のこの実施態様において、不十分な好中球レベルに罹患またはその危険のある患者は癌患者であり、とりわけ化学療法または放射線療法、特に化学療法で処置される癌患者である。
【0074】
本発明のPEG化G−CSFポリペプチドは、乳癌、非小細胞肺癌、小細胞肺癌、結腸直腸癌、子宮癌、卵巣癌、非ホジキンリンパ腫 (NHL)およびホジキン病を含む、あらゆる相違するタイプの癌に罹患した患者において、好中球の生産を刺激するのに有用であることが意図される。同様に、本発明のポリペプチドは、以下を含むあらゆる相違する化学療法剤を受ける患者に投与することが意図される:
・アルキル化剤、例えばマスタードガス誘導体、例えば、シクロホスファミド、クロラムブシル、イホスファミド、メクロレタミンまたはメルファラン;エチレンイミン類、例えば、ヘキサメチルメラミンまたはチオテパ;アルキルスルホネート類、例えば、ブスルファン;ヒドラジン類およびトリアジン類、例えば、アルトレタミン、デカルバジン、プロカルバジンまたはテモゾロミド;ニトロソウレア類、例えば、カルムスチン、ロムスチンまたはストレプトゾシン;および無機金属錯体試薬、例えば、シスプラチン、カルボプラチンまたはオキサリプラチン;
・植物アルカロイド類、例えば、タキサン類(例えば、ドセタキセルまたはパクリタキセル)、ビンカ・アルカロイド(例えば、ビンブラスチン、ビンクリスチンまたはビノレルビン)、カンプトテカン(camptothecan)誘導体(例えば、イリノテカンまたはトポテカン)およびポドフィロトキシン類(エトポシドまたはテニソピド);
・抗腫瘍抗生物質、例えば、アンスラサイクリン類、例えば、ダウノルビシン、ドキソルビシン、エピルビシン、イダルビシン、またはミトキサントロン;クロモマイシン類、例えば、ダクチノマイシンまたはプリカマイシン;および他の抗腫瘍抗生物質、例えば、ブレオマイシンまたはマイトマイシン;
・代謝拮抗物質、例えば、葉酸拮抗剤、例えば、メトトレキサート;ピリミジン拮抗剤、例えば、カペシタビン、シタラビン、5−フルオロウラシル(5−FU)、ホキシウリジン(Foxuridine)またはゲムシタビン;プリン拮抗薬、例えば、6−メルカプトプリンまたは6−チオグアニン;アデノシンデアミナーゼ阻害剤、例えば、クラドリビン(Cladribine)、フルダラビン、ネララビンまたはペントスタチン;およびリボヌクレアーゼレダクターゼ阻害剤、例えばヒドロキシウレア;
・トポイソメラーゼ阻害剤、例えば、トポイソメラーゼI阻害剤、例えば、イロノテカン(Ironotecan)またはトポテカン;およびトポイソメラーゼII阻害剤、例えば、アムサクリン、エトポシド、エトポシドホスフェートまたはテニポシド。
【0075】
本発明のPEG化G−CSFポリペプチドは、有効または治療有効量、例えば、投与される状態に関連した所望の効果を奏するのに十分な量、とりわけ、与えられた状況下で、好中球の所望の刺激を得るのに十分な量で、投与され得る。正確な用量は、例えば、個人患者および処置される疾患等の因子に依存し得、当業者、典型的には医者により決定され得る。PEG化G−CSFポリペプチドの用量は、例えば、ペグフィルグラスチン(pegfilgrastim)(Neulasta(登録商標))で現在推奨されている用量、成人患者当たり6mg、とほぼ同じ規模であり得る。したがって、本発明のPEG化G−CSFポリペプチドの適切な用量は、約1mgから約15mgの範囲、例えば、約2mgから約15mg、例えば、約3mgから約12mgであることが意図される。したがって、好適な用量は、例えば、約3mg、約6mg、または約9mgであり得る。それぞれの場合、投与量は、患者当たりの標準用量として表され、ここで、患者は成人またはさもなければ少なくとも45kgの体重の患者である。場合により、用量は、患者の体重によって決定され得、本発明のG−CSFポリペプチドの適切な用量は、約10μg/kgから約200μg/kgの範囲、例えば、約25μg/kgから約150μg/kg、例えば、約30μg/kgから約120μg/kgである。したがって、好適な用量は、約30μg/kg、約60μg/kg、約90μg/kgまたは約120μg/kgである。
【0076】
本発明はさらに以下の非限定的な実施例によって記載される。
【実施例】
【0077】
実施例1
部分的に脱PEG化されたG−CSF改変体の製造および分析
サンプルの調製および脱PEG化
野生型ヒトG−CSF(配列番号:1)に比較した置換K16R、K34R、K40R、T105KおよびS159Kを有するG−CSFを、WO 03/006501に実質的に記載されたCHO−K1細胞より製造した。4.5mg/mlのG−CSF改変体200ml(900mgG−CSF)を、mPEG−SPA5000(Nektar Therapeutics)を用いてPEG化した。簡単には、mPEG−SPA5000の13.2%(w/w)溶液100mLを、G−CSF溶液の200mLに10分に渡って添加し、ゆっくり攪拌し十分な混合を確保した。サンプルを21±3℃、pH8.5で44分インキュベートし、ゆっくり攪拌した。サンプル混合物を、その後、800mMホウ酸、pH10.0のストック溶液を用いてpH9.5に調整した。そして、サンプルを21±3℃で24時間、攪拌せずにインキュベーションした。その後、サンプルを100 mmol/kg クエン酸、20 mmol/kg NaOH、pH 2.5を用いて、約2.5倍に濃縮し、最終pHを3.5とした。
【0078】
部分的に脱PEG化されたG−CSFの単離
pHを3.5に低下させた後、直ぐに、サンプルを、20 mmol/kg クエン酸、15 mmol/kg NaOH、pH 3.4で平衡化させた約225 mLのSP-Sepharose HP (Amersham, GE Healthcare)を充填したVL44(Millipore)カラムに載せた。物質を載せた後、遊離のmPEG−酸等の非結合物質を取り除くために、カラムを洗浄した。25−100%溶出緩衝液(20 mmol/kg クエン酸、20 mmol/kg NaOH、200 mmol/kg NaCl、pH 3.5)の直線グラジエントを用い、カラムよりPEG化G−CSFを溶出した。グラジエントを25 CV(カラム体積)に対して展開した。カラム工程を21±3℃で実施し。使用した全ての緩衝液を同じ温度に調整した。カラムの搭載は4.1mg蛋白質/mlレジンであり、流速は8CV/時間であった。
【0079】
40mLのサンプルサイズを有するフラクションを集め、SDS−PAGEで解析した。SDS−PAGE分析に基づいて、約6.5CVに対応し、G−SCF分子当たり主に3つの結合されたPEG基を有する単離されたG−CSFを含む、1440mLの生成物プールを作成した。生成物プールの体積は、溶出グラジエントの傾斜を増加させることにより減らすことができることが、予想される。
【0080】
生成物プールをジアフィルトレーションして、約200mLとし、その後、10 mM 酢酸ナトリウム、43 mg/mL、pH 4.0でジアフィルトレーション
し、30kDaの分子量カットオフ(MWCO)の2つの50 cm2 Millipore Pellicon XL membraneを備えたMillipore LabScale TFF系を用いて、4.9 mg/mLに濃縮した。
【0081】
結果
生成物プールを10 mM 酢酸ナトリウム、43 mg/ml マンニトール、pH 4.0中で限外ろ過およびジアフィルトレーションを行い、物理化学的特徴付けを行った。図1は、上記したPEG化、部分的脱PEG化、および精製したG−CSF改変体のSDS−PAGE分析のスキャンを示し、7つのレーンは、以下を示す:
1.分子量マーカー
2.PEG化後
3.pH9.5、T=0h
4.pH9.5、T=24h
5.カチオン交換カラムへの添加物
6.カチオン交換カラムからの流出物
7.精製産物
【0082】
レーン7に、ポリペプチド分子当たり3つのmPEG−SPA5000基を有するG−CSF改変体に相当する、単一の大きなバンドが認められる。さらに、4つのmPEG−SPA5000基を有するG−CSF改変体に相当する小さいバンドが、また、レーン7で見られる。所望により、本分野で一般的に知られる方法により、精製手段の最適化または調整を行うことにより、要求される純度により収量が僅かに減り得るが、4PEG基に相当する小さなバンドを、減少させ、または実質的に取り除くことができる。
この手順の収量は、精製、ポリペプチド分子当たり主に3PEG基を有する部分的脱PEG化G−CSFの450mgであり、これは、全体の50%の収量であった。
【0083】
実施例2
部分的脱PEG化G−CSFの製造および解析
サンプル調製、脱PEG化および精製
野生型ヒトG−CSF(配列番号:1)に比較した、置換K16R、K34R、K40R、T105KおよびS159Kを有するG−CSF改変体を、CHO−K1細胞から製造し、その後、実質的に上記実施例1に記載したように、mPEG−SPA5000を用いてPEG化した。これを、10 kDa MWCOフィルターを備えたVivaspinろ過装置を用い、150mMホウ酸ナトリウム、pH9.5にジアフィルトレーションした。最終サンプルの濃度は4.7mg/mLであった。そして、サンプルを21±3℃、42時間インキュベーションした。
【0084】
インキュベーション後、サンプルを30 mM クエン酸、10 mM NaOH、pH 2.9で希釈することによって、カチオン交換クロマトグラフィーのために調製した。そして、サンプルを28mLのSP-Sepharose HP resinで充填されたXK16/20カラム(Amersham Biosciences)上に置いた。カラムを、サンプルを載せる前に、20 mM クエン酸、15 mM NaCl、pH 3.5の平衡化緩衝液で平衡化した。カラムに載せた後、カラムを同じ緩衝液で洗浄し、20 mM クエン酸、pH 3.5中、15 mMから200 mM NaClの直線グラジエントを用いて溶出し、相違するPEG化種を分離した。
【0085】
フラクションを集め、SDS−PAGE分析で分析した。3個のPEG部分を主に含むPEG化G−CSF改変体を含む生成物プールを、SDS−PAGEに基づき作成した。この生成物プールを、10kDaのMWCOを有するVivaspinろ過装置を用いてジアフィルトレーションし、緩衝液を交換した。サンプルを10mMコハク酸ナトリウム、43 mg/mL、pH 4.0にジアフィルトレーションし、最終的に3.0mg/mlに濃縮した。
【0086】
位置異性体解析
シアリダーゼ前処理と組み合わせたカチオン交換HPLC(CIEX-HPLC)を用いて、多様なPEG化種を含む生成物プール中の異なる位置異性体の組成について、データを得た。相違する位置異性体の存在によるPEG化後の不均一性に加えて、PEG化G−CSFは、また、0、1または2個のシアル酸基を有する、1つのO-グリコシレーション部位(Thr133)を含むという点で、不均一である。シアル酸基の相違する数の結果として、クロマトグラムにおけるピークの数を減少させるために、分析前に、シアリダーゼ酵素前処理工程が含まれる。シアリダーゼ処理は、最初に、必要であれば、50 mM 酢酸ナトリウム緩衝液、pH 5.0で1mg/mlに希釈し、その後、μg蛋白質当たり0.05μl(0.25m単位)のシアリダーゼを添加し、サンプルを37℃で18時間インキュベーションし、シアル酸を除くことによって、実施される。そして、サンプルを同日に解析するか、または解析の日まで4℃で保存する。HPLCを、PolySULFOETHYL A(登録商標)カチオン交換HPLCカラム(PolyLC Inc.)を用いて、214nmのUV検出で実施する。異なるピークの特徴付けをPolySULFOETHYL A(登録商標)CIEXカラムから手動のコレクションの後、SDS−PAGE分析により実施した。
【0087】
結果−PEG損失
緩衝液を交換したサンプルをSDS−PAGE分析により解析し、時間の関数としての、PEG損失の程度を評価した。結果(図2参照)は、実施例1に対する図1に示されるものと同様であり、24または42時間インキュベーションしたサンプル間に認められた全体的なPEG化の程度における僅かな変化のみが存在した(図2、レーン4および5)。
【0088】
結果−生成物プール中の位置異性体の評価
図3は、上記に記載されたような、SDS−PAGE分析により判断される主に3個のPEG5000基を含む、本発明の部分的脱PEG化G−CSF化生成物プールのカチオン交換クロマトグラムを示す。2つの大きなピークは、それぞれ、3個のPEG500基を有するメジャーな位置異性体を示す。3つの小さなピークは、4個のPEG基を有する2つの位置異性体および2個のPEG基を有する1つの位置異性体を示す。
【0089】
2つの大きなピークを回収し、PEG基が結合された位置を決定するためにネイティブペプチドマップ解析を行った。2つのメジャーな位置異性体は、以下のアミノ酸残基上でPEG化されていることが見出された:
異性体A:N末端、Lys23およびLys159
異性体B:N末端、Lys105およびLys159
これら2つのメジャーな異性体は、サンプルに存在する位置異性体の95%より多いことが示された。
【0090】
実施例3
比較例
比較する目的のために、図4は、本発明の脱PEG化を行わなかった精製、PEG化G−CSF改変体のカチオン交換クロマトグラムの結果を示す。この場合、G−CSF改変体は、実施例1および2で上記に示されたのと同じ、天然ヒトG−CSFに比較した5つの置換、つまり、K16R、K34R、K40R、T105KおよびS159Kを有した。それは、製造され、不安定なPEG部分を取り除くためにpH9.5でインキュベーションしたことを除いて、実施例1で実質的に記載されたようにmPEG−SPA5000でPEG化された。結果として、PEG化改変体は、2−6付加PEG部分を有する多くの相違するPEG異性体の混合物を含んだ。この位置異性体の混合物を、実施例1に実質的に記載されたようなカチオン交換クロマトグラフィーを用いて精製した。主に4−5付加PEG部分を含むフラクションを単離し、実質的に実施例1に記載されたような限外ろ過およびジアフィルトレーションの後、上記に記載したようなCIEX-HPLC分析にかけた。このフラクションは、実施例1および2に記載した3−PEGフラクションに相当するが、部分的に脱PEG化された3−PEG生成物に比較して1または2の位置で付加された(不安定な)PEG基が結合されており、つまり、この場合は、精製産物は、主として4−5付加PEG基を含む。
【0091】
図3に組成が示されている、本発明により調製された部分的に脱PEG化された生成物に比較して、図4に示された生成物は、明らかに、より複雑で、不均一な混合物である。図3に示された本発明により調製された生成物は、それぞれが3つのPEG部分を含む2つのメジャーな位置異性体を95%より多く含むが、図4に示された生成物は、それぞれ4または5の結合されたPEG部分を有する6つのメジャーな位置異性体を含む。これらの6つの4−5PEG位置異性体は、N末端および位置K23、K105およびK159の1または2で安定なPEG部分を、そして、Ser66またはTyr165(データは示さず)の1または両方で不安定なPEG部分を含む。立体的障害のために、単一のG−CSFポリペプチドのこれらの位置の全てが、PEG部分によって占められるわけではない。したがって、図4に示される生成物は、以下の6つのメジャーなPEG位置異性体の不均一な混合物を含む:
N末端、K23、S66、K159、Y165 (5-PEG)
N末端、S66、K105、K159、Y165 (5-PEG)
N末端、K23、S66、K159 (4-PEG)
N末端、K23、S66、Y165 (4-PEG)
N末端、S66、K105、K159 (4-PEG)
N末端、S66、K105、Y165 (4-PEG)。
【0092】
実施例4
安定性データ
結合されたPEG部分の安定性を、4つの相違する温度で保存された相違する水性製剤において試験した。ポリペプチドは、実施例1で記載されたように、製造された後、PEG化され、部分的に脱PEG化され、そしてまた精製された、実施例1で挙げられた5つの置換を有するG−CSF改変体であった。試験された製剤は以下のようである:
【0093】
【表1】

【0094】
各製剤のpHは4.0であった。
CIEX-HPLCを用いて、各サンプルのPEG異性体の分布を、26日、56日および89日後測定し、PEG化の安定性を検討した。結果を以下の表に示す。
【0095】
【表2】

【0096】
【表3】

【0097】
上記結果は、製剤および貯蔵温度にかかわらず、PEG化が高度の安定であり、3PEG異性体の割合は、26、56または89日でサンプリングしたとき、全ての温度で95%に大変近似する。表から容易に見受けられる違いは、-80℃のデータを対照に用いて、その他/特徴付けされないの割合において、主に25℃または35℃で貯蔵されたサンプルでの、時間に渡る僅かな相違であり、対応する、これらのサンプルの2PEG異性体の割合の増加である。
【0098】
比較して、下記の表は、上記に記載されたのと同様の製剤における同じG−CSF改変体、ただし、本発明の脱PEG化工程をしないで製造された、つまり、上記比較実施例3に記載された生成物に対応するものに対する、20、83日の貯蔵後に測定されたデータを示す。この場合の製剤は4.0のpHを有し、15 mM 酢酸ナトリウム、45 mg/mlマンニトール、および5 mg/mlPEG化G−CSF改変体からなり、ここで、PEG化G−CSF改変体は、実験の開始時には、主に(98-99%)4−5個の結合されたPEG部分を含む。下記の表は、示された4つの温度での83日後、並びにそれらの温度のうち2つの20日後に測定されたPEG異性体の分布を示す。5℃で貯蔵されたとき、83日後、4−5PEG部分を含むG−CSFポリペプチドの割合が、わずかにだけ減少する一方、25℃で貯蔵されたとき、4−5PEG異性体の実質的な損失とそれに応じた3PEG異性体の増加、そして、35℃での4−5PEG異性体の更なる大きな損失と、それに応じた3PEG異性体の増加が認められる。これは、本発明の脱PEG化方法がなければ、上記に記載されたように製造されたPEG化G−CSFポリペプチドは、水性製剤で貯蔵されるとき、時間に渡り、そして温度に依存して、ポリペプチドから脱離する、不安定なPEG基を含むことを示す。
【0099】
【表4】

【0100】
上記発明は、明確性および理解の目的で、いくらか詳しく記載されているが、当業者は、この開示を読むことにより、形態および詳細の多様な変化を、本発明の真の範囲から離れないで、することができることは明確である。本明細書で記載された実施例および実施態様が例示的な目的のみであること、そして、その観点から、多様な調整または変化が当業者に示唆され、そして、本出願の精神および範囲および添付する特許請求の範囲に含まれることは、理解される。本明細書で引用した、全ての刊行物、特許、特許出願および/または他の書類は、それぞれ個々の刊行物、特許、特許出願、および/または他の書類が、それぞれ、全ての目的で、その全体が、引用により本明細書に組み込まれることが示されているかのように、同じ程度に全ての目的に、その全体が、引用により、本明細書に組み込まれる。
【0101】
【表5】

【特許請求の範囲】
【請求項1】
リジン残基のイプシロンアミノ基またはN末端アミノ基に結合した少なくとも1つのPEG部分、およびヒドロキシル基に結合した少なくとも1つのPEG部分を有するPEG化G−CSFポリペプチドの安定性および均一性を増加させる方法であって、該ポリペプチドを、ヒドロキシル基に結合したPEG部分を取り除くために十分な時間、8.0を越える高められたpHとし、そして、該pHを低下させて約8.0またはそれ以下とすることを含む方法。
【請求項2】
高められたpHが、約8.5から約10.5の範囲にある、請求項1に記載の方法。
【請求項3】
高められたpHが、約9.0から約10.0の範囲にある、請求項2に記載の方法。
【請求項4】
高められたpHが、約9.2から約9.8の範囲、例えば9.5である、請求項3に記載の方法。
【請求項5】
ポリペプチドを、約2時間から約100時間の期間、高められたpHとする、請求項1−4のいずれかに記載の方法。
【請求項6】
ポリペプチドを、約4時間から約72時間の期間、高められたpHとする、請求項5に記載の方法。
【請求項7】
ポリペプチドを、約8時間から約48時間の期間、高められたpHとする、請求項6に記載の方法。
【請求項8】
ポリペプチドを、約12時間から約30時間の期間、高められたpHとする、請求項7に記載の方法。
【請求項9】
さらに、ポリペプチドを、低下させたpHで、少なくとも1つのクロマトグラフィー精製工程にかけることを含む、請求項1−8のいずれかに記載の方法。
【請求項10】
クロマトグラフィー精製工程が、イオン交換クロマトグラフィーである、請求項9に記載の方法。
【請求項11】
pHを、約7.0より下に低下させ、そして、クロマトグラフィー精製工程が、カチオン交換クロマトグラフィーである、請求項10に記載の方法。
【請求項12】
クロマトグラフィー精製工程が、ゲルろ過クロマトグラフィーである、請求項9に記載の方法。
【請求項13】
低下させたpHが、約2.0から約5.0の範囲である、請求項1−11のいずれかに記載の方法。
【請求項14】
低下させたpHが、約2.5から約4.5の範囲である、請求項13に記載の方法。
【請求項15】
G−CSFポリペプチドを、アミン特異的活性化ポリエチレングリコール(PEG)とPEG化反応させ、PEG化G−CSFポリペプチド中間体を製造し、そして、その後、該PEG化ポリペプチド中間体を、ヒドロキシル基に結合したPEG部分を取り除くために十分な時間、少なくとも約9.0の高められたpHとし、PEG化G−CSFポリペプチドを製造することを含む、PEG化G−CSFポリペプチドの製造方法。
【請求項16】
PEG化反応が、約7.0−9.0の範囲のpHで実施される、請求項15に記載の方法。
【請求項17】
PEG化反応が、9.0を超えるpHで実施される、請求項15に記載の方法。
【請求項18】
PEG化反応およびその後のヒドロキシル基に結合したPEG部分の除去が、単一pH値で、単一工程で実施される、請求項17に記載の方法。
【請求項19】
アミン特異的活性化PEGが、mPEG−スクシンイミジルプロピオネート(mPEG−SPA)、mPEG−スクシンイミジルブタノエート(mPEG−SBA)、またはmPEG−スクシンイミジルα−メチルブタノエート(mPEG−SMB)である、請求項15に記載の方法。
【請求項20】
アミン特異的活性化PEGが、約5kDaの分子量を有するmPEG−SPAである、請求項15に記載の方法。
【請求項21】
高められたpHが、約9.2から11.0の範囲である、請求項15に記載の方法。
【請求項22】
高められたpHが、約9.2から10.0の範囲である、請求項21に記載の方法。
【請求項23】
請求項1−22のいずれかに記載の方法で製造される、PEG化G−CSFポリペプチド。
【請求項24】
ポリペプチドが、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含む、G−CSF改変体である、請求項23に記載のPEG化G−CSFポリペプチド。
【請求項25】
ポリペプチドが、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含み、ポリペプチドのPEG位置異性体の少なくとも約80%が、3つの結合したPEG部分を有するリジン/N末端PEG位置異性体である、PEG化G−CSFポリペプチドのPEG位置異性体の混合物を含む、組成物。
【請求項26】
ポリペプチドのPEG位置異性体の少なくとも約85%が、3つの結合したPEG部分を有するリジン/N末端PEG位置異性体である、請求項25に記載の組成物。
【請求項27】
ポリペプチドのPEG位置異性体の少なくとも約90%が、3つの結合したPEG部分を有するリジン/N末端PEG位置異性体である、請求項25に記載の組成物。
【請求項28】
3つの結合したPEG部分を有するPEG位置異性体の少なくとも約80%が、2つのPEG位置異性体からなり、該異性体の一つが、N末端、Lys23およびLys159で結合しているPEG部分を有し、そして、他の異性体が、N末端、Lys105およびLys159で結合しているPEG部分を有する、請求項25に記載の組成物。
【請求項29】
3つの結合したPEG部分を有するPEG位置異性体の少なくとも約85%が、2つのPEG位置異性体からなり、該異性体の一つが、N末端、Lys23およびLys159で結合しているPEG部分を有し、そして、他の異性体が、N末端、Lys105およびLys159で結合しているPEG部分を有する、請求項26に記載の組成物。
【請求項30】
3つの結合したPEG部分を有するPEG位置異性体の少なくとも約90%が、2つのPEG位置異性体からなり、該異性体の一つが、N末端、Lys23およびLys159で結合しているPEG部分を有し、そして、他の異性体が、N末端、Lys105およびLys159で結合しているPEG部分を有する、請求項27に記載の組成物。
【請求項31】
ポリペプチドが、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含み、そして、ポリペプチドのPEG位置異性体の少なくとも約80%が、5℃の温度で、3ヶ月間、水性参照組成物中の貯蔵後に、3つの結合されたPEG部分を有するリジン/N末端PEG位置異性体である、PEG化G−CSFポリペプチドのPEG位置異性体の混合物を含む、組成物。
【請求項32】
医薬的に許容される担体、および請求項23または24に記載のPEG化G−CSFポリペプチドまたは請求項25−31のいずれかに記載の組成物を含む、組成物。
【請求項33】
野生型ヒトG−CSFに比較して置換K16R、K34R、K40R、T105KおよびS159Kを含む、組換えG−CSFポリペプチドの、リジン/N末端PEG位置異性体の混合物を製造する方法であって、
a)宿主細胞に組換えG−CSFポリペプチドを発現させ;
b)組換えG−CSFポリペプチドを単離し;
c)単離された組換えG−CSFポリペプチドとアミン特異的活性化PEGを反応させ、複数の組換えG−CSFポリペプチドのPEG位置異性体を製造し;そして、
d)pH8.5から10.5で複数のPEG位置異性体を反応させ、複数の部分的に脱PEG化された組換えG−CSFポリペプチドのリジン/N末端PEG位置異性体を製造する、
ことを含む方法。
【請求項34】
アミン特異的活性化PEGが、mPEG−スクシンイミジルプロピオネート(mPEG−SPA)、mPEG−スクシンイミジルブタノエート(mPEG−SBA)、またはmPEG−スクシンイミジルα−メチルブタノエート(mPEG−SMB)からなる群から選択される、請求項33に記載の方法。
【請求項35】
さらに、複数の組換えG−CSFポリペプチドのリジン/N末端PEG位置異性体を、1以上のクロマトグラフィー精製工程にかけ、実質的に精製されたG−CSFポリペプチドのリジン/N末端PEG位置異性体の混合物を製造することを含む、請求項33または34に記載の方法。
【請求項36】
さらに、組換えG−CSFポリペプチドのリジン/N末端PEG位置異性体の実質的に精製された混合物の有効用量を、少なくとも1つの医薬的に許容される賦形剤と混合し、医薬組成物を製造することを含む、請求項35に記載の方法。
【請求項37】
請求項33に記載の方法により製造される、複数の部分的に脱PEG化されたリジン/N末端PEG位置異性体。
【請求項38】
請求項35に記載の方法により製造される、リジン/N末端PEG位置異性体の実質的に精製された混合物。
【請求項39】
請求項36に記載の方法により製造される、医薬組成物。
【請求項40】
不十分な好中球レベルに罹患している、またはその危険性のある、患者における、好中球のレベルを増加させる方法であって、該患者に、請求項23または24に記載のPEG化G−CSFポリペプチド、または請求項25−32または36−39のいずれかに記載の組成物の有効量を該患者に投与することを含む、方法。
【請求項41】
不十分な好中球レベルが、化学療法または放射線療法の結果である、請求項40に記載の方法。
【請求項42】
不十分な好中球レベルに罹患している、またはその危険性のある患者における好中球のレベルを増加させる医薬の製造のための、請求項23または24に記載のPEG化G−CSFポリペプチド、または請求項25−32または36−39のいずれかに記載の組成物の使用。
【請求項43】
不十分な好中球レベルが、化学療法または放射線療法の結果である、請求項42に記載の使用。
【請求項44】
混合物のPEG位置異性体の少なくとも約80%が、2つのPEG位置異性体からなり、それぞれが、リジンのイプシロンアミノ基に結合した2個のPEG部分およびN末端アミノ基に結合した1個のPEG部分からなるPEG部分を有する、PEG化G−CSFポリペプチド改変体のPEG位置異性体の均一な混合物を含む、組成物。
【請求項45】
均一な混合物のPEG位置異性体の少なくとも約85%が、2つのPEG位置異性体からなり、それぞれが、リジンのイプシロンアミノ基に結合した2個のPEG部分およびN末端アミノ基に結合した1個のPEG部分からなるPEG部分を有する、請求項44に記載の組成物。
【請求項46】
均一な混合物のPEG位置異性体の少なくとも約90%が、2つのPEG位置異性体からなり、それぞれが、リジンのイプシロンアミノ基に結合した2個のPEG部分およびN末端アミノ基に結合した1個のPEG部分からなるPEG部分を有する、請求項44に記載の組成物。
【請求項47】
医薬的に許容される担体および請求項44−46のいずれかに記載の組成物を含む、組成物。
【請求項48】
不十分な好中球レベルに罹患しているか、またはその危険性のある患者において、好中球のレベルを増加させる方法であって、該患者に請求項44−46のいずれかに記載の組成物の有効量を投与することを含む、方法。
【請求項49】
不十分な好中球レベルに罹患しているか、またはその危険性のある患者において、好中球のレベルを増加させる医薬の製造のための、請求項44−46のいずれかに記載の組成物の使用。
【請求項1】
リジン残基のイプシロンアミノ基またはN末端アミノ基に結合した少なくとも1つのPEG部分、およびヒドロキシル基に結合した少なくとも1つのPEG部分を有するPEG化G−CSFポリペプチドの安定性および均一性を増加させる方法であって、該ポリペプチドを、ヒドロキシル基に結合したPEG部分を取り除くために十分な時間、8.0を越える高められたpHとし、そして、該pHを低下させて約8.0またはそれ以下とすることを含む方法。
【請求項2】
高められたpHが、約8.5から約10.5の範囲にある、請求項1に記載の方法。
【請求項3】
高められたpHが、約9.0から約10.0の範囲にある、請求項2に記載の方法。
【請求項4】
高められたpHが、約9.2から約9.8の範囲、例えば9.5である、請求項3に記載の方法。
【請求項5】
ポリペプチドを、約2時間から約100時間の期間、高められたpHとする、請求項1−4のいずれかに記載の方法。
【請求項6】
ポリペプチドを、約4時間から約72時間の期間、高められたpHとする、請求項5に記載の方法。
【請求項7】
ポリペプチドを、約8時間から約48時間の期間、高められたpHとする、請求項6に記載の方法。
【請求項8】
ポリペプチドを、約12時間から約30時間の期間、高められたpHとする、請求項7に記載の方法。
【請求項9】
さらに、ポリペプチドを、低下させたpHで、少なくとも1つのクロマトグラフィー精製工程にかけることを含む、請求項1−8のいずれかに記載の方法。
【請求項10】
クロマトグラフィー精製工程が、イオン交換クロマトグラフィーである、請求項9に記載の方法。
【請求項11】
pHを、約7.0より下に低下させ、そして、クロマトグラフィー精製工程が、カチオン交換クロマトグラフィーである、請求項10に記載の方法。
【請求項12】
クロマトグラフィー精製工程が、ゲルろ過クロマトグラフィーである、請求項9に記載の方法。
【請求項13】
低下させたpHが、約2.0から約5.0の範囲である、請求項1−11のいずれかに記載の方法。
【請求項14】
低下させたpHが、約2.5から約4.5の範囲である、請求項13に記載の方法。
【請求項15】
G−CSFポリペプチドを、アミン特異的活性化ポリエチレングリコール(PEG)とPEG化反応させ、PEG化G−CSFポリペプチド中間体を製造し、そして、その後、該PEG化ポリペプチド中間体を、ヒドロキシル基に結合したPEG部分を取り除くために十分な時間、少なくとも約9.0の高められたpHとし、PEG化G−CSFポリペプチドを製造することを含む、PEG化G−CSFポリペプチドの製造方法。
【請求項16】
PEG化反応が、約7.0−9.0の範囲のpHで実施される、請求項15に記載の方法。
【請求項17】
PEG化反応が、9.0を超えるpHで実施される、請求項15に記載の方法。
【請求項18】
PEG化反応およびその後のヒドロキシル基に結合したPEG部分の除去が、単一pH値で、単一工程で実施される、請求項17に記載の方法。
【請求項19】
アミン特異的活性化PEGが、mPEG−スクシンイミジルプロピオネート(mPEG−SPA)、mPEG−スクシンイミジルブタノエート(mPEG−SBA)、またはmPEG−スクシンイミジルα−メチルブタノエート(mPEG−SMB)である、請求項15に記載の方法。
【請求項20】
アミン特異的活性化PEGが、約5kDaの分子量を有するmPEG−SPAである、請求項15に記載の方法。
【請求項21】
高められたpHが、約9.2から11.0の範囲である、請求項15に記載の方法。
【請求項22】
高められたpHが、約9.2から10.0の範囲である、請求項21に記載の方法。
【請求項23】
請求項1−22のいずれかに記載の方法で製造される、PEG化G−CSFポリペプチド。
【請求項24】
ポリペプチドが、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含む、G−CSF改変体である、請求項23に記載のPEG化G−CSFポリペプチド。
【請求項25】
ポリペプチドが、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含み、ポリペプチドのPEG位置異性体の少なくとも約80%が、3つの結合したPEG部分を有するリジン/N末端PEG位置異性体である、PEG化G−CSFポリペプチドのPEG位置異性体の混合物を含む、組成物。
【請求項26】
ポリペプチドのPEG位置異性体の少なくとも約85%が、3つの結合したPEG部分を有するリジン/N末端PEG位置異性体である、請求項25に記載の組成物。
【請求項27】
ポリペプチドのPEG位置異性体の少なくとも約90%が、3つの結合したPEG部分を有するリジン/N末端PEG位置異性体である、請求項25に記載の組成物。
【請求項28】
3つの結合したPEG部分を有するPEG位置異性体の少なくとも約80%が、2つのPEG位置異性体からなり、該異性体の一つが、N末端、Lys23およびLys159で結合しているPEG部分を有し、そして、他の異性体が、N末端、Lys105およびLys159で結合しているPEG部分を有する、請求項25に記載の組成物。
【請求項29】
3つの結合したPEG部分を有するPEG位置異性体の少なくとも約85%が、2つのPEG位置異性体からなり、該異性体の一つが、N末端、Lys23およびLys159で結合しているPEG部分を有し、そして、他の異性体が、N末端、Lys105およびLys159で結合しているPEG部分を有する、請求項26に記載の組成物。
【請求項30】
3つの結合したPEG部分を有するPEG位置異性体の少なくとも約90%が、2つのPEG位置異性体からなり、該異性体の一つが、N末端、Lys23およびLys159で結合しているPEG部分を有し、そして、他の異性体が、N末端、Lys105およびLys159で結合しているPEG部分を有する、請求項27に記載の組成物。
【請求項31】
ポリペプチドが、野生型ヒトG−CSFに比較して、置換K16R、K34R、K40R、T105KおよびS159Kを含み、そして、ポリペプチドのPEG位置異性体の少なくとも約80%が、5℃の温度で、3ヶ月間、水性参照組成物中の貯蔵後に、3つの結合されたPEG部分を有するリジン/N末端PEG位置異性体である、PEG化G−CSFポリペプチドのPEG位置異性体の混合物を含む、組成物。
【請求項32】
医薬的に許容される担体、および請求項23または24に記載のPEG化G−CSFポリペプチドまたは請求項25−31のいずれかに記載の組成物を含む、組成物。
【請求項33】
野生型ヒトG−CSFに比較して置換K16R、K34R、K40R、T105KおよびS159Kを含む、組換えG−CSFポリペプチドの、リジン/N末端PEG位置異性体の混合物を製造する方法であって、
a)宿主細胞に組換えG−CSFポリペプチドを発現させ;
b)組換えG−CSFポリペプチドを単離し;
c)単離された組換えG−CSFポリペプチドとアミン特異的活性化PEGを反応させ、複数の組換えG−CSFポリペプチドのPEG位置異性体を製造し;そして、
d)pH8.5から10.5で複数のPEG位置異性体を反応させ、複数の部分的に脱PEG化された組換えG−CSFポリペプチドのリジン/N末端PEG位置異性体を製造する、
ことを含む方法。
【請求項34】
アミン特異的活性化PEGが、mPEG−スクシンイミジルプロピオネート(mPEG−SPA)、mPEG−スクシンイミジルブタノエート(mPEG−SBA)、またはmPEG−スクシンイミジルα−メチルブタノエート(mPEG−SMB)からなる群から選択される、請求項33に記載の方法。
【請求項35】
さらに、複数の組換えG−CSFポリペプチドのリジン/N末端PEG位置異性体を、1以上のクロマトグラフィー精製工程にかけ、実質的に精製されたG−CSFポリペプチドのリジン/N末端PEG位置異性体の混合物を製造することを含む、請求項33または34に記載の方法。
【請求項36】
さらに、組換えG−CSFポリペプチドのリジン/N末端PEG位置異性体の実質的に精製された混合物の有効用量を、少なくとも1つの医薬的に許容される賦形剤と混合し、医薬組成物を製造することを含む、請求項35に記載の方法。
【請求項37】
請求項33に記載の方法により製造される、複数の部分的に脱PEG化されたリジン/N末端PEG位置異性体。
【請求項38】
請求項35に記載の方法により製造される、リジン/N末端PEG位置異性体の実質的に精製された混合物。
【請求項39】
請求項36に記載の方法により製造される、医薬組成物。
【請求項40】
不十分な好中球レベルに罹患している、またはその危険性のある、患者における、好中球のレベルを増加させる方法であって、該患者に、請求項23または24に記載のPEG化G−CSFポリペプチド、または請求項25−32または36−39のいずれかに記載の組成物の有効量を該患者に投与することを含む、方法。
【請求項41】
不十分な好中球レベルが、化学療法または放射線療法の結果である、請求項40に記載の方法。
【請求項42】
不十分な好中球レベルに罹患している、またはその危険性のある患者における好中球のレベルを増加させる医薬の製造のための、請求項23または24に記載のPEG化G−CSFポリペプチド、または請求項25−32または36−39のいずれかに記載の組成物の使用。
【請求項43】
不十分な好中球レベルが、化学療法または放射線療法の結果である、請求項42に記載の使用。
【請求項44】
混合物のPEG位置異性体の少なくとも約80%が、2つのPEG位置異性体からなり、それぞれが、リジンのイプシロンアミノ基に結合した2個のPEG部分およびN末端アミノ基に結合した1個のPEG部分からなるPEG部分を有する、PEG化G−CSFポリペプチド改変体のPEG位置異性体の均一な混合物を含む、組成物。
【請求項45】
均一な混合物のPEG位置異性体の少なくとも約85%が、2つのPEG位置異性体からなり、それぞれが、リジンのイプシロンアミノ基に結合した2個のPEG部分およびN末端アミノ基に結合した1個のPEG部分からなるPEG部分を有する、請求項44に記載の組成物。
【請求項46】
均一な混合物のPEG位置異性体の少なくとも約90%が、2つのPEG位置異性体からなり、それぞれが、リジンのイプシロンアミノ基に結合した2個のPEG部分およびN末端アミノ基に結合した1個のPEG部分からなるPEG部分を有する、請求項44に記載の組成物。
【請求項47】
医薬的に許容される担体および請求項44−46のいずれかに記載の組成物を含む、組成物。
【請求項48】
不十分な好中球レベルに罹患しているか、またはその危険性のある患者において、好中球のレベルを増加させる方法であって、該患者に請求項44−46のいずれかに記載の組成物の有効量を投与することを含む、方法。
【請求項49】
不十分な好中球レベルに罹患しているか、またはその危険性のある患者において、好中球のレベルを増加させる医薬の製造のための、請求項44−46のいずれかに記載の組成物の使用。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−10765(P2013−10765A)
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−173959(P2012−173959)
【出願日】平成24年8月6日(2012.8.6)
【分割の表示】特願2008−513928(P2008−513928)の分割
【原出願日】平成18年5月26日(2006.5.26)
【出願人】(500382048)マキシジェン, インコーポレイテッド (17)
【Fターム(参考)】
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願番号】特願2012−173959(P2012−173959)
【出願日】平成24年8月6日(2012.8.6)
【分割の表示】特願2008−513928(P2008−513928)の分割
【原出願日】平成18年5月26日(2006.5.26)
【出願人】(500382048)マキシジェン, インコーポレイテッド (17)
【Fターム(参考)】
[ Back to top ]

