PI3−キナーゼ阻害剤としてのインダゾール誘導体
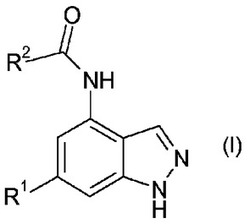
本発明は、特定の新規化合物に関する。詳細には、本発明は、式(I)の化合物およびその塩に関する。本発明の化合物は、PI3−キナーゼ活性の阻害剤である。


【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ホスホイノシチド3’OHキナーゼファミリー(本明細書中以後、PI3−キナーゼ)の活性または機能の阻害剤である、特定の新規化合物、それらを調製するためのプロセス、それらの化合物を含んでなる医薬組成物、および様々な障害の治療におけるその化合物または組成物の使用に関する。より詳細には、本発明の化合物は、例えば、PI3Kδ、PI3Kα、PI3Kβおよび/またはPI3Kγの活性または機能の阻害剤である。PI3−キナーゼの活性または機能の阻害剤である化合物は、障害(例えば、喘息および慢性閉塞性肺疾患(COPD)を含む呼吸器疾患、アレルギー性鼻炎およびアトピー性皮膚炎を含むアレルギー性疾患、関節リウマチおよび多発性硬化症を含む自己免疫疾患、炎症性腸疾患を含む炎症性障害、血栓症およびアテローム性動脈硬化症を含む循環器疾患、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、ならびに関節リウマチまたは変形性関節症に伴う疼痛、背痛、一般的な炎症性疼痛、肝後方神経痛、糖尿病性ニューロパシー、炎症性神経因性疼痛(トラマ(trama))、三叉神経痛および中枢性疼痛を含む疼痛)の治療において有用であり得る。
【背景技術】
【0002】
細胞膜は、種々のシグナル伝達経路に参加することができるセカンドメッセンジャーの大きな貯蔵所に相当する。リン脂質シグナル伝達経路におけるエフェクター酵素の機能および制御に関して、クラスI PI3−キナーゼ(例えば、PI3Kデルタ)は、膜リン脂質プールからセカンドメッセンジャーを生成する。クラスI PI3Kは、膜リン脂質PI(4,5)P2を、セカンドメッセンジャーとして機能するPI(3,4,5)P3に変換する。PIおよびPI(4)Pも、PI3Kの基質であり、リン酸化されて、それぞれPI3PおよびPI(3,4)P2に変換され得る。さらに、これらのホスホイノシチドは、5’特異的および3’特異的なホスファターゼ(phophatases)によって他のホスホイノシチドに変換され得る。このように、PI3Kの酵素活性は直接または間接的に、細胞内のシグナル伝達経路においてセカンドメッセンジャーとして機能する2つの3’−ホスホイノシチドサブタイプを生成する(Vanhaesebroeckら、Trends Biochem.Sci.22(7)p.267−72(1997)(非特許文献1);Leslieら、Chem.Rev.101(8)p.2365−80(2001)(非特許文献2);Katsoら、Annu.Rev.Cell Dev.Biol.17 p.615−75(2001)(非特許文献3);およびToker,Cell.Mol.Life Sci.59(5)p.761−79(2002)(非特許文献4))。現在まで、8種類の哺乳動物PI3Kが同定されており、配列相同性、構造、結合パートナー、活性化の様式および基質優先性に基づいて、主要な3つのクラス(I、IIおよびIII)に分類されている。インビトロでは、クラスI PI3Kは、ホスファチジルイノシトール(PI)、ホスファチジルイノシトール−4−リン酸(PI4P)およびホスファチジルイノシトール−4,5−二リン酸(PI(4,5)P2)をリン酸化することにより、それぞれホスファチジルイノシトール−3−リン酸(PI3P)、ホスファチジルイノシトール−3,4−二リン酸(PI(3,4)P2およびホスファチジルイノシトール−3,4,5−三リン酸(PI(3,4,5)P3を生成することができる。クラスII PI3Kは、PIおよびPI4Pをリン酸化することができる。クラスIII PI3Kは、PIだけをリン酸化することができる(Vanhaesebroeckら、(1997)上記;Vanhaesebroeckら、Exp.Cell Res.253(1)p.239−54(1999)(非特許文献5);およびLeslieら、(2001)上記)。
【0003】
クラスI PI3Kは、p110触媒サブユニットおよび調節サブユニットからなるヘテロ二量体であり、このファミリーはさらに、調節パートナーおよび制御機構に基づいて、クラスIaおよびクラスIb酵素に分類される。クラスIa酵素は、異なる5つの調節サブユニット(p85α、p55α、p50α、p85βおよびp55γ)と二量体化する異なる3つの触媒サブユニット(p110α、p110βおよびp110δ)からなり、すべての触媒サブユニットが、すべての調節サブユニットと相互作用することができ、それにより、種々のヘテロ二量体を形成する。クラスIa PI3Kは、一般に、受容体型チロシンキナーゼの成長因子刺激に応答して活性化され、その活性化は、調節サブユニットSH2ドメインと、その活性化された受容体の特定のホスホ−チロシン残基またはIRS−1などのアダプタータンパク質との相互作用を介する。低分子量GTPase(例としてras)も、受容体型チロシンキナーゼの活性化とともに、PI3Kの活性化に関わる。p110αとp110βの両方が、すべての細胞型において構成的に発現されるのに対し、p110δの発現は、白血球集団およびいくつかの上皮細胞に限定される。対照的に、単一のクラスIb酵素は、p101調節サブユニットと相互作用するp110γ触媒サブユニットからなる。さらに、クラスIb酵素は、Gタンパク質共役受容体(GPCR)系に応答して活性化され、その発現は、白血球に限定されるとみられる。
【0004】
スキームA:PI(4,5)P2からPI(3,4,5)P3への変換
【化1】

【0005】
上記のスキームAに図示されるように、ホスホイノシチド3−キナーゼ(PI3K)は、イノシトール環の3番目の炭素のヒドロキシルをリン酸化する。PtdIns(3,4,5)P3、PtdIns(3,4)P2およびPtdIns(3)Pを生成するホスホイノシチドのリン酸化は、細胞増殖、細胞分化、細胞成長、細胞サイズ、細胞生存、アポトーシス、接着、細胞運動、細胞遊走、走化性、浸潤、細胞骨格再編成、細胞形態の変化、小胞輸送および代謝経路に不可欠なシグナル伝達経路を含む種々のシグナル伝達経路に対するセカンドメッセンジャーを生成する(Katsoら、(2001)上記;およびSteinら、Mol.Med.Today 6(9)p.347−57(2000)(非特許文献6))。
【0006】
これらのリン酸化されたシグナル伝達産物の生成に関与するPI3−キナーゼの活性は、元来、ウイルス腫瘍性タンパク質、ならびにホスファチジルイノシトール(PI)およびそのリン酸化された誘導体をイノシトール環の3’−ヒドロキシルにおいてリン酸化する成長因子受容体型チロシンキナーゼに関連するものとして同定された(Panayotouら、Trends Cell Biol.2 p.358−60(1992)(非特許文献7))。しかしながら、より最近の生化学的研究から、クラスI PI3−キナーゼ(例えば、クラスIAアイソフォームPI3Kδ)が、二重特異性キナーゼ酵素(これは、その酵素が脂質キナーゼ活性(ホスホイノシチドのリン酸化)とタンパク質キナーゼ活性との両方を示すことを意味する)であり、基質として他のタンパク質をリン酸化すること(分子内の制御機構としての自己リン酸化を含む)ができることが明らかになった(Vanhaesebroeckら、EMBO J.18(5)p.1292−302(1999)(非特許文献8))。PI3Kが必須の役割を果たす細胞プロセスには、アポトーシスの抑制、アクチン骨格の再構築、心筋細胞の成長、インスリンによるグリコーゲンシンターゼ刺激、TNFαが媒介する好中球プライミングおよびスーパーオキシド生成、ならびに白血球の遊走および内皮細胞への接着が含まれる。
【0007】
PI3−キナーゼの活性化は、細胞の成長、分化およびアポトーシスを含む幅広い細胞応答に関わると考えられている(Parker,Current Biology,5(6)p.577−79(1995)(非特許文献9);およびYaoら、Science 267(5206)p.2003−06(1995)(非特許文献10))。PI3−キナーゼは、白血球活性化のいくつかの態様に関わるとみられる。p85が会合したPI3−キナーゼは、抗原に応答したT細胞活性化に対する重要な共刺激分子であるCD28の細胞質ドメインと物理的に会合すると示されている(Pagesら、Nature 369 p.327−29(1994)(非特許文献11);およびRudd,Immunity 4 p.527−34(1996)(非特許文献12))。CD28によるT細胞の活性化は、抗原による活性化に対する閾値を低下させ、増殖応答の規模および持続時間を増加させる。これらの作用は、重要なT細胞成長因子であるインターロイキン−2(IL2)を含むいくつかの遺伝子の転写の増加につながる(Fraserら、Science 251(4991)p.313−16(1991)(非特許文献13))。
【0008】
PI3Kγは、JNK活性のGベータ−ガンマ依存的制御のメディエーターと同定されており、Gベータ−ガンマは、ヘテロ三量体Gタンパク質のサブユニットである(Lopez−Ilasacaら、J.Biol.Chem.273(5)p.2505−8(1998)(非特許文献14))。最近(Laffargueら、Immunity 16(3)p.441−51(2002)(非特許文献15))、PI3Kγが、様々なG(i)共役受容体を介して炎症性シグナルを中継し、マスト細胞の機能、白血球における刺激、免疫学(例えば、サイトカイン、ケモカイン、アデノシン、抗体、インテグリン、凝集因子、成長因子、ウイルスまたはホルモンを含む)にとって中心的であることが報告された(Lawlorら、J.Cell Sci.114(Pt 16)p.2903−10(2001)(非特許文献16);Laffargueら、Immunity 16(3)p.441−51(2002)(非特許文献17);およびStephensら、Curr.Opinion Cell Biol.14(2)p.203−13(2002)(非特許文献18))。
【0009】
酵素ファミリーの個別のメンバーに対する特異的な阻害剤は、各酵素の機能を解明するための貴重なツールを提供する。2種の化合物、LY294002およびワートマニン(本明細書中以後)が、PI3−キナーゼ阻害剤として広く使用されている。これらの化合物は、クラスI PI3−キナーゼの4つのメンバーを区別しないので、非特異的なPI3K阻害剤である。例えば、様々なクラスI PI3−キナーゼの各々に対するワートマニンのIC50値は、1〜10nMの範囲である。同様に、これらのPI3−キナーゼの各々に対するLY294002のIC50値は、約15〜20μMであり(Frumanら、Ann.Rev.Biochem.67 p.481−507(1998)(非特許文献19))、また、CK2タンパク質キナーゼに対しては5〜10μMであり、ホスホリパーゼに対してはいくらかの阻害活性がある。ワートマニンは、PI3Kの触媒ドメインに共有結合することによって、この酵素の活性を不可逆的に阻害する真菌の代謝産物である。ワートマニンによるPI3K活性の阻害は、その後の細胞外因子への細胞応答を無くす。例えば、好中球は、PI3Kを刺激してPtdIns(3,4,5)P3を合成することによって、ケモカインfMet−Leu−Phe(fMLP)に応答する。この合成は、侵入微生物の好中球破壊に関わる呼吸バーストの活性化と相関する。好中球をワートマニンで処理することにより、fMLPによって誘導される呼吸バースト応答が妨げられる(Thelenら、Proc.Natl.Acad.Sci.USA 91 p.4960−64(1994)(非特許文献20))。実際に、ワートマニンを用いたこれらの実験ならびに他の実験的証拠は、造血系の細胞、特に、好中球、単球および他のタイプの白血球におけるPI3Kの活性が、急性および慢性炎症に関連する非記憶免疫応答の多くに関わることを示している。
【化2】

【0010】
ワートマニンを使用した研究に基づくと、PI3−キナーゼの機能が、Gタンパク質共役受容体を介した白血球シグナル伝達のいくつかの態様にとってもまた必要であるという証拠が存在する(Thelenら、(1994)上記)。さらに、ワートマニンおよびLY294002は、好中球遊走およびスーパーオキシド放出を阻止すると示されている。
【0011】
現在、癌遺伝子および癌抑制遺伝子の調節解除が、例えば、細胞の成長および増殖の増加または細胞生存の増加を介して、悪性腫瘍の形成に寄与すると十分理解されている。PI3Kファミリーによって媒介されるシグナル伝達経路が、増殖および生存を含むいくつかの細胞プロセスにおいて中心的役割を有すること、ならびにこれらの経路の調節解除が、広範囲のヒト癌および他の疾患を引き起こす因子であることも、現在知られている(Katsoら、Annual Rev.Cell Dev.Biol.(2001)17 p.615−675(非特許文献21)およびFosterら、J.Cell Science(2003)116(15)p.3037−3040(非特許文献22))。PI3Kエフェクタータンパク質は、PtdIns(3,4,5)P3と特異的に相互作用する保存されたプレクストリン相同(PH)ドメインを介して原形質膜に移行することによって、シグナル伝達経路およびシグナル伝達ネットワークを惹起する(Vanhaesebroeckら、Annu.Rev.Biochem.(2001)70 p.535−602(非特許文献23))。PtdIns(3,4,5)P3およびPHドメインを介してシグナル伝達するエフェクタータンパク質には、セリン/トレオニン(Ser/Thr)キナーゼ、チロシンキナーゼ、RacまたはArf GEF(グアニンヌクレオチド交換因子)およびArf GAP(GTPase活性化タンパク質)が含まれる。
【0012】
B細胞およびT細胞では、PI3Kは、B細胞におけるBrutonチロシンキナーゼ(BTK)およびT細胞におけるインターロイキン−2誘導性T細胞キナーゼ(ITK)を含む、タンパク質チロシンキナーゼのTecファミリーの活性化を介した重要な役割を有する。PI3Kが活性化されると、BTKまたはITKが、原形質膜に移行し、続いてそれらは、Srcキナーゼによってリン酸化される。活性化されたITKの主要な標的の1つは、ホスホリパーゼC−ガンマ(PLCγ1)であり、これは、PtdIns(4,5)P2をIns(3,4,5)P3に加水分解し、そして活性化されたT細胞においてタンパク質キナーゼCを活性化することができる、細胞内カルシウムレベルの上昇およびジアシルグリセロール(DAG)の細胞内の増加を惹起する。
【0013】
クラスIA p110αおよびp110βとは異なり、p110δは、組織限定的な様式で発現される。それらのリンパ球およびリンパ系組織での高発現レベルは、PI3Kによって媒介されるシグナル伝達の免疫系における役割を示唆する。p110δキナーゼデッド(kinase dead)ノックインマウスは、生存可能であり、それらの表現型は、免疫シグナル伝達の欠陥に限定される(Okkenhaugら、Science(2002)297 p.1031−4(非特許文献24))。これらのトランスジェニックマウスによって、B細胞およびT細胞のシグナル伝達におけるPI3Kδの機能が深く理解された。特に、p110δは、CD28および/またはT細胞受容体(TCR)のシグナル伝達の下流のPtdIns(3,4,5)P3形成にとって必要である。TCRの下流のPI3Kシグナル伝達の鍵となる作用は、抗アポトーシス因子ならびにサイトカイン産生のための様々な転写因子をリン酸化するAktの活性化である。結果として、不活性なp110δを有するT細胞は、増殖ならびにTh1およびTh2サイトカイン分泌に欠陥がある。CD28によるT細胞の活性化は、抗原によるTCR活性化に対する閾値を低下させ、増殖応答の規模および持続時間を増加させる。これらの作用は、重要なT細胞成長因子であるIL2を含むいくつかの遺伝子の転写のPI3Kδ依存的増加によって媒介される。
【0014】
ゆえに、PI3K阻害剤は、呼吸器疾患(例えば、喘息、COPDおよび嚢胞性線維症)に伴うT細胞媒介性炎症反応を調節する際のその役割による治療上の利点を提供すると予測される。さらに、T細胞を対象とした治療によって、コルチコステロイド節約特性がもたらされることがあるという指摘が存在する(Alexanderら、Lancet(1992)339 p.324−8(非特許文献25))ことから、それが呼吸器疾患において、独立して、または吸入もしくは経口副腎皮質ステロイドとの併用で、有用な治療を提供することがあると示唆される。PI3K阻害剤はまた、喘息における長時間作用性ベータ−作動薬(LABA)などの他の従来の治療と共に使用されるかもしれない。
【0015】
血管系において、PI3Kδは、内皮細胞によって発現されるものであり、TNFアルファに応答してこれらの細胞の接着促進性の(proadhesive)状態を調節することによって好中球の輸送に関与する(Puriら、Blood(2004)103(9)p.3448−56(非特許文献26))。内皮細胞のTNFアルファ誘導性のシグナル伝達におけるPI3Kδの役割は、Aktリン酸化およびPDK1活性の薬理学的阻害によって証明されている。さらに、PI3Kδは、VEGF経路を介した血管透過性および気道組織浮腫との関与が示唆されている(Leeら、J.Allergy Clin.Immunol.(2006)118(2)p.403−9(非特許文献27))。これらの所見から、白血球の血管外遊出の減少と喘息に関連する血管透過性の減少との組み合わせによる、喘息におけるPI3Kδ阻害の追加の利点が示唆される。さらに、PI3Kδ活性は、インビトロとインビボの両方においてマスト細胞の機能に必要である(Aliら、Nature(2004)431 p.1007−11(非特許文献28);およびAliら、J.Immunol.(2008)180(4)p.2538−44(非特許文献29))ことから、PI3Kの阻害が、アレルギー性の適応症(例えば、喘息、アレルギー性鼻炎およびアトピー性皮膚炎)にとって治療上有益であるはずとさらに示唆される。
【0016】
B細胞増殖、抗体分泌、B細胞抗原およびIL−4受容体シグナル伝達、B細胞の抗原提示機能におけるPI3Kδの役割も十分に確立されており(Okkenhaugら、(2002)上記;Al−Alwanら、J.Immunol.(2007)178(4)p.2328−35(非特許文献30);およびBilancioら、Blood(2006)107(2)p.642−50(非特許文献31))、関節リウマチまたは全身性エリテマトーデスなどの自己免疫疾患における役割が示唆される。ゆえに、PI3K阻害剤は、これらの適応症に対しても有益である可能性がある。
【0017】
PI3Kδの薬理学的阻害によって、ICAMがコーティングされたアガロースマトリックスインテグリン依存性のバイアス系(ICAM coated agarose matrix integrin−dependent biased system)におけるfMLP依存的な好中球の走化性が阻害される(Sadhuら、J.Immunol.(2003)170(5)p.2647−54(非特許文献32))。PI3Kδの阻害は、好中球媒介性のファゴサイトーシス、Staphylococcus aureusに対する殺菌活性に影響せずに、好中球の活性化、接着および遊走を制御する(Sadhuら、Biochem.Biophys.Res.Commun.(2003)308(4)p.764−9(非特許文献33))。全体として、データは、PI3Kδの阻害によって、自然免疫防御に必要とされる好中球の機能が一括で阻害されるはずがないことを示唆している。好中球におけるPI3Kδの役割は、COPDまたは関節リウマチなどの組織リモデリングに関わる炎症性疾患を治療するためのさらなる機会を与える。
【0018】
さらに、クラスIa PI3K酵素は、直接または間接的に、多種多様のヒトの癌における腫瘍形成の一因にもなるという妥当な証拠も存在する(Vivanco and Sawyers,Nature Reviews Cancer(2002)2(7)p.489−501(非特許文献34))。例えば、PI3Kδの阻害は、急性骨髄性白血病などの悪性の血液学的障害を治療するための治療上の役割を有する可能性がある(Billottetら、Oncogene(2006)25(50)p.6648−59(非特許文献35))。さらに、p110α(PIK3CA遺伝子)内の活性化変異は、他の様々な腫瘍(例えば、結腸ならびに乳房および肺の腫瘍)に関連している(Samuelsら、Science(2004)304(5670)p.554(非特許文献36))。
【0019】
PI3Kが、有痛性の炎症状態における中枢性感作の確立に関わることも示されている(Pezetら、The J.of Neuroscience(2008)28(16)p.4261−4270(非特許文献37))。
【先行技術文献】
【非特許文献】
【0020】
【非特許文献1】Vanhaesebroeckら、Trends Biochem.Sci.22(7)p.267−72(1997)
【非特許文献2】Leslieら、Chem.Rev.101(8)p.2365−80(2001)
【非特許文献3】Katsoら、Annu.Rev.Cell Dev.Biol.17 p.615−75(2001)
【非特許文献4】Toker,Cell.Mol.Life Sci.59(5)p.761−79(2002)
【非特許文献5】Vanhaesebroeckら、Exp.Cell Res.253(1)p.239−54(1999)
【非特許文献6】Steinら、Mol.Med.Today 6(9)p.347−57(2000)
【非特許文献7】Panayotouら、Trends Cell Biol.2 p.358−60(1992)
【非特許文献8】Vanhaesebroeckら、EMBO J.18(5)p.1292−302(1999)
【非特許文献9】Parker,Current Biology,5(6)p.577−79(1995)
【非特許文献10】Yaoら、Science 267(5206)p.2003−06(1995)
【非特許文献11】Pagesら、Nature 369 p.327−29(1994)
【非特許文献12】Rudd,Immunity 4 p.527−34(1996)
【非特許文献13】Fraserら、Science 251(4991)p.313−16(1991)
【非特許文献14】Lopez−Ilasacaら、J.Biol.Chem.273(5)p.2505−8(1998)
【非特許文献15】Laffargueら、Immunity 16(3)p.441−51(2002)
【非特許文献16】Lawlorら、J.Cell Sci.114(Pt 16)p.2903−10(2001)
【非特許文献17】Laffargueら、Immunity 16(3)p.441−51(2002)
【非特許文献18】Stephensら、Curr.Opinion Cell Biol.14(2)p.203−13(2002)(特許文献18)
【非特許文献19】Frumanら、Ann.Rev.Biochem.67 p.481−507(1998)
【非特許文献20】Thelenら、Proc.Natl.Acad.Sci.USA 91 p.4960−64(1994)
【非特許文献21】Katsoら、Annual Rev.Cell Dev.Biol.(2001)17 p.615−675
【非特許文献22】Fosterら、J.Cell Science(2003)116(15)p.3037−3040
【非特許文献23】Vanhaesebroeckら、Annu.Rev.Biochem.(2001)70 p.535−602
【非特許文献24】Okkenhaugら、Science(2002)297 p.1031−4
【非特許文献25】Alexanderら、Lancet(1992)339 p.324−8
【非特許文献26】Puriら、Blood(2004)103(9)p.3448−56
【非特許文献27】Leeら、J.Allergy Clin.Immunol.(2006)118(2)p.403−9
【非特許文献28】Aliら、Nature(2004)431 p.1007−11
【非特許文献29】Aliら、J.Immunol.(2008)180(4)p.2538−44
【非特許文献30】Okkenhaugら、(2002)上記;Al−Alwanら、J.Immunol.(2007)178(4)p.2328−35
【非特許文献31】Bilancioら、Blood(2006)107(2)p.642−50
【非特許文献32】Sadhuら、J.Immunol.(2003)170(5)p.2647−54
【非特許文献33】Sadhuら、Biochem.Biophys.Res.Commun.(2003)308(4)p.764−9
【非特許文献34】Vivanco and Sawyers,Nature Reviews Cancer(2002)2(7)p.489−501
【非特許文献35】Billottetら、Oncogene(2006)25(50)p.6648−59
【非特許文献36】Samuelsら、Science(2004)304(5670)p.554
【非特許文献37】Pezetら、The J.of Neuroscience(2008)28(16)p.4261−4270
【発明の概要】
【発明が解決しようとする課題】
【0021】
PI3−キナーゼ活性を阻害する化合物の調製が試みられており、いくつかのそのような化合物が当該分野において開示されている。しかしながら、PI3−キナーゼによって媒介される病的反応の数に鑑みて、種々の状態の治療に使用することができるPI3−キナーゼの阻害剤がなおも必要とされ続けている。
【課題を解決するための手段】
【0022】
本発明者らは、PI3−キナーゼ活性の阻害剤である新規化合物を発見した。PI3−キナーゼ阻害剤である化合物は、不適切なPI3−キナーゼ活性に関連する障害の治療、例えば、PI3−キナーゼ機構によって媒介される障害の治療および予防において有用である可能性がある。そのような障害としては、喘息および慢性閉塞性肺疾患(COPD)を含む呼吸器疾患、アレルギー性鼻炎およびアトピー性皮膚炎を含むアレルギー性疾患、関節リウマチおよび多発性硬化症を含む自己免疫疾患、炎症性腸疾患を含む炎症性障害、血栓症およびアテローム性動脈硬化症を含む循環器疾患、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、ならびに関節リウマチまたは変形性関節症に伴う疼痛、背痛、一般的な炎症性疼痛、肝後方神経痛、糖尿病性ニューロパシー、炎症性神経因性疼痛(トラマ)、三叉神経痛および中枢性疼痛を含む疼痛が挙げられる。
【0023】
1つの実施形態において、本発明の化合物は、他のキナーゼよりもPI3−キナーゼに対して選択性を示し得る。
【0024】
1つの実施形態において、本発明の化合物は、他のPI3−キナーゼよりもPI3Kδに対して選択性を示し得る。
【発明を実施するための形態】
【0025】
本発明は、特定の新規化合物に関する。詳細には、本発明は、式(I)の化合物
【化3】

【0026】
(式中、R1およびR2は、下記に定義されるとおりである)およびその塩に関する。
【0027】
その化合物は、PI3−キナーゼ活性の阻害剤である。PI3−キナーゼ阻害剤である化合物は、不適切なPI3−キナーゼ活性に関連する障害(例えば、喘息および慢性閉塞性肺疾患(COPD))の治療において有用であり得る。したがって、本発明はさらに、式(I)の化合物またはその薬学上許容可能な塩を含んでなる医薬組成物に関する。本発明は、なおもさらに、式(I)の化合物もしくはその薬学上許容可能な塩、または式(I)の化合物もしくはその薬学上許容可能な塩を含んでなる医薬組成物を用いた、PI3−キナーゼ活性の阻害方法およびそれに関連する障害の治療方法に関する。本発明は、さらにそのうえ、本発明の化合物についての調製プロセスに関する。
【0028】
1つの実施形態において、本発明は、式(I)の化合物
【化4】

【0029】
(式中、
R1は、−OR3、−CH2OR4もしくは−CH2CNによって置換されてもよいフェニル、5員ヘテロアリール(ここで、前記5員ヘテロアリールは、酸素、窒素および硫黄から独立して選択される1もしくは2個のヘテロ原子を含み、かつ−CH2フェニルによって置換されてもよい)、ピリジニル(ここで、前記ピリジニルは、−NH2、−CH2OR5、−CO2R6、−CONR7R8、−NHCO2R9、−XSO2R10、−SO2NR11R12および−NHSO2R13から選択される1つの置換基によって置換され、かつハロおよび−OR14から選択される第2の置換基によって置換されてもよい)、9員もしくは10員の二環式ヘテロアリール(ここで、前記9員もしくは10員の二環式ヘテロアリールは、酸素および窒素から独立して選択される1〜3個のヘテロ原子を含み、かつ−SO2R15によって置換される)、またはピロリジニルに縮合されたフェニル(ここで、前記ピロリジニルは、−COR16によって置換される)であり、
R2は、5員ヘテロアリール(ここで、前記5員ヘテロアリールは、酸素、窒素および硫黄から独立して選択される1または2個のヘテロ原子を含み、かつC1−6アルキルによって置換されてもよい)であり、
R3は、−CO2R17によって置換されるC1−6アルキルであり、
R4、R5、R6、R14およびR17は、各々独立して、水素またはC1−6アルキルであり、
R7およびR8は、各々水素であるか、またはR7およびR8は、それらが結合している窒素原子と一体となって連結されることにより、酸素原子を含んでもよい6員ヘテロシクリルを形成し、
R9は、フェニルによって置換されてもよいC1−6アルキルであり、
R10およびR15は、各々独立して、C1−6アルキルまたはフェニルであり、
R11およびR12は、それらが結合している窒素原子と一体となって連結されることにより、酸素原子を含んでもよい6員ヘテロシクリルを形成し、
R13は、−CF3およびハロによって置換されるフェニルであり、
R16は、C1−6アルキルであり、かつ
Xは、−CH2−、−CHF−または−N(CH3)−である)
およびその塩(本明細書中以後「本発明の化合物」)に関する。
【0030】
1つの実施形態において、R1は、−OR3または−CH2OR4によって置換されるフェニル、ピリジニル(ここで、そのピリジニルは、−NH2、−CH2OR5および−NHSO2R13から選択される1個の置換基によって置換され、かつハロおよび−OR14から選択される第2の置換基によって置換されてもよい)、または9員もしくは10員の二環式ヘテロアリール(ここで、その9員もしくは10員の二環式ヘテロアリールは、酸素および窒素から独立して選択される1〜3個のヘテロ原子を含み、かつ−SO2R15によって置換されている)である。さらなる実施形態において、R1は、ピリジニル(ここで、そのピリジニルは、−NH2および−NHSO2R13から選択される1個の置換基によって置換されており、かつ−OR14である第2の置換基によって置換されてもよい)、または9員の二環式ヘテロアリール(ここで、その9員の二環式ヘテロアリールは、3個の窒素原子を含み、かつ−SO2R15によって置換されている)である。
【0031】
1つの実施形態において、R2は、5員ヘテロアリールであり、ここで、その5員ヘテロアリールは、窒素および硫黄から独立して選択される1または2個のヘテロ原子を含み、かつC1−6アルキルによって置換されてもよい。さらなる実施形態において、R2は、C1−6アルキルによって置換されてもよいチアゾリルである。
【0032】
1つの実施形態において、R3は、−CO2R17によって置換されるメチルである;
1つの実施形態において、R4は、水素である。
【0033】
1つの実施形態において、R5は、水素である。
【0034】
1つの実施形態において、R6は、水素である。
【0035】
1つの実施形態において、R7およびR8は各々、水素である。さらなる実施形態において、R7およびR8は、それらが結合している窒素原子と一体となって連結されることにより、モルホリニルを形成する。
【0036】
1つの実施形態において、R9は、フェニルによって置換されるメチルである。
【0037】
1つの実施形態において、R10は、フェニルである。
【0038】
1つの実施形態において、R11およびR12は、それらが結合している窒素原子と一体となって連結されることにより、モルホリニルを形成する。
【0039】
1つの実施形態において、R13は、4−クロロ−3−(トリフルオロメチル)フェニルである。
【0040】
1つの実施形態において、R14は、メチルである。
【0041】
1つの実施形態において、R15は、メチルである。
【0042】
1つの実施形態において、R16は、メチルである。
【0043】
1つの実施形態において、R17は、水素である。
【0044】
1つの実施形態において、Xは、−N(CH3)−である。
【0045】
本発明は、本明細書の上記に記載された置換基のすべての組み合わせを包含すると理解されるべきである。
【0046】
本発明の化合物には、実施例1〜24の化合物およびそれらの塩が含まれる。
【0047】
1つの実施形態において、本発明の化合物は:
N−{6−[5−アミノ−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボン酸、
2−メチル−N−(6−フェニル−1H−インダゾール−4−イル)−1,3−チアゾール−4−カルボキサミド、
N−{6−[3−(シアノメチル)フェニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−[6−(5−アミノ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[3−(ヒドロキシメチル)フェニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−(ヒドロキシメチル)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
{[3−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)フェニル]オキシ}酢酸、
N−[6−(5−アミノ−6−クロロ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[6−クロロ−5−(ヒドロキシメチル)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−(6−{6−クロロ−5−[メチル(フェニルスルホニル)−アミノ]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−[6−(2−アミノ−4−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−(6−{6−クロロ−5−[(フェニルスルホニル)メチル]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
2−クロロ−5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボン酸、
5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボキサミド、
フェニルメチル[2−クロロ−5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジニル]カルバメート、
N−(6−{6−クロロ−5−[フルオロ(フェニルスルホニル)メチル]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[5−(4−モルホリニルスルホニル)−3−ピリジニル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−[6−(1H−ピラゾール−4−イル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[5−(4−モルホリニルカルボニル)−3−ピリジニル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[1−(フェニルメチル)−1H−ピラゾール−4−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
N−[6−(1−アセチル−2,3−ジヒドロ−1H−インドール−4−イル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−({[4−クロロ−3−(トリフルオロメチル)フェニル]スルホニル}アミノ)−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、または
それらの塩である。
【0048】
さらなる実施形態において、本発明の化合物は:
N−{6−[5−アミノ−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−[6−(5−アミノ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[3−(ヒドロキシメチル)フェニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−(ヒドロキシメチル)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
{[3−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)フェニル]オキシ}酢酸、
N−[6−(5−アミノ−6−クロロ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−({[4−クロロ−3−(トリフルオロメチル)フェニル]スルホニル}アミノ)−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、または
それらの塩である。
【0049】
用語および定義
「アルキル」とは、指定数のメンバー原子を有する飽和炭化水素鎖のことを指す。例えば、C1−6アルキルは、1〜6個のメンバー原子を有するアルキル基のことを指す。アルキル基は、本明細書中で1つ以上の置換基で置換されてもよいと定義される場合、そのように置換されてもよい。アルキル基は、直鎖状であってもよいし、分枝状であってもよい。代表的な分枝状のアルキル基は、1、2または3つの枝を有する。アルキルには、メチル、エチル、プロピル(n−プロピルおよびイソプロピル)、ブチル(n−ブチル、イソブチルおよびt−ブチル)、ペンチル(n−ペンチル、イソペンチルおよびネオペンチル)およびヘキシルが含まれる。
【0050】
「鏡像異性的に濃縮された」とは、その鏡像体過剰率が0より大きい生成物のことを指す。例えば、鏡像異性的に濃縮されたとは、その鏡像体過剰率が、50%eeより大きい、75%eeより大きい、および90%eeより大きい、生成物のことを指す。
【0051】
「鏡像体過剰率」または「ee」は、一方のエナンチオマーが他方に対して過剰であることをパーセンテージとして表したものである。結果として、ラセミ混合物中では、両方のエナンチオマーが等量で存在するので、鏡像体過剰率は、ゼロである(0%ee)。しかしながら、一方のエナンチオマーが、その生成物の95%を構成するように濃縮されている場合、鏡像体過剰率は、90%ee(濃縮されたエナンチオマーの量である95%−他方のエナンチオマーの量である5%)となるだろう。
【0052】
「鏡像異性的に純粋」とは、その鏡像体過剰率が99%eeまたはそれ以上である生成物のことを指す。
【0053】
「半減期(Half−life)」(または「半減期(half−lives)」)は、インビトロまたはインビボにおいて、ある物質の量の半分が別の化学的に異なる種に変換されるのに要する時間のことを指す。
【0054】
「ハロ」とは、ハロゲンラジカルであるフルオロ、クロロ、ブロモまたはヨードのことを指す。
【0055】
「ヘテロアリール」は、別段定義されない限り、その環のメンバー原子として1〜3個のヘテロ原子、例えば、1または2個のヘテロ原子を含む芳香族環のことを指す。2つ以上のヘテロ原子を含むヘテロアリール基は、異なるヘテロ原子を含んでもよい。ヘテロアリール基は、本明細書中で1つ以上の置換基で置換されてもよいと定義される場合、そのように置換されてもよい。本明細書中のヘテロアリール基は、単環式の環系であるか、または縮合された二環式の環系である。単環式ヘテロアリール環は、5個のメンバー原子を有する。二環式ヘテロアリール環は、9または10個のメンバー原子を有する。単環式ヘテロアリールには、ピロリル、フラニル、チエニル、ピラゾリル、イミダゾリル、オキサゾリル、イソオキサゾリル、チアゾリルおよびイソチアゾリルが含まれる。1つの実施形態において、単環式ヘテロアリールは、ピラゾリルである。二環式ヘテロアリールには、インドリル、イソインドリル、インドリジニル、ベンゾフラニル、イソベンゾフラニル、インダゾリル、プリニル、ベンズイミダゾリル、ピロロピリジニル、ピラゾロピリジニル、ピロロピリミジニル、キノリル、イソキノリニル、キノキサリニル、キナゾリニル、シンノリニル、ベンゾピラニル、ベンゾオキサゾリル、フロピリジニルおよびナフトリジニルが含まれる。1つの実施形態において、二環式ヘテロアリールは、ピラゾロピリジニルである。
【0056】
「ヘテロ原子」とは、窒素、硫黄または酸素原子のことを指す。
【0057】
「ヘテロシクリル」は、別段定義されない限り、その環のメンバー原子として1または2個のヘテロ原子を含む飽和または不飽和の環のことを指す。しかしながら、ヘテロシクリル環は、芳香族ではない。特定の実施形態において、ヘテロシクリルは、飽和である。他の実施形態において、ヘテロシクリルは、不飽和であるが、芳香族ではない。2つ以上のヘテロ原子を含むヘテロシクリル基は、異なるヘテロ原子を含んでもよい。本明細書中のヘテロシクリル基は、6個のメンバー原子を有する単環式の環系である。ヘテロシクリルには、ピペリジニルおよびモルホリニルが含まれる。
【0058】
「メンバー原子」は、鎖または環を形成する原子のことを指す。2つ以上のメンバー原子が、鎖および環内に存在する場合、各メンバー原子は、その鎖または環において隣接するメンバー原子に共有結合される。鎖または環上の置換基を構成する原子は、その鎖または環のメンバー原子ではない。
【0059】
「置換されてもよい」は、そのように本明細書中で定義される場合、ヘテロアリールなどの基が、置換されなくてもよいし、1つ以上の置換基で置換されてもよいことを示す。
【0060】
ある基に関する「置換される」は、ある基におけるメンバー原子に結合された水素原子が置換されていることを示す。用語「置換される」は、そのような置換が、置換される原子および置換基の許される原子価と一致し、かつ、その置換によって、安定な化合物(すなわち、転位、環化または脱離などによって自発的に転移を起こさない化合物)がもたらされるという暗黙の規定を含むことを理解するべきである。特定の実施形態において、その置換がその原子の許される原子価と一致する限り、1つの原子が2つ以上の置換基で置換されてもよい。適当な置換基は、置換される基または置換されてもよい基の各々に対して本明細書中で定義される。
【0061】
「薬学上許容可能」は、妥当な利益/リスク比に見合った、過剰の毒性、刺激作用または他の問題もしくは合併症なしに、まっとうな医学的判断の範囲内でヒトおよび動物の組織と接触して使用するために適している化合物、材料、組成物および剤形のことを指す。
【0062】
本明細書中で使用されるとき、これらのプロセス、スキームおよび実施例において使用されるシンボルおよび慣習は、現代の科学文献、例えば、Journal of the American Chemical SocietyまたはJournal of Biological Chemistryにおいて使用されているものと一致したものである。別段述べられない限り、一般に、L配置であるとみなされるアミノ酸残基を指し示すために、標準的な1文字または3文字の省略形が使用される。別段述べられない限り、すべての出発物質が、商業的供給業者から入手され、さらに精製することなく使用された。詳細には、実施例および明細書全体において、以下の省略形を使用することがある:
aq 水溶液
DCM ジクロロメタン
DIPEA ジイソプロピルエチルアミン
DMF N,N−ジメチルホルムアミド
DMSO ジメチルスルホキシド
Et3N トリエチルアミン
g グラム
h 時間
HATU O−(7−アザベンゾトリアゾール−1−イル)−N,N,N’,N’−テトラメチルウロニウムヘキサフルオロホスフェート
HCl 塩化水素
HPLC 高速液体クロマトグラフィー
IPA イソプロパノール
LCMS 液体クロマトグラフィー/質量分析
M モル濃度
MDAP 質量分析連結(Mass Directed)自動分取HPLC
MeOH メタノール
MeCN アセトニトリル
mg ミリグラム
min 分
ml ミリリットル
mmol ミリモル
mp 融点
Pd(dppf)Cl2 [1,1’−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(II)
Pd(dppf)Cl2−CH2Cl2 [1,1’−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(II)ジクロロメタン付加物
Pd(PPh3)4 テトラキス(トリフェニルホスフィン)パラジウム(0)
Rt 保持時間
RT 室温
s 秒
SCX 強陽イオン交換
Solvias触媒 クロロ[2’−(ジメチルアミノ)−2−ビフェニリル]パラジウム−(1R,4S)−ビシクロ[2.2.1]ヘプト−2−イル[(1S,4R)−ビシクロ[2.2.1]ヘプト−2−イル]ホスファン(1:1)
SPE 固相抽出
THF テトラヒドロフラン
TFA トリフルオロ酢酸
ブラインに対するすべての言及は、NaClの飽和水溶液に対する言及である。
【0063】
式(I)の化合物およびその塩の溶媒和化合物(水和物を含む)、錯体、多形、プロドラッグ、放射標識された誘導体、立体異性体および光学異性体のすべてが、「本発明の化合物」の範囲内に含まれる。
【0064】
本発明の化合物は、固体または液体の形態で存在し得る。本発明の化合物は、固体の状態では、結晶性の形態もしくは非晶質の形態で、またはそれらの混合物として、存在し得る。結晶性の形態である本発明の化合物の場合、当業者は、結晶化中に溶媒分子が結晶格子内に組み込まれた薬学上許容可能な溶媒和化合物が形成されることがあることを認識するだろう。溶媒和化合物は、非水溶媒(例えば、エタノール、イソプロパノール、DMSO、酢酸、エタノールアミンおよびEtOAc)を含み得るか、または結晶格子内に組み込まれた溶媒として水を含み得る。結晶格子内に組み込まれた溶媒が水である溶媒和化合物は、典型的には、「水和物」と呼ばれる。水和物には、化学量論的水和物、ならびに不定量の水を含む組成物が含まれる。本発明は、そのような溶媒和化合物のすべてを包含する。
【0065】
当業者は、その様々な溶媒和化合物をはじめとした、結晶性の形態で存在する本発明の特定の化合物が、多形性(すなわち、種々の結晶構造として存在する能力)を示し得ることをさらに認識するだろう。これらの種々の結晶性の形態は、典型的には「多形」として知られている。本発明は、そのような多形のすべてを包含する。多形は、同じ化学組成を有するが、結晶性の固体の状態の充填、幾何学的配置および他の記述的な特性が異なる。それゆえ、多形は、異なる物理的特性(例えば、形状、密度、硬度、変形能、安定性および溶解特性)を有し得る。多形は、典型的には、異なる融点、IRスペクトルおよび粉末X線回折パターンを示し、これらは、同定に用いられることがある。当業者は、例えば、化合物を生成する際または再結晶する際に使用される反応条件または試薬を変更することまたは調整することによって、種々の多形が生成され得ることを認識するだろう。例えば、温度、圧力または溶媒を変更することにより、多形がもたらされ得る。さらに、特定の条件下において、1つの多形が、自発的に別の多形に変換することがある。
【0066】
本発明は、1つ以上の原子が自然界で最も一般的に見られる原子質量または質量数と異なる原子質量または質量数を有する原子によって置換されているという事実を別にすれば式(I)の化合物およびその塩と同一である同位体的に標識された化合物も含む。本発明の化合物に組み込まれ得る同位体の例としては、水素、炭素、窒素、酸素およびフッ素の同位体(例えば、3H、11C、14Cおよび18F)が挙げられる。
【0067】
式(I)に係る化合物は、1つ以上の不斉中心(キラル中心とも呼ばれる)を含むことがあり、ゆえに、個別のエナンチオマー、ジアステレオマーもしくは他の立体異性体、またはそれらの混合物として存在することがある。キラル炭素原子などのキラル中心は、アルキル基などの置換基に存在することもある。式(I)または本明細書中に図示される任意の化学構造に存在するキラル中心の立体化学が、明記されない場合、その構造は、任意の立体異性体およびそれらの混合物のすべてを包含すると意図される。したがって、1つ以上のキラル中心を含む式(I)に係る化合物は、ラセミ混合物、鏡像異性的に濃縮された混合物として、または鏡像異性的に純粋な個別の立体異性体として使用され得る。
【0068】
1つ以上の不斉中心を含む式(I)に係る化合物の個別の立体異性体は、当業者に公知の方法によって分割され得る。例えば、そのような分割は、(1)ジアステレオ異性の塩、錯体または他の誘導体の形成、(2)例えば、酵素的酸化もしくは酵素的還元による、立体異性体特異的試薬との選択的な反応、または(3)キラル環境(chiral enviornment)における(例えば、キラルリガンドが結合したシリカなどのキラル支持体上またはキラル溶媒の存在下における)ガス−液体クロマトグラフィーもしくは液体クロマトグラフィーによって行われ得る。当業者は、所望の立体異性体が、上に記載された分離手順のうちの1つによって別の化学物質に変換される場合、所望の形態を遊離させるためにさらなる工程が必要であることを認識するだろう。あるいは、特定の立体異性体が、光学活性な試薬、基質、触媒もしくは溶媒を用いる不斉合成によって、または不斉転換によって一方のエナンチオマーを他方に変換することによって、合成されてもよい。
【0069】
式(I)に係る化合物は、幾何学的不斉中心を含むこともある。式(I)または本明細書中に例示される任意の化学構造に存在する幾何学的不斉中心の立体化学が明記されていない場合、その構造は、trans幾何異性体、cis幾何異性体およびそれらの混合物のすべてを包含すると意図されている。同様に、そのような互変異性体が、平衡して存在するのか、または主に1つの形態で存在するのかに関係なく、すべての互変異性体が、式(I)に含められる。
【0070】
本明細書中での式(I)の化合物およびその塩に対する言及は、遊離酸もしくは遊離塩基として、またはそれらの塩として、例えば、それらの薬学上許容可能な塩として、式(I)の化合物を網羅することが理解されるべきである。したがって、1つの実施形態において、本発明は、遊離酸または遊離塩基としての式(I)の化合物に関する。別の実施形態において、本発明は、式(I)の化合物およびその塩に関する。さらなる実施形態において、本発明は、式(I)の化合物およびその薬学上許容可能な塩に関する。
【0071】
当業者は、式(I)に係る化合物の薬学上許容可能な塩が調製され得ることを認識するだろう。実際に、本発明の特定の実施形態において、式(I)に係る化合物の薬学上許容可能な塩は、その分子に対してより高い安定性または溶解性を付与することにより、剤形への製剤化を容易にするので、そのような塩が、それぞれの遊離塩基または遊離酸よりも好ましい場合がある。したがって、本発明はさらに、式(I)の化合物およびその薬学上許容可能な塩に関する。
【0072】
本明細書中で使用されるとき、用語「薬学上許容可能な塩」は、主題の化合物の所望の生物学的活性を保持し、かつ最小の望まれない毒物学的作用を示す、塩のことを指す。これらの薬学上許容可能な塩は、その化合物の最終的な単離および精製中にそのまま調製され得るか、またはその遊離酸もしくは遊離塩基の形態で精製された化合物を、それぞれ適当な塩基もしくは酸と別々に反応させることによって調製され得る。
【0073】
薬学上許容可能でない対イオンまたは関連する溶媒を有する塩および溶媒和化合物は、例えば、式(I)の他の化合物およびそれらの薬学上許容可能な塩の調製において中間体として使用するためには、本発明の範囲内である。したがって、本発明の1つの実施形態は、式(I)の化合物およびその塩を包含する。
【0074】
特定の実施形態において、式(I)に係る化合物は、酸性の官能基を含むことがある。適当な薬学上許容可能な塩には、そのような酸性の官能基の塩が含まれる。代表的な塩としては、薬学上許容可能な金属塩(例えば、ナトリウム塩、カリウム塩、リチウム塩、カルシウム塩、マグネシウム塩、アルミニウム塩および亜鉛塩)、薬学上許容可能な金属カチオン(例えば、ナトリウム、カリウム、リチウム、カルシウム、マグネシウム、アルミニウムおよび亜鉛)の炭酸塩および重炭酸塩、薬学上許容可能な有機第一級、第二級および第三級アミン(脂肪族アミン、芳香族アミン、脂肪族ジアミンおよびヒドロキシアルキルアミン(例えば、メチルアミン、エチルアミン、2−ヒドロキシエチルアミン、ジエチルアミン、TEA、エチレンジアミン、エタノールアミン、ジエタノールアミンおよびシクロヘキシルアミン)を含む)が挙げられる。
【0075】
特定の実施形態において、式(I)に係る化合物は、塩基性の官能基を含むことがあり、ゆえに、適当な酸で処理することによって薬学上許容可能な酸付加塩を形成することができる。適当な酸には、薬学上許容可能な無機酸および薬学上許容可能な有機酸が含まれる。代表的な薬学上許容可能な酸付加塩としては、塩酸塩、臭化水素酸塩、硝酸塩、メチル硝酸塩、硫酸塩、重硫酸塩、スルファミン酸塩、リン酸塩、酢酸塩、ヒドロキシ酢酸塩、フェニル酢酸塩、プロピオン酸塩、酪酸塩、イソ酪酸塩、吉草酸塩、マレイン酸塩、ヒドロキシマレイン酸塩、アクリル酸塩、フマル酸塩、リンゴ酸塩、酒石酸塩、クエン酸塩、サリチル酸塩、p−アミノサリチル酸塩(p−aminosalicyclate)、グリコール酸塩、乳酸塩、ヘプタン酸塩、フタル酸塩、シュウ酸塩、コハク酸塩、安息香酸塩、o−アセトキシ安息香酸塩、クロロ安息香酸塩、メチル安息香酸塩、ジニトロ安息香酸塩、ヒドロキシ安息香酸塩、メトキシ安息香酸塩、ナフトエ酸塩、ヒドロキシナフトエ酸塩、マンデル酸塩、タンニン酸塩、ギ酸塩、ステアリン酸塩、アスコルビン酸塩、パルミチン酸塩、オレイン酸塩、ピルビン酸塩、パモ酸塩、マロン酸塩、ラウリン酸塩、グルタル酸塩、グルタミン酸塩、エストレート(estolate)、メタンスルホン酸塩(メシル酸塩)、エタンスルホン酸塩(エシル酸塩)、2−ヒドロキシエタンスルホン酸塩、ベンゼンスルホン酸塩(ベシル酸塩)、p−アミノベンゼンスルホン酸塩、p−トルエンスルホン酸塩(トシル酸塩)およびナフタレン(napthalene)−2−スルホン酸塩が挙げられる。
【0076】
化合物の調製
本発明の化合物は、標準的な化学を含む種々の方法によって生成され得る。先に定義されたいずれの可変部分も、別段示されない限り、先に定義された意味を有し続ける。例示的な一般的合成方法が下記に示され、本発明の特定の化合物は、実施例の項において調製される。
【0077】
プロセスa
式(I)の化合物(ここで、R1およびR2は、上で定義されたとおりである)およびその塩は、式(II)の化合物
【化5】

【0078】
(式中、R2は、上で定義されたとおりである)から、適当な温度(例えば、60〜180℃、例えば、約110℃)における、適当な塩基(例えば、三リン酸カリウムまたは炭酸ナトリウムの水溶液)の存在下の適当な溶媒(例えば、1,4−ジオキサン)中の適当なパラジウム触媒(例えば、Solvias触媒またはPd(dppf)Cl2)の存在下におけるマイクロ波照射下での5−ブロモ−2−(メチルオキシ)−3−ピリジンアミンなどの適当なハロゲン化物による処理に続く脱保護を含むプロセスによって調製され得る。
【0079】
式(II)の化合物(ここで、R2は、上で定義されたとおりである)は、式(III)の化合物
【化6】

【0080】
(式中、R2は、上で定義されたとおりである)から、適当な温度(例えば、60〜150℃、例えば、約80℃)における、適当な塩基(例えば、酢酸カリウム)の存在下の適当な溶媒(例えば、1,4−ジオキサン)中の適当なパラジウム触媒(例えば、Pd(dppf)Cl2)の存在下におけるマイクロ波照射下での適当なボロネート(例えば、4,4,4’,4’,6,6,6’,6’−オクタメチル−2,2’−ビ−1,3,2−ジオキサボリナン)による処理によって調製され得る。
【0081】
式(III)の化合物(ここで、R2は、上で定義されたとおりである)は、式(IV)の化合物
【化7】

【0082】
から、(i)式R2COOH(ここで、R2は上で定義されたとおりである)の適当な酸による処理、または(ii)式R2COCl(ここで、R2は上で定義されたとおりである)の酸塩化物による処理のいずれかによって調製され得る。(i)に適した条件には、適当な温度(例えば、室温、例えば、約20℃)において、カップリング試薬(例えば、O−(7−アザベンゾトリアゾール−1−イル)−N,N,N’N’− テトラメチルウロニウムヘキサフルオロホスフェート)の存在下、かつ適当な塩基(例えば、N,N−ジイソプロピルエチルアミン)の存在下の適当な溶媒(例えば、N,N−ジメチルホルムアミド)中で酸(例えば、2−メチル−1,3−チアゾール−4−カルボン酸(商業的に入手可能))を撹拌することが含まれる。あるいは、(ii)は、適当な温度(例えば、室温、例えば、約20℃)における、適当な塩基(例えば、N,N−ジイソプロピルアミン)の存在下の適当な溶媒(例えば、ジクロロメタン)中での適当なアシル化剤(例えば、酸塩化物)を用いたアシル化によって行われることがある。
【0083】
式(IV)の化合物は、式(V)の化合物
【化8】

【0084】
から、適当な温度(例えば、60〜100℃、例えば、約80℃)における、適当な溶媒(例えば、エタノールおよび水)中での還元剤(例えば、鉄のやすりくずおよび塩化アンモニウム)による処理によって調製され得る。
【0085】
式(V)の化合物は、式(VI)の化合物(これは商業的に入手可能である)
【化9】

【0086】
から、適当な温度(例えば、還流温度)における、適当な溶媒(例えば、ジクロロメタン)中の適当な酸触媒(例えば、p−トルエンスルホン酸ピリジニウム)の存在下における3,4−ジヒドロ−2H−ピランによる処理によって調製され得る。
【0087】
プロセスb
式(I)の化合物(ここで、R1およびR2は、上で定義されたとおりである)およびその塩はまた、式(IA)の化合物(ここで、R1およびR2は上で定義されたとおりであり、Pは保護基である)の適切に保護された誘導体の脱保護を含むプロセスによっても調製され得る。適当な保護基およびそれらを除去する手段の例は、T.W.Greene and P.G.M.Wuts ‘Protective Groups in Organic Synthesis’(3rd Ed.,J.Wiley and Sons,1999)に見出すことができる。
【化10】

【0088】
この例として、式(I)の化合物は、適切な条件下における脱保護(例えば、塩基、例えば、水酸化ナトリウム水溶液による処理)によって、式(IA)の化合物(インダゾール環窒素が、例えば、1−フェニルスルホニルで保護されている(P))から調製され得る。
【0089】
式(IA)の化合物(ここで、R1およびR2は、上で定義されたとおりである)は、式(VII)の化合物
【化11】

【0090】
(式中、R2は、上で定義されたとおりである)から、適当な温度(例えば、80〜150℃、例えば、約120℃)における、適当な溶媒(例えば、N,N−ジメチルホルムアミド)中での適当なパラジウム触媒(例えば、テトラキス(トリフェニルホスフィン)パラジウム(0))の存在下における適当なハロゲン化物(例えば、5−ブロモ−3−ピリジンアミン)による処理によって調製され得る。
【0091】
式(VII)の化合物(ここで、R2は、上で定義されたとおりである)は、式(VIII)の化合物
【化12】

【0092】
から、(i)式R2COOH(R2は上で定義されたとおりである)の酸による処理、または(ii)式R2COCl(R2は上で定義されたとおりである)の酸塩化物による処理によって調製され得る。(i)に適した条件には、適当な温度(例えば、室温、例えば、約20℃)において、カップリング試薬(例えば、O−(7−アザベンゾトリアゾール−1−イル)−N,N,N’N’−テトラメチルウロニウムヘキサフルオロホスフェート)の存在下、かつ適当な塩基(例えば、N,N−ジイソプロピルエチルアミン)の存在下で適当な溶媒(例えば、N,N−ジメチルホルムアミド)を撹拌することが含まれる。あるいは、(ii)は、適当な温度(例えば、室温、例えば、約20℃)における、適当な塩基(例えば、N,N−ジイソプロピルエチルアミン)の存在下の適当な溶媒(例えば、ジクロロメタン)中でのアシル化剤(例えば、酸塩化物)による処理によって行われることがある。
【0093】
式(VIII)の化合物は、式(IX)の化合物
【化13】

【0094】
から、適当な温度(例えば、80〜150℃、例えば、約120℃)における、適当な塩基(例えば、トリエチルアミン)の存在下の適当な溶媒(例えば、トルエン)中の適当なパラジウム触媒(例えば、テトラキス(トリフェニルホスフィン)パラジウム(0))の存在下におけるマイクロ波照射下での適当なスタンナン(例えば、ヘキサメチルジスタンナン)による処理によって調製され得る。
【0095】
プロセスc
式(I)の化合物(ここで、R2は、上で定義されたとおりであり、R1は、−NHCO2R9によって置換され、かつ第2の置換基R18(ハロまたは−OR4である)によって置換されてもよい、ピリジニルである)およびその塩は、式(X)の化合物
【化14】

【0096】
(式中、R2は、上で定義されたとおりであり、R1aは、−NH2によって置換され、かつ第2の置換基R18(ハロまたは−OR4である)によって置換されてもよい、ピリジニルであり、Pは、保護基、例えば、テトラヒドロピランである)から、適当な温度(例えば、室温、例えば、約20℃)における、適当な溶媒(例えば、DCM)中の適当な塩基(例えば、DIPEA)の存在下における式ClCO2R9のクロリドカーボネートによる処理を含むプロセスによって調製され得る。
【0097】
当業者が認識するように、式(X)の化合物において、保護基Pは、インダゾールの1位または2位に存在し得る。クロリドカーボネートとの反応の後、保護基Pは、適切な条件下の脱保護によって除去され得る。
【0098】
式(X)の化合物(ここで、R1a、R2およびPは、上で定義されたとおりである)は、式(XI)の化合物
【化15】

【0099】
(式中、R2およびPは、上で定義されたとおりである)から、適当な温度(例えば、60〜150℃、例えば、約140℃)における、適当な塩基(例えば、炭酸ナトリウム)の存在下の適当な溶媒(例えば、1,4−ジオキサン水溶液)中の適当な触媒(例えば、Pd(dppf)Cl2)の存在下におけるマイクロ波照射下での適当なハロゲン化物による処理を含むプロセスによって調製され得る。
【0100】
式(XI)の化合物(ここで、R2およびPは、上で定義されたとおりである)は、式(XII)の化合物
【化16】

【0101】
(式中、R2およびPは、上で定義されたとおりである)から、適当な温度(例えば、60〜150℃、例えば、約80℃)における、適当な塩基(例えば、酢酸カリウム)の存在下の適当な溶媒(例えば、1,4−ジオキサン)中の適当な触媒(例えば、Pd(dppf)Cl2)の存在下におけるマイクロ波照射下での適当なボロネート(例えば、4,4,4’,4’,6,6,6’,6’−オクタメチル−2,2’−ビ−1,3,2−ジオキサボリナン)による処理によって調製され得る。
【0102】
したがって、1つの実施形態において、本発明は:
a)式(II)の化合物
【化17】

【0103】
(式中、R2は、上で定義されたとおりである)を適当なハロゲン化物と反応させた後の脱保護、
b)式(IA)の化合物
【化18】

【0104】
(式中、R1およびR2は、上で定義されたとおりであり、Pは、保護基である)の適切に保護された誘導体の脱保護、または
c)式(I)の化合物(ここで、R2は、上で定義されたとおりであり、R1は、−NHCO2R9および第2の置換基R18(ハロまたは−OR4である)によって置換されてもよいピリジニルである)およびその塩のために、式(X)の化合物
【化19】

【0105】
(式中、R2は、上で定義されたとおりであり、R1aは、−NH2によって置換され、かつ第2の置換基R18(ハロまたは−OR4である)によって置換されてもよい、ピリジニルであり、Pは、保護基、例えば、テトラヒドロピランである)を、式ClCO2R9のクロリドカーボネートと反応させた後の脱保護
を含む、本発明の化合物を調製するためのプロセスを提供する。
【0106】
使用方法
本発明の化合物は、PI3−キナーゼ活性の阻害剤である。PI3−キナーゼ阻害剤である化合物は、基礎病理が不適切なPI3−キナーゼ活性に(少なくとも部分的に)帰する障害(例えば、喘息および慢性閉塞性肺疾患(COPD))の治療において有用であり得る。「不適切なPI3−キナーゼ活性」は、特定の患者において予想される、正常なPI3−キナーゼ活性から逸脱した任意のPI3−キナーゼ活性のことを指す。不適切なPI3−キナーゼは、例えば、活性の異常な増加、またはPI3−キナーゼ活性のタイミングおよび/もしくは調節の異常の形態をとることがある。そのような不適切な活性は、例えば、不適切な活性化または調節されていない活性化に至る、タンパク質キナーゼの過剰発現または変異に起因することがある。したがって、別の態様において、本発明は、そのような障害を治療する方法に関する。
【0107】
そのような障害としては、喘息および慢性閉塞性肺疾患(COPD)を含む呼吸器疾患、アレルギー性鼻炎およびアトピー性皮膚炎を含むアレルギー性疾患、関節リウマチおよび多発性硬化症を含む自己免疫疾患、炎症性腸疾患を含む炎症性障害、血栓症およびアテローム性動脈硬化症を含む循環器疾患、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、ならびに関節リウマチまたは変形性関節症に伴う疼痛、背痛、一般的な炎症性疼痛、肝後方神経痛、糖尿病性ニューロパシー、炎症性神経因性疼痛(トラマ)、三叉神経痛および中枢性疼痛を含む疼痛が挙げられる。
【0108】
本発明の治療方法は、それを必要とする患者に、安全かつ有効量の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む。本発明の個別の実施形態は、安全かつ有効量の式(I)の化合物またはその薬学上許容可能な塩を、それを必要とする患者に投与することによって、上で述べられた障害のうちのいずれか1つを治療する方法を含む。
【0109】
本明細書中で使用されるとき、障害に関する「治療する」は:(1)障害、または障害の生物学的徴候の1つ以上を寛解させるかまたは予防すること、(2)(a)その障害に至るかもしくはその障害に関与する生物学的カスケードにおける1つ以上の点、または(b)その障害の生物学的徴候の1つ以上を干渉すること、(3)その障害に関連する症状または作用の1つ以上を緩和すること、あるいは(4)その障害の進行、またはその障害の生物学的徴候の1つ以上の進行を遅延させることを意味する。
【0110】
上で指摘されたように、障害の「治療」には、障害の予防が含まれる。当業者は、「予防」が絶対的な用語でないことを認識するだろう。医学において、「予防」は、障害もしくはその生物学的徴候の見込みもしくは重症度を実質的に減少させるかまたはそのような障害もしくはその生物学的徴候の発生を遅らせるための、薬物の予防的な投与のことを指すと理解される。
【0111】
本明細書中で使用されるとき、式(I)の化合物もしくはその薬学上許容可能な塩または他の薬学上活性な薬剤に関する「安全かつ有効量」は、患者の状態を治療するのに十分であるが、まっとうな医学的判断の範囲内で重篤な副作用を回避するのに(妥当な利益/リスク比で)十分少ない、化合物の量のことを意味する。化合物の安全かつ有効量は、選択される特定の化合物(例えば、化合物の効力、有効性および半減期を考慮する)、選択される投与経路、治療される障害、治療される障害の重症度、治療される患者の年齢、サイズ、体重および身体的状態、治療される患者の病歴、治療の持続時間、併用療法の性質、所望の治療効果、ならびに類似の因子によって変動し得るが、それにもかかわらず、その量は、当業者が日常的に決定することができる。
【0112】
本明細書中で使用されるとき、「患者」は、ヒト(成人および小児を含む)または他の動物のことを指す。1つの実施形態において、「患者」は、ヒトのことを指す。
【0113】
式(I)の化合物またはその薬学上許容可能な塩は、全身投与と局所的投与の両方を含む任意の適当な投与経路によって投与されてよい。全身投与には、経口投与、非経口投与、経皮的投与および直腸投与が含まれる。非経口投与は、経腸または経皮以外の投与経路のことを指し、典型的には、注射または注入による。非経口投与には、静脈内、筋肉内および皮下への注射または注入が含まれる。局所的投与には、皮膚への適用、ならびに眼内、耳、膣内、吸入および鼻腔内投与が含まれる。吸入は、口腔からの吸入か鼻腔からの吸入かを問わず、患者の肺への投与のことを指す。1つの実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、経口投与され得る。別の実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、吸入によって投与され得る。さらなる実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、鼻腔内に投与され得る。
【0114】
式(I)の化合物またはその薬学上許容可能な塩は、1回だけ投与されてもよいし、何回かの投与が所与の時間にわたって様々な時間間隔で投与される投与レジメンに従って投与されてもよい。例えば、投与は、1日あたり1、2、3または4回行われ得る。1つの実施形態において、投与は、1日あたり1回行われる。さらなる実施形態において、投与は、1日あたり2回行われる。投与は、所望の治療効果が達成されるまで、または所望の治療効果を維持するために無期限に、行われ得る。式(I)の化合物またはその薬学上許容可能な塩に適した投与レジメンは、その化合物の薬物動態学的特性(例えば、吸収、分布および半減期)に依存し、その薬物動態学的特性は、当業者が測定することができる。さらに、式(I)の化合物またはその薬学上許容可能な塩に適した投与レジメン(そのようなレジメンが投与される持続時間を含む)は、治療される障害、治療される障害の重症度、治療される患者の年齢および身体的状態、治療される患者の病歴、併用療法の性質、所望の治療効果、ならびに当業者の知識および専門技術の範囲内の類似の因子に依存する。適当な投与レジメンが、その投与レジメンに対する個別の患者の反応を考慮して、または個別の患者が変更を必要とするにつれて、調整を要する場合があることが、係る当業者によってさらに理解されるだろう。
【0115】
典型的な1日の投薬量は、選択される特定の投与経路に応じて変動し得る。経口投与に対する典型的な1日の投薬量は、総体重1kgあたり0.001mg〜50mg、例えば、総体重1kgあたり1mg〜10mgの範囲である。例えば、経口投与に対する1日の投薬量は、患者1人あたり0.5mg〜2g(例えば、患者1人あたり10mg〜1g)であり得る。
【0116】
さらに、式(I)の化合物は、プロドラッグとして投与されてもよい。本明細書中で使用されるとき、式(I)の化合物の「プロドラッグ」は、患者に投与されるとインビボで最終的に式(I)の化合物を遊離する、その化合物の機能的誘導体である。プロドラッグとしての式(I)の化合物の投与によって、当業者は以下のうちの1つ以上を行うことができる可能性がある:(a)インビボにおけるその化合物の活性の開始を改変すること、(b)インビボにおけるその化合物の作用の持続時間を改変すること、(c)インビボにおけるその化合物の運搬または分布を改変すること、(d)インビボにおいて化合物の溶解性を改変すること、および(e)副作用、またはその化合物が遭遇する他の困難を克服すること。プロドラッグを調製するために使用される典型的な機能的誘導体は、インビボにおいて化学的または酵素的に切断可能な化合物の修飾を含む。そのような修飾(ホスフェート、アミド、エステル、チオエステル、カーボネートおよびカルバメートの調製を含む)は、当業者に周知である。
【0117】
したがって、本発明は、不適切なPI3−キナーゼ活性によって媒介される障害を治療する方法を提供し、その方法は、それを必要とする患者に、安全かつ有効量の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む。
【0118】
1つの実施形態において、不適切なPI3−キナーゼ活性によって媒介される障害は、呼吸器疾患(喘息および慢性閉塞性肺疾患(COPD)を含む)、アレルギー性疾患(アレルギー性鼻炎およびアトピー性皮膚炎を含む)、自己免疫疾患(関節リウマチおよび多発性硬化症を含む)、炎症性障害(炎症性腸疾患を含む)、循環器疾患(血栓症およびアテローム性動脈硬化症を含む)、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、および疼痛(関節リウマチまたは変形性関節症に伴う疼痛、背痛、一般的な炎症性疼痛、肝後方神経痛、糖尿病性ニューロパシー、炎症性神経因性疼痛(トラマ)、三叉神経痛および中枢性疼痛を含む)からなる群から選択される。
【0119】
1つの実施形態において、不適切なPI3−キナーゼ活性によって媒介される障害は、呼吸器疾患である。さらなる実施形態において、不適切なPI3−キナーゼ活性によって媒介される障害は、喘息である。さらなる実施形態において、不適切なPI3−キナーゼ活性によって媒介される障害は、慢性閉塞性肺疾患(COPD)である。
【0120】
1つの実施形態において、不適切なPI3−キナーゼ活性によって媒介される障害は、疼痛である。
【0121】
1つの実施形態において、本発明は、医学的療法において使用するための式(I)の化合物またはその薬学上許容可能な塩を提供する。別の実施形態において、本発明は、不適切なPI3−キナーゼ活性によって媒介される障害の治療において使用するための式(I)の化合物またはその薬学上許容可能な塩を提供する。さらなる実施形態において、本発明は、不適切なPI3−キナーゼ活性によって媒介される障害の治療において使用するための薬剤の製造における式(I)の化合物またはその薬学上許容可能な塩の使用を提供する。
【0122】
組成物
式(I)の化合物およびその薬学上許容可能な塩は、必ずしもそうとは限らないが、通常、患者に投与する前に医薬組成物に製剤化され得る。したがって、別の態様において、本発明は、式(I)の化合物またはその薬学上許容可能な塩および1つ以上の薬学上許容可能な賦形剤を含む医薬組成物に関する。
【0123】
本発明の医薬組成物は、バルクの形態で調製され、包装されることがあり、ここで、安全かつ有効量の式(I)の化合物またはその薬学上許容可能な塩が、抽出され、次いで、散剤またはシロップ剤などとして患者に投与され得る。あるいは、本発明の医薬組成物は、単位剤形で調製され、包装されることがあり、ここで、物理的に別個の各単位が、式(I)の化合物またはその薬学上許容可能な塩を含む。本発明の医薬組成物は、単位剤形で調製されるとき、典型的には、例えば、0.5mg〜1gまたは1mg〜700mgまたは5mg〜100mgの式(I)の化合物またはその薬学上許容可能な塩を含み得る。
【0124】
本発明の医薬組成物は、典型的には、1種類の式(I)の化合物またはその薬学上許容可能な塩を含む。
【0125】
本明細書中で使用されるとき、「薬学上許容可能な賦形剤」は、医薬組成物に対して形態または濃度(consistency)を与えるのに関わる薬学上許容可能な材料、組成物またはビヒクルのことを意味する。患者に投与されたときに式(I)の化合物またはその薬学上許容可能な塩の有効性を実質的に減少させ得る相互作用、および薬学上許容可能でない医薬組成物をもたらし得る相互作用が回避されるように、各賦形剤は、混ぜ合わされたときにその医薬組成物の他の成分と適合性でなければならない。さらに、当然のことながら、各賦形剤は、薬学上許容可能、例えば、十分に高い純度でなければならない。
【0126】
式(I)の化合物またはその薬学上許容可能な塩および薬学上許容可能な賦形剤は、典型的には、所望の投与経路による患者への投与に適合した剤形に製剤化される。例えば、剤形には、(1)経口投与に適合した剤形(例えば、錠剤、カプセル、カプレット、丸剤、トローチ剤、散剤、シロップ剤、エリキシル剤(elixers)、懸濁液、溶液、エマルジョン、サシェ剤およびカシェ剤)、(2)非経口投与に適合した剤形(例えば、無菌の溶液、懸濁液および再構成用の散剤)、(3)経皮的投与に適合した剤形(例えば、経皮パッチ)、(4)直腸投与に適合した剤形(例えば、坐剤)、(5)吸入に適合した剤形(例えば、エアロゾル、溶液および乾燥粉末)、ならびに(6)局所的投与に適合した剤形(例えば、クリーム、軟膏、ローション、溶液、ペースト、スプレー、泡沫およびゲル)が含まれる。
【0127】
適当な薬学上許容可能な賦形剤は、選択される特定の剤形に応じて変化し得る。さらに、適当な薬学上許容可能な賦形剤は、それらがその組成物において果たし得る特定の機能について選択されてもよい。例えば、特定の薬学上許容可能な賦形剤は、均一な剤形の生成を容易にする能力について選択されてもよい。特定の薬学上許容可能な賦形剤は、安定な剤形の生成を容易にする能力について選択されてもよい。特定の薬学上許容可能な賦形剤は、患者に投与された際の、1つの器官または身体の一部から別の器官または身体の別の一部への式(I)の化合物またはその薬学上許容可能な塩の運搬または輸送を容易にする能力について選択されてもよい。特定の薬学上許容可能な賦形剤は、患者の服薬率を高める能力について選択されてもよい。
【0128】
適当な薬学上許容可能な賦形剤には、以下のタイプの賦形剤が含まれる:希釈剤、充填剤、結合剤、崩壊剤、潤滑剤、滑剤、造粒剤、コーティング剤、湿潤剤、溶媒、共溶媒、懸濁剤、乳化剤、甘味料(sweetners)、着香剤、風味マスキング剤(flavor masking agents)、着色剤、アンチケーキング剤、吸湿剤(hemectants)、キレート剤、可塑剤、粘度増加剤、酸化防止剤、保存剤、安定剤、界面活性物質および緩衝剤。当業者は、特定の薬学上許容可能な賦形剤が、2つ以上の機能を果たすことがあること、ならびに製剤中にどれだけの量の賦形剤が存在するかおよび製剤中にどのような他の賦形剤が存在するかに応じて、代替機能を果たすことがあることを認識するだろう。
【0129】
当業者は、本発明において使用するための適切な量の適当な薬学上許容可能な賦形剤の選択を可能にする当該分野の知識および技能を有する。さらに、薬学上許容可能な賦形剤を説明しており、かつ適当な薬学上許容可能な賦形剤の選択に有用であり得る、当業者に利用可能ないくつかのリソースが存在する。例としては、Remington’s Pharmaceutical Sciences(Mack Publishing Company)、The Handbook of Pharmaceutical Additives(Gower Publishing Limited)およびThe Handbook of Pharmaceutical Excipients(the American Pharmaceutical Association and the Pharmaceutical Press)が挙げられる。
【0130】
本発明の医薬組成物は、当業者に公知の手法および方法を用いて調製される。当該分野において通常使用される方法のいくつかは、Remington’s Pharmaceutical Sciences(Mack Publishing Company)に記載されている。
【0131】
したがって、別の態様において、本発明は、式(I)の化合物またはその薬学上許容可能な塩および1つ以上の薬学上許容可能な賦形剤を含む医薬組成物を調製するためのプロセスに関し、そのプロセスは、それらの成分を混合することを含む。式(I)の化合物またはその薬学上許容可能な塩を含む医薬組成物は、例えば、外界温度および大気圧での混合によって調製され得る。
【0132】
1つの実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、経口投与用に製剤化され得る。別の実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、吸入投与用に製剤化され得る。さらなる実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、鼻腔内投与用に製剤化され得る。
【0133】
1つの態様において、本発明は、安全かつ有効量の式(I)の化合物またはその薬学上許容可能な塩および希釈剤または充填剤を含む経口用の固体剤形(例えば、錠剤またはカプセル)に関する。適当な希釈剤および充填剤としては、ラクトース、スクロース、デキストロース、マンニトール、ソルビトール、デンプン(例えば、トウモロコシデンプン、ジャガイモデンプンおよびアルファ化デンプン)、セルロースおよびその誘導体(例えば、微結晶性セルロース)、硫酸カルシウムならびにリン酸水素カルシウムが挙げられる。その経口用の固体剤形は、さらに結合剤を含むことがある。適当な結合剤としては、デンプン(例えば、トウモロコシデンプン、ジャガイモデンプンおよびアルファ化デンプン)、ゼラチン、アカシア、アルギン酸ナトリウム、アルギン酸、トラガント、グアーゴム、ポビドン、ならびにセルロースおよびその誘導体(例えば、微結晶性セルロース)が挙げられる。その経口用の固体剤形は、さらに崩壊剤を含むことがある。適当な崩壊剤としては、クロスポビドン、デンプングリコール酸ナトリウム、クロスカルメロース(croscarmelose)、アルギン酸およびカルボキシルメチルセルロースナトリウムが挙げられる。その経口用の固体剤形は、さらに潤滑剤を含むことがある。適当な潤滑剤としては、ステアリン酸、ステアリン酸マグネシウム(magnesuim stearate)、ステアリン酸カルシウムおよびタルクが挙げられる。
【0134】
必要に応じて、経口投与用の投薬単位製剤(dosage unit formulations)は、マイクロカプセル化され得る。その組成物は、例えば、粒状の材料をポリマー、ろうなどでコーティングするかまたはそれらに包埋することによって、放出を延長するかまたは持続させるように調製することもできる。
【0135】
式(I)の化合物またはその薬学上許容可能な塩は、標的化可能な薬物担体として溶解性ポリマーと結合されてもよい。それらのポリマーには、ポリビニルピロリドン、ピラン共重合体、ポリヒドロキシプロピルメタクリルアミド−フェノール、ポリヒドロキシエチルアスパルトアミドフェノール、またはパルミトイル残基で置換されるポリエチレンオキシドポリリジンが含まれ得る。さらに、式(I)の化合物またはその薬学上許容可能な塩は、薬物の制御放出を達成する際に有用なあるクラスの生分解性ポリマー、例えば、ポリ乳酸、ポリイプシロン(polepsilon)カプロラクトン、ポリヒドロキシ酪酸、ポリオルトエステル、ポリアセタール、ポリジヒドロピラン、ポリシアノアクリレート、および架橋されたまたは両親媒性の、ヒドロゲルのブロック共重合体に結合されてもよい。
【0136】
別の態様において、本発明は、経口用の液体剤形に関する。経口用の液体(例えば、溶液、シロップ剤およびエリキシル剤)は、所与の分量が所定量の式(I)の化合物またはその薬学上許容可能な塩を含むように投薬単位形態で調製され得る。シロップ剤は、式(I)の化合物またはその薬学上許容可能な塩を適切に風味がつけられた水溶液に溶解することによって調製され得、エリキシル剤は、無毒性のアルコール性ビヒクルを使用することによって調製される。懸濁液は、式(I)の化合物またはその薬学上許容可能な塩を無毒性ビヒクルに分散することによって製剤化することができる。可溶化剤および乳化剤(例えば、エトキシ化イソステアリルアルコールおよびポリオキシエチレンソルビトールエーテル)、保存剤、香味用添加物(例えば、ペパーミントオイル)あるいは天然の甘味料またはサッカリンもしくは他の人工甘味料なども加えることができる。
【0137】
別の態様において、本発明は、吸入による患者への投与に適合した剤形(例えば、乾燥粉末、エアロゾル、懸濁液または溶液組成物)に関する。例えば、本発明は、式(I)の化合物またはその薬学上許容可能な塩を含む、吸入に適合した乾燥粉末組成物に関する。
【0138】
吸入による肺への送達用の乾燥粉末組成物は、典型的には、微粉化された粉末としての式(I)の化合物またはその薬学上許容可能な塩を、微粉化された粉末としての1つ以上の薬学上許容可能な賦形剤とともに含む。乾燥粉末での使用に特にふさわしい薬学上許容可能な賦形剤は、当業者に公知であり、それらとしては、ラクトース、デンプン、マンニトール、ならびに単糖、二糖および多糖が挙げられる。微粉化された粉末は、例えば、微粒子化および製粉によって調製され得る。一般に、サイズが減少された(例えば、微粒子化された)化合物は、約1〜約10ミクロンというD50値(例えば、レーザー回折を用いて測定される)によって定義することができる。
【0139】
乾燥粉末は、複数回分の用量(未計量の用量)の乾燥粉末形態の医薬を貯蔵するのに適したレザバー(reservoir)を有するレザバー乾燥粉末吸入器(RDPI)によって患者に投与され得る。RDPIは、典型的には、レザバーから送達部位に各医薬用量を計量して供給するための手段を備える。例えば、その計量供給手段は、計量カップ(metering cup)を備えることがあり、そのカップは、第1の位置(そのカップがレザバーからの医薬で満たされ得る位置)から、第2の位置(計量された用量の医薬が吸入のために患者に利用可能となる位置)に移動可能である。
【0140】
あるいは、乾燥粉末は、複数回用量乾燥粉末吸入器(MDPI)において使用するためのカプセル(例えば、ゼラチンまたはプラスチック)、カートリッジまたはブリスター包装として提供されてもよい。MDPIは、医薬が、既定の複数回分の用量(またはその一部)の医薬を含む(または別途有する)複数回用量パック内に含められている、吸入器である。乾燥粉末が、ブリスター包装として提供されるとき、そのブリスター包装は、乾燥粉末の形態の医薬を含めるための複数のブリスターを備える。それらのブリスターは、典型的には、それらから医薬を放出するのを容易にするために規則的な様式で配置される。例えば、ブリスターは、円盤型のブリスター包装上にたいてい円形の形式で配置されていることもあるし、ブリスターは、例えば、ストリップまたはテープを備えた形態で細長いこともある。各カプセル、カートリッジまたはブリスターは、例えば、20μg〜10mgの式(I)の化合物またはその薬学上許容可能な塩を含み得る。
【0141】
式(I)の化合物またはその薬学上許容可能な塩を液体噴射剤に懸濁するかまたは溶解することによって、エアロゾルが形成され得る。適当な噴射剤には、ハロカーボン、炭化水素および他の液化ガスが含まれる。代表的な噴射剤としては:トリクロロフルオロメタン(propellant 11)、ジクロロフルオロメタン(propellant 12)、ジクロロテトラフルオロエタン(propellant 114)、テトラフルオロエタン(HFA−134a)、1,1−ジフルオロエタン(HFA−152a)、ジフルオロメタン(HFA−32)、ペンタフルオロエタン(HFA−12)、ヘプタフルオロプロパン(HFA−227a)、ペルフルオロプロパン、ペルフルオロブタン、ペルフルオロペンタン、ブタン、イソブタンおよびペンタンが挙げられる。式(I)の化合物またはその薬学上許容可能な塩を含むエアロゾルは、典型的には、定量吸入器(MDI)によって患者に投与され得る。そのようなデバイスは、当業者に公知である。
【0142】
そのエアロゾルは、典型的にMDIで使用される追加の薬学上許容可能な賦形剤(例えば、界面活性物質、潤滑剤、共溶媒、および製剤の物理的安定性を改善するか、バルブの性能を改善するか、溶解性を改善するか、または味を改善する他の賦形剤)を含むことがある。
【0143】
したがって、本発明のさらなる態様として、式(I)の化合物またはその薬学上許容可能な塩、および噴射剤としてフルオロカーボンまたは水素含有クロロフルオロカーボンを、必要に応じて界面活性物質および/または共溶媒とともに含む医薬エアロゾル製剤が提供される。
【0144】
本発明の別の態様によれば、噴射剤が、1,1,1,2−テトラフルオロエタン、1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンおよびそれらの混合物から選択される、医薬エアロゾル製剤が提供される。
【0145】
本発明の製剤は、適当な緩衝剤を加えることによって緩衝されることがある。
【0146】
式(I)の化合物またはその薬学上許容可能な塩と適当な粉末基剤(例えば、ラクトースまたはデンプン)との吸入用粉末混合物を含む、吸入器または注入器において使用するためのカプセルおよびカートリッジ(例えば、ゼラチン製)が、製剤化されることがある。カプセルまたはカートリッジの各々は、通常、20μg〜10mgの式(I)の化合物またはその薬学上許容可能な塩を含み得る。あるいは、式(I)の化合物またはその薬学上許容可能な塩は、ラクトースなどの賦形剤なしで提供されてもよい。
【0147】
本発明に係る局所用組成物中の式(I)の活性な化合物またはその薬学上許容可能な塩の比率は、調製される製剤の正確なタイプに依存するが、一般に、0.001〜10重量%の範囲内であり得る。一般に、調製物の大部分のタイプについて、使用される比率は、0.005〜1%、例えば、0.01〜0.5%の範囲内であり得る。しかしながら、吸入用またはガス注入用の粉末においては、使用される比率は、通常、0.1〜5%の範囲内であり得る。
【0148】
エアロゾル製剤は、好ましくは、各定量(each metered dose)または各「パフ」のエアロゾルに、20μg〜10mg、好ましくは、20μg〜2000μg、より好ましくは、約20μg〜500μgの式(I)の化合物が含まれるように取り決められる。投与は、1日に1回または1日に数回、例えば、2、3、4または8回であり得、各回、例えば、1、2または3用量投与され得る。エアロゾルを用いた全1日量は、100μg〜10mg、好ましくは、200μg〜2000μgの範囲内であり得る。吸入器または注入器においてカプセルおよびカートリッジによって送達される全1日量および定量は、一般に、エアロゾル製剤を用いて送達される量の2倍であり得る。
【0149】
懸濁エアロゾル(suspension aerosol)製剤の場合、粒状の(例えば、微粒子化された)薬物の粒径は、そのエアロゾル製剤が投与された際に実質的にすべての薬物が肺に吸入されるような粒径であるべきであり、ゆえに、100ミクロン未満、望ましくは20ミクロン未満、特に、1〜10ミクロン(例えば、1〜5ミクロン、より好ましくは、2〜3ミクロン)の範囲であり得る。
【0150】
本発明の製剤は、医薬および式(I)の化合物またはその薬学上許容可能な塩を、例えば超音波処理または高剪断ミキサーの助けを借りて、適切な容器内で選択された噴射剤に分散するかまたは溶解することによって調製され得る。そのプロセスは、望ましくは、調節された湿度条件下において行われる。
【0151】
本発明に係るエアロゾル製剤の化学的および物理的安定性ならびに医薬上の許容性は、当業者に周知の手法によって測定され得る。したがって、例えば、構成要素の化学安定性は、例えば、生成物の長期貯蔵後の、HPLCアッセイによって測定され得る。物理的安定性のデータは、他の従来の分析技術(例えば、漏れ検査、バルブ送達アッセイ(操作1回あたりの平均射出重量)、用量再現性アッセイ(操作1回あたりの活性成分量)およびスプレー分布分析)から得てもよい。
【0152】
本発明に係る懸濁エアロゾル製剤の安定性は、従来の手法、例えば、後方光散乱装置を用いてフロキュレーションサイズ分布を測定すること、またはカスケードインパクションもしくは「ツインインピンジャー」分析プロセスによって粒子サイズ分布を測定することによって測定され得る。本明細書中で使用されるとき、「ツインインピンジャー」アッセイに対する言及は、British Pharmacopaeia 1988,A204〜207頁,Appendix XVII Cに定義されているような「装置Aを用いた、加圧吸入における放出用量の沈着量の測定」のことを意味する。そのような手法によって、エアロゾル製剤の「呼吸性画分(respirable fraction)」の算出が可能である。「呼吸性画分」を算出するために使用される1つの方法は、操作1回あたりに下部のインピンジメントチャンバーに集められる活性成分の量である「細粒子画分」を参考とするものであり、これは、上に記載したツインインピンジャー法を用いて操作1回あたりに送達される活性成分の総量に対するパーセンテージとして表現される。
【0153】
用語「定量吸入器」またはMDIは、缶、その缶を覆う固定されたキャップ、およびそのキャップに位置している製剤計量バルブを備えるユニットのことを意味する。MDIシステムは、適当なチャネリングデバイスを備える。適当なチャネリングデバイスは、例えば、バルブアクチュエータおよび円筒形または円錐様の通路を備え、医薬は、それらを通って、充填されたキャニスターから計量バルブを経由して患者の鼻または口に送達され得る(例えば、マウスピースアクチュエータ)。
【0154】
MDIキャニスターは、一般に、使用される噴射剤の蒸気圧に耐えることができる容器(例えば、プラスチックボトルもしくはプラスチックでコーティングされたガラスボトル、または好ましくは、金属缶(それらは、必要に応じて、陽極酸化され得、ラッカーコーティングされ得、そして/またはプラスチックコーティングされ得る)、例えば、アルミニウムまたはその合金の缶(例えば、本明細書に参考として援用されるWO96/32099では、内面の一部または全部が、必要に応じて1つ以上の非フルオロカーボンポリマーとともに1つ以上のフルオロカーボンポリマーでコーティングされている))を含み、その容器は、計量バルブを用いて閉鎖されている。そのキャップは、超音波溶接、ねじ取り付け(screw fitting)またはクリンピングによって、その缶に固定されていることがある。本明細書中に教示されるMDIは、当該分野の方法(例えば、上記のByronおよびWO96/32099を参照のこと)によって作製され得る。好ましくは、そのキャニスターは、キャップの組立て部品と嵌合し、ここで、薬物計量バルブは、キャップに位置しており、前記キャップは、しかるべき位置にクリンピングされている。
【0155】
本発明の1つの実施形態において、その缶の金属性の内面は、フルオロポリマー、より好ましくは、非フルオロポリマーと混和されたフルオロポリマーでコーティングされている。本発明の別の実施形態において、その缶の金属性の内面は、ポリテトラフルオロエチレン(PTFE)とポリエーテルスルホン(PES)とのポリマー混和物でコーティングされている。本発明のさらなる実施形態において、その缶の金属性の内面の全体は、ポリテトラフルオロエチレン(PTFE)とポリエーテルスルホン(PES)とのポリマー混和物でコーティングされている。
【0156】
上記計量バルブは、操作1回あたりに定量の製剤を送達し、かつそのバルブを通って噴射剤が漏出するのを防ぐガスケットを組み込むように設計されている。そのガスケットは、任意の適当なエラストマー材料(例えば、低密度ポリエチレン、クロロブチル、ブロモブチル、EPDM、黒および白ブタジエン−アクリロニトリルゴム、ブチルゴム、ならびにネオプレン)を備えることがある。適当なバルブは、エアロゾル業界において周知の製造者、例えば、Valois,France(例えば、DF10、DF30、DF60)、Bespak plc,UK(例えば、BK300、BK357)および3M−Neotechnic Ltd,UK(例えば、SpraymiserTM)から商業的に入手可能である。
【0157】
様々な実施形態において、MDIは、他の構造物(例えば、限定されないが、MDIを格納して収容する外装(overwrap packages)(米国特許第6,119,853号明細書、同第6,179,118号明細書、同第6,315,112号明細書、同第6,352,152号明細書、同第6,390,291号明細書、および同第6,679,374号明細書に記載されているものを含む)ならびにドーズカウンターユニット(dose counter units)(例えば、限定されないが、米国特許第6,360,739号明細書および同第6,431,168号明細書に記載されているもの))とともに使用され得る。
【0158】
医薬エアロゾル製造に関する当業者に周知の従来のバルク製造の方法および仕組みが、充填されたキャニスターの商業生産のための大規模バッチ調製のために使用され得る。したがって、例えば、懸濁エアロゾル製剤を調製するための1つのバルク製造方法において、計量バルブが、アルミニウム缶にクリンピングされることにより、空のキャニスターが形成される。粒状の医薬を投入容器に加え、液化された噴射剤が、随意の賦形剤とともに、その投入容器を通って、製造容器に圧縮充填される。その薬物懸濁液が混合された後、充填機に再循環され、次いで、薬物懸濁液のアリコートが、計量バルブを通ってキャニスターに充填される。溶液エアロゾル製剤を調製するためのバルク製造方法の1つの例では、計量バルブが、アルミニウム缶にクリンピングされることにより、空のキャニスターが形成される。液化された噴射剤が、随意の賦形剤および溶解された薬物とともに、投入容器を通って、製造容器に圧縮充填される。
【0159】
代替プロセスでは、液化された製剤のアリコートを、製剤が確実に気化しないほど十分に冷えた条件下で開放キャニスターに加え、次いで、計量バルブをそのキャニスター上にクリンピングする。
【0160】
典型的には、薬学上使用するために調製されるバッチにおいて、充填された各キャニスターが、重量検査され、バッチ番号で符号化され、貯蔵のためにトレーに詰め込まれた後、リリース試験される。
【0161】
式(I)の化合物またはその薬学上許容可能な塩を含む懸濁液および溶液もまた、噴霧器によって患者に投与されることがある。噴霧化のために使用される溶媒または懸濁剤は、任意の薬学上許容可能な液体(例えば、水、食塩水溶液、アルコールもしくはグリコール、例えば、エタノール、イソプロピルアルコール、グリセロール、プロピレングリコール、ポリエチレングリコールなどまたはそれらの混合物)であり得る。食塩水溶液には、投与後にほとんどまたはまったく薬理学的活性を示さない塩を利用する。アルカリ金属塩またはアンモニウムハロゲン塩、例えば、塩化ナトリウム、塩化カリウムなどの有機塩と、カリウム塩、ナトリウム塩およびアンモニウム塩などの有機塩の両方、または有機酸(例えば、アスコルビン酸、クエン酸、酢酸、酒石酸など)を、この目的のために使用してよい。
【0162】
他の薬学上許容可能な賦形剤が、上記懸濁液または溶液に加えられてもよい。式(I)の化合物またはその薬学上許容可能な塩は、無機酸、例えば、塩酸、硝酸、硫酸および/もしくはリン酸、有機酸、例えば、アスコルビン酸、クエン酸、酢酸および酒石酸など、錯化剤(例えば、EDTAまたはクエン酸およびその塩)、または酸化防止剤(例えば、ビタミンEまたはアスコルビン酸などの酸化防止剤)を加えることによって安定化されることがある。これらは、式(I)の化合物またはその薬学上許容可能な塩を安定化させるために、単独で使用されてもよいし、同時に使用されてもよい。保存剤(例えば、塩化ベンザルコニウムまたは安息香酸およびその塩)が加えられてもよい。特に、懸濁液の物理的安定性を改善するために、界面活性物質が加えられてもよい。これらには、レシチン、ジオクチルスルホコハク酸二ナトリウム、オレイン酸およびソルビタンエステルが含まれる。
【0163】
さらなる態様において、本発明は、鼻腔内投与に適合した剤形に関する。
【0164】
鼻への投与用の製剤には、加圧エアロゾル製剤、および加圧ポンプによって鼻に投与される水性製剤が含まれ得る。加圧されていない、鼻腔への局所的投与に適合した製剤が、特に興味深い。適当な製剤は、この目的のための希釈剤または担体として水を含む。肺または鼻への投与用の水性製剤は、従来の賦形剤(例えば、緩衝剤、張度改変剤など)とともに提供され得る。水性製剤は、噴霧によって鼻に投与されてもよい。
【0165】
式(I)の化合物またはその薬学上許容可能な塩は、流体用ディスペンサーから送達するための流体製剤として製剤化され得、その流体用ディスペンサーは、例えば、そのディスペンサーのポンプ機構に使用者が力を適用したときに定量の流体製剤を供給する供給ノズルまたは供給オリフィスを有する流体用ディスペンサーである。そのような流体用ディスペンサーには、一般に、複数回分の定量の流体製剤のレザバーが提供され、その定量は、連続的にポンプを操作すると供給可能である。その供給ノズルまたは供給オリフィスは、流体製剤を鼻腔内に噴霧供給するために使用者の鼻孔内に挿入するように配置されている場合がある。上述のタイプの流体用ディスペンサーは、WO05/044354(この内容全体が本明細書に参考として援用される)に記載され、図示されている。そのディスペンサーは、流体製剤を収容するための容器に取り付けられた圧搾ポンプを有する流体発射デバイスを収納するハウジングを有する。そのハウジングは、指で操作可能な少なくとも1つのサイドレバーを有し、そのレバーは、ハウジングに対して内向きに動かすことができ、それにより、その容器がハウジング内で上向きに移動してポンプが圧縮され、定量の製剤がポンプステム(pump stem)からハウジングの鼻ノズルを通って送り出される。1つの実施形態において、流体用ディスペンサーは、WO05/044354の図30〜40に図示されている一般的なタイプである。
【0166】
鼻腔内投与に適合した医薬組成物(その担体は固体である)は、鼻に近づけて保持された散剤の容器から鼻腔を通って急速吸入によって投与される、例えば、20〜500ミクロンの範囲の粒径を有する粗末を含む。点鼻薬または点鼻液としての投与に適した組成物(その担体は液体である)は、式(I)の化合物またはその薬学上許容可能な塩の水性または油性の溶液を含む。
【0167】
経皮的投与に適合した医薬組成物は、長時間にわたって患者の表皮と密接に接触したままであることを意図された不連続のパッチとして提供され得る。例えば、活性成分は、Pharmaceutical Research,3(6),318(1986)に広く記載されているようなイオン導入によって、そのパッチから送達され得る。
【0168】
局所的投与に適合した医薬組成物は、軟膏、クリーム、懸濁液、ローション、散剤、溶液、ペースト、ゲル、スプレー、エアロゾルまたはオイルとして製剤化され得る。
【0169】
軟膏、クリームおよびゲルは、適当な増粘剤および/またはゲル化剤および/または溶媒を添加して、例えば、水性または油性の基剤を用いて製剤化され得る。したがって、そのような基剤は、例えば、水および/もしくは油(例えば、流動パラフィンまたは植物油(例えば、落花生油またはひまし油))またはポリエチレングリコールなどの溶媒を含み得る。基剤の性質に従って使用され得る増粘剤およびゲル化剤としては、軟パラフィン、ステアリン酸アルミニウム、セトステアリルアルコール、ポリエチレングリコール、羊毛脂、蜜ろう、カルボキシポリメチレンおよびセルロース誘導体、ならびに/またはモノステアリン酸グリセリルおよび/もしくは非イオン性乳化剤が挙げられる。
【0170】
ローションは、水性または油性の基剤を用いて製剤化され得、一般に、1つ以上の乳化剤、安定化剤、分散剤、懸濁剤または増粘剤も含み得る。
【0171】
外用のための散剤は、任意の適当な粉末基剤、例えば、タルク、ラクトースまたはデンプンの助けを借りて形成され得る。滴剤は、1つ以上の分散剤、可溶化剤、懸濁剤または保存剤も含む、水性または非水性の基剤を用いて製剤化され得る。
【0172】
局所用調製物は、1日あたり1回以上の患部への適用によって投与され得る、皮膚領域を覆う密封包帯が、都合よく使用され得る。持続的な送達または長期の送達は、接着性のレザバーシステムによって達成されることがある。
【0173】
眼または他の外面の組織、例えば、口および皮膚を治療する場合、本組成物は、局所用の軟膏またはクリームとして適用されてもよい。軟膏として製剤化されるとき、式(I)の化合物またはその薬学上許容可能な塩は、パラフィン系または水混和性の軟膏基剤とともに使用され得る。あるいは、式(I)の化合物またはその薬学上許容可能な塩は、水中油型クリーム基剤または油中水型基剤を用いてクリームとして製剤化され得る。
【0174】
非経口投与に適合した医薬組成物には、酸化防止剤、緩衝剤、静菌剤、ならびに意図されるレシピエントの血液と製剤を等張性にする溶質を含み得る水性および非水性の無菌注射溶液、ならびに懸濁剤および増粘剤を含み得る水性および非水性の無菌懸濁液が含まれる。その組成物は、単位用量または複数回用量が入った容器(例えば、密封されたアンプルおよびバイアル)として提供され得、使用の直前に無菌の液体担体(例えば、注射用水)の添加だけが必要なフリーズドライ(凍結乾燥)された状態で保管され得る。即時調合の注射溶液および注射懸濁液は、無菌の散剤、顆粒剤および錠剤から調製され得る。
【0175】
本発明に係る化合物および医薬製剤は、例えば、抗炎症剤、抗コリン剤(特に、M1/M2/M3受容体拮抗薬)、β2−アドレナリン受容体作動薬、抗感染症剤(例えば、抗生物質または抗ウイルス薬)または抗ヒスタミン剤から選択される1つ以上の他の治療薬と併用して使用され得るか、またはそれらを含み得る。したがって、本発明は、さらなる態様において、例えば、抗炎症剤(例えば、コルチコステロイドまたはNSAID)、抗コリン剤、β2−アドレナリン受容体作動薬、抗感染症剤(例えば、抗生物質または抗ウイルス薬)または抗ヒスタミン剤から選択される、1つ以上の他の治療上活性な薬剤とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。本発明の1つの実施形態は、β2−アドレナリン受容体作動薬および/または抗コリン薬および/またはPDE−4阻害剤および/または抗ヒスタミン剤とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを包含する。
【0176】
本発明の特定の化合物は、他のPI3−キナーゼよりもPI3Kδに対して選択性を示し得る。したがって、本発明は、さらなる態様において、PI3Kδに対して選択的な式(I)の化合物またはその薬学上許容可能な塩を、別のPI3−キナーゼ(例えば、PI3Kγ)に対して選択的な化合物またはその薬学上許容可能な塩とともに含む組み合わせを提供する。
【0177】
本発明の1つの実施形態は、1または2種類の他の治療薬を含む組み合わせを包含する。
【0178】
必要に応じて、他の治療成分が、その治療成分の活性および/または安定性および/または物理的特性(例えば、溶解性)を最適化するために、塩の形態で(例えば、アルカリ金属塩もしくはアミン塩または酸付加塩として)、またはプロドラッグとして、またはエステル(例えば、低級アルキルエステル)、または溶媒和化合物(例えば、水和物)として、使用され得ることは、当業者には明らかであろう。必要に応じて、その治療成分が光学的に純粋な形態で使用され得ることも明らかであろう。
【0179】
1つの実施形態において、本発明は、β2−アドレナリン受容体作動薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを包含する。
【0180】
β2−アドレナリン受容体作動薬の例としては、サルメテロール(ラセミ体であっても、R−エナンチオマーなどの単一のエナンチオマーであってもよい)、サルブタモール(ラセミ体であっても、R−エナンチオマーなどの単一のエナンチオマーであってもよい)、フォルモテロール(formoterol)(ラセミ体であっても、R,R−ジアステレオマーなどの単一のジアステレオマー(duastereomer)であってもよい)、サルメファモール(salmefamol)、フェノテロール、カルモテロール(carmoterol)、エタンテロール(etanterol)、ナミンテロール(naminterol)、クレンブテロール、ピルブテロール、フレルブテロール(flerbuterol)、レプロテロール(reproterol)、バンブテロール(bambuterol)、インダカテロール(indacaterol)、テルブタリンおよびそれらの塩、例えば、サルメテロールのキシナホ酸(1−ヒドロキシ−2−ナフタレンカルボン酸)塩、サルブタモールの硫酸塩もしくは遊離塩基、またはフォルモテロールのフマル酸塩が挙げられる。1つの実施形態において、長時間作用型β2−アドレナリン受容体作動薬、例えば、約12時間またはそれ以上にわたって有効な気管支拡張作用を提供する化合物が、好ましい。
【0181】
他のβ2−アドレナリン受容体作動薬としては、WO02/066422、WO02/070490、WO02/076933、WO03/024439、WO03/072539、WO03/091204、WO04/016578、WO2004/022547、WO2004/037807、WO2004/037773、WO2004/037768、WO2004/039762、WO2004/039766、WO01/42193およびWO03/042160に記載されているものが挙げられる。
【0182】
β2−アドレナリン受容体作動薬の例としては:
3−(4−{[6−({(2R)−2−ヒドロキシ−2−[4−ヒドロキシ−3−(ヒドロキシメチル)フェニル]エチル}アミノ)ヘキシル]オキシ}ブチル)ベンゼンスルホンアミド、
3−(3−{[7−({(2R)−2−ヒドロキシ−2−[4−ヒドロキシ−3−ヒドロキシメチル)フェニル]エチル}−アミノ)ヘプチル]オキシ}プロピル)ベンゼンスルホンアミド、
4−{(1R)−2−[(6−{2−[(2,6−ジクロロベンジル)オキシ]エトキシ}ヘキシル)アミノ]−1−ヒドロキシエチル}−2−(ヒドロキシメチル)フェノール、
4−{(1R)−2−[(6−{4−[3−(シクロペンチルスルホニル)フェニル]ブトキシ}ヘキシル)アミノ]−1−ヒドロキシエチル}−2−(ヒドロキシメチル)フェノール、
N−[2−ヒドロキシル−5−[(1R)−1−ヒドロキシ−2−[[2−4−[[(2R)−2−ヒドロキシ−2−フェニルエチル]アミノ]フェニル]エチル]アミノ]エチル]フェニル]ホルムアミド、
N−2{2−[4−(3−フェニル−4−メトキシフェニル)アミノフェニル]エチル}−2−ヒドロキシ−2−(8−ヒドロキシ−2(1H)−キノリノン−5−イル)エチルアミン、および
5−[(R)−2−(2−{4−[4−(2−アミノ−2−メチル−プロポキシ)−フェニルアミノ]−フェニル}−エチルアミノ)−1−ヒドロキシ−エチル]−8−ヒドロキシ−1H−キノリン−2−オン
が挙げられる。
【0183】
β2−アドレナリン受容体作動薬は、硫酸、塩酸、フマル酸、ヒドロキシナフトエ酸(例えば、1−または3−ヒドロキシ−2−ナフトエ酸)、桂皮酸、置換される桂皮酸、トリフェニル酢酸、スルファミン酸、スルファニル酸、ナフタレンアクリル酸、安息香酸、4−メトキシ安息香酸、2−または4−ヒドロキシ安息香酸、4−クロロ安息香酸および4−フェニル安息香酸から選択される薬学上許容可能な酸と形成される塩の形態で存在し得る。
【0184】
適当な抗炎症剤には、コルチコステロイドが含まれる。式(I)の化合物またはその薬学上許容可能な塩と併用して使用され得る適当なコルチコステロイドは、経口および吸入コルチコステロイド、ならびに抗炎症活性を有するそれらのプロドラッグである。例としては、メチルプレドニゾロン、プレドニゾロン、デキサメタゾン、プロピオン酸フルチカゾン、6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−17α−[(4−メチル−1,3−チアゾール−5−カルボニル)オキシ]−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステル、6α,9α−ジフルオロ−17α−[(2−フラニルカルボニル)オキシ]−11β−ヒドロキシ−16α−メチル−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステル(フロ酸フルチカゾン)、6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−3−オキソ−17α−プロピオニルオキシ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−(2−オキソ−テトラヒドロ−フラン−3S−イル)エステル、6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−3−オキソ−17α−(2,2,3,3−テトラメチルシクロプロピルカルボニル(tetramethycyclopropylcarbonyl))オキシ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−シアノメチルエステルおよび6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−17α−(1−メチルシクロプロピルカルボニル(methycyclopropylcarbonyl))オキシ−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステル、ベクロメタゾンエステル(例えば、17−プロピオン酸エステルまたは17,21−二プロピオン酸エステル)、ブデソニド(budesonide)、フルニソリド、モメタゾン(mometasone)エステル(例えば、フロ酸モメタゾン)、トリアムシノロンアセトニド、ロフレポニド(rofleponide)、シクレソニド(16α,17−[[(R)−シクロヘキシルメチレン]ビス(オキシ)]−11β,21−ジヒドロキシ−プレグナ−1,4−ジエン−3,20−ジオン)、プロピオン酸ブチキソコルト(butixocort propionate)、RPR−106541およびST−126が挙げられる。好ましいコルチコステロイドとしては、プロピオン酸フルチカゾン、6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−17α−[(4−メチル−1,3−チアゾール−5−カルボニル)オキシ]−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステル、6α,9α−ジフルオロ−17α−[(2−フラニルカルボニル)オキシ]−11β−ヒドロキシ−16α−メチル−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステル、6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−3−オキソ−17α−(2,2,3,3−テトラメチルシクロプロピルカルボニル)オキシ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−シアノメチルエステルおよび6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−17α−(1−メチルシクロプロピルカルボニル)オキシ−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステルが挙げられる。1つの実施形態において、コルチコステロイドは、6α,9α−ジフルオロ−17α−[(2−フラニルカルボニル)オキシ]−11β−ヒドロキシ−16α−メチル−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステルである。
【0185】
コルチコステロイドの例としては、WO2002/088167、WO2002/100879、WO2002/12265、WO2002/12266、WO2005/005451、WO2005/005452、WO2006/072599およびWO2006/072600に記載されているものが挙げられ得る。
【0186】
トランス活性化よりもトランス抑制に対して選択性を有し得、かつ併用療法において有用であり得る、グルココルチコイドアゴニズムを有する非ステロイド性化合物としては、以下の特許に包含されている化合物が挙げられる:WO03/082827、WO98/54159、WO04/005229、WO04/009017、WO04/018429、WO03/104195、WO03/082787、WO03/082280、WO03/059899、WO03/101932、WO02/02565、WO01/16128、WO00/66590、WO03/086294、WO04/026248、WO03/061651およびWO03/08277。さらなる非ステロイド性化合物は:WO2006/000401、WO2006/000398およびWO2006/015870に包含されている。
【0187】
抗炎症剤の例としては、非ステロイド性抗炎症薬(NSAID)が挙げられる。
【0188】
NSAIDの例としては、クロモグリク酸ナトリウム、ネドクロミルナトリウム、ホスホジエステラーゼ(PDE)阻害剤(例えば、テオフィリン、PDE4阻害剤、または混合PDE3/PDE4阻害剤)、ロイコトリエン拮抗薬、ロイコトリエン合成の阻害剤(例えば、モンテルカスト)、iNOS阻害剤、トリプターゼおよびエラスターゼの阻害剤、ベータ−2インテグリン拮抗薬、ならびにアデノシン受容体作動薬もしくは拮抗薬(例えば、アデノシン2a作動薬)、サイトカイン拮抗薬(例えば、CCR3拮抗薬などのケモカイン拮抗薬)もしくはサイトカイン合成の阻害剤、または5−リポキシゲナーゼ阻害剤が挙げられる。iNOS(誘導型一酸化窒素合成酵素阻害剤)は、好ましくは、経口投与用である。iNOS阻害剤の例としては、WO93/13055、WO98/30537、WO02/50021、WO95/34534およびWO99/62875に開示されているものが挙げられる。CCR3阻害剤の例としては、WO02/26722に開示されているものが挙げられる。
【0189】
1つの実施形態において、本発明は、ホスホジエステラーゼ4(PDE4)阻害剤との組み合わせ(特に、吸入に適合した製剤の場合)における式(I)の化合物の使用を提供する。本発明のこの態様において有用なPDE4特異的阻害剤は、PDE4酵素を阻害すると知られているかまたはPDE4阻害剤として作用すると発見されていて、かつ、PDE4と同様にPDEファミリーの他のメンバー(例えば、PDE3およびPDE5)を阻害する化合物ではない単なるPDE4阻害剤である、任意の化合物であり得る。
【0190】
化合物には、cis−4−シアノ−4−(3−シクロペンチルオキシ−4−メトキシフェニル)シクロヘキサン−1−カルボン酸、2−カルボメトキシ−4−シアノ−4−(3−シクロプロピルメトキシ−4−ジフルオロメトキシフェニル)シクロヘキサン−1−オンおよびcis−[4−シアノ−4−(3−シクロプロピルメトキシ−4−ジフルオロメトキシフェニル)シクロヘキサン−1−オール]が含まれる。また、1996年9月3日発行の米国特許第5,552,438号明細書に記載されている、cis−4−シアノ−4−[3−(シクロペンチルオキシ)−4−メトキシフェニル]シクロヘキサン−1−カルボン酸(シロミラスト(cilomilast)としても知られる)およびその塩、エステル、プロドラッグまたは物理的形態、この特許およびそれが開示する化合物は、その全体が参考として援用される。
【0191】
他の化合物としては、Elbion製のAWD−12−281(Hofgen,N.ら、15th EFMC Int Symp Med Chem(Sept 6−10,Edinburgh)1998,Abst P.98;CAS照合番号247584020−9);NCS−613(INSERM)と命名された9−ベンジルアデニン誘導体;ChiroscienceおよびSchering−Plough製のD−4418;CI−1018(PD−168787)として同定され、Pfizerに帰属するベンゾジアゼピンPDE4阻害剤;Kyowa HakkoによってWO99/16766に開示されたベンゾジオキソール誘導体;Kyowa Hakko製のK−34;Napp製のV−11294A(Landells,L.J.ら、Eur Resp J[Annu Cong Eur Resp Soc(Sept 19−23,Geneva)1998] 1998,12(Suppl.28):Abst P2393);ロフルミラスト(roflumilast)(CAS照合番号162401−32−3)およびByk−Gulden製のフタラジノン(pthalazinone)(WO99/47505(この開示は、本明細書に参考として援用される));Byk−Gulden(現Altana)によって調製され、公開された混合PDE3/PDE4阻害剤である、Pumafentrine、すなわち(−)−p−[(4aR*,10bS*)−9−エトキシ−1,2,3,4,4a,10b−ヘキサヒドロ−8−メトキシ−2−メチルベンゾ[c][1,6]ナフチリジン−6−イル]−N,N−ジイソプロピルベンズアミド;Almirall−Prodesfarmaが開発中のアロフィリン(arofylline);Vernalis製のVM554/UM565;またはT−440(Tanabe Seiyaku;Fuji,K.ら、Pharmacol Exp Ther,1998,284(1):162)およびT2585が挙げられる。
【0192】
さらなる化合物は、公開された国際特許出願WO04/024728(Glaxo Group Ltd)、WO04/056823(Glaxo Group Ltd)およびWO04/103998(Glaxo Group Ltd)(例えば、その中に開示されている実施例399または544)に開示されている。さらなる化合物は、WO2005/058892、WO2005/090348、WO2005/090353およびWO2005/090354(これらのすべてがGlaxo Group Limitedの名義である)にも開示されている。
【0193】
抗コリン剤の例は、ムスカリン受容体において拮抗薬として作用する化合物、特に、M1もしくはM3受容体の拮抗薬、M1/M3もしくはM2/M3受容体の二重拮抗薬、またはM1/M2/M3受容体の総拮抗薬(pan−antagonists)である化合物である。吸入によって投与するための例示的な化合物としては、イプラトロピウム(例えば、臭化物として、CAS22254−24−6、Atroventという名称で販売されている)、オキシトロピウム(例えば、臭化物として、CAS30286−75−0)およびチオトロピウム(例えば、臭化物として、CAS136310−93−5、Spirivaという名称で販売されている)が挙げられる。レバトロパート(revatropate)(例えば、臭化水素酸塩として、CAS262586−79−8)、およびWO01/04118に開示されているLAS−34273も興味深い。経口投与用の例示的な化合物としては、ピレンゼピン(CAS28797−61−7)、ダリフェナシン(CAS133099−04−4、またはEnablexという名称で販売されている臭化水素酸塩についてはCAS133099−07−7)、オキシブチニン(CAS5633−20−5、Ditropanという名称で販売されている)、テロジリン(CAS15793−40−5)、トルテロジン(CAS124937−51−5、またはDetrolという名称で販売されているタルトレートについてはCAS124937−52−6)、オチロニウム(例えば、臭化物として、CAS26095−59−0、Spasmomenという名称で販売されている)、塩化トロスピウム(CAS10405−02−4)およびソリフェナシン(CAS242478−37−1、またはYM−905としても知られ、Vesicareという名称で販売されているスクシネートについてはCAS242478−38−2)が挙げられる。
【0194】
追加の化合物は、本明細書に参考として援用されるWO2005/037280、WO2005/046586およびWO2005/104745に開示されている。本組み合わせとしては:
(3−endo)−3−(2,2−ジ−2−チエニルエテニル)−8,8−ジメチル−8−アゾニアビシクロ[3.2.1]オクタンヨウ化物、
(3−endo)−3−(2−シアノ−2,2−ジフェニルエチル)−8,8−ジメチル−8−アゾニアビシクロ[3.2.1]オクタン臭化物、
4−[ヒドロキシ(ジフェニル)メチル]−1−{2−[(フェニルメチル)オキシ]エチル}−1−アゾニアビシクロ[2.2.2]オクタン臭化物、および
(1R,5S)−3−(2−シアノ−2,2−ジフェニルエチル)−8−メチル−8−{2−[(フェニルメチル)オキシ]エチル}−8−アゾニアビシクロ[3.2.1]オクタン臭化物
が挙げられるが、これらに限定されない。
【0195】
他の抗コリン剤としては、例えば:
(3−endo)−3−(2,2−ジ−2−チエニルエテニル)−8,8−ジメチル−8−アゾニアビシクロ[3.2.1]オクタン臭化物、
(3−endo)−3−(2,2−ジフェニルエテニル)−8,8−ジメチル−8−アゾニアビシクロ[3.2.1]オクタン臭化物、
(3−endo)−3−(2,2−ジフェニルエテニル)−8,8−ジメチル−8−アゾニアビシクロ[3.2.1]オクタン4−メチルベンゼンスルホネート、
(3−endo)−8,8−ジメチル−3−[2−フェニル−2−(2−チエニル)エテニル]−8−アゾニアビシクロ[3.2.1]オクタン臭化物、および/または
(3−endo)−8,8−ジメチル−3−[2−フェニル−2−(2−ピリジニル)エテニル]−8−アゾニアビシクロ[3.2.1]オクタン臭化物
をはじめとした、米国特許出願60/487981に開示されている化合物が挙げられる。
【0196】
さらなる抗コリン剤としては、例えば:
(endo)−3−(2−メトキシ−2,2−ジ−チオフェン−2−イル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピオニトリル、
(endo)−8−メチル−3−(2,2,2−トリフェニル−エチル)−8−アザ−ビシクロ[3.2.1]オクタン、
3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピオンアミド、
3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピオン酸、
(endo)−3−(2−シアノ−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
(endo)−3−(2−シアノ−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタン臭化物、
3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロパン−1−オール、
N−ベンジル−3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピオンアミド、
(endo)−3−(2−カルバモイル−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
1−ベンジル−3−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−尿素、
1−エチル−3−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−尿素、
N−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−アセトアミド、
N−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−ベンズアミド、
3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジ−チオフェン−2−イル−プロピオニトリル、
(endo)−3−(2−シアノ−2,2−ジ−チオフェン−2−イル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
N−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−ベンゼンスルホンアミド、
[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−尿素、
N−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−メタンスルホンアミド、および/または
(endo)−3−{2,2−ジフェニル−3−[(1−フェニル−メタノイル)−アミノ]−プロピル}−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタン臭化物
をはじめとした、米国特許出願60/511009に開示されている化合物が挙げられる。
【0197】
さらなる化合物としては:
(endo)−3−(2−メトキシ−2,2−ジ−チオフェン−2−イル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
(endo)−3−(2−シアノ−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
(endo)−3−(2−シアノ−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタン臭化物、
(endo)−3−(2−カルバモイル−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
(endo)−3−(2−シアノ−2,2−ジ−チオフェン−2−イル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、および/または
(endo)−3−{2,2−ジフェニル−3−[(1−フェニル−メタノイル)−アミノ]−プロピル}−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタン臭化物
が挙げられる。
【0198】
1つの実施形態において、本発明は、H1拮抗薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。H1拮抗薬の例としては、アンレキサノクス(amelexanox)、アステミゾール、アザタジン、アゼラスチン(azelastine)、アクリバスチン(acrivastine)、ブロムフェニラミン、セチリジン、レボセチリジン(levocetirizine)、エフレチリジン(efletirizine)、クロルフェニラミン、クレマスチン、シクリジン、カレバスチン(carebastine)、シプロヘプタジン、カルビノキサミン、デスカルボエトキシロラタジン、ドキシラミン、ジメチンデン、エバスチン(ebastine)、エピナスチン(epinastine)、エフレチリジン(efletirizine)、フェキソフェナジン、ヒドロキシジン、ケトチフェン、ロラタジン、レボカバスチン、ミゾラスチン(mizolastine)、メキタジン、ミアンセリン、ノベラスチン(noberastine)、メクリジン、ノルアステミゾール、オロパタジン、ピクマスト(picumast)、ピリラミン、プロメタジン、テルフェナジン、トリペレナミン、テメラスチン(temelastine)、トリメプラジンおよびトリプロリジン、特に、セチリジン、レボセチリジン、エフレチリジンおよびフェキソフェナジンが挙げられるがこれらに限定されない。さらなる実施形態において、本発明は、H3拮抗薬(および/または逆作動薬)とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。H3拮抗薬の例としては、例えば、WO2004/035556およびWO2006/045416に開示されている化合物が挙げられる。本発明の化合物と併用して使用され得る他のヒスタミン受容体拮抗薬としては、H4受容体の拮抗薬(および/または逆作動薬)、例えば、Jablonowskiら、J.Med.Chem.46:3957−3960(2003)に開示されている化合物が挙げられる。
【0199】
したがって、本発明は、さらなる態様において、PDE4阻害剤とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0200】
したがって、本発明は、さらなる態様において、β2−アドレナリン受容体作動薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0201】
したがって、本発明は、さらなる態様において、コルチコステロイドとともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0202】
したがって、本発明は、さらなる態様において、非ステロイド性GR作動薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0203】
したがって、本発明は、さらなる態様において、抗コリン薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0204】
したがって、本発明は、さらなる態様において、抗ヒスタミン剤とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0205】
したがって、本発明は、さらなる態様において、PDE4阻害剤およびβ2−アドレナリン受容体作動薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0206】
したがって、本発明は、さらなる態様において、抗コリン薬およびPDE−4阻害剤とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0207】
好ましい態様において、本発明は、コルチコステロイドとともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0208】
さらに好ましい態様において、本発明は、β2−アドレナリン受容体作動薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0209】
上で言及された組み合わせは、医薬組成物の形態として使用するために都合よく提供され得、ゆえに、薬学上許容可能な希釈剤または担体とともに上で規定されたような組み合わせを含む医薬組成物は、本発明のさらなる態様に相当する。
【0210】
そのような組み合わせの個別の化合物は、別個の医薬製剤または組み合わされた医薬製剤として、連続的にまたは同時に投与され得る。1つの実施形態において、それらの個別の化合物は、組み合わされた医薬製剤として同時に投与され得る。公知の治療薬の適切な用量は、当業者によって直ちに認識されるだろう。
【0211】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩と別の治療上活性な薬剤との組み合わせを含む医薬組成物を提供する。
【0212】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩とPDE4阻害剤との組み合わせを含む医薬組成物を提供する。
【0213】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩とβ2−アドレナリン受容体作動薬との組み合わせを含む医薬組成物を提供する。
【0214】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩とコルチコステロイドとの組み合わせを含む医薬組成物を提供する。
【0215】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩と非ステロイド性GR作動薬との組み合わせを含む医薬組成物を提供する。
【0216】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩と抗コリン薬との組み合わせを含む医薬組成物を提供する。
【0217】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩と抗ヒスタミン剤との組み合わせを含む医薬組成物を提供する。
【0218】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩とPDE4阻害剤およびβ2−アドレナリン受容体作動薬との組み合わせを含む医薬組成物を提供する。
【0219】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩と抗コリン薬およびPDE4阻害剤との組み合わせを含む医薬組成物を提供する。
【0220】
好ましい態様において、本発明は、式(I)の化合物またはその薬学上許容可能な塩とコルチコステロイドとの組み合わせを含む医薬組成物を提供する。
【0221】
さらに好ましい態様において、本発明は、式(I)の化合物またはその薬学上許容可能な塩とβ2−アドレナリン受容体作動薬との組み合わせを含む医薬組成物を提供する。
【0222】
本発明は、以下の非限定的な例によってここに例示される。
【実施例】
【0223】
以下の実施例は、本発明を例示するものである。これらの実施例は、本発明の範囲を限定することを目的としておらず、本発明の化合物、組成物を調製する指針、ならびに本発明の化合物、組成物および方法を使用する指針を当業者に提供することを目的としている。本発明の特定の実施形態を記載するが、当業者は、本発明の精神および範囲から逸脱することなく様々な変更および改変を行うことができることを認識するだろう。
【0224】
一般的な方法
LCMS法
方法A
このHPLC解析は、摂氏30度にて、Sunfire C18カラム(30mm×4.6mm内径,3.5μmの充填直径)において行われた。
【0225】
溶媒A=0.1%v/vのギ酸の水溶液。
【0226】
溶媒B=0.1%v/vのギ酸のアセトニトリル溶液。
【0227】
以下のグラジエントを使用した:
【表1】

【0228】
UV検出は、210nm〜350nmの波長からの平均シグナルであり、質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0229】
方法B
このHPLC解析は、摂氏40度にて、Acquity UPLC BEH C18カラム(50mm×2.1mm内径,1.7μm充填直径)において行った。
【0230】
溶媒A=0.1%v/vのギ酸の水溶液。
【0231】
溶媒B=0.1%v/vのギ酸のアセトニトリル溶液。
【0232】
以下のグラジエントを使用した:
【表2】

【0233】
UV検出は、210nm〜350nmの波長からの平均シグナルであり、質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0234】
方法C
陽イオンエレクトロスプレーモードにおいて作動するWaters ZQ質量分析計,質量範囲100〜1000amu。
【0235】
UV波長:215〜330nm
カラム:3.3cm×4.6mm内径,3μm ABZ+PLUS
流速:3ml/分
注入量:5μl
溶媒A:95%MeCN+0.05%の、1%v/vギ酸水溶液
溶媒B:10mmol酢酸アンモニウム(水溶液)中の0.1%v/vギ酸溶液
グラジエント:溶媒Aと溶媒Bとの混合物を、以下のグラジエントプロファイルに従って使用する(その混合物中の%溶媒Aとして表現される):0%A;0.7分間,0〜100%A;3.5分間,100%A;0.4分間,100〜0%A;0.2分間。
【0236】
方法D
カラム:Acquity UPLC BEH C18 1.7μm,2.1mm×50mm。40℃のカラムオーブン
溶媒A:10mmol酢酸アンモニウムを含む0.1%ギ酸水溶液
溶媒B:0.05%ギ酸を含む、MeCN:水(95:5,v/v)
注入量:0.5μl
注入法:パーシャルループオーバーフィル(Partial loop overfill)
UV検出:220〜330nm
UVサンプリング速度:40点/s
MSスキャン範囲:100〜1000amu
MSスキャン速度:0.2s/スキャン(0.1sのスキャン間遅延を伴う)
MSスキャン機能:ポジティブネガティブ切り換えを備えるエレクトロスプレー
サイクル時間:150s
流速:1ml/分
グラジエント:
【表3】

【0237】
方法E
カラム;Waters Sunfire C18,3.5μM,2.1mm内径×30mm。
【0238】
移動相
A:0.1%ギ酸(水溶液)
B:0.1%ギ酸(MeCN溶液)
流速;1ml/分
グラジエント;
【表4】

【0239】
MDAP法
質量分析連結自動分取HPLCおよびMSの条件
方法A
固定相
この精製に使用した固定相は、5μmの粒径を有するSunfire C18だった。
【0240】
小規模分取カラム
カラム寸法:100mm×19mm内径
大規模分取カラム
カラム寸法:150mm×30mm内径
溶離剤
以下の溶離剤を使用した:
A=0.1%v/vのギ酸の水溶液
B=0.1%v/vのギ酸のアセトニトリル溶液
30mgまでの粗サンプル用の小規模分取の方法
10種類の集中的(foucused)小規模(small scale)分取方法が利用可能である。方法の選択は、2つの因子に依存する。
【0241】
1.一般的な分析用LCMS法における目的の構成要素の保持時間(RT)
2.目的の構成要素の近くで溶出する不純物の存在
分析用のRTから、5種類の小規模集中的分取方法のうちの1つが選択される。小規模分取方法は、特定の有機範囲に対する7分間のグラジエントに続く8分間のフラッシュを含む最も極性の方法を除いて、特定の有機範囲に対する10分間のグラジエントに続く5分間のフラッシュを含む。総ラン時間は、15分である。
【0242】
目的の構成要素の近くで溶出する不純物が存在する場合、5種類の延長小規模集中的分取方法が利用可能である。延長小規模分取方法は、特定の有機範囲に対する14分間のグラジエントに続く11分間のフラッシュを含む最も極性の方法を除いて、特定の有機範囲に対する20分間のグラジエントに続く5分間のフラッシュを含む。総ラン時間は、25分である。
【0243】
すべての小規模方法に対する流速は、20ml/分であり、精製は、外界温度において行われる。
【0244】
小規模分取に対する注入量は、500μlである。
【0245】
上記の10種類の小規模分取方法およびグラジエントの有機範囲を以下に示す。これらのグラジエントは、通常ランまたは延長ランに対して同じである。
【0246】
5〜30%B
15〜55%B
30〜85%B
50〜99%B
80〜99%B
フラッシュ工程では、溶離剤Bを、0.5分間で99%に上げ、次いで、そこでさらに4.5分間保持する。
【0247】
90mgまでの粗サンプル用の大規模分取の方法
10種類の集中的大規模(large scale)分取方法が利用可能である。方法の選択は、小規模分取の場合と同じ2つの因子に依存する。ラン時間(グラジエントおよびフラッシュ)は、小規模分取方法の場合と同じである。
【0248】
すべての大規模方法に対する流速は、40ml/分であり、精製は、外界温度において行われる。
【0249】
大規模分取の場合の注入量は、980μlである。
【0250】
上記の5種類の大規模方法の名称およびグラジエントの有機範囲を以下に示す。これらのグラジエントは、通常ランまたは延長ランに対して同じである。
【0251】
5〜30%B
15〜55%B
30〜85%B
50〜99%B
80〜99%B
フラッシュ工程では、溶離剤Bを、0.5分間で99%に上げ、次いで、そこでさらに4.5分間保持する。
【0252】
UV検出
すべての方法に対するUV検出は、210nm〜350nmのすべての波長からの平均シグナルだった。
【0253】
MS条件
MS:Waters ZQ
イオン化モード:ポジティブとネガティブの交互スキャンのエレクトロスプレー
スキャン範囲:100〜1000amu
スキャン時間:0.50秒
スキャン間遅延:0.20秒
方法B
カラムの詳細:XBRIDGE C18カラム(100mm×19mm内径、5μm充填直径)
溶媒:
A:アンモニア(水溶液)でpH10に調整された10mmol重炭酸アンモニウム(水溶液)
B:MeCN
UV検出は、210nm〜350nmの波長からの平均シグナルであり、質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0254】
方法C
Sunfire,低pH
カラムの詳細:SUNFIRE C18カラム(100mm×19mm内径、5μm)
以下の溶媒を使用した:
A=ギ酸の0.1%v/v水溶液
B=ギ酸の0.1%v/vアセトニトリル(Acetontrile)溶液
方法A
【表5】

【0255】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0256】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0257】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0258】
方法B
【表6】

【0259】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0260】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0261】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0262】
方法C
【表7】

【0263】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0264】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0265】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0266】
方法D
【表8】

【0267】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0268】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0269】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0270】
方法E
【表9】

【0271】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0272】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0273】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0274】
質量分析連結自動分取HPLCのカラム、条件および溶離剤
方法D
カラムの詳細:SUNFIRE C18カラム(100mm×19mm内径、5μm)
以下の溶媒を使用した:
A=0.1%v/vのトリフルオロ酢酸の水溶液。
【0275】
B=0.1%v/vのトリフルオロ酢酸のアセトニトリル溶液。
【0276】
下記の方法は、精製される化合物の分析用の保持時間に基づいて選択される。
【0277】
方法1
【表10】

【0278】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0279】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0280】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0281】
方法2
【表11】

【0282】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0283】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0284】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0285】
方法3
【表12】

【0286】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0287】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0288】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0289】
方法4
【表13】

【0290】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0291】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0292】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0293】
方法5
【表14】

【0294】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0295】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0296】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0297】
中間体および実施例
化合物または試薬の名称の後に商業的供給業者の名称が与えられるとき(例えば、「化合物X(Aldrich)」または「化合物X/Aldrich」)、これは、化合物Xが、指名された商業的供給業者などの商業的供給業者から入手可能であることを意味する。化合物または試薬について本明細書中で言及されていない場合、それらは、標準的な供給業者(例えば、Sigma Aldrich、Lancaster、Fluorochem、TCIなど)から購入することができる。
【0298】
同様に、化合物の名称の後に文献または特許参考文献が与えられるとき(例えば、化合物Y(EP0123456))、これは、その化合物の調製法が、指名された参考文献に記載されていることを意味する。
【0299】
実施例の名称は、構造に名称をマッチさせる化合物命名プログラム(例えば、ACD/Name Batch v 9.0)を用いて得た。
【0300】
中間体1
N−[6−ブロモ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド
【化20】

【0301】
DCM(120ml)に溶解された6−ブロモ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−アミン(2.77g)をピリジン(1.135ml)で処理した。数分後、2−メチル−1,3−チアゾール−4−カルボニルクロリド(2.267g)を加え、その反応物をRTで1時間撹拌した。その反応物をDCMと飽和炭酸水素ナトリウム(aq)とに抽出した。有機層を乾燥させた。残渣をDCMに溶解し、フロリジル上に吸着させた後、ISCO companion上に固体充填することによって、シリカカラム(40g)およびシクロヘキサン中の40%〜100%酢酸エチルのグラジエントを用いる精製を行った。適切な画分を合わせ、蒸発乾固することにより、表題化合物2.66gを得た。
【0302】
LC/MS(方法B)Rt=1.17分,MH+=423.
【0303】
中間体2
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド
【化21】

【0304】
2本の別個のマイクロ波用バイアルに、N−[6−ブロモ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド(1.13g)、酢酸カリウム(799mg)、4,4,4’,4’,6,6,6’,6’−オクタメチル−2,2’−ビ−1,3,2−ジオキサボリナン(2.0g)およびPdCl2(dppf)(348mg)を量り入れた。これに、1,4−ジオキサン(17ml)を加え、その反応物をマイクロ波で80℃にて30分間加熱した。再度、バイアル2本を、マイクロ波を用いて80℃にて30分間加熱した。そして、合わせた反応混合物をメタノールとともに、メタノールでプレコンディショニングされたシリカカートリッジ(10g)に通して洗浄した。その溶液を乾燥させた。固体をDCMと水とに分離し、DCM層を乾燥させた。その材料をDCMおよびメタノール(数滴)に溶解し、フロリジル上に吸着させ、次いで、シクロヘキサン中の40%〜100%酢酸エチルを用いてISCO companion,シリカカラム(80g)において精製した。回収された画分を生成物について解析し、適切な画分を合わせることにより、表題化合物1.25gを得た。
【0305】
LCMS(方法B)Rt=1.35分,MH+=483.
【0306】
中間体3
6−ブロモ−4−ニトロ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール
【化22】

【0307】
ジヒドロピラン(100ml)中の6−ブロモ−4−ニトロ−1H−インダゾール(10g)に、TFA(0.068ml)を加え、その反応物を1.5時間加熱還流した。冷却後、DCM(180ml)および飽和炭酸水素ナトリウム溶液(50ml)を加え、10分間撹拌した。DCMを水相から分離し、それをDCM(70ml)で再度洗浄した。合わせた有機層を疎水性フリットに通し、蒸発乾固した。残留固体を、エーテルを用いて粉末にし(triturated)、次いで、濾過した。その固体材料をDCMに溶解し、均一濃度グラジエントのDCMを用いて、ISCO Companionのシリカにおけるクロマトグラフィーによって精製した。精製された画分を合わせ、蒸発乾固することにより、表題化合物7.78gを得た。
【0308】
LCMS(方法C);Rt=3.51分,MH−=326/328.
【0309】
中間体4
6−ブロモ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−アミン
【化23】

【0310】
6−ブロモ−4−ニトロ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール(6g)、鉄のやすりくず(3.29g)および塩化アンモニウム(0.492g)を250ml丸底フラスコに量り入れ、エタノール(60ml)、次いで、水(18ml)を加えた。その反応物を80℃に2.5時間加熱した。その反応混合物を冷却した。酢酸エチル(100ml)および水(50ml)を加えた。目に見える層の分離がなかったので、その反応物を濃縮することにより、酢酸エチルおよびエタノールを除去した。次いで、酢酸エチル(250ml)を加え、有機層を水(50ml)で洗浄した後、疎水性フリットに通した。有機層を蒸発乾固した。残渣を、シリカにおけるカラムクロマトグラフィー(120gシリカカラム,ISCO Companion)によって、DCM中の1〜2%メタノールのグラジエントで25分間にわたって溶出して精製した。所望の材料を含む画分を合わせ、蒸発乾固することにより、表題化合物3.95gを得た。
【0311】
LCMS(方法C);Rt=2.87分,MH−=298.
【0312】
中間体5
2−メチル−1,3−チアゾール−4−カルボニルクロリド
【化24】

【0313】
2−メチル−1,3−チアゾール−4−カルボン酸(1g)に、塩化チオニル(5ml)を加えた。混合物を80℃で8時間加熱した。塩化チオニル(5ml)を加え、混合物を80℃で2時間加熱した。さらに、塩化チオニル(5ml)を加え、混合物を2時間加熱した。その混合物を真空中で濃縮し、トルエンと共沸することにより、表題化合物1.12gを得た。
【0314】
1H NMR(DSMO)δ8.34(s,1H),2.80(s,3H)
【0315】
中間体6
1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−アミン
【化25】

【0316】
トルエン(15ml)中の、6−ブロモ−1−(フェニルスルホニル)−1H−インダゾール−4−アミン(1.3g)と、ヘキサメチル二スズ(2.4g)と、トリエチルアミン(1ml)と、Pd(PPh3)4(0.2g)との混合物を、マイクロ波照射下において120℃で1時間加熱した。その反応物を、溶離剤として軽質石油40〜60℃を用いてシリカカートリッジに適用した。これを、エーテル/軽質石油40〜60℃に変更した。適切な画分を蒸発させることにより、表題化合物1.2gを得た。
【0317】
LCMS(方法A);Rt=3.3分,MH+=438.
【0318】
中間体7
6−ブロモ−1−(フェニルスルホニル)−1H−インダゾール−4−アミン
【化26】

【0319】
6−ブロモ−1H−インダゾール−4−アミン(5g)をDMF(20ml)に溶解し、氷浴内で冷却した。鉱油中の60%水素化ナトリウム(0.94g)を少しずつ加え、その反応物を氷浴に30分間放置した。DMF(5ml)中の塩化ベンゼンスルホニル(3ml)を15分間にわたってゆっくり加え、その反応物を一晩放置してRTまで温めた。水(100ml)を加え、その反応物を20分間撹拌した。酢酸エチル(120ml)を加え、水相を分離し、酢酸エチル(50ml×2)で洗浄し、合わせた有機相を7.5%塩化リチウム(aq)(50ml×2)、次いで、水(50ml)で洗浄した後、分離し、疎水性フリットに通した。酢酸エチルを蒸発させ、残渣をシリカカートリッジに通し、DCM(約300ml)に続いてジエチルエーテル(約400ml)で溶出した。生成物を含む純粋画分を合わせ、蒸発乾固することにより、表題化合物5.9gを得た。
【0320】
LCMS(方法B);Rt=1.12分,MH+=354.
【0321】
中間体8
2−メチル−N−[1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド
【化27】

【0322】
DCM(4ml)中の2−メチル−1,3−チアゾール−4−カルボニルクロリド(350mg)を、DCM(15ml)およびピリジン(0.167ml)中の1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−アミン(300mg)に滴下した。その反応物をRTで一晩撹拌した。飽和炭酸水素ナトリウム(aq)(25ml)を加え、その反応物を15分間激しく撹拌した。DCM相を疎水性フリットに通し、次いで、蒸発乾固した。残渣を、DCMに溶解し、シクロヘキサンでプレコンディショニングされたシリカカートリッジにおいて精製し、シクロヘキサンで洗浄した後、エーテルで溶出した。エーテルを蒸発させることにより、表題化合物373mgを得た。
【0323】
LCMS(方法D)Rt=1.42分,MH+=563.
【0324】
中間体9
N−(5−ブロモ−2−クロロ−3−ピリジニル)−N−メチルベンゼンスルホンアミド
【化28】

【0325】
N−(5−ブロモ−2−クロロ−3−ピリジニル)ベンゼンスルホンアミド(300mg)をDMF(8ml)に溶解し、0℃に冷却した。水素化ナトリウム(鉱油中60%)(41mg)を一度に加えた。その反応物を15分間放置し、次いで、ヨウ化メチル(0.108ml)をゆっくり加えた。その反応物を10分間放置し、次いで、RTまで温めた。その反応物を水(20ml)でクエンチし、次いで、酢酸エチル(40ml)を加えた後、さらに水(20ml)を加えた。酢酸エチル相を分離し、水相をさらなる酢酸エチルで洗浄した。合わせた有機相をブラインで洗浄し、分離し、次いで、疎水性フリットに通した後、蒸発乾固した。残渣を40gシリカカートリッジに通し、シクロヘキサン中の60〜100%DCMで溶出して精製した。適切な画分を合わせ、蒸発乾固することにより、表題化合物192mgを得た。
【0326】
LCMS(方法B)Rt=1.16分,MH+=404.
【0327】
中間体10
N−(5−ブロモ−2−クロロ−3−ピリジニル)ベンゼンスルホンアミド
【化29】

【0328】
塩化ベンゼンスルホニル(2.24ml)を、DCM(25ml)中の5−ブロモ−2−クロロ−3−ピリジンアミン(2.5g)およびピリジン(1.5ml)の溶液に5〜10分間にわたって滴下した。その反応物をRTで18時間撹拌した後、真空中で蒸発乾固した。残渣は、2つに分け、シリカゲルクロマトグラフィーによってシクロヘキサン中の0〜100%DCMで溶出して精製した。適切な画分を合わせ、蒸発させることにより、表題化合物1.81gを得た。
【0329】
LCMS(方法D)Rt=1.09分,MH−=347.
【0330】
中間体11
5−ブロモ−2−クロロ−3−[(フェニルスルホニル)メチル]ピリジン
【化30】

【0331】
(5−ブロモ−2−クロロ−3−ピリジニル)メチルメタンスルホネート(644mg)をDMF(10ml)に溶解し、ベンゼンスルフィン酸ナトリウム(1179mg)を加えた。その反応物をRTで一晩撹拌した。飽和炭酸水素ナトリウム(20ml)を加えた後、水(20ml)および酢酸エチル(20ml)を加えた。水相を分離し、さらに酢酸エチルで洗浄した。合わせた有機相をブラインで洗浄し、次いで、疎水性フリットに通した。粗材料をDCMとともに5gシリカカートリッジに通した。その材料を40gシリカカートリッジにおいて、シクロヘキサン:DCM(60〜100%)で溶出して精製した。精製された画分を合わせ、蒸発させることにより、表題化合物480mgを得た。
【0332】
LCMS(方法B)Rt=1.06分,MH+=346.
【0333】
中間体12
(5−ブロモ−2−クロロ−3−ピリジニル)メチルメタンスルホネート
【化31】

【0334】
トリエチルアミン(0.564ml)およびDCM(12ml)を、(5−ブロモ−2−クロロ−3−ピリジニル)メタノール(600mg)に加えた。その反応物を0℃に冷却し、塩化メタンスルホニル(0.219ml)を滴下した。その反応物を30分間放置し、次いで、RTまで温めた。その反応物を飽和炭酸水素ナトリウム(aq)(20ml)で抽出し、DCM相を分離し、疎水性フリットに通し、次いで、蒸発乾固した。残渣を5gシリカカートリッジに通して、シクロヘキサン、次いで、シクロヘキサン:DCM(50:50,v/v)、次いで、DCMで洗浄して精製した。生成物を含む画分を合わせ、蒸発乾固し、次いで、高真空において乾燥することにより、表題化合物644mgを得た。
【0335】
LCMS(方法B)Rt=0.93分,MH+=302.
【0336】
中間体13
N−[6−(5−アミノ−6−クロロ−3−ピリジニル)−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド
【化32】

【0337】
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(0.75g)、5−ブロモ−2−クロロ−3−ピリジンアミン(0.39g)、炭酸ナトリウム(0.66g)およびPd(dppf)Cl2(0.114g)を、10〜20mlマイクロ波用バイアルに量り入れ、1,4−ジオキサン(8ml)、次いで、水(8ml)を加えた。その反応物を140℃で20分間加熱した。その反応物を10gシリカカートリッジに通して、メタノール:DCM(1:1,v/v)で洗浄した。溶媒を蒸発させ、残渣を、40g ISCO companionシリカカートリッジにおいて、40ml/分においてDCM(1%アンモニアを含む)中の1.5〜7.5%メタノールで溶出して精製した。純粋画分を合わせ、蒸発乾固することにより、表題化合物(335mg)を得た。
【0338】
LCMS(方法D)Rt=1.05分,MH+=469/471.
【0339】
中間体14
5−ブロモ−2−クロロ−3−[フルオロ(フェニルスルホニル)メチル]ピリジン
【化33】

【0340】
5−ブロモ−2−クロロ−3−[(フェニルスルホニル)メチル]ピリジン(309mg)を2−メチルテトラヒドロフラン(20ml)に溶解し、−78℃に冷却した。ナトリウムビス(トリメチルシリル)アミド(0.594ml)を滴下した。15分後、N−フルオロ−N−(フェニルスルホニル)ベンゼンスルホンアミド(281mg)を少しずつ加えた。その反応物を1時間撹拌した。その反応物を飽和炭酸アンモニウム(saturated ammonium cabonate)(aq)(10ml)でクエンチし、RTまで温めた。水相を分離し、有機相を飽和炭酸水素ナトリウム(aq)(15ml)で洗浄した後、疎水性フリットに通し、蒸発乾固した。残渣をメタノールで粉末にし、次いで、濾過した。その濾液を蒸発乾固し、次いで、高真空において乾燥することにより、表題化合物221mgを白色固体として得た。
【0341】
LCMS(方法B)Rt=1.17分,MH+=366.
【0342】
中間体15
2−メチル−N−[6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1−(フェニルスルホニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド
【化34】

【0343】
2−メチル−N−[1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(200mg)および5−ブロモ−3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン(98mg)およびPd(PPh3)4(41mg)を、DMF(2ml)中に入れ、混合物をマイクロ波で120℃において合計75分間加熱した。その反応混合物をMDAP(方法A)によって精製した。生成物を含む画分に窒素流を吹き付けることにより、表題化合物17mgを得た。
【0344】
LCMS(方法B)Rt=1.03分,MH−=592.
【0345】
中間体16
5−ブロモ−3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン
【化35】

【0346】
250ml丸底フラスコ内のDMF(100ml)中のN−{5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジニル}アセトアミド(3.71g)の溶液に、酢酸カリウム(1.185g)、酢酸(1.037ml)および無水酢酸(1.151ml)を加えた。その溶液をRTで撹拌した後、亜硝酸tert−ブチル(4.31ml)を15分間にわたって加えた。その反応物を2.5時間、60℃に加熱した。亜硝酸Tert−ブチル(1.43ml)を加えた。1時間後、酢酸カリウム(0.65g)および無水酢酸(0.6ml)を加えた。1時間後、その反応物を冷却し、水を加え(250ml)、飽和炭酸水素ナトリウム(aq)を用いてpHを8に調整し、次いで、酢酸エチルで分配し、水層を酢酸エチルで十分抽出した(3×300ml)。水相を酢酸エチル(3×150ml)で再抽出した。合わせた有機相を飽和炭酸水素ナトリウム(aq)、塩化リチウム(aq)(4×100ml)、ブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させた。水相をLiClおよびNaClで塩析し、酢酸エチルで再抽出した。有機相を合わせ、蒸発させ、次いで、高真空下に一晩置いた。残渣をDCMに溶解し、濾過し、120g Companion XLシリカカートリッジにおいて12カラム体積を超えるシクロヘキサン中の0〜100%酢酸エチルで溶出して精製することにより、表題化合物384mgを得た。
【0347】
LCMS(方法B)Rt=0.7分,MH+=278.
【0348】
中間体17
N−{5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジニル}アセトアミド
【化36】

【0349】
窒素下の1L丸底フラスコ内の酢酸(100ml)中の5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジンアミン(4.7g)に、無水酢酸(3.35ml)を加え、その反応物を80℃に加熱した。3時間後、無水酢酸(3.35ml)を加え、その反応物を一晩加熱した。その反応物を冷却し、酢酸エチル(200ml)と水(400ml)とに分配し、水層を、酢酸エチルで十分抽出した。合わせた有機相を水で洗浄し、次いで、撹拌する一方で、大きなコニカルフラスコに飽和炭酸水素ナトリウム(aq)を加えた後、2M NaOH(aq)をpH8まで加えた。有機相をブラインで洗浄し、MgSO4で乾燥し、濾過し、蒸発させた。上記からの酸性の水相をpH8にして、酢酸エチルで抽出し、単離された材料を前の材料と合わせ、酢酸エチルを加え、次いで、濾過することにより、表題化合物3.86gを得た。
【0350】
LCMS(方法B)Rt=0.49分,MH+=309.
【0351】
中間体18
5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジンアミン
【化37】

【0352】
窒素下の1L丸底フラスコ内のメタノール(200ml)中のビス(1,1−ジメチルエチル){5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジニル}イミドジ−カーボネート(8.82g)に、ジエチルエーテル中の1M HCl(190ml)を加えた。その反応物を70分間放置し、次いで、ジエチルエーテル中の1M HCl(95ml)を加えた。その反応物を3.5時間放置し、ジエチルエーテル中の1M HCl(95ml)を加え、その反応物を一晩放置した。さらに、ジエチルエーテル中の1M HClを加え(60ml)、その反応物を45分間放置した。その反応物の体積を約200mlまで減少させ、ジオキサン中の4M HCl(70ml)を加えた。その反応物を3.75時間放置し、次いで、蒸発乾固した。得られた固体の一部を、酢酸エチルと飽和炭酸水素ナトリウムとに分配し、水層を、酢酸エチルで十分抽出した。合わせた有機相をブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させることにより、遊離塩基を得た。残りの材料を同様に処理し、合わせ、次いで、蒸発乾固することにより、表題化合物4.85gを得た。
【0353】
LCMS(方法B)Rt=0.46分,MH+=267.
【0354】
中間体19
ビス(1,1−ジメチルエチル){5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジニル}イミドジカーボネート
【化38】

【0355】
500ml丸底フラスコ内のMeCN(150ml)中のビス(1,1−ジメチルエチル){5−ブロモ−3−[(メチルチオ)メチル]−2−ピリジニル}イミドジカーボネート(19.6g,61%純粋)の溶液に、オキソン(59.6g)および水(120ml)を加えた。混合物をRTで2.25時間撹拌した。混合物を酢酸エチルと水とに分配し、水層を酢酸エチルで十分抽出した。合わせた有機相をブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させた。その材料を、330g Companion XLシリカカートリッジにおいて、12カラム体積を超えるシクロヘキサン中の0〜40%酢酸エチルで溶出して精製した。純粋画分を蒸発させることにより、表題化合物8.82gを得た。
【0356】
LCMS(方法B)Rt=1.12分,MH+=367(1つのboc基の喪失).
【0357】
中間体20
ビス(1,1−ジメチルエチル){5−ブロモ−3−[(メチルチオ)メチル]−2−ピリジニル}イミド−ジカーボネート
【化39】

【0358】
窒素下の50ml丸底フラスコ内のTHF(300ml)中のビス(1,1−ジメチルエチル)[5−ブロモ−3−(ブロモメチル)−2−ピリジニル]イミドジカーボネート(26.1g,64%純粋)に、ナトリウムチオメトキシド(3.78g)を加えた。その反応物をRTで80分間撹拌した後、ナトリウムチオメトキシド(1.9g)を加えた。2.25時間後、その反応物を酢酸エチルと水とに分配し、水層を酢酸エチルで十分抽出した。合わせた有機相を水、ブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させた。残渣を、750g Companion XLシリカカートリッジにおいて、12カラム体積を超えるシクロヘキサン中の0〜20%酢酸エチルで溶出して精製した。生成物を含む画分を蒸発させることにより、粗表題化合物19.6g(次の工程で直接使用した)を得た。
【0359】
LCMS(方法B)Rt=1.34分,MH+=435.
【0360】
中間体21
ビス(1,1−ジメチルエチル)[5−ブロモ−3−(ブロモメチル)−2−ピリジニル]イミドジカーボネート
【化40】

【0361】
300W白色スポットライトを用いてその反応物を照射しつつ、窒素下の1L丸底フラスコ内の四塩化炭素(600ml)中のビス(1,1−ジメチルエチル)(5−ブロモ−3−メチル−2−ピリジニル)イミドジカーボネート(27.33g)に、N−ブロモスクシンイミド(13.19g)を等しく4回に分けて15分ごとに加えた。1.25時間後、過酸化ベンゾイル(1.71g)を加えた。2.5時間後、混合物を濾過し、次いで、水で分配した。有機相をチオ硫酸ナトリウム(aq)、ブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させた。残渣を、330gm Companion XLシリカカートリッジにおいて、12カラム体積を超えるシクロヘキサン中の0〜25%酢酸エチルで溶出して精製した。生成物を含む画分を蒸発させることにより、粗表題化合物23.8g(次の工程で直接使用した)を得た。
【0362】
LCMS(方法A)Rt=3.41分,MH+=467.
不純画分を合わせ、120g Companion XLシリカカートリッジを用いて、10カラム体積を超えるシクロヘキサン中の0〜25%酢酸エチルで溶出して再精製した。生成物を含む最も清浄な画分を蒸発させることにより、粗表題化合物2.3g(次の工程で直接使用した)を得た。
【0363】
LCMS(方法B)Rt=1.33分,MH+=467.
【0364】
中間体22
ビス(1,1−ジメチルエチル)(5−ブロモ−3−メチル−2−ピリジニル)イミドジカーボネート
【化41】

【0365】
500ml丸底フラスコ内の5−ブロモ−3−メチル−2−ピリジンアミン(14.78g)に、DCM(300ml)を加えた後、DIPEA(30.4ml)、DMAP(9.65g)およびビス(1,1−ジメチルエチル)ジカーボネート(36.7ml)を加えた。その反応物を窒素下においてRTで1時間50分間撹拌した。その反応物をDCMと水とに分配し、水層を、DCMで十分抽出した。合わせた有機相を0.5M HCl(aq)、水、ブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させた。残渣をエーテル(約120ml)で粉末にし、いくらかのシクロヘキサンを加え、真空濾過により固体を回収した。これを、蒸発させた濾液と合わせ、330g Companion XLシリカカートリッジにおいて、10カラム体積を超えるシクロヘキサン中の0〜50%酢酸エチルで溶出して精製することにより、表題化合物27.33gを得た。
【0366】
LCMS(方法B)Rt=1.3分,MH+=389.
【0367】
中間体23
N−(6−ブロモ−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド
【化42】

【0368】
2−メチル−1,3−チアゾール−4−カルボン酸(4.59g)、HATU(13.4g)およびDIPEA(16.8ml)を、DMF(140ml)中において20℃で30分間撹拌した。6−ブロモ−1H−インダゾール−4−アミン(3.40g)を加え、その反応物を20℃で2日間撹拌した。溶媒を約40mlまで減少させ、その反応混合物を5×70gアミノプロピルSPEカートリッジに適用し、3時間静置した。それらのカートリッジをDCM:MeOH(1:1,v/v)で溶出し、溶媒を真空中で蒸発させた。残渣を、シリカゲルクロマトグラフィーによってDCM中の0〜15%メタノール(1%Et3Nを含む)で溶出して精製した。適切な画分を蒸発させることにより、表題化合物1.02gを得た。
【0369】
LC/MS(方法D)Rt=0.96分,MH+=339.
【0370】
中間体24
4−クロロ−N−[5−クロロ−2−(メチルオキシ)−3−ピリジニル]−3−(トリフルオロメチル)ベンゼン−スルホンアミド
【化43】

【0371】
4−クロロ−3−(トリフルオロメチル)ベンゼンスルホニルクロリド(56mg)を、ピリジン(1ml)に溶解し、DMAP(2mg)を加えた。5−クロロ−2−(メチルオキシ)−3−ピリジンアミン(32mg)を加え、その反応物を100℃に2時間加熱した。その反応物を、HPLCによって20〜80%MeCN:水:TFAを用いて精製することにより、表題化合物72mgを得た。
【0372】
LC/MS(方法E)Rt=3.13分,MH+=401.
【0373】
実施例1
N−{6−[5−アミノ−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド
【化44】

【0374】
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(50mg)、5−ブロモ−2−(メチルオキシ)−3−ピリジンアミン(21mg)およびPd(dppf)Cl2(8mg)をマイクロ波用バイアル内で合わせた。1,4−ジオキサン(0.5ml)を加えた後、水(0.5ml)に溶解された炭酸ナトリウム(44mg)を加えた。その反応物をマイクロ波で140℃において20分間加熱した。その反応物をシリカカートリッジ(1g)で濾過し、DCM:メタノール(3:1)で洗浄した。次いで、溶媒を窒素流の下で除去した。残渣をDMSO(1.2ml)およびメタノール(0.4ml)に溶解し、MDAP(方法D)を用いて精製した。生成物を含む画分を一晩放置することにより、脱保護した。残渣を1,4−ジオキサン:水(2ml,1:1,v/v)に溶解し、フリーズドライした。残渣をDCMに溶解し、数滴のTFAを加え、その反応物を一晩放置した。残渣を、MDAP(方法A)によってさらに精製し、次いで、窒素を吹き付けて乾燥することにより、表題化合物10mgを得た。
【0375】
LCMS(方法B)Rt=0.85分,MH+=381.
以下を、ボロン酸エステルおよび適切な臭化物から同様に調製した;
【表15】

【0376】
実施例5
N−[6−(5−アミノ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド
【化45】

【0377】
2−メチル−N−[1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(1g)をDMF(4ml)に溶解し、マイクロ波用容器内のDMF(400μl)中の5−ブロモ−3−ピリジンアミン(0.18mmol)に400μlを分注した。Solvias触媒(4mg)を加え、その反応物をAnton Parrマイクロ波で、最初の700Wを用いて135℃に20分間加熱した。その溶液をC18 SPE(MeCN中の0.1%TFAでプレコンディショニングされた)上に充填し、MeCN中の0.1%TFA(3ml)とともに流した。窒素を吹き付けて溶媒を除去した。サンプルをDMSO(0.5ml)に溶解し、MDAP(方法C)によって精製した。Genevacを用いて真空中で溶媒を蒸発させた。サンプルをIPA(300μl)に溶解し、2M NaOH(aq)(300μl)を加えた。その反応物を一晩放置した。サンプルをDMSO(0.6ml)に溶解し、MDAP(方法C)によって精製した。Genevacを用いて溶媒を真空中で蒸発させることにより、表題化合物4mgを得た。
【0378】
LCMS(方法B)Rt=0.55分,MH+=351.
以下を、適切な臭化物から同様に調製した;
【表16】

【0379】
実施例8
{[3−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)フェニル]オキシ}酢酸
【化46】

【0380】
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(50mg)、[(3−ブロモフェニル)オキシ]酢酸(7.6mg)および炭酸ナトリウム(44mg)をマイクロ波用バイアルに加えた。Pd(dppf)Cl2(24mg)を加えた後、1,4−ジオキサン(0.5ml)および水(0.5ml)を加えた。その反応物をマイクロ波で140℃において20分間加熱した。その材料をDCM:メタノールとともに1gシリカカートリッジに通した。残渣をDMSO:メタノール(1.6ml,1:1,v/v)に溶解し、C18カートリッジ(1g)に通し、MeCNで洗浄し、窒素を吹き付けて蒸発させた。残渣をDMSO:メタノール(1.6ml,1:1,v/v)に溶解し、MDAP(方法D)によって精製した。純粋画分を合わせ、窒素を吹きつけ、1,4−ジオキサン:水(約3ml,1:1,v/v)に懸濁し、フリーズドライした。MDAP(方法A)によるさらなる精製から、表題化合物9mgを得た。
【0381】
LCMS(方法B)Rt=0.9分,MH+=409.
以下を、適切な臭化物から同様に調製した;
【表17−1】

【表17−2】

【0382】
*2M HCl(aq)をMDAP画分に加えた後、乾燥した。
【0383】
#MDAPによって精製しなかった;1gシリカカートリッジに通し、次いで、2M HCl(aq)とともに撹拌した。
【0384】
実施例16
フェニルメチル[2−クロロ−5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジニル]カルバメート
【化47】

【0385】
DCM(2ml)およびDIPEA(0.037ml)を、N−[6−(5−アミノ−6−クロロ−3−ピリジニル)−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド(50mg)に加え、その反応物を撹拌した。フェニルメチルクロリドカーボネート(0.023ml)を加え、その反応物をRTで一晩撹拌した。その反応物を蒸発乾固した。ピリジン(1ml)を加えた後、フェニルメチルクロリドカーボネート(0.023ml)を加え、その反応物をRTで4時間撹拌した。DMAP(3mg)を加えた後、フェニルメチルクロリドカーボネート(0.023ml)を加え、その反応物をRTで撹拌した。フェニルメチルクロリドカーボネート(0.05ml)を加え、その反応物を一晩放置した。フェニルメチルクロリドカーボネート(0.05ml)を加え、その反応物をRTで1時間撹拌した。フェニルメチルクロリドカーボネート(0.05m)を加え、その反応物をRTで2時間撹拌した。2M HCl(aq)およびDCMを加えた。DCMを分離し、疎水性フリットに通し、蒸発乾固した。残渣をDMSO:メタノール(1ml,7:3,v/v)に溶解し、MDAP(方法A)によって精製した。生成物を含む画分を蒸発乾固し、メタノール(3ml)および数滴の2M HCl(aq)を加え、その反応物を1時間撹拌した。その反応物を蒸発乾固することにより、表題化合物13mgを得た。
【0386】
LCMS(方法B)Rt=1.17分,MH+=519
【0387】
実施例17
N−(6−{6−クロロ−5−[フルオロ(フェニルスルホニル)メチル]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド
【化48】

【0388】
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(62mg)、5−ブロモ−2−クロロ−3−[フルオロ(フェニルスルホニル)メチル]ピリジン(47mg)、Pd(dppf)Cl2(9mg)および炭酸ナトリウム(54mg)をマイクロ波用バイアル内で合わせた。1,4−ジオキサン(0.5ml)および水(0.5ml)を加え、その反応物をマイクロ波で140℃において20分間加熱した。その反応物を、メタノールでプレコンディショニングされた1gシリカカートリッジに通し、メタノールで洗浄した。窒素を吹き付けて溶媒を除去した。残渣をメタノール:DMSO(1:1,v/v)に溶解し、MDAP(方法A)によって精製した。画分を一晩放置し、次いで、回転蒸発によって溶媒を除去した。残渣をメタノールに溶解し、数滴の2M HCl(aq)を加えた。その反応物をRTで1時間放置し、次いで、窒素を吹き付けて溶媒を除去することにより、表題化合物3mgを得た。
【0389】
LCMS(方法B)Rt=1.12分,MH+=542.
【0390】
実施例18
2−メチル−N−{6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド
【化49】

【0391】
IPA(0.5ml)中の2−メチル−N−[6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1−(フェニルスルホニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(20mg)の懸濁液に、2M NaOH(aq)(0.5ml)を加え、その混合物を20℃で3時間撹拌した。IPAを窒素流の下で除去し、水相を2M HCl(aq)で中和し、次いで、DCMで抽出し、それを、疎水性フリットを用いて分離した。水層を酢酸エチルで抽出し、有機抽出物を合わせ、溶媒を真空中、次いで、窒素流の下で抽出することにより、表題化合物9mgを得た。
【0392】
LCMS(方法B)Rt=0.77分,MH−=452.
【0393】
実施例19
2−メチル−N−{6−[5−(4−モルホリニルスルホニル)−3−ピリジニル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド
【化50】

【0394】
2−メチル−N−[1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(50mg)を、Pd(PPh3)4(10mg)および4−[(5−ブロモ−3−ピリジニル)スルホニル]モルホリン(30mg)とともに、マイクロ波用バイアルに入れた。DMF(2ml)を加え、その反応物をマイクロ波で120℃において15分間加熱した。その残渣に、IPA(2ml)および2M NaOH(aq)(1ml)を加え、混合物をRTで3時間撹拌した。溶媒に窒素を吹き付け、その残渣をMDAP(方法A)によって精製することにより、表題化合物17mgを白色固体として得た。
【0395】
LCMS(方法B)Rt=0.86分,MH+=485.
【0396】
実施例20
2−メチル−N−[6−(1H−ピラゾール−4−イル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド
【化51】

【0397】
1,4−ジオキサン(1ml)中の4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール(23mg)に、1,4−ジオキサン(1ml)に溶解されたN−(6−ブロモ−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド(36mg)を加えた。水(0.2ml)に溶解された炭酸カリウム(18mg)およびPd(dppf)Cl2(10mg)を加え、その反応物をマイクロ波で150℃に30分間加熱した。Genevacを用いて、真空中で溶媒を蒸発させた。残渣を、C18カートリッジ(500mg)にメタノール中において充填し、MeCN:0.1%TFA(3×3ml)を用いて溶出した。適切な画分を合わせ、窒素流の下で乾燥した。サンプルをMeOH:DMSO(0.5ml,1:1)に溶解し、MDAP(方法B)によって精製した。Genevacを用いて真空中で溶媒を蒸発させることにより、表題化合物0.3mgを得た。
【0398】
LCMS(方法B)Rt=0.67分,MH+=325.
以下を、適切な臭化物から同様に調製した;
【表18】

【0399】
実施例23
N−[6−(1−アセチル−2,3−ジヒドロ−1H−インドール−4−イル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド
【化52】

【0400】
1,4−ジオキサン(0.4ml)中の2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(53mg)を、1−アセチル−4−ブロモ−2,3−ジヒドロ−1H−インドール(24mg)に加えた。1,4−ジオキサン(0.4ml)を加えた後、Solvias触媒(2mg)(マイクロスパーテル山盛り)および水(0.2ml)中のリン酸三カリウム(212mg)を加えた。その反応物をマイクロ波(mirowave)で110℃に20分間加熱した。次いで、その溶液をC18 SPE(MeCN:0.1%TFAでプレコンディショニングされたもの)上に充填し、MeCN:0.1%TFA(3ml)とともに流した。窒素を吹き付けて溶媒を除去した。残渣をメタノール(500μl)に溶解し、メタノールでプレコンディショニングされたSCX−2 SPE(1g)上に充填した。その化合物をカラム上で1時間放置し、次いで、メタノール中の2Mアンモニアで溶出した。サンプルをDMSO(0.5ml)に溶解し、MDAP(方法B)によって精製した。Genevacを用いて真空中で溶媒を蒸発させることにより、表題化合物8mgを得た。
【0401】
LCMS(方法B)Rt=0.9分,MH+=418.
【0402】
実施例24
N−{6−[5−({[4−クロロ−3−(トリフルオロメチル)フェニル]スルホニル}アミノ)−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミドトリフルオロアセテート
【化53】

【0403】
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(50mg)、Pd(dppf)Cl2(8mg)および炭酸ナトリウム(44mg)をマイクロ波用バイアルに加えた。4−クロロ−N−[5−クロロ−2−(メチルオキシ)−3−ピリジニル]−3−(トリフルオロメチル)ベンゼンスルホンアミド(42mg)を加えた後、1,4−ジオキサン(0.5ml)および水(0.5ml)を加えた。その反応物を140℃で30分間加熱した。その材料を、DCM:メタノールとともに1gシリカカートリッジに通し(passed though)、次いで、蒸発乾固した。残渣をDMSO:メタノール(1.6ml,1:1,v/v)に溶解し、MeCNで洗浄する1g C18カートリッジに通し、窒素を吹き付けて蒸発させた。残渣をDMSO:メタノール(1.6ml,1:1,v/v)に溶解し、MDAP(方法D)によって精製した。純粋画分を合わせ、吹きつけ、1,4−ジオキサン:水(約3ml,1:1,v/v)に懸濁し、フリーズドライすることにより、表題化合物7mgを得た。
【0404】
LCMS(方法B)Rt=1.21分,MH+=623.
【0405】
生物学的データ
PI3Kアルファ、ベータ、デルタおよびガンマアッセイ
アッセイ原理
アッセイ読み出しは、シグナルが生成される際の、単離されたプレクストリン相同(PH)ドメインへのPIP3の特異的かつ高親和性の結合を活用する。簡潔には、PIP3生成物は、ユウロピウム(Eu)で標識された抗GSTモノクローナル抗体、GSTでタグ化されたPHドメイン、ビオチン−PIP3およびストレプトアビジン−APCからなるエネルギー転移複合体からのビオチン化PIP3の置換によって検出される。Euの励起によって、エネルギーがAPCに転移し、感光性を与えられた蛍光が665nmで発光する。PI3キナーゼ活性によって形成されたPIP3は、PHドメイン上の結合部位について競合することから、エネルギー転移の喪失およびシグナルの低下がもたらされる。
【0406】
アッセイプロトコル
典型的には、固体の化合物を、384ウェルv底小容量Greinerプレートの全ウェル(カラム6および18を除く)に0.1μlの100%DMSOとともにプレーティングする。それらの化合物を、カラム1からカラム12およびカラム13からカラム24に向かって、プレートを横切って段階希釈し(100%DMSOで4倍の段階希釈)、カラム6および18はDMSOだけが入った状態で放置することにより、各試験化合物について11個の濃度を得る。
【0407】
Millipore製の特定のPI3キナーゼキット(Cat#33−001)を用いて、アッセイを行う。このアッセイキットは、以下からなる:
・4×PI3K反応緩衝液(200mM Hepes pH7、600mM NaCl、40mM Mgcl2、<1%Cholate(w/v)、<1%Chaps(w/v)、0.05%アジ化ナトリウム(w/v)を含む)
・PIP2(1mM)
・3×Biotin PIP3(50μM)
・検出混合液C(267mM KFを含む)
・検出混合液A(60μg/ml ストレプトアビジン(streptavadin)−APCを含む)
・検出混合液B(36μg/mlユウロピウム−抗GST(抗GST−K)および90μg/ml GST−GRP1−PH−ドメインおよび1mM DTTを含む)
・停止液(150mM EDTAを含む)
100%阻害コントロール(活性なし)のために、3μlの反応緩衝液(1mM DTTを含む)をカラム18だけに手動で加える。
【0408】
カラム18以外のすべてのウェルに3μlの2×酵素液を手動で加える。化合物とともに15分間プレインキュベートする。
【0409】
3μlの2×基質溶液をすべてのウェルに手動で加える(カラム6は、0%阻害コントロールに相当する)
プレートを1時間放置する(光から保護する)(ガンマについては、50分間のインキュベーションが必要とされるだけである)
3μlの停止/検出液をすべてのウェルに手動で加える。
【0410】
プレートを1時間放置する(光から保護する)。
【0411】
BMG Rubystarにおいてアッセイを読み出し、比率のデータを利用して11点の曲線を作成する。
【0412】
NB基質溶液(濃度)は、各アイソフォームによって異なる(下記を参照のこと)。
【0413】
アルファ
500μM ATP、16μM PIP2および0.030μM 3×ビオチン−PIP3を含む2×基質溶液。
【0414】
ベータ
800μM ATP、16μM PIP2および0.030μM 3×ビオチン−PIP3を含む2×基質溶液。
【0415】
デルタ
160μM ATP、10μM PIP2および0.030μM 3×ビオチン−PIP3を含む2×基質溶液。
【0416】
ガンマ
30μM ATP、16μM PIP2および0.030μM 3×ビオチン−PIP3を含む2×基質溶液。
【0417】
解析方法
データを、Activity BaseにおいてXC50 4−パラメータロジスティック曲線当てはめアルゴリズムによって処理した。
【0418】
高コントロールと低コントロール(それぞれ0%および100%阻害)との間の%阻害に正規化する。
【0419】
1次モジュールフィット:傾き、最小(Min)および最大漸近線(Max asymptotes)は変動する
2次モジュールフィット:(1)最小漸近線を固定、(2)最大漸近線を固定、(3)最小および最大漸近線を固定
カーブフィットQC:pXC50 95%CL比>10
−20<最小漸近線<20
80<最大漸近線<120
実施例1〜24の化合物を、上記のPI3Kアルファ、ベータ、デルタおよび/もしくはガンマアッセイまたは類似のアッセイのうちの1つ以上において試験し、5またはそれ以上の平均pIC50を有することが見出された。
【技術分野】
【0001】
本発明は、ホスホイノシチド3’OHキナーゼファミリー(本明細書中以後、PI3−キナーゼ)の活性または機能の阻害剤である、特定の新規化合物、それらを調製するためのプロセス、それらの化合物を含んでなる医薬組成物、および様々な障害の治療におけるその化合物または組成物の使用に関する。より詳細には、本発明の化合物は、例えば、PI3Kδ、PI3Kα、PI3Kβおよび/またはPI3Kγの活性または機能の阻害剤である。PI3−キナーゼの活性または機能の阻害剤である化合物は、障害(例えば、喘息および慢性閉塞性肺疾患(COPD)を含む呼吸器疾患、アレルギー性鼻炎およびアトピー性皮膚炎を含むアレルギー性疾患、関節リウマチおよび多発性硬化症を含む自己免疫疾患、炎症性腸疾患を含む炎症性障害、血栓症およびアテローム性動脈硬化症を含む循環器疾患、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、ならびに関節リウマチまたは変形性関節症に伴う疼痛、背痛、一般的な炎症性疼痛、肝後方神経痛、糖尿病性ニューロパシー、炎症性神経因性疼痛(トラマ(trama))、三叉神経痛および中枢性疼痛を含む疼痛)の治療において有用であり得る。
【背景技術】
【0002】
細胞膜は、種々のシグナル伝達経路に参加することができるセカンドメッセンジャーの大きな貯蔵所に相当する。リン脂質シグナル伝達経路におけるエフェクター酵素の機能および制御に関して、クラスI PI3−キナーゼ(例えば、PI3Kデルタ)は、膜リン脂質プールからセカンドメッセンジャーを生成する。クラスI PI3Kは、膜リン脂質PI(4,5)P2を、セカンドメッセンジャーとして機能するPI(3,4,5)P3に変換する。PIおよびPI(4)Pも、PI3Kの基質であり、リン酸化されて、それぞれPI3PおよびPI(3,4)P2に変換され得る。さらに、これらのホスホイノシチドは、5’特異的および3’特異的なホスファターゼ(phophatases)によって他のホスホイノシチドに変換され得る。このように、PI3Kの酵素活性は直接または間接的に、細胞内のシグナル伝達経路においてセカンドメッセンジャーとして機能する2つの3’−ホスホイノシチドサブタイプを生成する(Vanhaesebroeckら、Trends Biochem.Sci.22(7)p.267−72(1997)(非特許文献1);Leslieら、Chem.Rev.101(8)p.2365−80(2001)(非特許文献2);Katsoら、Annu.Rev.Cell Dev.Biol.17 p.615−75(2001)(非特許文献3);およびToker,Cell.Mol.Life Sci.59(5)p.761−79(2002)(非特許文献4))。現在まで、8種類の哺乳動物PI3Kが同定されており、配列相同性、構造、結合パートナー、活性化の様式および基質優先性に基づいて、主要な3つのクラス(I、IIおよびIII)に分類されている。インビトロでは、クラスI PI3Kは、ホスファチジルイノシトール(PI)、ホスファチジルイノシトール−4−リン酸(PI4P)およびホスファチジルイノシトール−4,5−二リン酸(PI(4,5)P2)をリン酸化することにより、それぞれホスファチジルイノシトール−3−リン酸(PI3P)、ホスファチジルイノシトール−3,4−二リン酸(PI(3,4)P2およびホスファチジルイノシトール−3,4,5−三リン酸(PI(3,4,5)P3を生成することができる。クラスII PI3Kは、PIおよびPI4Pをリン酸化することができる。クラスIII PI3Kは、PIだけをリン酸化することができる(Vanhaesebroeckら、(1997)上記;Vanhaesebroeckら、Exp.Cell Res.253(1)p.239−54(1999)(非特許文献5);およびLeslieら、(2001)上記)。
【0003】
クラスI PI3Kは、p110触媒サブユニットおよび調節サブユニットからなるヘテロ二量体であり、このファミリーはさらに、調節パートナーおよび制御機構に基づいて、クラスIaおよびクラスIb酵素に分類される。クラスIa酵素は、異なる5つの調節サブユニット(p85α、p55α、p50α、p85βおよびp55γ)と二量体化する異なる3つの触媒サブユニット(p110α、p110βおよびp110δ)からなり、すべての触媒サブユニットが、すべての調節サブユニットと相互作用することができ、それにより、種々のヘテロ二量体を形成する。クラスIa PI3Kは、一般に、受容体型チロシンキナーゼの成長因子刺激に応答して活性化され、その活性化は、調節サブユニットSH2ドメインと、その活性化された受容体の特定のホスホ−チロシン残基またはIRS−1などのアダプタータンパク質との相互作用を介する。低分子量GTPase(例としてras)も、受容体型チロシンキナーゼの活性化とともに、PI3Kの活性化に関わる。p110αとp110βの両方が、すべての細胞型において構成的に発現されるのに対し、p110δの発現は、白血球集団およびいくつかの上皮細胞に限定される。対照的に、単一のクラスIb酵素は、p101調節サブユニットと相互作用するp110γ触媒サブユニットからなる。さらに、クラスIb酵素は、Gタンパク質共役受容体(GPCR)系に応答して活性化され、その発現は、白血球に限定されるとみられる。
【0004】
スキームA:PI(4,5)P2からPI(3,4,5)P3への変換
【化1】

【0005】
上記のスキームAに図示されるように、ホスホイノシチド3−キナーゼ(PI3K)は、イノシトール環の3番目の炭素のヒドロキシルをリン酸化する。PtdIns(3,4,5)P3、PtdIns(3,4)P2およびPtdIns(3)Pを生成するホスホイノシチドのリン酸化は、細胞増殖、細胞分化、細胞成長、細胞サイズ、細胞生存、アポトーシス、接着、細胞運動、細胞遊走、走化性、浸潤、細胞骨格再編成、細胞形態の変化、小胞輸送および代謝経路に不可欠なシグナル伝達経路を含む種々のシグナル伝達経路に対するセカンドメッセンジャーを生成する(Katsoら、(2001)上記;およびSteinら、Mol.Med.Today 6(9)p.347−57(2000)(非特許文献6))。
【0006】
これらのリン酸化されたシグナル伝達産物の生成に関与するPI3−キナーゼの活性は、元来、ウイルス腫瘍性タンパク質、ならびにホスファチジルイノシトール(PI)およびそのリン酸化された誘導体をイノシトール環の3’−ヒドロキシルにおいてリン酸化する成長因子受容体型チロシンキナーゼに関連するものとして同定された(Panayotouら、Trends Cell Biol.2 p.358−60(1992)(非特許文献7))。しかしながら、より最近の生化学的研究から、クラスI PI3−キナーゼ(例えば、クラスIAアイソフォームPI3Kδ)が、二重特異性キナーゼ酵素(これは、その酵素が脂質キナーゼ活性(ホスホイノシチドのリン酸化)とタンパク質キナーゼ活性との両方を示すことを意味する)であり、基質として他のタンパク質をリン酸化すること(分子内の制御機構としての自己リン酸化を含む)ができることが明らかになった(Vanhaesebroeckら、EMBO J.18(5)p.1292−302(1999)(非特許文献8))。PI3Kが必須の役割を果たす細胞プロセスには、アポトーシスの抑制、アクチン骨格の再構築、心筋細胞の成長、インスリンによるグリコーゲンシンターゼ刺激、TNFαが媒介する好中球プライミングおよびスーパーオキシド生成、ならびに白血球の遊走および内皮細胞への接着が含まれる。
【0007】
PI3−キナーゼの活性化は、細胞の成長、分化およびアポトーシスを含む幅広い細胞応答に関わると考えられている(Parker,Current Biology,5(6)p.577−79(1995)(非特許文献9);およびYaoら、Science 267(5206)p.2003−06(1995)(非特許文献10))。PI3−キナーゼは、白血球活性化のいくつかの態様に関わるとみられる。p85が会合したPI3−キナーゼは、抗原に応答したT細胞活性化に対する重要な共刺激分子であるCD28の細胞質ドメインと物理的に会合すると示されている(Pagesら、Nature 369 p.327−29(1994)(非特許文献11);およびRudd,Immunity 4 p.527−34(1996)(非特許文献12))。CD28によるT細胞の活性化は、抗原による活性化に対する閾値を低下させ、増殖応答の規模および持続時間を増加させる。これらの作用は、重要なT細胞成長因子であるインターロイキン−2(IL2)を含むいくつかの遺伝子の転写の増加につながる(Fraserら、Science 251(4991)p.313−16(1991)(非特許文献13))。
【0008】
PI3Kγは、JNK活性のGベータ−ガンマ依存的制御のメディエーターと同定されており、Gベータ−ガンマは、ヘテロ三量体Gタンパク質のサブユニットである(Lopez−Ilasacaら、J.Biol.Chem.273(5)p.2505−8(1998)(非特許文献14))。最近(Laffargueら、Immunity 16(3)p.441−51(2002)(非特許文献15))、PI3Kγが、様々なG(i)共役受容体を介して炎症性シグナルを中継し、マスト細胞の機能、白血球における刺激、免疫学(例えば、サイトカイン、ケモカイン、アデノシン、抗体、インテグリン、凝集因子、成長因子、ウイルスまたはホルモンを含む)にとって中心的であることが報告された(Lawlorら、J.Cell Sci.114(Pt 16)p.2903−10(2001)(非特許文献16);Laffargueら、Immunity 16(3)p.441−51(2002)(非特許文献17);およびStephensら、Curr.Opinion Cell Biol.14(2)p.203−13(2002)(非特許文献18))。
【0009】
酵素ファミリーの個別のメンバーに対する特異的な阻害剤は、各酵素の機能を解明するための貴重なツールを提供する。2種の化合物、LY294002およびワートマニン(本明細書中以後)が、PI3−キナーゼ阻害剤として広く使用されている。これらの化合物は、クラスI PI3−キナーゼの4つのメンバーを区別しないので、非特異的なPI3K阻害剤である。例えば、様々なクラスI PI3−キナーゼの各々に対するワートマニンのIC50値は、1〜10nMの範囲である。同様に、これらのPI3−キナーゼの各々に対するLY294002のIC50値は、約15〜20μMであり(Frumanら、Ann.Rev.Biochem.67 p.481−507(1998)(非特許文献19))、また、CK2タンパク質キナーゼに対しては5〜10μMであり、ホスホリパーゼに対してはいくらかの阻害活性がある。ワートマニンは、PI3Kの触媒ドメインに共有結合することによって、この酵素の活性を不可逆的に阻害する真菌の代謝産物である。ワートマニンによるPI3K活性の阻害は、その後の細胞外因子への細胞応答を無くす。例えば、好中球は、PI3Kを刺激してPtdIns(3,4,5)P3を合成することによって、ケモカインfMet−Leu−Phe(fMLP)に応答する。この合成は、侵入微生物の好中球破壊に関わる呼吸バーストの活性化と相関する。好中球をワートマニンで処理することにより、fMLPによって誘導される呼吸バースト応答が妨げられる(Thelenら、Proc.Natl.Acad.Sci.USA 91 p.4960−64(1994)(非特許文献20))。実際に、ワートマニンを用いたこれらの実験ならびに他の実験的証拠は、造血系の細胞、特に、好中球、単球および他のタイプの白血球におけるPI3Kの活性が、急性および慢性炎症に関連する非記憶免疫応答の多くに関わることを示している。
【化2】

【0010】
ワートマニンを使用した研究に基づくと、PI3−キナーゼの機能が、Gタンパク質共役受容体を介した白血球シグナル伝達のいくつかの態様にとってもまた必要であるという証拠が存在する(Thelenら、(1994)上記)。さらに、ワートマニンおよびLY294002は、好中球遊走およびスーパーオキシド放出を阻止すると示されている。
【0011】
現在、癌遺伝子および癌抑制遺伝子の調節解除が、例えば、細胞の成長および増殖の増加または細胞生存の増加を介して、悪性腫瘍の形成に寄与すると十分理解されている。PI3Kファミリーによって媒介されるシグナル伝達経路が、増殖および生存を含むいくつかの細胞プロセスにおいて中心的役割を有すること、ならびにこれらの経路の調節解除が、広範囲のヒト癌および他の疾患を引き起こす因子であることも、現在知られている(Katsoら、Annual Rev.Cell Dev.Biol.(2001)17 p.615−675(非特許文献21)およびFosterら、J.Cell Science(2003)116(15)p.3037−3040(非特許文献22))。PI3Kエフェクタータンパク質は、PtdIns(3,4,5)P3と特異的に相互作用する保存されたプレクストリン相同(PH)ドメインを介して原形質膜に移行することによって、シグナル伝達経路およびシグナル伝達ネットワークを惹起する(Vanhaesebroeckら、Annu.Rev.Biochem.(2001)70 p.535−602(非特許文献23))。PtdIns(3,4,5)P3およびPHドメインを介してシグナル伝達するエフェクタータンパク質には、セリン/トレオニン(Ser/Thr)キナーゼ、チロシンキナーゼ、RacまたはArf GEF(グアニンヌクレオチド交換因子)およびArf GAP(GTPase活性化タンパク質)が含まれる。
【0012】
B細胞およびT細胞では、PI3Kは、B細胞におけるBrutonチロシンキナーゼ(BTK)およびT細胞におけるインターロイキン−2誘導性T細胞キナーゼ(ITK)を含む、タンパク質チロシンキナーゼのTecファミリーの活性化を介した重要な役割を有する。PI3Kが活性化されると、BTKまたはITKが、原形質膜に移行し、続いてそれらは、Srcキナーゼによってリン酸化される。活性化されたITKの主要な標的の1つは、ホスホリパーゼC−ガンマ(PLCγ1)であり、これは、PtdIns(4,5)P2をIns(3,4,5)P3に加水分解し、そして活性化されたT細胞においてタンパク質キナーゼCを活性化することができる、細胞内カルシウムレベルの上昇およびジアシルグリセロール(DAG)の細胞内の増加を惹起する。
【0013】
クラスIA p110αおよびp110βとは異なり、p110δは、組織限定的な様式で発現される。それらのリンパ球およびリンパ系組織での高発現レベルは、PI3Kによって媒介されるシグナル伝達の免疫系における役割を示唆する。p110δキナーゼデッド(kinase dead)ノックインマウスは、生存可能であり、それらの表現型は、免疫シグナル伝達の欠陥に限定される(Okkenhaugら、Science(2002)297 p.1031−4(非特許文献24))。これらのトランスジェニックマウスによって、B細胞およびT細胞のシグナル伝達におけるPI3Kδの機能が深く理解された。特に、p110δは、CD28および/またはT細胞受容体(TCR)のシグナル伝達の下流のPtdIns(3,4,5)P3形成にとって必要である。TCRの下流のPI3Kシグナル伝達の鍵となる作用は、抗アポトーシス因子ならびにサイトカイン産生のための様々な転写因子をリン酸化するAktの活性化である。結果として、不活性なp110δを有するT細胞は、増殖ならびにTh1およびTh2サイトカイン分泌に欠陥がある。CD28によるT細胞の活性化は、抗原によるTCR活性化に対する閾値を低下させ、増殖応答の規模および持続時間を増加させる。これらの作用は、重要なT細胞成長因子であるIL2を含むいくつかの遺伝子の転写のPI3Kδ依存的増加によって媒介される。
【0014】
ゆえに、PI3K阻害剤は、呼吸器疾患(例えば、喘息、COPDおよび嚢胞性線維症)に伴うT細胞媒介性炎症反応を調節する際のその役割による治療上の利点を提供すると予測される。さらに、T細胞を対象とした治療によって、コルチコステロイド節約特性がもたらされることがあるという指摘が存在する(Alexanderら、Lancet(1992)339 p.324−8(非特許文献25))ことから、それが呼吸器疾患において、独立して、または吸入もしくは経口副腎皮質ステロイドとの併用で、有用な治療を提供することがあると示唆される。PI3K阻害剤はまた、喘息における長時間作用性ベータ−作動薬(LABA)などの他の従来の治療と共に使用されるかもしれない。
【0015】
血管系において、PI3Kδは、内皮細胞によって発現されるものであり、TNFアルファに応答してこれらの細胞の接着促進性の(proadhesive)状態を調節することによって好中球の輸送に関与する(Puriら、Blood(2004)103(9)p.3448−56(非特許文献26))。内皮細胞のTNFアルファ誘導性のシグナル伝達におけるPI3Kδの役割は、Aktリン酸化およびPDK1活性の薬理学的阻害によって証明されている。さらに、PI3Kδは、VEGF経路を介した血管透過性および気道組織浮腫との関与が示唆されている(Leeら、J.Allergy Clin.Immunol.(2006)118(2)p.403−9(非特許文献27))。これらの所見から、白血球の血管外遊出の減少と喘息に関連する血管透過性の減少との組み合わせによる、喘息におけるPI3Kδ阻害の追加の利点が示唆される。さらに、PI3Kδ活性は、インビトロとインビボの両方においてマスト細胞の機能に必要である(Aliら、Nature(2004)431 p.1007−11(非特許文献28);およびAliら、J.Immunol.(2008)180(4)p.2538−44(非特許文献29))ことから、PI3Kの阻害が、アレルギー性の適応症(例えば、喘息、アレルギー性鼻炎およびアトピー性皮膚炎)にとって治療上有益であるはずとさらに示唆される。
【0016】
B細胞増殖、抗体分泌、B細胞抗原およびIL−4受容体シグナル伝達、B細胞の抗原提示機能におけるPI3Kδの役割も十分に確立されており(Okkenhaugら、(2002)上記;Al−Alwanら、J.Immunol.(2007)178(4)p.2328−35(非特許文献30);およびBilancioら、Blood(2006)107(2)p.642−50(非特許文献31))、関節リウマチまたは全身性エリテマトーデスなどの自己免疫疾患における役割が示唆される。ゆえに、PI3K阻害剤は、これらの適応症に対しても有益である可能性がある。
【0017】
PI3Kδの薬理学的阻害によって、ICAMがコーティングされたアガロースマトリックスインテグリン依存性のバイアス系(ICAM coated agarose matrix integrin−dependent biased system)におけるfMLP依存的な好中球の走化性が阻害される(Sadhuら、J.Immunol.(2003)170(5)p.2647−54(非特許文献32))。PI3Kδの阻害は、好中球媒介性のファゴサイトーシス、Staphylococcus aureusに対する殺菌活性に影響せずに、好中球の活性化、接着および遊走を制御する(Sadhuら、Biochem.Biophys.Res.Commun.(2003)308(4)p.764−9(非特許文献33))。全体として、データは、PI3Kδの阻害によって、自然免疫防御に必要とされる好中球の機能が一括で阻害されるはずがないことを示唆している。好中球におけるPI3Kδの役割は、COPDまたは関節リウマチなどの組織リモデリングに関わる炎症性疾患を治療するためのさらなる機会を与える。
【0018】
さらに、クラスIa PI3K酵素は、直接または間接的に、多種多様のヒトの癌における腫瘍形成の一因にもなるという妥当な証拠も存在する(Vivanco and Sawyers,Nature Reviews Cancer(2002)2(7)p.489−501(非特許文献34))。例えば、PI3Kδの阻害は、急性骨髄性白血病などの悪性の血液学的障害を治療するための治療上の役割を有する可能性がある(Billottetら、Oncogene(2006)25(50)p.6648−59(非特許文献35))。さらに、p110α(PIK3CA遺伝子)内の活性化変異は、他の様々な腫瘍(例えば、結腸ならびに乳房および肺の腫瘍)に関連している(Samuelsら、Science(2004)304(5670)p.554(非特許文献36))。
【0019】
PI3Kが、有痛性の炎症状態における中枢性感作の確立に関わることも示されている(Pezetら、The J.of Neuroscience(2008)28(16)p.4261−4270(非特許文献37))。
【先行技術文献】
【非特許文献】
【0020】
【非特許文献1】Vanhaesebroeckら、Trends Biochem.Sci.22(7)p.267−72(1997)
【非特許文献2】Leslieら、Chem.Rev.101(8)p.2365−80(2001)
【非特許文献3】Katsoら、Annu.Rev.Cell Dev.Biol.17 p.615−75(2001)
【非特許文献4】Toker,Cell.Mol.Life Sci.59(5)p.761−79(2002)
【非特許文献5】Vanhaesebroeckら、Exp.Cell Res.253(1)p.239−54(1999)
【非特許文献6】Steinら、Mol.Med.Today 6(9)p.347−57(2000)
【非特許文献7】Panayotouら、Trends Cell Biol.2 p.358−60(1992)
【非特許文献8】Vanhaesebroeckら、EMBO J.18(5)p.1292−302(1999)
【非特許文献9】Parker,Current Biology,5(6)p.577−79(1995)
【非特許文献10】Yaoら、Science 267(5206)p.2003−06(1995)
【非特許文献11】Pagesら、Nature 369 p.327−29(1994)
【非特許文献12】Rudd,Immunity 4 p.527−34(1996)
【非特許文献13】Fraserら、Science 251(4991)p.313−16(1991)
【非特許文献14】Lopez−Ilasacaら、J.Biol.Chem.273(5)p.2505−8(1998)
【非特許文献15】Laffargueら、Immunity 16(3)p.441−51(2002)
【非特許文献16】Lawlorら、J.Cell Sci.114(Pt 16)p.2903−10(2001)
【非特許文献17】Laffargueら、Immunity 16(3)p.441−51(2002)
【非特許文献18】Stephensら、Curr.Opinion Cell Biol.14(2)p.203−13(2002)(特許文献18)
【非特許文献19】Frumanら、Ann.Rev.Biochem.67 p.481−507(1998)
【非特許文献20】Thelenら、Proc.Natl.Acad.Sci.USA 91 p.4960−64(1994)
【非特許文献21】Katsoら、Annual Rev.Cell Dev.Biol.(2001)17 p.615−675
【非特許文献22】Fosterら、J.Cell Science(2003)116(15)p.3037−3040
【非特許文献23】Vanhaesebroeckら、Annu.Rev.Biochem.(2001)70 p.535−602
【非特許文献24】Okkenhaugら、Science(2002)297 p.1031−4
【非特許文献25】Alexanderら、Lancet(1992)339 p.324−8
【非特許文献26】Puriら、Blood(2004)103(9)p.3448−56
【非特許文献27】Leeら、J.Allergy Clin.Immunol.(2006)118(2)p.403−9
【非特許文献28】Aliら、Nature(2004)431 p.1007−11
【非特許文献29】Aliら、J.Immunol.(2008)180(4)p.2538−44
【非特許文献30】Okkenhaugら、(2002)上記;Al−Alwanら、J.Immunol.(2007)178(4)p.2328−35
【非特許文献31】Bilancioら、Blood(2006)107(2)p.642−50
【非特許文献32】Sadhuら、J.Immunol.(2003)170(5)p.2647−54
【非特許文献33】Sadhuら、Biochem.Biophys.Res.Commun.(2003)308(4)p.764−9
【非特許文献34】Vivanco and Sawyers,Nature Reviews Cancer(2002)2(7)p.489−501
【非特許文献35】Billottetら、Oncogene(2006)25(50)p.6648−59
【非特許文献36】Samuelsら、Science(2004)304(5670)p.554
【非特許文献37】Pezetら、The J.of Neuroscience(2008)28(16)p.4261−4270
【発明の概要】
【発明が解決しようとする課題】
【0021】
PI3−キナーゼ活性を阻害する化合物の調製が試みられており、いくつかのそのような化合物が当該分野において開示されている。しかしながら、PI3−キナーゼによって媒介される病的反応の数に鑑みて、種々の状態の治療に使用することができるPI3−キナーゼの阻害剤がなおも必要とされ続けている。
【課題を解決するための手段】
【0022】
本発明者らは、PI3−キナーゼ活性の阻害剤である新規化合物を発見した。PI3−キナーゼ阻害剤である化合物は、不適切なPI3−キナーゼ活性に関連する障害の治療、例えば、PI3−キナーゼ機構によって媒介される障害の治療および予防において有用である可能性がある。そのような障害としては、喘息および慢性閉塞性肺疾患(COPD)を含む呼吸器疾患、アレルギー性鼻炎およびアトピー性皮膚炎を含むアレルギー性疾患、関節リウマチおよび多発性硬化症を含む自己免疫疾患、炎症性腸疾患を含む炎症性障害、血栓症およびアテローム性動脈硬化症を含む循環器疾患、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、ならびに関節リウマチまたは変形性関節症に伴う疼痛、背痛、一般的な炎症性疼痛、肝後方神経痛、糖尿病性ニューロパシー、炎症性神経因性疼痛(トラマ)、三叉神経痛および中枢性疼痛を含む疼痛が挙げられる。
【0023】
1つの実施形態において、本発明の化合物は、他のキナーゼよりもPI3−キナーゼに対して選択性を示し得る。
【0024】
1つの実施形態において、本発明の化合物は、他のPI3−キナーゼよりもPI3Kδに対して選択性を示し得る。
【発明を実施するための形態】
【0025】
本発明は、特定の新規化合物に関する。詳細には、本発明は、式(I)の化合物
【化3】

【0026】
(式中、R1およびR2は、下記に定義されるとおりである)およびその塩に関する。
【0027】
その化合物は、PI3−キナーゼ活性の阻害剤である。PI3−キナーゼ阻害剤である化合物は、不適切なPI3−キナーゼ活性に関連する障害(例えば、喘息および慢性閉塞性肺疾患(COPD))の治療において有用であり得る。したがって、本発明はさらに、式(I)の化合物またはその薬学上許容可能な塩を含んでなる医薬組成物に関する。本発明は、なおもさらに、式(I)の化合物もしくはその薬学上許容可能な塩、または式(I)の化合物もしくはその薬学上許容可能な塩を含んでなる医薬組成物を用いた、PI3−キナーゼ活性の阻害方法およびそれに関連する障害の治療方法に関する。本発明は、さらにそのうえ、本発明の化合物についての調製プロセスに関する。
【0028】
1つの実施形態において、本発明は、式(I)の化合物
【化4】

【0029】
(式中、
R1は、−OR3、−CH2OR4もしくは−CH2CNによって置換されてもよいフェニル、5員ヘテロアリール(ここで、前記5員ヘテロアリールは、酸素、窒素および硫黄から独立して選択される1もしくは2個のヘテロ原子を含み、かつ−CH2フェニルによって置換されてもよい)、ピリジニル(ここで、前記ピリジニルは、−NH2、−CH2OR5、−CO2R6、−CONR7R8、−NHCO2R9、−XSO2R10、−SO2NR11R12および−NHSO2R13から選択される1つの置換基によって置換され、かつハロおよび−OR14から選択される第2の置換基によって置換されてもよい)、9員もしくは10員の二環式ヘテロアリール(ここで、前記9員もしくは10員の二環式ヘテロアリールは、酸素および窒素から独立して選択される1〜3個のヘテロ原子を含み、かつ−SO2R15によって置換される)、またはピロリジニルに縮合されたフェニル(ここで、前記ピロリジニルは、−COR16によって置換される)であり、
R2は、5員ヘテロアリール(ここで、前記5員ヘテロアリールは、酸素、窒素および硫黄から独立して選択される1または2個のヘテロ原子を含み、かつC1−6アルキルによって置換されてもよい)であり、
R3は、−CO2R17によって置換されるC1−6アルキルであり、
R4、R5、R6、R14およびR17は、各々独立して、水素またはC1−6アルキルであり、
R7およびR8は、各々水素であるか、またはR7およびR8は、それらが結合している窒素原子と一体となって連結されることにより、酸素原子を含んでもよい6員ヘテロシクリルを形成し、
R9は、フェニルによって置換されてもよいC1−6アルキルであり、
R10およびR15は、各々独立して、C1−6アルキルまたはフェニルであり、
R11およびR12は、それらが結合している窒素原子と一体となって連結されることにより、酸素原子を含んでもよい6員ヘテロシクリルを形成し、
R13は、−CF3およびハロによって置換されるフェニルであり、
R16は、C1−6アルキルであり、かつ
Xは、−CH2−、−CHF−または−N(CH3)−である)
およびその塩(本明細書中以後「本発明の化合物」)に関する。
【0030】
1つの実施形態において、R1は、−OR3または−CH2OR4によって置換されるフェニル、ピリジニル(ここで、そのピリジニルは、−NH2、−CH2OR5および−NHSO2R13から選択される1個の置換基によって置換され、かつハロおよび−OR14から選択される第2の置換基によって置換されてもよい)、または9員もしくは10員の二環式ヘテロアリール(ここで、その9員もしくは10員の二環式ヘテロアリールは、酸素および窒素から独立して選択される1〜3個のヘテロ原子を含み、かつ−SO2R15によって置換されている)である。さらなる実施形態において、R1は、ピリジニル(ここで、そのピリジニルは、−NH2および−NHSO2R13から選択される1個の置換基によって置換されており、かつ−OR14である第2の置換基によって置換されてもよい)、または9員の二環式ヘテロアリール(ここで、その9員の二環式ヘテロアリールは、3個の窒素原子を含み、かつ−SO2R15によって置換されている)である。
【0031】
1つの実施形態において、R2は、5員ヘテロアリールであり、ここで、その5員ヘテロアリールは、窒素および硫黄から独立して選択される1または2個のヘテロ原子を含み、かつC1−6アルキルによって置換されてもよい。さらなる実施形態において、R2は、C1−6アルキルによって置換されてもよいチアゾリルである。
【0032】
1つの実施形態において、R3は、−CO2R17によって置換されるメチルである;
1つの実施形態において、R4は、水素である。
【0033】
1つの実施形態において、R5は、水素である。
【0034】
1つの実施形態において、R6は、水素である。
【0035】
1つの実施形態において、R7およびR8は各々、水素である。さらなる実施形態において、R7およびR8は、それらが結合している窒素原子と一体となって連結されることにより、モルホリニルを形成する。
【0036】
1つの実施形態において、R9は、フェニルによって置換されるメチルである。
【0037】
1つの実施形態において、R10は、フェニルである。
【0038】
1つの実施形態において、R11およびR12は、それらが結合している窒素原子と一体となって連結されることにより、モルホリニルを形成する。
【0039】
1つの実施形態において、R13は、4−クロロ−3−(トリフルオロメチル)フェニルである。
【0040】
1つの実施形態において、R14は、メチルである。
【0041】
1つの実施形態において、R15は、メチルである。
【0042】
1つの実施形態において、R16は、メチルである。
【0043】
1つの実施形態において、R17は、水素である。
【0044】
1つの実施形態において、Xは、−N(CH3)−である。
【0045】
本発明は、本明細書の上記に記載された置換基のすべての組み合わせを包含すると理解されるべきである。
【0046】
本発明の化合物には、実施例1〜24の化合物およびそれらの塩が含まれる。
【0047】
1つの実施形態において、本発明の化合物は:
N−{6−[5−アミノ−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボン酸、
2−メチル−N−(6−フェニル−1H−インダゾール−4−イル)−1,3−チアゾール−4−カルボキサミド、
N−{6−[3−(シアノメチル)フェニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−[6−(5−アミノ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[3−(ヒドロキシメチル)フェニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−(ヒドロキシメチル)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
{[3−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)フェニル]オキシ}酢酸、
N−[6−(5−アミノ−6−クロロ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[6−クロロ−5−(ヒドロキシメチル)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−(6−{6−クロロ−5−[メチル(フェニルスルホニル)−アミノ]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−[6−(2−アミノ−4−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−(6−{6−クロロ−5−[(フェニルスルホニル)メチル]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
2−クロロ−5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボン酸、
5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボキサミド、
フェニルメチル[2−クロロ−5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジニル]カルバメート、
N−(6−{6−クロロ−5−[フルオロ(フェニルスルホニル)メチル]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[5−(4−モルホリニルスルホニル)−3−ピリジニル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−[6−(1H−ピラゾール−4−イル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[5−(4−モルホリニルカルボニル)−3−ピリジニル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[1−(フェニルメチル)−1H−ピラゾール−4−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
N−[6−(1−アセチル−2,3−ジヒドロ−1H−インドール−4−イル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−({[4−クロロ−3−(トリフルオロメチル)フェニル]スルホニル}アミノ)−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、または
それらの塩である。
【0048】
さらなる実施形態において、本発明の化合物は:
N−{6−[5−アミノ−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−[6−(5−アミノ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[3−(ヒドロキシメチル)フェニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−(ヒドロキシメチル)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
{[3−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)フェニル]オキシ}酢酸、
N−[6−(5−アミノ−6−クロロ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−({[4−クロロ−3−(トリフルオロメチル)フェニル]スルホニル}アミノ)−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、または
それらの塩である。
【0049】
用語および定義
「アルキル」とは、指定数のメンバー原子を有する飽和炭化水素鎖のことを指す。例えば、C1−6アルキルは、1〜6個のメンバー原子を有するアルキル基のことを指す。アルキル基は、本明細書中で1つ以上の置換基で置換されてもよいと定義される場合、そのように置換されてもよい。アルキル基は、直鎖状であってもよいし、分枝状であってもよい。代表的な分枝状のアルキル基は、1、2または3つの枝を有する。アルキルには、メチル、エチル、プロピル(n−プロピルおよびイソプロピル)、ブチル(n−ブチル、イソブチルおよびt−ブチル)、ペンチル(n−ペンチル、イソペンチルおよびネオペンチル)およびヘキシルが含まれる。
【0050】
「鏡像異性的に濃縮された」とは、その鏡像体過剰率が0より大きい生成物のことを指す。例えば、鏡像異性的に濃縮されたとは、その鏡像体過剰率が、50%eeより大きい、75%eeより大きい、および90%eeより大きい、生成物のことを指す。
【0051】
「鏡像体過剰率」または「ee」は、一方のエナンチオマーが他方に対して過剰であることをパーセンテージとして表したものである。結果として、ラセミ混合物中では、両方のエナンチオマーが等量で存在するので、鏡像体過剰率は、ゼロである(0%ee)。しかしながら、一方のエナンチオマーが、その生成物の95%を構成するように濃縮されている場合、鏡像体過剰率は、90%ee(濃縮されたエナンチオマーの量である95%−他方のエナンチオマーの量である5%)となるだろう。
【0052】
「鏡像異性的に純粋」とは、その鏡像体過剰率が99%eeまたはそれ以上である生成物のことを指す。
【0053】
「半減期(Half−life)」(または「半減期(half−lives)」)は、インビトロまたはインビボにおいて、ある物質の量の半分が別の化学的に異なる種に変換されるのに要する時間のことを指す。
【0054】
「ハロ」とは、ハロゲンラジカルであるフルオロ、クロロ、ブロモまたはヨードのことを指す。
【0055】
「ヘテロアリール」は、別段定義されない限り、その環のメンバー原子として1〜3個のヘテロ原子、例えば、1または2個のヘテロ原子を含む芳香族環のことを指す。2つ以上のヘテロ原子を含むヘテロアリール基は、異なるヘテロ原子を含んでもよい。ヘテロアリール基は、本明細書中で1つ以上の置換基で置換されてもよいと定義される場合、そのように置換されてもよい。本明細書中のヘテロアリール基は、単環式の環系であるか、または縮合された二環式の環系である。単環式ヘテロアリール環は、5個のメンバー原子を有する。二環式ヘテロアリール環は、9または10個のメンバー原子を有する。単環式ヘテロアリールには、ピロリル、フラニル、チエニル、ピラゾリル、イミダゾリル、オキサゾリル、イソオキサゾリル、チアゾリルおよびイソチアゾリルが含まれる。1つの実施形態において、単環式ヘテロアリールは、ピラゾリルである。二環式ヘテロアリールには、インドリル、イソインドリル、インドリジニル、ベンゾフラニル、イソベンゾフラニル、インダゾリル、プリニル、ベンズイミダゾリル、ピロロピリジニル、ピラゾロピリジニル、ピロロピリミジニル、キノリル、イソキノリニル、キノキサリニル、キナゾリニル、シンノリニル、ベンゾピラニル、ベンゾオキサゾリル、フロピリジニルおよびナフトリジニルが含まれる。1つの実施形態において、二環式ヘテロアリールは、ピラゾロピリジニルである。
【0056】
「ヘテロ原子」とは、窒素、硫黄または酸素原子のことを指す。
【0057】
「ヘテロシクリル」は、別段定義されない限り、その環のメンバー原子として1または2個のヘテロ原子を含む飽和または不飽和の環のことを指す。しかしながら、ヘテロシクリル環は、芳香族ではない。特定の実施形態において、ヘテロシクリルは、飽和である。他の実施形態において、ヘテロシクリルは、不飽和であるが、芳香族ではない。2つ以上のヘテロ原子を含むヘテロシクリル基は、異なるヘテロ原子を含んでもよい。本明細書中のヘテロシクリル基は、6個のメンバー原子を有する単環式の環系である。ヘテロシクリルには、ピペリジニルおよびモルホリニルが含まれる。
【0058】
「メンバー原子」は、鎖または環を形成する原子のことを指す。2つ以上のメンバー原子が、鎖および環内に存在する場合、各メンバー原子は、その鎖または環において隣接するメンバー原子に共有結合される。鎖または環上の置換基を構成する原子は、その鎖または環のメンバー原子ではない。
【0059】
「置換されてもよい」は、そのように本明細書中で定義される場合、ヘテロアリールなどの基が、置換されなくてもよいし、1つ以上の置換基で置換されてもよいことを示す。
【0060】
ある基に関する「置換される」は、ある基におけるメンバー原子に結合された水素原子が置換されていることを示す。用語「置換される」は、そのような置換が、置換される原子および置換基の許される原子価と一致し、かつ、その置換によって、安定な化合物(すなわち、転位、環化または脱離などによって自発的に転移を起こさない化合物)がもたらされるという暗黙の規定を含むことを理解するべきである。特定の実施形態において、その置換がその原子の許される原子価と一致する限り、1つの原子が2つ以上の置換基で置換されてもよい。適当な置換基は、置換される基または置換されてもよい基の各々に対して本明細書中で定義される。
【0061】
「薬学上許容可能」は、妥当な利益/リスク比に見合った、過剰の毒性、刺激作用または他の問題もしくは合併症なしに、まっとうな医学的判断の範囲内でヒトおよび動物の組織と接触して使用するために適している化合物、材料、組成物および剤形のことを指す。
【0062】
本明細書中で使用されるとき、これらのプロセス、スキームおよび実施例において使用されるシンボルおよび慣習は、現代の科学文献、例えば、Journal of the American Chemical SocietyまたはJournal of Biological Chemistryにおいて使用されているものと一致したものである。別段述べられない限り、一般に、L配置であるとみなされるアミノ酸残基を指し示すために、標準的な1文字または3文字の省略形が使用される。別段述べられない限り、すべての出発物質が、商業的供給業者から入手され、さらに精製することなく使用された。詳細には、実施例および明細書全体において、以下の省略形を使用することがある:
aq 水溶液
DCM ジクロロメタン
DIPEA ジイソプロピルエチルアミン
DMF N,N−ジメチルホルムアミド
DMSO ジメチルスルホキシド
Et3N トリエチルアミン
g グラム
h 時間
HATU O−(7−アザベンゾトリアゾール−1−イル)−N,N,N’,N’−テトラメチルウロニウムヘキサフルオロホスフェート
HCl 塩化水素
HPLC 高速液体クロマトグラフィー
IPA イソプロパノール
LCMS 液体クロマトグラフィー/質量分析
M モル濃度
MDAP 質量分析連結(Mass Directed)自動分取HPLC
MeOH メタノール
MeCN アセトニトリル
mg ミリグラム
min 分
ml ミリリットル
mmol ミリモル
mp 融点
Pd(dppf)Cl2 [1,1’−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(II)
Pd(dppf)Cl2−CH2Cl2 [1,1’−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(II)ジクロロメタン付加物
Pd(PPh3)4 テトラキス(トリフェニルホスフィン)パラジウム(0)
Rt 保持時間
RT 室温
s 秒
SCX 強陽イオン交換
Solvias触媒 クロロ[2’−(ジメチルアミノ)−2−ビフェニリル]パラジウム−(1R,4S)−ビシクロ[2.2.1]ヘプト−2−イル[(1S,4R)−ビシクロ[2.2.1]ヘプト−2−イル]ホスファン(1:1)
SPE 固相抽出
THF テトラヒドロフラン
TFA トリフルオロ酢酸
ブラインに対するすべての言及は、NaClの飽和水溶液に対する言及である。
【0063】
式(I)の化合物およびその塩の溶媒和化合物(水和物を含む)、錯体、多形、プロドラッグ、放射標識された誘導体、立体異性体および光学異性体のすべてが、「本発明の化合物」の範囲内に含まれる。
【0064】
本発明の化合物は、固体または液体の形態で存在し得る。本発明の化合物は、固体の状態では、結晶性の形態もしくは非晶質の形態で、またはそれらの混合物として、存在し得る。結晶性の形態である本発明の化合物の場合、当業者は、結晶化中に溶媒分子が結晶格子内に組み込まれた薬学上許容可能な溶媒和化合物が形成されることがあることを認識するだろう。溶媒和化合物は、非水溶媒(例えば、エタノール、イソプロパノール、DMSO、酢酸、エタノールアミンおよびEtOAc)を含み得るか、または結晶格子内に組み込まれた溶媒として水を含み得る。結晶格子内に組み込まれた溶媒が水である溶媒和化合物は、典型的には、「水和物」と呼ばれる。水和物には、化学量論的水和物、ならびに不定量の水を含む組成物が含まれる。本発明は、そのような溶媒和化合物のすべてを包含する。
【0065】
当業者は、その様々な溶媒和化合物をはじめとした、結晶性の形態で存在する本発明の特定の化合物が、多形性(すなわち、種々の結晶構造として存在する能力)を示し得ることをさらに認識するだろう。これらの種々の結晶性の形態は、典型的には「多形」として知られている。本発明は、そのような多形のすべてを包含する。多形は、同じ化学組成を有するが、結晶性の固体の状態の充填、幾何学的配置および他の記述的な特性が異なる。それゆえ、多形は、異なる物理的特性(例えば、形状、密度、硬度、変形能、安定性および溶解特性)を有し得る。多形は、典型的には、異なる融点、IRスペクトルおよび粉末X線回折パターンを示し、これらは、同定に用いられることがある。当業者は、例えば、化合物を生成する際または再結晶する際に使用される反応条件または試薬を変更することまたは調整することによって、種々の多形が生成され得ることを認識するだろう。例えば、温度、圧力または溶媒を変更することにより、多形がもたらされ得る。さらに、特定の条件下において、1つの多形が、自発的に別の多形に変換することがある。
【0066】
本発明は、1つ以上の原子が自然界で最も一般的に見られる原子質量または質量数と異なる原子質量または質量数を有する原子によって置換されているという事実を別にすれば式(I)の化合物およびその塩と同一である同位体的に標識された化合物も含む。本発明の化合物に組み込まれ得る同位体の例としては、水素、炭素、窒素、酸素およびフッ素の同位体(例えば、3H、11C、14Cおよび18F)が挙げられる。
【0067】
式(I)に係る化合物は、1つ以上の不斉中心(キラル中心とも呼ばれる)を含むことがあり、ゆえに、個別のエナンチオマー、ジアステレオマーもしくは他の立体異性体、またはそれらの混合物として存在することがある。キラル炭素原子などのキラル中心は、アルキル基などの置換基に存在することもある。式(I)または本明細書中に図示される任意の化学構造に存在するキラル中心の立体化学が、明記されない場合、その構造は、任意の立体異性体およびそれらの混合物のすべてを包含すると意図される。したがって、1つ以上のキラル中心を含む式(I)に係る化合物は、ラセミ混合物、鏡像異性的に濃縮された混合物として、または鏡像異性的に純粋な個別の立体異性体として使用され得る。
【0068】
1つ以上の不斉中心を含む式(I)に係る化合物の個別の立体異性体は、当業者に公知の方法によって分割され得る。例えば、そのような分割は、(1)ジアステレオ異性の塩、錯体または他の誘導体の形成、(2)例えば、酵素的酸化もしくは酵素的還元による、立体異性体特異的試薬との選択的な反応、または(3)キラル環境(chiral enviornment)における(例えば、キラルリガンドが結合したシリカなどのキラル支持体上またはキラル溶媒の存在下における)ガス−液体クロマトグラフィーもしくは液体クロマトグラフィーによって行われ得る。当業者は、所望の立体異性体が、上に記載された分離手順のうちの1つによって別の化学物質に変換される場合、所望の形態を遊離させるためにさらなる工程が必要であることを認識するだろう。あるいは、特定の立体異性体が、光学活性な試薬、基質、触媒もしくは溶媒を用いる不斉合成によって、または不斉転換によって一方のエナンチオマーを他方に変換することによって、合成されてもよい。
【0069】
式(I)に係る化合物は、幾何学的不斉中心を含むこともある。式(I)または本明細書中に例示される任意の化学構造に存在する幾何学的不斉中心の立体化学が明記されていない場合、その構造は、trans幾何異性体、cis幾何異性体およびそれらの混合物のすべてを包含すると意図されている。同様に、そのような互変異性体が、平衡して存在するのか、または主に1つの形態で存在するのかに関係なく、すべての互変異性体が、式(I)に含められる。
【0070】
本明細書中での式(I)の化合物およびその塩に対する言及は、遊離酸もしくは遊離塩基として、またはそれらの塩として、例えば、それらの薬学上許容可能な塩として、式(I)の化合物を網羅することが理解されるべきである。したがって、1つの実施形態において、本発明は、遊離酸または遊離塩基としての式(I)の化合物に関する。別の実施形態において、本発明は、式(I)の化合物およびその塩に関する。さらなる実施形態において、本発明は、式(I)の化合物およびその薬学上許容可能な塩に関する。
【0071】
当業者は、式(I)に係る化合物の薬学上許容可能な塩が調製され得ることを認識するだろう。実際に、本発明の特定の実施形態において、式(I)に係る化合物の薬学上許容可能な塩は、その分子に対してより高い安定性または溶解性を付与することにより、剤形への製剤化を容易にするので、そのような塩が、それぞれの遊離塩基または遊離酸よりも好ましい場合がある。したがって、本発明はさらに、式(I)の化合物およびその薬学上許容可能な塩に関する。
【0072】
本明細書中で使用されるとき、用語「薬学上許容可能な塩」は、主題の化合物の所望の生物学的活性を保持し、かつ最小の望まれない毒物学的作用を示す、塩のことを指す。これらの薬学上許容可能な塩は、その化合物の最終的な単離および精製中にそのまま調製され得るか、またはその遊離酸もしくは遊離塩基の形態で精製された化合物を、それぞれ適当な塩基もしくは酸と別々に反応させることによって調製され得る。
【0073】
薬学上許容可能でない対イオンまたは関連する溶媒を有する塩および溶媒和化合物は、例えば、式(I)の他の化合物およびそれらの薬学上許容可能な塩の調製において中間体として使用するためには、本発明の範囲内である。したがって、本発明の1つの実施形態は、式(I)の化合物およびその塩を包含する。
【0074】
特定の実施形態において、式(I)に係る化合物は、酸性の官能基を含むことがある。適当な薬学上許容可能な塩には、そのような酸性の官能基の塩が含まれる。代表的な塩としては、薬学上許容可能な金属塩(例えば、ナトリウム塩、カリウム塩、リチウム塩、カルシウム塩、マグネシウム塩、アルミニウム塩および亜鉛塩)、薬学上許容可能な金属カチオン(例えば、ナトリウム、カリウム、リチウム、カルシウム、マグネシウム、アルミニウムおよび亜鉛)の炭酸塩および重炭酸塩、薬学上許容可能な有機第一級、第二級および第三級アミン(脂肪族アミン、芳香族アミン、脂肪族ジアミンおよびヒドロキシアルキルアミン(例えば、メチルアミン、エチルアミン、2−ヒドロキシエチルアミン、ジエチルアミン、TEA、エチレンジアミン、エタノールアミン、ジエタノールアミンおよびシクロヘキシルアミン)を含む)が挙げられる。
【0075】
特定の実施形態において、式(I)に係る化合物は、塩基性の官能基を含むことがあり、ゆえに、適当な酸で処理することによって薬学上許容可能な酸付加塩を形成することができる。適当な酸には、薬学上許容可能な無機酸および薬学上許容可能な有機酸が含まれる。代表的な薬学上許容可能な酸付加塩としては、塩酸塩、臭化水素酸塩、硝酸塩、メチル硝酸塩、硫酸塩、重硫酸塩、スルファミン酸塩、リン酸塩、酢酸塩、ヒドロキシ酢酸塩、フェニル酢酸塩、プロピオン酸塩、酪酸塩、イソ酪酸塩、吉草酸塩、マレイン酸塩、ヒドロキシマレイン酸塩、アクリル酸塩、フマル酸塩、リンゴ酸塩、酒石酸塩、クエン酸塩、サリチル酸塩、p−アミノサリチル酸塩(p−aminosalicyclate)、グリコール酸塩、乳酸塩、ヘプタン酸塩、フタル酸塩、シュウ酸塩、コハク酸塩、安息香酸塩、o−アセトキシ安息香酸塩、クロロ安息香酸塩、メチル安息香酸塩、ジニトロ安息香酸塩、ヒドロキシ安息香酸塩、メトキシ安息香酸塩、ナフトエ酸塩、ヒドロキシナフトエ酸塩、マンデル酸塩、タンニン酸塩、ギ酸塩、ステアリン酸塩、アスコルビン酸塩、パルミチン酸塩、オレイン酸塩、ピルビン酸塩、パモ酸塩、マロン酸塩、ラウリン酸塩、グルタル酸塩、グルタミン酸塩、エストレート(estolate)、メタンスルホン酸塩(メシル酸塩)、エタンスルホン酸塩(エシル酸塩)、2−ヒドロキシエタンスルホン酸塩、ベンゼンスルホン酸塩(ベシル酸塩)、p−アミノベンゼンスルホン酸塩、p−トルエンスルホン酸塩(トシル酸塩)およびナフタレン(napthalene)−2−スルホン酸塩が挙げられる。
【0076】
化合物の調製
本発明の化合物は、標準的な化学を含む種々の方法によって生成され得る。先に定義されたいずれの可変部分も、別段示されない限り、先に定義された意味を有し続ける。例示的な一般的合成方法が下記に示され、本発明の特定の化合物は、実施例の項において調製される。
【0077】
プロセスa
式(I)の化合物(ここで、R1およびR2は、上で定義されたとおりである)およびその塩は、式(II)の化合物
【化5】

【0078】
(式中、R2は、上で定義されたとおりである)から、適当な温度(例えば、60〜180℃、例えば、約110℃)における、適当な塩基(例えば、三リン酸カリウムまたは炭酸ナトリウムの水溶液)の存在下の適当な溶媒(例えば、1,4−ジオキサン)中の適当なパラジウム触媒(例えば、Solvias触媒またはPd(dppf)Cl2)の存在下におけるマイクロ波照射下での5−ブロモ−2−(メチルオキシ)−3−ピリジンアミンなどの適当なハロゲン化物による処理に続く脱保護を含むプロセスによって調製され得る。
【0079】
式(II)の化合物(ここで、R2は、上で定義されたとおりである)は、式(III)の化合物
【化6】

【0080】
(式中、R2は、上で定義されたとおりである)から、適当な温度(例えば、60〜150℃、例えば、約80℃)における、適当な塩基(例えば、酢酸カリウム)の存在下の適当な溶媒(例えば、1,4−ジオキサン)中の適当なパラジウム触媒(例えば、Pd(dppf)Cl2)の存在下におけるマイクロ波照射下での適当なボロネート(例えば、4,4,4’,4’,6,6,6’,6’−オクタメチル−2,2’−ビ−1,3,2−ジオキサボリナン)による処理によって調製され得る。
【0081】
式(III)の化合物(ここで、R2は、上で定義されたとおりである)は、式(IV)の化合物
【化7】

【0082】
から、(i)式R2COOH(ここで、R2は上で定義されたとおりである)の適当な酸による処理、または(ii)式R2COCl(ここで、R2は上で定義されたとおりである)の酸塩化物による処理のいずれかによって調製され得る。(i)に適した条件には、適当な温度(例えば、室温、例えば、約20℃)において、カップリング試薬(例えば、O−(7−アザベンゾトリアゾール−1−イル)−N,N,N’N’− テトラメチルウロニウムヘキサフルオロホスフェート)の存在下、かつ適当な塩基(例えば、N,N−ジイソプロピルエチルアミン)の存在下の適当な溶媒(例えば、N,N−ジメチルホルムアミド)中で酸(例えば、2−メチル−1,3−チアゾール−4−カルボン酸(商業的に入手可能))を撹拌することが含まれる。あるいは、(ii)は、適当な温度(例えば、室温、例えば、約20℃)における、適当な塩基(例えば、N,N−ジイソプロピルアミン)の存在下の適当な溶媒(例えば、ジクロロメタン)中での適当なアシル化剤(例えば、酸塩化物)を用いたアシル化によって行われることがある。
【0083】
式(IV)の化合物は、式(V)の化合物
【化8】

【0084】
から、適当な温度(例えば、60〜100℃、例えば、約80℃)における、適当な溶媒(例えば、エタノールおよび水)中での還元剤(例えば、鉄のやすりくずおよび塩化アンモニウム)による処理によって調製され得る。
【0085】
式(V)の化合物は、式(VI)の化合物(これは商業的に入手可能である)
【化9】

【0086】
から、適当な温度(例えば、還流温度)における、適当な溶媒(例えば、ジクロロメタン)中の適当な酸触媒(例えば、p−トルエンスルホン酸ピリジニウム)の存在下における3,4−ジヒドロ−2H−ピランによる処理によって調製され得る。
【0087】
プロセスb
式(I)の化合物(ここで、R1およびR2は、上で定義されたとおりである)およびその塩はまた、式(IA)の化合物(ここで、R1およびR2は上で定義されたとおりであり、Pは保護基である)の適切に保護された誘導体の脱保護を含むプロセスによっても調製され得る。適当な保護基およびそれらを除去する手段の例は、T.W.Greene and P.G.M.Wuts ‘Protective Groups in Organic Synthesis’(3rd Ed.,J.Wiley and Sons,1999)に見出すことができる。
【化10】

【0088】
この例として、式(I)の化合物は、適切な条件下における脱保護(例えば、塩基、例えば、水酸化ナトリウム水溶液による処理)によって、式(IA)の化合物(インダゾール環窒素が、例えば、1−フェニルスルホニルで保護されている(P))から調製され得る。
【0089】
式(IA)の化合物(ここで、R1およびR2は、上で定義されたとおりである)は、式(VII)の化合物
【化11】

【0090】
(式中、R2は、上で定義されたとおりである)から、適当な温度(例えば、80〜150℃、例えば、約120℃)における、適当な溶媒(例えば、N,N−ジメチルホルムアミド)中での適当なパラジウム触媒(例えば、テトラキス(トリフェニルホスフィン)パラジウム(0))の存在下における適当なハロゲン化物(例えば、5−ブロモ−3−ピリジンアミン)による処理によって調製され得る。
【0091】
式(VII)の化合物(ここで、R2は、上で定義されたとおりである)は、式(VIII)の化合物
【化12】

【0092】
から、(i)式R2COOH(R2は上で定義されたとおりである)の酸による処理、または(ii)式R2COCl(R2は上で定義されたとおりである)の酸塩化物による処理によって調製され得る。(i)に適した条件には、適当な温度(例えば、室温、例えば、約20℃)において、カップリング試薬(例えば、O−(7−アザベンゾトリアゾール−1−イル)−N,N,N’N’−テトラメチルウロニウムヘキサフルオロホスフェート)の存在下、かつ適当な塩基(例えば、N,N−ジイソプロピルエチルアミン)の存在下で適当な溶媒(例えば、N,N−ジメチルホルムアミド)を撹拌することが含まれる。あるいは、(ii)は、適当な温度(例えば、室温、例えば、約20℃)における、適当な塩基(例えば、N,N−ジイソプロピルエチルアミン)の存在下の適当な溶媒(例えば、ジクロロメタン)中でのアシル化剤(例えば、酸塩化物)による処理によって行われることがある。
【0093】
式(VIII)の化合物は、式(IX)の化合物
【化13】

【0094】
から、適当な温度(例えば、80〜150℃、例えば、約120℃)における、適当な塩基(例えば、トリエチルアミン)の存在下の適当な溶媒(例えば、トルエン)中の適当なパラジウム触媒(例えば、テトラキス(トリフェニルホスフィン)パラジウム(0))の存在下におけるマイクロ波照射下での適当なスタンナン(例えば、ヘキサメチルジスタンナン)による処理によって調製され得る。
【0095】
プロセスc
式(I)の化合物(ここで、R2は、上で定義されたとおりであり、R1は、−NHCO2R9によって置換され、かつ第2の置換基R18(ハロまたは−OR4である)によって置換されてもよい、ピリジニルである)およびその塩は、式(X)の化合物
【化14】

【0096】
(式中、R2は、上で定義されたとおりであり、R1aは、−NH2によって置換され、かつ第2の置換基R18(ハロまたは−OR4である)によって置換されてもよい、ピリジニルであり、Pは、保護基、例えば、テトラヒドロピランである)から、適当な温度(例えば、室温、例えば、約20℃)における、適当な溶媒(例えば、DCM)中の適当な塩基(例えば、DIPEA)の存在下における式ClCO2R9のクロリドカーボネートによる処理を含むプロセスによって調製され得る。
【0097】
当業者が認識するように、式(X)の化合物において、保護基Pは、インダゾールの1位または2位に存在し得る。クロリドカーボネートとの反応の後、保護基Pは、適切な条件下の脱保護によって除去され得る。
【0098】
式(X)の化合物(ここで、R1a、R2およびPは、上で定義されたとおりである)は、式(XI)の化合物
【化15】

【0099】
(式中、R2およびPは、上で定義されたとおりである)から、適当な温度(例えば、60〜150℃、例えば、約140℃)における、適当な塩基(例えば、炭酸ナトリウム)の存在下の適当な溶媒(例えば、1,4−ジオキサン水溶液)中の適当な触媒(例えば、Pd(dppf)Cl2)の存在下におけるマイクロ波照射下での適当なハロゲン化物による処理を含むプロセスによって調製され得る。
【0100】
式(XI)の化合物(ここで、R2およびPは、上で定義されたとおりである)は、式(XII)の化合物
【化16】

【0101】
(式中、R2およびPは、上で定義されたとおりである)から、適当な温度(例えば、60〜150℃、例えば、約80℃)における、適当な塩基(例えば、酢酸カリウム)の存在下の適当な溶媒(例えば、1,4−ジオキサン)中の適当な触媒(例えば、Pd(dppf)Cl2)の存在下におけるマイクロ波照射下での適当なボロネート(例えば、4,4,4’,4’,6,6,6’,6’−オクタメチル−2,2’−ビ−1,3,2−ジオキサボリナン)による処理によって調製され得る。
【0102】
したがって、1つの実施形態において、本発明は:
a)式(II)の化合物
【化17】

【0103】
(式中、R2は、上で定義されたとおりである)を適当なハロゲン化物と反応させた後の脱保護、
b)式(IA)の化合物
【化18】

【0104】
(式中、R1およびR2は、上で定義されたとおりであり、Pは、保護基である)の適切に保護された誘導体の脱保護、または
c)式(I)の化合物(ここで、R2は、上で定義されたとおりであり、R1は、−NHCO2R9および第2の置換基R18(ハロまたは−OR4である)によって置換されてもよいピリジニルである)およびその塩のために、式(X)の化合物
【化19】

【0105】
(式中、R2は、上で定義されたとおりであり、R1aは、−NH2によって置換され、かつ第2の置換基R18(ハロまたは−OR4である)によって置換されてもよい、ピリジニルであり、Pは、保護基、例えば、テトラヒドロピランである)を、式ClCO2R9のクロリドカーボネートと反応させた後の脱保護
を含む、本発明の化合物を調製するためのプロセスを提供する。
【0106】
使用方法
本発明の化合物は、PI3−キナーゼ活性の阻害剤である。PI3−キナーゼ阻害剤である化合物は、基礎病理が不適切なPI3−キナーゼ活性に(少なくとも部分的に)帰する障害(例えば、喘息および慢性閉塞性肺疾患(COPD))の治療において有用であり得る。「不適切なPI3−キナーゼ活性」は、特定の患者において予想される、正常なPI3−キナーゼ活性から逸脱した任意のPI3−キナーゼ活性のことを指す。不適切なPI3−キナーゼは、例えば、活性の異常な増加、またはPI3−キナーゼ活性のタイミングおよび/もしくは調節の異常の形態をとることがある。そのような不適切な活性は、例えば、不適切な活性化または調節されていない活性化に至る、タンパク質キナーゼの過剰発現または変異に起因することがある。したがって、別の態様において、本発明は、そのような障害を治療する方法に関する。
【0107】
そのような障害としては、喘息および慢性閉塞性肺疾患(COPD)を含む呼吸器疾患、アレルギー性鼻炎およびアトピー性皮膚炎を含むアレルギー性疾患、関節リウマチおよび多発性硬化症を含む自己免疫疾患、炎症性腸疾患を含む炎症性障害、血栓症およびアテローム性動脈硬化症を含む循環器疾患、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、ならびに関節リウマチまたは変形性関節症に伴う疼痛、背痛、一般的な炎症性疼痛、肝後方神経痛、糖尿病性ニューロパシー、炎症性神経因性疼痛(トラマ)、三叉神経痛および中枢性疼痛を含む疼痛が挙げられる。
【0108】
本発明の治療方法は、それを必要とする患者に、安全かつ有効量の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む。本発明の個別の実施形態は、安全かつ有効量の式(I)の化合物またはその薬学上許容可能な塩を、それを必要とする患者に投与することによって、上で述べられた障害のうちのいずれか1つを治療する方法を含む。
【0109】
本明細書中で使用されるとき、障害に関する「治療する」は:(1)障害、または障害の生物学的徴候の1つ以上を寛解させるかまたは予防すること、(2)(a)その障害に至るかもしくはその障害に関与する生物学的カスケードにおける1つ以上の点、または(b)その障害の生物学的徴候の1つ以上を干渉すること、(3)その障害に関連する症状または作用の1つ以上を緩和すること、あるいは(4)その障害の進行、またはその障害の生物学的徴候の1つ以上の進行を遅延させることを意味する。
【0110】
上で指摘されたように、障害の「治療」には、障害の予防が含まれる。当業者は、「予防」が絶対的な用語でないことを認識するだろう。医学において、「予防」は、障害もしくはその生物学的徴候の見込みもしくは重症度を実質的に減少させるかまたはそのような障害もしくはその生物学的徴候の発生を遅らせるための、薬物の予防的な投与のことを指すと理解される。
【0111】
本明細書中で使用されるとき、式(I)の化合物もしくはその薬学上許容可能な塩または他の薬学上活性な薬剤に関する「安全かつ有効量」は、患者の状態を治療するのに十分であるが、まっとうな医学的判断の範囲内で重篤な副作用を回避するのに(妥当な利益/リスク比で)十分少ない、化合物の量のことを意味する。化合物の安全かつ有効量は、選択される特定の化合物(例えば、化合物の効力、有効性および半減期を考慮する)、選択される投与経路、治療される障害、治療される障害の重症度、治療される患者の年齢、サイズ、体重および身体的状態、治療される患者の病歴、治療の持続時間、併用療法の性質、所望の治療効果、ならびに類似の因子によって変動し得るが、それにもかかわらず、その量は、当業者が日常的に決定することができる。
【0112】
本明細書中で使用されるとき、「患者」は、ヒト(成人および小児を含む)または他の動物のことを指す。1つの実施形態において、「患者」は、ヒトのことを指す。
【0113】
式(I)の化合物またはその薬学上許容可能な塩は、全身投与と局所的投与の両方を含む任意の適当な投与経路によって投与されてよい。全身投与には、経口投与、非経口投与、経皮的投与および直腸投与が含まれる。非経口投与は、経腸または経皮以外の投与経路のことを指し、典型的には、注射または注入による。非経口投与には、静脈内、筋肉内および皮下への注射または注入が含まれる。局所的投与には、皮膚への適用、ならびに眼内、耳、膣内、吸入および鼻腔内投与が含まれる。吸入は、口腔からの吸入か鼻腔からの吸入かを問わず、患者の肺への投与のことを指す。1つの実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、経口投与され得る。別の実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、吸入によって投与され得る。さらなる実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、鼻腔内に投与され得る。
【0114】
式(I)の化合物またはその薬学上許容可能な塩は、1回だけ投与されてもよいし、何回かの投与が所与の時間にわたって様々な時間間隔で投与される投与レジメンに従って投与されてもよい。例えば、投与は、1日あたり1、2、3または4回行われ得る。1つの実施形態において、投与は、1日あたり1回行われる。さらなる実施形態において、投与は、1日あたり2回行われる。投与は、所望の治療効果が達成されるまで、または所望の治療効果を維持するために無期限に、行われ得る。式(I)の化合物またはその薬学上許容可能な塩に適した投与レジメンは、その化合物の薬物動態学的特性(例えば、吸収、分布および半減期)に依存し、その薬物動態学的特性は、当業者が測定することができる。さらに、式(I)の化合物またはその薬学上許容可能な塩に適した投与レジメン(そのようなレジメンが投与される持続時間を含む)は、治療される障害、治療される障害の重症度、治療される患者の年齢および身体的状態、治療される患者の病歴、併用療法の性質、所望の治療効果、ならびに当業者の知識および専門技術の範囲内の類似の因子に依存する。適当な投与レジメンが、その投与レジメンに対する個別の患者の反応を考慮して、または個別の患者が変更を必要とするにつれて、調整を要する場合があることが、係る当業者によってさらに理解されるだろう。
【0115】
典型的な1日の投薬量は、選択される特定の投与経路に応じて変動し得る。経口投与に対する典型的な1日の投薬量は、総体重1kgあたり0.001mg〜50mg、例えば、総体重1kgあたり1mg〜10mgの範囲である。例えば、経口投与に対する1日の投薬量は、患者1人あたり0.5mg〜2g(例えば、患者1人あたり10mg〜1g)であり得る。
【0116】
さらに、式(I)の化合物は、プロドラッグとして投与されてもよい。本明細書中で使用されるとき、式(I)の化合物の「プロドラッグ」は、患者に投与されるとインビボで最終的に式(I)の化合物を遊離する、その化合物の機能的誘導体である。プロドラッグとしての式(I)の化合物の投与によって、当業者は以下のうちの1つ以上を行うことができる可能性がある:(a)インビボにおけるその化合物の活性の開始を改変すること、(b)インビボにおけるその化合物の作用の持続時間を改変すること、(c)インビボにおけるその化合物の運搬または分布を改変すること、(d)インビボにおいて化合物の溶解性を改変すること、および(e)副作用、またはその化合物が遭遇する他の困難を克服すること。プロドラッグを調製するために使用される典型的な機能的誘導体は、インビボにおいて化学的または酵素的に切断可能な化合物の修飾を含む。そのような修飾(ホスフェート、アミド、エステル、チオエステル、カーボネートおよびカルバメートの調製を含む)は、当業者に周知である。
【0117】
したがって、本発明は、不適切なPI3−キナーゼ活性によって媒介される障害を治療する方法を提供し、その方法は、それを必要とする患者に、安全かつ有効量の式(I)の化合物またはその薬学上許容可能な塩を投与することを含む。
【0118】
1つの実施形態において、不適切なPI3−キナーゼ活性によって媒介される障害は、呼吸器疾患(喘息および慢性閉塞性肺疾患(COPD)を含む)、アレルギー性疾患(アレルギー性鼻炎およびアトピー性皮膚炎を含む)、自己免疫疾患(関節リウマチおよび多発性硬化症を含む)、炎症性障害(炎症性腸疾患を含む)、循環器疾患(血栓症およびアテローム性動脈硬化症を含む)、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、および疼痛(関節リウマチまたは変形性関節症に伴う疼痛、背痛、一般的な炎症性疼痛、肝後方神経痛、糖尿病性ニューロパシー、炎症性神経因性疼痛(トラマ)、三叉神経痛および中枢性疼痛を含む)からなる群から選択される。
【0119】
1つの実施形態において、不適切なPI3−キナーゼ活性によって媒介される障害は、呼吸器疾患である。さらなる実施形態において、不適切なPI3−キナーゼ活性によって媒介される障害は、喘息である。さらなる実施形態において、不適切なPI3−キナーゼ活性によって媒介される障害は、慢性閉塞性肺疾患(COPD)である。
【0120】
1つの実施形態において、不適切なPI3−キナーゼ活性によって媒介される障害は、疼痛である。
【0121】
1つの実施形態において、本発明は、医学的療法において使用するための式(I)の化合物またはその薬学上許容可能な塩を提供する。別の実施形態において、本発明は、不適切なPI3−キナーゼ活性によって媒介される障害の治療において使用するための式(I)の化合物またはその薬学上許容可能な塩を提供する。さらなる実施形態において、本発明は、不適切なPI3−キナーゼ活性によって媒介される障害の治療において使用するための薬剤の製造における式(I)の化合物またはその薬学上許容可能な塩の使用を提供する。
【0122】
組成物
式(I)の化合物およびその薬学上許容可能な塩は、必ずしもそうとは限らないが、通常、患者に投与する前に医薬組成物に製剤化され得る。したがって、別の態様において、本発明は、式(I)の化合物またはその薬学上許容可能な塩および1つ以上の薬学上許容可能な賦形剤を含む医薬組成物に関する。
【0123】
本発明の医薬組成物は、バルクの形態で調製され、包装されることがあり、ここで、安全かつ有効量の式(I)の化合物またはその薬学上許容可能な塩が、抽出され、次いで、散剤またはシロップ剤などとして患者に投与され得る。あるいは、本発明の医薬組成物は、単位剤形で調製され、包装されることがあり、ここで、物理的に別個の各単位が、式(I)の化合物またはその薬学上許容可能な塩を含む。本発明の医薬組成物は、単位剤形で調製されるとき、典型的には、例えば、0.5mg〜1gまたは1mg〜700mgまたは5mg〜100mgの式(I)の化合物またはその薬学上許容可能な塩を含み得る。
【0124】
本発明の医薬組成物は、典型的には、1種類の式(I)の化合物またはその薬学上許容可能な塩を含む。
【0125】
本明細書中で使用されるとき、「薬学上許容可能な賦形剤」は、医薬組成物に対して形態または濃度(consistency)を与えるのに関わる薬学上許容可能な材料、組成物またはビヒクルのことを意味する。患者に投与されたときに式(I)の化合物またはその薬学上許容可能な塩の有効性を実質的に減少させ得る相互作用、および薬学上許容可能でない医薬組成物をもたらし得る相互作用が回避されるように、各賦形剤は、混ぜ合わされたときにその医薬組成物の他の成分と適合性でなければならない。さらに、当然のことながら、各賦形剤は、薬学上許容可能、例えば、十分に高い純度でなければならない。
【0126】
式(I)の化合物またはその薬学上許容可能な塩および薬学上許容可能な賦形剤は、典型的には、所望の投与経路による患者への投与に適合した剤形に製剤化される。例えば、剤形には、(1)経口投与に適合した剤形(例えば、錠剤、カプセル、カプレット、丸剤、トローチ剤、散剤、シロップ剤、エリキシル剤(elixers)、懸濁液、溶液、エマルジョン、サシェ剤およびカシェ剤)、(2)非経口投与に適合した剤形(例えば、無菌の溶液、懸濁液および再構成用の散剤)、(3)経皮的投与に適合した剤形(例えば、経皮パッチ)、(4)直腸投与に適合した剤形(例えば、坐剤)、(5)吸入に適合した剤形(例えば、エアロゾル、溶液および乾燥粉末)、ならびに(6)局所的投与に適合した剤形(例えば、クリーム、軟膏、ローション、溶液、ペースト、スプレー、泡沫およびゲル)が含まれる。
【0127】
適当な薬学上許容可能な賦形剤は、選択される特定の剤形に応じて変化し得る。さらに、適当な薬学上許容可能な賦形剤は、それらがその組成物において果たし得る特定の機能について選択されてもよい。例えば、特定の薬学上許容可能な賦形剤は、均一な剤形の生成を容易にする能力について選択されてもよい。特定の薬学上許容可能な賦形剤は、安定な剤形の生成を容易にする能力について選択されてもよい。特定の薬学上許容可能な賦形剤は、患者に投与された際の、1つの器官または身体の一部から別の器官または身体の別の一部への式(I)の化合物またはその薬学上許容可能な塩の運搬または輸送を容易にする能力について選択されてもよい。特定の薬学上許容可能な賦形剤は、患者の服薬率を高める能力について選択されてもよい。
【0128】
適当な薬学上許容可能な賦形剤には、以下のタイプの賦形剤が含まれる:希釈剤、充填剤、結合剤、崩壊剤、潤滑剤、滑剤、造粒剤、コーティング剤、湿潤剤、溶媒、共溶媒、懸濁剤、乳化剤、甘味料(sweetners)、着香剤、風味マスキング剤(flavor masking agents)、着色剤、アンチケーキング剤、吸湿剤(hemectants)、キレート剤、可塑剤、粘度増加剤、酸化防止剤、保存剤、安定剤、界面活性物質および緩衝剤。当業者は、特定の薬学上許容可能な賦形剤が、2つ以上の機能を果たすことがあること、ならびに製剤中にどれだけの量の賦形剤が存在するかおよび製剤中にどのような他の賦形剤が存在するかに応じて、代替機能を果たすことがあることを認識するだろう。
【0129】
当業者は、本発明において使用するための適切な量の適当な薬学上許容可能な賦形剤の選択を可能にする当該分野の知識および技能を有する。さらに、薬学上許容可能な賦形剤を説明しており、かつ適当な薬学上許容可能な賦形剤の選択に有用であり得る、当業者に利用可能ないくつかのリソースが存在する。例としては、Remington’s Pharmaceutical Sciences(Mack Publishing Company)、The Handbook of Pharmaceutical Additives(Gower Publishing Limited)およびThe Handbook of Pharmaceutical Excipients(the American Pharmaceutical Association and the Pharmaceutical Press)が挙げられる。
【0130】
本発明の医薬組成物は、当業者に公知の手法および方法を用いて調製される。当該分野において通常使用される方法のいくつかは、Remington’s Pharmaceutical Sciences(Mack Publishing Company)に記載されている。
【0131】
したがって、別の態様において、本発明は、式(I)の化合物またはその薬学上許容可能な塩および1つ以上の薬学上許容可能な賦形剤を含む医薬組成物を調製するためのプロセスに関し、そのプロセスは、それらの成分を混合することを含む。式(I)の化合物またはその薬学上許容可能な塩を含む医薬組成物は、例えば、外界温度および大気圧での混合によって調製され得る。
【0132】
1つの実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、経口投与用に製剤化され得る。別の実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、吸入投与用に製剤化され得る。さらなる実施形態において、式(I)の化合物またはその薬学上許容可能な塩は、鼻腔内投与用に製剤化され得る。
【0133】
1つの態様において、本発明は、安全かつ有効量の式(I)の化合物またはその薬学上許容可能な塩および希釈剤または充填剤を含む経口用の固体剤形(例えば、錠剤またはカプセル)に関する。適当な希釈剤および充填剤としては、ラクトース、スクロース、デキストロース、マンニトール、ソルビトール、デンプン(例えば、トウモロコシデンプン、ジャガイモデンプンおよびアルファ化デンプン)、セルロースおよびその誘導体(例えば、微結晶性セルロース)、硫酸カルシウムならびにリン酸水素カルシウムが挙げられる。その経口用の固体剤形は、さらに結合剤を含むことがある。適当な結合剤としては、デンプン(例えば、トウモロコシデンプン、ジャガイモデンプンおよびアルファ化デンプン)、ゼラチン、アカシア、アルギン酸ナトリウム、アルギン酸、トラガント、グアーゴム、ポビドン、ならびにセルロースおよびその誘導体(例えば、微結晶性セルロース)が挙げられる。その経口用の固体剤形は、さらに崩壊剤を含むことがある。適当な崩壊剤としては、クロスポビドン、デンプングリコール酸ナトリウム、クロスカルメロース(croscarmelose)、アルギン酸およびカルボキシルメチルセルロースナトリウムが挙げられる。その経口用の固体剤形は、さらに潤滑剤を含むことがある。適当な潤滑剤としては、ステアリン酸、ステアリン酸マグネシウム(magnesuim stearate)、ステアリン酸カルシウムおよびタルクが挙げられる。
【0134】
必要に応じて、経口投与用の投薬単位製剤(dosage unit formulations)は、マイクロカプセル化され得る。その組成物は、例えば、粒状の材料をポリマー、ろうなどでコーティングするかまたはそれらに包埋することによって、放出を延長するかまたは持続させるように調製することもできる。
【0135】
式(I)の化合物またはその薬学上許容可能な塩は、標的化可能な薬物担体として溶解性ポリマーと結合されてもよい。それらのポリマーには、ポリビニルピロリドン、ピラン共重合体、ポリヒドロキシプロピルメタクリルアミド−フェノール、ポリヒドロキシエチルアスパルトアミドフェノール、またはパルミトイル残基で置換されるポリエチレンオキシドポリリジンが含まれ得る。さらに、式(I)の化合物またはその薬学上許容可能な塩は、薬物の制御放出を達成する際に有用なあるクラスの生分解性ポリマー、例えば、ポリ乳酸、ポリイプシロン(polepsilon)カプロラクトン、ポリヒドロキシ酪酸、ポリオルトエステル、ポリアセタール、ポリジヒドロピラン、ポリシアノアクリレート、および架橋されたまたは両親媒性の、ヒドロゲルのブロック共重合体に結合されてもよい。
【0136】
別の態様において、本発明は、経口用の液体剤形に関する。経口用の液体(例えば、溶液、シロップ剤およびエリキシル剤)は、所与の分量が所定量の式(I)の化合物またはその薬学上許容可能な塩を含むように投薬単位形態で調製され得る。シロップ剤は、式(I)の化合物またはその薬学上許容可能な塩を適切に風味がつけられた水溶液に溶解することによって調製され得、エリキシル剤は、無毒性のアルコール性ビヒクルを使用することによって調製される。懸濁液は、式(I)の化合物またはその薬学上許容可能な塩を無毒性ビヒクルに分散することによって製剤化することができる。可溶化剤および乳化剤(例えば、エトキシ化イソステアリルアルコールおよびポリオキシエチレンソルビトールエーテル)、保存剤、香味用添加物(例えば、ペパーミントオイル)あるいは天然の甘味料またはサッカリンもしくは他の人工甘味料なども加えることができる。
【0137】
別の態様において、本発明は、吸入による患者への投与に適合した剤形(例えば、乾燥粉末、エアロゾル、懸濁液または溶液組成物)に関する。例えば、本発明は、式(I)の化合物またはその薬学上許容可能な塩を含む、吸入に適合した乾燥粉末組成物に関する。
【0138】
吸入による肺への送達用の乾燥粉末組成物は、典型的には、微粉化された粉末としての式(I)の化合物またはその薬学上許容可能な塩を、微粉化された粉末としての1つ以上の薬学上許容可能な賦形剤とともに含む。乾燥粉末での使用に特にふさわしい薬学上許容可能な賦形剤は、当業者に公知であり、それらとしては、ラクトース、デンプン、マンニトール、ならびに単糖、二糖および多糖が挙げられる。微粉化された粉末は、例えば、微粒子化および製粉によって調製され得る。一般に、サイズが減少された(例えば、微粒子化された)化合物は、約1〜約10ミクロンというD50値(例えば、レーザー回折を用いて測定される)によって定義することができる。
【0139】
乾燥粉末は、複数回分の用量(未計量の用量)の乾燥粉末形態の医薬を貯蔵するのに適したレザバー(reservoir)を有するレザバー乾燥粉末吸入器(RDPI)によって患者に投与され得る。RDPIは、典型的には、レザバーから送達部位に各医薬用量を計量して供給するための手段を備える。例えば、その計量供給手段は、計量カップ(metering cup)を備えることがあり、そのカップは、第1の位置(そのカップがレザバーからの医薬で満たされ得る位置)から、第2の位置(計量された用量の医薬が吸入のために患者に利用可能となる位置)に移動可能である。
【0140】
あるいは、乾燥粉末は、複数回用量乾燥粉末吸入器(MDPI)において使用するためのカプセル(例えば、ゼラチンまたはプラスチック)、カートリッジまたはブリスター包装として提供されてもよい。MDPIは、医薬が、既定の複数回分の用量(またはその一部)の医薬を含む(または別途有する)複数回用量パック内に含められている、吸入器である。乾燥粉末が、ブリスター包装として提供されるとき、そのブリスター包装は、乾燥粉末の形態の医薬を含めるための複数のブリスターを備える。それらのブリスターは、典型的には、それらから医薬を放出するのを容易にするために規則的な様式で配置される。例えば、ブリスターは、円盤型のブリスター包装上にたいてい円形の形式で配置されていることもあるし、ブリスターは、例えば、ストリップまたはテープを備えた形態で細長いこともある。各カプセル、カートリッジまたはブリスターは、例えば、20μg〜10mgの式(I)の化合物またはその薬学上許容可能な塩を含み得る。
【0141】
式(I)の化合物またはその薬学上許容可能な塩を液体噴射剤に懸濁するかまたは溶解することによって、エアロゾルが形成され得る。適当な噴射剤には、ハロカーボン、炭化水素および他の液化ガスが含まれる。代表的な噴射剤としては:トリクロロフルオロメタン(propellant 11)、ジクロロフルオロメタン(propellant 12)、ジクロロテトラフルオロエタン(propellant 114)、テトラフルオロエタン(HFA−134a)、1,1−ジフルオロエタン(HFA−152a)、ジフルオロメタン(HFA−32)、ペンタフルオロエタン(HFA−12)、ヘプタフルオロプロパン(HFA−227a)、ペルフルオロプロパン、ペルフルオロブタン、ペルフルオロペンタン、ブタン、イソブタンおよびペンタンが挙げられる。式(I)の化合物またはその薬学上許容可能な塩を含むエアロゾルは、典型的には、定量吸入器(MDI)によって患者に投与され得る。そのようなデバイスは、当業者に公知である。
【0142】
そのエアロゾルは、典型的にMDIで使用される追加の薬学上許容可能な賦形剤(例えば、界面活性物質、潤滑剤、共溶媒、および製剤の物理的安定性を改善するか、バルブの性能を改善するか、溶解性を改善するか、または味を改善する他の賦形剤)を含むことがある。
【0143】
したがって、本発明のさらなる態様として、式(I)の化合物またはその薬学上許容可能な塩、および噴射剤としてフルオロカーボンまたは水素含有クロロフルオロカーボンを、必要に応じて界面活性物質および/または共溶媒とともに含む医薬エアロゾル製剤が提供される。
【0144】
本発明の別の態様によれば、噴射剤が、1,1,1,2−テトラフルオロエタン、1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンおよびそれらの混合物から選択される、医薬エアロゾル製剤が提供される。
【0145】
本発明の製剤は、適当な緩衝剤を加えることによって緩衝されることがある。
【0146】
式(I)の化合物またはその薬学上許容可能な塩と適当な粉末基剤(例えば、ラクトースまたはデンプン)との吸入用粉末混合物を含む、吸入器または注入器において使用するためのカプセルおよびカートリッジ(例えば、ゼラチン製)が、製剤化されることがある。カプセルまたはカートリッジの各々は、通常、20μg〜10mgの式(I)の化合物またはその薬学上許容可能な塩を含み得る。あるいは、式(I)の化合物またはその薬学上許容可能な塩は、ラクトースなどの賦形剤なしで提供されてもよい。
【0147】
本発明に係る局所用組成物中の式(I)の活性な化合物またはその薬学上許容可能な塩の比率は、調製される製剤の正確なタイプに依存するが、一般に、0.001〜10重量%の範囲内であり得る。一般に、調製物の大部分のタイプについて、使用される比率は、0.005〜1%、例えば、0.01〜0.5%の範囲内であり得る。しかしながら、吸入用またはガス注入用の粉末においては、使用される比率は、通常、0.1〜5%の範囲内であり得る。
【0148】
エアロゾル製剤は、好ましくは、各定量(each metered dose)または各「パフ」のエアロゾルに、20μg〜10mg、好ましくは、20μg〜2000μg、より好ましくは、約20μg〜500μgの式(I)の化合物が含まれるように取り決められる。投与は、1日に1回または1日に数回、例えば、2、3、4または8回であり得、各回、例えば、1、2または3用量投与され得る。エアロゾルを用いた全1日量は、100μg〜10mg、好ましくは、200μg〜2000μgの範囲内であり得る。吸入器または注入器においてカプセルおよびカートリッジによって送達される全1日量および定量は、一般に、エアロゾル製剤を用いて送達される量の2倍であり得る。
【0149】
懸濁エアロゾル(suspension aerosol)製剤の場合、粒状の(例えば、微粒子化された)薬物の粒径は、そのエアロゾル製剤が投与された際に実質的にすべての薬物が肺に吸入されるような粒径であるべきであり、ゆえに、100ミクロン未満、望ましくは20ミクロン未満、特に、1〜10ミクロン(例えば、1〜5ミクロン、より好ましくは、2〜3ミクロン)の範囲であり得る。
【0150】
本発明の製剤は、医薬および式(I)の化合物またはその薬学上許容可能な塩を、例えば超音波処理または高剪断ミキサーの助けを借りて、適切な容器内で選択された噴射剤に分散するかまたは溶解することによって調製され得る。そのプロセスは、望ましくは、調節された湿度条件下において行われる。
【0151】
本発明に係るエアロゾル製剤の化学的および物理的安定性ならびに医薬上の許容性は、当業者に周知の手法によって測定され得る。したがって、例えば、構成要素の化学安定性は、例えば、生成物の長期貯蔵後の、HPLCアッセイによって測定され得る。物理的安定性のデータは、他の従来の分析技術(例えば、漏れ検査、バルブ送達アッセイ(操作1回あたりの平均射出重量)、用量再現性アッセイ(操作1回あたりの活性成分量)およびスプレー分布分析)から得てもよい。
【0152】
本発明に係る懸濁エアロゾル製剤の安定性は、従来の手法、例えば、後方光散乱装置を用いてフロキュレーションサイズ分布を測定すること、またはカスケードインパクションもしくは「ツインインピンジャー」分析プロセスによって粒子サイズ分布を測定することによって測定され得る。本明細書中で使用されるとき、「ツインインピンジャー」アッセイに対する言及は、British Pharmacopaeia 1988,A204〜207頁,Appendix XVII Cに定義されているような「装置Aを用いた、加圧吸入における放出用量の沈着量の測定」のことを意味する。そのような手法によって、エアロゾル製剤の「呼吸性画分(respirable fraction)」の算出が可能である。「呼吸性画分」を算出するために使用される1つの方法は、操作1回あたりに下部のインピンジメントチャンバーに集められる活性成分の量である「細粒子画分」を参考とするものであり、これは、上に記載したツインインピンジャー法を用いて操作1回あたりに送達される活性成分の総量に対するパーセンテージとして表現される。
【0153】
用語「定量吸入器」またはMDIは、缶、その缶を覆う固定されたキャップ、およびそのキャップに位置している製剤計量バルブを備えるユニットのことを意味する。MDIシステムは、適当なチャネリングデバイスを備える。適当なチャネリングデバイスは、例えば、バルブアクチュエータおよび円筒形または円錐様の通路を備え、医薬は、それらを通って、充填されたキャニスターから計量バルブを経由して患者の鼻または口に送達され得る(例えば、マウスピースアクチュエータ)。
【0154】
MDIキャニスターは、一般に、使用される噴射剤の蒸気圧に耐えることができる容器(例えば、プラスチックボトルもしくはプラスチックでコーティングされたガラスボトル、または好ましくは、金属缶(それらは、必要に応じて、陽極酸化され得、ラッカーコーティングされ得、そして/またはプラスチックコーティングされ得る)、例えば、アルミニウムまたはその合金の缶(例えば、本明細書に参考として援用されるWO96/32099では、内面の一部または全部が、必要に応じて1つ以上の非フルオロカーボンポリマーとともに1つ以上のフルオロカーボンポリマーでコーティングされている))を含み、その容器は、計量バルブを用いて閉鎖されている。そのキャップは、超音波溶接、ねじ取り付け(screw fitting)またはクリンピングによって、その缶に固定されていることがある。本明細書中に教示されるMDIは、当該分野の方法(例えば、上記のByronおよびWO96/32099を参照のこと)によって作製され得る。好ましくは、そのキャニスターは、キャップの組立て部品と嵌合し、ここで、薬物計量バルブは、キャップに位置しており、前記キャップは、しかるべき位置にクリンピングされている。
【0155】
本発明の1つの実施形態において、その缶の金属性の内面は、フルオロポリマー、より好ましくは、非フルオロポリマーと混和されたフルオロポリマーでコーティングされている。本発明の別の実施形態において、その缶の金属性の内面は、ポリテトラフルオロエチレン(PTFE)とポリエーテルスルホン(PES)とのポリマー混和物でコーティングされている。本発明のさらなる実施形態において、その缶の金属性の内面の全体は、ポリテトラフルオロエチレン(PTFE)とポリエーテルスルホン(PES)とのポリマー混和物でコーティングされている。
【0156】
上記計量バルブは、操作1回あたりに定量の製剤を送達し、かつそのバルブを通って噴射剤が漏出するのを防ぐガスケットを組み込むように設計されている。そのガスケットは、任意の適当なエラストマー材料(例えば、低密度ポリエチレン、クロロブチル、ブロモブチル、EPDM、黒および白ブタジエン−アクリロニトリルゴム、ブチルゴム、ならびにネオプレン)を備えることがある。適当なバルブは、エアロゾル業界において周知の製造者、例えば、Valois,France(例えば、DF10、DF30、DF60)、Bespak plc,UK(例えば、BK300、BK357)および3M−Neotechnic Ltd,UK(例えば、SpraymiserTM)から商業的に入手可能である。
【0157】
様々な実施形態において、MDIは、他の構造物(例えば、限定されないが、MDIを格納して収容する外装(overwrap packages)(米国特許第6,119,853号明細書、同第6,179,118号明細書、同第6,315,112号明細書、同第6,352,152号明細書、同第6,390,291号明細書、および同第6,679,374号明細書に記載されているものを含む)ならびにドーズカウンターユニット(dose counter units)(例えば、限定されないが、米国特許第6,360,739号明細書および同第6,431,168号明細書に記載されているもの))とともに使用され得る。
【0158】
医薬エアロゾル製造に関する当業者に周知の従来のバルク製造の方法および仕組みが、充填されたキャニスターの商業生産のための大規模バッチ調製のために使用され得る。したがって、例えば、懸濁エアロゾル製剤を調製するための1つのバルク製造方法において、計量バルブが、アルミニウム缶にクリンピングされることにより、空のキャニスターが形成される。粒状の医薬を投入容器に加え、液化された噴射剤が、随意の賦形剤とともに、その投入容器を通って、製造容器に圧縮充填される。その薬物懸濁液が混合された後、充填機に再循環され、次いで、薬物懸濁液のアリコートが、計量バルブを通ってキャニスターに充填される。溶液エアロゾル製剤を調製するためのバルク製造方法の1つの例では、計量バルブが、アルミニウム缶にクリンピングされることにより、空のキャニスターが形成される。液化された噴射剤が、随意の賦形剤および溶解された薬物とともに、投入容器を通って、製造容器に圧縮充填される。
【0159】
代替プロセスでは、液化された製剤のアリコートを、製剤が確実に気化しないほど十分に冷えた条件下で開放キャニスターに加え、次いで、計量バルブをそのキャニスター上にクリンピングする。
【0160】
典型的には、薬学上使用するために調製されるバッチにおいて、充填された各キャニスターが、重量検査され、バッチ番号で符号化され、貯蔵のためにトレーに詰め込まれた後、リリース試験される。
【0161】
式(I)の化合物またはその薬学上許容可能な塩を含む懸濁液および溶液もまた、噴霧器によって患者に投与されることがある。噴霧化のために使用される溶媒または懸濁剤は、任意の薬学上許容可能な液体(例えば、水、食塩水溶液、アルコールもしくはグリコール、例えば、エタノール、イソプロピルアルコール、グリセロール、プロピレングリコール、ポリエチレングリコールなどまたはそれらの混合物)であり得る。食塩水溶液には、投与後にほとんどまたはまったく薬理学的活性を示さない塩を利用する。アルカリ金属塩またはアンモニウムハロゲン塩、例えば、塩化ナトリウム、塩化カリウムなどの有機塩と、カリウム塩、ナトリウム塩およびアンモニウム塩などの有機塩の両方、または有機酸(例えば、アスコルビン酸、クエン酸、酢酸、酒石酸など)を、この目的のために使用してよい。
【0162】
他の薬学上許容可能な賦形剤が、上記懸濁液または溶液に加えられてもよい。式(I)の化合物またはその薬学上許容可能な塩は、無機酸、例えば、塩酸、硝酸、硫酸および/もしくはリン酸、有機酸、例えば、アスコルビン酸、クエン酸、酢酸および酒石酸など、錯化剤(例えば、EDTAまたはクエン酸およびその塩)、または酸化防止剤(例えば、ビタミンEまたはアスコルビン酸などの酸化防止剤)を加えることによって安定化されることがある。これらは、式(I)の化合物またはその薬学上許容可能な塩を安定化させるために、単独で使用されてもよいし、同時に使用されてもよい。保存剤(例えば、塩化ベンザルコニウムまたは安息香酸およびその塩)が加えられてもよい。特に、懸濁液の物理的安定性を改善するために、界面活性物質が加えられてもよい。これらには、レシチン、ジオクチルスルホコハク酸二ナトリウム、オレイン酸およびソルビタンエステルが含まれる。
【0163】
さらなる態様において、本発明は、鼻腔内投与に適合した剤形に関する。
【0164】
鼻への投与用の製剤には、加圧エアロゾル製剤、および加圧ポンプによって鼻に投与される水性製剤が含まれ得る。加圧されていない、鼻腔への局所的投与に適合した製剤が、特に興味深い。適当な製剤は、この目的のための希釈剤または担体として水を含む。肺または鼻への投与用の水性製剤は、従来の賦形剤(例えば、緩衝剤、張度改変剤など)とともに提供され得る。水性製剤は、噴霧によって鼻に投与されてもよい。
【0165】
式(I)の化合物またはその薬学上許容可能な塩は、流体用ディスペンサーから送達するための流体製剤として製剤化され得、その流体用ディスペンサーは、例えば、そのディスペンサーのポンプ機構に使用者が力を適用したときに定量の流体製剤を供給する供給ノズルまたは供給オリフィスを有する流体用ディスペンサーである。そのような流体用ディスペンサーには、一般に、複数回分の定量の流体製剤のレザバーが提供され、その定量は、連続的にポンプを操作すると供給可能である。その供給ノズルまたは供給オリフィスは、流体製剤を鼻腔内に噴霧供給するために使用者の鼻孔内に挿入するように配置されている場合がある。上述のタイプの流体用ディスペンサーは、WO05/044354(この内容全体が本明細書に参考として援用される)に記載され、図示されている。そのディスペンサーは、流体製剤を収容するための容器に取り付けられた圧搾ポンプを有する流体発射デバイスを収納するハウジングを有する。そのハウジングは、指で操作可能な少なくとも1つのサイドレバーを有し、そのレバーは、ハウジングに対して内向きに動かすことができ、それにより、その容器がハウジング内で上向きに移動してポンプが圧縮され、定量の製剤がポンプステム(pump stem)からハウジングの鼻ノズルを通って送り出される。1つの実施形態において、流体用ディスペンサーは、WO05/044354の図30〜40に図示されている一般的なタイプである。
【0166】
鼻腔内投与に適合した医薬組成物(その担体は固体である)は、鼻に近づけて保持された散剤の容器から鼻腔を通って急速吸入によって投与される、例えば、20〜500ミクロンの範囲の粒径を有する粗末を含む。点鼻薬または点鼻液としての投与に適した組成物(その担体は液体である)は、式(I)の化合物またはその薬学上許容可能な塩の水性または油性の溶液を含む。
【0167】
経皮的投与に適合した医薬組成物は、長時間にわたって患者の表皮と密接に接触したままであることを意図された不連続のパッチとして提供され得る。例えば、活性成分は、Pharmaceutical Research,3(6),318(1986)に広く記載されているようなイオン導入によって、そのパッチから送達され得る。
【0168】
局所的投与に適合した医薬組成物は、軟膏、クリーム、懸濁液、ローション、散剤、溶液、ペースト、ゲル、スプレー、エアロゾルまたはオイルとして製剤化され得る。
【0169】
軟膏、クリームおよびゲルは、適当な増粘剤および/またはゲル化剤および/または溶媒を添加して、例えば、水性または油性の基剤を用いて製剤化され得る。したがって、そのような基剤は、例えば、水および/もしくは油(例えば、流動パラフィンまたは植物油(例えば、落花生油またはひまし油))またはポリエチレングリコールなどの溶媒を含み得る。基剤の性質に従って使用され得る増粘剤およびゲル化剤としては、軟パラフィン、ステアリン酸アルミニウム、セトステアリルアルコール、ポリエチレングリコール、羊毛脂、蜜ろう、カルボキシポリメチレンおよびセルロース誘導体、ならびに/またはモノステアリン酸グリセリルおよび/もしくは非イオン性乳化剤が挙げられる。
【0170】
ローションは、水性または油性の基剤を用いて製剤化され得、一般に、1つ以上の乳化剤、安定化剤、分散剤、懸濁剤または増粘剤も含み得る。
【0171】
外用のための散剤は、任意の適当な粉末基剤、例えば、タルク、ラクトースまたはデンプンの助けを借りて形成され得る。滴剤は、1つ以上の分散剤、可溶化剤、懸濁剤または保存剤も含む、水性または非水性の基剤を用いて製剤化され得る。
【0172】
局所用調製物は、1日あたり1回以上の患部への適用によって投与され得る、皮膚領域を覆う密封包帯が、都合よく使用され得る。持続的な送達または長期の送達は、接着性のレザバーシステムによって達成されることがある。
【0173】
眼または他の外面の組織、例えば、口および皮膚を治療する場合、本組成物は、局所用の軟膏またはクリームとして適用されてもよい。軟膏として製剤化されるとき、式(I)の化合物またはその薬学上許容可能な塩は、パラフィン系または水混和性の軟膏基剤とともに使用され得る。あるいは、式(I)の化合物またはその薬学上許容可能な塩は、水中油型クリーム基剤または油中水型基剤を用いてクリームとして製剤化され得る。
【0174】
非経口投与に適合した医薬組成物には、酸化防止剤、緩衝剤、静菌剤、ならびに意図されるレシピエントの血液と製剤を等張性にする溶質を含み得る水性および非水性の無菌注射溶液、ならびに懸濁剤および増粘剤を含み得る水性および非水性の無菌懸濁液が含まれる。その組成物は、単位用量または複数回用量が入った容器(例えば、密封されたアンプルおよびバイアル)として提供され得、使用の直前に無菌の液体担体(例えば、注射用水)の添加だけが必要なフリーズドライ(凍結乾燥)された状態で保管され得る。即時調合の注射溶液および注射懸濁液は、無菌の散剤、顆粒剤および錠剤から調製され得る。
【0175】
本発明に係る化合物および医薬製剤は、例えば、抗炎症剤、抗コリン剤(特に、M1/M2/M3受容体拮抗薬)、β2−アドレナリン受容体作動薬、抗感染症剤(例えば、抗生物質または抗ウイルス薬)または抗ヒスタミン剤から選択される1つ以上の他の治療薬と併用して使用され得るか、またはそれらを含み得る。したがって、本発明は、さらなる態様において、例えば、抗炎症剤(例えば、コルチコステロイドまたはNSAID)、抗コリン剤、β2−アドレナリン受容体作動薬、抗感染症剤(例えば、抗生物質または抗ウイルス薬)または抗ヒスタミン剤から選択される、1つ以上の他の治療上活性な薬剤とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。本発明の1つの実施形態は、β2−アドレナリン受容体作動薬および/または抗コリン薬および/またはPDE−4阻害剤および/または抗ヒスタミン剤とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを包含する。
【0176】
本発明の特定の化合物は、他のPI3−キナーゼよりもPI3Kδに対して選択性を示し得る。したがって、本発明は、さらなる態様において、PI3Kδに対して選択的な式(I)の化合物またはその薬学上許容可能な塩を、別のPI3−キナーゼ(例えば、PI3Kγ)に対して選択的な化合物またはその薬学上許容可能な塩とともに含む組み合わせを提供する。
【0177】
本発明の1つの実施形態は、1または2種類の他の治療薬を含む組み合わせを包含する。
【0178】
必要に応じて、他の治療成分が、その治療成分の活性および/または安定性および/または物理的特性(例えば、溶解性)を最適化するために、塩の形態で(例えば、アルカリ金属塩もしくはアミン塩または酸付加塩として)、またはプロドラッグとして、またはエステル(例えば、低級アルキルエステル)、または溶媒和化合物(例えば、水和物)として、使用され得ることは、当業者には明らかであろう。必要に応じて、その治療成分が光学的に純粋な形態で使用され得ることも明らかであろう。
【0179】
1つの実施形態において、本発明は、β2−アドレナリン受容体作動薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを包含する。
【0180】
β2−アドレナリン受容体作動薬の例としては、サルメテロール(ラセミ体であっても、R−エナンチオマーなどの単一のエナンチオマーであってもよい)、サルブタモール(ラセミ体であっても、R−エナンチオマーなどの単一のエナンチオマーであってもよい)、フォルモテロール(formoterol)(ラセミ体であっても、R,R−ジアステレオマーなどの単一のジアステレオマー(duastereomer)であってもよい)、サルメファモール(salmefamol)、フェノテロール、カルモテロール(carmoterol)、エタンテロール(etanterol)、ナミンテロール(naminterol)、クレンブテロール、ピルブテロール、フレルブテロール(flerbuterol)、レプロテロール(reproterol)、バンブテロール(bambuterol)、インダカテロール(indacaterol)、テルブタリンおよびそれらの塩、例えば、サルメテロールのキシナホ酸(1−ヒドロキシ−2−ナフタレンカルボン酸)塩、サルブタモールの硫酸塩もしくは遊離塩基、またはフォルモテロールのフマル酸塩が挙げられる。1つの実施形態において、長時間作用型β2−アドレナリン受容体作動薬、例えば、約12時間またはそれ以上にわたって有効な気管支拡張作用を提供する化合物が、好ましい。
【0181】
他のβ2−アドレナリン受容体作動薬としては、WO02/066422、WO02/070490、WO02/076933、WO03/024439、WO03/072539、WO03/091204、WO04/016578、WO2004/022547、WO2004/037807、WO2004/037773、WO2004/037768、WO2004/039762、WO2004/039766、WO01/42193およびWO03/042160に記載されているものが挙げられる。
【0182】
β2−アドレナリン受容体作動薬の例としては:
3−(4−{[6−({(2R)−2−ヒドロキシ−2−[4−ヒドロキシ−3−(ヒドロキシメチル)フェニル]エチル}アミノ)ヘキシル]オキシ}ブチル)ベンゼンスルホンアミド、
3−(3−{[7−({(2R)−2−ヒドロキシ−2−[4−ヒドロキシ−3−ヒドロキシメチル)フェニル]エチル}−アミノ)ヘプチル]オキシ}プロピル)ベンゼンスルホンアミド、
4−{(1R)−2−[(6−{2−[(2,6−ジクロロベンジル)オキシ]エトキシ}ヘキシル)アミノ]−1−ヒドロキシエチル}−2−(ヒドロキシメチル)フェノール、
4−{(1R)−2−[(6−{4−[3−(シクロペンチルスルホニル)フェニル]ブトキシ}ヘキシル)アミノ]−1−ヒドロキシエチル}−2−(ヒドロキシメチル)フェノール、
N−[2−ヒドロキシル−5−[(1R)−1−ヒドロキシ−2−[[2−4−[[(2R)−2−ヒドロキシ−2−フェニルエチル]アミノ]フェニル]エチル]アミノ]エチル]フェニル]ホルムアミド、
N−2{2−[4−(3−フェニル−4−メトキシフェニル)アミノフェニル]エチル}−2−ヒドロキシ−2−(8−ヒドロキシ−2(1H)−キノリノン−5−イル)エチルアミン、および
5−[(R)−2−(2−{4−[4−(2−アミノ−2−メチル−プロポキシ)−フェニルアミノ]−フェニル}−エチルアミノ)−1−ヒドロキシ−エチル]−8−ヒドロキシ−1H−キノリン−2−オン
が挙げられる。
【0183】
β2−アドレナリン受容体作動薬は、硫酸、塩酸、フマル酸、ヒドロキシナフトエ酸(例えば、1−または3−ヒドロキシ−2−ナフトエ酸)、桂皮酸、置換される桂皮酸、トリフェニル酢酸、スルファミン酸、スルファニル酸、ナフタレンアクリル酸、安息香酸、4−メトキシ安息香酸、2−または4−ヒドロキシ安息香酸、4−クロロ安息香酸および4−フェニル安息香酸から選択される薬学上許容可能な酸と形成される塩の形態で存在し得る。
【0184】
適当な抗炎症剤には、コルチコステロイドが含まれる。式(I)の化合物またはその薬学上許容可能な塩と併用して使用され得る適当なコルチコステロイドは、経口および吸入コルチコステロイド、ならびに抗炎症活性を有するそれらのプロドラッグである。例としては、メチルプレドニゾロン、プレドニゾロン、デキサメタゾン、プロピオン酸フルチカゾン、6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−17α−[(4−メチル−1,3−チアゾール−5−カルボニル)オキシ]−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステル、6α,9α−ジフルオロ−17α−[(2−フラニルカルボニル)オキシ]−11β−ヒドロキシ−16α−メチル−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステル(フロ酸フルチカゾン)、6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−3−オキソ−17α−プロピオニルオキシ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−(2−オキソ−テトラヒドロ−フラン−3S−イル)エステル、6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−3−オキソ−17α−(2,2,3,3−テトラメチルシクロプロピルカルボニル(tetramethycyclopropylcarbonyl))オキシ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−シアノメチルエステルおよび6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−17α−(1−メチルシクロプロピルカルボニル(methycyclopropylcarbonyl))オキシ−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステル、ベクロメタゾンエステル(例えば、17−プロピオン酸エステルまたは17,21−二プロピオン酸エステル)、ブデソニド(budesonide)、フルニソリド、モメタゾン(mometasone)エステル(例えば、フロ酸モメタゾン)、トリアムシノロンアセトニド、ロフレポニド(rofleponide)、シクレソニド(16α,17−[[(R)−シクロヘキシルメチレン]ビス(オキシ)]−11β,21−ジヒドロキシ−プレグナ−1,4−ジエン−3,20−ジオン)、プロピオン酸ブチキソコルト(butixocort propionate)、RPR−106541およびST−126が挙げられる。好ましいコルチコステロイドとしては、プロピオン酸フルチカゾン、6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−17α−[(4−メチル−1,3−チアゾール−5−カルボニル)オキシ]−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステル、6α,9α−ジフルオロ−17α−[(2−フラニルカルボニル)オキシ]−11β−ヒドロキシ−16α−メチル−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステル、6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−3−オキソ−17α−(2,2,3,3−テトラメチルシクロプロピルカルボニル)オキシ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−シアノメチルエステルおよび6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−17α−(1−メチルシクロプロピルカルボニル)オキシ−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステルが挙げられる。1つの実施形態において、コルチコステロイドは、6α,9α−ジフルオロ−17α−[(2−フラニルカルボニル)オキシ]−11β−ヒドロキシ−16α−メチル−3−オキソ−アンドロスタ−1,4−ジエン−17β−カルボチオ酸S−フルオロメチルエステルである。
【0185】
コルチコステロイドの例としては、WO2002/088167、WO2002/100879、WO2002/12265、WO2002/12266、WO2005/005451、WO2005/005452、WO2006/072599およびWO2006/072600に記載されているものが挙げられ得る。
【0186】
トランス活性化よりもトランス抑制に対して選択性を有し得、かつ併用療法において有用であり得る、グルココルチコイドアゴニズムを有する非ステロイド性化合物としては、以下の特許に包含されている化合物が挙げられる:WO03/082827、WO98/54159、WO04/005229、WO04/009017、WO04/018429、WO03/104195、WO03/082787、WO03/082280、WO03/059899、WO03/101932、WO02/02565、WO01/16128、WO00/66590、WO03/086294、WO04/026248、WO03/061651およびWO03/08277。さらなる非ステロイド性化合物は:WO2006/000401、WO2006/000398およびWO2006/015870に包含されている。
【0187】
抗炎症剤の例としては、非ステロイド性抗炎症薬(NSAID)が挙げられる。
【0188】
NSAIDの例としては、クロモグリク酸ナトリウム、ネドクロミルナトリウム、ホスホジエステラーゼ(PDE)阻害剤(例えば、テオフィリン、PDE4阻害剤、または混合PDE3/PDE4阻害剤)、ロイコトリエン拮抗薬、ロイコトリエン合成の阻害剤(例えば、モンテルカスト)、iNOS阻害剤、トリプターゼおよびエラスターゼの阻害剤、ベータ−2インテグリン拮抗薬、ならびにアデノシン受容体作動薬もしくは拮抗薬(例えば、アデノシン2a作動薬)、サイトカイン拮抗薬(例えば、CCR3拮抗薬などのケモカイン拮抗薬)もしくはサイトカイン合成の阻害剤、または5−リポキシゲナーゼ阻害剤が挙げられる。iNOS(誘導型一酸化窒素合成酵素阻害剤)は、好ましくは、経口投与用である。iNOS阻害剤の例としては、WO93/13055、WO98/30537、WO02/50021、WO95/34534およびWO99/62875に開示されているものが挙げられる。CCR3阻害剤の例としては、WO02/26722に開示されているものが挙げられる。
【0189】
1つの実施形態において、本発明は、ホスホジエステラーゼ4(PDE4)阻害剤との組み合わせ(特に、吸入に適合した製剤の場合)における式(I)の化合物の使用を提供する。本発明のこの態様において有用なPDE4特異的阻害剤は、PDE4酵素を阻害すると知られているかまたはPDE4阻害剤として作用すると発見されていて、かつ、PDE4と同様にPDEファミリーの他のメンバー(例えば、PDE3およびPDE5)を阻害する化合物ではない単なるPDE4阻害剤である、任意の化合物であり得る。
【0190】
化合物には、cis−4−シアノ−4−(3−シクロペンチルオキシ−4−メトキシフェニル)シクロヘキサン−1−カルボン酸、2−カルボメトキシ−4−シアノ−4−(3−シクロプロピルメトキシ−4−ジフルオロメトキシフェニル)シクロヘキサン−1−オンおよびcis−[4−シアノ−4−(3−シクロプロピルメトキシ−4−ジフルオロメトキシフェニル)シクロヘキサン−1−オール]が含まれる。また、1996年9月3日発行の米国特許第5,552,438号明細書に記載されている、cis−4−シアノ−4−[3−(シクロペンチルオキシ)−4−メトキシフェニル]シクロヘキサン−1−カルボン酸(シロミラスト(cilomilast)としても知られる)およびその塩、エステル、プロドラッグまたは物理的形態、この特許およびそれが開示する化合物は、その全体が参考として援用される。
【0191】
他の化合物としては、Elbion製のAWD−12−281(Hofgen,N.ら、15th EFMC Int Symp Med Chem(Sept 6−10,Edinburgh)1998,Abst P.98;CAS照合番号247584020−9);NCS−613(INSERM)と命名された9−ベンジルアデニン誘導体;ChiroscienceおよびSchering−Plough製のD−4418;CI−1018(PD−168787)として同定され、Pfizerに帰属するベンゾジアゼピンPDE4阻害剤;Kyowa HakkoによってWO99/16766に開示されたベンゾジオキソール誘導体;Kyowa Hakko製のK−34;Napp製のV−11294A(Landells,L.J.ら、Eur Resp J[Annu Cong Eur Resp Soc(Sept 19−23,Geneva)1998] 1998,12(Suppl.28):Abst P2393);ロフルミラスト(roflumilast)(CAS照合番号162401−32−3)およびByk−Gulden製のフタラジノン(pthalazinone)(WO99/47505(この開示は、本明細書に参考として援用される));Byk−Gulden(現Altana)によって調製され、公開された混合PDE3/PDE4阻害剤である、Pumafentrine、すなわち(−)−p−[(4aR*,10bS*)−9−エトキシ−1,2,3,4,4a,10b−ヘキサヒドロ−8−メトキシ−2−メチルベンゾ[c][1,6]ナフチリジン−6−イル]−N,N−ジイソプロピルベンズアミド;Almirall−Prodesfarmaが開発中のアロフィリン(arofylline);Vernalis製のVM554/UM565;またはT−440(Tanabe Seiyaku;Fuji,K.ら、Pharmacol Exp Ther,1998,284(1):162)およびT2585が挙げられる。
【0192】
さらなる化合物は、公開された国際特許出願WO04/024728(Glaxo Group Ltd)、WO04/056823(Glaxo Group Ltd)およびWO04/103998(Glaxo Group Ltd)(例えば、その中に開示されている実施例399または544)に開示されている。さらなる化合物は、WO2005/058892、WO2005/090348、WO2005/090353およびWO2005/090354(これらのすべてがGlaxo Group Limitedの名義である)にも開示されている。
【0193】
抗コリン剤の例は、ムスカリン受容体において拮抗薬として作用する化合物、特に、M1もしくはM3受容体の拮抗薬、M1/M3もしくはM2/M3受容体の二重拮抗薬、またはM1/M2/M3受容体の総拮抗薬(pan−antagonists)である化合物である。吸入によって投与するための例示的な化合物としては、イプラトロピウム(例えば、臭化物として、CAS22254−24−6、Atroventという名称で販売されている)、オキシトロピウム(例えば、臭化物として、CAS30286−75−0)およびチオトロピウム(例えば、臭化物として、CAS136310−93−5、Spirivaという名称で販売されている)が挙げられる。レバトロパート(revatropate)(例えば、臭化水素酸塩として、CAS262586−79−8)、およびWO01/04118に開示されているLAS−34273も興味深い。経口投与用の例示的な化合物としては、ピレンゼピン(CAS28797−61−7)、ダリフェナシン(CAS133099−04−4、またはEnablexという名称で販売されている臭化水素酸塩についてはCAS133099−07−7)、オキシブチニン(CAS5633−20−5、Ditropanという名称で販売されている)、テロジリン(CAS15793−40−5)、トルテロジン(CAS124937−51−5、またはDetrolという名称で販売されているタルトレートについてはCAS124937−52−6)、オチロニウム(例えば、臭化物として、CAS26095−59−0、Spasmomenという名称で販売されている)、塩化トロスピウム(CAS10405−02−4)およびソリフェナシン(CAS242478−37−1、またはYM−905としても知られ、Vesicareという名称で販売されているスクシネートについてはCAS242478−38−2)が挙げられる。
【0194】
追加の化合物は、本明細書に参考として援用されるWO2005/037280、WO2005/046586およびWO2005/104745に開示されている。本組み合わせとしては:
(3−endo)−3−(2,2−ジ−2−チエニルエテニル)−8,8−ジメチル−8−アゾニアビシクロ[3.2.1]オクタンヨウ化物、
(3−endo)−3−(2−シアノ−2,2−ジフェニルエチル)−8,8−ジメチル−8−アゾニアビシクロ[3.2.1]オクタン臭化物、
4−[ヒドロキシ(ジフェニル)メチル]−1−{2−[(フェニルメチル)オキシ]エチル}−1−アゾニアビシクロ[2.2.2]オクタン臭化物、および
(1R,5S)−3−(2−シアノ−2,2−ジフェニルエチル)−8−メチル−8−{2−[(フェニルメチル)オキシ]エチル}−8−アゾニアビシクロ[3.2.1]オクタン臭化物
が挙げられるが、これらに限定されない。
【0195】
他の抗コリン剤としては、例えば:
(3−endo)−3−(2,2−ジ−2−チエニルエテニル)−8,8−ジメチル−8−アゾニアビシクロ[3.2.1]オクタン臭化物、
(3−endo)−3−(2,2−ジフェニルエテニル)−8,8−ジメチル−8−アゾニアビシクロ[3.2.1]オクタン臭化物、
(3−endo)−3−(2,2−ジフェニルエテニル)−8,8−ジメチル−8−アゾニアビシクロ[3.2.1]オクタン4−メチルベンゼンスルホネート、
(3−endo)−8,8−ジメチル−3−[2−フェニル−2−(2−チエニル)エテニル]−8−アゾニアビシクロ[3.2.1]オクタン臭化物、および/または
(3−endo)−8,8−ジメチル−3−[2−フェニル−2−(2−ピリジニル)エテニル]−8−アゾニアビシクロ[3.2.1]オクタン臭化物
をはじめとした、米国特許出願60/487981に開示されている化合物が挙げられる。
【0196】
さらなる抗コリン剤としては、例えば:
(endo)−3−(2−メトキシ−2,2−ジ−チオフェン−2−イル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピオニトリル、
(endo)−8−メチル−3−(2,2,2−トリフェニル−エチル)−8−アザ−ビシクロ[3.2.1]オクタン、
3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピオンアミド、
3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピオン酸、
(endo)−3−(2−シアノ−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
(endo)−3−(2−シアノ−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタン臭化物、
3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロパン−1−オール、
N−ベンジル−3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピオンアミド、
(endo)−3−(2−カルバモイル−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
1−ベンジル−3−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−尿素、
1−エチル−3−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−尿素、
N−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−アセトアミド、
N−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−ベンズアミド、
3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジ−チオフェン−2−イル−プロピオニトリル、
(endo)−3−(2−シアノ−2,2−ジ−チオフェン−2−イル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
N−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−ベンゼンスルホンアミド、
[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−尿素、
N−[3−((endo)−8−メチル−8−アザ−ビシクロ[3.2.1]オクタ−3−イル)−2,2−ジフェニル−プロピル]−メタンスルホンアミド、および/または
(endo)−3−{2,2−ジフェニル−3−[(1−フェニル−メタノイル)−アミノ]−プロピル}−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタン臭化物
をはじめとした、米国特許出願60/511009に開示されている化合物が挙げられる。
【0197】
さらなる化合物としては:
(endo)−3−(2−メトキシ−2,2−ジ−チオフェン−2−イル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
(endo)−3−(2−シアノ−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
(endo)−3−(2−シアノ−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタン臭化物、
(endo)−3−(2−カルバモイル−2,2−ジフェニル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、
(endo)−3−(2−シアノ−2,2−ジ−チオフェン−2−イル−エチル)−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタンヨウ化物、および/または
(endo)−3−{2,2−ジフェニル−3−[(1−フェニル−メタノイル)−アミノ]−プロピル}−8,8−ジメチル−8−アゾニア−ビシクロ[3.2.1]オクタン臭化物
が挙げられる。
【0198】
1つの実施形態において、本発明は、H1拮抗薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。H1拮抗薬の例としては、アンレキサノクス(amelexanox)、アステミゾール、アザタジン、アゼラスチン(azelastine)、アクリバスチン(acrivastine)、ブロムフェニラミン、セチリジン、レボセチリジン(levocetirizine)、エフレチリジン(efletirizine)、クロルフェニラミン、クレマスチン、シクリジン、カレバスチン(carebastine)、シプロヘプタジン、カルビノキサミン、デスカルボエトキシロラタジン、ドキシラミン、ジメチンデン、エバスチン(ebastine)、エピナスチン(epinastine)、エフレチリジン(efletirizine)、フェキソフェナジン、ヒドロキシジン、ケトチフェン、ロラタジン、レボカバスチン、ミゾラスチン(mizolastine)、メキタジン、ミアンセリン、ノベラスチン(noberastine)、メクリジン、ノルアステミゾール、オロパタジン、ピクマスト(picumast)、ピリラミン、プロメタジン、テルフェナジン、トリペレナミン、テメラスチン(temelastine)、トリメプラジンおよびトリプロリジン、特に、セチリジン、レボセチリジン、エフレチリジンおよびフェキソフェナジンが挙げられるがこれらに限定されない。さらなる実施形態において、本発明は、H3拮抗薬(および/または逆作動薬)とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。H3拮抗薬の例としては、例えば、WO2004/035556およびWO2006/045416に開示されている化合物が挙げられる。本発明の化合物と併用して使用され得る他のヒスタミン受容体拮抗薬としては、H4受容体の拮抗薬(および/または逆作動薬)、例えば、Jablonowskiら、J.Med.Chem.46:3957−3960(2003)に開示されている化合物が挙げられる。
【0199】
したがって、本発明は、さらなる態様において、PDE4阻害剤とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0200】
したがって、本発明は、さらなる態様において、β2−アドレナリン受容体作動薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0201】
したがって、本発明は、さらなる態様において、コルチコステロイドとともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0202】
したがって、本発明は、さらなる態様において、非ステロイド性GR作動薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0203】
したがって、本発明は、さらなる態様において、抗コリン薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0204】
したがって、本発明は、さらなる態様において、抗ヒスタミン剤とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0205】
したがって、本発明は、さらなる態様において、PDE4阻害剤およびβ2−アドレナリン受容体作動薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0206】
したがって、本発明は、さらなる態様において、抗コリン薬およびPDE−4阻害剤とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0207】
好ましい態様において、本発明は、コルチコステロイドとともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0208】
さらに好ましい態様において、本発明は、β2−アドレナリン受容体作動薬とともに式(I)の化合物またはその薬学上許容可能な塩を含む組み合わせを提供する。
【0209】
上で言及された組み合わせは、医薬組成物の形態として使用するために都合よく提供され得、ゆえに、薬学上許容可能な希釈剤または担体とともに上で規定されたような組み合わせを含む医薬組成物は、本発明のさらなる態様に相当する。
【0210】
そのような組み合わせの個別の化合物は、別個の医薬製剤または組み合わされた医薬製剤として、連続的にまたは同時に投与され得る。1つの実施形態において、それらの個別の化合物は、組み合わされた医薬製剤として同時に投与され得る。公知の治療薬の適切な用量は、当業者によって直ちに認識されるだろう。
【0211】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩と別の治療上活性な薬剤との組み合わせを含む医薬組成物を提供する。
【0212】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩とPDE4阻害剤との組み合わせを含む医薬組成物を提供する。
【0213】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩とβ2−アドレナリン受容体作動薬との組み合わせを含む医薬組成物を提供する。
【0214】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩とコルチコステロイドとの組み合わせを含む医薬組成物を提供する。
【0215】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩と非ステロイド性GR作動薬との組み合わせを含む医薬組成物を提供する。
【0216】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩と抗コリン薬との組み合わせを含む医薬組成物を提供する。
【0217】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩と抗ヒスタミン剤との組み合わせを含む医薬組成物を提供する。
【0218】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩とPDE4阻害剤およびβ2−アドレナリン受容体作動薬との組み合わせを含む医薬組成物を提供する。
【0219】
したがって、本発明は、さらなる態様において、式(I)の化合物またはその薬学上許容可能な塩と抗コリン薬およびPDE4阻害剤との組み合わせを含む医薬組成物を提供する。
【0220】
好ましい態様において、本発明は、式(I)の化合物またはその薬学上許容可能な塩とコルチコステロイドとの組み合わせを含む医薬組成物を提供する。
【0221】
さらに好ましい態様において、本発明は、式(I)の化合物またはその薬学上許容可能な塩とβ2−アドレナリン受容体作動薬との組み合わせを含む医薬組成物を提供する。
【0222】
本発明は、以下の非限定的な例によってここに例示される。
【実施例】
【0223】
以下の実施例は、本発明を例示するものである。これらの実施例は、本発明の範囲を限定することを目的としておらず、本発明の化合物、組成物を調製する指針、ならびに本発明の化合物、組成物および方法を使用する指針を当業者に提供することを目的としている。本発明の特定の実施形態を記載するが、当業者は、本発明の精神および範囲から逸脱することなく様々な変更および改変を行うことができることを認識するだろう。
【0224】
一般的な方法
LCMS法
方法A
このHPLC解析は、摂氏30度にて、Sunfire C18カラム(30mm×4.6mm内径,3.5μmの充填直径)において行われた。
【0225】
溶媒A=0.1%v/vのギ酸の水溶液。
【0226】
溶媒B=0.1%v/vのギ酸のアセトニトリル溶液。
【0227】
以下のグラジエントを使用した:
【表1】

【0228】
UV検出は、210nm〜350nmの波長からの平均シグナルであり、質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0229】
方法B
このHPLC解析は、摂氏40度にて、Acquity UPLC BEH C18カラム(50mm×2.1mm内径,1.7μm充填直径)において行った。
【0230】
溶媒A=0.1%v/vのギ酸の水溶液。
【0231】
溶媒B=0.1%v/vのギ酸のアセトニトリル溶液。
【0232】
以下のグラジエントを使用した:
【表2】

【0233】
UV検出は、210nm〜350nmの波長からの平均シグナルであり、質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0234】
方法C
陽イオンエレクトロスプレーモードにおいて作動するWaters ZQ質量分析計,質量範囲100〜1000amu。
【0235】
UV波長:215〜330nm
カラム:3.3cm×4.6mm内径,3μm ABZ+PLUS
流速:3ml/分
注入量:5μl
溶媒A:95%MeCN+0.05%の、1%v/vギ酸水溶液
溶媒B:10mmol酢酸アンモニウム(水溶液)中の0.1%v/vギ酸溶液
グラジエント:溶媒Aと溶媒Bとの混合物を、以下のグラジエントプロファイルに従って使用する(その混合物中の%溶媒Aとして表現される):0%A;0.7分間,0〜100%A;3.5分間,100%A;0.4分間,100〜0%A;0.2分間。
【0236】
方法D
カラム:Acquity UPLC BEH C18 1.7μm,2.1mm×50mm。40℃のカラムオーブン
溶媒A:10mmol酢酸アンモニウムを含む0.1%ギ酸水溶液
溶媒B:0.05%ギ酸を含む、MeCN:水(95:5,v/v)
注入量:0.5μl
注入法:パーシャルループオーバーフィル(Partial loop overfill)
UV検出:220〜330nm
UVサンプリング速度:40点/s
MSスキャン範囲:100〜1000amu
MSスキャン速度:0.2s/スキャン(0.1sのスキャン間遅延を伴う)
MSスキャン機能:ポジティブネガティブ切り換えを備えるエレクトロスプレー
サイクル時間:150s
流速:1ml/分
グラジエント:
【表3】

【0237】
方法E
カラム;Waters Sunfire C18,3.5μM,2.1mm内径×30mm。
【0238】
移動相
A:0.1%ギ酸(水溶液)
B:0.1%ギ酸(MeCN溶液)
流速;1ml/分
グラジエント;
【表4】

【0239】
MDAP法
質量分析連結自動分取HPLCおよびMSの条件
方法A
固定相
この精製に使用した固定相は、5μmの粒径を有するSunfire C18だった。
【0240】
小規模分取カラム
カラム寸法:100mm×19mm内径
大規模分取カラム
カラム寸法:150mm×30mm内径
溶離剤
以下の溶離剤を使用した:
A=0.1%v/vのギ酸の水溶液
B=0.1%v/vのギ酸のアセトニトリル溶液
30mgまでの粗サンプル用の小規模分取の方法
10種類の集中的(foucused)小規模(small scale)分取方法が利用可能である。方法の選択は、2つの因子に依存する。
【0241】
1.一般的な分析用LCMS法における目的の構成要素の保持時間(RT)
2.目的の構成要素の近くで溶出する不純物の存在
分析用のRTから、5種類の小規模集中的分取方法のうちの1つが選択される。小規模分取方法は、特定の有機範囲に対する7分間のグラジエントに続く8分間のフラッシュを含む最も極性の方法を除いて、特定の有機範囲に対する10分間のグラジエントに続く5分間のフラッシュを含む。総ラン時間は、15分である。
【0242】
目的の構成要素の近くで溶出する不純物が存在する場合、5種類の延長小規模集中的分取方法が利用可能である。延長小規模分取方法は、特定の有機範囲に対する14分間のグラジエントに続く11分間のフラッシュを含む最も極性の方法を除いて、特定の有機範囲に対する20分間のグラジエントに続く5分間のフラッシュを含む。総ラン時間は、25分である。
【0243】
すべての小規模方法に対する流速は、20ml/分であり、精製は、外界温度において行われる。
【0244】
小規模分取に対する注入量は、500μlである。
【0245】
上記の10種類の小規模分取方法およびグラジエントの有機範囲を以下に示す。これらのグラジエントは、通常ランまたは延長ランに対して同じである。
【0246】
5〜30%B
15〜55%B
30〜85%B
50〜99%B
80〜99%B
フラッシュ工程では、溶離剤Bを、0.5分間で99%に上げ、次いで、そこでさらに4.5分間保持する。
【0247】
90mgまでの粗サンプル用の大規模分取の方法
10種類の集中的大規模(large scale)分取方法が利用可能である。方法の選択は、小規模分取の場合と同じ2つの因子に依存する。ラン時間(グラジエントおよびフラッシュ)は、小規模分取方法の場合と同じである。
【0248】
すべての大規模方法に対する流速は、40ml/分であり、精製は、外界温度において行われる。
【0249】
大規模分取の場合の注入量は、980μlである。
【0250】
上記の5種類の大規模方法の名称およびグラジエントの有機範囲を以下に示す。これらのグラジエントは、通常ランまたは延長ランに対して同じである。
【0251】
5〜30%B
15〜55%B
30〜85%B
50〜99%B
80〜99%B
フラッシュ工程では、溶離剤Bを、0.5分間で99%に上げ、次いで、そこでさらに4.5分間保持する。
【0252】
UV検出
すべての方法に対するUV検出は、210nm〜350nmのすべての波長からの平均シグナルだった。
【0253】
MS条件
MS:Waters ZQ
イオン化モード:ポジティブとネガティブの交互スキャンのエレクトロスプレー
スキャン範囲:100〜1000amu
スキャン時間:0.50秒
スキャン間遅延:0.20秒
方法B
カラムの詳細:XBRIDGE C18カラム(100mm×19mm内径、5μm充填直径)
溶媒:
A:アンモニア(水溶液)でpH10に調整された10mmol重炭酸アンモニウム(水溶液)
B:MeCN
UV検出は、210nm〜350nmの波長からの平均シグナルであり、質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0254】
方法C
Sunfire,低pH
カラムの詳細:SUNFIRE C18カラム(100mm×19mm内径、5μm)
以下の溶媒を使用した:
A=ギ酸の0.1%v/v水溶液
B=ギ酸の0.1%v/vアセトニトリル(Acetontrile)溶液
方法A
【表5】

【0255】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0256】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0257】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0258】
方法B
【表6】

【0259】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0260】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0261】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0262】
方法C
【表7】

【0263】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0264】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0265】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0266】
方法D
【表8】

【0267】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0268】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0269】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0270】
方法E
【表9】

【0271】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0272】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0273】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0274】
質量分析連結自動分取HPLCのカラム、条件および溶離剤
方法D
カラムの詳細:SUNFIRE C18カラム(100mm×19mm内径、5μm)
以下の溶媒を使用した:
A=0.1%v/vのトリフルオロ酢酸の水溶液。
【0275】
B=0.1%v/vのトリフルオロ酢酸のアセトニトリル溶液。
【0276】
下記の方法は、精製される化合物の分析用の保持時間に基づいて選択される。
【0277】
方法1
【表10】

【0278】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0279】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0280】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0281】
方法2
【表11】

【0282】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0283】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0284】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0285】
方法3
【表12】

【0286】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0287】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0288】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0289】
方法4
【表13】

【0290】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0291】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0292】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0293】
方法5
【表14】

【0294】
回収は、uv、msまたはそれら2つの組み合わせによって始動された。
【0295】
UV検出は、選択された波長、通常、230nm、210nmまたは254nmにおいて行った。
【0296】
質量スペクトルは、ポジティブモードとネガティブモードとの交互スキャンのエレクトロスプレーイオン化を用いて質量分析計において記録した。
【0297】
中間体および実施例
化合物または試薬の名称の後に商業的供給業者の名称が与えられるとき(例えば、「化合物X(Aldrich)」または「化合物X/Aldrich」)、これは、化合物Xが、指名された商業的供給業者などの商業的供給業者から入手可能であることを意味する。化合物または試薬について本明細書中で言及されていない場合、それらは、標準的な供給業者(例えば、Sigma Aldrich、Lancaster、Fluorochem、TCIなど)から購入することができる。
【0298】
同様に、化合物の名称の後に文献または特許参考文献が与えられるとき(例えば、化合物Y(EP0123456))、これは、その化合物の調製法が、指名された参考文献に記載されていることを意味する。
【0299】
実施例の名称は、構造に名称をマッチさせる化合物命名プログラム(例えば、ACD/Name Batch v 9.0)を用いて得た。
【0300】
中間体1
N−[6−ブロモ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド
【化20】

【0301】
DCM(120ml)に溶解された6−ブロモ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−アミン(2.77g)をピリジン(1.135ml)で処理した。数分後、2−メチル−1,3−チアゾール−4−カルボニルクロリド(2.267g)を加え、その反応物をRTで1時間撹拌した。その反応物をDCMと飽和炭酸水素ナトリウム(aq)とに抽出した。有機層を乾燥させた。残渣をDCMに溶解し、フロリジル上に吸着させた後、ISCO companion上に固体充填することによって、シリカカラム(40g)およびシクロヘキサン中の40%〜100%酢酸エチルのグラジエントを用いる精製を行った。適切な画分を合わせ、蒸発乾固することにより、表題化合物2.66gを得た。
【0302】
LC/MS(方法B)Rt=1.17分,MH+=423.
【0303】
中間体2
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド
【化21】

【0304】
2本の別個のマイクロ波用バイアルに、N−[6−ブロモ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド(1.13g)、酢酸カリウム(799mg)、4,4,4’,4’,6,6,6’,6’−オクタメチル−2,2’−ビ−1,3,2−ジオキサボリナン(2.0g)およびPdCl2(dppf)(348mg)を量り入れた。これに、1,4−ジオキサン(17ml)を加え、その反応物をマイクロ波で80℃にて30分間加熱した。再度、バイアル2本を、マイクロ波を用いて80℃にて30分間加熱した。そして、合わせた反応混合物をメタノールとともに、メタノールでプレコンディショニングされたシリカカートリッジ(10g)に通して洗浄した。その溶液を乾燥させた。固体をDCMと水とに分離し、DCM層を乾燥させた。その材料をDCMおよびメタノール(数滴)に溶解し、フロリジル上に吸着させ、次いで、シクロヘキサン中の40%〜100%酢酸エチルを用いてISCO companion,シリカカラム(80g)において精製した。回収された画分を生成物について解析し、適切な画分を合わせることにより、表題化合物1.25gを得た。
【0305】
LCMS(方法B)Rt=1.35分,MH+=483.
【0306】
中間体3
6−ブロモ−4−ニトロ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール
【化22】

【0307】
ジヒドロピラン(100ml)中の6−ブロモ−4−ニトロ−1H−インダゾール(10g)に、TFA(0.068ml)を加え、その反応物を1.5時間加熱還流した。冷却後、DCM(180ml)および飽和炭酸水素ナトリウム溶液(50ml)を加え、10分間撹拌した。DCMを水相から分離し、それをDCM(70ml)で再度洗浄した。合わせた有機層を疎水性フリットに通し、蒸発乾固した。残留固体を、エーテルを用いて粉末にし(triturated)、次いで、濾過した。その固体材料をDCMに溶解し、均一濃度グラジエントのDCMを用いて、ISCO Companionのシリカにおけるクロマトグラフィーによって精製した。精製された画分を合わせ、蒸発乾固することにより、表題化合物7.78gを得た。
【0308】
LCMS(方法C);Rt=3.51分,MH−=326/328.
【0309】
中間体4
6−ブロモ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−アミン
【化23】

【0310】
6−ブロモ−4−ニトロ−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール(6g)、鉄のやすりくず(3.29g)および塩化アンモニウム(0.492g)を250ml丸底フラスコに量り入れ、エタノール(60ml)、次いで、水(18ml)を加えた。その反応物を80℃に2.5時間加熱した。その反応混合物を冷却した。酢酸エチル(100ml)および水(50ml)を加えた。目に見える層の分離がなかったので、その反応物を濃縮することにより、酢酸エチルおよびエタノールを除去した。次いで、酢酸エチル(250ml)を加え、有機層を水(50ml)で洗浄した後、疎水性フリットに通した。有機層を蒸発乾固した。残渣を、シリカにおけるカラムクロマトグラフィー(120gシリカカラム,ISCO Companion)によって、DCM中の1〜2%メタノールのグラジエントで25分間にわたって溶出して精製した。所望の材料を含む画分を合わせ、蒸発乾固することにより、表題化合物3.95gを得た。
【0311】
LCMS(方法C);Rt=2.87分,MH−=298.
【0312】
中間体5
2−メチル−1,3−チアゾール−4−カルボニルクロリド
【化24】

【0313】
2−メチル−1,3−チアゾール−4−カルボン酸(1g)に、塩化チオニル(5ml)を加えた。混合物を80℃で8時間加熱した。塩化チオニル(5ml)を加え、混合物を80℃で2時間加熱した。さらに、塩化チオニル(5ml)を加え、混合物を2時間加熱した。その混合物を真空中で濃縮し、トルエンと共沸することにより、表題化合物1.12gを得た。
【0314】
1H NMR(DSMO)δ8.34(s,1H),2.80(s,3H)
【0315】
中間体6
1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−アミン
【化25】

【0316】
トルエン(15ml)中の、6−ブロモ−1−(フェニルスルホニル)−1H−インダゾール−4−アミン(1.3g)と、ヘキサメチル二スズ(2.4g)と、トリエチルアミン(1ml)と、Pd(PPh3)4(0.2g)との混合物を、マイクロ波照射下において120℃で1時間加熱した。その反応物を、溶離剤として軽質石油40〜60℃を用いてシリカカートリッジに適用した。これを、エーテル/軽質石油40〜60℃に変更した。適切な画分を蒸発させることにより、表題化合物1.2gを得た。
【0317】
LCMS(方法A);Rt=3.3分,MH+=438.
【0318】
中間体7
6−ブロモ−1−(フェニルスルホニル)−1H−インダゾール−4−アミン
【化26】

【0319】
6−ブロモ−1H−インダゾール−4−アミン(5g)をDMF(20ml)に溶解し、氷浴内で冷却した。鉱油中の60%水素化ナトリウム(0.94g)を少しずつ加え、その反応物を氷浴に30分間放置した。DMF(5ml)中の塩化ベンゼンスルホニル(3ml)を15分間にわたってゆっくり加え、その反応物を一晩放置してRTまで温めた。水(100ml)を加え、その反応物を20分間撹拌した。酢酸エチル(120ml)を加え、水相を分離し、酢酸エチル(50ml×2)で洗浄し、合わせた有機相を7.5%塩化リチウム(aq)(50ml×2)、次いで、水(50ml)で洗浄した後、分離し、疎水性フリットに通した。酢酸エチルを蒸発させ、残渣をシリカカートリッジに通し、DCM(約300ml)に続いてジエチルエーテル(約400ml)で溶出した。生成物を含む純粋画分を合わせ、蒸発乾固することにより、表題化合物5.9gを得た。
【0320】
LCMS(方法B);Rt=1.12分,MH+=354.
【0321】
中間体8
2−メチル−N−[1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド
【化27】

【0322】
DCM(4ml)中の2−メチル−1,3−チアゾール−4−カルボニルクロリド(350mg)を、DCM(15ml)およびピリジン(0.167ml)中の1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−アミン(300mg)に滴下した。その反応物をRTで一晩撹拌した。飽和炭酸水素ナトリウム(aq)(25ml)を加え、その反応物を15分間激しく撹拌した。DCM相を疎水性フリットに通し、次いで、蒸発乾固した。残渣を、DCMに溶解し、シクロヘキサンでプレコンディショニングされたシリカカートリッジにおいて精製し、シクロヘキサンで洗浄した後、エーテルで溶出した。エーテルを蒸発させることにより、表題化合物373mgを得た。
【0323】
LCMS(方法D)Rt=1.42分,MH+=563.
【0324】
中間体9
N−(5−ブロモ−2−クロロ−3−ピリジニル)−N−メチルベンゼンスルホンアミド
【化28】

【0325】
N−(5−ブロモ−2−クロロ−3−ピリジニル)ベンゼンスルホンアミド(300mg)をDMF(8ml)に溶解し、0℃に冷却した。水素化ナトリウム(鉱油中60%)(41mg)を一度に加えた。その反応物を15分間放置し、次いで、ヨウ化メチル(0.108ml)をゆっくり加えた。その反応物を10分間放置し、次いで、RTまで温めた。その反応物を水(20ml)でクエンチし、次いで、酢酸エチル(40ml)を加えた後、さらに水(20ml)を加えた。酢酸エチル相を分離し、水相をさらなる酢酸エチルで洗浄した。合わせた有機相をブラインで洗浄し、分離し、次いで、疎水性フリットに通した後、蒸発乾固した。残渣を40gシリカカートリッジに通し、シクロヘキサン中の60〜100%DCMで溶出して精製した。適切な画分を合わせ、蒸発乾固することにより、表題化合物192mgを得た。
【0326】
LCMS(方法B)Rt=1.16分,MH+=404.
【0327】
中間体10
N−(5−ブロモ−2−クロロ−3−ピリジニル)ベンゼンスルホンアミド
【化29】

【0328】
塩化ベンゼンスルホニル(2.24ml)を、DCM(25ml)中の5−ブロモ−2−クロロ−3−ピリジンアミン(2.5g)およびピリジン(1.5ml)の溶液に5〜10分間にわたって滴下した。その反応物をRTで18時間撹拌した後、真空中で蒸発乾固した。残渣は、2つに分け、シリカゲルクロマトグラフィーによってシクロヘキサン中の0〜100%DCMで溶出して精製した。適切な画分を合わせ、蒸発させることにより、表題化合物1.81gを得た。
【0329】
LCMS(方法D)Rt=1.09分,MH−=347.
【0330】
中間体11
5−ブロモ−2−クロロ−3−[(フェニルスルホニル)メチル]ピリジン
【化30】

【0331】
(5−ブロモ−2−クロロ−3−ピリジニル)メチルメタンスルホネート(644mg)をDMF(10ml)に溶解し、ベンゼンスルフィン酸ナトリウム(1179mg)を加えた。その反応物をRTで一晩撹拌した。飽和炭酸水素ナトリウム(20ml)を加えた後、水(20ml)および酢酸エチル(20ml)を加えた。水相を分離し、さらに酢酸エチルで洗浄した。合わせた有機相をブラインで洗浄し、次いで、疎水性フリットに通した。粗材料をDCMとともに5gシリカカートリッジに通した。その材料を40gシリカカートリッジにおいて、シクロヘキサン:DCM(60〜100%)で溶出して精製した。精製された画分を合わせ、蒸発させることにより、表題化合物480mgを得た。
【0332】
LCMS(方法B)Rt=1.06分,MH+=346.
【0333】
中間体12
(5−ブロモ−2−クロロ−3−ピリジニル)メチルメタンスルホネート
【化31】

【0334】
トリエチルアミン(0.564ml)およびDCM(12ml)を、(5−ブロモ−2−クロロ−3−ピリジニル)メタノール(600mg)に加えた。その反応物を0℃に冷却し、塩化メタンスルホニル(0.219ml)を滴下した。その反応物を30分間放置し、次いで、RTまで温めた。その反応物を飽和炭酸水素ナトリウム(aq)(20ml)で抽出し、DCM相を分離し、疎水性フリットに通し、次いで、蒸発乾固した。残渣を5gシリカカートリッジに通して、シクロヘキサン、次いで、シクロヘキサン:DCM(50:50,v/v)、次いで、DCMで洗浄して精製した。生成物を含む画分を合わせ、蒸発乾固し、次いで、高真空において乾燥することにより、表題化合物644mgを得た。
【0335】
LCMS(方法B)Rt=0.93分,MH+=302.
【0336】
中間体13
N−[6−(5−アミノ−6−クロロ−3−ピリジニル)−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド
【化32】

【0337】
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(0.75g)、5−ブロモ−2−クロロ−3−ピリジンアミン(0.39g)、炭酸ナトリウム(0.66g)およびPd(dppf)Cl2(0.114g)を、10〜20mlマイクロ波用バイアルに量り入れ、1,4−ジオキサン(8ml)、次いで、水(8ml)を加えた。その反応物を140℃で20分間加熱した。その反応物を10gシリカカートリッジに通して、メタノール:DCM(1:1,v/v)で洗浄した。溶媒を蒸発させ、残渣を、40g ISCO companionシリカカートリッジにおいて、40ml/分においてDCM(1%アンモニアを含む)中の1.5〜7.5%メタノールで溶出して精製した。純粋画分を合わせ、蒸発乾固することにより、表題化合物(335mg)を得た。
【0338】
LCMS(方法D)Rt=1.05分,MH+=469/471.
【0339】
中間体14
5−ブロモ−2−クロロ−3−[フルオロ(フェニルスルホニル)メチル]ピリジン
【化33】

【0340】
5−ブロモ−2−クロロ−3−[(フェニルスルホニル)メチル]ピリジン(309mg)を2−メチルテトラヒドロフラン(20ml)に溶解し、−78℃に冷却した。ナトリウムビス(トリメチルシリル)アミド(0.594ml)を滴下した。15分後、N−フルオロ−N−(フェニルスルホニル)ベンゼンスルホンアミド(281mg)を少しずつ加えた。その反応物を1時間撹拌した。その反応物を飽和炭酸アンモニウム(saturated ammonium cabonate)(aq)(10ml)でクエンチし、RTまで温めた。水相を分離し、有機相を飽和炭酸水素ナトリウム(aq)(15ml)で洗浄した後、疎水性フリットに通し、蒸発乾固した。残渣をメタノールで粉末にし、次いで、濾過した。その濾液を蒸発乾固し、次いで、高真空において乾燥することにより、表題化合物221mgを白色固体として得た。
【0341】
LCMS(方法B)Rt=1.17分,MH+=366.
【0342】
中間体15
2−メチル−N−[6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1−(フェニルスルホニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド
【化34】

【0343】
2−メチル−N−[1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(200mg)および5−ブロモ−3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン(98mg)およびPd(PPh3)4(41mg)を、DMF(2ml)中に入れ、混合物をマイクロ波で120℃において合計75分間加熱した。その反応混合物をMDAP(方法A)によって精製した。生成物を含む画分に窒素流を吹き付けることにより、表題化合物17mgを得た。
【0344】
LCMS(方法B)Rt=1.03分,MH−=592.
【0345】
中間体16
5−ブロモ−3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン
【化35】

【0346】
250ml丸底フラスコ内のDMF(100ml)中のN−{5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジニル}アセトアミド(3.71g)の溶液に、酢酸カリウム(1.185g)、酢酸(1.037ml)および無水酢酸(1.151ml)を加えた。その溶液をRTで撹拌した後、亜硝酸tert−ブチル(4.31ml)を15分間にわたって加えた。その反応物を2.5時間、60℃に加熱した。亜硝酸Tert−ブチル(1.43ml)を加えた。1時間後、酢酸カリウム(0.65g)および無水酢酸(0.6ml)を加えた。1時間後、その反応物を冷却し、水を加え(250ml)、飽和炭酸水素ナトリウム(aq)を用いてpHを8に調整し、次いで、酢酸エチルで分配し、水層を酢酸エチルで十分抽出した(3×300ml)。水相を酢酸エチル(3×150ml)で再抽出した。合わせた有機相を飽和炭酸水素ナトリウム(aq)、塩化リチウム(aq)(4×100ml)、ブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させた。水相をLiClおよびNaClで塩析し、酢酸エチルで再抽出した。有機相を合わせ、蒸発させ、次いで、高真空下に一晩置いた。残渣をDCMに溶解し、濾過し、120g Companion XLシリカカートリッジにおいて12カラム体積を超えるシクロヘキサン中の0〜100%酢酸エチルで溶出して精製することにより、表題化合物384mgを得た。
【0347】
LCMS(方法B)Rt=0.7分,MH+=278.
【0348】
中間体17
N−{5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジニル}アセトアミド
【化36】

【0349】
窒素下の1L丸底フラスコ内の酢酸(100ml)中の5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジンアミン(4.7g)に、無水酢酸(3.35ml)を加え、その反応物を80℃に加熱した。3時間後、無水酢酸(3.35ml)を加え、その反応物を一晩加熱した。その反応物を冷却し、酢酸エチル(200ml)と水(400ml)とに分配し、水層を、酢酸エチルで十分抽出した。合わせた有機相を水で洗浄し、次いで、撹拌する一方で、大きなコニカルフラスコに飽和炭酸水素ナトリウム(aq)を加えた後、2M NaOH(aq)をpH8まで加えた。有機相をブラインで洗浄し、MgSO4で乾燥し、濾過し、蒸発させた。上記からの酸性の水相をpH8にして、酢酸エチルで抽出し、単離された材料を前の材料と合わせ、酢酸エチルを加え、次いで、濾過することにより、表題化合物3.86gを得た。
【0350】
LCMS(方法B)Rt=0.49分,MH+=309.
【0351】
中間体18
5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジンアミン
【化37】

【0352】
窒素下の1L丸底フラスコ内のメタノール(200ml)中のビス(1,1−ジメチルエチル){5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジニル}イミドジ−カーボネート(8.82g)に、ジエチルエーテル中の1M HCl(190ml)を加えた。その反応物を70分間放置し、次いで、ジエチルエーテル中の1M HCl(95ml)を加えた。その反応物を3.5時間放置し、ジエチルエーテル中の1M HCl(95ml)を加え、その反応物を一晩放置した。さらに、ジエチルエーテル中の1M HClを加え(60ml)、その反応物を45分間放置した。その反応物の体積を約200mlまで減少させ、ジオキサン中の4M HCl(70ml)を加えた。その反応物を3.75時間放置し、次いで、蒸発乾固した。得られた固体の一部を、酢酸エチルと飽和炭酸水素ナトリウムとに分配し、水層を、酢酸エチルで十分抽出した。合わせた有機相をブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させることにより、遊離塩基を得た。残りの材料を同様に処理し、合わせ、次いで、蒸発乾固することにより、表題化合物4.85gを得た。
【0353】
LCMS(方法B)Rt=0.46分,MH+=267.
【0354】
中間体19
ビス(1,1−ジメチルエチル){5−ブロモ−3−[(メチルスルホニル)メチル]−2−ピリジニル}イミドジカーボネート
【化38】

【0355】
500ml丸底フラスコ内のMeCN(150ml)中のビス(1,1−ジメチルエチル){5−ブロモ−3−[(メチルチオ)メチル]−2−ピリジニル}イミドジカーボネート(19.6g,61%純粋)の溶液に、オキソン(59.6g)および水(120ml)を加えた。混合物をRTで2.25時間撹拌した。混合物を酢酸エチルと水とに分配し、水層を酢酸エチルで十分抽出した。合わせた有機相をブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させた。その材料を、330g Companion XLシリカカートリッジにおいて、12カラム体積を超えるシクロヘキサン中の0〜40%酢酸エチルで溶出して精製した。純粋画分を蒸発させることにより、表題化合物8.82gを得た。
【0356】
LCMS(方法B)Rt=1.12分,MH+=367(1つのboc基の喪失).
【0357】
中間体20
ビス(1,1−ジメチルエチル){5−ブロモ−3−[(メチルチオ)メチル]−2−ピリジニル}イミド−ジカーボネート
【化39】

【0358】
窒素下の50ml丸底フラスコ内のTHF(300ml)中のビス(1,1−ジメチルエチル)[5−ブロモ−3−(ブロモメチル)−2−ピリジニル]イミドジカーボネート(26.1g,64%純粋)に、ナトリウムチオメトキシド(3.78g)を加えた。その反応物をRTで80分間撹拌した後、ナトリウムチオメトキシド(1.9g)を加えた。2.25時間後、その反応物を酢酸エチルと水とに分配し、水層を酢酸エチルで十分抽出した。合わせた有機相を水、ブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させた。残渣を、750g Companion XLシリカカートリッジにおいて、12カラム体積を超えるシクロヘキサン中の0〜20%酢酸エチルで溶出して精製した。生成物を含む画分を蒸発させることにより、粗表題化合物19.6g(次の工程で直接使用した)を得た。
【0359】
LCMS(方法B)Rt=1.34分,MH+=435.
【0360】
中間体21
ビス(1,1−ジメチルエチル)[5−ブロモ−3−(ブロモメチル)−2−ピリジニル]イミドジカーボネート
【化40】

【0361】
300W白色スポットライトを用いてその反応物を照射しつつ、窒素下の1L丸底フラスコ内の四塩化炭素(600ml)中のビス(1,1−ジメチルエチル)(5−ブロモ−3−メチル−2−ピリジニル)イミドジカーボネート(27.33g)に、N−ブロモスクシンイミド(13.19g)を等しく4回に分けて15分ごとに加えた。1.25時間後、過酸化ベンゾイル(1.71g)を加えた。2.5時間後、混合物を濾過し、次いで、水で分配した。有機相をチオ硫酸ナトリウム(aq)、ブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させた。残渣を、330gm Companion XLシリカカートリッジにおいて、12カラム体積を超えるシクロヘキサン中の0〜25%酢酸エチルで溶出して精製した。生成物を含む画分を蒸発させることにより、粗表題化合物23.8g(次の工程で直接使用した)を得た。
【0362】
LCMS(方法A)Rt=3.41分,MH+=467.
不純画分を合わせ、120g Companion XLシリカカートリッジを用いて、10カラム体積を超えるシクロヘキサン中の0〜25%酢酸エチルで溶出して再精製した。生成物を含む最も清浄な画分を蒸発させることにより、粗表題化合物2.3g(次の工程で直接使用した)を得た。
【0363】
LCMS(方法B)Rt=1.33分,MH+=467.
【0364】
中間体22
ビス(1,1−ジメチルエチル)(5−ブロモ−3−メチル−2−ピリジニル)イミドジカーボネート
【化41】

【0365】
500ml丸底フラスコ内の5−ブロモ−3−メチル−2−ピリジンアミン(14.78g)に、DCM(300ml)を加えた後、DIPEA(30.4ml)、DMAP(9.65g)およびビス(1,1−ジメチルエチル)ジカーボネート(36.7ml)を加えた。その反応物を窒素下においてRTで1時間50分間撹拌した。その反応物をDCMと水とに分配し、水層を、DCMで十分抽出した。合わせた有機相を0.5M HCl(aq)、水、ブラインで洗浄し、乾燥し(MgSO4)、濾過し、蒸発させた。残渣をエーテル(約120ml)で粉末にし、いくらかのシクロヘキサンを加え、真空濾過により固体を回収した。これを、蒸発させた濾液と合わせ、330g Companion XLシリカカートリッジにおいて、10カラム体積を超えるシクロヘキサン中の0〜50%酢酸エチルで溶出して精製することにより、表題化合物27.33gを得た。
【0366】
LCMS(方法B)Rt=1.3分,MH+=389.
【0367】
中間体23
N−(6−ブロモ−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド
【化42】

【0368】
2−メチル−1,3−チアゾール−4−カルボン酸(4.59g)、HATU(13.4g)およびDIPEA(16.8ml)を、DMF(140ml)中において20℃で30分間撹拌した。6−ブロモ−1H−インダゾール−4−アミン(3.40g)を加え、その反応物を20℃で2日間撹拌した。溶媒を約40mlまで減少させ、その反応混合物を5×70gアミノプロピルSPEカートリッジに適用し、3時間静置した。それらのカートリッジをDCM:MeOH(1:1,v/v)で溶出し、溶媒を真空中で蒸発させた。残渣を、シリカゲルクロマトグラフィーによってDCM中の0〜15%メタノール(1%Et3Nを含む)で溶出して精製した。適切な画分を蒸発させることにより、表題化合物1.02gを得た。
【0369】
LC/MS(方法D)Rt=0.96分,MH+=339.
【0370】
中間体24
4−クロロ−N−[5−クロロ−2−(メチルオキシ)−3−ピリジニル]−3−(トリフルオロメチル)ベンゼン−スルホンアミド
【化43】

【0371】
4−クロロ−3−(トリフルオロメチル)ベンゼンスルホニルクロリド(56mg)を、ピリジン(1ml)に溶解し、DMAP(2mg)を加えた。5−クロロ−2−(メチルオキシ)−3−ピリジンアミン(32mg)を加え、その反応物を100℃に2時間加熱した。その反応物を、HPLCによって20〜80%MeCN:水:TFAを用いて精製することにより、表題化合物72mgを得た。
【0372】
LC/MS(方法E)Rt=3.13分,MH+=401.
【0373】
実施例1
N−{6−[5−アミノ−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド
【化44】

【0374】
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(50mg)、5−ブロモ−2−(メチルオキシ)−3−ピリジンアミン(21mg)およびPd(dppf)Cl2(8mg)をマイクロ波用バイアル内で合わせた。1,4−ジオキサン(0.5ml)を加えた後、水(0.5ml)に溶解された炭酸ナトリウム(44mg)を加えた。その反応物をマイクロ波で140℃において20分間加熱した。その反応物をシリカカートリッジ(1g)で濾過し、DCM:メタノール(3:1)で洗浄した。次いで、溶媒を窒素流の下で除去した。残渣をDMSO(1.2ml)およびメタノール(0.4ml)に溶解し、MDAP(方法D)を用いて精製した。生成物を含む画分を一晩放置することにより、脱保護した。残渣を1,4−ジオキサン:水(2ml,1:1,v/v)に溶解し、フリーズドライした。残渣をDCMに溶解し、数滴のTFAを加え、その反応物を一晩放置した。残渣を、MDAP(方法A)によってさらに精製し、次いで、窒素を吹き付けて乾燥することにより、表題化合物10mgを得た。
【0375】
LCMS(方法B)Rt=0.85分,MH+=381.
以下を、ボロン酸エステルおよび適切な臭化物から同様に調製した;
【表15】

【0376】
実施例5
N−[6−(5−アミノ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド
【化45】

【0377】
2−メチル−N−[1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(1g)をDMF(4ml)に溶解し、マイクロ波用容器内のDMF(400μl)中の5−ブロモ−3−ピリジンアミン(0.18mmol)に400μlを分注した。Solvias触媒(4mg)を加え、その反応物をAnton Parrマイクロ波で、最初の700Wを用いて135℃に20分間加熱した。その溶液をC18 SPE(MeCN中の0.1%TFAでプレコンディショニングされた)上に充填し、MeCN中の0.1%TFA(3ml)とともに流した。窒素を吹き付けて溶媒を除去した。サンプルをDMSO(0.5ml)に溶解し、MDAP(方法C)によって精製した。Genevacを用いて真空中で溶媒を蒸発させた。サンプルをIPA(300μl)に溶解し、2M NaOH(aq)(300μl)を加えた。その反応物を一晩放置した。サンプルをDMSO(0.6ml)に溶解し、MDAP(方法C)によって精製した。Genevacを用いて溶媒を真空中で蒸発させることにより、表題化合物4mgを得た。
【0378】
LCMS(方法B)Rt=0.55分,MH+=351.
以下を、適切な臭化物から同様に調製した;
【表16】

【0379】
実施例8
{[3−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)フェニル]オキシ}酢酸
【化46】

【0380】
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(50mg)、[(3−ブロモフェニル)オキシ]酢酸(7.6mg)および炭酸ナトリウム(44mg)をマイクロ波用バイアルに加えた。Pd(dppf)Cl2(24mg)を加えた後、1,4−ジオキサン(0.5ml)および水(0.5ml)を加えた。その反応物をマイクロ波で140℃において20分間加熱した。その材料をDCM:メタノールとともに1gシリカカートリッジに通した。残渣をDMSO:メタノール(1.6ml,1:1,v/v)に溶解し、C18カートリッジ(1g)に通し、MeCNで洗浄し、窒素を吹き付けて蒸発させた。残渣をDMSO:メタノール(1.6ml,1:1,v/v)に溶解し、MDAP(方法D)によって精製した。純粋画分を合わせ、窒素を吹きつけ、1,4−ジオキサン:水(約3ml,1:1,v/v)に懸濁し、フリーズドライした。MDAP(方法A)によるさらなる精製から、表題化合物9mgを得た。
【0381】
LCMS(方法B)Rt=0.9分,MH+=409.
以下を、適切な臭化物から同様に調製した;
【表17−1】

【表17−2】

【0382】
*2M HCl(aq)をMDAP画分に加えた後、乾燥した。
【0383】
#MDAPによって精製しなかった;1gシリカカートリッジに通し、次いで、2M HCl(aq)とともに撹拌した。
【0384】
実施例16
フェニルメチル[2−クロロ−5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジニル]カルバメート
【化47】

【0385】
DCM(2ml)およびDIPEA(0.037ml)を、N−[6−(5−アミノ−6−クロロ−3−ピリジニル)−2−(テトラヒドロ−2H−ピラン−2−イル)−2H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド(50mg)に加え、その反応物を撹拌した。フェニルメチルクロリドカーボネート(0.023ml)を加え、その反応物をRTで一晩撹拌した。その反応物を蒸発乾固した。ピリジン(1ml)を加えた後、フェニルメチルクロリドカーボネート(0.023ml)を加え、その反応物をRTで4時間撹拌した。DMAP(3mg)を加えた後、フェニルメチルクロリドカーボネート(0.023ml)を加え、その反応物をRTで撹拌した。フェニルメチルクロリドカーボネート(0.05ml)を加え、その反応物を一晩放置した。フェニルメチルクロリドカーボネート(0.05ml)を加え、その反応物をRTで1時間撹拌した。フェニルメチルクロリドカーボネート(0.05m)を加え、その反応物をRTで2時間撹拌した。2M HCl(aq)およびDCMを加えた。DCMを分離し、疎水性フリットに通し、蒸発乾固した。残渣をDMSO:メタノール(1ml,7:3,v/v)に溶解し、MDAP(方法A)によって精製した。生成物を含む画分を蒸発乾固し、メタノール(3ml)および数滴の2M HCl(aq)を加え、その反応物を1時間撹拌した。その反応物を蒸発乾固することにより、表題化合物13mgを得た。
【0386】
LCMS(方法B)Rt=1.17分,MH+=519
【0387】
実施例17
N−(6−{6−クロロ−5−[フルオロ(フェニルスルホニル)メチル]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド
【化48】

【0388】
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(62mg)、5−ブロモ−2−クロロ−3−[フルオロ(フェニルスルホニル)メチル]ピリジン(47mg)、Pd(dppf)Cl2(9mg)および炭酸ナトリウム(54mg)をマイクロ波用バイアル内で合わせた。1,4−ジオキサン(0.5ml)および水(0.5ml)を加え、その反応物をマイクロ波で140℃において20分間加熱した。その反応物を、メタノールでプレコンディショニングされた1gシリカカートリッジに通し、メタノールで洗浄した。窒素を吹き付けて溶媒を除去した。残渣をメタノール:DMSO(1:1,v/v)に溶解し、MDAP(方法A)によって精製した。画分を一晩放置し、次いで、回転蒸発によって溶媒を除去した。残渣をメタノールに溶解し、数滴の2M HCl(aq)を加えた。その反応物をRTで1時間放置し、次いで、窒素を吹き付けて溶媒を除去することにより、表題化合物3mgを得た。
【0389】
LCMS(方法B)Rt=1.12分,MH+=542.
【0390】
実施例18
2−メチル−N−{6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド
【化49】

【0391】
IPA(0.5ml)中の2−メチル−N−[6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1−(フェニルスルホニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(20mg)の懸濁液に、2M NaOH(aq)(0.5ml)を加え、その混合物を20℃で3時間撹拌した。IPAを窒素流の下で除去し、水相を2M HCl(aq)で中和し、次いで、DCMで抽出し、それを、疎水性フリットを用いて分離した。水層を酢酸エチルで抽出し、有機抽出物を合わせ、溶媒を真空中、次いで、窒素流の下で抽出することにより、表題化合物9mgを得た。
【0392】
LCMS(方法B)Rt=0.77分,MH−=452.
【0393】
実施例19
2−メチル−N−{6−[5−(4−モルホリニルスルホニル)−3−ピリジニル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド
【化50】

【0394】
2−メチル−N−[1−(フェニルスルホニル)−6−(トリメチルスタンナニル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(50mg)を、Pd(PPh3)4(10mg)および4−[(5−ブロモ−3−ピリジニル)スルホニル]モルホリン(30mg)とともに、マイクロ波用バイアルに入れた。DMF(2ml)を加え、その反応物をマイクロ波で120℃において15分間加熱した。その残渣に、IPA(2ml)および2M NaOH(aq)(1ml)を加え、混合物をRTで3時間撹拌した。溶媒に窒素を吹き付け、その残渣をMDAP(方法A)によって精製することにより、表題化合物17mgを白色固体として得た。
【0395】
LCMS(方法B)Rt=0.86分,MH+=485.
【0396】
実施例20
2−メチル−N−[6−(1H−ピラゾール−4−イル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド
【化51】

【0397】
1,4−ジオキサン(1ml)中の4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール(23mg)に、1,4−ジオキサン(1ml)に溶解されたN−(6−ブロモ−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド(36mg)を加えた。水(0.2ml)に溶解された炭酸カリウム(18mg)およびPd(dppf)Cl2(10mg)を加え、その反応物をマイクロ波で150℃に30分間加熱した。Genevacを用いて、真空中で溶媒を蒸発させた。残渣を、C18カートリッジ(500mg)にメタノール中において充填し、MeCN:0.1%TFA(3×3ml)を用いて溶出した。適切な画分を合わせ、窒素流の下で乾燥した。サンプルをMeOH:DMSO(0.5ml,1:1)に溶解し、MDAP(方法B)によって精製した。Genevacを用いて真空中で溶媒を蒸発させることにより、表題化合物0.3mgを得た。
【0398】
LCMS(方法B)Rt=0.67分,MH+=325.
以下を、適切な臭化物から同様に調製した;
【表18】

【0399】
実施例23
N−[6−(1−アセチル−2,3−ジヒドロ−1H−インドール−4−イル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド
【化52】

【0400】
1,4−ジオキサン(0.4ml)中の2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(53mg)を、1−アセチル−4−ブロモ−2,3−ジヒドロ−1H−インドール(24mg)に加えた。1,4−ジオキサン(0.4ml)を加えた後、Solvias触媒(2mg)(マイクロスパーテル山盛り)および水(0.2ml)中のリン酸三カリウム(212mg)を加えた。その反応物をマイクロ波(mirowave)で110℃に20分間加熱した。次いで、その溶液をC18 SPE(MeCN:0.1%TFAでプレコンディショニングされたもの)上に充填し、MeCN:0.1%TFA(3ml)とともに流した。窒素を吹き付けて溶媒を除去した。残渣をメタノール(500μl)に溶解し、メタノールでプレコンディショニングされたSCX−2 SPE(1g)上に充填した。その化合物をカラム上で1時間放置し、次いで、メタノール中の2Mアンモニアで溶出した。サンプルをDMSO(0.5ml)に溶解し、MDAP(方法B)によって精製した。Genevacを用いて真空中で溶媒を蒸発させることにより、表題化合物8mgを得た。
【0401】
LCMS(方法B)Rt=0.9分,MH+=418.
【0402】
実施例24
N−{6−[5−({[4−クロロ−3−(トリフルオロメチル)フェニル]スルホニル}アミノ)−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミドトリフルオロアセテート
【化53】

【0403】
2−メチル−N−[2−(テトラヒドロ−2H−ピラン−2−イル)−6−(4,4,6,6−テトラメチル−1,3,2−ジオキサボリナン−2−イル)−2H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド(50mg)、Pd(dppf)Cl2(8mg)および炭酸ナトリウム(44mg)をマイクロ波用バイアルに加えた。4−クロロ−N−[5−クロロ−2−(メチルオキシ)−3−ピリジニル]−3−(トリフルオロメチル)ベンゼンスルホンアミド(42mg)を加えた後、1,4−ジオキサン(0.5ml)および水(0.5ml)を加えた。その反応物を140℃で30分間加熱した。その材料を、DCM:メタノールとともに1gシリカカートリッジに通し(passed though)、次いで、蒸発乾固した。残渣をDMSO:メタノール(1.6ml,1:1,v/v)に溶解し、MeCNで洗浄する1g C18カートリッジに通し、窒素を吹き付けて蒸発させた。残渣をDMSO:メタノール(1.6ml,1:1,v/v)に溶解し、MDAP(方法D)によって精製した。純粋画分を合わせ、吹きつけ、1,4−ジオキサン:水(約3ml,1:1,v/v)に懸濁し、フリーズドライすることにより、表題化合物7mgを得た。
【0404】
LCMS(方法B)Rt=1.21分,MH+=623.
【0405】
生物学的データ
PI3Kアルファ、ベータ、デルタおよびガンマアッセイ
アッセイ原理
アッセイ読み出しは、シグナルが生成される際の、単離されたプレクストリン相同(PH)ドメインへのPIP3の特異的かつ高親和性の結合を活用する。簡潔には、PIP3生成物は、ユウロピウム(Eu)で標識された抗GSTモノクローナル抗体、GSTでタグ化されたPHドメイン、ビオチン−PIP3およびストレプトアビジン−APCからなるエネルギー転移複合体からのビオチン化PIP3の置換によって検出される。Euの励起によって、エネルギーがAPCに転移し、感光性を与えられた蛍光が665nmで発光する。PI3キナーゼ活性によって形成されたPIP3は、PHドメイン上の結合部位について競合することから、エネルギー転移の喪失およびシグナルの低下がもたらされる。
【0406】
アッセイプロトコル
典型的には、固体の化合物を、384ウェルv底小容量Greinerプレートの全ウェル(カラム6および18を除く)に0.1μlの100%DMSOとともにプレーティングする。それらの化合物を、カラム1からカラム12およびカラム13からカラム24に向かって、プレートを横切って段階希釈し(100%DMSOで4倍の段階希釈)、カラム6および18はDMSOだけが入った状態で放置することにより、各試験化合物について11個の濃度を得る。
【0407】
Millipore製の特定のPI3キナーゼキット(Cat#33−001)を用いて、アッセイを行う。このアッセイキットは、以下からなる:
・4×PI3K反応緩衝液(200mM Hepes pH7、600mM NaCl、40mM Mgcl2、<1%Cholate(w/v)、<1%Chaps(w/v)、0.05%アジ化ナトリウム(w/v)を含む)
・PIP2(1mM)
・3×Biotin PIP3(50μM)
・検出混合液C(267mM KFを含む)
・検出混合液A(60μg/ml ストレプトアビジン(streptavadin)−APCを含む)
・検出混合液B(36μg/mlユウロピウム−抗GST(抗GST−K)および90μg/ml GST−GRP1−PH−ドメインおよび1mM DTTを含む)
・停止液(150mM EDTAを含む)
100%阻害コントロール(活性なし)のために、3μlの反応緩衝液(1mM DTTを含む)をカラム18だけに手動で加える。
【0408】
カラム18以外のすべてのウェルに3μlの2×酵素液を手動で加える。化合物とともに15分間プレインキュベートする。
【0409】
3μlの2×基質溶液をすべてのウェルに手動で加える(カラム6は、0%阻害コントロールに相当する)
プレートを1時間放置する(光から保護する)(ガンマについては、50分間のインキュベーションが必要とされるだけである)
3μlの停止/検出液をすべてのウェルに手動で加える。
【0410】
プレートを1時間放置する(光から保護する)。
【0411】
BMG Rubystarにおいてアッセイを読み出し、比率のデータを利用して11点の曲線を作成する。
【0412】
NB基質溶液(濃度)は、各アイソフォームによって異なる(下記を参照のこと)。
【0413】
アルファ
500μM ATP、16μM PIP2および0.030μM 3×ビオチン−PIP3を含む2×基質溶液。
【0414】
ベータ
800μM ATP、16μM PIP2および0.030μM 3×ビオチン−PIP3を含む2×基質溶液。
【0415】
デルタ
160μM ATP、10μM PIP2および0.030μM 3×ビオチン−PIP3を含む2×基質溶液。
【0416】
ガンマ
30μM ATP、16μM PIP2および0.030μM 3×ビオチン−PIP3を含む2×基質溶液。
【0417】
解析方法
データを、Activity BaseにおいてXC50 4−パラメータロジスティック曲線当てはめアルゴリズムによって処理した。
【0418】
高コントロールと低コントロール(それぞれ0%および100%阻害)との間の%阻害に正規化する。
【0419】
1次モジュールフィット:傾き、最小(Min)および最大漸近線(Max asymptotes)は変動する
2次モジュールフィット:(1)最小漸近線を固定、(2)最大漸近線を固定、(3)最小および最大漸近線を固定
カーブフィットQC:pXC50 95%CL比>10
−20<最小漸近線<20
80<最大漸近線<120
実施例1〜24の化合物を、上記のPI3Kアルファ、ベータ、デルタおよび/もしくはガンマアッセイまたは類似のアッセイのうちの1つ以上において試験し、5またはそれ以上の平均pIC50を有することが見出された。
【特許請求の範囲】
【請求項1】
式(I)の化合物
【化1】

(式中、
R1は、−OR3、−CH2OR4もしくは−CH2CNによって置換されてもよいフェニル、5員ヘテロアリール(ここで、前記5員ヘテロアリールは、酸素、窒素および硫黄から独立して選択される1もしくは2個のヘテロ原子を含み、かつ−CH2フェニルによって置換されてもよい);ピリジニル(ここで、前記ピリジニルは、−NH2、−CH2OR5、−CO2R6、−CONR7R8、−NHCO2R9、−XSO2R10、−SO2NR11R12および−NHSO2R13から選択される1つの置換基によって置換され、かつハロおよび−OR14から選択される第2の置換基によって置換されてもよい);9員もしくは10員の二環式ヘテロアリール(ここで、前記9員もしくは10員の二環式ヘテロアリールは、酸素および窒素から独立して選択される1〜3個のヘテロ原子を含み、かつ−SO2R15によって置換される);またはピロリジニルに縮合されたフェニル(ここで、前記ピロリジニルは、−COR16によって置換される)であり、
R2は、5員ヘテロアリール(ここで、前記5員ヘテロアリールは、酸素、窒素および硫黄から独立して選択される1または2個のヘテロ原子を含み、かつC1−6アルキルによって置換されてもよい)であり、
R3は、−CO2R17によって置換されるC1−6アルキルであり、
R4、R5、R6、R14およびR17は、各々独立して、水素またはC1−6アルキルであり、
R7およびR8は、各々水素であるか、またはR7およびR8は、それらが結合している窒素原子と一体となって連結されることにより、酸素原子を含んでもよい6員ヘテロシクリルを形成し、
R9は、フェニルによって置換されてもよいC1−6アルキルであり、
R10およびR15は、各々独立して、C1−6アルキルまたはフェニルであり、
R11およびR12は、それらが結合している窒素原子と一体となって連結されることにより、酸素原子を含んでもよい6員ヘテロシクリルを形成し、
R13は、−CF3およびハロによって置換されるフェニルであり、
R16は、C1−6アルキルであり、かつ
Xは、−CH2−、−CHF−または−N(CH3)−である)
またはその塩。
【請求項2】
R1が、−OR3もしくは−CH2OR4によって置換されるフェニル;ピリジニル(ここで、前記ピリジニルは、−NH2、−CH2OR5および−NHSO2R13から選択される1つの置換基によって置換され、かつハロおよび−OR14から選択される第2の置換基によって置換されてもよい);または9員もしくは10員の二環式ヘテロアリール(ここで、前記9員もしくは10員の二環式ヘテロアリールは酸素および窒素から独立して選択される1〜3個のヘテロ原子を含み、かつ−SO2R15によって置換される)である、請求項1に記載の化合物。
【請求項3】
R1が、ピリジニル(ここで、前記ピリジニルは、−NH2および−NHSO2R13から選択される1つの置換基によって置換され、かつ−OR14である第2の置換基によって置換されてもよい);または9員の二環式ヘテロアリール(ここで、前記9員の二環式ヘテロアリールは、3個の窒素原子を含み、−SO2R15によって置換される)である、請求項1に記載の化合物。
【請求項4】
R2が、5員ヘテロアリール(ここで、前記5員ヘテロアリールは、窒素および硫黄から独立して選択される1または2個のヘテロ原子を含み、かつC1−6アルキルによって置換されてもよい)である、請求項1または請求項2に記載の化合物。
【請求項5】
N−{6−[5−アミノ−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボン酸、
2−メチル−N−(6−フェニル−1H−インダゾール−4−イル)−1,3−チアゾール−4−カルボキサミド、
N−{6−[3−(シアノメチル)フェニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−[6−(5−アミノ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[3−(ヒドロキシメチル)フェニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−(ヒドロキシメチル)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
{[3−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)フェニル]オキシ}酢酸、
N−[6−(5−アミノ−6−クロロ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[6−クロロ−5−(ヒドロキシメチル)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−(6−{6−クロロ−5−[メチル(フェニルスルホニル)−アミノ]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−[6−(2−アミノ−4−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−(6−{6−クロロ−5−[(フェニルスルホニル)メチル]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
2−クロロ−5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボン酸、
5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボキサミド、
フェニルメチル[2−クロロ−5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジニル]カルバメート、
N−(6−{6−クロロ−5−[フルオロ(フェニルスルホニル)メチル]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[5−(4−モルホリニルスルホニル)−3−ピリジニル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−[6−(1H−ピラゾール−4−イル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[5−(4−モルホリニルカルボニル)−3−ピリジニル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[1−(フェニルメチル)−1H−ピラゾール−4−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
N−[6−(1−アセチル−2,3−ジヒドロ−1H−インドール−4−イル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−({[4−クロロ−3−(トリフルオロメチル)フェニル]スルホニル}アミノ)−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
である化合物、またはその塩。
【請求項6】
薬学上許容可能な塩の形態である、請求項1〜5のいずれか一項に記載の化合物。
【請求項7】
請求項1〜5のいずれか一項に記載される化合物またはその薬学上許容可能な塩と、1種以上の薬学上許容可能な賦形剤とを含んでなる、医薬組成物。
【請求項8】
医学的療法において使用するための、請求項1〜5のいずれか一項に記載される化合物またはその薬学上許容可能な塩。
【請求項9】
不適切なPI3−キナーゼ活性によって媒介される障害の治療において使用するための、請求項1〜5のいずれか一項に記載される化合物またはその薬学上許容可能な塩。
【請求項10】
不適切なPI3−キナーゼ活性によって媒介される障害の治療において使用するための薬剤の製造における、請求項1〜5のいずれか一項に記載される化合物またはその薬学上許容可能な塩の使用。
【請求項11】
不適切なPI3−キナーゼ活性によって媒介される障害を治療する方法であって、安全かつ有効量の請求項1〜5のいずれか一項に記載される化合物またはその薬学上許容可能な塩を、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項12】
前記不適切なPI3−キナーゼ活性によって媒介される障害が、呼吸器疾患、アレルギー性疾患、自己免疫疾患、炎症性障害、循環器疾患、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、または疼痛である、請求項11に記載の方法。
【請求項13】
前記不適切なPI3−キナーゼ活性によって媒介される障害が、喘息、慢性閉塞性肺疾患(COPD)、アレルギー性鼻炎、アトピー性皮膚炎、関節リウマチ、多発性硬化症、炎症性腸疾患、血栓症、アテローム性動脈硬化症、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、関節リウマチまたは変形性関節症に伴う疼痛、背痛、一般的な炎症性疼痛、肝後方神経痛、糖尿病性ニューロパシー、炎症性神経因性疼痛(トラマ)、三叉神経痛または中枢性疼痛である、請求項11に記載の方法。
【請求項14】
前記不適切なPI3−キナーゼ活性によって媒介される障害が、喘息である、請求項11に記載の方法。
【請求項15】
前記不適切なPI3−キナーゼ活性によって媒介される障害が、COPDである、請求項11に記載の方法。
【請求項1】
式(I)の化合物
【化1】

(式中、
R1は、−OR3、−CH2OR4もしくは−CH2CNによって置換されてもよいフェニル、5員ヘテロアリール(ここで、前記5員ヘテロアリールは、酸素、窒素および硫黄から独立して選択される1もしくは2個のヘテロ原子を含み、かつ−CH2フェニルによって置換されてもよい);ピリジニル(ここで、前記ピリジニルは、−NH2、−CH2OR5、−CO2R6、−CONR7R8、−NHCO2R9、−XSO2R10、−SO2NR11R12および−NHSO2R13から選択される1つの置換基によって置換され、かつハロおよび−OR14から選択される第2の置換基によって置換されてもよい);9員もしくは10員の二環式ヘテロアリール(ここで、前記9員もしくは10員の二環式ヘテロアリールは、酸素および窒素から独立して選択される1〜3個のヘテロ原子を含み、かつ−SO2R15によって置換される);またはピロリジニルに縮合されたフェニル(ここで、前記ピロリジニルは、−COR16によって置換される)であり、
R2は、5員ヘテロアリール(ここで、前記5員ヘテロアリールは、酸素、窒素および硫黄から独立して選択される1または2個のヘテロ原子を含み、かつC1−6アルキルによって置換されてもよい)であり、
R3は、−CO2R17によって置換されるC1−6アルキルであり、
R4、R5、R6、R14およびR17は、各々独立して、水素またはC1−6アルキルであり、
R7およびR8は、各々水素であるか、またはR7およびR8は、それらが結合している窒素原子と一体となって連結されることにより、酸素原子を含んでもよい6員ヘテロシクリルを形成し、
R9は、フェニルによって置換されてもよいC1−6アルキルであり、
R10およびR15は、各々独立して、C1−6アルキルまたはフェニルであり、
R11およびR12は、それらが結合している窒素原子と一体となって連結されることにより、酸素原子を含んでもよい6員ヘテロシクリルを形成し、
R13は、−CF3およびハロによって置換されるフェニルであり、
R16は、C1−6アルキルであり、かつ
Xは、−CH2−、−CHF−または−N(CH3)−である)
またはその塩。
【請求項2】
R1が、−OR3もしくは−CH2OR4によって置換されるフェニル;ピリジニル(ここで、前記ピリジニルは、−NH2、−CH2OR5および−NHSO2R13から選択される1つの置換基によって置換され、かつハロおよび−OR14から選択される第2の置換基によって置換されてもよい);または9員もしくは10員の二環式ヘテロアリール(ここで、前記9員もしくは10員の二環式ヘテロアリールは酸素および窒素から独立して選択される1〜3個のヘテロ原子を含み、かつ−SO2R15によって置換される)である、請求項1に記載の化合物。
【請求項3】
R1が、ピリジニル(ここで、前記ピリジニルは、−NH2および−NHSO2R13から選択される1つの置換基によって置換され、かつ−OR14である第2の置換基によって置換されてもよい);または9員の二環式ヘテロアリール(ここで、前記9員の二環式ヘテロアリールは、3個の窒素原子を含み、−SO2R15によって置換される)である、請求項1に記載の化合物。
【請求項4】
R2が、5員ヘテロアリール(ここで、前記5員ヘテロアリールは、窒素および硫黄から独立して選択される1または2個のヘテロ原子を含み、かつC1−6アルキルによって置換されてもよい)である、請求項1または請求項2に記載の化合物。
【請求項5】
N−{6−[5−アミノ−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボン酸、
2−メチル−N−(6−フェニル−1H−インダゾール−4−イル)−1,3−チアゾール−4−カルボキサミド、
N−{6−[3−(シアノメチル)フェニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−[6−(5−アミノ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[3−(ヒドロキシメチル)フェニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−(ヒドロキシメチル)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
{[3−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)フェニル]オキシ}酢酸、
N−[6−(5−アミノ−6−クロロ−3−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[6−クロロ−5−(ヒドロキシメチル)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−(6−{6−クロロ−5−[メチル(フェニルスルホニル)−アミノ]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−[6−(2−アミノ−4−ピリジニル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−(6−{6−クロロ−5−[(フェニルスルホニル)メチル]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
2−クロロ−5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボン酸、
5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジンカルボキサミド、
フェニルメチル[2−クロロ−5−(4−{[(2−メチル−1,3−チアゾール−4−イル)カルボニル]アミノ}−1H−インダゾール−6−イル)−3−ピリジニル]カルバメート、
N−(6−{6−クロロ−5−[フルオロ(フェニルスルホニル)メチル]−3−ピリジニル}−1H−インダゾール−4−イル)−2−メチル−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[3−(メチルスルホニル)−1H−ピラゾロ[3,4−b]ピリジン−5−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[5−(4−モルホリニルスルホニル)−3−ピリジニル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−[6−(1H−ピラゾール−4−イル)−1H−インダゾール−4−イル]−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[5−(4−モルホリニルカルボニル)−3−ピリジニル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
2−メチル−N−{6−[1−(フェニルメチル)−1H−ピラゾール−4−イル]−1H−インダゾール−4−イル}−1,3−チアゾール−4−カルボキサミド、
N−[6−(1−アセチル−2,3−ジヒドロ−1H−インドール−4−イル)−1H−インダゾール−4−イル]−2−メチル−1,3−チアゾール−4−カルボキサミド、
N−{6−[5−({[4−クロロ−3−(トリフルオロメチル)フェニル]スルホニル}アミノ)−6−(メチルオキシ)−3−ピリジニル]−1H−インダゾール−4−イル}−2−メチル−1,3−チアゾール−4−カルボキサミド、
である化合物、またはその塩。
【請求項6】
薬学上許容可能な塩の形態である、請求項1〜5のいずれか一項に記載の化合物。
【請求項7】
請求項1〜5のいずれか一項に記載される化合物またはその薬学上許容可能な塩と、1種以上の薬学上許容可能な賦形剤とを含んでなる、医薬組成物。
【請求項8】
医学的療法において使用するための、請求項1〜5のいずれか一項に記載される化合物またはその薬学上許容可能な塩。
【請求項9】
不適切なPI3−キナーゼ活性によって媒介される障害の治療において使用するための、請求項1〜5のいずれか一項に記載される化合物またはその薬学上許容可能な塩。
【請求項10】
不適切なPI3−キナーゼ活性によって媒介される障害の治療において使用するための薬剤の製造における、請求項1〜5のいずれか一項に記載される化合物またはその薬学上許容可能な塩の使用。
【請求項11】
不適切なPI3−キナーゼ活性によって媒介される障害を治療する方法であって、安全かつ有効量の請求項1〜5のいずれか一項に記載される化合物またはその薬学上許容可能な塩を、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項12】
前記不適切なPI3−キナーゼ活性によって媒介される障害が、呼吸器疾患、アレルギー性疾患、自己免疫疾患、炎症性障害、循環器疾患、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、または疼痛である、請求項11に記載の方法。
【請求項13】
前記不適切なPI3−キナーゼ活性によって媒介される障害が、喘息、慢性閉塞性肺疾患(COPD)、アレルギー性鼻炎、アトピー性皮膚炎、関節リウマチ、多発性硬化症、炎症性腸疾患、血栓症、アテローム性動脈硬化症、血液悪性腫瘍、嚢胞性線維症、神経変性疾患、膵炎、多臓器不全、腎疾患、血小板凝集、癌、精子運動能、移植拒絶反応、移植片拒絶反応、肺損傷、関節リウマチまたは変形性関節症に伴う疼痛、背痛、一般的な炎症性疼痛、肝後方神経痛、糖尿病性ニューロパシー、炎症性神経因性疼痛(トラマ)、三叉神経痛または中枢性疼痛である、請求項11に記載の方法。
【請求項14】
前記不適切なPI3−キナーゼ活性によって媒介される障害が、喘息である、請求項11に記載の方法。
【請求項15】
前記不適切なPI3−キナーゼ活性によって媒介される障害が、COPDである、請求項11に記載の方法。
【公表番号】特表2013−512880(P2013−512880A)
【公表日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願番号】特願2012−541516(P2012−541516)
【出願日】平成22年12月3日(2010.12.3)
【国際出願番号】PCT/EP2010/068798
【国際公開番号】WO2011/067366
【国際公開日】平成23年6月9日(2011.6.9)
【出願人】(397009934)グラクソ グループ リミテッド (832)
【氏名又は名称原語表記】GLAXO GROUP LIMITED
【住所又は居所原語表記】Glaxo Wellcome House,Berkeley Avenue Greenford,Middlesex UB6 0NN,Great Britain
【Fターム(参考)】
【公表日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願日】平成22年12月3日(2010.12.3)
【国際出願番号】PCT/EP2010/068798
【国際公開番号】WO2011/067366
【国際公開日】平成23年6月9日(2011.6.9)
【出願人】(397009934)グラクソ グループ リミテッド (832)
【氏名又は名称原語表記】GLAXO GROUP LIMITED
【住所又は居所原語表記】Glaxo Wellcome House,Berkeley Avenue Greenford,Middlesex UB6 0NN,Great Britain
【Fターム(参考)】
[ Back to top ]

