PPARδ活性化剤およびPPARδ活性化剤の製造方法
【課題】ペルオキシゾーム増殖活性化受容体δ(PPARδ)を活性化し、肥満抑制、内蔵脂肪蓄積予防、インスリン抵抗性の予防・改善、赤筋増加による持久力の向上、抗炎症作用、皮膚炎治療などの効果が期待できるPPARδ活性化剤、および該活性化剤の製造方法の提供。
【解決手段】0℃以上10℃以下の温度において馴化されたエノキタケの子実体の抽出物を含有するPPARδ活性化剤、およびエノキタケの子実体を0℃以上10℃以下の温度で馴化する馴化工程と、前記馴化したエノキタケの子実体から低極性有機溶媒で抽出することによるPPARδ活性化剤の製造方法。
【解決手段】0℃以上10℃以下の温度において馴化されたエノキタケの子実体の抽出物を含有するPPARδ活性化剤、およびエノキタケの子実体を0℃以上10℃以下の温度で馴化する馴化工程と、前記馴化したエノキタケの子実体から低極性有機溶媒で抽出することによるPPARδ活性化剤の製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ペルオキシゾーム増殖活性化受容体(Peroxisome proliferator-activated receptor。以下、単に、PPARともいう)のうちのPPARδタイプを活性化するPPARδ活性化剤およびPPARδ活性化剤の製造方法に関する。
【背景技術】
【0002】
PPARは、細胞内小器官であるペルオキシソームを増加させる作用を有する核内受容体の一種であり、PPARα、δ、γの3つのタイプに分類される。
PPARの各タイプは、9−シスレチノイン酸をリガンドとするレチノイドX受容体と二量体を形成することで、遺伝子上のPPAR応答領域に結合して、種々の遺伝子発現を制御することが知られている。
このようにPPARが構造変化することで遺伝子への作用が可能になることをPPARの活性化という。
【0003】
PPARの中でもPPARδは、脂肪酸代謝の制御、インスリン感受性の増加、炎症性タンパクの発現の抑制あるいは表皮細胞分化などに関与していることが知られている。
すなわち、PPARδの活性化により、肥満抑制、内蔵脂肪蓄積予防、インスリン抵抗性の予防・改善、赤筋増加による持久力の向上、抗炎症作用、皮膚炎治療などの作用が期待できる。
【0004】
このようなPPARδの活性化剤としては、各種知られている。例えば、特許文献1には、甜菜、クマザサ、ショウガなど各種植物の乾燥粉末からの抽出物を有効成分として含むPPAR活性化剤が開示されている。
また、特許文献2には醤油粕からの抽出物を含むPPARδ活性剤が開示されている。
特許文献3には酒粕からの抽出物を含むPPARδ活性剤が開示されている。
【0005】
一方、従来から菌類の一種であるエノキダケ(Flammulina velutipes(Curt.:Fr.)Sing)には、肝機能の保護・改善成分、γ−アミノ酪酸、抗高血圧症成分などが含まれていることが下記特許文献4〜7に開示されている。エノキダケは安価で入手しやすく、且つ安全性の高い材料であるため、エノキダケから各種有効成分を抽出することで、安価で安全にこれらの有効成分が得られるという利点がある。
しかし、エノキダケにPPARδ活性化成分が含まれていることは知られていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2010−106001号公報
【特許文献2】特開2009−242382号公報
【特許文献3】特開2009−235068号公報
【特許文献4】特開2011−84537号公報
【特許文献5】特開2004−307453号公報
【特許文献6】特開2004−89128号公報
【特許文献7】特開2009−39082号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、上記のような点に鑑み、PPARδを活性化しうるPPARδ活性化剤を安価で安全な原料であるエノキタケから得ることを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、このような課題を解決すべく鋭意検討を行った結果、エノキタケの子実体を低温で馴化したものにPPARδ活性化作用があることを見出し、本発明を完成するに至った。
【0009】
すなわち、本発明の係るPPARδ活性化剤は、0℃以上10℃以下の温度において馴化されたエノキタケの子実体の抽出物を含有することを特徴とする。
【0010】
0℃以上10℃以下の温度で馴化されたエノキタケは子実体の抽出物は、PPARδに対する活性を示す。
尚、本発明における「馴化」とは、所定の温度、湿度環境下に試料を12時間以上静置することをいう。
【0011】
本発明において、前記抽出物が、前記馴化されたエノキタケの子実体を水に浸漬した後に、低極性有機溶媒で抽出されたものであることが好ましい。
【0012】
前記温度で馴化されたエノキタケをその後水に浸漬した後、該エノキタケから得られた抽出物は、PPARδ活性が向上する。
尚、本発明において浸漬工程で用いる水とは、0℃を超えて4℃の水をいい、純水に限らず、水道水などの上水、地下水などの天然水なども含み、且つ、pH調整剤などの各種添加物を含む水溶液をも含む。
また、浸漬とは、エノキタケの子実体を水中に存在させるようにすることをいう。
さらに、本発明において低極性溶媒とは、ヘキサン、ヘプタンなどの脂肪族炭化水素系溶媒や、ベンゼン、トルエンなどの芳香族炭化水素系溶媒や、シクロヘキサン、シクロヘプタンなどの脂環式炭化水素系溶媒をいう。
【0013】
また、本発明に係るPPARδ活性化剤の製造方法は、エノキタケの子実体を0℃以上10℃以下の温度で馴化する馴化工程と、前記馴化したエノキタケの子実体から低極性有機溶媒で抽出物を抽出する抽出工程とを実施することを特徴とする。
【0014】
本発明において、前記馴化工程の後に、エノキタケの子実体を0℃以上10℃以下の水に浸漬する浸漬工程を実施し、その後前記抽出工程を実施することが好ましい。
【0015】
本発明において、前記浸漬工程を10分以上120時間以下で行うことが好ましい。
【0016】
前記浸漬工程を前記時間の範囲で行った場合には、PPARδ活性がより向上する。
【0017】
本発明において、前記浸漬工程をpH4以上10以下で行うことが好ましい。
【0018】
前記浸漬工程を前記pHの範囲で行った場合には、PPARδ活性がより向上する。
【発明の効果】
【0019】
PPARδを活性化しうるPPARδ活性化剤を安価で安全性の高いエノキタケから得ることができる。
【図面の簡単な説明】
【0020】
【図1】実施例における子実体の酢酸エチル、ヘキサン抽出液、および菌糸体酢酸エチル抽出液のTLC法による分離プレートを示す図。
【図2】実施例における子実体の酢酸エチル、ヘキサン抽出液、および菌糸体酢酸エチル抽出液のTLC法による分離プレートを示す図。
【図3】実施例における子実体のヘキサン抽出液のTLC法による分離プレートを示す図。
【図4】実施例における子実体のヘキサン抽出液のAPCI−MSMSによる分析チャートを示す図。
【図5】実施例における子実体のヘキサン抽出液の遺伝子発現レベルを示すグラフ。
【図6】実施例における子実体のヘキサン抽出液の遺伝子発現レベルを示すグラフ。
【図7】実施例における子実体のヘキサン抽出液の遺伝子発現レベルの濃度による影響を示すグラフ。
【図8】実施例における子実体のヘキサン抽出液の遺伝子発現レベルの浸漬処理の時間による影響を示すグラフ。
【図9】実施例における子実体のヘキサン抽出液の遺伝子発現レベルの浸漬処理の浸漬水のpHによる影響を示すグラフ。
【図10】実施例における子実体のヘキサン抽出液の遺伝子発現レベルの浸漬処理の温度による影響を示すグラフ。
【発明を実施するための形態】
【0021】
本実施形態のPPARδ活性化剤は、0℃以上10℃以下の温度において馴化されたエノキタケの子実体の抽出物を含有するものである。
【0022】
本実施形態のPPARδ活性剤の材料としてはエノキタケ(Flammulina velutipes(Curt.:Fr.)Sing)の茎部分と傘部分とからなる子実体の部分が用いられる。
エノキタケは、天然のものあるいは人工栽培したものいずれであってもよく、その産地等も問わない。
【0023】
前記子実体は、0℃以上10℃以下の温度において馴化された後に、そのままの状態であるいは凍結乾燥など乾燥物として用いられる。
【0024】
馴化された前記子実体は、さらに、後述するような方法によって水に浸漬されたものであってもよい。
【0025】
本実施形態のPPARδ活性化剤は前記子実体から抽出された抽出物を含有する。
抽出物は、例えば、前記子実体を溶媒中に浸漬後、遠心分離、ろ過、デカンテーションなどの公知の適宜の方法で上清と沈殿物とに分離し、得られた上清のヘキサンなどの溶媒画分を分離することにより得られる。
【0026】
前記抽出物は、スフィンゴ脂質を含んでいると考えられる。スフィンゴ脂質はスフィンゴ骨格を有する脂質の総称である。
スフィンゴ脂質には、基本構造に糖がグリコシド結合されたスフィンゴ糖脂質と、リン酸基が結合されたスフィンゴリン脂質とがあるが、前記抽出物にはスフィンゴ糖脂質が含まれていると考えられる。
【0027】
前記抽出物は、そのままPPARδ活性化剤として用いてもよく、あるいは、公知の精製方法で精製を行ってもよい。
さらに、精製後、適切な溶剤で希釈した希釈液、濃縮した濃縮液、乾燥粉末等の粉状体、あるいはペースト状など種々の形状に形成してもよい。
【0028】
本実施形態のPPARδ活性化剤は、PPARの3タイプPPARα、PPARδ、PPRAβのうちのPPARδを活性化(遺伝子上のPPAR応答領域に結合して、種々の遺伝子発現を制御可能な状態)にして、PPARδに依存的な遺伝子の転写活性を亢進する作用を有する。
前記のとおりPPARδは、脂肪酸代謝の制御、インスリン感受性の増加、炎症性タンパクの発現の抑制あるいは表皮細胞分化などに関与していることから、本実施形態のPPARδ活性化剤により、肥満抑制、内蔵脂肪蓄積予防、インスリン抵抗性の予防・改善、赤筋増加による持久力の向上、抗炎症作用、皮膚炎治療などの作用が期待できる。
従って、本実施形態のPPARδ活性化剤は、機能性食品、病者用食品、特定保健用食品等のヒト若しくは動物用の食品、医薬品又は医薬部外品、化粧品など各種製品に応用しうる。
【0029】
次に、本実施形態のPPARδ活性剤の製造方法について説明する。
本実施形態のPPARδ活性剤の製造方法は、エノキタケの子実体を0℃以上10℃以下の温度で馴化する馴化工程と、前記馴化したエノキタケの子実体から低極性有機溶媒で抽出物を抽出する抽出工程とを実施する。
【0030】
(馴化工程)
前記のようなエノキタエケの子実体を0℃以上10℃以下、好ましくは、2℃以上7℃以下の温度で好気の条件下に、12時間から168時間、好ましくは15時間から30時間静置する馴化工程を実施する。
馴化されたエノキタケ子実体から抽出される抽出物はPPARδ活性を示すようになる。
【0031】
(凍結乾燥工程)
本実施形態においては、前記馴化工程を実施した後のエノキタケの子実体を凍結乾燥する工程を実施してもよい。
かかる凍結乾燥工程は、被処理物を氷点下で凍結させた後、真空または減圧下で凍結した水分を加熱、昇華させることで被処理物を乾燥させるいわゆるフリーズドライ方法で行うことができる。
凍結乾燥に用いる装置としては、公知の凍結乾燥装置を用いることができる。また、凍結乾燥条件としては、特に限定されるものではないが、例えば、−40℃〜−50℃の温度条件で24時間〜48時間程度で凍結乾燥を行うことが好ましい。
【0032】
(浸漬工程)
本実施形態のPPARδ活性剤の製造方法においては、前記馴化工程の後に、エノキタケ子実体を0℃以上10℃以下の水に浸漬する浸漬工程を実施してもよい。
【0033】
浸漬工程では、前記馴化工程で馴化されたエノキタケ子実体を水中に浸漬して、好ましくは、5分以上10日以内、好ましくは10分以上5日(120時間)以内、さらに好ましくは1日以上6日以内、静置する。
馴化されたエノキタケ子実体を水に浸漬することで前記抽出物のPPARδ活性がさらに向上する。
【0034】
本実施形態の浸漬工程において、水のpHをpH4以上10以下で、好ましくはpH4以上6以下に調整して、該pH調整水に前記エノキタケ子実体を浸漬することで、さらなるPPARδ活性の向上が認められる。
pH調整剤としては例えば塩酸等を用いることが好ましい。
【0035】
(抽出工程)
前記のような各工程を実施した後、エノキダケの子実体を低極性有機溶媒で処理して抽出物を抽出する抽出工程を実施する。
低極性有機溶媒としては、ヘキサン、クロロホルム等の中から任意の有機溶媒を用いることができるが、ヘキサンを用いることが食品利用の観点から好ましい。
【0036】
本実施形態の抽出工程では公知の抽出方法を採用することができるが、例えば、以下のような抽出方法で実施することができる。
まず、前記低極性有機溶媒としてのヘキサンの中に前記エノキタケの子実体の粉末を懸濁した懸濁液を所定時間、例えば、8時間から15時間程度静置した後に濾紙などで濾過した濾液を蒸発乾固する。さらに、ヘキサンで再懸濁して純水と混合してから遠心分離後、ヘキサン層を回収する。このヘキサン層をさらに純水と混合して遠心分離する処理を5回程度繰り返すことで回収したヘキサン相を蒸発乾固することで抽出物を得ることができる。
【実施例】
【0037】
以下に、実施例に基づいて本発明をより詳細に説明するが、本発明はこれらの実施例により何ら限定されるものではない。
【0038】
(抽出物の分析1)
エノキタケの子実体および菌糸体を4℃で24時間馴化させた後、凍結乾燥させた粉末をそれぞれ10gずつ試料とした。
前記各試料を、酢酸エチル500mlに懸濁した懸濁液を4℃で一晩(16時間)静置した。前記懸濁液を濾紙(No.1、ADVANTEC社製)で濾過し、該濾液を40℃でエバポレーターにかけて蒸発乾固させた。
乾固させた試料を酢酸エチル1mlで再懸濁し、0.2μmフィルター(材質PTFE、ADVANTEC社製)で濾過し、固体成分(子実体または菌糸体の粉末)を完全に除去した液体を得た。尚、以下、子実体から得られた抽出液を「子実体酢酸エチル抽出液」、菌糸体から得られた抽出液を「菌糸体酢酸エチル抽出液」という。
さらに、前記と同様に、エノキタケの子実体のみ、ヘキサンを用いて抽出した液を「子実体ヘキサン抽出液」として得た。
【0039】
前記子実体酢酸エチル抽出液、菌糸体酢酸エチル抽出液および子実体ヘキサン抽出液を以下のような条件で薄層クロマトグラフィー(TLC)を用いて分離した。
展開溶媒:クロロホルム:メタノール 9:1(体積比)
発色試薬:モリブデン酸アンモニウム−過塩素酸試薬(12質量%モリブデン酸アンモニウム水溶液A、1M塩酸B、60質量%過塩素酸Cを、質量比A:B:C=5:6:3で混合したもの。)
ヨウ素試薬(和光純薬社製)。
使用TLCプレート:Silica gel F254(メルク社製)
【0040】
前記各抽出液を分離したプレートに前記モリブデン酸アンモニウム試薬を噴霧して、105℃で10分間加熱した結果を図1に示す。
さらに同様に抽出液を分離したプレートを前記ヨウ素試薬を充満させた密閉容器中に入れて10分間放置した結果を図2に示す。
【0041】
図1および図2に示す1は子実体酢酸エチル抽出液、2は子実体ヘキサン抽出液、3は菌糸体酢酸エチル抽出液を示す。
図1に示すように、子実体酢酸エチル抽出1および子実体ヘキサン抽出液2は同じスポットRf値0.60に呈色を示したが、菌糸体酢酸エチル抽出液3では非常に薄くしか呈色を示さなかった。
モリブデン酸アンモニウム試薬は脂質の検出が可能であり、以上より、前記子実体からの抽出物中には脂質が含まれていることがわかった。
【0042】
また、図2に示すように、子実体酢酸エチル抽出1および子実体ヘキサン抽出液2は同じスポットRf値0.60に呈色を示したが、菌糸体酢酸エチル抽出液3ではほとんど呈色を示さなかった。
ヨウ素反応では不飽和化合物の検出が可能であり、以上より、前記子実体からの抽出物中には不飽和化合物が含まれていることがわかった。
すなわち、子実体からの抽出物には不飽和脂肪酸が含まれていることがわかった。
【0043】
(抽出物の分析2)
子実体からの抽出物をさらに詳細に分析するために以下のような分析を行った。
エノキタケの子実体を4℃で16時間馴化させた後凍結乾燥させた粉末1gを40mlの超純水(常温20℃)に懸濁して10分間浸漬させた懸濁液と、前記馴化させた後凍結乾燥させた粉末1gを40mlの超純水で10分間煮沸処理した懸濁液とをそれぞれ遠心分離(10000×g、4℃、15分)したものを試料とした。
前記各試料を用いて前記抽出物の分析1と同様にヘキサン抽出液を得た。
【0044】
前記各抽出液を以下のような条件で薄層クロマトグラフィー(TLC)を用いて分離した。
展開溶媒:クロロホルム:メタノール:酢酸 90:10:2(体積比)
発色試薬:Dittmer試薬(4%三酸化モリブデン・25N硫酸)
ニンヒドリン試薬(0.2%ニンヒドリン・無水エタノール溶液)
使用TLCプレート:Silica gel F254(メルク社製)
【0045】
前記各抽出液を分離したプレートに前記Dittmer試薬およびニンヒドリン試薬を噴霧し、120℃で数分間加熱したところ、常温水に浸漬後の子実体からの抽出物および熱水に浸漬後の子実体からの抽出物いずれも呈色しなかった。
前記ニンヒドリン試薬はアミノ酸の検出が可能であり、Dittmer試薬はリン酸の検出が可能である。
従って、子実体からの抽出物にはアミノ酸、リン酸は含まれていないことがわかった。
さらに、前記常温水に浸漬後の子実体からの抽出物および煮沸後の子実体からの抽出物を前記と同様に分離したプレートに前記Dittmer試薬を噴霧して、120℃で数分間
加熱した結果を図3に示す。
図3の1は常温水に浸漬後の子実体からの抽出物、2は熱水に浸漬後の子実体からの抽出物を示す。
図3からあきらかなように、熱水に浸漬後の子実体からの抽出物には、前記分析1で分析されたリン脂質は含まれていないことがわかる。
【0046】
(抽出物のAPCI−MSMSによる分析)
エノキタケの子実体を4℃で16時間馴化させた後凍結乾燥させた粉末1gを40mlの超純水(常温20℃)に懸濁して10分間浸漬させた懸濁液を、弱アルカリ処理(0.1MのNaOH溶液で、100℃、30分間処理)した後、前記分析1と同様の手法および条件でTLCを行い、TLCで分離されたRf0.60の画分を採取して得た試料を用いて、大気圧化学イオン化−質量分析計(APCI−MSMS)で以下の条件で分子量を測定した結果を図4に示す。
使用装置:Applied Biosystem API-3000
測定条件:移動相1%ギ酸超純水溶液と1%ギ酸アセトニトリル溶液を1:1に混合して1ml/mlの流速で、Positive(M+1)で分析した。
【0047】
図4に示すように試料中には分子量878.2の位置にピークを示した。
かかる位置にピークを示していることから、抽出物はスフィンゴ脂質の主構造であるスフィンゴ骨格を含むことがわかった。
【0048】
以上の各分析結果より、4℃で馴化したエノキタケの子実体から抽出される抽出物には不飽和脂肪酸を持ったスフィンゴ脂質構造を備える脂質および、リン酸、アミノ酸を含まないことが判った。
【0049】
(遺伝子発現レベル)
レポーター遺伝子アッセイによる遺伝子発現レベルを試験した。
レポーター遺伝子アッセイは、対象とする遺伝子の発現変化を転写レベルで分析する方法であり、目的遺伝子の転写調節領域の下流にレポーターとしてルシフェラーゼ遺伝子を組み込んだプラスミドを作成し、そのプラスミドを導入した細胞の酵素活性(生物化学発光)を測定する方法である。
【0050】
(1)馴化による遺伝子発現レベルへの影響
a)試料
エノキタケの子実体(馴化なし)を凍結乾燥させた粉末と、前記分析1で使用した馴化したエノキタケの子実体を凍結乾燥させた粉末とを各1gずつ、ヘキサン30mlに懸濁して、該懸濁液を4℃で一晩(16時間)静置した。該懸濁液を濾紙(No.1、ADVANTEC社製)で濾過した濾液をN2によって蒸発乾固させた。
この蒸発乾固試料をヘキサンで再度懸濁し等量の純水を加えて転倒混和し遠心分離(1000×g、4℃、5分)した。
ヘキサン層を回収した後、さらに超純水を加えて遠心分離(1000×g、4℃、5分)した。この操作を5回繰り返し、回収したヘキサン層をN2によって蒸発乾固させた。
【0051】
b)試薬等
使用細胞:ヒト培養細胞Hek 293(医薬基研究所製 代謝疾患タンパク検索プロジェクト)
培地:Dubeco's Modified Eagle's Medium(1000mg,グルコース、L−グルタミン酸、NaOCO3、pyridoxine HCL(SIGMA社製)、以下、DMEMという。)
PMプラスミド:pRL-TK(Int-) (Promega社;内部標準) 30ng、pTAL-5XGAL4(J Biol Chem. 2002 May 3;277(18):15629-37 に記載のもの) 150ng、pM-hPPARd 50ng、または、空VectorのPM(Clontech社)50ngを60ulのDMEMの無血清培地/1−wellになるように調整し、Lipofectamine2000を0.5ul/wellで導入したもの。
プロモーター:TKプロモーター
装置:ルミノメーター(TOYOBO社製)
【0052】
c)遺伝子導入
24穴細胞培養プレートに前記ヒト培養細胞を培養し、1.5mlエッペンドルフチューブに1ウエルにつきDMEM(−血清)100μl、SV40-rLuc100ng、GAL4-TAL150ng、比較する遺伝子を含まないプラスミドとしての前記PM50ng、Lipofrctamine(invitorogen))0.5μlとなるように混合した混合物を得た。
対象の受容体PPARδおよび、比較する受容体としてLXR(肝臓Xレセプター)、FXR(Farnesoid X受容体)、PPARα、PPARγの5種類の受容体に対応する遺伝子活性を測定するために、前記PMを、LXR、FXR、PPARδ、PPARα、PPARγに変えてそれぞれ同様の操作を行い6種類の遺伝子導入混合物を作製した。
前記培養細胞の培地を捨てて、新しいDMEM(−血清)で洗浄し、さらに250μlのDMEM(−血清)を追加した。
前記各遺伝子導入混合物1種類を50μlずつ4ウエルに分けた。CO2インキュベータ(37℃、5%CO2気流下)内で3時間培養後、培地をすててDMEM(+血清)を250μl添加し、さらにCO2インキュベータ(37℃、5%CO2気流下)内で24時間培養した。
【0053】
d)試料添加
前記各試料をジメチルスルホキシドに溶かして10mg/mlとした。
各試料およびブランクとしてのジメチルスルホキシド18μlをDMEM(+血清)6μlに混合した。これらを前記遺伝子導入された培養細胞が入った各ウエルに450μlずつ添加し、CO2インキュベータ(37℃、5%CO2気流下)内で一晩(16時間)培養した。
【0054】
e)光度測定
前記インキュベータから取り出した細胞をPBS(リン酸ナトリウム緩衝液)で洗浄して蒸留水で5倍希釈したLysisバッファー(Progma社製)を1ウエルに75μlずつ添加して、10分間振とうし、細胞を分離させた。
さらに、96穴プレートに分離させた細胞液を10μl、発光基質を添加したルシフェラーゼアッセイバッファー(Progma社製)50μl、Stop&Gloバッファー(Progma社製)45μlを加え、GLOMAX MULTI DETECTION SYSTEMのDual-Luciferase Reporter Assey systemのプロトコールに従い光度を測定した。
【0055】
f)遺伝子発現レベル
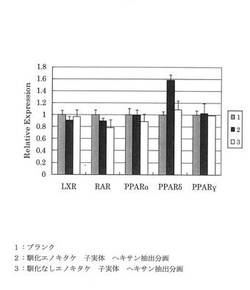
前記光度から各試料についてLXR/PM、FXR/PM、PPARδ/PM、PPARα/PM、PPARγ/PMを算出した値をブランクの値で割った値を遺伝子活性を示す相対活性として図5に示した。
【0056】
図5から、4℃で馴化したエノキタケの子実体からの抽出物は、PPARδの活性に特化していることがわかった。
【0057】
(2)浸漬処理による遺伝子発現レベルへの影響
試料として4℃で24時間馴化したエノキタケの子実体の凍結乾燥粉末と、前記と同様の馴化後凍結乾燥させた粉末を7日間常温の超純水(20℃)に浸漬させた懸濁液とを用いて、前記「(1)馴化による遺伝子発現レベルへの影響」と同様の手順で相対活性を試験した結果を図6に示す。
【0058】
図6から、浸漬処理を行ったエノキタケの子実体からの抽出物は、浸漬処理を行なわなかった子実体の抽出物に比してPPARδ活性が2倍以上向上していたことがわかった。
【0059】
(3)濃度による遺伝子発現レベルへの影響
前記「(2)浸漬処理による遺伝子発現レベルへの影響」で用いた各子実体で、濃度による相対活性の変化を試験した。
各子実体の抽出物は無希釈、3倍、10倍、30倍、100倍、300倍にDMSOで希釈して、図中の最終添加濃度となるように調製した。前記「(1)馴化による遺伝子発現レベルへの影響」と同様の手順で相対活性を試験した結果を図7に示す。
【0060】
図7からは、浸漬処理を行ったエノキタケの子実体抽出物では、希釈しないものでは、12.3、希釈倍率3倍のものでは2.87と、3倍希釈までPPARδ活性を示していた。
一方、浸漬処理を行っていないエノキタケからの抽出物では濃度による活性の変化が見られなかった。
【0061】
(4)浸漬時間による遺伝子発現レベルへの影響
4℃で16時間馴化されたエノキタケの子実体の凍結乾燥粉末1gをそれぞれ超純水40mlに懸濁した懸濁液を4℃で、0分(浸漬なし)、10分、30分、60分、1日、3日、5日、7日静置し、該懸濁液を遠心分離(10000×g、4℃、15分)した以外は前記「(1)馴化による遺伝子発現レベルへの影響」と同様の手順で相対活性を試験した結果を図8に示す。
図8から、10分以上浸漬を行ったものは浸漬処理を行わなかったものに比して活性は向上しており、5日間までであれば浸漬処理時間が長いほど活性は向上することがわかった。また、7日の浸漬処理であっても十分に高い相対活性を示していた。
【0062】
(5)pHによる遺伝子発現レベルへの影響
4℃で16時間馴化されたエノキタケの子実体の凍結乾燥粉末1gを、それぞれpH2、pH4、pH6、pH7、pH8、pH10(超純水にpH調整剤: 1M NaOHを添加して調整)の水溶液に懸濁した懸濁液を遠心分離(10000×g、4℃、15分)した以外は前記「(1)馴化による遺伝子発現レベルへの影響」と同様の手順で相対活性を試験した結果を図9に示す。
図9から、pH4からpH10の間ではpH2の場合よりも相対活性は向上することがわかった。
【0063】
(6)浸漬処理温度による遺伝子発現レベルへの影響
4℃で16時間馴化されたエノキタケの子実体の凍結乾燥粉末1gを、それぞれ常温水(20℃)40mlに懸濁し、一方はそのまま、他方は10分間煮沸した懸濁液をそれぞれ遠心分離(10000×g、4℃、15分)した以外は前記「(1)馴化による遺伝子発現レベルへの影響」と同様の手順で相対活性を試験した結果を図10に示す。
図10から、抽出物を煮沸した場合にはPPARδ活性を示さないことがわかった。
【技術分野】
【0001】
本発明は、ペルオキシゾーム増殖活性化受容体(Peroxisome proliferator-activated receptor。以下、単に、PPARともいう)のうちのPPARδタイプを活性化するPPARδ活性化剤およびPPARδ活性化剤の製造方法に関する。
【背景技術】
【0002】
PPARは、細胞内小器官であるペルオキシソームを増加させる作用を有する核内受容体の一種であり、PPARα、δ、γの3つのタイプに分類される。
PPARの各タイプは、9−シスレチノイン酸をリガンドとするレチノイドX受容体と二量体を形成することで、遺伝子上のPPAR応答領域に結合して、種々の遺伝子発現を制御することが知られている。
このようにPPARが構造変化することで遺伝子への作用が可能になることをPPARの活性化という。
【0003】
PPARの中でもPPARδは、脂肪酸代謝の制御、インスリン感受性の増加、炎症性タンパクの発現の抑制あるいは表皮細胞分化などに関与していることが知られている。
すなわち、PPARδの活性化により、肥満抑制、内蔵脂肪蓄積予防、インスリン抵抗性の予防・改善、赤筋増加による持久力の向上、抗炎症作用、皮膚炎治療などの作用が期待できる。
【0004】
このようなPPARδの活性化剤としては、各種知られている。例えば、特許文献1には、甜菜、クマザサ、ショウガなど各種植物の乾燥粉末からの抽出物を有効成分として含むPPAR活性化剤が開示されている。
また、特許文献2には醤油粕からの抽出物を含むPPARδ活性剤が開示されている。
特許文献3には酒粕からの抽出物を含むPPARδ活性剤が開示されている。
【0005】
一方、従来から菌類の一種であるエノキダケ(Flammulina velutipes(Curt.:Fr.)Sing)には、肝機能の保護・改善成分、γ−アミノ酪酸、抗高血圧症成分などが含まれていることが下記特許文献4〜7に開示されている。エノキダケは安価で入手しやすく、且つ安全性の高い材料であるため、エノキダケから各種有効成分を抽出することで、安価で安全にこれらの有効成分が得られるという利点がある。
しかし、エノキダケにPPARδ活性化成分が含まれていることは知られていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2010−106001号公報
【特許文献2】特開2009−242382号公報
【特許文献3】特開2009−235068号公報
【特許文献4】特開2011−84537号公報
【特許文献5】特開2004−307453号公報
【特許文献6】特開2004−89128号公報
【特許文献7】特開2009−39082号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、上記のような点に鑑み、PPARδを活性化しうるPPARδ活性化剤を安価で安全な原料であるエノキタケから得ることを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、このような課題を解決すべく鋭意検討を行った結果、エノキタケの子実体を低温で馴化したものにPPARδ活性化作用があることを見出し、本発明を完成するに至った。
【0009】
すなわち、本発明の係るPPARδ活性化剤は、0℃以上10℃以下の温度において馴化されたエノキタケの子実体の抽出物を含有することを特徴とする。
【0010】
0℃以上10℃以下の温度で馴化されたエノキタケは子実体の抽出物は、PPARδに対する活性を示す。
尚、本発明における「馴化」とは、所定の温度、湿度環境下に試料を12時間以上静置することをいう。
【0011】
本発明において、前記抽出物が、前記馴化されたエノキタケの子実体を水に浸漬した後に、低極性有機溶媒で抽出されたものであることが好ましい。
【0012】
前記温度で馴化されたエノキタケをその後水に浸漬した後、該エノキタケから得られた抽出物は、PPARδ活性が向上する。
尚、本発明において浸漬工程で用いる水とは、0℃を超えて4℃の水をいい、純水に限らず、水道水などの上水、地下水などの天然水なども含み、且つ、pH調整剤などの各種添加物を含む水溶液をも含む。
また、浸漬とは、エノキタケの子実体を水中に存在させるようにすることをいう。
さらに、本発明において低極性溶媒とは、ヘキサン、ヘプタンなどの脂肪族炭化水素系溶媒や、ベンゼン、トルエンなどの芳香族炭化水素系溶媒や、シクロヘキサン、シクロヘプタンなどの脂環式炭化水素系溶媒をいう。
【0013】
また、本発明に係るPPARδ活性化剤の製造方法は、エノキタケの子実体を0℃以上10℃以下の温度で馴化する馴化工程と、前記馴化したエノキタケの子実体から低極性有機溶媒で抽出物を抽出する抽出工程とを実施することを特徴とする。
【0014】
本発明において、前記馴化工程の後に、エノキタケの子実体を0℃以上10℃以下の水に浸漬する浸漬工程を実施し、その後前記抽出工程を実施することが好ましい。
【0015】
本発明において、前記浸漬工程を10分以上120時間以下で行うことが好ましい。
【0016】
前記浸漬工程を前記時間の範囲で行った場合には、PPARδ活性がより向上する。
【0017】
本発明において、前記浸漬工程をpH4以上10以下で行うことが好ましい。
【0018】
前記浸漬工程を前記pHの範囲で行った場合には、PPARδ活性がより向上する。
【発明の効果】
【0019】
PPARδを活性化しうるPPARδ活性化剤を安価で安全性の高いエノキタケから得ることができる。
【図面の簡単な説明】
【0020】
【図1】実施例における子実体の酢酸エチル、ヘキサン抽出液、および菌糸体酢酸エチル抽出液のTLC法による分離プレートを示す図。
【図2】実施例における子実体の酢酸エチル、ヘキサン抽出液、および菌糸体酢酸エチル抽出液のTLC法による分離プレートを示す図。
【図3】実施例における子実体のヘキサン抽出液のTLC法による分離プレートを示す図。
【図4】実施例における子実体のヘキサン抽出液のAPCI−MSMSによる分析チャートを示す図。
【図5】実施例における子実体のヘキサン抽出液の遺伝子発現レベルを示すグラフ。
【図6】実施例における子実体のヘキサン抽出液の遺伝子発現レベルを示すグラフ。
【図7】実施例における子実体のヘキサン抽出液の遺伝子発現レベルの濃度による影響を示すグラフ。
【図8】実施例における子実体のヘキサン抽出液の遺伝子発現レベルの浸漬処理の時間による影響を示すグラフ。
【図9】実施例における子実体のヘキサン抽出液の遺伝子発現レベルの浸漬処理の浸漬水のpHによる影響を示すグラフ。
【図10】実施例における子実体のヘキサン抽出液の遺伝子発現レベルの浸漬処理の温度による影響を示すグラフ。
【発明を実施するための形態】
【0021】
本実施形態のPPARδ活性化剤は、0℃以上10℃以下の温度において馴化されたエノキタケの子実体の抽出物を含有するものである。
【0022】
本実施形態のPPARδ活性剤の材料としてはエノキタケ(Flammulina velutipes(Curt.:Fr.)Sing)の茎部分と傘部分とからなる子実体の部分が用いられる。
エノキタケは、天然のものあるいは人工栽培したものいずれであってもよく、その産地等も問わない。
【0023】
前記子実体は、0℃以上10℃以下の温度において馴化された後に、そのままの状態であるいは凍結乾燥など乾燥物として用いられる。
【0024】
馴化された前記子実体は、さらに、後述するような方法によって水に浸漬されたものであってもよい。
【0025】
本実施形態のPPARδ活性化剤は前記子実体から抽出された抽出物を含有する。
抽出物は、例えば、前記子実体を溶媒中に浸漬後、遠心分離、ろ過、デカンテーションなどの公知の適宜の方法で上清と沈殿物とに分離し、得られた上清のヘキサンなどの溶媒画分を分離することにより得られる。
【0026】
前記抽出物は、スフィンゴ脂質を含んでいると考えられる。スフィンゴ脂質はスフィンゴ骨格を有する脂質の総称である。
スフィンゴ脂質には、基本構造に糖がグリコシド結合されたスフィンゴ糖脂質と、リン酸基が結合されたスフィンゴリン脂質とがあるが、前記抽出物にはスフィンゴ糖脂質が含まれていると考えられる。
【0027】
前記抽出物は、そのままPPARδ活性化剤として用いてもよく、あるいは、公知の精製方法で精製を行ってもよい。
さらに、精製後、適切な溶剤で希釈した希釈液、濃縮した濃縮液、乾燥粉末等の粉状体、あるいはペースト状など種々の形状に形成してもよい。
【0028】
本実施形態のPPARδ活性化剤は、PPARの3タイプPPARα、PPARδ、PPRAβのうちのPPARδを活性化(遺伝子上のPPAR応答領域に結合して、種々の遺伝子発現を制御可能な状態)にして、PPARδに依存的な遺伝子の転写活性を亢進する作用を有する。
前記のとおりPPARδは、脂肪酸代謝の制御、インスリン感受性の増加、炎症性タンパクの発現の抑制あるいは表皮細胞分化などに関与していることから、本実施形態のPPARδ活性化剤により、肥満抑制、内蔵脂肪蓄積予防、インスリン抵抗性の予防・改善、赤筋増加による持久力の向上、抗炎症作用、皮膚炎治療などの作用が期待できる。
従って、本実施形態のPPARδ活性化剤は、機能性食品、病者用食品、特定保健用食品等のヒト若しくは動物用の食品、医薬品又は医薬部外品、化粧品など各種製品に応用しうる。
【0029】
次に、本実施形態のPPARδ活性剤の製造方法について説明する。
本実施形態のPPARδ活性剤の製造方法は、エノキタケの子実体を0℃以上10℃以下の温度で馴化する馴化工程と、前記馴化したエノキタケの子実体から低極性有機溶媒で抽出物を抽出する抽出工程とを実施する。
【0030】
(馴化工程)
前記のようなエノキタエケの子実体を0℃以上10℃以下、好ましくは、2℃以上7℃以下の温度で好気の条件下に、12時間から168時間、好ましくは15時間から30時間静置する馴化工程を実施する。
馴化されたエノキタケ子実体から抽出される抽出物はPPARδ活性を示すようになる。
【0031】
(凍結乾燥工程)
本実施形態においては、前記馴化工程を実施した後のエノキタケの子実体を凍結乾燥する工程を実施してもよい。
かかる凍結乾燥工程は、被処理物を氷点下で凍結させた後、真空または減圧下で凍結した水分を加熱、昇華させることで被処理物を乾燥させるいわゆるフリーズドライ方法で行うことができる。
凍結乾燥に用いる装置としては、公知の凍結乾燥装置を用いることができる。また、凍結乾燥条件としては、特に限定されるものではないが、例えば、−40℃〜−50℃の温度条件で24時間〜48時間程度で凍結乾燥を行うことが好ましい。
【0032】
(浸漬工程)
本実施形態のPPARδ活性剤の製造方法においては、前記馴化工程の後に、エノキタケ子実体を0℃以上10℃以下の水に浸漬する浸漬工程を実施してもよい。
【0033】
浸漬工程では、前記馴化工程で馴化されたエノキタケ子実体を水中に浸漬して、好ましくは、5分以上10日以内、好ましくは10分以上5日(120時間)以内、さらに好ましくは1日以上6日以内、静置する。
馴化されたエノキタケ子実体を水に浸漬することで前記抽出物のPPARδ活性がさらに向上する。
【0034】
本実施形態の浸漬工程において、水のpHをpH4以上10以下で、好ましくはpH4以上6以下に調整して、該pH調整水に前記エノキタケ子実体を浸漬することで、さらなるPPARδ活性の向上が認められる。
pH調整剤としては例えば塩酸等を用いることが好ましい。
【0035】
(抽出工程)
前記のような各工程を実施した後、エノキダケの子実体を低極性有機溶媒で処理して抽出物を抽出する抽出工程を実施する。
低極性有機溶媒としては、ヘキサン、クロロホルム等の中から任意の有機溶媒を用いることができるが、ヘキサンを用いることが食品利用の観点から好ましい。
【0036】
本実施形態の抽出工程では公知の抽出方法を採用することができるが、例えば、以下のような抽出方法で実施することができる。
まず、前記低極性有機溶媒としてのヘキサンの中に前記エノキタケの子実体の粉末を懸濁した懸濁液を所定時間、例えば、8時間から15時間程度静置した後に濾紙などで濾過した濾液を蒸発乾固する。さらに、ヘキサンで再懸濁して純水と混合してから遠心分離後、ヘキサン層を回収する。このヘキサン層をさらに純水と混合して遠心分離する処理を5回程度繰り返すことで回収したヘキサン相を蒸発乾固することで抽出物を得ることができる。
【実施例】
【0037】
以下に、実施例に基づいて本発明をより詳細に説明するが、本発明はこれらの実施例により何ら限定されるものではない。
【0038】
(抽出物の分析1)
エノキタケの子実体および菌糸体を4℃で24時間馴化させた後、凍結乾燥させた粉末をそれぞれ10gずつ試料とした。
前記各試料を、酢酸エチル500mlに懸濁した懸濁液を4℃で一晩(16時間)静置した。前記懸濁液を濾紙(No.1、ADVANTEC社製)で濾過し、該濾液を40℃でエバポレーターにかけて蒸発乾固させた。
乾固させた試料を酢酸エチル1mlで再懸濁し、0.2μmフィルター(材質PTFE、ADVANTEC社製)で濾過し、固体成分(子実体または菌糸体の粉末)を完全に除去した液体を得た。尚、以下、子実体から得られた抽出液を「子実体酢酸エチル抽出液」、菌糸体から得られた抽出液を「菌糸体酢酸エチル抽出液」という。
さらに、前記と同様に、エノキタケの子実体のみ、ヘキサンを用いて抽出した液を「子実体ヘキサン抽出液」として得た。
【0039】
前記子実体酢酸エチル抽出液、菌糸体酢酸エチル抽出液および子実体ヘキサン抽出液を以下のような条件で薄層クロマトグラフィー(TLC)を用いて分離した。
展開溶媒:クロロホルム:メタノール 9:1(体積比)
発色試薬:モリブデン酸アンモニウム−過塩素酸試薬(12質量%モリブデン酸アンモニウム水溶液A、1M塩酸B、60質量%過塩素酸Cを、質量比A:B:C=5:6:3で混合したもの。)
ヨウ素試薬(和光純薬社製)。
使用TLCプレート:Silica gel F254(メルク社製)
【0040】
前記各抽出液を分離したプレートに前記モリブデン酸アンモニウム試薬を噴霧して、105℃で10分間加熱した結果を図1に示す。
さらに同様に抽出液を分離したプレートを前記ヨウ素試薬を充満させた密閉容器中に入れて10分間放置した結果を図2に示す。
【0041】
図1および図2に示す1は子実体酢酸エチル抽出液、2は子実体ヘキサン抽出液、3は菌糸体酢酸エチル抽出液を示す。
図1に示すように、子実体酢酸エチル抽出1および子実体ヘキサン抽出液2は同じスポットRf値0.60に呈色を示したが、菌糸体酢酸エチル抽出液3では非常に薄くしか呈色を示さなかった。
モリブデン酸アンモニウム試薬は脂質の検出が可能であり、以上より、前記子実体からの抽出物中には脂質が含まれていることがわかった。
【0042】
また、図2に示すように、子実体酢酸エチル抽出1および子実体ヘキサン抽出液2は同じスポットRf値0.60に呈色を示したが、菌糸体酢酸エチル抽出液3ではほとんど呈色を示さなかった。
ヨウ素反応では不飽和化合物の検出が可能であり、以上より、前記子実体からの抽出物中には不飽和化合物が含まれていることがわかった。
すなわち、子実体からの抽出物には不飽和脂肪酸が含まれていることがわかった。
【0043】
(抽出物の分析2)
子実体からの抽出物をさらに詳細に分析するために以下のような分析を行った。
エノキタケの子実体を4℃で16時間馴化させた後凍結乾燥させた粉末1gを40mlの超純水(常温20℃)に懸濁して10分間浸漬させた懸濁液と、前記馴化させた後凍結乾燥させた粉末1gを40mlの超純水で10分間煮沸処理した懸濁液とをそれぞれ遠心分離(10000×g、4℃、15分)したものを試料とした。
前記各試料を用いて前記抽出物の分析1と同様にヘキサン抽出液を得た。
【0044】
前記各抽出液を以下のような条件で薄層クロマトグラフィー(TLC)を用いて分離した。
展開溶媒:クロロホルム:メタノール:酢酸 90:10:2(体積比)
発色試薬:Dittmer試薬(4%三酸化モリブデン・25N硫酸)
ニンヒドリン試薬(0.2%ニンヒドリン・無水エタノール溶液)
使用TLCプレート:Silica gel F254(メルク社製)
【0045】
前記各抽出液を分離したプレートに前記Dittmer試薬およびニンヒドリン試薬を噴霧し、120℃で数分間加熱したところ、常温水に浸漬後の子実体からの抽出物および熱水に浸漬後の子実体からの抽出物いずれも呈色しなかった。
前記ニンヒドリン試薬はアミノ酸の検出が可能であり、Dittmer試薬はリン酸の検出が可能である。
従って、子実体からの抽出物にはアミノ酸、リン酸は含まれていないことがわかった。
さらに、前記常温水に浸漬後の子実体からの抽出物および煮沸後の子実体からの抽出物を前記と同様に分離したプレートに前記Dittmer試薬を噴霧して、120℃で数分間
加熱した結果を図3に示す。
図3の1は常温水に浸漬後の子実体からの抽出物、2は熱水に浸漬後の子実体からの抽出物を示す。
図3からあきらかなように、熱水に浸漬後の子実体からの抽出物には、前記分析1で分析されたリン脂質は含まれていないことがわかる。
【0046】
(抽出物のAPCI−MSMSによる分析)
エノキタケの子実体を4℃で16時間馴化させた後凍結乾燥させた粉末1gを40mlの超純水(常温20℃)に懸濁して10分間浸漬させた懸濁液を、弱アルカリ処理(0.1MのNaOH溶液で、100℃、30分間処理)した後、前記分析1と同様の手法および条件でTLCを行い、TLCで分離されたRf0.60の画分を採取して得た試料を用いて、大気圧化学イオン化−質量分析計(APCI−MSMS)で以下の条件で分子量を測定した結果を図4に示す。
使用装置:Applied Biosystem API-3000
測定条件:移動相1%ギ酸超純水溶液と1%ギ酸アセトニトリル溶液を1:1に混合して1ml/mlの流速で、Positive(M+1)で分析した。
【0047】
図4に示すように試料中には分子量878.2の位置にピークを示した。
かかる位置にピークを示していることから、抽出物はスフィンゴ脂質の主構造であるスフィンゴ骨格を含むことがわかった。
【0048】
以上の各分析結果より、4℃で馴化したエノキタケの子実体から抽出される抽出物には不飽和脂肪酸を持ったスフィンゴ脂質構造を備える脂質および、リン酸、アミノ酸を含まないことが判った。
【0049】
(遺伝子発現レベル)
レポーター遺伝子アッセイによる遺伝子発現レベルを試験した。
レポーター遺伝子アッセイは、対象とする遺伝子の発現変化を転写レベルで分析する方法であり、目的遺伝子の転写調節領域の下流にレポーターとしてルシフェラーゼ遺伝子を組み込んだプラスミドを作成し、そのプラスミドを導入した細胞の酵素活性(生物化学発光)を測定する方法である。
【0050】
(1)馴化による遺伝子発現レベルへの影響
a)試料
エノキタケの子実体(馴化なし)を凍結乾燥させた粉末と、前記分析1で使用した馴化したエノキタケの子実体を凍結乾燥させた粉末とを各1gずつ、ヘキサン30mlに懸濁して、該懸濁液を4℃で一晩(16時間)静置した。該懸濁液を濾紙(No.1、ADVANTEC社製)で濾過した濾液をN2によって蒸発乾固させた。
この蒸発乾固試料をヘキサンで再度懸濁し等量の純水を加えて転倒混和し遠心分離(1000×g、4℃、5分)した。
ヘキサン層を回収した後、さらに超純水を加えて遠心分離(1000×g、4℃、5分)した。この操作を5回繰り返し、回収したヘキサン層をN2によって蒸発乾固させた。
【0051】
b)試薬等
使用細胞:ヒト培養細胞Hek 293(医薬基研究所製 代謝疾患タンパク検索プロジェクト)
培地:Dubeco's Modified Eagle's Medium(1000mg,グルコース、L−グルタミン酸、NaOCO3、pyridoxine HCL(SIGMA社製)、以下、DMEMという。)
PMプラスミド:pRL-TK(Int-) (Promega社;内部標準) 30ng、pTAL-5XGAL4(J Biol Chem. 2002 May 3;277(18):15629-37 に記載のもの) 150ng、pM-hPPARd 50ng、または、空VectorのPM(Clontech社)50ngを60ulのDMEMの無血清培地/1−wellになるように調整し、Lipofectamine2000を0.5ul/wellで導入したもの。
プロモーター:TKプロモーター
装置:ルミノメーター(TOYOBO社製)
【0052】
c)遺伝子導入
24穴細胞培養プレートに前記ヒト培養細胞を培養し、1.5mlエッペンドルフチューブに1ウエルにつきDMEM(−血清)100μl、SV40-rLuc100ng、GAL4-TAL150ng、比較する遺伝子を含まないプラスミドとしての前記PM50ng、Lipofrctamine(invitorogen))0.5μlとなるように混合した混合物を得た。
対象の受容体PPARδおよび、比較する受容体としてLXR(肝臓Xレセプター)、FXR(Farnesoid X受容体)、PPARα、PPARγの5種類の受容体に対応する遺伝子活性を測定するために、前記PMを、LXR、FXR、PPARδ、PPARα、PPARγに変えてそれぞれ同様の操作を行い6種類の遺伝子導入混合物を作製した。
前記培養細胞の培地を捨てて、新しいDMEM(−血清)で洗浄し、さらに250μlのDMEM(−血清)を追加した。
前記各遺伝子導入混合物1種類を50μlずつ4ウエルに分けた。CO2インキュベータ(37℃、5%CO2気流下)内で3時間培養後、培地をすててDMEM(+血清)を250μl添加し、さらにCO2インキュベータ(37℃、5%CO2気流下)内で24時間培養した。
【0053】
d)試料添加
前記各試料をジメチルスルホキシドに溶かして10mg/mlとした。
各試料およびブランクとしてのジメチルスルホキシド18μlをDMEM(+血清)6μlに混合した。これらを前記遺伝子導入された培養細胞が入った各ウエルに450μlずつ添加し、CO2インキュベータ(37℃、5%CO2気流下)内で一晩(16時間)培養した。
【0054】
e)光度測定
前記インキュベータから取り出した細胞をPBS(リン酸ナトリウム緩衝液)で洗浄して蒸留水で5倍希釈したLysisバッファー(Progma社製)を1ウエルに75μlずつ添加して、10分間振とうし、細胞を分離させた。
さらに、96穴プレートに分離させた細胞液を10μl、発光基質を添加したルシフェラーゼアッセイバッファー(Progma社製)50μl、Stop&Gloバッファー(Progma社製)45μlを加え、GLOMAX MULTI DETECTION SYSTEMのDual-Luciferase Reporter Assey systemのプロトコールに従い光度を測定した。
【0055】
f)遺伝子発現レベル
前記光度から各試料についてLXR/PM、FXR/PM、PPARδ/PM、PPARα/PM、PPARγ/PMを算出した値をブランクの値で割った値を遺伝子活性を示す相対活性として図5に示した。
【0056】
図5から、4℃で馴化したエノキタケの子実体からの抽出物は、PPARδの活性に特化していることがわかった。
【0057】
(2)浸漬処理による遺伝子発現レベルへの影響
試料として4℃で24時間馴化したエノキタケの子実体の凍結乾燥粉末と、前記と同様の馴化後凍結乾燥させた粉末を7日間常温の超純水(20℃)に浸漬させた懸濁液とを用いて、前記「(1)馴化による遺伝子発現レベルへの影響」と同様の手順で相対活性を試験した結果を図6に示す。
【0058】
図6から、浸漬処理を行ったエノキタケの子実体からの抽出物は、浸漬処理を行なわなかった子実体の抽出物に比してPPARδ活性が2倍以上向上していたことがわかった。
【0059】
(3)濃度による遺伝子発現レベルへの影響
前記「(2)浸漬処理による遺伝子発現レベルへの影響」で用いた各子実体で、濃度による相対活性の変化を試験した。
各子実体の抽出物は無希釈、3倍、10倍、30倍、100倍、300倍にDMSOで希釈して、図中の最終添加濃度となるように調製した。前記「(1)馴化による遺伝子発現レベルへの影響」と同様の手順で相対活性を試験した結果を図7に示す。
【0060】
図7からは、浸漬処理を行ったエノキタケの子実体抽出物では、希釈しないものでは、12.3、希釈倍率3倍のものでは2.87と、3倍希釈までPPARδ活性を示していた。
一方、浸漬処理を行っていないエノキタケからの抽出物では濃度による活性の変化が見られなかった。
【0061】
(4)浸漬時間による遺伝子発現レベルへの影響
4℃で16時間馴化されたエノキタケの子実体の凍結乾燥粉末1gをそれぞれ超純水40mlに懸濁した懸濁液を4℃で、0分(浸漬なし)、10分、30分、60分、1日、3日、5日、7日静置し、該懸濁液を遠心分離(10000×g、4℃、15分)した以外は前記「(1)馴化による遺伝子発現レベルへの影響」と同様の手順で相対活性を試験した結果を図8に示す。
図8から、10分以上浸漬を行ったものは浸漬処理を行わなかったものに比して活性は向上しており、5日間までであれば浸漬処理時間が長いほど活性は向上することがわかった。また、7日の浸漬処理であっても十分に高い相対活性を示していた。
【0062】
(5)pHによる遺伝子発現レベルへの影響
4℃で16時間馴化されたエノキタケの子実体の凍結乾燥粉末1gを、それぞれpH2、pH4、pH6、pH7、pH8、pH10(超純水にpH調整剤: 1M NaOHを添加して調整)の水溶液に懸濁した懸濁液を遠心分離(10000×g、4℃、15分)した以外は前記「(1)馴化による遺伝子発現レベルへの影響」と同様の手順で相対活性を試験した結果を図9に示す。
図9から、pH4からpH10の間ではpH2の場合よりも相対活性は向上することがわかった。
【0063】
(6)浸漬処理温度による遺伝子発現レベルへの影響
4℃で16時間馴化されたエノキタケの子実体の凍結乾燥粉末1gを、それぞれ常温水(20℃)40mlに懸濁し、一方はそのまま、他方は10分間煮沸した懸濁液をそれぞれ遠心分離(10000×g、4℃、15分)した以外は前記「(1)馴化による遺伝子発現レベルへの影響」と同様の手順で相対活性を試験した結果を図10に示す。
図10から、抽出物を煮沸した場合にはPPARδ活性を示さないことがわかった。
【特許請求の範囲】
【請求項1】
0℃以上10℃以下の温度において馴化されたエノキタケの子実体の抽出物を含有することを特徴とするPPARδ活性化剤。
【請求項2】
前記子実体が、前記馴化された後に水に浸漬されたものである請求項1に記載のPPARδ活性化剤。
【請求項3】
前記抽出物が、前記子実体から低極性有機溶媒で抽出された抽出物である請求項1または2に記載のPPARδ活性化剤。
【請求項4】
エノキタケの子実体を0℃以上10℃以下の温度で馴化する馴化工程と、
前記馴化したエノキタケの子実体から低極性有機溶媒で抽出物を抽出する抽出工程とを実施することを特徴とするPPARδ活性化剤の製造方法。
【請求項5】
前記馴化工程の後に、エノキタケの子実体を0℃以上10℃以下の水に浸漬する浸漬工程を実施し、その後前記抽出工程を実施する請求項4に記載のPPARδ活性化剤の製造方法。
【請求項6】
前記浸漬工程を10分間以上120時間以下で行う請求項4または5に記載のPPARδ活性化剤の製造方法。
【請求項7】
前記浸漬工程をpH4以上10以下で行う請求項4乃至6のいずれか一項に記載のPPARδ活性化剤の製造方法。
【請求項1】
0℃以上10℃以下の温度において馴化されたエノキタケの子実体の抽出物を含有することを特徴とするPPARδ活性化剤。
【請求項2】
前記子実体が、前記馴化された後に水に浸漬されたものである請求項1に記載のPPARδ活性化剤。
【請求項3】
前記抽出物が、前記子実体から低極性有機溶媒で抽出された抽出物である請求項1または2に記載のPPARδ活性化剤。
【請求項4】
エノキタケの子実体を0℃以上10℃以下の温度で馴化する馴化工程と、
前記馴化したエノキタケの子実体から低極性有機溶媒で抽出物を抽出する抽出工程とを実施することを特徴とするPPARδ活性化剤の製造方法。
【請求項5】
前記馴化工程の後に、エノキタケの子実体を0℃以上10℃以下の水に浸漬する浸漬工程を実施し、その後前記抽出工程を実施する請求項4に記載のPPARδ活性化剤の製造方法。
【請求項6】
前記浸漬工程を10分間以上120時間以下で行う請求項4または5に記載のPPARδ活性化剤の製造方法。
【請求項7】
前記浸漬工程をpH4以上10以下で行う請求項4乃至6のいずれか一項に記載のPPARδ活性化剤の製造方法。
【図4】


【図7】


【図8】


【図9】


【図10】


【図1】


【図2】


【図3】


【図5】


【図6】




【図7】


【図8】


【図9】


【図10】


【図1】


【図2】


【図3】


【図5】


【図6】


【公開番号】特開2013−103926(P2013−103926A)
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願番号】特願2011−250865(P2011−250865)
【出願日】平成23年11月16日(2011.11.16)
【出願人】(399030060)学校法人 関西大学 (208)
【出願人】(505314022)独立行政法人医薬基盤研究所 (17)
【出願人】(309035073)有限会社一栄 (2)
【Fターム(参考)】
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願日】平成23年11月16日(2011.11.16)
【出願人】(399030060)学校法人 関西大学 (208)
【出願人】(505314022)独立行政法人医薬基盤研究所 (17)
【出願人】(309035073)有限会社一栄 (2)
【Fターム(参考)】
[ Back to top ]

