PSMA抗体を用いる増殖性障害の治療
患者における癌の治療方法を提供する。幾つかの実施態様では、該方法は、PSMAの細胞外ドメインに結合することができる抗体を投与することを含む。幾つかの実施態様では、該方法は、患者による葉酸摂取を制限することを含む。癌のモニターリング方法も、癌の治療用キット及び癌治療のモニターリング用キットと同様に、提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、障害に関連した1つ以上の細胞種類が前立腺特異的膜抗原(PSMA)を発現する増殖性障害の治療に関する。
【背景技術】
【0002】
前立腺特異的膜抗原(PSMA)発現は、前立腺癌及び他の充実性腫瘍に高度に関連している;しかし、癌におけるPSMAの機能的役割は全く理解されていない。
【0003】
PSMAは、一部の正常な前立腺上皮細胞、正常な腎近位尿細管細胞、近位小腸細胞及び一部のアストロサイト(脳に存在)の細胞表面上に存在する。PSMAは前立腺癌(Pca)細胞上で高度にアップレギュレート/過発現する。PSMAの発現レベルは、前立腺癌の進行と共に上昇し、早期段階の前立腺癌におけるPSMAレベルは、再発の大きな可能性を予測する。さらに、実際に全ての充実性腫瘍はそれらの腫瘍の新脈管構造中でPSMAを発現するが、正常な血管内皮はPSMA陰性である。PSMA発現と前立腺癌との相互関係を超えて、そして非前立腺癌新血管構造においては、癌生物学におけるPSMAの機能的役割は実証されていない。さらに、PSMAは、幾分かは本能的に対抗するとしても、細胞運動性及び浸潤を低下させうることが報告されている。
【0004】
PSMAは、葉酸ヒドロラーゼ1(腸中に存在)及びNAALADアーゼ(脳中に存在)と同じであり、グルタミン酸カルボキシペプチダーゼ酵素活性を有する。PSMAは、例えばアスパラギン酸−グルタメートのようなジペプチドを、その構成成分である、個々のアミノ酸に加水分解する、これは、神経伝達のプロセスに及び恐らくは、種々な神経変性障害に関与すると考えられるプロセスである。その結果、研究者は、可能な神経治療薬として小分子阻害剤を開発中である。PSMAはさらに、葉酸ヒドロラーゼ活性を有し、ホリルポリグルタメートからグルタメート残基を切断してホリルモノグルタメートを生じることを可能にする。
【0005】
ホリルポリグルタメートは、食物中に見出される、葉酸(folate)の天然形であり、細胞膜又は腸上皮を横切ることができないが、ホリルモノグルタメートは細胞膜及び腸を横切って輸送されることができる。小分子PSMA酵素阻害剤はin vitroでPSMA発現Pca細胞の増殖速度を緩慢にすることができることが、最近判明している(Yao and Bacich, the Prostate 66:867 (2006))。しかし、これまでのPSMA酵素阻害剤の使用は、動物モデルにおいて腫瘍細胞増殖に如何なる有意義な効果も及ぼすことができていない。他の細胞傷害剤の不存在下での酵素による妨害の今までの試みは、動物モデルにおいて抗腫瘍効果を及ぼしていない。Nanus, D.M., Milowsky, M.I., Kostakoglu, L., Vallabahajosula, S., and Goldsmith, S.J.: Targeted systemic therapy of prostate cancer with a monoclonal antibody to prostate specific membrane antigen (PSMA). Seminars in Oncology, 2003; 30: 667-676).正常な生理的プロセスにとって全身葉酸代謝は重要である。しかし、PSMA/葉酸ヒドロラーゼの小分子阻害剤は、細胞内外の両スペース並びに腎尿細管の迅速な通過を包含する、非常に大きな分布容積を有し、腫瘍部位と正常組織の両方に対する阻害効果(inhibitory impact)を有し、それによって、正常体葉酸代謝を妨害する。
【0006】
前立腺癌は、米国人男性の最も一般的な癌死亡原因の一つである。2007年には、約219,000の新しいケースが診断されると予想され、この疾患による27,000件の死亡が予想される(NCI SEER data; Cancer Facts and Figures, American Cancer Society)。前立腺癌はひと度転移(前立腺を超えて拡散)したならば、前立腺癌の治療法は現在非常に限定されている。全身療法は、種々な形式のアンドロゲン(男性ホルモン)剥奪に限定されている。大抵の患者は初期の臨床的改善を示すであろうが、実際に不可避に、アンドロゲン非依存性細胞が発生する。したがって、内分泌療法は姑息的であり、治癒的ではない(Eisenberger M. A., et al. (1998) NEJM 339:1036-42)。アンドロゲン非依存性細胞が発生している、これらの患者の総生存期間中央値(median overall survival)は、ホルモン治療の開始から28〜52か月間であった(Eisenberger M. A., et al. (1998) supra.).。アンドロゲン非依存性の発生後には、タキサン系(即ち、ドセタキセル)化学療法のみが、19か月間の生存期間中央値の延命効果を与えることが判明している。いったん患者がドセタキセルに反応しなくなると、生存期間中央値は12か月間になる。
【0007】
前立腺癌が限局性であり、患者の余命が10年間以上である場合には、根治的前立腺摘出術が該疾患を根除するための最善のチャンスを与える。歴史的に見ると、この方法の欠点は、多くの癌が、検出される時点までに、該手術の範囲を超えて拡散していることである。しかし、前立腺特異的抗原試験の使用は、前立腺癌の早期検出を可能にしている。その結果、手術の範囲が狭ければ狭いほど、併発症は少なくなる。大きい高度腫瘍を有する患者は、根治的前立腺摘出術による治療で成功する可能性が低い。根治的前立腺摘出術の代替手段として、放射線療法も広く用いられている。放射線療法によって全身的に治療される患者は、高齢であって、健康でない患者及び高度な、臨床的に大きく進行した腫瘍を有する患者である。しかし、手術又は放射線療法後に、前立腺特異的抗原の検出可能な血清濃度が存在する場合には、癌遺残(persistent cancer)が指摘される。多くの場合に、放射線治療によって前立腺特異的抗原濃度が低下する可能性がある。しかし、この濃度は2年間以内に再び上昇する。
【0008】
局所的に進行した疾患を有する患者を治療するために、根治的前立腺摘出術又は放射線療法の前又は後にホルモン療法が用いられている。睾丸摘出術は血清テストステロン濃度を低下させるが、エストロゲン治療が同様に有利である。
【0009】
PSMAを認識するモノクローナル抗体が、細胞内ドメインに結合する7E11(Horoszewicz et al. (1987) Anticancer Res. 7:927-936, U.S. Pat. Nos. 5,162,504; 6,107,090; US 6,150,508; 及び 7,045,605)と、細胞外ドメインに結合する、他の抗PSMA抗体を含めて、開発されている。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】米国特許第5,162,504号明細書
【特許文献2】米国特許第6,107,090号明細書
【特許文献3】米国特許第6,150,508号明細書
【特許文献4】米国特許第7,045,605号明細書
【非特許文献】
【0011】
【非特許文献1】Yao及びBacich著、The Prostate 66:867 (2006)
【非特許文献2】Nanus, D.M.、Milowsky, M.I.、Kostakoglu, L.、Vallabahajosula, S.及びGoldsmith, S.J.著、「Targeted systemic therapy of prostate cancer with a monoclonal antibody to prostate specific membrane antigen (PSMA)」Seminars in Oncology, 2003;30:667-676
【非特許文献3】NCI SEER data;「Cancer Facts and Figures」、American Cancer Society
【非特許文献4】Eisenberger M. A.等著 (1998) NEJM 339:1036-42
【非特許文献5】Horoszewicz 等著 (1987) Anticancer Res. 7:927-936
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明では、患者における癌の治療方法を提供する。幾つかの実施態様では、該方法は、患者(例えば、癌と診断されている患者)に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害して、該患者の葉酸(folate)摂取を制限することができる。幾つかの実施態様では、患者による葉酸摂取(folate intake)は、葉酸含有栄養補助食品(folate containing dietary supplements)を禁止することによって制限される、或いは患者による葉酸摂取は1日につき400μg以下に、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベル(folate level)が300nmol/L以下になるように制限される、又はこれらの組み合わせによって制限される。幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントは標識されていない。
【0013】
他の実施態様では、患者における癌の治療方法は、患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害し、該患者における葉酸(folate)の血中レベルを測定することができる。
【0014】
幾つかの実施態様では、患者における癌の治療方法は、患者に第1抗体若しくはその抗原結合フラグメント(該第1抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害し、該患者による葉酸摂取を制限することができる)を投与すること、及び該患者に第2抗体若しくはその抗原結合フラグメント(該第2抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメイン(又は別の細胞外エピトープ)に結合することができる)を投与することを含む。幾つかの実施態様では、葉酸摂取は、葉酸摂取が1日につき400μg以下になるように、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように制限される。幾つかの実施態様では、第2抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインの異なるエピトープに結合することができ、この場合、第2抗体若しくはその抗原結合フラグメントは細胞傷害剤若しくはアイソトープ剤(cytotoxic or radioisotopic agent)にコンジュゲートする、又は二次免疫応答を誘出することができる。幾つかの実施態様では、葉酸摂取が制限された後2〜4週間目に、第2抗体の初回量(the first dose)を投与する。
【0015】
幾つかの実施態様では、患者における癌の治療方法は、該患者による葉酸摂取を制限すること及び該患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインに結合することができ、そして該抗体若しくはその抗原結合フラグメントの初回量は、該患者のPSMA発現細胞上のPSMA細胞表面レベルが5倍以上までに増加した後1〜5日目に投与する。幾つかの実施態様では、葉酸摂取が1日につき400μg以下になるように、又は患者における葉酸の血清レベルが10nm/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nm/L以下になるように、葉酸摂取を制限する。
【0016】
幾つかの実施態様では、患者における癌の治療方法は、該患者のPSMA発現細胞上のPSMA表面レベルを測定することを含む。幾つかの実施態様では、患者のPSMA発現細胞上のPSMA細胞表面レベルが5倍以上までに増加したときに、該抗体若しくはその抗原結合フラグメントの初回量を投与する。
【0017】
患者における前立腺癌の治療方法も提供する。幾つかの実施態様では、該方法は該患者に、該患者が微小転移性前立腺癌(時には、ステージD0又は前立腺特異的抗原のみ再発(prostate specific antigen-only relapse)又は生化学的再発と呼ばれる)と診断されている場合にホルモン療法を投与し、そしてPSMAの細胞外ドメインに結合することができる、抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはルテチウム177又は他の短距離α若しくはβ放射性同位体にコンジュゲートし、該抗体若しくはその抗原結合フラグメントの初回量は、ホルモン療法を開始した後1日〜3週間目に投与する。
【0018】
前立腺癌の治療方法の幾つかの実施態様では、該方法は、ホルモン療法を患者(例えば、前立腺癌と診断されている患者)に投与し、そして該患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインに結合することができ、該抗体若しくはその抗原結合フラグメントの初回量は、該患者の血清テストステロンレベルが50ng/ml以下に達した後1日〜4週間目に該患者に投与する。
【0019】
本明細書では、患者における癌治療のモニターリング方法を提供する。幾つかの実施態様では、該方法は、患者における葉酸の血中レベルを測定することを含み、この場合、患者による葉酸摂取は、葉酸摂取が1日につき400μg以下になるように、又は該患者における葉酸の血清レベルが10nmol/L以下になるように、又は該患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように制限されており、そして該患者は、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも1回量を受容している。
【0020】
患者における癌治療をモニターリングする幾つかの実施態様では、患者のPSMA発現細胞のPSMA活性を測定する、この場合、患者による葉酸摂取は、葉酸摂取が1日につき400μg以下になるように、又は該患者における葉酸の血清レベルが10nmol/L以下になるように、又は該患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように制限されており、そして該患者は、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも1回量を受容している。
【0021】
さらに、本明細書では癌の治療キットを提供する。幾つかの実施態様では、該キットは、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントと、患者による葉酸摂取を制限する及び/又は該患者における葉酸の血中レベルをモニターするための使用説明書を含む。
【0022】
さらに、本明細書では、患者における癌治療のモニターリング・キットを提供する。幾つかの実施態様では、該キットは、組織若しくは血液採集装置、PSMA活性検出試薬、及び該PSMA活性検出試薬を用いて該患者から得られた組織又は血液を検査するための使用説明書を含む。
【0023】
幾つかの実施態様では、該キットは、血液採取装置、葉酸検出試薬、及び該葉酸検出試薬を用いて該患者から得られた赤血球又は血清を検査するための使用説明書を含む。幾つかの実施態様では、該キットは、さらに、患者による葉酸摂取を減ずるための使用説明書を含む。
【0024】
本明細書で提供する方法及びキットの幾つかの実施態様では、PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメント、及び/又はPSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントは、標識されていない又は裸の抗体若しくはその抗原結合フラグメントである。他の実施態様では、該抗体若しくはその抗原結合フラグメントは、以下に述べるように、標識されている。
【0025】
さらに、本明細書では、患者における早期前立腺癌の治療キットも提供する。幾つかの実施態様では、該キットは、(i)PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメント(この場合には、該抗体若しくはその抗原結合フラグメントはルテチウム177にコンジュゲートする);及び(ii)ホルモン療法を開始した後1日〜4週間目に又は患者の血清テストステロン・レベルが50ng/ml以下に達した後1日〜4週間目のいずれかに該抗体若しくはその抗原結合フラグメントの初回量を投与するための使用説明書を含む。
【0026】
さらに、本明細書では、患者における癌の治療キットを提供する。幾つかの実施態様では、該キットは、(i)PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる、標識されていない抗体若しくはその抗原結合フラグメント;及び(ii)患者による葉酸摂取の制限と関連して、該標識されていない抗体若しくはその抗原結合フラグメントを投与するための使用説明書を含む。
【0027】
本明細書に記載する、種々な実施態様は相補的であることができ、本明細書に含まれる教えに関連して当業者に理解されるやり方で、組み合わせる又は共に用いることができる。
【図面の簡単な説明】
【0028】
【図1】図1は、標準RPMI培地中で増殖し、J591抗体で標識されたLNCaP細胞上のPSMA発現レベルのヒストグラムを示す(1=陰性対照、J591抗体なし;2=10%胎仔ウシ血清(FCS)を含有する標準RPMI培地中で増殖した細胞;3、4及び5=それぞれ、1、2及び3週間、活性炭処理した培地(charcoal stripped media)中で増殖した細胞)。
【図2】図2は、標準RPMI培地中で増殖し、J591抗体で標識されたMDA−PCa−2b細胞上のPSMA発現レベルのヒストグラムを示す(1=陰性対照、J591抗体なし;2=10%胎仔ウシ血清(FCS)を含有する標準RPMI培地中で増殖した細胞;3及び4=それぞれ、2及び3週間、活性炭処理した培地中で増殖した細胞)。
【図3】図3は、葉酸の濃度が上昇するにつれて、LNCaP細胞の上昇する増殖速度を示す。
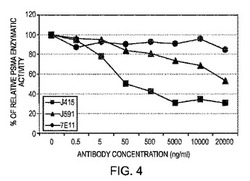
【図4】図4は、抗PSMA抗体J415、J591及び7E11の指示濃度の存在下でのLNCaP細胞の相対的PSMA酵素活性を示す。
【図5】図5は、培地中の葉酸濃度が生理的濃度(10nmol/L又は4.4ng/ml)方向に低下するにつれて、ヒト腎臓癌細胞系SK−RC−31においてPSMA発現レベルが上昇することを示す。
【図6】図6は、指示濃度の葉酸(folate)の存在下でのヒト腎臓癌細胞系SK−RC−42におけるPSMA発現レベルを示す。
【図7】図7は、培地中の葉酸濃度が生理的濃度(10nmol/L)方向に低下するにつれて、ヒト腎臓癌細胞系SK−RC−39においてPSMA発現レベルが上昇することを示す。
【図8】図8は、培地中の葉酸濃度が生理的濃度(10nmol/L)方向に低下するにつれて、ヒト腎臓癌細胞系SK−RC−06においてPSMA発現レベルが上昇することを示す。
【図9】図9は、培地中の葉酸濃度が生理的濃度(10nmol/L)方向に低下するにつれて、ヒト前立腺癌細胞系Cwr22rv1においてPSMA発現レベルが上昇することを示す。
【図10】図10は、培地中の葉酸濃度が生理的濃度(10nmol/L)方向に低下するにつれて、ヒト前立腺癌細胞系PC3においてPSMA発現レベルが上昇することを示す。
【図11】図11は、指示濃度の葉酸の存在下でのヒト前立腺癌細胞系LNCaPにおけるPSMA発現レベルを示す。
【図12】図12は、指示濃度のタキソテールの存在下の細胞培養培地における細胞数対葉酸濃度のグラフを示す。
【図13】図13は、3種類の異なる抗PSMA抗体、J591、7E11及びJ415で処理したマウスにおける腫瘍サイズ対時間のグラフを示す、この場合、A群とB群のマウスはさらにホリルポリグルタメート補充水も与えられていた。
【発明を実施するための形態】
【0029】
本明細書では、癌の治療方法及び癌の治療のモニターリング方法を提供する。さらに、癌の治療キット並びに患者における癌の治療のモニターリング・キットを提供する。本明細書に記載するように、幾つかの実施態様では、治療は、PSMAの細胞外ドメインに結合することができ、PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントを投与することを含む。本明細書で実証するように、このような抗体若しくはその抗原結合フラグメントの投与は、患者による葉酸摂取が制限されたときに、in vivoでのPSMA発現細胞の増殖を阻害する。意外にも、該抗体若しくはその抗原結合フラグメントは、非標識の又は裸の抗体若しくはその抗原結合フラグメントであることができる。
【0030】
抗体若しくはその抗原結合フラグメントは、それらの物理的サイズ、組成及び電荷(charge)のために、細胞外空間に限定され、血液脳関門を横切ることができず、糸球体濾過又は腎尿細管排出に支配されず、それによって、例えば腎臓の近位尿細管、近位小腸及び脳のような、重要な正常機能の部位におけるPSMA/葉酸ヒドロラーゼとの接触を防止する生体内分布を有すると考えられる。抗体若しくはその抗原結合フラグメントは、腫瘍又は腫瘍関連組織上に存在する場合には、これらは、PSMA/葉酸ヒドロラーゼが循環中の抗体若しくはその抗原結合フラグメントに暴露される唯一の部位であるので、PSMA/葉酸ヒドロラーゼとの結合にアクセスすると予想される。このことは、抗体若しくはその抗原結合フラグメントの作用に機能的特異性を与え、それによって、葉酸代謝は腫瘍部位では影響を受けるが、正常組織では影響されないことになる。その結果、正常な生理的プロセスのために重要である全身葉酸代謝は影響されないことになり、腫瘍葉酸代謝は特異的に阻害される可能性がある。
【0031】
しかし、本明細書に記載するように、低用量の小分子PSMA/葉酸ヒドロラーゼ阻害剤をPSMA/葉酸ヒドロラーゼの酵素活性を阻害する抗体若しくはその抗原結合フラグメントに加える又は組み合わせて、正常組織では正常な葉酸代謝を妨害しないように最少の阻害のみを生じながら、腫瘍部位では相加的な又は相乗的な阻害を達成することができる。
【0032】
さらに、本明細書で実証するように、葉酸量の減少は、PSMA発現細胞の表面上のPSMA量の増加を生じる。本明細書では、葉酸制限の結果としてのPSMA発現細胞の表面上のPSMA量の増加を利用する、癌の治療方法を提供する。その上、本明細書で実証するように、前立腺癌細胞からアンドロゲンを剥奪するために前立腺癌患者に投与されるホルモン療法も、PSMA発現細胞の表面上のPSMA量を増加させる。テストステロンの血清レベルが去勢レベル(≦50ng/ml)に達した後に、PSMA発現細胞の表面上のPSMA量は約9倍に増加する。本明細書では、ホルモン療法の結果としてのPSMA発現細胞の表面上のPSMA量の増加を利用する、癌の治療方法を提供する。PSMAに結合して、PSMA酵素活性を阻害することができる、抗体若しくはその抗原結合フラグメントによる治療は、例えば、前立腺癌及び腫瘍の血管内皮中にPSMA発現細胞を有する他の腫瘍のような癌を治療するための他の療法と組み合わせることができる。
【0033】
前立腺癌の治療方法、葉酸の制御(folate control)
本明細書では、患者における癌を治療するための方法及び組成物を提供する。癌の治療の幾つかの実施態様では、該方法は、患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインに結合して、PSMAの酵素活性を阻害し、そして患者による葉酸摂取を制限することができる。幾つかの実施態様では、患者による葉酸含有栄養補助食品の摂取を禁止する(制止する)。他の実施態様では、患者による葉酸摂取は1日につき400μg以下に、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように制限される。幾つかの実施態様では、患者による葉酸摂取は1日につき300、200、100、50、5μg以下に制限される。本明細書に記載する葉酸レベルは、化学発光イムノアッセイに基づくものであり、他の方法で測定する場合には、幾らか異なる可能性がある。当業者は、他の方法を用いて測定した葉酸レベルを本明細書に記載したレベルと比較することができるであろう。
【0034】
葉酸摂取の制限は、例えば葉酸のような膜透過型葉酸(membrane permeable forms of folate)(栄養ビタミン補助食品中に存在)の摂取の制限、又はある一定の食品中に自然に見出される膜不透過型葉酸(membrane impermeable forms of folate)(ホリルポリグルタメート)の摂取の制限、又はこれらの組み合わせを包含しうる。好ましくは、葉酸は、腫瘍内葉酸レベルが低下するように制限される。
【0035】
他の実施態様では、患者における癌の治療方法は、患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合して、該患者の血清葉酸レベルのモニターリングと共に、該PSMAの葉酸ヒドロラーゼ活性を阻害することができる。幾つかの実施態様では、患者による葉酸摂取は、該患者の血清葉酸レベルの測定に依存して、増減することができる。
【0036】
幾つかの実施態様では、患者における癌の治療方法は、患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントは、PSMAの細胞外フラグメントに結合して、該PSMAの酵素活性を阻害することができ、そして例えば、最適レベルの酵素阻害を維持するために、該抗体若しくはその抗原結合フラグメントの血清レベルを測定することができる。他の実施態様では、該方法は、上述したように、抗体若しくはその抗原結合フラグメントを投与し、例えば、最適レベルの酵素阻害を維持するために、該患者のPSMA発現細胞の残留PSMA活性を測定することを含む。幾つかの実施態様では、患者に投与される抗体若しくはその抗原結合フラグメントの量は、該患者のPSMA発現細胞のPSMA活性の測定に依存して、増減することができる。
【0037】
癌の治療方法、PSMAアップレギュレーション
低レベルの葉酸(reduced levels of folate)にPSMA発現細胞を暴露すると、PSMA発現細胞上のPSMA表面レベルが増加する。この増加は、幾つかの型の葉酸の低レベルへの暴露を開始した後約3〜4週間目に、又は事前の細胞内葉酸貯蓄が低いならば短い時間内にピークに達する。その結果、低レベルの葉酸への暴露が開始した後約3〜4週間目に、PSMAは10倍に増加した。それ故、低レベルの膜透過型葉酸への暴露の結果としてのPSMA発現細胞上のPSMAの表面レベルの増加を利用する、癌の治療方法を提供する。
【0038】
幾つかの実施態様では、癌の治療方法は、患者に第1抗体若しくはその抗原結合フラグメント(該第1抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害し、該患者による葉酸摂取を制限することができる)を投与すること、及び該患者に、PSMAの細胞外ドメインに結合することができる第2抗体若しくはその抗原結合フラグメントを投与することを含む。幾つかの実施態様では、患者による葉酸摂取は、葉酸摂取が1日につき400μg以下になるように、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように制限される。幾つかの実施態様では、第2抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインの異なるエピトープに結合することができる。幾つかの実施態様では、第2抗体若しくはその抗原結合フラグメントは細胞傷害剤及び/又はアイソトープ剤にコンジュゲートする、又は二次免疫応答を誘出することができる。幾つかの実施態様では、葉酸摂取が制限された後2〜4週間目に、第2抗体若しくはその抗原結合フラグメントの初回量を投与する。幾つかの実施態様では、葉酸摂取が制限された後約2、3若しくは4週間目に、第2抗体若しくはその抗原結合フラグメントの初回量を投与する。
【0039】
他の実施態様では、癌の治療方法は、患者による葉酸摂取を制限し、該患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインに結合することができ、そして該抗体若しくはその抗原結合フラグメントの初回量は、葉酸摂取が制限された後2〜4週間目に投与される。幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントの初回量は、葉酸摂取が制限された後約2、3若しくは4週間目にを投与する。幾つかの実施態様では、患者のPSMA発現細胞上のPSMA量を測定して、PSMA発現細胞の表面上のPSMAレベルが増加したかどうかを知ることができる。PSMA発現細胞の表面上のPSMAレベルが増加したことが分かった後に、抗体若しくはその抗原結合フラグメントの初回量を投与することができる。
【0040】
前立腺癌の増殖を刺激する抗原を除去するように設計したホルモン療法の結果として、PSMA発現細胞上のPSMA表面レベルは増加する。この増加は、テストステロン・レベルが減少した後及び/又は去勢レベル(約50ng/ml以下)に達した後に開始し、2〜3週間後にピークに達する。その結果、PSMA発現細胞の表面上のPSMA発現は、約9倍に増加する。それ故、ホルモン療法の結果としてPSMA発現細胞上のPSMA表面レベルの増加を利用する、前立腺癌の治療方法を提供する。さらに、葉酸制御(folate control)とホルモン療法との利点を組み合わせた、前立腺癌の治療方法を提供する。
【0041】
幾つかの実施態様では、前立腺癌の治療方法は、患者にホルモン療法を投与し、そして患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインに結合することができる。幾つかの実施態様では、患者の血清テストステロン・レベルが去勢レベル(50ng/ml以下)に達した後2〜3週間目に、抗体若しくはその抗原結合フラグメントの初回量を患者に投与する。
【0042】
抗PSMA抗体治療は、PSMA表面発現の増加のタイミングと一致するように時期を選ぶことができ、それによって、その効力がPSMA表面密度の関数である作用剤(agent)を疾患の進行中にできるだけ早期にデリバリーすることができる。例えば、抗体若しくはその抗原結合フラグメントが放射性同位体とコンジュゲートする場合には、腫瘍細胞に可能なかぎり最高量の放射線をデリバリーすることが望ましい。しかし、放射性同位体に基づく治療の固有の骨髄毒性のために、投与することができる線量数(the number of doses)は限定される。細胞毒素コンジュゲート抗体若しくはその抗原結合フラグメント(cytotoxin-conjugated antibody or antigen binding fragment thereof)のデリバリーも、細胞表面におけるPSMAの発現の増加と一致するような投与のタイミングから利益を得るであろう。しかし、このような治療を放射免疫療法よりも頻繁に投与することが可能であるので、細胞傷害性抗体療法はPSMAアップレギュレーションに依存することが幾らか低い。両方の場合に、腫瘍細胞中にデリバリーされる同位体と細胞毒素の量は細胞表面におけるPSMAの密度の直接の関数である、それ故、抗PSMA療法のタイミングをPSMA発現のアップレギュレーションによって調整することは有利である。
【0043】
さらに、本明細書に記載するように、ルテチウム177及び他の短距離α若しくはβ放射性同位体は、早期の非塊状前立腺癌患者の治療に用いる場合に、PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントのための放射性標識として、より効果的であるように思われる。本明細書に記載するように、早期の非塊状前立腺癌患者は典型的に、異常に高い血清前立腺特異的抗原(PSA)を有するが、画像診断(imaging study)での癌拡散の証拠を有さない(例えば、CT又はMRIスキャンで明らかになる高体積軟組織疾患)。異常に高いPSAは、先行の根治前立腺切除術後の0.1ng/mlより大きいPSA又は前立腺放射線療法後の0.5ng/mlより大きいPSA又は前立腺に対する先行治療が存在しない場合の4.0ng/mlより大きいPSAから成る。1つの実施態様では、早期前立腺癌は、上昇した及び/又は上昇中のPSAレベルを含み、直径0.9cmより大きい軟組織疾患の証拠を含まない。それ故、ホルモン療法に及び/又は、PSMAの葉酸ヒドロラーゼ活性の阻害の有無に拘わらず、食事による葉酸制限に反応したPSMAアップレギュレーション及び例えばルテチウム177のような短距離同位体に対する非塊状前立腺癌の感受性を利用する治療計画を提供する。
【0044】
幾つかの実施態様では、前立腺癌の治療方法は患者にホルモン療法を投与すること(この場合、該患者は早期非塊状前立腺癌と診断されている)、及びPSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントを投与すること(この場合、該抗体若しくはその抗原結合フラグメントはルテチウム177及び他の短距離同位体にコンジュゲートする)を含む。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントの初回量は、ホルモン療法を開始した後3〜4週間目に投与する。
【0045】
治療のモニターリング方法
本明細書では、患者における癌治療のモニターリング方法も提供する。幾つかの実施態様では、癌治療のモニターリング方法は、患者における葉酸の血中レベルを測定することを含み、この場合、該患者による葉酸摂取は制限されており、該患者は、PSMAの細胞外ドメインに結合して、PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも1回量を受容している。
【0046】
他の実施態様では、患者における癌治療のモニターリング方法は、患者のPSMA発現細胞のPSMA活性の測定を含み、この場合、該患者による葉酸摂取は制限されており、該患者は、PSMAの細胞外ドメインに結合して、PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも1回量を受容している。幾つかの実施態様では、葉酸摂取は、1日につき400μg以下であるように、又は患者における葉酸の血清レベルが10nm/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nm/L以下になるように制限される。
【0047】
キット
本明細書では、癌を治療するためのキットも提供する。幾つかの実施態様では、該キットは、PSMAの細胞外ドメインに結合して、PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメント及び患者による葉酸摂取を制限するための使用説明書を含む。幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントは細胞傷害剤(cytotoxic agent)にコンジュゲートして、抗体に依存する、細胞の細胞傷害反応を誘出することができる。
【0048】
本明細書では、患者における癌治療のモニターリング・キットも提供する。幾つかの実施態様では、該キットは、組織又は血液採取装置、PSMA活性検出試薬、及び該PSMA活性検出試薬を用いて患者から得た組織又は血液を検査するための使用説明書を含む。
【0049】
他の実施態様では、該キットは、血液採取装置;葉酸検出試薬;該葉酸検出試薬を用いて患者から得た赤血球又は血清を検査するための使用説明書を含む。幾つかの実施態様では、該キットはさらに、このキットを用いて検出された葉酸レベルに基づいて、患者による葉酸摂取を低減するための使用説明書を含む。
【0050】
適当なPSMA活性検出試薬は、例えば、PSMA基質及び/又は、PSMAに結合することができる、1つ以上の抗体若しくはその抗原結合フラグメントを包含する。幾つかの実施態様では、PSMA基質又は少なくとも1つの抗体若しくはその抗原結合フラグメントを固体表面に固定させる。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントを検出可能なラベルで標識する。付加的な抗体若しくはその抗原結合フラグメントが存在する場合には、このような付加的な抗体若しくはその抗原結合フラグメントを、第1抗体若しくはその抗原結合フラグメントのラベルとは識別可能である検出可能なラベルで標識することができる。適当な検出可能なラベルは、例えば、蛍光を発する部分、放射性同位体、又は酵素ラベル(例えば、ホースラディッシュ・ペルオキシダーゼ若しくはアルカリ・ホスファターゼ)を包含する。該キットは、PSMA活性を検査するための使用説明書を含むこともできる。
【0051】
幾つかの実施態様では、該キットはPSMA検出試薬と、該PSMA検出試薬を用いて患者から得た組織又は血液を検査するための使用説明書を含む。1つの実施態様では、患者からの組織、血液、血清又は血漿サンプルをPSMA酵素基質と、PSMAを該基質に作用させて、該サンプル中に存在するPSMA活性量に比例して検出可能な生成物を生成するのに適した条件下で、反応させる。
【0052】
投与及び治療計画
本明細書に記載する抗体若しくはその抗原結合フラグメントは患者(本明細書では、対象とも呼ぶ)に単回量若しくは複数回量として投与して、前立腺障害若しくは癌性障害を治療又は予防することができる。対象に投与される抗体若しくはその抗原結合フラグメントの投与量は、種々なパラメーターに従って、特に、用いる投与形式及び対象の状態に従って選択することができる。その他の要因は、望ましい治療期間及び、他の治療形式が該抗体若しくはその抗原結合フラグメントと共投与又は併用(used in conjunction with)されているかどうかを包含する。上述したように、患者における抗体若しくはその抗原結合フラグメント又はPSMA酵素活性のレベルをモニターすることができ、検出したレベルに従って、抗体若しくはその抗原結合フラグメントの投与量を調整することができる。
【0053】
一般に、抗体若しくはその抗原結合フラグメントの投与量は、約1mg〜約1000mgの範囲であることができる。幾つかの実施態様では、PSMA酵素活性の最大の阻害を達成するために充分な量で、抗体若しくはその抗原結合フラグメントを投与する。幾つかの実施態様では、対象における抗体の少なくとも約5μg/mlの血清濃度を得るために充分な量で、患者に該抗体若しくはその抗原結合フラグメントを投与する。幾つかの実施態様では、10、25、50、100又は200μg/mlの血清濃度を得るために充分な量で、該抗体若しくはその抗原結合フラグメントを投与する。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、例えば、(Fab’)2のような抗体の抗原結合フラグメントであり、対象において該抗原結合フラグメントの少なくとも約3.3ng/mlの血清濃度を得るために充分な量で患者に投与される。幾つかの実施態様では、6.6、10、20、40又は80ng/mlの血清濃度を得るために(Fab’)2を投与する。幾つかの実施態様では、所望の量の持続血清濃度を得るために充分な量で抗体若しくはその抗原結合フラグメントを投与する。該血清レベルが所望の期間維持されるように、該抗体若しくはその抗原結合フラグメントを投与することができる。所望の血清レベルは、血液、血清若しくは血漿のサンプル中で測定されうる抗体若しくはその抗原結合フラグメントの量に基づくことができる、又はPSMA活性の阻害レベルに基づくことができる。幾つかの実施態様では、患者のPSMA発現細胞のPSMA活性の50、60、70、80若しくは90%より大きい阻害を達成するために充分な量で、抗体若しくはその抗原結合フラグメントを投与する。抗体若しくはその抗原結合フラグメントの投与量は、例えば、抗体若しくはその抗原結合フラグメントの大きさ、及び抗体若しくはその抗原結合フラグメントとPSMAとの結合アフィニティに基づいて、当業者が調整することができる。血清中の抗体若しくはその抗原結合フラグメントの適当なレベルは、反復投与によって維持することができる。
【0054】
幾つかの実施態様では、抗体若しくはその抗原結合フラグメントの次の投与量を投与する前に、抗体若しくはその抗原結合フラグメントの血清トラフ及び/又はピーク・レベルを測定することができる。当該技術分野で知られた標準技術を用いて、血清トラフ及び/又はピーク・レベルを測定することができる。血清トラフ及び/又はピーク・レベルを用いて、個々の患者又は患者群に対する抗体若しくはその抗原結合フラグメントの所定投与量(prescribed dose)を調整することができる。
【0055】
多様な経路を用いて、抗体若しくはその抗原結合フラグメントを投与することができる。特定の投与形式(particular mode)の選択は、選択した特定の薬物、治療する病状(disease state)の重症度及び治療効果を挙げるために必要な投与量に依存するであろう。本発明の方法は、一般的に言うと、医学的に許容できる如何なる投与形式(これは、臨床的に許容されない副作用を惹起しないで活性化合物の有効レベルを生じる如何なる投与形式もを意味する)を用いても、実施することができる。このような投与形式には、経口、直腸、舌下、局所、鼻腔、経皮又は非経口経路が含まれる。「非経口」なる用語には、皮下、静脈内、筋肉内又は注入(infusion)が含まれる。
【0056】
該抗体若しくはその抗原結合フラグメントは単回投与、例えば連続ポンプによるような持続的投与、又は周期的な間隔を置いて投与することができる。周期的な間隔とは、週1回、2週1回又は1か月1回であることができる。適当な体液及び/若しくは細胞免疫応答を誘出するため又はPSMAの所望のレベルの酵素阻害を維持するために、投与を1か月、2か月、3か月又はそれ以上の期間にわたって行なうことができる。特定の組成物の複数回投与の所望の時間間隔は、不当な実験なしに、当業者が決定することができる。投与量、投与スケジュール、投与部位、投与形式などが前記のものとは異なる、抗体若しくはその抗原結合フラグメントの他の投与プロトコルは、当業者に知られているであろう。
【0057】
本明細書で提供する方法及びキットの幾つかの実施態様では、本明細書に述べる1つ以上の抗体若しくはその抗原結合フラグメントは、非誘導体化若しくは非コンジュゲート化形(本明細書では、「裸の」又は「非標識の」とも呼ぶ)で用いられる。
【0058】
本明細書で提供する方法及びキットの他の実施態様では、本明細書に述べる1つ以上の抗体若しくはその抗原結合フラグメントを作用剤にコンジュゲートさせる。PSMAは通常、細胞膜から細胞中にインターナライズされる。したがって、PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントは、PSMAによってインターナライズすることができ、それによって該抗体にコンジュゲートされる作用剤のデリバリーを可能にすることができる。該作用剤は、例えば、ラベリング剤(labeling agent)、細胞傷害剤、ナノ粒子又はウイルス粒子(例えば、細胞傷害剤、例えばアポトーシス促進因子をコードする遺伝子を含有するウイルス粒子)であることができる。
【0059】
幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントは別の分子的実体、典型的には、ラベル又は治療剤(例えば、細胞傷害剤又は細胞成長抑止剤)にコンジュゲート又は連結することができる。該抗体若しくはその抗原結合フラグメントは、例えば、化学的カップリング、遺伝的融合、非共有結合(non-covalent association)によって、又はさもなくば、1つ以上の他の分子的実体に、機能的に連結することができる。
【0060】
幾つかの実施態様では、ラベルは、例えば、蛍光ラベル、生物学的活性酵素ラベル、放射性同位体(例えば、放射性イオン)、核磁気共鳴活性ラベル、発光ラベル又は発色団である。幾つかの実施態様では、治療剤は、例えば、細胞傷害性部分、例えば、治療薬、放射性同位体、植物由来、真菌由来若しくは細菌起源の分子、又は生物学的タンパク質(例えば、タンパク質毒素)又は粒子(例えば、ナノ粒子若しくは、例えばウイルスコートタンパク質による、組み換えウイルス粒子)又はこれらの混合物である。該治療剤は、例えば、本明細書に記載するような、短距離高エネルギーα−エミッタを含めた短距離放射線エミッタのような、細胞内活性の薬物若しくは他の作用剤であることができる。適当な放射性同位体は、α−、β−若しくはγ−エミッタ、又はβ−及びγ−エミッタを包含する。治療剤として有用な放射性同位体は、イットリウム(90Y)、ルテチウム(177Lu)、アクチニウム(225Ac)、アスタチン(211At)、レニウム(186Re)、ビスマス(212Bi又は213Bi)、及びロジウム(188Rh)を包含する。例えば、診断法に用いるためのラベルとして有用な放射性同位体は、ヨウ素(131I、124I若しくは125I)、インジウム(111In)、テクネチウム(99mTc)、リン(32P)、炭素(14C)及びトリチウム(3H)又は上記した治療用同位体の1つを包含する。幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントを、植物起源若しくは細菌起源若しくは真菌起源の分子(又はその誘導体)、例えば、メイタンシノイド(例えば、メイタンシノール若しくはDM1メイタンシノイド)、タキサン又はカリチェアミシンにカップリングさせることができる。該抗体若しくはその抗原結合フラグメントはさらに、別の抗体に連結させて、二機能性若しくは多機能性抗体を形成することも可能である。
【0061】
幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントを、例えば、共有結合によって、プロテオソーム阻害剤又はトポイソメラーゼ阻害剤にカップリングさせる。[(1R)−3−メチル−1−[[(2S)−1−オキソ−3−フェニル−2−[(3−メルカプトアセチル)アミノ]プロピル]アミノ]ブチル]ブロン酸は、適当なプロテオソーム阻害剤である。N,N’−ビス[2−(9−メチルフェナジン−1−カルボキサミド)エチル]−1,2−エタンジアミンは、適当なトポイソメラーゼ阻害剤である。
【0062】
幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントを、PSMA活性の小分子若しくはペプチド阻害剤又はアプタマー阻害剤と組み合わせて用いる。PSMA活性の適当な小分子阻害剤は、一例として、キスカル酸(quisqualate)及び2−(ホスホノメチル)−ペンタン二酸(2−PMPA)を包含する。小分子PSMA阻害剤は該抗体若しくはその抗原結合フラグメントに連結させることも、又は該抗体若しくはその抗原結合フラグメントに連結させないことも可能である。PSMA活性の適当なペプチド阻害剤は、例えば、WQPDTAHHWATL(配列番号NO.1)とそのダイマー形若しくはマルチマー形を包含する。ペプチド阻害剤又はアプタマー阻害剤は、該抗体若しくはその抗原結合フラグメントに連結することも、又は連結しないことも可能である。本明細書で提供する方法は、PSMAの小分子阻害剤又はペプチド阻害剤又はアプタマー阻害剤の低投与量の使用を可能にして、それによって、例えば腎臓近位尿細管、小腸及び/又は脳のような、非腫瘍部位におけるこれらの作用剤の副作用を最小にする。
【0063】
幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントを、本明細書に記載するような治療剤に、リンカー(例えば、切断可能なリンカー若しくは切断不能なリンカー)を介して連結させる。切断可能なリンカーの使用は、コンジュゲートした抗体若しくはその抗原結合フラグメントがインターナライズしたときに、細胞内細胞質中への治療剤の放出を可能にする。切断不能なリンカーは、抗体若しくはその抗原結合フラグメントの消化時の放出を可能にするか、又は切断不能なリンカーを、該抗体からの放出を必要としない作用剤と併用することができる。
【0064】
他の治療法との組み合わせ
癌の治療方法の幾つかの実施態様では、PSMAの細胞外ドメインに結合して、酵素活性を抑制することができる抗体若しくはその抗原結合フラグメントを、他の治療法と組み合わせて用いることができる。幾つかの実施態様では、他の治療法は、対象に細胞傷害剤又は化学療法剤を投与することを含む。典型的な細胞傷害剤は、微小管阻害剤(antimicrotubule agent)、トポイソメラーゼ阻害剤、代謝拮抗物質、分裂抑制剤、アルキル化剤、挿入剤(intercalating agent)、シグナル伝達経路の妨害可能な作用剤、アポトーシスを促進する作用剤、葉酸代謝(folate metabolism)を妨害する作用剤及び放射線を包含する。幾つかの実施態様では、細胞傷害剤は、タキソール、タキソテール、サイトカラシンB、グラミシジンD、臭化エチジウム、エメチン、マイトマイシン、エトポシド、テノポシド、ビンクリスチン、ビンブラスチン、コルチシン、ドキソルビシン、ダウノルビシン、ジヒドロキシアントラシンジオン、メトトレキセート、ミトキサントロン、ミトラマイシン、アクチノマイシンD、1−デヒドロテストステロン、グルココルチコイド、プロカイン、テトラカイン、リドカイン、プロプラノロール、ピューロマイシン、メイタンシノイド、例えば、メイタンシノール(米国特許No.5,208,020参照)、CC−1065(米国特許Nos.5,475,092、5,585,499、5,846,545参照)及び/又はこれらの類似体若しくは同族体を包含する。葉酸代謝を妨害する、適当な作用剤(葉酸アンタゴニスト)は、例えば、メトトレキセート、アミノプテリン、トリメトレキセート、ロメトレキソール、ペメトレキセド、チミタク及び5−フルオロウラシルを包含する。化学療法剤はさらに、例えば、PSMA活性の阻害剤を包含する。
【0065】
幾つかの実施態様では、PSMAの細胞外ドメインに結合して、PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの投与を、細胞傷害剤の低投与量と組み合わせて、それによって、該細胞傷害剤の不快な副作用の可能性を低減することができる。幾つかの実施態様では、該細胞傷害剤は、癌の同様なステージ及び、例えば体重、身長、年齢及び治療歴のような、同様な身体的特徴を有する患者に通常投与されるであろう標準投与量の10%、20%、30%、40%、50%、60%、70%又は80%で投与される。同様に、葉酸摂取の制限は、治療法を組み合わせて用いる場合に、低い量の細胞傷害剤の投与を可能にする。
【0066】
PSMAの細胞外ドメインに結合して、その酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントを、活性に増殖する細胞に対してより大きく効果的である治療法と組み合わせて投与する。幾つかの実施態様では、患者による葉酸摂取の制限と、該抗体若しくはその抗原結合フラグメントの投与とのサイクルを、他の治療法の投与サイクルと交互形式で投与する。このやり方で、該他の治療法は細胞増殖を可能にする時間の範囲中に投与されるので、該他の治療法の効果は最大化される。
【0067】
他の実施態様では、PSMAの細胞外ドメインに結合して、その酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントを、外科及び/又は放射線手段と組み合わせて用いることができる。さらに他の実施態様では、PSMAの細胞外ドメインに結合して、葉酸ヒドロラーゼ活性(folate hydrolase activity)を阻害することができる抗体若しくはその抗原結合フラグメントを、免疫調節剤、例えば、IL−1、2、4、6若しくは12又はそれらのアンタゴニスト、又はインターフェロンα若しくはγ、又は細胞成長因子(例えば、GCSF及び/又はGM−CSF)と組み合わせて用いることができる。PSMAの細胞外ドメインに結合して、葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントはさらに、例えば、赤血球の産生を刺激する処置(エリスロポエチン(EPO))、骨形成若しくは構造を促進する処置(例えば、ビホスホネート(例えば、パミドロン酸二ナトリウム及び/又はゾレドロネート))及び他の副作用のための処置(例えば、アセトアミノフェン及び塩酸ジフェニルドラミン)の1つ以上を包含する癌治療の副作用を低減するために投与される、他の作用剤と組み合わせて投与することもできる。
【0068】
本明細書で提供する方法及び組成物を前立腺障害(例えば、前立腺癌)患者の治療に用いる場合には、PSMAの細胞外ドメインに結合して、葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントは、既存の治療モダリティ(existing therapeutic modalities)、例えば、前立腺摘除術(部分的又は根治的)、放射線療法、前立腺切除療法(例えば、ホルモン療法、凍結手術、レーザー切除、高密度焦点式超音波療法など)、及び上述したような細胞傷害性化学療法と組み合わせて用いることができる。典型的に、ホルモン療法は患者におけるアンドロゲンのレベルを低減するように作用し、この療法は、黄体形成ホルモン放出ホルモン(LHRH)類似体若しくはアゴニスト(例えば、Lupron(登録商標)、Zoladex(登録商標)、ロイプロリド、ブセレリン若しくはゴセレリン)並びにアンタゴニスト(例えば、アバレリクス)の投与を包含することができる。非ステロイド系抗アンドロゲン剤(例えば、フルタミド、ビカルタミド若しくはニルタミド)も、ステロイド系抗アンドロゲン剤(例えば、酢酸シプロテロン若しくは酢酸メガストロール)、エストロゲン(例えば、ジエチルスチルベストロール)、手術による去勢、二次的若しくは三次的ホルモン処置(secondary or tertiary hormonal manipulations)[例えば、コルチコステロイド(例えば、ヒドロコルチゾン、プレドニゾン若しくはデキサメタゾン)、ケトコナゾール、アビラテロン及び/又はアミノグルテチミドを包含する]、5a−レダクターゼ阻害剤(例えば、フィナステリド)、漢方薬、下垂体摘除、及び副腎摘除と同様に、ホルモン療法に用いることができる。その上、ホルモン療法は連続的、断続的に、又は上記処置のいずれかの組み合わせ(例えば、ロイプロリドとビカルタミドとの併用)を用いて実施することができる。
【0069】
幾つかの実施態様では、LHRHアンタゴニスト(例えば、アバレリクス)の投与後2週間以上経ってから、該抗体若しくはその抗原結合フラグメントの初回量を投与する。幾つかの実施態様では、LHRHアゴニストを抗アンドロゲン剤(例えばビカルタミド、フルタミド、ニルチミド)と共に投与した後2週間以上経ってから、該抗体若しくはその抗原結合フラグメントの初回量を投与する。
【0070】
PSMAの細胞外ドメインに結合して、葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントは、例えば、PSMA(例えば、PSMAの細胞外部分)又はPSMA以外の抗原(例えば、PSCA(前立腺幹細胞抗原)又は前立腺の6−膜貫通上皮抗原(six transmembrane epithelial antigen of prostate)(STEAP))に結合する、別の抗体若しくはその抗原結合フラグメントと組み合わせて用いることができる。これらの抗体若しくはその抗原結合フラグメントの一方又は両方は、上述したように、コンジュゲートすることも、コンジュゲートしないことも可能である。両方がコンジュゲートする場合には、これらは同じ又は異なる治療剤又はラベルとコンジュゲートすることができる。
【0071】
PSMAの細胞外ドメインに結合して、葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントは、他の治療法又は予防処置(例えば、抗癌ワクチン)と組み合わせて用いることができる。
【0072】
葉酸レベルの測定
癌の治療方法又は癌治療のモニターリング方法の幾つかの実施態様では、該方法は患者における葉酸レベルを測定することを含み、この場合、該患者は、PSMAの細胞外ドメインに結合して、PSMAの葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントによって治療されている。
【0073】
PSMAの酵素活性は、例えば、熱量分析、デンシトメトリー分析、スペクトログラフィ分析及びクロマトグラフィ分析、並びに映像法[例えば、磁気共鳴分光法(MRS)、磁気共鳴映像法(MRI)、単一光子放出型コンピュータ断層撮影法(SPECT)及び陽電子放出断層撮影法(PET)]を包含する、当該技術分野で知られた技術を、NAALADアーゼの検出可能な基質(本明細書ではPSMA基質とも呼ぶ)又は検出可能なPSMA結合分子と共に用いて、検出及び/又は測定することができる。
【0074】
患者における葉酸レベルの測定は、例えば、血清若しくは血漿葉酸レベル、赤血球葉酸又は両方を、例えば、化学発光イムノアッセイ、ラジオイムノアッセイ又はミクロ生物学的方法(microbiologic methods)のような 標準技術を用いて測定することを包含することができる。幾つかの実施態様では、血清葉酸レベルを、例えばWaxman and Schreiber, Blood, 42(2):281-290 (1972)によって記載されているように、測定する。葉酸の血清レベルは、患者の年齢及び使用方法に依存して、通常7〜40nmol/Lの範囲内である。体内への葉酸蓄積は、患者による低い葉酸摂取の3〜6か月間に消耗される可能性があり、葉酸摂取制限の可能な効果は、葉酸欠乏性貧血である。葉酸欠乏性貧血の診断は、低い血清葉酸レベル(<2ng/ml(<5nmol/L))又は低いRBC葉酸レベル(<100ng/ml(<227nmol/L))によって一部は確証される。それ故、幾つかの実施態様では、患者の血清若しくはRBCsを葉酸レベルに関してモニターすることができ、約5nmol/Lの血清葉酸レベルを維持するように葉酸摂取を調節することができる。他の実施態様では、1か月、2か月、3か月、4か月、5か月又は6か月間のような、ある一定の期間後に、葉酸制限を終了することができる。さらに他の実施態様では、摂取がある一定の期間制限され、その後ある一定の期間制限が解除され、これらの2つの期間が交互に繰り返されるように、葉酸制限を処方することができる。
【0075】
患者による葉酸摂取を変えることによって、患者における葉酸レベルを必要に応じて増減することができる。例えば、葉酸又は葉酸の他の膜透過形(other membrane permeable form of folate)の消耗されうる量を制限する食事を、患者に処方することができる。葉酸(folic acid)(プテログルタミン酸)は、例えば、栄養補助食品中、緑葉野菜、全粒粉、又は強化粉とレバーで作られた食品(food products made with fortified flour and liver)中に見出される。さらに、又は或いは、患者が静脈内輸液を受けている場合には、該流体を存在する葉酸量において制限することができる。さらに、又は代替的に、天然生成形の葉酸(naturally occuring forms of folate)に富んだ食品の量を制限する又は禁止する食事を、患者に処方することができる。例えば、ロメイン・レタス、ホウレン草、アスパラガス、カブ若葉、カラシ菜、子牛肝臓、パセリ、コラード葉、ブロッコリ、カリフラワー、砂糖大根及びレンティルのような食品が、豊富な葉酸供給源である。このような食品の消費を避けるように、又はこのような食品の制限された量のみを消費するように、患者に指示することができる。葉酸に富んだ食品のリストを患者に与えることができる。
【0076】
幾つかの実施態様では、患者の血清葉酸レベル又はRBC葉酸レベルが低く過ぎるレベルに、例えば、血清葉酸の場合には5nmol/L未満にまで低下することがありうる。それ故、幾つかの実施態様では、患者に葉酸(folate)を投与して、血清レベルを5nmol/Lに高めることができる。葉酸は任意の適当な手法によって、例えば、静脈内注入又は経口によって投与することができる。血清葉酸を5nmol/Lに高めるために充分であるが、血清葉酸を例えば10nmol/Lを超えては高めないような葉酸量(a dose of folic acid)を含有する、適当な栄養補助食品を患者に処方することができる。或いは、ポリグルタミルフォレート(フォリルポリグルタメート)に富んだ食品の規定量を消費する又は食べるように、患者に指示することができる。
【0077】
治療法のモニターリング、PSMAの測定
幾つかの実施態様では、PSMAの検出及び/又は測定方法は、PSMA酵素活性(本明細書ではPSMA活性とも呼ぶ)の測定及び/又は検出を含む。幾つかの実施態様では、PSMA活性の測定は、患者の組織若しくは体液のサンプル中のPSMA活性を分析することを含む。サンプル中の酵素活性レベルを検出するための任意の適当なアッセイを用いることができる。例えば、PSMAの検出可能な又は標識した基質の加水分解を用いることができる。PSMAの基質は、本明細書では、酵素基質とも呼ぶ。検査すべき組織若しくは体液のサンプルをPSMA基質と接触させて、代謝産物の適当な分離及び/又は検出方法を用いて検出することができる量の検出可能な又は標識した代謝産物を生じることができる。サンプルからの標識代謝産物の量を、既知量のPSMAを有する、少なくとも1つの基準若しくは対照と比較することができる。サンプル中のPSMA量の定量的又は定性的評価を可能にする、任意の適当な対照若しくは基準を用いることができる。例えば、陽性の対照若しくは基準は、前立腺癌細胞中又は新血管構造若しくはその他のPSMA発現腫瘍中の酵素活性なPSMAの量を表示する、組織若しくは体液からの標識代謝産物の量によって表すことができる。陰性の対照若しくは基準は、活性PSMAの不存在又は低レベルの活性PSMAの存在を表示する、組織若しくは体液からの標識代謝産物の量を表すことができる。サンプルによって生じる、検出可能な若しくは標識した代謝産物のレベルと基準若しくは対照との比較は、サンプル中の活性PSMAのレベルを表示する。PSMA活性は、PSMA活性の検出可能な代謝産物の定量的な値である。他の実施態様では、PSMA活性は、標準若しくは対照サンプルに比較した、PSMAの検出可能な代謝産物の定性的な値である。
【0078】
適当なPSMA基質は、N−アセチルアスパルチルグルタメート(NAAG)、フォレートポリグルタメート、メトトレキセートトリ−γグルタメート、メトトレキセートジ−γグルタメート、プテロイルペンタグルタメート及びこれらの誘導体を包含する。該基質は、例えば、放射性マーカー、化学発光性マーカー、酵素マーカー、発色体マーカー、又は他の検出可能なマーカーによって標識することができる。PSMA活性を検出するための適当な方法は、例えば、米国特許No.5,981,209の6欄60行〜7欄40行及び8欄63行〜9欄20行と、例えば、Clin.Cancer Res.2:1445-1451(1996); Urology 49:104-112(1997)に記載されており、これらの教示は本明細書に援用される。PSMA活性は、例えば、米国公開特許出願No.2006/0009525の段落[0281]-[0283]に記載されているような、当該技術分野における既知方法を用いて、in vitroにおいて測定することもできる。
【0079】
適当なサンプルは、PSMA又はPSMA発現細胞を含有すると予想される又は推測される、任意の体組織又は体液であることができる。幾つかの実施態様では、細胞膜からPSMAを可溶化する及び/又は放出するように、該サンプルを処理することができる。幾つかの実施態様では、PSMAをサンプル環境から浄化する又は少なくとも部分的に浄化するように、サンプルを処理することができる。好ましくは、いずれの酵素活性PSMAも酵素活性を維持し、いずれの酵素不活性PSMAも酵素不活性を維持するように、サンプルを任意に処理することができる。
【0080】
幾つかの実施態様では、適当なPSMA基質又は検出可能なPSMA結合分子を用いる、上述したような既知映像手法を用いて、PSMA量をin vivoで測定することができる。適当なPSMA結合分子は、例えば、PSMAに結合することができる抗体若しくはその抗原結合フラグメントであることができる。幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合することができる。適当なPSMA結合分子は、当該技術分野で知られた技術を用いて、検出可能なマーカーで標識することができる。有用な検出可能なマーカーは、非限定的に、酵素基質及びイメージング試薬(imaging reagents)を包含する。イメージング試薬の例は、放射性ラベル(例えば、131I、111In、123I、99Tc、32P、125I、3H及び14C);蛍光ラベル(例えば、フルオレセイン及びローダミン);並びに化学発光分子(例えば、ルシフェリン)を包含する。適当な酵素試薬は上述してある。
【0081】
幾つかの実施態様では、PSMAに抗体若しくはその抗原結合フラグメントが結合すると、該PSMAのダイマー形成能力は阻害される。それ故、PSMAダイマーの量を、例えば、PSMA結合分子を用いて検出する又は測定することによって、「PSMA活性」を間接的に測定することができる。適当なPSMA結合分子は、例えば、PSMAに結合することができる抗体若しくはその抗原結合フラグメントを包含する。該PSMA結合分子は、上述したような、検出可能なマーカーによって標識することができる。PSMAダイマーは、例えば、ダイマーPSMAとモノマーPSMAに結合することができるPSMA結合分子、又はダイマーPSMAに特異的に結合するが、モノマーPSMAには結合しないPSMA結合分子を用いて、検出する又は測定することができる。PSMA結合分子がダイマーPSMAに対して特異的である場合には、ダイマーPSMAの測定は、サンプル若しくはその部分を該結合分子と、該結合分子が存在するいずれのダイマーPSMAとも結合するために適した条件下で接触させ、結合したPSMA結合分子のレベルを測定することを含む。
【0082】
PSMA結合分子がモノマーPSMA又はダイマーPSMAに結合することができる場合には、PSMAダイマーの測定は、例えば、サンプル若しくはその部分を該結合分子と、該抗体若しくはその抗原結合フラグメントが存在するいずれのPSMA(モノマー又はダイマー)をも結合するために適した条件下で接触させ、結合した結合分子のレベルを測定することを含む。サンプル又はその部分を、モノマーPSMAと結合することができるが、ダイマーPSMAとは結合することができないPSMA結合分子と、該結合分子が存在するいずれのPSMAとも結合するために適した条件下で接触させ、結合した結合分子のレベルを測定することを含む。ダイマーPSMAとモノマーPSMAに結合することができる結合分子のレベルを、モノマーPSMAに結合することができる該結合分子のレベルと比較して、ダイマーPSMAのレベルを決定する。
【0083】
本明細書では、患者における癌治療法のモニターリング方法をも提供する。幾つかの実施態様では、該方法は、PSMAの細胞外ドメインに結合して、該PSMAの葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントによって治療されている患者からPSMA発現細胞を得て、該細胞のPSMA活性を測定することを含む。
【0084】
PSMA発現細胞は、PSMA発現細胞を含有すると思われる患者からの細胞の任意の適当なソースの一部として又は該ソースから得ることができる。例えば、該細胞ソースは、血管内皮細胞を含む充実性腫瘍からのバイオプシー材料であることができる。該細胞ソースは、原発性前立腺腫瘍から又は続発性部位由来の腫瘍からのバイオプシー材料であることができる。該細胞ソースは、循環する前立腺癌細胞を含むと思われる血液であることができる。該細胞は、標準手法を用いて患者から得ることができ、PSMAが存在するならば検出されうるように保存することができる。
【0085】
PSMA活性は、細胞上に存在するダイマーPSMAの量を測定することによって、間接的に測定することができる。PSMAはダイマー分子及びモノマー分子として存在する。PSMAのダイマー形は酵素活性を有するが、モノマー形は有さない。PSMAに結合することができる、検出可能に標識された抗体若しくはその抗原結合フラグメントを用いて、細胞上に存在するダイマーPSMAの量を測定することができる。例えば、該ダイマー形を特異的に認識する、検出可能に標識された抗体若しくはその抗原結合フラグメントを用いて、細胞上のPSMAを検出することができる。該細胞を、該検出可能に標識された抗体若しくはその抗原結合フラグメントに、該抗体若しくはその抗原結合フラグメントが、存在するいずれのダイマーPSMAにも結合するために適した条件下で接触させて、結合した抗体若しくはその抗原結合フラグメントのレベルを測定することができる。
【0086】
他の実施態様では、癌の治療方法及び癌の治療のモニターリング方法は、血清中の抗体若しくはその抗原結合フラグメントのレベルを測定することを含む。幾つかの実施態様では、抗PSMA抗体は、PSMAの細胞外ドメインに結合して、PSMA酵素活性を阻害することができる。抗体若しくはその抗原結合フラグメントの血清レベルは、固定化PSMAを用いる酵素免疫測定法(Enzyme Linked Immunosorbant Assay)(ELISA)のような、当該技術分野での標準手法を用いて、測定することができる。血清は当該技術分野での標準手法を用いて患者から得る。血清を望ましい倍率で希釈して、固体担体上に固定されているPSMAに、いずれの抗PSMA抗体若しくはその抗原結合フラグメントも該固定化PSMAに結合させるために適した条件下で暴露させることができる。結合しなかった抗体若しくはその抗原結合フラグメントを洗い流して、結合した抗体若しくはその抗原結合フラグメントを、抗PSMA抗体若しくはその抗原結合フラグメントと結合させることができる、検出可能に標識した抗体を用いて、検出することができる。他の実施態様では、PSMA発現細胞(例えば、LNCaP細胞)のPSMA活性を阻害する、患者から得た血清の能力を検査することによって、抗PSMA抗体若しくはその抗原結合フラグメントのレベルを測定することができる。
【0087】
上述したように、患者への抗体若しくはその抗原結合フラグメントの投与量は、PSMA活性の量又は検出された抗体若しくはその抗原結合フラグメントの血清レベルに基づいて調節することができる。
【0088】
本明細書では、患者における癌治療法のモニターリング方法に用いることができるキットも提供する。幾つかの実施態様では、該キットは、組織若しくは血液採取装置、PSMA検出試薬、及び該PSMA検出試薬を用いて患者から得た組織若しくは血液を検査するための使用説明書を含む。
【0089】
幾つかの実施態様では、該キットは、組織若しくは血液採取装置、PSMAに結合することができる、少なくとも1つの抗体若しくはその抗原結合フラグメント、及び該少なくとも1つの抗体若しくはその抗原結合フラグメントを用いて、患者から得た組織、血液若しくは血清を検査するための使用説明書を含む。1つの実施態様では、患者からの組織、血液若しくは血清サンプルを、表面結合PSMAを有する固相試薬と反応させる。該PSMAを血清中に存在するいずれの特異的抗体若しくはその抗原結合フラグメントとも結合させた後に、結合しなかった血清構成成分を洗浄によって除去する。抗体若しくはその抗原結合フラグメントに特異的に結合することができる、検出可能に標識された抗体を加えて、結合しなかった検出可能に標識された抗体を洗浄によって除去して、結合した標識抗体を検出する。該検出可能に標識された抗体若しくはその抗原結合フラグメントのラベルが酵素である場合には、該酵素のための基質を該固相と共に、該酵素を該基質に作用させて、固体担体上の結合した抗体若しくはその抗原結合フラグメント量に比例して検出可能な生成物を生成させるために適した条件下でインキュベートする。典型的には、該レポーターは、適当な蛍光基質、発光基質又は熱量的基質の存在下で該固相をインキュベートすることによって検出される酵素である。
【0090】
それに結合したPSMAを有する固体表面は、固体担体物質(例えば、ポリマービーズ、ディップスティック、96ウェルプレート又はフィルター材)にタンパク質物質を付着させるための既知手法によって作製することができる。これらの付着方法は、一般に、該担体への該タンパク質の非特異的吸着、又は該固体担体上の化学的反応基(例えば、活性化したカルボキシル、ヒドロキシル若しくはアルデヒド基)への、通常は遊離アミン基を介した、該タンパク質の共有結合付着(covalent attachment)を包含する。或いは、ストレプトアビジン塗付プレートをビオチン化抗原(biotinylated antigen(s))(単数又は複数)と共に用いることができる。
【0091】
癌の種類
本明細書で提供する癌治療方法は、それらの細胞表面上にPSMAを発現する、少なくとも数個の細胞を含む任意の癌の治療に用いることができる。ヒトでは、正常な良性肥厚性上皮細胞(例えば、良性前立腺分泌性腺房上皮)、癌性前立腺上皮細胞(例えば、前立腺上皮内腫瘍形成及び前立腺腺癌)、及びある一定の癌細胞に近接した血管内皮細胞の表面上に発現する。このような癌細胞は、(非限定的に)、例えば、腎臓癌細胞、尿路上皮(例えば、膀胱)癌細胞、睾丸癌細胞、結腸癌細胞、直腸癌細胞、肺癌細胞(例えば、非小細胞肺癌)、乳癌細胞、肝臓癌細胞、神経(例えば、神経内分泌細胞)癌細胞、グリア癌細胞(例えば、グリア芽細胞腫)、膵臓(例えば、膵管)癌細胞、黒色腫(例えば、悪性黒色腫)癌細胞又は軟組織肉腫癌細胞を包含する。
【0092】
治療又は予防することができる前立腺障害の例は、非限定的に、前立腺炎におけるような尿生殖器炎症(例えば、平滑筋細胞の炎症);良性肥大、例えば、小結節性過形成(良性前立腺肥大若しくは肥厚);及び前立腺癌(例えば、腺癌若しくは癌)及び/又は睾丸腫瘍(再発性前立腺癌を包含する)を包含する。「再発」若しくは「再発性」前立腺癌とは、1か月間の間隔をおいた2つの継続試験での、抗癌治療(例えば、前立腺摘除若しくは放射線)後の0.4ng/dlを超えるまでのPSAレベルの上昇を意味する。癌再発は、抗癌治療から短期間にわたって、例えば、治療後数か月に起りうる、又は抗癌治療後数年経って起りうる。例えば、前立腺癌患者では、再発は、抗癌治療後数年経って、例えば、治療後4、5、6、7、8、9、10、12、14、15年まで起りうる。再発は、「局所再発」又は「遠隔再発」として分類することができる。「局所再発」は、癌になった組織又は器官に隣接した又は近接した組織又は器官で再発する癌を意味する。例えば、前立腺癌を有する対象では、前立腺に一番近い組織、精嚢、骨盤内の周囲リンパ節、前立腺に一番近い筋肉、並びに直腸及び/又は骨盤壁において、局所再発が起りうる。「遠隔再発」は、癌になった組織又は器官から遠く離れた組織又は器官で再発する癌を意味する。例えば、前立腺癌を有する対象では、遠隔再発は、骨又は他の器官に蔓延した癌を包含する。
【0093】
「癌」なる用語は、あらゆる種類の癌性増殖若しくは発癌プロセス、転移組織、又は悪性に変化した細胞、組織若しくは器官を、癌細胞若しくは該癌細胞の隣接細胞(例えば、血管内皮細胞)がそれらの細胞表面上にPSMAを発現する場合には、組織病理学的種類又は侵襲性ステージに関係なく、包含する。
【0094】
非前立腺癌性障害の例は、非限定的に、充実性腫瘍、軟組織腫瘍及び転移病変を包含する。充実性腫瘍の例は、種々な器官系の悪性腫瘍(例えば、肉腫、腺癌及び癌)、例えば、肺、胸部(breast)、リンパ系、胃腸(例えば、結腸)及び尿生殖路(例えば、腎細胞、尿路上皮細胞)、咽頭をおかす悪性腫瘍を包含する。腺癌は、大抵の結腸癌、直腸癌、腎細胞癌、肝臓癌、肺の非小細胞癌、小腸の癌及び食道の癌のような悪性腫瘍を包含する。前記癌の転移病変も、本明細書で提供する方法及び組成物を用いて、治療することも、予防することもできる。
【0095】
本明細書で提供する方法及び組成物は、種々な器官系の悪性腫瘍、例えば、肺、胸部、リンパ系、胃腸(例えば、結腸)、膀胱、尿生殖路(例えば、前立腺)、咽頭をおかす悪性腫瘍の治療に、並びに大抵の結腸癌、腎細胞癌、前立腺癌及び/又は睾丸腫瘍、肺の非小細胞癌、小腸の癌及び食道の癌のような悪性腫瘍を包含する腺癌の治療に有用でありうる。
【0096】
適当な抗体
「抗体」なる用語は、少なくとも1つの、好ましくは2つの免疫グロブリン重(H)鎖可変領域(本明細書ではVHと略記)と、少なくとも1つの、好ましくは2つの免疫グロブリン軽(L)鎖可変領域(本明細書ではVLと略記)とを含み、特定の抗原に特異的に結合することができるタンパク質を包含する。本明細書で用いる限り、「特異的結合(specific binding)」とは、少なくとも1x107M−1のアフィニティで、抗原(例えば、PSMA)に結合する、抗体の性質を意味する。幾つかの実施態様では、特異的結合は、PSMA以外の抗原(例えば、BSA、カゼイン)に結合するそのアフィニティよりも少なくとも2倍、50倍、100倍、1000倍又はそれ以上のアフィニティで、PSMA(例えば、ヒトPSMAタンパク質)に結合する能力を意味する。
【0097】
VH領域及びVL領域はさらに、「フレームワーク領域」(FR)と呼ばれる、より大きく保存される領域が散在する、「相補性決定領域」(「CDR」)と呼ばれる超可変性領域に再分割される。フレームワーク領域とCDRsの範囲は、正確に定義されている(Kabat, E. A., et al. (1991) Sequences of proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, and Chothia, C. et al. (1987) J. Mol. Biol. 196:901-917参照)。幾つかの実施態様では、VHとVLの各々は、下記順序:FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4でアミノ末端からカルボキシ末端まで配置された、3つのCDと4つのFRから構成される。
【0098】
該抗体のVH鎖又はVL鎖はさらに、免疫グロブリン重鎖又は軽鎖定常領域の全て又は一部を含むことができる。1つの実施態様では、該抗体は、2つの免疫グロブリン重鎖と2つの免疫グロブリン軽鎖から成るテトラマーである。幾つかの実施態様では、重鎖と軽鎖が、例えばジスルフィド結合によって相互に連結する。幾つかの実施態様では、重鎖定常領域は、3つのドメイン、CH1、CH2及びCH3から構成される。幾つかの実施態様では、軽鎖定常領域は、1つのドメイン、CLから構成される。重鎖及び軽鎖の可変領域は、抗原と、例えば、PSMAの細胞外部分又はその一部と相互作用する結合ドメインを含有する。幾つかの実施態様では、抗体の定常領域は、免疫系の種々な細胞(例えば、エフェクター細胞)及び伝統的な補体系の第1構成要素(C1q)を含めた、宿主組織若しくは因子への該抗体の結合を仲介する。このようにして、該抗体は、抗体依存性の細胞の細胞傷害応答及び/又は補体仲介細胞傷害性を誘出することができる。「抗体」なる用語は、IgA型、IgG型、IgE型、IgD型、IgM型(並びにこれらの亜型)の完全な免疫グロブリンを包含し、この場合に免疫グロブリンの軽鎖はκ型又はλ型でありうる。
【0099】
「その抗原結合フラグメント」なる用語は、抗原(例えば、PSMA又はPSMAの細胞外部分)に特異的に結合する抗体のいずれの部分をも包含する。例えば、抗体の抗原結合フラグメントは、それにおける1つの以上の免疫グロブリン鎖が全長ではないが、抗原に特異的に結合することができる分子を包含する。「その抗原結合フラグメント」なる用語の範囲内に包含される結合フラグメントの例は、例えば、(i)Fabフラグメント、例えば、VL、VH、CL及びCH1ドメインから成る一価フラグメント;(ii)F(ab’)2フラグメント、ヒンジ領域におけるジスルフィド架橋によって連結した2つのFabフラグメントを含む二価フラグメント;(iii)VHドメインとCH1ドメインから成るFdフラグメント;(iv)抗体のシングル・アームのVLドメインとVHドメインから成るFvフラグメント;(v)VHドメインから成るdAbフラグメント(Ward et al., (1989) Nature 341:544-546);及び(vi)抗原に特異的に結合することができる、充分なフレームワークを有する単離相補性決定領域(CDR)、例えば、可変領域の抗原結合部分を包含する。軽鎖可変領域の抗原結合部分と重鎖可変領域の抗原結合部分、例えば、Fvフラグメントの2つのドメイン、VLとVHは、組み換え方法を用いて、これらが、VL領域とVH領域が一緒になって一価分子(一本鎖Fv(scFv)として知られる;例えば、Bird et al. (1988) Science 242:423-426; and Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883参照)を形成している単一タンパク質鎖として形成されるのを可能にする合成リンカーによって、接続させることができる。このような一本鎖抗体も「その抗原結合フラグメント」なる用語の範囲内に包含されるように意図される。これらの抗体フラグメントを、当業者に知られた慣用的な手法を用いて得て、該フラグメントを、完全な抗体の場合と同じ方法で結合能力に関してスクリーニングする。
【0100】
多くの種類の抗体若しくはその抗原結合フラグメントが、本明細書で提供する方法及び組成物に有用である。抗体は、IgG(例えば、IgG1、IgG2、IgG3、IgG4)、IgM、IgA1、IgA2、IgD又はIgEを含めた、種々なアイソタイプであることができる。好ましくは、抗体はIgGアイソタイプ、例えばIgG1である。抗体分子は全長(例えば、IgG1又はIgG4)であることも、抗原結合フラグメント(例えば、Fab、F(ab’)2、Fv又は一本鎖Fvフラグメント)のみを含むこともできる。これらは、モノクローナル抗体、組換え抗体、キメラ抗体、ヒト化抗体、脱免疫化抗体及びヒト抗体、並びに前記抗体の抗原結合フラグメントを包含する。好ましくは、モノクローナル抗体又はその抗原結合フラグメントはPSMAの細胞外ドメイン又はその部分(例えば、細胞の外部に位置するPSMAのエピトープ)に結合する。PSMAに結合して、PSMA酵素活性を阻害することができる、好ましいモノクローナル抗体の例は、非限定的に、J415(ATCC寄託番号HB−12101を有するハイブリドーマ細胞系によって産生される)を包含する。
【0101】
抗体若しくはその抗原結合フラグメントは、当該技術分野で知られた方法によってヒト化することができる。マウス抗体が得られたならば、該可変領域の配列決定することができる。CDRsとフレームワーク残部の位置は決定することができる( Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, and Chothia, C. et al. (1987) J. Mol. Biol. 196:901-917参照)。軽鎖及び重鎖の可変領域は、任意に、対応する定常領域にライゲートすることができる。
【0102】
抗体若しくはその抗原結合フラグメントは、さらに、特定のヒトT細胞エピトープを削除するように修飾することもできる(本明細書では、「脱免疫化」とも呼ぶ)。抗体を脱免疫化するために適した方法は、例えば、WO 98/52976及びWO 00/34317に開示されている。簡単には、抗体若しくはその抗原結合フラグメント(例えば、マウス抗体若しくはその抗原結合フラグメント)の重鎖及び軽鎖の可変領域を、MHC Class IIに結合するペプチドに関して分析することができる:これらのペプチドは、可能なT細胞エピトープ(WO 98/52976及びWO 00/34317において定義されているような)を表す。 可能なT細胞エピトープを検出するために、コンピュータ・モデリング・アプローチを適用することができ、さらに、ヒトMHC Class II結合ペプチドのデータベースをマウスVH及びVL配列中に存在するモチーフに関して検索することができる。これらのモチーフは、18主要MHC Class II DRアロタイプのいずれにも結合する、したがって、可能なT細胞エピトープを構成する。検出された、いずれの可能なT細胞エピトープも、可変領域中のアミノ酸残基の置換によって又は単一アミノ酸置換によって削除することができる。可能な保存的置換(conservative substitution)を頻繁ではあるが排他的ではなく行なう限り、ヒト生殖細胞系抗体配列中のこの位置に共通なアミノ酸を用いることができる。ヒト生殖細胞系配列は、Tomlinson, I. A. et al. (1992) J. Mol. Biol. 227:776-798; Cook, G. P. et al. (1995) Immunol. Today Vol. 16 (5): 237-242; Chothia, D. et al. (1992) J. Mol. Bio. 227:799-817に開示されている。V BASEディレクトリー はヒト免疫グロブリン可変領域配列の包括的ディレクトリーを直接提供する (Tomlinson, I. A. et al. MRC Centre for Protein Engineering, Cambridge, UKによってコンパイルされたもの)。脱免疫化VH及びVL配列を構築した後に、該突然変異誘発した可変領域を、任意に、ヒト定常領域に融合することができる。
【0103】
他の実施態様では、抗体若しくはその抗原結合フラグメントは、ATCC寄託番号HB−12126を有する細胞系によって産生されたJ591抗体又はATCC寄託番号PTA−3709を有する細胞系によって産生された脱免疫化J591(脱J591)抗体からの軽鎖若しくは重鎖可変領域からの少なくとも1つ、2つ、好ましくは3つのCDRを有することができる。
【0104】
他の実施態様では、抗体若しくはその抗原結合フラグメントは、ATCC寄託番号HB−12109を有する細胞系によって産生された抗体J415又はATCC寄託番号PTA−4174を有する細胞系によって産生された脱免疫化J415の軽鎖若しくは重鎖可変領域からの少なくとも1つ、2つ、好ましくは3つのCDRを有することができる。
【0105】
さらに他の実施態様では、抗体若しくはその抗原結合フラグメントは、ATCC寄託番号HB−12127を有する細胞系によって産生された抗体J533又はATCC寄託番号HB−12101を有する細胞系によって産生された抗体E99の軽鎖若しくは重鎖可変領域からの少なくとも1つ、2つ、好ましくは3つのCDRを有することができる。
【0106】
幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、本明細書に記載する抗体、例えば、J591(ATCCに寄託されたハイブリドーマHB−12126によって産生)、E99(ATCCに寄託されたハイブリドーマHB−12101によって産生)、J415(ATCCに寄託されたハイブリドーマHB−12107によって産生)及びJ533(ATCCに寄託されたハイブリドーマHB−12127によって産生)のエピトープの全体又は一部に結合する。抗体若しくはその抗原結合フラグメントは、本明細書に記載する抗体、例えば、J591、E99、J415及びJ533のヒトPSMAへの結合を阻害する、例えば、競合的に阻害することができる。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、J415によって認識されるエピトープに結合する。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、J591によって認識されるエピトープに結合する。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、E99のエピトープに結合する。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、J533によって認識されるエピトープに結合する。
【0107】
2つの抗体若しくはその抗原結合フラグメントが同じ若しくは重複エピトープに特異的に結合することができるかどうかは、Scatchard分析及び/又は競合結合アッセイによって判定することができる。抗体若しくはその抗原結合フラグメントの「特異的結合」とは、該抗体が抗原又は好ましいエピトープに対して充分なアフィニティを示し、好ましくは、有意な交差反応性(crossreactivity)を示さないことを意味する。「特異的結合」とは、少なくとも107、108、109又は1010M−1のアフィニティで結合する抗体を包含する。有意な交差反応性を示さない抗体若しくはその抗原結合フラグメントは、抗体特異性の測定に適した条件下で、好ましくない実体(例えば、好ましくないタンパク質性実体)に感知されうるほどには結合しない抗体若しくはその抗原結合フラグメントである。例えば、PSMAに特異的に結合する抗体若しくはその抗原結合フラグメントは、PSMAとは感知されうるほどに結合するが、非PSMAタンパク質若しくはペプチドとは有意に反応しない。好ましいエピトープに特異的な抗体若しくはその抗原結合フラグメントは、例えば、同じタンパク質若しくはペプチド上の遠隔エピトープ(remote epitopes)とは有意に交差反応しないか、又は該遠隔エピトープへの結合を競合的に阻害するであろう。同じエピトープを認識する抗体若しくはその抗原結合フラグメントは、1つの抗体の、標的抗原への別の抗体の結合をブロックする能力を示す、簡単なイムノアッセイ(例えば、競合結合アッセイ)で同定することができる。競合結合は、試験を受ける抗体が共通抗原(例えば、PSMA)への基準抗体の特異的結合を阻害するアッセイで測定される。非常に多くの種類の競合結合アッセイが知られている、例えば:固相直接若しくは間接ラジオイムノアッセイ(RIA)、固相直接若しくは間接エンザイム・イムノアッセイ(EIA)、サンドイッチ競合アッセイ( Stahli et al., Methods in Enzymology 9:242 (1983)参照、 さらに Kim, et al., Infect. Immun. 57:944 (1989)も参照);固相直接ビオチン−アビジンEIA( Kirkland et al., J. Immunol. 137:3614 (1986)参照);固相直接標識アッセイ、固相直接標識サンドイッチ・アッセイ (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Press (1988) pp 567-569 and 583参照);I−125ラベルを用いた固相直接ラベルRIA (Morel et al., Mol. Immunol. 25(1):7 (1988)参照);固相直接ビオチン−アビジンEIA(Cheung et al., Virology 176:546 (1990)参照);直接標識RIA(Moldenhauer et al., Scand. J. Immunol. 32:77 (1990);及び (Belanger L., Sylvestre C. and Dufour D. (1973)。このようなアッセイは、典型的に、これらの非標識試験免疫グロブリンと標識基準免疫グロブリンのいずれかを有する、固体表面又は細胞に結合した精製抗原の使用を必要とする。試験抗体の存在下で該固体表面又は細胞に結合したラベルの量を測定することによって、競合阻害が評価される。
【0108】
本明細書で提供する方法及びキットの幾つかの実施態様では、PSMAへの抗体若しくはその抗原結合フラグメントの結合は、PSMAの酵素活性を阻害する。NAALADアーゼ及びヒト・グルタミン酸カルボキシペプチダーゼII(「GCP II」)としても知られるPSMAは、ニューロペプチドN−アセチル−アスパルチル−グルタメート(「NAAG」)のN−アセチル−アスパルテート(「NAA」)とグルタメートへの加水分解に触媒作用を及ぼす酵素活性を有する。PSMA酵素活性(本明細書では、葉酸ヒドロラーゼ活性とも呼ばれる)は、以下に述べるように、検出する又は測定することができる。本明細書で用いる限り、「酵素活性を阻害する」とは、葉酸ヒドロラーゼ活性の部分的阻害を包含する。
【0109】
本明細書では、PSMA酵素活性を阻害するモノクローナル抗体を選択する又は製造する方法も提供する。モノクローナル抗体を選択する又は製造する方法の幾つかの実施態様では、該方法は、PSMAによって免疫化されている動物から得た抗体産生細胞を用いてハイブリドーマ細胞を作製する工程、PSMA酵素活性を阻害することができる抗体をハイブリドーマ細胞が産生するかどうかを判定する工程、それによってPSMA酵素活性を阻害するモノクローナル抗体を選択する工程を含む。モノクローナル抗体を選択する又は製造する他の実施態様では、細胞外PSMAに結合することができる抗体を産生するハイブリドーマ細胞を作製し、該ハイブリドーマ細胞が産生する抗体を、in vitroにおいてPSMA基質のPSMA依存性加水分解を阻害する能力に関して試験する。モノクローナル抗体は、体細胞ハイブリダイゼーション法(Kohler and Milstein, Nature 256: 495 (1975))を含めた、多様な手法によって製造することができる。一般的には、Harlow, E. and Lane, D. (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.を参照のこと。
【0110】
抗体を製造するための有用なイムノゲンは、PSMA(例えば、ヒトPSMA)負荷細胞(PSMA-bearing cell)(例えば、前立腺腫瘍細胞系、例えば、LNCaP細胞、又はMDA−Pca2b若しくはLAPC4細胞、又は新鮮な若しくは凍結前立腺腫瘍細胞);PSMA発現細胞(例えば、前立腺腫瘍細胞系、例えば、LNCaP細胞、又は新鮮な若しくは凍結前立腺腫瘍細胞;PSMA発現血管内皮細胞)の膜画分(membrane fraction);単離若しくは精製PSMA、例えば、ヒトPSMAタンパク質(例えば、生化学的に単離したPSMA若しくはその一部、例えば、PSMAの細胞外ドメイン)を包含する。PSMAに対する抗体を作製する方法は、米国特許No.6,107,090、米国特許No.6,136,311に記載されている、これらの特許の全ての内容は明確に本明細書に援用される。
【0111】
PSMA酵素活性を阻害することができる抗体は、製造した任意の抗体を、直接、酵素活性に関して、例えば、上述したようなPSMA酵素基質を用いて、最初にスクリーニングすることによって製造することができる。
【0112】
別の実施態様では、抗体をPSMAへの結合能力に関して最初にスクリーニングする。PSMAに特異的に結合することができる抗体は、PSMA酵素活性に関して検査することができる。
【0113】
ヒトタンパク質に対するヒトモノクローナル抗体(mAbs)は、マウス免疫グロブリン遺伝子ではなくヒト免疫グロブリン遺伝子を有するトランスジェニック・マウスを用いて作製することができる。所定の抗原(antigen of interest)によって免疫化した、これらのトランスジェニック・マウスからの脾細胞を用いて、ヒトタンパク質からのエピトープに対して特異的アフィニティを有するヒトmAbsを分泌するハイブリドーマを製造する(例えば、Wood et al. International Application WO 91/00906, Kucherlapati et al. PCT publication WO 91/10741; Lonberg et al. International Application WO 92/03918; Kay et al. International Application 92/03917; Lonberg, N. et al. 1994 Nature 368:856-859; Green, L. L. et al. 1994 Nature Genet. 7:13-21; Morrison, S. L. et al. 1994 Proc. Natl. Acad. Sci. USA 81:6851-6855; Bruggeman et al. 1993 Year Immunol. 7:33-40; Tuaillon et al. 1993 PNAS 90:3720-3724; Bruggeman et al. 1991 Eur J Immunol 21:1323-1326参照)。
【0114】
本発明に有用な抗体若しくはその抗原結合フラグメントは、所望の抗体の免疫グロブリン軽鎖及び重鎖をコードするDNAによって形質転換した宿主細胞が産生した組換え抗体であることもできる。組換え抗体は、既知の遺伝子工学手法によって製造することができる。例えば、ヌクレオチド配列、例えば、所望の抗体の免疫グロブリン軽鎖及び重鎖をコードするcDNA若しくはゲノムDNAをクローニングすることによって、組換え抗体を製造することができる。次に、これらのポリペプチドをコードするヌクレオチド配列を発現ベクター中に挿入して、両方の遺伝子がそれらの独自の転写及び翻訳発現制御配列に作用的に連結するようにする。用いる発現宿主細胞と適合するように、発現ベクターと発現制御配列を選択する。典型的に、両方の遺伝子を同一発現ベクターに挿入する。原核生物又は真核生物の宿主細胞が使用可能である。
【0115】
真核生物細胞は、適当に折り畳まれた免疫活性な抗体(properly folded and immunologically active antibody)をアセンブルして、分泌するために原核生物細胞よりも有望であるので、真核生物宿主細胞における発現が好ましい。しかし、産生された抗体が、不適当な折り畳み(folding)のために不活性であっても、周知の方法によって再生可能でありうる(Kim and Baldwin, "Specific Intermediates in the Folding Reactions of Small Proteins and the Mechanism of Protein Folding", Ann. Rev. Biochem. 51, pp. 459-89 (1982))。該宿主細胞が、完全な抗体の一部、例えば、軽鎖ダイマー又は重鎖ダイマーを産生する可能性があり、これらも抗体若しくはその抗原結合フラグメントに包含される。
【0116】
上記手段の幾つかの変形(variations)が、本明細書で提供する方法及び組成物のために有用であることは理解されよう。例えば、抗体の軽鎖又は重鎖のいずれか(但し、両方ではなく)をコードするDNAによって宿主細胞を形質転換することが望ましい可能性がある。PSMA結合のために必要ではない、軽鎖及び重鎖のいずれか又は両方をコードするDNAの一部又は全てを除去するために組換えDNAテクノロジーを利用することもできる、例えば、特定のアミノ酸を欠失させることによって、定常領域を修飾することができる。このような切断型DNA分子から発現された分子は、本明細書に記載する方法及び組成物のために有用である。さらに、1つの重鎖と1つの軽鎖が抗PSMA抗体であり、他方の重鎖及び軽鎖がPSMA以外の抗原又はPSMAの別のエピトープに特異的である二官能性抗体を製造することができる。
【0117】
当該技術分野で知られた組換えDNA手法によって、キメラ抗体を製造することができる。例えば、マウス(又は他の種)モノクローナル抗体分子のFc定常領域をコードする遺伝子を制限酵素によって消化させて、マウスFcをコードする領域を取り出して、ヒトFc定常領域をコードする遺伝子の同等部分を置換する。
【0118】
抗体又は免疫グロブリン鎖を当該技術分野で知られた方法によってヒト化することができる。マウス抗体がひと度得られたならば、可変領域を配列決定することができる。CDRsとフレームワーク残基の位置を知ることができる。場合によっては、軽鎖及び重鎖の可変領域を対応する定常領域にライゲートすることができる。
【0119】
ヒト化された又はCDR移植された抗体分子又は免疫グロブリンをCDR移植又はCDR置換によって製造することができ、この場合には、免疫グロブリン鎖のCDRsの1つ、2つ又は全てを交換することが可能である。例えば、米国特許No. 5,225,539;Jones et al. 1986 Nature 321:552-525;Verhoeyan et al. 1988 Science 239:1534;;Beidler et al. 1988 J. Immunol. 141:4053-4060; Winter 米国特許. No. 5,225,539.参照。
【0120】
特定ヒト抗体のCDRの全てを、所定の抗原(the antigen of interest)に結合することができる、抗体若しくはその抗原結合フラグメントからの非ヒトCDRの少なくとも一部と交換することができる、又は該CDRの一部のみを非ヒトCDRと交換することができる。所定の抗原にヒト化抗体を結合させるために必要な数のCDRを交換することのみが必要である。
【0121】
抗原結合に直接関与しないFv可変領域の配列を、ヒトFv可変領域からの同等配列と交換することによって、ヒト化抗体を作製することができる。ヒト化抗体を作製するための一般的な方法は、Morrison, S. L., 1985, Science 229:1202-1207;Oi et al., 1986, BioTechniques 4:214、及び Queen et al. 米国特許No. 5,585,089、米国特許No. 5,693,761 及び米国特許No. 5,693,762によって提供されている。これらの方法は、重鎖又は軽鎖の少なくとも一方からの免疫グロブリンFv可変領域の全て又は一部をコードする核酸配列の単離、操作(manipulating)及び発現を包含する。このような核酸のソースは、当業者に周知であり、所定の抗原に対する抗体を産生するハイブリドーマから得ることができる。ヒト化抗体若しくはそのフラグメントをコードする組換えDNAを次に、適当な発現ベクターにクローン化することができる。
【0122】
抗PSMA抗体若しくはその抗原フラグメントは、WO 98/52976 及び WO 00/34317に開示された方法による、ヒトT細胞エピトープの特定の欠失又は「脱免疫化」によって修飾することもできる。簡単に説明すると、抗PSMA抗体のマウス重鎖及び軽鎖可変領域を、MHC ClassIIに結合するペプチドに関して分析することができる;これらのペプチドは可能なT細胞エピトープを表す。
【実施例】
【0123】
PSMA発現に対するホルモン消退の影響
前立腺癌細胞系、LNCaPとMDA−Pca−2bを、10%胎仔ウシ血清(FCS)又は活性炭処理してある(charcoal stripped)10%FCS(CS−FCS)を含有する標準培地中で増殖させた。FCSは、アンドロゲンを含めたステロイドホルモンを含有するが、CS−FCSは、活性炭処理(charcoal stripping)がステロイドホルモンを含めた、血清の一部の成分を除去するので、アンドロゲンを含めたステロイドホルモンを有さない。活性炭処理は、培地からホルモンを除去するための標準方法である。種々な曲線が、CS−FCS中で指定の期間細胞を増殖させた後のPSMAレベルを表す。該細胞をJ591、抗PSMA抗体と接触させ、続いて、J591を認識する標識第2抗体と接触させることによって、PSMAレベルは検出される。次に、標識細胞をFACSに関して分析する。
【0124】
図1は、LNCaP細胞におけるPSMA発現が1週間目(ライン3)には殆ど増加していないことを示す。しかし、2週間(ライン4)までには、PSMA発現が9倍増加に同等であることを示す。ピークが右側にもはや移動していないことを実証するように、2週間を経て3週間目(ライン5)にはPSMA発現にアップレギュレーションは殆ど存在しない。3週間ピークは、細胞の一部がホルモン補給の損失のために死んでいる(これはこのアッセイでは測定しない)ため、y軸上で低下する。
【0125】
図2は、MDA−Pca−2bが、ホルモン消退が無い場合に、非常に類似したPSMA発現パターンを有することを示す。ライン1は陰性対照を表し、ライン2は、10%FCSを含む標準培地における発現レベルを表し、ライン3は、該細胞をCS−FCS培地中で2週間培養した後のPSMA発現を表し、ライン4は、該細胞をCS−FCS培地中で3週間培養した後のPSMA発現を表す。
【0126】
細胞増殖速度に対する葉酸濃度の影響
図3において実証されるように、前立腺癌(PC)細胞の増殖速度は、利用可能な葉酸(folate)に直接比例して上昇し、このことは、PC細胞が葉酸(folate)をより多量に取り込むならば、PC細胞はより迅速に増殖することができることを示す。葉酸レベルが生理的レベルを超えて上昇するならば、増殖速度はほぼ2倍に上昇しうる。PSMAを発現する細胞系(例えば、LNCaP)では、PSMAによって消化されてモノグルタメート化葉酸(monoglutamated folate)になる、「天然」若しくは食物葉酸(例えば、ポリグルタメート化葉酸(polyglutamated folate)の形態で葉酸が提供される場合にも、同じ増殖上昇が見出される。前者(モノグルタメート化葉酸)は細胞膜を横切ることができるが、ポリグルタメート化葉酸はできない。
【0127】
抗PSMA抗体、J415はPSMA酵素活性を阻害する
標準培地中で増殖したLNCaP細胞を、指示濃度の指示抗体と共にインキュベートする。細胞をPSMA酵素活性に関して検査した。簡単に説明すると、PSMAを放射性標識した基質(例えば、NAAG)と共にインキュベートした。インキュベーション後に、反応混合物を、標識グルタメート生成物を保持するが、該基質を保持しないカラム上をランさせた。γカウンター中で標識グルタメート量を測定した。標識グルタメートの測定された量は、酵素活性の量に比例する。PSMAは精製された、組換え体又は細胞関連型(cell-associated)であることができる。第1インキュベーション工程に阻害剤を含めることによって、そして適当な陽性対照と陰性対照を用いることによって、阻害に関して分析して、阻害のレベルを算出することができる。図4によって実証されるように、抗体J415は、5,000ng/ml(5μg/ml)の濃度において、PSMA/FolH1酵素活性を最大に阻害する。最大阻害は約70%である。J591もPSMA/FolH1酵素活性を阻害するが、J415ほどではない。酵素部位から離れた、PSMAの細胞内エピトープと結合する7E11抗体は、PSMA/FolH1阻害活性を有さない。
【0128】
図4によって実証されるように、抗体J415は、5,000ng/ml(5μg/ml)の濃度において、PSMA/FolH1酵素活性を最大に阻害する。最大阻害は約70%である。J591もPSMA/FolH1酵素活性を阻害する。酵素部位から離れた、PSMAの細胞内エピトープと結合する7E11抗体は、PSMA/FolH1阻害活性を有さない。したがって、J415によって最も効果的に達成される、PSMA(葉酸ヒドロラーゼ)酵素活性の阻害は、PSMA発現細胞が細胞不透過性フォリルポリグルタメートを細胞透過性フォリルポリグルタメートに転化させる能力を低下させ、それによって、細胞の代謝と増殖のための葉酸の細胞内有効性を低下させる。PSMA発現は、倍地中の葉酸減少に応じてアップレギュレートする。
【0129】
世界保健機構によると、血清葉酸の生理的レベルは12nmol/Lである。標準の組織培養培地は、ヒト血清/血漿中に見出される葉酸濃度の約150倍を含有する。本明細書で実証されるように、倍地中の葉酸濃度が生理的レベルに変化すると、種々な腎臓癌細胞系及び前立腺癌細胞系におけるPSMA発現レベルはアップレギュレートする。図5〜11は、標準培地(生理的レベルの150倍の葉酸を含有;ライン2)、50nM葉酸のみを含む標準培地(ライン3)、又は10nM葉酸のみを含む標準培地(ライン4)中で3週間増殖させた、種々な細胞系のPSMA発現レベルを示す。細胞は抗PSMA抗体J591で標識し、次に、J591を認識する蛍光標識された第2抗体で標識した。ライン1は陰性アイソタイプ対照抗体で標識し、次に、該標識された第2抗体で標識した細胞を示す。
【0130】
図5は、葉酸レベルが10nMに低下すると、ヒト腎臓癌細胞系、SK−RC−31によるPSMA発現が250%増加したことを示す。図6は、葉酸レベルが10〜50nMに低下すると、ヒト腎臓癌細胞系、SK−RC−42によるPSMA発現が650%増加したことを示す。図7は、葉酸レベルが10nMに低下すると、ヒト腎臓癌細胞系、SK−RC−39によるPSMA発現が250%増加したことを示す。図8は、葉酸レベルが50nM以下に低下すると、ヒト腎臓癌細胞系、SK−RC−06によるPSMA発現が225%増加したことを示す。図9は、葉酸レベルが10nMに低下すると、ヒト前立腺癌細胞系、Cwr22rv1によるPSMA発現が950%増加したことを示す。図10は、葉酸レベルが50nM以下に低下すると、ヒト前立腺癌細胞系、PC3によるPSMA発現が400%増加したことを示す。図11は、培地中の葉酸レベルの低下が、ヒト前立腺癌細胞系、LNCaP(構成的に非常に高レベルのPSMAを発現する細胞系)によるPSMA発現のアップレギュレーションを惹起しなかったことを示す。
【0131】
ライン4「低葉酸(low folate)」は、ヒトに見出される、標準の生理的葉酸レベルに近い。これまでの葉酸蓄積を消去させるために3週間を選択した、これはPSMA発現上昇のタイミングに基づくものであった。
【0132】
葉酸レベルの低下はLNCaP細胞増殖のドセタキセル阻害を可能にする。
【0133】
10若しくは20μg/mlの濃度でのドセタキセル(タキソテール)をLNCaP細胞と共に、培養培地から葉酸の形態で供給された葉酸の種々な濃度で、72時間インキュベートした。1週間後に細胞をカウントした。図12に示すように、葉酸レベルが低下すると、ドセタキセル(前立腺癌及びその他の癌に用いられる認可化学療法剤)に由来する細胞死傷/増殖阻害は増加する。無地バー(open bar)はドセタキセルで処理しない対照であり、斑点入りバーは、指示濃度の葉酸と共にドセタキセル10μg/mlで処理した細胞であり、縞模様バーは、指示濃度の葉酸と共にドセタキセル20μg/mlで処理した細胞である。指示濃度の葉酸は、胎仔ウシ血清中に存在する葉酸によって生じる葉酸の生理的レベル以上である(例えば、12nm葉酸は生理的レベルを超えた12nm葉酸を表す)。図12によって実証されるように、葉酸レベルが低下すると、タキソテールの効力は上昇する。癌細胞に対する葉酸有効性が低下すると、他の細胞傷害剤、細胞増殖抑制剤及びホルモン剤の抗腫瘍効果は増強する可能性がある。
【0134】
PSMA活性を阻害する抗体によるマウス前立腺癌腫瘍モデルの治療は、腫瘍増殖を50%緩慢にする。
【0135】
ヌードマウス(8匹/グループ)に、マトリゲル中のヒトLNCaP前立腺癌細胞を0日目に注入した。マウス血清葉酸レベルは、平均して、ヒト血清レベルの10〜40倍である。それ故、葉酸を添加せず、そしてマウスの血清葉酸濃度を低下させるために腸内細菌が葉酸合成するのを阻止するように抗生物質を添加した食餌で、全てのマウスを飼育した。2グループのマウス(AとB)には、かれらの飲料水中でフォリルポリグルタメートを与えた。フォリルポリグルタメートは、食物中に天然に見出される葉酸の形態(the form of folate)であり、既述したように、細胞膜を横切らない。PSMAはフォリルポリグルタメートからグルタメートを除去して、細胞膜を横切ることができるフォリルモノグルタメートを生成する。マウスの葉酸摂取と葉酸合成を制御して、ヒトの葉酸生理学をできる限り密接に模倣する。
【0136】
動物を3種類の異なる抗PSMA抗体、J591、7E11及びJ415によって、1日目に、そしてその後は2週間毎に処理した。グループ1はJ591を摂取し、グループ2は7E11を受容し、グループ3はJ415を受容した。これらの抗体は標識されない、裸の抗体であった。投与量は、マウス1匹につき250μg/1回量であった。腫瘍測定は、各グループが受けた治療を知らされていない実験助手(laboratory assistants)がキャリパーによって行なった。Bグループの動物は、有効な処理を受けない対照グループである。図13に示すように、PSMA/FOLH1酵素活性を阻害する能力を有さない7E11と、PSMA/FOLH1酵素活性を阻害する最少の能力を有するJ591とは、腫瘍増殖に殆ど影響を及ぼさない。しかし、J415処理したマウスの2グループ[1グループはフォリルポリグルタメート受容(グループA)そして1グループは処理せず(グループ3)]は、両方とも50%低下した腫瘍増殖を示す。
【0137】
抗体若しくはその抗原結合フラグメントを放射性ラベル又は細胞傷害剤で標識する方法の実施例は、Banderへの米国公開出願No.20060088539とNo.20060275212に見出され、特に、該実施例では、これらの出願の教示がそれらの全体で本明細書に援用される。
【0138】
本明細書で提供するテクノロジーは、本発明の要旨又はその本質的な特徴から逸脱することなく、他の特定の形態でも具体化することが可能である。それ故、上記実施態様は、あらゆる観点で、本明細書に記載するテクノロジーに対する制限ではなく例示と見なすべきである。したがって、本明細書で提供するテクノロジーの範囲は、上記の説明によってではなく、添付する特許請求の範囲によって表示される、そして該特許請求の範囲の同等物の意味及び範囲内に入る、あらゆる変化は、それ故、本発明の範囲内に包含されるように意図される。
【技術分野】
【0001】
本発明は、障害に関連した1つ以上の細胞種類が前立腺特異的膜抗原(PSMA)を発現する増殖性障害の治療に関する。
【背景技術】
【0002】
前立腺特異的膜抗原(PSMA)発現は、前立腺癌及び他の充実性腫瘍に高度に関連している;しかし、癌におけるPSMAの機能的役割は全く理解されていない。
【0003】
PSMAは、一部の正常な前立腺上皮細胞、正常な腎近位尿細管細胞、近位小腸細胞及び一部のアストロサイト(脳に存在)の細胞表面上に存在する。PSMAは前立腺癌(Pca)細胞上で高度にアップレギュレート/過発現する。PSMAの発現レベルは、前立腺癌の進行と共に上昇し、早期段階の前立腺癌におけるPSMAレベルは、再発の大きな可能性を予測する。さらに、実際に全ての充実性腫瘍はそれらの腫瘍の新脈管構造中でPSMAを発現するが、正常な血管内皮はPSMA陰性である。PSMA発現と前立腺癌との相互関係を超えて、そして非前立腺癌新血管構造においては、癌生物学におけるPSMAの機能的役割は実証されていない。さらに、PSMAは、幾分かは本能的に対抗するとしても、細胞運動性及び浸潤を低下させうることが報告されている。
【0004】
PSMAは、葉酸ヒドロラーゼ1(腸中に存在)及びNAALADアーゼ(脳中に存在)と同じであり、グルタミン酸カルボキシペプチダーゼ酵素活性を有する。PSMAは、例えばアスパラギン酸−グルタメートのようなジペプチドを、その構成成分である、個々のアミノ酸に加水分解する、これは、神経伝達のプロセスに及び恐らくは、種々な神経変性障害に関与すると考えられるプロセスである。その結果、研究者は、可能な神経治療薬として小分子阻害剤を開発中である。PSMAはさらに、葉酸ヒドロラーゼ活性を有し、ホリルポリグルタメートからグルタメート残基を切断してホリルモノグルタメートを生じることを可能にする。
【0005】
ホリルポリグルタメートは、食物中に見出される、葉酸(folate)の天然形であり、細胞膜又は腸上皮を横切ることができないが、ホリルモノグルタメートは細胞膜及び腸を横切って輸送されることができる。小分子PSMA酵素阻害剤はin vitroでPSMA発現Pca細胞の増殖速度を緩慢にすることができることが、最近判明している(Yao and Bacich, the Prostate 66:867 (2006))。しかし、これまでのPSMA酵素阻害剤の使用は、動物モデルにおいて腫瘍細胞増殖に如何なる有意義な効果も及ぼすことができていない。他の細胞傷害剤の不存在下での酵素による妨害の今までの試みは、動物モデルにおいて抗腫瘍効果を及ぼしていない。Nanus, D.M., Milowsky, M.I., Kostakoglu, L., Vallabahajosula, S., and Goldsmith, S.J.: Targeted systemic therapy of prostate cancer with a monoclonal antibody to prostate specific membrane antigen (PSMA). Seminars in Oncology, 2003; 30: 667-676).正常な生理的プロセスにとって全身葉酸代謝は重要である。しかし、PSMA/葉酸ヒドロラーゼの小分子阻害剤は、細胞内外の両スペース並びに腎尿細管の迅速な通過を包含する、非常に大きな分布容積を有し、腫瘍部位と正常組織の両方に対する阻害効果(inhibitory impact)を有し、それによって、正常体葉酸代謝を妨害する。
【0006】
前立腺癌は、米国人男性の最も一般的な癌死亡原因の一つである。2007年には、約219,000の新しいケースが診断されると予想され、この疾患による27,000件の死亡が予想される(NCI SEER data; Cancer Facts and Figures, American Cancer Society)。前立腺癌はひと度転移(前立腺を超えて拡散)したならば、前立腺癌の治療法は現在非常に限定されている。全身療法は、種々な形式のアンドロゲン(男性ホルモン)剥奪に限定されている。大抵の患者は初期の臨床的改善を示すであろうが、実際に不可避に、アンドロゲン非依存性細胞が発生する。したがって、内分泌療法は姑息的であり、治癒的ではない(Eisenberger M. A., et al. (1998) NEJM 339:1036-42)。アンドロゲン非依存性細胞が発生している、これらの患者の総生存期間中央値(median overall survival)は、ホルモン治療の開始から28〜52か月間であった(Eisenberger M. A., et al. (1998) supra.).。アンドロゲン非依存性の発生後には、タキサン系(即ち、ドセタキセル)化学療法のみが、19か月間の生存期間中央値の延命効果を与えることが判明している。いったん患者がドセタキセルに反応しなくなると、生存期間中央値は12か月間になる。
【0007】
前立腺癌が限局性であり、患者の余命が10年間以上である場合には、根治的前立腺摘出術が該疾患を根除するための最善のチャンスを与える。歴史的に見ると、この方法の欠点は、多くの癌が、検出される時点までに、該手術の範囲を超えて拡散していることである。しかし、前立腺特異的抗原試験の使用は、前立腺癌の早期検出を可能にしている。その結果、手術の範囲が狭ければ狭いほど、併発症は少なくなる。大きい高度腫瘍を有する患者は、根治的前立腺摘出術による治療で成功する可能性が低い。根治的前立腺摘出術の代替手段として、放射線療法も広く用いられている。放射線療法によって全身的に治療される患者は、高齢であって、健康でない患者及び高度な、臨床的に大きく進行した腫瘍を有する患者である。しかし、手術又は放射線療法後に、前立腺特異的抗原の検出可能な血清濃度が存在する場合には、癌遺残(persistent cancer)が指摘される。多くの場合に、放射線治療によって前立腺特異的抗原濃度が低下する可能性がある。しかし、この濃度は2年間以内に再び上昇する。
【0008】
局所的に進行した疾患を有する患者を治療するために、根治的前立腺摘出術又は放射線療法の前又は後にホルモン療法が用いられている。睾丸摘出術は血清テストステロン濃度を低下させるが、エストロゲン治療が同様に有利である。
【0009】
PSMAを認識するモノクローナル抗体が、細胞内ドメインに結合する7E11(Horoszewicz et al. (1987) Anticancer Res. 7:927-936, U.S. Pat. Nos. 5,162,504; 6,107,090; US 6,150,508; 及び 7,045,605)と、細胞外ドメインに結合する、他の抗PSMA抗体を含めて、開発されている。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】米国特許第5,162,504号明細書
【特許文献2】米国特許第6,107,090号明細書
【特許文献3】米国特許第6,150,508号明細書
【特許文献4】米国特許第7,045,605号明細書
【非特許文献】
【0011】
【非特許文献1】Yao及びBacich著、The Prostate 66:867 (2006)
【非特許文献2】Nanus, D.M.、Milowsky, M.I.、Kostakoglu, L.、Vallabahajosula, S.及びGoldsmith, S.J.著、「Targeted systemic therapy of prostate cancer with a monoclonal antibody to prostate specific membrane antigen (PSMA)」Seminars in Oncology, 2003;30:667-676
【非特許文献3】NCI SEER data;「Cancer Facts and Figures」、American Cancer Society
【非特許文献4】Eisenberger M. A.等著 (1998) NEJM 339:1036-42
【非特許文献5】Horoszewicz 等著 (1987) Anticancer Res. 7:927-936
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明では、患者における癌の治療方法を提供する。幾つかの実施態様では、該方法は、患者(例えば、癌と診断されている患者)に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害して、該患者の葉酸(folate)摂取を制限することができる。幾つかの実施態様では、患者による葉酸摂取(folate intake)は、葉酸含有栄養補助食品(folate containing dietary supplements)を禁止することによって制限される、或いは患者による葉酸摂取は1日につき400μg以下に、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベル(folate level)が300nmol/L以下になるように制限される、又はこれらの組み合わせによって制限される。幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントは標識されていない。
【0013】
他の実施態様では、患者における癌の治療方法は、患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害し、該患者における葉酸(folate)の血中レベルを測定することができる。
【0014】
幾つかの実施態様では、患者における癌の治療方法は、患者に第1抗体若しくはその抗原結合フラグメント(該第1抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害し、該患者による葉酸摂取を制限することができる)を投与すること、及び該患者に第2抗体若しくはその抗原結合フラグメント(該第2抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメイン(又は別の細胞外エピトープ)に結合することができる)を投与することを含む。幾つかの実施態様では、葉酸摂取は、葉酸摂取が1日につき400μg以下になるように、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように制限される。幾つかの実施態様では、第2抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインの異なるエピトープに結合することができ、この場合、第2抗体若しくはその抗原結合フラグメントは細胞傷害剤若しくはアイソトープ剤(cytotoxic or radioisotopic agent)にコンジュゲートする、又は二次免疫応答を誘出することができる。幾つかの実施態様では、葉酸摂取が制限された後2〜4週間目に、第2抗体の初回量(the first dose)を投与する。
【0015】
幾つかの実施態様では、患者における癌の治療方法は、該患者による葉酸摂取を制限すること及び該患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインに結合することができ、そして該抗体若しくはその抗原結合フラグメントの初回量は、該患者のPSMA発現細胞上のPSMA細胞表面レベルが5倍以上までに増加した後1〜5日目に投与する。幾つかの実施態様では、葉酸摂取が1日につき400μg以下になるように、又は患者における葉酸の血清レベルが10nm/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nm/L以下になるように、葉酸摂取を制限する。
【0016】
幾つかの実施態様では、患者における癌の治療方法は、該患者のPSMA発現細胞上のPSMA表面レベルを測定することを含む。幾つかの実施態様では、患者のPSMA発現細胞上のPSMA細胞表面レベルが5倍以上までに増加したときに、該抗体若しくはその抗原結合フラグメントの初回量を投与する。
【0017】
患者における前立腺癌の治療方法も提供する。幾つかの実施態様では、該方法は該患者に、該患者が微小転移性前立腺癌(時には、ステージD0又は前立腺特異的抗原のみ再発(prostate specific antigen-only relapse)又は生化学的再発と呼ばれる)と診断されている場合にホルモン療法を投与し、そしてPSMAの細胞外ドメインに結合することができる、抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはルテチウム177又は他の短距離α若しくはβ放射性同位体にコンジュゲートし、該抗体若しくはその抗原結合フラグメントの初回量は、ホルモン療法を開始した後1日〜3週間目に投与する。
【0018】
前立腺癌の治療方法の幾つかの実施態様では、該方法は、ホルモン療法を患者(例えば、前立腺癌と診断されている患者)に投与し、そして該患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインに結合することができ、該抗体若しくはその抗原結合フラグメントの初回量は、該患者の血清テストステロンレベルが50ng/ml以下に達した後1日〜4週間目に該患者に投与する。
【0019】
本明細書では、患者における癌治療のモニターリング方法を提供する。幾つかの実施態様では、該方法は、患者における葉酸の血中レベルを測定することを含み、この場合、患者による葉酸摂取は、葉酸摂取が1日につき400μg以下になるように、又は該患者における葉酸の血清レベルが10nmol/L以下になるように、又は該患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように制限されており、そして該患者は、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも1回量を受容している。
【0020】
患者における癌治療をモニターリングする幾つかの実施態様では、患者のPSMA発現細胞のPSMA活性を測定する、この場合、患者による葉酸摂取は、葉酸摂取が1日につき400μg以下になるように、又は該患者における葉酸の血清レベルが10nmol/L以下になるように、又は該患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように制限されており、そして該患者は、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも1回量を受容している。
【0021】
さらに、本明細書では癌の治療キットを提供する。幾つかの実施態様では、該キットは、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントと、患者による葉酸摂取を制限する及び/又は該患者における葉酸の血中レベルをモニターするための使用説明書を含む。
【0022】
さらに、本明細書では、患者における癌治療のモニターリング・キットを提供する。幾つかの実施態様では、該キットは、組織若しくは血液採集装置、PSMA活性検出試薬、及び該PSMA活性検出試薬を用いて該患者から得られた組織又は血液を検査するための使用説明書を含む。
【0023】
幾つかの実施態様では、該キットは、血液採取装置、葉酸検出試薬、及び該葉酸検出試薬を用いて該患者から得られた赤血球又は血清を検査するための使用説明書を含む。幾つかの実施態様では、該キットは、さらに、患者による葉酸摂取を減ずるための使用説明書を含む。
【0024】
本明細書で提供する方法及びキットの幾つかの実施態様では、PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメント、及び/又はPSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントは、標識されていない又は裸の抗体若しくはその抗原結合フラグメントである。他の実施態様では、該抗体若しくはその抗原結合フラグメントは、以下に述べるように、標識されている。
【0025】
さらに、本明細書では、患者における早期前立腺癌の治療キットも提供する。幾つかの実施態様では、該キットは、(i)PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメント(この場合には、該抗体若しくはその抗原結合フラグメントはルテチウム177にコンジュゲートする);及び(ii)ホルモン療法を開始した後1日〜4週間目に又は患者の血清テストステロン・レベルが50ng/ml以下に達した後1日〜4週間目のいずれかに該抗体若しくはその抗原結合フラグメントの初回量を投与するための使用説明書を含む。
【0026】
さらに、本明細書では、患者における癌の治療キットを提供する。幾つかの実施態様では、該キットは、(i)PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる、標識されていない抗体若しくはその抗原結合フラグメント;及び(ii)患者による葉酸摂取の制限と関連して、該標識されていない抗体若しくはその抗原結合フラグメントを投与するための使用説明書を含む。
【0027】
本明細書に記載する、種々な実施態様は相補的であることができ、本明細書に含まれる教えに関連して当業者に理解されるやり方で、組み合わせる又は共に用いることができる。
【図面の簡単な説明】
【0028】
【図1】図1は、標準RPMI培地中で増殖し、J591抗体で標識されたLNCaP細胞上のPSMA発現レベルのヒストグラムを示す(1=陰性対照、J591抗体なし;2=10%胎仔ウシ血清(FCS)を含有する標準RPMI培地中で増殖した細胞;3、4及び5=それぞれ、1、2及び3週間、活性炭処理した培地(charcoal stripped media)中で増殖した細胞)。
【図2】図2は、標準RPMI培地中で増殖し、J591抗体で標識されたMDA−PCa−2b細胞上のPSMA発現レベルのヒストグラムを示す(1=陰性対照、J591抗体なし;2=10%胎仔ウシ血清(FCS)を含有する標準RPMI培地中で増殖した細胞;3及び4=それぞれ、2及び3週間、活性炭処理した培地中で増殖した細胞)。
【図3】図3は、葉酸の濃度が上昇するにつれて、LNCaP細胞の上昇する増殖速度を示す。
【図4】図4は、抗PSMA抗体J415、J591及び7E11の指示濃度の存在下でのLNCaP細胞の相対的PSMA酵素活性を示す。
【図5】図5は、培地中の葉酸濃度が生理的濃度(10nmol/L又は4.4ng/ml)方向に低下するにつれて、ヒト腎臓癌細胞系SK−RC−31においてPSMA発現レベルが上昇することを示す。
【図6】図6は、指示濃度の葉酸(folate)の存在下でのヒト腎臓癌細胞系SK−RC−42におけるPSMA発現レベルを示す。
【図7】図7は、培地中の葉酸濃度が生理的濃度(10nmol/L)方向に低下するにつれて、ヒト腎臓癌細胞系SK−RC−39においてPSMA発現レベルが上昇することを示す。
【図8】図8は、培地中の葉酸濃度が生理的濃度(10nmol/L)方向に低下するにつれて、ヒト腎臓癌細胞系SK−RC−06においてPSMA発現レベルが上昇することを示す。
【図9】図9は、培地中の葉酸濃度が生理的濃度(10nmol/L)方向に低下するにつれて、ヒト前立腺癌細胞系Cwr22rv1においてPSMA発現レベルが上昇することを示す。
【図10】図10は、培地中の葉酸濃度が生理的濃度(10nmol/L)方向に低下するにつれて、ヒト前立腺癌細胞系PC3においてPSMA発現レベルが上昇することを示す。
【図11】図11は、指示濃度の葉酸の存在下でのヒト前立腺癌細胞系LNCaPにおけるPSMA発現レベルを示す。
【図12】図12は、指示濃度のタキソテールの存在下の細胞培養培地における細胞数対葉酸濃度のグラフを示す。
【図13】図13は、3種類の異なる抗PSMA抗体、J591、7E11及びJ415で処理したマウスにおける腫瘍サイズ対時間のグラフを示す、この場合、A群とB群のマウスはさらにホリルポリグルタメート補充水も与えられていた。
【発明を実施するための形態】
【0029】
本明細書では、癌の治療方法及び癌の治療のモニターリング方法を提供する。さらに、癌の治療キット並びに患者における癌の治療のモニターリング・キットを提供する。本明細書に記載するように、幾つかの実施態様では、治療は、PSMAの細胞外ドメインに結合することができ、PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントを投与することを含む。本明細書で実証するように、このような抗体若しくはその抗原結合フラグメントの投与は、患者による葉酸摂取が制限されたときに、in vivoでのPSMA発現細胞の増殖を阻害する。意外にも、該抗体若しくはその抗原結合フラグメントは、非標識の又は裸の抗体若しくはその抗原結合フラグメントであることができる。
【0030】
抗体若しくはその抗原結合フラグメントは、それらの物理的サイズ、組成及び電荷(charge)のために、細胞外空間に限定され、血液脳関門を横切ることができず、糸球体濾過又は腎尿細管排出に支配されず、それによって、例えば腎臓の近位尿細管、近位小腸及び脳のような、重要な正常機能の部位におけるPSMA/葉酸ヒドロラーゼとの接触を防止する生体内分布を有すると考えられる。抗体若しくはその抗原結合フラグメントは、腫瘍又は腫瘍関連組織上に存在する場合には、これらは、PSMA/葉酸ヒドロラーゼが循環中の抗体若しくはその抗原結合フラグメントに暴露される唯一の部位であるので、PSMA/葉酸ヒドロラーゼとの結合にアクセスすると予想される。このことは、抗体若しくはその抗原結合フラグメントの作用に機能的特異性を与え、それによって、葉酸代謝は腫瘍部位では影響を受けるが、正常組織では影響されないことになる。その結果、正常な生理的プロセスのために重要である全身葉酸代謝は影響されないことになり、腫瘍葉酸代謝は特異的に阻害される可能性がある。
【0031】
しかし、本明細書に記載するように、低用量の小分子PSMA/葉酸ヒドロラーゼ阻害剤をPSMA/葉酸ヒドロラーゼの酵素活性を阻害する抗体若しくはその抗原結合フラグメントに加える又は組み合わせて、正常組織では正常な葉酸代謝を妨害しないように最少の阻害のみを生じながら、腫瘍部位では相加的な又は相乗的な阻害を達成することができる。
【0032】
さらに、本明細書で実証するように、葉酸量の減少は、PSMA発現細胞の表面上のPSMA量の増加を生じる。本明細書では、葉酸制限の結果としてのPSMA発現細胞の表面上のPSMA量の増加を利用する、癌の治療方法を提供する。その上、本明細書で実証するように、前立腺癌細胞からアンドロゲンを剥奪するために前立腺癌患者に投与されるホルモン療法も、PSMA発現細胞の表面上のPSMA量を増加させる。テストステロンの血清レベルが去勢レベル(≦50ng/ml)に達した後に、PSMA発現細胞の表面上のPSMA量は約9倍に増加する。本明細書では、ホルモン療法の結果としてのPSMA発現細胞の表面上のPSMA量の増加を利用する、癌の治療方法を提供する。PSMAに結合して、PSMA酵素活性を阻害することができる、抗体若しくはその抗原結合フラグメントによる治療は、例えば、前立腺癌及び腫瘍の血管内皮中にPSMA発現細胞を有する他の腫瘍のような癌を治療するための他の療法と組み合わせることができる。
【0033】
前立腺癌の治療方法、葉酸の制御(folate control)
本明細書では、患者における癌を治療するための方法及び組成物を提供する。癌の治療の幾つかの実施態様では、該方法は、患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインに結合して、PSMAの酵素活性を阻害し、そして患者による葉酸摂取を制限することができる。幾つかの実施態様では、患者による葉酸含有栄養補助食品の摂取を禁止する(制止する)。他の実施態様では、患者による葉酸摂取は1日につき400μg以下に、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように制限される。幾つかの実施態様では、患者による葉酸摂取は1日につき300、200、100、50、5μg以下に制限される。本明細書に記載する葉酸レベルは、化学発光イムノアッセイに基づくものであり、他の方法で測定する場合には、幾らか異なる可能性がある。当業者は、他の方法を用いて測定した葉酸レベルを本明細書に記載したレベルと比較することができるであろう。
【0034】
葉酸摂取の制限は、例えば葉酸のような膜透過型葉酸(membrane permeable forms of folate)(栄養ビタミン補助食品中に存在)の摂取の制限、又はある一定の食品中に自然に見出される膜不透過型葉酸(membrane impermeable forms of folate)(ホリルポリグルタメート)の摂取の制限、又はこれらの組み合わせを包含しうる。好ましくは、葉酸は、腫瘍内葉酸レベルが低下するように制限される。
【0035】
他の実施態様では、患者における癌の治療方法は、患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合して、該患者の血清葉酸レベルのモニターリングと共に、該PSMAの葉酸ヒドロラーゼ活性を阻害することができる。幾つかの実施態様では、患者による葉酸摂取は、該患者の血清葉酸レベルの測定に依存して、増減することができる。
【0036】
幾つかの実施態様では、患者における癌の治療方法は、患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントは、PSMAの細胞外フラグメントに結合して、該PSMAの酵素活性を阻害することができ、そして例えば、最適レベルの酵素阻害を維持するために、該抗体若しくはその抗原結合フラグメントの血清レベルを測定することができる。他の実施態様では、該方法は、上述したように、抗体若しくはその抗原結合フラグメントを投与し、例えば、最適レベルの酵素阻害を維持するために、該患者のPSMA発現細胞の残留PSMA活性を測定することを含む。幾つかの実施態様では、患者に投与される抗体若しくはその抗原結合フラグメントの量は、該患者のPSMA発現細胞のPSMA活性の測定に依存して、増減することができる。
【0037】
癌の治療方法、PSMAアップレギュレーション
低レベルの葉酸(reduced levels of folate)にPSMA発現細胞を暴露すると、PSMA発現細胞上のPSMA表面レベルが増加する。この増加は、幾つかの型の葉酸の低レベルへの暴露を開始した後約3〜4週間目に、又は事前の細胞内葉酸貯蓄が低いならば短い時間内にピークに達する。その結果、低レベルの葉酸への暴露が開始した後約3〜4週間目に、PSMAは10倍に増加した。それ故、低レベルの膜透過型葉酸への暴露の結果としてのPSMA発現細胞上のPSMAの表面レベルの増加を利用する、癌の治療方法を提供する。
【0038】
幾つかの実施態様では、癌の治療方法は、患者に第1抗体若しくはその抗原結合フラグメント(該第1抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害し、該患者による葉酸摂取を制限することができる)を投与すること、及び該患者に、PSMAの細胞外ドメインに結合することができる第2抗体若しくはその抗原結合フラグメントを投与することを含む。幾つかの実施態様では、患者による葉酸摂取は、葉酸摂取が1日につき400μg以下になるように、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように制限される。幾つかの実施態様では、第2抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインの異なるエピトープに結合することができる。幾つかの実施態様では、第2抗体若しくはその抗原結合フラグメントは細胞傷害剤及び/又はアイソトープ剤にコンジュゲートする、又は二次免疫応答を誘出することができる。幾つかの実施態様では、葉酸摂取が制限された後2〜4週間目に、第2抗体若しくはその抗原結合フラグメントの初回量を投与する。幾つかの実施態様では、葉酸摂取が制限された後約2、3若しくは4週間目に、第2抗体若しくはその抗原結合フラグメントの初回量を投与する。
【0039】
他の実施態様では、癌の治療方法は、患者による葉酸摂取を制限し、該患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインに結合することができ、そして該抗体若しくはその抗原結合フラグメントの初回量は、葉酸摂取が制限された後2〜4週間目に投与される。幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントの初回量は、葉酸摂取が制限された後約2、3若しくは4週間目にを投与する。幾つかの実施態様では、患者のPSMA発現細胞上のPSMA量を測定して、PSMA発現細胞の表面上のPSMAレベルが増加したかどうかを知ることができる。PSMA発現細胞の表面上のPSMAレベルが増加したことが分かった後に、抗体若しくはその抗原結合フラグメントの初回量を投与することができる。
【0040】
前立腺癌の増殖を刺激する抗原を除去するように設計したホルモン療法の結果として、PSMA発現細胞上のPSMA表面レベルは増加する。この増加は、テストステロン・レベルが減少した後及び/又は去勢レベル(約50ng/ml以下)に達した後に開始し、2〜3週間後にピークに達する。その結果、PSMA発現細胞の表面上のPSMA発現は、約9倍に増加する。それ故、ホルモン療法の結果としてPSMA発現細胞上のPSMA表面レベルの増加を利用する、前立腺癌の治療方法を提供する。さらに、葉酸制御(folate control)とホルモン療法との利点を組み合わせた、前立腺癌の治療方法を提供する。
【0041】
幾つかの実施態様では、前立腺癌の治療方法は、患者にホルモン療法を投与し、そして患者に抗体若しくはその抗原結合フラグメントを投与することを含み、この場合、該抗体若しくはその抗原結合フラグメントはPSMAの細胞外ドメインに結合することができる。幾つかの実施態様では、患者の血清テストステロン・レベルが去勢レベル(50ng/ml以下)に達した後2〜3週間目に、抗体若しくはその抗原結合フラグメントの初回量を患者に投与する。
【0042】
抗PSMA抗体治療は、PSMA表面発現の増加のタイミングと一致するように時期を選ぶことができ、それによって、その効力がPSMA表面密度の関数である作用剤(agent)を疾患の進行中にできるだけ早期にデリバリーすることができる。例えば、抗体若しくはその抗原結合フラグメントが放射性同位体とコンジュゲートする場合には、腫瘍細胞に可能なかぎり最高量の放射線をデリバリーすることが望ましい。しかし、放射性同位体に基づく治療の固有の骨髄毒性のために、投与することができる線量数(the number of doses)は限定される。細胞毒素コンジュゲート抗体若しくはその抗原結合フラグメント(cytotoxin-conjugated antibody or antigen binding fragment thereof)のデリバリーも、細胞表面におけるPSMAの発現の増加と一致するような投与のタイミングから利益を得るであろう。しかし、このような治療を放射免疫療法よりも頻繁に投与することが可能であるので、細胞傷害性抗体療法はPSMAアップレギュレーションに依存することが幾らか低い。両方の場合に、腫瘍細胞中にデリバリーされる同位体と細胞毒素の量は細胞表面におけるPSMAの密度の直接の関数である、それ故、抗PSMA療法のタイミングをPSMA発現のアップレギュレーションによって調整することは有利である。
【0043】
さらに、本明細書に記載するように、ルテチウム177及び他の短距離α若しくはβ放射性同位体は、早期の非塊状前立腺癌患者の治療に用いる場合に、PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントのための放射性標識として、より効果的であるように思われる。本明細書に記載するように、早期の非塊状前立腺癌患者は典型的に、異常に高い血清前立腺特異的抗原(PSA)を有するが、画像診断(imaging study)での癌拡散の証拠を有さない(例えば、CT又はMRIスキャンで明らかになる高体積軟組織疾患)。異常に高いPSAは、先行の根治前立腺切除術後の0.1ng/mlより大きいPSA又は前立腺放射線療法後の0.5ng/mlより大きいPSA又は前立腺に対する先行治療が存在しない場合の4.0ng/mlより大きいPSAから成る。1つの実施態様では、早期前立腺癌は、上昇した及び/又は上昇中のPSAレベルを含み、直径0.9cmより大きい軟組織疾患の証拠を含まない。それ故、ホルモン療法に及び/又は、PSMAの葉酸ヒドロラーゼ活性の阻害の有無に拘わらず、食事による葉酸制限に反応したPSMAアップレギュレーション及び例えばルテチウム177のような短距離同位体に対する非塊状前立腺癌の感受性を利用する治療計画を提供する。
【0044】
幾つかの実施態様では、前立腺癌の治療方法は患者にホルモン療法を投与すること(この場合、該患者は早期非塊状前立腺癌と診断されている)、及びPSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントを投与すること(この場合、該抗体若しくはその抗原結合フラグメントはルテチウム177及び他の短距離同位体にコンジュゲートする)を含む。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントの初回量は、ホルモン療法を開始した後3〜4週間目に投与する。
【0045】
治療のモニターリング方法
本明細書では、患者における癌治療のモニターリング方法も提供する。幾つかの実施態様では、癌治療のモニターリング方法は、患者における葉酸の血中レベルを測定することを含み、この場合、該患者による葉酸摂取は制限されており、該患者は、PSMAの細胞外ドメインに結合して、PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも1回量を受容している。
【0046】
他の実施態様では、患者における癌治療のモニターリング方法は、患者のPSMA発現細胞のPSMA活性の測定を含み、この場合、該患者による葉酸摂取は制限されており、該患者は、PSMAの細胞外ドメインに結合して、PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも1回量を受容している。幾つかの実施態様では、葉酸摂取は、1日につき400μg以下であるように、又は患者における葉酸の血清レベルが10nm/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nm/L以下になるように制限される。
【0047】
キット
本明細書では、癌を治療するためのキットも提供する。幾つかの実施態様では、該キットは、PSMAの細胞外ドメインに結合して、PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメント及び患者による葉酸摂取を制限するための使用説明書を含む。幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントは細胞傷害剤(cytotoxic agent)にコンジュゲートして、抗体に依存する、細胞の細胞傷害反応を誘出することができる。
【0048】
本明細書では、患者における癌治療のモニターリング・キットも提供する。幾つかの実施態様では、該キットは、組織又は血液採取装置、PSMA活性検出試薬、及び該PSMA活性検出試薬を用いて患者から得た組織又は血液を検査するための使用説明書を含む。
【0049】
他の実施態様では、該キットは、血液採取装置;葉酸検出試薬;該葉酸検出試薬を用いて患者から得た赤血球又は血清を検査するための使用説明書を含む。幾つかの実施態様では、該キットはさらに、このキットを用いて検出された葉酸レベルに基づいて、患者による葉酸摂取を低減するための使用説明書を含む。
【0050】
適当なPSMA活性検出試薬は、例えば、PSMA基質及び/又は、PSMAに結合することができる、1つ以上の抗体若しくはその抗原結合フラグメントを包含する。幾つかの実施態様では、PSMA基質又は少なくとも1つの抗体若しくはその抗原結合フラグメントを固体表面に固定させる。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントを検出可能なラベルで標識する。付加的な抗体若しくはその抗原結合フラグメントが存在する場合には、このような付加的な抗体若しくはその抗原結合フラグメントを、第1抗体若しくはその抗原結合フラグメントのラベルとは識別可能である検出可能なラベルで標識することができる。適当な検出可能なラベルは、例えば、蛍光を発する部分、放射性同位体、又は酵素ラベル(例えば、ホースラディッシュ・ペルオキシダーゼ若しくはアルカリ・ホスファターゼ)を包含する。該キットは、PSMA活性を検査するための使用説明書を含むこともできる。
【0051】
幾つかの実施態様では、該キットはPSMA検出試薬と、該PSMA検出試薬を用いて患者から得た組織又は血液を検査するための使用説明書を含む。1つの実施態様では、患者からの組織、血液、血清又は血漿サンプルをPSMA酵素基質と、PSMAを該基質に作用させて、該サンプル中に存在するPSMA活性量に比例して検出可能な生成物を生成するのに適した条件下で、反応させる。
【0052】
投与及び治療計画
本明細書に記載する抗体若しくはその抗原結合フラグメントは患者(本明細書では、対象とも呼ぶ)に単回量若しくは複数回量として投与して、前立腺障害若しくは癌性障害を治療又は予防することができる。対象に投与される抗体若しくはその抗原結合フラグメントの投与量は、種々なパラメーターに従って、特に、用いる投与形式及び対象の状態に従って選択することができる。その他の要因は、望ましい治療期間及び、他の治療形式が該抗体若しくはその抗原結合フラグメントと共投与又は併用(used in conjunction with)されているかどうかを包含する。上述したように、患者における抗体若しくはその抗原結合フラグメント又はPSMA酵素活性のレベルをモニターすることができ、検出したレベルに従って、抗体若しくはその抗原結合フラグメントの投与量を調整することができる。
【0053】
一般に、抗体若しくはその抗原結合フラグメントの投与量は、約1mg〜約1000mgの範囲であることができる。幾つかの実施態様では、PSMA酵素活性の最大の阻害を達成するために充分な量で、抗体若しくはその抗原結合フラグメントを投与する。幾つかの実施態様では、対象における抗体の少なくとも約5μg/mlの血清濃度を得るために充分な量で、患者に該抗体若しくはその抗原結合フラグメントを投与する。幾つかの実施態様では、10、25、50、100又は200μg/mlの血清濃度を得るために充分な量で、該抗体若しくはその抗原結合フラグメントを投与する。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、例えば、(Fab’)2のような抗体の抗原結合フラグメントであり、対象において該抗原結合フラグメントの少なくとも約3.3ng/mlの血清濃度を得るために充分な量で患者に投与される。幾つかの実施態様では、6.6、10、20、40又は80ng/mlの血清濃度を得るために(Fab’)2を投与する。幾つかの実施態様では、所望の量の持続血清濃度を得るために充分な量で抗体若しくはその抗原結合フラグメントを投与する。該血清レベルが所望の期間維持されるように、該抗体若しくはその抗原結合フラグメントを投与することができる。所望の血清レベルは、血液、血清若しくは血漿のサンプル中で測定されうる抗体若しくはその抗原結合フラグメントの量に基づくことができる、又はPSMA活性の阻害レベルに基づくことができる。幾つかの実施態様では、患者のPSMA発現細胞のPSMA活性の50、60、70、80若しくは90%より大きい阻害を達成するために充分な量で、抗体若しくはその抗原結合フラグメントを投与する。抗体若しくはその抗原結合フラグメントの投与量は、例えば、抗体若しくはその抗原結合フラグメントの大きさ、及び抗体若しくはその抗原結合フラグメントとPSMAとの結合アフィニティに基づいて、当業者が調整することができる。血清中の抗体若しくはその抗原結合フラグメントの適当なレベルは、反復投与によって維持することができる。
【0054】
幾つかの実施態様では、抗体若しくはその抗原結合フラグメントの次の投与量を投与する前に、抗体若しくはその抗原結合フラグメントの血清トラフ及び/又はピーク・レベルを測定することができる。当該技術分野で知られた標準技術を用いて、血清トラフ及び/又はピーク・レベルを測定することができる。血清トラフ及び/又はピーク・レベルを用いて、個々の患者又は患者群に対する抗体若しくはその抗原結合フラグメントの所定投与量(prescribed dose)を調整することができる。
【0055】
多様な経路を用いて、抗体若しくはその抗原結合フラグメントを投与することができる。特定の投与形式(particular mode)の選択は、選択した特定の薬物、治療する病状(disease state)の重症度及び治療効果を挙げるために必要な投与量に依存するであろう。本発明の方法は、一般的に言うと、医学的に許容できる如何なる投与形式(これは、臨床的に許容されない副作用を惹起しないで活性化合物の有効レベルを生じる如何なる投与形式もを意味する)を用いても、実施することができる。このような投与形式には、経口、直腸、舌下、局所、鼻腔、経皮又は非経口経路が含まれる。「非経口」なる用語には、皮下、静脈内、筋肉内又は注入(infusion)が含まれる。
【0056】
該抗体若しくはその抗原結合フラグメントは単回投与、例えば連続ポンプによるような持続的投与、又は周期的な間隔を置いて投与することができる。周期的な間隔とは、週1回、2週1回又は1か月1回であることができる。適当な体液及び/若しくは細胞免疫応答を誘出するため又はPSMAの所望のレベルの酵素阻害を維持するために、投与を1か月、2か月、3か月又はそれ以上の期間にわたって行なうことができる。特定の組成物の複数回投与の所望の時間間隔は、不当な実験なしに、当業者が決定することができる。投与量、投与スケジュール、投与部位、投与形式などが前記のものとは異なる、抗体若しくはその抗原結合フラグメントの他の投与プロトコルは、当業者に知られているであろう。
【0057】
本明細書で提供する方法及びキットの幾つかの実施態様では、本明細書に述べる1つ以上の抗体若しくはその抗原結合フラグメントは、非誘導体化若しくは非コンジュゲート化形(本明細書では、「裸の」又は「非標識の」とも呼ぶ)で用いられる。
【0058】
本明細書で提供する方法及びキットの他の実施態様では、本明細書に述べる1つ以上の抗体若しくはその抗原結合フラグメントを作用剤にコンジュゲートさせる。PSMAは通常、細胞膜から細胞中にインターナライズされる。したがって、PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントは、PSMAによってインターナライズすることができ、それによって該抗体にコンジュゲートされる作用剤のデリバリーを可能にすることができる。該作用剤は、例えば、ラベリング剤(labeling agent)、細胞傷害剤、ナノ粒子又はウイルス粒子(例えば、細胞傷害剤、例えばアポトーシス促進因子をコードする遺伝子を含有するウイルス粒子)であることができる。
【0059】
幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントは別の分子的実体、典型的には、ラベル又は治療剤(例えば、細胞傷害剤又は細胞成長抑止剤)にコンジュゲート又は連結することができる。該抗体若しくはその抗原結合フラグメントは、例えば、化学的カップリング、遺伝的融合、非共有結合(non-covalent association)によって、又はさもなくば、1つ以上の他の分子的実体に、機能的に連結することができる。
【0060】
幾つかの実施態様では、ラベルは、例えば、蛍光ラベル、生物学的活性酵素ラベル、放射性同位体(例えば、放射性イオン)、核磁気共鳴活性ラベル、発光ラベル又は発色団である。幾つかの実施態様では、治療剤は、例えば、細胞傷害性部分、例えば、治療薬、放射性同位体、植物由来、真菌由来若しくは細菌起源の分子、又は生物学的タンパク質(例えば、タンパク質毒素)又は粒子(例えば、ナノ粒子若しくは、例えばウイルスコートタンパク質による、組み換えウイルス粒子)又はこれらの混合物である。該治療剤は、例えば、本明細書に記載するような、短距離高エネルギーα−エミッタを含めた短距離放射線エミッタのような、細胞内活性の薬物若しくは他の作用剤であることができる。適当な放射性同位体は、α−、β−若しくはγ−エミッタ、又はβ−及びγ−エミッタを包含する。治療剤として有用な放射性同位体は、イットリウム(90Y)、ルテチウム(177Lu)、アクチニウム(225Ac)、アスタチン(211At)、レニウム(186Re)、ビスマス(212Bi又は213Bi)、及びロジウム(188Rh)を包含する。例えば、診断法に用いるためのラベルとして有用な放射性同位体は、ヨウ素(131I、124I若しくは125I)、インジウム(111In)、テクネチウム(99mTc)、リン(32P)、炭素(14C)及びトリチウム(3H)又は上記した治療用同位体の1つを包含する。幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントを、植物起源若しくは細菌起源若しくは真菌起源の分子(又はその誘導体)、例えば、メイタンシノイド(例えば、メイタンシノール若しくはDM1メイタンシノイド)、タキサン又はカリチェアミシンにカップリングさせることができる。該抗体若しくはその抗原結合フラグメントはさらに、別の抗体に連結させて、二機能性若しくは多機能性抗体を形成することも可能である。
【0061】
幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントを、例えば、共有結合によって、プロテオソーム阻害剤又はトポイソメラーゼ阻害剤にカップリングさせる。[(1R)−3−メチル−1−[[(2S)−1−オキソ−3−フェニル−2−[(3−メルカプトアセチル)アミノ]プロピル]アミノ]ブチル]ブロン酸は、適当なプロテオソーム阻害剤である。N,N’−ビス[2−(9−メチルフェナジン−1−カルボキサミド)エチル]−1,2−エタンジアミンは、適当なトポイソメラーゼ阻害剤である。
【0062】
幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントを、PSMA活性の小分子若しくはペプチド阻害剤又はアプタマー阻害剤と組み合わせて用いる。PSMA活性の適当な小分子阻害剤は、一例として、キスカル酸(quisqualate)及び2−(ホスホノメチル)−ペンタン二酸(2−PMPA)を包含する。小分子PSMA阻害剤は該抗体若しくはその抗原結合フラグメントに連結させることも、又は該抗体若しくはその抗原結合フラグメントに連結させないことも可能である。PSMA活性の適当なペプチド阻害剤は、例えば、WQPDTAHHWATL(配列番号NO.1)とそのダイマー形若しくはマルチマー形を包含する。ペプチド阻害剤又はアプタマー阻害剤は、該抗体若しくはその抗原結合フラグメントに連結することも、又は連結しないことも可能である。本明細書で提供する方法は、PSMAの小分子阻害剤又はペプチド阻害剤又はアプタマー阻害剤の低投与量の使用を可能にして、それによって、例えば腎臓近位尿細管、小腸及び/又は脳のような、非腫瘍部位におけるこれらの作用剤の副作用を最小にする。
【0063】
幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントを、本明細書に記載するような治療剤に、リンカー(例えば、切断可能なリンカー若しくは切断不能なリンカー)を介して連結させる。切断可能なリンカーの使用は、コンジュゲートした抗体若しくはその抗原結合フラグメントがインターナライズしたときに、細胞内細胞質中への治療剤の放出を可能にする。切断不能なリンカーは、抗体若しくはその抗原結合フラグメントの消化時の放出を可能にするか、又は切断不能なリンカーを、該抗体からの放出を必要としない作用剤と併用することができる。
【0064】
他の治療法との組み合わせ
癌の治療方法の幾つかの実施態様では、PSMAの細胞外ドメインに結合して、酵素活性を抑制することができる抗体若しくはその抗原結合フラグメントを、他の治療法と組み合わせて用いることができる。幾つかの実施態様では、他の治療法は、対象に細胞傷害剤又は化学療法剤を投与することを含む。典型的な細胞傷害剤は、微小管阻害剤(antimicrotubule agent)、トポイソメラーゼ阻害剤、代謝拮抗物質、分裂抑制剤、アルキル化剤、挿入剤(intercalating agent)、シグナル伝達経路の妨害可能な作用剤、アポトーシスを促進する作用剤、葉酸代謝(folate metabolism)を妨害する作用剤及び放射線を包含する。幾つかの実施態様では、細胞傷害剤は、タキソール、タキソテール、サイトカラシンB、グラミシジンD、臭化エチジウム、エメチン、マイトマイシン、エトポシド、テノポシド、ビンクリスチン、ビンブラスチン、コルチシン、ドキソルビシン、ダウノルビシン、ジヒドロキシアントラシンジオン、メトトレキセート、ミトキサントロン、ミトラマイシン、アクチノマイシンD、1−デヒドロテストステロン、グルココルチコイド、プロカイン、テトラカイン、リドカイン、プロプラノロール、ピューロマイシン、メイタンシノイド、例えば、メイタンシノール(米国特許No.5,208,020参照)、CC−1065(米国特許Nos.5,475,092、5,585,499、5,846,545参照)及び/又はこれらの類似体若しくは同族体を包含する。葉酸代謝を妨害する、適当な作用剤(葉酸アンタゴニスト)は、例えば、メトトレキセート、アミノプテリン、トリメトレキセート、ロメトレキソール、ペメトレキセド、チミタク及び5−フルオロウラシルを包含する。化学療法剤はさらに、例えば、PSMA活性の阻害剤を包含する。
【0065】
幾つかの実施態様では、PSMAの細胞外ドメインに結合して、PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの投与を、細胞傷害剤の低投与量と組み合わせて、それによって、該細胞傷害剤の不快な副作用の可能性を低減することができる。幾つかの実施態様では、該細胞傷害剤は、癌の同様なステージ及び、例えば体重、身長、年齢及び治療歴のような、同様な身体的特徴を有する患者に通常投与されるであろう標準投与量の10%、20%、30%、40%、50%、60%、70%又は80%で投与される。同様に、葉酸摂取の制限は、治療法を組み合わせて用いる場合に、低い量の細胞傷害剤の投与を可能にする。
【0066】
PSMAの細胞外ドメインに結合して、その酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントを、活性に増殖する細胞に対してより大きく効果的である治療法と組み合わせて投与する。幾つかの実施態様では、患者による葉酸摂取の制限と、該抗体若しくはその抗原結合フラグメントの投与とのサイクルを、他の治療法の投与サイクルと交互形式で投与する。このやり方で、該他の治療法は細胞増殖を可能にする時間の範囲中に投与されるので、該他の治療法の効果は最大化される。
【0067】
他の実施態様では、PSMAの細胞外ドメインに結合して、その酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントを、外科及び/又は放射線手段と組み合わせて用いることができる。さらに他の実施態様では、PSMAの細胞外ドメインに結合して、葉酸ヒドロラーゼ活性(folate hydrolase activity)を阻害することができる抗体若しくはその抗原結合フラグメントを、免疫調節剤、例えば、IL−1、2、4、6若しくは12又はそれらのアンタゴニスト、又はインターフェロンα若しくはγ、又は細胞成長因子(例えば、GCSF及び/又はGM−CSF)と組み合わせて用いることができる。PSMAの細胞外ドメインに結合して、葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントはさらに、例えば、赤血球の産生を刺激する処置(エリスロポエチン(EPO))、骨形成若しくは構造を促進する処置(例えば、ビホスホネート(例えば、パミドロン酸二ナトリウム及び/又はゾレドロネート))及び他の副作用のための処置(例えば、アセトアミノフェン及び塩酸ジフェニルドラミン)の1つ以上を包含する癌治療の副作用を低減するために投与される、他の作用剤と組み合わせて投与することもできる。
【0068】
本明細書で提供する方法及び組成物を前立腺障害(例えば、前立腺癌)患者の治療に用いる場合には、PSMAの細胞外ドメインに結合して、葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントは、既存の治療モダリティ(existing therapeutic modalities)、例えば、前立腺摘除術(部分的又は根治的)、放射線療法、前立腺切除療法(例えば、ホルモン療法、凍結手術、レーザー切除、高密度焦点式超音波療法など)、及び上述したような細胞傷害性化学療法と組み合わせて用いることができる。典型的に、ホルモン療法は患者におけるアンドロゲンのレベルを低減するように作用し、この療法は、黄体形成ホルモン放出ホルモン(LHRH)類似体若しくはアゴニスト(例えば、Lupron(登録商標)、Zoladex(登録商標)、ロイプロリド、ブセレリン若しくはゴセレリン)並びにアンタゴニスト(例えば、アバレリクス)の投与を包含することができる。非ステロイド系抗アンドロゲン剤(例えば、フルタミド、ビカルタミド若しくはニルタミド)も、ステロイド系抗アンドロゲン剤(例えば、酢酸シプロテロン若しくは酢酸メガストロール)、エストロゲン(例えば、ジエチルスチルベストロール)、手術による去勢、二次的若しくは三次的ホルモン処置(secondary or tertiary hormonal manipulations)[例えば、コルチコステロイド(例えば、ヒドロコルチゾン、プレドニゾン若しくはデキサメタゾン)、ケトコナゾール、アビラテロン及び/又はアミノグルテチミドを包含する]、5a−レダクターゼ阻害剤(例えば、フィナステリド)、漢方薬、下垂体摘除、及び副腎摘除と同様に、ホルモン療法に用いることができる。その上、ホルモン療法は連続的、断続的に、又は上記処置のいずれかの組み合わせ(例えば、ロイプロリドとビカルタミドとの併用)を用いて実施することができる。
【0069】
幾つかの実施態様では、LHRHアンタゴニスト(例えば、アバレリクス)の投与後2週間以上経ってから、該抗体若しくはその抗原結合フラグメントの初回量を投与する。幾つかの実施態様では、LHRHアゴニストを抗アンドロゲン剤(例えばビカルタミド、フルタミド、ニルチミド)と共に投与した後2週間以上経ってから、該抗体若しくはその抗原結合フラグメントの初回量を投与する。
【0070】
PSMAの細胞外ドメインに結合して、葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントは、例えば、PSMA(例えば、PSMAの細胞外部分)又はPSMA以外の抗原(例えば、PSCA(前立腺幹細胞抗原)又は前立腺の6−膜貫通上皮抗原(six transmembrane epithelial antigen of prostate)(STEAP))に結合する、別の抗体若しくはその抗原結合フラグメントと組み合わせて用いることができる。これらの抗体若しくはその抗原結合フラグメントの一方又は両方は、上述したように、コンジュゲートすることも、コンジュゲートしないことも可能である。両方がコンジュゲートする場合には、これらは同じ又は異なる治療剤又はラベルとコンジュゲートすることができる。
【0071】
PSMAの細胞外ドメインに結合して、葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントは、他の治療法又は予防処置(例えば、抗癌ワクチン)と組み合わせて用いることができる。
【0072】
葉酸レベルの測定
癌の治療方法又は癌治療のモニターリング方法の幾つかの実施態様では、該方法は患者における葉酸レベルを測定することを含み、この場合、該患者は、PSMAの細胞外ドメインに結合して、PSMAの葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントによって治療されている。
【0073】
PSMAの酵素活性は、例えば、熱量分析、デンシトメトリー分析、スペクトログラフィ分析及びクロマトグラフィ分析、並びに映像法[例えば、磁気共鳴分光法(MRS)、磁気共鳴映像法(MRI)、単一光子放出型コンピュータ断層撮影法(SPECT)及び陽電子放出断層撮影法(PET)]を包含する、当該技術分野で知られた技術を、NAALADアーゼの検出可能な基質(本明細書ではPSMA基質とも呼ぶ)又は検出可能なPSMA結合分子と共に用いて、検出及び/又は測定することができる。
【0074】
患者における葉酸レベルの測定は、例えば、血清若しくは血漿葉酸レベル、赤血球葉酸又は両方を、例えば、化学発光イムノアッセイ、ラジオイムノアッセイ又はミクロ生物学的方法(microbiologic methods)のような 標準技術を用いて測定することを包含することができる。幾つかの実施態様では、血清葉酸レベルを、例えばWaxman and Schreiber, Blood, 42(2):281-290 (1972)によって記載されているように、測定する。葉酸の血清レベルは、患者の年齢及び使用方法に依存して、通常7〜40nmol/Lの範囲内である。体内への葉酸蓄積は、患者による低い葉酸摂取の3〜6か月間に消耗される可能性があり、葉酸摂取制限の可能な効果は、葉酸欠乏性貧血である。葉酸欠乏性貧血の診断は、低い血清葉酸レベル(<2ng/ml(<5nmol/L))又は低いRBC葉酸レベル(<100ng/ml(<227nmol/L))によって一部は確証される。それ故、幾つかの実施態様では、患者の血清若しくはRBCsを葉酸レベルに関してモニターすることができ、約5nmol/Lの血清葉酸レベルを維持するように葉酸摂取を調節することができる。他の実施態様では、1か月、2か月、3か月、4か月、5か月又は6か月間のような、ある一定の期間後に、葉酸制限を終了することができる。さらに他の実施態様では、摂取がある一定の期間制限され、その後ある一定の期間制限が解除され、これらの2つの期間が交互に繰り返されるように、葉酸制限を処方することができる。
【0075】
患者による葉酸摂取を変えることによって、患者における葉酸レベルを必要に応じて増減することができる。例えば、葉酸又は葉酸の他の膜透過形(other membrane permeable form of folate)の消耗されうる量を制限する食事を、患者に処方することができる。葉酸(folic acid)(プテログルタミン酸)は、例えば、栄養補助食品中、緑葉野菜、全粒粉、又は強化粉とレバーで作られた食品(food products made with fortified flour and liver)中に見出される。さらに、又は或いは、患者が静脈内輸液を受けている場合には、該流体を存在する葉酸量において制限することができる。さらに、又は代替的に、天然生成形の葉酸(naturally occuring forms of folate)に富んだ食品の量を制限する又は禁止する食事を、患者に処方することができる。例えば、ロメイン・レタス、ホウレン草、アスパラガス、カブ若葉、カラシ菜、子牛肝臓、パセリ、コラード葉、ブロッコリ、カリフラワー、砂糖大根及びレンティルのような食品が、豊富な葉酸供給源である。このような食品の消費を避けるように、又はこのような食品の制限された量のみを消費するように、患者に指示することができる。葉酸に富んだ食品のリストを患者に与えることができる。
【0076】
幾つかの実施態様では、患者の血清葉酸レベル又はRBC葉酸レベルが低く過ぎるレベルに、例えば、血清葉酸の場合には5nmol/L未満にまで低下することがありうる。それ故、幾つかの実施態様では、患者に葉酸(folate)を投与して、血清レベルを5nmol/Lに高めることができる。葉酸は任意の適当な手法によって、例えば、静脈内注入又は経口によって投与することができる。血清葉酸を5nmol/Lに高めるために充分であるが、血清葉酸を例えば10nmol/Lを超えては高めないような葉酸量(a dose of folic acid)を含有する、適当な栄養補助食品を患者に処方することができる。或いは、ポリグルタミルフォレート(フォリルポリグルタメート)に富んだ食品の規定量を消費する又は食べるように、患者に指示することができる。
【0077】
治療法のモニターリング、PSMAの測定
幾つかの実施態様では、PSMAの検出及び/又は測定方法は、PSMA酵素活性(本明細書ではPSMA活性とも呼ぶ)の測定及び/又は検出を含む。幾つかの実施態様では、PSMA活性の測定は、患者の組織若しくは体液のサンプル中のPSMA活性を分析することを含む。サンプル中の酵素活性レベルを検出するための任意の適当なアッセイを用いることができる。例えば、PSMAの検出可能な又は標識した基質の加水分解を用いることができる。PSMAの基質は、本明細書では、酵素基質とも呼ぶ。検査すべき組織若しくは体液のサンプルをPSMA基質と接触させて、代謝産物の適当な分離及び/又は検出方法を用いて検出することができる量の検出可能な又は標識した代謝産物を生じることができる。サンプルからの標識代謝産物の量を、既知量のPSMAを有する、少なくとも1つの基準若しくは対照と比較することができる。サンプル中のPSMA量の定量的又は定性的評価を可能にする、任意の適当な対照若しくは基準を用いることができる。例えば、陽性の対照若しくは基準は、前立腺癌細胞中又は新血管構造若しくはその他のPSMA発現腫瘍中の酵素活性なPSMAの量を表示する、組織若しくは体液からの標識代謝産物の量によって表すことができる。陰性の対照若しくは基準は、活性PSMAの不存在又は低レベルの活性PSMAの存在を表示する、組織若しくは体液からの標識代謝産物の量を表すことができる。サンプルによって生じる、検出可能な若しくは標識した代謝産物のレベルと基準若しくは対照との比較は、サンプル中の活性PSMAのレベルを表示する。PSMA活性は、PSMA活性の検出可能な代謝産物の定量的な値である。他の実施態様では、PSMA活性は、標準若しくは対照サンプルに比較した、PSMAの検出可能な代謝産物の定性的な値である。
【0078】
適当なPSMA基質は、N−アセチルアスパルチルグルタメート(NAAG)、フォレートポリグルタメート、メトトレキセートトリ−γグルタメート、メトトレキセートジ−γグルタメート、プテロイルペンタグルタメート及びこれらの誘導体を包含する。該基質は、例えば、放射性マーカー、化学発光性マーカー、酵素マーカー、発色体マーカー、又は他の検出可能なマーカーによって標識することができる。PSMA活性を検出するための適当な方法は、例えば、米国特許No.5,981,209の6欄60行〜7欄40行及び8欄63行〜9欄20行と、例えば、Clin.Cancer Res.2:1445-1451(1996); Urology 49:104-112(1997)に記載されており、これらの教示は本明細書に援用される。PSMA活性は、例えば、米国公開特許出願No.2006/0009525の段落[0281]-[0283]に記載されているような、当該技術分野における既知方法を用いて、in vitroにおいて測定することもできる。
【0079】
適当なサンプルは、PSMA又はPSMA発現細胞を含有すると予想される又は推測される、任意の体組織又は体液であることができる。幾つかの実施態様では、細胞膜からPSMAを可溶化する及び/又は放出するように、該サンプルを処理することができる。幾つかの実施態様では、PSMAをサンプル環境から浄化する又は少なくとも部分的に浄化するように、サンプルを処理することができる。好ましくは、いずれの酵素活性PSMAも酵素活性を維持し、いずれの酵素不活性PSMAも酵素不活性を維持するように、サンプルを任意に処理することができる。
【0080】
幾つかの実施態様では、適当なPSMA基質又は検出可能なPSMA結合分子を用いる、上述したような既知映像手法を用いて、PSMA量をin vivoで測定することができる。適当なPSMA結合分子は、例えば、PSMAに結合することができる抗体若しくはその抗原結合フラグメントであることができる。幾つかの実施態様では、該抗体若しくはその抗原結合フラグメントは、PSMAの細胞外ドメインに結合することができる。適当なPSMA結合分子は、当該技術分野で知られた技術を用いて、検出可能なマーカーで標識することができる。有用な検出可能なマーカーは、非限定的に、酵素基質及びイメージング試薬(imaging reagents)を包含する。イメージング試薬の例は、放射性ラベル(例えば、131I、111In、123I、99Tc、32P、125I、3H及び14C);蛍光ラベル(例えば、フルオレセイン及びローダミン);並びに化学発光分子(例えば、ルシフェリン)を包含する。適当な酵素試薬は上述してある。
【0081】
幾つかの実施態様では、PSMAに抗体若しくはその抗原結合フラグメントが結合すると、該PSMAのダイマー形成能力は阻害される。それ故、PSMAダイマーの量を、例えば、PSMA結合分子を用いて検出する又は測定することによって、「PSMA活性」を間接的に測定することができる。適当なPSMA結合分子は、例えば、PSMAに結合することができる抗体若しくはその抗原結合フラグメントを包含する。該PSMA結合分子は、上述したような、検出可能なマーカーによって標識することができる。PSMAダイマーは、例えば、ダイマーPSMAとモノマーPSMAに結合することができるPSMA結合分子、又はダイマーPSMAに特異的に結合するが、モノマーPSMAには結合しないPSMA結合分子を用いて、検出する又は測定することができる。PSMA結合分子がダイマーPSMAに対して特異的である場合には、ダイマーPSMAの測定は、サンプル若しくはその部分を該結合分子と、該結合分子が存在するいずれのダイマーPSMAとも結合するために適した条件下で接触させ、結合したPSMA結合分子のレベルを測定することを含む。
【0082】
PSMA結合分子がモノマーPSMA又はダイマーPSMAに結合することができる場合には、PSMAダイマーの測定は、例えば、サンプル若しくはその部分を該結合分子と、該抗体若しくはその抗原結合フラグメントが存在するいずれのPSMA(モノマー又はダイマー)をも結合するために適した条件下で接触させ、結合した結合分子のレベルを測定することを含む。サンプル又はその部分を、モノマーPSMAと結合することができるが、ダイマーPSMAとは結合することができないPSMA結合分子と、該結合分子が存在するいずれのPSMAとも結合するために適した条件下で接触させ、結合した結合分子のレベルを測定することを含む。ダイマーPSMAとモノマーPSMAに結合することができる結合分子のレベルを、モノマーPSMAに結合することができる該結合分子のレベルと比較して、ダイマーPSMAのレベルを決定する。
【0083】
本明細書では、患者における癌治療法のモニターリング方法をも提供する。幾つかの実施態様では、該方法は、PSMAの細胞外ドメインに結合して、該PSMAの葉酸ヒドロラーゼ活性を阻害することができる抗体若しくはその抗原結合フラグメントによって治療されている患者からPSMA発現細胞を得て、該細胞のPSMA活性を測定することを含む。
【0084】
PSMA発現細胞は、PSMA発現細胞を含有すると思われる患者からの細胞の任意の適当なソースの一部として又は該ソースから得ることができる。例えば、該細胞ソースは、血管内皮細胞を含む充実性腫瘍からのバイオプシー材料であることができる。該細胞ソースは、原発性前立腺腫瘍から又は続発性部位由来の腫瘍からのバイオプシー材料であることができる。該細胞ソースは、循環する前立腺癌細胞を含むと思われる血液であることができる。該細胞は、標準手法を用いて患者から得ることができ、PSMAが存在するならば検出されうるように保存することができる。
【0085】
PSMA活性は、細胞上に存在するダイマーPSMAの量を測定することによって、間接的に測定することができる。PSMAはダイマー分子及びモノマー分子として存在する。PSMAのダイマー形は酵素活性を有するが、モノマー形は有さない。PSMAに結合することができる、検出可能に標識された抗体若しくはその抗原結合フラグメントを用いて、細胞上に存在するダイマーPSMAの量を測定することができる。例えば、該ダイマー形を特異的に認識する、検出可能に標識された抗体若しくはその抗原結合フラグメントを用いて、細胞上のPSMAを検出することができる。該細胞を、該検出可能に標識された抗体若しくはその抗原結合フラグメントに、該抗体若しくはその抗原結合フラグメントが、存在するいずれのダイマーPSMAにも結合するために適した条件下で接触させて、結合した抗体若しくはその抗原結合フラグメントのレベルを測定することができる。
【0086】
他の実施態様では、癌の治療方法及び癌の治療のモニターリング方法は、血清中の抗体若しくはその抗原結合フラグメントのレベルを測定することを含む。幾つかの実施態様では、抗PSMA抗体は、PSMAの細胞外ドメインに結合して、PSMA酵素活性を阻害することができる。抗体若しくはその抗原結合フラグメントの血清レベルは、固定化PSMAを用いる酵素免疫測定法(Enzyme Linked Immunosorbant Assay)(ELISA)のような、当該技術分野での標準手法を用いて、測定することができる。血清は当該技術分野での標準手法を用いて患者から得る。血清を望ましい倍率で希釈して、固体担体上に固定されているPSMAに、いずれの抗PSMA抗体若しくはその抗原結合フラグメントも該固定化PSMAに結合させるために適した条件下で暴露させることができる。結合しなかった抗体若しくはその抗原結合フラグメントを洗い流して、結合した抗体若しくはその抗原結合フラグメントを、抗PSMA抗体若しくはその抗原結合フラグメントと結合させることができる、検出可能に標識した抗体を用いて、検出することができる。他の実施態様では、PSMA発現細胞(例えば、LNCaP細胞)のPSMA活性を阻害する、患者から得た血清の能力を検査することによって、抗PSMA抗体若しくはその抗原結合フラグメントのレベルを測定することができる。
【0087】
上述したように、患者への抗体若しくはその抗原結合フラグメントの投与量は、PSMA活性の量又は検出された抗体若しくはその抗原結合フラグメントの血清レベルに基づいて調節することができる。
【0088】
本明細書では、患者における癌治療法のモニターリング方法に用いることができるキットも提供する。幾つかの実施態様では、該キットは、組織若しくは血液採取装置、PSMA検出試薬、及び該PSMA検出試薬を用いて患者から得た組織若しくは血液を検査するための使用説明書を含む。
【0089】
幾つかの実施態様では、該キットは、組織若しくは血液採取装置、PSMAに結合することができる、少なくとも1つの抗体若しくはその抗原結合フラグメント、及び該少なくとも1つの抗体若しくはその抗原結合フラグメントを用いて、患者から得た組織、血液若しくは血清を検査するための使用説明書を含む。1つの実施態様では、患者からの組織、血液若しくは血清サンプルを、表面結合PSMAを有する固相試薬と反応させる。該PSMAを血清中に存在するいずれの特異的抗体若しくはその抗原結合フラグメントとも結合させた後に、結合しなかった血清構成成分を洗浄によって除去する。抗体若しくはその抗原結合フラグメントに特異的に結合することができる、検出可能に標識された抗体を加えて、結合しなかった検出可能に標識された抗体を洗浄によって除去して、結合した標識抗体を検出する。該検出可能に標識された抗体若しくはその抗原結合フラグメントのラベルが酵素である場合には、該酵素のための基質を該固相と共に、該酵素を該基質に作用させて、固体担体上の結合した抗体若しくはその抗原結合フラグメント量に比例して検出可能な生成物を生成させるために適した条件下でインキュベートする。典型的には、該レポーターは、適当な蛍光基質、発光基質又は熱量的基質の存在下で該固相をインキュベートすることによって検出される酵素である。
【0090】
それに結合したPSMAを有する固体表面は、固体担体物質(例えば、ポリマービーズ、ディップスティック、96ウェルプレート又はフィルター材)にタンパク質物質を付着させるための既知手法によって作製することができる。これらの付着方法は、一般に、該担体への該タンパク質の非特異的吸着、又は該固体担体上の化学的反応基(例えば、活性化したカルボキシル、ヒドロキシル若しくはアルデヒド基)への、通常は遊離アミン基を介した、該タンパク質の共有結合付着(covalent attachment)を包含する。或いは、ストレプトアビジン塗付プレートをビオチン化抗原(biotinylated antigen(s))(単数又は複数)と共に用いることができる。
【0091】
癌の種類
本明細書で提供する癌治療方法は、それらの細胞表面上にPSMAを発現する、少なくとも数個の細胞を含む任意の癌の治療に用いることができる。ヒトでは、正常な良性肥厚性上皮細胞(例えば、良性前立腺分泌性腺房上皮)、癌性前立腺上皮細胞(例えば、前立腺上皮内腫瘍形成及び前立腺腺癌)、及びある一定の癌細胞に近接した血管内皮細胞の表面上に発現する。このような癌細胞は、(非限定的に)、例えば、腎臓癌細胞、尿路上皮(例えば、膀胱)癌細胞、睾丸癌細胞、結腸癌細胞、直腸癌細胞、肺癌細胞(例えば、非小細胞肺癌)、乳癌細胞、肝臓癌細胞、神経(例えば、神経内分泌細胞)癌細胞、グリア癌細胞(例えば、グリア芽細胞腫)、膵臓(例えば、膵管)癌細胞、黒色腫(例えば、悪性黒色腫)癌細胞又は軟組織肉腫癌細胞を包含する。
【0092】
治療又は予防することができる前立腺障害の例は、非限定的に、前立腺炎におけるような尿生殖器炎症(例えば、平滑筋細胞の炎症);良性肥大、例えば、小結節性過形成(良性前立腺肥大若しくは肥厚);及び前立腺癌(例えば、腺癌若しくは癌)及び/又は睾丸腫瘍(再発性前立腺癌を包含する)を包含する。「再発」若しくは「再発性」前立腺癌とは、1か月間の間隔をおいた2つの継続試験での、抗癌治療(例えば、前立腺摘除若しくは放射線)後の0.4ng/dlを超えるまでのPSAレベルの上昇を意味する。癌再発は、抗癌治療から短期間にわたって、例えば、治療後数か月に起りうる、又は抗癌治療後数年経って起りうる。例えば、前立腺癌患者では、再発は、抗癌治療後数年経って、例えば、治療後4、5、6、7、8、9、10、12、14、15年まで起りうる。再発は、「局所再発」又は「遠隔再発」として分類することができる。「局所再発」は、癌になった組織又は器官に隣接した又は近接した組織又は器官で再発する癌を意味する。例えば、前立腺癌を有する対象では、前立腺に一番近い組織、精嚢、骨盤内の周囲リンパ節、前立腺に一番近い筋肉、並びに直腸及び/又は骨盤壁において、局所再発が起りうる。「遠隔再発」は、癌になった組織又は器官から遠く離れた組織又は器官で再発する癌を意味する。例えば、前立腺癌を有する対象では、遠隔再発は、骨又は他の器官に蔓延した癌を包含する。
【0093】
「癌」なる用語は、あらゆる種類の癌性増殖若しくは発癌プロセス、転移組織、又は悪性に変化した細胞、組織若しくは器官を、癌細胞若しくは該癌細胞の隣接細胞(例えば、血管内皮細胞)がそれらの細胞表面上にPSMAを発現する場合には、組織病理学的種類又は侵襲性ステージに関係なく、包含する。
【0094】
非前立腺癌性障害の例は、非限定的に、充実性腫瘍、軟組織腫瘍及び転移病変を包含する。充実性腫瘍の例は、種々な器官系の悪性腫瘍(例えば、肉腫、腺癌及び癌)、例えば、肺、胸部(breast)、リンパ系、胃腸(例えば、結腸)及び尿生殖路(例えば、腎細胞、尿路上皮細胞)、咽頭をおかす悪性腫瘍を包含する。腺癌は、大抵の結腸癌、直腸癌、腎細胞癌、肝臓癌、肺の非小細胞癌、小腸の癌及び食道の癌のような悪性腫瘍を包含する。前記癌の転移病変も、本明細書で提供する方法及び組成物を用いて、治療することも、予防することもできる。
【0095】
本明細書で提供する方法及び組成物は、種々な器官系の悪性腫瘍、例えば、肺、胸部、リンパ系、胃腸(例えば、結腸)、膀胱、尿生殖路(例えば、前立腺)、咽頭をおかす悪性腫瘍の治療に、並びに大抵の結腸癌、腎細胞癌、前立腺癌及び/又は睾丸腫瘍、肺の非小細胞癌、小腸の癌及び食道の癌のような悪性腫瘍を包含する腺癌の治療に有用でありうる。
【0096】
適当な抗体
「抗体」なる用語は、少なくとも1つの、好ましくは2つの免疫グロブリン重(H)鎖可変領域(本明細書ではVHと略記)と、少なくとも1つの、好ましくは2つの免疫グロブリン軽(L)鎖可変領域(本明細書ではVLと略記)とを含み、特定の抗原に特異的に結合することができるタンパク質を包含する。本明細書で用いる限り、「特異的結合(specific binding)」とは、少なくとも1x107M−1のアフィニティで、抗原(例えば、PSMA)に結合する、抗体の性質を意味する。幾つかの実施態様では、特異的結合は、PSMA以外の抗原(例えば、BSA、カゼイン)に結合するそのアフィニティよりも少なくとも2倍、50倍、100倍、1000倍又はそれ以上のアフィニティで、PSMA(例えば、ヒトPSMAタンパク質)に結合する能力を意味する。
【0097】
VH領域及びVL領域はさらに、「フレームワーク領域」(FR)と呼ばれる、より大きく保存される領域が散在する、「相補性決定領域」(「CDR」)と呼ばれる超可変性領域に再分割される。フレームワーク領域とCDRsの範囲は、正確に定義されている(Kabat, E. A., et al. (1991) Sequences of proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, and Chothia, C. et al. (1987) J. Mol. Biol. 196:901-917参照)。幾つかの実施態様では、VHとVLの各々は、下記順序:FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4でアミノ末端からカルボキシ末端まで配置された、3つのCDと4つのFRから構成される。
【0098】
該抗体のVH鎖又はVL鎖はさらに、免疫グロブリン重鎖又は軽鎖定常領域の全て又は一部を含むことができる。1つの実施態様では、該抗体は、2つの免疫グロブリン重鎖と2つの免疫グロブリン軽鎖から成るテトラマーである。幾つかの実施態様では、重鎖と軽鎖が、例えばジスルフィド結合によって相互に連結する。幾つかの実施態様では、重鎖定常領域は、3つのドメイン、CH1、CH2及びCH3から構成される。幾つかの実施態様では、軽鎖定常領域は、1つのドメイン、CLから構成される。重鎖及び軽鎖の可変領域は、抗原と、例えば、PSMAの細胞外部分又はその一部と相互作用する結合ドメインを含有する。幾つかの実施態様では、抗体の定常領域は、免疫系の種々な細胞(例えば、エフェクター細胞)及び伝統的な補体系の第1構成要素(C1q)を含めた、宿主組織若しくは因子への該抗体の結合を仲介する。このようにして、該抗体は、抗体依存性の細胞の細胞傷害応答及び/又は補体仲介細胞傷害性を誘出することができる。「抗体」なる用語は、IgA型、IgG型、IgE型、IgD型、IgM型(並びにこれらの亜型)の完全な免疫グロブリンを包含し、この場合に免疫グロブリンの軽鎖はκ型又はλ型でありうる。
【0099】
「その抗原結合フラグメント」なる用語は、抗原(例えば、PSMA又はPSMAの細胞外部分)に特異的に結合する抗体のいずれの部分をも包含する。例えば、抗体の抗原結合フラグメントは、それにおける1つの以上の免疫グロブリン鎖が全長ではないが、抗原に特異的に結合することができる分子を包含する。「その抗原結合フラグメント」なる用語の範囲内に包含される結合フラグメントの例は、例えば、(i)Fabフラグメント、例えば、VL、VH、CL及びCH1ドメインから成る一価フラグメント;(ii)F(ab’)2フラグメント、ヒンジ領域におけるジスルフィド架橋によって連結した2つのFabフラグメントを含む二価フラグメント;(iii)VHドメインとCH1ドメインから成るFdフラグメント;(iv)抗体のシングル・アームのVLドメインとVHドメインから成るFvフラグメント;(v)VHドメインから成るdAbフラグメント(Ward et al., (1989) Nature 341:544-546);及び(vi)抗原に特異的に結合することができる、充分なフレームワークを有する単離相補性決定領域(CDR)、例えば、可変領域の抗原結合部分を包含する。軽鎖可変領域の抗原結合部分と重鎖可変領域の抗原結合部分、例えば、Fvフラグメントの2つのドメイン、VLとVHは、組み換え方法を用いて、これらが、VL領域とVH領域が一緒になって一価分子(一本鎖Fv(scFv)として知られる;例えば、Bird et al. (1988) Science 242:423-426; and Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883参照)を形成している単一タンパク質鎖として形成されるのを可能にする合成リンカーによって、接続させることができる。このような一本鎖抗体も「その抗原結合フラグメント」なる用語の範囲内に包含されるように意図される。これらの抗体フラグメントを、当業者に知られた慣用的な手法を用いて得て、該フラグメントを、完全な抗体の場合と同じ方法で結合能力に関してスクリーニングする。
【0100】
多くの種類の抗体若しくはその抗原結合フラグメントが、本明細書で提供する方法及び組成物に有用である。抗体は、IgG(例えば、IgG1、IgG2、IgG3、IgG4)、IgM、IgA1、IgA2、IgD又はIgEを含めた、種々なアイソタイプであることができる。好ましくは、抗体はIgGアイソタイプ、例えばIgG1である。抗体分子は全長(例えば、IgG1又はIgG4)であることも、抗原結合フラグメント(例えば、Fab、F(ab’)2、Fv又は一本鎖Fvフラグメント)のみを含むこともできる。これらは、モノクローナル抗体、組換え抗体、キメラ抗体、ヒト化抗体、脱免疫化抗体及びヒト抗体、並びに前記抗体の抗原結合フラグメントを包含する。好ましくは、モノクローナル抗体又はその抗原結合フラグメントはPSMAの細胞外ドメイン又はその部分(例えば、細胞の外部に位置するPSMAのエピトープ)に結合する。PSMAに結合して、PSMA酵素活性を阻害することができる、好ましいモノクローナル抗体の例は、非限定的に、J415(ATCC寄託番号HB−12101を有するハイブリドーマ細胞系によって産生される)を包含する。
【0101】
抗体若しくはその抗原結合フラグメントは、当該技術分野で知られた方法によってヒト化することができる。マウス抗体が得られたならば、該可変領域の配列決定することができる。CDRsとフレームワーク残部の位置は決定することができる( Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, and Chothia, C. et al. (1987) J. Mol. Biol. 196:901-917参照)。軽鎖及び重鎖の可変領域は、任意に、対応する定常領域にライゲートすることができる。
【0102】
抗体若しくはその抗原結合フラグメントは、さらに、特定のヒトT細胞エピトープを削除するように修飾することもできる(本明細書では、「脱免疫化」とも呼ぶ)。抗体を脱免疫化するために適した方法は、例えば、WO 98/52976及びWO 00/34317に開示されている。簡単には、抗体若しくはその抗原結合フラグメント(例えば、マウス抗体若しくはその抗原結合フラグメント)の重鎖及び軽鎖の可変領域を、MHC Class IIに結合するペプチドに関して分析することができる:これらのペプチドは、可能なT細胞エピトープ(WO 98/52976及びWO 00/34317において定義されているような)を表す。 可能なT細胞エピトープを検出するために、コンピュータ・モデリング・アプローチを適用することができ、さらに、ヒトMHC Class II結合ペプチドのデータベースをマウスVH及びVL配列中に存在するモチーフに関して検索することができる。これらのモチーフは、18主要MHC Class II DRアロタイプのいずれにも結合する、したがって、可能なT細胞エピトープを構成する。検出された、いずれの可能なT細胞エピトープも、可変領域中のアミノ酸残基の置換によって又は単一アミノ酸置換によって削除することができる。可能な保存的置換(conservative substitution)を頻繁ではあるが排他的ではなく行なう限り、ヒト生殖細胞系抗体配列中のこの位置に共通なアミノ酸を用いることができる。ヒト生殖細胞系配列は、Tomlinson, I. A. et al. (1992) J. Mol. Biol. 227:776-798; Cook, G. P. et al. (1995) Immunol. Today Vol. 16 (5): 237-242; Chothia, D. et al. (1992) J. Mol. Bio. 227:799-817に開示されている。V BASEディレクトリー はヒト免疫グロブリン可変領域配列の包括的ディレクトリーを直接提供する (Tomlinson, I. A. et al. MRC Centre for Protein Engineering, Cambridge, UKによってコンパイルされたもの)。脱免疫化VH及びVL配列を構築した後に、該突然変異誘発した可変領域を、任意に、ヒト定常領域に融合することができる。
【0103】
他の実施態様では、抗体若しくはその抗原結合フラグメントは、ATCC寄託番号HB−12126を有する細胞系によって産生されたJ591抗体又はATCC寄託番号PTA−3709を有する細胞系によって産生された脱免疫化J591(脱J591)抗体からの軽鎖若しくは重鎖可変領域からの少なくとも1つ、2つ、好ましくは3つのCDRを有することができる。
【0104】
他の実施態様では、抗体若しくはその抗原結合フラグメントは、ATCC寄託番号HB−12109を有する細胞系によって産生された抗体J415又はATCC寄託番号PTA−4174を有する細胞系によって産生された脱免疫化J415の軽鎖若しくは重鎖可変領域からの少なくとも1つ、2つ、好ましくは3つのCDRを有することができる。
【0105】
さらに他の実施態様では、抗体若しくはその抗原結合フラグメントは、ATCC寄託番号HB−12127を有する細胞系によって産生された抗体J533又はATCC寄託番号HB−12101を有する細胞系によって産生された抗体E99の軽鎖若しくは重鎖可変領域からの少なくとも1つ、2つ、好ましくは3つのCDRを有することができる。
【0106】
幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、本明細書に記載する抗体、例えば、J591(ATCCに寄託されたハイブリドーマHB−12126によって産生)、E99(ATCCに寄託されたハイブリドーマHB−12101によって産生)、J415(ATCCに寄託されたハイブリドーマHB−12107によって産生)及びJ533(ATCCに寄託されたハイブリドーマHB−12127によって産生)のエピトープの全体又は一部に結合する。抗体若しくはその抗原結合フラグメントは、本明細書に記載する抗体、例えば、J591、E99、J415及びJ533のヒトPSMAへの結合を阻害する、例えば、競合的に阻害することができる。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、J415によって認識されるエピトープに結合する。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、J591によって認識されるエピトープに結合する。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、E99のエピトープに結合する。幾つかの実施態様では、抗体若しくはその抗原結合フラグメントは、J533によって認識されるエピトープに結合する。
【0107】
2つの抗体若しくはその抗原結合フラグメントが同じ若しくは重複エピトープに特異的に結合することができるかどうかは、Scatchard分析及び/又は競合結合アッセイによって判定することができる。抗体若しくはその抗原結合フラグメントの「特異的結合」とは、該抗体が抗原又は好ましいエピトープに対して充分なアフィニティを示し、好ましくは、有意な交差反応性(crossreactivity)を示さないことを意味する。「特異的結合」とは、少なくとも107、108、109又は1010M−1のアフィニティで結合する抗体を包含する。有意な交差反応性を示さない抗体若しくはその抗原結合フラグメントは、抗体特異性の測定に適した条件下で、好ましくない実体(例えば、好ましくないタンパク質性実体)に感知されうるほどには結合しない抗体若しくはその抗原結合フラグメントである。例えば、PSMAに特異的に結合する抗体若しくはその抗原結合フラグメントは、PSMAとは感知されうるほどに結合するが、非PSMAタンパク質若しくはペプチドとは有意に反応しない。好ましいエピトープに特異的な抗体若しくはその抗原結合フラグメントは、例えば、同じタンパク質若しくはペプチド上の遠隔エピトープ(remote epitopes)とは有意に交差反応しないか、又は該遠隔エピトープへの結合を競合的に阻害するであろう。同じエピトープを認識する抗体若しくはその抗原結合フラグメントは、1つの抗体の、標的抗原への別の抗体の結合をブロックする能力を示す、簡単なイムノアッセイ(例えば、競合結合アッセイ)で同定することができる。競合結合は、試験を受ける抗体が共通抗原(例えば、PSMA)への基準抗体の特異的結合を阻害するアッセイで測定される。非常に多くの種類の競合結合アッセイが知られている、例えば:固相直接若しくは間接ラジオイムノアッセイ(RIA)、固相直接若しくは間接エンザイム・イムノアッセイ(EIA)、サンドイッチ競合アッセイ( Stahli et al., Methods in Enzymology 9:242 (1983)参照、 さらに Kim, et al., Infect. Immun. 57:944 (1989)も参照);固相直接ビオチン−アビジンEIA( Kirkland et al., J. Immunol. 137:3614 (1986)参照);固相直接標識アッセイ、固相直接標識サンドイッチ・アッセイ (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Press (1988) pp 567-569 and 583参照);I−125ラベルを用いた固相直接ラベルRIA (Morel et al., Mol. Immunol. 25(1):7 (1988)参照);固相直接ビオチン−アビジンEIA(Cheung et al., Virology 176:546 (1990)参照);直接標識RIA(Moldenhauer et al., Scand. J. Immunol. 32:77 (1990);及び (Belanger L., Sylvestre C. and Dufour D. (1973)。このようなアッセイは、典型的に、これらの非標識試験免疫グロブリンと標識基準免疫グロブリンのいずれかを有する、固体表面又は細胞に結合した精製抗原の使用を必要とする。試験抗体の存在下で該固体表面又は細胞に結合したラベルの量を測定することによって、競合阻害が評価される。
【0108】
本明細書で提供する方法及びキットの幾つかの実施態様では、PSMAへの抗体若しくはその抗原結合フラグメントの結合は、PSMAの酵素活性を阻害する。NAALADアーゼ及びヒト・グルタミン酸カルボキシペプチダーゼII(「GCP II」)としても知られるPSMAは、ニューロペプチドN−アセチル−アスパルチル−グルタメート(「NAAG」)のN−アセチル−アスパルテート(「NAA」)とグルタメートへの加水分解に触媒作用を及ぼす酵素活性を有する。PSMA酵素活性(本明細書では、葉酸ヒドロラーゼ活性とも呼ばれる)は、以下に述べるように、検出する又は測定することができる。本明細書で用いる限り、「酵素活性を阻害する」とは、葉酸ヒドロラーゼ活性の部分的阻害を包含する。
【0109】
本明細書では、PSMA酵素活性を阻害するモノクローナル抗体を選択する又は製造する方法も提供する。モノクローナル抗体を選択する又は製造する方法の幾つかの実施態様では、該方法は、PSMAによって免疫化されている動物から得た抗体産生細胞を用いてハイブリドーマ細胞を作製する工程、PSMA酵素活性を阻害することができる抗体をハイブリドーマ細胞が産生するかどうかを判定する工程、それによってPSMA酵素活性を阻害するモノクローナル抗体を選択する工程を含む。モノクローナル抗体を選択する又は製造する他の実施態様では、細胞外PSMAに結合することができる抗体を産生するハイブリドーマ細胞を作製し、該ハイブリドーマ細胞が産生する抗体を、in vitroにおいてPSMA基質のPSMA依存性加水分解を阻害する能力に関して試験する。モノクローナル抗体は、体細胞ハイブリダイゼーション法(Kohler and Milstein, Nature 256: 495 (1975))を含めた、多様な手法によって製造することができる。一般的には、Harlow, E. and Lane, D. (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.を参照のこと。
【0110】
抗体を製造するための有用なイムノゲンは、PSMA(例えば、ヒトPSMA)負荷細胞(PSMA-bearing cell)(例えば、前立腺腫瘍細胞系、例えば、LNCaP細胞、又はMDA−Pca2b若しくはLAPC4細胞、又は新鮮な若しくは凍結前立腺腫瘍細胞);PSMA発現細胞(例えば、前立腺腫瘍細胞系、例えば、LNCaP細胞、又は新鮮な若しくは凍結前立腺腫瘍細胞;PSMA発現血管内皮細胞)の膜画分(membrane fraction);単離若しくは精製PSMA、例えば、ヒトPSMAタンパク質(例えば、生化学的に単離したPSMA若しくはその一部、例えば、PSMAの細胞外ドメイン)を包含する。PSMAに対する抗体を作製する方法は、米国特許No.6,107,090、米国特許No.6,136,311に記載されている、これらの特許の全ての内容は明確に本明細書に援用される。
【0111】
PSMA酵素活性を阻害することができる抗体は、製造した任意の抗体を、直接、酵素活性に関して、例えば、上述したようなPSMA酵素基質を用いて、最初にスクリーニングすることによって製造することができる。
【0112】
別の実施態様では、抗体をPSMAへの結合能力に関して最初にスクリーニングする。PSMAに特異的に結合することができる抗体は、PSMA酵素活性に関して検査することができる。
【0113】
ヒトタンパク質に対するヒトモノクローナル抗体(mAbs)は、マウス免疫グロブリン遺伝子ではなくヒト免疫グロブリン遺伝子を有するトランスジェニック・マウスを用いて作製することができる。所定の抗原(antigen of interest)によって免疫化した、これらのトランスジェニック・マウスからの脾細胞を用いて、ヒトタンパク質からのエピトープに対して特異的アフィニティを有するヒトmAbsを分泌するハイブリドーマを製造する(例えば、Wood et al. International Application WO 91/00906, Kucherlapati et al. PCT publication WO 91/10741; Lonberg et al. International Application WO 92/03918; Kay et al. International Application 92/03917; Lonberg, N. et al. 1994 Nature 368:856-859; Green, L. L. et al. 1994 Nature Genet. 7:13-21; Morrison, S. L. et al. 1994 Proc. Natl. Acad. Sci. USA 81:6851-6855; Bruggeman et al. 1993 Year Immunol. 7:33-40; Tuaillon et al. 1993 PNAS 90:3720-3724; Bruggeman et al. 1991 Eur J Immunol 21:1323-1326参照)。
【0114】
本発明に有用な抗体若しくはその抗原結合フラグメントは、所望の抗体の免疫グロブリン軽鎖及び重鎖をコードするDNAによって形質転換した宿主細胞が産生した組換え抗体であることもできる。組換え抗体は、既知の遺伝子工学手法によって製造することができる。例えば、ヌクレオチド配列、例えば、所望の抗体の免疫グロブリン軽鎖及び重鎖をコードするcDNA若しくはゲノムDNAをクローニングすることによって、組換え抗体を製造することができる。次に、これらのポリペプチドをコードするヌクレオチド配列を発現ベクター中に挿入して、両方の遺伝子がそれらの独自の転写及び翻訳発現制御配列に作用的に連結するようにする。用いる発現宿主細胞と適合するように、発現ベクターと発現制御配列を選択する。典型的に、両方の遺伝子を同一発現ベクターに挿入する。原核生物又は真核生物の宿主細胞が使用可能である。
【0115】
真核生物細胞は、適当に折り畳まれた免疫活性な抗体(properly folded and immunologically active antibody)をアセンブルして、分泌するために原核生物細胞よりも有望であるので、真核生物宿主細胞における発現が好ましい。しかし、産生された抗体が、不適当な折り畳み(folding)のために不活性であっても、周知の方法によって再生可能でありうる(Kim and Baldwin, "Specific Intermediates in the Folding Reactions of Small Proteins and the Mechanism of Protein Folding", Ann. Rev. Biochem. 51, pp. 459-89 (1982))。該宿主細胞が、完全な抗体の一部、例えば、軽鎖ダイマー又は重鎖ダイマーを産生する可能性があり、これらも抗体若しくはその抗原結合フラグメントに包含される。
【0116】
上記手段の幾つかの変形(variations)が、本明細書で提供する方法及び組成物のために有用であることは理解されよう。例えば、抗体の軽鎖又は重鎖のいずれか(但し、両方ではなく)をコードするDNAによって宿主細胞を形質転換することが望ましい可能性がある。PSMA結合のために必要ではない、軽鎖及び重鎖のいずれか又は両方をコードするDNAの一部又は全てを除去するために組換えDNAテクノロジーを利用することもできる、例えば、特定のアミノ酸を欠失させることによって、定常領域を修飾することができる。このような切断型DNA分子から発現された分子は、本明細書に記載する方法及び組成物のために有用である。さらに、1つの重鎖と1つの軽鎖が抗PSMA抗体であり、他方の重鎖及び軽鎖がPSMA以外の抗原又はPSMAの別のエピトープに特異的である二官能性抗体を製造することができる。
【0117】
当該技術分野で知られた組換えDNA手法によって、キメラ抗体を製造することができる。例えば、マウス(又は他の種)モノクローナル抗体分子のFc定常領域をコードする遺伝子を制限酵素によって消化させて、マウスFcをコードする領域を取り出して、ヒトFc定常領域をコードする遺伝子の同等部分を置換する。
【0118】
抗体又は免疫グロブリン鎖を当該技術分野で知られた方法によってヒト化することができる。マウス抗体がひと度得られたならば、可変領域を配列決定することができる。CDRsとフレームワーク残基の位置を知ることができる。場合によっては、軽鎖及び重鎖の可変領域を対応する定常領域にライゲートすることができる。
【0119】
ヒト化された又はCDR移植された抗体分子又は免疫グロブリンをCDR移植又はCDR置換によって製造することができ、この場合には、免疫グロブリン鎖のCDRsの1つ、2つ又は全てを交換することが可能である。例えば、米国特許No. 5,225,539;Jones et al. 1986 Nature 321:552-525;Verhoeyan et al. 1988 Science 239:1534;;Beidler et al. 1988 J. Immunol. 141:4053-4060; Winter 米国特許. No. 5,225,539.参照。
【0120】
特定ヒト抗体のCDRの全てを、所定の抗原(the antigen of interest)に結合することができる、抗体若しくはその抗原結合フラグメントからの非ヒトCDRの少なくとも一部と交換することができる、又は該CDRの一部のみを非ヒトCDRと交換することができる。所定の抗原にヒト化抗体を結合させるために必要な数のCDRを交換することのみが必要である。
【0121】
抗原結合に直接関与しないFv可変領域の配列を、ヒトFv可変領域からの同等配列と交換することによって、ヒト化抗体を作製することができる。ヒト化抗体を作製するための一般的な方法は、Morrison, S. L., 1985, Science 229:1202-1207;Oi et al., 1986, BioTechniques 4:214、及び Queen et al. 米国特許No. 5,585,089、米国特許No. 5,693,761 及び米国特許No. 5,693,762によって提供されている。これらの方法は、重鎖又は軽鎖の少なくとも一方からの免疫グロブリンFv可変領域の全て又は一部をコードする核酸配列の単離、操作(manipulating)及び発現を包含する。このような核酸のソースは、当業者に周知であり、所定の抗原に対する抗体を産生するハイブリドーマから得ることができる。ヒト化抗体若しくはそのフラグメントをコードする組換えDNAを次に、適当な発現ベクターにクローン化することができる。
【0122】
抗PSMA抗体若しくはその抗原フラグメントは、WO 98/52976 及び WO 00/34317に開示された方法による、ヒトT細胞エピトープの特定の欠失又は「脱免疫化」によって修飾することもできる。簡単に説明すると、抗PSMA抗体のマウス重鎖及び軽鎖可変領域を、MHC ClassIIに結合するペプチドに関して分析することができる;これらのペプチドは可能なT細胞エピトープを表す。
【実施例】
【0123】
PSMA発現に対するホルモン消退の影響
前立腺癌細胞系、LNCaPとMDA−Pca−2bを、10%胎仔ウシ血清(FCS)又は活性炭処理してある(charcoal stripped)10%FCS(CS−FCS)を含有する標準培地中で増殖させた。FCSは、アンドロゲンを含めたステロイドホルモンを含有するが、CS−FCSは、活性炭処理(charcoal stripping)がステロイドホルモンを含めた、血清の一部の成分を除去するので、アンドロゲンを含めたステロイドホルモンを有さない。活性炭処理は、培地からホルモンを除去するための標準方法である。種々な曲線が、CS−FCS中で指定の期間細胞を増殖させた後のPSMAレベルを表す。該細胞をJ591、抗PSMA抗体と接触させ、続いて、J591を認識する標識第2抗体と接触させることによって、PSMAレベルは検出される。次に、標識細胞をFACSに関して分析する。
【0124】
図1は、LNCaP細胞におけるPSMA発現が1週間目(ライン3)には殆ど増加していないことを示す。しかし、2週間(ライン4)までには、PSMA発現が9倍増加に同等であることを示す。ピークが右側にもはや移動していないことを実証するように、2週間を経て3週間目(ライン5)にはPSMA発現にアップレギュレーションは殆ど存在しない。3週間ピークは、細胞の一部がホルモン補給の損失のために死んでいる(これはこのアッセイでは測定しない)ため、y軸上で低下する。
【0125】
図2は、MDA−Pca−2bが、ホルモン消退が無い場合に、非常に類似したPSMA発現パターンを有することを示す。ライン1は陰性対照を表し、ライン2は、10%FCSを含む標準培地における発現レベルを表し、ライン3は、該細胞をCS−FCS培地中で2週間培養した後のPSMA発現を表し、ライン4は、該細胞をCS−FCS培地中で3週間培養した後のPSMA発現を表す。
【0126】
細胞増殖速度に対する葉酸濃度の影響
図3において実証されるように、前立腺癌(PC)細胞の増殖速度は、利用可能な葉酸(folate)に直接比例して上昇し、このことは、PC細胞が葉酸(folate)をより多量に取り込むならば、PC細胞はより迅速に増殖することができることを示す。葉酸レベルが生理的レベルを超えて上昇するならば、増殖速度はほぼ2倍に上昇しうる。PSMAを発現する細胞系(例えば、LNCaP)では、PSMAによって消化されてモノグルタメート化葉酸(monoglutamated folate)になる、「天然」若しくは食物葉酸(例えば、ポリグルタメート化葉酸(polyglutamated folate)の形態で葉酸が提供される場合にも、同じ増殖上昇が見出される。前者(モノグルタメート化葉酸)は細胞膜を横切ることができるが、ポリグルタメート化葉酸はできない。
【0127】
抗PSMA抗体、J415はPSMA酵素活性を阻害する
標準培地中で増殖したLNCaP細胞を、指示濃度の指示抗体と共にインキュベートする。細胞をPSMA酵素活性に関して検査した。簡単に説明すると、PSMAを放射性標識した基質(例えば、NAAG)と共にインキュベートした。インキュベーション後に、反応混合物を、標識グルタメート生成物を保持するが、該基質を保持しないカラム上をランさせた。γカウンター中で標識グルタメート量を測定した。標識グルタメートの測定された量は、酵素活性の量に比例する。PSMAは精製された、組換え体又は細胞関連型(cell-associated)であることができる。第1インキュベーション工程に阻害剤を含めることによって、そして適当な陽性対照と陰性対照を用いることによって、阻害に関して分析して、阻害のレベルを算出することができる。図4によって実証されるように、抗体J415は、5,000ng/ml(5μg/ml)の濃度において、PSMA/FolH1酵素活性を最大に阻害する。最大阻害は約70%である。J591もPSMA/FolH1酵素活性を阻害するが、J415ほどではない。酵素部位から離れた、PSMAの細胞内エピトープと結合する7E11抗体は、PSMA/FolH1阻害活性を有さない。
【0128】
図4によって実証されるように、抗体J415は、5,000ng/ml(5μg/ml)の濃度において、PSMA/FolH1酵素活性を最大に阻害する。最大阻害は約70%である。J591もPSMA/FolH1酵素活性を阻害する。酵素部位から離れた、PSMAの細胞内エピトープと結合する7E11抗体は、PSMA/FolH1阻害活性を有さない。したがって、J415によって最も効果的に達成される、PSMA(葉酸ヒドロラーゼ)酵素活性の阻害は、PSMA発現細胞が細胞不透過性フォリルポリグルタメートを細胞透過性フォリルポリグルタメートに転化させる能力を低下させ、それによって、細胞の代謝と増殖のための葉酸の細胞内有効性を低下させる。PSMA発現は、倍地中の葉酸減少に応じてアップレギュレートする。
【0129】
世界保健機構によると、血清葉酸の生理的レベルは12nmol/Lである。標準の組織培養培地は、ヒト血清/血漿中に見出される葉酸濃度の約150倍を含有する。本明細書で実証されるように、倍地中の葉酸濃度が生理的レベルに変化すると、種々な腎臓癌細胞系及び前立腺癌細胞系におけるPSMA発現レベルはアップレギュレートする。図5〜11は、標準培地(生理的レベルの150倍の葉酸を含有;ライン2)、50nM葉酸のみを含む標準培地(ライン3)、又は10nM葉酸のみを含む標準培地(ライン4)中で3週間増殖させた、種々な細胞系のPSMA発現レベルを示す。細胞は抗PSMA抗体J591で標識し、次に、J591を認識する蛍光標識された第2抗体で標識した。ライン1は陰性アイソタイプ対照抗体で標識し、次に、該標識された第2抗体で標識した細胞を示す。
【0130】
図5は、葉酸レベルが10nMに低下すると、ヒト腎臓癌細胞系、SK−RC−31によるPSMA発現が250%増加したことを示す。図6は、葉酸レベルが10〜50nMに低下すると、ヒト腎臓癌細胞系、SK−RC−42によるPSMA発現が650%増加したことを示す。図7は、葉酸レベルが10nMに低下すると、ヒト腎臓癌細胞系、SK−RC−39によるPSMA発現が250%増加したことを示す。図8は、葉酸レベルが50nM以下に低下すると、ヒト腎臓癌細胞系、SK−RC−06によるPSMA発現が225%増加したことを示す。図9は、葉酸レベルが10nMに低下すると、ヒト前立腺癌細胞系、Cwr22rv1によるPSMA発現が950%増加したことを示す。図10は、葉酸レベルが50nM以下に低下すると、ヒト前立腺癌細胞系、PC3によるPSMA発現が400%増加したことを示す。図11は、培地中の葉酸レベルの低下が、ヒト前立腺癌細胞系、LNCaP(構成的に非常に高レベルのPSMAを発現する細胞系)によるPSMA発現のアップレギュレーションを惹起しなかったことを示す。
【0131】
ライン4「低葉酸(low folate)」は、ヒトに見出される、標準の生理的葉酸レベルに近い。これまでの葉酸蓄積を消去させるために3週間を選択した、これはPSMA発現上昇のタイミングに基づくものであった。
【0132】
葉酸レベルの低下はLNCaP細胞増殖のドセタキセル阻害を可能にする。
【0133】
10若しくは20μg/mlの濃度でのドセタキセル(タキソテール)をLNCaP細胞と共に、培養培地から葉酸の形態で供給された葉酸の種々な濃度で、72時間インキュベートした。1週間後に細胞をカウントした。図12に示すように、葉酸レベルが低下すると、ドセタキセル(前立腺癌及びその他の癌に用いられる認可化学療法剤)に由来する細胞死傷/増殖阻害は増加する。無地バー(open bar)はドセタキセルで処理しない対照であり、斑点入りバーは、指示濃度の葉酸と共にドセタキセル10μg/mlで処理した細胞であり、縞模様バーは、指示濃度の葉酸と共にドセタキセル20μg/mlで処理した細胞である。指示濃度の葉酸は、胎仔ウシ血清中に存在する葉酸によって生じる葉酸の生理的レベル以上である(例えば、12nm葉酸は生理的レベルを超えた12nm葉酸を表す)。図12によって実証されるように、葉酸レベルが低下すると、タキソテールの効力は上昇する。癌細胞に対する葉酸有効性が低下すると、他の細胞傷害剤、細胞増殖抑制剤及びホルモン剤の抗腫瘍効果は増強する可能性がある。
【0134】
PSMA活性を阻害する抗体によるマウス前立腺癌腫瘍モデルの治療は、腫瘍増殖を50%緩慢にする。
【0135】
ヌードマウス(8匹/グループ)に、マトリゲル中のヒトLNCaP前立腺癌細胞を0日目に注入した。マウス血清葉酸レベルは、平均して、ヒト血清レベルの10〜40倍である。それ故、葉酸を添加せず、そしてマウスの血清葉酸濃度を低下させるために腸内細菌が葉酸合成するのを阻止するように抗生物質を添加した食餌で、全てのマウスを飼育した。2グループのマウス(AとB)には、かれらの飲料水中でフォリルポリグルタメートを与えた。フォリルポリグルタメートは、食物中に天然に見出される葉酸の形態(the form of folate)であり、既述したように、細胞膜を横切らない。PSMAはフォリルポリグルタメートからグルタメートを除去して、細胞膜を横切ることができるフォリルモノグルタメートを生成する。マウスの葉酸摂取と葉酸合成を制御して、ヒトの葉酸生理学をできる限り密接に模倣する。
【0136】
動物を3種類の異なる抗PSMA抗体、J591、7E11及びJ415によって、1日目に、そしてその後は2週間毎に処理した。グループ1はJ591を摂取し、グループ2は7E11を受容し、グループ3はJ415を受容した。これらの抗体は標識されない、裸の抗体であった。投与量は、マウス1匹につき250μg/1回量であった。腫瘍測定は、各グループが受けた治療を知らされていない実験助手(laboratory assistants)がキャリパーによって行なった。Bグループの動物は、有効な処理を受けない対照グループである。図13に示すように、PSMA/FOLH1酵素活性を阻害する能力を有さない7E11と、PSMA/FOLH1酵素活性を阻害する最少の能力を有するJ591とは、腫瘍増殖に殆ど影響を及ぼさない。しかし、J415処理したマウスの2グループ[1グループはフォリルポリグルタメート受容(グループA)そして1グループは処理せず(グループ3)]は、両方とも50%低下した腫瘍増殖を示す。
【0137】
抗体若しくはその抗原結合フラグメントを放射性ラベル又は細胞傷害剤で標識する方法の実施例は、Banderへの米国公開出願No.20060088539とNo.20060275212に見出され、特に、該実施例では、これらの出願の教示がそれらの全体で本明細書に援用される。
【0138】
本明細書で提供するテクノロジーは、本発明の要旨又はその本質的な特徴から逸脱することなく、他の特定の形態でも具体化することが可能である。それ故、上記実施態様は、あらゆる観点で、本明細書に記載するテクノロジーに対する制限ではなく例示と見なすべきである。したがって、本明細書で提供するテクノロジーの範囲は、上記の説明によってではなく、添付する特許請求の範囲によって表示される、そして該特許請求の範囲の同等物の意味及び範囲内に入る、あらゆる変化は、それ故、本発明の範囲内に包含されるように意図される。
【特許請求の範囲】
【請求項1】
ホルモン療法に適したホルモンと、PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントであって、ルテチウム−177にコンジュゲートする該抗体若しくはその抗原結合フラグメントとの、患者の早期前立腺癌の治療用薬物の製造における使用であって、この場合、該抗体若しくはその抗原結合フラグメントの初回量は、ホルモン療法を開始した後1日目〜4週間目に該患者に投与すべきである、又は該抗体若しくはその抗原結合フラグメントの初回量は、該患者の血清テストステロンレベルが50ng/ml以下に達した後1日目〜4週間目に該患者に投与すべきである使用。
【請求項2】
患者が高い前立腺特異的抗原(PSA)レベルを有し、直径0.9cmより大きい軟組織疾患を有さない場合の請求項1及び3〜7のいずれか1項に記載の使用。
【請求項3】
該抗体若しくはその抗原結合フラグメントが作用剤にコンジュゲートする、又は抗体依存性の細胞の細胞傷害反応を誘出することができる場合の請求項1、2及び4〜7のいずれか1項に記載の使用。
【請求項4】
該抗体若しくはその抗原結合フラグメントがPSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる場合の請求項1〜3及び5〜7のいずれか1項に記載の使用。
【請求項5】
患者のPSMA発現細胞上のPSMAの表面レベルを測定することをさらに含み、該患者のPSMA発現細胞上のPSMAの細胞表面レベルが5倍以上に上昇した後1〜5日間目に、該抗体若しくはその抗原結合フラグメントの初回量を投与する、請求項1〜4、6及び7のいずれか1項に記載の使用。
【請求項6】
患者のPSMA発現細胞上のPSMAの表面レベルを測定することをさらに含み、PSMA発現細胞上のPSMAの細胞表面レベルが9倍以上に上昇した後1〜5日間の範囲内に、該抗体若しくはその抗原結合フラグメントの初回量を投与する、請求項1〜5及び7のいずれか1項に記載の使用。
【請求項7】
患者の血清テストステロン・レベルをモニターリングすることをさらに含む、請求項1〜6のいずれか1項に記載の使用。
【請求項8】
PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる、標識されていない抗体若しくはその抗原結合フラグメントの、患者における癌の治療用薬剤の製造における使用であって、該患者による葉酸摂取の制限と組み合わせて、該薬剤が用いられることになる使用。
【請求項9】
患者による葉酸摂取が、葉酸を含有する栄養補助食品を禁止することによって、制限される、請求項8及び10〜27のいずれか1項に記載の使用。
【請求項10】
葉酸摂取が400μg/日以下になるように、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、患者による葉酸摂取が制限される、請求項8、9及び11〜27のいずれか1項に記載の使用。
【請求項11】
該癌が前立腺癌である、請求項8〜10及び12〜27のいずれか1項に記載の使用。
【請求項12】
標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与する前に、患者による葉酸摂取が制限される、請求項8〜11及び13〜27のいずれか1項に記載の使用。
【請求項13】
患者による葉酸摂取を制限した24時間以内に、標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与することになる、請求項8〜12及び14〜27のいずれか1項に記載の使用。
【請求項14】
患者による葉酸摂取を制限した後2週間目に、標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与することになる、請求項8〜13及び15〜27のいずれか1項に記載の使用。
【請求項15】
患者の血清又は血漿中に抗体若しくはその抗原結合フラグメントの5μg/ml以上の血清濃度を維持するために充分な量で、該標識されていない抗体若しくはその抗原結合フラグメントが投与される、請求項8〜14及び16〜27のいずれか1項に記載の使用。
【請求項16】
該標識されていない抗体若しくはその抗原結合フラグメントが抗体であり、患者中に該抗体の約50μg/mlの血清濃度を得るために充分な量で、該抗体が投与される、請求項8〜15及び17〜27のいずれか1項に記載の使用。
【請求項17】
該標識されていない抗体若しくはその抗原結合フラグメントが、ATCC寄託受け入れ番号HB−12109で寄託されたハイブリドーマによって産生されたモノクローナル抗体若しくはその抗原結合フラグメントである、請求項8〜16及び18〜27のいずれか1項に記載の使用。
【請求項18】
患者における該標識されていない抗体若しくはその抗原結合フラグメントの血中レベルを測定して、抗体若しくはその抗原結合フラグメントの投与量を調節して、5μg/ml以上の血清濃度を維持することをさらに含む、請求項8〜17及び19〜27のいずれか1項に記載の使用。
【請求項19】
患者における葉酸の血中レベルを測定することをさらに含む、請求項8〜18及び20〜27のいずれか1項に記載の使用。
【請求項20】
患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、葉酸の血中レベルに基づいて、患者による葉酸摂取を調節することをさらに含む、請求項19記載の使用。
【請求項21】
患者に化学療法剤を投与することをさらに含む、請求項8〜20及び22〜27のいずれか1項に記載の使用。
【請求項22】
該化学療法剤が葉酸代謝のアンタゴニストである、請求項21記載の使用。
【請求項23】
該アンタゴニストが、葉酸代謝活性を約40%以下だけ低減させる用量で投与される、請求項22記載の使用。
【請求項24】
該化学療法剤がドセタキセルである、請求項21記載の使用。
【請求項25】
患者のPSMA発現細胞のPSMA活性を測定することをさらに含む、請求項8〜24、26及び27のいずれか1項に記載の使用。
【請求項26】
患者にホルモン療法を投与することをさらに含む、請求項8〜25及び27のいずれか1項に記載の使用。
【請求項27】
患者に、標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与した24時間以内にホルモン療法を開始する、請求項26記載の使用。
【請求項28】
癌治療用キットであって、(a)PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントと、(b)患者による葉酸摂取を制限するための使用説明書を含むキット。
【請求項29】
該抗体若しくはその抗原結合フラグメントが細胞傷害剤にコンジュゲートする、又は抗体依存性の細胞の細胞傷害反応を誘出することができる、請求項28記載のキット。
【請求項30】
患者における癌治療のモニターリング・キットであって、(a)組織若しくは血液採集装置;(b)PSMA活性検出試薬;及び(c)該PSMA活性検出試薬を用いて,該患者から得られた組織若しくは血液サンプルを検査するための使用説明書を含むキット。
【請求項31】
患者における癌治療のモニターリング・キットであって、(a)血液採取装置;(b)葉酸検出試薬、及び(c)該葉酸検出試薬を用いて,該患者から得られた赤血球又は血清を検査するための使用説明書を含むキット。
【請求項32】
該キットを用いて検出した葉酸レベルに基づいて、患者による葉酸摂取を低減するための使用説明書をさらに含む、請求項31記載のキット。
【請求項33】
患者における前立腺癌の治療方法であって、患者が早期前立腺癌を有すると診断された場合に、該患者にホルモン療法を投与する段階と;PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントであって、ルテチウム−177にコンジュゲートする該抗体若しくはその抗原結合フラグメントを投与する段階を含み、該抗体若しくはその抗原結合フラグメントの初回量は、ホルモン療法を開始した後1日目〜4週間目に投与される方法。
【請求項34】
患者が高い前立腺特異的抗原(PSA)レベルを有し、直径0.9cmより大きい軟組織疾患を有さない、請求項33記載の方法。
【請求項35】
患者における前立腺癌の治療方法であって、患者にホルモン療法を投与する段階と、PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントを該患者に投与する段階とを含み、該患者の血清テストステロン・レベルが50ng/ml以下に達した後1日目〜4週間目に、該抗体若しくはその抗原結合フラグメントの初回量が投与される方法。
【請求項36】
該抗体若しくはその抗原結合フラグメントが作用剤にコンジュゲートする、又は抗体依存性の細胞の細胞傷害反応を誘出することができる、請求項35及び37〜42のいずれか1項に記載の方法。
【請求項37】
該抗体若しくはその抗原結合フラグメントがPSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる、請求項35、36及び38〜42のいずれか1項に記載の方法。
【請求項38】
患者のPSMA発現細胞上のPSMAの表面レベルを測定することをさらに含む、請求項35〜37及び39〜42のいずれか1項に記載の方法。
【請求項39】
患者のPSMA発現細胞上のPSMAの細胞表面レベルが5倍以上に上昇したときに、該抗体若しくはその抗原結合フラグメントの初回量が投与される、請求項35〜38及び40〜42のいずれか1項に記載の方法。
【請求項40】
患者のPSMA発現細胞上のPSMAの表面レベルを測定することをさらに含み、該患者のPSMA発現細胞上のPSMAの細胞表面レベルが5倍以上に上昇した後1〜5日間目に、該抗体若しくはその抗原結合フラグメントの初回量が投与される、請求項35〜39、41及び42のいずれか1項に記載の方法。
【請求項41】
患者のPSMA発現細胞上のPSMAの表面レベルを測定することをさらに含み、PSMA発現細胞上のPSMAの細胞表面レベルが9倍以上に上昇した後1〜5日間以内に、該抗体若しくはその抗原結合フラグメントの初回量が投与される、請求項35〜40及び42のいずれか1項に記載の方法。
【請求項42】
患者における血清テストステロン・レベルをモニターリングすることをさらに含む、請求項35〜41のいずれか1項に記載の方法。
【請求項43】
標識されていない抗体若しくはその抗原結合フラグメントによる患者における癌の治療方法であって、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる該標識されていない抗体若しくはその抗原結合フラグメントを該患者に投与する段階と、該患者による葉酸摂取を制限する段階を含む方法。
【請求項44】
葉酸を含有する栄養補助食品を禁止することによって、患者による葉酸摂取が制限される、請求項43及び45〜62のいずれか1項に記載の方法。
【請求項45】
葉酸摂取が400μg/日以下になるように、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、患者による葉酸摂取が制限される、請求項43、44及び46〜62のいずれか1項に記載の方法。
【請求項46】
該癌が前立腺癌である、請求項43〜45及び47〜62のいずれか1項に記載の方法。
【請求項47】
標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与する前に、患者による葉酸摂取を制限する、請求項43〜46及び48〜62のいずれか1項に記載の方法。
【請求項48】
患者による葉酸摂取を制限した24時間以内に、標識されていない抗体若しくはその抗原結合フラグメントの初回量が投与される、請求項43〜47及び49〜62のいずれか1項に記載の方法。
【請求項49】
患者による葉酸摂取の制限を開始した後2週間目に、該標識されていない抗体若しくはその抗原結合フラグメントの初回量が投与される、請求項43〜48及び50〜62のいずれか1項に記載の方法。
【請求項50】
患者の血清又は血漿中の抗体若しくはその抗原結合フラグメントの5μg/ml以上の血清濃度を維持するために充分な量で、該標識されていない抗体若しくはその抗原結合フラグメントが投与される、請求項43〜49及び51〜62のいずれか1項に記載の方法。
【請求項51】
該標識されていない抗体若しくはその抗原結合フラグメントが抗体であり、患者中に抗体の約50μg/mlの血清濃度を得るために充分な量で、該抗体が投与される、請求項43〜50及び52〜62のいずれか1項に記載の方法。
【請求項52】
該標識されない抗体若しくはその抗原結合フラグメントが、ATCC寄託受け入れ番号HB−12109で寄託されたハイブリドーマによって産生されたモノクローナル抗体若しくはその抗原結合フラグメントである、請求項43〜51及び53〜62のいずれか1項に記載の方法。
【請求項53】
患者における標識されない抗体若しくはその抗原結合フラグメントの血中レベルを測定して、5μg/ml以上の血清濃度を維持するために抗体若しくはその抗原結合フラグメントの投与量を調節することをさらに含む、請求項43〜52及び54〜62のいずれか1項に記載の方法。
【請求項54】
患者における葉酸の血中レベルを測定することをさらに含む、請求項43〜53及び55〜62のいずれか1項に記載の方法。
【請求項55】
患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、葉酸の血中レベルに基づいて、患者による葉酸摂取を調節することをさらに含む、請求項54記載の方法。
【請求項56】
患者に化学療法剤を投与することをさらに含む、請求項43〜55及び57〜62のいずれか1項に記載の方法。
【請求項57】
該化学療法剤が葉酸代謝のアンタゴニストである、請求項56記載の方法。
【請求項58】
該アンタゴニストが、葉酸代謝活性を約40%以下だけ低減する用量で投与される、請求項43〜57及び59〜62のいずれか1項に記載の方法。
【請求項59】
該化学療法剤がドセタキセルである、請求項56記載の方法。
【請求項60】
患者のPSMA発現細胞のPSMA活性を測定することをさらに含む、請求項43〜59及び61〜62のいずれか1項に記載の方法。
【請求項61】
患者にホルモン療法を投与することをさらに含む、請求項43〜60及び62〜62のいずれか1項に記載の方法。
【請求項62】
患者に、標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与した24時間以内にホルモン療法を開始する、請求項61記載の方法。
【請求項63】
患者における葉酸の血中レベルを測定することを含む、患者における癌治療のモニターリング方法であって、この場合に、患者による葉酸摂取が400μg/日以下に、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、制限されており、そしてPSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも単回量を患者が受容している方法。
【請求項64】
患者のPSMA発現細胞のPSMA活性を測定することを含む、患者における癌治療のモニターリング方法であって、この場合に、患者による葉酸摂取が400μg/日以下に、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、制限されており、そしてPSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも単回量を患者が受容している方法。
【請求項65】
患者における早期前立腺癌の治療用キットであって、PSMAの細胞外ドメインに結合することできる抗体若しくはその抗原結合フラグメントであって、ルテチウム177にコンジュゲートする抗体若しくはその抗原結合フラグメントと;ホルモン療法を開始した後1日目〜4週間目、又は患者の血清テストステロン・レベルが50ng/ml以下に達した後1日目〜4週間目のいずれかに該抗体若しくはその抗原結合フラグメントの初回量を投与するための使用説明書を含むキット。
【請求項66】
患者における癌治療用キットであって、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる、標識されていない抗体若しくはその抗原結合フラグメントと;患者による葉酸摂取の制限と組み合わせて、該標識されていない抗体若しくはその抗原結合フラグメントを投与するための使用説明書を含むキット。
【請求項1】
ホルモン療法に適したホルモンと、PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントであって、ルテチウム−177にコンジュゲートする該抗体若しくはその抗原結合フラグメントとの、患者の早期前立腺癌の治療用薬物の製造における使用であって、この場合、該抗体若しくはその抗原結合フラグメントの初回量は、ホルモン療法を開始した後1日目〜4週間目に該患者に投与すべきである、又は該抗体若しくはその抗原結合フラグメントの初回量は、該患者の血清テストステロンレベルが50ng/ml以下に達した後1日目〜4週間目に該患者に投与すべきである使用。
【請求項2】
患者が高い前立腺特異的抗原(PSA)レベルを有し、直径0.9cmより大きい軟組織疾患を有さない場合の請求項1及び3〜7のいずれか1項に記載の使用。
【請求項3】
該抗体若しくはその抗原結合フラグメントが作用剤にコンジュゲートする、又は抗体依存性の細胞の細胞傷害反応を誘出することができる場合の請求項1、2及び4〜7のいずれか1項に記載の使用。
【請求項4】
該抗体若しくはその抗原結合フラグメントがPSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる場合の請求項1〜3及び5〜7のいずれか1項に記載の使用。
【請求項5】
患者のPSMA発現細胞上のPSMAの表面レベルを測定することをさらに含み、該患者のPSMA発現細胞上のPSMAの細胞表面レベルが5倍以上に上昇した後1〜5日間目に、該抗体若しくはその抗原結合フラグメントの初回量を投与する、請求項1〜4、6及び7のいずれか1項に記載の使用。
【請求項6】
患者のPSMA発現細胞上のPSMAの表面レベルを測定することをさらに含み、PSMA発現細胞上のPSMAの細胞表面レベルが9倍以上に上昇した後1〜5日間の範囲内に、該抗体若しくはその抗原結合フラグメントの初回量を投与する、請求項1〜5及び7のいずれか1項に記載の使用。
【請求項7】
患者の血清テストステロン・レベルをモニターリングすることをさらに含む、請求項1〜6のいずれか1項に記載の使用。
【請求項8】
PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる、標識されていない抗体若しくはその抗原結合フラグメントの、患者における癌の治療用薬剤の製造における使用であって、該患者による葉酸摂取の制限と組み合わせて、該薬剤が用いられることになる使用。
【請求項9】
患者による葉酸摂取が、葉酸を含有する栄養補助食品を禁止することによって、制限される、請求項8及び10〜27のいずれか1項に記載の使用。
【請求項10】
葉酸摂取が400μg/日以下になるように、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、患者による葉酸摂取が制限される、請求項8、9及び11〜27のいずれか1項に記載の使用。
【請求項11】
該癌が前立腺癌である、請求項8〜10及び12〜27のいずれか1項に記載の使用。
【請求項12】
標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与する前に、患者による葉酸摂取が制限される、請求項8〜11及び13〜27のいずれか1項に記載の使用。
【請求項13】
患者による葉酸摂取を制限した24時間以内に、標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与することになる、請求項8〜12及び14〜27のいずれか1項に記載の使用。
【請求項14】
患者による葉酸摂取を制限した後2週間目に、標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与することになる、請求項8〜13及び15〜27のいずれか1項に記載の使用。
【請求項15】
患者の血清又は血漿中に抗体若しくはその抗原結合フラグメントの5μg/ml以上の血清濃度を維持するために充分な量で、該標識されていない抗体若しくはその抗原結合フラグメントが投与される、請求項8〜14及び16〜27のいずれか1項に記載の使用。
【請求項16】
該標識されていない抗体若しくはその抗原結合フラグメントが抗体であり、患者中に該抗体の約50μg/mlの血清濃度を得るために充分な量で、該抗体が投与される、請求項8〜15及び17〜27のいずれか1項に記載の使用。
【請求項17】
該標識されていない抗体若しくはその抗原結合フラグメントが、ATCC寄託受け入れ番号HB−12109で寄託されたハイブリドーマによって産生されたモノクローナル抗体若しくはその抗原結合フラグメントである、請求項8〜16及び18〜27のいずれか1項に記載の使用。
【請求項18】
患者における該標識されていない抗体若しくはその抗原結合フラグメントの血中レベルを測定して、抗体若しくはその抗原結合フラグメントの投与量を調節して、5μg/ml以上の血清濃度を維持することをさらに含む、請求項8〜17及び19〜27のいずれか1項に記載の使用。
【請求項19】
患者における葉酸の血中レベルを測定することをさらに含む、請求項8〜18及び20〜27のいずれか1項に記載の使用。
【請求項20】
患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、葉酸の血中レベルに基づいて、患者による葉酸摂取を調節することをさらに含む、請求項19記載の使用。
【請求項21】
患者に化学療法剤を投与することをさらに含む、請求項8〜20及び22〜27のいずれか1項に記載の使用。
【請求項22】
該化学療法剤が葉酸代謝のアンタゴニストである、請求項21記載の使用。
【請求項23】
該アンタゴニストが、葉酸代謝活性を約40%以下だけ低減させる用量で投与される、請求項22記載の使用。
【請求項24】
該化学療法剤がドセタキセルである、請求項21記載の使用。
【請求項25】
患者のPSMA発現細胞のPSMA活性を測定することをさらに含む、請求項8〜24、26及び27のいずれか1項に記載の使用。
【請求項26】
患者にホルモン療法を投与することをさらに含む、請求項8〜25及び27のいずれか1項に記載の使用。
【請求項27】
患者に、標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与した24時間以内にホルモン療法を開始する、請求項26記載の使用。
【請求項28】
癌治療用キットであって、(a)PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントと、(b)患者による葉酸摂取を制限するための使用説明書を含むキット。
【請求項29】
該抗体若しくはその抗原結合フラグメントが細胞傷害剤にコンジュゲートする、又は抗体依存性の細胞の細胞傷害反応を誘出することができる、請求項28記載のキット。
【請求項30】
患者における癌治療のモニターリング・キットであって、(a)組織若しくは血液採集装置;(b)PSMA活性検出試薬;及び(c)該PSMA活性検出試薬を用いて,該患者から得られた組織若しくは血液サンプルを検査するための使用説明書を含むキット。
【請求項31】
患者における癌治療のモニターリング・キットであって、(a)血液採取装置;(b)葉酸検出試薬、及び(c)該葉酸検出試薬を用いて,該患者から得られた赤血球又は血清を検査するための使用説明書を含むキット。
【請求項32】
該キットを用いて検出した葉酸レベルに基づいて、患者による葉酸摂取を低減するための使用説明書をさらに含む、請求項31記載のキット。
【請求項33】
患者における前立腺癌の治療方法であって、患者が早期前立腺癌を有すると診断された場合に、該患者にホルモン療法を投与する段階と;PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントであって、ルテチウム−177にコンジュゲートする該抗体若しくはその抗原結合フラグメントを投与する段階を含み、該抗体若しくはその抗原結合フラグメントの初回量は、ホルモン療法を開始した後1日目〜4週間目に投与される方法。
【請求項34】
患者が高い前立腺特異的抗原(PSA)レベルを有し、直径0.9cmより大きい軟組織疾患を有さない、請求項33記載の方法。
【請求項35】
患者における前立腺癌の治療方法であって、患者にホルモン療法を投与する段階と、PSMAの細胞外ドメインに結合することができる抗体若しくはその抗原結合フラグメントを該患者に投与する段階とを含み、該患者の血清テストステロン・レベルが50ng/ml以下に達した後1日目〜4週間目に、該抗体若しくはその抗原結合フラグメントの初回量が投与される方法。
【請求項36】
該抗体若しくはその抗原結合フラグメントが作用剤にコンジュゲートする、又は抗体依存性の細胞の細胞傷害反応を誘出することができる、請求項35及び37〜42のいずれか1項に記載の方法。
【請求項37】
該抗体若しくはその抗原結合フラグメントがPSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる、請求項35、36及び38〜42のいずれか1項に記載の方法。
【請求項38】
患者のPSMA発現細胞上のPSMAの表面レベルを測定することをさらに含む、請求項35〜37及び39〜42のいずれか1項に記載の方法。
【請求項39】
患者のPSMA発現細胞上のPSMAの細胞表面レベルが5倍以上に上昇したときに、該抗体若しくはその抗原結合フラグメントの初回量が投与される、請求項35〜38及び40〜42のいずれか1項に記載の方法。
【請求項40】
患者のPSMA発現細胞上のPSMAの表面レベルを測定することをさらに含み、該患者のPSMA発現細胞上のPSMAの細胞表面レベルが5倍以上に上昇した後1〜5日間目に、該抗体若しくはその抗原結合フラグメントの初回量が投与される、請求項35〜39、41及び42のいずれか1項に記載の方法。
【請求項41】
患者のPSMA発現細胞上のPSMAの表面レベルを測定することをさらに含み、PSMA発現細胞上のPSMAの細胞表面レベルが9倍以上に上昇した後1〜5日間以内に、該抗体若しくはその抗原結合フラグメントの初回量が投与される、請求項35〜40及び42のいずれか1項に記載の方法。
【請求項42】
患者における血清テストステロン・レベルをモニターリングすることをさらに含む、請求項35〜41のいずれか1項に記載の方法。
【請求項43】
標識されていない抗体若しくはその抗原結合フラグメントによる患者における癌の治療方法であって、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる該標識されていない抗体若しくはその抗原結合フラグメントを該患者に投与する段階と、該患者による葉酸摂取を制限する段階を含む方法。
【請求項44】
葉酸を含有する栄養補助食品を禁止することによって、患者による葉酸摂取が制限される、請求項43及び45〜62のいずれか1項に記載の方法。
【請求項45】
葉酸摂取が400μg/日以下になるように、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、患者による葉酸摂取が制限される、請求項43、44及び46〜62のいずれか1項に記載の方法。
【請求項46】
該癌が前立腺癌である、請求項43〜45及び47〜62のいずれか1項に記載の方法。
【請求項47】
標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与する前に、患者による葉酸摂取を制限する、請求項43〜46及び48〜62のいずれか1項に記載の方法。
【請求項48】
患者による葉酸摂取を制限した24時間以内に、標識されていない抗体若しくはその抗原結合フラグメントの初回量が投与される、請求項43〜47及び49〜62のいずれか1項に記載の方法。
【請求項49】
患者による葉酸摂取の制限を開始した後2週間目に、該標識されていない抗体若しくはその抗原結合フラグメントの初回量が投与される、請求項43〜48及び50〜62のいずれか1項に記載の方法。
【請求項50】
患者の血清又は血漿中の抗体若しくはその抗原結合フラグメントの5μg/ml以上の血清濃度を維持するために充分な量で、該標識されていない抗体若しくはその抗原結合フラグメントが投与される、請求項43〜49及び51〜62のいずれか1項に記載の方法。
【請求項51】
該標識されていない抗体若しくはその抗原結合フラグメントが抗体であり、患者中に抗体の約50μg/mlの血清濃度を得るために充分な量で、該抗体が投与される、請求項43〜50及び52〜62のいずれか1項に記載の方法。
【請求項52】
該標識されない抗体若しくはその抗原結合フラグメントが、ATCC寄託受け入れ番号HB−12109で寄託されたハイブリドーマによって産生されたモノクローナル抗体若しくはその抗原結合フラグメントである、請求項43〜51及び53〜62のいずれか1項に記載の方法。
【請求項53】
患者における標識されない抗体若しくはその抗原結合フラグメントの血中レベルを測定して、5μg/ml以上の血清濃度を維持するために抗体若しくはその抗原結合フラグメントの投与量を調節することをさらに含む、請求項43〜52及び54〜62のいずれか1項に記載の方法。
【請求項54】
患者における葉酸の血中レベルを測定することをさらに含む、請求項43〜53及び55〜62のいずれか1項に記載の方法。
【請求項55】
患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、葉酸の血中レベルに基づいて、患者による葉酸摂取を調節することをさらに含む、請求項54記載の方法。
【請求項56】
患者に化学療法剤を投与することをさらに含む、請求項43〜55及び57〜62のいずれか1項に記載の方法。
【請求項57】
該化学療法剤が葉酸代謝のアンタゴニストである、請求項56記載の方法。
【請求項58】
該アンタゴニストが、葉酸代謝活性を約40%以下だけ低減する用量で投与される、請求項43〜57及び59〜62のいずれか1項に記載の方法。
【請求項59】
該化学療法剤がドセタキセルである、請求項56記載の方法。
【請求項60】
患者のPSMA発現細胞のPSMA活性を測定することをさらに含む、請求項43〜59及び61〜62のいずれか1項に記載の方法。
【請求項61】
患者にホルモン療法を投与することをさらに含む、請求項43〜60及び62〜62のいずれか1項に記載の方法。
【請求項62】
患者に、標識されていない抗体若しくはその抗原結合フラグメントの初回量を投与した24時間以内にホルモン療法を開始する、請求項61記載の方法。
【請求項63】
患者における葉酸の血中レベルを測定することを含む、患者における癌治療のモニターリング方法であって、この場合に、患者による葉酸摂取が400μg/日以下に、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、制限されており、そしてPSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも単回量を患者が受容している方法。
【請求項64】
患者のPSMA発現細胞のPSMA活性を測定することを含む、患者における癌治療のモニターリング方法であって、この場合に、患者による葉酸摂取が400μg/日以下に、又は患者における葉酸の血清レベルが10nmol/L以下になるように、又は患者における赤血球(RBC)葉酸レベルが300nmol/L以下になるように、制限されており、そしてPSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる抗体若しくはその抗原結合フラグメントの少なくとも単回量を患者が受容している方法。
【請求項65】
患者における早期前立腺癌の治療用キットであって、PSMAの細胞外ドメインに結合することできる抗体若しくはその抗原結合フラグメントであって、ルテチウム177にコンジュゲートする抗体若しくはその抗原結合フラグメントと;ホルモン療法を開始した後1日目〜4週間目、又は患者の血清テストステロン・レベルが50ng/ml以下に達した後1日目〜4週間目のいずれかに該抗体若しくはその抗原結合フラグメントの初回量を投与するための使用説明書を含むキット。
【請求項66】
患者における癌治療用キットであって、PSMAの細胞外ドメインに結合して、該PSMAの酵素活性を阻害することができる、標識されていない抗体若しくはその抗原結合フラグメントと;患者による葉酸摂取の制限と組み合わせて、該標識されていない抗体若しくはその抗原結合フラグメントを投与するための使用説明書を含むキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公表番号】特表2010−540657(P2010−540657A)
【公表日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願番号】特願2010−528161(P2010−528161)
【出願日】平成20年10月3日(2008.10.3)
【国際出願番号】PCT/US2008/078742
【国際公開番号】WO2009/046294
【国際公開日】平成21年4月9日(2009.4.9)
【出願人】(508298488)コーネル ユニヴァーシティー (8)
【Fターム(参考)】
【公表日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願日】平成20年10月3日(2008.10.3)
【国際出願番号】PCT/US2008/078742
【国際公開番号】WO2009/046294
【国際公開日】平成21年4月9日(2009.4.9)
【出願人】(508298488)コーネル ユニヴァーシティー (8)
【Fターム(参考)】
[ Back to top ]

