R3遺伝子に連鎖するDNAマーカーを用いたジャガイモ疫病抵抗性検定法
【課題】DNAマーカーを用いた抵抗性検定を利用可能にして、ジャガイモ疫病に対する
抵抗性個体をDNAレベルで、しかも短時間に検定できるようにすることにより、抵抗性
品種育成を効率的に行うことのできる検定法を提供することにある。
【解決手段】下記の特定配列で表されるR3遺伝子に連鎖するDNAマーカー検定用プラ
イマーよりなる。“5’−TGCCAAATGACTTGTTTATC−3’”の20塩
基の合成プライマーと“5’−CAAATATAACCTGTCGACG−3’”の19
塩基の合成プライマーから構成される。または、“5’−CTTCTCCTGTCATC
TTGTTA−3’”の20塩基の合成プライマーと“5’−CAAATATAACCT
GTCGACG−3’”の19塩基の合成プライマーから構成される。
抵抗性個体をDNAレベルで、しかも短時間に検定できるようにすることにより、抵抗性
品種育成を効率的に行うことのできる検定法を提供することにある。
【解決手段】下記の特定配列で表されるR3遺伝子に連鎖するDNAマーカー検定用プラ
イマーよりなる。“5’−TGCCAAATGACTTGTTTATC−3’”の20塩
基の合成プライマーと“5’−CAAATATAACCTGTCGACG−3’”の19
塩基の合成プライマーから構成される。または、“5’−CTTCTCCTGTCATC
TTGTTA−3’”の20塩基の合成プライマーと“5’−CAAATATAACCT
GTCGACG−3’”の19塩基の合成プライマーから構成される。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、ジャガイモ栽培における最重要病害であるジャガイモ疫病に抵抗性を持つ品
種育成を効率的に進めるため、交配によって得た雑種後代の抵抗性の有無を判別する検定
法であって、特に、Solanum demissum に由来するジャガイモ疫病抵抗
性遺伝子(R3)に連鎖し、ジャガイモ疫病抵抗性または罹病性を判別するDNAマーカ
ーを用いたジャガイモ疫病抵抗性検定法に関するものである。
【背景技術】
【0002】
ジャガイモ疫病は、世界のジャガイモ栽培において最も重要な病害である。疫病は一旦発
生すると防除が困難なため、予防的な農薬散布が必要である。ジャガイモ栽培における農
薬使用の大半は、疫病発生の予防目的で行われている。減農薬栽培や環境保全型農業の推
進、薬剤費節減のためには、疫病抵抗性品種が極めて有効である。
これまでに、国内では疫病真性抵抗性遺伝子R1やR3を持つ抵抗性品種が多く育成され
ている。従来、品種や育成系統のジャガイモ疫病抵抗性検定は、疫病無防除栽培圃場等に
おいて、植物体への疫病菌の感染による病斑の有無によって判別している。また、切り取
った葉に接種する室内検定法がある。近年、R1遺伝子を検出するDNAマーカーが、R
1遺伝子の有無の判別や交配における雑種後代からの抵抗性個体を効率良く選抜できる手
法として実用化している。しかし、R3遺伝子を検出するDNAマーカーは実用化されて
いない。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】「育種学研究 第12巻 別冊1 39頁」日本育種学会発行 2010年
【発明の概要】
【発明が解決しようとする課題】
【0004】
従来のジャガイモ疫病抵抗性検定は、無防除栽培圃場等において、植物体への疫病菌の感
染による病斑の有無によって判別する方法がなされているが、結果を得るまでに3〜4ヶ
月かかり、多くの労力と検定圃場を要する。また、無防除栽培圃場での検定は、気象や発
生する疫病菌の病原性によって影響され、検定精度が安定しない。切り取った葉に接種す
る室内検定法もあるが、スペースが限られるため、検定数に限界がある。
一方、どの疫病菌レースにも同様の抵抗性を示し、罹病するものの程度が軽い圃場抵抗性
を正確に評価するためには、疫病菌の特定のレースに対し特異的な抵抗性を示す真性抵抗
性遺伝子の遺伝子型を把握することが重要である。しかしながら、真性抵抗性遺伝子型の
判別に必要な疫病菌レースが保存されていないため、個体が持っている遺伝子型をほとん
ど判別することができない。
育種現場において、交配における雑種後代から抵抗性個体を効率良く選抜できる手法を開
発するため、疫病真性抵抗性遺伝子に連鎖するDNAマーカーを開発する。
育種の早期世代でのDNAマーカーを用いた抵抗性個体の選抜が可能になると、今まで以
上に多くの個体を取り扱うことができ、新品種育成を効率的に行うことができる。
【0005】
この発明は、上記のような課題に鑑み、その課題を解決すべく創案されたものであって、
その目的とするところは、DNAマーカーを用いた抵抗性検定を利用可能にして、ジャガ
イモ疫病に対する抵抗性個体をDNAレベルで、しかも短時間に検定できるようにするこ
とにより、抵抗性品種育成を効率的に行うことのできる検定法を提供することにある。
【課題を解決するための手段】
【0006】
以上の目的を達成するために、この発明は、配列番号1及び配列番号2、配列番号3で表
されるR3遺伝子に連鎖するDNAマーカー検定用プライマーよりなる。
ここで、配列番号1は“5’−TGCCAAATGACTTGTTTATC−3’”の2
0塩基の合成プライマーから構成され、配列番号2は“5’−CTTCTCCTGTCA
TCTTGTTA−3’”の20塩基の合成プライマーから構成され、配列番号3は“5
’−CAAATATAACCTGTCGACG−3’”の19塩基の合成プライマーから
構成される。
【0007】
疫病真性抵抗性遺伝子R1を持つ品種「アトランチック」と、Solanum demi
ssum に由来する疫病真性抵抗性遺伝子R3を持つことが知られているコナフブキ由
来の「K97031−95」のF1雑種から、R1遺伝子を持たない97個体を選抜し、
疫病菌レース0株を用いた接種検定を行った。遊走子形成率30%以下の10個体及び7
0%以上の10個体から抽出したDNAをそれぞれ等量ずつ混ぜて抵抗性混合DNA試料
及び罹病性混合DNA試料とした。R3a遺伝子領域の一部を増幅するプライマーセット
(R3a−FとR3a−R)を設計・合成し、これを用いたPCRの増幅産物を制限酵素
で消化するPCR−RFLP分析を行い、抵抗性混合DNA試料に特異的なDNAバンド
(CAPSマーカーバンド)を得た。「K97031−95」および「アトランチック」
からプライマーセット(R3a−FとR3a−R)を用いてPCR増幅し、増幅断片をT
Aクローニングによりクローン化した。制限酵素TaqIで消化されるクローン断片と消
化されないクローン断片の塩基配列を比較して、R3遺伝子に特異的なDNA断片のみを
増幅するプライマーセット(R3SP-S1とR3SP−A4)並びに(R3SP−S2
とR3SP−A4)を設計・合成した(図1)。プライマーセット(R3SP-S1とR
3SP−A4)で増幅されるDNA断片はR3−400、プライマーセット(R3SP−
S2とR3SP−A4)で増幅されるDNA断片はR3−300と命名した。
【発明の効果】
【0008】
F1集団の疫病抵抗性有無が、従来の無防除栽培圃場における検定に比べ、短期間で精度
良く判別できるようになった。また、圃場検定や接種検定は、実施時期が栽培期間中に限
られていたが、本法を用いることでジャガイモが栽培されていない時期でも検定が可能と
なったことから、今まで以上に多くの個体を取り扱うことができ、新品種育成を効率的に
行うことができる。
開発したDNAマーカーを使うことで、R3遺伝子を持つ抵抗性品種・系統を特定できる
ので、交配親が有している疫病抵抗性遺伝子を考慮した交配計画を立てることができ、圃
場抵抗性品種や疫病真性抵抗性遺伝子を集積した品種の育成に活用できる。
【図面の簡単な説明】
【0009】
【図1】R3遺伝子に連鎖するDNAマーカー検定用プライマー配列を示す図である。
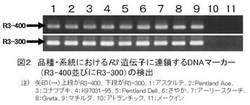
【図2】品種・系統におけるR3遺伝子に連鎖するDNAマーカー(R3−400並びにR3−300)の検出(矢印で表示)を示す図である。
【発明を実施するための形態】
【0010】
〔バイレショDNA抽出法(CTAB-LiCl法)〕
(1)50mg組織を1.5mlチューブに入れ、ペッスルですりつぶす。
(2)175μlの2%CATB液と175μlの8M LiClを加えて、撹拌する。
(3)55℃、5分間インキュベート(時々撹拌する)。
(4)350μl クロロホルム/イソアミルアルコール(24:1)を加えて、10分
間振盪する。
(5)12,000rpmで3分間遠心分離する。
(6)上澄み300μlを新しい1.5mlチューブに移す。
(7)210μlの冷イソプロパノールを加えて、優しく撹拌する。
(8)−30℃で15分間放置する。
(9)12,000rpmで10分間、4℃で遠心分離する。
(10)1mlの70%冷エタノールを加えて、すぐに吸い出す。
(11)1mlの冷エタノールを加えて、すぐに吸い出す。
(12)遠心濃縮機で5分間乾燥する。
(13)50μlの滅菌水(10μg/ml RNaseAを含む)を加え、55℃で溶
解する。
【0011】
〔抽出DNA濃度測定〕
(1)2ml Low Range(A)液(0.1μg/ml H33258、0.2M
NaCl、10mM Tris−HCl、1mM EDTA;pH7.4)をガラスセル
に入れ、「ZERO」を押し、0点調整を行う。
(2)λDNA液(100μg/ml)を2μl加えて撹拌し、「CALIB」を押し、
「l」「0」「0」と入力後、「ENTER」を押す。
(3)Calibration終了後、ガラスセルの液を捨て、新しい2ml Low
Range(A)液を入れ、「ZERO」を押し0点調整後、抽出DNAサンプルの2μ
lを加えて撹拌し、濃度を測定する。
ここで、使用機器は、DyNA Quant 200(Hoefer社)を用いた。
【0012】
〔ジャガイモ疫病抵抗性遺伝子に連鎖するDNAマーカー反応液組成〕
10×PCR Buffer
(MgCl2 free) 10μl(最終濃度:1×)
25mM MgCl2 8μl(最終濃度:2mM)
2.5mM dNTP Mixture 8μl(最終濃度:0.2mM)
50μM R3SP−S1
またはR3SP−S2 1μl(最終濃度:0.5μM)
50μM R3SP−A4 1μl(最終濃度:0.5μM)
5units/μl Ex Taq 0.5μl(最終量:2.5u)
鋳型DNA(5ng/μl) 10μl(最終量:50ng)
滅菌水 61.5μl
計 100μl
ここで、使用試薬は、タカラバイオ社のTaKaRa Ex TaqTMを用いた。
【0013】
〔ジャガイモ疫病抵抗性遺伝子に連鎖するDNAマーカー反応温度条件〕
94℃3分を1サイクル
94℃30秒→53℃30秒→72℃1分を35サイクル
72℃5分を1サイクル
【0014】
〔電気泳動〕
(1)アガロース0.42gを耐熱ビンに入れ、1×TAE Buffer(40mM T
ris、20mM 氷酢酸、1mM EDTA、pH8.0)30mlを加えて電子レンジ
で加熱し撹拌しながら完全に溶かす。
(2)溶液の温度が約40℃に冷えたら、ゲルトレイに注ぎコームを差し込む。ゲルが固
まったら泳動槽にセットする。
(3)Loading Buffer(0.25% bromophenol blue、
0.25% xylen cyanol FF、1mM EDTA、30%グリセロール)
1μl取り、PCR反応させたチューブに直接加えて混合し、そこから5μl取る。
(4)5μlのサンプルを泳動槽にセットしたアガロースゲルの注入穴に静かに注入する
。
(5)100Vで30分間電気泳動後、0.5μg/mlエチジウムブロマイド(臭化エ
チジウム)を含む1×TAE Bufferに浸して30分間ゆっくり振盪し、ゲルをト
ランスイルミネーターにのせ、紫外線を照射してカメラで撮影する。
【実施例】
【0015】
「アトランチック」と「K97031−95」のF1雑種において、接種検定結果とR3
−400並びにR3−300の有無との間には83.5%の相関が認められた(表1)。
【0016】
【表1】

【0017】
ジャガイモ48品種・系統における疫病菌レース0株接種による遊走子のう形成率とR3
−400並びにR3−300の有無を検討したところ、15品種・系統でR3−400並
びにR3−300が検出された。(表2、図2)。
【0018】
【表2】

【配列表フリーテキスト】
【0019】
配列番号1:合成DNA
配列番号2:合成DNA
配列番号3:合成DNA
【技術分野】
【0001】
この発明は、ジャガイモ栽培における最重要病害であるジャガイモ疫病に抵抗性を持つ品
種育成を効率的に進めるため、交配によって得た雑種後代の抵抗性の有無を判別する検定
法であって、特に、Solanum demissum に由来するジャガイモ疫病抵抗
性遺伝子(R3)に連鎖し、ジャガイモ疫病抵抗性または罹病性を判別するDNAマーカ
ーを用いたジャガイモ疫病抵抗性検定法に関するものである。
【背景技術】
【0002】
ジャガイモ疫病は、世界のジャガイモ栽培において最も重要な病害である。疫病は一旦発
生すると防除が困難なため、予防的な農薬散布が必要である。ジャガイモ栽培における農
薬使用の大半は、疫病発生の予防目的で行われている。減農薬栽培や環境保全型農業の推
進、薬剤費節減のためには、疫病抵抗性品種が極めて有効である。
これまでに、国内では疫病真性抵抗性遺伝子R1やR3を持つ抵抗性品種が多く育成され
ている。従来、品種や育成系統のジャガイモ疫病抵抗性検定は、疫病無防除栽培圃場等に
おいて、植物体への疫病菌の感染による病斑の有無によって判別している。また、切り取
った葉に接種する室内検定法がある。近年、R1遺伝子を検出するDNAマーカーが、R
1遺伝子の有無の判別や交配における雑種後代からの抵抗性個体を効率良く選抜できる手
法として実用化している。しかし、R3遺伝子を検出するDNAマーカーは実用化されて
いない。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】「育種学研究 第12巻 別冊1 39頁」日本育種学会発行 2010年
【発明の概要】
【発明が解決しようとする課題】
【0004】
従来のジャガイモ疫病抵抗性検定は、無防除栽培圃場等において、植物体への疫病菌の感
染による病斑の有無によって判別する方法がなされているが、結果を得るまでに3〜4ヶ
月かかり、多くの労力と検定圃場を要する。また、無防除栽培圃場での検定は、気象や発
生する疫病菌の病原性によって影響され、検定精度が安定しない。切り取った葉に接種す
る室内検定法もあるが、スペースが限られるため、検定数に限界がある。
一方、どの疫病菌レースにも同様の抵抗性を示し、罹病するものの程度が軽い圃場抵抗性
を正確に評価するためには、疫病菌の特定のレースに対し特異的な抵抗性を示す真性抵抗
性遺伝子の遺伝子型を把握することが重要である。しかしながら、真性抵抗性遺伝子型の
判別に必要な疫病菌レースが保存されていないため、個体が持っている遺伝子型をほとん
ど判別することができない。
育種現場において、交配における雑種後代から抵抗性個体を効率良く選抜できる手法を開
発するため、疫病真性抵抗性遺伝子に連鎖するDNAマーカーを開発する。
育種の早期世代でのDNAマーカーを用いた抵抗性個体の選抜が可能になると、今まで以
上に多くの個体を取り扱うことができ、新品種育成を効率的に行うことができる。
【0005】
この発明は、上記のような課題に鑑み、その課題を解決すべく創案されたものであって、
その目的とするところは、DNAマーカーを用いた抵抗性検定を利用可能にして、ジャガ
イモ疫病に対する抵抗性個体をDNAレベルで、しかも短時間に検定できるようにするこ
とにより、抵抗性品種育成を効率的に行うことのできる検定法を提供することにある。
【課題を解決するための手段】
【0006】
以上の目的を達成するために、この発明は、配列番号1及び配列番号2、配列番号3で表
されるR3遺伝子に連鎖するDNAマーカー検定用プライマーよりなる。
ここで、配列番号1は“5’−TGCCAAATGACTTGTTTATC−3’”の2
0塩基の合成プライマーから構成され、配列番号2は“5’−CTTCTCCTGTCA
TCTTGTTA−3’”の20塩基の合成プライマーから構成され、配列番号3は“5
’−CAAATATAACCTGTCGACG−3’”の19塩基の合成プライマーから
構成される。
【0007】
疫病真性抵抗性遺伝子R1を持つ品種「アトランチック」と、Solanum demi
ssum に由来する疫病真性抵抗性遺伝子R3を持つことが知られているコナフブキ由
来の「K97031−95」のF1雑種から、R1遺伝子を持たない97個体を選抜し、
疫病菌レース0株を用いた接種検定を行った。遊走子形成率30%以下の10個体及び7
0%以上の10個体から抽出したDNAをそれぞれ等量ずつ混ぜて抵抗性混合DNA試料
及び罹病性混合DNA試料とした。R3a遺伝子領域の一部を増幅するプライマーセット
(R3a−FとR3a−R)を設計・合成し、これを用いたPCRの増幅産物を制限酵素
で消化するPCR−RFLP分析を行い、抵抗性混合DNA試料に特異的なDNAバンド
(CAPSマーカーバンド)を得た。「K97031−95」および「アトランチック」
からプライマーセット(R3a−FとR3a−R)を用いてPCR増幅し、増幅断片をT
Aクローニングによりクローン化した。制限酵素TaqIで消化されるクローン断片と消
化されないクローン断片の塩基配列を比較して、R3遺伝子に特異的なDNA断片のみを
増幅するプライマーセット(R3SP-S1とR3SP−A4)並びに(R3SP−S2
とR3SP−A4)を設計・合成した(図1)。プライマーセット(R3SP-S1とR
3SP−A4)で増幅されるDNA断片はR3−400、プライマーセット(R3SP−
S2とR3SP−A4)で増幅されるDNA断片はR3−300と命名した。
【発明の効果】
【0008】
F1集団の疫病抵抗性有無が、従来の無防除栽培圃場における検定に比べ、短期間で精度
良く判別できるようになった。また、圃場検定や接種検定は、実施時期が栽培期間中に限
られていたが、本法を用いることでジャガイモが栽培されていない時期でも検定が可能と
なったことから、今まで以上に多くの個体を取り扱うことができ、新品種育成を効率的に
行うことができる。
開発したDNAマーカーを使うことで、R3遺伝子を持つ抵抗性品種・系統を特定できる
ので、交配親が有している疫病抵抗性遺伝子を考慮した交配計画を立てることができ、圃
場抵抗性品種や疫病真性抵抗性遺伝子を集積した品種の育成に活用できる。
【図面の簡単な説明】
【0009】
【図1】R3遺伝子に連鎖するDNAマーカー検定用プライマー配列を示す図である。
【図2】品種・系統におけるR3遺伝子に連鎖するDNAマーカー(R3−400並びにR3−300)の検出(矢印で表示)を示す図である。
【発明を実施するための形態】
【0010】
〔バイレショDNA抽出法(CTAB-LiCl法)〕
(1)50mg組織を1.5mlチューブに入れ、ペッスルですりつぶす。
(2)175μlの2%CATB液と175μlの8M LiClを加えて、撹拌する。
(3)55℃、5分間インキュベート(時々撹拌する)。
(4)350μl クロロホルム/イソアミルアルコール(24:1)を加えて、10分
間振盪する。
(5)12,000rpmで3分間遠心分離する。
(6)上澄み300μlを新しい1.5mlチューブに移す。
(7)210μlの冷イソプロパノールを加えて、優しく撹拌する。
(8)−30℃で15分間放置する。
(9)12,000rpmで10分間、4℃で遠心分離する。
(10)1mlの70%冷エタノールを加えて、すぐに吸い出す。
(11)1mlの冷エタノールを加えて、すぐに吸い出す。
(12)遠心濃縮機で5分間乾燥する。
(13)50μlの滅菌水(10μg/ml RNaseAを含む)を加え、55℃で溶
解する。
【0011】
〔抽出DNA濃度測定〕
(1)2ml Low Range(A)液(0.1μg/ml H33258、0.2M
NaCl、10mM Tris−HCl、1mM EDTA;pH7.4)をガラスセル
に入れ、「ZERO」を押し、0点調整を行う。
(2)λDNA液(100μg/ml)を2μl加えて撹拌し、「CALIB」を押し、
「l」「0」「0」と入力後、「ENTER」を押す。
(3)Calibration終了後、ガラスセルの液を捨て、新しい2ml Low
Range(A)液を入れ、「ZERO」を押し0点調整後、抽出DNAサンプルの2μ
lを加えて撹拌し、濃度を測定する。
ここで、使用機器は、DyNA Quant 200(Hoefer社)を用いた。
【0012】
〔ジャガイモ疫病抵抗性遺伝子に連鎖するDNAマーカー反応液組成〕
10×PCR Buffer
(MgCl2 free) 10μl(最終濃度:1×)
25mM MgCl2 8μl(最終濃度:2mM)
2.5mM dNTP Mixture 8μl(最終濃度:0.2mM)
50μM R3SP−S1
またはR3SP−S2 1μl(最終濃度:0.5μM)
50μM R3SP−A4 1μl(最終濃度:0.5μM)
5units/μl Ex Taq 0.5μl(最終量:2.5u)
鋳型DNA(5ng/μl) 10μl(最終量:50ng)
滅菌水 61.5μl
計 100μl
ここで、使用試薬は、タカラバイオ社のTaKaRa Ex TaqTMを用いた。
【0013】
〔ジャガイモ疫病抵抗性遺伝子に連鎖するDNAマーカー反応温度条件〕
94℃3分を1サイクル
94℃30秒→53℃30秒→72℃1分を35サイクル
72℃5分を1サイクル
【0014】
〔電気泳動〕
(1)アガロース0.42gを耐熱ビンに入れ、1×TAE Buffer(40mM T
ris、20mM 氷酢酸、1mM EDTA、pH8.0)30mlを加えて電子レンジ
で加熱し撹拌しながら完全に溶かす。
(2)溶液の温度が約40℃に冷えたら、ゲルトレイに注ぎコームを差し込む。ゲルが固
まったら泳動槽にセットする。
(3)Loading Buffer(0.25% bromophenol blue、
0.25% xylen cyanol FF、1mM EDTA、30%グリセロール)
1μl取り、PCR反応させたチューブに直接加えて混合し、そこから5μl取る。
(4)5μlのサンプルを泳動槽にセットしたアガロースゲルの注入穴に静かに注入する
。
(5)100Vで30分間電気泳動後、0.5μg/mlエチジウムブロマイド(臭化エ
チジウム)を含む1×TAE Bufferに浸して30分間ゆっくり振盪し、ゲルをト
ランスイルミネーターにのせ、紫外線を照射してカメラで撮影する。
【実施例】
【0015】
「アトランチック」と「K97031−95」のF1雑種において、接種検定結果とR3
−400並びにR3−300の有無との間には83.5%の相関が認められた(表1)。
【0016】
【表1】

【0017】
ジャガイモ48品種・系統における疫病菌レース0株接種による遊走子のう形成率とR3
−400並びにR3−300の有無を検討したところ、15品種・系統でR3−400並
びにR3−300が検出された。(表2、図2)。
【0018】
【表2】

【配列表フリーテキスト】
【0019】
配列番号1:合成DNA
配列番号2:合成DNA
配列番号3:合成DNA
【特許請求の範囲】
【請求項1】
配列番号1及び配列番号2、配列番号3で表されるR3遺伝子に連鎖するDNAマーカ
ー検定用プライマー。
【請求項1】
配列番号1及び配列番号2、配列番号3で表されるR3遺伝子に連鎖するDNAマーカ
ー検定用プライマー。
【図1】


【図2】




【図2】


【公開番号】特開2012−55173(P2012−55173A)
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願番号】特願2010−198527(P2010−198527)
【出願日】平成22年9月6日(2010.9.6)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 「育種学研究(日本育種学会第117回講演会要旨集) 第12巻 別冊1 39頁」日本育種学会発行 平成22年3月26日発行
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度、農林水産省、国産バイオ燃料への利用に向けた資源作物の育成と低コスト栽培技術等の開発委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(000214191)長崎県 (106)
【Fターム(参考)】
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願日】平成22年9月6日(2010.9.6)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 「育種学研究(日本育種学会第117回講演会要旨集) 第12巻 別冊1 39頁」日本育種学会発行 平成22年3月26日発行
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度、農林水産省、国産バイオ燃料への利用に向けた資源作物の育成と低コスト栽培技術等の開発委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(000214191)長崎県 (106)
【Fターム(参考)】
[ Back to top ]

