RASGRF1の定量的メチル化測定を用いた発癌リスク予測
【課題】癌の発生した臓器の癌以外の組織においてエピジェネティックなサイレンシングを受ける遺伝子を網羅的に解析し、発癌リスクに関連する遺伝子を同定してその癌における役割を解明し、当該遺伝子に関連した新規な発癌リスクを判断するための指標を得る方法および癌の治療剤を提供すること。
【解決手段】前記課題は、対象における発癌リスクを検出する方法であって、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出することを含む、前記方法、あるいは、RASGRF1遺伝子をコードする核酸もしくはRASGRF1を含有してなる癌治療剤により解決される。
【解決手段】前記課題は、対象における発癌リスクを検出する方法であって、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出することを含む、前記方法、あるいは、RASGRF1遺伝子をコードする核酸もしくはRASGRF1を含有してなる癌治療剤により解決される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、癌を検出するための指標を得る方法、発癌リスクを判断するための指標を得る方法、癌の検出用キット、発癌リスクの検出用キット、癌の予防剤、癌の治療剤、癌の予防剤の探索方法、および癌の治療剤の探索方法に関する。
【背景技術】
【0002】
癌は、先進国における死因の上位にあり、例えば、2003年度に日本人の31%が癌で死亡しており、ここ20年程わが国における死因の第1位であり続けている。
【0003】
死因となった癌を部位別に見た場合には、胃癌が一貫して最近20年間、第1または第2位を占めているが、胃癌罹患症例の内訳については明らかな経年変化が見られ、かつては、進行胃癌に代表される、StageIII、IVが主たる患者層を占めていたのに対し、現在では、50%以上がStageIで占められている。StageIはStageIaおよびIbからなるが、いずれも癌が粘膜下層にとどまることが特徴であり、いわゆる早期癌に分類される。
【0004】
また、近年、Helicobacter pylori(H.pylori)の感染による胃炎が胃癌の原因となることが認知されるようになったが、H.pylori感染率は胃癌発生率よりも遙かに高く、感染者のなかで胃癌ハイリスク群を設定することが胃癌の早期発見や予防のために極めて重要である。
【0005】
このような癌の早期発見においては、現在、肉眼診断による術前評価が100%の診断能を持たない。
【0006】
一般に、胃癌の約90%が分化型である。分化型の胃癌は、内視鏡検査で強い萎縮または腸上皮化生がみられるほど癌化しやすいことが知られているので早期診断しやすい。また、萎縮の指標となる血清ペプシノゲン法も分化型胃癌のハイリスク群の同定に有用であると考えられ、近年健康診断などで応用されるようになってきた(図1)。このような萎縮、腸上皮化生は分化型胃癌の背景粘膜においてみられる。分化型胃癌の前癌病変である腺腫や腸上皮化生では、P16、MLH1等の癌抑制遺伝子のCpGアイランドの異常メチル化が蓄積していることが知られている(Kang GH, Shim YH, Jung HY, et al. CpG island methylation in premalignant stages of gastric carcinoma. Cancer Res 2001;61:2847-51. Lee JH, Park SJ, Abraham SC, et al. Frequent CpG island methylation in precursor lesions and early gastric adenocarcinomas. Oncogene 2004;23:4646-54.)。
しかしながら、分化型胃癌の発癌リスクを判断するマーカーはいずれも未分化型の発癌リスクの判断には使用できなかった。
さらに、発癌遺伝子の機能を促進する遺伝子のCpGアイランドのDNAメチル化と胃癌との関連は知られていない。また、発癌遺伝子の機能を促進する遺伝子のCpGアイランドのDNAメチル化と胃癌の発癌リスクを判断するための指標を得る方法との関連は知られていない。
【0007】
一方で、胃癌の約10%を占める未分化型胃癌は、萎縮、腸上皮化生を伴わずに発生することが知られ、血清ペプシノゲン法でも陰性となり、ハイリスク群の同定が困難である。未分化型胃癌の早期病変を内視鏡検査で発見することは、分化型癌に比べ困難であり、また進行も早く、早期にリンパ節転移をきたすため予後が悪い(図2)。しかしながら、現在、未分化型胃癌の発癌リスクを判断するための指標を得る方法は知られていない。したがって、このような未分化型胃癌の発癌リスクを予測する分子マーカーの確立が求められている。
【0008】
未分化型癌の発生は分化型癌とは異なるメカニズムによって生ずると考えられており、未分化型癌の発生リスクを検出しうる新規遺伝子の同定が必要であると思われる。また、未分化型癌の発生リスクの検出に際しては、未だ癌化していない組織を用いて未分化型癌の発生リスクを検出しうることが必要であると考えられる。従って、未だ癌化していない組織を用いて、未分化型の胃癌の発生リスクを検出しうる新規遺伝子の同定が必要であると考えられる。
【0009】
尚、H.pyloriの感染は、これら分化型および未分化型のいずれの胃癌をも生じさせる(Uemura N, Okamoto S, Yamamoto S, et al. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med 2001;345:784-9.)。
【0010】
このような状況下、癌の早期発見に関し、近年、異常メチル化による遺伝子発現抑制が種々の癌細胞株で重要な役割を担っていることがわかってきつつあり、異常メチル化を指標とした癌の検出方法が提案されている。例えば、インターフェロン調節因子4遺伝子、インターフェロン調節因子5遺伝子、インターフェロン調節因子8遺伝子の異常メチル化による遺伝子発現抑制が種々の癌細胞株で重要な役割を担っていることが報告されている(非特許文献1:Yamashita M, et al, Cancer Science 2010, 101(7), 1708-1716)。またH.pylori感染により胃の粘膜において、LOX、HAND1、THBD、p41ARC、FLNcなどの様々な遺伝子に異常メチル化が生じ、分化型癌のリスクが高まることも明らかにされている(非特許文献2:Maekita T. et al., Clinical Cancer Research, 2006, 12(3), 989-995; 非特許文献3:Nakajima T., Cancer Epidemiology, Biomarkers and Prevention, 2006, 15(11), 2317-2321)。
【0011】
癌抑制遺伝子の不活性化のメカニズムとしては、エピジェネティックな遺伝子の発現抑制(サイレンシング)が広く知られている。特に、癌抑制遺伝子の転写開始領域におけるCpGアイランドのシトシンメチル化(DNAメチル化)は、ほぼあらゆる癌において見られる現象であり、既知の癌抑制遺伝子の多くが、DNAメチル化によりサイレンシングを受けることが報告されている。近年、癌において特異的にDNAメチル化が認められる遺伝子が次々と発見され、癌におけるDNAメチル化は、発癌リスクの上昇および癌の発生・進展に関与する遺伝子異常のメカニズムとして、変異や欠失と並ぶ重要性を持っていると考えられるようになっている(Jones PA and Baylin SB. The epigenomics of cancer. Cell 2007;128:683-92.)。
【0012】
しかしながら、これまでに、未分化型癌と特定遺伝子のDNAメチル化の関連については知られていない。
【0013】
一方、発癌リスクの上昇および癌の発生・進展の要因の1つに、癌抑制遺伝子の不活性化、および発癌遺伝子の変異等による活性化が挙げられる。
【0014】
一方、発癌遺伝子として最もよく知られたものにras遺伝子がある。ras遺伝子はヒトの癌において、最も高頻度に異常が認められる発癌遺伝子であり、ヒトの発癌原因の一つとして、しばしばras遺伝子の異常が報告されている(例えば、Ellis RW et al. Mol. Cell. Biol. 2: 1339-1345, 1982参照。)。
【0015】
ヒトのras遺伝子として、H-ras、K-ras、N-rasの3種類のファミリーが見いだされ、それぞれヒトの第11染色体、第12染色体、第1染色体に存在していることが知られている(例えば、Hall A et al. Nature 303: 396-400, 1983参照。)。
【0016】
ras遺伝子はそのままでは発癌活性を持たない癌原遺伝子であり、ras遺伝子の12番目、13番目、59番目、61番目のアミノ酸にアミノ酸置換を生じさせる変異により恒常的に活性化されたrasタンパク質となり、発癌活性を獲得することが知られている(例えば、Storer RD et al. Cancer Res. 46: 1458-1464, 1986;Adams, J.M. & Cory, S., Science 254, 1161-1167 (1991)参照。)。
【0017】
ヒト腫瘍全体の約30%がras遺伝子変異を有し(Adjei,A.A.,Journal of National Cancer Institute,93(14): 1062-1074 (July 18,2001); Almoguera,C.et al., Cell(1988)53:549-54;Smit,V.T.et al., Nucleic Acids Res(1988)16,7773-82; Bos,J.L,Cancer Research,49: 4682-4689 (1989))、3つの腫瘍形成性ras遺伝子、H-ras、K-ras、およびN-rasの活性化に至る変異は、膵臓癌の90%、結腸直腸癌の50%、および肺癌の50%、甲状腺癌の50%、肝癌の30%、皮膚癌の25%、ならびに骨髄性白血病の30%を含む様々な腫瘍タイプにおいて頻繁に見いだされている(Clark, G.J. & Der, C.J., Cellular Cancer Markers (eds Garrett, C. T. & Sell, S.) 17-52 (Humana Press, Totowa, New Jersey (1995), Bos, J.L., Cancer Res. 49, 4682-4689 (1989); Rodenhuis,S.et al., Cancer Res.(1988)48:5738-41; Adjei,A.A.,Journal of National Cancer Institute,93(14): 1062-1074 (July 18,2001); Almoguera,C.et al., Cell(1988)53:549-54;Migley,R.S.; Kerr,D.J., Crit Rev Oncol Hematol.(2002)44:109-20)。
【0018】
ras遺伝子は分子量21kDaのGTP結合タンパク質をコードしており、GTP結合タンパク質と共役する細胞外受容体にリガンドが結合した際に、GDPが遊離して代わりにGTPが結合することによって活性な立体構造を形成し(Hall A, Annu.Rev Cell Biol 1994, 10:31-54)、Raf、ホスホイノシチド3-キナーゼ、RalGDSなどのタンパク質を介して細胞内に信号を伝える分子スイッチとして働く(Campbell SL et al., Oncogene 1998, 17:1395-413;Quilliam LA et al., Bioessays 1995, 17:395-404)。
【0019】
不活性型であるGDP結合型のrasタンパク質から活性型であるGTP結合型のrasタンパク質への変換はGDP/GTP交換因子(GEF)タンパク質によって行なわれ、活性型であるGTP結合型から不活性型であるGDP結合型への変換はGTP 分解酵素活性促進タンパク質(GAP)によって行なわれる。
【0020】
rasタンパク質に作用する GEFの数は限られており、例えばRASGRF1遺伝子が知られているが(Schweighoffer et al., Oncogene 8: 1477-1485, 1993)、RASGRF1遺伝子のDNAメチル化と発癌リスクまたは癌の発生・進展との関係は知られていない。
【先行技術文献】
【非特許文献】
【0021】
【非特許文献1】Yamashita M, Toyota M, Suzuki H, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae. Cancer Sci 2010
【非特許文献2】Maekita T, Nakazawa K, Mihara M, et al. High levels of aberrant DNA methylation in Helicobacter pylori-infected gastric mucosae and its possible association with gastric cancer risk. Clin Cancer Res 2006;12:989-95.
【非特許文献3】Nakajima T, Maekita T, Oda I, et al. Higher methylation levels in gastric mucosae significantly correlate with higher risk of gastric cancers. Cancer Epidemiol Biomarkers Prev 2006;15:2317-21.
【発明の概要】
【発明が解決しようとする課題】
【0022】
したがって、本発明の課題は、癌の発生によってエピジェネティックなサイレンシングを受ける遺伝子について網羅的な解析を行うことにより、癌に関連する遺伝子を同定してその癌における役割を解明し、当該遺伝子に関連した、癌を検出するための指標を得る方法、発癌リスクを判断するための指標を得る方法、癌の検出用キット、発癌リスクの検出用キット、癌の予防剤、癌の治療剤、癌の予防剤の探索方法、および癌の治療剤の探索方法を提供することにある。
【0023】
また、本発明の課題は、特に未分化型の癌について、癌の発生によってエピジェネティックなサイレンシングを受ける遺伝子の網羅的な解析を行うことにより、癌に関連する遺伝子を同定してその癌における役割を解明し、当該遺伝子に関連した、未分化型の癌を検出するための指標を得る方法、未分化型の癌の発癌リスクを判断するための指標を得る方法、未分化型の癌の検出用キット、未分化型の癌の発癌リスクの検出用キット、未分化型の癌の予防剤、未分化型の癌の治療剤、未分化型の癌の予防剤の探索方法、および未分化型の癌の治療剤の探索方法を提供することにある。
【0024】
さらに、本発明の課題は、対象から得た生検組織のうちの背景組織を用いて、癌の発生リスクが高まった状態においてエピジェネティックなサイレンシングを受ける遺伝子について網羅的な解析を行うことにより、発癌リスクに関連する遺伝子を同定して、未だ癌化していない組織における発癌しやすい状態における役割を解明し、当該遺伝子に関連して、背景組織を用いて癌を検出するための指標を得る方法、背景組織を用いて発癌リスクを判断するための指標を得る方法、背景組織を用いて行なう癌の検出用キット、背景組織を用いて行なう発癌リスクの検出用キット、癌の予防剤、癌の治療剤、癌の予防剤の探索方法、および癌の治療剤の探索方法を提供することにある。
【0025】
さらにまた、本発明の課題は、胃癌の発生によってエピジェネティックなサイレンシングを受ける遺伝子について網羅的な解析を行うことにより、胃癌に関連する遺伝子を同定してその胃癌における役割を解明し、当該遺伝子に関連した、胃癌を検出するための指標を得る方法、胃癌の発癌リスクを判断するための指標を得る方法、胃癌の検出用キット、胃癌の発癌リスクの検出用キット、胃癌の予防剤、胃癌の治療剤、胃癌の予防剤の探索方法、および胃癌の治療剤の探索方法を提供することにある。
【課題を解決するための手段】
【0026】
そこで、本発明者らは、上記課題を解決すべく鋭意検討を行う中で、癌の発生した臓器の癌組織において特異的にエピジェネティックなサイレンシングによる制御を受けて発現が低下している遺伝子としてRASGRF1を初めて同定し、その遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、癌化していない組織ではほとんど認められないのに対し、癌の発生した臓器の癌組織では高いレベルで認められることから、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することにより、対象における癌を検出するための指標を得る方法を見出し、本発明を完成させた。本発明は、分化型癌のみならず、未分化型癌においても適用可能である点で優れている。
【0027】
また、本発明者らは、上記課題を解決すべく鋭意検討を行う中で、癌の発生した臓器の背景組織において特異的にエピジェネティックなサイレンシングによる制御を受けて発現が低下している遺伝子としてRASGRF1を初めて同定し、その遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、癌化していない組織ではほとんど認められないのに対し、癌の発生した臓器の背景組織では高いレベルで認められることから、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することにより、対象における発癌リスクを判断するための指標を得る方法を見出し、本発明を完成させた。本発明は、分化型癌のみならず、未分化型癌においても適用可能である点で優れている。
【0028】
また、本発明は、対象における癌を検出するための指標を得る方法または発癌リスクを判断するための指標を得る方法であって、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することを含む、前記方法に関する。
【0029】
また、本発明は、対象における未分化型の癌を検出するための指標を得る方法または発癌リスクを判断するための指標を得る方法であって、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することを含む、前記方法に関する。
【0030】
また、本発明は、血清ペプシノゲンが陰性である対象における癌を検出するための指標を得る方法または発癌リスクを判断するための指標を得る方法であって、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することを含む、前記方法に関する。
【0031】
また、本発明は、対象における癌を検出するための指標を得る方法または発癌リスクを判断するための指標を得る方法であって、対象から得た背景組織のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することを含む、前記方法に関する。
【0032】
さらに、本発明は、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化される領域が、配列番号7で表わされる塩基配列と同一もしくは実質的に同一の塩基配列を有するDNA領域である、前記の方法に関する。
【0033】
また、本発明は、メチル化特異的PCR法、バイサルファイトシークエンス法、パイロシークエンス法、コブラ法およびメチライト法からなる群より選択される1つまたは2つ以上の方法を用いて、メチル化されたCpGを検出する、前記の方法に関する。
【0034】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも8%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0035】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも10%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0036】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも15%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0037】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも20%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0038】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも30%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0039】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも50%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0040】
そしてまた、本発明は、配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、メチル化されたCpGを検出する、前記の方法に関する。
【0041】
そしてまた、本発明は、配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、バイサルファイト処理したゲノムDNA中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、メチル化されていないCpGを検出する、前記の方法に関する。
【0042】
そしてまた、本発明は、配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、バイサルファイト処理したゲノムDNA中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、メチル化されたCpGを検出する、前記の方法に関する。
【0043】
本発明はさらに、配列番号19〜32のいずれかに記載の塩基配列を有するオリゴヌクレオチドを用いて、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、メチル化されたCpGを検出する、前記の方法に関する。
【0044】
また、本発明は、配列番号19と配列番号20、配列番号21と配列番号22、配列番号23と配列番号24、配列番号25と配列番号26、配列番号27と配列番号28、配列番号29と配列番号30、配列番号31と配列番号32で表される塩基配列を有するオリゴヌクレオチドの組合わせ、または、これらの塩基配列を有するオリゴヌクレオチドの組合わせと実質的に同一である塩基配列を有するオリゴヌクレオチドの組み合わせのうち、いずれか一以上のオリゴヌクレオチドの組み合わせを用いて、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出する、前記の方法に関する。
【0045】
さらに、本発明はまた、生物学的試料が、胃、十二指腸、大腸、膵または肺の生検試料、血清、糞便、大腸洗浄液、胃洗浄液、および膵液からなる群から選択される1種または2種以上である、前記の方法に関する。
【0046】
また、本発明は、胃の萎縮がないか軽度である胃の前庭部の生検試料を用いて指標を得るものである、前記の方法に関する。
【0047】
また、本発明は、腸上皮化生がみられない胃の前庭部の生検試料を用いて指標を得るものである、前記の方法に関する。
【0048】
また、本発明は、対象から得た検体が胃の洗浄液または胃の生検試料である、前記の方法に関する。
【0049】
また、本発明は、対象から得た検体が胃の前庭部の生検試料である、前記の方法に関する。
【0050】
また、本発明は、対象から得た検体が十二指腸の洗浄液または十二指腸の生検試料である、前記の方法に関する。
【0051】
また、本発明は、対象から得た検体が大腸の洗浄液または大腸の生検試料である、前記の方法に関する。
【0052】
また、本発明は、対象から得た検体が膵液または膵の生検試料である、前記の方法に関する。
【0053】
また、本発明は、対象から得た検体が喀痰または肺の生検試料である、前記の方法に関する。
【0054】
また、本発明は、対象から得た検体が血液、血清、腹水、尿、または糞便である、前記の方法に関する。
【0055】
本発明はまた、癌が、胃癌、十二指腸癌、大腸癌、膵癌または肺癌である、前記の方法に関する。
【0056】
また、本発明は、対象から得た検体におけるRASGRF1遺伝子の発現量を測定することにより指標を得るものである、前記の方法に関する。
【0057】
また、本発明は、RASGRF1遺伝子の転写開始領域におけるCpGアイランドを増幅するための、フォワードプライマーおよびリバースプライマーからなるPCRプライマーセットに関する。
【0058】
また、本発明は、配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の検出用のPCRプライマーセットに関する。
【0059】
また、本発明は、配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の検出用のPCRプライマーセットに関する。
【0060】
また、本発明は、配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の検出用のPCRプライマーセットに関する。
【0061】
また、本発明は、配列番号19と配列番号20、配列番号21と配列番号22、配列番号23と配列番号24、配列番号25と配列番号26、配列番号27と配列番号28、配列番号29と配列番号30、配列番号31と配列番号32で表される塩基配列を有するオリゴヌクレオチドの組合わせ、または、これらの塩基配列を有するオリゴヌクレオチドの組合わせと実質的に同一である塩基配列を有するオリゴヌクレオチドの組み合わせのうち、いずれか一以上のオリゴヌクレオチドの組み合わせを含んでなる、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の検出用のPCRプライマーセットに関する。
【0062】
また、本発明は、前記のいずれかのPCRプライマーセットを含み、かつ、水酸化ナトリウム、ハイドロキノン、亜硫酸水素塩、デオキシリボヌクレオチド三リン酸、ミネラルオイルまたは緩衝液の中から選択される1以上のものを含む、癌を検出するための指標または発癌リスクを判断するための指標を得るためのキットに関する。
【0063】
本発明はまた、RASGRF1タンパク質またはRASGRF1遺伝子を含んでなる、癌の予防剤または治療剤に関する。
【0064】
本発明はまた、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を抑制する薬剤を含んでなる、癌の予防剤または治療剤に関する。
【0065】
加えて、本発明は、癌の予防剤または治療剤の探索方法であって、試験物質の存在下および非存在下において動物細胞を培養し、それぞれの細胞におけるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の頻度を測定し、そして、当該メチル化を抑制する効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【0066】
また、本発明は、癌の予防剤または治療剤の探索方法であって、試験物質の存在下および非存在下において動物細胞を培養し、それぞれの細胞におけるRASGRF1遺伝子の発現量を測定し、そして、RASGRF1遺伝子の発現を促進する効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【発明の効果】
【0067】
本発明による癌を検出するための指標を得る方法および発癌リスクを判断するための指標を得る方法は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出することに基づくものである。RASGRF1遺伝子は、正常組織では高い発現が維持され、癌組織および発癌リスクの高い組織で特異的に発現が低下していることから、その発現を直接制御しているプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出する本願発明の方法によれば、極めて正確に癌の検出および発癌リスクの検出を行うことが可能である。また、本発明の方法によれば、検出に用いる生物学的試料は、対象から得た胃組織もしくは胃癌組織、大腸組織もしくは大腸癌組織、十二指腸組織もしくは十二指腸癌組織、膵組織または膵癌組織、肺組織または肺癌組織等の各組織や癌組織の他、血清、糞便、胃洗浄液、大腸洗浄液、膵液など比較的容易に入手可能なものを用いることができるため、簡便に癌の検出を行うことができる。また、本発明の方法によれば、未だ癌が発生していないものの癌の発生リスクが高まっている状態を検出することができる。さらに、本発明による方法は、メチル化特異的PCR法、バイサルファイトシークエンス法、パイロシークエンス法、コブラ法およびメチライト法などを用いて行うことができるから、極めて少量の生物学的試料を用いて高い検出感度で、短時間のうちに精度の高い検出結果を得ることができ、対象に対して負担をかけることがなく、また、癌の早期発見、癌の進達度予測、癌再発リスクの予測、発癌リスクの予測にも資するものである。さらにまた、本発明による方法は、分化型の癌のみならず、未分化型の癌の発癌リスクをも検出しうる点で画期的な方法である。
【0068】
また、同様に、本発明による癌の検出用キットおよび発癌リスクの検出用キットは、検出の標的であるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGが、癌組織において特異的に上昇している一方で、癌化していない組織においては少ないことから、良好な精度で簡便に癌を検出することを可能にし、極めて初期の段階での癌の検出や、癌の再発のモニタリング、発癌リスクの検出、癌の進行度予測などに適したものである。加えて、本願発明の方法およびキットは、内視鏡検査等の他の検査方法との併用にも有用であり、より精密な検査結果を得ることを可能にするものである。
【0069】
さらに、本発明の癌の予防剤および癌の治療剤は、RASGRF1タンパク質、RASGRF1遺伝子をコードする核酸、またはRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を抑制する薬剤を含んでなるものである。したがって、本発明の治療剤は、RASGRF1タンパク質の癌細胞への導入、癌細胞におけるRASGRF1遺伝子の発現、あるいはRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を抑制する薬剤の癌細胞への導入を介して、癌細胞の増殖を抑制することができ、優れた治療効果を得ることが可能である。また、本発明の治療剤に含まれるRASGRF1タンパク質もしくはRASGRF1遺伝子は、癌組織および発癌リスクの高い組織において発現が抑制されている一方で、正常組織においては高い発現が認められるものであることから、本発明の治療剤は、エピジェネティックな異常により不活性化されている遺伝子もしくはその遺伝子産物の発現を、癌細胞において特異的に回復させることを可能にするものであって、正常組織に毒性を与えることなく、予防又は治療が必要な標的組織において特異的に効果を発揮することができる、副作用が少なく安全性が高いものであり、より効果的で副作用の少ない治療法の開発にも役立つものである。
【0070】
さらに、本発明の癌の予防剤の探索方法および癌の治療剤の探索方法は、試験物質の存在下および非存在下において哺乳動物細胞を培養し、それぞれの細胞におけるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の頻度、あるいはRASGRF1遺伝子の発現量を測定し、そして、当該メチル化を抑制する効果を有する試験物質またはRASGRF1遺伝子の発現量を増加させる試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関するものである。したがって、本発明の前記探索方法は、細胞を用いて効率よく行なうことのできる探索方法であり、新しい作用機序を有する癌の予防剤又は治療剤を幅広い試験物質に対して探索することができるものである。
【図面の簡単な説明】
【0071】
【図1】H.pylori感染からの発癌過程と発癌リスクの上昇を示す模式図である。H. pylori感染は慢性胃炎から萎縮性胃炎、腸上皮化生を経て分化型胃癌が発生する経路に重要な役割を担っていると考えられ、萎縮性胃炎や腸上皮化生は胃癌のハイリスク群としてよく知られている。萎縮の程度を表す指標として血清のペプシノゲンが有用である。また腸上皮化生の進展に伴いH. pylori抗体が陰性となる。またH. pylori感染は、胃上皮のDNAメチル化異常を誘発することが知られ、腸上皮化生粘膜で異常メチル化が蓄積しており発癌に関与していることが示唆されている。一方、未分化型胃癌の発生経路はいまだ不明な点が多い。分化型胃癌と異なる、未分化型胃癌の特徴のひとつとして、萎縮性胃炎や腸上皮化生を伴わずに発生する経路が存在することがある。
【0072】
【図2】未分化型胃癌のリンパ節転移の頻度を深達度ごとに示した表である。%で示した数字は、リンパ節転移が認められた症例の割合をパーセントで示したものである。粘膜内癌では分化型胃癌は潰瘍形成がない場合は大きさにかかわらず、また潰瘍形成を伴う場合でも3cm以下の場合はリンパ節転移を伴わないと考えられている。一方で未分化型胃癌は潰瘍形成を伴わなくとも2cm以上、また潰瘍形成を伴う場合は大きさにかかわらずリンパ節転移をきたしている可能性があることが示されており、未分化型胃癌は分化型胃癌に比べ早期にリンパ節転移をきたすと考えられる。(Gotoda T, et al: Incidence of lymph node metastasis from early gastric cancer. The estimation using a large number of cases in two large centers. Gastric Cancer 3:219-225, 2000)
【0073】
【図3】各種の胃癌細胞株におけるRASGRF1遺伝子のDNAメチル化の割合を示す図である。縦軸はRASGRF1遺伝子のDNAメチル化の割合を%で示し、各棒はそれぞれ胃癌細胞株を示す。胃癌細胞株は、MKN1、MKN7、MKN74、SH101、SNU1、SNU638、JRST、KatoIII、AZ521、MKN28、MKN45、NUGC3、NUGC4、AGS、NCI-N87の各胃癌細胞株についてRASGRF1遺伝子のDNAメチル化を測定した。RASGRF1遺伝子のDNAメチル化の測定方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、パイロシークエンス法により行なった。RASGRF1遺伝子は、MKN7、SH101、SNU638、JRST、KatoIII、MKN28、AGS、NCI-N87の各胃癌細胞株について90%以上のDNAメチル化を示し、MKN74とSNU1について70%以上のDNAメチル化を示し、AZ521については約55%のDNAメチル化を、NUGC4については約45%のDNAメチル化を、MKN45については約20%のDNAメチル化をそれぞれ示した。このように、RASGRF1遺伝子は胃癌細胞株において高頻度にメチル化されていた。
【0074】
【図4】RASGRF1遺伝子がDNAメチル化されている胃癌細胞株において、RASGRF1遺伝子の発現が消失していることを示す図である。縦軸はRASGRF1遺伝子の発現レベルを相対量(RQ:Relative Quantitation)で示し、各棒はそれぞれ胃癌細胞株を示す。胃癌細胞株は、MKN1、MKN7、MKN74、SH101、SNU1、SNU638、JRST、KatoIII、AZ521、MKN28、MKN45、NUGC3、NUGC4、AGS、NCI-N87の各胃癌細胞株についてRASGRF1遺伝子の発現レベルを測定した。RASGRF1遺伝子の発現レベルの測定方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、フォワードプライマーとして5'-[TTCGGACAACACAAAATGGCAAACC]-3'(配列番号34)の配列を用い、リバースプライマーとして5'-[TCTTCTCTGTCTCCACGATCTGCA]-3'(配列番号35)または5'-[CCATTCGTCACAATCTTTTGCGTC]-3'(配列番号36)の配列を用いてTaqMan RT-PCR法により行なった。RASGRF1遺伝子の発現は、90%以上の同遺伝子のDNAメチル化を示したSH101、SNU638、JRST、MKN28、AGS、NCI-N87の各胃癌細胞株、同じく約45%のDNAメチル化示したNUGC4、同じく約20%のDNAメチル化を示したMKN45においてほぼ消失していた。一方、RASGRF1遺伝子のDNAメチル化がほとんど生じていなかったNUGC3遺伝子の発現レベルは高かった。このように、RASGRF1遺伝子のメチル化を認める細胞において、RASGRF1遺伝子の発現が消失していた。
【0075】
【図5】RASGRF1遺伝子がDNAメチル化されている胃癌細胞株を5-aza-2'deoxycytidine (5-aza-dc)で処理するとRASGRF1遺伝子の発現が回復することを示す図である。縦軸はRASGRF1遺伝子の発現レベルを相対量(RQ:Relative Quantitation)で示し、各棒はそれぞれ胃癌細胞株を示す。胃癌細胞株は、MKN1、MKN7、MKN74、SH101、SNU1、SNU638、JRST、KatoIII、AZ521、MKN28、MKN45、NUGC3、NUGC4、AGS、NCI-N87の各胃癌細胞株を用い、5-aza-dcで処理しない細胞株と5-aza-dcで処理した細胞株のそれぞれについて、RASGRF1遺伝子の発現レベルを測定した。各棒は、5-aza-dcで処理しない場合と5-aza-dcで処理した場合を並べて示す。「AZA」と表記した棒は5-aza-dcで処理した場合を示し、「AZA」と表記していない棒は5-aza-dcで処理していない場合を示す。たとえば、「MKN1」は5-aza-dcで処理していないMKN1胃癌細胞株を示し、「MKN1 AZA」は5-aza-dcで処理したMKN1胃癌細胞株を示す。RASGRF1遺伝子の発現レベルの測定方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、フォワードプライマーとして5'-[TTCGGACAACACAAAATGGCAAACC]-3'(配列番号34)の配列を用い、リバースプライマーとして5'-[TCTTCTCTGTCTCCACGATCTGCA]-3'(配列番号35)または5'-[CCATTCGTCACAATCTTTTGCGTC]-3'(配列番号36)の配列を用いてTaqMan RT-PCR法により行なった。MKN74とAZ521を除く細胞株で、5-aza-dc処理により、RASGRF1遺伝子の発現が回復することが確認された。
【0076】
【図6】MCAM法(Methylated CpG Island Amplification Microarray法)により未分化型胃癌の背景粘膜で異常メチル化を認める遺伝子としてRASGRF1を同定したことを示す図である。胃癌症例の胃の背景粘膜およびH.pylori胃炎症例の胃の粘膜における胃粘膜生検検体中のRASGRF1遺伝子のパイロシークエンス法を用いたメチル化解析の結果を示す図である。各行が対象に対応し、塗りつぶしたセルは、メチル化頻度が15%以上であることを示す。癌症例の背景粘膜では高頻度で異常メチル化を認めるが、H.pylori胃炎症例では異常メチル化を示す症例は少ない。
【0077】
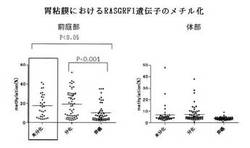
【図7】胃粘膜生検検体中のRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析の結果を示す図である。各点が各症例を示している。左側の図は胃の前庭部から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示し、右側の図は胃の体部から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示す。「未分化」はヘマトキシリン・エオジン染色標本により組織形態学に未分化型と判定された胃癌の罹患症例を、「分化」は同じ方法で分化型と判定された胃癌の罹患症例を、「非癌」はH.pyloriに感染しているものの胃癌に罹患していない症例を示す。横棒は各群のメチル化頻度の平均値を、P値は一元配置分散分析による有意差を示す。未分化型胃癌症例の胃前庭部の背景粘膜のメチル化率は、非癌症例の胃前庭部の粘膜に比べ有意に高メチル化を示していた。
【0078】
【図8】Updated Sydney Systemによる病理組織学評価で、萎縮がみられないか萎縮の程度が軽度、または腸上皮化生がみられないと診断された胃前庭部の胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析の結果を示す図である。各点が各症例を示している。左側の図は萎縮がみられないか萎縮の程度が軽度と判定された対象から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示し、右側の図は腸上皮化生がみられない症例から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示す。「未分化型」はヘマトキシリン・エオジン染色標本により組織形態学に未分化型と判定された胃癌の罹患症例を、「分化型」は同じ方法で分化型と判定された胃癌の罹患症例を、「非癌」はH.pyloriに感染しているものの胃癌に罹患していない症例を示す。横棒は各群のメチル化頻度の平均値を、P値は一元配置分散分析による有意差を示す。萎縮がみられないか萎縮の程度が軽度、または腸上皮化生がみられないと診断された未分化癌症例の背景粘膜におけるRASGRF1遺伝子のメチル化頻度は、非癌症例の背景粘膜におけるRASGRF1遺伝子のメチル化頻度よりも有意に高い頻度であった。
【0079】
【図9】血清ペプシノゲン陰性症例の胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析の結果を示す図である。各点が各症例を示している。左側の図は血清ペプシノゲンが陰性であった症例から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示し、右側の図は血清ペプシノゲンが陽性であった症例から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示す。「癌背景前庭部」は胃癌に罹患していた症例の胃前庭部の背景粘膜を、「非癌前庭部」はH.pyloriに感染しているものの胃癌に罹患していない症例の胃前庭部の粘膜を示す。横棒は各群のメチル化頻度の平均値を、P値はt-testによる有意差を示す。血清ペプシノゲンが陽性であるか陰性であるかに関わらず、癌背景前庭部のRASGRF1遺伝子のメチル化頻度は、非癌前庭部におけるRASGRF1遺伝子のメチル化頻度よりも有意に高い頻度であった。
【発明を実施するための形態】
【0080】
以下、本発明について詳細に説明する。
【0081】
本明細書中に別記のない限り、本発明に関して用いられる科学的および技術的用語は、当業者に通常理解されている意味を有するものとする。一般的に、本明細書中に記載された細胞および組織培養、分子生物学、免疫学、微生物学、遺伝子およびタンパク質および核酸化学に関して用いられる用語、およびその技術は、当該技術分野においてよく知られ、通常用いられているものとする。また、別記のない限り、本発明の方法および技術は、当該技術分野においてよく知られた慣用の方法に従って、本明細書中で引用され、議論されている種々の一般的な、および、より専門的な参考文献に記載されたとおりに行われる。かかる文献としては、例えば、Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Press(1989)およびSambrook et al., Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Press(2001); Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates(1992,および2000の補遺); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology - 4th Ed., Wiley & Sons(1999);Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press(1990);およびHarlow andLane, Using Antibodies: A Laboratory Manual, Cold Spring Harbor LaboratoryPress(1999)などが挙げられる。
【0082】
本明細書中に記載された分析化学、合成有機化学ならびに医薬品化学および薬化学に関して用いられる用語、ならびにその実験手順および技術は、当該技術分野においてよく知られ、通常用いられているものである。標準的な技術を、化学合成、化学分析、薬剤の製造、製剤および送達、ならびに対象の処置に用いるものとする。
【0083】
なお、本発明における用語「対象」は、任意の生物個体を意味し、好ましくは脊椎動物、より好ましくは哺乳動物、さらに好ましくはヒトの個体である。本発明において、対象は健常であっても、何らかの疾患に罹患していてもよいものとするが、癌に対する処置が企図される場合には、当該疾患に罹患している対象または実験的に罹患させた対象、例えばマウス、ラット、スナネズミ、モルモットなどの齧歯類、ネコ、ピューマ、トラなどのネコ科動物、シカ、オオシカなどのシカ科動物等の他、ウサギ、イヌ、ミンク、ヒツジ、ヤギ、ウシ、ウマ、サル、ヒトなどであることが好ましい。
【0084】
なお、本発明における用語「症例」は、ヒトの患者である対象をいう。
【0085】
本明細書においては、別記のない限り、遺伝子の名称はアルファベット(もしくはアルファベットと数字)等に「遺伝子」と付記して表記し、その遺伝子によってコードされるタンパク質は、前記のアルファベット(もしくはアルファベットと数字)等で表記したものに「タンパク質」と付記して表記するものとする。単にアルファベット(もしくはアルファベットと数字)等によってのみ標記した場合には、遺伝子またはタンパク質を意味する。前記の「遺伝子」は、ゲノム遺伝子、メッセンジャーRNAまたはcDNAのいずれかを意味するものとし、いずれかを特定する場合には、特定して表記するものとする。したがって、別記のない限り、例えば、単に「RASGRF1」と表記した場合には、RASGRF1(Ras Protein Specific Guanine Nucleotide-Releasing Factor 1)の遺伝子またはRASGRF1遺伝子によってコードされるタンパク質を意味し、「RASGRF1タンパク質」と表記した場合には、RASGRF1遺伝子によってコードされるタンパク質を意味し、特に「RASGRF1ゲノム遺伝子」と表記した場合には、RASGRF1をコードするゲノム遺伝子を意味する。
【0086】
本発明において、「背景組織」とは、癌に罹患した対象の癌を有する臓器における癌以外の部分から得た組織をいう。本発明において、「背景粘膜」とは、背景組織であって、かつ、粘膜組織であるものをいう。本発明において、「癌背景」とは、癌に罹患している症例の背景組織のことをいう。したがって、例えば「癌背景胃前庭部」と表記した場合には、胃癌に罹患している症例の胃前庭部の背景組織を意味する。
【0087】
本発明において、「癌組織」または「癌部」とは、癌に罹患した対象の癌を有する臓器における癌を含む部分から得た組織をいう。
【0088】
本明細書において、「エピジェネティック」とは、本発明の属する技術分野における通常の意味を有するものとし、例えば、DNA配列の変化を伴うことなく、クロマチンへの後天的な修飾により遺伝子発現が制御されることを例示することができる。クロマチンへの後天的な修飾の例としては、DNA塩基のメチル化のほか、ヒストンのメチル化、アセチル化、リン酸化などの化学修飾を例示することができる。
【0089】
本明細書において、「サイレンシング」とは、本発明の属する技術分野における通常の意味を有するものとし、遺伝子組み換え以外の機序でメッセンジャーRNAの量が低下することを意味する。「サイレンシング」には、転写型遺伝子サイレンシングと転写後遺伝子サイレンシングが含まれる。転写型遺伝子サイレンシングとしては、エピジェネティックなサイレンシング、ゲノムインプリンティング、パラミューテーション、トランスポゾン抑制、トランスジーン抑制、配置効果を例示することができ、転写後遺伝子サイレンシングとしては、RNA干渉、ナンセンス仲介減衰を例示することができる。
【0090】
本発明において用いられるRASGRF1タンパク質は、ヒトでは染色体15q24に位置するRASGRF1ゲノム遺伝子から転写されるRNAに由来するタンパク質であり、1273アミノ酸からなる1型アイソフォーム(NP_002882)、489アミノ酸からなる2型アイソフォーム(NP_722522)、1257アミノ酸からなる3型アイソフォーム(NP_001139120)の3種類のアイソフォームが知られている。それぞれのアイソフォームは、1型アイソフォームがアクセッション番号NM_002891で登録されているmRNA配列、2型アイソフォームがアクセッション番号NM_153815で登録されているmRNA配列、3型アイソフォームがアクセッション番号NM_001145648で登録されているmRNA配列としてそれぞれ発現している。したがって、RASGRF1タンパク質としては、配列番号2、配列番号4、または配列番号6で表わされるアミノ酸配列と同一もしくは実質的に同一のアミノ酸配列からなるタンパク質が挙げられる。また、RASGRF1遺伝子のmRNAとしては、配列番号1、配列番号3、または配列番号5で表わされる塩基配列と同一もしくは実質的に同一の塩基配列からなる核酸が挙げられる。
【0091】
ここで、配列番号1、3、または5で表わされる塩基配列と実質的に同一の塩基配列としては、配列番号1、3、または5で表される塩基配列と約70%以上、好ましくは約80%以上、より好ましくは約90%以上、さらに好ましくは約95%以上、最も好ましくは約98%以上の相同性を有する塩基配列等を例示することができる。さらに、配列番号1、3、または5で表わされる塩基配列と実質的に同一の塩基配列としては、配列番号2、配列番号4、または配列番号6で表わされるアミノ酸配列と同一もしくは実質的に同一のアミノ酸配列からなるタンパク質をコードする核酸の塩基配列であって、RASGRF1タンパク質の機能を有するタンパク質をコードする核酸の塩基配列を例示することができる。RASGRF1タンパク質の機能としては、配列番号2、4、または6で表わされるアミノ酸配列からなるRASGRF1タンパク質が有する機能、またはrasタンパク質に結合しているGDPの放出を促進してGTP結合型に変換する機能を例示することができる。
【0092】
また、同様に、配列番号2、4、または6で表されるアミノ酸配列と実質的に同一のアミノ酸配列としては、配列番号2、4、または6で表されるアミノ酸配列と約70%以上、好ましくは約80%以上、より好ましくは約90%以上、さらに好ましくは約95%以上、最も好ましくは約98%以上の相同性を有するアミノ酸配列等を例示することができる。そしてさらに、配列番号2、4、または6で表されるアミノ酸配列と実質的に同一のアミノ酸配列としては、配列番号2、4、または6で表されるアミノ酸配列において、好ましくは1〜10個の任意のアミノ酸が欠失、置換、付加した配列、より好ましくは、1〜5個の任意のアミノ酸が欠失、置換、付加した配列、さらに好ましくは1〜3個の任意のアミノ酸が欠失、置換、付加した配列を例示することができる。
【0093】
また、本発明において用いられるRASGRF1遺伝子には、例えば、配列番号1、3、または5で表される塩基配列を含有する核酸、または配列番号1、3、または5で表される塩基配列とストリンジェントな条件下で特異的にハイブリダイズする塩基配列を含有し、かつ前記の配列番号2、4、または6で表されるアミノ酸配列を含有するタンパク質と実質的に同等の性質を有するタンパク質をコードする核酸などが含まれる。ここで、配列番号1、3、または5で表される塩基配列とストリンジェントな条件下で特異的にハイブリダイズする塩基配列を含有する核酸としては、例えば、配列番号1、3、または5で表される塩基配列に対して相補的な塩基配列と約60%以上、好ましくは約70%以上、より好ましくは約80%以上、さらに好ましくは約90%以上、特に好ましくは約95%以上、最も好ましくは約98%以上の相同性を有する塩基配列を含有する核酸等を用いることができる。
【0094】
本明細書において、「ストリンジェントな条件」とは、通常、42℃、2×SSCおよび0.1%SDSの条件であり、好ましくは、65℃、0.1×SSCおよび0.1%SDSの条件である。
【0095】
なお、異種動物間はもちろんのこと、同種動物間でも、多型、アイソフォーム等によってRASGRF1遺伝子の塩基配列に相違が見られる場合があるが、塩基配列が相違する場合であってもRASGRF1タンパク質をコードする限り、RASGRF1遺伝子に含まれる。
【0096】
また、本発明において用いられるRASGRF1ゲノム遺伝子には、例えば、ヒト染色体15q24に位置するRASGRF1ゲノム遺伝子、RASGRF1遺伝子の哺乳類におけるホモログのゲノム遺伝子を例示することができる。
【0097】
本発明において、RASGRF1遺伝子のプロモーター領域は、染色体上でRASGRF1遺伝子の転写の開始に関与するDNA上の特定領域をいい、これにRNAポリメラーゼが結合し、転写が開始される領域である。一般に、プロモーター配列は、転写開始位置から-20〜-110 bpに位置し、TATA box、CAAT boxまたはGC boxなどのコンセンサス配列を有することが多い。しかし、転写開始位置から-20〜-110 bpに位置していなくとも、あるいは、これらのコンセンサス配列を有さなくても、転写開始位置の上流に位置し、RASGRF1遺伝子の転写の開始に関与するゲノムDNA上の特定領域であれば、RASGRF1遺伝子のプロモーター領域である。本発明においては、転写開始位置または開始コドンの5’端から2000bp上流までの全長2000bpの領域を意味し、好ましくは、配列番号7で表わされる領域である。
【0098】
本発明において、CpGアイランドとは、CpG(すなわち、5’側にシトシン、3’側にグアニンが隣接して互いにホスホジエステル結合により結合しているもの)に富む領域であり、GC含量が50%以上であって、かつ、CpGジヌクレオチドの実測頻度対予測頻度の比が0.6以上となるDNA領域を意味する。
【0099】
本発明において「DNAメチル化」とは、任意のゲノム遺伝子のプロモーター領域のCpGアイランドにおけるシトシンがメチル化されることをいう。
【0100】
本発明において「CpGアイランドのメチル化」とは、任意のゲノム遺伝子のプロモーター領域に存在するCpGアイランドにおけるDNAメチル化をいう。
【0101】
本発明において「異常メチル化」とは、任意のゲノム遺伝子のプロモーター領域に存在するCpGアイランドにおけるDNAメチル化が正常組織に比べて高い状態をいう。
【0102】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドは、上記で述べたプロモーター領域のうちCpGアイランドに該当する領域であれば、限定されることなく本発明の方法による癌の検出に用いることができる。
【0103】
前記のヒトRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのうち、本発明による癌の検出方法において、好ましいのは、例えば、配列番号7で表わされる配列の第267番目〜第671番目の塩基までの全長405bpの領域(配列番号8で表わされる塩基配列からなる領域)もしくはこれと実質的に同一の塩基配列を有する領域であり、より好ましいのは、配列番号7で表わされる配列の第296番目〜第610番目の塩基までの全長315bpの領域(配列番号9で表わされる塩基配列からなる領域)もしくはこれと実質的に同一の塩基配列を有する領域であり、最も好ましいのは配列番号7で表わされる配列の第387番目〜第524番目までの全長138bpの領域であり(配列番号10で表わされる塩基配列からなる領域)もしくはこれと実質的に同一の塩基配列を有する領域である。
【0104】
ここで、配列番号7、8、9または10で表される塩基配列と実質的に同一の塩基配列としては、配列番号7、8、9または10で表される塩基配列と約70%以上、好ましくは約80%以上、より好ましくは約90%以上、さらに好ましくは約95%以上、最も好ましくは約98%以上の相同性を有する塩基配列等を例示することができる。
【0105】
本発明の方法において、「メチル化されたCpGを検出する」とは、DNA塩基配列中のメチル化されたシトシン(すなわち、DNAメチル化)を検出することを意味する。
本発明の方法は、「対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出することを含む」限り、その対象において発癌のリスクが高いと判断する基準は特に限定されることなく実施することができ、個々の状況や癌の種類等に応じて適宜選択した基準を採用して発癌のリスクを検出してもよいが、正常組織では前記CpGアイランドにおけるメチル化されたCpGの割合は低く、癌組織では前記CpGアイランドにおけるメチル化されたCpGの割合は高い傾向にあることから、対象から得た生物学的試料中の前記CpGアイランドのメチル化されたCpGが、前記対象と同種の健常な対象から得た生物学的試料中のCpGアイランドのメチル化されたCpGと比較して、あるいは、前記対象と同一の個体から得た対照とする正常組織である生物学的試料中のCpGアイランドのメチル化されたCpGと比較して、定量的に多いことを基準として、対象において発癌リスクが高いとの検出結果とすることが好ましい。
【0106】
本発明においては、対象における癌を検出する方法であって、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出することを含む、前記方法が提供される。
【0107】
さらに、本願発明者らの研究によれば、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGは、対象から得た生物学的試料が正常組織である場合には、試料中の全CpGに占める割合は高くても5〜6%程度に止まるのに対し、対象から得た生物学的試料が癌組織または背景組織である場合には、試料中の全CpGに占める割合はこれをはるかに上回り50%を超える場合が多いことが見出されている。しかしながら、生物学的試料として、生検組織などを用いる場合には、癌組織と正常組織とが混在している場合が多いため、癌組織または背景組織の部分のみが高値であっても正常組織の部分の低値により平均化されて、試料中の全CpGに占めるメチル化されたCpGの割合は、実際に癌が存在する場合でも低値として表れる傾向にある。したがって、より好適な態様としては、本発明の方法は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGが、前記対象から得た生物学的試料中の前記領域におけるCpGアイランドの全てのCpG中(すなわち、前記試料中の全アレル中)、少なくとも8%、好ましくは少なくとも10%、より好ましくは少なくとも15%、さらに好ましくは少なくとも20%、よりさらに好ましくは少なくとも30%、もっとも好ましくは少なくとも50%を超えて含まれることを基準として癌を検出し、癌が存在するとの検出結果とすることができる。
【0108】
本発明の方法において、メチル化されたCpGの検出は、特に限定されず、どのような方法を用いて行ってもよいが、バイサルファイト(bisulfite)シークエンス法、パイロシークエンス(Pyrosequencing)法、コブラ(cobra)法、メチル化特異的PCR(MSP:Methylation-specific PCR)法、およびメチライト(methylight)法といったDNAメチル化(メチル化シトシン)を検出するための公知の方法を用いるのが好ましく、これらの方法は、いずれかを単独で用いてもよく、2つ以上を組み合わせて用いてもよい。前記で挙げた方法のうち、メチライト法は微量の検体から高い感度でメチル化を検出できるという点から特に好ましく用いられ、また、定量的なメチル化検出を目的とする場合にはパイロシークエンス法が特に好ましく用いられる。
【0109】
バイサルファイトシークエンス法によるDNAメチル化解析は、バイサルファイト(bisulfite:亜硫酸水素塩)で処理したDNAを用いてメチル化アレルと非メチル化アレルを同時に増幅し、得られたPCR産物をTOPO-cloning vector(invitorogen社)などにクローニングした後、シークエンス反応によりメチル化の有無を検出するものである。増幅した領域内の全てのCpG配列のメチル化の状態が分かるという利点があるが、一方で、解析に労力を要するので、多数の検体の解析には向いていない場合もある(Methods. 2002 Jun;27(2):101-7および鈴木拓,豊田実,今井浩三:bisulfitePCR法.新遺伝子工学ハンドブック改訂第4版(村松正實・山本雅編),羊土社,pp99-106,2003を参照)。
【0110】
具体的には、バイサルファイトシークエンス法によるDNAメチル化解析は、EpiTect Bisulfite Kits (Qiagen社)を用いてバイサルファイト処理したのち、一組のバイサルファイトシークエンス用のプライマーで目的の領域をPCRにより増幅し、増幅したPCR産物をTOPO TA Cloning Kit (Invitrogen社)でクローニングした後、ABI3130xシークエンサー(Applied Biosystems社)で塩基配列を解析することにより行なうことができる。プライマーは、CpGアイランド中の特定の領域を特異的に増幅するように設計することができる。
【0111】
パイロシークエンス法は、バイサルファイト処理したDNAを用いてメチル化アレルと非メチル化アレルを同時に増幅し、得られたPCR産物をパイロシークエンス法により解析するものである。DNAメチル化の割合は、シトシンとチミンの塩基多型として検出され、シトシンの蛍光強度をシトシンの蛍光強度とチミンの蛍光強度の合計で割って得た値として算出する。パイロシークエンス法は、定量的かつハイスループットなメチル化解析法として有用である(Nat Protoc. 2007;2(9):2265-75を参照)。
【0112】
具体的には、パイロシークエンス法によるDNAメチル化解析は、EpiTect Bisulfite Kits(Qiagen社)を用いてバイサルファイト処理した後、一組のパイロシークエンス用のプライマーで目的の領域をPCRにより増幅し、Pyro Goldリージェント(Biotage社)およびシークエンス用プライマーを用いてシークエンス解析することにより行なうことができる。これらのプライマーは、CpGアイランド中の特定の領域を特異的に増幅するように設計することができる。
【0113】
コブラ法(COBRA法;Combined Bisulfite Restriction Analysis)は、バイサルファイト処理したDNAを用いてメチル化アレルと非メチル化アレルを同時に増幅し、得られたPCR産物を制限酵素で切断した後、アガロースゲルで電気泳動し、エチジウムブロマイドによる染色を行い、制限酵素で切断されるバンドの有無により、メチル化の有無を判定するものである(Methods Mol Biol. 2002;200:71-85、鈴木拓,豊田実,今井浩三:bisulfitePCR法.新 遺伝子工学ハンドブック改訂第4版(村松正實・山本雅編),羊土社,pp99-106, 2003および鈴木拓 豊田実 COBRA法 エピジェネティクス実験プロトコール(牛島俊和・眞貝洋一編)羊土社 p69を参照)。
【0114】
具体的には、コブラ法によるDNAメチル化解析は、EZ DNAメチレーションキット(Zymo Research社,CA,USA)を使用し、胃粘膜生検検体に由来するゲノムDNAを亜硫酸水素ナトリウム溶液中において50℃で1晩処理を行ない、目的とする領域を増幅するようにデザインしたプライマーを用いてPCRを行ない、得られたPCR産物を適切な制限酵素で消化することにより行なうことができる。制限酵素を適切に選択することにより、増幅された目的とするゲノムDNAがメチル化されていない場合には亜硫酸水素ナトリウムでシトシンが修飾されて生じた配列は消化しない一方で、増幅された目的とするゲノムDNAがメチル化されている場合には亜硫酸水素ナトリウムでシトシンが修飾されないために制限酵素によって消化されるように実験をデザインすることができ、得られたPCR断片を電気泳動後、メチル化されている断片のバンドとメチル化されていない断片のバンドの濃度比をデンシトメトリーにより測定することができる。
【0115】
メチル化特異的PCR法は、バイサルファイト反応の際、メチル化の有無によりシトシンからウラシルへ変換される感受性に差があることを利用して、メチル化アレル及び非メチル化アレルに特異的なプライマーを作製し、PCR法により増幅して検出するものであり、得られたPCR産物はアガロースゲルで電気泳動し、エチジウムブロマイドによる染色を行って、バンドの有無によりメチル化の有無を判定することができる(Methods Mol Med. 2005;113:279-91および鈴木拓、豊田実、今井浩三:bisulfite PCR法 新 遺伝子工学ハンドブック改訂第4版(村松正實・山本雅編)、羊土社、pp99-106, 2003を参照)。
【0116】
具体的には、メチル化特異的PCR法は、EpiTect Bisulfite Kits (Qiagen社)を用いてバイサルファイト処理した後、一組のメチル化特異的プライマーでメチル化を検出し、また、一組の非メチル化特異的プライマーで非メチル化を検出することができる。これらのプライマーは、CpGアイランド中の特定の部位を特異的に増幅するように設計することができる。
【0117】
メチライト法は、メチル化特異的PCR法の一種であり、メチル化特異的配列を認識するようなプライマーとTaqMan Probeを組み合わせてリアルタイムPCR法によりメチル化の検出を蛍光を用いて行う方法である。メチライト法を用いることで高感度なメチル化検出が可能であり、微量の検体からメチル化検出を行う際に有用である(Methods. 2001 Dec;25(4):456-62を参照)。
【0118】
具体的には、メチライト法によるDNAメチル化解析は、DNAを亜硫酸水素塩処理によって改変して、5'蛍光レポーター色素および3'消光色素と共にオリゴヌクレオチドプローブに隣接する位置特異的PCRプライマーを用いて、蛍光に基づくリアルタイム定量的PCRにより増幅する。反応の間に蛍光レポーター色素は酵素によって放出される。放出される蛍光レポーター色素はPCR産物の量に比例するので、メチル化の程度に比例する蛍光を、自動ヌクレオチドシーケンサー装置において連続的に検出することができる(Eads CA, et al., Cancer Res. 1999 May 15;59(10):2302-6)。メチライト法によるDNAメチル化解析は、例えば、EpiTect MethyLight PCR Kit(Qiagen社)を用いて行なうことができる。
【0119】
バイサルファイトシークエンス法、パイロシークエンス法、コブラ法、メチル化特異的PCR法、メチライト法等を用いる場合には、バイサルファイト処理により、メチル化されていないシトシンが特異的にウラシルに変換され、メチル化されているシトシンはウラシルに変換されない。
【0120】
したがって、RASGRF1ゲノム遺伝子のプロモーター領域におけるCpGアイランドのシトシンがメチル化されていない場合には、配列番号7、8、9または10で表わされる領域は、バイサルファイト処理により、それぞれ、配列番号11、12、13または14で表わされる配列に変換される。一方、RASGRF1ゲノム遺伝子のプロモーター領域におけるCpGアイランドのシトシンがメチル化されている場合には、配列番号7、8、9または10で表わされる領域は、バイサルファイト処理により、それぞれ、配列番号15、16、17または18で表わされる配列に変換される。
【0121】
したがって、好ましい態様においては、本発明による上記のCpGの検出は、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドの塩基配列に特異的な一対のプライマー、例えば、配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、より好ましくは、配列番号8で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号8で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、さらに好ましくは、配列番号9で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号9で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、特に好ましくは、配列番号10で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号10で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、行われる。
【0122】
また、本発明の方法において、試料のバイサルファイト処理を行う場合には、試料中に含まれる配列番号7で示される塩基配列を有するDNA領域は、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドがメチル化されていない場合には配列番号11で示される塩基配列を有する領域に、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドがメチル化されている場合には配列番号15で示される塩基配列を有する領域に変換される。
【0123】
そのため、本発明による上記のメチル化されていないCpGの検出は、例えば、配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、より好ましくは、配列番号12で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号12で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、さらに好ましくは、配列番号13で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号13で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、特に好ましくは、配列番号14で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号14で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、行うことができる。
【0124】
同様に、本発明による上記のメチル化されているCpGの検出は、例えば、配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、より好ましくは、配列番号16で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号16で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、さらに好ましくは、配列番号17で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号17で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、特に好ましくは、配列番号18で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号18で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、行うことができる。
【0125】
ここで、配列番号7〜18で表される塩基配列と実質的に同一の塩基配列としては、配列番号7〜18で表される塩基配列と約70%以上、好ましくは約80%以上、より好ましくは約90%以上、さらに好ましくは約95%以上、最も好ましくは約98%以上の相同性を有する塩基配列等を例示することができる。前記プライマーの塩基長は、例えば、15〜40塩基、好ましくは17〜35塩基である。
【0126】
したがって、例えば、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドとして配列番号8に記載の領域を用いて、バイサルファイトシークエンス法、パイロシークエンス法、またはコブラ法により本願発明の方法を実施する場合には、試料をバイサルファイト処理することによって、試料中の配列番号8で表わされる配列中のCpGアイランドがメチル化されていない場合には配列番号12で表わされる配列に変換され、一方、試料中の配列番号8で表わされる配列中のCpGアイランドがメチル化されている場合には配列番号16で表わされる配列に変換される。そして、配列番号12で表わされる配列および配列番号16で表わされる配列は、ともに、フォワードプライマー:5’-[AGTGTGGGGTGTGTGTGTGT]-3’(配列番号19)およびリバースプライマー :5’-[ACTAAAAATTTTCTACAAAT]-3’(配列番号20)を用いてPCRにより増幅することができ、増幅された配列をシークエンス等することによりメチル化CpGを検出することができる。
【0127】
また、例えば、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドとして配列番号9に記載の領域を用いて、バイサルファイトシークエンス法、パイロシークエンス法、またはコブラ法により本願発明の方法を実施する場合には、試料をバイサルファイト処理することによって、試料中の配列番号9で表わされる配列中のCpGアイランドがメチル化されていない場合には配列番号13で表わされる配列に変換され、一方、試料中の配列番号9で表わされる配列中のCpGアイランドがメチル化されている場合には配列番号17で表わされる配列に変換される。そして、配列番号13で表わされる配列および配列番号17で表わされる配列は、ともに、フォワードプライマー:5’-[AAGATGGTGTTTTTTTTTTATAGGGTTG]-3’(配列番号21)およびリバースプライマー:5’- [AAAACCATAAAAACCTTCAAATAACTAC]-3’(配列番号22)を用いてPCRにより増幅することができ、増幅された配列をシークエンス等することによりメチル化CpGを検出することができる。同様に、試料中の配列番号7で表わされる塩基配列中の1204番目から1504番目までの塩基配列は、CpGアイランドがメチル化されている場合であっても、CpGアイランドがメチル化されていない場合であっても、ともに、フォワードプライマー:5’-[GGAGGAGGTATTAAGTTGTAGTTTG]-3’(配列番号23)およびリバースプライマー:5’- [CCAAATATCTACACTCCAAAATCTAAC]-3’(配列番号24)を用いてPCRにより増幅することができ、増幅された配列をシークエンス等することによりメチル化CpGを検出することができる。
【0128】
また、例えば、メチル化特異的PCR法またはメチライト法により本願発明の方法を実施する場合には、配列番号7で表わされる配列の第387番目〜第524番目までの全長138bpの領域(配列番号10で表わされる塩基配列からなる領域)を用いることができる。この場合、試料をバイサルファイト処理することによって、試料中の配列番号10で表わされる配列中のCpGアイランドがメチル化されていない場合には配列番号14で表わされる配列に変換され、試料中の配列番号10で表わされる配列中のCpGアイランドがメチル化されている場合には配列番号18で表わされる配列に変換される。
【0129】
したがって、メチル化特異的PCR法またはメチライト法により本願発明の方法を実施する場合には、フォワードプライマー:5’- [AGTTTGTTGTTTTTTGTGGTAGATAG]-3’(配列番号25)およびリバースプライマー:5’- [CCTACACAATTACACAACATTTATCC]-3’(配列番号26)を用いてPCR反応を行い、メチル化されていないCpGアイランドを特異的に増幅することができる。同様に、フォワードプライマー:5’- [AGTTCGTTGTTTTTTGCGGTAGATAG]-3’(配列番号27)およびリバースプライマー :5’- [CCTACACAATTACACGACATTTATCC]-3’(配列番号28)を用いてPCR反応を行い、メチル化されているCpGアイランドを特異的に増幅することができる。そして、メチル化特異的バンドおよび非メチル化特異的バンドの有無に基づいてメチル化CpGを検出することができる。
【0130】
メチル化特異的PCR法またはメチライト法により本願発明の方法を実施する場合には、また、フォワードプライマー:5’- [GTTGTTTTTTGTGGTAGATAGT]-3’(配列番号29)およびリバースプライマー :5’- [ACAACATTTATCCAAAAACA]-3’(配列番号30)を用いてPCR反応を行い、メチル化されていないCpGアイランドを特異的に増幅することもできる。同様に、フォワードプライマー:5’- [GTTGTTTTTTGCGGTAGATAGC]-3’(配列番号31)およびリバースプライマー :5’- [ACGACATTTATCCGAAAACG]-3’(配列番号32)を用いてPCR反応を行い、メチル化されているCpGアイランドを特異的に増幅することもできる。そして、メチル化特異的バンドおよび非メチル化特異的バンドの有無に基づいてメチル化CpGを検出することができる。
【0131】
また、配列番号25と配列番号26、配列番号27と配列番号28、配列番号29と配列番号30、配列番号31と配列番号32の各プライマーの組み合わせによって増幅された配列中のメチル化されたCpGをパイロシークエンス法により検出することもでき、その場合、シークエンスプライマー:5’- [GTTTTTTGYGGTAGATAG]-3’(配列番号33)を用いてメチル化CpGを検出することができる。
【0132】
尚、本発明においてメチル化DNAの検出に用いるプライマーの配列の標記において、「Y」で表記される塩基は、メチル化されていないCpGアイランド中のシトシンを検出する場合にはチミン(T)を意味するものとし、メチル化されているCpGアイランド中のメチル化シトシンを検出する場合にはシトシン(C)を意味するものとする。
本発明においてメチル化DNAの検出に用いるプライマーの配列の標記において、「R」で表記される塩基は、アデニン(A)またはグアニン(G)を意味する。
【0133】
なお、バイサルファイト処理は、2本鎖DNAを1本鎖にした後、シトシンをウラシルに変換することから、処理後のDNAは相補性を失い、処理後のセンス鎖に基づいてPCR増幅した場合と、アンチセンス鎖に基づいてPCR増幅した場合とでは、PCR産物の配列が一部異なる。これは、バイサルファイト処理の化学的性質に基づく現象で、どちらの鎖に基づいてPCRを行っても、理論的には同一の解析結果が得られる。通常は、遺伝子のセンス鎖の塩基配列に基づいてPCRプライマーを設計するが、繰り返し配列が多いなどの理由でPCR増幅やシークエンス反応が困難な場合には、アンチセンス鎖の塩基配列に基づいてプライマーを設計することにより、かかる技術的な困難性を解決することが可能な場合もある。
【0134】
またさらに、本発明によれば、対象から得た生物学的試料における上記のメチル化されたCpGを検出もしくは定量するための試薬として、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドの塩基配列に特異的な一対のプライマーであるオリゴヌクレオチドを含む、癌検出用キットまたは発癌リスクの検出用キットが提供される。
【0135】
上記の癌検出用キットまたは発癌リスクの検出用キットに含まれる、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのCpGを検出もしくは定量するために用いられるプライマーとして、例えば、配列番号7、8、9または10で表される塩基配列と同一または実質的に同一の塩基配列の一部を含むフォワードプライマー、およびそれぞれ配列番号7、8、9または10で表される塩基配列と同一または実質的に同一の塩基配列に相補的な塩基配列の一部を含むリバースプライマー用いて行うことができる。また、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを、メチル化されていないCpG特異的に検出する場合には、バイサルファイト処理した後のゲノムDNAを、配列番号11、12、13または14で表わされる塩基配列と同一または実質的に同一の塩基配列の一部を含むフォワードプライマー、およびそれぞれ配列番号11、12、13または14で表される塩基配列と同一または実質的に同一の塩基配列に相補的な塩基配列の一部を含むリバースプライマーを、それぞれ適宜設計して用いることにより行うことができる。さらにまた、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを、メチル化されているCpG特異的に検出する場合には、バイサルファイト処理した後のゲノムDNAを、配列番号15、16、17または18で表わされる塩基配列と同一または実質的に同一の塩基配列の一部を含むフォワードプライマー、およびそれぞれ配列番号15、16、17または18で表される塩基配列と同一または実質的に同一の塩基配列に相補的な塩基配列の一部を含むリバースプライマーを、それぞれ適宜設計して用いることにより行うことができる。
【0136】
本発明のキットに含まれる特に好ましいPCRプライマーセット用のオリゴヌクレオチドの組み合わせの例としては、配列番号19で表わされる塩基配列を有するオリゴヌクレオチドと配列番号20で表わされる塩基配列を有するオリゴヌクレオチドとの組み合わせ、配列番号21で表わされる塩基配列を有するオリゴヌクレオチドと配列番号22で表わされる塩基配列を有するオリゴヌクレオチドとの組み合わせ、配列番号23で表わされる塩基配列を有するオリゴヌクレオチドと配列番号24で表わされる塩基配列を有するオリゴヌクレオチドとの組み合わせ、配列番号25で表わされる塩基配列を有するオリゴヌクレオチドと、配列番号26で表わされる塩基配列を有するオリゴヌクレオチドとの組み合わせ、配列番号27で表わされる塩基配列を有するオリゴヌクレオチドおよび配列番号28で表わされる塩基配列を有するオリゴヌクレオチドとの組み合わせ、配列番号29で表わされる塩基配列を有するオリゴヌクレオチドと配列番号30で表わされる塩基配列を有するオリゴヌクレオチドの組み合わせ、もしくは、配列番号31で表わされる塩基配列を有するオリゴヌクレオチドと配列番号32で表わされる塩基配列を有するオリゴヌクレオチドの組み合わせ、または、これらの塩基配列を有するオリゴヌクレオチドの組合わせと実質的に同一である塩基配列からなるオリゴヌクレオチドの組み合わせなどが挙げられる。
【0137】
ここで、前記のPCRプライマーセット用のオリゴヌクレオチドの組み合わせと実質的に同一である塩基配列からなるオリゴヌクレオチドの組み合わせとは、これらのPCRプライマーセットを構成する配列番号19〜配列番号32の塩基配列からなるオリゴヌクレオチドにおいて、1塩基または2塩基の欠失、置換、付加を有する塩基配列からなるオリゴヌクレオチドをいい、好ましくは配列番号19〜配列番号32の塩基配列において1塩基の欠失、置換、付加を有する塩基配列からなるオリゴヌクレオチド、より好ましくは配列番号19〜配列番号32の塩基配列において1塩基の置換を有する塩基配列からなるオリゴヌクレオチドをいう。
【0138】
上記のごとく、配列番号19〜24で示されるオリゴヌクレオチドは、バイサルファイトシークエンス法、パイロシークエンス法、またはコブラ法により本願発明の方法を実施する場合に用いることができ、配列番号25〜32で示されるオリゴヌクレオチドは、メチル化特異的PCR法またはメチライト法により本願発明の方法を実施する場合に用いることができる。
【0139】
本発明の癌検出用キットは、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出するのに好適なものであるから、当該キットを用いて本発明による癌を検出するための指標を得る方法または発癌リスクを判断するための指標を得る方法を実施することができる。
【0140】
本発明の癌検出用キットは、上記いずれかのオリゴヌクレオチドもしくはプライマーを含む限り、いかなる形態であってもよく、試薬、器具、取扱説明書等を適宜含むことができ、組織や細胞等の生物学的試料からのDNAの抽出に用いられる溶液(例えば、組織もしくは細胞溶解用のバッファー、フェノール/クロロホルム、エタノール等)や器具、PCRに必要な試薬(例えばH2O、バッファー、MgCl2、dNTPミックス、Taqポリメラーゼ等)、PCR増幅断片の定量に必要な試薬(例えばRI、蛍光色素等)などの1種または2種以上を含むことができる。
【0141】
また、本発明において、癌とは、悪性腫瘍をいい、一般的に癌の概念に含まれるものを包含する。
さらに、胃癌とは、一般的に胃癌の概念に含まれるものを包含し、胃上皮粘膜から発生する悪性腫瘍などが含まれ、十二指腸癌とは、一般的に十二指腸癌の概念に含まれるものを包含し、十二指腸粘膜から直接発生した癌、十二指腸腺腫または十二指腸ポリープの癌化したもの、十二指腸に迷入した膵組織が癌化したもの、Brunel腺過誤腫の癌化したものが含まれる。大腸癌とは、一般的に大腸癌の概念に含まれるものを包含し、大腸上皮粘膜から発生する悪性腫瘍のほか、大腸腺腫などが含まれる。
【0142】
そして、膵癌とは、一般的に膵癌の概念に含まれるものを包含し、浸潤性膵管癌、膵内分泌腫瘍 、膵管内乳頭粘液性腫瘍、粘液性嚢胞腫瘍、腺房細胞癌が含まれる。また、肺癌とは、一般的に肺癌の概念に含まれるものを包含し、小細胞肺癌、肺扁平上皮癌、肺腺癌、肺大細胞癌、カルチノイド、円柱腫、粘表皮癌を含む。
【0143】
本発明における「対象から得た生物学的試料」としては、癌を検出することが可能な限りにおいて、特に限定されることなく、例えば、血液、血清、腹水、尿、糞便、胃洗浄液、膵液、あるいは、消化管組織(胃、十二指腸、小腸、大腸、膵臓等)の生検試料、肺の生検試料、喀痰等を利用することができる。RASGRF1遺伝子の発現レベルは、一般に、いずれの正常組織でも高く、癌組織において顕著に低下している傾向にあることから、対象から得た生物学的試料は、目的に応じて適宜選択することができ、例えば、大腸癌の検出を目的とする場合には、血清、糞便、大腸洗浄液、大腸組織等であることが好ましく、十二指腸癌の検出を目的とする場合には、十二指腸組織の生検試料であることが好ましく、胃癌の検出を目的とする場合には、血清、胃洗浄液、胃組織等であることが好ましく、膵癌の検出を目的とする場合には、血清、膵液、膵臓組織等であることが好ましく、肺癌の検出を目的とする場合には、肺の生検試料、喀痰であることが好ましい。
【0144】
また、かかる生物学的試料は、どのような方法で採取されたものでも本発明の方法に用いることができ、例えば、外科手術により採取されたものでもよく、組織採取用の穿刺針により採取されたものでもよく、あるいは、膵液の他、胃洗浄液、乳腺から分泌される分泌物または乳腺から分泌される洗浄液(乳管洗浄液(ductal fluid))として採取されたものでもよい。
【0145】
本発明の方法を実施するにあたっては、上記のような対象から得た生物学的試料について、DNA抽出等の前処理を行わずに、直接、上記のメチル化CpGの検出を行うことも可能であるが、生物学的試料中のDNAを抽出してから上記の方法、例えば、バイサルファイトシークエンス法、パイロシークエンス法、コブラ法、メチル化特異的PCR法、メチライト法等によってメチル化CpGの検出を行うことが好ましい。生物学的試料からDNAを抽出する方法は、当該技術分野においてよく知られており、例えば、フェノール・クロロホルムやエタノール、市販のDNA抽出試薬を用いて行うことができる。
【0146】
さらに、本発明者らは、RASGRF1が、正常細胞においては高い発現レベルが認められるのに対し、癌細胞においては、顕著に発現が抑制されていることを発見した。したがって、RASGRF1は癌細胞の増殖や転移の抑制に有効であると考えられるから、本発明はまた、RASGRF1タンパク質 を含んでなる癌治療剤、さらにまた、RASGRF1遺伝子を含んでなる癌治療剤を提供する。
【0147】
ここで、上記で述べた通り、RASGRF1タンパク質としては、具体的には、配列番号2、4、または6で表わされるアミノ酸配列と同一もしくは実質的に同一のアミノ酸配列を有するタンパク質が挙げられる。
【0148】
また、RASGRF1遺伝子としては、例えば、配列番号1、3、または5で表される塩基配列を含有する核酸、または、配列番号1、3、または5で表される塩基配列とストリンジェントな条件下で特異的にハイブリダイズする塩基配列を含有し、かつ前記の配列番号2、4、または6で表されるアミノ酸配列を含有するタンパク質と実質的に同等の性質を有するタンパク質をコードする核酸などが含まれる。ここで、配列番号1、3、または5で表される塩基配列とストリンジェントな条件下で特異的にハイブリダイズする塩基配列を含有する核酸としては、例えば、配列番号1、3、または5で表される塩基配列に対して相補的な塩基配列と約60%以上、好ましくは約70%以上、より好ましくは約80%以上、さらに好ましくは約90%以上、特に好ましくは約95%以上、最も好ましくは約98%以上の相同性を有する塩基配列を含有する核酸を用いることができる。
【0149】
本発明による上記癌治療剤は、いずれも、どのような癌に対しても用いることができるが、上記で述べたような胃癌、十二指腸癌、大腸癌、膵癌、肺癌に対して特に好ましく用いられる。
【0150】
本発明の癌治療剤は、医薬上許容可能な担体(例えば、賦形剤、結合剤、崩壊剤、滑沢剤、安定剤、防腐剤、pH調整剤、矯味矯臭剤、希釈剤、注射剤用溶剤等)と組み合わせて癌のための治療剤として製剤化して提供することができる。また、本発明の治療剤は、特異的に標的組織へ送達させることを可能にする標識やナノカプセル等を含有してもよい。なお、本発明の治療剤には、RASGRF1タンパク質またはRASGRF1をコードする核酸、のいずれかが単独で含まれていてもよく、2つ以上が組み合わされて含まれていてもよい。
【0151】
さらに、本発明の治療剤は、癌の治療に有効な公知の抗癌剤などの他の薬効成分をさらに含んでもよく、また、これらの有効成分と組み合わせて用いることもできる。ここで、公知の抗癌剤としては、例えば、フルオロウラシル、タモキシフェン、アナストロゾール、アクラルビシン、ドキソルビシン、テガフール、シクロホスファミド、イリノテカン、シタラビン、パクリタキセル、ドセタキセル、エピルビシン、カルボプラチン、シスプラチン、チオテパ、またはこれらの医薬上許容される塩等を例示することができる。
【0152】
本発明の治療剤の投与経路としては、例えば、静脈内投与、動脈内投与、皮下投与、筋肉内投与、腹腔内投与、局所投与等の非経口投与、および経口投与が挙げられ、投与剤形としては、噴霧剤、カプセル剤、錠剤、顆粒剤、シロップ剤、乳剤、座剤、注射剤、懸濁剤等が例示される。具体的には、局所投与の場合、外科手術にて患部を露出し、癌組織に注射器等の手段で本発明の治療剤を直接投与することができ、また、非局所投与の場合、腫瘍栄養血管内投与により行うことができる。好ましい投与経路は、局所投与である。
【0153】
また、特に、RASGRF1遺伝子をコードする核酸を含む本発明の癌治療剤については、RASGRF1遺伝子を癌細胞に導入して発現させることを目的とした遺伝子治療剤として用いることができる。
【0154】
遺伝子治療剤として用いられる本発明の癌治療剤は、HVJリポソーム法、前記遺伝子の塩基配列を注射等によってそのまま投与する方法、リン酸カルシウム法、DEAE−デキストラン法、エレクトロポレーション法、遺伝子銃による方法、リポフェクション法によって投与する方法、適当な発現ベクターを使う方法等によって、非経口的投与経路で対象に投与することができる。ここで、適当な発現ベクターとしては、例えば、アデノウイルスベクター、アデノ随伴ウイルスベクター、ヘルペスウイルスベクター、ワクシニアウイルスベクター、レトロウイルスベクター等を例示することができる。
【0155】
本発明の癌治療剤の投与量及び投与回数は、目的とする作用効果、投与方法、治療期間、対象の年齢、体重、性別等により異なるが、RASGRF1タンパク質を利用する場合の投与量は、対象がヒトである場合には成人1日当たり通常100μg〜100mg、好ましくは1〜20mgの範囲から適宜選択でき、RASGRF1遺伝子をコードする核酸、またはこれらを含む発現ベクターを利用する場合の投与量は、対象がヒトである場合には成人1日当たり通常0.01mg/kg〜1g/kg、好ましくは0.1mg/kg〜500mg/kg、より好ましくは1mg/kg〜50mg/kgの範囲から適宜選択でき、投与回数は、1日1回から数回の範囲から適宜選択できる。但し、投与量は、種々の条件により変動し得るため、上記範囲に限定されない。
【0156】
また、本発明によれば、RASGRF1タンパク質をコードする核酸の使用、特に、本発明による治療剤の製造における使用および本発明による治療剤としての使用、が提供される。
【0157】
さらにまた、本発明によれば、RASGRF1遺伝子をコードする核酸を投与することを含んでなる、癌の治療方法が提供される。この場合の有効投与量、投与方法、および投与形態等は、上記に準ずることができる。
【0158】
本発明の癌の予防剤または治療剤の探索方法は、動物に由来する細胞又は動物を用いて行なうことができる。細胞は、初代培養細胞であっても株化された細胞であってもよく、遺伝子改変された細胞であっても良い。動物は、ヒト以外の動物であれば、野生型であっても、遺伝子改変された動物であっても良い。本発明の癌の予防剤または治療剤の探索方法に用いる動物に由来する細胞は、哺乳動物に由来することが好ましく、動物を用いる場合にはヒト以外の哺乳動物を用いることができる。
【0159】
本発明の探索方法は、試験物質の存在下および非存在下において動物細胞を培養し、それぞれの細胞におけるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の頻度を測定し、そして、当該メチル化を抑制する効果を有する試験物質または当該メチル化の頻度を低下させる効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【0160】
また、本発明の探索方法は、試験物質の存在下および非存在下において動物細胞を培養し、それぞれの細胞におけるRASGRF1遺伝子の発現量を測定し、そして、RASGRF1遺伝子の発現を促進する効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【0161】
本発明の探索方法は、動物に試験物質を投与したのち、特定の組織におけるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の頻度を測定し、そして、試験物質を投与しなかった場合に比べて当該メチル化を抑制する効果を有する試験物質または当該メチル化の頻度を低下させる効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【0162】
また、本発明の探索方法は、動物に試験物質を投与したのち、特定の組織におけるRASGRF1遺伝子の発現量を測定し、そして、試験物質を投与しなかった場合に比べてRASGRF1遺伝子の発現を促進する効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【0163】
本発明を以下の実施例を用いてより具体的に説明するが、本発明の範囲は、これらの実施例に限定されない。
【実施例】
【0164】
<実施例1> 胃粘膜生検検体の採取
上部消化管内視鏡検査時に、患者へのインフォームドコンセント及び施設の倫理委員会の了承を得た上で、H.pylori感染胃炎の診断のために採取された非癌部の胃粘膜生検検体の一部からフェノール・クロロホルムによりDNAを抽出してメチル化解析を行った。142症例、284検体(未分化癌32症例(DGC)、分化型癌59症例(IGC)、非癌51症例(NGC))を対象とした。H.pylori感染の診断は血清H.pylori抗体、鏡検法、迅速ウレアーゼ法、呼気試験のいずれかで判定した。
【0165】
<実施例2> 未分化癌背景粘膜でメチル化されている遺伝子の網羅的なスクリーニング
未分化型胃癌の癌部3検体、胃前庭部と胃体部の非癌粘膜各6検体、分化型胃癌の癌部3検体、胃前庭部と胃体部の各4検体、非癌症例の胃前庭部と胃体部の各6検体を用いてMCAM法(Methylated CpG Island Amplification Microarray法)によって、メチル化されているゲノム遺伝子探索を行った。MCAM法は、Estecio MRH, et al., High-throughput methylation profiling by MCA coupled to CpG island microarray., Genome Research, 2007;17:1529-1536またはGao W, et al., Variable DNA methylation patterns associated with progression of disease in hepatocellular carcinomas. Carcinogenesis 2008;29:1901-10に記載の方法に準じて行なった。
その結果、これまで報告されているmicroRNA34b/c,IRF4,SFRP2,DKK2等の癌抑制遺伝子の異常メチル化を未分化型胃癌の背景粘膜で検討したところ、これらの癌抑制遺伝子の中に未分化型胃癌の背景粘膜で異常メチル化が蓄積されている遺伝子は認めなかった。
一方、クラスター解析により、一部の未分化癌組織、その胃前庭部背景粘膜でのメチル化を認める一方で、分化癌組織、分化癌の背景ではメチル化を認めない遺伝子としてRASGRF1を抽出した。クラスター解析は、genespring ver.11(アジレントテクノロジー社)を用いて行なった。
【0166】
<実施例3> 胃癌細胞株におけるRASGRF1遺伝子のメチル化
各種の胃癌細胞株を用いてRASGRF1遺伝子のDNAメチル化を測定した。胃癌細胞株は、MKN1、MKN7、MKN74、SH101、SNU1、SNU638、JRST、KatoIII、AZ521、MKN28、MKN45、NUGC3、NUGC4、AGS、NCI-N87の各胃癌細胞株についてRASGRF1遺伝子のDNAメチル化を測定した。RASGRF1遺伝子のDNAメチル化の測定方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、パイロシークエンス法により行なった。図3に示すように、RASGRF1遺伝子は、MKN7、SH101、SNU638、JRST、KatoIII、MKN28、AGS、NCI-N87の各胃癌細胞株について90%以上のDNAメチル化を示し、MKN74とSNU1について70%以上のDNAメチル化を示し、AZ521については約55%のDNAメチル化を、NUGC4については約45%のDNAメチル化を、MKN45については約20%のDNAメチル化をそれぞれ示した。このように、RASGRF1遺伝子は胃癌細胞株において高頻度にメチル化されていた。
【0167】
<実施例4> 胃癌細胞株におけるRASGRF1遺伝子の発現消失
各種の胃癌細胞株を用いてRASGRF1遺伝子の発現レベルを測定した。胃癌細胞株は、MKN1、MKN7、MKN74、SH101、SNU1、SNU638、JRST、KatoIII、AZ521、MKN28、MKN45、NUGC3、NUGC4、AGS、NCI-N87の各胃癌細胞株についてRASGRF1遺伝子の発現レベルを測定した。RASGRF1遺伝子の発現レベルの測定方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、フォワードプライマーとして5'-[TTCGGACAACACAAAATGGCAAACC]-3'(配列番号34)の配列を用い、リバースプライマーとして5'-[TCTTCTCTGTCTCCACGATCTGCA]-3'(配列番号35)または5'-[CCATTCGTCACAATCTTTTGCGTC]-3'(配列番号36)の配列を用いて TaqMan RT-PCR法により行なった。図4に示すように、RASGRF1遺伝子の発現は、90%以上の同遺伝子のDNAメチル化を示したSH101、SNU638、JRST、MKN28、AGS、NCI-N87の各胃癌細胞株、同じく約45%のDNAメチル化を示したNUGC4、同じく約20%のDNAメチル化を示したMKN45においてほぼ消失していた。一方、RASGRF1遺伝子のDNAメチル化がほとんど生じていなかったNUGC3遺伝子の発現レベルは高かった。このように、RASGRF1遺伝子のメチル化を認める細胞において、RASGRF1遺伝子の発現が消失していた。
【0168】
<実施例5> 5-aza-2'-deoxycytidine(5-aza-dc)処理による、胃癌細胞株におけるRASGRF1遺伝子の発現の回復
実施例3および実施例4で用いたのと同じ胃癌細胞株を5-aza-2'-deoxycytidineで処理し、RASGRF1遺伝子の発現レベルを測定した。5-aza-dc処理は、2μMの5-aza-dcの存在下で各胃癌細胞株を72時間培養することにより行なった。RASGRF1遺伝子の発現レベルの測定方法は実施例4と同様に行ない、5-aza-2'-deoxycytidineによる処理方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて行なった。メチル化酵素阻害剤である5-aza-2'-deoxycytidine処理により、MKN74とAZ521を除く細胞株で、RASGRF1遺伝子の発現の回復を認めた。
【0169】
<実施例6> MCAM法による胃粘膜生検検体中のRASGRF1遺伝子のメチル化解析
次に臨床検体によるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を行った。MCAM法(Methylated CpG Island Amplification Microarray法)によって、胃癌組織と背景粘膜が同時に採取されている58症例(未分化型癌28症例、分化型癌25症例)とH.pylori感染胃炎症例22症例についてメチル化されているゲノム遺伝子探索を行った。MCAM法は、Estecio MRH, et al., High-throughput methylation profiling by MCA coupled to CpG island microarray., Genome Research, 2007;17:1529-1536またはGao W, et al., Variable DNA methylation patterns associated with progression of disease in hepatocellular carcinomas. Carcinogenesis 2008;29:1901-10に記載の方法に準じて行ない、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGの割合が15%以上である場合に陽性とした(図6)。
未分化型胃癌の癌部14症例(50%)、背景粘膜14症例(50%)、分化型胃癌の癌部13症例(52%)、背景粘膜15症例(60%)でメチル化を認めた。H.pylori感染胃炎症例では2症例(9%)でメチル化を認めるのみであった。RASGRF1遺伝子のメチル化を非癌胃粘膜で認める場合、胃癌が存在するオッズ比は12.1倍であった。
【0170】
<実施例7> 胃粘膜生検検体中のRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析
次にRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を全検体について定量的に行った。RASGRF1遺伝子のメチル化解析の方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、パイロシークエンス法により行なった。その結果、胃前庭部の背景粘膜におけるメチル化されたCpGの割合の平均値は、未分化型癌症例では17.67%、分化型癌症例では19.07%、H.pylori感染胃炎症例では10.10%であった。メチル化されたCpGの割合は、未分化型癌症例、分化型癌症例のそれぞれにおいて、H.pylori感染胃炎症例に比べて、有意(p<0.05, p<0.001)に高かった。したがって、胃前庭部の背景粘膜におけるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析が発癌リスク予測に有用であることが示された(図7)。なお、胃体部の背景粘膜におけるメチル化されたCpGの割合は、未分化型癌症例、分化型癌症例、H.pylori感染胃炎症例の間で有意差が認められなかった。
【0171】
<実施例8> Updated Sydney Systemによる胃粘膜生検検体の病理組織学的評価
胃炎の診断は胃前庭部大彎、胃体中部大彎より生検しUpdated Sydney Systemにより、活動性、炎症、萎縮、腸上皮化生の程度を評価した。Updated Sydney Systemは、Dixon MF, et al. Classification and grading of gastritis. The updated Sydney System. international Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol 1996;20:1161-81.に基づいて行なった。
【0172】
<実施例9> 病理組織学的に萎縮がないか軽度である胃前庭部の胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析
Updated Sydney Systemにより病理組織学的評価が得られた症例のうち、萎縮の程度が無しまたは軽度と判定された30症例についてRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を、実施例3および実施例7と同様の方法で行った(図8)。その結果、胃前庭部の背景粘膜におけるメチル化されたCpGの割合の平均値は、未分化型癌症例では17.58%、分化型癌症例では13.2%、H.pylori感染胃炎症例では7.29%であった。未分化型癌症例におけるメチル化されたCpGの割合は、H.pylori感染胃炎症例におけるメチル化されたCpGの割合に比べて有意(p<0.05)に高かった。
【0173】
<実施例10> 病理組織学的に腸上皮化生を認めない胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析
Updated Sydney Systemにより病理組織学的評価が得られた症例のうち、腸上皮化生を認めない33症例についてRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を、実施例3および実施例7と同様の方法で行った(図8)。その結果、胃前庭部の背景粘膜におけるメチル化されたCpGの割合の平均値は、未分化型癌症例では10.65%、分化型癌症例では7.45%、H.pylori感染胃炎症例では4.15%であった。未分化型癌症例におけるメチル化されたCpGの割合は、H.pylori感染胃炎症例におけるメチル化されたCpGの割合に比べて有意(p<0.05)に高かった。
【0174】
<実施例11> 血清ペプシノゲンの測定
血清H.pylori抗体検査の際に採取された血清でペプシノゲンI、IIを測定した。ペプシノゲンIの血清中濃度が70ng/mlを超えているいるか、あるいは、ペプシノゲンIの血清中濃度がペプシノゲンIIの血清中濃度の3倍を超えている場合に血清ペプシノゲンが陰性であり、胃の萎縮がみられないものと判定した。
【0175】
<実施例12> 血清ペプシノゲン陰性症例の胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析
血清ペプシノゲンが陰性であった29症例の胃前庭部粘膜についてRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を、実施例3および実施例7と同様の方法で行った。その結果、胃前庭部の背景粘膜におけるメチル化されたCpGの割合の平均値は、H.pylori感染胃炎症例(非癌前庭部)では7.1%であるのに対して、胃癌罹患症例(癌背景前庭部)では15.78%であり、有意(p<0.05)に高いメチル化を示した(図9)。ペプシノゲン陰性症例において、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGの割合が10%以上である場合に胃癌に罹患している確率は、胃癌に罹患していない確率に比べて、オッズ比9.3であった。
【0176】
<実施例13> 血清ペプシノゲン陽性症例の胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析
血清ペプシノゲンが陽性であった30症例の胃前庭部粘膜についてRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を、実施例3および実施例7と同様の方法で行った。その結果、胃前庭部の背景粘膜におけるメチル化されたCpGの割合の平均値は、H.pylori感染胃炎症例(非癌前庭部)では11.27%であるのに対して、胃癌罹患症例(癌背景前庭部)では20.4%であり、有意(p<0.05)に高いメチル化を示した(図9)。
ペプシノゲン陽性症例において、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGの割合が10%以上である場合に胃癌に罹患している確率は、胃癌に罹患していない確率に比べて、オッズ比3.0であった。
【0177】
<実施例14> 統計解析
全ての統計解析は、PRISM version 5 for windowsを用い、one way ANOVA(一元配置分散分析)、Student's t-test(スチューデントのt検定)による統計的検定を行った。
【0178】
以上の結果より、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化は、胃癌に罹患した症例における胃粘膜組織のうちの癌化していない部分(背景粘膜)において高いレベルで検出され、H.pyloriに感染したのみで胃癌に罹患していない症例の胃粘膜組織においてはほとんど検出されなかったことから、胃癌の発癌リスクが高いほどRASGRF1遺伝子のプロモーター領域におけるCpGアイランドが特異的に高い割合でメチル化されていることが明らかになるとともに、胃癌特異的にRASGRF1遺伝子がサイレンシングされていることが示唆された。また、胃癌のみならず、十二指腸癌、大腸癌などの消化器癌、および膵癌または肺癌などのras遺伝子が発癌に関与する癌においても、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドがメチル化され、RASGRF1遺伝子がサイレンシングされているものと考えられた。
【0179】
RASGRF1は、発癌遺伝子であるrasのGTP交換促進因子であり、RASGRF1の遺伝子発現抑制は、本来、癌の抑制に資すると推定されるはずである。しかし、本願の発明者は、予想に反して、胃癌に罹患した症例における胃粘膜組織のうちの癌化していない部分において、RASGRF1遺伝子が高頻度のメチル化によって発現抑制されていることを見出したものである。
【0180】
以上の通り、本願発明者らは、未分化型胃癌の背景粘膜で、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのCpGが高い割合でメチル化していることを見出した。RASGRF1遺伝子は胃癌の約50%でメチル化されており(図6)、胃癌に罹患した症例における胃粘膜組織のうちの癌化していない部分においても高頻度にメチル化されていた。単にH.pylori胃炎を患ったのみではメチル化を認めないことも明らかとなり、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGの割合は、胃癌の検出の指標、および胃癌の発癌リスクを判断するための指標として有用であると考えられた。また、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドは未分化型胃癌および分化型胃癌に罹患した症例における胃粘膜組織のうちの癌化していない部分(背景粘膜)において、H.pylori胃炎に罹患した胃粘膜より有意に高頻度にメチル化されていた。さらに驚くべきことに病理学的な萎縮・腸上皮化生を認めない癌症例、あるいは血清ペプシノゲン陰性症例においても、胃癌に罹患した症例における胃粘膜組織のうちの癌化していない部分においてRASGRF1遺伝子のプロモーター領域におけるCpGアイランドが異常に高い割合でメチル化していることが明らかとなった。この結果よりRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化を測定することは、萎縮、腸上皮化生を経ずに発癌する胃癌、特に未分化型癌の存在診断、さらに未分化型癌の発癌リスクの予測に有用であることが明らかとなった。
【0181】
これらの結果から、本願発明の方法により、あるいは、本発明のキットを用いることにより、対象から得た生物学的試料を用いて、対象における癌、特に、胃癌、十二指腸癌、大腸癌、膵癌、肺癌を、容易にしかも正確に検出することが可能であることが示された。また、本願発明の方法または本願発明のキットは、癌の検出のみならず、癌の進達度予測、発癌リスクの予測、再発リスクの予測にも極めて有用であると考えられた。前記CpGアイランドは、上記の通り癌細胞においてRASGRF1遺伝子という癌の背景組織特異的に発現が低下している遺伝子の発現を直接調節していることから、この領域のメチル化を基準として癌を検出する本願発明の方法は、極めて精度の高いものである。
また、本願発明の癌の予防剤または治療剤は、胃癌、十二指腸癌、大腸癌、膵癌、肺癌等の癌において、癌抑制遺伝子産物的に機能するRASGRF1の発現を増加させるものであることから、有効に癌細胞の増殖を抑制し得るものであることが示された。
さらにまた、本願発明の癌の予防剤または治療剤の探索方法は、細胞を用いて効率よく行なうことのできる探索方法であり、新しい作用機序に基づいて未分化型胃癌の予防または治療に有用な物質を探索し得るものであることが示された。
【産業上の利用可能性】
【0182】
RASGRF1遺伝子は、胃癌、十二指腸癌、大腸癌、膵癌、肺癌等の癌において特異的に発現が抑制されており、本発明によれば、かかるRASGRF1遺伝子の発現抑制を直接的に制御するRASGRF1遺伝子プロモーター領域のCpGアイランドにおけるDNAメチル化を検出することを含む発癌リスクを判断するための指標を得るため方法、およびかかる方法に基づく発癌リスクの指標を得るためのキットを提供することができる。したがって、本発明は、胃癌、十二指腸癌、大腸癌、膵癌、肺癌等の癌の診断に加え、その治療や研究にも大いに貢献するものである。
また、RASGRF1は、癌の背景組織および癌細胞において特異的に発現が低下しているとともに、発癌遺伝子等の発現を抑制する作用を有することから、RASGRF1、あるいは、RASGRF1遺伝子をコードする核酸を含む癌の治療剤の探索方法を提供することができ、かかる癌の治療剤の探索方法は高い治療効果が得られる医薬品開発に有用であることが期待される。
【技術分野】
【0001】
本発明は、癌を検出するための指標を得る方法、発癌リスクを判断するための指標を得る方法、癌の検出用キット、発癌リスクの検出用キット、癌の予防剤、癌の治療剤、癌の予防剤の探索方法、および癌の治療剤の探索方法に関する。
【背景技術】
【0002】
癌は、先進国における死因の上位にあり、例えば、2003年度に日本人の31%が癌で死亡しており、ここ20年程わが国における死因の第1位であり続けている。
【0003】
死因となった癌を部位別に見た場合には、胃癌が一貫して最近20年間、第1または第2位を占めているが、胃癌罹患症例の内訳については明らかな経年変化が見られ、かつては、進行胃癌に代表される、StageIII、IVが主たる患者層を占めていたのに対し、現在では、50%以上がStageIで占められている。StageIはStageIaおよびIbからなるが、いずれも癌が粘膜下層にとどまることが特徴であり、いわゆる早期癌に分類される。
【0004】
また、近年、Helicobacter pylori(H.pylori)の感染による胃炎が胃癌の原因となることが認知されるようになったが、H.pylori感染率は胃癌発生率よりも遙かに高く、感染者のなかで胃癌ハイリスク群を設定することが胃癌の早期発見や予防のために極めて重要である。
【0005】
このような癌の早期発見においては、現在、肉眼診断による術前評価が100%の診断能を持たない。
【0006】
一般に、胃癌の約90%が分化型である。分化型の胃癌は、内視鏡検査で強い萎縮または腸上皮化生がみられるほど癌化しやすいことが知られているので早期診断しやすい。また、萎縮の指標となる血清ペプシノゲン法も分化型胃癌のハイリスク群の同定に有用であると考えられ、近年健康診断などで応用されるようになってきた(図1)。このような萎縮、腸上皮化生は分化型胃癌の背景粘膜においてみられる。分化型胃癌の前癌病変である腺腫や腸上皮化生では、P16、MLH1等の癌抑制遺伝子のCpGアイランドの異常メチル化が蓄積していることが知られている(Kang GH, Shim YH, Jung HY, et al. CpG island methylation in premalignant stages of gastric carcinoma. Cancer Res 2001;61:2847-51. Lee JH, Park SJ, Abraham SC, et al. Frequent CpG island methylation in precursor lesions and early gastric adenocarcinomas. Oncogene 2004;23:4646-54.)。
しかしながら、分化型胃癌の発癌リスクを判断するマーカーはいずれも未分化型の発癌リスクの判断には使用できなかった。
さらに、発癌遺伝子の機能を促進する遺伝子のCpGアイランドのDNAメチル化と胃癌との関連は知られていない。また、発癌遺伝子の機能を促進する遺伝子のCpGアイランドのDNAメチル化と胃癌の発癌リスクを判断するための指標を得る方法との関連は知られていない。
【0007】
一方で、胃癌の約10%を占める未分化型胃癌は、萎縮、腸上皮化生を伴わずに発生することが知られ、血清ペプシノゲン法でも陰性となり、ハイリスク群の同定が困難である。未分化型胃癌の早期病変を内視鏡検査で発見することは、分化型癌に比べ困難であり、また進行も早く、早期にリンパ節転移をきたすため予後が悪い(図2)。しかしながら、現在、未分化型胃癌の発癌リスクを判断するための指標を得る方法は知られていない。したがって、このような未分化型胃癌の発癌リスクを予測する分子マーカーの確立が求められている。
【0008】
未分化型癌の発生は分化型癌とは異なるメカニズムによって生ずると考えられており、未分化型癌の発生リスクを検出しうる新規遺伝子の同定が必要であると思われる。また、未分化型癌の発生リスクの検出に際しては、未だ癌化していない組織を用いて未分化型癌の発生リスクを検出しうることが必要であると考えられる。従って、未だ癌化していない組織を用いて、未分化型の胃癌の発生リスクを検出しうる新規遺伝子の同定が必要であると考えられる。
【0009】
尚、H.pyloriの感染は、これら分化型および未分化型のいずれの胃癌をも生じさせる(Uemura N, Okamoto S, Yamamoto S, et al. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med 2001;345:784-9.)。
【0010】
このような状況下、癌の早期発見に関し、近年、異常メチル化による遺伝子発現抑制が種々の癌細胞株で重要な役割を担っていることがわかってきつつあり、異常メチル化を指標とした癌の検出方法が提案されている。例えば、インターフェロン調節因子4遺伝子、インターフェロン調節因子5遺伝子、インターフェロン調節因子8遺伝子の異常メチル化による遺伝子発現抑制が種々の癌細胞株で重要な役割を担っていることが報告されている(非特許文献1:Yamashita M, et al, Cancer Science 2010, 101(7), 1708-1716)。またH.pylori感染により胃の粘膜において、LOX、HAND1、THBD、p41ARC、FLNcなどの様々な遺伝子に異常メチル化が生じ、分化型癌のリスクが高まることも明らかにされている(非特許文献2:Maekita T. et al., Clinical Cancer Research, 2006, 12(3), 989-995; 非特許文献3:Nakajima T., Cancer Epidemiology, Biomarkers and Prevention, 2006, 15(11), 2317-2321)。
【0011】
癌抑制遺伝子の不活性化のメカニズムとしては、エピジェネティックな遺伝子の発現抑制(サイレンシング)が広く知られている。特に、癌抑制遺伝子の転写開始領域におけるCpGアイランドのシトシンメチル化(DNAメチル化)は、ほぼあらゆる癌において見られる現象であり、既知の癌抑制遺伝子の多くが、DNAメチル化によりサイレンシングを受けることが報告されている。近年、癌において特異的にDNAメチル化が認められる遺伝子が次々と発見され、癌におけるDNAメチル化は、発癌リスクの上昇および癌の発生・進展に関与する遺伝子異常のメカニズムとして、変異や欠失と並ぶ重要性を持っていると考えられるようになっている(Jones PA and Baylin SB. The epigenomics of cancer. Cell 2007;128:683-92.)。
【0012】
しかしながら、これまでに、未分化型癌と特定遺伝子のDNAメチル化の関連については知られていない。
【0013】
一方、発癌リスクの上昇および癌の発生・進展の要因の1つに、癌抑制遺伝子の不活性化、および発癌遺伝子の変異等による活性化が挙げられる。
【0014】
一方、発癌遺伝子として最もよく知られたものにras遺伝子がある。ras遺伝子はヒトの癌において、最も高頻度に異常が認められる発癌遺伝子であり、ヒトの発癌原因の一つとして、しばしばras遺伝子の異常が報告されている(例えば、Ellis RW et al. Mol. Cell. Biol. 2: 1339-1345, 1982参照。)。
【0015】
ヒトのras遺伝子として、H-ras、K-ras、N-rasの3種類のファミリーが見いだされ、それぞれヒトの第11染色体、第12染色体、第1染色体に存在していることが知られている(例えば、Hall A et al. Nature 303: 396-400, 1983参照。)。
【0016】
ras遺伝子はそのままでは発癌活性を持たない癌原遺伝子であり、ras遺伝子の12番目、13番目、59番目、61番目のアミノ酸にアミノ酸置換を生じさせる変異により恒常的に活性化されたrasタンパク質となり、発癌活性を獲得することが知られている(例えば、Storer RD et al. Cancer Res. 46: 1458-1464, 1986;Adams, J.M. & Cory, S., Science 254, 1161-1167 (1991)参照。)。
【0017】
ヒト腫瘍全体の約30%がras遺伝子変異を有し(Adjei,A.A.,Journal of National Cancer Institute,93(14): 1062-1074 (July 18,2001); Almoguera,C.et al., Cell(1988)53:549-54;Smit,V.T.et al., Nucleic Acids Res(1988)16,7773-82; Bos,J.L,Cancer Research,49: 4682-4689 (1989))、3つの腫瘍形成性ras遺伝子、H-ras、K-ras、およびN-rasの活性化に至る変異は、膵臓癌の90%、結腸直腸癌の50%、および肺癌の50%、甲状腺癌の50%、肝癌の30%、皮膚癌の25%、ならびに骨髄性白血病の30%を含む様々な腫瘍タイプにおいて頻繁に見いだされている(Clark, G.J. & Der, C.J., Cellular Cancer Markers (eds Garrett, C. T. & Sell, S.) 17-52 (Humana Press, Totowa, New Jersey (1995), Bos, J.L., Cancer Res. 49, 4682-4689 (1989); Rodenhuis,S.et al., Cancer Res.(1988)48:5738-41; Adjei,A.A.,Journal of National Cancer Institute,93(14): 1062-1074 (July 18,2001); Almoguera,C.et al., Cell(1988)53:549-54;Migley,R.S.; Kerr,D.J., Crit Rev Oncol Hematol.(2002)44:109-20)。
【0018】
ras遺伝子は分子量21kDaのGTP結合タンパク質をコードしており、GTP結合タンパク質と共役する細胞外受容体にリガンドが結合した際に、GDPが遊離して代わりにGTPが結合することによって活性な立体構造を形成し(Hall A, Annu.Rev Cell Biol 1994, 10:31-54)、Raf、ホスホイノシチド3-キナーゼ、RalGDSなどのタンパク質を介して細胞内に信号を伝える分子スイッチとして働く(Campbell SL et al., Oncogene 1998, 17:1395-413;Quilliam LA et al., Bioessays 1995, 17:395-404)。
【0019】
不活性型であるGDP結合型のrasタンパク質から活性型であるGTP結合型のrasタンパク質への変換はGDP/GTP交換因子(GEF)タンパク質によって行なわれ、活性型であるGTP結合型から不活性型であるGDP結合型への変換はGTP 分解酵素活性促進タンパク質(GAP)によって行なわれる。
【0020】
rasタンパク質に作用する GEFの数は限られており、例えばRASGRF1遺伝子が知られているが(Schweighoffer et al., Oncogene 8: 1477-1485, 1993)、RASGRF1遺伝子のDNAメチル化と発癌リスクまたは癌の発生・進展との関係は知られていない。
【先行技術文献】
【非特許文献】
【0021】
【非特許文献1】Yamashita M, Toyota M, Suzuki H, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae. Cancer Sci 2010
【非特許文献2】Maekita T, Nakazawa K, Mihara M, et al. High levels of aberrant DNA methylation in Helicobacter pylori-infected gastric mucosae and its possible association with gastric cancer risk. Clin Cancer Res 2006;12:989-95.
【非特許文献3】Nakajima T, Maekita T, Oda I, et al. Higher methylation levels in gastric mucosae significantly correlate with higher risk of gastric cancers. Cancer Epidemiol Biomarkers Prev 2006;15:2317-21.
【発明の概要】
【発明が解決しようとする課題】
【0022】
したがって、本発明の課題は、癌の発生によってエピジェネティックなサイレンシングを受ける遺伝子について網羅的な解析を行うことにより、癌に関連する遺伝子を同定してその癌における役割を解明し、当該遺伝子に関連した、癌を検出するための指標を得る方法、発癌リスクを判断するための指標を得る方法、癌の検出用キット、発癌リスクの検出用キット、癌の予防剤、癌の治療剤、癌の予防剤の探索方法、および癌の治療剤の探索方法を提供することにある。
【0023】
また、本発明の課題は、特に未分化型の癌について、癌の発生によってエピジェネティックなサイレンシングを受ける遺伝子の網羅的な解析を行うことにより、癌に関連する遺伝子を同定してその癌における役割を解明し、当該遺伝子に関連した、未分化型の癌を検出するための指標を得る方法、未分化型の癌の発癌リスクを判断するための指標を得る方法、未分化型の癌の検出用キット、未分化型の癌の発癌リスクの検出用キット、未分化型の癌の予防剤、未分化型の癌の治療剤、未分化型の癌の予防剤の探索方法、および未分化型の癌の治療剤の探索方法を提供することにある。
【0024】
さらに、本発明の課題は、対象から得た生検組織のうちの背景組織を用いて、癌の発生リスクが高まった状態においてエピジェネティックなサイレンシングを受ける遺伝子について網羅的な解析を行うことにより、発癌リスクに関連する遺伝子を同定して、未だ癌化していない組織における発癌しやすい状態における役割を解明し、当該遺伝子に関連して、背景組織を用いて癌を検出するための指標を得る方法、背景組織を用いて発癌リスクを判断するための指標を得る方法、背景組織を用いて行なう癌の検出用キット、背景組織を用いて行なう発癌リスクの検出用キット、癌の予防剤、癌の治療剤、癌の予防剤の探索方法、および癌の治療剤の探索方法を提供することにある。
【0025】
さらにまた、本発明の課題は、胃癌の発生によってエピジェネティックなサイレンシングを受ける遺伝子について網羅的な解析を行うことにより、胃癌に関連する遺伝子を同定してその胃癌における役割を解明し、当該遺伝子に関連した、胃癌を検出するための指標を得る方法、胃癌の発癌リスクを判断するための指標を得る方法、胃癌の検出用キット、胃癌の発癌リスクの検出用キット、胃癌の予防剤、胃癌の治療剤、胃癌の予防剤の探索方法、および胃癌の治療剤の探索方法を提供することにある。
【課題を解決するための手段】
【0026】
そこで、本発明者らは、上記課題を解決すべく鋭意検討を行う中で、癌の発生した臓器の癌組織において特異的にエピジェネティックなサイレンシングによる制御を受けて発現が低下している遺伝子としてRASGRF1を初めて同定し、その遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、癌化していない組織ではほとんど認められないのに対し、癌の発生した臓器の癌組織では高いレベルで認められることから、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することにより、対象における癌を検出するための指標を得る方法を見出し、本発明を完成させた。本発明は、分化型癌のみならず、未分化型癌においても適用可能である点で優れている。
【0027】
また、本発明者らは、上記課題を解決すべく鋭意検討を行う中で、癌の発生した臓器の背景組織において特異的にエピジェネティックなサイレンシングによる制御を受けて発現が低下している遺伝子としてRASGRF1を初めて同定し、その遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、癌化していない組織ではほとんど認められないのに対し、癌の発生した臓器の背景組織では高いレベルで認められることから、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することにより、対象における発癌リスクを判断するための指標を得る方法を見出し、本発明を完成させた。本発明は、分化型癌のみならず、未分化型癌においても適用可能である点で優れている。
【0028】
また、本発明は、対象における癌を検出するための指標を得る方法または発癌リスクを判断するための指標を得る方法であって、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することを含む、前記方法に関する。
【0029】
また、本発明は、対象における未分化型の癌を検出するための指標を得る方法または発癌リスクを判断するための指標を得る方法であって、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することを含む、前記方法に関する。
【0030】
また、本発明は、血清ペプシノゲンが陰性である対象における癌を検出するための指標を得る方法または発癌リスクを判断するための指標を得る方法であって、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することを含む、前記方法に関する。
【0031】
また、本発明は、対象における癌を検出するための指標を得る方法または発癌リスクを判断するための指標を得る方法であって、対象から得た背景組織のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することを含む、前記方法に関する。
【0032】
さらに、本発明は、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化される領域が、配列番号7で表わされる塩基配列と同一もしくは実質的に同一の塩基配列を有するDNA領域である、前記の方法に関する。
【0033】
また、本発明は、メチル化特異的PCR法、バイサルファイトシークエンス法、パイロシークエンス法、コブラ法およびメチライト法からなる群より選択される1つまたは2つ以上の方法を用いて、メチル化されたCpGを検出する、前記の方法に関する。
【0034】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも8%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0035】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも10%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0036】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも15%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0037】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも20%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0038】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも30%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0039】
また、本発明は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化が、前記対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドの CpG中、少なくとも50%を超えて含まれることを基準として癌の有無または発癌リスクを判断するための指標を得る、前記方法に関する。
【0040】
そしてまた、本発明は、配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、メチル化されたCpGを検出する、前記の方法に関する。
【0041】
そしてまた、本発明は、配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、バイサルファイト処理したゲノムDNA中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、メチル化されていないCpGを検出する、前記の方法に関する。
【0042】
そしてまた、本発明は、配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、バイサルファイト処理したゲノムDNA中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、メチル化されたCpGを検出する、前記の方法に関する。
【0043】
本発明はさらに、配列番号19〜32のいずれかに記載の塩基配列を有するオリゴヌクレオチドを用いて、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、メチル化されたCpGを検出する、前記の方法に関する。
【0044】
また、本発明は、配列番号19と配列番号20、配列番号21と配列番号22、配列番号23と配列番号24、配列番号25と配列番号26、配列番号27と配列番号28、配列番号29と配列番号30、配列番号31と配列番号32で表される塩基配列を有するオリゴヌクレオチドの組合わせ、または、これらの塩基配列を有するオリゴヌクレオチドの組合わせと実質的に同一である塩基配列を有するオリゴヌクレオチドの組み合わせのうち、いずれか一以上のオリゴヌクレオチドの組み合わせを用いて、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出する、前記の方法に関する。
【0045】
さらに、本発明はまた、生物学的試料が、胃、十二指腸、大腸、膵または肺の生検試料、血清、糞便、大腸洗浄液、胃洗浄液、および膵液からなる群から選択される1種または2種以上である、前記の方法に関する。
【0046】
また、本発明は、胃の萎縮がないか軽度である胃の前庭部の生検試料を用いて指標を得るものである、前記の方法に関する。
【0047】
また、本発明は、腸上皮化生がみられない胃の前庭部の生検試料を用いて指標を得るものである、前記の方法に関する。
【0048】
また、本発明は、対象から得た検体が胃の洗浄液または胃の生検試料である、前記の方法に関する。
【0049】
また、本発明は、対象から得た検体が胃の前庭部の生検試料である、前記の方法に関する。
【0050】
また、本発明は、対象から得た検体が十二指腸の洗浄液または十二指腸の生検試料である、前記の方法に関する。
【0051】
また、本発明は、対象から得た検体が大腸の洗浄液または大腸の生検試料である、前記の方法に関する。
【0052】
また、本発明は、対象から得た検体が膵液または膵の生検試料である、前記の方法に関する。
【0053】
また、本発明は、対象から得た検体が喀痰または肺の生検試料である、前記の方法に関する。
【0054】
また、本発明は、対象から得た検体が血液、血清、腹水、尿、または糞便である、前記の方法に関する。
【0055】
本発明はまた、癌が、胃癌、十二指腸癌、大腸癌、膵癌または肺癌である、前記の方法に関する。
【0056】
また、本発明は、対象から得た検体におけるRASGRF1遺伝子の発現量を測定することにより指標を得るものである、前記の方法に関する。
【0057】
また、本発明は、RASGRF1遺伝子の転写開始領域におけるCpGアイランドを増幅するための、フォワードプライマーおよびリバースプライマーからなるPCRプライマーセットに関する。
【0058】
また、本発明は、配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の検出用のPCRプライマーセットに関する。
【0059】
また、本発明は、配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の検出用のPCRプライマーセットに関する。
【0060】
また、本発明は、配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の検出用のPCRプライマーセットに関する。
【0061】
また、本発明は、配列番号19と配列番号20、配列番号21と配列番号22、配列番号23と配列番号24、配列番号25と配列番号26、配列番号27と配列番号28、配列番号29と配列番号30、配列番号31と配列番号32で表される塩基配列を有するオリゴヌクレオチドの組合わせ、または、これらの塩基配列を有するオリゴヌクレオチドの組合わせと実質的に同一である塩基配列を有するオリゴヌクレオチドの組み合わせのうち、いずれか一以上のオリゴヌクレオチドの組み合わせを含んでなる、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の検出用のPCRプライマーセットに関する。
【0062】
また、本発明は、前記のいずれかのPCRプライマーセットを含み、かつ、水酸化ナトリウム、ハイドロキノン、亜硫酸水素塩、デオキシリボヌクレオチド三リン酸、ミネラルオイルまたは緩衝液の中から選択される1以上のものを含む、癌を検出するための指標または発癌リスクを判断するための指標を得るためのキットに関する。
【0063】
本発明はまた、RASGRF1タンパク質またはRASGRF1遺伝子を含んでなる、癌の予防剤または治療剤に関する。
【0064】
本発明はまた、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を抑制する薬剤を含んでなる、癌の予防剤または治療剤に関する。
【0065】
加えて、本発明は、癌の予防剤または治療剤の探索方法であって、試験物質の存在下および非存在下において動物細胞を培養し、それぞれの細胞におけるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の頻度を測定し、そして、当該メチル化を抑制する効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【0066】
また、本発明は、癌の予防剤または治療剤の探索方法であって、試験物質の存在下および非存在下において動物細胞を培養し、それぞれの細胞におけるRASGRF1遺伝子の発現量を測定し、そして、RASGRF1遺伝子の発現を促進する効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【発明の効果】
【0067】
本発明による癌を検出するための指標を得る方法および発癌リスクを判断するための指標を得る方法は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出することに基づくものである。RASGRF1遺伝子は、正常組織では高い発現が維持され、癌組織および発癌リスクの高い組織で特異的に発現が低下していることから、その発現を直接制御しているプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出する本願発明の方法によれば、極めて正確に癌の検出および発癌リスクの検出を行うことが可能である。また、本発明の方法によれば、検出に用いる生物学的試料は、対象から得た胃組織もしくは胃癌組織、大腸組織もしくは大腸癌組織、十二指腸組織もしくは十二指腸癌組織、膵組織または膵癌組織、肺組織または肺癌組織等の各組織や癌組織の他、血清、糞便、胃洗浄液、大腸洗浄液、膵液など比較的容易に入手可能なものを用いることができるため、簡便に癌の検出を行うことができる。また、本発明の方法によれば、未だ癌が発生していないものの癌の発生リスクが高まっている状態を検出することができる。さらに、本発明による方法は、メチル化特異的PCR法、バイサルファイトシークエンス法、パイロシークエンス法、コブラ法およびメチライト法などを用いて行うことができるから、極めて少量の生物学的試料を用いて高い検出感度で、短時間のうちに精度の高い検出結果を得ることができ、対象に対して負担をかけることがなく、また、癌の早期発見、癌の進達度予測、癌再発リスクの予測、発癌リスクの予測にも資するものである。さらにまた、本発明による方法は、分化型の癌のみならず、未分化型の癌の発癌リスクをも検出しうる点で画期的な方法である。
【0068】
また、同様に、本発明による癌の検出用キットおよび発癌リスクの検出用キットは、検出の標的であるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGが、癌組織において特異的に上昇している一方で、癌化していない組織においては少ないことから、良好な精度で簡便に癌を検出することを可能にし、極めて初期の段階での癌の検出や、癌の再発のモニタリング、発癌リスクの検出、癌の進行度予測などに適したものである。加えて、本願発明の方法およびキットは、内視鏡検査等の他の検査方法との併用にも有用であり、より精密な検査結果を得ることを可能にするものである。
【0069】
さらに、本発明の癌の予防剤および癌の治療剤は、RASGRF1タンパク質、RASGRF1遺伝子をコードする核酸、またはRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を抑制する薬剤を含んでなるものである。したがって、本発明の治療剤は、RASGRF1タンパク質の癌細胞への導入、癌細胞におけるRASGRF1遺伝子の発現、あるいはRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を抑制する薬剤の癌細胞への導入を介して、癌細胞の増殖を抑制することができ、優れた治療効果を得ることが可能である。また、本発明の治療剤に含まれるRASGRF1タンパク質もしくはRASGRF1遺伝子は、癌組織および発癌リスクの高い組織において発現が抑制されている一方で、正常組織においては高い発現が認められるものであることから、本発明の治療剤は、エピジェネティックな異常により不活性化されている遺伝子もしくはその遺伝子産物の発現を、癌細胞において特異的に回復させることを可能にするものであって、正常組織に毒性を与えることなく、予防又は治療が必要な標的組織において特異的に効果を発揮することができる、副作用が少なく安全性が高いものであり、より効果的で副作用の少ない治療法の開発にも役立つものである。
【0070】
さらに、本発明の癌の予防剤の探索方法および癌の治療剤の探索方法は、試験物質の存在下および非存在下において哺乳動物細胞を培養し、それぞれの細胞におけるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の頻度、あるいはRASGRF1遺伝子の発現量を測定し、そして、当該メチル化を抑制する効果を有する試験物質またはRASGRF1遺伝子の発現量を増加させる試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関するものである。したがって、本発明の前記探索方法は、細胞を用いて効率よく行なうことのできる探索方法であり、新しい作用機序を有する癌の予防剤又は治療剤を幅広い試験物質に対して探索することができるものである。
【図面の簡単な説明】
【0071】
【図1】H.pylori感染からの発癌過程と発癌リスクの上昇を示す模式図である。H. pylori感染は慢性胃炎から萎縮性胃炎、腸上皮化生を経て分化型胃癌が発生する経路に重要な役割を担っていると考えられ、萎縮性胃炎や腸上皮化生は胃癌のハイリスク群としてよく知られている。萎縮の程度を表す指標として血清のペプシノゲンが有用である。また腸上皮化生の進展に伴いH. pylori抗体が陰性となる。またH. pylori感染は、胃上皮のDNAメチル化異常を誘発することが知られ、腸上皮化生粘膜で異常メチル化が蓄積しており発癌に関与していることが示唆されている。一方、未分化型胃癌の発生経路はいまだ不明な点が多い。分化型胃癌と異なる、未分化型胃癌の特徴のひとつとして、萎縮性胃炎や腸上皮化生を伴わずに発生する経路が存在することがある。
【0072】
【図2】未分化型胃癌のリンパ節転移の頻度を深達度ごとに示した表である。%で示した数字は、リンパ節転移が認められた症例の割合をパーセントで示したものである。粘膜内癌では分化型胃癌は潰瘍形成がない場合は大きさにかかわらず、また潰瘍形成を伴う場合でも3cm以下の場合はリンパ節転移を伴わないと考えられている。一方で未分化型胃癌は潰瘍形成を伴わなくとも2cm以上、また潰瘍形成を伴う場合は大きさにかかわらずリンパ節転移をきたしている可能性があることが示されており、未分化型胃癌は分化型胃癌に比べ早期にリンパ節転移をきたすと考えられる。(Gotoda T, et al: Incidence of lymph node metastasis from early gastric cancer. The estimation using a large number of cases in two large centers. Gastric Cancer 3:219-225, 2000)
【0073】
【図3】各種の胃癌細胞株におけるRASGRF1遺伝子のDNAメチル化の割合を示す図である。縦軸はRASGRF1遺伝子のDNAメチル化の割合を%で示し、各棒はそれぞれ胃癌細胞株を示す。胃癌細胞株は、MKN1、MKN7、MKN74、SH101、SNU1、SNU638、JRST、KatoIII、AZ521、MKN28、MKN45、NUGC3、NUGC4、AGS、NCI-N87の各胃癌細胞株についてRASGRF1遺伝子のDNAメチル化を測定した。RASGRF1遺伝子のDNAメチル化の測定方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、パイロシークエンス法により行なった。RASGRF1遺伝子は、MKN7、SH101、SNU638、JRST、KatoIII、MKN28、AGS、NCI-N87の各胃癌細胞株について90%以上のDNAメチル化を示し、MKN74とSNU1について70%以上のDNAメチル化を示し、AZ521については約55%のDNAメチル化を、NUGC4については約45%のDNAメチル化を、MKN45については約20%のDNAメチル化をそれぞれ示した。このように、RASGRF1遺伝子は胃癌細胞株において高頻度にメチル化されていた。
【0074】
【図4】RASGRF1遺伝子がDNAメチル化されている胃癌細胞株において、RASGRF1遺伝子の発現が消失していることを示す図である。縦軸はRASGRF1遺伝子の発現レベルを相対量(RQ:Relative Quantitation)で示し、各棒はそれぞれ胃癌細胞株を示す。胃癌細胞株は、MKN1、MKN7、MKN74、SH101、SNU1、SNU638、JRST、KatoIII、AZ521、MKN28、MKN45、NUGC3、NUGC4、AGS、NCI-N87の各胃癌細胞株についてRASGRF1遺伝子の発現レベルを測定した。RASGRF1遺伝子の発現レベルの測定方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、フォワードプライマーとして5'-[TTCGGACAACACAAAATGGCAAACC]-3'(配列番号34)の配列を用い、リバースプライマーとして5'-[TCTTCTCTGTCTCCACGATCTGCA]-3'(配列番号35)または5'-[CCATTCGTCACAATCTTTTGCGTC]-3'(配列番号36)の配列を用いてTaqMan RT-PCR法により行なった。RASGRF1遺伝子の発現は、90%以上の同遺伝子のDNAメチル化を示したSH101、SNU638、JRST、MKN28、AGS、NCI-N87の各胃癌細胞株、同じく約45%のDNAメチル化示したNUGC4、同じく約20%のDNAメチル化を示したMKN45においてほぼ消失していた。一方、RASGRF1遺伝子のDNAメチル化がほとんど生じていなかったNUGC3遺伝子の発現レベルは高かった。このように、RASGRF1遺伝子のメチル化を認める細胞において、RASGRF1遺伝子の発現が消失していた。
【0075】
【図5】RASGRF1遺伝子がDNAメチル化されている胃癌細胞株を5-aza-2'deoxycytidine (5-aza-dc)で処理するとRASGRF1遺伝子の発現が回復することを示す図である。縦軸はRASGRF1遺伝子の発現レベルを相対量(RQ:Relative Quantitation)で示し、各棒はそれぞれ胃癌細胞株を示す。胃癌細胞株は、MKN1、MKN7、MKN74、SH101、SNU1、SNU638、JRST、KatoIII、AZ521、MKN28、MKN45、NUGC3、NUGC4、AGS、NCI-N87の各胃癌細胞株を用い、5-aza-dcで処理しない細胞株と5-aza-dcで処理した細胞株のそれぞれについて、RASGRF1遺伝子の発現レベルを測定した。各棒は、5-aza-dcで処理しない場合と5-aza-dcで処理した場合を並べて示す。「AZA」と表記した棒は5-aza-dcで処理した場合を示し、「AZA」と表記していない棒は5-aza-dcで処理していない場合を示す。たとえば、「MKN1」は5-aza-dcで処理していないMKN1胃癌細胞株を示し、「MKN1 AZA」は5-aza-dcで処理したMKN1胃癌細胞株を示す。RASGRF1遺伝子の発現レベルの測定方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、フォワードプライマーとして5'-[TTCGGACAACACAAAATGGCAAACC]-3'(配列番号34)の配列を用い、リバースプライマーとして5'-[TCTTCTCTGTCTCCACGATCTGCA]-3'(配列番号35)または5'-[CCATTCGTCACAATCTTTTGCGTC]-3'(配列番号36)の配列を用いてTaqMan RT-PCR法により行なった。MKN74とAZ521を除く細胞株で、5-aza-dc処理により、RASGRF1遺伝子の発現が回復することが確認された。
【0076】
【図6】MCAM法(Methylated CpG Island Amplification Microarray法)により未分化型胃癌の背景粘膜で異常メチル化を認める遺伝子としてRASGRF1を同定したことを示す図である。胃癌症例の胃の背景粘膜およびH.pylori胃炎症例の胃の粘膜における胃粘膜生検検体中のRASGRF1遺伝子のパイロシークエンス法を用いたメチル化解析の結果を示す図である。各行が対象に対応し、塗りつぶしたセルは、メチル化頻度が15%以上であることを示す。癌症例の背景粘膜では高頻度で異常メチル化を認めるが、H.pylori胃炎症例では異常メチル化を示す症例は少ない。
【0077】
【図7】胃粘膜生検検体中のRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析の結果を示す図である。各点が各症例を示している。左側の図は胃の前庭部から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示し、右側の図は胃の体部から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示す。「未分化」はヘマトキシリン・エオジン染色標本により組織形態学に未分化型と判定された胃癌の罹患症例を、「分化」は同じ方法で分化型と判定された胃癌の罹患症例を、「非癌」はH.pyloriに感染しているものの胃癌に罹患していない症例を示す。横棒は各群のメチル化頻度の平均値を、P値は一元配置分散分析による有意差を示す。未分化型胃癌症例の胃前庭部の背景粘膜のメチル化率は、非癌症例の胃前庭部の粘膜に比べ有意に高メチル化を示していた。
【0078】
【図8】Updated Sydney Systemによる病理組織学評価で、萎縮がみられないか萎縮の程度が軽度、または腸上皮化生がみられないと診断された胃前庭部の胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析の結果を示す図である。各点が各症例を示している。左側の図は萎縮がみられないか萎縮の程度が軽度と判定された対象から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示し、右側の図は腸上皮化生がみられない症例から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示す。「未分化型」はヘマトキシリン・エオジン染色標本により組織形態学に未分化型と判定された胃癌の罹患症例を、「分化型」は同じ方法で分化型と判定された胃癌の罹患症例を、「非癌」はH.pyloriに感染しているものの胃癌に罹患していない症例を示す。横棒は各群のメチル化頻度の平均値を、P値は一元配置分散分析による有意差を示す。萎縮がみられないか萎縮の程度が軽度、または腸上皮化生がみられないと診断された未分化癌症例の背景粘膜におけるRASGRF1遺伝子のメチル化頻度は、非癌症例の背景粘膜におけるRASGRF1遺伝子のメチル化頻度よりも有意に高い頻度であった。
【0079】
【図9】血清ペプシノゲン陰性症例の胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析の結果を示す図である。各点が各症例を示している。左側の図は血清ペプシノゲンが陰性であった症例から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示し、右側の図は血清ペプシノゲンが陽性であった症例から得た生検試料におけるRASGRF1遺伝子のメチル化頻度を示す。「癌背景前庭部」は胃癌に罹患していた症例の胃前庭部の背景粘膜を、「非癌前庭部」はH.pyloriに感染しているものの胃癌に罹患していない症例の胃前庭部の粘膜を示す。横棒は各群のメチル化頻度の平均値を、P値はt-testによる有意差を示す。血清ペプシノゲンが陽性であるか陰性であるかに関わらず、癌背景前庭部のRASGRF1遺伝子のメチル化頻度は、非癌前庭部におけるRASGRF1遺伝子のメチル化頻度よりも有意に高い頻度であった。
【発明を実施するための形態】
【0080】
以下、本発明について詳細に説明する。
【0081】
本明細書中に別記のない限り、本発明に関して用いられる科学的および技術的用語は、当業者に通常理解されている意味を有するものとする。一般的に、本明細書中に記載された細胞および組織培養、分子生物学、免疫学、微生物学、遺伝子およびタンパク質および核酸化学に関して用いられる用語、およびその技術は、当該技術分野においてよく知られ、通常用いられているものとする。また、別記のない限り、本発明の方法および技術は、当該技術分野においてよく知られた慣用の方法に従って、本明細書中で引用され、議論されている種々の一般的な、および、より専門的な参考文献に記載されたとおりに行われる。かかる文献としては、例えば、Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Press(1989)およびSambrook et al., Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Press(2001); Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates(1992,および2000の補遺); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology - 4th Ed., Wiley & Sons(1999);Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press(1990);およびHarlow andLane, Using Antibodies: A Laboratory Manual, Cold Spring Harbor LaboratoryPress(1999)などが挙げられる。
【0082】
本明細書中に記載された分析化学、合成有機化学ならびに医薬品化学および薬化学に関して用いられる用語、ならびにその実験手順および技術は、当該技術分野においてよく知られ、通常用いられているものである。標準的な技術を、化学合成、化学分析、薬剤の製造、製剤および送達、ならびに対象の処置に用いるものとする。
【0083】
なお、本発明における用語「対象」は、任意の生物個体を意味し、好ましくは脊椎動物、より好ましくは哺乳動物、さらに好ましくはヒトの個体である。本発明において、対象は健常であっても、何らかの疾患に罹患していてもよいものとするが、癌に対する処置が企図される場合には、当該疾患に罹患している対象または実験的に罹患させた対象、例えばマウス、ラット、スナネズミ、モルモットなどの齧歯類、ネコ、ピューマ、トラなどのネコ科動物、シカ、オオシカなどのシカ科動物等の他、ウサギ、イヌ、ミンク、ヒツジ、ヤギ、ウシ、ウマ、サル、ヒトなどであることが好ましい。
【0084】
なお、本発明における用語「症例」は、ヒトの患者である対象をいう。
【0085】
本明細書においては、別記のない限り、遺伝子の名称はアルファベット(もしくはアルファベットと数字)等に「遺伝子」と付記して表記し、その遺伝子によってコードされるタンパク質は、前記のアルファベット(もしくはアルファベットと数字)等で表記したものに「タンパク質」と付記して表記するものとする。単にアルファベット(もしくはアルファベットと数字)等によってのみ標記した場合には、遺伝子またはタンパク質を意味する。前記の「遺伝子」は、ゲノム遺伝子、メッセンジャーRNAまたはcDNAのいずれかを意味するものとし、いずれかを特定する場合には、特定して表記するものとする。したがって、別記のない限り、例えば、単に「RASGRF1」と表記した場合には、RASGRF1(Ras Protein Specific Guanine Nucleotide-Releasing Factor 1)の遺伝子またはRASGRF1遺伝子によってコードされるタンパク質を意味し、「RASGRF1タンパク質」と表記した場合には、RASGRF1遺伝子によってコードされるタンパク質を意味し、特に「RASGRF1ゲノム遺伝子」と表記した場合には、RASGRF1をコードするゲノム遺伝子を意味する。
【0086】
本発明において、「背景組織」とは、癌に罹患した対象の癌を有する臓器における癌以外の部分から得た組織をいう。本発明において、「背景粘膜」とは、背景組織であって、かつ、粘膜組織であるものをいう。本発明において、「癌背景」とは、癌に罹患している症例の背景組織のことをいう。したがって、例えば「癌背景胃前庭部」と表記した場合には、胃癌に罹患している症例の胃前庭部の背景組織を意味する。
【0087】
本発明において、「癌組織」または「癌部」とは、癌に罹患した対象の癌を有する臓器における癌を含む部分から得た組織をいう。
【0088】
本明細書において、「エピジェネティック」とは、本発明の属する技術分野における通常の意味を有するものとし、例えば、DNA配列の変化を伴うことなく、クロマチンへの後天的な修飾により遺伝子発現が制御されることを例示することができる。クロマチンへの後天的な修飾の例としては、DNA塩基のメチル化のほか、ヒストンのメチル化、アセチル化、リン酸化などの化学修飾を例示することができる。
【0089】
本明細書において、「サイレンシング」とは、本発明の属する技術分野における通常の意味を有するものとし、遺伝子組み換え以外の機序でメッセンジャーRNAの量が低下することを意味する。「サイレンシング」には、転写型遺伝子サイレンシングと転写後遺伝子サイレンシングが含まれる。転写型遺伝子サイレンシングとしては、エピジェネティックなサイレンシング、ゲノムインプリンティング、パラミューテーション、トランスポゾン抑制、トランスジーン抑制、配置効果を例示することができ、転写後遺伝子サイレンシングとしては、RNA干渉、ナンセンス仲介減衰を例示することができる。
【0090】
本発明において用いられるRASGRF1タンパク質は、ヒトでは染色体15q24に位置するRASGRF1ゲノム遺伝子から転写されるRNAに由来するタンパク質であり、1273アミノ酸からなる1型アイソフォーム(NP_002882)、489アミノ酸からなる2型アイソフォーム(NP_722522)、1257アミノ酸からなる3型アイソフォーム(NP_001139120)の3種類のアイソフォームが知られている。それぞれのアイソフォームは、1型アイソフォームがアクセッション番号NM_002891で登録されているmRNA配列、2型アイソフォームがアクセッション番号NM_153815で登録されているmRNA配列、3型アイソフォームがアクセッション番号NM_001145648で登録されているmRNA配列としてそれぞれ発現している。したがって、RASGRF1タンパク質としては、配列番号2、配列番号4、または配列番号6で表わされるアミノ酸配列と同一もしくは実質的に同一のアミノ酸配列からなるタンパク質が挙げられる。また、RASGRF1遺伝子のmRNAとしては、配列番号1、配列番号3、または配列番号5で表わされる塩基配列と同一もしくは実質的に同一の塩基配列からなる核酸が挙げられる。
【0091】
ここで、配列番号1、3、または5で表わされる塩基配列と実質的に同一の塩基配列としては、配列番号1、3、または5で表される塩基配列と約70%以上、好ましくは約80%以上、より好ましくは約90%以上、さらに好ましくは約95%以上、最も好ましくは約98%以上の相同性を有する塩基配列等を例示することができる。さらに、配列番号1、3、または5で表わされる塩基配列と実質的に同一の塩基配列としては、配列番号2、配列番号4、または配列番号6で表わされるアミノ酸配列と同一もしくは実質的に同一のアミノ酸配列からなるタンパク質をコードする核酸の塩基配列であって、RASGRF1タンパク質の機能を有するタンパク質をコードする核酸の塩基配列を例示することができる。RASGRF1タンパク質の機能としては、配列番号2、4、または6で表わされるアミノ酸配列からなるRASGRF1タンパク質が有する機能、またはrasタンパク質に結合しているGDPの放出を促進してGTP結合型に変換する機能を例示することができる。
【0092】
また、同様に、配列番号2、4、または6で表されるアミノ酸配列と実質的に同一のアミノ酸配列としては、配列番号2、4、または6で表されるアミノ酸配列と約70%以上、好ましくは約80%以上、より好ましくは約90%以上、さらに好ましくは約95%以上、最も好ましくは約98%以上の相同性を有するアミノ酸配列等を例示することができる。そしてさらに、配列番号2、4、または6で表されるアミノ酸配列と実質的に同一のアミノ酸配列としては、配列番号2、4、または6で表されるアミノ酸配列において、好ましくは1〜10個の任意のアミノ酸が欠失、置換、付加した配列、より好ましくは、1〜5個の任意のアミノ酸が欠失、置換、付加した配列、さらに好ましくは1〜3個の任意のアミノ酸が欠失、置換、付加した配列を例示することができる。
【0093】
また、本発明において用いられるRASGRF1遺伝子には、例えば、配列番号1、3、または5で表される塩基配列を含有する核酸、または配列番号1、3、または5で表される塩基配列とストリンジェントな条件下で特異的にハイブリダイズする塩基配列を含有し、かつ前記の配列番号2、4、または6で表されるアミノ酸配列を含有するタンパク質と実質的に同等の性質を有するタンパク質をコードする核酸などが含まれる。ここで、配列番号1、3、または5で表される塩基配列とストリンジェントな条件下で特異的にハイブリダイズする塩基配列を含有する核酸としては、例えば、配列番号1、3、または5で表される塩基配列に対して相補的な塩基配列と約60%以上、好ましくは約70%以上、より好ましくは約80%以上、さらに好ましくは約90%以上、特に好ましくは約95%以上、最も好ましくは約98%以上の相同性を有する塩基配列を含有する核酸等を用いることができる。
【0094】
本明細書において、「ストリンジェントな条件」とは、通常、42℃、2×SSCおよび0.1%SDSの条件であり、好ましくは、65℃、0.1×SSCおよび0.1%SDSの条件である。
【0095】
なお、異種動物間はもちろんのこと、同種動物間でも、多型、アイソフォーム等によってRASGRF1遺伝子の塩基配列に相違が見られる場合があるが、塩基配列が相違する場合であってもRASGRF1タンパク質をコードする限り、RASGRF1遺伝子に含まれる。
【0096】
また、本発明において用いられるRASGRF1ゲノム遺伝子には、例えば、ヒト染色体15q24に位置するRASGRF1ゲノム遺伝子、RASGRF1遺伝子の哺乳類におけるホモログのゲノム遺伝子を例示することができる。
【0097】
本発明において、RASGRF1遺伝子のプロモーター領域は、染色体上でRASGRF1遺伝子の転写の開始に関与するDNA上の特定領域をいい、これにRNAポリメラーゼが結合し、転写が開始される領域である。一般に、プロモーター配列は、転写開始位置から-20〜-110 bpに位置し、TATA box、CAAT boxまたはGC boxなどのコンセンサス配列を有することが多い。しかし、転写開始位置から-20〜-110 bpに位置していなくとも、あるいは、これらのコンセンサス配列を有さなくても、転写開始位置の上流に位置し、RASGRF1遺伝子の転写の開始に関与するゲノムDNA上の特定領域であれば、RASGRF1遺伝子のプロモーター領域である。本発明においては、転写開始位置または開始コドンの5’端から2000bp上流までの全長2000bpの領域を意味し、好ましくは、配列番号7で表わされる領域である。
【0098】
本発明において、CpGアイランドとは、CpG(すなわち、5’側にシトシン、3’側にグアニンが隣接して互いにホスホジエステル結合により結合しているもの)に富む領域であり、GC含量が50%以上であって、かつ、CpGジヌクレオチドの実測頻度対予測頻度の比が0.6以上となるDNA領域を意味する。
【0099】
本発明において「DNAメチル化」とは、任意のゲノム遺伝子のプロモーター領域のCpGアイランドにおけるシトシンがメチル化されることをいう。
【0100】
本発明において「CpGアイランドのメチル化」とは、任意のゲノム遺伝子のプロモーター領域に存在するCpGアイランドにおけるDNAメチル化をいう。
【0101】
本発明において「異常メチル化」とは、任意のゲノム遺伝子のプロモーター領域に存在するCpGアイランドにおけるDNAメチル化が正常組織に比べて高い状態をいう。
【0102】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドは、上記で述べたプロモーター領域のうちCpGアイランドに該当する領域であれば、限定されることなく本発明の方法による癌の検出に用いることができる。
【0103】
前記のヒトRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのうち、本発明による癌の検出方法において、好ましいのは、例えば、配列番号7で表わされる配列の第267番目〜第671番目の塩基までの全長405bpの領域(配列番号8で表わされる塩基配列からなる領域)もしくはこれと実質的に同一の塩基配列を有する領域であり、より好ましいのは、配列番号7で表わされる配列の第296番目〜第610番目の塩基までの全長315bpの領域(配列番号9で表わされる塩基配列からなる領域)もしくはこれと実質的に同一の塩基配列を有する領域であり、最も好ましいのは配列番号7で表わされる配列の第387番目〜第524番目までの全長138bpの領域であり(配列番号10で表わされる塩基配列からなる領域)もしくはこれと実質的に同一の塩基配列を有する領域である。
【0104】
ここで、配列番号7、8、9または10で表される塩基配列と実質的に同一の塩基配列としては、配列番号7、8、9または10で表される塩基配列と約70%以上、好ましくは約80%以上、より好ましくは約90%以上、さらに好ましくは約95%以上、最も好ましくは約98%以上の相同性を有する塩基配列等を例示することができる。
【0105】
本発明の方法において、「メチル化されたCpGを検出する」とは、DNA塩基配列中のメチル化されたシトシン(すなわち、DNAメチル化)を検出することを意味する。
本発明の方法は、「対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出することを含む」限り、その対象において発癌のリスクが高いと判断する基準は特に限定されることなく実施することができ、個々の状況や癌の種類等に応じて適宜選択した基準を採用して発癌のリスクを検出してもよいが、正常組織では前記CpGアイランドにおけるメチル化されたCpGの割合は低く、癌組織では前記CpGアイランドにおけるメチル化されたCpGの割合は高い傾向にあることから、対象から得た生物学的試料中の前記CpGアイランドのメチル化されたCpGが、前記対象と同種の健常な対象から得た生物学的試料中のCpGアイランドのメチル化されたCpGと比較して、あるいは、前記対象と同一の個体から得た対照とする正常組織である生物学的試料中のCpGアイランドのメチル化されたCpGと比較して、定量的に多いことを基準として、対象において発癌リスクが高いとの検出結果とすることが好ましい。
【0106】
本発明においては、対象における癌を検出する方法であって、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出することを含む、前記方法が提供される。
【0107】
さらに、本願発明者らの研究によれば、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGは、対象から得た生物学的試料が正常組織である場合には、試料中の全CpGに占める割合は高くても5〜6%程度に止まるのに対し、対象から得た生物学的試料が癌組織または背景組織である場合には、試料中の全CpGに占める割合はこれをはるかに上回り50%を超える場合が多いことが見出されている。しかしながら、生物学的試料として、生検組織などを用いる場合には、癌組織と正常組織とが混在している場合が多いため、癌組織または背景組織の部分のみが高値であっても正常組織の部分の低値により平均化されて、試料中の全CpGに占めるメチル化されたCpGの割合は、実際に癌が存在する場合でも低値として表れる傾向にある。したがって、より好適な態様としては、本発明の方法は、対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGが、前記対象から得た生物学的試料中の前記領域におけるCpGアイランドの全てのCpG中(すなわち、前記試料中の全アレル中)、少なくとも8%、好ましくは少なくとも10%、より好ましくは少なくとも15%、さらに好ましくは少なくとも20%、よりさらに好ましくは少なくとも30%、もっとも好ましくは少なくとも50%を超えて含まれることを基準として癌を検出し、癌が存在するとの検出結果とすることができる。
【0108】
本発明の方法において、メチル化されたCpGの検出は、特に限定されず、どのような方法を用いて行ってもよいが、バイサルファイト(bisulfite)シークエンス法、パイロシークエンス(Pyrosequencing)法、コブラ(cobra)法、メチル化特異的PCR(MSP:Methylation-specific PCR)法、およびメチライト(methylight)法といったDNAメチル化(メチル化シトシン)を検出するための公知の方法を用いるのが好ましく、これらの方法は、いずれかを単独で用いてもよく、2つ以上を組み合わせて用いてもよい。前記で挙げた方法のうち、メチライト法は微量の検体から高い感度でメチル化を検出できるという点から特に好ましく用いられ、また、定量的なメチル化検出を目的とする場合にはパイロシークエンス法が特に好ましく用いられる。
【0109】
バイサルファイトシークエンス法によるDNAメチル化解析は、バイサルファイト(bisulfite:亜硫酸水素塩)で処理したDNAを用いてメチル化アレルと非メチル化アレルを同時に増幅し、得られたPCR産物をTOPO-cloning vector(invitorogen社)などにクローニングした後、シークエンス反応によりメチル化の有無を検出するものである。増幅した領域内の全てのCpG配列のメチル化の状態が分かるという利点があるが、一方で、解析に労力を要するので、多数の検体の解析には向いていない場合もある(Methods. 2002 Jun;27(2):101-7および鈴木拓,豊田実,今井浩三:bisulfitePCR法.新遺伝子工学ハンドブック改訂第4版(村松正實・山本雅編),羊土社,pp99-106,2003を参照)。
【0110】
具体的には、バイサルファイトシークエンス法によるDNAメチル化解析は、EpiTect Bisulfite Kits (Qiagen社)を用いてバイサルファイト処理したのち、一組のバイサルファイトシークエンス用のプライマーで目的の領域をPCRにより増幅し、増幅したPCR産物をTOPO TA Cloning Kit (Invitrogen社)でクローニングした後、ABI3130xシークエンサー(Applied Biosystems社)で塩基配列を解析することにより行なうことができる。プライマーは、CpGアイランド中の特定の領域を特異的に増幅するように設計することができる。
【0111】
パイロシークエンス法は、バイサルファイト処理したDNAを用いてメチル化アレルと非メチル化アレルを同時に増幅し、得られたPCR産物をパイロシークエンス法により解析するものである。DNAメチル化の割合は、シトシンとチミンの塩基多型として検出され、シトシンの蛍光強度をシトシンの蛍光強度とチミンの蛍光強度の合計で割って得た値として算出する。パイロシークエンス法は、定量的かつハイスループットなメチル化解析法として有用である(Nat Protoc. 2007;2(9):2265-75を参照)。
【0112】
具体的には、パイロシークエンス法によるDNAメチル化解析は、EpiTect Bisulfite Kits(Qiagen社)を用いてバイサルファイト処理した後、一組のパイロシークエンス用のプライマーで目的の領域をPCRにより増幅し、Pyro Goldリージェント(Biotage社)およびシークエンス用プライマーを用いてシークエンス解析することにより行なうことができる。これらのプライマーは、CpGアイランド中の特定の領域を特異的に増幅するように設計することができる。
【0113】
コブラ法(COBRA法;Combined Bisulfite Restriction Analysis)は、バイサルファイト処理したDNAを用いてメチル化アレルと非メチル化アレルを同時に増幅し、得られたPCR産物を制限酵素で切断した後、アガロースゲルで電気泳動し、エチジウムブロマイドによる染色を行い、制限酵素で切断されるバンドの有無により、メチル化の有無を判定するものである(Methods Mol Biol. 2002;200:71-85、鈴木拓,豊田実,今井浩三:bisulfitePCR法.新 遺伝子工学ハンドブック改訂第4版(村松正實・山本雅編),羊土社,pp99-106, 2003および鈴木拓 豊田実 COBRA法 エピジェネティクス実験プロトコール(牛島俊和・眞貝洋一編)羊土社 p69を参照)。
【0114】
具体的には、コブラ法によるDNAメチル化解析は、EZ DNAメチレーションキット(Zymo Research社,CA,USA)を使用し、胃粘膜生検検体に由来するゲノムDNAを亜硫酸水素ナトリウム溶液中において50℃で1晩処理を行ない、目的とする領域を増幅するようにデザインしたプライマーを用いてPCRを行ない、得られたPCR産物を適切な制限酵素で消化することにより行なうことができる。制限酵素を適切に選択することにより、増幅された目的とするゲノムDNAがメチル化されていない場合には亜硫酸水素ナトリウムでシトシンが修飾されて生じた配列は消化しない一方で、増幅された目的とするゲノムDNAがメチル化されている場合には亜硫酸水素ナトリウムでシトシンが修飾されないために制限酵素によって消化されるように実験をデザインすることができ、得られたPCR断片を電気泳動後、メチル化されている断片のバンドとメチル化されていない断片のバンドの濃度比をデンシトメトリーにより測定することができる。
【0115】
メチル化特異的PCR法は、バイサルファイト反応の際、メチル化の有無によりシトシンからウラシルへ変換される感受性に差があることを利用して、メチル化アレル及び非メチル化アレルに特異的なプライマーを作製し、PCR法により増幅して検出するものであり、得られたPCR産物はアガロースゲルで電気泳動し、エチジウムブロマイドによる染色を行って、バンドの有無によりメチル化の有無を判定することができる(Methods Mol Med. 2005;113:279-91および鈴木拓、豊田実、今井浩三:bisulfite PCR法 新 遺伝子工学ハンドブック改訂第4版(村松正實・山本雅編)、羊土社、pp99-106, 2003を参照)。
【0116】
具体的には、メチル化特異的PCR法は、EpiTect Bisulfite Kits (Qiagen社)を用いてバイサルファイト処理した後、一組のメチル化特異的プライマーでメチル化を検出し、また、一組の非メチル化特異的プライマーで非メチル化を検出することができる。これらのプライマーは、CpGアイランド中の特定の部位を特異的に増幅するように設計することができる。
【0117】
メチライト法は、メチル化特異的PCR法の一種であり、メチル化特異的配列を認識するようなプライマーとTaqMan Probeを組み合わせてリアルタイムPCR法によりメチル化の検出を蛍光を用いて行う方法である。メチライト法を用いることで高感度なメチル化検出が可能であり、微量の検体からメチル化検出を行う際に有用である(Methods. 2001 Dec;25(4):456-62を参照)。
【0118】
具体的には、メチライト法によるDNAメチル化解析は、DNAを亜硫酸水素塩処理によって改変して、5'蛍光レポーター色素および3'消光色素と共にオリゴヌクレオチドプローブに隣接する位置特異的PCRプライマーを用いて、蛍光に基づくリアルタイム定量的PCRにより増幅する。反応の間に蛍光レポーター色素は酵素によって放出される。放出される蛍光レポーター色素はPCR産物の量に比例するので、メチル化の程度に比例する蛍光を、自動ヌクレオチドシーケンサー装置において連続的に検出することができる(Eads CA, et al., Cancer Res. 1999 May 15;59(10):2302-6)。メチライト法によるDNAメチル化解析は、例えば、EpiTect MethyLight PCR Kit(Qiagen社)を用いて行なうことができる。
【0119】
バイサルファイトシークエンス法、パイロシークエンス法、コブラ法、メチル化特異的PCR法、メチライト法等を用いる場合には、バイサルファイト処理により、メチル化されていないシトシンが特異的にウラシルに変換され、メチル化されているシトシンはウラシルに変換されない。
【0120】
したがって、RASGRF1ゲノム遺伝子のプロモーター領域におけるCpGアイランドのシトシンがメチル化されていない場合には、配列番号7、8、9または10で表わされる領域は、バイサルファイト処理により、それぞれ、配列番号11、12、13または14で表わされる配列に変換される。一方、RASGRF1ゲノム遺伝子のプロモーター領域におけるCpGアイランドのシトシンがメチル化されている場合には、配列番号7、8、9または10で表わされる領域は、バイサルファイト処理により、それぞれ、配列番号15、16、17または18で表わされる配列に変換される。
【0121】
したがって、好ましい態様においては、本発明による上記のCpGの検出は、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドの塩基配列に特異的な一対のプライマー、例えば、配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、より好ましくは、配列番号8で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号8で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、さらに好ましくは、配列番号9で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号9で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、特に好ましくは、配列番号10で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号10で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、行われる。
【0122】
また、本発明の方法において、試料のバイサルファイト処理を行う場合には、試料中に含まれる配列番号7で示される塩基配列を有するDNA領域は、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドがメチル化されていない場合には配列番号11で示される塩基配列を有する領域に、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドがメチル化されている場合には配列番号15で示される塩基配列を有する領域に変換される。
【0123】
そのため、本発明による上記のメチル化されていないCpGの検出は、例えば、配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、より好ましくは、配列番号12で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号12で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、さらに好ましくは、配列番号13で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号13で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、特に好ましくは、配列番号14で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号14で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、行うことができる。
【0124】
同様に、本発明による上記のメチル化されているCpGの検出は、例えば、配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、より好ましくは、配列番号16で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号16で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、さらに好ましくは、配列番号17で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号17で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、特に好ましくは、配列番号18で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号18で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、行うことができる。
【0125】
ここで、配列番号7〜18で表される塩基配列と実質的に同一の塩基配列としては、配列番号7〜18で表される塩基配列と約70%以上、好ましくは約80%以上、より好ましくは約90%以上、さらに好ましくは約95%以上、最も好ましくは約98%以上の相同性を有する塩基配列等を例示することができる。前記プライマーの塩基長は、例えば、15〜40塩基、好ましくは17〜35塩基である。
【0126】
したがって、例えば、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドとして配列番号8に記載の領域を用いて、バイサルファイトシークエンス法、パイロシークエンス法、またはコブラ法により本願発明の方法を実施する場合には、試料をバイサルファイト処理することによって、試料中の配列番号8で表わされる配列中のCpGアイランドがメチル化されていない場合には配列番号12で表わされる配列に変換され、一方、試料中の配列番号8で表わされる配列中のCpGアイランドがメチル化されている場合には配列番号16で表わされる配列に変換される。そして、配列番号12で表わされる配列および配列番号16で表わされる配列は、ともに、フォワードプライマー:5’-[AGTGTGGGGTGTGTGTGTGT]-3’(配列番号19)およびリバースプライマー :5’-[ACTAAAAATTTTCTACAAAT]-3’(配列番号20)を用いてPCRにより増幅することができ、増幅された配列をシークエンス等することによりメチル化CpGを検出することができる。
【0127】
また、例えば、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドとして配列番号9に記載の領域を用いて、バイサルファイトシークエンス法、パイロシークエンス法、またはコブラ法により本願発明の方法を実施する場合には、試料をバイサルファイト処理することによって、試料中の配列番号9で表わされる配列中のCpGアイランドがメチル化されていない場合には配列番号13で表わされる配列に変換され、一方、試料中の配列番号9で表わされる配列中のCpGアイランドがメチル化されている場合には配列番号17で表わされる配列に変換される。そして、配列番号13で表わされる配列および配列番号17で表わされる配列は、ともに、フォワードプライマー:5’-[AAGATGGTGTTTTTTTTTTATAGGGTTG]-3’(配列番号21)およびリバースプライマー:5’- [AAAACCATAAAAACCTTCAAATAACTAC]-3’(配列番号22)を用いてPCRにより増幅することができ、増幅された配列をシークエンス等することによりメチル化CpGを検出することができる。同様に、試料中の配列番号7で表わされる塩基配列中の1204番目から1504番目までの塩基配列は、CpGアイランドがメチル化されている場合であっても、CpGアイランドがメチル化されていない場合であっても、ともに、フォワードプライマー:5’-[GGAGGAGGTATTAAGTTGTAGTTTG]-3’(配列番号23)およびリバースプライマー:5’- [CCAAATATCTACACTCCAAAATCTAAC]-3’(配列番号24)を用いてPCRにより増幅することができ、増幅された配列をシークエンス等することによりメチル化CpGを検出することができる。
【0128】
また、例えば、メチル化特異的PCR法またはメチライト法により本願発明の方法を実施する場合には、配列番号7で表わされる配列の第387番目〜第524番目までの全長138bpの領域(配列番号10で表わされる塩基配列からなる領域)を用いることができる。この場合、試料をバイサルファイト処理することによって、試料中の配列番号10で表わされる配列中のCpGアイランドがメチル化されていない場合には配列番号14で表わされる配列に変換され、試料中の配列番号10で表わされる配列中のCpGアイランドがメチル化されている場合には配列番号18で表わされる配列に変換される。
【0129】
したがって、メチル化特異的PCR法またはメチライト法により本願発明の方法を実施する場合には、フォワードプライマー:5’- [AGTTTGTTGTTTTTTGTGGTAGATAG]-3’(配列番号25)およびリバースプライマー:5’- [CCTACACAATTACACAACATTTATCC]-3’(配列番号26)を用いてPCR反応を行い、メチル化されていないCpGアイランドを特異的に増幅することができる。同様に、フォワードプライマー:5’- [AGTTCGTTGTTTTTTGCGGTAGATAG]-3’(配列番号27)およびリバースプライマー :5’- [CCTACACAATTACACGACATTTATCC]-3’(配列番号28)を用いてPCR反応を行い、メチル化されているCpGアイランドを特異的に増幅することができる。そして、メチル化特異的バンドおよび非メチル化特異的バンドの有無に基づいてメチル化CpGを検出することができる。
【0130】
メチル化特異的PCR法またはメチライト法により本願発明の方法を実施する場合には、また、フォワードプライマー:5’- [GTTGTTTTTTGTGGTAGATAGT]-3’(配列番号29)およびリバースプライマー :5’- [ACAACATTTATCCAAAAACA]-3’(配列番号30)を用いてPCR反応を行い、メチル化されていないCpGアイランドを特異的に増幅することもできる。同様に、フォワードプライマー:5’- [GTTGTTTTTTGCGGTAGATAGC]-3’(配列番号31)およびリバースプライマー :5’- [ACGACATTTATCCGAAAACG]-3’(配列番号32)を用いてPCR反応を行い、メチル化されているCpGアイランドを特異的に増幅することもできる。そして、メチル化特異的バンドおよび非メチル化特異的バンドの有無に基づいてメチル化CpGを検出することができる。
【0131】
また、配列番号25と配列番号26、配列番号27と配列番号28、配列番号29と配列番号30、配列番号31と配列番号32の各プライマーの組み合わせによって増幅された配列中のメチル化されたCpGをパイロシークエンス法により検出することもでき、その場合、シークエンスプライマー:5’- [GTTTTTTGYGGTAGATAG]-3’(配列番号33)を用いてメチル化CpGを検出することができる。
【0132】
尚、本発明においてメチル化DNAの検出に用いるプライマーの配列の標記において、「Y」で表記される塩基は、メチル化されていないCpGアイランド中のシトシンを検出する場合にはチミン(T)を意味するものとし、メチル化されているCpGアイランド中のメチル化シトシンを検出する場合にはシトシン(C)を意味するものとする。
本発明においてメチル化DNAの検出に用いるプライマーの配列の標記において、「R」で表記される塩基は、アデニン(A)またはグアニン(G)を意味する。
【0133】
なお、バイサルファイト処理は、2本鎖DNAを1本鎖にした後、シトシンをウラシルに変換することから、処理後のDNAは相補性を失い、処理後のセンス鎖に基づいてPCR増幅した場合と、アンチセンス鎖に基づいてPCR増幅した場合とでは、PCR産物の配列が一部異なる。これは、バイサルファイト処理の化学的性質に基づく現象で、どちらの鎖に基づいてPCRを行っても、理論的には同一の解析結果が得られる。通常は、遺伝子のセンス鎖の塩基配列に基づいてPCRプライマーを設計するが、繰り返し配列が多いなどの理由でPCR増幅やシークエンス反応が困難な場合には、アンチセンス鎖の塩基配列に基づいてプライマーを設計することにより、かかる技術的な困難性を解決することが可能な場合もある。
【0134】
またさらに、本発明によれば、対象から得た生物学的試料における上記のメチル化されたCpGを検出もしくは定量するための試薬として、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドの塩基配列に特異的な一対のプライマーであるオリゴヌクレオチドを含む、癌検出用キットまたは発癌リスクの検出用キットが提供される。
【0135】
上記の癌検出用キットまたは発癌リスクの検出用キットに含まれる、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのCpGを検出もしくは定量するために用いられるプライマーとして、例えば、配列番号7、8、9または10で表される塩基配列と同一または実質的に同一の塩基配列の一部を含むフォワードプライマー、およびそれぞれ配列番号7、8、9または10で表される塩基配列と同一または実質的に同一の塩基配列に相補的な塩基配列の一部を含むリバースプライマー用いて行うことができる。また、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを、メチル化されていないCpG特異的に検出する場合には、バイサルファイト処理した後のゲノムDNAを、配列番号11、12、13または14で表わされる塩基配列と同一または実質的に同一の塩基配列の一部を含むフォワードプライマー、およびそれぞれ配列番号11、12、13または14で表される塩基配列と同一または実質的に同一の塩基配列に相補的な塩基配列の一部を含むリバースプライマーを、それぞれ適宜設計して用いることにより行うことができる。さらにまた、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを、メチル化されているCpG特異的に検出する場合には、バイサルファイト処理した後のゲノムDNAを、配列番号15、16、17または18で表わされる塩基配列と同一または実質的に同一の塩基配列の一部を含むフォワードプライマー、およびそれぞれ配列番号15、16、17または18で表される塩基配列と同一または実質的に同一の塩基配列に相補的な塩基配列の一部を含むリバースプライマーを、それぞれ適宜設計して用いることにより行うことができる。
【0136】
本発明のキットに含まれる特に好ましいPCRプライマーセット用のオリゴヌクレオチドの組み合わせの例としては、配列番号19で表わされる塩基配列を有するオリゴヌクレオチドと配列番号20で表わされる塩基配列を有するオリゴヌクレオチドとの組み合わせ、配列番号21で表わされる塩基配列を有するオリゴヌクレオチドと配列番号22で表わされる塩基配列を有するオリゴヌクレオチドとの組み合わせ、配列番号23で表わされる塩基配列を有するオリゴヌクレオチドと配列番号24で表わされる塩基配列を有するオリゴヌクレオチドとの組み合わせ、配列番号25で表わされる塩基配列を有するオリゴヌクレオチドと、配列番号26で表わされる塩基配列を有するオリゴヌクレオチドとの組み合わせ、配列番号27で表わされる塩基配列を有するオリゴヌクレオチドおよび配列番号28で表わされる塩基配列を有するオリゴヌクレオチドとの組み合わせ、配列番号29で表わされる塩基配列を有するオリゴヌクレオチドと配列番号30で表わされる塩基配列を有するオリゴヌクレオチドの組み合わせ、もしくは、配列番号31で表わされる塩基配列を有するオリゴヌクレオチドと配列番号32で表わされる塩基配列を有するオリゴヌクレオチドの組み合わせ、または、これらの塩基配列を有するオリゴヌクレオチドの組合わせと実質的に同一である塩基配列からなるオリゴヌクレオチドの組み合わせなどが挙げられる。
【0137】
ここで、前記のPCRプライマーセット用のオリゴヌクレオチドの組み合わせと実質的に同一である塩基配列からなるオリゴヌクレオチドの組み合わせとは、これらのPCRプライマーセットを構成する配列番号19〜配列番号32の塩基配列からなるオリゴヌクレオチドにおいて、1塩基または2塩基の欠失、置換、付加を有する塩基配列からなるオリゴヌクレオチドをいい、好ましくは配列番号19〜配列番号32の塩基配列において1塩基の欠失、置換、付加を有する塩基配列からなるオリゴヌクレオチド、より好ましくは配列番号19〜配列番号32の塩基配列において1塩基の置換を有する塩基配列からなるオリゴヌクレオチドをいう。
【0138】
上記のごとく、配列番号19〜24で示されるオリゴヌクレオチドは、バイサルファイトシークエンス法、パイロシークエンス法、またはコブラ法により本願発明の方法を実施する場合に用いることができ、配列番号25〜32で示されるオリゴヌクレオチドは、メチル化特異的PCR法またはメチライト法により本願発明の方法を実施する場合に用いることができる。
【0139】
本発明の癌検出用キットは、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGを検出するのに好適なものであるから、当該キットを用いて本発明による癌を検出するための指標を得る方法または発癌リスクを判断するための指標を得る方法を実施することができる。
【0140】
本発明の癌検出用キットは、上記いずれかのオリゴヌクレオチドもしくはプライマーを含む限り、いかなる形態であってもよく、試薬、器具、取扱説明書等を適宜含むことができ、組織や細胞等の生物学的試料からのDNAの抽出に用いられる溶液(例えば、組織もしくは細胞溶解用のバッファー、フェノール/クロロホルム、エタノール等)や器具、PCRに必要な試薬(例えばH2O、バッファー、MgCl2、dNTPミックス、Taqポリメラーゼ等)、PCR増幅断片の定量に必要な試薬(例えばRI、蛍光色素等)などの1種または2種以上を含むことができる。
【0141】
また、本発明において、癌とは、悪性腫瘍をいい、一般的に癌の概念に含まれるものを包含する。
さらに、胃癌とは、一般的に胃癌の概念に含まれるものを包含し、胃上皮粘膜から発生する悪性腫瘍などが含まれ、十二指腸癌とは、一般的に十二指腸癌の概念に含まれるものを包含し、十二指腸粘膜から直接発生した癌、十二指腸腺腫または十二指腸ポリープの癌化したもの、十二指腸に迷入した膵組織が癌化したもの、Brunel腺過誤腫の癌化したものが含まれる。大腸癌とは、一般的に大腸癌の概念に含まれるものを包含し、大腸上皮粘膜から発生する悪性腫瘍のほか、大腸腺腫などが含まれる。
【0142】
そして、膵癌とは、一般的に膵癌の概念に含まれるものを包含し、浸潤性膵管癌、膵内分泌腫瘍 、膵管内乳頭粘液性腫瘍、粘液性嚢胞腫瘍、腺房細胞癌が含まれる。また、肺癌とは、一般的に肺癌の概念に含まれるものを包含し、小細胞肺癌、肺扁平上皮癌、肺腺癌、肺大細胞癌、カルチノイド、円柱腫、粘表皮癌を含む。
【0143】
本発明における「対象から得た生物学的試料」としては、癌を検出することが可能な限りにおいて、特に限定されることなく、例えば、血液、血清、腹水、尿、糞便、胃洗浄液、膵液、あるいは、消化管組織(胃、十二指腸、小腸、大腸、膵臓等)の生検試料、肺の生検試料、喀痰等を利用することができる。RASGRF1遺伝子の発現レベルは、一般に、いずれの正常組織でも高く、癌組織において顕著に低下している傾向にあることから、対象から得た生物学的試料は、目的に応じて適宜選択することができ、例えば、大腸癌の検出を目的とする場合には、血清、糞便、大腸洗浄液、大腸組織等であることが好ましく、十二指腸癌の検出を目的とする場合には、十二指腸組織の生検試料であることが好ましく、胃癌の検出を目的とする場合には、血清、胃洗浄液、胃組織等であることが好ましく、膵癌の検出を目的とする場合には、血清、膵液、膵臓組織等であることが好ましく、肺癌の検出を目的とする場合には、肺の生検試料、喀痰であることが好ましい。
【0144】
また、かかる生物学的試料は、どのような方法で採取されたものでも本発明の方法に用いることができ、例えば、外科手術により採取されたものでもよく、組織採取用の穿刺針により採取されたものでもよく、あるいは、膵液の他、胃洗浄液、乳腺から分泌される分泌物または乳腺から分泌される洗浄液(乳管洗浄液(ductal fluid))として採取されたものでもよい。
【0145】
本発明の方法を実施するにあたっては、上記のような対象から得た生物学的試料について、DNA抽出等の前処理を行わずに、直接、上記のメチル化CpGの検出を行うことも可能であるが、生物学的試料中のDNAを抽出してから上記の方法、例えば、バイサルファイトシークエンス法、パイロシークエンス法、コブラ法、メチル化特異的PCR法、メチライト法等によってメチル化CpGの検出を行うことが好ましい。生物学的試料からDNAを抽出する方法は、当該技術分野においてよく知られており、例えば、フェノール・クロロホルムやエタノール、市販のDNA抽出試薬を用いて行うことができる。
【0146】
さらに、本発明者らは、RASGRF1が、正常細胞においては高い発現レベルが認められるのに対し、癌細胞においては、顕著に発現が抑制されていることを発見した。したがって、RASGRF1は癌細胞の増殖や転移の抑制に有効であると考えられるから、本発明はまた、RASGRF1タンパク質 を含んでなる癌治療剤、さらにまた、RASGRF1遺伝子を含んでなる癌治療剤を提供する。
【0147】
ここで、上記で述べた通り、RASGRF1タンパク質としては、具体的には、配列番号2、4、または6で表わされるアミノ酸配列と同一もしくは実質的に同一のアミノ酸配列を有するタンパク質が挙げられる。
【0148】
また、RASGRF1遺伝子としては、例えば、配列番号1、3、または5で表される塩基配列を含有する核酸、または、配列番号1、3、または5で表される塩基配列とストリンジェントな条件下で特異的にハイブリダイズする塩基配列を含有し、かつ前記の配列番号2、4、または6で表されるアミノ酸配列を含有するタンパク質と実質的に同等の性質を有するタンパク質をコードする核酸などが含まれる。ここで、配列番号1、3、または5で表される塩基配列とストリンジェントな条件下で特異的にハイブリダイズする塩基配列を含有する核酸としては、例えば、配列番号1、3、または5で表される塩基配列に対して相補的な塩基配列と約60%以上、好ましくは約70%以上、より好ましくは約80%以上、さらに好ましくは約90%以上、特に好ましくは約95%以上、最も好ましくは約98%以上の相同性を有する塩基配列を含有する核酸を用いることができる。
【0149】
本発明による上記癌治療剤は、いずれも、どのような癌に対しても用いることができるが、上記で述べたような胃癌、十二指腸癌、大腸癌、膵癌、肺癌に対して特に好ましく用いられる。
【0150】
本発明の癌治療剤は、医薬上許容可能な担体(例えば、賦形剤、結合剤、崩壊剤、滑沢剤、安定剤、防腐剤、pH調整剤、矯味矯臭剤、希釈剤、注射剤用溶剤等)と組み合わせて癌のための治療剤として製剤化して提供することができる。また、本発明の治療剤は、特異的に標的組織へ送達させることを可能にする標識やナノカプセル等を含有してもよい。なお、本発明の治療剤には、RASGRF1タンパク質またはRASGRF1をコードする核酸、のいずれかが単独で含まれていてもよく、2つ以上が組み合わされて含まれていてもよい。
【0151】
さらに、本発明の治療剤は、癌の治療に有効な公知の抗癌剤などの他の薬効成分をさらに含んでもよく、また、これらの有効成分と組み合わせて用いることもできる。ここで、公知の抗癌剤としては、例えば、フルオロウラシル、タモキシフェン、アナストロゾール、アクラルビシン、ドキソルビシン、テガフール、シクロホスファミド、イリノテカン、シタラビン、パクリタキセル、ドセタキセル、エピルビシン、カルボプラチン、シスプラチン、チオテパ、またはこれらの医薬上許容される塩等を例示することができる。
【0152】
本発明の治療剤の投与経路としては、例えば、静脈内投与、動脈内投与、皮下投与、筋肉内投与、腹腔内投与、局所投与等の非経口投与、および経口投与が挙げられ、投与剤形としては、噴霧剤、カプセル剤、錠剤、顆粒剤、シロップ剤、乳剤、座剤、注射剤、懸濁剤等が例示される。具体的には、局所投与の場合、外科手術にて患部を露出し、癌組織に注射器等の手段で本発明の治療剤を直接投与することができ、また、非局所投与の場合、腫瘍栄養血管内投与により行うことができる。好ましい投与経路は、局所投与である。
【0153】
また、特に、RASGRF1遺伝子をコードする核酸を含む本発明の癌治療剤については、RASGRF1遺伝子を癌細胞に導入して発現させることを目的とした遺伝子治療剤として用いることができる。
【0154】
遺伝子治療剤として用いられる本発明の癌治療剤は、HVJリポソーム法、前記遺伝子の塩基配列を注射等によってそのまま投与する方法、リン酸カルシウム法、DEAE−デキストラン法、エレクトロポレーション法、遺伝子銃による方法、リポフェクション法によって投与する方法、適当な発現ベクターを使う方法等によって、非経口的投与経路で対象に投与することができる。ここで、適当な発現ベクターとしては、例えば、アデノウイルスベクター、アデノ随伴ウイルスベクター、ヘルペスウイルスベクター、ワクシニアウイルスベクター、レトロウイルスベクター等を例示することができる。
【0155】
本発明の癌治療剤の投与量及び投与回数は、目的とする作用効果、投与方法、治療期間、対象の年齢、体重、性別等により異なるが、RASGRF1タンパク質を利用する場合の投与量は、対象がヒトである場合には成人1日当たり通常100μg〜100mg、好ましくは1〜20mgの範囲から適宜選択でき、RASGRF1遺伝子をコードする核酸、またはこれらを含む発現ベクターを利用する場合の投与量は、対象がヒトである場合には成人1日当たり通常0.01mg/kg〜1g/kg、好ましくは0.1mg/kg〜500mg/kg、より好ましくは1mg/kg〜50mg/kgの範囲から適宜選択でき、投与回数は、1日1回から数回の範囲から適宜選択できる。但し、投与量は、種々の条件により変動し得るため、上記範囲に限定されない。
【0156】
また、本発明によれば、RASGRF1タンパク質をコードする核酸の使用、特に、本発明による治療剤の製造における使用および本発明による治療剤としての使用、が提供される。
【0157】
さらにまた、本発明によれば、RASGRF1遺伝子をコードする核酸を投与することを含んでなる、癌の治療方法が提供される。この場合の有効投与量、投与方法、および投与形態等は、上記に準ずることができる。
【0158】
本発明の癌の予防剤または治療剤の探索方法は、動物に由来する細胞又は動物を用いて行なうことができる。細胞は、初代培養細胞であっても株化された細胞であってもよく、遺伝子改変された細胞であっても良い。動物は、ヒト以外の動物であれば、野生型であっても、遺伝子改変された動物であっても良い。本発明の癌の予防剤または治療剤の探索方法に用いる動物に由来する細胞は、哺乳動物に由来することが好ましく、動物を用いる場合にはヒト以外の哺乳動物を用いることができる。
【0159】
本発明の探索方法は、試験物質の存在下および非存在下において動物細胞を培養し、それぞれの細胞におけるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の頻度を測定し、そして、当該メチル化を抑制する効果を有する試験物質または当該メチル化の頻度を低下させる効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【0160】
また、本発明の探索方法は、試験物質の存在下および非存在下において動物細胞を培養し、それぞれの細胞におけるRASGRF1遺伝子の発現量を測定し、そして、RASGRF1遺伝子の発現を促進する効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【0161】
本発明の探索方法は、動物に試験物質を投与したのち、特定の組織におけるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化の頻度を測定し、そして、試験物質を投与しなかった場合に比べて当該メチル化を抑制する効果を有する試験物質または当該メチル化の頻度を低下させる効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【0162】
また、本発明の探索方法は、動物に試験物質を投与したのち、特定の組織におけるRASGRF1遺伝子の発現量を測定し、そして、試験物質を投与しなかった場合に比べてRASGRF1遺伝子の発現を促進する効果を有する試験物質を癌の予防剤または治療剤の候補物質として選定することを含む前記方法に関する。
【0163】
本発明を以下の実施例を用いてより具体的に説明するが、本発明の範囲は、これらの実施例に限定されない。
【実施例】
【0164】
<実施例1> 胃粘膜生検検体の採取
上部消化管内視鏡検査時に、患者へのインフォームドコンセント及び施設の倫理委員会の了承を得た上で、H.pylori感染胃炎の診断のために採取された非癌部の胃粘膜生検検体の一部からフェノール・クロロホルムによりDNAを抽出してメチル化解析を行った。142症例、284検体(未分化癌32症例(DGC)、分化型癌59症例(IGC)、非癌51症例(NGC))を対象とした。H.pylori感染の診断は血清H.pylori抗体、鏡検法、迅速ウレアーゼ法、呼気試験のいずれかで判定した。
【0165】
<実施例2> 未分化癌背景粘膜でメチル化されている遺伝子の網羅的なスクリーニング
未分化型胃癌の癌部3検体、胃前庭部と胃体部の非癌粘膜各6検体、分化型胃癌の癌部3検体、胃前庭部と胃体部の各4検体、非癌症例の胃前庭部と胃体部の各6検体を用いてMCAM法(Methylated CpG Island Amplification Microarray法)によって、メチル化されているゲノム遺伝子探索を行った。MCAM法は、Estecio MRH, et al., High-throughput methylation profiling by MCA coupled to CpG island microarray., Genome Research, 2007;17:1529-1536またはGao W, et al., Variable DNA methylation patterns associated with progression of disease in hepatocellular carcinomas. Carcinogenesis 2008;29:1901-10に記載の方法に準じて行なった。
その結果、これまで報告されているmicroRNA34b/c,IRF4,SFRP2,DKK2等の癌抑制遺伝子の異常メチル化を未分化型胃癌の背景粘膜で検討したところ、これらの癌抑制遺伝子の中に未分化型胃癌の背景粘膜で異常メチル化が蓄積されている遺伝子は認めなかった。
一方、クラスター解析により、一部の未分化癌組織、その胃前庭部背景粘膜でのメチル化を認める一方で、分化癌組織、分化癌の背景ではメチル化を認めない遺伝子としてRASGRF1を抽出した。クラスター解析は、genespring ver.11(アジレントテクノロジー社)を用いて行なった。
【0166】
<実施例3> 胃癌細胞株におけるRASGRF1遺伝子のメチル化
各種の胃癌細胞株を用いてRASGRF1遺伝子のDNAメチル化を測定した。胃癌細胞株は、MKN1、MKN7、MKN74、SH101、SNU1、SNU638、JRST、KatoIII、AZ521、MKN28、MKN45、NUGC3、NUGC4、AGS、NCI-N87の各胃癌細胞株についてRASGRF1遺伝子のDNAメチル化を測定した。RASGRF1遺伝子のDNAメチル化の測定方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、パイロシークエンス法により行なった。図3に示すように、RASGRF1遺伝子は、MKN7、SH101、SNU638、JRST、KatoIII、MKN28、AGS、NCI-N87の各胃癌細胞株について90%以上のDNAメチル化を示し、MKN74とSNU1について70%以上のDNAメチル化を示し、AZ521については約55%のDNAメチル化を、NUGC4については約45%のDNAメチル化を、MKN45については約20%のDNAメチル化をそれぞれ示した。このように、RASGRF1遺伝子は胃癌細胞株において高頻度にメチル化されていた。
【0167】
<実施例4> 胃癌細胞株におけるRASGRF1遺伝子の発現消失
各種の胃癌細胞株を用いてRASGRF1遺伝子の発現レベルを測定した。胃癌細胞株は、MKN1、MKN7、MKN74、SH101、SNU1、SNU638、JRST、KatoIII、AZ521、MKN28、MKN45、NUGC3、NUGC4、AGS、NCI-N87の各胃癌細胞株についてRASGRF1遺伝子の発現レベルを測定した。RASGRF1遺伝子の発現レベルの測定方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、フォワードプライマーとして5'-[TTCGGACAACACAAAATGGCAAACC]-3'(配列番号34)の配列を用い、リバースプライマーとして5'-[TCTTCTCTGTCTCCACGATCTGCA]-3'(配列番号35)または5'-[CCATTCGTCACAATCTTTTGCGTC]-3'(配列番号36)の配列を用いて TaqMan RT-PCR法により行なった。図4に示すように、RASGRF1遺伝子の発現は、90%以上の同遺伝子のDNAメチル化を示したSH101、SNU638、JRST、MKN28、AGS、NCI-N87の各胃癌細胞株、同じく約45%のDNAメチル化を示したNUGC4、同じく約20%のDNAメチル化を示したMKN45においてほぼ消失していた。一方、RASGRF1遺伝子のDNAメチル化がほとんど生じていなかったNUGC3遺伝子の発現レベルは高かった。このように、RASGRF1遺伝子のメチル化を認める細胞において、RASGRF1遺伝子の発現が消失していた。
【0168】
<実施例5> 5-aza-2'-deoxycytidine(5-aza-dc)処理による、胃癌細胞株におけるRASGRF1遺伝子の発現の回復
実施例3および実施例4で用いたのと同じ胃癌細胞株を5-aza-2'-deoxycytidineで処理し、RASGRF1遺伝子の発現レベルを測定した。5-aza-dc処理は、2μMの5-aza-dcの存在下で各胃癌細胞株を72時間培養することにより行なった。RASGRF1遺伝子の発現レベルの測定方法は実施例4と同様に行ない、5-aza-2'-deoxycytidineによる処理方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて行なった。メチル化酵素阻害剤である5-aza-2'-deoxycytidine処理により、MKN74とAZ521を除く細胞株で、RASGRF1遺伝子の発現の回復を認めた。
【0169】
<実施例6> MCAM法による胃粘膜生検検体中のRASGRF1遺伝子のメチル化解析
次に臨床検体によるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を行った。MCAM法(Methylated CpG Island Amplification Microarray法)によって、胃癌組織と背景粘膜が同時に採取されている58症例(未分化型癌28症例、分化型癌25症例)とH.pylori感染胃炎症例22症例についてメチル化されているゲノム遺伝子探索を行った。MCAM法は、Estecio MRH, et al., High-throughput methylation profiling by MCA coupled to CpG island microarray., Genome Research, 2007;17:1529-1536またはGao W, et al., Variable DNA methylation patterns associated with progression of disease in hepatocellular carcinomas. Carcinogenesis 2008;29:1901-10に記載の方法に準じて行ない、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGの割合が15%以上である場合に陽性とした(図6)。
未分化型胃癌の癌部14症例(50%)、背景粘膜14症例(50%)、分化型胃癌の癌部13症例(52%)、背景粘膜15症例(60%)でメチル化を認めた。H.pylori感染胃炎症例では2症例(9%)でメチル化を認めるのみであった。RASGRF1遺伝子のメチル化を非癌胃粘膜で認める場合、胃癌が存在するオッズ比は12.1倍であった。
【0170】
<実施例7> 胃粘膜生検検体中のRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析
次にRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を全検体について定量的に行った。RASGRF1遺伝子のメチル化解析の方法は、Yamashita M, et al. DNA methylation of interferon regulatory factors in gastric cancer and noncancerous gastric mucosae., Cancer Sci 2010, vol.101, No.7, 1708-1716に記載の方法に基づいて、パイロシークエンス法により行なった。その結果、胃前庭部の背景粘膜におけるメチル化されたCpGの割合の平均値は、未分化型癌症例では17.67%、分化型癌症例では19.07%、H.pylori感染胃炎症例では10.10%であった。メチル化されたCpGの割合は、未分化型癌症例、分化型癌症例のそれぞれにおいて、H.pylori感染胃炎症例に比べて、有意(p<0.05, p<0.001)に高かった。したがって、胃前庭部の背景粘膜におけるRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析が発癌リスク予測に有用であることが示された(図7)。なお、胃体部の背景粘膜におけるメチル化されたCpGの割合は、未分化型癌症例、分化型癌症例、H.pylori感染胃炎症例の間で有意差が認められなかった。
【0171】
<実施例8> Updated Sydney Systemによる胃粘膜生検検体の病理組織学的評価
胃炎の診断は胃前庭部大彎、胃体中部大彎より生検しUpdated Sydney Systemにより、活動性、炎症、萎縮、腸上皮化生の程度を評価した。Updated Sydney Systemは、Dixon MF, et al. Classification and grading of gastritis. The updated Sydney System. international Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol 1996;20:1161-81.に基づいて行なった。
【0172】
<実施例9> 病理組織学的に萎縮がないか軽度である胃前庭部の胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析
Updated Sydney Systemにより病理組織学的評価が得られた症例のうち、萎縮の程度が無しまたは軽度と判定された30症例についてRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を、実施例3および実施例7と同様の方法で行った(図8)。その結果、胃前庭部の背景粘膜におけるメチル化されたCpGの割合の平均値は、未分化型癌症例では17.58%、分化型癌症例では13.2%、H.pylori感染胃炎症例では7.29%であった。未分化型癌症例におけるメチル化されたCpGの割合は、H.pylori感染胃炎症例におけるメチル化されたCpGの割合に比べて有意(p<0.05)に高かった。
【0173】
<実施例10> 病理組織学的に腸上皮化生を認めない胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析
Updated Sydney Systemにより病理組織学的評価が得られた症例のうち、腸上皮化生を認めない33症例についてRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を、実施例3および実施例7と同様の方法で行った(図8)。その結果、胃前庭部の背景粘膜におけるメチル化されたCpGの割合の平均値は、未分化型癌症例では10.65%、分化型癌症例では7.45%、H.pylori感染胃炎症例では4.15%であった。未分化型癌症例におけるメチル化されたCpGの割合は、H.pylori感染胃炎症例におけるメチル化されたCpGの割合に比べて有意(p<0.05)に高かった。
【0174】
<実施例11> 血清ペプシノゲンの測定
血清H.pylori抗体検査の際に採取された血清でペプシノゲンI、IIを測定した。ペプシノゲンIの血清中濃度が70ng/mlを超えているいるか、あるいは、ペプシノゲンIの血清中濃度がペプシノゲンIIの血清中濃度の3倍を超えている場合に血清ペプシノゲンが陰性であり、胃の萎縮がみられないものと判定した。
【0175】
<実施例12> 血清ペプシノゲン陰性症例の胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析
血清ペプシノゲンが陰性であった29症例の胃前庭部粘膜についてRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を、実施例3および実施例7と同様の方法で行った。その結果、胃前庭部の背景粘膜におけるメチル化されたCpGの割合の平均値は、H.pylori感染胃炎症例(非癌前庭部)では7.1%であるのに対して、胃癌罹患症例(癌背景前庭部)では15.78%であり、有意(p<0.05)に高いメチル化を示した(図9)。ペプシノゲン陰性症例において、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGの割合が10%以上である場合に胃癌に罹患している確率は、胃癌に罹患していない確率に比べて、オッズ比9.3であった。
【0176】
<実施例13> 血清ペプシノゲン陽性症例の胃粘膜生検検体におけるRASGRF1遺伝子のパイロシークエンシング法による定量的メチル化解析
血清ペプシノゲンが陽性であった30症例の胃前庭部粘膜についてRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化解析を、実施例3および実施例7と同様の方法で行った。その結果、胃前庭部の背景粘膜におけるメチル化されたCpGの割合の平均値は、H.pylori感染胃炎症例(非癌前庭部)では11.27%であるのに対して、胃癌罹患症例(癌背景前庭部)では20.4%であり、有意(p<0.05)に高いメチル化を示した(図9)。
ペプシノゲン陽性症例において、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGの割合が10%以上である場合に胃癌に罹患している確率は、胃癌に罹患していない確率に比べて、オッズ比3.0であった。
【0177】
<実施例14> 統計解析
全ての統計解析は、PRISM version 5 for windowsを用い、one way ANOVA(一元配置分散分析)、Student's t-test(スチューデントのt検定)による統計的検定を行った。
【0178】
以上の結果より、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化は、胃癌に罹患した症例における胃粘膜組織のうちの癌化していない部分(背景粘膜)において高いレベルで検出され、H.pyloriに感染したのみで胃癌に罹患していない症例の胃粘膜組織においてはほとんど検出されなかったことから、胃癌の発癌リスクが高いほどRASGRF1遺伝子のプロモーター領域におけるCpGアイランドが特異的に高い割合でメチル化されていることが明らかになるとともに、胃癌特異的にRASGRF1遺伝子がサイレンシングされていることが示唆された。また、胃癌のみならず、十二指腸癌、大腸癌などの消化器癌、および膵癌または肺癌などのras遺伝子が発癌に関与する癌においても、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドがメチル化され、RASGRF1遺伝子がサイレンシングされているものと考えられた。
【0179】
RASGRF1は、発癌遺伝子であるrasのGTP交換促進因子であり、RASGRF1の遺伝子発現抑制は、本来、癌の抑制に資すると推定されるはずである。しかし、本願の発明者は、予想に反して、胃癌に罹患した症例における胃粘膜組織のうちの癌化していない部分において、RASGRF1遺伝子が高頻度のメチル化によって発現抑制されていることを見出したものである。
【0180】
以上の通り、本願発明者らは、未分化型胃癌の背景粘膜で、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのCpGが高い割合でメチル化していることを見出した。RASGRF1遺伝子は胃癌の約50%でメチル化されており(図6)、胃癌に罹患した症例における胃粘膜組織のうちの癌化していない部分においても高頻度にメチル化されていた。単にH.pylori胃炎を患ったのみではメチル化を認めないことも明らかとなり、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化されたCpGの割合は、胃癌の検出の指標、および胃癌の発癌リスクを判断するための指標として有用であると考えられた。また、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドは未分化型胃癌および分化型胃癌に罹患した症例における胃粘膜組織のうちの癌化していない部分(背景粘膜)において、H.pylori胃炎に罹患した胃粘膜より有意に高頻度にメチル化されていた。さらに驚くべきことに病理学的な萎縮・腸上皮化生を認めない癌症例、あるいは血清ペプシノゲン陰性症例においても、胃癌に罹患した症例における胃粘膜組織のうちの癌化していない部分においてRASGRF1遺伝子のプロモーター領域におけるCpGアイランドが異常に高い割合でメチル化していることが明らかとなった。この結果よりRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化を測定することは、萎縮、腸上皮化生を経ずに発癌する胃癌、特に未分化型癌の存在診断、さらに未分化型癌の発癌リスクの予測に有用であることが明らかとなった。
【0181】
これらの結果から、本願発明の方法により、あるいは、本発明のキットを用いることにより、対象から得た生物学的試料を用いて、対象における癌、特に、胃癌、十二指腸癌、大腸癌、膵癌、肺癌を、容易にしかも正確に検出することが可能であることが示された。また、本願発明の方法または本願発明のキットは、癌の検出のみならず、癌の進達度予測、発癌リスクの予測、再発リスクの予測にも極めて有用であると考えられた。前記CpGアイランドは、上記の通り癌細胞においてRASGRF1遺伝子という癌の背景組織特異的に発現が低下している遺伝子の発現を直接調節していることから、この領域のメチル化を基準として癌を検出する本願発明の方法は、極めて精度の高いものである。
また、本願発明の癌の予防剤または治療剤は、胃癌、十二指腸癌、大腸癌、膵癌、肺癌等の癌において、癌抑制遺伝子産物的に機能するRASGRF1の発現を増加させるものであることから、有効に癌細胞の増殖を抑制し得るものであることが示された。
さらにまた、本願発明の癌の予防剤または治療剤の探索方法は、細胞を用いて効率よく行なうことのできる探索方法であり、新しい作用機序に基づいて未分化型胃癌の予防または治療に有用な物質を探索し得るものであることが示された。
【産業上の利用可能性】
【0182】
RASGRF1遺伝子は、胃癌、十二指腸癌、大腸癌、膵癌、肺癌等の癌において特異的に発現が抑制されており、本発明によれば、かかるRASGRF1遺伝子の発現抑制を直接的に制御するRASGRF1遺伝子プロモーター領域のCpGアイランドにおけるDNAメチル化を検出することを含む発癌リスクを判断するための指標を得るため方法、およびかかる方法に基づく発癌リスクの指標を得るためのキットを提供することができる。したがって、本発明は、胃癌、十二指腸癌、大腸癌、膵癌、肺癌等の癌の診断に加え、その治療や研究にも大いに貢献するものである。
また、RASGRF1は、癌の背景組織および癌細胞において特異的に発現が低下しているとともに、発癌遺伝子等の発現を抑制する作用を有することから、RASGRF1、あるいは、RASGRF1遺伝子をコードする核酸を含む癌の治療剤の探索方法を提供することができ、かかる癌の治療剤の探索方法は高い治療効果が得られる医薬品開発に有用であることが期待される。
【特許請求の範囲】
【請求項1】
対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することにより、対象における、癌を検出するための指標または発癌リスクを判断するための指標を得る方法。
【請求項2】
未分化型癌の癌の検出または発癌リスクを判断するための指標を得るものである、請求項1の方法。
【請求項3】
血清ペプシノゲンが陰性である対象の、癌を検出するための指標または発癌リスクを判断するための指標を得るものである、請求項1または請求項2の方法。
【請求項4】
生物学的試料が背景組織である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドが、配列番号7で表わされる塩基配列と同一もしくは実質的に同一の塩基配列を有するDNA領域である、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化を測定する方法が、メチル化特異的PCR法、バイサルファイトシークエンス法、パイロシークエンス法、コブラ法およびメチライト法からなる群より選択される1つまたは2つ以上の方法である、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも8%を超えている場合に発癌リスクが高いと決定する、請求項1〜6のいずれか一項に記載の方法。
【請求項8】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも10%を超えている場合に発癌リスクが高いと決定する、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも15%を超えている場合に発癌リスクが高いと決定する、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも20%を超えている場合に発癌リスクが高いと決定する、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも30%を超えている場合に発癌リスクが高いと決定する、請求項1〜10のいずれか一項に記載の方法。
【請求項12】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも50%を超えている場合に発癌リスクが高いと決定する、請求項1〜11のいずれか一項に記載の方法。
【請求項13】
配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、当該CpGアイランドのメチル化されたCpGを検出する、請求項1〜12のいずれか一項に記載の方法。
【請求項14】
配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、バイサルファイト処理したゲノムDNA中の、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、当該CpGアイランドのメチル化されていないCpGを検出することを含む、請求項1〜12のいずれか一項に記載の方法。
【請求項15】
配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、バイサルファイト処理したゲノムDNA中の、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、当該CpGアイランドのメチル化されたCpGを検出することを含む、請求項1〜12のいずれか一項に記載の方法。
【請求項16】
配列番号19と配列番号20、配列番号21と配列番号22、配列番号23と配列番号24、配列番号25と配列番号26、配列番号27と配列番号28、配列番号29と配列番号30、配列番号31と配列番号32で表される塩基配列を有するオリゴヌクレオチドの組合わせ、または、これらの塩基配列を有するオリゴヌクレオチドの組合わせと実質的に同一である塩基配列を有するオリゴヌクレオチドの組み合わせのうち、いずれか一以上のオリゴヌクレオチドの組み合わせを用いて、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することを含む、請求項1〜15のいずれか一項に記載の方法。
【請求項17】
胃の萎縮がないか軽度である胃の前庭部の生検試料を用いて指標を得るものである、請求項1〜16のいずれか一項に記載の方法。
【請求項18】
腸上皮化生がみられない胃の前庭部の生検試料を用いて指標を得るものである、請求項1〜17のいずれか一項に記載の方法。
【請求項19】
対象から得た検体が胃の洗浄液または胃の生検試料である、請求項1〜18のいずれか一項に記載の方法。
【請求項20】
対象から得た検体が胃の前庭部の生検試料である、請求項1〜19のいずれか一項に記載の方法。
【請求項21】
対象から得た検体が十二指腸の洗浄液または十二指腸の生検試料である請求項1〜20のいずれか一項に記載の方法。
【請求項22】
対象から得た検体が大腸の洗浄液または大腸の生検試料である、請求項1〜21のいずれか一項に記載の方法。
【請求項23】
対象から得た検体が膵液または膵の生検試料である、請求項1〜22のいずれか一項に記載の方法。
【請求項24】
対象から得た検体が喀痰または肺の生検試料である、請求項1〜23のいずれか一項に記載の方法。
【請求項25】
対象から得た検体が血液、血清、腹水、尿、または糞便である、請求項1〜24のいずれか一項に記載の方法。
【請求項26】
癌が、胃癌、十二指腸癌、大腸癌、膵癌または肺癌である、請求項1〜25のいずれか一項に記載の方法。
【請求項27】
対象から得た生物学的試料中のRASGRF1遺伝子の発現量を測定することにより、対象における、癌を検出するための指標または発癌リスクを判断するための指標を得る方法。
【請求項28】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅するための、フォワードプライマーおよびリバースプライマーからなるPCRプライマーセット。
【請求項29】
配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、請求項28のPCRプライマーセット。
【請求項30】
配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、請求項28のPCRプライマーセット。
【請求項31】
配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、請求項28のPCRプライマーセット。
【請求項32】
配列番号19と配列番号20、配列番号21と配列番号22、配列番号23と配列番号24、配列番号25と配列番号26、配列番号27と配列番号28、配列番号29と配列番号30、配列番号31と配列番号32で表される塩基配列を有するオリゴヌクレオチドの組合わせ、または、これらの塩基配列を有するオリゴヌクレオチドの組合わせと実質的に同一である塩基配列を有するオリゴヌクレオチドの組み合わせのうち、いずれか一以上のオリゴヌクレオチドの組み合わせを含んでなる、請求項28のPCRプライマーセット。
【請求項33】
請求項28〜32のいずれか一項に記載のPCRプライマーセットを含み、かつ、水酸化ナトリウム、ハイドロキノン、亜硫酸水素塩、デオキシリボヌクレオチド三リン酸、ミネラルオイルまたは緩衝液の中から選択される1以上のものを含む、癌を検出するための指標または発癌リスクを判断するための指標を得るためのキット。
【請求項1】
対象から得た生物学的試料中のRASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することにより、対象における、癌を検出するための指標または発癌リスクを判断するための指標を得る方法。
【請求項2】
未分化型癌の癌の検出または発癌リスクを判断するための指標を得るものである、請求項1の方法。
【請求項3】
血清ペプシノゲンが陰性である対象の、癌を検出するための指標または発癌リスクを判断するための指標を得るものである、請求項1または請求項2の方法。
【請求項4】
生物学的試料が背景組織である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドが、配列番号7で表わされる塩基配列と同一もしくは実質的に同一の塩基配列を有するDNA領域である、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化を測定する方法が、メチル化特異的PCR法、バイサルファイトシークエンス法、パイロシークエンス法、コブラ法およびメチライト法からなる群より選択される1つまたは2つ以上の方法である、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも8%を超えている場合に発癌リスクが高いと決定する、請求項1〜6のいずれか一項に記載の方法。
【請求項8】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも10%を超えている場合に発癌リスクが高いと決定する、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも15%を超えている場合に発癌リスクが高いと決定する、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも20%を超えている場合に発癌リスクが高いと決定する、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも30%を超えている場合に発癌リスクが高いと決定する、請求項1〜10のいずれか一項に記載の方法。
【請求項12】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのメチル化が少なくとも50%を超えている場合に発癌リスクが高いと決定する、請求項1〜11のいずれか一項に記載の方法。
【請求項13】
配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、当該CpGアイランドのメチル化されたCpGを検出する、請求項1〜12のいずれか一項に記載の方法。
【請求項14】
配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、バイサルファイト処理したゲノムDNA中の、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、当該CpGアイランドのメチル化されていないCpGを検出することを含む、請求項1〜12のいずれか一項に記載の方法。
【請求項15】
配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーを用いて、バイサルファイト処理したゲノムDNA中の、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅することにより、当該CpGアイランドのメチル化されたCpGを検出することを含む、請求項1〜12のいずれか一項に記載の方法。
【請求項16】
配列番号19と配列番号20、配列番号21と配列番号22、配列番号23と配列番号24、配列番号25と配列番号26、配列番号27と配列番号28、配列番号29と配列番号30、配列番号31と配列番号32で表される塩基配列を有するオリゴヌクレオチドの組合わせ、または、これらの塩基配列を有するオリゴヌクレオチドの組合わせと実質的に同一である塩基配列を有するオリゴヌクレオチドの組み合わせのうち、いずれか一以上のオリゴヌクレオチドの組み合わせを用いて、RASGRF1遺伝子のプロモーター領域におけるCpGアイランドのDNAメチル化を検出することを含む、請求項1〜15のいずれか一項に記載の方法。
【請求項17】
胃の萎縮がないか軽度である胃の前庭部の生検試料を用いて指標を得るものである、請求項1〜16のいずれか一項に記載の方法。
【請求項18】
腸上皮化生がみられない胃の前庭部の生検試料を用いて指標を得るものである、請求項1〜17のいずれか一項に記載の方法。
【請求項19】
対象から得た検体が胃の洗浄液または胃の生検試料である、請求項1〜18のいずれか一項に記載の方法。
【請求項20】
対象から得た検体が胃の前庭部の生検試料である、請求項1〜19のいずれか一項に記載の方法。
【請求項21】
対象から得た検体が十二指腸の洗浄液または十二指腸の生検試料である請求項1〜20のいずれか一項に記載の方法。
【請求項22】
対象から得た検体が大腸の洗浄液または大腸の生検試料である、請求項1〜21のいずれか一項に記載の方法。
【請求項23】
対象から得た検体が膵液または膵の生検試料である、請求項1〜22のいずれか一項に記載の方法。
【請求項24】
対象から得た検体が喀痰または肺の生検試料である、請求項1〜23のいずれか一項に記載の方法。
【請求項25】
対象から得た検体が血液、血清、腹水、尿、または糞便である、請求項1〜24のいずれか一項に記載の方法。
【請求項26】
癌が、胃癌、十二指腸癌、大腸癌、膵癌または肺癌である、請求項1〜25のいずれか一項に記載の方法。
【請求項27】
対象から得た生物学的試料中のRASGRF1遺伝子の発現量を測定することにより、対象における、癌を検出するための指標または発癌リスクを判断するための指標を得る方法。
【請求項28】
RASGRF1遺伝子のプロモーター領域におけるCpGアイランドを増幅するための、フォワードプライマーおよびリバースプライマーからなるPCRプライマーセット。
【請求項29】
配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号7で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、請求項28のPCRプライマーセット。
【請求項30】
配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号11で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、請求項28のPCRプライマーセット。
【請求項31】
配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列中の連続する15〜40塩基を含むフォワードプライマー、および配列番号15で表される塩基配列と同一もしくは実質的に同一の塩基配列に相補的な塩基配列中の連続する15〜40塩基を含むリバースプライマーからなる、請求項28のPCRプライマーセット。
【請求項32】
配列番号19と配列番号20、配列番号21と配列番号22、配列番号23と配列番号24、配列番号25と配列番号26、配列番号27と配列番号28、配列番号29と配列番号30、配列番号31と配列番号32で表される塩基配列を有するオリゴヌクレオチドの組合わせ、または、これらの塩基配列を有するオリゴヌクレオチドの組合わせと実質的に同一である塩基配列を有するオリゴヌクレオチドの組み合わせのうち、いずれか一以上のオリゴヌクレオチドの組み合わせを含んでなる、請求項28のPCRプライマーセット。
【請求項33】
請求項28〜32のいずれか一項に記載のPCRプライマーセットを含み、かつ、水酸化ナトリウム、ハイドロキノン、亜硫酸水素塩、デオキシリボヌクレオチド三リン酸、ミネラルオイルまたは緩衝液の中から選択される1以上のものを含む、癌を検出するための指標または発癌リスクを判断するための指標を得るためのキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−90555(P2012−90555A)
【公開日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願番号】特願2010−239932(P2010−239932)
【出願日】平成22年10月26日(2010.10.26)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.WINDOWS
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度 文部科学省 科学技術試験研究委託事業「オール北海道先進医学・医療拠点形成」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(307014555)北海道公立大学法人 札幌医科大学 (31)
【Fターム(参考)】
【公開日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願日】平成22年10月26日(2010.10.26)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.WINDOWS
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度 文部科学省 科学技術試験研究委託事業「オール北海道先進医学・医療拠点形成」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(307014555)北海道公立大学法人 札幌医科大学 (31)
【Fターム(参考)】
[ Back to top ]

