RNA干渉効果が高い脂質修飾2本鎖RNA
【課題】本発明の目的は、ヌクレアーゼ耐性及び細胞内導入率が高く、優れたRNA干渉効
果を奏し得る新規な二本鎖RNAを提供することである。
【解決手段】標的配列に相補的な塩基配列を含むセンス鎖RNA、及び該センス鎖RNAに相補的な塩基配列を含むアンチセンス鎖RNAを有し、標的遺伝子の発現を抑制できる二本鎖RNAにおいて、該センス鎖RNAの5’末端側から1〜6番目のヌクレオチドの少なくとも1つに直接又はリンカーを介して脂質を結合させた脂質修飾2本鎖RNAを提供する。
果を奏し得る新規な二本鎖RNAを提供することである。
【解決手段】標的配列に相補的な塩基配列を含むセンス鎖RNA、及び該センス鎖RNAに相補的な塩基配列を含むアンチセンス鎖RNAを有し、標的遺伝子の発現を抑制できる二本鎖RNAにおいて、該センス鎖RNAの5’末端側から1〜6番目のヌクレオチドの少なくとも1つに直接又はリンカーを介して脂質を結合させた脂質修飾2本鎖RNAを提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、標的遺伝子の発現を効率的に抑制できる脂質修飾2本鎖RNAに関する。より具体的には、ヌクレアーゼ耐性及び細胞内導入率が高く、優れたRNA干渉効果を奏することができる脂質修飾2本鎖RNAに関する。
【背景技術】
【0002】
ガンやエイズなどの難病を効率的に治療する医薬の開発は、ライフサイエンス分野における大きな一つの課題である。この課題を克服できる可能性がある有力な方法の一つとして、特定の遺伝子にのみ作用する遺伝子医薬がある。この遺伝子医薬の中でも特に最近21塩基の短い2本鎖RNA (small interfering RNA:siRNA )を利用するRNA干渉(RNA interference:RNAi)法が注目されている。このRNAi法は、1998年にFireらにより初めて報告された(非特許文献1参照)。Fireらの報告によると、機能阻害したい遺伝子の特定領域と相同な100塩基対程度の2本鎖RNAを細胞内へ導入させることにより、細胞質内でDicerの働きにより20〜25塩基対程度の2本鎖RNAへと分解され、その後複数のタンパク質とRNA/タンパク質複合体を形成し(この複合体をRICS:RNA-induced silencing complexと呼ぶ)、標的遺伝子から産出されたmRNAの相同部位と結合し強力に遺伝子発現を抑制するというものである。しかしながら、哺乳細胞では、約30塩基対以上の長い2本鎖RNAを導入させると、ウィルス応答反応であるインターフェロン反応が誘導され結果的に細胞が死んでしまうという現象が報告され、哺乳動物細胞系ではRNAi法は適用し難いと考えられた。そこでTuschlらは、2本鎖RNAの両3’末端にダングリングエンドをもつ21塩基長の2本鎖RNAを化学的に合成し、哺乳動物細胞へ直接導入させることにより、インターフェロン応答を回避し配列特異的に高い遺伝子発現抑制能を示すことを報告した(非特許文献2参照)。また彼らは、2本鎖領域が19塩基対で、3’末端又は5’末端に様々な長さのダングリングエンド鎖をもつ短い2本鎖RNAを合成しRNA干渉効果を検討した。その結果、両3’末端に2塩基のダングリングエンドをもつ21塩基長のsiRNAは非常に高いRNA干渉効果が観測されたが、それ以外のあらゆるタイプの短い2 本鎖RNAにおいては顕著なRNA干渉効果が観測されなかった。この報告により、今日では21塩基長であり、両3’末端に2塩基のダングリングエンドをもつ2本鎖RNAを用いたRNA干渉法が一般的となっている。ここでは21塩基長の短い2本鎖RNAを用いて標的遺伝子発現を阻害する方法を、RNAi法と区別してsiRNA法と呼ぶ。
【0003】
このsiRNA法は合成RNAを用いるのでサンプル調製も比較的容易であり、取り扱い操作も簡便で、かつ、非常に強力な効果を示す為、ライフサイエンス分野のみならずバイオビジネス分野においても大きな注目を浴びている。
【0004】
しかしながら、この優れたsiRNA法にも解決しなければならない問題点がある。上記したようにsiRNAはRNA分子から構成されており、ヌクレアーゼの働きにより速やかに分解される。また2本鎖RNA領域は1本鎖RNAに比べ、細胞内及び培地中に含まれるヌクレアーゼに比較的高い耐性を示すが、19塩基対からなる2本鎖RNAは殆ど従来のRNA干渉効果を示さない。そのため合成siRNAは、標的遺伝子配列をもつ細胞への導入後、2日〜4日間程度までは高い遺伝子発現抑制効果を示すが、その後はRNA干渉効果が急激に弱まり、7日程度でRNA干渉効果が殆ど無くなると報告されている。
【0005】
最近、合成siRNAにおいて細胞導入性に優れ長時間高活性なRNA干渉効果を獲得するために、様々な化学修飾型siRNAが報告されている。例えば、エキソヌクレアーゼからの分解耐性を獲得する為に、siRNAの末端をアミノ基やチオール基、アベーシックなどに修飾したsiRNAが合成されている。しかしながら、末端を修飾した21塩基長のsiRNAのほとんどの場合で、RNA干渉効果が著しく減少すると既に報告されている。
【0006】
一方、近年、J. Rossiらの報告により、27塩基対からなる2本鎖RNAが21塩基長からなるsiRNAに比べ100倍程度高いRNA干渉効果を示すことが明らかとなった(非特許文献3参照)。これは、27塩基対からなるRNAがRNase III様の酵素であるDicerによって21塩基長のsiRNAに切断された後、タンパク複合体であるRISCにそのまま認識され、高効率にsiRNA効果を発揮できる為だと考えられている。
【0007】
このように、27塩基長のRNAは、優れたRNA干渉効果を奏し得るため、今後、遺伝子医薬としての応用が益々期待されている。しかしながら、27塩基長のRNAによるRNA干渉効果をより増強させるためには、どのような技術的手段が有効であるかについては一切分かっていない。更に、RNA干渉効果を奏する二本鎖RNAに関して、27塩基長のRNAのみならず、他の塩基長のRNAについても、RNA干渉効果を高めるための技術的手段については明らかにされていない。
【0008】
また、RNA干渉効果を奏する二本鎖RNAでは、末端にダングリングエンドを有する構造が一般的に採用されているが、末端にダングリングエンドを有していない構造(即ち、平滑末端を有する構造)についても、RNA干渉効果の検討が行われている。しかしながら、センス鎖RNAの5’末端側を平滑末端にした構造では、センス鎖RNAの5’末端側にダングリングエンドがある場合に比して、RNA干渉効果が殆ど変わらない、或いはRNA干渉効果が低減することが示唆されている(非特許文献4参照)。
【0009】
一方、脂質は、細胞膜に対する透過能が高く、細胞内に薬物を送達するのに有用であることが分かっている。このような脂質を、RNA干渉効果を奏する二本鎖RNAに結合させることによって、細胞内導入率を高めて、RNA干渉効果をより一層有効に奏させることが期待される。しかしながら、RNA干渉効果を奏する二本鎖RNAに、単に脂質を結合させると、RNA干渉効果の顕著な減弱化を招くことが分かっており、従来技術では、優れたRNA干渉効果と脂質に基づく有用効果とを兼ね備えた脂質修飾2本鎖RNAを構築できていないのが現状である。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Fire et. al, Nature, 391, 806-811 (1998)
【非特許文献2】Tuschl et. al., EMBO Journal, 20, 6877-6888 (2001)
【非特許文献3】J. Rossi et. al. Nature Biotech., 23, 222-226 (2005)
【非特許文献4】J. T. Marques et. al., Nature Biotech., 24, 559-565 (2005)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、ヌクレアーゼ耐性及び細胞内導入率が高く、優れたRNA干渉効果を奏し得る新規な二本鎖RNAを提供することを目的とする。また、本発明は、該新規な2本鎖RNAを含む医薬組成物を提供することを目的とする。また、本発明は、該新規な二本鎖RNAを細胞内に導入することにより標的とする遺伝子の発現を抑制するための標的遺伝子の発現抑制方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明者等は、上記課題を解決するため鋭意研究を重ねたところ、標的遺伝子中の標的配列に相補的な塩基配列を含むセンス鎖RNA、及び該センス鎖RNAに相補的な塩基配列を含むアンチセンス鎖RNAを有し、標的遺伝子の発現を抑制できる二本鎖RNAにおいて、該センス鎖RNAの5’末端側から1〜6番目のヌクレオチドの少なくとも1つに直接又はリンカーを介して脂質を結合させることによって、ヌクレアーゼ耐性及び細胞内導入率が高く、優れたRNA干渉効果を奏する2本鎖RNAを構築できることを見出した。本発明は、かかる知見に基づいて、更に改良を重ねることにより完成したものである。
【0013】
即ち、本発明は、下記に掲げる脂質修飾2本鎖RNA、該新規な2本鎖RNAを含む医薬組成物、及び標的遺伝子の発現抑制方法等を提供する。
項1. 標的遺伝子中の標的配列に相補的な塩基配列を有するセンス鎖RNA、及び該センス鎖RNAに相補的な塩基配列を有するアンチセンス鎖RNAを有し、且つ前記標的遺伝子の発現を抑制できる二本鎖RNAであって、該センス鎖RNAの5’末端から1〜6番目のヌクレオチドの少なくとも1つに直接又はリンカーを介して脂質が結合していることを特徴とする、脂質修飾2本鎖RNA。
項2. 前記センス鎖RNAの5’末端側が平滑末端であり、且つ前記センス鎖RNAの3’末端側が平滑末端又はダングリングエンドを有している、項1に記載の脂質修飾2本鎖RNA。
項3. 前記センス鎖RNAの5’末端側及び3’末端側が共にダングリングエンドを有している、項1に記載の脂質修飾2本鎖RNA。
項4. 前記センス鎖RNAを構成するヌクレオチドの数が21〜27である、項1乃至3のいずれかに記載の脂質修飾2本鎖RNA。
項5. 前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ27個のヌクレオチドから構成されている、項2に記載の脂質修飾2本鎖RNA。
項6. 前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ23個のヌクレオチドから構成されている、項2に記載の脂質修飾2本鎖RNA。
項7. 前記センス鎖RNAの5’末端側が平滑末端であり、前記センス鎖RNAが25個のヌクレオチドから構成され、且つ前記アンチセンス鎖が23個のヌクレオチドから構成されている、項2に記載の脂質修飾2本鎖RNA。
項8. 前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ21個のヌクレオチドから構成されている、項3に記載の脂質修飾2本鎖RNA。
項9. 前記脂質が、炭素数6〜50の脂肪酸である、項1乃至8のいずれかに記載の脂質修飾2本鎖RNA。
項10. 前記脂質が、ラウリン酸、ステアリン酸、ミリスチン酸、又はパルミチン酸である、項1乃至9のいずれかに記載の脂質修飾2本鎖RNA。
項11. 前記センス鎖RNAの5’末端から1〜6番目のヌクレオチドの少なくとも1つに、下記一般式(L-4)で表される構造のリンカーを介して脂質が結合している、項1乃至10のいずれかに記載の脂質修飾2本鎖RNA。
【0014】
【化1】

【0015】
[式中、n1は、1〜40の整数を示す。]
項12. 項1乃至10のいずれかに記載の脂質修飾2本鎖RNAと、薬学的に許容される基剤を含む、医薬組成物。
項13. 標的遺伝子の発現を抑制するための医薬を製造するための、項1乃至10のいずれかに記載の脂質修飾2本鎖RNAの使用。
項14. 項1乃至10のいずれかに記載の脂質修飾2本鎖RNAを細胞内に導入することにより、標的遺伝子の発現を抑制する、標的遺伝子の発現抑制方法。
【発明の効果】
【0016】
本発明の脂質修飾2本鎖RNAは、センス鎖RNAの5’末端側が脂質で修飾されており、これによって飛躍的にRNA干渉効果が向上している。特に、本発明の脂質修飾2本鎖RNAは、特定の部位に対して脂質が結合することにより、DicerによるプロセシングやRISCとの複合体を妨げることなく、しかもヌクレアーゼ耐性及び細胞内導入率が顕著に向上しているので、医薬用途への応用に大きく貢献できる。
【0017】
更に、本発明の脂質修飾2本鎖RNAは、単独でも優れた細胞内移行能を示すので、従来の遺伝子導入試薬を別途用いずに、或いは従来の遺伝子導入試薬の使用量を低減して、細胞内に導入することも可能である。故に、本発明の脂質修飾2本鎖RNAは、従来の遺伝子導入試薬の使用によって懸念される細胞毒性の発現を抑制でき、臨床的な応用において高い安全性が確保できる。
【0018】
このため、本発明の医薬組成物又は標的遺伝子の発現抑制方法によれば、より効果的に標的遺伝子の発現を抑制又は阻害することができる。
【図面の簡単な説明】
【0019】
【図1】実施例1で合成した未修飾及び脂質修飾2本鎖RNAの構造を示す図である。
【図2】実施例1において、脂質修飾1本鎖RNAのHPLC解析結果を示す図である。
【図3】実施例1において、5’末端を脂質修飾した2本鎖RNAのヌクレアーゼ耐性結果を示す図である。
【図4】実施例1において、それぞれの脂質修飾2本鎖RNAのDicerによるプロセシングを検討した結果を示す図である。
【図5】実施例1において、0.2 nM濃度のときの脂質修飾27nt dsRNAのRNA干渉効果の評価結果を示す図である。
【図6】実施例1において、5’末端を脂質修飾した2本鎖RNAのRNA干渉効果(遺伝子導入剤未使用)の評価結果を示す図である。
【図7−1】実施例1において、脂質修飾2本鎖RNAのHeLa及び A549細胞に対する細胞内導入性を評価した結果を示す図である。図中、FLには蛍光顕微鏡にて撮影した像、transは、上記FLと同一視野を位相差顕微鏡にて撮影した像、mergeは上記FLとtransを重ね合わせた像を示す。
【図7−2】実施例1において、脂質修飾2本鎖RNAのSH10-TC及びK562細胞に対する細胞内導入性を評価した結果を示す図である。図中、FLには蛍光顕微鏡にて撮影した像、transは、上記FLと同一視野を位相差顕微鏡にて撮影した像、mergeは上記FLとtransを重ね合わせた像を示す。
【図7−3】実施例1において、脂質修飾2本鎖RNAのJurkat及びHeLa細胞に対する細胞内導入性を評価した結果を示す図である。図中、FLには蛍光顕微鏡にて撮影した像、transは、上記FLと同一視野を位相差顕微鏡にて撮影した像、mergeは上記FLとtransを重ね合わせた像を示す。
【図8】実施例2で合成した未修飾及び脂質修飾2本鎖RNAの構造を示す図である。
【図9】実施例2において、それぞれの脂質修飾2本鎖RNAのDicerによるプロセシングを検討した結果を示す図である。
【図10−1】実施例2において、脂質修飾2本鎖RNAのHeLa細胞中のVEGF遺伝子に対するRNA干渉効果の結果を示す図である。
【図10−2】実施例2において、脂質修飾2本鎖RNAのA549及びSH10-TC細胞中のVEGF遺伝子に対するRNA干渉効果の結果を示す図である。
【図10−3】実施例2において、脂質修飾2本鎖RNAのJurkat及びK562細胞中のVEGF遺伝子に対するRNA干渉効果の結果を示す図である。
【発明を実施するための形態】
【0020】
本明細書において、「平滑末端」とは、2本鎖RNAの末端部分において、センス鎖の末端領域とそれに対合するアンチセンス鎖の末端領域が、1本鎖部分を形成することなく対合している構造のことである。また、「ダングリングエンド」とは、2本鎖RNAの末端部分のセンス鎖の末端領域又はそれに対合するアンチセンス鎖の末端領域において、対合する塩基が存在しないために二本鎖を形成できず、一本鎖が存在している塩基配列部分を意味する。
【0021】
本発明の脂質修飾2本鎖RNAは、標的遺伝子中の標的配列に相補的な塩基配列を有するセンス鎖RNAを含む。
【0022】
ここで、標的遺伝子とは、RNA干渉効果によって遺伝子発現の抑制対象となる遺伝子である。本発明の脂質修飾2本鎖RNAにおいて、標的対象遺伝子については、特に制限されず、該脂質修飾2本鎖RNAの用途に基づいて適宜選択することができる。
【0023】
標的遺伝子中の標的配列については、RNA干渉効果によって遺伝子発現を抑制可能な配列である限り特に制限されず、公知の方法で、具体的には、NCBIのBLASTサーチ等を用いて適宜決定することができる。例えば、標的遺伝子のコード領域(ORF)の開始コドンから50〜100塩基下流のエキソン部分にある塩基"AA"に続く19〜30塩基からなる領域であって、GC含有量が50%前後の領域を標的配列とすればよい。このような標的配列に対する相補鎖を採用することで、優れたRNA干渉効果を獲得することが、当業界で経験的に明らかにされている。また、例えば、上記標的配列は、IDT社(Integrated DNA Technologies, INC)のマニュアル(Dicer Substrate RNAi Design)に従って設定することが出来る。また最近では、(i)アンチセンス鎖RNAの5’末端がA/Uペアであり、(ii)センス鎖RNAの5’末端がG/Cペアであり、(iii)アンチセンス鎖RNAの5’末端側に5つ程度のA/Uペアがあり、且つ(vi)2本鎖中に9つ以上のG/Cペアが無い2本鎖RNAを設計することで高いRNA干渉効果をもつ2本鎖RNAをデザインできると報告されている(Ui-Tei et. al, Nucleic Acids Res., 32, 936-948 (2004))。
【0024】
本発明の脂質修飾2本鎖RNAにおいて、センス鎖にダングリングエンドが存在しない場合、該センス鎖は標的配列に相補的な塩基配列からなるものである。また、ダングリングエンドがセンス鎖の5'末端及び/又は3'末端に存在している場合、該センス鎖は、標的配列に相補的な塩基配列の5'末端及び/又は3'末端に、ダングリングエンドを構成する塩基配列が連結した塩基配列からなるものである。
【0025】
本発明の脂質修飾2本鎖RNAにおいて、前記センス鎖RNAを構成するヌクレオチドの数についてはRNA干渉効果を奏し得る限り特に制限されず、該2本鎖RNAに備えさせる構造等に応じて適宜設定されるが、通常21〜27個、好ましくは21、23、25、又は27個、更に好ましくは21、23又は27個が挙げられる。なお、ここでいうセンス鎖RNAを構成するヌクレオチドの数とは、該センス鎖にダングリングエンドが存在していない場合には標的配列に相補的な塩基配列を構成するヌクレオチドの総数を意味し、該センス鎖にダングリングエンドが存在している場合には該ダングリングエンドを構成するヌクレオチドの数と標的配列に相補的な塩基配列を構成するヌクレオチドの数の総和を意味する。また、本発明の脂質修飾2本鎖RNAは、前記センス鎖に相補的な塩基配列を含むアンチセンス鎖を有する。
【0026】
本発明の脂質修飾2本鎖RNAにおいて、アンチセンス鎖にダングリングエンドが存在しない場合、該アンチセンス鎖は、前記センス鎖の「標的配列に相補的な塩基配列」の一部又は全部に対して相補的である塩基配列からなるものである。また、ダングリングエンドがアンチセンス鎖の5'末端及び/又は3'末端に存在している場合、該アンチセンス鎖は、前記センス鎖の「標的配列に相補的な塩基配列」の一部又は全部に対して相補的である塩基配列の5'末端及び/又は3'末端に、ダングリングエンドを構成する塩基配列が連結した塩基配列からなるものである。本発明の脂質修飾2本鎖RNAにおいて、前記アンチセンス鎖RNAを構成するヌクレオチドの数についてはRNA干渉効果を奏し得る限り特に制限されず、該2本鎖RNAに備えさせる2本鎖RNA構造等に応じて適宜設定されるが、通常21〜27個、好ましくは21、23、25、又は27個、更に好ましくは21、23、又は27個が挙げられる。なお、ここでいうアンチセンス鎖RNAを構成するヌクレオチドの数とは、該アンチセンス鎖にダングリングエンドが存在していない場合には標的配列に相補的な塩基配列を構成するヌクレオチドの総数を意味し、該アンチセンス鎖にダングリングエンドが存在している場合には該ダングリングエンドを構成するヌクレオチドの数と標的配列に相補的な塩基配列を構成するヌクレオチドの数の総和を意味する。
【0027】
本発明の脂質修飾2本鎖RNAにおいて、前記センス鎖RNAと前記アンチセンス鎖RNAを構成するヌクレオチドは、基本的にはリボヌクレオチドであるが、分解酵素耐性の向上を目的として2’−O−メチル修飾型や2’−F修飾型、LNA(Locked Nucleic Acid)等の各種化学修飾型ヌクレオチド、或いはデオキシリボヌクレオチド等をRNA配列中に含んでいてもよい。特に、本発明の脂質修飾2本鎖RNAがダングリングエンドを有する構造の場合には、前記センス鎖RNA及び/又は前記アンチセンス鎖RNAにおける当該ダングリングエンドの構成部分は、デオキシリボヌクレオチドで構成されていてもよい。このような化学修飾型ヌクレオチドとしては、具体的には、ホスホロチオエート型、ボラノフォスフェート型DNA/RNA等のリン酸骨格を修飾したもの;2’−0Me修飾RNA、2’−F修飾RNA等の2’修飾ヌクレオチド;LNA(Locked Nucleic Acid)やENA(2'-O,4'-C-Ethylene-bridged nucleic acids)等のヌクレオチドの糖分子を架橋した修飾ヌクレオチド;PNA(ペプチド核酸)、モリフォリノヌクレオチド等の基本骨格が異なる修飾ヌクレオチド;5−フルオロウリジンや5−プロピルウリジンなどといった塩基修飾型ヌクレオチド等が例示される。
【0028】
本発明の脂質修飾2本鎖RNAにおいて、前記センス鎖RNAと前記アンチセンス鎖RNAがハイブリダイズして2本鎖を形成している限り、その構造については特に制限されないが、好ましい構造として、(A)前記センス鎖RNAの5'末端側が平滑末端(ブランドエンド)であり、且つ前記センス鎖RNAの3'末端側が平滑末端又はダングリングエンド(一本鎖領域)を有している構造、並びに(B)前記センス鎖RNAの5'末端側及び3'末端側の双方にダングリングエンドを有している構造が例示される。ここで、センス鎖RNAの3'末端側にダングリングエンドを有する構造には、センス鎖の3'末端領域がダングリングエンドを構成している場合と、アンチセンス鎖の5'末端領域がダングリングエンドを構成している場合が含まれる。また、センス鎖RNAの5'末端側にダングリングエンドを有する構造には、センス鎖の5'末端領域がダングリングエンドを構成している場合と、アンチセンス鎖の3'末端領域がダングリングエンドを構成していている場合が含まれる。
【0029】
本発明の脂質修飾2本鎖RNAを構成する2本鎖RNAの内、一層優れたRNA干渉効果を発現させるという観点から、特に好ましい構造として、上記(A)の構造に含まれるものとして以下の(A-1)〜(A-3)の構造が例示され、上記(B)の構造に含まれるものとして以下の(B-1)の構造が例示される:(A-1)前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、該センス鎖RNA及び該アンチセンス鎖がそれぞれ27個のヌクレオチドから構成されている構造;(A-2)前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、該センス鎖RNA及び該アンチセンス鎖がそれぞれ23個のヌクレオチドから構成されている構造;(A-3)前記センス鎖RNAの5’末端側が平滑末端であり、該センス鎖RNAが25個のヌクレオチドから構成され、且つ前記アンチセンス鎖が23個のヌクレオチドから構成されている構造;(B-1)前記センス鎖RNAの3'末端及び前記アンチセンス鎖の3'末端の双方に2個のヌクレオチドからなるダングリングエンドがそれぞれ形成されており、該センス鎖RNA及び該アンチセンス鎖がそれぞれ21個のヌクレオチドから構成されている構造。
【0030】
即ち、上記(A-1)及び(A-2)の構造は、センス鎖RNAとアンチセンス鎖RNAが、両末端にダングリングエンドを形成させることなく、ハイブリダイズしている構造である。また、上記(A-3)の構造は、センス鎖RNAの5’末端側が平滑末端であり、且つセンス鎖RNAの3’末端から1〜2番目のヌクレオチドがダングリングエンドを形成するように、センス鎖RNAとアンチセンス鎖RNAがハイブリダイズしている構造である。また、上記(B-1)の構造は、センス鎖の5'末端から1〜19番目のヌクレオチドとアンチセンス鎖の3'末端から3〜21番目のヌクレオチドがハイブリダイズしており、センス鎖の3'末端から1〜2番目のヌクレオチドとアンチセンス鎖の3'末端から1〜2番目のヌクレオチドがぞれぞれダングリングエンドを形成している構造である。
【0031】
本発明の脂質修飾2本鎖RNAは、上記センス鎖RNAの5'末端側から1〜6番目のヌクレオチドの少なくとも1つに脂質が結合している。本発明の脂質修飾2本鎖RNAは、上記センス鎖RNAの5'末端側以外の部位には、他の置換基は結合していない。即ち、上記センス鎖RNAの5'末端側以外の部分、及びアンチセンス鎖RNA部分は他の置換基によって置換されておらず、ヌクレオチドのみから構成される。このように、上記センス鎖RNAの5'末端側にのみ脂質が結合していることによって、細胞内導入率を高め、且つ格段に優れたRNA干渉効果を発現させることが可能になる。
【0032】
本発明の脂質修飾2本鎖RNAにおいて、上記センス鎖RNAに結合している脂質としては、特に制限されないが、例えば、単純脂質(脂肪酸と各種アルコールとのエステル);リン脂質、糖脂質等の複合脂質;脂肪酸、高級アルコール、脂溶性ビタミン、ステロイド、炭化水素等の誘導脂質等が例示される。これらの中で、細胞内導入率及びRNA干渉効果の向上という観点から、好ましくは誘導脂質、更に好ましくは炭素数6〜50の脂肪酸、特に好ましくは炭素数が10〜22の脂肪酸、より好ましくは炭素数12〜18の脂肪酸、特に好ましくは、ラウリン酸、ステアリン酸、ミリスチン酸、及びパルミチン酸、更に特に好ましくはパルミチン酸である。
【0033】
本発明の脂質修飾2本鎖RNAにおいて、上記脂質と上記センス鎖の結合様式については特に制限されず、これらが直接結合していてもよく、またこれらがリンカーを介して結合していてもよい。但し、本発明において、上記脂質と上記センス鎖とを連結するリンカーには、核酸から構成されるものは含まれない。ここで、リンカーとしては、上記脂質と上記センス鎖とを連結可能な限り、特に制限されないが、具体的には、上記リンカーとして、下記の構造のものが例示される。
【0034】
【化2】

【0035】
上記一般式(L-4)〜(L-21)、において、n1は、1〜40の整数、好ましくは2〜20の整数、更に好ましくは2〜12の整数を示す。
【0036】
また、上記一般式(L-22)及び(L-23)、において、n2は、1〜20の整数、好ましくは1〜10の整数、更に好ましくは1〜6の整数を示す。
【0037】
上記一般式(L-4)〜(L-23)に示すリンカーは、その右側又は左側のいずれにセンス鎖RNAが結合していてもよい。好ましくは上記一般式(L-4)〜(L-23)に示すリンカーの右側に上記センス鎖RNA(又は核酸コンジュゲートの場合は核酸)の所定の部位が結合し、該リンカーの左側に脂質が結合するように構成されているものである。
【0038】
また、上記脂質における上記リンカーの結合部位については、脂質の種類やリンカーの種類に応じて適宜設定されるが、例えば、脂質として脂肪酸を使用する場合であれば、脂肪酸のカルボキシル基が、上記リンカーと、エステル結合やアミド結合等を形成することによって連結されていればよい。より具体的には、脂質として脂肪酸を使用する場合、上記リンカーが、脂肪酸のカルボキシル基部分の−OHと置換されて結合していることが好ましい。
【0039】
上記リンカーは、連結させる脂質の種類に応じて適宜選択されるが、例えば、脂質として脂肪酸を使用する場合であれば、上記リンカーとしては、一般式(L-4)のリンカーが好適である。
【0040】
また、上記リンカー以外にも、例えば、N-スクシニミジル=3-(2-ピリジルジチオ)プロピナート、N-4-マレイミド酪酸、S-(2-ピリジルジチオ)システアミン、ヨードアセトキシスクシンイミド、N-(4-マレイミドブチリルオキシ)スクシンイミド、N-[5-(3’-マレイミドプロピルアミド)−1−カルボキシペンチル]イミノジアセティクアシッド、N-(5-アミノペンチル)-イミノジアセテックアシッド等の二官能性リンカー(官能基を2つ含むリンカー)を使用することもできる。上記センス鎖RNAにおいて、脂質又は脂質を連結するリンカーの結合対象となるヌクレオチドは、上記センス鎖RNAの5'末端側から1〜6番目のヌクレオチドであれば特に制限されないが、好ましくは5'末端側から1〜4番目のヌクレオチド、更に好ましくは5'末端側から1及び/又は2番目のヌクレオチド、特に好ましくは5'末端(5'末端側から1番目)のヌクレオチドである。
【0041】
また、上記センス鎖RNAにおける、脂質又は脂質を連結するリンカーの結合部位については、特に限定されるものではないが、脂質又は脂質を連結したリンカーが、上記センス鎖RNAの所定のヌクレオチドのリン酸部分の水酸基を構成する水素原子と置換されて結合していることが好ましい。
【0042】
本発明の脂質修飾2本鎖RNAに結合した脂質の数としては、特に制限されないが、例えば1〜3個、好ましくは1又は2個、更に好ましくは1個が例示される。
【0043】
本発明の脂質修飾2本鎖RNAは、脂質が連結された上記センス鎖RNA、及び上記アンチセンス鎖RNAをそれぞれ合成し、これらのセンス鎖RNA及びアンチセンス鎖RNAを公知の方法に従ってハイブリダイズさせることにより、製造される。また、脂質が連結された上記センス鎖RNAについても、公知の合成技術を用いて製造することができる。
【0044】
本発明の修飾型2本鎖RNAは、細胞内に導入されることにより、標的遺伝子の発現を抑制又は阻害することができるので、標的遺伝子の発現抑制又は発現阻害を目的とした医薬や遺伝子治療用の組成物として、すなわち医薬組成物として使用できる。本発明の医薬組成物は、各種の剤形に調製され得る。本発明の医薬組成物の剤形としては、例えば、液剤(シロップ等を含む)、点滴剤、注射剤等の液状製剤;錠剤、丸剤、散剤、顆粒剤、カプセル剤(ソフトカプセルを含む)等の固形製剤が挙げられる。本発明の医薬組成物が液状製剤である場合は、凍結保存することもでき、また凍結乾燥等により水分を除去して保存してもよい。凍結乾燥製剤やドライシロップ等は、使用時に注射用蒸留水、滅菌水等を加え、溶解して使用される。また、本発明の医薬組成物が固形製剤である場合は、使用時に注射用蒸留水、滅菌水等を加え、溶解して使用してもよい。
【0045】
該医薬組成物は、脂質修飾2本鎖RNA自体であってもよいが、必要に応じて、更に薬学的に許容される基剤が含有されていてもよい。基剤としては、本発明の修飾型2本鎖RNAの標的遺伝子発現抑制効果を妨げない限り制限されず、剤形に応じて適宜選択される。例えば、基剤としては、精製水、糖水溶液、緩衝液、生理食塩水、高分子水溶液、RNase free水等が挙げられる。本発明の医薬組成物に基剤が含まれている場合、これらの配合割合も本発明の修飾型2本鎖RNAの標的遺伝子発現抑制及び/又は阻害効果を妨げない限り制限されず、剤形に応じて適宜設定される。
【0046】
例えば、本発明の医薬組成物には、修飾型2本鎖RNAが組成物あたり、0.001〜50、好ましくは0.01〜10、更に好ましくは0.1〜1とすることができる。また、本発明の医薬組成物には、医薬組成物あたり基剤50〜99.999重量%、好ましくは90〜99.99重量%、更に好ましくは99〜99.9重量%とすることができる。
【0047】
本発明の医薬組成物が適用される標的遺伝子や疾患は特に限定されず、標的遺伝子と疾患の関係については公知である。また、本発明の医薬組成物が適用される細胞の種類も限定されず、ヒト由来の細胞であってもよくヒト以外の動物由来の細胞であってもよい。また、本発明の医薬組成物は、in vitroで適用されてもよくin vivoで適用されてもよい。
【0048】
本発明の脂質修飾2本鎖RNAの細胞内への導入量や方法は、従来siRNAの場合と同様である。例えば、本発明の医薬組成物を適用して、前述の脂質修飾2本鎖RNAをin vitroで細胞内に導入させようとする場合、適当量の医薬組成物の存在下で細胞を培養する方法が例示される。また、医薬組成物を適用して、前述の脂質修飾2本鎖RNAをin vitroで培養細胞や生体から抽出した細胞に導入させようとする場合には、血清の存在下で導入させることもできる。また、本発明の医薬組成物を適用して、前述の脂質修飾2本鎖RNAをin vivoで細胞内に導入させようとする場合には、該医薬組成物の組織への直接注入;静脈、皮下、筋肉、腹腔、眼内、消化器官内、歯内等への注射;鼻腔、口腔、肺等への吸入投与;経口投与;皮膚を介した経皮投与;及び口腔粘膜、膣粘膜、眼粘膜、直腸粘膜、子宮粘膜を介した経粘膜投与等が例示される。
【0049】
本発明の医薬組成物を適用するにあったっては、siRNAの細胞内への導入に使用されている従来の遺伝子導入試薬を併用してもよく、また併用しなくてもよい。また、本発明の医薬組成物には、更に遺伝子導入試薬が含まれていてもよい。なお、本発明の脂質修飾2本鎖RNAは、単独でも優れた細胞内移行能を示すので、siRNAの細胞内への導入に使用されている従来の遺伝子導入試薬を用いずに、或いは従来の遺伝子導入試薬の使用量を低減して、細胞内に導入することも可能である。
【0050】
本発明の医薬組成物を適用する場合、その有効量を適用すればよいが、例えば、1細胞あたり、脂質修飾2本鎖RNAを0.001〜10pM、好ましくは0.001〜1pM、更に好ましくは0.01〜0.1pM適用される。
【0051】
このような本発明の医薬組成物によれば、標的遺伝子の発現を抑制又は阻害することにより該標的遺伝子の発現に起因する疾患を予防、軽減又は治療することができる。
【0052】
本発明はまた、標的遺伝子の発現抑制方法を提供するものである。本発明の標的遺伝子の発現抑制方法は、前記脂質修飾2本鎖RNAを細胞内に導入させる工程を含む。
【0053】
ここで、標的遺伝子や疾患は特に限定されず、前述したように標的遺伝子と疾患の関係については公知である。また、本発明の修飾型2本鎖RNAが導入される細胞の種類も限定されず、ヒト由来の細胞であってもよくヒト以外の動物由来の細胞であってもよい。また、本発明における修飾型2本鎖RNAの細胞への導入は、in vitroで行われてもよくin vivoで行われてもよい。
【0054】
また、本発明の標的遺伝子の発現抑制方法において、本発明の脂質修飾2本鎖RNAの細胞内への導入量や方法も、従来siRNAの場合と同様であり、適宜設定される。例えば、本発明の標的遺伝子の発現抑制方法において、本発明の脂質修飾2本鎖RNAをin vitroで細胞内に導入させようとする場合、適当量の脂質修飾2本鎖RNAの存在下で細胞を培養する工程を使用できる。また、本発明の標的遺伝子の発現抑制方法において、培養細胞や生体から抽出した細胞に本発明の脂質修飾2本鎖RNAをin vitroで導入させようとする場合には、血清の存在下で導入させる工程を使用できる。また、本発明の標的遺伝子の発現抑制方法において、本発明の脂質修飾2本鎖RNAをin vivoで細胞内に導入させようとする場合には、本発明の脂質修飾2本鎖RNAの組織への直接注入;静脈、皮下、筋肉、腹腔、眼内、消化器官内、歯内等への注射;鼻腔、口腔、肺等への吸入投与;経口投与;皮膚を介した経皮投与;及び口腔粘膜、膣粘膜、眼粘膜、直腸粘膜、子宮粘膜を介した経粘膜投与等の工程を使用できる。また、本発明の脂質修飾2本鎖RNAを細胞内に導入するにあたり、有効量の脂質修飾2本鎖RNAを細胞に接触させればよいが、その投与量は、例えば、1細胞あたり、脂質修飾2本鎖RNAを0.001〜10pM、好ましくは0.001〜1pM、更に好ましくは0.01〜0.1pMとできる。
【0055】
なお、本発明の脂質修飾2本鎖RNAは、単独でも優れた細胞内移行能を示すので、従来の遺伝子導入試薬を用いずに、或いは従来の遺伝子導入試薬の使用量を低減して、細胞内に導入することも可能である。
【0056】
このような本発明の標的遺伝子の発現抑制方法によれば、標的遺伝子の発現を抑制又は阻害することにより該標的遺伝子の発現に起因する疾患を予防、軽減又は治療することができる。
【実施例】
【0057】
以下に、実施例に基づいて本発明を詳細に説明するが、本発明はこれらによって限定されるものではない。
実施例1 5’脂質修飾2本鎖RNAのルシフェラーゼ遺伝子発現阻害効果
1.ルシフェラーゼ遺伝子をターゲットとした脂質修飾2本鎖RNAの合成
1−1.センス鎖RNA及びアンチセンス鎖RNAの配列
ウミシイタケルシフェラーゼと相同配列を持ち、ウミシイタケルシフェラーゼの遺伝子発現を抑制できる21〜27塩基長のセンス鎖RNAと21〜27塩基長のアンチセンス鎖RNAの2本鎖RNAをデザインした。該二本鎖RNAはアンチセンス鎖とセンス鎖の組み合わせにより様々な形態の二本鎖を形成できる。該2本鎖RNAにおいて、ダングリングエンド(一本鎖領域)を持たない完全2本鎖RNA(センス鎖RNAの5’末端側及び3’末端側が共に平滑末端である2本鎖RNA)をDS (double strand) RNA;二本鎖RNAの両末端にダングリングエンド(オーバーハング)を持つ2本鎖RNAをSi RNA;センス鎖の5’末端を左側に示したときに右側のみにダングリングエンドを持つ2本鎖RNAをRO (Right Overhang) RNA、と名付けた。また、各種2本鎖RNAの命名はセンス鎖をA(A1又はA2)、アンチセンス鎖をBとし、センス鎖及びアンチセンス鎖となる1本鎖RNAの塩基の数を記載することにより区別している。また、センス鎖は2種類のものをデザインしたので区別のためにA1及びA2としている。また、センス鎖の5’末端を脂質で修飾したものについてはセンス鎖RNA名の次にCx(x=16又は12)と記載している。使用したRNAの配列は、以下の通りである。
<センス鎖>
27nt 27A1:5’-CUGGCCUUUCACUACUCCUACGAGCAC-3’(配列番号1)
25nt 25A1:5’-CUGGCCUUUCACUACUCCUACGAGC-3’(配列番号2)
23nt 23A1:5’-CUGGCCUUUCACUACUCCUACGA-3’(配列番号3)
21nt 21A1:5’-CUGGCCUUUCACUACUCCUAC-3’(配列番号4)
21nt 21A2:5’-GGCCUUUCACUACUCCUACGA-3’(配列番号5)
<アンチセンス鎖>
27nt 27B:5’-GUGCUCGUAGGAGUAGUGAAAGGCCAG-3’(配列番号6)
25nt 27B:5’-GCUCGUAGGAGUAGUGAAAGGCCAG -3’(配列番号7)
23nt 27B:5’-UCGUAGGAGUAGUGAAAGGCCAG-3’(配列番号8)
21nt 27B:5’-GUAGGAGUAGUGAAAGGCCAG-3’(配列番号9)
1−2.ルシフェラーゼ遺伝子をターゲットとした脂質未修飾2本鎖RNAの合成
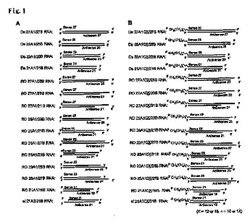
これら上記センス鎖RNA及びアンチセンス鎖を用いて様々な2本鎖RNAを作成した。2本鎖RNAの作成は、universal buffer(林化成株式会社)中、同モルのセンス鎖及びアンチセンス鎖RNAを混合し、92℃で2分間加熱した後、4℃まで徐々に温度を下げることで作成した。合成した各種2本鎖RNAは、20% ポリアクリルアミドゲルを用い、250Vの条件化で60分間電気泳動し、その後、銀染色キット(GEヘルスケア バイオサイエンス)で2本鎖RNAを染色することにより確認した。未修飾の2本鎖RNAの構造を図1Aに示す。
【0058】
1−3.ルシフェラーゼ遺伝子をターゲットとした脂質修飾2本鎖RNAの合成
ルシフェラーゼ遺伝子の発現を抑制できる2本鎖RNAのセンス鎖の5’末端に脂質を結合させた脂質修飾センス鎖RNAを合成した。当該脂質修飾センス鎖RNAにおいて、脂質は上記センス鎖RNAの5’末端に連結されているアミノアルキル基(Amino Modifier C6; Glen Research)を介して共有結合で結合している。脂質修飾センス鎖RNAは、活性エステル基もつ脂質化合物(以下、活性エステル化脂質化合物と表記する)と5’末端をアミノ化修飾したセンス鎖RNAとを液相中で反応させることで合成した(反応式1、2)。
【0059】
【化3】

【0060】
具体的な合成法を以下に示す。センス鎖RNAの5’末端をアミノ化するために、RNA固相合成上で5’-Amino-Modifier C6 (Glen Research)を用いて通常の方法(ホスホロアミダイト合成法)を実施すればよく、これによって、5’末端アミノアルキル基修飾センス鎖RNA(21塩基長)が合成できる。なお、上記5’末端アミノアルキル基修飾センス鎖RNAはHPLC精製、MALDI-TOF MS解析済みのものを林化成株式会社より購入した。合成された5’末端アミノアルキル基修飾センス鎖RNAは、該末端(5’末端側から1番目のヌクレオチドのリン酸残基)に−(CH2)6−NH2が結合されている。合成した1本鎖RNAは、UVスペクトル検出器を用い、260nmの吸光度を測定することにより濃度を算出した。このアミノアルキル基修飾1本鎖RNAと、DMF(N,N-ジメチルホルムアミド)に溶解した活性エステル化脂質化合物[Palmitic acid N-hydroxy succinimide easter(シグマ−アルドリッチ社)、又はラウリン酸-4-ニトロフェニルエステル(TCI)]と、縮合反応条件下で混合して、脂質修飾センス鎖RNAを合成した。反応後、脂質修飾センス鎖RNAが含まれる反応液中の不要な試薬を取り除くため、反応液をHPLCで精製した。HPLC精製は、緩衝液としてA:100% 20mM TEAA(pH 7.0), B:70% CH3CN/20mM TEAA (pH 7.0)を用い、10% B緩衝液から100% B緩衝液を50分のリニアーグラジェントになるよう設定し精製を行った。また、精製用カラムはCAP CELL (4.6 x 150 mm, 5μm;SHISEIDO)を使用した。HPLC解析結果の一例を図2に示す。HPLCにおいて精製された脂質修飾センス鎖RNAは凍結乾燥し、精製水に溶解させた後、UVスペクトル解析により濃度及び合成収率を算出した。
【0061】
以下に脂質修飾センス鎖RNAの構造モデル及び収率を示す。
【0062】
【化4】

【0063】
合成した脂質修飾センス鎖RNAは、アンチセンスRNAと2本鎖を形成させ、脂質修飾2本鎖RNAを得た。2本鎖RNAの形成は、上記と同様の方法で行い、20% ポリアクリルアミドゲル電気泳動により確認した。脂質修飾2本鎖RNAの構造を図1Bに示す。図1Bにおいて、Xはパルミチン酸誘導体を結合させたときはX=16、ラウリン酸誘導体を結合させたときはX=12となる。
【0064】
2.脂質修飾2本鎖RNAの分解酵素耐性
脂質修飾27nt dsRNA(Ds 27A1C16/27B)のヌクレアーゼ耐性を検討した。まず、最終濃度が2 μMになるよう調整したセンス鎖5’-末端脂質修飾27nt dsRNAを10%FBS(三光純薬株式会社)を含むRPMI-1640培地(インビトロジェン)中 (最終量110μl)、37℃でインキュベートし、0h、0.5h、1h、2h、4h、6h、8h、12h、24h、48h後にそれぞれ10μl取り、2μlのローディングダイを含むサンプルチューブに添加した。次いで、分解反応を停止させる為、サンプル採取後すばやく液体窒素中にて凍結し、−20℃にて保存した。得られた産物を20% ポリアクリルアミドゲルを用い250Vで70分間サンプルを電気泳動した。その後、銀染色キット(GEヘルスケア バイオサイエンス)で産物を染色し(染色条件は製品マニュアル参照)、ChemiImager 4000(Alpha Innotech corporation)でゲル解析を行った。また比較として一般に広く使用されている21塩基長からなる21siRNA(si 21A2/21B)及び未修飾27nt dsRNA(Ds 27A1/27B)のヌクレアーゼ耐性結果も同様に評価した。ゲル電気泳動の結果を図3に示す。
【0065】
その結果、21siRNAは血清を含む培地中において速やかに分解されており、1〜2時間程度で21siRNAの消失が確認された。一方、未修飾27nt dsRNA及び脂質修飾27nt dsRNAは、21siRNAに比べ非常に高いヌクレアーゼ耐性を示し、48時間後においても2本鎖RNAは生存していた。この結果から、脂質修飾2本鎖RNAは一般に広く使用されている21siRNAに比べ格段に高い生体内安定性を保有しているという新たな知見が得られた。
【0066】
3.ルシフェラーゼ遺伝子をターゲットとした脂質修飾2本鎖RNAのDicerによるプロセシング
合成した2本鎖RNA及び脂質修飾2本鎖RNAのリコンビナントDicerによるプロセシングを検討した。Dicerによる切断実験は、20mM Tris-HCl(pH 8.0), 15 mM NaCl, 2.5mM Mg2Cl溶液中、0.5 UのリコンビナントDicer(Gene Therapy Systems)と最終濃度2 μMになるよう調整した未修飾2本鎖RNA及び脂質修飾2本鎖RNAをサンプルチューブに10μl準備し、37℃に設定したインキュベーター中、12時間インキュベートした。その後、Dicerによる切断反応を停止させる為に、2μlのDicer Stop Solution (Gene Therapy Systems)を反応溶液に加え、更に2μlのローディングダイを加えた。得られた産物を20% ポリアクリルアミドゲルを用い250Vで70分間サンプルを電気泳動した。その後、銀染色キット(GEヘルスケア バイオサイエンス)で産物を染色し(染色条件は製品マニュアル参照)、ChemiImager4000(Alpha Innotech corporation)でゲル解析を行った。また、コントロールとして未修飾の21siRNA(si 21A2/21B)もゲル電気泳動にて解析した。その結果を図4に示す。
【0067】
得られた結果から、Ds RNA (Ds 27A1/27B、Ds 25A1/25B、Ds 23A1/23B、Ds 21A1/21B)のセンス鎖RNAを脂質で修飾した2本鎖RNAにおいて、Ds 27A1C16/27B及びDs 27A1C12/27BはリコンビナントDicerの働きにより、未修飾21 siRNAと同様の位置にバンドが確認され、Dicerの切断によって2塩基のダングリングエンドを含む21塩基長のsiRNAが生成していることが強く示唆された。また、Ds 25A1C16/25B及びDs 23A1C16/23BにおいてもDicer存在下において21siRNAと同様の位置に新たなバンドが確認され、Dicerによるプロセシングを受けていることが明らかとなった。一方、Ds 21A1C16/21B においてはDicer存在下においても顕著な変化は観察されず、Dicerによるプロセシングを受けていないことが明らかとなった。
【0068】
また、センス鎖RNAの3’末端に2塩基のダングリングエンドを持つRO RNA (RO 27A1/25B、RO 25A1/23B、RO 23A1/21B、RO 21A1/19B)のセンス鎖を脂質で修飾した2本鎖RNAにおいて同様にDicerによるプロセシングを検討した結果、RO 27A1C16/25B、RO 25A1C16/23B、RO 23A1C16/21Bの3種でDicer存在下において21siRNAと同位置に新たなバンドが確認され、Dicerによるプロセシングが行われていることが明らかとなった。特に、RO 27A1C16/25B及びRO 25A1C16/23BはDcierによる顕著なプロセシング効果が確認された。一方、比較的短いRO 21A1C16/19Bにおいては、Dicer存在下においても2本鎖RNAに変化が観測されず、Dicerによるプロセシングを受けていないことが示唆された。
【0069】
更に、センス鎖RNAの3’末端に4塩基のダングリングエンドを持つRO RNA(RO 27A1/23B、RO 25A1/21B)、6塩基のダングリングエンドを持つRO RNA (RO 27A1/21B)のセンス鎖RNAを脂質で修飾した2本鎖RNAについても同様にDicerによるプロセシングを検討した。その結果、上記のRO RNAにおいて全てDicerによるプロセシングを受け21nt siRNAと同位置に新たなバンドが確認された。
【0070】
そして更に、アンチセンス鎖RNAの5’末端にダングリングエンドを持つRO RNA(RO 25A1/27B、RO 23A1/25B、RO 23A1/27B)のセンス鎖を脂質で修飾した2本鎖RNAについても同様にDicerによるプロセシングを検討した。その結果、アンチセンス鎖の5’末端にダングリングエンドを持つ脂質修飾RO RNAは、その一部はDicerによるプロセシングを受け新たなバンドが確認されたが、同時にDicer非存在下時と同様の位置にバンドが確認され、Dicerによるプロセシング速度がDs RNAやその他のRO RNAに比べ遅いということが明らかとなった。
【0071】
4.脂質修飾2本鎖RNAのルシフェラーゼ遺伝子発現抑制
合成した未修飾2本鎖RNA及び脂質修飾2本鎖RNAのRNA干渉効果はウミシイタケルシフェラーゼをターゲットとして評価した。実験前に1x105cell/mlに調整したHeLa細胞(ヒト子宮頸ガン細胞、東北大学加齢医学研究所)を96wellプレート上にそれぞれ100μl撒き、37℃で一晩インキュベートした。翌日、ウェル上の古い培地を取り除き、抗生物質を含まない新しい培地をウェルにそれぞれ80 μl加え、ホタル及びウミシイタケルシフェラーゼを発現するベクター(psiCHECKTM-2 Vector: プロメガ)とLipofectamineTM 2000 (商品名、インビトロジェン)の複合溶液を10μlずつHeLa細胞が入ったそれぞれのウェルに加えた。ここで発現ベクターは1ウェルあたり0.02μgになるように、またLipofectamineTM 2000は1ウェルあたり0.2μlになるよう設定し、OptiMem(インビトロジェン)で必要量を調整した。また、複合体を形成させる為に、発現ベクターとLipofectamineTM 2000をOptiMemを用いて混合した後、室温で30分間インキュベートした。複合溶液を加えた後、細胞を5% CO2 存在下、37℃で4時間インキュベートした。その後、ウミシイタケルシフェラーゼの遺伝配列と相同的なアンチセンス配列を含む未修飾の2本鎖RNA及び末端脂質修飾2本鎖RNA を最終濃度が0nM, 0.2nM, 0.5nM, 1nM, 2nM, 5nM, 10nMになるようLipofectamineTM 2000 (インビトロジェン)と複合体を形成させ、10μlの複合体溶液を発現ベクターを導入したHeLa細胞に加えた。ここで、1ウェルあたりの最終量は100 μlとなる。RNAとLipofectamineTM 2000の複合溶液は、1ウェルあたり5 μlのRNA水溶液と5 μlのLipofectamineTM 2000 (0.2μl)及びOptiMemの溶液を混合し、30分間室温でインキュベートすることにより作成した。RNAを導入させた後、48時間インキュベートしDula-GloTM Luciferase Assay System(プロメガ)を用いてホタル及びウミシイタケルシフェラーゼの発現量をルミノメーター(MicroLumat LB96p: BERTHOLD)で測定し、ホタルルシフェラーゼの発現量をコントロールとしてウミシイタケルシフェラーゼの発現抑制効果を算出した。
【0072】
図5に未修飾2本鎖RNA及び脂質修飾2本鎖RNAの濃度が0.2 nMのときの遺伝子発現抑制効果を示す。その結果、DS RNAやRO RNAのようなセンス鎖RNAの5’末端側が平滑末端である2本鎖RNAに脂質を修飾することにより、脂質が修飾されていない同様の構造の2本鎖RNAに比べ飛躍的なRNA干渉効果の向上が観察された。また、その効果はRO RNAにおけるダングリングエンドの鎖長や位置に関係なく、センス鎖の5’末端を脂質修飾することにより修飾していない同じ構造をもつRO RNAに比べ高いRNA干渉効果が得られた。この結果より、DS RNAやRO RNAといったセンス鎖の5’末端側が平滑末端となっているRNA干渉分子のセンス鎖の5’末端に、脂質修飾を施すことにより飛躍的にRNA干渉効果が向上するという新たな知見が得られた。また、21nt siRNAのセンス鎖の5’末端に脂質を修飾したsi 21A2C16/21B及びsi 21A2C12/21Bについても、未修飾の21nt siRNAに比べ高いRNA干渉効果を奏することが確認された。
【0073】
5.ルシフェラーゼ遺伝子をターゲットとした脂質修飾2本鎖RNAのRNA干渉効果 (遺伝子導入剤なし)
次に、LipofectamineTM 2000等の遺伝子導入剤と使用せず、脂質修飾2本鎖RNA単独で細胞内に導入し、かつ、RNA干渉効果を示すか検討した。
【0074】
実験前に1x105cell/mlに調整したHeLa細胞(ヒト子宮頸ガン細胞、東北大学加齢医学研究所)を96wellプレート上にそれぞれ100μl撒き、37℃で一晩インキュベートした。翌日、ウェル上の古い培地を取り除き、抗生物質を含まない新しい培地をウェルにそれぞれ80μl加え、ホタル及びウミシイタケルシフェラーゼを発現するベクター(psiCHECKTM-2Vector: プロメガ)とLipofectamineTM 2000 (商品名、インビトロジェン)の複合溶液を10μlずつHeLa細胞が入ったそれぞれのウェルに加えた。ここで発現ベクターは1ウェルあたり0.02μgになるように、またLipofectamineTM 2000は1ウェルあたり0.2μlになるよう設定し、OptiMem(インビトロジェン)で必要量を調整した。また、複合体を形成させる為に、発現ベクターとLipofectamineTM 2000をOptiMemを用いて混合した後、室温で30分間インキュベートした。複合溶液を加えた後、細胞を5% CO2 存在下、37℃で4時間インキュベートした。その後、Lipofectamine TM 2000を培地から取り除く為、100 μlの培地でウェルをそれぞれ3回洗浄した。その後、90 μlの抗生物質を含む培地を細胞に加え、ウミシイタケルシフェラーゼの遺伝配列と相同的なアンチセンス配列を含む未修飾2本鎖RNA及び脂質修飾2本鎖RNA型を最終濃度が0nM, 25nM, 50nM, 100nM, 200nM, 400nM, 600n, 800nM, 1μMになるようにOptiMemで調整したサンプル10μlを細胞へ添加し、37℃で48時間インキュベートした。Dula-GloTMLuciferase Assay System(プロメガ)を用いてホタル及びウミシイタケルシフェラーゼの発現量をルミノメーター(MicroLumat LB96p: BERTHOLD)で測定した。また、比較として未修飾の21nt siRNA (si 21A2/21B)及び27nt dsRNA(Ds 27A1/27B)も上記と同様の条件でRNA干渉効果を検討した。
【0075】
RNA干渉効果はホタルルシフェラーゼの発現量をコントロールとしウミシイタケルシフェラーゼの発現量を算出した。終濃度が50nM 〜1μMのときのsi 21A2/21B、Ds 27A1/27B、Ds 27A1C16/27Bの結果を図6Aに、終濃度が25nM 〜800nMのときのDs 23A1/23B、Ds 23A1C16/23Bの結果を図6Bに示す。その結果、パルミチン酸をセンス鎖の5’末端に修飾したDs 27A1C16/27B 及びDs 23A1C16/23Bにおいて、2本鎖RNAの濃度依存的にウミシイタケルシフェラーゼ発現を抑制しており、パルミチン酸を修飾することにより単独でも細胞内へ導入し、RNA干渉反応を起こしていることが明らかとなった。一方、未修飾の2本鎖RNA(si 21A2/21B、Ds 27A1/27B、Ds 23A1/23B)は高濃度領域においても顕著な遺伝子発現抑制効果が確認されなかったことからも、パルミチン酸修飾2本鎖RNAが、細胞内導入能が格段に優れており、遺伝子導入剤を使用しなくても優れた遺伝子発現抑制能を発揮していることが確認された。
【0076】
6.脂質修飾2本鎖RNAの細胞導入性の検討
実験前に1x105 cell/mlに調整したHeLa細胞(ヒト子宮頸ガン細胞、東北大学加齢医学研究所)、A549細胞(ヒト肺ガン細胞、東北大学加齢医学研究所)、SH10-TC細胞(ヒト胃ガン細胞、東北大学加齢医学研究所)及び2x105cell/mlに調整したJurkat細胞(急性リンパ性白血病細胞、東北大学加齢医学研究所)、K-562細胞(慢性骨髄性白血病細胞)を24ウェルプレートにそれぞれ1ml撒き10 % ウシ胎児血清 (FBS:三光純薬株式会社製)及び抗生物質含む培地中、5 % CO2存在下、37 ℃で培養した。ここで用いた抗生物質及び培地について、全ての細胞でストレプトマイシンを抗生物質として、またHeLa細胞はMEM培地(インビトロジェン社)を、その他の細胞はRPMI-1640(インビトロジェン社)を培地として用いた。蛍光ラベル化オリゴヌクレオチド導入前に、抗生物質を含まない培地(450μl)へ交換した。蛍光ラベル化オリゴヌクレオチドは、27ntアンチセンス鎖RNAの5’末端を6-FAMラベル化したものを使用し、未修飾の27nt センス鎖RNA及び5’末端を脂質で修飾した27ntセンス鎖RNAと2本鎖を形成させた。細胞導入実験は、蛍光ラベル化オリゴヌクレオチドとLipofectamineTM 2000 (インビトロジェン社製)との複合体を形成させる為に、10μM の蛍光ラベル化オリゴヌクレオチド水溶液10μlとOptiMem溶液15μlの混合溶液25μlと、LipofectamineTM 2000 (インビトロジェン社製)溶液2μlとOptiMem溶液23μlの混合溶液25μlそれぞれ混ぜ合わせた50μlの混合溶液を室温で30分間インキュベートした。また、LipofectamineTM 2000 (インビトロジェン社製)を使用しない場合(図7中のF;‐LF2000)は、上記複合体形成条件中の2μlのLipofectamineTM 2000溶液をOptiMem溶液に代え、同様の操作でサンプルを調整した。調整した50μlの蛍光ラベル化オリゴヌクレオチド複合体は、上記で準備した450μlの細胞へ添加し(2本鎖RNAの終濃度:200 nM)、5 % CO2存在下、37 ℃で4時間インキュベートした。その後、細胞をPBS(-)又は培地で3回洗浄し、共焦点蛍光レーザー顕微鏡、及びフローサイトメトリーにて細胞導入を評価した。
【0077】
共焦点蛍光レーザー顕微鏡による評価では、Radiance 2000システム(Bio Rad社)を用い、アルゴンレーザーを用いて蛍光を観察した。フローサイトメトリーは、coulter EPICS XL cytometer(Beckman coulter)を用い、細胞10000カウントあたりの細胞導入性について測定した。フローサイトメトリー解析はXL EXPO32TM software (Beckman coulter) を用いた。
【0078】
結果を図7-1〜7-3に示す。図7-3中のF(-LF2000)はLipofectamineTM 2000を使用しなかった場合の結果であり、図7-1〜7-3中のA〜E(+LF2000)はLipofectamineTM 2000を導入剤として使用した場合の結果である。また、図7-1中のAはHeLa細胞、図7-1中のBはA549細胞、図7-2中のCはSH10-TC細胞、図7-2中のDはK-562細胞、図7-3中のEはJurkat細胞に対して、LipofectamineTM 2000を導入剤として用いたときの各種2本鎖RNAの細胞導入性の結果である。また、図7-3中のFはHeLa細胞に対し市販の導入剤を使用しなかったときの各種2本鎖RNAの細胞導入性の結果である。その結果、LipofectamineTM 2000存在下において未修飾2本鎖RNA及び脂質修飾2本鎖RNAは、全ての細胞(HeLa細胞、A549細胞、SH10-TC細胞、Jurkat細胞、K-562細胞)への導入が確認された。特にパルミチン酸をセンス鎖の5’末端に修飾したDs 27A1C16/27Bは未修飾2本鎖RNA及びラウリン酸修飾2本鎖RNAに比べ、非常に高い細胞導入性が共焦点蛍光顕微鏡及びフローサイトメトリーにおいて観測された。また、このパルミチン酸修飾2本鎖RNAは細胞内において積極的に細胞質へ局在化していることが共焦点蛍光顕微鏡観察により示唆された。特に接着細胞(HeLa細胞、A549細胞、SH10-TC細胞)において、その導入性は顕著に表れた。また、LipofectamineTM 2000存在下においてもパルミチン酸修飾2本鎖RNAは未修飾2本鎖RNAに比べ高い細胞導入性がフローサイトメトリー解析により確認された。この結果より、2本鎖RNAのセンス鎖の5’末端にパルミチン酸等の脂質を共有結合させることにより飛躍的に細胞導入性を向上させ、且つ、細胞内において細胞質へ局在化させることが可能であるという知見が得られた。
【0079】
実施例2 5’脂質修飾2本鎖RNAによるVEGF遺伝子発現阻害効果
1.VEGF遺伝子をターゲットとした脂質修飾2本鎖RNAの合成
1−1.センス鎖RNA及びアンチセンス鎖RNAの配列
VEGF(vascular endothelial growth factor: 血管内皮成長因子)と相同配列を持ち、VEGFの遺伝子発現を抑制できる27及び21塩基長のセンス鎖RNAと27及び21塩基長のアンチセンス鎖RNAの2本鎖RNAをデザインした。これらの2本鎖RNAを用いて、以下の実験を行った。なお、27nt dsRNAは、ダングリングエンド(1本鎖領域)を持たない完全2本鎖RNA(センス鎖RNAの5’末端側及び3’末端側が共に平滑末端である2本鎖RNA)であり、21siRNAはセンス鎖RNA及びアンチセンス鎖RNAの双方の3’末端に2塩基のダングリングエンドを持つ2本鎖RNAである。使用した27nt dsRNA及び21siRNAの配列は、以下の通りである。
27nt dsRNA センス鎖 v27A:5’- CUUCCUACAGCACAACAAAUGUGAAUG -3’(配列番号10)
アンチセンス鎖 v27B:3’- GAAGGAUGUCGUGUUGUUUACACUUAC-5’(配列番号11)
21siRNA センス鎖 v21A:5’- UCCUACAGCACAACAAAUGUG-3’(配列番号12)
アンチセンス鎖 v21B:3’- GAAGGAUGUCGUGUUGUUUAC−5’(配列番号13)
1−2.VEGF遺伝子をターゲットとした脂質未修飾2本鎖RNAの合成
これら上記センス鎖RNA及びアンチセンス鎖を用いて、実施例1と同様の方法でアニーリングし2本鎖を形成させ、脂質未修飾2本鎖RNAを得た。2本鎖形成確認は実施例1の同様の方法で20% アクリルアミドゲル電気泳動で確認した。
【0080】
1−3.VEGF遺伝子をターゲットとした脂質修飾2本鎖RNAの合成
VEGF遺伝子の発現を抑制できる上記2本鎖RNAのセンス鎖の5’末端に脂質を結合させた脂質修飾2本鎖RNAを合成した。当該脂質修飾2本鎖RNAにおいて、脂質は上記センス鎖RNAの5’末端に修飾されたアミノアルキル基(Amino Modifier C6; Glen Research)を介して共有結合で結合している。脂質修飾1本鎖RNA(センス鎖)は、実施例1と同様の方法で合成した。
【0081】
以下にVEGF遺伝子をターゲットとした脂質修飾RNAの構造モデル及び収率を示す。
【0082】
【化5】

【0083】
合成した脂質修飾センス鎖RNAは、アンチセンス鎖RNAと2本鎖を形成させることにより、脂質修飾2本鎖RNAを得た。2本鎖の形成は、実施例1と同様の方法で行い、20% ポリアクリルアミドゲル電気泳動により確認した。脂質修飾2本鎖RNAの構造を図8に示す。なお、VEGF遺伝子をターゲットとした脂質修飾RNAにおいても、実施例1とほぼ同様の溶出時間であった。
2.VEGF遺伝子をターゲットとした脂質修飾2本鎖RNAのDicerによるプロセシング
合成した脂質未修飾2本鎖RNA及び脂質修飾2本鎖RNAのリコンビナントDicerによるプロセシングを検討した。Dicerによる切断実験は、実施例1と同様の方法で行った。その結果を図9に示す。
【0084】
その結果、Ds v27AC16/v27B及びDs v27AC12/v27BはリコンビナントDicerの働きにより、未修飾21 siRNAと同様の位置にバンドが確認され、Dicerの切断によって2塩基のダングリングエンドを含む21塩基長のsiRNAが生成していることが強く示唆された。この結果より、27nt dsRNAのセンス鎖の5’末端に脂質を結合させてもDicerによるプロセシングを妨げないことが確認された。一方、si v21AC16/v21B及びsi v21AC12/v21Bは、Dicer存在下でも、非存在下に比べバンドの変化が確認されず、Dicerにプロセシングを受けていないことが明らかとなった。
【0085】
3.脂質修飾2本鎖RNAのVEGF遺伝子発現抑制
末端を修飾していない21nt siRNA、末端を修飾していない27nt dsRNA、センス鎖RNAの5’末端を脂質修飾した27nt dsRNA(末端脂質修飾27nt dsRNA)及びセンス鎖RNAの5’末端を脂質修飾した21nt siRNA(末端脂質修飾21nt siRNA)のVEGF遺伝子発現阻害効果をHeLa細胞(ヒト子宮頸ガン細胞、東北大学加齢医学研究所)、A549細胞(ヒト肺ガン細胞、東北大学加齢医学研究所)、SH10-TC細胞(ヒト胃ガン細胞、東北大学加齢医学研究所)Jurkat細胞(急性リンパ性白血病細胞、東北大学加齢医学研究所)、及びK-562細胞(慢性骨髄性白血病細胞、東北大学加齢医学研究所)を用いて評価した。また、VEGF遺伝子と相同な遺伝子配列を持たない2本鎖RNA(27nt dsRNA(Random)、21nt siRNA(Random))及びそれらの2本鎖RNAのセンスの5‘末端に脂質を結合させた脂質修飾2本鎖RNAについても同様の評価を行った。
【0086】
実験は以下の操作で行った。実験前に1x105 cell/mlに調整したHeLa細胞、A549細胞及びSH10-TC細胞、また、2x105cell/mlに調整したJurkat細胞及びK-562細胞を24wellプレート上にそれぞれ500μl撒き、37℃で一晩インキュベートした。翌日、ウェル上の古い培地を取り除き、抗生物質を含まない新しい培地をウェルにそれぞれ450 μl加えた。ここで、HeLa細胞はMEM培地、その他の細胞はPRMI-1640培地を用いた。VEGFの遺伝配列と相同的なアンチセンス配列を含む未修飾又は脂質修飾2本鎖RNA(25μl)とLipofectamineTM 2000 (インビトロジェン)溶液(25μl)との複合体を形成させ、50μlの2本鎖RNA溶液を450μlの上記細胞に加えた。ここで、1ウェルあたりの最終量は500 μlとなる。RNAとLipofectamineTM 2000の複合溶液は、1ウェルあたり25 μlのRNA水溶液と25 μlのLipofectamineTM 2000 (2μl) 及びOptiMemの溶液を混合し、30分間室温でインキュベートすることにより作成した。RNAを導入させた後、37℃で48時間、5%CO2存在下インキュベートした。インキュベート後、細胞をPBS(-)で3回洗浄し、RNeasy Plus Mini Kit (キアゲン)で細胞中のTotal-RNAを抽出した。その後、VEGFのmRNA量を測定するためにRT-PCR反応を行った。RT-PCR反応用としてQiagen OneStep RT-PCR Kit (キアゲン)を用い行い、VEGF用PCRプライマーとして、5’-CCC TGA TGA GAT CGA GTA CAT CTT-3’(配列番号14)及び5’-ACC GCC TCG GCT TGT CAC-3’(配列番号15)を用いた。またコントロールとしてGAPDH遺伝子を同様の方法で測定した。GAPDH用プライマーとして5’-GGAAAGCTGTGGCGTGATG-3’(配列番号16)及び5’-CTGTTGCTGTAGCCGTATTC-3’(配列番号17)を用いた。RT-PCR反応は、50℃で30分間RT(Reverse Transcripratase)反応を行い、PCR反応として92℃で30秒間2本鎖解離反応、55℃で30秒間アニーリング反応、68℃で45秒間伸長反応を25回〜28回(使用する細胞により異なる)繰り返し行い、最後に68℃で10分間インキュベートし、4℃まで温度を下げ反応を終了した。RT-PCRに用いた試薬、Total-RNA、プライマー等はQiagen OneStep RT-PCR Kit (キアゲン)の反応条件に従い作成した。RT-PCR反応後、ローディングダイを2μl加え、2%アガロースゲルでVEGF及びGAPDHのmRNAからのRT-PCR産物を確認した。遺伝子発現抑制効果の評価は、コントロール細胞(2本鎖RNAを導入していない細胞)のVEGF遺伝子発現量を100%としたときの、2本鎖RNA(未修飾、修飾を含む)を導入した細胞のVEGF発現量を測定することにより行った。また、各細胞間の発現量の誤差はコントロール遺伝子(GAPDH)の遺伝子発現量で補正した。
【0087】
図10-1〜10-3に、VEGFをターゲットとし、2本鎖RNA濃度が200nMの際の未修飾2本鎖RNA及び脂質修飾2本鎖RNAのRNA干渉効果の結果を示す。図10-1中のAはHeLa細胞、図10-2中のBはA549細胞、図10-2中のCはSH10-TC細胞、図10-3中のDはJurkat細胞、図10-3中のEはK-562細胞に対する未修飾2本鎖RNA及び脂質修飾2本鎖RNAのVEGF遺伝子発現抑制効果を示すグラフである。この結果から、27塩基長の2本鎖RNA(Ds v27A/v27B)のセンス鎖の5’末端に脂質を修飾したDs v27AC16/v27B及びDs v27AC12/v27B、及び21塩基長の2本鎖RNA(si v21A/v21B)のセンス鎖の5’末端に脂質を修飾したsi v21AC16/v21B及びsi v21AC12/v21Bは、未修飾の2本鎖RNA(si v21A/21B及びDs v27A/v27B)比べ非常に高いVEGF遺伝子発現抑制効果を保有していることが明らかとなった。特に、パルミチン酸を修飾したDs v27AC16/v27Bは全ての細胞(HeLa細胞、A549細胞、SH10-TC細胞、Jurkat細胞、K-562細胞)において未修飾の2本鎖RNA(si v21A/21B及びDs v27A/v27B)に比べ格段に高い遺伝子発現抑制能を示し、パルミチン酸等の脂質を2本鎖RNAに修飾することによりRNA干渉効果を飛躍的に向上させ得ることが確認された。また、VEGF遺伝子と相同配列を持たない未修飾2本鎖RNA及び脂質修飾2本鎖RNAについても同様に遺伝子発現抑制能を検討したが、その全てにおいて顕著なVEGF遺伝子発現抑制は確認されなかった。この結果より、今回使用したVEGFをターゲットとした2本鎖RNAは配列特異性高く標的遺伝子の発現を抑制していることが明らかとなり、また2本鎖RNAに脂質を結合させることによって細胞に対する副作用をも低減できることが示唆された。
【技術分野】
【0001】
本発明は、標的遺伝子の発現を効率的に抑制できる脂質修飾2本鎖RNAに関する。より具体的には、ヌクレアーゼ耐性及び細胞内導入率が高く、優れたRNA干渉効果を奏することができる脂質修飾2本鎖RNAに関する。
【背景技術】
【0002】
ガンやエイズなどの難病を効率的に治療する医薬の開発は、ライフサイエンス分野における大きな一つの課題である。この課題を克服できる可能性がある有力な方法の一つとして、特定の遺伝子にのみ作用する遺伝子医薬がある。この遺伝子医薬の中でも特に最近21塩基の短い2本鎖RNA (small interfering RNA:siRNA )を利用するRNA干渉(RNA interference:RNAi)法が注目されている。このRNAi法は、1998年にFireらにより初めて報告された(非特許文献1参照)。Fireらの報告によると、機能阻害したい遺伝子の特定領域と相同な100塩基対程度の2本鎖RNAを細胞内へ導入させることにより、細胞質内でDicerの働きにより20〜25塩基対程度の2本鎖RNAへと分解され、その後複数のタンパク質とRNA/タンパク質複合体を形成し(この複合体をRICS:RNA-induced silencing complexと呼ぶ)、標的遺伝子から産出されたmRNAの相同部位と結合し強力に遺伝子発現を抑制するというものである。しかしながら、哺乳細胞では、約30塩基対以上の長い2本鎖RNAを導入させると、ウィルス応答反応であるインターフェロン反応が誘導され結果的に細胞が死んでしまうという現象が報告され、哺乳動物細胞系ではRNAi法は適用し難いと考えられた。そこでTuschlらは、2本鎖RNAの両3’末端にダングリングエンドをもつ21塩基長の2本鎖RNAを化学的に合成し、哺乳動物細胞へ直接導入させることにより、インターフェロン応答を回避し配列特異的に高い遺伝子発現抑制能を示すことを報告した(非特許文献2参照)。また彼らは、2本鎖領域が19塩基対で、3’末端又は5’末端に様々な長さのダングリングエンド鎖をもつ短い2本鎖RNAを合成しRNA干渉効果を検討した。その結果、両3’末端に2塩基のダングリングエンドをもつ21塩基長のsiRNAは非常に高いRNA干渉効果が観測されたが、それ以外のあらゆるタイプの短い2 本鎖RNAにおいては顕著なRNA干渉効果が観測されなかった。この報告により、今日では21塩基長であり、両3’末端に2塩基のダングリングエンドをもつ2本鎖RNAを用いたRNA干渉法が一般的となっている。ここでは21塩基長の短い2本鎖RNAを用いて標的遺伝子発現を阻害する方法を、RNAi法と区別してsiRNA法と呼ぶ。
【0003】
このsiRNA法は合成RNAを用いるのでサンプル調製も比較的容易であり、取り扱い操作も簡便で、かつ、非常に強力な効果を示す為、ライフサイエンス分野のみならずバイオビジネス分野においても大きな注目を浴びている。
【0004】
しかしながら、この優れたsiRNA法にも解決しなければならない問題点がある。上記したようにsiRNAはRNA分子から構成されており、ヌクレアーゼの働きにより速やかに分解される。また2本鎖RNA領域は1本鎖RNAに比べ、細胞内及び培地中に含まれるヌクレアーゼに比較的高い耐性を示すが、19塩基対からなる2本鎖RNAは殆ど従来のRNA干渉効果を示さない。そのため合成siRNAは、標的遺伝子配列をもつ細胞への導入後、2日〜4日間程度までは高い遺伝子発現抑制効果を示すが、その後はRNA干渉効果が急激に弱まり、7日程度でRNA干渉効果が殆ど無くなると報告されている。
【0005】
最近、合成siRNAにおいて細胞導入性に優れ長時間高活性なRNA干渉効果を獲得するために、様々な化学修飾型siRNAが報告されている。例えば、エキソヌクレアーゼからの分解耐性を獲得する為に、siRNAの末端をアミノ基やチオール基、アベーシックなどに修飾したsiRNAが合成されている。しかしながら、末端を修飾した21塩基長のsiRNAのほとんどの場合で、RNA干渉効果が著しく減少すると既に報告されている。
【0006】
一方、近年、J. Rossiらの報告により、27塩基対からなる2本鎖RNAが21塩基長からなるsiRNAに比べ100倍程度高いRNA干渉効果を示すことが明らかとなった(非特許文献3参照)。これは、27塩基対からなるRNAがRNase III様の酵素であるDicerによって21塩基長のsiRNAに切断された後、タンパク複合体であるRISCにそのまま認識され、高効率にsiRNA効果を発揮できる為だと考えられている。
【0007】
このように、27塩基長のRNAは、優れたRNA干渉効果を奏し得るため、今後、遺伝子医薬としての応用が益々期待されている。しかしながら、27塩基長のRNAによるRNA干渉効果をより増強させるためには、どのような技術的手段が有効であるかについては一切分かっていない。更に、RNA干渉効果を奏する二本鎖RNAに関して、27塩基長のRNAのみならず、他の塩基長のRNAについても、RNA干渉効果を高めるための技術的手段については明らかにされていない。
【0008】
また、RNA干渉効果を奏する二本鎖RNAでは、末端にダングリングエンドを有する構造が一般的に採用されているが、末端にダングリングエンドを有していない構造(即ち、平滑末端を有する構造)についても、RNA干渉効果の検討が行われている。しかしながら、センス鎖RNAの5’末端側を平滑末端にした構造では、センス鎖RNAの5’末端側にダングリングエンドがある場合に比して、RNA干渉効果が殆ど変わらない、或いはRNA干渉効果が低減することが示唆されている(非特許文献4参照)。
【0009】
一方、脂質は、細胞膜に対する透過能が高く、細胞内に薬物を送達するのに有用であることが分かっている。このような脂質を、RNA干渉効果を奏する二本鎖RNAに結合させることによって、細胞内導入率を高めて、RNA干渉効果をより一層有効に奏させることが期待される。しかしながら、RNA干渉効果を奏する二本鎖RNAに、単に脂質を結合させると、RNA干渉効果の顕著な減弱化を招くことが分かっており、従来技術では、優れたRNA干渉効果と脂質に基づく有用効果とを兼ね備えた脂質修飾2本鎖RNAを構築できていないのが現状である。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Fire et. al, Nature, 391, 806-811 (1998)
【非特許文献2】Tuschl et. al., EMBO Journal, 20, 6877-6888 (2001)
【非特許文献3】J. Rossi et. al. Nature Biotech., 23, 222-226 (2005)
【非特許文献4】J. T. Marques et. al., Nature Biotech., 24, 559-565 (2005)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、ヌクレアーゼ耐性及び細胞内導入率が高く、優れたRNA干渉効果を奏し得る新規な二本鎖RNAを提供することを目的とする。また、本発明は、該新規な2本鎖RNAを含む医薬組成物を提供することを目的とする。また、本発明は、該新規な二本鎖RNAを細胞内に導入することにより標的とする遺伝子の発現を抑制するための標的遺伝子の発現抑制方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明者等は、上記課題を解決するため鋭意研究を重ねたところ、標的遺伝子中の標的配列に相補的な塩基配列を含むセンス鎖RNA、及び該センス鎖RNAに相補的な塩基配列を含むアンチセンス鎖RNAを有し、標的遺伝子の発現を抑制できる二本鎖RNAにおいて、該センス鎖RNAの5’末端側から1〜6番目のヌクレオチドの少なくとも1つに直接又はリンカーを介して脂質を結合させることによって、ヌクレアーゼ耐性及び細胞内導入率が高く、優れたRNA干渉効果を奏する2本鎖RNAを構築できることを見出した。本発明は、かかる知見に基づいて、更に改良を重ねることにより完成したものである。
【0013】
即ち、本発明は、下記に掲げる脂質修飾2本鎖RNA、該新規な2本鎖RNAを含む医薬組成物、及び標的遺伝子の発現抑制方法等を提供する。
項1. 標的遺伝子中の標的配列に相補的な塩基配列を有するセンス鎖RNA、及び該センス鎖RNAに相補的な塩基配列を有するアンチセンス鎖RNAを有し、且つ前記標的遺伝子の発現を抑制できる二本鎖RNAであって、該センス鎖RNAの5’末端から1〜6番目のヌクレオチドの少なくとも1つに直接又はリンカーを介して脂質が結合していることを特徴とする、脂質修飾2本鎖RNA。
項2. 前記センス鎖RNAの5’末端側が平滑末端であり、且つ前記センス鎖RNAの3’末端側が平滑末端又はダングリングエンドを有している、項1に記載の脂質修飾2本鎖RNA。
項3. 前記センス鎖RNAの5’末端側及び3’末端側が共にダングリングエンドを有している、項1に記載の脂質修飾2本鎖RNA。
項4. 前記センス鎖RNAを構成するヌクレオチドの数が21〜27である、項1乃至3のいずれかに記載の脂質修飾2本鎖RNA。
項5. 前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ27個のヌクレオチドから構成されている、項2に記載の脂質修飾2本鎖RNA。
項6. 前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ23個のヌクレオチドから構成されている、項2に記載の脂質修飾2本鎖RNA。
項7. 前記センス鎖RNAの5’末端側が平滑末端であり、前記センス鎖RNAが25個のヌクレオチドから構成され、且つ前記アンチセンス鎖が23個のヌクレオチドから構成されている、項2に記載の脂質修飾2本鎖RNA。
項8. 前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ21個のヌクレオチドから構成されている、項3に記載の脂質修飾2本鎖RNA。
項9. 前記脂質が、炭素数6〜50の脂肪酸である、項1乃至8のいずれかに記載の脂質修飾2本鎖RNA。
項10. 前記脂質が、ラウリン酸、ステアリン酸、ミリスチン酸、又はパルミチン酸である、項1乃至9のいずれかに記載の脂質修飾2本鎖RNA。
項11. 前記センス鎖RNAの5’末端から1〜6番目のヌクレオチドの少なくとも1つに、下記一般式(L-4)で表される構造のリンカーを介して脂質が結合している、項1乃至10のいずれかに記載の脂質修飾2本鎖RNA。
【0014】
【化1】

【0015】
[式中、n1は、1〜40の整数を示す。]
項12. 項1乃至10のいずれかに記載の脂質修飾2本鎖RNAと、薬学的に許容される基剤を含む、医薬組成物。
項13. 標的遺伝子の発現を抑制するための医薬を製造するための、項1乃至10のいずれかに記載の脂質修飾2本鎖RNAの使用。
項14. 項1乃至10のいずれかに記載の脂質修飾2本鎖RNAを細胞内に導入することにより、標的遺伝子の発現を抑制する、標的遺伝子の発現抑制方法。
【発明の効果】
【0016】
本発明の脂質修飾2本鎖RNAは、センス鎖RNAの5’末端側が脂質で修飾されており、これによって飛躍的にRNA干渉効果が向上している。特に、本発明の脂質修飾2本鎖RNAは、特定の部位に対して脂質が結合することにより、DicerによるプロセシングやRISCとの複合体を妨げることなく、しかもヌクレアーゼ耐性及び細胞内導入率が顕著に向上しているので、医薬用途への応用に大きく貢献できる。
【0017】
更に、本発明の脂質修飾2本鎖RNAは、単独でも優れた細胞内移行能を示すので、従来の遺伝子導入試薬を別途用いずに、或いは従来の遺伝子導入試薬の使用量を低減して、細胞内に導入することも可能である。故に、本発明の脂質修飾2本鎖RNAは、従来の遺伝子導入試薬の使用によって懸念される細胞毒性の発現を抑制でき、臨床的な応用において高い安全性が確保できる。
【0018】
このため、本発明の医薬組成物又は標的遺伝子の発現抑制方法によれば、より効果的に標的遺伝子の発現を抑制又は阻害することができる。
【図面の簡単な説明】
【0019】
【図1】実施例1で合成した未修飾及び脂質修飾2本鎖RNAの構造を示す図である。
【図2】実施例1において、脂質修飾1本鎖RNAのHPLC解析結果を示す図である。
【図3】実施例1において、5’末端を脂質修飾した2本鎖RNAのヌクレアーゼ耐性結果を示す図である。
【図4】実施例1において、それぞれの脂質修飾2本鎖RNAのDicerによるプロセシングを検討した結果を示す図である。
【図5】実施例1において、0.2 nM濃度のときの脂質修飾27nt dsRNAのRNA干渉効果の評価結果を示す図である。
【図6】実施例1において、5’末端を脂質修飾した2本鎖RNAのRNA干渉効果(遺伝子導入剤未使用)の評価結果を示す図である。
【図7−1】実施例1において、脂質修飾2本鎖RNAのHeLa及び A549細胞に対する細胞内導入性を評価した結果を示す図である。図中、FLには蛍光顕微鏡にて撮影した像、transは、上記FLと同一視野を位相差顕微鏡にて撮影した像、mergeは上記FLとtransを重ね合わせた像を示す。
【図7−2】実施例1において、脂質修飾2本鎖RNAのSH10-TC及びK562細胞に対する細胞内導入性を評価した結果を示す図である。図中、FLには蛍光顕微鏡にて撮影した像、transは、上記FLと同一視野を位相差顕微鏡にて撮影した像、mergeは上記FLとtransを重ね合わせた像を示す。
【図7−3】実施例1において、脂質修飾2本鎖RNAのJurkat及びHeLa細胞に対する細胞内導入性を評価した結果を示す図である。図中、FLには蛍光顕微鏡にて撮影した像、transは、上記FLと同一視野を位相差顕微鏡にて撮影した像、mergeは上記FLとtransを重ね合わせた像を示す。
【図8】実施例2で合成した未修飾及び脂質修飾2本鎖RNAの構造を示す図である。
【図9】実施例2において、それぞれの脂質修飾2本鎖RNAのDicerによるプロセシングを検討した結果を示す図である。
【図10−1】実施例2において、脂質修飾2本鎖RNAのHeLa細胞中のVEGF遺伝子に対するRNA干渉効果の結果を示す図である。
【図10−2】実施例2において、脂質修飾2本鎖RNAのA549及びSH10-TC細胞中のVEGF遺伝子に対するRNA干渉効果の結果を示す図である。
【図10−3】実施例2において、脂質修飾2本鎖RNAのJurkat及びK562細胞中のVEGF遺伝子に対するRNA干渉効果の結果を示す図である。
【発明を実施するための形態】
【0020】
本明細書において、「平滑末端」とは、2本鎖RNAの末端部分において、センス鎖の末端領域とそれに対合するアンチセンス鎖の末端領域が、1本鎖部分を形成することなく対合している構造のことである。また、「ダングリングエンド」とは、2本鎖RNAの末端部分のセンス鎖の末端領域又はそれに対合するアンチセンス鎖の末端領域において、対合する塩基が存在しないために二本鎖を形成できず、一本鎖が存在している塩基配列部分を意味する。
【0021】
本発明の脂質修飾2本鎖RNAは、標的遺伝子中の標的配列に相補的な塩基配列を有するセンス鎖RNAを含む。
【0022】
ここで、標的遺伝子とは、RNA干渉効果によって遺伝子発現の抑制対象となる遺伝子である。本発明の脂質修飾2本鎖RNAにおいて、標的対象遺伝子については、特に制限されず、該脂質修飾2本鎖RNAの用途に基づいて適宜選択することができる。
【0023】
標的遺伝子中の標的配列については、RNA干渉効果によって遺伝子発現を抑制可能な配列である限り特に制限されず、公知の方法で、具体的には、NCBIのBLASTサーチ等を用いて適宜決定することができる。例えば、標的遺伝子のコード領域(ORF)の開始コドンから50〜100塩基下流のエキソン部分にある塩基"AA"に続く19〜30塩基からなる領域であって、GC含有量が50%前後の領域を標的配列とすればよい。このような標的配列に対する相補鎖を採用することで、優れたRNA干渉効果を獲得することが、当業界で経験的に明らかにされている。また、例えば、上記標的配列は、IDT社(Integrated DNA Technologies, INC)のマニュアル(Dicer Substrate RNAi Design)に従って設定することが出来る。また最近では、(i)アンチセンス鎖RNAの5’末端がA/Uペアであり、(ii)センス鎖RNAの5’末端がG/Cペアであり、(iii)アンチセンス鎖RNAの5’末端側に5つ程度のA/Uペアがあり、且つ(vi)2本鎖中に9つ以上のG/Cペアが無い2本鎖RNAを設計することで高いRNA干渉効果をもつ2本鎖RNAをデザインできると報告されている(Ui-Tei et. al, Nucleic Acids Res., 32, 936-948 (2004))。
【0024】
本発明の脂質修飾2本鎖RNAにおいて、センス鎖にダングリングエンドが存在しない場合、該センス鎖は標的配列に相補的な塩基配列からなるものである。また、ダングリングエンドがセンス鎖の5'末端及び/又は3'末端に存在している場合、該センス鎖は、標的配列に相補的な塩基配列の5'末端及び/又は3'末端に、ダングリングエンドを構成する塩基配列が連結した塩基配列からなるものである。
【0025】
本発明の脂質修飾2本鎖RNAにおいて、前記センス鎖RNAを構成するヌクレオチドの数についてはRNA干渉効果を奏し得る限り特に制限されず、該2本鎖RNAに備えさせる構造等に応じて適宜設定されるが、通常21〜27個、好ましくは21、23、25、又は27個、更に好ましくは21、23又は27個が挙げられる。なお、ここでいうセンス鎖RNAを構成するヌクレオチドの数とは、該センス鎖にダングリングエンドが存在していない場合には標的配列に相補的な塩基配列を構成するヌクレオチドの総数を意味し、該センス鎖にダングリングエンドが存在している場合には該ダングリングエンドを構成するヌクレオチドの数と標的配列に相補的な塩基配列を構成するヌクレオチドの数の総和を意味する。また、本発明の脂質修飾2本鎖RNAは、前記センス鎖に相補的な塩基配列を含むアンチセンス鎖を有する。
【0026】
本発明の脂質修飾2本鎖RNAにおいて、アンチセンス鎖にダングリングエンドが存在しない場合、該アンチセンス鎖は、前記センス鎖の「標的配列に相補的な塩基配列」の一部又は全部に対して相補的である塩基配列からなるものである。また、ダングリングエンドがアンチセンス鎖の5'末端及び/又は3'末端に存在している場合、該アンチセンス鎖は、前記センス鎖の「標的配列に相補的な塩基配列」の一部又は全部に対して相補的である塩基配列の5'末端及び/又は3'末端に、ダングリングエンドを構成する塩基配列が連結した塩基配列からなるものである。本発明の脂質修飾2本鎖RNAにおいて、前記アンチセンス鎖RNAを構成するヌクレオチドの数についてはRNA干渉効果を奏し得る限り特に制限されず、該2本鎖RNAに備えさせる2本鎖RNA構造等に応じて適宜設定されるが、通常21〜27個、好ましくは21、23、25、又は27個、更に好ましくは21、23、又は27個が挙げられる。なお、ここでいうアンチセンス鎖RNAを構成するヌクレオチドの数とは、該アンチセンス鎖にダングリングエンドが存在していない場合には標的配列に相補的な塩基配列を構成するヌクレオチドの総数を意味し、該アンチセンス鎖にダングリングエンドが存在している場合には該ダングリングエンドを構成するヌクレオチドの数と標的配列に相補的な塩基配列を構成するヌクレオチドの数の総和を意味する。
【0027】
本発明の脂質修飾2本鎖RNAにおいて、前記センス鎖RNAと前記アンチセンス鎖RNAを構成するヌクレオチドは、基本的にはリボヌクレオチドであるが、分解酵素耐性の向上を目的として2’−O−メチル修飾型や2’−F修飾型、LNA(Locked Nucleic Acid)等の各種化学修飾型ヌクレオチド、或いはデオキシリボヌクレオチド等をRNA配列中に含んでいてもよい。特に、本発明の脂質修飾2本鎖RNAがダングリングエンドを有する構造の場合には、前記センス鎖RNA及び/又は前記アンチセンス鎖RNAにおける当該ダングリングエンドの構成部分は、デオキシリボヌクレオチドで構成されていてもよい。このような化学修飾型ヌクレオチドとしては、具体的には、ホスホロチオエート型、ボラノフォスフェート型DNA/RNA等のリン酸骨格を修飾したもの;2’−0Me修飾RNA、2’−F修飾RNA等の2’修飾ヌクレオチド;LNA(Locked Nucleic Acid)やENA(2'-O,4'-C-Ethylene-bridged nucleic acids)等のヌクレオチドの糖分子を架橋した修飾ヌクレオチド;PNA(ペプチド核酸)、モリフォリノヌクレオチド等の基本骨格が異なる修飾ヌクレオチド;5−フルオロウリジンや5−プロピルウリジンなどといった塩基修飾型ヌクレオチド等が例示される。
【0028】
本発明の脂質修飾2本鎖RNAにおいて、前記センス鎖RNAと前記アンチセンス鎖RNAがハイブリダイズして2本鎖を形成している限り、その構造については特に制限されないが、好ましい構造として、(A)前記センス鎖RNAの5'末端側が平滑末端(ブランドエンド)であり、且つ前記センス鎖RNAの3'末端側が平滑末端又はダングリングエンド(一本鎖領域)を有している構造、並びに(B)前記センス鎖RNAの5'末端側及び3'末端側の双方にダングリングエンドを有している構造が例示される。ここで、センス鎖RNAの3'末端側にダングリングエンドを有する構造には、センス鎖の3'末端領域がダングリングエンドを構成している場合と、アンチセンス鎖の5'末端領域がダングリングエンドを構成している場合が含まれる。また、センス鎖RNAの5'末端側にダングリングエンドを有する構造には、センス鎖の5'末端領域がダングリングエンドを構成している場合と、アンチセンス鎖の3'末端領域がダングリングエンドを構成していている場合が含まれる。
【0029】
本発明の脂質修飾2本鎖RNAを構成する2本鎖RNAの内、一層優れたRNA干渉効果を発現させるという観点から、特に好ましい構造として、上記(A)の構造に含まれるものとして以下の(A-1)〜(A-3)の構造が例示され、上記(B)の構造に含まれるものとして以下の(B-1)の構造が例示される:(A-1)前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、該センス鎖RNA及び該アンチセンス鎖がそれぞれ27個のヌクレオチドから構成されている構造;(A-2)前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、該センス鎖RNA及び該アンチセンス鎖がそれぞれ23個のヌクレオチドから構成されている構造;(A-3)前記センス鎖RNAの5’末端側が平滑末端であり、該センス鎖RNAが25個のヌクレオチドから構成され、且つ前記アンチセンス鎖が23個のヌクレオチドから構成されている構造;(B-1)前記センス鎖RNAの3'末端及び前記アンチセンス鎖の3'末端の双方に2個のヌクレオチドからなるダングリングエンドがそれぞれ形成されており、該センス鎖RNA及び該アンチセンス鎖がそれぞれ21個のヌクレオチドから構成されている構造。
【0030】
即ち、上記(A-1)及び(A-2)の構造は、センス鎖RNAとアンチセンス鎖RNAが、両末端にダングリングエンドを形成させることなく、ハイブリダイズしている構造である。また、上記(A-3)の構造は、センス鎖RNAの5’末端側が平滑末端であり、且つセンス鎖RNAの3’末端から1〜2番目のヌクレオチドがダングリングエンドを形成するように、センス鎖RNAとアンチセンス鎖RNAがハイブリダイズしている構造である。また、上記(B-1)の構造は、センス鎖の5'末端から1〜19番目のヌクレオチドとアンチセンス鎖の3'末端から3〜21番目のヌクレオチドがハイブリダイズしており、センス鎖の3'末端から1〜2番目のヌクレオチドとアンチセンス鎖の3'末端から1〜2番目のヌクレオチドがぞれぞれダングリングエンドを形成している構造である。
【0031】
本発明の脂質修飾2本鎖RNAは、上記センス鎖RNAの5'末端側から1〜6番目のヌクレオチドの少なくとも1つに脂質が結合している。本発明の脂質修飾2本鎖RNAは、上記センス鎖RNAの5'末端側以外の部位には、他の置換基は結合していない。即ち、上記センス鎖RNAの5'末端側以外の部分、及びアンチセンス鎖RNA部分は他の置換基によって置換されておらず、ヌクレオチドのみから構成される。このように、上記センス鎖RNAの5'末端側にのみ脂質が結合していることによって、細胞内導入率を高め、且つ格段に優れたRNA干渉効果を発現させることが可能になる。
【0032】
本発明の脂質修飾2本鎖RNAにおいて、上記センス鎖RNAに結合している脂質としては、特に制限されないが、例えば、単純脂質(脂肪酸と各種アルコールとのエステル);リン脂質、糖脂質等の複合脂質;脂肪酸、高級アルコール、脂溶性ビタミン、ステロイド、炭化水素等の誘導脂質等が例示される。これらの中で、細胞内導入率及びRNA干渉効果の向上という観点から、好ましくは誘導脂質、更に好ましくは炭素数6〜50の脂肪酸、特に好ましくは炭素数が10〜22の脂肪酸、より好ましくは炭素数12〜18の脂肪酸、特に好ましくは、ラウリン酸、ステアリン酸、ミリスチン酸、及びパルミチン酸、更に特に好ましくはパルミチン酸である。
【0033】
本発明の脂質修飾2本鎖RNAにおいて、上記脂質と上記センス鎖の結合様式については特に制限されず、これらが直接結合していてもよく、またこれらがリンカーを介して結合していてもよい。但し、本発明において、上記脂質と上記センス鎖とを連結するリンカーには、核酸から構成されるものは含まれない。ここで、リンカーとしては、上記脂質と上記センス鎖とを連結可能な限り、特に制限されないが、具体的には、上記リンカーとして、下記の構造のものが例示される。
【0034】
【化2】

【0035】
上記一般式(L-4)〜(L-21)、において、n1は、1〜40の整数、好ましくは2〜20の整数、更に好ましくは2〜12の整数を示す。
【0036】
また、上記一般式(L-22)及び(L-23)、において、n2は、1〜20の整数、好ましくは1〜10の整数、更に好ましくは1〜6の整数を示す。
【0037】
上記一般式(L-4)〜(L-23)に示すリンカーは、その右側又は左側のいずれにセンス鎖RNAが結合していてもよい。好ましくは上記一般式(L-4)〜(L-23)に示すリンカーの右側に上記センス鎖RNA(又は核酸コンジュゲートの場合は核酸)の所定の部位が結合し、該リンカーの左側に脂質が結合するように構成されているものである。
【0038】
また、上記脂質における上記リンカーの結合部位については、脂質の種類やリンカーの種類に応じて適宜設定されるが、例えば、脂質として脂肪酸を使用する場合であれば、脂肪酸のカルボキシル基が、上記リンカーと、エステル結合やアミド結合等を形成することによって連結されていればよい。より具体的には、脂質として脂肪酸を使用する場合、上記リンカーが、脂肪酸のカルボキシル基部分の−OHと置換されて結合していることが好ましい。
【0039】
上記リンカーは、連結させる脂質の種類に応じて適宜選択されるが、例えば、脂質として脂肪酸を使用する場合であれば、上記リンカーとしては、一般式(L-4)のリンカーが好適である。
【0040】
また、上記リンカー以外にも、例えば、N-スクシニミジル=3-(2-ピリジルジチオ)プロピナート、N-4-マレイミド酪酸、S-(2-ピリジルジチオ)システアミン、ヨードアセトキシスクシンイミド、N-(4-マレイミドブチリルオキシ)スクシンイミド、N-[5-(3’-マレイミドプロピルアミド)−1−カルボキシペンチル]イミノジアセティクアシッド、N-(5-アミノペンチル)-イミノジアセテックアシッド等の二官能性リンカー(官能基を2つ含むリンカー)を使用することもできる。上記センス鎖RNAにおいて、脂質又は脂質を連結するリンカーの結合対象となるヌクレオチドは、上記センス鎖RNAの5'末端側から1〜6番目のヌクレオチドであれば特に制限されないが、好ましくは5'末端側から1〜4番目のヌクレオチド、更に好ましくは5'末端側から1及び/又は2番目のヌクレオチド、特に好ましくは5'末端(5'末端側から1番目)のヌクレオチドである。
【0041】
また、上記センス鎖RNAにおける、脂質又は脂質を連結するリンカーの結合部位については、特に限定されるものではないが、脂質又は脂質を連結したリンカーが、上記センス鎖RNAの所定のヌクレオチドのリン酸部分の水酸基を構成する水素原子と置換されて結合していることが好ましい。
【0042】
本発明の脂質修飾2本鎖RNAに結合した脂質の数としては、特に制限されないが、例えば1〜3個、好ましくは1又は2個、更に好ましくは1個が例示される。
【0043】
本発明の脂質修飾2本鎖RNAは、脂質が連結された上記センス鎖RNA、及び上記アンチセンス鎖RNAをそれぞれ合成し、これらのセンス鎖RNA及びアンチセンス鎖RNAを公知の方法に従ってハイブリダイズさせることにより、製造される。また、脂質が連結された上記センス鎖RNAについても、公知の合成技術を用いて製造することができる。
【0044】
本発明の修飾型2本鎖RNAは、細胞内に導入されることにより、標的遺伝子の発現を抑制又は阻害することができるので、標的遺伝子の発現抑制又は発現阻害を目的とした医薬や遺伝子治療用の組成物として、すなわち医薬組成物として使用できる。本発明の医薬組成物は、各種の剤形に調製され得る。本発明の医薬組成物の剤形としては、例えば、液剤(シロップ等を含む)、点滴剤、注射剤等の液状製剤;錠剤、丸剤、散剤、顆粒剤、カプセル剤(ソフトカプセルを含む)等の固形製剤が挙げられる。本発明の医薬組成物が液状製剤である場合は、凍結保存することもでき、また凍結乾燥等により水分を除去して保存してもよい。凍結乾燥製剤やドライシロップ等は、使用時に注射用蒸留水、滅菌水等を加え、溶解して使用される。また、本発明の医薬組成物が固形製剤である場合は、使用時に注射用蒸留水、滅菌水等を加え、溶解して使用してもよい。
【0045】
該医薬組成物は、脂質修飾2本鎖RNA自体であってもよいが、必要に応じて、更に薬学的に許容される基剤が含有されていてもよい。基剤としては、本発明の修飾型2本鎖RNAの標的遺伝子発現抑制効果を妨げない限り制限されず、剤形に応じて適宜選択される。例えば、基剤としては、精製水、糖水溶液、緩衝液、生理食塩水、高分子水溶液、RNase free水等が挙げられる。本発明の医薬組成物に基剤が含まれている場合、これらの配合割合も本発明の修飾型2本鎖RNAの標的遺伝子発現抑制及び/又は阻害効果を妨げない限り制限されず、剤形に応じて適宜設定される。
【0046】
例えば、本発明の医薬組成物には、修飾型2本鎖RNAが組成物あたり、0.001〜50、好ましくは0.01〜10、更に好ましくは0.1〜1とすることができる。また、本発明の医薬組成物には、医薬組成物あたり基剤50〜99.999重量%、好ましくは90〜99.99重量%、更に好ましくは99〜99.9重量%とすることができる。
【0047】
本発明の医薬組成物が適用される標的遺伝子や疾患は特に限定されず、標的遺伝子と疾患の関係については公知である。また、本発明の医薬組成物が適用される細胞の種類も限定されず、ヒト由来の細胞であってもよくヒト以外の動物由来の細胞であってもよい。また、本発明の医薬組成物は、in vitroで適用されてもよくin vivoで適用されてもよい。
【0048】
本発明の脂質修飾2本鎖RNAの細胞内への導入量や方法は、従来siRNAの場合と同様である。例えば、本発明の医薬組成物を適用して、前述の脂質修飾2本鎖RNAをin vitroで細胞内に導入させようとする場合、適当量の医薬組成物の存在下で細胞を培養する方法が例示される。また、医薬組成物を適用して、前述の脂質修飾2本鎖RNAをin vitroで培養細胞や生体から抽出した細胞に導入させようとする場合には、血清の存在下で導入させることもできる。また、本発明の医薬組成物を適用して、前述の脂質修飾2本鎖RNAをin vivoで細胞内に導入させようとする場合には、該医薬組成物の組織への直接注入;静脈、皮下、筋肉、腹腔、眼内、消化器官内、歯内等への注射;鼻腔、口腔、肺等への吸入投与;経口投与;皮膚を介した経皮投与;及び口腔粘膜、膣粘膜、眼粘膜、直腸粘膜、子宮粘膜を介した経粘膜投与等が例示される。
【0049】
本発明の医薬組成物を適用するにあったっては、siRNAの細胞内への導入に使用されている従来の遺伝子導入試薬を併用してもよく、また併用しなくてもよい。また、本発明の医薬組成物には、更に遺伝子導入試薬が含まれていてもよい。なお、本発明の脂質修飾2本鎖RNAは、単独でも優れた細胞内移行能を示すので、siRNAの細胞内への導入に使用されている従来の遺伝子導入試薬を用いずに、或いは従来の遺伝子導入試薬の使用量を低減して、細胞内に導入することも可能である。
【0050】
本発明の医薬組成物を適用する場合、その有効量を適用すればよいが、例えば、1細胞あたり、脂質修飾2本鎖RNAを0.001〜10pM、好ましくは0.001〜1pM、更に好ましくは0.01〜0.1pM適用される。
【0051】
このような本発明の医薬組成物によれば、標的遺伝子の発現を抑制又は阻害することにより該標的遺伝子の発現に起因する疾患を予防、軽減又は治療することができる。
【0052】
本発明はまた、標的遺伝子の発現抑制方法を提供するものである。本発明の標的遺伝子の発現抑制方法は、前記脂質修飾2本鎖RNAを細胞内に導入させる工程を含む。
【0053】
ここで、標的遺伝子や疾患は特に限定されず、前述したように標的遺伝子と疾患の関係については公知である。また、本発明の修飾型2本鎖RNAが導入される細胞の種類も限定されず、ヒト由来の細胞であってもよくヒト以外の動物由来の細胞であってもよい。また、本発明における修飾型2本鎖RNAの細胞への導入は、in vitroで行われてもよくin vivoで行われてもよい。
【0054】
また、本発明の標的遺伝子の発現抑制方法において、本発明の脂質修飾2本鎖RNAの細胞内への導入量や方法も、従来siRNAの場合と同様であり、適宜設定される。例えば、本発明の標的遺伝子の発現抑制方法において、本発明の脂質修飾2本鎖RNAをin vitroで細胞内に導入させようとする場合、適当量の脂質修飾2本鎖RNAの存在下で細胞を培養する工程を使用できる。また、本発明の標的遺伝子の発現抑制方法において、培養細胞や生体から抽出した細胞に本発明の脂質修飾2本鎖RNAをin vitroで導入させようとする場合には、血清の存在下で導入させる工程を使用できる。また、本発明の標的遺伝子の発現抑制方法において、本発明の脂質修飾2本鎖RNAをin vivoで細胞内に導入させようとする場合には、本発明の脂質修飾2本鎖RNAの組織への直接注入;静脈、皮下、筋肉、腹腔、眼内、消化器官内、歯内等への注射;鼻腔、口腔、肺等への吸入投与;経口投与;皮膚を介した経皮投与;及び口腔粘膜、膣粘膜、眼粘膜、直腸粘膜、子宮粘膜を介した経粘膜投与等の工程を使用できる。また、本発明の脂質修飾2本鎖RNAを細胞内に導入するにあたり、有効量の脂質修飾2本鎖RNAを細胞に接触させればよいが、その投与量は、例えば、1細胞あたり、脂質修飾2本鎖RNAを0.001〜10pM、好ましくは0.001〜1pM、更に好ましくは0.01〜0.1pMとできる。
【0055】
なお、本発明の脂質修飾2本鎖RNAは、単独でも優れた細胞内移行能を示すので、従来の遺伝子導入試薬を用いずに、或いは従来の遺伝子導入試薬の使用量を低減して、細胞内に導入することも可能である。
【0056】
このような本発明の標的遺伝子の発現抑制方法によれば、標的遺伝子の発現を抑制又は阻害することにより該標的遺伝子の発現に起因する疾患を予防、軽減又は治療することができる。
【実施例】
【0057】
以下に、実施例に基づいて本発明を詳細に説明するが、本発明はこれらによって限定されるものではない。
実施例1 5’脂質修飾2本鎖RNAのルシフェラーゼ遺伝子発現阻害効果
1.ルシフェラーゼ遺伝子をターゲットとした脂質修飾2本鎖RNAの合成
1−1.センス鎖RNA及びアンチセンス鎖RNAの配列
ウミシイタケルシフェラーゼと相同配列を持ち、ウミシイタケルシフェラーゼの遺伝子発現を抑制できる21〜27塩基長のセンス鎖RNAと21〜27塩基長のアンチセンス鎖RNAの2本鎖RNAをデザインした。該二本鎖RNAはアンチセンス鎖とセンス鎖の組み合わせにより様々な形態の二本鎖を形成できる。該2本鎖RNAにおいて、ダングリングエンド(一本鎖領域)を持たない完全2本鎖RNA(センス鎖RNAの5’末端側及び3’末端側が共に平滑末端である2本鎖RNA)をDS (double strand) RNA;二本鎖RNAの両末端にダングリングエンド(オーバーハング)を持つ2本鎖RNAをSi RNA;センス鎖の5’末端を左側に示したときに右側のみにダングリングエンドを持つ2本鎖RNAをRO (Right Overhang) RNA、と名付けた。また、各種2本鎖RNAの命名はセンス鎖をA(A1又はA2)、アンチセンス鎖をBとし、センス鎖及びアンチセンス鎖となる1本鎖RNAの塩基の数を記載することにより区別している。また、センス鎖は2種類のものをデザインしたので区別のためにA1及びA2としている。また、センス鎖の5’末端を脂質で修飾したものについてはセンス鎖RNA名の次にCx(x=16又は12)と記載している。使用したRNAの配列は、以下の通りである。
<センス鎖>
27nt 27A1:5’-CUGGCCUUUCACUACUCCUACGAGCAC-3’(配列番号1)
25nt 25A1:5’-CUGGCCUUUCACUACUCCUACGAGC-3’(配列番号2)
23nt 23A1:5’-CUGGCCUUUCACUACUCCUACGA-3’(配列番号3)
21nt 21A1:5’-CUGGCCUUUCACUACUCCUAC-3’(配列番号4)
21nt 21A2:5’-GGCCUUUCACUACUCCUACGA-3’(配列番号5)
<アンチセンス鎖>
27nt 27B:5’-GUGCUCGUAGGAGUAGUGAAAGGCCAG-3’(配列番号6)
25nt 27B:5’-GCUCGUAGGAGUAGUGAAAGGCCAG -3’(配列番号7)
23nt 27B:5’-UCGUAGGAGUAGUGAAAGGCCAG-3’(配列番号8)
21nt 27B:5’-GUAGGAGUAGUGAAAGGCCAG-3’(配列番号9)
1−2.ルシフェラーゼ遺伝子をターゲットとした脂質未修飾2本鎖RNAの合成
これら上記センス鎖RNA及びアンチセンス鎖を用いて様々な2本鎖RNAを作成した。2本鎖RNAの作成は、universal buffer(林化成株式会社)中、同モルのセンス鎖及びアンチセンス鎖RNAを混合し、92℃で2分間加熱した後、4℃まで徐々に温度を下げることで作成した。合成した各種2本鎖RNAは、20% ポリアクリルアミドゲルを用い、250Vの条件化で60分間電気泳動し、その後、銀染色キット(GEヘルスケア バイオサイエンス)で2本鎖RNAを染色することにより確認した。未修飾の2本鎖RNAの構造を図1Aに示す。
【0058】
1−3.ルシフェラーゼ遺伝子をターゲットとした脂質修飾2本鎖RNAの合成
ルシフェラーゼ遺伝子の発現を抑制できる2本鎖RNAのセンス鎖の5’末端に脂質を結合させた脂質修飾センス鎖RNAを合成した。当該脂質修飾センス鎖RNAにおいて、脂質は上記センス鎖RNAの5’末端に連結されているアミノアルキル基(Amino Modifier C6; Glen Research)を介して共有結合で結合している。脂質修飾センス鎖RNAは、活性エステル基もつ脂質化合物(以下、活性エステル化脂質化合物と表記する)と5’末端をアミノ化修飾したセンス鎖RNAとを液相中で反応させることで合成した(反応式1、2)。
【0059】
【化3】

【0060】
具体的な合成法を以下に示す。センス鎖RNAの5’末端をアミノ化するために、RNA固相合成上で5’-Amino-Modifier C6 (Glen Research)を用いて通常の方法(ホスホロアミダイト合成法)を実施すればよく、これによって、5’末端アミノアルキル基修飾センス鎖RNA(21塩基長)が合成できる。なお、上記5’末端アミノアルキル基修飾センス鎖RNAはHPLC精製、MALDI-TOF MS解析済みのものを林化成株式会社より購入した。合成された5’末端アミノアルキル基修飾センス鎖RNAは、該末端(5’末端側から1番目のヌクレオチドのリン酸残基)に−(CH2)6−NH2が結合されている。合成した1本鎖RNAは、UVスペクトル検出器を用い、260nmの吸光度を測定することにより濃度を算出した。このアミノアルキル基修飾1本鎖RNAと、DMF(N,N-ジメチルホルムアミド)に溶解した活性エステル化脂質化合物[Palmitic acid N-hydroxy succinimide easter(シグマ−アルドリッチ社)、又はラウリン酸-4-ニトロフェニルエステル(TCI)]と、縮合反応条件下で混合して、脂質修飾センス鎖RNAを合成した。反応後、脂質修飾センス鎖RNAが含まれる反応液中の不要な試薬を取り除くため、反応液をHPLCで精製した。HPLC精製は、緩衝液としてA:100% 20mM TEAA(pH 7.0), B:70% CH3CN/20mM TEAA (pH 7.0)を用い、10% B緩衝液から100% B緩衝液を50分のリニアーグラジェントになるよう設定し精製を行った。また、精製用カラムはCAP CELL (4.6 x 150 mm, 5μm;SHISEIDO)を使用した。HPLC解析結果の一例を図2に示す。HPLCにおいて精製された脂質修飾センス鎖RNAは凍結乾燥し、精製水に溶解させた後、UVスペクトル解析により濃度及び合成収率を算出した。
【0061】
以下に脂質修飾センス鎖RNAの構造モデル及び収率を示す。
【0062】
【化4】

【0063】
合成した脂質修飾センス鎖RNAは、アンチセンスRNAと2本鎖を形成させ、脂質修飾2本鎖RNAを得た。2本鎖RNAの形成は、上記と同様の方法で行い、20% ポリアクリルアミドゲル電気泳動により確認した。脂質修飾2本鎖RNAの構造を図1Bに示す。図1Bにおいて、Xはパルミチン酸誘導体を結合させたときはX=16、ラウリン酸誘導体を結合させたときはX=12となる。
【0064】
2.脂質修飾2本鎖RNAの分解酵素耐性
脂質修飾27nt dsRNA(Ds 27A1C16/27B)のヌクレアーゼ耐性を検討した。まず、最終濃度が2 μMになるよう調整したセンス鎖5’-末端脂質修飾27nt dsRNAを10%FBS(三光純薬株式会社)を含むRPMI-1640培地(インビトロジェン)中 (最終量110μl)、37℃でインキュベートし、0h、0.5h、1h、2h、4h、6h、8h、12h、24h、48h後にそれぞれ10μl取り、2μlのローディングダイを含むサンプルチューブに添加した。次いで、分解反応を停止させる為、サンプル採取後すばやく液体窒素中にて凍結し、−20℃にて保存した。得られた産物を20% ポリアクリルアミドゲルを用い250Vで70分間サンプルを電気泳動した。その後、銀染色キット(GEヘルスケア バイオサイエンス)で産物を染色し(染色条件は製品マニュアル参照)、ChemiImager 4000(Alpha Innotech corporation)でゲル解析を行った。また比較として一般に広く使用されている21塩基長からなる21siRNA(si 21A2/21B)及び未修飾27nt dsRNA(Ds 27A1/27B)のヌクレアーゼ耐性結果も同様に評価した。ゲル電気泳動の結果を図3に示す。
【0065】
その結果、21siRNAは血清を含む培地中において速やかに分解されており、1〜2時間程度で21siRNAの消失が確認された。一方、未修飾27nt dsRNA及び脂質修飾27nt dsRNAは、21siRNAに比べ非常に高いヌクレアーゼ耐性を示し、48時間後においても2本鎖RNAは生存していた。この結果から、脂質修飾2本鎖RNAは一般に広く使用されている21siRNAに比べ格段に高い生体内安定性を保有しているという新たな知見が得られた。
【0066】
3.ルシフェラーゼ遺伝子をターゲットとした脂質修飾2本鎖RNAのDicerによるプロセシング
合成した2本鎖RNA及び脂質修飾2本鎖RNAのリコンビナントDicerによるプロセシングを検討した。Dicerによる切断実験は、20mM Tris-HCl(pH 8.0), 15 mM NaCl, 2.5mM Mg2Cl溶液中、0.5 UのリコンビナントDicer(Gene Therapy Systems)と最終濃度2 μMになるよう調整した未修飾2本鎖RNA及び脂質修飾2本鎖RNAをサンプルチューブに10μl準備し、37℃に設定したインキュベーター中、12時間インキュベートした。その後、Dicerによる切断反応を停止させる為に、2μlのDicer Stop Solution (Gene Therapy Systems)を反応溶液に加え、更に2μlのローディングダイを加えた。得られた産物を20% ポリアクリルアミドゲルを用い250Vで70分間サンプルを電気泳動した。その後、銀染色キット(GEヘルスケア バイオサイエンス)で産物を染色し(染色条件は製品マニュアル参照)、ChemiImager4000(Alpha Innotech corporation)でゲル解析を行った。また、コントロールとして未修飾の21siRNA(si 21A2/21B)もゲル電気泳動にて解析した。その結果を図4に示す。
【0067】
得られた結果から、Ds RNA (Ds 27A1/27B、Ds 25A1/25B、Ds 23A1/23B、Ds 21A1/21B)のセンス鎖RNAを脂質で修飾した2本鎖RNAにおいて、Ds 27A1C16/27B及びDs 27A1C12/27BはリコンビナントDicerの働きにより、未修飾21 siRNAと同様の位置にバンドが確認され、Dicerの切断によって2塩基のダングリングエンドを含む21塩基長のsiRNAが生成していることが強く示唆された。また、Ds 25A1C16/25B及びDs 23A1C16/23BにおいてもDicer存在下において21siRNAと同様の位置に新たなバンドが確認され、Dicerによるプロセシングを受けていることが明らかとなった。一方、Ds 21A1C16/21B においてはDicer存在下においても顕著な変化は観察されず、Dicerによるプロセシングを受けていないことが明らかとなった。
【0068】
また、センス鎖RNAの3’末端に2塩基のダングリングエンドを持つRO RNA (RO 27A1/25B、RO 25A1/23B、RO 23A1/21B、RO 21A1/19B)のセンス鎖を脂質で修飾した2本鎖RNAにおいて同様にDicerによるプロセシングを検討した結果、RO 27A1C16/25B、RO 25A1C16/23B、RO 23A1C16/21Bの3種でDicer存在下において21siRNAと同位置に新たなバンドが確認され、Dicerによるプロセシングが行われていることが明らかとなった。特に、RO 27A1C16/25B及びRO 25A1C16/23BはDcierによる顕著なプロセシング効果が確認された。一方、比較的短いRO 21A1C16/19Bにおいては、Dicer存在下においても2本鎖RNAに変化が観測されず、Dicerによるプロセシングを受けていないことが示唆された。
【0069】
更に、センス鎖RNAの3’末端に4塩基のダングリングエンドを持つRO RNA(RO 27A1/23B、RO 25A1/21B)、6塩基のダングリングエンドを持つRO RNA (RO 27A1/21B)のセンス鎖RNAを脂質で修飾した2本鎖RNAについても同様にDicerによるプロセシングを検討した。その結果、上記のRO RNAにおいて全てDicerによるプロセシングを受け21nt siRNAと同位置に新たなバンドが確認された。
【0070】
そして更に、アンチセンス鎖RNAの5’末端にダングリングエンドを持つRO RNA(RO 25A1/27B、RO 23A1/25B、RO 23A1/27B)のセンス鎖を脂質で修飾した2本鎖RNAについても同様にDicerによるプロセシングを検討した。その結果、アンチセンス鎖の5’末端にダングリングエンドを持つ脂質修飾RO RNAは、その一部はDicerによるプロセシングを受け新たなバンドが確認されたが、同時にDicer非存在下時と同様の位置にバンドが確認され、Dicerによるプロセシング速度がDs RNAやその他のRO RNAに比べ遅いということが明らかとなった。
【0071】
4.脂質修飾2本鎖RNAのルシフェラーゼ遺伝子発現抑制
合成した未修飾2本鎖RNA及び脂質修飾2本鎖RNAのRNA干渉効果はウミシイタケルシフェラーゼをターゲットとして評価した。実験前に1x105cell/mlに調整したHeLa細胞(ヒト子宮頸ガン細胞、東北大学加齢医学研究所)を96wellプレート上にそれぞれ100μl撒き、37℃で一晩インキュベートした。翌日、ウェル上の古い培地を取り除き、抗生物質を含まない新しい培地をウェルにそれぞれ80 μl加え、ホタル及びウミシイタケルシフェラーゼを発現するベクター(psiCHECKTM-2 Vector: プロメガ)とLipofectamineTM 2000 (商品名、インビトロジェン)の複合溶液を10μlずつHeLa細胞が入ったそれぞれのウェルに加えた。ここで発現ベクターは1ウェルあたり0.02μgになるように、またLipofectamineTM 2000は1ウェルあたり0.2μlになるよう設定し、OptiMem(インビトロジェン)で必要量を調整した。また、複合体を形成させる為に、発現ベクターとLipofectamineTM 2000をOptiMemを用いて混合した後、室温で30分間インキュベートした。複合溶液を加えた後、細胞を5% CO2 存在下、37℃で4時間インキュベートした。その後、ウミシイタケルシフェラーゼの遺伝配列と相同的なアンチセンス配列を含む未修飾の2本鎖RNA及び末端脂質修飾2本鎖RNA を最終濃度が0nM, 0.2nM, 0.5nM, 1nM, 2nM, 5nM, 10nMになるようLipofectamineTM 2000 (インビトロジェン)と複合体を形成させ、10μlの複合体溶液を発現ベクターを導入したHeLa細胞に加えた。ここで、1ウェルあたりの最終量は100 μlとなる。RNAとLipofectamineTM 2000の複合溶液は、1ウェルあたり5 μlのRNA水溶液と5 μlのLipofectamineTM 2000 (0.2μl)及びOptiMemの溶液を混合し、30分間室温でインキュベートすることにより作成した。RNAを導入させた後、48時間インキュベートしDula-GloTM Luciferase Assay System(プロメガ)を用いてホタル及びウミシイタケルシフェラーゼの発現量をルミノメーター(MicroLumat LB96p: BERTHOLD)で測定し、ホタルルシフェラーゼの発現量をコントロールとしてウミシイタケルシフェラーゼの発現抑制効果を算出した。
【0072】
図5に未修飾2本鎖RNA及び脂質修飾2本鎖RNAの濃度が0.2 nMのときの遺伝子発現抑制効果を示す。その結果、DS RNAやRO RNAのようなセンス鎖RNAの5’末端側が平滑末端である2本鎖RNAに脂質を修飾することにより、脂質が修飾されていない同様の構造の2本鎖RNAに比べ飛躍的なRNA干渉効果の向上が観察された。また、その効果はRO RNAにおけるダングリングエンドの鎖長や位置に関係なく、センス鎖の5’末端を脂質修飾することにより修飾していない同じ構造をもつRO RNAに比べ高いRNA干渉効果が得られた。この結果より、DS RNAやRO RNAといったセンス鎖の5’末端側が平滑末端となっているRNA干渉分子のセンス鎖の5’末端に、脂質修飾を施すことにより飛躍的にRNA干渉効果が向上するという新たな知見が得られた。また、21nt siRNAのセンス鎖の5’末端に脂質を修飾したsi 21A2C16/21B及びsi 21A2C12/21Bについても、未修飾の21nt siRNAに比べ高いRNA干渉効果を奏することが確認された。
【0073】
5.ルシフェラーゼ遺伝子をターゲットとした脂質修飾2本鎖RNAのRNA干渉効果 (遺伝子導入剤なし)
次に、LipofectamineTM 2000等の遺伝子導入剤と使用せず、脂質修飾2本鎖RNA単独で細胞内に導入し、かつ、RNA干渉効果を示すか検討した。
【0074】
実験前に1x105cell/mlに調整したHeLa細胞(ヒト子宮頸ガン細胞、東北大学加齢医学研究所)を96wellプレート上にそれぞれ100μl撒き、37℃で一晩インキュベートした。翌日、ウェル上の古い培地を取り除き、抗生物質を含まない新しい培地をウェルにそれぞれ80μl加え、ホタル及びウミシイタケルシフェラーゼを発現するベクター(psiCHECKTM-2Vector: プロメガ)とLipofectamineTM 2000 (商品名、インビトロジェン)の複合溶液を10μlずつHeLa細胞が入ったそれぞれのウェルに加えた。ここで発現ベクターは1ウェルあたり0.02μgになるように、またLipofectamineTM 2000は1ウェルあたり0.2μlになるよう設定し、OptiMem(インビトロジェン)で必要量を調整した。また、複合体を形成させる為に、発現ベクターとLipofectamineTM 2000をOptiMemを用いて混合した後、室温で30分間インキュベートした。複合溶液を加えた後、細胞を5% CO2 存在下、37℃で4時間インキュベートした。その後、Lipofectamine TM 2000を培地から取り除く為、100 μlの培地でウェルをそれぞれ3回洗浄した。その後、90 μlの抗生物質を含む培地を細胞に加え、ウミシイタケルシフェラーゼの遺伝配列と相同的なアンチセンス配列を含む未修飾2本鎖RNA及び脂質修飾2本鎖RNA型を最終濃度が0nM, 25nM, 50nM, 100nM, 200nM, 400nM, 600n, 800nM, 1μMになるようにOptiMemで調整したサンプル10μlを細胞へ添加し、37℃で48時間インキュベートした。Dula-GloTMLuciferase Assay System(プロメガ)を用いてホタル及びウミシイタケルシフェラーゼの発現量をルミノメーター(MicroLumat LB96p: BERTHOLD)で測定した。また、比較として未修飾の21nt siRNA (si 21A2/21B)及び27nt dsRNA(Ds 27A1/27B)も上記と同様の条件でRNA干渉効果を検討した。
【0075】
RNA干渉効果はホタルルシフェラーゼの発現量をコントロールとしウミシイタケルシフェラーゼの発現量を算出した。終濃度が50nM 〜1μMのときのsi 21A2/21B、Ds 27A1/27B、Ds 27A1C16/27Bの結果を図6Aに、終濃度が25nM 〜800nMのときのDs 23A1/23B、Ds 23A1C16/23Bの結果を図6Bに示す。その結果、パルミチン酸をセンス鎖の5’末端に修飾したDs 27A1C16/27B 及びDs 23A1C16/23Bにおいて、2本鎖RNAの濃度依存的にウミシイタケルシフェラーゼ発現を抑制しており、パルミチン酸を修飾することにより単独でも細胞内へ導入し、RNA干渉反応を起こしていることが明らかとなった。一方、未修飾の2本鎖RNA(si 21A2/21B、Ds 27A1/27B、Ds 23A1/23B)は高濃度領域においても顕著な遺伝子発現抑制効果が確認されなかったことからも、パルミチン酸修飾2本鎖RNAが、細胞内導入能が格段に優れており、遺伝子導入剤を使用しなくても優れた遺伝子発現抑制能を発揮していることが確認された。
【0076】
6.脂質修飾2本鎖RNAの細胞導入性の検討
実験前に1x105 cell/mlに調整したHeLa細胞(ヒト子宮頸ガン細胞、東北大学加齢医学研究所)、A549細胞(ヒト肺ガン細胞、東北大学加齢医学研究所)、SH10-TC細胞(ヒト胃ガン細胞、東北大学加齢医学研究所)及び2x105cell/mlに調整したJurkat細胞(急性リンパ性白血病細胞、東北大学加齢医学研究所)、K-562細胞(慢性骨髄性白血病細胞)を24ウェルプレートにそれぞれ1ml撒き10 % ウシ胎児血清 (FBS:三光純薬株式会社製)及び抗生物質含む培地中、5 % CO2存在下、37 ℃で培養した。ここで用いた抗生物質及び培地について、全ての細胞でストレプトマイシンを抗生物質として、またHeLa細胞はMEM培地(インビトロジェン社)を、その他の細胞はRPMI-1640(インビトロジェン社)を培地として用いた。蛍光ラベル化オリゴヌクレオチド導入前に、抗生物質を含まない培地(450μl)へ交換した。蛍光ラベル化オリゴヌクレオチドは、27ntアンチセンス鎖RNAの5’末端を6-FAMラベル化したものを使用し、未修飾の27nt センス鎖RNA及び5’末端を脂質で修飾した27ntセンス鎖RNAと2本鎖を形成させた。細胞導入実験は、蛍光ラベル化オリゴヌクレオチドとLipofectamineTM 2000 (インビトロジェン社製)との複合体を形成させる為に、10μM の蛍光ラベル化オリゴヌクレオチド水溶液10μlとOptiMem溶液15μlの混合溶液25μlと、LipofectamineTM 2000 (インビトロジェン社製)溶液2μlとOptiMem溶液23μlの混合溶液25μlそれぞれ混ぜ合わせた50μlの混合溶液を室温で30分間インキュベートした。また、LipofectamineTM 2000 (インビトロジェン社製)を使用しない場合(図7中のF;‐LF2000)は、上記複合体形成条件中の2μlのLipofectamineTM 2000溶液をOptiMem溶液に代え、同様の操作でサンプルを調整した。調整した50μlの蛍光ラベル化オリゴヌクレオチド複合体は、上記で準備した450μlの細胞へ添加し(2本鎖RNAの終濃度:200 nM)、5 % CO2存在下、37 ℃で4時間インキュベートした。その後、細胞をPBS(-)又は培地で3回洗浄し、共焦点蛍光レーザー顕微鏡、及びフローサイトメトリーにて細胞導入を評価した。
【0077】
共焦点蛍光レーザー顕微鏡による評価では、Radiance 2000システム(Bio Rad社)を用い、アルゴンレーザーを用いて蛍光を観察した。フローサイトメトリーは、coulter EPICS XL cytometer(Beckman coulter)を用い、細胞10000カウントあたりの細胞導入性について測定した。フローサイトメトリー解析はXL EXPO32TM software (Beckman coulter) を用いた。
【0078】
結果を図7-1〜7-3に示す。図7-3中のF(-LF2000)はLipofectamineTM 2000を使用しなかった場合の結果であり、図7-1〜7-3中のA〜E(+LF2000)はLipofectamineTM 2000を導入剤として使用した場合の結果である。また、図7-1中のAはHeLa細胞、図7-1中のBはA549細胞、図7-2中のCはSH10-TC細胞、図7-2中のDはK-562細胞、図7-3中のEはJurkat細胞に対して、LipofectamineTM 2000を導入剤として用いたときの各種2本鎖RNAの細胞導入性の結果である。また、図7-3中のFはHeLa細胞に対し市販の導入剤を使用しなかったときの各種2本鎖RNAの細胞導入性の結果である。その結果、LipofectamineTM 2000存在下において未修飾2本鎖RNA及び脂質修飾2本鎖RNAは、全ての細胞(HeLa細胞、A549細胞、SH10-TC細胞、Jurkat細胞、K-562細胞)への導入が確認された。特にパルミチン酸をセンス鎖の5’末端に修飾したDs 27A1C16/27Bは未修飾2本鎖RNA及びラウリン酸修飾2本鎖RNAに比べ、非常に高い細胞導入性が共焦点蛍光顕微鏡及びフローサイトメトリーにおいて観測された。また、このパルミチン酸修飾2本鎖RNAは細胞内において積極的に細胞質へ局在化していることが共焦点蛍光顕微鏡観察により示唆された。特に接着細胞(HeLa細胞、A549細胞、SH10-TC細胞)において、その導入性は顕著に表れた。また、LipofectamineTM 2000存在下においてもパルミチン酸修飾2本鎖RNAは未修飾2本鎖RNAに比べ高い細胞導入性がフローサイトメトリー解析により確認された。この結果より、2本鎖RNAのセンス鎖の5’末端にパルミチン酸等の脂質を共有結合させることにより飛躍的に細胞導入性を向上させ、且つ、細胞内において細胞質へ局在化させることが可能であるという知見が得られた。
【0079】
実施例2 5’脂質修飾2本鎖RNAによるVEGF遺伝子発現阻害効果
1.VEGF遺伝子をターゲットとした脂質修飾2本鎖RNAの合成
1−1.センス鎖RNA及びアンチセンス鎖RNAの配列
VEGF(vascular endothelial growth factor: 血管内皮成長因子)と相同配列を持ち、VEGFの遺伝子発現を抑制できる27及び21塩基長のセンス鎖RNAと27及び21塩基長のアンチセンス鎖RNAの2本鎖RNAをデザインした。これらの2本鎖RNAを用いて、以下の実験を行った。なお、27nt dsRNAは、ダングリングエンド(1本鎖領域)を持たない完全2本鎖RNA(センス鎖RNAの5’末端側及び3’末端側が共に平滑末端である2本鎖RNA)であり、21siRNAはセンス鎖RNA及びアンチセンス鎖RNAの双方の3’末端に2塩基のダングリングエンドを持つ2本鎖RNAである。使用した27nt dsRNA及び21siRNAの配列は、以下の通りである。
27nt dsRNA センス鎖 v27A:5’- CUUCCUACAGCACAACAAAUGUGAAUG -3’(配列番号10)
アンチセンス鎖 v27B:3’- GAAGGAUGUCGUGUUGUUUACACUUAC-5’(配列番号11)
21siRNA センス鎖 v21A:5’- UCCUACAGCACAACAAAUGUG-3’(配列番号12)
アンチセンス鎖 v21B:3’- GAAGGAUGUCGUGUUGUUUAC−5’(配列番号13)
1−2.VEGF遺伝子をターゲットとした脂質未修飾2本鎖RNAの合成
これら上記センス鎖RNA及びアンチセンス鎖を用いて、実施例1と同様の方法でアニーリングし2本鎖を形成させ、脂質未修飾2本鎖RNAを得た。2本鎖形成確認は実施例1の同様の方法で20% アクリルアミドゲル電気泳動で確認した。
【0080】
1−3.VEGF遺伝子をターゲットとした脂質修飾2本鎖RNAの合成
VEGF遺伝子の発現を抑制できる上記2本鎖RNAのセンス鎖の5’末端に脂質を結合させた脂質修飾2本鎖RNAを合成した。当該脂質修飾2本鎖RNAにおいて、脂質は上記センス鎖RNAの5’末端に修飾されたアミノアルキル基(Amino Modifier C6; Glen Research)を介して共有結合で結合している。脂質修飾1本鎖RNA(センス鎖)は、実施例1と同様の方法で合成した。
【0081】
以下にVEGF遺伝子をターゲットとした脂質修飾RNAの構造モデル及び収率を示す。
【0082】
【化5】

【0083】
合成した脂質修飾センス鎖RNAは、アンチセンス鎖RNAと2本鎖を形成させることにより、脂質修飾2本鎖RNAを得た。2本鎖の形成は、実施例1と同様の方法で行い、20% ポリアクリルアミドゲル電気泳動により確認した。脂質修飾2本鎖RNAの構造を図8に示す。なお、VEGF遺伝子をターゲットとした脂質修飾RNAにおいても、実施例1とほぼ同様の溶出時間であった。
2.VEGF遺伝子をターゲットとした脂質修飾2本鎖RNAのDicerによるプロセシング
合成した脂質未修飾2本鎖RNA及び脂質修飾2本鎖RNAのリコンビナントDicerによるプロセシングを検討した。Dicerによる切断実験は、実施例1と同様の方法で行った。その結果を図9に示す。
【0084】
その結果、Ds v27AC16/v27B及びDs v27AC12/v27BはリコンビナントDicerの働きにより、未修飾21 siRNAと同様の位置にバンドが確認され、Dicerの切断によって2塩基のダングリングエンドを含む21塩基長のsiRNAが生成していることが強く示唆された。この結果より、27nt dsRNAのセンス鎖の5’末端に脂質を結合させてもDicerによるプロセシングを妨げないことが確認された。一方、si v21AC16/v21B及びsi v21AC12/v21Bは、Dicer存在下でも、非存在下に比べバンドの変化が確認されず、Dicerにプロセシングを受けていないことが明らかとなった。
【0085】
3.脂質修飾2本鎖RNAのVEGF遺伝子発現抑制
末端を修飾していない21nt siRNA、末端を修飾していない27nt dsRNA、センス鎖RNAの5’末端を脂質修飾した27nt dsRNA(末端脂質修飾27nt dsRNA)及びセンス鎖RNAの5’末端を脂質修飾した21nt siRNA(末端脂質修飾21nt siRNA)のVEGF遺伝子発現阻害効果をHeLa細胞(ヒト子宮頸ガン細胞、東北大学加齢医学研究所)、A549細胞(ヒト肺ガン細胞、東北大学加齢医学研究所)、SH10-TC細胞(ヒト胃ガン細胞、東北大学加齢医学研究所)Jurkat細胞(急性リンパ性白血病細胞、東北大学加齢医学研究所)、及びK-562細胞(慢性骨髄性白血病細胞、東北大学加齢医学研究所)を用いて評価した。また、VEGF遺伝子と相同な遺伝子配列を持たない2本鎖RNA(27nt dsRNA(Random)、21nt siRNA(Random))及びそれらの2本鎖RNAのセンスの5‘末端に脂質を結合させた脂質修飾2本鎖RNAについても同様の評価を行った。
【0086】
実験は以下の操作で行った。実験前に1x105 cell/mlに調整したHeLa細胞、A549細胞及びSH10-TC細胞、また、2x105cell/mlに調整したJurkat細胞及びK-562細胞を24wellプレート上にそれぞれ500μl撒き、37℃で一晩インキュベートした。翌日、ウェル上の古い培地を取り除き、抗生物質を含まない新しい培地をウェルにそれぞれ450 μl加えた。ここで、HeLa細胞はMEM培地、その他の細胞はPRMI-1640培地を用いた。VEGFの遺伝配列と相同的なアンチセンス配列を含む未修飾又は脂質修飾2本鎖RNA(25μl)とLipofectamineTM 2000 (インビトロジェン)溶液(25μl)との複合体を形成させ、50μlの2本鎖RNA溶液を450μlの上記細胞に加えた。ここで、1ウェルあたりの最終量は500 μlとなる。RNAとLipofectamineTM 2000の複合溶液は、1ウェルあたり25 μlのRNA水溶液と25 μlのLipofectamineTM 2000 (2μl) 及びOptiMemの溶液を混合し、30分間室温でインキュベートすることにより作成した。RNAを導入させた後、37℃で48時間、5%CO2存在下インキュベートした。インキュベート後、細胞をPBS(-)で3回洗浄し、RNeasy Plus Mini Kit (キアゲン)で細胞中のTotal-RNAを抽出した。その後、VEGFのmRNA量を測定するためにRT-PCR反応を行った。RT-PCR反応用としてQiagen OneStep RT-PCR Kit (キアゲン)を用い行い、VEGF用PCRプライマーとして、5’-CCC TGA TGA GAT CGA GTA CAT CTT-3’(配列番号14)及び5’-ACC GCC TCG GCT TGT CAC-3’(配列番号15)を用いた。またコントロールとしてGAPDH遺伝子を同様の方法で測定した。GAPDH用プライマーとして5’-GGAAAGCTGTGGCGTGATG-3’(配列番号16)及び5’-CTGTTGCTGTAGCCGTATTC-3’(配列番号17)を用いた。RT-PCR反応は、50℃で30分間RT(Reverse Transcripratase)反応を行い、PCR反応として92℃で30秒間2本鎖解離反応、55℃で30秒間アニーリング反応、68℃で45秒間伸長反応を25回〜28回(使用する細胞により異なる)繰り返し行い、最後に68℃で10分間インキュベートし、4℃まで温度を下げ反応を終了した。RT-PCRに用いた試薬、Total-RNA、プライマー等はQiagen OneStep RT-PCR Kit (キアゲン)の反応条件に従い作成した。RT-PCR反応後、ローディングダイを2μl加え、2%アガロースゲルでVEGF及びGAPDHのmRNAからのRT-PCR産物を確認した。遺伝子発現抑制効果の評価は、コントロール細胞(2本鎖RNAを導入していない細胞)のVEGF遺伝子発現量を100%としたときの、2本鎖RNA(未修飾、修飾を含む)を導入した細胞のVEGF発現量を測定することにより行った。また、各細胞間の発現量の誤差はコントロール遺伝子(GAPDH)の遺伝子発現量で補正した。
【0087】
図10-1〜10-3に、VEGFをターゲットとし、2本鎖RNA濃度が200nMの際の未修飾2本鎖RNA及び脂質修飾2本鎖RNAのRNA干渉効果の結果を示す。図10-1中のAはHeLa細胞、図10-2中のBはA549細胞、図10-2中のCはSH10-TC細胞、図10-3中のDはJurkat細胞、図10-3中のEはK-562細胞に対する未修飾2本鎖RNA及び脂質修飾2本鎖RNAのVEGF遺伝子発現抑制効果を示すグラフである。この結果から、27塩基長の2本鎖RNA(Ds v27A/v27B)のセンス鎖の5’末端に脂質を修飾したDs v27AC16/v27B及びDs v27AC12/v27B、及び21塩基長の2本鎖RNA(si v21A/v21B)のセンス鎖の5’末端に脂質を修飾したsi v21AC16/v21B及びsi v21AC12/v21Bは、未修飾の2本鎖RNA(si v21A/21B及びDs v27A/v27B)比べ非常に高いVEGF遺伝子発現抑制効果を保有していることが明らかとなった。特に、パルミチン酸を修飾したDs v27AC16/v27Bは全ての細胞(HeLa細胞、A549細胞、SH10-TC細胞、Jurkat細胞、K-562細胞)において未修飾の2本鎖RNA(si v21A/21B及びDs v27A/v27B)に比べ格段に高い遺伝子発現抑制能を示し、パルミチン酸等の脂質を2本鎖RNAに修飾することによりRNA干渉効果を飛躍的に向上させ得ることが確認された。また、VEGF遺伝子と相同配列を持たない未修飾2本鎖RNA及び脂質修飾2本鎖RNAについても同様に遺伝子発現抑制能を検討したが、その全てにおいて顕著なVEGF遺伝子発現抑制は確認されなかった。この結果より、今回使用したVEGFをターゲットとした2本鎖RNAは配列特異性高く標的遺伝子の発現を抑制していることが明らかとなり、また2本鎖RNAに脂質を結合させることによって細胞に対する副作用をも低減できることが示唆された。
【特許請求の範囲】
【請求項1】
標的遺伝子中の標的配列に相補的な塩基配列を有するセンス鎖RNA、及び該センス鎖RNAに相補的な塩基配列を有するアンチセンス鎖RNAを有し、且つ前記標的遺伝子の発現を抑制できる二本鎖RNAであって、該センス鎖RNAの5’末端から1〜6番目のヌクレオチドの少なくとも1つに直接又はリンカーを介して脂質が結合していることを特徴とする、脂質修飾2本鎖RNA。
【請求項2】
前記センス鎖RNAの5’末端側が平滑末端であり、且つ前記センス鎖RNAの3’末端側が平滑末端又はダングリングエンドを有している、請求項1に記載の脂質修飾2本鎖RNA。
【請求項3】
前記センス鎖RNAの5’末端側及び3’末端側が共にダングリングエンドを有している、請求項1に記載の脂質修飾2本鎖RNA。
【請求項4】
前記センス鎖RNAを構成するヌクレオチドの数が21〜27である、請求項1乃至3のいずれかに記載の脂質修飾2本鎖RNA。
【請求項5】
前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ27個のヌクレオチドから構成されている、請求項2に記載の脂質修飾2本鎖RNA。
【請求項6】
前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ23個のヌクレオチドから構成されている、請求項2に記載の脂質修飾2本鎖RNA。
【請求項7】
前記センス鎖RNAの5’末端側が平滑末端であり、前記センス鎖RNAが25個のヌクレオチドから構成され、且つ前記アンチセンス鎖が23個のヌクレオチドから構成されている、請求項2に記載の脂質修飾2本鎖RNA。
【請求項8】
前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ21個のヌクレオチドから構成されている、請求項3に記載の脂質修飾2本鎖RNA。
【請求項9】
前記脂質が、炭素数6〜50の脂肪酸である、請求項1乃至8のいずれかに記載の脂質修飾2本鎖RNA。
【請求項10】
前記脂質が、ラウリン酸、ステアリン酸、ミリスチン酸、又はパルミチン酸である、請求項1乃至9のいずれかに記載の脂質修飾2本鎖RNA。
【請求項11】
前記センス鎖RNAの5’末端から1〜6番目のヌクレオチドの少なくとも1つに、下記一般式(L-4)で表される構造のリンカーを介して脂質が結合している、請求項1乃至10のいずれかに記載の脂質修飾2本鎖RNA。
【化1】

[式中、n1は、1〜40の整数を示す。]
【請求項12】
請求項1乃至10のいずれかに記載の脂質修飾2本鎖RNAと、薬学的に許容される基剤を含む、医薬組成物。
【請求項13】
標的遺伝子の発現を抑制するための医薬を製造するための、請求項1乃至10のいずれかに記載の脂質修飾2本鎖RNAの使用。
【請求項14】
請求項1乃至10のいずれかに記載の脂質修飾2本鎖RNAを細胞内に導入することにより、標的遺伝子の発現を抑制する、標的遺伝子の発現抑制方法。
【請求項1】
標的遺伝子中の標的配列に相補的な塩基配列を有するセンス鎖RNA、及び該センス鎖RNAに相補的な塩基配列を有するアンチセンス鎖RNAを有し、且つ前記標的遺伝子の発現を抑制できる二本鎖RNAであって、該センス鎖RNAの5’末端から1〜6番目のヌクレオチドの少なくとも1つに直接又はリンカーを介して脂質が結合していることを特徴とする、脂質修飾2本鎖RNA。
【請求項2】
前記センス鎖RNAの5’末端側が平滑末端であり、且つ前記センス鎖RNAの3’末端側が平滑末端又はダングリングエンドを有している、請求項1に記載の脂質修飾2本鎖RNA。
【請求項3】
前記センス鎖RNAの5’末端側及び3’末端側が共にダングリングエンドを有している、請求項1に記載の脂質修飾2本鎖RNA。
【請求項4】
前記センス鎖RNAを構成するヌクレオチドの数が21〜27である、請求項1乃至3のいずれかに記載の脂質修飾2本鎖RNA。
【請求項5】
前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ27個のヌクレオチドから構成されている、請求項2に記載の脂質修飾2本鎖RNA。
【請求項6】
前記センス鎖RNAの5’末端側及び3’末端側が共に平滑末端であり、前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ23個のヌクレオチドから構成されている、請求項2に記載の脂質修飾2本鎖RNA。
【請求項7】
前記センス鎖RNAの5’末端側が平滑末端であり、前記センス鎖RNAが25個のヌクレオチドから構成され、且つ前記アンチセンス鎖が23個のヌクレオチドから構成されている、請求項2に記載の脂質修飾2本鎖RNA。
【請求項8】
前記センス鎖RNA及び前記アンチセンス鎖がそれぞれ21個のヌクレオチドから構成されている、請求項3に記載の脂質修飾2本鎖RNA。
【請求項9】
前記脂質が、炭素数6〜50の脂肪酸である、請求項1乃至8のいずれかに記載の脂質修飾2本鎖RNA。
【請求項10】
前記脂質が、ラウリン酸、ステアリン酸、ミリスチン酸、又はパルミチン酸である、請求項1乃至9のいずれかに記載の脂質修飾2本鎖RNA。
【請求項11】
前記センス鎖RNAの5’末端から1〜6番目のヌクレオチドの少なくとも1つに、下記一般式(L-4)で表される構造のリンカーを介して脂質が結合している、請求項1乃至10のいずれかに記載の脂質修飾2本鎖RNA。
【化1】

[式中、n1は、1〜40の整数を示す。]
【請求項12】
請求項1乃至10のいずれかに記載の脂質修飾2本鎖RNAと、薬学的に許容される基剤を含む、医薬組成物。
【請求項13】
標的遺伝子の発現を抑制するための医薬を製造するための、請求項1乃至10のいずれかに記載の脂質修飾2本鎖RNAの使用。
【請求項14】
請求項1乃至10のいずれかに記載の脂質修飾2本鎖RNAを細胞内に導入することにより、標的遺伝子の発現を抑制する、標的遺伝子の発現抑制方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7−1】


【図7−2】


【図7−3】


【図8】


【図9】


【図10−1】


【図10−2】


【図10−3】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7−1】


【図7−2】


【図7−3】


【図8】


【図9】


【図10−1】


【図10−2】


【図10−3】


【公表番号】特表2011−500002(P2011−500002A)
【公表日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願番号】特願2010−516104(P2010−516104)
【出願日】平成20年10月24日(2008.10.24)
【国際出願番号】PCT/JP2008/069829
【国際公開番号】WO2009/054551
【国際公開日】平成21年4月30日(2009.4.30)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(000206956)大塚製薬株式会社 (230)
【出願人】(504105737)林化成株式会社 (4)
【Fターム(参考)】
【公表日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願日】平成20年10月24日(2008.10.24)
【国際出願番号】PCT/JP2008/069829
【国際公開番号】WO2009/054551
【国際公開日】平成21年4月30日(2009.4.30)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(000206956)大塚製薬株式会社 (230)
【出願人】(504105737)林化成株式会社 (4)
【Fターム(参考)】
[ Back to top ]

