RNA高精度検出用蛍光プローブ
【課題】配列が類似したRNAを高感度で特異的に検出する。
【解決手段】グアニン含有標的核酸を検出可能な準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物であって、前記準安定二重鎖は少なくとも1つのC/I塩基対を有し、前記準安定二重鎖は少なくとも1つのシトシン残基を有する第1鎖と、前記シトシン残基と塩基対形成し得る少なくとも1つのイノシン残基(I)を有する第2鎖から構成され、前記第2鎖は前記イノシン残基を除いて標的核酸に対応する配列を有し、前記準安定二重鎖プローブは標的核酸の存在下に鎖交換を生じて第1鎖と標的核酸の安定二重鎖を生じ得る、準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【解決手段】グアニン含有標的核酸を検出可能な準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物であって、前記準安定二重鎖は少なくとも1つのC/I塩基対を有し、前記準安定二重鎖は少なくとも1つのシトシン残基を有する第1鎖と、前記シトシン残基と塩基対形成し得る少なくとも1つのイノシン残基(I)を有する第2鎖から構成され、前記第2鎖は前記イノシン残基を除いて標的核酸に対応する配列を有し、前記準安定二重鎖プローブは標的核酸の存在下に鎖交換を生じて第1鎖と標的核酸の安定二重鎖を生じ得る、準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物、標的核酸検出用キット及び標的核酸の検出方法に関する。
【背景技術】
【0002】
近年、RNA、特に、生体内においてタンパク質に翻訳されずに機能するノンコーディングRNA(non-coding RNA)に非常に注目が集まっている。さらにその中でもmicro RNAは、高度に保存されている短いRNA分子で、発生、細胞増殖、分化、細胞周期において鍵となる制御物質として作用し、現在では多くのmiRNA配列が知られているが、いまだその機能などに関して未解明な部分も多い。また研究の次なる展開の一つとして、異なる組織間、発生段階、疾病段階におけるmicro RNA発現レベルの分析が注視されている。そのため、これらを簡便かつ正確に検出するための検出法の開発が必要である。
【0003】
これまでにもいくつかの製品が開発されているが、いくつかの問題がある。通常RNAの検出のための方法としては、(i)ポリメラーゼ連鎖反応法(PCR法)、(ii)ハイブリダイゼーション法に分類される。まず、(i)は、RNAを逆転写後、PCRによって増幅して検出する方法であるが、総じて増幅過程を経るために、本来のRNA量との相関関係に大きな疑問が残る方法である。また、(i)、(ii)ともに、標的RNAと非常に類似した配列を有するRNAに対しても認識してしまうという問題点があるため、特定のRNAの高選択的な検出が達成されていなかった。特にmicro RNAにおいては、類似の配列を有しながら、その機能が大きく異なることが示唆されているlet-7群などが存在していることが知られており(非特許文献1:Cell Research (2008) 18, 549-557.)、これらの発現量を精度高く検出できることが重要である。TaqMan(登録商標) MicroRNA Assays (applied biosystems)においてlet-7a,let-7fの識別ができなかったことが示されている(非特許文献2:PNAS, (2007) 104, 11400-11405、図1)また、AmbionのmirVana miRNA Probeにおいては、miRNAの一塩基の違いを見分けることができなかったことがApplied Biosystems のHP(TechNotes 12(2))に示されている(http://www.ambion.com/jp/techlib/tn/122/1.html、図2)。
【0004】
さらに、従来の標的RNAに対してPCRや複数回のハイブリダイゼーションと洗浄作業、蛍光色素等でラベリング処理などが必要であり、安定した結果が得られるためには熟練した技術が必要である。また、従来の製品のいくつかは2塩基または1塩基の違いを識別できるものがあるが、そのためには標的配列ごとの設計が必要となり、時間、コストが必要となる。
【0005】
特許文献1は、競合プローブを用いたハイブリダイゼーションにより標的RNAを検出する方法を開示しているが、配列が極めて類似したRNAの場合、感度及び特異性が十分ではなかった。
【0006】
特許文献2は、核酸の二重らせんを検出する方法を開示するが、RNAの検出感度は十分ではなかった。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平08-116997
【特許文献2】特開2011-173891
【非特許文献】
【0008】
【非特許文献1】Cell Research (2008) 18, 549-557.
【非特許文献2】PNAS, (2007) 104, 11400-11405
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、非常に配列の類似した一群のRNAなどの標的核酸をすべて高感度かつ特異的に検出可能な技術を提供することを主な目的とする。
【課題を解決するための手段】
【0010】
本発明は、以下の標的核酸(DNAまたはRNA)の高精度検出用準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物、標的核酸(DNAまたはRNA、特にRNA)検出用キット、標的核酸(DNAまたはRNA、特にRNA )の検出方法を提供するものである。
項1:グアニン含有標的核酸を検出可能な準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物であって、前記準安定二重鎖は少なくとも1つのC/I塩基対を有し、前記準安定二重鎖は少なくとも1つのシトシン残基を有する第1鎖 と、前記シトシン残基と塩基対形成し得る少なくとも1つのイノシン残基(I)を有する第2鎖 から構成され、前記第2鎖は前記イノシン残基を除いて標的核酸 に対応する配列を有し、前記準安定二重鎖プローブは標的核酸の存在下に鎖交換を生じて第1鎖と標的核酸の安定二重鎖を生じ得る、準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項2:前記第1鎖は、DNA、RNA、LNA(BNA)またはPNA である、項1に記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項3:第1鎖及び/又は第2鎖が蛍光標識されてなる、項1又は2に記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項4:標的核酸がRNAである、項1〜3のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項5:前記第2鎖は、イノシン残基を1個含む、項1〜4のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項6:前記第1鎖が蛍光標識を有し、前記第2鎖が消光(クエンチャー)標識を有する、項1〜5のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項7:項1〜6のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物を含む、標的核酸検出用キット。
項8:項1〜6のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物と標的核酸を有し得る試料を接触させ、標的核酸と第1鎖の安定二重鎖の形成の有無を検出することを特徴とする、標的核酸の検出方法。
【発明の効果】
【0011】
本発明によれば、標的核酸、特に細胞内において、他の遺伝子の発現を調節する機能を有しているとして注目されているmicro-RNAを含むRNA全般に対し非常に高精度かつ高感度に検出することができる。本発明は既存の技術と比較して(i)RNAの評価に際して増幅操作を含まない点、(ii)1塩基レベルの違いを見分けることができる点で優れている。
【0012】
miRNAは20-25塩基程度の1本鎖RNAであり、遺伝子発現を制御しており、ガンから代謝や発生、分化にいたるまでの多くの重要な生物学的プロセスにおいて、マイクロRNAがかかわっていると言われている。miRNAは配列のわずかに異なる一群のRNAが存在しているが、本発明によれば、これまで困難であったRNAの一塩基の違いまでも、増幅操作なく正確に検出することが可能となった。特に、実際、20mer RNA中 (AUACACUGAANUGAAAACUG N = A,G,C,U)のN = Gの配列のみ特異的に検出できることをLet-7aとlet-7fの識別により実証した。 さらに、導入する蛍光色素と消光物質の種類を変えることで、容易に多色での同時検出を達成することができる(例えば3色、4色での同時検出が可能である)。
【0013】
また、蛍光色素(波長)の数だけ同時に標的DNA/RNAの有無が検出できる。
【図面の簡単な説明】
【0014】
【図1】非特許文献2において、TaqMan(登録商標) MicroRNA Assays (applied biosystems)においてlet-7a,let-7fの識別ができなかったことを示す。
【図2】AmbionのmirVana miRNA Probeにおいては、miRNAの一塩基の違いを見分けることができなかったことが記載されたApplied Biosystems のHP(TechNotes 12(2)を示す。
【図3】has-let-7aからhas-let-7iおよびmir-98までの類似したRNA配列を示す。
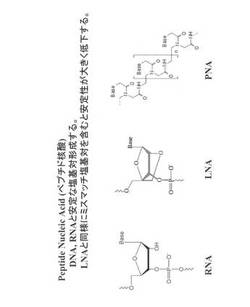
【図4】PNAの構造をLNA(BNA)、RNAと共に示す。
【図5】準安定な二重鎖の設計。図5中、「Full match duplex」は、C/I塩基対がC/G塩基対に置換されて安定になった二重鎖を示し、Full match duplexの塩基対は、C/G,A/TまたはA/Uの3種の塩基対のいずれかから構成される。Full match duplex中のいずれかのグアニン塩基をイノシン塩基に代えることで水素結合1本分不安定な準安定な2重鎖を形成出来る。
【図6】安定二重鎖(Full match)、準安定二重鎖、不安定二重鎖(Mismatch)が標的核酸、非標的核酸の存在下でどのように平衡が移動するのかを示す図である。標的核酸(Full match)が存在すると平衡は安定二重鎖(Full match)を形成するように傾き、非標的核酸(Mismatch)が存在しても準安定二重鎖が不安定二重鎖(Mismatch)よりも安定であるので、不安定二重鎖(Mismatch)は実質的に生成しない。
【図7】第1鎖に蛍光標識(F)、第2鎖に消光標識(クエンチャー、Q)を結合した場合を示す。準安定な二重鎖はFull match配列のDNA,RNAが存在するときのみ鎖交換を起こし、蛍光を発する。
【図8】DNA,RNA duplexとPNA/DNA,RNA duplexの安定性の違いを示す。PNA(peptide Nucleic Acid)を用いることでFull match とMismatchの安定性の差を大きくできる。
【図9】準安定二重鎖プローブの設計。 図9は、標的核酸がDNAの場合を示しているが、標的核酸がRNAの場合にも同様に準安定二重鎖プローブを設計できる。
【図10】準安定二重鎖プローブを用いたDNA識別能の評価
【図11】検出波長を設計する方法を示す。蛍光物質と消光物質の組み合わせを変えることで、2種以上の標的核酸を1回の試験で検出することができる。
【図12】検出塩基を設計する方法を示す。蛍光物質と消光物質の組み合わせを変えることで、2種以上の標的核酸を1回の試験で検出することができる。
【図13】2波長を用いた一塩基レベルのターゲット配列認識。
【図14】RNA配列の認識
【図15】ALDH2 全長mRNAの検出
【図16】ALDH2 全長mRNAの検出
【図17】target DNA の検出領域。100 nM のプローブで5 nMのターゲットDNAのSNP識別が可能であることが実証された。
【図18】let-7aとlet-7fの区別が可能であることを示す。
【図19】ゲルシフトアッセイの結果(コントロールも含む)を示す。
【発明を実施するための形態】
【0015】
本明細書において、標的核酸としては、DNA、RNAが挙げられるが、RNAが好ましい。RNAとしては、mRNA、tRNA、miRNAなどが挙げられ、miRNAが特に好ましい標的核酸である。 RNAは主に4種類の塩基から構成され、細胞内には十数塩基から数千塩基を超えるものまで様々なRNAが存在し、類似配列のRNAが細胞内に多数存在するため、特定のRNAのみを検出することは容易ではない。例えばmiRNAであるlet-7 familyは、図3に示すようなhas-let-7aからhas-let-7i, mir-98までの類似した配列を有し、これらを識別するには一塩基レベルで配列を認識できるプローブが必要であるが、本発明の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物を使用すれば図18に示すように識別可能である。
【0016】
標的核酸の長さは、核酸塩基の数が15以上、好ましくは20以上であれば良く、上限は特になく、数百から数千の塩基を有する標的核酸を識別することができる。
【0017】
本発明の準安定二重鎖プローブは、アデニン、グアニン、シトシン、チミン、ウラシル、イノシンなどの核酸塩基の塩基対により2つの鎖が結合したものであればよく、DNA、RNA、LNA(BNA)、PNAなどのいずれであってもよい。LNA(BNA)、PNAなどは、シトシン残基を含有する第1鎖に適用することが望ましく、第2鎖はGをIに変更した以外は標的核酸と同じ種類の核酸(DNA又はRNA)であるのが好ましい。 RNA、LNA(BNA)、PNAの構造を図4に示す。LNA(BNA)、PNAなどは、標的核酸がハイブリダイズした安定二重鎖(Full match duplex)と、配列が類似する非標的核酸が結合した不安定二重鎖(Mismatch duplex)との安定性の差が大きくなり、配列識別能の向上する(図5〜8)。
【0018】
本発明のプローブは、準安定二重鎖プローブを予め形成させて用いても良く、準安定二重鎖プローブを構成する第1鎖と第2鎖を含む組成物として用いても良い。該組成物は、単独で溶液中で反応させると準安定二重鎖プローブを形成するが、標的核酸と反応させた場合、予め二重鎖を形成させていると、第1鎖と第2鎖の鎖分離を行った後に標的核酸が第1鎖と結合することになるので、例えば第1鎖と第2鎖は各々合成して粉末状で混合するか、別々の溶液を作成して試料中で混合して準安定二重鎖プローブを形成できる条件においてもよい。本発明の組成物では、シトシン含有第1鎖とイノシン含有第2鎖を等モルないし等量用いてもよく、第2鎖を過剰に用いてもよい。第1鎖に蛍光標識し、第2鎖に消光標識した場合、第2鎖は等モル〜過剰量で使用するのがよい。
【0019】
本明細書において、シトシン残基(C)とイノシン残基(I)の塩基対を「C/I」と表記する。同様に、アデニン残基(A)とウラシル残基(U)の塩基対は「A/U」;アデニン残基(A)とチミン残基(T)の塩基対は「A/T」;シトシン残基(C)とグアニン残基(G)の塩基対は「C/G」と各々表記する。
【0020】
「準安定二重鎖」とは、少なくとも1個のシトシン残基(C)とイノシン残基(I)の塩基対(C/I)を有する二重鎖を指す。準安定二重鎖は、通常1個又は2個、特に1個のC/Iを有するが、準安定二重鎖が長くなるにつれて、C/Iを2個以上有することが可能である。準安定二重鎖が30個以下の塩基対を有する場合には、C/I塩基対を通常1個有する。準安定二重鎖の長さが50塩基以上、例えば100塩基以上であるような長い二重鎖である場合には、長さに比例してイノシン残基の数を多くすることができる。また、準安定二重鎖におけるG/C含量が高い場合には、それに応じてイノシン残基の数を多くすることができる。
【0021】
「安定二重鎖(Full match duplex)」とは、C/GとA/T、或いはC/GとA/Uの2種の塩基対の組み合わせのいずれかから構成される二重鎖を指し、例えば標的核酸がRNAの場合にはC/GとA/Uの2種の塩基対の組み合わせ、標的核酸がDNAの場合にはC/G、A/Tの2種の塩基対の組み合わせから安定二重鎖は構成されてもよい。
【0022】
「不安定二重鎖(Mismatch duplex)」とは、第1鎖の配列に含まれるいずれかの塩基対が一つ以上相補鎖を形成していないものである。「不安定二重鎖(Mismatch duplex)」に含まれるミスマッチの位置は、端部であっても中央部であっても良い。
【0023】
「第2鎖は前記イノシン残基を除いて標的核酸に対応する配列を有する」とは、イノシン残基以外の第2鎖の核酸残基(A、T、C、G、U)は、標的核酸とA/TもしくはA/U、C/Gの塩基対を形成するような塩基であることを意味する。
【0024】
第2鎖のイノシン残基(I)の位置は、端部であっても中央部であっても良いが、中央部又はそれに近い位置にイノシン残基を有するのが、感度、特異性を向上するために好ましい。
【0025】
グアニン含有標的核酸のうち、グアニン部位をイノシン残基に置換したものが第2鎖であり、標的核酸がDNAの場合には、第2鎖はDNA、標的核酸がRNAの場合には第2鎖はRNAで構成されるのが好ましい。
【0026】
図5に示すように、本発明の準安定二重鎖プローブに標的核酸が共存すると、標的核酸とシトシン残基を含有する第1鎖との二重鎖がより安定になるために、準安定二重鎖の第2鎖と標的核酸の鎖交換が起こる。標的核酸とシトシン残基を含有する第1鎖との二重鎖は、準安定二重鎖のC/IがC/Gに置換されたものであり、安定二重鎖(Full match duplex)となる。一方、本発明の準安定二重鎖プローブのいずれか位置に配列が異なる非標的核酸が共存すると、非標的核酸とシトシン残基を含有する第1鎖との二重鎖は準安定二重鎖よりも安定性が低い二重鎖(Mismatch duplex)であるため、鎖交換が生じることはなく、準安定二重鎖はそのまま存在する。
【0027】
標的核酸を含み得るサンプルと本発明の準安定二重鎖プローブの鎖交換は、室温で行ってもよいが、加熱条件下に行うのが好ましい。加熱条件は、例えば50〜100℃、好ましくは60〜95℃程度、より好ましくは70〜90℃程度である。鎖交換の反応時間は、0.1分〜1時間程度、好ましくは0.2〜30分程度、より好ましくは0.3〜10分程度、さらに好ましくは0.4〜5分程度、特に0.5〜3分程度である。温度が低いほど鎖交換反応に時間がかかるので、反応条件は、適宜選択できる。
【0028】
このように、標的核酸のみが準安定二重鎖プローブと鎖交換を生じるため、1塩基の相違を鋭敏に検出することができ、高感度かつ特異的に標的核酸を検出できる。
【0029】
本発明の準安定二重鎖プローブを構成する第1鎖、第2鎖は、塩基配列のみから構成されても良いが、水溶性を向上させるために一方又は両方の末端に水溶性の基を結合させることができる。このような水溶性の基としては、アミノ酸又はペプチド、ポリエチレングリコール(PEG)などのポリエーテル基、糖鎖などが挙げられる。アミノ酸又はペプチドは、核酸との結合の場合、塩基性のアミノ酸(Arg,Lys,His、好ましくはLys)または塩基性アミノ酸を含むペプチド(例えばKKK)が、電荷の中和と水溶性の付与を兼ねているので好ましいが、酸性アミノ酸(Glu、Aspなど)も水溶性を付与するために使用可能である。さらにSerなどの中性かつ水溶性のアミノ酸を使用することもでき、酸性、中性、塩基性アミノ酸を適宜組み合わせて使用することもできる。 また、蛍光物質とクエンチャーの位置関係を調整するために、例えばAEEAのような任意のスペーサーを結合させてもよい。
【0030】
図6に示すように、標的核酸の配列と相補的な第1鎖(PNA、DNA、RNA、LNA(BNA)などで良い)に対し、適切な蛍光色素を修飾する。その第1鎖に対して標的RNAよりも不安定な第2鎖(具体的には、GをIに置換することで水素結合1本分だけ安定性が落ちるdecoy RNA)に消光物質を修飾したものを用意する。そうすることで、標的RNAが存在しない場合、第1鎖と第2鎖(decoy RNA)が相補鎖を形成するため、蛍光がoffの状態となる。そこに標的RNAが存在すると、鎖交換がおこり、蛍光が回復することになる。特筆すべきは、標的RNAと比べ、わずか1塩基しか異ならないRNA(偽RNA)が存在した場合、decoy RNAの方が安定であるため、鎖交換は起こらない。つまり、従来法に比べると、標的RNA以外の偽RNAが共存していてもそれらとは応答しないため、高選択的に検出することができる。準安定二重鎖プローブに対し、このような蛍光物質と消光物質で標識した本発明の好ましい実施形態の特徴としては、以下が挙げられる:
(i)標的RNAの存在を、蛍光強度を測定するだけの簡便な操作によって評価できる。
(ii) 準安定二重鎖プローブとして標的RNAよりもわずか水素結合1本分だけ不安定なイノシン-グアニン塩基対を利用すること。
(iii)標的配列を含む1本鎖または2重鎖のDNA存在下でもRNAのみを特異的に検出できる。
(iv)標的RNAに対する処理(PCR増幅蛍光色素での標識)が必要ない。
(v)標的RNAに対するプローブの設計が容易である。
【0031】
準安定二重鎖プローブ又は組成物の第2鎖のプローブの設計方法を図9に示す。図9に示すように、第2鎖は、標的核酸の少なくとも1個のGをIに変えることにより容易に設計できる。
【0032】
準安定二重鎖プローブは、蛍光標識を有するのが好ましい。図7は準安定二重鎖プローブが蛍光標識を有する場合を示す。標識のための蛍光物質としては、FAM(5−または6−カルボキシフルオレセイン)、VIC、NED、フルオレセイン、FITC、IRD−700/800、CY2、CY3、CY5、CY3.5、CY5.5、HEX、TET、TAMRA 、 SNARF、SNAFL、Naphtofluorescein、JOE、ROX、BODIPY TMR、オレゴングリーン、ローダミングリーン、ローダミンレッド、テキサスレッド、ヤキマイエロー、アレクシアフルオレ(Alexa Fluor)PET、バイオサーチブルー(商標)、マリーナブルー(登録商標)、ボセルブルー(登録商標)、アレクシアフルオレ(登録商標)、350FAM(商標)、SYBR(登録商標)グリーン1、フルオレセイン、エバグリーン(商標)、アレクシアフルオレ(登録商標)488 JOE(商標)、VIC(商標)、HEX(商標)、TET(商標)、カルフルオレ(CAL Fluor)(登録商標)ゴールド540、ヤキマイエロー(登録商標)、ROX(商標)、カルフルオレ(登録商標)レッド610、Cy3.5(商標)、テキサスレッド(登録商標)、アレクシアフルオレ(登録商標)、568Cy5(商標)、クエーサー(Quasar)(商標)670、ライトサイクラー(Light Cycler)レッド640(登録商標)、アレクシアフルオレ633クエーサー(商標)705、ライトサイクラーレッド705(登録商標)、アレクシアフルオレ(登録商標)680、SYTO(登録商標)9、LCグリーン(登録商標)、LCグリーン(登録商標)プラス、エバグリーン(商標)、ナフタレン、ピレン、ペリレン、アントラセン、ペンタセン、ダンシル(Dansyl)、コロネン、量子ドットなどが挙げられる。
【0033】
準安定二重鎖プローブは、二重鎖が結合しているときには消光し、標的核酸との鎖交換が生じたときには発光するような蛍光物質と消光物質(クエンチャー)の組み合わせが好ましい(図5)。このような組み合わせとしては、以下のCy5とBHQ3、Cy3とBHQ2、FAMとBHQ1、Cy2とBHQ1、CoumarinとDabsyl 、BHQ1とTET、BHQ2とHEX、BHQ2とJOE、BHQ0とAlexa(登録商標)350、BHQ0とPacific Blue、BHQ0とDansyl、BHQ0とCY2、BHQ1とFAM、BHQ1とJOE、BHQ1とOrenge Green(登録商標)、BHQ2とTAMRA、BHQ2とCAL Fluore Red、BHQ2とROX、BHQ2とQuasar 570、BHQ2とQuasar670、BHQ3とCAL Fluore Red、BHQ3とQuasar670
などが挙げられる。
【0034】
図11に示すように、蛍光物質と蛍光波長の組み合わせを選択することで、検出波長を任意に選択することができる。
【0035】
図12に示すように、蛍光物質と消光物質の組み合わせを複数使用し、各々に異なる検出塩基を適用することで、検出塩基を容易に変更できる。
【0036】
蛍光物質は第1鎖に結合され、消光物質は第2鎖に結合されるのがよいが、蛍光物質が第2鎖に結合され、消光物質が第1鎖に結合されてもよい。このような構成によると、蛍光の測定により、標的核酸の有無を検出できる。
【0037】
従来、RNA検出キットとして、例えば以下の(i)〜(v)の商品が市販されている。本発明の準安定二重鎖プローブまたは組成物は、これらキットにさらに加えることで、従来のキットと同様の条件で反応させることができ、感度及び特異性をさらに向上させることができる。
(i) Applied Biosystems: TaqMan(登録商標) MicroRNA Assays
(ii) Ambion: mirVana miRNA Probe
(iii) EXIQON: miRCURY probe (miRCURY LNA microRNA Array)
(iv) Veritas: QuantiGene 2.0 miRNA Assay
(v) TORAY: miRNA Oligo chip
【0038】
準安定二重鎖プローブまたは組成物は、標的核酸が少なくとも1 nM〜1μMの範囲では測定可能であるが、蛍光物質の測定感度を向上させることで、さらに低濃度の標的核酸を検出することも可能である。
【0039】
本発明のプローブは、標的核酸と等量から100倍量(好ましくは3〜10倍量)又はそれ以上検出系中に存在するのが好ましく、図17に示すように、 準安定二重鎖プローブが100 nMの濃度の際に、5 nM-1 mMの濃度範囲にて標的核酸を有意な差として検出することができる。
【0040】
これらは、検出対象となるRNAなどの標的核酸が1塩基のみの相違の場合にも検出できることを示している。
【0041】
標的核酸(DNAまたはRNA)を含むサンプルに、イノシン残基含有第2鎖(DNAまたはRNA)或いはそれを含む準安定二重鎖プローブを加え、従来のマイクロアレイにアニーリングを行うことでマイクロアレイの精度の向上が期待できる。その他、サザンブロッティング、ノーザンブロッティングなどのハイブリダイゼーションを用いた様々なキットの精度向上が期待できる。
【0042】
本発明の準安定二重鎖プローブは、適切な蛍光標識を結合させることで、洗浄操作が不要になり、生細胞において標的核酸を検出することもでき、細胞破砕液において標的核酸を検出することもできる。
【0043】
本発明の検出方法は非常に高感度かつ特異的であり、1個の細胞における標的核酸を検出し得る。
【実施例】
【0044】
以下、本発明を実施例に基づきより詳細に説明するが、本発明がこれら実施例に限定されないことはいうまでもない。
【0045】
実施例1
(1)PNA合成
ペプチド自動合成機(SHIMADZU PSSM-8)を用いてペプチド固相合成法(Fmoc法)で合成を行った。担体にはFmocLys(Boc)-Alko-PEG-Resin(0.21 mmol/g, 100-200 mesh, 1%DVB) 10 mgを用い、各PNAモノマー及びアミノ酸を伸長させた。NMP(N-メチルピロリドン)に溶解させたそれぞれのモノマーFmoc-A(Bhoc)aeg-OH (10.0 mg, 5 eq.), Fmoc-G(Bhoc)aeg-OH (10.2 mg, 5 eq.), Fmoc-C(Bhoc)aeg-OH (9.6 mg, 5 eq.), Fmoc-Taeg-OH (7.0 mg, 5 eq.), Fmoc-Lys(Boc)-OH(4.9 mg, 5 eq.), Fmoc-AEEA-OH(4.9 mg, 5 eq.)を0.3 M HBTU/HOBt(35 ul, 5eq.), 1M N,N-diisopropylethylamine (23 ul, 5 eq.)中で30分反応させた。Fmoc保護基の脱保護には30%ピペリジン(500 ul)を用い2回行った。合成後、90% トリフルオロ酢酸(TFA)、10% m-クレゾール 1mlで3時間切り出し、脱保護を行い、冷エーテルで沈殿させた後、HPLC で精製を行った。
【0046】
合成PNAのリストとMSの結果を表1に示す。
【0047】
【表1】

【0048】
(2)DNA合成
株式会社ジーンデザインに以下の配列のDNA合成を依頼した。
【0049】
合成DNAのリストと精製方法を以下の表2に示す。DNAの確認はMS(質量分析)により行った。
【0050】
【表2】

【0051】
RNA合成
表3に示すALDH2 cRNA(rI)-BHQ3は株式会社ジーンデザインに作製を依頼した。
【0052】
表3のlet-7a dI-RNA-BHQ3はDNA/RNA自動合成機(Applied Biosystems 392 DNA/RNA synthesizer)を用いて合成した。合成後、28%アンモニア水中で切り出し、脱保護(室温、12時間)後、凍結乾燥した。これを無水DMSO中(100 ul)で1M tetrabutylammonium fluoride (in THF, 50 ul)で60℃で1時間処理し、HPLCで精製した。
【0053】
目的RNA配列の5’側にT7プロモーター配列(TAATA CGACT CACTA TAGGG)を付加したDNAテンプレート(50 uM, 2 ul)、100 mM DTT (10 ul), 10 x reaction buffer (10 ul), 25 mM rNTP(30 ul), T7 RNA polymerase (10 ul)、精製水(38 ul)を37℃で2.5時間反応させた。反応後、8%PAGEで精製を行った。
【0054】
【表3】

【0055】
RNA検出
10 uM PNA (1 uL), 30 uM decoy RNA (1uL), 10x PBS buffer (1uL) 1 mg/mL BSA (1 uL) MQ水 (6 uL)を混合し、80℃で1分間加熱処理を行った。その後、室温で冷却することで10xプローブ溶液を調整した。この10xプローブ溶液2 uLを、各標的RNAサンプル18 uLに加え、80 ℃で1分間加熱処理を行った。その後、室温で冷却し、それぞれのサンプルの蛍光強度をTECAN infinite 200 PROで測定した。結果を図14に示す。また、図15に示すALDH2 全長mRNAの検出についても同様に検出できることを確認した(図16)。
【0056】
DNA検出
10 uM PNA (1 uL), 30 uM decoy DNA (1uL), 10x PBS buffer (1uL) 1 mg/mL BSA (1 uL) 水 (6 uL)を混合し、95℃で3分間加熱処理を行った。その後、室温で冷却することで10xプローブ溶液を調整した。 この10xプローブ溶液2 uLを、各標的DNAサンプル18 uLに加え、95 ℃で3分間加熱処理を行った。その後、室温で冷却し、それぞれのサンプルの蛍光強度をTECAN infinite 200 PRO で測定した。DNA識別能の評価結果を図10、図11、図12、図13に各々示す。
【0057】
DNA検出プローブの結果、本発明の準安定二重鎖プローブを用いてDNA塩基配列20塩基のうち、僅か一塩基の違いを識別することに成功した(図10、図11、図12、図13)。
【0058】
本発明の準安定二重鎖プローブ又は該プローブを形成可能な組成物は、以下の利点を有する。
・プローブの励起波長/検出波長を任意に選ぶことができる。
・標的配列、検出塩基を簡単に設計できる。
・多数の標的核酸を同時に検出することができる。
【0059】
DNAを含む準安定二重鎖プローブ(例えば、PNA/DNA)をRNAを含む準安定二重鎖プローブ(例えば、PNA/RNA)にするだけでRNAの配列選択的なプローブは容易に得られる。
【0060】
ゲルシフトアッセイ(DNA)
10 uM DNA(2uL), PNK (10 U/uL, 0.8 uL), 10x PNK buffer (2 uL), γ32P-ATP(1.66 uM, 2 uL) 水(13.2 uL)を混合し、37℃で2時間インキュベーションした。これに精製水を30 uL加え、100 uLのフェノール/クロロホルム処理を行い、水相を1x PBSで置換したBio-spin 6 columnsで精製した。これを未ラベルDNA 111 nMに1000 count/uLになるように加え、標的DNA溶液とした。
【0061】
また、10 uM PNA (1 uL), 30 uM decoy DNA (1uL), 10x PBS buffer (1uL) 1 mg/mL BSA (1 uL) 30% スクロース(w/v) (2 uL) MQ水 (4 uL)を混合し、95℃で3分間加熱処理を行った。その後、室温で冷却することで10xプローブ溶液を調整した。
【0062】
この10xプローブ溶液2 uLを、各標的DNA溶液18 uL (6% スクロース) に加え、95 ℃で3分間加熱処理を行った。その後、室温で30分放置した。この溶液4 uLを、15% ポリアクリルアミドゲル(1x TBE buffer,)で150 V, 45分間泳動した後、GE healthcare社製phosphor imager STORM820にてSCAN画像を取得した。
【0063】
ゲルシフトアッセイによられたアクリルアミドゲルのイメージ結果を図19に示す。
【0064】
1x PBS bufferの組成を以下に示す。
KCl 200 mg/L
KH2PO4 200 mg/L
NaCl 8 g/L
Na2HPO4 1.15 g/L
【産業上の利用可能性】
【0065】
本発明の好ましいプローブは、DNA、RNAともに同じ方法でプローブが設計できる、目的配列に制限がほとんどない、設計が簡単である、配列選択性が高い、検出波長に制限がない、蛍光色素(波長)の数だけ同時にターゲットDNA/RNAの有無が検出できるなどの特徴を有し、標的核酸によって線上条件を検討する必要はなく、DNAないしRNA検出用キットおよびその受託サービスに適している。
【技術分野】
【0001】
本発明は、準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物、標的核酸検出用キット及び標的核酸の検出方法に関する。
【背景技術】
【0002】
近年、RNA、特に、生体内においてタンパク質に翻訳されずに機能するノンコーディングRNA(non-coding RNA)に非常に注目が集まっている。さらにその中でもmicro RNAは、高度に保存されている短いRNA分子で、発生、細胞増殖、分化、細胞周期において鍵となる制御物質として作用し、現在では多くのmiRNA配列が知られているが、いまだその機能などに関して未解明な部分も多い。また研究の次なる展開の一つとして、異なる組織間、発生段階、疾病段階におけるmicro RNA発現レベルの分析が注視されている。そのため、これらを簡便かつ正確に検出するための検出法の開発が必要である。
【0003】
これまでにもいくつかの製品が開発されているが、いくつかの問題がある。通常RNAの検出のための方法としては、(i)ポリメラーゼ連鎖反応法(PCR法)、(ii)ハイブリダイゼーション法に分類される。まず、(i)は、RNAを逆転写後、PCRによって増幅して検出する方法であるが、総じて増幅過程を経るために、本来のRNA量との相関関係に大きな疑問が残る方法である。また、(i)、(ii)ともに、標的RNAと非常に類似した配列を有するRNAに対しても認識してしまうという問題点があるため、特定のRNAの高選択的な検出が達成されていなかった。特にmicro RNAにおいては、類似の配列を有しながら、その機能が大きく異なることが示唆されているlet-7群などが存在していることが知られており(非特許文献1:Cell Research (2008) 18, 549-557.)、これらの発現量を精度高く検出できることが重要である。TaqMan(登録商標) MicroRNA Assays (applied biosystems)においてlet-7a,let-7fの識別ができなかったことが示されている(非特許文献2:PNAS, (2007) 104, 11400-11405、図1)また、AmbionのmirVana miRNA Probeにおいては、miRNAの一塩基の違いを見分けることができなかったことがApplied Biosystems のHP(TechNotes 12(2))に示されている(http://www.ambion.com/jp/techlib/tn/122/1.html、図2)。
【0004】
さらに、従来の標的RNAに対してPCRや複数回のハイブリダイゼーションと洗浄作業、蛍光色素等でラベリング処理などが必要であり、安定した結果が得られるためには熟練した技術が必要である。また、従来の製品のいくつかは2塩基または1塩基の違いを識別できるものがあるが、そのためには標的配列ごとの設計が必要となり、時間、コストが必要となる。
【0005】
特許文献1は、競合プローブを用いたハイブリダイゼーションにより標的RNAを検出する方法を開示しているが、配列が極めて類似したRNAの場合、感度及び特異性が十分ではなかった。
【0006】
特許文献2は、核酸の二重らせんを検出する方法を開示するが、RNAの検出感度は十分ではなかった。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平08-116997
【特許文献2】特開2011-173891
【非特許文献】
【0008】
【非特許文献1】Cell Research (2008) 18, 549-557.
【非特許文献2】PNAS, (2007) 104, 11400-11405
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、非常に配列の類似した一群のRNAなどの標的核酸をすべて高感度かつ特異的に検出可能な技術を提供することを主な目的とする。
【課題を解決するための手段】
【0010】
本発明は、以下の標的核酸(DNAまたはRNA)の高精度検出用準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物、標的核酸(DNAまたはRNA、特にRNA)検出用キット、標的核酸(DNAまたはRNA、特にRNA )の検出方法を提供するものである。
項1:グアニン含有標的核酸を検出可能な準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物であって、前記準安定二重鎖は少なくとも1つのC/I塩基対を有し、前記準安定二重鎖は少なくとも1つのシトシン残基を有する第1鎖 と、前記シトシン残基と塩基対形成し得る少なくとも1つのイノシン残基(I)を有する第2鎖 から構成され、前記第2鎖は前記イノシン残基を除いて標的核酸 に対応する配列を有し、前記準安定二重鎖プローブは標的核酸の存在下に鎖交換を生じて第1鎖と標的核酸の安定二重鎖を生じ得る、準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項2:前記第1鎖は、DNA、RNA、LNA(BNA)またはPNA である、項1に記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項3:第1鎖及び/又は第2鎖が蛍光標識されてなる、項1又は2に記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項4:標的核酸がRNAである、項1〜3のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項5:前記第2鎖は、イノシン残基を1個含む、項1〜4のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項6:前記第1鎖が蛍光標識を有し、前記第2鎖が消光(クエンチャー)標識を有する、項1〜5のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
項7:項1〜6のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物を含む、標的核酸検出用キット。
項8:項1〜6のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物と標的核酸を有し得る試料を接触させ、標的核酸と第1鎖の安定二重鎖の形成の有無を検出することを特徴とする、標的核酸の検出方法。
【発明の効果】
【0011】
本発明によれば、標的核酸、特に細胞内において、他の遺伝子の発現を調節する機能を有しているとして注目されているmicro-RNAを含むRNA全般に対し非常に高精度かつ高感度に検出することができる。本発明は既存の技術と比較して(i)RNAの評価に際して増幅操作を含まない点、(ii)1塩基レベルの違いを見分けることができる点で優れている。
【0012】
miRNAは20-25塩基程度の1本鎖RNAであり、遺伝子発現を制御しており、ガンから代謝や発生、分化にいたるまでの多くの重要な生物学的プロセスにおいて、マイクロRNAがかかわっていると言われている。miRNAは配列のわずかに異なる一群のRNAが存在しているが、本発明によれば、これまで困難であったRNAの一塩基の違いまでも、増幅操作なく正確に検出することが可能となった。特に、実際、20mer RNA中 (AUACACUGAANUGAAAACUG N = A,G,C,U)のN = Gの配列のみ特異的に検出できることをLet-7aとlet-7fの識別により実証した。 さらに、導入する蛍光色素と消光物質の種類を変えることで、容易に多色での同時検出を達成することができる(例えば3色、4色での同時検出が可能である)。
【0013】
また、蛍光色素(波長)の数だけ同時に標的DNA/RNAの有無が検出できる。
【図面の簡単な説明】
【0014】
【図1】非特許文献2において、TaqMan(登録商標) MicroRNA Assays (applied biosystems)においてlet-7a,let-7fの識別ができなかったことを示す。
【図2】AmbionのmirVana miRNA Probeにおいては、miRNAの一塩基の違いを見分けることができなかったことが記載されたApplied Biosystems のHP(TechNotes 12(2)を示す。
【図3】has-let-7aからhas-let-7iおよびmir-98までの類似したRNA配列を示す。
【図4】PNAの構造をLNA(BNA)、RNAと共に示す。
【図5】準安定な二重鎖の設計。図5中、「Full match duplex」は、C/I塩基対がC/G塩基対に置換されて安定になった二重鎖を示し、Full match duplexの塩基対は、C/G,A/TまたはA/Uの3種の塩基対のいずれかから構成される。Full match duplex中のいずれかのグアニン塩基をイノシン塩基に代えることで水素結合1本分不安定な準安定な2重鎖を形成出来る。
【図6】安定二重鎖(Full match)、準安定二重鎖、不安定二重鎖(Mismatch)が標的核酸、非標的核酸の存在下でどのように平衡が移動するのかを示す図である。標的核酸(Full match)が存在すると平衡は安定二重鎖(Full match)を形成するように傾き、非標的核酸(Mismatch)が存在しても準安定二重鎖が不安定二重鎖(Mismatch)よりも安定であるので、不安定二重鎖(Mismatch)は実質的に生成しない。
【図7】第1鎖に蛍光標識(F)、第2鎖に消光標識(クエンチャー、Q)を結合した場合を示す。準安定な二重鎖はFull match配列のDNA,RNAが存在するときのみ鎖交換を起こし、蛍光を発する。
【図8】DNA,RNA duplexとPNA/DNA,RNA duplexの安定性の違いを示す。PNA(peptide Nucleic Acid)を用いることでFull match とMismatchの安定性の差を大きくできる。
【図9】準安定二重鎖プローブの設計。 図9は、標的核酸がDNAの場合を示しているが、標的核酸がRNAの場合にも同様に準安定二重鎖プローブを設計できる。
【図10】準安定二重鎖プローブを用いたDNA識別能の評価
【図11】検出波長を設計する方法を示す。蛍光物質と消光物質の組み合わせを変えることで、2種以上の標的核酸を1回の試験で検出することができる。
【図12】検出塩基を設計する方法を示す。蛍光物質と消光物質の組み合わせを変えることで、2種以上の標的核酸を1回の試験で検出することができる。
【図13】2波長を用いた一塩基レベルのターゲット配列認識。
【図14】RNA配列の認識
【図15】ALDH2 全長mRNAの検出
【図16】ALDH2 全長mRNAの検出
【図17】target DNA の検出領域。100 nM のプローブで5 nMのターゲットDNAのSNP識別が可能であることが実証された。
【図18】let-7aとlet-7fの区別が可能であることを示す。
【図19】ゲルシフトアッセイの結果(コントロールも含む)を示す。
【発明を実施するための形態】
【0015】
本明細書において、標的核酸としては、DNA、RNAが挙げられるが、RNAが好ましい。RNAとしては、mRNA、tRNA、miRNAなどが挙げられ、miRNAが特に好ましい標的核酸である。 RNAは主に4種類の塩基から構成され、細胞内には十数塩基から数千塩基を超えるものまで様々なRNAが存在し、類似配列のRNAが細胞内に多数存在するため、特定のRNAのみを検出することは容易ではない。例えばmiRNAであるlet-7 familyは、図3に示すようなhas-let-7aからhas-let-7i, mir-98までの類似した配列を有し、これらを識別するには一塩基レベルで配列を認識できるプローブが必要であるが、本発明の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物を使用すれば図18に示すように識別可能である。
【0016】
標的核酸の長さは、核酸塩基の数が15以上、好ましくは20以上であれば良く、上限は特になく、数百から数千の塩基を有する標的核酸を識別することができる。
【0017】
本発明の準安定二重鎖プローブは、アデニン、グアニン、シトシン、チミン、ウラシル、イノシンなどの核酸塩基の塩基対により2つの鎖が結合したものであればよく、DNA、RNA、LNA(BNA)、PNAなどのいずれであってもよい。LNA(BNA)、PNAなどは、シトシン残基を含有する第1鎖に適用することが望ましく、第2鎖はGをIに変更した以外は標的核酸と同じ種類の核酸(DNA又はRNA)であるのが好ましい。 RNA、LNA(BNA)、PNAの構造を図4に示す。LNA(BNA)、PNAなどは、標的核酸がハイブリダイズした安定二重鎖(Full match duplex)と、配列が類似する非標的核酸が結合した不安定二重鎖(Mismatch duplex)との安定性の差が大きくなり、配列識別能の向上する(図5〜8)。
【0018】
本発明のプローブは、準安定二重鎖プローブを予め形成させて用いても良く、準安定二重鎖プローブを構成する第1鎖と第2鎖を含む組成物として用いても良い。該組成物は、単独で溶液中で反応させると準安定二重鎖プローブを形成するが、標的核酸と反応させた場合、予め二重鎖を形成させていると、第1鎖と第2鎖の鎖分離を行った後に標的核酸が第1鎖と結合することになるので、例えば第1鎖と第2鎖は各々合成して粉末状で混合するか、別々の溶液を作成して試料中で混合して準安定二重鎖プローブを形成できる条件においてもよい。本発明の組成物では、シトシン含有第1鎖とイノシン含有第2鎖を等モルないし等量用いてもよく、第2鎖を過剰に用いてもよい。第1鎖に蛍光標識し、第2鎖に消光標識した場合、第2鎖は等モル〜過剰量で使用するのがよい。
【0019】
本明細書において、シトシン残基(C)とイノシン残基(I)の塩基対を「C/I」と表記する。同様に、アデニン残基(A)とウラシル残基(U)の塩基対は「A/U」;アデニン残基(A)とチミン残基(T)の塩基対は「A/T」;シトシン残基(C)とグアニン残基(G)の塩基対は「C/G」と各々表記する。
【0020】
「準安定二重鎖」とは、少なくとも1個のシトシン残基(C)とイノシン残基(I)の塩基対(C/I)を有する二重鎖を指す。準安定二重鎖は、通常1個又は2個、特に1個のC/Iを有するが、準安定二重鎖が長くなるにつれて、C/Iを2個以上有することが可能である。準安定二重鎖が30個以下の塩基対を有する場合には、C/I塩基対を通常1個有する。準安定二重鎖の長さが50塩基以上、例えば100塩基以上であるような長い二重鎖である場合には、長さに比例してイノシン残基の数を多くすることができる。また、準安定二重鎖におけるG/C含量が高い場合には、それに応じてイノシン残基の数を多くすることができる。
【0021】
「安定二重鎖(Full match duplex)」とは、C/GとA/T、或いはC/GとA/Uの2種の塩基対の組み合わせのいずれかから構成される二重鎖を指し、例えば標的核酸がRNAの場合にはC/GとA/Uの2種の塩基対の組み合わせ、標的核酸がDNAの場合にはC/G、A/Tの2種の塩基対の組み合わせから安定二重鎖は構成されてもよい。
【0022】
「不安定二重鎖(Mismatch duplex)」とは、第1鎖の配列に含まれるいずれかの塩基対が一つ以上相補鎖を形成していないものである。「不安定二重鎖(Mismatch duplex)」に含まれるミスマッチの位置は、端部であっても中央部であっても良い。
【0023】
「第2鎖は前記イノシン残基を除いて標的核酸に対応する配列を有する」とは、イノシン残基以外の第2鎖の核酸残基(A、T、C、G、U)は、標的核酸とA/TもしくはA/U、C/Gの塩基対を形成するような塩基であることを意味する。
【0024】
第2鎖のイノシン残基(I)の位置は、端部であっても中央部であっても良いが、中央部又はそれに近い位置にイノシン残基を有するのが、感度、特異性を向上するために好ましい。
【0025】
グアニン含有標的核酸のうち、グアニン部位をイノシン残基に置換したものが第2鎖であり、標的核酸がDNAの場合には、第2鎖はDNA、標的核酸がRNAの場合には第2鎖はRNAで構成されるのが好ましい。
【0026】
図5に示すように、本発明の準安定二重鎖プローブに標的核酸が共存すると、標的核酸とシトシン残基を含有する第1鎖との二重鎖がより安定になるために、準安定二重鎖の第2鎖と標的核酸の鎖交換が起こる。標的核酸とシトシン残基を含有する第1鎖との二重鎖は、準安定二重鎖のC/IがC/Gに置換されたものであり、安定二重鎖(Full match duplex)となる。一方、本発明の準安定二重鎖プローブのいずれか位置に配列が異なる非標的核酸が共存すると、非標的核酸とシトシン残基を含有する第1鎖との二重鎖は準安定二重鎖よりも安定性が低い二重鎖(Mismatch duplex)であるため、鎖交換が生じることはなく、準安定二重鎖はそのまま存在する。
【0027】
標的核酸を含み得るサンプルと本発明の準安定二重鎖プローブの鎖交換は、室温で行ってもよいが、加熱条件下に行うのが好ましい。加熱条件は、例えば50〜100℃、好ましくは60〜95℃程度、より好ましくは70〜90℃程度である。鎖交換の反応時間は、0.1分〜1時間程度、好ましくは0.2〜30分程度、より好ましくは0.3〜10分程度、さらに好ましくは0.4〜5分程度、特に0.5〜3分程度である。温度が低いほど鎖交換反応に時間がかかるので、反応条件は、適宜選択できる。
【0028】
このように、標的核酸のみが準安定二重鎖プローブと鎖交換を生じるため、1塩基の相違を鋭敏に検出することができ、高感度かつ特異的に標的核酸を検出できる。
【0029】
本発明の準安定二重鎖プローブを構成する第1鎖、第2鎖は、塩基配列のみから構成されても良いが、水溶性を向上させるために一方又は両方の末端に水溶性の基を結合させることができる。このような水溶性の基としては、アミノ酸又はペプチド、ポリエチレングリコール(PEG)などのポリエーテル基、糖鎖などが挙げられる。アミノ酸又はペプチドは、核酸との結合の場合、塩基性のアミノ酸(Arg,Lys,His、好ましくはLys)または塩基性アミノ酸を含むペプチド(例えばKKK)が、電荷の中和と水溶性の付与を兼ねているので好ましいが、酸性アミノ酸(Glu、Aspなど)も水溶性を付与するために使用可能である。さらにSerなどの中性かつ水溶性のアミノ酸を使用することもでき、酸性、中性、塩基性アミノ酸を適宜組み合わせて使用することもできる。 また、蛍光物質とクエンチャーの位置関係を調整するために、例えばAEEAのような任意のスペーサーを結合させてもよい。
【0030】
図6に示すように、標的核酸の配列と相補的な第1鎖(PNA、DNA、RNA、LNA(BNA)などで良い)に対し、適切な蛍光色素を修飾する。その第1鎖に対して標的RNAよりも不安定な第2鎖(具体的には、GをIに置換することで水素結合1本分だけ安定性が落ちるdecoy RNA)に消光物質を修飾したものを用意する。そうすることで、標的RNAが存在しない場合、第1鎖と第2鎖(decoy RNA)が相補鎖を形成するため、蛍光がoffの状態となる。そこに標的RNAが存在すると、鎖交換がおこり、蛍光が回復することになる。特筆すべきは、標的RNAと比べ、わずか1塩基しか異ならないRNA(偽RNA)が存在した場合、decoy RNAの方が安定であるため、鎖交換は起こらない。つまり、従来法に比べると、標的RNA以外の偽RNAが共存していてもそれらとは応答しないため、高選択的に検出することができる。準安定二重鎖プローブに対し、このような蛍光物質と消光物質で標識した本発明の好ましい実施形態の特徴としては、以下が挙げられる:
(i)標的RNAの存在を、蛍光強度を測定するだけの簡便な操作によって評価できる。
(ii) 準安定二重鎖プローブとして標的RNAよりもわずか水素結合1本分だけ不安定なイノシン-グアニン塩基対を利用すること。
(iii)標的配列を含む1本鎖または2重鎖のDNA存在下でもRNAのみを特異的に検出できる。
(iv)標的RNAに対する処理(PCR増幅蛍光色素での標識)が必要ない。
(v)標的RNAに対するプローブの設計が容易である。
【0031】
準安定二重鎖プローブ又は組成物の第2鎖のプローブの設計方法を図9に示す。図9に示すように、第2鎖は、標的核酸の少なくとも1個のGをIに変えることにより容易に設計できる。
【0032】
準安定二重鎖プローブは、蛍光標識を有するのが好ましい。図7は準安定二重鎖プローブが蛍光標識を有する場合を示す。標識のための蛍光物質としては、FAM(5−または6−カルボキシフルオレセイン)、VIC、NED、フルオレセイン、FITC、IRD−700/800、CY2、CY3、CY5、CY3.5、CY5.5、HEX、TET、TAMRA 、 SNARF、SNAFL、Naphtofluorescein、JOE、ROX、BODIPY TMR、オレゴングリーン、ローダミングリーン、ローダミンレッド、テキサスレッド、ヤキマイエロー、アレクシアフルオレ(Alexa Fluor)PET、バイオサーチブルー(商標)、マリーナブルー(登録商標)、ボセルブルー(登録商標)、アレクシアフルオレ(登録商標)、350FAM(商標)、SYBR(登録商標)グリーン1、フルオレセイン、エバグリーン(商標)、アレクシアフルオレ(登録商標)488 JOE(商標)、VIC(商標)、HEX(商標)、TET(商標)、カルフルオレ(CAL Fluor)(登録商標)ゴールド540、ヤキマイエロー(登録商標)、ROX(商標)、カルフルオレ(登録商標)レッド610、Cy3.5(商標)、テキサスレッド(登録商標)、アレクシアフルオレ(登録商標)、568Cy5(商標)、クエーサー(Quasar)(商標)670、ライトサイクラー(Light Cycler)レッド640(登録商標)、アレクシアフルオレ633クエーサー(商標)705、ライトサイクラーレッド705(登録商標)、アレクシアフルオレ(登録商標)680、SYTO(登録商標)9、LCグリーン(登録商標)、LCグリーン(登録商標)プラス、エバグリーン(商標)、ナフタレン、ピレン、ペリレン、アントラセン、ペンタセン、ダンシル(Dansyl)、コロネン、量子ドットなどが挙げられる。
【0033】
準安定二重鎖プローブは、二重鎖が結合しているときには消光し、標的核酸との鎖交換が生じたときには発光するような蛍光物質と消光物質(クエンチャー)の組み合わせが好ましい(図5)。このような組み合わせとしては、以下のCy5とBHQ3、Cy3とBHQ2、FAMとBHQ1、Cy2とBHQ1、CoumarinとDabsyl 、BHQ1とTET、BHQ2とHEX、BHQ2とJOE、BHQ0とAlexa(登録商標)350、BHQ0とPacific Blue、BHQ0とDansyl、BHQ0とCY2、BHQ1とFAM、BHQ1とJOE、BHQ1とOrenge Green(登録商標)、BHQ2とTAMRA、BHQ2とCAL Fluore Red、BHQ2とROX、BHQ2とQuasar 570、BHQ2とQuasar670、BHQ3とCAL Fluore Red、BHQ3とQuasar670
などが挙げられる。
【0034】
図11に示すように、蛍光物質と蛍光波長の組み合わせを選択することで、検出波長を任意に選択することができる。
【0035】
図12に示すように、蛍光物質と消光物質の組み合わせを複数使用し、各々に異なる検出塩基を適用することで、検出塩基を容易に変更できる。
【0036】
蛍光物質は第1鎖に結合され、消光物質は第2鎖に結合されるのがよいが、蛍光物質が第2鎖に結合され、消光物質が第1鎖に結合されてもよい。このような構成によると、蛍光の測定により、標的核酸の有無を検出できる。
【0037】
従来、RNA検出キットとして、例えば以下の(i)〜(v)の商品が市販されている。本発明の準安定二重鎖プローブまたは組成物は、これらキットにさらに加えることで、従来のキットと同様の条件で反応させることができ、感度及び特異性をさらに向上させることができる。
(i) Applied Biosystems: TaqMan(登録商標) MicroRNA Assays
(ii) Ambion: mirVana miRNA Probe
(iii) EXIQON: miRCURY probe (miRCURY LNA microRNA Array)
(iv) Veritas: QuantiGene 2.0 miRNA Assay
(v) TORAY: miRNA Oligo chip
【0038】
準安定二重鎖プローブまたは組成物は、標的核酸が少なくとも1 nM〜1μMの範囲では測定可能であるが、蛍光物質の測定感度を向上させることで、さらに低濃度の標的核酸を検出することも可能である。
【0039】
本発明のプローブは、標的核酸と等量から100倍量(好ましくは3〜10倍量)又はそれ以上検出系中に存在するのが好ましく、図17に示すように、 準安定二重鎖プローブが100 nMの濃度の際に、5 nM-1 mMの濃度範囲にて標的核酸を有意な差として検出することができる。
【0040】
これらは、検出対象となるRNAなどの標的核酸が1塩基のみの相違の場合にも検出できることを示している。
【0041】
標的核酸(DNAまたはRNA)を含むサンプルに、イノシン残基含有第2鎖(DNAまたはRNA)或いはそれを含む準安定二重鎖プローブを加え、従来のマイクロアレイにアニーリングを行うことでマイクロアレイの精度の向上が期待できる。その他、サザンブロッティング、ノーザンブロッティングなどのハイブリダイゼーションを用いた様々なキットの精度向上が期待できる。
【0042】
本発明の準安定二重鎖プローブは、適切な蛍光標識を結合させることで、洗浄操作が不要になり、生細胞において標的核酸を検出することもでき、細胞破砕液において標的核酸を検出することもできる。
【0043】
本発明の検出方法は非常に高感度かつ特異的であり、1個の細胞における標的核酸を検出し得る。
【実施例】
【0044】
以下、本発明を実施例に基づきより詳細に説明するが、本発明がこれら実施例に限定されないことはいうまでもない。
【0045】
実施例1
(1)PNA合成
ペプチド自動合成機(SHIMADZU PSSM-8)を用いてペプチド固相合成法(Fmoc法)で合成を行った。担体にはFmocLys(Boc)-Alko-PEG-Resin(0.21 mmol/g, 100-200 mesh, 1%DVB) 10 mgを用い、各PNAモノマー及びアミノ酸を伸長させた。NMP(N-メチルピロリドン)に溶解させたそれぞれのモノマーFmoc-A(Bhoc)aeg-OH (10.0 mg, 5 eq.), Fmoc-G(Bhoc)aeg-OH (10.2 mg, 5 eq.), Fmoc-C(Bhoc)aeg-OH (9.6 mg, 5 eq.), Fmoc-Taeg-OH (7.0 mg, 5 eq.), Fmoc-Lys(Boc)-OH(4.9 mg, 5 eq.), Fmoc-AEEA-OH(4.9 mg, 5 eq.)を0.3 M HBTU/HOBt(35 ul, 5eq.), 1M N,N-diisopropylethylamine (23 ul, 5 eq.)中で30分反応させた。Fmoc保護基の脱保護には30%ピペリジン(500 ul)を用い2回行った。合成後、90% トリフルオロ酢酸(TFA)、10% m-クレゾール 1mlで3時間切り出し、脱保護を行い、冷エーテルで沈殿させた後、HPLC で精製を行った。
【0046】
合成PNAのリストとMSの結果を表1に示す。
【0047】
【表1】

【0048】
(2)DNA合成
株式会社ジーンデザインに以下の配列のDNA合成を依頼した。
【0049】
合成DNAのリストと精製方法を以下の表2に示す。DNAの確認はMS(質量分析)により行った。
【0050】
【表2】

【0051】
RNA合成
表3に示すALDH2 cRNA(rI)-BHQ3は株式会社ジーンデザインに作製を依頼した。
【0052】
表3のlet-7a dI-RNA-BHQ3はDNA/RNA自動合成機(Applied Biosystems 392 DNA/RNA synthesizer)を用いて合成した。合成後、28%アンモニア水中で切り出し、脱保護(室温、12時間)後、凍結乾燥した。これを無水DMSO中(100 ul)で1M tetrabutylammonium fluoride (in THF, 50 ul)で60℃で1時間処理し、HPLCで精製した。
【0053】
目的RNA配列の5’側にT7プロモーター配列(TAATA CGACT CACTA TAGGG)を付加したDNAテンプレート(50 uM, 2 ul)、100 mM DTT (10 ul), 10 x reaction buffer (10 ul), 25 mM rNTP(30 ul), T7 RNA polymerase (10 ul)、精製水(38 ul)を37℃で2.5時間反応させた。反応後、8%PAGEで精製を行った。
【0054】
【表3】

【0055】
RNA検出
10 uM PNA (1 uL), 30 uM decoy RNA (1uL), 10x PBS buffer (1uL) 1 mg/mL BSA (1 uL) MQ水 (6 uL)を混合し、80℃で1分間加熱処理を行った。その後、室温で冷却することで10xプローブ溶液を調整した。この10xプローブ溶液2 uLを、各標的RNAサンプル18 uLに加え、80 ℃で1分間加熱処理を行った。その後、室温で冷却し、それぞれのサンプルの蛍光強度をTECAN infinite 200 PROで測定した。結果を図14に示す。また、図15に示すALDH2 全長mRNAの検出についても同様に検出できることを確認した(図16)。
【0056】
DNA検出
10 uM PNA (1 uL), 30 uM decoy DNA (1uL), 10x PBS buffer (1uL) 1 mg/mL BSA (1 uL) 水 (6 uL)を混合し、95℃で3分間加熱処理を行った。その後、室温で冷却することで10xプローブ溶液を調整した。 この10xプローブ溶液2 uLを、各標的DNAサンプル18 uLに加え、95 ℃で3分間加熱処理を行った。その後、室温で冷却し、それぞれのサンプルの蛍光強度をTECAN infinite 200 PRO で測定した。DNA識別能の評価結果を図10、図11、図12、図13に各々示す。
【0057】
DNA検出プローブの結果、本発明の準安定二重鎖プローブを用いてDNA塩基配列20塩基のうち、僅か一塩基の違いを識別することに成功した(図10、図11、図12、図13)。
【0058】
本発明の準安定二重鎖プローブ又は該プローブを形成可能な組成物は、以下の利点を有する。
・プローブの励起波長/検出波長を任意に選ぶことができる。
・標的配列、検出塩基を簡単に設計できる。
・多数の標的核酸を同時に検出することができる。
【0059】
DNAを含む準安定二重鎖プローブ(例えば、PNA/DNA)をRNAを含む準安定二重鎖プローブ(例えば、PNA/RNA)にするだけでRNAの配列選択的なプローブは容易に得られる。
【0060】
ゲルシフトアッセイ(DNA)
10 uM DNA(2uL), PNK (10 U/uL, 0.8 uL), 10x PNK buffer (2 uL), γ32P-ATP(1.66 uM, 2 uL) 水(13.2 uL)を混合し、37℃で2時間インキュベーションした。これに精製水を30 uL加え、100 uLのフェノール/クロロホルム処理を行い、水相を1x PBSで置換したBio-spin 6 columnsで精製した。これを未ラベルDNA 111 nMに1000 count/uLになるように加え、標的DNA溶液とした。
【0061】
また、10 uM PNA (1 uL), 30 uM decoy DNA (1uL), 10x PBS buffer (1uL) 1 mg/mL BSA (1 uL) 30% スクロース(w/v) (2 uL) MQ水 (4 uL)を混合し、95℃で3分間加熱処理を行った。その後、室温で冷却することで10xプローブ溶液を調整した。
【0062】
この10xプローブ溶液2 uLを、各標的DNA溶液18 uL (6% スクロース) に加え、95 ℃で3分間加熱処理を行った。その後、室温で30分放置した。この溶液4 uLを、15% ポリアクリルアミドゲル(1x TBE buffer,)で150 V, 45分間泳動した後、GE healthcare社製phosphor imager STORM820にてSCAN画像を取得した。
【0063】
ゲルシフトアッセイによられたアクリルアミドゲルのイメージ結果を図19に示す。
【0064】
1x PBS bufferの組成を以下に示す。
KCl 200 mg/L
KH2PO4 200 mg/L
NaCl 8 g/L
Na2HPO4 1.15 g/L
【産業上の利用可能性】
【0065】
本発明の好ましいプローブは、DNA、RNAともに同じ方法でプローブが設計できる、目的配列に制限がほとんどない、設計が簡単である、配列選択性が高い、検出波長に制限がない、蛍光色素(波長)の数だけ同時にターゲットDNA/RNAの有無が検出できるなどの特徴を有し、標的核酸によって線上条件を検討する必要はなく、DNAないしRNA検出用キットおよびその受託サービスに適している。
【特許請求の範囲】
【請求項1】
グアニン含有標的核酸を検出可能な準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物であって、前記準安定二重鎖は少なくとも1つのC/I塩基対を有し、前記準安定二重鎖は少なくとも1つのシトシン残基を有する第1鎖 と、前記シトシン残基と塩基対形成し得る少なくとも1つのイノシン残基(I)を有する第2鎖 から構成され、前記第2鎖は前記イノシン残基を除いて標的核酸に対応する配列を有し、前記準安定二重鎖プローブは標的核酸の存在下に鎖交換を生じて第1鎖と標的核酸の安定二重鎖を生じ得る、準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項2】
前記第1鎖は、DNA、RNA、LNA(BNA)またはPNAである、請求項1に記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項3】
第1鎖及び/又は第2鎖が蛍光標識されてなる、請求項1又は2に記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項4】
標的核酸がRNAである、請求項1〜3のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項5】
前記第2鎖は、イノシン残基を1個含む、請求項1〜4のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項6】
前記第1鎖が蛍光標識を有し、前記第2鎖が消光(クエンチャー)標識を有する、請求項1〜5のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項7】
請求項1〜6のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物を含む、標的核酸検出用キット。
【請求項8】
請求項1〜6のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物と標的核酸を有し得る試料を接触させ、標的核酸と第1鎖の安定二重鎖の形成の有無を検出することを特徴とする、標的核酸の検出方法。
【請求項1】
グアニン含有標的核酸を検出可能な準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物であって、前記準安定二重鎖は少なくとも1つのC/I塩基対を有し、前記準安定二重鎖は少なくとも1つのシトシン残基を有する第1鎖 と、前記シトシン残基と塩基対形成し得る少なくとも1つのイノシン残基(I)を有する第2鎖 から構成され、前記第2鎖は前記イノシン残基を除いて標的核酸に対応する配列を有し、前記準安定二重鎖プローブは標的核酸の存在下に鎖交換を生じて第1鎖と標的核酸の安定二重鎖を生じ得る、準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項2】
前記第1鎖は、DNA、RNA、LNA(BNA)またはPNAである、請求項1に記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項3】
第1鎖及び/又は第2鎖が蛍光標識されてなる、請求項1又は2に記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項4】
標的核酸がRNAである、請求項1〜3のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項5】
前記第2鎖は、イノシン残基を1個含む、請求項1〜4のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項6】
前記第1鎖が蛍光標識を有し、前記第2鎖が消光(クエンチャー)標識を有する、請求項1〜5のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物。
【請求項7】
請求項1〜6のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物を含む、標的核酸検出用キット。
【請求項8】
請求項1〜6のいずれかに記載の準安定二重鎖プローブまたは準安定二重鎖プローブを形成可能な組成物と標的核酸を有し得る試料を接触させ、標的核酸と第1鎖の安定二重鎖の形成の有無を検出することを特徴とする、標的核酸の検出方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【公開番号】特開2013−99277(P2013−99277A)
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願番号】特願2011−244709(P2011−244709)
【出願日】平成23年11月8日(2011.11.8)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 刊行物名 第5回バイオ関連化学シンポジウム講演要旨集 発行日 平成23年9月12日 発行所 日本化学会 生体機能関連化学部会 日本化学会 バイオテクノロジー部会 日本化学会 生体機能関連化学・バイオテクノロジーディビジョン 日本化学会 フロンティア生命化学研究会 ホスト−ゲスト・超分子化学研究会 該当頁 第62頁 3B−08 公開者 松本桂彦、中田栄司及び森井孝 公開のタイトル 準安定二重鎖を用いたRNA配列認識PNA蛍光センサー
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願日】平成23年11月8日(2011.11.8)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 刊行物名 第5回バイオ関連化学シンポジウム講演要旨集 発行日 平成23年9月12日 発行所 日本化学会 生体機能関連化学部会 日本化学会 バイオテクノロジー部会 日本化学会 生体機能関連化学・バイオテクノロジーディビジョン 日本化学会 フロンティア生命化学研究会 ホスト−ゲスト・超分子化学研究会 該当頁 第62頁 3B−08 公開者 松本桂彦、中田栄司及び森井孝 公開のタイトル 準安定二重鎖を用いたRNA配列認識PNA蛍光センサー
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
[ Back to top ]

