S−ニトロソ化α1−酸性糖タンパク質を含有する抗菌剤
【課題】抗菌活性が高く、種々の細菌に効果を有する、安全な抗菌剤を提供する。
【解決手段】本発明は、S−ニトロソ化α1−酸性糖タンパク質またはその変異体を有効成分として含有する抗菌剤を提供する。前記α1−酸性糖タンパク質は、α1−酸性糖タンパク質バリアントA体である。また、前記S−ニトロソ化α1−酸性糖タンパク質は糖鎖末端の少なくとも1個のシアル酸が除去されている。本発明は、また、糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体を提供する。
【解決手段】本発明は、S−ニトロソ化α1−酸性糖タンパク質またはその変異体を有効成分として含有する抗菌剤を提供する。前記α1−酸性糖タンパク質は、α1−酸性糖タンパク質バリアントA体である。また、前記S−ニトロソ化α1−酸性糖タンパク質は糖鎖末端の少なくとも1個のシアル酸が除去されている。本発明は、また、糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、S−ニトロソ化α1−酸性糖タンパク質を有効成分として含有する抗菌剤に関する。
【背景技術】
【0002】
α1−酸性糖タンパク質は、183個のアミノ酸と5本の糖鎖からなる分子量約44kDaのオロソムコイドとも呼ばれる血清タンパク質である。α1−酸性糖タンパク質の糖鎖含量は分子量の45%と他のタンパク質の中でも極めて高く、その糖鎖末端にシアル酸残基を有しているために、血清中で最も負に帯電している(pI値:2.7)。α1−酸性糖タンパク質の血清中濃度は、健常時において0.5〜1.0g/Lであるが、感染症、炎症時などに血液および組織中で約2〜4倍に増加し、主に抗炎症および免疫調節分子として機能していると考えられている。しかしながら、その詳細な作用機序については未だ不明な点が残されている。また、このα1−酸性糖タンパク質は「F1*S体」と「A体」という二つのバリアントが生体内に約2〜3:1の割合で存在する。「F1*S体」と「A体」のアミノ酸配列の違いの一つに、A体のみが持つ149番目の遊離型システイン(Cys−149)残基がある。しかし、その機能的差異に関する報告はリガンド結合能に関するものにとどまっている。
【0003】
一酸化窒素(NO)は、パーオキシナイトライト(ONOO−)となり殺菌作用を示すが、その一方で、一電子酸化されてNO+となると、グルタチオン(GSH)などの低分子やタンパク質のシステイン残基と反応し、化学的に安定なS−ニトロソチオール(RS−NO)へと変換される。これまでに本発明者らは、ヒト血清アルブミン(HSA)などのS−ニトロソ化体(SNO−HSA)が、NO自身や低分子のRS−NOであるS−ニトロソグルタチオン(GS−NO)と比較して数百倍強力な抗菌活性を示すことをすでに明らかにしている(特許文献1)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2005−206577号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、抗菌活性が高く、種々の細菌に効果を有する、安全な抗菌剤を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明は、S−ニトロソ化α1−酸性糖タンパク質またはその変異体を有効成分として含有する抗菌剤を提供する。
【0007】
1つの実施形態では、上記S−ニトロソ化α1−酸性糖タンパク質が、S−ニトロソ化α1−酸性糖タンパク質バリアントA体である。
【0008】
1つの実施形態では、上記S−ニトロソ化α1−酸性糖タンパク質バリアントA体が、149位のシステイン残基がニトロソ化されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体である。
【0009】
1つの実施形態では、上記S−ニトロソ化α1−酸性糖タンパク質が、糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質である。
【0010】
1つの実施形態では、上記S−ニトロソ化α1−酸性糖タンパク質が、S−ニトロソ化アシアロα1−酸性糖タンパク質である。
【0011】
本発明は、また、糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体またはその変異体である。
【0012】
1つの実施形態は、S−ニトロソ化α1−酸性糖タンパク質バリアントA体またはその変異体から、ノイラミニダーゼによってシアル酸が除去されて得られる、上記糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体またはその変異体である。
【0013】
1つの実施形態では、上記糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体は、149位のシステイン残基がS−ニトロソ化されている。
【発明の効果】
【0014】
本発明の抗菌剤は、有効成分であるS−ニトロソ化α1−酸性糖タンパク質が細菌内へ一酸化窒素(NO)を効率よく輸送することにより強い抗菌活性を有する。生体内物質であることより安全な薬剤を提供できる。本発明のS−ニトロソ化α1−酸性糖タンパク質は、S−ニトロソ基が凍結乾燥後も安定に存在することから、凍結乾燥による保存が可能である。また、本発明のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質は、特に強い抗菌活性を有する。
【図面の簡単な説明】
【0015】
【図1】S−ニトロソ化α1−酸性糖タンパク質バリアントA体の製造方法を示す工程図である。
【図2】HPLCによるS−ニトロソ化タンパク質のNO付加率定量法の説明図である。
【図3】α1−酸性糖タンパク質のN−結合型糖鎖の構造を示す図である。
【図4】S−ニトロソ化α1−酸性糖タンパク質バリアントA体の抗菌活性を示すグラフである。
【図5】S−ニトロソ化α1−酸性糖タンパク質バリアントA体の抗菌活性を示すグラフである。
【図6】S−ニトロソ化アシアロα1−酸性糖タンパク質バリアントA体の抗菌活性を示すグラフである。
【図7】各種S−ニトロソ化タンパク質から細菌内へのNO輸送効率を示すグラフである。
【図8】NO検出プローブであるDAF−FMの蛍光強度と大腸菌の増殖率の関係を示すグラフである。
【図9】大腸菌の菌体表面の修飾方法と修飾による菌体内へのNO輸送量測定方法を示す図である。
【図10】大腸菌の菌体表面の修飾による菌体内へのNO輸送量の変化を示すグラフである。
【発明を実施するための形態】
【0016】
本発明の抗菌剤は、S−ニトロソ化α1−酸性糖タンパク質またはその変異体を有効成分として含有する。
【0017】
上記α1−酸性糖タンパク質(以下、AGPともいう。)は、その由来については特に限定されない。例えば、ヒト、サル、ウシ、イヌ、ブタ、マウス由来AGPが挙げられる。好ましくは、ヒト由来のAGPである。ヒト由来のAGPは、183個のアミノ酸残基と5本の糖鎖からなる分子量44100の血清タンパク質である。ヒト由来AGPは2つのバリアント(A体とF1*S体)が存在し、AGPバリアントA体(以下、AGP・A体ともいう。)のアミノ酸配列は配列番号1で示され、バリアントF1*S体のアミノ酸配列は配列番号2で示される。本発明では、好適にはAGP・A体が用いられる。AGPは、血漿から公知の方法により得ることができ、また、遺伝子組換え技術を用いて常法により得ることができる。
配列番号1:QIPLCANLVPVPITNATLDRITGKWFYIASAFRNEEYNKSVQEIQATFFYFTPNKTEDTIFLREYQTRQNQCFYNSSYLNVQRENGTVSRYEGGREHVAHLLFLRDTKTLMFGSYLDDEKNWGLSFYADKPETTKEQLGEFYEALDCLCIPRSDVMYTDWKKDKCEPLEKQHEKERKQEEGES
配列番号2:QIPLCANLVPVPITNATLDQITGKWFYIASAFRNEEYNKSVQEIQATFFYFTPNKTEDTIFLREYQTRQDQCIYNTTYLNVQRENGTISRYVGGQEHFAHLLILRDTKTYMLAFDVNDEKNWGLSVYADKPETTKEQLGEFYEALDCLRIPKSDVVYTDWKKDKCEPLEKQHEKERKQEEGES
【0018】
S−ニトロソ化AGPの変異体とは、S−ニトロソ化されたAGP変異体である。AGP変異体とはアミノ酸残基が置換、欠失、挿入されたAGPであって、AGPと同様の活性を有する限り、特に限定されるものではない。好適には、AGPの少なくとも1つのアミノ酸残基がシステインに置換された変異体、または少なくとも1つのシステインが挿入された変異体である。1〜3のシステインが置換または挿入された変異体が好適である。変異体は遺伝子組換え技術を用いて常法により得ることができる。
【0019】
本発明のS−ニトロソ化AGPまたはその変異体とは、AGPまたはその変異体の少なくとも1つのシステイン残基のチオール基にS−ニトロソ基(−NO)が付加され−SNOとなったAGPまたはその変異体である。システイン残基は天然由来のシステイン残基であっても、挿入または置換されたシステイン残基であってもよい。好適には、AGP・A体が有する149位のシステイン残基がニトロソ化されたS−ニトロソ化AGP・A体が挙げられる。
【0020】
S−ニトロソ化は亜硝酸塩と反応させる等の公知の方法によって達成することができる。しかし、ヘモグロビンのようにタンパク質のS−ニトロソ化に成功している例もあるが、一般的には、タンパク質にとってS−ニトロソ化は厳しい条件での反応である。したがって、より穏和な条件でのチオール基へのNOの導入が可能な方法を用いることが好ましく、イソアミルナイトライトを用いた方法(De Master E.G. et al., Biochemistry, 34, p.11494-11499, 1995)やn−ブチルナイトライトと反応させる方法(Meyer D.J. et al., FEBS Letters, 345, p.177-180, 1994)を好適に使用することができる。
【0021】
AGPまたはその変異体には複数本の糖鎖が付加されており、その糖鎖末端の少なくとも1個のシアル酸を除去することにより、シアル酸が除去されているAGPまたはAGP変異体が得られる。シアル酸の除去によりガラクトース残基が新たに糖鎖の非還元末端に現われる。複数のシアル酸が除去されることによりα1−酸性糖タンパク質の等電点は上昇し、分子量は減少する。
【0022】
アシアロα1−酸性糖タンパク質とは、α1−酸性糖タンパク質からシアル酸が95%以上除去されているものであり、好ましくは、すべてのシアル酸が除去されているものである。例えば、α1−酸性糖タンパク質から14個のシアル酸、15個のシアル酸が除去されているα1−酸性糖タンパク質が挙げられる。シアル酸が除かれると、代わりに同じ数のガラクトース残基が新たに糖鎖の非還元末端に現われる。
【0023】
AGP・A体には5本の糖鎖が付加されている。具体的には、15位、38位、54位、75位、85位の各アスパラギンに糖鎖が付加されている。これら糖鎖は分岐しておりその末端にはシアル酸が存在する。その少なくとも1個のシアル酸を除去することにより、シアル酸が除去されているAGP・A体を得ることができる。5個以上、より好ましくは10個以上、さらに好ましくは糖鎖末端に存在するシアル酸すべてが除去されているAGP・A体またはその変異体が好ましい。例えば、14個または15個のシアル酸が除去されているAGP・A体が挙げられる。糖鎖末端に存在するシアル酸の95%以上のシアル酸が除去されているAGP・A体はアシアロAGP・A体である。
【0024】
糖鎖の末端のシアル酸の除去方法は限定されない。例えば、酵素による除去などが挙げられる。好適には酵素によって除去される。酵素としては、例えばノイラミニダーゼが挙げられる。
【0025】
本発明の抗菌剤は、細菌内に一酸化窒素を効率的に輸送することができる。一酸化窒素輸送メカニズムには、S−ニトロソ化AGPから菌体表面のチオール基へのS−ニトロソ転移反応が関与すると考えられる。よって、本発明の抗菌剤は、種々の細菌に対して優れた抗菌性を有し、グラム陽性菌感染症、グラム陰性菌感染症など種々の細菌の感染症の治療薬として極めて有用なものである。感染症としては、例えば、レンサ球菌(A群β溶連菌、肺炎球菌など)、黄色ブドウ球菌(MSSA、MRSA)、表皮ブドウ球菌、腸球菌、リステリア、髄膜炎球菌、淋菌、病原性大腸菌(0157:H7など)、クレブシエラ(肺炎桿菌)、プロテウス菌、百日咳菌、緑膿菌、セラチア菌、シトロバクター、アシネトバクター、エンテロバクター、マイコプラズマ、クラミジア、クロストリジウムなどによる各種感染症、結核、コレラ、ジフテリア、赤痢、猩紅熱、炭疽、トラコーマ、梅毒、破傷風、ハンセン病、レジオネラ、レプトスピラ、ライム病、野兎病、Q熱などが挙げられる。
【0026】
本発明の抗菌剤は、注射用剤、外用剤、経口剤などの製剤とすることができる。他の抗菌剤と組み合わせて用いることもできる。注射剤の場合は、常法により液剤、凍結乾燥製剤にすることができ、スクロースなどの安定化剤などを含むことができる。
【0027】
本発明の抗菌剤に含有される有効成分の量、即ち、抗菌活性を有する投与量は、予防または疾患の過程と状態に対して所望の治療効果を発揮するのに充分な量とすべきであり、患者に対する投与量は、処置すべき個々の患者の年齢、および感染症の程度等の条件によって変化するが、一般的には1日あたりの有効成分の投与量1mg〜10gが、1日に1〜4回予防または治療のために投与される。
【0028】
本発明は、また、糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体(以下シアル酸除去S−ニトロソ化AGP・A体ともいう。)またはその変異体に関する。
【0029】
シアル酸除去S−ニトロソ化AGP・A体またはその変異体とは、AGP・A体またはその変異体の糖鎖末端の少なくとも1個のシアル酸が除去され、かつ、少なくとも1つのシステイン残基のチオール基がS−ニトロソ化されているAGP・A体またはその変異体である。
【0030】
上述したように、AGP・A体は183個のアミノ酸残基と5本の糖鎖からなる分子量44100の血清タンパク質である。AGP・A体は、配列番号1で示されるアミノ酸配列を有する。
【0031】
糖鎖末端の少なくとも1個のシアル酸が除去されているとは、AGP・A体またはその変異体の15位、38位、54位、75位、85位の各アスパラギン残基に付加されている糖鎖の末端のシアル酸が少なくとも1個除去されていることであり、好ましくは、5個以上、より好ましくは10個以上除去されており、さらに好ましくは糖鎖末端に存在するシアル酸の95%以上が除去されている。例えば、14個または15個のシアル酸が除去されている。
【0032】
S−ニトロソ化されるとは、AGP・A体またはその変異体の少なくとも1個のシステイン残基のチオール基にS−ニトロソ基(−NO)が付加され−SNOにされることである。S−ニトロソ化は、シアル酸の除去前であっても、シアル酸の除去後であってもよい。好ましくは、149位のシステインのチオール基がS−ニトロソ化される。
【0033】
AGP・A体の変異体とはアミノ酸残基が置換、欠失、挿入されたAGP・A体である。該アミノ酸残基の置換、欠失、挿入の位置、アミノ酸残基数などは、シアル酸除去S−ニトロソ化AGP・A体の変異体が、シアル酸除去S−ニトロソ化AGP・A体と同様の強い抗菌活性を有する限り、特に限定されるものではない。
【0034】
AGP・A体の取得方法、糖鎖末端のシアル酸の除去方法、S−ニトロソ化方法については、上述した方法と同様の方法を用いることができる。
【0035】
1つの実施形態では、シアル酸除去S−ニトロソ化AGP・A体またはその変異体は、S−ニトロソ化されたAGP・A体またはその変異体から、ノイラミニダーゼによってシアル酸が除去されて得られる。他の実施形態では、シアル酸除去S−ニトロソ化AGP・A体またはその変異体は、ノイラミニダーゼによって少なくとも1個のシアル酸が除去されているAGP・A体またはその変異体をS−ニトロソ化して得られる。AGP・A体1〜100mg、好ましくは20mgをノイラミニダーゼ0.05〜0.5単位、好ましくは0.2単位と混合し、37℃にて2〜48時間、好ましくは24時間反応させて得られるシアル酸除去S−ニトロソ化AGP・A体が好適である。
【0036】
本発明の好ましいシアル酸除去S−ニトロソ化AGP・A体は、149位のシステイン残基がS−ニトロソ化されたシアル酸除去S−ニトロソ化AGP・A体である。また、シアル酸が95%以上除去されているS−ニトロソ化アシアロAGF・A体である。さらに好ましいシアル酸除去S−ニトロソ化AGP・A体は、149位のシステイン残基がS−ニトロソ化されているS−ニトロソ化アシアロAGF・A体であり、その分子量は約40,000である。
【0037】
本発明のシアル酸除去S−ニトロソ化AGP・A体またはその変異体は、強い抗菌作用を示す。本物質は、細菌内に一酸化窒素を効率的に輸送することができる。一酸化窒素輸送メカニズムには、シアル酸除去S−ニトロソ化AGP・A体から菌体表面のチオール基へのS−ニトロソ転移反応が関与すると考えられる。よって、本発明のシアル酸除去S−ニトロソ化AGP・A体は、種々の細菌に対して優れた抗菌性を有し、グラム陽性菌感染症、グラム陰性菌感染症など種々の細菌の感染症の治療薬として極めて有用である。
【実施例】
【0038】
以下に、実施例に基づいて、本発明をより詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【0039】
(実施例1)
ヒト血清から分離精製したAGP分画は、一般財団法人 化学及血清療法研究所より恵与されたもの、あるいは購入したヒト血清由来のAGP(G9885、Sigma−Aldrich社)を使用した。AGPバリアントそれぞれの分離精製方法は、Herveらの方法に従って行った。すなわち、iminodiacetate−Sepharose gel(18−8769−01、Chelating Sepharose Fast Flow,GEヘルスケアバイオサイエンス社)50mLをイオン交換水で洗浄後、0.2M CuCl2水溶液を流し、Cu2+イオンをキレートした。次に、0.1M酢酸ナトリウム緩衝液(pH3.8)を流すことにより過剰なCu2+イオンを除去した。その後、20mMリン酸ナトリウム緩衝液(pH7.0)+0.5M NaClの移動相を流速0.4mL/分で流して安定化し、20mgのAGPを1mLの移動相に溶解したサンプルをカラムに添加した。添加後、約1.5時間に保持されずに溶出するF1*S体を分取した。次いで、イミダゾール(最終濃度20mM)を加えた移動相を流し、約5時間後に溶出されるA体を分取した。分取した各バリアントをイオン交換水にて透析後、凍結乾燥した。さらに、F1*S体およびA体の回収率より、AGPバリアント比を算出した。
【0040】
得られたAGP・A体に3倍モル量の1,4−dithiothreitol(以下、DTT)(100mMリン酸カリウム緩衝液(pH7.4)+5mM EDTA)を添加、混合し、AGP・A体中に存在する遊離型Cys残基のSH基の還元を行った。これをゲル濾過し、ろ液にその10倍量のS−ニトロソグルタチオン(GS−NO)(100mMリン酸カリウム緩衝液(pH8.0)+1mM DTPA)を添加、混合し、37℃にてS−ニトロソ化反応を行った。混合物をゲル濾過し、ろ液にS−ニトロソ化AGP・A体(以下、SNO−AGPという。)を得た(図1)。
【0041】
SNO−AGPのS−ニトロソ化部位をHPLC flow reactorシステムにより分析した。まず、血漿から精製したAGPバリアントF1*S体を上記と同様にS−ニトロソ化した。また、AGPバリアントA体の149位のシステインをNishiら(Nishi K, et al.,Drug Metab Pharmacokinet,25,200-207,2010)の方法によりアルギニンに変異させたC149Rを得た。得られたC149Rを上記と同様にS−ニトロソ化した。そして、それぞれのNO付加率の定量を、Akaikeら(T. Akaike, et al., J. Biochemistry, 122, 459-466, 1997)の方法により行った。すなわち、図2に示すHPLC flow reactorシステムにおいて、上記SNO−AGP、F1*S体およびC149RにHg2+を反応させて生成するNO2−とGriess試薬との反応生成物であるアゾ色素を540nmで測定することにより、各種S−ニトロソ化タンパク質を分離・定量した。各タンパク質のNO付加率を表1に示す。表1の結果から、SNO−AGPの149位のシステインがS−ニトロソ化されていることが確認された。
【0042】
【表1】

【0043】
(実施例2)
実施例1で得られたAGP・A体20mgにノイラミニダーゼ0.2単位を添加、混合し、37℃にて24時間反応させ、糖鎖末端のシアル酸が95%以上除去されたアシアロAGP・A体を得た。得られたアシアロAGP・A体を実施例1に従いS−ニトロソ化してS−ニトロソ化アシアロAGP・A体(以下、SNO−asialo−AGPという。)を得た(図3)。得られたSNO−asialo−AGPは、95%以上のシアル酸が除去されており、分子量は約40,000であった。
【0044】
(実施例3)
実施例1のゲル濾過で得られたSNO−AGP溶液を常法により凍結乾燥して、凍結乾燥製剤を得た。また、液状におけるSNO−AGPのpH7およびpH5での安定性を評価したところ、pH7では半減期13日であり、pH5では、半減期が24日であり、非常に安定であることが確認された。
【0045】
(実施例4)
実施例2で得られたSNO−asialo−AGP溶液を常法により凍結乾燥して凍結乾燥製剤を得た。
【0046】
(比較例1)
S−ニトロソ化ヒト血清アルブミン(以下、SNO−HSAという。)を特開2005−206577号公報に記載の方法によって得た。
【0047】
(試験例1)
グラム陰性菌である、大腸菌(E. coli)、ネズミチフス菌(S. typhimurium LT2)、緑膿菌(P. aeruginosa)、およびグラム陽性菌である、枯草菌(B. subtilis)、化膿性溶血性連鎖球菌(S. pyogenes)を用いて、SNO−AGPの抗菌活性を調べた。
【0048】
各菌株を、20重量%のグルコースを添加した M9培地(Na2HPO4 64g、KH2PO4 15g、NaCl 2.5g、NH4Cl 5g/L)で、1晩培養し、M9で3回洗浄し、M9培地中で、菌数をOD630=0.05±0.01に調整した。この培地に実施例1で得られたSNO−AGP、比較例で得られたSNO−HSA、コントロールとしてリン酸緩衝液(PBS)を添加し、37℃にて9時間静置後、OD630を測定した。この値をコントロール群と比較することで増殖率を算出した。
【0049】
【数1】

【0050】
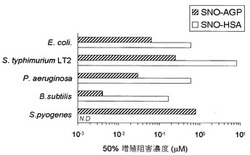
SNO−AGPとSNO−HSAの大腸菌に対する増殖阻害率を図4に示す。また、種々の細菌に対する50%阻害活性濃度(IC50)を表2および図5に示す。図5より明らかなようにSNO−AGPは極めて低濃度で菌の増殖を阻害した。SNO−AGPの抗菌活性は既知のS−ニトロソ化タンパク質の中では最も強力であった。
【0051】
【表2】

【0052】
(試験例2)
SNO−AGPに代えて実施例2で得られたSNO−asialo−AGPを用いた以外は試験例1と同様に試験した。結果を図6に示す。50%阻害活性濃度(IC50)はSNO−AGPで65nMであり、SNO−asialo−AGPで800pMであった。SNO−asialo−AGPはSNO−AGPの80倍の抗菌活性を有し、さらに極めて低い濃度で菌の増殖を阻害し、非常に高い抗菌活性を有することが明らかとなった。
【0053】
(試験例3)
SNO−AGP、SNO−asialo−AGPおよびSNO−HSAから細菌内へのNO輸送効率について検討した。
【0054】
大腸菌培養液にSNO−AGP、SNO−asialo−AGP、SNO−HSAを各々添加し、37℃にて7時間大腸菌を培養した。細胞内NO検出プローブであるDiaminofluorescein−FM diacetate(DAF−FM DA)を添加してさらに1時間培養した後、励起波長:485nm、測定波長:535nmで大腸菌体内のNO量の指標となる蛍光を測定した。結果を図7および図8に示す。SNO−AGP、SNO−asialo−AGPおよびSNO−HSAの抗菌活性は、細菌内へのNO輸送能に依存していた。
【0055】
(試験例4)
SNO−AGPから細菌へのNO輸送機構について検討した。大腸菌の菌体表面チオール基をN−エチルマレイミド(NEM)で修飾して、菌体内へのNOの取込み量に変化が生じるかを検討した。方法を図9に示す。結果を図10に示す。図10から明らかなように、NEMで菌体表面のチオール基が修飾された大腸菌ではNOの菌体内輸送が阻害された。よって、SNO−AGPのNO輸送機構には、SNO−AGPから菌体表面のチオール基へのS−ニトロソ転移反応が関与することがわかった。
【産業上の利用可能性】
【0056】
本発明の抗菌剤および本発明のシアル酸が除去されているS−ニトロソ化AGP・A体またはその変異体は、抗菌活性が非常に高く、抗菌スペクトルも広いことより、種々の感染症の治療薬として医療分野に貢献できる。
【技術分野】
【0001】
本発明は、S−ニトロソ化α1−酸性糖タンパク質を有効成分として含有する抗菌剤に関する。
【背景技術】
【0002】
α1−酸性糖タンパク質は、183個のアミノ酸と5本の糖鎖からなる分子量約44kDaのオロソムコイドとも呼ばれる血清タンパク質である。α1−酸性糖タンパク質の糖鎖含量は分子量の45%と他のタンパク質の中でも極めて高く、その糖鎖末端にシアル酸残基を有しているために、血清中で最も負に帯電している(pI値:2.7)。α1−酸性糖タンパク質の血清中濃度は、健常時において0.5〜1.0g/Lであるが、感染症、炎症時などに血液および組織中で約2〜4倍に増加し、主に抗炎症および免疫調節分子として機能していると考えられている。しかしながら、その詳細な作用機序については未だ不明な点が残されている。また、このα1−酸性糖タンパク質は「F1*S体」と「A体」という二つのバリアントが生体内に約2〜3:1の割合で存在する。「F1*S体」と「A体」のアミノ酸配列の違いの一つに、A体のみが持つ149番目の遊離型システイン(Cys−149)残基がある。しかし、その機能的差異に関する報告はリガンド結合能に関するものにとどまっている。
【0003】
一酸化窒素(NO)は、パーオキシナイトライト(ONOO−)となり殺菌作用を示すが、その一方で、一電子酸化されてNO+となると、グルタチオン(GSH)などの低分子やタンパク質のシステイン残基と反応し、化学的に安定なS−ニトロソチオール(RS−NO)へと変換される。これまでに本発明者らは、ヒト血清アルブミン(HSA)などのS−ニトロソ化体(SNO−HSA)が、NO自身や低分子のRS−NOであるS−ニトロソグルタチオン(GS−NO)と比較して数百倍強力な抗菌活性を示すことをすでに明らかにしている(特許文献1)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2005−206577号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、抗菌活性が高く、種々の細菌に効果を有する、安全な抗菌剤を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明は、S−ニトロソ化α1−酸性糖タンパク質またはその変異体を有効成分として含有する抗菌剤を提供する。
【0007】
1つの実施形態では、上記S−ニトロソ化α1−酸性糖タンパク質が、S−ニトロソ化α1−酸性糖タンパク質バリアントA体である。
【0008】
1つの実施形態では、上記S−ニトロソ化α1−酸性糖タンパク質バリアントA体が、149位のシステイン残基がニトロソ化されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体である。
【0009】
1つの実施形態では、上記S−ニトロソ化α1−酸性糖タンパク質が、糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質である。
【0010】
1つの実施形態では、上記S−ニトロソ化α1−酸性糖タンパク質が、S−ニトロソ化アシアロα1−酸性糖タンパク質である。
【0011】
本発明は、また、糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体またはその変異体である。
【0012】
1つの実施形態は、S−ニトロソ化α1−酸性糖タンパク質バリアントA体またはその変異体から、ノイラミニダーゼによってシアル酸が除去されて得られる、上記糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体またはその変異体である。
【0013】
1つの実施形態では、上記糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体は、149位のシステイン残基がS−ニトロソ化されている。
【発明の効果】
【0014】
本発明の抗菌剤は、有効成分であるS−ニトロソ化α1−酸性糖タンパク質が細菌内へ一酸化窒素(NO)を効率よく輸送することにより強い抗菌活性を有する。生体内物質であることより安全な薬剤を提供できる。本発明のS−ニトロソ化α1−酸性糖タンパク質は、S−ニトロソ基が凍結乾燥後も安定に存在することから、凍結乾燥による保存が可能である。また、本発明のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質は、特に強い抗菌活性を有する。
【図面の簡単な説明】
【0015】
【図1】S−ニトロソ化α1−酸性糖タンパク質バリアントA体の製造方法を示す工程図である。
【図2】HPLCによるS−ニトロソ化タンパク質のNO付加率定量法の説明図である。
【図3】α1−酸性糖タンパク質のN−結合型糖鎖の構造を示す図である。
【図4】S−ニトロソ化α1−酸性糖タンパク質バリアントA体の抗菌活性を示すグラフである。
【図5】S−ニトロソ化α1−酸性糖タンパク質バリアントA体の抗菌活性を示すグラフである。
【図6】S−ニトロソ化アシアロα1−酸性糖タンパク質バリアントA体の抗菌活性を示すグラフである。
【図7】各種S−ニトロソ化タンパク質から細菌内へのNO輸送効率を示すグラフである。
【図8】NO検出プローブであるDAF−FMの蛍光強度と大腸菌の増殖率の関係を示すグラフである。
【図9】大腸菌の菌体表面の修飾方法と修飾による菌体内へのNO輸送量測定方法を示す図である。
【図10】大腸菌の菌体表面の修飾による菌体内へのNO輸送量の変化を示すグラフである。
【発明を実施するための形態】
【0016】
本発明の抗菌剤は、S−ニトロソ化α1−酸性糖タンパク質またはその変異体を有効成分として含有する。
【0017】
上記α1−酸性糖タンパク質(以下、AGPともいう。)は、その由来については特に限定されない。例えば、ヒト、サル、ウシ、イヌ、ブタ、マウス由来AGPが挙げられる。好ましくは、ヒト由来のAGPである。ヒト由来のAGPは、183個のアミノ酸残基と5本の糖鎖からなる分子量44100の血清タンパク質である。ヒト由来AGPは2つのバリアント(A体とF1*S体)が存在し、AGPバリアントA体(以下、AGP・A体ともいう。)のアミノ酸配列は配列番号1で示され、バリアントF1*S体のアミノ酸配列は配列番号2で示される。本発明では、好適にはAGP・A体が用いられる。AGPは、血漿から公知の方法により得ることができ、また、遺伝子組換え技術を用いて常法により得ることができる。
配列番号1:QIPLCANLVPVPITNATLDRITGKWFYIASAFRNEEYNKSVQEIQATFFYFTPNKTEDTIFLREYQTRQNQCFYNSSYLNVQRENGTVSRYEGGREHVAHLLFLRDTKTLMFGSYLDDEKNWGLSFYADKPETTKEQLGEFYEALDCLCIPRSDVMYTDWKKDKCEPLEKQHEKERKQEEGES
配列番号2:QIPLCANLVPVPITNATLDQITGKWFYIASAFRNEEYNKSVQEIQATFFYFTPNKTEDTIFLREYQTRQDQCIYNTTYLNVQRENGTISRYVGGQEHFAHLLILRDTKTYMLAFDVNDEKNWGLSVYADKPETTKEQLGEFYEALDCLRIPKSDVVYTDWKKDKCEPLEKQHEKERKQEEGES
【0018】
S−ニトロソ化AGPの変異体とは、S−ニトロソ化されたAGP変異体である。AGP変異体とはアミノ酸残基が置換、欠失、挿入されたAGPであって、AGPと同様の活性を有する限り、特に限定されるものではない。好適には、AGPの少なくとも1つのアミノ酸残基がシステインに置換された変異体、または少なくとも1つのシステインが挿入された変異体である。1〜3のシステインが置換または挿入された変異体が好適である。変異体は遺伝子組換え技術を用いて常法により得ることができる。
【0019】
本発明のS−ニトロソ化AGPまたはその変異体とは、AGPまたはその変異体の少なくとも1つのシステイン残基のチオール基にS−ニトロソ基(−NO)が付加され−SNOとなったAGPまたはその変異体である。システイン残基は天然由来のシステイン残基であっても、挿入または置換されたシステイン残基であってもよい。好適には、AGP・A体が有する149位のシステイン残基がニトロソ化されたS−ニトロソ化AGP・A体が挙げられる。
【0020】
S−ニトロソ化は亜硝酸塩と反応させる等の公知の方法によって達成することができる。しかし、ヘモグロビンのようにタンパク質のS−ニトロソ化に成功している例もあるが、一般的には、タンパク質にとってS−ニトロソ化は厳しい条件での反応である。したがって、より穏和な条件でのチオール基へのNOの導入が可能な方法を用いることが好ましく、イソアミルナイトライトを用いた方法(De Master E.G. et al., Biochemistry, 34, p.11494-11499, 1995)やn−ブチルナイトライトと反応させる方法(Meyer D.J. et al., FEBS Letters, 345, p.177-180, 1994)を好適に使用することができる。
【0021】
AGPまたはその変異体には複数本の糖鎖が付加されており、その糖鎖末端の少なくとも1個のシアル酸を除去することにより、シアル酸が除去されているAGPまたはAGP変異体が得られる。シアル酸の除去によりガラクトース残基が新たに糖鎖の非還元末端に現われる。複数のシアル酸が除去されることによりα1−酸性糖タンパク質の等電点は上昇し、分子量は減少する。
【0022】
アシアロα1−酸性糖タンパク質とは、α1−酸性糖タンパク質からシアル酸が95%以上除去されているものであり、好ましくは、すべてのシアル酸が除去されているものである。例えば、α1−酸性糖タンパク質から14個のシアル酸、15個のシアル酸が除去されているα1−酸性糖タンパク質が挙げられる。シアル酸が除かれると、代わりに同じ数のガラクトース残基が新たに糖鎖の非還元末端に現われる。
【0023】
AGP・A体には5本の糖鎖が付加されている。具体的には、15位、38位、54位、75位、85位の各アスパラギンに糖鎖が付加されている。これら糖鎖は分岐しておりその末端にはシアル酸が存在する。その少なくとも1個のシアル酸を除去することにより、シアル酸が除去されているAGP・A体を得ることができる。5個以上、より好ましくは10個以上、さらに好ましくは糖鎖末端に存在するシアル酸すべてが除去されているAGP・A体またはその変異体が好ましい。例えば、14個または15個のシアル酸が除去されているAGP・A体が挙げられる。糖鎖末端に存在するシアル酸の95%以上のシアル酸が除去されているAGP・A体はアシアロAGP・A体である。
【0024】
糖鎖の末端のシアル酸の除去方法は限定されない。例えば、酵素による除去などが挙げられる。好適には酵素によって除去される。酵素としては、例えばノイラミニダーゼが挙げられる。
【0025】
本発明の抗菌剤は、細菌内に一酸化窒素を効率的に輸送することができる。一酸化窒素輸送メカニズムには、S−ニトロソ化AGPから菌体表面のチオール基へのS−ニトロソ転移反応が関与すると考えられる。よって、本発明の抗菌剤は、種々の細菌に対して優れた抗菌性を有し、グラム陽性菌感染症、グラム陰性菌感染症など種々の細菌の感染症の治療薬として極めて有用なものである。感染症としては、例えば、レンサ球菌(A群β溶連菌、肺炎球菌など)、黄色ブドウ球菌(MSSA、MRSA)、表皮ブドウ球菌、腸球菌、リステリア、髄膜炎球菌、淋菌、病原性大腸菌(0157:H7など)、クレブシエラ(肺炎桿菌)、プロテウス菌、百日咳菌、緑膿菌、セラチア菌、シトロバクター、アシネトバクター、エンテロバクター、マイコプラズマ、クラミジア、クロストリジウムなどによる各種感染症、結核、コレラ、ジフテリア、赤痢、猩紅熱、炭疽、トラコーマ、梅毒、破傷風、ハンセン病、レジオネラ、レプトスピラ、ライム病、野兎病、Q熱などが挙げられる。
【0026】
本発明の抗菌剤は、注射用剤、外用剤、経口剤などの製剤とすることができる。他の抗菌剤と組み合わせて用いることもできる。注射剤の場合は、常法により液剤、凍結乾燥製剤にすることができ、スクロースなどの安定化剤などを含むことができる。
【0027】
本発明の抗菌剤に含有される有効成分の量、即ち、抗菌活性を有する投与量は、予防または疾患の過程と状態に対して所望の治療効果を発揮するのに充分な量とすべきであり、患者に対する投与量は、処置すべき個々の患者の年齢、および感染症の程度等の条件によって変化するが、一般的には1日あたりの有効成分の投与量1mg〜10gが、1日に1〜4回予防または治療のために投与される。
【0028】
本発明は、また、糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体(以下シアル酸除去S−ニトロソ化AGP・A体ともいう。)またはその変異体に関する。
【0029】
シアル酸除去S−ニトロソ化AGP・A体またはその変異体とは、AGP・A体またはその変異体の糖鎖末端の少なくとも1個のシアル酸が除去され、かつ、少なくとも1つのシステイン残基のチオール基がS−ニトロソ化されているAGP・A体またはその変異体である。
【0030】
上述したように、AGP・A体は183個のアミノ酸残基と5本の糖鎖からなる分子量44100の血清タンパク質である。AGP・A体は、配列番号1で示されるアミノ酸配列を有する。
【0031】
糖鎖末端の少なくとも1個のシアル酸が除去されているとは、AGP・A体またはその変異体の15位、38位、54位、75位、85位の各アスパラギン残基に付加されている糖鎖の末端のシアル酸が少なくとも1個除去されていることであり、好ましくは、5個以上、より好ましくは10個以上除去されており、さらに好ましくは糖鎖末端に存在するシアル酸の95%以上が除去されている。例えば、14個または15個のシアル酸が除去されている。
【0032】
S−ニトロソ化されるとは、AGP・A体またはその変異体の少なくとも1個のシステイン残基のチオール基にS−ニトロソ基(−NO)が付加され−SNOにされることである。S−ニトロソ化は、シアル酸の除去前であっても、シアル酸の除去後であってもよい。好ましくは、149位のシステインのチオール基がS−ニトロソ化される。
【0033】
AGP・A体の変異体とはアミノ酸残基が置換、欠失、挿入されたAGP・A体である。該アミノ酸残基の置換、欠失、挿入の位置、アミノ酸残基数などは、シアル酸除去S−ニトロソ化AGP・A体の変異体が、シアル酸除去S−ニトロソ化AGP・A体と同様の強い抗菌活性を有する限り、特に限定されるものではない。
【0034】
AGP・A体の取得方法、糖鎖末端のシアル酸の除去方法、S−ニトロソ化方法については、上述した方法と同様の方法を用いることができる。
【0035】
1つの実施形態では、シアル酸除去S−ニトロソ化AGP・A体またはその変異体は、S−ニトロソ化されたAGP・A体またはその変異体から、ノイラミニダーゼによってシアル酸が除去されて得られる。他の実施形態では、シアル酸除去S−ニトロソ化AGP・A体またはその変異体は、ノイラミニダーゼによって少なくとも1個のシアル酸が除去されているAGP・A体またはその変異体をS−ニトロソ化して得られる。AGP・A体1〜100mg、好ましくは20mgをノイラミニダーゼ0.05〜0.5単位、好ましくは0.2単位と混合し、37℃にて2〜48時間、好ましくは24時間反応させて得られるシアル酸除去S−ニトロソ化AGP・A体が好適である。
【0036】
本発明の好ましいシアル酸除去S−ニトロソ化AGP・A体は、149位のシステイン残基がS−ニトロソ化されたシアル酸除去S−ニトロソ化AGP・A体である。また、シアル酸が95%以上除去されているS−ニトロソ化アシアロAGF・A体である。さらに好ましいシアル酸除去S−ニトロソ化AGP・A体は、149位のシステイン残基がS−ニトロソ化されているS−ニトロソ化アシアロAGF・A体であり、その分子量は約40,000である。
【0037】
本発明のシアル酸除去S−ニトロソ化AGP・A体またはその変異体は、強い抗菌作用を示す。本物質は、細菌内に一酸化窒素を効率的に輸送することができる。一酸化窒素輸送メカニズムには、シアル酸除去S−ニトロソ化AGP・A体から菌体表面のチオール基へのS−ニトロソ転移反応が関与すると考えられる。よって、本発明のシアル酸除去S−ニトロソ化AGP・A体は、種々の細菌に対して優れた抗菌性を有し、グラム陽性菌感染症、グラム陰性菌感染症など種々の細菌の感染症の治療薬として極めて有用である。
【実施例】
【0038】
以下に、実施例に基づいて、本発明をより詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【0039】
(実施例1)
ヒト血清から分離精製したAGP分画は、一般財団法人 化学及血清療法研究所より恵与されたもの、あるいは購入したヒト血清由来のAGP(G9885、Sigma−Aldrich社)を使用した。AGPバリアントそれぞれの分離精製方法は、Herveらの方法に従って行った。すなわち、iminodiacetate−Sepharose gel(18−8769−01、Chelating Sepharose Fast Flow,GEヘルスケアバイオサイエンス社)50mLをイオン交換水で洗浄後、0.2M CuCl2水溶液を流し、Cu2+イオンをキレートした。次に、0.1M酢酸ナトリウム緩衝液(pH3.8)を流すことにより過剰なCu2+イオンを除去した。その後、20mMリン酸ナトリウム緩衝液(pH7.0)+0.5M NaClの移動相を流速0.4mL/分で流して安定化し、20mgのAGPを1mLの移動相に溶解したサンプルをカラムに添加した。添加後、約1.5時間に保持されずに溶出するF1*S体を分取した。次いで、イミダゾール(最終濃度20mM)を加えた移動相を流し、約5時間後に溶出されるA体を分取した。分取した各バリアントをイオン交換水にて透析後、凍結乾燥した。さらに、F1*S体およびA体の回収率より、AGPバリアント比を算出した。
【0040】
得られたAGP・A体に3倍モル量の1,4−dithiothreitol(以下、DTT)(100mMリン酸カリウム緩衝液(pH7.4)+5mM EDTA)を添加、混合し、AGP・A体中に存在する遊離型Cys残基のSH基の還元を行った。これをゲル濾過し、ろ液にその10倍量のS−ニトロソグルタチオン(GS−NO)(100mMリン酸カリウム緩衝液(pH8.0)+1mM DTPA)を添加、混合し、37℃にてS−ニトロソ化反応を行った。混合物をゲル濾過し、ろ液にS−ニトロソ化AGP・A体(以下、SNO−AGPという。)を得た(図1)。
【0041】
SNO−AGPのS−ニトロソ化部位をHPLC flow reactorシステムにより分析した。まず、血漿から精製したAGPバリアントF1*S体を上記と同様にS−ニトロソ化した。また、AGPバリアントA体の149位のシステインをNishiら(Nishi K, et al.,Drug Metab Pharmacokinet,25,200-207,2010)の方法によりアルギニンに変異させたC149Rを得た。得られたC149Rを上記と同様にS−ニトロソ化した。そして、それぞれのNO付加率の定量を、Akaikeら(T. Akaike, et al., J. Biochemistry, 122, 459-466, 1997)の方法により行った。すなわち、図2に示すHPLC flow reactorシステムにおいて、上記SNO−AGP、F1*S体およびC149RにHg2+を反応させて生成するNO2−とGriess試薬との反応生成物であるアゾ色素を540nmで測定することにより、各種S−ニトロソ化タンパク質を分離・定量した。各タンパク質のNO付加率を表1に示す。表1の結果から、SNO−AGPの149位のシステインがS−ニトロソ化されていることが確認された。
【0042】
【表1】

【0043】
(実施例2)
実施例1で得られたAGP・A体20mgにノイラミニダーゼ0.2単位を添加、混合し、37℃にて24時間反応させ、糖鎖末端のシアル酸が95%以上除去されたアシアロAGP・A体を得た。得られたアシアロAGP・A体を実施例1に従いS−ニトロソ化してS−ニトロソ化アシアロAGP・A体(以下、SNO−asialo−AGPという。)を得た(図3)。得られたSNO−asialo−AGPは、95%以上のシアル酸が除去されており、分子量は約40,000であった。
【0044】
(実施例3)
実施例1のゲル濾過で得られたSNO−AGP溶液を常法により凍結乾燥して、凍結乾燥製剤を得た。また、液状におけるSNO−AGPのpH7およびpH5での安定性を評価したところ、pH7では半減期13日であり、pH5では、半減期が24日であり、非常に安定であることが確認された。
【0045】
(実施例4)
実施例2で得られたSNO−asialo−AGP溶液を常法により凍結乾燥して凍結乾燥製剤を得た。
【0046】
(比較例1)
S−ニトロソ化ヒト血清アルブミン(以下、SNO−HSAという。)を特開2005−206577号公報に記載の方法によって得た。
【0047】
(試験例1)
グラム陰性菌である、大腸菌(E. coli)、ネズミチフス菌(S. typhimurium LT2)、緑膿菌(P. aeruginosa)、およびグラム陽性菌である、枯草菌(B. subtilis)、化膿性溶血性連鎖球菌(S. pyogenes)を用いて、SNO−AGPの抗菌活性を調べた。
【0048】
各菌株を、20重量%のグルコースを添加した M9培地(Na2HPO4 64g、KH2PO4 15g、NaCl 2.5g、NH4Cl 5g/L)で、1晩培養し、M9で3回洗浄し、M9培地中で、菌数をOD630=0.05±0.01に調整した。この培地に実施例1で得られたSNO−AGP、比較例で得られたSNO−HSA、コントロールとしてリン酸緩衝液(PBS)を添加し、37℃にて9時間静置後、OD630を測定した。この値をコントロール群と比較することで増殖率を算出した。
【0049】
【数1】

【0050】
SNO−AGPとSNO−HSAの大腸菌に対する増殖阻害率を図4に示す。また、種々の細菌に対する50%阻害活性濃度(IC50)を表2および図5に示す。図5より明らかなようにSNO−AGPは極めて低濃度で菌の増殖を阻害した。SNO−AGPの抗菌活性は既知のS−ニトロソ化タンパク質の中では最も強力であった。
【0051】
【表2】

【0052】
(試験例2)
SNO−AGPに代えて実施例2で得られたSNO−asialo−AGPを用いた以外は試験例1と同様に試験した。結果を図6に示す。50%阻害活性濃度(IC50)はSNO−AGPで65nMであり、SNO−asialo−AGPで800pMであった。SNO−asialo−AGPはSNO−AGPの80倍の抗菌活性を有し、さらに極めて低い濃度で菌の増殖を阻害し、非常に高い抗菌活性を有することが明らかとなった。
【0053】
(試験例3)
SNO−AGP、SNO−asialo−AGPおよびSNO−HSAから細菌内へのNO輸送効率について検討した。
【0054】
大腸菌培養液にSNO−AGP、SNO−asialo−AGP、SNO−HSAを各々添加し、37℃にて7時間大腸菌を培養した。細胞内NO検出プローブであるDiaminofluorescein−FM diacetate(DAF−FM DA)を添加してさらに1時間培養した後、励起波長:485nm、測定波長:535nmで大腸菌体内のNO量の指標となる蛍光を測定した。結果を図7および図8に示す。SNO−AGP、SNO−asialo−AGPおよびSNO−HSAの抗菌活性は、細菌内へのNO輸送能に依存していた。
【0055】
(試験例4)
SNO−AGPから細菌へのNO輸送機構について検討した。大腸菌の菌体表面チオール基をN−エチルマレイミド(NEM)で修飾して、菌体内へのNOの取込み量に変化が生じるかを検討した。方法を図9に示す。結果を図10に示す。図10から明らかなように、NEMで菌体表面のチオール基が修飾された大腸菌ではNOの菌体内輸送が阻害された。よって、SNO−AGPのNO輸送機構には、SNO−AGPから菌体表面のチオール基へのS−ニトロソ転移反応が関与することがわかった。
【産業上の利用可能性】
【0056】
本発明の抗菌剤および本発明のシアル酸が除去されているS−ニトロソ化AGP・A体またはその変異体は、抗菌活性が非常に高く、抗菌スペクトルも広いことより、種々の感染症の治療薬として医療分野に貢献できる。
【特許請求の範囲】
【請求項1】
S−ニトロソ化α1−酸性糖タンパク質またはその変異体を有効成分として含有する抗菌剤。
【請求項2】
前記S−ニトロソ化α1−酸性糖タンパク質が、S−ニトロソ化α1−酸性糖タンパク質バリアントA体である、請求項1に記載の抗菌剤。
【請求項3】
前記S−ニトロソ化α1−酸性糖タンパク質バリアントA体が、149位のシステイン残基がニトロソ化されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体である請求項2に記載の抗菌剤。
【請求項4】
前記S−ニトロソ化α1−酸性糖タンパク質が、糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質である、請求項1から3のいずれかの項に記載の抗菌剤。
【請求項5】
前記S−ニトロソ化α1−酸性糖タンパク質が、S−ニトロソ化アシアロα1−酸性糖タンパク質である、請求項4に記載の抗菌剤。
【請求項6】
糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体またはその変異体。
【請求項7】
ノイラミニダーゼによって少なくとも1個のシアル酸が除去されているα1−酸性糖タンパク質バリアントA体またはその変異体をS−ニトロソ化して得られる、請求項6に記載のα1−酸性糖タンパク質バリアントA体またはその変異体。
【請求項8】
149位のシステイン残基がニトロソ化されている、請求項6または7に記載のα1−酸性糖タンパク質バリアントA体またはその変異体。
【請求項9】
S−ニトロソ化アシアロα1−酸性糖タンパク質バリアントA体である、請求項6から8のいずれかの項に記載のα1−酸性糖タンパク質バリアントA体またはその変異体。
【請求項1】
S−ニトロソ化α1−酸性糖タンパク質またはその変異体を有効成分として含有する抗菌剤。
【請求項2】
前記S−ニトロソ化α1−酸性糖タンパク質が、S−ニトロソ化α1−酸性糖タンパク質バリアントA体である、請求項1に記載の抗菌剤。
【請求項3】
前記S−ニトロソ化α1−酸性糖タンパク質バリアントA体が、149位のシステイン残基がニトロソ化されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体である請求項2に記載の抗菌剤。
【請求項4】
前記S−ニトロソ化α1−酸性糖タンパク質が、糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質である、請求項1から3のいずれかの項に記載の抗菌剤。
【請求項5】
前記S−ニトロソ化α1−酸性糖タンパク質が、S−ニトロソ化アシアロα1−酸性糖タンパク質である、請求項4に記載の抗菌剤。
【請求項6】
糖鎖末端の少なくとも1個のシアル酸が除去されているS−ニトロソ化α1−酸性糖タンパク質バリアントA体またはその変異体。
【請求項7】
ノイラミニダーゼによって少なくとも1個のシアル酸が除去されているα1−酸性糖タンパク質バリアントA体またはその変異体をS−ニトロソ化して得られる、請求項6に記載のα1−酸性糖タンパク質バリアントA体またはその変異体。
【請求項8】
149位のシステイン残基がニトロソ化されている、請求項6または7に記載のα1−酸性糖タンパク質バリアントA体またはその変異体。
【請求項9】
S−ニトロソ化アシアロα1−酸性糖タンパク質バリアントA体である、請求項6から8のいずれかの項に記載のα1−酸性糖タンパク質バリアントA体またはその変異体。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2012−240984(P2012−240984A)
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願番号】特願2011−114669(P2011−114669)
【出願日】平成23年5月23日(2011.5.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2010年11月25日 日本薬学会九州支部発行の「第27回 日本薬学会九州支部大会 講演要旨集」および2010年11月29日 公益社団法人 日本薬学会発行の「第32回生体膜と薬物の相互作用シンポジウム 講演要旨集」に発表
【出願人】(000135036)ニプロ株式会社 (583)
【Fターム(参考)】
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願日】平成23年5月23日(2011.5.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2010年11月25日 日本薬学会九州支部発行の「第27回 日本薬学会九州支部大会 講演要旨集」および2010年11月29日 公益社団法人 日本薬学会発行の「第32回生体膜と薬物の相互作用シンポジウム 講演要旨集」に発表
【出願人】(000135036)ニプロ株式会社 (583)
【Fターム(参考)】
[ Back to top ]

