SGLT1阻害剤としての4−イソプロピルフェニルグルシトール化合物
【課題】体内貯留性の傾向がなく、SGLT1活性を阻害し、小腸でのグルコース等の吸収を抑制することで、食後高血糖(又は耐糖能異常)を抑制し、それにより、例えば、糖尿病やメタボリックシンドロームの発症を抑制する、若しくは、それらの疾患を治療することができる4−イソプロピルフェニル グルシトール化合物を提供する。
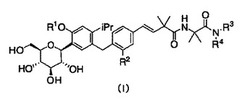
【解決手段】下記式(I)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩。
【化1】

式中、R1は水素原子等を示し、R2はメチル基等を示し、R3はアミノ基で置換されたC1−4アルキル基等を示し、R4は水素原子等を示す。
【解決手段】下記式(I)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩。
【化1】

式中、R1は水素原子等を示し、R2はメチル基等を示し、R3はアミノ基で置換されたC1−4アルキル基等を示し、R4は水素原子等を示す。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、小腸でのグルコ−ス及びガラクトースの吸収に関わるナトリウム依存性グルコ−ス共輸送体1(以下、適宜に「SGLT1」と略記する。)に特異的な阻害活性を有する4−イソプロピルフェニル グルシトール化合物に関する。
【背景技術】
【0002】
血糖値はメタボリックシンドロームのバイオマーカーの一つとなっており、空腹時血糖が126mg/dL以上を示すと糖尿病と診断される。また、空腹時血糖が正常であっても、食後2時間血糖値が140〜200mg/dLの場合には、耐糖能異常(又は食後高血糖)と診断される。近年の疫学的研究によれば、耐糖能異常が心血管障害のリスクを高めると報告されている(非特許文献1及び2参照)。さらに、運動療法や薬物治療を施すことで耐糖能異常から2型糖尿病への移行を抑制し、高血圧の発症も有意に抑制することが報告されている(非特許文献3参照)。
【0003】
以上のことから、食後高血糖を抑制することが糖尿病やメタボリックシンドロームの発症抑制に重要であると考えられ、食後高血糖をコントロールする薬剤の需要が高まりつつある。
【0004】
従来、食後高血糖改善薬としては、糖類の加水分解酵素を阻害し、小腸からの糖の吸収を遅延させるα−グルコシダ−ゼ阻害剤が汎用されてきたが、新しい作用機序を有する食後高血糖改善薬の開発も行われている。
【0005】
哺乳動物の小腸上皮には高い頻度でナトリウム依存性グルコ−ス共輸送体1(SGLT1)が発現している。このSGLT1は小腸において、ナトリウムに依存し、グルコ−ス又はガラクト−スの能動輸送を司ることが知られている。そこで、SGLT1活性を阻害することによって、食事由来のグルコ−ス吸収を抑制し、食後高血糖の予防又は治療に用いることができる、ピラゾ−ル誘導体が報告されている(特許文献1〜6参照)。一方で、腎臓には高頻度にナトリウム依存性グルコ−ス共輸送体2(SGLT2)が発現しており、糸球体で一旦濾過されたグルコ−スはSGLT2を介して再吸収される(非特許文献4参照)。そして、SGLT2活性を阻害することによって、尿への糖排泄が促進され、血糖低下作用を示すことが報告されている(非特許文献5参照)。SGLT2阻害剤の特徴として、随時血糖を低下させる作用が優れているが、SGLT1阻害剤の様に食後高血糖を是正する作用は低い。また、SGLT1活性に加えて、SGLT2活性も同時に阻害するC−フェニル グルシトール誘導体についての報告もある(特許文献7参照)。
【0006】
一方、食後高血糖改善薬のような持続投与が必要な薬剤にとっては、薬効量と、毒性、副作用の発現量との間の安全域が広いことが重要である。特に、体内残留性薬物の場合は、治療に必要な投与量をコントロールすることが難しく、体内に残留している薬物が加算されて過剰量の薬物の効果が発現されることになり、予期せぬ毒性及び副作用につながる。例えば、分子内に3級アミンの様な親水性基と芳香環の様な疎水性基をもつ、陽イオン性薬物は、リン脂質と疎水結合し、ライソゾーム内に取り込まれ全身の器官に蓄積されることがあることが知られている。代表例として、クロロキンでは網膜障害、パーヘキシリンでは肺や小脳に変化があり神経障害が問題となった(非特許文献6参照)。
【0007】
したがって、薬物は、薬効を示した後に体内から速やかに排泄されることが望ましく、特に、持続投与が必須の食後高血糖改善薬では、体内残留性の問題のない薬物が望まれる。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】国際公開第WO2002/098893号パンフレット
【特許文献2】国際公開第WO2004/014932号パンフレット
【特許文献3】国際公開第WO2004/018491号パンフレット
【特許文献4】国際公開第WO2004/019958号パンフレット
【特許文献5】国際公開第WO2005/121161号パンフレット
【特許文献6】国際公開第WO2004/050122号パンフレット
【特許文献7】国際公開第WO2007/136116号パンフレット
【非特許文献1】Pan XR, et al. Diabetes Care, 第20巻, 537項, 1997年
【非特許文献2】M Tominaga, et al. Diabetes Care, 第22巻, 920項, 1999年
【非特許文献3】J.−L. Chiasson, et al. Lancent, 第359巻, 2072項, 2002年
【非特許文献4】E. M. Wright, Am. J. Physiol. Renal. Physiol., 第280巻, F10項, 2001年
【非特許文献5】G. Toggenburger, et al. Biochem. Biophys. Acta., 第688巻, 557項, 1982年
【非特許文献6】日薬理誌 Folia Pharmacol. Jpn. 第113巻, 19項, 1999年
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の目的は、薬効量と毒性、副作用の発現量との間の安全域が広いSGLT1阻害作用を示す化合物又はその塩、及びそれらを含む医薬を提供することである。
【課題を解決するための手段】
【0010】
特許文献7に記載のC−フェニル グルシトール誘導体は排泄されず腎臓に残留する傾向が見られることがわかった。そこで本発明者らは体内蓄積性の問題がない化合物を探索し鋭意検討した。その結果、特に、糖部分に直接結合するベンゼン環にイソプロピル基を導入し、その他のベンゼン環に、アミノ基を有するブテノイル基を導入して得られる、下記一般式(I)で示される、4−イソプロピルフェニル グルシトール化合物は、意外にも腎臓に残留する傾向がないことを見出し、本発明を完成した。
【0011】
以下に、本発明の4−イソプロピルフェニル グルシトール化合物(以下、「本発明化合物」という)の態様を述べる。
(1)下記式(I)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩:
【0012】
【化1】

【0013】
式中、
R1は水素原子、又はC1−4アルキル基であり、
R2は水素原子、又はメチル基であり、
R3は“アミノ基若しくはジC1−4アルキルアミノ基で置換されたC1−4アルキル基”、又はピペリジル基であり、
R4は水素原子であり、又はR3とR4は隣接する窒素原子と共にピペリジノ基若しくはピペラジニル基を形成し、それらはC1−4アルキル基若しくはジメチルアミノ基で置換されていてもよい。
(2)下記群から選択される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩。
【0014】
【化2】

【0015】

【0016】
(3)下記群から選択される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩。
【0017】
【化3】

【0018】
(4)前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む医薬。
(5)前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含むナトリウム依存性グルコース共輸送体1(SGLT1)活性阻害剤。
(6)前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む食後高血糖改善薬。
(7)前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む糖尿病の予防又は治療薬。
(8)糖尿病の予防又は治療用の薬剤の製造における、前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩の使用。
(9)前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩の予防又は治療に有効量を哺乳動物に投与することを含む糖尿病を予防又治療する方法。
【発明の効果】
【0019】
本発明により、体内蓄積性の傾向がない、SGLT1活性を阻害する4−イソプロピルフェニル グルシトール化合物を提供することが可能となった。
【発明を実施するための形態】
【0020】
本発明において使用する用語を以下に定義する。
【0021】
「C1-4アルキル基」とは、炭素原子を1−4個有する直鎖状又は分枝状のアルキル基を意味する。例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、tert−ブチル基が挙げられる。
【0022】
「ジC1-4アルキルアミノ基」とは、2つのC1-4アルキル基で置換されたアミノ基を意味する。例えば、ジメチルアミノ基やジエチルアミノ基が挙げられる。
【0023】
また、「製薬学的に許容される塩」とは、アルカリ金属類、アルカリ土類金属類、アンモニウム、アルキルアンモニウムなどとの塩、鉱酸又は有機酸との塩であり、例えば、ナトリウム塩、カリウム塩、カルシウム塩、アンモニウム塩、アルミニウム塩、トリエチルアンモニウム塩、ぎ酸塩、酢酸塩、プロピオン酸塩、酪酸塩、ヘキサン酸塩、オクタン酸塩、トリフルオロ酢酸塩、マレイン酸塩、酒石酸塩、クエン酸塩、ステアリン酸塩、コハク酸塩、エチルコハク酸塩、ラクトビオン酸塩、グルコン酸塩、グルクロン酸塩、グルコヘプトン酸塩、グルタール酸塩、ピメリン酸塩、スベリン酸塩、アゼライン酸塩、セバシン酸塩、1,9−ノナンジカルボン酸塩、ドデカン二酸塩、トリデカン二酸塩、テトラデカン二酸塩、ペンタデカン二酸塩、ヘキサデカン二酸塩、ヘプタデカン二酸塩、安息香酸塩、2−ヒドロキシ安息香酸塩、メタンスルホン酸塩、エタンスルホン酸塩、エタンジスルホン酸塩、2−ヒドロキシエタンスルホン酸塩、ベンゼンスルホン酸塩、p−トルエンスルホン酸塩、1,5−ナフタレンジスルホン酸塩、ラウリル硫酸塩、乳酸塩、馬尿酸塩、フマル酸塩、マロン酸塩、トランスケイ皮酸塩、リンゴ酸塩、アスパラギン酸塩、グルタミン酸塩、アジピン酸塩、システインとの塩、N−アセチルシステインとの塩、塩酸塩、臭化水素酸塩、リン酸塩、硫酸塩、よう化水素酸塩、ニコチン酸塩、シュウ酸塩、ピクリン酸塩、チオシアン酸塩、ウンデカン酸塩、アクリル酸ポリマーとの塩、カルボキシビニルポリマーとの塩を挙げることができる。
【0024】
「食後高血糖改善薬」とは、食後高血糖を抑制することにより、食後高血糖に関連する疾患、例えば、糖尿病やメタボリックシンドロームの発症を抑制する、若しくは、それらの疾患を治療する薬物をいう。ここで、「食後高血糖」とは、食後に血糖値が異常に高くなる状態、具体的には、食後2時間の血糖値が140mg/dlを上回る状態をいう。
【0025】
本発明化合物の有用性について以下に説明する(詳細は以下の試験例参照)。
【0026】
本発明化合物は、強いSGLT1阻害活性を有し、また、SGLT2阻害活性も弱いがある程度の活性を有する。また、本発明化合物は、WO2007/136116号に開示された化合物と同程度に強い血糖降下作用を有する。さらに、WO2007/136116号に開示の化合物は、1mg/kg経口投与した7日後でも、化合物が排泄されず腎臓に残留する傾向が見られたのに対して、本発明化合物は、意外にも3mg/kgの用量で3日間連続投与したにも関わらず、2日後に腎臓に残留しないという特徴を示した。
【0027】
したがって、本発明化合物は、体内残留性の傾向がなく、連続投与による副作用及び毒性が少ない医薬品として実用性に優れた性質を有すると考えられる。
【0028】
本発明化合物を医薬として提供する場合、固形剤、液剤等の種々の態様の製剤形態を適宜に採択することができる。その際、製薬学的に許容される担体を配合することも可能である。そのような担体の例としては、一般的な賦形剤、増量剤、結合剤、崩壊剤、被覆剤、糖衣剤、pH調整剤、溶解剤又は水性若しくは非水性溶媒などが挙げられる。本発明の化合物とこれらの担体から、錠剤、丸剤、カプセル剤、顆粒剤、粉剤、散剤、液剤、乳剤、懸濁剤等を調製することができる。
【0029】
例えば、本発明化合物と固形製剤の製造等に用いられる一般的な賦形剤等を混合等した後に打錠し、経口投与用の錠剤として提供することができる。
【0030】
また、本発明化合物は、α、β若しくはγ−シクロデキストリン又はメチル化シクロデキストリン等に包接させて、その溶解性を改善することも可能である。
【0031】
本発明化合物の投与量は、疾患、症状、体重、年齢、性別、投与経路等により異なってくるが、成人に対し、1日当たり0.1〜1000mg/kg体重であり、0.1〜200mg/kg体重が好ましく、0.1〜10mg/kg体重がより好ましい。これを1日1回から数回に分けて投与することができる。
【0032】
本発明の好ましい態様として、以下に示す実施例化合物があげられる。
【0033】
【化4】

【0034】
以下に、本発明化合物(I)の製造方法を例を挙げて詳細に説明するが、例示されたものに特に限定されない。
【0035】
製造法1
本発明化合物(I)は以下の方法で合成することができる。
【0036】
ただし、Xはアセチル基またはC1−4アルキル基を示し、R5はR3もしくはアミノ基がtert−ブチルカーボネート(Boc)で保護されたR3を示し、その他の記号は前記と同義である。
【0037】
【化5】

【0038】
(1)工程1(Heck反応)
化合物(II)とオレフィンカルボン酸(III)をパラジウム触媒とホスフィンリガンド、及び適当な塩基の存在下、Heck反応を行うことにより化合物(IV)を得ることができる。このとき用いるパラジウム触媒としては、酢酸パラジウム、テトラキス(トリフェニルホスフィン)パラジウム、ジベンジリデンアセトンパラジウム、ビス(トリフェニルホスフィン)パラジウムクロリド、ビス(トリシクロヘキシルホスフィン)パラジウムクロリド、パラジウム活性炭等が挙げられる。ホスフィンリガンドとしてはトリフェニルホスフィンやトリ−O−トリルホスフィン等が挙げられる。また、塩基にはトリエチルアミン、N−エチル−N,N−ジイソプロピルアミン、炭酸カリウム、炭酸カルシウム、炭酸セシウム、カリウムt−ブトキシド等が用いられる。反応に用いられる溶媒としては、アセトニトリル、トルエン、テトラヒドロフラン等が挙げられる。反応温度は0℃から還流温度であるが、マイクロウェ−ブを用いることもある。
(2)工程2(アミド基への変換)
化合物(IV)をアミン(R5R4NH)と脱水縮合し、化合物(V)を得ることができる。この反応に使用する溶媒としては、クロロホルム、ジクロロメタン、N,N−ジメチルホルムアミド等が好ましく、脱水縮合剤としては、N,N´−ジシクロヘキシルカルボジイミド(DCC)、N−エチル−N´−3−ジメチルアミノプロピルカルボジイミド塩酸塩(EDC・HCl)、1、1´−カルボニルジイミダゾ−ル(CDI)、EDC・HCl/1−ヒドロキシベンゾトリアゾ−ル1水和物(HOBt・H2O)等が好ましい。ここでの反応温度は0℃〜60℃である。
(3)工程3(脱保護)
化合物(V)中のBoc基を酸性条件化除去し、アセチル(Ac)基を塩基性条件下除去することで化合物(I)を得ることができる。Boc基には、ジクロロメタン、クロロホルム、ジオキサン等の溶媒中、または無溶媒で塩酸またはトリフルオロ酢酸を作用させる。アセチル基には、ナトリウムメトキシド、水酸化ナトリウム、水酸化リチウム、炭酸カリウム、炭酸セシウム、トリエチルアミン等の塩基を用いることができる。溶媒としては、メタノール、エタノール、含水メタノール等が好ましい。ここでの反応温度は0℃〜60℃である。
【0039】
製造法2
本発明化合物(I)は以下に示す別ルートによって合成することもできる。ただし、記号は前記と同義である。
【0040】
【化6】

【0041】
(4)工程4(Heck反応)
化合物(II)とオレフィンカルボン酸(VI)を用いて製造法1、工程1に記載したHeck反応を行うことにより、化合物(VII)を得ることができる。
(5)工程5(アミド基への変換)
化合物(VII)とアミン(VIII)を用いて製造法1、工程2に記載した脱水縮合反応を行うことにより、化合物(V)を得ることができる。
(6)工程6(脱保護)
上記で得られた化合物(V)を製造法1、工程3に記載した脱保護反応によって化合物(I)へ導くことができる。
【0042】
製造法3
中間体(II)の製造法
本発明化合物(I)の製造に必要な中間体(II)の製造法を以下に示す。
【0043】
ただし、X1はベンジル基又はC1−4アルキル基を示し、X2はトリメチルシリル基又はC1−4アルキル基を示し、その他の記号は前記と同義である。
【0044】
【化7】

【0045】
(7)工程7(カップリング)
化合物(IX)にn−ブチルリチウム、sec−ブチルリチウム、tert−ブチルリチウム等の有機金属試薬を用いてアリ−ルリチウム試薬を調製することができる。これに、グルコノラクトン(X)を加えることで化合物(XI)を得ることができる。このとき反応に用いられる溶媒としては、テトラヒドロフラン、ジエチルエ−テル、トルエン等が挙げられる。反応温度は−80℃から室温であり、好ましくは−78℃〜−25℃である。
(8)工程8(酸加水分解)
化合物(XI)中のシリル基を酸性条件化メタノール中で除去すると共に、糖の1位をメチルエーテル化し化合物(XII)を得ることができる。このとき用いる酸としては、塩酸、硫酸、メタンスルホン酸、p−トルエンスルホン酸1水和物、ピリジニウムp−トルエンスルホン酸、フッ化水素ピリジン、n−Bu4NF等を用いることができる。反応温度は用いる酸によって異なるが、0℃〜100℃、好ましくは25℃〜80℃である。
(9)工程9(アセチル化)
化合物(XII)中の水酸基をアセチル基で保護することにより、化合物(XIII)を得ることができる。化合物(XII)と、無水酢酸、またはアセチルクロリド等を溶媒中、適当な塩基存在下反応させ化合物(XIII)を得ることができる。反応に用いる溶媒としては、クロロホルム、ジクロロメタン、ジオキサン、酢酸エチル、テトラヒドロフラン、N,N−ジメチルホルムアミド等である。塩基としてはトリエチルアミン、コリジン、ピリジン等が好ましい。反応の触媒として4−ジメチルアミノピリジンを用いることもできる。また、好ましい反応温度は0℃〜室温である。
(10)工程10(還元)
化合物(XIII)とEt3SiH、i−Pr3SiH、t−BuMe2SiH又はPh2SiHClを、ルイス酸の存在下で反応させ、化合物(XIV)を得ることができる。この反応に使用するルイス酸としては、BF3・Et2O、CF3COOH、InCl3、TiCl4、TMSOTf、p−トルエンスルホン酸、メタンスルホン酸等が挙げられ、溶媒としては、クロロホルム、ジクロロメタン、トルエン、テトラヒドロフラン、アセトニトリル又はそれらの混合溶媒が挙げられ、好ましい溶媒はアセトニトリル/クロロホルム、アセトニトリル/ジクロロメタン、アセトニトリル/テトラヒドロフラン、アセトニトリル/テトラヒドロフラン/トルエン等のアセトニトリルとの混合溶媒である。ここでの反応温度は−60℃〜25℃、好ましくは−30℃〜25℃である。
(11)工程11(脱保護)
化合物(XIV)中のX1がベンジル基の場合は、パラジウム活性炭、水酸化パラジウム、又は白金−パラジウム活性炭等の触媒を用いて水素雰囲気下にて接触水素添加することにより、脱ベンジル化を行うことができる。中でもパラジウム活性炭、水酸化パラジウムが触媒として好ましい。この反応に使用する溶媒としては、メタノ−ル、エタノ−ル、イソプロパノ−ル、酢酸エチル、酢酸、およびこれらの混合溶媒が挙げられる。反応温度は室温から還流温度であるが、室温が好ましい。
(12)工程12(ブロモ化)
化合物(XIV)、または上記工程11で得られた化合物と、臭素、N−ブロモスクシンイミド、臭化水素等を溶媒中反応させて、化合物(XV)を得ることができる。反応に用いる溶媒としては、クロロホルム、ジクロロメタン、酢酸、メタノール、N,N−ジメチルホルムアミド等である。ここでの反応温度は0℃〜室温である。
(13)工程13(脱保護)
化合物(XV)中のアセチル基を塩基性条件下除去することで化合物(XVI)を得ることができる。塩基としては、ナトリウムメトキシド、水酸化ナトリウム、水酸化リチウム、炭酸カリウム、炭酸セシウム、トリエチルアミン等の塩基を用いることができる。溶媒としては、メタノール、エタノール、含水メタノール等が好ましい。ここでの反応温度は0℃〜60℃である。
(14)工程14(シリル化)
化合物(XVI)中の水酸基をトリメチルシリル基等のシリル基で保護することにより、化合物(XVII)を得ることができる。化合物(XVI)と、トリメチルシリルクロリド、トリエチルシリルクロリド、tert−ブチルジメチルシリルクロリド等を溶媒中、適当な塩基存在下反応させ化合物(XVII)を得ることができる。反応に用いる溶媒としては、クロロホルム、ジクロロメタン、ジオキサン、酢酸エチル、テトラヒドロフラン、N,N−ジメチルホルムアミド等である。塩基としてはトリエチルアミン、コリジン、ピリジン等が好ましい。また、好ましい反応温度は0℃〜室温である。
(15)工程15(カップリング)
化合物(XVII)にn−ブチルリチウム、sec−ブチルリチウム、tert−ブチルリチウム等の有機金属試薬を用いてアリ−ルリチウム試薬を調製することができる。これに、アルデヒド(XVIII)を加えることで化合物(XIX)を得ることができる。このとき反応に用いられる溶媒としては、テトラヒドロフラン、ジエチルエ−テル、トルエン等が挙げられる。反応温度は−80℃から室温であり、好ましくは−78℃〜−25℃である。
(16)工程16(酸加水分解)
上記で得られた化合物(XIX)を製造法3、工程8に記載した酸加水分解反応によって化合物(XX)へ導くことができる。
(17)工程17(アセチル化)
上記で得られた化合物(XX)を製造法3、工程9に記載したアセチル化反応によって化合物(XXI)へ導くことができる。
(18)工程18(還元)
上記で得られた化合物(XXI)を製造法3、工程10に記載した還元反応によって中間体(II)へ導くことができる。
【0046】
製造法4
中間体(II)の製造法
中間体(II)は以下に示す別ルートによって合成することもできる。ここでは、工程19から21までワンポットで行い工程数を短縮することができる。
【0047】
ただし、記号は前記と同義である。
【0048】
【化8】

【0049】
(19)工程19(カップリング)
化合物(XXII)にn−ブチルリチウム、sec−ブチルリチウム、tert−ブチルリチウム等の有機金属試薬を用いてアリ−ルリチウム試薬を調製することができる。これに、グルコノラクトン(X)を加えることで化合物(XXIII)を得ることができる。このとき反応に用いられる溶媒としては、テトラヒドロフラン、ジエチルエ−テル、トルエン等が挙げられる。反応温度は−80℃から室温であり、好ましくは−78℃〜−25℃である。
(20)工程20(シリル化)
上記工程19に引き続いて、化合物(XXIII)の1位水酸基をトリメチルシリル基等のシリル基で保護することができる。工程19の反応液に、トリメチルシリルクロリドを反応させ化合物(XXIV)を得ることができる。反応に用いる溶媒および好ましい反応温度は、工程19と同じである。
(21)工程21(カップリング)
上記工程20に引き続いて、生成した化合物(XXIV)にn−ブチルリチウム、sec−ブチルリチウム、tert−ブチルリチウム等の有機金属試薬を用いてアリ−ルリチウム試薬を調製することができる。これに、アルデヒド(XVIII)を加えることで化合物(XXV)を得ることができる。このとき反応に用いられる溶媒および好ましい反応温度は、工程19と同じである。
(22)工程22(酸加水分解)
上記で得られた化合物(XXV)を製造法3、工程8に記載した酸加水分解反応によって化合物(XXVI)へ導くことができる。
(23)工程23(アセチル化)
上記で得られた化合物(XXVI)を製造法3、工程9に記載したアセチル化反応によって化合物(XXVII)へ導くことができる。
(24)工程24(還元)
上記で得られた化合物(XXVII)を製造法3、工程10に記載した還元反応によって化合物(XXVIII)へ導くことができる。
(25)工程25(アセチル化またはアルキル化)
化合物(XXVIII)の水酸基を、アセチル基で保護するまたはメチル化等のアルキル化を行うことで、中間体(II)を製造することができる。化合物(XXVIII)と、無水酢酸、またはアセチルクロリド等を溶媒中、適当な塩基存在下反応させ中間体(II)を得ることができる。反応に用いる溶媒としては、クロロホルム、ジクロロメタン、ジオキサン、酢酸エチル、テトラヒドロフラン、N,N−ジメチルホルムアミド等である。塩基としてはトリエチルアミン、コリジン、ピリジン等が好ましい。触媒として4−ジメチルアミノピリジン等を用いることもできる。また、好ましい反応温度は0℃〜室温である。一方、化合物(XXVIII)と、ヨウ化メチル、ヨウ化エチル、2−ヨードプロパン等を溶媒中、適当な塩基存在下反応させ中間体(II)を得ることができる。反応に用いる溶媒としては、クロロホルム、ジクロロメタン、テトラヒドロフラン、N,N−ジメチルホルムアミド、アセトン等である。塩基としては炭酸カリウム、炭酸セシウム等が好ましい。
【実施例】
【0050】
以下に、参考例、実施例及び試験例を挙げ、本発明をより詳細に説明するが、本発明はこれらの記載によって限定的に解釈されるものではない。
【0051】
参考例1 中間体(A)の製造
【0052】
【化9】

【0053】
(1)参考例1−1 化合物(A1)
【0054】
【化10】

【0055】
3−イソプロピルフェノール(25.0g,0.184mol)の酢酸(200mL)溶液にヨウ素酸カリウム(7.88g,0.0368mol)の水懸濁溶液(75mL)とヨウ素(18.7g,0.0736mol)を加え、この反応溶液を室温で20時間攪拌した。ジエチルエーテル(400mL)と水(300mL)を加えた後に有機層を分離した。その有機層を水、飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=95:5)にて精製し、無色油状の化合物(A1)(27.6g,57%)を得た。
1H NMR (200 MHz, CHLOROFORM-d) δ ppm 1.16 - 1.25 (m, 6 H) 2.64 - 2.98 (m, 1 H) 5.21 (s, 1 H) 6.57 (dd, J=8.13, 2.20 Hz, 1 H) 6.88 (d, J=2.20 Hz, 1 H) 7.54 (d, J=8.13 Hz, 1 H).
(2)参考例1−2 化合物(A2)
【0056】
【化11】

【0057】
化合物(A1)(26.5g,0.101mol)と炭酸カリウム(20.9g,0.152mol)のアセトニトリル懸濁液に臭化ベンジル(14.4mL,0.121mol)を加え室温で2時間攪拌した。メタノール(1.0mL)を加え30分攪拌した。不溶物をろ過し、ろ液を濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=95:5)にて精製し、無色油状の化合物(A2)(30.2g,85%)を得た。
1H NMR (200 MHz, CHLOROFORM-d) δ ppm 1.21 (d, J=7.03 Hz, 6 H) 2.84 (sept, J=7.03 Hz, 1 H) 5.14 (s, 2 H) 6.62 (dd, J=8.35, 2.20 Hz, 1 H) 6.74 (d, J=2.20 Hz, 1 H) 7.23 - 7.58 (m, 5 H) 7.68 (d, J=8.35 Hz, 1 H).
(3)参考例1−3 化合物(A3)
【0058】
【化12】

【0059】
化合物(A2)(30.2g,85.7mmol)のTHF(450mL)溶液に窒素雰囲気下、−78℃にて2.6M n−ブチルリチウムへキサン溶液(33mL,85.7mmol)を滴下し、同温にて15分間攪拌した。次いで2,3,4,6−テトラ−O−トリメチルシリル−D−グルコノ−1,5−ラクトン(40.0g,85.7mmol)のTHF(230mL)溶液を15分かけて滴下し、同温にて20分間攪拌した。反応液に飽和塩化アンモニウム水溶液(150mL)と水(100mL)を加えた。この混合物を室温まで温めた後に、酢酸エチルで2回抽出した。合わせた有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。
【0060】
得られた残渣をメタンスルホン酸(2.9g)を含むメタノール(840mL)溶液に溶解し、室温で14.5時間攪拌した。トリエチルアミン(2.5mL)で中和し、反応混合物を濃縮した。
【0061】
得られた残渣(46.4g)をピリジン(125mL)に溶解し、4℃に冷却した。この溶液に無水酢酸(75mL)と4−ジメチルアミノピリジン(102mg,0.835mmol)を加え、室温で19時間攪拌した。氷水(500mL)を加え、混合物を酢酸エチル(500mL)で2回抽出した。合わせた有機層を飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し粗化合物(53g)を得た。
【0062】
この粗化合物のクロロホルム(250mL)とアセトニトリル(250mL)溶液に、窒素雰囲気下4℃にてEt3SiH(13.7mL,85.7mmol)とBF3・Et2O(10.9mL,85.7mmol)を加え、同温で1.5時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=5:1→2:1)にて精製し、淡黄色のアモルファスとして化合物(A3)(19.1g,40%;4工程)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.21 (d, J=6.99 Hz, 6 H) 1.78 (s, 3 H) 2.01 (s, 6 H) 2.05 (s, 3 H) 2.86 (sept, J=6.99 Hz, 1 H) 3.80 (ddd, J=9.95, 4.59, 2.25 Hz, 1 H) 4.06 - 4.13 (m, 1 H) 4.19 - 4.27 (m, 1 H) 4.96 (d, J=9.95 Hz, 1 H) 5.10 (s, 2 H) 5.16 - 5.25 (m, 1 H) 5.33 (t, J=9.17 Hz, 1 H) 5.40 - 5.49 (m, 1 H) 6.79 (d, J=1.40 Hz, 1 H) 6.85 (dd, J=7.93, 1.40 Hz, 1 H) 7.26 - 7.52 (m, 6 H).
MS ESI/APCI Dual posi : 579[M+Na]+.
(4)参考例1−4 化合物(A4)
【0063】
【化13】

【0064】
化合物(A3)(19.1g,34.3mmol)のメタノール(200mL)溶液に10%パラジウム活性炭(1.8g)を加え、水素雰囲気下、室温にて2時間攪拌した。反応液をセライト濾過後、溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=2:1→1:1)にて精製し、無色アモルファスとして化合物(A4)(12.3g,77%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.20 (d, J=6.89 Hz, 6 H) 1.83 (s, 3 H) 2.01 (s, 3 H) 2.06 (s, 3 H) 2.12 (s, 3 H) 2.82 (sept, J=6.89 Hz, 1 H) 3.87 (ddd, J=9.60, 3.85, 2.25 Hz, 1 H) 4.14 - 4.21 (m, 1 H) 4.27 - 4.36 (m, 1 H) 4.59 (d, J=9.33 Hz, 1 H) 5.23 - 5.39 (m, 3 H) 6.70 (dd, J=7.93, 1.71 Hz, 1 H) 6.77 (d, J=1.71 Hz, 1 H) 6.80 (s, 1 H) 6.91 (d, J=7.93 Hz, 1 H).
MS ESI/APCI Dual posi : 489[M+Na]+.
MS ESI/APCI Dual nega : 501[M+Cl]−.
(5)参考例1−5 化合物(A5)
【0065】
【化14】

【0066】
化合物(A4)(12.3g,26.3mmol)の酢酸(120mL)溶液に、臭素(4.2g,26.3mmol)を室温にて滴下した。反応混合液を1.5時間攪拌し、氷水(150mL)を加えた。この混合物を酢酸エチルで2回抽出し、合わせた有機層を飽和炭酸水素ナトリウム水溶液、10%チオ硫酸ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣を2−プロパノール(20mL)に溶解し、ヘキサン(50mL)を滴下した。混合物を4℃で1時間攪拌し、析出した沈殿をろ過して無色粉末の化合物(A5)(9.8g,68%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12 - 1.26 (m, 6 H) 1.89 (s, 3 H) 2.01 (s, 3 H) 2.07 (s, 3 H) 2.13 (s, 3 H) 3.22 (sept, J=6.74 Hz, 1 H) 3.87 (ddd, J=9.48, 3.73, 2.18 Hz, 1 H) 4.14 - 4.22 (m, 1 H) 4.28 - 4.36 (m, 1 H) 4.53 (d, J=9.33 Hz, 1 H) 5.16 - 5.39 (m, 3 H) 6.82 (s, 1 H) 7.14 (s, 1 H).
MS ESI/APCI Dual posi : 567[M+Na]+, 569[M+2+Na]+.
MS ESI/APCI Dual nega : 579[M+Cl]−, 581[M+2+Cl]−.
(6)参考例1−6 化合物(A6)
【0067】
【化15】

【0068】
化合物(A5)(12.2g,22.3mmol)のメタノール(120mL)溶液に、トリエチルアミン(24mL)と水(24mL)を加えた。反応混合物を室温で15時間、さらに50℃で10時間攪拌し、溶媒を減圧下留去した。
得られた残渣をN,N−ジメチルホルムアミド(106mL)に溶解し、窒素雰囲気下4℃にてトリエチルアミン(18.6mL,134mmol)とクロロトリメチルシラン(14.3mL,112mmol)を加えた。反応混合物を4℃にて1時間攪拌し、氷水(150mL)を加えた。この混合物をトルエンで3回抽出し、合わせた有機層を水、飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、油状の化合物(A6)(17.4g)を得た。これを精製せずに次の反応に用いた。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm -0.28 (s, 9 H) 0.08 (s, 9 H) 0.19 (s, 9 H) 0.20 (s, 9 H) 0.29 (s, 9 H) 1.16 (d, J=6.84 Hz, 3 H) 1.21 (d, J=6.84 Hz, 3 H) 3.17 - 3.37 (m, 1 H) 3.41 - 3.56 (m, 3 H) 3.62 - 3.72 (m, 1 H) 3.76 - 3.86 (m, 1 H) 4.46 (d, J=8.24 Hz, 1 H) 6.64 (s, 1 H) 7.47 (s, 1 H).
(7)参考例1−7 化合物(A7)
【0069】
【化16】

【0070】
化合物(A6)(13.4g,15.9mmol)のTHF(140mL)溶液に窒素雰囲気下、−78℃にて2.6M n−ブチルリチウムへキサン溶液(7.7mL,20.0mmol)を10分かけて滴下し、同温にて5分間攪拌した。次いで4−ブロモ−2−メチルベンズアルデヒド(3.2g,15.9mmol)のTHF(24mL)溶液を15分かけて滴下し、同温にて45分間攪拌した。反応液に飽和塩化アンモニウム水溶液(100mL)と水(100mL)を加えた。この混合物を室温まで温めた後に、酢酸エチルで2回抽出した。合わせた有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。
【0071】
得られた残渣をメタンスルホン酸(0.9g)を含むメタノール(200mL)溶液に溶解し、室温で0.5時間攪拌した。トリエチルアミンで中和し、反応混合物を濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム:メタノール=10:1→8:1)で精製し、無色アモルファスの化合物(A7)(5.75g,73%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.01 and 1.04 (each d, J=6.88 Hz, 3 H) 1.18 and 1.19 (each d, J=6.88 Hz, 3 H) 2.24 and 2.26 (each s, 3 H) 2.95 - 3.07 (m, 1 H) 3.35 - 3.69 (m, 5 H) 3.78 - 3.87 (m, 1 H) 4.37 - 4.50 (m, 1 H) 5.59 (s, 1 H) 6.80 (s, 1 H) 6.98 - 7.10 (m, 2 H) 7.24 - 7.30 (m, 1 H) 7.33 (s, 1 H).
MS ESI/APCI Dual posi : 479[M-OH]+, 481[M+2-OH]+.
(8)参考例1−8 中間体(A)
【0072】
【化17】

【0073】
化合物(A7)(5.7g,11.5mmol)をピリジン(34mL)に溶解した。この溶液に無水酢酸(17mL)と4−ジメチルアミノピリジン(10mg)を加え、室温で0.5時間攪拌した。氷水(500mL)を加え、混合物を酢酸エチル(500mL)で2回抽出した。合わせた有機層を飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、粗化合物(8.5g)を得た。
【0074】
この粗化合物(8.5g)のクロロホルム(80mL)とアセトニトリル(80mL)溶液に、窒素雰囲気下、4℃にてEt3SiH(2.7mL,17.0mmol)とBF3・Et2O(2.2mL,17.0mmol)を加えた。反応液を室温まで温めた後に、同温で0.5時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣をヘキサン:酢酸エチル=4:1混合液から結晶化し、析出した沈殿をろ過して無色粉末の中間体(A)(5.3g,68%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12 (d, J=6.68 Hz, 3 H) 1.14 (d, J=6.68 Hz, 3 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.06 (s, 3 H) 2.27 (s, 3 H) 2.37 (s, 3 H) 2.93 (sept, J=6.68 Hz, 1 H) 3.76 (ddd, J=9.87, 4.51, 2.25 Hz, 1 H) 3.87 (s, 2 H) 4.06 (dd, J=12.51, 2.25 Hz, 1 H) 4.27 (dd, J=12.51, 4.51 Hz, 1 H) 4.49 (d, J=9.64 Hz, 1 H) 5.10 - 5.33 (m, 3 H) 6.59 (d, J=8.39 Hz, 1 H) 6.97 (s, 1 H) 7.00 (s, 1 H) 7.20 (dd, J=8.39, 2.49 Hz, 1 H) 7.34 (d, J=2.49 Hz, 1 H).
MS ESI/APCI Dual posi : 713[M+Na]+, 715[M+2+Na]+.
また、中間体(A)は参考例1−9、10、11に記載の方法でも合成することができる。
(9)参考例1−9 化合物(A8)
【0075】
【化18】

【0076】
3−イソプロピルフェノール(160g,1.18mol)の酢酸(1.6L)溶液に、氷冷で内温19℃を超えないように臭素(469g,2.94mol)の酢酸(320mL)溶液を32分かけて滴下し、室温で1時間攪拌した。トルエン(1.6L)を加えた後に氷冷し、内温20℃を超えないように10%亜硫酸ナトリウム水溶液(1.0L)を滴下して有機層を分離した。その有機層を10%亜硫酸ナトリウム水溶液(1.0L)、10%塩化ナトリウム水溶液(1.0L)で2回洗浄した後、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、淡黄色油状化合物(A8)(342g,99%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.21 (d, J=6.84 Hz, 6 H) 3.25 (sept, J=6.84 Hz, 1 H) 5.40 (s, 1 H) 6.96 (s, 1 H) 7.61 (s, 1 H).
(10)参考例1−10 化合物(A9)
【0077】
【化19】

【0078】
化合物(A8)(512g,1.74mol)のクロロホルム(1.74L)溶液に、N、N−ジイソプロピルエチルアミン(364mL,2.09mol)を加えて氷冷した。クロロメチルメチルエーテル(159mL,2.09mol)を60分かけて滴下し、室温で1時間攪拌した。反応液を氷冷し、1M水酸化ナトリウム水溶液(1.5L)を滴下して有機層を分離した。その有機層を1M水酸化ナトリウム水溶液(1.5L)、水(1.5L)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣を減圧蒸留(0.93〜1.5hpa,122℃〜137℃)にて精製し、淡黄色油状化合物(A9)(548g,96%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.22 (d, J=6.84 Hz, 6 H) 3.28 (sept, J=6.84 Hz, 1 H) 3.52 (s, 3 H) 5.23 (s, 2 H) 7.06 (s, 1 H) 7.69 (s, 1 H).
MS ESI/APCI Dual posi : 339[M+H]+, 341[M+2+H]+.
(11)参考例1−11 中間体(A)
化合物(A9)(210g,0.621mol)のTHF(3.1L)溶液に、アルゴン雰囲気下−86〜−74℃にて2.76M n−ブチルリチウムへキサン溶液(236mL,0.652mol)を20分かけて滴下し、同温にて35分間攪拌した。次いで2,3,4,6−テトラ−O−トリメチルシリル−D−グルコノ−1,5−ラクトン(305g,0.652mol)のTHF(890mL)溶液を38分かけて滴下し、同温にて50分間攪拌した。さらにトリメチルクロロシラン(82.8mL,0.652mmol)を4分かけて滴下し、同温にて3時間撹拌した。次いで2.76M n−ブチルリチウムへキサン溶液(326mL,0.901mol)を23分かけて滴下し、同温にて40分間攪拌した。最後に4−ブロモ−2−メチルベンズアルデヒド(136g,0.683mmol)のTHF(890mL)溶液を43分かけて滴下し、同温にて35分間撹拌した。反応液に水(3.1L)を加えて室温まで温めた。トルエン(3.1L)を加えて有機層を分離し、溶媒を減圧下留去した。
【0079】
得られた残渣(633g)をメタノール(3.1L)に溶解し、メタンスルホン酸(4.03mL,0.0621mol)を加えて1時間加熱還流を行った。反応液を室温まで冷却後、トリエチルアミン(17.3mL,0.124mol)で中和し、反応混合物を濃縮した。濃縮物(413g)をトルエン(1.1L)に溶解し、水(1.65L)で3回洗浄した。その有機層をトルエン(0.55L)で希釈し、1M水酸化ナトリウム水溶液(0.55L)で抽出した。その水層をトルエン(1.65L)で洗浄し、2M塩酸水溶液(0.43L)を加えて酸性にした。これをトルエン(1.1L)にて抽出した。その有機層を10%塩化ナトリウム水溶液(1.1L)で洗浄し、溶媒を減圧下留去した。
【0080】
得られた残渣(273g)をTHF(1.01L)に溶解し、N、N−ジイソプロピルエチルアミン(776mL,4.53mol)、無水酢酸(381mL,4.03mol)と4−ジメチルアミノピリジン(615mg,5.04mmol)を加え、室温で21時間攪拌した。反応液を氷冷して水(1.0L)とトルエン(1.0L)を加え、有機層を分離した。その有機層を飽和炭酸水素ナトリウム水溶液(1.0L)で洗浄し、溶媒を減圧下留去した。
得られた残渣(390g)をアセトニトリル(3.85L)に溶解し、水(9.07mL,0.504mol)、t−BuMe2SiH(334mL,2.02mol)を加え、氷冷後TMSOTf(392mL,2.17mol)を30分かけて滴下した。同温で1時間撹拌後、無水酢酸(95.2mL,1.01mol)を10分かけて滴下し、さらに同温で15分間撹拌した。反応液にトルエン(3.85mL)と3%炭酸水素ナトリウム水溶液(1.92L)を加え、有機層を分離した。その有機層を3%炭酸水素ナトリウム水溶液(1.92L)、10%塩化ナトリウム水溶液(1.92L)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し得られた残渣を2−プロパノール(1.42L)から結晶化し、析出した沈殿をろ過して無色粉末の中間体(A)(201g,47%;4工程)を得た。
【0081】
参考例2 中間体(B)の製造
【0082】
【化20】

【0083】
(1)参考例2−1 化合物(B1)
【0084】
【化21】

【0085】
化合物(A1)(27.4g,0.104mol)と炭酸カリウム(21.7g,0.156mol)のアセトニトリル懸濁液(200mL)にヨウ化メチル(9.8mL,0.156mol)を加え40℃で2.5時間攪拌した。ヨウ化メチル(3.5mL,0.052mol)を更に加え、同温で1時間攪拌した。不溶物をろ過し、ろ液を酢酸エチルで希釈した。有機層を水、10%チオ硫酸ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン→ヘキサン:酢酸エチル=95:5)にて精製し、淡黄色油状の化合物(B1)(24.5g,85%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.24 (d, J=6.84 Hz, 6 H) 2.87 (sept, J=6.84 Hz, 1 H) 3.88 (s, 3 H) 6.58 - 6.65 (m, 1 H) 6.70 (d, J=1.87 Hz, 1 H) 7.65 (d, J=8.08 Hz, 1 H).
MS ESI/APCI Dual posi : 277[M+H]+.
(2)参考例2−2 化合物(B2)
【0086】
【化22】

【0087】
化合物(B1)(24.5g,88.6mmol)のTHF(100mL)溶液に窒素雰囲気下、−78℃にて2.6M n−ブチルリチウムへキサン溶液(34mL,88.6mmol)を滴下し、同温にて5分間攪拌した。次いで2,3,4,6−テトラ−O−トリメチルシリル−D−グルコノ−1,5−ラクトン(37.6g,80.5mmol)のTHF(60mL)溶液を25分かけて滴下し、同温にて10分間攪拌した。反応液に氷と水を加え、混合物を室温まで温めた後に、酢酸エチルで抽出した。合わせた有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。
【0088】
得られた残渣をメタンスルホン酸(1.55g,16.1mmol)を含むメタノール(380mL)溶液に溶解し、室温で2時間攪拌した。トリエチルアミン(11.2mL,80.5mmol)で中和し、反応混合物を濃縮した。
【0089】
得られた残渣(30.2g)をピリジン(100mL)に溶解し、無水酢酸(100mL)を加え、室温で14時間攪拌した。氷水(400mL)を加え、混合物を酢酸エチル(200mL)で2回抽出した。合わせた有機層を1M塩酸水溶液、飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン→ヘキサン:酢酸エチル=6:4)にて精製し、淡黄色油状の化合物(B2)(32.8g,80%;3工程)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.23 (d,J=6.92 Hz, 6 H) 1.84 (s, 3 H) 1.97 (s, 3 H) 2.06 (s, 3 H) 2.10 (s, 3 H) 2.87 (sept, J=6.92 Hz, 1 H) 3.32 (s, 3 H) 3.87 (s, 3 H) 4.04 (ddd, J=10.18, 4.74, 2.41 Hz, 1 H) 4.17 - 4.23 (m, 1 H) 4.28 - 4.36 (m, 1 H) 5.25 (dd, J=10.18, 9.40 Hz, 1 H) 5.36 (d, J=10.18 Hz, 1 H) 5.60 (dd, J=10.18, 9.40 Hz, 1 H) 6.74 (d, J=1.55 Hz, 1 H) 6.79 (dd, J=8.08, 1.55 Hz, 1 H) 7.26 - 7.33 (m, 1 H).
MS ESI/APCI Dual posi : 533[M+Na]+.
(3)参考例2−3 化合物(B3)
【0090】
【化23】

【0091】
化合物(B2)(32.8g,64.0mmol)のクロロホルム(150mL)とアセトニトリル(150mL)溶液に窒素雰囲気下、4℃にてEt3SiH(21mL,128mmol)とBF3・Et2O(49mL,385mmol)を加え、同温で1時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=2:1)にて精製し、淡黄色ガム状の化合物(B3)(22.9g,74%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.22 (d, J=6.99 Hz, 6 H) 1.77 (s, 3 H) 2.01 (s, 3 H) 2.05 (s, 3 H) 2.07 (s, 3 H) 2.87 (sept, J=6.96 Hz, 1 H) 3.80 - 3.87 (m, 1 H) 3.84 (s, 3 H) 4.09 - 4.16 (m, 1 H) 4.22 - 4.29 (m, 1 H) 4.88 - 4.95 (m, 1 H) 5.18 - 5.27 (m, 1 H) 5.32 - 5.38 (m, 2 H) 6.71 (d, J=1.55 Hz, 1 H) 6.83 (dd, J=7.93, 1.55 Hz, 1 H) 7.23 - 7.30 (m, 1 H).
MS ESI/APCI Dual posi : 503[M+H]+.
MS ESI/APCI Dual nega : 515[M+Cl]−.
(4)参考例2−4 化合物(B4)
【0092】
【化24】

【0093】
化合物(A4)の代わりに化合物(B3)を用いて、参考例1−5と同様の方法で淡黄色アモルファスの化合物(B4)(25.5g,96%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.20 (d, J=6.84 Hz, 3 H) 1.23 (d, J=6.84 Hz, 3 H) 1.80 (s, 3 H) 2.01 (s, 3 H) 2.05 (s, 3 H) 2.09 (s, 3 H) 3.31 (sept, J=6.84 Hz, 1 H) 3.77 - 3.82 (m, 1 H) 3.83 (s, 3 H) 4.10 - 4.17 (m, 1 H) 4.22 - 4.30 (m, 1 H) 4.83 (d, J=9.48 Hz, 1 H) 5.17 - 5.38 (m, 3 H) 6.75 (s, 1 H) 7.49 (s, 1 H).
MS ESI/APCI Dual posi : 581[M+Na]+, 583[M+2+Na]+.
(5)参考例2−5 化合物(B5)
【0094】
【化25】

【0095】
化合物(A5)の代わりに化合物(B4)を用いて、参考例1−6と同様の方法で茶色油状の化合物(B5)(30.3g)を得た。これを精製せずに次の反応に用いた。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm -0.32 (s, 9 H) 0.09 (s, 9 H) 0.18 (s, 9 H) 0.20 (s, 9 H) 1.19 (d, J=6.84 Hz, 3 H) 1.23 (d, J=6.84 Hz, 3 H) 3.26 - 3.44 (m, 3 H) 3.52 - 3.58 (m, 2 H) 3.65 - 3.75 (m, 3 H) 3.76 - 3.83 (m, 1 H) 3.80 (s, 3 H) 4.60 (d, J=8.55 Hz, 1 H) 6.72 (s, 1 H) 7.51 (s, 1 H).
MS ESI/APCI Dual posi : 701[M+Na]+, 703[M+2+Na]+.
(6)参考例2−6 化合物(B6)
【0096】
【化26】

【0097】
化合物(A6)の代わりに化合物(B5)を用いて、参考例1−7と同様の方法で茶色アモルファスの化合物(B6)(14.7g,60%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.23 and 1.25 (each d, J=6.84 Hz, 6 H) 1.80 (s, 2 H) 2.27 and 2.29 (each s, 3 H) 2.30 - 2.58 (m, 2 H) 2.82 - 3.06 (m, 2 H) 3.34 and 3.35 (each s, 3 H) 3.38 - 3.86 (m, 6 H) 4.56 - 4.73 (m, 1 H) 5.53 (d, J=3.11 Hz, 1 H) 6.75 - 7.35 (m, 5 H).
MS ESI/APCI Dual posi : 493[M-OH]+, 495[M+2-OH]+
(7)参考例2−7 中間体(B)
【0098】
【化27】

【0099】
化合物(A7)の代わりに化合物(B6)を用いて、参考例1−8と同様の方法で無色アモルファスの中間体(B)(14.2g,88%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.11 (d, J=6.68 Hz, 3 H) 1.14 (d, J=6.68 Hz, 3 H) 1.75 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.05 (s, 3 H) 2.28 (s, 3 H) 2.90 (sept, J=6.68 Hz, 1 H) 3.71 - 3.90 (m, 3 H) 3.86 (s, 3H) 3.85 - 3.87 (m, 1 H) 4.05 - 4.15 (m, 1 H) 4.19 - 4.28 (m, 1 H) 4.77 - 4.85 (m, 1 H) 5.11 - 5.23 (m, 1 H) 5.26 - 5.37 (m, 2 H) 6.54 (d, J=8.24 Hz, 1 H) 6.81 (s, 1 H) 6.96 (s, 1 H) 7.17 (dd, J=8.24, 2.64 Hz, 1 H) 7.32 (d, J=2.64 Hz, 1 H).
MS ESI/APCI Dual posi : 685[M+Na]+, 687[M+2+Na]+.
参考例3 中間体(C)の製造
【0100】
【化28】

【0101】
化合物(6A)の代わりに化合物(B5)、4−ブロモ−2−メチルベンズアルデヒドの代わりに4−ブロモベンズアルデヒドを用いて、参考例1−7および参考例1−8と同様の方法で淡黄色アモルファスとして化合物(C)(2.26g)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.04 (d, J=6.84 Hz, 3 H) 1.09 (d, J=6.84 Hz, 3 H) 1.76 (s, 3 H) 2.01 (s, 3 H) 2.05 (s, 3 H) 2.06 (s, 3 H) 2.91 - 3.06 (m, 1 H) 3.80 - 3.88 (m, 4 H) 3.91 (d, J=5.13 Hz, 2 H) 4.06 - 4.18 (m, 1 H) 4.20 - 4.31 (m, 1 H) 4.82 - 4.93 (m, 1 H) 5.15 - 5.43 (m, 3 H) 6.77 (s, 1 H) 6.92 (d, J=8.55 Hz, 2 H) 7.11 (s, 1 H) 7.36 (d, J=8.55 Hz, 2 H).
参考例4 中間体(D)の製造
【0102】
【化29】

【0103】
(1)参考例4−1 化合物(D1)
【0104】
【化30】

【0105】
2,2−ジメチル−3−ブテノイックアシッド(J. Org. Chem., 第65巻, 8402項,2000年)(5.42g,47.5mmol)のクロロホルム(250mL)溶液に窒素雰囲気下、塩化オキサリル(4.43mL,49.9mmol)とN,N−ジメチルホルムアミド(3滴)を加え、室温で1.5時間攪拌した。その後反応液を氷冷し、トリエチルアミン(19.9mL,143mmol)とα−アミノイソブチリックアシッドメチルエステル塩酸塩(10.9g,71.2mmol)を加え、室温で1時間攪拌した。反応液に水を加え、クロロホルムで抽出後、有機層を3M塩酸水溶液、飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン→ヘキサン:酢酸エチル=4:1)にて精製し、無色粉末の化合物(D1)(9.38g,93%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.27 (s, 6 H) 1.51 (s, 6 H) 3.73 (s, 3 H) 5.17 - 5.32 (m, 2 H) 6.02 (dd, J=17.56, 10.57 Hz, 1 H) 6.25 (br. s., 1 H).
MS ESI/APCI Dual posi : 214[M+H]+.
(2)参考例4−2 中間体(D)
【0106】
【化31】

【0107】
化合物(D1)(9.38g,43.9mmol)のメタノール(20mL)溶液に4M水酸化ナトリウム水溶液(16.5mL,66.0mmol)を加え、室温で1時間攪拌した。その後、反応混合物を濃縮した。得られた残渣を水に溶解し、3M塩酸水溶液を加えて中和した。この混合物を酢酸エチルで抽出し、合わせた有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、無色粉末の中間体(D)(8.19g,94%)を得た。
1H NMR (300 MHz, CHLOROFORM-d)δ ppm 1.29 (s, 6 H) 1.54 (s, 6 H) 5.16 - 5.36 (m, 2 H) 6.01 (dd, J=17.49, 10.65 Hz, 1 H) 6.14 (s, 1 H).
MS ESI/APCI Dual posi : 200[M+H]+, 222[M+Na]+.
MS ESI/APCI Dual nega : 198[M-H]−.
参考例5 中間体(E)の製造
【0108】
【化32】

【0109】
アルゴン雰囲気下、中間体(A)(5.0g,7.23mmol)、中間体(D)(2.59g,13.0mmol)、酢酸パラジウム(II)(328mg,1.45mmol)、トリ-O-トリルホスフィン(880mg,2.89mmol)、トリエチルアミン(3.0mL,9.00mmol)のアセトニトリル(24mL)懸濁液を、マイクロウェーブ照射下120℃で20分間攪拌した。反応液をセライトろ過し、酢酸エチルで洗浄した。ろ液を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=1:1→酢酸エチル)にて精製し、淡黄色粉末の中間体(E)(4.59g,78%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.16, 1.18 (each d,
J=6.84 Hz, each 3 H) 1.40 (s, 6 H) 1.54 - 1.58 (m, 6 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.28 (s, 3 H) 2.36 (s, 3 H) 2.98 - 3.10 (m, 1 H) 3.71 - 3.79 (m, 1 H) 3.94 (s, 2 H) 4.01 - 4.08 (m, 1 H) 4.24 (dd, J=12.43, 4.51 Hz, 1 H) 4.47 (d, J=9.17 Hz, 1 H) 5.07 - 5.32 (m, 3 H) 6.31 (d, J=16.32 Hz, 1 H) 6.35 (s, 1 H) 6.55 (d, J=16.32 Hz, 1 H) 6.77 (d, J=7.62 Hz, 1 H) 6.92 (s, 1 H) 6.99 (s, 1 H) 7.12 - 7.18 (m, 1 H) 7.26 (s, 1 H) .
MS ESI/APCI Dual posi : 810[M+H]+, 832[M+Na]+.
MS ESI/APCI Dual nega : 808[M-H]−.
参考例6 中間体(F)の製造
【0110】
【化33】

【0111】
中間体Aの代わりに中間体Bを用いて参考例5と同様の方法で黄色粉末の中間体(F)(2.03g,87%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.17, 1.14 (each d, J=6.99 Hz, 3 H) 1.38 (s, 6 H) 1.55 (s, 6 H) 1.76 (s, 3 H) 1.98 (s, 3 H) 2.04 (s, 6 H) 2.30 (s, 3 H) 2.94 - 3.03 (m, 1 H) 3.76 - 3.83 (m, 1 H) 3.84 - 3.95 (m, 4 H) 4.06 - 4.15 (m, 1 H) 4.16 - 4.25 (m, 1 H) 4.81 (d, J=9.79 Hz, 1 H) 5.12 - 5.20 (m, 1 H) 5.23 - 5.35 (m, 2 H) 6.29 (s, 1H) 6.31 (d, J=16.32 Hz, 1 H) 6.52 (d, J=16.32 Hz, 1 H) 6.67 (d, J=8.08 Hz, 1 H) 6.81 (s, 1 H) 6.94 (s, 1 H) 7.06 - 7.14 (m, 1 H) 7.24 (s, 1 H).
MS ESI/APCI Dual posi : 782[M+H]+, 804[M+Na]+.
MS ESI/APCI Dual nega : 780[M-H]−.
参考例7 中間体(G)の製造
【0112】
【化34】

【0113】
中間体(A)の代わりに中間体(C)を用いて参考例5と同様の方法で淡黄色アモルファスの中間体(G)(854mg,60%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.84 Hz, 3 H) 1.12 (d, J=6.84 Hz, 3 H) 1.38 (s, 6 H) 1.53 (s, 6 H) 1.77 (s, 3 H) 2.00 (s, 3 H) 2.05 (s, 6 H) 3.06 (sept, J=6.84 Hz, 1 H) 3.78 - 3.83 (m, 1 H) 3.84 (s, 3 H) 3.97 (s, 2 H) 4.07 - 4.18 (m, 1 H) 4.17 - 4.27 (m, 1 H) 4.87 (dd, J=6.76, 2.88 Hz, 1 H) 5.16 - 5.25 (m, 1 H) 5.27 - 5.40 (m, 2 H) 6.18 - 6.33 (m, 2 H) 6.54 (d, J=16.48 Hz, 1 H) 6.77 (s, 1 H) 7.03 (d, J=8.08 Hz, 2 H) 7.10 (s, 1 H) 7.29 (d, J=8.08 Hz, 2 H).
MS ESI/APCI Dual posi : 768[M+H]+, 790[M+Na]+.
MS ESI/APCI Dual nega : 766[M-H]−.
参考例8 中間体(H)の製造
【0114】
【化35】

【0115】
アルゴン雰囲気下、中間体(A)(216g,0.312mol)、2,2−ジメチル−3−ブテノイックアシッド(53.4g,0.467mol)、酢酸パラジウム(II)(3.50g,15.6mmol)、トリ-O-トリルホスフィン(9.48g,31.2mmol)、トリエチルアミン(86.9mL,0.623mol)のアセトニトリル(623mL)懸濁液を、3時間加熱還流した。反応液を室温まで冷却した後にクロロホルム(300mL)とメタノール(100mL)を加えて希釈し、セライトろ過した。ろ液を減圧下濃縮し、得られた残渣を酢酸エチル(1.32L)に溶解させた。1M塩酸水溶液(0.96L)、10%塩化ナトリウム水溶液(1.2L)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、ろ液にさらに酢酸エチル(1.2L)を追加して、イソプロピルアミン(28.2mL,0.327mol)を加え、氷浴中で1時間撹拌した。析出した沈殿をろ過して中間体(H)のイソプロピルアミン塩を得た。この塩を酢酸エチル(1.2L)、1M塩酸水溶液(500mL)に溶解させて30分間撹拌し、有機層を分離した。その有機層を10%塩化ナトリウム水溶液(500mL)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去して無色のアモルファスとして中間体(H)(207g,88%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.13 (d, J=6.80 Hz, 3 H) 1.14 (d, J=6.80 Hz, 3 H) 1.43 (s, 6 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.28 (s, 3 H) 2.37 (s, 3 H) 2.98 (sept, J=6.80 Hz, 1 H) 3.70 - 3.80 (m, 1 H) 3.91 (s, 2 H) 4.05 (dd, J=12.43, 2.18 Hz, 1 H) 4.28 (dd, J=12.43, 4.35 Hz, 1 H) 4.43 - 4.50 (m, 1 H) 5.11 - 5.20 (m, 1 H) 5.22 - 5.33 (m, 2 H) 6.33 - 6.49 (m, 2 H) 6.68 (d, J=7.93 Hz, 1 H) 6.96 (s, 1 H) 6.99 (s, 1 H) 7.06 - 7.14 (m, 1 H) 7.23 (d, J=1.40 Hz, 1 H).
MS ESI/APCI Dual posi : 747[M+Na]+.
参考例9 中間体(I)の製造
【0116】
【化36】

【0117】
2−アミノイソ酪酸(150g,1.45mol)を水(2.2L)に溶解し、炭酸ナトリウム(465g,4.39mol)を加えた。反応液を氷冷し、クロロギ酸ベンジル(227mL,1.60mol)の1、4−ジオキサン(0.63L)溶液を内温が10℃を超えないように45分かけて滴下した。室温で一晩撹拌後、反応液に水(3.5L)とトルエン(1.0L)を加え、水層を分離した。その水層にpH=1になるまで濃塩酸(700mL)を滴下した。酢酸エチル(1.0L)を加えて1時間撹拌し、有機層を分離した。その有機層を無水硫酸マグネシウムで乾燥して乾燥剤を濾別後、溶媒を減圧下留去した。
【0118】
得られた残渣(338g)をクロロホルム(1.7L)に溶解し、氷冷下N,N’−カルボニルジイミダゾール(CDI)(253g,1.56mol)を内温が20℃を超えないように少量ずつ加えた。室温で30分間撹拌後、再度氷冷して1,2−ジアミノ−2−メチルプロパン(138g,1.56mol)を25分かけて滴下した。室温で1晩撹拌後、10%炭酸カリウム水溶液(1.7L)を加え、有機層を分離した。その有機層を無水硫酸マグネシウムで乾燥して乾燥剤を濾別後、溶媒を減圧下留去した。
【0119】
得られた残渣(417g)をTHF(2.0L)に溶解し、Boc2O(355g,1.63mol)を加えて、室温で1.5時間撹拌した。その後反応液に飽和炭酸水素ナトリウム水溶液(1.0L)を加え、有機層を分離した。その有機層を無水硫酸マグネシウムで乾燥して乾燥剤を濾別後、溶媒を減圧下留去した。
【0120】
得られた残渣(549g)をメタノール(2.75L)に溶解し、10%水酸化パラジウム(27.5g)を加え、水素雰囲気下室温にて4.5時間攪拌した。反応液をセライト濾過後、溶媒を減圧下留去し、得られた残渣をヘプタン:酢酸エチル=2:1混合液(1.75L)から結晶化し、析出した沈殿をろ過して無色粉末の中間体(I)(193g,53%;4工程)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.27 (s, 6 H) 1.37 (s, 6 H) 1.43 (s, 9 H) 1.53 (br. s, 2 H) 3.39 (d, J=6.53 Hz, 2 H) 4.78 (br. s, 1 H) 8.04 (br. s, 1 H).
MS ESI/APCI Dual posi : 274[M+H]+, 296[M+Na]+.
MS ESI/APCI Dual nega : 308[M+Cl]−.
実施例1−1
【0121】
【化37】

【0122】
中間体(E)(200mg,0.25mmol)、1−ヒドロキシベンゾトリアゾ−ル1水和物(HOBt・H2O)(57mg,0.37mmol)、N,N−ジメチルエチレンジアミン(65mg,0.74mmol)のN,N−ジメチルホルムアミド(3.0mL)溶液にN−エチル−N’−3−ジメチルアミノプロピルカルボジイミド塩酸塩(EDC・HCl)(71mg,0.37mmol)を加え、室温で8時間攪拌した。反応液を水(50mL)にあけ、酢酸エチル(50mL)で抽出した。有機層を飽和食塩水(20mL)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム→クロロホルム:メタノール=9:1)で精製し、無色アモルファスの化合物(1−1)(132mg,61%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.13, 1.15 (each d, J=6.92Hz, each 3 H) 1.38 (s, 6 H) 1.53 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.23 (s, 6 H) 2.31 (s, 3 H) 2.37 (s, 3 H) 2.41 (t, J=5.67 Hz, 2 H) 2.90 - 3.03 (m, 1 H) 3.25 - 3.34 (m, 2 H) 3.71 - 3.80 (m, 1 H) 3.92 (s, 2 H) 4.05 (dd, J=12.59, 2.18 Hz, 1 H) 4.23 - 4.32 (m, 1 H) 4.44 - 4.52 (m, 1 H) 5.11 - 5.20 (m, 1 H) 5.22 - 5.33 (m, 2 H) 6.33 (d, J=16.63 Hz, 1 H) 6.41 (br. s., 1 H) 6.51 (d, J=16.63 Hz, 1 H) 6.68 (d, J=7.77 Hz, 1 H) 6.77 (br. s., 1 H) 7.00 (s, 2 H) 7.12 (d, J=7.77 Hz, 1 H) 7.26 (s, 1 H) .
MS ESI/APCI Dual posi : 880[M+H]+, 902[M+Na]+.
MS ESI/APCI Dual nega : 914[M+Cl]−.
実施例1−2
【0123】
【化38】

【0124】
化合物(1−1)(127mg,0.14mmol)のメタノール(2.0mL)溶液にナトリウムメトキシド(4.88M / MeOH,10μL)を加え、室温で1時間攪拌した。ドライアイスを少量加えて、反応液を中和し、溶媒を減圧下留去した。
【0125】
得られた残渣をNH型シリカゲルカラムクロマトグラフィ−(クロロホルム:メタノール=9:1→6:4)で精製し、無色アモルファスの化合物(1−2)(77mg,80%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.10 (d, J=6.92 Hz, 6 H) 1.36 (s, 6 H) 1.45 (s, 6 H) 2.23 (s, 6 H) 2.31 (s, 3 H) 2.40 (t, J=6.88 Hz, 2 H) 2.87 - 2.96 (m, 1 H) 3.28 (t, J=6.88 Hz, 2 H) 3.34 - 3.41 (m, 2 H) 3.43 - 3.50 (m, 1 H) 3.51 - 3.57 (m, 1 H) 3.67 (dd, J=12.15, 2.52 Hz, 1 H) 3.84 (d, J=11.46 Hz, 1 H) 3.89 (s, 2 H) 4.47 (d, J=9.63 Hz, 1 H) 6.39 (d, J=16.05 Hz, 1 H) 6.50 (d, J=16.05 Hz, 1 H) 6.75 (d, J=8.25 Hz, 1 H) 6.80 (s, 1 H) 6.97 (s, 1 H) 7.11 (d, J=8.25 Hz, 1 H) 7.25 (s, 1 H) .
MS ESI/APCI Dual posi : 670[M+H]+.
MS ESI/APCI Dual nega : 668[M-H]−, 704[M+Cl]−.
Anal. Calcd for C37H55N3O8・1.4H2O: C, 63.94; H,8.38; N,6.05. Found: C, 64.13; H, 8.39; N, 5.88.
実施例2−1
【0126】
【化39】

【0127】
N,N−ジメチルエチレンジアミンの代わりにピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(2−1)(103mg,47%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.14, 1.16 (each d, J=6.99 Hz, each 3 H) 1.38 (s, 6 H) 1.61 (s, 6 H) 1.71 (s, 3 H) 1.99 (s, 3 H) 2.05 (s, 3 H) 2.12 (s, 3 H) 2.27 (s, 3 H) 2.79 - 2.87 (m, 4 H) 2.87 - 2.99 (m, 1 H) 3.56 - 3.66 (m, 4 H) 3.75 - 3.94 (m, 3 H) 4.12 - 4.20 (m, 1 H) 4.25 - 4.34 (m, 1 H) 4.44 - 4.52 (m, 1 H) 5.23 - 5.32 (m, 3 H) 6.30 (d, J=16.32 Hz, 1 H) 6.48 (d, J=16.32 Hz, 1 H) 6.53 (s, 1 H) 6.68 (d, J=7.77 Hz, 1 H) 6.88 (s, 1 H) 6.97 (s, 1 H) 7.05 - 7.12 (m, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 836[M+H]+, 858[M+Na]+.
MS ESI/APCI Dual nega : 834[M-H]−, 870[M+Cl]−.
実施例2−2
【0128】
【化40】

【0129】
化合物(1−1)の代わりに化合物(2−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(2−2)(52mg,66%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.10 (d, J=6.42 Hz, 6 H) 1.36 (s, 6 H) 1.44 (s, 6 H) 2.31 (s, 3 H) 2.70 (br. s, 4 H) 2.90 - 2.95 (m, 1 H) 3.36 - 3.39 (m, 2 H) 3.43 - 3.61 (m, 7 H) 3.65 - 3.69 (m, 1 H) 3.84 (d, J=11.92 Hz, 1 H) 3.88 (s, 2 H) 4.46 (d, J=9.63 Hz, 1 H) 6.38 (d, J=16.05 Hz, 1 H) 6.47 (d, J=16.05 Hz, 1 H) 6.76 (d, J=7.79 Hz, 1 H) 6.80 (s, 1 H) 6.95 (s, 1 H) 7.10 (d, J=7.79 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 668[M+H]+, 690[M+Na]+.
MS ESI/APCI Dual nega : 666[M-H]−, 702[M+Cl]−.
実施例3−1
【0130】
【化41】

【0131】
N,N−ジメチルエチレンジアミンの代わりに1−メチルピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(3−1)(135mg,61%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.13, 1.15 (each d, J=6.84 Hz, each 3 H) 1.37 (s, 6 H) 1.60 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.27 (s, 3 H) 2.30 (s, 3 H) 2.33 - 2.41 (m, 7 H) 2.88 - 3.04 (m, 1 H) 3.60 - 3.70 (m, 4 H) 3.72 - 3.80 (m, 1 H) 3.92 (s, 2 H) 4.05 (dd, J=12.59, 2.33 Hz, 1 H) 4.27 (dd, J=12.59, 4.51 Hz, 1 H) 4.43 - 4.54 (m, 1 H) 5.10 - 5.20 (m, 1 H) 5.22 - 5.32 (m, 2 H) 6.31 (d, J=16.48 Hz, 1 H) 6.49 (d, J=16.48 Hz, 1 H) 6.68 (d, J=8.08 Hz, 1 H) 6.86 (s, 1 H) 7.00 (s, 2 H) 7.08 - 7.14 (m, 1 H) 7.24 (s, 1 H).
MS ESI/APCI Dual posi : 892[M+H]+, 914[M+Na]+.
MS ESI/APCI Dual nega : 926[M+Cl]−.
実施例3−2
【0132】
【化42】

【0133】
化合物(1−1)の代わりに化合物(3−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(3−2)(79mg,79%)を得た。
1H NMR (600 MHz, METHANOL-d4)δ ppm 1.10 (d, J=6.88 Hz, 6 H) 1.37 (s, 6 H) 1.44 (s, 6 H) 2.16 (s, 3 H) 2.22 - 2.38 (m, 7 H) 2.87 - 2.96 (m, 1 H) 3.35 - 3.41 (m, 2 H) 3.42 - 3.51 (m, 2 H) 3.51 - 3.56 (m, 1 H) 3.56 - 3.71 (m, 5 H) 3.84 (d, J=12.38 Hz, 1 H) 3.88 (s, 2 H) 4.47 (d, J=9.63 Hz, 1 H) 6.38 (d, J=16.51 Hz, 1 H) 6.46 (d, J=16.51 Hz, 1 H) 6.75 (d, J=8.25 Hz, 1 H) 6.80 (s, 1 H) 6.97 (s, 1 H) 7.09 (d, J=8.25 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 682[M+H]+, 704[M+Na]+.
MS ESI/APCI Dual nega : 680[M-H]−, 716[M+Cl]−.
実施例4−1
【0134】
【化43】

【0135】
N,N−ジメチルエチレンジアミンの代わりに1−エチルピペラジンを用いて実施例1−1と同様の方法で無色ガム状の化合物(4−1A)(87.9mg,38%)と無色ガム状の化合物(4−1B)(42.9mg,19%)を得た。
【0136】
化合物(4−1A)
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.07 (t, J=7.23 Hz, 3 H) 1.12 -1.16 (m, 6 H) 1.37 (s, 6 H) 1.61 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.30 (s, 3 H) 2.34 - 2.44 (m, 9 H) 2.90 - 3.05 (m, 1 H) 3.60 - 3.72 (m, 4 H) 3.72 - 3.80 (m, 1 H) 3.92 (s, 2 H) 4.05 (dd, J=12.36, 1.94 Hz, 1 H) 4.27 (dd, J=12.36, 4.43 Hz, 1 H) 4.48 (d, J=9.79 Hz, 1 H) 5.15 (t, J=9.79 Hz, 1 H) 5.22 - 5.31 (m, 2 H) 6.31 (d, J=16.2 Hz, 1 H) 6.49 (d, J=16.2 Hz, 1 H) 6.68 (d, J=8.08 Hz, 1 H) 6.86 - 6.93 (m, 1 H) 7.00 (s, 2 H) 7.11 (d, J=8.08 Hz, 1 H) 7.24 (s, 1 H).
MS ESI/APCI Dual posi : 907[M+H]+, 929[M+Na]+.
MS ESI/APCI Dual nega : 941[M+Cl]−.
化合物(4−1B)
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.03 - 1.19 (m, 9 H) 1.37 (s, 6 H) 1.62 (s, 6 H) 1.71 (s, 3 H) 1.99 (s, 3 H) 2.05 (s, 3 H) 2.12 (s, 3 H) 2.27 (s, 3 H) 2.33 - 2.46 (m, 6 H) 2.93 (sept, J=6.76 Hz, 1 H) 3.58 - 3.71 (m, 4 H) 3.73 - 3.91 (m, 3 H) 4.12 - 4.21 (m, 1 H) 4.24 - 4.34 (m, 1 H) 4.48 (d, J=9.17 Hz, 1 H) 5.21 - 5.34 (m, 3 H) 6.30 (d, J=16.1 Hz, 1 H) 6.48 (d, J=16.1 Hz, 1 H) 6.53 (s, 1 H) 6.68 (d, J=7.93 Hz, 1 H) 6.88 (s, 1 H) 6.99 (s, 1 H) 7.08 (d, J=7.93 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 865[M+H]+, 887[M+Na]+.
MS ESI/APCI Dual nega : 899[M+Cl]−.
実施例4−2
【0137】
【化44】

【0138】
化合物(4−1A)(87.9mg,0.0973mmol)と化合物(4−1B)(42.9mg,0.0486mmol)にトリエチルアミン/水/メタノール(1/1/5,5mL)を加えた。反応混合物を室温で1晩攪拌し、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム→クロロホルム:メタノール=8:2)で精製し、無色アモルファスの化合物(4−2)(79.2mg,78%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 0.98 (t, J=7.23 Hz, 3 H) 1.10 (d, J=6.88 Hz, 6 H) 1.36 (s, 6 H) 1.44 (s, 6 H) 2.23 - 2.42 (m, 9 H) 2.85 - 2.99 (m, 1 H) 3.35 - 3.41 (m, 2 H) 3.42 - 3.48 (m, 1 H) 3.50 - 3.56 (m, 1 H) 3.55 - 3.71 (m, 5 H) 3.81 - 3.90 (m, 3 H) 4.47 (d, J=9.63 Hz, 1 H) 6.39 (d, J=16.1 Hz, 1 H) 6.46 (d, J=16.1 Hz, 1 H) 6.71 - 6.77 (m, 1 H) 6.80 (s, 1 H) 6.98 (s, 1 H) 7.09 (d, J=7.79 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 696[M+H]+, 718[M+Na]+.
MS ESI/APCI Dual nega : 694[M-H]−.
Anal. Calcd for C39H57N3O8・1.2H2O : C, 65.3; H, 8.34; N, 5.86. Found : C, 65.3; H, 8.36; N, 5.68.
実施例5−1
【0139】
【化45】

【0140】
中間体(E)(205mg,0.253mmol)、HOBt・H2O(68mg,0.506mmol)、4−ジメチルアミノピペリジン(65mg,0.506mmol)のN,N−ジメチルホルムアミド(2.0mL)溶液にEDC・HCl(97mg,0.506mmol)を加え、70℃で2時間攪拌した。反応液を水(50mL)にあけ、酢酸エチル(50mL)で抽出した。有機層を飽和食塩水(20mL)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム→クロロホルム:メタノール=3:1)で精製し、無色アモルファスの化合物(5−1)(80mg,34%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.13 (d, J=6.76 Hz, 3 H) 1.15 (d, J=6.76 Hz, 3 H) 1.30 - 1.49 (m, 2 H) 1.38 (s, 6 H) 1.61 (s, 6 H) 1.77 (s, 3 H) 1.84 (d, J=12.75 Hz, 2 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.27 (s, 6 H) 2.30 (s, 3 H) 2.37 (s, 3 H) 2.81 (t, J=12.28 Hz, 2 H) 2.97 (sept, J=6.76 Hz, 1 H) 3.76 (ddd, J=10.03, 4.66, 2.25 Hz, 1 H) 3.92 (s, 2 H) 4.05 (dd, J=12.43, 2.25 Hz, 1 H) 4.28 (dd, J=12.43, 4.66 Hz, 1 H) 4.33 - 4.53 (m, 3 H) 5.10 - 5.34 (m, 3 H) 6.31 (d, J=15.00 Hz, 1 H) 6.50 (d, J=15.00 Hz, 1 H) 6.68 (d, J=8.08 Hz, 1 H) 6.97 - 7.04 (m, 2 H) 7.11 (d, J=8.08 Hz, 1 H) 7.25 (s, 1 H).
MS ESI/APCI Dual posi : 920[M+H]+.
MS ESI/APCI Dual nega : 954[M+Cl]−.
実施例5−2
【0141】
【化46】

【0142】
化合物(1−1)の代わりに化合物(5−1)を用いて、実施例1−2と同様の方法で、無色アモルファスの化合物(5−2)(33mg,53%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.08 (d, J=6.42 Hz, 6 H) 1.21 - 1.32 (m, 2 H) 1.35 (s, 6 H) 1.43 (s, 6 H) 1.73 (br. s., 2 H) 2.16 (s, 6 H) 2.28 (s, 3H) 2.28 - 2.37 (m, 1 H) 2.89 (sept, J=6.42 Hz, 1 H) 3.31 - 3.33 (m, 2 H) 3.44 (t, J=8.71 Hz, 1 H) 3.48 - 3.56 (m, 1 H) 3.66 (dd, J=11.92, 2.75 Hz, 1 H) 3.83 (d, J=11.92 Hz, 1 H) 3.86 (s, 2 H) 4.45 (d, J=9.63 Hz, 1 H) 6.35 - 6.41 (m, 1 H) 6.43 - 6.47 (m, 1 H) 6.72 (d, J=7.79 Hz, 1 H) 6.78 (s, 1 H) 6.96 (s, 1 H) 7.08 (d, J=7.79 Hz, 1 H) 7.21 (s, 1 H).
MS ESI/APCI Dual posi : 710[M+H]+.
MS ESI/APCI Dual nega : 708[M-H]−.
Anal. Calcd for C40H59N3O8・1.5H2O : C, 65.19; H, 8.50; N, 5.70. Found : C, 64.81; H, 8.46; N, 5.61.
実施例6−1
【0143】
【化47】

【0144】
中間体(E)(680mg,0.746mmol)のクロロホルム(5.0mL)溶液にCDI(182mg,1.12mmol)を加え、室温で1時間攪拌した。次いで、1,2−ジアミノ−2−メチルプロパン(79mg,0.895mmol)を加え、室温で18時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで2回抽出した。合わせた有機層を、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム→クロロホルム:メタノール=85:15)で精製し、無色アモルファスの化合物(6−1)(140mg,21%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.11 - 1.17 (m, 6 H) 1.11 (s, 6 H) 1.39 (s, 6 H) 1.53 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.31 (s, 3 H) 2.37 (s, 3 H) 2.89 - 3.05 (m, 1 H) 3.14 (d, J=5.91 Hz, 2 H) 3.76 (ddd, J=9.71, 4.51, 2.10 Hz, 1 H) 3.93 (s, 2 H) 4.05 (dd, J=12.51, 2.10 Hz, 1 H) 4.27 (dd, J=12.51, 4.51 Hz, 1 H) 4.49 (d, J=7.46 Hz, 1 H) 5.11 - 5.20 (m, 1 H) 5.23 - 5.31 (m, 2 H) 6.26 (s, 1 H) 6.29 - 6.38 (m, 1 H) 6.48 - 6.57 (m, 1 H) 6.69 (d, J=7.93 Hz, 1 H) 6.97 - 7.03 (m, 3 H) 7.12 (d, J=7.93 Hz, 1 H) 7.25 (s, 1 H).
MS ESI/APCI Dual posi : 880[M+H]+.
実施例6−2
【0145】
【化48】

【0146】
化合物(1−1)の代わりに化合物(6−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(6−2)(104mg,98%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.02 (s, 6 H) 1.05 - 1.10 (m, 6 H) 1.35 (s, 6 H) 1.44 (s, 6 H) 2.29 (s, 3 H) 2.85 - 2.93 (m, 1 H) 3.09 (s, 2 H) 3.34 - 3.39 (m, 2 H) 3.42 - 3.47 (m, 1 H) 3.52 (t, J=9.40 Hz, 1 H) 3.63 - 3.69 (m, 1 H) 3.80 - 3.85 (m, 1 H) 3.86 (s, 2 H) 4.46 (d, J=9.63 Hz, 1 H) 6.35 - 6.41 (m, 1 H) 6.44 - 6.51 (m, 1 H) 6.73 (d, J=7.79 Hz, 1 H) 6.78 (s, 1 H) 6.96 (s, 1 H) 7.06 - 7.10 (m, 1 H) 7.23 (s, 1 H).
MS ESI/APCI Dual posi : 670[M+H]+, 692[M+Na]+.
MS ESI/APCI Dual nega : 668[M-H]-, 704[M+Cl]−.
また、化合物(6−2)は、次の実施例6−3及び6−4に記載の方法でも合成することができる。
【0147】
実施例6−3
【0148】
【化49】

【0149】
中間体(H)(205g,0.273mol)、中間体(I)(97.0g,0.355mol)、HOBt・H2O(62.7g,0.410mol)、トリエチルアミン(114mL,0.819mol)のN,N−ジメチルホルムアミド(1.98L)溶液にEDC・HCl(78.5g,0.410mol)を加え、室温で11時間攪拌した。反応液にトルエン(1.0L)と10%塩化ナトリウム水溶液(2.0L)を加え、有機層を分離した。水層をトルエン(1.0L)から抽出し、合わせた有機層を5%塩化ナトリウム水溶液(1.0L)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣を2−プロパノール(300mL)に50℃で溶解させ、ヘプタン(2.7L)を滴下した。混合溶液を氷冷で1時間攪拌し、析出した沈殿をろ過して無色粉末の化合物(6−3)(221g,83%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.13 (d, J=6.88 Hz, 3 H) 1.14 (d, J=6.88 Hz, 3 H) 1.26 (s, 6 H) 1.39 (s, 6 H) 1.44 (s, 9 H) 1.55 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.30 (s, 3 H) 2.37 (s, 3 H) 2.97 (sept, J=6.88 Hz, 1 H) 3.41 (d, J=5.60 Hz, 2 H) 3.72 - 3.80 (m, 1 H) 3.92 (s, 2 H) 4.05 (dd, J=12.43, 2.02 Hz, 1 H) 4.28 (dd, J=12.43, 4.51 Hz, 1 H) 4.45 - 4.52 (m, 1 H) 4.65 (s, 1 H) 5.11 - 5.19 (m, 1 H) 5.22 - 5.33 (m, 2 H) 6.29 - 6.39 (m, 1 H) 6.46 - 6.57 (m, 2 H) 6.69 (d, J=8.00 Hz, 1 H) 6.96 - 7.03 (m, 2 H) 7.11 (dd, J=8.00, 1.63 Hz, 1 H) 7.24 - 7.26 (m, 1 H) 7.59 (br. s, 1 H).
実施例6−4
化合物(6−3)(220g,0.225mol)のクロロホルム(3.0L)溶液に、室温でトリフルオロ酢酸(297mL,3.88mol)を10分かけて滴下し、同温にて20時間攪拌した。反応液をトルエン(3.0L)で希釈して濃縮した。残渣を酢酸エチル(3.0L)に溶解し、10%炭酸ナトリウム水溶液(1.2L)、飽和食塩水(1.0L)で洗浄し、溶媒を減圧下留去した。
【0150】
得られた残渣(240g)をメタノール(1.5L)に溶解し、氷冷後トリエチルアミン(0.3L)、水(0.3L)を加えた。室温で13時間撹拌後、更にメタノール(1.5L)、トリエチルアミン(0.3L)、水(0.3L)を加えて室温で20時間撹拌した。反応混合物を濃縮し、メタノールで共沸した。得られた残渣をNH型シリカゲルカラムクロマトグラフィ−(酢酸エチル:エタノール:水=15:2:1→10:2:1)で精製し、無色アモルファスの化合物(6−2)(129g,86%;2工程)を得た。
【0151】
実施例7−1
【0152】
【化50】

【0153】
中間体(E)の代わりに中間体(F)を用いて実施例1−1と同様の方法で無色アモルファスの化合物(7−1)(112mg,74%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12, 1.14 (each d, J=6.84 Hz, each 3 H) 1.37 (s, 6 H) 1.51 (s, 6 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.04 (s, 3 H) 2.23 (s, 6 H) 2.32 (s, 3 H) 2.41 (t, J=6.22 Hz, 2 H) 2.86 - 2.99 (m, 1 H) 3.25 - 3.33 (m, 2 H) 3.76 - 3.90 (m, 6 H) 4.07 - 4.15 (m, 1 H) 4.18 - 4.26 (m, 1 H) 4.76 - 4.85 (m, 1 H) 5.13 - 5.22 (m, 1 H) 5.26 - 5.36 (m, 2 H) 6.31 (d, J=16.48 Hz, 1 H) 6.37 (s, 1 H) 6.50 (d, J=16.48 Hz, 1 H) 6.61 - 6.67 (m, 1 H) 6.81 (s, 1 H) 6.99 (s, 1 H) 7.06 - 7.12 (m, 1 H) 7.24 (s, 1 H).
MS ESI/APCI Dual posi : 852[M+H]+.
MS ESI/APCI Dual nega : 886[M+Cl]−.
実施例7−2
【0154】
【化51】

【0155】
化合物(1−1)の代わりに化合物(7−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(7−2)(69mg,78%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.13, 1.15 (each d, J=6.84 Hz, each 3 H) 1.36 (s, 6 H) 1.45 (s, 6 H) 2.21 (s, 6 H) 2.32 (s, 3 H) 2.39 (t, J=6.88 Hz, 2 H) 2.93 - 3.02 (m, 1 H) 3.24 - 3.39 (m, 4 H) 3.42 - 3.48 (m, 1 H) 3.49 - 3.54 (m, 1 H) 3.58 - 3.65 (m, 1 H) 3.80 - 3.87 (m, 4 H) 3.91 (s, 2 H) 4.61 (d, J=9.63 Hz, 1 H) 6.39 (d, J=16.51 Hz, 1 H) 6.50 (d, J=16.51 Hz, 1 H) 6.73 (d, J=7.80 Hz, 1 H) 6.92 (s, 1 H) 7.08 (s, 1 H) 7.10 (d, J=7.80 Hz, 1 H) 7.25 (s, 1 H).
MS ESI/APCI Dual posi : 684[M+H]+.
MS ESI/APCI Dual nega : 682[M-H]−, 718[M+Cl]−.
Anal. Calcd for C38H57N3O8・1.7H2O: C, 63.88; H, 8.52; N, 5.88. Found: C, 63.84; H, 8.41; N, 5.75.
実施例8−1
【0156】
【化52】

【0157】
中間体(E)の代わりに中間体(F)、N,N−ジメチルエチレンジアミンの代わりにN−t−ブトキシカルボニルエチレンジアミンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(8−1)(145mg,89%)を得た。
MS ESI/APCI Dual posi : 924[M+H]+,946[M+Na]+.
MS ESI/APCI Dual nega : 958[M+Cl]−.
実施例8−2
【0158】
【化53】

【0159】
化合物(8−1)のクロロホルム(3.0ml)溶液に、トリフルオロ酢酸(600μL)を加えて室温で3時間攪拌した。反応液を減圧下濃縮後、シリカゲルカラムクロマトグラフィー(クロロホルム:メタノール=95:5→60:40)で精製して、無色アモルファスの化合物(8−2)(68mg、55%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.14,1.16 (each d, J=6.37 Hz, each 3 H) 1.32 (s, 6 H) 1.42 (s, 6 H) 1.77 (s, 3 H) 1.98 (s, 3 H) 2.03 (s, 3 H) 2.04 (s, 3 H) 2.32 (s, 3 H) 2.90 - 3.02 (m, 1 H) 3.22 - 3.34 (m, 2 H) 3.48 - 3.57 (m, 2 H) 3.76 - 3.96 (m, 6 H) 4.07 - 4.14 (m, 1 H) 4.17 - 4.25 (m, 1 H) 4.79 - 4.87 (m, 1 H) 5.12 - 5.22 (m, 1 H) 5.24 - 5.36 (m, 2 H) 6.32 (s, 1 H) 6.40 (d, J=16.63 Hz, 1 H) 6.51 (d, J=16.63 Hz, 1 H) 6.65 (d, J=8.55 Hz, 1 H) 6.82 (s, 1 H) 6.96 (s, 1 H) 7.07 - 7.13 (m, 1 H) 7.28 - 7.31 (m, 1 H) 8.04 (br. s., 2 H).
MS ESI/APCI Dual posi : 824[M+H]+, 846[M+Na]+.
MS ESI/APCI Dual nega : 858[M+Cl]−.
実施例8−3
【0160】
【化54】

【0161】
化合物(1−1)の代わりに化合物(8−2)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(8−3)(22mg,44%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.13, 1.15 (each d, J=6.84 Hz, each 3 H) 1.36 (s, 6 H) 1.45 (s, 6 H) 2.32 (s, 3 H) 2.63 - 2.71 (m, 2 H) 2.94 - 3.03 (m, 1 H) 3.23 (t, J=5.96 Hz, 2 H) 3.28 - 3.39 (m, 4 H) 3.43 - 3.48 (m, 1 H) 3.48 - 3.54 (m, 1 H) 3.62 (dd, J=12.15, 5.73 Hz, 1 H) 3.79 - 3.88 (m, 2 H) 3.92 (s, 2 H) 4.61 (d, J=9.63 Hz, 1 H) 6.40 (d, J=16.51 Hz, 1 H) 6.50 (d, J=16.51 Hz, 1 H) 6.74 (d, J=7.79 Hz, 1 H) 6.92 (s, 1 H) 7.07 (s, 1 H) 7.11 (d, J=7.79 Hz, 1 H) 7.26 (s, 1 H).
MS ESI/APCI Dual posi : 656[M+H]+.
MS ESI/APCI Dual nega : 654[M-H]−, 690[M+Cl]−.
実施例9−1
【0162】
【化55】

【0163】
中間体(E)の代わりに中間体(F)、N,N−ジメチルエチレンジアミンの代わりにピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(9−1)(42mg,38%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12, 1.14 (each d, J=6.99 Hz, each 3 H) 1.37 (s, 6 H) 1.58 (s, 6 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.04 (s, 3 H) 2.32 (s, 3 H) 2.79 - 2.86 (m, 4 H) 2.88 - 2.99 (m, 1 H) 3.57 - 3.64 (m, 4 H) 3.76 - 3.95 (m, 6 H) 4.07 - 4.14 (m, 1 H) 4.18 - 4.26 (m, 1 H) 4.77 - 4.84 (m, 1 H) 5.13 - 5.22 (m, 1 H) 5.26 - 5.37 (m, 2 H) 6.29 (d, J=16.16 Hz, 1 H) 6.49 (d, J=16.16 Hz, 1 H) 6.64 (d, J=7.93 Hz, 1 H) 6.77 - 6.83 (m, 2 H) 6.99 (s, 1 H) 7.05 - 7.11 (m, 1 H) 7.22 (br. s., 1 H).
MS ESI/APCI Dual posi : 850[M+H]+, 872[M+Na]+.
MS ESI/APCI Dual nega : 884[M+Cl]−.
実施例9−2
【0164】
【化56】

【0165】
化合物(1−1)の代わりに化合物(9−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(9−2)(27mg,94%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.14, 1.16 (each d, J=6.42Hz, each 3 H) 1.36 (s, 6 H) 1.44 (s, 6 H) 2.32 (s, 3 H) 2.69 (br. s., 4 H) 2.95 - 3.03 (m, 1 H) 3.28 - 3.38 (m, 2 H) 3.42 - 3.52 (m, 2 H) 3.53 - 3.65 (m, 5 H) 3.80 - 3.84 (m, 1 H) 3.84 (s, 3 H) 3.92 (s, 2 H) 4.61 (d, J=9.17 Hz, 1 H) 6.39 (d, J=16.05 Hz, 1 H) 6.47 (d, J=16.05 Hz, 1 H) 6.74 (d, J=7.79 Hz, 1 H) 6.92 (s, 1 H) 7.06 (s, 1 H) 7.10 (d, J=7.79 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 682[M+H]+.
MS ESI/APCI Dual nega : 680[M-H]−, 716[M+Cl]−.
実施例10−1
【0166】
【化57】

【0167】
中間体(E)の代わりに中間体(F)、N,N−ジメチルエチレンジアミンの代わりにN−メチルピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの粗化合物(10−1)(100mg)を得た。この物をさらに精製することなく、次の反応に用いた。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12 (d, J=8.5 Hz, 3 H) 1.15 (d, J=8.5 Hz, 3 H) 1.36 (s, 6 H) 1.56 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 6 H) 2.30 (s, 3 H) 2.32 (s, 3 H) 2.38 - 2.50 (m, 4 H) 2.85 - 3.02 (m, 1 H) 3.61 - 3.74 (m, 4 H) 3.76 - 3.84 (m, 1 H) 3.81 - 3.96 (m, 1 H) 3.86 (s, 3 H) 4.07 - 4.15 (m, 1 H) 4.18 - 4.27 (m, 1 H) 4.75 - 4.88 (m, 1 H) 5.11 - 5.24 (m, 1 H) 5.26 - 5.37 (m, 2 H) 6.22 - 6.38 (m, 1 H) 6.43 - 6.54 (m, 1 H) 6.59 - 6.70 (m, 2 H) 6.81 (s, 1 H) 6.96 - 7.02 (m, 1 H) 7.04 - 7.12 (m, 1 H) 7.20 - 7.26 (m, 1 H).
実施例10−2
【0168】
【化58】

【0169】
化合物(1−1)の代わりに化合物(10−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(10−2)(8.0mg,9%;2工程)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.09 - 1.16 (m, 6 H) 1.35 (s, 6 H) 1.42 (s, 6 H) 2.12 - 2.16 (m, 3 H) 2.23 - 2.33 (br. s., 4 H) 2.30 (s, 3 H) 2.92 - 3.01 (m, 1 H) 3.28 (s, 2 H) 3.30 - 3.38 (m, 1 H) 3.41 - 3.51 (m, 2 H) 3.55 - 3.66 (m, 5 H) 3.78 - 3.86 (m, 4 H) 3.90 (s, 2 H) 4.59 (d, J=9.17 Hz, 1 H) 6.33 - 6.39 (m, 1 H) 6.42 - 6.47 (m, 1 H) 6.72 (d, J=7.79 Hz, 1 H) 6.90 (s, 1 H) 7.04 - 7.11 (m, 2 H) 7.19 - 7.24 (m, 1 H).
MS ESI/APCI Dual posi : 696[M+H]+, 718[M+Na]+.
MS ESI/APCI Dual nega : 694[M-H]-, 730[M+Cl]−.
実施例11−1
【0170】
【化59】

【0171】
中間体(E)の代わりに中間体(F)、N,N−ジメチルエチレンジアミンの代わりに1−エチルピペラジンを用いて実施例1−1と同様の方法で淡黄色アモルファスの化合物(11−1)(200mg,89%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.07 (t, J=7.23 Hz, 3 H) 1.11 (d, J=6.84 Hz, 3 H) 1.14 (d, J=6.84 Hz, 3 H) 1.36 (s, 6 H) 1.59 (s, 6 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.04 (s, 3 H) 2.32 (s, 3 H) 2.36 - 2.44 (m, 6 H) 2.93 (sept, J=6.84 Hz, 1 H) 3.61 - 3.71 (m, 4 H) 3.77 - 3.84 (m, 1 H) 3.83 - 3.94 (m, 5 H) 4.05 - 4.16 (m, 1 H) 4.18 - 4.27 (m, 1 H) 4.76 - 4.86 (m, 1 H) 5.14 - 5.23 (m, 1 H) 5.25 - 5.37 (m, 2 H) 6.29 (d, J=16.1 Hz, 1 H) 6.48 (d, J=16.1 Hz, 1 H) 6.64 (d, J=7.62 Hz, 1 H) 6.77 - 6.86 (m, 2 H) 6.99 (s, 1 H) 7.08 (d, J=7.62 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 879[M+H]+, 901[M+Na]+.
MS ESI/APCI Dual nega : 913[M+Cl]−.
実施例11−2
【0172】
【化60】

【0173】
化合物(4−1A)、化合物(4−1B)の代わりに化合物(11−1)を用いて実施例4−2と同様の方法で無色アモルファスの化合物(11−2)(118mg,73%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 0.97 (t, J=7.11 Hz, 3 H) 1.10 - 1.19 (m, 6 H) 1.37 (s, 6 H) 1.45 (s, 6 H) 2.26 - 2.42 (m, 9 H) 2.97 (sept, J=6.76 Hz, 1 H) 3.32 - 3.40 (m, 2 H) 3.43 - 3.48 (m, 1 H) 3.48 - 3.55 (m, 1 H) 3.55 - 3.72 (m, 5 H) 3.79 - 3.89 (m, 4 H) 3.91 (s, 2 H) 4.61 (d, J=9.17 Hz, 1 H) 6.39 (d, J=16.5 Hz, 1 H) 6.46 (d, J=16.5 Hz, 1 H) 6.73 (d, J=7.79 Hz, 1 H) 6.92 (s, 1 H) 7.04 - 7.14 (m, 2 H) 7.23 (s, 1 H).
MS ESI/APCI Dual posi : 710[M+H]+, 732[M+Na]+.
MS ESI/APCI Dual nega : 744[M+Cl]−.
Anal. Calcd for C40H59N3O8・1.5H2O : C, 65.2; H, 8.48; N, 5.70. Found : C, 65.1; H, 8.38; N, 5.64.
実施例12−1
【0174】
【化61】

【0175】
中間体(E)の代わりに中間体(F)を用いて実施例5−1と同様の方法で、無色アモルファスの化合物(12−1)(55mg、40%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12, 1.14 (each d, J=6.92 Hz, each 3 H) 1.28 - 1.47 (m, 8 H) 1.60 (s, 6 H) 1.73 - 1.89 (m, 5 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.04 (s, 3 H) 2.22 - 2.35 (m, 10 H) 2.73 - 2.99 (m, 3 H) 3.76 - 3.84 (m, 1 H) 3.84 - 3.90 (m, 5 H) 4.07 - 4.15 (m, 1 H) 4.18 - 4.26 (m, 1 H) 4.34 - 4.50 (m, 2 H) 4.75 - 4.86 (m, 1 H) 5.13 - 5.23 (m, 1 H) 5.26 - 5.39 (m, 2 H) 6.30 (d, J=16.48 Hz, 1 H) 6.48 (d, J=16.48 Hz, 1 H) 6.63 (d, J=8.39 Hz, 1 H) 6.81 (s, 1 H) 6.94 - 7.01 (m, 2 H) 7.04 - 7.11 (m, 1 H) 7.23 (s, 1 H).
MS ESI/APCI Dual posi : 892[M+H]+, 914[M+Na]+.
実施例12−2
【0176】
【化62】

【0177】
化合物(1−1)の代わりに化合物(12−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(12−2)(55mg,82%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.13, 1.15 (each d, J=6.84 Hz, each 3 H) 1.24 - 1.33 (m, 2 H) 1.37 (s, 6 H) 1.44 (s, 6 H) 1.75 (br. s, 2 H) 2.17 (s, 6 H) 2.30 - 2.39 (m, 4 H) 2.93 - 3.01 (m, 1 H) 3.28 - 3.38 (m, 5 H) 3.43 - 3.47 (m, 1 H) 3.47 - 3.53 (m, 1 H) 3.62 (dd, J=12.15, 5.73 Hz, 1 H) 3.80 - 3.86 (m, 3 H) 3.91 (s, 2 H) 4.48 (br. s., 2 H) 4.61 (d, J=9.63 Hz, 1 H) 6.40 (d, J=16.05 Hz, 1 H) 6.47 (d, J=16.05 Hz, 1 H) 6.73 (d, J=7.79 Hz, 1 H) 6.92 (s, 1 H) 7.06 - 7.11 (m, 2 H) 7.23 (s, 1 H).
MS ESI/APCI Dual posi : 724[M+H]+, 746[M+Na]+ .
MS ESI/APCI Dual nega : 722[M-H]−, 758[M+Cl]−.
Anal. Calcd for C41H61N3O8・2.5H2O: C, 64.04; H,8.65; N,5.46. Found: C, 64.01; H, 8.38; N,5.49.
実施例13−1
【0178】
【化63】

【0179】
中間体(E)の代わりに中間体(F)を用いて実施例6−1と同様の方法で無色アモルファスの化合物(13−1)(1.98g,99%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.10 (s, 6 H) 1.12 (d, J=6.84 Hz, 3 H) 1.14 (d, J=6.84 Hz, 3 H) 1.36 (s, 6 H) 1.56 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 6 H) 2.30 (s, 3 H) 2.85 - 3.02 (m, 1 H) 3.13 (d, J=5.91 Hz, 2 H) 3.76 - 3.84 (m, 1 H) 3.81 - 3.96 (m, 1 H) 3.86 (s, 3 H) 4.07 - 4.15 (m, 1 H) 4.18 - 4.27 (m, 1 H) 4.75 - 4.88 (m, 1 H) 5.11 - 5.24 (m, 1 H) 5.26 - 5.37 (m, 2 H) 6.22 - 6.38 (m, 1 H) 6.43 - 6.54 (m, 1 H) 6.59 - 6.70 (m, 1 H) 6.81 (s, 1 H) 6.96 - 7.02 (m, 2 H) 7.04 - 7.12 (m, 1 H) 7.20 - 7.26 (m, 1 H).
実施例13−2
【0180】
【化64】

【0181】
化合物(1−1)の代わりに化合物(13−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(13−2)(1.0g,65%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.01 (s, 6 H) 1.09 - 1.15 (m, 6 H) 1.35 (s, 6 H) 1.43 (s, 6 H) 2.31 (s, 3 H) 2.91 - 3.00 (m, 1 H) 3.08 (s, 2 H) 3.27 - 3.36 (m, 5 H) 3.41 - 3.46 (m, 1 H) 3.47 - 3.52 (m, 1 H) 3.60 (dd, J=11.92, 5.96 Hz, 1 H) 3.80 - 3.84 (m, 4 H) 3.90 (s, 2 H) 4.59 (d, J=9.63 Hz, 1 H) 6.36 - 6.41 (m, 1 H) 6.45 - 6.50 (m, 1 H) 6.71 (d, J=7.79 Hz, 1 H) 6.90 (s, 1 H) 7.06 (s, 1 H) 7.07 - 7.10 (m, 1 H) 7.20 - 7.25 (m, 1 H).
MS ESI/APCI Dual posi : 684[M+H]+.
MS ESI/APCI Dual nega : 682[M-H]-, 718[M+Cl]−.
実施例14−1
【0182】
【化65】

【0183】
中間体(E)の代わりに中間体(F)、N,N−ジメチルエチレンジアミンの代わりに4−アミノ−1−t−ブトキシカルボニルピペリジンを用いて実施例1−1と同様の方法で淡黄色の油状化合物(14−1)(200mg,quant.)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.11 (d, J=6.99 Hz, 3 H) 1.14 (d, J=6.99 Hz, 3 H) 1.25 - 1.33 (m, 2 H) 1.36 (s, 6 H) 1.45 (s, 9 H) 1.48 (s, 6 H) 1.77 (s, 3 H) 1.79 - 1.93 (m, 2 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.04 (s, 3 H) 2.32 (s, 3 H) 2.90 - 2.98 (m, 3 H) 3.75 - 4.00 (m, 9 H) 4.07 - 4.15 (m, 1 H) 4.18 - 4.27 (m, 1 H) 4.79 - 4.86 (m, 1 H) 5.19 (d, J=10.10 Hz, 1 H) 5.26 - 5.35 (m, 2 H) 6.09 (s, 1 H) 6.26 (d, J=16.48 Hz, 1 H) 6.50 (d, J=16.48 Hz, 1 H) 6.65 (d, J=8.32 Hz, 1 H) 6.74 - 6.83 (m, 2 H) 6.99 (s, 1 H) 7.08 (dd, J=8.32, 2.72 Hz, 1 H) 7.22 (d, J=2.72 Hz, 1 H).
MS ESI/APCI Dual posi : 965[M+H]+, 987[M+Na]+.
MS ESI/APCI Dual nega : 999[M+Cl]−.
実施例14−2
【0184】
【化66】

【0185】
化合物(14−1)(185mg,0.192mmol)のクロロホルム(2mL)溶液に、トリフルオロ酢酸(450μL)を加えた。反応混合物を室温で2時間攪拌し、溶媒を減圧下留去した。得られた残渣にトリエチルアミン/水/メタノール(1/1/5,4mL)を加え、反応混合物を室温で一晩攪拌した。溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム→クロロホルム:メタノール=8:2)で精製し、無色アモルファスの化合物(14−2)(103mg,77%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.14 (d, J=5.50 Hz, 3 H) 1.15 (d, J=5.50 Hz, 3 H) 1.27 - 1.35 (m, 2 H) 1.37 (s, 6 H) 1.45 (s, 6 H) 1.78 (d, J=11.46 Hz, 2 H) 2.33 (s, 3 H) 2.56 - 2.68 (m, 2 H) 2.95 - 3.03 (m, 3 H) 3.33 - 3.37 (m, 2 H) 3.43 - 3.48 (m, 1 H) 3.49 - 3.53 (m, 1 H) 3.57 - 3.66 (m, 1 H) 3.68 - 3.75 (m, 1 H) 3.81 - 3.84 (m, 1 H) 3.85 (s, 3 H) 3.92 (s, 2 H) 4.61 (d, J=9.17 Hz, 1 H) 6.34 - 6.43 (m, 1 H) 6.45 - 6.56 (m, 1 H) 6.74 (d, J=7.79 Hz, 1 H) 6.92 (s, 1 H) 7.04 - 7.16 (m, 2 H) 7.26 (s, 1 H).
MS ESI/APCI Dual posi : 696[M+H]+, 718[M+Na]+.
実施例15−1
【0186】
【化67】

【0187】
中間体(E)の代わりに中間体(G)を用いて実施例1−1と同様の方法で無色アモルファスの化合物(15−1)(103mg,94%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.05 (d, J=6.84 Hz, 3 H) 1.10 (d, J=6.84 Hz, 3 H) 1.38 (s, 6 H) 1.49 (s, 6 H) 1.77 (s, 3 H) 2.00 (s, 3 H) 2.05 (s, 3 H) 2.06 (s, 3 H) 2.46 (s, 6 H) 2.64 - 2.78 (m, 2 H) 3.04 (sept, J=6.84 Hz, 1 H) 3.38 - 3.49 (m, 2 H) 3.78 - 3.83 (m, 1 H) 3.85 (s, 3 H) 3.87 - 4.04 (m, 2 H) 4.08 - 4.18 (m, 1 H) 4.18 - 4.30 (m, 1 H) 4.87 (d, J=9.48 Hz, 1 H) 5.16 - 5.27 (m, 1 H) 5.28 - 5.44 (m, 2 H) 6.35 (s, 1 H) 6.40 - 6.57 (m, 2 H) 6.77 (s, 1 H) 7.01 (d, J=8.24 Hz, 2 H) 7.13 (s, 1 H) 7.32 (d, J=8.24 Hz, 2 H) 7.40 (s, 1 H).
MS ESI/APCI Dual posi : 839[M+H]+.
MS ESI/APCI Dual nega : 873[M+Cl]−.
実施例15−2
【0188】
【化68】

【0189】
化合物(4−1A)、化合物(4−1B)の代わりに化合物(15−1)を用いて実施例4−2と同様の方法で無色アモルファスの化合物(15−2)(62.1mg,75%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.07 (d, J=6.76 Hz, 3 H) 1.09 (d, J=6.76 Hz, 3 H) 1.36 (s, 6 H) 1.44 (s, 6 H) 2.23 (s, 6 H) 2.41 (t, J=6.88 Hz, 2 H) 3.10 (sept, J=6.76 Hz, 1 H) 3.26 - 3.30 (m, 2 H) 3.35 - 3.45 (m, 2 H) 3.45 - 3.52 (m, 1 H) 3.54 - 3.60 (m, 1 H) 3.62 - 3.69 (m, 1 H) 3.79 - 3.89 (m, 4 H) 3.99 (s, 2 H) 4.65 (d, J=9.63 Hz, 1 H) 6.39 (d, J=16.51 Hz, 1 H) 6.52 (d, J=16.51 Hz, 1 H) 6.88 (s, 1 H) 7.07 (d, J=8.25 Hz, 2 H) 7.23 (s, 1 H) 7.31 (d, J=8.25 Hz, 2 H).
MS ESI/APCI Dual posi : 670[M+H]+.
MS ESI/APCI Dual nega : 704[M+Cl]−.
Anal. Calcd for C37H55N3O8・1.0H2O : C, 64.6; H, 8.36; N, 6.11. Found : C, 64.5; H, 8.31; N, 6.02.
実施例16−1
【0190】
【化69】

【0191】
中間体(E)の代わりに中間体(G)、N,N−ジメチルエチレンジアミンの代わりにピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(16−1)(90mg,55%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.06 (d, J=6.6 Hz, 3 H) 1.11 (d, J=6.6 Hz, 3 H) 1.35 (s, 6 H) 1.77 (s, 6 H) 2.00 (s, 3 H) 2.04 (s, 3 H) 2.06 (s, 3 H) 2.25 (br. s., 2 H) 2.78 - 2.88 (m, 4 H) 2.96 - 3.12 (m, 1 H) 3.55 - 3.65 (m, 4 H) 3.78 - 3.88 (m, 1 H) 3.85 (s, 3 H) 3.88 - 4.04 (m, 2 H) 4.09 - 4.18 (m, 1 H) 4.20 - 4.30 (m, 1 H) 4.88 (d, J=9.48 Hz, 1 H) 5.15 - 5.27 (m, 1 H) 5.28 - 5.44 (m, 2 H) 6.22 - 6.33 (m, 1 H) 6.41 - 6.55 (m, 1 H) 6.72 - 6.85 (m, 2 H) 6.96 - 7.06 (m, 2 H) 7.14 (s, 1 H) 7.23 - 7.32 (m, 2 H).
MS ESI/APCI Dual posi : 836[M+H]+.
実施例16−2
【0192】
【化70】

【0193】
化合物(1−1)の代わりに化合物(16−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(16−2)(52mg,70%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.06 (d, J=6.80 Hz, 3 H) 1.07 (d, J=6.80 Hz, 3 H) 1.34 (s, 6 H) 1.42 (s, 6 H) 2.67 (br. s., 4 H) 3.04 - 3.12 (m, 1 H) 3.27 - 3.30 (m, 2 H) 3.33 - 3.38 (m, 2 H) 3.43 - 3.49 (m, 1 H) 3.50 - 3.61 (m, 3 H) 3.61 - 3.66 (m, 1 H) 3.80 (s, 3 H) 3.83 (d, J=11.92 Hz, 1 H) 3.92 - 4.00 (m, 2 H) 4.63 (d, J=9.63 Hz, 1 H) 6.33 - 6.39 (m, 1 H) 6.44 - 6.49 (m, 1 H) 6.86 (s, 1 H) 7.06 (d, J=8.25 Hz, 2 H) 7.21 (s, 1 H) 7.27 (d, J=8.25 Hz, 2 H).
MS ESI/APCI Dual posi : 668[M+H]+, 690[M+Na]+.
MS ESI/APCI Dual nega : 666[M-H]−, 702[M+Cl]−.
実施例17−1
【0194】
【化71】

【0195】
中間体(E)の代わりに中間体(G)、N,N−ジメチルエチレンジアミンの代わりに1−メチルピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(17−1)(187mg,95%)を得た。
1H NMR (300 MHz, CHLOROFORM-d)δ ppm 1.05 (d, J=6.84 Hz, 3 H) 1.10 (d, J=6.84 Hz, 3 H) 1.36 (s, 6 H) 1.59 (s, 6 H) 1.77 (s, 3 H) 2.00 (s, 3 H) 2.05 (s, 3 H) 2.06 (s, 3 H) 2.26 (s, 3 H) 2.32 - 2.40 (m, 4 H) 2.96 - 3.12 (m, 1 H) 3.59 - 3.71 (m, 4 H) 3.79 - 3.84 (m, 1 H) 3.85 (s, 3 H) 3.90 - 4.05 (m, 2 H) 4.10 - 4.16 (m, 1 H) 4.21 - 4.28 (m, 1 H) 4.87 (d, J=9.64 Hz, 1 H) 5.16 - 5.27 (m, 1 H) 5.29 - 5.44 (m, 2 H) 6.28 (d, J=16.4 Hz, 1 H) 6.49 (d, J=16.4 Hz, 1 H) 6.77 (s, 1 H) 6.83 (s, 1 H) 7.01 (d, J=8.08 Hz, 2 H) 7.13 (s, 1 H) 7.25 - 7.32 (m, 2 H).
MS ESI/APCI Dual posi : 850[M+H]+.
MS ESI/APCI Dual nega : 884[M+Cl]−.
実施例17−2
【0196】
【化72】

【0197】
化合物(4−1A)、化合物(4−1B)の代わりに化合物(17−1)を用いて実施例4−2と同様の方法で無色アモルファスの化合物(17−2)(127mg,84%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.05 (d, J=6.65 Hz, 3 H) 1.07 (d, J=6.65 Hz, 3 H) 1.36 (s, 6 H) 1.45 (s, 6 H) 2.14 (s, 3 H) 2.23 - 2.40 (m, 4 H) 3.06 - 3.16 (m, 1 H) 3.34 - 3.42 (m, 2 H) 3.46 - 3.52 (m, 1 H) 3.51 - 3.73 (m, 6 H) 3.79 - 3.91 (m, 4 H) 3.98 (s, 2 H) 4.65 (d, J=9.63 Hz, 1 H) 6.38 (d, J=16.1 Hz, 1 H) 6.48 (d, J=16.1 Hz, 1 H) 6.88 (s, 1 H) 7.08 (d, J=8.25 Hz, 2 H) 7.23 (s, 1 H) 7.29 (d, J=8.25 Hz, 2 H).
MS ESI/APCI Dual posi : 682[M+H]+, 704[M+Na]+.
MS ESI/APCI Dual nega : 716[M+Cl]−.
Anal. Calcd for C38H55N3O8・1.6H2O : C, 64.2; H, 8.25; N, 5.91. Found : C, 64.3; H, 8.08; N, 5.89.
試験例1
(1)ヒトSGLT1を安定に発現するCHO−K1細胞の作製
ヒトSGLT1蛋白質を発現するプラスミドベクターを、リポフェクトアミン2000(インビトロジェン社)を用いてCHO−K1細胞にトランスフェクションした。SGLT1発現細胞は、500μg/mLの濃度のジェネティシンの存在下で培養し耐性株を選択し、下記に示す系により糖取り込み能を指標に取得した。
(2)ヒトSGLT2を安定に発現するCHO−K1細胞の作製
方法A(WO2007/136116に記載の方法):ヒトSGLT2カルボキシ末端の最終残基にLeuGluSerArgGlyProValが付加された蛋白質を発現するプラスミドベクターを、リポフェクトアミン2000(インビトロジェン社)を用いてCHO−K1細胞にトランスフェクションした。SGLT2発現細胞は、500μg/mLの濃度のハイグロマイシンBの存在下で培養し耐性株を選択し、下記に示す系により糖取り込み能を指標に取得した。本安定発現細胞を用いて算出された結果を表1に方法Aとして示した。
【0198】
方法B:ヒトSGLT2蛋白質を発現するプラスミドベクターを、リポフェクトアミンLTX(インビトロジェン社)を用いてCHO−K1細胞にトランスフェクションした。SGLT2発現細胞は、1000μg/mLの濃度のジェネティシンの存在下で培養し耐性株を選択し、下記に示す系により糖取り込み能を指標に取得した。本安定発現細胞を用いて算出された結果を表1に方法Bとして示した。
(3)安定発現細胞におけるナトリウム依存的糖取り込み阻害試験
上記で調製した安定発現細胞を用いて下記試験を行った。
【0199】
前処理用緩衝液(140mM 塩化コリン、2mM KCl、1mM CaCl2、1mM MgCl2、10mM HEPES/5mM Tris、pH7.4)200μLをSGLT1安定発現細胞に、または方法Aでは2mL、方法Bでは200μLを各SGLT2安定発現細胞に加え、20分間インキュベーションした。前処理用緩衝液を除去し、試験化合物を含む取り込み用緩衝液([14C]メチル α−D−グルコピラノシドを含むメチル α−D−グルコピラノシド(1mM)、140mM NaCl、2mM KCl、1mM CaCl2、1mM MgCl2、10mM HEPES/5mM Tris、pH7.4)を75μL(SGLT1および方法Bの場合)、または200μL(方法Aの場合)加え、37℃にて30分(SGLT1)または60分(SGLT2)取り込み反応を行った。反応後細胞を洗浄用緩衝液(10mM メチル α−D−グルコピラノシド、140mM 塩化コリン、2mM KCl、1mM CaCl2、1mM MgCl2、10mM HEPES/5mM Tris、pH7.4)200μL(SGLT1および方法Bの場合)、または2mL(方法Aの場合)で2回洗浄し、0.25M NaOH溶液75μL(SGLT1および方法Bの場合)、または400μL(方法Aの場合)に溶かした。液体シンチレーター(パーキンエルマー社)を加えよく混和した後、β 線測定装置を用いて放射活性を測定した。対照群として試験化合物を含まない取り込み用緩衝液を調製した。また基礎取り込み用としてNaClに代えて塩化コリンを含む取り込み用緩衝液を調製した。
IC50値を求めるにあたり、適当な6濃度の試験化合物を用い、対照群の糖取り込み量(100%)に対し、糖取り込み量が50%阻害される試験化合物濃度(IC50値)を算出した。試験結果を表1に示す。
【0200】
【表1】

表1より、本発明化合物は、強いSGLT1阻害活性を有し、また、SGLT2阻害活性も弱いがある程度の活性を有することが示された。
【0201】
試験例2 ストレプトゾトシン糖尿病モデルラットにおける血糖値上昇抑制作用確認試験
(1)糖尿病モデルラットの作製
7週齢のSD/IGSラット(日本チャールスリバー株式会社,雄性)について約16時間の絶食後、エーテル麻酔下でストレプトゾトシン(STZ)50mg/kgを尾静脈内投与し、糖尿病モデルラットを作製した。7週齢のSD/IGSラットを同様にエーテル麻酔下,1.25mmol/Lクエン酸生理食塩液1mL/kgを尾静脈内投与し、正常対照ラットを作製した。STZまたは1.25mmol/Lクエン酸生理食塩液投与1週間後に、ラットを経口グルコース負荷試験に供した。
(2)経口グルコース負荷試験(OGTT)
糖尿病モデルラットを約16時間の絶食後、薬物投与群には、0.5%カルボキシメチルセルロースナトリウム(CMC)水溶液に溶解した薬物(1mg/kg)を,対照群には0.5%CMC水溶液のみ経口投与した。薬物として、WO07/136116に開示された化合物10、11および33、並びに、本発明化合物1−2、5−2、6−2、13−2、15−2を用いた。薬物投与直後に、グルコース溶液(2g/kg)を経口投与し、薬物投与前(0time)、及び、経口投与0.25、0.5、1、1.5、2時間後の計6点で採血した。
【0202】
採血は、無麻酔下で尾静脈よりヘパリンコート採血管を用いて行い、遠心分離後、血漿を分取した。血漿中グルコース濃度の定量は、グルコースCIIテストワコー(和光純薬株式会社)を用いて測定した。血糖値上昇抑制作用強度は、各薬物投与群の経口投与後1時間までの各血糖値より薬物投与前の血糖値を差し引いた値から、台形法を用いて血糖値-時間曲線下面積の増加量(ΔAUC)を算出し、対照群のそれに対する降下の割合で表記した。
【0203】
結果を表2及び表3に示す。
【0204】
試験例3
(1)WO07/136116に開示された化合物の経口投与後1週間までの腎臓中濃度推移
7週齢のSD/IGSラット(日本チャールスリバー株式会社,雄性,非絶食)に、0.5%CMC水溶液にて調製した化合物10、33(各1mg/kg)、および化合物11(0.3mg/kg)を経口投与した。薬物投与後24、72、168時間にエーテル麻酔下、後大静脈より全採血し、安楽死確認後に腎臓を摘出した。生理食塩液で組織表面を洗浄後、重量を測定し4倍量の精製水を加え氷冷下ホモジナイズした。ホモジネートに内標準物質を含むアセトニトリル/メタノール溶液を加えて除タンパクした後、上清をLC−MS/MS(アプライドバイオシステムズAPI3000)に供した。ポジティブイオンモードのエレクトロスプレーイオン化法にて生成した薬物由来のイオンを選択反応モニタリングにて検出した。得られた抽出イオンクロマトグラムのピーク面積から内標準法にてホモジネート中薬物濃度を算出した。
ここで、化合物10および33の内部標準物質には、(1S)−1,5−アンヒドロ−1−[5−(4−エトキシベンジル)−2−メトキシ−4−メチルフェニル]−1−チオ−D−グルシトール,エチル−D5を用い、化合物11の内部標準物質には、化合物11(トリスヒドロキシメチル−D6;−C(CD2OH)3)を用いた。
【0205】
実験結果を表2に示す。
【0206】
(2)本発明化合物の3日間反復経口投与後の腎臓中濃度
7週齢のSD/IGSラット(日本チャールスリバー株式会社,雄性,非絶食)に、0.5%CMC水溶液にて調製した本発明化合物1−2、5−2、6−2、13−2、15−2(3mg/kg)を1日1回3日間連続経口投与した。最終日の薬物投与後48時間にイソフルラン麻酔下、後大静脈より全採血し、安楽死確認後に腎臓を摘出した。生理食塩液で組織表面を洗浄後、重量を測定し4倍量の精製水を加え氷冷下ホモジナイズした。ホモジネート中薬物濃度の測定は、試験例3(1)と同じ方法で、内部標準物質に化合物11を用い、LC−MS/MSにより行った。
【0207】
実験結果を表3に示す。
【0208】
【表2】

WO2007/136116に開示の化合物10、11および33は、下記である。
【0209】
【化73】

【0210】
【表3】

WO2007/136116号に開示の化合物は1mg/kg経口投与後の糖負荷試験において、強い血糖低下作用を示した。しかし、1mg/kg経口投与した1、3及び7日後において腎臓中の化合物濃度があまり減少せず、7日後でも化合物は排泄されず腎臓に残留する傾向が見られた(表2)。
【0211】
一方、本発明の化合物は上記先行技術化合物と同様に強い血糖降下作用を有した。また、3mg/kgの用量で3日間連続投与したにも関わらず、投与2日後に意外にも化合物は腎臓に残留しないという特徴を示した(表3)。
【0212】
この相違の原因として、本発明化合物は、小腸での吸収が少なく、吸収された化合物も腎臓に残留されずに排泄されることが想定される。
【0213】
したがって、本発明化合物は、体内残留性の傾向がなく、連続投与による副作用及び毒性が少ない医薬品として実用性に優れた性質を有すると考えられる。
【産業上の利用可能性】
【0214】
本発明により、SGLT1阻害活性が強く、かつ体内貯留性の傾向がない食後高血糖改善薬を提供することができ、SGLT1活性を阻害することが有効な食後高血糖に由来する疾患の治療・予防に貢献することを通じて、人類の健康の増進に寄与し、健全な医薬品産業の発達を図ることができる。
【技術分野】
【0001】
本発明は、小腸でのグルコ−ス及びガラクトースの吸収に関わるナトリウム依存性グルコ−ス共輸送体1(以下、適宜に「SGLT1」と略記する。)に特異的な阻害活性を有する4−イソプロピルフェニル グルシトール化合物に関する。
【背景技術】
【0002】
血糖値はメタボリックシンドロームのバイオマーカーの一つとなっており、空腹時血糖が126mg/dL以上を示すと糖尿病と診断される。また、空腹時血糖が正常であっても、食後2時間血糖値が140〜200mg/dLの場合には、耐糖能異常(又は食後高血糖)と診断される。近年の疫学的研究によれば、耐糖能異常が心血管障害のリスクを高めると報告されている(非特許文献1及び2参照)。さらに、運動療法や薬物治療を施すことで耐糖能異常から2型糖尿病への移行を抑制し、高血圧の発症も有意に抑制することが報告されている(非特許文献3参照)。
【0003】
以上のことから、食後高血糖を抑制することが糖尿病やメタボリックシンドロームの発症抑制に重要であると考えられ、食後高血糖をコントロールする薬剤の需要が高まりつつある。
【0004】
従来、食後高血糖改善薬としては、糖類の加水分解酵素を阻害し、小腸からの糖の吸収を遅延させるα−グルコシダ−ゼ阻害剤が汎用されてきたが、新しい作用機序を有する食後高血糖改善薬の開発も行われている。
【0005】
哺乳動物の小腸上皮には高い頻度でナトリウム依存性グルコ−ス共輸送体1(SGLT1)が発現している。このSGLT1は小腸において、ナトリウムに依存し、グルコ−ス又はガラクト−スの能動輸送を司ることが知られている。そこで、SGLT1活性を阻害することによって、食事由来のグルコ−ス吸収を抑制し、食後高血糖の予防又は治療に用いることができる、ピラゾ−ル誘導体が報告されている(特許文献1〜6参照)。一方で、腎臓には高頻度にナトリウム依存性グルコ−ス共輸送体2(SGLT2)が発現しており、糸球体で一旦濾過されたグルコ−スはSGLT2を介して再吸収される(非特許文献4参照)。そして、SGLT2活性を阻害することによって、尿への糖排泄が促進され、血糖低下作用を示すことが報告されている(非特許文献5参照)。SGLT2阻害剤の特徴として、随時血糖を低下させる作用が優れているが、SGLT1阻害剤の様に食後高血糖を是正する作用は低い。また、SGLT1活性に加えて、SGLT2活性も同時に阻害するC−フェニル グルシトール誘導体についての報告もある(特許文献7参照)。
【0006】
一方、食後高血糖改善薬のような持続投与が必要な薬剤にとっては、薬効量と、毒性、副作用の発現量との間の安全域が広いことが重要である。特に、体内残留性薬物の場合は、治療に必要な投与量をコントロールすることが難しく、体内に残留している薬物が加算されて過剰量の薬物の効果が発現されることになり、予期せぬ毒性及び副作用につながる。例えば、分子内に3級アミンの様な親水性基と芳香環の様な疎水性基をもつ、陽イオン性薬物は、リン脂質と疎水結合し、ライソゾーム内に取り込まれ全身の器官に蓄積されることがあることが知られている。代表例として、クロロキンでは網膜障害、パーヘキシリンでは肺や小脳に変化があり神経障害が問題となった(非特許文献6参照)。
【0007】
したがって、薬物は、薬効を示した後に体内から速やかに排泄されることが望ましく、特に、持続投与が必須の食後高血糖改善薬では、体内残留性の問題のない薬物が望まれる。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】国際公開第WO2002/098893号パンフレット
【特許文献2】国際公開第WO2004/014932号パンフレット
【特許文献3】国際公開第WO2004/018491号パンフレット
【特許文献4】国際公開第WO2004/019958号パンフレット
【特許文献5】国際公開第WO2005/121161号パンフレット
【特許文献6】国際公開第WO2004/050122号パンフレット
【特許文献7】国際公開第WO2007/136116号パンフレット
【非特許文献1】Pan XR, et al. Diabetes Care, 第20巻, 537項, 1997年
【非特許文献2】M Tominaga, et al. Diabetes Care, 第22巻, 920項, 1999年
【非特許文献3】J.−L. Chiasson, et al. Lancent, 第359巻, 2072項, 2002年
【非特許文献4】E. M. Wright, Am. J. Physiol. Renal. Physiol., 第280巻, F10項, 2001年
【非特許文献5】G. Toggenburger, et al. Biochem. Biophys. Acta., 第688巻, 557項, 1982年
【非特許文献6】日薬理誌 Folia Pharmacol. Jpn. 第113巻, 19項, 1999年
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の目的は、薬効量と毒性、副作用の発現量との間の安全域が広いSGLT1阻害作用を示す化合物又はその塩、及びそれらを含む医薬を提供することである。
【課題を解決するための手段】
【0010】
特許文献7に記載のC−フェニル グルシトール誘導体は排泄されず腎臓に残留する傾向が見られることがわかった。そこで本発明者らは体内蓄積性の問題がない化合物を探索し鋭意検討した。その結果、特に、糖部分に直接結合するベンゼン環にイソプロピル基を導入し、その他のベンゼン環に、アミノ基を有するブテノイル基を導入して得られる、下記一般式(I)で示される、4−イソプロピルフェニル グルシトール化合物は、意外にも腎臓に残留する傾向がないことを見出し、本発明を完成した。
【0011】
以下に、本発明の4−イソプロピルフェニル グルシトール化合物(以下、「本発明化合物」という)の態様を述べる。
(1)下記式(I)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩:
【0012】
【化1】

【0013】
式中、
R1は水素原子、又はC1−4アルキル基であり、
R2は水素原子、又はメチル基であり、
R3は“アミノ基若しくはジC1−4アルキルアミノ基で置換されたC1−4アルキル基”、又はピペリジル基であり、
R4は水素原子であり、又はR3とR4は隣接する窒素原子と共にピペリジノ基若しくはピペラジニル基を形成し、それらはC1−4アルキル基若しくはジメチルアミノ基で置換されていてもよい。
(2)下記群から選択される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩。
【0014】
【化2】

【0015】

【0016】
(3)下記群から選択される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩。
【0017】
【化3】

【0018】
(4)前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む医薬。
(5)前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含むナトリウム依存性グルコース共輸送体1(SGLT1)活性阻害剤。
(6)前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む食後高血糖改善薬。
(7)前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む糖尿病の予防又は治療薬。
(8)糖尿病の予防又は治療用の薬剤の製造における、前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩の使用。
(9)前記(1)〜(3)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩の予防又は治療に有効量を哺乳動物に投与することを含む糖尿病を予防又治療する方法。
【発明の効果】
【0019】
本発明により、体内蓄積性の傾向がない、SGLT1活性を阻害する4−イソプロピルフェニル グルシトール化合物を提供することが可能となった。
【発明を実施するための形態】
【0020】
本発明において使用する用語を以下に定義する。
【0021】
「C1-4アルキル基」とは、炭素原子を1−4個有する直鎖状又は分枝状のアルキル基を意味する。例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、tert−ブチル基が挙げられる。
【0022】
「ジC1-4アルキルアミノ基」とは、2つのC1-4アルキル基で置換されたアミノ基を意味する。例えば、ジメチルアミノ基やジエチルアミノ基が挙げられる。
【0023】
また、「製薬学的に許容される塩」とは、アルカリ金属類、アルカリ土類金属類、アンモニウム、アルキルアンモニウムなどとの塩、鉱酸又は有機酸との塩であり、例えば、ナトリウム塩、カリウム塩、カルシウム塩、アンモニウム塩、アルミニウム塩、トリエチルアンモニウム塩、ぎ酸塩、酢酸塩、プロピオン酸塩、酪酸塩、ヘキサン酸塩、オクタン酸塩、トリフルオロ酢酸塩、マレイン酸塩、酒石酸塩、クエン酸塩、ステアリン酸塩、コハク酸塩、エチルコハク酸塩、ラクトビオン酸塩、グルコン酸塩、グルクロン酸塩、グルコヘプトン酸塩、グルタール酸塩、ピメリン酸塩、スベリン酸塩、アゼライン酸塩、セバシン酸塩、1,9−ノナンジカルボン酸塩、ドデカン二酸塩、トリデカン二酸塩、テトラデカン二酸塩、ペンタデカン二酸塩、ヘキサデカン二酸塩、ヘプタデカン二酸塩、安息香酸塩、2−ヒドロキシ安息香酸塩、メタンスルホン酸塩、エタンスルホン酸塩、エタンジスルホン酸塩、2−ヒドロキシエタンスルホン酸塩、ベンゼンスルホン酸塩、p−トルエンスルホン酸塩、1,5−ナフタレンジスルホン酸塩、ラウリル硫酸塩、乳酸塩、馬尿酸塩、フマル酸塩、マロン酸塩、トランスケイ皮酸塩、リンゴ酸塩、アスパラギン酸塩、グルタミン酸塩、アジピン酸塩、システインとの塩、N−アセチルシステインとの塩、塩酸塩、臭化水素酸塩、リン酸塩、硫酸塩、よう化水素酸塩、ニコチン酸塩、シュウ酸塩、ピクリン酸塩、チオシアン酸塩、ウンデカン酸塩、アクリル酸ポリマーとの塩、カルボキシビニルポリマーとの塩を挙げることができる。
【0024】
「食後高血糖改善薬」とは、食後高血糖を抑制することにより、食後高血糖に関連する疾患、例えば、糖尿病やメタボリックシンドロームの発症を抑制する、若しくは、それらの疾患を治療する薬物をいう。ここで、「食後高血糖」とは、食後に血糖値が異常に高くなる状態、具体的には、食後2時間の血糖値が140mg/dlを上回る状態をいう。
【0025】
本発明化合物の有用性について以下に説明する(詳細は以下の試験例参照)。
【0026】
本発明化合物は、強いSGLT1阻害活性を有し、また、SGLT2阻害活性も弱いがある程度の活性を有する。また、本発明化合物は、WO2007/136116号に開示された化合物と同程度に強い血糖降下作用を有する。さらに、WO2007/136116号に開示の化合物は、1mg/kg経口投与した7日後でも、化合物が排泄されず腎臓に残留する傾向が見られたのに対して、本発明化合物は、意外にも3mg/kgの用量で3日間連続投与したにも関わらず、2日後に腎臓に残留しないという特徴を示した。
【0027】
したがって、本発明化合物は、体内残留性の傾向がなく、連続投与による副作用及び毒性が少ない医薬品として実用性に優れた性質を有すると考えられる。
【0028】
本発明化合物を医薬として提供する場合、固形剤、液剤等の種々の態様の製剤形態を適宜に採択することができる。その際、製薬学的に許容される担体を配合することも可能である。そのような担体の例としては、一般的な賦形剤、増量剤、結合剤、崩壊剤、被覆剤、糖衣剤、pH調整剤、溶解剤又は水性若しくは非水性溶媒などが挙げられる。本発明の化合物とこれらの担体から、錠剤、丸剤、カプセル剤、顆粒剤、粉剤、散剤、液剤、乳剤、懸濁剤等を調製することができる。
【0029】
例えば、本発明化合物と固形製剤の製造等に用いられる一般的な賦形剤等を混合等した後に打錠し、経口投与用の錠剤として提供することができる。
【0030】
また、本発明化合物は、α、β若しくはγ−シクロデキストリン又はメチル化シクロデキストリン等に包接させて、その溶解性を改善することも可能である。
【0031】
本発明化合物の投与量は、疾患、症状、体重、年齢、性別、投与経路等により異なってくるが、成人に対し、1日当たり0.1〜1000mg/kg体重であり、0.1〜200mg/kg体重が好ましく、0.1〜10mg/kg体重がより好ましい。これを1日1回から数回に分けて投与することができる。
【0032】
本発明の好ましい態様として、以下に示す実施例化合物があげられる。
【0033】
【化4】

【0034】
以下に、本発明化合物(I)の製造方法を例を挙げて詳細に説明するが、例示されたものに特に限定されない。
【0035】
製造法1
本発明化合物(I)は以下の方法で合成することができる。
【0036】
ただし、Xはアセチル基またはC1−4アルキル基を示し、R5はR3もしくはアミノ基がtert−ブチルカーボネート(Boc)で保護されたR3を示し、その他の記号は前記と同義である。
【0037】
【化5】

【0038】
(1)工程1(Heck反応)
化合物(II)とオレフィンカルボン酸(III)をパラジウム触媒とホスフィンリガンド、及び適当な塩基の存在下、Heck反応を行うことにより化合物(IV)を得ることができる。このとき用いるパラジウム触媒としては、酢酸パラジウム、テトラキス(トリフェニルホスフィン)パラジウム、ジベンジリデンアセトンパラジウム、ビス(トリフェニルホスフィン)パラジウムクロリド、ビス(トリシクロヘキシルホスフィン)パラジウムクロリド、パラジウム活性炭等が挙げられる。ホスフィンリガンドとしてはトリフェニルホスフィンやトリ−O−トリルホスフィン等が挙げられる。また、塩基にはトリエチルアミン、N−エチル−N,N−ジイソプロピルアミン、炭酸カリウム、炭酸カルシウム、炭酸セシウム、カリウムt−ブトキシド等が用いられる。反応に用いられる溶媒としては、アセトニトリル、トルエン、テトラヒドロフラン等が挙げられる。反応温度は0℃から還流温度であるが、マイクロウェ−ブを用いることもある。
(2)工程2(アミド基への変換)
化合物(IV)をアミン(R5R4NH)と脱水縮合し、化合物(V)を得ることができる。この反応に使用する溶媒としては、クロロホルム、ジクロロメタン、N,N−ジメチルホルムアミド等が好ましく、脱水縮合剤としては、N,N´−ジシクロヘキシルカルボジイミド(DCC)、N−エチル−N´−3−ジメチルアミノプロピルカルボジイミド塩酸塩(EDC・HCl)、1、1´−カルボニルジイミダゾ−ル(CDI)、EDC・HCl/1−ヒドロキシベンゾトリアゾ−ル1水和物(HOBt・H2O)等が好ましい。ここでの反応温度は0℃〜60℃である。
(3)工程3(脱保護)
化合物(V)中のBoc基を酸性条件化除去し、アセチル(Ac)基を塩基性条件下除去することで化合物(I)を得ることができる。Boc基には、ジクロロメタン、クロロホルム、ジオキサン等の溶媒中、または無溶媒で塩酸またはトリフルオロ酢酸を作用させる。アセチル基には、ナトリウムメトキシド、水酸化ナトリウム、水酸化リチウム、炭酸カリウム、炭酸セシウム、トリエチルアミン等の塩基を用いることができる。溶媒としては、メタノール、エタノール、含水メタノール等が好ましい。ここでの反応温度は0℃〜60℃である。
【0039】
製造法2
本発明化合物(I)は以下に示す別ルートによって合成することもできる。ただし、記号は前記と同義である。
【0040】
【化6】

【0041】
(4)工程4(Heck反応)
化合物(II)とオレフィンカルボン酸(VI)を用いて製造法1、工程1に記載したHeck反応を行うことにより、化合物(VII)を得ることができる。
(5)工程5(アミド基への変換)
化合物(VII)とアミン(VIII)を用いて製造法1、工程2に記載した脱水縮合反応を行うことにより、化合物(V)を得ることができる。
(6)工程6(脱保護)
上記で得られた化合物(V)を製造法1、工程3に記載した脱保護反応によって化合物(I)へ導くことができる。
【0042】
製造法3
中間体(II)の製造法
本発明化合物(I)の製造に必要な中間体(II)の製造法を以下に示す。
【0043】
ただし、X1はベンジル基又はC1−4アルキル基を示し、X2はトリメチルシリル基又はC1−4アルキル基を示し、その他の記号は前記と同義である。
【0044】
【化7】

【0045】
(7)工程7(カップリング)
化合物(IX)にn−ブチルリチウム、sec−ブチルリチウム、tert−ブチルリチウム等の有機金属試薬を用いてアリ−ルリチウム試薬を調製することができる。これに、グルコノラクトン(X)を加えることで化合物(XI)を得ることができる。このとき反応に用いられる溶媒としては、テトラヒドロフラン、ジエチルエ−テル、トルエン等が挙げられる。反応温度は−80℃から室温であり、好ましくは−78℃〜−25℃である。
(8)工程8(酸加水分解)
化合物(XI)中のシリル基を酸性条件化メタノール中で除去すると共に、糖の1位をメチルエーテル化し化合物(XII)を得ることができる。このとき用いる酸としては、塩酸、硫酸、メタンスルホン酸、p−トルエンスルホン酸1水和物、ピリジニウムp−トルエンスルホン酸、フッ化水素ピリジン、n−Bu4NF等を用いることができる。反応温度は用いる酸によって異なるが、0℃〜100℃、好ましくは25℃〜80℃である。
(9)工程9(アセチル化)
化合物(XII)中の水酸基をアセチル基で保護することにより、化合物(XIII)を得ることができる。化合物(XII)と、無水酢酸、またはアセチルクロリド等を溶媒中、適当な塩基存在下反応させ化合物(XIII)を得ることができる。反応に用いる溶媒としては、クロロホルム、ジクロロメタン、ジオキサン、酢酸エチル、テトラヒドロフラン、N,N−ジメチルホルムアミド等である。塩基としてはトリエチルアミン、コリジン、ピリジン等が好ましい。反応の触媒として4−ジメチルアミノピリジンを用いることもできる。また、好ましい反応温度は0℃〜室温である。
(10)工程10(還元)
化合物(XIII)とEt3SiH、i−Pr3SiH、t−BuMe2SiH又はPh2SiHClを、ルイス酸の存在下で反応させ、化合物(XIV)を得ることができる。この反応に使用するルイス酸としては、BF3・Et2O、CF3COOH、InCl3、TiCl4、TMSOTf、p−トルエンスルホン酸、メタンスルホン酸等が挙げられ、溶媒としては、クロロホルム、ジクロロメタン、トルエン、テトラヒドロフラン、アセトニトリル又はそれらの混合溶媒が挙げられ、好ましい溶媒はアセトニトリル/クロロホルム、アセトニトリル/ジクロロメタン、アセトニトリル/テトラヒドロフラン、アセトニトリル/テトラヒドロフラン/トルエン等のアセトニトリルとの混合溶媒である。ここでの反応温度は−60℃〜25℃、好ましくは−30℃〜25℃である。
(11)工程11(脱保護)
化合物(XIV)中のX1がベンジル基の場合は、パラジウム活性炭、水酸化パラジウム、又は白金−パラジウム活性炭等の触媒を用いて水素雰囲気下にて接触水素添加することにより、脱ベンジル化を行うことができる。中でもパラジウム活性炭、水酸化パラジウムが触媒として好ましい。この反応に使用する溶媒としては、メタノ−ル、エタノ−ル、イソプロパノ−ル、酢酸エチル、酢酸、およびこれらの混合溶媒が挙げられる。反応温度は室温から還流温度であるが、室温が好ましい。
(12)工程12(ブロモ化)
化合物(XIV)、または上記工程11で得られた化合物と、臭素、N−ブロモスクシンイミド、臭化水素等を溶媒中反応させて、化合物(XV)を得ることができる。反応に用いる溶媒としては、クロロホルム、ジクロロメタン、酢酸、メタノール、N,N−ジメチルホルムアミド等である。ここでの反応温度は0℃〜室温である。
(13)工程13(脱保護)
化合物(XV)中のアセチル基を塩基性条件下除去することで化合物(XVI)を得ることができる。塩基としては、ナトリウムメトキシド、水酸化ナトリウム、水酸化リチウム、炭酸カリウム、炭酸セシウム、トリエチルアミン等の塩基を用いることができる。溶媒としては、メタノール、エタノール、含水メタノール等が好ましい。ここでの反応温度は0℃〜60℃である。
(14)工程14(シリル化)
化合物(XVI)中の水酸基をトリメチルシリル基等のシリル基で保護することにより、化合物(XVII)を得ることができる。化合物(XVI)と、トリメチルシリルクロリド、トリエチルシリルクロリド、tert−ブチルジメチルシリルクロリド等を溶媒中、適当な塩基存在下反応させ化合物(XVII)を得ることができる。反応に用いる溶媒としては、クロロホルム、ジクロロメタン、ジオキサン、酢酸エチル、テトラヒドロフラン、N,N−ジメチルホルムアミド等である。塩基としてはトリエチルアミン、コリジン、ピリジン等が好ましい。また、好ましい反応温度は0℃〜室温である。
(15)工程15(カップリング)
化合物(XVII)にn−ブチルリチウム、sec−ブチルリチウム、tert−ブチルリチウム等の有機金属試薬を用いてアリ−ルリチウム試薬を調製することができる。これに、アルデヒド(XVIII)を加えることで化合物(XIX)を得ることができる。このとき反応に用いられる溶媒としては、テトラヒドロフラン、ジエチルエ−テル、トルエン等が挙げられる。反応温度は−80℃から室温であり、好ましくは−78℃〜−25℃である。
(16)工程16(酸加水分解)
上記で得られた化合物(XIX)を製造法3、工程8に記載した酸加水分解反応によって化合物(XX)へ導くことができる。
(17)工程17(アセチル化)
上記で得られた化合物(XX)を製造法3、工程9に記載したアセチル化反応によって化合物(XXI)へ導くことができる。
(18)工程18(還元)
上記で得られた化合物(XXI)を製造法3、工程10に記載した還元反応によって中間体(II)へ導くことができる。
【0046】
製造法4
中間体(II)の製造法
中間体(II)は以下に示す別ルートによって合成することもできる。ここでは、工程19から21までワンポットで行い工程数を短縮することができる。
【0047】
ただし、記号は前記と同義である。
【0048】
【化8】

【0049】
(19)工程19(カップリング)
化合物(XXII)にn−ブチルリチウム、sec−ブチルリチウム、tert−ブチルリチウム等の有機金属試薬を用いてアリ−ルリチウム試薬を調製することができる。これに、グルコノラクトン(X)を加えることで化合物(XXIII)を得ることができる。このとき反応に用いられる溶媒としては、テトラヒドロフラン、ジエチルエ−テル、トルエン等が挙げられる。反応温度は−80℃から室温であり、好ましくは−78℃〜−25℃である。
(20)工程20(シリル化)
上記工程19に引き続いて、化合物(XXIII)の1位水酸基をトリメチルシリル基等のシリル基で保護することができる。工程19の反応液に、トリメチルシリルクロリドを反応させ化合物(XXIV)を得ることができる。反応に用いる溶媒および好ましい反応温度は、工程19と同じである。
(21)工程21(カップリング)
上記工程20に引き続いて、生成した化合物(XXIV)にn−ブチルリチウム、sec−ブチルリチウム、tert−ブチルリチウム等の有機金属試薬を用いてアリ−ルリチウム試薬を調製することができる。これに、アルデヒド(XVIII)を加えることで化合物(XXV)を得ることができる。このとき反応に用いられる溶媒および好ましい反応温度は、工程19と同じである。
(22)工程22(酸加水分解)
上記で得られた化合物(XXV)を製造法3、工程8に記載した酸加水分解反応によって化合物(XXVI)へ導くことができる。
(23)工程23(アセチル化)
上記で得られた化合物(XXVI)を製造法3、工程9に記載したアセチル化反応によって化合物(XXVII)へ導くことができる。
(24)工程24(還元)
上記で得られた化合物(XXVII)を製造法3、工程10に記載した還元反応によって化合物(XXVIII)へ導くことができる。
(25)工程25(アセチル化またはアルキル化)
化合物(XXVIII)の水酸基を、アセチル基で保護するまたはメチル化等のアルキル化を行うことで、中間体(II)を製造することができる。化合物(XXVIII)と、無水酢酸、またはアセチルクロリド等を溶媒中、適当な塩基存在下反応させ中間体(II)を得ることができる。反応に用いる溶媒としては、クロロホルム、ジクロロメタン、ジオキサン、酢酸エチル、テトラヒドロフラン、N,N−ジメチルホルムアミド等である。塩基としてはトリエチルアミン、コリジン、ピリジン等が好ましい。触媒として4−ジメチルアミノピリジン等を用いることもできる。また、好ましい反応温度は0℃〜室温である。一方、化合物(XXVIII)と、ヨウ化メチル、ヨウ化エチル、2−ヨードプロパン等を溶媒中、適当な塩基存在下反応させ中間体(II)を得ることができる。反応に用いる溶媒としては、クロロホルム、ジクロロメタン、テトラヒドロフラン、N,N−ジメチルホルムアミド、アセトン等である。塩基としては炭酸カリウム、炭酸セシウム等が好ましい。
【実施例】
【0050】
以下に、参考例、実施例及び試験例を挙げ、本発明をより詳細に説明するが、本発明はこれらの記載によって限定的に解釈されるものではない。
【0051】
参考例1 中間体(A)の製造
【0052】
【化9】

【0053】
(1)参考例1−1 化合物(A1)
【0054】
【化10】

【0055】
3−イソプロピルフェノール(25.0g,0.184mol)の酢酸(200mL)溶液にヨウ素酸カリウム(7.88g,0.0368mol)の水懸濁溶液(75mL)とヨウ素(18.7g,0.0736mol)を加え、この反応溶液を室温で20時間攪拌した。ジエチルエーテル(400mL)と水(300mL)を加えた後に有機層を分離した。その有機層を水、飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=95:5)にて精製し、無色油状の化合物(A1)(27.6g,57%)を得た。
1H NMR (200 MHz, CHLOROFORM-d) δ ppm 1.16 - 1.25 (m, 6 H) 2.64 - 2.98 (m, 1 H) 5.21 (s, 1 H) 6.57 (dd, J=8.13, 2.20 Hz, 1 H) 6.88 (d, J=2.20 Hz, 1 H) 7.54 (d, J=8.13 Hz, 1 H).
(2)参考例1−2 化合物(A2)
【0056】
【化11】

【0057】
化合物(A1)(26.5g,0.101mol)と炭酸カリウム(20.9g,0.152mol)のアセトニトリル懸濁液に臭化ベンジル(14.4mL,0.121mol)を加え室温で2時間攪拌した。メタノール(1.0mL)を加え30分攪拌した。不溶物をろ過し、ろ液を濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=95:5)にて精製し、無色油状の化合物(A2)(30.2g,85%)を得た。
1H NMR (200 MHz, CHLOROFORM-d) δ ppm 1.21 (d, J=7.03 Hz, 6 H) 2.84 (sept, J=7.03 Hz, 1 H) 5.14 (s, 2 H) 6.62 (dd, J=8.35, 2.20 Hz, 1 H) 6.74 (d, J=2.20 Hz, 1 H) 7.23 - 7.58 (m, 5 H) 7.68 (d, J=8.35 Hz, 1 H).
(3)参考例1−3 化合物(A3)
【0058】
【化12】

【0059】
化合物(A2)(30.2g,85.7mmol)のTHF(450mL)溶液に窒素雰囲気下、−78℃にて2.6M n−ブチルリチウムへキサン溶液(33mL,85.7mmol)を滴下し、同温にて15分間攪拌した。次いで2,3,4,6−テトラ−O−トリメチルシリル−D−グルコノ−1,5−ラクトン(40.0g,85.7mmol)のTHF(230mL)溶液を15分かけて滴下し、同温にて20分間攪拌した。反応液に飽和塩化アンモニウム水溶液(150mL)と水(100mL)を加えた。この混合物を室温まで温めた後に、酢酸エチルで2回抽出した。合わせた有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。
【0060】
得られた残渣をメタンスルホン酸(2.9g)を含むメタノール(840mL)溶液に溶解し、室温で14.5時間攪拌した。トリエチルアミン(2.5mL)で中和し、反応混合物を濃縮した。
【0061】
得られた残渣(46.4g)をピリジン(125mL)に溶解し、4℃に冷却した。この溶液に無水酢酸(75mL)と4−ジメチルアミノピリジン(102mg,0.835mmol)を加え、室温で19時間攪拌した。氷水(500mL)を加え、混合物を酢酸エチル(500mL)で2回抽出した。合わせた有機層を飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し粗化合物(53g)を得た。
【0062】
この粗化合物のクロロホルム(250mL)とアセトニトリル(250mL)溶液に、窒素雰囲気下4℃にてEt3SiH(13.7mL,85.7mmol)とBF3・Et2O(10.9mL,85.7mmol)を加え、同温で1.5時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=5:1→2:1)にて精製し、淡黄色のアモルファスとして化合物(A3)(19.1g,40%;4工程)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.21 (d, J=6.99 Hz, 6 H) 1.78 (s, 3 H) 2.01 (s, 6 H) 2.05 (s, 3 H) 2.86 (sept, J=6.99 Hz, 1 H) 3.80 (ddd, J=9.95, 4.59, 2.25 Hz, 1 H) 4.06 - 4.13 (m, 1 H) 4.19 - 4.27 (m, 1 H) 4.96 (d, J=9.95 Hz, 1 H) 5.10 (s, 2 H) 5.16 - 5.25 (m, 1 H) 5.33 (t, J=9.17 Hz, 1 H) 5.40 - 5.49 (m, 1 H) 6.79 (d, J=1.40 Hz, 1 H) 6.85 (dd, J=7.93, 1.40 Hz, 1 H) 7.26 - 7.52 (m, 6 H).
MS ESI/APCI Dual posi : 579[M+Na]+.
(4)参考例1−4 化合物(A4)
【0063】
【化13】

【0064】
化合物(A3)(19.1g,34.3mmol)のメタノール(200mL)溶液に10%パラジウム活性炭(1.8g)を加え、水素雰囲気下、室温にて2時間攪拌した。反応液をセライト濾過後、溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=2:1→1:1)にて精製し、無色アモルファスとして化合物(A4)(12.3g,77%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.20 (d, J=6.89 Hz, 6 H) 1.83 (s, 3 H) 2.01 (s, 3 H) 2.06 (s, 3 H) 2.12 (s, 3 H) 2.82 (sept, J=6.89 Hz, 1 H) 3.87 (ddd, J=9.60, 3.85, 2.25 Hz, 1 H) 4.14 - 4.21 (m, 1 H) 4.27 - 4.36 (m, 1 H) 4.59 (d, J=9.33 Hz, 1 H) 5.23 - 5.39 (m, 3 H) 6.70 (dd, J=7.93, 1.71 Hz, 1 H) 6.77 (d, J=1.71 Hz, 1 H) 6.80 (s, 1 H) 6.91 (d, J=7.93 Hz, 1 H).
MS ESI/APCI Dual posi : 489[M+Na]+.
MS ESI/APCI Dual nega : 501[M+Cl]−.
(5)参考例1−5 化合物(A5)
【0065】
【化14】

【0066】
化合物(A4)(12.3g,26.3mmol)の酢酸(120mL)溶液に、臭素(4.2g,26.3mmol)を室温にて滴下した。反応混合液を1.5時間攪拌し、氷水(150mL)を加えた。この混合物を酢酸エチルで2回抽出し、合わせた有機層を飽和炭酸水素ナトリウム水溶液、10%チオ硫酸ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣を2−プロパノール(20mL)に溶解し、ヘキサン(50mL)を滴下した。混合物を4℃で1時間攪拌し、析出した沈殿をろ過して無色粉末の化合物(A5)(9.8g,68%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12 - 1.26 (m, 6 H) 1.89 (s, 3 H) 2.01 (s, 3 H) 2.07 (s, 3 H) 2.13 (s, 3 H) 3.22 (sept, J=6.74 Hz, 1 H) 3.87 (ddd, J=9.48, 3.73, 2.18 Hz, 1 H) 4.14 - 4.22 (m, 1 H) 4.28 - 4.36 (m, 1 H) 4.53 (d, J=9.33 Hz, 1 H) 5.16 - 5.39 (m, 3 H) 6.82 (s, 1 H) 7.14 (s, 1 H).
MS ESI/APCI Dual posi : 567[M+Na]+, 569[M+2+Na]+.
MS ESI/APCI Dual nega : 579[M+Cl]−, 581[M+2+Cl]−.
(6)参考例1−6 化合物(A6)
【0067】
【化15】

【0068】
化合物(A5)(12.2g,22.3mmol)のメタノール(120mL)溶液に、トリエチルアミン(24mL)と水(24mL)を加えた。反応混合物を室温で15時間、さらに50℃で10時間攪拌し、溶媒を減圧下留去した。
得られた残渣をN,N−ジメチルホルムアミド(106mL)に溶解し、窒素雰囲気下4℃にてトリエチルアミン(18.6mL,134mmol)とクロロトリメチルシラン(14.3mL,112mmol)を加えた。反応混合物を4℃にて1時間攪拌し、氷水(150mL)を加えた。この混合物をトルエンで3回抽出し、合わせた有機層を水、飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、油状の化合物(A6)(17.4g)を得た。これを精製せずに次の反応に用いた。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm -0.28 (s, 9 H) 0.08 (s, 9 H) 0.19 (s, 9 H) 0.20 (s, 9 H) 0.29 (s, 9 H) 1.16 (d, J=6.84 Hz, 3 H) 1.21 (d, J=6.84 Hz, 3 H) 3.17 - 3.37 (m, 1 H) 3.41 - 3.56 (m, 3 H) 3.62 - 3.72 (m, 1 H) 3.76 - 3.86 (m, 1 H) 4.46 (d, J=8.24 Hz, 1 H) 6.64 (s, 1 H) 7.47 (s, 1 H).
(7)参考例1−7 化合物(A7)
【0069】
【化16】

【0070】
化合物(A6)(13.4g,15.9mmol)のTHF(140mL)溶液に窒素雰囲気下、−78℃にて2.6M n−ブチルリチウムへキサン溶液(7.7mL,20.0mmol)を10分かけて滴下し、同温にて5分間攪拌した。次いで4−ブロモ−2−メチルベンズアルデヒド(3.2g,15.9mmol)のTHF(24mL)溶液を15分かけて滴下し、同温にて45分間攪拌した。反応液に飽和塩化アンモニウム水溶液(100mL)と水(100mL)を加えた。この混合物を室温まで温めた後に、酢酸エチルで2回抽出した。合わせた有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。
【0071】
得られた残渣をメタンスルホン酸(0.9g)を含むメタノール(200mL)溶液に溶解し、室温で0.5時間攪拌した。トリエチルアミンで中和し、反応混合物を濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム:メタノール=10:1→8:1)で精製し、無色アモルファスの化合物(A7)(5.75g,73%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.01 and 1.04 (each d, J=6.88 Hz, 3 H) 1.18 and 1.19 (each d, J=6.88 Hz, 3 H) 2.24 and 2.26 (each s, 3 H) 2.95 - 3.07 (m, 1 H) 3.35 - 3.69 (m, 5 H) 3.78 - 3.87 (m, 1 H) 4.37 - 4.50 (m, 1 H) 5.59 (s, 1 H) 6.80 (s, 1 H) 6.98 - 7.10 (m, 2 H) 7.24 - 7.30 (m, 1 H) 7.33 (s, 1 H).
MS ESI/APCI Dual posi : 479[M-OH]+, 481[M+2-OH]+.
(8)参考例1−8 中間体(A)
【0072】
【化17】

【0073】
化合物(A7)(5.7g,11.5mmol)をピリジン(34mL)に溶解した。この溶液に無水酢酸(17mL)と4−ジメチルアミノピリジン(10mg)を加え、室温で0.5時間攪拌した。氷水(500mL)を加え、混合物を酢酸エチル(500mL)で2回抽出した。合わせた有機層を飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、粗化合物(8.5g)を得た。
【0074】
この粗化合物(8.5g)のクロロホルム(80mL)とアセトニトリル(80mL)溶液に、窒素雰囲気下、4℃にてEt3SiH(2.7mL,17.0mmol)とBF3・Et2O(2.2mL,17.0mmol)を加えた。反応液を室温まで温めた後に、同温で0.5時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣をヘキサン:酢酸エチル=4:1混合液から結晶化し、析出した沈殿をろ過して無色粉末の中間体(A)(5.3g,68%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12 (d, J=6.68 Hz, 3 H) 1.14 (d, J=6.68 Hz, 3 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.06 (s, 3 H) 2.27 (s, 3 H) 2.37 (s, 3 H) 2.93 (sept, J=6.68 Hz, 1 H) 3.76 (ddd, J=9.87, 4.51, 2.25 Hz, 1 H) 3.87 (s, 2 H) 4.06 (dd, J=12.51, 2.25 Hz, 1 H) 4.27 (dd, J=12.51, 4.51 Hz, 1 H) 4.49 (d, J=9.64 Hz, 1 H) 5.10 - 5.33 (m, 3 H) 6.59 (d, J=8.39 Hz, 1 H) 6.97 (s, 1 H) 7.00 (s, 1 H) 7.20 (dd, J=8.39, 2.49 Hz, 1 H) 7.34 (d, J=2.49 Hz, 1 H).
MS ESI/APCI Dual posi : 713[M+Na]+, 715[M+2+Na]+.
また、中間体(A)は参考例1−9、10、11に記載の方法でも合成することができる。
(9)参考例1−9 化合物(A8)
【0075】
【化18】

【0076】
3−イソプロピルフェノール(160g,1.18mol)の酢酸(1.6L)溶液に、氷冷で内温19℃を超えないように臭素(469g,2.94mol)の酢酸(320mL)溶液を32分かけて滴下し、室温で1時間攪拌した。トルエン(1.6L)を加えた後に氷冷し、内温20℃を超えないように10%亜硫酸ナトリウム水溶液(1.0L)を滴下して有機層を分離した。その有機層を10%亜硫酸ナトリウム水溶液(1.0L)、10%塩化ナトリウム水溶液(1.0L)で2回洗浄した後、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、淡黄色油状化合物(A8)(342g,99%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.21 (d, J=6.84 Hz, 6 H) 3.25 (sept, J=6.84 Hz, 1 H) 5.40 (s, 1 H) 6.96 (s, 1 H) 7.61 (s, 1 H).
(10)参考例1−10 化合物(A9)
【0077】
【化19】

【0078】
化合物(A8)(512g,1.74mol)のクロロホルム(1.74L)溶液に、N、N−ジイソプロピルエチルアミン(364mL,2.09mol)を加えて氷冷した。クロロメチルメチルエーテル(159mL,2.09mol)を60分かけて滴下し、室温で1時間攪拌した。反応液を氷冷し、1M水酸化ナトリウム水溶液(1.5L)を滴下して有機層を分離した。その有機層を1M水酸化ナトリウム水溶液(1.5L)、水(1.5L)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣を減圧蒸留(0.93〜1.5hpa,122℃〜137℃)にて精製し、淡黄色油状化合物(A9)(548g,96%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.22 (d, J=6.84 Hz, 6 H) 3.28 (sept, J=6.84 Hz, 1 H) 3.52 (s, 3 H) 5.23 (s, 2 H) 7.06 (s, 1 H) 7.69 (s, 1 H).
MS ESI/APCI Dual posi : 339[M+H]+, 341[M+2+H]+.
(11)参考例1−11 中間体(A)
化合物(A9)(210g,0.621mol)のTHF(3.1L)溶液に、アルゴン雰囲気下−86〜−74℃にて2.76M n−ブチルリチウムへキサン溶液(236mL,0.652mol)を20分かけて滴下し、同温にて35分間攪拌した。次いで2,3,4,6−テトラ−O−トリメチルシリル−D−グルコノ−1,5−ラクトン(305g,0.652mol)のTHF(890mL)溶液を38分かけて滴下し、同温にて50分間攪拌した。さらにトリメチルクロロシラン(82.8mL,0.652mmol)を4分かけて滴下し、同温にて3時間撹拌した。次いで2.76M n−ブチルリチウムへキサン溶液(326mL,0.901mol)を23分かけて滴下し、同温にて40分間攪拌した。最後に4−ブロモ−2−メチルベンズアルデヒド(136g,0.683mmol)のTHF(890mL)溶液を43分かけて滴下し、同温にて35分間撹拌した。反応液に水(3.1L)を加えて室温まで温めた。トルエン(3.1L)を加えて有機層を分離し、溶媒を減圧下留去した。
【0079】
得られた残渣(633g)をメタノール(3.1L)に溶解し、メタンスルホン酸(4.03mL,0.0621mol)を加えて1時間加熱還流を行った。反応液を室温まで冷却後、トリエチルアミン(17.3mL,0.124mol)で中和し、反応混合物を濃縮した。濃縮物(413g)をトルエン(1.1L)に溶解し、水(1.65L)で3回洗浄した。その有機層をトルエン(0.55L)で希釈し、1M水酸化ナトリウム水溶液(0.55L)で抽出した。その水層をトルエン(1.65L)で洗浄し、2M塩酸水溶液(0.43L)を加えて酸性にした。これをトルエン(1.1L)にて抽出した。その有機層を10%塩化ナトリウム水溶液(1.1L)で洗浄し、溶媒を減圧下留去した。
【0080】
得られた残渣(273g)をTHF(1.01L)に溶解し、N、N−ジイソプロピルエチルアミン(776mL,4.53mol)、無水酢酸(381mL,4.03mol)と4−ジメチルアミノピリジン(615mg,5.04mmol)を加え、室温で21時間攪拌した。反応液を氷冷して水(1.0L)とトルエン(1.0L)を加え、有機層を分離した。その有機層を飽和炭酸水素ナトリウム水溶液(1.0L)で洗浄し、溶媒を減圧下留去した。
得られた残渣(390g)をアセトニトリル(3.85L)に溶解し、水(9.07mL,0.504mol)、t−BuMe2SiH(334mL,2.02mol)を加え、氷冷後TMSOTf(392mL,2.17mol)を30分かけて滴下した。同温で1時間撹拌後、無水酢酸(95.2mL,1.01mol)を10分かけて滴下し、さらに同温で15分間撹拌した。反応液にトルエン(3.85mL)と3%炭酸水素ナトリウム水溶液(1.92L)を加え、有機層を分離した。その有機層を3%炭酸水素ナトリウム水溶液(1.92L)、10%塩化ナトリウム水溶液(1.92L)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し得られた残渣を2−プロパノール(1.42L)から結晶化し、析出した沈殿をろ過して無色粉末の中間体(A)(201g,47%;4工程)を得た。
【0081】
参考例2 中間体(B)の製造
【0082】
【化20】

【0083】
(1)参考例2−1 化合物(B1)
【0084】
【化21】

【0085】
化合物(A1)(27.4g,0.104mol)と炭酸カリウム(21.7g,0.156mol)のアセトニトリル懸濁液(200mL)にヨウ化メチル(9.8mL,0.156mol)を加え40℃で2.5時間攪拌した。ヨウ化メチル(3.5mL,0.052mol)を更に加え、同温で1時間攪拌した。不溶物をろ過し、ろ液を酢酸エチルで希釈した。有機層を水、10%チオ硫酸ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン→ヘキサン:酢酸エチル=95:5)にて精製し、淡黄色油状の化合物(B1)(24.5g,85%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.24 (d, J=6.84 Hz, 6 H) 2.87 (sept, J=6.84 Hz, 1 H) 3.88 (s, 3 H) 6.58 - 6.65 (m, 1 H) 6.70 (d, J=1.87 Hz, 1 H) 7.65 (d, J=8.08 Hz, 1 H).
MS ESI/APCI Dual posi : 277[M+H]+.
(2)参考例2−2 化合物(B2)
【0086】
【化22】

【0087】
化合物(B1)(24.5g,88.6mmol)のTHF(100mL)溶液に窒素雰囲気下、−78℃にて2.6M n−ブチルリチウムへキサン溶液(34mL,88.6mmol)を滴下し、同温にて5分間攪拌した。次いで2,3,4,6−テトラ−O−トリメチルシリル−D−グルコノ−1,5−ラクトン(37.6g,80.5mmol)のTHF(60mL)溶液を25分かけて滴下し、同温にて10分間攪拌した。反応液に氷と水を加え、混合物を室温まで温めた後に、酢酸エチルで抽出した。合わせた有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。
【0088】
得られた残渣をメタンスルホン酸(1.55g,16.1mmol)を含むメタノール(380mL)溶液に溶解し、室温で2時間攪拌した。トリエチルアミン(11.2mL,80.5mmol)で中和し、反応混合物を濃縮した。
【0089】
得られた残渣(30.2g)をピリジン(100mL)に溶解し、無水酢酸(100mL)を加え、室温で14時間攪拌した。氷水(400mL)を加え、混合物を酢酸エチル(200mL)で2回抽出した。合わせた有機層を1M塩酸水溶液、飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン→ヘキサン:酢酸エチル=6:4)にて精製し、淡黄色油状の化合物(B2)(32.8g,80%;3工程)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.23 (d,J=6.92 Hz, 6 H) 1.84 (s, 3 H) 1.97 (s, 3 H) 2.06 (s, 3 H) 2.10 (s, 3 H) 2.87 (sept, J=6.92 Hz, 1 H) 3.32 (s, 3 H) 3.87 (s, 3 H) 4.04 (ddd, J=10.18, 4.74, 2.41 Hz, 1 H) 4.17 - 4.23 (m, 1 H) 4.28 - 4.36 (m, 1 H) 5.25 (dd, J=10.18, 9.40 Hz, 1 H) 5.36 (d, J=10.18 Hz, 1 H) 5.60 (dd, J=10.18, 9.40 Hz, 1 H) 6.74 (d, J=1.55 Hz, 1 H) 6.79 (dd, J=8.08, 1.55 Hz, 1 H) 7.26 - 7.33 (m, 1 H).
MS ESI/APCI Dual posi : 533[M+Na]+.
(3)参考例2−3 化合物(B3)
【0090】
【化23】

【0091】
化合物(B2)(32.8g,64.0mmol)のクロロホルム(150mL)とアセトニトリル(150mL)溶液に窒素雰囲気下、4℃にてEt3SiH(21mL,128mmol)とBF3・Et2O(49mL,385mmol)を加え、同温で1時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=2:1)にて精製し、淡黄色ガム状の化合物(B3)(22.9g,74%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.22 (d, J=6.99 Hz, 6 H) 1.77 (s, 3 H) 2.01 (s, 3 H) 2.05 (s, 3 H) 2.07 (s, 3 H) 2.87 (sept, J=6.96 Hz, 1 H) 3.80 - 3.87 (m, 1 H) 3.84 (s, 3 H) 4.09 - 4.16 (m, 1 H) 4.22 - 4.29 (m, 1 H) 4.88 - 4.95 (m, 1 H) 5.18 - 5.27 (m, 1 H) 5.32 - 5.38 (m, 2 H) 6.71 (d, J=1.55 Hz, 1 H) 6.83 (dd, J=7.93, 1.55 Hz, 1 H) 7.23 - 7.30 (m, 1 H).
MS ESI/APCI Dual posi : 503[M+H]+.
MS ESI/APCI Dual nega : 515[M+Cl]−.
(4)参考例2−4 化合物(B4)
【0092】
【化24】

【0093】
化合物(A4)の代わりに化合物(B3)を用いて、参考例1−5と同様の方法で淡黄色アモルファスの化合物(B4)(25.5g,96%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.20 (d, J=6.84 Hz, 3 H) 1.23 (d, J=6.84 Hz, 3 H) 1.80 (s, 3 H) 2.01 (s, 3 H) 2.05 (s, 3 H) 2.09 (s, 3 H) 3.31 (sept, J=6.84 Hz, 1 H) 3.77 - 3.82 (m, 1 H) 3.83 (s, 3 H) 4.10 - 4.17 (m, 1 H) 4.22 - 4.30 (m, 1 H) 4.83 (d, J=9.48 Hz, 1 H) 5.17 - 5.38 (m, 3 H) 6.75 (s, 1 H) 7.49 (s, 1 H).
MS ESI/APCI Dual posi : 581[M+Na]+, 583[M+2+Na]+.
(5)参考例2−5 化合物(B5)
【0094】
【化25】

【0095】
化合物(A5)の代わりに化合物(B4)を用いて、参考例1−6と同様の方法で茶色油状の化合物(B5)(30.3g)を得た。これを精製せずに次の反応に用いた。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm -0.32 (s, 9 H) 0.09 (s, 9 H) 0.18 (s, 9 H) 0.20 (s, 9 H) 1.19 (d, J=6.84 Hz, 3 H) 1.23 (d, J=6.84 Hz, 3 H) 3.26 - 3.44 (m, 3 H) 3.52 - 3.58 (m, 2 H) 3.65 - 3.75 (m, 3 H) 3.76 - 3.83 (m, 1 H) 3.80 (s, 3 H) 4.60 (d, J=8.55 Hz, 1 H) 6.72 (s, 1 H) 7.51 (s, 1 H).
MS ESI/APCI Dual posi : 701[M+Na]+, 703[M+2+Na]+.
(6)参考例2−6 化合物(B6)
【0096】
【化26】

【0097】
化合物(A6)の代わりに化合物(B5)を用いて、参考例1−7と同様の方法で茶色アモルファスの化合物(B6)(14.7g,60%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.23 and 1.25 (each d, J=6.84 Hz, 6 H) 1.80 (s, 2 H) 2.27 and 2.29 (each s, 3 H) 2.30 - 2.58 (m, 2 H) 2.82 - 3.06 (m, 2 H) 3.34 and 3.35 (each s, 3 H) 3.38 - 3.86 (m, 6 H) 4.56 - 4.73 (m, 1 H) 5.53 (d, J=3.11 Hz, 1 H) 6.75 - 7.35 (m, 5 H).
MS ESI/APCI Dual posi : 493[M-OH]+, 495[M+2-OH]+
(7)参考例2−7 中間体(B)
【0098】
【化27】

【0099】
化合物(A7)の代わりに化合物(B6)を用いて、参考例1−8と同様の方法で無色アモルファスの中間体(B)(14.2g,88%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.11 (d, J=6.68 Hz, 3 H) 1.14 (d, J=6.68 Hz, 3 H) 1.75 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.05 (s, 3 H) 2.28 (s, 3 H) 2.90 (sept, J=6.68 Hz, 1 H) 3.71 - 3.90 (m, 3 H) 3.86 (s, 3H) 3.85 - 3.87 (m, 1 H) 4.05 - 4.15 (m, 1 H) 4.19 - 4.28 (m, 1 H) 4.77 - 4.85 (m, 1 H) 5.11 - 5.23 (m, 1 H) 5.26 - 5.37 (m, 2 H) 6.54 (d, J=8.24 Hz, 1 H) 6.81 (s, 1 H) 6.96 (s, 1 H) 7.17 (dd, J=8.24, 2.64 Hz, 1 H) 7.32 (d, J=2.64 Hz, 1 H).
MS ESI/APCI Dual posi : 685[M+Na]+, 687[M+2+Na]+.
参考例3 中間体(C)の製造
【0100】
【化28】

【0101】
化合物(6A)の代わりに化合物(B5)、4−ブロモ−2−メチルベンズアルデヒドの代わりに4−ブロモベンズアルデヒドを用いて、参考例1−7および参考例1−8と同様の方法で淡黄色アモルファスとして化合物(C)(2.26g)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.04 (d, J=6.84 Hz, 3 H) 1.09 (d, J=6.84 Hz, 3 H) 1.76 (s, 3 H) 2.01 (s, 3 H) 2.05 (s, 3 H) 2.06 (s, 3 H) 2.91 - 3.06 (m, 1 H) 3.80 - 3.88 (m, 4 H) 3.91 (d, J=5.13 Hz, 2 H) 4.06 - 4.18 (m, 1 H) 4.20 - 4.31 (m, 1 H) 4.82 - 4.93 (m, 1 H) 5.15 - 5.43 (m, 3 H) 6.77 (s, 1 H) 6.92 (d, J=8.55 Hz, 2 H) 7.11 (s, 1 H) 7.36 (d, J=8.55 Hz, 2 H).
参考例4 中間体(D)の製造
【0102】
【化29】

【0103】
(1)参考例4−1 化合物(D1)
【0104】
【化30】

【0105】
2,2−ジメチル−3−ブテノイックアシッド(J. Org. Chem., 第65巻, 8402項,2000年)(5.42g,47.5mmol)のクロロホルム(250mL)溶液に窒素雰囲気下、塩化オキサリル(4.43mL,49.9mmol)とN,N−ジメチルホルムアミド(3滴)を加え、室温で1.5時間攪拌した。その後反応液を氷冷し、トリエチルアミン(19.9mL,143mmol)とα−アミノイソブチリックアシッドメチルエステル塩酸塩(10.9g,71.2mmol)を加え、室温で1時間攪拌した。反応液に水を加え、クロロホルムで抽出後、有機層を3M塩酸水溶液、飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン→ヘキサン:酢酸エチル=4:1)にて精製し、無色粉末の化合物(D1)(9.38g,93%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.27 (s, 6 H) 1.51 (s, 6 H) 3.73 (s, 3 H) 5.17 - 5.32 (m, 2 H) 6.02 (dd, J=17.56, 10.57 Hz, 1 H) 6.25 (br. s., 1 H).
MS ESI/APCI Dual posi : 214[M+H]+.
(2)参考例4−2 中間体(D)
【0106】
【化31】

【0107】
化合物(D1)(9.38g,43.9mmol)のメタノール(20mL)溶液に4M水酸化ナトリウム水溶液(16.5mL,66.0mmol)を加え、室温で1時間攪拌した。その後、反応混合物を濃縮した。得られた残渣を水に溶解し、3M塩酸水溶液を加えて中和した。この混合物を酢酸エチルで抽出し、合わせた有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去し、無色粉末の中間体(D)(8.19g,94%)を得た。
1H NMR (300 MHz, CHLOROFORM-d)δ ppm 1.29 (s, 6 H) 1.54 (s, 6 H) 5.16 - 5.36 (m, 2 H) 6.01 (dd, J=17.49, 10.65 Hz, 1 H) 6.14 (s, 1 H).
MS ESI/APCI Dual posi : 200[M+H]+, 222[M+Na]+.
MS ESI/APCI Dual nega : 198[M-H]−.
参考例5 中間体(E)の製造
【0108】
【化32】

【0109】
アルゴン雰囲気下、中間体(A)(5.0g,7.23mmol)、中間体(D)(2.59g,13.0mmol)、酢酸パラジウム(II)(328mg,1.45mmol)、トリ-O-トリルホスフィン(880mg,2.89mmol)、トリエチルアミン(3.0mL,9.00mmol)のアセトニトリル(24mL)懸濁液を、マイクロウェーブ照射下120℃で20分間攪拌した。反応液をセライトろ過し、酢酸エチルで洗浄した。ろ液を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィ−(ヘキサン:酢酸エチル=1:1→酢酸エチル)にて精製し、淡黄色粉末の中間体(E)(4.59g,78%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.16, 1.18 (each d,
J=6.84 Hz, each 3 H) 1.40 (s, 6 H) 1.54 - 1.58 (m, 6 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.28 (s, 3 H) 2.36 (s, 3 H) 2.98 - 3.10 (m, 1 H) 3.71 - 3.79 (m, 1 H) 3.94 (s, 2 H) 4.01 - 4.08 (m, 1 H) 4.24 (dd, J=12.43, 4.51 Hz, 1 H) 4.47 (d, J=9.17 Hz, 1 H) 5.07 - 5.32 (m, 3 H) 6.31 (d, J=16.32 Hz, 1 H) 6.35 (s, 1 H) 6.55 (d, J=16.32 Hz, 1 H) 6.77 (d, J=7.62 Hz, 1 H) 6.92 (s, 1 H) 6.99 (s, 1 H) 7.12 - 7.18 (m, 1 H) 7.26 (s, 1 H) .
MS ESI/APCI Dual posi : 810[M+H]+, 832[M+Na]+.
MS ESI/APCI Dual nega : 808[M-H]−.
参考例6 中間体(F)の製造
【0110】
【化33】

【0111】
中間体Aの代わりに中間体Bを用いて参考例5と同様の方法で黄色粉末の中間体(F)(2.03g,87%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.17, 1.14 (each d, J=6.99 Hz, 3 H) 1.38 (s, 6 H) 1.55 (s, 6 H) 1.76 (s, 3 H) 1.98 (s, 3 H) 2.04 (s, 6 H) 2.30 (s, 3 H) 2.94 - 3.03 (m, 1 H) 3.76 - 3.83 (m, 1 H) 3.84 - 3.95 (m, 4 H) 4.06 - 4.15 (m, 1 H) 4.16 - 4.25 (m, 1 H) 4.81 (d, J=9.79 Hz, 1 H) 5.12 - 5.20 (m, 1 H) 5.23 - 5.35 (m, 2 H) 6.29 (s, 1H) 6.31 (d, J=16.32 Hz, 1 H) 6.52 (d, J=16.32 Hz, 1 H) 6.67 (d, J=8.08 Hz, 1 H) 6.81 (s, 1 H) 6.94 (s, 1 H) 7.06 - 7.14 (m, 1 H) 7.24 (s, 1 H).
MS ESI/APCI Dual posi : 782[M+H]+, 804[M+Na]+.
MS ESI/APCI Dual nega : 780[M-H]−.
参考例7 中間体(G)の製造
【0112】
【化34】

【0113】
中間体(A)の代わりに中間体(C)を用いて参考例5と同様の方法で淡黄色アモルファスの中間体(G)(854mg,60%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.84 Hz, 3 H) 1.12 (d, J=6.84 Hz, 3 H) 1.38 (s, 6 H) 1.53 (s, 6 H) 1.77 (s, 3 H) 2.00 (s, 3 H) 2.05 (s, 6 H) 3.06 (sept, J=6.84 Hz, 1 H) 3.78 - 3.83 (m, 1 H) 3.84 (s, 3 H) 3.97 (s, 2 H) 4.07 - 4.18 (m, 1 H) 4.17 - 4.27 (m, 1 H) 4.87 (dd, J=6.76, 2.88 Hz, 1 H) 5.16 - 5.25 (m, 1 H) 5.27 - 5.40 (m, 2 H) 6.18 - 6.33 (m, 2 H) 6.54 (d, J=16.48 Hz, 1 H) 6.77 (s, 1 H) 7.03 (d, J=8.08 Hz, 2 H) 7.10 (s, 1 H) 7.29 (d, J=8.08 Hz, 2 H).
MS ESI/APCI Dual posi : 768[M+H]+, 790[M+Na]+.
MS ESI/APCI Dual nega : 766[M-H]−.
参考例8 中間体(H)の製造
【0114】
【化35】

【0115】
アルゴン雰囲気下、中間体(A)(216g,0.312mol)、2,2−ジメチル−3−ブテノイックアシッド(53.4g,0.467mol)、酢酸パラジウム(II)(3.50g,15.6mmol)、トリ-O-トリルホスフィン(9.48g,31.2mmol)、トリエチルアミン(86.9mL,0.623mol)のアセトニトリル(623mL)懸濁液を、3時間加熱還流した。反応液を室温まで冷却した後にクロロホルム(300mL)とメタノール(100mL)を加えて希釈し、セライトろ過した。ろ液を減圧下濃縮し、得られた残渣を酢酸エチル(1.32L)に溶解させた。1M塩酸水溶液(0.96L)、10%塩化ナトリウム水溶液(1.2L)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、ろ液にさらに酢酸エチル(1.2L)を追加して、イソプロピルアミン(28.2mL,0.327mol)を加え、氷浴中で1時間撹拌した。析出した沈殿をろ過して中間体(H)のイソプロピルアミン塩を得た。この塩を酢酸エチル(1.2L)、1M塩酸水溶液(500mL)に溶解させて30分間撹拌し、有機層を分離した。その有機層を10%塩化ナトリウム水溶液(500mL)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去して無色のアモルファスとして中間体(H)(207g,88%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.13 (d, J=6.80 Hz, 3 H) 1.14 (d, J=6.80 Hz, 3 H) 1.43 (s, 6 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.28 (s, 3 H) 2.37 (s, 3 H) 2.98 (sept, J=6.80 Hz, 1 H) 3.70 - 3.80 (m, 1 H) 3.91 (s, 2 H) 4.05 (dd, J=12.43, 2.18 Hz, 1 H) 4.28 (dd, J=12.43, 4.35 Hz, 1 H) 4.43 - 4.50 (m, 1 H) 5.11 - 5.20 (m, 1 H) 5.22 - 5.33 (m, 2 H) 6.33 - 6.49 (m, 2 H) 6.68 (d, J=7.93 Hz, 1 H) 6.96 (s, 1 H) 6.99 (s, 1 H) 7.06 - 7.14 (m, 1 H) 7.23 (d, J=1.40 Hz, 1 H).
MS ESI/APCI Dual posi : 747[M+Na]+.
参考例9 中間体(I)の製造
【0116】
【化36】

【0117】
2−アミノイソ酪酸(150g,1.45mol)を水(2.2L)に溶解し、炭酸ナトリウム(465g,4.39mol)を加えた。反応液を氷冷し、クロロギ酸ベンジル(227mL,1.60mol)の1、4−ジオキサン(0.63L)溶液を内温が10℃を超えないように45分かけて滴下した。室温で一晩撹拌後、反応液に水(3.5L)とトルエン(1.0L)を加え、水層を分離した。その水層にpH=1になるまで濃塩酸(700mL)を滴下した。酢酸エチル(1.0L)を加えて1時間撹拌し、有機層を分離した。その有機層を無水硫酸マグネシウムで乾燥して乾燥剤を濾別後、溶媒を減圧下留去した。
【0118】
得られた残渣(338g)をクロロホルム(1.7L)に溶解し、氷冷下N,N’−カルボニルジイミダゾール(CDI)(253g,1.56mol)を内温が20℃を超えないように少量ずつ加えた。室温で30分間撹拌後、再度氷冷して1,2−ジアミノ−2−メチルプロパン(138g,1.56mol)を25分かけて滴下した。室温で1晩撹拌後、10%炭酸カリウム水溶液(1.7L)を加え、有機層を分離した。その有機層を無水硫酸マグネシウムで乾燥して乾燥剤を濾別後、溶媒を減圧下留去した。
【0119】
得られた残渣(417g)をTHF(2.0L)に溶解し、Boc2O(355g,1.63mol)を加えて、室温で1.5時間撹拌した。その後反応液に飽和炭酸水素ナトリウム水溶液(1.0L)を加え、有機層を分離した。その有機層を無水硫酸マグネシウムで乾燥して乾燥剤を濾別後、溶媒を減圧下留去した。
【0120】
得られた残渣(549g)をメタノール(2.75L)に溶解し、10%水酸化パラジウム(27.5g)を加え、水素雰囲気下室温にて4.5時間攪拌した。反応液をセライト濾過後、溶媒を減圧下留去し、得られた残渣をヘプタン:酢酸エチル=2:1混合液(1.75L)から結晶化し、析出した沈殿をろ過して無色粉末の中間体(I)(193g,53%;4工程)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.27 (s, 6 H) 1.37 (s, 6 H) 1.43 (s, 9 H) 1.53 (br. s, 2 H) 3.39 (d, J=6.53 Hz, 2 H) 4.78 (br. s, 1 H) 8.04 (br. s, 1 H).
MS ESI/APCI Dual posi : 274[M+H]+, 296[M+Na]+.
MS ESI/APCI Dual nega : 308[M+Cl]−.
実施例1−1
【0121】
【化37】

【0122】
中間体(E)(200mg,0.25mmol)、1−ヒドロキシベンゾトリアゾ−ル1水和物(HOBt・H2O)(57mg,0.37mmol)、N,N−ジメチルエチレンジアミン(65mg,0.74mmol)のN,N−ジメチルホルムアミド(3.0mL)溶液にN−エチル−N’−3−ジメチルアミノプロピルカルボジイミド塩酸塩(EDC・HCl)(71mg,0.37mmol)を加え、室温で8時間攪拌した。反応液を水(50mL)にあけ、酢酸エチル(50mL)で抽出した。有機層を飽和食塩水(20mL)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム→クロロホルム:メタノール=9:1)で精製し、無色アモルファスの化合物(1−1)(132mg,61%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.13, 1.15 (each d, J=6.92Hz, each 3 H) 1.38 (s, 6 H) 1.53 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.23 (s, 6 H) 2.31 (s, 3 H) 2.37 (s, 3 H) 2.41 (t, J=5.67 Hz, 2 H) 2.90 - 3.03 (m, 1 H) 3.25 - 3.34 (m, 2 H) 3.71 - 3.80 (m, 1 H) 3.92 (s, 2 H) 4.05 (dd, J=12.59, 2.18 Hz, 1 H) 4.23 - 4.32 (m, 1 H) 4.44 - 4.52 (m, 1 H) 5.11 - 5.20 (m, 1 H) 5.22 - 5.33 (m, 2 H) 6.33 (d, J=16.63 Hz, 1 H) 6.41 (br. s., 1 H) 6.51 (d, J=16.63 Hz, 1 H) 6.68 (d, J=7.77 Hz, 1 H) 6.77 (br. s., 1 H) 7.00 (s, 2 H) 7.12 (d, J=7.77 Hz, 1 H) 7.26 (s, 1 H) .
MS ESI/APCI Dual posi : 880[M+H]+, 902[M+Na]+.
MS ESI/APCI Dual nega : 914[M+Cl]−.
実施例1−2
【0123】
【化38】

【0124】
化合物(1−1)(127mg,0.14mmol)のメタノール(2.0mL)溶液にナトリウムメトキシド(4.88M / MeOH,10μL)を加え、室温で1時間攪拌した。ドライアイスを少量加えて、反応液を中和し、溶媒を減圧下留去した。
【0125】
得られた残渣をNH型シリカゲルカラムクロマトグラフィ−(クロロホルム:メタノール=9:1→6:4)で精製し、無色アモルファスの化合物(1−2)(77mg,80%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.10 (d, J=6.92 Hz, 6 H) 1.36 (s, 6 H) 1.45 (s, 6 H) 2.23 (s, 6 H) 2.31 (s, 3 H) 2.40 (t, J=6.88 Hz, 2 H) 2.87 - 2.96 (m, 1 H) 3.28 (t, J=6.88 Hz, 2 H) 3.34 - 3.41 (m, 2 H) 3.43 - 3.50 (m, 1 H) 3.51 - 3.57 (m, 1 H) 3.67 (dd, J=12.15, 2.52 Hz, 1 H) 3.84 (d, J=11.46 Hz, 1 H) 3.89 (s, 2 H) 4.47 (d, J=9.63 Hz, 1 H) 6.39 (d, J=16.05 Hz, 1 H) 6.50 (d, J=16.05 Hz, 1 H) 6.75 (d, J=8.25 Hz, 1 H) 6.80 (s, 1 H) 6.97 (s, 1 H) 7.11 (d, J=8.25 Hz, 1 H) 7.25 (s, 1 H) .
MS ESI/APCI Dual posi : 670[M+H]+.
MS ESI/APCI Dual nega : 668[M-H]−, 704[M+Cl]−.
Anal. Calcd for C37H55N3O8・1.4H2O: C, 63.94; H,8.38; N,6.05. Found: C, 64.13; H, 8.39; N, 5.88.
実施例2−1
【0126】
【化39】

【0127】
N,N−ジメチルエチレンジアミンの代わりにピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(2−1)(103mg,47%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.14, 1.16 (each d, J=6.99 Hz, each 3 H) 1.38 (s, 6 H) 1.61 (s, 6 H) 1.71 (s, 3 H) 1.99 (s, 3 H) 2.05 (s, 3 H) 2.12 (s, 3 H) 2.27 (s, 3 H) 2.79 - 2.87 (m, 4 H) 2.87 - 2.99 (m, 1 H) 3.56 - 3.66 (m, 4 H) 3.75 - 3.94 (m, 3 H) 4.12 - 4.20 (m, 1 H) 4.25 - 4.34 (m, 1 H) 4.44 - 4.52 (m, 1 H) 5.23 - 5.32 (m, 3 H) 6.30 (d, J=16.32 Hz, 1 H) 6.48 (d, J=16.32 Hz, 1 H) 6.53 (s, 1 H) 6.68 (d, J=7.77 Hz, 1 H) 6.88 (s, 1 H) 6.97 (s, 1 H) 7.05 - 7.12 (m, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 836[M+H]+, 858[M+Na]+.
MS ESI/APCI Dual nega : 834[M-H]−, 870[M+Cl]−.
実施例2−2
【0128】
【化40】

【0129】
化合物(1−1)の代わりに化合物(2−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(2−2)(52mg,66%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.10 (d, J=6.42 Hz, 6 H) 1.36 (s, 6 H) 1.44 (s, 6 H) 2.31 (s, 3 H) 2.70 (br. s, 4 H) 2.90 - 2.95 (m, 1 H) 3.36 - 3.39 (m, 2 H) 3.43 - 3.61 (m, 7 H) 3.65 - 3.69 (m, 1 H) 3.84 (d, J=11.92 Hz, 1 H) 3.88 (s, 2 H) 4.46 (d, J=9.63 Hz, 1 H) 6.38 (d, J=16.05 Hz, 1 H) 6.47 (d, J=16.05 Hz, 1 H) 6.76 (d, J=7.79 Hz, 1 H) 6.80 (s, 1 H) 6.95 (s, 1 H) 7.10 (d, J=7.79 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 668[M+H]+, 690[M+Na]+.
MS ESI/APCI Dual nega : 666[M-H]−, 702[M+Cl]−.
実施例3−1
【0130】
【化41】

【0131】
N,N−ジメチルエチレンジアミンの代わりに1−メチルピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(3−1)(135mg,61%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.13, 1.15 (each d, J=6.84 Hz, each 3 H) 1.37 (s, 6 H) 1.60 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.27 (s, 3 H) 2.30 (s, 3 H) 2.33 - 2.41 (m, 7 H) 2.88 - 3.04 (m, 1 H) 3.60 - 3.70 (m, 4 H) 3.72 - 3.80 (m, 1 H) 3.92 (s, 2 H) 4.05 (dd, J=12.59, 2.33 Hz, 1 H) 4.27 (dd, J=12.59, 4.51 Hz, 1 H) 4.43 - 4.54 (m, 1 H) 5.10 - 5.20 (m, 1 H) 5.22 - 5.32 (m, 2 H) 6.31 (d, J=16.48 Hz, 1 H) 6.49 (d, J=16.48 Hz, 1 H) 6.68 (d, J=8.08 Hz, 1 H) 6.86 (s, 1 H) 7.00 (s, 2 H) 7.08 - 7.14 (m, 1 H) 7.24 (s, 1 H).
MS ESI/APCI Dual posi : 892[M+H]+, 914[M+Na]+.
MS ESI/APCI Dual nega : 926[M+Cl]−.
実施例3−2
【0132】
【化42】

【0133】
化合物(1−1)の代わりに化合物(3−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(3−2)(79mg,79%)を得た。
1H NMR (600 MHz, METHANOL-d4)δ ppm 1.10 (d, J=6.88 Hz, 6 H) 1.37 (s, 6 H) 1.44 (s, 6 H) 2.16 (s, 3 H) 2.22 - 2.38 (m, 7 H) 2.87 - 2.96 (m, 1 H) 3.35 - 3.41 (m, 2 H) 3.42 - 3.51 (m, 2 H) 3.51 - 3.56 (m, 1 H) 3.56 - 3.71 (m, 5 H) 3.84 (d, J=12.38 Hz, 1 H) 3.88 (s, 2 H) 4.47 (d, J=9.63 Hz, 1 H) 6.38 (d, J=16.51 Hz, 1 H) 6.46 (d, J=16.51 Hz, 1 H) 6.75 (d, J=8.25 Hz, 1 H) 6.80 (s, 1 H) 6.97 (s, 1 H) 7.09 (d, J=8.25 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 682[M+H]+, 704[M+Na]+.
MS ESI/APCI Dual nega : 680[M-H]−, 716[M+Cl]−.
実施例4−1
【0134】
【化43】

【0135】
N,N−ジメチルエチレンジアミンの代わりに1−エチルピペラジンを用いて実施例1−1と同様の方法で無色ガム状の化合物(4−1A)(87.9mg,38%)と無色ガム状の化合物(4−1B)(42.9mg,19%)を得た。
【0136】
化合物(4−1A)
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.07 (t, J=7.23 Hz, 3 H) 1.12 -1.16 (m, 6 H) 1.37 (s, 6 H) 1.61 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.30 (s, 3 H) 2.34 - 2.44 (m, 9 H) 2.90 - 3.05 (m, 1 H) 3.60 - 3.72 (m, 4 H) 3.72 - 3.80 (m, 1 H) 3.92 (s, 2 H) 4.05 (dd, J=12.36, 1.94 Hz, 1 H) 4.27 (dd, J=12.36, 4.43 Hz, 1 H) 4.48 (d, J=9.79 Hz, 1 H) 5.15 (t, J=9.79 Hz, 1 H) 5.22 - 5.31 (m, 2 H) 6.31 (d, J=16.2 Hz, 1 H) 6.49 (d, J=16.2 Hz, 1 H) 6.68 (d, J=8.08 Hz, 1 H) 6.86 - 6.93 (m, 1 H) 7.00 (s, 2 H) 7.11 (d, J=8.08 Hz, 1 H) 7.24 (s, 1 H).
MS ESI/APCI Dual posi : 907[M+H]+, 929[M+Na]+.
MS ESI/APCI Dual nega : 941[M+Cl]−.
化合物(4−1B)
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.03 - 1.19 (m, 9 H) 1.37 (s, 6 H) 1.62 (s, 6 H) 1.71 (s, 3 H) 1.99 (s, 3 H) 2.05 (s, 3 H) 2.12 (s, 3 H) 2.27 (s, 3 H) 2.33 - 2.46 (m, 6 H) 2.93 (sept, J=6.76 Hz, 1 H) 3.58 - 3.71 (m, 4 H) 3.73 - 3.91 (m, 3 H) 4.12 - 4.21 (m, 1 H) 4.24 - 4.34 (m, 1 H) 4.48 (d, J=9.17 Hz, 1 H) 5.21 - 5.34 (m, 3 H) 6.30 (d, J=16.1 Hz, 1 H) 6.48 (d, J=16.1 Hz, 1 H) 6.53 (s, 1 H) 6.68 (d, J=7.93 Hz, 1 H) 6.88 (s, 1 H) 6.99 (s, 1 H) 7.08 (d, J=7.93 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 865[M+H]+, 887[M+Na]+.
MS ESI/APCI Dual nega : 899[M+Cl]−.
実施例4−2
【0137】
【化44】

【0138】
化合物(4−1A)(87.9mg,0.0973mmol)と化合物(4−1B)(42.9mg,0.0486mmol)にトリエチルアミン/水/メタノール(1/1/5,5mL)を加えた。反応混合物を室温で1晩攪拌し、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム→クロロホルム:メタノール=8:2)で精製し、無色アモルファスの化合物(4−2)(79.2mg,78%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 0.98 (t, J=7.23 Hz, 3 H) 1.10 (d, J=6.88 Hz, 6 H) 1.36 (s, 6 H) 1.44 (s, 6 H) 2.23 - 2.42 (m, 9 H) 2.85 - 2.99 (m, 1 H) 3.35 - 3.41 (m, 2 H) 3.42 - 3.48 (m, 1 H) 3.50 - 3.56 (m, 1 H) 3.55 - 3.71 (m, 5 H) 3.81 - 3.90 (m, 3 H) 4.47 (d, J=9.63 Hz, 1 H) 6.39 (d, J=16.1 Hz, 1 H) 6.46 (d, J=16.1 Hz, 1 H) 6.71 - 6.77 (m, 1 H) 6.80 (s, 1 H) 6.98 (s, 1 H) 7.09 (d, J=7.79 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 696[M+H]+, 718[M+Na]+.
MS ESI/APCI Dual nega : 694[M-H]−.
Anal. Calcd for C39H57N3O8・1.2H2O : C, 65.3; H, 8.34; N, 5.86. Found : C, 65.3; H, 8.36; N, 5.68.
実施例5−1
【0139】
【化45】

【0140】
中間体(E)(205mg,0.253mmol)、HOBt・H2O(68mg,0.506mmol)、4−ジメチルアミノピペリジン(65mg,0.506mmol)のN,N−ジメチルホルムアミド(2.0mL)溶液にEDC・HCl(97mg,0.506mmol)を加え、70℃で2時間攪拌した。反応液を水(50mL)にあけ、酢酸エチル(50mL)で抽出した。有機層を飽和食塩水(20mL)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム→クロロホルム:メタノール=3:1)で精製し、無色アモルファスの化合物(5−1)(80mg,34%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.13 (d, J=6.76 Hz, 3 H) 1.15 (d, J=6.76 Hz, 3 H) 1.30 - 1.49 (m, 2 H) 1.38 (s, 6 H) 1.61 (s, 6 H) 1.77 (s, 3 H) 1.84 (d, J=12.75 Hz, 2 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.27 (s, 6 H) 2.30 (s, 3 H) 2.37 (s, 3 H) 2.81 (t, J=12.28 Hz, 2 H) 2.97 (sept, J=6.76 Hz, 1 H) 3.76 (ddd, J=10.03, 4.66, 2.25 Hz, 1 H) 3.92 (s, 2 H) 4.05 (dd, J=12.43, 2.25 Hz, 1 H) 4.28 (dd, J=12.43, 4.66 Hz, 1 H) 4.33 - 4.53 (m, 3 H) 5.10 - 5.34 (m, 3 H) 6.31 (d, J=15.00 Hz, 1 H) 6.50 (d, J=15.00 Hz, 1 H) 6.68 (d, J=8.08 Hz, 1 H) 6.97 - 7.04 (m, 2 H) 7.11 (d, J=8.08 Hz, 1 H) 7.25 (s, 1 H).
MS ESI/APCI Dual posi : 920[M+H]+.
MS ESI/APCI Dual nega : 954[M+Cl]−.
実施例5−2
【0141】
【化46】

【0142】
化合物(1−1)の代わりに化合物(5−1)を用いて、実施例1−2と同様の方法で、無色アモルファスの化合物(5−2)(33mg,53%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.08 (d, J=6.42 Hz, 6 H) 1.21 - 1.32 (m, 2 H) 1.35 (s, 6 H) 1.43 (s, 6 H) 1.73 (br. s., 2 H) 2.16 (s, 6 H) 2.28 (s, 3H) 2.28 - 2.37 (m, 1 H) 2.89 (sept, J=6.42 Hz, 1 H) 3.31 - 3.33 (m, 2 H) 3.44 (t, J=8.71 Hz, 1 H) 3.48 - 3.56 (m, 1 H) 3.66 (dd, J=11.92, 2.75 Hz, 1 H) 3.83 (d, J=11.92 Hz, 1 H) 3.86 (s, 2 H) 4.45 (d, J=9.63 Hz, 1 H) 6.35 - 6.41 (m, 1 H) 6.43 - 6.47 (m, 1 H) 6.72 (d, J=7.79 Hz, 1 H) 6.78 (s, 1 H) 6.96 (s, 1 H) 7.08 (d, J=7.79 Hz, 1 H) 7.21 (s, 1 H).
MS ESI/APCI Dual posi : 710[M+H]+.
MS ESI/APCI Dual nega : 708[M-H]−.
Anal. Calcd for C40H59N3O8・1.5H2O : C, 65.19; H, 8.50; N, 5.70. Found : C, 64.81; H, 8.46; N, 5.61.
実施例6−1
【0143】
【化47】

【0144】
中間体(E)(680mg,0.746mmol)のクロロホルム(5.0mL)溶液にCDI(182mg,1.12mmol)を加え、室温で1時間攪拌した。次いで、1,2−ジアミノ−2−メチルプロパン(79mg,0.895mmol)を加え、室温で18時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで2回抽出した。合わせた有機層を、無水硫酸ナトリウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム→クロロホルム:メタノール=85:15)で精製し、無色アモルファスの化合物(6−1)(140mg,21%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.11 - 1.17 (m, 6 H) 1.11 (s, 6 H) 1.39 (s, 6 H) 1.53 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.31 (s, 3 H) 2.37 (s, 3 H) 2.89 - 3.05 (m, 1 H) 3.14 (d, J=5.91 Hz, 2 H) 3.76 (ddd, J=9.71, 4.51, 2.10 Hz, 1 H) 3.93 (s, 2 H) 4.05 (dd, J=12.51, 2.10 Hz, 1 H) 4.27 (dd, J=12.51, 4.51 Hz, 1 H) 4.49 (d, J=7.46 Hz, 1 H) 5.11 - 5.20 (m, 1 H) 5.23 - 5.31 (m, 2 H) 6.26 (s, 1 H) 6.29 - 6.38 (m, 1 H) 6.48 - 6.57 (m, 1 H) 6.69 (d, J=7.93 Hz, 1 H) 6.97 - 7.03 (m, 3 H) 7.12 (d, J=7.93 Hz, 1 H) 7.25 (s, 1 H).
MS ESI/APCI Dual posi : 880[M+H]+.
実施例6−2
【0145】
【化48】

【0146】
化合物(1−1)の代わりに化合物(6−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(6−2)(104mg,98%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.02 (s, 6 H) 1.05 - 1.10 (m, 6 H) 1.35 (s, 6 H) 1.44 (s, 6 H) 2.29 (s, 3 H) 2.85 - 2.93 (m, 1 H) 3.09 (s, 2 H) 3.34 - 3.39 (m, 2 H) 3.42 - 3.47 (m, 1 H) 3.52 (t, J=9.40 Hz, 1 H) 3.63 - 3.69 (m, 1 H) 3.80 - 3.85 (m, 1 H) 3.86 (s, 2 H) 4.46 (d, J=9.63 Hz, 1 H) 6.35 - 6.41 (m, 1 H) 6.44 - 6.51 (m, 1 H) 6.73 (d, J=7.79 Hz, 1 H) 6.78 (s, 1 H) 6.96 (s, 1 H) 7.06 - 7.10 (m, 1 H) 7.23 (s, 1 H).
MS ESI/APCI Dual posi : 670[M+H]+, 692[M+Na]+.
MS ESI/APCI Dual nega : 668[M-H]-, 704[M+Cl]−.
また、化合物(6−2)は、次の実施例6−3及び6−4に記載の方法でも合成することができる。
【0147】
実施例6−3
【0148】
【化49】

【0149】
中間体(H)(205g,0.273mol)、中間体(I)(97.0g,0.355mol)、HOBt・H2O(62.7g,0.410mol)、トリエチルアミン(114mL,0.819mol)のN,N−ジメチルホルムアミド(1.98L)溶液にEDC・HCl(78.5g,0.410mol)を加え、室温で11時間攪拌した。反応液にトルエン(1.0L)と10%塩化ナトリウム水溶液(2.0L)を加え、有機層を分離した。水層をトルエン(1.0L)から抽出し、合わせた有機層を5%塩化ナトリウム水溶液(1.0L)で洗浄し、無水硫酸マグネシウムで乾燥した。乾燥剤を濾別後、溶媒を減圧下留去した。得られた残渣を2−プロパノール(300mL)に50℃で溶解させ、ヘプタン(2.7L)を滴下した。混合溶液を氷冷で1時間攪拌し、析出した沈殿をろ過して無色粉末の化合物(6−3)(221g,83%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.13 (d, J=6.88 Hz, 3 H) 1.14 (d, J=6.88 Hz, 3 H) 1.26 (s, 6 H) 1.39 (s, 6 H) 1.44 (s, 9 H) 1.55 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.03 (s, 3 H) 2.05 (s, 3 H) 2.30 (s, 3 H) 2.37 (s, 3 H) 2.97 (sept, J=6.88 Hz, 1 H) 3.41 (d, J=5.60 Hz, 2 H) 3.72 - 3.80 (m, 1 H) 3.92 (s, 2 H) 4.05 (dd, J=12.43, 2.02 Hz, 1 H) 4.28 (dd, J=12.43, 4.51 Hz, 1 H) 4.45 - 4.52 (m, 1 H) 4.65 (s, 1 H) 5.11 - 5.19 (m, 1 H) 5.22 - 5.33 (m, 2 H) 6.29 - 6.39 (m, 1 H) 6.46 - 6.57 (m, 2 H) 6.69 (d, J=8.00 Hz, 1 H) 6.96 - 7.03 (m, 2 H) 7.11 (dd, J=8.00, 1.63 Hz, 1 H) 7.24 - 7.26 (m, 1 H) 7.59 (br. s, 1 H).
実施例6−4
化合物(6−3)(220g,0.225mol)のクロロホルム(3.0L)溶液に、室温でトリフルオロ酢酸(297mL,3.88mol)を10分かけて滴下し、同温にて20時間攪拌した。反応液をトルエン(3.0L)で希釈して濃縮した。残渣を酢酸エチル(3.0L)に溶解し、10%炭酸ナトリウム水溶液(1.2L)、飽和食塩水(1.0L)で洗浄し、溶媒を減圧下留去した。
【0150】
得られた残渣(240g)をメタノール(1.5L)に溶解し、氷冷後トリエチルアミン(0.3L)、水(0.3L)を加えた。室温で13時間撹拌後、更にメタノール(1.5L)、トリエチルアミン(0.3L)、水(0.3L)を加えて室温で20時間撹拌した。反応混合物を濃縮し、メタノールで共沸した。得られた残渣をNH型シリカゲルカラムクロマトグラフィ−(酢酸エチル:エタノール:水=15:2:1→10:2:1)で精製し、無色アモルファスの化合物(6−2)(129g,86%;2工程)を得た。
【0151】
実施例7−1
【0152】
【化50】

【0153】
中間体(E)の代わりに中間体(F)を用いて実施例1−1と同様の方法で無色アモルファスの化合物(7−1)(112mg,74%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12, 1.14 (each d, J=6.84 Hz, each 3 H) 1.37 (s, 6 H) 1.51 (s, 6 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.04 (s, 3 H) 2.23 (s, 6 H) 2.32 (s, 3 H) 2.41 (t, J=6.22 Hz, 2 H) 2.86 - 2.99 (m, 1 H) 3.25 - 3.33 (m, 2 H) 3.76 - 3.90 (m, 6 H) 4.07 - 4.15 (m, 1 H) 4.18 - 4.26 (m, 1 H) 4.76 - 4.85 (m, 1 H) 5.13 - 5.22 (m, 1 H) 5.26 - 5.36 (m, 2 H) 6.31 (d, J=16.48 Hz, 1 H) 6.37 (s, 1 H) 6.50 (d, J=16.48 Hz, 1 H) 6.61 - 6.67 (m, 1 H) 6.81 (s, 1 H) 6.99 (s, 1 H) 7.06 - 7.12 (m, 1 H) 7.24 (s, 1 H).
MS ESI/APCI Dual posi : 852[M+H]+.
MS ESI/APCI Dual nega : 886[M+Cl]−.
実施例7−2
【0154】
【化51】

【0155】
化合物(1−1)の代わりに化合物(7−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(7−2)(69mg,78%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.13, 1.15 (each d, J=6.84 Hz, each 3 H) 1.36 (s, 6 H) 1.45 (s, 6 H) 2.21 (s, 6 H) 2.32 (s, 3 H) 2.39 (t, J=6.88 Hz, 2 H) 2.93 - 3.02 (m, 1 H) 3.24 - 3.39 (m, 4 H) 3.42 - 3.48 (m, 1 H) 3.49 - 3.54 (m, 1 H) 3.58 - 3.65 (m, 1 H) 3.80 - 3.87 (m, 4 H) 3.91 (s, 2 H) 4.61 (d, J=9.63 Hz, 1 H) 6.39 (d, J=16.51 Hz, 1 H) 6.50 (d, J=16.51 Hz, 1 H) 6.73 (d, J=7.80 Hz, 1 H) 6.92 (s, 1 H) 7.08 (s, 1 H) 7.10 (d, J=7.80 Hz, 1 H) 7.25 (s, 1 H).
MS ESI/APCI Dual posi : 684[M+H]+.
MS ESI/APCI Dual nega : 682[M-H]−, 718[M+Cl]−.
Anal. Calcd for C38H57N3O8・1.7H2O: C, 63.88; H, 8.52; N, 5.88. Found: C, 63.84; H, 8.41; N, 5.75.
実施例8−1
【0156】
【化52】

【0157】
中間体(E)の代わりに中間体(F)、N,N−ジメチルエチレンジアミンの代わりにN−t−ブトキシカルボニルエチレンジアミンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(8−1)(145mg,89%)を得た。
MS ESI/APCI Dual posi : 924[M+H]+,946[M+Na]+.
MS ESI/APCI Dual nega : 958[M+Cl]−.
実施例8−2
【0158】
【化53】

【0159】
化合物(8−1)のクロロホルム(3.0ml)溶液に、トリフルオロ酢酸(600μL)を加えて室温で3時間攪拌した。反応液を減圧下濃縮後、シリカゲルカラムクロマトグラフィー(クロロホルム:メタノール=95:5→60:40)で精製して、無色アモルファスの化合物(8−2)(68mg、55%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.14,1.16 (each d, J=6.37 Hz, each 3 H) 1.32 (s, 6 H) 1.42 (s, 6 H) 1.77 (s, 3 H) 1.98 (s, 3 H) 2.03 (s, 3 H) 2.04 (s, 3 H) 2.32 (s, 3 H) 2.90 - 3.02 (m, 1 H) 3.22 - 3.34 (m, 2 H) 3.48 - 3.57 (m, 2 H) 3.76 - 3.96 (m, 6 H) 4.07 - 4.14 (m, 1 H) 4.17 - 4.25 (m, 1 H) 4.79 - 4.87 (m, 1 H) 5.12 - 5.22 (m, 1 H) 5.24 - 5.36 (m, 2 H) 6.32 (s, 1 H) 6.40 (d, J=16.63 Hz, 1 H) 6.51 (d, J=16.63 Hz, 1 H) 6.65 (d, J=8.55 Hz, 1 H) 6.82 (s, 1 H) 6.96 (s, 1 H) 7.07 - 7.13 (m, 1 H) 7.28 - 7.31 (m, 1 H) 8.04 (br. s., 2 H).
MS ESI/APCI Dual posi : 824[M+H]+, 846[M+Na]+.
MS ESI/APCI Dual nega : 858[M+Cl]−.
実施例8−3
【0160】
【化54】

【0161】
化合物(1−1)の代わりに化合物(8−2)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(8−3)(22mg,44%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.13, 1.15 (each d, J=6.84 Hz, each 3 H) 1.36 (s, 6 H) 1.45 (s, 6 H) 2.32 (s, 3 H) 2.63 - 2.71 (m, 2 H) 2.94 - 3.03 (m, 1 H) 3.23 (t, J=5.96 Hz, 2 H) 3.28 - 3.39 (m, 4 H) 3.43 - 3.48 (m, 1 H) 3.48 - 3.54 (m, 1 H) 3.62 (dd, J=12.15, 5.73 Hz, 1 H) 3.79 - 3.88 (m, 2 H) 3.92 (s, 2 H) 4.61 (d, J=9.63 Hz, 1 H) 6.40 (d, J=16.51 Hz, 1 H) 6.50 (d, J=16.51 Hz, 1 H) 6.74 (d, J=7.79 Hz, 1 H) 6.92 (s, 1 H) 7.07 (s, 1 H) 7.11 (d, J=7.79 Hz, 1 H) 7.26 (s, 1 H).
MS ESI/APCI Dual posi : 656[M+H]+.
MS ESI/APCI Dual nega : 654[M-H]−, 690[M+Cl]−.
実施例9−1
【0162】
【化55】

【0163】
中間体(E)の代わりに中間体(F)、N,N−ジメチルエチレンジアミンの代わりにピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(9−1)(42mg,38%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12, 1.14 (each d, J=6.99 Hz, each 3 H) 1.37 (s, 6 H) 1.58 (s, 6 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.04 (s, 3 H) 2.32 (s, 3 H) 2.79 - 2.86 (m, 4 H) 2.88 - 2.99 (m, 1 H) 3.57 - 3.64 (m, 4 H) 3.76 - 3.95 (m, 6 H) 4.07 - 4.14 (m, 1 H) 4.18 - 4.26 (m, 1 H) 4.77 - 4.84 (m, 1 H) 5.13 - 5.22 (m, 1 H) 5.26 - 5.37 (m, 2 H) 6.29 (d, J=16.16 Hz, 1 H) 6.49 (d, J=16.16 Hz, 1 H) 6.64 (d, J=7.93 Hz, 1 H) 6.77 - 6.83 (m, 2 H) 6.99 (s, 1 H) 7.05 - 7.11 (m, 1 H) 7.22 (br. s., 1 H).
MS ESI/APCI Dual posi : 850[M+H]+, 872[M+Na]+.
MS ESI/APCI Dual nega : 884[M+Cl]−.
実施例9−2
【0164】
【化56】

【0165】
化合物(1−1)の代わりに化合物(9−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(9−2)(27mg,94%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.14, 1.16 (each d, J=6.42Hz, each 3 H) 1.36 (s, 6 H) 1.44 (s, 6 H) 2.32 (s, 3 H) 2.69 (br. s., 4 H) 2.95 - 3.03 (m, 1 H) 3.28 - 3.38 (m, 2 H) 3.42 - 3.52 (m, 2 H) 3.53 - 3.65 (m, 5 H) 3.80 - 3.84 (m, 1 H) 3.84 (s, 3 H) 3.92 (s, 2 H) 4.61 (d, J=9.17 Hz, 1 H) 6.39 (d, J=16.05 Hz, 1 H) 6.47 (d, J=16.05 Hz, 1 H) 6.74 (d, J=7.79 Hz, 1 H) 6.92 (s, 1 H) 7.06 (s, 1 H) 7.10 (d, J=7.79 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 682[M+H]+.
MS ESI/APCI Dual nega : 680[M-H]−, 716[M+Cl]−.
実施例10−1
【0166】
【化57】

【0167】
中間体(E)の代わりに中間体(F)、N,N−ジメチルエチレンジアミンの代わりにN−メチルピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの粗化合物(10−1)(100mg)を得た。この物をさらに精製することなく、次の反応に用いた。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12 (d, J=8.5 Hz, 3 H) 1.15 (d, J=8.5 Hz, 3 H) 1.36 (s, 6 H) 1.56 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 6 H) 2.30 (s, 3 H) 2.32 (s, 3 H) 2.38 - 2.50 (m, 4 H) 2.85 - 3.02 (m, 1 H) 3.61 - 3.74 (m, 4 H) 3.76 - 3.84 (m, 1 H) 3.81 - 3.96 (m, 1 H) 3.86 (s, 3 H) 4.07 - 4.15 (m, 1 H) 4.18 - 4.27 (m, 1 H) 4.75 - 4.88 (m, 1 H) 5.11 - 5.24 (m, 1 H) 5.26 - 5.37 (m, 2 H) 6.22 - 6.38 (m, 1 H) 6.43 - 6.54 (m, 1 H) 6.59 - 6.70 (m, 2 H) 6.81 (s, 1 H) 6.96 - 7.02 (m, 1 H) 7.04 - 7.12 (m, 1 H) 7.20 - 7.26 (m, 1 H).
実施例10−2
【0168】
【化58】

【0169】
化合物(1−1)の代わりに化合物(10−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(10−2)(8.0mg,9%;2工程)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.09 - 1.16 (m, 6 H) 1.35 (s, 6 H) 1.42 (s, 6 H) 2.12 - 2.16 (m, 3 H) 2.23 - 2.33 (br. s., 4 H) 2.30 (s, 3 H) 2.92 - 3.01 (m, 1 H) 3.28 (s, 2 H) 3.30 - 3.38 (m, 1 H) 3.41 - 3.51 (m, 2 H) 3.55 - 3.66 (m, 5 H) 3.78 - 3.86 (m, 4 H) 3.90 (s, 2 H) 4.59 (d, J=9.17 Hz, 1 H) 6.33 - 6.39 (m, 1 H) 6.42 - 6.47 (m, 1 H) 6.72 (d, J=7.79 Hz, 1 H) 6.90 (s, 1 H) 7.04 - 7.11 (m, 2 H) 7.19 - 7.24 (m, 1 H).
MS ESI/APCI Dual posi : 696[M+H]+, 718[M+Na]+.
MS ESI/APCI Dual nega : 694[M-H]-, 730[M+Cl]−.
実施例11−1
【0170】
【化59】

【0171】
中間体(E)の代わりに中間体(F)、N,N−ジメチルエチレンジアミンの代わりに1−エチルピペラジンを用いて実施例1−1と同様の方法で淡黄色アモルファスの化合物(11−1)(200mg,89%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.07 (t, J=7.23 Hz, 3 H) 1.11 (d, J=6.84 Hz, 3 H) 1.14 (d, J=6.84 Hz, 3 H) 1.36 (s, 6 H) 1.59 (s, 6 H) 1.76 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.04 (s, 3 H) 2.32 (s, 3 H) 2.36 - 2.44 (m, 6 H) 2.93 (sept, J=6.84 Hz, 1 H) 3.61 - 3.71 (m, 4 H) 3.77 - 3.84 (m, 1 H) 3.83 - 3.94 (m, 5 H) 4.05 - 4.16 (m, 1 H) 4.18 - 4.27 (m, 1 H) 4.76 - 4.86 (m, 1 H) 5.14 - 5.23 (m, 1 H) 5.25 - 5.37 (m, 2 H) 6.29 (d, J=16.1 Hz, 1 H) 6.48 (d, J=16.1 Hz, 1 H) 6.64 (d, J=7.62 Hz, 1 H) 6.77 - 6.86 (m, 2 H) 6.99 (s, 1 H) 7.08 (d, J=7.62 Hz, 1 H) 7.22 (s, 1 H).
MS ESI/APCI Dual posi : 879[M+H]+, 901[M+Na]+.
MS ESI/APCI Dual nega : 913[M+Cl]−.
実施例11−2
【0172】
【化60】

【0173】
化合物(4−1A)、化合物(4−1B)の代わりに化合物(11−1)を用いて実施例4−2と同様の方法で無色アモルファスの化合物(11−2)(118mg,73%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 0.97 (t, J=7.11 Hz, 3 H) 1.10 - 1.19 (m, 6 H) 1.37 (s, 6 H) 1.45 (s, 6 H) 2.26 - 2.42 (m, 9 H) 2.97 (sept, J=6.76 Hz, 1 H) 3.32 - 3.40 (m, 2 H) 3.43 - 3.48 (m, 1 H) 3.48 - 3.55 (m, 1 H) 3.55 - 3.72 (m, 5 H) 3.79 - 3.89 (m, 4 H) 3.91 (s, 2 H) 4.61 (d, J=9.17 Hz, 1 H) 6.39 (d, J=16.5 Hz, 1 H) 6.46 (d, J=16.5 Hz, 1 H) 6.73 (d, J=7.79 Hz, 1 H) 6.92 (s, 1 H) 7.04 - 7.14 (m, 2 H) 7.23 (s, 1 H).
MS ESI/APCI Dual posi : 710[M+H]+, 732[M+Na]+.
MS ESI/APCI Dual nega : 744[M+Cl]−.
Anal. Calcd for C40H59N3O8・1.5H2O : C, 65.2; H, 8.48; N, 5.70. Found : C, 65.1; H, 8.38; N, 5.64.
実施例12−1
【0174】
【化61】

【0175】
中間体(E)の代わりに中間体(F)を用いて実施例5−1と同様の方法で、無色アモルファスの化合物(12−1)(55mg、40%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.12, 1.14 (each d, J=6.92 Hz, each 3 H) 1.28 - 1.47 (m, 8 H) 1.60 (s, 6 H) 1.73 - 1.89 (m, 5 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.04 (s, 3 H) 2.22 - 2.35 (m, 10 H) 2.73 - 2.99 (m, 3 H) 3.76 - 3.84 (m, 1 H) 3.84 - 3.90 (m, 5 H) 4.07 - 4.15 (m, 1 H) 4.18 - 4.26 (m, 1 H) 4.34 - 4.50 (m, 2 H) 4.75 - 4.86 (m, 1 H) 5.13 - 5.23 (m, 1 H) 5.26 - 5.39 (m, 2 H) 6.30 (d, J=16.48 Hz, 1 H) 6.48 (d, J=16.48 Hz, 1 H) 6.63 (d, J=8.39 Hz, 1 H) 6.81 (s, 1 H) 6.94 - 7.01 (m, 2 H) 7.04 - 7.11 (m, 1 H) 7.23 (s, 1 H).
MS ESI/APCI Dual posi : 892[M+H]+, 914[M+Na]+.
実施例12−2
【0176】
【化62】

【0177】
化合物(1−1)の代わりに化合物(12−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(12−2)(55mg,82%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.13, 1.15 (each d, J=6.84 Hz, each 3 H) 1.24 - 1.33 (m, 2 H) 1.37 (s, 6 H) 1.44 (s, 6 H) 1.75 (br. s, 2 H) 2.17 (s, 6 H) 2.30 - 2.39 (m, 4 H) 2.93 - 3.01 (m, 1 H) 3.28 - 3.38 (m, 5 H) 3.43 - 3.47 (m, 1 H) 3.47 - 3.53 (m, 1 H) 3.62 (dd, J=12.15, 5.73 Hz, 1 H) 3.80 - 3.86 (m, 3 H) 3.91 (s, 2 H) 4.48 (br. s., 2 H) 4.61 (d, J=9.63 Hz, 1 H) 6.40 (d, J=16.05 Hz, 1 H) 6.47 (d, J=16.05 Hz, 1 H) 6.73 (d, J=7.79 Hz, 1 H) 6.92 (s, 1 H) 7.06 - 7.11 (m, 2 H) 7.23 (s, 1 H).
MS ESI/APCI Dual posi : 724[M+H]+, 746[M+Na]+ .
MS ESI/APCI Dual nega : 722[M-H]−, 758[M+Cl]−.
Anal. Calcd for C41H61N3O8・2.5H2O: C, 64.04; H,8.65; N,5.46. Found: C, 64.01; H, 8.38; N,5.49.
実施例13−1
【0178】
【化63】

【0179】
中間体(E)の代わりに中間体(F)を用いて実施例6−1と同様の方法で無色アモルファスの化合物(13−1)(1.98g,99%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.10 (s, 6 H) 1.12 (d, J=6.84 Hz, 3 H) 1.14 (d, J=6.84 Hz, 3 H) 1.36 (s, 6 H) 1.56 (s, 6 H) 1.77 (s, 3 H) 1.99 (s, 3 H) 2.04 (s, 6 H) 2.30 (s, 3 H) 2.85 - 3.02 (m, 1 H) 3.13 (d, J=5.91 Hz, 2 H) 3.76 - 3.84 (m, 1 H) 3.81 - 3.96 (m, 1 H) 3.86 (s, 3 H) 4.07 - 4.15 (m, 1 H) 4.18 - 4.27 (m, 1 H) 4.75 - 4.88 (m, 1 H) 5.11 - 5.24 (m, 1 H) 5.26 - 5.37 (m, 2 H) 6.22 - 6.38 (m, 1 H) 6.43 - 6.54 (m, 1 H) 6.59 - 6.70 (m, 1 H) 6.81 (s, 1 H) 6.96 - 7.02 (m, 2 H) 7.04 - 7.12 (m, 1 H) 7.20 - 7.26 (m, 1 H).
実施例13−2
【0180】
【化64】

【0181】
化合物(1−1)の代わりに化合物(13−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(13−2)(1.0g,65%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.01 (s, 6 H) 1.09 - 1.15 (m, 6 H) 1.35 (s, 6 H) 1.43 (s, 6 H) 2.31 (s, 3 H) 2.91 - 3.00 (m, 1 H) 3.08 (s, 2 H) 3.27 - 3.36 (m, 5 H) 3.41 - 3.46 (m, 1 H) 3.47 - 3.52 (m, 1 H) 3.60 (dd, J=11.92, 5.96 Hz, 1 H) 3.80 - 3.84 (m, 4 H) 3.90 (s, 2 H) 4.59 (d, J=9.63 Hz, 1 H) 6.36 - 6.41 (m, 1 H) 6.45 - 6.50 (m, 1 H) 6.71 (d, J=7.79 Hz, 1 H) 6.90 (s, 1 H) 7.06 (s, 1 H) 7.07 - 7.10 (m, 1 H) 7.20 - 7.25 (m, 1 H).
MS ESI/APCI Dual posi : 684[M+H]+.
MS ESI/APCI Dual nega : 682[M-H]-, 718[M+Cl]−.
実施例14−1
【0182】
【化65】

【0183】
中間体(E)の代わりに中間体(F)、N,N−ジメチルエチレンジアミンの代わりに4−アミノ−1−t−ブトキシカルボニルピペリジンを用いて実施例1−1と同様の方法で淡黄色の油状化合物(14−1)(200mg,quant.)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.11 (d, J=6.99 Hz, 3 H) 1.14 (d, J=6.99 Hz, 3 H) 1.25 - 1.33 (m, 2 H) 1.36 (s, 6 H) 1.45 (s, 9 H) 1.48 (s, 6 H) 1.77 (s, 3 H) 1.79 - 1.93 (m, 2 H) 1.99 (s, 3 H) 2.04 (s, 3 H) 2.04 (s, 3 H) 2.32 (s, 3 H) 2.90 - 2.98 (m, 3 H) 3.75 - 4.00 (m, 9 H) 4.07 - 4.15 (m, 1 H) 4.18 - 4.27 (m, 1 H) 4.79 - 4.86 (m, 1 H) 5.19 (d, J=10.10 Hz, 1 H) 5.26 - 5.35 (m, 2 H) 6.09 (s, 1 H) 6.26 (d, J=16.48 Hz, 1 H) 6.50 (d, J=16.48 Hz, 1 H) 6.65 (d, J=8.32 Hz, 1 H) 6.74 - 6.83 (m, 2 H) 6.99 (s, 1 H) 7.08 (dd, J=8.32, 2.72 Hz, 1 H) 7.22 (d, J=2.72 Hz, 1 H).
MS ESI/APCI Dual posi : 965[M+H]+, 987[M+Na]+.
MS ESI/APCI Dual nega : 999[M+Cl]−.
実施例14−2
【0184】
【化66】

【0185】
化合物(14−1)(185mg,0.192mmol)のクロロホルム(2mL)溶液に、トリフルオロ酢酸(450μL)を加えた。反応混合物を室温で2時間攪拌し、溶媒を減圧下留去した。得られた残渣にトリエチルアミン/水/メタノール(1/1/5,4mL)を加え、反応混合物を室温で一晩攪拌した。溶媒を減圧下留去し、得られた残渣をシリカゲルカラムクロマトグラフィ−(クロロホルム→クロロホルム:メタノール=8:2)で精製し、無色アモルファスの化合物(14−2)(103mg,77%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.14 (d, J=5.50 Hz, 3 H) 1.15 (d, J=5.50 Hz, 3 H) 1.27 - 1.35 (m, 2 H) 1.37 (s, 6 H) 1.45 (s, 6 H) 1.78 (d, J=11.46 Hz, 2 H) 2.33 (s, 3 H) 2.56 - 2.68 (m, 2 H) 2.95 - 3.03 (m, 3 H) 3.33 - 3.37 (m, 2 H) 3.43 - 3.48 (m, 1 H) 3.49 - 3.53 (m, 1 H) 3.57 - 3.66 (m, 1 H) 3.68 - 3.75 (m, 1 H) 3.81 - 3.84 (m, 1 H) 3.85 (s, 3 H) 3.92 (s, 2 H) 4.61 (d, J=9.17 Hz, 1 H) 6.34 - 6.43 (m, 1 H) 6.45 - 6.56 (m, 1 H) 6.74 (d, J=7.79 Hz, 1 H) 6.92 (s, 1 H) 7.04 - 7.16 (m, 2 H) 7.26 (s, 1 H).
MS ESI/APCI Dual posi : 696[M+H]+, 718[M+Na]+.
実施例15−1
【0186】
【化67】

【0187】
中間体(E)の代わりに中間体(G)を用いて実施例1−1と同様の方法で無色アモルファスの化合物(15−1)(103mg,94%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.05 (d, J=6.84 Hz, 3 H) 1.10 (d, J=6.84 Hz, 3 H) 1.38 (s, 6 H) 1.49 (s, 6 H) 1.77 (s, 3 H) 2.00 (s, 3 H) 2.05 (s, 3 H) 2.06 (s, 3 H) 2.46 (s, 6 H) 2.64 - 2.78 (m, 2 H) 3.04 (sept, J=6.84 Hz, 1 H) 3.38 - 3.49 (m, 2 H) 3.78 - 3.83 (m, 1 H) 3.85 (s, 3 H) 3.87 - 4.04 (m, 2 H) 4.08 - 4.18 (m, 1 H) 4.18 - 4.30 (m, 1 H) 4.87 (d, J=9.48 Hz, 1 H) 5.16 - 5.27 (m, 1 H) 5.28 - 5.44 (m, 2 H) 6.35 (s, 1 H) 6.40 - 6.57 (m, 2 H) 6.77 (s, 1 H) 7.01 (d, J=8.24 Hz, 2 H) 7.13 (s, 1 H) 7.32 (d, J=8.24 Hz, 2 H) 7.40 (s, 1 H).
MS ESI/APCI Dual posi : 839[M+H]+.
MS ESI/APCI Dual nega : 873[M+Cl]−.
実施例15−2
【0188】
【化68】

【0189】
化合物(4−1A)、化合物(4−1B)の代わりに化合物(15−1)を用いて実施例4−2と同様の方法で無色アモルファスの化合物(15−2)(62.1mg,75%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.07 (d, J=6.76 Hz, 3 H) 1.09 (d, J=6.76 Hz, 3 H) 1.36 (s, 6 H) 1.44 (s, 6 H) 2.23 (s, 6 H) 2.41 (t, J=6.88 Hz, 2 H) 3.10 (sept, J=6.76 Hz, 1 H) 3.26 - 3.30 (m, 2 H) 3.35 - 3.45 (m, 2 H) 3.45 - 3.52 (m, 1 H) 3.54 - 3.60 (m, 1 H) 3.62 - 3.69 (m, 1 H) 3.79 - 3.89 (m, 4 H) 3.99 (s, 2 H) 4.65 (d, J=9.63 Hz, 1 H) 6.39 (d, J=16.51 Hz, 1 H) 6.52 (d, J=16.51 Hz, 1 H) 6.88 (s, 1 H) 7.07 (d, J=8.25 Hz, 2 H) 7.23 (s, 1 H) 7.31 (d, J=8.25 Hz, 2 H).
MS ESI/APCI Dual posi : 670[M+H]+.
MS ESI/APCI Dual nega : 704[M+Cl]−.
Anal. Calcd for C37H55N3O8・1.0H2O : C, 64.6; H, 8.36; N, 6.11. Found : C, 64.5; H, 8.31; N, 6.02.
実施例16−1
【0190】
【化69】

【0191】
中間体(E)の代わりに中間体(G)、N,N−ジメチルエチレンジアミンの代わりにピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(16−1)(90mg,55%)を得た。
1H NMR (300 MHz, CHLOROFORM-d) δ ppm 1.06 (d, J=6.6 Hz, 3 H) 1.11 (d, J=6.6 Hz, 3 H) 1.35 (s, 6 H) 1.77 (s, 6 H) 2.00 (s, 3 H) 2.04 (s, 3 H) 2.06 (s, 3 H) 2.25 (br. s., 2 H) 2.78 - 2.88 (m, 4 H) 2.96 - 3.12 (m, 1 H) 3.55 - 3.65 (m, 4 H) 3.78 - 3.88 (m, 1 H) 3.85 (s, 3 H) 3.88 - 4.04 (m, 2 H) 4.09 - 4.18 (m, 1 H) 4.20 - 4.30 (m, 1 H) 4.88 (d, J=9.48 Hz, 1 H) 5.15 - 5.27 (m, 1 H) 5.28 - 5.44 (m, 2 H) 6.22 - 6.33 (m, 1 H) 6.41 - 6.55 (m, 1 H) 6.72 - 6.85 (m, 2 H) 6.96 - 7.06 (m, 2 H) 7.14 (s, 1 H) 7.23 - 7.32 (m, 2 H).
MS ESI/APCI Dual posi : 836[M+H]+.
実施例16−2
【0192】
【化70】

【0193】
化合物(1−1)の代わりに化合物(16−1)を用いて実施例1−2と同様の方法で無色アモルファスの化合物(16−2)(52mg,70%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.06 (d, J=6.80 Hz, 3 H) 1.07 (d, J=6.80 Hz, 3 H) 1.34 (s, 6 H) 1.42 (s, 6 H) 2.67 (br. s., 4 H) 3.04 - 3.12 (m, 1 H) 3.27 - 3.30 (m, 2 H) 3.33 - 3.38 (m, 2 H) 3.43 - 3.49 (m, 1 H) 3.50 - 3.61 (m, 3 H) 3.61 - 3.66 (m, 1 H) 3.80 (s, 3 H) 3.83 (d, J=11.92 Hz, 1 H) 3.92 - 4.00 (m, 2 H) 4.63 (d, J=9.63 Hz, 1 H) 6.33 - 6.39 (m, 1 H) 6.44 - 6.49 (m, 1 H) 6.86 (s, 1 H) 7.06 (d, J=8.25 Hz, 2 H) 7.21 (s, 1 H) 7.27 (d, J=8.25 Hz, 2 H).
MS ESI/APCI Dual posi : 668[M+H]+, 690[M+Na]+.
MS ESI/APCI Dual nega : 666[M-H]−, 702[M+Cl]−.
実施例17−1
【0194】
【化71】

【0195】
中間体(E)の代わりに中間体(G)、N,N−ジメチルエチレンジアミンの代わりに1−メチルピペラジンを用いて実施例1−1と同様の方法で無色アモルファスの化合物(17−1)(187mg,95%)を得た。
1H NMR (300 MHz, CHLOROFORM-d)δ ppm 1.05 (d, J=6.84 Hz, 3 H) 1.10 (d, J=6.84 Hz, 3 H) 1.36 (s, 6 H) 1.59 (s, 6 H) 1.77 (s, 3 H) 2.00 (s, 3 H) 2.05 (s, 3 H) 2.06 (s, 3 H) 2.26 (s, 3 H) 2.32 - 2.40 (m, 4 H) 2.96 - 3.12 (m, 1 H) 3.59 - 3.71 (m, 4 H) 3.79 - 3.84 (m, 1 H) 3.85 (s, 3 H) 3.90 - 4.05 (m, 2 H) 4.10 - 4.16 (m, 1 H) 4.21 - 4.28 (m, 1 H) 4.87 (d, J=9.64 Hz, 1 H) 5.16 - 5.27 (m, 1 H) 5.29 - 5.44 (m, 2 H) 6.28 (d, J=16.4 Hz, 1 H) 6.49 (d, J=16.4 Hz, 1 H) 6.77 (s, 1 H) 6.83 (s, 1 H) 7.01 (d, J=8.08 Hz, 2 H) 7.13 (s, 1 H) 7.25 - 7.32 (m, 2 H).
MS ESI/APCI Dual posi : 850[M+H]+.
MS ESI/APCI Dual nega : 884[M+Cl]−.
実施例17−2
【0196】
【化72】

【0197】
化合物(4−1A)、化合物(4−1B)の代わりに化合物(17−1)を用いて実施例4−2と同様の方法で無色アモルファスの化合物(17−2)(127mg,84%)を得た。
1H NMR (600 MHz, METHANOL-d4) δ ppm 1.05 (d, J=6.65 Hz, 3 H) 1.07 (d, J=6.65 Hz, 3 H) 1.36 (s, 6 H) 1.45 (s, 6 H) 2.14 (s, 3 H) 2.23 - 2.40 (m, 4 H) 3.06 - 3.16 (m, 1 H) 3.34 - 3.42 (m, 2 H) 3.46 - 3.52 (m, 1 H) 3.51 - 3.73 (m, 6 H) 3.79 - 3.91 (m, 4 H) 3.98 (s, 2 H) 4.65 (d, J=9.63 Hz, 1 H) 6.38 (d, J=16.1 Hz, 1 H) 6.48 (d, J=16.1 Hz, 1 H) 6.88 (s, 1 H) 7.08 (d, J=8.25 Hz, 2 H) 7.23 (s, 1 H) 7.29 (d, J=8.25 Hz, 2 H).
MS ESI/APCI Dual posi : 682[M+H]+, 704[M+Na]+.
MS ESI/APCI Dual nega : 716[M+Cl]−.
Anal. Calcd for C38H55N3O8・1.6H2O : C, 64.2; H, 8.25; N, 5.91. Found : C, 64.3; H, 8.08; N, 5.89.
試験例1
(1)ヒトSGLT1を安定に発現するCHO−K1細胞の作製
ヒトSGLT1蛋白質を発現するプラスミドベクターを、リポフェクトアミン2000(インビトロジェン社)を用いてCHO−K1細胞にトランスフェクションした。SGLT1発現細胞は、500μg/mLの濃度のジェネティシンの存在下で培養し耐性株を選択し、下記に示す系により糖取り込み能を指標に取得した。
(2)ヒトSGLT2を安定に発現するCHO−K1細胞の作製
方法A(WO2007/136116に記載の方法):ヒトSGLT2カルボキシ末端の最終残基にLeuGluSerArgGlyProValが付加された蛋白質を発現するプラスミドベクターを、リポフェクトアミン2000(インビトロジェン社)を用いてCHO−K1細胞にトランスフェクションした。SGLT2発現細胞は、500μg/mLの濃度のハイグロマイシンBの存在下で培養し耐性株を選択し、下記に示す系により糖取り込み能を指標に取得した。本安定発現細胞を用いて算出された結果を表1に方法Aとして示した。
【0198】
方法B:ヒトSGLT2蛋白質を発現するプラスミドベクターを、リポフェクトアミンLTX(インビトロジェン社)を用いてCHO−K1細胞にトランスフェクションした。SGLT2発現細胞は、1000μg/mLの濃度のジェネティシンの存在下で培養し耐性株を選択し、下記に示す系により糖取り込み能を指標に取得した。本安定発現細胞を用いて算出された結果を表1に方法Bとして示した。
(3)安定発現細胞におけるナトリウム依存的糖取り込み阻害試験
上記で調製した安定発現細胞を用いて下記試験を行った。
【0199】
前処理用緩衝液(140mM 塩化コリン、2mM KCl、1mM CaCl2、1mM MgCl2、10mM HEPES/5mM Tris、pH7.4)200μLをSGLT1安定発現細胞に、または方法Aでは2mL、方法Bでは200μLを各SGLT2安定発現細胞に加え、20分間インキュベーションした。前処理用緩衝液を除去し、試験化合物を含む取り込み用緩衝液([14C]メチル α−D−グルコピラノシドを含むメチル α−D−グルコピラノシド(1mM)、140mM NaCl、2mM KCl、1mM CaCl2、1mM MgCl2、10mM HEPES/5mM Tris、pH7.4)を75μL(SGLT1および方法Bの場合)、または200μL(方法Aの場合)加え、37℃にて30分(SGLT1)または60分(SGLT2)取り込み反応を行った。反応後細胞を洗浄用緩衝液(10mM メチル α−D−グルコピラノシド、140mM 塩化コリン、2mM KCl、1mM CaCl2、1mM MgCl2、10mM HEPES/5mM Tris、pH7.4)200μL(SGLT1および方法Bの場合)、または2mL(方法Aの場合)で2回洗浄し、0.25M NaOH溶液75μL(SGLT1および方法Bの場合)、または400μL(方法Aの場合)に溶かした。液体シンチレーター(パーキンエルマー社)を加えよく混和した後、β 線測定装置を用いて放射活性を測定した。対照群として試験化合物を含まない取り込み用緩衝液を調製した。また基礎取り込み用としてNaClに代えて塩化コリンを含む取り込み用緩衝液を調製した。
IC50値を求めるにあたり、適当な6濃度の試験化合物を用い、対照群の糖取り込み量(100%)に対し、糖取り込み量が50%阻害される試験化合物濃度(IC50値)を算出した。試験結果を表1に示す。
【0200】
【表1】

表1より、本発明化合物は、強いSGLT1阻害活性を有し、また、SGLT2阻害活性も弱いがある程度の活性を有することが示された。
【0201】
試験例2 ストレプトゾトシン糖尿病モデルラットにおける血糖値上昇抑制作用確認試験
(1)糖尿病モデルラットの作製
7週齢のSD/IGSラット(日本チャールスリバー株式会社,雄性)について約16時間の絶食後、エーテル麻酔下でストレプトゾトシン(STZ)50mg/kgを尾静脈内投与し、糖尿病モデルラットを作製した。7週齢のSD/IGSラットを同様にエーテル麻酔下,1.25mmol/Lクエン酸生理食塩液1mL/kgを尾静脈内投与し、正常対照ラットを作製した。STZまたは1.25mmol/Lクエン酸生理食塩液投与1週間後に、ラットを経口グルコース負荷試験に供した。
(2)経口グルコース負荷試験(OGTT)
糖尿病モデルラットを約16時間の絶食後、薬物投与群には、0.5%カルボキシメチルセルロースナトリウム(CMC)水溶液に溶解した薬物(1mg/kg)を,対照群には0.5%CMC水溶液のみ経口投与した。薬物として、WO07/136116に開示された化合物10、11および33、並びに、本発明化合物1−2、5−2、6−2、13−2、15−2を用いた。薬物投与直後に、グルコース溶液(2g/kg)を経口投与し、薬物投与前(0time)、及び、経口投与0.25、0.5、1、1.5、2時間後の計6点で採血した。
【0202】
採血は、無麻酔下で尾静脈よりヘパリンコート採血管を用いて行い、遠心分離後、血漿を分取した。血漿中グルコース濃度の定量は、グルコースCIIテストワコー(和光純薬株式会社)を用いて測定した。血糖値上昇抑制作用強度は、各薬物投与群の経口投与後1時間までの各血糖値より薬物投与前の血糖値を差し引いた値から、台形法を用いて血糖値-時間曲線下面積の増加量(ΔAUC)を算出し、対照群のそれに対する降下の割合で表記した。
【0203】
結果を表2及び表3に示す。
【0204】
試験例3
(1)WO07/136116に開示された化合物の経口投与後1週間までの腎臓中濃度推移
7週齢のSD/IGSラット(日本チャールスリバー株式会社,雄性,非絶食)に、0.5%CMC水溶液にて調製した化合物10、33(各1mg/kg)、および化合物11(0.3mg/kg)を経口投与した。薬物投与後24、72、168時間にエーテル麻酔下、後大静脈より全採血し、安楽死確認後に腎臓を摘出した。生理食塩液で組織表面を洗浄後、重量を測定し4倍量の精製水を加え氷冷下ホモジナイズした。ホモジネートに内標準物質を含むアセトニトリル/メタノール溶液を加えて除タンパクした後、上清をLC−MS/MS(アプライドバイオシステムズAPI3000)に供した。ポジティブイオンモードのエレクトロスプレーイオン化法にて生成した薬物由来のイオンを選択反応モニタリングにて検出した。得られた抽出イオンクロマトグラムのピーク面積から内標準法にてホモジネート中薬物濃度を算出した。
ここで、化合物10および33の内部標準物質には、(1S)−1,5−アンヒドロ−1−[5−(4−エトキシベンジル)−2−メトキシ−4−メチルフェニル]−1−チオ−D−グルシトール,エチル−D5を用い、化合物11の内部標準物質には、化合物11(トリスヒドロキシメチル−D6;−C(CD2OH)3)を用いた。
【0205】
実験結果を表2に示す。
【0206】
(2)本発明化合物の3日間反復経口投与後の腎臓中濃度
7週齢のSD/IGSラット(日本チャールスリバー株式会社,雄性,非絶食)に、0.5%CMC水溶液にて調製した本発明化合物1−2、5−2、6−2、13−2、15−2(3mg/kg)を1日1回3日間連続経口投与した。最終日の薬物投与後48時間にイソフルラン麻酔下、後大静脈より全採血し、安楽死確認後に腎臓を摘出した。生理食塩液で組織表面を洗浄後、重量を測定し4倍量の精製水を加え氷冷下ホモジナイズした。ホモジネート中薬物濃度の測定は、試験例3(1)と同じ方法で、内部標準物質に化合物11を用い、LC−MS/MSにより行った。
【0207】
実験結果を表3に示す。
【0208】
【表2】

WO2007/136116に開示の化合物10、11および33は、下記である。
【0209】
【化73】

【0210】
【表3】

WO2007/136116号に開示の化合物は1mg/kg経口投与後の糖負荷試験において、強い血糖低下作用を示した。しかし、1mg/kg経口投与した1、3及び7日後において腎臓中の化合物濃度があまり減少せず、7日後でも化合物は排泄されず腎臓に残留する傾向が見られた(表2)。
【0211】
一方、本発明の化合物は上記先行技術化合物と同様に強い血糖降下作用を有した。また、3mg/kgの用量で3日間連続投与したにも関わらず、投与2日後に意外にも化合物は腎臓に残留しないという特徴を示した(表3)。
【0212】
この相違の原因として、本発明化合物は、小腸での吸収が少なく、吸収された化合物も腎臓に残留されずに排泄されることが想定される。
【0213】
したがって、本発明化合物は、体内残留性の傾向がなく、連続投与による副作用及び毒性が少ない医薬品として実用性に優れた性質を有すると考えられる。
【産業上の利用可能性】
【0214】
本発明により、SGLT1阻害活性が強く、かつ体内貯留性の傾向がない食後高血糖改善薬を提供することができ、SGLT1活性を阻害することが有効な食後高血糖に由来する疾患の治療・予防に貢献することを通じて、人類の健康の増進に寄与し、健全な医薬品産業の発達を図ることができる。
【特許請求の範囲】
【請求項1】
下記式(I)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩:
【化1】

式中、
R1は水素原子、又はC1−4アルキル基であり、
R2は水素原子、又はメチル基であり、
R3は“アミノ基若しくはジC1−4アルキルアミノ基で置換されたC1−4アルキル基”、又はピペリジル基であり、
R4は水素原子であり、又はR3とR4は隣接する窒素原子と共にピペリジノ基若しくはピペラジニル基を形成し、それらはC1−4アルキル基若しくはジメチルアミノ基で置換されていてもよい。
【請求項2】
下記群から選択される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩。
【化2】


【請求項3】
下記群から選択される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩。
【化3】

【請求項4】
請求項1乃至3記載の4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む医薬。
【請求項5】
請求項1乃至3記載の4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含むナトリウム依存性グルコース共輸送体1(SGLT1)活性阻害剤。
【請求項6】
請求項1乃至3記載の4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む食後高血糖改善薬。
【請求項7】
請求項1乃至3記載の4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む糖尿病の予防又は治療薬。
【請求項1】
下記式(I)で表される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩:
【化1】

式中、
R1は水素原子、又はC1−4アルキル基であり、
R2は水素原子、又はメチル基であり、
R3は“アミノ基若しくはジC1−4アルキルアミノ基で置換されたC1−4アルキル基”、又はピペリジル基であり、
R4は水素原子であり、又はR3とR4は隣接する窒素原子と共にピペリジノ基若しくはピペラジニル基を形成し、それらはC1−4アルキル基若しくはジメチルアミノ基で置換されていてもよい。
【請求項2】
下記群から選択される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩。
【化2】


【請求項3】
下記群から選択される4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩。
【化3】

【請求項4】
請求項1乃至3記載の4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む医薬。
【請求項5】
請求項1乃至3記載の4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含むナトリウム依存性グルコース共輸送体1(SGLT1)活性阻害剤。
【請求項6】
請求項1乃至3記載の4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む食後高血糖改善薬。
【請求項7】
請求項1乃至3記載の4−イソプロピルフェニル グルシトール化合物又はその製薬学的に許容される塩を有効成分として含む糖尿病の予防又は治療薬。
【公表番号】特表2012−518631(P2012−518631A)
【公表日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願番号】特願2011−550784(P2011−550784)
【出願日】平成22年2月23日(2010.2.23)
【国際出願番号】PCT/JP2010/053187
【国際公開番号】WO2010/095768
【国際公開日】平成22年8月26日(2010.8.26)
【出願人】(000002819)大正製薬株式会社 (437)
【Fターム(参考)】
【公表日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願日】平成22年2月23日(2010.2.23)
【国際出願番号】PCT/JP2010/053187
【国際公開番号】WO2010/095768
【国際公開日】平成22年8月26日(2010.8.26)
【出願人】(000002819)大正製薬株式会社 (437)
【Fターム(参考)】
[ Back to top ]

