SLC28A1/A2/A3遺伝子の多型検出用プローブおよびその用途
【課題】SLC28A1/A2/A3遺伝子のSLC28A1(G565A)、SLC28A2(C65T)およびSLC28A3(A338G)の多型を正確に判別することができる多型検出用プローブを提供する。
【解決手段】多型検出用プローブは、SLC28A1/A2/A3遺伝子の多型を検出するためのプローブであって、(P1)、(P2)および(P3)から選択される少なくとも1種の蛍光標識オリゴヌクレオチドからなる。例えば、(P1)は、特定の塩基配列において塩基番号292〜301を含む10〜43塩基長の塩基配列であり、塩基番号292に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチドである。
【解決手段】多型検出用プローブは、SLC28A1/A2/A3遺伝子の多型を検出するためのプローブであって、(P1)、(P2)および(P3)から選択される少なくとも1種の蛍光標識オリゴヌクレオチドからなる。例えば、(P1)は、特定の塩基配列において塩基番号292〜301を含む10〜43塩基長の塩基配列であり、塩基番号292に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチドである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸代謝、輸送に関連するSLC(solute carrier)28A遺伝子ファミリー(CNT)の多型を検出するためのプローブ、およびその用途に関する。
【背景技術】
【0002】
SLC28A遺伝子ファミリーは、核酸代謝、輸送に関連するトランスポーターであり、薬物動態に関与していることがわかっている(非特許文献1参照)。つまり、細胞膜に存在する膜タンパク質であるトランスポーターのSLC28A遺伝子ファミリーが、細胞への薬物吸収および分布、ならびに細胞からの排泄に関わっているということが解明されている。特に、非特許文献2および非特許文献3では、SLC28A1/A2/A3遺伝子についての性質が開示されている。
【0003】
SLC28A1/A2/A3遺伝子は、上皮細胞膜のNa+依存インフラックス・トランスポーターであり、3遺伝子とも核酸代謝、輸送に特有の性質を有している。詳細には、SLC28A1遺伝子は、ピリミジンヌクレオシドを選択的に核酸代謝、輸送する。SLC28A2遺伝子は、プリンヌクレオシドとウリジンとを選択的に核酸代謝、輸送する。SLC28A3遺伝子は、ピリミジンヌクレオシドとプリンヌクレオシド、更に多種の薬剤核種を核酸代謝、輸送する。これらのSLC28A1/A2/A3遺伝子は、多型を複数有している。例えば、SLC28A1遺伝子ではSLC28A1(G565A)、SLC28A2遺伝子ではSLC28A2(C65T)、SLC28A3遺伝子ではSLC28A3(A338G)を挙げることができる。また、特許文献1には、核酸プローブを用いる方法により、多型を検出する方法が記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2002−119291号公報
【非特許文献】
【0005】
【非特許文献1】Gerloff T.、2004 Jan.、Naunyn Schmiedebergs Arch Pharmacol、369(1)、69−77
【非特許文献2】Ryan P, et al.、2006 Sep.8、THE JOURNAL OF BIOLOGICAL CHEMISTRY、281(36)、26675−26682
【非特許文献3】Maria Rius, et al.、2010 Jul.、DRUG METABOLISM AND DISPOSITION、38(7)、1054−1063
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、特許文献1に記載のような、多型の有無を判断する際に用いるプローブの塩基配列は、例えば遺伝子多型の場所さえ解明すれば任意に製造可能であるわけではなく、当該多型の変異毎に適当な塩基配列を有するプローブを見出す必要がある。そこで、本発明では、薬物動態に関与する可能性が高い、SLC28A1(G565A)、SLC28A2(C65T)およびSLC28A3(A338G)の多型の有無を判断する際に用いる適当な塩基配列を有するプローブを見出すことを課題とする。
【課題を解決するための手段】
【0007】
本発明者らは、SLC28A1/A2/A3遺伝子における多型のSLC28A1(G565A)、SLC28A2(C65T)およびSLC28A3(A338G)を含む特定の領域に基づいてプローブを設計し、当該プローブを用いるTm解析を行うことにより当該変異部位における多型を検出できることを見出し、本発明を完成させるに至った。
【0008】
そこで、本発明の第1の観点に係る多型検出用プローブは、下記(P1)、(P2)および(P3)から選択される少なくとも1種の蛍光標識オリゴヌクレオチドであるSLC28A1/A2/A3遺伝子の多型を検出するための多型検出用プローブであることを特徴とする。
(P1)配列番号1に示す塩基配列において塩基番号292〜301を含む10〜43塩基長の塩基配列であり、塩基番号292に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P2)配列番号2に示す塩基配列において塩基番号301〜309を含む9〜52塩基長の塩基配列であり、塩基番号309に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P3)配列番号3に示す塩基配列において塩基番号290〜301を含む12〜51塩基長の塩基配列であり、塩基番号290に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【0009】
好ましくは、前記(P1)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号292に対応する塩基のシトシンを3’末端から数えて1〜3番目の位置に有し、
前記(P2)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号309に対応する塩基のシトシンを5’末端から数えて1〜3番目の位置に有し、
前記(P3)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号290に対応する塩基のシトシンを5’末端から数えて1〜3番目の位置に有する、
ことを特徴とする。
【0010】
より好ましくは、前記(P1)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号292に対応する塩基のシトシンを3’末端に有し、
前記(P2)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号309に対応する塩基のシトシンを5’末端に有し、
前記(P3)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号290に対応する塩基のシトシンを5’末端に有する、
ことを特徴とする。
【0011】
さらに好ましくは、前記蛍光標識オリゴヌクレオチドは、標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ前記標的塩基配列にハイブリダイズしたときに蛍光強度が減少するかまたは増加することを特徴とする。
【0012】
また、好ましくは、前記蛍光標識オリゴヌクレオチドは、標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ前記標的塩基配列にハイブリダイズしたときに蛍光強度が減少することを特徴とする。
【0013】
より好ましくは、前記(P1)の蛍光標識オリゴヌクレオチドは10〜28塩基長であり、
前記(P2)の蛍光標識オリゴヌクレオチドは9〜27塩基長であり、
前記(P3)の蛍光標識オリゴヌクレオチドは12〜31塩基長である、
ことを特徴とする。
【0014】
さらに好ましくは、前記(P1)の蛍光標識オリゴヌクレオチドは10〜18塩基長であり、
前記(P2)の蛍光標識オリゴヌクレオチドは9〜17塩基長であり、
前記(P3)の蛍光標識オリゴヌクレオチドは12〜21塩基長である、
ことを特徴とする。
【0015】
また、好ましくは、前記多型検出用プローブは、融解曲線分析用のプローブであることを特徴とする。
【0016】
本発明の第2の観点に係るSLC28A1/A2/A3遺伝子の多型検出方法は、第1の観点に係る多型検出用プローブを用いることを特徴とする。
【0017】
好ましくは、(i)第1の観点に係る多型検出用プローブおよび試料中の1本鎖核酸を接触させ、前記蛍光標識オリゴヌクレオチドおよび前記1本鎖核酸のハイブリッド形成体を得ることと、
(ii)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定することと、
(iii)前記蛍光シグナルの変動に基づいて、前記ハイブリッド形成体の解離温度であるTm値を評価することと、
(iv)前記Tm値に基づいて、SLC28A1/A2/A3遺伝子における、多型の存在を評価することと、
を含む。
【0018】
より好ましくは、さらに、前記(i)の前、または、前記(i)と同時に核酸を増幅することを含む。
【0019】
本発明の第3の観点に係る薬剤の評価方法は、(I)第2の観点に係るSLC28A1/A2/A3遺伝子の多型検出方法により、SLC28A1/A2/A3遺伝子における多型を検出することと、
(II)検出されたSLC28A1/A2/A3遺伝子の多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価することと、
を含む。
【0020】
本発明の第4の観点に係るSLC28A1/A2/A3遺伝子の多型検出用キットは、第1の観点に係る多型検出用プローブを含むことを特徴とする。
【0021】
好ましくは、前記(P1)の蛍光標識オリゴヌクレオチド、前記(P2)の蛍光標識オリゴヌクレオチドおよび前記(P3)の蛍光標識オリゴヌクレオチドから選択される少なくとも1種の前記蛍光標識オリゴヌクレオチドがハイブリダイズする塩基配列を含む領域を鋳型として増幅可能なプライマーをさらに含むことを特徴とする。
【発明の効果】
【0022】
本発明によれば、SLC28A1/A2/A3遺伝子多型を、高い感度で、簡便に検出することを可能にする多型検出用プローブ、これを用いた多型検出方法および薬効評価方法、ならびに多型検出用キットを提供することができる。
【図面の簡単な説明】
【0023】
【図1】(A)は核酸混合物の融解曲線の一例であり、(B)は微分融解曲線の一例である。
【図2】(A)〜(J)は、本発明の実施例1にかかる試料の微分融解曲線である。
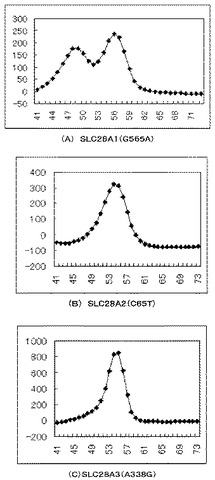
【図3】(A)〜(C)は、本発明の実施例2にかかる試料の微分融解曲線である。
【図4】(A)〜(C)は、本発明の実施例3にかかる試料の微分融解曲線である。
【図5】(A)〜(J)は、本発明の比較例1にかかる試料の微分融解曲線である。
【図6】(A)〜(C)は、本発明の比較例2にかかる試料の微分融解曲線である。
【図7】(A)〜(C)は、本発明の実施例4にかかる精製ヒトゲノムを含む試料の微分融解曲線である。
【図8】(A)〜(C)は、本発明の実施例4にかかる全血を含む試料の微分融解曲線である。
【発明を実施するための形態】
【0024】
本発明において、検出する目的の多型とは、基本的に、SLC28A1/A2/A3遺伝子における多型を意味する。当該多型は、それぞれ前述した例のSLC28A1(G565A)と、SLC28A2(C65T)と、SLC28A3(A338G)である。これらの詳細は、NCBI(National Center for Biotechnology Information)に開示されており、SLC28A1(G565A)はdbSNP No.rs2290272、SLC28A2(C65T)はNo.rs11854484、SLC28A3(A338G)はNo.rs10868138として登録されている。NCBIに登録されているこれらの多型の周辺塩基配列について、SLC28A1(G565A)の周辺塩基配列を配列番号1に、SLC28A2(C65T)の周辺塩基配列を配列番号2に、SLC28A3(A338G)の周辺塩基配列を配列番号3に示す。
【0025】
本発明において、検出対象となる試料中の試料核酸、多型検出用プローブまたはプライマーの個々の配列に関して、これら互いの相補的な関係に基づいて記述された事項は、特に断らない限り、それぞれの配列と、各配列に対して相補的な配列とについても適用される。各配列に対して相補的な当該配列について本発明の事項を適用する際には、当該相補的な配列が認識する配列について、当業者にとっての技術常識の範囲内で、対応する本明細書に記載された配列に相補的な配列として、明細書全体を読み替えるものとする。
【0026】
本発明において、「Tm値」とは、二本鎖核酸が隔離する温度(解離温度:Tm)であって、一般に、260nmにおける吸光度が、吸光度全上昇分の50%に達した時の温度と定義される。すなわち、二本鎖核酸、例えば、二本鎖DNAを含む溶液を加熱していくと、260nmにおける吸光度が上昇する。これは、二本鎖DNAにおける両鎖間の水素結合が加熱によってほどけ、一本鎖DNAに解離(DNAの融解)することが原因である。そして、全ての二本鎖DNAが解離して一本鎖DNAになると、その吸光度は加熱開始時の吸光度(二本鎖DNAのみの吸光度)の約1.5倍程度を示し、これによって融解が完了したと判断できる。Tm値は、この現象に基づき設定される。本発明におけるTm値は、特に断らない限り、50%の塩基が二本鎖を形成し、残る50%が一本鎖に融解する温度をいう。
【0027】
本発明において「工程」、「〜すること」または「〜こと」等の所作に係る語は、独立した工程だけでなく、他の工程と明確に区別できない場合であっても本工程の所期の作用が達成されれば、本用語に含まれる。また、本発明において「〜」を用いて示された数値範囲は、「〜」の前後に記載される数値をそれぞれ最小値および最大値として含む範囲を示す。また、本発明において、組成物中の各成分の量について言及する場合、組成物中に各成分に該当する物質が複数存在する場合には、特に断らない限り、組成物中に存在する当該複数の物質の合計量を意味する。また、本発明において「変異」とは、野生型の塩基配列の一部の塩基が置換、欠失、重複または挿入されることによって生じる新たな塩基配列を意味する。また、「多型」とは、変異によって生じる塩基配列の多型を意味する。
【0028】
本発明における「塩基番号」とは、配列番号1、配列番号2および配列番号3に示す塩基配列の、5’末端から3’末端方向に数えた当該塩基の番号、すなわち配列番号1、配列番号2および配列番号3のいずれの場合も、塩基番号1〜塩基番号601で示される。それぞれの配列番号において、塩基番号301が多型となっている。SLC28A1(G565A)の多型は、Cが野生型で、Tが変異型である。SLC28A2(C65T)の多型は、Cが野生型でTが変異型である。SLC28A3(A338G)の多型は、Tが野生型でCが変異型である。
【0029】
本発明における「標的塩基配列」とは、多型を検出するためにプローブがハイブリダイズする(1本鎖構造の)標的核酸塩基配列を意味する。なお、本発明における「含む」および「有する」は、「からなる」および「から構成される」との意も含むものとする。本発明における「相同性(相同または相同的)」とは、特定の塩基配列において、当該塩基配列に80%以上、より好ましくは90%以上、最も好ましくは95%以上の塩基配列が同一であることをいい、5塩基、4塩基、3塩基、2塩基、または1塩基のみ異なる場合も含む。
【0030】
以下、本発明について説明する。
【0031】
〈多型検出用プローブ〉
本発明の多型検出用プローブは、下記(P1)、(P2)および(P3)から選択される少なくとも1種の蛍光標識オリゴヌクレオチドであるSLC28A1/A2/A3遺伝子の多型を検出するためのプローブである。
(P1)配列番号1に示す塩基配列において塩基番号292〜301を含む10〜43塩基長の塩基配列であり、塩基番号292に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P2)配列番号2に示す塩基配列において塩基番号301〜309を含む9〜52塩基長の塩基配列であり、塩基番号309に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P3)配列番号3に示す塩基配列において塩基番号290〜301を含む12〜51塩基長の塩基配列であり、塩基番号290に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【0032】
本発明における(P1)〜(P3)の蛍光標識ヌクレオチドには、当該(P1)〜(P3)の蛍光標識ヌクレオチドの塩基配列に相同性が認められる蛍光標識ヌクレオチドも包含される。当該相同性が認められる蛍光標識ヌクレオチドは、(P1)〜(P3)の蛍光標識ヌクレオチドと同等程度の作用を示す。また、(P1)〜(P3)の蛍光標識ヌクレオチドと同等程度の作用を示すものであれば、(P1)〜(P3)の蛍光標識ヌクレオチドの相補鎖とストリンジェントな条件下でハイブリダイズする蛍光標識ヌクレオチドも、本発明における(P1)〜(P3)の蛍光標識ヌクレオチドに含有される。
【0033】
ハイブリダイゼーションは、公知の方法あるいはそれに準じる方法、例えば、モレキュラー・クローニング(Molecular Cloning)2nd(J. Sambrook et al.,Cold Spring Harbor Lab.Prees,1989)に記載の方法等に従って行うことができる。ストリンジェントな条件とは、例えば、ナトリウム濃度が約19mM〜約40mM、好ましくは約19mM〜約20mMで、温度が約50度〜約70度、好ましくは約60度〜約65度の条件を示す。特に、ナトリウム濃度が約19mMで温度が約65度の場合がもっとも好ましい。
【0034】
これらの蛍光標識オリゴヌクレオチドは、好ましくは標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ、標的塩基配列にハイブリダイズしたとき蛍光強度が減少するかまたは増加する。より好ましくは、標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ、標的塩基配列にハイブリダイズしたときに蛍光強度が減少する。
【0035】
蛍光消光現象(Quenching phenomenon)を利用したプローブとしては、一般的に、グアニン消光プローブと呼ばれており、いわゆるQ−Probe(登録商標)として知られている。中でもオリゴヌクレオチドの3’末端または5’末端がcとなるように設計し、その末端のcが、gに近づくと蛍光強度が弱くなるような蛍光色素で標識化されたオリゴヌクレオチドが好ましい。
【0036】
このような蛍光色素は、公知のものを使用することができるが、それに制限されない。例えば、フルオレセイン、リン光体、ローダミンまたはポリメチン色素誘導体等が挙げられる。市販の蛍光色素としては、例えば、BODIPY FL、Pacific Blue、FAM、Cy3およびCy5、または、TAMRA等が挙げられる。当該プローブの検出条件は、特に制限されず、使用する蛍光色素により適宜決定すればよい。例えば、Pacific Blueの場合は検出波長445〜480nmで、TAMRAの場合は検出波長585〜700nmで、BODIPY FLの場合は検出波長520〜555nmで検出可能である。このようなプローブを使用すれば、シグナルの変動により、ハイブリダイズと解離とを容易に確認することができる。
【0037】
また、本発明の多型検出用プローブは、例えば、3’末端にリン酸基が付加されてもよい。後述するように、標的塩基配列は、PCR法等の遺伝子増幅法によって調製することもできる。この際、本発明の多型検出用プローブを遺伝子増幅反応の反応液中に共存させることができる。このような場合に、多型検出用プローブの3’末端にリン酸基を付加させておけば、当該多型検出用プローブ自体が遺伝子増幅反応によって伸長することを充分に防止できる。また、3’末端に前述のような標識化物質を付加することによっても、同様の効果が得られる。以下に、(P1)、(P2)および(P3)それぞれの蛍光標識オリゴヌクレオチドについて詳細に述べる。
【0038】
まず、(P1)を再掲する。
(P1)配列番号1に示す塩基配列において塩基番号292〜301を含む10〜43塩基長の塩基配列であり、塩基番号292に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【0039】
ここで、(P1)の蛍光標識オリゴヌクレオチドの「塩基番号292に対応する塩基」とは、配列番号1に示す塩基配列において塩基番号292となる塩基「g(グアニン)」に対応する相補塩基「c(シトシン)」を意味する。すなわち、(P1)の蛍光標識オリゴヌクレオチドは、配列番号1に示す塩基配列に相同的な塩基配列でもよいが、当該塩基配列は、塩基番号292に対応する塩基がシトシンであるということが条件となっている。(P1)の蛍光標識オリゴヌクレオチドにおいて、蛍光色素で標識されるcの部位は、下記の具体的なバリエーションのように必ずしも3’末端である必要はないが、このcが3’末端から数えて1〜3番目の位置に有することが好ましく、このcが3’末端に存在することがより好ましい。当該(P1)の蛍光標識オリゴヌクレオチドの長さは、好ましくは10〜28塩基長、より好ましくは10〜18塩基長である。
【0040】
例えば、具体的な(P1)のバリエーションとして、以下のような蛍光標識オリゴヌクレオチドが挙げられる。
WT(野生型)に相補的な塩基配列を有するプローブ、18mer、配列番号4
5’−gcgtgttcGtcCctctcc−(蛍光標識)−3’
WT(野生型)に相補的な塩基配列を有するプローブ、10mer、配列番号5
5’−GtcCctctcc−(蛍光標識)−3’
WT(野生型)に相補的な塩基配列を有するプローブ、43mer、配列番号6
5’−caactggtgtccttcgcaggaatctgcgtgttcGtcCctctcc−(蛍光標識)−3’
これらのプローブの塩基配列の大文字の「G」が野生型の塩基番号301のCに相補的となっている。これらの「G」を「A」とすると、変異型の塩基番号301のTに相補的となる。これらのプローブの塩基配列の大文字の「C」は目的外多型(NCBIのdbSNP No.rs45523532)の影響を回避するためである。
【0041】
次に、(P2)を再掲する。
(P2)配列番号2に示す塩基配列において塩基番号301〜309を含む9〜52塩基長の塩基配列であり、塩基番号309に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【0042】
ここで、(P2)の蛍光標識オリゴヌクレオチドの「塩基番号309に対応する塩基」とは、配列番号2に示す塩基配列において塩基番号309となる塩基「g(グアニン)」に対応する相補塩基「c(シトシン)」を意味する。すなわち、(P2)の蛍光標識オリゴヌクレオチドは、配列番号2に示す塩基配列に相同的な塩基配列でもよいが、当該塩基配列は、塩基番号309に対応する塩基がシトシンであるということが条件となっている。(P2)の蛍光標識オリゴヌクレオチドにおいて、蛍光色素で標識されるcの部位は、下記の具体的なバリエーションのように必ずしも5’末端である必要はないが、このcが5’末端から数えて1〜3番目の位置に有することが好ましく、このcが5’末端に存在することがより好ましい。当該(P2)の蛍光標識オリゴヌクレオチドの長さは、好ましくは9〜27塩基長、より好ましくは9〜17塩基長である。
【0043】
例えば、具体的な(P2)のバリエーションとして、以下のような蛍光標識オリゴヌクレオチドが挙げられる。
mt(変異型)に相補的な塩基配列を有するプローブ、17mer、配列番号7
5’−(蛍光標識)−ccagccccAggttcact−P−3’
mt(変異型)に相補的な塩基配列を有するプローブ、9mer
5’−(蛍光標識)−ccagccccA−3’
mt(変異型)に相補的な塩基配列を有するプローブ、52mer、配列番号8
5’−(蛍光標識)−ccagccccAggttcactgtgccagtctccactgtggacagagcaatggactg−3’
これらのプローブの塩基配列の大文字の「A」が変異型の塩基番号301のTに相補的となっている。これらの「A」を「G」とすると、野生型の塩基番号301のCに相補的となる。
【0044】
最後に、(P3)を再掲する。
(P3)配列番号3に示す塩基配列において塩基番号290〜301を含む12〜51塩基長の塩基配列であり、塩基番号290に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【0045】
ここで、(P3)の蛍光標識オリゴヌクレオチドの「塩基番号290に対応する塩基」とは、配列番号3に示す塩基配列において塩基番号290となる塩基「c(シトシン)」を意味する。すなわち、(P3)の蛍光標識オリゴヌクレオチドは、配列番号3に示す塩基配列以外にも当該塩基配列に相同的な塩基配列でもよいが、当該塩基配列は、塩基番号290に対応する塩基がシトシンであるということが条件となっている。(P3)の蛍光標識オリゴヌクレオチドにおいて、蛍光色素で標識されるcの部位は、下記の具体的なバリエーションのように必ずしも5’末端である必要はないが、このcが5’末端から数えて1〜3番目の位置に有することが好ましく、このcが5’末端に存在することがより好ましい。当該(P3)の蛍光標識オリゴヌクレオチドの長さは、好ましくは12〜31塩基長、より好ましくは12〜21塩基長である。
【0046】
例えば、具体的な(P3)のバリエーションとして、以下のような蛍光標識オリゴヌクレオチドが挙げられる。
mt(変異型)に相同的な塩基配列を有するプローブ、21mer、配列番号9
5’−(蛍光標識)−ccataaccagaCaacctgtcc−P−3’
mt(変異型)に相同的な塩基配列を有するプローブ、12mer、配列番号10
5’−(蛍光標識)−ccataaccagaC−3’
mt(変異型)に相同的な塩基配列を有するプローブ、51mer、配列番号11
5’−(蛍光標識)−ccataaccagaCaacctgtccaggaagcaaaaacagacactgaacatcact−3’
これらのプローブの塩基配列の大文字の「C」が変異型の塩基番号301のCに相同的となっている。これらの「C」を「T」とすると、野生型の塩基番号301のTに相同的となる。
【0047】
このような(P1)、(P2)または(P3)の蛍光標識オリゴヌクレオチドのような本発明に係る多型検出用プローブは、SLC28A1/A2/A3遺伝子の野生型または変異型の多型検出に利用することができる。検出方法は、何ら限定されず、標的塩基配列とこれらの多型検出用プローブとのハイブリダイズを利用する方法であればよい。例えば、(P1)、(P2)および(P3)から選択される少なくとも1種の蛍光標識オリゴヌクレオチドからなる野生型または変異型の多型検出用プローブを用い、SLC28A1/A2/A3遺伝子ファミリーとして、SLC28A1(G565A)、SLC28A2(C65T)およびSLC28A3(A338G)から選択される1種以上の多型を同時に検出することも可能である。また、(P1)、(P2)または(P3)のいずれか1種の蛍光標識オリゴヌクレオチドからなる野生型または変異型の多型検出用プローブを用い、SLC28A1(G565A)、SLC28A2(C65T)またはSLC28A3(A338G)のいずれか1種の多型を検出することも可能である。さらに好ましくは、本発明の多型検出用プローブは、融解曲線分析用のプローブであることを特徴とする。このような融解曲線分析による方法も含め、SLC28A1/A2/A3遺伝子の多型検出方法の詳細について以下に述べる。
【0048】
〈SLC28A1/A2/A3遺伝子の多型検出方法〉
本発明のSLC28A1/A2/A3遺伝子の多型検出方法は、前述した多型検出用プローブを使用することを特徴とする。すなわち、本発明の多型検出方法は、前述した本発明の多型検出用プローブを使用することが特徴であって、その他の構成または条件等は、以下の記載に制限されない。
【0049】
本発明の多型検出方法は、例えば、下記工程(i)、工程(ii)、工程(iii)および工程(iv)を含む。
(i)前述の多型検出用プローブおよび試料中の1本鎖核酸を接触させ、前記蛍光標識オリゴヌクレオチドおよび前記1本鎖核酸のハイブリッド形成体を得る工程。
(ii)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定する工程。
(iii)前記蛍光シグナルの変動に基づいて、前記ハイブリッド形成体の解離温度であるTm値を評価する工程。
(iv)前記Tm値に基づいて、SLC28A1/A2/A3遺伝子における、多型の存在を評価する工程。
【0050】
なお、上記工程(iii)において、Tm値を評価するとは、Tm値での温度を評価する(決定する)ことだけでもよいし、Tm解析でのピークの高さ、すなわち単位時間当たりの蛍光強度の変化量のピークを評価する(決定する)ことを含んでも構わない。
【0051】
より具体的に説明すると、例えば、野生型プローブのみを使用してこのような多型検出法を行う場合、予め野生型1本鎖核酸を用いた場合によるTm値を測定しておく。野生型1本鎖核酸は、例えば、全血等からゲノムDNAを市販のゲノムDNA単離キットを用いて単離して使用する。その後、当該野生型のTm値と、試料のTm値とを比較することによって、試料のSLC28A1/A2/A3遺伝子が多型を有しているか否かを評価することができる。すなわち、Tm値が野生型の場合と全く同じ値となった場合、試料は野生型プローブとパーフェクトマッチとなっていることが判断される。しかし、Tm値が野生型よりも小さい場合には、試料の1本鎖核酸と野生型プローブとの解離温度が低いことを意味しているため、この場合には、試料の1本鎖構造の核酸が多型を有しているということがわかる。
【0052】
また、野生型プローブでなくとも、変異型プローブであってもこのような方法を用い、パーフェクトマッチかミスマッチかを評価し、試料の変異を正確に検出することができる。また、このような種々の多型検出用プローブは、少なくとも1種類を使用すればよく、2種類以上を併用しても構わない。2種類以上の多型検出用プローブを併用し、単位時間当たりの蛍光強度の変化量(蛍光シグナル)のピークを評価することによって、それぞれの多型検出用プローブにパーフェクトマッチする標的塩基配列の存在比を一度に評価することができる。反応系における本発明の多型検出用プローブの添加濃度は、特に制限されないが、例えば、1種類の多型検出用プローブにつき、10〜1000nmol/Lの範囲となるように添加することが好ましく、より好ましくは20〜500nmol/Lである。
【0053】
核酸の増幅方法としては、ポリメラーゼを用いる方法が好ましく、その例としては、PCR法、ICAN法、LAMP法またはNASBA法等が挙げられる。ポリメラーゼを用いる方法により増幅する場合は、本発明プローブの存在下で増幅を行うことが好ましい。用いるプローブおよびポリメラーゼに応じて、増幅の反応条件等を調整することは当業者であれば容易である。これにより、核酸の増幅後にプローブのTm値を解析するだけで多型を評価できるので、反応終了後増幅産物を取り扱う必要がない。よって、増幅産物による汚染の心配がない。また、増幅に必要な機器と同じ機器で検出することが可能なので、容器を移動する必要がなく、自動化も容易である。
【0054】
鋳型とする核酸からの増幅産物の生成には、例えば、当該検出目的の多型を含む塩基配列を増幅するためのプライマーを使用することが好ましい。当該プライマーの増幅領域は、特に制限されず検出目的の多型に応じて適宜設定できる。例えば、前述の(P1)、(P2)または(P3)の蛍光標識オリゴヌクレオチドがハイブリダイズする塩基配列を含む領域が好ましい。また、当該プライマーの塩基配列は、特に制限されず、例えば、検出目的の多型の塩基配列を増幅できればよく、当該検出塩基配列およびその周辺塩基配列等に応じて従来公知の方法により適宜設定できる。さらに、当該プライマーの長さは、特に制限されず、一般的な長さに設定可能であり、例えば10mer〜50merが挙げられる。
【0055】
具体的には、PCR法に適用するプライマーは、本発明の多型検出用プローブがハイブリダイズする領域を含む塩基配列を増幅できるものであれば特に制限されず、配列番号1、配列番号2および配列番号3で示される塩基配列から、当業者であれば適宜設計することができる。プライマーの長さおよびTm値は、通常には、12mer〜40merおよび40度〜70度、好ましくは16mer〜30merおよび55度〜60度である。また、プライマーセットの各プライマーの長さは同一でなくてもよいが、両プライマーのTm値は、ほぼ同一(または、Tm値の両プライマーでの差が5度以内)であることが好ましい。
【0056】
核酸増幅を行う際の鋳型となる核酸を含む試料としては、核酸を含んでいればよく、特に制限されない。例えば、血液、口腔粘膜懸濁液、爪や毛髪等の体細胞、生殖細胞、乳、腹水液、パラフィン包埋組織、胃液、胃洗浄液、腹膜液、羊水、細胞培養などの任意の生物学的起源に由来するまたは由来しうるものを挙げられる。鋳型となる核酸は、該起源から得られたままで直接的に、あるいは該サンプルの特性を改変するために前処理した後で使用することができる。例えば、全血を試料とする場合、全血からのゲノムDNAの単離は、従来公知の方法によって行うことができる。例えば、市販のゲノムDNA単離キット(商品名GFX Genomic Blood DNA Purification kit;GEヘルスケアバイオサイエンス社製)等が使用できる。
【0057】
またPCR法に用いるDNAポリメラーゼとしては、通常用いられるDNAポリメラーゼを特に制限なく用いることができる。例えば、GeneTaq(ニッポンジーン社製)、PrimeSTAR Max DNA Polymerase(タカラバイオ社製)、Taq ポリメラーゼ等を挙げることができる。ポリメラーゼの使用量としては、通常用いられている濃度であれば特に制限はない。例えば、Taqポリメラーゼを用いる場合、好ましくは、反応溶液量50μlに対して0.01U〜100Uの濃度とすることができる。これにより、遺伝子多型の検出感度が高まるなどの利点がある。
【0058】
またPCR法は、通常用いられる条件を適宜選択することで行うことができる。なお、増幅の際、リアルタイムPCRによって増幅をモニタリングし、試料に含まれるDNA(検出対象配列)のコピー数を調べることもできる。すなわち、PCRによるDNA(検出対象配列)の増幅に従ってハイブリッドを形成するプローブの割合が増えるので蛍光強度が変動する。これをモニタリングすることで、試料に含まれる検出対象配列(正常DNAまたは変異型DNA)のコピーを検出することができる。
【0059】
本発明の多形検出方法においては、前記蛍光標識オリゴヌクレオチドと、試料中の一本鎖核酸とを接触させて、両者をハイブリダイズさせる。試料中の一本鎖核酸は、例えば、上記のようにして得られたPCR増幅産物を解離することで調製することができる。
【0060】
前記PCR増幅産物の解離(解離工程)における加熱温度は、前記増幅産物が解離できる温度であれば特に制限されない。例えば、85℃〜95℃である。加熱時間も特に制限されない。通常、1秒〜10分であり、好ましくは1秒〜5分である。
【0061】
また、解離した一本鎖DNAと前記蛍光標識オリゴヌクレオチドとのハイブリダイズは、例えば、前記解離工程の後、前記解離工程における加熱温度を降下させることによって行うことができる。温度条件としては、例えば、40℃〜50℃である。
【0062】
ハイブリダイズ工程の反応液における各組成の体積や濃度は、特に制限されない。具体例としては、前記反応液におけるDNAの濃度は、例えば、0.01μM〜1μMであり、好ましくは0.1μM〜0.5μM、前記蛍光標識オリゴヌクレオチドの濃度は、例えば、前記DNAに対する添加割合を満たす範囲が好ましく、例えば、0.001μM〜10μMであり、好ましくは0.001μM〜1μMである。
【0063】
そして、得られた前記一本鎖DNAと前記蛍光標識オリゴヌクレオチドとのハイブリッド形成体を徐々に加熱し、温度上昇に伴う蛍光シグナルの変動を測定する。例えば、Q−probe(登録商標)を使用した場合、一本鎖DNAとハイブリダイズした状態では、解離した状態に比べて蛍光強度が減少(または消光)する。したがって、例えば、蛍光が減少(または消光)しているハイブリッド形成体を徐々に加熱し、温度上昇に伴う蛍光強度の増加を測定すればよい。
【0064】
蛍光強度の変動を測定する際の温度範囲は、特に制限されないが、例えば、開始温度が室温〜85℃であり、好ましくは25℃〜70℃であり、終了温度は、例えば、40℃〜105℃である。また、温度の上昇速度は、特に制限されないが、例えば、0.1℃/秒〜20℃/秒であり、好ましくは0.3℃/秒〜5℃/秒である。
【0065】
次に、前記シグナルの変動を解析してTm値として決定する。具体的には、得られた蛍光強度から各温度における微分値(−d蛍光強度/dt)を算出し、最も低い値を示す温度をTm値として決定できる。また、単位時間当たりの蛍光強度増加量(蛍光強度増加量/t)が最も高い点をTm値として決定することもできる。なお、標識化プローブとして、消光プローブではなく、ハイブリッド形成によりシグナル強度が増加するプローブを使用した場合には、反対に、蛍光強度の減少量を測定すればよい。
【0066】
また、本発明においては、前述のように、ハイブリッド形成体を加熱して、温度上昇に伴う蛍光シグナル変動(好ましくは蛍光強度の増加)を測定するが、この方法に代えて、例えば、ハイブリッド形成時におけるシグナル変動の測定を行ってもよい。すなわち、前記プローブを添加した試料の温度を降下させてハイブリッド形成体を形成する際の前記温度降下に伴う蛍光シグナル変動を測定してもよい。
【0067】
具体例として、相補配列にハイブリダイズしていないときの蛍光強度に比べて、相補配列にハイブリダイズしているときの蛍光強度が減少(消光)する蛍光標識オリゴヌクレオチドプローブ(例えば、Q−Probe(登録商標))を使用した場合、前記プローブを試料に添加した際には、前記プローブは解離状態にあるため蛍光強度が大きいが、温度の降下によりハイブリッド形成体を形成すると、前記蛍光が減少(または消光)する。したがって、例えば、前記加熱した試料の温度を徐々に降下して、温度下降に伴う蛍光強度の減少を測定すればよい。他方、ハイブリッド形成によりシグナルが増加する標識化プローブを使用した場合、前記プローブを試料に添加した際には、前記プローブは解離状態にあるため蛍光強度が小さい(または消光)が、温度の降下によりハイブリッドを形成すると、蛍光強度が増加するようになる。したがって、例えば、前記試料の温度を徐々に降下して、温度下降に伴う蛍光強度の増加を測定すればよい。
【0068】
〈薬剤の評価方法〉
本発明の薬剤の評価方法は、前述の多型検出方法を利用することにより、SLC28A1/A2/A3遺伝子に関連する薬剤の耐性または薬効を評価することを特徴とする。すなわち、本発明の薬剤の評価方法は、前述のSLC28A1/A2/A3遺伝子の多型検出方法を用いて評価することに特徴があり、その他の構成または条件等は、以下の記載に制限されない。
【0069】
本発明の薬剤の評価方法は、例えば、下記工程(I)および工程(II)を含む。
(I)前述のSLC28A1/A2/A3遺伝子の多型検出方法により、SLC28A1/A2/A3遺伝子における多型を検出する工程。
(II)検出されたSLC28A1/A2/A3遺伝子の多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価する工程。
【0070】
(I)の検出工程は、前述の多型検出方法と同様である。(II)の、検出された多型の有無に基づく薬剤に対する耐性または薬剤の薬効の評価とは、例えば、細胞への薬物吸収および分布、細胞からの排泄等における、変異型および野生型に基づく関連性、評価を行うことも含まれる。このような薬剤の評価方法は、薬剤の投与量の増減、または他の治療薬への変更等の当該SLC28A1(G565A)、SLC28A2(C65T)またはSLC28A3(A338G)の多型が原因となる疾患の発見、さらにはその治療方針を決定するのに有用である。
【0071】
〈SLC28A1/A2/A3遺伝子の多型検出用キット〉
本発明のSLC28A1/A2/A3遺伝子の多型検出用キットは、前述の多型検出用プローブを含むことを特徴とする。すなわち、本発明のSLC28A1/A2/A3遺伝子の多型検出用キットは、前述の多型検出用プローブを含むことに特徴があって、その他の構成または条件等は、以下の記載に制限されない。なお、前述の多型検出用プローブの(P1)、(P2)または(P3)の蛍光標識オリゴヌクレオチドがハイブリダイズする塩基配列を含む領域を鋳型として増幅可能なプライマー(プライマーセット)をさらに含むとより好ましい。
【0072】
本発明のSLC28A1/A2/A3遺伝子の多型検出用キットの一例について述べる。例えば、本発明のSLC28A1/A2/A3遺伝子の多型検出用キットは、SLC28A1/A2/A3遺伝子のSLC28A1(G565A)、SLC28A2(C65T)および/またはSLC28A3(A338G)の多型の検出に使用する試薬キットである。試薬キットにおいて、前述の多型検出用プローブは、1種類でもよいし2種類以上であっても構わない。後者の場合、2種類以上の多型検出用プローブは、混合された状態で含まれてもよいし、別個の試薬として含まれていてもよい。また、2種類以上の本発明の多型検出用プローブが混合された状態で、本発明のSLC28A1/A2/A3遺伝子の多型検出用キットに含まれる場合、または、別個の試薬として含まれているが、例えば、使用時に同じ反応系で各多型検出用プローブと各標的塩基配列とのTm解離分析を行う場合、各多型検出用プローブは、異なる蛍光色素で標識化されていることが好ましい。このように蛍光色素の種類を変えることで、同じ反応系であっても、それぞれの多型検出用プローブについての検出が容易に可能になる。前記蛍光色素としては、例えば、検出波長が異なる物質であることが好ましい。
【0073】
前述したように、SLC28A1/A2/A3遺伝子(SLC28A遺伝子ファミリー)は、薬物動態に関与し、細胞への薬物吸収および分布、細胞からの排泄に関わっていることが確認されている。そこで、本発明の多型検出用プローブ、SLC28A1/A2/A3遺伝子の多型検出方法およびSLC28A1/A2/A3遺伝子の多型検出用キット等によれば、それら薬物動態等に関与する可能性が示唆される当該多型を正確に検出することができるため、今後の薬物動態、細胞への薬物吸収および薬物分布等に関するさらなる研究に繋がる可能性が高い。
【0074】
次に、本発明の実施例について説明する。ただし、本発明は下記の実施例により制限されない。
【実施例】
【0075】
SLC28A1/A2/A3遺伝子のSLC28A1(G565A)、SLC28A2(C65T)およびSLC28A3(A338G)の多型を、本発明の多型検出用プローブを使用し評価した実施例、ならびにこれらの多型を検出できなかった比較例について、以下に述べる。
【0076】
(実施例1)
実施例1では、本発明のSLC28A1遺伝子における多型検出用プローブであるSLC28A1(G565A)probe(前述した配列番号4の蛍光標識(BODIPY FL)オリゴヌクレオチドからなるもの)を利用し、SLC28A1(G565A)の多型について、全自動SNPs検査装置を用いTm解析を行った。装置に添加するプローブ等の溶液、試薬の処方は下記の表の通りである。なお、表1に示すGene Taq Universal bufferはニッポンジーン社製である。
【表1】

【0077】
表1に示す試料の鋳型の人工オリゴ塩基配列(ID−1〜ID−10)は、以下の通りである。いずれの人工オリゴ塩基配列も、3’末端に近い大文字のCまたはTが目的多型であり、5’末端に近い大文字のCまたはAが目的外多型である。
ID−1、22mer、配列番号12
5’−gaggagagCgaCgaacacgcag−3’
ID−2、22mer、配列番号13
5’−gaggagagAgaCgaacacgcag−3’
ID−3、22mer、配列番号14
5’−gaggagagCgaTgaacacgcag−3’
ID−4、22mer、配列番号15
5’−gaggagagAgaTgaacacgcag−3’
ID−5、配列番号12と配列番号13の人工オリゴ塩基配列を1:1で混合
ID−6、配列番号12と配列番号14の人工オリゴ塩基配列を1:1で混合
ID−7、配列番号12と配列番号15の人工オリゴ塩基配列を1:1で混合
ID−8、配列番号13と配列番号14の人工オリゴ塩基配列を1:1で混合
ID−9、配列番号13と配列番号15の人工オリゴ塩基配列を1:1で混合
ID−10、配列番号14と配列番号15の人工オリゴ塩基配列を1:1で混合
【0078】
Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。なお、図1の(A)は核酸混合物の融解曲線の一例であり、(B)は微分融解曲線の一例である。図2の(A)〜(J)は、本発明の実施例1にかかる試料の微分融解曲線である。
【0079】
図2の(A)〜(J)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。図2の(A)〜(J)に示すように、目的外多型の有無に関わらず、目的多型の有無を検出できた。遺伝子配列がC/CのTm値は60(61)度で、T/TのTm値は53(54)度であり、CとTの区別が付くことが確認できた。また、C/T(ヘテロ型)の遺伝子配列を検出した場合には、検出ピークは60(61)度と53(54)度の2箇所に得られ、遺伝子配列の区別ができることも確認できた。
【0080】
(実施例2)
実施例2では、本発明のSLC28A2遺伝子における多型検出用プローブであるSLC28A2(C65T)probe(前述した配列番号5の蛍光標識(TAMRA)オリゴヌクレオチドからなるもの)を利用し、SLC28A2(C65T)の多型について、全自動SNPs検査装置を用いTm解析を行った。装置に添加するプローブ等の溶液、試薬の処方は下記の表の通りである。なお、表2に示すGene Taq Universal bufferはニッポンジーン社製である。
【表2】

【0081】
表2に示す試料の鋳型の人工オリゴ塩基配列(ID−11〜ID−13)は、以下の通りである。いずれの人工オリゴ塩基配列も、大文字のCまたはTが目的多型である。
ID−11、26mer、配列番号16
5’−gcacagtgaaccCggggctggagctc−3’
ID−12、26mer、配列番号17
5’−gcacagtgaaccTggggctggagctc−3’
ID−13、配列番号16と配列番号17の人工オリゴ塩基配列を1:1で混合
【0082】
Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。図3の(A)〜(C)は、本発明の実施例2にかかる試料の微分融解曲線である。
【0083】
図3の(A)〜(C)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。図3の(A)〜(C)に示すように、遺伝子配列がC/CのTm値は60度で、T/TのTm値は68度であり、CとTの区別が付くことが確認できた。また、C/T(ヘテロ型)の遺伝子配列を検出した場合には、検出ピークは60度と68度の2箇所に得られ、遺伝子配列の区別ができることも確認できた。
【0084】
(実施例3)
実施例3では、本発明のSLC28A3遺伝子における多型検出用プローブであるSLC28A3(A338G)probe(前述した配列番号6の蛍光標識(Pacific Blue)オリゴヌクレオチドからなるもの)を利用し、SLC28A3(A338G)の多型について、全自動SNPs検査装置を用いTm解析を行った。装置に添加するプローブ等の溶液、試薬の処方は下記の表の通りである。なお、表3に示すGene Taq Universal bufferはニッポンジーン社製である。
【表3】

【0085】
表3に示す試料の鋳型の人工オリゴ塩基配列(ID−14〜ID−16)は、以下の通りである。いずれの人工オリゴ塩基配列も、大文字のGまたはAが目的多型である。
ID−14、28mer、配列番号18
5’−cctggacaggttGtctggttatggtgat−3’
ID−15、28mer、配列番号19
5’−cctggacaggttAtctggttatggtgat−3’
ID−16、配列番号18と配列番号19の人工オリゴ塩基配列を1:1で混合
【0086】
Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。図4の(A)〜(C)は、本発明の実施例3にかかる試料の微分融解曲線である。
【0087】
図4の(A)〜(C)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。図4の(A)〜(C)に示すように、遺伝子配列がC/CのTm値は67度で、T/TのTm値は58度であり、CとTの区別が付くことが確認できた。また、C/T(ヘテロ型)の遺伝子配列を検出した場合には、検出ピークは58度と67度の2箇所に得られ、遺伝子配列の区別ができることも確認できた。
【0088】
(比較例1)
比較例1では、前述した実施例1と比較するために、WT(野生型)に相補的ではあるが、配列番号1の塩基番号292に対応するcに蛍光標識されていない下記のプローブを利用し、SLC28A1(G565A)の多型について、全自動SNPs検査装置を用いTm解析を行った。なお、プローブの塩基配列の大文字のGは目的多型であり、プローブの塩基配列の大文字のTは目的外多型の影響を回避するためである。
SLC28A1(G565A)probe2、17mer、配列番号20
5’−ctgcgtgttcGtcTctc−(TAMRA)−3’
【0089】
装置に添加するプローブ等の溶液、試薬の処方は下記の表の通りである。なお、表4に示すGene Taq Universal bufferはニッポンジーン社製である。
【表4】

【0090】
表4に示す試料の鋳型の人工オリゴ塩基配列(ID−17〜ID−26)は、以下の通り実施例1と同様である。
ID−17、配列番号12
ID−18、配列番号13
ID−19、配列番号14
ID−20、配列番号15
ID−21、配列番号12と配列番号13の人工オリゴ塩基配列を1:1で混合
ID−22、配列番号12と配列番号14の人工オリゴ塩基配列を1:1で混合
ID−23、配列番号12と配列番号15の人工オリゴ塩基配列を1:1で混合
ID−24、配列番号13と配列番号14の人工オリゴ塩基配列を1:1で混合
ID−25、配列番号13と配列番号15の人工オリゴ塩基配列を1:1で混合
ID−26、配列番号14と配列番号15の人工オリゴ塩基配列を1:1で混合
【0091】
Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。図5の(A)〜(J)は、本発明の比較例1にかかる試料の微分融解曲線である。
【0092】
図5の(A)〜(J)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。図5の(A)〜(J)に示すように、目的外多型の有無の影響を受け、目的多型の有無の検出が困難となっている。詳細に言うと、目的多型がC/Cの際には、Tm値が57度または65度の一つのピークの場合、あるいは56度および64度の二つのピークの場合がある。目的多型がT/Tの際には、Tm値は48度または57度のピークとなる。目的多型がC/T(ヘテロ型)の際には、Tm値は、57度の一つのピーク、48度および56度の二つのピーク、または57度および64度の二つのピークのいずれかとなっている。このような結果から、配列番号20のSLC28A1(G565A)probe2を使用するのは困難であると判断した。
【0093】
(比較例2)
比較例2では、前述した実施例3と比較するために、WT(野生型)に相補的であり、配列番号3の塩基番号290に対応するcに蛍光標識されていない下記のプローブを利用し、SLC28A3(A338G)の多型について、全自動SNPs検査装置を用いTm解析を行った。プローブの塩基配列の大文字のAは目的多型である。
SLC28A3(A338G)probe2、17mer、配列番号21
5’−(TAMRA)−cctggacaggttAtctg−P−3’
【0094】
装置に添加するプローブ等の溶液、試薬の処方は下記の表の通りである。なお、表5に示すGene Taq Universal bufferはニッポンジーン社製である。
【表5】

【0095】
表5に示す試料の鋳型の人工オリゴ塩基配列(ID−27〜ID−29)は、以下の通りである。いずれの人工オリゴ塩基配列も、大文字のTまたはCが目的多型である。
ID−27、24mer、配列番号22
5’−taaccagaTaacctgtccaggaag−3’
ID−28、24mer、配列番号23
5’−taaccagaCaacctgtccaggaag−3’
ID−29、配列番号22と配列番号23の人工オリゴ塩基配列を1:1で混合
【0096】
Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。図6の(A)〜(C)は、本発明の比較例2にかかる試料の微分融解曲線である。
【0097】
図6の(A)〜(C)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。しかし、図6の(A)〜(C)のいずれの図においてもピーク値が検出できないため、配列番号21のSLC28A3(A338G)probe2を使用するのは困難であると判断した。
【0098】
(実施例4)
実施例4では、前述した本発明のSLC28A1/A2/A3遺伝子における多型検出用プローブであるSLC28A1(G565A)probe、SLC28A2(C65T)probeおよびSLC28A3(A338G)probeを利用し、それぞれの多型について、全自動SNPs検査装置(商品名i−densy(登録商標)、アークレイ社製)を用い、PCRおよびTm解析を行った。鋳型として、精製したヒトゲノムを使用する場合と、同一人の全血を使用する場合と、二通り実験を行った。
【0099】
まず、鋳型として精製したヒトゲノム(全血から一般的な方法を用いて精製したヒトゲノム)を使用した場合について述べる。PCRおよびTm解析で使用した試料等は下記の表の通りである。
【表6】

【0100】
表6に示すそれぞれのプライマーの塩基配列は以下の通りである。
SLC28A1−F、23mer、配列番号24
5’−ctgcgcaatgatgctttgagcag−3’
SLC28A1−R、23mer、配列番号25
5’−aactggtgtccttcgcaggaatc−3’
SLC28A2−F、25mer、配列番号26
5’−gcaagtggaagacagtccattgctc−3’
SLC28A2−R、30mer、配列番号27
5’−ctgcagagagaaactaaactggtgattacc−3’
SLC28A3−F、26mer、配列番号28
5’−agaggaagggctctgtgaaagttcag−3’
SLC28A3−R、27mer、配列番号29
5’−ccagtggttagtgatgttcagtgtctg−3’
【0101】
PCRは95度で60秒間処理した後、95度で1秒間および60度で30秒間を1サイクルとして、50サイクル繰り返した。Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。
【0102】
図7の(A)〜(C)は、本発明の実施例4にかかる精製ヒトゲノムを含む試料の微分融解曲線である。図7の(A)〜(C)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。
【0103】
図7の(A)に示すように、49度と56度とにピークが検出されているため、SLC28A1(G565A)は、ヘテロ型(G/A)の多型であることがわかった。図7の(B)に示すように、54度にピークが検出されているため、SLC28A2(C65T)は、野生型(C/C)の多型であることがわかった。図7の(C)に示すように、55度にピークが検出されているため、SLC28A3(A338G)は、野生型(A/A)の多型であることがわかった。
【0104】
次に、鋳型として全血を使用した場合について述べる。使用する全血の前処理として、全血10μlを下記の表7に示す「希釈液1」70μlに加え、よく混合した後、この混合液10μlを下記の表8に示す「希釈液2」70μlに加えた。その後、この混合液17μlを95度で10分間加熱すると、4μlの前処理済全血が得られる。これを1回の実験において鋳型として使用した。
【表7】

【表8】

【0105】
PCRおよびTm解析で使用した試料等は下記の表の通りである。表9に示すプライマーおよびプローブの塩基配列は、前述と同様である。
【表9】

【0106】
条件についても同様に、PCRは95度で60秒間処理した後、95度で1秒間および60度で30秒間を1サイクルとして、50サイクル繰り返した。Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。
【0107】
図8の(A)〜(C)は、本発明の実施例4にかかる全血を含む試料の微分融解曲線である。図8の(A)〜(C)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。
【0108】
図8の(A)に示すように、48度と55度とにピークが検出されているため、SLC28A1(G565A)はヘテロ型(G/A)の多型で精製ヒトゲノムを検体とした場合と同様であることがわかった。図8の(B)に示すように、54度にピークが検出されているため、SLC28A2(C65T)は野生型(C/C)の多型で精製ヒトゲノムを検体とした場合と同様であることがわかった。図8の(C)に示すように、54度にピークが検出されているため、SLC28A3(A338G)は、野生型(A/A)の多型で精製ヒトゲノムを検体とした場合と同様であることがわかった。
【0109】
以上のことから、精製ゲノムまたは血液検体を用い、PCR増幅してTm解析することによって、容易にSLC28A1/A2/A3遺伝子多型を同時に検出可能であることが確認された。
【0110】
本発明は、上記発明の実施の形態および実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0111】
本明細書の中で明示した論文および公開特許公報等の内容は、その全ての内容を援用によって引用することとする。
【産業上の利用可能性】
【0112】
以上の通りであるので、本発明によれば、高い感度で、簡便にSLC28A1/A2/A3遺伝子における多型を検出することができることが明らかになった。
【技術分野】
【0001】
本発明は、核酸代謝、輸送に関連するSLC(solute carrier)28A遺伝子ファミリー(CNT)の多型を検出するためのプローブ、およびその用途に関する。
【背景技術】
【0002】
SLC28A遺伝子ファミリーは、核酸代謝、輸送に関連するトランスポーターであり、薬物動態に関与していることがわかっている(非特許文献1参照)。つまり、細胞膜に存在する膜タンパク質であるトランスポーターのSLC28A遺伝子ファミリーが、細胞への薬物吸収および分布、ならびに細胞からの排泄に関わっているということが解明されている。特に、非特許文献2および非特許文献3では、SLC28A1/A2/A3遺伝子についての性質が開示されている。
【0003】
SLC28A1/A2/A3遺伝子は、上皮細胞膜のNa+依存インフラックス・トランスポーターであり、3遺伝子とも核酸代謝、輸送に特有の性質を有している。詳細には、SLC28A1遺伝子は、ピリミジンヌクレオシドを選択的に核酸代謝、輸送する。SLC28A2遺伝子は、プリンヌクレオシドとウリジンとを選択的に核酸代謝、輸送する。SLC28A3遺伝子は、ピリミジンヌクレオシドとプリンヌクレオシド、更に多種の薬剤核種を核酸代謝、輸送する。これらのSLC28A1/A2/A3遺伝子は、多型を複数有している。例えば、SLC28A1遺伝子ではSLC28A1(G565A)、SLC28A2遺伝子ではSLC28A2(C65T)、SLC28A3遺伝子ではSLC28A3(A338G)を挙げることができる。また、特許文献1には、核酸プローブを用いる方法により、多型を検出する方法が記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2002−119291号公報
【非特許文献】
【0005】
【非特許文献1】Gerloff T.、2004 Jan.、Naunyn Schmiedebergs Arch Pharmacol、369(1)、69−77
【非特許文献2】Ryan P, et al.、2006 Sep.8、THE JOURNAL OF BIOLOGICAL CHEMISTRY、281(36)、26675−26682
【非特許文献3】Maria Rius, et al.、2010 Jul.、DRUG METABOLISM AND DISPOSITION、38(7)、1054−1063
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、特許文献1に記載のような、多型の有無を判断する際に用いるプローブの塩基配列は、例えば遺伝子多型の場所さえ解明すれば任意に製造可能であるわけではなく、当該多型の変異毎に適当な塩基配列を有するプローブを見出す必要がある。そこで、本発明では、薬物動態に関与する可能性が高い、SLC28A1(G565A)、SLC28A2(C65T)およびSLC28A3(A338G)の多型の有無を判断する際に用いる適当な塩基配列を有するプローブを見出すことを課題とする。
【課題を解決するための手段】
【0007】
本発明者らは、SLC28A1/A2/A3遺伝子における多型のSLC28A1(G565A)、SLC28A2(C65T)およびSLC28A3(A338G)を含む特定の領域に基づいてプローブを設計し、当該プローブを用いるTm解析を行うことにより当該変異部位における多型を検出できることを見出し、本発明を完成させるに至った。
【0008】
そこで、本発明の第1の観点に係る多型検出用プローブは、下記(P1)、(P2)および(P3)から選択される少なくとも1種の蛍光標識オリゴヌクレオチドであるSLC28A1/A2/A3遺伝子の多型を検出するための多型検出用プローブであることを特徴とする。
(P1)配列番号1に示す塩基配列において塩基番号292〜301を含む10〜43塩基長の塩基配列であり、塩基番号292に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P2)配列番号2に示す塩基配列において塩基番号301〜309を含む9〜52塩基長の塩基配列であり、塩基番号309に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P3)配列番号3に示す塩基配列において塩基番号290〜301を含む12〜51塩基長の塩基配列であり、塩基番号290に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【0009】
好ましくは、前記(P1)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号292に対応する塩基のシトシンを3’末端から数えて1〜3番目の位置に有し、
前記(P2)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号309に対応する塩基のシトシンを5’末端から数えて1〜3番目の位置に有し、
前記(P3)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号290に対応する塩基のシトシンを5’末端から数えて1〜3番目の位置に有する、
ことを特徴とする。
【0010】
より好ましくは、前記(P1)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号292に対応する塩基のシトシンを3’末端に有し、
前記(P2)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号309に対応する塩基のシトシンを5’末端に有し、
前記(P3)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号290に対応する塩基のシトシンを5’末端に有する、
ことを特徴とする。
【0011】
さらに好ましくは、前記蛍光標識オリゴヌクレオチドは、標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ前記標的塩基配列にハイブリダイズしたときに蛍光強度が減少するかまたは増加することを特徴とする。
【0012】
また、好ましくは、前記蛍光標識オリゴヌクレオチドは、標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ前記標的塩基配列にハイブリダイズしたときに蛍光強度が減少することを特徴とする。
【0013】
より好ましくは、前記(P1)の蛍光標識オリゴヌクレオチドは10〜28塩基長であり、
前記(P2)の蛍光標識オリゴヌクレオチドは9〜27塩基長であり、
前記(P3)の蛍光標識オリゴヌクレオチドは12〜31塩基長である、
ことを特徴とする。
【0014】
さらに好ましくは、前記(P1)の蛍光標識オリゴヌクレオチドは10〜18塩基長であり、
前記(P2)の蛍光標識オリゴヌクレオチドは9〜17塩基長であり、
前記(P3)の蛍光標識オリゴヌクレオチドは12〜21塩基長である、
ことを特徴とする。
【0015】
また、好ましくは、前記多型検出用プローブは、融解曲線分析用のプローブであることを特徴とする。
【0016】
本発明の第2の観点に係るSLC28A1/A2/A3遺伝子の多型検出方法は、第1の観点に係る多型検出用プローブを用いることを特徴とする。
【0017】
好ましくは、(i)第1の観点に係る多型検出用プローブおよび試料中の1本鎖核酸を接触させ、前記蛍光標識オリゴヌクレオチドおよび前記1本鎖核酸のハイブリッド形成体を得ることと、
(ii)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定することと、
(iii)前記蛍光シグナルの変動に基づいて、前記ハイブリッド形成体の解離温度であるTm値を評価することと、
(iv)前記Tm値に基づいて、SLC28A1/A2/A3遺伝子における、多型の存在を評価することと、
を含む。
【0018】
より好ましくは、さらに、前記(i)の前、または、前記(i)と同時に核酸を増幅することを含む。
【0019】
本発明の第3の観点に係る薬剤の評価方法は、(I)第2の観点に係るSLC28A1/A2/A3遺伝子の多型検出方法により、SLC28A1/A2/A3遺伝子における多型を検出することと、
(II)検出されたSLC28A1/A2/A3遺伝子の多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価することと、
を含む。
【0020】
本発明の第4の観点に係るSLC28A1/A2/A3遺伝子の多型検出用キットは、第1の観点に係る多型検出用プローブを含むことを特徴とする。
【0021】
好ましくは、前記(P1)の蛍光標識オリゴヌクレオチド、前記(P2)の蛍光標識オリゴヌクレオチドおよび前記(P3)の蛍光標識オリゴヌクレオチドから選択される少なくとも1種の前記蛍光標識オリゴヌクレオチドがハイブリダイズする塩基配列を含む領域を鋳型として増幅可能なプライマーをさらに含むことを特徴とする。
【発明の効果】
【0022】
本発明によれば、SLC28A1/A2/A3遺伝子多型を、高い感度で、簡便に検出することを可能にする多型検出用プローブ、これを用いた多型検出方法および薬効評価方法、ならびに多型検出用キットを提供することができる。
【図面の簡単な説明】
【0023】
【図1】(A)は核酸混合物の融解曲線の一例であり、(B)は微分融解曲線の一例である。
【図2】(A)〜(J)は、本発明の実施例1にかかる試料の微分融解曲線である。
【図3】(A)〜(C)は、本発明の実施例2にかかる試料の微分融解曲線である。
【図4】(A)〜(C)は、本発明の実施例3にかかる試料の微分融解曲線である。
【図5】(A)〜(J)は、本発明の比較例1にかかる試料の微分融解曲線である。
【図6】(A)〜(C)は、本発明の比較例2にかかる試料の微分融解曲線である。
【図7】(A)〜(C)は、本発明の実施例4にかかる精製ヒトゲノムを含む試料の微分融解曲線である。
【図8】(A)〜(C)は、本発明の実施例4にかかる全血を含む試料の微分融解曲線である。
【発明を実施するための形態】
【0024】
本発明において、検出する目的の多型とは、基本的に、SLC28A1/A2/A3遺伝子における多型を意味する。当該多型は、それぞれ前述した例のSLC28A1(G565A)と、SLC28A2(C65T)と、SLC28A3(A338G)である。これらの詳細は、NCBI(National Center for Biotechnology Information)に開示されており、SLC28A1(G565A)はdbSNP No.rs2290272、SLC28A2(C65T)はNo.rs11854484、SLC28A3(A338G)はNo.rs10868138として登録されている。NCBIに登録されているこれらの多型の周辺塩基配列について、SLC28A1(G565A)の周辺塩基配列を配列番号1に、SLC28A2(C65T)の周辺塩基配列を配列番号2に、SLC28A3(A338G)の周辺塩基配列を配列番号3に示す。
【0025】
本発明において、検出対象となる試料中の試料核酸、多型検出用プローブまたはプライマーの個々の配列に関して、これら互いの相補的な関係に基づいて記述された事項は、特に断らない限り、それぞれの配列と、各配列に対して相補的な配列とについても適用される。各配列に対して相補的な当該配列について本発明の事項を適用する際には、当該相補的な配列が認識する配列について、当業者にとっての技術常識の範囲内で、対応する本明細書に記載された配列に相補的な配列として、明細書全体を読み替えるものとする。
【0026】
本発明において、「Tm値」とは、二本鎖核酸が隔離する温度(解離温度:Tm)であって、一般に、260nmにおける吸光度が、吸光度全上昇分の50%に達した時の温度と定義される。すなわち、二本鎖核酸、例えば、二本鎖DNAを含む溶液を加熱していくと、260nmにおける吸光度が上昇する。これは、二本鎖DNAにおける両鎖間の水素結合が加熱によってほどけ、一本鎖DNAに解離(DNAの融解)することが原因である。そして、全ての二本鎖DNAが解離して一本鎖DNAになると、その吸光度は加熱開始時の吸光度(二本鎖DNAのみの吸光度)の約1.5倍程度を示し、これによって融解が完了したと判断できる。Tm値は、この現象に基づき設定される。本発明におけるTm値は、特に断らない限り、50%の塩基が二本鎖を形成し、残る50%が一本鎖に融解する温度をいう。
【0027】
本発明において「工程」、「〜すること」または「〜こと」等の所作に係る語は、独立した工程だけでなく、他の工程と明確に区別できない場合であっても本工程の所期の作用が達成されれば、本用語に含まれる。また、本発明において「〜」を用いて示された数値範囲は、「〜」の前後に記載される数値をそれぞれ最小値および最大値として含む範囲を示す。また、本発明において、組成物中の各成分の量について言及する場合、組成物中に各成分に該当する物質が複数存在する場合には、特に断らない限り、組成物中に存在する当該複数の物質の合計量を意味する。また、本発明において「変異」とは、野生型の塩基配列の一部の塩基が置換、欠失、重複または挿入されることによって生じる新たな塩基配列を意味する。また、「多型」とは、変異によって生じる塩基配列の多型を意味する。
【0028】
本発明における「塩基番号」とは、配列番号1、配列番号2および配列番号3に示す塩基配列の、5’末端から3’末端方向に数えた当該塩基の番号、すなわち配列番号1、配列番号2および配列番号3のいずれの場合も、塩基番号1〜塩基番号601で示される。それぞれの配列番号において、塩基番号301が多型となっている。SLC28A1(G565A)の多型は、Cが野生型で、Tが変異型である。SLC28A2(C65T)の多型は、Cが野生型でTが変異型である。SLC28A3(A338G)の多型は、Tが野生型でCが変異型である。
【0029】
本発明における「標的塩基配列」とは、多型を検出するためにプローブがハイブリダイズする(1本鎖構造の)標的核酸塩基配列を意味する。なお、本発明における「含む」および「有する」は、「からなる」および「から構成される」との意も含むものとする。本発明における「相同性(相同または相同的)」とは、特定の塩基配列において、当該塩基配列に80%以上、より好ましくは90%以上、最も好ましくは95%以上の塩基配列が同一であることをいい、5塩基、4塩基、3塩基、2塩基、または1塩基のみ異なる場合も含む。
【0030】
以下、本発明について説明する。
【0031】
〈多型検出用プローブ〉
本発明の多型検出用プローブは、下記(P1)、(P2)および(P3)から選択される少なくとも1種の蛍光標識オリゴヌクレオチドであるSLC28A1/A2/A3遺伝子の多型を検出するためのプローブである。
(P1)配列番号1に示す塩基配列において塩基番号292〜301を含む10〜43塩基長の塩基配列であり、塩基番号292に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P2)配列番号2に示す塩基配列において塩基番号301〜309を含む9〜52塩基長の塩基配列であり、塩基番号309に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P3)配列番号3に示す塩基配列において塩基番号290〜301を含む12〜51塩基長の塩基配列であり、塩基番号290に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【0032】
本発明における(P1)〜(P3)の蛍光標識ヌクレオチドには、当該(P1)〜(P3)の蛍光標識ヌクレオチドの塩基配列に相同性が認められる蛍光標識ヌクレオチドも包含される。当該相同性が認められる蛍光標識ヌクレオチドは、(P1)〜(P3)の蛍光標識ヌクレオチドと同等程度の作用を示す。また、(P1)〜(P3)の蛍光標識ヌクレオチドと同等程度の作用を示すものであれば、(P1)〜(P3)の蛍光標識ヌクレオチドの相補鎖とストリンジェントな条件下でハイブリダイズする蛍光標識ヌクレオチドも、本発明における(P1)〜(P3)の蛍光標識ヌクレオチドに含有される。
【0033】
ハイブリダイゼーションは、公知の方法あるいはそれに準じる方法、例えば、モレキュラー・クローニング(Molecular Cloning)2nd(J. Sambrook et al.,Cold Spring Harbor Lab.Prees,1989)に記載の方法等に従って行うことができる。ストリンジェントな条件とは、例えば、ナトリウム濃度が約19mM〜約40mM、好ましくは約19mM〜約20mMで、温度が約50度〜約70度、好ましくは約60度〜約65度の条件を示す。特に、ナトリウム濃度が約19mMで温度が約65度の場合がもっとも好ましい。
【0034】
これらの蛍光標識オリゴヌクレオチドは、好ましくは標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ、標的塩基配列にハイブリダイズしたとき蛍光強度が減少するかまたは増加する。より好ましくは、標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ、標的塩基配列にハイブリダイズしたときに蛍光強度が減少する。
【0035】
蛍光消光現象(Quenching phenomenon)を利用したプローブとしては、一般的に、グアニン消光プローブと呼ばれており、いわゆるQ−Probe(登録商標)として知られている。中でもオリゴヌクレオチドの3’末端または5’末端がcとなるように設計し、その末端のcが、gに近づくと蛍光強度が弱くなるような蛍光色素で標識化されたオリゴヌクレオチドが好ましい。
【0036】
このような蛍光色素は、公知のものを使用することができるが、それに制限されない。例えば、フルオレセイン、リン光体、ローダミンまたはポリメチン色素誘導体等が挙げられる。市販の蛍光色素としては、例えば、BODIPY FL、Pacific Blue、FAM、Cy3およびCy5、または、TAMRA等が挙げられる。当該プローブの検出条件は、特に制限されず、使用する蛍光色素により適宜決定すればよい。例えば、Pacific Blueの場合は検出波長445〜480nmで、TAMRAの場合は検出波長585〜700nmで、BODIPY FLの場合は検出波長520〜555nmで検出可能である。このようなプローブを使用すれば、シグナルの変動により、ハイブリダイズと解離とを容易に確認することができる。
【0037】
また、本発明の多型検出用プローブは、例えば、3’末端にリン酸基が付加されてもよい。後述するように、標的塩基配列は、PCR法等の遺伝子増幅法によって調製することもできる。この際、本発明の多型検出用プローブを遺伝子増幅反応の反応液中に共存させることができる。このような場合に、多型検出用プローブの3’末端にリン酸基を付加させておけば、当該多型検出用プローブ自体が遺伝子増幅反応によって伸長することを充分に防止できる。また、3’末端に前述のような標識化物質を付加することによっても、同様の効果が得られる。以下に、(P1)、(P2)および(P3)それぞれの蛍光標識オリゴヌクレオチドについて詳細に述べる。
【0038】
まず、(P1)を再掲する。
(P1)配列番号1に示す塩基配列において塩基番号292〜301を含む10〜43塩基長の塩基配列であり、塩基番号292に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【0039】
ここで、(P1)の蛍光標識オリゴヌクレオチドの「塩基番号292に対応する塩基」とは、配列番号1に示す塩基配列において塩基番号292となる塩基「g(グアニン)」に対応する相補塩基「c(シトシン)」を意味する。すなわち、(P1)の蛍光標識オリゴヌクレオチドは、配列番号1に示す塩基配列に相同的な塩基配列でもよいが、当該塩基配列は、塩基番号292に対応する塩基がシトシンであるということが条件となっている。(P1)の蛍光標識オリゴヌクレオチドにおいて、蛍光色素で標識されるcの部位は、下記の具体的なバリエーションのように必ずしも3’末端である必要はないが、このcが3’末端から数えて1〜3番目の位置に有することが好ましく、このcが3’末端に存在することがより好ましい。当該(P1)の蛍光標識オリゴヌクレオチドの長さは、好ましくは10〜28塩基長、より好ましくは10〜18塩基長である。
【0040】
例えば、具体的な(P1)のバリエーションとして、以下のような蛍光標識オリゴヌクレオチドが挙げられる。
WT(野生型)に相補的な塩基配列を有するプローブ、18mer、配列番号4
5’−gcgtgttcGtcCctctcc−(蛍光標識)−3’
WT(野生型)に相補的な塩基配列を有するプローブ、10mer、配列番号5
5’−GtcCctctcc−(蛍光標識)−3’
WT(野生型)に相補的な塩基配列を有するプローブ、43mer、配列番号6
5’−caactggtgtccttcgcaggaatctgcgtgttcGtcCctctcc−(蛍光標識)−3’
これらのプローブの塩基配列の大文字の「G」が野生型の塩基番号301のCに相補的となっている。これらの「G」を「A」とすると、変異型の塩基番号301のTに相補的となる。これらのプローブの塩基配列の大文字の「C」は目的外多型(NCBIのdbSNP No.rs45523532)の影響を回避するためである。
【0041】
次に、(P2)を再掲する。
(P2)配列番号2に示す塩基配列において塩基番号301〜309を含む9〜52塩基長の塩基配列であり、塩基番号309に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【0042】
ここで、(P2)の蛍光標識オリゴヌクレオチドの「塩基番号309に対応する塩基」とは、配列番号2に示す塩基配列において塩基番号309となる塩基「g(グアニン)」に対応する相補塩基「c(シトシン)」を意味する。すなわち、(P2)の蛍光標識オリゴヌクレオチドは、配列番号2に示す塩基配列に相同的な塩基配列でもよいが、当該塩基配列は、塩基番号309に対応する塩基がシトシンであるということが条件となっている。(P2)の蛍光標識オリゴヌクレオチドにおいて、蛍光色素で標識されるcの部位は、下記の具体的なバリエーションのように必ずしも5’末端である必要はないが、このcが5’末端から数えて1〜3番目の位置に有することが好ましく、このcが5’末端に存在することがより好ましい。当該(P2)の蛍光標識オリゴヌクレオチドの長さは、好ましくは9〜27塩基長、より好ましくは9〜17塩基長である。
【0043】
例えば、具体的な(P2)のバリエーションとして、以下のような蛍光標識オリゴヌクレオチドが挙げられる。
mt(変異型)に相補的な塩基配列を有するプローブ、17mer、配列番号7
5’−(蛍光標識)−ccagccccAggttcact−P−3’
mt(変異型)に相補的な塩基配列を有するプローブ、9mer
5’−(蛍光標識)−ccagccccA−3’
mt(変異型)に相補的な塩基配列を有するプローブ、52mer、配列番号8
5’−(蛍光標識)−ccagccccAggttcactgtgccagtctccactgtggacagagcaatggactg−3’
これらのプローブの塩基配列の大文字の「A」が変異型の塩基番号301のTに相補的となっている。これらの「A」を「G」とすると、野生型の塩基番号301のCに相補的となる。
【0044】
最後に、(P3)を再掲する。
(P3)配列番号3に示す塩基配列において塩基番号290〜301を含む12〜51塩基長の塩基配列であり、塩基番号290に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【0045】
ここで、(P3)の蛍光標識オリゴヌクレオチドの「塩基番号290に対応する塩基」とは、配列番号3に示す塩基配列において塩基番号290となる塩基「c(シトシン)」を意味する。すなわち、(P3)の蛍光標識オリゴヌクレオチドは、配列番号3に示す塩基配列以外にも当該塩基配列に相同的な塩基配列でもよいが、当該塩基配列は、塩基番号290に対応する塩基がシトシンであるということが条件となっている。(P3)の蛍光標識オリゴヌクレオチドにおいて、蛍光色素で標識されるcの部位は、下記の具体的なバリエーションのように必ずしも5’末端である必要はないが、このcが5’末端から数えて1〜3番目の位置に有することが好ましく、このcが5’末端に存在することがより好ましい。当該(P3)の蛍光標識オリゴヌクレオチドの長さは、好ましくは12〜31塩基長、より好ましくは12〜21塩基長である。
【0046】
例えば、具体的な(P3)のバリエーションとして、以下のような蛍光標識オリゴヌクレオチドが挙げられる。
mt(変異型)に相同的な塩基配列を有するプローブ、21mer、配列番号9
5’−(蛍光標識)−ccataaccagaCaacctgtcc−P−3’
mt(変異型)に相同的な塩基配列を有するプローブ、12mer、配列番号10
5’−(蛍光標識)−ccataaccagaC−3’
mt(変異型)に相同的な塩基配列を有するプローブ、51mer、配列番号11
5’−(蛍光標識)−ccataaccagaCaacctgtccaggaagcaaaaacagacactgaacatcact−3’
これらのプローブの塩基配列の大文字の「C」が変異型の塩基番号301のCに相同的となっている。これらの「C」を「T」とすると、野生型の塩基番号301のTに相同的となる。
【0047】
このような(P1)、(P2)または(P3)の蛍光標識オリゴヌクレオチドのような本発明に係る多型検出用プローブは、SLC28A1/A2/A3遺伝子の野生型または変異型の多型検出に利用することができる。検出方法は、何ら限定されず、標的塩基配列とこれらの多型検出用プローブとのハイブリダイズを利用する方法であればよい。例えば、(P1)、(P2)および(P3)から選択される少なくとも1種の蛍光標識オリゴヌクレオチドからなる野生型または変異型の多型検出用プローブを用い、SLC28A1/A2/A3遺伝子ファミリーとして、SLC28A1(G565A)、SLC28A2(C65T)およびSLC28A3(A338G)から選択される1種以上の多型を同時に検出することも可能である。また、(P1)、(P2)または(P3)のいずれか1種の蛍光標識オリゴヌクレオチドからなる野生型または変異型の多型検出用プローブを用い、SLC28A1(G565A)、SLC28A2(C65T)またはSLC28A3(A338G)のいずれか1種の多型を検出することも可能である。さらに好ましくは、本発明の多型検出用プローブは、融解曲線分析用のプローブであることを特徴とする。このような融解曲線分析による方法も含め、SLC28A1/A2/A3遺伝子の多型検出方法の詳細について以下に述べる。
【0048】
〈SLC28A1/A2/A3遺伝子の多型検出方法〉
本発明のSLC28A1/A2/A3遺伝子の多型検出方法は、前述した多型検出用プローブを使用することを特徴とする。すなわち、本発明の多型検出方法は、前述した本発明の多型検出用プローブを使用することが特徴であって、その他の構成または条件等は、以下の記載に制限されない。
【0049】
本発明の多型検出方法は、例えば、下記工程(i)、工程(ii)、工程(iii)および工程(iv)を含む。
(i)前述の多型検出用プローブおよび試料中の1本鎖核酸を接触させ、前記蛍光標識オリゴヌクレオチドおよび前記1本鎖核酸のハイブリッド形成体を得る工程。
(ii)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定する工程。
(iii)前記蛍光シグナルの変動に基づいて、前記ハイブリッド形成体の解離温度であるTm値を評価する工程。
(iv)前記Tm値に基づいて、SLC28A1/A2/A3遺伝子における、多型の存在を評価する工程。
【0050】
なお、上記工程(iii)において、Tm値を評価するとは、Tm値での温度を評価する(決定する)ことだけでもよいし、Tm解析でのピークの高さ、すなわち単位時間当たりの蛍光強度の変化量のピークを評価する(決定する)ことを含んでも構わない。
【0051】
より具体的に説明すると、例えば、野生型プローブのみを使用してこのような多型検出法を行う場合、予め野生型1本鎖核酸を用いた場合によるTm値を測定しておく。野生型1本鎖核酸は、例えば、全血等からゲノムDNAを市販のゲノムDNA単離キットを用いて単離して使用する。その後、当該野生型のTm値と、試料のTm値とを比較することによって、試料のSLC28A1/A2/A3遺伝子が多型を有しているか否かを評価することができる。すなわち、Tm値が野生型の場合と全く同じ値となった場合、試料は野生型プローブとパーフェクトマッチとなっていることが判断される。しかし、Tm値が野生型よりも小さい場合には、試料の1本鎖核酸と野生型プローブとの解離温度が低いことを意味しているため、この場合には、試料の1本鎖構造の核酸が多型を有しているということがわかる。
【0052】
また、野生型プローブでなくとも、変異型プローブであってもこのような方法を用い、パーフェクトマッチかミスマッチかを評価し、試料の変異を正確に検出することができる。また、このような種々の多型検出用プローブは、少なくとも1種類を使用すればよく、2種類以上を併用しても構わない。2種類以上の多型検出用プローブを併用し、単位時間当たりの蛍光強度の変化量(蛍光シグナル)のピークを評価することによって、それぞれの多型検出用プローブにパーフェクトマッチする標的塩基配列の存在比を一度に評価することができる。反応系における本発明の多型検出用プローブの添加濃度は、特に制限されないが、例えば、1種類の多型検出用プローブにつき、10〜1000nmol/Lの範囲となるように添加することが好ましく、より好ましくは20〜500nmol/Lである。
【0053】
核酸の増幅方法としては、ポリメラーゼを用いる方法が好ましく、その例としては、PCR法、ICAN法、LAMP法またはNASBA法等が挙げられる。ポリメラーゼを用いる方法により増幅する場合は、本発明プローブの存在下で増幅を行うことが好ましい。用いるプローブおよびポリメラーゼに応じて、増幅の反応条件等を調整することは当業者であれば容易である。これにより、核酸の増幅後にプローブのTm値を解析するだけで多型を評価できるので、反応終了後増幅産物を取り扱う必要がない。よって、増幅産物による汚染の心配がない。また、増幅に必要な機器と同じ機器で検出することが可能なので、容器を移動する必要がなく、自動化も容易である。
【0054】
鋳型とする核酸からの増幅産物の生成には、例えば、当該検出目的の多型を含む塩基配列を増幅するためのプライマーを使用することが好ましい。当該プライマーの増幅領域は、特に制限されず検出目的の多型に応じて適宜設定できる。例えば、前述の(P1)、(P2)または(P3)の蛍光標識オリゴヌクレオチドがハイブリダイズする塩基配列を含む領域が好ましい。また、当該プライマーの塩基配列は、特に制限されず、例えば、検出目的の多型の塩基配列を増幅できればよく、当該検出塩基配列およびその周辺塩基配列等に応じて従来公知の方法により適宜設定できる。さらに、当該プライマーの長さは、特に制限されず、一般的な長さに設定可能であり、例えば10mer〜50merが挙げられる。
【0055】
具体的には、PCR法に適用するプライマーは、本発明の多型検出用プローブがハイブリダイズする領域を含む塩基配列を増幅できるものであれば特に制限されず、配列番号1、配列番号2および配列番号3で示される塩基配列から、当業者であれば適宜設計することができる。プライマーの長さおよびTm値は、通常には、12mer〜40merおよび40度〜70度、好ましくは16mer〜30merおよび55度〜60度である。また、プライマーセットの各プライマーの長さは同一でなくてもよいが、両プライマーのTm値は、ほぼ同一(または、Tm値の両プライマーでの差が5度以内)であることが好ましい。
【0056】
核酸増幅を行う際の鋳型となる核酸を含む試料としては、核酸を含んでいればよく、特に制限されない。例えば、血液、口腔粘膜懸濁液、爪や毛髪等の体細胞、生殖細胞、乳、腹水液、パラフィン包埋組織、胃液、胃洗浄液、腹膜液、羊水、細胞培養などの任意の生物学的起源に由来するまたは由来しうるものを挙げられる。鋳型となる核酸は、該起源から得られたままで直接的に、あるいは該サンプルの特性を改変するために前処理した後で使用することができる。例えば、全血を試料とする場合、全血からのゲノムDNAの単離は、従来公知の方法によって行うことができる。例えば、市販のゲノムDNA単離キット(商品名GFX Genomic Blood DNA Purification kit;GEヘルスケアバイオサイエンス社製)等が使用できる。
【0057】
またPCR法に用いるDNAポリメラーゼとしては、通常用いられるDNAポリメラーゼを特に制限なく用いることができる。例えば、GeneTaq(ニッポンジーン社製)、PrimeSTAR Max DNA Polymerase(タカラバイオ社製)、Taq ポリメラーゼ等を挙げることができる。ポリメラーゼの使用量としては、通常用いられている濃度であれば特に制限はない。例えば、Taqポリメラーゼを用いる場合、好ましくは、反応溶液量50μlに対して0.01U〜100Uの濃度とすることができる。これにより、遺伝子多型の検出感度が高まるなどの利点がある。
【0058】
またPCR法は、通常用いられる条件を適宜選択することで行うことができる。なお、増幅の際、リアルタイムPCRによって増幅をモニタリングし、試料に含まれるDNA(検出対象配列)のコピー数を調べることもできる。すなわち、PCRによるDNA(検出対象配列)の増幅に従ってハイブリッドを形成するプローブの割合が増えるので蛍光強度が変動する。これをモニタリングすることで、試料に含まれる検出対象配列(正常DNAまたは変異型DNA)のコピーを検出することができる。
【0059】
本発明の多形検出方法においては、前記蛍光標識オリゴヌクレオチドと、試料中の一本鎖核酸とを接触させて、両者をハイブリダイズさせる。試料中の一本鎖核酸は、例えば、上記のようにして得られたPCR増幅産物を解離することで調製することができる。
【0060】
前記PCR増幅産物の解離(解離工程)における加熱温度は、前記増幅産物が解離できる温度であれば特に制限されない。例えば、85℃〜95℃である。加熱時間も特に制限されない。通常、1秒〜10分であり、好ましくは1秒〜5分である。
【0061】
また、解離した一本鎖DNAと前記蛍光標識オリゴヌクレオチドとのハイブリダイズは、例えば、前記解離工程の後、前記解離工程における加熱温度を降下させることによって行うことができる。温度条件としては、例えば、40℃〜50℃である。
【0062】
ハイブリダイズ工程の反応液における各組成の体積や濃度は、特に制限されない。具体例としては、前記反応液におけるDNAの濃度は、例えば、0.01μM〜1μMであり、好ましくは0.1μM〜0.5μM、前記蛍光標識オリゴヌクレオチドの濃度は、例えば、前記DNAに対する添加割合を満たす範囲が好ましく、例えば、0.001μM〜10μMであり、好ましくは0.001μM〜1μMである。
【0063】
そして、得られた前記一本鎖DNAと前記蛍光標識オリゴヌクレオチドとのハイブリッド形成体を徐々に加熱し、温度上昇に伴う蛍光シグナルの変動を測定する。例えば、Q−probe(登録商標)を使用した場合、一本鎖DNAとハイブリダイズした状態では、解離した状態に比べて蛍光強度が減少(または消光)する。したがって、例えば、蛍光が減少(または消光)しているハイブリッド形成体を徐々に加熱し、温度上昇に伴う蛍光強度の増加を測定すればよい。
【0064】
蛍光強度の変動を測定する際の温度範囲は、特に制限されないが、例えば、開始温度が室温〜85℃であり、好ましくは25℃〜70℃であり、終了温度は、例えば、40℃〜105℃である。また、温度の上昇速度は、特に制限されないが、例えば、0.1℃/秒〜20℃/秒であり、好ましくは0.3℃/秒〜5℃/秒である。
【0065】
次に、前記シグナルの変動を解析してTm値として決定する。具体的には、得られた蛍光強度から各温度における微分値(−d蛍光強度/dt)を算出し、最も低い値を示す温度をTm値として決定できる。また、単位時間当たりの蛍光強度増加量(蛍光強度増加量/t)が最も高い点をTm値として決定することもできる。なお、標識化プローブとして、消光プローブではなく、ハイブリッド形成によりシグナル強度が増加するプローブを使用した場合には、反対に、蛍光強度の減少量を測定すればよい。
【0066】
また、本発明においては、前述のように、ハイブリッド形成体を加熱して、温度上昇に伴う蛍光シグナル変動(好ましくは蛍光強度の増加)を測定するが、この方法に代えて、例えば、ハイブリッド形成時におけるシグナル変動の測定を行ってもよい。すなわち、前記プローブを添加した試料の温度を降下させてハイブリッド形成体を形成する際の前記温度降下に伴う蛍光シグナル変動を測定してもよい。
【0067】
具体例として、相補配列にハイブリダイズしていないときの蛍光強度に比べて、相補配列にハイブリダイズしているときの蛍光強度が減少(消光)する蛍光標識オリゴヌクレオチドプローブ(例えば、Q−Probe(登録商標))を使用した場合、前記プローブを試料に添加した際には、前記プローブは解離状態にあるため蛍光強度が大きいが、温度の降下によりハイブリッド形成体を形成すると、前記蛍光が減少(または消光)する。したがって、例えば、前記加熱した試料の温度を徐々に降下して、温度下降に伴う蛍光強度の減少を測定すればよい。他方、ハイブリッド形成によりシグナルが増加する標識化プローブを使用した場合、前記プローブを試料に添加した際には、前記プローブは解離状態にあるため蛍光強度が小さい(または消光)が、温度の降下によりハイブリッドを形成すると、蛍光強度が増加するようになる。したがって、例えば、前記試料の温度を徐々に降下して、温度下降に伴う蛍光強度の増加を測定すればよい。
【0068】
〈薬剤の評価方法〉
本発明の薬剤の評価方法は、前述の多型検出方法を利用することにより、SLC28A1/A2/A3遺伝子に関連する薬剤の耐性または薬効を評価することを特徴とする。すなわち、本発明の薬剤の評価方法は、前述のSLC28A1/A2/A3遺伝子の多型検出方法を用いて評価することに特徴があり、その他の構成または条件等は、以下の記載に制限されない。
【0069】
本発明の薬剤の評価方法は、例えば、下記工程(I)および工程(II)を含む。
(I)前述のSLC28A1/A2/A3遺伝子の多型検出方法により、SLC28A1/A2/A3遺伝子における多型を検出する工程。
(II)検出されたSLC28A1/A2/A3遺伝子の多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価する工程。
【0070】
(I)の検出工程は、前述の多型検出方法と同様である。(II)の、検出された多型の有無に基づく薬剤に対する耐性または薬剤の薬効の評価とは、例えば、細胞への薬物吸収および分布、細胞からの排泄等における、変異型および野生型に基づく関連性、評価を行うことも含まれる。このような薬剤の評価方法は、薬剤の投与量の増減、または他の治療薬への変更等の当該SLC28A1(G565A)、SLC28A2(C65T)またはSLC28A3(A338G)の多型が原因となる疾患の発見、さらにはその治療方針を決定するのに有用である。
【0071】
〈SLC28A1/A2/A3遺伝子の多型検出用キット〉
本発明のSLC28A1/A2/A3遺伝子の多型検出用キットは、前述の多型検出用プローブを含むことを特徴とする。すなわち、本発明のSLC28A1/A2/A3遺伝子の多型検出用キットは、前述の多型検出用プローブを含むことに特徴があって、その他の構成または条件等は、以下の記載に制限されない。なお、前述の多型検出用プローブの(P1)、(P2)または(P3)の蛍光標識オリゴヌクレオチドがハイブリダイズする塩基配列を含む領域を鋳型として増幅可能なプライマー(プライマーセット)をさらに含むとより好ましい。
【0072】
本発明のSLC28A1/A2/A3遺伝子の多型検出用キットの一例について述べる。例えば、本発明のSLC28A1/A2/A3遺伝子の多型検出用キットは、SLC28A1/A2/A3遺伝子のSLC28A1(G565A)、SLC28A2(C65T)および/またはSLC28A3(A338G)の多型の検出に使用する試薬キットである。試薬キットにおいて、前述の多型検出用プローブは、1種類でもよいし2種類以上であっても構わない。後者の場合、2種類以上の多型検出用プローブは、混合された状態で含まれてもよいし、別個の試薬として含まれていてもよい。また、2種類以上の本発明の多型検出用プローブが混合された状態で、本発明のSLC28A1/A2/A3遺伝子の多型検出用キットに含まれる場合、または、別個の試薬として含まれているが、例えば、使用時に同じ反応系で各多型検出用プローブと各標的塩基配列とのTm解離分析を行う場合、各多型検出用プローブは、異なる蛍光色素で標識化されていることが好ましい。このように蛍光色素の種類を変えることで、同じ反応系であっても、それぞれの多型検出用プローブについての検出が容易に可能になる。前記蛍光色素としては、例えば、検出波長が異なる物質であることが好ましい。
【0073】
前述したように、SLC28A1/A2/A3遺伝子(SLC28A遺伝子ファミリー)は、薬物動態に関与し、細胞への薬物吸収および分布、細胞からの排泄に関わっていることが確認されている。そこで、本発明の多型検出用プローブ、SLC28A1/A2/A3遺伝子の多型検出方法およびSLC28A1/A2/A3遺伝子の多型検出用キット等によれば、それら薬物動態等に関与する可能性が示唆される当該多型を正確に検出することができるため、今後の薬物動態、細胞への薬物吸収および薬物分布等に関するさらなる研究に繋がる可能性が高い。
【0074】
次に、本発明の実施例について説明する。ただし、本発明は下記の実施例により制限されない。
【実施例】
【0075】
SLC28A1/A2/A3遺伝子のSLC28A1(G565A)、SLC28A2(C65T)およびSLC28A3(A338G)の多型を、本発明の多型検出用プローブを使用し評価した実施例、ならびにこれらの多型を検出できなかった比較例について、以下に述べる。
【0076】
(実施例1)
実施例1では、本発明のSLC28A1遺伝子における多型検出用プローブであるSLC28A1(G565A)probe(前述した配列番号4の蛍光標識(BODIPY FL)オリゴヌクレオチドからなるもの)を利用し、SLC28A1(G565A)の多型について、全自動SNPs検査装置を用いTm解析を行った。装置に添加するプローブ等の溶液、試薬の処方は下記の表の通りである。なお、表1に示すGene Taq Universal bufferはニッポンジーン社製である。
【表1】

【0077】
表1に示す試料の鋳型の人工オリゴ塩基配列(ID−1〜ID−10)は、以下の通りである。いずれの人工オリゴ塩基配列も、3’末端に近い大文字のCまたはTが目的多型であり、5’末端に近い大文字のCまたはAが目的外多型である。
ID−1、22mer、配列番号12
5’−gaggagagCgaCgaacacgcag−3’
ID−2、22mer、配列番号13
5’−gaggagagAgaCgaacacgcag−3’
ID−3、22mer、配列番号14
5’−gaggagagCgaTgaacacgcag−3’
ID−4、22mer、配列番号15
5’−gaggagagAgaTgaacacgcag−3’
ID−5、配列番号12と配列番号13の人工オリゴ塩基配列を1:1で混合
ID−6、配列番号12と配列番号14の人工オリゴ塩基配列を1:1で混合
ID−7、配列番号12と配列番号15の人工オリゴ塩基配列を1:1で混合
ID−8、配列番号13と配列番号14の人工オリゴ塩基配列を1:1で混合
ID−9、配列番号13と配列番号15の人工オリゴ塩基配列を1:1で混合
ID−10、配列番号14と配列番号15の人工オリゴ塩基配列を1:1で混合
【0078】
Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。なお、図1の(A)は核酸混合物の融解曲線の一例であり、(B)は微分融解曲線の一例である。図2の(A)〜(J)は、本発明の実施例1にかかる試料の微分融解曲線である。
【0079】
図2の(A)〜(J)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。図2の(A)〜(J)に示すように、目的外多型の有無に関わらず、目的多型の有無を検出できた。遺伝子配列がC/CのTm値は60(61)度で、T/TのTm値は53(54)度であり、CとTの区別が付くことが確認できた。また、C/T(ヘテロ型)の遺伝子配列を検出した場合には、検出ピークは60(61)度と53(54)度の2箇所に得られ、遺伝子配列の区別ができることも確認できた。
【0080】
(実施例2)
実施例2では、本発明のSLC28A2遺伝子における多型検出用プローブであるSLC28A2(C65T)probe(前述した配列番号5の蛍光標識(TAMRA)オリゴヌクレオチドからなるもの)を利用し、SLC28A2(C65T)の多型について、全自動SNPs検査装置を用いTm解析を行った。装置に添加するプローブ等の溶液、試薬の処方は下記の表の通りである。なお、表2に示すGene Taq Universal bufferはニッポンジーン社製である。
【表2】

【0081】
表2に示す試料の鋳型の人工オリゴ塩基配列(ID−11〜ID−13)は、以下の通りである。いずれの人工オリゴ塩基配列も、大文字のCまたはTが目的多型である。
ID−11、26mer、配列番号16
5’−gcacagtgaaccCggggctggagctc−3’
ID−12、26mer、配列番号17
5’−gcacagtgaaccTggggctggagctc−3’
ID−13、配列番号16と配列番号17の人工オリゴ塩基配列を1:1で混合
【0082】
Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。図3の(A)〜(C)は、本発明の実施例2にかかる試料の微分融解曲線である。
【0083】
図3の(A)〜(C)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。図3の(A)〜(C)に示すように、遺伝子配列がC/CのTm値は60度で、T/TのTm値は68度であり、CとTの区別が付くことが確認できた。また、C/T(ヘテロ型)の遺伝子配列を検出した場合には、検出ピークは60度と68度の2箇所に得られ、遺伝子配列の区別ができることも確認できた。
【0084】
(実施例3)
実施例3では、本発明のSLC28A3遺伝子における多型検出用プローブであるSLC28A3(A338G)probe(前述した配列番号6の蛍光標識(Pacific Blue)オリゴヌクレオチドからなるもの)を利用し、SLC28A3(A338G)の多型について、全自動SNPs検査装置を用いTm解析を行った。装置に添加するプローブ等の溶液、試薬の処方は下記の表の通りである。なお、表3に示すGene Taq Universal bufferはニッポンジーン社製である。
【表3】

【0085】
表3に示す試料の鋳型の人工オリゴ塩基配列(ID−14〜ID−16)は、以下の通りである。いずれの人工オリゴ塩基配列も、大文字のGまたはAが目的多型である。
ID−14、28mer、配列番号18
5’−cctggacaggttGtctggttatggtgat−3’
ID−15、28mer、配列番号19
5’−cctggacaggttAtctggttatggtgat−3’
ID−16、配列番号18と配列番号19の人工オリゴ塩基配列を1:1で混合
【0086】
Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。図4の(A)〜(C)は、本発明の実施例3にかかる試料の微分融解曲線である。
【0087】
図4の(A)〜(C)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。図4の(A)〜(C)に示すように、遺伝子配列がC/CのTm値は67度で、T/TのTm値は58度であり、CとTの区別が付くことが確認できた。また、C/T(ヘテロ型)の遺伝子配列を検出した場合には、検出ピークは58度と67度の2箇所に得られ、遺伝子配列の区別ができることも確認できた。
【0088】
(比較例1)
比較例1では、前述した実施例1と比較するために、WT(野生型)に相補的ではあるが、配列番号1の塩基番号292に対応するcに蛍光標識されていない下記のプローブを利用し、SLC28A1(G565A)の多型について、全自動SNPs検査装置を用いTm解析を行った。なお、プローブの塩基配列の大文字のGは目的多型であり、プローブの塩基配列の大文字のTは目的外多型の影響を回避するためである。
SLC28A1(G565A)probe2、17mer、配列番号20
5’−ctgcgtgttcGtcTctc−(TAMRA)−3’
【0089】
装置に添加するプローブ等の溶液、試薬の処方は下記の表の通りである。なお、表4に示すGene Taq Universal bufferはニッポンジーン社製である。
【表4】

【0090】
表4に示す試料の鋳型の人工オリゴ塩基配列(ID−17〜ID−26)は、以下の通り実施例1と同様である。
ID−17、配列番号12
ID−18、配列番号13
ID−19、配列番号14
ID−20、配列番号15
ID−21、配列番号12と配列番号13の人工オリゴ塩基配列を1:1で混合
ID−22、配列番号12と配列番号14の人工オリゴ塩基配列を1:1で混合
ID−23、配列番号12と配列番号15の人工オリゴ塩基配列を1:1で混合
ID−24、配列番号13と配列番号14の人工オリゴ塩基配列を1:1で混合
ID−25、配列番号13と配列番号15の人工オリゴ塩基配列を1:1で混合
ID−26、配列番号14と配列番号15の人工オリゴ塩基配列を1:1で混合
【0091】
Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。図5の(A)〜(J)は、本発明の比較例1にかかる試料の微分融解曲線である。
【0092】
図5の(A)〜(J)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。図5の(A)〜(J)に示すように、目的外多型の有無の影響を受け、目的多型の有無の検出が困難となっている。詳細に言うと、目的多型がC/Cの際には、Tm値が57度または65度の一つのピークの場合、あるいは56度および64度の二つのピークの場合がある。目的多型がT/Tの際には、Tm値は48度または57度のピークとなる。目的多型がC/T(ヘテロ型)の際には、Tm値は、57度の一つのピーク、48度および56度の二つのピーク、または57度および64度の二つのピークのいずれかとなっている。このような結果から、配列番号20のSLC28A1(G565A)probe2を使用するのは困難であると判断した。
【0093】
(比較例2)
比較例2では、前述した実施例3と比較するために、WT(野生型)に相補的であり、配列番号3の塩基番号290に対応するcに蛍光標識されていない下記のプローブを利用し、SLC28A3(A338G)の多型について、全自動SNPs検査装置を用いTm解析を行った。プローブの塩基配列の大文字のAは目的多型である。
SLC28A3(A338G)probe2、17mer、配列番号21
5’−(TAMRA)−cctggacaggttAtctg−P−3’
【0094】
装置に添加するプローブ等の溶液、試薬の処方は下記の表の通りである。なお、表5に示すGene Taq Universal bufferはニッポンジーン社製である。
【表5】

【0095】
表5に示す試料の鋳型の人工オリゴ塩基配列(ID−27〜ID−29)は、以下の通りである。いずれの人工オリゴ塩基配列も、大文字のTまたはCが目的多型である。
ID−27、24mer、配列番号22
5’−taaccagaTaacctgtccaggaag−3’
ID−28、24mer、配列番号23
5’−taaccagaCaacctgtccaggaag−3’
ID−29、配列番号22と配列番号23の人工オリゴ塩基配列を1:1で混合
【0096】
Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。図6の(A)〜(C)は、本発明の比較例2にかかる試料の微分融解曲線である。
【0097】
図6の(A)〜(C)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。しかし、図6の(A)〜(C)のいずれの図においてもピーク値が検出できないため、配列番号21のSLC28A3(A338G)probe2を使用するのは困難であると判断した。
【0098】
(実施例4)
実施例4では、前述した本発明のSLC28A1/A2/A3遺伝子における多型検出用プローブであるSLC28A1(G565A)probe、SLC28A2(C65T)probeおよびSLC28A3(A338G)probeを利用し、それぞれの多型について、全自動SNPs検査装置(商品名i−densy(登録商標)、アークレイ社製)を用い、PCRおよびTm解析を行った。鋳型として、精製したヒトゲノムを使用する場合と、同一人の全血を使用する場合と、二通り実験を行った。
【0099】
まず、鋳型として精製したヒトゲノム(全血から一般的な方法を用いて精製したヒトゲノム)を使用した場合について述べる。PCRおよびTm解析で使用した試料等は下記の表の通りである。
【表6】

【0100】
表6に示すそれぞれのプライマーの塩基配列は以下の通りである。
SLC28A1−F、23mer、配列番号24
5’−ctgcgcaatgatgctttgagcag−3’
SLC28A1−R、23mer、配列番号25
5’−aactggtgtccttcgcaggaatc−3’
SLC28A2−F、25mer、配列番号26
5’−gcaagtggaagacagtccattgctc−3’
SLC28A2−R、30mer、配列番号27
5’−ctgcagagagaaactaaactggtgattacc−3’
SLC28A3−F、26mer、配列番号28
5’−agaggaagggctctgtgaaagttcag−3’
SLC28A3−R、27mer、配列番号29
5’−ccagtggttagtgatgttcagtgtctg−3’
【0101】
PCRは95度で60秒間処理した後、95度で1秒間および60度で30秒間を1サイクルとして、50サイクル繰り返した。Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。
【0102】
図7の(A)〜(C)は、本発明の実施例4にかかる精製ヒトゲノムを含む試料の微分融解曲線である。図7の(A)〜(C)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。
【0103】
図7の(A)に示すように、49度と56度とにピークが検出されているため、SLC28A1(G565A)は、ヘテロ型(G/A)の多型であることがわかった。図7の(B)に示すように、54度にピークが検出されているため、SLC28A2(C65T)は、野生型(C/C)の多型であることがわかった。図7の(C)に示すように、55度にピークが検出されているため、SLC28A3(A338G)は、野生型(A/A)の多型であることがわかった。
【0104】
次に、鋳型として全血を使用した場合について述べる。使用する全血の前処理として、全血10μlを下記の表7に示す「希釈液1」70μlに加え、よく混合した後、この混合液10μlを下記の表8に示す「希釈液2」70μlに加えた。その後、この混合液17μlを95度で10分間加熱すると、4μlの前処理済全血が得られる。これを1回の実験において鋳型として使用した。
【表7】

【表8】

【0105】
PCRおよびTm解析で使用した試料等は下記の表の通りである。表9に示すプライマーおよびプローブの塩基配列は、前述と同様である。
【表9】

【0106】
条件についても同様に、PCRは95度で60秒間処理した後、95度で1秒間および60度で30秒間を1サイクルとして、50サイクル繰り返した。Tm解析は、95度で1秒間、次に40度で60秒間、さらに温度の上昇速度を3秒間に1度として40度から75度まで加熱し、当該プローブの蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定した。
【0107】
図8の(A)〜(C)は、本発明の実施例4にかかる全血を含む試料の微分融解曲線である。図8の(A)〜(C)のいずれも、横軸は温度(℃)であり、縦軸は単位時間当たりの蛍光強度の変化量である。
【0108】
図8の(A)に示すように、48度と55度とにピークが検出されているため、SLC28A1(G565A)はヘテロ型(G/A)の多型で精製ヒトゲノムを検体とした場合と同様であることがわかった。図8の(B)に示すように、54度にピークが検出されているため、SLC28A2(C65T)は野生型(C/C)の多型で精製ヒトゲノムを検体とした場合と同様であることがわかった。図8の(C)に示すように、54度にピークが検出されているため、SLC28A3(A338G)は、野生型(A/A)の多型で精製ヒトゲノムを検体とした場合と同様であることがわかった。
【0109】
以上のことから、精製ゲノムまたは血液検体を用い、PCR増幅してTm解析することによって、容易にSLC28A1/A2/A3遺伝子多型を同時に検出可能であることが確認された。
【0110】
本発明は、上記発明の実施の形態および実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0111】
本明細書の中で明示した論文および公開特許公報等の内容は、その全ての内容を援用によって引用することとする。
【産業上の利用可能性】
【0112】
以上の通りであるので、本発明によれば、高い感度で、簡便にSLC28A1/A2/A3遺伝子における多型を検出することができることが明らかになった。
【特許請求の範囲】
【請求項1】
下記(P1)、(P2)および(P3)から選択される少なくとも1種の蛍光標識オリゴヌクレオチドであるSLC28A1/A2/A3遺伝子の多型を検出するための多型検出用プローブ。
(P1)配列番号1に示す塩基配列において塩基番号292〜301を含む10〜43塩基長の塩基配列であり、塩基番号292に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P2)配列番号2に示す塩基配列において塩基番号301〜309を含む9〜52塩基長の塩基配列であり、塩基番号309に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P3)配列番号3に示す塩基配列において塩基番号290〜301を含む12〜51塩基長の塩基配列であり、塩基番号290に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【請求項2】
前記(P1)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号292に対応する塩基のシトシンを3’末端から数えて1〜3番目の位置に有し、
前記(P2)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号309に対応する塩基のシトシンを5’末端から数えて1〜3番目の位置に有し、
前記(P3)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号290に対応する塩基のシトシンを5’末端から数えて1〜3番目の位置に有する、
ことを特徴とする、請求項1に記載の多型検出用プローブ。
【請求項3】
前記(P1)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号292に対応する塩基のシトシンを3’末端に有し、
前記(P2)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号309に対応する塩基のシトシンを5’末端に有し、
前記(P3)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号290に対応する塩基のシトシンを5’末端に有する、
ことを特徴とする、請求項1に記載の多型検出用プローブ。
【請求項4】
前記蛍光標識オリゴヌクレオチドは、標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ前記標的塩基配列にハイブリダイズしたときに蛍光強度が減少するかまたは増加することを特徴とする、請求項1ないし3のいずれか1項に記載の多型検出用プローブ。
【請求項5】
前記蛍光標識オリゴヌクレオチドは、標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ前記標的塩基配列にハイブリダイズしたときに蛍光強度が減少することを特徴とする、請求項4に記載の多型検出用プローブ。
【請求項6】
前記(P1)の蛍光標識オリゴヌクレオチドは10〜28塩基長であり、
前記(P2)の蛍光標識オリゴヌクレオチドは9〜27塩基長であり、
前記(P3)の蛍光標識オリゴヌクレオチドは12〜31塩基長である、
ことを特徴とする、請求項1ないし5のいずれか1項に記載の多型検出用プローブ。
【請求項7】
前記(P1)の蛍光標識オリゴヌクレオチドは10〜18塩基長であり、
前記(P2)の蛍光標識オリゴヌクレオチドは9〜17塩基長であり、
前記(P3)の蛍光標識オリゴヌクレオチドは12〜21塩基長である、
ことを特徴とする、請求項1ないし6のいずれか1項に記載の多型検出用プローブ。
【請求項8】
前記多型検出用プローブは、融解曲線分析用のプローブであることを特徴とする、請求項1ないし7のいずれか1項に記載の多型検出用プローブ。
【請求項9】
請求項1ないし8のいずれか1項に記載の多型検出用プローブを用いることを特徴とする、SLC28A1/A2/A3遺伝子の多型検出方法。
【請求項10】
(i)請求項1ないし8のいずれか1項に記載の多型検出用プローブおよび試料中の1本鎖核酸を接触させ、前記蛍光標識オリゴヌクレオチドおよび前記1本鎖核酸のハイブリッド形成体を得ることと、
(ii)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定することと、
(iii)前記蛍光シグナルの変動に基づいて、前記ハイブリッド形成体の解離温度であるTm値を評価することと、
(iv)前記Tm値に基づいて、SLC28A1/A2/A3遺伝子における、多型の存在を評価することと、
を含む、請求項9に記載のSLC28A1/A2/A3遺伝子の多型検出方法。
【請求項11】
さらに、前記(i)の前、または、前記(i)と同時に核酸を増幅することを含む、請求項10に記載のSLC28A1/A2/A3遺伝子の多型検出方法。
【請求項12】
(I)請求項9ないし11のいずれか1項に記載のSLC28A1/A2/A3遺伝子の多型検出方法により、SLC28A1/A2/A3遺伝子における多型を検出することと、
(II)検出されたSLC28A1/A2/A3遺伝子の多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価することと、
を含む、薬剤の評価方法。
【請求項13】
請求項1ないし8のいずれか1項に記載の多型検出用プローブを含むことを特徴とする、SLC28A1/A2/A3遺伝子の多型検出用キット。
【請求項14】
前記(P1)の蛍光標識オリゴヌクレオチド、前記(P2)の蛍光標識オリゴヌクレオチドおよび前記(P3)の蛍光標識オリゴヌクレオチドから選択される少なくとも1種の前記蛍光標識オリゴヌクレオチドがハイブリダイズする塩基配列を含む領域を鋳型として増幅可能なプライマーをさらに含むことを特徴とする、請求項13に記載のSLC28A1/A2/A3遺伝子の多型検出用キット。
【請求項1】
下記(P1)、(P2)および(P3)から選択される少なくとも1種の蛍光標識オリゴヌクレオチドであるSLC28A1/A2/A3遺伝子の多型を検出するための多型検出用プローブ。
(P1)配列番号1に示す塩基配列において塩基番号292〜301を含む10〜43塩基長の塩基配列であり、塩基番号292に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P2)配列番号2に示す塩基配列において塩基番号301〜309を含む9〜52塩基長の塩基配列であり、塩基番号309に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
(P3)配列番号3に示す塩基配列において塩基番号290〜301を含む12〜51塩基長の塩基配列であり、塩基番号290に対応する塩基がシトシンであり蛍光色素で標識されている、蛍光標識オリゴヌクレオチド。
【請求項2】
前記(P1)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号292に対応する塩基のシトシンを3’末端から数えて1〜3番目の位置に有し、
前記(P2)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号309に対応する塩基のシトシンを5’末端から数えて1〜3番目の位置に有し、
前記(P3)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号290に対応する塩基のシトシンを5’末端から数えて1〜3番目の位置に有する、
ことを特徴とする、請求項1に記載の多型検出用プローブ。
【請求項3】
前記(P1)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号292に対応する塩基のシトシンを3’末端に有し、
前記(P2)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号309に対応する塩基のシトシンを5’末端に有し、
前記(P3)の蛍光標識オリゴヌクレオチドは、蛍光色素で標識された塩基番号290に対応する塩基のシトシンを5’末端に有する、
ことを特徴とする、請求項1に記載の多型検出用プローブ。
【請求項4】
前記蛍光標識オリゴヌクレオチドは、標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ前記標的塩基配列にハイブリダイズしたときに蛍光強度が減少するかまたは増加することを特徴とする、請求項1ないし3のいずれか1項に記載の多型検出用プローブ。
【請求項5】
前記蛍光標識オリゴヌクレオチドは、標的塩基配列にハイブリダイズしないときに蛍光を発し、かつ前記標的塩基配列にハイブリダイズしたときに蛍光強度が減少することを特徴とする、請求項4に記載の多型検出用プローブ。
【請求項6】
前記(P1)の蛍光標識オリゴヌクレオチドは10〜28塩基長であり、
前記(P2)の蛍光標識オリゴヌクレオチドは9〜27塩基長であり、
前記(P3)の蛍光標識オリゴヌクレオチドは12〜31塩基長である、
ことを特徴とする、請求項1ないし5のいずれか1項に記載の多型検出用プローブ。
【請求項7】
前記(P1)の蛍光標識オリゴヌクレオチドは10〜18塩基長であり、
前記(P2)の蛍光標識オリゴヌクレオチドは9〜17塩基長であり、
前記(P3)の蛍光標識オリゴヌクレオチドは12〜21塩基長である、
ことを特徴とする、請求項1ないし6のいずれか1項に記載の多型検出用プローブ。
【請求項8】
前記多型検出用プローブは、融解曲線分析用のプローブであることを特徴とする、請求項1ないし7のいずれか1項に記載の多型検出用プローブ。
【請求項9】
請求項1ないし8のいずれか1項に記載の多型検出用プローブを用いることを特徴とする、SLC28A1/A2/A3遺伝子の多型検出方法。
【請求項10】
(i)請求項1ないし8のいずれか1項に記載の多型検出用プローブおよび試料中の1本鎖核酸を接触させ、前記蛍光標識オリゴヌクレオチドおよび前記1本鎖核酸のハイブリッド形成体を得ることと、
(ii)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定することと、
(iii)前記蛍光シグナルの変動に基づいて、前記ハイブリッド形成体の解離温度であるTm値を評価することと、
(iv)前記Tm値に基づいて、SLC28A1/A2/A3遺伝子における、多型の存在を評価することと、
を含む、請求項9に記載のSLC28A1/A2/A3遺伝子の多型検出方法。
【請求項11】
さらに、前記(i)の前、または、前記(i)と同時に核酸を増幅することを含む、請求項10に記載のSLC28A1/A2/A3遺伝子の多型検出方法。
【請求項12】
(I)請求項9ないし11のいずれか1項に記載のSLC28A1/A2/A3遺伝子の多型検出方法により、SLC28A1/A2/A3遺伝子における多型を検出することと、
(II)検出されたSLC28A1/A2/A3遺伝子の多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価することと、
を含む、薬剤の評価方法。
【請求項13】
請求項1ないし8のいずれか1項に記載の多型検出用プローブを含むことを特徴とする、SLC28A1/A2/A3遺伝子の多型検出用キット。
【請求項14】
前記(P1)の蛍光標識オリゴヌクレオチド、前記(P2)の蛍光標識オリゴヌクレオチドおよび前記(P3)の蛍光標識オリゴヌクレオチドから選択される少なくとも1種の前記蛍光標識オリゴヌクレオチドがハイブリダイズする塩基配列を含む領域を鋳型として増幅可能なプライマーをさらに含むことを特徴とする、請求項13に記載のSLC28A1/A2/A3遺伝子の多型検出用キット。
【図1】


【図6】


【図7】


【図8】


【図2】


【図3】


【図4】


【図5】




【図6】


【図7】


【図8】


【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−94116(P2013−94116A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2011−239754(P2011−239754)
【出願日】平成23年10月31日(2011.10.31)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成23年10月31日(2011.10.31)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
[ Back to top ]

