SSEA系新規糖鎖化合物
【課題】胚発生に伴い発現が変化する糖鎖抗原であるSSEA(stage-specific embryonic antigen)と構造が類似する非天然型の新規な糖鎖化合物および該化合物の製造方法の提供。
【解決手段】下記の化合物など4種の糖鎖化合物および該化合物の製造方法。


(上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である)
【解決手段】下記の化合物など4種の糖鎖化合物および該化合物の製造方法。


(上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、哺乳動物の胚発生に伴い発現が変化することが知られている糖鎖抗原マーカーである、SSEA-3、SSEA-4などのSSEA系糖鎖の新規な構造異性体、および、天然から得られた酵素を用いてこれらの構造異性体を合成する方法に関するものである。
【背景技術】
【0002】
stage-specific embryonic antigen (SSEA)は、胚発生に伴い発現が変化する糖鎖抗原であり、細胞の分化、発生に深く寄与しているといわれる糖鎖である。このうち、SSEA-1は糖タンパク、糖脂質どちらにもみられるが、SSEA-3、SSES-4は、通常、スフィンゴ糖脂質のみに見られる糖鎖抗原であり、細胞膜上のラフトマクロドメインの構成分子となることが知られている(非特許文献1)。
現在、ES細胞やiPS細胞を利用展開した研究が盛んに進められているが、SSEAを抗原マーカーとすることで、これらの分化細胞の状態が検定できる。
【0003】
このように、糖鎖化合物は、生化学的、医科学的研究で非常に活発に利用活用されている化合物群である。その入手はin situで生産されたものを単離精製することで天然から得ることができる他、現在ではin vivoでの細胞法、in vitroでの酵素法や有機化学法により、多くの化合物を人工的に合成することも可能となっている。
また、糖鎖化合物の研究の一手法として、糖鎖の構造を一部変更した非天然型糖鎖化合物を合成し、当該新たな非天然型糖鎖化合物の特性を研究し、天然型糖鎖との比較を行うなども行われている。
【0004】
糖鎖化合物を合成する上述の3種の方法(「細胞法」、「化学法」、「酵素法」)には、それぞれ長所と短所がある。一般に糖鎖化合物には、数多くの立体異性体や結合異性体が存在し得、そのうちの一異性体である所望の糖鎖化合物を選択的に得るためには、合成反応が高度に制御されることが必要であるが、化学法ではこれを実現するために、多段階反応、ヒドロキシル基の選択的保護、脱保護などをおこなう必要がある。一方、酵素法は、基質特異性が高く、立体異性体や結合異性体を生産しないので、その手間が必要ない。また、反応に用いる酵素量は触媒量でよく、産業的に糖鎖生産をする上での利点が多い。
糖鎖合成で利用される酵素は、糖と糖を結合させるグリコシル化反応では、各種「糖転移酵素」や「糖加水分解酵素」が利用される。そのほか、糖鎖を構成する糖単位のヒドロキシル基の修飾反応に利用される、例えば硫酸基導入のための硫酸化酵素などの酵素もある。
【0005】
一方、酵素法の短所としては、酵素反応は分子認識能力、差別化能力が高く、基質特異性が高いゆえに、汎用性に乏しく、基質とする化合物は天然体に限られるのが一般的であることが挙げられる。
したがって、酵素反応で非天然体を含む多様な糖鎖を合成することは、必ずしも容易なことではないのが実情である。
【0006】
【非特許文献1】Trends in Glycoscience andGlycotechnology Vol.20,No.113(2008)pp.131-136
【発明の開示】
【発明が解決しようとする課題】
【0007】
天然のSSEA系糖鎖は、上述のとおり、細胞の分化、発生に深く寄与しているといわれる糖鎖であり、ES細胞やiPS細胞の分化にも役割を果たしていることが推察される。一方で、これらの細胞においては、細胞分化をあるステージで止めるなど、細胞の分化、分裂を調節することができれば、先にあげた細胞を利用する研究の展開がより見込めるが、実際は放っておいてもどんどん分化、分裂がすすみ、細胞分裂を制御することは非常に困難であるという問題がある。
天然のSSEA系糖鎖と構造が類似する糖鎖化合物の中には、天然のSSEA系糖鎖の生理的役割や機能、例えば上述の細胞分化に果たす役割を調節することができるものがあることが期待される。
しかしながら、天然の糖鎖化合物に類似する任意の糖鎖化合物を合成することは、上述のとおり、容易なことではない。
そこで、本発明は、天然のSSEA系糖鎖と構造が類似する非天然型の新規な糖鎖化合物を提供することを課題とし、その中から、天然のSSEA系糖鎖の生理的役割や機能を調節することができるものを提供することをさらなる目標とする。
また、本発明は、糖結合物質であるレクチンの新たな分類用試薬として用い得る、新規な糖鎖化合物を提供することをも、目的とする。
本発明は、また、当該新規な非天然型の糖鎖化合物を容易に調製することができる方法を提供することを課題とする。
【課題を解決するための手段】
【0008】
上記課題を解決するため、本発明は、以下の4種の新規な非天然型糖鎖化合物を提供する。
(1)以下の化学構造式で表される糖鎖化合物。
【化1】

上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である。好適な保護基としては、p−メトキシフェニル基等のアリール基、アルキル基、アリル基、アルキルアジド基、糖基が挙げられる。
この化合物は、天然のSSEA系糖鎖化合物の出発物質である三糖体Gb3(図1参照)を用いれば、GlcNAcβ1-3Gb3と表記することができ、Gb3に結合する糖が天然のGb4(図1参照)と相違する四糖体である (以下、これをneoGb4と称する。)。
(2)以下の化学構造式で表される糖鎖化合物。
【化2】

上記化学構造式中のXおよびRについては、(1)の化学構造式と同様である。
この化合物は、天然のSSEA系糖鎖化合物の出発物質である三糖体Gb3を用いれば、Galβ1-4GlcNAcβ1-3Gb3あるいはLacNAcβ1-3Gb3と表記することができ、Gb3に結合する糖が天然のGb5(SSEA-3とも呼ばれる)(図1参照)と相違する五糖体である (以下、これをneoGb5 あるいはneoSSEA-3 と称する。)。
(3)以下の化学構造式で表される糖鎖化合物。
【化3】

上記化学構造式中のXおよびRについては、(1)の化学構造式と同様である。
この化合物は、天然のSSEA系糖鎖化合物の出発物質である三糖体Gb3を用いれば、Siaα2-3Galβ1-4GlcNAcβ1-3Gb3 あるいはSiaα2-3LacNAcβ1-3Gb3と表記することができ、Gb3に結合する糖が天然のsialyl Gb5(SSEA-4とも呼ばれる)(図1参照)と相違する六糖体である (以下、これをsialyl-neoGb5 あるいはneoSSEA-4と称する。)。)
(4)以下の化学構造式で表される糖鎖化合物。
【化4】

上記化学構造式中のXおよびRについては、(1)の化学構造式と同様である。
この化合物は、天然のSSEA系糖鎖化合物の出発物質である三糖体Gb3を用いれば、Siaα2-6Galβ1-4GlcNAcβ1-3Gb3 あるいはSiaα2-6LacNAcβ1-3Gb3と表記することができ、Gb3に結合する糖および末端のシアリル酸(Sia)の結合位置が天然のsialyl Gb5(SSEA-4とも呼ばれる)と相違する六糖体である (以下、これを2,6sialyl-neoGb5 あるいは2,6neoSSEA-4と称する。)。
これらは、いずれも未だ報告されたことのない、新規な非天然型糖鎖化合物である。
【0009】
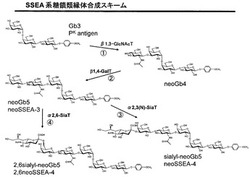
天然のSSEA系糖鎖においては、Gb3(PK抗原)に、GalNAcが付加してGb4(P抗原)が生成し、これに、Galが付加してGb5(SSEA-3)が生成し、これに、NeuAc(Sia)が付加してsialylGb5(SSEA-4)が生成する(図1参照)。
【0010】
これに対し、我々は、適切な酵素を用いて、天然のGb3(PK抗原)に、GlcNAcを付加させれば、neo Gb4が生成し、これに、Galを付加させれば、neo Gb5(neo SSEA-3)が生成し、更に、これに、NeuAc(Sia)を付加させれば、sialyl-neoGb5(neoSSEA-4)と2,6sialyl-neoGb5(2,6neoSSEA-4)が生成することを見出し(図2参照)、本発明を完成した(詳細は実施例1〜4参照)。
【0011】
したがって、本発明は、また、上記4種の新規な非天然型糖鎖化合物を酵素反応を利用して調製する、以下の4種の新規な非天然型糖鎖化合物の製造方法を提供する。
(1)Gb3+UDP-GlcNAc(酵素β1,3-GlcNacTを使用)→ GlcNAcβ1-3Gb3
(2)GlcNAcβ1-3Gb3+UDP-Gal(酵素β1,4-GalTを使用)→ Galβ1-4GlcNAcβ1-3Gb3
(3)Galβ1-4GlcNAcβ1-3Gb3+CMP-NeuAc (CMP-NANA)(酵素α2,3(N)-SiaTを使用)
→ Siaα2-3Galβ1-4GlcNAcβ1-3Gb3
(4)Galβ1-4GlcNAcβ1-3Gb3+CMP-NeuAc (CMP-NANA)(酵素α2,6-SiaTを使用)
→ Siaα2-6Galβ1-4GlcNAcβ1-3Gb3
【0012】
上記非天然型糖鎖化合物は、糖結合物質であるレクチンの新たな分類用試薬として用い得るほか、細胞の分化発生に関与し、初期胚におけるStage-Specific Embryonic Antigens (SSEA)抗原として知られている、Gb4、Gb5(SSEA-3)、sialylGb5(SSEA-4)に非常に似た構造を有しているから、これらSSEA系糖鎖の有する生理的役割や機能と同様の機能、ないし、これを抑制するなどの調節機能を有することが期待される。
また、これらの非天然型糖鎖化合物のうち、2,6sialyl-neoGb5については、メルケル細胞ポリオマーウイルス(MCV)との結合活性を有することが確認されている(実施例5参照)。
【発明の効果】
【0013】
本発明により、近年非常に注目されているSSEA抗原に極めて構造が似た、非天然型糖鎖化合物が提供される。当該非天然型糖鎖化合物は、糖結合物質であるレクチンの新たな分類用試薬として用い得るほか、その構造の類似性から、SSEA系糖鎖の有する生理的役割や機能と同様の機能、ないし、これを抑制するなどの調節機能を有することが期待される。
また、当該非天然型糖鎖化合物のうち、2,6sialyl-neoGb5は、メルケル細胞ポリオマーウイルス(MCV)との結合活性を有するので、当該ウイルスの検出等に利用することができる。
また、本発明の方法により、本発明の新規糖鎖化合物を容易に調製することができる。
【図面の簡単な説明】
【0014】
【図1】図1は天然におけるSSEA系糖鎖の相互関係を示す図である。
【図2】図2は本発明のSSEA系新規糖鎖化合物群の合成スキームを示す図である。
【図3】図3はneoGb4の合成スキームを示す図である。
【図4】図4はneoGb5の合成スキームを示す図である。
【図5】図5はsialyl- neoGb5の合成スキームを示す図である。
【図6】図6は2,6 sialyl- neoGb5の合成スキームを示す図である。
【図7】図7は2,6sialyl- neoGb5糖鎖とMCVウイルスとの相互作用を表面プラズモン共鳴(SPR)分析法により解析した図である。縦軸はレゾナンスユニット(RU)、横軸は時間(秒)を示す。
【図8】図8は本発明のSSEA系新規糖鎖化合物群の有機合成に用いるシントンの合成スキームを示す図である。
【図9】図9は本発明のSSEA系新規糖鎖化合物群の有機合成スキームを示す図である。
【発明を実施するための最良の形態】
【0015】
以下に、本発明の実施例を示す。各実施例の実験では、XとしてOを、またRとしてp−メトキシフェニル基を用いたが、XおよびRはこれに限定されない。
また、実施例で用いた具体的な酵素は、以下のとおりである。
β1,3-GlcNacT=β1,3-N-アセチルグルコサミン転移酵素:北海道大学西村研究室で調製したNeisseria由来のもの(J.Org.Chem.2006,71,9609-9621)。
β1,4-GalT=β1,4ガラクトース転移酵素:TOYOBOから市販されているHuman由来のもの(code: BTG-401, EC Number: 2.4.1.22, Glycoconjugate Journal,1995,12,865-878)。
α2,3(N)-SiaT=α2,3シアル酸転移酵素:CalBioChemから市販されているRat由来のもの(cat.No.566218, EC Number: 2.4.99.5, Glycoconjugate Journal,1995,12,755-762)。
α2,6-SiaT=α2,6シアル酸転移酵素:TOYOBOから市販されているHuman由来のもの(code: AST-601, EC Number: 2.4.99.1, Nucleic Acid Research,1990,18,667)。
【実施例1】
【0016】
反応容器に、50mMのTris-HCl(pH7.4)、11.0mg(2mM)のGb3-OMP、6mMのUDP-GlcNac、10mMのMnCl2、10mMのMgCl2および10mU/mlのβ1,3-GlcNacT(Neisseria Meningitidis由来のβ1,3-N-アセチルグルコサミン転移酵素)を収容し(反応容量9ml)、20℃で攪拌することなく静置し、反応をHPLCでモニターした。48時間後にGlcNacβ1-3Gb3(neoGb4)が60%の収率で得られた。ここで、更に20mU/mlのβ1,3-GlcNacTと12mMのUDP-GlcNacを加えると、その6日後には収率88%であった(図3参照)。
【実施例2】
【0017】
反応容器に、50mMのHEPES−NaOH(pH7.5)、8.1mg(1mM)のGlcNacβ1-3Gb3-OMP、3mMのUDP-Gal、10mMのMnCl2、0.01%のTriton X-100および200mU/mlのβ1,4-GalT(TOYOBO社製:human由来のβ1,4ガラクトース転移酵素)を収容し(反応容量10ml)、25℃で攪拌することなく静置し、反応をHPLCでモニターした。3時間後にLacNAcβ1-3Gb3(neoGb5またはneoSSEA-3)が98.5%の収率で得られ、更に、4時間経過後には、反応は完結した(図4参照)。
【実施例3】
【0018】
反応容器に、50mMのHEPES−NaOH(pH7.0)、3.5mg(2mM)のLacNAcβ1-3Gb3-OMP、10mMのCMP-NANA、10mMのMnCl2、0.1%のBSAおよび111mU/mlのα2,3(N)-SiaT(CARBIOCHEM社製:Rat由来のα2,3シアル酸転移酵素)を収容し(反応容量1.8ml)、25℃で攪拌することなく静置し、反応をHPLCでモニターした。Siaα2-3 LacNAcβ1-3Gb3(sialyl-neoGb5またはneoSSEA-4)が得られ、3時間で反応は完結した(図5参照)。
【実施例4】
【0019】
反応容器に、50mMのHEPES−NaOH(pH7.0)、3.5mg(2mM)のLacNAcβ1-3Gb3-OMP、10mMのCMP-NANA、10mMのMnCl2、0.1%のBSAおよび100mU/mlのα2,6-SiaT(TOYOBO社製:human由来のα2,6シアル酸転移酵素)を収容し(反応容量1.8ml)、25℃で攪拌することなく静置し、反応をHPLCでモニターした。3時間後にSiaα2-6 LacNAcβ1-3Gb3(2,6sialyl-neoGb5または2,6neoSSEA-4)が42%の収率で得られた。ここで、更に150mU/mlのα2,6-SiaTと15mMのCMP-NANAを加えると、その26.5時間後には収率99.6%であった(図6参照)。
【実施例5】
【0020】
メルケル細胞ポリオーマウイルス(MCV)と本願の合成糖鎖化合物の結合解析
MCVは2008年皮膚がんの一種であるメルケル細胞がんから発見された新しいポリオーマウイルスであり、メルケル細胞がん、カポシ肉腫などとの関連が知られている。
(1)バキュロウイルスを用いた組換えMCV様粒子の作製
日本人カポシ肉腫患者よりクローン化したMCV遺伝子全長のうちVP1領域遺伝子(1269塩基)をバキュロウイルストランスファーベクターpVL1393へ挿入した。得られたpVLMCVVP1をlinearized baculovirus DNAとともに昆虫細胞Sf9へトランスフェクションし、相同組換えにより組換えバキュロウイルス(AcMCVVP1)を作製した。プラークアッセイにより精製した組換えウイルスからのMCV蛋白の発現をSDS-PAGE電気泳動後のクマシーブルー染色およびウエスタンブロット法で確認した。
AcMCVVP1を昆虫細胞Sf9またはTn5に感染させ1週間培養後の培養上清を10,000xgで1時間遠心し、上清をさらに100,000xgで3時間遠心しMCV様粒子を沈査に回収した。これを4.5 mL培地(EX-CELL)に懸濁した後2.1 gの塩化セシウムを加えた。35,000 rpm、36時間遠心した後、分画操作を行った。浮上密度1.3 g/cm3の分画を回収し、塩化セシウムを除去して精製MCV様粒子(MCV-LP)を得た。
MCV-LPは、本来のウイルス粒子と同様の構造を有しながら、ウイルスゲノムを持たないため増殖性は有していないことから、安全で汎用性の高い構造体である。MCVの診断系開発またワクチン開発への利用が考えられる。
(2)表面プラズモン共鳴(SPR)分析法によるウイルス-糖鎖相互作用の解析
2 mM 1.2-Dimyristoyl-SN-Glycero-3-phosphocholinの0.01M HEPES(pH7.4), 0.15M NaCl緩衝液(HBS-N)に終濃度5%となるよう、Siaα2-6LacNAcβ1-3Gb3などの本願の各糖鎖を有する糖脂質を添加し、超音波破砕法により糖鎖含リポソームを作製した。
バイオセンサーBIAcore2000(GE Healthcare社)のセンサーチップHPAに各糖鎖含リポソームを流速2 uL/分で120 uL流し、さらに5 uLの50 mM NaOH/ HBS-Nを2回、 25 uLのBSA/HBS-Nを1回流して糖鎖含リポソームのセンサーチップへの固定化、及びブロッキングを行った。糖鎖固定化センサーチップに1 ug/uL MCV-LP溶液を20 uL/minで40 uL流した。その後、HBS-Nを2分間流しMCV-LPの糖鎖からの解離を観察した。さらに、50mM NaOHを20uL/分で10uL、BSA 5uL/minを25uL流しリポソーム表面を再生した後、0.5 ug/uL MCV-LPを同様に流した。このように、段階希釈したMCV-LPを順番に流し、糖鎖との結合、解離を解析した。
Siaα2-6LacNAcβ1-3Gb3(2,6 sialyl- neoGb5)は、MCV-LPとの相互作用が認められた(図7参照)。
【0021】
《有機化学法による本発明のSSEA系新規糖鎖化合物群の合成》
実施例1〜4においては、酵素反応を用いて本発明の糖鎖化合物を合成したが、以下の手順を用いれば、これらを有機化学的に合成することも可能である。
(1)単糖合成シントンの調製(図8参照)
化合物1(H. Shimizu et. al, Biosci. Biotech. Biochem., 60, 73-76, 1996)の3位ヒドロキシル基をアセチル化し(Ac2O, Py)、グルコサミン誘導体2とする。
また、ガラクタールから4,6ベンジリデン化(C6H5CH(OCH3)2, TsOH)、レブリノイル化(LevOH, DCC)、脱ベンジリデンと引き続きベンジル化(1) HCl; 2)BnBr, Ag2O)、オスミニウム酸化と引き続きアセチル化(1) OsO4, 2) Ac2O, Py)、チオメチル化(TMSSMe, TMSOTf)にてガラクトース糖供与体3が合成されうる。
同じくガラクタールから、3,4,イソプロピリデン化(acetone, TsOH)、レブリノイル化(LevOH, DCC)、脱イソプロピリデンと引き続きベンジル化(1) HCl; 2)BnBr, Ag2O)、オスミニウム酸化と引き続きアセチル化(1) OsO4, 2) Ac2O, Py)、チオメチル化(TMSSMe, TMSOTf)にてガラクトース糖供与体4が合成されうる。
また、シアル酸シントン5はすでに報告のある化合物である。(T. Murase et. Al, Carbohydr. Res., 184, C1-C4, 1988)
(2)Gb3からの本発明の糖鎖化合物群の合成(図9参照)
東京化成から市販されている化合物6にアリル保護基を脱保護(BuOK, then HCl)して化合物7とする。これに化合物2を活性化剤(PeSePhth-TMSOTfなど)存在下でグリコシル化することにより化合物8が得られ、化合物8を脱保護(1) NH2CH2CH2NH2; 2) Ac2O, MeOH; 3) Pd-C, H2)するとneoGb4が得られる。
さらに、化合物8を塩基処理(NaOMe, MeOH)し化合物9とした後、化合物3と活性化剤(PeSePhth-TMSOTfなど)存在下でグリコシル化することにより化合物10が得られ、脱保護(1) NH2CH2CH2NH2; 2) Ac2O, MeOH; 3) Pd-C, H2)するとneoGb5が得られる。
また、化合物10のレブリノイル基を脱保護(NH2NH2, AcOH)し化合物11とした後、化合物5を活性化剤(DMTSTなど)存在下でグリコシル化することにより得られる化合物12を脱保護(1) NH2CH2CH2NH2; 2) Ac2O, MeOH; 3) Pd-C, H2)するとneoSSEA-4が得られる。
さらに、化合物9と化合物4を活性化剤(PeSePhth-TMSOTfなど)存在下でグリコシル化することにより得られる化合物13のレブリノイル基を脱保護(NH2NH2, AcOH)し化合物14とした後、化合物5を活性化剤(DMTSTなど)存在下でグリコシル化することにより得られる化合物15を脱保護(1) NH2CH2CH2NH2; 2) Ac2O, MeOH; 3) Pd-C, H2)すると2,6neoSSEA-4が得られる。
【技術分野】
【0001】
本発明は、哺乳動物の胚発生に伴い発現が変化することが知られている糖鎖抗原マーカーである、SSEA-3、SSEA-4などのSSEA系糖鎖の新規な構造異性体、および、天然から得られた酵素を用いてこれらの構造異性体を合成する方法に関するものである。
【背景技術】
【0002】
stage-specific embryonic antigen (SSEA)は、胚発生に伴い発現が変化する糖鎖抗原であり、細胞の分化、発生に深く寄与しているといわれる糖鎖である。このうち、SSEA-1は糖タンパク、糖脂質どちらにもみられるが、SSEA-3、SSES-4は、通常、スフィンゴ糖脂質のみに見られる糖鎖抗原であり、細胞膜上のラフトマクロドメインの構成分子となることが知られている(非特許文献1)。
現在、ES細胞やiPS細胞を利用展開した研究が盛んに進められているが、SSEAを抗原マーカーとすることで、これらの分化細胞の状態が検定できる。
【0003】
このように、糖鎖化合物は、生化学的、医科学的研究で非常に活発に利用活用されている化合物群である。その入手はin situで生産されたものを単離精製することで天然から得ることができる他、現在ではin vivoでの細胞法、in vitroでの酵素法や有機化学法により、多くの化合物を人工的に合成することも可能となっている。
また、糖鎖化合物の研究の一手法として、糖鎖の構造を一部変更した非天然型糖鎖化合物を合成し、当該新たな非天然型糖鎖化合物の特性を研究し、天然型糖鎖との比較を行うなども行われている。
【0004】
糖鎖化合物を合成する上述の3種の方法(「細胞法」、「化学法」、「酵素法」)には、それぞれ長所と短所がある。一般に糖鎖化合物には、数多くの立体異性体や結合異性体が存在し得、そのうちの一異性体である所望の糖鎖化合物を選択的に得るためには、合成反応が高度に制御されることが必要であるが、化学法ではこれを実現するために、多段階反応、ヒドロキシル基の選択的保護、脱保護などをおこなう必要がある。一方、酵素法は、基質特異性が高く、立体異性体や結合異性体を生産しないので、その手間が必要ない。また、反応に用いる酵素量は触媒量でよく、産業的に糖鎖生産をする上での利点が多い。
糖鎖合成で利用される酵素は、糖と糖を結合させるグリコシル化反応では、各種「糖転移酵素」や「糖加水分解酵素」が利用される。そのほか、糖鎖を構成する糖単位のヒドロキシル基の修飾反応に利用される、例えば硫酸基導入のための硫酸化酵素などの酵素もある。
【0005】
一方、酵素法の短所としては、酵素反応は分子認識能力、差別化能力が高く、基質特異性が高いゆえに、汎用性に乏しく、基質とする化合物は天然体に限られるのが一般的であることが挙げられる。
したがって、酵素反応で非天然体を含む多様な糖鎖を合成することは、必ずしも容易なことではないのが実情である。
【0006】
【非特許文献1】Trends in Glycoscience andGlycotechnology Vol.20,No.113(2008)pp.131-136
【発明の開示】
【発明が解決しようとする課題】
【0007】
天然のSSEA系糖鎖は、上述のとおり、細胞の分化、発生に深く寄与しているといわれる糖鎖であり、ES細胞やiPS細胞の分化にも役割を果たしていることが推察される。一方で、これらの細胞においては、細胞分化をあるステージで止めるなど、細胞の分化、分裂を調節することができれば、先にあげた細胞を利用する研究の展開がより見込めるが、実際は放っておいてもどんどん分化、分裂がすすみ、細胞分裂を制御することは非常に困難であるという問題がある。
天然のSSEA系糖鎖と構造が類似する糖鎖化合物の中には、天然のSSEA系糖鎖の生理的役割や機能、例えば上述の細胞分化に果たす役割を調節することができるものがあることが期待される。
しかしながら、天然の糖鎖化合物に類似する任意の糖鎖化合物を合成することは、上述のとおり、容易なことではない。
そこで、本発明は、天然のSSEA系糖鎖と構造が類似する非天然型の新規な糖鎖化合物を提供することを課題とし、その中から、天然のSSEA系糖鎖の生理的役割や機能を調節することができるものを提供することをさらなる目標とする。
また、本発明は、糖結合物質であるレクチンの新たな分類用試薬として用い得る、新規な糖鎖化合物を提供することをも、目的とする。
本発明は、また、当該新規な非天然型の糖鎖化合物を容易に調製することができる方法を提供することを課題とする。
【課題を解決するための手段】
【0008】
上記課題を解決するため、本発明は、以下の4種の新規な非天然型糖鎖化合物を提供する。
(1)以下の化学構造式で表される糖鎖化合物。
【化1】

上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である。好適な保護基としては、p−メトキシフェニル基等のアリール基、アルキル基、アリル基、アルキルアジド基、糖基が挙げられる。
この化合物は、天然のSSEA系糖鎖化合物の出発物質である三糖体Gb3(図1参照)を用いれば、GlcNAcβ1-3Gb3と表記することができ、Gb3に結合する糖が天然のGb4(図1参照)と相違する四糖体である (以下、これをneoGb4と称する。)。
(2)以下の化学構造式で表される糖鎖化合物。
【化2】

上記化学構造式中のXおよびRについては、(1)の化学構造式と同様である。
この化合物は、天然のSSEA系糖鎖化合物の出発物質である三糖体Gb3を用いれば、Galβ1-4GlcNAcβ1-3Gb3あるいはLacNAcβ1-3Gb3と表記することができ、Gb3に結合する糖が天然のGb5(SSEA-3とも呼ばれる)(図1参照)と相違する五糖体である (以下、これをneoGb5 あるいはneoSSEA-3 と称する。)。
(3)以下の化学構造式で表される糖鎖化合物。
【化3】

上記化学構造式中のXおよびRについては、(1)の化学構造式と同様である。
この化合物は、天然のSSEA系糖鎖化合物の出発物質である三糖体Gb3を用いれば、Siaα2-3Galβ1-4GlcNAcβ1-3Gb3 あるいはSiaα2-3LacNAcβ1-3Gb3と表記することができ、Gb3に結合する糖が天然のsialyl Gb5(SSEA-4とも呼ばれる)(図1参照)と相違する六糖体である (以下、これをsialyl-neoGb5 あるいはneoSSEA-4と称する。)。)
(4)以下の化学構造式で表される糖鎖化合物。
【化4】

上記化学構造式中のXおよびRについては、(1)の化学構造式と同様である。
この化合物は、天然のSSEA系糖鎖化合物の出発物質である三糖体Gb3を用いれば、Siaα2-6Galβ1-4GlcNAcβ1-3Gb3 あるいはSiaα2-6LacNAcβ1-3Gb3と表記することができ、Gb3に結合する糖および末端のシアリル酸(Sia)の結合位置が天然のsialyl Gb5(SSEA-4とも呼ばれる)と相違する六糖体である (以下、これを2,6sialyl-neoGb5 あるいは2,6neoSSEA-4と称する。)。
これらは、いずれも未だ報告されたことのない、新規な非天然型糖鎖化合物である。
【0009】
天然のSSEA系糖鎖においては、Gb3(PK抗原)に、GalNAcが付加してGb4(P抗原)が生成し、これに、Galが付加してGb5(SSEA-3)が生成し、これに、NeuAc(Sia)が付加してsialylGb5(SSEA-4)が生成する(図1参照)。
【0010】
これに対し、我々は、適切な酵素を用いて、天然のGb3(PK抗原)に、GlcNAcを付加させれば、neo Gb4が生成し、これに、Galを付加させれば、neo Gb5(neo SSEA-3)が生成し、更に、これに、NeuAc(Sia)を付加させれば、sialyl-neoGb5(neoSSEA-4)と2,6sialyl-neoGb5(2,6neoSSEA-4)が生成することを見出し(図2参照)、本発明を完成した(詳細は実施例1〜4参照)。
【0011】
したがって、本発明は、また、上記4種の新規な非天然型糖鎖化合物を酵素反応を利用して調製する、以下の4種の新規な非天然型糖鎖化合物の製造方法を提供する。
(1)Gb3+UDP-GlcNAc(酵素β1,3-GlcNacTを使用)→ GlcNAcβ1-3Gb3
(2)GlcNAcβ1-3Gb3+UDP-Gal(酵素β1,4-GalTを使用)→ Galβ1-4GlcNAcβ1-3Gb3
(3)Galβ1-4GlcNAcβ1-3Gb3+CMP-NeuAc (CMP-NANA)(酵素α2,3(N)-SiaTを使用)
→ Siaα2-3Galβ1-4GlcNAcβ1-3Gb3
(4)Galβ1-4GlcNAcβ1-3Gb3+CMP-NeuAc (CMP-NANA)(酵素α2,6-SiaTを使用)
→ Siaα2-6Galβ1-4GlcNAcβ1-3Gb3
【0012】
上記非天然型糖鎖化合物は、糖結合物質であるレクチンの新たな分類用試薬として用い得るほか、細胞の分化発生に関与し、初期胚におけるStage-Specific Embryonic Antigens (SSEA)抗原として知られている、Gb4、Gb5(SSEA-3)、sialylGb5(SSEA-4)に非常に似た構造を有しているから、これらSSEA系糖鎖の有する生理的役割や機能と同様の機能、ないし、これを抑制するなどの調節機能を有することが期待される。
また、これらの非天然型糖鎖化合物のうち、2,6sialyl-neoGb5については、メルケル細胞ポリオマーウイルス(MCV)との結合活性を有することが確認されている(実施例5参照)。
【発明の効果】
【0013】
本発明により、近年非常に注目されているSSEA抗原に極めて構造が似た、非天然型糖鎖化合物が提供される。当該非天然型糖鎖化合物は、糖結合物質であるレクチンの新たな分類用試薬として用い得るほか、その構造の類似性から、SSEA系糖鎖の有する生理的役割や機能と同様の機能、ないし、これを抑制するなどの調節機能を有することが期待される。
また、当該非天然型糖鎖化合物のうち、2,6sialyl-neoGb5は、メルケル細胞ポリオマーウイルス(MCV)との結合活性を有するので、当該ウイルスの検出等に利用することができる。
また、本発明の方法により、本発明の新規糖鎖化合物を容易に調製することができる。
【図面の簡単な説明】
【0014】
【図1】図1は天然におけるSSEA系糖鎖の相互関係を示す図である。
【図2】図2は本発明のSSEA系新規糖鎖化合物群の合成スキームを示す図である。
【図3】図3はneoGb4の合成スキームを示す図である。
【図4】図4はneoGb5の合成スキームを示す図である。
【図5】図5はsialyl- neoGb5の合成スキームを示す図である。
【図6】図6は2,6 sialyl- neoGb5の合成スキームを示す図である。
【図7】図7は2,6sialyl- neoGb5糖鎖とMCVウイルスとの相互作用を表面プラズモン共鳴(SPR)分析法により解析した図である。縦軸はレゾナンスユニット(RU)、横軸は時間(秒)を示す。
【図8】図8は本発明のSSEA系新規糖鎖化合物群の有機合成に用いるシントンの合成スキームを示す図である。
【図9】図9は本発明のSSEA系新規糖鎖化合物群の有機合成スキームを示す図である。
【発明を実施するための最良の形態】
【0015】
以下に、本発明の実施例を示す。各実施例の実験では、XとしてOを、またRとしてp−メトキシフェニル基を用いたが、XおよびRはこれに限定されない。
また、実施例で用いた具体的な酵素は、以下のとおりである。
β1,3-GlcNacT=β1,3-N-アセチルグルコサミン転移酵素:北海道大学西村研究室で調製したNeisseria由来のもの(J.Org.Chem.2006,71,9609-9621)。
β1,4-GalT=β1,4ガラクトース転移酵素:TOYOBOから市販されているHuman由来のもの(code: BTG-401, EC Number: 2.4.1.22, Glycoconjugate Journal,1995,12,865-878)。
α2,3(N)-SiaT=α2,3シアル酸転移酵素:CalBioChemから市販されているRat由来のもの(cat.No.566218, EC Number: 2.4.99.5, Glycoconjugate Journal,1995,12,755-762)。
α2,6-SiaT=α2,6シアル酸転移酵素:TOYOBOから市販されているHuman由来のもの(code: AST-601, EC Number: 2.4.99.1, Nucleic Acid Research,1990,18,667)。
【実施例1】
【0016】
反応容器に、50mMのTris-HCl(pH7.4)、11.0mg(2mM)のGb3-OMP、6mMのUDP-GlcNac、10mMのMnCl2、10mMのMgCl2および10mU/mlのβ1,3-GlcNacT(Neisseria Meningitidis由来のβ1,3-N-アセチルグルコサミン転移酵素)を収容し(反応容量9ml)、20℃で攪拌することなく静置し、反応をHPLCでモニターした。48時間後にGlcNacβ1-3Gb3(neoGb4)が60%の収率で得られた。ここで、更に20mU/mlのβ1,3-GlcNacTと12mMのUDP-GlcNacを加えると、その6日後には収率88%であった(図3参照)。
【実施例2】
【0017】
反応容器に、50mMのHEPES−NaOH(pH7.5)、8.1mg(1mM)のGlcNacβ1-3Gb3-OMP、3mMのUDP-Gal、10mMのMnCl2、0.01%のTriton X-100および200mU/mlのβ1,4-GalT(TOYOBO社製:human由来のβ1,4ガラクトース転移酵素)を収容し(反応容量10ml)、25℃で攪拌することなく静置し、反応をHPLCでモニターした。3時間後にLacNAcβ1-3Gb3(neoGb5またはneoSSEA-3)が98.5%の収率で得られ、更に、4時間経過後には、反応は完結した(図4参照)。
【実施例3】
【0018】
反応容器に、50mMのHEPES−NaOH(pH7.0)、3.5mg(2mM)のLacNAcβ1-3Gb3-OMP、10mMのCMP-NANA、10mMのMnCl2、0.1%のBSAおよび111mU/mlのα2,3(N)-SiaT(CARBIOCHEM社製:Rat由来のα2,3シアル酸転移酵素)を収容し(反応容量1.8ml)、25℃で攪拌することなく静置し、反応をHPLCでモニターした。Siaα2-3 LacNAcβ1-3Gb3(sialyl-neoGb5またはneoSSEA-4)が得られ、3時間で反応は完結した(図5参照)。
【実施例4】
【0019】
反応容器に、50mMのHEPES−NaOH(pH7.0)、3.5mg(2mM)のLacNAcβ1-3Gb3-OMP、10mMのCMP-NANA、10mMのMnCl2、0.1%のBSAおよび100mU/mlのα2,6-SiaT(TOYOBO社製:human由来のα2,6シアル酸転移酵素)を収容し(反応容量1.8ml)、25℃で攪拌することなく静置し、反応をHPLCでモニターした。3時間後にSiaα2-6 LacNAcβ1-3Gb3(2,6sialyl-neoGb5または2,6neoSSEA-4)が42%の収率で得られた。ここで、更に150mU/mlのα2,6-SiaTと15mMのCMP-NANAを加えると、その26.5時間後には収率99.6%であった(図6参照)。
【実施例5】
【0020】
メルケル細胞ポリオーマウイルス(MCV)と本願の合成糖鎖化合物の結合解析
MCVは2008年皮膚がんの一種であるメルケル細胞がんから発見された新しいポリオーマウイルスであり、メルケル細胞がん、カポシ肉腫などとの関連が知られている。
(1)バキュロウイルスを用いた組換えMCV様粒子の作製
日本人カポシ肉腫患者よりクローン化したMCV遺伝子全長のうちVP1領域遺伝子(1269塩基)をバキュロウイルストランスファーベクターpVL1393へ挿入した。得られたpVLMCVVP1をlinearized baculovirus DNAとともに昆虫細胞Sf9へトランスフェクションし、相同組換えにより組換えバキュロウイルス(AcMCVVP1)を作製した。プラークアッセイにより精製した組換えウイルスからのMCV蛋白の発現をSDS-PAGE電気泳動後のクマシーブルー染色およびウエスタンブロット法で確認した。
AcMCVVP1を昆虫細胞Sf9またはTn5に感染させ1週間培養後の培養上清を10,000xgで1時間遠心し、上清をさらに100,000xgで3時間遠心しMCV様粒子を沈査に回収した。これを4.5 mL培地(EX-CELL)に懸濁した後2.1 gの塩化セシウムを加えた。35,000 rpm、36時間遠心した後、分画操作を行った。浮上密度1.3 g/cm3の分画を回収し、塩化セシウムを除去して精製MCV様粒子(MCV-LP)を得た。
MCV-LPは、本来のウイルス粒子と同様の構造を有しながら、ウイルスゲノムを持たないため増殖性は有していないことから、安全で汎用性の高い構造体である。MCVの診断系開発またワクチン開発への利用が考えられる。
(2)表面プラズモン共鳴(SPR)分析法によるウイルス-糖鎖相互作用の解析
2 mM 1.2-Dimyristoyl-SN-Glycero-3-phosphocholinの0.01M HEPES(pH7.4), 0.15M NaCl緩衝液(HBS-N)に終濃度5%となるよう、Siaα2-6LacNAcβ1-3Gb3などの本願の各糖鎖を有する糖脂質を添加し、超音波破砕法により糖鎖含リポソームを作製した。
バイオセンサーBIAcore2000(GE Healthcare社)のセンサーチップHPAに各糖鎖含リポソームを流速2 uL/分で120 uL流し、さらに5 uLの50 mM NaOH/ HBS-Nを2回、 25 uLのBSA/HBS-Nを1回流して糖鎖含リポソームのセンサーチップへの固定化、及びブロッキングを行った。糖鎖固定化センサーチップに1 ug/uL MCV-LP溶液を20 uL/minで40 uL流した。その後、HBS-Nを2分間流しMCV-LPの糖鎖からの解離を観察した。さらに、50mM NaOHを20uL/分で10uL、BSA 5uL/minを25uL流しリポソーム表面を再生した後、0.5 ug/uL MCV-LPを同様に流した。このように、段階希釈したMCV-LPを順番に流し、糖鎖との結合、解離を解析した。
Siaα2-6LacNAcβ1-3Gb3(2,6 sialyl- neoGb5)は、MCV-LPとの相互作用が認められた(図7参照)。
【0021】
《有機化学法による本発明のSSEA系新規糖鎖化合物群の合成》
実施例1〜4においては、酵素反応を用いて本発明の糖鎖化合物を合成したが、以下の手順を用いれば、これらを有機化学的に合成することも可能である。
(1)単糖合成シントンの調製(図8参照)
化合物1(H. Shimizu et. al, Biosci. Biotech. Biochem., 60, 73-76, 1996)の3位ヒドロキシル基をアセチル化し(Ac2O, Py)、グルコサミン誘導体2とする。
また、ガラクタールから4,6ベンジリデン化(C6H5CH(OCH3)2, TsOH)、レブリノイル化(LevOH, DCC)、脱ベンジリデンと引き続きベンジル化(1) HCl; 2)BnBr, Ag2O)、オスミニウム酸化と引き続きアセチル化(1) OsO4, 2) Ac2O, Py)、チオメチル化(TMSSMe, TMSOTf)にてガラクトース糖供与体3が合成されうる。
同じくガラクタールから、3,4,イソプロピリデン化(acetone, TsOH)、レブリノイル化(LevOH, DCC)、脱イソプロピリデンと引き続きベンジル化(1) HCl; 2)BnBr, Ag2O)、オスミニウム酸化と引き続きアセチル化(1) OsO4, 2) Ac2O, Py)、チオメチル化(TMSSMe, TMSOTf)にてガラクトース糖供与体4が合成されうる。
また、シアル酸シントン5はすでに報告のある化合物である。(T. Murase et. Al, Carbohydr. Res., 184, C1-C4, 1988)
(2)Gb3からの本発明の糖鎖化合物群の合成(図9参照)
東京化成から市販されている化合物6にアリル保護基を脱保護(BuOK, then HCl)して化合物7とする。これに化合物2を活性化剤(PeSePhth-TMSOTfなど)存在下でグリコシル化することにより化合物8が得られ、化合物8を脱保護(1) NH2CH2CH2NH2; 2) Ac2O, MeOH; 3) Pd-C, H2)するとneoGb4が得られる。
さらに、化合物8を塩基処理(NaOMe, MeOH)し化合物9とした後、化合物3と活性化剤(PeSePhth-TMSOTfなど)存在下でグリコシル化することにより化合物10が得られ、脱保護(1) NH2CH2CH2NH2; 2) Ac2O, MeOH; 3) Pd-C, H2)するとneoGb5が得られる。
また、化合物10のレブリノイル基を脱保護(NH2NH2, AcOH)し化合物11とした後、化合物5を活性化剤(DMTSTなど)存在下でグリコシル化することにより得られる化合物12を脱保護(1) NH2CH2CH2NH2; 2) Ac2O, MeOH; 3) Pd-C, H2)するとneoSSEA-4が得られる。
さらに、化合物9と化合物4を活性化剤(PeSePhth-TMSOTfなど)存在下でグリコシル化することにより得られる化合物13のレブリノイル基を脱保護(NH2NH2, AcOH)し化合物14とした後、化合物5を活性化剤(DMTSTなど)存在下でグリコシル化することにより得られる化合物15を脱保護(1) NH2CH2CH2NH2; 2) Ac2O, MeOH; 3) Pd-C, H2)すると2,6neoSSEA-4が得られる。
【特許請求の範囲】
【請求項1】
以下の化学構造式GlcNAcβ1-3Gb3で表される糖鎖化合物neoGb4。
【化1】

(上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である)
【請求項2】
以下の化学構造式Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物neoGb5(neoSSEA-3)。
【化2】

(上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である)
【請求項3】
以下の化学構造式Siaα2-3Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物sialyl-neoGb5(neoSSEA-4)。
【化3】

(上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である)
【請求項4】
以下の化学構造式Siaα2-6Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物2,6sialyl-neoGb5(2,6neoSSEA-4)。
【化4】

(上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である)
【請求項5】
以下の反応式で表される酵素反応により、化学構造式GlcNAcβ1-3Gb3で表される糖鎖化合物neoGb4を製造する方法。
Gb3+UDP-GlcNAc(酵素β1,3-GlcNacTの存在下)→ GlcNAcβ1-3Gb3
【請求項6】
以下の反応式で表される酵素反応により、化学構造式Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物neoGb5(neoSSEA-3)を製造する方法。
GlcNAcβ1-3Gb3+UDP-Gal(酵素β1,4-GalTの存在下)→ Galβ1-4GlcNAcβ1-3Gb3
【請求項7】
以下の反応式で表される酵素反応により、化学構造式Siaα2-3Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物sialyl-neoGb5(neoSSEA-4)を製造する方法。
Galβ1-4GlcNAcβ1-3Gb3+CMP-NeuAc (CMP-NANA)(酵素α2,3(N)-SiaTの存在下)
→ Siaα2-3Galβ1-4GlcNAcβ1-3Gb3
【請求項8】
以下の反応式で表される酵素反応により、化学構造式Siaα2-6Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物2,6sialyl-neoGb5(2,6neoSSEA-4)を製造する方法。
Galβ1-4GlcNAcβ1-3Gb3+CMP-NeuAc (CMP-NANA)(酵素α2,6-SiaTの存在下)
→ Siaα2-6Galβ1-4GlcNAcβ1-3Gb3
【請求項1】
以下の化学構造式GlcNAcβ1-3Gb3で表される糖鎖化合物neoGb4。
【化1】

(上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である)
【請求項2】
以下の化学構造式Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物neoGb5(neoSSEA-3)。
【化2】

(上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である)
【請求項3】
以下の化学構造式Siaα2-3Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物sialyl-neoGb5(neoSSEA-4)。
【化3】

(上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である)
【請求項4】
以下の化学構造式Siaα2-6Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物2,6sialyl-neoGb5(2,6neoSSEA-4)。
【化4】

(上記化学構造式中のXはO、S、NHまたはCH2であり、Rは保護基である)
【請求項5】
以下の反応式で表される酵素反応により、化学構造式GlcNAcβ1-3Gb3で表される糖鎖化合物neoGb4を製造する方法。
Gb3+UDP-GlcNAc(酵素β1,3-GlcNacTの存在下)→ GlcNAcβ1-3Gb3
【請求項6】
以下の反応式で表される酵素反応により、化学構造式Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物neoGb5(neoSSEA-3)を製造する方法。
GlcNAcβ1-3Gb3+UDP-Gal(酵素β1,4-GalTの存在下)→ Galβ1-4GlcNAcβ1-3Gb3
【請求項7】
以下の反応式で表される酵素反応により、化学構造式Siaα2-3Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物sialyl-neoGb5(neoSSEA-4)を製造する方法。
Galβ1-4GlcNAcβ1-3Gb3+CMP-NeuAc (CMP-NANA)(酵素α2,3(N)-SiaTの存在下)
→ Siaα2-3Galβ1-4GlcNAcβ1-3Gb3
【請求項8】
以下の反応式で表される酵素反応により、化学構造式Siaα2-6Galβ1-4GlcNAcβ1-3Gb3で表される糖鎖化合物2,6sialyl-neoGb5(2,6neoSSEA-4)を製造する方法。
Galβ1-4GlcNAcβ1-3Gb3+CMP-NeuAc (CMP-NANA)(酵素α2,6-SiaTの存在下)
→ Siaα2-6Galβ1-4GlcNAcβ1-3Gb3
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2011−32206(P2011−32206A)
【公開日】平成23年2月17日(2011.2.17)
【国際特許分類】
【出願番号】特願2009−179705(P2009−179705)
【出願日】平成21年7月31日(2009.7.31)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度 独立行政法人新エネルギー・産業技術総合開発機構「健康安心イノベーションプログラム/糖鎖機能活用技術開発」 産業技術力強化法第19条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成23年2月17日(2011.2.17)
【国際特許分類】
【出願日】平成21年7月31日(2009.7.31)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度 独立行政法人新エネルギー・産業技術総合開発機構「健康安心イノベーションプログラム/糖鎖機能活用技術開発」 産業技術力強化法第19条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

