STI−571に対する耐性に関連するBCR−ABLチロシンキナーゼの変異
【課題】CMLおよび関連する癌におけるSTI-571を投与した患者で観察されるSTI-571耐性に関連する機構、ならびに診断法および治療法の提供。
【解決手段】STI-571に対する耐性に関連する変異体(Mutants Associated with Resistance to STI-571)(例えばT315I Bcr-Abl)と呼ばれる新規の遺伝子、および、これにコードされるタンパク質、また診断法および治療法、ならびにMARSを発現するさまざまな癌の管理に有用な組成物。MARSに結合、および/またはその機能活性を調節する分子を同定する。
【解決手段】STI-571に対する耐性に関連する変異体(Mutants Associated with Resistance to STI-571)(例えばT315I Bcr-Abl)と呼ばれる新規の遺伝子、および、これにコードされるタンパク質、また診断法および治療法、ならびにMARSを発現するさまざまな癌の管理に有用な組成物。MARSに結合、および/またはその機能活性を調節する分子を同定する。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
ヒト癌細胞で発現される少なくとも1つのBcr-Ablポリペプチドのポリペプチド配列を決定する段階、ならびにヒト癌細胞で発現されるBcr-Ablポリペプチドのポリペプチド配列を、配列番号:1に示されたBcr-Ablポリペプチド配列と比較することで、ヒト癌細胞で発現されるBcr-Ablポリペプチドのアミノ酸の置換が同定可能な段階を含む、チロシンキナーゼ阻害剤を用いる治療対象として選択された被験者に由来するヒト癌細胞で発現される少なくとも1つのBcr-Ablポリペプチド中のアミノ酸の置換を同定する方法。
【請求項2】
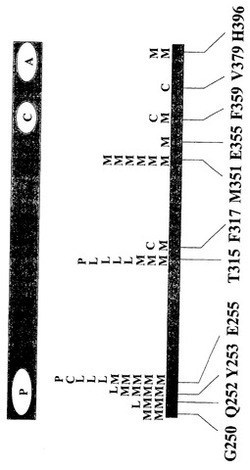
アミノ酸の置換が、残基D233〜残基T406を含む配列番号:1に示されたBcr-Ablポリペプチド配列の領域に存在する、請求項1記載の方法。
【請求項3】
アミノ酸の置換が、Pループ(配列番号:1に示されたBcr-Ablポリペプチド配列の残基G249〜残基V256)、ヘリックスC(配列番号:1に示されたBcr-Ablポリペプチド配列の残基E279〜残基I293)、触媒ドメイン(配列番号:1に示されたBcr-Ablポリペプチド配列の残基H361〜残基R367)、または活性化ループ(配列番号:1に示されたBcr-Ablポリペプチド配列の残基A380〜残基P402)に存在する、請求項2記載の方法。
【請求項4】
アミノ酸の置換が残基

に存在する、請求項2記載の方法。
【請求項5】
アミノ酸の置換が

である、請求項4記載の方法。
【請求項6】
アミノ酸の置換が残基

に存在する、請求項4記載の方法。
【請求項7】
アミノ酸の置換が残基

に存在する、請求項4記載の方法。
【請求項8】
アミノ酸の置換が残基E255に存在しない、請求項4記載の方法。
【請求項9】
キナーゼ阻害剤が2-フェニルアミノピリミジンである、請求項1記載の方法。
【請求項10】
アミノ酸の置換が、STI-571によるチロシンキナーゼ活性の阻害に対する耐性をもたらす、請求項9記載の方法。
【請求項11】
ヒト癌細胞で発現される少なくとも1つのBcr-Ablポリペプチドのポリペプチド配列が、Bcr-Ablポリペプチドをコードする、ヒト癌細胞で発現されるポリヌクレオチドのヌクレオチド配列を決定することで決定される、請求項1記載の方法。
【請求項12】
ヒト癌細胞で発現されるBcr-Ablポリヌクレオチドがポリメラーゼ連鎖反応によって単離される、請求項11記載の方法。
【請求項13】
哺乳類細胞で発現される少なくとも1つのBcr-Ablポリヌクレオチドの配列を決定する段階、ならびにBcr-Ablポリヌクレオチドの配列を、配列番号:1に示されたポリペプチド配列をコードするBcr-Ablポリヌクレオチド配列と比較する段階(Bcr-Ablポリヌクレオチド中の変異が、配列番号:1に示されたポリペプチド配列の

の位置のアミノ酸残基における変化を含む)を含む、哺乳類細胞内のBcr-Ablポリヌクレオチド中の変異を同定する方法(Bcr-Ablポリヌクレオチド中の変異が、2-フェニルアミノピリミジンによるBcr-Ablチロシンキナーゼ活性の阻害に対する耐性と関連する)。
【請求項14】
哺乳類細胞がヒト癌細胞である、請求項13記載の方法。
【請求項15】
ヒト癌細胞が慢性骨髄性白血病細胞である、請求項14記載の方法。
【請求項16】
ヒト癌細胞を、STI-571を投与した被験者から得る、請求項14記載の方法。
【請求項17】
置換変異が、残基

に存在する、請求項13記載の方法。
【請求項18】
置換変異が、残基E255に存在しない、請求項17記載の方法。
【請求項19】
2-フェニルアミノピリミジンがSTI-571である、請求項13記載の方法。
【請求項20】
ヒト癌細胞で発現されるBcr-Ablポリペプチドのアミノ酸の置換が、STI-571によるチロシンキナーゼ活性の阻害に対する耐性をもたらす、請求項19記載の方法。
【請求項21】
ヒト癌細胞で発現される少なくとも1つのBcr-Ablポリペプチドのポリペプチド配列が、Bcr-Ablポリペプチドをコードする、ヒト癌細胞で発現されるポリヌクレオチドの配列を決定することで決定される、請求項13記載の方法(ヒト癌細胞で発現されるBcr-Ablポリヌクレオチドが、ポリメラーゼ連鎖反応で単離される)。
【請求項22】
以下の段階を含む、哺乳類癌細胞で発現される変異型アベルソンタンパク質チロシンキナーゼの同定法:
(a)細胞で発現されるアベルソンタンパク質チロシンキナーゼのキナーゼドメインをコードするポリヌクレオチドの一部のヌクレオチド配列を決定する段階;ならびに
(b)このように決定されたヌクレオチド配列を、アベルソンタンパク質チロシンキナーゼの野生型の配列と比較することで、変異型アベルソンタンパク質チロシンキナーゼ中のアミノ酸の置換の有無を判定する段階(このように同定された任意のアミノ酸の置換が、アベルソンタンパク質チロシンキナーゼのポリペプチド配列内に、WU-BLAST-2解析の相同性パラメータを用いて決定可能なように、2-フェニルアミノピリミジンによるチロシンキナーゼ活性の阻害に対する耐性と関連することがわかっている、配列番号:1に示されたC-Ablタンパク質キナーゼにおけるアミノ酸の置換と同じ相対位置に位置するアミノ酸残基に存在するという特性をもつ)。
【請求項23】
変異型アベルソンタンパク質チロシンキナーゼを発現する細胞が、2-フェニルアミノピリミジン曝露後にチロシンキナーゼ活性の阻害に対して耐性を示すことが観察される哺乳類癌細胞の集団内に見出される、請求項22記載の方法。
【請求項24】
哺乳類癌細胞が、2-フェニルアミノピリミジンを含むチロシンキナーゼ阻害剤を用いる治療対象として選択された被験者から得られたヒト癌細胞である、請求項22記載の方法。
【請求項25】
2-フェニルアミノピリミジンによるチロシンキナーゼ活性の阻害に対する耐性と関連することがわかっている、配列番号:1に示されたC-Ablタンパク質キナーゼの変異が、アミノ酸残基

と同じ相対位置に存在する、請求項22記載の方法。
【請求項26】
アミノ酸の置換が、アミノ酸残基

と同じ相対位置に存在する、請求項25記載の方法。
【請求項27】
アミノ酸の置換が、STI-571によるチロシンキナーゼ活性の阻害に対する耐性をもたらす、請求項22記載の方法。
【請求項28】
細胞で発現される変異型アベルソンチロシンキナーゼが、変異型c-Abl、Bcr-Abl、PDGFR、c-kit、TEL-Abl、またはTEL-PDGFRである、請求項22記載の方法。
【請求項29】
異なる個体に由来する別の哺乳類癌細胞を対象に段階(a)〜(b)を繰り返す段階;ならびに
(c)哺乳類癌細胞中に存在する変異型アベルソンタンパク質チロシンキナーゼ中に見出される変異のカタログを作成する段階をさらに含む、請求項22記載の方法。
【請求項30】
以下の段階を含む、変異型Bcr-Ablのポリペプチドに特異的に結合する化合物を同定する方法(Bcr-Ablポリペプチドが、残基D233〜残基T406を含む配列番号:1に示されたBcr-Ablポリペプチド配列の領域に存在するアミノ酸の置換を含む):変異型Bcr-Ablのポリペプチドに被験化合物を、結合が起こりやすい条件で接触させる段階;ならびに被験化合物が、変異型Bcr-Ablのポリペプチドに特異的に結合するか否かを判定して、変異型Bcr-Ablのポリペプチドに結合する化合物が同定可能な段階。
【請求項31】
アミノ酸の置換が残基

に存在する、請求項30記載の方法。
【請求項32】
アミノ酸の置換が

である、請求項31記載の方法。
【請求項33】
アミノ酸の置換が残基

に存在する、請求項30記載の方法。
【請求項34】
アミノ酸の置換が残基

に存在する、請求項30記載の方法。
【請求項35】
アミノ酸の置換が残基E255に存在しない、請求項30記載の方法。
【請求項36】
化合物が2-フェニルアミノピリミジンである、請求項30記載の方法。
【請求項37】
以下の段階を含む、被験化合物が、変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性を阻害するか否かを判定する段階をさらに含む、請求項30記載の方法:
哺乳類細胞に、変異型Bcr-Ablのポリペプチドをコードするコンストラクトをトランスフェクトする段階;
哺乳類細胞に、被験化合物を接触させる段階;ならびに
変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性に関して、哺乳類細胞をモニタリングする段階(被験化合物の非存在下と比較することで、被験化合物の存在下でチロシンキナーゼ活性の阻害が認められれば、被験化合物が変異型Bcr-Ablのポリペプチドの阻害剤であることがわかる)。
【請求項38】
アミノ酸の置換が残基T315に存在する、請求項37記載の方法。
【請求項39】
変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性を、Crklのホスホチロシン量を調べることで測定する、請求項37記載の方法。
【請求項40】
以下の段階を含む、被験化合物が、変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性を阻害するか否かを判定する方法(Bcr-Ablポリペプチドが、残基D233〜残基T406を含む、配列番号:1に示されたBcr-Ablポリペプチド配列の領域に存在するアミノ酸の置換を含む):
哺乳類細胞に、変異型Bcr-Ablのポリペプチドをコードするコンストラクトをトランスフェクトして、変異型Bcr-Ablのポリペプチドを哺乳類細胞で発現させる段階;
哺乳類細胞に被験化合物を接触させる段階;ならびに
変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性に関して、哺乳類細胞をモニタリングする段階(被験化合物の非存在下と比較することで、被験化合物の存在下でチロシンキナーゼ活性の阻害が認められれば、被験化合物が変異型Bcr-Ablのポリペプチドの阻害剤であることがわかる。
【請求項41】
変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性を、Crklのホスホチロシン量を調べることで測定する、請求項40記載の方法。
【請求項42】
変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性を、抗ホスホチロシン抗体を用いるウエスタンブロット解析で測定して、哺乳類細胞の可溶化液のホスホチロシン量を調べる、請求項40記載の方法。
【請求項43】
哺乳類細胞が293-T細胞である、請求項40記載の方法。
【請求項44】
アミノ酸の置換が残基

に存在する、請求項40記載の方法。
【請求項45】
アミノ酸の置換が

である、請求項44記載の方法。
【請求項46】
アミノ酸の置換が残基

に存在する、請求項40記載の方法。
【請求項47】
アミノ酸の置換が残基

に存在する、請求項40記載の方法。
【請求項48】
アミノ酸の置換が残基E255に存在しない、請求項40記載の方法。
【請求項49】
化合物が2-フェニルアミノピリミジンである、請求項40記載の方法。
【請求項50】
化合物がピリド[2,3-d]ピリミジンである、請求項40記載の方法。
【請求項1】
ヒト癌細胞で発現される少なくとも1つのBcr-Ablポリペプチドのポリペプチド配列を決定する段階、ならびにヒト癌細胞で発現されるBcr-Ablポリペプチドのポリペプチド配列を、配列番号:1に示されたBcr-Ablポリペプチド配列と比較することで、ヒト癌細胞で発現されるBcr-Ablポリペプチドのアミノ酸の置換が同定可能な段階を含む、チロシンキナーゼ阻害剤を用いる治療対象として選択された被験者に由来するヒト癌細胞で発現される少なくとも1つのBcr-Ablポリペプチド中のアミノ酸の置換を同定する方法。
【請求項2】
アミノ酸の置換が、残基D233〜残基T406を含む配列番号:1に示されたBcr-Ablポリペプチド配列の領域に存在する、請求項1記載の方法。
【請求項3】
アミノ酸の置換が、Pループ(配列番号:1に示されたBcr-Ablポリペプチド配列の残基G249〜残基V256)、ヘリックスC(配列番号:1に示されたBcr-Ablポリペプチド配列の残基E279〜残基I293)、触媒ドメイン(配列番号:1に示されたBcr-Ablポリペプチド配列の残基H361〜残基R367)、または活性化ループ(配列番号:1に示されたBcr-Ablポリペプチド配列の残基A380〜残基P402)に存在する、請求項2記載の方法。
【請求項4】
アミノ酸の置換が残基

に存在する、請求項2記載の方法。
【請求項5】
アミノ酸の置換が

である、請求項4記載の方法。
【請求項6】
アミノ酸の置換が残基

に存在する、請求項4記載の方法。
【請求項7】
アミノ酸の置換が残基

に存在する、請求項4記載の方法。
【請求項8】
アミノ酸の置換が残基E255に存在しない、請求項4記載の方法。
【請求項9】
キナーゼ阻害剤が2-フェニルアミノピリミジンである、請求項1記載の方法。
【請求項10】
アミノ酸の置換が、STI-571によるチロシンキナーゼ活性の阻害に対する耐性をもたらす、請求項9記載の方法。
【請求項11】
ヒト癌細胞で発現される少なくとも1つのBcr-Ablポリペプチドのポリペプチド配列が、Bcr-Ablポリペプチドをコードする、ヒト癌細胞で発現されるポリヌクレオチドのヌクレオチド配列を決定することで決定される、請求項1記載の方法。
【請求項12】
ヒト癌細胞で発現されるBcr-Ablポリヌクレオチドがポリメラーゼ連鎖反応によって単離される、請求項11記載の方法。
【請求項13】
哺乳類細胞で発現される少なくとも1つのBcr-Ablポリヌクレオチドの配列を決定する段階、ならびにBcr-Ablポリヌクレオチドの配列を、配列番号:1に示されたポリペプチド配列をコードするBcr-Ablポリヌクレオチド配列と比較する段階(Bcr-Ablポリヌクレオチド中の変異が、配列番号:1に示されたポリペプチド配列の

の位置のアミノ酸残基における変化を含む)を含む、哺乳類細胞内のBcr-Ablポリヌクレオチド中の変異を同定する方法(Bcr-Ablポリヌクレオチド中の変異が、2-フェニルアミノピリミジンによるBcr-Ablチロシンキナーゼ活性の阻害に対する耐性と関連する)。
【請求項14】
哺乳類細胞がヒト癌細胞である、請求項13記載の方法。
【請求項15】
ヒト癌細胞が慢性骨髄性白血病細胞である、請求項14記載の方法。
【請求項16】
ヒト癌細胞を、STI-571を投与した被験者から得る、請求項14記載の方法。
【請求項17】
置換変異が、残基

に存在する、請求項13記載の方法。
【請求項18】
置換変異が、残基E255に存在しない、請求項17記載の方法。
【請求項19】
2-フェニルアミノピリミジンがSTI-571である、請求項13記載の方法。
【請求項20】
ヒト癌細胞で発現されるBcr-Ablポリペプチドのアミノ酸の置換が、STI-571によるチロシンキナーゼ活性の阻害に対する耐性をもたらす、請求項19記載の方法。
【請求項21】
ヒト癌細胞で発現される少なくとも1つのBcr-Ablポリペプチドのポリペプチド配列が、Bcr-Ablポリペプチドをコードする、ヒト癌細胞で発現されるポリヌクレオチドの配列を決定することで決定される、請求項13記載の方法(ヒト癌細胞で発現されるBcr-Ablポリヌクレオチドが、ポリメラーゼ連鎖反応で単離される)。
【請求項22】
以下の段階を含む、哺乳類癌細胞で発現される変異型アベルソンタンパク質チロシンキナーゼの同定法:
(a)細胞で発現されるアベルソンタンパク質チロシンキナーゼのキナーゼドメインをコードするポリヌクレオチドの一部のヌクレオチド配列を決定する段階;ならびに
(b)このように決定されたヌクレオチド配列を、アベルソンタンパク質チロシンキナーゼの野生型の配列と比較することで、変異型アベルソンタンパク質チロシンキナーゼ中のアミノ酸の置換の有無を判定する段階(このように同定された任意のアミノ酸の置換が、アベルソンタンパク質チロシンキナーゼのポリペプチド配列内に、WU-BLAST-2解析の相同性パラメータを用いて決定可能なように、2-フェニルアミノピリミジンによるチロシンキナーゼ活性の阻害に対する耐性と関連することがわかっている、配列番号:1に示されたC-Ablタンパク質キナーゼにおけるアミノ酸の置換と同じ相対位置に位置するアミノ酸残基に存在するという特性をもつ)。
【請求項23】
変異型アベルソンタンパク質チロシンキナーゼを発現する細胞が、2-フェニルアミノピリミジン曝露後にチロシンキナーゼ活性の阻害に対して耐性を示すことが観察される哺乳類癌細胞の集団内に見出される、請求項22記載の方法。
【請求項24】
哺乳類癌細胞が、2-フェニルアミノピリミジンを含むチロシンキナーゼ阻害剤を用いる治療対象として選択された被験者から得られたヒト癌細胞である、請求項22記載の方法。
【請求項25】
2-フェニルアミノピリミジンによるチロシンキナーゼ活性の阻害に対する耐性と関連することがわかっている、配列番号:1に示されたC-Ablタンパク質キナーゼの変異が、アミノ酸残基

と同じ相対位置に存在する、請求項22記載の方法。
【請求項26】
アミノ酸の置換が、アミノ酸残基

と同じ相対位置に存在する、請求項25記載の方法。
【請求項27】
アミノ酸の置換が、STI-571によるチロシンキナーゼ活性の阻害に対する耐性をもたらす、請求項22記載の方法。
【請求項28】
細胞で発現される変異型アベルソンチロシンキナーゼが、変異型c-Abl、Bcr-Abl、PDGFR、c-kit、TEL-Abl、またはTEL-PDGFRである、請求項22記載の方法。
【請求項29】
異なる個体に由来する別の哺乳類癌細胞を対象に段階(a)〜(b)を繰り返す段階;ならびに
(c)哺乳類癌細胞中に存在する変異型アベルソンタンパク質チロシンキナーゼ中に見出される変異のカタログを作成する段階をさらに含む、請求項22記載の方法。
【請求項30】
以下の段階を含む、変異型Bcr-Ablのポリペプチドに特異的に結合する化合物を同定する方法(Bcr-Ablポリペプチドが、残基D233〜残基T406を含む配列番号:1に示されたBcr-Ablポリペプチド配列の領域に存在するアミノ酸の置換を含む):変異型Bcr-Ablのポリペプチドに被験化合物を、結合が起こりやすい条件で接触させる段階;ならびに被験化合物が、変異型Bcr-Ablのポリペプチドに特異的に結合するか否かを判定して、変異型Bcr-Ablのポリペプチドに結合する化合物が同定可能な段階。
【請求項31】
アミノ酸の置換が残基

に存在する、請求項30記載の方法。
【請求項32】
アミノ酸の置換が

である、請求項31記載の方法。
【請求項33】
アミノ酸の置換が残基

に存在する、請求項30記載の方法。
【請求項34】
アミノ酸の置換が残基

に存在する、請求項30記載の方法。
【請求項35】
アミノ酸の置換が残基E255に存在しない、請求項30記載の方法。
【請求項36】
化合物が2-フェニルアミノピリミジンである、請求項30記載の方法。
【請求項37】
以下の段階を含む、被験化合物が、変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性を阻害するか否かを判定する段階をさらに含む、請求項30記載の方法:
哺乳類細胞に、変異型Bcr-Ablのポリペプチドをコードするコンストラクトをトランスフェクトする段階;
哺乳類細胞に、被験化合物を接触させる段階;ならびに
変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性に関して、哺乳類細胞をモニタリングする段階(被験化合物の非存在下と比較することで、被験化合物の存在下でチロシンキナーゼ活性の阻害が認められれば、被験化合物が変異型Bcr-Ablのポリペプチドの阻害剤であることがわかる)。
【請求項38】
アミノ酸の置換が残基T315に存在する、請求項37記載の方法。
【請求項39】
変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性を、Crklのホスホチロシン量を調べることで測定する、請求項37記載の方法。
【請求項40】
以下の段階を含む、被験化合物が、変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性を阻害するか否かを判定する方法(Bcr-Ablポリペプチドが、残基D233〜残基T406を含む、配列番号:1に示されたBcr-Ablポリペプチド配列の領域に存在するアミノ酸の置換を含む):
哺乳類細胞に、変異型Bcr-Ablのポリペプチドをコードするコンストラクトをトランスフェクトして、変異型Bcr-Ablのポリペプチドを哺乳類細胞で発現させる段階;
哺乳類細胞に被験化合物を接触させる段階;ならびに
変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性に関して、哺乳類細胞をモニタリングする段階(被験化合物の非存在下と比較することで、被験化合物の存在下でチロシンキナーゼ活性の阻害が認められれば、被験化合物が変異型Bcr-Ablのポリペプチドの阻害剤であることがわかる。
【請求項41】
変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性を、Crklのホスホチロシン量を調べることで測定する、請求項40記載の方法。
【請求項42】
変異型Bcr-Ablのポリペプチドのチロシンキナーゼ活性を、抗ホスホチロシン抗体を用いるウエスタンブロット解析で測定して、哺乳類細胞の可溶化液のホスホチロシン量を調べる、請求項40記載の方法。
【請求項43】
哺乳類細胞が293-T細胞である、請求項40記載の方法。
【請求項44】
アミノ酸の置換が残基

に存在する、請求項40記載の方法。
【請求項45】
アミノ酸の置換が

である、請求項44記載の方法。
【請求項46】
アミノ酸の置換が残基

に存在する、請求項40記載の方法。
【請求項47】
アミノ酸の置換が残基

に存在する、請求項40記載の方法。
【請求項48】
アミノ酸の置換が残基E255に存在しない、請求項40記載の方法。
【請求項49】
化合物が2-フェニルアミノピリミジンである、請求項40記載の方法。
【請求項50】
化合物がピリド[2,3-d]ピリミジンである、請求項40記載の方法。
【図2】


【図3】


【図4A】


【図4B】


【図4C】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図3】


【図4A】


【図4B】


【図4C】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2009−278978(P2009−278978A)
【公開日】平成21年12月3日(2009.12.3)
【国際特許分類】
【出願番号】特願2009−144788(P2009−144788)
【出願日】平成21年6月18日(2009.6.18)
【分割の表示】特願2003−506431(P2003−506431)の分割
【原出願日】平成14年6月14日(2002.6.14)
【出願人】(592130699)ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア (364)
【氏名又は名称原語表記】The Regents of The University of California
【Fターム(参考)】
【公開日】平成21年12月3日(2009.12.3)
【国際特許分類】
【出願日】平成21年6月18日(2009.6.18)
【分割の表示】特願2003−506431(P2003−506431)の分割
【原出願日】平成14年6月14日(2002.6.14)
【出願人】(592130699)ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア (364)
【氏名又は名称原語表記】The Regents of The University of California
【Fターム(参考)】
[ Back to top ]

