Sc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための方法
【課題】汎用性のある試薬を用いてSc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離する技術を提供する。
【解決手段】Sc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための方法は、Sc3+とSc3+以外の金属イオンとを含む水溶液に、有機溶媒と、Sc3+を有機溶媒中で錯形成させるための第1のキレート剤とを加える工程と、水溶液と有機溶媒とを混合して混合液を形成させ、Sc3+と第1のキレート剤とを錯形成させる工程と、混合液を有機相と水相とに相分離する工程と、を含む。
【解決手段】Sc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための方法は、Sc3+とSc3+以外の金属イオンとを含む水溶液に、有機溶媒と、Sc3+を有機溶媒中で錯形成させるための第1のキレート剤とを加える工程と、水溶液と有機溶媒とを混合して混合液を形成させ、Sc3+と第1のキレート剤とを錯形成させる工程と、混合液を有機相と水相とに相分離する工程と、を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、Sc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための技術に関する。
【背景技術】
【0002】
スカンジウム(Sc)は、地殻中に広く含まれている。そのため、Scの存在量は、全元素中21番目と比較的多い。しかし、Scは低濃度に分散された状態で存在しているため、濃縮された鉱物として産出しない。Scは現在、ウランやタングステン精錬の副産物としてわずかに回収されるにとどまっており、工業的生産量は極めて少ない。そのため、Scは非常に高価なレアメタルであり、取引価格は1kgあたり約200万円とも言われている。
【0003】
しかし、Scは、様々な工業的用途に有用であることが知られている。たとえば、Scをアルミニウム(Al)合金に0.2〜0.5質量%程度添加するだけで、Al合金の機械強度を飛躍的に向上させることができる。また、Scの添加によって、金属の溶接性、鋳造性、耐食性など様々な特性が改善される。そのため、Scの航空機や自動車の構造材料への応用が期待されている。また、Sc化合物は、ルイス塩基として反応を触媒する機能を有することも知られている。
【0004】
Scの回収方法として、含Sc溶液から溶媒抽出法を用いて酸化スカンジウム(Sc2O3)を回収する方法が知られている(特許文献1)。また、高分子材料(吸着処理材)中または溶液中のScを回収する方法も知られている(特許文献2)。また、強塩基性陰イオン交換樹脂を用いたチオシアン酸系における金属イオンのイオン交換挙動も報告されている(非特許文献1)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平9−291320号公報
【特許文献2】特開2007−327126号公報
【非特許文献】
【0006】
【非特許文献1】桐山哲也 強塩基性陰イオン交換樹脂−チオシアン酸系からの金属イオンの分離 鹿児島大学教育学部研究紀要 自然科学編 第54巻(2003年)
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかし、スカンジウムイオン(Sc3+)と、Sc3+と類似した性質を有する金属元素イオンとを含む水溶液から、Sc3+を選択的に分離することは非常に困難であった。具体的には、ジルコニウム(Zr)の製錬廃液などの水溶液から、Sc3+を選択的に分離する方法は知られていなかった。特に、Zr、チタン(Ti)、イットリウム(Y)などを含む水溶液からScを分離することは極めて困難であると従来は考えられていた。
【0008】
たとえば、特許文献1および特許文献2の技術では、ScとZrとを分離する方法は検討されていなかった。また、非特許文献1の技術では、ScとZrとのそれぞれについて、チオシアン酸系における分配係数が算出されている。しかし、この程度の分配係数を有する技術では、Sc3+を高純度で分離することは困難であった。
【0009】
本発明はこうした状況に鑑みてなされており、その目的とするところは、汎用性のある試薬を用いてSc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための技術を提供することにある。
【課題を解決するための手段】
【0010】
上記課題を解決するために、本発明のある態様のSc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための方法は、Sc3+とSc3+以外の金属イオンとを含む水溶液に、有機溶媒と、Sc3+を有機溶媒中で錯形成させるための第1のキレート剤とを加える工程と、水溶液と有機溶媒とを混合して混合液を形成させ、Sc3+と第1のキレート剤とを錯形成させる工程と、混合液を有機相と水相とに相分離する工程と、を含む。
【0011】
この態様によると、汎用性のある試薬を用いてSc3+とSc3+以外の金属イオンとを含む水溶液から簡便に、Sc3+を高純度かつ高収率で分離することができる。
【0012】
水溶液は、Sc3+以外の金属イオンとしてZrO2+、Ti3+またはY3+の少なくとも1つを含んでもよい。この態様によると、Sc3+と、ZrO2+、Ti3+またはY3+の少なくとも1つとを含む水溶液から、Sc3+を選択的に分離することができる。
【0013】
第1のキレート剤は、少なくとも一部が酸化分解されたアルキルモノチオリン酸またはアルキルジチオリン酸であってもよい。この態様によると、有機溶媒中におけるSc3+と第1のキレート剤との錯形成の効率を高めることにより、Sc3+の抽出率を高めることができる。
【0014】
第1のキレート剤は、少なくとも一部が酸化分解されたジ(2−エチルヘキシル)ジチオリン酸であってもよい。この態様によると、有機溶媒中におけるSc3+と第1のキレート剤との錯形成の効率をさらに高めることにより、Sc3+の抽出率をさらに高めることができる。
【0015】
Sc3+以外の金属イオンの有機溶媒への移行を阻害するための第2のキレート剤を、混合液を形成させる前にさらに添加してもよい。この態様によると、Sc3+以外の金属イオンの有機溶媒への移行を阻害することにより、回収されるSc3+の純度を高めることができる。
【0016】
第2のキレート剤は、ヒドロキシ酸もしくはヒドロキシ酸塩であってもよい。この態様によると、Sc3+以外の金属イオンの有機溶媒への移行をさらに効率的に阻害することにより、回収されるSc3+の純度をさらに高めることができる。
【0017】
相分離された有機相に酸を加えることにより、Sc3+の逆抽出を行う工程をさらに含んでもよい。この態様によると、Sc3+を有機相から効率的に回収することができる。
【0018】
なお、上述した各要素を適宜組み合わせたものも、本件特許出願によって特許による保護を求める発明の範囲に含まれうる。
【発明の効果】
【0019】
本発明によれば、Sc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離することができる。
【図面の簡単な説明】
【0020】
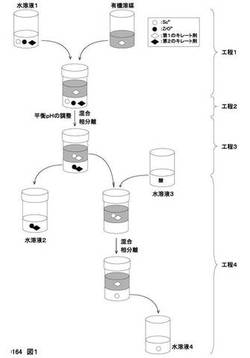
【図1】Sc3+とSc3+以外の金属イオンとを含む水溶液から溶媒抽出法を用いてSc3+を分離するための方法を示す概略図である。
【図2】比較例として、第1のキレート剤にKelex 100を用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【図3】比較例として、第1のキレート剤にPC88Aを用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【図4】比較例として、第1のキレート剤にTMpMTPを用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【図5】第1のキレート剤としてPhoslex DT−8を用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【図6】第1のキレート剤としてPhoslex DT−8を用い、水溶液1にSc3+およびZrO2+に代えてAl3+およびFe3+を加えた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【図7】第1のキレート剤としてPhoslex DT−8を用い、水溶液1にSc3+およびZrO2+に代えてY3+を加えた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【発明を実施するための形態】
【0021】
以下、図面を参照しながら、本発明を実施するための形態について詳細に説明する。なお、図面の説明において重複する説明を適宜省略する。
【0022】
図1は、Sc3+とSc3+以外の金属イオンとを含む水溶液から溶媒抽出法を用いてSc3+を分離するための方法を示す概略図である。ここでは、Sc3+以外の金属イオンとして、水溶液中にZrO2+が含まれている場合を例に説明する。
【0023】
Sc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための方法は、Sc3+とSc3+以外の金属イオンとを含む水溶液に、有機溶媒と、Sc3+を有機溶媒中で錯形成させるための第1のキレート剤とを加える工程(工程1)と、水溶液と有機溶媒とを混合して混合液を形成させ、Sc3+と第1のキレート剤とを錯形成させる工程(工程2)と、混合液を有機相と水相とに相分離する工程(工程3)と、を含む。また、本方法は、相分離された有機相に酸を加えることにより、Sc3+の逆抽出を行う工程(工程4)をさらに含む。以下、本方法を工程1から順に説明する。
【0024】
(工程1)
本工程では、Sc3+とSc3+以外の金属イオンとを含む水溶液(水溶液1)に、有機溶媒と、Sc3+を有機溶媒中で錯形成させるための第1のキレート剤とを加える。キレート剤とは、複数の配位座をもつ配位子(多座配位子)を有することにより、金属イオンに結合(配位)する物質をいう。
【0025】
Sc3+とSc3+以外の金属イオンとを含む水溶液とは、Sc3+に加え、少なくとも1つの他の水溶性の金属を含む水溶液を言う。この水溶液として、従来はSc3+との分離が困難であったZrO2+、チタンイオン(Ti3+)またはイットリウムイオン(Y3+)のうちの少なくとも1つを含む水溶液を用いることができる。
【0026】
ZrとTiは第4族の金属であり、互いに性質が類似している。ZrO2+とTi3+を含む水溶液として主に想定されるのは、ZrまたはTiの製錬廃液である。また、本手法を用いることにより、Sc3+を第4族に属するZrおよびTi以外の元素であるハフニウム(Hf)からも分離することができるものと考えられる。Yは、Scと同じ第3族である。平衡pH約0.95〜約4.58の広範囲で本方法によるY3+の抽出率が低いことを利用して、Sc3+をY3+から分離することができる。平衡pHは、後述する工程3で有機相を分離した後の水相のpHを示す。
【0027】
さらに、Sc3+をAl3+やFe3+からも分離することができる。Sc3+は、pH約1.0〜約4.5において、高純度でAl3+から分離することができる。また、Sc3+は、pH約3.9〜約4.5において、高純度でFe3+から分離することができる。つまり、pH約3.9〜約4.5では、高純度でSc3+をAl3+およびFe3+から分離することができる。
【0028】
ZrやTiの製錬廃液は、大量に廃棄されているのが現状であるため、低コストかつ容易に入手可能である。Zrの製錬廃液は、Zrの抽出時に使用される塩酸(HCl)の水溶液である。Zrの製錬廃液には、約200ppmのSc3+、約20000ppmのZrO2+、約2000ppmのTi3+、約1500ppmのY3+、約5000ppmのFe3+、約500ppmのAl3+などが含まれる。同様に、Tiの製錬廃液にも、Ti3+だけでなくZrO2+も含まれる。
【0029】
有機溶媒としては、第1のキレート剤を溶解させることができ、実験条件下で液体として存在する任意の溶媒を使用することができる。このような有機溶媒としては、たとえばメチルイソブチルケトン、ニトロベンゼン、オクタノール、ヘキサン、シクロヘキサン、オクタン、デカン、ドデカン、ベンゼン、トルエン、キシレン、エチルベンゼン、石油エーテルを使用することができる。コストの観点からは、有機溶媒としてヘキサンまたはシクロヘキサンを使用することが好ましい。
【0030】
第1のキレート剤は、有機溶媒中でSc3+と選択的に錯形成(キレート形成)する。つまり、第1のキレート剤は、Sc3+を錯形成するが、ZrO2+、Ti3+およびY3+とは錯形成しにくい。第1のキレート剤を用いることにより、性質が類似するため従来は分離が非常に困難であったSc3+と、ZrO2+、Ti3+およびY3+とを効率的に分離することができる。同様に、Sc3+をAl3+やFe3+からも分離することができる。
【0031】
第1のキレート剤としては、抽出率の観点から、配位原子がS,Sである少なくとも一部が酸化分解されたアルキルモノチオリン酸またはアルキルジチオリン酸を使用することが好ましい。アルキルモノチオリン酸およびアルキルジチオリン酸は、アルキル基の炭素数と親油性との間に正の相関関係を有する。そのため、炭素数が少なすぎると、第1のキレート剤が有機溶媒に溶解しづらい場合がある。特に炭素数が3未満では、第1のキレート剤が有機溶媒に非常に溶解しづらい。この場合、Sc3+を有機溶媒中に分離することが非常に困難である。また、炭素数が多すぎると、第1のキレート剤の親水性が低くなるため、水溶液中に存在するSc3+と錯形成するのに時間がかかる場合がある。また、工業的には炭素数18以下のアルキルモノチオリン酸およびアルキルジチオリン酸が入手しやすい。そのため、抽出効率および入手容易性の観点から、これらのアルキル基は、炭素数が3以上であることが好ましく、6〜18であることがより好ましい。
【0032】
第1のキレート剤としては、Sc3+の収率を高める観点から、以下に示すジ(2−エチルヘキシル)ジチオリン酸を使用することが特に好ましい。ジ(2−エチルヘキシル)ジチオリン酸としては、Phoslex DT−8(SC有機化学株式会社製)を使用することができる。
【0033】
【化1】

【0034】
本実施の形態では、第1のキレート剤の濃度は0.1Mであるが、これに限られない。有機溶媒中に第1のキレート剤が多く含まれる場合、Sc3+と第1のキレート剤との錯形成の効率は高まるが、ZrO2+、Ti3+およびY3+など他の金属イオンも第1のキレート剤と錯形成されてしまう可能性がある。そのため、第1のキレート剤の濃度は、水溶液1中のSc3+の濃度および他の金属イオンの濃度に基づいて決定すればよい。また、第1のキレート剤を添加するタイミングは、本工程中であればよく、たとえばSc3+とSc3+以外の金属イオンとを含む水溶液に有機溶媒を加えた後であってもよい。
【0035】
また、Sc3+とSc3+以外の金属イオンとを含む水溶液には、有機溶媒と混合する前に、Sc3+以外の金属イオンの有機溶媒への移行を阻害するための第2のキレート剤を加えることが好ましい。第2のキレート剤をSc3+とSc3+以外の金属イオンとを含む水溶液に添加することにより、Sc3+の有機溶媒への移行は阻害されないが、ZrO2+を含むその他のイオンの有機溶媒への移行を阻害することができる。これにより、Sc3+の有機溶媒への移行の特異性を高め、回収時の純度を高めることができる。
【0036】
第2のキレート剤としては、ヒドロキシ酸(オキシカルボン酸)もしくはヒドロキシ酸塩(オキシカルボン酸塩)を用いることができる。ヒドロキシ酸として、クエン酸やグリコール酸などを用いることが好ましい。ヒドロキシ酸塩としては、ナトリウム塩、カリウム塩、またはクエン酸塩などを用いることが好ましい。クエン酸塩としては、たとえばクエン酸三カリウムを用いることができる。第2のキレート剤としてクエン酸塩を用いることにより、Sc3+の有機溶媒への移行の特異性をさらに高めることができる。本実施の形態では、クエン酸三カリウムの濃度は0.01Mであるが、これに限られない。特に、第2のキレート剤の濃度は、水溶液1中のSc3+の濃度およびZrO2+の濃度に基づいて決定する。たとえば、1モルのZrO2+に対して、第2のキレート剤を1〜1000モル倍、より好ましくは2〜300モル倍添加する。
【0037】
(工程2)
本工程では、工程1で得られた混合液を振とうや撹拌により混合し、混合液を形成させる。混合液では、水溶液と有機溶媒とがエマルジョン状態となり、両者の接触面積が増大することにより、水溶液中に存在するSc3+と、有機溶媒中に存在する第1のキレート剤との接触頻度が増大する。これにより、Sc3+と有機溶媒中の第1のキレート剤との錯形成が促進され、Sc3+が有機溶媒中に移行する。有機相と水相とが十分に混合できる方法であれば、振とうや撹拌以外によって混合してもよい。水相と有機相の体積比は特に限定されないが、水相と有機相の体積比を約10:1〜約1:10とすることができる。
【0038】
Sc3+の抽出率を高めるためには、本工程における水溶液のpH(平衡pH)が約1.3〜約4.6であることが好ましく、平衡pHが約3.2〜約4.4であることがより好ましい。水相の平衡pHを高くする場合、3MのNaOHまたは3MのKOHなどの塩基性試薬を水相に滴下することにより、水相の平衡pHを調整することが好ましい。一方、水相の平衡pHを低くする場合、3MのHClなどの酸性試薬を水相に滴下することにより、水相の平衡pHを調整することが好ましい。
【0039】
(工程3)
本工程では、遠心分離などを用いて、混合液を有機相と水相とに相分離する。有機溶媒としてヘキサンを用いた場合、遠心分離後の試験管を静置すれば、有機相が水相よりも上側となる。この有機相には第1のキレート剤と錯形成されたSc3+が含まれ、水相(水溶液2)中にはZrO2+が含まれる。なお、有機相と水相とが十分に分離できさえすれば、相分離の条件はこれに限られない。たとえば、遠心分離をせず、振とう後の混合液を静置して自然に相分離させてもよい。
【0040】
(工程4)
本工程では、相分離された有機相を新たな試験管に取り出し、その有機相に酸を加えることにより、Sc3+の逆抽出を行う。用いる酸は、塩酸、硝酸または硫酸が好ましい。このときの酸濃度は約1〜約4Mが好ましい。図1では、まず有機相を新たな試験管に移し、ここに1Mの塩酸水溶液(水溶液3)を加える。
【0041】
その後、得られた混合液を振とうや撹拌により混合し、混合液を形成させる。振とう後の混合液を遠心分離などにより有機相と水相とに相分離させる。その結果、錯形成が解除されたSc3+は有機相から水相へと移動する(逆抽出)。水相と有機相の体積比は特に限定されないが、たとえば約10:1〜約1:10とすることができる。逆抽出後の水相を、Sc3+含有水溶液(水溶液4)として回収する。なお、工程3と同様に、有機相と水相とが十分に分離できさえすれば、相分離の条件はこれに限られない。
【0042】
溶媒抽出法では、有機溶媒中から金属イオンを回収する逆抽出が、非常に困難な場合がある。本方法では、第1のキレート剤として少なくとも一部が酸化分解されたアルキルモノチオリン酸またはアルキルジチオリン酸を使用し、工程2において水相のpHを調整することにより、容易に高収率でSc3+の抽出を行うことができる。Sc3+は、キレート剤の配位原子Oにおいて、最も安定的に錯形成する。しかし、本方法で好適に使用されるアルキルモノチオリン酸およびアルキルジチオリン酸は、配位原子がS,Sである。そのため、Sc3+とアルキルモノチオリン酸またはアルキルジチオリン酸との錯形成における結合が比較的弱いため、逆抽出時に酸を加えることにより、容易に錯形成が解除され、Sc3+が水溶液4へと移行すると考えられる。
【0043】
以上の工程1〜4により、汎用性のある試薬を用い、Sc3+とSc3+以外の金属イオンとを含む水溶液から簡便に、Sc3+を高純度かつ高収率で分離することができる。逆抽出されたSc3+からScを精製するためには、公知の方法を使用すればよい。なお、工程3で相分離された水相(水溶液2)を用いて工程1〜3を繰り返すことにより、水相中に残留するSc3+をさらに抽出し、Sc3+の収率を高めてもよい。
【0044】
(金属イオンの濃度測定)
次に、工程4により得られた水溶液4中のSc3+の濃度(ppm)を測定する。この測定には、誘導結合プラズマ発光装置(ICP−OES)を好適に使用することができる。水溶液4中の金属イオンの濃度が高い場合には、装置の測定範囲に入るように、測定前に水溶液4を希釈する。
【0045】
この場合、以下に示す直接法の式(1)または間接法の式(2)を使用し、抽出率(E%)を算出することができる。なお、ここでは水相と有機相の体積比が1:1の場合の式を示す。
【0046】
【数1】

式中、[M]aqは抽出操作後に水相中に存在する金属イオン濃度を、[M]oは抽出後に有機相中に存在する金属イオン濃度を表す。
【0047】
【数2】

式中、[M]initは金属イオンの初期濃度を、[M]aqは抽出操作後に水相中に残存する金属イオン濃度を表す。
【0048】
第1のキレート剤としてPhoslex DT−8を用い、図1に示す方法によりSc3+(0.1mM)とZrO2+(0.1mM)を含む水溶液からSc3+を抽出した場合、抽出時の平衡pHが約1.3〜約4.6の広範囲で、Sc3+を約60%以上の抽出率で回収することができる。この場合、回収された金属イオンに占めるSc3+の割合(Sc3+の純度)はほぼ100%である。さらに、抽出時の平衡pHが約3.2〜約4.4の範囲では、Sc3+を約75%以上、さらには約85%の抽出率で回収することができる。
【0049】
(有用性)
自然界でScの含有濃度が0.05%を超える物質はほとんど存在しない。そのため、Scの含有濃度が相対的に高い鉱石から、Scを精製して回収する技術が必要となる。Scを含有する鉱石は、他の有用な元素を主成分として含むことが多い。そのため、多くの場合、鉱石の主成分である他の有用な元素を精製加工した後、残った製錬廃液などを利用して、Scを精製することになると考えられる。たとえば、Zrを主成分として含む鉱石からZrを精製加工した後の製錬廃液を用いて、Scを精製することが考えられる。Zrの製錬廃液はこれまで使用の用途がなかったため、大量に廃棄されているのが現状であった。しかし、Zrの製錬廃液中には、上述のとおり、高濃度(200ppm)のSc3+が含まれる。そのため、本方法を用いることにより、Zrの製錬廃液などのSc3+とSc3+以外の金属イオンとを含む水溶液から、汎用性のある試薬を用いてSc3+を簡便に分離することができる。つまり、Zrの製錬廃液に対して本方法を用いれば、新たに採掘などを行うことなく、Scの安定供給に大きく貢献することができる。
【0050】
その結果、従来は非常に希少価値の高いレアメタルであったScを様々な用途に使用することが可能となる。たとえば、固体酸化物型燃料電池(SOFC)の電解質原料として、Scを酸化スカンジウム(Sc2O3)の状態で供給する。この場合、ジルコニア(ZrO2)に酸化スカンジウムを4〜11モル%固溶させたスカンジア安定化ジルコニアを、SOFCの電解質として使用することができる。8モル%スカンジウム安定化酸化ジルコニウムは、8モル%イットリア安定化ジルコニアと比較して2倍以上の電気伝導度を示し、SOFCの作動温度も約200℃下げることができるため注目されている。燃料電池のマーケットには将来性があるため、スカンジウムの安定供給が燃料電池の性能向上に大きな契機となると期待されている。
【0051】
また、ジルコニウム鉱石は、中国だけでなく、たとえば南アフリカ、オーストラリア、東南アジア、南米など多くの国で産出されている。これらの国で本方法を用いた工業生産を行うことにより、中国に依存することなくScの供給源を確保することができる。
【実施例】
【0052】
第1のキレート剤の評価を行った。図1に示す方法により、Sc3+(0.1mM)とZrO2+(0.1mM)を含む水溶液10mlから、Sc3+を抽出した。水溶液(水溶液1)には、第2のキレート剤としてクエン酸三カリウムが0.01M含まれている。第1のキレート剤として、配位原子がN,Oである7−(4−エチル−1−メチルオクチル)−8−キノリノール(Kelex 100:ハイケム株式会社製)、配位原子がO,Oであるリン酸2−エチルヘキシル(PC88A:大八化学工業株式会社製)、配位原子がO,Sであるビス(2,4,4−トリメチルペンチル)モノチオホスフィン酸(TMpMTP:Fluka社製)、配位原子がS,Sであるジ(2−エチルヘキシル)ジチオリン酸(Phoslex DT−8:SC有機化学株式会社製)を用いた。
【0053】
PC88A、TMpMTPおよびPhoslex DT−8は、最終濃度が0.1Mとなるようにヘキサンに溶解させ、10mlを分取した。一方、Kelex 100は分子が大きいため、溶媒への溶解度が低く、トルエンやヘキサンでは十分な濃度の溶液にすることができなかった。そのため、Kelex 100のみ最終濃度が0.1Mとなるようにオクタノールに溶解させ、10mlを用いた。
【0054】
工程3における水溶液の平衡pHが以下の図2〜5および表1に示す値となるように、工程2において3MのNaOHを水相に加えることにより、水相のpHを調整した。また、図1の工程4では、1Mの塩酸水溶液を用いて逆抽出を行った。工程3で得られた有機相7mlを別の試験管に移し、1Mの塩酸水溶液を7ml加えた。
【0055】
得られた水溶液中の各金属イオンの濃度を、誘導結合プラズマ発光装置(ICP−OES:Varian社製)を用いて測定した。この測定結果に基づき、抽出率(%)を算出した。第1のキレート剤としてPhoslex DT−8を用いた場合、上述の式1を用いて抽出率(%)を算出した。第1のキレート剤としてKelex 100、PC88AおよびTMpMTPを用いた場合、[M]oを求めることができなかったため、上述の式2を用いて抽出率(%)を算出した。
【0056】
(比較例1)
図2は、比較例として、第1のキレート剤にKelex 100を用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。本比較例では、Sc3+(0.1mM)およびZrO2+(0.1mM)に代えて、Al3+(0.1mM)およびFe3+(0.1mM)を含む水溶液1を用いた。この場合、平衡pHがどの範囲であっても、Sc3+を高い抽出率で抽出することはできなかった。また、Sc3+を他の金属イオンから高純度で分離することもできなかった。
【0057】
(比較例2)
図3は、比較例として、第1のキレート剤にPC88Aを用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。この場合、広いpH領域でSc3+が約100%の抽出率で抽出された。しかし、これらの場合には、ZrO2+も抽出されたため、Sc3+を高純度で抽出することはできなかった。
【0058】
(比較例3)
図4は、比較例として、第1のキレート剤にTMpMTPを用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。この場合、広いpH領域でSc3+が約100%の抽出率で抽出された。しかし、これらの場合には、ZrO2+も抽出されたため、Sc3+を高純度で抽出することはできなかった。
【0059】
(実施例1)
図5は、第1のキレート剤としてPhoslex DT−8を用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。また、表1には、第1のキレート剤としてPhoslex DT−8を用いた場合の金属イオンの抽出率(%)を示す。表1に、図5の基となる実験データを示す。
【0060】
【表1】

【0061】
ここで、「設定pH」は、工程2でSc3+とSc3+以外の金属イオンと第2のキレート剤を含む混合水溶液に3MのNaOHを加えた場合のpHの初期値を示す。また、「平衡pH」は、工程3で有機相を分離した後の水相のpHを示す。
【0062】
Sc3+の抽出率(%)は、工程3における平衡pHが1.04(試料1)〜4.36(試料12)の範囲で、平衡pHが上昇するにつれて約43.0%から約85.2%に増加した。この場合、平衡pHが約1.6〜約4.65の広範囲で、Sc3+を約60%以上の抽出率で回収することができた。さらに、平衡pHが約3.1〜約4.5の範囲では、Sc3+を約75%以上、さらには約85%の抽出率で抽出することができた。いずれの平衡pHでも、ZrO2+は全く抽出されなかった。これは、第2のキレート剤として加えたクエン酸イオンがZrO2+の有機相中への移行を効率的に阻害したためであると考えられる。また、第1のキレート剤としてPhoslex DT−8を用いた場合、1.0MのHCl溶液を用いて逆抽出すると、逆抽出を容易に高収率で行うことができた。
【0063】
(実施例2)
図6は、第1のキレート剤としてPhoslex DT−8を用い、水溶液1にSc3+およびZrO2+に代えてAl3+およびFe3+を加えた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【0064】
平衡pHが約1.0〜約4.5の範囲において、水溶液4に分離されるAl3+を低濃度にすることができた。また、平衡pHが約3.9〜約4.5の範囲において、水溶液4に分離されるFe3+を低濃度にすることができた。
【0065】
(実施例3)
図7は、第1のキレート剤としてPhoslex DT−8を用い、水溶液1にSc3+およびZrO2+に代えてY3+を加えた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【0066】
この場合、平衡pH約0.95〜約4.58の範囲において、水溶液4に分離されるY3+を低濃度にすることができた。特に平衡pH約3.6〜約4.5の範囲では、水溶液4に分離されるY3+を10%未満に抑えることができた。
【0067】
つまり、実施例1〜3に基づくと、平衡pHが約3.9〜約4.5の範囲では、Sc3+、ZrO2+、Al3+、Fe3+およびY3+を含む水溶液から、Sc3+を高純度で分離できることが明らかとなった。
【0068】
以上、本発明を上述の実施の形態を参照して説明したが、本発明は上述の実施の形態に限定されるものではなく、実施の形態の構成を適宜組み合わせたものや置換したものについても本発明に含まれるものである。また、当業者の知識に基づいて実施の形態における組合せや工程の順番を適宜組み替えることや各種の設計変更等の変形を実施の形態に対して加えることも可能であり、そのような変形が加えられた実施の形態も本発明の範囲に含まれうる。
【技術分野】
【0001】
本発明は、Sc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための技術に関する。
【背景技術】
【0002】
スカンジウム(Sc)は、地殻中に広く含まれている。そのため、Scの存在量は、全元素中21番目と比較的多い。しかし、Scは低濃度に分散された状態で存在しているため、濃縮された鉱物として産出しない。Scは現在、ウランやタングステン精錬の副産物としてわずかに回収されるにとどまっており、工業的生産量は極めて少ない。そのため、Scは非常に高価なレアメタルであり、取引価格は1kgあたり約200万円とも言われている。
【0003】
しかし、Scは、様々な工業的用途に有用であることが知られている。たとえば、Scをアルミニウム(Al)合金に0.2〜0.5質量%程度添加するだけで、Al合金の機械強度を飛躍的に向上させることができる。また、Scの添加によって、金属の溶接性、鋳造性、耐食性など様々な特性が改善される。そのため、Scの航空機や自動車の構造材料への応用が期待されている。また、Sc化合物は、ルイス塩基として反応を触媒する機能を有することも知られている。
【0004】
Scの回収方法として、含Sc溶液から溶媒抽出法を用いて酸化スカンジウム(Sc2O3)を回収する方法が知られている(特許文献1)。また、高分子材料(吸着処理材)中または溶液中のScを回収する方法も知られている(特許文献2)。また、強塩基性陰イオン交換樹脂を用いたチオシアン酸系における金属イオンのイオン交換挙動も報告されている(非特許文献1)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平9−291320号公報
【特許文献2】特開2007−327126号公報
【非特許文献】
【0006】
【非特許文献1】桐山哲也 強塩基性陰イオン交換樹脂−チオシアン酸系からの金属イオンの分離 鹿児島大学教育学部研究紀要 自然科学編 第54巻(2003年)
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかし、スカンジウムイオン(Sc3+)と、Sc3+と類似した性質を有する金属元素イオンとを含む水溶液から、Sc3+を選択的に分離することは非常に困難であった。具体的には、ジルコニウム(Zr)の製錬廃液などの水溶液から、Sc3+を選択的に分離する方法は知られていなかった。特に、Zr、チタン(Ti)、イットリウム(Y)などを含む水溶液からScを分離することは極めて困難であると従来は考えられていた。
【0008】
たとえば、特許文献1および特許文献2の技術では、ScとZrとを分離する方法は検討されていなかった。また、非特許文献1の技術では、ScとZrとのそれぞれについて、チオシアン酸系における分配係数が算出されている。しかし、この程度の分配係数を有する技術では、Sc3+を高純度で分離することは困難であった。
【0009】
本発明はこうした状況に鑑みてなされており、その目的とするところは、汎用性のある試薬を用いてSc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための技術を提供することにある。
【課題を解決するための手段】
【0010】
上記課題を解決するために、本発明のある態様のSc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための方法は、Sc3+とSc3+以外の金属イオンとを含む水溶液に、有機溶媒と、Sc3+を有機溶媒中で錯形成させるための第1のキレート剤とを加える工程と、水溶液と有機溶媒とを混合して混合液を形成させ、Sc3+と第1のキレート剤とを錯形成させる工程と、混合液を有機相と水相とに相分離する工程と、を含む。
【0011】
この態様によると、汎用性のある試薬を用いてSc3+とSc3+以外の金属イオンとを含む水溶液から簡便に、Sc3+を高純度かつ高収率で分離することができる。
【0012】
水溶液は、Sc3+以外の金属イオンとしてZrO2+、Ti3+またはY3+の少なくとも1つを含んでもよい。この態様によると、Sc3+と、ZrO2+、Ti3+またはY3+の少なくとも1つとを含む水溶液から、Sc3+を選択的に分離することができる。
【0013】
第1のキレート剤は、少なくとも一部が酸化分解されたアルキルモノチオリン酸またはアルキルジチオリン酸であってもよい。この態様によると、有機溶媒中におけるSc3+と第1のキレート剤との錯形成の効率を高めることにより、Sc3+の抽出率を高めることができる。
【0014】
第1のキレート剤は、少なくとも一部が酸化分解されたジ(2−エチルヘキシル)ジチオリン酸であってもよい。この態様によると、有機溶媒中におけるSc3+と第1のキレート剤との錯形成の効率をさらに高めることにより、Sc3+の抽出率をさらに高めることができる。
【0015】
Sc3+以外の金属イオンの有機溶媒への移行を阻害するための第2のキレート剤を、混合液を形成させる前にさらに添加してもよい。この態様によると、Sc3+以外の金属イオンの有機溶媒への移行を阻害することにより、回収されるSc3+の純度を高めることができる。
【0016】
第2のキレート剤は、ヒドロキシ酸もしくはヒドロキシ酸塩であってもよい。この態様によると、Sc3+以外の金属イオンの有機溶媒への移行をさらに効率的に阻害することにより、回収されるSc3+の純度をさらに高めることができる。
【0017】
相分離された有機相に酸を加えることにより、Sc3+の逆抽出を行う工程をさらに含んでもよい。この態様によると、Sc3+を有機相から効率的に回収することができる。
【0018】
なお、上述した各要素を適宜組み合わせたものも、本件特許出願によって特許による保護を求める発明の範囲に含まれうる。
【発明の効果】
【0019】
本発明によれば、Sc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離することができる。
【図面の簡単な説明】
【0020】
【図1】Sc3+とSc3+以外の金属イオンとを含む水溶液から溶媒抽出法を用いてSc3+を分離するための方法を示す概略図である。
【図2】比較例として、第1のキレート剤にKelex 100を用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【図3】比較例として、第1のキレート剤にPC88Aを用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【図4】比較例として、第1のキレート剤にTMpMTPを用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【図5】第1のキレート剤としてPhoslex DT−8を用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【図6】第1のキレート剤としてPhoslex DT−8を用い、水溶液1にSc3+およびZrO2+に代えてAl3+およびFe3+を加えた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【図7】第1のキレート剤としてPhoslex DT−8を用い、水溶液1にSc3+およびZrO2+に代えてY3+を加えた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【発明を実施するための形態】
【0021】
以下、図面を参照しながら、本発明を実施するための形態について詳細に説明する。なお、図面の説明において重複する説明を適宜省略する。
【0022】
図1は、Sc3+とSc3+以外の金属イオンとを含む水溶液から溶媒抽出法を用いてSc3+を分離するための方法を示す概略図である。ここでは、Sc3+以外の金属イオンとして、水溶液中にZrO2+が含まれている場合を例に説明する。
【0023】
Sc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための方法は、Sc3+とSc3+以外の金属イオンとを含む水溶液に、有機溶媒と、Sc3+を有機溶媒中で錯形成させるための第1のキレート剤とを加える工程(工程1)と、水溶液と有機溶媒とを混合して混合液を形成させ、Sc3+と第1のキレート剤とを錯形成させる工程(工程2)と、混合液を有機相と水相とに相分離する工程(工程3)と、を含む。また、本方法は、相分離された有機相に酸を加えることにより、Sc3+の逆抽出を行う工程(工程4)をさらに含む。以下、本方法を工程1から順に説明する。
【0024】
(工程1)
本工程では、Sc3+とSc3+以外の金属イオンとを含む水溶液(水溶液1)に、有機溶媒と、Sc3+を有機溶媒中で錯形成させるための第1のキレート剤とを加える。キレート剤とは、複数の配位座をもつ配位子(多座配位子)を有することにより、金属イオンに結合(配位)する物質をいう。
【0025】
Sc3+とSc3+以外の金属イオンとを含む水溶液とは、Sc3+に加え、少なくとも1つの他の水溶性の金属を含む水溶液を言う。この水溶液として、従来はSc3+との分離が困難であったZrO2+、チタンイオン(Ti3+)またはイットリウムイオン(Y3+)のうちの少なくとも1つを含む水溶液を用いることができる。
【0026】
ZrとTiは第4族の金属であり、互いに性質が類似している。ZrO2+とTi3+を含む水溶液として主に想定されるのは、ZrまたはTiの製錬廃液である。また、本手法を用いることにより、Sc3+を第4族に属するZrおよびTi以外の元素であるハフニウム(Hf)からも分離することができるものと考えられる。Yは、Scと同じ第3族である。平衡pH約0.95〜約4.58の広範囲で本方法によるY3+の抽出率が低いことを利用して、Sc3+をY3+から分離することができる。平衡pHは、後述する工程3で有機相を分離した後の水相のpHを示す。
【0027】
さらに、Sc3+をAl3+やFe3+からも分離することができる。Sc3+は、pH約1.0〜約4.5において、高純度でAl3+から分離することができる。また、Sc3+は、pH約3.9〜約4.5において、高純度でFe3+から分離することができる。つまり、pH約3.9〜約4.5では、高純度でSc3+をAl3+およびFe3+から分離することができる。
【0028】
ZrやTiの製錬廃液は、大量に廃棄されているのが現状であるため、低コストかつ容易に入手可能である。Zrの製錬廃液は、Zrの抽出時に使用される塩酸(HCl)の水溶液である。Zrの製錬廃液には、約200ppmのSc3+、約20000ppmのZrO2+、約2000ppmのTi3+、約1500ppmのY3+、約5000ppmのFe3+、約500ppmのAl3+などが含まれる。同様に、Tiの製錬廃液にも、Ti3+だけでなくZrO2+も含まれる。
【0029】
有機溶媒としては、第1のキレート剤を溶解させることができ、実験条件下で液体として存在する任意の溶媒を使用することができる。このような有機溶媒としては、たとえばメチルイソブチルケトン、ニトロベンゼン、オクタノール、ヘキサン、シクロヘキサン、オクタン、デカン、ドデカン、ベンゼン、トルエン、キシレン、エチルベンゼン、石油エーテルを使用することができる。コストの観点からは、有機溶媒としてヘキサンまたはシクロヘキサンを使用することが好ましい。
【0030】
第1のキレート剤は、有機溶媒中でSc3+と選択的に錯形成(キレート形成)する。つまり、第1のキレート剤は、Sc3+を錯形成するが、ZrO2+、Ti3+およびY3+とは錯形成しにくい。第1のキレート剤を用いることにより、性質が類似するため従来は分離が非常に困難であったSc3+と、ZrO2+、Ti3+およびY3+とを効率的に分離することができる。同様に、Sc3+をAl3+やFe3+からも分離することができる。
【0031】
第1のキレート剤としては、抽出率の観点から、配位原子がS,Sである少なくとも一部が酸化分解されたアルキルモノチオリン酸またはアルキルジチオリン酸を使用することが好ましい。アルキルモノチオリン酸およびアルキルジチオリン酸は、アルキル基の炭素数と親油性との間に正の相関関係を有する。そのため、炭素数が少なすぎると、第1のキレート剤が有機溶媒に溶解しづらい場合がある。特に炭素数が3未満では、第1のキレート剤が有機溶媒に非常に溶解しづらい。この場合、Sc3+を有機溶媒中に分離することが非常に困難である。また、炭素数が多すぎると、第1のキレート剤の親水性が低くなるため、水溶液中に存在するSc3+と錯形成するのに時間がかかる場合がある。また、工業的には炭素数18以下のアルキルモノチオリン酸およびアルキルジチオリン酸が入手しやすい。そのため、抽出効率および入手容易性の観点から、これらのアルキル基は、炭素数が3以上であることが好ましく、6〜18であることがより好ましい。
【0032】
第1のキレート剤としては、Sc3+の収率を高める観点から、以下に示すジ(2−エチルヘキシル)ジチオリン酸を使用することが特に好ましい。ジ(2−エチルヘキシル)ジチオリン酸としては、Phoslex DT−8(SC有機化学株式会社製)を使用することができる。
【0033】
【化1】

【0034】
本実施の形態では、第1のキレート剤の濃度は0.1Mであるが、これに限られない。有機溶媒中に第1のキレート剤が多く含まれる場合、Sc3+と第1のキレート剤との錯形成の効率は高まるが、ZrO2+、Ti3+およびY3+など他の金属イオンも第1のキレート剤と錯形成されてしまう可能性がある。そのため、第1のキレート剤の濃度は、水溶液1中のSc3+の濃度および他の金属イオンの濃度に基づいて決定すればよい。また、第1のキレート剤を添加するタイミングは、本工程中であればよく、たとえばSc3+とSc3+以外の金属イオンとを含む水溶液に有機溶媒を加えた後であってもよい。
【0035】
また、Sc3+とSc3+以外の金属イオンとを含む水溶液には、有機溶媒と混合する前に、Sc3+以外の金属イオンの有機溶媒への移行を阻害するための第2のキレート剤を加えることが好ましい。第2のキレート剤をSc3+とSc3+以外の金属イオンとを含む水溶液に添加することにより、Sc3+の有機溶媒への移行は阻害されないが、ZrO2+を含むその他のイオンの有機溶媒への移行を阻害することができる。これにより、Sc3+の有機溶媒への移行の特異性を高め、回収時の純度を高めることができる。
【0036】
第2のキレート剤としては、ヒドロキシ酸(オキシカルボン酸)もしくはヒドロキシ酸塩(オキシカルボン酸塩)を用いることができる。ヒドロキシ酸として、クエン酸やグリコール酸などを用いることが好ましい。ヒドロキシ酸塩としては、ナトリウム塩、カリウム塩、またはクエン酸塩などを用いることが好ましい。クエン酸塩としては、たとえばクエン酸三カリウムを用いることができる。第2のキレート剤としてクエン酸塩を用いることにより、Sc3+の有機溶媒への移行の特異性をさらに高めることができる。本実施の形態では、クエン酸三カリウムの濃度は0.01Mであるが、これに限られない。特に、第2のキレート剤の濃度は、水溶液1中のSc3+の濃度およびZrO2+の濃度に基づいて決定する。たとえば、1モルのZrO2+に対して、第2のキレート剤を1〜1000モル倍、より好ましくは2〜300モル倍添加する。
【0037】
(工程2)
本工程では、工程1で得られた混合液を振とうや撹拌により混合し、混合液を形成させる。混合液では、水溶液と有機溶媒とがエマルジョン状態となり、両者の接触面積が増大することにより、水溶液中に存在するSc3+と、有機溶媒中に存在する第1のキレート剤との接触頻度が増大する。これにより、Sc3+と有機溶媒中の第1のキレート剤との錯形成が促進され、Sc3+が有機溶媒中に移行する。有機相と水相とが十分に混合できる方法であれば、振とうや撹拌以外によって混合してもよい。水相と有機相の体積比は特に限定されないが、水相と有機相の体積比を約10:1〜約1:10とすることができる。
【0038】
Sc3+の抽出率を高めるためには、本工程における水溶液のpH(平衡pH)が約1.3〜約4.6であることが好ましく、平衡pHが約3.2〜約4.4であることがより好ましい。水相の平衡pHを高くする場合、3MのNaOHまたは3MのKOHなどの塩基性試薬を水相に滴下することにより、水相の平衡pHを調整することが好ましい。一方、水相の平衡pHを低くする場合、3MのHClなどの酸性試薬を水相に滴下することにより、水相の平衡pHを調整することが好ましい。
【0039】
(工程3)
本工程では、遠心分離などを用いて、混合液を有機相と水相とに相分離する。有機溶媒としてヘキサンを用いた場合、遠心分離後の試験管を静置すれば、有機相が水相よりも上側となる。この有機相には第1のキレート剤と錯形成されたSc3+が含まれ、水相(水溶液2)中にはZrO2+が含まれる。なお、有機相と水相とが十分に分離できさえすれば、相分離の条件はこれに限られない。たとえば、遠心分離をせず、振とう後の混合液を静置して自然に相分離させてもよい。
【0040】
(工程4)
本工程では、相分離された有機相を新たな試験管に取り出し、その有機相に酸を加えることにより、Sc3+の逆抽出を行う。用いる酸は、塩酸、硝酸または硫酸が好ましい。このときの酸濃度は約1〜約4Mが好ましい。図1では、まず有機相を新たな試験管に移し、ここに1Mの塩酸水溶液(水溶液3)を加える。
【0041】
その後、得られた混合液を振とうや撹拌により混合し、混合液を形成させる。振とう後の混合液を遠心分離などにより有機相と水相とに相分離させる。その結果、錯形成が解除されたSc3+は有機相から水相へと移動する(逆抽出)。水相と有機相の体積比は特に限定されないが、たとえば約10:1〜約1:10とすることができる。逆抽出後の水相を、Sc3+含有水溶液(水溶液4)として回収する。なお、工程3と同様に、有機相と水相とが十分に分離できさえすれば、相分離の条件はこれに限られない。
【0042】
溶媒抽出法では、有機溶媒中から金属イオンを回収する逆抽出が、非常に困難な場合がある。本方法では、第1のキレート剤として少なくとも一部が酸化分解されたアルキルモノチオリン酸またはアルキルジチオリン酸を使用し、工程2において水相のpHを調整することにより、容易に高収率でSc3+の抽出を行うことができる。Sc3+は、キレート剤の配位原子Oにおいて、最も安定的に錯形成する。しかし、本方法で好適に使用されるアルキルモノチオリン酸およびアルキルジチオリン酸は、配位原子がS,Sである。そのため、Sc3+とアルキルモノチオリン酸またはアルキルジチオリン酸との錯形成における結合が比較的弱いため、逆抽出時に酸を加えることにより、容易に錯形成が解除され、Sc3+が水溶液4へと移行すると考えられる。
【0043】
以上の工程1〜4により、汎用性のある試薬を用い、Sc3+とSc3+以外の金属イオンとを含む水溶液から簡便に、Sc3+を高純度かつ高収率で分離することができる。逆抽出されたSc3+からScを精製するためには、公知の方法を使用すればよい。なお、工程3で相分離された水相(水溶液2)を用いて工程1〜3を繰り返すことにより、水相中に残留するSc3+をさらに抽出し、Sc3+の収率を高めてもよい。
【0044】
(金属イオンの濃度測定)
次に、工程4により得られた水溶液4中のSc3+の濃度(ppm)を測定する。この測定には、誘導結合プラズマ発光装置(ICP−OES)を好適に使用することができる。水溶液4中の金属イオンの濃度が高い場合には、装置の測定範囲に入るように、測定前に水溶液4を希釈する。
【0045】
この場合、以下に示す直接法の式(1)または間接法の式(2)を使用し、抽出率(E%)を算出することができる。なお、ここでは水相と有機相の体積比が1:1の場合の式を示す。
【0046】
【数1】

式中、[M]aqは抽出操作後に水相中に存在する金属イオン濃度を、[M]oは抽出後に有機相中に存在する金属イオン濃度を表す。
【0047】
【数2】

式中、[M]initは金属イオンの初期濃度を、[M]aqは抽出操作後に水相中に残存する金属イオン濃度を表す。
【0048】
第1のキレート剤としてPhoslex DT−8を用い、図1に示す方法によりSc3+(0.1mM)とZrO2+(0.1mM)を含む水溶液からSc3+を抽出した場合、抽出時の平衡pHが約1.3〜約4.6の広範囲で、Sc3+を約60%以上の抽出率で回収することができる。この場合、回収された金属イオンに占めるSc3+の割合(Sc3+の純度)はほぼ100%である。さらに、抽出時の平衡pHが約3.2〜約4.4の範囲では、Sc3+を約75%以上、さらには約85%の抽出率で回収することができる。
【0049】
(有用性)
自然界でScの含有濃度が0.05%を超える物質はほとんど存在しない。そのため、Scの含有濃度が相対的に高い鉱石から、Scを精製して回収する技術が必要となる。Scを含有する鉱石は、他の有用な元素を主成分として含むことが多い。そのため、多くの場合、鉱石の主成分である他の有用な元素を精製加工した後、残った製錬廃液などを利用して、Scを精製することになると考えられる。たとえば、Zrを主成分として含む鉱石からZrを精製加工した後の製錬廃液を用いて、Scを精製することが考えられる。Zrの製錬廃液はこれまで使用の用途がなかったため、大量に廃棄されているのが現状であった。しかし、Zrの製錬廃液中には、上述のとおり、高濃度(200ppm)のSc3+が含まれる。そのため、本方法を用いることにより、Zrの製錬廃液などのSc3+とSc3+以外の金属イオンとを含む水溶液から、汎用性のある試薬を用いてSc3+を簡便に分離することができる。つまり、Zrの製錬廃液に対して本方法を用いれば、新たに採掘などを行うことなく、Scの安定供給に大きく貢献することができる。
【0050】
その結果、従来は非常に希少価値の高いレアメタルであったScを様々な用途に使用することが可能となる。たとえば、固体酸化物型燃料電池(SOFC)の電解質原料として、Scを酸化スカンジウム(Sc2O3)の状態で供給する。この場合、ジルコニア(ZrO2)に酸化スカンジウムを4〜11モル%固溶させたスカンジア安定化ジルコニアを、SOFCの電解質として使用することができる。8モル%スカンジウム安定化酸化ジルコニウムは、8モル%イットリア安定化ジルコニアと比較して2倍以上の電気伝導度を示し、SOFCの作動温度も約200℃下げることができるため注目されている。燃料電池のマーケットには将来性があるため、スカンジウムの安定供給が燃料電池の性能向上に大きな契機となると期待されている。
【0051】
また、ジルコニウム鉱石は、中国だけでなく、たとえば南アフリカ、オーストラリア、東南アジア、南米など多くの国で産出されている。これらの国で本方法を用いた工業生産を行うことにより、中国に依存することなくScの供給源を確保することができる。
【実施例】
【0052】
第1のキレート剤の評価を行った。図1に示す方法により、Sc3+(0.1mM)とZrO2+(0.1mM)を含む水溶液10mlから、Sc3+を抽出した。水溶液(水溶液1)には、第2のキレート剤としてクエン酸三カリウムが0.01M含まれている。第1のキレート剤として、配位原子がN,Oである7−(4−エチル−1−メチルオクチル)−8−キノリノール(Kelex 100:ハイケム株式会社製)、配位原子がO,Oであるリン酸2−エチルヘキシル(PC88A:大八化学工業株式会社製)、配位原子がO,Sであるビス(2,4,4−トリメチルペンチル)モノチオホスフィン酸(TMpMTP:Fluka社製)、配位原子がS,Sであるジ(2−エチルヘキシル)ジチオリン酸(Phoslex DT−8:SC有機化学株式会社製)を用いた。
【0053】
PC88A、TMpMTPおよびPhoslex DT−8は、最終濃度が0.1Mとなるようにヘキサンに溶解させ、10mlを分取した。一方、Kelex 100は分子が大きいため、溶媒への溶解度が低く、トルエンやヘキサンでは十分な濃度の溶液にすることができなかった。そのため、Kelex 100のみ最終濃度が0.1Mとなるようにオクタノールに溶解させ、10mlを用いた。
【0054】
工程3における水溶液の平衡pHが以下の図2〜5および表1に示す値となるように、工程2において3MのNaOHを水相に加えることにより、水相のpHを調整した。また、図1の工程4では、1Mの塩酸水溶液を用いて逆抽出を行った。工程3で得られた有機相7mlを別の試験管に移し、1Mの塩酸水溶液を7ml加えた。
【0055】
得られた水溶液中の各金属イオンの濃度を、誘導結合プラズマ発光装置(ICP−OES:Varian社製)を用いて測定した。この測定結果に基づき、抽出率(%)を算出した。第1のキレート剤としてPhoslex DT−8を用いた場合、上述の式1を用いて抽出率(%)を算出した。第1のキレート剤としてKelex 100、PC88AおよびTMpMTPを用いた場合、[M]oを求めることができなかったため、上述の式2を用いて抽出率(%)を算出した。
【0056】
(比較例1)
図2は、比較例として、第1のキレート剤にKelex 100を用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。本比較例では、Sc3+(0.1mM)およびZrO2+(0.1mM)に代えて、Al3+(0.1mM)およびFe3+(0.1mM)を含む水溶液1を用いた。この場合、平衡pHがどの範囲であっても、Sc3+を高い抽出率で抽出することはできなかった。また、Sc3+を他の金属イオンから高純度で分離することもできなかった。
【0057】
(比較例2)
図3は、比較例として、第1のキレート剤にPC88Aを用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。この場合、広いpH領域でSc3+が約100%の抽出率で抽出された。しかし、これらの場合には、ZrO2+も抽出されたため、Sc3+を高純度で抽出することはできなかった。
【0058】
(比較例3)
図4は、比較例として、第1のキレート剤にTMpMTPを用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。この場合、広いpH領域でSc3+が約100%の抽出率で抽出された。しかし、これらの場合には、ZrO2+も抽出されたため、Sc3+を高純度で抽出することはできなかった。
【0059】
(実施例1)
図5は、第1のキレート剤としてPhoslex DT−8を用いた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。また、表1には、第1のキレート剤としてPhoslex DT−8を用いた場合の金属イオンの抽出率(%)を示す。表1に、図5の基となる実験データを示す。
【0060】
【表1】

【0061】
ここで、「設定pH」は、工程2でSc3+とSc3+以外の金属イオンと第2のキレート剤を含む混合水溶液に3MのNaOHを加えた場合のpHの初期値を示す。また、「平衡pH」は、工程3で有機相を分離した後の水相のpHを示す。
【0062】
Sc3+の抽出率(%)は、工程3における平衡pHが1.04(試料1)〜4.36(試料12)の範囲で、平衡pHが上昇するにつれて約43.0%から約85.2%に増加した。この場合、平衡pHが約1.6〜約4.65の広範囲で、Sc3+を約60%以上の抽出率で回収することができた。さらに、平衡pHが約3.1〜約4.5の範囲では、Sc3+を約75%以上、さらには約85%の抽出率で抽出することができた。いずれの平衡pHでも、ZrO2+は全く抽出されなかった。これは、第2のキレート剤として加えたクエン酸イオンがZrO2+の有機相中への移行を効率的に阻害したためであると考えられる。また、第1のキレート剤としてPhoslex DT−8を用いた場合、1.0MのHCl溶液を用いて逆抽出すると、逆抽出を容易に高収率で行うことができた。
【0063】
(実施例2)
図6は、第1のキレート剤としてPhoslex DT−8を用い、水溶液1にSc3+およびZrO2+に代えてAl3+およびFe3+を加えた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【0064】
平衡pHが約1.0〜約4.5の範囲において、水溶液4に分離されるAl3+を低濃度にすることができた。また、平衡pHが約3.9〜約4.5の範囲において、水溶液4に分離されるFe3+を低濃度にすることができた。
【0065】
(実施例3)
図7は、第1のキレート剤としてPhoslex DT−8を用い、水溶液1にSc3+およびZrO2+に代えてY3+を加えた場合に、工程3における平衡時のpH(平衡pH)が金属イオンの抽出率(%)に及ぼす影響を示すグラフである。
【0066】
この場合、平衡pH約0.95〜約4.58の範囲において、水溶液4に分離されるY3+を低濃度にすることができた。特に平衡pH約3.6〜約4.5の範囲では、水溶液4に分離されるY3+を10%未満に抑えることができた。
【0067】
つまり、実施例1〜3に基づくと、平衡pHが約3.9〜約4.5の範囲では、Sc3+、ZrO2+、Al3+、Fe3+およびY3+を含む水溶液から、Sc3+を高純度で分離できることが明らかとなった。
【0068】
以上、本発明を上述の実施の形態を参照して説明したが、本発明は上述の実施の形態に限定されるものではなく、実施の形態の構成を適宜組み合わせたものや置換したものについても本発明に含まれるものである。また、当業者の知識に基づいて実施の形態における組合せや工程の順番を適宜組み替えることや各種の設計変更等の変形を実施の形態に対して加えることも可能であり、そのような変形が加えられた実施の形態も本発明の範囲に含まれうる。
【特許請求の範囲】
【請求項1】
Sc3+とSc3+以外の金属イオンとを含む水溶液に、有機溶媒と、Sc3+を有機溶媒中で錯形成させるための第1のキレート剤とを加える工程と、
前記水溶液と前記有機溶媒とを混合して混合液を形成させ、Sc3+と前記第1のキレート剤とを錯形成させる工程と、
前記混合液を有機相と水相とに相分離する工程と、を含むことを特徴とするSc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための方法。
【請求項2】
前記水溶液は、Sc3+以外の金属イオンとしてZrO2+、Ti3+またはY3+の少なくとも1つを含むことを特徴とする請求項1に記載の方法。
【請求項3】
前記第1のキレート剤は、少なくとも一部が酸化分解されたアルキルモノチオリン酸またはアルキルジチオリン酸であることを特徴とする請求項1または2に記載の方法。
【請求項4】
前記第1のキレート剤は、少なくとも一部が酸化分解されたジ(2−エチルヘキシル)ジチオリン酸であることを特徴とする請求項3に記載の方法。
【請求項5】
Sc3+以外の金属イオンの前記有機溶媒への移行を阻害するための第2のキレート剤を、前記混合液を形成させる前にさらに添加することを特徴とする請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記第2のキレート剤は、ヒドロキシ酸もしくはヒドロキシ酸塩であることを特徴とする請求項5に記載の方法。
【請求項7】
相分離された有機相に酸を加えることにより、Sc3+の逆抽出を行う工程をさらに含むことを特徴とする請求項1〜6のいずれか1項に記載の方法。
【請求項1】
Sc3+とSc3+以外の金属イオンとを含む水溶液に、有機溶媒と、Sc3+を有機溶媒中で錯形成させるための第1のキレート剤とを加える工程と、
前記水溶液と前記有機溶媒とを混合して混合液を形成させ、Sc3+と前記第1のキレート剤とを錯形成させる工程と、
前記混合液を有機相と水相とに相分離する工程と、を含むことを特徴とするSc3+とSc3+以外の金属イオンとを含む水溶液からSc3+を分離するための方法。
【請求項2】
前記水溶液は、Sc3+以外の金属イオンとしてZrO2+、Ti3+またはY3+の少なくとも1つを含むことを特徴とする請求項1に記載の方法。
【請求項3】
前記第1のキレート剤は、少なくとも一部が酸化分解されたアルキルモノチオリン酸またはアルキルジチオリン酸であることを特徴とする請求項1または2に記載の方法。
【請求項4】
前記第1のキレート剤は、少なくとも一部が酸化分解されたジ(2−エチルヘキシル)ジチオリン酸であることを特徴とする請求項3に記載の方法。
【請求項5】
Sc3+以外の金属イオンの前記有機溶媒への移行を阻害するための第2のキレート剤を、前記混合液を形成させる前にさらに添加することを特徴とする請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記第2のキレート剤は、ヒドロキシ酸もしくはヒドロキシ酸塩であることを特徴とする請求項5に記載の方法。
【請求項7】
相分離された有機相に酸を加えることにより、Sc3+の逆抽出を行う工程をさらに含むことを特徴とする請求項1〜6のいずれか1項に記載の方法。
【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図1】




【図3】


【図4】


【図5】


【図6】


【図7】


【図1】


【公開番号】特開2013−57115(P2013−57115A)
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【出願番号】特願2011−197549(P2011−197549)
【出願日】平成23年9月9日(2011.9.9)
【出願人】(593165487)学校法人金沢工業大学 (202)
【出願人】(000208662)第一稀元素化学工業株式会社 (56)
【Fターム(参考)】
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【出願日】平成23年9月9日(2011.9.9)
【出願人】(593165487)学校法人金沢工業大学 (202)
【出願人】(000208662)第一稀元素化学工業株式会社 (56)
【Fターム(参考)】
[ Back to top ]

