SmgGDS遺伝子欠損動物
【課題】 低分子量G蛋白質の調節因子Smg GDS遺伝子を欠損した動物個体を提供する。
【解決手段】 低分子量GTP結合蛋白質に対する調節因子であるGDP解離刺激因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されている分化全能性細胞を発生させた非ヒト動物個体およびその子孫動物であるSmg GDS遺伝子欠損動物。
【解決手段】 低分子量GTP結合蛋白質に対する調節因子であるGDP解離刺激因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されている分化全能性細胞を発生させた非ヒト動物個体およびその子孫動物であるSmg GDS遺伝子欠損動物。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】この出願の発明は、Smg GDS遺伝子欠損動物に関するものである。さらに詳しくは、この出願の発明は、低分子量GTP結合蛋白質(G蛋白質)の調節因子であるSmg GDS遺伝子がその機能欠失型変異遺伝子に置換された遺伝子ノックアウト動物であって、体内においてSmg GDSを合成する能力を持たない、または合成能が低い遺伝子欠損動物と、この動物の作成に不可欠なES細胞に関するものである。この遺伝子欠損動物は、医薬品開発等の分野において有用である。
【0002】
【従来の技術】低分子量GTP結合蛋白質(G蛋白質)は、100を越えるメンバーから成るスーパーファミリーを構成している(Bourne et al., 1990, 1991; Hall, 1990; Takaiet al., 1992)。このスーパーファミリーは、5つのファミリー、Ras、Rho、Rab、Arf/SarおよびRanファミリーで構成されている。ファミリーはそれぞれサブファミリーを持っている。すなわち、Rasファミリーは、主として遺伝子発現を調節しており、Rhoファミリーは、細胞骨格および遺伝子発現を調節し、RabおよびArf/Sarファミリーは、細胞内小胞輸送を調節し、そしてRanファミリーは、細胞質と核の間の輸送を調節している。このように多くの低分子量G蛋白質の機能が分類されているが、スーパーファミリーの個々のメンバーが、何時、どのように相互作用し、シグナル交換を行って多くの細胞機能を効果的に調節しているのかは判っていない。
【0003】標的遺伝子組換えは、その方法が主として、破壊された1つの遺伝子によってもたらされる表現型の変化に基づいているために、低分子量G蛋白質の各メンバーの役割を分析するのに役立つとは限らない。この出願の発明者らは、Rasファミリーの機能的な重複性に取り組んできた。たとえば、Ki-Rasの欠損は、胎児性致死を生じさせる(Koera et al., 1997; Johnson et al., 1997)のに対し、Ha-RasあるいはN-Ras欠損マウスは明白な異常は示さない(Katsuki, 私信;Umanoffet al., 1995)。注目べきことに、Ha-RasおよびN-Rasの両方のノックアウトマウスは生存可能である(Katsuki, 私信)ということは、Ki−RasがHa-RasおよびN-Rasの機能を代替できることを示唆している。もう1つの問題は、機能が重複していないRhoファミリーメンバーが決定的な役割を演じていることである。すなわち、Rac1およびCdc42を破壊すると、胎児性の致死を生じる(Sugihara et al., 1998; Togawa, 未発表データ)ため、発生段階におけるこれら遺伝子の役割を検討することができない。マウスにおけるRho欠損は報告されていないが、RHO1を欠く酵母株は致死であることが知られている(Yamochi et al., 1994)。このように低分子量G蛋白質の各メンバーを破壊することは、マウスにおいてその機能を分析する上ではさほど効果的ではない。
【0004】一方、Cre-LoxP法は前記のノックアウト法に代わる方法として役立つ可能性はあるが、低分子量G蛋白質の活性化が介在する基本的な細胞機能を研究するために、何時何処でCreリコンビナーゼを発現すべきかを決めるのは困難である。
【0005】この出願の発明者らは、低分子量G蛋白質の調節因子を破壊することによって低分子量G蛋白質の活性を抑制しようと試みてきた。低分子量G蛋白質は、GTP結合状態とGDP結合状態を交換することによってシグナル伝達における分子スイッチとして作用しており、3つの型の調節因子が同定されている。すなわち、グアニン-ヌクレオチド交換蛋白質(GEP)、GDP解離阻害因子(GDI)およびGTPアーゼ活性化蛋白質(GAP)である。GEPは、GDP結合型からのGDPの解離を刺激することにより、GDP結合不活性型をGTP結合活性型に変換する。GDIは、GDP結合型からのGDPの解離を阻害することによってGEPが誘導する変換を阻害する。そして、GAPはGTPアーゼ活性を刺激することによりGTP結合型をGDP結合型に変換する(Takaiet al., 1993)。このような調節因子は、低分子量G蛋白質を介してシグナル伝達の効率を高めているが、動物固体の生存には必ずしも必須ではない。この出願の発明者らは、Rho GDIα欠損マウスを作出し(Togawa et al., 1999)、この蛋白質の欠損がその基質である低分子量G蛋白質自体の欠損ほど有害な表現型は生じないことを見い出した。実際、このことは、低分子量G蛋白質GDP解離刺激因子(Smg GDS)の欠損の場合も同様である。
【0006】Smg GDSは、低分子量G蛋白質に対する4番目の型の調節因子である。この調節因子は元々Rap1Bの調節因子としてウシの脳の細胞内可溶質から精製された(Yamamoto et al., 1990)。続いて、この出願の発明者らがウシとヒトのSmg GDSのcDNAを単離し、そのヌクレオチド配列とアミノ酸配列を決定した(Kaibuchi et al., 1991; Kikuchi et al., 1992)。精製した試料を用いた無細胞系において、Smg GDSは、Rap1BのみならずKi-Ras、Rho、Rac、およびCdc42サブファミリーを含む低分子量G蛋白質群からのGDPの解離を刺激するが、Ha−Rasには作用しない(Mizuno et al., 1991, 1992; Ando et al., 1992; Hiraoka et al., 1992; Yaku et al., 1994)。この基質特異性は、Rasサブファミリーに対するSOS(Simon et al., 1991)とCdc25(Jones et al., 1991)、およびRapサブファミリーに対するC3G(Gotoh et al., 1995)とEpac/サイクリックAMP-グアニンヌクレオチド交換因子(de Rooij et al., 1998; Kawasaki et al., 1998)とは異なっているが、Rho GDI(Takai et al., 1993)やRab GDI(Takai et al., 1993)のようなGDIの基質特異性とは似通っている。無処理のNIH3T3細胞で、Smg GDSはKi-Rasと共同して形質転換活性を示し(Fujioka et al., 1992)、Swiss3T3細胞ではKi-RasあるいはRap1と共同して分裂促進活性を示す(Yoshida et al., 1992)ということは、Cdc25やSOSで言われているように(Hughes et al., 1990; Crechet et al., 1990; Bonfiniet al., 1992)、Smg GDSは無処理の細胞でこのような低分子量G蛋白質に対する刺激性調節因子として作用していることを示唆している。しかしながら、Smg GDSの生理的機能は判っていない。
【0007】
【発明が解決しようとする課題】G蛋白質は、ホルモンや神経伝達物質等の細胞外情報物質が結合する細胞膜上の受容体と共役し、細胞内へのシグナル伝達・増幅因子として機能しており、細胞(そして細胞集団である個体)の発生、生存、あるいはアポトーシス等において重要な役割を果たしている。従って、G蛋白質の調節に係わる分子機構を解明することは、これらの生物機能の全貌を解明するばかりでなく、これらの生物機能の異常を原因とする各種疾患の診断やその治療法、治療薬等の開発への応用も期待される。そして、G蛋白質の調節機構を解明するためには、個体レベルでの解析が不可欠である。
【0008】この出願の発明は、以上のとおりの事情に鑑みてなされたものであって、低分子量G蛋白質の調節因子Smg GDS遺伝子を欠損した動物個体を提供することを課題としている。
【0009】
【課題を解決するための手段】この出願は、前記の課題を解決するための発明として、以下の(1)〜(5)の発明を提供する。
(1) 低分子量GTP結合蛋白質に対する調節因子であるGDP解離刺激因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されている分化全能性細胞を発生させた非ヒト動物個体およびその子孫動物であるSmg GDS遺伝子欠損動物。
(2) 非ヒト動物が、マウスである前記発明(1)のSmg GDS遺伝子欠損動物。
(3) 前記発明(1)または(2)の動物由来の組織または細胞。
(4) 低分子量GTP結合蛋白質に対する調節因子であるGDP解離刺激因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されているES細胞。
(5) マウス由来である前記発明(4)のES細胞。
【0010】以下、上記の各発明について実施の形態を詳しく説明する。
【0011】
【発明の実施の形態】この出願によって提供される前記発明(1)のSmg GDS遺伝子欠損動物は、調節因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されている分化全能性細胞発生させた遺伝子ノックアウト非ヒト動物である。さらに詳しくは、この発明(1)のSmg GDS遺伝子欠損動物は、体細胞染色体のSmg GDS遺伝子がその変異配列に置換されているヘテロ接合体、あるいはホモ接合体として提供される。
【0012】この発明(1)のSmg GDS遺伝子欠損動物は、公知の標的遺伝子組換え法(ジーンターゲティング法:Science 244:1288-1292, 1989)により作製することができる。この標的遺伝子組換え法では、分化全能性細胞としてES(embryonic stem)細胞等を使用する。ES細胞は、マウス(Nature 292:154-156, 1981)、ラット(Dev. Biol. 163(1):288-292, 1994)、サル(Proc. Natl. Acad. Sci. U.S.A.92(17):7844-7848, 1995)、ウサギ(Mol. Reprod. Dev. 45(4):439-443, 1996)で確立している。また、ブタについてはEG(embryonic germ)細胞が確立している(Biol. Reprod 57(5):1089-1095, 1997)。従ってこの発明(1)のSmg GDS遺伝子欠損動物は、これらの動物種を対象に作製することができるが、特に遺伝子ノックアウト動物の作製に関して技術が整っているマウスが最適である。作製の具体的手続を、前記発明(2)のマウスを例にとって説明すれば以下のとおりである。
【0013】先ず、Smg GDS遺伝子のゲノムDNA断片を単離し、そのDNA断片を試験管内にて遺伝子操作し、Smg GDS遺伝子の開始コドンを含むDNA断片に対して改変を施すなどの、Smg GDS遺伝子の機能を欠失させるような変異DNA断片を作製する。Smg GDSゲノムDNAの単離は、例えば、公知のSmg GDSのcDNA配列(Kaibuchi et al., 1991; Kikuchi et al., 1992)に基づいて合成されたオリゴヌクレオチドプローブを用いてマウスゲノムDNAライブラリーをスクリーニングすることにより得られる。また、このSmg GDSのcDNAの一部または両端に相当する合成オリゴヌクレオチドをプライマーとするPCR法によっても目的とするゲノムDNAを得ることができる。なお、マウス以外の動物を対象とする場合にも、前記のcDNA配列に基づいて合成されたオリゴヌクレオチドをプローブまたはプライマーとする前記の方法により、各動物のSmg GDS遺伝子を単離することができる。
【0014】上記のとおりの方法によって得られたマウスSmg GDS遺伝子のゲノムDNAの一部を改変し、全能性細胞(ES細胞)のSmg GDS遺伝子に変異を導入するためのターゲティングベクターを、公知の方法(例えば、Science 244:1288-1292, 1989)に準じて作製する。例えば、Smg GDS遺伝子のゲノムDNAの一部をG418等の細胞毒に対する耐性遺伝子(例えば、ネオマイシン耐性遺伝子)に置換することにより、もしくは細胞毒に対する耐性遺伝子をSmg GDS遺伝子のゲノムDNAの一部に挿入することで、Smg GDSのゲノムDNAと相同な配列を両端に有する変異遺伝子を保有する組換えプラスミドDNA、すなわちターゲティングベクターを作製する。なお、細胞毒に対する耐性遺伝子には、その発現を制御するためのPGK1プロモーター等の配列およびPGK1ポリアデニレーションシグナル等を連結することもできる。また、細胞毒に対する耐性遺伝子により置換、または挿入されるSmg GDS遺伝子のゲノムDNA部位は、開始コドンを含んだエクソン領域を含むゲノムDNA領域であることが好ましい。
【0015】上記Smg GDS遺伝子のゲノムDNAの一部に変異を導入するためのターゲティングベクターには、Smg GDS遺伝子のゲノムDNAに相同な配列を有すること以外には特に制限はなく、他の薬剤耐性遺伝子や、細胞選択用遺伝子(例えば、ジフテリア毒素A遺伝子やヘルペスウイルスのサイミジンキナーゼ遺伝子)、プロモーター、エンハンサー等の配列を適宜に組み合わせて使用することができる。
【0016】次に、このターゲティングベクターを、公知の方法に準じてマウスES細胞に導入する。このような遺伝子導入法としては、公知の電気パルス法、リポソーム法、リン酸カルシウム法等も利用できるが、導入遺伝子の相同遺伝子組換え効率を勘案した場合、ES細胞への電気パルス法が好ましい。
【0017】遺伝子導入された各ES細胞のDNAを抽出し、サザンブロット分析やPCRアッセイ等により、染色体上に存在する野生型Smg GDS遺伝子と導入したSmg GDS変異遺伝子断片の間で正しく相同遺伝子組換えが起こり、染色体上のSmg GDS遺伝子に変異が移った細胞を選択する。
【0018】こうして得た変異遺伝子を持つES細胞を野生型マウスのブラストシストに注入し、つづいてこのキメラ胚を仮親の子宮に移植する。出生した動物を里親につけて飼育させた後、Smg GDS変異遺伝子が生殖系細胞に入ったキメラ動物を選別する。選別は毛色の違い、または体の一部(例えば尾部先端)からDNAを抽出し、サザンブロット分析やPCRアッセイ等により行う。Smg GDS変異遺伝子が生殖系細胞に入ったキメラ動物と野生型動物の交配により得られる子孫について、さらに体の一部(例えば尾部先端)からの抽出DNAを材料とした、サザンブロット分析やPCRアッセイ等を行い、Smg GDS変異遺伝子が導入されたヘテロ接合体を同定する。作出されたSmg GDS変異遺伝子を保有するヘテロ接合体は生殖細胞および体細胞のすべてに安定的にSmg GDS遺伝子変異を保有しており、交配等により、効率よくその変異を子孫動物に伝達することができる。
【0019】発明(3)は、前記のSmg GDS遺伝子欠損動物から単離した組織または細胞である。後記の実施例に示したように、この遺伝子欠損動物の心臓や胸腺細胞はアポトーシス刺激に対して敏感に反応するため、抗アポトーシス剤等のスクリーニング系として有用である。
【0020】以下、実施例を示してこの発明についてさらに詳細かつ具体的に説明するが、この発明は以下の例に限定されるものではない。
【0021】
【実施例】1. 材料と方法1.1 DNAライブラリーのスクリーニングSmg GDSのcDNAは、細菌株と製造者のプロトコールを用いて、マウスの脳cDNAライブラリλTriplEx(クローンテック)から単離し、ABI DNAシークエンサーを用いて配列決定した。Smg GDSのN末端半分をコードしているcDNA断片を適当なプラスミドベクターにサブクローニングし、プローブとして用いて、129SVJマウスのゲノムライブラリλFIXII(ストラタジーン)の相同性をスクリーニングした。
1.2 Smg GDS-/-マウスの作出Smg GDS遺伝子のエクソン5の3’側半分とそれに続くエクソン6およびエクソン7(Smg GDSタンパクのアミノ酸配列212-343)をneo耐性遺伝子カセットと置き換えてターゲティングベクターを構築した。RW4胎児性幹(ES)細胞に遺伝子移入し、文献(Togawa et al., 1999)の記載に従って選択した。相同組換えは5’-および3’-外部プローブおよびネオ耐性遺伝子プローブを用いてサザンハイブリッド形成によって確認した。Smg GDS+/-ES細胞をE3.5 C57BL/6Jマウスの胚盤胞に微量注入し、偽妊娠したMCH雌マウスに移し、キメラマウスを生ませ、生殖系列に組み込ませるためにBDF1と交配した。また、変異遺伝子を持ったマウスをC57BL/6マウスに戻し交配した。遺伝子型は、neo耐性遺伝子(配列番号1および配列番号2)および置換したSmg GDS遺伝子(配列番号3および配列番号4)におけるプライマーを用い、サザン解析とPCRによって決定した。PCR混合物は95℃にて2分間で変性させ、55℃にて1分間でアニ−リングした。PCRは25サイクルで以下のように行った:72℃にて2分間(伸張)、95℃にて30秒(変性)、55℃にて1分間(アニ−リング)。試料はさらに72℃にて5分間伸張させた。PCR産物は4% 3:1 NuSieveアガロース(タカラ)/TAEゲルにて観察した。
1.3 抗体およびウエスタンブロット分析抗Smg GDS抗体は、文献(Kikuchi et al., 1992)の記載に従って作成した。マウスの脳は、320 mMサッカロース、20mM Tris-Cl pH7.5、2mM EDTA、および10mMPMSFからなる溶解緩衝液中でホモゲナイズした。50mgの蛋白質をSDS-PAGEにて分画し、Immobilon膜(ミリポア)に移し、5% BSAを含むトリス緩衝液生理食塩水中にて1時間ブロックした。抗Smg GDS抗体と共に1時間、次いでペルオキシターゼを結合した2次抗体と共に1時間インキュベートした後、ECL(アマシャム ファルマシア バイオテック)によりブロットを視覚化した。
1.4 Smg GDS特異的なRT-PCRTRIzol試薬(ギブコBRL)を用いて各遺伝子型を持つマウスの脳から全RNAを抽出し、製造者のプロトコールに従って処理した。モロニー逆転写酵素およびcDNA合成キット(ストラタジーン)の試薬を用いてcDNAの1本目の鎖を作成した。反応の20%(4μl)を50μlのPCR増幅に用いた。PCR増幅には、5UのTaq-DNAポリメラーゼ、2mMのMgCl2、150μMのdNTPs、1μMのプライマー(配列番号5および配列番号6)を用いた。PCRは25サイクルで以下のように行った:72℃にて2分間(伸張)、95℃にて30秒(変性)、55℃にて1分間(アニ−リング)。試料はさらに72℃にて5分間伸張させた。PCR産物は4% 3:1 NuSieveアガロース(タカラ)ゲルにて電気泳動を行い、Smg GDS cDNAプローブを用いてサザンブロット解析した。
1.5 組織学的な分析マウスの胎児と新生児をブアン液あるいは4%パラホルムアルデヒドで固定し、パラフィン包埋し、連続切片(5μm)を作成して、ヘマトキシリンおよびエオシン(HE)で染色した。ターミナルデオキシヌクレオチジルトランスフェラーゼ(TdT)が介在するdUTPニック端標識(TUNEL)染色は、in situアポトーシス検出キット(タカラ)を利用してパラホルムアルデヒド固定した切片で行った。すなわち、切片をプロテイナーゼK(20 μg/ml)と共に37℃にて15分間インキュベートし、次いで3%H2O2中でインキュベートすることにより内在性のペルオキシターゼをブロックした。リン酸緩衝液生理食塩水(PBS)にて洗浄した後、TdT酵素と標識保護緩衝液を含むTUNEL反応混合物を湿気を含んだ反応槽中の切片にかけ、37℃にて75分間インキュベートした。次いでPBSにて切片を3回洗浄し、抗FITC HRP-結合2次抗体とともに30分間インキュベートし、2回すすいで、3,3-ジアミノベンジジン テトラヒドロクロライドとH2O2にて視覚化した。最後にヘマトキシリンで切片を対比染色した。in vivoにおけるブロモデオキシウリジン(BrdU)標識については、BrdU(マウス当たり0.5mlの生理食塩水に0.5mg溶解した)を11.5日目および12.5日目の妊娠したメスの腹腔内に注射した。注射後1時間でメスを屠殺した;4%パラホルムアルデヒド中で4℃にて一晩、胎児を固定し、文献(Fushiki et al., 1997)の記載に従って免疫組織化学的に検索した。
1.6 Ex vivoにおける胸腺細胞アポトーシスの誘導新生児胸腺の単一細胞浮遊液を10%DCC-FCSを添加したRPMIで2回洗浄し、5%CO2環境で37℃にて30分間インキュベートし、内在性のグルココルチコイドを除去した。1x106/ml個の胸腺細胞を24穴組織培養用プレートに入れ、以下の細胞死刺激によって処理した:デキサメサゾン(シグマ)、エトポシド(クローンテック)、抗Fas抗体Jo2(ファーミンジェン)と30μg/mlのシクロヘキシミド、およびUV照射。ApoAlert CPP32/Casp-3蛍光アッセイキット(クローンテック)を用いてカスパーゼ-3の活性を測定した。DEVD-AFCの開裂は蛍光分光光度計(シマヅRF-1500)によって測定した。胸腺細胞を、ヨウ化プロピジウム(シグマ)およびCD4、CD8、およびアネキシンVに対する抗体(ファーミンジェン)で染色し、FACSヴァンテージ二重レーザーフローサイトメーター(ベクトン-ディッキンソン、サンノゼ、CA)によって解析した。
1.7 レトロウイルスによる遺伝子移入完全長のSmg GDS cDNAおよび対照としての増強緑色蛍光タンパク(EGEP)cDNAをpLNCXレトロウイルスベクターのHpaI部位にサブクローニングし、PT96細胞に遺伝子移入して、感染性組換えレトロウイルスを作成した。パッキングした細胞をG418(500μg/ml)の存在下で1週間選抜した。レトロウイルスによるトランスフェクションは製造者のプロトコール(クローンテック)に記載されているとおりに行った。1ml当たり106-107個のウイルス粒子を含んでいる細胞培養液を0.45μmのフィルター(ミリポア)で濾過し、1x106個の胸腺細胞に24時間加え、遺伝子を発現させた。次いでエトポシドで胸腺細胞を処理することによりアポトーシスを誘導した。
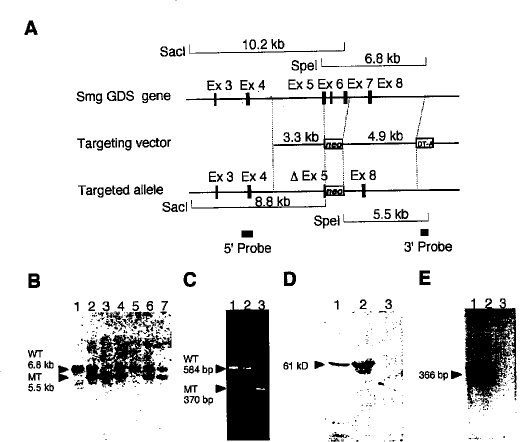
2. 結果2.1 Smg GDS-/-マウスの作出Smg GDS遺伝子のエクソン5の3'側半分とそれに続くエクソン6およびエクソン7を含む1.7kbのゲノムDNAを削除するように設計されたターゲティングベクターを用いた相同組換えによってSmg GDS+/-ES細胞を作出した(図1A)。ベクターをエレクトロポレーションによりES細胞に導入し、G418抵抗性のSmg GDS変異遺伝子へテロ接合体のコロニーを3つ得た。サザンブロット分析によりG418抵抗性コロニーの遺伝子型を確認した。これらのESクローンを用いてキメラマウスを作成した。Smg GDSヘテロ接合体同志を交配し、ホモ接合体の変異遺伝子を持った子孫を作成した(図1BおよびC)。破壊した遺伝子座についてホモ接合体マウスは、元々のSmg GDS蛋白質も、Smg GDS mRNAに由来するRT-PCR産物も発現していなかった(図1DおよびE)。
2.2 新生児の生存に対するSmg GDSの必要性Smg GDSヘテロ接合体マウスは取り立てて表現型の変化も無く生存可能である。それに対して、Smg GDS欠損マウスは、Smg GDS-/-マウスの生存比率が非常に減少した。ヘテロ接合体同志の交配において、3週令のホモ接合体マウスは全体の7%で、期待値である25%よりも有意に低かった(表I)。胎児の遺伝子型と胎児致死性には相関関係が認められないことから、Smg GDSはマウスの発生には必須ではないが、出生後の生存には意味があることを示唆している。次に、出生後0-10日間におけるSmg GDS-/-マウスの生存率を調べた。Smg GDS-/-の約70%のマウスが生後5日以内に死亡した(図2A)。このようなマウスは生後0-2日(P0-2)で衰弱し、症状の発症後20-30時間以内に死亡する傾向があった。Smg GDS-/-の約30%のマウスはこの期間を生き延び、少なくとも1年間は生存可能であった。このように生き延びたマウスは特別な細菌のいない環境で相対的に正常に発達し、繁殖可能であった。2世代目のSmg GDS-/-子孫における生存率も30%であり、最初のヘテロ接合体交配で得られたSmg GDS-/-マウスの生存率と同様であった(図2B)。さらに、この生存傾向は3回の戻し交配後、C57BL/6の遺伝的背景にも保存されていた。このような知見は、Smg GDS-/-マウスが、野生型やSmg GDS+/-の同腹仔に比べて生存上有意に不利であり、Smg GDSは遺伝的に新生児死亡を起こすということを示している。
【0022】
【表1】

【0023】2.3 Smg GDS-/-マウスにおける心不全生後1日で衰弱しつつあるSmg GDS-/-マウスを様々なレベルで観察した。その結果、それらのほとんどが、心不全の徴候:チアノーゼ、浮腫および皮膚の膨圧の低下を示していた。予想通りSmg GDS-/-マウスの心臓は肉眼的に拡張しており、心房、心室および中隔壁は極めて薄くなっていた。組織学的に両方の心房および心室は拡張し、対応する野生型同腹仔に比べて梁状突起が低下していた(図3、AaおよびBa)。Smg GDS-/-マウスの心筋は顕著な細胞減少を示したが、炎症性細胞の浸潤とは関連していなかった(図3、AbおよびBb)。Smg GDS-/-マウス心臓のこのような形態的な変化は、Ki-Ras-/-マウス心臓の形態(Koera et al., 1997)に酷似しているように思われた。Smg GDS-/-マウスの肝臓および肺は対照同腹仔に比べて1.2から1.5倍の重量があり、組織学的には顕著な鬱血を示した(図3、Ac、Bc、Ad、およびBd)。これらのことを総合すると、Smg GDS-/-マウスにおける新生児死亡は心不全により引き起こされると結論付けられる。
2.4 Smg GDS-/-心筋細胞におけるアポトーシスSmg GDS-/-マウスの心臓における細胞数の減少および異常構造が細胞増殖能力の低下によるものなのか、あるいはアポトーシスの亢進によるものなのかを調べた。実際、Ras/MAPK経路は長い間、分裂促進シグナルによる細胞増殖に含まれると考えられていた(Buday et al., 1993; Egan et al., 1993; Liu et al., 1993; Vojtek et al 1993)。しかし、最近になって無脊椎動物(Bergmann et al., 1998a, 1998b;Kurada およびWhite, 1998)およびマウスの造血系細胞株BaF3(Walker et al., 1998)においてRasは細胞の生存シグナルに介在することが明らかにされた。Ki-Rasマウスにおける心臓の病変は、交尾後13.5-15.5日(dpc)に見られ、心筋の増殖不全により引き起こされると考えられているので、in vivoにおける胎児心筋の増殖について調べた。11.5dcpの胎児を抱えた妊娠マウスの腹腔内にBrdUを注射し、BrdUの胎児組織への取り込みを組織学的に評価した。心臓切片のHE染色では、Smg GDS-/-マウスと対照の間で明確な差異を示さなかった(図4、AaおよびBa)。Smg GDS+/-マウスおよびSmg GDS-/-マウス心臓(4匹の胎児から得た32の切片を調べたデータ)における心筋細胞核の総数に対するS期の核(BrdU陽性)の量的な比較では、Smg GDS+/-マウス心臓おける比率は22.2±3.3%およびSmg GDS-/-心臓マウスにおける比率は21.3±3.7%であり、BrdUは同じようなレベルでSmg GDS-/-マウス心臓および対照心臓に取り込まれることを示した(図4、AbおよびBb)。さらに13.5、15.5、および16.5dpcにおける胎児の心筋細胞の1次培養を分析したが、心筋細胞の変異マーカーである、αアクチン−サルコメア単位の形成に変化を認めることはできなかった(データは示さず)。このような結果は、Smg GDS-/-マウスの胚形成において心筋細胞は正常に増殖することを示し、Smg GDSヘテロ接合体間交配で生じる胎児のメンデル遺伝様式による遺伝に一致している。
【0024】次に、心筋細胞におけるアポトーシスの亢進が生後1日のSmg GDS-/-マウス心臓における心房、心室および中隔壁の薄化を導いているという可能性を検討した。ただし、生後1日では既にアポトーシス細胞が処理されるか、消えているかもしれないので、胎令E18.5および生後P0日の心臓をTUNEL染色法を用いて調べた。HEおよびTUNEL染色した連続切片を、Smg GDS-/-マウスと同腹仔の間でアポトーシスを受けている細胞について視覚化して比較した。18.5dpcでは核濃縮した細胞やTUNEL陽性細胞は対照およびSmg GDS-/-マウス胎児の心筋細胞ではほとんど見られなかったのに対し、出生当日、主として6時間後にSmg GDS-/-マウスのTUNEL染色では、対照のSmg GDS+/-同腹仔に比べて大量の細胞死が見い出された(図5、AaおよびBa)。退行変性は、左心室内膜で優勢であり(図5、BcおよびBd)、心筋細胞の剥離および心室の拡張を起こしていた。Smg GDS-/-の心臓ではアポトーシスを受けている細胞は両方の心室で見られるのに対し、対照のSmg GDS+/-心臓では右心室にのみ見られたのは興味深い(図5、AbおよびBb)。このような知見は心臓の右側におけるアポトーシスは生理的過程の一部であり、新生児期における心臓血管系の難局のために過剰に負荷される血圧を反映することを示唆している。心臓血管系の力学的変化によって引き起こされる同様の知見は、gp130欠損マウスの心臓においても報告されている(Hirota et al., 1999)。このような結果は、胎生循環から体循環への変化の間における心臓血管系の過剰負荷が引きがねとなってSmg GDS-/-マウスの心筋細胞でアポトーシスが起き、形態的な変化を起こし、心不全に至ることを示唆している。
2.5 Smg GDS-/-新生児胸腺細胞のアポトーシス心臓の病変に加え、生後1日目におけるSmg GDS-/-マウスの胸腺が、野生型あるいはSmg GDS+/-マウスの同腹仔対象に比べて著しく小さく、胸腺細胞の総数が5から10倍減少していることを見い出した(データは示さず)。Smg GDS-/-マウスの胸腺の組織切片は、皮質と髄質の構造は保存されたままであるが、濃縮した核が広く分布することを示した(図6、Aa、Ab、Ba、およびBb)。濃縮した核はアポトーシスを示しているので、次にTUNEL染色を行い、実際にSmg GDS-/-マウスの胸腺ではアポトーシスを受けている胸腺細胞が増加していることを見い出した(図6、AcおよびBc)。さらに、Smg GDSの欠損が胸腺細胞の成熟を阻止するのかどうかを確認するために、Smg GDS-/-マウスの胸腺細胞をフローサイトメーターで解析した。しかしながら、CD4陽性細胞とCD8陽性細胞の集団は正常値範囲内にあり(図6、AdおよびBd)、Smg GDSはT細胞の分化には必須ではないことを示唆していた。
2.6 エトポシドおよびUV照射に反応した培養Smg GDS-/-胸腺細胞のアポトーシスSmg GDSの欠損とアポトーシスの亢進の関係を検討するために、ex vivoでの様々なアポトーシスアッセイに適している培養Smg GDS-/-胸腺細胞を用いた。SmgGDS-/-および対照胸腺細胞をマウス新生児から単離し、アポトーシスを誘導することが知られている4つの刺激剤で刺激した。アポトーシスの程度は、アポトーシスの間にDNAの断片化を起こすデオキシリボヌクレアーゼの直接的な上流活性因子であるカスパーゼ-3の活性によって測定した(Liu et al., 1997; Enari etal., 1998)。デキサメサゾンおよび抗Fas抗体はSmg GDS-/-および対照胸腺細胞に充分な効果を示さなかった(図7、AおよびB)、エトポシドおよびUV照射によって、Smg GDS-/-の胸腺細胞で同腹仔対照に比べて3から4倍カスパーゼ活性が増加していた(図7、CおよびD)。両方の刺激剤はDNAの損傷反応経路を誘導するので、Smg GDSが哺乳類細胞におけるp53チェックポイント機能に連結した増殖停止/アポトーシスの機構に関連する可能性が想定される。しかし、Smg GDS-/-がFas誘導アポトーシスにむしろ不応性だったということは(図7B)、Smg GDSがFas誘導アポトーシスにおいて負の作用を果していることが示唆されるが、これがどのようなものかは不明である。
2.7 Smg GDS-/-胸腺細胞において外因性に発現させたSmg GDSによるエトポシド誘発アポトーシスの回避Smg GDSの欠損が実際にマウスにおけるアポトーシスの表現型に関わっていることを明らかにするために、Smg GDSの機能を導入することによりSmg GDS-/-マウスにおける特性のいくつかが回避されるか否かを検討した。すなわち、Smg GDSのcDNAの発現によってエトポシドで誘発されるSmg GDS-/-胸腺細胞のアポトーシスを克服できるかどうか調べた。まず、出生日に新生児マウスから野生型とSmg GDS-/-型の胸腺細胞を単離し、Smg GDSあるいは対照としてEGFPを発現しているレトロウイルスを形質導入し、さらに24時間培養した。次いでアポトーシスを誘発するためにエトポシドで4時間処理をした。アポトーシスの指標としてフローサイトメーターによるパターンとカスパーゼ-3の活性を解析した。ベクターのみを形質導入したSmg GDS-/-の胸腺細胞については、エトポシドの4時間処理によって10%から約40%の細胞がアポトーシスを起こした(図8A、左と中央のパネル)。しかしながら、エトポシド処理をする前にSmg GDS発現ウイルスを導入したSmg GDS-/-の胸腺細胞の場合、Smg GDSの導入によって、アネキシンVおよびヨウ化プロピジウム陰性の生存細胞の比率が60%から66%に増加し、逆にアネキシンVおよびヨウ化プロピジウム陽性のアポトーシスを受けている細胞は40%から34%に減少した(図8A、右のパネル)。対照として、ウイルスベクターのみ(図8A、上のパネル)およびEGFP(データは示さず)を形質導入した細胞では、アネキシンおよびおよびヨウ化プロピジウム陽性の死細胞の比率における有意な効果は認められなかった。
【0025】さらに、同じレトロウイルスを形質導入したSmg GDS-/-胸腺細胞のカスパーゼ-3活性では、Smg GDS欠損の回復が見られた(図8B)。エトポシド処理に先だって胸腺細胞へSmg GDSを導入した場合、Smg GDS-/-胸腺細胞ではカスパーゼ-3の活性を有意に低下させたが、対照では低下しなかった。5つの代表的な結果の平均値は、胸腺細胞の調製によってある程度ばらついたが、Smg GDSの導入により、Smg GDS-/-胸腺細胞のおよそ半分の事例でカスパーゼ-3の活性が低下した。これは、Smg GDS-/-マウスの新生児期で見られた生存率の差異に一致していた。以上の結果は、Smg GDSの機能はエトポシドで誘発されるアポトーシスを克服するのにほぼ充分であることを示唆している。
2.8 Smg GDS-/-ニューロン細胞におけるアポトーシスノーザンブロット分析では、Smg GDSのmRNAは主として脳に発現しており、insituハイブリッド分析では、Smg GDSの転写物は、18.5 dpcの胎児の延髄、三叉神経節、および後根神経節で発現している(データは示さず)。さらにKi-Ras欠損マウスの胎生期の神経発生においてアポトーシスのレベルが上昇していることが知られている(Koera et al., 1997)。神経発生におけるSmg GDS欠損の影響をKi-Rasに関連した機能という背景で説明できるかどうか調べるために、Smg GDS-/-胎児における中枢神経系の損傷の可能性を調べた。Smg GDS-/-の脳では肉眼的な異常は認められなかったが、濃縮した核は12.5 dpcで延髄(図9Aa)および脊髄(データは示さず)で見られた。次いで死細胞の程度を比較するためにTUNEL染色を行い、延髄(図9、AbおよびAc)、三叉神経節、脊髄および後根神経節においてアポトーシス細胞が同腹仔対照(図9、B-D)に比べて増加していることを確認した。脳の細胞構造を決めるのに著しいレベルのアポトーシスが必要であると考えられているので(Datta and Greenberg, 1988)、このようなアポトーシスの変化について病理学的な意味を評価するのは難しく、当然胎児を死に至らしめることはできない。しかしながら、このような結果は、時間的、空間的にKi-Ras欠損マウスで見られた知見に一致していることに注目すべきである。
【0026】
【発明の効果】以上詳しく説明したとおり、この出願の発明によって、低分子量G蛋白質の調整因子であるSmg GDS遺伝子が機能的にノックアウトされた動物個体、その組織または細胞、およびES細胞が提供される。個体発生やアポトーシスのメカニズムの解明、発生異常やアポトーシス性疾患の診断やその治療法、治療薬等の開発に有用である。
【0027】
【配列表】
<110> Japan Science and Technology Corporation<120> Smg GDS遺伝子欠損動物<130> NP99366-YS<160> 6<210> 1<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 1CCGCTTGGGT GGAGAGGCTA T 21<210> 2<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 2TGGTGGTCGA ATGGGCAGGT A 21<210> 3<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 3TCCCCGCTAT CTTCAGTATC T 21<210> 4<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 4GCACAGTATT CAAAACCATC C 21<210> 5<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 5AAGCTACTGG GCATTCACTG C 21<210> 6<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 6TTTCTGCATG GACTCATCTC C 21
【0028】
【参考文献】Ando, S., K. Kaibuchi, T, Sasaki, K. Hiraoka, T. Nishiyama, T. Mizuno, M. Asada,H. Nunoi, I. Matsuda, Y. Matsuura, P. Polakis, F. McCormick, and Y. Takai. 1992. Post-translational processing of rac p21s is important both for their interaction with the GDP/GTP exchange proteins and for their activation of NADPH oxidase. J. Bio. Chem. 267:25709-25713.Bergmann, A., J. Agapite, K. Macall, and H. Steller. 1998a. The Drosophila gene hid is a direst molecular target of Ras-dependent survivalsignaling. Cell. 95:331-341.Bergmann, A., J. Agapite, and H. Steller. 1998b. Mechanisms and control of programmed cell death in invertebrates. Oncogene. 17:3215-3223.Bonfini, L., C. A. Karlovich, C. Dasgupta and U. Banerjee. 1992. The son of sevenless gene product: a putative activator of Ras. Science. 255:603-606.Bourne, H. R., D. A. Sanders, and F. McCormick. 1990. The GTPase superfamily: conserved switch for diverse cell functions. Nature. 348:125-132.Bourne, H. R., D. A. Sanders, and F. McCormick. 1991. The GTPase superfamily: conserved structure and molecular mechanism. Nature. 349:117-127.Buday, L., and J. Downward. 1993. Epidermal growth factor regulatesp2ras through the formation of a complex of receptor, Grb2 adapter protein, and Sos nucleotide exchange factor. Cell. 73:611-620.Cheng, A. M., T. M. Saxton, R. Sasaki, S. Kulkarni, G. Mbamalu, W.Vogel, C. G. Tortorice, R. D. Cardiff, J. C. Cross, W. J. Muller, and T.Pawson. 1998. Mammalian Grb2 regulates multiple steps in embryonic development and malignant transformation. Cell. 95: 793-803.Crechet, J. B., P. Poullet, M. Y. Mistou, A. Parmeggiani, J. Camonis, E. Boy-Marcotte, F. Damak, and M. Jaquet. 1990. Enhancement of GDP-GTP exchange of RAS proteins by the carboxyl-terminal domain of SCD25. Science. 248:866-868.Crespo, P., X. R. Bustelo, D. S. Aaronson, O. A. Coso, M. Lopez-Barahona, M. barbacid and J. S. Gutkind. 1996. Rac-1 dependent stimulationof the JNK/SAPK signaling pathway by Vav. Oncogene. 13:455-460.Datta, S. R. and M. E. Greeberg. 1998. Molecular mechanisms of neuronal survival, and apoptosis. Hormones and Signaling. 1:94-103.Deng, C., P. Zhang, J. W. Harper, S. J. Elledge, and P. Leder. 1995. Mice lacking p21CIPI/WAF1 undergo normal development, but are defective in G1 checkpoint control. Cell. 82:675-684.de Rooij, J., F. J. Zwartkruis, M. H. Verheijen, R. H. Cool, S. M.Nijman, A. Wittinggofer, and J. L. Bos. 1998. Epac is a Rap1 guanine-nucleotide -exchange factor directly activated by cyclic AMP. Nature. 396:474-477.Egan, S. E., B. W. Giddings, M. W. Brooks, L. Buday, A. M. Sizeland, and R. A. Weinberg. 1993. Association of Sos Ras exchange protein withGrb2 is implicated in tyrosine kinase signal transduction and transformation. Nature. 363:45-51.Enari, M., H. Sakahira, H. Yokoyama, K. Okawa, A. Iwamatsu, and S.Nagata. 1998. A caspase-activated DNase that degrades DNA during apoptosis, and its inhibitor ICAD. Nature. 391:43-50Esteve, P., N. Embade, R. Perona, B. Jimenez, L. del Peso, J. Leon,M. Arends, T. Miki, and J. C. Lacal. 1998. Rho-regulated signals induceapoptosis in vitro and in vivo by p53-independent, but Bc12 dependent pathway. Oncogene. 17:1855-1869.Eves, E. M., W. Xiong, A. Bellacosa, S. G. Kennedy, P. N. Tsichlis,M. R. Rosner, and N. Hay. 1998. Akt, a target of phosphatidylinositol 3-kinase, inhibits apoptosis in a differentiating neuronal cell line. Mol. Cell Biol. 18:2143-2152.Fischer, K. D., A. Zmuldzinas, S. Gardner, M. Barbacid, A. Berstein, and C. Guidos. 1995. Defective T cell receptor signalling and positiveselection of Vav-deficient CD4+VD8+ thymocytes. Nature 374:474-477.Fushiki, S., Y. Hyodo-Taguchi, C. Kinoshita, Y. Ishikawa, and T. Hirobe. 1997. Short- and long-term effects of low-dose prenatal X-irradiation in mouse cerebral cortex, with special reference to neuronal migration. Acta. Neuropathol. (Berl) 93:443-449.Fujioka, H., K. Kkaibuchi, K. Kishi, T. Yamamoto, M. Kawamura, T. Sakoda, T. Mizuno, and Y. Takai. 1992. Transforming and c-fos promoter/enhancer-stimulating activities of a stimulatory GDP/DTP exchange proteinfor small GTP-binding proteins. J. biol. Chem. 267:926-930.Gotoh, T., S. Hattori, S. Nakamura, H. Kirayama, M. Noda, Y. Takai,K. kaibuchi, H. Matsui, O. Hatase, H. Takahashi, T. Kurata, and M. Matsuda. 1995. Identification of Rsp1 as a target for the Crk SH3 domain-binding guanine nucleotide-releasing factor C3G. Mol. Cell Biol. 15:6749-6753.Gulbins, E., K. M. Coggeshall, B. Brenner, K. Schlottmann, O. Linderkamp, and F. Lang. 1996. Fas-induced apoptosis is mediated by activation of a Ras and Rac protein-regulated signalling pathway. J. Biol. Chem.271:26389-26394.Harvey, M., A. T. Sands, R. S. Weiss, M. E. Hegi, R. W. Wiseman, P.Pantazis, B. C. Giovanella, M. A. Tainsky, A. Bradley, and L. A. Donehower. 1993. In vitro growth characteristics of embryo fibroblasts isolated from p53-deficient mice. Oncogene 8:2457-2467.Hall, A. 1990. The cellular functions of small GTP-binding proteins. Science 249:635-640.Henning, S. W., R. Galandrini, A. Hall, and D. A. Cantrell. 1997. The GTPase Rho has a critical regulatory role in thymus development. EMBOJ. 16:2397-2407.Hiraoka, K., K. Kkaibuchi, S. Ando, T. Musha, K. Takaishi, T. Mizuno,M. Asada, L. Menard, E. Tomhave, J. Didsbury, and Y. Takai. 1992. Bothstimulatory and inhibitory GDP/GTP exchange proteins, smg GDS and rho GDI, are active on multiple small GTP-binding proteins. Biochem. Biophys.Res. Commun. 182:921-930.Hirota, H., J. Chen, U. A. K. Betz, K. Rajewsky, Y. Gu, J. Ross, Jr., W. Mular, and K. R. Chien. 1999. Cell survival pathway is a criticalevent in the onset of heart failure during biomechanical stress. Cell 97:189-198.Huges, D. A., Y. Fukui, and M. Yamamoto. 1990. Homologous activators of ras in fission and budding yeast. Nature, 344:355-357.Jimenez B., M. Arends, P. Estreve, R. Perona, R. Sanchez, S. Ramony Cajal, A. Wyllie, and J. C. Lacal. 1995.Induction of apoptosis in NIH3T3 cells after serum deprivation by overexpression of rho-p21, a GTPaseprotein of the ras superfamily. Oncogene 10:811-816.Johnson, L., D. Greenbaum, K. Cichowski, K. Mercer, E. Murphy, E. Schmitt, R. T. Bronson, H. Umanoff, W. Edelmann, R. Kucherlapati, and T.Jacks. 1997. K-ras is an essential gene in the mouse with partial functional overlap with N-ras. Genes Dev. 11:2468-2481.Jones, S., M. L. Vignais, and J. R. Broach. 1991. The CDC25 proteinof Saccharomyces cerevisiae promotes exchange of guanine nucleotides bound to ras. Mol. Cell Biol. 11:2641-2646.Kamijo, T., F. Zindy, M. F. Riussel, D. E. Quelle, J. R. Downing, R. A. Ashmun, G. Grosveld, and C. J. Dherr. 1997. Tumor suppression at the mouse INK4a locus mediated by the alternative reading frame product p19ARF. Cell 91:649-659.Kaibuchi, K., T. Mizuno, H. Fujioka, T. Yamamoto, K. Kishi, Y. Fukumoto, Y. Hori, and Y. Takai. 1991. Molecular cloning of the cDNA for stimulatory GDP/GTP exchange protein for smg p21s(ras p21-like small GTP-binding proteins) and characterization of stimulatory GDP/GTP exchange protein. Mol. Cell Biol. 11:2873-2880.Kauffmann-Zeh, A., O. Rodriguez-Viciana, E. Ulrich, C. Gilbert, P.Coffer, J. Downward, and G. Evan. 1997. Suppression of c-Myc-induced apoptosis by Ras signalling through PI(3)K and PKB. Nature 385:544-548.Kawamura, M., K. Kaibuchi, K. Kishi, and Y. Takai. 1993. Translocation of Ki-ras p21 between membrane and cytoplasm by smg GDS. Biochem. Biophys Res. Commun. 190:832-841.Kawasaki, H., G. M. Springett, N. Mochizuki, S. Toki, M. Matsuda, D. E. Houseman, A. M. Graybiel. 1998. A family of cAMP-binding proteins that directly activates rap1. Science 282:2275-2279.Kennedy, S. G., A. J. Wagner, S. D. Conzen, J. Jordan, A. Bellacosa, P. N. Tsichils, and N. Hay. 1997. The PI3-kinase/Akt signaling pathwaydelivers an anti-apoptotic signal. Genes Dev. 11:701-713.Kikuchi, A., S. Kuroda, T. Sasaki, K. Kotani, K. Hirata, M. Katayama, and Y. Takai. 1992. Functional interactions of stimulatory and inhibitory GDP/GTP exchange proteins and their common substrate small GTP-binding protein. J. Biol. Chem. 267:14611-14615.Koera, K., K. Nakamura, K. Nakano, J. Miyoshi, K. Toyoshima, T. Hatta, H. Otani, A. Aiba, and M. Katsuki. 1997. K-ras is essential for thedevelopment of the mouse embryo. Oncogene 15:1151-1159.Kotani, K., A. Kikuchi, K. Doi, S. Kishida, T. Sakoda, K. Kishi, and Y. Takai. 1992. The functional domain of the stimulatory GDP/GTP exchange protein (smg GDS) which interacts with the C-terminal geranylgeranykated region of rap1/Krev-1/smg p21. Oncogene 7:1699-1704.Kuroda, V., and K. White. 1998. Ras promotes cell survival in Drosophila by downregulating hid expression. Cell 95:319-329.Liu, B., W. Wei, and D. Broek. 1993. The catalytic domain of the mouse sos1 gene product activates Ras proteins in vivo and in vitro. Oncogene 8:3081-3084.Liu, X., H. Zou, C. Slaughter, and X. Wang. 1997. DFF, a heterodimeric protein that functions downstream of caspase-3 to trigger DNA fragmentation during apoptosis. Cell 89:175-184.Lowe, S. W., H. E. Ruley, T. Jacks, and D. E. Housman. 1993. p53-dependent apoptosis modulates the cytotoxicity of anti-cancer agents. Cell74:957-967.Lowe, S. W., E. M. Schmitt, S. W. Smith, B. A. Osborne, and T. Jacks. 1993. p53 is required for radiation-induced apoptosis in mouse thymocytes. Nature 362:847-849.McCrea, P.D., C. W. Turck, and B. Gumbiner. 1991. A homolog of thearmadillo protein in Drosophila (plakoglobin) associated with E-cadherin. Science 254:1359-1361.Meier, P. and G. Evan. 1998. dying like flies. Cell 95:295-298.Mizuno, T., K. Kaibuchi, T. Yamamoto, M. Kawamura, T. Sakoda, H. Fujioka, Y. Matsuura, and T. Takai. 1991. A stimulatory GDP/GTP exchange protein for smg p21 is active on the post-translationally processed formof c-Ki-ras p21 and rhoA p21. Proc. Natl. Acad Sci. USA. 88:6442-6446.Moorman, J. P., D. Luu, J. Wickham, D. A. Bobak, and C. S. Hahn. 1999. A balance of signaling by Rho family small GTPases RhoA, Rac1 and Cdc42 coordinates cytoskeltal morphology but not cell survival. Oncogene.18: 47-57.Nakanishi, H., K. Kaibuchi, S. Orita, N. Ueno, and Y. Takai. 1994.Different functions of Smg GDS dissociation stimulatorNakayama, K., K. Nakayama, I. Negishi, K. Kuida, H. Sawa, and D. Y.Loh. 1994. Targeted disruption of Bcl-2 alpha beta in mice : occurrenceof gray hair, polycystic kidney disease, and lymphcytopenia. Proc. Natl. Acad. Sci. USA. 91:3700-3704.Nishida, K., Y. Kaziro, and T. Satoh. 1999. Anti-apoptotic functionof Rac in hematopoietic cells. Oncogene 18:407-415.Orita, S., K. Kaibuchi, K. Kuroda, K. Shimizu, H. Nakanishi, and Y.Takai. 1993. Comparison of kinetic properties between two mammalian rasp21 GDP/GTP exchange proteins, ras guanine-releasing factor and smg GDPdissociation stimulator. J. Biol. Chem. 268:25542-255461.Pritchard, C. A., L. Bolin, R. Slattery, R. Murray, and M. McMahon.1996. Post-natal lethality and neurological and gastrointestinal defects in mice with targeted disruption of the A-Raf protein kinase gene. Curr. Biol. 6:614-617.Simon, M. A., D. D. Bowtell, G. S. Dodson, T. R. Laverty, and G. M.Rubin. 1991. Ras1 and a putative guanine nucleotide exchange factor perform crucial steps in signaling by the sevenless protein tyrosine kinase. Cell 67:701-716.Sugiura, K., N. Nakatsuji, K. Nakamura, K. Nakano, R. Hashimoto, H.Otani, H. Sakagami, H. Kondo, S. Nozawa, A. Aiba, and M. Katsuki. 1998.Rac1 is required for the formation of three germ layers during gastrulaton. Oncogene. 17:3427-3433.Takai, Y., Kaibuchi, A. Kikuchi, and M. Kawata. 1992. Small GTP-binding proteins. Int. Rev. Cytol. 133:187230.Takai,Y., K. kaibuchi, A. Kikuchi, Sasaki, T., and H. Shirataki. 1993. Regulation of small GTPases. Ciba Found. Symp. 176:128-138.Tarakhovsky, A., M. Turner, S. Schaal. P. J. Mee, L. P. Duddy, K. Rajewsky, and V. L. Tybulewicz. 1995. Defective antigen receptor-mediatedproliferation of B and T cells in the absence of Vav. Nature 374:467-470.Togawa, A., J. Miyoshi, H. Ishizaki, M. Tanaka, A. Takakura, H. Nishioka, H. Yoshida, T. Doi, A. Mizoguchi, N. Matsuura, Y. Niho, Y. Nishimune, S. Nishikawa, and Y. Takai. 1999. Progressive impairment of kidneysand reproductive organs in mice lacking Rho GDIα. Oncogene. 18:5373-5380.Umanoff, H., W. Edelmann, A. Pellicer, and R. Kucherlapati. 1995. The murine N-ras gene is not essential for growth and development. Proc.Natl. Acad. Sci. USA. 92:1709-1713.Vithalani, K. k., C. A. Parent, E. M. Thorn, M. Penn, D. A. Larochelle, P. N. Devreotes, and A. De Lozanne. 1998. Identification of Darlin,a Dictyostelium protein with Armadillo-like repeats that binds to smallGTPases and is important for the proper aggregation of developing cells. Mol. Biol. Cell. 8:3095-3106.Vojtek, A. B., S. M. Hollenberg, and J. A. Cooper. 1993. MammalianRas interacts directly with the serine/threonine kinase Raf. Cell 74:205-214.Veis, D. J., C. M. Sorenson, J. R. Shutter, and S. J. Korsmeyer. 1993. Bcl-2-deficient mice demonstrate fulminant lymphoid apoptosis, polycystic kidneys, and hypopigmented hair. Cell 75:229-240.Walker, F., A. Kato, L. J. Conez, M. L. Hibbs, N. Pouliot, A. Levitzki, and A. W. Burgress. 1998. Activation of the Ras/mitogen-activated protein kinase pathway by kinase-defective epidermal growth factor receptors results in cell survival but not proliferation. Mol. Cell Biol. 18:7192-7204.Wang, D. Z., V. E. Hammond, H. E. Abud, I. Bertoncello, J. W. McAvoy, and D. D. Bowtell. 1997. Mutation in Sos1 dominantly enhances a weakallele of the EGFR, demonstrating a requirement for Sos1 in EGFR signaling and development. Genes Dev. 11:309-320.Wojnowski, L., A. M. Zimmer, T. W. Beck, H. Hahn, R. Bernal, U. R.Rapp, and A. Zimmer. 1997. Endothelial apoptosis in Braf-deficient mice.Nat. Genet. 16:293-297.Wojnowski, L., L. F. Stancato, A. M. Zimmer, H. Hahn, T. W. Beck, A. C. Larner, U. R. Rapp, and A. Zimmer. 1998. Craf-1 protein kinase isessential for mouse development. Mech. Dev. 76;141-149.Yaku, H., T. Sasaki, and Y. Takai. 1994. The Db1 oncogene product as a GDP/GTP exchange protein for the Rho family : its properties in comparison with those of Smg GDS. Biochem. Biophys. Res. Commun. 198:811-817.Yamamoto, T., K. Kaibuchi, T. Mizuno, M. Hiroyoshi, H. Shirataki, and Y. Takai. 1990. Purification and characterization from bovine brain cytosol of proteins that regulate the GDP/GTP exchange reaction of smg p21s, ras p21-like GTP-binding protein, J. Biol. Chem. 265:16626-16634.Yamochi, W., K. Tanaka, H. Nonaka, A. Maeda, T. Musha, and Y. Takai. 1994. Growth site localization of Sho1 small GTP-binding protein and its involvement in bud formation in Saccharomyces cerevisiae. J. Cell Biol. 125:1077-1093.Yoshida, Y., M. Kawata, Y. Miura, T. Musha, T. Sasaki, A. Kikuchi,and Y. Takai. 1992. Micro injection of smg/rap1/Krev-1 p21 into Swiss 3T3 cells induces DNA synthesis and morphological changes. Mol. Cell Biol.12:3407-3414.Zhang, R., F. W. Alt, L. Davidson, S. H. Orkin, and W. Swat. 1995.Defective signalling through the T- and B-cell antigen receptors in lymphoid cells lacking the vav proto-oncogene. Nature 374: 470-473.Zmuidzinas, A., K. D. Fischer, S. A. Lira, L. Forrester, S. Bryant,A. Bernstein, and M. Barbacid. 1995. The vav proto-oncogene is requiredearly in embryogenesis but not for hematopoietic development in vitro.EMBO J. 14:1-11.
【図面の簡単な説明】
【図1】Smg GDS遺伝子のジーンターゲティングの結果である。(A)エクソン3-8をコードしているマウスのSmg GDS遺伝子の構造を上に示す。エクソン5の一部とエクソン6およびエクソン7を除くようにターゲティングベクターを設計した。コンストラクトは3.3kbの5’側隣接配列と4.9kbの3’側隣接配列を含んでいた。MC1-neoカセットはエクソン5のPstI部位に挿入したが、5’のスプライシング受容部位はそのままにしておいた。ジフテリア毒素DT-Aカセットは3’末端に挿入した。標的遺伝子内では、MC1-neoカセットが1.7kbのゲノムDNA領域と入れ替わった。示したような制限酵素断片とプローブを用いて相同組換えを確認した。(B)マウスの尾から得たDNAをSpeIで分解したものと図1Aに示す3’外部プローブとのサザンハイブリッド形成。マウスの遺伝子型は、6.8kbの野生型(WT)断片および5.5kbの変異型(MT)断片で確認した。レーン1と5は野生型;レーン2、4、6および7はSmg GDS+/-;レーン3はSmg GDS-/-。(C)21日令の同腹仔マウスから得たDNAのPCR解析による遺伝子型の決定。野生型(WT)に対して584bpのDNA断片、標的組換えしたSmg GDS遺伝子座(MT)については370bpのDNA産物を得るようにPCRプライマーを選択した。レーン1は野生型マウス;レーン2はSmg GDS+/-;レーン3はSmg GDS-/-マウスである。(D)各遺伝子型の脳から抽出した蛋白質のウエスタンブロット分析。61kDのSmg GDS蛋白質が検出された。レーン1は野生型マウス;レーン2はSmg GDS+/-;レーン3はSmg GDS-/-マウスである。(E)エクソン5とエクソン7にあるイントロン架橋プライマーと各遺伝子型の脳から得たSmg GDS mRNAを用いたRT-PCR。Smg GDS特異的プラーマーで366bpのバンドが増幅された。レーン1は野生型マウス;レーン2はSmg GDS+/-;レーン3はSmg GDS-/-マウスである。
【図2】Smg GDS-/-マウスの生存期間を調べた結果である。(A)へテロ接合体同志の交配に由来するSmg GDS-/-マウスの第一世代の生存率(n=274)。(B)ホモ接合体同志の交配による第二世代におけるSmg GDS-/-マウスの生存期間。129/BDFと129/C57BLという遺伝的背景では結果は似通っていた(データは示さず)。
【図3】生後1日目の野生型およびSmg GDS-/-型マウスにおける心臓、肝臓および肺切片の組織学的検査の結果である。(AaおよびBa)野生型の心臓(Aa)およびSmg GDS-/-型の心臓(Ba)におけるHE染色の代表的な矢状断面。同腹仔対照に比べて、Smg GDS-/-型の心臓は心房壁、心室壁および隔壁が薄くなり、膨張して拡張していた。(AbおよびBb)野生型の心臓(Ab)およびSmg GDS-/-型の心臓(Bb)における左心室(AaおよびBaで四角で囲んだ部分)壁、高出力拡大(200x)。心筋の細胞がSmg GDS-/-型の心臓で顕著に低下していた。(AcおよびBc)野生型の肝臓(Ac)およびSmg GDS-/-型の肝臓(Bc)におけるHE染色した代表的な切片。Smg GDS-/-型の肝臓では、血液細胞が中心静脈(cv)と肝類洞(hs)を満たしていた。(AdおよびBd)野生型の肺(Ad)およびSmg GDS-/-型の肺(Bd)におけるHE染色した代表的な切片。Smg GDS-/-型の肺の切片では、血液細胞が肺胞毛細血管を満たしていた。Smg GDS-/-マウスの肝臓および肺における鬱血は左右の心不全の存在を示している。
【図4】Smg GDS-/-型の心臓における心筋細胞の正常な増殖を調べた結果である。11.5dpcにおける胎児心臓の横断面切片を示す。(AaおよびBa)HE染色したSmg GDS+/-の心臓(Aa)およびSmg GDS-/-の心臓(Ba)。(AbおよびBb)免疫組織化学分析によって増殖している心筋細胞に取りこまれるBrdUを測定した結果。11.5 dpcにおける胎児のSmg GDS+/-切片(Ab)およびSmg GDS-/-の切片(Bb)をBrdU特異的抗体で染色し、視野当たりのBrdU陽性細胞をスコア化した。
【図5】出生日のSmg GDS-/-心臓において亢進しているアポトーシスを調べた結果である。(AaおよびBa)Smg GDS+/-の心臓およびSmg GDS-/-の心臓のTUNEL染色。両者は同腹仔から作成した。出生日のSmg GDS-/-の心臓(20x)(Ba)は野生型の心臓(20x)(Aa)に比べて保存的構造を示していた。図3、BaおよびBbで示されるような出生後1日目で心筋細胞が顕著に失われていたのに比べて、出生日のSmg GDS-/-心筋細胞は低下していなかった。(AbおよびBb)中程度拡大(100x)での、Smg GDS+/-心臓の右心室(Ab、Aaで囲われている部分)およびSmg GDS-/-心臓の右心室(Bb、Baで囲われている部分)。TUNEL陽性細胞は、Smg GDS+/-心臓では右心室に局在しているのに対してSmg GDS-/-の心臓では両方の心室に見られることに注意。(BcおよびBd)中程度の拡大(100x)(Bc)および高拡大(200x)(Bd)でのSmg GDS-/-心臓における左心室(Baにおいて囲った部分)。Smg GDS-/-心臓の心内膜ではアポトーシスを受けている多数の心筋細胞が容易に検出されるが、Smg GDS+/-心臓の左心室壁ではアポトーシスを受けている細胞は見られない。左心室および右心室はそれぞれlvおよびrvで表す。
【図6】出生後1日目のSmg GDS-/-胸腺において亢進しているアポトーシスを調べた結果である。(AaおよびAb)野生型胸腺(Aa)およびSmg GDS-/-胸腺(Ba)の切片は同腹仔から作成し、HE染色を行った(20x)。Smg GDS-/-の胸腺は野生型胸腺の3分の1の大きさだった。(AbおよびBb)高拡大での野生型胸腺(Ab)およびSmgGDS-/-胸腺(Bb)のHE染色。野生型胸腺細胞に比べてSmg GDS-/-の胸腺細胞では濃縮している核が大量に見られた。(AcおよびBc)野生型胸腺(Ac)およびSmg GDS-/-胸腺(Bc)におけるTUNEL染色。Smg GDS-/-胸腺ではTUNEL陽性細胞が増加している。(AdおよびBd)野生型胸腺細胞およびSmg GDS-/-の胸腺細胞のFACS分析。野生型胸腺細胞(Ad)およびSmg GDS-/-の胸腺細胞(Bd)をCD4およびCD8に対する抗体で染色し、FACSにて解析した。
【図7】出生日のマウス胸腺細胞におけるアポトーシスの指標であるカスパーゼ-3開裂活性を調べた結果である。アポトーシスを誘導するために、マウスの胸腺細胞を、デキサメサゾン(A)、マウスFasモノクローナル抗体(B)、およびエトポシド(C)を、図中の濃度にて2時間処理した。細胞にはまた、図中の時間で紫外線照射した(D)。カスパーゼ-3の活性は、蛍光発色基質DEVD-AMCの開裂に基づく相対的な蛍光強度によって測定した。Smg GDS+/-胸腺細胞(白丸)およびSmg GDS-/-胸腺細胞(黒四角)におけるカスパーゼ-3活性を示した。無処理の細胞では活性のあるカスパーゼ-3は陰性だった。
【図8】Smg GDS-/-胸腺細胞に外因性に発現させたSmg GDS cDNAによるエトポシド誘発アポトーシスの回避を調べた結果である。(A)Smg GDS+/-(上のパネル)およびSmg GDS-/-(下のパネル)新生児マウスに由来する1x106個の胸腺細胞の培養で、無処理(左のパネル)、レトロウイルスベクターpLNCXのみで(真ん中のパネル)、およびSmg GDS cDNAを発現しているpLNCX(右のパネル)で遺伝子導入した。次いでアポトーシスを誘導するために、レトロウイルス処理した胸腺細胞をエトポシドで4時間刺激し、ヨードプロピジウムおよびFITC標識した抗アネキシンV抗体で染色し、フローサイトメーターにより解析した。区分して解析した全細胞数の比率をパネルの中に示す。(B)図7のようにカスパーゼ-3活性を測定した。Smg GDS+/-およびSmg GDS-/-胸腺細胞を用い、レトロウイルスベクターpLNCXのみ(白抜き)およびSmg GDS cDNA発現pLNCX(黒)処理に続いてエトポシドで4時間処理した5回の別々の実験の平均値を示す。
【図9】Smg GDS-/-胎児におけるニューロン細胞死の増加を示した結果である。12.5 dpcのSmg GDS-/-胎児における第三脳室および間脳の横断面切片。(Aa)Smg GDS-/-脳のHE染色(20x)。(Ab)Smg GDS-/-脳のTUNEL染色(20x)。(Ac-D)高拡大(200x)TUNEL陽性細胞は、延髄(Ac、Abにおいて囲った部分)、三叉神経節(B)、脊髄(C)、および後根神経節(D)で増加していた。
【0001】
【発明の属する技術分野】この出願の発明は、Smg GDS遺伝子欠損動物に関するものである。さらに詳しくは、この出願の発明は、低分子量GTP結合蛋白質(G蛋白質)の調節因子であるSmg GDS遺伝子がその機能欠失型変異遺伝子に置換された遺伝子ノックアウト動物であって、体内においてSmg GDSを合成する能力を持たない、または合成能が低い遺伝子欠損動物と、この動物の作成に不可欠なES細胞に関するものである。この遺伝子欠損動物は、医薬品開発等の分野において有用である。
【0002】
【従来の技術】低分子量GTP結合蛋白質(G蛋白質)は、100を越えるメンバーから成るスーパーファミリーを構成している(Bourne et al., 1990, 1991; Hall, 1990; Takaiet al., 1992)。このスーパーファミリーは、5つのファミリー、Ras、Rho、Rab、Arf/SarおよびRanファミリーで構成されている。ファミリーはそれぞれサブファミリーを持っている。すなわち、Rasファミリーは、主として遺伝子発現を調節しており、Rhoファミリーは、細胞骨格および遺伝子発現を調節し、RabおよびArf/Sarファミリーは、細胞内小胞輸送を調節し、そしてRanファミリーは、細胞質と核の間の輸送を調節している。このように多くの低分子量G蛋白質の機能が分類されているが、スーパーファミリーの個々のメンバーが、何時、どのように相互作用し、シグナル交換を行って多くの細胞機能を効果的に調節しているのかは判っていない。
【0003】標的遺伝子組換えは、その方法が主として、破壊された1つの遺伝子によってもたらされる表現型の変化に基づいているために、低分子量G蛋白質の各メンバーの役割を分析するのに役立つとは限らない。この出願の発明者らは、Rasファミリーの機能的な重複性に取り組んできた。たとえば、Ki-Rasの欠損は、胎児性致死を生じさせる(Koera et al., 1997; Johnson et al., 1997)のに対し、Ha-RasあるいはN-Ras欠損マウスは明白な異常は示さない(Katsuki, 私信;Umanoffet al., 1995)。注目べきことに、Ha-RasおよびN-Rasの両方のノックアウトマウスは生存可能である(Katsuki, 私信)ということは、Ki−RasがHa-RasおよびN-Rasの機能を代替できることを示唆している。もう1つの問題は、機能が重複していないRhoファミリーメンバーが決定的な役割を演じていることである。すなわち、Rac1およびCdc42を破壊すると、胎児性の致死を生じる(Sugihara et al., 1998; Togawa, 未発表データ)ため、発生段階におけるこれら遺伝子の役割を検討することができない。マウスにおけるRho欠損は報告されていないが、RHO1を欠く酵母株は致死であることが知られている(Yamochi et al., 1994)。このように低分子量G蛋白質の各メンバーを破壊することは、マウスにおいてその機能を分析する上ではさほど効果的ではない。
【0004】一方、Cre-LoxP法は前記のノックアウト法に代わる方法として役立つ可能性はあるが、低分子量G蛋白質の活性化が介在する基本的な細胞機能を研究するために、何時何処でCreリコンビナーゼを発現すべきかを決めるのは困難である。
【0005】この出願の発明者らは、低分子量G蛋白質の調節因子を破壊することによって低分子量G蛋白質の活性を抑制しようと試みてきた。低分子量G蛋白質は、GTP結合状態とGDP結合状態を交換することによってシグナル伝達における分子スイッチとして作用しており、3つの型の調節因子が同定されている。すなわち、グアニン-ヌクレオチド交換蛋白質(GEP)、GDP解離阻害因子(GDI)およびGTPアーゼ活性化蛋白質(GAP)である。GEPは、GDP結合型からのGDPの解離を刺激することにより、GDP結合不活性型をGTP結合活性型に変換する。GDIは、GDP結合型からのGDPの解離を阻害することによってGEPが誘導する変換を阻害する。そして、GAPはGTPアーゼ活性を刺激することによりGTP結合型をGDP結合型に変換する(Takaiet al., 1993)。このような調節因子は、低分子量G蛋白質を介してシグナル伝達の効率を高めているが、動物固体の生存には必ずしも必須ではない。この出願の発明者らは、Rho GDIα欠損マウスを作出し(Togawa et al., 1999)、この蛋白質の欠損がその基質である低分子量G蛋白質自体の欠損ほど有害な表現型は生じないことを見い出した。実際、このことは、低分子量G蛋白質GDP解離刺激因子(Smg GDS)の欠損の場合も同様である。
【0006】Smg GDSは、低分子量G蛋白質に対する4番目の型の調節因子である。この調節因子は元々Rap1Bの調節因子としてウシの脳の細胞内可溶質から精製された(Yamamoto et al., 1990)。続いて、この出願の発明者らがウシとヒトのSmg GDSのcDNAを単離し、そのヌクレオチド配列とアミノ酸配列を決定した(Kaibuchi et al., 1991; Kikuchi et al., 1992)。精製した試料を用いた無細胞系において、Smg GDSは、Rap1BのみならずKi-Ras、Rho、Rac、およびCdc42サブファミリーを含む低分子量G蛋白質群からのGDPの解離を刺激するが、Ha−Rasには作用しない(Mizuno et al., 1991, 1992; Ando et al., 1992; Hiraoka et al., 1992; Yaku et al., 1994)。この基質特異性は、Rasサブファミリーに対するSOS(Simon et al., 1991)とCdc25(Jones et al., 1991)、およびRapサブファミリーに対するC3G(Gotoh et al., 1995)とEpac/サイクリックAMP-グアニンヌクレオチド交換因子(de Rooij et al., 1998; Kawasaki et al., 1998)とは異なっているが、Rho GDI(Takai et al., 1993)やRab GDI(Takai et al., 1993)のようなGDIの基質特異性とは似通っている。無処理のNIH3T3細胞で、Smg GDSはKi-Rasと共同して形質転換活性を示し(Fujioka et al., 1992)、Swiss3T3細胞ではKi-RasあるいはRap1と共同して分裂促進活性を示す(Yoshida et al., 1992)ということは、Cdc25やSOSで言われているように(Hughes et al., 1990; Crechet et al., 1990; Bonfiniet al., 1992)、Smg GDSは無処理の細胞でこのような低分子量G蛋白質に対する刺激性調節因子として作用していることを示唆している。しかしながら、Smg GDSの生理的機能は判っていない。
【0007】
【発明が解決しようとする課題】G蛋白質は、ホルモンや神経伝達物質等の細胞外情報物質が結合する細胞膜上の受容体と共役し、細胞内へのシグナル伝達・増幅因子として機能しており、細胞(そして細胞集団である個体)の発生、生存、あるいはアポトーシス等において重要な役割を果たしている。従って、G蛋白質の調節に係わる分子機構を解明することは、これらの生物機能の全貌を解明するばかりでなく、これらの生物機能の異常を原因とする各種疾患の診断やその治療法、治療薬等の開発への応用も期待される。そして、G蛋白質の調節機構を解明するためには、個体レベルでの解析が不可欠である。
【0008】この出願の発明は、以上のとおりの事情に鑑みてなされたものであって、低分子量G蛋白質の調節因子Smg GDS遺伝子を欠損した動物個体を提供することを課題としている。
【0009】
【課題を解決するための手段】この出願は、前記の課題を解決するための発明として、以下の(1)〜(5)の発明を提供する。
(1) 低分子量GTP結合蛋白質に対する調節因子であるGDP解離刺激因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されている分化全能性細胞を発生させた非ヒト動物個体およびその子孫動物であるSmg GDS遺伝子欠損動物。
(2) 非ヒト動物が、マウスである前記発明(1)のSmg GDS遺伝子欠損動物。
(3) 前記発明(1)または(2)の動物由来の組織または細胞。
(4) 低分子量GTP結合蛋白質に対する調節因子であるGDP解離刺激因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されているES細胞。
(5) マウス由来である前記発明(4)のES細胞。
【0010】以下、上記の各発明について実施の形態を詳しく説明する。
【0011】
【発明の実施の形態】この出願によって提供される前記発明(1)のSmg GDS遺伝子欠損動物は、調節因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されている分化全能性細胞発生させた遺伝子ノックアウト非ヒト動物である。さらに詳しくは、この発明(1)のSmg GDS遺伝子欠損動物は、体細胞染色体のSmg GDS遺伝子がその変異配列に置換されているヘテロ接合体、あるいはホモ接合体として提供される。
【0012】この発明(1)のSmg GDS遺伝子欠損動物は、公知の標的遺伝子組換え法(ジーンターゲティング法:Science 244:1288-1292, 1989)により作製することができる。この標的遺伝子組換え法では、分化全能性細胞としてES(embryonic stem)細胞等を使用する。ES細胞は、マウス(Nature 292:154-156, 1981)、ラット(Dev. Biol. 163(1):288-292, 1994)、サル(Proc. Natl. Acad. Sci. U.S.A.92(17):7844-7848, 1995)、ウサギ(Mol. Reprod. Dev. 45(4):439-443, 1996)で確立している。また、ブタについてはEG(embryonic germ)細胞が確立している(Biol. Reprod 57(5):1089-1095, 1997)。従ってこの発明(1)のSmg GDS遺伝子欠損動物は、これらの動物種を対象に作製することができるが、特に遺伝子ノックアウト動物の作製に関して技術が整っているマウスが最適である。作製の具体的手続を、前記発明(2)のマウスを例にとって説明すれば以下のとおりである。
【0013】先ず、Smg GDS遺伝子のゲノムDNA断片を単離し、そのDNA断片を試験管内にて遺伝子操作し、Smg GDS遺伝子の開始コドンを含むDNA断片に対して改変を施すなどの、Smg GDS遺伝子の機能を欠失させるような変異DNA断片を作製する。Smg GDSゲノムDNAの単離は、例えば、公知のSmg GDSのcDNA配列(Kaibuchi et al., 1991; Kikuchi et al., 1992)に基づいて合成されたオリゴヌクレオチドプローブを用いてマウスゲノムDNAライブラリーをスクリーニングすることにより得られる。また、このSmg GDSのcDNAの一部または両端に相当する合成オリゴヌクレオチドをプライマーとするPCR法によっても目的とするゲノムDNAを得ることができる。なお、マウス以外の動物を対象とする場合にも、前記のcDNA配列に基づいて合成されたオリゴヌクレオチドをプローブまたはプライマーとする前記の方法により、各動物のSmg GDS遺伝子を単離することができる。
【0014】上記のとおりの方法によって得られたマウスSmg GDS遺伝子のゲノムDNAの一部を改変し、全能性細胞(ES細胞)のSmg GDS遺伝子に変異を導入するためのターゲティングベクターを、公知の方法(例えば、Science 244:1288-1292, 1989)に準じて作製する。例えば、Smg GDS遺伝子のゲノムDNAの一部をG418等の細胞毒に対する耐性遺伝子(例えば、ネオマイシン耐性遺伝子)に置換することにより、もしくは細胞毒に対する耐性遺伝子をSmg GDS遺伝子のゲノムDNAの一部に挿入することで、Smg GDSのゲノムDNAと相同な配列を両端に有する変異遺伝子を保有する組換えプラスミドDNA、すなわちターゲティングベクターを作製する。なお、細胞毒に対する耐性遺伝子には、その発現を制御するためのPGK1プロモーター等の配列およびPGK1ポリアデニレーションシグナル等を連結することもできる。また、細胞毒に対する耐性遺伝子により置換、または挿入されるSmg GDS遺伝子のゲノムDNA部位は、開始コドンを含んだエクソン領域を含むゲノムDNA領域であることが好ましい。
【0015】上記Smg GDS遺伝子のゲノムDNAの一部に変異を導入するためのターゲティングベクターには、Smg GDS遺伝子のゲノムDNAに相同な配列を有すること以外には特に制限はなく、他の薬剤耐性遺伝子や、細胞選択用遺伝子(例えば、ジフテリア毒素A遺伝子やヘルペスウイルスのサイミジンキナーゼ遺伝子)、プロモーター、エンハンサー等の配列を適宜に組み合わせて使用することができる。
【0016】次に、このターゲティングベクターを、公知の方法に準じてマウスES細胞に導入する。このような遺伝子導入法としては、公知の電気パルス法、リポソーム法、リン酸カルシウム法等も利用できるが、導入遺伝子の相同遺伝子組換え効率を勘案した場合、ES細胞への電気パルス法が好ましい。
【0017】遺伝子導入された各ES細胞のDNAを抽出し、サザンブロット分析やPCRアッセイ等により、染色体上に存在する野生型Smg GDS遺伝子と導入したSmg GDS変異遺伝子断片の間で正しく相同遺伝子組換えが起こり、染色体上のSmg GDS遺伝子に変異が移った細胞を選択する。
【0018】こうして得た変異遺伝子を持つES細胞を野生型マウスのブラストシストに注入し、つづいてこのキメラ胚を仮親の子宮に移植する。出生した動物を里親につけて飼育させた後、Smg GDS変異遺伝子が生殖系細胞に入ったキメラ動物を選別する。選別は毛色の違い、または体の一部(例えば尾部先端)からDNAを抽出し、サザンブロット分析やPCRアッセイ等により行う。Smg GDS変異遺伝子が生殖系細胞に入ったキメラ動物と野生型動物の交配により得られる子孫について、さらに体の一部(例えば尾部先端)からの抽出DNAを材料とした、サザンブロット分析やPCRアッセイ等を行い、Smg GDS変異遺伝子が導入されたヘテロ接合体を同定する。作出されたSmg GDS変異遺伝子を保有するヘテロ接合体は生殖細胞および体細胞のすべてに安定的にSmg GDS遺伝子変異を保有しており、交配等により、効率よくその変異を子孫動物に伝達することができる。
【0019】発明(3)は、前記のSmg GDS遺伝子欠損動物から単離した組織または細胞である。後記の実施例に示したように、この遺伝子欠損動物の心臓や胸腺細胞はアポトーシス刺激に対して敏感に反応するため、抗アポトーシス剤等のスクリーニング系として有用である。
【0020】以下、実施例を示してこの発明についてさらに詳細かつ具体的に説明するが、この発明は以下の例に限定されるものではない。
【0021】
【実施例】1. 材料と方法1.1 DNAライブラリーのスクリーニングSmg GDSのcDNAは、細菌株と製造者のプロトコールを用いて、マウスの脳cDNAライブラリλTriplEx(クローンテック)から単離し、ABI DNAシークエンサーを用いて配列決定した。Smg GDSのN末端半分をコードしているcDNA断片を適当なプラスミドベクターにサブクローニングし、プローブとして用いて、129SVJマウスのゲノムライブラリλFIXII(ストラタジーン)の相同性をスクリーニングした。
1.2 Smg GDS-/-マウスの作出Smg GDS遺伝子のエクソン5の3’側半分とそれに続くエクソン6およびエクソン7(Smg GDSタンパクのアミノ酸配列212-343)をneo耐性遺伝子カセットと置き換えてターゲティングベクターを構築した。RW4胎児性幹(ES)細胞に遺伝子移入し、文献(Togawa et al., 1999)の記載に従って選択した。相同組換えは5’-および3’-外部プローブおよびネオ耐性遺伝子プローブを用いてサザンハイブリッド形成によって確認した。Smg GDS+/-ES細胞をE3.5 C57BL/6Jマウスの胚盤胞に微量注入し、偽妊娠したMCH雌マウスに移し、キメラマウスを生ませ、生殖系列に組み込ませるためにBDF1と交配した。また、変異遺伝子を持ったマウスをC57BL/6マウスに戻し交配した。遺伝子型は、neo耐性遺伝子(配列番号1および配列番号2)および置換したSmg GDS遺伝子(配列番号3および配列番号4)におけるプライマーを用い、サザン解析とPCRによって決定した。PCR混合物は95℃にて2分間で変性させ、55℃にて1分間でアニ−リングした。PCRは25サイクルで以下のように行った:72℃にて2分間(伸張)、95℃にて30秒(変性)、55℃にて1分間(アニ−リング)。試料はさらに72℃にて5分間伸張させた。PCR産物は4% 3:1 NuSieveアガロース(タカラ)/TAEゲルにて観察した。
1.3 抗体およびウエスタンブロット分析抗Smg GDS抗体は、文献(Kikuchi et al., 1992)の記載に従って作成した。マウスの脳は、320 mMサッカロース、20mM Tris-Cl pH7.5、2mM EDTA、および10mMPMSFからなる溶解緩衝液中でホモゲナイズした。50mgの蛋白質をSDS-PAGEにて分画し、Immobilon膜(ミリポア)に移し、5% BSAを含むトリス緩衝液生理食塩水中にて1時間ブロックした。抗Smg GDS抗体と共に1時間、次いでペルオキシターゼを結合した2次抗体と共に1時間インキュベートした後、ECL(アマシャム ファルマシア バイオテック)によりブロットを視覚化した。
1.4 Smg GDS特異的なRT-PCRTRIzol試薬(ギブコBRL)を用いて各遺伝子型を持つマウスの脳から全RNAを抽出し、製造者のプロトコールに従って処理した。モロニー逆転写酵素およびcDNA合成キット(ストラタジーン)の試薬を用いてcDNAの1本目の鎖を作成した。反応の20%(4μl)を50μlのPCR増幅に用いた。PCR増幅には、5UのTaq-DNAポリメラーゼ、2mMのMgCl2、150μMのdNTPs、1μMのプライマー(配列番号5および配列番号6)を用いた。PCRは25サイクルで以下のように行った:72℃にて2分間(伸張)、95℃にて30秒(変性)、55℃にて1分間(アニ−リング)。試料はさらに72℃にて5分間伸張させた。PCR産物は4% 3:1 NuSieveアガロース(タカラ)ゲルにて電気泳動を行い、Smg GDS cDNAプローブを用いてサザンブロット解析した。
1.5 組織学的な分析マウスの胎児と新生児をブアン液あるいは4%パラホルムアルデヒドで固定し、パラフィン包埋し、連続切片(5μm)を作成して、ヘマトキシリンおよびエオシン(HE)で染色した。ターミナルデオキシヌクレオチジルトランスフェラーゼ(TdT)が介在するdUTPニック端標識(TUNEL)染色は、in situアポトーシス検出キット(タカラ)を利用してパラホルムアルデヒド固定した切片で行った。すなわち、切片をプロテイナーゼK(20 μg/ml)と共に37℃にて15分間インキュベートし、次いで3%H2O2中でインキュベートすることにより内在性のペルオキシターゼをブロックした。リン酸緩衝液生理食塩水(PBS)にて洗浄した後、TdT酵素と標識保護緩衝液を含むTUNEL反応混合物を湿気を含んだ反応槽中の切片にかけ、37℃にて75分間インキュベートした。次いでPBSにて切片を3回洗浄し、抗FITC HRP-結合2次抗体とともに30分間インキュベートし、2回すすいで、3,3-ジアミノベンジジン テトラヒドロクロライドとH2O2にて視覚化した。最後にヘマトキシリンで切片を対比染色した。in vivoにおけるブロモデオキシウリジン(BrdU)標識については、BrdU(マウス当たり0.5mlの生理食塩水に0.5mg溶解した)を11.5日目および12.5日目の妊娠したメスの腹腔内に注射した。注射後1時間でメスを屠殺した;4%パラホルムアルデヒド中で4℃にて一晩、胎児を固定し、文献(Fushiki et al., 1997)の記載に従って免疫組織化学的に検索した。
1.6 Ex vivoにおける胸腺細胞アポトーシスの誘導新生児胸腺の単一細胞浮遊液を10%DCC-FCSを添加したRPMIで2回洗浄し、5%CO2環境で37℃にて30分間インキュベートし、内在性のグルココルチコイドを除去した。1x106/ml個の胸腺細胞を24穴組織培養用プレートに入れ、以下の細胞死刺激によって処理した:デキサメサゾン(シグマ)、エトポシド(クローンテック)、抗Fas抗体Jo2(ファーミンジェン)と30μg/mlのシクロヘキシミド、およびUV照射。ApoAlert CPP32/Casp-3蛍光アッセイキット(クローンテック)を用いてカスパーゼ-3の活性を測定した。DEVD-AFCの開裂は蛍光分光光度計(シマヅRF-1500)によって測定した。胸腺細胞を、ヨウ化プロピジウム(シグマ)およびCD4、CD8、およびアネキシンVに対する抗体(ファーミンジェン)で染色し、FACSヴァンテージ二重レーザーフローサイトメーター(ベクトン-ディッキンソン、サンノゼ、CA)によって解析した。
1.7 レトロウイルスによる遺伝子移入完全長のSmg GDS cDNAおよび対照としての増強緑色蛍光タンパク(EGEP)cDNAをpLNCXレトロウイルスベクターのHpaI部位にサブクローニングし、PT96細胞に遺伝子移入して、感染性組換えレトロウイルスを作成した。パッキングした細胞をG418(500μg/ml)の存在下で1週間選抜した。レトロウイルスによるトランスフェクションは製造者のプロトコール(クローンテック)に記載されているとおりに行った。1ml当たり106-107個のウイルス粒子を含んでいる細胞培養液を0.45μmのフィルター(ミリポア)で濾過し、1x106個の胸腺細胞に24時間加え、遺伝子を発現させた。次いでエトポシドで胸腺細胞を処理することによりアポトーシスを誘導した。
2. 結果2.1 Smg GDS-/-マウスの作出Smg GDS遺伝子のエクソン5の3'側半分とそれに続くエクソン6およびエクソン7を含む1.7kbのゲノムDNAを削除するように設計されたターゲティングベクターを用いた相同組換えによってSmg GDS+/-ES細胞を作出した(図1A)。ベクターをエレクトロポレーションによりES細胞に導入し、G418抵抗性のSmg GDS変異遺伝子へテロ接合体のコロニーを3つ得た。サザンブロット分析によりG418抵抗性コロニーの遺伝子型を確認した。これらのESクローンを用いてキメラマウスを作成した。Smg GDSヘテロ接合体同志を交配し、ホモ接合体の変異遺伝子を持った子孫を作成した(図1BおよびC)。破壊した遺伝子座についてホモ接合体マウスは、元々のSmg GDS蛋白質も、Smg GDS mRNAに由来するRT-PCR産物も発現していなかった(図1DおよびE)。
2.2 新生児の生存に対するSmg GDSの必要性Smg GDSヘテロ接合体マウスは取り立てて表現型の変化も無く生存可能である。それに対して、Smg GDS欠損マウスは、Smg GDS-/-マウスの生存比率が非常に減少した。ヘテロ接合体同志の交配において、3週令のホモ接合体マウスは全体の7%で、期待値である25%よりも有意に低かった(表I)。胎児の遺伝子型と胎児致死性には相関関係が認められないことから、Smg GDSはマウスの発生には必須ではないが、出生後の生存には意味があることを示唆している。次に、出生後0-10日間におけるSmg GDS-/-マウスの生存率を調べた。Smg GDS-/-の約70%のマウスが生後5日以内に死亡した(図2A)。このようなマウスは生後0-2日(P0-2)で衰弱し、症状の発症後20-30時間以内に死亡する傾向があった。Smg GDS-/-の約30%のマウスはこの期間を生き延び、少なくとも1年間は生存可能であった。このように生き延びたマウスは特別な細菌のいない環境で相対的に正常に発達し、繁殖可能であった。2世代目のSmg GDS-/-子孫における生存率も30%であり、最初のヘテロ接合体交配で得られたSmg GDS-/-マウスの生存率と同様であった(図2B)。さらに、この生存傾向は3回の戻し交配後、C57BL/6の遺伝的背景にも保存されていた。このような知見は、Smg GDS-/-マウスが、野生型やSmg GDS+/-の同腹仔に比べて生存上有意に不利であり、Smg GDSは遺伝的に新生児死亡を起こすということを示している。
【0022】
【表1】

【0023】2.3 Smg GDS-/-マウスにおける心不全生後1日で衰弱しつつあるSmg GDS-/-マウスを様々なレベルで観察した。その結果、それらのほとんどが、心不全の徴候:チアノーゼ、浮腫および皮膚の膨圧の低下を示していた。予想通りSmg GDS-/-マウスの心臓は肉眼的に拡張しており、心房、心室および中隔壁は極めて薄くなっていた。組織学的に両方の心房および心室は拡張し、対応する野生型同腹仔に比べて梁状突起が低下していた(図3、AaおよびBa)。Smg GDS-/-マウスの心筋は顕著な細胞減少を示したが、炎症性細胞の浸潤とは関連していなかった(図3、AbおよびBb)。Smg GDS-/-マウス心臓のこのような形態的な変化は、Ki-Ras-/-マウス心臓の形態(Koera et al., 1997)に酷似しているように思われた。Smg GDS-/-マウスの肝臓および肺は対照同腹仔に比べて1.2から1.5倍の重量があり、組織学的には顕著な鬱血を示した(図3、Ac、Bc、Ad、およびBd)。これらのことを総合すると、Smg GDS-/-マウスにおける新生児死亡は心不全により引き起こされると結論付けられる。
2.4 Smg GDS-/-心筋細胞におけるアポトーシスSmg GDS-/-マウスの心臓における細胞数の減少および異常構造が細胞増殖能力の低下によるものなのか、あるいはアポトーシスの亢進によるものなのかを調べた。実際、Ras/MAPK経路は長い間、分裂促進シグナルによる細胞増殖に含まれると考えられていた(Buday et al., 1993; Egan et al., 1993; Liu et al., 1993; Vojtek et al 1993)。しかし、最近になって無脊椎動物(Bergmann et al., 1998a, 1998b;Kurada およびWhite, 1998)およびマウスの造血系細胞株BaF3(Walker et al., 1998)においてRasは細胞の生存シグナルに介在することが明らかにされた。Ki-Rasマウスにおける心臓の病変は、交尾後13.5-15.5日(dpc)に見られ、心筋の増殖不全により引き起こされると考えられているので、in vivoにおける胎児心筋の増殖について調べた。11.5dcpの胎児を抱えた妊娠マウスの腹腔内にBrdUを注射し、BrdUの胎児組織への取り込みを組織学的に評価した。心臓切片のHE染色では、Smg GDS-/-マウスと対照の間で明確な差異を示さなかった(図4、AaおよびBa)。Smg GDS+/-マウスおよびSmg GDS-/-マウス心臓(4匹の胎児から得た32の切片を調べたデータ)における心筋細胞核の総数に対するS期の核(BrdU陽性)の量的な比較では、Smg GDS+/-マウス心臓おける比率は22.2±3.3%およびSmg GDS-/-心臓マウスにおける比率は21.3±3.7%であり、BrdUは同じようなレベルでSmg GDS-/-マウス心臓および対照心臓に取り込まれることを示した(図4、AbおよびBb)。さらに13.5、15.5、および16.5dpcにおける胎児の心筋細胞の1次培養を分析したが、心筋細胞の変異マーカーである、αアクチン−サルコメア単位の形成に変化を認めることはできなかった(データは示さず)。このような結果は、Smg GDS-/-マウスの胚形成において心筋細胞は正常に増殖することを示し、Smg GDSヘテロ接合体間交配で生じる胎児のメンデル遺伝様式による遺伝に一致している。
【0024】次に、心筋細胞におけるアポトーシスの亢進が生後1日のSmg GDS-/-マウス心臓における心房、心室および中隔壁の薄化を導いているという可能性を検討した。ただし、生後1日では既にアポトーシス細胞が処理されるか、消えているかもしれないので、胎令E18.5および生後P0日の心臓をTUNEL染色法を用いて調べた。HEおよびTUNEL染色した連続切片を、Smg GDS-/-マウスと同腹仔の間でアポトーシスを受けている細胞について視覚化して比較した。18.5dpcでは核濃縮した細胞やTUNEL陽性細胞は対照およびSmg GDS-/-マウス胎児の心筋細胞ではほとんど見られなかったのに対し、出生当日、主として6時間後にSmg GDS-/-マウスのTUNEL染色では、対照のSmg GDS+/-同腹仔に比べて大量の細胞死が見い出された(図5、AaおよびBa)。退行変性は、左心室内膜で優勢であり(図5、BcおよびBd)、心筋細胞の剥離および心室の拡張を起こしていた。Smg GDS-/-の心臓ではアポトーシスを受けている細胞は両方の心室で見られるのに対し、対照のSmg GDS+/-心臓では右心室にのみ見られたのは興味深い(図5、AbおよびBb)。このような知見は心臓の右側におけるアポトーシスは生理的過程の一部であり、新生児期における心臓血管系の難局のために過剰に負荷される血圧を反映することを示唆している。心臓血管系の力学的変化によって引き起こされる同様の知見は、gp130欠損マウスの心臓においても報告されている(Hirota et al., 1999)。このような結果は、胎生循環から体循環への変化の間における心臓血管系の過剰負荷が引きがねとなってSmg GDS-/-マウスの心筋細胞でアポトーシスが起き、形態的な変化を起こし、心不全に至ることを示唆している。
2.5 Smg GDS-/-新生児胸腺細胞のアポトーシス心臓の病変に加え、生後1日目におけるSmg GDS-/-マウスの胸腺が、野生型あるいはSmg GDS+/-マウスの同腹仔対象に比べて著しく小さく、胸腺細胞の総数が5から10倍減少していることを見い出した(データは示さず)。Smg GDS-/-マウスの胸腺の組織切片は、皮質と髄質の構造は保存されたままであるが、濃縮した核が広く分布することを示した(図6、Aa、Ab、Ba、およびBb)。濃縮した核はアポトーシスを示しているので、次にTUNEL染色を行い、実際にSmg GDS-/-マウスの胸腺ではアポトーシスを受けている胸腺細胞が増加していることを見い出した(図6、AcおよびBc)。さらに、Smg GDSの欠損が胸腺細胞の成熟を阻止するのかどうかを確認するために、Smg GDS-/-マウスの胸腺細胞をフローサイトメーターで解析した。しかしながら、CD4陽性細胞とCD8陽性細胞の集団は正常値範囲内にあり(図6、AdおよびBd)、Smg GDSはT細胞の分化には必須ではないことを示唆していた。
2.6 エトポシドおよびUV照射に反応した培養Smg GDS-/-胸腺細胞のアポトーシスSmg GDSの欠損とアポトーシスの亢進の関係を検討するために、ex vivoでの様々なアポトーシスアッセイに適している培養Smg GDS-/-胸腺細胞を用いた。SmgGDS-/-および対照胸腺細胞をマウス新生児から単離し、アポトーシスを誘導することが知られている4つの刺激剤で刺激した。アポトーシスの程度は、アポトーシスの間にDNAの断片化を起こすデオキシリボヌクレアーゼの直接的な上流活性因子であるカスパーゼ-3の活性によって測定した(Liu et al., 1997; Enari etal., 1998)。デキサメサゾンおよび抗Fas抗体はSmg GDS-/-および対照胸腺細胞に充分な効果を示さなかった(図7、AおよびB)、エトポシドおよびUV照射によって、Smg GDS-/-の胸腺細胞で同腹仔対照に比べて3から4倍カスパーゼ活性が増加していた(図7、CおよびD)。両方の刺激剤はDNAの損傷反応経路を誘導するので、Smg GDSが哺乳類細胞におけるp53チェックポイント機能に連結した増殖停止/アポトーシスの機構に関連する可能性が想定される。しかし、Smg GDS-/-がFas誘導アポトーシスにむしろ不応性だったということは(図7B)、Smg GDSがFas誘導アポトーシスにおいて負の作用を果していることが示唆されるが、これがどのようなものかは不明である。
2.7 Smg GDS-/-胸腺細胞において外因性に発現させたSmg GDSによるエトポシド誘発アポトーシスの回避Smg GDSの欠損が実際にマウスにおけるアポトーシスの表現型に関わっていることを明らかにするために、Smg GDSの機能を導入することによりSmg GDS-/-マウスにおける特性のいくつかが回避されるか否かを検討した。すなわち、Smg GDSのcDNAの発現によってエトポシドで誘発されるSmg GDS-/-胸腺細胞のアポトーシスを克服できるかどうか調べた。まず、出生日に新生児マウスから野生型とSmg GDS-/-型の胸腺細胞を単離し、Smg GDSあるいは対照としてEGFPを発現しているレトロウイルスを形質導入し、さらに24時間培養した。次いでアポトーシスを誘発するためにエトポシドで4時間処理をした。アポトーシスの指標としてフローサイトメーターによるパターンとカスパーゼ-3の活性を解析した。ベクターのみを形質導入したSmg GDS-/-の胸腺細胞については、エトポシドの4時間処理によって10%から約40%の細胞がアポトーシスを起こした(図8A、左と中央のパネル)。しかしながら、エトポシド処理をする前にSmg GDS発現ウイルスを導入したSmg GDS-/-の胸腺細胞の場合、Smg GDSの導入によって、アネキシンVおよびヨウ化プロピジウム陰性の生存細胞の比率が60%から66%に増加し、逆にアネキシンVおよびヨウ化プロピジウム陽性のアポトーシスを受けている細胞は40%から34%に減少した(図8A、右のパネル)。対照として、ウイルスベクターのみ(図8A、上のパネル)およびEGFP(データは示さず)を形質導入した細胞では、アネキシンおよびおよびヨウ化プロピジウム陽性の死細胞の比率における有意な効果は認められなかった。
【0025】さらに、同じレトロウイルスを形質導入したSmg GDS-/-胸腺細胞のカスパーゼ-3活性では、Smg GDS欠損の回復が見られた(図8B)。エトポシド処理に先だって胸腺細胞へSmg GDSを導入した場合、Smg GDS-/-胸腺細胞ではカスパーゼ-3の活性を有意に低下させたが、対照では低下しなかった。5つの代表的な結果の平均値は、胸腺細胞の調製によってある程度ばらついたが、Smg GDSの導入により、Smg GDS-/-胸腺細胞のおよそ半分の事例でカスパーゼ-3の活性が低下した。これは、Smg GDS-/-マウスの新生児期で見られた生存率の差異に一致していた。以上の結果は、Smg GDSの機能はエトポシドで誘発されるアポトーシスを克服するのにほぼ充分であることを示唆している。
2.8 Smg GDS-/-ニューロン細胞におけるアポトーシスノーザンブロット分析では、Smg GDSのmRNAは主として脳に発現しており、insituハイブリッド分析では、Smg GDSの転写物は、18.5 dpcの胎児の延髄、三叉神経節、および後根神経節で発現している(データは示さず)。さらにKi-Ras欠損マウスの胎生期の神経発生においてアポトーシスのレベルが上昇していることが知られている(Koera et al., 1997)。神経発生におけるSmg GDS欠損の影響をKi-Rasに関連した機能という背景で説明できるかどうか調べるために、Smg GDS-/-胎児における中枢神経系の損傷の可能性を調べた。Smg GDS-/-の脳では肉眼的な異常は認められなかったが、濃縮した核は12.5 dpcで延髄(図9Aa)および脊髄(データは示さず)で見られた。次いで死細胞の程度を比較するためにTUNEL染色を行い、延髄(図9、AbおよびAc)、三叉神経節、脊髄および後根神経節においてアポトーシス細胞が同腹仔対照(図9、B-D)に比べて増加していることを確認した。脳の細胞構造を決めるのに著しいレベルのアポトーシスが必要であると考えられているので(Datta and Greenberg, 1988)、このようなアポトーシスの変化について病理学的な意味を評価するのは難しく、当然胎児を死に至らしめることはできない。しかしながら、このような結果は、時間的、空間的にKi-Ras欠損マウスで見られた知見に一致していることに注目すべきである。
【0026】
【発明の効果】以上詳しく説明したとおり、この出願の発明によって、低分子量G蛋白質の調整因子であるSmg GDS遺伝子が機能的にノックアウトされた動物個体、その組織または細胞、およびES細胞が提供される。個体発生やアポトーシスのメカニズムの解明、発生異常やアポトーシス性疾患の診断やその治療法、治療薬等の開発に有用である。
【0027】
【配列表】
<110> Japan Science and Technology Corporation<120> Smg GDS遺伝子欠損動物<130> NP99366-YS<160> 6<210> 1<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 1CCGCTTGGGT GGAGAGGCTA T 21<210> 2<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 2TGGTGGTCGA ATGGGCAGGT A 21<210> 3<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 3TCCCCGCTAT CTTCAGTATC T 21<210> 4<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 4GCACAGTATT CAAAACCATC C 21<210> 5<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 5AAGCTACTGG GCATTCACTG C 21<210> 6<211> 21<212> DNA<213> Artificial Sequence<220><233> Synthesized Oligonucleotide<400> 6TTTCTGCATG GACTCATCTC C 21
【0028】
【参考文献】Ando, S., K. Kaibuchi, T, Sasaki, K. Hiraoka, T. Nishiyama, T. Mizuno, M. Asada,H. Nunoi, I. Matsuda, Y. Matsuura, P. Polakis, F. McCormick, and Y. Takai. 1992. Post-translational processing of rac p21s is important both for their interaction with the GDP/GTP exchange proteins and for their activation of NADPH oxidase. J. Bio. Chem. 267:25709-25713.Bergmann, A., J. Agapite, K. Macall, and H. Steller. 1998a. The Drosophila gene hid is a direst molecular target of Ras-dependent survivalsignaling. Cell. 95:331-341.Bergmann, A., J. Agapite, and H. Steller. 1998b. Mechanisms and control of programmed cell death in invertebrates. Oncogene. 17:3215-3223.Bonfini, L., C. A. Karlovich, C. Dasgupta and U. Banerjee. 1992. The son of sevenless gene product: a putative activator of Ras. Science. 255:603-606.Bourne, H. R., D. A. Sanders, and F. McCormick. 1990. The GTPase superfamily: conserved switch for diverse cell functions. Nature. 348:125-132.Bourne, H. R., D. A. Sanders, and F. McCormick. 1991. The GTPase superfamily: conserved structure and molecular mechanism. Nature. 349:117-127.Buday, L., and J. Downward. 1993. Epidermal growth factor regulatesp2ras through the formation of a complex of receptor, Grb2 adapter protein, and Sos nucleotide exchange factor. Cell. 73:611-620.Cheng, A. M., T. M. Saxton, R. Sasaki, S. Kulkarni, G. Mbamalu, W.Vogel, C. G. Tortorice, R. D. Cardiff, J. C. Cross, W. J. Muller, and T.Pawson. 1998. Mammalian Grb2 regulates multiple steps in embryonic development and malignant transformation. Cell. 95: 793-803.Crechet, J. B., P. Poullet, M. Y. Mistou, A. Parmeggiani, J. Camonis, E. Boy-Marcotte, F. Damak, and M. Jaquet. 1990. Enhancement of GDP-GTP exchange of RAS proteins by the carboxyl-terminal domain of SCD25. Science. 248:866-868.Crespo, P., X. R. Bustelo, D. S. Aaronson, O. A. Coso, M. Lopez-Barahona, M. barbacid and J. S. Gutkind. 1996. Rac-1 dependent stimulationof the JNK/SAPK signaling pathway by Vav. Oncogene. 13:455-460.Datta, S. R. and M. E. Greeberg. 1998. Molecular mechanisms of neuronal survival, and apoptosis. Hormones and Signaling. 1:94-103.Deng, C., P. Zhang, J. W. Harper, S. J. Elledge, and P. Leder. 1995. Mice lacking p21CIPI/WAF1 undergo normal development, but are defective in G1 checkpoint control. Cell. 82:675-684.de Rooij, J., F. J. Zwartkruis, M. H. Verheijen, R. H. Cool, S. M.Nijman, A. Wittinggofer, and J. L. Bos. 1998. Epac is a Rap1 guanine-nucleotide -exchange factor directly activated by cyclic AMP. Nature. 396:474-477.Egan, S. E., B. W. Giddings, M. W. Brooks, L. Buday, A. M. Sizeland, and R. A. Weinberg. 1993. Association of Sos Ras exchange protein withGrb2 is implicated in tyrosine kinase signal transduction and transformation. Nature. 363:45-51.Enari, M., H. Sakahira, H. Yokoyama, K. Okawa, A. Iwamatsu, and S.Nagata. 1998. A caspase-activated DNase that degrades DNA during apoptosis, and its inhibitor ICAD. Nature. 391:43-50Esteve, P., N. Embade, R. Perona, B. Jimenez, L. del Peso, J. Leon,M. Arends, T. Miki, and J. C. Lacal. 1998. Rho-regulated signals induceapoptosis in vitro and in vivo by p53-independent, but Bc12 dependent pathway. Oncogene. 17:1855-1869.Eves, E. M., W. Xiong, A. Bellacosa, S. G. Kennedy, P. N. Tsichlis,M. R. Rosner, and N. Hay. 1998. Akt, a target of phosphatidylinositol 3-kinase, inhibits apoptosis in a differentiating neuronal cell line. Mol. Cell Biol. 18:2143-2152.Fischer, K. D., A. Zmuldzinas, S. Gardner, M. Barbacid, A. Berstein, and C. Guidos. 1995. Defective T cell receptor signalling and positiveselection of Vav-deficient CD4+VD8+ thymocytes. Nature 374:474-477.Fushiki, S., Y. Hyodo-Taguchi, C. Kinoshita, Y. Ishikawa, and T. Hirobe. 1997. Short- and long-term effects of low-dose prenatal X-irradiation in mouse cerebral cortex, with special reference to neuronal migration. Acta. Neuropathol. (Berl) 93:443-449.Fujioka, H., K. Kkaibuchi, K. Kishi, T. Yamamoto, M. Kawamura, T. Sakoda, T. Mizuno, and Y. Takai. 1992. Transforming and c-fos promoter/enhancer-stimulating activities of a stimulatory GDP/DTP exchange proteinfor small GTP-binding proteins. J. biol. Chem. 267:926-930.Gotoh, T., S. Hattori, S. Nakamura, H. Kirayama, M. Noda, Y. Takai,K. kaibuchi, H. Matsui, O. Hatase, H. Takahashi, T. Kurata, and M. Matsuda. 1995. Identification of Rsp1 as a target for the Crk SH3 domain-binding guanine nucleotide-releasing factor C3G. Mol. Cell Biol. 15:6749-6753.Gulbins, E., K. M. Coggeshall, B. Brenner, K. Schlottmann, O. Linderkamp, and F. Lang. 1996. Fas-induced apoptosis is mediated by activation of a Ras and Rac protein-regulated signalling pathway. J. Biol. Chem.271:26389-26394.Harvey, M., A. T. Sands, R. S. Weiss, M. E. Hegi, R. W. Wiseman, P.Pantazis, B. C. Giovanella, M. A. Tainsky, A. Bradley, and L. A. Donehower. 1993. In vitro growth characteristics of embryo fibroblasts isolated from p53-deficient mice. Oncogene 8:2457-2467.Hall, A. 1990. The cellular functions of small GTP-binding proteins. Science 249:635-640.Henning, S. W., R. Galandrini, A. Hall, and D. A. Cantrell. 1997. The GTPase Rho has a critical regulatory role in thymus development. EMBOJ. 16:2397-2407.Hiraoka, K., K. Kkaibuchi, S. Ando, T. Musha, K. Takaishi, T. Mizuno,M. Asada, L. Menard, E. Tomhave, J. Didsbury, and Y. Takai. 1992. Bothstimulatory and inhibitory GDP/GTP exchange proteins, smg GDS and rho GDI, are active on multiple small GTP-binding proteins. Biochem. Biophys.Res. Commun. 182:921-930.Hirota, H., J. Chen, U. A. K. Betz, K. Rajewsky, Y. Gu, J. Ross, Jr., W. Mular, and K. R. Chien. 1999. Cell survival pathway is a criticalevent in the onset of heart failure during biomechanical stress. Cell 97:189-198.Huges, D. A., Y. Fukui, and M. Yamamoto. 1990. Homologous activators of ras in fission and budding yeast. Nature, 344:355-357.Jimenez B., M. Arends, P. Estreve, R. Perona, R. Sanchez, S. Ramony Cajal, A. Wyllie, and J. C. Lacal. 1995.Induction of apoptosis in NIH3T3 cells after serum deprivation by overexpression of rho-p21, a GTPaseprotein of the ras superfamily. Oncogene 10:811-816.Johnson, L., D. Greenbaum, K. Cichowski, K. Mercer, E. Murphy, E. Schmitt, R. T. Bronson, H. Umanoff, W. Edelmann, R. Kucherlapati, and T.Jacks. 1997. K-ras is an essential gene in the mouse with partial functional overlap with N-ras. Genes Dev. 11:2468-2481.Jones, S., M. L. Vignais, and J. R. Broach. 1991. The CDC25 proteinof Saccharomyces cerevisiae promotes exchange of guanine nucleotides bound to ras. Mol. Cell Biol. 11:2641-2646.Kamijo, T., F. Zindy, M. F. Riussel, D. E. Quelle, J. R. Downing, R. A. Ashmun, G. Grosveld, and C. J. Dherr. 1997. Tumor suppression at the mouse INK4a locus mediated by the alternative reading frame product p19ARF. Cell 91:649-659.Kaibuchi, K., T. Mizuno, H. Fujioka, T. Yamamoto, K. Kishi, Y. Fukumoto, Y. Hori, and Y. Takai. 1991. Molecular cloning of the cDNA for stimulatory GDP/GTP exchange protein for smg p21s(ras p21-like small GTP-binding proteins) and characterization of stimulatory GDP/GTP exchange protein. Mol. Cell Biol. 11:2873-2880.Kauffmann-Zeh, A., O. Rodriguez-Viciana, E. Ulrich, C. Gilbert, P.Coffer, J. Downward, and G. Evan. 1997. Suppression of c-Myc-induced apoptosis by Ras signalling through PI(3)K and PKB. Nature 385:544-548.Kawamura, M., K. Kaibuchi, K. Kishi, and Y. Takai. 1993. Translocation of Ki-ras p21 between membrane and cytoplasm by smg GDS. Biochem. Biophys Res. Commun. 190:832-841.Kawasaki, H., G. M. Springett, N. Mochizuki, S. Toki, M. Matsuda, D. E. Houseman, A. M. Graybiel. 1998. A family of cAMP-binding proteins that directly activates rap1. Science 282:2275-2279.Kennedy, S. G., A. J. Wagner, S. D. Conzen, J. Jordan, A. Bellacosa, P. N. Tsichils, and N. Hay. 1997. The PI3-kinase/Akt signaling pathwaydelivers an anti-apoptotic signal. Genes Dev. 11:701-713.Kikuchi, A., S. Kuroda, T. Sasaki, K. Kotani, K. Hirata, M. Katayama, and Y. Takai. 1992. Functional interactions of stimulatory and inhibitory GDP/GTP exchange proteins and their common substrate small GTP-binding protein. J. Biol. Chem. 267:14611-14615.Koera, K., K. Nakamura, K. Nakano, J. Miyoshi, K. Toyoshima, T. Hatta, H. Otani, A. Aiba, and M. Katsuki. 1997. K-ras is essential for thedevelopment of the mouse embryo. Oncogene 15:1151-1159.Kotani, K., A. Kikuchi, K. Doi, S. Kishida, T. Sakoda, K. Kishi, and Y. Takai. 1992. The functional domain of the stimulatory GDP/GTP exchange protein (smg GDS) which interacts with the C-terminal geranylgeranykated region of rap1/Krev-1/smg p21. Oncogene 7:1699-1704.Kuroda, V., and K. White. 1998. Ras promotes cell survival in Drosophila by downregulating hid expression. Cell 95:319-329.Liu, B., W. Wei, and D. Broek. 1993. The catalytic domain of the mouse sos1 gene product activates Ras proteins in vivo and in vitro. Oncogene 8:3081-3084.Liu, X., H. Zou, C. Slaughter, and X. Wang. 1997. DFF, a heterodimeric protein that functions downstream of caspase-3 to trigger DNA fragmentation during apoptosis. Cell 89:175-184.Lowe, S. W., H. E. Ruley, T. Jacks, and D. E. Housman. 1993. p53-dependent apoptosis modulates the cytotoxicity of anti-cancer agents. Cell74:957-967.Lowe, S. W., E. M. Schmitt, S. W. Smith, B. A. Osborne, and T. Jacks. 1993. p53 is required for radiation-induced apoptosis in mouse thymocytes. Nature 362:847-849.McCrea, P.D., C. W. Turck, and B. Gumbiner. 1991. A homolog of thearmadillo protein in Drosophila (plakoglobin) associated with E-cadherin. Science 254:1359-1361.Meier, P. and G. Evan. 1998. dying like flies. Cell 95:295-298.Mizuno, T., K. Kaibuchi, T. Yamamoto, M. Kawamura, T. Sakoda, H. Fujioka, Y. Matsuura, and T. Takai. 1991. A stimulatory GDP/GTP exchange protein for smg p21 is active on the post-translationally processed formof c-Ki-ras p21 and rhoA p21. Proc. Natl. Acad Sci. USA. 88:6442-6446.Moorman, J. P., D. Luu, J. Wickham, D. A. Bobak, and C. S. Hahn. 1999. A balance of signaling by Rho family small GTPases RhoA, Rac1 and Cdc42 coordinates cytoskeltal morphology but not cell survival. Oncogene.18: 47-57.Nakanishi, H., K. Kaibuchi, S. Orita, N. Ueno, and Y. Takai. 1994.Different functions of Smg GDS dissociation stimulatorNakayama, K., K. Nakayama, I. Negishi, K. Kuida, H. Sawa, and D. Y.Loh. 1994. Targeted disruption of Bcl-2 alpha beta in mice : occurrenceof gray hair, polycystic kidney disease, and lymphcytopenia. Proc. Natl. Acad. Sci. USA. 91:3700-3704.Nishida, K., Y. Kaziro, and T. Satoh. 1999. Anti-apoptotic functionof Rac in hematopoietic cells. Oncogene 18:407-415.Orita, S., K. Kaibuchi, K. Kuroda, K. Shimizu, H. Nakanishi, and Y.Takai. 1993. Comparison of kinetic properties between two mammalian rasp21 GDP/GTP exchange proteins, ras guanine-releasing factor and smg GDPdissociation stimulator. J. Biol. Chem. 268:25542-255461.Pritchard, C. A., L. Bolin, R. Slattery, R. Murray, and M. McMahon.1996. Post-natal lethality and neurological and gastrointestinal defects in mice with targeted disruption of the A-Raf protein kinase gene. Curr. Biol. 6:614-617.Simon, M. A., D. D. Bowtell, G. S. Dodson, T. R. Laverty, and G. M.Rubin. 1991. Ras1 and a putative guanine nucleotide exchange factor perform crucial steps in signaling by the sevenless protein tyrosine kinase. Cell 67:701-716.Sugiura, K., N. Nakatsuji, K. Nakamura, K. Nakano, R. Hashimoto, H.Otani, H. Sakagami, H. Kondo, S. Nozawa, A. Aiba, and M. Katsuki. 1998.Rac1 is required for the formation of three germ layers during gastrulaton. Oncogene. 17:3427-3433.Takai, Y., Kaibuchi, A. Kikuchi, and M. Kawata. 1992. Small GTP-binding proteins. Int. Rev. Cytol. 133:187230.Takai,Y., K. kaibuchi, A. Kikuchi, Sasaki, T., and H. Shirataki. 1993. Regulation of small GTPases. Ciba Found. Symp. 176:128-138.Tarakhovsky, A., M. Turner, S. Schaal. P. J. Mee, L. P. Duddy, K. Rajewsky, and V. L. Tybulewicz. 1995. Defective antigen receptor-mediatedproliferation of B and T cells in the absence of Vav. Nature 374:467-470.Togawa, A., J. Miyoshi, H. Ishizaki, M. Tanaka, A. Takakura, H. Nishioka, H. Yoshida, T. Doi, A. Mizoguchi, N. Matsuura, Y. Niho, Y. Nishimune, S. Nishikawa, and Y. Takai. 1999. Progressive impairment of kidneysand reproductive organs in mice lacking Rho GDIα. Oncogene. 18:5373-5380.Umanoff, H., W. Edelmann, A. Pellicer, and R. Kucherlapati. 1995. The murine N-ras gene is not essential for growth and development. Proc.Natl. Acad. Sci. USA. 92:1709-1713.Vithalani, K. k., C. A. Parent, E. M. Thorn, M. Penn, D. A. Larochelle, P. N. Devreotes, and A. De Lozanne. 1998. Identification of Darlin,a Dictyostelium protein with Armadillo-like repeats that binds to smallGTPases and is important for the proper aggregation of developing cells. Mol. Biol. Cell. 8:3095-3106.Vojtek, A. B., S. M. Hollenberg, and J. A. Cooper. 1993. MammalianRas interacts directly with the serine/threonine kinase Raf. Cell 74:205-214.Veis, D. J., C. M. Sorenson, J. R. Shutter, and S. J. Korsmeyer. 1993. Bcl-2-deficient mice demonstrate fulminant lymphoid apoptosis, polycystic kidneys, and hypopigmented hair. Cell 75:229-240.Walker, F., A. Kato, L. J. Conez, M. L. Hibbs, N. Pouliot, A. Levitzki, and A. W. Burgress. 1998. Activation of the Ras/mitogen-activated protein kinase pathway by kinase-defective epidermal growth factor receptors results in cell survival but not proliferation. Mol. Cell Biol. 18:7192-7204.Wang, D. Z., V. E. Hammond, H. E. Abud, I. Bertoncello, J. W. McAvoy, and D. D. Bowtell. 1997. Mutation in Sos1 dominantly enhances a weakallele of the EGFR, demonstrating a requirement for Sos1 in EGFR signaling and development. Genes Dev. 11:309-320.Wojnowski, L., A. M. Zimmer, T. W. Beck, H. Hahn, R. Bernal, U. R.Rapp, and A. Zimmer. 1997. Endothelial apoptosis in Braf-deficient mice.Nat. Genet. 16:293-297.Wojnowski, L., L. F. Stancato, A. M. Zimmer, H. Hahn, T. W. Beck, A. C. Larner, U. R. Rapp, and A. Zimmer. 1998. Craf-1 protein kinase isessential for mouse development. Mech. Dev. 76;141-149.Yaku, H., T. Sasaki, and Y. Takai. 1994. The Db1 oncogene product as a GDP/GTP exchange protein for the Rho family : its properties in comparison with those of Smg GDS. Biochem. Biophys. Res. Commun. 198:811-817.Yamamoto, T., K. Kaibuchi, T. Mizuno, M. Hiroyoshi, H. Shirataki, and Y. Takai. 1990. Purification and characterization from bovine brain cytosol of proteins that regulate the GDP/GTP exchange reaction of smg p21s, ras p21-like GTP-binding protein, J. Biol. Chem. 265:16626-16634.Yamochi, W., K. Tanaka, H. Nonaka, A. Maeda, T. Musha, and Y. Takai. 1994. Growth site localization of Sho1 small GTP-binding protein and its involvement in bud formation in Saccharomyces cerevisiae. J. Cell Biol. 125:1077-1093.Yoshida, Y., M. Kawata, Y. Miura, T. Musha, T. Sasaki, A. Kikuchi,and Y. Takai. 1992. Micro injection of smg/rap1/Krev-1 p21 into Swiss 3T3 cells induces DNA synthesis and morphological changes. Mol. Cell Biol.12:3407-3414.Zhang, R., F. W. Alt, L. Davidson, S. H. Orkin, and W. Swat. 1995.Defective signalling through the T- and B-cell antigen receptors in lymphoid cells lacking the vav proto-oncogene. Nature 374: 470-473.Zmuidzinas, A., K. D. Fischer, S. A. Lira, L. Forrester, S. Bryant,A. Bernstein, and M. Barbacid. 1995. The vav proto-oncogene is requiredearly in embryogenesis but not for hematopoietic development in vitro.EMBO J. 14:1-11.
【図面の簡単な説明】
【図1】Smg GDS遺伝子のジーンターゲティングの結果である。(A)エクソン3-8をコードしているマウスのSmg GDS遺伝子の構造を上に示す。エクソン5の一部とエクソン6およびエクソン7を除くようにターゲティングベクターを設計した。コンストラクトは3.3kbの5’側隣接配列と4.9kbの3’側隣接配列を含んでいた。MC1-neoカセットはエクソン5のPstI部位に挿入したが、5’のスプライシング受容部位はそのままにしておいた。ジフテリア毒素DT-Aカセットは3’末端に挿入した。標的遺伝子内では、MC1-neoカセットが1.7kbのゲノムDNA領域と入れ替わった。示したような制限酵素断片とプローブを用いて相同組換えを確認した。(B)マウスの尾から得たDNAをSpeIで分解したものと図1Aに示す3’外部プローブとのサザンハイブリッド形成。マウスの遺伝子型は、6.8kbの野生型(WT)断片および5.5kbの変異型(MT)断片で確認した。レーン1と5は野生型;レーン2、4、6および7はSmg GDS+/-;レーン3はSmg GDS-/-。(C)21日令の同腹仔マウスから得たDNAのPCR解析による遺伝子型の決定。野生型(WT)に対して584bpのDNA断片、標的組換えしたSmg GDS遺伝子座(MT)については370bpのDNA産物を得るようにPCRプライマーを選択した。レーン1は野生型マウス;レーン2はSmg GDS+/-;レーン3はSmg GDS-/-マウスである。(D)各遺伝子型の脳から抽出した蛋白質のウエスタンブロット分析。61kDのSmg GDS蛋白質が検出された。レーン1は野生型マウス;レーン2はSmg GDS+/-;レーン3はSmg GDS-/-マウスである。(E)エクソン5とエクソン7にあるイントロン架橋プライマーと各遺伝子型の脳から得たSmg GDS mRNAを用いたRT-PCR。Smg GDS特異的プラーマーで366bpのバンドが増幅された。レーン1は野生型マウス;レーン2はSmg GDS+/-;レーン3はSmg GDS-/-マウスである。
【図2】Smg GDS-/-マウスの生存期間を調べた結果である。(A)へテロ接合体同志の交配に由来するSmg GDS-/-マウスの第一世代の生存率(n=274)。(B)ホモ接合体同志の交配による第二世代におけるSmg GDS-/-マウスの生存期間。129/BDFと129/C57BLという遺伝的背景では結果は似通っていた(データは示さず)。
【図3】生後1日目の野生型およびSmg GDS-/-型マウスにおける心臓、肝臓および肺切片の組織学的検査の結果である。(AaおよびBa)野生型の心臓(Aa)およびSmg GDS-/-型の心臓(Ba)におけるHE染色の代表的な矢状断面。同腹仔対照に比べて、Smg GDS-/-型の心臓は心房壁、心室壁および隔壁が薄くなり、膨張して拡張していた。(AbおよびBb)野生型の心臓(Ab)およびSmg GDS-/-型の心臓(Bb)における左心室(AaおよびBaで四角で囲んだ部分)壁、高出力拡大(200x)。心筋の細胞がSmg GDS-/-型の心臓で顕著に低下していた。(AcおよびBc)野生型の肝臓(Ac)およびSmg GDS-/-型の肝臓(Bc)におけるHE染色した代表的な切片。Smg GDS-/-型の肝臓では、血液細胞が中心静脈(cv)と肝類洞(hs)を満たしていた。(AdおよびBd)野生型の肺(Ad)およびSmg GDS-/-型の肺(Bd)におけるHE染色した代表的な切片。Smg GDS-/-型の肺の切片では、血液細胞が肺胞毛細血管を満たしていた。Smg GDS-/-マウスの肝臓および肺における鬱血は左右の心不全の存在を示している。
【図4】Smg GDS-/-型の心臓における心筋細胞の正常な増殖を調べた結果である。11.5dpcにおける胎児心臓の横断面切片を示す。(AaおよびBa)HE染色したSmg GDS+/-の心臓(Aa)およびSmg GDS-/-の心臓(Ba)。(AbおよびBb)免疫組織化学分析によって増殖している心筋細胞に取りこまれるBrdUを測定した結果。11.5 dpcにおける胎児のSmg GDS+/-切片(Ab)およびSmg GDS-/-の切片(Bb)をBrdU特異的抗体で染色し、視野当たりのBrdU陽性細胞をスコア化した。
【図5】出生日のSmg GDS-/-心臓において亢進しているアポトーシスを調べた結果である。(AaおよびBa)Smg GDS+/-の心臓およびSmg GDS-/-の心臓のTUNEL染色。両者は同腹仔から作成した。出生日のSmg GDS-/-の心臓(20x)(Ba)は野生型の心臓(20x)(Aa)に比べて保存的構造を示していた。図3、BaおよびBbで示されるような出生後1日目で心筋細胞が顕著に失われていたのに比べて、出生日のSmg GDS-/-心筋細胞は低下していなかった。(AbおよびBb)中程度拡大(100x)での、Smg GDS+/-心臓の右心室(Ab、Aaで囲われている部分)およびSmg GDS-/-心臓の右心室(Bb、Baで囲われている部分)。TUNEL陽性細胞は、Smg GDS+/-心臓では右心室に局在しているのに対してSmg GDS-/-の心臓では両方の心室に見られることに注意。(BcおよびBd)中程度の拡大(100x)(Bc)および高拡大(200x)(Bd)でのSmg GDS-/-心臓における左心室(Baにおいて囲った部分)。Smg GDS-/-心臓の心内膜ではアポトーシスを受けている多数の心筋細胞が容易に検出されるが、Smg GDS+/-心臓の左心室壁ではアポトーシスを受けている細胞は見られない。左心室および右心室はそれぞれlvおよびrvで表す。
【図6】出生後1日目のSmg GDS-/-胸腺において亢進しているアポトーシスを調べた結果である。(AaおよびAb)野生型胸腺(Aa)およびSmg GDS-/-胸腺(Ba)の切片は同腹仔から作成し、HE染色を行った(20x)。Smg GDS-/-の胸腺は野生型胸腺の3分の1の大きさだった。(AbおよびBb)高拡大での野生型胸腺(Ab)およびSmgGDS-/-胸腺(Bb)のHE染色。野生型胸腺細胞に比べてSmg GDS-/-の胸腺細胞では濃縮している核が大量に見られた。(AcおよびBc)野生型胸腺(Ac)およびSmg GDS-/-胸腺(Bc)におけるTUNEL染色。Smg GDS-/-胸腺ではTUNEL陽性細胞が増加している。(AdおよびBd)野生型胸腺細胞およびSmg GDS-/-の胸腺細胞のFACS分析。野生型胸腺細胞(Ad)およびSmg GDS-/-の胸腺細胞(Bd)をCD4およびCD8に対する抗体で染色し、FACSにて解析した。
【図7】出生日のマウス胸腺細胞におけるアポトーシスの指標であるカスパーゼ-3開裂活性を調べた結果である。アポトーシスを誘導するために、マウスの胸腺細胞を、デキサメサゾン(A)、マウスFasモノクローナル抗体(B)、およびエトポシド(C)を、図中の濃度にて2時間処理した。細胞にはまた、図中の時間で紫外線照射した(D)。カスパーゼ-3の活性は、蛍光発色基質DEVD-AMCの開裂に基づく相対的な蛍光強度によって測定した。Smg GDS+/-胸腺細胞(白丸)およびSmg GDS-/-胸腺細胞(黒四角)におけるカスパーゼ-3活性を示した。無処理の細胞では活性のあるカスパーゼ-3は陰性だった。
【図8】Smg GDS-/-胸腺細胞に外因性に発現させたSmg GDS cDNAによるエトポシド誘発アポトーシスの回避を調べた結果である。(A)Smg GDS+/-(上のパネル)およびSmg GDS-/-(下のパネル)新生児マウスに由来する1x106個の胸腺細胞の培養で、無処理(左のパネル)、レトロウイルスベクターpLNCXのみで(真ん中のパネル)、およびSmg GDS cDNAを発現しているpLNCX(右のパネル)で遺伝子導入した。次いでアポトーシスを誘導するために、レトロウイルス処理した胸腺細胞をエトポシドで4時間刺激し、ヨードプロピジウムおよびFITC標識した抗アネキシンV抗体で染色し、フローサイトメーターにより解析した。区分して解析した全細胞数の比率をパネルの中に示す。(B)図7のようにカスパーゼ-3活性を測定した。Smg GDS+/-およびSmg GDS-/-胸腺細胞を用い、レトロウイルスベクターpLNCXのみ(白抜き)およびSmg GDS cDNA発現pLNCX(黒)処理に続いてエトポシドで4時間処理した5回の別々の実験の平均値を示す。
【図9】Smg GDS-/-胎児におけるニューロン細胞死の増加を示した結果である。12.5 dpcのSmg GDS-/-胎児における第三脳室および間脳の横断面切片。(Aa)Smg GDS-/-脳のHE染色(20x)。(Ab)Smg GDS-/-脳のTUNEL染色(20x)。(Ac-D)高拡大(200x)TUNEL陽性細胞は、延髄(Ac、Abにおいて囲った部分)、三叉神経節(B)、脊髄(C)、および後根神経節(D)で増加していた。
【特許請求の範囲】
【請求項1】 低分子量GTP結合蛋白質に対する調節因子であるGDP解離刺激因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されている分化全能性細胞を発生させた非ヒト動物個体およびその子孫動物であるSmg GDS遺伝子欠損動物。
【請求項2】 非ヒト動物が、マウスである請求項1のSmg GDS遺伝子欠損動物。
【請求項3】 請求項1または2の動物由来の組織または細胞。
【請求項4】 低分子量GTP結合蛋白質に対する調節因子であるGDP解離刺激因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されているES細胞。
【請求項5】 マウス由来である請求項4のES細胞。
【請求項1】 低分子量GTP結合蛋白質に対する調節因子であるGDP解離刺激因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されている分化全能性細胞を発生させた非ヒト動物個体およびその子孫動物であるSmg GDS遺伝子欠損動物。
【請求項2】 非ヒト動物が、マウスである請求項1のSmg GDS遺伝子欠損動物。
【請求項3】 請求項1または2の動物由来の組織または細胞。
【請求項4】 低分子量GTP結合蛋白質に対する調節因子であるGDP解離刺激因子Smg GDSをコードするゲノム遺伝子がその機能欠失型変異遺伝子に置換されているES細胞。
【請求項5】 マウス由来である請求項4のES細胞。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図9】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図9】


【図7】


【図8】


【公開番号】特開2001−309735(P2001−309735A)
【公開日】平成13年11月6日(2001.11.6)
【国際特許分類】
【出願番号】特願2000−131257(P2000−131257)
【出願日】平成12年4月28日(2000.4.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成11年11月22日 第22回日本分子生物学会年会組織委員会発行の「第22回日本分子生物学会年会プログラム・講演要旨集」に発表
【出願人】(396020800)科学技術振興事業団 (35)
【Fターム(参考)】
【公開日】平成13年11月6日(2001.11.6)
【国際特許分類】
【出願日】平成12年4月28日(2000.4.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成11年11月22日 第22回日本分子生物学会年会組織委員会発行の「第22回日本分子生物学会年会プログラム・講演要旨集」に発表
【出願人】(396020800)科学技術振興事業団 (35)
【Fターム(参考)】
[ Back to top ]

