Staphylococcusaureusの改変型フィブロネクチン結合タンパク質
【課題】凝固第XIIIa因子に対する反応性が低く、フィブロネクチンおよびフィブリンへの架橋および不可逆的結合を効果的に阻害する改変型のFnbを提供する。
【解決手段】黄色ブドウ球菌(S.aureus)の単離された改変型フィブロネクチン結合タンパク質(Fnb)であって、S.aureus株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に相当する残基から選択されるアミノ酸に少なくとも1つの変異を有するFnbが、記載される。フィブロネクチン結合タンパク質中のこれらの反応性残基を置換することにより、このタンパク質は、野生型のFnbよりもフィブロネクチンおよびフィブリンを共有結合的に架橋する能力が低下する。
【解決手段】黄色ブドウ球菌(S.aureus)の単離された改変型フィブロネクチン結合タンパク質(Fnb)であって、S.aureus株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に相当する残基から選択されるアミノ酸に少なくとも1つの変異を有するFnbが、記載される。フィブロネクチン結合タンパク質中のこれらの反応性残基を置換することにより、このタンパク質は、野生型のFnbよりもフィブロネクチンおよびフィブリンを共有結合的に架橋する能力が低下する。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の分野)
本発明は、凝固第XIIIa因子に対する反応性が低下した、黄色ブドウ球菌(Staphylococcal aureus)の改変型フィブロネクチン結合タンパク質に関する。この改変型フィブロネクチン結合タンパク質を含む免疫原性組成物は、改善された抗原性特性をもち、より安全に使用される。
【背景技術】
【0002】
(発明の背景)
黄色ブドウ球菌(Staphylococcal aureus;S.aureus)のフィブロネクチン結合タンパク質(Fnb)は、フィブロネクチン、フィブリン、およびフィブリノゲンのようなヒトタンパク質への特異的可逆的結合に関与する表面結合型多機能性レセプターである。このような結合によって、微生物は、手術や血管損傷などの間にヒト宿主に効果的に付着し、その後、侵入して定住できるようになる。Fnbは、S.aureusの感染を防ぐための免疫原性組成物中の含有のための有力な候補物質として評価されてきた。組み換えFnbで免疫化し、かつ、このタンパク質に対する機能的に活性な抗体を作製することは、ヒト組織に対するS.aureusの初期付着を防ぎ得、それによって、感染を防止し得る可能性がある。しかし、最近の研究は、マウス、ウサギ、およびヒトで生成された抗体は、野生型Fnbがヒトのフィブロネクチンおよびフィブリンに結合することを阻害しないことを示している。それどころか、これらの抗体は、これらのヒトタンパク質にFnbが結合するのを誘導して、細菌が宿主組織に接着するのを促進する。このことは、ヒトタンパク質への可逆的結合は、宿主組織へのブドウ球菌接着の過程における初期段階としてのみ機能していることを示している。
【0003】
最近の研究では、ブドウ球菌のフィブロネクチン結合タンパク質A(FnbA)は、血漿トランスグルタミナーゼと呼ばれるヒト酵素に対する基質として機能することが実証された(非特許文献1)。これは、FnbAについて、これまで知られていなかった新たな機能である。血漿トランスグルタミナーゼ(第XIIIa因子としても知られる)は、非常に限定された数のヒトタンパク質(表1)の(非可逆的)共有結合架橋を触媒する酵素であり、高分子量のホモポリマーおよびヘテロポリマーの形成をもたらす。第XIII因子は、ポリペプチド鎖内またはポリペプチド鎖間におけるイソペプチド結合の形成を触媒するトランスグルタミナーゼファミリーの酵素の一員である。第XIII因子は血液中を循環しており、従って、細胞外酵素と考えられているが、組織トランスグルタミナーゼ(TG)(例えば、肝臓TG、ケラチノサイトTG、表皮TG、前立腺TG、および赤血球TG)は、細胞の内側に存在しており、従って、細胞内酵素として作用する(非特許文献2)。別のトランスグルタミナーゼは、同じタンパク質を基質として認識するが、しばしば、異なったアフィニティーおよび/または特異性で認識する。概して、第XIIIa因子に対する基質特異性は、組織トランスグルタミナーゼに対するよりも厳密である(非特許文献3、非特許文献4、非特許文献5)。
【0004】
第XIIIa因子によって触媒される架橋反応は、血液凝固、創傷治癒、および線維素溶解を含む多様な正常な生理学的反応において重要な段階である。第XIIIa因子に触媒されるタンパク質架橋は、グルタミン(Gln)アミノ酸残基とリジン(Lys)アミノ酸残基との間に特異的な共有結合を形成することによって起こる。FnbAは、第XIIIa因子によって簡単にヒトフィブロネクチンおよびヒトフィブリンに架橋されえることが実証されている(非特許文献1)。したがって、FnbAで免疫化すると、FnbA
は、直ちにフィブロネクチンおよびフィブリンに対する共有結合的(不可逆的な)架橋を行う。この抗原とヒトタンパク質との不可逆的複合体の形成は、免疫反応を低下させる可能性、および阻害/中和活性を持たない抗体の産生をもたらす可能性が非常に高い。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Matsukaら,「Staphyloccoccus aureus Fibronectin−Binding Protein Serves as a Substrate for Coagulation Factor XIIIa:Evidence for Factor XIIIa−Catalyzed Covalent Cross−Linking to Fibronectin and Fibrin.」,Biochemistry,2003年,第42巻,p.14643−14652
【非特許文献2】Aeschlimann D.およびPaulsson M.,「Transglutaminases:Protein Cross−Linking Enzymes in Tissues and Body Fluids.」,Thrombosis and Haemostasis,1994年,第71巻,p.402−415
【非特許文献3】Gorman J.J.およびFolk J.E.「Structural features of glutamine substrates for transglutaminases:Specificities of human plasma factor XIIIa and guinea pig liver enzyme toward syntheticpeptides.」,J. Biol. Chem.,1981年,第256巻,p.2712−2715
【非特許文献4】Gorman J.J.およびFolk J.E.「Structural features of glutamine substrates for transglutaminases:Role of extended interactions in the specificity of human plasma factor XIIIa and guinea pig liver enzyme.」,J.Biol.Chem.,1984年,第259巻,9007−9010
【非特許文献5】Fesus L.,Metsis M.L.,Muszbek L.およびKoteliansky,V.E.,「Transglutaminasesensitive glutamine residues of human plasma fibronectin revealed by studying its proteolytic fragments.」,Eur.J.Biochem.,1986年,第154巻,p.371−374
【発明の概要】
【発明が解決しようとする課題】
【0006】
したがって、第XIIIa因子によって触媒されるヒトタンパク質との共有結合架橋に直接関与する、野生型のブドウ球菌フィブロネクチン結合タンパク質の内部にある特異的反応性アミノ酸残基(GlnおよびLys)を同定し、それらの残基を置換して、凝固第XIIIa因子に対する反応性が低く、フィブロネクチンおよびフィブリンへの架橋および不可逆的結合を効果的に阻害する改変型のFnbを作製する必要がある。
【課題を解決するための手段】
【0007】
(発明の要旨)
このように、本発明は、黄色ブドウ球菌(S.aureus)の単離された改変型フィブロネクチン結合タンパク質(Fnb)に関し、この改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミ
ノ酸の変異であり、この改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が野生型Fnbよりも低く、フィブロネクチンおよびフィブリンからなる群より選択される。1つの実施態様においては、これらのアミノ酸はアラニンに変異する。さらなる実施態様においては、単離された改変型FnbはFnbAまたはFnbBに由来する。
【0008】
また、本発明は、上記記載の改変型Fnbであって、その改変がアミノ酸Lys702の変異であるものにも関する。
【0009】
また、本発明は、上記記載の改変型Fnbであって、その改変が、以下に記載のタンパク質および黄色ブドウ球菌(S.aureus)株の残基からなる群より選択される少なくとも1つのアミノ酸の変異である改変型Fnbにも関する。
【0010】
【表1−1】

また、本発明は、黄色ブドウ球菌(S.aureus)の改変型フィブロネクチン結合タンパク質をコードする単離された核酸分子核酸分子にも関し、その改変は、黄色ブドウ球菌(S.aureus)株ATCC49525由来のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、ここでこの改変型フィブロネクチン結合タンパク質は、免疫原性を保持しており、かつ免疫原性組成物に取り込まれて脊椎動物に投与される場合、第XIII因子、第XIIIa因子または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低くなっており、そしてこのヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択される。
【0011】
また、本発明は、上記記載の単離された核酸分子であって、その改変がアミノ酸Lys702の変異である単離された核酸分子にも関する。
【0012】
また、本発明は、調節配列に作動できるように連結された、本明細書記載の単離核酸分子を含む核酸構築物にも関連する。
【0013】
また、本発明は、本明細書記載の核酸構築物を含む組み換え宿主細胞、および本明細書記載の黄色ブドウ球菌(S.aureus)の改変型フィブロネクチン結合タンパク質を産生する方法にも関し、この方法は、本発明の組み換え宿主細胞を、改変型フィブロネクチン結合タンパク質を発現させるために適した条件下で維持することを包含する。
【0014】
また、本発明は、黄色ブドウ球菌(S.aureus)に対する免疫応答を引き起こす免疫原性組成物を調製するために改変型フィブロネクチン結合タンパク質、またはそれを発現する組み換え宿主細胞を使用することにも関連する。
【0015】
さらに、本発明は、生理学的に受容可能なビヒクルと、黄色ブドウ球菌(S.aureus)の改変型フィブロネクチン結合タンパク質とを含む免疫原性組成物に関し、このFnbタンパク質は、免疫原性を保持しており、免疫原性組成物に取り込まれて脊椎動物に投与されると、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質(例えば、フィブロネクチンおよびフィブリン)と共有結合架橋する能力が、野生型Fnbよりも低くなっている。改変型Fnbは、後に脊椎動物が黄色ブドウ球菌(S.aureus)に感染する際に野生型Fnbがフィブロネクチンおよびフィブリンに結合することを促進しない。この改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異である。この免疫原性組成物はまた、アジュバントも含み得る。
【0016】
本発明は、また、生理学的に受容可能なビヒクル、および黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする核酸分子を含む免疫原性組成物にも関する。ここで、この改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、この改変型Fnbは免疫原性を保持しており、また、免疫原性組成物に取り込まれて脊椎動物に投与される場合、この改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質(フィブロネクチンおよびフィブリンからなる群より選択される)と共有結合架橋する能力が野生型Fnbよりも低く、かつ、後にこの脊椎動物が黄色ブドウ球菌(S.aureus)に感染する際に、野生型Fnbがフィブロネクチンおよびフィブリンに結合することを促進しない。
【0017】
また、本発明は、改変がアミノ酸Lys702の変異である、上記のような免疫原性組成物にも関連する。
【0018】
また、本発明は、黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法にも関連し、この方法は、生理学的に受容可能なビヒクル、および免疫学的に有効な量の黄色ブドウ球菌(S.aureus)改変型フィブロネクチン結合タンパク質を含む組成物を脊椎動物に投与する工程を包含し、ここでこの改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、この改変型フィブロネクチン結合タンパク質は、免疫原性を保持しており、かつ、免疫原性組成物に取り込まれて脊椎動物に投与されると、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質(例えば、フィブロネクチンおよびフィブリン)に共有結合架橋する能力が野生型Fnbよりも低く、また、後に脊椎動物が黄色ブドウ球菌(S.aureus)に感染する際に、野生型フィブロネクチン結合タンパク質がこのヒトタンパク質に結合することを促進しない。
【0019】
さらに、本発明は、生理学的に受容可能なビヒクル、および改変型黄色ブドウ球菌(S.aureus)フィブロネクチン結合タンパク質をコードする、免疫学的に有効な量の核酸分子を、場合によってはトランスフェクション促進因子とともに含む組成物を脊椎動物に投与する工程を包含する、黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法に関連し、この改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、この改変型フィブロネクチン結合タンパク質は、免疫原性を保持しており、かつ、免疫原性組成物に取り込まれて脊椎動物に投与される場合、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質(例えば、フィブロネクチンおよびフィブリン)に共有結合架橋する能力が野生型Fnbよりも低く、また、後に脊椎動物が黄色ブドウ球菌(S.aureus)に感染する際に、野生型フィブロネクチン結合タンパク質がこのヒトタンパク質に結合することを促進しない。
【0020】
一つの実施態様において、脊椎動物は血清反応陰性のヒトである。
【0021】
また、本発明は、上記したような免疫化の方法であって、改変がアミノ酸Lys702の変異である方法にも関連する。
本発明はまた、以下の項目を提供する。
(項目1)
黄色ブドウ球菌(Staphylococcal aureus(S.aureus))の単離された改変型フィブロネクチン結合タンパク質(Fnb)であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、ここで該改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合により架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択される、単離された改変型Fnb。
(項目2)
FnbAまたはFnbBに由来する、項目1に記載の単離された改変型Fnb。
(項目3)
上記変異がGln103に存在する、項目1に記載の単離された改変型Fnb。
(項目4)
上記変異が、グルタミンからアラニンへである、項目3に記載の単離された改変型Fnb。
(項目5)
上記変異がGln105に存在する、項目1に記載の単離された改変型Fnb。
(項目6)
上記変異がグルタミンからアラニンへである、項目5に記載の単離された改変型Fnb。
(項目7)
上記変異がLys157に存在する、項目1に記載の単離された改変型Fnb。
(項目8)
上記変異がリジンからアラニンへである、項目7に記載の単離された改変型Fnb。
(項目9)
上記変異がLys503に存在する、項目1に記載の単離された改変型Fnb。
(項目10)
上記変異がリジンからアラニンへである、項目9に記載の単離された改変型Fnb。
(項目11)
上記変異がLys620に存在する、項目1に記載の単離された改変型Fnb。
(項目12)
上記変異がリジンからアラニンへである、項目11に記載の単離された改変型Fnb。
(項目13)
上記変異がLys762に存在する、項目1に記載の単離された改変型Fnb。
(項目14)
上記変異がリジンからアラニンへである、項目13に記載の単離された改変型Fnb。
(項目15)
上記変異がGln783に存在する、項目1に記載の単離された改変型Fnb。
(項目16)
上記変異がグルタミンからアラニンへである、項目15に記載の単離された改変型Fnb。
(項目17)
上記変異がGln830に存在する、項目1に記載の単離された改変型Fnb。
(項目18)
上記変異がグルタミンからアラニンへである、項目17に記載の単離された改変型Fnb。
(項目19)
上記変異が、Gln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830の各残基に存在する、項目1に記載の単離された改変型Fnb。
(項目20)
Gln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830における各残基の変異が、Alaへの変異である、項目19に記載の単離された改変型Fnb。
(項目21)
Gln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830のいずれか1つの残基の変異が、Alaへの変異である、項目19に記載の単離された改変型Fnb。
(項目22)
生理学的に受容可能なキャリアと、黄色ブドウ球菌(S.aureus)の改変型フィブロネクチン結合タンパク質(Fnb)とを含む免疫原性組成物であって、該改変が、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、該免疫原性組成物に組み込まれて脊椎動物に投与される場合に、該改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、該改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、免疫原性組成物。
(項目23)
アジュバントをさらに含む、項目22に記載の免疫原性組成物。
(項目24)
黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法であって、該方法は、生理学的に受容可能なビヒクルおよび免疫学的に有効な量の単離された改変型黄色ブドウ球菌(S.aureus)Fnbを含む組成物を、該脊椎動物に投与する工程を包含し、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、かつ、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質に共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該単離された改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、方法。
(項目25)
脊椎動物がセロネガティブのヒトである、項目24に記載の方法。
(項目26)
上記改変が、黄色ブドウ球菌(S.aureus)株Mu50のFnbAのグルタミン(Gln)134、Gln136、リジン(Lys)188、Lys534、Lys651、Lys793、Gln814、およびGln861の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目27)
上記改変が、黄色ブドウ球菌(S.aureus)株N315のFnbAのグルタミン(Gln)134、Gln136、リジン(Lys)188、Lys534、Lys651、Lys793、Gln814、およびGln861の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目28)
上記改変が、黄色ブドウ球菌(S.aureus)株MW2のFnbAのグルタミン(Gln)139、Gln141、リジン(Lys)539、Lys656、Lys798、Lys819、およびGln866の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目29)
上記改変が、黄色ブドウ球菌(S.aureus)株MSSA−476のFnbAのグルタミン(Gln)147、Gln149、リジン(Lys)547、Lys664、Lys806、Gln827、およびGln874の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目30)
上記改変が、黄色ブドウ球菌(S.aureus)株COLのFnbAのグルタミン(Gln)139、Gln141、リジン(Lys)655、Lys797、およびGln865の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目31)
上記改変が、黄色ブドウ球菌(S.aureus)株8325−4のFnbAのグルタミン(Gln)139、Gln141、リジン(Lys)655、Lys797、およびGln865の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目32)
上記改変が、黄色ブドウ球菌(S.aureus)株EMRSA−16のFnbAのグルタミン(Gln)147、Gln149、リジン(Lys)549、Lys666、Gln791、およびGln838の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目33)
上記改変が、黄色ブドウ球菌(S.aureus)株Mu50のFnbBのグルタミン(Gln)111、リジン(Lys)602、Gln765、およびGln812の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目34)
上記改変が、黄色ブドウ球菌(S.aureus)株N315のFnbBのグルタミン(Gln)111、リジン(Lys)602、Gln765、およびGln812の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目35)
上記改変が、黄色ブドウ球菌(S.aureus)株MW2のFnbBのリジン(Lys)598、Lys740、およびグルタミン(Gln)808の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目36)
上記改変が、黄色ブドウ球菌(S.aureus)株MSSA−476のFnbBのリジン(Lys)598、Lys740、およびグルタミン(Gln)808の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目37)
上記改変が、黄色ブドウ球菌(S.aureus)株COLのFnbBのリジン(Lys)591、Lys733、およびグルタミン(Gln)801の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目38)
上記改変が、黄色ブドウ球菌(S.aureus)株8325−4のFnbBのリジン(Lys)591、Lys733、およびグルタミン(Gln)801の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目39)
黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする単離された核酸分子であって、該改変が、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択される、核酸分子。
(項目40)
制御配列に制御可能に連結された項目39に記載の単離された核酸分子を含む、発現ベクター。
(項目41)
項目40に記載の発現ベクターを含む、組み換え宿主細胞。
(項目42)
改変型Fnbを産生する方法であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質となるヒトタンパク質に共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、該方法は、項目41に記載の組み換え宿主細胞を、改変型Fnbの発現に適した条件下で維持する工程を包含する、方法。
(項目43)
生理学的に受容可能なビヒクルと、黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする単離核酸分子とを含む免疫原性組成物であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、該改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、免疫原性組成物。
(項目44)
形質転換促進剤をさらに含む、項目43に記載の免疫原性組成物。
(項目45)
脊椎動物において免疫応答を誘導する方法であって、該方法は、該脊椎動物に項目43に記載の免疫原性組成物を、免疫応答を誘導するのに有効な量投与する工程を包含する、方法。
(項目46)
黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法であって、該方法は、生理学的に受容可能なキャリアと、免疫学的に有効な量の黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする核酸分子とを含む組成物を、該脊椎動物に投与する工程を包含し、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、かつ、免疫原性組成物に取り込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質に共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該改変型Fnbが、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、方法。
(項目47)
上記脊椎動物がセロネガティブのヒトである、項目46に記載の方法。
(項目48)
黄色ブドウ球菌(Staphylococcal aureus(S.aureus))の単離された改変型フィブロネクチン結合タンパク質(Fnb)であって、該改変が、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbが、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択される、単離された改変型Fnb。
(項目49)
上記変異がLys702に存在する、項目48に記載の単離された改変型Fnb。
(項目50)
上記変異がリジンからアラニンへである、項目49に記載の単離された改変型Fnb。
(項目51)
上記変異が、Gln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830の各残基に存在する、項目48に記載の単離された改変型Fnb。
(項目52)
Gln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830の各残基の変異がAlaへの変異である、項目51に記載の単離された改変型Fnb。
(項目53)
Gln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830のいずれか1つの残基の変異がAlaへの変異である、項目48に記載の単離された改変型Fnb。
(項目54)
生理学的に受容可能なビヒクルと、黄色ブドウ球菌(S.aureus)の単離された改変型フィブロネクチン結合タンパク質(Fnb)とを含む免疫原性組成物であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、免疫原性組成物に取り込まれて脊椎動物に投与される場合に、該改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、免疫原性組成物。
(項目55)
さらにアジュバントを含む、項目54に記載の免疫原性組成物。
(項目56)
黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法であって、該方法は、生理学的に受容可能なキャリアと、免疫学的に有効な量の黄色ブドウ球菌(S.aureus)の単離された改変型Fnbとを含む組成物を該脊椎動物に投与する工程を包含し、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質に共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、該単離された改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染する際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、方法。
(項目57)
上記脊椎動物がセロネガティブのヒトである、項目56に記載の方法。
(項目58)
黄色ブドウ球菌(S.aureus)の改変型フィブロネクチン結合タンパク質をコードする単離された核酸分子であって、該改変が、黄色ブドウ球菌(S.aureus)株ATCC49525由来のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択される、核酸分子。
(項目59)
制御配列に操作可能に連結された項目58に記載の単離された核酸分子を含む、発現ベクター。
(項目60)
項目59に記載の発現ベクターを含む、組み換え宿主細胞。
(項目61)
改変型Fnbを産生する方法であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質に共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、該方法は、項目60に記載の組み換え宿主細胞を、該改変型Fnbの発現に適した条件下で維持する工程を包含する、方法。
(項目62)
生理学的に受容可能なビヒクルと、黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする単離核酸分子とを含む免疫原性組成物であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与されると、該改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、免疫原性組成物。
(項目63)
形質転換促進剤をさらに含む、項目62に記載の免疫原性組成物。
(項目64)
脊椎動物において免疫応答を誘導する方法であって、該方法は、該脊椎動物に項目62に記載の免疫原性組成物を、免疫応答を誘導するのに有効な量投与する工程を包含する、方法。
(項目65)
黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法であって、該方法は、生理学的に受容可能なビヒクルと、免疫学的に有効な量の黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする核酸分子とを含む組成物を、該脊椎動物に投与する工程を包含し、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質に共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、方法。
(項目66)
上記脊椎動物がセロネガティブのヒトである、項目65に記載の方法。
【図面の簡単な説明】
【0022】
【図1】図1は、第XIIIa因子触媒によるダンシルカダベリンプローブ(パネルAおよびC)およびダンシル−PGGQQIVプローブ(パネルBおよびD)のrFnbAへの取り込みを示す。修飾反応を4時間および18時間行った。4時間(レーン1)および18時間(レーン3)にわたって修飾された未反応のプローブを除去した後、rFnbAサンプルをSDS−PAGEによって分析した。あるいは、4時間および18時間にわたって修飾されたrFnbAサンプルを、トロンビンによりタンパク質限定分解供してから、SDS−PAGEにより分析した(レーン2および4)。電気泳動後、紫外光下でゲルを撮影し(パネルCおよびD)、その後クーマシーブリリアントブルーで染色した(パネルAおよびB)。矢印は、プローブ修飾されたrFnbA、およびトロンビンによって生成したそのフラグメントの位置を示している。各パネルの第5レーンは、表示されている通りの分子量標準を含む。
【図2】図2は、第XIIIa因子で修飾されたrFnbAのトリプシン分解物からの、ダンシルカダベリンで標識されたペプチドのHPLC分離を示す。第XIIIa因子触媒によるrFnbAへのダンシルカダベリンの取り込みを、4時間(パネルAおよびB)および18時間(パネルCおよびD)行った。ダンシルカダベリンで標識されたrFnbA調製物をトリプシンで分解し、ペプチドをAquapore RP−300 C8逆相カラム上で分離した。溶出液を210nmの吸光度および550nmの蛍光によりモニタリングした。蛍光ピークの1(パネルBおよびD)、2、および3(パネルD)を回収して、2回目の逆相クロマトグラフィーを行った後、NH2−末端配列分析および質量スペクトル解析に供した。
【図3】図3は、第XIIIa因子で修飾されたrFnbAのGlu−Cプロテアーゼ分解物からの、ダンシルカダベリンで標識されたペプチドのHPLC分離を示す。第XIIIa因子触媒によるrFnbAへのダンシルカダベリンの取り込みを、4時間(パネルAおよびB)および18時間(パネルCおよびD)行った。ダンシルカダベリンで標識されたrFnbA調製物をGlu−Cプロテアーゼで分解し、ペプチドをAquapore RP−300 C8逆相カラム上で分離した。溶出液を210nmの吸光度および550nmの蛍光によりモニタリングした。蛍光ピークの1(パネルBおよびD)、2、3、4、5、6、および7(パネルD)を回収して、2回目の逆相クロマトグラフィーを行った後、NH2−末端配列分析および質量スペクトル分析に供した。
【図4】図4は、第XIIIa因子で修飾されたrFnbAのGlu−Cプロテアーゼ分解物からの、ダンシル−PGGQQIVで標識されたペプチドのHPLC分離を示す。第XIIIa因子触媒によるrFnbAへのダンシル−PGGQQIVの取り込みは、4時間(パネルAおよびB)および18時間(パネルCおよびD)行った。ダンシル−PGGQQIVで標識されたrFnbA調製物をGlu−Cプロテアーゼで分解し、ペプチドをAquapore RP−300 C8逆相カラム上で分離した。溶出液を210nmの吸光度および550nmの蛍光によりモニタリングした。アスタリスクで示された蛍光ピーク(パネルBおよびD)およびピーク1、2、3、4、5、6、および7(パネルD)を回収して、2回目の逆相クロマトグラフィーを行った後、NH2−末端配列分析および質量スペクトル解析に供した。
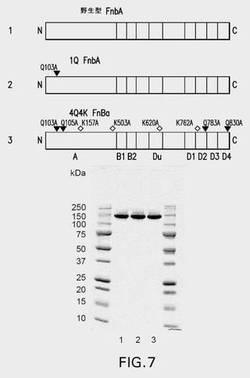
【図5】図5は、野生型FnbAのアミノ酸配列内における第XIIIa因子反応性のGln残基およびLys残基の位置を示している。これは、本研究で使用した黄色ブドウ球菌(S.aureus)株ATCC49525のrFnbA(Ala1〜Pro839残基)の構造的構成の概要図(上図)およびそのアミノ酸配列(下図)(配列番号1)である。図5には以下の主な領域の位置が示されている:A−フィブリノゲン結合領域;機能不明のB1−相同反復配列およびB2−相同反復配列;Du、D1、D2、D3、およびD4−フィブロネクチン結合反復配列。矢印は、FnbAのA、Du、D2、およびD4領域内にある、第XIIIa因子反応性Gln残基(103、105、783、および830)およびLys残基(157、503、620、および762)の位置を示す。太字は、FnbAの一次配列における同一の第XIIIa因子反応性のGln残基およびLys残基を表している。下線を引いた文字は、トロンビン分断推定部位Arg202−Gly203の位置を示している。
【図6A】図6は、さまざまな黄色ブドウ球菌(S.aureus)株のFnbAおよびFnbBの分子種のアミノ酸配列のアラインメントを示す(配列番号1〜配列番号14)。第XIIIa因子反応性のGln残基およびLys残基の周辺領域を示す。一番上で特定されている反応性のGln残基およびLys残基の位置は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAでの位置に対応している。FnbA種およびFnbB種の一次配列中の太字は、第XIIIa因子反応性のGln受容体およびLys供与体の保存された部位を強調している。CLUSTAL W(1.81)プログラムを用いた多重配列アラインメントを行った。
【図6B】図6は、さまざまな黄色ブドウ球菌(S.aureus)株のFnbAおよびFnbBの分子種のアミノ酸配列のアラインメントを示す(配列番号1〜配列番号14)。第XIIIa因子反応性のGln残基およびLys残基の周辺領域を示す。一番上で特定されている反応性のGln残基およびLys残基の位置は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAでの位置に対応している。FnbA種およびFnbB種の一次配列中の太字は、第XIIIa因子反応性のGln受容体およびLys供与体の保存された部位を強調している。CLUSTAL W(1.81)プログラムを用いた多重配列アラインメントを行った。
【図7】図7は、本研究で使用した野生型および変異型のFnbA種の略図(上図)と、単離されたタンパク質のSDS−PAGE解析(下図)とを示す。この図は、黄色ブドウ球菌(S.aureus)株ATCC49525由来のFnbA中の以下の主な領域の位置が示されている:A−フィブリン(フィブリノゲン)結合領域;機能不明のB1−相同反復配列およびB2−相同反復配列;ならびにDu、D1、D2、D3、およびD4−フィブロネクチン結合反復配列。反応性Gln残基および導入されたGln→Ala変異の位置を黒い三角形で示し、一方、反応性Lys残基および導入されたLys→Ala変異の位置を白いひし形で示す。FnbA種の略図、および精製タンパク質のSDS−PAGE(4〜20%ゲル)解析を以下の順に示す:1−野生型FnbA;2−1Q FnbA変異型;3−4Q4K FnbA変異型。ゲルの外側のレーンは、図示されているとおりの分子量標準を含む。
【図8】図8は、第XIIIa因子触媒によるダンシルカダベリン(A)およびダンシル−PGGQQIVプローブ(B)の野生型および変異型のFnbAへの取り込みを示す。ダンシルカダベリンの取り込みは、20mMのTris、pH7.4、150mMのNaCl、5mMのDTT、5mMのCaCl2の中で行われたが、ダンシル−PGGQQIVの取り込みは、20mMのTris、pH8.5、15mMのNaCl、5mMのDTT、5mMのCaCl2の中で行われた。対照反応も、2mMのEDTAを含む同じバッファー内で行った。指定された時点でアリコートを取り出し、SDSと混合し、加熱して、SDS−PAGEにより4〜20勾配ゲル上で解析した。60分(A)および120分(B)後に対照反応から取り出されたアリコートにアスタリスクで印をつけた。電気泳動後、紫外光下でゲルを撮影し(パネルAおよびB、下図)、その後クーマシーブリリアントブルーで染色した(パネルAおよびB、上図)。ゲルの外側のレーンは、図示されているとおりの分子量標準を含む。
【図9A】図9は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブリンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、3〜8%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブリノゲンα鎖抗体(C)による免疫染色を行った。矢印は、FnbA、およびフィブリンのα鎖、β鎖、γ鎖、ならびにフィブリンの架橋したγγ鎖の位置を示す。FnbAおよびフィブリンα鎖の間の主な高移動性架橋産物をaと名づけ、架橋産物の低移動性産物をb、c、およびdとして図示している。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、50kDa、および37kDa。
【図9B】図9は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブリンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、3〜8%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブリノゲンα鎖抗体(C)による免疫染色を行った。矢印は、FnbA、およびフィブリンのα鎖、β鎖、γ鎖、ならびにフィブリンの架橋したγγ鎖の位置を示す。FnbAおよびフィブリンα鎖の間の主な高移動性架橋産物をaと名づけ、架橋産物の低移動性産物をb、c、およびdとして図示している。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、50kDa、および37kDa。
【図9C】図9は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブリンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、3〜8%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブリノゲンα鎖抗体(C)による免疫染色を行った。矢印は、FnbA、およびフィブリンのα鎖、β鎖、γ鎖、ならびにフィブリンの架橋したγγ鎖の位置を示す。FnbAおよびフィブリンα鎖の間の主な高移動性架橋産物をaと名づけ、架橋産物の低移動性産物をb、c、およびdとして図示している。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、50kDa、および37kDa。
【図10】図10は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブリンのα鎖への架橋速度を示す。残存する単量体(未架橋)の野生型FnbA(黒丸)、1Q FnbA(白丸)、および4Q4K FnbA(黒三角)の量を、「材料と方法」に記載されるようにアッセイして、時間の関数としてプロットした。
【図11A】図11は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブロネクチンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、4〜20%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブロネクチン抗体(C)による免疫染色を行った。矢印は、FnbAおよびフィブロネクチンの位置を示す。FnbAとフィブロネクチンとの間の架橋産物はa、b、c、およびdとして示されている。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、および50kDa。
【図11B】図11は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブロネクチンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、4〜20%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブロネクチン抗体(C)による免疫染色を行った。矢印は、FnbAおよびフィブロネクチンの位置を示す。FnbAとフィブロネクチンとの間の架橋産物はa、b、c、およびdとして示されている。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、および50kDa。
【図11C】図11は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブロネクチンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、4〜20%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブロネクチン抗体(C)による免疫染色を行った。矢印は、FnbAおよびフィブロネクチンの位置を示す。FnbAとフィブロネクチンとの間の架橋産物はa、b、c、およびdとして示されている。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、および50kDa。
【図12】図12は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブロネクチンへの架橋速度を示す。残存する単量体(未架橋)の野生型FnbA(黒丸)、1Q FnbA(白丸)、および4Q4K FnbA(黒三角)の量を、「材料と方法」に記載されるようにアッセイして、時間の関数としてプロットした。
【図13】図13は、第XIIIa因子により修飾された野生型FnbAのGlu−Cプロテアーゼ分解物からの単離されたダンシル−PGGQQIV標識ペプチド(蛍光ピーク3(Andersonら、2004))のMALDI−TOF質量スペクトルを示す。
【図14】図14は、さまざまな黄色ブドウ球菌(S.aureus)株由来のFnbA種およびFnbB種のアミノ酸配列のアラインメントを示す。第XIIIa因子反応性Lys702の周辺領域を示す。一番上で特定されている反応性Lys残基の位置は、黄色ブドウ球菌(S.aureus)株ATCC49525由来のFnbAでの位置に対応している。CLUSTAL W(1.81)プログラムを用いて多重配列アラインメントを行った(Thompson,et al.1994)。
【発明を実施するための形態】
【0023】
(発明の詳細な説明)
FnbAは、第XIIIa因子のトランスグルタミナーゼ作用によって、フィブロネクチンまたはフィブリンに共有結合架橋しており、レセプター−リガンドのホモポリマーまたはヘテロポリマーの形成をもたらす。凝固第XIIIa因子または血漿トランスグルタミナーゼ(EC2.3.2.13)は、分子間ε−(γ−グルタミル)リジンのイソペプチド結合の形成を介して、特異的なタンパク質基質の共有結合架橋を触媒する酵素のトランスアミダーゼという分類級に属する。架橋は、グルタミンのγカルボキシアミド基がアシル供与体(アミン受容体)として働き、リジンのε−アミノ基がアシル受容体(アミン供与体)として働くアシル転移反応を介して起きる(Henschen and McDonagh 1986;Lorand 2001)。
【0024】
第XIII因子は、2つの触媒Aサブユニットと2つの調節Bサブユニットとからなる非活性型テトラマー前駆体A2B2として血液中を循環している。トロンビンに曝露された後、第XIII因子チモーゲンはCa2+依存型の活性化を受けて第XIIIa因子(活性化された第XIII因子:Factor XIII activated)となり、その後フィブリン塊とγ鎖との間、およびフィブリン塊とα鎖との間における共有結合架橋の形成を触媒する。この反応は、血液凝固カスケードの最終事象に相当し、正常な止血に必須のものである。また、第XIIIa因子は、同様のメカニズムによって、いくつか異なるヒトタンパク質をフィブリン塊の中に共有結合的に取り込むことにも関与している。表1参照。それらの中には、血塊への架橋が創傷治癒および線維素溶解に重要な役割を果たす、フィブロネクチンおよびα2−抗プラスミンがある。
【0025】
第XIIIa因子により触媒されるタンパク質−タンパク質の架橋反応は2段階のプロセスを示す。まず、タンパク質同士が互いに特異的に結合して可逆的(非共有結合的)複合体を形成し、次に、第XIIIa因子によって共有結合的に架橋される。通常、第XIIIa因子によって触媒されるタンパク質の架橋は、多くの生理学的反応において重要な役割を果たすさまざまな融合型のホモ重合体構造およびヘテロ重合体構造を生み出す(Lorand and Graham 2003)。黄色ブドウ球菌(S.aureus)がヒトの細胞外マトリックス(ECM)分子に接着するためにトランスグルタミナーゼ活性を利用できるという最近の知見(Matsukaら, 2003)は、タンパク質架橋が、細菌感染に伴う病理反応に関与することを示す。
【0026】
ほとんどの黄色ブドウ球菌(S.aureus)株は、異なってはいるが非常に近縁の2つの遺伝子によってコードされている、1つ(FnbA)または2つ(FnbAおよびFnbB)のフィブロネクチン結合タンパク質を発現する(Signas,Raucciら,1989;Jonsson,Signasら,1991)。成熟型フィブロネクチン結合タンパク質のNH2末端領域は、レセプターのフィブリノゲン/フィブリン結合活性に関与する、約500残基長のA領域によって形成されている。FnbAのA領域は、このタンパク質のFnbB型には存在しない、機能未知の30残基長の反復配列であるB1−B2二重コピーを含む。フィブロネクチン結合タンパク質のCOOH末端領域は、レセプターのフィブロネクチン結合領域を形成するDu、D1、D2、D3、およびD4という、5つの約40残基長の保存的反復配列を含む。フィブロネクチン結合タンパク質のCOOH末端領域は、ソルターゼ(sortase)のトランスペプチダーゼ活性により細胞壁ペプチドグリカンに共有結合的に結合している(Schneewind,Fowlerら,1995)。フィブロネクチンまたはフィブリンに対するFnbAの可逆的結合が、効率的な分子間共有結合架橋には必須である。FnbAのフィブロネクチンまたはフィブリンとの結合は、その後第XIIIa因子によって架橋される供与体リジン残基と受容体グルタミン残基とを適当に配置させる。また、第XIIIa因子は、ペプチドに結合した反応性グルタミン残基のγ−カルボキサミド基と、さまざまな一級アミン(例えば、プトレシン一級アミン、スペルミジン一級アミン、およびカダベリン一級アミン)のアミノ基との間のイソペプチド結合の形成も触媒する(Lorand,Ruleら,1968;Lorand,Siefringら,1979)。別のアミン供与体の取り込みは、タンパク質架橋を阻害し、受容体タンパク質において関与グルタミン残基の酵素指向性で部位特異的な標識をもたらす(Lorand,2001)。同様に、反応性グルタミン残基を含む、フィブロネクチンまたはα2−抗プラスミンのN末端配列を模倣したペプチドを利用することによって、供与体タンパク質中の関与リジン残基の特異的標識が達成され得る(Parameswaran,Velascoら,1990;Lorand,Parameswaranら,1992;SobelおよびGawinowicz,1996)。最近になって、第XIIIa因子存在下で、ブドウ球菌rFnbAが、アミン供与体である合成プローブのダンシルカダベリンと、アミン受容体プローブとして作用する、フィブロネクチンのN末端配列を模倣したダンシル化ペプチドとによって修飾され得ることが分かった(Matsukaら,2003)。
【0027】
本願発明において、ブドウ球菌FnbAの中にヒト凝固第XIIIa因子または組織トランスグルタミナーゼにより標的化される反応性のGln残基とLys残基とがあることが同定されている。これは、細菌のタンパク質において第XIIIa因子反応性のアミン受容体および供与体の部位が局在することに関する最初の報告である。蛍光性リジンアナログであるダンシルカダベリンを用いて、第XIIIa因子反応性グルタミンの部位特異的標識を行った(Lorand,Ruleら,1968;Lorand,Siefringら,1979)。第XIIIa因子は、rFnbAレセプターに存在する48個のGln残基のうち4個とだけ反応した。FnbAをダンシルカダベリンおよび凝固第XIIIa因子とともにインキュベートする場合、Gln103、Gln105、Gln783、およびGln830残基が、FnbAにおいてアミン受容体部位として働く。Gln103のダンシルカダベリン修飾の速度および程度は、Gln105、Gln783、およびGln830のそれよりも有意に大きかった(図2、B、Dおよび図3、B、D)が、これは、Gln103が主要なアミン受容体部位として作用することを示唆している。反応性残基Gln103およびGln105は、FnbAレセプターのNH2末端のA領域の内部に位置する(図5)が、Gln783およびGln830残基は、この分子のCOOH末端部分に位置し、それぞれD1反復配列およびD4反復配列に属している。Gln103をFnbAの主要なアミン受容体部位として同定することは、タンパク質限定分解実験の結果と整合する。ダンシルカダベリン修飾されたrFnbAのトロンビンによる切断は低分子量のNH2末端フラグメントの遊離をもたらすが、主要なGln103受容体部位が存在することに起因して、UV照射の際に高い強度の蛍光を示した。COOH末端側フラグメントに相当し、副次的なGln783部位とGln830部位とを含む高分子量バンド(図5)は、小さな発光シグナルを生じた(図1AおよびC)。このように、ダンシルカダベリン修飾されたrFnbAについて得られたタンパク質限定分解およびSDS−PAGEのデータは、同定された受容体部位のさまざまな程度の反応性を示唆する別の一連の証拠を提示した。SDS−PAGE解析において、トロンビン生成されたrFnbAフラグメントと、親rFnbAとは、予想したよりも低い電気泳動移動度を示した。たぶん、これは、SDSの結合能力が低下するために電気泳動移動度が低くなることが知られている荷電残基のFnbAにおける高い含有率によって生じる。rFnbA試料を質量スペクトル解析に供したところ、その実験的に測定された分子量値は、計算された値と本質的には区別できなかった。
【0028】
反応性グルタミン残基を含む、フィブロネクチンのNH2末端配列を模倣したダンシル−PGGQQIVペプチドプローブを、第XIIIa因子反応性リジン残基を標識するために利用した(Parameswaran,Velascoら,1990;Lorand,Parameswaranら,1992)。標識処理は、rFnbA内部にある56個の潜在的リジン供与体残基のうち4個がペプチドプローブを取り込むことを明らかにした。これらの残基はLys157、Lys503、Lys620、およびLys762である。同定された第XIIIa因子反応性のリジン部位は、フィブリン(フィブリノゲン)結合領域Aと、フィブロネクチン結合D反復配列との間に分布している。Lys157は、A領域のNH2末端部分内に位置するが、Lys503は、B1B2反復配列に隣接するそのCOOH末端セグメントに位置する。フィブロネクチン結合DuおよびD2反復配列は、それぞれ、第XIIIa因子反応性のLys620部位およびLys762部位を含む(図5)。興味深いことに、反応性Lys157がNH2末端に位置するのにもかかわらず、ダンシル−PGGQQIVによって修飾されたrFnbAをトロンビンで切断しても、蛍光性の低分子量フラグメントを生じなかった(図1D、レーン2および4)。クーマシーブリリアントブルーによってゲルを染色しても、低分子量フラグメントを検出することができなかった(図1B、レーン2および4)。これらの観察結果は、Lys157のダンシル−PGGQQIVプローブでの修飾は、FnbAのNH2末端領域のトロンビン攻撃に対するより高い感受性を誘導し得、SDS−PAGEでは検出できない小さなペプチドの生成をもたらし得ることを示している。
【0029】
全体的に見ると、同定された反応性Gln受容体残基およびLys供与体残基はすべて、フィブリン(フィブリノゲン)結合部位およびフィブロネクチン結合部位を形成する、FnbAのNH2末端領域およびCOOHの末端領域にかたまって存在する傾向をもつ。しかし、ピーク2(図2D)、ピーク2、3、5(図3D)、およびピーク3(図4D)に相当するペプチドを含む蛍光トレーサーが明確には同定されなかったため、ブドウ球菌FnbAレセプター内のさらなるGln受容体残基およびLys供与体残基の存在を排除できない。それにもかかわらず、部位特異的な標識によって、第XIIIa因子に触媒される、FnbAと、フィブロネクチン、フィブリン、および、場合によっては他のヒト宿主タンパク質との架橋反応に関与する反応性のGln残基およびLys残基の正確な位置を決めることが可能になる。配列決定において、いくつかのピークが、各サイクルにおいて1つよりも多い残基を生じ、HPLC画分が不均一であることを示した。これら試料の不均質性は、質量スペクトル解析の結果からも明らかであった。各サイクルにおける残基の、FnbAの既知の配列、およびトリプシンまたはGlu−Cプロテイナーゼによって生じる予測された切断部位をもつ利用可能なマップに対する比較は、個々の配列のほとんどの同定を可能にした。本研究におけるNH2末端配列解析の結果は、予測されたプローブ修飾ペプチドに対応するシグナルの存在を示した質量スペクトルデータと常に相関していた。
【0030】
今までのところ、凝固第XIIIa因子に対し1ダースそこそこのタンパク質基質が同定されているにすぎない。第XIIIa因子に対する既知のグルタミン含有基質には、配列相同性がほとんどないため、反応性を予測することは不可能ではないにしても困難である。同定された反応性グルタミンは、大抵、溶媒露出表面領域または可動的伸長部(flexible extensions)に位置している(Cottrell,Strongら,1979;McDonagh,McDonaghら,1981;Matsuka,Medvedら,1996)。理論に捉われることなく言えば、タンパク質の一次構造と立体構造の両方が、グルタミン残基が反応性であるか否かを決定することができると考えられる。これらの観察結果は、本明細書においてブドウ球菌FnbAレセプターについて示したデータと整合している。
【0031】
反応性のGln783受容体部位およびGln830受容体部位は、いくつかの報告によれば、コンパクトな構造を持たず、どちらかといえば折り畳まれていない状態で存在するD2およびD4のフィブロネクチン結合反復配列の中に存在する(House−Pompeo,Xuら,1996;Penkett,Redfieldら,1997;Penkett,Redfieldら,1998)。反応性のGln103部位およびGln105部位は、タンパク質分解に対して感受性があるとみられ、そのため、秩序ある構造を欠くことがここでも示され得るFnbAのNH2末端領域の中に位置する。タンパク質におけるアミン供与体であるリジン残基に対する第XIIIa因子の選択性もまた、十分に理解されてはいない。第XIIIa因子は、リジン残基に対する選択性がグルタミン残基に対するよりも低いという一般概念にもかかわらず、限られた数のアミン供与体部位だけが、特定のタンパク質−タンパク質架橋反応に関与することができ、ペプチドプローブによる修飾を受けることができる。第XIIIa因子は、タンパク質基質において、広範ではあるが、アミン供与体であるリジンの前にある残基に関して明らかに異なる寛容を示すことが示された。第XIIIa因子または組織トランスグルタミナーゼに対するタンパク質基質の解析は、アミン供与体部位の直前にある残基は、非荷電性残基、および塩基性で極性の残基、ならびに低分子の脂肪族残基を含むことを明らかにした(Grootjans,Groenenら,1995)。本明細書で開示されているブドウ球菌FnbAレセプターに関するデータは、さらにこれらの観察結果を裏付けている。4つの同定された第XIIIa因子反応性リジンにおいては、Lys157の前はValであり、Lys503の前はAlaであり、また、Lys620の前はThrである。唯一の例外は、GluがLys762の前にあることである(図5)。
【0032】
同定された第XIIIa因子反応部位が、異なったブドウ球菌株に由来する他のフィブロネクチン結合タンパク質の間で保存されているか否かを調べるために、多重配列アラインメントを用いてそれらのアミノ酸配列を解析した。ブドウ球菌(S.aures)株ATCC49525のFnbAのアミノ酸配列(配列番号1)を、以下の菌株のFnbAおよびFnbBの配列と比較した:菌株8325−4(配列番号7および配列番号14)(Signas,Rauciら,1989;Jonsson,Signasら,1991)、MW2(配列番号4および配列番号11)(Baba,Takeuchiら,2002)、EMRSA−16(配列番号8)、MSSA−476(配列番号5および配列番号12)、COL(配列番号6および配列番号13)、Mu50(配列番号2および配列番号9)、およびN315(配列番号3および配列番号10)(Kuroda,Ohta,ら,2001)。菌株EMRSA−16およびMSSA−476のFnbAおよびFnbBのアミノ酸配列は、Wellcome Trust Sanger Instituteから入手した。ブドウ球菌COLの配列は、Institute for Genomic Researchから入手した。多重配列アラインメントは、CLUSTAL W(1.81)プログラムを用いて実施した(Thompson, Higginsら,1994)。
【0033】
図6は、ブドウ球菌(S.aures)株ATCC49525のFnbAにおいて同定された反応性のGln残基およびLys残基の周辺領域のアミノ酸配列アラインメントを示している。多重アラインメントは、反応性のGln103、Gln105、Gln830、およびLys620という残基が、すべての解析されたFnbA配列においては保存されていることを明らかにした。菌株MW2、MSSA−476、COL、8325−4、およびEMRSA−16のFnbAでは、反応性Lys157がThr残基で置換されている。菌株のCOLおよび8325−4では、反応性Lys503がAsn残基で置換されている。EMRSA−16株のFnbA配列では、反応性Lys762を含むポリペプチド鎖のセグメントが失われており、COL株および8325−4株では、反応性Gln783がHisに置換されている(図6)。この観察結果は、第XIIIa因子のトランスグルタミナーゼ作用に対するさまざまなブドウ球菌(S.aures)株のFnbAの反応性は異なり得ることを示している。
【0034】
また、第XIIIa因子反応性の受容体部位および供与体部位は、レセプターのFnbBファミリー内ではあまり保存されていないように見える。解析されたFnbB配列はいずれも、反応性のGln103、Lys157、およびLys503を有しておらず、一方、Mu50株およびN315株ではLys762が失われている。菌株MW2、MSSA−476、COL、および8325−4のFnbB配列では、反応性のGln105およびGln783は保存されていない。同定された第XIIIa因子反応性部位のすべての中で、Lys620残基およびGln830残基のみが高度に保存されており、解析したすべてのFnbA配列およびFnbB配列に存在する(図6)。
【0035】
興味深いことに、FnbAを第XIIIa因子で処理すると、保存されている反応性Lys620残基は一貫してダンシル−PGGQQIVプローブに対して最も高い反応性を示した(図4Bのピーク*、および図4Dのピーク5、表3)。これは、さらに、620位におけるLys供与体部位の生理学的な重要性を示している。主要なGln103受容体部位が、Lys157およびLys503の供与体部位とともに、すべての調べられたFnbB配列に存在しないという事実は、フィブロネクチン結合タンパク質のB型が、第XIIIa因子に触媒される架橋反応においてあまり顕著な役割を果たしていないことを示唆している。また、これらの違いは、フィブロネクチン結合タンパク質のA型およびB型が、それらのヒト宿主タンパク質の架橋相手に対して異なった選択性を示すことを示している。
【0036】
ブドウ球菌FnbAレセプター以外、現在知られているすべての第XIIIa因子のタンパク質基質は、血液凝固、線維素溶解、細胞外マトリックスの集合、および創傷治癒反応に関与している。黄色ブドウ球菌(S.aureus)FnbAが、第XIIIa因子の二機能性基質として作用し、フィブロネクチンまたはフィブリンに架橋されるという本発明者らの発見(Matsukaら,2003)は、凝固第XIIIa因子も、分子生物学的病原機構において重要な役割を果たしていることを示唆している。病原性黄色ブドウ球菌(S.aureus)がヒト宿主分子に共有結合するために第XIIIa因子のトランスグルタミナーゼ活性を利用可能である、黄色ブドウ球菌(S.aureus)の能力が、組織損傷において非常に高い効率での細菌コロニー形成を説明する。損傷後、血塊の形成は、血管を完全な状態に戻すため、および創傷修復を開始するための一時的なマトリックスを提供するために役立つ(Mosesson 1992)。血塊の主なタンパク質成分であるフィブリンおよび血漿フィブロネクチンは、これらの機能に不可欠である。フィブリンおよびフィブロネクチンは、どちらも黄色ブドウ球菌(S.aureus)の表面結合型FnbAレセプターに対するリガンドとして作用するため、細菌の創傷部位への結合に関与する。血塊が成熟するにつれて、凝固第XIIIa因子は、フィブリン分子間、ならびにフィブリンとフィブロネクチンとの間における分子間架橋の触媒を開始する。フィブリン分子間における共有結合架橋は、血塊の構造的安定性を高める(HenschenおよびMcDonagh 1986)が、フィブロネクチンのフィブリンへの架橋は、創傷治癒過程に必要とされる細胞接着および細胞移動という事象にとって重要である(Grinnel,Feldら,1980;Knox,Crooksら,1986;Corbett,Leeら,1997)。この段階でフィブリンまたはフィブロネクチンに可逆的に結合しているブドウ球菌FnbAレセプターは、第XIIIa因子によってそのリガンドに共有結合架橋され得る。FnbAを共有結合によってフィブリンまたはフィブロネクチンに取り込むと、ブドウ球菌のコロニー形成および感染成立の確率が増加する。それは、また、フィブリン−フィブリンおよびフィブリン−フィブロネクチンの架橋反応とも競合する(Matsuka,Medvedら,1994;Matsuka,Miglioriniら,1997)(Matsukaら,2003)ため、血塊の構造的完全性に影響を与え、創傷治癒反応を阻害する。第XIIIa因子が触媒するブドウ球菌FnbAのヒト細胞外マトリックスタンパク質への架橋のこのような影響は、FnbAレセプターの分子進化に対する原動力として寄与し得、その結果、ついには新しく有用な性質を獲得する可能性が最も高い。第XIIIa因子に対するFnbAの進化した反応性は、宿主のコロニー形成において顕著な利益を与え、そのため、黄色ブドウ球菌(S.aureus)の生存率に対してプラスの影響を与えてきた。
【0037】
本明細書記載の第XIIIa因子触媒による共有結合架橋反応に直接関与する野生型ブドウ球菌FnbAの中で反応性アミノ酸残基(GlnおよびLys)を同定することに加え、本発明は、黄色ブドウ球菌(S.aureus)感染後、フィブロネクチンおよびフィブリンに共有結合架橋する能力が野生型Fnbよりも低い、Fnbに由来するタンパク質の合成に関係する。具体的には、本明細書に記載した研究は、改変されたフィブロネクチン結合性のタンパク質またはポリペプチドを含む、タンパク質および/またはポリペプチドを調製する組成物および方法を目的とし、これは、免疫原性組成物製剤(多価免疫原組成物を含む)における免疫原として使用することができ、能動的免疫化に使用することができる。この方法は、Fnb配列における1個以上のアミノ酸を改変して、後に黄色ブドウ球菌(S.aureus)に感染した際に野生型Fnbがフィブロネクチンおよびフィブリンに結合することを促進させることなくして免疫原性であるFnbに由来するタンパク質またはポリペプチドを生じさせることを含む。本明細書において同定されている2つ、3つ、またはそれ以上のアミノ酸残基の変異は本発明の範囲に含まれる。
【0038】
Fnbの野生型(天然型)のヌクレオチドおよびアミノ酸の配列は当技術分野において既知である(米国特許第5,320,951号、第5,571,514号、第5,175,096号、第5,652,217号など)。本明細書において使用される場合、「改変」およびその派生語は、野生型配列とは異なるアミノ酸配列、および、野生型のアミノ酸配列とは異なるアミノ酸配列をコードするヌクレオチド配列を意味するものである。改変には、ヌクレオチドまたはアミノ酸の1個以上の挿入、欠失、および/または置換が含まれる。
【0039】
例えば、改変は、フレームシフト変異をもたらす、1個のヌクレオチド、または1個よりも多いヌクレオチドの挿入または欠失であるかもしれない;コードされたアミノ酸の1個以上の変化をもたらす、少なくとも1個のヌクレオチドの変化であるかもしれない;未成熟終止コドンの生成をもたらす少なくとも1個のヌクレオチドの変化であるかもしれない;いくつかのヌクレオチドの欠失であって、そのヌクレオチドにコードされている1個以上のアミノ酸の欠失をもたらすものかもしれない;遺伝子のコード配列の中断をもたらす1個またはいくつかのヌクレオチドの挿入であるかもしれない;遺伝子のすべてまたは一部の重複であるかもしれない;遺伝子のすべてまたは一部の転位であるかもしれない;または、遺伝子のすべてまたは一部の再配列であるかもしれない。このような変異の1つ以上が1個の遺伝子に存在することも可能である。このような配列の変化は、その遺伝子によってコードされたFnbの改変を生じる。例えば、改変がフレームシフト変異であれば、このフレームシフトは、コードされたアミノ酸に変化を生じさせるか、および/または未成熟終止コドンの生成をもたらし、短縮タンパク質の生成をもたらす可能性がある。
【0040】
例えば、改変は、好ましくは、天然型Fnbの3次元立体構造を保存するものである。さらに、Fnbの機能、特に免疫原性に不可欠のアミノ酸を、当技術分野において既知の方法によって同定することができる。特に有用な方法としては、保存されたアミノ酸の同定法、部位特異的変異誘発法、およびアラニンスキャニング変異法(例えば、CunninghamおよびWells 1989)、結晶および核磁気共鳴法などが挙げられる。これらの方法によって作成された改変型ポリペプチドは、免疫原性および抗原性を含む、具体的な生物活性についてテストされ得る。
【0041】
具体的には、疎水性、塩基性または酸性という特徴、電荷、極性、大きさ、官能基(例、−SHまたはグリコシル化部位)の有無、および芳香族特性を含む、いくかの基準に基づいて適当なアミノ酸改変が行われ得る。上記の性質に基づいて、さまざまなアミノ酸を類似したグループに割り当てることは、当業者に容易に分かることであり、さらに適当なアミノ酸の変化については、Bowieら,(Science 247:1306−1310(1990))に記載されている。
【0042】
例えば、改変は、防御免疫反応に関与するFnbAの領域の特性は維持するが、黄色ブドウ球菌(S.aureus)感染の刺激に関与するエピトープを欠失または変更させる、グルタミン残基およびリジン残基の保存的な(例えば、アラニンに対しグリシン;イソロイシンに対しバリン、リジンに対しヒスチジン、グルタミンに対しアスパラギン)部位特異的突然変異の形(図6)をとることも可能である(すなわち生物学的等価体)。また、改変は、黄色ブドウ球菌(S.aureus)感染を悪化させるような刺激を低減または除去する非保存的変異(例えば、スレオニンに対しリジン;リジンに対しアラニン、グルタミンに対しアラニン)という形をとることも可能である。また、改変は、残りのFnbに由来する部分を引き続き利用しつつ、本明細書において同定されたグルタミン残基またはリジン残基の任意のものを完全に欠失させた形をとることも可能である。欠失部位は、最適な翻訳および/または免疫原性のために残りのFnbまたはポリペプチドの空間性を維持するリンカー領域によって置換することができる。改変は、任意の標準的な変異原または変異誘発法(例えば、ファージを含む部位特異的変異誘発法、合成オリゴヌクレオチドを含むポリメラーゼ連鎖反応(PCR)技術の使用)を用いて行うことができる。
【0043】
したがって、本発明は、免疫原性を保持する黄色ブドウ球菌(S.aureus)の改変型Fnbまたはその一部をコードする単離されたヌクレオチド配列に関係する。本明細書において使用される場合、「改変型Fnb」という用語は、免疫原性を保持し、かつ、免疫原組成物に取り込まれて脊椎動物に投与されると、その後黄色ブドウ球菌(S.aureus)に感染してもフィブロネクチンまたはフィブリンへの結合を促進しない黄色ブドウ球菌(S.aureus)のFnb(またはその一部)を意味することを意図される。具体的な実施態様において、改変型Fnbは、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異を含む。一つの実施態様において、これらのアミノ酸はアラニンに変異している。
【0044】
本発明は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当するアミノ酸との関係で具体的に記載されているが、これらの残基を同定するために使用された本明細書記載の方法を、野生型Fnbのさらなる残基に適用して、さらなる改変のための残基を同定することができる。
【0045】
必要に応じて、本発明の核酸分子は、例えばmRNAのようなRNA、またはcDNAおよびゲノムDNAなどのDNAであってもよい。DNA分子は2本鎖または1本鎖であってよく、1本鎖RNAまたはDNAは、コード鎖またはセンス鎖、あるいは非コード鎖またはアンチセンス鎖であってもよい。1つの実施態様において、核酸分子は、少なくとも約14のヌクレオチドを含み、別の実施態様においては、少なくとも約50のヌクレオチドを含み、さらに別に実施態様においては、少なくとも200のヌクレオチドを含む。ヌクレオチド配列は、改変型Fnbのアミノ酸配列の少なくともフラグメントをコードするものにすぎなくてよく、あるいは、このヌクレオチド配列は、少なくとも改変型Fnbアミノ酸をコードする配列のフラグメントを、イントロン、および非コード3’および5’配列(例えば、調節配列を含む)のような付加的な非コード配列とともに含むことができる。さらに、ヌクレオチド配列は、マーカー配列、例えば、ポリペプチドの単離または精製に役に立つようなポリペプチドをコードする配列などに融合され得る。
【0046】
「ヌクレオチド配列」という用語は、化学的にまたは組み換え手段によって合成されるヌクレオチド配列を含むことができる。したがって、ベクターに含まれる組み換えDNAは、本発明に包含される。また、ヌクレオチド配列は、異種の宿主細胞中の組み換えDNA分子、および部分的または実質的に精製された、溶液中のDNA分子を含む。本発明のDNA分子のインビボおよびインビトロにおけるRNA転写物も、本発明のヌクレオチド配列に含まれる。このようなヌクレオチド配列は、例えば、コードされた改変型Fnbを製造する場合に有用である。
【0047】
改変型Fnbの一部、アナログまたは誘導体をコードするもののような、本発明のヌクレオチド配列のバリエーションも、その一部、アナログまたは誘導体が改変型Fnbを含んでいれば、本発明に包含される。このようなバリエーションは、対立遺伝子バリエーションの場合のように、ヌクレオチド配列の非改変部分に天然に生じるバリエーションであってよく、または、さまざまな突然変異原および突然変異誘発処理によって誘導されるものなど、非天然に生じるものであってもよい。対象となるバリエーションとしては、付加および欠失を含む保存型または非保存型のアミノ酸変化をもたらすことができる、1つ以上のヌクレオチドの付加、欠失および置換が挙げられるが、これらに限定されない。
【0048】
本明細書記載の発明は、上記の核酸分子のフラグメントにも関する。「フラグメント」という用語は、フラグメントが改変型Fnbポリペプチドをコードし、すなわち、フラグメントがプライマーとして有用であるならば、長さが少なくとも約14個の連続したヌクレオチドから少なくとも約50個の連続した以上のヌクレオチドまでである、本明細書記載のヌクレオチド配列の一部を包含することを意図される。一定のプライマーおよびプローブは、本明細書に記載されている改変型Fnbをコードする核酸分子と選択的にハイブリダイズする。例えば、本明細書記載の改変型Fnbの抗原部分をコードするフラグメントは有用である。
【0049】
本発明は、中度および高度にストリンジェントなハイブリダイゼーション条件(例えば、選択的ハイブリダイゼーションのための条件)下で、本明細書記載のヌクレオチド配列とハイブリダイズするヌクレオチド配列にも関係する。適当なストリンジェンシー条件は当業者に知られているか、Current Protocols in Molecular Biology,John Wiley & Sons,N.Y.(1989),6.3.1−6.3.6のような標準的な教科書に記載されている。
【0050】
したがって、本発明は、本明細書記載の改変型のヌクレオチド配列に実質的に同一である、例えば、これらの配列に少なくとも90%、または少なくとも95%同一であるようなヌクレオチド配列に関連する。特定のヌクレオチド配列は、本明細書記載の改変型Fnbとして、実質的に類似した抗原活性をもつポリペプチドをコードする。
【0051】
また、本発明は、黄色ブドウ球菌(S.aureus)の改変型Fnb、または、そのポリペプチドにも関連する。改変型Fnbまたはポリペプチドは、免疫原性を保持し、免疫原性組成物に組み込まれて脊椎動物に投与されると、その後黄色ブドウ球菌(S.aureus)に感染した際、フィブロネクチンおよびフィブリンと架橋する能力が野生型Fnbよりも低くなっている、黄色ブドウ球菌(S.aureus)のFnb(またはその一部)である。具体的な実施態様において、改変型Fnbは、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異を含む。本発明の改変型Fnbは、実質的に精製されており(例えば、均質になるまで精製されている)、他のタンパク質を実質的に含まない。
【0052】
また、本発明は、少なくとも1つの調節配列と作動できるように結合している、改変型Fnbまたはポリペプチドをコードする核酸配列を含む、発現ベクター(例えば、プラスミドおよびコスミドのような核酸構築物)も提供する。このような多くベクターの多くは市販されており、当業者は他の適当なベクターを容易に調製することができる。「作動できるように結合する」とは、核酸配列の発現を可能にする態様で、ヌクレオチド配列が調節配列に結合していることを意味し、この用語は、直接の物理的結合、およびリンカーまたは介在配列による連結の両方を含むことを意図される。調節配列は当業者に知られており、改変型Fnbまたはポリペプチドであるポリペプチドを産生するために選択される。したがって、「調節配列」という用語は、プロモーター、エンハンサー、および、Goeddel,Gene Expression Technology;Methods in Enzymology 185,Academic Press,San Diego,Calif.(1990)に記載されている他の発現制御要素を含む。例えば、固有の調節配列、または形質転換宿主細胞に固有の調節配列が用いられ得る。発現ベクターの設計は、形質転換される宿主細胞の選択、および/または発現を所望されるタンパク質のタイプなどの要素に依存し得ることが理解される。
【0053】
例えば、本発明の改変型Fnbおよびポリペプチドは、核酸分子、またはその一部を、原核細胞、真核細胞またはその両方で発現させるのに適したベクターの中にライゲーションすることによって産生され得る(例えば、Broachら,,1983,Sambrookら,,1989参照)。
【0054】
記載されたベクターによって形質導入された原核生物および真核生物の宿主細胞も、本発明によって提供される。例えば,本発明の発現ベクターで形質転換、形質導入または感染され得る細胞は、大腸菌(E.coli)(例えば、大腸菌(E.coli)K12菌株)のような細菌細胞、ストレプトミセス(Streptomyces)、シュードモナス(Pseudomonas)、セラチア・マルセッセンス(Serratia marcescens)およびネズミチフス菌(Salmonella typhimurium)、ショウジョウバエ(Drosophila)細胞、Sf9細胞、およびSf21細胞を含む昆虫細胞(バキュロウイルス)、酵母菌などの真菌細胞、植物細胞、および胸腺細胞、チャイニーズハムスター卵巣(CHO)細胞、HEp−2細胞、ベロ(Vero)細胞およびコス(COS)細胞のような哺乳動物細胞を含むが、これらに限定されない。
【0055】
したがって、本明細書記載の改変型Fnbをコードするヌクレオチド配列は、微生物または真核細胞による処理を介して組み換え型タンパク質を産生するために使用され得る。発現ベクターのような遺伝子構築物にポリヌクレオチド配列をライゲーションして、真核生物(酵母、鳥類、昆虫、植物または哺乳動物)または原核生物(細菌細胞)の宿主に形質転換または形質移入することは、他の周知のタンパク質の生産に用いられる標準的な処理法である。アデノウイルス、アデノ随伴ウイルス、単純ヘルペスウイルス、レトロウイルス、レンチウイルス、ワクシニアウイルスなどのポックスウイルス、シンドビズウイルス、セムリキ森林ウイルス、およびベネズエラウマ脳炎ウイルスなどのアルファウイルス、ならびに、はしかウイルス、おたふくかぜウイルス、および水疱性口内炎ウイルスのような非セグメント化マイナス鎖RNAウイルスなどであるが、これらに限定されないウイルス性ベクターを使用することもできる。したがって、本発明は組み換え技術による改変型Fnbの産生に関する。
【0056】
本発明の改変型Fnbがインビトロで産生される上記宿主細胞系に加え、多様な系が、このような改変型Fnbをインビボで発現させ、送達するのに適している。これらの系は、細菌またはウイルスなどの弱毒化した病原体を送達因子として利用する。これらの生きた弱毒化病原体は、異種核酸セグメントとして、それらの内部に、本発明の所望の改変型Fnbをコードする核酸配列を挿入されている。これらの系を用いると、脊椎動物の体内で、生きている弱毒化された細菌またはウイルスによって、所望の改変型Fnbが発現される。
【0057】
本発明のタンパク質は、多様な方法によって、組み換え細胞培養物から単離または(例えば、均質になるまで)精製され得る。これらは、陰イオン交換クロマトグラフィーまたは陽イオン交換クロマトグラフィー、エタノール沈殿法、アフィニティークロマトグラフィーおよび高速液体クロマトグラフィー(HPLC)を含むが、これらに限定されない。用いられる具体的な方法は、ポリペプチドの性質および宿主細胞の選択に依存し、適当な方法が、当業者には容易に理解される。
【0058】
本発明は、本明細書に記載された改変型Fnbを含む免疫原性組成物にも関連する。例えば、本発明の改変型Fnbを、生理学的に受容可能なビヒクルとともに処方して、免疫原性組成物を調製し得る。具体的な生理的ビヒクルは、水、緩衝生理食塩水、ポリオール(例えば、グリセロール、プロピレングリコール、液体ポリエチレングリコール)、およびブドウ糖溶液を含むが、これらに限定されない。選ばれたビヒクルの活性成分の最適濃度は、所望の最終的薬学的処方物に依存する、周知の方法に従って実験的に決定され得る。
【0059】
改変型Fnbは、哺乳動物宿主のような脊椎動物の中の抗原に対する免疫反応を誘導する抗原として使用され得る。
【0060】
本発明の方法は、改変型Fnbと任意の適当なアジュバントとの混合物を含む免疫原性組成物の免疫学的に有効な投与量を脊椎動物に投与する工程を包含する。本明細書において使用される場合、「アジュバント」は、抗原に対する免疫反応を促進するか、または変更するのに十分な任意の薬剤を意味することが意図される。本明細書において使用される場合、免疫原性組成物の「免疫学的に有効な」投与量は、免疫反応を誘導するのに適切な投与量である。具体的な投与量は、処理を受ける脊椎動物の年齢、体重および病状、ならびに投与法に依存する。当業者は、容易に適切な投与量を決定する。免疫原性組成物は、必要に応じて、生理的食塩水またはエタノールポリオール(グリセロールもしくはプロピレングリコール)のような、薬学的および生理学的に受容可能なビヒクル中で投与され得る。
【0061】
組成物の効力を促進する適当なアジュバントとしては以下のものが挙げられるが、それらに限定されない:
(1)水酸化アルミニウム、リン酸アルミニウム、硫酸アルミニウムなどのアルミニウム塩(ミョウバン);
(2)例えば、以下のような、水中油型エマルジョン処方物(ムラミルペプチド(下記参照)または細菌細胞壁成分など、他の特異的免疫促進因子の有無に関わらない):
(a)5%スクアレン、0.5%Tween80、および0.5%Span85を含み(必要に応じて、種々の量のMTP−PEを含む(必要とはされないが、下記を参照のこと))、Model 110Yのようなマイクロ流動化装置(Microfluidics,Newton,MA)を使用して極微粒子に処方されたMF59(PCT公報WO90/14837号)、
(b)10%スクアレン、0.4%Tween80、5%プルロニック−ブロックポリマーL121、およびthr−MDP(以下を参照)を含み、極微粒子にマイクロ流動体化されているか、またはボルテックス処理されてより大きな粒子サイズのエマルジョンを生じているかのいずれかである、SAF、ならびに
(c)2%スクアレン、0.2%Tween80、および米国特許第4,912,094号(Corixa)に記載された3−O−脱アシル化(deaylated)モノホスホリルリピドA(3−O−deaylated monophosphorylipid A)(MPLTM)、トレハロースジミコール酸(dimycolate)(TDM)、および細胞壁骨格(CWS)もしくはMPL+CWS(DetoxTM)からなるグループに由来する、1つ以上の細菌細胞壁組成を含む、RibiTMアジュバント系(RAS)(Corixa,Hamilton,MT);
(3)Quil AまたはSTIMULONTM QS−21(Antigenics,Framingham,MA)(米国特許第5,057,540号)などのサポニンアジュバント、またはそれらから生じた、ISCOM(免疫促進複合体)などの粒子を用いることができる;
(4)細菌のリポポリサッカライド、アミノアルキルグルコサミンリン酸化合物(AGP)、または、その誘導体もしくはアナログなどの合成リピドAアナログ。これらはCorixaから購入可能であり、米国特許第6,113,918号に記載されている;このようなAGPの1つが、2−[(R)−3−テトラデカノイルオキシテトラデカノイルアミノ]エチル2−デオキシ−4−O−ホスホノ−3−O−[(R)−3−テトラデカノイルオキシテトラデカノイル]−2−[(R)−3−テトラデカノイルオキシテトラデカノイルアミノ]−b−D−グルコピラノシドであり、529としても知られており(以前はRC529として知られていた)、これは水性形態としてか、または安定したエマルジョンとして書法され、CpGモチーフを含むオリゴヌクレオチドなどのポリヌクレオチド(米国特許第6,207,646号);
(5)インターロイキン(例えば、IL−1、IL−2、IL−4、IL−5、IL−6、IL−7、IL−12、IL−15、IL−18など)、インターフェロン(例えば、γインターフェロン)、顆粒球マクロファージコロニー刺激因子(GM−CSF)、マクロファージコロニー刺激因子(M−CSF)、腫瘍壊死因子(TNF)などの、サイトカイン;
(6)例えば、国際特許出願公報WO00/18434号(WO02/098368およびWO02/098369も参照)に従って、29位のアミノ酸のグルタミン酸が別のアミノ酸(好ましくはヒスチジン)に置換されている、野生型または変異型いずれかのコレラ毒(CT)のような細菌性ADPリボシル化毒素の無毒化変異体、百日咳毒素(PT)、または大腸菌易熱性毒素(LT)、具体的にはLT−K63、LT−R72、CT−S109、PT−K9/G129(例えば、WO93/13302およびWO92/19265参照)、および
(7)免疫促進因子として作用して、上記組成物の効力を増大させる他の物質。
【0062】
上記のように、ムラミルペプチドとしては、N−アセチル−ムラミル−L−トレオニル−D−イソグルタミン(thr−MDP)、N−アセチル−ノルムラミル−L−アラニン−2−(1’−2’ジパルミトイル−sn−グリセロ−3−ヒドロキシホスホリルオキシ)−エチルアミン(MTPPE)などが挙げられるが、これらに限定されない。
【0063】
本発明の組成物は、非経口経路、動脈内経路、内皮経路、(徐放性ポリマーの使用による)経皮経路、筋肉内経路、腹腔内経路、静脈内経路、皮下経路、経口経路および鼻腔内経路による投与など、種々の経路で、ヒトまたは非ヒト脊椎動物に投与され得る。このような組成物に用いられるFnbの量は、投与経路および被験体脊椎動物の身体的特徴に依存して変動する。従来型キャリア抗原とともに用いられる、確立された投与量の範囲を調整および操作することは、当業者が適宜なしうることである。本発明の組成物は、未成熟および成熟した脊椎動物、特にヒトの処置における使用が意図される。
【0064】
改変型Fnbは、さらなる免疫原と一緒に投与され得る;この改変型Fnbは、さらなる免疫原と、別個にか、連続的にか、または同時に投与され得る。
【0065】
本発明の改変型Fnbは、免疫反応を調節または促進するために、キャリア分子と結合することができる。適切なキャリアタンパク質は、脊椎動物に安全に投与でき、キャリアとして免疫学的に有効な細菌性毒素を含む。例としては、百日咳、ジフテリア、および破傷風のトキソイド、ならびにジフテリアトキソイドの非毒性変異体であるCRM197などの非毒性変異タンパク質(交差反応性物質(CRM))などがある。天然の毒素またはトキソイドのフラグメントであって、少なくとも1つのT細胞エピトープを含むものもまた、抗原のキャリアとして有用である。抗原の結合体およびキャリア分子を調製する方法は、当該分野において周知である(Wong 1991; Bernatowicz and Matsueda 1986; Frisch et al. 1996; Boeckler et al. 1996)。
【0066】
さらに、特定のペプチド領域が欠失している場合には、二価ワクチンを作成するために、別の生物の抗原に由来する1つ以上のエピトープを、その欠失領域に挿入することができる。
【0067】
本発明はまた、生理学的に受容可能なキャリアと、黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする核酸分子とを含む免疫原性組成物に関連し、この改変型Fnbは、免疫原性を保ち、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、その後その脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbの結合を促進しない。このような免疫原性組成物は、本明細書において、核酸免疫原性組成物またはDNA免疫原性組成物と称され、脊椎動物を免疫化するのに有用である。
【0068】
本明細書において、「遺伝子による免疫化」という用語は、脊椎動物による黄色ブドウ球菌(S.aureus)に対する免疫反応の創出をもたらす、脊椎動物(具体的には哺乳動物)への、病原体(具体的には黄色ブドウ球菌(S.aureus))に対する核酸免疫原性組成物の接種を意味する。本明細書で用いられる「核酸免疫原性組成物」または「DNA免疫原性組成物」は、ポリペプチド抗原、具体的には本明細書記載の黄色ブドウ球菌の改変型Fnbをコードする核酸分子を含む核酸構築物である。この核酸構築物は、転写プロモーター因子、エンハンサー因子、スプライシングシグナル、終結シグナルおよびポリアデニル化シグナル、ならびに他の核酸配列を含むこともできる。核酸免疫原性組成物は、後に脊椎動物が黄色ブドウ球菌に感染した際に、野生型Fnbのフィブロネクチンまたはフィブロンへの結合を促進しない。
【0069】
核酸免疫原性組成物は、標準的な方法によって作成される。例えば、既知の方法を用いて、黄色ブドウ球菌の改変型Fnbをコードする核酸(例えば、DNA)を発現ベクターに挿入し、核酸免疫原性組成物を構築する(Maniatis et al.1989)。
【0070】
個々の脊椎動物を、標準的な方法を用いて核酸免疫原性組成物で免疫化する。脊椎動物は、皮下的、静脈内、腹腔内、皮内、筋内、局所的、経口、直腸内、鼻内、頬内、膣内、吸入噴霧によるか、または従来型の非毒性で生理学的に受容可能なキャリアまたはビヒクルを含む投薬処方物中のインプラントリザーバーを介して免疫化される(すなわち、その組成物が投与される)。あるいは、粒子加速装置(「遺伝子銃」)を使って、脊椎動物に核酸免疫原性組成物を接種する。投与形態(例えば、カプセル、錠剤、溶液、エマルジョン)は、投与経路に部分的に依存する。例えば、粘膜投与には、点鼻薬、吸入または坐薬を用いることができる。
【0071】
核酸免疫原性組成物は、上記したような任意の適当なアジュバントとともに投与することができる。このアジュバントは十分な量で投与されるが、その量とは、組成物に対するより強い免疫反応を生じさせるのに十分な量のことである。アジュバントは、核酸免疫原性組成物を接種する前にか、同時にか、同時に(一斉に)か、またはその後に、投与することができる。アジュバントは、1回以上投与することもできる。アジュバントおよび核酸免疫原性組成物は、脊椎動物のほぼ同じ場所に投与することができる;例えば、両者を脊椎動物の肢の標識部位に投与する。
【0072】
具体的な実施態様において、核酸構築物は、形質導入促進因子とともに同時投与される。1つの実施態様において、形質導入促進因子はジオクチルグリシルスペルミン(DOGS)である(PCT公開出願WO 96/21356号)。別の実施態様において、形質導入促進因子は、ブピバカインのような局部麻酔薬である(米国特許第5,593,972号)。
【0073】
本発明はまた、脊椎動物(例えば、黄色ブドウ球菌セロネガティブのヒト)を、黄色ブドウ球菌(S.aureus)に対して免疫化する方法も提供する。この方法は、上記の黄色ブドウ球菌(S.aureus)の改変型Fnbの免疫学的に有効な量を含む組成物を、その脊椎動物に投与する工程を包含する。あるいは、この組成物は、免疫原性を保持しており、かつ、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、フィブロネクチンおよびフィブリンと架橋する能力が低下して、後に脊椎動物が黄色ブドウ球菌に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、免疫学的な有効量の改変型Fnbをコードする核酸分子を含む。
【0074】
ヒトに投与する前に、本発明の免疫原性組成物を動物モデルにおいて評価する。ここで、代表的な非限定的動物モデルを以下に説明する。
【0075】
マウス腎盂腎炎モデルにおいて、4週齢の雌性CD−1マウスに、0週、3週、および6週に、適切なアジュバント中の改変型Fnbを、皮下注射によって接種する。これらのマウスから、初回接種の前と8週目に採血する。最後の採血の2日後、コロンビア塩寒天培地(1×コロンビア寒天、0.1%グルコース、1%酵母エキス、0.5%NaCl)上で一晩増殖させた3×108cfuの黄色ブドウ球菌(S.aureus)レイノルズを、腹腔内注射によってマウスに投与する。投与の48時間後、マウスを屠殺して、腎臓内の細菌数を数える。
【0076】
ラット心内膜炎モデルでは、3週齢のSprague−Dawley雄性ラットに、0週、2週、および4週目に、適切なアジュバント中の改変型Fnbを筋肉内注射によって接種する。これらのラットから、初回接種前に採血する。6週目に、ラットから採血し、手術を行って、頚動脈および大動脈弓を介して、心臓の左心室にポリエチレン製カテーテルを設置する。カテーテルは、絹縫合糸で適所に保たれ、無菌的な植生(vegetation)形成を引き起こす。細菌の投与の際に、この植生は、細菌が付着および感染するための基質として作用する。手術の2日後、トリプティックソイブロス中で中期対数増殖期まで増殖させた1×105cfuの黄色ブドウ球菌(S.aureus)レイノルズを、静脈注射によってラットに投与する。投与の48時間後、ラットを屠殺して、心臓内の細菌数を数える。
【実施例】
【0077】
上記の開示は、本発明を一般的に説明する。以下の具体的な実施例を参照することによって、より完全な理解を得ることができる。これらの実施例は、単に例示的に説明する目的で記載するものであって、発明の範囲を制限することを意図したものではない。
【0078】
(略語)
HPLC 高速液体クロマトグラフィー;
MALDI−TOF MS マトリクス支援レーザー脱離/イオン化飛行時間型質量分析法;
SDS−PAGE ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動;
DTT ジチオスレイトール
TCA トリクロロ酢酸;
Dansyl 5−ジメチルアミノナフタレン−1−スルホニル;
PTH フェニルチオヒダントイン;
ECM 細胞外マトリックスタンパク質
TBS TRIS緩衝食塩水
PBS リン酸ナトリウム緩衝食塩水
FXIII 第XIII因子または血漿トランスグルタミナーゼ
EDTA エチレンジアミン四酢酸のナトリウム塩
1Q rFnbA 組み換えGln103Ala型FnbA変異体
4Q4K rFnbA 組み換えGln103Ala,Gln105Ala,Gln783Ala,Gln830Ala,Lys157Ala,Lys503Ala,Lys620Ala,およびLys762Ala型変異体
wt FnbA 野生型FnbA。
【0079】
(材料および方法)
黄色ブドウ球菌(Staphylococcal)フィブロネクチン結合タンパク質。黄色ブドウ球菌(S.aureus)株ATCC49525由来のAla1からPro839までの残基を含む組み換えフィブロネクチン結合タンパク質A(rFnbA)を大腸菌で産生させ、既述されたとおり(Matsuka et al.2003)細胞溶解物の可溶性画分から単離した。簡単に言うと、FnbAアミノ酸残基の1〜839をコードするfnbA遺伝子を、黄色ブドウ球菌(S.aureus)株ATCC49525の染色体DNAを鋳型として用いたPCR増幅法により作成した。単離されたrFnbAの同一性をSDS−PAGE、ウエスタンブロット、およびNH2末端配列の解析を用いて確認した。すべての実験におけるタンパク質濃度は、使用説明書(Pierce Chemical Company,Rockford,IL)に従ってビシンコニン酸(BCA)アッセイ法を用いて測定した。
【0080】
第XIIIa因子により触媒されるダンシルカダベリン(dansylcadaverine)およびダンシル−PGGQQIVプローブのrFnbAへの取り込み。ダンシルカダベリン(Sigma,St.Louis,MO)またはダンシル−PGGQQIV(New England Peptide,Inc.,Fitchburg,MAによって特注合成)をrFnbAに取り込ませるために、予め活性化した第XIII因子を用いた。このために、500μg/mlの第XIII因子(Haematologic Technologies,Inc.,Essex Junction,VT)を、10mMのジチオスレイトールおよび20mMのCaC12を含むTBS緩衝液(pH7.4)中、0.25U/mlのトロンビン(Sigma)で処理して活性化した。37℃で20分間インキュベートした後、ヒルジン(hirudin)(Sigma)を加えてトロンビンを不活性化して、この混合液を第XIIIa因子として使用した(Takagi,Aoyama et al.1995)。rFnbA内にある反応性グルタミン残基の第XIIIa因子触媒による標識は、1〜2mgのrFnbAを、20mM Tris(pH7.4)、150mMのNaCl、5mMのDTT、5mMのCaC12の緩衝液中で、2.5mMのダンシルカダベリンおよび第XIIIa因子(30μg/ml)とともに、37℃で4時間または18時間インキュベートして実施した。第XIIIa因子反応性リジン残基の標識は、1〜2mgのrFnbAを、20mM Tris(pH8.5)、15mMのNaCl、5mMのDTT、5mMのCaC12の緩衝液中で、2mMのダンシル−PGGQQIVおよび第XIIIa因子(30μg/ml)とともに37℃で4時間または18時間インキュベートして実施した。いずれの場合でも、反応混合液の全容量は0.3mlであった。保温時間の最後に、7%TCAでタンパク質を沈殿させ、遠心分離(14,000×gで5分間)によって回収し、未処理のダンシルカダベリンを除去するために1mlのエタノール:エーテル(1:1容量/容量)で、または、未処理のダンシル−PGGQQIVプローブを除去するために、1%N−メチルモルフォリンおよび5%H2Oを含む1mlのN,N−ジメチルホルムアミドで、沈殿物を反復(8回)抽出した(Clement,Velasco et al.1998)。
【0081】
ダンシルカダベリンおよびダンシル−PGGQQIVで標識されたrFnbAのトロンビンによるフラグメント化。ダンシルカダベリンまたはダンシル−PGGQQIVで修飾されたrFnbAのタンパク質分解によるフラグメント化を、トロンビン(Sigma)を用いて行った。未処理のダンシルカダベリンおよびダンシル−PGGQQIVプローブを除去した後、修飾されたrFnbAの沈殿物を5mMのCaC12を含む0.5mlのTBS緩衝液(pH7.4)に溶解させた。修飾されたrFnbAをトロンビンとともに、1:200(w/w)の酵素/基質比で25℃で1時間インキュベートして、タンパク質限定分解を行った。2%SDS存在下において、95℃で加熱して反応を停止させ、SDS−PAGEにより解析を行った。
【0082】
SDS−PAGE解析。ダンシルカダベリンまたはダンシル−PGGQQIVで修飾されたrFnbA調製物、およびそれらのトロンビン生成フラグメントを、既製の4〜20%勾配ゲル(BioRad Laboratories,Hercules,CA)を用いてSDS−PAGEにより解析した。本研究におけるSDSポリアクリルアミドゲルはすべて、紫外光線下で試験した後、クーマシーブリリアントブルーR(BioRad Laboratories)で染色した。
【0083】
ダンシルカダベリンおよびダンシル−PGGQQIVで標識されたrFnbAの分解。ダンシルカダベリンで修飾されたrFnbAの酵素的加水分解を、Glu−C(V−8)プロテアーゼ(Worthington Biochemical Corp.,Freehold,NJ)およびL−(トシルアミド2−フェニル)エチルクロロメチルケトン(TPCK)処理トリプシン(Worthington Biochemical Corp.)によって処理して行った。ダンシル−PGGQQIV修飾されたrFnbAの加水分解は、Glu−Cプロテアーゼのみを用いて行った。TCA沈殿および抽出後、修飾されたrFnbAの沈殿物を、トリプシンで切断するためには0.3mlのTBS(pH7.4)に、または、Glu−Cプロテアーゼで切断するためには0.3mlのPBS(pH7.8)に溶解した。修飾されたrFnbAを、トリプシンまたはGlu−Cプロテアーゼとともに、1:20(w/w)の酵素/基質比で37℃で16時間インキュベートして酵素切断を実施した。この反応混合液にさらなる量のトリプシンまたはGlu−Cプロテアーゼを加えて、最終の酵素/基質比を1:10(w/w)とし、さらに37℃で8時間分解を継続させた。この分解混合液を、0.2%のトリフルオロ酢酸で1:1(vol/vol)に希釈し、14,000×gで5分間遠心分離して、上清に対して逆相HPLCを行った。
【0084】
ダンシルカダベリンおよびダンシル−PGGQQIVで標識されたペプチドの逆相HPLCによる分離。ダンシルカダベリンおよびダンシル−PGGQQIVで標識されたペプチドを、0.1%のトリフルオロ酢酸中のアセトニトリルによる勾配溶離によってAquapore RP−300 C8カラム(Brownlee Labs,Santa Clara,CA)上で分離した。分離は、ProStar蛍光検出装置(Varian,Walnut Creek,CA)を備えたDynamax HPLC装置(station)を用いて実施した。ペプチドを、アセトニトリルの0〜50%の直線的勾配で流速0.5ml/分で90分間にわたり溶離させた。210nmにおける吸光度、および350nmで励起したときの550nmにおける蛍光を観測してペプチドの溶離を検出した。この蛍光トレーサーのピークを回収して、より小さな容量(50〜200μl)に濃縮した後、同じカラムに再注入した。溶離の第2回目を、アセトニトリルの10〜20%または20〜35%の直線的勾配を用いて流速0.5ml/分で60分間隔にわたって行った。単離されたダンシルカダベリンまたはダンシル−PGGQQIVによって標識されたペプチドに質量分析およびNH2末端配列の解析を行った。
【0085】
配列解析。Applied Biosystems model 490配列解析装置を用いて、NH2末端配列の解析を行った。また、選択されたサンプルを、M−Scan Inc.のサービス解析にも供した。これらのサンプルを、Applied Biosystems model 477A配列解析装置を用いて解析した。最高18サイクルまで配列決定し、単離されたペプチドのNH2末端を決定した。
【0086】
ペプチドの分子量の理論計算。既知のブドウ球菌rFnbAの一次配列から、Peptide Companion V1.25ソフトウエアを用いて、トリプシンおよびGlu−Cプロテイナーゼによって生じたペプチドの分子量の計算を行った。ダンシルカダベリン(335.50Da)またはダンシル−PGGQQIV(932.00Da)による修飾がペプチドの質量に対して与える効果を、プローブの分子量を加えて計算した。各ε−(γ−グルタミル)リジンのイソペプチド結合の形成は、1個のアンモニア(17.04Da)を放出を伴うため、それに従って最終的な分子量値を調整した。
【0087】
質量スペクトル解析。MALDI−TOF質量分析計Voyager DE−STR (Perseptive Biosystems,Foster City,CA)を用いて、単離されたペプチドの分子量の決定を行った。337nmでレーザー脱離(N2レーザー)によって形成されたイオンを、反射方式における20kVの加圧電圧にして記録した。通常、200個の単一のスペクトルを、その単一/ノイズ比を向上させるために蓄積して、質量分析計に同梱されていたData Exploreソフトウエアを用いて解析した。α−シアノ−4−ヒドロキシ桂皮酸(Aldrich Chemical Co.,Milwaukee,WI)を紫外光吸着基質として用いた。70%アセトニトリル/0.1%トリフルオロ酢酸中10mg/mlの基質化合物溶液の1μlを、1μlのペプチド溶液(5〜10pmole/μl)と混合した。MALDI−TOF MSのため、1μlのこの混合液をステンレス鋼のサンプル標的の上にスポットして、室温で乾燥させた。以下の外部標準を用いて質量スペクトルを較正した:ウシ血清アルブミン、ヒトGlu1−フィブリノペプチドB、ヒトアンギオテンシンI、および合成des−Arg1−ブラジキニン。質量の精度は0.1%の範囲内である。
【0088】
(実施例1)
(第XIIIa因子によるダンシルカダベリンおよびダンシル−PGGQQIVのrFnbAへの取り込みと、プローブ修飾されたタンパク質のトロンビンによるフラグメント化)
黄色ブドウ球菌(S.aureus)株ATCC49525由来のフィブロネクチン結合タンパク質Aは、反応性のGlnおよびLysの両残基を含む、凝固第XIIIa因子に対する二機能性基質として働く(Matsuka et al.2003)ことが報告されている。反応性のGlnおよびLys残基のFnbA内での位置を評価するため、第XIIIa因子の触媒作用によって、アミン供与体(ダンシルカダベリン)またはアミン受容体(ダンシル−PGGQQIV)の蛍光プローブをrFnbAに取り込ませた。反応を4時間または8時間実施した後、未反応のプローブを除去して、トロンビンにより蛍光トレーサー標識rFnbAのフラグメント化を行った。トロンビン攻撃に対して感受性である、FnbA内にある単一のArg202−Gly203ペプチド結合が存在することによって、rFnbAのN末端およびC末端の部位に相当する、理論的に計算されたそれぞれの分子量が22kDaおよび70.7kDaである2つのフラグメントの生成が可能になる。rFnbAのトロンビン媒介性切断の産物を、SDS−PAGEと、その後、クーマシーブリリアントブルー染色の前にUV光下でゲルを調べることによって評価した(図1)。ダンシルカダベリンまたはダンシル−PGGQQIVによって修飾されたrFnbAをトロンビンとインキュベートしたところ、2つの別々のフラグメントが出現し、このことは、1つのペプチド結合を加水分解したことと整合した。トロンビンによって生じた低分子量および高分子量のフラグメントのSDS−PAGE上での移動度は、22kDaおよび70.7kDaのフラグメントについて予想されたものよりもやや低かった。しかし、この観察結果は、120kDaおよび203kDaの標準の中間で移動する親rFnbA(未修飾のもの、および蛍光プローブ修飾されたものの両方)に対応するバンドのSDS−PAGE上での全体的に低い移動度と整合している。質量スペクトル解析を用いてrFnbAについて得られた分子量は、一次配列から算定された値(92.656kDa)に非常に近似しており、したがって、rFnbAおよびそのフラグメントがSDS−PAGE上で異常に低い移動度になることが示唆された。
【0089】
第XIIIa因子によって4時間触媒された、ダンシルカダベリンによるrFnbAの修飾は、単量体rFnbAに相当するバンドが蛍光を発する結果をもたらした(図1Aおよび図1C、レーン1)。トロンビンによって生じた、ダンシルカダベリン修飾されたrFnbAの切断、およびその後のSDS−PAGEによる反応混合物の解析によって、蛍光が低分子質量フラグメントの中にほぼ完全に局在していることが明らかになった。顕著な高分子量フラグメントに相当するバンドは、総ダンシルカダベリン蛍光の僅かな部分しか提供されなかった(図1Aおよび図1C、レーン2)。同様の結果が、ダンシルカダベリンでさらに長い時間、すなわち18時間にわたって修飾されたrFnbAでも観察された(図1Aおよび図1C、レーン3および4)。rFnbAをダンシルカダベリンおよび第XIIIa因子とより長い時間インキュベートしても、rFnbA二量体に相当する副次的な高分子量バンドが出現する結果となった(図1Aおよび図1C、レーン3)。rFnbAを第XIIIa因子およびダンシル−PGGQQIVペプチド存在下で4時間または18時間インキュベートすると、単量体のrFnbAにプローブが取り込まれるとともに、二量体および高分子量ポリマーに相当するバンドが出現する結果となった(図1Bおよび図1D)。それにもかかわらず、用いられた実験条件下では、タンパク質の架橋がほぼ完全に阻害され、また、ダンシルカダベリンおよびダンシル−PGGQQIVプローブの取り込みが主にrFnbAの単量体型で起きることが明らかである。ダンシル−PGGQQIV修飾されたrFnbAをトロンビン触媒によって切断すると、高分子量フラグメントだけが、UV照射の際に蛍光を呈した(図1Bおよび図1D、レーン2および4)。このように、タンパク質限定分解データによって、主要なグルタミン受容体部位およびリジン供与体部位が、rFnbA分子のポリペプチド鎖の中で空間的に分離されていて、それぞれN末端領域およびC末端領域に位置していることが明らかになった。
【0090】
(実施例2)
(第XIIIa因子の架橋反応に関与する、rFnbAのグルタミン受容体部位の同定)
rFnbAの内部における特異的反応性Gln残基を同定するために、rFnbAを、第XIIIa因子およびモル過剰の蛍光プローブダンシルカダベリン存在下で4時間および18時間インキュベートした。ダンシルカダベリン標識反応の後、修飾されたrFnbA調製物を未反応のプローブから洗い出して、トリプシンで分解した。第XIIIa因子触媒によるダンシルカダベリンのrFnbAへの取り込みを4時間行って産生されたトリプシンペプチドをHPLCで分離することにより、210nmにおける複雑なプロフィールが明らかになった(図2A)。これに対し、同じサンプルで550nmにおける蛍光を観察したところ、約44分間の保持時間では、たった1つの主要ピークが検出された(図2B、ピーク1)。第XIIIa因子およびダンシルカダベリン存在下でのrFnbAのインキュベート時間を4時間から18時間に延長して、その後トリプシンで分解すると、210nmにおける溶離プロフィール(図2C)にも、主要な蛍光ピークの強度および保持時間(図2D、ピーク1)にも影響を与えることはなかった。同時に、ダンシルカダベリンがrFnbAに取り込まれる時間を延長すると、2および3として図示されている2つの副次的な蛍光ピーク(図2D)の強度が増した。ピーク1として(図2B)、およびピーク1、2、3(図2D)として標識されている、蛍光トレーサーで修飾されたペプチドを回収し、C8カラムに2回通した後、NH2末端配列および質量スペクトルの解析によって特徴を調べた(表2)。主要な蛍光ピーク1に由来するペプチドの配列解析によって、ピーク1は、rFnbAのNH2末端部位に由来する13マーのフラグメントに対応することが明らかにされた。エドマン分解の過程で、12サイクル目には残基を検出することができなかったが、次の13サイクル目では正しい配列決定に戻った。12番目の残基は、通常認識されるアミノ酸をエドマン処理で得ることができなかったが、Gln103に相当し、このことから、このGln103が修飾されていることを示唆している。このペプチドに存在する2つの別のGln残基(Gln95およびGln97)は、PTH(フェニルチオヒダントイン)誘導体として、それぞれ4サイクル目と6サイクル目に遊離した。トリプシン13マーペプチド(ピーク1)について得られた配列解析データは、さらに、質量スペクトル解析の結果によって裏付けられている。このペプチドの測定された質量はm/z1783.83を示し、1個のダンシルカダベリン修飾を含むペプチドの計算上の質量である1783.07に対応する(表2)。図2Dにおける副次的な蛍光ピーク3に由来するトリプシンペプチドの配列および質量スペクトルの解析によって、このペプチドもまた、FnbA分子のNH2末端領域に由来していることが示された。配列を決定する際、1サイクル目には1つのGln残基(Gln105)が検出されなかったが、表2に示す残基のPHT誘導体の記録は、それ以降のサイクルで再開されたことから、Gln105がもう一つの受容体部位として同定され得ることを示唆している。観察されたこのペプチドの分子量は、1つのダンシルカダベリン修飾部位をもつ理論値と一致していた(表2)。ピーク2の物質は、さらにC8逆相カラムに通しても、NH2末端配列決定を行えるほど均質ではなかったため、エドマン分解によって明確には同定できなかった。
【0091】
予測されたトリプシンペプチドのいくつかは、どちらかといえば大きかった(特に、このタンパク質のCOOH末端部位に由来するペプチド)ため、Glu−Cプロテイナーゼを用いて、ダンシルカダベリン修飾されたrFnbAの分解も行ったところ、より小さく扱いやすいペプチドが生成された。「材料と方法」に記載されているように、rFnbAおよび第XIIIa因子をダンシルカダベリン存在下でインキュベートし、Glu−Cプロテイナーゼで分解した。rFnbAを4時間にわたってダンシルカダベリンで修飾した後では、Glu−Cプロテイナーゼ分解混合物において46分間の保持時間をもつ単一の蛍光ピークが繰り返し観測された(図3B、ピーク1)。延長して18時間ダンシルカダベリンをrFnbAに取り込ませた後でGlu−C分解すると、同一の主要ピーク1と、2、3、4、5、6、および7と名づけられた複数の副次的なピークが生じた(図3D)。表2に示すように、4つのペプチドがGlu−Cプロテイナーゼ分解混合物から回収され、明確に同定された。ピーク1および7のペプチドは、トリプシン分解で同定されたものと同じ反応性のGln103残基およびGln105残基を含んでいた。どちらのペプチドも、93から107までの配列に相当し、ダンシルカダベリン修飾の数が異なっているだけであった。主要蛍光ピーク1由来のペプチドは、修飾されたGln103残基を1つ含むが、ピーク7のペプチドでは、Gln103およびGln105の両方が修飾されている。Glu−Cプロテイナーゼ分解も、rFnbAのCOOH末端部位に由来する2つの蛍光性ペプチドを生じさせた。ピーク4および6のペプチドは、それぞれ修飾されたGln830およびGln783の残基を含んでいた(表2)。
【0092】
いくつか別々のダンシルカダベリン標識実験を4時間および18時間にわたって行ない、その後トリプシンまたはGlu−Cプロテイナーゼで分解した解析により、Gln103が、rFnbAにおいて第XIIIa因子に対する主要なアミン受容体部位として機能していることを示唆した。Gln103部位の高い反応性が、トリプシンペプチドETTQSQDNSGDQ103R(図2B)またはGlu−Cプロテイナーゼによって生じるTTQSQDNSGDQ103RQVDペプチド(図3B)のいずれかに相当する単一の主要蛍光ピークの起源に関与している。Gln103の修飾は、反応の4時間後(またはそれよりも早く)に完全に完了した。なぜなら、第XIIIa因子とさらにインキュベートしてもピーク1の強度に影響しなかったからである(図2Dおよび3D)。これに対し、トリプシン分解混合物(ピーク2、3)およびGlu−Cプロテイナーゼ分解混合物(ピーク4、6、および7)から得られたさらに別の蛍光性ペプチドの回収は、第XIIIa因子による処理を延長した場合にだけ得られた。これらの蛍光ピークの強度は、主要ピーク1の強度と比較すると、それでもなお顕著に低く、このことは、105位、783位、および830位の反応性Gln残基の画分だけが修飾を受けたことを示している。このように、ダンシルカダベリンによる修飾実験は、rFnbAが1つの主要な(Gln103)、また3つの副次的な(Gln105、Gln783、およびGln830)第XIIIa因子反応性アミン受容体部位を含むことを明らかにした。
【0093】
(実施例3)
(第XIIIa因子の架橋反応に関与する、rFnbAのリジン供与体部位の同定)
第XIIIa因子媒介によるrFnbAのリジン側鎖の滴定を、フィブロネクチンのN末端配列を模倣したダンシル−PGGQQIVペプチドを用いて行った。第XIIIa因子およびダンシル−PGGQQIVプローブ存在下でこのrFnbAを4時間インキュベートした後、Glu−Cプロテイナーゼで分解した。Glu−Cプロテイナーゼにより生成されたペプチドをHPLCで分離させると、210nmで検出される複数のピークとわずかに数個の蛍光ピークが約60分間の間に溶離されることが再び明らかになった(図4Aおよび図4B)。しかし、アスタリスクで示されたピーク(図4B)以外には、プローブ修飾されたペプチドの標識の程度ひいてはその精製度が、必要な配列解析を行うには十分でなかった。ダンシル−PGGQQIV修飾ペプチドの回収を向上させるために、rFnbAを第XIIIa因子およびダンシル−PGGQQIV修飾ペプチドとともに18時間インキュベートして、「材料と方法」の項に記載されているようにGlu−Cプロテイナーゼで分解した。この分解混合物をHPLCで分離すると、全部で7つの蛍光ピークが生じた(図4D)。蛍光ピーク1〜7の溶離プロフィール(図4D)は、rFnbA修飾の4時間後に生成された分解混合物の溶離プロフィール(図4B)に類似しており、より標識程度の高い同一のペプチドが産生されたことを示していた。これらの蛍光ピーク(図4Bのアスタリスクで示されたピーク、および図4Dのピーク1〜7)のそれぞれを、逆相C8カラムでさらに精製してから、質量スペクトルおよび配列解析により評価を行った。行われた解析の結果を表3にまとめた。全部で6つの修飾されたペプチドを、質量スペクトルおよび配列の解析を用いて明確に同定した。ピーク4、5、および7の画分について信頼性の高い配列が得られ、Lys157、Lys620、およびLys503が、明確にプローブ修飾された残基であると同定された(表3)。エドマン分解の過程で、ダンシル−PGGQQIV修飾されたLys残基は、通常のPTH誘導体としては認識されないため、検出することができない。ピーク4を配列決定したところ、2サイクル目でこの結果が観察されたが、一方、1サイクル目ではVal残基がPTH誘導体として遊離した。次の3サイクル目では配列が回復し、中断することなく続いた。9サイクル目で得られたLys残基は、修飾されたリジン(Lys157)が2サイクル目に存在したという結論をさらに補強した。ピーク5および7由来のペプチド解析によって、それぞれ3サイクル目と2サイクル目で配列決定の中断が起きることが明らかになった。ここでも、これらのデータは、Lys620(ペプチド5の3サイクル目)およびLys503(ペプチド7の2サイクル目)が第XIIIa因子によって修飾されたことを示唆している。表3から分かるように、ピーク4、5、および7に対して得られたNH2末端配列解析の結果は、測定されたm/z値と整合している。これらのプローブ修飾された画分のそれぞれは、単一のダンシル−PGGQQIV修飾を含む各ペプチドの算定分子量と正確に一致したm/z値を示した(表3)。蛍光ピーク1および2のそれぞれは、本質的には等量で存在する2つの標識ペプチドと非標識ペプチドの混合物に相当した。FnbAの既知の一次配列、および予測切断部位のマップを利用して、この2重配列の確実な読み取りを行った。同様に、蛍光ピーク6について得られた配列の読み取りも、FnbAのアミノ酸配列と、Glu−Cプロテイナーゼによって触媒される予測切断部位の位置とを知ることによって行われた。単離された画分の分析によって、いくつかのダンシル−PGGQQIV標識ペプチドが、ポリペプチド鎖の同一の領域に由来することが明らかになった。Asp160−Val161のペプチド結合をGlu−Cプロテイナーゼによって部分的に加水分解したところ、プローブ修飾されたペプチド1(フラグメント156〜160)のより短いもの、およびより長いペプチド4(フラグメント156〜168)が得られた。同様に、Asp629−His630のペプチド結合を不完全加水分解したところ、ペプチド5(フラグメント618〜629)およびペプチド6(フラグメント618〜634)が生成される結果となった(表3)。このように、ここでもLys157およびLys620は、それぞれ蛍光ピーク1および6におけるプローブ修飾された残基であると同定された。Lys762の第XIIIa因子触媒による修飾が、蛍光ピーク2に相当する画分の配列決定によって実証された。画分1、2、および6の質量スペクトル解析によって、NH2末端配列決定の結果を裏付ける別の証拠が提供された。m/zが1432.37、1820.22、および2614.83における質量ピークは、それぞれ画分1、2、および6に存在した。蛍光ピーク1、2、および6について得られた測定分子量は、各単一ダンシル−PGGQQIV修飾による理論値と一致していた(表3)。アスタリスクで示された蛍光ピーク(図4B)は、2つのペプチドの混合物に相当する。FnbAの一次配列を知ることによって、また、この画分の読み取りを行った。非標識ペプチドをフラグメント266〜280と同定した(図5)一方で、トレーサーを含むペプチドは、図4D上のピーク5と一致し、単一プローブ修飾Lys620を含んでいた(表3)。ピーク3に対応する画分(図4D)は、それらの配列がエドマン分解では分析できなかった、いくつかのペプチドの混合物と考えられる。このように、rFnbAを第XIIIa因子によって、ダンシル−PGGQQIVプローブ存在下で処理すると、Lys157、Lys503、Lys620、およびLys762の特異的修飾をもたらし、これらの残基がアミン供与体部位として働くことを示唆している。
【0094】
(実施例4)
(同定された第XIIIa因子反応性のGln残基およびLys残基の部位特異的変異誘発法を用いた置換)
同定された反応性のGln残基およびLys残基の置換を、各変異を別々に導入して行った。この目的ため、所望のコード領域にわたる合成オリゴヌクレオチド(GlnからAla、またはLysからAlaへの変化を含む)をrFnbA遺伝子のPCR増幅に利用した。この2520bpの遺伝子の特異的なサブクローン(例えば、Gln103、Gln105、およびLys157にわたるサブクローン、ならびにGln503、Lys620、Lys762、Gln783、およびGln830にわたるサブクローン)を利用することによって、8個全部の変異を含む改変型遺伝子を「モジュール毎(modular stepwise)」に再構築することが簡便化された。いずれの場合においても、再構築された遺伝子が大腸菌(E.coli)発現ベクターにサブクローニングされたら、変異rFnbA遺伝子の配列を決定して、所望の変異が存在することを確認した。例えば、合成オリゴヌクレオチド
【0095】
【化1】

(およびその相補配列)を用いて、野生型fnbA遺伝子の5’側のほぼ半分に相当するヌクレオチドを含むプラスミドpLP1143にアニールさせて、FnbAのGln103残基をAlaに変えた。Pfu Turboポリメラーゼを用いてこのプライマーを伸長させ、fnbA遺伝子の改変された領域(Gln103Ala)の多数の非メチル化コピーを産生した。メチル化されている鋳型DNAをDpn1で分解した後、上記反応産物で大腸菌を形質転換すると、元のメチル化(野生型)コピーの回収率が低下する。次いで、形質転換混合物から回収したプラスミドを、クローニングされたfnbA領域の一部にわたって配列決定して、プラスミドfnbA103Aにおける本来のコドンであるGln(CCA)がアラニンに置換されているコドンGCA(下線部)を有する以下の所望の配列が存在することを確認した:
【0096】
【化2】

全長fnbAのコード配列を得るため、Nco1およびKpn1を用いて、プラスミドfnbA103Aに含まれている変異型Gln103Ala fnbA遺伝子の5’側半分を切り出した。そして、得られたDNAフラグメントをpLP1125(全長の野生型fnbAを含む)のNco1−Kpn1部位にクローニングした。このライゲーションの産物(pLP1149)は、全部で2.517kbのfnbA遺伝子のDNA配列解析によれば、全長fnbA遺伝子の中にGln103Ala変異を含んでいる。
【0097】
同様にして、Lysに対するコドン(AAA)がAlaに対するコドン(GCA、下線部)に置換されている合成オリゴヌクレオチド
【0098】
【化3】

を用いて野生型FnbAのLys762をAlaによって置換させた。このプライマーを用いて、野生型fnbA遺伝子の3’側のほぼ半分に相当するヌクレオチドを含むプラスミドpLP1144にアニールした。プライマー伸長および大腸菌宿主の形質転換の後、上記したように、プラスミドfnbA762AにおいてLysコドン(AAA)が、Alaに対するコドン(GCA、下線部)で置換されていることを示すDNA配列解析によって変異領域の存在を確認した。プラスミドfnbA762AをSpe1およびNot1で分解し、同じ酵素で切断したpLP1125の中に得られたフラグメントをライゲーションして、プラスミドfnbA762Aに含まれているLys762Ala変異を全長fnbAに導入した。fnbA遺伝子全部のDNA配列決定によれば、得られた組み換えプラスミドpLP1150は、Lys762Ala変異を含んでいる。
【0099】
Gln103Ala変異(イタリック体)に加えてAla105に対するコドン(GCA、下線部)を含む合成オリゴヌクレオチド配列:
【0100】
【化4】

を用いて、二重変異
【0101】
【化5】

(103位および105位のGlnがAlaで置換されている)を構築した。このプライマーをpLP1149(fnbAQ103A)にアニールし、この変異を含む遺伝子部分の全域にわたって伸長産物(プラスミド5’103A+5’105A)の配列を決定した。そして、この二重変異を含むNco1,Kpn1フラグメントを用いて、pLP1125の野生型配列を置換してpLP1155を産生した。pLP1155に含まれる全fnbA遺伝子を配列決定して、二重変異が存在することを確認した。鋳型であるプラスミドpLP1150を用いたDNA合成を開始させるためにオリゴヌクレオチド
【0102】
【化6】

を用いて、この二重変異Lys620Ala,Lys762Alaを構築した。このオリゴヌクレオチドは、野生型Lys620コドンの代わりにAla620(下線部)に対するGCAコドンを含んでいた。DNA配列決定したところによれば、得られたプラスミドは、pLP1150本来のLys762Ala変異に加えてLys620Ala変異を含んでいた。野生型配列を置換している二重変異体のSpe1,Not1 DNAフラグメントを用いて、pLP1125に二重変異領域をサブクローニングした。得られたプラスミドpLP1156を全fnbA遺伝子にわたって配列決定して、Lys620Ala,Lys762Ala変異の存在を確認した。すべての変異が、fnbA遺伝子を2つの部分に分けたものに構築されるまでこの処理を繰り返す。上記した産物クローニング処理法によって各セットの変異を組み合わせると、8個すべての変異を含むfnbA遺伝子が得られる。
【0103】
(実施例5)
(rFnbA変異体の架橋特性の評価)
第XIIIa因子に対する変異型rFnbAの反応性の低下が、さまざまな方法を用いて示される。蛍光性低分子プローブであるダンシルカダベリンおよびダンシル−PGGQQIVを、変異型rFnbAのトランスグルタミナーゼ反応性を評価するために利用する。第XIIIa因子による上記プローブの変異型rFnbAへの取り込みがないことは、反応性Gln残基およびLys残基が存在しないことを示す。第XIIIa因子に対する変異型rFnbAの反応性が低下または消失していることの実証は、第XIIIa因子に触媒されるヒトフィブロネクチンおよびフィブリンへの架橋を受ける能力を評価することによっても行われる。第XIIIa因子触媒による蛍光プローブの取り込み、およびフィブロネクチンおよびフィブリンへとの架橋反応も、野生型rFnbAを陽性対照として行われる。
【0104】
以下の例では、部位特異的変異誘発法を用いて、同定された反応性のGln部位およびLys部位をAla残基で置換し、これらの変異の効果を、FnbA−フィブリンおよびFnbA−フィブロネクチンの架橋反応で評価した。単一残基FnbA変異体では、主要な反応性Gln103部位をAla残基で置換し、1QFnbAと名づけた。FnbA変異体において、同定されたGln103、105、783、830、およびLys157、503、620、762の部位のすべてをAla残基で置換して、4Q4KFnbAと名づけた。1QFnbA変異体および4Q4KFnbA変異体の第XIIIa因子反応性を、野生型FnbAレセプターのそれと比較し、その結果を、ブドウ球菌の接着およびコロニー形成における宿主のトランスグルタミナーゼの役割に関して検討する。
【0105】
(実施例6)
(1QFnbA変異体の生成(Q103A変異))
黄色ブドウ球菌(S.aureus)株ATCC49525由来の染色体DNAを鋳型として用いたPCR増幅によって、ブドウ球菌FnbAのNH2末端A領域(残基1〜511)をコードするfnbA遺伝子の1533領域を産生した。以下の
【0106】
【化7】

のPCRプライマーを用いて増幅を行った。順方向プライマーは、成熟配列のコード領域の直前にNco1制限酵素部位(下線部)およびATG開始コドンを取り込んでいた。逆方向プライマーは、コードセグメントの直後にTAA終止コドン、その後にBamHI部位(下線部)を含んでいた。増幅されたDNAフラグメントを単離し、NcoIおよびBamHI制限酵素で処理し、その後pET−28aベクター(Novagen,Inc.,Madison,WI)にライゲーションした。fnbA遺伝子の変異誘発は、QuikChange II XL部位特異的変異誘発キット(Stratagene,La Jolla,CA)を用いて行った。変異体DNA鎖を合成するために、本発明者らは、1533bpのfnbA遺伝子フラグメントを含むpET−28aベクターを鋳型として用いた。合成オリゴヌクレオチド
【0107】
【化8】

およびその相補鎖を、変異原プライマーとして利用した。変異原プライマーは、103位で所望のGln→Ala変異を生成するためにCAAに代わってGCAコドンを含む。温度サイクリング、Pfu Ultra DNAポリメラーゼを用いたプライマー伸長、およびエンドヌクレアーゼDpnI(Stratagene,La Jolla,CA)による(ヘミ)メチル化された鋳型の分解を、製造業者の指示に従って行った。変異したDNAを、ニック修復させるために形質転換受容性XL 10−Gold大腸菌細胞(Stratagene)の中に形質転換した。得られたプラスミドDNAを制限酵素のNcoIおよびKpnIで分解して、CAA→GCA変異を含むfnbA遺伝子の680bpのDNAフラグメントを、野生型fnbA遺伝子(FnbA残基1〜839)を含むpET−28aベクターの中にサブクローニングした(Matsuka et al.2003)。制限酵素のNcoIおよびKpnIを用いて、pET−28a/fnbA遺伝子ベクターの中に変異した680bpのDNAフラグメントをライゲーションした結果、変異型FnbA(Q103A FnbA)をコードする2517bpのfnbA遺伝子の回復が得られた。タンパク質発現のため、得られたpET−28aプラスミド(Q103A FnbA変異体)を、BL21(DE3)大腸菌細胞に形質転換した。所望のQ103A変異が存在することを、fnbA遺伝子の変異領域を配列決定して確認した。
【0108】
(実施例7)
(4Q4K FnbA変異体の作出(Gln103Ala、Gln105Ala、Gln783Ala、Gln830Ala、Lys157Ala、Lys503Ala、Lys620Ala、およびLys762Ala変異))
K762A変異の導入。黄色ブドウ球菌(S.aureus)株ATCC49525由来の染色体DNAを鋳型として用いたPCR増幅によって、ブドウ球菌(S.aureus)FnbAのCOOH末端領域(残基512〜839)をコードするfnbA遺伝子の領域を産生した。以下の
【0109】
【化9】

のPCRプライマーを用いて増幅を行った。順方向プライマーおよび逆方向プライマーは、それぞれNcoI部位およびBamHI部位(下線部)を取り込んでいた。増幅されたDNAフラグメントを単離し、NcoIおよびBamHI制限酵素で処理して、pET−28aベクター(Novagen,Inc.,Madison,WI)にライゲーションした。fnbA遺伝子の984bpのフラグメントを含むpET−28aベクターを鋳型として、そして合成オリゴヌクレオチド
【0110】
【化10】

およびその相補鎖を変異原プライマーとして用いて、変異DNA鎖の合成を行った。変異原プライマーは、762位で所望のLys→Ala変異を作出するためにAAAに代わってGCAコドンを含んでいた。変異したDNAを、形質転換受容性XL 10−Gold大腸菌(E.coli)細胞(Stratagene,La Jolla,CA)の中に形質転換した。得られたプラスミドをSpeIおよびNotI制限酵素で切断し、612bpの変異DNAフラグメントを、全長の野生型fnbA遺伝子(FnbA残基1〜839)を含むpET−28aベクターの中にサブクローニングした。
【0111】
Q105A変異およびK157A変異の導入。単一変異(Q103A)および二重変異(Q103A、Q105A)をそれぞれfnbA遺伝子に含むpET−28a鋳型を用いて、連続的にQ105A変異およびK157A変異を生成した。合成オリゴヌクレオチド
【0112】
【化11】

およびその相補鎖を、Q105A変異の変異原プライマーとして採用し、一方、
【0113】
【化12】

およびこの相補鎖を、K157A変異を導入するために利用した。3つ(Q103A、Q105A、およびK157A)の変異を含む変異DNAを形質転換受容性DH 10B大腸菌(E.coli)細胞(Invitrogen,Carlsbad,CA)に形質転換した。得られたプラスミドをNcoIおよびKpnI制限酵素で切断し、その後pET−28aベクターの中にサブクローニングするために680bpの変異DNAフラグメントを単離した。
【0114】
K620A変異の導入。単一変異(K762A)をfnbA遺伝子に含むpET−28a鋳型を用いてK620A変異を生成した。これは、変異原オリゴヌクレオチド
【0115】
【化13】

およびその相補鎖を用いて行われた。2つ(K620AおよびK762A)の変異を含む変異DNAを形質転換受容性DH 10B大腸菌(E.coli)細胞(Invitrogen,Carlsbad,CA)に形質転換した。得られたプラスミドをBsrGIおよびSpeI制限酵素で切断し、1119bpの変異DNAフラグメントを単離して、単一のK762A変異を有するfnbA遺伝子を含むpET−28aベクターの中にサブクローニングした。
【0116】
K503A変異の導入。fnbA遺伝子に二重変異(K620A、K762A)を含むpET−28a鋳型を用いてK503A変異を作出した。合成オリゴヌクレオチド
【0117】
【化14】

およびその相補鎖を変異原プライマーとして利用した。変異DNAを形質転換受容性DH
10B大腸菌(E.coli)細胞(Invitrogen,Carlsbad,CA)に形質転換した。得られたプラスミドをKpnIおよびSpeI制限酵素で切断し、K503A変異およびK620A変異を含む1256bpの変異DNAフラグメントを、引き続きpET−28aベクターの中にサブクローニングするために単離した。
【0118】
Q783A変異の導入。fnbA遺伝子に二重変異(K620A、K762A)を含むpET−28a鋳型を用いてQ783A変異を生成した。合成オリゴヌクレオチド
【0119】
【化15】

およびその相補鎖を変異原プライマーとして利用した。変異DNAを形質転換受容性DH
10B大腸菌細胞(Invitrogen,Carlsbad,CA)に形質転換した。得られたプラスミドをSpeIおよびNotI制限酵素で切断し、2つ(K762AおよびQ783A)の変異を含む612bpの変異DNAフラグメントを、引き続きpET−28aベクターの中にサブクローニングするために単離した。
【0120】
7つの変異(680bp−Q103A、Q105A、K157A;1265bp−K503A、K620A;および612bp−K762A、Q783A)を含む3つのDNAフラグメントを、NcoIおよびNotI制限酵素で切断したpET−28aベクターの中にライゲーションした結果、Q103A、Q105A、K157A、K503A、K620A、K762A、Q783A FnbA変異体をコードする、2516bpのfnbA遺伝子の回復が得られた。
【0121】
Q830A変異の導入。fnbA遺伝子に3つ(K620A、K762AおよびQ783A)を含むpET−28a鋳型を用いてQ830A変異を作出した。合成オリゴヌクレオチド
【0122】
【化16】

およびその相補鎖を変異原プライマーとして利用した。変異DNAを形質転換受容性DH
10B大腸菌細胞(Invitrogen,Carlsbad,CA)に形質転換した。得られたプラスミドをSpeIおよびNotI制限酵素で切断し、K762A、Q783AおよびQ830Aの変異を含む612bpの変異DNAフラグメントを、pET−28aベクターの中にサブクローニングするために単離した。この結果、Q103A、Q105A、K157A、K503A、K620A、K762A、Q783A、およびQ830Aという全部で8個の変異を含むFnbAをコードするfnbA遺伝子の回復が得られた。
【0123】
得られたプラスミドDNAを、タンパク質発現のためにBL21(DE3)大腸菌細胞に形質転換した。pET−28aベクターにサブクローニングする前に特異的変異を含む各生成DNAフラグメントを配列決定した。回復された変異fnbA遺伝子をもう一度配列決定して、所望の変異が存在すること、および全コード領域の完全性を確認した。
【0124】
タンパク質。野生型FnbA、ならびに1Q FnbA変異体および4Q4K FnbA変異体の発現および精製を、他で記載されたように(Matsuka et al.2003)実施した。単離されたFnbA調製物を、20mMのTris(pH7.4)、150mMのNaClに対して透析し、アリコート化し、そして−20℃で凍結保存した。
【0125】
抗体。既述した通りに、ウサギにおいて抗rFnbAポリクローナル抗体を作製した(Matsuka et al.2003)。マウスモノクローナル抗フィブリノゲンAα鎖(Aα 529〜539、クローン1C2−2)抗体は、Accurate Chemical and Scientific Corp.(Westbury,NY)から購入した。マウスモノクローナル抗フィブロネクチン抗体(クローン2B6−F9)は、Cedarlane Laboratories(Hornby,Ontario,Canada)から入手した。ヤギの抗ウサギおよび抗マウスのIgGアルカリホスファターゼ結合体は、BioRad Laboratories(Hercules,CA)から購入した。
【0126】
ペプチドの分子量の理論的推定。Peptide Companion V1.25ソフトウエア(CSPS Pharmaceuticals,Inc.,San Diego,CA)を用いて、ブドウ球菌rFnbAの既知の配列から、Glu−Cプロテイナーゼによって生じるペプチドの分子量の計算を行った。ペプチドの分子量に対するダンシル−PGGQQIV(930.44Da)修飾の効果を、プローブによる質量増加を考慮して計算した。各ε−(γ−グルタミル)リジンのイソペプチド結合は、1個のアンモニア(17.03Da)の遊離を伴うため、それに従って最終分子量値を調整した。
【0127】
ダンシル−PGGQQIV標識ペプチドの逆相HPLC分離。Aquapore RP−300 C8カラム(Brownlee Labs,San Francisco,CA)上で、0.1%トリフルオロ酢酸中のアセトニトリルを用いた勾配溶離によってダンシル−PGGQQIV標識ペプチドを分離した。分離は、ProStar蛍光検出装置(Varian,Palo Alto,CA)を装備したDynamax HPLC装置を用いて実施した。ペプチドを、アセトニトリルの0〜50%の直線的勾配で流速0.5ml/分で90分間にわたり溶離させた。210nmにおける吸光度、および350nmで励起したときの550nmにおける蛍光を観測してペプチドの溶離を検出した。この蛍光トレーサーのピークを回収して、より小さな容量(50〜200μl)に濃縮した後、同じカラムに再注入した。第2回目の溶離を、アセトニトリルの10〜20%または20〜35%の直線的勾配を用いて流速0.5ml/分で60分間にわたって行った。単離されたダンシル−PGGQQIVによって標識されたペプチドを、質量分析に供した。
【0128】
質量スペクトル解析。MALDI−TOF質量分析計Voyager DE−STR (Perseptive Biosystems,Foster City,CA)を用いて、単離されたペプチドの分子量の決定を行った。337nmでのレーザー脱離(N2レーザー)によって形成されたイオンを、反射方式における20kVの加圧電圧にして記録した。通常、200個の単一のスペクトルを、その単一/ノイズ比を向上させるために蓄積して、Data Exploreソフトウエアを用いて解析した。α−シアノ−4−ヒドロキシ桂皮酸(Aldrich Chemical Co.,St.Louis,MO)を基質として用いた。70%アセトニトリル/0.1%トリフルオロ酢酸中10mg/mlの基質化合物溶液の1μlを、1μlのペプチド溶液(5〜10pmole/μl)と混合した。MALDI−TOF MSのため、1μlのこの混合液をステンレス鋼のサンプル標的の上にスポットして、室温で乾燥させた。ヒトGlu1−フィブリノペプチドB、ヒトアンギオテンシンI、および合成des−Arg1−ブラジキニンを用いて、質量スペクトルを外部的に較正した。
【0129】
SDS−PAGEおよびウエスタンブロット解析。SDS−PAGEは、既製の3〜8%Tris−酢酸勾配ゲル(Invitrogen,Carlsbad,CA)を用いて実施した。本研究におけるSDSポリアクリルアミドゲルはすべて、クーマシーブリリアントブルーR(BioRad Laboratories,Hercules,CA)で染色した。ウエスタンブロット解析には、タンパク質サンプルをニトロセルロース膜に電気ブロットして、対応するウサギポリクローナル抗体またはマウスモノクローナル抗体によって免疫染色した。膜をヤギの抗ウサギまたは抗マウスのアルカリホスファターゼ結合二次抗体で処理し、アルカリホスファターゼ活性を、アルカリホスファターゼ結合基質(BioRad Laboratories,Hercules,CA)で現像した。
【0130】
第XIII因子の活性化。500μg/mlの第XIII因子(Haematologic Technologies,Inc.,Essex Junction,VT)を、10mMのジチオスレイトールおよび20mMのCaC12を含むTBS緩衝液(pH7.4)中、0.25U/mlのトロンビン(Sigma,St.Louis,MO)で処理して活性化した。37℃で20分間インキュベートした後、モル過剰のヒルジン(Sigma,St.Louis,MO)を加えてトロンビンを不活性化し、この混合液を第XIIIa因子として使用した(Takagi,et al.1995)。
【0131】
ダンシルカダベリンおよびダンシル−PGGQQIVプローブの取り込み。活性化された第XIII因子を用いてダンシルカダベリン(Sigma,St.Louis,MO)またはダンシル−PGGQQIV(New England Peptide,Inc.,Gardner,MA)をFnbA分子種に取り込ませた。ダンシルカダベリンを利用して、第XIIIa因子反応性グルタミンを探査し、ペプチドであるダンシル−PGGQQIVを用いて、反応性リジンを探査した。取り込みは、2μMの野生型または変異型のrFnbAを30μg/mlの第XIIIa因子とともに、2mMのダンシルカダベリンまたは2mMのダンシル−PGGQQIVのいずれかの存在下で、それぞれ、20mM Tris(pH7.4)、150mMのNaCl、5mMのDTT、5mMのCaC12中か、または20mM Tris(pH8.5)、15mMのNaCl、5mMのDTT、5mMのCaC12中で、3℃でインキュベートすることにより実施した。対照反応も、2mMのEDTAを含む同じ緩衝液中で行った。種々の時点で、2%SDSおよび10%β−メルカプトエタノールを加えて反応を停止させ、95℃で加熱してSDS−PAGEで解析した。紫外光下でゲルを試験し、次いでクーマシーブリリアントブルーで染色した。
【0132】
フィブリンへの架橋。2μMの野生型または変異型のFnbAの存在下または不在下で、5μMのヒトフィブリノゲン(Calbiochem,San Diego,CA)および15μg/mlの第XIII因子を含む溶液に、0.5U/mlのトロンビンを加えて、フィブリン重合および第XIIIa因子触媒によるフィブリンの架橋を開始させた。架橋反応は、5mMのCaC12を含むTBS緩衝液(pH7.4)中、37℃で実施した。種々の時点で、20mM Tris(pH7.2)、9M尿素、40mMジチオスレイトール、2%SDSを加えて反応を停止させた。血塊を37℃で30分間溶解させ、95℃で加熱し、サンプルをSDS−PAGE/ウエスタンブロットで解析した。
【0133】
フィブロネクチンへの架橋。1μMの野生型または変異型のFnbA、および2μMのヒト血漿フィブロネクチン(Sigma,St.Louis,MO)を含む溶液に、15μg/mlの活性化第XIII因子を加えて、フィブロネクチンとの架橋反応を開始させた。この反応は、5mMのCaC12を含むTBS緩衝液(pH7.4)中、37℃で実施した。その後さまざまな時点で、2%SDSおよび10%β−メルカプトエタノールを加えて架橋反応を停止させ、95℃で加熱し、サンプルをSDS−PAGE/ウエスタンブロットで解析した。
【0134】
架橋の反応速度論。第XIIIa因子媒介性のFnbA分子種のフィブリンおよびフィブロネクチンへの架橋の反応速度論を、クーマシーブリリアントブルーで染色されたゲルのデンシトメトリー解析によって調べた。パーソナル・デンシトメーターS1(Molecular Dynamics,Piscataway,NJ)を用いて、レーザーによる濃度測定を行った。各ゲルをスキャンし、生成された画像を、ImageQuant 5.2ソフトウエアを用いて解析した。FnbAがフィブリンまたはフィブロネクチンに架橋したときのFnbAの減少によって反応速度を推定した。FnbAバンドに相当するピークの下にある領域を用いて、反応混合液におけるFnbAの相対量を測定してから、時間の関数としてプロットした。
【0135】
(結果)
ダンシルカダベリンおよびダンシル−PGGQQIVプローブの取り込み。残基Ala1からPro839までを含む、FnbAの野生型および変異型(1Q、4Q4K)(図7A)を、以前記載されたように(Matsuka et al.2003)、pET−28a発現ベクターを用いて大腸菌の中で産生させ、細菌溶解物の可溶性画分から単離した。単離されたタンパク質のそれぞれが、SDS−PAGE上で単一のバンドを示し(図7B)、ASEQKTTTVEで始まる単一のNH2末端配列を示した。同定されたGlnおよびLys部位のAla残基による置換が、第XIIIa因子に対するFnbAの反応性に影響するか否かを調べるために、FnbAの野生型および変異型(1Q、4Q4K)を第XIIIa因子の基質として試験する一連の実験を設計した。ダンシルカダベリンおよびダンシル−PGGQQIVプローブを用いて、野生型FnbAの第XIIIa因子反応性と、1Qおよび4Q4K FnbA変異体の当該反応性との比較を最初に行った(図8)。種々の時点で、ダンシルカダベリンまたはダンシル−PGGQQIVとの反応混合液のアリコートを回収し、SDS−PAGEで解析して、クーマシーブルーで染色する前に紫外光下で調べた。第XIIIa因子およびモル過剰のダンシルカダベリンの存在下では、野生型FnbAに相当するバンドでは、プローブの分子を増加させる酵素結合を反映する蛍光の増加が継続した(図8A)。同じ実験条件下において、1QFnbA変異体へのダンシルカダベリンの取り込みは劇的に低下し、このことは、103位のGlnが、FnbAにおける主要な反応性Gln部位として実際に作用していることを示唆した。さらなる蛍光強度の低下が、4つの同定された反応性Gln残基(Gln103、Gln105、Gln783、およびGln830)のすべてがAlaに置換されている4Q4K
rFnbA変異体で観察された(図8A)。しかし、4Q4K FnbA変異体をダンシルカダベリンおよび第XIIIa因子とともに60分間インキュベートすると、微弱ではあるが検出可能なプローブの取り込みが起きた(図8A)。ダンシルカダベリンとの反応で観察された4Q4K FnbA変異体の残留反応性は、FnbAにさらに別の副次的な反応性Gln部位が存在することを示している可能性がある。
【0136】
第XIIIa因子触媒によるダンシル−PGGQQIVプローブの野生型FnbAへの取り込みが図8Bに示されている。1Q FnbA変異体を同じ反応でアッセイしたところ、そのタンパク質バンドは、野生型FnbAと比較すると僅かに高い蛍光強度を示した(図8)。この結果は、主要な反応性Gln103をAlaで置換すると、1Q FnbA変異体の中にあるLys部位のより効率的なダンシル−PGGQQIV標識が得られたことを示唆している。この効果は、分子内および/または分子間におけるタンパク質架橋に関与することによって、ダンシル−PGGQQIVペプチドプローブと効果的に競合し得る、Gln103部位の強い反応性によるものである。ダンシル−PGGQQIVプローブを野生型FnbAの取り込む際にタンパク質架橋が起きることは、紫外光下で、およびクーマシーブルー染色したときに検出できる低移動度バンドの存在によって裏付けられている(図8B)。第XIIIa因子は、低速度かつ低効率でダンシル−PGGQQIVプローブを4Q4K FnbA変異体に取り込まれたが、このことは、変異したLys157、Lys503、Lys620、およびLys762がアミン供与体部位として作用することを示唆している。しかし、4Q4K FnbA変異体で見られる、ダンシル−PGGQQIVプローブに対する第XIIIa因子反応性の全体的な低下が、ダンシルカダベリンに対するほど顕著ではなかったことは明らかである。これは、さらに別の反応性Lys部位が、ダンシル−PGGQQIVプローブによる酵素的修飾に利用可能なままであることを示している。
【0137】
第XIIIa因子介在によるフィブリンへの架橋。1Q FnbA変異体および4Q4K FnbA変異体の第XIIIa因子反応性を、フィブリン架橋反応において評価した。対照反応では、野生型FnbAが、高分子量ヘテロ複合体の形成をもたらすフィブリンのα鎖に架橋された(Matsuka et al.2003)。架橋は、野生型FnbAに相当するバンドの減弱と、FnbA−α鎖ヘテロダイマーに相当する見かけの分子量をもつ顕著なバンドの出現とを伴っていた(図9A、B、およびC、バンドa)。架橋反応の産物(バンドa、b、c、およびd)は、抗FnbAポリクローナル抗体および抗フィブリノゲンα鎖モノクローナル抗体の両方と反応し(図9BおよびC)、これらの複合体がFnbAとフィブリンα鎖との共有結合から構成されていることを示唆している。同じ実験条件下で、2つのFnbA変異体(1Qおよび4Q4K)が、極めて低い第XIIIa因子架橋反応を示した。クーマシーブルー染色(図9A)、または抗FnbAポリクローナル抗体(図9B)および抗フィブリノゲンα鎖モノクローナル抗体(図9C)による免疫染色を行うと、ほんの微量のFnbA変異体−αフィブリン鎖ヘテロダイマーが検出された。フィブリンおよび第XIIIa因子とインキュベートしたときの野生型および変異型のFnbA分子種の消費を、デンシトメトリー解析を用いて調べた(図10)。図10に示されているように、野生型のFnbAは、1Qまたは4Q4KのFnbA変異体よりもずっと速い速度で反応した。120分間インキュベートした後に、残っている遊離した(架橋されていない)1Qまたは4Q4KのFnbA変異体の量は、野生型FnbAと比較すると約85%多かった。これらのデータは、103位のGln部位が、第XIIIa因子触媒によるFnbAのフィブリンα鎖への結合にもっとも関与していることを示唆している。また、得られたデータは、1Qおよび4Q4Kの両FnbA変異体が、フィブリンとの架橋反応において約85%の反応性の低下を示すことも示している。
【0138】
第XIIIa因子介在によるフィブロネクチンへの架橋。また、1Qまたは4Q4KのFnbA変異体の反応性も、血漿フィブロネクチンとの反応でテストした。このために、SDS−PAGEおよびウエスタンブロット解析をまた利用して、FnbA変異体の反応性をアッセイした。フィブロネクチンとインキュベートとすると、野生型または変異型のFnbAに相当するバンドは、タンパク質が高分子量ヘテロ複合体の中に架橋されていくにつれて徐々に減弱した(図11A、B、およびC)。野生型FnbAまたは変異型FnbAとフィブロネクチンとからなる共有結合架橋高分子量複合体が形成されたことは、抗FnbAポリクローナル抗体(図11B)および抗フィブロネクチンモノクローナル抗体(図11C)を用いたウエスタンブロット解析の結果から明らかであった。SDS−PAGEおよびウエスタンブロットはともに、野生型および変異型のFnbA分子種の反応性の間に殆ど違いがないことを明らかにした(図11)。しかし、デンシトメトリー解析を用いて、反応速度を測定したところ、架橋速度の違いが明らかになった(図12)。1Q
FnbA変異体は、野生型FnbAに近似した速度で反応したが、4Q4K FnbA変異体は、より遅い架橋速度を示した。360分間インキュベートした後、残っている遊離した(架橋されていない)4Q4K FnbA変異体の量は、野生型FnbAまたは1Q FnbA変異体の量と比較すると約35%少なかった。これらのデータは、157位、503位、620位、および762位のLys部位が、第XIIIa因子媒介性FnbAとフィブロネクチンとの架橋に関与し、全部で約35%のFnbAの反応性に寄与することを示唆している。また、これらのデータは、FnbAのさらに別の未同定の反応性Lys部位が、フィブロネクチンとの架橋に関与していることも示唆している。
【0139】
FnbAにおけるさらなる反応性部位としてのLys702の同定。ダンシル−PGGQQIVプローブによる標識実験、およびフィブロネクチンとの架橋の結果は、4Q4K
FnbA変異体において第XIIIa因子にとって利用可能なさらに別の反応性Lys部位があることを示唆している。第XIIIa因子反応性Lys部位の同定について以前報告されたように(米国特許出願第60/573,724号、およびAnderson et al.2004)、ダンシル−PGGQQIVでFnbAを標識することを利用した方法が採用された(Parameswaran et al.1990;Lorand
et al.(1992))。蛍光トレーサーとしてダンシル−PGGQQIVを用い、本発明者らは、FnbAをプローブで標識し、修飾されたタンパク質をGlu−Cプロテイナーゼで切断して、標識されたFnbAペプチドのHPLC分離を行った。その後、単離された蛍光ピーク(トレーサーを含むペプチド)の質量スペクトルおよびNH2末端配列の解析を行ったところ、1つ(ピーク3と名づけられている)を除くすべてのピークの同定ができた(Anderson et al.2004)。FnbAにおけるさらに別の反応性Lys部位を同定するために、逆相HPLCを用いて蛍光ピーク3に相当する物質をさらに精製した後、質量スペクトル解析を行った。ピーク3に由来するプローブ修飾された物質を解析したところ、測定質量[M+H]+が1941.98であるペプチドの存在を明らかにした(図13)。この値は、1つのダンシル−PGGQQIV修飾を含む9重合体NSHVDIKSEペプチドの算定質量と一致する(表4)。このNSHVDIKSEペプチドは、FnbAのCOOH末端領域に由来しており、702位に1個のLys残基を含む。したがって、Lys702が、第XIIIa因子によって標的とされるプローブ修飾された残基として同定された。さまざまな黄色ブドウ球菌(S.aureus)株に由来する既知のFnbAおよびFnbB分子種の多重配列アラインメントによって、Lys702が極めてよく保存されていて、解析されたすべての配列に存在することが明らかになった(図14)。Lys702部位は、FnbAのDuおよびD1のフィブロネクチン結合反復配列の間に位置する領域に存在する(図7)ため、フィブロネクチンをGln3と架橋するために容易に利用できるはずである。さらに、新たに同定されたLys702は、反応性Lys620(Anderson et al.2004)とともに、解析されたFnbAおよびFnbBのすべての配列に存在するただ2つのLys部位である。また、Lys620(蛍光ピーク5、図11D[7])およびLys702(蛍光ピーク3、図11D(Anderson et al.2004))の両部位は、ダンシル−PGGQQIVプローブに対して最も高い反応性を示した。新たに同定されたLys702で観察された高い反応性をもつこと、およびそれがFnbAおよびFnbBの配列で高度に保存されていることは、この部位が、第XIIIa因子が触媒する架橋反応にとって重要であることを示唆している。
【0140】
上記考察および実施例は、特定の実施態様の詳細な説明を提示するにすぎないことが、理解されるべきである。したがって、本発明の精神と範囲を逸脱することなく、さまざまな改変および等価なことがなされ得ることは、当業者にとって明白なはずである。
【0141】
本特許出願において特定されている、すべての雑誌論文、その他の参考文献、特許および特許出願は、その全体が参考として本明細書中に援用される。
【0142】
【数1】

【0143】
【数2】

【0144】
【数3】

【0145】
【数4】

【0146】
【数5】

【0147】
【数6】

【0148】
【表1−2】

【0149】
【表2】

【0150】
【表3】

【0151】
【表4】

【技術分野】
【0001】
(発明の分野)
本発明は、凝固第XIIIa因子に対する反応性が低下した、黄色ブドウ球菌(Staphylococcal aureus)の改変型フィブロネクチン結合タンパク質に関する。この改変型フィブロネクチン結合タンパク質を含む免疫原性組成物は、改善された抗原性特性をもち、より安全に使用される。
【背景技術】
【0002】
(発明の背景)
黄色ブドウ球菌(Staphylococcal aureus;S.aureus)のフィブロネクチン結合タンパク質(Fnb)は、フィブロネクチン、フィブリン、およびフィブリノゲンのようなヒトタンパク質への特異的可逆的結合に関与する表面結合型多機能性レセプターである。このような結合によって、微生物は、手術や血管損傷などの間にヒト宿主に効果的に付着し、その後、侵入して定住できるようになる。Fnbは、S.aureusの感染を防ぐための免疫原性組成物中の含有のための有力な候補物質として評価されてきた。組み換えFnbで免疫化し、かつ、このタンパク質に対する機能的に活性な抗体を作製することは、ヒト組織に対するS.aureusの初期付着を防ぎ得、それによって、感染を防止し得る可能性がある。しかし、最近の研究は、マウス、ウサギ、およびヒトで生成された抗体は、野生型Fnbがヒトのフィブロネクチンおよびフィブリンに結合することを阻害しないことを示している。それどころか、これらの抗体は、これらのヒトタンパク質にFnbが結合するのを誘導して、細菌が宿主組織に接着するのを促進する。このことは、ヒトタンパク質への可逆的結合は、宿主組織へのブドウ球菌接着の過程における初期段階としてのみ機能していることを示している。
【0003】
最近の研究では、ブドウ球菌のフィブロネクチン結合タンパク質A(FnbA)は、血漿トランスグルタミナーゼと呼ばれるヒト酵素に対する基質として機能することが実証された(非特許文献1)。これは、FnbAについて、これまで知られていなかった新たな機能である。血漿トランスグルタミナーゼ(第XIIIa因子としても知られる)は、非常に限定された数のヒトタンパク質(表1)の(非可逆的)共有結合架橋を触媒する酵素であり、高分子量のホモポリマーおよびヘテロポリマーの形成をもたらす。第XIII因子は、ポリペプチド鎖内またはポリペプチド鎖間におけるイソペプチド結合の形成を触媒するトランスグルタミナーゼファミリーの酵素の一員である。第XIII因子は血液中を循環しており、従って、細胞外酵素と考えられているが、組織トランスグルタミナーゼ(TG)(例えば、肝臓TG、ケラチノサイトTG、表皮TG、前立腺TG、および赤血球TG)は、細胞の内側に存在しており、従って、細胞内酵素として作用する(非特許文献2)。別のトランスグルタミナーゼは、同じタンパク質を基質として認識するが、しばしば、異なったアフィニティーおよび/または特異性で認識する。概して、第XIIIa因子に対する基質特異性は、組織トランスグルタミナーゼに対するよりも厳密である(非特許文献3、非特許文献4、非特許文献5)。
【0004】
第XIIIa因子によって触媒される架橋反応は、血液凝固、創傷治癒、および線維素溶解を含む多様な正常な生理学的反応において重要な段階である。第XIIIa因子に触媒されるタンパク質架橋は、グルタミン(Gln)アミノ酸残基とリジン(Lys)アミノ酸残基との間に特異的な共有結合を形成することによって起こる。FnbAは、第XIIIa因子によって簡単にヒトフィブロネクチンおよびヒトフィブリンに架橋されえることが実証されている(非特許文献1)。したがって、FnbAで免疫化すると、FnbA
は、直ちにフィブロネクチンおよびフィブリンに対する共有結合的(不可逆的な)架橋を行う。この抗原とヒトタンパク質との不可逆的複合体の形成は、免疫反応を低下させる可能性、および阻害/中和活性を持たない抗体の産生をもたらす可能性が非常に高い。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Matsukaら,「Staphyloccoccus aureus Fibronectin−Binding Protein Serves as a Substrate for Coagulation Factor XIIIa:Evidence for Factor XIIIa−Catalyzed Covalent Cross−Linking to Fibronectin and Fibrin.」,Biochemistry,2003年,第42巻,p.14643−14652
【非特許文献2】Aeschlimann D.およびPaulsson M.,「Transglutaminases:Protein Cross−Linking Enzymes in Tissues and Body Fluids.」,Thrombosis and Haemostasis,1994年,第71巻,p.402−415
【非特許文献3】Gorman J.J.およびFolk J.E.「Structural features of glutamine substrates for transglutaminases:Specificities of human plasma factor XIIIa and guinea pig liver enzyme toward syntheticpeptides.」,J. Biol. Chem.,1981年,第256巻,p.2712−2715
【非特許文献4】Gorman J.J.およびFolk J.E.「Structural features of glutamine substrates for transglutaminases:Role of extended interactions in the specificity of human plasma factor XIIIa and guinea pig liver enzyme.」,J.Biol.Chem.,1984年,第259巻,9007−9010
【非特許文献5】Fesus L.,Metsis M.L.,Muszbek L.およびKoteliansky,V.E.,「Transglutaminasesensitive glutamine residues of human plasma fibronectin revealed by studying its proteolytic fragments.」,Eur.J.Biochem.,1986年,第154巻,p.371−374
【発明の概要】
【発明が解決しようとする課題】
【0006】
したがって、第XIIIa因子によって触媒されるヒトタンパク質との共有結合架橋に直接関与する、野生型のブドウ球菌フィブロネクチン結合タンパク質の内部にある特異的反応性アミノ酸残基(GlnおよびLys)を同定し、それらの残基を置換して、凝固第XIIIa因子に対する反応性が低く、フィブロネクチンおよびフィブリンへの架橋および不可逆的結合を効果的に阻害する改変型のFnbを作製する必要がある。
【課題を解決するための手段】
【0007】
(発明の要旨)
このように、本発明は、黄色ブドウ球菌(S.aureus)の単離された改変型フィブロネクチン結合タンパク質(Fnb)に関し、この改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミ
ノ酸の変異であり、この改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が野生型Fnbよりも低く、フィブロネクチンおよびフィブリンからなる群より選択される。1つの実施態様においては、これらのアミノ酸はアラニンに変異する。さらなる実施態様においては、単離された改変型FnbはFnbAまたはFnbBに由来する。
【0008】
また、本発明は、上記記載の改変型Fnbであって、その改変がアミノ酸Lys702の変異であるものにも関する。
【0009】
また、本発明は、上記記載の改変型Fnbであって、その改変が、以下に記載のタンパク質および黄色ブドウ球菌(S.aureus)株の残基からなる群より選択される少なくとも1つのアミノ酸の変異である改変型Fnbにも関する。
【0010】
【表1−1】

また、本発明は、黄色ブドウ球菌(S.aureus)の改変型フィブロネクチン結合タンパク質をコードする単離された核酸分子核酸分子にも関し、その改変は、黄色ブドウ球菌(S.aureus)株ATCC49525由来のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、ここでこの改変型フィブロネクチン結合タンパク質は、免疫原性を保持しており、かつ免疫原性組成物に取り込まれて脊椎動物に投与される場合、第XIII因子、第XIIIa因子または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低くなっており、そしてこのヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択される。
【0011】
また、本発明は、上記記載の単離された核酸分子であって、その改変がアミノ酸Lys702の変異である単離された核酸分子にも関する。
【0012】
また、本発明は、調節配列に作動できるように連結された、本明細書記載の単離核酸分子を含む核酸構築物にも関連する。
【0013】
また、本発明は、本明細書記載の核酸構築物を含む組み換え宿主細胞、および本明細書記載の黄色ブドウ球菌(S.aureus)の改変型フィブロネクチン結合タンパク質を産生する方法にも関し、この方法は、本発明の組み換え宿主細胞を、改変型フィブロネクチン結合タンパク質を発現させるために適した条件下で維持することを包含する。
【0014】
また、本発明は、黄色ブドウ球菌(S.aureus)に対する免疫応答を引き起こす免疫原性組成物を調製するために改変型フィブロネクチン結合タンパク質、またはそれを発現する組み換え宿主細胞を使用することにも関連する。
【0015】
さらに、本発明は、生理学的に受容可能なビヒクルと、黄色ブドウ球菌(S.aureus)の改変型フィブロネクチン結合タンパク質とを含む免疫原性組成物に関し、このFnbタンパク質は、免疫原性を保持しており、免疫原性組成物に取り込まれて脊椎動物に投与されると、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質(例えば、フィブロネクチンおよびフィブリン)と共有結合架橋する能力が、野生型Fnbよりも低くなっている。改変型Fnbは、後に脊椎動物が黄色ブドウ球菌(S.aureus)に感染する際に野生型Fnbがフィブロネクチンおよびフィブリンに結合することを促進しない。この改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異である。この免疫原性組成物はまた、アジュバントも含み得る。
【0016】
本発明は、また、生理学的に受容可能なビヒクル、および黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする核酸分子を含む免疫原性組成物にも関する。ここで、この改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、この改変型Fnbは免疫原性を保持しており、また、免疫原性組成物に取り込まれて脊椎動物に投与される場合、この改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質(フィブロネクチンおよびフィブリンからなる群より選択される)と共有結合架橋する能力が野生型Fnbよりも低く、かつ、後にこの脊椎動物が黄色ブドウ球菌(S.aureus)に感染する際に、野生型Fnbがフィブロネクチンおよびフィブリンに結合することを促進しない。
【0017】
また、本発明は、改変がアミノ酸Lys702の変異である、上記のような免疫原性組成物にも関連する。
【0018】
また、本発明は、黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法にも関連し、この方法は、生理学的に受容可能なビヒクル、および免疫学的に有効な量の黄色ブドウ球菌(S.aureus)改変型フィブロネクチン結合タンパク質を含む組成物を脊椎動物に投与する工程を包含し、ここでこの改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、この改変型フィブロネクチン結合タンパク質は、免疫原性を保持しており、かつ、免疫原性組成物に取り込まれて脊椎動物に投与されると、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質(例えば、フィブロネクチンおよびフィブリン)に共有結合架橋する能力が野生型Fnbよりも低く、また、後に脊椎動物が黄色ブドウ球菌(S.aureus)に感染する際に、野生型フィブロネクチン結合タンパク質がこのヒトタンパク質に結合することを促進しない。
【0019】
さらに、本発明は、生理学的に受容可能なビヒクル、および改変型黄色ブドウ球菌(S.aureus)フィブロネクチン結合タンパク質をコードする、免疫学的に有効な量の核酸分子を、場合によってはトランスフェクション促進因子とともに含む組成物を脊椎動物に投与する工程を包含する、黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法に関連し、この改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、この改変型フィブロネクチン結合タンパク質は、免疫原性を保持しており、かつ、免疫原性組成物に取り込まれて脊椎動物に投与される場合、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質(例えば、フィブロネクチンおよびフィブリン)に共有結合架橋する能力が野生型Fnbよりも低く、また、後に脊椎動物が黄色ブドウ球菌(S.aureus)に感染する際に、野生型フィブロネクチン結合タンパク質がこのヒトタンパク質に結合することを促進しない。
【0020】
一つの実施態様において、脊椎動物は血清反応陰性のヒトである。
【0021】
また、本発明は、上記したような免疫化の方法であって、改変がアミノ酸Lys702の変異である方法にも関連する。
本発明はまた、以下の項目を提供する。
(項目1)
黄色ブドウ球菌(Staphylococcal aureus(S.aureus))の単離された改変型フィブロネクチン結合タンパク質(Fnb)であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、ここで該改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合により架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択される、単離された改変型Fnb。
(項目2)
FnbAまたはFnbBに由来する、項目1に記載の単離された改変型Fnb。
(項目3)
上記変異がGln103に存在する、項目1に記載の単離された改変型Fnb。
(項目4)
上記変異が、グルタミンからアラニンへである、項目3に記載の単離された改変型Fnb。
(項目5)
上記変異がGln105に存在する、項目1に記載の単離された改変型Fnb。
(項目6)
上記変異がグルタミンからアラニンへである、項目5に記載の単離された改変型Fnb。
(項目7)
上記変異がLys157に存在する、項目1に記載の単離された改変型Fnb。
(項目8)
上記変異がリジンからアラニンへである、項目7に記載の単離された改変型Fnb。
(項目9)
上記変異がLys503に存在する、項目1に記載の単離された改変型Fnb。
(項目10)
上記変異がリジンからアラニンへである、項目9に記載の単離された改変型Fnb。
(項目11)
上記変異がLys620に存在する、項目1に記載の単離された改変型Fnb。
(項目12)
上記変異がリジンからアラニンへである、項目11に記載の単離された改変型Fnb。
(項目13)
上記変異がLys762に存在する、項目1に記載の単離された改変型Fnb。
(項目14)
上記変異がリジンからアラニンへである、項目13に記載の単離された改変型Fnb。
(項目15)
上記変異がGln783に存在する、項目1に記載の単離された改変型Fnb。
(項目16)
上記変異がグルタミンからアラニンへである、項目15に記載の単離された改変型Fnb。
(項目17)
上記変異がGln830に存在する、項目1に記載の単離された改変型Fnb。
(項目18)
上記変異がグルタミンからアラニンへである、項目17に記載の単離された改変型Fnb。
(項目19)
上記変異が、Gln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830の各残基に存在する、項目1に記載の単離された改変型Fnb。
(項目20)
Gln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830における各残基の変異が、Alaへの変異である、項目19に記載の単離された改変型Fnb。
(項目21)
Gln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830のいずれか1つの残基の変異が、Alaへの変異である、項目19に記載の単離された改変型Fnb。
(項目22)
生理学的に受容可能なキャリアと、黄色ブドウ球菌(S.aureus)の改変型フィブロネクチン結合タンパク質(Fnb)とを含む免疫原性組成物であって、該改変が、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、該免疫原性組成物に組み込まれて脊椎動物に投与される場合に、該改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、該改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、免疫原性組成物。
(項目23)
アジュバントをさらに含む、項目22に記載の免疫原性組成物。
(項目24)
黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法であって、該方法は、生理学的に受容可能なビヒクルおよび免疫学的に有効な量の単離された改変型黄色ブドウ球菌(S.aureus)Fnbを含む組成物を、該脊椎動物に投与する工程を包含し、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、かつ、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質に共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該単離された改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、方法。
(項目25)
脊椎動物がセロネガティブのヒトである、項目24に記載の方法。
(項目26)
上記改変が、黄色ブドウ球菌(S.aureus)株Mu50のFnbAのグルタミン(Gln)134、Gln136、リジン(Lys)188、Lys534、Lys651、Lys793、Gln814、およびGln861の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目27)
上記改変が、黄色ブドウ球菌(S.aureus)株N315のFnbAのグルタミン(Gln)134、Gln136、リジン(Lys)188、Lys534、Lys651、Lys793、Gln814、およびGln861の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目28)
上記改変が、黄色ブドウ球菌(S.aureus)株MW2のFnbAのグルタミン(Gln)139、Gln141、リジン(Lys)539、Lys656、Lys798、Lys819、およびGln866の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目29)
上記改変が、黄色ブドウ球菌(S.aureus)株MSSA−476のFnbAのグルタミン(Gln)147、Gln149、リジン(Lys)547、Lys664、Lys806、Gln827、およびGln874の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目30)
上記改変が、黄色ブドウ球菌(S.aureus)株COLのFnbAのグルタミン(Gln)139、Gln141、リジン(Lys)655、Lys797、およびGln865の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目31)
上記改変が、黄色ブドウ球菌(S.aureus)株8325−4のFnbAのグルタミン(Gln)139、Gln141、リジン(Lys)655、Lys797、およびGln865の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目32)
上記改変が、黄色ブドウ球菌(S.aureus)株EMRSA−16のFnbAのグルタミン(Gln)147、Gln149、リジン(Lys)549、Lys666、Gln791、およびGln838の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目33)
上記改変が、黄色ブドウ球菌(S.aureus)株Mu50のFnbBのグルタミン(Gln)111、リジン(Lys)602、Gln765、およびGln812の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目34)
上記改変が、黄色ブドウ球菌(S.aureus)株N315のFnbBのグルタミン(Gln)111、リジン(Lys)602、Gln765、およびGln812の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目35)
上記改変が、黄色ブドウ球菌(S.aureus)株MW2のFnbBのリジン(Lys)598、Lys740、およびグルタミン(Gln)808の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目36)
上記改変が、黄色ブドウ球菌(S.aureus)株MSSA−476のFnbBのリジン(Lys)598、Lys740、およびグルタミン(Gln)808の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目37)
上記改変が、黄色ブドウ球菌(S.aureus)株COLのFnbBのリジン(Lys)591、Lys733、およびグルタミン(Gln)801の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目38)
上記改変が、黄色ブドウ球菌(S.aureus)株8325−4のFnbBのリジン(Lys)591、Lys733、およびグルタミン(Gln)801の残基からなる群より選択される少なくとも1つのアミノ酸の変異である、項目1に記載の単離された改変型Fnb。
(項目39)
黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする単離された核酸分子であって、該改変が、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択される、核酸分子。
(項目40)
制御配列に制御可能に連結された項目39に記載の単離された核酸分子を含む、発現ベクター。
(項目41)
項目40に記載の発現ベクターを含む、組み換え宿主細胞。
(項目42)
改変型Fnbを産生する方法であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質となるヒトタンパク質に共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、該方法は、項目41に記載の組み換え宿主細胞を、改変型Fnbの発現に適した条件下で維持する工程を包含する、方法。
(項目43)
生理学的に受容可能なビヒクルと、黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする単離核酸分子とを含む免疫原性組成物であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、該改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、免疫原性組成物。
(項目44)
形質転換促進剤をさらに含む、項目43に記載の免疫原性組成物。
(項目45)
脊椎動物において免疫応答を誘導する方法であって、該方法は、該脊椎動物に項目43に記載の免疫原性組成物を、免疫応答を誘導するのに有効な量投与する工程を包含する、方法。
(項目46)
黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法であって、該方法は、生理学的に受容可能なキャリアと、免疫学的に有効な量の黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする核酸分子とを含む組成物を、該脊椎動物に投与する工程を包含し、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、かつ、免疫原性組成物に取り込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質に共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該改変型Fnbが、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、方法。
(項目47)
上記脊椎動物がセロネガティブのヒトである、項目46に記載の方法。
(項目48)
黄色ブドウ球菌(Staphylococcal aureus(S.aureus))の単離された改変型フィブロネクチン結合タンパク質(Fnb)であって、該改変が、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbが、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択される、単離された改変型Fnb。
(項目49)
上記変異がLys702に存在する、項目48に記載の単離された改変型Fnb。
(項目50)
上記変異がリジンからアラニンへである、項目49に記載の単離された改変型Fnb。
(項目51)
上記変異が、Gln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830の各残基に存在する、項目48に記載の単離された改変型Fnb。
(項目52)
Gln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830の各残基の変異がAlaへの変異である、項目51に記載の単離された改変型Fnb。
(項目53)
Gln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830のいずれか1つの残基の変異がAlaへの変異である、項目48に記載の単離された改変型Fnb。
(項目54)
生理学的に受容可能なビヒクルと、黄色ブドウ球菌(S.aureus)の単離された改変型フィブロネクチン結合タンパク質(Fnb)とを含む免疫原性組成物であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、免疫原性組成物に取り込まれて脊椎動物に投与される場合に、該改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、免疫原性組成物。
(項目55)
さらにアジュバントを含む、項目54に記載の免疫原性組成物。
(項目56)
黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法であって、該方法は、生理学的に受容可能なキャリアと、免疫学的に有効な量の黄色ブドウ球菌(S.aureus)の単離された改変型Fnbとを含む組成物を該脊椎動物に投与する工程を包含し、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質に共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、該単離された改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染する際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、方法。
(項目57)
上記脊椎動物がセロネガティブのヒトである、項目56に記載の方法。
(項目58)
黄色ブドウ球菌(S.aureus)の改変型フィブロネクチン結合タンパク質をコードする単離された核酸分子であって、該改変が、黄色ブドウ球菌(S.aureus)株ATCC49525由来のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択される、核酸分子。
(項目59)
制御配列に操作可能に連結された項目58に記載の単離された核酸分子を含む、発現ベクター。
(項目60)
項目59に記載の発現ベクターを含む、組み換え宿主細胞。
(項目61)
改変型Fnbを産生する方法であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのグルタミン(Gln)103、Gln105、リジン(Lys)157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質に共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、該方法は、項目60に記載の組み換え宿主細胞を、該改変型Fnbの発現に適した条件下で維持する工程を包含する、方法。
(項目62)
生理学的に受容可能なビヒクルと、黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする単離核酸分子とを含む免疫原性組成物であって、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与されると、該改変型Fnbは、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質と共有結合架橋する能力が、野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、免疫原性組成物。
(項目63)
形質転換促進剤をさらに含む、項目62に記載の免疫原性組成物。
(項目64)
脊椎動物において免疫応答を誘導する方法であって、該方法は、該脊椎動物に項目62に記載の免疫原性組成物を、免疫応答を誘導するのに有効な量投与する工程を包含する、方法。
(項目65)
黄色ブドウ球菌(S.aureus)に対して脊椎動物を免疫化する方法であって、該方法は、生理学的に受容可能なビヒクルと、免疫学的に有効な量の黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする核酸分子とを含む組成物を、該脊椎動物に投与する工程を包含し、該改変は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys702、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異であり、該改変型Fnbは、免疫原性を保持しており、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、第XIII因子、第XIIIa因子、または組織トランスグルタミナーゼに対する基質として機能するヒトタンパク質に共有結合架橋する能力が野生型Fnbよりも低く、該ヒトタンパク質は、フィブロネクチンおよびフィブリンからなる群より選択され、そして該改変型Fnbは、その後に該脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、方法。
(項目66)
上記脊椎動物がセロネガティブのヒトである、項目65に記載の方法。
【図面の簡単な説明】
【0022】
【図1】図1は、第XIIIa因子触媒によるダンシルカダベリンプローブ(パネルAおよびC)およびダンシル−PGGQQIVプローブ(パネルBおよびD)のrFnbAへの取り込みを示す。修飾反応を4時間および18時間行った。4時間(レーン1)および18時間(レーン3)にわたって修飾された未反応のプローブを除去した後、rFnbAサンプルをSDS−PAGEによって分析した。あるいは、4時間および18時間にわたって修飾されたrFnbAサンプルを、トロンビンによりタンパク質限定分解供してから、SDS−PAGEにより分析した(レーン2および4)。電気泳動後、紫外光下でゲルを撮影し(パネルCおよびD)、その後クーマシーブリリアントブルーで染色した(パネルAおよびB)。矢印は、プローブ修飾されたrFnbA、およびトロンビンによって生成したそのフラグメントの位置を示している。各パネルの第5レーンは、表示されている通りの分子量標準を含む。
【図2】図2は、第XIIIa因子で修飾されたrFnbAのトリプシン分解物からの、ダンシルカダベリンで標識されたペプチドのHPLC分離を示す。第XIIIa因子触媒によるrFnbAへのダンシルカダベリンの取り込みを、4時間(パネルAおよびB)および18時間(パネルCおよびD)行った。ダンシルカダベリンで標識されたrFnbA調製物をトリプシンで分解し、ペプチドをAquapore RP−300 C8逆相カラム上で分離した。溶出液を210nmの吸光度および550nmの蛍光によりモニタリングした。蛍光ピークの1(パネルBおよびD)、2、および3(パネルD)を回収して、2回目の逆相クロマトグラフィーを行った後、NH2−末端配列分析および質量スペクトル解析に供した。
【図3】図3は、第XIIIa因子で修飾されたrFnbAのGlu−Cプロテアーゼ分解物からの、ダンシルカダベリンで標識されたペプチドのHPLC分離を示す。第XIIIa因子触媒によるrFnbAへのダンシルカダベリンの取り込みを、4時間(パネルAおよびB)および18時間(パネルCおよびD)行った。ダンシルカダベリンで標識されたrFnbA調製物をGlu−Cプロテアーゼで分解し、ペプチドをAquapore RP−300 C8逆相カラム上で分離した。溶出液を210nmの吸光度および550nmの蛍光によりモニタリングした。蛍光ピークの1(パネルBおよびD)、2、3、4、5、6、および7(パネルD)を回収して、2回目の逆相クロマトグラフィーを行った後、NH2−末端配列分析および質量スペクトル分析に供した。
【図4】図4は、第XIIIa因子で修飾されたrFnbAのGlu−Cプロテアーゼ分解物からの、ダンシル−PGGQQIVで標識されたペプチドのHPLC分離を示す。第XIIIa因子触媒によるrFnbAへのダンシル−PGGQQIVの取り込みは、4時間(パネルAおよびB)および18時間(パネルCおよびD)行った。ダンシル−PGGQQIVで標識されたrFnbA調製物をGlu−Cプロテアーゼで分解し、ペプチドをAquapore RP−300 C8逆相カラム上で分離した。溶出液を210nmの吸光度および550nmの蛍光によりモニタリングした。アスタリスクで示された蛍光ピーク(パネルBおよびD)およびピーク1、2、3、4、5、6、および7(パネルD)を回収して、2回目の逆相クロマトグラフィーを行った後、NH2−末端配列分析および質量スペクトル解析に供した。
【図5】図5は、野生型FnbAのアミノ酸配列内における第XIIIa因子反応性のGln残基およびLys残基の位置を示している。これは、本研究で使用した黄色ブドウ球菌(S.aureus)株ATCC49525のrFnbA(Ala1〜Pro839残基)の構造的構成の概要図(上図)およびそのアミノ酸配列(下図)(配列番号1)である。図5には以下の主な領域の位置が示されている:A−フィブリノゲン結合領域;機能不明のB1−相同反復配列およびB2−相同反復配列;Du、D1、D2、D3、およびD4−フィブロネクチン結合反復配列。矢印は、FnbAのA、Du、D2、およびD4領域内にある、第XIIIa因子反応性Gln残基(103、105、783、および830)およびLys残基(157、503、620、および762)の位置を示す。太字は、FnbAの一次配列における同一の第XIIIa因子反応性のGln残基およびLys残基を表している。下線を引いた文字は、トロンビン分断推定部位Arg202−Gly203の位置を示している。
【図6A】図6は、さまざまな黄色ブドウ球菌(S.aureus)株のFnbAおよびFnbBの分子種のアミノ酸配列のアラインメントを示す(配列番号1〜配列番号14)。第XIIIa因子反応性のGln残基およびLys残基の周辺領域を示す。一番上で特定されている反応性のGln残基およびLys残基の位置は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAでの位置に対応している。FnbA種およびFnbB種の一次配列中の太字は、第XIIIa因子反応性のGln受容体およびLys供与体の保存された部位を強調している。CLUSTAL W(1.81)プログラムを用いた多重配列アラインメントを行った。
【図6B】図6は、さまざまな黄色ブドウ球菌(S.aureus)株のFnbAおよびFnbBの分子種のアミノ酸配列のアラインメントを示す(配列番号1〜配列番号14)。第XIIIa因子反応性のGln残基およびLys残基の周辺領域を示す。一番上で特定されている反応性のGln残基およびLys残基の位置は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAでの位置に対応している。FnbA種およびFnbB種の一次配列中の太字は、第XIIIa因子反応性のGln受容体およびLys供与体の保存された部位を強調している。CLUSTAL W(1.81)プログラムを用いた多重配列アラインメントを行った。
【図7】図7は、本研究で使用した野生型および変異型のFnbA種の略図(上図)と、単離されたタンパク質のSDS−PAGE解析(下図)とを示す。この図は、黄色ブドウ球菌(S.aureus)株ATCC49525由来のFnbA中の以下の主な領域の位置が示されている:A−フィブリン(フィブリノゲン)結合領域;機能不明のB1−相同反復配列およびB2−相同反復配列;ならびにDu、D1、D2、D3、およびD4−フィブロネクチン結合反復配列。反応性Gln残基および導入されたGln→Ala変異の位置を黒い三角形で示し、一方、反応性Lys残基および導入されたLys→Ala変異の位置を白いひし形で示す。FnbA種の略図、および精製タンパク質のSDS−PAGE(4〜20%ゲル)解析を以下の順に示す:1−野生型FnbA;2−1Q FnbA変異型;3−4Q4K FnbA変異型。ゲルの外側のレーンは、図示されているとおりの分子量標準を含む。
【図8】図8は、第XIIIa因子触媒によるダンシルカダベリン(A)およびダンシル−PGGQQIVプローブ(B)の野生型および変異型のFnbAへの取り込みを示す。ダンシルカダベリンの取り込みは、20mMのTris、pH7.4、150mMのNaCl、5mMのDTT、5mMのCaCl2の中で行われたが、ダンシル−PGGQQIVの取り込みは、20mMのTris、pH8.5、15mMのNaCl、5mMのDTT、5mMのCaCl2の中で行われた。対照反応も、2mMのEDTAを含む同じバッファー内で行った。指定された時点でアリコートを取り出し、SDSと混合し、加熱して、SDS−PAGEにより4〜20勾配ゲル上で解析した。60分(A)および120分(B)後に対照反応から取り出されたアリコートにアスタリスクで印をつけた。電気泳動後、紫外光下でゲルを撮影し(パネルAおよびB、下図)、その後クーマシーブリリアントブルーで染色した(パネルAおよびB、上図)。ゲルの外側のレーンは、図示されているとおりの分子量標準を含む。
【図9A】図9は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブリンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、3〜8%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブリノゲンα鎖抗体(C)による免疫染色を行った。矢印は、FnbA、およびフィブリンのα鎖、β鎖、γ鎖、ならびにフィブリンの架橋したγγ鎖の位置を示す。FnbAおよびフィブリンα鎖の間の主な高移動性架橋産物をaと名づけ、架橋産物の低移動性産物をb、c、およびdとして図示している。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、50kDa、および37kDa。
【図9B】図9は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブリンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、3〜8%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブリノゲンα鎖抗体(C)による免疫染色を行った。矢印は、FnbA、およびフィブリンのα鎖、β鎖、γ鎖、ならびにフィブリンの架橋したγγ鎖の位置を示す。FnbAおよびフィブリンα鎖の間の主な高移動性架橋産物をaと名づけ、架橋産物の低移動性産物をb、c、およびdとして図示している。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、50kDa、および37kDa。
【図9C】図9は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブリンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、3〜8%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブリノゲンα鎖抗体(C)による免疫染色を行った。矢印は、FnbA、およびフィブリンのα鎖、β鎖、γ鎖、ならびにフィブリンの架橋したγγ鎖の位置を示す。FnbAおよびフィブリンα鎖の間の主な高移動性架橋産物をaと名づけ、架橋産物の低移動性産物をb、c、およびdとして図示している。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、50kDa、および37kDa。
【図10】図10は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブリンのα鎖への架橋速度を示す。残存する単量体(未架橋)の野生型FnbA(黒丸)、1Q FnbA(白丸)、および4Q4K FnbA(黒三角)の量を、「材料と方法」に記載されるようにアッセイして、時間の関数としてプロットした。
【図11A】図11は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブロネクチンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、4〜20%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブロネクチン抗体(C)による免疫染色を行った。矢印は、FnbAおよびフィブロネクチンの位置を示す。FnbAとフィブロネクチンとの間の架橋産物はa、b、c、およびdとして示されている。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、および50kDa。
【図11B】図11は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブロネクチンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、4〜20%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブロネクチン抗体(C)による免疫染色を行った。矢印は、FnbAおよびフィブロネクチンの位置を示す。FnbAとフィブロネクチンとの間の架橋産物はa、b、c、およびdとして示されている。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、および50kDa。
【図11C】図11は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブロネクチンへの架橋を示す。表示された時点で、反応を終了させ、還元条件下、4〜20%の勾配ゲル上でSDS−PAGEにより解析した。ゲルを電気泳動した後、クーマシーブリリアントブルーで染色するか(A)、または、ニトロセルロース膜への転移に供した後、抗FnbA抗体(B)および抗フィブロネクチン抗体(C)による免疫染色を行った。矢印は、FnbAおよびフィブロネクチンの位置を示す。FnbAとフィブロネクチンとの間の架橋産物はa、b、c、およびdとして示されている。各パネル内の左側のレーンは、上から下へ以下のMr値を有する分子量標準を含む:250kDa、150kDa、100kDa、75kDa、および50kDa。
【図12】図12は、第XIIIa因子触媒による、野生型および変異型のFnbAのフィブロネクチンへの架橋速度を示す。残存する単量体(未架橋)の野生型FnbA(黒丸)、1Q FnbA(白丸)、および4Q4K FnbA(黒三角)の量を、「材料と方法」に記載されるようにアッセイして、時間の関数としてプロットした。
【図13】図13は、第XIIIa因子により修飾された野生型FnbAのGlu−Cプロテアーゼ分解物からの単離されたダンシル−PGGQQIV標識ペプチド(蛍光ピーク3(Andersonら、2004))のMALDI−TOF質量スペクトルを示す。
【図14】図14は、さまざまな黄色ブドウ球菌(S.aureus)株由来のFnbA種およびFnbB種のアミノ酸配列のアラインメントを示す。第XIIIa因子反応性Lys702の周辺領域を示す。一番上で特定されている反応性Lys残基の位置は、黄色ブドウ球菌(S.aureus)株ATCC49525由来のFnbAでの位置に対応している。CLUSTAL W(1.81)プログラムを用いて多重配列アラインメントを行った(Thompson,et al.1994)。
【発明を実施するための形態】
【0023】
(発明の詳細な説明)
FnbAは、第XIIIa因子のトランスグルタミナーゼ作用によって、フィブロネクチンまたはフィブリンに共有結合架橋しており、レセプター−リガンドのホモポリマーまたはヘテロポリマーの形成をもたらす。凝固第XIIIa因子または血漿トランスグルタミナーゼ(EC2.3.2.13)は、分子間ε−(γ−グルタミル)リジンのイソペプチド結合の形成を介して、特異的なタンパク質基質の共有結合架橋を触媒する酵素のトランスアミダーゼという分類級に属する。架橋は、グルタミンのγカルボキシアミド基がアシル供与体(アミン受容体)として働き、リジンのε−アミノ基がアシル受容体(アミン供与体)として働くアシル転移反応を介して起きる(Henschen and McDonagh 1986;Lorand 2001)。
【0024】
第XIII因子は、2つの触媒Aサブユニットと2つの調節Bサブユニットとからなる非活性型テトラマー前駆体A2B2として血液中を循環している。トロンビンに曝露された後、第XIII因子チモーゲンはCa2+依存型の活性化を受けて第XIIIa因子(活性化された第XIII因子:Factor XIII activated)となり、その後フィブリン塊とγ鎖との間、およびフィブリン塊とα鎖との間における共有結合架橋の形成を触媒する。この反応は、血液凝固カスケードの最終事象に相当し、正常な止血に必須のものである。また、第XIIIa因子は、同様のメカニズムによって、いくつか異なるヒトタンパク質をフィブリン塊の中に共有結合的に取り込むことにも関与している。表1参照。それらの中には、血塊への架橋が創傷治癒および線維素溶解に重要な役割を果たす、フィブロネクチンおよびα2−抗プラスミンがある。
【0025】
第XIIIa因子により触媒されるタンパク質−タンパク質の架橋反応は2段階のプロセスを示す。まず、タンパク質同士が互いに特異的に結合して可逆的(非共有結合的)複合体を形成し、次に、第XIIIa因子によって共有結合的に架橋される。通常、第XIIIa因子によって触媒されるタンパク質の架橋は、多くの生理学的反応において重要な役割を果たすさまざまな融合型のホモ重合体構造およびヘテロ重合体構造を生み出す(Lorand and Graham 2003)。黄色ブドウ球菌(S.aureus)がヒトの細胞外マトリックス(ECM)分子に接着するためにトランスグルタミナーゼ活性を利用できるという最近の知見(Matsukaら, 2003)は、タンパク質架橋が、細菌感染に伴う病理反応に関与することを示す。
【0026】
ほとんどの黄色ブドウ球菌(S.aureus)株は、異なってはいるが非常に近縁の2つの遺伝子によってコードされている、1つ(FnbA)または2つ(FnbAおよびFnbB)のフィブロネクチン結合タンパク質を発現する(Signas,Raucciら,1989;Jonsson,Signasら,1991)。成熟型フィブロネクチン結合タンパク質のNH2末端領域は、レセプターのフィブリノゲン/フィブリン結合活性に関与する、約500残基長のA領域によって形成されている。FnbAのA領域は、このタンパク質のFnbB型には存在しない、機能未知の30残基長の反復配列であるB1−B2二重コピーを含む。フィブロネクチン結合タンパク質のCOOH末端領域は、レセプターのフィブロネクチン結合領域を形成するDu、D1、D2、D3、およびD4という、5つの約40残基長の保存的反復配列を含む。フィブロネクチン結合タンパク質のCOOH末端領域は、ソルターゼ(sortase)のトランスペプチダーゼ活性により細胞壁ペプチドグリカンに共有結合的に結合している(Schneewind,Fowlerら,1995)。フィブロネクチンまたはフィブリンに対するFnbAの可逆的結合が、効率的な分子間共有結合架橋には必須である。FnbAのフィブロネクチンまたはフィブリンとの結合は、その後第XIIIa因子によって架橋される供与体リジン残基と受容体グルタミン残基とを適当に配置させる。また、第XIIIa因子は、ペプチドに結合した反応性グルタミン残基のγ−カルボキサミド基と、さまざまな一級アミン(例えば、プトレシン一級アミン、スペルミジン一級アミン、およびカダベリン一級アミン)のアミノ基との間のイソペプチド結合の形成も触媒する(Lorand,Ruleら,1968;Lorand,Siefringら,1979)。別のアミン供与体の取り込みは、タンパク質架橋を阻害し、受容体タンパク質において関与グルタミン残基の酵素指向性で部位特異的な標識をもたらす(Lorand,2001)。同様に、反応性グルタミン残基を含む、フィブロネクチンまたはα2−抗プラスミンのN末端配列を模倣したペプチドを利用することによって、供与体タンパク質中の関与リジン残基の特異的標識が達成され得る(Parameswaran,Velascoら,1990;Lorand,Parameswaranら,1992;SobelおよびGawinowicz,1996)。最近になって、第XIIIa因子存在下で、ブドウ球菌rFnbAが、アミン供与体である合成プローブのダンシルカダベリンと、アミン受容体プローブとして作用する、フィブロネクチンのN末端配列を模倣したダンシル化ペプチドとによって修飾され得ることが分かった(Matsukaら,2003)。
【0027】
本願発明において、ブドウ球菌FnbAの中にヒト凝固第XIIIa因子または組織トランスグルタミナーゼにより標的化される反応性のGln残基とLys残基とがあることが同定されている。これは、細菌のタンパク質において第XIIIa因子反応性のアミン受容体および供与体の部位が局在することに関する最初の報告である。蛍光性リジンアナログであるダンシルカダベリンを用いて、第XIIIa因子反応性グルタミンの部位特異的標識を行った(Lorand,Ruleら,1968;Lorand,Siefringら,1979)。第XIIIa因子は、rFnbAレセプターに存在する48個のGln残基のうち4個とだけ反応した。FnbAをダンシルカダベリンおよび凝固第XIIIa因子とともにインキュベートする場合、Gln103、Gln105、Gln783、およびGln830残基が、FnbAにおいてアミン受容体部位として働く。Gln103のダンシルカダベリン修飾の速度および程度は、Gln105、Gln783、およびGln830のそれよりも有意に大きかった(図2、B、Dおよび図3、B、D)が、これは、Gln103が主要なアミン受容体部位として作用することを示唆している。反応性残基Gln103およびGln105は、FnbAレセプターのNH2末端のA領域の内部に位置する(図5)が、Gln783およびGln830残基は、この分子のCOOH末端部分に位置し、それぞれD1反復配列およびD4反復配列に属している。Gln103をFnbAの主要なアミン受容体部位として同定することは、タンパク質限定分解実験の結果と整合する。ダンシルカダベリン修飾されたrFnbAのトロンビンによる切断は低分子量のNH2末端フラグメントの遊離をもたらすが、主要なGln103受容体部位が存在することに起因して、UV照射の際に高い強度の蛍光を示した。COOH末端側フラグメントに相当し、副次的なGln783部位とGln830部位とを含む高分子量バンド(図5)は、小さな発光シグナルを生じた(図1AおよびC)。このように、ダンシルカダベリン修飾されたrFnbAについて得られたタンパク質限定分解およびSDS−PAGEのデータは、同定された受容体部位のさまざまな程度の反応性を示唆する別の一連の証拠を提示した。SDS−PAGE解析において、トロンビン生成されたrFnbAフラグメントと、親rFnbAとは、予想したよりも低い電気泳動移動度を示した。たぶん、これは、SDSの結合能力が低下するために電気泳動移動度が低くなることが知られている荷電残基のFnbAにおける高い含有率によって生じる。rFnbA試料を質量スペクトル解析に供したところ、その実験的に測定された分子量値は、計算された値と本質的には区別できなかった。
【0028】
反応性グルタミン残基を含む、フィブロネクチンのNH2末端配列を模倣したダンシル−PGGQQIVペプチドプローブを、第XIIIa因子反応性リジン残基を標識するために利用した(Parameswaran,Velascoら,1990;Lorand,Parameswaranら,1992)。標識処理は、rFnbA内部にある56個の潜在的リジン供与体残基のうち4個がペプチドプローブを取り込むことを明らかにした。これらの残基はLys157、Lys503、Lys620、およびLys762である。同定された第XIIIa因子反応性のリジン部位は、フィブリン(フィブリノゲン)結合領域Aと、フィブロネクチン結合D反復配列との間に分布している。Lys157は、A領域のNH2末端部分内に位置するが、Lys503は、B1B2反復配列に隣接するそのCOOH末端セグメントに位置する。フィブロネクチン結合DuおよびD2反復配列は、それぞれ、第XIIIa因子反応性のLys620部位およびLys762部位を含む(図5)。興味深いことに、反応性Lys157がNH2末端に位置するのにもかかわらず、ダンシル−PGGQQIVによって修飾されたrFnbAをトロンビンで切断しても、蛍光性の低分子量フラグメントを生じなかった(図1D、レーン2および4)。クーマシーブリリアントブルーによってゲルを染色しても、低分子量フラグメントを検出することができなかった(図1B、レーン2および4)。これらの観察結果は、Lys157のダンシル−PGGQQIVプローブでの修飾は、FnbAのNH2末端領域のトロンビン攻撃に対するより高い感受性を誘導し得、SDS−PAGEでは検出できない小さなペプチドの生成をもたらし得ることを示している。
【0029】
全体的に見ると、同定された反応性Gln受容体残基およびLys供与体残基はすべて、フィブリン(フィブリノゲン)結合部位およびフィブロネクチン結合部位を形成する、FnbAのNH2末端領域およびCOOHの末端領域にかたまって存在する傾向をもつ。しかし、ピーク2(図2D)、ピーク2、3、5(図3D)、およびピーク3(図4D)に相当するペプチドを含む蛍光トレーサーが明確には同定されなかったため、ブドウ球菌FnbAレセプター内のさらなるGln受容体残基およびLys供与体残基の存在を排除できない。それにもかかわらず、部位特異的な標識によって、第XIIIa因子に触媒される、FnbAと、フィブロネクチン、フィブリン、および、場合によっては他のヒト宿主タンパク質との架橋反応に関与する反応性のGln残基およびLys残基の正確な位置を決めることが可能になる。配列決定において、いくつかのピークが、各サイクルにおいて1つよりも多い残基を生じ、HPLC画分が不均一であることを示した。これら試料の不均質性は、質量スペクトル解析の結果からも明らかであった。各サイクルにおける残基の、FnbAの既知の配列、およびトリプシンまたはGlu−Cプロテイナーゼによって生じる予測された切断部位をもつ利用可能なマップに対する比較は、個々の配列のほとんどの同定を可能にした。本研究におけるNH2末端配列解析の結果は、予測されたプローブ修飾ペプチドに対応するシグナルの存在を示した質量スペクトルデータと常に相関していた。
【0030】
今までのところ、凝固第XIIIa因子に対し1ダースそこそこのタンパク質基質が同定されているにすぎない。第XIIIa因子に対する既知のグルタミン含有基質には、配列相同性がほとんどないため、反応性を予測することは不可能ではないにしても困難である。同定された反応性グルタミンは、大抵、溶媒露出表面領域または可動的伸長部(flexible extensions)に位置している(Cottrell,Strongら,1979;McDonagh,McDonaghら,1981;Matsuka,Medvedら,1996)。理論に捉われることなく言えば、タンパク質の一次構造と立体構造の両方が、グルタミン残基が反応性であるか否かを決定することができると考えられる。これらの観察結果は、本明細書においてブドウ球菌FnbAレセプターについて示したデータと整合している。
【0031】
反応性のGln783受容体部位およびGln830受容体部位は、いくつかの報告によれば、コンパクトな構造を持たず、どちらかといえば折り畳まれていない状態で存在するD2およびD4のフィブロネクチン結合反復配列の中に存在する(House−Pompeo,Xuら,1996;Penkett,Redfieldら,1997;Penkett,Redfieldら,1998)。反応性のGln103部位およびGln105部位は、タンパク質分解に対して感受性があるとみられ、そのため、秩序ある構造を欠くことがここでも示され得るFnbAのNH2末端領域の中に位置する。タンパク質におけるアミン供与体であるリジン残基に対する第XIIIa因子の選択性もまた、十分に理解されてはいない。第XIIIa因子は、リジン残基に対する選択性がグルタミン残基に対するよりも低いという一般概念にもかかわらず、限られた数のアミン供与体部位だけが、特定のタンパク質−タンパク質架橋反応に関与することができ、ペプチドプローブによる修飾を受けることができる。第XIIIa因子は、タンパク質基質において、広範ではあるが、アミン供与体であるリジンの前にある残基に関して明らかに異なる寛容を示すことが示された。第XIIIa因子または組織トランスグルタミナーゼに対するタンパク質基質の解析は、アミン供与体部位の直前にある残基は、非荷電性残基、および塩基性で極性の残基、ならびに低分子の脂肪族残基を含むことを明らかにした(Grootjans,Groenenら,1995)。本明細書で開示されているブドウ球菌FnbAレセプターに関するデータは、さらにこれらの観察結果を裏付けている。4つの同定された第XIIIa因子反応性リジンにおいては、Lys157の前はValであり、Lys503の前はAlaであり、また、Lys620の前はThrである。唯一の例外は、GluがLys762の前にあることである(図5)。
【0032】
同定された第XIIIa因子反応部位が、異なったブドウ球菌株に由来する他のフィブロネクチン結合タンパク質の間で保存されているか否かを調べるために、多重配列アラインメントを用いてそれらのアミノ酸配列を解析した。ブドウ球菌(S.aures)株ATCC49525のFnbAのアミノ酸配列(配列番号1)を、以下の菌株のFnbAおよびFnbBの配列と比較した:菌株8325−4(配列番号7および配列番号14)(Signas,Rauciら,1989;Jonsson,Signasら,1991)、MW2(配列番号4および配列番号11)(Baba,Takeuchiら,2002)、EMRSA−16(配列番号8)、MSSA−476(配列番号5および配列番号12)、COL(配列番号6および配列番号13)、Mu50(配列番号2および配列番号9)、およびN315(配列番号3および配列番号10)(Kuroda,Ohta,ら,2001)。菌株EMRSA−16およびMSSA−476のFnbAおよびFnbBのアミノ酸配列は、Wellcome Trust Sanger Instituteから入手した。ブドウ球菌COLの配列は、Institute for Genomic Researchから入手した。多重配列アラインメントは、CLUSTAL W(1.81)プログラムを用いて実施した(Thompson, Higginsら,1994)。
【0033】
図6は、ブドウ球菌(S.aures)株ATCC49525のFnbAにおいて同定された反応性のGln残基およびLys残基の周辺領域のアミノ酸配列アラインメントを示している。多重アラインメントは、反応性のGln103、Gln105、Gln830、およびLys620という残基が、すべての解析されたFnbA配列においては保存されていることを明らかにした。菌株MW2、MSSA−476、COL、8325−4、およびEMRSA−16のFnbAでは、反応性Lys157がThr残基で置換されている。菌株のCOLおよび8325−4では、反応性Lys503がAsn残基で置換されている。EMRSA−16株のFnbA配列では、反応性Lys762を含むポリペプチド鎖のセグメントが失われており、COL株および8325−4株では、反応性Gln783がHisに置換されている(図6)。この観察結果は、第XIIIa因子のトランスグルタミナーゼ作用に対するさまざまなブドウ球菌(S.aures)株のFnbAの反応性は異なり得ることを示している。
【0034】
また、第XIIIa因子反応性の受容体部位および供与体部位は、レセプターのFnbBファミリー内ではあまり保存されていないように見える。解析されたFnbB配列はいずれも、反応性のGln103、Lys157、およびLys503を有しておらず、一方、Mu50株およびN315株ではLys762が失われている。菌株MW2、MSSA−476、COL、および8325−4のFnbB配列では、反応性のGln105およびGln783は保存されていない。同定された第XIIIa因子反応性部位のすべての中で、Lys620残基およびGln830残基のみが高度に保存されており、解析したすべてのFnbA配列およびFnbB配列に存在する(図6)。
【0035】
興味深いことに、FnbAを第XIIIa因子で処理すると、保存されている反応性Lys620残基は一貫してダンシル−PGGQQIVプローブに対して最も高い反応性を示した(図4Bのピーク*、および図4Dのピーク5、表3)。これは、さらに、620位におけるLys供与体部位の生理学的な重要性を示している。主要なGln103受容体部位が、Lys157およびLys503の供与体部位とともに、すべての調べられたFnbB配列に存在しないという事実は、フィブロネクチン結合タンパク質のB型が、第XIIIa因子に触媒される架橋反応においてあまり顕著な役割を果たしていないことを示唆している。また、これらの違いは、フィブロネクチン結合タンパク質のA型およびB型が、それらのヒト宿主タンパク質の架橋相手に対して異なった選択性を示すことを示している。
【0036】
ブドウ球菌FnbAレセプター以外、現在知られているすべての第XIIIa因子のタンパク質基質は、血液凝固、線維素溶解、細胞外マトリックスの集合、および創傷治癒反応に関与している。黄色ブドウ球菌(S.aureus)FnbAが、第XIIIa因子の二機能性基質として作用し、フィブロネクチンまたはフィブリンに架橋されるという本発明者らの発見(Matsukaら,2003)は、凝固第XIIIa因子も、分子生物学的病原機構において重要な役割を果たしていることを示唆している。病原性黄色ブドウ球菌(S.aureus)がヒト宿主分子に共有結合するために第XIIIa因子のトランスグルタミナーゼ活性を利用可能である、黄色ブドウ球菌(S.aureus)の能力が、組織損傷において非常に高い効率での細菌コロニー形成を説明する。損傷後、血塊の形成は、血管を完全な状態に戻すため、および創傷修復を開始するための一時的なマトリックスを提供するために役立つ(Mosesson 1992)。血塊の主なタンパク質成分であるフィブリンおよび血漿フィブロネクチンは、これらの機能に不可欠である。フィブリンおよびフィブロネクチンは、どちらも黄色ブドウ球菌(S.aureus)の表面結合型FnbAレセプターに対するリガンドとして作用するため、細菌の創傷部位への結合に関与する。血塊が成熟するにつれて、凝固第XIIIa因子は、フィブリン分子間、ならびにフィブリンとフィブロネクチンとの間における分子間架橋の触媒を開始する。フィブリン分子間における共有結合架橋は、血塊の構造的安定性を高める(HenschenおよびMcDonagh 1986)が、フィブロネクチンのフィブリンへの架橋は、創傷治癒過程に必要とされる細胞接着および細胞移動という事象にとって重要である(Grinnel,Feldら,1980;Knox,Crooksら,1986;Corbett,Leeら,1997)。この段階でフィブリンまたはフィブロネクチンに可逆的に結合しているブドウ球菌FnbAレセプターは、第XIIIa因子によってそのリガンドに共有結合架橋され得る。FnbAを共有結合によってフィブリンまたはフィブロネクチンに取り込むと、ブドウ球菌のコロニー形成および感染成立の確率が増加する。それは、また、フィブリン−フィブリンおよびフィブリン−フィブロネクチンの架橋反応とも競合する(Matsuka,Medvedら,1994;Matsuka,Miglioriniら,1997)(Matsukaら,2003)ため、血塊の構造的完全性に影響を与え、創傷治癒反応を阻害する。第XIIIa因子が触媒するブドウ球菌FnbAのヒト細胞外マトリックスタンパク質への架橋のこのような影響は、FnbAレセプターの分子進化に対する原動力として寄与し得、その結果、ついには新しく有用な性質を獲得する可能性が最も高い。第XIIIa因子に対するFnbAの進化した反応性は、宿主のコロニー形成において顕著な利益を与え、そのため、黄色ブドウ球菌(S.aureus)の生存率に対してプラスの影響を与えてきた。
【0037】
本明細書記載の第XIIIa因子触媒による共有結合架橋反応に直接関与する野生型ブドウ球菌FnbAの中で反応性アミノ酸残基(GlnおよびLys)を同定することに加え、本発明は、黄色ブドウ球菌(S.aureus)感染後、フィブロネクチンおよびフィブリンに共有結合架橋する能力が野生型Fnbよりも低い、Fnbに由来するタンパク質の合成に関係する。具体的には、本明細書に記載した研究は、改変されたフィブロネクチン結合性のタンパク質またはポリペプチドを含む、タンパク質および/またはポリペプチドを調製する組成物および方法を目的とし、これは、免疫原性組成物製剤(多価免疫原組成物を含む)における免疫原として使用することができ、能動的免疫化に使用することができる。この方法は、Fnb配列における1個以上のアミノ酸を改変して、後に黄色ブドウ球菌(S.aureus)に感染した際に野生型Fnbがフィブロネクチンおよびフィブリンに結合することを促進させることなくして免疫原性であるFnbに由来するタンパク質またはポリペプチドを生じさせることを含む。本明細書において同定されている2つ、3つ、またはそれ以上のアミノ酸残基の変異は本発明の範囲に含まれる。
【0038】
Fnbの野生型(天然型)のヌクレオチドおよびアミノ酸の配列は当技術分野において既知である(米国特許第5,320,951号、第5,571,514号、第5,175,096号、第5,652,217号など)。本明細書において使用される場合、「改変」およびその派生語は、野生型配列とは異なるアミノ酸配列、および、野生型のアミノ酸配列とは異なるアミノ酸配列をコードするヌクレオチド配列を意味するものである。改変には、ヌクレオチドまたはアミノ酸の1個以上の挿入、欠失、および/または置換が含まれる。
【0039】
例えば、改変は、フレームシフト変異をもたらす、1個のヌクレオチド、または1個よりも多いヌクレオチドの挿入または欠失であるかもしれない;コードされたアミノ酸の1個以上の変化をもたらす、少なくとも1個のヌクレオチドの変化であるかもしれない;未成熟終止コドンの生成をもたらす少なくとも1個のヌクレオチドの変化であるかもしれない;いくつかのヌクレオチドの欠失であって、そのヌクレオチドにコードされている1個以上のアミノ酸の欠失をもたらすものかもしれない;遺伝子のコード配列の中断をもたらす1個またはいくつかのヌクレオチドの挿入であるかもしれない;遺伝子のすべてまたは一部の重複であるかもしれない;遺伝子のすべてまたは一部の転位であるかもしれない;または、遺伝子のすべてまたは一部の再配列であるかもしれない。このような変異の1つ以上が1個の遺伝子に存在することも可能である。このような配列の変化は、その遺伝子によってコードされたFnbの改変を生じる。例えば、改変がフレームシフト変異であれば、このフレームシフトは、コードされたアミノ酸に変化を生じさせるか、および/または未成熟終止コドンの生成をもたらし、短縮タンパク質の生成をもたらす可能性がある。
【0040】
例えば、改変は、好ましくは、天然型Fnbの3次元立体構造を保存するものである。さらに、Fnbの機能、特に免疫原性に不可欠のアミノ酸を、当技術分野において既知の方法によって同定することができる。特に有用な方法としては、保存されたアミノ酸の同定法、部位特異的変異誘発法、およびアラニンスキャニング変異法(例えば、CunninghamおよびWells 1989)、結晶および核磁気共鳴法などが挙げられる。これらの方法によって作成された改変型ポリペプチドは、免疫原性および抗原性を含む、具体的な生物活性についてテストされ得る。
【0041】
具体的には、疎水性、塩基性または酸性という特徴、電荷、極性、大きさ、官能基(例、−SHまたはグリコシル化部位)の有無、および芳香族特性を含む、いくかの基準に基づいて適当なアミノ酸改変が行われ得る。上記の性質に基づいて、さまざまなアミノ酸を類似したグループに割り当てることは、当業者に容易に分かることであり、さらに適当なアミノ酸の変化については、Bowieら,(Science 247:1306−1310(1990))に記載されている。
【0042】
例えば、改変は、防御免疫反応に関与するFnbAの領域の特性は維持するが、黄色ブドウ球菌(S.aureus)感染の刺激に関与するエピトープを欠失または変更させる、グルタミン残基およびリジン残基の保存的な(例えば、アラニンに対しグリシン;イソロイシンに対しバリン、リジンに対しヒスチジン、グルタミンに対しアスパラギン)部位特異的突然変異の形(図6)をとることも可能である(すなわち生物学的等価体)。また、改変は、黄色ブドウ球菌(S.aureus)感染を悪化させるような刺激を低減または除去する非保存的変異(例えば、スレオニンに対しリジン;リジンに対しアラニン、グルタミンに対しアラニン)という形をとることも可能である。また、改変は、残りのFnbに由来する部分を引き続き利用しつつ、本明細書において同定されたグルタミン残基またはリジン残基の任意のものを完全に欠失させた形をとることも可能である。欠失部位は、最適な翻訳および/または免疫原性のために残りのFnbまたはポリペプチドの空間性を維持するリンカー領域によって置換することができる。改変は、任意の標準的な変異原または変異誘発法(例えば、ファージを含む部位特異的変異誘発法、合成オリゴヌクレオチドを含むポリメラーゼ連鎖反応(PCR)技術の使用)を用いて行うことができる。
【0043】
したがって、本発明は、免疫原性を保持する黄色ブドウ球菌(S.aureus)の改変型Fnbまたはその一部をコードする単離されたヌクレオチド配列に関係する。本明細書において使用される場合、「改変型Fnb」という用語は、免疫原性を保持し、かつ、免疫原組成物に取り込まれて脊椎動物に投与されると、その後黄色ブドウ球菌(S.aureus)に感染してもフィブロネクチンまたはフィブリンへの結合を促進しない黄色ブドウ球菌(S.aureus)のFnb(またはその一部)を意味することを意図される。具体的な実施態様において、改変型Fnbは、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当する残基からなる群より選択される少なくとも1つのアミノ酸の変異を含む。一つの実施態様において、これらのアミノ酸はアラニンに変異している。
【0044】
本発明は、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に相当するアミノ酸との関係で具体的に記載されているが、これらの残基を同定するために使用された本明細書記載の方法を、野生型Fnbのさらなる残基に適用して、さらなる改変のための残基を同定することができる。
【0045】
必要に応じて、本発明の核酸分子は、例えばmRNAのようなRNA、またはcDNAおよびゲノムDNAなどのDNAであってもよい。DNA分子は2本鎖または1本鎖であってよく、1本鎖RNAまたはDNAは、コード鎖またはセンス鎖、あるいは非コード鎖またはアンチセンス鎖であってもよい。1つの実施態様において、核酸分子は、少なくとも約14のヌクレオチドを含み、別の実施態様においては、少なくとも約50のヌクレオチドを含み、さらに別に実施態様においては、少なくとも200のヌクレオチドを含む。ヌクレオチド配列は、改変型Fnbのアミノ酸配列の少なくともフラグメントをコードするものにすぎなくてよく、あるいは、このヌクレオチド配列は、少なくとも改変型Fnbアミノ酸をコードする配列のフラグメントを、イントロン、および非コード3’および5’配列(例えば、調節配列を含む)のような付加的な非コード配列とともに含むことができる。さらに、ヌクレオチド配列は、マーカー配列、例えば、ポリペプチドの単離または精製に役に立つようなポリペプチドをコードする配列などに融合され得る。
【0046】
「ヌクレオチド配列」という用語は、化学的にまたは組み換え手段によって合成されるヌクレオチド配列を含むことができる。したがって、ベクターに含まれる組み換えDNAは、本発明に包含される。また、ヌクレオチド配列は、異種の宿主細胞中の組み換えDNA分子、および部分的または実質的に精製された、溶液中のDNA分子を含む。本発明のDNA分子のインビボおよびインビトロにおけるRNA転写物も、本発明のヌクレオチド配列に含まれる。このようなヌクレオチド配列は、例えば、コードされた改変型Fnbを製造する場合に有用である。
【0047】
改変型Fnbの一部、アナログまたは誘導体をコードするもののような、本発明のヌクレオチド配列のバリエーションも、その一部、アナログまたは誘導体が改変型Fnbを含んでいれば、本発明に包含される。このようなバリエーションは、対立遺伝子バリエーションの場合のように、ヌクレオチド配列の非改変部分に天然に生じるバリエーションであってよく、または、さまざまな突然変異原および突然変異誘発処理によって誘導されるものなど、非天然に生じるものであってもよい。対象となるバリエーションとしては、付加および欠失を含む保存型または非保存型のアミノ酸変化をもたらすことができる、1つ以上のヌクレオチドの付加、欠失および置換が挙げられるが、これらに限定されない。
【0048】
本明細書記載の発明は、上記の核酸分子のフラグメントにも関する。「フラグメント」という用語は、フラグメントが改変型Fnbポリペプチドをコードし、すなわち、フラグメントがプライマーとして有用であるならば、長さが少なくとも約14個の連続したヌクレオチドから少なくとも約50個の連続した以上のヌクレオチドまでである、本明細書記載のヌクレオチド配列の一部を包含することを意図される。一定のプライマーおよびプローブは、本明細書に記載されている改変型Fnbをコードする核酸分子と選択的にハイブリダイズする。例えば、本明細書記載の改変型Fnbの抗原部分をコードするフラグメントは有用である。
【0049】
本発明は、中度および高度にストリンジェントなハイブリダイゼーション条件(例えば、選択的ハイブリダイゼーションのための条件)下で、本明細書記載のヌクレオチド配列とハイブリダイズするヌクレオチド配列にも関係する。適当なストリンジェンシー条件は当業者に知られているか、Current Protocols in Molecular Biology,John Wiley & Sons,N.Y.(1989),6.3.1−6.3.6のような標準的な教科書に記載されている。
【0050】
したがって、本発明は、本明細書記載の改変型のヌクレオチド配列に実質的に同一である、例えば、これらの配列に少なくとも90%、または少なくとも95%同一であるようなヌクレオチド配列に関連する。特定のヌクレオチド配列は、本明細書記載の改変型Fnbとして、実質的に類似した抗原活性をもつポリペプチドをコードする。
【0051】
また、本発明は、黄色ブドウ球菌(S.aureus)の改変型Fnb、または、そのポリペプチドにも関連する。改変型Fnbまたはポリペプチドは、免疫原性を保持し、免疫原性組成物に組み込まれて脊椎動物に投与されると、その後黄色ブドウ球菌(S.aureus)に感染した際、フィブロネクチンおよびフィブリンと架橋する能力が野生型Fnbよりも低くなっている、黄色ブドウ球菌(S.aureus)のFnb(またはその一部)である。具体的な実施態様において、改変型Fnbは、黄色ブドウ球菌(S.aureus)株ATCC49525のFnbAのGln103、Gln105、Lys157、Lys503、Lys620、Lys762、Gln783、およびGln830に対応する残基からなる群より選択される少なくとも1つのアミノ酸の変異を含む。本発明の改変型Fnbは、実質的に精製されており(例えば、均質になるまで精製されている)、他のタンパク質を実質的に含まない。
【0052】
また、本発明は、少なくとも1つの調節配列と作動できるように結合している、改変型Fnbまたはポリペプチドをコードする核酸配列を含む、発現ベクター(例えば、プラスミドおよびコスミドのような核酸構築物)も提供する。このような多くベクターの多くは市販されており、当業者は他の適当なベクターを容易に調製することができる。「作動できるように結合する」とは、核酸配列の発現を可能にする態様で、ヌクレオチド配列が調節配列に結合していることを意味し、この用語は、直接の物理的結合、およびリンカーまたは介在配列による連結の両方を含むことを意図される。調節配列は当業者に知られており、改変型Fnbまたはポリペプチドであるポリペプチドを産生するために選択される。したがって、「調節配列」という用語は、プロモーター、エンハンサー、および、Goeddel,Gene Expression Technology;Methods in Enzymology 185,Academic Press,San Diego,Calif.(1990)に記載されている他の発現制御要素を含む。例えば、固有の調節配列、または形質転換宿主細胞に固有の調節配列が用いられ得る。発現ベクターの設計は、形質転換される宿主細胞の選択、および/または発現を所望されるタンパク質のタイプなどの要素に依存し得ることが理解される。
【0053】
例えば、本発明の改変型Fnbおよびポリペプチドは、核酸分子、またはその一部を、原核細胞、真核細胞またはその両方で発現させるのに適したベクターの中にライゲーションすることによって産生され得る(例えば、Broachら,,1983,Sambrookら,,1989参照)。
【0054】
記載されたベクターによって形質導入された原核生物および真核生物の宿主細胞も、本発明によって提供される。例えば,本発明の発現ベクターで形質転換、形質導入または感染され得る細胞は、大腸菌(E.coli)(例えば、大腸菌(E.coli)K12菌株)のような細菌細胞、ストレプトミセス(Streptomyces)、シュードモナス(Pseudomonas)、セラチア・マルセッセンス(Serratia marcescens)およびネズミチフス菌(Salmonella typhimurium)、ショウジョウバエ(Drosophila)細胞、Sf9細胞、およびSf21細胞を含む昆虫細胞(バキュロウイルス)、酵母菌などの真菌細胞、植物細胞、および胸腺細胞、チャイニーズハムスター卵巣(CHO)細胞、HEp−2細胞、ベロ(Vero)細胞およびコス(COS)細胞のような哺乳動物細胞を含むが、これらに限定されない。
【0055】
したがって、本明細書記載の改変型Fnbをコードするヌクレオチド配列は、微生物または真核細胞による処理を介して組み換え型タンパク質を産生するために使用され得る。発現ベクターのような遺伝子構築物にポリヌクレオチド配列をライゲーションして、真核生物(酵母、鳥類、昆虫、植物または哺乳動物)または原核生物(細菌細胞)の宿主に形質転換または形質移入することは、他の周知のタンパク質の生産に用いられる標準的な処理法である。アデノウイルス、アデノ随伴ウイルス、単純ヘルペスウイルス、レトロウイルス、レンチウイルス、ワクシニアウイルスなどのポックスウイルス、シンドビズウイルス、セムリキ森林ウイルス、およびベネズエラウマ脳炎ウイルスなどのアルファウイルス、ならびに、はしかウイルス、おたふくかぜウイルス、および水疱性口内炎ウイルスのような非セグメント化マイナス鎖RNAウイルスなどであるが、これらに限定されないウイルス性ベクターを使用することもできる。したがって、本発明は組み換え技術による改変型Fnbの産生に関する。
【0056】
本発明の改変型Fnbがインビトロで産生される上記宿主細胞系に加え、多様な系が、このような改変型Fnbをインビボで発現させ、送達するのに適している。これらの系は、細菌またはウイルスなどの弱毒化した病原体を送達因子として利用する。これらの生きた弱毒化病原体は、異種核酸セグメントとして、それらの内部に、本発明の所望の改変型Fnbをコードする核酸配列を挿入されている。これらの系を用いると、脊椎動物の体内で、生きている弱毒化された細菌またはウイルスによって、所望の改変型Fnbが発現される。
【0057】
本発明のタンパク質は、多様な方法によって、組み換え細胞培養物から単離または(例えば、均質になるまで)精製され得る。これらは、陰イオン交換クロマトグラフィーまたは陽イオン交換クロマトグラフィー、エタノール沈殿法、アフィニティークロマトグラフィーおよび高速液体クロマトグラフィー(HPLC)を含むが、これらに限定されない。用いられる具体的な方法は、ポリペプチドの性質および宿主細胞の選択に依存し、適当な方法が、当業者には容易に理解される。
【0058】
本発明は、本明細書に記載された改変型Fnbを含む免疫原性組成物にも関連する。例えば、本発明の改変型Fnbを、生理学的に受容可能なビヒクルとともに処方して、免疫原性組成物を調製し得る。具体的な生理的ビヒクルは、水、緩衝生理食塩水、ポリオール(例えば、グリセロール、プロピレングリコール、液体ポリエチレングリコール)、およびブドウ糖溶液を含むが、これらに限定されない。選ばれたビヒクルの活性成分の最適濃度は、所望の最終的薬学的処方物に依存する、周知の方法に従って実験的に決定され得る。
【0059】
改変型Fnbは、哺乳動物宿主のような脊椎動物の中の抗原に対する免疫反応を誘導する抗原として使用され得る。
【0060】
本発明の方法は、改変型Fnbと任意の適当なアジュバントとの混合物を含む免疫原性組成物の免疫学的に有効な投与量を脊椎動物に投与する工程を包含する。本明細書において使用される場合、「アジュバント」は、抗原に対する免疫反応を促進するか、または変更するのに十分な任意の薬剤を意味することが意図される。本明細書において使用される場合、免疫原性組成物の「免疫学的に有効な」投与量は、免疫反応を誘導するのに適切な投与量である。具体的な投与量は、処理を受ける脊椎動物の年齢、体重および病状、ならびに投与法に依存する。当業者は、容易に適切な投与量を決定する。免疫原性組成物は、必要に応じて、生理的食塩水またはエタノールポリオール(グリセロールもしくはプロピレングリコール)のような、薬学的および生理学的に受容可能なビヒクル中で投与され得る。
【0061】
組成物の効力を促進する適当なアジュバントとしては以下のものが挙げられるが、それらに限定されない:
(1)水酸化アルミニウム、リン酸アルミニウム、硫酸アルミニウムなどのアルミニウム塩(ミョウバン);
(2)例えば、以下のような、水中油型エマルジョン処方物(ムラミルペプチド(下記参照)または細菌細胞壁成分など、他の特異的免疫促進因子の有無に関わらない):
(a)5%スクアレン、0.5%Tween80、および0.5%Span85を含み(必要に応じて、種々の量のMTP−PEを含む(必要とはされないが、下記を参照のこと))、Model 110Yのようなマイクロ流動化装置(Microfluidics,Newton,MA)を使用して極微粒子に処方されたMF59(PCT公報WO90/14837号)、
(b)10%スクアレン、0.4%Tween80、5%プルロニック−ブロックポリマーL121、およびthr−MDP(以下を参照)を含み、極微粒子にマイクロ流動体化されているか、またはボルテックス処理されてより大きな粒子サイズのエマルジョンを生じているかのいずれかである、SAF、ならびに
(c)2%スクアレン、0.2%Tween80、および米国特許第4,912,094号(Corixa)に記載された3−O−脱アシル化(deaylated)モノホスホリルリピドA(3−O−deaylated monophosphorylipid A)(MPLTM)、トレハロースジミコール酸(dimycolate)(TDM)、および細胞壁骨格(CWS)もしくはMPL+CWS(DetoxTM)からなるグループに由来する、1つ以上の細菌細胞壁組成を含む、RibiTMアジュバント系(RAS)(Corixa,Hamilton,MT);
(3)Quil AまたはSTIMULONTM QS−21(Antigenics,Framingham,MA)(米国特許第5,057,540号)などのサポニンアジュバント、またはそれらから生じた、ISCOM(免疫促進複合体)などの粒子を用いることができる;
(4)細菌のリポポリサッカライド、アミノアルキルグルコサミンリン酸化合物(AGP)、または、その誘導体もしくはアナログなどの合成リピドAアナログ。これらはCorixaから購入可能であり、米国特許第6,113,918号に記載されている;このようなAGPの1つが、2−[(R)−3−テトラデカノイルオキシテトラデカノイルアミノ]エチル2−デオキシ−4−O−ホスホノ−3−O−[(R)−3−テトラデカノイルオキシテトラデカノイル]−2−[(R)−3−テトラデカノイルオキシテトラデカノイルアミノ]−b−D−グルコピラノシドであり、529としても知られており(以前はRC529として知られていた)、これは水性形態としてか、または安定したエマルジョンとして書法され、CpGモチーフを含むオリゴヌクレオチドなどのポリヌクレオチド(米国特許第6,207,646号);
(5)インターロイキン(例えば、IL−1、IL−2、IL−4、IL−5、IL−6、IL−7、IL−12、IL−15、IL−18など)、インターフェロン(例えば、γインターフェロン)、顆粒球マクロファージコロニー刺激因子(GM−CSF)、マクロファージコロニー刺激因子(M−CSF)、腫瘍壊死因子(TNF)などの、サイトカイン;
(6)例えば、国際特許出願公報WO00/18434号(WO02/098368およびWO02/098369も参照)に従って、29位のアミノ酸のグルタミン酸が別のアミノ酸(好ましくはヒスチジン)に置換されている、野生型または変異型いずれかのコレラ毒(CT)のような細菌性ADPリボシル化毒素の無毒化変異体、百日咳毒素(PT)、または大腸菌易熱性毒素(LT)、具体的にはLT−K63、LT−R72、CT−S109、PT−K9/G129(例えば、WO93/13302およびWO92/19265参照)、および
(7)免疫促進因子として作用して、上記組成物の効力を増大させる他の物質。
【0062】
上記のように、ムラミルペプチドとしては、N−アセチル−ムラミル−L−トレオニル−D−イソグルタミン(thr−MDP)、N−アセチル−ノルムラミル−L−アラニン−2−(1’−2’ジパルミトイル−sn−グリセロ−3−ヒドロキシホスホリルオキシ)−エチルアミン(MTPPE)などが挙げられるが、これらに限定されない。
【0063】
本発明の組成物は、非経口経路、動脈内経路、内皮経路、(徐放性ポリマーの使用による)経皮経路、筋肉内経路、腹腔内経路、静脈内経路、皮下経路、経口経路および鼻腔内経路による投与など、種々の経路で、ヒトまたは非ヒト脊椎動物に投与され得る。このような組成物に用いられるFnbの量は、投与経路および被験体脊椎動物の身体的特徴に依存して変動する。従来型キャリア抗原とともに用いられる、確立された投与量の範囲を調整および操作することは、当業者が適宜なしうることである。本発明の組成物は、未成熟および成熟した脊椎動物、特にヒトの処置における使用が意図される。
【0064】
改変型Fnbは、さらなる免疫原と一緒に投与され得る;この改変型Fnbは、さらなる免疫原と、別個にか、連続的にか、または同時に投与され得る。
【0065】
本発明の改変型Fnbは、免疫反応を調節または促進するために、キャリア分子と結合することができる。適切なキャリアタンパク質は、脊椎動物に安全に投与でき、キャリアとして免疫学的に有効な細菌性毒素を含む。例としては、百日咳、ジフテリア、および破傷風のトキソイド、ならびにジフテリアトキソイドの非毒性変異体であるCRM197などの非毒性変異タンパク質(交差反応性物質(CRM))などがある。天然の毒素またはトキソイドのフラグメントであって、少なくとも1つのT細胞エピトープを含むものもまた、抗原のキャリアとして有用である。抗原の結合体およびキャリア分子を調製する方法は、当該分野において周知である(Wong 1991; Bernatowicz and Matsueda 1986; Frisch et al. 1996; Boeckler et al. 1996)。
【0066】
さらに、特定のペプチド領域が欠失している場合には、二価ワクチンを作成するために、別の生物の抗原に由来する1つ以上のエピトープを、その欠失領域に挿入することができる。
【0067】
本発明はまた、生理学的に受容可能なキャリアと、黄色ブドウ球菌(S.aureus)の改変型Fnbをコードする核酸分子とを含む免疫原性組成物に関連し、この改変型Fnbは、免疫原性を保ち、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、その後その脊椎動物が黄色ブドウ球菌(S.aureus)に感染した際に、野生型Fnbの結合を促進しない。このような免疫原性組成物は、本明細書において、核酸免疫原性組成物またはDNA免疫原性組成物と称され、脊椎動物を免疫化するのに有用である。
【0068】
本明細書において、「遺伝子による免疫化」という用語は、脊椎動物による黄色ブドウ球菌(S.aureus)に対する免疫反応の創出をもたらす、脊椎動物(具体的には哺乳動物)への、病原体(具体的には黄色ブドウ球菌(S.aureus))に対する核酸免疫原性組成物の接種を意味する。本明細書で用いられる「核酸免疫原性組成物」または「DNA免疫原性組成物」は、ポリペプチド抗原、具体的には本明細書記載の黄色ブドウ球菌の改変型Fnbをコードする核酸分子を含む核酸構築物である。この核酸構築物は、転写プロモーター因子、エンハンサー因子、スプライシングシグナル、終結シグナルおよびポリアデニル化シグナル、ならびに他の核酸配列を含むこともできる。核酸免疫原性組成物は、後に脊椎動物が黄色ブドウ球菌に感染した際に、野生型Fnbのフィブロネクチンまたはフィブロンへの結合を促進しない。
【0069】
核酸免疫原性組成物は、標準的な方法によって作成される。例えば、既知の方法を用いて、黄色ブドウ球菌の改変型Fnbをコードする核酸(例えば、DNA)を発現ベクターに挿入し、核酸免疫原性組成物を構築する(Maniatis et al.1989)。
【0070】
個々の脊椎動物を、標準的な方法を用いて核酸免疫原性組成物で免疫化する。脊椎動物は、皮下的、静脈内、腹腔内、皮内、筋内、局所的、経口、直腸内、鼻内、頬内、膣内、吸入噴霧によるか、または従来型の非毒性で生理学的に受容可能なキャリアまたはビヒクルを含む投薬処方物中のインプラントリザーバーを介して免疫化される(すなわち、その組成物が投与される)。あるいは、粒子加速装置(「遺伝子銃」)を使って、脊椎動物に核酸免疫原性組成物を接種する。投与形態(例えば、カプセル、錠剤、溶液、エマルジョン)は、投与経路に部分的に依存する。例えば、粘膜投与には、点鼻薬、吸入または坐薬を用いることができる。
【0071】
核酸免疫原性組成物は、上記したような任意の適当なアジュバントとともに投与することができる。このアジュバントは十分な量で投与されるが、その量とは、組成物に対するより強い免疫反応を生じさせるのに十分な量のことである。アジュバントは、核酸免疫原性組成物を接種する前にか、同時にか、同時に(一斉に)か、またはその後に、投与することができる。アジュバントは、1回以上投与することもできる。アジュバントおよび核酸免疫原性組成物は、脊椎動物のほぼ同じ場所に投与することができる;例えば、両者を脊椎動物の肢の標識部位に投与する。
【0072】
具体的な実施態様において、核酸構築物は、形質導入促進因子とともに同時投与される。1つの実施態様において、形質導入促進因子はジオクチルグリシルスペルミン(DOGS)である(PCT公開出願WO 96/21356号)。別の実施態様において、形質導入促進因子は、ブピバカインのような局部麻酔薬である(米国特許第5,593,972号)。
【0073】
本発明はまた、脊椎動物(例えば、黄色ブドウ球菌セロネガティブのヒト)を、黄色ブドウ球菌(S.aureus)に対して免疫化する方法も提供する。この方法は、上記の黄色ブドウ球菌(S.aureus)の改変型Fnbの免疫学的に有効な量を含む組成物を、その脊椎動物に投与する工程を包含する。あるいは、この組成物は、免疫原性を保持しており、かつ、免疫原性組成物に組み込まれて脊椎動物に投与される場合に、フィブロネクチンおよびフィブリンと架橋する能力が低下して、後に脊椎動物が黄色ブドウ球菌に感染した際に、野生型Fnbのフィブロネクチンおよびフィブリンへの結合を促進しない、免疫学的な有効量の改変型Fnbをコードする核酸分子を含む。
【0074】
ヒトに投与する前に、本発明の免疫原性組成物を動物モデルにおいて評価する。ここで、代表的な非限定的動物モデルを以下に説明する。
【0075】
マウス腎盂腎炎モデルにおいて、4週齢の雌性CD−1マウスに、0週、3週、および6週に、適切なアジュバント中の改変型Fnbを、皮下注射によって接種する。これらのマウスから、初回接種の前と8週目に採血する。最後の採血の2日後、コロンビア塩寒天培地(1×コロンビア寒天、0.1%グルコース、1%酵母エキス、0.5%NaCl)上で一晩増殖させた3×108cfuの黄色ブドウ球菌(S.aureus)レイノルズを、腹腔内注射によってマウスに投与する。投与の48時間後、マウスを屠殺して、腎臓内の細菌数を数える。
【0076】
ラット心内膜炎モデルでは、3週齢のSprague−Dawley雄性ラットに、0週、2週、および4週目に、適切なアジュバント中の改変型Fnbを筋肉内注射によって接種する。これらのラットから、初回接種前に採血する。6週目に、ラットから採血し、手術を行って、頚動脈および大動脈弓を介して、心臓の左心室にポリエチレン製カテーテルを設置する。カテーテルは、絹縫合糸で適所に保たれ、無菌的な植生(vegetation)形成を引き起こす。細菌の投与の際に、この植生は、細菌が付着および感染するための基質として作用する。手術の2日後、トリプティックソイブロス中で中期対数増殖期まで増殖させた1×105cfuの黄色ブドウ球菌(S.aureus)レイノルズを、静脈注射によってラットに投与する。投与の48時間後、ラットを屠殺して、心臓内の細菌数を数える。
【実施例】
【0077】
上記の開示は、本発明を一般的に説明する。以下の具体的な実施例を参照することによって、より完全な理解を得ることができる。これらの実施例は、単に例示的に説明する目的で記載するものであって、発明の範囲を制限することを意図したものではない。
【0078】
(略語)
HPLC 高速液体クロマトグラフィー;
MALDI−TOF MS マトリクス支援レーザー脱離/イオン化飛行時間型質量分析法;
SDS−PAGE ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動;
DTT ジチオスレイトール
TCA トリクロロ酢酸;
Dansyl 5−ジメチルアミノナフタレン−1−スルホニル;
PTH フェニルチオヒダントイン;
ECM 細胞外マトリックスタンパク質
TBS TRIS緩衝食塩水
PBS リン酸ナトリウム緩衝食塩水
FXIII 第XIII因子または血漿トランスグルタミナーゼ
EDTA エチレンジアミン四酢酸のナトリウム塩
1Q rFnbA 組み換えGln103Ala型FnbA変異体
4Q4K rFnbA 組み換えGln103Ala,Gln105Ala,Gln783Ala,Gln830Ala,Lys157Ala,Lys503Ala,Lys620Ala,およびLys762Ala型変異体
wt FnbA 野生型FnbA。
【0079】
(材料および方法)
黄色ブドウ球菌(Staphylococcal)フィブロネクチン結合タンパク質。黄色ブドウ球菌(S.aureus)株ATCC49525由来のAla1からPro839までの残基を含む組み換えフィブロネクチン結合タンパク質A(rFnbA)を大腸菌で産生させ、既述されたとおり(Matsuka et al.2003)細胞溶解物の可溶性画分から単離した。簡単に言うと、FnbAアミノ酸残基の1〜839をコードするfnbA遺伝子を、黄色ブドウ球菌(S.aureus)株ATCC49525の染色体DNAを鋳型として用いたPCR増幅法により作成した。単離されたrFnbAの同一性をSDS−PAGE、ウエスタンブロット、およびNH2末端配列の解析を用いて確認した。すべての実験におけるタンパク質濃度は、使用説明書(Pierce Chemical Company,Rockford,IL)に従ってビシンコニン酸(BCA)アッセイ法を用いて測定した。
【0080】
第XIIIa因子により触媒されるダンシルカダベリン(dansylcadaverine)およびダンシル−PGGQQIVプローブのrFnbAへの取り込み。ダンシルカダベリン(Sigma,St.Louis,MO)またはダンシル−PGGQQIV(New England Peptide,Inc.,Fitchburg,MAによって特注合成)をrFnbAに取り込ませるために、予め活性化した第XIII因子を用いた。このために、500μg/mlの第XIII因子(Haematologic Technologies,Inc.,Essex Junction,VT)を、10mMのジチオスレイトールおよび20mMのCaC12を含むTBS緩衝液(pH7.4)中、0.25U/mlのトロンビン(Sigma)で処理して活性化した。37℃で20分間インキュベートした後、ヒルジン(hirudin)(Sigma)を加えてトロンビンを不活性化して、この混合液を第XIIIa因子として使用した(Takagi,Aoyama et al.1995)。rFnbA内にある反応性グルタミン残基の第XIIIa因子触媒による標識は、1〜2mgのrFnbAを、20mM Tris(pH7.4)、150mMのNaCl、5mMのDTT、5mMのCaC12の緩衝液中で、2.5mMのダンシルカダベリンおよび第XIIIa因子(30μg/ml)とともに、37℃で4時間または18時間インキュベートして実施した。第XIIIa因子反応性リジン残基の標識は、1〜2mgのrFnbAを、20mM Tris(pH8.5)、15mMのNaCl、5mMのDTT、5mMのCaC12の緩衝液中で、2mMのダンシル−PGGQQIVおよび第XIIIa因子(30μg/ml)とともに37℃で4時間または18時間インキュベートして実施した。いずれの場合でも、反応混合液の全容量は0.3mlであった。保温時間の最後に、7%TCAでタンパク質を沈殿させ、遠心分離(14,000×gで5分間)によって回収し、未処理のダンシルカダベリンを除去するために1mlのエタノール:エーテル(1:1容量/容量)で、または、未処理のダンシル−PGGQQIVプローブを除去するために、1%N−メチルモルフォリンおよび5%H2Oを含む1mlのN,N−ジメチルホルムアミドで、沈殿物を反復(8回)抽出した(Clement,Velasco et al.1998)。
【0081】
ダンシルカダベリンおよびダンシル−PGGQQIVで標識されたrFnbAのトロンビンによるフラグメント化。ダンシルカダベリンまたはダンシル−PGGQQIVで修飾されたrFnbAのタンパク質分解によるフラグメント化を、トロンビン(Sigma)を用いて行った。未処理のダンシルカダベリンおよびダンシル−PGGQQIVプローブを除去した後、修飾されたrFnbAの沈殿物を5mMのCaC12を含む0.5mlのTBS緩衝液(pH7.4)に溶解させた。修飾されたrFnbAをトロンビンとともに、1:200(w/w)の酵素/基質比で25℃で1時間インキュベートして、タンパク質限定分解を行った。2%SDS存在下において、95℃で加熱して反応を停止させ、SDS−PAGEにより解析を行った。
【0082】
SDS−PAGE解析。ダンシルカダベリンまたはダンシル−PGGQQIVで修飾されたrFnbA調製物、およびそれらのトロンビン生成フラグメントを、既製の4〜20%勾配ゲル(BioRad Laboratories,Hercules,CA)を用いてSDS−PAGEにより解析した。本研究におけるSDSポリアクリルアミドゲルはすべて、紫外光線下で試験した後、クーマシーブリリアントブルーR(BioRad Laboratories)で染色した。
【0083】
ダンシルカダベリンおよびダンシル−PGGQQIVで標識されたrFnbAの分解。ダンシルカダベリンで修飾されたrFnbAの酵素的加水分解を、Glu−C(V−8)プロテアーゼ(Worthington Biochemical Corp.,Freehold,NJ)およびL−(トシルアミド2−フェニル)エチルクロロメチルケトン(TPCK)処理トリプシン(Worthington Biochemical Corp.)によって処理して行った。ダンシル−PGGQQIV修飾されたrFnbAの加水分解は、Glu−Cプロテアーゼのみを用いて行った。TCA沈殿および抽出後、修飾されたrFnbAの沈殿物を、トリプシンで切断するためには0.3mlのTBS(pH7.4)に、または、Glu−Cプロテアーゼで切断するためには0.3mlのPBS(pH7.8)に溶解した。修飾されたrFnbAを、トリプシンまたはGlu−Cプロテアーゼとともに、1:20(w/w)の酵素/基質比で37℃で16時間インキュベートして酵素切断を実施した。この反応混合液にさらなる量のトリプシンまたはGlu−Cプロテアーゼを加えて、最終の酵素/基質比を1:10(w/w)とし、さらに37℃で8時間分解を継続させた。この分解混合液を、0.2%のトリフルオロ酢酸で1:1(vol/vol)に希釈し、14,000×gで5分間遠心分離して、上清に対して逆相HPLCを行った。
【0084】
ダンシルカダベリンおよびダンシル−PGGQQIVで標識されたペプチドの逆相HPLCによる分離。ダンシルカダベリンおよびダンシル−PGGQQIVで標識されたペプチドを、0.1%のトリフルオロ酢酸中のアセトニトリルによる勾配溶離によってAquapore RP−300 C8カラム(Brownlee Labs,Santa Clara,CA)上で分離した。分離は、ProStar蛍光検出装置(Varian,Walnut Creek,CA)を備えたDynamax HPLC装置(station)を用いて実施した。ペプチドを、アセトニトリルの0〜50%の直線的勾配で流速0.5ml/分で90分間にわたり溶離させた。210nmにおける吸光度、および350nmで励起したときの550nmにおける蛍光を観測してペプチドの溶離を検出した。この蛍光トレーサーのピークを回収して、より小さな容量(50〜200μl)に濃縮した後、同じカラムに再注入した。溶離の第2回目を、アセトニトリルの10〜20%または20〜35%の直線的勾配を用いて流速0.5ml/分で60分間隔にわたって行った。単離されたダンシルカダベリンまたはダンシル−PGGQQIVによって標識されたペプチドに質量分析およびNH2末端配列の解析を行った。
【0085】
配列解析。Applied Biosystems model 490配列解析装置を用いて、NH2末端配列の解析を行った。また、選択されたサンプルを、M−Scan Inc.のサービス解析にも供した。これらのサンプルを、Applied Biosystems model 477A配列解析装置を用いて解析した。最高18サイクルまで配列決定し、単離されたペプチドのNH2末端を決定した。
【0086】
ペプチドの分子量の理論計算。既知のブドウ球菌rFnbAの一次配列から、Peptide Companion V1.25ソフトウエアを用いて、トリプシンおよびGlu−Cプロテイナーゼによって生じたペプチドの分子量の計算を行った。ダンシルカダベリン(335.50Da)またはダンシル−PGGQQIV(932.00Da)による修飾がペプチドの質量に対して与える効果を、プローブの分子量を加えて計算した。各ε−(γ−グルタミル)リジンのイソペプチド結合の形成は、1個のアンモニア(17.04Da)を放出を伴うため、それに従って最終的な分子量値を調整した。
【0087】
質量スペクトル解析。MALDI−TOF質量分析計Voyager DE−STR (Perseptive Biosystems,Foster City,CA)を用いて、単離されたペプチドの分子量の決定を行った。337nmでレーザー脱離(N2レーザー)によって形成されたイオンを、反射方式における20kVの加圧電圧にして記録した。通常、200個の単一のスペクトルを、その単一/ノイズ比を向上させるために蓄積して、質量分析計に同梱されていたData Exploreソフトウエアを用いて解析した。α−シアノ−4−ヒドロキシ桂皮酸(Aldrich Chemical Co.,Milwaukee,WI)を紫外光吸着基質として用いた。70%アセトニトリル/0.1%トリフルオロ酢酸中10mg/mlの基質化合物溶液の1μlを、1μlのペプチド溶液(5〜10pmole/μl)と混合した。MALDI−TOF MSのため、1μlのこの混合液をステンレス鋼のサンプル標的の上にスポットして、室温で乾燥させた。以下の外部標準を用いて質量スペクトルを較正した:ウシ血清アルブミン、ヒトGlu1−フィブリノペプチドB、ヒトアンギオテンシンI、および合成des−Arg1−ブラジキニン。質量の精度は0.1%の範囲内である。
【0088】
(実施例1)
(第XIIIa因子によるダンシルカダベリンおよびダンシル−PGGQQIVのrFnbAへの取り込みと、プローブ修飾されたタンパク質のトロンビンによるフラグメント化)
黄色ブドウ球菌(S.aureus)株ATCC49525由来のフィブロネクチン結合タンパク質Aは、反応性のGlnおよびLysの両残基を含む、凝固第XIIIa因子に対する二機能性基質として働く(Matsuka et al.2003)ことが報告されている。反応性のGlnおよびLys残基のFnbA内での位置を評価するため、第XIIIa因子の触媒作用によって、アミン供与体(ダンシルカダベリン)またはアミン受容体(ダンシル−PGGQQIV)の蛍光プローブをrFnbAに取り込ませた。反応を4時間または8時間実施した後、未反応のプローブを除去して、トロンビンにより蛍光トレーサー標識rFnbAのフラグメント化を行った。トロンビン攻撃に対して感受性である、FnbA内にある単一のArg202−Gly203ペプチド結合が存在することによって、rFnbAのN末端およびC末端の部位に相当する、理論的に計算されたそれぞれの分子量が22kDaおよび70.7kDaである2つのフラグメントの生成が可能になる。rFnbAのトロンビン媒介性切断の産物を、SDS−PAGEと、その後、クーマシーブリリアントブルー染色の前にUV光下でゲルを調べることによって評価した(図1)。ダンシルカダベリンまたはダンシル−PGGQQIVによって修飾されたrFnbAをトロンビンとインキュベートしたところ、2つの別々のフラグメントが出現し、このことは、1つのペプチド結合を加水分解したことと整合した。トロンビンによって生じた低分子量および高分子量のフラグメントのSDS−PAGE上での移動度は、22kDaおよび70.7kDaのフラグメントについて予想されたものよりもやや低かった。しかし、この観察結果は、120kDaおよび203kDaの標準の中間で移動する親rFnbA(未修飾のもの、および蛍光プローブ修飾されたものの両方)に対応するバンドのSDS−PAGE上での全体的に低い移動度と整合している。質量スペクトル解析を用いてrFnbAについて得られた分子量は、一次配列から算定された値(92.656kDa)に非常に近似しており、したがって、rFnbAおよびそのフラグメントがSDS−PAGE上で異常に低い移動度になることが示唆された。
【0089】
第XIIIa因子によって4時間触媒された、ダンシルカダベリンによるrFnbAの修飾は、単量体rFnbAに相当するバンドが蛍光を発する結果をもたらした(図1Aおよび図1C、レーン1)。トロンビンによって生じた、ダンシルカダベリン修飾されたrFnbAの切断、およびその後のSDS−PAGEによる反応混合物の解析によって、蛍光が低分子質量フラグメントの中にほぼ完全に局在していることが明らかになった。顕著な高分子量フラグメントに相当するバンドは、総ダンシルカダベリン蛍光の僅かな部分しか提供されなかった(図1Aおよび図1C、レーン2)。同様の結果が、ダンシルカダベリンでさらに長い時間、すなわち18時間にわたって修飾されたrFnbAでも観察された(図1Aおよび図1C、レーン3および4)。rFnbAをダンシルカダベリンおよび第XIIIa因子とより長い時間インキュベートしても、rFnbA二量体に相当する副次的な高分子量バンドが出現する結果となった(図1Aおよび図1C、レーン3)。rFnbAを第XIIIa因子およびダンシル−PGGQQIVペプチド存在下で4時間または18時間インキュベートすると、単量体のrFnbAにプローブが取り込まれるとともに、二量体および高分子量ポリマーに相当するバンドが出現する結果となった(図1Bおよび図1D)。それにもかかわらず、用いられた実験条件下では、タンパク質の架橋がほぼ完全に阻害され、また、ダンシルカダベリンおよびダンシル−PGGQQIVプローブの取り込みが主にrFnbAの単量体型で起きることが明らかである。ダンシル−PGGQQIV修飾されたrFnbAをトロンビン触媒によって切断すると、高分子量フラグメントだけが、UV照射の際に蛍光を呈した(図1Bおよび図1D、レーン2および4)。このように、タンパク質限定分解データによって、主要なグルタミン受容体部位およびリジン供与体部位が、rFnbA分子のポリペプチド鎖の中で空間的に分離されていて、それぞれN末端領域およびC末端領域に位置していることが明らかになった。
【0090】
(実施例2)
(第XIIIa因子の架橋反応に関与する、rFnbAのグルタミン受容体部位の同定)
rFnbAの内部における特異的反応性Gln残基を同定するために、rFnbAを、第XIIIa因子およびモル過剰の蛍光プローブダンシルカダベリン存在下で4時間および18時間インキュベートした。ダンシルカダベリン標識反応の後、修飾されたrFnbA調製物を未反応のプローブから洗い出して、トリプシンで分解した。第XIIIa因子触媒によるダンシルカダベリンのrFnbAへの取り込みを4時間行って産生されたトリプシンペプチドをHPLCで分離することにより、210nmにおける複雑なプロフィールが明らかになった(図2A)。これに対し、同じサンプルで550nmにおける蛍光を観察したところ、約44分間の保持時間では、たった1つの主要ピークが検出された(図2B、ピーク1)。第XIIIa因子およびダンシルカダベリン存在下でのrFnbAのインキュベート時間を4時間から18時間に延長して、その後トリプシンで分解すると、210nmにおける溶離プロフィール(図2C)にも、主要な蛍光ピークの強度および保持時間(図2D、ピーク1)にも影響を与えることはなかった。同時に、ダンシルカダベリンがrFnbAに取り込まれる時間を延長すると、2および3として図示されている2つの副次的な蛍光ピーク(図2D)の強度が増した。ピーク1として(図2B)、およびピーク1、2、3(図2D)として標識されている、蛍光トレーサーで修飾されたペプチドを回収し、C8カラムに2回通した後、NH2末端配列および質量スペクトルの解析によって特徴を調べた(表2)。主要な蛍光ピーク1に由来するペプチドの配列解析によって、ピーク1は、rFnbAのNH2末端部位に由来する13マーのフラグメントに対応することが明らかにされた。エドマン分解の過程で、12サイクル目には残基を検出することができなかったが、次の13サイクル目では正しい配列決定に戻った。12番目の残基は、通常認識されるアミノ酸をエドマン処理で得ることができなかったが、Gln103に相当し、このことから、このGln103が修飾されていることを示唆している。このペプチドに存在する2つの別のGln残基(Gln95およびGln97)は、PTH(フェニルチオヒダントイン)誘導体として、それぞれ4サイクル目と6サイクル目に遊離した。トリプシン13マーペプチド(ピーク1)について得られた配列解析データは、さらに、質量スペクトル解析の結果によって裏付けられている。このペプチドの測定された質量はm/z1783.83を示し、1個のダンシルカダベリン修飾を含むペプチドの計算上の質量である1783.07に対応する(表2)。図2Dにおける副次的な蛍光ピーク3に由来するトリプシンペプチドの配列および質量スペクトルの解析によって、このペプチドもまた、FnbA分子のNH2末端領域に由来していることが示された。配列を決定する際、1サイクル目には1つのGln残基(Gln105)が検出されなかったが、表2に示す残基のPHT誘導体の記録は、それ以降のサイクルで再開されたことから、Gln105がもう一つの受容体部位として同定され得ることを示唆している。観察されたこのペプチドの分子量は、1つのダンシルカダベリン修飾部位をもつ理論値と一致していた(表2)。ピーク2の物質は、さらにC8逆相カラムに通しても、NH2末端配列決定を行えるほど均質ではなかったため、エドマン分解によって明確には同定できなかった。
【0091】
予測されたトリプシンペプチドのいくつかは、どちらかといえば大きかった(特に、このタンパク質のCOOH末端部位に由来するペプチド)ため、Glu−Cプロテイナーゼを用いて、ダンシルカダベリン修飾されたrFnbAの分解も行ったところ、より小さく扱いやすいペプチドが生成された。「材料と方法」に記載されているように、rFnbAおよび第XIIIa因子をダンシルカダベリン存在下でインキュベートし、Glu−Cプロテイナーゼで分解した。rFnbAを4時間にわたってダンシルカダベリンで修飾した後では、Glu−Cプロテイナーゼ分解混合物において46分間の保持時間をもつ単一の蛍光ピークが繰り返し観測された(図3B、ピーク1)。延長して18時間ダンシルカダベリンをrFnbAに取り込ませた後でGlu−C分解すると、同一の主要ピーク1と、2、3、4、5、6、および7と名づけられた複数の副次的なピークが生じた(図3D)。表2に示すように、4つのペプチドがGlu−Cプロテイナーゼ分解混合物から回収され、明確に同定された。ピーク1および7のペプチドは、トリプシン分解で同定されたものと同じ反応性のGln103残基およびGln105残基を含んでいた。どちらのペプチドも、93から107までの配列に相当し、ダンシルカダベリン修飾の数が異なっているだけであった。主要蛍光ピーク1由来のペプチドは、修飾されたGln103残基を1つ含むが、ピーク7のペプチドでは、Gln103およびGln105の両方が修飾されている。Glu−Cプロテイナーゼ分解も、rFnbAのCOOH末端部位に由来する2つの蛍光性ペプチドを生じさせた。ピーク4および6のペプチドは、それぞれ修飾されたGln830およびGln783の残基を含んでいた(表2)。
【0092】
いくつか別々のダンシルカダベリン標識実験を4時間および18時間にわたって行ない、その後トリプシンまたはGlu−Cプロテイナーゼで分解した解析により、Gln103が、rFnbAにおいて第XIIIa因子に対する主要なアミン受容体部位として機能していることを示唆した。Gln103部位の高い反応性が、トリプシンペプチドETTQSQDNSGDQ103R(図2B)またはGlu−Cプロテイナーゼによって生じるTTQSQDNSGDQ103RQVDペプチド(図3B)のいずれかに相当する単一の主要蛍光ピークの起源に関与している。Gln103の修飾は、反応の4時間後(またはそれよりも早く)に完全に完了した。なぜなら、第XIIIa因子とさらにインキュベートしてもピーク1の強度に影響しなかったからである(図2Dおよび3D)。これに対し、トリプシン分解混合物(ピーク2、3)およびGlu−Cプロテイナーゼ分解混合物(ピーク4、6、および7)から得られたさらに別の蛍光性ペプチドの回収は、第XIIIa因子による処理を延長した場合にだけ得られた。これらの蛍光ピークの強度は、主要ピーク1の強度と比較すると、それでもなお顕著に低く、このことは、105位、783位、および830位の反応性Gln残基の画分だけが修飾を受けたことを示している。このように、ダンシルカダベリンによる修飾実験は、rFnbAが1つの主要な(Gln103)、また3つの副次的な(Gln105、Gln783、およびGln830)第XIIIa因子反応性アミン受容体部位を含むことを明らかにした。
【0093】
(実施例3)
(第XIIIa因子の架橋反応に関与する、rFnbAのリジン供与体部位の同定)
第XIIIa因子媒介によるrFnbAのリジン側鎖の滴定を、フィブロネクチンのN末端配列を模倣したダンシル−PGGQQIVペプチドを用いて行った。第XIIIa因子およびダンシル−PGGQQIVプローブ存在下でこのrFnbAを4時間インキュベートした後、Glu−Cプロテイナーゼで分解した。Glu−Cプロテイナーゼにより生成されたペプチドをHPLCで分離させると、210nmで検出される複数のピークとわずかに数個の蛍光ピークが約60分間の間に溶離されることが再び明らかになった(図4Aおよび図4B)。しかし、アスタリスクで示されたピーク(図4B)以外には、プローブ修飾されたペプチドの標識の程度ひいてはその精製度が、必要な配列解析を行うには十分でなかった。ダンシル−PGGQQIV修飾ペプチドの回収を向上させるために、rFnbAを第XIIIa因子およびダンシル−PGGQQIV修飾ペプチドとともに18時間インキュベートして、「材料と方法」の項に記載されているようにGlu−Cプロテイナーゼで分解した。この分解混合物をHPLCで分離すると、全部で7つの蛍光ピークが生じた(図4D)。蛍光ピーク1〜7の溶離プロフィール(図4D)は、rFnbA修飾の4時間後に生成された分解混合物の溶離プロフィール(図4B)に類似しており、より標識程度の高い同一のペプチドが産生されたことを示していた。これらの蛍光ピーク(図4Bのアスタリスクで示されたピーク、および図4Dのピーク1〜7)のそれぞれを、逆相C8カラムでさらに精製してから、質量スペクトルおよび配列解析により評価を行った。行われた解析の結果を表3にまとめた。全部で6つの修飾されたペプチドを、質量スペクトルおよび配列の解析を用いて明確に同定した。ピーク4、5、および7の画分について信頼性の高い配列が得られ、Lys157、Lys620、およびLys503が、明確にプローブ修飾された残基であると同定された(表3)。エドマン分解の過程で、ダンシル−PGGQQIV修飾されたLys残基は、通常のPTH誘導体としては認識されないため、検出することができない。ピーク4を配列決定したところ、2サイクル目でこの結果が観察されたが、一方、1サイクル目ではVal残基がPTH誘導体として遊離した。次の3サイクル目では配列が回復し、中断することなく続いた。9サイクル目で得られたLys残基は、修飾されたリジン(Lys157)が2サイクル目に存在したという結論をさらに補強した。ピーク5および7由来のペプチド解析によって、それぞれ3サイクル目と2サイクル目で配列決定の中断が起きることが明らかになった。ここでも、これらのデータは、Lys620(ペプチド5の3サイクル目)およびLys503(ペプチド7の2サイクル目)が第XIIIa因子によって修飾されたことを示唆している。表3から分かるように、ピーク4、5、および7に対して得られたNH2末端配列解析の結果は、測定されたm/z値と整合している。これらのプローブ修飾された画分のそれぞれは、単一のダンシル−PGGQQIV修飾を含む各ペプチドの算定分子量と正確に一致したm/z値を示した(表3)。蛍光ピーク1および2のそれぞれは、本質的には等量で存在する2つの標識ペプチドと非標識ペプチドの混合物に相当した。FnbAの既知の一次配列、および予測切断部位のマップを利用して、この2重配列の確実な読み取りを行った。同様に、蛍光ピーク6について得られた配列の読み取りも、FnbAのアミノ酸配列と、Glu−Cプロテイナーゼによって触媒される予測切断部位の位置とを知ることによって行われた。単離された画分の分析によって、いくつかのダンシル−PGGQQIV標識ペプチドが、ポリペプチド鎖の同一の領域に由来することが明らかになった。Asp160−Val161のペプチド結合をGlu−Cプロテイナーゼによって部分的に加水分解したところ、プローブ修飾されたペプチド1(フラグメント156〜160)のより短いもの、およびより長いペプチド4(フラグメント156〜168)が得られた。同様に、Asp629−His630のペプチド結合を不完全加水分解したところ、ペプチド5(フラグメント618〜629)およびペプチド6(フラグメント618〜634)が生成される結果となった(表3)。このように、ここでもLys157およびLys620は、それぞれ蛍光ピーク1および6におけるプローブ修飾された残基であると同定された。Lys762の第XIIIa因子触媒による修飾が、蛍光ピーク2に相当する画分の配列決定によって実証された。画分1、2、および6の質量スペクトル解析によって、NH2末端配列決定の結果を裏付ける別の証拠が提供された。m/zが1432.37、1820.22、および2614.83における質量ピークは、それぞれ画分1、2、および6に存在した。蛍光ピーク1、2、および6について得られた測定分子量は、各単一ダンシル−PGGQQIV修飾による理論値と一致していた(表3)。アスタリスクで示された蛍光ピーク(図4B)は、2つのペプチドの混合物に相当する。FnbAの一次配列を知ることによって、また、この画分の読み取りを行った。非標識ペプチドをフラグメント266〜280と同定した(図5)一方で、トレーサーを含むペプチドは、図4D上のピーク5と一致し、単一プローブ修飾Lys620を含んでいた(表3)。ピーク3に対応する画分(図4D)は、それらの配列がエドマン分解では分析できなかった、いくつかのペプチドの混合物と考えられる。このように、rFnbAを第XIIIa因子によって、ダンシル−PGGQQIVプローブ存在下で処理すると、Lys157、Lys503、Lys620、およびLys762の特異的修飾をもたらし、これらの残基がアミン供与体部位として働くことを示唆している。
【0094】
(実施例4)
(同定された第XIIIa因子反応性のGln残基およびLys残基の部位特異的変異誘発法を用いた置換)
同定された反応性のGln残基およびLys残基の置換を、各変異を別々に導入して行った。この目的ため、所望のコード領域にわたる合成オリゴヌクレオチド(GlnからAla、またはLysからAlaへの変化を含む)をrFnbA遺伝子のPCR増幅に利用した。この2520bpの遺伝子の特異的なサブクローン(例えば、Gln103、Gln105、およびLys157にわたるサブクローン、ならびにGln503、Lys620、Lys762、Gln783、およびGln830にわたるサブクローン)を利用することによって、8個全部の変異を含む改変型遺伝子を「モジュール毎(modular stepwise)」に再構築することが簡便化された。いずれの場合においても、再構築された遺伝子が大腸菌(E.coli)発現ベクターにサブクローニングされたら、変異rFnbA遺伝子の配列を決定して、所望の変異が存在することを確認した。例えば、合成オリゴヌクレオチド
【0095】
【化1】

(およびその相補配列)を用いて、野生型fnbA遺伝子の5’側のほぼ半分に相当するヌクレオチドを含むプラスミドpLP1143にアニールさせて、FnbAのGln103残基をAlaに変えた。Pfu Turboポリメラーゼを用いてこのプライマーを伸長させ、fnbA遺伝子の改変された領域(Gln103Ala)の多数の非メチル化コピーを産生した。メチル化されている鋳型DNAをDpn1で分解した後、上記反応産物で大腸菌を形質転換すると、元のメチル化(野生型)コピーの回収率が低下する。次いで、形質転換混合物から回収したプラスミドを、クローニングされたfnbA領域の一部にわたって配列決定して、プラスミドfnbA103Aにおける本来のコドンであるGln(CCA)がアラニンに置換されているコドンGCA(下線部)を有する以下の所望の配列が存在することを確認した:
【0096】
【化2】

全長fnbAのコード配列を得るため、Nco1およびKpn1を用いて、プラスミドfnbA103Aに含まれている変異型Gln103Ala fnbA遺伝子の5’側半分を切り出した。そして、得られたDNAフラグメントをpLP1125(全長の野生型fnbAを含む)のNco1−Kpn1部位にクローニングした。このライゲーションの産物(pLP1149)は、全部で2.517kbのfnbA遺伝子のDNA配列解析によれば、全長fnbA遺伝子の中にGln103Ala変異を含んでいる。
【0097】
同様にして、Lysに対するコドン(AAA)がAlaに対するコドン(GCA、下線部)に置換されている合成オリゴヌクレオチド
【0098】
【化3】

を用いて野生型FnbAのLys762をAlaによって置換させた。このプライマーを用いて、野生型fnbA遺伝子の3’側のほぼ半分に相当するヌクレオチドを含むプラスミドpLP1144にアニールした。プライマー伸長および大腸菌宿主の形質転換の後、上記したように、プラスミドfnbA762AにおいてLysコドン(AAA)が、Alaに対するコドン(GCA、下線部)で置換されていることを示すDNA配列解析によって変異領域の存在を確認した。プラスミドfnbA762AをSpe1およびNot1で分解し、同じ酵素で切断したpLP1125の中に得られたフラグメントをライゲーションして、プラスミドfnbA762Aに含まれているLys762Ala変異を全長fnbAに導入した。fnbA遺伝子全部のDNA配列決定によれば、得られた組み換えプラスミドpLP1150は、Lys762Ala変異を含んでいる。
【0099】
Gln103Ala変異(イタリック体)に加えてAla105に対するコドン(GCA、下線部)を含む合成オリゴヌクレオチド配列:
【0100】
【化4】

を用いて、二重変異
【0101】
【化5】

(103位および105位のGlnがAlaで置換されている)を構築した。このプライマーをpLP1149(fnbAQ103A)にアニールし、この変異を含む遺伝子部分の全域にわたって伸長産物(プラスミド5’103A+5’105A)の配列を決定した。そして、この二重変異を含むNco1,Kpn1フラグメントを用いて、pLP1125の野生型配列を置換してpLP1155を産生した。pLP1155に含まれる全fnbA遺伝子を配列決定して、二重変異が存在することを確認した。鋳型であるプラスミドpLP1150を用いたDNA合成を開始させるためにオリゴヌクレオチド
【0102】
【化6】

を用いて、この二重変異Lys620Ala,Lys762Alaを構築した。このオリゴヌクレオチドは、野生型Lys620コドンの代わりにAla620(下線部)に対するGCAコドンを含んでいた。DNA配列決定したところによれば、得られたプラスミドは、pLP1150本来のLys762Ala変異に加えてLys620Ala変異を含んでいた。野生型配列を置換している二重変異体のSpe1,Not1 DNAフラグメントを用いて、pLP1125に二重変異領域をサブクローニングした。得られたプラスミドpLP1156を全fnbA遺伝子にわたって配列決定して、Lys620Ala,Lys762Ala変異の存在を確認した。すべての変異が、fnbA遺伝子を2つの部分に分けたものに構築されるまでこの処理を繰り返す。上記した産物クローニング処理法によって各セットの変異を組み合わせると、8個すべての変異を含むfnbA遺伝子が得られる。
【0103】
(実施例5)
(rFnbA変異体の架橋特性の評価)
第XIIIa因子に対する変異型rFnbAの反応性の低下が、さまざまな方法を用いて示される。蛍光性低分子プローブであるダンシルカダベリンおよびダンシル−PGGQQIVを、変異型rFnbAのトランスグルタミナーゼ反応性を評価するために利用する。第XIIIa因子による上記プローブの変異型rFnbAへの取り込みがないことは、反応性Gln残基およびLys残基が存在しないことを示す。第XIIIa因子に対する変異型rFnbAの反応性が低下または消失していることの実証は、第XIIIa因子に触媒されるヒトフィブロネクチンおよびフィブリンへの架橋を受ける能力を評価することによっても行われる。第XIIIa因子触媒による蛍光プローブの取り込み、およびフィブロネクチンおよびフィブリンへとの架橋反応も、野生型rFnbAを陽性対照として行われる。
【0104】
以下の例では、部位特異的変異誘発法を用いて、同定された反応性のGln部位およびLys部位をAla残基で置換し、これらの変異の効果を、FnbA−フィブリンおよびFnbA−フィブロネクチンの架橋反応で評価した。単一残基FnbA変異体では、主要な反応性Gln103部位をAla残基で置換し、1QFnbAと名づけた。FnbA変異体において、同定されたGln103、105、783、830、およびLys157、503、620、762の部位のすべてをAla残基で置換して、4Q4KFnbAと名づけた。1QFnbA変異体および4Q4KFnbA変異体の第XIIIa因子反応性を、野生型FnbAレセプターのそれと比較し、その結果を、ブドウ球菌の接着およびコロニー形成における宿主のトランスグルタミナーゼの役割に関して検討する。
【0105】
(実施例6)
(1QFnbA変異体の生成(Q103A変異))
黄色ブドウ球菌(S.aureus)株ATCC49525由来の染色体DNAを鋳型として用いたPCR増幅によって、ブドウ球菌FnbAのNH2末端A領域(残基1〜511)をコードするfnbA遺伝子の1533領域を産生した。以下の
【0106】
【化7】

のPCRプライマーを用いて増幅を行った。順方向プライマーは、成熟配列のコード領域の直前にNco1制限酵素部位(下線部)およびATG開始コドンを取り込んでいた。逆方向プライマーは、コードセグメントの直後にTAA終止コドン、その後にBamHI部位(下線部)を含んでいた。増幅されたDNAフラグメントを単離し、NcoIおよびBamHI制限酵素で処理し、その後pET−28aベクター(Novagen,Inc.,Madison,WI)にライゲーションした。fnbA遺伝子の変異誘発は、QuikChange II XL部位特異的変異誘発キット(Stratagene,La Jolla,CA)を用いて行った。変異体DNA鎖を合成するために、本発明者らは、1533bpのfnbA遺伝子フラグメントを含むpET−28aベクターを鋳型として用いた。合成オリゴヌクレオチド
【0107】
【化8】

およびその相補鎖を、変異原プライマーとして利用した。変異原プライマーは、103位で所望のGln→Ala変異を生成するためにCAAに代わってGCAコドンを含む。温度サイクリング、Pfu Ultra DNAポリメラーゼを用いたプライマー伸長、およびエンドヌクレアーゼDpnI(Stratagene,La Jolla,CA)による(ヘミ)メチル化された鋳型の分解を、製造業者の指示に従って行った。変異したDNAを、ニック修復させるために形質転換受容性XL 10−Gold大腸菌細胞(Stratagene)の中に形質転換した。得られたプラスミドDNAを制限酵素のNcoIおよびKpnIで分解して、CAA→GCA変異を含むfnbA遺伝子の680bpのDNAフラグメントを、野生型fnbA遺伝子(FnbA残基1〜839)を含むpET−28aベクターの中にサブクローニングした(Matsuka et al.2003)。制限酵素のNcoIおよびKpnIを用いて、pET−28a/fnbA遺伝子ベクターの中に変異した680bpのDNAフラグメントをライゲーションした結果、変異型FnbA(Q103A FnbA)をコードする2517bpのfnbA遺伝子の回復が得られた。タンパク質発現のため、得られたpET−28aプラスミド(Q103A FnbA変異体)を、BL21(DE3)大腸菌細胞に形質転換した。所望のQ103A変異が存在することを、fnbA遺伝子の変異領域を配列決定して確認した。
【0108】
(実施例7)
(4Q4K FnbA変異体の作出(Gln103Ala、Gln105Ala、Gln783Ala、Gln830Ala、Lys157Ala、Lys503Ala、Lys620Ala、およびLys762Ala変異))
K762A変異の導入。黄色ブドウ球菌(S.aureus)株ATCC49525由来の染色体DNAを鋳型として用いたPCR増幅によって、ブドウ球菌(S.aureus)FnbAのCOOH末端領域(残基512〜839)をコードするfnbA遺伝子の領域を産生した。以下の
【0109】
【化9】

のPCRプライマーを用いて増幅を行った。順方向プライマーおよび逆方向プライマーは、それぞれNcoI部位およびBamHI部位(下線部)を取り込んでいた。増幅されたDNAフラグメントを単離し、NcoIおよびBamHI制限酵素で処理して、pET−28aベクター(Novagen,Inc.,Madison,WI)にライゲーションした。fnbA遺伝子の984bpのフラグメントを含むpET−28aベクターを鋳型として、そして合成オリゴヌクレオチド
【0110】
【化10】

およびその相補鎖を変異原プライマーとして用いて、変異DNA鎖の合成を行った。変異原プライマーは、762位で所望のLys→Ala変異を作出するためにAAAに代わってGCAコドンを含んでいた。変異したDNAを、形質転換受容性XL 10−Gold大腸菌(E.coli)細胞(Stratagene,La Jolla,CA)の中に形質転換した。得られたプラスミドをSpeIおよびNotI制限酵素で切断し、612bpの変異DNAフラグメントを、全長の野生型fnbA遺伝子(FnbA残基1〜839)を含むpET−28aベクターの中にサブクローニングした。
【0111】
Q105A変異およびK157A変異の導入。単一変異(Q103A)および二重変異(Q103A、Q105A)をそれぞれfnbA遺伝子に含むpET−28a鋳型を用いて、連続的にQ105A変異およびK157A変異を生成した。合成オリゴヌクレオチド
【0112】
【化11】

およびその相補鎖を、Q105A変異の変異原プライマーとして採用し、一方、
【0113】
【化12】

およびこの相補鎖を、K157A変異を導入するために利用した。3つ(Q103A、Q105A、およびK157A)の変異を含む変異DNAを形質転換受容性DH 10B大腸菌(E.coli)細胞(Invitrogen,Carlsbad,CA)に形質転換した。得られたプラスミドをNcoIおよびKpnI制限酵素で切断し、その後pET−28aベクターの中にサブクローニングするために680bpの変異DNAフラグメントを単離した。
【0114】
K620A変異の導入。単一変異(K762A)をfnbA遺伝子に含むpET−28a鋳型を用いてK620A変異を生成した。これは、変異原オリゴヌクレオチド
【0115】
【化13】

およびその相補鎖を用いて行われた。2つ(K620AおよびK762A)の変異を含む変異DNAを形質転換受容性DH 10B大腸菌(E.coli)細胞(Invitrogen,Carlsbad,CA)に形質転換した。得られたプラスミドをBsrGIおよびSpeI制限酵素で切断し、1119bpの変異DNAフラグメントを単離して、単一のK762A変異を有するfnbA遺伝子を含むpET−28aベクターの中にサブクローニングした。
【0116】
K503A変異の導入。fnbA遺伝子に二重変異(K620A、K762A)を含むpET−28a鋳型を用いてK503A変異を作出した。合成オリゴヌクレオチド
【0117】
【化14】

およびその相補鎖を変異原プライマーとして利用した。変異DNAを形質転換受容性DH
10B大腸菌(E.coli)細胞(Invitrogen,Carlsbad,CA)に形質転換した。得られたプラスミドをKpnIおよびSpeI制限酵素で切断し、K503A変異およびK620A変異を含む1256bpの変異DNAフラグメントを、引き続きpET−28aベクターの中にサブクローニングするために単離した。
【0118】
Q783A変異の導入。fnbA遺伝子に二重変異(K620A、K762A)を含むpET−28a鋳型を用いてQ783A変異を生成した。合成オリゴヌクレオチド
【0119】
【化15】

およびその相補鎖を変異原プライマーとして利用した。変異DNAを形質転換受容性DH
10B大腸菌細胞(Invitrogen,Carlsbad,CA)に形質転換した。得られたプラスミドをSpeIおよびNotI制限酵素で切断し、2つ(K762AおよびQ783A)の変異を含む612bpの変異DNAフラグメントを、引き続きpET−28aベクターの中にサブクローニングするために単離した。
【0120】
7つの変異(680bp−Q103A、Q105A、K157A;1265bp−K503A、K620A;および612bp−K762A、Q783A)を含む3つのDNAフラグメントを、NcoIおよびNotI制限酵素で切断したpET−28aベクターの中にライゲーションした結果、Q103A、Q105A、K157A、K503A、K620A、K762A、Q783A FnbA変異体をコードする、2516bpのfnbA遺伝子の回復が得られた。
【0121】
Q830A変異の導入。fnbA遺伝子に3つ(K620A、K762AおよびQ783A)を含むpET−28a鋳型を用いてQ830A変異を作出した。合成オリゴヌクレオチド
【0122】
【化16】

およびその相補鎖を変異原プライマーとして利用した。変異DNAを形質転換受容性DH
10B大腸菌細胞(Invitrogen,Carlsbad,CA)に形質転換した。得られたプラスミドをSpeIおよびNotI制限酵素で切断し、K762A、Q783AおよびQ830Aの変異を含む612bpの変異DNAフラグメントを、pET−28aベクターの中にサブクローニングするために単離した。この結果、Q103A、Q105A、K157A、K503A、K620A、K762A、Q783A、およびQ830Aという全部で8個の変異を含むFnbAをコードするfnbA遺伝子の回復が得られた。
【0123】
得られたプラスミドDNAを、タンパク質発現のためにBL21(DE3)大腸菌細胞に形質転換した。pET−28aベクターにサブクローニングする前に特異的変異を含む各生成DNAフラグメントを配列決定した。回復された変異fnbA遺伝子をもう一度配列決定して、所望の変異が存在すること、および全コード領域の完全性を確認した。
【0124】
タンパク質。野生型FnbA、ならびに1Q FnbA変異体および4Q4K FnbA変異体の発現および精製を、他で記載されたように(Matsuka et al.2003)実施した。単離されたFnbA調製物を、20mMのTris(pH7.4)、150mMのNaClに対して透析し、アリコート化し、そして−20℃で凍結保存した。
【0125】
抗体。既述した通りに、ウサギにおいて抗rFnbAポリクローナル抗体を作製した(Matsuka et al.2003)。マウスモノクローナル抗フィブリノゲンAα鎖(Aα 529〜539、クローン1C2−2)抗体は、Accurate Chemical and Scientific Corp.(Westbury,NY)から購入した。マウスモノクローナル抗フィブロネクチン抗体(クローン2B6−F9)は、Cedarlane Laboratories(Hornby,Ontario,Canada)から入手した。ヤギの抗ウサギおよび抗マウスのIgGアルカリホスファターゼ結合体は、BioRad Laboratories(Hercules,CA)から購入した。
【0126】
ペプチドの分子量の理論的推定。Peptide Companion V1.25ソフトウエア(CSPS Pharmaceuticals,Inc.,San Diego,CA)を用いて、ブドウ球菌rFnbAの既知の配列から、Glu−Cプロテイナーゼによって生じるペプチドの分子量の計算を行った。ペプチドの分子量に対するダンシル−PGGQQIV(930.44Da)修飾の効果を、プローブによる質量増加を考慮して計算した。各ε−(γ−グルタミル)リジンのイソペプチド結合は、1個のアンモニア(17.03Da)の遊離を伴うため、それに従って最終分子量値を調整した。
【0127】
ダンシル−PGGQQIV標識ペプチドの逆相HPLC分離。Aquapore RP−300 C8カラム(Brownlee Labs,San Francisco,CA)上で、0.1%トリフルオロ酢酸中のアセトニトリルを用いた勾配溶離によってダンシル−PGGQQIV標識ペプチドを分離した。分離は、ProStar蛍光検出装置(Varian,Palo Alto,CA)を装備したDynamax HPLC装置を用いて実施した。ペプチドを、アセトニトリルの0〜50%の直線的勾配で流速0.5ml/分で90分間にわたり溶離させた。210nmにおける吸光度、および350nmで励起したときの550nmにおける蛍光を観測してペプチドの溶離を検出した。この蛍光トレーサーのピークを回収して、より小さな容量(50〜200μl)に濃縮した後、同じカラムに再注入した。第2回目の溶離を、アセトニトリルの10〜20%または20〜35%の直線的勾配を用いて流速0.5ml/分で60分間にわたって行った。単離されたダンシル−PGGQQIVによって標識されたペプチドを、質量分析に供した。
【0128】
質量スペクトル解析。MALDI−TOF質量分析計Voyager DE−STR (Perseptive Biosystems,Foster City,CA)を用いて、単離されたペプチドの分子量の決定を行った。337nmでのレーザー脱離(N2レーザー)によって形成されたイオンを、反射方式における20kVの加圧電圧にして記録した。通常、200個の単一のスペクトルを、その単一/ノイズ比を向上させるために蓄積して、Data Exploreソフトウエアを用いて解析した。α−シアノ−4−ヒドロキシ桂皮酸(Aldrich Chemical Co.,St.Louis,MO)を基質として用いた。70%アセトニトリル/0.1%トリフルオロ酢酸中10mg/mlの基質化合物溶液の1μlを、1μlのペプチド溶液(5〜10pmole/μl)と混合した。MALDI−TOF MSのため、1μlのこの混合液をステンレス鋼のサンプル標的の上にスポットして、室温で乾燥させた。ヒトGlu1−フィブリノペプチドB、ヒトアンギオテンシンI、および合成des−Arg1−ブラジキニンを用いて、質量スペクトルを外部的に較正した。
【0129】
SDS−PAGEおよびウエスタンブロット解析。SDS−PAGEは、既製の3〜8%Tris−酢酸勾配ゲル(Invitrogen,Carlsbad,CA)を用いて実施した。本研究におけるSDSポリアクリルアミドゲルはすべて、クーマシーブリリアントブルーR(BioRad Laboratories,Hercules,CA)で染色した。ウエスタンブロット解析には、タンパク質サンプルをニトロセルロース膜に電気ブロットして、対応するウサギポリクローナル抗体またはマウスモノクローナル抗体によって免疫染色した。膜をヤギの抗ウサギまたは抗マウスのアルカリホスファターゼ結合二次抗体で処理し、アルカリホスファターゼ活性を、アルカリホスファターゼ結合基質(BioRad Laboratories,Hercules,CA)で現像した。
【0130】
第XIII因子の活性化。500μg/mlの第XIII因子(Haematologic Technologies,Inc.,Essex Junction,VT)を、10mMのジチオスレイトールおよび20mMのCaC12を含むTBS緩衝液(pH7.4)中、0.25U/mlのトロンビン(Sigma,St.Louis,MO)で処理して活性化した。37℃で20分間インキュベートした後、モル過剰のヒルジン(Sigma,St.Louis,MO)を加えてトロンビンを不活性化し、この混合液を第XIIIa因子として使用した(Takagi,et al.1995)。
【0131】
ダンシルカダベリンおよびダンシル−PGGQQIVプローブの取り込み。活性化された第XIII因子を用いてダンシルカダベリン(Sigma,St.Louis,MO)またはダンシル−PGGQQIV(New England Peptide,Inc.,Gardner,MA)をFnbA分子種に取り込ませた。ダンシルカダベリンを利用して、第XIIIa因子反応性グルタミンを探査し、ペプチドであるダンシル−PGGQQIVを用いて、反応性リジンを探査した。取り込みは、2μMの野生型または変異型のrFnbAを30μg/mlの第XIIIa因子とともに、2mMのダンシルカダベリンまたは2mMのダンシル−PGGQQIVのいずれかの存在下で、それぞれ、20mM Tris(pH7.4)、150mMのNaCl、5mMのDTT、5mMのCaC12中か、または20mM Tris(pH8.5)、15mMのNaCl、5mMのDTT、5mMのCaC12中で、3℃でインキュベートすることにより実施した。対照反応も、2mMのEDTAを含む同じ緩衝液中で行った。種々の時点で、2%SDSおよび10%β−メルカプトエタノールを加えて反応を停止させ、95℃で加熱してSDS−PAGEで解析した。紫外光下でゲルを試験し、次いでクーマシーブリリアントブルーで染色した。
【0132】
フィブリンへの架橋。2μMの野生型または変異型のFnbAの存在下または不在下で、5μMのヒトフィブリノゲン(Calbiochem,San Diego,CA)および15μg/mlの第XIII因子を含む溶液に、0.5U/mlのトロンビンを加えて、フィブリン重合および第XIIIa因子触媒によるフィブリンの架橋を開始させた。架橋反応は、5mMのCaC12を含むTBS緩衝液(pH7.4)中、37℃で実施した。種々の時点で、20mM Tris(pH7.2)、9M尿素、40mMジチオスレイトール、2%SDSを加えて反応を停止させた。血塊を37℃で30分間溶解させ、95℃で加熱し、サンプルをSDS−PAGE/ウエスタンブロットで解析した。
【0133】
フィブロネクチンへの架橋。1μMの野生型または変異型のFnbA、および2μMのヒト血漿フィブロネクチン(Sigma,St.Louis,MO)を含む溶液に、15μg/mlの活性化第XIII因子を加えて、フィブロネクチンとの架橋反応を開始させた。この反応は、5mMのCaC12を含むTBS緩衝液(pH7.4)中、37℃で実施した。その後さまざまな時点で、2%SDSおよび10%β−メルカプトエタノールを加えて架橋反応を停止させ、95℃で加熱し、サンプルをSDS−PAGE/ウエスタンブロットで解析した。
【0134】
架橋の反応速度論。第XIIIa因子媒介性のFnbA分子種のフィブリンおよびフィブロネクチンへの架橋の反応速度論を、クーマシーブリリアントブルーで染色されたゲルのデンシトメトリー解析によって調べた。パーソナル・デンシトメーターS1(Molecular Dynamics,Piscataway,NJ)を用いて、レーザーによる濃度測定を行った。各ゲルをスキャンし、生成された画像を、ImageQuant 5.2ソフトウエアを用いて解析した。FnbAがフィブリンまたはフィブロネクチンに架橋したときのFnbAの減少によって反応速度を推定した。FnbAバンドに相当するピークの下にある領域を用いて、反応混合液におけるFnbAの相対量を測定してから、時間の関数としてプロットした。
【0135】
(結果)
ダンシルカダベリンおよびダンシル−PGGQQIVプローブの取り込み。残基Ala1からPro839までを含む、FnbAの野生型および変異型(1Q、4Q4K)(図7A)を、以前記載されたように(Matsuka et al.2003)、pET−28a発現ベクターを用いて大腸菌の中で産生させ、細菌溶解物の可溶性画分から単離した。単離されたタンパク質のそれぞれが、SDS−PAGE上で単一のバンドを示し(図7B)、ASEQKTTTVEで始まる単一のNH2末端配列を示した。同定されたGlnおよびLys部位のAla残基による置換が、第XIIIa因子に対するFnbAの反応性に影響するか否かを調べるために、FnbAの野生型および変異型(1Q、4Q4K)を第XIIIa因子の基質として試験する一連の実験を設計した。ダンシルカダベリンおよびダンシル−PGGQQIVプローブを用いて、野生型FnbAの第XIIIa因子反応性と、1Qおよび4Q4K FnbA変異体の当該反応性との比較を最初に行った(図8)。種々の時点で、ダンシルカダベリンまたはダンシル−PGGQQIVとの反応混合液のアリコートを回収し、SDS−PAGEで解析して、クーマシーブルーで染色する前に紫外光下で調べた。第XIIIa因子およびモル過剰のダンシルカダベリンの存在下では、野生型FnbAに相当するバンドでは、プローブの分子を増加させる酵素結合を反映する蛍光の増加が継続した(図8A)。同じ実験条件下において、1QFnbA変異体へのダンシルカダベリンの取り込みは劇的に低下し、このことは、103位のGlnが、FnbAにおける主要な反応性Gln部位として実際に作用していることを示唆した。さらなる蛍光強度の低下が、4つの同定された反応性Gln残基(Gln103、Gln105、Gln783、およびGln830)のすべてがAlaに置換されている4Q4K
rFnbA変異体で観察された(図8A)。しかし、4Q4K FnbA変異体をダンシルカダベリンおよび第XIIIa因子とともに60分間インキュベートすると、微弱ではあるが検出可能なプローブの取り込みが起きた(図8A)。ダンシルカダベリンとの反応で観察された4Q4K FnbA変異体の残留反応性は、FnbAにさらに別の副次的な反応性Gln部位が存在することを示している可能性がある。
【0136】
第XIIIa因子触媒によるダンシル−PGGQQIVプローブの野生型FnbAへの取り込みが図8Bに示されている。1Q FnbA変異体を同じ反応でアッセイしたところ、そのタンパク質バンドは、野生型FnbAと比較すると僅かに高い蛍光強度を示した(図8)。この結果は、主要な反応性Gln103をAlaで置換すると、1Q FnbA変異体の中にあるLys部位のより効率的なダンシル−PGGQQIV標識が得られたことを示唆している。この効果は、分子内および/または分子間におけるタンパク質架橋に関与することによって、ダンシル−PGGQQIVペプチドプローブと効果的に競合し得る、Gln103部位の強い反応性によるものである。ダンシル−PGGQQIVプローブを野生型FnbAの取り込む際にタンパク質架橋が起きることは、紫外光下で、およびクーマシーブルー染色したときに検出できる低移動度バンドの存在によって裏付けられている(図8B)。第XIIIa因子は、低速度かつ低効率でダンシル−PGGQQIVプローブを4Q4K FnbA変異体に取り込まれたが、このことは、変異したLys157、Lys503、Lys620、およびLys762がアミン供与体部位として作用することを示唆している。しかし、4Q4K FnbA変異体で見られる、ダンシル−PGGQQIVプローブに対する第XIIIa因子反応性の全体的な低下が、ダンシルカダベリンに対するほど顕著ではなかったことは明らかである。これは、さらに別の反応性Lys部位が、ダンシル−PGGQQIVプローブによる酵素的修飾に利用可能なままであることを示している。
【0137】
第XIIIa因子介在によるフィブリンへの架橋。1Q FnbA変異体および4Q4K FnbA変異体の第XIIIa因子反応性を、フィブリン架橋反応において評価した。対照反応では、野生型FnbAが、高分子量ヘテロ複合体の形成をもたらすフィブリンのα鎖に架橋された(Matsuka et al.2003)。架橋は、野生型FnbAに相当するバンドの減弱と、FnbA−α鎖ヘテロダイマーに相当する見かけの分子量をもつ顕著なバンドの出現とを伴っていた(図9A、B、およびC、バンドa)。架橋反応の産物(バンドa、b、c、およびd)は、抗FnbAポリクローナル抗体および抗フィブリノゲンα鎖モノクローナル抗体の両方と反応し(図9BおよびC)、これらの複合体がFnbAとフィブリンα鎖との共有結合から構成されていることを示唆している。同じ実験条件下で、2つのFnbA変異体(1Qおよび4Q4K)が、極めて低い第XIIIa因子架橋反応を示した。クーマシーブルー染色(図9A)、または抗FnbAポリクローナル抗体(図9B)および抗フィブリノゲンα鎖モノクローナル抗体(図9C)による免疫染色を行うと、ほんの微量のFnbA変異体−αフィブリン鎖ヘテロダイマーが検出された。フィブリンおよび第XIIIa因子とインキュベートしたときの野生型および変異型のFnbA分子種の消費を、デンシトメトリー解析を用いて調べた(図10)。図10に示されているように、野生型のFnbAは、1Qまたは4Q4KのFnbA変異体よりもずっと速い速度で反応した。120分間インキュベートした後に、残っている遊離した(架橋されていない)1Qまたは4Q4KのFnbA変異体の量は、野生型FnbAと比較すると約85%多かった。これらのデータは、103位のGln部位が、第XIIIa因子触媒によるFnbAのフィブリンα鎖への結合にもっとも関与していることを示唆している。また、得られたデータは、1Qおよび4Q4Kの両FnbA変異体が、フィブリンとの架橋反応において約85%の反応性の低下を示すことも示している。
【0138】
第XIIIa因子介在によるフィブロネクチンへの架橋。また、1Qまたは4Q4KのFnbA変異体の反応性も、血漿フィブロネクチンとの反応でテストした。このために、SDS−PAGEおよびウエスタンブロット解析をまた利用して、FnbA変異体の反応性をアッセイした。フィブロネクチンとインキュベートとすると、野生型または変異型のFnbAに相当するバンドは、タンパク質が高分子量ヘテロ複合体の中に架橋されていくにつれて徐々に減弱した(図11A、B、およびC)。野生型FnbAまたは変異型FnbAとフィブロネクチンとからなる共有結合架橋高分子量複合体が形成されたことは、抗FnbAポリクローナル抗体(図11B)および抗フィブロネクチンモノクローナル抗体(図11C)を用いたウエスタンブロット解析の結果から明らかであった。SDS−PAGEおよびウエスタンブロットはともに、野生型および変異型のFnbA分子種の反応性の間に殆ど違いがないことを明らかにした(図11)。しかし、デンシトメトリー解析を用いて、反応速度を測定したところ、架橋速度の違いが明らかになった(図12)。1Q
FnbA変異体は、野生型FnbAに近似した速度で反応したが、4Q4K FnbA変異体は、より遅い架橋速度を示した。360分間インキュベートした後、残っている遊離した(架橋されていない)4Q4K FnbA変異体の量は、野生型FnbAまたは1Q FnbA変異体の量と比較すると約35%少なかった。これらのデータは、157位、503位、620位、および762位のLys部位が、第XIIIa因子媒介性FnbAとフィブロネクチンとの架橋に関与し、全部で約35%のFnbAの反応性に寄与することを示唆している。また、これらのデータは、FnbAのさらに別の未同定の反応性Lys部位が、フィブロネクチンとの架橋に関与していることも示唆している。
【0139】
FnbAにおけるさらなる反応性部位としてのLys702の同定。ダンシル−PGGQQIVプローブによる標識実験、およびフィブロネクチンとの架橋の結果は、4Q4K
FnbA変異体において第XIIIa因子にとって利用可能なさらに別の反応性Lys部位があることを示唆している。第XIIIa因子反応性Lys部位の同定について以前報告されたように(米国特許出願第60/573,724号、およびAnderson et al.2004)、ダンシル−PGGQQIVでFnbAを標識することを利用した方法が採用された(Parameswaran et al.1990;Lorand
et al.(1992))。蛍光トレーサーとしてダンシル−PGGQQIVを用い、本発明者らは、FnbAをプローブで標識し、修飾されたタンパク質をGlu−Cプロテイナーゼで切断して、標識されたFnbAペプチドのHPLC分離を行った。その後、単離された蛍光ピーク(トレーサーを含むペプチド)の質量スペクトルおよびNH2末端配列の解析を行ったところ、1つ(ピーク3と名づけられている)を除くすべてのピークの同定ができた(Anderson et al.2004)。FnbAにおけるさらに別の反応性Lys部位を同定するために、逆相HPLCを用いて蛍光ピーク3に相当する物質をさらに精製した後、質量スペクトル解析を行った。ピーク3に由来するプローブ修飾された物質を解析したところ、測定質量[M+H]+が1941.98であるペプチドの存在を明らかにした(図13)。この値は、1つのダンシル−PGGQQIV修飾を含む9重合体NSHVDIKSEペプチドの算定質量と一致する(表4)。このNSHVDIKSEペプチドは、FnbAのCOOH末端領域に由来しており、702位に1個のLys残基を含む。したがって、Lys702が、第XIIIa因子によって標的とされるプローブ修飾された残基として同定された。さまざまな黄色ブドウ球菌(S.aureus)株に由来する既知のFnbAおよびFnbB分子種の多重配列アラインメントによって、Lys702が極めてよく保存されていて、解析されたすべての配列に存在することが明らかになった(図14)。Lys702部位は、FnbAのDuおよびD1のフィブロネクチン結合反復配列の間に位置する領域に存在する(図7)ため、フィブロネクチンをGln3と架橋するために容易に利用できるはずである。さらに、新たに同定されたLys702は、反応性Lys620(Anderson et al.2004)とともに、解析されたFnbAおよびFnbBのすべての配列に存在するただ2つのLys部位である。また、Lys620(蛍光ピーク5、図11D[7])およびLys702(蛍光ピーク3、図11D(Anderson et al.2004))の両部位は、ダンシル−PGGQQIVプローブに対して最も高い反応性を示した。新たに同定されたLys702で観察された高い反応性をもつこと、およびそれがFnbAおよびFnbBの配列で高度に保存されていることは、この部位が、第XIIIa因子が触媒する架橋反応にとって重要であることを示唆している。
【0140】
上記考察および実施例は、特定の実施態様の詳細な説明を提示するにすぎないことが、理解されるべきである。したがって、本発明の精神と範囲を逸脱することなく、さまざまな改変および等価なことがなされ得ることは、当業者にとって明白なはずである。
【0141】
本特許出願において特定されている、すべての雑誌論文、その他の参考文献、特許および特許出願は、その全体が参考として本明細書中に援用される。
【0142】
【数1】

【0143】
【数2】

【0144】
【数3】

【0145】
【数4】

【0146】
【数5】

【0147】
【数6】

【0148】
【表1−2】

【0149】
【表2】

【0150】
【表3】

【0151】
【表4】

【特許請求の範囲】
【請求項1】
明細書中に記載のタンパク質。
【請求項1】
明細書中に記載のタンパク質。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7】


【図8】


【図9A】


【図9B】


【図9C】


【図10】


【図11A】


【図11B】


【図11C】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7】


【図8】


【図9A】


【図9B】


【図9C】


【図10】


【図11A】


【図11B】


【図11C】


【図12】


【図13】


【図14】


【公開番号】特開2010−279391(P2010−279391A)
【公開日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願番号】特願2010−204962(P2010−204962)
【出願日】平成22年9月13日(2010.9.13)
【分割の表示】特願2007−527357(P2007−527357)の分割
【原出願日】平成17年5月17日(2005.5.17)
【出願人】(309040701)ワイス・エルエルシー (181)
【公開日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願日】平成22年9月13日(2010.9.13)
【分割の表示】特願2007−527357(P2007−527357)の分割
【原出願日】平成17年5月17日(2005.5.17)
【出願人】(309040701)ワイス・エルエルシー (181)
[ Back to top ]

