T細胞刺激タンパク質Bおよび使用方法
N.メニンギティディスのT細胞刺激タンパク質B(TspB)に結合する抗体を誘発することができるポリペプチド、および使用方法が提供される。


【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
本出願は、2009年11月6日に出願された米国仮出願第61/259,032号の優先権恩典を主張し、その仮出願は、全体として、参照により本明細書に組み入れられている。
【0002】
連邦支援の研究に関する言明
本発明は、助成金番号R01 AI064314における政府支援でなされた。政府は本発明において一定の権利を有する。
【背景技術】
【0003】
ナイセリア−メニンギティディス(Neisseria meningitidis)は、ヒト上気道にコロニー形成するグラム陰性細菌であり、最も顕著には髄膜炎および敗血症の、世界的な孤発性および周期性の流行的発生の原因である。発病率および罹患率は、2歳未満の小児で最も高い。他のグラム陰性細菌のように、ナイセリア−メニンギティディスは、典型的には、原形質膜、ペプチドグリカン層、莢膜多糖と共に細菌細胞壁を構成する外膜、および外側の環境へ突き出す線毛を有する。ナイセリア−メニンギティディスの被包性菌株は、小児および若年成人における細菌性髄膜炎および敗血症の主な原因である。侵襲性ナイセリア−メニンギティディス感染症の流行および経済的重要性によって、異なる菌株にわたる、特に異なる血清型または血清亜型を有する遺伝子的に多様なB群菌株にわたる免疫を与えることができる効果的なワクチンについての研究が促されている。
【0004】
T細胞刺激タンパク質(Tsp)は、Ala’Aldeenらによって、鉄除去培地で増殖したナイセリア−メニンギティディスB群SD株の膜において同定された(Woodridge KGら、11th International Pathogenic Neisseria Conference 1998、Nice、France)。TspAおよびTspBと名付けられたT細胞刺激タンパク質は、その後、膜画分で免疫することによって産生されたウサギ抗血清を用いて、ゲノム発現ライブラリーから同定された(Woodridge KGら、前記;Kizil GIら、1999 Infect.Immun 67:3533〜3541)。TspAおよびTspBはどちらもT細胞を刺激することが見出されたが、DNA配列に関しては無関係である。
【0005】
TspBは、Orf6と相同であり、Orf6は、疾患を引き起こさない共生単離物のゲノム配列を、疾患を引き起こす侵襲性単離物のゲノム配列と比較した場合、侵襲性髄膜炎菌と関連していることが見出された(Bille EJRら、2005 J.Exp.Med.201:1905〜1913)。Orf6を不活性化することによって、病原性の関連現象(例えば、ウサギ血清における増殖、T84ヒト細胞への接着、免疫不全マウスモデルにおける毒性)について一般的に用いられる実験室アッセイにおいて観察可能な効果は生じなかった(Bille EJRら、2005、前記)。
【発明の概要】
【0006】
N.メニンギティディスのT細胞刺激タンパク質B(TspB)エピトープを結合する抗体を誘発し、ナイセリアTspBがヒトIgに結合するのを阻害することができるポリペプチド、および使用方法。
【0007】
本開示は、TspBの変種ペプチド領域(VN)を含む単離されたポリペプチドを提供し、ポリペプチドは、TspBの完全長アミノ酸配列より短い連続したアミノ酸配列を含有する。
【図面の簡単な説明】
【0008】
【図1】示されているように、細胞が異なる条件下で培養され、かつ血清または精製IgG無しまたは有りでインキュベートされた場合、ナイセリア−メニンギティディスW135群A22株の表面に結合したヒトまたはマウスのIgGの存在を検出するように設計されたフローサイトメトリー実験の結果を示す図である。
【図2】2人の異なるドナー由来の血清の存在下で培養されたナイセリア−メニンギティディスW135群A22株(パネルA)、または単一のドナー由来の血清の存在下での遺伝子的に多様なナイセリア−メニンギティディスW135群、B群、C群の菌株(RGM)(パネルB)に結合したヒトIgGの存在を検出するように設計されたフローサイトメトリー実験の結果を示す図である。
【図3】示されているように、プロテインAビーズもしくはプロテインGビーズから溶出された、IgG結合活性を含有する、ヒト血清を追加されたCDM(CDM/HuS)中またはMueller−Hinton培地中で培養された場合のMenW135のA22株から精製されたタンパク質を検出するために染色されたSDS−PAGEゲルの画像の図である。
【図4】Mascotを用いるMALDI−TOF質量フィンガープリンティングによって同定されたタンパク質のアミノ酸配列を示す図である。一致したペプチドは下線が引かれている。
【図5】NMA0776のタンパク質配列を用いて検索されるNCBIで入手可能な、侵襲性ナイセリア−メニンギティディスA群(Z2491;NMA)、B群(MC58;NMB)、およびC群(FAM18;NMC)、ならびにナイセリア−ゴノレア(FA 1090;NGO)のゲノムを含む様々な菌株由来のTspBアミノ酸配列のアラインメントの図である。
【図6】変性条件下で精製された、pQE31からのTspB−IGB発現からの精製産物(レーンA)および周辺質から非変性条件下で精製された、pET22b(+)からのTspB−IGB発現からの精製産物(レーンB)を示す図である。
【図7】MC58株ゲノム配列由来の遺伝子NMB1548によってコードされる完全長TspBのアミノ酸配列を示す図である。
【図8】NMA0776も加えた、図5に示されたタンパク質配列のうちの4つのアラインメントの図である。IGBドメイン、変種ペプチド領域、およびプロリンリッチ領域は、タンパク質配列の範囲に沿って名称が表示されている。
【図9】各群内で高い配列同一性を共有する3つの群の変種ペプチド配列についてのアラインメントを示す図である。変種ペプチドは、NMA0776のアミノ酸配列も加えた、図5に示されたアミノ酸配列に由来する。
【図10】パネルAは、変種ペプチド領域のN末端側であるIGBドメインのセグメントのアラインメントの図である。パネルBは、変種ペプチド領域のC末端側であるIGBドメインのセグメントのアラインメントの図である。図10に示された全ての配列は、図5および図8において前に示された様々なTspB配列に由来する。
【図11】ELISAによる、TspB1548IGBかまたはTspB628IGBのいずれかを含有するウェルへのヒトIgGの結合を示す図である。
【図12】顕微鏡スライド上にスポットされ、一晩乾燥された、TspB1628IGB(パネルA)およびTspB1548IGB(パネルB)の顕微鏡像の図である。
【図13】ドナー1血清およびドナー2血清由来のヒトIgGへの様々なナイセリア細菌株の結合を示すフローサイトメトリー実験の図である。
【図14】IgG結合能力についてナイセリア細菌の様々な菌株の選択をモニターする、フローサイトメトリー実験の図である。
【図15】NmBのMC58株(パネルA)およびNmAのZ2491株(パネルB)への、部分的に変性したTspB1628IGBで免疫されたマウス由来の血清の結合を示す図である。
【図16】自然に折り畳まれたTspB1548IGB(nTspB1548IGB)、自然に折り畳まれたTspB1628IGB(nTspB1628IGB)、または部分的に変性したTspB1628IGB(rfTspB1628IGB)で免疫されたマウス由来の追加の血清に関して、図15と同様の結合実験を示す図である。
【発明を実施するための形態】
【0009】
本発明および本発明の実施形態の特定の例を記載する前に、当然ながら、そのようなものは変化し得るため、本発明は、記載された特定の実施形態に限定されないことは理解されるべきである。本明細書に用いられる専門用語は、特定の実施形態を記載することのみを目的とし、本発明の範囲は添付された特許請求の範囲によってのみ限定されるものであるから、限定的であることを意図するものではないこともまた理解されるべきである。
【0010】
値の範囲が提供される場合、文脈上明らかに他の指示がない限り、下限値の単位の10分の1までの、その範囲の上限値と下限値の間のそれぞれの介在する値、およびその述べられた範囲における任意の他の述べられた値または介在する値が本発明内に含まれることは理解されている。これらのより小さい範囲の上限値および下限値は、そのより小さい範囲に独立して含まれることができ、その述べられた範囲における任意の具体的に除外された限界に従って、同様に本発明内に含まれる。述べられた範囲がその限界の一方または両方を含む場合、それらの含まれる限界のいずれかまたは両方を除外する範囲もまた本発明に含まれる。
【0011】
他に規定がない限り、本明細書に用いられる全ての技術用語および科学用語は、この発明が属する技術分野の当業者によって一般的に理解されているのと同じ意味をもつ。本明細書に記載されたものと類似または等価の任意の方法および材料もまた、本発明の実施または試験に用いることができるが、好ましい方法および材料はここで記載されている。本明細書で言及された全ての刊行物は、その引用されている刊行物に関連した方法および/または材料を開示および記載するために参照により本明細書に組み入れられている。
【0012】
本明細書および添付された特許請求の範囲で用いられる場合、単数形「1つの(a)」、「1つの(an)」、および「その(the)」は、文脈上明らかに他に規定されていない限り、複数の指示対象を含むことは留意されなければならない。したがって、例えば、「1つの抗原(an antigen)」への言及は、複数のそのような抗原を含み、「そのタンパク質(the protein)」への言及は、1つまたは複数のタンパク質への言及を含むなどである。
【0013】
本明細書で論じられている刊行物は、ただ単に、本出願の出願日前のそれらの開示として提供されている。本発明が、先発明という理由でそのような刊行物に先行する資格がないことを認めるものとして解釈されるべきことは本明細書には存在しない。さらに、提供される刊行物の日付は、実際の刊行日とは異なる場合があり、その実際の刊行日を別途、確認する必要があり得る。
【0014】
概要
本開示のポリペプチドは、T細胞刺激タンパク質B(TspB)に由来する(例えば、TspBの連続したアミノ酸配列を含有する)。TspBは、様々なナイセリア株によって発現しており、またOrf6と相同であり、Orf6は、ヒト髄膜炎菌疾患の大部分を引き起こすことが知られた多くの侵襲性ナイセリア−メニンギティディス株に見出される。
【0015】
本開示において、ナイセリア細菌の細胞表面でのTspB/Orf6の発現は、ヒト血清を含有する培地中で培養された場合、増強されることが見出されている。本明細書に提示されたポリペプチドは、ヒトIgの抗原特異性に依存せず(例えば、Fc領域に結合することによって)、ヒトIgに結合することができることも見出されている。TspB/Orf6のヒトIgへの結合は、結果として、ヒト補体の活性化を生じるが、生産的な溶菌またはオプソニン化貪食作用をもたらさない。したがって、TspB/Orf6は、ヒト補体活性化を避け、それにより細菌排除を低下させる細菌の能力を促進し得る。
【0016】
本開示のポリペプチドをワクチンとして用いることは、抗体を誘発することができる。そのような抗体はまた、TspBのヒトIgへの結合を防ぎ得る。本明細書に提示されたワクチンによって誘発される抗体は、その後、ヒト血液においてN.メニンギティディスの生存にとって重要な機構の不活性化をもたらし得る。
【0017】
そのようなポリペプチドは、他のワクチン(例えば、r3CなどのH因子結合タンパク質含有ワクチン)と組み合わせて用いられ、宿主においてそのワクチンによって誘発される抗ナイセリア免疫応答の殺菌活性を増強することができる。
【0018】
本開示のポリペプチドはまた、他のタンパク質または生体分子とコンジュゲートする場合、担体タンパク質として働き得る。そのようなコンジュゲートは、例えば、タンパク質−多糖コンジュゲートワクチンに用いられ得る。
【0019】
本開示は、完全長TspBではないが、TspBのアミノ酸配列由来のポリペプチド、ならびにワクチンの調製および抗体(例えば、ヒトIgGのFc領域を結合するなどのTspBの機能を遮断する抗体)の誘発におけるそのようなポリペプチドの使用方法を提供する。そのような実施形態の例は下に記載されている。
【0020】
本ポリペプチドおよび/または完全長TspBを作製するための方法もまた本明細書に提供される。方法は、ヒト血清の1つまたは複数の成分を追加した既知組成培地においてポリペプチドを発現する宿主細胞を培養することを含む。方法はまた、微小胞、外膜小胞、または両方の組み合わせなどの本ポリペプチドおよび/または完全長TspBを有する小胞を作製するために用いることもできる。
【0021】
定義
NMA0776、NMA1797、およびOrf6などの遺伝子によってコードされるタンパク質と相同のタンパク質としても文献中で知られている、「T細胞刺激タンパク質B」(TspB)は、T細胞およびB細胞の刺激タンパク質である。Orf6は、N.メニンギティディスによって、特に若年成人において(Billeら、2008 PLoS One 3:e3885)、引き起こされる侵襲性疾患と関連づけられているプロファージDNAに見出される9個の遺伝子のうちの1個である(Bille Eら、2005 J.Exp.Med.201:1905〜1913)。明確にするために、本開示は、TspBまたはOrf6を交換可能に用い得る。TspB/Orf6の例のアミノ酸配列について図5および図7を参照されたい。
【0022】
本明細書で用いられる場合、「成熟TspB」は、リーダーペプチド領域を欠くTspBを指す。リーダーペプチドは、天然の未成熟TspBのN末端に存在する。
【0023】
TspBにおけるアミノ酸残基に関して、NMB1548によってコードされるB群MC58株の天然のTspB(NP_274555)が、残基番号付けを目的とした参照配列として本明細書で用いられる(例えば、図7参照)。図7に示されているように、このTspBアミノ酸配列がリーダーペプチド領域を含有することは留意されたい。TspBの長さは、1つの遺伝子と別の遺伝子とでは5個、19個、または最高44個までのアミノ酸残基だけ異なり得るため、TspBタンパク質におけるアミノ酸残基を指すために本明細書で用いられる番号付けシステムは、これらのタンパク質の実際のアミノ酸配列に基づいた番号付けとは異なる場合がある。したがって、例えば、図5におけるMC58(NP_274555)配列の位置216のメチオニン残基(M)への言及は、NMC0283(YP_974402)の位置211の残基を指す。さらに明確にするために、図5におけるアラインメントを参照されたい。
【0024】
用語「ポリペプチド」、「ペプチド」、および「タンパク質」は、本明細書で交換可能に用いられ、任意の長さのアミノ酸の重合体型を指し、それには、遺伝子コード化アミノ酸および非遺伝子コード化アミノ酸、化学的または生化学的に改変または誘導体化されたアミノ酸、ならびに改変ペプチドバックボーンを有するポリペプチドが挙げられる。その用語は、融合タンパク質を包含し、それには、異種性アミノ酸配列を有する融合タンパク質、N末端メチオニン残基を有するまたは有さない、異種性および相同性リーダー配列を有する融合体;免疫学的タグの付いたタンパク質などが挙げられるが、それらに限定されない。
【0025】
この本開示を通して、1文字表記または三文字表記によるアミノ酸が参照されることは理解されよう。読者の便宜のために、一文字および三文字アミノ酸表記を下記に提供する:
【0026】
【表A】

【0027】
用語「核酸分子」および「ポリヌクレオチド」は、交換可能に用いられ、デオキシリボヌクレオチドもしくはリボヌクレオチド、またはその類似体のいずれかの、任意の長さのヌクレオチドの重合体型を指す。ポリヌクレオチドの非限定的例には、線状および環状核酸、メッセンジャーRNA(mRNA)、cDNA、組換えポリヌクレオチド、ベクター、プローブ、ならびにプライマーが挙げられる。
【0028】
用語「異種性」は、例えば、天然で見出されない核酸またはタンパク質を提供するために、異なる源由来の構造によって定義される2つの成分を指す。例えば、「異種性」がポリペプチドとの関連で用いられる場合、ポリペプチドには、異なるポリペプチドに由来し得る、作動可能に連結したアミノ酸配列(例えば、組換えペプチドで構成される第1の成分、および天然のTspBポリペプチド由来の第2の成分)が挙げられる。同様に、キメラポリペプチドをコードするポリヌクレオチドとの関連における「異種性」には、異なる遺伝子に由来し得る、作動可能に連結した核酸配列(例えば、本明細書に開示された実施形態によるペプチドをコードする核酸由来の第1の成分、および担体ポリペプチドをコードする核酸由来の第2の成分)が挙げられる。本明細書に記載されているような融合ポリペプチドは、異なるポリペプチドに通常見出される、単一ポリペプチドにおけるエピトープの提示を提供する。他の例示的な「異種性」核酸には、(例えば、プロモーター、コード配列、または両方に対して異なる遺伝的起源であり得る関心対象の宿主細胞における発現を提供するために)、コード配列を含む核酸が、コード配列のものとは異なる遺伝的起源由来である制御エレメント(例えば、プロモーター)と作動可能に連結している、発現構築物が挙げられる。例えば、TspBポリペプチドまたはそのドメインをコードするポリヌクレオチドに作動可能に連結したT7プロモーターが異種性核酸であると言われる。組換え細胞との関連における「異種性」は、核酸が存在している宿主細胞と異なる遺伝的起源である核酸(またはポリペプチドなどの遺伝子産物)の存在を指し得る。例えば、1つの株のナイセリアアミノ酸配列または核酸配列は、別の株のナイセリア宿主に対して異種性である。
【0029】
用語「作動可能に連結した」は、所望の機能を提供するために分子間の機能的連結を指す。例えば、核酸との関連における「作動可能に連結した」とは、転写、翻訳などの所望の機能を提供するための核酸間の機能的連結を指し、例えば、(プロモーター、シグナル配列、または転写因子結合部位のアレイなどの)核酸発現調節配列と、第2のポリヌクレオチドとの間の機能的連結であって、発現調節配列が第2のポリヌクレオチドの転写および/または翻訳に影響する、機能的連結を指す。ポリペプチドとの関連における「作動可能に連結した」とは、ポリペプチドの記載された活性(例えば、エピトープを特異的に結合する抗体の産生を促進するためのそのエピトープの提示)を提供するための、(例えば、異なるドメインの)アミノ酸配列間の機能的連結を指す。
【0030】
ポリペプチドの構造との関連において本明細書で用いられる場合、「N末端」および「C末端」は、それぞれ、ポリペプチドの一番端のアミノ端およびカルボキシル端を指し、一方、「N末端側」および「C末端側」は、それぞれ、N末端およびC末端の方へのポリペプチドのアミノ酸配列における相対的位置を指し、それには、それぞれ、N末端およびC末端における残基を挙げることができる。「N末端側へすぐの」または「C末端側へすぐの」とは、第1のアミノ酸残基の第2のアミノ酸残基に対する位置を指し、第1アミノ酸残基と第2アミノ酸残基は、共有結合して連続したアミノ酸配列を提供している。
【0031】
アミノ酸配列またはポリヌクレオチド配列との関連における「由来の」(例えば、TspB「由来の」アミノ酸配列)とは、ポリペプチドまたは核酸が、参照ポリペプチドまたは核酸(例えば、天然のTspBまたはコード核酸)の配列に基づいている配列を有することを示すように意図され、タンパク質または核酸が作製される供給源または方法に関して限定的であることを意図するものではない。細菌株との関連における「由来の」とは、菌株が、親株の継代インビボもしくはインビトロ培養によって得られ、および/または親株の改変によって得られた組換え細胞であることを示すように意図される。したがって、例えば、「TspB由来ポリペプチド」は、天然のTspBポリペプチドのアミノ酸配列に基づいたアミノ酸配列を有するポリペプチドを記載するために用いられる。
【0032】
用語「防御免疫」とは、哺乳動物に投与されるワクチンまたは免疫スケジュールが、ナイセリア−メニンギティディスによって引き起こされる疾患の発生を防ぎ、遅らせ、もしくはその疾患の重症度を低下させ、またはその疾患の症状を減少させ、もしくは完全に除去する免疫応答を誘導することを意味する。防御免疫は、殺菌抗体の産生に付随して起こり得る。ナイセリア−メニンギティディスに対する殺菌抗体の産生が、ヒトにおけるワクチンの防御効果を予測するものとして当分野で受け入れられていることは留意されるべきである(Goldschneiderら、1969、J.Exp.Med.129:1307;Borrowら、2001 Infect Immun.69:1568)。
【0033】
句「ナイセリア−メニンギティディスによって引き起こされる疾患」は、ナイセリア−メニンギティディスによるヒトの感染において存在する任意の臨床症状または臨床症状の組み合わせを包含する。これらの症状には、ナイセリア−メニンギティディスの病原株による上気道(例えば、鼻咽頭および扁桃腺の粘膜)のコロニー形成、粘膜および粘膜下血管床への細菌の侵入、敗血症、敗血症性ショック、炎症、出血性皮膚病変、線維素溶解および血液凝固の活性化、腎不全、肺不全、および心不全などの臓器不全、副腎出血および筋肉梗塞、毛細管漏出、浮腫、末梢性肢虚血、呼吸促迫症候群、心膜炎、ならびに髄膜炎が挙げられるが、それらに限定されない。
【0034】
句「広域防御免疫」とは、ワクチンまたは免疫スケジュールが、ナイセリア−メニンギティディスの少なくとも1つより多い変種、亜変種、および/または菌株に対して(および少なくとも2つ、少なくとも3つ、少なくとも4つ、少なくとも5つの菌株に対して、少なくとも8つ、またはそれ以上の菌株に対してであり得る)「防御免疫」を誘発することを意味する。本開示は、具体的には、任意の莢膜群のメンバー(例えば、A、B、C、W135、X、Y、29E)によって引き起こされる疾患に対して防御を与えるワクチンまたはワクチン投与計画を企図し、包含し、ナイセリア−メニンギティディスの莢膜群Bの菌株によって引き起こされる疾患に対する防御は、この莢膜群に関する疾患を引き起こす菌株の疫学的蔓延および広く効果的なB群ワクチンの欠如によって関心をもたれている。例えば、単独での、または関心対象となるエピトープ(複数可)を提示する他の成分と組み合わせての本開示のポリペプチドは、多様な莢膜群にわたって交差反応する殺菌抗体応答を増強するために用いることができる。
【0035】
用語「宿主」または「対象」は、ヒトおよび非ヒト動物を指すために本明細書で交換可能に用いられ、非ヒト動物は、一般的に、抗ナイセリア抗体の産生との関連において指示され、ヒトは、ナイセリア感染による疾患のリスクを低下させるワクチン接種についての関心対象の宿主である。
【0036】
抗原(例えば、ポリペプチド抗原)との関連における句「抗体に特異的に結合する」または「に特異的免疫反応性である」とは、他の分子の異種性集団も含む可能性がある試料において抗原の存在に基づく、および/または抗原の存在の証拠となる結合反応を指す。したがって、指定された条件下で、特定化された1つまたは複数の抗体は、試料において特定の1つまたは複数の抗原に結合し、試料に存在する他の分子に有意な量では結合しない。抗原のエピトープ(例えば、ポリペプチドのエピトープ)との関連における「抗体に特異的に結合する」または「に特異的免疫反応性である」とは、他のエピトープの異種性集団も、加えて抗原の異種性集団も含む可能性がある抗原(例えば、ポリペプチド)におけるエピトープの存在に基づく、および/またはエピトープの存在の証拠となる結合反応を指す。したがって、指定された条件下で、特定化された1つまたは複数の抗体は、抗原の特定のエピトープに結合し、その抗原内および/または試料中に存在する他のエピトープに有意な量では結合しない。
【0037】
句「免疫応答を誘発するのに十分な量で」とは、特定の抗原調製物の投与前と後に測定される免疫応答指標間に検出可能な差があることを意味する。免疫応答指標には、酵素結合イムノアッセイ(ELISA)、殺菌性アッセイ、フローサイトメトリー、免疫沈降法、オークタロニー免疫拡散法;例えば、スポット、ウェスタンブロット、または抗原アレイの結合検出アッセイ;細胞毒性アッセイなどのアッセイによって検出されるような、抗体力価または特異性が挙げられるが、それらに限定されない。
【0038】
「表面抗原」は、細胞、特にナイセリア−メニンギティディスなどの細菌の細胞の表面構造に存在する抗原(例えば、外膜、莢膜、線毛など)である。
【0039】
「単離された」とは、その化合物が、天然に存在する場合には、天然で存在し得る環境とは異なる環境にある関心対象の化合物を指す。「単離された」とは、関心対象の化合物について実質的に濃縮され、および/または関心対象の化合物が部分的もしくは実質的に精製されている試料内にある化合物を含むことを意図される。化合物が天然に存在しない場合、「単離された」とは、化合物が、それが合成手段または組換え手段のいずれかによって作製された環境から分離されていることを示す。
【0040】
「濃縮された」とは、関心対象の化合物が生体試料(例えば、その化合物が自然発生している試料、またはそれが投与後に存在する試料)などの出発試料、または化合物が作製された(例えば、細菌性ポリペプチド、抗体、キメラポリペプチドなどにおいてのような)出発試料中のその化合物の濃度より高い濃度(例えば、少なくとも3倍高い、少なくとも4倍高い、少なくとも8倍高い、少なくとも64倍高い、またはそれ以上)で存在するように、試料が非自然的に(例えば、実験者または臨床医によって)操作されることを意味する。
【0041】
「実質的に純粋な」とは、実体(例えば、ポリペプチド)が、その組成の全内容物(例えば、組成の全タンパク質)の約50%より多く、典型的には、全タンパク質内容物の約60%より多くを構成することを示す。より典型的には、「実質的に純粋な」とは、全組成の少なくとも75%、少なくとも85%、少なくとも90%、またはそれ以上が関心対象の実体である、組成(例えば、全タンパク質についてを指す。好ましくは、そのタンパク質は、組成における全タンパク質の約90%より多く、より好ましくは約95%より多くを構成する。
【0042】
TspB由来ポリペプチド
本ポリペプチドは、抗体を誘発するのに用いられる。誘発された抗体がTspBを結合する場合、抗体は、TspBのヒトIgへの結合を阻害し得る。そのようなポリペプチドは、抗ナイセリア免疫応答を促進する抗TspB抗体を誘発する方法に用いることができる免疫原性組成物の作製に用いられる。
【0043】
本開示のポリペプチドは、(例えば、免疫原性組成物において提供することができる)抗原性断片としての機能を果たすのに十分な長さのTspB由来の連続したアミノ酸残基を含有する。そのようなポリペプチドは、少なくとも55アミノ酸残基長、少なくとも60〜100アミノ酸残基長、少なくとも60〜150アミノ酸残基長、少なくとも60〜200アミノ酸残基長、少なくとも60〜250アミノ酸残基長、少なくとも60〜300アミノ酸残基長、または少なくとも60〜400アミノ酸残基長であるTspBの連続したアミノ酸配列を有し得る。抗原性断片であることに加えて、本開示のポリペプチドはまた、ヒトIgの抗原特異性に依存しない(例えば、Fc領域への結合による)、ヒトIgへの結合活性を保持し得る。
【0044】
本開示のポリペプチドの1つの例は、図5、図7、および図8において区画を定められているような、NMB1548株由来の免疫グロブリン結合(IGB)ドメイン(例えば、配列番号47)を含有する。本開示のポリペプチドの別の例は、図8に示されているような、NMB1628などの別の株由来のIGBドメイン(例えば、配列番号48)を含有する。
【0045】
用語「IGBドメイン」はまた、TspBの「球状βシート」ドメインまたは「定常領域」(CR)とも本明細書で呼ばれる。完全長TspBアミノ酸配列を、図5で整列させており、そこでは、IGBドメインが区画を定められている。Nmb 1548 TspBに見出される特定のIGBドメインは図7において区画を定められている。TspBのIGBドメインおよび他のドメインもまた、図8でのTspBアミノ酸配列の例において区画を定められている。
【0046】
ナイセリアTspBのアミノ酸配列と実質的に類似しているアミノ酸配列を含むポリペプチドには、ナイセリアTspBの約55アミノ酸から約75アミノ酸まで、約75アミノ酸から約100アミノ酸まで、約100アミノ酸から約150アミノ酸まで、約150アミノ酸から約200アミノ酸まで、約200アミノ酸から約250アミノ酸まで、約250アミノ酸から約300アミノ酸まで、約300アミノ酸から約350アミノ酸まで、約350アミノ酸から約400アミノ酸まで、約400アミノ酸から約450アミノ酸まで、約450アミノ酸から約500アミノ酸まで、約500アミノ酸から約550アミノ酸まで、または約550アミノ酸から約580アミノ酸までの連続したひと続きと少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約98%、または少なくとも約99%のアミノ酸配列同一性を有するアミノ酸配列を含むポリペプチド(例えば、配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、または配列番号12に示されているようなTspB)が挙げられる。
【0047】
本ポリペプチドは、完全長成熟TspBを含有していなくてもよく、天然の完全長成熟TspBに対して少なくとも5アミノ酸、少なくとも10アミノ酸、少なくとも50アミノ酸、少なくとも100アミノ酸、少なくとも200アミノ酸以上までを欠いてもよい。例えば、本ポリペプチドは、リーダーペプチド配列および/またはN末端可変ドメインを欠く切断型TspBであってもよい。1つのそのようなポリペプチドは、それが天然の未成熟ポリペプチドの104個の最もN末端側のアミノ酸残基を欠くというように、切断されている遺伝子NMB1548によってコードされるTspBとして記載することができる。リーダーペプチド配列および/またはN末端可変ドメインは、図7および図8に示されているように、免疫グロブリン結合(IGB)ドメインよりN末端側の配列である。ポリペプチドはまた、プロリンリッチドメインを含むことも、排除することもできる。
【0048】
本開示のポリペプチドは、図5、図7、および図8において示されているように、IGBドメインを有するとして記載することができる。TspBのIGBドメインは、セリン105から始まり、プロリン358で始まるプロリンリッチドメインの前で終わる。IGBドメインの始まりおよびプロリンリッチドメインの始まりをそれぞれ、特徴づける各TspBにおけるセリンおよびプロリンは、図5および図8において太字で示されている。上記で述べたように、本明細書で参照される場合のアミノ酸残基番号付けシステムは、MC58株のNMB1548によってコードされているようなNP_274555に基づいている。上記で述べたように、用語「IGBドメイン」はまた、図7に示されているように球状βシートドメインまたは定常領域(CR)と同義である。
【0049】
TspBの各IGB領域内に、図5および図8に示された全てのTspB配列にわたって高いアミノ酸配列同一性を共有しないアミノ酸残基の連続したセグメントがある。図8において「変種群ペプチド」と名称を付けられたこのアミノ酸配列の連続したセグメントは、そのN末端およびC末端の両方において、図5および図8に示されたTspB配列にわたって高度に保存されているアミノ酸配列に隣接している。変種ペプチド領域のアミノ酸配列は、本明細書でTspB群と呼ばれた群に変種ペプチド領域を分類する根拠として用いることができる。変種ペプチド領域のアラインメントにより、各TspB群内の高度に保存された変種ペプチド配列が示されている。変種ペプチド領域のいくつかの例のそのようなアラインメントは、図9に示されている。
【0050】
「変種群ペプチド」または「VN」は、この領域におけるアミノ酸配列の類似性に基づいた「群」にナイセリア株を割り当てるために用いることができる、TspBの連続したアミノ酸配列を指す。図7、図8、および図9に示されているように、VNは、メチオニン214(M214)から始まり、リシン277(K277)で終わり、それらは、TspBのアミノ酸配列において太字および下線で示されている(図7)。各TspBについて変種群ペプチド領域を始めるメチオニンもまた、図8において太字で示されている。図9に示されているように、変種群ペプチドは、示された3つの群のそれぞれの中で高度に保存されている。
【0051】
本ポリペプチドは、変種群ペプチド領域の1つまたは多量体(例えば、少なくとも2つ、少なくとも3つ以上)を含有することができ、それぞれは、図9に示された群から非依存的に選択される。例えば、本ポリペプチドは、図9に示されているような配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、または配列番号22と少なくとも84%、少なくとも85%、少なくとも86%、少なくとも88%、少なくとも89%、少なくとも93%、少なくとも95%、少なくとも98%、100%までの同一性の連続したアミノ酸配列を含有することができる。
【0052】
本ポリペプチドが1つより多い変種群ペプチドを有する場合、変種群ペプチドは、リンカーによって分離されていてもよい。例えば、VNが3つの変種群ペプチド領域を含有する場合には、それはV1−L1−V2−L2−V3と表され得る。1つより多いリンカーが本ポリペプチドに用いられる場合、用いられる各リンカーは非依存的に選択され、本ポリペプチドにおける他のリンカーと異なってもよい。変種群ペプチドに加えて、本開示のポリペプチドはまた、図5および図8に示されたTspBアミノ酸配列において変種ペプチド領域に隣接するIGBドメイン内のアミノ酸配列などのTspBにおける他のアミノ酸配列(SN)を任意で有することができる。
【0053】
本ポリペプチドが変種ペプチド領域(複数可)に隣接するアミノ酸配列(SN)を含有する場合、隣接アミノ酸配列は、変種群ペプチド領域よりN末端側の(例えば、先行する)IGBドメインのセグメント(例えば、S1)、および/または変種群ペプチド領域よりC末端側の(例えば、後の)IGBドメインのセグメント(例えば、S2)であってもよい。TspBの他の区域由来の連続したアミノ酸セグメントもまた、本ポリペプチドへSN(例えば、IGBドメイン以外のアミノ酸配列)として組み入れることができる。
【0054】
変種ペプチド領域よりN末端側であるIGBドメインのアミノ酸配列の例(例えば、S1)は、図10のパネルAにおいて、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29、配列番号30、配列番号31、配列番号32、配列番号33、および配列番号34として示されている。
【0055】
変種ペプチド領域よりC末端側であるアミノ酸配列の例(例えば、S2)は、図10のパネルBにおいて、配列番号35、配列番号36、配列番号37、配列番号38、配列番号39、配列番号40、配列番号41、配列番号42、配列番号43、配列番号44、配列番号45、および配列番号46として示されている。
【0056】
したがって、本ポリペプチドの例は、以下の式、S1−L1−VN−L2−S2によって表すことができ、式中、LNは、本ポリペプチドにおいてアミノ酸配列を一緒に連結するために任意で存在してもよいし、存在しなくてもよい1つまたは複数のリンカーを指し、VNは、上記のように、変種群ペプチドアミノ酸配列の1つまたは複数を指し、S1およびS2は、また上記のように、隣接アミノ酸配列(例えば、IGBドメイン由来のアミノ酸配列など)を指す。本ポリペプチドのいくつかの例は、S1−V1−L1−V2−L2−V3−S2、S1−V1−S2−L1−S1−V2−S2、またはS1−L1−V1−L2−S2と表すことができる。他の組み合わせおよび順列もまた本明細書で企図される。
【0057】
変種群ペプチド領域の連続したアミノ酸配列を包含する場合もある、IGBドメイン由来の連続したアミノ酸配列を有することの他に、本ポリペプチドは、TspBの他のドメインを含有することができる。例えば、本ポリペプチドは、図7および図8において名称が付けられているように、プロリンリッチドメインおよび/または膜貫通アンカードメイン由来の連続したアミノ酸配列をさらに含有することができる。そのようなポリペプチドの例は、V1−S1−S2−S3によって表すことができ、式中、S1はIGBドメイン由来の隣接アミノ酸配列を表し、S2はプロリンリッチドメインを表し、S3は膜アンカードメインを表す。S1、S2、S3はまた、それぞれ、TspBまたは他の型のタンパク質の任意のセグメント由来の連続したアミノ酸配列に非依存的に置換することができる。例えば、ポリペプチドは、TspB以外のタンパク質由来の膜貫通ドメイン(「異種性」膜貫通ドメイン)を含んでもよい。膜貫通ドメインを含有する本ポリペプチドは、本ポリペプチドを小胞内に提供するのに用いることができる。
【0058】
本開示は、単離されたポリペプチド、TspBの抗原性断片、およびTspBの変種を提供する。本ポリペプチドは、天然源から単離されていてもよく、例えば、それの天然の環境以外の環境にある。本ポリペプチドはまた、例えば、遺伝子改変の宿主細胞(例えば、細菌、酵母、ピキア(Pichia)、昆虫細胞など)において、組換えで作製されてもよく、遺伝子改変の宿主細胞は、本ポリペプチドをコードするヌクレオチド配列を含む核酸で遺伝子改変されている。本ポリペプチドは合成ポリペプチドを含み、例えば、本合成ポリペプチドは、実験室で(例えば、無細胞化学合成により)化学合成される。
【0059】
本明細書で開示されたポリペプチドには、本明細書で提供された特定の連続したアミノ酸配列のポリペプチド、および1個、2個、3個、4個、5個、6個、7個、8個、9個、または10個、通常には10個以下、6個以下、または4個以下のアミノ酸置換を有するポリペプチドが挙げられ、その置換は、通常、保存的アミノ酸置換である。「保存的アミノ酸置換」とは、一般的に、以下のグループ内のアミノ酸残基の置換を指す:
1)L、I、M、V、F;
2)R、K;
3)F、Y、H、W、R;
4)G、A、T、S;
5)Q、N;および
6)D、E
【0060】
本明細書に開示されたペプチドまたはポリペプチドとの関連における保存的アミノ酸置換は、関心対象のエピトープの提示かまたはポリペプチドのFc結合活性のいずれかを保存するように選択される。そのような提示は、置き換えられることになっているアミノ酸の側鎖と類似した酸度、塩基度、電荷、極性、またはサイズの側鎖を有するアミノ酸で置換することによって保存することができる。そのような置換についてのガイダンスは、TspBのアミノ酸配列のアラインメントにおいて導き出され得る。例えば、図5に示されたアラインメントにより、完全に保存されている特定の残基位置(*)において、置換、欠失、または挿入を許すことはできないが、1個または複数の残基が保存されていない他の位置において、アミノ酸変化が許容され得る。半保存されている残基(.または:)は、電荷、極性、および/またはサイズを保存する変化を許容し得る。
【0061】
本開示のポリペプチドは、天然の折り畳まれた形、または少なくとも部分的に変性した形(例えば、部分的に変性した、または完全に変性した形)で提供することができる。
【0062】
一実施形態において、ポリペプチドは、少なくとも部分的に変性している。ポリペプチドが少なくとも部分的に変性した形をとる場合、ポリペプチドは成熟の完全長TspBまたはその断片であってもよい。部分的に変性したポリペプチドは、TspBに対する抗体を誘発する免疫原として用いることができる。TspBタンパク質またはその断片との関連における「少なくとも部分的に変性した」とは、タンパク質がTspBまたはその断片と重合体を形成する能力を減少させるように、タンパク質が、天然のTspBまたはその断片に対して三次構造において改変されていることを意味する。部分的変性は、例えば、変性剤(例えば、尿素、還元剤、高塩濃度(例えば、塩化リチウム、過塩素酸ナトリウム))、加熱、界面活性剤などの存在下での精製によって達成することができる。例えば、部分的に変性したポリペプチドは、変性条件下でポリペプチドを精製することによって得ることができる。
【0063】
少なくとも部分的に変性したTspBポリペプチドは、ポリペプチドが重合体を形成する能力を調べることによって同定することができる。例えば、顕微鏡による目に見える重合体の形成、またはTspBの水溶液中でのゲルの形成による。
【0064】
少なくとも部分的に変性したTspBポリペプチドは、免疫グロブリンの天然TspBへの結合を遮断する抗TspB抗体を誘発するそれらの能力によって同定することができる。フローサイトメトリーによる、生きているナイセリア細菌へのIgG結合を遮断する抗TspBの能力。
【0065】
本開示の少なくとも部分的に変性したTspBまたはその断片での免疫化は、ヒト免疫グロブリンの結合を遮断する抗体を誘発する。そのようなことは、ナイセリアの病原性にとって重要な機構を阻害することができる。部分的に変性したポリペプチドの例には、変性条件下で精製されるNmB 1628(rf TspB1628IGB)由来のTspBのIGBドメインを挙げることができる。
【0066】
タンパク質コンジュゲート
本開示のポリペプチドは、本明細書に記載されているような本ポリペプチドを含有する融合タンパク質として提供することができる。例えば、上記のようなポリペプチドは、別のタンパク質のN末端に融合することができる。
【0067】
本開示のポリペプチドは、(例えば、本ポリペプチドに対して異種性のアミノ酸配列を有する)タンパク質および/または担体分子などの、ポリペプチドのN末端および/またはC末端に1つまたは複数の追加のエレメントを含有していてもよい。本ポリペプチドに連結され得る例示的なエレメントには、脂肪酸部分(例えば、脂肪族カルボン酸)および/または担体分子(例えば、担体タンパク質(例えば、ウシ血清アルブミン(BSA))、オボアルブミン、キーホールリンペットヘマシアニン(KLH)、ウシチログロブリン、大豆トリプシンインヒビター、ツベルクリンの精製タンパク質誘導体(PPD)、サイトカイン、またはfHbp、NadA、GNA2132などの他のワクチン抗原などが挙げられる。そのような追加のエレメントは、リンカー、例えば、可動性リンカーを介してポリペプチドに連結されてもよい。例えば、ポリペプチドは、例えば、投与を促進するために、および/またはN.メニンギティディスに対してワクチン接種もしくは処置される対象において免疫原性を増加させるために、担体分子にコンジュゲートされてもよい。追加の部分はまた、免疫原性、もしくはワクチンにおいて別の成分と複合体を形成するのに役に立つことができ、および/または関心対象の細胞もしくは組織への送達を促進することができる。
【0068】
ポリペプチドはまた、分子模倣体、莢膜多糖、またはその誘導体などの抗原とコンジュゲートするように改変することができる。莢膜多糖は、髄膜炎菌群A、C、W135、Y、および/またはXに見出されるものであってもよい。そのようなものの例は、米国特許第4,727,136号および第6,030,619号に記載されており、その特許の開示は参照により本明細書に組み入れられている。
【0069】
本ポリペプチドが多糖誘導体にコンジュゲートしている場合、多糖誘導体は、長鎖炭化水素を含有するものなどのN−アセチルまたはデ−N−アセチルポリシアル酸誘導体の混合物、およびその凝集体であってもよい。多糖は、本ポリペプチドに、N末端/C末端の一方および/もしくは両方で、または内部のアミノ酸残基へ付着していてもよい。多糖は、アミノ酸残基に、リンカーを介して、または直接的にコンジュゲートしてもよい。本明細書で企図されるTspBコンジュゲートに用いるのに適した多糖誘導体、およびそのような多糖誘導体を作製する方法は、当技術分野において知られている。
【0070】
融合タンパク質として提供される場合、担体分子は、TspBの球状ドメインの免疫系への提示を促進し、それにしたがって、ヒトIgに結合する性質を有する抗N.メニンギティディス抗体の産生を促進し得る。ポリペプチドは、N末端に融合することができ、C末端に融合することができ、またはTspBの球状ドメインのアミノ酸配列が担体タンパク質配列に隣接しているようにスキャフォールド内に位置することができる。スキャフォールドはまた、膜表面上でのポリペプチドのディスプレイを促進し得る(例えば、小胞ワクチン)。ポリペプチドは担体タンパク質に対して異種性であり、したがって、天然では見出されない融合ポリペプチドを提供する。
【0071】
リンカー
上記で述べたように、リンカーは、任意で、本ポリペプチドのコンジュゲート内に存在してもよい。上記で例示された追加のエレメントを含むようにポリペプチドを改変するために用いるのに適したリンカーには「可動性リンカー」が挙げられる。適切なリンカーは、容易に選択することができ、4アミノ酸から10アミノ酸まで、5アミノ酸から9アミノ酸まで、6アミノ酸から8アミノ酸まで、または7アミノ酸から8アミノ酸までを含む、1アミノ酸(例えば、Gly)から20アミノ酸まで、2アミノ酸から15アミノ酸まで、3アミノ酸から12アミノ酸までなどの適切な様々な長さのいずれかであり得、1アミノ酸、2アミノ酸、3アミノ酸、4アミノ酸、5アミノ酸、6アミノ酸、または7アミノ酸であってもよい。
【0072】
可動性リンカーの例として、グリシンポリマー(G)n、グリシン−セリンポリマー(例えば、(GS)n、GSGGSn(配列番号50)およびGGGSn(配列番号60)、式中、nは少なくとも1の整数である)が挙げられる)、グリシン−アラニンポリマー、アラニン−セリンポリマー、および当技術分野において知られた他の可動性リンカーが挙げられる。グリシンおよびグリシン−セリンポリマーは、これらのアミノ酸のどちらも比較的、構造化されておらず、それゆえに、成分間の中立のつなぎ鎖としての役割を果たし得るため、関心対象となる。グリシンポリマーは、グリシンが、アラニンよりもさえ、有意に大きいφ−ψ空間に到達し、かつより長い側鎖を有する残基よりはるかに制限が少ないため、特に関心対象となる(Scheraga、Rev.Computational Chem.11173〜142(1992)参照)。例示的な可動性リンカーには、GGSG(配列番号51)、GGSGG(配列番号52)、GSGSG(配列番号53)、GSGGG(配列番号54)、GGGSG(配列番号55)、GSSSG(配列番号56)などが挙げられるが、それらに限定されない。上記の任意のエレメントにコンジュゲートしたポリペプチドの設計は全面的に、または部分的に可動性であるリンカーを含むことができ、それゆえに、リンカーが、可動性リンカーだけでなく、可動性に劣る構造を与える1つまたは複数の部分を含み得ることを、当業者は認識しているであろう。
【0073】
作製方法
本開示のポリペプチドは、組換え方法および非組換え方法(例えば、化学合成)を含めた任意の適切な方法によって作製することができる。ポリペプチドが化学合成される場合、合成は、液相または固相を介して進行し得る。固相合成(SPPS)は、非天然アミノ酸の取り込み、ポリペプチド/タンパク質バックボーンの改変を可能にする。FmocおよびBocなどの様々な型のSPPSが本発明のポリペプチドを合成するのに利用可能である。化学合成の詳細は当技術分野において知られている(例えば、Ganesan A.2006 Mini Rev.Med Chem.6:3〜10、およびCamarero JAら、2005 Protein Pept Lett.12:723〜8)。
【0074】
簡単に述べれば、小さい不溶性多孔性ビーズを、ポリペプチド鎖が構築される機能単位で処理する。結合/脱保護のサイクリングを繰り返した後、付着した固相の遊離N末端アミンを、単一のN−保護化アミノ酸単位に結合させる。その後、この単位は脱保護され、さらなるアミノ酸が付着し得る新しいN末端アミンを顕わにする。ポリペプチドは固相に固定化されたままであり、切断される前に濾過工程を受ける。
【0075】
ポリペプチドが組換え技術を用いて作製される場合、方法は任意の適切な構築物および任意の適切な宿主細胞を含み得、その宿主細胞は、原核細胞または真核細胞、通常には細菌細胞(例えば、大腸菌(E.coli)BL21(DE3)または大腸菌TOP10F’)または酵母宿主細胞であり得る。
【0076】
本ポリペプチドを作製するために、例えば、ポリペプチドが小胞に基づいたワクチンにおいて提供されることになっている場合、ナイセリア細菌などの細菌細胞を用いてもよい。様々なナイセリア株のいずれも、本開示のポリペプチドを作製する方法に用いることができる。病原性ナイセリア種または病原性ナイセリア種由来の株、特にヒトにとって病原性の株またはヒトにとって病原性もしくは共生の株由来の株が、特に関心対象となる。例示的なナイセリア種として、N.メニンギティディス(N.meningitidis)、N.フラベセンス(N.flavescens)、N.ゴノレア(N.gonorrhoeae)、N.ラクタミカ(N.lactamica)、N.ポリサッカレア(N.polysaccharea)、N.シネレア(N.cinerea)、N.ムコーサ(N.mucosa)、N.スブフラバ(N.subflava)、N.シッカ(N.sicca)、N.エロンガータ(N.elongata)などが挙げられる。細菌株との関連における「由来の」とは、菌株が、親株のインビボでの継代を通して、もしくはインビトロ培養において得られ、および/または親株の改変によって得られた組換え細胞であることを示すように意図される。
【0077】
宿主細胞として用いられ得るN.メニンギティディス株の例は、任意の血清学的群、血清型または亜型、例えば、血清群A、B、C、X、Y、Z、29−E、およびW−135であり得る。血清群A、B、C、X、Y、およびW−135の株が特に関心対象となる。
【0078】
本開示のTspB由来ポリペプチドに加えて、本ポリペプチドの発現に用いられるナイセリア宿主細胞は、H因子結合タンパク質(fHbp)、PorA、GNA2132などの関心対象となる他の抗原を自然に発現することができ、またはそれらを発現するように遺伝子改変することができる。宿主細胞へ導入された核酸から発現するポリペプチドは、本明細書で「外因性」であると呼ばれる。宿主細胞が内因性TspBを産生する場合、外因性の本ポリペプチドは、内因性TspBの連続したアミノ酸配列と同じ、または異なるアミノ酸配列を有し得る。宿主細胞の天然TspBをコードする遺伝子は、任意で、例えば、TspBノックアウト株などの、機能的内因性TspBを発現しない宿主細胞を提供するために、改変されてもよい。
【0079】
ナイセリア細菌はまた、下記のように、LPS生合成に欠陥を有するように遺伝子改変されてもよい。例えば、宿主細胞は、lpxL1遺伝子の産物の活性の減少または欠損を提供するように遺伝子改変されてもよく、かつそれは、対象に投与された場合、血清抗TspB抗体を誘起する小胞を提供するのに十分な、本開示のポリペプチドのレベルを産生する。膜小胞調製およびlpxL1遺伝子の発現を減少させることに関する詳細は、後で下文に記載されており、米国特許出願公開第20090035328およびPCT公開WO2006/081259にも見出すことができ、それらの特許出願の開示は参照により本明細書に組み入れられている。
【0080】
本開示はまた、ナイセリア宿主細胞がヒト血清の存在下で培養される、本ポリペプチドおよび/または完全長成熟TspBを産生する方法を提供する。本方法を、(例えば、小胞ワクチン用として)小胞内に本ポリペプチドおよび/または完全長成熟TspBを提供するために用いてもよい。方法が小胞内にポリペプチドを提供するために用いられる場合、産生される小胞は、上記のポリペプチドの1つ、2つ、3つ、またはそれ以上の異なる型を含有することができる。小胞はまた、完全長成熟TspBを単独で、または上記のポリペプチドのいずれかに加えて含んでもよい。用いられる宿主細胞は、任意で、上記のように、内因性TspB産生が破壊されていてもよい。産生方法は、外膜小胞(OMV)および/または微小胞(MV)を産生するために用いることができ、それらは、小胞に基づいたワクチンにおいて単独かまたは組み合わせてかのいずれかで、免疫原性組成物に用いることができる。小胞ワクチンは、米国特許出願公開第20080248065号に見出すことができ、その特許出願の開示は、参照により本明細書に組み入れられている。例示的な宿主細胞の培養条件は下記で論じられている。
【0081】
菌血症がヒト血流に現れる条件をシミュレートすることにより、本タンパク質および完全長成熟TspBの産生が向上する。したがって、宿主細胞において本ポリペプチドおよび/または完全長成熟TspBを産生する場合、宿主細胞は、ヒト血液の1つまたは複数の成分を追加した既知組成培地で培養される。「既知組成培地」とは、培地に用いられるたいていの成分が知られており、したがって、未確認の動物血清または未確認の複合天然源に関係している成分を有意な量または検出可能な量を含有しない培地を意味する。本ポリペプチドを産生するために用いられる既知組成培地(または「CDM」)は、非ヒト動物の副産物を欠き、血漿、血清、凝固因子、ヒト補体などのヒト血液の1つまたは複数の成分を追加されている。ヒト血液の成分には、コーン分画IV(Cohn Fraction IV)血清に見出されるもの(例えば、α−グロブリンおよび/またはβ−グロブリン)が挙げられる。ヒトコーン分画IVは、ヒト血漿の分画であり、SIGMA−ALDRICH(登録商標)(カタログ番号G3637)などの商業的供給源から得ることができる。宿主細胞として用いられるナイセリア細菌を培養するための既知組成培地は、所望の抗原決定基の発現に適した必要な成分を全て含有し、非ヒト動物の副産物を欠き、ヒト血液の1つまたは複数の成分を含有する。
【0082】
いくつかの既知組成の合成培地が本開示のポリペプチドを産生するために(例えば、組換えタンパク質の産生および単離、または組換えタンパク質を有する小胞の産生を目的として)、およびTspBに対する抗体をスクリーニングするために利用することができる。本方法に用いられ得る培地には、NMFM、Watson−Scherp、Frantz、改変Frantz、NMFM、CatlinおよびCatlin 6培地(Frantz、I.D.Jr.、J.Bact.(1942)43:757〜761;Catlin、B.W.、J.Inf.Dis.(1973)128(2):178〜194;Watsonら、Chemical Nature.J Immunol.(1958)81:337〜44;Marcelo Fossa da Pazら、Braz.J.Microbiol.34(1)Sao Paulo January/April 2003)が挙げられる。菌血症用薬剤において莢膜多糖産生を調節するために様々な組成改変がある他の合成培地はよく知られており、それらには、以下が挙げられるが、それらに限定されない:窒素源として大豆ペプトンを含有する動物成分不含の髄膜炎菌多糖発酵培地(U.S.6,933,137)、およびラージスケールの血清群特異的髄膜炎菌培地調合物(U.S.7,491,517)。同様に、他の細菌についての既知組成培地がよく知られており、本方法に用いることができる(例えば、「Handbook of media for clinical microbiology」、Ronald M.AtlasおよびJames W.Snyder、第2版、CRC Press、2006参照)。同じものが哺乳類細胞に当てはまる(例えば、「Towards chemically−defined,serum−free media for mammalian cell culture」、HR Maurer、Animal Cell Culture:A Practical Approach、Oxford University Press、USA、1986;Hesseら、(2000)Trends in Biotechnology 18(4):173〜180;およびZhangら、(2005)J Cytotechnology 48(1−3):59〜74参照)。
【0083】
上記で述べたように、宿主細胞が培養される培地は、ヒト血液のコーン分画IV血清および/または他の成分などの補充物を含む。ヒト血液の成分には、血漿、白血球(バフィーコート)を伴った血漿、血清などが挙げられるが、それらに限定されない。追加成分は、スクリーニング条件および/または評価条件の1つまたは複数のパラメータを改変するために培地へ単独で、または様々な組み合わせで加えることができる。
【0084】
上記で述べたように、宿主細胞は、本開示のポリペプチドを発現する(例えば、過剰発現する)ように遺伝子改変されてもよい。遺伝物質の宿主細胞への導入の方法には、例えば、形質転換、エレクトロポレーション、コンジュゲーション、リン酸カルシウム方法などが挙げられる。移入のための方法は、本開示のポリペプチドをコードする、導入される核酸の安定な発現を提供するように選択することができる。ポリペプチドコード化核酸は、遺伝性エピソームエレメント(例えば、プラスミド)として提供することができ、またはゲノム的に組み込むことができる。遺伝子形質転換はまた、Amburら、2007(J.Bacteriology 189:2077〜2085)およびBakkali Mら、2007(PLoS ONE 2:e741)に記載されているように、DNA取り込み配列(DUS)でタグ付けされたポリペプチドコード化核酸を用いて実行することができる。相同組換えもまた、構築物全体を宿主細胞(例えば、ナイセリア株)へ移入させるために用いてもよい。
【0085】
ベクターは、宿主細胞における染色体外維持を提供することができ、または宿主細胞ゲノムへの組込みを提供することができる。関心対象となるポリペプチドの産生に用いる様々な適切なベクターは市販されている(例えば、実施例セクションで用いられているようなpET)。発現ベクターは、転写制御配列および翻訳制御配列を提供し、誘導性発現または構成的発現を提供することができ、コード領域は、転写開始領域ならびに転写および翻訳終結領域の転写調節下で作動可能に連結されている。一般的に、転写制御配列および翻訳制御配列には、リーダーペプチド配列(例えば、pe1B)、プロモーター配列、リボソーム結合部位、転写開始配列および転写終止配列、翻訳開始配列および翻訳終止配列、ならびにエンハンサー配列またはアクチベーター配列が挙げられるが、それらに限定されない。本ポリペプチドは、TspBをコードする核酸に対して異種性であり得るプロモーターの調節下で遺伝子によって発現することができる。プロモーターは、構成的発現(例えば、RmpM(還元修飾可能タンパク質(reduction modifiable protein))のプロモーター、PorAプロモーターなど)、一過性発現、および/またはヒト血清の存在下での発現を提供することができる。例えば、プロモーターは、構成的かまたは誘導性かのいずれかであり得、強力な構成的プロモーター(例えば、T7、PorA、RmpMなど)であり得る。
【0086】
本ポリペプチドを産生するために用いることができるベクターの例は、実施例に記載され、かつ当技術分野においても知られたpETプラスミドである。そのプラスミドは、pe1Bリーダーペプチド、続いて、本ポリペプチドをコードする核酸を有することができる。ポリペプチドコード化核酸は、上記の本ポリペプチド(例えば、IGB、続いてプロリンリッチドメイン、その後に、膜アンカードメインが続く)のいずれかをコードし得る。ポリペプチドコード化核酸はまた、後にタンパク質検出および/または精製を促進する任意のタグ(例えば、hisタグ)が続くこともできる。
【0087】
発現構築物は、一般的に、関心対象となるタンパク質をコードする核酸配列の挿入を与えるためにプロモーター配列の近くに位置する好都合な制限部位を有する。発現宿主において作動する選択マーカーが、ベクターを含有する細胞の選択を容易にするために存在してもよい(例えば、エリスロマイシン選択マーカー)。選択マーカーは、プロモーター(例えば、PorAプロモーター)の前に置かれてもよい。加えて、発現構築物は、追加のエレメントを含んでもよい。例えば、発現ベクターは、1つまたは2つの複製系を有してもよく、それにしたがって、発現ベクターが、生物体において、例えば、発現のための哺乳類細胞または昆虫細胞において、およびクローニングおよび増幅のための原核生物宿主において、維持されることを可能にする。加えて、発現構築物は、形質転換された宿主細胞の選択を可能にするために選択マーカー遺伝子を含有していてもよい。選択遺伝子は当技術分野においてよく知られており、用いられる宿主細胞によって異なる。
【0088】
ポリペプチドの単離および精製は、当技術分野において知られた方法により達成することができる。例えば、ポリペプチドは、ポリペプチドを発現するように遺伝子改変された細胞の可溶化液から、または合成反応混合物から、免疫親和性精製によって単離することができ、その免疫親和性精製は、一般的には、試料を抗ポリペプチド抗体と接触させること、非特異的に結合した材料を除去するために洗浄すること、および特異的に結合したポリペプチドを溶出することを含む。単離されたポリペプチドは、透析、およびタンパク質精製方法に通常用いられる他の方法によってさらに精製することができる。一実施形態において、ポリペプチドは、金属キレートクロマトグラフィー方法を用いて単離することができる。
【0089】
本ポリペプチドは、実質的に純粋な、または単離された形(例えば、他のポリペプチドを含まない)で調製することができる。特定の実施形態において、ポリペプチドは、存在する可能性がある他の成分(例えば、他のポリペプチドまたは他の宿主細胞成分)に対してそのポリペプチドについて濃縮されている組成物中に存在する。精製されたポリペプチドは、他の発現したポリペプチドを実質的に含まない、例えば、組成物の90%未満、通常には60%未満、より通常には50%未満が他の発現したポリペプチドで構成される組成物中に、そのポリペプチドが存在するように提供することができる。
【0090】
コンジュゲートに関する本ポリペプチドの調製について、マレイミドベンゾイルスルホスクシンイミドエステル(システイン残基を通してのコンジュゲーション)、N−ヒドロキシスクシンイミド(リシン残基を通して)、カルボジイミド、グルタルアルデヒド、無水コハク酸などの二官能価結合剤を用いて、結合を達成することができる。代替として、または加えて、抗原および担体タンパク質を、上記の融合タンパク質として作製してもよい。
【0091】
核酸
上記で論じたように、本ポリペプチドは、関心対象となるポリペプチドをコードする構築物を提供するように当技術分野において知られた異なるTspBの核酸を操作する組換え技術を用いて産生することができる。アミノ酸配列が提供されたならば、当業者はすぐに、遺伝暗号の知識に照らしてそのようなアミノ酸配列をコードする様々な異なる核酸を認識するであろうことは理解されよう。
【0092】
天然ポリペプチド由来の本ポリペプチドの産生について、ナイセリア細菌の様々な異なるTspBをコードする核酸が当技術分野において知られており利用可能であることは留意されたい。Tspポリペプチドおよびそれらの核酸の例は、例えば、US6,861,507;Robinson Kら、2005 Infect.and Immun.73:4684〜4692;Bille Eら、2005 J.Exp.Med.201:1905〜1913;およびBille Eら、2008 PLoS One 3:e3885に記載されており、それらの開示は参照により本明細書に組み入れられている。
【0093】
様々なTspBについての核酸(およびアミノ酸配列)はまた、遺伝子ID:NMA0776、タンパク質アクセッション番号A1IQJ2(N.メニンギティディス血清群A由来);遺伝子ID:NMA1173、タンパク質アクセッション番号A1IRJ0(N.メニンギティディス血清群A由来);遺伝子ID:NMA1797、タンパク質アクセッション番号A1IT08(N.メニンギティディス血清群A由来);遺伝子ID:NMA2005、タンパク質アクセッション番号A1ITJ3(N.メニンギティディス血清群A由来);遺伝子ID:NMC0025、タンパク質アクセッション番号A1KR75(N.メニンギティディス血清群C、血清型2a由来);遺伝子ID:NMC0283、タンパク質アクセッション番号A1KRW7(N.メニンギティディス血清群C、血清型2a由来);遺伝子ID:NMC0956、タンパク質アクセッション番号A1KTP2(N.メニンギティディス血清群C、血清型2a由来);遺伝子ID:NMC1668、タンパク質アクセッション番号A1KVE8(N.メニンギティディス血清群C、血清型2a);遺伝子ID:NMC1715、タンパク質アクセッション番号A1KVI9(N.メニンギティディス血清群C、血清型2a);遺伝子ID:NMC1866、タンパク質アクセッション番号A1KVX5(N.メニンギティディス血清群C、血清型2a由来);遺伝子ID:NMCC_0151、タンパク質アクセッション番号A9M0A8(N.メニンギティディス血清群C由来);遺伝子ID:NMCC_0919、タンパク質アクセッション番号A9M243(N.メニンギティディス血清群C由来);遺伝子ID:NGK_1481、タンパク質アクセッション番号B4RJA5(N.ゴノレア由来);遺伝子ID:NGK_2027、タンパク質アクセッション番号B4RNK3(N.ゴノレア由来);遺伝子ID:NGO1140、タンパク質アクセッション番号Q5F7B3(N.ゴノレア由来);遺伝子ID:NGO1167、タンパク質アクセッション番号Q5F7K4(N.ゴノレア由来);遺伝子ID:NMB0480、タンパク質アクセッション番号Q7DDP6(N.メニンギティディス血清群B由来);遺伝子ID:NMB1747、タンパク質アクセッション番号Q9JY49(N.メニンギティディス血清群B由来);遺伝子ID:NMB1628、タンパク質アクセッション番号Q9JYD9(N.メニンギティディス血清群B由来);および遺伝子ID:NMB1548、タンパク質アクセッション番号Q9JYK0(N.メニンギティディス血清群B由来)などのアクセッション番号としてGenBankに提供されている。他のものと共に、上記の配列の一部はまた、図5、図7、および図8において対応する遺伝子名で提供されている。
【0094】
本ポリペプチドをコードするヌクレオチド配列が、関心対象となる宿主細胞(例えば、大腸菌、N.メニンギティディス、(DNAに基づいたワクチンの場合のように)ヒトなど)における発現を促進するためにコドン使用頻度を最適化するように改変されてもよいことは理解されよう。コドン最適化配列の作成方法は、当技術分野において知られている。核酸配列はまた、上記の関心対象となるポリペプチドのいずれをも発現するように改変されてもよい。例として、リーダーペプチド配列およびN末端可変ドメインの両方が切断されているTspB、またはIGBドメインを含有するTspBのセグメントが挙げられる。核酸が、小胞内にポリペプチドを提供するように宿主細胞において用いられる場合(例えば、小胞に基づいたワクチン)、核酸はまた、完全長成熟TspB、上記の任意の本ポリペプチド、または両方の組み合わせをコードしてもよい。
【0095】
製剤
本明細書では、「抗原組成物」、「抗原性組成物」、または「免疫原性組成物」は、便宜上、本明細書に開示されているような、ヒトIgのFc領域に結合するポリペプチドを含む組成物を総称的に指すために用いられ、本ポリペプチドは任意で、免疫原性を増強するためにコンジュゲートされてもよく、および/または併用して提供されてもよい。抗N.メニンギティディス抗体をヒトにおいて誘発するのに有用な組成物が、本開示によって具体的に企図される。
【0096】
抗原性組成物は、本明細書に記載されているような、2個、3個、4個、5個、6個、またはそれ以上の異なるポリペプチドを含有することができ、それぞれの本ポリペプチドは、アミノ酸配列が異なってもよい。
【0097】
追加の抗原、例えば、TspBに加えての、またはそれ以外の、抗ナイセリア抗体を誘発することができるポリペプチド抗原が、任意で、本組成物に含まれてもよい。例えば、そのポリペプチドは、例えば、ナイセリア疾患に関連した他のタンパク質を結合する抗体の産生を提供するためなど、v.1、v.2、および/またはv.3 H因子結合タンパク質(fHbp)のアミノ酸配列を含むポリペプチドと組み合わせて提供することができる。
【0098】
一実施形態において、本ポリペプチドは、ナイセリア抗原fHbp、GNA2132、NadA、GNA2091、およびGNA1030、またはそれらの抗原性断片もしくは融合タンパク質の1つまたは複数を含む組成物と組み合わせて(すなわち、同じまたは異なる製剤中で)投与される。例示的な組み合わせには、fHbpとGNA2132とNadA;およびfHbpとGNA2132とNadAとGNA2091とGNA1030が挙げられる。一実施形態において、本開示のポリペプチドは、Giulianiら、2006 Proc Natl Acad Sci USA 103:10834〜9に記載されているように、5成分の組換えタンパク質ワクチンと組み合わせて提供される。
【0099】
本ポリペプチドは、N.メニンギティディス小胞(例えば、微小胞および/または外膜小胞)を含有する様々な組成物のいずれかと組み合わせて提供することができ、その小胞は、fHbp、特にv.1 fHbpおよび/またはv.2 fHbpおよび/またはv.3 fHbpを発現するN.メニンギティディス株から産生される。様々なそのような小胞組成物は当技術分野において知られており、様々な異なる株からのそれらの調製方法はよく知られている。
【0100】
抗原性組成物は、一般的に、免疫学的有効量の本ポリペプチドを含み、必要に応じて他の適合性の成分をさらに含んでもよい。「免疫学的有効量」とは、単一用量か、または一連の同じもしくは異なる抗原性組成物の一部としてかのいずれかでのその量の個体への投与が、例えば、ナイセリア、具体的にはN.メニンギティディスによる感染の症状、または感染によって引き起こされる疾患の処置または予防に有効な抗体応答を誘発および/または増強するのに有効であることを意味する。この量は、処置されるべき個体の健康状態および身体的状態、年齢、抗体を産生する個体の免疫系の能力、望まれる防御の程度、ワクチンの剤形、処置を行う医師による医学的状況の評価、および他の関連因子に依存して変化する。量は、日常的試行によって決定することができる比較的広い範囲に収まるだろうことが予想される。
【0101】
製剤中の本ポリペプチドの濃度は、大きく異なり得(例えば、約0.1重量%未満から、通常、約2重量%または少なくとも約2重量%から、20重量%〜50重量%くらいまたはそれ以上まで)、通常には、主に、液体容量、粘度、および選択された特定の投与様式および患者の要求に応じた患者に基づく因子に基づいて、選択される。
【0102】
ポリペプチド組成物は、薬学的に許容される賦形剤中に提供することができ、その賦形剤は、滅菌水溶液などの溶液、多くの場合、食塩水であり得、または粉末の形で提供することができる。そのような賦形剤は、必要に応じて、実質的に不活性であり得る。
【0103】
ポリペプチド組成物は、アジュバントを含み得る。ヒトに用いることができる公知の適切なアジュバントの例には、ミョウバン、リン酸アルミニウム、水酸化アルミニウム、MF59(4.3%重量/体積のスクワレン、0.5%重量/体積のTween 80(商標)、0.5%重量/体積のSpan 85)、CpG含有核酸(シトシンが非メチル化されている)、QS21、MPL、3DMPL、Aquillaからの抽出物、ISCOMS、LT/CT突然変異体、ポリ(D,L−ラクチド−コ−グリコリド)(PLG)微粒子、Quil A、インターロイキンなどが挙げられるが、必ずしもそれらに限定されない。実験動物については、フロイント、N−アセチル−ムラミル−L−スレオニル−D−イソグルタミン(thr−MDP)、N−アセチル−ノル−ムラミル−L−アラニル−D−イソグルタミン(ノル−MDPと呼ばれるCGP 11637)、N−アセチルムラミル−L−アラニル−D−イソグルタミニル−L−アラニン−2−(1’−2’−ジパルミトイル−sn−グリセロ−3−ヒドロキシホスホリルオキシ)−エチルアミン(MTP−PEと呼ばれるCGP 19835A)、およびRIBI(細菌から抽出された3つの成分である、モノホスホリルリピドA、トレハロースジミコレート、および細胞壁骨格(MPL+TDM+CWS)を2%スクワレン/Tween 80乳濁液中に含有する)を用いることができる。アジュバントの効果は、免疫原性抗原またはその抗原性エピトープに対して産生される抗体の量を測定することによって決定することができる。
【0104】
組成物の効果を増強するためのさらなる例示的なアジュバントとして、(1)水中油形乳剤(ムラミルペプチド(下記参照)または細菌細胞壁成分などの他の特定の免疫刺激剤と共にまたはなしで)、例えば、(a)マイクロ流動化装置を用いてサブミクロン粒子へ製剤化された、5%のスクワレン、0.5%のTween 80、および0.5%のSpan 85を含有する(任意でMTP−PEを含有する)MF59(商標)(WO90/14837;Vaccine design:the subunit and adjuvant approach、Powell & Newman編、Plenum Press 1995の10章)、(b)サブミクロン乳剤へマイクロ流動化されたかまたはより大きい粒子サイズの乳剤を生じるようにボルテックスされたかのいずれかの、10%のスクワレン、0.4%のTween 80、5%のプルロニックブロック化ポリマーL121、およびthr−MDPを含有するSAF、ならびに(c)2%のスクワレン、0.2%のTween 80、およびモノホスホリルリピドA(MPL)、トレハロースジミコレート(TDM)、および細胞壁骨格(CWS)、好ましくはMPL+CWS(Detox(商標))などの1つまたは複数の細菌細胞壁成分を含有するRIBI(商標)アジュバント系(RAS)(Ribi Immunochem、Hamilton、Mont.);(2)QS21もしくはStimulon(商標)(Cambridge Bioscience、Worcester、Mass.)などのサポニンアジュバント、またはISCOM(免疫賦活性複合体)などのそれらから作製された粒子を用いてもよい(ISCOMSは追加の界面活性剤を欠いていてもよい、例えば、WO00/07621);(3)完全フロイントのアジュバント(CFA)および不完全フロイントのアジュバント(IFA);(4)インターロイキン(例えば、IL−I、IL−2、IL−4、IL−5、IL−6、IL−7、IL−12(WO99/44636)など)、インターフェロン(例えば、γインターフェロン)、マクロファージコロニー刺激因子(M−CSF)、腫瘍壊死因子(TNF)などのサイトカイン;(5)任意で、肺炎球菌サッカライドと共に用いる場合、ミョウバンの実質的非存在下における(例えば、WO00/56358)、モノホスホリルリピドA(MPL)または3−O−脱アシル化MPL(3dMPL)、例えば、GB−2220221、EP−A−0689454;(6)例えば、QS21および/または水中油乳剤と3dMPLの組み合わせ、例えば、EP−A−0835318、EP−A−0735898、EP−A−0761231;(7)CpGモチーフを含む、すなわち、シトシンが非メチル化されている場合、少なくとも1つのCGジヌクレオチドを含有する、オリゴヌクレオチド(Krieg Vaccine 2000、19、618〜622;Krieg Curr opin Mol Ther2001 3:15〜24;Romanら、Nat.Med、1997、3、849〜854;Weinerら、PNAS USA、1997、94、10833〜10837;Davisら、J.Immunol、1998、160、810−876;Chuら、J.Exp.Med、1997、186、1623〜1631;Lipfordら、Ear.J.Immunol.、1997、27、2340〜2344;Moldoveamiら、Vaccine、1988、16、1216〜1224、Kriegら、Nature、1995、374、546〜549;Klinmanら、PNAS USA、1996、93、2879〜2883;Ballasら、J.Immunol、1996、157、1840〜1845;Cowderyら、J.Immunol、1996、156、4570〜4575;Halpernら、Cell Immunol、1996、167、72〜78;Yamamotoら、Jpn.J.Cancer Res.、1988、79、866〜873;Staceyら、J.Immunol.、1996、157、2116〜2122;Messinaら、J.Immunol、1991、147、1759〜1764;Yiら、J.Immunol、1996、157、4918〜4925;Yiら、J.Immunol、1996、157、5394〜5402;Yiら、J.Immunol、1998、160、4755〜4761;およびYiら、J.Immunol、1998、160、5898〜5906;国際公開特許出願WO96/02555、WO98/16247、WO98/18810、WO98/40100、WO98/55495、WO98/37919、およびWO98/52581);(8)ポリオキシエチレンエーテルまたはポリオキシエチレンエステル、例えば、WO99/52549;(9)オクトキシノールと組み合わされたポリオキシエチレンソルビタンエステル界面活性剤(WO01/21207)、またはオクトキシノールなどの少なくとも1つの追加の非イオン性界面活性剤と組み合わされたポリオキシエチレンアルキルエーテルもしくはエステル界面活性剤(WO01/21152);(10)サポニンおよび免疫賦活性オリゴヌクレオチド(例えば、CpGオリゴヌクレオチド)(WO00/62800);(11)免疫賦活剤および金属塩の粒子、例えば、WO00/23105;(12)サポニンおよび水中油形乳剤、例えば、WO99/11241;(13)サポニン(例えば、QS21)+3dMPL+IM2(任意で+ステロール)、例えば、WO98/57659;(14)組成物の効力を増強するための免疫賦活剤として働く他の物質が挙げられるが、それらに限定されない。ムラミルペプチドには、N−アセチル−ムラミル−L−スレオニル−D−イソグルタミン(thr−MDP)、N−25アセチル−ノルムラミル−L−アラニル−D−イソグルタミン(ノル−MDP)、N−アセチルムラミル−L−アラニル−D−イソグルタミニル−L−アラニン−2−(1’−2’−ジパルミトイル−sn−グリセロ−3−ヒドロキシホスホリルオキシ)−エチルアミン(MTP−PE)などが挙げられる。ヒトへの投与に適したアジュバントは特に関心対象となる。
【0105】
ポリペプチド組成物は、医薬品グレードのマンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、サッカリンナトリウム、タルク、セルロース、グルコース、スクロース、マグネシウム、炭酸塩などの他の成分を含んでもよい。組成物は、pH調整剤および緩衝剤、毒性調整剤などの適切な生理的条件に必要とされる薬学的に許容される補助物質、例えば、酢酸ナトリウム、塩化ナトリウム、塩化カリウム、塩化カルシウム、乳酸ナトリウムなどを含有していてもよい。
【0106】
ポリペプチド含有製剤は、溶液、懸濁液、錠剤、丸薬、カプセル、粉末、ゲル、クリーム、ローション、軟膏、エアゾールなどの形で提供することができる。経口投与は、組成物の消化からの保護を必要とし得ることは認められる。これは、組成物を酸性および酵素的加水分解に対して抵抗性にする作用物質との組成物の結合によるか、または適切に抵抗性である担体分子中に組成物をパッケージングすることによるかのいずれかで達成することができる。消化から保護する手段は当技術分野においてよく知られている。
【0107】
ポリペプチド含有製剤はまた、投与後の本ポリペプチドの血中半減期を向上させるように提供することができる。例えば、単離されたポリペプチドが注射用に製剤化される場合、ポリペプチドは、リポソーム製剤中に提供され、コロイドとして調製され、または血中半減期を延ばすための他の従来技術を用いて調製することができる。リポソームを調製するために、例えば、Szokaら、Ann.Rev.Biophys.Bioeng.9:467(1980)、米国特許第4,235,871号、第4,501,728号、および第4,837,028号に記載されているような様々な方法が利用できる。調製物はまた、放出制御または持続放出の形で提供されてもよい。
【0108】
混合ワクチン
上記で述べたように、本ポリペプチドは、対象においてN.メニンギティディスに対する免疫応答を誘発するのに用いられる様々な抗原性組成物のいずれかと組み合わせて提供することができる。本明細書で用いられる場合の「組み合わせ」とは、別々の投与として別々に製剤化される(例えば、キット内に提供することができるような)組成物、および単一の製剤中での投与としての(すなわち、「共製剤化される」)組成物を含むことを意味する。
【0109】
上記を考慮すれば、例示的な抗原性組成物は、本開示のポリペプチドの1つまたは複数を、異なるナイセリアタンパク質またはその断片を含む組換えワクチンと共に含み、その組換えワクチンは、単離されたタンパク質として提供されてもよいし、および/または小胞ワクチン内で提供されてもよい。本開示の抗原性組成物に含まれ得る本明細書に記載された様々な成分は、インビトロで、エクスビボで一緒に組み合わされてもよいし、および/または本方法に用いられる宿主細胞によってすでに提供されていてもよい。当業者は、最適な任意の方法を用いてその組み合わせを作製することができる。
【0110】
上記で述べたように、抗原性組成物は、本開示のポリペプチドに融合することができる上記のエレメントを含むことができ、または上記のエレメントを組成物中に別々の成分として含むことができる。本ポリペプチドに加えての組成物中に含まれ得る成分の例は、(MC58株由来の遺伝子によってコードされる)組換えfHbp v.1、(NZ98/254株由来の遺伝子によってコードされる)GNA2132、および(2996株由来の遺伝子によってコードされる)NadAを含有する「r3C」ワクチンである。特定の実施形態において、その小胞は、5成分組換えタンパク質ワクチン(5Cまたはr5CV)と組み合わされてもよい。5成分組換えタンパク質ワクチン(r5Cv)は、fHbp v.1と融合したGNA2091、GNA1030と融合したGNA2132(NZ98/254由来)、およびNadAを含有する組換えタンパク質ワクチンを指し、Giulianiら、2006 Proc Natl Acad Sci USA 103:10834〜9に記載されている。
【0111】
免疫化
本明細書に記載されたポリペプチドは、一般的に、ナイセリア疾患に罹るリスクがあるヒト対象に、疾患およびその合併症の発生を防ぎ、または少なくとも部分的に停止させるために免疫原性組成物中において投与される。これを達成するのに十分な量は、「治療的有効量」として定義される。用いるのに有効な量は、例えば、免疫原性組成物、投与様式、患者の体重および全身的健康状態、ならびに処方医師の判断に依存する。免疫原性組成物の単一用量または複数回用量は、患者に必要とされ、かつ許容される用量および頻度、ならびに投与経路に依存して投与され得る。
【0112】
本明細書に記載されたポリペプチドは、一般的に、宿主において体液性免疫応答を誘発するのに有効な量で投与される。上記で述べたように、免疫化のための量は、様々であり、一般的には、70kgの患者あたり約1μgから100μgまで、通常には、5μg〜50μg/70kgの範囲であり得る。実質的により高い用量(例えば、10mg〜100mgまたはそれ以上)が適する場合があり、非経口的に(例えば、注射または局所投与により)、または経口経路もしくは経鼻経路によって投与されてもよい。初回投与の後に、同じまたは異なるポリペプチドを含有する抗原性組成物の追加免疫を行うことができる。通常には、ワクチン接種は、少なくとも1回の追加免疫、より通常には2回の追加免疫を含む。
【0113】
一般的に、免疫化は、任意の適切な経路による投与によって達成することができ、その投与には、経口で、経鼻で、経鼻咽頭で、経腸で、局所的に、経皮で、皮下に、筋肉内に、望ましい投与経路に適し得るように、錠剤、固体、粉末化、液体、エアゾールの形で、局部的にまたは全身的に、賦形剤の添加有りまたはなしでの組成物の投与が挙げられる。非経口的に投与可能な組成物を調製するための実際的な方法は、当業者に知られているであろう、または明らかであろうし、Remington’s Pharmaceutical Science、第15版、Mack Publishing Company、Easton、Pa.(1980)のような刊行物でより詳細に記載されている。
【0114】
免疫応答は、公知の方法によって(例えば、初回免疫化の前および後に個体から血清を採取し、個体の免疫状態における変化を、例えば、免疫沈降アッセイ、またはELISA、または殺菌アッセイ、またはウェスタンブロット、またはフローサイトメトリーアッセイなどにより示すことによって)評価することができる。
【0115】
一実施形態において、抗原性組成物は、ヒト対象に投与することができ、その対象は、ナイセリア−メニンギティディスに関して免疫学的にナイーブであってもよい。特定の実施形態において、対象は、約5歳以下、好ましくは約2歳以下のヒトの子どもであり、抗原性組成物は以下の時点のうちの任意の1時点または複数時点に投与される:生後2週間目、1カ月目、2カ月目、3カ月目、4カ月目、5カ月目、6カ月目、7カ月目、8カ月目、9カ月目、10カ月目、もしくは11カ月目、もしくは1年目、もしくは15カ月目、18カ月目、もしくは21カ月目、または2歳、3歳、4歳、もしくは5歳時点。
【0116】
一般的には、疾患症状の最初の兆候前に、または(例えば、ナイセリアによる暴露または感染による)感染もしくは疾患への可能性のある、もしくは実際の暴露の最初の兆候時点で、免疫化を開始することが望ましくあり得る。
【0117】
スクリーニングアッセイ
本開示はまた、効果的なワクチンについてスクリーニングする方法、および候補作用物質(例えば、抗体)、それをコードする核酸、または抗血清を誘発するのに効果的な免疫原についてスクリーニングする方法を特徴とする。
【0118】
例えば、方法は、抗体のFc部を介する結合と、抗原特異的部分の結合(すなわち、抗体の抗原結合領域を通してTspBに結合する能力)との両方の点から抗体結合を評価するために用いることができる。そのようなアッセイ方法は、結合が抗原特異性に依存しない(例えば、Fc領域への結合による)、TspBのヒトIgへの結合を阻害することができる候補作用物質をスクリーニングするのに用いられる。方法は、ナイセリアタンパク質の機能(例えば、TspBのヒトIgGへの結合)を阻害する抗体を同定するために抗体をスクリーニングすることを包含し得る。例えば、TspBのヒトIgまたはその断片(例えば、Fc部)に対する親和性と比較して少なくとも約30倍、少なくとも約40倍、少なくとも約50倍、または少なくとも約100倍、約1000倍以上までの結合活性(例えば、50nM対50pM)でTspBに結合する候補作用物質が、TspBのヒトIgへの結合を阻害するために用いられる候補として選択されるであろう。
【0119】
本方法は、TspBのヒトIgへの結合を阻害するための候補である可能性がある候補作用物質(例えば、抗体)を分析するステップであって、その結合がIgの抗原特異性に依存しない(例えば、Fc領域における結合による)、ステップを含む。任意で、方法は、非ヒト動物をワクチン(例えば、TspBのエピトープを含有するポリペプチド)で免疫するステップ、そのような免疫化動物から血清抗体を採取するステップ、およびTspBのIgへの結合を阻害する能力について血清をスクリーニングするステップを含んでもよい。
【0120】
本明細書に用いられる場合の用語「候補作用物質」は、任意の分子、例えば、タンパク質または小分子化合物を記載する。したがって、候補作用物質は、典型的には、有機分子、好ましくは、50ダルトンより大きく、約2,500ダルトン未満の分子量を有する小さい有機化合物であるが、多数の化学的クラスを包含する。候補作用物質は、タンパク質との構造的相互作用、例えば、水素結合を促進する官能基を含み、アミン基、カルボニル基、ヒドロキシル基、またはカルボキシル基を含むことができる。候補作用物質は、上記の官能基の1つまたは複数で置換される環式炭素構造もしくは複素環式構造および/または芳香族構造もしくは多環芳香族構造を含む場合が多い。候補作用物質はまた、生体分子の間で見出され、それには、ペプチド、糖類、脂肪酸、ステロイド、プリン、ピリミジン、それらの誘導体、構造的類似体、または組み合わせが挙げられるが、それらに限定されない。候補作用物質は、合成または天然の化合物のライブラリーを含めた幅広い種類の供給源から得ることができる。例えば、ランダム化オリゴヌクレオチドおよびオリゴペプチドの発現を含めた、幅広い種類の有機化合物および生体分子のランダム合成および指向性合成に多数の手段が利用できる。
【0121】
あるいは、細菌、真菌、植物、および動物の抽出物(TspBの機能に影響を及ぼす内因性因子を同定するためのヒト組織からの抽出物を含む)の形をとる天然化合物のライブラリーが入手でき、または容易に作製される。加えて、天然の、または合成的に作製されたライブラリーおよび化合物は、通常の化学的、物理的、および生化学的手段を通して容易に改変され、コンビナトリアルライブラリーを作製するのに用いることができる。既知の薬理学的物質を、アセチル化、アルキル化、エステル化、アミド化などの指向性またはランダム化学修飾に供して、構造的類似体を生成してもよい。
【0122】
上記で述べたように、候補作用物質の分析を、無細胞アッセイかまたは細胞に基づいたアッセイのいずれかにおいて、候補作用物質の存在下で、TspBのヒトIgまたはその断片(例えば、Fc断片)に結合する能力を評価することによって行ってもよい。ヒトIgまたはその断片(例えば、Fc断片)と比較して何倍も増加したTspBに対する親和性を示す候補について選択するために段階希釈実験を行うことができる。アッセイに用いられるTspBには、ナイセリア細菌から単離された、合成的に作製された、組換えで作製された、および/またはナイセリア細菌の細胞表面上に存在する、完全長またはその断片を挙げることができる。候補作用物質をまた、当技術分野において知られた、および下記の実施例に記載された方法を用いて殺菌活性を促進するその能力について評価してもよい。
【0123】
用いられるアッセイ形式に依存して、本スクリーニング方法において、ヒトIg(またはその断片)を含有するポリペプチド、TspBタンパク質、および/または本ポリペプチドが標識され得る。TspB、本ポリペプチド、および/またはヒトIgもしくはその断片(例えば、Fc部)を含有するポリペプチドは、任意で、共有結合性または非共有結合性付着を通して支持体に固定化することができる。例示的なスクリーニングアッセイは、競合的結合アッセイであってもよく、そのアッセイにおいて、ヒトIgまたはその断片(例えば、Fc領域)を含有するポリペプチドが検出可能に標識され、固定化TspBに結合することができる。その後、この検出可能に標識された試薬の結合したTspBからの転置が、候補作用物質の存在下で評価される。
【0124】
検出可能な標識には、直接的に検出可能なシグナル(例えば、フルオロフォア)または間接的に検出可能なシグナル(例えば、検出可能な標識を有する二次抗体の使用)を提供するものが挙げられる。例えば、放射性標識、蛍光標識、化学発光剤、酵素、特異的結合分子、粒子、例えば、磁気粒子など。様々な方法(例えば、親和性捕獲など)を通して単離を促進するために追加のエレメント(例えば、ビオチンタグ、HAタグ、ポリヒスチジンタグ、免疫学的に検出可能なタグ)を提供することができる。特異的結合分子には、ビオチンとストレプトアビジン、ジゴキシンと抗ジゴキシンなどのペアが挙げられる。特異的結合メンバーについて、相補的メンバーが、通常、公知の手順に従って、検出を提供する分子で標識される。
【0125】
候補作用物質をまた、関心対象となる細菌細胞に対するその親和性について評価してもよい。スクリーニングのための細菌細胞は、大腸菌K1、大腸菌K92、任意のナイセリア細菌(例えば、ナイセリア−メニンギティディス血清群B、ナイセリア−メニンギティディス血清群C、ナイセリア−メニンギティディス血清群X、ナイセリア−メニンギティディス血清群Y、ナイセリア−メニンギティディス血清群W−135など)から選択することができる。
【0126】
候補作用物質が抗体である場合、それは抗体集団内に提供され、方法は、細菌細胞を結合し、TspBを結合し、および/またはTspBのヒトIgへの結合を阻害する、抗体集団由来の1つまたは複数の抗体を単離するステップを含むことができる。そのようなスクリーニングによって同定された単離抗体は、細菌細胞に対する殺菌活性を、例えば、ヒト血液中の細菌の生存率を減少させる能力がある、補体媒介性殺菌活性および/またはオプソニン化貪食作用活性を促進することによって、促進することができる。
【0127】
本方法に用いるために、TspBまたは本ポリペプチドを細菌おいて製造する場合、細菌細胞を、ヒト血液の1つまたは複数の成分を追加した既知組成培地中で培養する。ヒト血清を追加している既知組成培地が、細菌細胞が培養される条件および/または候補作用物質結合(例えば、抗体結合)が遂行される条件として本スクリーニング方法に用いられる。したがって、本開示のスクリーニング方法は、ヒトにおける菌血症および/または腫瘍症をシミュレートする条件下で実行される。
【0128】
本明細書に記載された本スクリーニングアッセイに関連して用いられる場合、「既知組成培地」とは、非ヒト動物の副産物を欠く培地であることを意図される。本開示に用いられるナイセリア−メニンギティディスについての既知組成培地は、所望の抗原決定基の発現に適した既知の成分を含有し、非ヒト動物の副産物を欠き、ヒト血液の1つまたは複数の成分をさらに追加されている。
【0129】
ヒト血液の成分には、血漿、白血球を含む血漿、補体、フィブリノーゲン、フィブロネクチン、フィブリン、プラスミノーゲンなどの凝固因子、α−グロブリン、β−グロブリンなどが挙げられるが、それらに限定されない。ヒト血液成分が血漿である場合、血漿を、内因性補体活性を不活性化するために熱失活させる。アッセイが特定のヒト抗体への結合を検出することを含む場合、その特定の抗体またはその特定のクラスの抗体(例えば、IgG)を血漿から除去する。血漿はまた、関心対象となるN.メニンギティディスに対する内因性殺菌活性を欠損するドナーから得られる。上記で述べたように、ヒト血液成分の例は、ヒトコーン分画IV血清であり、それは商業的供給源から入手することができる。
【0130】
スクリーニングおよび/または評価はさらに、ウシ血清などの1つまたは複数の非ヒト動物の副産物を含有する培地などの未知組成培地中で増殖した細菌細胞への候補作用物質(例えば、抗体)の結合を比較するステップを含んでもよい。この目的に適した多くの未知組成培地が知られている。例えば、ナイセリア−メニンギティディス細胞の増殖および/または生存能を援助するための未知組成培地の例には、Mueller−Hinton培地などが挙げられるが、それらに限定されない。認識されているように、既知組成培地および/または未知組成培地で培養された細菌細胞への作用物質の結合を比較する本方法のステップの順序は変えることができ、したがって、所定の最終用途のためにユーザーによって選択され得る。
【0131】
本開示はまた、上記の方法によって作製された単離抗体、および方法により作製された単離抗体を産生する能力がある単離細胞系を提供する。細胞系における単離および産生は、当技術分野において知られたいくつもの手順によってでも実施することができる。
【0132】
本開示はまた、TspB(例えば、NmB1628のIGBドメインなどのそのIGBドメイン)の重合体構造の形成への候補作用物質の効果を検出することによって、TspBとIgの結合を阻害するのに効果的な候補作用物質(例えば、抗体)をスクリーニングするための方法を提供する。候補作用物質が抗体である場合、その抗体は、候補抗原の投与によって誘発されてもよい。その方法は、TspBポリペプチドの重合体構造へ凝集する傾向、およびTspBのIg結合活性を阻害する抗体に接触した場合に分散するそれらの能力を利用している。例えば、方法は、候補作用物質(例えば、抗血清中の抗体)をTspBに接触させるステップ、ならびにそのような接触後に形成される反応混合物において重合体構造の存在および/または量を検出するステップを含む。重合体構造の検出は、任意の適切な手段、例えば、光学顕微鏡を用いる反応混合物における凝集体の検出によって達成することができる。反応混合物は、水溶液中および/またはゲル中に提供することができる。候補作用物質が、候補作用物質の非存在下での凝集と比較して本ポリペプチドの凝集を分散および/または阻害する場合、その候補作用物質は、TspBのIg結合活性の阻害のための候補として同定される。
【0133】
キット
本明細書に開示された組成物を用いるための、および上記のように方法を実施するためのキットもまた本発明によって提供される。キットは、N.メニンギティディスに対する(例えば、予防的または治療的)ワクチンの投与のために提供されてもよい。キットは、本明細書に開示されたポリペプチドまたはコード化核酸の1つまたは複数を含むことができ、それは滅菌容器内に提供されてもよく、対象への投与のための薬学的に許容される賦形剤と製剤化して提供することができる。ポリペプチドは、抗TspB抗体の産生を与える抗N.メニンギティディスワクチンの製剤(例えば、組換えTspB断片を含有する製剤、ヒト血清と培養されたTspB発現株由来の小胞など)と共に提供することができ、本開示のポリペプチドは、そのようなワクチンと別々に製剤化されてもよいし、組み合わせて製剤化されてもよい。
【0134】
上記の成分に加えて、キットはさらに、本方法を実施するためにキットの成分を用いることについての使用説明書を含むことができる。本方法を実施するための使用説明書は、一般的に、適切な記録媒体上に記録される。例えば、使用説明書は、紙またはプラスチックなどの基材上に印刷されてもよい。それとして、使用説明書は、パッケージ挿入物としてキット内に、キットまたはその成分の容器のラベル付けにおいて(すなわち、パッケージングまたはサブパッケージングに付随して)など、存在してもよい。他の実施形態において、使用説明書は、適切なコンピュータ可読記憶媒体、例えば、CD−ROM、ディスケットなどに存在する電子記憶データファイルとして存在する。さらに他の実施形態において、実在の使用説明書はキット内に存在しないが、リモート供給源から使用説明書を入手するための手段、例えば、インターネットを介する手段が提供される。この実施形態の例は、使用説明書を見ることができ、および/または使用説明書がダウンロードすることができるウェブアドレスを含むキットである。使用説明書と同様に、使用説明書を入手するためのこの手段は、適切な基材上に記録されている。
【実施例】
【0135】
本明細書に記載された実施例および実施形態は、例示を目的とするのみであること、およびそれを鑑みての様々な改変または変化が当業者に示唆されるであろうし、本出願の精神および権限内、ならびに添付された特許請求の範囲の範囲内に含まれ得ることは、理解されている。本明細書に引用された全ての刊行物、特許、および特許出願は、全ての目的のために全体として参照により本明細書に組み入れられている。
【0136】
材料および方法
以下の方法および材料を下記の実施例に用いた。
【0137】
Catlin 6培地の調製。Catlin 6培地(CDM)の組成をFossa da Paz(Fossa da Pazら、2003 Brazil.J.Micro.34:27〜32)から適応させた。アミノ酸、塩、グルコース、および鉄のあらかじめ作製されたストック溶液を混合することによって、各実験の前に新鮮に培地を調製した。下記のように調製された56℃で熱失活させた5パーセントのIgG除去血清をCDMに追加した(CDM−dHuS)。2Mのグルタミンを加えること(UCSF cell culture facility)が、CDM中で培養された、いくつかのNm株の倍加時間を減少させることが観察され、それゆえに、CDMの調製に含まれた。システインをCatlin 6製剤から排除し、それは、システインを含まないCatlin培地が、システインを含む培地よりたいていのNm株についてより一貫した増殖率を生じることが見出されたからである。
【0138】
IgGを除去されたヒト補体の調製。5mlのプロテインGカラム(HiTrap Protein G HP、GE Healthcare Bio−sciences、Piscataway NJ)に、カラムの先端および底に滅菌されたルアーロックバルブおよび2つの10mlのシリンジを装着した。Ca+およびMg+、0.5%グルコースを含む25mlの滅菌濾過されたDulbeccos緩衝食塩水(DPBS+glu)を用いて、カラムを洗浄し、その後、それを4℃で20分間、冷却した。血清を−80℃の貯蔵から取り出し、氷上で解凍した。5.5mlの血清をカラムに負荷し、5分間、4℃に置いた。その後、DPBS+gluをカラムにアプライして、IgGを除去された血清と置き換えた。約5mlの除去された血清を収集し、すぐに氷上に置いた。追加の5mlのDPBS+gluを、通過画分が完全に透明になるまでカラムにアプライした。プロテインGに結合したIgGを、0.1M酢酸ヒスチジン、pH2.7、0.02%Tween 20でカラムから溶出した。最初の1.5mlの通過画分を捨てた。その後の15mlを収集し、緩衝液をPD 10サイズ排除カラム(GE Healthcare Bio−Sciences)を用いて、0.002%Tween 20および24mMスクロースを含有する2mMヒスチジン、pH6と交換し、その後、凍結乾燥した。
【0139】
フローサイトメトリーによるヒトIgGのNm株への結合の検出
髄膜炎菌株(W135群A22株、B群NMB株、C群4243株)を、0.25%(重量/体積)グルコースを含むMueller−Hinton(MH;BD)培地、Catlin 6(CDM)培地(9)、または5%(重量/体積)ヒト血清(HuS)もしくはマウス血清(MoS)を追加したCatlin 6培地中で約0.6のOD620nmまで増殖させた。ヒトドナー由来の血清を、上記のように、その血清を56℃で30分間、インキュベートすることによって熱失活させ(HuS)、プロテインGカラムにその血清を通過させることによってIgGを除去した(dHuS)。細胞をペレット化し、洗浄し、ブロッキング緩衝液(1%ウシ血清アルブミンを含有するPBS緩衝液(Sigma))中に最初の体積の80%に再懸濁した。細胞の混合物を、周期的に穏やかに撹拌しながら4℃で1時間、インキュベートした。細胞をペレット化し、フルオレセインイソチオシアネート(FITC)連結型ヤギ抗ヒト二次抗体のブロッキング緩衝液中1:200希釈溶液の200μlに再懸濁した。IgG(H+L)F(ab’)2およびIgMに対するFITC連結型抗体(Jackson ImmunoResearch、West Grove、PA)。二次抗体を加えた後、チューブを、周期的に穏やかに撹拌しながら4℃で1時間、インキュベートした。細胞を、ペレット化し、新鮮に作製されかつ濾過された400μlの0.5%ホルムアルデヒド(重量/体積)含有PBS(Steriflip、Millipore、Billerica、MA)に再懸濁した。試料をすぐに、フローサイトメトリー(BD FACSCalibur System、BD Biosciences、San Jose、CA)によって分析した。
【0140】
マウス抗血清の収集。CD1マウス(6〜8週齢、Charles River Laboratories、Wilmington、MA)の群を、50%生理食塩水/50%フロイント完全アジュバント(Pierce)乳濁液中、または3.25mg/mlアルハイドロゲル(ミョウバン)(Brenntag Biosector、Frederikssund、Denmark)もしくは生理食塩水単独中の合計1μg、5μg、10μg、もしくは252μg、または10μgのTspB−IGB(すなわち、TspB−IGBワクチン)で腹腔内注射によって免疫した。各注射から40日後、顔面静脈のランセットにより血液試料を採取し、ELISAによって試験した。
【0141】
追加免疫用量を、不完全フロイントアジュバント(Pierce)、ミョウバン、または生理食塩水単独と共に28日後に与え、免疫後14日目に採取された抗血清の力価を評価した。抗血清力価をELISAによって決定した。個々のマウス由来の抗血清をプールし、全てのさらなる実験を、プールされた抗血清を用いて行った。各TspB−IGBを1:200で希釈してPBS中10μg/mlにし、96ウェルマイクロタイタープレート(Immulon II HB)へウェルあたり100μlを加えることによってELISAプレートを調製した。プレートを使用前に4℃で一晩、貯蔵した。プレートをPBS緩衝液で5回、洗浄し、1%(重量/体積)のBSAを含有するPBS緩衝液(ブロッキング緩衝液)で、周囲温度で1時間、ブロッキングした。抗血清をブロッキング緩衝液中に1:100希釈で加え、続いて、3倍段階希釈を行った(2連)。4℃での一晩のインキュベーション後、プレートをPBS緩衝液で5回、洗浄し、ブロッキング緩衝液中に1:3000希釈したウサギ抗マウスアルカリフォスファターゼ連結型抗体(Zymed)を加えた。さらに1時間、周囲温度でインキュベートした後、プレートをPBS緩衝液中で(5回)洗浄し、結合した抗体を、1mM MgCl2を含有する50mM炭酸ナトリウム緩衝液、pH9中の1mg/ml リン酸p−ニトロフェニル(Sigma−Aldrich)を加えることによって検出した。周囲温度での30分間のインキュベーション後の405nmにおける吸光度を、Molecular Devices SpectraMax 340マイクロタイタープレートリーダーを用いて測定した。抗血清をTspB−IGBに対して試験した。
【0142】
天然条件下でのTspB IGBおよびIGBproの精製。250mlの細胞培養物からの凍結細胞ペレットを解凍し、50mM Tris・HCl、150mM塩化ナトリウム、pH7.5(TBS)の20mlと、0.1mMフッ化フェニルメタンスルホニル(PMSF)および10μg/ml DNアーゼ(Sigma−Aldrich)を含有するPBSの20mlに溶解した、0.5%(重量/体積)オクチルグルコピラノシド(Calbiochem、San Diego、CA)中に再懸濁した。18G針および一定の長さのTeflon管を取り付けたシリンジを用いて、溶液を、針を通して強制的に繰り返し、往復させることによって、混合物をホモジナイズした。ホモジナイズされた溶液を、周囲温度で20分間、ロッキングプラットフォーム上で撹拌し、その後、20,000xgで10分間、遠心分離した。上清を捨て、ペレットを、10mlのTBSと、0.1mM PMSFおよび10μg/ml DNアーゼを含有するPBSの10ml中に溶解した、0.5%(重量/体積)EmpigenTT(Calbiochem)中に懸濁した。ホモジナイズされた溶液を、上記のように、周囲温度で20分間、ロッキングプラットフォーム上で撹拌し、その後、遠心分離した。生じた上清を新しいチューブに移し、一方、ペレットは、0.5%EmpigenTT含有溶液中で2回目の抽出を行い、再びペレット化する前に周囲温度で5分間、ロッキングプラットフォーム上で撹拌した。生じた上清を、最初のEmpigenTT抽出由来の上清と混合し、固体イミダゾールを10mMの最終濃度まで加え、その溶液を0.2μフィルター(Steriflip、Millipore、Billerica、MA)を通して濾過した。その後、濾過された溶液を、溶解緩衝液(300mM NaCl、10mMイミダゾール、および1%(体積/体積)EmpigenTTを含有する50mMリン酸ナトリウム、pH8)で平衡した5ml Ni Sepharose HisTrap高性能HPカラム(GE BioScience、Piscataway、NJ)に通過させた。カラムを、50mlの洗浄緩衝液(300mM NaCl、20mMイミダゾール、および1%(体積/体積)EmpigenTTを含有する50mMリン酸ナトリウム、pH8)で洗浄し、TspBタンパク質を、最初に125mMイミダゾール(14ml)、その後250mMイミダゾール(16ml)を含有する溶出緩衝液(300mM NaClおよび1%(体積/体積)EmpigenTTを含有する50mMリン酸ナトリウム、pH8)で段階溶出した。2mlの画分を収集し、SDS−PAGEによって分析した。精製されたTspB誘導体を含有する画分を混合し、0.9%NaClに対して透析し、YM−10濃縮器(Millipore)を用いて0.2〜2mg/mlタンパク質まで濃縮した。
【実施例1】
【0143】
ヒト血清の存在下で培養された髄膜炎菌株によるヒトIgG結合の検出
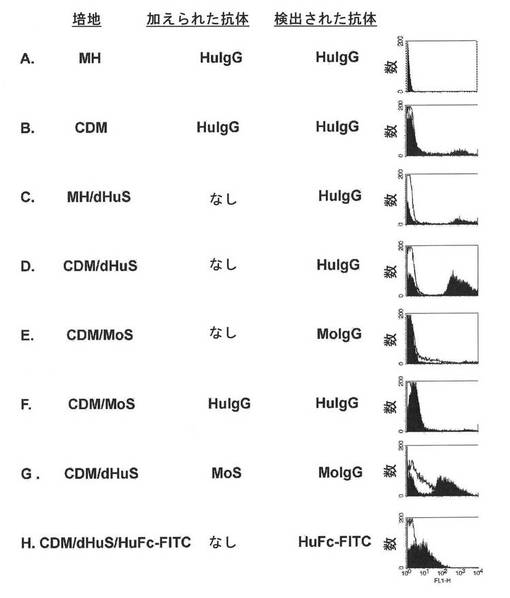
ナイセリア−メニンギティディスW135群(NmW135)A22株の表面へのヒトIgGの結合に影響を及ぼす可能性がある細菌細胞の増殖条件を同定するためにフローサイトメトリー実験を行った。精製ヒトIgGが特定の試料に加えられる結合実験に加えて、対照の場合は、マウス血清を加えない場合および加える場合を含んだ。
【0144】
NmW135のA22株の結果は図1に示されている。黒色のヒストグラムは、示された試験条件についての結果を示し、白色のヒストグラムは添加物無しの陰性対照である。A22細胞をMH培地単独またはCDM単独中で増殖させ、かつ試験株に対する内因性血清殺菌活性を欠くドナー(ドナー1)由来の精製ヒトIgGを結合実験中に加えた場合、IgGの結合は検出されず、またはわずかに検出された(それぞれ、図1A、B)。その結果より、血清から精製された抗体と反応性である、細菌によって発現される抗原は、いずれの培養条件下においてもないことが示されている。再び、細菌を、精製IgGの同じドナー源(ドナー1)由来のdHuSを追加したMH中で培養した場合(図1C)、わずかなIgG結合が観察された。しかしながら、細菌を、dHuSを追加したCDM中で培養した場合、細胞の部分集団の蛍光が右へシフトし(図1D)、IgGの99%より多くが血清から除去されている(除去および希釈後、[IgG]>2μg/ml)にもかかわらず、結合したヒトIgGの存在を示している。CDM/dHuS(D列)と比較して、MH/dHuS(C列)中で培養した細胞についてのはるかに低いIgG陽性細胞集団により、ヒト血清により誘導されるIg結合活性の発現が、MH培地において抑制されることが示唆されている。マウス血清を追加したCDM(CDM/MoS)中で培養された細胞は、マウスIgGの結合を示さなかった(図1E)。また、細菌をMoSの存在下で培養し、かつ精製ヒトIgGを加えた場合には、ヒトIgGの結合が観察されなかった(図1F)。その結果より、Ig結合活性の発現を誘発するヒト血清中の因子がマウス血清中に存在しないことが示されている。しかしながら、細菌をヒト血清の存在下で培養し、その後、マウス血清とインキュベートした場合には、マウスIgGの結合が観察されたが、蛍光はより弱い(図1G)。したがって、Ig結合活性は、ヒトIgGに対して完全に特異的というわけではないが、Ig結合活性の発現を引き起こすためにヒト血清因子を必要とする。
【0145】
観察されたIg結合活性が、細菌をヒト血清の存在下で培養した場合に発現した抗原のみを免疫IgGが認識するという結果ではないことを示すために、細菌を、蛍光タグで修飾されている(ポリクローナルヒトIgGから調製された)精製ヒトFc断片(Jackson ImmunoResearch Laboratories、West Grove、PAから入手された、HuFc−FITC)を追加したCDMHuS中で増殖させた。図1Hに示されているように、細菌は、Fcドメインのみに結合する。Fcドメインは、培地中に存在する無傷ヒトIgGと競合するため、結合がより弱く、またはFcドメインがエピトープ全体を表すわけではないため、より弱い可能性があるが、HuFc−FITCの存在下でdHuSを含まないCDM中で増殖した細菌の陰性対照(白色のヒストグラム)と比較して、それは明らかに増加している。Fc断片は結合性部位を欠くため、観察された結合は、抗体の抗原への結合の結果ではなく、むしろ、抗原のFcドメインへの結合の結果であり得る。さらに、Ig結合の証拠は、下記の実施例2に提供されており、実施例2において、そのタンパク質が同定され、そのタンパク質の組換えサブドメイン(すなわち、上記のIGBドメイン)がヒトおよびマウスのIgA、IgG、およびIgMを結合することが示されている。
【0146】
図2Aは、2人のドナー(ドナー1およびドナー3)由来のdHuSを用いる結合実験、ならびにW135群A22株、M9262株、および4383株に加えて遺伝的かつ抗原的に多様なB群(NMB)およびC群(4243)の株によるヒトIgG結合(図2B)を示す。結果より、IgG結合タンパク質のHuS依存性発現が特定のドナーに特有ではないこと、およびIgG結合タンパク質発現がA22株に限定されないことが示されている。株の遺伝的および抗原的多様性、ならびにドナーおよび特にマウスの侵襲性Nm株への可能性の低い暴露を考慮すれば、ドナー血清が、細菌がヒト血清の存在下で培養された場合のみに発現する、共通の抗原に反応性の抗体を含有することは可能性が低い。
【実施例2】
【0147】
ナイセリア−メニンギティディス細菌によって発現されたヒトIgG結合タンパク質の親和性精製および同定
ヒトIgG結合タンパク質の親和性精製。NmW135のA22株の細胞をMHまたはCDMHuS中、37℃で増殖させた。各培養条件について、7mLの5つの培養を0.15(MH)または0.2(CDMHuS)のOD620nmから開始した。OD620nmが約0.6に達したとき、5つの培養物を混合し、65mLのそれぞれの培地をさらに加えて、合計100mLにし、OD620nm=0.6までインキュベーションを続けた。細胞を10,000xgで30分間、遠心分離し、細胞をペレット化した。細胞ペレットを、10mLのフィルター処理(Steriflip、Millipore)されたPBS緩衝液中で2回、洗浄した(緩衝液中に再懸濁し、遠心分離した)。最終洗浄後、2mLのアリコート中の細胞をペレット化し、ドライアイス上で凍結させた。
【0148】
1つの2mL細胞アリコートを解凍し、PBSで2回、洗浄した。洗浄後、細胞ペレットを2mLの可溶化緩衝液(10mM EDTA、150mM NaCl、1%(重量/体積)Triton X−100、0.2%(重量/体積)デオキシコール酸ナトリウム、および0.1%(重量/体積)ドデシル硫酸ナトリウムを含有する10mM Tris、pH7.8)中に再懸濁し、37℃で60分間、インキュベートした。試料を45,000xgで20℃、60分間、遠心分離した。上清を、プロテインAまたはプロテインG Sepharose CL−4Bビーズ(Sigma)(プロテインA:50μLのPBS中にあらかじめ膨潤した3〜4mgのビーズ、プロテインG:PBS中で3回、洗浄された50μLのビーズを用いた)を含有するマイクロチューブに移した(免疫沈降あたり1mL)。試料およびビーズの混合物を、4℃でロッキングさせながら、一晩、インキュベートした。ビーズを、2分間の遠心分離を用いて可溶化緩衝液で5回、洗浄して、各洗浄後、ビーズをペレット化した。最終の洗浄後、ビーズを、2−メルカプトエタノールを含まない75μLの試料緩衝液中に懸濁し、100℃で5分間、インキュベートして、結合した免疫グロブリンおよびタンパク質を遊離させた。試料を、上記のように3分間、遠心分離して、ビーズをペレット化し、上清を新しいチューブに移した。2μLの2−メルカプトエタノールを加え、上清を100℃で5分間、加熱した。ビーズから溶出されたタンパク質を、4%〜12%SDS−PAGEゲル(Invitrogen社製のNovexプレキャストゲル)上で分解し、それを製造会社の使用説明書に従ってGelCode Blue(Pierce Chemical Co.、Rockford、IL)で染色し、ゲル中のバンドを、図3に示されているように、LI−COR Odyssey IR撮像装置(Lincoln、NE)を用いて検出した。
【0149】
MALDI−TOF質量フィンガープリント分析によるナイセリアのヒトIgG結合タンパク質の同定。上記のように免疫沈降されたIgG結合抗原を含有するGelCode Blueで染色されたSDS−PAGEゲルの部分を、清潔な安全かみそりの刃を用いて切り取り、シリコン処理されたチューブ(Fisher Scientific)内で切り刻んだ。ボルテクサー上で撹拌しながら10分間、40%(体積/体積)アセトニトリルを含有する200mM NH4HCO3緩衝液で3回、洗浄することによってゲル小片から染色を取り除いた。ゲル小片を減圧下で30分間、乾燥させ、その後、トリプシン(12ng/μl、Worthington、Lakewood、NJ)を含有する最小量の25mM NH4HCO3緩衝液中で再水和させ、37℃で一晩、インキュベートした。緩衝溶液と、50%(体積/体積)アセトニトリル中の0.1%(体積/体積)トリフルオロ酢酸(TFA)でゲル小片中から抽出されたトリプシンペプチドを混合した。溶出されたペプチドをspin−vac(Savant、Thermo−Fisher)内で乾燥させた後、その残留物を、4μlの0.1%TFA/50%アセトニトリル中に再懸濁した。1μlのこの溶液を、α−シアノ−4−ヒドロキシ桂皮酸(Bruker Daltonics、Fremont、CA)で飽和した3μlの0.1%TFA/50%アセトニトリルに加えた。0.5μlの試料/マトリックス溶液を、MALDI−TOF分析のためにステンレススチール標的プレート(Bruker Daltonics、Billerica、MA)上へスポットした。MALDI−TOF(Autoflex、Bruker Daltonics)を、陽イオンリフレクターモード(30ショットN2レーザー)で行った。質量スペクトルを、外部ペプチド標準(Bruker Daltonics)を用いて較正した。観察された質量の誤差は、≦0.1%であると推定される。観察されたペプチド質量のセットを、Mascot(matrixscience.com;Perkins DNら、1999 Electrophoresis 20:3551〜3567)を用いて分析した。いったんタンパク質が同定されたならば、タンパク質分解性断片の予想質量を、PeptideMass(Wilkins MRら、1997 Electrophoresis 20:3551〜3567)を用いて計算した。
【0150】
図3に示されているように、ある範囲の分子量を有するタンパク質が、CDM/dHuS中で増殖した可溶化細胞とインキュベートされたプロテインAおよびGから溶出されたが、MH中では溶出されなかった。しかしながら、ゲルから単離された各タンパク質バンド由来のトリプシンペプチドをMALDI−TOF質量分析法によって分析した場合、それらの全てが類似した一連の質量を含有し、単一のタンパク質の存在が、変動する移動度でゲル内を移動したことを示している(図3)。Mascotを用いる質量フィンガープリント分析によって決定されたタンパク質のアイデンティティ(図4)は、64の確率に基づいたMowseスコア(50より大きい値が有意である)および0.0026の対応する期待値(0.05未満の値が有意である)を以て、NmAのZ2491株NMA0776遺伝子によってコードされたものであることが見出された。NmAのZ2491株ゲノム由来のNMA0776および相同性遺伝子のNMA1797は、Ala’Aldeenおよび共同研究者(Kizil GIら、1999 Infect.Immun.67:3533〜3541;米国特許第6861507号)によって同定されたT細胞およびB細胞の刺激タンパク質B、ならびにBille Eら、2005 J.Exp.Med.201:1905〜1913およびBille Eら、2008 PLoS One 3:e3885によって同定されたOrf6と配列相同性を共有する。
【実施例3】
【0151】
ナイセリアのヒトIgG結合タンパク質の配列分析および構造モデル。
NMA0776の翻訳タンパク質配列およびNCBI(ncbi.nlm.nih.gov/sutils/genom_table.cgi)で利用可能な13個のナイセリア科ゲノムのBLAST配列相同性検索を用いて、相同性タンパク質配列が侵襲性髄膜炎菌A群(Z2491)、B群(MC58)、およびC群(FAM18)、ならびにナイセリア−ゴノレア(FA1090)株および非侵襲性ナイセリア−ラクタミカ(ATCC 23970)株に見出された。推定TspB/Orf6タンパク質をコードする遺伝子の数は、1個の部分配列(ラクタミカ株ATCC 23970)から4個の完全長配列(髄膜炎菌B群MC58、C群FAM18およびN.ゴノレアFA1090株)までの範囲であった。A群、B群、およびC群の株由来の翻訳されたタンパク質配列を比較した場合、パターンが現れた。
【0152】
図5に示されているように、そのタンパク質のアミノ末端およびカルボキシル末端の配列は、多岐にわたるが、比較的保存されているコア領域がある。可変アミノ末端配列は、新生タンパク質を細胞の外へ輸送されるように方向づける機能的リーダーペプチド配列の可能性がある。そのタンパク質のカルボキシル末端において、可変配列は、一般的に、機能的に等価であるために同じ配列を有する必要はない可能性がある疎水性膜貫通セグメントである。保存された内部ドメインに関しては、後にプロリンリッチセグメントが続く、二次構造予測に基づいたβシート構造で主に構成されている典型的な球状ドメインがある。プロリンリッチセグメントは、伸長したヘリカル構造をとることが知られている(Butcher DJら、1996 Biochemistry 35:698〜703)。
【0153】
分析により、少なくともいくつかのTspB/Orf6遺伝子は、細菌表面へ運び出され得るタンパク質をコードする。そのタンパク質は、超可変N末端ドメイン、続いて、可変膜貫通セグメントによって膜に繋ぎ止められているプロリンリッチヘリカルセグメントの末端で膜から外へ伸びる球状ドメインを含有する。この構造モデルに基づいて、球状セグメントおよび/またはプロリンリッチセグメントは、それらが高度に保存されているため、いくつかの機能活性を有するが、可変N末端ドメインは、抗体応答を崩壊させるための不必要な「偽装」としての役割を果たすことは明らかである。したがって、TspB/Orf6を標的とする抗体を誘発するために設計されるワクチンは、一方または両方の保存ドメインのみを含有するものでもよい。
【実施例4】
【0154】
ナイセリアのヒトIgG結合タンパク質の定常領域ドメインを含有する様々なIg結合性構築物のクローニングおよび発現
保存された球状ドメイン(CR)を、下記のようにクローン化した(本明細書ではTspB−IGBと呼ぶ)。ゲノムDNAを、QiagenゲノムDNA単離キット(Qiagen、Valencia、CA)を用い、製造会社の使用説明書に従って、MC58株から調製した。TspB−IGBをコードするDNAを、以下のプライマーを用いるPCRによって増幅した:5’−CATGGATCCATCAGTTTCCCG−3’(配列番号49)および5’−CATAAGCTTTGCTTCCGCGCTTC−3’(配列番号50)。PCRは、Invitrogen(Carlsbad、CA)社製のPfx DNAポリメラーゼ、ヌクレオチド、および緩衝液を用いるIdaho Technology(Salt Lake City、Utah)RapidCycleサーモサイクラーでの95℃での変性、50℃でのアニーリング、および72℃での伸長の30サイクルからなった。PCR断片を、QIAquick PCR精製キットを用い、製造会社の使用説明書に従って精製し、T4 DNAリガーゼ(New England Biolabs、Ipswich、MA)を用いて、20℃で一晩、プラスミドpCR2.1(Invitrogen)へライゲーションした。ライゲーション反応産物を用いて、大腸菌BL21株(DE3)(Invitrogen)を形質転換した。形質転換された大腸菌を、100μg/mlアンピシリン(Sigma)およびBlue White Selectスクリーニング試薬(Sigma)を含有するLB寒天プレートに蒔いた。Qiagenミニプラスミドプレップキットを用いてプラスミドを白色コロニーから調製し、TspB−IGB DNA断片の存在を下記のように確認した。
【0155】
プラスミドを、まず、Eco RI(New England Biolabs)で消化し、挿入断片のサイズを確認した。クローニングに用いられる断片を制限エンドヌクレアーゼHind III、続いてBam HI(New England Biolabs)で処理した。生じた断片を、TBE緩衝液(Gibco)中の0.5μg/ml臭化エチジウムを含有する1%(重量/体積)アガロース(Promega、Madison、WS)ゲルにおける電気泳動によって単離した。予想されたサイズのTspB−IGB DNA断片に対応するバンドを、ゲルから切り取ることによって単離し、Qiagen QIAquick Gel Extractionキットを用いて精製した。Hind III/BamHI TspB−IGB DNA断片を従来通り、上記のように前もって同じ制限エンドヌクレアーゼで消化し、エビアルカリフォスファターゼ(USB、Cleveland、OH)で処理し、アガロースゲル電気泳動によって精製したプラスミドpQE31(Qiagen)およびpET21b(+)(Novagen now EMD、Gibbstown、NJ)へライゲーションした。ライゲーション反応からのDNA産物を用いてBL(DE3)株を形質転換し、それを、上記のように、LB寒天/アンピシリンプレート上に蒔いた。プラスミドDNAを形質転換体から調製し、正しい挿入断片の存在を、制限エンドヌクレアーゼ消化およびDNAシークエンシングによって確認した。
【0156】
プラスミドpQE31は、アミノ末端に(6個のヒスチジン残基を含有するセグメントである)Hisタグを有するTspB−IGBの高レベルの細胞内発現を可能にした。他方、プラスミドpET22b(+)からの発現は、TspB−IGBのカルボキシル末端にHisタグ、およびTspB−IGBのアミノ末端に、タンパク質を周辺質への分泌へと方向づけるpelBリーダーペプチドを組み込むであろう。プラスミドpQE31の利点には、非常に高いレベルのタンパク質発現が挙げられ、一方、プラスミドpET22b(+)は、細胞外の細胞膜周辺腔内での天然の折り畳みを可能にする。TspB−IGB含有プラスミド構築物を、大腸菌BL21(DE3)株(Invitrogen)へ形質転換した。個々のコロニーを、100μg/mlアンピシリンを含有する50mlのLB培地中、37℃で一晩、振盪インキュベータ内で増殖させた。次の日、一晩の培養物を用いて、振盪インキュベータ内、37℃で、500mlの2x YT培地に播種した。pQE31−TspB−IGB構築物を含有する細胞についてOD620nmが0.5から1の間になったとき、IPTG(Sigma)を1mMの最終濃度まで、およびアンピシリンを200μg/mlまで加えた。培養を3時間、続け、細胞を8000xgで20分間の遠心分離によって収集し、上清を捨て、細胞ペレットを、下記のように処理するまで、−80℃で凍結させた。pET22b(+)−TspB−IGBプラスミドを含有するBL21(DE3)の培養物を、OD620nmが約0.6である時点で、22℃まで冷却した。IPTGおよびアンピシリンをそれぞれ、1mMおよび200μg/mlの最終濃度まで加え、培養を22℃で一晩、続けた。細胞を遠心分離によって回収し、下記のように用いるまで凍結させた。
【0157】
上記の方法に基づいて、組換えTspBを発現するためのいくつかの構築物を作製した。NmBのMC58株は、以下の3個のTspB遺伝子を有する:NMB1548、NMB1628、およびNMB1747。NMB1628およびNMB1747 TspB遺伝子は、同一のアミノ酸配列を有するポリペプチドをコードする。NMB1628由来の配列を、(N末端Hisタグを有する)pQEベクター内でクローン化し、NMB1548由来の配列を、pQEベクターおよび(C末端Hisタグを有する)pETベクターの両方へクローン化した。
【0158】
作製した追加のバージョンの構築物は以下を含んだ:1)pQEベクターおよびpETベクターの両方における、本明細書でIGBproおよび完全長NMB1628と呼ばれる、NMB1628定常領域およびプロリンリピート。下記の詳細を参照されたい。
【0159】
1)IGBproを含有するNMB1628由来のTspB:
NMB1628の保存された球状ドメイン、続いて保存されたプロリンリッチリピートにわたるDNA断片を下記のようにクローン化した(本明細書ではTspB−IGBproと呼ぶ)。ゲノムDNAを、QiagenゲノムDNA単離キット(Qiagen、Valencia、CA)を用い、製造会社の使用説明書に従ってMC58株から調製した。TspB−IGBpro(NMB1628)をコードするDNAを、以下のプライマーを用いるPCRによって増幅した:5’−CATGGATCCATCAGTTTCCCGCGCCGCCGTCTT−3’(配列番号51)および5’−CATAAGCTTGTTCTCAAAGCTGAACGCG−3’(配列番号52)。PCRは、New England Biolabs(Ipswich、MA)社製のTaq DNAポリメラーゼ、ヌクレオチド、および反応緩衝液を用いるIdaho Technology(Salt Lake City、Utah)RapidCycleサーモサイクラーでの95℃での変性、48℃でのアニーリング、および72℃での伸長の5サイクル、続いて、95℃での変性、52℃でのアニーリング、および72℃での伸長の25サイクルからなった。PCR断片を、QIAquick PCR精製キット(Qiagen)を用い、製造会社の使用説明書に従って精製した。TOPO−TAクローニングキット(Invitrogen)を用いて、製造会社の使用説明書の通り、PCR産物を、プラスミドpCR2.1(Invitrogen)へライゲーションし、ライゲーション反応産物を用いて、大腸菌TOP 10株(Invitrogen)を形質転換した。形質転換された大腸菌細胞を、100μg/mlアンピシリン(Sigma)およびX−Gal(ブロモ−クロロ−インドリル−ガラクトピラノシド、Gold Biotechnology)を含有するLB寒天プレート上に蒔いた。他の2つのゲノム遺伝子座(NMB1548およびNMB1747)由来のTspB−IGBproの増幅および組込みを排除して、正しい挿入断片を含むプラスミドDNAを有する白色コロニーについてスクリーニングするために、検証プライマー5’−GCCGCCGTCTTGTCAGGAGTC−3’(配列番号53)および5’−ATCAAGCACAGTCACTGTGAA−3’(配列番号54)を用いるコロニーPCRを実施した。その後、プラスミドDNAを、Qiagenミニ−プラスミドプレップキットを用いて、選択された形質転換体から調製し、TspB−IGBproをコードする正しい配列を、DNAシークエンシングによって検証した。
【0160】
挿入断片を有するプラスミドpCR2.1を、制限エンドヌクレアーゼBam HIおよびHind III(New England Biolabs)で消化した。生じた断片を、TAE緩衝液(40mM酢酸Tris、1mM EDTA)中の1.5%(重量/体積)アガロース(Promega、Madison、WS)ゲルにおける電気泳動によって単離した。電気泳動後、DNAバンドを、アガロースゲルを0.5%臭化エチジウム溶液(Gibco)中に浸水させることによって可視化した。予想されたサイズのTspB−IGBpro DNA断片に対応するバンドを、ゲルから切り取り、Qiagen QIAquick Gel Extractionキットを用いて精製することにより単離した。Bam HI/Hind III TspB−IGBpro DNA断片を、前もって同じ制限エンドヌクレアーゼで消化し、エビアルカリフォスファターゼ(USB、Cleveland、OH)で処理した発現プラスミドpQE31(Qiagen)へライゲーションした。その後、ライゲーション反応物を用いて、BL21(DE3)(Invitrogen)株を形質転換し、それを、上記のように、LB寒天/アンピシリンプレート上に蒔いた。正しい挿入断片を含むプラスミドDNAを有するコロニーを選択するために、検証プライマー5’−GCCGCCGTCTTGTCAGGAGTC−3’(配列番号53)および5’−ATCAAGCACAGTCACTGTGAA−3’(配列番号54)を用いるコロニーPCRを実施した。その後、DNAを、選択された形質転換体から調製し、TspB−IGBproをコードする正しい配列をDNAシークエンシングによって検証した。
【0161】
2)NMB1628由来の完全長TspB(TspB−FL)
NMB1628の完全長オープンリーディングフレーム(開始コドンから停止コドンまで)を下記のようにクローン化した(本明細書ではTspB−FLと呼ぶ)。ゲノムDNAを、QiagenゲノムDNA単離キット(Qiagen、Valencia、CA)を用い、製造会社の使用説明書に従ってMC58株から調製した。TspB−FLをコードするDNAを、プラスミドpET22b(+)へクローン化するためにプライマー対5’−AGCATATGTTGGGGATGTTTTCGGT−3’(配列番号55)および5’−AGAAGCTTGACTTCACGAGATACTGTGC−3’(配列番号56)、プラスミドpQE30へクローン化するためにプライマー対5’−ACGGATCCTTGGGGATGTTTTCGGTTAA−3’(配列番号57)および5’−AGAAGCTTCTAGACTTCACGAGATACTG−3’(配列番号58)を用いるPCRによって増幅した。両方の増幅反応についてのPCRは、New England Biolabs(Ipswich、MA)社製のTaq DNAポリメラーゼ、ヌクレオチド、および反応緩衝液を用いるIdaho Technology(Salt Lake City、Utah)RapidCycleサーモサイクラーでの95℃での変性、48℃でのアニーリング、および72℃での伸長の5サイクル、続いて、95℃での変性、52℃でのアニーリング、および72℃での伸長の25サイクルからなった。PCR断片を、QIAquick PCR精製キット(Qiagen)を用い、製造会社の使用説明書に従って精製した。TOPO−TAクローニングキット(Invitrogen)を用いて、製造会社の使用説明書の通り、PCR産物を、プラスミドpCR2.1(Invitrogen)へライゲーションし、ライゲーション反応産物を用いて、大腸菌TOP 10株(Invitrogen)を形質転換した。形質転換された大腸菌細胞を、100μg/mlアンピシリン(Sigma)およびX−Gal(Gold Biotechnology)を含有するLB寒天プレート上に蒔いた。Qiagenミニ−プラスミドプレップキットを用いて、TspB−FL断片の最初の増幅に用いたプライマーでのコロニーPCR中にPCR産物を生じた白色コロニーからプラスミドを調製した。正しいTspB−FL挿入断片配列を、DNAシークエンシングによって確認した。
【0162】
プラスミドを、制限エンドヌクレアーゼNde IおよびHind III、またはBam HIおよびHind III(New England Biolabs)で消化して、ベクターpET22b(+)およびpQE30、それぞれへクローン化するために用いる断片を遊離させた。生じた断片を、TAE緩衝液(40mM酢酸Tris、1mM EDTA)中の1.5%(重量/体積)アガロース(Promega、Madison、WS)ゲルにおける電気泳動によって単離した。電気泳動後、DNAバンドを、アガロースゲルを0.5%臭化エチジウム溶液(Gibco)中に浸水させることによって可視化した。予想されたサイズのTspB−FL DNA断片に対応するバンドを、ゲルから切り取り、Qiagen QIAquick Gel Extractionキットを用いて精製することにより単離した。Nde I/Hind IIIおよびBam HI/Hind III TspB−FL DNA断片を、前もって同じ制限エンドヌクレアーゼで消化し、エビアルカリフォスファターゼ(USB、Cleveland、OH)で処理した発現プラスミドpET22b(+)およびpQE30(Qiagen)、それぞれへライゲーションした。ライゲーション反応からのDNA産物を用いて、大腸菌TOP 10F’株の細胞(Invitrogen)を形質転換し、それを、上記のように、LB寒天/アンピシリンプレート上に蒔いた。Qiagenミニ−プラスミドプレップキットを用いて、上記のようにコロニーPCR中にPCR産物を生じた形質転換体からプラスミドを調製した。正しいTspB−FL挿入断片配列を、再び、DNAシークエンシングによって確認した。
【0163】
3)NMA0776および1797由来のTspB IGB
NMA0776およびNMA1797によってコードされる保存された球状ドメインTspB−IGBを、MC58におけるNMB1628によってコードされたTspB−IGBproについて上で記載されているように、クローン化した。ゲノムDNAを、QiagenゲノムDNA単離キット(Qiagen、Valencia、CA)を用い、製造会社の使用説明書に従ってZ2491株から調製した。NMA0776のTspB−IGBをコードするDNAを、以下のプライマー:5’−CATGGATCCATCAGTATCCCGCGCCG−3’(配列番号59)および5’−CATAAGCTTTGCTTCTGCGCTTCCG−3’(配列番号60)を用いるPCRによって増幅し、一方、NMA1797のTspB−IGBをコードするDNAを、以下のプライマー:5’−CATGGATCCATCAGTTTCCCGCGCCG−3’(配列番号61)および5’−CATAAGCTTTGCTTCCGCGCTTC−3’(配列番号62)を用いるPCRによって増幅した。両方の増幅反応についてのPCRは、New England Biolabs(Ipswich、MA)社製のTaq DNAポリメラーゼ、ヌクレオチド、および反応緩衝液を用いるIdaho Technology(Salt Lake City、Utah)RapidCycleサーモサイクラーでの95℃での変性、48℃でのアニーリング、および72℃での伸長の5サイクル、続いて、95℃での変性、52℃でのアニーリング、および72℃での伸長の25サイクルからなった。PCR断片を、QIAquick PCR精製キット(Qiagen)を用い、製造会社の使用説明書に従って精製した。TOPO−TAクローニングキット(Invitrogen)を用いて、製造会社の使用説明書の通り、PCR産物を、プラスミドpCR2.1(Invitrogen)へライゲーションし、ライゲーション反応産物を用いて、大腸菌TOP 10株(Invitrogen)を形質転換した。形質転換された大腸菌を、100μg/mlアンピシリン(Sigma)およびX−Gal(Gold Biotechnology)を含有するLB寒天プレート上に蒔いた。Qiagenミニ−プラスミドプレップキットを用いて、NMA0776およびNMA1797によってコードされるTspB−IGBの最初の増幅に用いたプライマーでのコロニーPCR中にPCR産物を生じた白色コロニーからプラスミドを調製した。正しいTspB−IGB挿入断片配列を、DNAシークエンシングによって確認した。
【0164】
両方のTspB−IGB挿入断片配列を有するプラスミドを、制限エンドヌクレアーゼBam HIおよびHind III(New England Biolabs)で消化して、クローン化するのに用いる2つの断片を遊離させた。生じた断片を、TAE緩衝液(40mM酢酸Tris、1mM EDTA)中の1.5%(重量/体積)アガロース(Promega、Madison、WS)ゲルにおける電気泳動によって単離した。電気泳動後、DNAバンドを、アガロースゲルを0.5%臭化エチジウム溶液(Gibco)中に浸水させることによって可視化した。予想されたサイズのTspB−IGB DNA断片に対応するバンドを、ゲルから切り取り、Qiagen QIAquick Gel Extractionキットを用いて精製することにより単離した。Hind III/Bam HI TspB−IGB DNA断片を、前もって同じ制限エンドヌクレアーゼで消化し、エビアルカリフォスファターゼ(USB、Cleveland、OH)で処理した発現プラスミドpQE31(Qiagen)へライゲーションした。ライゲーション反応物を用いて、大腸菌TOP 10F’株(Invitrogen)を形質転換し、それを、上記のように、LB寒天/アンピシリンプレート上に蒔いた。Qiagenミニ−プラスミドプレップキットを用いて、2つのTspB−IGB断片の最初の増幅に用いたプライマーでのコロニーPCR中にPCR産物を生じたコロニーからプラスミドDNAを調製した。正しいTspB−IGB挿入断片配列を、DNAシークエンシングによって確認した。
【実施例5】
【0165】
組換えTspB−IGBの精製
TspB−IGBタンパク質の精製を、Qiaexpressionist Handbook第5版(2003、Qiagen)に記載されているように、pQE31−TspB−IGB発現プラスミドについては変性条件下で、またはpET22b(+)−TspB−IGB発現プラスミドについては非変性条件下で、5ml Ni Sepharose HisTrap高性能HPカラム(GE BioScience、Piscataway、NJ)を用いて実施した。カラムからの画分を、Invitrogen社製のプレキャストゲルを用いるSDS−PAGEによって分析し、続いて、SimplyBlue SafeStain(Invitrogen)で染色し、Odyssey IRスキャナ(LI−COR)でゲルをスキャンすることによって記録した。変性条件下で精製されたTspB−IGBを含有する画分を混合し(合計6ml)、10mM Tris・HClおよび8M尿素を含有する100mM NaH2PO4緩衝液、pH8.0中30mlに希釈し、1日にわたって、1回に25mlのPBS緩衝液を加えることによって、周囲温度でPBS緩衝液(合計1L)中、透析した(1kDaカットオフSpectropor膜、Fisher)。最後に、再び折り畳まれたTspBタンパク質を、0.002%Tween 20および24mMスクロースを含有する4Lの2mMヒスチジン、pH6中で透析し、凍結乾燥した。非変性条件下で精製されたTspB−IGB(pET22b(+)−TspB−IGB構築物)を、0.002%Tween 20および24mMスクロースを含有する4Lの2mMヒスチジン、pH6中で透析し、凍結乾燥した。
【0166】
図6に示されているように、pQE31プラスミドまたはpET22b(+)プラスミドのどちらから発現した精製産物も、上記の両方の方法が、高純度のTspB−IGBポリペプチドを産生することができることを立証した。図6、レーンAは、pQE31から発現し、変性条件下で精製され、再び折り畳まれたTspB−IGBを示している。図6,レーンBは、pET21b(+)から発現し、非変性条件下で周辺質から精製されたTspB−IGBを示している。
【実施例6】
【0167】
組換えTspB−IGBのIg結合活性
産生され、変性条件下で精製され、その後、再び折り畳まれた、または非変性条件下で精製されたTspB−IGBポリペプチドを、様々な源由来のIgGに結合するそれらの能力について固相ELISAアッセイにより評価した。TspB−IGB(PBS中10μg/mlの濃度で100μl/ウェル)をマイクロタイタープレート(Immulon 2;Dynatech Laboratories,Inc.、Chantilly、VA)に4℃で一晩、吸着させた。PBSで3回、洗浄した後、プレートを、250μlのブロッキング緩衝液(1%ウシ血清アルブミンおよび0.1%アジ化ナトリウムを含有するPBS、pH7.4)で、室温で30〜60分間、ブロッキングした。プレートをPBSで3回、洗浄した後、4人の異なるドナー(ドナー1、3、4、および5)由来のヒト血清、ドナー3およびドナー1血清から精製されたIgG、Jackson ImmunoResearch Laboratories(West Grove、PA)製の精製ヒトIgG、IgM、およびIgA、骨髄腫細胞系から得られた(BioDesign International、Saco、ME)、およびCHO細胞において産生された(本発明者らの研究室からのmAb DA2)、精製ヒトIgG1、IgG2、IgG3、およびIgG4、4匹のマウス由来およびZymed(South San Francisco、CA)社製のマウス血清、ならびにマウス骨髄腫(全て、Southern Biotech、Birmingham、AL社製)およびハイブリドーマ(SEAM 12)細胞系から得られた精製マウスIgG1、IgG2a、IgG2b、IgG3、およびIgMモノクローナル抗体をウェルに加え、ブロッキング緩衝液中に段階希釈した。次の日、ウェルをPBSで5回、洗浄し、ブロッキング緩衝液中に1:3000希釈された、100μl/ウェルのアルカリフォスファターゼ連結型抗ヒトポリクローナル抗体(Jackson ImmunoResearch、West Grove、PA)または抗マウスポリクローナル抗体(IgA+IgG+IgM;Zymed、South San Francisco、CA)と周囲温度で1時間、インキュベートした。その後、プレートをPBSで洗浄し、基質緩衝液(50mM Na2CO3、1mM MgCl2、pH9.8)中に1mg/mlに希釈された100μlの新鮮に調製された基質(p−ニトロフェニルリン酸;Sigma)を各ウェルに加えた。405nmでの吸光度を、約60分後、測定した。各試料におけるIgG抗体濃度を、捕獲ELISA(マウスについてはSouthern Biotech、およびヒトについてはImmunological Consultants)によって決定した。下記の表1は結合データを要約する。
【0168】
【表1】

【0169】
*BC、基質での60分間の発色後の0.5のOD405nmを与える抗体の濃度。ストック溶液中の抗体濃度を、Ig標準を除いて、捕獲ELISAによって測定し、そのIg標準は製造会社によって提供された。DA2はCHO細胞において産生し、SEAM 12はハイブリドーマ細胞系において産生した。陰性対照はBSAであり、それはデータ点希釈においてのみ二次と同じであった。
【0170】
血清中か精製されたかにかかわらず、全てのヒトポリクローナル抗体の調製物は、陰性対照BSA単独と比較して、天然TspB−IGBおよび再び折り畳まれたTspB−IGBの両方への結合を示している(表1)。しかしながら、骨髄腫細胞系において産生した、商業的供給源から入手されたヒトおよびマウスのIgG標準モノクローナル抗体による結合は、Jackson ImmunoResearchから入手されたヒトIgMパラプロテインを除いて、ほとんど結合を示さなかった。対照的に、CHO細胞において産生したヒト化IgG1モノクローナル抗体(DA2)およびハイブリドーマ細胞系において産生したマウスIgG2aモノクローナル抗体(SEAM 12)について結合が観察された。結果より、組換えTspB−IGBが、完全長TspBのIgG結合機能的活性の少なくとも一部を含むこと、およびTspB−IGBがヒトIgGおよびマウスIgGの両方を結合することができることが示されている。等価のELISA読みを与えるIgの濃度がヒトIgについて5分の1〜10分の1であったため、ヒトIgへの優先度が高い可能性がある。また、マウスIgの存在下における細胞の蛍光は、ヒトIgの存在下においてより低かった(図1のDおよびGを比較する)。商業的に入手されたアイソタイプ標準の一部との明らかな反応性の欠如についての理由は、はっきりしないが、骨髄腫に存在するFcグリコフォームにおける違いと関係がある可能性がある(Farooq Mら、1997 Glycoconj J.14:489〜492)。あるいは、TspB−IGBには見られない完全長のTspBタンパク質の他のドメインが、結合に寄与している可能性がある。例えば、プロリンリッチセグメントは、単量体型より高い結合活性を示すことが予想される多量体の形成を促進する可能性がある。
【0171】
NMB1628コード化TspB対NMB1548コード化TspBによるヒトIgGへの結合
精製ヒトIgGの組換えTspB1628IGBおよびTspB1548IGBへの結合。アミノ末端にHisタグを有するpQEプラスミドから発現し、かつ非変性条件下で精製された、NMB1628およびNMB1548によりコードされるTspB IGBを、上記のように、マイクロタイタープレートのウェルに吸着させた(10μg/mlの100μl)。ブロッキング緩衝液でのブロッキング後、ブロッキング緩衝液中での精製ヒトIgGの段階希釈溶液を、ウェルに加え、4℃で一晩、放置しておいた。上記のように、プレートを洗浄し、結合したIgGを検出した。対照として、再び折り畳まれたTspB1628IGB(rTspB1628IGB)に対する抗血清(TspB1628IGBおよびTspB1548IGBに等しくよく結合する)を用いて、等量のタンパク質がプレート上にコーティングされたことを示した。
【0172】
図11は、NMB1628によりコードされたTspB IGBが精製ヒトIgGに強く結合したが、NMB1548によりコードされたTspB IGBはヒトIgGをあまり結合しなかった。
【0173】
精製TspB1628IGBの溶液は、ゲル様沈殿物を有することが観察されたが、精製TspB1548IGBの溶液は、類似したゲル様物質を含有していないように思われた。それぞれの溶液を顕微鏡スライド上にスポットし、カバーガラスで覆い、一晩、乾燥させた。次の日、スライドを調べると、TspB1628IGB試料が、特徴的な重合体構造の広範なネットワークを含有することが顕微鏡(Zeiss Axioplan)下で観察された。対照的に、TspB1548IGB試料については、少数のより短い重合体構造のみが観察された。2つの誘導体の重合体構造を形成する能力の違いが、ヒトIgGを結合するそれらの能力の違いに関連している可能性がある。図12は、NMB1628によりコードされたTspB IGB(図12、パネルA)が凝集して特徴的な重合体構造を形成したが、NMB1548によりコードされたTspB IGB(図12、パネルB)は限られた重合体構造を形成し、または全く形成しなかったことを示している。したがって、TspB IGB誘導体の重合体構造を形成する能力を、ヒトIgGを結合する能力に関連づけることができる。
【実施例7】
【0174】
TspBを発現する細菌の選択
図13は、フローサイトメトリーによって決定されたように(実施例1)、2人の異なるドナー(ドナー1およびドナー2)血清由来のヒトIgGを結合する、異なる莢膜群由来のいくつかのN.メニンギティディス株の能力を示している。菌株の一部(例えば、NmCの4243株)は、IgGに強く結合したが、他のもの(例えば、NmW135のA22株)はほとんど結合しなかったかまったく結合しなかった。ほとんどIgG結合を示さなかったかまったくIgG結合を示さなかったA22株、NMB株、およびZ1092株を、以下のように、ヒト補体の存在下での選択に供した。
【0175】
チョコレート寒天(Remel、Lenexa、KS)上で増殖した細菌コロニーを用いて、(材料および方法に記載されているように調製した)5%(体積/体積)の熱失活化したIgG除去ヒト血清を含有する5mlのCatlin 6培地(CDMHuS)に0.18のOD620nmまで播種し、0.72のOD620nmまで37℃で増殖させた。培養物を遠心分離して細菌を収集し、それを、同体積の培地中に懸濁した。細菌溶液の一部を、20%(体積/体積)ヒト補体を含有する1mlのCDM中に1:80,000希釈した。細菌を37℃で一晩、増殖させた。次の朝、細菌を、5mlのCDMHuS中に0.18のOD620nmまで希釈し、再び、0.72のOD620nmまで増殖させた。その手順を2回、繰り返し、20%ヒト補体中での一晩の選択の各ラウンド後に得られた細菌を、フローサイトメトリーによってIgG結合について分析した。
【0176】
図14に示されているように、IgG結合について陽性であった細胞の画分は、選択のラウンドごとに増加した。図14における参照として、選択前のIgGの菌株への結合(図13)が、白色ヒストグラムで示されている。IgGの結合活性の発現は、ヒト血清因子の存在下で増殖しなかった細菌においては変化しやすくあり得る。しかしながら、IgGの結合は、活性補体を含有するヒト血清における繰り返しの培養によって回復した。結合を測定するために用いられた細菌、および下記の実施例に記載された抗TspB−IGBの殺菌活性(BCA)について用いられ得る細菌は、この実施例に記載された方法を用いて選択された。細菌を、将来用いるために、5mlのCDMHuS中で増殖した細菌を200μlのヒト全血清に懸濁し、その後、ドライアイス上で20μlのアリコートを凍結させることによって貯蔵した。細菌アリコートを、使用するまで−80℃で貯蔵した。
【実施例8】
【0177】
抗血清のナイセリア−メニンギティディス細菌への結合の評価
上の材料および方法のセクションに記載されているように免疫されたマウスから抗血清を収集した。マウスを以下で免疫した:
1)変性条件下および非変性条件下で精製された、pQEに発現したNMB1628IGB(rfTspB1628IGB)
2)pQEから産生され、かつ非変性条件下で精製されたNMB1628IGBPro(nTspB1628IGB);ならびに
3)pETから産生され、かつ非変性条件下で精製されたNMB1548(nTspB1548IGB)。
【0178】
TspB−IGBに基づいたワクチンの、ナイセリアに結合する抗体を誘発する能力を、フローサイトメトリーによって試験した。TspB/Orf6を発現するように誘導された細胞が、誘導されなかった細胞と比較することができるように、ナイセリア株を、CDMまたはCDMHuSにおいて約0.6のO.D.620まで増殖させた。細胞をペレット化し、洗浄し、ブロッキング緩衝液に最初の体積の80%で再懸濁した。その後、細菌懸濁液を、最終濃度が50%の細菌懸濁液、10%抗血清、および40%ブロッキング緩衝液になるように、反応混合物に加えた。混合物を、周期的に穏やかに撹拌しながら4℃で2時間、インキュベートした。細胞を、遠心分離によってペレット化し、フルオレセインイソチオシアネート(FITC)連結型ヤギ抗マウス二次抗体のブロッキング緩衝液中の1:300希釈溶液の100μlに再懸濁した。IgG(H+L)F(ab’)2およびIgM(Jackson ImmunoResearch、West Grove、PA)、加えてIgG1、IgG2a、IgG2b、およびIgG3(Bethyl Laboratories、Montgomery、TX)に対するFITC連結型抗体を用いた。二次抗体を加えた後、チューブを、周期的に穏やかに撹拌しながら4℃で1時間、インキュベートした。細胞をペレット化し、新鮮に作製されかつ濾過された、0.5%ホルムアルデヒド(重量/体積)を含有する450μlのPBS中に再懸濁した。その後、試料を、フローサイトメトリー(BD FACSCalibur System、BD Biosciences、San Jose、CA)によって分析した。
【0179】
図15は、抗1628IGBのNmBのMC58株(図15、パネルA)またはNmAのZ2491株(図15、パネルB)への結合のフローサイトメトリー実験を示す。対照として、抗血清の添加なし、またはアジュバントのみの対照血清が挙げられる。両方のパネルにおいて、グラフは右へシフトしており、それは、抗1628IGBの蛍光の増加に対応した。このように、ワクチンによって誘発された抗体は、NmA株およびNmB株の両方に強く結合した。
【0180】
図15のパネルAおよびBにおける下の方のパネルは、ヒトIgGの各菌株への結合を示す。ヒトIgGの細菌への結合のレベルは、rfTspB1628IGBに対する抗血清の存在下で減少し、抗血清が、ヒトIgGの細菌への結合を阻害したことを示唆する。
【0181】
図16は、以下の免疫原によって誘発された抗体の結合が比較されている、NmBのMC58株に関する類似した結合実験を示す:
1)ミョウバンアジュバント単独
2)TspB1548IGB
3)非変性条件下で精製されたTspB1628IGB
4)変性条件下で精製され、かつ再び折り畳まれたTspB1628IGB(rfTspBIGB1628)。
【0182】
各実験において、細胞を、CDM+5%Cohn FIV+1%精製ヒトIgG、および示された抗血清の1:200の希釈溶液中で増殖させた。細胞が0.6のOD620nmに達した後、細胞を2つの等しい画分へ分割した。一方の画分を抗マウスIgG−FITC二次抗体で処理し、他方を抗ヒトIgG−FITC二次抗体で処理して、それぞれのIgGの結合を検出した。結果より、rfTspB1628IGBが、NmBのMC58株に最も強く結合するIgG抗体を誘発したことが示されている。また、3つのTspBIGBタンパク質によって誘発された抗体が、ヒトIgG結合を阻害することができ、抗rfTspB1628IGBがヒトIgG結合を遮断するのに最も効果的であった。TspB、特にIGBドメインが、ヒトIgG結合活性を媒介する、Nm株によって発現されたタンパク質であることが見出された。したがって、TspBIGBに基づいたワクチンによって誘発される抗体は、ヒト血液中でのNm株の生存にとって重要な機構であるヒトIgG結合を遮断することができる。
【実施例9】
【0183】
補体活性化におけるタンパク質沈着についての試験
TspB IGBワクチンでの免疫化によって誘発された抗体の、B群、C群、X群、Y群、およびW135群細菌の代表的なナイセリア−メニンギティディス細菌へのヒト補体成分の沈着を活性化する能力は、下記のように決定することができる。
【0184】
抗体を誘発するために用いられたTspB−IGBワクチンは、任意のアジュバント(例えば、水酸化アルミニウム、リン酸アルミニウム、MF59、フロイントアジュバントなど)と組み合わされたTspB−IGBポリペプチドを含有していてもよい。ワクチンの抗血清による補体活性化は、Welschら(Welschら、2003 J.Infec.Dis.188:1730)によって記載されているように決定してもよい。簡単に述べれば、ナイセリア細胞を、CDM/dHuS中で約0.6のOD620まで増殖させる。細胞をペレット化し、1%(重量/体積)BSA(Sigma−Aldrich)を含有するDulbeccoのPBS(Invitrogen、Carlsbad、CA)(D−BSA)で洗浄し、最初の増殖培地のD−BSAの体積の半分に再懸濁する。D−BSA中に1:20または1:200まで希釈した2μgまたは10μgのいずれかで免疫されたマウス由来のプールされた抗血清と細菌(30μl)を混合する。ナイセリア細胞に対する抗体の非存在について試験されたドナー由来のヒト補体を、200μlの全体積において5%(体積/体積)の濃度まで加える。時々撹拌しながら、周囲温度で30分間、反応を進行させる。細胞をペレット化し、200μlのD−BSAで洗浄し、FITC連結型ヒツジ抗ヒトC3c抗体(BioDesign International、Saco、ME)をD−BSAに加える。時々撹拌しながらの氷上での30分間のインキュベーション後、細胞をペレット化し、0.5%(重量/体積)ホルムアルデヒドを含有する滅菌濾過されたPBS緩衝液中に再懸濁し、フローサイトメトリー(BD FACSCalibur System、BD Biosciences、San Jose、CA).によって分析する。
【0185】
細胞表面への補体成分の沈着は、細胞の蛍光を増加させ、蛍光ピークにおけるグラフの右へのシフトによって示され得る。抗体活性化は、活性のある補体、または熱失活化補体を含む抗血清に関してのみの細胞の蛍光の欠如によって示され得る。フローサイトメトリーからの細菌をさらにZeiss Axioplan(Carl Zeiss,Inc.)蛍光顕微鏡を用いる顕微鏡法によって分析する。NmB細菌の細胞表面への補体因子沈着の活性化は、ナイセリア−メニンギティディスによって引き起こされる疾患からの防御と関連づけられる(Welschら、2003 J.Infec.Dis.188:1730)。
【実施例10】
【0186】
血清殺菌アッセイ
補体媒介性殺菌抗体活性。抗TspB IGB抗血清の、ヒト補体の存在下において溶菌を媒介する能力は、血清殺菌アッセイ(SBA)によって測定することができる。殺菌アッセイを、以前に記載されているように(Moe G.R.ら、2002 Infect Immun 70:6021〜31)、チョコレート寒天プレート上で一晩増殖し、その後CDM/dHuS中で培養された対数増殖中期の細胞を用いて、実施し、またはTspB IGBを発現するように誘導されていない細胞と比較するために、0.25%グルコースを追加されたMueller Hinton培地ブロスが用いられる。チョコレート寒天プレートから採取された細胞を、培養を開始するために約0.18のOD620nmまで培地中に希釈し、その後、約0.62のOD620nmまで増殖させる。細菌をペレット化し、その後、1%BSA(Equitech)を含む、または含まない、Ca+およびMg+含有Dulbeccos緩衝食塩水(DBS;Mediatech.Manassas VA)中で洗浄する。各アッセイに用いられるヒト補体の供給源は、60%補体の存在下での試験菌株に対する内因性SBAについて評価される。
【0187】
最終反応混合物は、試験血清の異なる希釈溶液、および20%(体積/体積)ヒト補体を含有する。緩衝液は、0.9mM CaCl2×2H2O、0.5mM MgCl2×6H2O、および1%(重量/体積)BSAを含有する、Dulbeccoのリン酸緩衝食塩水(Sigma−Aldrich)である。
【0188】
補体の供給源は、検出可能な内因性殺菌活性をもたない健康な成人由来のヒト血清である(Granoffら、1998 J Immunol 160:5028〜36;Welschら、2003 J.Infec.Dis.188:1730)。血清殺菌力価は、0時間目における1mlあたりの対照CFUと比較して、反応混合物における細菌の60分間のインキュベーション後の1mlあたりCFUにおける50%減少を生じる、血清希釈度として定義される。典型的には、陰性対照抗体および補体とインキュベートされた細菌が、60分間のインキュベーション中にCFU/mLにおける150〜200%の増加を示す。
【実施例11】
【0189】
乳児ラット防御
乳児ラットにおける受動防御。抗TspB−IGB抗血清は、下記のように、菌血症からの受動防御について試験することができる。この実験の結果は、TspB−IGBに基づいたワクチンの、ヒトにおいて侵襲性疾患から防御する能力を決定することができる。
【0190】
乳児(生後4〜6日)のウィスターラットを母親から引き離し、それぞれ5匹のラットの群へランダムに分けた。それぞれの子に1%BSAを含有する滅菌PBS(PBS−BSA)中に1:10で希釈した100μlの抗血清を腹腔内に与え、その後、母親に戻し、同時に、負荷細菌を調製する。NmBのM986株またはNmCの4243株をCDM−/dHuS中でO.D.620=約0.6まで増殖させ、洗浄し、PBS−BSA中に再懸濁し、104CFU/mlまで希釈する。その後、各ラットの子に、最終負荷用量が約1000CFU/ラットであるように、100μlの細菌を与える。その後、子を母親に戻す。次の日、子をイソフルランで麻酔し、ヘパリン処理された針を用いて心穿刺により血液を採取する。その動物をCO2無酸素により安楽死させ、100μl、10μl、および1μlの血液をチョコレート寒天(Remel)上にプレーティングする。プレートを37℃、5%CO2で一晩、インキュベートした後、コロニーを数える。
【実施例12】
【0191】
髄膜炎菌性菌血症のエクスビボのヒト血液モデルにおける受動防御
代替として、ワクチンによって誘発される抗体の、ナイセリア−メニンギティディスによって引き起こされる疾患から防御する能力を評価することへのアプローチは、抗血清が、エクスビボでのヒト血液中において、ナイセリア−メニンギティディスB群を溶解すること、またはその増殖を阻害することができるかどうかを決定することである。試験される抗血清(上記のようにTsp−IGBに基づいたワクチンで免疫されたCD1マウス由来のプールされた抗血清)および試験細菌(上記のように、CDM/dHuS培地中に新鮮に増殖した約1000CFUのナイセリア株)を、下記のように、滅菌ガラスバイアル中で試験菌株に対する抗体を欠くドナーから新鮮に採取されたヒト血液中で混合し、調製し、試験する。
【0192】
エクスビボ受動防御アッセイ(PPA)。抗凝固剤として組換えヒルジン(レピルジン、27.8μg/ml最終濃度)を含有するシリンジを用いて健康な成人由来の新鮮な血液を採取する。血液ドナーは、血清が上記の血清殺菌活性を測定するための補体について用いられた人と同じであってもよい。マイクロタイタープレートの各ウェルへ、65μlの血液、25μlの試験血清、ならびに15%の加熱補体および1%ウシ血清アルブミン(Equitech)を含有する10μlのPBS緩衝液、ならびに約4000CFUを加える。陽性対照は、関連抗PorAモノクローナル抗体(NIBSC、P1.4またはP1.12)、ならびにそれぞれの試験菌株に対する、高い、中位の、または低いオプソニン作用性殺活性(PlestedおよびGranoff 2008 Clin Vaccine Immunol 15:799〜804)および血清殺菌活性をもつヒト血清試料を含み得る。陰性対照血清は、補体ドナー由来の熱失活血清または緩衝液単独であり得る。マイクロタイタープレートを、成分が完全に混合するようにMS 3デジタル小型振盪機(IKA、Wilmington、NC)において1分あたり500振動で撹拌しながら、5%CO2中、37℃で90分間、インキュベートする。ウェルから試料を取り出し、5%CO2中、37℃でインキュベートする、チョコレート寒天プレート上で、定量的培養を実施する。
【0193】
次の日、CFU/mlを確認し、その結果を、陰性対照試験血清についての時間0におけるそれと比較した、90分目でのCFU/mlにおけるlog10変化として計算する。異なる日に実施した同型アッセイの再現性に基づいて、陽性の受動防御活性は、CFU/mlにおいて、時間0におけるそれと比較して、≧0.5log10減少(すなわち、CFU/mlにおける約70%減少)を与える血清として定義することができる。
【技術分野】
【0001】
関連出願の相互参照
本出願は、2009年11月6日に出願された米国仮出願第61/259,032号の優先権恩典を主張し、その仮出願は、全体として、参照により本明細書に組み入れられている。
【0002】
連邦支援の研究に関する言明
本発明は、助成金番号R01 AI064314における政府支援でなされた。政府は本発明において一定の権利を有する。
【背景技術】
【0003】
ナイセリア−メニンギティディス(Neisseria meningitidis)は、ヒト上気道にコロニー形成するグラム陰性細菌であり、最も顕著には髄膜炎および敗血症の、世界的な孤発性および周期性の流行的発生の原因である。発病率および罹患率は、2歳未満の小児で最も高い。他のグラム陰性細菌のように、ナイセリア−メニンギティディスは、典型的には、原形質膜、ペプチドグリカン層、莢膜多糖と共に細菌細胞壁を構成する外膜、および外側の環境へ突き出す線毛を有する。ナイセリア−メニンギティディスの被包性菌株は、小児および若年成人における細菌性髄膜炎および敗血症の主な原因である。侵襲性ナイセリア−メニンギティディス感染症の流行および経済的重要性によって、異なる菌株にわたる、特に異なる血清型または血清亜型を有する遺伝子的に多様なB群菌株にわたる免疫を与えることができる効果的なワクチンについての研究が促されている。
【0004】
T細胞刺激タンパク質(Tsp)は、Ala’Aldeenらによって、鉄除去培地で増殖したナイセリア−メニンギティディスB群SD株の膜において同定された(Woodridge KGら、11th International Pathogenic Neisseria Conference 1998、Nice、France)。TspAおよびTspBと名付けられたT細胞刺激タンパク質は、その後、膜画分で免疫することによって産生されたウサギ抗血清を用いて、ゲノム発現ライブラリーから同定された(Woodridge KGら、前記;Kizil GIら、1999 Infect.Immun 67:3533〜3541)。TspAおよびTspBはどちらもT細胞を刺激することが見出されたが、DNA配列に関しては無関係である。
【0005】
TspBは、Orf6と相同であり、Orf6は、疾患を引き起こさない共生単離物のゲノム配列を、疾患を引き起こす侵襲性単離物のゲノム配列と比較した場合、侵襲性髄膜炎菌と関連していることが見出された(Bille EJRら、2005 J.Exp.Med.201:1905〜1913)。Orf6を不活性化することによって、病原性の関連現象(例えば、ウサギ血清における増殖、T84ヒト細胞への接着、免疫不全マウスモデルにおける毒性)について一般的に用いられる実験室アッセイにおいて観察可能な効果は生じなかった(Bille EJRら、2005、前記)。
【発明の概要】
【0006】
N.メニンギティディスのT細胞刺激タンパク質B(TspB)エピトープを結合する抗体を誘発し、ナイセリアTspBがヒトIgに結合するのを阻害することができるポリペプチド、および使用方法。
【0007】
本開示は、TspBの変種ペプチド領域(VN)を含む単離されたポリペプチドを提供し、ポリペプチドは、TspBの完全長アミノ酸配列より短い連続したアミノ酸配列を含有する。
【図面の簡単な説明】
【0008】
【図1】示されているように、細胞が異なる条件下で培養され、かつ血清または精製IgG無しまたは有りでインキュベートされた場合、ナイセリア−メニンギティディスW135群A22株の表面に結合したヒトまたはマウスのIgGの存在を検出するように設計されたフローサイトメトリー実験の結果を示す図である。
【図2】2人の異なるドナー由来の血清の存在下で培養されたナイセリア−メニンギティディスW135群A22株(パネルA)、または単一のドナー由来の血清の存在下での遺伝子的に多様なナイセリア−メニンギティディスW135群、B群、C群の菌株(RGM)(パネルB)に結合したヒトIgGの存在を検出するように設計されたフローサイトメトリー実験の結果を示す図である。
【図3】示されているように、プロテインAビーズもしくはプロテインGビーズから溶出された、IgG結合活性を含有する、ヒト血清を追加されたCDM(CDM/HuS)中またはMueller−Hinton培地中で培養された場合のMenW135のA22株から精製されたタンパク質を検出するために染色されたSDS−PAGEゲルの画像の図である。
【図4】Mascotを用いるMALDI−TOF質量フィンガープリンティングによって同定されたタンパク質のアミノ酸配列を示す図である。一致したペプチドは下線が引かれている。
【図5】NMA0776のタンパク質配列を用いて検索されるNCBIで入手可能な、侵襲性ナイセリア−メニンギティディスA群(Z2491;NMA)、B群(MC58;NMB)、およびC群(FAM18;NMC)、ならびにナイセリア−ゴノレア(FA 1090;NGO)のゲノムを含む様々な菌株由来のTspBアミノ酸配列のアラインメントの図である。
【図6】変性条件下で精製された、pQE31からのTspB−IGB発現からの精製産物(レーンA)および周辺質から非変性条件下で精製された、pET22b(+)からのTspB−IGB発現からの精製産物(レーンB)を示す図である。
【図7】MC58株ゲノム配列由来の遺伝子NMB1548によってコードされる完全長TspBのアミノ酸配列を示す図である。
【図8】NMA0776も加えた、図5に示されたタンパク質配列のうちの4つのアラインメントの図である。IGBドメイン、変種ペプチド領域、およびプロリンリッチ領域は、タンパク質配列の範囲に沿って名称が表示されている。
【図9】各群内で高い配列同一性を共有する3つの群の変種ペプチド配列についてのアラインメントを示す図である。変種ペプチドは、NMA0776のアミノ酸配列も加えた、図5に示されたアミノ酸配列に由来する。
【図10】パネルAは、変種ペプチド領域のN末端側であるIGBドメインのセグメントのアラインメントの図である。パネルBは、変種ペプチド領域のC末端側であるIGBドメインのセグメントのアラインメントの図である。図10に示された全ての配列は、図5および図8において前に示された様々なTspB配列に由来する。
【図11】ELISAによる、TspB1548IGBかまたはTspB628IGBのいずれかを含有するウェルへのヒトIgGの結合を示す図である。
【図12】顕微鏡スライド上にスポットされ、一晩乾燥された、TspB1628IGB(パネルA)およびTspB1548IGB(パネルB)の顕微鏡像の図である。
【図13】ドナー1血清およびドナー2血清由来のヒトIgGへの様々なナイセリア細菌株の結合を示すフローサイトメトリー実験の図である。
【図14】IgG結合能力についてナイセリア細菌の様々な菌株の選択をモニターする、フローサイトメトリー実験の図である。
【図15】NmBのMC58株(パネルA)およびNmAのZ2491株(パネルB)への、部分的に変性したTspB1628IGBで免疫されたマウス由来の血清の結合を示す図である。
【図16】自然に折り畳まれたTspB1548IGB(nTspB1548IGB)、自然に折り畳まれたTspB1628IGB(nTspB1628IGB)、または部分的に変性したTspB1628IGB(rfTspB1628IGB)で免疫されたマウス由来の追加の血清に関して、図15と同様の結合実験を示す図である。
【発明を実施するための形態】
【0009】
本発明および本発明の実施形態の特定の例を記載する前に、当然ながら、そのようなものは変化し得るため、本発明は、記載された特定の実施形態に限定されないことは理解されるべきである。本明細書に用いられる専門用語は、特定の実施形態を記載することのみを目的とし、本発明の範囲は添付された特許請求の範囲によってのみ限定されるものであるから、限定的であることを意図するものではないこともまた理解されるべきである。
【0010】
値の範囲が提供される場合、文脈上明らかに他の指示がない限り、下限値の単位の10分の1までの、その範囲の上限値と下限値の間のそれぞれの介在する値、およびその述べられた範囲における任意の他の述べられた値または介在する値が本発明内に含まれることは理解されている。これらのより小さい範囲の上限値および下限値は、そのより小さい範囲に独立して含まれることができ、その述べられた範囲における任意の具体的に除外された限界に従って、同様に本発明内に含まれる。述べられた範囲がその限界の一方または両方を含む場合、それらの含まれる限界のいずれかまたは両方を除外する範囲もまた本発明に含まれる。
【0011】
他に規定がない限り、本明細書に用いられる全ての技術用語および科学用語は、この発明が属する技術分野の当業者によって一般的に理解されているのと同じ意味をもつ。本明細書に記載されたものと類似または等価の任意の方法および材料もまた、本発明の実施または試験に用いることができるが、好ましい方法および材料はここで記載されている。本明細書で言及された全ての刊行物は、その引用されている刊行物に関連した方法および/または材料を開示および記載するために参照により本明細書に組み入れられている。
【0012】
本明細書および添付された特許請求の範囲で用いられる場合、単数形「1つの(a)」、「1つの(an)」、および「その(the)」は、文脈上明らかに他に規定されていない限り、複数の指示対象を含むことは留意されなければならない。したがって、例えば、「1つの抗原(an antigen)」への言及は、複数のそのような抗原を含み、「そのタンパク質(the protein)」への言及は、1つまたは複数のタンパク質への言及を含むなどである。
【0013】
本明細書で論じられている刊行物は、ただ単に、本出願の出願日前のそれらの開示として提供されている。本発明が、先発明という理由でそのような刊行物に先行する資格がないことを認めるものとして解釈されるべきことは本明細書には存在しない。さらに、提供される刊行物の日付は、実際の刊行日とは異なる場合があり、その実際の刊行日を別途、確認する必要があり得る。
【0014】
概要
本開示のポリペプチドは、T細胞刺激タンパク質B(TspB)に由来する(例えば、TspBの連続したアミノ酸配列を含有する)。TspBは、様々なナイセリア株によって発現しており、またOrf6と相同であり、Orf6は、ヒト髄膜炎菌疾患の大部分を引き起こすことが知られた多くの侵襲性ナイセリア−メニンギティディス株に見出される。
【0015】
本開示において、ナイセリア細菌の細胞表面でのTspB/Orf6の発現は、ヒト血清を含有する培地中で培養された場合、増強されることが見出されている。本明細書に提示されたポリペプチドは、ヒトIgの抗原特異性に依存せず(例えば、Fc領域に結合することによって)、ヒトIgに結合することができることも見出されている。TspB/Orf6のヒトIgへの結合は、結果として、ヒト補体の活性化を生じるが、生産的な溶菌またはオプソニン化貪食作用をもたらさない。したがって、TspB/Orf6は、ヒト補体活性化を避け、それにより細菌排除を低下させる細菌の能力を促進し得る。
【0016】
本開示のポリペプチドをワクチンとして用いることは、抗体を誘発することができる。そのような抗体はまた、TspBのヒトIgへの結合を防ぎ得る。本明細書に提示されたワクチンによって誘発される抗体は、その後、ヒト血液においてN.メニンギティディスの生存にとって重要な機構の不活性化をもたらし得る。
【0017】
そのようなポリペプチドは、他のワクチン(例えば、r3CなどのH因子結合タンパク質含有ワクチン)と組み合わせて用いられ、宿主においてそのワクチンによって誘発される抗ナイセリア免疫応答の殺菌活性を増強することができる。
【0018】
本開示のポリペプチドはまた、他のタンパク質または生体分子とコンジュゲートする場合、担体タンパク質として働き得る。そのようなコンジュゲートは、例えば、タンパク質−多糖コンジュゲートワクチンに用いられ得る。
【0019】
本開示は、完全長TspBではないが、TspBのアミノ酸配列由来のポリペプチド、ならびにワクチンの調製および抗体(例えば、ヒトIgGのFc領域を結合するなどのTspBの機能を遮断する抗体)の誘発におけるそのようなポリペプチドの使用方法を提供する。そのような実施形態の例は下に記載されている。
【0020】
本ポリペプチドおよび/または完全長TspBを作製するための方法もまた本明細書に提供される。方法は、ヒト血清の1つまたは複数の成分を追加した既知組成培地においてポリペプチドを発現する宿主細胞を培養することを含む。方法はまた、微小胞、外膜小胞、または両方の組み合わせなどの本ポリペプチドおよび/または完全長TspBを有する小胞を作製するために用いることもできる。
【0021】
定義
NMA0776、NMA1797、およびOrf6などの遺伝子によってコードされるタンパク質と相同のタンパク質としても文献中で知られている、「T細胞刺激タンパク質B」(TspB)は、T細胞およびB細胞の刺激タンパク質である。Orf6は、N.メニンギティディスによって、特に若年成人において(Billeら、2008 PLoS One 3:e3885)、引き起こされる侵襲性疾患と関連づけられているプロファージDNAに見出される9個の遺伝子のうちの1個である(Bille Eら、2005 J.Exp.Med.201:1905〜1913)。明確にするために、本開示は、TspBまたはOrf6を交換可能に用い得る。TspB/Orf6の例のアミノ酸配列について図5および図7を参照されたい。
【0022】
本明細書で用いられる場合、「成熟TspB」は、リーダーペプチド領域を欠くTspBを指す。リーダーペプチドは、天然の未成熟TspBのN末端に存在する。
【0023】
TspBにおけるアミノ酸残基に関して、NMB1548によってコードされるB群MC58株の天然のTspB(NP_274555)が、残基番号付けを目的とした参照配列として本明細書で用いられる(例えば、図7参照)。図7に示されているように、このTspBアミノ酸配列がリーダーペプチド領域を含有することは留意されたい。TspBの長さは、1つの遺伝子と別の遺伝子とでは5個、19個、または最高44個までのアミノ酸残基だけ異なり得るため、TspBタンパク質におけるアミノ酸残基を指すために本明細書で用いられる番号付けシステムは、これらのタンパク質の実際のアミノ酸配列に基づいた番号付けとは異なる場合がある。したがって、例えば、図5におけるMC58(NP_274555)配列の位置216のメチオニン残基(M)への言及は、NMC0283(YP_974402)の位置211の残基を指す。さらに明確にするために、図5におけるアラインメントを参照されたい。
【0024】
用語「ポリペプチド」、「ペプチド」、および「タンパク質」は、本明細書で交換可能に用いられ、任意の長さのアミノ酸の重合体型を指し、それには、遺伝子コード化アミノ酸および非遺伝子コード化アミノ酸、化学的または生化学的に改変または誘導体化されたアミノ酸、ならびに改変ペプチドバックボーンを有するポリペプチドが挙げられる。その用語は、融合タンパク質を包含し、それには、異種性アミノ酸配列を有する融合タンパク質、N末端メチオニン残基を有するまたは有さない、異種性および相同性リーダー配列を有する融合体;免疫学的タグの付いたタンパク質などが挙げられるが、それらに限定されない。
【0025】
この本開示を通して、1文字表記または三文字表記によるアミノ酸が参照されることは理解されよう。読者の便宜のために、一文字および三文字アミノ酸表記を下記に提供する:
【0026】
【表A】

【0027】
用語「核酸分子」および「ポリヌクレオチド」は、交換可能に用いられ、デオキシリボヌクレオチドもしくはリボヌクレオチド、またはその類似体のいずれかの、任意の長さのヌクレオチドの重合体型を指す。ポリヌクレオチドの非限定的例には、線状および環状核酸、メッセンジャーRNA(mRNA)、cDNA、組換えポリヌクレオチド、ベクター、プローブ、ならびにプライマーが挙げられる。
【0028】
用語「異種性」は、例えば、天然で見出されない核酸またはタンパク質を提供するために、異なる源由来の構造によって定義される2つの成分を指す。例えば、「異種性」がポリペプチドとの関連で用いられる場合、ポリペプチドには、異なるポリペプチドに由来し得る、作動可能に連結したアミノ酸配列(例えば、組換えペプチドで構成される第1の成分、および天然のTspBポリペプチド由来の第2の成分)が挙げられる。同様に、キメラポリペプチドをコードするポリヌクレオチドとの関連における「異種性」には、異なる遺伝子に由来し得る、作動可能に連結した核酸配列(例えば、本明細書に開示された実施形態によるペプチドをコードする核酸由来の第1の成分、および担体ポリペプチドをコードする核酸由来の第2の成分)が挙げられる。本明細書に記載されているような融合ポリペプチドは、異なるポリペプチドに通常見出される、単一ポリペプチドにおけるエピトープの提示を提供する。他の例示的な「異種性」核酸には、(例えば、プロモーター、コード配列、または両方に対して異なる遺伝的起源であり得る関心対象の宿主細胞における発現を提供するために)、コード配列を含む核酸が、コード配列のものとは異なる遺伝的起源由来である制御エレメント(例えば、プロモーター)と作動可能に連結している、発現構築物が挙げられる。例えば、TspBポリペプチドまたはそのドメインをコードするポリヌクレオチドに作動可能に連結したT7プロモーターが異種性核酸であると言われる。組換え細胞との関連における「異種性」は、核酸が存在している宿主細胞と異なる遺伝的起源である核酸(またはポリペプチドなどの遺伝子産物)の存在を指し得る。例えば、1つの株のナイセリアアミノ酸配列または核酸配列は、別の株のナイセリア宿主に対して異種性である。
【0029】
用語「作動可能に連結した」は、所望の機能を提供するために分子間の機能的連結を指す。例えば、核酸との関連における「作動可能に連結した」とは、転写、翻訳などの所望の機能を提供するための核酸間の機能的連結を指し、例えば、(プロモーター、シグナル配列、または転写因子結合部位のアレイなどの)核酸発現調節配列と、第2のポリヌクレオチドとの間の機能的連結であって、発現調節配列が第2のポリヌクレオチドの転写および/または翻訳に影響する、機能的連結を指す。ポリペプチドとの関連における「作動可能に連結した」とは、ポリペプチドの記載された活性(例えば、エピトープを特異的に結合する抗体の産生を促進するためのそのエピトープの提示)を提供するための、(例えば、異なるドメインの)アミノ酸配列間の機能的連結を指す。
【0030】
ポリペプチドの構造との関連において本明細書で用いられる場合、「N末端」および「C末端」は、それぞれ、ポリペプチドの一番端のアミノ端およびカルボキシル端を指し、一方、「N末端側」および「C末端側」は、それぞれ、N末端およびC末端の方へのポリペプチドのアミノ酸配列における相対的位置を指し、それには、それぞれ、N末端およびC末端における残基を挙げることができる。「N末端側へすぐの」または「C末端側へすぐの」とは、第1のアミノ酸残基の第2のアミノ酸残基に対する位置を指し、第1アミノ酸残基と第2アミノ酸残基は、共有結合して連続したアミノ酸配列を提供している。
【0031】
アミノ酸配列またはポリヌクレオチド配列との関連における「由来の」(例えば、TspB「由来の」アミノ酸配列)とは、ポリペプチドまたは核酸が、参照ポリペプチドまたは核酸(例えば、天然のTspBまたはコード核酸)の配列に基づいている配列を有することを示すように意図され、タンパク質または核酸が作製される供給源または方法に関して限定的であることを意図するものではない。細菌株との関連における「由来の」とは、菌株が、親株の継代インビボもしくはインビトロ培養によって得られ、および/または親株の改変によって得られた組換え細胞であることを示すように意図される。したがって、例えば、「TspB由来ポリペプチド」は、天然のTspBポリペプチドのアミノ酸配列に基づいたアミノ酸配列を有するポリペプチドを記載するために用いられる。
【0032】
用語「防御免疫」とは、哺乳動物に投与されるワクチンまたは免疫スケジュールが、ナイセリア−メニンギティディスによって引き起こされる疾患の発生を防ぎ、遅らせ、もしくはその疾患の重症度を低下させ、またはその疾患の症状を減少させ、もしくは完全に除去する免疫応答を誘導することを意味する。防御免疫は、殺菌抗体の産生に付随して起こり得る。ナイセリア−メニンギティディスに対する殺菌抗体の産生が、ヒトにおけるワクチンの防御効果を予測するものとして当分野で受け入れられていることは留意されるべきである(Goldschneiderら、1969、J.Exp.Med.129:1307;Borrowら、2001 Infect Immun.69:1568)。
【0033】
句「ナイセリア−メニンギティディスによって引き起こされる疾患」は、ナイセリア−メニンギティディスによるヒトの感染において存在する任意の臨床症状または臨床症状の組み合わせを包含する。これらの症状には、ナイセリア−メニンギティディスの病原株による上気道(例えば、鼻咽頭および扁桃腺の粘膜)のコロニー形成、粘膜および粘膜下血管床への細菌の侵入、敗血症、敗血症性ショック、炎症、出血性皮膚病変、線維素溶解および血液凝固の活性化、腎不全、肺不全、および心不全などの臓器不全、副腎出血および筋肉梗塞、毛細管漏出、浮腫、末梢性肢虚血、呼吸促迫症候群、心膜炎、ならびに髄膜炎が挙げられるが、それらに限定されない。
【0034】
句「広域防御免疫」とは、ワクチンまたは免疫スケジュールが、ナイセリア−メニンギティディスの少なくとも1つより多い変種、亜変種、および/または菌株に対して(および少なくとも2つ、少なくとも3つ、少なくとも4つ、少なくとも5つの菌株に対して、少なくとも8つ、またはそれ以上の菌株に対してであり得る)「防御免疫」を誘発することを意味する。本開示は、具体的には、任意の莢膜群のメンバー(例えば、A、B、C、W135、X、Y、29E)によって引き起こされる疾患に対して防御を与えるワクチンまたはワクチン投与計画を企図し、包含し、ナイセリア−メニンギティディスの莢膜群Bの菌株によって引き起こされる疾患に対する防御は、この莢膜群に関する疾患を引き起こす菌株の疫学的蔓延および広く効果的なB群ワクチンの欠如によって関心をもたれている。例えば、単独での、または関心対象となるエピトープ(複数可)を提示する他の成分と組み合わせての本開示のポリペプチドは、多様な莢膜群にわたって交差反応する殺菌抗体応答を増強するために用いることができる。
【0035】
用語「宿主」または「対象」は、ヒトおよび非ヒト動物を指すために本明細書で交換可能に用いられ、非ヒト動物は、一般的に、抗ナイセリア抗体の産生との関連において指示され、ヒトは、ナイセリア感染による疾患のリスクを低下させるワクチン接種についての関心対象の宿主である。
【0036】
抗原(例えば、ポリペプチド抗原)との関連における句「抗体に特異的に結合する」または「に特異的免疫反応性である」とは、他の分子の異種性集団も含む可能性がある試料において抗原の存在に基づく、および/または抗原の存在の証拠となる結合反応を指す。したがって、指定された条件下で、特定化された1つまたは複数の抗体は、試料において特定の1つまたは複数の抗原に結合し、試料に存在する他の分子に有意な量では結合しない。抗原のエピトープ(例えば、ポリペプチドのエピトープ)との関連における「抗体に特異的に結合する」または「に特異的免疫反応性である」とは、他のエピトープの異種性集団も、加えて抗原の異種性集団も含む可能性がある抗原(例えば、ポリペプチド)におけるエピトープの存在に基づく、および/またはエピトープの存在の証拠となる結合反応を指す。したがって、指定された条件下で、特定化された1つまたは複数の抗体は、抗原の特定のエピトープに結合し、その抗原内および/または試料中に存在する他のエピトープに有意な量では結合しない。
【0037】
句「免疫応答を誘発するのに十分な量で」とは、特定の抗原調製物の投与前と後に測定される免疫応答指標間に検出可能な差があることを意味する。免疫応答指標には、酵素結合イムノアッセイ(ELISA)、殺菌性アッセイ、フローサイトメトリー、免疫沈降法、オークタロニー免疫拡散法;例えば、スポット、ウェスタンブロット、または抗原アレイの結合検出アッセイ;細胞毒性アッセイなどのアッセイによって検出されるような、抗体力価または特異性が挙げられるが、それらに限定されない。
【0038】
「表面抗原」は、細胞、特にナイセリア−メニンギティディスなどの細菌の細胞の表面構造に存在する抗原(例えば、外膜、莢膜、線毛など)である。
【0039】
「単離された」とは、その化合物が、天然に存在する場合には、天然で存在し得る環境とは異なる環境にある関心対象の化合物を指す。「単離された」とは、関心対象の化合物について実質的に濃縮され、および/または関心対象の化合物が部分的もしくは実質的に精製されている試料内にある化合物を含むことを意図される。化合物が天然に存在しない場合、「単離された」とは、化合物が、それが合成手段または組換え手段のいずれかによって作製された環境から分離されていることを示す。
【0040】
「濃縮された」とは、関心対象の化合物が生体試料(例えば、その化合物が自然発生している試料、またはそれが投与後に存在する試料)などの出発試料、または化合物が作製された(例えば、細菌性ポリペプチド、抗体、キメラポリペプチドなどにおいてのような)出発試料中のその化合物の濃度より高い濃度(例えば、少なくとも3倍高い、少なくとも4倍高い、少なくとも8倍高い、少なくとも64倍高い、またはそれ以上)で存在するように、試料が非自然的に(例えば、実験者または臨床医によって)操作されることを意味する。
【0041】
「実質的に純粋な」とは、実体(例えば、ポリペプチド)が、その組成の全内容物(例えば、組成の全タンパク質)の約50%より多く、典型的には、全タンパク質内容物の約60%より多くを構成することを示す。より典型的には、「実質的に純粋な」とは、全組成の少なくとも75%、少なくとも85%、少なくとも90%、またはそれ以上が関心対象の実体である、組成(例えば、全タンパク質についてを指す。好ましくは、そのタンパク質は、組成における全タンパク質の約90%より多く、より好ましくは約95%より多くを構成する。
【0042】
TspB由来ポリペプチド
本ポリペプチドは、抗体を誘発するのに用いられる。誘発された抗体がTspBを結合する場合、抗体は、TspBのヒトIgへの結合を阻害し得る。そのようなポリペプチドは、抗ナイセリア免疫応答を促進する抗TspB抗体を誘発する方法に用いることができる免疫原性組成物の作製に用いられる。
【0043】
本開示のポリペプチドは、(例えば、免疫原性組成物において提供することができる)抗原性断片としての機能を果たすのに十分な長さのTspB由来の連続したアミノ酸残基を含有する。そのようなポリペプチドは、少なくとも55アミノ酸残基長、少なくとも60〜100アミノ酸残基長、少なくとも60〜150アミノ酸残基長、少なくとも60〜200アミノ酸残基長、少なくとも60〜250アミノ酸残基長、少なくとも60〜300アミノ酸残基長、または少なくとも60〜400アミノ酸残基長であるTspBの連続したアミノ酸配列を有し得る。抗原性断片であることに加えて、本開示のポリペプチドはまた、ヒトIgの抗原特異性に依存しない(例えば、Fc領域への結合による)、ヒトIgへの結合活性を保持し得る。
【0044】
本開示のポリペプチドの1つの例は、図5、図7、および図8において区画を定められているような、NMB1548株由来の免疫グロブリン結合(IGB)ドメイン(例えば、配列番号47)を含有する。本開示のポリペプチドの別の例は、図8に示されているような、NMB1628などの別の株由来のIGBドメイン(例えば、配列番号48)を含有する。
【0045】
用語「IGBドメイン」はまた、TspBの「球状βシート」ドメインまたは「定常領域」(CR)とも本明細書で呼ばれる。完全長TspBアミノ酸配列を、図5で整列させており、そこでは、IGBドメインが区画を定められている。Nmb 1548 TspBに見出される特定のIGBドメインは図7において区画を定められている。TspBのIGBドメインおよび他のドメインもまた、図8でのTspBアミノ酸配列の例において区画を定められている。
【0046】
ナイセリアTspBのアミノ酸配列と実質的に類似しているアミノ酸配列を含むポリペプチドには、ナイセリアTspBの約55アミノ酸から約75アミノ酸まで、約75アミノ酸から約100アミノ酸まで、約100アミノ酸から約150アミノ酸まで、約150アミノ酸から約200アミノ酸まで、約200アミノ酸から約250アミノ酸まで、約250アミノ酸から約300アミノ酸まで、約300アミノ酸から約350アミノ酸まで、約350アミノ酸から約400アミノ酸まで、約400アミノ酸から約450アミノ酸まで、約450アミノ酸から約500アミノ酸まで、約500アミノ酸から約550アミノ酸まで、または約550アミノ酸から約580アミノ酸までの連続したひと続きと少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約98%、または少なくとも約99%のアミノ酸配列同一性を有するアミノ酸配列を含むポリペプチド(例えば、配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、または配列番号12に示されているようなTspB)が挙げられる。
【0047】
本ポリペプチドは、完全長成熟TspBを含有していなくてもよく、天然の完全長成熟TspBに対して少なくとも5アミノ酸、少なくとも10アミノ酸、少なくとも50アミノ酸、少なくとも100アミノ酸、少なくとも200アミノ酸以上までを欠いてもよい。例えば、本ポリペプチドは、リーダーペプチド配列および/またはN末端可変ドメインを欠く切断型TspBであってもよい。1つのそのようなポリペプチドは、それが天然の未成熟ポリペプチドの104個の最もN末端側のアミノ酸残基を欠くというように、切断されている遺伝子NMB1548によってコードされるTspBとして記載することができる。リーダーペプチド配列および/またはN末端可変ドメインは、図7および図8に示されているように、免疫グロブリン結合(IGB)ドメインよりN末端側の配列である。ポリペプチドはまた、プロリンリッチドメインを含むことも、排除することもできる。
【0048】
本開示のポリペプチドは、図5、図7、および図8において示されているように、IGBドメインを有するとして記載することができる。TspBのIGBドメインは、セリン105から始まり、プロリン358で始まるプロリンリッチドメインの前で終わる。IGBドメインの始まりおよびプロリンリッチドメインの始まりをそれぞれ、特徴づける各TspBにおけるセリンおよびプロリンは、図5および図8において太字で示されている。上記で述べたように、本明細書で参照される場合のアミノ酸残基番号付けシステムは、MC58株のNMB1548によってコードされているようなNP_274555に基づいている。上記で述べたように、用語「IGBドメイン」はまた、図7に示されているように球状βシートドメインまたは定常領域(CR)と同義である。
【0049】
TspBの各IGB領域内に、図5および図8に示された全てのTspB配列にわたって高いアミノ酸配列同一性を共有しないアミノ酸残基の連続したセグメントがある。図8において「変種群ペプチド」と名称を付けられたこのアミノ酸配列の連続したセグメントは、そのN末端およびC末端の両方において、図5および図8に示されたTspB配列にわたって高度に保存されているアミノ酸配列に隣接している。変種ペプチド領域のアミノ酸配列は、本明細書でTspB群と呼ばれた群に変種ペプチド領域を分類する根拠として用いることができる。変種ペプチド領域のアラインメントにより、各TspB群内の高度に保存された変種ペプチド配列が示されている。変種ペプチド領域のいくつかの例のそのようなアラインメントは、図9に示されている。
【0050】
「変種群ペプチド」または「VN」は、この領域におけるアミノ酸配列の類似性に基づいた「群」にナイセリア株を割り当てるために用いることができる、TspBの連続したアミノ酸配列を指す。図7、図8、および図9に示されているように、VNは、メチオニン214(M214)から始まり、リシン277(K277)で終わり、それらは、TspBのアミノ酸配列において太字および下線で示されている(図7)。各TspBについて変種群ペプチド領域を始めるメチオニンもまた、図8において太字で示されている。図9に示されているように、変種群ペプチドは、示された3つの群のそれぞれの中で高度に保存されている。
【0051】
本ポリペプチドは、変種群ペプチド領域の1つまたは多量体(例えば、少なくとも2つ、少なくとも3つ以上)を含有することができ、それぞれは、図9に示された群から非依存的に選択される。例えば、本ポリペプチドは、図9に示されているような配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、または配列番号22と少なくとも84%、少なくとも85%、少なくとも86%、少なくとも88%、少なくとも89%、少なくとも93%、少なくとも95%、少なくとも98%、100%までの同一性の連続したアミノ酸配列を含有することができる。
【0052】
本ポリペプチドが1つより多い変種群ペプチドを有する場合、変種群ペプチドは、リンカーによって分離されていてもよい。例えば、VNが3つの変種群ペプチド領域を含有する場合には、それはV1−L1−V2−L2−V3と表され得る。1つより多いリンカーが本ポリペプチドに用いられる場合、用いられる各リンカーは非依存的に選択され、本ポリペプチドにおける他のリンカーと異なってもよい。変種群ペプチドに加えて、本開示のポリペプチドはまた、図5および図8に示されたTspBアミノ酸配列において変種ペプチド領域に隣接するIGBドメイン内のアミノ酸配列などのTspBにおける他のアミノ酸配列(SN)を任意で有することができる。
【0053】
本ポリペプチドが変種ペプチド領域(複数可)に隣接するアミノ酸配列(SN)を含有する場合、隣接アミノ酸配列は、変種群ペプチド領域よりN末端側の(例えば、先行する)IGBドメインのセグメント(例えば、S1)、および/または変種群ペプチド領域よりC末端側の(例えば、後の)IGBドメインのセグメント(例えば、S2)であってもよい。TspBの他の区域由来の連続したアミノ酸セグメントもまた、本ポリペプチドへSN(例えば、IGBドメイン以外のアミノ酸配列)として組み入れることができる。
【0054】
変種ペプチド領域よりN末端側であるIGBドメインのアミノ酸配列の例(例えば、S1)は、図10のパネルAにおいて、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29、配列番号30、配列番号31、配列番号32、配列番号33、および配列番号34として示されている。
【0055】
変種ペプチド領域よりC末端側であるアミノ酸配列の例(例えば、S2)は、図10のパネルBにおいて、配列番号35、配列番号36、配列番号37、配列番号38、配列番号39、配列番号40、配列番号41、配列番号42、配列番号43、配列番号44、配列番号45、および配列番号46として示されている。
【0056】
したがって、本ポリペプチドの例は、以下の式、S1−L1−VN−L2−S2によって表すことができ、式中、LNは、本ポリペプチドにおいてアミノ酸配列を一緒に連結するために任意で存在してもよいし、存在しなくてもよい1つまたは複数のリンカーを指し、VNは、上記のように、変種群ペプチドアミノ酸配列の1つまたは複数を指し、S1およびS2は、また上記のように、隣接アミノ酸配列(例えば、IGBドメイン由来のアミノ酸配列など)を指す。本ポリペプチドのいくつかの例は、S1−V1−L1−V2−L2−V3−S2、S1−V1−S2−L1−S1−V2−S2、またはS1−L1−V1−L2−S2と表すことができる。他の組み合わせおよび順列もまた本明細書で企図される。
【0057】
変種群ペプチド領域の連続したアミノ酸配列を包含する場合もある、IGBドメイン由来の連続したアミノ酸配列を有することの他に、本ポリペプチドは、TspBの他のドメインを含有することができる。例えば、本ポリペプチドは、図7および図8において名称が付けられているように、プロリンリッチドメインおよび/または膜貫通アンカードメイン由来の連続したアミノ酸配列をさらに含有することができる。そのようなポリペプチドの例は、V1−S1−S2−S3によって表すことができ、式中、S1はIGBドメイン由来の隣接アミノ酸配列を表し、S2はプロリンリッチドメインを表し、S3は膜アンカードメインを表す。S1、S2、S3はまた、それぞれ、TspBまたは他の型のタンパク質の任意のセグメント由来の連続したアミノ酸配列に非依存的に置換することができる。例えば、ポリペプチドは、TspB以外のタンパク質由来の膜貫通ドメイン(「異種性」膜貫通ドメイン)を含んでもよい。膜貫通ドメインを含有する本ポリペプチドは、本ポリペプチドを小胞内に提供するのに用いることができる。
【0058】
本開示は、単離されたポリペプチド、TspBの抗原性断片、およびTspBの変種を提供する。本ポリペプチドは、天然源から単離されていてもよく、例えば、それの天然の環境以外の環境にある。本ポリペプチドはまた、例えば、遺伝子改変の宿主細胞(例えば、細菌、酵母、ピキア(Pichia)、昆虫細胞など)において、組換えで作製されてもよく、遺伝子改変の宿主細胞は、本ポリペプチドをコードするヌクレオチド配列を含む核酸で遺伝子改変されている。本ポリペプチドは合成ポリペプチドを含み、例えば、本合成ポリペプチドは、実験室で(例えば、無細胞化学合成により)化学合成される。
【0059】
本明細書で開示されたポリペプチドには、本明細書で提供された特定の連続したアミノ酸配列のポリペプチド、および1個、2個、3個、4個、5個、6個、7個、8個、9個、または10個、通常には10個以下、6個以下、または4個以下のアミノ酸置換を有するポリペプチドが挙げられ、その置換は、通常、保存的アミノ酸置換である。「保存的アミノ酸置換」とは、一般的に、以下のグループ内のアミノ酸残基の置換を指す:
1)L、I、M、V、F;
2)R、K;
3)F、Y、H、W、R;
4)G、A、T、S;
5)Q、N;および
6)D、E
【0060】
本明細書に開示されたペプチドまたはポリペプチドとの関連における保存的アミノ酸置換は、関心対象のエピトープの提示かまたはポリペプチドのFc結合活性のいずれかを保存するように選択される。そのような提示は、置き換えられることになっているアミノ酸の側鎖と類似した酸度、塩基度、電荷、極性、またはサイズの側鎖を有するアミノ酸で置換することによって保存することができる。そのような置換についてのガイダンスは、TspBのアミノ酸配列のアラインメントにおいて導き出され得る。例えば、図5に示されたアラインメントにより、完全に保存されている特定の残基位置(*)において、置換、欠失、または挿入を許すことはできないが、1個または複数の残基が保存されていない他の位置において、アミノ酸変化が許容され得る。半保存されている残基(.または:)は、電荷、極性、および/またはサイズを保存する変化を許容し得る。
【0061】
本開示のポリペプチドは、天然の折り畳まれた形、または少なくとも部分的に変性した形(例えば、部分的に変性した、または完全に変性した形)で提供することができる。
【0062】
一実施形態において、ポリペプチドは、少なくとも部分的に変性している。ポリペプチドが少なくとも部分的に変性した形をとる場合、ポリペプチドは成熟の完全長TspBまたはその断片であってもよい。部分的に変性したポリペプチドは、TspBに対する抗体を誘発する免疫原として用いることができる。TspBタンパク質またはその断片との関連における「少なくとも部分的に変性した」とは、タンパク質がTspBまたはその断片と重合体を形成する能力を減少させるように、タンパク質が、天然のTspBまたはその断片に対して三次構造において改変されていることを意味する。部分的変性は、例えば、変性剤(例えば、尿素、還元剤、高塩濃度(例えば、塩化リチウム、過塩素酸ナトリウム))、加熱、界面活性剤などの存在下での精製によって達成することができる。例えば、部分的に変性したポリペプチドは、変性条件下でポリペプチドを精製することによって得ることができる。
【0063】
少なくとも部分的に変性したTspBポリペプチドは、ポリペプチドが重合体を形成する能力を調べることによって同定することができる。例えば、顕微鏡による目に見える重合体の形成、またはTspBの水溶液中でのゲルの形成による。
【0064】
少なくとも部分的に変性したTspBポリペプチドは、免疫グロブリンの天然TspBへの結合を遮断する抗TspB抗体を誘発するそれらの能力によって同定することができる。フローサイトメトリーによる、生きているナイセリア細菌へのIgG結合を遮断する抗TspBの能力。
【0065】
本開示の少なくとも部分的に変性したTspBまたはその断片での免疫化は、ヒト免疫グロブリンの結合を遮断する抗体を誘発する。そのようなことは、ナイセリアの病原性にとって重要な機構を阻害することができる。部分的に変性したポリペプチドの例には、変性条件下で精製されるNmB 1628(rf TspB1628IGB)由来のTspBのIGBドメインを挙げることができる。
【0066】
タンパク質コンジュゲート
本開示のポリペプチドは、本明細書に記載されているような本ポリペプチドを含有する融合タンパク質として提供することができる。例えば、上記のようなポリペプチドは、別のタンパク質のN末端に融合することができる。
【0067】
本開示のポリペプチドは、(例えば、本ポリペプチドに対して異種性のアミノ酸配列を有する)タンパク質および/または担体分子などの、ポリペプチドのN末端および/またはC末端に1つまたは複数の追加のエレメントを含有していてもよい。本ポリペプチドに連結され得る例示的なエレメントには、脂肪酸部分(例えば、脂肪族カルボン酸)および/または担体分子(例えば、担体タンパク質(例えば、ウシ血清アルブミン(BSA))、オボアルブミン、キーホールリンペットヘマシアニン(KLH)、ウシチログロブリン、大豆トリプシンインヒビター、ツベルクリンの精製タンパク質誘導体(PPD)、サイトカイン、またはfHbp、NadA、GNA2132などの他のワクチン抗原などが挙げられる。そのような追加のエレメントは、リンカー、例えば、可動性リンカーを介してポリペプチドに連結されてもよい。例えば、ポリペプチドは、例えば、投与を促進するために、および/またはN.メニンギティディスに対してワクチン接種もしくは処置される対象において免疫原性を増加させるために、担体分子にコンジュゲートされてもよい。追加の部分はまた、免疫原性、もしくはワクチンにおいて別の成分と複合体を形成するのに役に立つことができ、および/または関心対象の細胞もしくは組織への送達を促進することができる。
【0068】
ポリペプチドはまた、分子模倣体、莢膜多糖、またはその誘導体などの抗原とコンジュゲートするように改変することができる。莢膜多糖は、髄膜炎菌群A、C、W135、Y、および/またはXに見出されるものであってもよい。そのようなものの例は、米国特許第4,727,136号および第6,030,619号に記載されており、その特許の開示は参照により本明細書に組み入れられている。
【0069】
本ポリペプチドが多糖誘導体にコンジュゲートしている場合、多糖誘導体は、長鎖炭化水素を含有するものなどのN−アセチルまたはデ−N−アセチルポリシアル酸誘導体の混合物、およびその凝集体であってもよい。多糖は、本ポリペプチドに、N末端/C末端の一方および/もしくは両方で、または内部のアミノ酸残基へ付着していてもよい。多糖は、アミノ酸残基に、リンカーを介して、または直接的にコンジュゲートしてもよい。本明細書で企図されるTspBコンジュゲートに用いるのに適した多糖誘導体、およびそのような多糖誘導体を作製する方法は、当技術分野において知られている。
【0070】
融合タンパク質として提供される場合、担体分子は、TspBの球状ドメインの免疫系への提示を促進し、それにしたがって、ヒトIgに結合する性質を有する抗N.メニンギティディス抗体の産生を促進し得る。ポリペプチドは、N末端に融合することができ、C末端に融合することができ、またはTspBの球状ドメインのアミノ酸配列が担体タンパク質配列に隣接しているようにスキャフォールド内に位置することができる。スキャフォールドはまた、膜表面上でのポリペプチドのディスプレイを促進し得る(例えば、小胞ワクチン)。ポリペプチドは担体タンパク質に対して異種性であり、したがって、天然では見出されない融合ポリペプチドを提供する。
【0071】
リンカー
上記で述べたように、リンカーは、任意で、本ポリペプチドのコンジュゲート内に存在してもよい。上記で例示された追加のエレメントを含むようにポリペプチドを改変するために用いるのに適したリンカーには「可動性リンカー」が挙げられる。適切なリンカーは、容易に選択することができ、4アミノ酸から10アミノ酸まで、5アミノ酸から9アミノ酸まで、6アミノ酸から8アミノ酸まで、または7アミノ酸から8アミノ酸までを含む、1アミノ酸(例えば、Gly)から20アミノ酸まで、2アミノ酸から15アミノ酸まで、3アミノ酸から12アミノ酸までなどの適切な様々な長さのいずれかであり得、1アミノ酸、2アミノ酸、3アミノ酸、4アミノ酸、5アミノ酸、6アミノ酸、または7アミノ酸であってもよい。
【0072】
可動性リンカーの例として、グリシンポリマー(G)n、グリシン−セリンポリマー(例えば、(GS)n、GSGGSn(配列番号50)およびGGGSn(配列番号60)、式中、nは少なくとも1の整数である)が挙げられる)、グリシン−アラニンポリマー、アラニン−セリンポリマー、および当技術分野において知られた他の可動性リンカーが挙げられる。グリシンおよびグリシン−セリンポリマーは、これらのアミノ酸のどちらも比較的、構造化されておらず、それゆえに、成分間の中立のつなぎ鎖としての役割を果たし得るため、関心対象となる。グリシンポリマーは、グリシンが、アラニンよりもさえ、有意に大きいφ−ψ空間に到達し、かつより長い側鎖を有する残基よりはるかに制限が少ないため、特に関心対象となる(Scheraga、Rev.Computational Chem.11173〜142(1992)参照)。例示的な可動性リンカーには、GGSG(配列番号51)、GGSGG(配列番号52)、GSGSG(配列番号53)、GSGGG(配列番号54)、GGGSG(配列番号55)、GSSSG(配列番号56)などが挙げられるが、それらに限定されない。上記の任意のエレメントにコンジュゲートしたポリペプチドの設計は全面的に、または部分的に可動性であるリンカーを含むことができ、それゆえに、リンカーが、可動性リンカーだけでなく、可動性に劣る構造を与える1つまたは複数の部分を含み得ることを、当業者は認識しているであろう。
【0073】
作製方法
本開示のポリペプチドは、組換え方法および非組換え方法(例えば、化学合成)を含めた任意の適切な方法によって作製することができる。ポリペプチドが化学合成される場合、合成は、液相または固相を介して進行し得る。固相合成(SPPS)は、非天然アミノ酸の取り込み、ポリペプチド/タンパク質バックボーンの改変を可能にする。FmocおよびBocなどの様々な型のSPPSが本発明のポリペプチドを合成するのに利用可能である。化学合成の詳細は当技術分野において知られている(例えば、Ganesan A.2006 Mini Rev.Med Chem.6:3〜10、およびCamarero JAら、2005 Protein Pept Lett.12:723〜8)。
【0074】
簡単に述べれば、小さい不溶性多孔性ビーズを、ポリペプチド鎖が構築される機能単位で処理する。結合/脱保護のサイクリングを繰り返した後、付着した固相の遊離N末端アミンを、単一のN−保護化アミノ酸単位に結合させる。その後、この単位は脱保護され、さらなるアミノ酸が付着し得る新しいN末端アミンを顕わにする。ポリペプチドは固相に固定化されたままであり、切断される前に濾過工程を受ける。
【0075】
ポリペプチドが組換え技術を用いて作製される場合、方法は任意の適切な構築物および任意の適切な宿主細胞を含み得、その宿主細胞は、原核細胞または真核細胞、通常には細菌細胞(例えば、大腸菌(E.coli)BL21(DE3)または大腸菌TOP10F’)または酵母宿主細胞であり得る。
【0076】
本ポリペプチドを作製するために、例えば、ポリペプチドが小胞に基づいたワクチンにおいて提供されることになっている場合、ナイセリア細菌などの細菌細胞を用いてもよい。様々なナイセリア株のいずれも、本開示のポリペプチドを作製する方法に用いることができる。病原性ナイセリア種または病原性ナイセリア種由来の株、特にヒトにとって病原性の株またはヒトにとって病原性もしくは共生の株由来の株が、特に関心対象となる。例示的なナイセリア種として、N.メニンギティディス(N.meningitidis)、N.フラベセンス(N.flavescens)、N.ゴノレア(N.gonorrhoeae)、N.ラクタミカ(N.lactamica)、N.ポリサッカレア(N.polysaccharea)、N.シネレア(N.cinerea)、N.ムコーサ(N.mucosa)、N.スブフラバ(N.subflava)、N.シッカ(N.sicca)、N.エロンガータ(N.elongata)などが挙げられる。細菌株との関連における「由来の」とは、菌株が、親株のインビボでの継代を通して、もしくはインビトロ培養において得られ、および/または親株の改変によって得られた組換え細胞であることを示すように意図される。
【0077】
宿主細胞として用いられ得るN.メニンギティディス株の例は、任意の血清学的群、血清型または亜型、例えば、血清群A、B、C、X、Y、Z、29−E、およびW−135であり得る。血清群A、B、C、X、Y、およびW−135の株が特に関心対象となる。
【0078】
本開示のTspB由来ポリペプチドに加えて、本ポリペプチドの発現に用いられるナイセリア宿主細胞は、H因子結合タンパク質(fHbp)、PorA、GNA2132などの関心対象となる他の抗原を自然に発現することができ、またはそれらを発現するように遺伝子改変することができる。宿主細胞へ導入された核酸から発現するポリペプチドは、本明細書で「外因性」であると呼ばれる。宿主細胞が内因性TspBを産生する場合、外因性の本ポリペプチドは、内因性TspBの連続したアミノ酸配列と同じ、または異なるアミノ酸配列を有し得る。宿主細胞の天然TspBをコードする遺伝子は、任意で、例えば、TspBノックアウト株などの、機能的内因性TspBを発現しない宿主細胞を提供するために、改変されてもよい。
【0079】
ナイセリア細菌はまた、下記のように、LPS生合成に欠陥を有するように遺伝子改変されてもよい。例えば、宿主細胞は、lpxL1遺伝子の産物の活性の減少または欠損を提供するように遺伝子改変されてもよく、かつそれは、対象に投与された場合、血清抗TspB抗体を誘起する小胞を提供するのに十分な、本開示のポリペプチドのレベルを産生する。膜小胞調製およびlpxL1遺伝子の発現を減少させることに関する詳細は、後で下文に記載されており、米国特許出願公開第20090035328およびPCT公開WO2006/081259にも見出すことができ、それらの特許出願の開示は参照により本明細書に組み入れられている。
【0080】
本開示はまた、ナイセリア宿主細胞がヒト血清の存在下で培養される、本ポリペプチドおよび/または完全長成熟TspBを産生する方法を提供する。本方法を、(例えば、小胞ワクチン用として)小胞内に本ポリペプチドおよび/または完全長成熟TspBを提供するために用いてもよい。方法が小胞内にポリペプチドを提供するために用いられる場合、産生される小胞は、上記のポリペプチドの1つ、2つ、3つ、またはそれ以上の異なる型を含有することができる。小胞はまた、完全長成熟TspBを単独で、または上記のポリペプチドのいずれかに加えて含んでもよい。用いられる宿主細胞は、任意で、上記のように、内因性TspB産生が破壊されていてもよい。産生方法は、外膜小胞(OMV)および/または微小胞(MV)を産生するために用いることができ、それらは、小胞に基づいたワクチンにおいて単独かまたは組み合わせてかのいずれかで、免疫原性組成物に用いることができる。小胞ワクチンは、米国特許出願公開第20080248065号に見出すことができ、その特許出願の開示は、参照により本明細書に組み入れられている。例示的な宿主細胞の培養条件は下記で論じられている。
【0081】
菌血症がヒト血流に現れる条件をシミュレートすることにより、本タンパク質および完全長成熟TspBの産生が向上する。したがって、宿主細胞において本ポリペプチドおよび/または完全長成熟TspBを産生する場合、宿主細胞は、ヒト血液の1つまたは複数の成分を追加した既知組成培地で培養される。「既知組成培地」とは、培地に用いられるたいていの成分が知られており、したがって、未確認の動物血清または未確認の複合天然源に関係している成分を有意な量または検出可能な量を含有しない培地を意味する。本ポリペプチドを産生するために用いられる既知組成培地(または「CDM」)は、非ヒト動物の副産物を欠き、血漿、血清、凝固因子、ヒト補体などのヒト血液の1つまたは複数の成分を追加されている。ヒト血液の成分には、コーン分画IV(Cohn Fraction IV)血清に見出されるもの(例えば、α−グロブリンおよび/またはβ−グロブリン)が挙げられる。ヒトコーン分画IVは、ヒト血漿の分画であり、SIGMA−ALDRICH(登録商標)(カタログ番号G3637)などの商業的供給源から得ることができる。宿主細胞として用いられるナイセリア細菌を培養するための既知組成培地は、所望の抗原決定基の発現に適した必要な成分を全て含有し、非ヒト動物の副産物を欠き、ヒト血液の1つまたは複数の成分を含有する。
【0082】
いくつかの既知組成の合成培地が本開示のポリペプチドを産生するために(例えば、組換えタンパク質の産生および単離、または組換えタンパク質を有する小胞の産生を目的として)、およびTspBに対する抗体をスクリーニングするために利用することができる。本方法に用いられ得る培地には、NMFM、Watson−Scherp、Frantz、改変Frantz、NMFM、CatlinおよびCatlin 6培地(Frantz、I.D.Jr.、J.Bact.(1942)43:757〜761;Catlin、B.W.、J.Inf.Dis.(1973)128(2):178〜194;Watsonら、Chemical Nature.J Immunol.(1958)81:337〜44;Marcelo Fossa da Pazら、Braz.J.Microbiol.34(1)Sao Paulo January/April 2003)が挙げられる。菌血症用薬剤において莢膜多糖産生を調節するために様々な組成改変がある他の合成培地はよく知られており、それらには、以下が挙げられるが、それらに限定されない:窒素源として大豆ペプトンを含有する動物成分不含の髄膜炎菌多糖発酵培地(U.S.6,933,137)、およびラージスケールの血清群特異的髄膜炎菌培地調合物(U.S.7,491,517)。同様に、他の細菌についての既知組成培地がよく知られており、本方法に用いることができる(例えば、「Handbook of media for clinical microbiology」、Ronald M.AtlasおよびJames W.Snyder、第2版、CRC Press、2006参照)。同じものが哺乳類細胞に当てはまる(例えば、「Towards chemically−defined,serum−free media for mammalian cell culture」、HR Maurer、Animal Cell Culture:A Practical Approach、Oxford University Press、USA、1986;Hesseら、(2000)Trends in Biotechnology 18(4):173〜180;およびZhangら、(2005)J Cytotechnology 48(1−3):59〜74参照)。
【0083】
上記で述べたように、宿主細胞が培養される培地は、ヒト血液のコーン分画IV血清および/または他の成分などの補充物を含む。ヒト血液の成分には、血漿、白血球(バフィーコート)を伴った血漿、血清などが挙げられるが、それらに限定されない。追加成分は、スクリーニング条件および/または評価条件の1つまたは複数のパラメータを改変するために培地へ単独で、または様々な組み合わせで加えることができる。
【0084】
上記で述べたように、宿主細胞は、本開示のポリペプチドを発現する(例えば、過剰発現する)ように遺伝子改変されてもよい。遺伝物質の宿主細胞への導入の方法には、例えば、形質転換、エレクトロポレーション、コンジュゲーション、リン酸カルシウム方法などが挙げられる。移入のための方法は、本開示のポリペプチドをコードする、導入される核酸の安定な発現を提供するように選択することができる。ポリペプチドコード化核酸は、遺伝性エピソームエレメント(例えば、プラスミド)として提供することができ、またはゲノム的に組み込むことができる。遺伝子形質転換はまた、Amburら、2007(J.Bacteriology 189:2077〜2085)およびBakkali Mら、2007(PLoS ONE 2:e741)に記載されているように、DNA取り込み配列(DUS)でタグ付けされたポリペプチドコード化核酸を用いて実行することができる。相同組換えもまた、構築物全体を宿主細胞(例えば、ナイセリア株)へ移入させるために用いてもよい。
【0085】
ベクターは、宿主細胞における染色体外維持を提供することができ、または宿主細胞ゲノムへの組込みを提供することができる。関心対象となるポリペプチドの産生に用いる様々な適切なベクターは市販されている(例えば、実施例セクションで用いられているようなpET)。発現ベクターは、転写制御配列および翻訳制御配列を提供し、誘導性発現または構成的発現を提供することができ、コード領域は、転写開始領域ならびに転写および翻訳終結領域の転写調節下で作動可能に連結されている。一般的に、転写制御配列および翻訳制御配列には、リーダーペプチド配列(例えば、pe1B)、プロモーター配列、リボソーム結合部位、転写開始配列および転写終止配列、翻訳開始配列および翻訳終止配列、ならびにエンハンサー配列またはアクチベーター配列が挙げられるが、それらに限定されない。本ポリペプチドは、TspBをコードする核酸に対して異種性であり得るプロモーターの調節下で遺伝子によって発現することができる。プロモーターは、構成的発現(例えば、RmpM(還元修飾可能タンパク質(reduction modifiable protein))のプロモーター、PorAプロモーターなど)、一過性発現、および/またはヒト血清の存在下での発現を提供することができる。例えば、プロモーターは、構成的かまたは誘導性かのいずれかであり得、強力な構成的プロモーター(例えば、T7、PorA、RmpMなど)であり得る。
【0086】
本ポリペプチドを産生するために用いることができるベクターの例は、実施例に記載され、かつ当技術分野においても知られたpETプラスミドである。そのプラスミドは、pe1Bリーダーペプチド、続いて、本ポリペプチドをコードする核酸を有することができる。ポリペプチドコード化核酸は、上記の本ポリペプチド(例えば、IGB、続いてプロリンリッチドメイン、その後に、膜アンカードメインが続く)のいずれかをコードし得る。ポリペプチドコード化核酸はまた、後にタンパク質検出および/または精製を促進する任意のタグ(例えば、hisタグ)が続くこともできる。
【0087】
発現構築物は、一般的に、関心対象となるタンパク質をコードする核酸配列の挿入を与えるためにプロモーター配列の近くに位置する好都合な制限部位を有する。発現宿主において作動する選択マーカーが、ベクターを含有する細胞の選択を容易にするために存在してもよい(例えば、エリスロマイシン選択マーカー)。選択マーカーは、プロモーター(例えば、PorAプロモーター)の前に置かれてもよい。加えて、発現構築物は、追加のエレメントを含んでもよい。例えば、発現ベクターは、1つまたは2つの複製系を有してもよく、それにしたがって、発現ベクターが、生物体において、例えば、発現のための哺乳類細胞または昆虫細胞において、およびクローニングおよび増幅のための原核生物宿主において、維持されることを可能にする。加えて、発現構築物は、形質転換された宿主細胞の選択を可能にするために選択マーカー遺伝子を含有していてもよい。選択遺伝子は当技術分野においてよく知られており、用いられる宿主細胞によって異なる。
【0088】
ポリペプチドの単離および精製は、当技術分野において知られた方法により達成することができる。例えば、ポリペプチドは、ポリペプチドを発現するように遺伝子改変された細胞の可溶化液から、または合成反応混合物から、免疫親和性精製によって単離することができ、その免疫親和性精製は、一般的には、試料を抗ポリペプチド抗体と接触させること、非特異的に結合した材料を除去するために洗浄すること、および特異的に結合したポリペプチドを溶出することを含む。単離されたポリペプチドは、透析、およびタンパク質精製方法に通常用いられる他の方法によってさらに精製することができる。一実施形態において、ポリペプチドは、金属キレートクロマトグラフィー方法を用いて単離することができる。
【0089】
本ポリペプチドは、実質的に純粋な、または単離された形(例えば、他のポリペプチドを含まない)で調製することができる。特定の実施形態において、ポリペプチドは、存在する可能性がある他の成分(例えば、他のポリペプチドまたは他の宿主細胞成分)に対してそのポリペプチドについて濃縮されている組成物中に存在する。精製されたポリペプチドは、他の発現したポリペプチドを実質的に含まない、例えば、組成物の90%未満、通常には60%未満、より通常には50%未満が他の発現したポリペプチドで構成される組成物中に、そのポリペプチドが存在するように提供することができる。
【0090】
コンジュゲートに関する本ポリペプチドの調製について、マレイミドベンゾイルスルホスクシンイミドエステル(システイン残基を通してのコンジュゲーション)、N−ヒドロキシスクシンイミド(リシン残基を通して)、カルボジイミド、グルタルアルデヒド、無水コハク酸などの二官能価結合剤を用いて、結合を達成することができる。代替として、または加えて、抗原および担体タンパク質を、上記の融合タンパク質として作製してもよい。
【0091】
核酸
上記で論じたように、本ポリペプチドは、関心対象となるポリペプチドをコードする構築物を提供するように当技術分野において知られた異なるTspBの核酸を操作する組換え技術を用いて産生することができる。アミノ酸配列が提供されたならば、当業者はすぐに、遺伝暗号の知識に照らしてそのようなアミノ酸配列をコードする様々な異なる核酸を認識するであろうことは理解されよう。
【0092】
天然ポリペプチド由来の本ポリペプチドの産生について、ナイセリア細菌の様々な異なるTspBをコードする核酸が当技術分野において知られており利用可能であることは留意されたい。Tspポリペプチドおよびそれらの核酸の例は、例えば、US6,861,507;Robinson Kら、2005 Infect.and Immun.73:4684〜4692;Bille Eら、2005 J.Exp.Med.201:1905〜1913;およびBille Eら、2008 PLoS One 3:e3885に記載されており、それらの開示は参照により本明細書に組み入れられている。
【0093】
様々なTspBについての核酸(およびアミノ酸配列)はまた、遺伝子ID:NMA0776、タンパク質アクセッション番号A1IQJ2(N.メニンギティディス血清群A由来);遺伝子ID:NMA1173、タンパク質アクセッション番号A1IRJ0(N.メニンギティディス血清群A由来);遺伝子ID:NMA1797、タンパク質アクセッション番号A1IT08(N.メニンギティディス血清群A由来);遺伝子ID:NMA2005、タンパク質アクセッション番号A1ITJ3(N.メニンギティディス血清群A由来);遺伝子ID:NMC0025、タンパク質アクセッション番号A1KR75(N.メニンギティディス血清群C、血清型2a由来);遺伝子ID:NMC0283、タンパク質アクセッション番号A1KRW7(N.メニンギティディス血清群C、血清型2a由来);遺伝子ID:NMC0956、タンパク質アクセッション番号A1KTP2(N.メニンギティディス血清群C、血清型2a由来);遺伝子ID:NMC1668、タンパク質アクセッション番号A1KVE8(N.メニンギティディス血清群C、血清型2a);遺伝子ID:NMC1715、タンパク質アクセッション番号A1KVI9(N.メニンギティディス血清群C、血清型2a);遺伝子ID:NMC1866、タンパク質アクセッション番号A1KVX5(N.メニンギティディス血清群C、血清型2a由来);遺伝子ID:NMCC_0151、タンパク質アクセッション番号A9M0A8(N.メニンギティディス血清群C由来);遺伝子ID:NMCC_0919、タンパク質アクセッション番号A9M243(N.メニンギティディス血清群C由来);遺伝子ID:NGK_1481、タンパク質アクセッション番号B4RJA5(N.ゴノレア由来);遺伝子ID:NGK_2027、タンパク質アクセッション番号B4RNK3(N.ゴノレア由来);遺伝子ID:NGO1140、タンパク質アクセッション番号Q5F7B3(N.ゴノレア由来);遺伝子ID:NGO1167、タンパク質アクセッション番号Q5F7K4(N.ゴノレア由来);遺伝子ID:NMB0480、タンパク質アクセッション番号Q7DDP6(N.メニンギティディス血清群B由来);遺伝子ID:NMB1747、タンパク質アクセッション番号Q9JY49(N.メニンギティディス血清群B由来);遺伝子ID:NMB1628、タンパク質アクセッション番号Q9JYD9(N.メニンギティディス血清群B由来);および遺伝子ID:NMB1548、タンパク質アクセッション番号Q9JYK0(N.メニンギティディス血清群B由来)などのアクセッション番号としてGenBankに提供されている。他のものと共に、上記の配列の一部はまた、図5、図7、および図8において対応する遺伝子名で提供されている。
【0094】
本ポリペプチドをコードするヌクレオチド配列が、関心対象となる宿主細胞(例えば、大腸菌、N.メニンギティディス、(DNAに基づいたワクチンの場合のように)ヒトなど)における発現を促進するためにコドン使用頻度を最適化するように改変されてもよいことは理解されよう。コドン最適化配列の作成方法は、当技術分野において知られている。核酸配列はまた、上記の関心対象となるポリペプチドのいずれをも発現するように改変されてもよい。例として、リーダーペプチド配列およびN末端可変ドメインの両方が切断されているTspB、またはIGBドメインを含有するTspBのセグメントが挙げられる。核酸が、小胞内にポリペプチドを提供するように宿主細胞において用いられる場合(例えば、小胞に基づいたワクチン)、核酸はまた、完全長成熟TspB、上記の任意の本ポリペプチド、または両方の組み合わせをコードしてもよい。
【0095】
製剤
本明細書では、「抗原組成物」、「抗原性組成物」、または「免疫原性組成物」は、便宜上、本明細書に開示されているような、ヒトIgのFc領域に結合するポリペプチドを含む組成物を総称的に指すために用いられ、本ポリペプチドは任意で、免疫原性を増強するためにコンジュゲートされてもよく、および/または併用して提供されてもよい。抗N.メニンギティディス抗体をヒトにおいて誘発するのに有用な組成物が、本開示によって具体的に企図される。
【0096】
抗原性組成物は、本明細書に記載されているような、2個、3個、4個、5個、6個、またはそれ以上の異なるポリペプチドを含有することができ、それぞれの本ポリペプチドは、アミノ酸配列が異なってもよい。
【0097】
追加の抗原、例えば、TspBに加えての、またはそれ以外の、抗ナイセリア抗体を誘発することができるポリペプチド抗原が、任意で、本組成物に含まれてもよい。例えば、そのポリペプチドは、例えば、ナイセリア疾患に関連した他のタンパク質を結合する抗体の産生を提供するためなど、v.1、v.2、および/またはv.3 H因子結合タンパク質(fHbp)のアミノ酸配列を含むポリペプチドと組み合わせて提供することができる。
【0098】
一実施形態において、本ポリペプチドは、ナイセリア抗原fHbp、GNA2132、NadA、GNA2091、およびGNA1030、またはそれらの抗原性断片もしくは融合タンパク質の1つまたは複数を含む組成物と組み合わせて(すなわち、同じまたは異なる製剤中で)投与される。例示的な組み合わせには、fHbpとGNA2132とNadA;およびfHbpとGNA2132とNadAとGNA2091とGNA1030が挙げられる。一実施形態において、本開示のポリペプチドは、Giulianiら、2006 Proc Natl Acad Sci USA 103:10834〜9に記載されているように、5成分の組換えタンパク質ワクチンと組み合わせて提供される。
【0099】
本ポリペプチドは、N.メニンギティディス小胞(例えば、微小胞および/または外膜小胞)を含有する様々な組成物のいずれかと組み合わせて提供することができ、その小胞は、fHbp、特にv.1 fHbpおよび/またはv.2 fHbpおよび/またはv.3 fHbpを発現するN.メニンギティディス株から産生される。様々なそのような小胞組成物は当技術分野において知られており、様々な異なる株からのそれらの調製方法はよく知られている。
【0100】
抗原性組成物は、一般的に、免疫学的有効量の本ポリペプチドを含み、必要に応じて他の適合性の成分をさらに含んでもよい。「免疫学的有効量」とは、単一用量か、または一連の同じもしくは異なる抗原性組成物の一部としてかのいずれかでのその量の個体への投与が、例えば、ナイセリア、具体的にはN.メニンギティディスによる感染の症状、または感染によって引き起こされる疾患の処置または予防に有効な抗体応答を誘発および/または増強するのに有効であることを意味する。この量は、処置されるべき個体の健康状態および身体的状態、年齢、抗体を産生する個体の免疫系の能力、望まれる防御の程度、ワクチンの剤形、処置を行う医師による医学的状況の評価、および他の関連因子に依存して変化する。量は、日常的試行によって決定することができる比較的広い範囲に収まるだろうことが予想される。
【0101】
製剤中の本ポリペプチドの濃度は、大きく異なり得(例えば、約0.1重量%未満から、通常、約2重量%または少なくとも約2重量%から、20重量%〜50重量%くらいまたはそれ以上まで)、通常には、主に、液体容量、粘度、および選択された特定の投与様式および患者の要求に応じた患者に基づく因子に基づいて、選択される。
【0102】
ポリペプチド組成物は、薬学的に許容される賦形剤中に提供することができ、その賦形剤は、滅菌水溶液などの溶液、多くの場合、食塩水であり得、または粉末の形で提供することができる。そのような賦形剤は、必要に応じて、実質的に不活性であり得る。
【0103】
ポリペプチド組成物は、アジュバントを含み得る。ヒトに用いることができる公知の適切なアジュバントの例には、ミョウバン、リン酸アルミニウム、水酸化アルミニウム、MF59(4.3%重量/体積のスクワレン、0.5%重量/体積のTween 80(商標)、0.5%重量/体積のSpan 85)、CpG含有核酸(シトシンが非メチル化されている)、QS21、MPL、3DMPL、Aquillaからの抽出物、ISCOMS、LT/CT突然変異体、ポリ(D,L−ラクチド−コ−グリコリド)(PLG)微粒子、Quil A、インターロイキンなどが挙げられるが、必ずしもそれらに限定されない。実験動物については、フロイント、N−アセチル−ムラミル−L−スレオニル−D−イソグルタミン(thr−MDP)、N−アセチル−ノル−ムラミル−L−アラニル−D−イソグルタミン(ノル−MDPと呼ばれるCGP 11637)、N−アセチルムラミル−L−アラニル−D−イソグルタミニル−L−アラニン−2−(1’−2’−ジパルミトイル−sn−グリセロ−3−ヒドロキシホスホリルオキシ)−エチルアミン(MTP−PEと呼ばれるCGP 19835A)、およびRIBI(細菌から抽出された3つの成分である、モノホスホリルリピドA、トレハロースジミコレート、および細胞壁骨格(MPL+TDM+CWS)を2%スクワレン/Tween 80乳濁液中に含有する)を用いることができる。アジュバントの効果は、免疫原性抗原またはその抗原性エピトープに対して産生される抗体の量を測定することによって決定することができる。
【0104】
組成物の効果を増強するためのさらなる例示的なアジュバントとして、(1)水中油形乳剤(ムラミルペプチド(下記参照)または細菌細胞壁成分などの他の特定の免疫刺激剤と共にまたはなしで)、例えば、(a)マイクロ流動化装置を用いてサブミクロン粒子へ製剤化された、5%のスクワレン、0.5%のTween 80、および0.5%のSpan 85を含有する(任意でMTP−PEを含有する)MF59(商標)(WO90/14837;Vaccine design:the subunit and adjuvant approach、Powell & Newman編、Plenum Press 1995の10章)、(b)サブミクロン乳剤へマイクロ流動化されたかまたはより大きい粒子サイズの乳剤を生じるようにボルテックスされたかのいずれかの、10%のスクワレン、0.4%のTween 80、5%のプルロニックブロック化ポリマーL121、およびthr−MDPを含有するSAF、ならびに(c)2%のスクワレン、0.2%のTween 80、およびモノホスホリルリピドA(MPL)、トレハロースジミコレート(TDM)、および細胞壁骨格(CWS)、好ましくはMPL+CWS(Detox(商標))などの1つまたは複数の細菌細胞壁成分を含有するRIBI(商標)アジュバント系(RAS)(Ribi Immunochem、Hamilton、Mont.);(2)QS21もしくはStimulon(商標)(Cambridge Bioscience、Worcester、Mass.)などのサポニンアジュバント、またはISCOM(免疫賦活性複合体)などのそれらから作製された粒子を用いてもよい(ISCOMSは追加の界面活性剤を欠いていてもよい、例えば、WO00/07621);(3)完全フロイントのアジュバント(CFA)および不完全フロイントのアジュバント(IFA);(4)インターロイキン(例えば、IL−I、IL−2、IL−4、IL−5、IL−6、IL−7、IL−12(WO99/44636)など)、インターフェロン(例えば、γインターフェロン)、マクロファージコロニー刺激因子(M−CSF)、腫瘍壊死因子(TNF)などのサイトカイン;(5)任意で、肺炎球菌サッカライドと共に用いる場合、ミョウバンの実質的非存在下における(例えば、WO00/56358)、モノホスホリルリピドA(MPL)または3−O−脱アシル化MPL(3dMPL)、例えば、GB−2220221、EP−A−0689454;(6)例えば、QS21および/または水中油乳剤と3dMPLの組み合わせ、例えば、EP−A−0835318、EP−A−0735898、EP−A−0761231;(7)CpGモチーフを含む、すなわち、シトシンが非メチル化されている場合、少なくとも1つのCGジヌクレオチドを含有する、オリゴヌクレオチド(Krieg Vaccine 2000、19、618〜622;Krieg Curr opin Mol Ther2001 3:15〜24;Romanら、Nat.Med、1997、3、849〜854;Weinerら、PNAS USA、1997、94、10833〜10837;Davisら、J.Immunol、1998、160、810−876;Chuら、J.Exp.Med、1997、186、1623〜1631;Lipfordら、Ear.J.Immunol.、1997、27、2340〜2344;Moldoveamiら、Vaccine、1988、16、1216〜1224、Kriegら、Nature、1995、374、546〜549;Klinmanら、PNAS USA、1996、93、2879〜2883;Ballasら、J.Immunol、1996、157、1840〜1845;Cowderyら、J.Immunol、1996、156、4570〜4575;Halpernら、Cell Immunol、1996、167、72〜78;Yamamotoら、Jpn.J.Cancer Res.、1988、79、866〜873;Staceyら、J.Immunol.、1996、157、2116〜2122;Messinaら、J.Immunol、1991、147、1759〜1764;Yiら、J.Immunol、1996、157、4918〜4925;Yiら、J.Immunol、1996、157、5394〜5402;Yiら、J.Immunol、1998、160、4755〜4761;およびYiら、J.Immunol、1998、160、5898〜5906;国際公開特許出願WO96/02555、WO98/16247、WO98/18810、WO98/40100、WO98/55495、WO98/37919、およびWO98/52581);(8)ポリオキシエチレンエーテルまたはポリオキシエチレンエステル、例えば、WO99/52549;(9)オクトキシノールと組み合わされたポリオキシエチレンソルビタンエステル界面活性剤(WO01/21207)、またはオクトキシノールなどの少なくとも1つの追加の非イオン性界面活性剤と組み合わされたポリオキシエチレンアルキルエーテルもしくはエステル界面活性剤(WO01/21152);(10)サポニンおよび免疫賦活性オリゴヌクレオチド(例えば、CpGオリゴヌクレオチド)(WO00/62800);(11)免疫賦活剤および金属塩の粒子、例えば、WO00/23105;(12)サポニンおよび水中油形乳剤、例えば、WO99/11241;(13)サポニン(例えば、QS21)+3dMPL+IM2(任意で+ステロール)、例えば、WO98/57659;(14)組成物の効力を増強するための免疫賦活剤として働く他の物質が挙げられるが、それらに限定されない。ムラミルペプチドには、N−アセチル−ムラミル−L−スレオニル−D−イソグルタミン(thr−MDP)、N−25アセチル−ノルムラミル−L−アラニル−D−イソグルタミン(ノル−MDP)、N−アセチルムラミル−L−アラニル−D−イソグルタミニル−L−アラニン−2−(1’−2’−ジパルミトイル−sn−グリセロ−3−ヒドロキシホスホリルオキシ)−エチルアミン(MTP−PE)などが挙げられる。ヒトへの投与に適したアジュバントは特に関心対象となる。
【0105】
ポリペプチド組成物は、医薬品グレードのマンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、サッカリンナトリウム、タルク、セルロース、グルコース、スクロース、マグネシウム、炭酸塩などの他の成分を含んでもよい。組成物は、pH調整剤および緩衝剤、毒性調整剤などの適切な生理的条件に必要とされる薬学的に許容される補助物質、例えば、酢酸ナトリウム、塩化ナトリウム、塩化カリウム、塩化カルシウム、乳酸ナトリウムなどを含有していてもよい。
【0106】
ポリペプチド含有製剤は、溶液、懸濁液、錠剤、丸薬、カプセル、粉末、ゲル、クリーム、ローション、軟膏、エアゾールなどの形で提供することができる。経口投与は、組成物の消化からの保護を必要とし得ることは認められる。これは、組成物を酸性および酵素的加水分解に対して抵抗性にする作用物質との組成物の結合によるか、または適切に抵抗性である担体分子中に組成物をパッケージングすることによるかのいずれかで達成することができる。消化から保護する手段は当技術分野においてよく知られている。
【0107】
ポリペプチド含有製剤はまた、投与後の本ポリペプチドの血中半減期を向上させるように提供することができる。例えば、単離されたポリペプチドが注射用に製剤化される場合、ポリペプチドは、リポソーム製剤中に提供され、コロイドとして調製され、または血中半減期を延ばすための他の従来技術を用いて調製することができる。リポソームを調製するために、例えば、Szokaら、Ann.Rev.Biophys.Bioeng.9:467(1980)、米国特許第4,235,871号、第4,501,728号、および第4,837,028号に記載されているような様々な方法が利用できる。調製物はまた、放出制御または持続放出の形で提供されてもよい。
【0108】
混合ワクチン
上記で述べたように、本ポリペプチドは、対象においてN.メニンギティディスに対する免疫応答を誘発するのに用いられる様々な抗原性組成物のいずれかと組み合わせて提供することができる。本明細書で用いられる場合の「組み合わせ」とは、別々の投与として別々に製剤化される(例えば、キット内に提供することができるような)組成物、および単一の製剤中での投与としての(すなわち、「共製剤化される」)組成物を含むことを意味する。
【0109】
上記を考慮すれば、例示的な抗原性組成物は、本開示のポリペプチドの1つまたは複数を、異なるナイセリアタンパク質またはその断片を含む組換えワクチンと共に含み、その組換えワクチンは、単離されたタンパク質として提供されてもよいし、および/または小胞ワクチン内で提供されてもよい。本開示の抗原性組成物に含まれ得る本明細書に記載された様々な成分は、インビトロで、エクスビボで一緒に組み合わされてもよいし、および/または本方法に用いられる宿主細胞によってすでに提供されていてもよい。当業者は、最適な任意の方法を用いてその組み合わせを作製することができる。
【0110】
上記で述べたように、抗原性組成物は、本開示のポリペプチドに融合することができる上記のエレメントを含むことができ、または上記のエレメントを組成物中に別々の成分として含むことができる。本ポリペプチドに加えての組成物中に含まれ得る成分の例は、(MC58株由来の遺伝子によってコードされる)組換えfHbp v.1、(NZ98/254株由来の遺伝子によってコードされる)GNA2132、および(2996株由来の遺伝子によってコードされる)NadAを含有する「r3C」ワクチンである。特定の実施形態において、その小胞は、5成分組換えタンパク質ワクチン(5Cまたはr5CV)と組み合わされてもよい。5成分組換えタンパク質ワクチン(r5Cv)は、fHbp v.1と融合したGNA2091、GNA1030と融合したGNA2132(NZ98/254由来)、およびNadAを含有する組換えタンパク質ワクチンを指し、Giulianiら、2006 Proc Natl Acad Sci USA 103:10834〜9に記載されている。
【0111】
免疫化
本明細書に記載されたポリペプチドは、一般的に、ナイセリア疾患に罹るリスクがあるヒト対象に、疾患およびその合併症の発生を防ぎ、または少なくとも部分的に停止させるために免疫原性組成物中において投与される。これを達成するのに十分な量は、「治療的有効量」として定義される。用いるのに有効な量は、例えば、免疫原性組成物、投与様式、患者の体重および全身的健康状態、ならびに処方医師の判断に依存する。免疫原性組成物の単一用量または複数回用量は、患者に必要とされ、かつ許容される用量および頻度、ならびに投与経路に依存して投与され得る。
【0112】
本明細書に記載されたポリペプチドは、一般的に、宿主において体液性免疫応答を誘発するのに有効な量で投与される。上記で述べたように、免疫化のための量は、様々であり、一般的には、70kgの患者あたり約1μgから100μgまで、通常には、5μg〜50μg/70kgの範囲であり得る。実質的により高い用量(例えば、10mg〜100mgまたはそれ以上)が適する場合があり、非経口的に(例えば、注射または局所投与により)、または経口経路もしくは経鼻経路によって投与されてもよい。初回投与の後に、同じまたは異なるポリペプチドを含有する抗原性組成物の追加免疫を行うことができる。通常には、ワクチン接種は、少なくとも1回の追加免疫、より通常には2回の追加免疫を含む。
【0113】
一般的に、免疫化は、任意の適切な経路による投与によって達成することができ、その投与には、経口で、経鼻で、経鼻咽頭で、経腸で、局所的に、経皮で、皮下に、筋肉内に、望ましい投与経路に適し得るように、錠剤、固体、粉末化、液体、エアゾールの形で、局部的にまたは全身的に、賦形剤の添加有りまたはなしでの組成物の投与が挙げられる。非経口的に投与可能な組成物を調製するための実際的な方法は、当業者に知られているであろう、または明らかであろうし、Remington’s Pharmaceutical Science、第15版、Mack Publishing Company、Easton、Pa.(1980)のような刊行物でより詳細に記載されている。
【0114】
免疫応答は、公知の方法によって(例えば、初回免疫化の前および後に個体から血清を採取し、個体の免疫状態における変化を、例えば、免疫沈降アッセイ、またはELISA、または殺菌アッセイ、またはウェスタンブロット、またはフローサイトメトリーアッセイなどにより示すことによって)評価することができる。
【0115】
一実施形態において、抗原性組成物は、ヒト対象に投与することができ、その対象は、ナイセリア−メニンギティディスに関して免疫学的にナイーブであってもよい。特定の実施形態において、対象は、約5歳以下、好ましくは約2歳以下のヒトの子どもであり、抗原性組成物は以下の時点のうちの任意の1時点または複数時点に投与される:生後2週間目、1カ月目、2カ月目、3カ月目、4カ月目、5カ月目、6カ月目、7カ月目、8カ月目、9カ月目、10カ月目、もしくは11カ月目、もしくは1年目、もしくは15カ月目、18カ月目、もしくは21カ月目、または2歳、3歳、4歳、もしくは5歳時点。
【0116】
一般的には、疾患症状の最初の兆候前に、または(例えば、ナイセリアによる暴露または感染による)感染もしくは疾患への可能性のある、もしくは実際の暴露の最初の兆候時点で、免疫化を開始することが望ましくあり得る。
【0117】
スクリーニングアッセイ
本開示はまた、効果的なワクチンについてスクリーニングする方法、および候補作用物質(例えば、抗体)、それをコードする核酸、または抗血清を誘発するのに効果的な免疫原についてスクリーニングする方法を特徴とする。
【0118】
例えば、方法は、抗体のFc部を介する結合と、抗原特異的部分の結合(すなわち、抗体の抗原結合領域を通してTspBに結合する能力)との両方の点から抗体結合を評価するために用いることができる。そのようなアッセイ方法は、結合が抗原特異性に依存しない(例えば、Fc領域への結合による)、TspBのヒトIgへの結合を阻害することができる候補作用物質をスクリーニングするのに用いられる。方法は、ナイセリアタンパク質の機能(例えば、TspBのヒトIgGへの結合)を阻害する抗体を同定するために抗体をスクリーニングすることを包含し得る。例えば、TspBのヒトIgまたはその断片(例えば、Fc部)に対する親和性と比較して少なくとも約30倍、少なくとも約40倍、少なくとも約50倍、または少なくとも約100倍、約1000倍以上までの結合活性(例えば、50nM対50pM)でTspBに結合する候補作用物質が、TspBのヒトIgへの結合を阻害するために用いられる候補として選択されるであろう。
【0119】
本方法は、TspBのヒトIgへの結合を阻害するための候補である可能性がある候補作用物質(例えば、抗体)を分析するステップであって、その結合がIgの抗原特異性に依存しない(例えば、Fc領域における結合による)、ステップを含む。任意で、方法は、非ヒト動物をワクチン(例えば、TspBのエピトープを含有するポリペプチド)で免疫するステップ、そのような免疫化動物から血清抗体を採取するステップ、およびTspBのIgへの結合を阻害する能力について血清をスクリーニングするステップを含んでもよい。
【0120】
本明細書に用いられる場合の用語「候補作用物質」は、任意の分子、例えば、タンパク質または小分子化合物を記載する。したがって、候補作用物質は、典型的には、有機分子、好ましくは、50ダルトンより大きく、約2,500ダルトン未満の分子量を有する小さい有機化合物であるが、多数の化学的クラスを包含する。候補作用物質は、タンパク質との構造的相互作用、例えば、水素結合を促進する官能基を含み、アミン基、カルボニル基、ヒドロキシル基、またはカルボキシル基を含むことができる。候補作用物質は、上記の官能基の1つまたは複数で置換される環式炭素構造もしくは複素環式構造および/または芳香族構造もしくは多環芳香族構造を含む場合が多い。候補作用物質はまた、生体分子の間で見出され、それには、ペプチド、糖類、脂肪酸、ステロイド、プリン、ピリミジン、それらの誘導体、構造的類似体、または組み合わせが挙げられるが、それらに限定されない。候補作用物質は、合成または天然の化合物のライブラリーを含めた幅広い種類の供給源から得ることができる。例えば、ランダム化オリゴヌクレオチドおよびオリゴペプチドの発現を含めた、幅広い種類の有機化合物および生体分子のランダム合成および指向性合成に多数の手段が利用できる。
【0121】
あるいは、細菌、真菌、植物、および動物の抽出物(TspBの機能に影響を及ぼす内因性因子を同定するためのヒト組織からの抽出物を含む)の形をとる天然化合物のライブラリーが入手でき、または容易に作製される。加えて、天然の、または合成的に作製されたライブラリーおよび化合物は、通常の化学的、物理的、および生化学的手段を通して容易に改変され、コンビナトリアルライブラリーを作製するのに用いることができる。既知の薬理学的物質を、アセチル化、アルキル化、エステル化、アミド化などの指向性またはランダム化学修飾に供して、構造的類似体を生成してもよい。
【0122】
上記で述べたように、候補作用物質の分析を、無細胞アッセイかまたは細胞に基づいたアッセイのいずれかにおいて、候補作用物質の存在下で、TspBのヒトIgまたはその断片(例えば、Fc断片)に結合する能力を評価することによって行ってもよい。ヒトIgまたはその断片(例えば、Fc断片)と比較して何倍も増加したTspBに対する親和性を示す候補について選択するために段階希釈実験を行うことができる。アッセイに用いられるTspBには、ナイセリア細菌から単離された、合成的に作製された、組換えで作製された、および/またはナイセリア細菌の細胞表面上に存在する、完全長またはその断片を挙げることができる。候補作用物質をまた、当技術分野において知られた、および下記の実施例に記載された方法を用いて殺菌活性を促進するその能力について評価してもよい。
【0123】
用いられるアッセイ形式に依存して、本スクリーニング方法において、ヒトIg(またはその断片)を含有するポリペプチド、TspBタンパク質、および/または本ポリペプチドが標識され得る。TspB、本ポリペプチド、および/またはヒトIgもしくはその断片(例えば、Fc部)を含有するポリペプチドは、任意で、共有結合性または非共有結合性付着を通して支持体に固定化することができる。例示的なスクリーニングアッセイは、競合的結合アッセイであってもよく、そのアッセイにおいて、ヒトIgまたはその断片(例えば、Fc領域)を含有するポリペプチドが検出可能に標識され、固定化TspBに結合することができる。その後、この検出可能に標識された試薬の結合したTspBからの転置が、候補作用物質の存在下で評価される。
【0124】
検出可能な標識には、直接的に検出可能なシグナル(例えば、フルオロフォア)または間接的に検出可能なシグナル(例えば、検出可能な標識を有する二次抗体の使用)を提供するものが挙げられる。例えば、放射性標識、蛍光標識、化学発光剤、酵素、特異的結合分子、粒子、例えば、磁気粒子など。様々な方法(例えば、親和性捕獲など)を通して単離を促進するために追加のエレメント(例えば、ビオチンタグ、HAタグ、ポリヒスチジンタグ、免疫学的に検出可能なタグ)を提供することができる。特異的結合分子には、ビオチンとストレプトアビジン、ジゴキシンと抗ジゴキシンなどのペアが挙げられる。特異的結合メンバーについて、相補的メンバーが、通常、公知の手順に従って、検出を提供する分子で標識される。
【0125】
候補作用物質をまた、関心対象となる細菌細胞に対するその親和性について評価してもよい。スクリーニングのための細菌細胞は、大腸菌K1、大腸菌K92、任意のナイセリア細菌(例えば、ナイセリア−メニンギティディス血清群B、ナイセリア−メニンギティディス血清群C、ナイセリア−メニンギティディス血清群X、ナイセリア−メニンギティディス血清群Y、ナイセリア−メニンギティディス血清群W−135など)から選択することができる。
【0126】
候補作用物質が抗体である場合、それは抗体集団内に提供され、方法は、細菌細胞を結合し、TspBを結合し、および/またはTspBのヒトIgへの結合を阻害する、抗体集団由来の1つまたは複数の抗体を単離するステップを含むことができる。そのようなスクリーニングによって同定された単離抗体は、細菌細胞に対する殺菌活性を、例えば、ヒト血液中の細菌の生存率を減少させる能力がある、補体媒介性殺菌活性および/またはオプソニン化貪食作用活性を促進することによって、促進することができる。
【0127】
本方法に用いるために、TspBまたは本ポリペプチドを細菌おいて製造する場合、細菌細胞を、ヒト血液の1つまたは複数の成分を追加した既知組成培地中で培養する。ヒト血清を追加している既知組成培地が、細菌細胞が培養される条件および/または候補作用物質結合(例えば、抗体結合)が遂行される条件として本スクリーニング方法に用いられる。したがって、本開示のスクリーニング方法は、ヒトにおける菌血症および/または腫瘍症をシミュレートする条件下で実行される。
【0128】
本明細書に記載された本スクリーニングアッセイに関連して用いられる場合、「既知組成培地」とは、非ヒト動物の副産物を欠く培地であることを意図される。本開示に用いられるナイセリア−メニンギティディスについての既知組成培地は、所望の抗原決定基の発現に適した既知の成分を含有し、非ヒト動物の副産物を欠き、ヒト血液の1つまたは複数の成分をさらに追加されている。
【0129】
ヒト血液の成分には、血漿、白血球を含む血漿、補体、フィブリノーゲン、フィブロネクチン、フィブリン、プラスミノーゲンなどの凝固因子、α−グロブリン、β−グロブリンなどが挙げられるが、それらに限定されない。ヒト血液成分が血漿である場合、血漿を、内因性補体活性を不活性化するために熱失活させる。アッセイが特定のヒト抗体への結合を検出することを含む場合、その特定の抗体またはその特定のクラスの抗体(例えば、IgG)を血漿から除去する。血漿はまた、関心対象となるN.メニンギティディスに対する内因性殺菌活性を欠損するドナーから得られる。上記で述べたように、ヒト血液成分の例は、ヒトコーン分画IV血清であり、それは商業的供給源から入手することができる。
【0130】
スクリーニングおよび/または評価はさらに、ウシ血清などの1つまたは複数の非ヒト動物の副産物を含有する培地などの未知組成培地中で増殖した細菌細胞への候補作用物質(例えば、抗体)の結合を比較するステップを含んでもよい。この目的に適した多くの未知組成培地が知られている。例えば、ナイセリア−メニンギティディス細胞の増殖および/または生存能を援助するための未知組成培地の例には、Mueller−Hinton培地などが挙げられるが、それらに限定されない。認識されているように、既知組成培地および/または未知組成培地で培養された細菌細胞への作用物質の結合を比較する本方法のステップの順序は変えることができ、したがって、所定の最終用途のためにユーザーによって選択され得る。
【0131】
本開示はまた、上記の方法によって作製された単離抗体、および方法により作製された単離抗体を産生する能力がある単離細胞系を提供する。細胞系における単離および産生は、当技術分野において知られたいくつもの手順によってでも実施することができる。
【0132】
本開示はまた、TspB(例えば、NmB1628のIGBドメインなどのそのIGBドメイン)の重合体構造の形成への候補作用物質の効果を検出することによって、TspBとIgの結合を阻害するのに効果的な候補作用物質(例えば、抗体)をスクリーニングするための方法を提供する。候補作用物質が抗体である場合、その抗体は、候補抗原の投与によって誘発されてもよい。その方法は、TspBポリペプチドの重合体構造へ凝集する傾向、およびTspBのIg結合活性を阻害する抗体に接触した場合に分散するそれらの能力を利用している。例えば、方法は、候補作用物質(例えば、抗血清中の抗体)をTspBに接触させるステップ、ならびにそのような接触後に形成される反応混合物において重合体構造の存在および/または量を検出するステップを含む。重合体構造の検出は、任意の適切な手段、例えば、光学顕微鏡を用いる反応混合物における凝集体の検出によって達成することができる。反応混合物は、水溶液中および/またはゲル中に提供することができる。候補作用物質が、候補作用物質の非存在下での凝集と比較して本ポリペプチドの凝集を分散および/または阻害する場合、その候補作用物質は、TspBのIg結合活性の阻害のための候補として同定される。
【0133】
キット
本明細書に開示された組成物を用いるための、および上記のように方法を実施するためのキットもまた本発明によって提供される。キットは、N.メニンギティディスに対する(例えば、予防的または治療的)ワクチンの投与のために提供されてもよい。キットは、本明細書に開示されたポリペプチドまたはコード化核酸の1つまたは複数を含むことができ、それは滅菌容器内に提供されてもよく、対象への投与のための薬学的に許容される賦形剤と製剤化して提供することができる。ポリペプチドは、抗TspB抗体の産生を与える抗N.メニンギティディスワクチンの製剤(例えば、組換えTspB断片を含有する製剤、ヒト血清と培養されたTspB発現株由来の小胞など)と共に提供することができ、本開示のポリペプチドは、そのようなワクチンと別々に製剤化されてもよいし、組み合わせて製剤化されてもよい。
【0134】
上記の成分に加えて、キットはさらに、本方法を実施するためにキットの成分を用いることについての使用説明書を含むことができる。本方法を実施するための使用説明書は、一般的に、適切な記録媒体上に記録される。例えば、使用説明書は、紙またはプラスチックなどの基材上に印刷されてもよい。それとして、使用説明書は、パッケージ挿入物としてキット内に、キットまたはその成分の容器のラベル付けにおいて(すなわち、パッケージングまたはサブパッケージングに付随して)など、存在してもよい。他の実施形態において、使用説明書は、適切なコンピュータ可読記憶媒体、例えば、CD−ROM、ディスケットなどに存在する電子記憶データファイルとして存在する。さらに他の実施形態において、実在の使用説明書はキット内に存在しないが、リモート供給源から使用説明書を入手するための手段、例えば、インターネットを介する手段が提供される。この実施形態の例は、使用説明書を見ることができ、および/または使用説明書がダウンロードすることができるウェブアドレスを含むキットである。使用説明書と同様に、使用説明書を入手するためのこの手段は、適切な基材上に記録されている。
【実施例】
【0135】
本明細書に記載された実施例および実施形態は、例示を目的とするのみであること、およびそれを鑑みての様々な改変または変化が当業者に示唆されるであろうし、本出願の精神および権限内、ならびに添付された特許請求の範囲の範囲内に含まれ得ることは、理解されている。本明細書に引用された全ての刊行物、特許、および特許出願は、全ての目的のために全体として参照により本明細書に組み入れられている。
【0136】
材料および方法
以下の方法および材料を下記の実施例に用いた。
【0137】
Catlin 6培地の調製。Catlin 6培地(CDM)の組成をFossa da Paz(Fossa da Pazら、2003 Brazil.J.Micro.34:27〜32)から適応させた。アミノ酸、塩、グルコース、および鉄のあらかじめ作製されたストック溶液を混合することによって、各実験の前に新鮮に培地を調製した。下記のように調製された56℃で熱失活させた5パーセントのIgG除去血清をCDMに追加した(CDM−dHuS)。2Mのグルタミンを加えること(UCSF cell culture facility)が、CDM中で培養された、いくつかのNm株の倍加時間を減少させることが観察され、それゆえに、CDMの調製に含まれた。システインをCatlin 6製剤から排除し、それは、システインを含まないCatlin培地が、システインを含む培地よりたいていのNm株についてより一貫した増殖率を生じることが見出されたからである。
【0138】
IgGを除去されたヒト補体の調製。5mlのプロテインGカラム(HiTrap Protein G HP、GE Healthcare Bio−sciences、Piscataway NJ)に、カラムの先端および底に滅菌されたルアーロックバルブおよび2つの10mlのシリンジを装着した。Ca+およびMg+、0.5%グルコースを含む25mlの滅菌濾過されたDulbeccos緩衝食塩水(DPBS+glu)を用いて、カラムを洗浄し、その後、それを4℃で20分間、冷却した。血清を−80℃の貯蔵から取り出し、氷上で解凍した。5.5mlの血清をカラムに負荷し、5分間、4℃に置いた。その後、DPBS+gluをカラムにアプライして、IgGを除去された血清と置き換えた。約5mlの除去された血清を収集し、すぐに氷上に置いた。追加の5mlのDPBS+gluを、通過画分が完全に透明になるまでカラムにアプライした。プロテインGに結合したIgGを、0.1M酢酸ヒスチジン、pH2.7、0.02%Tween 20でカラムから溶出した。最初の1.5mlの通過画分を捨てた。その後の15mlを収集し、緩衝液をPD 10サイズ排除カラム(GE Healthcare Bio−Sciences)を用いて、0.002%Tween 20および24mMスクロースを含有する2mMヒスチジン、pH6と交換し、その後、凍結乾燥した。
【0139】
フローサイトメトリーによるヒトIgGのNm株への結合の検出
髄膜炎菌株(W135群A22株、B群NMB株、C群4243株)を、0.25%(重量/体積)グルコースを含むMueller−Hinton(MH;BD)培地、Catlin 6(CDM)培地(9)、または5%(重量/体積)ヒト血清(HuS)もしくはマウス血清(MoS)を追加したCatlin 6培地中で約0.6のOD620nmまで増殖させた。ヒトドナー由来の血清を、上記のように、その血清を56℃で30分間、インキュベートすることによって熱失活させ(HuS)、プロテインGカラムにその血清を通過させることによってIgGを除去した(dHuS)。細胞をペレット化し、洗浄し、ブロッキング緩衝液(1%ウシ血清アルブミンを含有するPBS緩衝液(Sigma))中に最初の体積の80%に再懸濁した。細胞の混合物を、周期的に穏やかに撹拌しながら4℃で1時間、インキュベートした。細胞をペレット化し、フルオレセインイソチオシアネート(FITC)連結型ヤギ抗ヒト二次抗体のブロッキング緩衝液中1:200希釈溶液の200μlに再懸濁した。IgG(H+L)F(ab’)2およびIgMに対するFITC連結型抗体(Jackson ImmunoResearch、West Grove、PA)。二次抗体を加えた後、チューブを、周期的に穏やかに撹拌しながら4℃で1時間、インキュベートした。細胞を、ペレット化し、新鮮に作製されかつ濾過された400μlの0.5%ホルムアルデヒド(重量/体積)含有PBS(Steriflip、Millipore、Billerica、MA)に再懸濁した。試料をすぐに、フローサイトメトリー(BD FACSCalibur System、BD Biosciences、San Jose、CA)によって分析した。
【0140】
マウス抗血清の収集。CD1マウス(6〜8週齢、Charles River Laboratories、Wilmington、MA)の群を、50%生理食塩水/50%フロイント完全アジュバント(Pierce)乳濁液中、または3.25mg/mlアルハイドロゲル(ミョウバン)(Brenntag Biosector、Frederikssund、Denmark)もしくは生理食塩水単独中の合計1μg、5μg、10μg、もしくは252μg、または10μgのTspB−IGB(すなわち、TspB−IGBワクチン)で腹腔内注射によって免疫した。各注射から40日後、顔面静脈のランセットにより血液試料を採取し、ELISAによって試験した。
【0141】
追加免疫用量を、不完全フロイントアジュバント(Pierce)、ミョウバン、または生理食塩水単独と共に28日後に与え、免疫後14日目に採取された抗血清の力価を評価した。抗血清力価をELISAによって決定した。個々のマウス由来の抗血清をプールし、全てのさらなる実験を、プールされた抗血清を用いて行った。各TspB−IGBを1:200で希釈してPBS中10μg/mlにし、96ウェルマイクロタイタープレート(Immulon II HB)へウェルあたり100μlを加えることによってELISAプレートを調製した。プレートを使用前に4℃で一晩、貯蔵した。プレートをPBS緩衝液で5回、洗浄し、1%(重量/体積)のBSAを含有するPBS緩衝液(ブロッキング緩衝液)で、周囲温度で1時間、ブロッキングした。抗血清をブロッキング緩衝液中に1:100希釈で加え、続いて、3倍段階希釈を行った(2連)。4℃での一晩のインキュベーション後、プレートをPBS緩衝液で5回、洗浄し、ブロッキング緩衝液中に1:3000希釈したウサギ抗マウスアルカリフォスファターゼ連結型抗体(Zymed)を加えた。さらに1時間、周囲温度でインキュベートした後、プレートをPBS緩衝液中で(5回)洗浄し、結合した抗体を、1mM MgCl2を含有する50mM炭酸ナトリウム緩衝液、pH9中の1mg/ml リン酸p−ニトロフェニル(Sigma−Aldrich)を加えることによって検出した。周囲温度での30分間のインキュベーション後の405nmにおける吸光度を、Molecular Devices SpectraMax 340マイクロタイタープレートリーダーを用いて測定した。抗血清をTspB−IGBに対して試験した。
【0142】
天然条件下でのTspB IGBおよびIGBproの精製。250mlの細胞培養物からの凍結細胞ペレットを解凍し、50mM Tris・HCl、150mM塩化ナトリウム、pH7.5(TBS)の20mlと、0.1mMフッ化フェニルメタンスルホニル(PMSF)および10μg/ml DNアーゼ(Sigma−Aldrich)を含有するPBSの20mlに溶解した、0.5%(重量/体積)オクチルグルコピラノシド(Calbiochem、San Diego、CA)中に再懸濁した。18G針および一定の長さのTeflon管を取り付けたシリンジを用いて、溶液を、針を通して強制的に繰り返し、往復させることによって、混合物をホモジナイズした。ホモジナイズされた溶液を、周囲温度で20分間、ロッキングプラットフォーム上で撹拌し、その後、20,000xgで10分間、遠心分離した。上清を捨て、ペレットを、10mlのTBSと、0.1mM PMSFおよび10μg/ml DNアーゼを含有するPBSの10ml中に溶解した、0.5%(重量/体積)EmpigenTT(Calbiochem)中に懸濁した。ホモジナイズされた溶液を、上記のように、周囲温度で20分間、ロッキングプラットフォーム上で撹拌し、その後、遠心分離した。生じた上清を新しいチューブに移し、一方、ペレットは、0.5%EmpigenTT含有溶液中で2回目の抽出を行い、再びペレット化する前に周囲温度で5分間、ロッキングプラットフォーム上で撹拌した。生じた上清を、最初のEmpigenTT抽出由来の上清と混合し、固体イミダゾールを10mMの最終濃度まで加え、その溶液を0.2μフィルター(Steriflip、Millipore、Billerica、MA)を通して濾過した。その後、濾過された溶液を、溶解緩衝液(300mM NaCl、10mMイミダゾール、および1%(体積/体積)EmpigenTTを含有する50mMリン酸ナトリウム、pH8)で平衡した5ml Ni Sepharose HisTrap高性能HPカラム(GE BioScience、Piscataway、NJ)に通過させた。カラムを、50mlの洗浄緩衝液(300mM NaCl、20mMイミダゾール、および1%(体積/体積)EmpigenTTを含有する50mMリン酸ナトリウム、pH8)で洗浄し、TspBタンパク質を、最初に125mMイミダゾール(14ml)、その後250mMイミダゾール(16ml)を含有する溶出緩衝液(300mM NaClおよび1%(体積/体積)EmpigenTTを含有する50mMリン酸ナトリウム、pH8)で段階溶出した。2mlの画分を収集し、SDS−PAGEによって分析した。精製されたTspB誘導体を含有する画分を混合し、0.9%NaClに対して透析し、YM−10濃縮器(Millipore)を用いて0.2〜2mg/mlタンパク質まで濃縮した。
【実施例1】
【0143】
ヒト血清の存在下で培養された髄膜炎菌株によるヒトIgG結合の検出
ナイセリア−メニンギティディスW135群(NmW135)A22株の表面へのヒトIgGの結合に影響を及ぼす可能性がある細菌細胞の増殖条件を同定するためにフローサイトメトリー実験を行った。精製ヒトIgGが特定の試料に加えられる結合実験に加えて、対照の場合は、マウス血清を加えない場合および加える場合を含んだ。
【0144】
NmW135のA22株の結果は図1に示されている。黒色のヒストグラムは、示された試験条件についての結果を示し、白色のヒストグラムは添加物無しの陰性対照である。A22細胞をMH培地単独またはCDM単独中で増殖させ、かつ試験株に対する内因性血清殺菌活性を欠くドナー(ドナー1)由来の精製ヒトIgGを結合実験中に加えた場合、IgGの結合は検出されず、またはわずかに検出された(それぞれ、図1A、B)。その結果より、血清から精製された抗体と反応性である、細菌によって発現される抗原は、いずれの培養条件下においてもないことが示されている。再び、細菌を、精製IgGの同じドナー源(ドナー1)由来のdHuSを追加したMH中で培養した場合(図1C)、わずかなIgG結合が観察された。しかしながら、細菌を、dHuSを追加したCDM中で培養した場合、細胞の部分集団の蛍光が右へシフトし(図1D)、IgGの99%より多くが血清から除去されている(除去および希釈後、[IgG]>2μg/ml)にもかかわらず、結合したヒトIgGの存在を示している。CDM/dHuS(D列)と比較して、MH/dHuS(C列)中で培養した細胞についてのはるかに低いIgG陽性細胞集団により、ヒト血清により誘導されるIg結合活性の発現が、MH培地において抑制されることが示唆されている。マウス血清を追加したCDM(CDM/MoS)中で培養された細胞は、マウスIgGの結合を示さなかった(図1E)。また、細菌をMoSの存在下で培養し、かつ精製ヒトIgGを加えた場合には、ヒトIgGの結合が観察されなかった(図1F)。その結果より、Ig結合活性の発現を誘発するヒト血清中の因子がマウス血清中に存在しないことが示されている。しかしながら、細菌をヒト血清の存在下で培養し、その後、マウス血清とインキュベートした場合には、マウスIgGの結合が観察されたが、蛍光はより弱い(図1G)。したがって、Ig結合活性は、ヒトIgGに対して完全に特異的というわけではないが、Ig結合活性の発現を引き起こすためにヒト血清因子を必要とする。
【0145】
観察されたIg結合活性が、細菌をヒト血清の存在下で培養した場合に発現した抗原のみを免疫IgGが認識するという結果ではないことを示すために、細菌を、蛍光タグで修飾されている(ポリクローナルヒトIgGから調製された)精製ヒトFc断片(Jackson ImmunoResearch Laboratories、West Grove、PAから入手された、HuFc−FITC)を追加したCDMHuS中で増殖させた。図1Hに示されているように、細菌は、Fcドメインのみに結合する。Fcドメインは、培地中に存在する無傷ヒトIgGと競合するため、結合がより弱く、またはFcドメインがエピトープ全体を表すわけではないため、より弱い可能性があるが、HuFc−FITCの存在下でdHuSを含まないCDM中で増殖した細菌の陰性対照(白色のヒストグラム)と比較して、それは明らかに増加している。Fc断片は結合性部位を欠くため、観察された結合は、抗体の抗原への結合の結果ではなく、むしろ、抗原のFcドメインへの結合の結果であり得る。さらに、Ig結合の証拠は、下記の実施例2に提供されており、実施例2において、そのタンパク質が同定され、そのタンパク質の組換えサブドメイン(すなわち、上記のIGBドメイン)がヒトおよびマウスのIgA、IgG、およびIgMを結合することが示されている。
【0146】
図2Aは、2人のドナー(ドナー1およびドナー3)由来のdHuSを用いる結合実験、ならびにW135群A22株、M9262株、および4383株に加えて遺伝的かつ抗原的に多様なB群(NMB)およびC群(4243)の株によるヒトIgG結合(図2B)を示す。結果より、IgG結合タンパク質のHuS依存性発現が特定のドナーに特有ではないこと、およびIgG結合タンパク質発現がA22株に限定されないことが示されている。株の遺伝的および抗原的多様性、ならびにドナーおよび特にマウスの侵襲性Nm株への可能性の低い暴露を考慮すれば、ドナー血清が、細菌がヒト血清の存在下で培養された場合のみに発現する、共通の抗原に反応性の抗体を含有することは可能性が低い。
【実施例2】
【0147】
ナイセリア−メニンギティディス細菌によって発現されたヒトIgG結合タンパク質の親和性精製および同定
ヒトIgG結合タンパク質の親和性精製。NmW135のA22株の細胞をMHまたはCDMHuS中、37℃で増殖させた。各培養条件について、7mLの5つの培養を0.15(MH)または0.2(CDMHuS)のOD620nmから開始した。OD620nmが約0.6に達したとき、5つの培養物を混合し、65mLのそれぞれの培地をさらに加えて、合計100mLにし、OD620nm=0.6までインキュベーションを続けた。細胞を10,000xgで30分間、遠心分離し、細胞をペレット化した。細胞ペレットを、10mLのフィルター処理(Steriflip、Millipore)されたPBS緩衝液中で2回、洗浄した(緩衝液中に再懸濁し、遠心分離した)。最終洗浄後、2mLのアリコート中の細胞をペレット化し、ドライアイス上で凍結させた。
【0148】
1つの2mL細胞アリコートを解凍し、PBSで2回、洗浄した。洗浄後、細胞ペレットを2mLの可溶化緩衝液(10mM EDTA、150mM NaCl、1%(重量/体積)Triton X−100、0.2%(重量/体積)デオキシコール酸ナトリウム、および0.1%(重量/体積)ドデシル硫酸ナトリウムを含有する10mM Tris、pH7.8)中に再懸濁し、37℃で60分間、インキュベートした。試料を45,000xgで20℃、60分間、遠心分離した。上清を、プロテインAまたはプロテインG Sepharose CL−4Bビーズ(Sigma)(プロテインA:50μLのPBS中にあらかじめ膨潤した3〜4mgのビーズ、プロテインG:PBS中で3回、洗浄された50μLのビーズを用いた)を含有するマイクロチューブに移した(免疫沈降あたり1mL)。試料およびビーズの混合物を、4℃でロッキングさせながら、一晩、インキュベートした。ビーズを、2分間の遠心分離を用いて可溶化緩衝液で5回、洗浄して、各洗浄後、ビーズをペレット化した。最終の洗浄後、ビーズを、2−メルカプトエタノールを含まない75μLの試料緩衝液中に懸濁し、100℃で5分間、インキュベートして、結合した免疫グロブリンおよびタンパク質を遊離させた。試料を、上記のように3分間、遠心分離して、ビーズをペレット化し、上清を新しいチューブに移した。2μLの2−メルカプトエタノールを加え、上清を100℃で5分間、加熱した。ビーズから溶出されたタンパク質を、4%〜12%SDS−PAGEゲル(Invitrogen社製のNovexプレキャストゲル)上で分解し、それを製造会社の使用説明書に従ってGelCode Blue(Pierce Chemical Co.、Rockford、IL)で染色し、ゲル中のバンドを、図3に示されているように、LI−COR Odyssey IR撮像装置(Lincoln、NE)を用いて検出した。
【0149】
MALDI−TOF質量フィンガープリント分析によるナイセリアのヒトIgG結合タンパク質の同定。上記のように免疫沈降されたIgG結合抗原を含有するGelCode Blueで染色されたSDS−PAGEゲルの部分を、清潔な安全かみそりの刃を用いて切り取り、シリコン処理されたチューブ(Fisher Scientific)内で切り刻んだ。ボルテクサー上で撹拌しながら10分間、40%(体積/体積)アセトニトリルを含有する200mM NH4HCO3緩衝液で3回、洗浄することによってゲル小片から染色を取り除いた。ゲル小片を減圧下で30分間、乾燥させ、その後、トリプシン(12ng/μl、Worthington、Lakewood、NJ)を含有する最小量の25mM NH4HCO3緩衝液中で再水和させ、37℃で一晩、インキュベートした。緩衝溶液と、50%(体積/体積)アセトニトリル中の0.1%(体積/体積)トリフルオロ酢酸(TFA)でゲル小片中から抽出されたトリプシンペプチドを混合した。溶出されたペプチドをspin−vac(Savant、Thermo−Fisher)内で乾燥させた後、その残留物を、4μlの0.1%TFA/50%アセトニトリル中に再懸濁した。1μlのこの溶液を、α−シアノ−4−ヒドロキシ桂皮酸(Bruker Daltonics、Fremont、CA)で飽和した3μlの0.1%TFA/50%アセトニトリルに加えた。0.5μlの試料/マトリックス溶液を、MALDI−TOF分析のためにステンレススチール標的プレート(Bruker Daltonics、Billerica、MA)上へスポットした。MALDI−TOF(Autoflex、Bruker Daltonics)を、陽イオンリフレクターモード(30ショットN2レーザー)で行った。質量スペクトルを、外部ペプチド標準(Bruker Daltonics)を用いて較正した。観察された質量の誤差は、≦0.1%であると推定される。観察されたペプチド質量のセットを、Mascot(matrixscience.com;Perkins DNら、1999 Electrophoresis 20:3551〜3567)を用いて分析した。いったんタンパク質が同定されたならば、タンパク質分解性断片の予想質量を、PeptideMass(Wilkins MRら、1997 Electrophoresis 20:3551〜3567)を用いて計算した。
【0150】
図3に示されているように、ある範囲の分子量を有するタンパク質が、CDM/dHuS中で増殖した可溶化細胞とインキュベートされたプロテインAおよびGから溶出されたが、MH中では溶出されなかった。しかしながら、ゲルから単離された各タンパク質バンド由来のトリプシンペプチドをMALDI−TOF質量分析法によって分析した場合、それらの全てが類似した一連の質量を含有し、単一のタンパク質の存在が、変動する移動度でゲル内を移動したことを示している(図3)。Mascotを用いる質量フィンガープリント分析によって決定されたタンパク質のアイデンティティ(図4)は、64の確率に基づいたMowseスコア(50より大きい値が有意である)および0.0026の対応する期待値(0.05未満の値が有意である)を以て、NmAのZ2491株NMA0776遺伝子によってコードされたものであることが見出された。NmAのZ2491株ゲノム由来のNMA0776および相同性遺伝子のNMA1797は、Ala’Aldeenおよび共同研究者(Kizil GIら、1999 Infect.Immun.67:3533〜3541;米国特許第6861507号)によって同定されたT細胞およびB細胞の刺激タンパク質B、ならびにBille Eら、2005 J.Exp.Med.201:1905〜1913およびBille Eら、2008 PLoS One 3:e3885によって同定されたOrf6と配列相同性を共有する。
【実施例3】
【0151】
ナイセリアのヒトIgG結合タンパク質の配列分析および構造モデル。
NMA0776の翻訳タンパク質配列およびNCBI(ncbi.nlm.nih.gov/sutils/genom_table.cgi)で利用可能な13個のナイセリア科ゲノムのBLAST配列相同性検索を用いて、相同性タンパク質配列が侵襲性髄膜炎菌A群(Z2491)、B群(MC58)、およびC群(FAM18)、ならびにナイセリア−ゴノレア(FA1090)株および非侵襲性ナイセリア−ラクタミカ(ATCC 23970)株に見出された。推定TspB/Orf6タンパク質をコードする遺伝子の数は、1個の部分配列(ラクタミカ株ATCC 23970)から4個の完全長配列(髄膜炎菌B群MC58、C群FAM18およびN.ゴノレアFA1090株)までの範囲であった。A群、B群、およびC群の株由来の翻訳されたタンパク質配列を比較した場合、パターンが現れた。
【0152】
図5に示されているように、そのタンパク質のアミノ末端およびカルボキシル末端の配列は、多岐にわたるが、比較的保存されているコア領域がある。可変アミノ末端配列は、新生タンパク質を細胞の外へ輸送されるように方向づける機能的リーダーペプチド配列の可能性がある。そのタンパク質のカルボキシル末端において、可変配列は、一般的に、機能的に等価であるために同じ配列を有する必要はない可能性がある疎水性膜貫通セグメントである。保存された内部ドメインに関しては、後にプロリンリッチセグメントが続く、二次構造予測に基づいたβシート構造で主に構成されている典型的な球状ドメインがある。プロリンリッチセグメントは、伸長したヘリカル構造をとることが知られている(Butcher DJら、1996 Biochemistry 35:698〜703)。
【0153】
分析により、少なくともいくつかのTspB/Orf6遺伝子は、細菌表面へ運び出され得るタンパク質をコードする。そのタンパク質は、超可変N末端ドメイン、続いて、可変膜貫通セグメントによって膜に繋ぎ止められているプロリンリッチヘリカルセグメントの末端で膜から外へ伸びる球状ドメインを含有する。この構造モデルに基づいて、球状セグメントおよび/またはプロリンリッチセグメントは、それらが高度に保存されているため、いくつかの機能活性を有するが、可変N末端ドメインは、抗体応答を崩壊させるための不必要な「偽装」としての役割を果たすことは明らかである。したがって、TspB/Orf6を標的とする抗体を誘発するために設計されるワクチンは、一方または両方の保存ドメインのみを含有するものでもよい。
【実施例4】
【0154】
ナイセリアのヒトIgG結合タンパク質の定常領域ドメインを含有する様々なIg結合性構築物のクローニングおよび発現
保存された球状ドメイン(CR)を、下記のようにクローン化した(本明細書ではTspB−IGBと呼ぶ)。ゲノムDNAを、QiagenゲノムDNA単離キット(Qiagen、Valencia、CA)を用い、製造会社の使用説明書に従って、MC58株から調製した。TspB−IGBをコードするDNAを、以下のプライマーを用いるPCRによって増幅した:5’−CATGGATCCATCAGTTTCCCG−3’(配列番号49)および5’−CATAAGCTTTGCTTCCGCGCTTC−3’(配列番号50)。PCRは、Invitrogen(Carlsbad、CA)社製のPfx DNAポリメラーゼ、ヌクレオチド、および緩衝液を用いるIdaho Technology(Salt Lake City、Utah)RapidCycleサーモサイクラーでの95℃での変性、50℃でのアニーリング、および72℃での伸長の30サイクルからなった。PCR断片を、QIAquick PCR精製キットを用い、製造会社の使用説明書に従って精製し、T4 DNAリガーゼ(New England Biolabs、Ipswich、MA)を用いて、20℃で一晩、プラスミドpCR2.1(Invitrogen)へライゲーションした。ライゲーション反応産物を用いて、大腸菌BL21株(DE3)(Invitrogen)を形質転換した。形質転換された大腸菌を、100μg/mlアンピシリン(Sigma)およびBlue White Selectスクリーニング試薬(Sigma)を含有するLB寒天プレートに蒔いた。Qiagenミニプラスミドプレップキットを用いてプラスミドを白色コロニーから調製し、TspB−IGB DNA断片の存在を下記のように確認した。
【0155】
プラスミドを、まず、Eco RI(New England Biolabs)で消化し、挿入断片のサイズを確認した。クローニングに用いられる断片を制限エンドヌクレアーゼHind III、続いてBam HI(New England Biolabs)で処理した。生じた断片を、TBE緩衝液(Gibco)中の0.5μg/ml臭化エチジウムを含有する1%(重量/体積)アガロース(Promega、Madison、WS)ゲルにおける電気泳動によって単離した。予想されたサイズのTspB−IGB DNA断片に対応するバンドを、ゲルから切り取ることによって単離し、Qiagen QIAquick Gel Extractionキットを用いて精製した。Hind III/BamHI TspB−IGB DNA断片を従来通り、上記のように前もって同じ制限エンドヌクレアーゼで消化し、エビアルカリフォスファターゼ(USB、Cleveland、OH)で処理し、アガロースゲル電気泳動によって精製したプラスミドpQE31(Qiagen)およびpET21b(+)(Novagen now EMD、Gibbstown、NJ)へライゲーションした。ライゲーション反応からのDNA産物を用いてBL(DE3)株を形質転換し、それを、上記のように、LB寒天/アンピシリンプレート上に蒔いた。プラスミドDNAを形質転換体から調製し、正しい挿入断片の存在を、制限エンドヌクレアーゼ消化およびDNAシークエンシングによって確認した。
【0156】
プラスミドpQE31は、アミノ末端に(6個のヒスチジン残基を含有するセグメントである)Hisタグを有するTspB−IGBの高レベルの細胞内発現を可能にした。他方、プラスミドpET22b(+)からの発現は、TspB−IGBのカルボキシル末端にHisタグ、およびTspB−IGBのアミノ末端に、タンパク質を周辺質への分泌へと方向づけるpelBリーダーペプチドを組み込むであろう。プラスミドpQE31の利点には、非常に高いレベルのタンパク質発現が挙げられ、一方、プラスミドpET22b(+)は、細胞外の細胞膜周辺腔内での天然の折り畳みを可能にする。TspB−IGB含有プラスミド構築物を、大腸菌BL21(DE3)株(Invitrogen)へ形質転換した。個々のコロニーを、100μg/mlアンピシリンを含有する50mlのLB培地中、37℃で一晩、振盪インキュベータ内で増殖させた。次の日、一晩の培養物を用いて、振盪インキュベータ内、37℃で、500mlの2x YT培地に播種した。pQE31−TspB−IGB構築物を含有する細胞についてOD620nmが0.5から1の間になったとき、IPTG(Sigma)を1mMの最終濃度まで、およびアンピシリンを200μg/mlまで加えた。培養を3時間、続け、細胞を8000xgで20分間の遠心分離によって収集し、上清を捨て、細胞ペレットを、下記のように処理するまで、−80℃で凍結させた。pET22b(+)−TspB−IGBプラスミドを含有するBL21(DE3)の培養物を、OD620nmが約0.6である時点で、22℃まで冷却した。IPTGおよびアンピシリンをそれぞれ、1mMおよび200μg/mlの最終濃度まで加え、培養を22℃で一晩、続けた。細胞を遠心分離によって回収し、下記のように用いるまで凍結させた。
【0157】
上記の方法に基づいて、組換えTspBを発現するためのいくつかの構築物を作製した。NmBのMC58株は、以下の3個のTspB遺伝子を有する:NMB1548、NMB1628、およびNMB1747。NMB1628およびNMB1747 TspB遺伝子は、同一のアミノ酸配列を有するポリペプチドをコードする。NMB1628由来の配列を、(N末端Hisタグを有する)pQEベクター内でクローン化し、NMB1548由来の配列を、pQEベクターおよび(C末端Hisタグを有する)pETベクターの両方へクローン化した。
【0158】
作製した追加のバージョンの構築物は以下を含んだ:1)pQEベクターおよびpETベクターの両方における、本明細書でIGBproおよび完全長NMB1628と呼ばれる、NMB1628定常領域およびプロリンリピート。下記の詳細を参照されたい。
【0159】
1)IGBproを含有するNMB1628由来のTspB:
NMB1628の保存された球状ドメイン、続いて保存されたプロリンリッチリピートにわたるDNA断片を下記のようにクローン化した(本明細書ではTspB−IGBproと呼ぶ)。ゲノムDNAを、QiagenゲノムDNA単離キット(Qiagen、Valencia、CA)を用い、製造会社の使用説明書に従ってMC58株から調製した。TspB−IGBpro(NMB1628)をコードするDNAを、以下のプライマーを用いるPCRによって増幅した:5’−CATGGATCCATCAGTTTCCCGCGCCGCCGTCTT−3’(配列番号51)および5’−CATAAGCTTGTTCTCAAAGCTGAACGCG−3’(配列番号52)。PCRは、New England Biolabs(Ipswich、MA)社製のTaq DNAポリメラーゼ、ヌクレオチド、および反応緩衝液を用いるIdaho Technology(Salt Lake City、Utah)RapidCycleサーモサイクラーでの95℃での変性、48℃でのアニーリング、および72℃での伸長の5サイクル、続いて、95℃での変性、52℃でのアニーリング、および72℃での伸長の25サイクルからなった。PCR断片を、QIAquick PCR精製キット(Qiagen)を用い、製造会社の使用説明書に従って精製した。TOPO−TAクローニングキット(Invitrogen)を用いて、製造会社の使用説明書の通り、PCR産物を、プラスミドpCR2.1(Invitrogen)へライゲーションし、ライゲーション反応産物を用いて、大腸菌TOP 10株(Invitrogen)を形質転換した。形質転換された大腸菌細胞を、100μg/mlアンピシリン(Sigma)およびX−Gal(ブロモ−クロロ−インドリル−ガラクトピラノシド、Gold Biotechnology)を含有するLB寒天プレート上に蒔いた。他の2つのゲノム遺伝子座(NMB1548およびNMB1747)由来のTspB−IGBproの増幅および組込みを排除して、正しい挿入断片を含むプラスミドDNAを有する白色コロニーについてスクリーニングするために、検証プライマー5’−GCCGCCGTCTTGTCAGGAGTC−3’(配列番号53)および5’−ATCAAGCACAGTCACTGTGAA−3’(配列番号54)を用いるコロニーPCRを実施した。その後、プラスミドDNAを、Qiagenミニ−プラスミドプレップキットを用いて、選択された形質転換体から調製し、TspB−IGBproをコードする正しい配列を、DNAシークエンシングによって検証した。
【0160】
挿入断片を有するプラスミドpCR2.1を、制限エンドヌクレアーゼBam HIおよびHind III(New England Biolabs)で消化した。生じた断片を、TAE緩衝液(40mM酢酸Tris、1mM EDTA)中の1.5%(重量/体積)アガロース(Promega、Madison、WS)ゲルにおける電気泳動によって単離した。電気泳動後、DNAバンドを、アガロースゲルを0.5%臭化エチジウム溶液(Gibco)中に浸水させることによって可視化した。予想されたサイズのTspB−IGBpro DNA断片に対応するバンドを、ゲルから切り取り、Qiagen QIAquick Gel Extractionキットを用いて精製することにより単離した。Bam HI/Hind III TspB−IGBpro DNA断片を、前もって同じ制限エンドヌクレアーゼで消化し、エビアルカリフォスファターゼ(USB、Cleveland、OH)で処理した発現プラスミドpQE31(Qiagen)へライゲーションした。その後、ライゲーション反応物を用いて、BL21(DE3)(Invitrogen)株を形質転換し、それを、上記のように、LB寒天/アンピシリンプレート上に蒔いた。正しい挿入断片を含むプラスミドDNAを有するコロニーを選択するために、検証プライマー5’−GCCGCCGTCTTGTCAGGAGTC−3’(配列番号53)および5’−ATCAAGCACAGTCACTGTGAA−3’(配列番号54)を用いるコロニーPCRを実施した。その後、DNAを、選択された形質転換体から調製し、TspB−IGBproをコードする正しい配列をDNAシークエンシングによって検証した。
【0161】
2)NMB1628由来の完全長TspB(TspB−FL)
NMB1628の完全長オープンリーディングフレーム(開始コドンから停止コドンまで)を下記のようにクローン化した(本明細書ではTspB−FLと呼ぶ)。ゲノムDNAを、QiagenゲノムDNA単離キット(Qiagen、Valencia、CA)を用い、製造会社の使用説明書に従ってMC58株から調製した。TspB−FLをコードするDNAを、プラスミドpET22b(+)へクローン化するためにプライマー対5’−AGCATATGTTGGGGATGTTTTCGGT−3’(配列番号55)および5’−AGAAGCTTGACTTCACGAGATACTGTGC−3’(配列番号56)、プラスミドpQE30へクローン化するためにプライマー対5’−ACGGATCCTTGGGGATGTTTTCGGTTAA−3’(配列番号57)および5’−AGAAGCTTCTAGACTTCACGAGATACTG−3’(配列番号58)を用いるPCRによって増幅した。両方の増幅反応についてのPCRは、New England Biolabs(Ipswich、MA)社製のTaq DNAポリメラーゼ、ヌクレオチド、および反応緩衝液を用いるIdaho Technology(Salt Lake City、Utah)RapidCycleサーモサイクラーでの95℃での変性、48℃でのアニーリング、および72℃での伸長の5サイクル、続いて、95℃での変性、52℃でのアニーリング、および72℃での伸長の25サイクルからなった。PCR断片を、QIAquick PCR精製キット(Qiagen)を用い、製造会社の使用説明書に従って精製した。TOPO−TAクローニングキット(Invitrogen)を用いて、製造会社の使用説明書の通り、PCR産物を、プラスミドpCR2.1(Invitrogen)へライゲーションし、ライゲーション反応産物を用いて、大腸菌TOP 10株(Invitrogen)を形質転換した。形質転換された大腸菌細胞を、100μg/mlアンピシリン(Sigma)およびX−Gal(Gold Biotechnology)を含有するLB寒天プレート上に蒔いた。Qiagenミニ−プラスミドプレップキットを用いて、TspB−FL断片の最初の増幅に用いたプライマーでのコロニーPCR中にPCR産物を生じた白色コロニーからプラスミドを調製した。正しいTspB−FL挿入断片配列を、DNAシークエンシングによって確認した。
【0162】
プラスミドを、制限エンドヌクレアーゼNde IおよびHind III、またはBam HIおよびHind III(New England Biolabs)で消化して、ベクターpET22b(+)およびpQE30、それぞれへクローン化するために用いる断片を遊離させた。生じた断片を、TAE緩衝液(40mM酢酸Tris、1mM EDTA)中の1.5%(重量/体積)アガロース(Promega、Madison、WS)ゲルにおける電気泳動によって単離した。電気泳動後、DNAバンドを、アガロースゲルを0.5%臭化エチジウム溶液(Gibco)中に浸水させることによって可視化した。予想されたサイズのTspB−FL DNA断片に対応するバンドを、ゲルから切り取り、Qiagen QIAquick Gel Extractionキットを用いて精製することにより単離した。Nde I/Hind IIIおよびBam HI/Hind III TspB−FL DNA断片を、前もって同じ制限エンドヌクレアーゼで消化し、エビアルカリフォスファターゼ(USB、Cleveland、OH)で処理した発現プラスミドpET22b(+)およびpQE30(Qiagen)、それぞれへライゲーションした。ライゲーション反応からのDNA産物を用いて、大腸菌TOP 10F’株の細胞(Invitrogen)を形質転換し、それを、上記のように、LB寒天/アンピシリンプレート上に蒔いた。Qiagenミニ−プラスミドプレップキットを用いて、上記のようにコロニーPCR中にPCR産物を生じた形質転換体からプラスミドを調製した。正しいTspB−FL挿入断片配列を、再び、DNAシークエンシングによって確認した。
【0163】
3)NMA0776および1797由来のTspB IGB
NMA0776およびNMA1797によってコードされる保存された球状ドメインTspB−IGBを、MC58におけるNMB1628によってコードされたTspB−IGBproについて上で記載されているように、クローン化した。ゲノムDNAを、QiagenゲノムDNA単離キット(Qiagen、Valencia、CA)を用い、製造会社の使用説明書に従ってZ2491株から調製した。NMA0776のTspB−IGBをコードするDNAを、以下のプライマー:5’−CATGGATCCATCAGTATCCCGCGCCG−3’(配列番号59)および5’−CATAAGCTTTGCTTCTGCGCTTCCG−3’(配列番号60)を用いるPCRによって増幅し、一方、NMA1797のTspB−IGBをコードするDNAを、以下のプライマー:5’−CATGGATCCATCAGTTTCCCGCGCCG−3’(配列番号61)および5’−CATAAGCTTTGCTTCCGCGCTTC−3’(配列番号62)を用いるPCRによって増幅した。両方の増幅反応についてのPCRは、New England Biolabs(Ipswich、MA)社製のTaq DNAポリメラーゼ、ヌクレオチド、および反応緩衝液を用いるIdaho Technology(Salt Lake City、Utah)RapidCycleサーモサイクラーでの95℃での変性、48℃でのアニーリング、および72℃での伸長の5サイクル、続いて、95℃での変性、52℃でのアニーリング、および72℃での伸長の25サイクルからなった。PCR断片を、QIAquick PCR精製キット(Qiagen)を用い、製造会社の使用説明書に従って精製した。TOPO−TAクローニングキット(Invitrogen)を用いて、製造会社の使用説明書の通り、PCR産物を、プラスミドpCR2.1(Invitrogen)へライゲーションし、ライゲーション反応産物を用いて、大腸菌TOP 10株(Invitrogen)を形質転換した。形質転換された大腸菌を、100μg/mlアンピシリン(Sigma)およびX−Gal(Gold Biotechnology)を含有するLB寒天プレート上に蒔いた。Qiagenミニ−プラスミドプレップキットを用いて、NMA0776およびNMA1797によってコードされるTspB−IGBの最初の増幅に用いたプライマーでのコロニーPCR中にPCR産物を生じた白色コロニーからプラスミドを調製した。正しいTspB−IGB挿入断片配列を、DNAシークエンシングによって確認した。
【0164】
両方のTspB−IGB挿入断片配列を有するプラスミドを、制限エンドヌクレアーゼBam HIおよびHind III(New England Biolabs)で消化して、クローン化するのに用いる2つの断片を遊離させた。生じた断片を、TAE緩衝液(40mM酢酸Tris、1mM EDTA)中の1.5%(重量/体積)アガロース(Promega、Madison、WS)ゲルにおける電気泳動によって単離した。電気泳動後、DNAバンドを、アガロースゲルを0.5%臭化エチジウム溶液(Gibco)中に浸水させることによって可視化した。予想されたサイズのTspB−IGB DNA断片に対応するバンドを、ゲルから切り取り、Qiagen QIAquick Gel Extractionキットを用いて精製することにより単離した。Hind III/Bam HI TspB−IGB DNA断片を、前もって同じ制限エンドヌクレアーゼで消化し、エビアルカリフォスファターゼ(USB、Cleveland、OH)で処理した発現プラスミドpQE31(Qiagen)へライゲーションした。ライゲーション反応物を用いて、大腸菌TOP 10F’株(Invitrogen)を形質転換し、それを、上記のように、LB寒天/アンピシリンプレート上に蒔いた。Qiagenミニ−プラスミドプレップキットを用いて、2つのTspB−IGB断片の最初の増幅に用いたプライマーでのコロニーPCR中にPCR産物を生じたコロニーからプラスミドDNAを調製した。正しいTspB−IGB挿入断片配列を、DNAシークエンシングによって確認した。
【実施例5】
【0165】
組換えTspB−IGBの精製
TspB−IGBタンパク質の精製を、Qiaexpressionist Handbook第5版(2003、Qiagen)に記載されているように、pQE31−TspB−IGB発現プラスミドについては変性条件下で、またはpET22b(+)−TspB−IGB発現プラスミドについては非変性条件下で、5ml Ni Sepharose HisTrap高性能HPカラム(GE BioScience、Piscataway、NJ)を用いて実施した。カラムからの画分を、Invitrogen社製のプレキャストゲルを用いるSDS−PAGEによって分析し、続いて、SimplyBlue SafeStain(Invitrogen)で染色し、Odyssey IRスキャナ(LI−COR)でゲルをスキャンすることによって記録した。変性条件下で精製されたTspB−IGBを含有する画分を混合し(合計6ml)、10mM Tris・HClおよび8M尿素を含有する100mM NaH2PO4緩衝液、pH8.0中30mlに希釈し、1日にわたって、1回に25mlのPBS緩衝液を加えることによって、周囲温度でPBS緩衝液(合計1L)中、透析した(1kDaカットオフSpectropor膜、Fisher)。最後に、再び折り畳まれたTspBタンパク質を、0.002%Tween 20および24mMスクロースを含有する4Lの2mMヒスチジン、pH6中で透析し、凍結乾燥した。非変性条件下で精製されたTspB−IGB(pET22b(+)−TspB−IGB構築物)を、0.002%Tween 20および24mMスクロースを含有する4Lの2mMヒスチジン、pH6中で透析し、凍結乾燥した。
【0166】
図6に示されているように、pQE31プラスミドまたはpET22b(+)プラスミドのどちらから発現した精製産物も、上記の両方の方法が、高純度のTspB−IGBポリペプチドを産生することができることを立証した。図6、レーンAは、pQE31から発現し、変性条件下で精製され、再び折り畳まれたTspB−IGBを示している。図6,レーンBは、pET21b(+)から発現し、非変性条件下で周辺質から精製されたTspB−IGBを示している。
【実施例6】
【0167】
組換えTspB−IGBのIg結合活性
産生され、変性条件下で精製され、その後、再び折り畳まれた、または非変性条件下で精製されたTspB−IGBポリペプチドを、様々な源由来のIgGに結合するそれらの能力について固相ELISAアッセイにより評価した。TspB−IGB(PBS中10μg/mlの濃度で100μl/ウェル)をマイクロタイタープレート(Immulon 2;Dynatech Laboratories,Inc.、Chantilly、VA)に4℃で一晩、吸着させた。PBSで3回、洗浄した後、プレートを、250μlのブロッキング緩衝液(1%ウシ血清アルブミンおよび0.1%アジ化ナトリウムを含有するPBS、pH7.4)で、室温で30〜60分間、ブロッキングした。プレートをPBSで3回、洗浄した後、4人の異なるドナー(ドナー1、3、4、および5)由来のヒト血清、ドナー3およびドナー1血清から精製されたIgG、Jackson ImmunoResearch Laboratories(West Grove、PA)製の精製ヒトIgG、IgM、およびIgA、骨髄腫細胞系から得られた(BioDesign International、Saco、ME)、およびCHO細胞において産生された(本発明者らの研究室からのmAb DA2)、精製ヒトIgG1、IgG2、IgG3、およびIgG4、4匹のマウス由来およびZymed(South San Francisco、CA)社製のマウス血清、ならびにマウス骨髄腫(全て、Southern Biotech、Birmingham、AL社製)およびハイブリドーマ(SEAM 12)細胞系から得られた精製マウスIgG1、IgG2a、IgG2b、IgG3、およびIgMモノクローナル抗体をウェルに加え、ブロッキング緩衝液中に段階希釈した。次の日、ウェルをPBSで5回、洗浄し、ブロッキング緩衝液中に1:3000希釈された、100μl/ウェルのアルカリフォスファターゼ連結型抗ヒトポリクローナル抗体(Jackson ImmunoResearch、West Grove、PA)または抗マウスポリクローナル抗体(IgA+IgG+IgM;Zymed、South San Francisco、CA)と周囲温度で1時間、インキュベートした。その後、プレートをPBSで洗浄し、基質緩衝液(50mM Na2CO3、1mM MgCl2、pH9.8)中に1mg/mlに希釈された100μlの新鮮に調製された基質(p−ニトロフェニルリン酸;Sigma)を各ウェルに加えた。405nmでの吸光度を、約60分後、測定した。各試料におけるIgG抗体濃度を、捕獲ELISA(マウスについてはSouthern Biotech、およびヒトについてはImmunological Consultants)によって決定した。下記の表1は結合データを要約する。
【0168】
【表1】

【0169】
*BC、基質での60分間の発色後の0.5のOD405nmを与える抗体の濃度。ストック溶液中の抗体濃度を、Ig標準を除いて、捕獲ELISAによって測定し、そのIg標準は製造会社によって提供された。DA2はCHO細胞において産生し、SEAM 12はハイブリドーマ細胞系において産生した。陰性対照はBSAであり、それはデータ点希釈においてのみ二次と同じであった。
【0170】
血清中か精製されたかにかかわらず、全てのヒトポリクローナル抗体の調製物は、陰性対照BSA単独と比較して、天然TspB−IGBおよび再び折り畳まれたTspB−IGBの両方への結合を示している(表1)。しかしながら、骨髄腫細胞系において産生した、商業的供給源から入手されたヒトおよびマウスのIgG標準モノクローナル抗体による結合は、Jackson ImmunoResearchから入手されたヒトIgMパラプロテインを除いて、ほとんど結合を示さなかった。対照的に、CHO細胞において産生したヒト化IgG1モノクローナル抗体(DA2)およびハイブリドーマ細胞系において産生したマウスIgG2aモノクローナル抗体(SEAM 12)について結合が観察された。結果より、組換えTspB−IGBが、完全長TspBのIgG結合機能的活性の少なくとも一部を含むこと、およびTspB−IGBがヒトIgGおよびマウスIgGの両方を結合することができることが示されている。等価のELISA読みを与えるIgの濃度がヒトIgについて5分の1〜10分の1であったため、ヒトIgへの優先度が高い可能性がある。また、マウスIgの存在下における細胞の蛍光は、ヒトIgの存在下においてより低かった(図1のDおよびGを比較する)。商業的に入手されたアイソタイプ標準の一部との明らかな反応性の欠如についての理由は、はっきりしないが、骨髄腫に存在するFcグリコフォームにおける違いと関係がある可能性がある(Farooq Mら、1997 Glycoconj J.14:489〜492)。あるいは、TspB−IGBには見られない完全長のTspBタンパク質の他のドメインが、結合に寄与している可能性がある。例えば、プロリンリッチセグメントは、単量体型より高い結合活性を示すことが予想される多量体の形成を促進する可能性がある。
【0171】
NMB1628コード化TspB対NMB1548コード化TspBによるヒトIgGへの結合
精製ヒトIgGの組換えTspB1628IGBおよびTspB1548IGBへの結合。アミノ末端にHisタグを有するpQEプラスミドから発現し、かつ非変性条件下で精製された、NMB1628およびNMB1548によりコードされるTspB IGBを、上記のように、マイクロタイタープレートのウェルに吸着させた(10μg/mlの100μl)。ブロッキング緩衝液でのブロッキング後、ブロッキング緩衝液中での精製ヒトIgGの段階希釈溶液を、ウェルに加え、4℃で一晩、放置しておいた。上記のように、プレートを洗浄し、結合したIgGを検出した。対照として、再び折り畳まれたTspB1628IGB(rTspB1628IGB)に対する抗血清(TspB1628IGBおよびTspB1548IGBに等しくよく結合する)を用いて、等量のタンパク質がプレート上にコーティングされたことを示した。
【0172】
図11は、NMB1628によりコードされたTspB IGBが精製ヒトIgGに強く結合したが、NMB1548によりコードされたTspB IGBはヒトIgGをあまり結合しなかった。
【0173】
精製TspB1628IGBの溶液は、ゲル様沈殿物を有することが観察されたが、精製TspB1548IGBの溶液は、類似したゲル様物質を含有していないように思われた。それぞれの溶液を顕微鏡スライド上にスポットし、カバーガラスで覆い、一晩、乾燥させた。次の日、スライドを調べると、TspB1628IGB試料が、特徴的な重合体構造の広範なネットワークを含有することが顕微鏡(Zeiss Axioplan)下で観察された。対照的に、TspB1548IGB試料については、少数のより短い重合体構造のみが観察された。2つの誘導体の重合体構造を形成する能力の違いが、ヒトIgGを結合するそれらの能力の違いに関連している可能性がある。図12は、NMB1628によりコードされたTspB IGB(図12、パネルA)が凝集して特徴的な重合体構造を形成したが、NMB1548によりコードされたTspB IGB(図12、パネルB)は限られた重合体構造を形成し、または全く形成しなかったことを示している。したがって、TspB IGB誘導体の重合体構造を形成する能力を、ヒトIgGを結合する能力に関連づけることができる。
【実施例7】
【0174】
TspBを発現する細菌の選択
図13は、フローサイトメトリーによって決定されたように(実施例1)、2人の異なるドナー(ドナー1およびドナー2)血清由来のヒトIgGを結合する、異なる莢膜群由来のいくつかのN.メニンギティディス株の能力を示している。菌株の一部(例えば、NmCの4243株)は、IgGに強く結合したが、他のもの(例えば、NmW135のA22株)はほとんど結合しなかったかまったく結合しなかった。ほとんどIgG結合を示さなかったかまったくIgG結合を示さなかったA22株、NMB株、およびZ1092株を、以下のように、ヒト補体の存在下での選択に供した。
【0175】
チョコレート寒天(Remel、Lenexa、KS)上で増殖した細菌コロニーを用いて、(材料および方法に記載されているように調製した)5%(体積/体積)の熱失活化したIgG除去ヒト血清を含有する5mlのCatlin 6培地(CDMHuS)に0.18のOD620nmまで播種し、0.72のOD620nmまで37℃で増殖させた。培養物を遠心分離して細菌を収集し、それを、同体積の培地中に懸濁した。細菌溶液の一部を、20%(体積/体積)ヒト補体を含有する1mlのCDM中に1:80,000希釈した。細菌を37℃で一晩、増殖させた。次の朝、細菌を、5mlのCDMHuS中に0.18のOD620nmまで希釈し、再び、0.72のOD620nmまで増殖させた。その手順を2回、繰り返し、20%ヒト補体中での一晩の選択の各ラウンド後に得られた細菌を、フローサイトメトリーによってIgG結合について分析した。
【0176】
図14に示されているように、IgG結合について陽性であった細胞の画分は、選択のラウンドごとに増加した。図14における参照として、選択前のIgGの菌株への結合(図13)が、白色ヒストグラムで示されている。IgGの結合活性の発現は、ヒト血清因子の存在下で増殖しなかった細菌においては変化しやすくあり得る。しかしながら、IgGの結合は、活性補体を含有するヒト血清における繰り返しの培養によって回復した。結合を測定するために用いられた細菌、および下記の実施例に記載された抗TspB−IGBの殺菌活性(BCA)について用いられ得る細菌は、この実施例に記載された方法を用いて選択された。細菌を、将来用いるために、5mlのCDMHuS中で増殖した細菌を200μlのヒト全血清に懸濁し、その後、ドライアイス上で20μlのアリコートを凍結させることによって貯蔵した。細菌アリコートを、使用するまで−80℃で貯蔵した。
【実施例8】
【0177】
抗血清のナイセリア−メニンギティディス細菌への結合の評価
上の材料および方法のセクションに記載されているように免疫されたマウスから抗血清を収集した。マウスを以下で免疫した:
1)変性条件下および非変性条件下で精製された、pQEに発現したNMB1628IGB(rfTspB1628IGB)
2)pQEから産生され、かつ非変性条件下で精製されたNMB1628IGBPro(nTspB1628IGB);ならびに
3)pETから産生され、かつ非変性条件下で精製されたNMB1548(nTspB1548IGB)。
【0178】
TspB−IGBに基づいたワクチンの、ナイセリアに結合する抗体を誘発する能力を、フローサイトメトリーによって試験した。TspB/Orf6を発現するように誘導された細胞が、誘導されなかった細胞と比較することができるように、ナイセリア株を、CDMまたはCDMHuSにおいて約0.6のO.D.620まで増殖させた。細胞をペレット化し、洗浄し、ブロッキング緩衝液に最初の体積の80%で再懸濁した。その後、細菌懸濁液を、最終濃度が50%の細菌懸濁液、10%抗血清、および40%ブロッキング緩衝液になるように、反応混合物に加えた。混合物を、周期的に穏やかに撹拌しながら4℃で2時間、インキュベートした。細胞を、遠心分離によってペレット化し、フルオレセインイソチオシアネート(FITC)連結型ヤギ抗マウス二次抗体のブロッキング緩衝液中の1:300希釈溶液の100μlに再懸濁した。IgG(H+L)F(ab’)2およびIgM(Jackson ImmunoResearch、West Grove、PA)、加えてIgG1、IgG2a、IgG2b、およびIgG3(Bethyl Laboratories、Montgomery、TX)に対するFITC連結型抗体を用いた。二次抗体を加えた後、チューブを、周期的に穏やかに撹拌しながら4℃で1時間、インキュベートした。細胞をペレット化し、新鮮に作製されかつ濾過された、0.5%ホルムアルデヒド(重量/体積)を含有する450μlのPBS中に再懸濁した。その後、試料を、フローサイトメトリー(BD FACSCalibur System、BD Biosciences、San Jose、CA)によって分析した。
【0179】
図15は、抗1628IGBのNmBのMC58株(図15、パネルA)またはNmAのZ2491株(図15、パネルB)への結合のフローサイトメトリー実験を示す。対照として、抗血清の添加なし、またはアジュバントのみの対照血清が挙げられる。両方のパネルにおいて、グラフは右へシフトしており、それは、抗1628IGBの蛍光の増加に対応した。このように、ワクチンによって誘発された抗体は、NmA株およびNmB株の両方に強く結合した。
【0180】
図15のパネルAおよびBにおける下の方のパネルは、ヒトIgGの各菌株への結合を示す。ヒトIgGの細菌への結合のレベルは、rfTspB1628IGBに対する抗血清の存在下で減少し、抗血清が、ヒトIgGの細菌への結合を阻害したことを示唆する。
【0181】
図16は、以下の免疫原によって誘発された抗体の結合が比較されている、NmBのMC58株に関する類似した結合実験を示す:
1)ミョウバンアジュバント単独
2)TspB1548IGB
3)非変性条件下で精製されたTspB1628IGB
4)変性条件下で精製され、かつ再び折り畳まれたTspB1628IGB(rfTspBIGB1628)。
【0182】
各実験において、細胞を、CDM+5%Cohn FIV+1%精製ヒトIgG、および示された抗血清の1:200の希釈溶液中で増殖させた。細胞が0.6のOD620nmに達した後、細胞を2つの等しい画分へ分割した。一方の画分を抗マウスIgG−FITC二次抗体で処理し、他方を抗ヒトIgG−FITC二次抗体で処理して、それぞれのIgGの結合を検出した。結果より、rfTspB1628IGBが、NmBのMC58株に最も強く結合するIgG抗体を誘発したことが示されている。また、3つのTspBIGBタンパク質によって誘発された抗体が、ヒトIgG結合を阻害することができ、抗rfTspB1628IGBがヒトIgG結合を遮断するのに最も効果的であった。TspB、特にIGBドメインが、ヒトIgG結合活性を媒介する、Nm株によって発現されたタンパク質であることが見出された。したがって、TspBIGBに基づいたワクチンによって誘発される抗体は、ヒト血液中でのNm株の生存にとって重要な機構であるヒトIgG結合を遮断することができる。
【実施例9】
【0183】
補体活性化におけるタンパク質沈着についての試験
TspB IGBワクチンでの免疫化によって誘発された抗体の、B群、C群、X群、Y群、およびW135群細菌の代表的なナイセリア−メニンギティディス細菌へのヒト補体成分の沈着を活性化する能力は、下記のように決定することができる。
【0184】
抗体を誘発するために用いられたTspB−IGBワクチンは、任意のアジュバント(例えば、水酸化アルミニウム、リン酸アルミニウム、MF59、フロイントアジュバントなど)と組み合わされたTspB−IGBポリペプチドを含有していてもよい。ワクチンの抗血清による補体活性化は、Welschら(Welschら、2003 J.Infec.Dis.188:1730)によって記載されているように決定してもよい。簡単に述べれば、ナイセリア細胞を、CDM/dHuS中で約0.6のOD620まで増殖させる。細胞をペレット化し、1%(重量/体積)BSA(Sigma−Aldrich)を含有するDulbeccoのPBS(Invitrogen、Carlsbad、CA)(D−BSA)で洗浄し、最初の増殖培地のD−BSAの体積の半分に再懸濁する。D−BSA中に1:20または1:200まで希釈した2μgまたは10μgのいずれかで免疫されたマウス由来のプールされた抗血清と細菌(30μl)を混合する。ナイセリア細胞に対する抗体の非存在について試験されたドナー由来のヒト補体を、200μlの全体積において5%(体積/体積)の濃度まで加える。時々撹拌しながら、周囲温度で30分間、反応を進行させる。細胞をペレット化し、200μlのD−BSAで洗浄し、FITC連結型ヒツジ抗ヒトC3c抗体(BioDesign International、Saco、ME)をD−BSAに加える。時々撹拌しながらの氷上での30分間のインキュベーション後、細胞をペレット化し、0.5%(重量/体積)ホルムアルデヒドを含有する滅菌濾過されたPBS緩衝液中に再懸濁し、フローサイトメトリー(BD FACSCalibur System、BD Biosciences、San Jose、CA).によって分析する。
【0185】
細胞表面への補体成分の沈着は、細胞の蛍光を増加させ、蛍光ピークにおけるグラフの右へのシフトによって示され得る。抗体活性化は、活性のある補体、または熱失活化補体を含む抗血清に関してのみの細胞の蛍光の欠如によって示され得る。フローサイトメトリーからの細菌をさらにZeiss Axioplan(Carl Zeiss,Inc.)蛍光顕微鏡を用いる顕微鏡法によって分析する。NmB細菌の細胞表面への補体因子沈着の活性化は、ナイセリア−メニンギティディスによって引き起こされる疾患からの防御と関連づけられる(Welschら、2003 J.Infec.Dis.188:1730)。
【実施例10】
【0186】
血清殺菌アッセイ
補体媒介性殺菌抗体活性。抗TspB IGB抗血清の、ヒト補体の存在下において溶菌を媒介する能力は、血清殺菌アッセイ(SBA)によって測定することができる。殺菌アッセイを、以前に記載されているように(Moe G.R.ら、2002 Infect Immun 70:6021〜31)、チョコレート寒天プレート上で一晩増殖し、その後CDM/dHuS中で培養された対数増殖中期の細胞を用いて、実施し、またはTspB IGBを発現するように誘導されていない細胞と比較するために、0.25%グルコースを追加されたMueller Hinton培地ブロスが用いられる。チョコレート寒天プレートから採取された細胞を、培養を開始するために約0.18のOD620nmまで培地中に希釈し、その後、約0.62のOD620nmまで増殖させる。細菌をペレット化し、その後、1%BSA(Equitech)を含む、または含まない、Ca+およびMg+含有Dulbeccos緩衝食塩水(DBS;Mediatech.Manassas VA)中で洗浄する。各アッセイに用いられるヒト補体の供給源は、60%補体の存在下での試験菌株に対する内因性SBAについて評価される。
【0187】
最終反応混合物は、試験血清の異なる希釈溶液、および20%(体積/体積)ヒト補体を含有する。緩衝液は、0.9mM CaCl2×2H2O、0.5mM MgCl2×6H2O、および1%(重量/体積)BSAを含有する、Dulbeccoのリン酸緩衝食塩水(Sigma−Aldrich)である。
【0188】
補体の供給源は、検出可能な内因性殺菌活性をもたない健康な成人由来のヒト血清である(Granoffら、1998 J Immunol 160:5028〜36;Welschら、2003 J.Infec.Dis.188:1730)。血清殺菌力価は、0時間目における1mlあたりの対照CFUと比較して、反応混合物における細菌の60分間のインキュベーション後の1mlあたりCFUにおける50%減少を生じる、血清希釈度として定義される。典型的には、陰性対照抗体および補体とインキュベートされた細菌が、60分間のインキュベーション中にCFU/mLにおける150〜200%の増加を示す。
【実施例11】
【0189】
乳児ラット防御
乳児ラットにおける受動防御。抗TspB−IGB抗血清は、下記のように、菌血症からの受動防御について試験することができる。この実験の結果は、TspB−IGBに基づいたワクチンの、ヒトにおいて侵襲性疾患から防御する能力を決定することができる。
【0190】
乳児(生後4〜6日)のウィスターラットを母親から引き離し、それぞれ5匹のラットの群へランダムに分けた。それぞれの子に1%BSAを含有する滅菌PBS(PBS−BSA)中に1:10で希釈した100μlの抗血清を腹腔内に与え、その後、母親に戻し、同時に、負荷細菌を調製する。NmBのM986株またはNmCの4243株をCDM−/dHuS中でO.D.620=約0.6まで増殖させ、洗浄し、PBS−BSA中に再懸濁し、104CFU/mlまで希釈する。その後、各ラットの子に、最終負荷用量が約1000CFU/ラットであるように、100μlの細菌を与える。その後、子を母親に戻す。次の日、子をイソフルランで麻酔し、ヘパリン処理された針を用いて心穿刺により血液を採取する。その動物をCO2無酸素により安楽死させ、100μl、10μl、および1μlの血液をチョコレート寒天(Remel)上にプレーティングする。プレートを37℃、5%CO2で一晩、インキュベートした後、コロニーを数える。
【実施例12】
【0191】
髄膜炎菌性菌血症のエクスビボのヒト血液モデルにおける受動防御
代替として、ワクチンによって誘発される抗体の、ナイセリア−メニンギティディスによって引き起こされる疾患から防御する能力を評価することへのアプローチは、抗血清が、エクスビボでのヒト血液中において、ナイセリア−メニンギティディスB群を溶解すること、またはその増殖を阻害することができるかどうかを決定することである。試験される抗血清(上記のようにTsp−IGBに基づいたワクチンで免疫されたCD1マウス由来のプールされた抗血清)および試験細菌(上記のように、CDM/dHuS培地中に新鮮に増殖した約1000CFUのナイセリア株)を、下記のように、滅菌ガラスバイアル中で試験菌株に対する抗体を欠くドナーから新鮮に採取されたヒト血液中で混合し、調製し、試験する。
【0192】
エクスビボ受動防御アッセイ(PPA)。抗凝固剤として組換えヒルジン(レピルジン、27.8μg/ml最終濃度)を含有するシリンジを用いて健康な成人由来の新鮮な血液を採取する。血液ドナーは、血清が上記の血清殺菌活性を測定するための補体について用いられた人と同じであってもよい。マイクロタイタープレートの各ウェルへ、65μlの血液、25μlの試験血清、ならびに15%の加熱補体および1%ウシ血清アルブミン(Equitech)を含有する10μlのPBS緩衝液、ならびに約4000CFUを加える。陽性対照は、関連抗PorAモノクローナル抗体(NIBSC、P1.4またはP1.12)、ならびにそれぞれの試験菌株に対する、高い、中位の、または低いオプソニン作用性殺活性(PlestedおよびGranoff 2008 Clin Vaccine Immunol 15:799〜804)および血清殺菌活性をもつヒト血清試料を含み得る。陰性対照血清は、補体ドナー由来の熱失活血清または緩衝液単独であり得る。マイクロタイタープレートを、成分が完全に混合するようにMS 3デジタル小型振盪機(IKA、Wilmington、NC)において1分あたり500振動で撹拌しながら、5%CO2中、37℃で90分間、インキュベートする。ウェルから試料を取り出し、5%CO2中、37℃でインキュベートする、チョコレート寒天プレート上で、定量的培養を実施する。
【0193】
次の日、CFU/mlを確認し、その結果を、陰性対照試験血清についての時間0におけるそれと比較した、90分目でのCFU/mlにおけるlog10変化として計算する。異なる日に実施した同型アッセイの再現性に基づいて、陽性の受動防御活性は、CFU/mlにおいて、時間0におけるそれと比較して、≧0.5log10減少(すなわち、CFU/mlにおける約70%減少)を与える血清として定義することができる。
【特許請求の範囲】
【請求項1】
T細胞刺激タンパク質B(TspB)の連続した免疫グロブリン結合ドメインまたはその抗原性断片と少なくとも75%のアミノ酸配列同一性を有する連続したアミノ酸配列を含む単離されたポリペプチドであって、前記連続したアミノ酸配列がTspBの完全長成熟アミノ酸配列より短く、および/または前記ポリペプチドが少なくとも部分的に変性している、単離されたポリペプチド。
【請求項2】
前記連続した免疫グロブリン結合ドメインが配列番号48を含む、請求項1に記載の単離されたポリペプチド。
【請求項3】
前記連続した免疫グロブリン結合ドメインが配列番号47を含む、請求項1に記載の単離されたポリペプチド。
【請求項4】
前記連続した免疫グロブリン結合ドメインが配列番号14または配列番号17を含む、請求項1に記載の単離されたポリペプチド。
【請求項5】
前記抗原性断片が、配列番号13、14、15、16、17、18、19、20、21、または22に示されたアミノ酸配列と少なくとも85%のアミノ酸配列同一性を含む変種群ペプチド(VN)を含む、請求項1に記載の単離されたポリペプチド。
【請求項6】
前記ポリペプチドが担体タンパク質にコンジュゲートしている、請求項1に記載の単離されたポリペプチド。
【請求項7】
前記ポリペプチドが抗原にコンジュゲートしている、請求項1に記載の単離されたポリペプチド。
【請求項8】
請求項1に記載のポリペプチドをコードする核酸。
【請求項9】
請求項1〜7のいずれか一項に記載の単離されたポリペプチド、および
薬学的に許容される賦形剤
を含む免疫原性組成物。
【請求項10】
膜小胞を含む、請求項9に記載の免疫原性組成物。
【請求項11】
TspBのIg結合活性を阻害するための候補作用物質を試験する方法であって、
前記候補作用物質を、それぞれが配列番号48と少なくとも85%のアミノ酸配列同一性を含むポリペプチドに接触させるステップを含み、
TspBに対して効果的な候補作用物質が、前記ポリペプチドの凝集物の阻害および/または分散を生じる、方法。
【請求項12】
対象においてナイセリア−メニンギティディスに対する免疫応答を誘導する方法であって、
請求項9に記載の免疫原性組成物を対象に、対象において抗体の産生を誘発するのに効果的な量で投与するステップ
を含む方法。
【請求項13】
前記対象がヒトである、請求項12に記載の方法。
【請求項14】
前記投与するステップが、N.メニンギティディス株のT細胞刺激タンパク質BのヒトIgへの結合を阻害する抗体の産生をもたらす、請求項12に記載の方法。
【請求項15】
請求項1に記載のポリペプチドを発現する宿主細胞を既知組成培地において培養するステップを含み、
前記既知組成培地がヒト血液成分を含み、前記培養するステップが、ポリペプチドの発現をもたらす条件下で行われる、方法。
【請求項16】
前記ヒト血液成分がヒトコーン分画IVを含む、請求項15に記載の方法。
【請求項17】
前記ヒト血液成分がヒト血清を含む、請求項15に記載の方法。
【請求項18】
前記宿主細胞がナイセリア細菌である、請求項15に記載の方法。
【請求項19】
前記ポリペプチドを含有する小胞を得るステップを含む、請求項15に記載の方法。
【請求項20】
TspBのヒトIgGへの結合の阻害のための候補作用物質をスクリーニングする方法であって、
TspBのIg結合領域を含む第1のポリペプチドの、ヒトIgまたはその断片を含む第2のポリペプチドへの結合を前記候補作用物質の存在下で検出するステップ
を含む方法。
【請求項21】
前記検出するステップが、ヒト血液の成分を追加された既知組成培地の存在下で行われ、前記既知組成培地がヒトIgを除去されている、請求項20に記載の方法。
【請求項22】
前記TspBが細菌の表面上に存在し、前記細菌が、ヒト血液成分を追加された既知組成培地中で培養される、請求項20に記載の方法。
【請求項23】
前記細菌がナイセリア細菌である、請求項22に記載の方法。
【請求項24】
前記細菌が、配列番号48に示された連続したアミノ酸配列と少なくとも85%のアミノ酸配列同一性を含むポリペプチドを発現するように遺伝子改変されている、請求項22に記載の方法。
【請求項25】
前記TspBが、ヒト血液の1つまたは複数の成分を追加された既知組成培地の存在下で増殖した細菌由来である、請求項22に記載の方法。
【請求項26】
候補作用物質が抗体である、請求項20に記載の方法。
【請求項1】
T細胞刺激タンパク質B(TspB)の連続した免疫グロブリン結合ドメインまたはその抗原性断片と少なくとも75%のアミノ酸配列同一性を有する連続したアミノ酸配列を含む単離されたポリペプチドであって、前記連続したアミノ酸配列がTspBの完全長成熟アミノ酸配列より短く、および/または前記ポリペプチドが少なくとも部分的に変性している、単離されたポリペプチド。
【請求項2】
前記連続した免疫グロブリン結合ドメインが配列番号48を含む、請求項1に記載の単離されたポリペプチド。
【請求項3】
前記連続した免疫グロブリン結合ドメインが配列番号47を含む、請求項1に記載の単離されたポリペプチド。
【請求項4】
前記連続した免疫グロブリン結合ドメインが配列番号14または配列番号17を含む、請求項1に記載の単離されたポリペプチド。
【請求項5】
前記抗原性断片が、配列番号13、14、15、16、17、18、19、20、21、または22に示されたアミノ酸配列と少なくとも85%のアミノ酸配列同一性を含む変種群ペプチド(VN)を含む、請求項1に記載の単離されたポリペプチド。
【請求項6】
前記ポリペプチドが担体タンパク質にコンジュゲートしている、請求項1に記載の単離されたポリペプチド。
【請求項7】
前記ポリペプチドが抗原にコンジュゲートしている、請求項1に記載の単離されたポリペプチド。
【請求項8】
請求項1に記載のポリペプチドをコードする核酸。
【請求項9】
請求項1〜7のいずれか一項に記載の単離されたポリペプチド、および
薬学的に許容される賦形剤
を含む免疫原性組成物。
【請求項10】
膜小胞を含む、請求項9に記載の免疫原性組成物。
【請求項11】
TspBのIg結合活性を阻害するための候補作用物質を試験する方法であって、
前記候補作用物質を、それぞれが配列番号48と少なくとも85%のアミノ酸配列同一性を含むポリペプチドに接触させるステップを含み、
TspBに対して効果的な候補作用物質が、前記ポリペプチドの凝集物の阻害および/または分散を生じる、方法。
【請求項12】
対象においてナイセリア−メニンギティディスに対する免疫応答を誘導する方法であって、
請求項9に記載の免疫原性組成物を対象に、対象において抗体の産生を誘発するのに効果的な量で投与するステップ
を含む方法。
【請求項13】
前記対象がヒトである、請求項12に記載の方法。
【請求項14】
前記投与するステップが、N.メニンギティディス株のT細胞刺激タンパク質BのヒトIgへの結合を阻害する抗体の産生をもたらす、請求項12に記載の方法。
【請求項15】
請求項1に記載のポリペプチドを発現する宿主細胞を既知組成培地において培養するステップを含み、
前記既知組成培地がヒト血液成分を含み、前記培養するステップが、ポリペプチドの発現をもたらす条件下で行われる、方法。
【請求項16】
前記ヒト血液成分がヒトコーン分画IVを含む、請求項15に記載の方法。
【請求項17】
前記ヒト血液成分がヒト血清を含む、請求項15に記載の方法。
【請求項18】
前記宿主細胞がナイセリア細菌である、請求項15に記載の方法。
【請求項19】
前記ポリペプチドを含有する小胞を得るステップを含む、請求項15に記載の方法。
【請求項20】
TspBのヒトIgGへの結合の阻害のための候補作用物質をスクリーニングする方法であって、
TspBのIg結合領域を含む第1のポリペプチドの、ヒトIgまたはその断片を含む第2のポリペプチドへの結合を前記候補作用物質の存在下で検出するステップ
を含む方法。
【請求項21】
前記検出するステップが、ヒト血液の成分を追加された既知組成培地の存在下で行われ、前記既知組成培地がヒトIgを除去されている、請求項20に記載の方法。
【請求項22】
前記TspBが細菌の表面上に存在し、前記細菌が、ヒト血液成分を追加された既知組成培地中で培養される、請求項20に記載の方法。
【請求項23】
前記細菌がナイセリア細菌である、請求項22に記載の方法。
【請求項24】
前記細菌が、配列番号48に示された連続したアミノ酸配列と少なくとも85%のアミノ酸配列同一性を含むポリペプチドを発現するように遺伝子改変されている、請求項22に記載の方法。
【請求項25】
前記TspBが、ヒト血液の1つまたは複数の成分を追加された既知組成培地の存在下で増殖した細菌由来である、請求項22に記載の方法。
【請求項26】
候補作用物質が抗体である、請求項20に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5−1】


【図5−2】


【図5−3】


【図5−4】


【図6】


【図7】


【図8−1】


【図8−2】


【図9】


【図10−1】


【図10−2】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5−1】


【図5−2】


【図5−3】


【図5−4】


【図6】


【図7】


【図8−1】


【図8−2】


【図9】


【図10−1】


【図10−2】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公表番号】特表2013−509881(P2013−509881A)
【公表日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願番号】特願2012−537998(P2012−537998)
【出願日】平成22年11月4日(2010.11.4)
【国際出願番号】PCT/US2010/055505
【国際公開番号】WO2011/057011
【国際公開日】平成23年5月12日(2011.5.12)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.TEFLON
【出願人】(505307563)チルドレンズ ホスピタル アンド リサーチ センター アット オークランド (12)
【Fターム(参考)】
【公表日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願日】平成22年11月4日(2010.11.4)
【国際出願番号】PCT/US2010/055505
【国際公開番号】WO2011/057011
【国際公開日】平成23年5月12日(2011.5.12)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.TEFLON
【出願人】(505307563)チルドレンズ ホスピタル アンド リサーチ センター アット オークランド (12)
【Fターム(参考)】
[ Back to top ]

