TGFβに対する抗体
【課題】抗体分子、特に、トランスフォーミング増殖因子β(TGFβ)に結合する抗体分子、およびその使用に関する方法を提供する。
【解決手段】TGFβ1、TGFβ2、およびTGFβ3に結合し、かつ好ましくは中和する抗体分子、いわゆる「汎特異的」抗体分子、ならびにそのような抗体分子の使用。好ましい態様は抗体分子であり、全抗体(例えば、IgG1もしくはIgG4などのIgG)、または抗体断片(例えば、scFv、Fab、dAb)であってよい。
【解決手段】TGFβ1、TGFβ2、およびTGFβ3に結合し、かつ好ましくは中和する抗体分子、いわゆる「汎特異的」抗体分子、ならびにそのような抗体分子の使用。好ましい態様は抗体分子であり、全抗体(例えば、IgG1もしくはIgG4などのIgG)、または抗体断片(例えば、scFv、Fab、dAb)であってよい。
【発明の詳細な説明】
【技術分野】
【0001】
技術分野
本発明は、抗体分子、特に、トランスフォーミング増殖因子β(TGFβ)に結合する抗体分子、およびその使用に関する。より具体的には、本発明は、TGFβ1、TGFβ2、およびTGFβ3に結合し、かつ好ましくは中和する抗体分子、いわゆる「汎特異的(pan-specific)」抗体分子、ならびにそのような抗体分子の使用に関する。
【背景技術】
【0002】
背景
TGFβは、1981年に最初に同定された(Roberts et al., 1981)。ヒトでは、3種のアイソフォーム、すなわちTGFβ1、TGFβ2、およびTGFβ3(それぞれ、Swiss Protアクセッション番号P01137、P08112、およびP10600)があり、これらは、生物学的に活性な状態において、鎖間のジスルフィド架橋によって結合された2つの112アミノ酸単量体を含む、25kDaのホモ二量体である。TGFβ1は、TGFβ2と27個のアミノ酸が異なり、かつTGFβ3と22個のアミノ酸が異なり、主に保存的アミノ酸変化である。これらの差異は、X線結晶構造解析によって決定されたTGFβの3次元構造上にマッピングされ(Schlunegger et al.,1992;Peer et al.,1996)、かつ受容体結合領域が定められた(Griffith et al., 1996;Qian et al., 1996)。
【0003】
ヒトTGFβは、マウスTGFβに極めて類似している:ヒトTGFβ1とマウスTGFβ1のアミノ酸の差異はわずか1つであり、ヒトTGFβ2とマウスTGFβ2のアミノ酸の差異はわずか3つであり、ヒトTGFβ3は、マウスTGFβ3と同一である。結果として、トランスジェニックマウスを含むマウスにおけるヒトTGFβに対する抗体の作製は、難しい場合がある。
【0004】
TGFβは、細胞の増殖および分化、胚発生、細胞外基質形成、骨の発達、創傷治癒、造血、ならびに免疫反応および炎症反応に関与している多機能性サイトカインである(Border et al., 1995a)。TGFβの調節解除は、ヒトにおいて、多数の状態、例えば、先天性欠損、癌、慢性炎症性疾患、自己免疫性疾患、および線維症に関係があるとされている病理学的プロセスを招く(Border et al., 1994;Border et al., 1995b)。
【0005】
拮抗物質として中和抗体を用いて、多くの線維症動物モデル(Border et al., 1995b;Border et al., 1994)、例えば、糸球体腎炎(Border et al., 1990)、神経瘢痕化(Logan et al., 1994)、皮膚瘢痕化(Shah et al., 1994)、および肺線維症(Giri et al., 1993)において研究が実施された。これらのモデルによって表される疾患はすべて、新しい治療用生成物が必要とされているがまだ実現されていない(Bonewald, 1999;Jackson, 1998)。しかしながら、これらおよび他の動物研究において使用された抗体は、動物において産生され、かつヒトにおけるこれらの治療的利益は、それらが免疫原性応答を誘導する可能性、およびそれらの急速な薬物動態学的クリアランスが原因で、制限されることがある(Vaughan et al., 1998)。TGFβによって媒介される疾患の治療のためには、ヒト抗体がより望ましい。
【0006】
様々な抗体断片が、特異的かつ十分な親和力で標的タンパク質に結合できることは公知である。例えば、単鎖Fv(scFv)として公知である、短いペプチドリンカーによって結合された重鎖の可変ドメイン(VH)および軽鎖の可変ドメイン(VL)のみを含む抗体断片が広く使用されている。TGFβ1のヒト中和抗体(CAT-192)またはTGFβ2のヒト中和抗体(CAT-152もしくはTrabio(商標))が、以前に作製されている(EP0945464,EP0853661,Thompson et al. 1999)。しかしながら、当技術分野において利用可能なTGFβ抗体の大多数は、ヒト以外に由来する。さらに、本発明以前は、TGFβに対する汎特異的な唯一のモノクローナル抗体は、げっ歯動物由来であった。
【0007】
中和エピトープおよび非中和エピトープの両方に対するヒトTGFβ1およびヒトTGFβ2に結合するポリクローナル抗体が、ウサギ(Danielpour et al. 1989b;Roberts et al., 1990)、ニワトリ(R&D Systems, Minneapolis)、およびシチメンチョウ(Danielpour et al., 1989c)において産生させられた。TGFβの部分配列に相当するペプチドもまた、ウサギにおいてポリクローナル中和抗血清を産生させるための免疫原として使用された(Border et al., 1990;Flanders et al., 1988)。このような非ヒトポリクローナル抗体は、ヒトでの治療的使用には不適切である。
【0008】
1D11.16は、様々なインビトロアッセイ法においてヒトおよびマウスのTGFβ1、TGFβ2、およびTGFβ3を中和する、マウスの汎特異的抗TGFβ抗体であり(Dasch et al., 1989;Dasch et al., 1996;R&D System MAB1835の製品情報シート)、かつ線維症の動物モデルにおける原理証明研究において有効である(Ling et al., 2003;Miyajima et al., 2000;Schneider et al., 1999;Khanna et al., 1999;Shenkar et al., 1994)。しかしながら、1D11.16は、マウスのモノクローナル抗体であるため(Dasch et al., 1989;Dasch et al., 1996)、ヒトでの治療的使用には不適切である。
【発明の概要】
【0009】
発明の概要
本発明の様々な局面において、以下を含む態様の主題が提供される。本発明のさらなる局面および態様は、本明細書における説明において開示される。
【0010】
本発明は、TGFβ、特にヒトTGFβに対する特異的結合メンバーを提供する。TGFβ1、TGFβ2、およびTGFβ3を対象とする特異的結合メンバーが、特に提供される。本発明の範囲内の好ましい態様は抗体分子であり、全抗体(例えば、IgG1もしくはIgG4などのIgG)、または抗体断片(例えば、scFv、Fab、dAb)であってよい。抗体の抗原結合領域および抗体の抗原結合部位が、このような領域を含む抗体のVHドメインおよびVLドメインと同様に提供される。VHドメインおよびVLドメイン内で、相補性決定領域、すなわちCDRが提供される。CDRは、場合によっては、異なるフレームワーク領域(FR)内で提供されて、VHドメインまたはVLドメインを形成することがある。抗原結合部位は、抗体のVHドメインおよび/もしくはVLドメイン、またはそれらの抗原結合部分からなり得る。
【0011】
1つの局面において、本発明は、抗体の抗原結合部位、HCDRセット、LCDRセット、もしくは両方、および/またはヒト抗体のVHドメイン、VLドメイン、もしくは両方を含む、ヒトTGFβに対する特異的結合メンバーを提供する。
【0012】
HCDR1、HCDR2、およびHCDR3のセットは、以下の群より選択される配列を有し得る:
HCDR1 SEQ ID NO:3、HCDR2 SEQ ID NO:4、HCDR3 SEQ ID NO:5(本明細書において、「HCDRのPET1073G12セット」と呼ばれる);
HCDR1 SEQ ID NO:13、HCDR2 SEQ ID NO:14、HCDR3 SEQ ID NO:15(本明細書において、「HCDRのPET1074B9セット」と呼ばれる);
HCDR1 SEQ ID NO:23、HCDR2 SEQ ID NO:24、HCDR3 SEQ ID NO:25(本明細書において、「HCDRのPET1287A10セット」と呼ばれる)。
【0013】
LCDR1、LCDR2、およびLCDR3のセットは、以下の群より選択される配列を有し得る:
LCDR1 SEQ ID NO:8、LCDR2 SEQ ID NO:9、LCDR3 SEQ ID NO:10(本明細書において、「LCDRのPET1073G12セット」と呼ばれる);
LCDR1 SEQ ID NO:18、LCDR2 SEQ ID NO:19、LCDR3 SEQ ID NO:20(本明細書において、「LCDRのPET1074B9セット」と呼ばれる);
LCDR1 SEQ ID NO:28、LCDR2 SEQ ID NO:29、LCDR3 SEQ ID NO:30(本明細書において、「LCDRのPET1287A10セット」と呼ばれる)。
【0014】
HCDRのPET1073G12セットは、LCDRのPET1073G12セットと合わせて、本明細書においてCDRのPET1073G12セットと呼ばれる。
【0015】
HCDRのPET1074B9セットは、LCDRのPET1074B9セットと合わせて、本明細書においてCDRのPET1074B9セットと呼ばれる。
【0016】
HCDRのPET1287A10セットは、LCDRのPET1287A10セットと合わせて、本明細書においてCDRのPET1287A10セットと呼ばれる。
【0017】
本明細書において開示されるLCDRのセットを含むVLドメインが別に提供されるように、本明細書において開示されるHCDRのセットを含むVHドメインもまた、本発明によって提供される。好ましくは、このようなVHドメインは、このようなVLドメインと対形成しており、かつ最も好ましくは、VHドメインおよびVLドメインの対形成は、本明細書において説明されるクローンにおけるものと同じである。
【0018】
HCDRのセット、すなわちHCDR1、HCDR2、およびHCDR3を含むVHドメインであって、HCDRのセットが、1つまたは2つのアミノ酸置換を有するPET1073G12、PET1074B9、またはPET1287A10に対するものに相当するVHドメインが、本発明によってさらに提供される。
【0019】
LCDRのセット、すなわちLCDR1、LCDR2、およびLCDR3を含むVLドメインであって、CDRのセットが、1つまたは2つのアミノ酸置換を有するPET1073G12、PET1074B9、またはPET1287A10に対するものに相当するVLドメインが、本発明によってさらに提供される。
【0020】
このようなVHドメインおよび/またはVLドメイン内に抗体の抗原結合部位を含む特異的結合メンバーもまた、本発明によって提供される。
【0021】
構造/特性と活性との関係に多変量データ解析技術を応用する際の計算化学の先例に従い(Wold, et al. Multivariate data analysis in chemistry. Chemometrics-Mathematics and Statistics in Chemistry(Ed.:B. Kowalski), D. Reidel Publishing Company, Dordrecht, Holland, 1984(ISBN 90-277-1846-6))、統計的回帰、パターン認識、および分類など周知の数学的技術(Norman et al. Applied Regression Analysis. Wiley-Interscience;3rd edition(April 1998)ISBN:0471170828;Abraham Kandel, Eric Backer. Computer-Assisted Reasoning in Cluster Analysis. Prentice Hall PTR;(May 11, 1995), ISBN:0133418847;Wojtek Krzanowski. Principles of Multivariate Analysis :A User's Perspective(Oxford Statistical Science Series, No 22(Paper)). Oxford University Press, (December 2000), ISBN:0198507089;Ian H. Witten, Eibe Frank. Data Mining:Practical Machine Learning Tools and Techniques with Java Implementations. Morgan Kaufmann;(October 11, 1999), ISBN:1558605525;David G. T. Denison(Editor), Christopher C. Holmes, Bani K. Mallick, Adrian F. M. Smith. Bayesian Methods for Nonlinear Classification and Regression(Wiley Series in Probability and Statistics). John Wiley & Sons;(July 2002), ISBN:0471490369;Arup K. Ghose, Vellarkad. N. Viswanadhan. Combinatorial Library Design and Evaluation Principles, Software, Tools, and Applications in Drug Discovery. ISBN:0-8247-0487-8)を用いて、抗体の活性と特性の定量的な関係を導くことができる。抗体の特性は、抗体の配列、機能的構造、および3次元構造の実験的モデルおよび理論的モデルから導くことができ(例えば、接触する可能性がある残基または算出された物理化学的特性の解析)、かつこれらの特性は、個々におよび組み合わせて考察することができる。
【0022】
原子構造が公知である抗体の解析により、抗体の結合部位の配列と3次元構造の関係が明らかにされた(Chothia C. et al. Journal Molecular Biology(1992)227, 799-817;Al-Lazikani, et al. Journal Molecular Biology(1997)273(4), 927-948)。これらの関係は、VHドメイン中の第3の領域(ループ)を除いて、結合部位ループが、少数の主鎖立体構造、すなわちカノニカルな構造のうちの1つを有することを暗示する。特定のループ中で形成されるカノニカルな構造は、そのサイズ、ならびにループおよびフレームワーク領域の両方の重要な部位における特定の残基の存在によって決定されていることが示された(Chothia et al.およびAl-Lazikani et al.、前記)。
【0023】
配列と構造の関係のこの研究は、CDRループの3次元構造を維持する際に、およびしたがって、結合特異性を維持する際に重要である、配列は公知であるが3次元構造は公知ではないある抗体中の残基を予測するために使用することができる。これらの予測は、リード最適化実験の結果と予測を比較することによって確認することができる。構造的アプローチにおいて、WAM(Whitelegg, N. R. u.およびRees, A. R(2000)Prot. Eng., 12, 815-824)のような自由に利用可能であるか、または市販されている任意のパッケージを用いて、抗体分子の理論的モデルを作製することができる(Chothia, et al. Science, 223, 755-758(1986))。次いで、Insight II(Accelerys, Inc.)またはDeep View(Guex, N.およびPeitsch, M. C. Electrophoresis(1997)18, 2714-2723)のようなタンパク質可視化および解析用ソフトウェアパッケージを用いて、CDRおよびFR中の各位置において起こり得る置換を評価することができる。次いで、この情報を用いて、活性に最小限または有益な影響を与える可能性がある置換を行うことができる。
【0024】
CDR、抗体のVHドメインまたはVLドメイン、および特異的結合メンバーのアミノ酸配列内に置換を起こすために必要とされる技術は、一般に、当技術分野において利用可能である。活性に最小限または有益な影響を与えることが予測されることもあればされないこともある置換により、変異配列を作製し、かつTGFβに結合し、かつ/もしくは中和する能力、および/または他の任意の所望の特性に関して試験することができる。これについては、以下でさらに考察する。
【0025】
上述したように、本発明は、CDRの所定のセット、特に、PET1073G12、PET1074B9、およびPET1287A10のCDRセット、ならびに、CDRセット内に1つもしくは2つの置換を有する、PET1073G12、PET1074B9、またはPET1287A10のCDRセットを含む、特異的結合メンバーを提供する。
【0026】
CDRの関連するセットは、抗体のフレームワーク領域または他のタンパク質足場、例えば、フィブロネクチンもしくはシトクロムBの内部で提供される。好ましくは、抗体のフレームワーク領域が使用される。
【0027】
好ましい態様において、重鎖は、ヒトVH1ファミリー遺伝子を使用する。様々な態様において、重鎖のフレームワークのアミノ酸配列は、ヒトVH1ファミリー遺伝子の生殖系列アミノ酸配列と比べて、1〜12個、好ましくは3〜12個、およびより好ましくは3〜8個のアミノ酸差異を含む。いくつかの態様において、重鎖のフレームワーク配列は、生殖系列の配列である。特に好ましい態様において、抗体の重鎖のフレームワーク領域は、VH1ファミリーに由来するヒトDP-10(VH1-69)またはヒトDP-88(VH1-e)でよい。好ましくは、ヒトDP-10遺伝子を使用する態様は、27番、78番、および94番残基に非生殖系列アミノ酸を有する。いくつかの態様において、27番残基はチロシンであり、78番残基はトレオニンであり、かつ94番残基はセリンまたはロイシンである。いくつかの態様において、軽鎖は、生殖系列アミノ酸配列と比べて、1〜5個、好ましくは1〜4個、より好ましくは1〜3個のアミノ酸差異を有するヒトVκ3ファミリー遺伝子を使用する。いくつかの態様において、軽鎖のフレームワーク配列は、生殖系列ヒトVκ3ファミリー遺伝子の配列である。特に好ましい態様において、軽鎖のフレームワーク領域は、ヒトDPK-22(A27)でよい。いくつかのこのような態様において、2番残基は、非生殖系列アミノ酸である。いくつかの態様において、2番残基はトレオニンである。
【0028】
極めて好ましい態様において、SEQ ID NO:2のアミノ酸配列を有するVHドメインが提供され、これは、「PET1073G12 VHドメイン」と呼ばれ、または、SEQ ID NO:12のアミノ酸配列を有するVHドメインが提供され、これは、「PET1074B9 VHドメイン」と呼ばれ、または、SEQ ID NO:22のアミノ酸配列を有するVHドメインが提供され、これは、「PET1287A10 VHドメイン」と呼ばれる。
【0029】
さらなる極めて好ましい態様において、SEQ ID NO:7のアミノ酸配列を有するVLドメインが提供され、これは、「PET1073G12 VLドメイン」と呼ばれ、または、SEQ ID NO:17 のアミノ酸配列を有するVLドメインが提供され、これは、「PET1074B9 VLドメイン」と呼ばれ、または、SEQ ID NO:27のアミノ酸配列を有するVLドメインが提供され、これは、「PET1287A10 VLドメイン」と呼ばれる。本発明によって提供される極めて好ましい態様は、PET1073G12 VHドメインであるSEQ ID NO:2、およびPET1073G12 VLドメインであるSEQ ID NO:7から構成される。本発明によって提供される別の極めて好ましい態様は、PET1074B9 VHドメインであるSEQ ID NO:12、およびPET1074B9 VLドメインであるSEQ ID NO:17から構成される。本発明によって提供される別の極めて好ましい態様は、PET1287A10 VHドメインであるSEQ ID NO:22、およびPET1287A10 VLドメインであるSEQ ID NO:27から構成される。本発明によって提供されるこれらまたは他の任意の抗体の抗原結合部位は、本明細書において別の箇所でさらに考察されるように、任意の所望の抗体分子の形式、例えば、scFv、Fab、IgG1、IgG4、dAbなどの範囲内で提供され得る。
【0030】
さらなる極めて好ましい態様において、本発明は、PET1073G12、PET1074B9、またはPET1287A10のVHドメインを含み、好ましくは、対応するPET1073G12、PET1074B9、またはPET1287A10のVLドメインも含む、IgG4抗体分子を提供する。
【0031】
抗体のVHドメイン内にPET1073G12、PET1074B9、もしくはPET1287A10のHCDRセットを含み、かつ/または抗体のVLドメイン内にPET1073G12、PET1074B9、もしくはPET1287A10のLCDRセットを含む他の抗体分子が提供されるように、PET1073G12、PET1074B9、もしくはPET1287A10のVHドメイン、および/またはPET1073G12、PET1074B9、もしくはPET1287A10のVLドメインを含む、他のIgG4もしくは他の抗体分子が、本発明によって提供される。
【0032】
本明細書において使用される「および/または」が、2つの特定された特徴または構成要素のそれぞれを他方の有無に関わらず具体的に開示することとしてみなされるべきであることをここで指摘することは好都合である。例えば、「Aおよび/またはB」は、それぞれが本明細書において個々に説明されるかのように、(i)A、(ii)B、ならびに(iii)AおよびBのそれぞれの具体的な開示としてみなされるべきである。
【0033】
上述したように、本発明の特定の態様において、ヒトTGFβの3種のアイソフォームすべてに結合し、かつPET1073G12、PET1074B9、もしくはPET1287A10のVHドメインおよび/もしくはVLドメイン、またはこれらのドメインの抗原結合部分を含む、特異的結合メンバーが提供される。
【0034】
いくつかの態様において、VHドメインはVLドメインと対形成して、抗原結合部位を提供する。好ましい態様において、PET1073G12 VHドメイン(SEQ ID NO:2)は、PET1073G12 VLドメイン(SEQ ID NO:7)と対形成して、その結果、PET1073G12のVHドメインおよびVLドメインの両方を含む抗原結合部位が形成される。好ましい態様において、PET1074B9 VHドメイン(SEQ ID NO:12)は、PET1074B9 VLドメイン(SEQ ID NO:17)と対形成して、その結果、PET1074B9 のVHドメインおよびVLドメインの両方を含む抗原結合部位が形成される。好ましい態様において、PET1287A10 VHドメイン(SEQ ID NO:22)は、PET1287A10 VLドメイン(SEQ ID NO:27)と対形成して、その結果、PET1287A10 のVHドメインおよびVLドメインの両方を含む、抗体の抗原結合部位が形成される。他の態様において、PET1073G12、PET1074B9、またはPET1287A10のVHは、対応するPET1073G12、PET1074B9、またはPET1287A10のVL以外のVLドメインと対形成する。軽鎖の無差別な対形成(promiscuity)は、当技術分野において十分に確立されている。
【0035】
同様に、本明細書において開示される任意のHCDRセットを、単独で、またはVLドメインと組み合わせて特異的結合メンバーとして使用されるVHドメイン中で提供することができる。VHドメインは、本明細書において開示されるHCDRセットと共に提供されてよく、かつそのようなVHドメインがVLドメインと対形成するならば、その場合、VLドメインは、本明細書において開示されるLCDRセットと共に提供されてよい。HCDRセットとLCDRセットの対形成は、PET1073G12、PET1074B9、およびPET1287A10の抗体に関して本明細書において開示されるようなものであってよい。VHドメインおよび/またはVLドメインのフレームワーク領域は、生殖系列フレームワークであってよい。重鎖ドメインのフレームワーク領域は、VH-1ファミリーより選択されてよく、かつ好ましいVH-1フレームワークは、DP-10またはDP-88のフレームワークである。軽鎖のフレームワーク領域は、Vκ3ファミリーより選択されてよく、かつ好ましいこのようなフレームワークは、DPK-22である。
【0036】
1つまたは複数のCDRは、その配列が本明細書において開示されるVHドメインまたはVLドメインに由来してよく、かつ適切なフレームワーク中に組み入れられてよい。これについては、本明細書においてさらに考察する。同じことが、本明細書において説明する方法を用いて得られる抗体の他のCDRおよびCDRセットに当てはまる。
【0037】
他の分子に関して本明細書において開示される本発明の任意の局面および態様、例えば、力価が改善された抗原結合部位の変異および選択の方法において、抗体のVHドメイン、抗体のVLドメイン、HCDRのセット、LCDRのセット、CDRのセット、1つもしくは複数のHCDR、例えばHCDR3、および/または1つもしくは複数のLCR、例えばLCDR3を使用してよい。
【0038】
そのアミノ酸配列が本明細書において説明され、かつTGFβに対する特異的結合メンバー中で使用され得るものを含む、本発明のVHドメインおよびVLドメインならびにCDRの変異体は、配列の改変または変異およびスクリーニングの方法を用いて得ることができる。このような方法もまた、本発明によって提供される。
【0039】
その配列が本明細書において具体的に開示されるVHドメインおよびVLドメインのいずれかの可変ドメインアミノ酸配列変異体は、考察されるように、本発明に従って使用され得る。個々の変異体は、1つまたは複数のアミノ酸配列改変(アミノ酸残基の付加、欠失、置換、および/もしくは挿入)を含んでよく、約20個未満の改変、約15個未満の改変、約10個未満の改変、または、約5個未満、4個、3個、2個、もしくは1個の改変でよい。改変は、1つもしくは複数のフレームワーク領域、および/または1つもしくは複数のCDRにおいて実施されてよい。
【0040】
本発明のさらなる局面によれば、抗原に結合し、かつ特異的な抗体の抗原結合領域、本明細書において開示されるVHドメインおよび/もしくはVLドメイン、本明細書において開示されるCDRセットもしくはHCDR3、またはこれらのいずれかの変異体も含む、任意の特異的結合メンバーと、抗原への結合に際して競合するか、または交差競合する、ヒト、ヒト化、キメラ、または合成の特異的結合メンバーが提供される。結合メンバー間の競合は、例えば、ELISAを用いて、かつ/または、1つの結合メンバーに特異的なレポーター分子をタグ化し、他のタグ無し結合メンバーの存在下で検出することができるようにして、同じエピトープもしくは重複するエピトープに結合する特異的結合メンバーの同定を可能にすることによって、インビトロで容易に分析することができる。結合メンバー間の交差競合は、逆アッセイ法を実施することによって、例えば、タグ化される結合メンバーとタグ無し結合メンバーを逆転させて、両方の方向の結合を妨害するペアを同定することによって、容易に分析することができる。
【0041】
したがって、本発明の別の局面は、TGFβへの結合に際して、PET1073G12、PET1074B9、もしくはPET1287A10の抗体分子、特に、PET1073G12、PET1074B9、もしくはPET1287A10のscFv、および/またはIgG4と競合するか、または交差競合する抗体の抗原結合部位を含む、特異的結合メンバーを提供する。様々な態様において、この抗体は、ヒト抗体、ヒト化抗体、キメラ抗体、または合成抗体である。別の局面において、本発明は、TGFβへの結合に際して、本発明の抗原結合部位と競合するか、または交差競合する、ヒト抗体、ヒト化抗体、キメラ抗体、または合成抗体の抗原結合部位を含む特異的結合メンバーであって、ヒト抗体、ヒト化抗体、キメラ抗体、または合成抗体の抗原結合部位が、VHドメインおよびVLドメインから構成され、かつVHドメインおよびVLドメインが、本明細書において開示されるCDRのセットを含む、特異的結合メンバーを提供する。
【0042】
本明細書において開示される情報があれば、TGFβへの結合に際して、PET1073G12、PET1074B9、もしくはPET1287A10の抗体分子、PET1073G12、PET1074B9、もしくはPET1287A10のCDRセットを有する抗体分子、PET1073G12、PET1074B9、もしくはPET1287A10のHCDRセットを有する抗体分子、または、PET1073G12、PET1074B9、もしくはPET1287A10のLCDRセットを有する抗体分子と競合し得るか、または交差競合し得る、TGFβに対するヒト抗体、ヒト化抗体、キメラ抗体、または合成抗体を得るために、様々な方法が当技術分野において利用可能である。
【0043】
さらなる局面において、本発明は、TGFβ1、TGFβ2、およびTGFβ3に結合できる1種もしくは複数種の特異的結合メンバーを得る方法であって、本発明による特異的結合メンバーのライブラリーおよび該TGFβを接触させる段階、ならびに該TGFβのすべてに結合できる、ライブラリーの1種もしくは複数種の特異的結合メンバーを選択する段階を含む方法を提供する。
【0044】
このライブラリーは、バクテリオファージ粒子の表面に提示することができ、各粒子は、その表面に提示される抗体のVH可変ドメイン、および任意で、存在する場合は提示されるVLドメインもコードしている核酸を含む。
【0045】
抗原に結合でき、かつバクテリオファージ粒子上に提示される特異的結合メンバーを選択した後、選択された該特異的結合メンバーを提示しているバクテリオファージ粒子から核酸を取り出すことができる。このような核酸は、選択された前記特異的結合メンバーを提示しているバクテリオファージ粒子から取り出された核酸の配列を有する核酸からの発現によって、特異的結合メンバーまたは抗体のVH可変ドメイン(および任意で抗体のVL可変ドメイン)を続いて作製する際に使用することができる。
【0046】
選択された前記特異的結合メンバーの抗体VHドメインのアミノ酸配列を有する抗体VHドメインは、そのようなVHドメインを含む特異的結合メンバーと同じように、単離された形態で提供され得る。TGFβの3種のアイソフォームすべてに結合する能力、また、TGFβの3種のヒトアイソフォームすべてに結合する際に、PET1073G12、PET1074B9、またはPET1287A10(例えば、scFv型および/もしくはIgG型、例えばIgG4)と競合するか、または交差競合する能力も、さらに試験することができる。以下にさらに考察するように、TGFβを中和する能力を試験することができる。
【0047】
本発明による特異的結合メンバーは、PET1073G12、PET1074B9、もしくはPET1287A10の抗体分子、例えばscFv、もしくは好ましくはIgG4の親和力で、または、上記の分子のうち1種より大きな親和力で、TGFβ1、TGFβ2、および/またはTGFβ3に結合し得る。本発明による特異的結合メンバーは、PET1073G12、PET1074B9、もしくはPET1287A10の抗体分子、例えばscFv、もしくは好ましくはPET1073G12、PET1074B9、もしくはPET1287A10のIgG4の力価で、または、上記の分子のうち1種より大きな力価で、TGFβ1、TGFβ2、および/またはTGFβを中和し得る。
【0048】
本発明による特異的結合メンバーは、PET1073G12、PET1074B9、もしくはPET1287A10の抗体分子、例えばscFv、もしくは好ましくはIgG4の力価で、または、上記の分子のうち1種より大きな力価で、天然のTGFβを中和し得る。様々な特異的結合メンバーの結合親和力および中和力価を、適切な条件下で比較することができる。
【0049】
本発明の好ましい態様は、PET1073G12、PET1074B9、もしくはPET1287A10のVHドメイン、および対応するPET1073G12、PET1074B9、もしくはPET1287A10のVLドメインによって形成されるTGFβ抗原結合部位の力価に等しいか、またはそれを上回る力価を有する、天然のTGFβを中和する、ヒト抗体、ヒト化抗体、キメラ抗体、または合成抗体を好ましくは含む。
【0050】
抗体配列に加えて、本発明による特異的結合メンバーは、他のアミノ酸、例えば、折り畳まれたドメインのようなペプチドもしくはポリペプチドを形成するアミノ酸、または、抗原に結合する能力に加えて別の機能的特徴を分子に与えるアミノ酸も含んでよい。本発明の特異的結合メンバーは、検出可能な標識を有してよく、または、(例えばペプチジル結合もしくはリンカーを介して)毒素またはターゲティング部分もしくは酵素に結合されていてもよい。
【0051】
別の局面において、本発明は、本発明による特異的結合メンバー、VHドメインおよび/もしくはVLドメイン、またはCDRをコードする配列を含む単離された核酸、ならびに、本発明の特異的結合メンバー、VHドメインおよび/もしくはVLドメイン、またはCDRを調製する方法であって、該特異的結合メンバー、VHドメインおよび/もしくはVLドメイン、またはCDRの生成を実現する条件下で前記核酸を発現させる段階、ならびにそれを回収する段階を含む方法を提供する。
【0052】
本発明による特異的結合メンバーは、ヒト患者の疾患または障害の(予防的治療を含み得る)治療の方法であって、該患者に有効量の本発明の特異的結合メンバーを投与する段階を含む方法のような、ヒトまたは動物の身体の治療または診断の方法において使用され得る。本発明に従って治療可能な状態には、TGFβがある役割を果たしている任意の状態が含まれ、特に、線維症の治療、創傷治癒の調節、および癌の治療である。
【0053】
より具体的には、本発明の特異的結合メンバーは、インビトロまたはインビボで、ヒトTGFβの3種のアイソフォームのいずれかまたはすべての活性を阻害するのに有用である。このような活性には、TGFβによって媒介されるシグナル伝達、細胞外基質(ECM)沈着、上皮細胞および内皮細胞の増殖の阻害、平滑筋増殖の促進、III型コラーゲン発現の誘導、TGF-β、フィブロネクチン、VEGF、およびIL-11の発現の誘導、潜伏期関連ペプチドへの結合、腫瘍によって誘導される免疫抑制、血管新生の促進、筋線維芽細胞の活性化、転移の促進、ならびにNK細胞活性の阻害が含まれるが、これらに限定されるわけではない。
【0054】
本発明の特異的結合メンバーはまた、TGFβ活性に直接的にまたは間接的に起因する疾患および状態を治療するのにも有用である。本発明の特異的結合メンバーは汎特異的であるため、すなわち、TGFβの3種のアイソフォームすべてに結合し、かつそれらの活性を阻害するため、これらは、2種またはそれ以上のTGFβアイソフォームが関係する状態および疾患(感染症および腫瘍など)、ならびに複数の標的を阻害することが望ましい重度の状態を治療するために特に有利である。
【0055】
特異的結合メンバーは、限定されるわけではないが、線維症(糸球体腎炎、神経瘢痕化、皮膚瘢痕化、肺線維症(pulmonary fibrosis)、肺線維化(lung fibrosis)、放射線によって誘導された線維症、肝線維症、骨髄線維症など)、熱傷、免疫介在性疾患、炎症性疾患(関節リウマチを含む)、移植拒絶、癌、デュピュイトラン拘縮、および胃潰瘍を含む、疾患および状態を治療するのに有用である。これらはまた、限定されるわけではないが、糖尿病(I型およびII型)性腎症、放射線腎症、閉塞性腎症、びまん性全身性硬化症、肺線維症、同種移植拒絶、遺伝性の腎疾患(例えば、多発性嚢胞腎、髄質海綿腎、馬蹄腎)、糸球体腎炎、腎硬化症、腎石灰化症、全身性エリテマトーデス、シェーグレン症候群、ベルガー病、全身または糸球体の高血圧、尿細管間質性腎症、尿細管性アシドーシス、腎結核、ならびに腎梗塞を含む腎不全を治療し、予防し、かつその発生リスクを減少させるのにも有用である。特に、それらは、限定されるわけではないが、レニン阻害物質、アンギオテンシン変換酵素(ACE)阻害物質、AngII受容体拮抗物質(「AngII受容体遮断薬」としても公知)、およびアルドステロン拮抗物質を含む、レニン-アンギオテンシン-アルドステロン系の拮抗物質と組み合わされた場合に有用である。本発明の特異的結合メンバーをこのような拮抗物質と組み合わせて使用するための方法は、その内容が参照により本明細書に組み入れられるPCT/US04/13677において説明されている。
【0056】
本発明の特異的結合メンバーはまた、ECMの沈着に関連した疾患および状態を治療するのにも有用であり、該疾患および状態には、全身性硬化症、術後癒着、ケロイドおよび肥厚性瘢痕化、増殖性硝子体網膜症、緑内障ドレナージ手術、角膜損傷、白内障、ペーロニー病、成人型呼吸窮迫症候群、肝硬変、心筋梗塞後の瘢痕化、血管形成術後の再狭窄、くも膜下出血後の瘢痕化、多発性硬化症、椎弓切除術後の線維化、腱および他の部分の修復後の線維化、入れ墨除去に起因する瘢痕化、胆汁性肝硬変(硬化性胆管炎を含む)、心膜炎、胸膜炎、気管切開術、CNS穿通損傷、好酸球増加筋痛症候群、血管再狭窄、静脈閉塞症、膵炎、ならびに乾癬性関節症が含まれる。
【0057】
本発明の特異的結合メンバーはさらに、再上皮化の促進が有益である状態において有用である。このような状態には、静脈性潰瘍、虚血性潰瘍(褥瘡)、糖尿病性潰瘍、グラフト部位、グラフト供与部位、擦過傷および熱傷、喘息、ARDSなどの気管支上皮の疾患、細胞毒性治療に関連した粘膜炎、食道潰瘍(逆流症)、胃潰瘍、小腸および大腸の病変(炎症性腸疾患)などの腸上皮の疾患がが含まれるがそれらに限定されるわけではない。
【0058】
本発明の特異的結合メンバーはさらにまた、内皮細胞増殖が望ましい状態において、例えば、アテローム斑を安定化させる際、血管吻合の治癒を促進する際、または、動脈疾患、再狭窄、および喘息など平滑筋細胞増殖の阻害が望ましい状態においても使用される。
【0059】
本発明の特異的結合メンバーはまた、リーシュマニア(Leishmania)種、クルーズ・トリパノソーナ(Trypanosorna cruzi)、結核菌(Mycobacterium tuberculosis)およびらい菌(Mycobacterium leprae)、ならびに、原虫トキソプラズマ・ゴンディ(Toxoplasma gondii)、菌類のヒストプラスマ・カプスラーツム(Histoplasma capsulatum)、カンジダ・アルビカンス(Candida albicans)、カンジダ・パラプシローシス(Candida parapsilosis)、およびクリプトコックス・ネオフォルマンス(Cryptococcus neoformans)、ならびにリケッチア(Rickettsia)、例えば、発疹チフスリケッチア(R. prowazekii)、リケッチア・コロニー(R. coronii)、およびツツガムシ病リケッチア(R. tsutsugamushi)によって引き起こされるもののようなマクロファージ介在性の感染症に対する免疫応答を増強するのにも有用である。これらはまた、例えば、腫瘍、AIDS、または肉芽腫症によって引き起こされる免疫抑制を軽減するのにも有用である。
【0060】
本発明の特異的結合メンバーは、限定されるわけではないが、乳癌、前立腺癌、卵巣癌、胃癌、腎臓癌、膵臓癌、結腸直腸癌、皮膚癌、肺癌、子宮頚癌、および膀胱癌を含む癌、神経膠腫、中皮腫、ならびに、様々な白血病および肉腫、例えばカポジ肉腫など、過剰増殖疾患の治療においてさらに有用であり、かつ特に、このような腫瘍の治療またはそれらの再発もしくは転移の予防に有用である。特に、本発明の拮抗物質特異的結合メンバーは、シクロスポリンによって媒介される転移を阻害するのに有用である。
【0061】
癌治療の文脈において、「治療」は、患者の平均余命を延長するために、腫瘍増殖の減速または腫瘍転移の減少、ならびに癌の部分寛解をもたらす、任意の医学的介入を含むことが、当然理解されると考えられる。
【0062】
本発明のさらなる局面は、本明細書において開示される抗体のVH可変ドメインおよび/またはVL可変ドメインをコードする、一般に単離された核酸を提供する。
【0063】
本発明の別の局面は、本明細書において開示されるHCDR配列またはLCDR配列、特に、SEQ ID NO:3、4、5、13、14、15、23、24、および25より選択されるHCDRまたはSEQ ID NO:8、9、10、18、19、20、28、29、30より選択されるVLのCDR、最も好ましくはPET1073G12、PET1074B9、またはPET1287A10のHCDR3(それぞれSEQ ID NO:5、15、もしくは25)をコードする、一般に単離された核酸を提供する。個々のCDR、HCDR、LCDR、およびPET1073G12、PET1074B9、またはPET1287A10のCDR、HCDR、LCDRのセットをコードする核酸と同様に、PET1073G12、PET1074B9、またはPET1287A10のCDRセットをコードする核酸、PET1073G12、PET1074B9、またはPET1287A10のHCDRセットをコードする核酸、およびPET1073G12、PET1074B9、またはPET1287A10のLCDRセットをコードする核酸もまた、本発明によって提供される。
【0064】
さらなる局面は、本発明の核酸で形質転換された宿主細胞を提供する。
【0065】
なおさらなる局面は、コードしている核酸からの発現を引き起こす段階を含む、抗体のVH可変ドメインを作製する方法を提供する。このような方法は、抗体の前記VH可変ドメインを産生するための条件下で宿主細胞を培養する段階、または抗体の前記VHドメインがインビボで発現されるようにする段階を含み得る。
【0066】
VL可変ドメインならびにVHドメインおよび/またはVLドメインを含む特異的結合メンバーを作製するための類似した方法が、本発明の別の局面として提供される。
【0067】
作製の方法は、生成物を単離および/または精製する段階を含み得る。
【0068】
作製の方法は、薬学的に許容される賦形剤のような少なくとも1種の付加的な成分を含む組成物中に生成物を配合する段階を含み得る。
【0069】
本発明のこれらおよび他の局面を、以下にさらに詳細に説明する。
【図面の簡単な説明】
【0070】
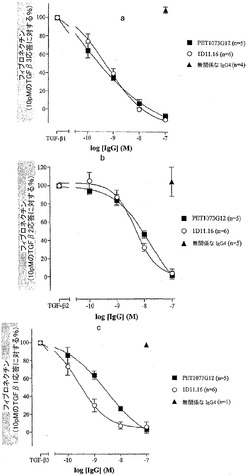
【図1】PET1073G12生殖系列のIgG4(ベタ塗りの四角形(closed square))および1D11.16(白抜きの円(open circle))による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図1b】PET1073G12生殖系列のIgG4(ベタ塗りの四角形(closed square))および1D11.16(白抜きの円(open circle))による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図1c】PET1073G12生殖系列のIgG4(ベタ塗りの四角形(closed square))および1D11.16(白抜きの円(open circle))による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図2a】PET1074B9生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図2b】PET1074B9生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図2c】PET1074B9生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図3a】PET1287A10生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図3b】PET1287A10生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図3c】PET1287A10生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【発明を実施するための形態】
【0071】
詳細な説明
用語
特異的結合メンバー
この用語は、互いに対する結合特異性を有する一対の分子のメンバーを示す。特異的結合対のメンバーは、天然に由来しても、または、全体的もしくは部分的に合成によって作製されてもよい。分子対の一方のメンバーは、分子対のもう一方のメンバーの表面上の領域またはくぼみに特異的に結合する、表面上の領域またはくぼみを有する。したがって、対のメンバーは、互いに特異的に結合する特性を有している。本発明は、標的抗原に結合する特異的結合メンバーに関係している。
【0072】
特異的
この用語は、ある特異的結合メンバーが、所与の動物に由来するその特異的結合相手以外の分子に対していかなる有意な結合も示さないと考えられる状況を意味するために使用され得る。例えば、ヒトTGFβに特異的な特異的結合メンバーは、他のTGFβ以外のヒト分子には有意な結合を示さないと考えられるが、他の種に由来するTGFβとは交差反応し得る。
【0073】
抗原に結合する特異的結合メンバーは、抗原結合部位を含む。例えば、特異的結合メンバーは、抗体分子でよい。抗原結合部位は、フィブロネクチンまたはシトクロムBなどの非抗体タンパク質足場上にCDRを配置することによって提供することもできる(Koide et al.,(1998)Journal of Molecular Biology, 284:1141-1151;Nygren et al.(1997)Current Opinion in Structural Biology, Vol. 7:463-469)。タンパク質中に新規な結合部位を作り出すための足場は、前記のNygrenらによって詳細に概説されている。抗体模倣物のためのタンパク質足場は、少なくとも1つのランダム化されたループを有するフィブロネクチンIII型ドメインを含むタンパク質(抗体模倣物)を記載したWO 00/34784において開示されている。1つまたは複数のCDR、例えば、HCDRのセットを継ぎ足すのに適した足場は、免疫グロブリン遺伝子スーパーファミリーの任意のドメインメンバーによって提供され得る。足場は、ヒトタンパク質または非ヒトタンパク質でよい。
【0074】
非抗体タンパク質足場の利点は、それが、少なくともいくつかの抗体分子よりも小さく、かつ/または製造するのが容易である保存されたフレームワーク領域中で抗原結合部位を提供できることである。特異的結合メンバーの大きさが小さいことにより、細胞に移行する能力、組織深部に侵入する能力もしくは他の構造体内の標的に到達する能力、または標的抗原のタンパク質のくぼみ内に結合する能力など、有用な生理学的特性が与えられ得る。
【0075】
非抗体タンパク質足場中の抗原結合部位の使用は、Wess, 2004において概説されている。安定な主鎖および1つまたは複数の可変ループを有するタンパク質が典型的であり、この1つまたは複数のループのアミノ酸配列は、標的抗原に結合するための特異性を有する抗原結合部位を作り出すために、特異的に、またはランダムに変異させられている。このようなタンパク質には、S.アウレウス(S. aureus)に由来するプロテインA、トランスフェリン、テトラネクチン、フィブロネクチン(例えば10番目のフィブロネクチンIII型ドメイン)、およびリポカリンのIgG結合ドメインが含まれる。他のアプローチには、分子内ジスルフィド結合を有する小型タンパク質であるシクロチド(cyclotide)をベースとする、合成「Microbodies」(Selecore GmbH)が含まれる。
【0076】
抗体配列および/または抗原結合部位に加えて、本発明による特異的結合メンバーは、他のアミノ酸、例えば、折り畳まれたドメインのようなペプチドもしくはポリペプチドを形成するアミノ酸、または、抗原に結合する能力に加えて別の機能的特徴を分子に与えるアミノ酸も含んでよい。本発明の特異的結合メンバーは、検出可能な標識を有してよく、または、(例えばペプチジル結合もしくはリンカーを介して)毒素またはターゲティング部分もしくは酵素に結合されていてもよい。例えば、特異的結合メンバーは、触媒部位(例えば酵素ドメイン中)、ならびに、抗原に結合し、したがって、抗原に触媒部位を導く抗原結合部位を含んでよい。触媒部位は、例えば切断によって、抗原の生物学的機能を阻害し得る。
【0077】
前述したように、CDRは、フィブロネクチンまたはシトクロムBのような足場によって保有され得るが(HaanおよびMaggos, 2004 BioCentury, 12(5):A1-A6;Koide et al.、前記;Nygren et al.、前記)、本発明のCDRまたはCDRセットを保有するための構造体は、CDRもしくはCDRセットが、再配列された免疫グロブリン遺伝子によってコードされる天然のVHおよびVL抗体可変ドメインのCDRもしくはCDRセットに対応する位置に位置している、抗体の重鎖配列もしくは軽鎖配列、またはその実質的な部分を一般に有すると考えられる。免疫グロブリン可変ドメインの構造および位置は、Kabat, et al., 1987、および現在インターネットで利用可能なその最新版(http://immuno. bme.nwu.edu、または任意の検索エンジンを用いて「Kabat」を発見されたい)を参照することにより、決定することができる。
【0078】
抗体分子
この用語は、天然であろうと、部分的または全体的に合成によって作製されようと、免疫グロブリンを示す。この用語はまた、抗体の抗原結合ドメインを含む任意のポリペプチドまたはタンパク質も包含する。抗原結合ドメインを含む抗体断片は、Fab、scFv、Fv、dAb、Fd、およびジアボディ(diabody)などの分子である。
【0079】
ヒト生殖系列細胞のゲノムにおいて、抗体ポリペプチド鎖の遺伝情報は、様々な染色体に沿って散在している遺伝子座内の複数の遺伝子セグメント中に含まれている。ヒト重鎖(VH)は、第14染色体上でコードされており、κ軽鎖(VΚ)は第2染色体上でコードされており、かつλ軽鎖(Vλ)は、第22染色体上でコードされている。Bリンパ球(抗体産生細胞)の発達中に、これらの遺伝子座中の遺伝子セグメントは、組換えによって組み立てられて、抗体の重鎖または軽鎖の完全な遺伝子の形成をもたらす(Tonegawa S. Nature, 302, 575-81, 1983)。抗体定常領域(VH、VΚ、およびVλ)はヒト集団の全体にわたって大部分は同一であるが、可変ドメイン内にはかなりの多様性が存在する。このような多様性により、異なる標的抗原に対する特異性をそれぞれ有する、何十億もの異なる抗体の開発が可能になる。
【0080】
抗体の可変領域内の多様性は、いくつかの方法で生み出される。第一に、遺伝子レベルでは、抗体可変部分の生殖系列遺伝子配列内にかなりの多様性がある。約50種の異なるVH生殖系列(Tomlinson I. M. et al, J. Mol. Biol., 227, 776-798, 1992)、35種の異なるVκ生殖系列(Tomlinson I. M. et al EMBO J, 14, 4628-38, 1995)、および30種の異なるVλ生殖系列(Williams S. C.およびWinter G. Eur. J. Immunol, 23, 1456-61, 1993;Kawasaki K. et al Genome Res, 7, 250-61, 1997)が説明されている。これらの生殖系列遺伝子配列の様々な組み合わせから抗体を作製する。次いで、体細胞組換えおよび超変異などのプロセスによって、抗体の可変ドメイン中にさらなる多様性を導入する(Tonegawa S. Nature, 302, 575-81, 1983)。
【0081】
抗体可変部分の生殖系列遺伝子配列内にはかなりの多様性があるが、配列相同性に基づいてこれらの配列をファミリーにグループ分けすることが可能である。50種の異なるVH遺伝子配列は、7個のファミリーに、35種のVκ配列は6個のファミリーに、かつ30種のVλファミリーは、10個のファミリーにグループ分けすることができる。これらのグループは、1つのメンバーから(VH6およびVκ4)、最大21メンバー(VH3)まで大きさが異なり、かつ各グループのメンバーは、高度な配列相同性を共有している。
【0082】
VHおよびVLの生殖系列配列データベースに対して抗体を整列させて、最も類似した生殖系列のマッチを決定し、かつ体細胞超変異によって導入された任意のアミノ酸変化を同定することができる。研究により、ヒト免疫系が、免疫応答中に、他のもの(例えばVH2)より、いくつかの生殖系列(例えばVH3 DP47)を優先して使用することが示された(Knappik A. et al J. Mol. Biol, 296, 57-86, 2000)
しかしながら、ファージディスプレイによって単離された抗体集団は、単一の抗原に対して単離された場合でさえ、典型的には、広範な生殖系列遺伝子を使用する(Edwards B. et al J. Mol Biol, 334, 103-118, 2003)。
【0083】
モノクローナル抗体および他の抗体を獲得し、かつ組換えDNAテクノロジーの技術を用いて、元の抗体の特異性を保持している他の抗体またはキメラ分子を作製することが可能である。このような技術は、免疫グロブリンの可変領域をコードしているDNAを定常領域に連結する段階、またはある抗体の相補性決定領域(CDR)を、異なる免疫グロブリンの定常領域にフレームワーク領域を加えた部分中に導入する段階を含み得る。例えば、EP-A-184187、GB2188638A、またはEP-A-239400、およびそれに続く文献の多くの部分を参照されたい。抗体を産生するハイブリドーマまたは他の細胞は、遺伝的変異または他の変化の影響を受けることがあり、これにより、産生される抗体の結合特異性が改変されることもあればされないこともある。
【0084】
多くの方法で抗体を改変することができるため、「抗体分子」という用語は、必要とされる特異性を有する抗体の抗原結合部位を有する、任意の特異的結合メンバーまたは物質を包含するものとして解釈されるべきである。したがって、この用語は、天然であろうと、全体的または部分的に合成であろうと、抗原結合ドメインを含む任意のポリペプチドを含む、抗体の断片および誘導体を包含する。したがって、別のポリペプチドに融合された、抗体の抗原結合ドメインまたは等価物を含むキメラ分子が含まれる。キメラ抗体のクローニングおよび発現は、EP-A-0120694およびEP-A-0125023、ならびにそれに続く文献の多くの部分において記載されている。
【0085】
抗体工学の技術分野において利用可能なさらなる技術により、ヒト抗体およびヒト化抗体を単離することが可能になった。例えば、ヒトハイブリドーマは、Kontermannらによって説明されているようにして作製することができる(Kontermann RおよびDubel Stefan;Antibody Engineering, Springer-Verlag New York, LLC;2001, ISBN:3540413545)。特異的結合メンバーを作製するための確立された別の技術であるファージディスプレイは、Kontermannらの前記文献およびWO 92/01047など多くの刊行物において詳細に説明されている(以下にさらに考察する)。マウス免疫系の完全な他の構成要素を残しつつ、マウス抗体遺伝子を不活性化し、かつヒト抗体遺伝子で機能的に置換したトランスジェニックマウスを、ヒト抗原に対するヒト抗体を単離するために使用することができる(Mendez et al., 1997)。モノクローナルまたはポリクローナルいずれかのヒト抗体はまた、ヤギ、雌ウシ、ヒツジ、ウサギなど他のトランスジェニック動物中で作製することもできる。
【0086】
例えば、Knappikらの前記文献、またはKrebs et al., Journal of Immunological Methods 254 2001 67-84によって説明されているように、適切な発現ベクター内で合成され、かつ組み立てられたオリゴヌクレオチドを用いて作製した遺伝子からの発現によって、合成抗体分子を作製することができる。
【0087】
全抗体の断片は、抗原に結合する機能を果たすことができることが示された。結合断片の例は、(i)VLドメイン、CLドメイン、VHドメイン、およびCHIドメインからなるFab断片;(ii)VHドメインおよびCHIドメインからなるFd断片;(iii)単一の抗体のVLドメインおよびVHドメインからなるFv断片;(iv)VHドメインからなるdAb断片(Ward, E. S. et al., Nature 341, 544-546(1989), McCafferty et al.(1990)Nature, 348, 552-554);(v)単離されたCDR領域;(vi)F(ab')2断片、すなわち、2つの連結されたFab断片を含む2価断片、(vii)VHドメインおよびVLドメインが、ペプチドリンカーによって連結されており、それによってこれら2つのドメインが結合して抗原結合部位を形成している、単鎖Fv分子(scFv)(Bird et al., Science, 242, 423-426, 1988;Huston et al., Proc. Natl. Acad. Sci USA 85, 5879-5883;1998)、(viii)二重特異性の単鎖Fv2量体(PCT/US92/09665)、ならびに(ix)「ジアボディ」、すなわち遺伝子融合によって構築された多価性または多重特異性の断片(WO/13804;F. Holliger et al., Proc. Natl. Acad. Sci. USA 90 6444-6448, 1993)である。Fv分子、scFv分子、またはジアボディ分子は、VHドメインおよびVLドメインを連結するジスルフィド架橋の組込みによって安定化され得る(Y. Reiter et al.,Nature Biotech, 14, 1239-1245, 1996)。CH3ドメインに結合されたscFvを含むミニ抗体(minibody)もまた、作製され得る(S. Hu et al., Cancer Res., 56, 3055-3061, 1996)。
【0088】
dAb(ドメイン抗体)は、抗体の小さな単量体抗原結合断片、すなわち、抗体の重鎖または軽鎖の可変領域である(Holt et al.,2003)。VH dAbは、ラクダ科の動物(例えば、ラクダ、ラマ)中に天然に存在し、かつラクダを標的抗原で免疫化し、抗原特異的B細胞を単離し、かつ個々のB細胞からdAb遺伝子を直接クローニングすることによって、作製することができる。dAbはまた、細胞培養で産生させることもできる。これらはサイズが小さく、溶解度が優れており、かつ温度に対して安定であるため、特に生理学的に有用であり、かつ選択および親和性成熟に適している。本発明の特異的結合メンバーは、実質的に本明細書において説明されるVHドメインもしくはVLドメイン、または実質的に本明細書において説明されるCDRのセットを含むVHドメインもしくはVLドメインを含むdAbでよい。
【0089】
二重特異性抗体が使用される予定である場合、これらは、様々な方法で製造することができる(Holliger, P.およびWinter G. Current Opinion Biotechnol. 4, 446-449(1993))、例えば、化学的にもしくはハイブリッドハイブリドーマから調製することができる、従来の二重特異性抗体でよく、または、前述の二重特異性抗体断片のいずれかでよい。二重特異性抗体の例には、異なる特異性を有する2つの抗体の結合ドメインを使用し、かつ柔軟な短いペプチドによって直接連結することができるBiTE(商標)技術のものが含まれる。これは、短いポリペプチド単鎖上で2つの抗体を結合する。ジアボディおよびscFvは、Fc領域無しで、可変ドメインのみを用いて構築して、抗イディオタイプ反応の影響を潜在的に低減することができる。
【0090】
二重特異性の全抗体とは対照的に、二重特異性ジアボディはまた、大腸菌(E.coli)中で容易に構築し、かつ発現させることができるため、特に有用であり得る。適切な結合特異性を有するジアボディ(および抗体断片のような他の多くのポリペプチド)は、ファージディスプレイ(WO94/13804)を用いて、ライブラリーから容易に選択することができる。例えば、TGFβを対象とする特異性を有する、ジアボディの一方の腕が一定に保たれるべき場合は、他方の腕が変更され、かつ適切な特異性を有する抗体が選択されるライブラリーを作製することができる。二重特異性の全抗体は、へこみにノブを入れる(knobs-into-holes)操作によって作製され得る(C. E. B. Ridgeway et al., Protein Eng., 9, 616-621, 1996)。
【0091】
抗原結合部位
この用語は、結合対、すなわち抗原中の他のメンバーの一部分または全体に接触し、かつそれらに相補的である、抗体分子のような特異的結合メンバーの一部分を示す。抗体分子において、抗原結合部位は、抗体の抗原結合部位と呼ぶことができ、かつ標的抗原の全体または一部分に特異的に結合し、かつそれらに相補的である、抗体の一部分を含む。抗原が大型である場合、抗体は、エピトープと呼ばれる、抗原の特定の部分にしか結合しないことがある。
【0092】
抗原結合ドメイン
抗原結合ドメインは、抗原結合部位を含み、かつ標的抗原に結合する、特異的結合メンバーの一部分である。いくつかの態様において、抗原結合ドメインは、1つもしくは複数の抗体可変ドメイン(例えば、VHドメインからなるいわゆるFd抗体断片)またはその抗原結合部分によって提供され得る。いくつかの態様において、抗原結合ドメインは、抗体の軽鎖可変領域(VL)および抗体の重鎖可変領域(VH)を含む。
【0093】
特異的結合メンバーは、天然に、もしくは様々な真核細胞(例えばCHOもしくはNSO(ECACC 85110503)細胞の系によって、グリコシル化されてもよく、または、それらは、(例えば、原核細胞における発現によって作製される場合は)グリコシル化されていなくてもよい。グリコシル化はまた、例えば、結果として生じる抗体のADCC活性を増大させるために、フコシル化を阻害することによって、意図的に改変してもよい。したがって、フコシル化を最小化するか、または無くすように本発明の特異的結合メンバーのうちいずれかを発現させてもよい。
【0094】
いくつかの態様において、本発明のCDRまたはVHドメインもしくはVLドメインは、本明細書においてその配列が説明される指定された領域に同一であるか、または著しく類似していると考えられる。CDRおよび/またはVHドメインもしくはVLドメインにおいて、1つ〜5つ、好ましくは1つ〜4つ、または1つもしくは2つ、または3つもしくは4つのアミノ酸置換がなされ得ることが企図される。本明細書においてその配列が与えられるものに著しく類似しているVHドメインまたはVLドメインならびにCDRおよびCDRのセットは、実質的に本明細書において説明される配列を有するものと同様に、本発明の局面に包含される。
【0095】
本発明のCDRまたはCDRセットを保有するための構造体は、CDRもしくはCDRセットが、再配列された免疫グロブリン遺伝子によってコードされる天然のVHおよびVL抗体可変ドメインのCDRもしくはCDRセットに対応する位置に位置している、抗体の重鎖配列もしくは軽鎖配列、またはその実質的な部分を一般に有すると考えられる。免疫グロブリン可変ドメインの構造および位置は、Kabat, E. A. et al., Sequences of Proteins of Immunological Interest. 4th Edition. US Department of Health and Human Services.1987、および現在インターネットで利用可能なその最新版(http://immuno.bme.nwu.edu、または任意の検索エンジンを用いて「Kabat」を発見されたい)を参照することにより、決定することができる。CDRは、Kabatらに従って定義される。
【0096】
CDRはまた、フィブロネクチンまたはシトクロムBなど他の足場によって保有されてもよい。
【0097】
好ましくは、実質的に本明細書において説明されるCDRアミノ酸配列は、ヒトの可変ドメインまたはその実質的な部分中にCDRとして保有されている。実質的に本明細書において説明されるHCDR3配列は、本発明の好ましい態様に相当し、かつこれらはそれぞれ、ヒトの重鎖可変ドメインまたはその実質的な部分中にHCDR3として保有されていることが好ましい。
【0098】
本発明において使用される可変ドメインは、任意の生殖系列もしくは再配列されたヒト可変ドメインから得るか、もしくはそれらに由来してよく、または、公知のヒト可変ドメインのコンセンサス配列もしくは実際の配列に基づいた合成の可変ドメインでもよい。本発明のCDR配列(例えばCDR3)は、組換えDNAテクノロジーを用いて、CDR(例えばCDR3)を欠いている可変ドメインのレパートリー中に導入することができる。好ましい生殖系列フレームワークは、既に本明細書において確認した。
【0099】
例えば、Marks et al.(Bio/Technology, 1992, 10:779-783)では、可変ドメイン領域の5'末端に向けられているか、または隣接しているコンセンサスプライマーを、ヒトVH遺伝子の第3フレームワーク領域に対するコンセンサスプライマーと組み合わせて使用して、CDR2を欠くVΚ可変ドメインのレパートリーを提供する、抗体可変ドメインのレパートリーを作製する方法が説明されている。Marksらは、どのようにこのレパートリーを特定の抗体のCDR2と組み合わせることができるかも、さらに説明している。類似した技術を用いて、本発明のCDR3に由来する配列を、CDR3を欠いているVHドメインまたはVLドメインのレパートリーとシャッフルし、かつそのシャッフルされた完全なVHドメインまたはVLドメインを同族のVHドメインまたはVLドメインと組み合わせて、本発明の特異的結合メンバーを提供することができる。次いで、適切な特異的結合メンバーを選択することができるように、WO92/01047、またはKay, B. K., Winter,J.およびMcCafferty, J.(1996)Phage Display of Peptides and Proteins:A Laboratory Manual, San Diego:Academic Pressを含む、後続の文献の多くの部分のいずれかのファージディスプレイ系のような適切な宿主系においてレパートリーを提示することができる。レパートリーは、104個より多い個々のメンバー、例えば、106個〜108個または1010個のメンバーからなり得る。他の適切な宿主系には、酵母ディスプレイ、最近ディスプレイ、T7ディスプレイ、リボソームディスプレイ、共有結合ディスプレイなどが含まれる。
【0100】
類似したシャッフリング技術またはコンビナトリアル技術もまた、Stemmer(Nature, 1994, 370:389-391)によって開示されており、彼は、βラクタマーゼ遺伝子に関してこの技術を説明しているが、このアプローチを抗体作製のために使用できることを述べている。
【0101】
さらなる代替案は、可変ドメイン全体の内部に変異を発生させるために、1つまたは複数の選択されたVH遺伝子および/またはVL遺伝子のランダム変異誘発を用いて、本発明のCDR由来配列を保有する新規なVH領域またはVL領域を作製することである。このような技術は、誤りがちなPCRを使用したGramらによって説明されている(1992, Proc. Natl. Acad. Sci., USA, 89:3576-3580)。好ましい態様において、1つまたは2つのアミノ酸置換が、HCDRセットおよび/またはLCDRセットの内部で行われる。
【0102】
使用し得る別の方法は、VH遺伝子またはVL遺伝子のCDR領域に変異誘発を誘導することである。このような技術は、Barbasら(1994, Proc. Natl. Acad. Sci., USA, 91:3809-3813)およびSchierら(1996, J. Mol. Biol. 263:551-567)によって開示されている。
【0103】
上述の技術はすべて、それ自体が当技術分野において公知であり、かつそれら自体で、本発明の一部分を形成しない。本明細書において提供される開示を考慮すれば、当業者は、このような技術を使用して、当技術分野においてルーチンな方法論を用いて本発明の特異的結合メンバーを提供することができると考えられる。
【0104】
本発明のさらなる局面は、TGFβ抗原に特異的な抗体の抗原結合部位を得るための方法であって、本明細書において説明されるVHドメインのアミノ酸配列中の1つまたは複数のアミノ酸の付加、欠失、置換、または挿入によって、VHドメインのアミノ酸配列変異体であるVHドメインを提供する段階、任意で、このようにして提供されたVHドメインを1つまたは複数のVLドメインと組み合わせる段階、ならびに、VHドメインまたは1つもしくは複数のVH/VL組み合わせを試験して、TGFβに特異的であり、かつ1つまたは複数の好ましい特性、好ましくは、TGFβ活性を中和する能力を任意で有する、特異的結合メンバーまたは抗原結合ドメインを同定する段階を含む方法を提供する。前記VLドメインは、実質的に本明細書において説明されるアミノ酸配列を有してよい。
【0105】
本明細書において開示されるVLドメインの1つまたは複数の配列変異体が、1つまたは複数のVHドメインと組み合わされる類似した方法を使用してもよい。
【0106】
好ましい態様において、PET1073G12、PET1074B9、またはPET1287A10のVHドメインは、変異の影響を受けて、1つまたは複数のVLドメインと組み合わされ得る1つまたは複数のVHドメインのアミノ酸配列変異体を提供し得る。
【0107】
本発明のさらなる局面は、以下の段階を含む、ヒトTGFβの3種のアイソフォームすべてに特異的な特異的結合メンバーを調製する方法を提供する:
(a)置換される予定のCDR3を含むか、またはCDR3コード領域を欠くVHドメインをコードしている核酸の出発レパートリーを提供する段階;
(b)HCDR3に関して実質的に本明細書において説明されるアミノ酸配列をコードしているドナー核酸がレパートリー中のCDR3領域中に挿入されて、VHドメインをコードする核酸の生成物レパートリーを提供するように、前記レパートリーを該ドナー核酸と組み合わせる段階;
(c)前記生成物レパートリーの核酸を発現させる段階;
(d)TGFβの少なくとも1種のアイソフォームに特異的な特異的結合メンバーを選択する段階;および
(e)前記特異的結合メンバーまたはそれをコードする核酸を回収する段階。
【0108】
本方法は、TGFβの3種のアイソフォームそれぞれを用いた結合アッセイ法および中和アッセイ法を実施して、3種のアイソフォームすべてに結合し、かつ中和する特異的結合メンバーを同定する段階も、さらに含み得る。
【0109】
やはり、本発明のLCDR3を、置換される予定のCDR3を含むか、またはCDR3コード領域を欠くVLドメインをコードしている核酸のレパートリーと組み合わせる類似した方法も使用することができる。
【0110】
同様に、1種もしくは複数種、または3種すべてのCDRをVHドメインまたはVLドメインのレパートリーに継ぎ足し、次いでこれらを、ヒトTGFβのアイソフォームすべてに対して特異的な1種または複数種の特異的結合メンバーについてスクリーニングしてもよい。
【0111】
VHドメインは、生殖系列配列を有してよく、かつ好ましい態様において、DP-10またはDP-88である。VLドメイン配列は、生殖系列配列を有してよく、かつ好ましい態様において、DPK-22である。
【0112】
好ましい態様において、PET1073G12、PET1074B9、もしくはPET1287A10のHCDR1、HCDR2、およびHCDR3のうちの1つもしくは複数、または、PET1073G12、PET1074B9、もしくはPET1287A10のHCDRセットが使用され得、かつ/または、PET1073G12、PET1074B9、もしくはPET1287A10のLCDR1、LCDR2、およびLCDR3のうちの1つもしくは複数、またはPET1073G12、PET1074B9、もしくはPET1287A10のLCDRセットが使用され得る。
【0113】
免疫グロブリン可変ドメインの実質的な部分は、少なくとも3種のCDR領域を、介在するフレームワーク領域と共に含むと考えられる。好ましくは、この部分は、第1および第4のフレームワーク領域のいずれかまたは両方の少なくとも約50%も含むと考えられ、この50%は、第1のフレームワーク領域のC末端の50%および第4のフレームワーク領域のN末端の50%である。可変ドメインの実質的な部分のN末端またはC末端の付加的な残基は、天然の可変ドメイン領域とは通常関連していないものでよい。例えば、組換えDNA技術によって作製される本発明の特異的結合メンバーを構築することにより、クローニング段階または他の操作段階を容易にするために導入されるリンカーによってコードされたN末端またはC末端残基の導入がもたらされ得る。他の操作段階には、リンカーを導入して、免疫グロブリン重鎖、(例えばジアボディの作製における)他の可変ドメイン、または本明細書において別の箇所でより詳細に考察するタンパク質ラベルを含む別のタンパク質配列に、本発明の可変ドメインを結合させる段階が含まれる。
【0114】
本発明の好ましい局面において、VHドメインおよびVLドメインの対を含む特異的結合メンバーが好ましいが、VHドメイン配列またはVLドメイン配列のいずれかをベースとする単一の結合ドメインは、本発明の別の局面を形成する。単一の免疫グロブリンドメイン、特にVHドメインが、特異的な様式で標的抗原に結合できることは公知である。
【0115】
単一の特異的結合ドメインのいずれかの場合において、これらのドメインを使用して、ヒトTGFβの3種のアイソフォームに結合できる、2ドメインの特異的結合メンバーを形成することができる相補的ドメインについてスクリーニングすることができる。
【0116】
これは、WO92/01047において開示されている、いわゆる階層的な二重組み合わせのアプローチを用いて、ファージディスプレイスクリーニング法によって実現することができる。このアプローチでは、H鎖クローンまたはL鎖クローンのいずれかを含む個々のコロニーを使用して、他の鎖(LまたはH)をコードするクローンの完全なライブラリーを感染させ、かつ結果として生じる2種の鎖に特異的な結合メンバーを、この参考文献において説明されているもののようなファージディスプレイ技術に従って選択する。この技術は、Marksらの同書においても開示されている。
【0117】
本発明の特異的結合メンバーは、抗体の定常領域またはそれらの一部分をさらに含んでよい。例えば、VLドメインは、ヒトのCκ鎖またはCλ鎖、好ましくはCκ鎖を含む、抗体軽鎖の定常ドメインに、C末端が結合されていてよい。同様に、VHドメインをベースとする特異的結合メンバーは、任意の抗体アイソタイプ、例えば、IgG、IgA、IgE、およびIgM、ならびにアイソタイプサブクラスのうちのいずれか、特にIgG1およびIgG4に由来する免疫グロブリン重鎖の全体または一部分(例えばCH1ドメイン)に、C末端が結合されていてよい。IgG4が好ましい。IgG4は、補体に結合せず、かつエフェクター機能を生じないため、いくつかの用途に好ましい。エフェクター機能が望ましい場合は、IgG1が好ましい。エフェクター機能はまた、フコース含有量を減少させるなど、当技術分野において公知である方法によって、抗体のグリコシル化状態を操作することによって、増大させてもよい。重鎖は、C末端にリシン残基を有しても、有さなくてもよい。これらの特性を有し、かつ可変領域を安定させる、任意の合成定常領域変異体または他の定常領域変異体もまた、本発明の態様において使用するのに好ましい。
【0118】
本明細書において開示される特異的結合メンバーまたはその抗原結合断片の異種調製物もまた、本発明の範囲内である。例えば、このような調製物は、完全長の重鎖およびC末端のリシンを欠く重鎖を有する抗体、様々な程度にグリコシル化された抗体、N末端のグルタミン酸が環化してピログルタミン酸残基を形成したもののような誘導体化されたアミノ酸を有する抗体、ならびに/または、脱アミド化型の重鎖および/もしくは軽鎖を有する抗体の混合物でよい。
【0119】
本発明の特異的結合メンバーは、検出可能または機能的な標識で標識されてよい。検出可能な標識には、131Iまたは99TCなどの放射性標識物質が含まれ、これらは、抗体イメージングの技術分野において公知である従来の化学反応を用いて、本発明の抗体に結合させることができる。標識には、西洋ワサビペルオキシダーゼのような酵素標識も含まれる。標識にはさらに、特異的な関連した検出可能部分、例えば標識されたアビジンへの結合を介して検出することができるビオチンのような化学的部分が含まれる。
【0120】
本発明の特異的結合メンバーは、ヒト被験体または動物被験体、好ましくはヒトの診断または治療の方法において使用されるように設計される。
【0121】
いくつかの態様において、本発明の特異的結合メンバーは、限定されるわけではないが、受容体セリン/トレオニンキナーゼI型もしくはII型およびプロテオグリカンβグリカン(TGFβIII型受容体)を含む複合体を含む、細胞表面のTGFβ受容体または受容体複合体に、TGFβ1、TGFβ2、および/またはTGFβ3が結合するのを阻害する。したがって、本発明は、細胞表面のTGFβ受容体または受容体複合体へのTGFβ結合を阻害するための方法であって、本発明の特異的結合メンバーにTGFβを接触させる段階、および受容体または受容体複合体への結合の阻害を検出する段階を含む方法を含む。様々な態様において、受容体へのTGFβ結合の阻害は、TGFβ受容体I型のリン酸化の減少、TGFβ受容体I型の活性化の減少、R-SMADタンパク質、特にSMAD2およびSMAD3のリン酸化および/もしくは活性化の減少、該SMADタンパク質の核移行の減少、DNAへのSMADタンパク質の結合の減少、ならびに/または前記細胞もしくは細胞型における発現がTGFβシグナル伝達によって媒介されることが公知である遺伝子の発現の調節によって、示すことができる。さらなるアッセイ法は、実施例において明らかにする。
【0122】
したがって、本発明の別の局面は、提供される特異的結合メンバーの投与を含む治療の方法、そのような特異的結合メンバーを含む薬学的組成物、および、投与用の薬剤の製造、例えば、特異的結合メンバーを薬学的に許容される賦形剤と配合する段階を含む、薬剤または薬学的組成物を製造する方法における、このような特異的結合メンバーの使用を提供する。
【0123】
本発明の特異的結合メンバーは、注射(例えば、皮下、静脈内、体腔内(例えば腫瘍切除後)、病巣内、腹腔内、もしくは筋肉内)によって、吸入によって、または、局所的に(例えば、眼内、鼻腔内、直腸、創傷中、皮膚表面)、もしくは経口的に投与され得る。投与経路は、製品の物理化学的特質によって、疾患を特別に考慮することによって、用量もしくは投与間隔によって、または、有効性を最適化するか、もしくは副作用を最小限に抑えるための条件によって、決定することができる。
【0124】
抗TGFβ治療は、医療従事者による投与に制限されないと予想される。したがって、皮下注射、特に、無針器具を使用するものが適切である場合がある。
【0125】
本発明によれば、提供される組成物は、それを必要とする個体に投与され得る。投与は、好ましくは、「治療的有効量」であり、これは、患者に利益を与えるのに十分な量である。このような利益は、少なくとも、特定の疾患または障害の少なくとも1種の症状の改善である。投与される実際の量、ならびに投与速度および投与のタイムコースは、治療される疾患の性質および重症度に依存すると考えられる。治療の処方、例えば、投薬量の決定などは、前臨床的研究および臨床的研究に基づいて決定することができ、これらの研究の設計は、十分に当業者のレベルの範囲内である。
【0126】
正確な用量は、抗体が診断用であるか、または治療用であるかどうか、治療しようとする領域のサイズおよび位置、抗体の正確な性質(例えば、全抗体、断片、もしくはジアボディ)、ならびに、抗体に結合された任意の検出可能な標識または他の分子の性質を含む、いくつかの因子に依存すると考えられる。典型的な抗体用量は、全身適用の場合は100μg〜1gmの範囲、および局所適用の場合は1μg〜1mgの範囲であると考えられる。典型的に、抗体は、全抗体、好ましくはIgG4アイソタイプであると考えられる。これは、成人患者の1回の治療用の用量であり、小児および乳児のために比例的に調整することができ、また、分子量および活性に比例して、他の抗体形態用に調整することもできる。治療は、医師の判断で、毎日、1週2回、毎週、毎月、または他の間隔で繰り返してよい。本発明の好ましい態様において、治療は周期的であり、かつ各投与の間の期間は、約2週間もしくはそれ以上、好ましくは約3週間もしくはそれ以上、より好ましくは約4週間もしくはそれ以上、または1ヶ月に約1回である。
【0127】
本発明の特異的結合メンバーは、通常、特異的結合メンバーに加えて少なくとも1種の成分を含み得る、薬学的組成物の形態で投与される。
【0128】
したがって、本発明による、かつ本発明に従って使用するための薬学的組成物は、有効成分に加えて、薬学的に許容される賦形剤、担体、緩衝剤、安定化剤、または当業者に周知の他の材料を含んでよい。このような材料は、非毒性であるべきであり、かつ有効成分の有効性を妨害するべきではない。このような材料には、例えば、生理学的に適合性である、任意およびすべての溶剤、分散媒、コーティング剤、抗菌薬および抗真菌薬、ならびに、等張化剤および吸収遅延剤などが含まれ得る。薬学的に許容される担体のいくつかの例は、水、生理食塩水、リン酸緩衝化生理食塩水、デキストロース、グリセロール、およびエタノールなど、ならびにそれらの組み合わせである。多くの場合において、等張化剤、例えば糖、マンニトール、ソルビトールなどの多価アルコール、または塩化ナトリウムを組成物中に含むことが好ましいと考えられる。薬学的に許容される物質のさらなる例は、抗体の貯蔵寿命または有効性を向上させる、湿潤剤、または、湿潤剤もしくは乳化剤、保存剤、または緩衝剤など少量の補助物質である。担体または他の材料の正確な性質は、経口、局所、吸入、または注射、例えば静脈注射でよい、投与経路に依存すると考えられる。好ましい態様において、抗体は、静脈内注入または静脈注射によって投与される。別の好ましい態様において、抗体は、筋肉内注射または皮下注射によって投与される。
【0129】
経口投与用の薬学的組成物は、例えば、不活性な希釈剤または吸収可能な可食担体を含む、錠剤、カプセル剤、散剤、または液剤の形態であってよい。錠剤は、ゼラチンまたは補助剤のような固形担体を含んでよい。液状の薬学的組成物は、一般に、水、石油、動物油もしくは植物油、鉱油、または合成油などの液体担体を含む。生理食塩水溶液、デキストロースもしくは他の糖類の溶液、またはエチレングリコール、プロピレングリコール、もしくはポリエチレングリコールなどのグリコールが含まれてよい。特異的結合メンバー(および、所望の場合は、他の成分)はまた、硬いもしくは軟らかい殻のゼラチンカプセル剤に封入されるか、圧縮して錠剤にされるか、または、被験体の食事中に直接組み込まれてもよい。経口的な治療的投与の場合、有効成分を賦形剤と混合し、かつ摂取可能な錠剤、バッカル錠、トローチ剤、カプセル剤、エリキシル剤、懸濁剤、シロップ剤、およびカシェ剤などの形態で使用することができる。非経口投与以外によって本発明の化合物を投与するためには、不活性化を防止する材料でその化合物をコーティングするか、または、不活性化を防止する材料と共にその化合物を同時投与することが必要である場合がある。
【0130】
静脈注射、または疾患部位への注射の場合、有効成分は、パイロジェンフリーであり、かつ適切なpK、等張性、および安定性を有する、経口的に許容される水性液剤の形態であると考えられる。当業者は、例えば、塩化ナトリウム注射液、リンゲル注射液、乳酸リンゲル注射液などの等張性ビヒクルを用いて、適切な液剤を首尾よく調製することができる。保存剤、安定化剤、緩衝剤、抗酸化剤、および/または他の添加剤も、必要に応じて含まれてよい。
【0131】
組成物は、治療される状態に応じて、単独でまたは他の治療と組み合わせて、同時にまたは逐次的に投与されてよい。
【0132】
本発明の特異的結合メンバーは、溶液剤(例えば、注射可能な液剤および注入可能な液剤)、分散剤もしくは懸濁剤、錠剤、丸剤、散剤、リポソーム、および坐剤などの液体、半固体、または固体の形態で製剤化され得る。好ましい形態は、意図される投与様式、治療的用途、分子の物理化学的特性、および送達経路に依存する。製剤は、賦形剤、または賦形剤の組み合わせ、例えば、糖、アミノ酸、および界面活性剤を含んでよい。液体製剤は、広範囲の抗体濃度およびpHを含んでよい。固形製剤は、例えば、凍結乾燥、噴霧乾燥、または超臨界流体技術による乾燥によって、製造され得る。
【0133】
治療用組成物は、典型的には、製造および貯蔵の条件下で、無菌かつ安定でなければならない。組成物は、溶液、マイクロエマルジョン、分散系、リポソーム、または高い薬物濃度に適した他の規則構造体として製剤化することができる。無菌の注射液剤は、適切な溶媒中の必要とされる量の特異的結合メンバーを、必要に応じて、上記に列挙した成分のうちの1つまたは組み合わせと混合し、続いてろ過滅菌することによって調製することができる。一般に、分散剤は、基本となる分散媒体および上記に列挙したもののうち必要な他の成分を含む無菌ビヒクル中に活性化合物を混合することによって調製される。無菌注射液剤を調製するための無菌粉末の場合、好ましい調製方法は、活性成分および任意の付加的な所望の成分の粉末を、予め滅菌ろ過したその溶液から生じさせる、真空乾燥および凍結乾燥である。液剤の適切な流動性は、例えば、レシチンなどのコーティングの使用によって、分散系の場合は必要な粒径の維持によって、および界面活性剤の使用によって維持することができる。注射用組成物の持続吸収は、吸収を遅延させる作用物質、例えば、モノステアリン酸塩およびゼラチンを組成物中に含めることによって、実現することができる。
【0134】
特定の態様において、抗体組成物活性化合物は、埋め込み剤、経皮パッチ、およびマイクロカプセル化送達系を含む制御放出製剤のように、急速な放出から抗体を保護すると考えられる担体と共に調製され得る。エチレン酢酸ビニル、ポリ無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、およびポリ乳酸など、生分解性かつ生体適合性のポリマーを使用することができる。このような製剤を調製するための多くの方法は、特許権を与えられているか、または、一般に当業者に公知である。例えば、Sustained and Controlled Release Drug Delivery Systems(J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978)を参照されたい。
【0135】
本発明は、本明細書において提供される特異的結合メンバーのTGFβへの結合を引き起こす段階または可能にさせる段階を含む方法を提供する。前述したように、このような結合は、例えば、特異的結合メンバーもしくは特異的結合メンバーをコードする核酸を患者に投与した後にインビボで起こってもよく、またはこれは、インビトロで、例えば、ELISA、ウェスタンブロット法、免疫細胞化学、免疫沈降、アフィニティクロマトグラフィー、もしくは細胞ベースのアッセイ法において、またはエクスビボベースの治療方法(例えば、細胞もしくは体液を本発明による特異的結合メンバーにエクスビボで接触させ、次いで患者に投与する方法)において、起こってもよい。
【0136】
特異的結合メンバーのTGFβへの結合量は、測定することができる。定量は、診断上の関心対象であり得る、試験試料中の抗原の量に関係している場合がある。
【0137】
本発明の任意の局面または態様による特異的結合メンバーまたは抗体分子を含むキットもまた、本発明のある局面として提供される。本発明のキットにおいて、特異的結合メンバーまたは抗体分子は、例えば以下にさらに説明するように、判定しようとする試料中での反応性を与えるために標識されてもよい。キットの構成要素は、一般に無菌であり、かつ密封されたバイアル瓶または他の容器中に入れられている。キットは、抗体分子が有用である診断的解析または他の方法において使用され得る。キットは、ある方法、例えば本発明による方法においてそれらの構成要素を使用するための取扱い説明書を含んでよい。このような方法を補助するか、または実施するのを可能にする補助的な材料は、本発明のキット内に含まれてよい。
【0138】
試料中の抗体の反応性は、任意の適切な手段によって判定され得る。ラジオイムノアッセイ法(RIA)は、1つの実行可能な手段である。放射性標識された抗原を非標識抗原(試験試料)と混合し、かつ抗体と結合させる。結合された抗原を、未結合の抗原から物理的に分離し、かつ抗体に結合された放射性抗原の量を決定する。試験試料中に存在する抗原が多いほど、抗体に結合する放射性抗原は少ないと考えられる。レポーター分子に連結された抗原または類似体を用いる競合結合測定法もまた、非放射性抗原と共に使用してよい。レポーター分子は、蛍光色素、リン光体、または、分光的に孤立した吸光もしくは発光の特徴を有するレーザー色素でよい。適切な蛍光色素には、フルオレセイン、ローダミン、フィコエリトリン、およびテキサスレッドが含まれる。適切な発色色素には、ジアミノベンジジンが含まれる。
【0139】
他のレポーターには、着色されている磁性または常磁性のラテックスビーズのような、高分子コロイド粒子また粒子状物質、および、検出可能なシグナルの視覚的な観察、電子的な検出、または別の方法による記録を、直接的にまたは間接的に引き起こすことができる、生物学的または化学的に活性な作用物質が含まれる。これらの分子は、顕色もしくは変色させるか、または例えば電気的特性の変化を引き起こす反応を触媒する酵素でよい。これらは、エネルギー状態の間の電子遷移が、特徴的なスペクトルの吸収または放出をもたらすように、分子的に励起可能であってよい。これらは、バイオセンサーと組み合わせて使用される化学成分を含んでよい。ビオチン/アビジンまたはビオチン/ストレプトアビジンおよびアルカリ性ホスファターゼ検出系が使用され得る。個々の抗体-レポーター結合物によって生成されるシグナルを用いて、試料(正常および試験)中の関連する抗体結合の定量化可能な絶対的または相対的データを導き出すことができる。
【0140】
本発明はまた、競合アッセイ法において抗原レベルを測定するための、前述の特異的結合メンバーの使用、すなわち、競合アッセイ法において、本発明によって提供される特異的結合メンバーを使用することによって、試料中の抗原のレベルを測定する方法も提供する。これは、未結合抗体からの結合抗体の物理的分離が必要とされない場合であり得る。結合の際に物理的または光学的変化が生じるように特異的結合メンバーにレポーター分子を連結することは、1つの実行可能な手段である。レポーター分子は、検出可能な、かつ好ましくは測定可能なシグナルを直接的にまたは間接的に生じさせてよい。レポーター分子の結合は、直接的もしくは間接的、共有結合的、例えばペプチド結合を介して、または非共有結合的でよい。ペプチド結合を介した結合は、抗体およびレポーター分子をコードする融合遺伝子の組換え発現の結果としてでもよい。
【0141】
本発明はまた、例えばバイオセンサーシステムにおいて、本発明による特異的結合メンバーを使用することによって、抗原レベルを直接測定することを提供する。
【0142】
結合を測定する様式は本発明の特徴ではなく、かつ当業者は、彼らの好みおよび一般的知識に従って適切な様式を選択することができる。
【0143】
前述したように、様々な局面および態様において、本発明は、TGFβ(TGFβ1、TGFβ2、および/またはTGFβ3)への結合に際して、本明細書において定義される任意の特異的結合メンバー、例えば、PET1037GR、PET1074B9、もしくはPET1287A10のIgG4と競合する、ヒト、ヒト化、キメラ、または合成の特異的結合メンバーにまで及ぶ。結合メンバー間の競合または交差競合は、例えば、1つの結合メンバーに特異的なレポーター分子をタグ化し、他のタグ無し結合メンバーの存在下で検出することができるようにして、同じエピトープもしくは重複するエピトープに結合する特異的結合メンバーの同定を可能にすることによって、インビトロで容易に分析することができる。
【0144】
競合は、例えば、TGFβがプレートに固定化されており、かつ第1のタグ化された結合メンバー(参照結合メンバー)が、1つまたは複数の他のタグ無し結合メンバーと共にプレートに添加される、ELISAを用いて判定され得る。タグ化結合メンバーと競合するタグ無し結合メンバーの存在は、タグ化結合メンバーによって発されるシグナルの減少によって観察される。
【0145】
競合に関して試験する際、抗原のペプチド断片、特に、関心対象のエピトープを含むペプチドが使用され得る。エピトープ配列に加えて両端に1つもしくは複数のアミノ酸を有するペプチドが使用され得る。このようなペプチドは、指定された配列から「本質的になる」と言うことができる。本発明による特異的結合メンバーは、抗原に対するそれらの結合が、所与の配列を有するか、または所与の配列を含むペプチドによって阻害されるようなものであり得る。これに関して試験する際、いずれかの配列に加えて1つもしくは複数のアミノ酸を有するペプチドが使用され得る。
【0146】
特定のペプチドに結合する特異的結合メンバーは、ペプチドを用いたパニングによって、例えば、ファージディスプレイライブラリーから単離することができる。
【0147】
本発明はさらに、本発明の特異的結合メンバーをコードする単離された核酸も提供する。核酸には、DNAおよび/またはRNAが含まれ得る。好ましい局面において、本発明は、CDRもしくはCDRセット、または、抗体の抗原結合部位またはVHドメインもしくはVLドメイン、または上記に定義した本発明の抗体分子、例えばscFvもしくはIgG4をコードする核酸を提供する。
【0148】
本発明はまた、前述の少なくとも1種のポリヌクレオチドを含む、プラスミド、ベクター、転写カセット、または発現カセットの形態の構築物も提供する。
【0149】
本発明はまた、前述の1種または複数種の構築物を含む、組換え宿主細胞も提供する。コード核酸からの発現を含む、コードされた生成物を産生する方法と同様に、提供される任意のCDRもしくはCDRセット、またはVHドメインもしくはVLドメイン、または抗原結合部位、または抗体分子、例えばscFvもしくはIgG4をコードする核酸は、それ自体で本発明のある局面を形成する。発現は、その核酸を含む組換え宿主細胞を適切な条件下で培養することによって、簡便に実現され得る。発現によって生成された後、VHドメインもしくはVLドメイン、または特異的結合メンバーは、任意の適切な技術を用いて単離および/または精製され、次いで、必要に応じて使用され得る。
【0150】
本発明による特異的結合メンバー、VHドメインおよび/またはVLドメイン、ならびにコードしている核酸分子およびベクターは、例えば天然の環境から、実質的に純粋もしくは均質な形態で、または、核酸の場合には、必要とされる機能を有するポリペプチドをコードする配列以外の核酸も遺伝子源も含まずに、もしくは実質的に含まずに、単離および/または精製して提供され得る。本発明による核酸は、DNAまたはRNAを含んでよく、かつ全体的にまたは部分的に合成でよい。本明細書において説明されるヌクレオチド配列への言及は、指定された配列を有するDNA分子を包含し、かつ文脈において特に指示がない限り、TがUで置換されている指定された配列を有するRNA分子を包含する。
【0151】
様々な異なる宿主細胞においてポリペプチドをクローニングおよび発現するための系は周知である。適切な宿主細胞には、細菌、哺乳動物細胞、植物細胞、昆虫細胞、菌、酵母、ならびにトランスジェニック植物およびトランスジェニック動物が含まれる。異種ポリペプチドを発現させるために当技術分野において利用可能な哺乳動物細胞株には、チャイニーズハムスター卵巣(CHO)細胞、HeLa細胞、仔ハムスター腎臓細胞、NSOマウス黒色腫細胞、YB2/0ラット骨髄腫細胞、ヒト胚性腎臓細胞、ヒト胚性網膜細胞、および他多数が含まれる。一般的な、好ましい細菌宿主は大腸菌である。
【0152】
大腸菌のような原核細胞における抗体および抗体断片の発現は、当技術分野において十分に確立されている。再検討するためには、例えば、Pluckthun, A.Bio/Technology 9:545-551(1991)を参照されたい。培養状態の真核細胞における発現もまた、特異的結合メンバーの作製のための1つの選択肢として当業者は利用可能である。例えば、Chadd HEおよびChamow SM(2001)110 Current Opinion in Biotechnology 12:188-194, Andersen DCおよびKrummen L(2002)Current Opinion in Biotechnology 13:117, Larrick JWおよびThomas DW(2001)Current Opinion in Biotechnology 12:411-418に記載されている。
【0153】
必要に応じて、プロモーター配列、ターミネーター配列、ポリアデニル化配列、エンハンサー配列、マーカー遺伝子、および他の配列を含む、適切な調節配列を含む適切なベクターを選択または構築することができる。ベクターは、必要に応じて、プラスミド、ウイルス、例えば、ファージもしくはファージミド、または、アデノウイルス、AAV、レンチウイルスなどでよい。さらなる詳細については、例えば、Molecular Cloning: A Laboratory Manual, 3rd edition, SambrookおよびRussell, 2001, Cold Spring Harbor Laboratory Pressを参照されたい。例えば、核酸構築物の調製、変異誘発、配列決定、細胞中へのDNAの導入および遺伝子発現における核酸の操作ならびにタンパク質の解析のための多くの公知の技術およびプロトコールは、Current Protocols in Molecular Biology, Second Edition, Ausubel et al. eds., John Wiley & Sons, 1986、Short Protocols in Molecular Biology:A Compendium of Methods from Current-Protocols in Molecular Biology, Ausubel et al. eds., John Wiley & Sons, 4th edition 1999に詳細に説明されている。SambrookらおよびAusubelらの開示内容(両方)は、参照により本明細書に組み入れられる。
【0154】
したがって、本発明の別の局面は、本明細書において開示される核酸を含む宿主細胞を提供する。このような宿主細胞は、インビトロでよく、かつ培養状態にあってよい。このような宿主細胞は、インビボでもよい。宿主細胞がインビボで存在する場合、本発明の特異的結合メンバーを「イントラボディ」または細胞内抗体として細胞内発現させることが可能になることがある。イントラボディは、遺伝子療法用に使用され得る(Marasco WA(1997)Gene Therapy, 4(1):11)。
【0155】
なおさらなる局面は、このような核酸を宿主細胞に導入する段階を含む方法を提供する。この導入には、任意の利用可能な技術を使用してよい。真核細胞の場合、適切な技術には、リン酸カルシウムトランスフェクション、DEAE-デキストラン、エレクトロポレーション、リポソームを介したトランスフェクション、およびレトロウイルスまたは他のウイルス、例えば、ワクシニア、もしくは昆虫細胞の場合、バキュロウイルスを使用する形質導入が含まれ得る。宿主細胞、特に、真核細胞中に核酸を導入する段階では、ウイルスまたはプラスミドに基づく系を使用してよい。プラスミド系はエピソームによって維持され得るか、または、宿主細胞もしくは人工染色体中に組み入れられ得る(Csonka E et al.(2000)Journal of Cell Science, 113:3207-3216;Vanderbyl S et al.(2002)Molecular Therapy, 5(5):10)。組み入れは、単一または複数の位置における1つまたは複数のコピーのランダムな組込みまたは標的化された組込みのいずれかによってでよい。細菌細胞の場合、適切な技術には、塩化カルシウム形質転換、エレクトロポレーション、およびバクテリオファージを用いたトラスフェクションが含まれ得る。
【0156】
導入に続いて、例えば、遺伝子発現のための条件下で宿主細胞を培養することによって、核酸からの発現を引き起こすか、または可能にさせることができる。
【0157】
1つの態様において、本発明の核酸は、宿主細胞のゲノム(例えば染色体)中に組み込まれる。組込みは、標準的な技術に従って、ゲノムとの組換えを促進する配列を含めることによって促進され得る。
【0158】
本発明はまた、前述の特異的結合メンバーまたはポリペプチドを発現させるために、発現系において前述の構築物を使用する段階を含む方法も提供する。
【0159】
本発明の核酸分子は、遺伝子療法を介して、それを必要とする患者に投与することができる。この療法は、インビボまたはエクスビボのいずれかでよい。好ましい態様において、重鎖および軽鎖の両方をコードしている核酸分子が、患者に投与される。より好ましい態様において、これらの核酸分子は、B細胞の染色体中に安定に組み込まれるように投与される。これは、B細胞が、抗体を産生するように特化されているためである。好ましい態様において、B細胞前駆体は、エクスビボでトランスフェクトまたは感染させられ、かつそれを必要とする患者に再移植される。別の態様において、B細胞前駆体または他の細胞は、対象となる細胞型に感染することが公知であるウイルスを用いて、インビボで感染させられる。遺伝子療法用に使用される典型的なベクターには、リポソーム、プラスミド、およびウイルスベクターが含まれる。例示的なウイルスベクターは、レトロウイルス、アデノウイルス、およびアデノ随伴ウイルスである。インビボまたはエクスビボのいずれかで感染させた後、抗体発現のレベルは、処置された患者から試料を採取し、かつ当技術分野において公知であるか、または本明細書において考察する任意のイムノアッセイを用いることによって、モニターすることができる。遺伝子療法において抗TGFβ抗体を使用する方法は、当技術分野において公知である。例えば、その全体が参照により本明細書に組み入れられる、米国特許第5,824,655号(Border)を参照されたい。
【0160】
好ましい態様において、遺伝子療法の方法は、抗TGFβ抗体の重鎖またはその抗原結合部分をコードする単離された核酸分子を投与する段階、およびその核酸分子を発現させる段階を含む。別の態様において、遺伝子療法の方法は、抗TGFβ抗体の軽鎖またはその抗原結合部分をコードする単離された核酸分子を投与する段階、およびその核酸分子を発現させる段階を含む。より好ましい方法において、遺伝子療法の方法は、本発明の抗TGFβ抗体の、重鎖もしくはその抗原結合部分をコードする単離された核酸分子および軽鎖もしくはその抗原結合部分をコードする単離された核酸分子を投与する段階、ならびにそれらの核酸分子を発現させる段階を含む。
【0161】
活性な作用物質が、血管系中または血管系の近くで作用する抗体である場合、様々な種にわたる用量補正には、一般に、体重に対する調整しか必要ではない。本発明の抗体の有効量は、急性の設定のラットおよびマウスにおいて0.5mg/kg〜5mg/kgであった。したがって、長期に渡る投薬の場合、半減期(ヒトでは約21日であると予想される)に投与される0.3mg/kg〜10mg/kgは、適当であると考えられる。好ましい用量は、有効性は十分であるが、最適な投与を容易にするのに十分な程度少量である。例えば、50mg未満の用量は、皮下投与を容易にする。静脈内投与は、初期の臨床試験において好ましく、かつ用量が多く、投薬間隔が長い場合には、重度の疾患のための送達経路として使用され得る。皮下注射は、自己投与が可能になるため、一般に、静脈内送達より好都合である。しかしながら、皮下注射は、製品に対する任意の免疫応答を増大させる可能性を有する。限局性疾患に対する局所的投与により、必要とされる製品の量を最低限に抑え、かつ作用部位での濃度を最大にすることができる。有意な安全性(治療濃度域)という利点は、局所投与により、長期的な全身投与から生じる場合がある任意の潜在的な副作用を回避することによって、与えられ得る。
【0162】
本発明の別の局面および態様は、以下の実施例の例証を含む本発明の開示に照らして、当業者に明らかになると考えられる。本明細書の任意の箇所で参照されるすべての文献は、参照により本明細書に組み入れられる。
【実施例】
【0163】
実施例1
抗TGFβ ScFvの作製
ScFvのナイーブ抗体ライブラリー
ドナー20名の脾臓リンパ球から誘導され、かつファージミドベクター中にクローニングされた、大型の単鎖Fv(scFv)ヒト抗体ライブラリー(Hutchings et al., 2001)を選択のために使用した。
【0164】
ScFv誘導選択ライブラリー
1D11.16VH-ヒトVLライブラリーを構築し、かつ所望の結合特性を有するマウス-ヒトキメラ抗体を選択するのに使用した。次いで、これらのキメラ抗体に由来するヒト軽鎖を、ヒトVH-VLライブラリーおよびヒトVH(1D11CDR3)-VLアクセプターライブラリー中にクローニングした。これらのライブラリーを、所望の結合特性を有するヒト抗体についてスクリーニングした。
【0165】
ScFvファージライブラリーの選択
組換えヒトTGFβ1およびTGFβ2は、Genzyme Corp.(Framingham, MA)によって供給され、かつTGFβ3は、R&D Systemsから購入した。
【0166】
本質的にVaughan et al.(1996)において説明されるような組換えヒトTGFβに対する一連の反復選択サイクルの後に、TGFβを認識するScFvを、ScFv誘導選択ライブラリーから単離した。手短に言えば、ライブラリーと共にインキュベーションした後に、常磁性ビーズに予め結合させておいた固定化抗原、および結合されたファージを磁気分離によって回収し、一方、未結合のファージを洗い流した。次いで、Vaughanら(1996)によって説明されているように、結合されたファージを救出し、かつ選択プロセスを繰り返した。
【0167】
選択は、製造業者の推奨に従って、Dynabeads M-270アミン(Dynal)に結合されたTGFβ1、TGFβ2、またはTGFβ3を用いて実施した。あるいは、製造業者の取扱い説明書(EZ link NHS LC Biotin, Pierce)に従って、第1級アミンに特異的な試薬スクシンイミジル-6-ビオチンアニド(biotinannido)ヘキサノアートを用いて調製されたビオチン化TGFβ1またはTGFβ2を選択に使用した。
【0168】
選択した結果物は、細胞周辺調製物中に存在するscFvが、TGFβへの結合に際して、1D11.16または組換えヒトTGFβの可溶性受容体II-Fcキメラ(sRII,R&D Systems)と競合する能力を測定する競合アッセイ法に基づくハイスループットスクリーニングにおいて、細胞周辺調製物として試験した。
【0169】
ハイスループットスクリーニングにおいて1D11.16またはsRIIと競合した試料を、Vaughanら(1996)およびOsbournら(1996)によって説明されているようなDNA配列決定に供した。scFvまたはIgGとしてクローンを発現させ、精製し、かつそれぞれ実施例4および実施例5において説明されるMLECアッセイ法および/またはNHLFアッセイ法において、TGFβを中和する能力を評価した。scFvの精製調製物は、WO 01/66754の実施例3において説明されているようにして調製した。scFvの精製調製物のタンパク質濃度は、BCA法(Pierce)によって測定した。IgGの精製調製物は、実施例3において後述するようにして調製した。
【0170】
実施例2
抗TGFβ scFvの最適化
実施例1で説明したようにして、TGFβに結合し、かつ中和するScFvを作製した。TGFβ1および/またはTGFβ2および/またはTGFβ3に対するこれらの抗体の中和力価を、DNA変異誘発および/または組み合わせ技術によって増大させた。本質的に実施例1で説明されているようにして、ファージ抗体ライブラリーを選択およびスクリーニングすることによって、TGFβ1および/またはTGFβ2および/またはTGFβ3に対する力価が有意に改善された抗体を作製した。作製したscFvを、MLEC増殖アッセイ法において1D11.16と比較した。
【0171】
高力価のTGFβ中和scFvの集団のうちで、特定の生殖系列が多く現れていることが判明した。これらは、重鎖に関してはDP-10/1-69およびDP-88/1-e(両方ともVH1生殖系列ファミリーのメンバー)であり、かつ軽鎖に関してはDPK22/A27(Vκ3ファミリー)であった。これらの生殖系列は、TGFβを汎的に中和する(pan-neutralizing)高力価の抗体に特に適した構造的フレームワークを提供すると思われる。1D11.16VH遺伝子セグメントは、ヒト生殖系列DP-7に最も類似しており、かつ1D11.16VL遺伝子セグメントは、ヒト生殖系列L16に最も類似しているため、これは予想可能ではなかった。
【0172】
PET1073G12、PET1074B9、およびPET1287A10のscFvは、MLEC増殖アッセイ法において、3種すべてのTGFβアイソフォームに対して1D11.16の力価に迫るか、またはそれを超える力価を示した。
【0173】
PET1073G12、PET1074B9、およびPET1287A10のVHおよびVLの遺伝子セグメントの誘導されたアミノ酸配列を、VBASEデータベース(Tomlinson et al., 1997)中の公知のヒト生殖系列配列に対して整列させ、かつ配列類似性によって最も近いヒト生殖系列を同定した。PET1073G12およびPET1074B9のVH遺伝子セグメントに最も近いヒト生殖系列遺伝子は、DP-10/1-69(VH1生殖系列ファミリー)として同定され、かつPET1287A10のVH遺伝子セグメントに最も近いヒト生殖系列遺伝子は、DP-88/1-e(VH1生殖系列ファミリー)として同定された。PET1073G12、PET1074B9、およびPET1287A10のVL遺伝子セグメントに最も近いヒト生殖系列遺伝子は、DPK22/A27(Vκ3生殖系列ファミリー)として同定された。部位特異的変異誘発を用いて、生殖系列とは異なるフレームワーク残基を生殖系列残基に変更した。ただし、このような変更によって、MLEC増殖アッセイ法において、結果として生じる抗体の任意のTGFβアイソフォームに対する力価の低下が3倍を超えないことを条件とした。このような力価の低下が観察された場合は、非生殖系列フレームワークのアミノ酸が最終抗体中で維持されていた。
【0174】
生殖系列化されたPET1073G12および生殖系列化されたPET1074B9において、すべてのフレームワーク残基は、VH中の2つの残基およびVL中の1つの残基を除いて生殖系列である。生殖系列化されたPET1073G12のアミノ酸配列は、VHについてはSEQ ID NO:2、およびVLについてはSEQ ID NO:7に記載されている。生殖系列化されたPET1074B9のアミノ酸配列は、VHについてはSEQ ID NO:12、およびVLについてはSEQ ID NO:17に記載されている。
【0175】
生殖系列化されたPET1287A10において、VHおよびVLのフレームワークの残基はすべて生殖系列である。生殖系列化されたPET1287A10のアミノ酸配列は、VHについてはSEQ ID NO:22、およびVLについてはSEQ ID NO:27に記載されている。
【0176】
実施例3
IgG4の作製
生殖系列化されたPET1073G12、PET1074B9、およびPET1287A10のscFvを、全抗体の重鎖および軽鎖をそれぞれ発現するベクター中にそれらのVHドメインおよびVLドメインをサブクローニングすることによって、scFv型からIgG4型に変換した。VH遺伝子セグメントをscFv発現ベクターpCantab6から増幅させ、かつヒトγ4重鎖の定常ドメイン、および哺乳動物細胞において完全な重鎖を発現させるための調節エレメントを含むpEU8.1(+)ベクター中にクローニングした。同様に、VL遺伝子セグメントをscFv発現ベクターpCantab6から増幅させ、かつヒトκ軽鎖の定常ドメイン、および哺乳動物細胞において完全な軽鎖を発現させるための調節エレメントを含むpEU3.1(-)ベクター中にクローニングした。pEU3.1(-)ベクターおよびpEU8.1(+)ベクターは、Persicら(1987)によって説明されたベクターに基づき、かつ産生される抗体の収量を増加させるためのoriP配列を導入するように改変された(Shen. et al., 1995;Langle-Rouault et al., 1998)。クローニング後、3種すべての抗体のVHドメインおよびVLドメインを配列決定して、クローニング手順の進行中に変異が導入されなかったことを確認した。
【0177】
PET1073G12、PET1074B9、およびPET1287A10の重鎖および軽鎖を発現するためのベクターをEBNA-293細胞(Invitrogen)中にトランスフェクトした。遺伝子発現および細胞上清における分泌の後、プロテインAアフィニティクロマトグラフィー(Amersham)によって、PET1073G12、PET1074B9、およびPET1287A10のIgG4を精製した。精製した抗体調製物を滅菌ろ過し、かつリン酸緩衝化生理食塩水(PBS)中、4℃で保存した後、評価した。IgGの濃度は、Mach et al.(1992)において説明されているように、IgGのアミノ酸配列に基づく吸光係数を用いて、分光光度的に測定した。Biosep-SEC-S2000カラム(Phenomenex)を使用するSEC-HPLCによって精製IgGを解析して、タンパク質の凝集または分解について検査した。それぞれ実施例4および実施例5において説明される、細胞ベースのMLECアッセイ法およびNHLFアッセイ法において、再編成されたヒトIgG4全抗体を1D11.16抗体と比較した。
【0178】
実施例4
TGFβ依存性のMLEC増殖アッセイ法における抗TGFβ抗体の中和力価
ミンク肺上皮細胞(MLEC)増殖アッセイ法を用いて、ヒトTGFβの生物活性に対する、精製した抗体調製物の中和力価を評価した。
【0179】
MLEC増殖アッセイ法は、Danielpourら(1989a)によって説明されたアッセイ法に基づいている。このアッセイ法は、TGFβ1、TGFβ2、またはTGFβ3をミンク肺上皮細胞に添加した場合、血清誘導細胞増殖の阻害が引き起こされるという原理に基づいて機能する。細胞増殖の修復をもたらすTGFβ1、TGFβ2、またはTGFβ3の中和について抗体を試験した。増殖は、[3H]-チミジンの取込みによって測定した。抗体の力価は、単一濃度のTGFβ1、TGFβ2、またはTGFβ3を50%のレベルで中和した抗体の濃度(IC50)(単位nM)と定義した。
【0180】
MLEC増殖アッセイ法のプロトコール
MLECの平板培養
MLEC系統をAmerican Type Culture Collectionから得た(カタログ番号CCL-64)。10%FBS(Gibco)、1%ペニシリン/ストレプトマイシン(Gibco)、および1%MEM非必須アミノ酸溶液(Gibco)を含む最小必須培地(MEM、Gibco)中で細胞を増殖させた。T-175フラスコ中のコンフルエントな細胞をフラスコから分離し、遠心沈殿させ、洗浄し、かつ1%FBS、1%ペニシリン/ストレプトマイシン、および1%MEM非必須アミノ酸溶液を含むMEMで作られたMLECアッセイ用培地中に再懸濁した。次いで、細胞のアリコートをトリパンブルーで標識し、血球計算器で計数し、かつアッセイ用培地を用いて、1ml当たり1.75×105細胞の濃度に細胞ストック溶液を希釈した。この懸濁液100μlを平底の96ウェル組織培養プレートの各ウェルに添加し、かつ3〜5時間インキュベートした。
【0181】
TGFβの調製/抗体溶液
6ng/ml(最終アッセイ濃度の6倍)のTGFβ1、TGFβ2、またはTGFβ3の希釈標準溶液、および最高の最終アッセイ濃度の3倍の(1D11.16のような対照を含む)抗体の希釈標準溶液を、MLECアッセイ用培地中で調製した。アッセイ法におけるTGFβの最終濃度(1ng/mlまたは40pM)は、TGFβを含まない対照と比べて約80%の細胞増殖阻害を誘導する濃度(すなわちEC80値)に相当した。
【0182】
希釈プレートの準備
試験抗体および対照抗体の試料を、MLECアッセイ用培地中で3倍希釈ステップで滴定し、かつTGFβ1、TGFβ2、またはTGFβ3の存在下および不在下でインキュベートした。1D11.16および/または必要に応じて参照抗体を試験し、かつTGFβ1、TGFβ2、もしくはTGFβ3の滴定を実施するすべての実験において、関連するすべての対照が含まれた。完了したプレートは、組織培養用の加湿インキュベーター中に1時間±15分入れておいた。
【0183】
平板培養細胞へのTGFβ/抗体溶液の添加
適切なインキュベーション時間の後、希釈プレートの各ウェルから100μlを平板培養したMLECに移し、かつそれらのプレートをインキュベーターに戻して44±2時間インキュベートした。
【0184】
[3H]-チミジンの添加
10μCi/ml[3H]-チミジン25μl(PBS中で希釈)を各ウェルに添加した(0.25μCi/ウェル)。次いで、プレートをインキュベーターに戻して4時間±30分間インキュベートした。
【0185】
細胞の回収
トリプシン-EDTA(0.25%、Gibco)100μLを各ウェルに添加し、プレートをインキュベーター中で10分間インキュベートし、かつTomtecまたはPackardの96ウェル用細胞回収装置を用いて細胞を回収した。
【0186】
データの蓄積および解析
βプレートリーダー(TopCount、Packard)を用いて、回収した細胞からのデータを読み取った。データを解析して、IC50値および標準偏差値を得た。IC50値は、Prism 2.0(GraphPad)ソフトウェアを用いることによって得た。
【0187】
結果
精製した、PET1073G12、PET1074B9、およびFET1287A10の生殖系列化されたIgG4を、1D11.16と一緒にMLEC増殖アッセイ法において試験した。IgG4は、実施例3で説明したようにして作製した。IC50の算術平均±標準偏差(IC50は、40pMのTGFβ1、TGFβ2、またはTGFβ3を50%中和するのに必要とされる抗体の濃度である)を表1に示す。
【0188】
PET1073G12およびPET1287A10のIgG4に対する平均IC50のデータにより、これらの抗体が、TGFβ1、TGFβ2、およびTGFβ3に対して、1D11.16に類似した、またはそれに迫る力価を有することが示される。
【0189】
平均IC50のデータにより、(MLECアッセイ法において、完全な用量反応曲線は得られなかったが)、PET1074B9のIgG4が、TGFβ1に対して有意に強力であることが示唆される。比較の手段として、1D11.16は、濃度91pMでTGFβ1に対して12%の中和を示し、かつPET1074B9は、同様の濃度92pMで78%の中和を示した。さらに、PET1074B9を、正常ヒト肺線維芽細胞アッセイ(NHLF)フィブロネクチン産生アッセイ法(実施例5)においても、1D11.16と一緒に試験した。NHLFアッセイ法において得られた結果は、MLECアッセイ法で得られた結果を裏付ける。すなわち、PET1074B9は、TGFβ2およびTGFβ3に対して1D11.16の力価と同様の力価を有し、かつPET1074B9は、TGFβ1に対しては1D11.16より強力である。
【0190】
実施例5
TGFβ3依存性のNHLF細胞アッセイ法における抗TGFβ抗体の力価の中和
正常ヒト肺線維芽細胞(NHLF)フィブロネクチン産生アッセイ法を用いて、ヒトTGFβの生物活性に対する、精製した抗体調製物の中和力価を評価した。このアッセイ法では、抗体が細胞外基質(ECM)の糖タンパク質であるフィブロネクチンの産生を中和する能力を測定する。TGFβは、培養された線維芽細胞におけるフィブロネクチン産生の強力な刺激因子であり(IgnotzおよびMassaoue, 1986)、c-JunのN末端キナーゼ経路の活性化を介してそれらの効果を及ぼす(Hocevar et al., 1999)。
【0191】
NHLF細胞アッセイ法のプロトコール
NHLF細胞をClonetics(商標)から入手し、かつ5%CO2を含む37℃の加湿インキュベーター中で、完全な線維芽細胞増殖培地2(FGM-2)中で維持した。90〜100%コンフルエントになった段階で、FGM-2培地1.5ml中に線維芽細胞を播種し(1.5×105個/ウェル、24ウェル型)、かつ37℃で24時間、付着させた。無血清線維芽細胞基本培地(FBM)で細胞を洗浄し、かつヒトインスリン(100μg/ml)、ゲンタマイシン/フンギソン(50μg/ml)、およびアスコルビン酸(50μg/ml)を添加したFBM1.5ml中で一晩、血清飢餓状態にし、かつ37℃で24時間インキュベートした。実験はすべて、3〜6継代の間の細胞に対して実施した。
【0192】
TGFβ溶液および抗体溶液の調製
25ng/ml(1nM)のTGFβ1、TGFβ2、またはTGFβ3の希釈標準溶液、および(1D11.16のような対照を含む)抗体の希釈標準溶液を、アッセイ用培地中で調製した。アッセイ法におけるTGFβの最終濃度(250pg/mlまたは10pM)は、TGFβを含まない対照と比べて約80%のフィブロネクチン産生の刺激を誘導する濃度(すなわちEC80値)に相当した。
【0193】
希釈プレートの準備
試験抗体および対照抗体の試料を、アッセイ用培地中で10倍希釈ステップで順次希釈し、かつTGFβ1、TGFβ2、またはTGFβ3 32の存在下および不在下で30分間プレインキュベートした。NHLF細胞を2ml/ウェルのアッセイ用培地中で、37℃で48時間インキュベートした。48時間後、培地上清の0.5mlのアリコートを、ELISAによるフィブロネクチン解析のために採取した。
【0194】
ヒトフィブロネクチンELISA
ヒト抗フィブロネクチン捕捉モノクローナル抗体(クローン6FN)およびHRP結合型抗フィブロネクチンモノクローナル二次抗体を含むTechnoclone(商標)ヒトフィブロネクチン抗原ELISAキットを用いて、新鮮なNHLF上清試料または凍結した(-20℃)NHLF上清試料を解析した。この方法論は以下のとおりであった。
【0195】
Nunc-Immuno(商標)Maxisorp(商標)96ウェルプレートを、4℃で16時間、コーティング緩衝液(蒸留水中12mM Na2CO3、35mM NaHCO3、0.01%(w/v)チメロサール、pH9.6)中の抗フィブロネクチン捕捉抗体でコーティングした(1μg/ウェル)。捕捉抗体を除去し、かつ37℃で1時間、希釈緩衝液(PBS中1%(w/v)BSA)100μlで各ウェルをブロッキングした。洗浄緩衝液(PBS中0.5%(v/v)Tween20、250μg/ウェル)で3回洗浄した後、ヒト血漿フィブロネクチンの標準物質および試料をプレートに添加し、かつ37℃で1時間インキュベートした。次いで、プレートを3回洗浄し、かつ抗フィブロネクチンHRP二次抗体(希釈緩衝液中、100μg/ウェル)と共に37℃で30分間インキュベートした。洗浄緩衝液でプレートを3回洗浄し、かつ100μg/ウェルのテトラメチルベンジジン(TMB)基質をプレートに添加した。室温で20分間プレートをインキュベーションした後、100μg/ウェルの2M硫酸でこの反応を停止させた。次いで、Dynex MRXプレートリーダーを用いて450nmでの吸光度を測定した。
【0196】
データ解析
データは、TGFβアイソフォームに対する供試の対照の応答(100%)に対する百分率として示される。4パラメーターのロジスティック曲線の当てはめを用いて(Prism 2,GraphPad Software, San Diego, USA)、pIC50の幾何平均値および95%信頼限界を推定した。4パラメーターの当てはめが失敗した場合は、曲線の最高値および/または最低値を一定に保つことによって、3パラメーターまたは2パラメーターの当てはめを実施した。
【0197】
結果
精製した、PET1073G12、PET1074B9、およびPET1287A10の生殖系列化されたIgG4を、1D11.16と一緒にNHLFフィブロネクチン産生アッセイ法において試験した。IgG4は、実施例3で説明したようにして作製した。IC50の算術平均±標準偏差(IC50は、10pMのTGFβ1、TGFβ2、またはTGFβ3を50%中和するのに必要とされる抗体の濃度である)を表2に示す。
【0198】
実施例6
IL-11誘導アッセイ法における力価
本発明者らは、A549細胞(ヒト肺上皮癌細胞)IL-11誘導アッセイ法を用いて、ヒトTGFβの生物活性に対する、精製した抗体調製物の中和力価を評価した。
【0199】
本発明者らは、増殖/アッセイ用培地(DMEM 435mL、ウシ胎児血清(FBS)50mL、ペニシリン/ストレプトマイシン5mL、改変イーグル培地中非必須アミノ酸5mL、100×L-グルタミン5mL;すべてGibco/Invitrogen)中でA549細胞(ATCC、品番:CCL-185)を維持した。約90%コンフルエントになった段階で、本発明者らは、増殖/アッセイ用培地100μL中に細胞を播種し、かつ37℃、5%CO2で24時間、細胞を付着させた。
【0200】
TGFβ溶液および抗体溶液の調製
本発明者らは、TGFβ1(1.8ng/ml)、TGFβ2(4.2ng/ml)、またはTGFβ3(4.2ng/ml)、および(対照を含む)抗体の増殖/アッセイ用培地中の希釈標準溶液を調製した。
【0201】
希釈プレートの準備
本発明者らは、試験抗体および対照抗体の試料を、増殖/アッセイ用培地中で、5倍(TGFβ2もしくはTGFβ3)または10倍(TGFβ1)の希釈ステップで順次希釈し、かつTGFβ1、TGFβ2、またはTGFβ3の存在下および不在下、37℃で75分間プレインキュベートした。本発明者らは、37℃で18〜24時間、200μl/ウェルのアッセイ用培地中でA549細胞をインキュベートした。18〜24時間後、培地上清の100μlのアリコートを、ELISAによるIL-11解析のために採取した。
【0202】
実施例7
慢性腎疾患、および病原性の線維化を特徴とする他の臨床的適応症を治療するための、TGFβを汎的に中和するヒトモノクローナル抗体の生物学的有効性を判定するために、本発明者らは、一側尿管閉塞(UUO)ラットモデルにおける抗体の効果を研究した。
【0203】
体重250〜280グラム(約6週)の成体のスプラーグドーリーラット(Taconic Farms, Germantown, NY)を、空気、温度、および光を制御した環境において飼育した。UUOを実施するラットの腹側に小さな腹部正中切開を施して、左腎臓および尿管上部を露出させた。本発明者らは、絹縫合糸を用いて腎臓の下端のレベルで尿管を結紮し、かつ1つ目の約0.2cm下で2回目の結紮を施した。偽手術ラットには同じ外科的プロトコールを実施したが、尿管結紮は実施しなかった。
【0204】
以下のようにして、PBS、汎的に中和するマウスモノクローナル抗体(1D11)、アイソタイプを一致させた対照抗体(13C4)、または本発明のTGFβを汎的に中和するヒトモノクローナル抗体で、閉塞させたラットを処置した。本発明者らは、尿管結紮の日から開始して、3週間、抗体をラットに腹腔内投与した。13C4および1D11 5mg/kgを投与し(3回/週)、かつ汎的に中和するヒト抗体5mg/kgをラットに与えた(5日毎)。3週間の最後に、本発明者らはラットを屠殺し、腎臓にPBSを3分間灌流させ、かつmRNAの解析、コラーゲン含有量の測定、および組織学的検査のために、灌流させた腎臓を採取した。
【0205】
組織線維化の程度を評価するために、本発明者らは、Kivirikkoらに従って、加水分解抽出物中のヒドロキシプロリンを生化学的に解析することによって、組織のコラーゲン全含有量を測定した。このアッセイ法は、動物組織中のヒドロキシプロリンは本質的にすべて、コラーゲン中に存在するという知見に基づいている。
【0206】
本発明者らはまた、コラーゲン全含有量に関するSircolコラーゲンアッセイ法も実施した。Sircolコラーゲンアッセイ法では、シリウスレッド色素と組織コラーゲンの側鎖との特異的結合に基づいて、酸/ペプシン可溶性のコラーゲンの総量を測定する。
【0207】
汎的に中和するヒトモノクローナル抗体で処置されたUUOラットは、PBS処置群(3.5±0.3μg/mg乾燥組織、p<0.05)と比べた場合、ヒドロキシプロリン含有量の43.4%の減少を示した(1.98±0.26μg/mg乾燥組織)。シリウスレッド色素に基づいたアッセイ法によって測定されたように(偽処置群:18.5±2.6、PBS群:69.3±3.8、および汎的に中和するヒトモノクローナル抗体群:35.6±5.2μg/100mg組織、PBS群に対してp<0.05)、腎臓の線維化の減少は、罹患した腎臓における可溶化コラーゲンの総量の減少によってさらに裏付けられた。
【0208】
本発明者らはまた、汎的に中和する抗TGF-βヒトモノクローナル抗体が組織線維化を減少させる能力を、免疫組織化学的検査によって評価した。
【0209】
対照動物において、3週間の尿管閉塞は、著しい膨満、細胞の萎縮およびネクローシス/アポトーシス、組織炎症、ならびに明らかな線維化を伴う尿細管間質拡大を伴う、腎尿細管構造の広範囲に及ぶ破壊を引き起こした。糸球体の損傷の証拠はほとんどなかった。これに対して、1D11または汎的に中和するヒトモノクローナル抗体で処置されたラットは、尿細管の拡張および崩壊の減少、炎症性浸潤物(細胞性)の減少、ならびに尿細管間質の拡大および線維化の減少によって判断されるように、腎臓構造の維持を示した。
【0210】
本発明者らはまた、汎的に中和する抗TGF-βヒトモノクローナル抗体を用いた治療がTGF-βによって調節される遺伝子発現に対して与える効果も測定した。
【0211】
TGF-β1のmRNAは、PBSで処置された動物または対照抗体13C4で処置された動物のいずれかと比べて、汎的に中和するヒトモノクローナル抗体で処置されたUUO動物において有意に減少していた。III型コラーゲンのmRNAレベルの有意な減少もまた、PBSまたは13C4で処置された群と比べて、ヒトおよびマウスの抗TGF-β抗体で処置された閉塞された腎臓において認められ、コラーゲン合成の減少が示唆された。
【0212】
本発明者らはさらに、腎臓のTGF-β1タンパク質総量を測定することによって、汎的に中和する抗TGF-βヒトモノクローナル抗体が自己誘導によるTGF-β合成を減少させる有効性を確認した。
【0213】
偽手術動物と比べて、閉塞された腎臓は、組織TGF-β1の総量の著しい増加を示した。しかしながら、汎的に中和するヒトモノクローナル抗体を投薬された、閉塞処置ラットは、組織TGF-β1レベルの75%の低下を示し、これは、両方の対照群に対して記録されたレベルより有意に低かった。比較すると、マウスの1D11抗体の方が、対照群と比べて組織TGF-β1レベルを45%減少させた。
【0214】
前述の結果により、汎的に中和する抗TGF-βヒトモノクローナル抗体によるTGF-β中和が、TGF-β1の産生およびコラーゲンIIIのmRNA発現の防止と同時に、TGF-βの自己分泌調節ループを効果的に妨害したことが実証される。
【0215】
本発明者らはさらに、汎的に中和する抗TGF-βヒトモノクローナル抗体が、TGF-β阻害の間接的な指標としての平滑筋アクチン(α-SMA)の発現に与える効果を判定した。平滑筋アクチン発現は、組織線維化に関連しており、かつ線維性の結合組織を生じる、活性化された筋線維芽細胞の指標である。TGF-βは、間質線維芽細胞および常在上皮細胞の活性化および筋線維芽細胞への表現型転換の重要な誘導物質である。
【0216】
本発明者らは、標準的なウェスタンブロット解析によって、α-SMAタンパク質を検出した。
【0217】
偽手術動物と比べた場合、閉塞された腎臓を有するラットは、組織ホモジネートのウェスタンブロット法によって測定されるように、α-SMAタンパク質の劇的な上方調節を示した(データ不掲載)。汎的に中和する抗TGF-βヒトモノクローナル抗体を投薬された閉塞処置ラットは、測定可能なα-SMA発現の有意な減少(PBS対照群と比べて75%)を示した。
【0218】
これらの結果により、線維性腎臓におけるコラーゲン沈着を減少させるにあたって、汎的に中和する抗TGF-βヒトモノクローナル抗体が有効であることが実証され、この抗体が、重度の腎損傷および尿細管間質線維症の本モデルにおける腎臓コラーゲンの産生および沈着の強力な阻害物質であることが明瞭に示された。肺、肝臓、または腎臓などの臓器における組織線維化のプロセスは、共通のメカニズムまたは経路を有しているため、当業者は、この抗体が、慢性腎疾患、ならびに病原性の線維化を特徴とする他の臨床的適応症の治療において有用であることを理解すると考えられる。
【0219】
本発明のいくつかの好ましい特許請求の範囲の記載は、前述のとおりである。





【0220】
【表1】

PET1073G12、PET1074B9、またはPET1287A10の生殖系列化されたIgG4または1D11.16を用いた、TGFβ1、TGFβ2、およびTGFβ3のMLECに対する抗増殖作用の中和。各平均値に対するデータポイントの総数は、数字nによって示されており、かつ各抗体の独立した力価測定に相当する。#:試験した濃度範囲において抗体が強力すぎ、かつ完全な用量反応曲線は得られなかったため、IC50値を決定することができなかった。
【0221】
【表2】

NHLFアッセイ法における、PET1073G12、PET1074B9、またはPET1287A10の生殖系列化されたIgG4または1D11.16の力価。各平均値に対するデータポイントの総数は、数字nによって示されており、かつ各抗体の独立した力価測定に相当する。
【技術分野】
【0001】
技術分野
本発明は、抗体分子、特に、トランスフォーミング増殖因子β(TGFβ)に結合する抗体分子、およびその使用に関する。より具体的には、本発明は、TGFβ1、TGFβ2、およびTGFβ3に結合し、かつ好ましくは中和する抗体分子、いわゆる「汎特異的(pan-specific)」抗体分子、ならびにそのような抗体分子の使用に関する。
【背景技術】
【0002】
背景
TGFβは、1981年に最初に同定された(Roberts et al., 1981)。ヒトでは、3種のアイソフォーム、すなわちTGFβ1、TGFβ2、およびTGFβ3(それぞれ、Swiss Protアクセッション番号P01137、P08112、およびP10600)があり、これらは、生物学的に活性な状態において、鎖間のジスルフィド架橋によって結合された2つの112アミノ酸単量体を含む、25kDaのホモ二量体である。TGFβ1は、TGFβ2と27個のアミノ酸が異なり、かつTGFβ3と22個のアミノ酸が異なり、主に保存的アミノ酸変化である。これらの差異は、X線結晶構造解析によって決定されたTGFβの3次元構造上にマッピングされ(Schlunegger et al.,1992;Peer et al.,1996)、かつ受容体結合領域が定められた(Griffith et al., 1996;Qian et al., 1996)。
【0003】
ヒトTGFβは、マウスTGFβに極めて類似している:ヒトTGFβ1とマウスTGFβ1のアミノ酸の差異はわずか1つであり、ヒトTGFβ2とマウスTGFβ2のアミノ酸の差異はわずか3つであり、ヒトTGFβ3は、マウスTGFβ3と同一である。結果として、トランスジェニックマウスを含むマウスにおけるヒトTGFβに対する抗体の作製は、難しい場合がある。
【0004】
TGFβは、細胞の増殖および分化、胚発生、細胞外基質形成、骨の発達、創傷治癒、造血、ならびに免疫反応および炎症反応に関与している多機能性サイトカインである(Border et al., 1995a)。TGFβの調節解除は、ヒトにおいて、多数の状態、例えば、先天性欠損、癌、慢性炎症性疾患、自己免疫性疾患、および線維症に関係があるとされている病理学的プロセスを招く(Border et al., 1994;Border et al., 1995b)。
【0005】
拮抗物質として中和抗体を用いて、多くの線維症動物モデル(Border et al., 1995b;Border et al., 1994)、例えば、糸球体腎炎(Border et al., 1990)、神経瘢痕化(Logan et al., 1994)、皮膚瘢痕化(Shah et al., 1994)、および肺線維症(Giri et al., 1993)において研究が実施された。これらのモデルによって表される疾患はすべて、新しい治療用生成物が必要とされているがまだ実現されていない(Bonewald, 1999;Jackson, 1998)。しかしながら、これらおよび他の動物研究において使用された抗体は、動物において産生され、かつヒトにおけるこれらの治療的利益は、それらが免疫原性応答を誘導する可能性、およびそれらの急速な薬物動態学的クリアランスが原因で、制限されることがある(Vaughan et al., 1998)。TGFβによって媒介される疾患の治療のためには、ヒト抗体がより望ましい。
【0006】
様々な抗体断片が、特異的かつ十分な親和力で標的タンパク質に結合できることは公知である。例えば、単鎖Fv(scFv)として公知である、短いペプチドリンカーによって結合された重鎖の可変ドメイン(VH)および軽鎖の可変ドメイン(VL)のみを含む抗体断片が広く使用されている。TGFβ1のヒト中和抗体(CAT-192)またはTGFβ2のヒト中和抗体(CAT-152もしくはTrabio(商標))が、以前に作製されている(EP0945464,EP0853661,Thompson et al. 1999)。しかしながら、当技術分野において利用可能なTGFβ抗体の大多数は、ヒト以外に由来する。さらに、本発明以前は、TGFβに対する汎特異的な唯一のモノクローナル抗体は、げっ歯動物由来であった。
【0007】
中和エピトープおよび非中和エピトープの両方に対するヒトTGFβ1およびヒトTGFβ2に結合するポリクローナル抗体が、ウサギ(Danielpour et al. 1989b;Roberts et al., 1990)、ニワトリ(R&D Systems, Minneapolis)、およびシチメンチョウ(Danielpour et al., 1989c)において産生させられた。TGFβの部分配列に相当するペプチドもまた、ウサギにおいてポリクローナル中和抗血清を産生させるための免疫原として使用された(Border et al., 1990;Flanders et al., 1988)。このような非ヒトポリクローナル抗体は、ヒトでの治療的使用には不適切である。
【0008】
1D11.16は、様々なインビトロアッセイ法においてヒトおよびマウスのTGFβ1、TGFβ2、およびTGFβ3を中和する、マウスの汎特異的抗TGFβ抗体であり(Dasch et al., 1989;Dasch et al., 1996;R&D System MAB1835の製品情報シート)、かつ線維症の動物モデルにおける原理証明研究において有効である(Ling et al., 2003;Miyajima et al., 2000;Schneider et al., 1999;Khanna et al., 1999;Shenkar et al., 1994)。しかしながら、1D11.16は、マウスのモノクローナル抗体であるため(Dasch et al., 1989;Dasch et al., 1996)、ヒトでの治療的使用には不適切である。
【発明の概要】
【0009】
発明の概要
本発明の様々な局面において、以下を含む態様の主題が提供される。本発明のさらなる局面および態様は、本明細書における説明において開示される。
【0010】
本発明は、TGFβ、特にヒトTGFβに対する特異的結合メンバーを提供する。TGFβ1、TGFβ2、およびTGFβ3を対象とする特異的結合メンバーが、特に提供される。本発明の範囲内の好ましい態様は抗体分子であり、全抗体(例えば、IgG1もしくはIgG4などのIgG)、または抗体断片(例えば、scFv、Fab、dAb)であってよい。抗体の抗原結合領域および抗体の抗原結合部位が、このような領域を含む抗体のVHドメインおよびVLドメインと同様に提供される。VHドメインおよびVLドメイン内で、相補性決定領域、すなわちCDRが提供される。CDRは、場合によっては、異なるフレームワーク領域(FR)内で提供されて、VHドメインまたはVLドメインを形成することがある。抗原結合部位は、抗体のVHドメインおよび/もしくはVLドメイン、またはそれらの抗原結合部分からなり得る。
【0011】
1つの局面において、本発明は、抗体の抗原結合部位、HCDRセット、LCDRセット、もしくは両方、および/またはヒト抗体のVHドメイン、VLドメイン、もしくは両方を含む、ヒトTGFβに対する特異的結合メンバーを提供する。
【0012】
HCDR1、HCDR2、およびHCDR3のセットは、以下の群より選択される配列を有し得る:
HCDR1 SEQ ID NO:3、HCDR2 SEQ ID NO:4、HCDR3 SEQ ID NO:5(本明細書において、「HCDRのPET1073G12セット」と呼ばれる);
HCDR1 SEQ ID NO:13、HCDR2 SEQ ID NO:14、HCDR3 SEQ ID NO:15(本明細書において、「HCDRのPET1074B9セット」と呼ばれる);
HCDR1 SEQ ID NO:23、HCDR2 SEQ ID NO:24、HCDR3 SEQ ID NO:25(本明細書において、「HCDRのPET1287A10セット」と呼ばれる)。
【0013】
LCDR1、LCDR2、およびLCDR3のセットは、以下の群より選択される配列を有し得る:
LCDR1 SEQ ID NO:8、LCDR2 SEQ ID NO:9、LCDR3 SEQ ID NO:10(本明細書において、「LCDRのPET1073G12セット」と呼ばれる);
LCDR1 SEQ ID NO:18、LCDR2 SEQ ID NO:19、LCDR3 SEQ ID NO:20(本明細書において、「LCDRのPET1074B9セット」と呼ばれる);
LCDR1 SEQ ID NO:28、LCDR2 SEQ ID NO:29、LCDR3 SEQ ID NO:30(本明細書において、「LCDRのPET1287A10セット」と呼ばれる)。
【0014】
HCDRのPET1073G12セットは、LCDRのPET1073G12セットと合わせて、本明細書においてCDRのPET1073G12セットと呼ばれる。
【0015】
HCDRのPET1074B9セットは、LCDRのPET1074B9セットと合わせて、本明細書においてCDRのPET1074B9セットと呼ばれる。
【0016】
HCDRのPET1287A10セットは、LCDRのPET1287A10セットと合わせて、本明細書においてCDRのPET1287A10セットと呼ばれる。
【0017】
本明細書において開示されるLCDRのセットを含むVLドメインが別に提供されるように、本明細書において開示されるHCDRのセットを含むVHドメインもまた、本発明によって提供される。好ましくは、このようなVHドメインは、このようなVLドメインと対形成しており、かつ最も好ましくは、VHドメインおよびVLドメインの対形成は、本明細書において説明されるクローンにおけるものと同じである。
【0018】
HCDRのセット、すなわちHCDR1、HCDR2、およびHCDR3を含むVHドメインであって、HCDRのセットが、1つまたは2つのアミノ酸置換を有するPET1073G12、PET1074B9、またはPET1287A10に対するものに相当するVHドメインが、本発明によってさらに提供される。
【0019】
LCDRのセット、すなわちLCDR1、LCDR2、およびLCDR3を含むVLドメインであって、CDRのセットが、1つまたは2つのアミノ酸置換を有するPET1073G12、PET1074B9、またはPET1287A10に対するものに相当するVLドメインが、本発明によってさらに提供される。
【0020】
このようなVHドメインおよび/またはVLドメイン内に抗体の抗原結合部位を含む特異的結合メンバーもまた、本発明によって提供される。
【0021】
構造/特性と活性との関係に多変量データ解析技術を応用する際の計算化学の先例に従い(Wold, et al. Multivariate data analysis in chemistry. Chemometrics-Mathematics and Statistics in Chemistry(Ed.:B. Kowalski), D. Reidel Publishing Company, Dordrecht, Holland, 1984(ISBN 90-277-1846-6))、統計的回帰、パターン認識、および分類など周知の数学的技術(Norman et al. Applied Regression Analysis. Wiley-Interscience;3rd edition(April 1998)ISBN:0471170828;Abraham Kandel, Eric Backer. Computer-Assisted Reasoning in Cluster Analysis. Prentice Hall PTR;(May 11, 1995), ISBN:0133418847;Wojtek Krzanowski. Principles of Multivariate Analysis :A User's Perspective(Oxford Statistical Science Series, No 22(Paper)). Oxford University Press, (December 2000), ISBN:0198507089;Ian H. Witten, Eibe Frank. Data Mining:Practical Machine Learning Tools and Techniques with Java Implementations. Morgan Kaufmann;(October 11, 1999), ISBN:1558605525;David G. T. Denison(Editor), Christopher C. Holmes, Bani K. Mallick, Adrian F. M. Smith. Bayesian Methods for Nonlinear Classification and Regression(Wiley Series in Probability and Statistics). John Wiley & Sons;(July 2002), ISBN:0471490369;Arup K. Ghose, Vellarkad. N. Viswanadhan. Combinatorial Library Design and Evaluation Principles, Software, Tools, and Applications in Drug Discovery. ISBN:0-8247-0487-8)を用いて、抗体の活性と特性の定量的な関係を導くことができる。抗体の特性は、抗体の配列、機能的構造、および3次元構造の実験的モデルおよび理論的モデルから導くことができ(例えば、接触する可能性がある残基または算出された物理化学的特性の解析)、かつこれらの特性は、個々におよび組み合わせて考察することができる。
【0022】
原子構造が公知である抗体の解析により、抗体の結合部位の配列と3次元構造の関係が明らかにされた(Chothia C. et al. Journal Molecular Biology(1992)227, 799-817;Al-Lazikani, et al. Journal Molecular Biology(1997)273(4), 927-948)。これらの関係は、VHドメイン中の第3の領域(ループ)を除いて、結合部位ループが、少数の主鎖立体構造、すなわちカノニカルな構造のうちの1つを有することを暗示する。特定のループ中で形成されるカノニカルな構造は、そのサイズ、ならびにループおよびフレームワーク領域の両方の重要な部位における特定の残基の存在によって決定されていることが示された(Chothia et al.およびAl-Lazikani et al.、前記)。
【0023】
配列と構造の関係のこの研究は、CDRループの3次元構造を維持する際に、およびしたがって、結合特異性を維持する際に重要である、配列は公知であるが3次元構造は公知ではないある抗体中の残基を予測するために使用することができる。これらの予測は、リード最適化実験の結果と予測を比較することによって確認することができる。構造的アプローチにおいて、WAM(Whitelegg, N. R. u.およびRees, A. R(2000)Prot. Eng., 12, 815-824)のような自由に利用可能であるか、または市販されている任意のパッケージを用いて、抗体分子の理論的モデルを作製することができる(Chothia, et al. Science, 223, 755-758(1986))。次いで、Insight II(Accelerys, Inc.)またはDeep View(Guex, N.およびPeitsch, M. C. Electrophoresis(1997)18, 2714-2723)のようなタンパク質可視化および解析用ソフトウェアパッケージを用いて、CDRおよびFR中の各位置において起こり得る置換を評価することができる。次いで、この情報を用いて、活性に最小限または有益な影響を与える可能性がある置換を行うことができる。
【0024】
CDR、抗体のVHドメインまたはVLドメイン、および特異的結合メンバーのアミノ酸配列内に置換を起こすために必要とされる技術は、一般に、当技術分野において利用可能である。活性に最小限または有益な影響を与えることが予測されることもあればされないこともある置換により、変異配列を作製し、かつTGFβに結合し、かつ/もしくは中和する能力、および/または他の任意の所望の特性に関して試験することができる。これについては、以下でさらに考察する。
【0025】
上述したように、本発明は、CDRの所定のセット、特に、PET1073G12、PET1074B9、およびPET1287A10のCDRセット、ならびに、CDRセット内に1つもしくは2つの置換を有する、PET1073G12、PET1074B9、またはPET1287A10のCDRセットを含む、特異的結合メンバーを提供する。
【0026】
CDRの関連するセットは、抗体のフレームワーク領域または他のタンパク質足場、例えば、フィブロネクチンもしくはシトクロムBの内部で提供される。好ましくは、抗体のフレームワーク領域が使用される。
【0027】
好ましい態様において、重鎖は、ヒトVH1ファミリー遺伝子を使用する。様々な態様において、重鎖のフレームワークのアミノ酸配列は、ヒトVH1ファミリー遺伝子の生殖系列アミノ酸配列と比べて、1〜12個、好ましくは3〜12個、およびより好ましくは3〜8個のアミノ酸差異を含む。いくつかの態様において、重鎖のフレームワーク配列は、生殖系列の配列である。特に好ましい態様において、抗体の重鎖のフレームワーク領域は、VH1ファミリーに由来するヒトDP-10(VH1-69)またはヒトDP-88(VH1-e)でよい。好ましくは、ヒトDP-10遺伝子を使用する態様は、27番、78番、および94番残基に非生殖系列アミノ酸を有する。いくつかの態様において、27番残基はチロシンであり、78番残基はトレオニンであり、かつ94番残基はセリンまたはロイシンである。いくつかの態様において、軽鎖は、生殖系列アミノ酸配列と比べて、1〜5個、好ましくは1〜4個、より好ましくは1〜3個のアミノ酸差異を有するヒトVκ3ファミリー遺伝子を使用する。いくつかの態様において、軽鎖のフレームワーク配列は、生殖系列ヒトVκ3ファミリー遺伝子の配列である。特に好ましい態様において、軽鎖のフレームワーク領域は、ヒトDPK-22(A27)でよい。いくつかのこのような態様において、2番残基は、非生殖系列アミノ酸である。いくつかの態様において、2番残基はトレオニンである。
【0028】
極めて好ましい態様において、SEQ ID NO:2のアミノ酸配列を有するVHドメインが提供され、これは、「PET1073G12 VHドメイン」と呼ばれ、または、SEQ ID NO:12のアミノ酸配列を有するVHドメインが提供され、これは、「PET1074B9 VHドメイン」と呼ばれ、または、SEQ ID NO:22のアミノ酸配列を有するVHドメインが提供され、これは、「PET1287A10 VHドメイン」と呼ばれる。
【0029】
さらなる極めて好ましい態様において、SEQ ID NO:7のアミノ酸配列を有するVLドメインが提供され、これは、「PET1073G12 VLドメイン」と呼ばれ、または、SEQ ID NO:17 のアミノ酸配列を有するVLドメインが提供され、これは、「PET1074B9 VLドメイン」と呼ばれ、または、SEQ ID NO:27のアミノ酸配列を有するVLドメインが提供され、これは、「PET1287A10 VLドメイン」と呼ばれる。本発明によって提供される極めて好ましい態様は、PET1073G12 VHドメインであるSEQ ID NO:2、およびPET1073G12 VLドメインであるSEQ ID NO:7から構成される。本発明によって提供される別の極めて好ましい態様は、PET1074B9 VHドメインであるSEQ ID NO:12、およびPET1074B9 VLドメインであるSEQ ID NO:17から構成される。本発明によって提供される別の極めて好ましい態様は、PET1287A10 VHドメインであるSEQ ID NO:22、およびPET1287A10 VLドメインであるSEQ ID NO:27から構成される。本発明によって提供されるこれらまたは他の任意の抗体の抗原結合部位は、本明細書において別の箇所でさらに考察されるように、任意の所望の抗体分子の形式、例えば、scFv、Fab、IgG1、IgG4、dAbなどの範囲内で提供され得る。
【0030】
さらなる極めて好ましい態様において、本発明は、PET1073G12、PET1074B9、またはPET1287A10のVHドメインを含み、好ましくは、対応するPET1073G12、PET1074B9、またはPET1287A10のVLドメインも含む、IgG4抗体分子を提供する。
【0031】
抗体のVHドメイン内にPET1073G12、PET1074B9、もしくはPET1287A10のHCDRセットを含み、かつ/または抗体のVLドメイン内にPET1073G12、PET1074B9、もしくはPET1287A10のLCDRセットを含む他の抗体分子が提供されるように、PET1073G12、PET1074B9、もしくはPET1287A10のVHドメイン、および/またはPET1073G12、PET1074B9、もしくはPET1287A10のVLドメインを含む、他のIgG4もしくは他の抗体分子が、本発明によって提供される。
【0032】
本明細書において使用される「および/または」が、2つの特定された特徴または構成要素のそれぞれを他方の有無に関わらず具体的に開示することとしてみなされるべきであることをここで指摘することは好都合である。例えば、「Aおよび/またはB」は、それぞれが本明細書において個々に説明されるかのように、(i)A、(ii)B、ならびに(iii)AおよびBのそれぞれの具体的な開示としてみなされるべきである。
【0033】
上述したように、本発明の特定の態様において、ヒトTGFβの3種のアイソフォームすべてに結合し、かつPET1073G12、PET1074B9、もしくはPET1287A10のVHドメインおよび/もしくはVLドメイン、またはこれらのドメインの抗原結合部分を含む、特異的結合メンバーが提供される。
【0034】
いくつかの態様において、VHドメインはVLドメインと対形成して、抗原結合部位を提供する。好ましい態様において、PET1073G12 VHドメイン(SEQ ID NO:2)は、PET1073G12 VLドメイン(SEQ ID NO:7)と対形成して、その結果、PET1073G12のVHドメインおよびVLドメインの両方を含む抗原結合部位が形成される。好ましい態様において、PET1074B9 VHドメイン(SEQ ID NO:12)は、PET1074B9 VLドメイン(SEQ ID NO:17)と対形成して、その結果、PET1074B9 のVHドメインおよびVLドメインの両方を含む抗原結合部位が形成される。好ましい態様において、PET1287A10 VHドメイン(SEQ ID NO:22)は、PET1287A10 VLドメイン(SEQ ID NO:27)と対形成して、その結果、PET1287A10 のVHドメインおよびVLドメインの両方を含む、抗体の抗原結合部位が形成される。他の態様において、PET1073G12、PET1074B9、またはPET1287A10のVHは、対応するPET1073G12、PET1074B9、またはPET1287A10のVL以外のVLドメインと対形成する。軽鎖の無差別な対形成(promiscuity)は、当技術分野において十分に確立されている。
【0035】
同様に、本明細書において開示される任意のHCDRセットを、単独で、またはVLドメインと組み合わせて特異的結合メンバーとして使用されるVHドメイン中で提供することができる。VHドメインは、本明細書において開示されるHCDRセットと共に提供されてよく、かつそのようなVHドメインがVLドメインと対形成するならば、その場合、VLドメインは、本明細書において開示されるLCDRセットと共に提供されてよい。HCDRセットとLCDRセットの対形成は、PET1073G12、PET1074B9、およびPET1287A10の抗体に関して本明細書において開示されるようなものであってよい。VHドメインおよび/またはVLドメインのフレームワーク領域は、生殖系列フレームワークであってよい。重鎖ドメインのフレームワーク領域は、VH-1ファミリーより選択されてよく、かつ好ましいVH-1フレームワークは、DP-10またはDP-88のフレームワークである。軽鎖のフレームワーク領域は、Vκ3ファミリーより選択されてよく、かつ好ましいこのようなフレームワークは、DPK-22である。
【0036】
1つまたは複数のCDRは、その配列が本明細書において開示されるVHドメインまたはVLドメインに由来してよく、かつ適切なフレームワーク中に組み入れられてよい。これについては、本明細書においてさらに考察する。同じことが、本明細書において説明する方法を用いて得られる抗体の他のCDRおよびCDRセットに当てはまる。
【0037】
他の分子に関して本明細書において開示される本発明の任意の局面および態様、例えば、力価が改善された抗原結合部位の変異および選択の方法において、抗体のVHドメイン、抗体のVLドメイン、HCDRのセット、LCDRのセット、CDRのセット、1つもしくは複数のHCDR、例えばHCDR3、および/または1つもしくは複数のLCR、例えばLCDR3を使用してよい。
【0038】
そのアミノ酸配列が本明細書において説明され、かつTGFβに対する特異的結合メンバー中で使用され得るものを含む、本発明のVHドメインおよびVLドメインならびにCDRの変異体は、配列の改変または変異およびスクリーニングの方法を用いて得ることができる。このような方法もまた、本発明によって提供される。
【0039】
その配列が本明細書において具体的に開示されるVHドメインおよびVLドメインのいずれかの可変ドメインアミノ酸配列変異体は、考察されるように、本発明に従って使用され得る。個々の変異体は、1つまたは複数のアミノ酸配列改変(アミノ酸残基の付加、欠失、置換、および/もしくは挿入)を含んでよく、約20個未満の改変、約15個未満の改変、約10個未満の改変、または、約5個未満、4個、3個、2個、もしくは1個の改変でよい。改変は、1つもしくは複数のフレームワーク領域、および/または1つもしくは複数のCDRにおいて実施されてよい。
【0040】
本発明のさらなる局面によれば、抗原に結合し、かつ特異的な抗体の抗原結合領域、本明細書において開示されるVHドメインおよび/もしくはVLドメイン、本明細書において開示されるCDRセットもしくはHCDR3、またはこれらのいずれかの変異体も含む、任意の特異的結合メンバーと、抗原への結合に際して競合するか、または交差競合する、ヒト、ヒト化、キメラ、または合成の特異的結合メンバーが提供される。結合メンバー間の競合は、例えば、ELISAを用いて、かつ/または、1つの結合メンバーに特異的なレポーター分子をタグ化し、他のタグ無し結合メンバーの存在下で検出することができるようにして、同じエピトープもしくは重複するエピトープに結合する特異的結合メンバーの同定を可能にすることによって、インビトロで容易に分析することができる。結合メンバー間の交差競合は、逆アッセイ法を実施することによって、例えば、タグ化される結合メンバーとタグ無し結合メンバーを逆転させて、両方の方向の結合を妨害するペアを同定することによって、容易に分析することができる。
【0041】
したがって、本発明の別の局面は、TGFβへの結合に際して、PET1073G12、PET1074B9、もしくはPET1287A10の抗体分子、特に、PET1073G12、PET1074B9、もしくはPET1287A10のscFv、および/またはIgG4と競合するか、または交差競合する抗体の抗原結合部位を含む、特異的結合メンバーを提供する。様々な態様において、この抗体は、ヒト抗体、ヒト化抗体、キメラ抗体、または合成抗体である。別の局面において、本発明は、TGFβへの結合に際して、本発明の抗原結合部位と競合するか、または交差競合する、ヒト抗体、ヒト化抗体、キメラ抗体、または合成抗体の抗原結合部位を含む特異的結合メンバーであって、ヒト抗体、ヒト化抗体、キメラ抗体、または合成抗体の抗原結合部位が、VHドメインおよびVLドメインから構成され、かつVHドメインおよびVLドメインが、本明細書において開示されるCDRのセットを含む、特異的結合メンバーを提供する。
【0042】
本明細書において開示される情報があれば、TGFβへの結合に際して、PET1073G12、PET1074B9、もしくはPET1287A10の抗体分子、PET1073G12、PET1074B9、もしくはPET1287A10のCDRセットを有する抗体分子、PET1073G12、PET1074B9、もしくはPET1287A10のHCDRセットを有する抗体分子、または、PET1073G12、PET1074B9、もしくはPET1287A10のLCDRセットを有する抗体分子と競合し得るか、または交差競合し得る、TGFβに対するヒト抗体、ヒト化抗体、キメラ抗体、または合成抗体を得るために、様々な方法が当技術分野において利用可能である。
【0043】
さらなる局面において、本発明は、TGFβ1、TGFβ2、およびTGFβ3に結合できる1種もしくは複数種の特異的結合メンバーを得る方法であって、本発明による特異的結合メンバーのライブラリーおよび該TGFβを接触させる段階、ならびに該TGFβのすべてに結合できる、ライブラリーの1種もしくは複数種の特異的結合メンバーを選択する段階を含む方法を提供する。
【0044】
このライブラリーは、バクテリオファージ粒子の表面に提示することができ、各粒子は、その表面に提示される抗体のVH可変ドメイン、および任意で、存在する場合は提示されるVLドメインもコードしている核酸を含む。
【0045】
抗原に結合でき、かつバクテリオファージ粒子上に提示される特異的結合メンバーを選択した後、選択された該特異的結合メンバーを提示しているバクテリオファージ粒子から核酸を取り出すことができる。このような核酸は、選択された前記特異的結合メンバーを提示しているバクテリオファージ粒子から取り出された核酸の配列を有する核酸からの発現によって、特異的結合メンバーまたは抗体のVH可変ドメイン(および任意で抗体のVL可変ドメイン)を続いて作製する際に使用することができる。
【0046】
選択された前記特異的結合メンバーの抗体VHドメインのアミノ酸配列を有する抗体VHドメインは、そのようなVHドメインを含む特異的結合メンバーと同じように、単離された形態で提供され得る。TGFβの3種のアイソフォームすべてに結合する能力、また、TGFβの3種のヒトアイソフォームすべてに結合する際に、PET1073G12、PET1074B9、またはPET1287A10(例えば、scFv型および/もしくはIgG型、例えばIgG4)と競合するか、または交差競合する能力も、さらに試験することができる。以下にさらに考察するように、TGFβを中和する能力を試験することができる。
【0047】
本発明による特異的結合メンバーは、PET1073G12、PET1074B9、もしくはPET1287A10の抗体分子、例えばscFv、もしくは好ましくはIgG4の親和力で、または、上記の分子のうち1種より大きな親和力で、TGFβ1、TGFβ2、および/またはTGFβ3に結合し得る。本発明による特異的結合メンバーは、PET1073G12、PET1074B9、もしくはPET1287A10の抗体分子、例えばscFv、もしくは好ましくはPET1073G12、PET1074B9、もしくはPET1287A10のIgG4の力価で、または、上記の分子のうち1種より大きな力価で、TGFβ1、TGFβ2、および/またはTGFβを中和し得る。
【0048】
本発明による特異的結合メンバーは、PET1073G12、PET1074B9、もしくはPET1287A10の抗体分子、例えばscFv、もしくは好ましくはIgG4の力価で、または、上記の分子のうち1種より大きな力価で、天然のTGFβを中和し得る。様々な特異的結合メンバーの結合親和力および中和力価を、適切な条件下で比較することができる。
【0049】
本発明の好ましい態様は、PET1073G12、PET1074B9、もしくはPET1287A10のVHドメイン、および対応するPET1073G12、PET1074B9、もしくはPET1287A10のVLドメインによって形成されるTGFβ抗原結合部位の力価に等しいか、またはそれを上回る力価を有する、天然のTGFβを中和する、ヒト抗体、ヒト化抗体、キメラ抗体、または合成抗体を好ましくは含む。
【0050】
抗体配列に加えて、本発明による特異的結合メンバーは、他のアミノ酸、例えば、折り畳まれたドメインのようなペプチドもしくはポリペプチドを形成するアミノ酸、または、抗原に結合する能力に加えて別の機能的特徴を分子に与えるアミノ酸も含んでよい。本発明の特異的結合メンバーは、検出可能な標識を有してよく、または、(例えばペプチジル結合もしくはリンカーを介して)毒素またはターゲティング部分もしくは酵素に結合されていてもよい。
【0051】
別の局面において、本発明は、本発明による特異的結合メンバー、VHドメインおよび/もしくはVLドメイン、またはCDRをコードする配列を含む単離された核酸、ならびに、本発明の特異的結合メンバー、VHドメインおよび/もしくはVLドメイン、またはCDRを調製する方法であって、該特異的結合メンバー、VHドメインおよび/もしくはVLドメイン、またはCDRの生成を実現する条件下で前記核酸を発現させる段階、ならびにそれを回収する段階を含む方法を提供する。
【0052】
本発明による特異的結合メンバーは、ヒト患者の疾患または障害の(予防的治療を含み得る)治療の方法であって、該患者に有効量の本発明の特異的結合メンバーを投与する段階を含む方法のような、ヒトまたは動物の身体の治療または診断の方法において使用され得る。本発明に従って治療可能な状態には、TGFβがある役割を果たしている任意の状態が含まれ、特に、線維症の治療、創傷治癒の調節、および癌の治療である。
【0053】
より具体的には、本発明の特異的結合メンバーは、インビトロまたはインビボで、ヒトTGFβの3種のアイソフォームのいずれかまたはすべての活性を阻害するのに有用である。このような活性には、TGFβによって媒介されるシグナル伝達、細胞外基質(ECM)沈着、上皮細胞および内皮細胞の増殖の阻害、平滑筋増殖の促進、III型コラーゲン発現の誘導、TGF-β、フィブロネクチン、VEGF、およびIL-11の発現の誘導、潜伏期関連ペプチドへの結合、腫瘍によって誘導される免疫抑制、血管新生の促進、筋線維芽細胞の活性化、転移の促進、ならびにNK細胞活性の阻害が含まれるが、これらに限定されるわけではない。
【0054】
本発明の特異的結合メンバーはまた、TGFβ活性に直接的にまたは間接的に起因する疾患および状態を治療するのにも有用である。本発明の特異的結合メンバーは汎特異的であるため、すなわち、TGFβの3種のアイソフォームすべてに結合し、かつそれらの活性を阻害するため、これらは、2種またはそれ以上のTGFβアイソフォームが関係する状態および疾患(感染症および腫瘍など)、ならびに複数の標的を阻害することが望ましい重度の状態を治療するために特に有利である。
【0055】
特異的結合メンバーは、限定されるわけではないが、線維症(糸球体腎炎、神経瘢痕化、皮膚瘢痕化、肺線維症(pulmonary fibrosis)、肺線維化(lung fibrosis)、放射線によって誘導された線維症、肝線維症、骨髄線維症など)、熱傷、免疫介在性疾患、炎症性疾患(関節リウマチを含む)、移植拒絶、癌、デュピュイトラン拘縮、および胃潰瘍を含む、疾患および状態を治療するのに有用である。これらはまた、限定されるわけではないが、糖尿病(I型およびII型)性腎症、放射線腎症、閉塞性腎症、びまん性全身性硬化症、肺線維症、同種移植拒絶、遺伝性の腎疾患(例えば、多発性嚢胞腎、髄質海綿腎、馬蹄腎)、糸球体腎炎、腎硬化症、腎石灰化症、全身性エリテマトーデス、シェーグレン症候群、ベルガー病、全身または糸球体の高血圧、尿細管間質性腎症、尿細管性アシドーシス、腎結核、ならびに腎梗塞を含む腎不全を治療し、予防し、かつその発生リスクを減少させるのにも有用である。特に、それらは、限定されるわけではないが、レニン阻害物質、アンギオテンシン変換酵素(ACE)阻害物質、AngII受容体拮抗物質(「AngII受容体遮断薬」としても公知)、およびアルドステロン拮抗物質を含む、レニン-アンギオテンシン-アルドステロン系の拮抗物質と組み合わされた場合に有用である。本発明の特異的結合メンバーをこのような拮抗物質と組み合わせて使用するための方法は、その内容が参照により本明細書に組み入れられるPCT/US04/13677において説明されている。
【0056】
本発明の特異的結合メンバーはまた、ECMの沈着に関連した疾患および状態を治療するのにも有用であり、該疾患および状態には、全身性硬化症、術後癒着、ケロイドおよび肥厚性瘢痕化、増殖性硝子体網膜症、緑内障ドレナージ手術、角膜損傷、白内障、ペーロニー病、成人型呼吸窮迫症候群、肝硬変、心筋梗塞後の瘢痕化、血管形成術後の再狭窄、くも膜下出血後の瘢痕化、多発性硬化症、椎弓切除術後の線維化、腱および他の部分の修復後の線維化、入れ墨除去に起因する瘢痕化、胆汁性肝硬変(硬化性胆管炎を含む)、心膜炎、胸膜炎、気管切開術、CNS穿通損傷、好酸球増加筋痛症候群、血管再狭窄、静脈閉塞症、膵炎、ならびに乾癬性関節症が含まれる。
【0057】
本発明の特異的結合メンバーはさらに、再上皮化の促進が有益である状態において有用である。このような状態には、静脈性潰瘍、虚血性潰瘍(褥瘡)、糖尿病性潰瘍、グラフト部位、グラフト供与部位、擦過傷および熱傷、喘息、ARDSなどの気管支上皮の疾患、細胞毒性治療に関連した粘膜炎、食道潰瘍(逆流症)、胃潰瘍、小腸および大腸の病変(炎症性腸疾患)などの腸上皮の疾患がが含まれるがそれらに限定されるわけではない。
【0058】
本発明の特異的結合メンバーはさらにまた、内皮細胞増殖が望ましい状態において、例えば、アテローム斑を安定化させる際、血管吻合の治癒を促進する際、または、動脈疾患、再狭窄、および喘息など平滑筋細胞増殖の阻害が望ましい状態においても使用される。
【0059】
本発明の特異的結合メンバーはまた、リーシュマニア(Leishmania)種、クルーズ・トリパノソーナ(Trypanosorna cruzi)、結核菌(Mycobacterium tuberculosis)およびらい菌(Mycobacterium leprae)、ならびに、原虫トキソプラズマ・ゴンディ(Toxoplasma gondii)、菌類のヒストプラスマ・カプスラーツム(Histoplasma capsulatum)、カンジダ・アルビカンス(Candida albicans)、カンジダ・パラプシローシス(Candida parapsilosis)、およびクリプトコックス・ネオフォルマンス(Cryptococcus neoformans)、ならびにリケッチア(Rickettsia)、例えば、発疹チフスリケッチア(R. prowazekii)、リケッチア・コロニー(R. coronii)、およびツツガムシ病リケッチア(R. tsutsugamushi)によって引き起こされるもののようなマクロファージ介在性の感染症に対する免疫応答を増強するのにも有用である。これらはまた、例えば、腫瘍、AIDS、または肉芽腫症によって引き起こされる免疫抑制を軽減するのにも有用である。
【0060】
本発明の特異的結合メンバーは、限定されるわけではないが、乳癌、前立腺癌、卵巣癌、胃癌、腎臓癌、膵臓癌、結腸直腸癌、皮膚癌、肺癌、子宮頚癌、および膀胱癌を含む癌、神経膠腫、中皮腫、ならびに、様々な白血病および肉腫、例えばカポジ肉腫など、過剰増殖疾患の治療においてさらに有用であり、かつ特に、このような腫瘍の治療またはそれらの再発もしくは転移の予防に有用である。特に、本発明の拮抗物質特異的結合メンバーは、シクロスポリンによって媒介される転移を阻害するのに有用である。
【0061】
癌治療の文脈において、「治療」は、患者の平均余命を延長するために、腫瘍増殖の減速または腫瘍転移の減少、ならびに癌の部分寛解をもたらす、任意の医学的介入を含むことが、当然理解されると考えられる。
【0062】
本発明のさらなる局面は、本明細書において開示される抗体のVH可変ドメインおよび/またはVL可変ドメインをコードする、一般に単離された核酸を提供する。
【0063】
本発明の別の局面は、本明細書において開示されるHCDR配列またはLCDR配列、特に、SEQ ID NO:3、4、5、13、14、15、23、24、および25より選択されるHCDRまたはSEQ ID NO:8、9、10、18、19、20、28、29、30より選択されるVLのCDR、最も好ましくはPET1073G12、PET1074B9、またはPET1287A10のHCDR3(それぞれSEQ ID NO:5、15、もしくは25)をコードする、一般に単離された核酸を提供する。個々のCDR、HCDR、LCDR、およびPET1073G12、PET1074B9、またはPET1287A10のCDR、HCDR、LCDRのセットをコードする核酸と同様に、PET1073G12、PET1074B9、またはPET1287A10のCDRセットをコードする核酸、PET1073G12、PET1074B9、またはPET1287A10のHCDRセットをコードする核酸、およびPET1073G12、PET1074B9、またはPET1287A10のLCDRセットをコードする核酸もまた、本発明によって提供される。
【0064】
さらなる局面は、本発明の核酸で形質転換された宿主細胞を提供する。
【0065】
なおさらなる局面は、コードしている核酸からの発現を引き起こす段階を含む、抗体のVH可変ドメインを作製する方法を提供する。このような方法は、抗体の前記VH可変ドメインを産生するための条件下で宿主細胞を培養する段階、または抗体の前記VHドメインがインビボで発現されるようにする段階を含み得る。
【0066】
VL可変ドメインならびにVHドメインおよび/またはVLドメインを含む特異的結合メンバーを作製するための類似した方法が、本発明の別の局面として提供される。
【0067】
作製の方法は、生成物を単離および/または精製する段階を含み得る。
【0068】
作製の方法は、薬学的に許容される賦形剤のような少なくとも1種の付加的な成分を含む組成物中に生成物を配合する段階を含み得る。
【0069】
本発明のこれらおよび他の局面を、以下にさらに詳細に説明する。
【図面の簡単な説明】
【0070】
【図1】PET1073G12生殖系列のIgG4(ベタ塗りの四角形(closed square))および1D11.16(白抜きの円(open circle))による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図1b】PET1073G12生殖系列のIgG4(ベタ塗りの四角形(closed square))および1D11.16(白抜きの円(open circle))による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図1c】PET1073G12生殖系列のIgG4(ベタ塗りの四角形(closed square))および1D11.16(白抜きの円(open circle))による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図2a】PET1074B9生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図2b】PET1074B9生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図2c】PET1074B9生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図3a】PET1287A10生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図3b】PET1287A10生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【図3c】PET1287A10生殖系列のIgG4(ベタ塗りの四角形)および1D11.16(白抜きの円)による、TGFβ1(a)、TGFβ2(b)、またはTGFβ3(c)(10pM)によって誘導されるNHLF細胞からのフィブロネクチン産生の中和(阻害率(%))を示す。ベタ塗りの三角形は、最高濃度(100nM)で試験された無関係なIgG4を表す。データは、デュプリケートで実施されたn回の実験の平均値±平均値の標準誤差として示される。IC50値については表2を参照されたい。
【発明を実施するための形態】
【0071】
詳細な説明
用語
特異的結合メンバー
この用語は、互いに対する結合特異性を有する一対の分子のメンバーを示す。特異的結合対のメンバーは、天然に由来しても、または、全体的もしくは部分的に合成によって作製されてもよい。分子対の一方のメンバーは、分子対のもう一方のメンバーの表面上の領域またはくぼみに特異的に結合する、表面上の領域またはくぼみを有する。したがって、対のメンバーは、互いに特異的に結合する特性を有している。本発明は、標的抗原に結合する特異的結合メンバーに関係している。
【0072】
特異的
この用語は、ある特異的結合メンバーが、所与の動物に由来するその特異的結合相手以外の分子に対していかなる有意な結合も示さないと考えられる状況を意味するために使用され得る。例えば、ヒトTGFβに特異的な特異的結合メンバーは、他のTGFβ以外のヒト分子には有意な結合を示さないと考えられるが、他の種に由来するTGFβとは交差反応し得る。
【0073】
抗原に結合する特異的結合メンバーは、抗原結合部位を含む。例えば、特異的結合メンバーは、抗体分子でよい。抗原結合部位は、フィブロネクチンまたはシトクロムBなどの非抗体タンパク質足場上にCDRを配置することによって提供することもできる(Koide et al.,(1998)Journal of Molecular Biology, 284:1141-1151;Nygren et al.(1997)Current Opinion in Structural Biology, Vol. 7:463-469)。タンパク質中に新規な結合部位を作り出すための足場は、前記のNygrenらによって詳細に概説されている。抗体模倣物のためのタンパク質足場は、少なくとも1つのランダム化されたループを有するフィブロネクチンIII型ドメインを含むタンパク質(抗体模倣物)を記載したWO 00/34784において開示されている。1つまたは複数のCDR、例えば、HCDRのセットを継ぎ足すのに適した足場は、免疫グロブリン遺伝子スーパーファミリーの任意のドメインメンバーによって提供され得る。足場は、ヒトタンパク質または非ヒトタンパク質でよい。
【0074】
非抗体タンパク質足場の利点は、それが、少なくともいくつかの抗体分子よりも小さく、かつ/または製造するのが容易である保存されたフレームワーク領域中で抗原結合部位を提供できることである。特異的結合メンバーの大きさが小さいことにより、細胞に移行する能力、組織深部に侵入する能力もしくは他の構造体内の標的に到達する能力、または標的抗原のタンパク質のくぼみ内に結合する能力など、有用な生理学的特性が与えられ得る。
【0075】
非抗体タンパク質足場中の抗原結合部位の使用は、Wess, 2004において概説されている。安定な主鎖および1つまたは複数の可変ループを有するタンパク質が典型的であり、この1つまたは複数のループのアミノ酸配列は、標的抗原に結合するための特異性を有する抗原結合部位を作り出すために、特異的に、またはランダムに変異させられている。このようなタンパク質には、S.アウレウス(S. aureus)に由来するプロテインA、トランスフェリン、テトラネクチン、フィブロネクチン(例えば10番目のフィブロネクチンIII型ドメイン)、およびリポカリンのIgG結合ドメインが含まれる。他のアプローチには、分子内ジスルフィド結合を有する小型タンパク質であるシクロチド(cyclotide)をベースとする、合成「Microbodies」(Selecore GmbH)が含まれる。
【0076】
抗体配列および/または抗原結合部位に加えて、本発明による特異的結合メンバーは、他のアミノ酸、例えば、折り畳まれたドメインのようなペプチドもしくはポリペプチドを形成するアミノ酸、または、抗原に結合する能力に加えて別の機能的特徴を分子に与えるアミノ酸も含んでよい。本発明の特異的結合メンバーは、検出可能な標識を有してよく、または、(例えばペプチジル結合もしくはリンカーを介して)毒素またはターゲティング部分もしくは酵素に結合されていてもよい。例えば、特異的結合メンバーは、触媒部位(例えば酵素ドメイン中)、ならびに、抗原に結合し、したがって、抗原に触媒部位を導く抗原結合部位を含んでよい。触媒部位は、例えば切断によって、抗原の生物学的機能を阻害し得る。
【0077】
前述したように、CDRは、フィブロネクチンまたはシトクロムBのような足場によって保有され得るが(HaanおよびMaggos, 2004 BioCentury, 12(5):A1-A6;Koide et al.、前記;Nygren et al.、前記)、本発明のCDRまたはCDRセットを保有するための構造体は、CDRもしくはCDRセットが、再配列された免疫グロブリン遺伝子によってコードされる天然のVHおよびVL抗体可変ドメインのCDRもしくはCDRセットに対応する位置に位置している、抗体の重鎖配列もしくは軽鎖配列、またはその実質的な部分を一般に有すると考えられる。免疫グロブリン可変ドメインの構造および位置は、Kabat, et al., 1987、および現在インターネットで利用可能なその最新版(http://immuno. bme.nwu.edu、または任意の検索エンジンを用いて「Kabat」を発見されたい)を参照することにより、決定することができる。
【0078】
抗体分子
この用語は、天然であろうと、部分的または全体的に合成によって作製されようと、免疫グロブリンを示す。この用語はまた、抗体の抗原結合ドメインを含む任意のポリペプチドまたはタンパク質も包含する。抗原結合ドメインを含む抗体断片は、Fab、scFv、Fv、dAb、Fd、およびジアボディ(diabody)などの分子である。
【0079】
ヒト生殖系列細胞のゲノムにおいて、抗体ポリペプチド鎖の遺伝情報は、様々な染色体に沿って散在している遺伝子座内の複数の遺伝子セグメント中に含まれている。ヒト重鎖(VH)は、第14染色体上でコードされており、κ軽鎖(VΚ)は第2染色体上でコードされており、かつλ軽鎖(Vλ)は、第22染色体上でコードされている。Bリンパ球(抗体産生細胞)の発達中に、これらの遺伝子座中の遺伝子セグメントは、組換えによって組み立てられて、抗体の重鎖または軽鎖の完全な遺伝子の形成をもたらす(Tonegawa S. Nature, 302, 575-81, 1983)。抗体定常領域(VH、VΚ、およびVλ)はヒト集団の全体にわたって大部分は同一であるが、可変ドメイン内にはかなりの多様性が存在する。このような多様性により、異なる標的抗原に対する特異性をそれぞれ有する、何十億もの異なる抗体の開発が可能になる。
【0080】
抗体の可変領域内の多様性は、いくつかの方法で生み出される。第一に、遺伝子レベルでは、抗体可変部分の生殖系列遺伝子配列内にかなりの多様性がある。約50種の異なるVH生殖系列(Tomlinson I. M. et al, J. Mol. Biol., 227, 776-798, 1992)、35種の異なるVκ生殖系列(Tomlinson I. M. et al EMBO J, 14, 4628-38, 1995)、および30種の異なるVλ生殖系列(Williams S. C.およびWinter G. Eur. J. Immunol, 23, 1456-61, 1993;Kawasaki K. et al Genome Res, 7, 250-61, 1997)が説明されている。これらの生殖系列遺伝子配列の様々な組み合わせから抗体を作製する。次いで、体細胞組換えおよび超変異などのプロセスによって、抗体の可変ドメイン中にさらなる多様性を導入する(Tonegawa S. Nature, 302, 575-81, 1983)。
【0081】
抗体可変部分の生殖系列遺伝子配列内にはかなりの多様性があるが、配列相同性に基づいてこれらの配列をファミリーにグループ分けすることが可能である。50種の異なるVH遺伝子配列は、7個のファミリーに、35種のVκ配列は6個のファミリーに、かつ30種のVλファミリーは、10個のファミリーにグループ分けすることができる。これらのグループは、1つのメンバーから(VH6およびVκ4)、最大21メンバー(VH3)まで大きさが異なり、かつ各グループのメンバーは、高度な配列相同性を共有している。
【0082】
VHおよびVLの生殖系列配列データベースに対して抗体を整列させて、最も類似した生殖系列のマッチを決定し、かつ体細胞超変異によって導入された任意のアミノ酸変化を同定することができる。研究により、ヒト免疫系が、免疫応答中に、他のもの(例えばVH2)より、いくつかの生殖系列(例えばVH3 DP47)を優先して使用することが示された(Knappik A. et al J. Mol. Biol, 296, 57-86, 2000)
しかしながら、ファージディスプレイによって単離された抗体集団は、単一の抗原に対して単離された場合でさえ、典型的には、広範な生殖系列遺伝子を使用する(Edwards B. et al J. Mol Biol, 334, 103-118, 2003)。
【0083】
モノクローナル抗体および他の抗体を獲得し、かつ組換えDNAテクノロジーの技術を用いて、元の抗体の特異性を保持している他の抗体またはキメラ分子を作製することが可能である。このような技術は、免疫グロブリンの可変領域をコードしているDNAを定常領域に連結する段階、またはある抗体の相補性決定領域(CDR)を、異なる免疫グロブリンの定常領域にフレームワーク領域を加えた部分中に導入する段階を含み得る。例えば、EP-A-184187、GB2188638A、またはEP-A-239400、およびそれに続く文献の多くの部分を参照されたい。抗体を産生するハイブリドーマまたは他の細胞は、遺伝的変異または他の変化の影響を受けることがあり、これにより、産生される抗体の結合特異性が改変されることもあればされないこともある。
【0084】
多くの方法で抗体を改変することができるため、「抗体分子」という用語は、必要とされる特異性を有する抗体の抗原結合部位を有する、任意の特異的結合メンバーまたは物質を包含するものとして解釈されるべきである。したがって、この用語は、天然であろうと、全体的または部分的に合成であろうと、抗原結合ドメインを含む任意のポリペプチドを含む、抗体の断片および誘導体を包含する。したがって、別のポリペプチドに融合された、抗体の抗原結合ドメインまたは等価物を含むキメラ分子が含まれる。キメラ抗体のクローニングおよび発現は、EP-A-0120694およびEP-A-0125023、ならびにそれに続く文献の多くの部分において記載されている。
【0085】
抗体工学の技術分野において利用可能なさらなる技術により、ヒト抗体およびヒト化抗体を単離することが可能になった。例えば、ヒトハイブリドーマは、Kontermannらによって説明されているようにして作製することができる(Kontermann RおよびDubel Stefan;Antibody Engineering, Springer-Verlag New York, LLC;2001, ISBN:3540413545)。特異的結合メンバーを作製するための確立された別の技術であるファージディスプレイは、Kontermannらの前記文献およびWO 92/01047など多くの刊行物において詳細に説明されている(以下にさらに考察する)。マウス免疫系の完全な他の構成要素を残しつつ、マウス抗体遺伝子を不活性化し、かつヒト抗体遺伝子で機能的に置換したトランスジェニックマウスを、ヒト抗原に対するヒト抗体を単離するために使用することができる(Mendez et al., 1997)。モノクローナルまたはポリクローナルいずれかのヒト抗体はまた、ヤギ、雌ウシ、ヒツジ、ウサギなど他のトランスジェニック動物中で作製することもできる。
【0086】
例えば、Knappikらの前記文献、またはKrebs et al., Journal of Immunological Methods 254 2001 67-84によって説明されているように、適切な発現ベクター内で合成され、かつ組み立てられたオリゴヌクレオチドを用いて作製した遺伝子からの発現によって、合成抗体分子を作製することができる。
【0087】
全抗体の断片は、抗原に結合する機能を果たすことができることが示された。結合断片の例は、(i)VLドメイン、CLドメイン、VHドメイン、およびCHIドメインからなるFab断片;(ii)VHドメインおよびCHIドメインからなるFd断片;(iii)単一の抗体のVLドメインおよびVHドメインからなるFv断片;(iv)VHドメインからなるdAb断片(Ward, E. S. et al., Nature 341, 544-546(1989), McCafferty et al.(1990)Nature, 348, 552-554);(v)単離されたCDR領域;(vi)F(ab')2断片、すなわち、2つの連結されたFab断片を含む2価断片、(vii)VHドメインおよびVLドメインが、ペプチドリンカーによって連結されており、それによってこれら2つのドメインが結合して抗原結合部位を形成している、単鎖Fv分子(scFv)(Bird et al., Science, 242, 423-426, 1988;Huston et al., Proc. Natl. Acad. Sci USA 85, 5879-5883;1998)、(viii)二重特異性の単鎖Fv2量体(PCT/US92/09665)、ならびに(ix)「ジアボディ」、すなわち遺伝子融合によって構築された多価性または多重特異性の断片(WO/13804;F. Holliger et al., Proc. Natl. Acad. Sci. USA 90 6444-6448, 1993)である。Fv分子、scFv分子、またはジアボディ分子は、VHドメインおよびVLドメインを連結するジスルフィド架橋の組込みによって安定化され得る(Y. Reiter et al.,Nature Biotech, 14, 1239-1245, 1996)。CH3ドメインに結合されたscFvを含むミニ抗体(minibody)もまた、作製され得る(S. Hu et al., Cancer Res., 56, 3055-3061, 1996)。
【0088】
dAb(ドメイン抗体)は、抗体の小さな単量体抗原結合断片、すなわち、抗体の重鎖または軽鎖の可変領域である(Holt et al.,2003)。VH dAbは、ラクダ科の動物(例えば、ラクダ、ラマ)中に天然に存在し、かつラクダを標的抗原で免疫化し、抗原特異的B細胞を単離し、かつ個々のB細胞からdAb遺伝子を直接クローニングすることによって、作製することができる。dAbはまた、細胞培養で産生させることもできる。これらはサイズが小さく、溶解度が優れており、かつ温度に対して安定であるため、特に生理学的に有用であり、かつ選択および親和性成熟に適している。本発明の特異的結合メンバーは、実質的に本明細書において説明されるVHドメインもしくはVLドメイン、または実質的に本明細書において説明されるCDRのセットを含むVHドメインもしくはVLドメインを含むdAbでよい。
【0089】
二重特異性抗体が使用される予定である場合、これらは、様々な方法で製造することができる(Holliger, P.およびWinter G. Current Opinion Biotechnol. 4, 446-449(1993))、例えば、化学的にもしくはハイブリッドハイブリドーマから調製することができる、従来の二重特異性抗体でよく、または、前述の二重特異性抗体断片のいずれかでよい。二重特異性抗体の例には、異なる特異性を有する2つの抗体の結合ドメインを使用し、かつ柔軟な短いペプチドによって直接連結することができるBiTE(商標)技術のものが含まれる。これは、短いポリペプチド単鎖上で2つの抗体を結合する。ジアボディおよびscFvは、Fc領域無しで、可変ドメインのみを用いて構築して、抗イディオタイプ反応の影響を潜在的に低減することができる。
【0090】
二重特異性の全抗体とは対照的に、二重特異性ジアボディはまた、大腸菌(E.coli)中で容易に構築し、かつ発現させることができるため、特に有用であり得る。適切な結合特異性を有するジアボディ(および抗体断片のような他の多くのポリペプチド)は、ファージディスプレイ(WO94/13804)を用いて、ライブラリーから容易に選択することができる。例えば、TGFβを対象とする特異性を有する、ジアボディの一方の腕が一定に保たれるべき場合は、他方の腕が変更され、かつ適切な特異性を有する抗体が選択されるライブラリーを作製することができる。二重特異性の全抗体は、へこみにノブを入れる(knobs-into-holes)操作によって作製され得る(C. E. B. Ridgeway et al., Protein Eng., 9, 616-621, 1996)。
【0091】
抗原結合部位
この用語は、結合対、すなわち抗原中の他のメンバーの一部分または全体に接触し、かつそれらに相補的である、抗体分子のような特異的結合メンバーの一部分を示す。抗体分子において、抗原結合部位は、抗体の抗原結合部位と呼ぶことができ、かつ標的抗原の全体または一部分に特異的に結合し、かつそれらに相補的である、抗体の一部分を含む。抗原が大型である場合、抗体は、エピトープと呼ばれる、抗原の特定の部分にしか結合しないことがある。
【0092】
抗原結合ドメイン
抗原結合ドメインは、抗原結合部位を含み、かつ標的抗原に結合する、特異的結合メンバーの一部分である。いくつかの態様において、抗原結合ドメインは、1つもしくは複数の抗体可変ドメイン(例えば、VHドメインからなるいわゆるFd抗体断片)またはその抗原結合部分によって提供され得る。いくつかの態様において、抗原結合ドメインは、抗体の軽鎖可変領域(VL)および抗体の重鎖可変領域(VH)を含む。
【0093】
特異的結合メンバーは、天然に、もしくは様々な真核細胞(例えばCHOもしくはNSO(ECACC 85110503)細胞の系によって、グリコシル化されてもよく、または、それらは、(例えば、原核細胞における発現によって作製される場合は)グリコシル化されていなくてもよい。グリコシル化はまた、例えば、結果として生じる抗体のADCC活性を増大させるために、フコシル化を阻害することによって、意図的に改変してもよい。したがって、フコシル化を最小化するか、または無くすように本発明の特異的結合メンバーのうちいずれかを発現させてもよい。
【0094】
いくつかの態様において、本発明のCDRまたはVHドメインもしくはVLドメインは、本明細書においてその配列が説明される指定された領域に同一であるか、または著しく類似していると考えられる。CDRおよび/またはVHドメインもしくはVLドメインにおいて、1つ〜5つ、好ましくは1つ〜4つ、または1つもしくは2つ、または3つもしくは4つのアミノ酸置換がなされ得ることが企図される。本明細書においてその配列が与えられるものに著しく類似しているVHドメインまたはVLドメインならびにCDRおよびCDRのセットは、実質的に本明細書において説明される配列を有するものと同様に、本発明の局面に包含される。
【0095】
本発明のCDRまたはCDRセットを保有するための構造体は、CDRもしくはCDRセットが、再配列された免疫グロブリン遺伝子によってコードされる天然のVHおよびVL抗体可変ドメインのCDRもしくはCDRセットに対応する位置に位置している、抗体の重鎖配列もしくは軽鎖配列、またはその実質的な部分を一般に有すると考えられる。免疫グロブリン可変ドメインの構造および位置は、Kabat, E. A. et al., Sequences of Proteins of Immunological Interest. 4th Edition. US Department of Health and Human Services.1987、および現在インターネットで利用可能なその最新版(http://immuno.bme.nwu.edu、または任意の検索エンジンを用いて「Kabat」を発見されたい)を参照することにより、決定することができる。CDRは、Kabatらに従って定義される。
【0096】
CDRはまた、フィブロネクチンまたはシトクロムBなど他の足場によって保有されてもよい。
【0097】
好ましくは、実質的に本明細書において説明されるCDRアミノ酸配列は、ヒトの可変ドメインまたはその実質的な部分中にCDRとして保有されている。実質的に本明細書において説明されるHCDR3配列は、本発明の好ましい態様に相当し、かつこれらはそれぞれ、ヒトの重鎖可変ドメインまたはその実質的な部分中にHCDR3として保有されていることが好ましい。
【0098】
本発明において使用される可変ドメインは、任意の生殖系列もしくは再配列されたヒト可変ドメインから得るか、もしくはそれらに由来してよく、または、公知のヒト可変ドメインのコンセンサス配列もしくは実際の配列に基づいた合成の可変ドメインでもよい。本発明のCDR配列(例えばCDR3)は、組換えDNAテクノロジーを用いて、CDR(例えばCDR3)を欠いている可変ドメインのレパートリー中に導入することができる。好ましい生殖系列フレームワークは、既に本明細書において確認した。
【0099】
例えば、Marks et al.(Bio/Technology, 1992, 10:779-783)では、可変ドメイン領域の5'末端に向けられているか、または隣接しているコンセンサスプライマーを、ヒトVH遺伝子の第3フレームワーク領域に対するコンセンサスプライマーと組み合わせて使用して、CDR2を欠くVΚ可変ドメインのレパートリーを提供する、抗体可変ドメインのレパートリーを作製する方法が説明されている。Marksらは、どのようにこのレパートリーを特定の抗体のCDR2と組み合わせることができるかも、さらに説明している。類似した技術を用いて、本発明のCDR3に由来する配列を、CDR3を欠いているVHドメインまたはVLドメインのレパートリーとシャッフルし、かつそのシャッフルされた完全なVHドメインまたはVLドメインを同族のVHドメインまたはVLドメインと組み合わせて、本発明の特異的結合メンバーを提供することができる。次いで、適切な特異的結合メンバーを選択することができるように、WO92/01047、またはKay, B. K., Winter,J.およびMcCafferty, J.(1996)Phage Display of Peptides and Proteins:A Laboratory Manual, San Diego:Academic Pressを含む、後続の文献の多くの部分のいずれかのファージディスプレイ系のような適切な宿主系においてレパートリーを提示することができる。レパートリーは、104個より多い個々のメンバー、例えば、106個〜108個または1010個のメンバーからなり得る。他の適切な宿主系には、酵母ディスプレイ、最近ディスプレイ、T7ディスプレイ、リボソームディスプレイ、共有結合ディスプレイなどが含まれる。
【0100】
類似したシャッフリング技術またはコンビナトリアル技術もまた、Stemmer(Nature, 1994, 370:389-391)によって開示されており、彼は、βラクタマーゼ遺伝子に関してこの技術を説明しているが、このアプローチを抗体作製のために使用できることを述べている。
【0101】
さらなる代替案は、可変ドメイン全体の内部に変異を発生させるために、1つまたは複数の選択されたVH遺伝子および/またはVL遺伝子のランダム変異誘発を用いて、本発明のCDR由来配列を保有する新規なVH領域またはVL領域を作製することである。このような技術は、誤りがちなPCRを使用したGramらによって説明されている(1992, Proc. Natl. Acad. Sci., USA, 89:3576-3580)。好ましい態様において、1つまたは2つのアミノ酸置換が、HCDRセットおよび/またはLCDRセットの内部で行われる。
【0102】
使用し得る別の方法は、VH遺伝子またはVL遺伝子のCDR領域に変異誘発を誘導することである。このような技術は、Barbasら(1994, Proc. Natl. Acad. Sci., USA, 91:3809-3813)およびSchierら(1996, J. Mol. Biol. 263:551-567)によって開示されている。
【0103】
上述の技術はすべて、それ自体が当技術分野において公知であり、かつそれら自体で、本発明の一部分を形成しない。本明細書において提供される開示を考慮すれば、当業者は、このような技術を使用して、当技術分野においてルーチンな方法論を用いて本発明の特異的結合メンバーを提供することができると考えられる。
【0104】
本発明のさらなる局面は、TGFβ抗原に特異的な抗体の抗原結合部位を得るための方法であって、本明細書において説明されるVHドメインのアミノ酸配列中の1つまたは複数のアミノ酸の付加、欠失、置換、または挿入によって、VHドメインのアミノ酸配列変異体であるVHドメインを提供する段階、任意で、このようにして提供されたVHドメインを1つまたは複数のVLドメインと組み合わせる段階、ならびに、VHドメインまたは1つもしくは複数のVH/VL組み合わせを試験して、TGFβに特異的であり、かつ1つまたは複数の好ましい特性、好ましくは、TGFβ活性を中和する能力を任意で有する、特異的結合メンバーまたは抗原結合ドメインを同定する段階を含む方法を提供する。前記VLドメインは、実質的に本明細書において説明されるアミノ酸配列を有してよい。
【0105】
本明細書において開示されるVLドメインの1つまたは複数の配列変異体が、1つまたは複数のVHドメインと組み合わされる類似した方法を使用してもよい。
【0106】
好ましい態様において、PET1073G12、PET1074B9、またはPET1287A10のVHドメインは、変異の影響を受けて、1つまたは複数のVLドメインと組み合わされ得る1つまたは複数のVHドメインのアミノ酸配列変異体を提供し得る。
【0107】
本発明のさらなる局面は、以下の段階を含む、ヒトTGFβの3種のアイソフォームすべてに特異的な特異的結合メンバーを調製する方法を提供する:
(a)置換される予定のCDR3を含むか、またはCDR3コード領域を欠くVHドメインをコードしている核酸の出発レパートリーを提供する段階;
(b)HCDR3に関して実質的に本明細書において説明されるアミノ酸配列をコードしているドナー核酸がレパートリー中のCDR3領域中に挿入されて、VHドメインをコードする核酸の生成物レパートリーを提供するように、前記レパートリーを該ドナー核酸と組み合わせる段階;
(c)前記生成物レパートリーの核酸を発現させる段階;
(d)TGFβの少なくとも1種のアイソフォームに特異的な特異的結合メンバーを選択する段階;および
(e)前記特異的結合メンバーまたはそれをコードする核酸を回収する段階。
【0108】
本方法は、TGFβの3種のアイソフォームそれぞれを用いた結合アッセイ法および中和アッセイ法を実施して、3種のアイソフォームすべてに結合し、かつ中和する特異的結合メンバーを同定する段階も、さらに含み得る。
【0109】
やはり、本発明のLCDR3を、置換される予定のCDR3を含むか、またはCDR3コード領域を欠くVLドメインをコードしている核酸のレパートリーと組み合わせる類似した方法も使用することができる。
【0110】
同様に、1種もしくは複数種、または3種すべてのCDRをVHドメインまたはVLドメインのレパートリーに継ぎ足し、次いでこれらを、ヒトTGFβのアイソフォームすべてに対して特異的な1種または複数種の特異的結合メンバーについてスクリーニングしてもよい。
【0111】
VHドメインは、生殖系列配列を有してよく、かつ好ましい態様において、DP-10またはDP-88である。VLドメイン配列は、生殖系列配列を有してよく、かつ好ましい態様において、DPK-22である。
【0112】
好ましい態様において、PET1073G12、PET1074B9、もしくはPET1287A10のHCDR1、HCDR2、およびHCDR3のうちの1つもしくは複数、または、PET1073G12、PET1074B9、もしくはPET1287A10のHCDRセットが使用され得、かつ/または、PET1073G12、PET1074B9、もしくはPET1287A10のLCDR1、LCDR2、およびLCDR3のうちの1つもしくは複数、またはPET1073G12、PET1074B9、もしくはPET1287A10のLCDRセットが使用され得る。
【0113】
免疫グロブリン可変ドメインの実質的な部分は、少なくとも3種のCDR領域を、介在するフレームワーク領域と共に含むと考えられる。好ましくは、この部分は、第1および第4のフレームワーク領域のいずれかまたは両方の少なくとも約50%も含むと考えられ、この50%は、第1のフレームワーク領域のC末端の50%および第4のフレームワーク領域のN末端の50%である。可変ドメインの実質的な部分のN末端またはC末端の付加的な残基は、天然の可変ドメイン領域とは通常関連していないものでよい。例えば、組換えDNA技術によって作製される本発明の特異的結合メンバーを構築することにより、クローニング段階または他の操作段階を容易にするために導入されるリンカーによってコードされたN末端またはC末端残基の導入がもたらされ得る。他の操作段階には、リンカーを導入して、免疫グロブリン重鎖、(例えばジアボディの作製における)他の可変ドメイン、または本明細書において別の箇所でより詳細に考察するタンパク質ラベルを含む別のタンパク質配列に、本発明の可変ドメインを結合させる段階が含まれる。
【0114】
本発明の好ましい局面において、VHドメインおよびVLドメインの対を含む特異的結合メンバーが好ましいが、VHドメイン配列またはVLドメイン配列のいずれかをベースとする単一の結合ドメインは、本発明の別の局面を形成する。単一の免疫グロブリンドメイン、特にVHドメインが、特異的な様式で標的抗原に結合できることは公知である。
【0115】
単一の特異的結合ドメインのいずれかの場合において、これらのドメインを使用して、ヒトTGFβの3種のアイソフォームに結合できる、2ドメインの特異的結合メンバーを形成することができる相補的ドメインについてスクリーニングすることができる。
【0116】
これは、WO92/01047において開示されている、いわゆる階層的な二重組み合わせのアプローチを用いて、ファージディスプレイスクリーニング法によって実現することができる。このアプローチでは、H鎖クローンまたはL鎖クローンのいずれかを含む個々のコロニーを使用して、他の鎖(LまたはH)をコードするクローンの完全なライブラリーを感染させ、かつ結果として生じる2種の鎖に特異的な結合メンバーを、この参考文献において説明されているもののようなファージディスプレイ技術に従って選択する。この技術は、Marksらの同書においても開示されている。
【0117】
本発明の特異的結合メンバーは、抗体の定常領域またはそれらの一部分をさらに含んでよい。例えば、VLドメインは、ヒトのCκ鎖またはCλ鎖、好ましくはCκ鎖を含む、抗体軽鎖の定常ドメインに、C末端が結合されていてよい。同様に、VHドメインをベースとする特異的結合メンバーは、任意の抗体アイソタイプ、例えば、IgG、IgA、IgE、およびIgM、ならびにアイソタイプサブクラスのうちのいずれか、特にIgG1およびIgG4に由来する免疫グロブリン重鎖の全体または一部分(例えばCH1ドメイン)に、C末端が結合されていてよい。IgG4が好ましい。IgG4は、補体に結合せず、かつエフェクター機能を生じないため、いくつかの用途に好ましい。エフェクター機能が望ましい場合は、IgG1が好ましい。エフェクター機能はまた、フコース含有量を減少させるなど、当技術分野において公知である方法によって、抗体のグリコシル化状態を操作することによって、増大させてもよい。重鎖は、C末端にリシン残基を有しても、有さなくてもよい。これらの特性を有し、かつ可変領域を安定させる、任意の合成定常領域変異体または他の定常領域変異体もまた、本発明の態様において使用するのに好ましい。
【0118】
本明細書において開示される特異的結合メンバーまたはその抗原結合断片の異種調製物もまた、本発明の範囲内である。例えば、このような調製物は、完全長の重鎖およびC末端のリシンを欠く重鎖を有する抗体、様々な程度にグリコシル化された抗体、N末端のグルタミン酸が環化してピログルタミン酸残基を形成したもののような誘導体化されたアミノ酸を有する抗体、ならびに/または、脱アミド化型の重鎖および/もしくは軽鎖を有する抗体の混合物でよい。
【0119】
本発明の特異的結合メンバーは、検出可能または機能的な標識で標識されてよい。検出可能な標識には、131Iまたは99TCなどの放射性標識物質が含まれ、これらは、抗体イメージングの技術分野において公知である従来の化学反応を用いて、本発明の抗体に結合させることができる。標識には、西洋ワサビペルオキシダーゼのような酵素標識も含まれる。標識にはさらに、特異的な関連した検出可能部分、例えば標識されたアビジンへの結合を介して検出することができるビオチンのような化学的部分が含まれる。
【0120】
本発明の特異的結合メンバーは、ヒト被験体または動物被験体、好ましくはヒトの診断または治療の方法において使用されるように設計される。
【0121】
いくつかの態様において、本発明の特異的結合メンバーは、限定されるわけではないが、受容体セリン/トレオニンキナーゼI型もしくはII型およびプロテオグリカンβグリカン(TGFβIII型受容体)を含む複合体を含む、細胞表面のTGFβ受容体または受容体複合体に、TGFβ1、TGFβ2、および/またはTGFβ3が結合するのを阻害する。したがって、本発明は、細胞表面のTGFβ受容体または受容体複合体へのTGFβ結合を阻害するための方法であって、本発明の特異的結合メンバーにTGFβを接触させる段階、および受容体または受容体複合体への結合の阻害を検出する段階を含む方法を含む。様々な態様において、受容体へのTGFβ結合の阻害は、TGFβ受容体I型のリン酸化の減少、TGFβ受容体I型の活性化の減少、R-SMADタンパク質、特にSMAD2およびSMAD3のリン酸化および/もしくは活性化の減少、該SMADタンパク質の核移行の減少、DNAへのSMADタンパク質の結合の減少、ならびに/または前記細胞もしくは細胞型における発現がTGFβシグナル伝達によって媒介されることが公知である遺伝子の発現の調節によって、示すことができる。さらなるアッセイ法は、実施例において明らかにする。
【0122】
したがって、本発明の別の局面は、提供される特異的結合メンバーの投与を含む治療の方法、そのような特異的結合メンバーを含む薬学的組成物、および、投与用の薬剤の製造、例えば、特異的結合メンバーを薬学的に許容される賦形剤と配合する段階を含む、薬剤または薬学的組成物を製造する方法における、このような特異的結合メンバーの使用を提供する。
【0123】
本発明の特異的結合メンバーは、注射(例えば、皮下、静脈内、体腔内(例えば腫瘍切除後)、病巣内、腹腔内、もしくは筋肉内)によって、吸入によって、または、局所的に(例えば、眼内、鼻腔内、直腸、創傷中、皮膚表面)、もしくは経口的に投与され得る。投与経路は、製品の物理化学的特質によって、疾患を特別に考慮することによって、用量もしくは投与間隔によって、または、有効性を最適化するか、もしくは副作用を最小限に抑えるための条件によって、決定することができる。
【0124】
抗TGFβ治療は、医療従事者による投与に制限されないと予想される。したがって、皮下注射、特に、無針器具を使用するものが適切である場合がある。
【0125】
本発明によれば、提供される組成物は、それを必要とする個体に投与され得る。投与は、好ましくは、「治療的有効量」であり、これは、患者に利益を与えるのに十分な量である。このような利益は、少なくとも、特定の疾患または障害の少なくとも1種の症状の改善である。投与される実際の量、ならびに投与速度および投与のタイムコースは、治療される疾患の性質および重症度に依存すると考えられる。治療の処方、例えば、投薬量の決定などは、前臨床的研究および臨床的研究に基づいて決定することができ、これらの研究の設計は、十分に当業者のレベルの範囲内である。
【0126】
正確な用量は、抗体が診断用であるか、または治療用であるかどうか、治療しようとする領域のサイズおよび位置、抗体の正確な性質(例えば、全抗体、断片、もしくはジアボディ)、ならびに、抗体に結合された任意の検出可能な標識または他の分子の性質を含む、いくつかの因子に依存すると考えられる。典型的な抗体用量は、全身適用の場合は100μg〜1gmの範囲、および局所適用の場合は1μg〜1mgの範囲であると考えられる。典型的に、抗体は、全抗体、好ましくはIgG4アイソタイプであると考えられる。これは、成人患者の1回の治療用の用量であり、小児および乳児のために比例的に調整することができ、また、分子量および活性に比例して、他の抗体形態用に調整することもできる。治療は、医師の判断で、毎日、1週2回、毎週、毎月、または他の間隔で繰り返してよい。本発明の好ましい態様において、治療は周期的であり、かつ各投与の間の期間は、約2週間もしくはそれ以上、好ましくは約3週間もしくはそれ以上、より好ましくは約4週間もしくはそれ以上、または1ヶ月に約1回である。
【0127】
本発明の特異的結合メンバーは、通常、特異的結合メンバーに加えて少なくとも1種の成分を含み得る、薬学的組成物の形態で投与される。
【0128】
したがって、本発明による、かつ本発明に従って使用するための薬学的組成物は、有効成分に加えて、薬学的に許容される賦形剤、担体、緩衝剤、安定化剤、または当業者に周知の他の材料を含んでよい。このような材料は、非毒性であるべきであり、かつ有効成分の有効性を妨害するべきではない。このような材料には、例えば、生理学的に適合性である、任意およびすべての溶剤、分散媒、コーティング剤、抗菌薬および抗真菌薬、ならびに、等張化剤および吸収遅延剤などが含まれ得る。薬学的に許容される担体のいくつかの例は、水、生理食塩水、リン酸緩衝化生理食塩水、デキストロース、グリセロール、およびエタノールなど、ならびにそれらの組み合わせである。多くの場合において、等張化剤、例えば糖、マンニトール、ソルビトールなどの多価アルコール、または塩化ナトリウムを組成物中に含むことが好ましいと考えられる。薬学的に許容される物質のさらなる例は、抗体の貯蔵寿命または有効性を向上させる、湿潤剤、または、湿潤剤もしくは乳化剤、保存剤、または緩衝剤など少量の補助物質である。担体または他の材料の正確な性質は、経口、局所、吸入、または注射、例えば静脈注射でよい、投与経路に依存すると考えられる。好ましい態様において、抗体は、静脈内注入または静脈注射によって投与される。別の好ましい態様において、抗体は、筋肉内注射または皮下注射によって投与される。
【0129】
経口投与用の薬学的組成物は、例えば、不活性な希釈剤または吸収可能な可食担体を含む、錠剤、カプセル剤、散剤、または液剤の形態であってよい。錠剤は、ゼラチンまたは補助剤のような固形担体を含んでよい。液状の薬学的組成物は、一般に、水、石油、動物油もしくは植物油、鉱油、または合成油などの液体担体を含む。生理食塩水溶液、デキストロースもしくは他の糖類の溶液、またはエチレングリコール、プロピレングリコール、もしくはポリエチレングリコールなどのグリコールが含まれてよい。特異的結合メンバー(および、所望の場合は、他の成分)はまた、硬いもしくは軟らかい殻のゼラチンカプセル剤に封入されるか、圧縮して錠剤にされるか、または、被験体の食事中に直接組み込まれてもよい。経口的な治療的投与の場合、有効成分を賦形剤と混合し、かつ摂取可能な錠剤、バッカル錠、トローチ剤、カプセル剤、エリキシル剤、懸濁剤、シロップ剤、およびカシェ剤などの形態で使用することができる。非経口投与以外によって本発明の化合物を投与するためには、不活性化を防止する材料でその化合物をコーティングするか、または、不活性化を防止する材料と共にその化合物を同時投与することが必要である場合がある。
【0130】
静脈注射、または疾患部位への注射の場合、有効成分は、パイロジェンフリーであり、かつ適切なpK、等張性、および安定性を有する、経口的に許容される水性液剤の形態であると考えられる。当業者は、例えば、塩化ナトリウム注射液、リンゲル注射液、乳酸リンゲル注射液などの等張性ビヒクルを用いて、適切な液剤を首尾よく調製することができる。保存剤、安定化剤、緩衝剤、抗酸化剤、および/または他の添加剤も、必要に応じて含まれてよい。
【0131】
組成物は、治療される状態に応じて、単独でまたは他の治療と組み合わせて、同時にまたは逐次的に投与されてよい。
【0132】
本発明の特異的結合メンバーは、溶液剤(例えば、注射可能な液剤および注入可能な液剤)、分散剤もしくは懸濁剤、錠剤、丸剤、散剤、リポソーム、および坐剤などの液体、半固体、または固体の形態で製剤化され得る。好ましい形態は、意図される投与様式、治療的用途、分子の物理化学的特性、および送達経路に依存する。製剤は、賦形剤、または賦形剤の組み合わせ、例えば、糖、アミノ酸、および界面活性剤を含んでよい。液体製剤は、広範囲の抗体濃度およびpHを含んでよい。固形製剤は、例えば、凍結乾燥、噴霧乾燥、または超臨界流体技術による乾燥によって、製造され得る。
【0133】
治療用組成物は、典型的には、製造および貯蔵の条件下で、無菌かつ安定でなければならない。組成物は、溶液、マイクロエマルジョン、分散系、リポソーム、または高い薬物濃度に適した他の規則構造体として製剤化することができる。無菌の注射液剤は、適切な溶媒中の必要とされる量の特異的結合メンバーを、必要に応じて、上記に列挙した成分のうちの1つまたは組み合わせと混合し、続いてろ過滅菌することによって調製することができる。一般に、分散剤は、基本となる分散媒体および上記に列挙したもののうち必要な他の成分を含む無菌ビヒクル中に活性化合物を混合することによって調製される。無菌注射液剤を調製するための無菌粉末の場合、好ましい調製方法は、活性成分および任意の付加的な所望の成分の粉末を、予め滅菌ろ過したその溶液から生じさせる、真空乾燥および凍結乾燥である。液剤の適切な流動性は、例えば、レシチンなどのコーティングの使用によって、分散系の場合は必要な粒径の維持によって、および界面活性剤の使用によって維持することができる。注射用組成物の持続吸収は、吸収を遅延させる作用物質、例えば、モノステアリン酸塩およびゼラチンを組成物中に含めることによって、実現することができる。
【0134】
特定の態様において、抗体組成物活性化合物は、埋め込み剤、経皮パッチ、およびマイクロカプセル化送達系を含む制御放出製剤のように、急速な放出から抗体を保護すると考えられる担体と共に調製され得る。エチレン酢酸ビニル、ポリ無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、およびポリ乳酸など、生分解性かつ生体適合性のポリマーを使用することができる。このような製剤を調製するための多くの方法は、特許権を与えられているか、または、一般に当業者に公知である。例えば、Sustained and Controlled Release Drug Delivery Systems(J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978)を参照されたい。
【0135】
本発明は、本明細書において提供される特異的結合メンバーのTGFβへの結合を引き起こす段階または可能にさせる段階を含む方法を提供する。前述したように、このような結合は、例えば、特異的結合メンバーもしくは特異的結合メンバーをコードする核酸を患者に投与した後にインビボで起こってもよく、またはこれは、インビトロで、例えば、ELISA、ウェスタンブロット法、免疫細胞化学、免疫沈降、アフィニティクロマトグラフィー、もしくは細胞ベースのアッセイ法において、またはエクスビボベースの治療方法(例えば、細胞もしくは体液を本発明による特異的結合メンバーにエクスビボで接触させ、次いで患者に投与する方法)において、起こってもよい。
【0136】
特異的結合メンバーのTGFβへの結合量は、測定することができる。定量は、診断上の関心対象であり得る、試験試料中の抗原の量に関係している場合がある。
【0137】
本発明の任意の局面または態様による特異的結合メンバーまたは抗体分子を含むキットもまた、本発明のある局面として提供される。本発明のキットにおいて、特異的結合メンバーまたは抗体分子は、例えば以下にさらに説明するように、判定しようとする試料中での反応性を与えるために標識されてもよい。キットの構成要素は、一般に無菌であり、かつ密封されたバイアル瓶または他の容器中に入れられている。キットは、抗体分子が有用である診断的解析または他の方法において使用され得る。キットは、ある方法、例えば本発明による方法においてそれらの構成要素を使用するための取扱い説明書を含んでよい。このような方法を補助するか、または実施するのを可能にする補助的な材料は、本発明のキット内に含まれてよい。
【0138】
試料中の抗体の反応性は、任意の適切な手段によって判定され得る。ラジオイムノアッセイ法(RIA)は、1つの実行可能な手段である。放射性標識された抗原を非標識抗原(試験試料)と混合し、かつ抗体と結合させる。結合された抗原を、未結合の抗原から物理的に分離し、かつ抗体に結合された放射性抗原の量を決定する。試験試料中に存在する抗原が多いほど、抗体に結合する放射性抗原は少ないと考えられる。レポーター分子に連結された抗原または類似体を用いる競合結合測定法もまた、非放射性抗原と共に使用してよい。レポーター分子は、蛍光色素、リン光体、または、分光的に孤立した吸光もしくは発光の特徴を有するレーザー色素でよい。適切な蛍光色素には、フルオレセイン、ローダミン、フィコエリトリン、およびテキサスレッドが含まれる。適切な発色色素には、ジアミノベンジジンが含まれる。
【0139】
他のレポーターには、着色されている磁性または常磁性のラテックスビーズのような、高分子コロイド粒子また粒子状物質、および、検出可能なシグナルの視覚的な観察、電子的な検出、または別の方法による記録を、直接的にまたは間接的に引き起こすことができる、生物学的または化学的に活性な作用物質が含まれる。これらの分子は、顕色もしくは変色させるか、または例えば電気的特性の変化を引き起こす反応を触媒する酵素でよい。これらは、エネルギー状態の間の電子遷移が、特徴的なスペクトルの吸収または放出をもたらすように、分子的に励起可能であってよい。これらは、バイオセンサーと組み合わせて使用される化学成分を含んでよい。ビオチン/アビジンまたはビオチン/ストレプトアビジンおよびアルカリ性ホスファターゼ検出系が使用され得る。個々の抗体-レポーター結合物によって生成されるシグナルを用いて、試料(正常および試験)中の関連する抗体結合の定量化可能な絶対的または相対的データを導き出すことができる。
【0140】
本発明はまた、競合アッセイ法において抗原レベルを測定するための、前述の特異的結合メンバーの使用、すなわち、競合アッセイ法において、本発明によって提供される特異的結合メンバーを使用することによって、試料中の抗原のレベルを測定する方法も提供する。これは、未結合抗体からの結合抗体の物理的分離が必要とされない場合であり得る。結合の際に物理的または光学的変化が生じるように特異的結合メンバーにレポーター分子を連結することは、1つの実行可能な手段である。レポーター分子は、検出可能な、かつ好ましくは測定可能なシグナルを直接的にまたは間接的に生じさせてよい。レポーター分子の結合は、直接的もしくは間接的、共有結合的、例えばペプチド結合を介して、または非共有結合的でよい。ペプチド結合を介した結合は、抗体およびレポーター分子をコードする融合遺伝子の組換え発現の結果としてでもよい。
【0141】
本発明はまた、例えばバイオセンサーシステムにおいて、本発明による特異的結合メンバーを使用することによって、抗原レベルを直接測定することを提供する。
【0142】
結合を測定する様式は本発明の特徴ではなく、かつ当業者は、彼らの好みおよび一般的知識に従って適切な様式を選択することができる。
【0143】
前述したように、様々な局面および態様において、本発明は、TGFβ(TGFβ1、TGFβ2、および/またはTGFβ3)への結合に際して、本明細書において定義される任意の特異的結合メンバー、例えば、PET1037GR、PET1074B9、もしくはPET1287A10のIgG4と競合する、ヒト、ヒト化、キメラ、または合成の特異的結合メンバーにまで及ぶ。結合メンバー間の競合または交差競合は、例えば、1つの結合メンバーに特異的なレポーター分子をタグ化し、他のタグ無し結合メンバーの存在下で検出することができるようにして、同じエピトープもしくは重複するエピトープに結合する特異的結合メンバーの同定を可能にすることによって、インビトロで容易に分析することができる。
【0144】
競合は、例えば、TGFβがプレートに固定化されており、かつ第1のタグ化された結合メンバー(参照結合メンバー)が、1つまたは複数の他のタグ無し結合メンバーと共にプレートに添加される、ELISAを用いて判定され得る。タグ化結合メンバーと競合するタグ無し結合メンバーの存在は、タグ化結合メンバーによって発されるシグナルの減少によって観察される。
【0145】
競合に関して試験する際、抗原のペプチド断片、特に、関心対象のエピトープを含むペプチドが使用され得る。エピトープ配列に加えて両端に1つもしくは複数のアミノ酸を有するペプチドが使用され得る。このようなペプチドは、指定された配列から「本質的になる」と言うことができる。本発明による特異的結合メンバーは、抗原に対するそれらの結合が、所与の配列を有するか、または所与の配列を含むペプチドによって阻害されるようなものであり得る。これに関して試験する際、いずれかの配列に加えて1つもしくは複数のアミノ酸を有するペプチドが使用され得る。
【0146】
特定のペプチドに結合する特異的結合メンバーは、ペプチドを用いたパニングによって、例えば、ファージディスプレイライブラリーから単離することができる。
【0147】
本発明はさらに、本発明の特異的結合メンバーをコードする単離された核酸も提供する。核酸には、DNAおよび/またはRNAが含まれ得る。好ましい局面において、本発明は、CDRもしくはCDRセット、または、抗体の抗原結合部位またはVHドメインもしくはVLドメイン、または上記に定義した本発明の抗体分子、例えばscFvもしくはIgG4をコードする核酸を提供する。
【0148】
本発明はまた、前述の少なくとも1種のポリヌクレオチドを含む、プラスミド、ベクター、転写カセット、または発現カセットの形態の構築物も提供する。
【0149】
本発明はまた、前述の1種または複数種の構築物を含む、組換え宿主細胞も提供する。コード核酸からの発現を含む、コードされた生成物を産生する方法と同様に、提供される任意のCDRもしくはCDRセット、またはVHドメインもしくはVLドメイン、または抗原結合部位、または抗体分子、例えばscFvもしくはIgG4をコードする核酸は、それ自体で本発明のある局面を形成する。発現は、その核酸を含む組換え宿主細胞を適切な条件下で培養することによって、簡便に実現され得る。発現によって生成された後、VHドメインもしくはVLドメイン、または特異的結合メンバーは、任意の適切な技術を用いて単離および/または精製され、次いで、必要に応じて使用され得る。
【0150】
本発明による特異的結合メンバー、VHドメインおよび/またはVLドメイン、ならびにコードしている核酸分子およびベクターは、例えば天然の環境から、実質的に純粋もしくは均質な形態で、または、核酸の場合には、必要とされる機能を有するポリペプチドをコードする配列以外の核酸も遺伝子源も含まずに、もしくは実質的に含まずに、単離および/または精製して提供され得る。本発明による核酸は、DNAまたはRNAを含んでよく、かつ全体的にまたは部分的に合成でよい。本明細書において説明されるヌクレオチド配列への言及は、指定された配列を有するDNA分子を包含し、かつ文脈において特に指示がない限り、TがUで置換されている指定された配列を有するRNA分子を包含する。
【0151】
様々な異なる宿主細胞においてポリペプチドをクローニングおよび発現するための系は周知である。適切な宿主細胞には、細菌、哺乳動物細胞、植物細胞、昆虫細胞、菌、酵母、ならびにトランスジェニック植物およびトランスジェニック動物が含まれる。異種ポリペプチドを発現させるために当技術分野において利用可能な哺乳動物細胞株には、チャイニーズハムスター卵巣(CHO)細胞、HeLa細胞、仔ハムスター腎臓細胞、NSOマウス黒色腫細胞、YB2/0ラット骨髄腫細胞、ヒト胚性腎臓細胞、ヒト胚性網膜細胞、および他多数が含まれる。一般的な、好ましい細菌宿主は大腸菌である。
【0152】
大腸菌のような原核細胞における抗体および抗体断片の発現は、当技術分野において十分に確立されている。再検討するためには、例えば、Pluckthun, A.Bio/Technology 9:545-551(1991)を参照されたい。培養状態の真核細胞における発現もまた、特異的結合メンバーの作製のための1つの選択肢として当業者は利用可能である。例えば、Chadd HEおよびChamow SM(2001)110 Current Opinion in Biotechnology 12:188-194, Andersen DCおよびKrummen L(2002)Current Opinion in Biotechnology 13:117, Larrick JWおよびThomas DW(2001)Current Opinion in Biotechnology 12:411-418に記載されている。
【0153】
必要に応じて、プロモーター配列、ターミネーター配列、ポリアデニル化配列、エンハンサー配列、マーカー遺伝子、および他の配列を含む、適切な調節配列を含む適切なベクターを選択または構築することができる。ベクターは、必要に応じて、プラスミド、ウイルス、例えば、ファージもしくはファージミド、または、アデノウイルス、AAV、レンチウイルスなどでよい。さらなる詳細については、例えば、Molecular Cloning: A Laboratory Manual, 3rd edition, SambrookおよびRussell, 2001, Cold Spring Harbor Laboratory Pressを参照されたい。例えば、核酸構築物の調製、変異誘発、配列決定、細胞中へのDNAの導入および遺伝子発現における核酸の操作ならびにタンパク質の解析のための多くの公知の技術およびプロトコールは、Current Protocols in Molecular Biology, Second Edition, Ausubel et al. eds., John Wiley & Sons, 1986、Short Protocols in Molecular Biology:A Compendium of Methods from Current-Protocols in Molecular Biology, Ausubel et al. eds., John Wiley & Sons, 4th edition 1999に詳細に説明されている。SambrookらおよびAusubelらの開示内容(両方)は、参照により本明細書に組み入れられる。
【0154】
したがって、本発明の別の局面は、本明細書において開示される核酸を含む宿主細胞を提供する。このような宿主細胞は、インビトロでよく、かつ培養状態にあってよい。このような宿主細胞は、インビボでもよい。宿主細胞がインビボで存在する場合、本発明の特異的結合メンバーを「イントラボディ」または細胞内抗体として細胞内発現させることが可能になることがある。イントラボディは、遺伝子療法用に使用され得る(Marasco WA(1997)Gene Therapy, 4(1):11)。
【0155】
なおさらなる局面は、このような核酸を宿主細胞に導入する段階を含む方法を提供する。この導入には、任意の利用可能な技術を使用してよい。真核細胞の場合、適切な技術には、リン酸カルシウムトランスフェクション、DEAE-デキストラン、エレクトロポレーション、リポソームを介したトランスフェクション、およびレトロウイルスまたは他のウイルス、例えば、ワクシニア、もしくは昆虫細胞の場合、バキュロウイルスを使用する形質導入が含まれ得る。宿主細胞、特に、真核細胞中に核酸を導入する段階では、ウイルスまたはプラスミドに基づく系を使用してよい。プラスミド系はエピソームによって維持され得るか、または、宿主細胞もしくは人工染色体中に組み入れられ得る(Csonka E et al.(2000)Journal of Cell Science, 113:3207-3216;Vanderbyl S et al.(2002)Molecular Therapy, 5(5):10)。組み入れは、単一または複数の位置における1つまたは複数のコピーのランダムな組込みまたは標的化された組込みのいずれかによってでよい。細菌細胞の場合、適切な技術には、塩化カルシウム形質転換、エレクトロポレーション、およびバクテリオファージを用いたトラスフェクションが含まれ得る。
【0156】
導入に続いて、例えば、遺伝子発現のための条件下で宿主細胞を培養することによって、核酸からの発現を引き起こすか、または可能にさせることができる。
【0157】
1つの態様において、本発明の核酸は、宿主細胞のゲノム(例えば染色体)中に組み込まれる。組込みは、標準的な技術に従って、ゲノムとの組換えを促進する配列を含めることによって促進され得る。
【0158】
本発明はまた、前述の特異的結合メンバーまたはポリペプチドを発現させるために、発現系において前述の構築物を使用する段階を含む方法も提供する。
【0159】
本発明の核酸分子は、遺伝子療法を介して、それを必要とする患者に投与することができる。この療法は、インビボまたはエクスビボのいずれかでよい。好ましい態様において、重鎖および軽鎖の両方をコードしている核酸分子が、患者に投与される。より好ましい態様において、これらの核酸分子は、B細胞の染色体中に安定に組み込まれるように投与される。これは、B細胞が、抗体を産生するように特化されているためである。好ましい態様において、B細胞前駆体は、エクスビボでトランスフェクトまたは感染させられ、かつそれを必要とする患者に再移植される。別の態様において、B細胞前駆体または他の細胞は、対象となる細胞型に感染することが公知であるウイルスを用いて、インビボで感染させられる。遺伝子療法用に使用される典型的なベクターには、リポソーム、プラスミド、およびウイルスベクターが含まれる。例示的なウイルスベクターは、レトロウイルス、アデノウイルス、およびアデノ随伴ウイルスである。インビボまたはエクスビボのいずれかで感染させた後、抗体発現のレベルは、処置された患者から試料を採取し、かつ当技術分野において公知であるか、または本明細書において考察する任意のイムノアッセイを用いることによって、モニターすることができる。遺伝子療法において抗TGFβ抗体を使用する方法は、当技術分野において公知である。例えば、その全体が参照により本明細書に組み入れられる、米国特許第5,824,655号(Border)を参照されたい。
【0160】
好ましい態様において、遺伝子療法の方法は、抗TGFβ抗体の重鎖またはその抗原結合部分をコードする単離された核酸分子を投与する段階、およびその核酸分子を発現させる段階を含む。別の態様において、遺伝子療法の方法は、抗TGFβ抗体の軽鎖またはその抗原結合部分をコードする単離された核酸分子を投与する段階、およびその核酸分子を発現させる段階を含む。より好ましい方法において、遺伝子療法の方法は、本発明の抗TGFβ抗体の、重鎖もしくはその抗原結合部分をコードする単離された核酸分子および軽鎖もしくはその抗原結合部分をコードする単離された核酸分子を投与する段階、ならびにそれらの核酸分子を発現させる段階を含む。
【0161】
活性な作用物質が、血管系中または血管系の近くで作用する抗体である場合、様々な種にわたる用量補正には、一般に、体重に対する調整しか必要ではない。本発明の抗体の有効量は、急性の設定のラットおよびマウスにおいて0.5mg/kg〜5mg/kgであった。したがって、長期に渡る投薬の場合、半減期(ヒトでは約21日であると予想される)に投与される0.3mg/kg〜10mg/kgは、適当であると考えられる。好ましい用量は、有効性は十分であるが、最適な投与を容易にするのに十分な程度少量である。例えば、50mg未満の用量は、皮下投与を容易にする。静脈内投与は、初期の臨床試験において好ましく、かつ用量が多く、投薬間隔が長い場合には、重度の疾患のための送達経路として使用され得る。皮下注射は、自己投与が可能になるため、一般に、静脈内送達より好都合である。しかしながら、皮下注射は、製品に対する任意の免疫応答を増大させる可能性を有する。限局性疾患に対する局所的投与により、必要とされる製品の量を最低限に抑え、かつ作用部位での濃度を最大にすることができる。有意な安全性(治療濃度域)という利点は、局所投与により、長期的な全身投与から生じる場合がある任意の潜在的な副作用を回避することによって、与えられ得る。
【0162】
本発明の別の局面および態様は、以下の実施例の例証を含む本発明の開示に照らして、当業者に明らかになると考えられる。本明細書の任意の箇所で参照されるすべての文献は、参照により本明細書に組み入れられる。
【実施例】
【0163】
実施例1
抗TGFβ ScFvの作製
ScFvのナイーブ抗体ライブラリー
ドナー20名の脾臓リンパ球から誘導され、かつファージミドベクター中にクローニングされた、大型の単鎖Fv(scFv)ヒト抗体ライブラリー(Hutchings et al., 2001)を選択のために使用した。
【0164】
ScFv誘導選択ライブラリー
1D11.16VH-ヒトVLライブラリーを構築し、かつ所望の結合特性を有するマウス-ヒトキメラ抗体を選択するのに使用した。次いで、これらのキメラ抗体に由来するヒト軽鎖を、ヒトVH-VLライブラリーおよびヒトVH(1D11CDR3)-VLアクセプターライブラリー中にクローニングした。これらのライブラリーを、所望の結合特性を有するヒト抗体についてスクリーニングした。
【0165】
ScFvファージライブラリーの選択
組換えヒトTGFβ1およびTGFβ2は、Genzyme Corp.(Framingham, MA)によって供給され、かつTGFβ3は、R&D Systemsから購入した。
【0166】
本質的にVaughan et al.(1996)において説明されるような組換えヒトTGFβに対する一連の反復選択サイクルの後に、TGFβを認識するScFvを、ScFv誘導選択ライブラリーから単離した。手短に言えば、ライブラリーと共にインキュベーションした後に、常磁性ビーズに予め結合させておいた固定化抗原、および結合されたファージを磁気分離によって回収し、一方、未結合のファージを洗い流した。次いで、Vaughanら(1996)によって説明されているように、結合されたファージを救出し、かつ選択プロセスを繰り返した。
【0167】
選択は、製造業者の推奨に従って、Dynabeads M-270アミン(Dynal)に結合されたTGFβ1、TGFβ2、またはTGFβ3を用いて実施した。あるいは、製造業者の取扱い説明書(EZ link NHS LC Biotin, Pierce)に従って、第1級アミンに特異的な試薬スクシンイミジル-6-ビオチンアニド(biotinannido)ヘキサノアートを用いて調製されたビオチン化TGFβ1またはTGFβ2を選択に使用した。
【0168】
選択した結果物は、細胞周辺調製物中に存在するscFvが、TGFβへの結合に際して、1D11.16または組換えヒトTGFβの可溶性受容体II-Fcキメラ(sRII,R&D Systems)と競合する能力を測定する競合アッセイ法に基づくハイスループットスクリーニングにおいて、細胞周辺調製物として試験した。
【0169】
ハイスループットスクリーニングにおいて1D11.16またはsRIIと競合した試料を、Vaughanら(1996)およびOsbournら(1996)によって説明されているようなDNA配列決定に供した。scFvまたはIgGとしてクローンを発現させ、精製し、かつそれぞれ実施例4および実施例5において説明されるMLECアッセイ法および/またはNHLFアッセイ法において、TGFβを中和する能力を評価した。scFvの精製調製物は、WO 01/66754の実施例3において説明されているようにして調製した。scFvの精製調製物のタンパク質濃度は、BCA法(Pierce)によって測定した。IgGの精製調製物は、実施例3において後述するようにして調製した。
【0170】
実施例2
抗TGFβ scFvの最適化
実施例1で説明したようにして、TGFβに結合し、かつ中和するScFvを作製した。TGFβ1および/またはTGFβ2および/またはTGFβ3に対するこれらの抗体の中和力価を、DNA変異誘発および/または組み合わせ技術によって増大させた。本質的に実施例1で説明されているようにして、ファージ抗体ライブラリーを選択およびスクリーニングすることによって、TGFβ1および/またはTGFβ2および/またはTGFβ3に対する力価が有意に改善された抗体を作製した。作製したscFvを、MLEC増殖アッセイ法において1D11.16と比較した。
【0171】
高力価のTGFβ中和scFvの集団のうちで、特定の生殖系列が多く現れていることが判明した。これらは、重鎖に関してはDP-10/1-69およびDP-88/1-e(両方ともVH1生殖系列ファミリーのメンバー)であり、かつ軽鎖に関してはDPK22/A27(Vκ3ファミリー)であった。これらの生殖系列は、TGFβを汎的に中和する(pan-neutralizing)高力価の抗体に特に適した構造的フレームワークを提供すると思われる。1D11.16VH遺伝子セグメントは、ヒト生殖系列DP-7に最も類似しており、かつ1D11.16VL遺伝子セグメントは、ヒト生殖系列L16に最も類似しているため、これは予想可能ではなかった。
【0172】
PET1073G12、PET1074B9、およびPET1287A10のscFvは、MLEC増殖アッセイ法において、3種すべてのTGFβアイソフォームに対して1D11.16の力価に迫るか、またはそれを超える力価を示した。
【0173】
PET1073G12、PET1074B9、およびPET1287A10のVHおよびVLの遺伝子セグメントの誘導されたアミノ酸配列を、VBASEデータベース(Tomlinson et al., 1997)中の公知のヒト生殖系列配列に対して整列させ、かつ配列類似性によって最も近いヒト生殖系列を同定した。PET1073G12およびPET1074B9のVH遺伝子セグメントに最も近いヒト生殖系列遺伝子は、DP-10/1-69(VH1生殖系列ファミリー)として同定され、かつPET1287A10のVH遺伝子セグメントに最も近いヒト生殖系列遺伝子は、DP-88/1-e(VH1生殖系列ファミリー)として同定された。PET1073G12、PET1074B9、およびPET1287A10のVL遺伝子セグメントに最も近いヒト生殖系列遺伝子は、DPK22/A27(Vκ3生殖系列ファミリー)として同定された。部位特異的変異誘発を用いて、生殖系列とは異なるフレームワーク残基を生殖系列残基に変更した。ただし、このような変更によって、MLEC増殖アッセイ法において、結果として生じる抗体の任意のTGFβアイソフォームに対する力価の低下が3倍を超えないことを条件とした。このような力価の低下が観察された場合は、非生殖系列フレームワークのアミノ酸が最終抗体中で維持されていた。
【0174】
生殖系列化されたPET1073G12および生殖系列化されたPET1074B9において、すべてのフレームワーク残基は、VH中の2つの残基およびVL中の1つの残基を除いて生殖系列である。生殖系列化されたPET1073G12のアミノ酸配列は、VHについてはSEQ ID NO:2、およびVLについてはSEQ ID NO:7に記載されている。生殖系列化されたPET1074B9のアミノ酸配列は、VHについてはSEQ ID NO:12、およびVLについてはSEQ ID NO:17に記載されている。
【0175】
生殖系列化されたPET1287A10において、VHおよびVLのフレームワークの残基はすべて生殖系列である。生殖系列化されたPET1287A10のアミノ酸配列は、VHについてはSEQ ID NO:22、およびVLについてはSEQ ID NO:27に記載されている。
【0176】
実施例3
IgG4の作製
生殖系列化されたPET1073G12、PET1074B9、およびPET1287A10のscFvを、全抗体の重鎖および軽鎖をそれぞれ発現するベクター中にそれらのVHドメインおよびVLドメインをサブクローニングすることによって、scFv型からIgG4型に変換した。VH遺伝子セグメントをscFv発現ベクターpCantab6から増幅させ、かつヒトγ4重鎖の定常ドメイン、および哺乳動物細胞において完全な重鎖を発現させるための調節エレメントを含むpEU8.1(+)ベクター中にクローニングした。同様に、VL遺伝子セグメントをscFv発現ベクターpCantab6から増幅させ、かつヒトκ軽鎖の定常ドメイン、および哺乳動物細胞において完全な軽鎖を発現させるための調節エレメントを含むpEU3.1(-)ベクター中にクローニングした。pEU3.1(-)ベクターおよびpEU8.1(+)ベクターは、Persicら(1987)によって説明されたベクターに基づき、かつ産生される抗体の収量を増加させるためのoriP配列を導入するように改変された(Shen. et al., 1995;Langle-Rouault et al., 1998)。クローニング後、3種すべての抗体のVHドメインおよびVLドメインを配列決定して、クローニング手順の進行中に変異が導入されなかったことを確認した。
【0177】
PET1073G12、PET1074B9、およびPET1287A10の重鎖および軽鎖を発現するためのベクターをEBNA-293細胞(Invitrogen)中にトランスフェクトした。遺伝子発現および細胞上清における分泌の後、プロテインAアフィニティクロマトグラフィー(Amersham)によって、PET1073G12、PET1074B9、およびPET1287A10のIgG4を精製した。精製した抗体調製物を滅菌ろ過し、かつリン酸緩衝化生理食塩水(PBS)中、4℃で保存した後、評価した。IgGの濃度は、Mach et al.(1992)において説明されているように、IgGのアミノ酸配列に基づく吸光係数を用いて、分光光度的に測定した。Biosep-SEC-S2000カラム(Phenomenex)を使用するSEC-HPLCによって精製IgGを解析して、タンパク質の凝集または分解について検査した。それぞれ実施例4および実施例5において説明される、細胞ベースのMLECアッセイ法およびNHLFアッセイ法において、再編成されたヒトIgG4全抗体を1D11.16抗体と比較した。
【0178】
実施例4
TGFβ依存性のMLEC増殖アッセイ法における抗TGFβ抗体の中和力価
ミンク肺上皮細胞(MLEC)増殖アッセイ法を用いて、ヒトTGFβの生物活性に対する、精製した抗体調製物の中和力価を評価した。
【0179】
MLEC増殖アッセイ法は、Danielpourら(1989a)によって説明されたアッセイ法に基づいている。このアッセイ法は、TGFβ1、TGFβ2、またはTGFβ3をミンク肺上皮細胞に添加した場合、血清誘導細胞増殖の阻害が引き起こされるという原理に基づいて機能する。細胞増殖の修復をもたらすTGFβ1、TGFβ2、またはTGFβ3の中和について抗体を試験した。増殖は、[3H]-チミジンの取込みによって測定した。抗体の力価は、単一濃度のTGFβ1、TGFβ2、またはTGFβ3を50%のレベルで中和した抗体の濃度(IC50)(単位nM)と定義した。
【0180】
MLEC増殖アッセイ法のプロトコール
MLECの平板培養
MLEC系統をAmerican Type Culture Collectionから得た(カタログ番号CCL-64)。10%FBS(Gibco)、1%ペニシリン/ストレプトマイシン(Gibco)、および1%MEM非必須アミノ酸溶液(Gibco)を含む最小必須培地(MEM、Gibco)中で細胞を増殖させた。T-175フラスコ中のコンフルエントな細胞をフラスコから分離し、遠心沈殿させ、洗浄し、かつ1%FBS、1%ペニシリン/ストレプトマイシン、および1%MEM非必須アミノ酸溶液を含むMEMで作られたMLECアッセイ用培地中に再懸濁した。次いで、細胞のアリコートをトリパンブルーで標識し、血球計算器で計数し、かつアッセイ用培地を用いて、1ml当たり1.75×105細胞の濃度に細胞ストック溶液を希釈した。この懸濁液100μlを平底の96ウェル組織培養プレートの各ウェルに添加し、かつ3〜5時間インキュベートした。
【0181】
TGFβの調製/抗体溶液
6ng/ml(最終アッセイ濃度の6倍)のTGFβ1、TGFβ2、またはTGFβ3の希釈標準溶液、および最高の最終アッセイ濃度の3倍の(1D11.16のような対照を含む)抗体の希釈標準溶液を、MLECアッセイ用培地中で調製した。アッセイ法におけるTGFβの最終濃度(1ng/mlまたは40pM)は、TGFβを含まない対照と比べて約80%の細胞増殖阻害を誘導する濃度(すなわちEC80値)に相当した。
【0182】
希釈プレートの準備
試験抗体および対照抗体の試料を、MLECアッセイ用培地中で3倍希釈ステップで滴定し、かつTGFβ1、TGFβ2、またはTGFβ3の存在下および不在下でインキュベートした。1D11.16および/または必要に応じて参照抗体を試験し、かつTGFβ1、TGFβ2、もしくはTGFβ3の滴定を実施するすべての実験において、関連するすべての対照が含まれた。完了したプレートは、組織培養用の加湿インキュベーター中に1時間±15分入れておいた。
【0183】
平板培養細胞へのTGFβ/抗体溶液の添加
適切なインキュベーション時間の後、希釈プレートの各ウェルから100μlを平板培養したMLECに移し、かつそれらのプレートをインキュベーターに戻して44±2時間インキュベートした。
【0184】
[3H]-チミジンの添加
10μCi/ml[3H]-チミジン25μl(PBS中で希釈)を各ウェルに添加した(0.25μCi/ウェル)。次いで、プレートをインキュベーターに戻して4時間±30分間インキュベートした。
【0185】
細胞の回収
トリプシン-EDTA(0.25%、Gibco)100μLを各ウェルに添加し、プレートをインキュベーター中で10分間インキュベートし、かつTomtecまたはPackardの96ウェル用細胞回収装置を用いて細胞を回収した。
【0186】
データの蓄積および解析
βプレートリーダー(TopCount、Packard)を用いて、回収した細胞からのデータを読み取った。データを解析して、IC50値および標準偏差値を得た。IC50値は、Prism 2.0(GraphPad)ソフトウェアを用いることによって得た。
【0187】
結果
精製した、PET1073G12、PET1074B9、およびFET1287A10の生殖系列化されたIgG4を、1D11.16と一緒にMLEC増殖アッセイ法において試験した。IgG4は、実施例3で説明したようにして作製した。IC50の算術平均±標準偏差(IC50は、40pMのTGFβ1、TGFβ2、またはTGFβ3を50%中和するのに必要とされる抗体の濃度である)を表1に示す。
【0188】
PET1073G12およびPET1287A10のIgG4に対する平均IC50のデータにより、これらの抗体が、TGFβ1、TGFβ2、およびTGFβ3に対して、1D11.16に類似した、またはそれに迫る力価を有することが示される。
【0189】
平均IC50のデータにより、(MLECアッセイ法において、完全な用量反応曲線は得られなかったが)、PET1074B9のIgG4が、TGFβ1に対して有意に強力であることが示唆される。比較の手段として、1D11.16は、濃度91pMでTGFβ1に対して12%の中和を示し、かつPET1074B9は、同様の濃度92pMで78%の中和を示した。さらに、PET1074B9を、正常ヒト肺線維芽細胞アッセイ(NHLF)フィブロネクチン産生アッセイ法(実施例5)においても、1D11.16と一緒に試験した。NHLFアッセイ法において得られた結果は、MLECアッセイ法で得られた結果を裏付ける。すなわち、PET1074B9は、TGFβ2およびTGFβ3に対して1D11.16の力価と同様の力価を有し、かつPET1074B9は、TGFβ1に対しては1D11.16より強力である。
【0190】
実施例5
TGFβ3依存性のNHLF細胞アッセイ法における抗TGFβ抗体の力価の中和
正常ヒト肺線維芽細胞(NHLF)フィブロネクチン産生アッセイ法を用いて、ヒトTGFβの生物活性に対する、精製した抗体調製物の中和力価を評価した。このアッセイ法では、抗体が細胞外基質(ECM)の糖タンパク質であるフィブロネクチンの産生を中和する能力を測定する。TGFβは、培養された線維芽細胞におけるフィブロネクチン産生の強力な刺激因子であり(IgnotzおよびMassaoue, 1986)、c-JunのN末端キナーゼ経路の活性化を介してそれらの効果を及ぼす(Hocevar et al., 1999)。
【0191】
NHLF細胞アッセイ法のプロトコール
NHLF細胞をClonetics(商標)から入手し、かつ5%CO2を含む37℃の加湿インキュベーター中で、完全な線維芽細胞増殖培地2(FGM-2)中で維持した。90〜100%コンフルエントになった段階で、FGM-2培地1.5ml中に線維芽細胞を播種し(1.5×105個/ウェル、24ウェル型)、かつ37℃で24時間、付着させた。無血清線維芽細胞基本培地(FBM)で細胞を洗浄し、かつヒトインスリン(100μg/ml)、ゲンタマイシン/フンギソン(50μg/ml)、およびアスコルビン酸(50μg/ml)を添加したFBM1.5ml中で一晩、血清飢餓状態にし、かつ37℃で24時間インキュベートした。実験はすべて、3〜6継代の間の細胞に対して実施した。
【0192】
TGFβ溶液および抗体溶液の調製
25ng/ml(1nM)のTGFβ1、TGFβ2、またはTGFβ3の希釈標準溶液、および(1D11.16のような対照を含む)抗体の希釈標準溶液を、アッセイ用培地中で調製した。アッセイ法におけるTGFβの最終濃度(250pg/mlまたは10pM)は、TGFβを含まない対照と比べて約80%のフィブロネクチン産生の刺激を誘導する濃度(すなわちEC80値)に相当した。
【0193】
希釈プレートの準備
試験抗体および対照抗体の試料を、アッセイ用培地中で10倍希釈ステップで順次希釈し、かつTGFβ1、TGFβ2、またはTGFβ3 32の存在下および不在下で30分間プレインキュベートした。NHLF細胞を2ml/ウェルのアッセイ用培地中で、37℃で48時間インキュベートした。48時間後、培地上清の0.5mlのアリコートを、ELISAによるフィブロネクチン解析のために採取した。
【0194】
ヒトフィブロネクチンELISA
ヒト抗フィブロネクチン捕捉モノクローナル抗体(クローン6FN)およびHRP結合型抗フィブロネクチンモノクローナル二次抗体を含むTechnoclone(商標)ヒトフィブロネクチン抗原ELISAキットを用いて、新鮮なNHLF上清試料または凍結した(-20℃)NHLF上清試料を解析した。この方法論は以下のとおりであった。
【0195】
Nunc-Immuno(商標)Maxisorp(商標)96ウェルプレートを、4℃で16時間、コーティング緩衝液(蒸留水中12mM Na2CO3、35mM NaHCO3、0.01%(w/v)チメロサール、pH9.6)中の抗フィブロネクチン捕捉抗体でコーティングした(1μg/ウェル)。捕捉抗体を除去し、かつ37℃で1時間、希釈緩衝液(PBS中1%(w/v)BSA)100μlで各ウェルをブロッキングした。洗浄緩衝液(PBS中0.5%(v/v)Tween20、250μg/ウェル)で3回洗浄した後、ヒト血漿フィブロネクチンの標準物質および試料をプレートに添加し、かつ37℃で1時間インキュベートした。次いで、プレートを3回洗浄し、かつ抗フィブロネクチンHRP二次抗体(希釈緩衝液中、100μg/ウェル)と共に37℃で30分間インキュベートした。洗浄緩衝液でプレートを3回洗浄し、かつ100μg/ウェルのテトラメチルベンジジン(TMB)基質をプレートに添加した。室温で20分間プレートをインキュベーションした後、100μg/ウェルの2M硫酸でこの反応を停止させた。次いで、Dynex MRXプレートリーダーを用いて450nmでの吸光度を測定した。
【0196】
データ解析
データは、TGFβアイソフォームに対する供試の対照の応答(100%)に対する百分率として示される。4パラメーターのロジスティック曲線の当てはめを用いて(Prism 2,GraphPad Software, San Diego, USA)、pIC50の幾何平均値および95%信頼限界を推定した。4パラメーターの当てはめが失敗した場合は、曲線の最高値および/または最低値を一定に保つことによって、3パラメーターまたは2パラメーターの当てはめを実施した。
【0197】
結果
精製した、PET1073G12、PET1074B9、およびPET1287A10の生殖系列化されたIgG4を、1D11.16と一緒にNHLFフィブロネクチン産生アッセイ法において試験した。IgG4は、実施例3で説明したようにして作製した。IC50の算術平均±標準偏差(IC50は、10pMのTGFβ1、TGFβ2、またはTGFβ3を50%中和するのに必要とされる抗体の濃度である)を表2に示す。
【0198】
実施例6
IL-11誘導アッセイ法における力価
本発明者らは、A549細胞(ヒト肺上皮癌細胞)IL-11誘導アッセイ法を用いて、ヒトTGFβの生物活性に対する、精製した抗体調製物の中和力価を評価した。
【0199】
本発明者らは、増殖/アッセイ用培地(DMEM 435mL、ウシ胎児血清(FBS)50mL、ペニシリン/ストレプトマイシン5mL、改変イーグル培地中非必須アミノ酸5mL、100×L-グルタミン5mL;すべてGibco/Invitrogen)中でA549細胞(ATCC、品番:CCL-185)を維持した。約90%コンフルエントになった段階で、本発明者らは、増殖/アッセイ用培地100μL中に細胞を播種し、かつ37℃、5%CO2で24時間、細胞を付着させた。
【0200】
TGFβ溶液および抗体溶液の調製
本発明者らは、TGFβ1(1.8ng/ml)、TGFβ2(4.2ng/ml)、またはTGFβ3(4.2ng/ml)、および(対照を含む)抗体の増殖/アッセイ用培地中の希釈標準溶液を調製した。
【0201】
希釈プレートの準備
本発明者らは、試験抗体および対照抗体の試料を、増殖/アッセイ用培地中で、5倍(TGFβ2もしくはTGFβ3)または10倍(TGFβ1)の希釈ステップで順次希釈し、かつTGFβ1、TGFβ2、またはTGFβ3の存在下および不在下、37℃で75分間プレインキュベートした。本発明者らは、37℃で18〜24時間、200μl/ウェルのアッセイ用培地中でA549細胞をインキュベートした。18〜24時間後、培地上清の100μlのアリコートを、ELISAによるIL-11解析のために採取した。
【0202】
実施例7
慢性腎疾患、および病原性の線維化を特徴とする他の臨床的適応症を治療するための、TGFβを汎的に中和するヒトモノクローナル抗体の生物学的有効性を判定するために、本発明者らは、一側尿管閉塞(UUO)ラットモデルにおける抗体の効果を研究した。
【0203】
体重250〜280グラム(約6週)の成体のスプラーグドーリーラット(Taconic Farms, Germantown, NY)を、空気、温度、および光を制御した環境において飼育した。UUOを実施するラットの腹側に小さな腹部正中切開を施して、左腎臓および尿管上部を露出させた。本発明者らは、絹縫合糸を用いて腎臓の下端のレベルで尿管を結紮し、かつ1つ目の約0.2cm下で2回目の結紮を施した。偽手術ラットには同じ外科的プロトコールを実施したが、尿管結紮は実施しなかった。
【0204】
以下のようにして、PBS、汎的に中和するマウスモノクローナル抗体(1D11)、アイソタイプを一致させた対照抗体(13C4)、または本発明のTGFβを汎的に中和するヒトモノクローナル抗体で、閉塞させたラットを処置した。本発明者らは、尿管結紮の日から開始して、3週間、抗体をラットに腹腔内投与した。13C4および1D11 5mg/kgを投与し(3回/週)、かつ汎的に中和するヒト抗体5mg/kgをラットに与えた(5日毎)。3週間の最後に、本発明者らはラットを屠殺し、腎臓にPBSを3分間灌流させ、かつmRNAの解析、コラーゲン含有量の測定、および組織学的検査のために、灌流させた腎臓を採取した。
【0205】
組織線維化の程度を評価するために、本発明者らは、Kivirikkoらに従って、加水分解抽出物中のヒドロキシプロリンを生化学的に解析することによって、組織のコラーゲン全含有量を測定した。このアッセイ法は、動物組織中のヒドロキシプロリンは本質的にすべて、コラーゲン中に存在するという知見に基づいている。
【0206】
本発明者らはまた、コラーゲン全含有量に関するSircolコラーゲンアッセイ法も実施した。Sircolコラーゲンアッセイ法では、シリウスレッド色素と組織コラーゲンの側鎖との特異的結合に基づいて、酸/ペプシン可溶性のコラーゲンの総量を測定する。
【0207】
汎的に中和するヒトモノクローナル抗体で処置されたUUOラットは、PBS処置群(3.5±0.3μg/mg乾燥組織、p<0.05)と比べた場合、ヒドロキシプロリン含有量の43.4%の減少を示した(1.98±0.26μg/mg乾燥組織)。シリウスレッド色素に基づいたアッセイ法によって測定されたように(偽処置群:18.5±2.6、PBS群:69.3±3.8、および汎的に中和するヒトモノクローナル抗体群:35.6±5.2μg/100mg組織、PBS群に対してp<0.05)、腎臓の線維化の減少は、罹患した腎臓における可溶化コラーゲンの総量の減少によってさらに裏付けられた。
【0208】
本発明者らはまた、汎的に中和する抗TGF-βヒトモノクローナル抗体が組織線維化を減少させる能力を、免疫組織化学的検査によって評価した。
【0209】
対照動物において、3週間の尿管閉塞は、著しい膨満、細胞の萎縮およびネクローシス/アポトーシス、組織炎症、ならびに明らかな線維化を伴う尿細管間質拡大を伴う、腎尿細管構造の広範囲に及ぶ破壊を引き起こした。糸球体の損傷の証拠はほとんどなかった。これに対して、1D11または汎的に中和するヒトモノクローナル抗体で処置されたラットは、尿細管の拡張および崩壊の減少、炎症性浸潤物(細胞性)の減少、ならびに尿細管間質の拡大および線維化の減少によって判断されるように、腎臓構造の維持を示した。
【0210】
本発明者らはまた、汎的に中和する抗TGF-βヒトモノクローナル抗体を用いた治療がTGF-βによって調節される遺伝子発現に対して与える効果も測定した。
【0211】
TGF-β1のmRNAは、PBSで処置された動物または対照抗体13C4で処置された動物のいずれかと比べて、汎的に中和するヒトモノクローナル抗体で処置されたUUO動物において有意に減少していた。III型コラーゲンのmRNAレベルの有意な減少もまた、PBSまたは13C4で処置された群と比べて、ヒトおよびマウスの抗TGF-β抗体で処置された閉塞された腎臓において認められ、コラーゲン合成の減少が示唆された。
【0212】
本発明者らはさらに、腎臓のTGF-β1タンパク質総量を測定することによって、汎的に中和する抗TGF-βヒトモノクローナル抗体が自己誘導によるTGF-β合成を減少させる有効性を確認した。
【0213】
偽手術動物と比べて、閉塞された腎臓は、組織TGF-β1の総量の著しい増加を示した。しかしながら、汎的に中和するヒトモノクローナル抗体を投薬された、閉塞処置ラットは、組織TGF-β1レベルの75%の低下を示し、これは、両方の対照群に対して記録されたレベルより有意に低かった。比較すると、マウスの1D11抗体の方が、対照群と比べて組織TGF-β1レベルを45%減少させた。
【0214】
前述の結果により、汎的に中和する抗TGF-βヒトモノクローナル抗体によるTGF-β中和が、TGF-β1の産生およびコラーゲンIIIのmRNA発現の防止と同時に、TGF-βの自己分泌調節ループを効果的に妨害したことが実証される。
【0215】
本発明者らはさらに、汎的に中和する抗TGF-βヒトモノクローナル抗体が、TGF-β阻害の間接的な指標としての平滑筋アクチン(α-SMA)の発現に与える効果を判定した。平滑筋アクチン発現は、組織線維化に関連しており、かつ線維性の結合組織を生じる、活性化された筋線維芽細胞の指標である。TGF-βは、間質線維芽細胞および常在上皮細胞の活性化および筋線維芽細胞への表現型転換の重要な誘導物質である。
【0216】
本発明者らは、標準的なウェスタンブロット解析によって、α-SMAタンパク質を検出した。
【0217】
偽手術動物と比べた場合、閉塞された腎臓を有するラットは、組織ホモジネートのウェスタンブロット法によって測定されるように、α-SMAタンパク質の劇的な上方調節を示した(データ不掲載)。汎的に中和する抗TGF-βヒトモノクローナル抗体を投薬された閉塞処置ラットは、測定可能なα-SMA発現の有意な減少(PBS対照群と比べて75%)を示した。
【0218】
これらの結果により、線維性腎臓におけるコラーゲン沈着を減少させるにあたって、汎的に中和する抗TGF-βヒトモノクローナル抗体が有効であることが実証され、この抗体が、重度の腎損傷および尿細管間質線維症の本モデルにおける腎臓コラーゲンの産生および沈着の強力な阻害物質であることが明瞭に示された。肺、肝臓、または腎臓などの臓器における組織線維化のプロセスは、共通のメカニズムまたは経路を有しているため、当業者は、この抗体が、慢性腎疾患、ならびに病原性の線維化を特徴とする他の臨床的適応症の治療において有用であることを理解すると考えられる。
【0219】
本発明のいくつかの好ましい特許請求の範囲の記載は、前述のとおりである。





【0220】
【表1】

PET1073G12、PET1074B9、またはPET1287A10の生殖系列化されたIgG4または1D11.16を用いた、TGFβ1、TGFβ2、およびTGFβ3のMLECに対する抗増殖作用の中和。各平均値に対するデータポイントの総数は、数字nによって示されており、かつ各抗体の独立した力価測定に相当する。#:試験した濃度範囲において抗体が強力すぎ、かつ完全な用量反応曲線は得られなかったため、IC50値を決定することができなかった。
【0221】
【表2】

NHLFアッセイ法における、PET1073G12、PET1074B9、またはPET1287A10の生殖系列化されたIgG4または1D11.16の力価。各平均値に対するデータポイントの総数は、数字nによって示されており、かつ各抗体の独立した力価測定に相当する。
【特許請求の範囲】
【請求項1】
抗体の抗原結合ドメインを含む、ヒトTGFβ1、TGFβ2、およびTGFβ3に結合し、かつ中和する単離された特異的結合メンバーであって、該抗原結合ドメインがCDRのセット、HCDR1、HCDR2、およびHCDR3を含み、かつ該抗原結合ドメインがヒトVH1ファミリー遺伝子を使用し、かつ該HCDR3がSEQ ID NO:5、SEQ ID NO:15、およびSEQ ID NO:25からなる群より選択されるアミノ酸配列を有する、単離された特異的結合メンバー。
【請求項2】
ヒトVH1ファミリー遺伝子がヒトVH1-2遺伝子である、請求項1記載の特異的結合メンバー。
【請求項3】
ヒトVH1-2遺伝子がDP-10遺伝子またはDP-88遺伝子である、請求項2記載の特異的結合メンバー。
【請求項4】
抗原結合ドメインがCDRのセット、LCDR1、LCDR2、およびLCDR3をさらに含み、かつ該抗原結合ドメインがヒトVκ3ファミリー遺伝子を使用し、かつ該LCDR3がSEQ ID NO:10、SEQ ID NO:20、およびSEQ ID NO:30からなる群より選択されるアミノ酸配列を有する、請求項1〜3のいずれか一項記載の特異的結合メンバー。
【請求項5】
HCDR3およびLCDR3が以下からなる群より選択される、請求項4記載の特異的結合メンバー:
(a)それぞれSEQ ID NO:5およびSEQ ID NO:10;
(b)それぞれSEQ ID NO:15およびSEQ ID NO:20;ならびに、
(c)それぞれSEQ ID NO:25およびSEQ ID NO:30。
【請求項6】
ヒトVκ3ファミリー遺伝子がヒトVκ DPK22遺伝子である、請求項4記載の特異的結合メンバー。
【請求項7】
VHドメインのHCDR1、HCDR2、およびHCDR3が、生殖系列重鎖フレームワーク内にある、請求項1記載の特異的結合メンバー。
【請求項8】
VHドメインのHCDR1、HCDR2、およびHCDR3が、生殖系列のアミノ酸配列から最大12個の変異を含むフレームワーク内にある、請求項1記載の特異的結合メンバー。
【請求項9】
VκドメインのLCDR1、LCDR2、およびLCDR3が、生殖系列重鎖フレームワーク内にある、請求項4記載の特異的結合メンバー。
【請求項10】
VκドメインのLCDR1、LCDR2、およびLCDR3が、生殖系列Vκアミノ酸配列から最大5個の変異を含むフレームワーク内にある、請求項4記載の特異的結合メンバー。
【請求項11】
抗体の抗原結合ドメインを含む、ヒトTGFβ1、TGFβ2、およびTGFβ3に結合し、かつ中和する単離された特異的結合メンバーであって、該抗原結合ドメインがヒトVH DP-10遺伝子またはヒトVH DP-88遺伝子を使用し、かつSEQ ID NO:31のアミノ酸配列を含むFR4アミノ酸配列を含む、単離された特異的結合メンバー。
【請求項12】
抗原結合ドメインがヒトVH DP-10遺伝子またはヒトVH DP-88遺伝子を使用し、かつCDRのセット、HCDR1、HCDR2、およびHCDR3を含み、該HCDR3がSEQ ID NO:5、SEQ ID NO:15、およびSEQ ID NO:25からなる群より選択されるアミノ酸配列を有し、かつSEQ ID NO:31のアミノ酸配列を含むFR4アミノ酸配列をさらに含む、請求項11記載の特異的結合メンバー。
【請求項13】
抗原結合ドメインが、ヒトVκ3ファミリー遺伝子およびヒトJκ5遺伝子をさらに使用する、請求項11記載の特異的結合メンバー。
【請求項14】
ヒトVκ3ファミリー遺伝子およびヒトJκ5遺伝子を使用する抗原結合ドメインが、CDRのセット、LCDR1、LCDR2、およびLCDR3を含み、かつ該LCDR3がSEQ ID NO:10、SEQ ID NO:20、およびSEQ ID NO:30からなる群より選択されるアミノ酸配列を有する、請求項13記載の特異的結合メンバー。
【請求項15】
抗体の抗原結合ドメインを含む、ヒトTGFβ1、TGFβ2、およびTGFβ3に結合し、かつ中和する単離された特異的結合メンバーであって、該抗原結合ドメインが以下を含む、単離された特異的結合メンバー:
(a)SEQ ID NO:3のアミノ酸配列のHCDR1、SEQ ID NO:4のアミノ酸配列のHCDR2、SEQ ID NO:5のアミノ酸配列のHCDR3;
(b)SEQ ID NO:13のアミノ酸配列のHCDR1、SEQ ID NO:14のアミノ酸配列のHCDR2、SEQ ID NO:15のアミノ酸配列のHCDR3;または、
(c)SEQ ID NO:23のアミノ酸配列のHCDR1、SEQ ID NO:24のアミノ酸配列のHCDR2、SEQ ID NO:25のアミノ酸配列のHCDR3。
【請求項16】
抗原結合ドメインが、抗体VLドメインをさらに含む、請求項15記載の単離された特異的結合メンバー。
【請求項17】
抗原結合ドメインが、以下からなる群より選択されるLCDRを含む、請求項15記載の単離された特異的結合メンバー:
(a)SEQ ID NO:8のアミノ酸配列のLCDR1、SEQ ID NO:9のアミノ酸配列のLCDR2、SEQ ID NO:10のアミノ酸配列のLCDR3;
(b)SEQ ID NO:18のアミノ酸配列のLCDR1、SEQ ID NO:19のアミノ酸配列のLCDR2、SEQ ID NO:20のアミノ酸配列のLCDR3;および、
(c)SEQ ID NO:28のアミノ酸配列のLCDR1、SEQ ID NO:29のアミノ酸配列のLCDR2、SEQ ID NO:30のアミノ酸配列のLCDR3。
【請求項18】
VHドメインのHCDR1、HCDR2、およびHCDR3が、生殖系列重鎖フレームワーク内にある、請求項15記載の単離された特異的結合メンバー。
【請求項19】
生殖系列重鎖フレームワークがヒトVH1ファミリーフレームワークである、請求項18記載の単離された特異的結合メンバー。
【請求項20】
VHドメインのHCDR1、HCDR2、およびHCDR3が、生殖系列ヒト重鎖フレームワークVH1 DP-10またはDP-88の内部にある、請求項15記載の単離された特異的結合メンバー。
【請求項21】
VLドメインのLCDR1、LCDR2、およびLCDR3が、生殖系列軽鎖フレームワーク内にある、請求項17記載の単離された特異的結合メンバー。
【請求項22】
生殖系列軽鎖フレームワークがヒトVκ3ファミリーフレームワークである、請求項21記載の単離された特異的結合メンバー。
【請求項23】
抗原結合ドメインが、ヒトJκ5遺伝子をさらに使用する、請求項21記載の単離された特異的結合メンバー。
【請求項24】
ヒトVκ3ファミリー遺伝子がVκ DPK22遺伝子である、請求項22記載の単離された特異的結合メンバー。
【請求項25】
最大5個の変異を有するPET1073G12 VHドメイン(SEQ ID NO:2)、またはその抗原結合部分を含む、単離された特異的結合メンバー。
【請求項26】
最大5個の変異を有するPET1074B9 VHドメイン(SEQ ID NO:12)、またはその抗原結合部分を含む、単離された特異的結合メンバー。
【請求項27】
最大5個の変異を有するPET1287A10 VHドメイン(SEQ ID NO:22)、またはその抗原結合部分を含む、単離された特異的結合メンバー。
【請求項28】
最大5個の変異を有するPET1073G12 VLドメイン(SEQ ID NO:7)、またはその抗原結合部分をさらに含む、請求項10記載の単離された特異的結合メンバー。
【請求項29】
最大5個の変異を有するPET1074B9 VLドメイン(SEQ ID NO:17)、またはその抗原結合部分をさらに含む、請求項25記載の単離された特異的結合メンバー。
【請求項30】
最大5個の変異を有するPET1287A10 VLドメイン(SEQ ID NO:27)、またはその抗原結合部分をさらに含む、請求項26記載の単離された特異的結合メンバー。
【請求項31】
PET1073G12 VHドメイン(SEQ ID NO:2)およびPET1073G12 VLドメイン(SEQ ID NO:7)を含む抗体。
【請求項32】
PET1074B9 VHドメイン(SEQ ID NO:12)およびPET1074B9 VLドメイン(SEQ ID NO:17)を含む抗体。
【請求項33】
PET1287A10 VHドメイン(SEQ ID NO:22)およびPET1287A10 VLドメイン(SEQ ID NO:27)を含む抗体。
【請求項34】
scFv抗体分子を含む、請求項1〜30のいずれか一項記載の単離された特異的結合メンバー。
【請求項35】
抗体定常領域を含む、請求項1〜30のいずれか一項記載の単離された特異的結合メンバー。
【請求項36】
定常領域がIgG4に由来する、請求項35記載の単離された特異的結合メンバー。
【請求項37】
請求項1〜30のいずれか一項記載の特異的結合メンバーを含む組成物。
【請求項38】
請求項1〜30のいずれか一項記載の特異的結合メンバーをコードするヌクレオチド配列を含む、単離された核酸。
【請求項39】
請求項38記載の核酸で形質転換された宿主細胞。
【請求項40】
特異的結合メンバーを作製するための条件下で請求項39記載の宿主細胞を培養する段階、ならびに該特異的結合メンバーを単離および/または精製する段階を含む、特異的結合メンバーを作製する方法。
【請求項41】
特異的結合メンバーまたは抗体のVHもしくはVL可変ドメインを、少なくとも1種の付加的な有効成分を含む組成物中に配合する段階をさらに含む、請求項40記載の方法。
【請求項42】
以下の段階を含む、ヒトTGFβ1、TGFβ2、およびTGFβ3に特異的に結合する特異的結合メンバーを作製する方法:
(a)VHドメインをコードしている出発核酸、またはVHドメインをそれぞれコードしている核酸の出発レパートリーを提供する段階であって、該1つまたは複数のVHドメインが、生殖系列ヒトフレームワークVH1 DP-10もしくはDP-88を含み、かつ置換される予定のHCDR1、HCDR2、および/もしくはHCDR3を含むか、またはHCDR1、HCDR2、および/もしくはHCDR3のコード領域を欠く、段階;
(b)前記出発核酸または出発レパートリーを、1つの潜在的なHCDRをコードする1つのドナー核酸または複数の潜在的なHCDRをコードする複数のドナー核酸と組み合わせる段階であって、該1つまたは複数のドナー核酸が、出発核酸または出発レパートリー中のHCDR1、HCDR2、および/またはHCDR3領域中に挿入され、VHドメインをコードする核酸の生成物レパートリーを提供する段階;
(c)前記生成物レパートリーの核酸を発現させて、生成物VHドメインを産生させる段階;
(d)任意で、前記生成物VHドメインを1つまたは複数のVLドメインと組み合わせる段階;
(e)生成物VHドメインおよび任意でVLドメインを含む、ヒトTGFβ1、TGFβ2、およびTGFβ3に対する特異的結合メンバーを選択する段階;ならびに、
(f)前記特異的結合メンバーまたはそれをコードする核酸を回収する段階。
【請求項43】
1つまたは複数のドナー核酸が、以下のアミノ酸配列をコードするか、またはそれらの変異によって作製される、請求項42記載の方法:
(a)SEQ ID NO:3、SEQ ID NO:13、もしくはSEQ ID NO:23のHCDR1;
(b)SEQ ID NO:4、SEQ ID NO:14、もしくはSEQ ID NO:24のHCDR2;および/または
(c)SEQ ID NO:5、SEQ ID NO:15、もしくはSEQ ID NO:25のHCDR3。
【請求項44】
回収された特異的結合メンバーを抗体の定常領域に融合する段階をさらに含む、請求項42または43記載の方法。
【請求項45】
特異的結合メンバーがscFv抗体分子である、請求項42記載の方法。
【請求項46】
特異的結合メンバーがFab抗体分子である、請求項42記載の方法。
【請求項47】
特異的結合メンバーが全抗体である、請求項42記載の方法。
【請求項48】
請求項37記載の組成物の薬学的有効量を投与することによって、線維症、癌、または免疫介在性疾患からなる群より選択される疾患または障害を治療する方法。
【請求項49】
線維症、癌、または免疫介在性疾患からなる群より選択される疾患または障害の治療のための医薬の製造における、請求項1〜30のいずれか一項記載の特異的結合メンバーの使用。
【請求項50】
TGFβ1、TGFβ2、およびTGFβ3を請求項1〜30のいずれか一項記載の特異的結合メンバーとインビボで接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3のシグナル伝達を阻害する方法。
【請求項51】
TGFβ1、TGFβ2、およびTGFβ3を請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3によって媒介されるフィブロネクチン産生を阻害するための方法。
【請求項52】
TGFβ1、TGFβ2、およびTGFβ3を請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3によって媒介されるVEGF産生を阻害するための方法。
【請求項53】
以下の段階からなる群より選択される、細胞増殖を調節するための方法:
(a)TGFβ1、TGFβ2、またはTGFβ3によって媒介される上皮細胞増殖阻害を軽減させる段階;
(b)TGFβ1、TGFβ2、またはTGFβ3によって媒介される内皮細胞増殖阻害を軽減させる段階;および、
(c)TGFβ1、TGFβ2、またはTGFβ3を発現する細胞を、請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3によって媒介される平滑筋細胞増殖を阻害する段階。
【請求項54】
TGFβ1、TGFβ2、またはTGFβ3を請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、シクロスポリンに誘導されるTGFβ1、TGFβ2、またはTGFβ3の活性を阻害するための方法。
【請求項55】
TGFβ1、TGFβ2、またはTGFβ3を発現する細胞を、請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、NK細胞活性を増大させるための方法。
【請求項56】
TGFβ1、TGFβ2、またはTGFβ3を発現する細胞を、請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3によって媒介される免疫抑制を阻害するための方法。
【請求項57】
TGFβ1、TGFβ2、またはTGFβ3を発現する細胞を、請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3を発現する腫瘍の増殖を阻害するための方法。
【請求項58】
ヒトVH1遺伝子ファミリーに由来する生殖系列重鎖フレームワーク配列を含む、TGFβ1、TGFβ2、およびTGFβ3に特異的に結合し、かつ中和する、単離された特異的結合メンバー。
【請求項59】
生殖系列重鎖フレームワーク配列がヒトDP-10 VH1遺伝子ファミリーに由来する、請求項58記載の単離された特異的結合メンバー。
【請求項60】
生殖系列重鎖フレームワーク配列がヒトDP-88 VH1遺伝子ファミリーに由来する、請求項59記載の単離された特異的結合メンバー。
【請求項61】
ヒトVκ3遺伝子ファミリーに由来する生殖系列軽鎖配列を含むTGFβ1、TGFβ2、およびTGFβ3に特異的に結合し、かつ中和する、単離された特異的結合メンバー。
【請求項62】
軽鎖のフレームワーク領域がDPK-22に由来する、請求項61記載の単離された特異的結合メンバー。
【請求項63】
定常領域がIgG1に由来する、請求項35記載の単離された特異的結合メンバー。
【請求項1】
抗体の抗原結合ドメインを含む、ヒトTGFβ1、TGFβ2、およびTGFβ3に結合し、かつ中和する単離された特異的結合メンバーであって、該抗原結合ドメインがCDRのセット、HCDR1、HCDR2、およびHCDR3を含み、かつ該抗原結合ドメインがヒトVH1ファミリー遺伝子を使用し、かつ該HCDR3がSEQ ID NO:5、SEQ ID NO:15、およびSEQ ID NO:25からなる群より選択されるアミノ酸配列を有する、単離された特異的結合メンバー。
【請求項2】
ヒトVH1ファミリー遺伝子がヒトVH1-2遺伝子である、請求項1記載の特異的結合メンバー。
【請求項3】
ヒトVH1-2遺伝子がDP-10遺伝子またはDP-88遺伝子である、請求項2記載の特異的結合メンバー。
【請求項4】
抗原結合ドメインがCDRのセット、LCDR1、LCDR2、およびLCDR3をさらに含み、かつ該抗原結合ドメインがヒトVκ3ファミリー遺伝子を使用し、かつ該LCDR3がSEQ ID NO:10、SEQ ID NO:20、およびSEQ ID NO:30からなる群より選択されるアミノ酸配列を有する、請求項1〜3のいずれか一項記載の特異的結合メンバー。
【請求項5】
HCDR3およびLCDR3が以下からなる群より選択される、請求項4記載の特異的結合メンバー:
(a)それぞれSEQ ID NO:5およびSEQ ID NO:10;
(b)それぞれSEQ ID NO:15およびSEQ ID NO:20;ならびに、
(c)それぞれSEQ ID NO:25およびSEQ ID NO:30。
【請求項6】
ヒトVκ3ファミリー遺伝子がヒトVκ DPK22遺伝子である、請求項4記載の特異的結合メンバー。
【請求項7】
VHドメインのHCDR1、HCDR2、およびHCDR3が、生殖系列重鎖フレームワーク内にある、請求項1記載の特異的結合メンバー。
【請求項8】
VHドメインのHCDR1、HCDR2、およびHCDR3が、生殖系列のアミノ酸配列から最大12個の変異を含むフレームワーク内にある、請求項1記載の特異的結合メンバー。
【請求項9】
VκドメインのLCDR1、LCDR2、およびLCDR3が、生殖系列重鎖フレームワーク内にある、請求項4記載の特異的結合メンバー。
【請求項10】
VκドメインのLCDR1、LCDR2、およびLCDR3が、生殖系列Vκアミノ酸配列から最大5個の変異を含むフレームワーク内にある、請求項4記載の特異的結合メンバー。
【請求項11】
抗体の抗原結合ドメインを含む、ヒトTGFβ1、TGFβ2、およびTGFβ3に結合し、かつ中和する単離された特異的結合メンバーであって、該抗原結合ドメインがヒトVH DP-10遺伝子またはヒトVH DP-88遺伝子を使用し、かつSEQ ID NO:31のアミノ酸配列を含むFR4アミノ酸配列を含む、単離された特異的結合メンバー。
【請求項12】
抗原結合ドメインがヒトVH DP-10遺伝子またはヒトVH DP-88遺伝子を使用し、かつCDRのセット、HCDR1、HCDR2、およびHCDR3を含み、該HCDR3がSEQ ID NO:5、SEQ ID NO:15、およびSEQ ID NO:25からなる群より選択されるアミノ酸配列を有し、かつSEQ ID NO:31のアミノ酸配列を含むFR4アミノ酸配列をさらに含む、請求項11記載の特異的結合メンバー。
【請求項13】
抗原結合ドメインが、ヒトVκ3ファミリー遺伝子およびヒトJκ5遺伝子をさらに使用する、請求項11記載の特異的結合メンバー。
【請求項14】
ヒトVκ3ファミリー遺伝子およびヒトJκ5遺伝子を使用する抗原結合ドメインが、CDRのセット、LCDR1、LCDR2、およびLCDR3を含み、かつ該LCDR3がSEQ ID NO:10、SEQ ID NO:20、およびSEQ ID NO:30からなる群より選択されるアミノ酸配列を有する、請求項13記載の特異的結合メンバー。
【請求項15】
抗体の抗原結合ドメインを含む、ヒトTGFβ1、TGFβ2、およびTGFβ3に結合し、かつ中和する単離された特異的結合メンバーであって、該抗原結合ドメインが以下を含む、単離された特異的結合メンバー:
(a)SEQ ID NO:3のアミノ酸配列のHCDR1、SEQ ID NO:4のアミノ酸配列のHCDR2、SEQ ID NO:5のアミノ酸配列のHCDR3;
(b)SEQ ID NO:13のアミノ酸配列のHCDR1、SEQ ID NO:14のアミノ酸配列のHCDR2、SEQ ID NO:15のアミノ酸配列のHCDR3;または、
(c)SEQ ID NO:23のアミノ酸配列のHCDR1、SEQ ID NO:24のアミノ酸配列のHCDR2、SEQ ID NO:25のアミノ酸配列のHCDR3。
【請求項16】
抗原結合ドメインが、抗体VLドメインをさらに含む、請求項15記載の単離された特異的結合メンバー。
【請求項17】
抗原結合ドメインが、以下からなる群より選択されるLCDRを含む、請求項15記載の単離された特異的結合メンバー:
(a)SEQ ID NO:8のアミノ酸配列のLCDR1、SEQ ID NO:9のアミノ酸配列のLCDR2、SEQ ID NO:10のアミノ酸配列のLCDR3;
(b)SEQ ID NO:18のアミノ酸配列のLCDR1、SEQ ID NO:19のアミノ酸配列のLCDR2、SEQ ID NO:20のアミノ酸配列のLCDR3;および、
(c)SEQ ID NO:28のアミノ酸配列のLCDR1、SEQ ID NO:29のアミノ酸配列のLCDR2、SEQ ID NO:30のアミノ酸配列のLCDR3。
【請求項18】
VHドメインのHCDR1、HCDR2、およびHCDR3が、生殖系列重鎖フレームワーク内にある、請求項15記載の単離された特異的結合メンバー。
【請求項19】
生殖系列重鎖フレームワークがヒトVH1ファミリーフレームワークである、請求項18記載の単離された特異的結合メンバー。
【請求項20】
VHドメインのHCDR1、HCDR2、およびHCDR3が、生殖系列ヒト重鎖フレームワークVH1 DP-10またはDP-88の内部にある、請求項15記載の単離された特異的結合メンバー。
【請求項21】
VLドメインのLCDR1、LCDR2、およびLCDR3が、生殖系列軽鎖フレームワーク内にある、請求項17記載の単離された特異的結合メンバー。
【請求項22】
生殖系列軽鎖フレームワークがヒトVκ3ファミリーフレームワークである、請求項21記載の単離された特異的結合メンバー。
【請求項23】
抗原結合ドメインが、ヒトJκ5遺伝子をさらに使用する、請求項21記載の単離された特異的結合メンバー。
【請求項24】
ヒトVκ3ファミリー遺伝子がVκ DPK22遺伝子である、請求項22記載の単離された特異的結合メンバー。
【請求項25】
最大5個の変異を有するPET1073G12 VHドメイン(SEQ ID NO:2)、またはその抗原結合部分を含む、単離された特異的結合メンバー。
【請求項26】
最大5個の変異を有するPET1074B9 VHドメイン(SEQ ID NO:12)、またはその抗原結合部分を含む、単離された特異的結合メンバー。
【請求項27】
最大5個の変異を有するPET1287A10 VHドメイン(SEQ ID NO:22)、またはその抗原結合部分を含む、単離された特異的結合メンバー。
【請求項28】
最大5個の変異を有するPET1073G12 VLドメイン(SEQ ID NO:7)、またはその抗原結合部分をさらに含む、請求項10記載の単離された特異的結合メンバー。
【請求項29】
最大5個の変異を有するPET1074B9 VLドメイン(SEQ ID NO:17)、またはその抗原結合部分をさらに含む、請求項25記載の単離された特異的結合メンバー。
【請求項30】
最大5個の変異を有するPET1287A10 VLドメイン(SEQ ID NO:27)、またはその抗原結合部分をさらに含む、請求項26記載の単離された特異的結合メンバー。
【請求項31】
PET1073G12 VHドメイン(SEQ ID NO:2)およびPET1073G12 VLドメイン(SEQ ID NO:7)を含む抗体。
【請求項32】
PET1074B9 VHドメイン(SEQ ID NO:12)およびPET1074B9 VLドメイン(SEQ ID NO:17)を含む抗体。
【請求項33】
PET1287A10 VHドメイン(SEQ ID NO:22)およびPET1287A10 VLドメイン(SEQ ID NO:27)を含む抗体。
【請求項34】
scFv抗体分子を含む、請求項1〜30のいずれか一項記載の単離された特異的結合メンバー。
【請求項35】
抗体定常領域を含む、請求項1〜30のいずれか一項記載の単離された特異的結合メンバー。
【請求項36】
定常領域がIgG4に由来する、請求項35記載の単離された特異的結合メンバー。
【請求項37】
請求項1〜30のいずれか一項記載の特異的結合メンバーを含む組成物。
【請求項38】
請求項1〜30のいずれか一項記載の特異的結合メンバーをコードするヌクレオチド配列を含む、単離された核酸。
【請求項39】
請求項38記載の核酸で形質転換された宿主細胞。
【請求項40】
特異的結合メンバーを作製するための条件下で請求項39記載の宿主細胞を培養する段階、ならびに該特異的結合メンバーを単離および/または精製する段階を含む、特異的結合メンバーを作製する方法。
【請求項41】
特異的結合メンバーまたは抗体のVHもしくはVL可変ドメインを、少なくとも1種の付加的な有効成分を含む組成物中に配合する段階をさらに含む、請求項40記載の方法。
【請求項42】
以下の段階を含む、ヒトTGFβ1、TGFβ2、およびTGFβ3に特異的に結合する特異的結合メンバーを作製する方法:
(a)VHドメインをコードしている出発核酸、またはVHドメインをそれぞれコードしている核酸の出発レパートリーを提供する段階であって、該1つまたは複数のVHドメインが、生殖系列ヒトフレームワークVH1 DP-10もしくはDP-88を含み、かつ置換される予定のHCDR1、HCDR2、および/もしくはHCDR3を含むか、またはHCDR1、HCDR2、および/もしくはHCDR3のコード領域を欠く、段階;
(b)前記出発核酸または出発レパートリーを、1つの潜在的なHCDRをコードする1つのドナー核酸または複数の潜在的なHCDRをコードする複数のドナー核酸と組み合わせる段階であって、該1つまたは複数のドナー核酸が、出発核酸または出発レパートリー中のHCDR1、HCDR2、および/またはHCDR3領域中に挿入され、VHドメインをコードする核酸の生成物レパートリーを提供する段階;
(c)前記生成物レパートリーの核酸を発現させて、生成物VHドメインを産生させる段階;
(d)任意で、前記生成物VHドメインを1つまたは複数のVLドメインと組み合わせる段階;
(e)生成物VHドメインおよび任意でVLドメインを含む、ヒトTGFβ1、TGFβ2、およびTGFβ3に対する特異的結合メンバーを選択する段階;ならびに、
(f)前記特異的結合メンバーまたはそれをコードする核酸を回収する段階。
【請求項43】
1つまたは複数のドナー核酸が、以下のアミノ酸配列をコードするか、またはそれらの変異によって作製される、請求項42記載の方法:
(a)SEQ ID NO:3、SEQ ID NO:13、もしくはSEQ ID NO:23のHCDR1;
(b)SEQ ID NO:4、SEQ ID NO:14、もしくはSEQ ID NO:24のHCDR2;および/または
(c)SEQ ID NO:5、SEQ ID NO:15、もしくはSEQ ID NO:25のHCDR3。
【請求項44】
回収された特異的結合メンバーを抗体の定常領域に融合する段階をさらに含む、請求項42または43記載の方法。
【請求項45】
特異的結合メンバーがscFv抗体分子である、請求項42記載の方法。
【請求項46】
特異的結合メンバーがFab抗体分子である、請求項42記載の方法。
【請求項47】
特異的結合メンバーが全抗体である、請求項42記載の方法。
【請求項48】
請求項37記載の組成物の薬学的有効量を投与することによって、線維症、癌、または免疫介在性疾患からなる群より選択される疾患または障害を治療する方法。
【請求項49】
線維症、癌、または免疫介在性疾患からなる群より選択される疾患または障害の治療のための医薬の製造における、請求項1〜30のいずれか一項記載の特異的結合メンバーの使用。
【請求項50】
TGFβ1、TGFβ2、およびTGFβ3を請求項1〜30のいずれか一項記載の特異的結合メンバーとインビボで接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3のシグナル伝達を阻害する方法。
【請求項51】
TGFβ1、TGFβ2、およびTGFβ3を請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3によって媒介されるフィブロネクチン産生を阻害するための方法。
【請求項52】
TGFβ1、TGFβ2、およびTGFβ3を請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3によって媒介されるVEGF産生を阻害するための方法。
【請求項53】
以下の段階からなる群より選択される、細胞増殖を調節するための方法:
(a)TGFβ1、TGFβ2、またはTGFβ3によって媒介される上皮細胞増殖阻害を軽減させる段階;
(b)TGFβ1、TGFβ2、またはTGFβ3によって媒介される内皮細胞増殖阻害を軽減させる段階;および、
(c)TGFβ1、TGFβ2、またはTGFβ3を発現する細胞を、請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3によって媒介される平滑筋細胞増殖を阻害する段階。
【請求項54】
TGFβ1、TGFβ2、またはTGFβ3を請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、シクロスポリンに誘導されるTGFβ1、TGFβ2、またはTGFβ3の活性を阻害するための方法。
【請求項55】
TGFβ1、TGFβ2、またはTGFβ3を発現する細胞を、請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、NK細胞活性を増大させるための方法。
【請求項56】
TGFβ1、TGFβ2、またはTGFβ3を発現する細胞を、請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3によって媒介される免疫抑制を阻害するための方法。
【請求項57】
TGFβ1、TGFβ2、またはTGFβ3を発現する細胞を、請求項1〜30のいずれか一項記載の特異的結合メンバーと接触させる段階を含む、TGFβ1、TGFβ2、またはTGFβ3を発現する腫瘍の増殖を阻害するための方法。
【請求項58】
ヒトVH1遺伝子ファミリーに由来する生殖系列重鎖フレームワーク配列を含む、TGFβ1、TGFβ2、およびTGFβ3に特異的に結合し、かつ中和する、単離された特異的結合メンバー。
【請求項59】
生殖系列重鎖フレームワーク配列がヒトDP-10 VH1遺伝子ファミリーに由来する、請求項58記載の単離された特異的結合メンバー。
【請求項60】
生殖系列重鎖フレームワーク配列がヒトDP-88 VH1遺伝子ファミリーに由来する、請求項59記載の単離された特異的結合メンバー。
【請求項61】
ヒトVκ3遺伝子ファミリーに由来する生殖系列軽鎖配列を含むTGFβ1、TGFβ2、およびTGFβ3に特異的に結合し、かつ中和する、単離された特異的結合メンバー。
【請求項62】
軽鎖のフレームワーク領域がDPK-22に由来する、請求項61記載の単離された特異的結合メンバー。
【請求項63】
定常領域がIgG1に由来する、請求項35記載の単離された特異的結合メンバー。
【図1】


【図1b】


【図1c】


【図2a】


【図2b】


【図2c】


【図3a】


【図3b】


【図3c】




【図1b】


【図1c】


【図2a】


【図2b】


【図2c】


【図3a】


【図3b】


【図3c】


【公開番号】特開2013−31444(P2013−31444A)
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2012−180580(P2012−180580)
【出願日】平成24年8月16日(2012.8.16)
【分割の表示】特願2007−554339(P2007−554339)の分割
【原出願日】平成18年2月8日(2006.2.8)
【出願人】(500034653)ジェンザイム・コーポレーション (37)
【出願人】(508119806)オプテイン,インコーポレーティッド (2)
【Fターム(参考)】
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願日】平成24年8月16日(2012.8.16)
【分割の表示】特願2007−554339(P2007−554339)の分割
【原出願日】平成18年2月8日(2006.2.8)
【出願人】(500034653)ジェンザイム・コーポレーション (37)
【出願人】(508119806)オプテイン,インコーポレーティッド (2)
【Fターム(参考)】
[ Back to top ]

