TMPRSS4―特異的なヒト抗体
本発明のTMPRSS4(Transmembrane protease,serine4)−特異的なヒト抗体に関するもので、詳細には、TMPRSS4に特異的に結合するヒトから誘導された相補性決定領域(complementarity determining region,CDR)とフレームワーク領域(framework region,FR)で構成されたヒト抗体に関するものである。本発明の多くの種類の癌細胞で発現するTMPRSS4に特異的なヒト抗体は、前記癌の診断、疾患の分類、映像化、治療及び予後判定などに用いることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明のTMPRSS4(Transmembrane protease,serine4)−特異的なヒト抗体に関するものである。
【背景技術】
【0002】
TMPRSS4は、肺癌、肝臓癌、大腸癌、膵臓癌と胃癌においてその遺伝子が顕著に上向き調節されて発現され、大多数の膵臓癌細胞株で高く過発現されることが確認され、悪性甲状腺腫瘍で過発現し、このような類型の腫瘍の診断及び予後の評価マーカーとして提案された(非特許文献1、2)。
【0003】
最近、TMPRSS4の癌での生物学的機能が明らかにされているが(非特許文献3)、それによると、TMPRSS4が浸潤、転移、移動及び癒着とヒト上皮性腫瘍細胞でのEMT(epithelial mesenchymal transition)に重要な媒介物であり、TMPRSS4の癌に対する新しい治療用標的可能性を説明している。TMPRSS4に対する研究はあまり多くないが、強力で独立的な予後マーカーとしての可能性と、それに対する阻害剤の開発が浸潤及び転移抑制ターゲットとして可能性が大きいので、抗癌ターゲットとしてのTMPRSS4に対する抗体を開発する必要性もまた増大している。
【0004】
それで、本発明者等は、大腸癌細胞株の表面で発現するTMPRSS4に特異的に結合する13種のヒト抗体を選別して、前記ヒト抗体が既存の非ヒト由来抗体と類似水準の結合能を有することを確認して本発明を完成した。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Kebebew E.等,Ann Surg,2005年,第242(3)巻,p.353−361
【非特許文献2】Kebebew E.等,Cancer,2006年,第106(12)巻,p.2592−2597
【非特許文献3】Jung H.等,Oncogene17,2007年,第27(18)巻,p.2635−2647
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の目的は、TMPRSS4に特異的なヒト抗体を提供することである。
【0007】
本発明の他の目的は、前記ヒト抗体の重鎖またはその断片をコードするポリヌクレオチド、及び前記ポリヌクレオチド及びヒト重鎖の不変領域を含む発現ベクターを提供することである。
【0008】
本発明の他の目的は、前記ヒト抗体の軽鎖またはその断片をコードするポリヌクレオチド、及び前記ポリヌクレオチド及びヒト軽鎖の不変領域を含む発現ベクターを提供することである。
【0009】
本発明の他の目的は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを宿主細胞に導入して製造された形質転換体を提供することである。
【0010】
本発明の他の目的は、前記ヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供することである。
【0011】
本発明の他の目的は、前記ヒト抗体の重鎖またはその断片をコードするポリヌクレオチドを含む発現ベクター、及び軽鎖またはその断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供することである。
【0012】
本発明の他の目的は、前記形質転換体を培養してTMPRSS4に特異的なヒト抗体を製造する方法を提供することである。
【0013】
また、本発明は、前記ヒト抗体を含む組成物を提供することである。
【0014】
また、本発明は、前記ヒト抗体を含む薬学的組成物を提供することである。
【0015】
本発明の他の目的は、薬学的に有効な量の前記ヒト抗体をTMPRSS4が過発現される癌にかかった個体に投与する工程を含む、TMPRSS4が過発現される癌を予防及び治療する方法を提供することである。
【0016】
また、本発明は、前記ヒト抗体、ヒト抗体の軽鎖または重鎖、またはその免疫学的に活性を有した断片及び放射性同位元素を含む組成物を提供することである。
【0017】
本発明の他の目的は、前記癌の検出用組成物を癌細胞と接触させる工程を含む試験管内のTMPRSS4が過発現される癌の免疫検出方法を提供することである。
【0018】
本発明の他の目的は、前記癌の検出用組成物の診断的有効量を個体に投与する工程を含む、生体内TMPRSS4が過発現される癌の映像化方法を提供することである。
【0019】
本発明の他の目的は、前記検出用組成物を用いたTMPRSS4が過発現される癌の生体内治療方法を提供することである。
【0020】
本発明の他の目的は、前記検出用組成物を用いた癌治療の予後評価方法を提供することである。
【課題を解決するための手段】
【0021】
前記目的を達成するため、本発明は、配列番号7〜18からなる群から選択されるいずれか一つのアミノ酸配列を有する重鎖相補性決定領域(以下、HCDR)1、配列番号19〜31からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR2、及び配列番号32〜44からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR3を含む重鎖可変領域(VH)を含む重鎖またはその断片、及び、配列番号58〜70からなる群から選択されるいずれか一つのアミノ酸配列を有する軽鎖相補性決定領域(以下、LCDR)1、配列番号71〜83からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR2、及び配列番号84〜96からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR3を含む軽鎖可変領域(VL)を含む軽鎖またはその断片を含むTMPRSS4に特異的なヒト抗体を提供する。
【0022】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチド、及び前記ポリヌクレオチドを含む発現ベクターを提供する。
【0023】
また、本発明は、前記ヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチド、及び前記ポリヌクレオチドを含む発現ベクターを提供する。
【0024】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを宿主細胞に導入して製造された形質転換体を提供する。
【0025】
また、本発明は、前記ヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供する。
【0026】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクター、及び軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供する。
【0027】
また、本発明は、前記形質転換体を培養してTMPRSS4に特異的なヒト抗体を製造する方法を提供する。
【0028】
また、本発明は、前記ヒト抗体を含む組成物を提供する。
【0029】
また、本発明は、前記ヒト抗体を含む薬学的組成物を提供する。
【0030】
また、本発明の薬学的に有効な量の前記ヒト抗体をTMPRSS4が過発現される癌にかかった個体に投与する工程を含む、TMPRSS4が過発現される癌を治療する方法を提供する。
【0031】
また、本発明は、前記ヒト抗体、ヒト抗体の軽鎖または重鎖、またはその免疫学的に活性を有した断片及び放射性同位元素を含む組成物を提供する。
【0032】
また、本発明は、前記癌の検出用組成物を癌細胞と接触させる工程を含む試験管内のTMPRSS4が過発現される癌の免疫検出方法を提供する。
【0033】
また、本発明は、前記検出用組成物の診断的有効量を個体に投与する工程、及び、前記個体に対する検出映像を得る工程を含む、生体内TMPRSS4が過発現される癌の映像化方法を提供する。
【0034】
また、本発明は、
1)前記放射性同位元素を含む組成物を個体の静脈内に投与する工程、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、
3)工程2)で確認された腫瘍細胞を手術的切除によって除去する工程を含む、TMPRSS4が過発現される癌の生体内治療方法を提供する。
【0035】
同時に、本発明は、
1)前記放射性同位元素を含む組成物を腫瘍細胞が除去された患者の静脈内に投与する工程、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、
3)工程2)で腫瘍細胞が検出されなければ、腫瘍細胞がすべて除去されたと判断することを特徴とする、癌治療患者の予後評価方法を提供する。
【発明の効果】
【0036】
本発明の大腸癌細胞で発現するTMPRSS4に特異的なヒト抗体は、前記TMPRSS4が過発現した癌の診断、疾患の分類、映像化、治療及び予後判定などに用いることができる。
【図面の簡単な説明】
【0037】
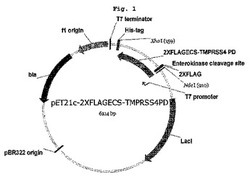
【図1】TMPRSS4−FLAG発現ベクターの開列地図である。
【図2】精製された2XFLAG−TMPRSS4をSDS−PAGEで確認した結果を示した図である。
【図3】FLAGが除去されて精製されたTM−EKをSDS−PAGEで確認した結果を示した図で、a:TM−EK製造模式図、及び、b:精製されたTM−EKをSDS−PAGEで確認した結果。
【図4】TMPRSS4のタンパク質分解活性を測定した結果を示した図である。
【図5】精製された抗−TMPS4−FLAG多クローン性抗体をSDS−PAGEで確認した結果を示した図である。
【図6】パニング1〜3次でのファージ抗体探索結果を示した図で、a:TMPS4−EK、及び、b:TMPS4−FLAG。
【図7】TMPRSS4に対する単一ファージクローン抗体の多様性をフィンガープリンティングを通じて確認した結果を示した図である。
【図8a】TMPRSS4に対する単一ファージクローン抗体の重鎖及び軽鎖CDRで用いられているポリペプチドを分析した結果を示した図で、a:重鎖、及び、b:軽鎖。
【図8b】TMPRSS4に対する単一ファージクローン抗体の重鎖及び軽鎖CDRで用いられているポリペプチドを分析した結果を示した図で、a:重鎖、及び、b:軽鎖。
【図9】TMPRSS4多クローン性抗体と単一クローン抗体の結合特異性を比較した結果を示した図で、a:多クローン性抗体、及び、b:単一クローン抗体。
【図10】TMPRSS4多クローン性抗体と単一クローン抗体が大腸癌細胞株に特異的に結合することを確認した結果を示した図で、a:多クローン性抗体、b:単一クローン抗体T2−6G、c:単一クローン抗体T2−12A、及び、d:単一クローン抗体T1−9F。
【図11】pNATAB Hベクター及びpNATAB Lベクターの開列地図を示した図で、a:pNATAB Hベクター、及び、b:pNATAB Lベクター。
【図12】全長形態のIgGを発現及び精製してウエスタンブロットで確認した結果を示した図で、a:単一クローン抗体T2−6C、及び、b:単一クローン抗体T2−6G、T2−3A及びT2−8F。
【図13】精製された単一クローン抗体T2−6C及びT2−6GをSDS−PAGEで確認した結果を示した図である。
【図14】TMPRSS4多クローン性抗体と精製された単一クローン抗体T2−6C及びT2−6Gが、大腸癌細胞株に特異的に結合することを確認した結果を示した図で、a:多クローン性抗体、b:単一クローン抗体T2−6C、及び、c:単一クローン抗体T2−6G。
【図15】TMPRSS4多クローン性抗体が、大腸癌細胞株colo205の浸潤を阻害することを確認した結果を示した図である。
【図16】単一クローン抗体T2−6Cが、大腸癌細胞株Colo205の浸潤を阻害することを確認した結果を示した図である。
【図17】単一クローン抗体T2−6Gが、大腸癌細胞株Colo205の浸潤を阻害することを確認した結果を示した図である。
【図18】TMPRSS4過発現細胞株Colo205及び低発現細胞株Sw480の移動に、TMPRSS4多クローン性抗体が及ぼす影響を確認した結果を示した図である。
【図19】単一クローン抗体T2−6Cが、TMPRSS4過発現細胞株Colo205の移動を阻害することを確認した結果を示した図である。
【図20】単一クローン抗体T2−6Gが、TMPRSS4過発現細胞株Colo205の移動を阻害することを確認した結果を示した図である。
【発明を実施するための形態】
【0038】
以下、本発明で用いた用語を説明する。
【0039】
「可変領域」と言うのは、抗原と特異的に結合する機能を遂行しながら配列上の多くの変異を見せる抗体分子の部分を意味し、可変領域には、CDR1、CDR2及びCDR3が存在する。前記CDRの間には、フレームワーク領域(FR)部分が存在してCDR環を支持する役割をする。
【0040】
「相補性決定領域」は、抗原の認識に関与する環状の部位で、この部位の配列が変わることによって抗体の抗原に対する特異性が決定される。
【0041】
「パニング(panning)」は、ファージの外壁(coat)にペプチドを発現するファージライブラリーから、標的分子(抗体、酵素、細胞表面レセプターなど)と結合する性質を有したペプチドを表面に発現しているファージのみを選択し出す過程をいう。
【0042】
以下、本発明を詳しく説明する。
【0043】
本発明の配列番号7〜18からなる群から選択されるいずれか一つのアミノ酸配列を有する重鎖相補性決定領域(以下、HCDR)1、配列番号19〜31からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR2及び配列番号32〜44からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR3を含む重鎖可変領域(VH)を含む重鎖またはその断片、及び、配列番号58〜70からなる群から選択されるいずれか一つのアミノ酸配列を有する軽鎖相補性決定領域(以下、LCDR)1、配列番号71〜83からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR2及び配列番号84〜96からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR3を含む軽鎖可変領域(VL)を含む軽鎖またはその断片を含むTMPRSS4に特異的なヒト抗体を提供する。
【0044】
好ましくは、前記重鎖可変領域は、配列番号45〜57からなる群から選択されるいずれか一つのアミノ酸配列を有し、前記軽鎖可変領域は配列番号97〜109からなる群から選択されるいずれか一つのアミノ酸配列を有する。
【0045】
前記抗体は、全長抗体形態であるのみならず抗体分子の機能的な断片を含む。全長抗体は、2個の全長の軽鎖及び2個の全長の重鎖を有する構造でそれぞれの軽鎖は、重鎖とジスルフィド結合で連結されている。抗体分子の機能的な断片と言うのは、抗原結合機能を保有している断片を意味し、抗体断片の例は、(i)軽鎖の可変領域(VL)及び重鎖の可変領域(VH)と軽鎖の不変領域(CL)及び重鎖の一番目不変領域(CH1)からなるFab断片;(ii)VH及びCH1ドメインからなるFd断片;(iii)単一抗体のVL及びVHドメインからなるFv断片;(iv)VHドメインからなるdAb断片(Ward ES等,Nature,1989年,第341巻,p.544−546)];(v)分離したCDR領域;(vi)2個の連結されたFab断片を含む2価断片のF(ab’)2断片;(vii)VHドメイン及びVLドメインが抗原結合部位を形成するように結合させるペプチドリンカーによって結合された単一鎖Fv分子(scFv);(viii)二特異的な単一鎖Fv二量体(PCT/US92/09965)及び(ix)遺伝子融合によって製作された多価または多特異的な断片のディアボディ(diabody)WO94/13804)などを含む。
【0046】
本発明では、TMPRSS4に対するヒト抗体をファージディスプレイ技術を用いて、scFv形態で得て、単一ファージクローン(mono phage clone)形態でスクリーニングすることで、TMPRSS4に特異的な13種の単一クローンファージ(monoclone phage)を得た。
【0047】
本発明の具体的な実施例で組換え技術で得たTMPRSS4(図1及び図2参照)の活性を確認した後(図3及び図4参照)、多クローン性抗体(図5参照)及び単一クローン抗体の製造に用いた。前記TMPRSS4を多様性を有したヒト由来scFvライブラリー細胞(human naive scFv library cell)から製造したライブラリーファージと反応してパニング(panning)させた後、TMPRSS4抗原に強く結合する単一クローンをスクリーニングした(表2、3及び図6参照)。前記選別された単一クローンをフィンガープリンティング(fingerprinting)で確認した後(図7参照)、それぞれの配列を分析して抗体のVHとVLのCDR部位を確認した(表6及び図8参照)。前記抗体と生殖系列抗体群の類似性をNCBIのIg BLASTプログラム(//www.ncbi.nlm.nih.gov/igblast/)を用いて確認した結果(表7参照)、13種のTMPRSS4に特異的なファージ抗体を得た。前記選別された単一クローン抗体は、多クローン性抗体に比べて信号の強さは小さかったが、非特異的結合なしにきれいに約30KDaの抗原タンパク質を検出することができ(図9参照)、TMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合することができた(図10参照)。
【0048】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチド、及び前記ポリヌクレオチドを含む発現ベクターを提供する。
【0049】
また、本発明は、前記ヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチド、及び前記ポリヌクレオチドを含む発現ベクターを提供する。
【0050】
本発明の具体的な実施例から組換え技術で得たTMPRSS4を用いて、TMPRSS4抗原に強く結合する単一クローンをスクリーニングした(表2、3及び図6参照)。前記選別された単一クローンをフィンガープリンティングで確認した後(図7参照)、それぞれの配列を分析して抗体のVHとVLのCDR部位を確認した(表6及び図8参照)。前記抗体と生殖系列抗体群の類似性を確認した結果(表7参照)、13種のTMPRSS4に特異的なファージ抗体を得た。前記選別された単一クローン抗体は、非特異的結合なしにきれいに約30KDaの抗原タンパク質を検出することができ(図9参照)、TMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合することができた(図10参照)。
【0051】
本発明のヒト抗体の軽鎖及び重鎖またはその断片をコードするポリヌクレオチドは、コドンの縮退性によってまたは前記ヒト抗体の軽鎖及び重鎖またはその断片を発現させようとする生物で選り好みされるコドンを考慮して、コーディング領域から発現されるヒト抗体の軽鎖及び重鎖またはその断片のアミノ酸配列を変化させない範囲内でコーディング領域に多様な変形が成り立ち得、コーディング領域を除いた部分でも遺伝子の発現に影響を及ぼさない範囲内で多様な変形または修飾が成り立ち得、そのような変形遺伝子も本発明の範囲に含まれることを当業者はよく理解することができるでしょう。すなわち、本発明のポリヌクレオチドは、これと同等な活性を有するタンパク質をコーディングする限り、一つ以上の核酸塩基が置換、欠失、挿入またはそれらの組合わせによって変異され得るし、それらも本発明の範囲に含まれる。このようなポリヌクレオチドの配列は、単鎖または二重鎖であり得、DNA分子またはRNA(mRNA)分子であり得る。
【0052】
前記発現ベクターの製作時には、前記ヒト抗体の軽鎖及び重鎖またはその断片を生産しようとする宿主細胞の種類によって、プロモーター、ターミネータ−、エンハンサーなどの発現調節配列、膜標的化または分泌のための配列などを適切に選択して目的によって多様に組み合わせることができる。
【0053】
本発明の発現ベクターは、プラスミドベクター、コズミドベクター、バクテリオファージベクター及びウイルスベクターなどを含むがこれに制限されない。相応しい発現ベクターは、プローモーター、オペレーター、開始コドン、終結コドン、ポリアデニル化シグナル及びエンハンサーのような発現調節エレメントの外にも、膜標的化または分泌のためのシグナル配列またはリーダー配列を含み、目的によって多様に製造することができる。発現ベクターのプローモーターは、構成的または誘導性であり得る。前記シグナル配列には、宿主がエシェリキア属菌の場合には、PhoAシグナル配列、OmpAシグナル配列などが、宿主がバシラス属菌の場合には、α−アミラーゼシグナル配列、スブチリシンシグナル配列などが、宿主が酵母の場合には、MFαシグナル配列、SUC2シグナル配列などが、宿主が動物細胞の場合には、インシュリンシグナル配列、α−インターフェロンシグナル配列、抗体分子シグナル配列などを用いることができるが、これに制限されない。また、発現ベクターは、ベクターを含む宿主細胞を選択するための選択マーカーを含むことができ、複製可能な発現ベクターの場合、複製原点を含む。
【0054】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを宿主細胞に導入して製造された形質転換体を提供する。
【0055】
また、本発明は、前記ヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供する。
【0056】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクター、及び軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供する。
【0057】
本発明の具体的な実施例では、単一クローンファージの軽鎖及び重鎖をコードする遺伝子を収得してそれぞれベクターに連結した後、前記発現ベクターを同時に宿主細胞に導入して発現された全長IgG形態のヒト抗体を確認した(図12参照)。前記全長IgG形態のヒト抗体を精製した後(図13参照)、TMPRSS4に対する結合力をFACSで確認した(図14参照)。
【0058】
本発明による前記発現ベクターを適切な宿主細胞、例えば、大腸菌または酵母細胞などに形質転換させた後、形質転換された宿主細胞を培養することで本発明によるヒト抗体の軽鎖及び重鎖またはその断片を大量生産することができる。宿主細胞の種類による適切な培養方法及び培地条件などは、当該分野の通常の技術者に知られた公知技術から当業者が容易に選択することができる。前記宿主細胞は、大腸菌またはバシラスサブチリスのような原核生物であることができる。また、サッカロマイセスセレビシエのような酵母、昆虫細胞、植物細胞、動物細胞から由来した真核細胞であることができる。さらに好ましくは、前記動物細胞は、自家または同種異系動物細胞であることができる。自家または同種異系動物細胞に導入して製造された形質転換体は、個体に投与されて癌を治療する細胞治療などに用いることもできる。前記宿主細胞への発現ベクター導入方法は、当業者に公知されたいずれの方法を用いても構わない。
【0059】
また、本発明は、前記形質転換体を培養してTMPRSS4に特異的なヒト抗体を製造する方法を提供する。
【0060】
具体的に、
1)前記形質転換体を培養する工程、及び
2)前記培養液から前記ヒト抗体を精製する工程を含むTMPRSS4に特異的なヒト抗体の製造方法を提供する。
【0061】
前記培養培地には、当業者に公知された培養培地の中で形質転換体に相応しい培地を選択して用いるのが好ましい。前記抗体精製方法は、当業者に公知されたいずれの精製方法も使用可能である。
【0062】
本発明の具体的な実施例では、単一クローンファージの軽鎖及び重鎖をコードする遺伝子を収得して、それぞれベクターに連結した後、前記発現ベクターを同時に宿主細胞に導入して発現された全長IgG形態のヒト抗体を確認した(図12参照)。前記全長IgG形態のヒト抗体をタンパク質A−親和度クロマトグラフィーカラムを用いて精製した後(図13参照)、TMPRSS4に対する結合力をFACSで確認した(図14参照)。
【0063】
また、本発明は、前記ヒト抗体を含む組成物を提供する。
【0064】
また、本発明は、前記ヒト抗体を含む薬学的組成物を提供する。
【0065】
前記薬学的組成物は、TMPRSS4が過発現される癌の予防及び治療に有用に用いることができる。前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれかひとつであることが好ましいが、これに限定されず、TMPRSS4が過発現される癌はすべて可能である。
【0066】
本発明の具体的な実施例で、TMPRSS4単一クローン抗体は、大腸癌細胞株でラビット及びヒト正常IgGに比べて50%以上明らかな浸潤の阻害を示し(図15、図16及び図17参照)、TMPRSS4によって惹起された大腸癌細胞株の移動を、TMPRSS4特異的な多クローン性抗体及び単一クローン抗体で阻害したことを確認した(図18〜19参照)。同時に、本発明単一クローン抗体が、TMPRSS4が過発現された大腸癌細胞株の増殖を抑制するように誘発されたことを確認した。それで、本発明単一クローン抗体は、TMPRSS4が過発現された癌予防及び治療用組成物として有用に用いることができる。
【0067】
本発明の薬学的組成物は、前記TMPRSS4に特異的なヒト抗体または前記形質転換体を選択的に含むことができ、前記成分に追加で同一または類似の機能を示す有効成分を 1種以上含むことができる。また、本発明薬学的組成物の投与のために、前記に記載した有効成分以外に追加で薬剤学的許容可能な担体を1種以上含んで製造することができる。例えば、薬剤学的に許容可能な担体としては、食塩水、滅菌水、リンゲル液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エチルアルコール、リポソーム及びこれら成分中の一つ以上の成分を混合して用いることができ、必要によって抗酸化剤、緩衝液及び静菌剤など異なる通常の添加剤を添加することができる。また、希釈剤、分散剤、界面活性剤、結合剤及び滑剤を付加的に添加して水溶液、懸濁液及び乳濁液などのような注射用剤形に製剤化することができ、標的細胞に特異的に作用するように標的細胞に特異的な抗体またはその他リガンドを前記の担体とともに結合させて用いることができる。同時に、当該技術分野の適正な方法またはレミングトンの文献(Remington’s Pharmaceutical Science,Mack Publishing Company,Easton PA)に掲載されている方法などを用いて各疾患または成分によって好ましく製剤化することができる。
【0068】
本発明の薬学的組成物は、非経口で投与することができ、非経口投与としては、皮下注射、静脈注射、筋肉内注射または胸部内注射注入方式が挙げられる。非経口投与用剤形に製剤化するためには、本発明の薬学的組成物は、安定剤または緩衝液とともに混合して溶液または懸濁液に製造してこれをアンプルまたはバイアルの単位投与型に製剤化する。
【0069】
本発明の薬学的組成物は、投与経路によって多様な形態で製造することができる。例えば、本発明薬学的組成物は、注射用途に相応しい滅菌水溶液または分散液の形態に製造することができ、または凍結乾燥技術を用いて凍結乾燥された形態に製造することができる。凍結乾燥された薬学的組成物は、典型的に約4℃で維持され、補助剤を含むか含まない安定化溶液、例えば、食塩水または/及びHEPESによって復元することができる。
【0070】
本発明の方法を実施するにおいて、投与される薬学的組成物の量に影響を及ぼす因子としては、これに限定されるのではないが、投与方式、投与頻度、治療が進行中の特定疾病、疾病の重症度、疾病の病歴、個体が異なる治療剤とともに併用治療法が進行中かどうか、及び治療が進行中の個体の年齢、身長、体重、健康、及び身体条件を含む。一般的に治療が進行中の患者の体重が増加するほど、本発明の薬学的組成物をより多く投薬することが好ましい。
【0071】
また、本発明の薬学的に有効な量の前記ヒト抗体を、TMPRSS4が過発現される癌にかかった個体に投与する工程を含む、TMPRSS4が過発現される癌を治療する方法を提供する。
【0072】
前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれかひとつであることが好ましいが、これに限定されないでTMPRSS4が過発現される癌はすべて可能である。
【0073】
本発明の具体的な実施例で、TMPRSS4単一クローン抗体は、大腸癌細胞株で浸潤、移動及び増殖を阻害することを確認した(図15〜19参照)。それで、本発明の単一クローン抗体は、TMPRSS4が過発現された癌予防及び治療に有用に用いることができる。
【0074】
本発明が適用可能な個体は脊椎動物で、好ましくは哺乳動物であり、さらに好ましいのはネズミ、ウサギ、モルモット、ハムスター、犬、猫のような実験動物で、最も好ましいのはチンパンジー、ゴリラのような類人猿類動物である。
【0075】
本発明のヒト抗体の投与方法は、使用目的によって非経口投与(例えば、静脈内、皮下、腹腔内または局所などに投与する方法)が可能で、静脈投与が好ましい。場合によって固形癌に対する投与では、抗体の接近を早く容易にするために局所的な投与が好ましいこともある。投与量は、患者の体重、年齢、性別、健康状態、食餌、投与時間、投与方法、排泄率及び疾患の重症度等によってその範囲が多様である。1回の投与量は、約5〜500mg/m2の量で、一日単位または週単位で投与することができる。前記有効量は、前記患者を治療する医師の裁量によって調節することができる。
【0076】
本発明のヒト抗体は、癌患者の治療のために単独または手術、ホルモン治療、薬物治療及び生物学的反応調節剤と並行して用いることができる。
【0077】
また、本発明の前記ヒト抗体、ヒト抗体の軽鎖または重鎖、またはその免疫学的に活性を有した断片及び放射性同位元素を含む組成物を提供する。
【0078】
本発明の具体的な実施例で、単一クローンTMPRSS4抗体は、TMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合したことを確認した(図10参照)。それで、本発明単一クローン抗体は、TMPRSS4が過発現される癌の検出用組成物として有用に用いることができる。
【0079】
前記組成物は、TMPRSS4が過発現される癌の放射線免疫治療用及び検出用として有用に用いることができる。前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれか一つであることが好ましいが、これに限定されないでTMPRSS4が過発現される癌はすべて可能である。
【0080】
好ましい治療用放射性同位元素の例としては、3H、11C、14C、18F、64Cu、76Br、86Y、99mTc、111In、123I、177Lu及びこれらの混合物及び組み合わせを含む。前記治療用放射性同位元素は、ヒト抗体と結合するかヒト抗体が結合された運搬体に含まれることを特徴とする。
【0081】
また、本発明は、前記放射性同位元素を含む組成物を癌細胞と接触する工程を含む試験管内のTMPRSS4が過発現される癌の免疫検出方法を提供する。
【0082】
前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれか一つであることが好ましいが、これに限定されないでTMPRSS4が過発現される癌はすべて可能である。
【0083】
本発明の具体的な実施例で、単一クローンTMPRSS4抗体は、TMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合したことを確認した(図10参照)。それで、本発明の単一クローン抗体は、TMPRSS4が過発現される癌の検出用組成物として有用に用いることができる。
【0084】
前記放射性同位元素を含む組成物は、洗浄や複合体の分離などその後の工程を容易にするために固形基質に結合することができる。固形基質は、例えば合成樹脂、ニトロセルロース、ガラス基板、金属基板、グラスファイバー、微細球体及び微細ビードなどがある。また、前記合成樹脂には、ポリエステル、ポリ塩化ビニル、ポリスチレン、ポリプロピレン、PVDF及びナイロンなどがある。
【0085】
また、癌細胞は、前記検出用組成物と接触前に適当な程度に希釈することができる。
【0086】
また、本発明は、1)前記放射性同位元素を含む組成物の診断的有効量を個体に投与する工程、及び、
2)前記個体に対する検出映像を収得する工程を含む生体内TMPRSS4が過発現される癌の映像化方法を提供する。
【0087】
前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれか一つであることが好ましいが、これに限定されないでTMPRSS4が過発現される癌はすべて可能である。
【0088】
本発明の具体的な実施例で、単一クローンTMPRSS4抗体は、TMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合したことを確認した(図10参照)。それで、本発明の単一クローン抗体は、TMPRSS4が過発現される癌の検出用組成物として有用に用いることができる。
【0089】
前記検出映像は、近赤外光イメージング、PET、MRIまたは超音波イメージングによって得られることを特徴とする。
【0090】
また、本発明は、
1)前記放射性同位元素を含む組成物を個体の静脈内に投与する工程、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、
3)工程2)で確認された腫瘍細胞を手術的切除によって除去する工程を含む、TMPRSS4が過発現される癌の生体内治療方法を提供する。
【0091】
前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれか一つであることが好ましいが、これに限定されないでTMPRSS4が過発現される癌はすべて可能である。
【0092】
本発明の具体的な実施例で、TMPRSS4単一クローン抗体は、大腸癌細胞株で浸潤、移動及び増殖を阻害することを確認した(図15〜19参照)。それで、本発明の単一クローン抗体は、TMPRSS4が過発現される癌予防及び治療に有用に用いることができる。
【0093】
同時に、本発明は、
1)前記放射性同位元素を含む組成物を大腸癌腫瘍細胞が除去された患者の静脈内に投与する工程、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、
3)工程2)で腫瘍細胞が検出されなければ、腫瘍細胞がすべて除去されたと判断することを特徴とする癌治療患者の予後評価方法を提供する。
(発明を実施するための形態)
以下、本発明の実施例によってさらに詳しく説明する。
【0094】
但し、下記の実施例は、本発明を例示するだけのものであって、本発明の内容が下記の実施例によって限定されるのではない。
【実施例1】
【0095】
TMPRSS4抗原タンパク質の製造
<1−1>TMPRSS4遺伝子クローニング
韓国生命工学研究院人間遺伝体機能研究産業団のKUGI(Korean UniGene Information)からヒトTMPRSS4遺伝子を含んでいるプラスミド(IRAU−61−E06;クローンID:hMU011286)の分譲を受けた。前記プラスミドを鋳型DNAにして、前記TMPRSS4のプロテアーゼドメイン(aa205〜434)のみを発現させるために、正方向プライマー(配列番号1:5’−GAGGAGCATATGGATTATAAAGATCATGATATTGATTATAAAGATGATGATGATAAAGTGGTGGGTGGGGAGGAG−3’)及び逆方向プライマー(配列番号2:5’−GAGGAGCTCGAGCAGCTCAGCCTTCCAGAC−3’)を用いて遺伝子を下記の条件で増幅した後、NdeIとXhoIで処理した後、ライゲースを用いてpET21c(Novagen,米国)にサーブクローニングした。PCR条件は、全体反応液が50μlの時、鋳型は100ngになるように加えて、94℃で2分、94℃で30秒、55℃で30秒、72℃で1分30秒で30サイクル、72℃で10分間反応させてPCR産物を得た。同時に、前記サーブクローニングされたベクターの塩基配列を確認した(図1)。
【0096】
<1−2>TMPRSS4タンパク質の発現及び精製
前記サーブクローニングされたベクターをBL21(DE3)で形質転換させた後、LB(+amp)培地に接種して一晩中培養した後、500ml LB(+amp)培地に1/100に希釈して接種した。37℃で2時間程度OD=0.5まで追加で培養した後、IPTGを1mMの濃度で処理した後、4時間の間培養した。大腸菌を5000rpmで10分間遠心分離して得た後、バグバスター(Bug buster)溶液10mlに懸濁した後、15分間砕いた後、12000rpmで30分間遠心分離して水溶性分画と不溶性分画を分離した。これをSDS−PAGEで分析した結果、TMPRSS4タンパク質は不溶性分画に存在した。不溶性分画を8Mウレア溶液(8M urea,0.1M NaH2PO4,0.01M TrisCl pH7.9)で溶解した後、Ni−NTAレジン(Qiagen,米国)1mlに結合させた後、10mlの洗浄緩衝溶液(8M urea,0.1M NaH2PO4,0.01M TrisCl pH5.9)で洗浄して、5mlの溶離緩衝溶液(8M urea,0.1M NaH2PO4,0.01M TrisCl pH4.5)で溶離した。溶離したTMPRSS4タンパク質(TMPS4−FLAG)は、PBS(+10% glycerol)溶液に透析して10%SDS−PAGEゲルで電気泳動した後、クマシー染色して約35kDaの大きさを確認した(図2)。
【0097】
前記精製されたTMPS4−FLAGタンパク質1mgを図3のaに示したように、40ngエンテロキナーゼ(Enterokinase;NEB,米国)で6時間の間室温で反応させた後、Ni−NTAレジンを用いてTMPRSS4のみを精製した(TM−EK)。前記精製されたタンパク質を10%SDS−PAGEゲルで電気泳動した後、クマシー染色して約31kDaの大きさを確認した(図3b)。
【実施例2】
【0098】
TMPRSS4タンパク質による酵素活性測定
TMPRSS4の細胞外ドメインのトリプシン類似タンパク質分解活性を測定するために、TMPS4−FLAGタンパク質(2.25μg)に蛍光ペプチドトリプシン基質であるBoc−Gln−Ala−Arg−AMC(t−butyloxycarbonylv(t−Boc)−Gln−Ala−Arg−7amido−4−メチルクマリン;B4153,Sigma,米国)とカリクレイン基質であるZ−Phe−Arg−AMC(Z−Phe−Arg7−アミド−4−メチルクマリンハイドロクロライド;C9521,Sigma,米国)をそれぞれ基質緩衝溶液(50mM tris,10mM CaCl2,1μM ZnCl2)に100μMの濃度で溶解して、TMPS4−FLAGタンパク質と混ぜた後、エンテロキナーゼ(0.09ng)を添加して時間別にVictor3プレートリーダー(PerkinElmer,米国)を用いて380/460nmでペプチド基質の加水分解による蛍光信号を測定した。
【0099】
その結果、図4に示したようにエンテロキナーゼによるTMPRSS4の活性型(TM−EK)のトリプシン類似活性による基質の加水分解が、対照群と対比して時間別に活性を示すことを確認することができた。したがって、標的抗原としてTMPRSS4が成功的に合成されたことを確認した。
【実施例3】
【0100】
ファージライブラリーの製造
多様性を有したヒト由来scFvライブラリー細胞2.7×1010を2×YT CM[Tryptone(CONDA,1612.00)17g、酵母エキス(CONDA,1702.00)10g、NaCl(sigma,S7653−5kg)5g、クロラムフェニコール(sigma,C0857)34μg/ml)]、2%グルコース(sigma,G5400)及び5mM MgCl2(sigma,M2393)を含む培地(3L)で、37℃で2〜3時間の間培養した後(OD600=0.5〜0.7)、ヘルパーファージを感染させて2×YTCMK[2×YT CM,カナマイシン(sigma,K1876)70μg/ml,1mM IPTG(ELPISBIO,IPTG025)]培地に30℃で16時間の間培養した。培養した細胞を遠心分離(4500rpm,15分,4℃)した後、上澄み液に4%PEG(Fluka,81253)6000と3%NaCl(sigma,S7653)を添加してよく溶解した後、氷で1時間の間反応させた。再び遠心分離(8000rpm,20分,4℃)した後、ペレットにPBSを添加して溶解した後、遠心分離(12000rpm,10分,4℃)してファージライブラリーを含む上澄み液を新しいチューブに入れて4℃で保管した。
【実施例4】
【0101】
多クローン性抗体の製造
TMPS4−FLAGを抗原としてエイビーフロンティア(韓国)に依頼し、2匹のウサギに3回反復注射して多クローン性抗体血清を得た。これを再び抗原特異的親和度を用いて精製を行なって、TMPS4−FLAGに特異的に結合する多クローン性抗体を2mg/mlの濃度で1mlを収得した。前記収得した多クローン性抗体を非還元性条件で、10%SDS−PAGEで確認した。
【0102】
その結果、図5に示したように精製された抗体を確認した。以後、これを陽性対照群に用いた。
【実施例5】
【0103】
単一クローン抗体の製造
<5−1>パニング(Panning)過程
実施例2で収得した精製されたTMPRSS4抗原(TMPS4−FLAGとTM−EK)各30μgをイムノソルブ(Immunosorb)チューブ(Nunc470319)に4mlのコーティング緩衝溶液[Na2CO3(sigma,S7795)1.59g、NaHCO3(sigma,S8875)2.93g、NaN3(sigma,S2002),0.2g]で4℃で16時間程度回転機でコーティングした後、室温で2時間の間PBSに溶解してスキムミルク[(BD,232100)−4%in 1XPBS]を用いて免疫チューブでブロッキングした。免疫チューブに実施例3で製造したファージライブラリー2mlを添加して室温で2時間の間反応させ、PBST(0.05%)で5回、PBSで2回洗浄した。洗浄後、特異的に結合したscFv−ファージのみ100mM TEA(Sigma T−0886)に溶離して、溶出したファージを大腸菌(XL1−Blue,stratagene,200249)に感染させて増幅した。一回目パニングで増幅されたファージを、PBST洗浄回数のみ増やして(2次:13回、3次:23回)同一な方法で2次及び3次パニングを行なった。
【0104】
その結果、表1に示したように3次で抗原に対するファージのコロニー力価が100倍以上増幅されることを確認した。
【0105】
【表1】

【0106】
<5−2>ファージELISAによるファージ抗体探索
<5−2−1>パニング結果確認
1次から3次までパニングして氷らせておいた細胞ストックを5mlの2×YTCM、2%グルコース,5mM MgCl2培地にOD600=0.1になるように入れた後、37℃で2〜3時間(OD600=0.5〜0.7)培養した。以後、M1ヘルパーファージを感染させて2×YTCMK、5mM MgCl2、1mM IPTG培地に30℃で16時間の間培養した。培養細胞を遠心分離した後(4500rpm、15分、4℃)上澄み液(1次〜3次パニング ポリscFv−ファージ)を新しいチューブに移した。96ウェル免疫プレート(NUNC 439454)に二種類の抗原をウェル当り100ngずつ4℃で16時間程度コーティング緩衝溶液で処理してコーティングした後、PBSに溶解したスキムミルク(4%)を用いて各ウェルをブロッキングした。各ウェルにPBS−ツイーン20(0.05%)0.2mlで洗浄後、1次〜3次パニング ポリscFV−ファージを各ウェルに100μlずつ入れて常温で2時間の間反応させた。また、各ウェルにPBS−ツイーン20(0.05%)0.2mlを用いて4回洗浄した後、二次抗体である抗−M13−HRP(Amersham27−9421−01)を1:2000に希釈して室温で1時間の間反応した。PBS−ツイーン20(0.05%)0.2mlで洗浄した後、OPDタブレット(Sigmap8787−TAB)をPC緩衝溶液[C6H8O7.H2O(sigma,C0706)5.1g、Na2HPO4(sigma,S7907)7.3g]に溶解した基質溶液を作って、ウェル当り100μlずつ入れて10分間発色させた後、490nmで吸光度を分光光度計(MolecularDevice,米国)で測定した。
【0107】
その結果、図6に示したように3次で抗原に対する特異的な結合能が増強されることを確認した。
【0108】
<5−2−2>単一クローン抗体の選別
前記結合能が大きい多クローンファージ抗体群(3次パニング)から得たコロニーを、2×YTCM、2%グルコース、5mM MgCl2培地1mlを含んだ96ディープウェルプレート(バイオニア90030)で、37℃で16時間の間培養した。培養した細胞のOD600値が0.1になるように100〜200μlを取って1mlの2×YTCM、2%グルコース、5mM MgCl2培地に希釈した後、96ディープウェルプレートで37℃でOD600値が0.5〜0.7になるように2〜3時間培養した。M1ヘルパーファージをMOI値が1:20になるように感染させた後、2×YTCMK、5mM MgCl2、1mM IPTG培地に30℃で16時間培養した。培養した細胞を遠心分離(4500rpm、15分、4℃)した後、上澄み液を取って4%PEG6000と3%NaClを添加してよく溶解した後、氷で1時間の間反応させた。再び遠心分離(8000rpm、20分、4℃)した後、ペレットにPBSを添加して溶解した後、遠心分離(12000rpm、10分、4℃)して上澄み液を取って新しいチューブに移して、3次パニングして得た単一クローンscFv−ファージを4℃で保管した。
【0109】
以後、96ウェル免疫プレートに二つの抗原をウェル当り100ngずつ入れて、4℃で16時間の間コーティングした後、PBSに溶解したスキムミルク(4%)を用いて各ウェルをブロッキングした。各ウェルにPBS−ツイーン20(0.05%)0.2mlを用いて洗浄した後、3次パニングして得た単一クローンscFv−ファージ(each100 scFv−phage)を各ウェルに100μlずつ入れて常温で2時間の間反応させた。再び、各ウェルにPBS−ツイーン20(0.05%)0.2mlを用いて4回洗浄した後、2次抗体である抗−M13−HRPを1/2000に希釈して室温で1時間の間反応した。PBS−ツイーン20(0.05%)0.2mlで洗浄した後、発色して吸光度490nmで測定した。
【0110】
その結果、各抗原に対する結合能が強い単一ファージクローンは、TMPS4−FLAGに対して15個(表2)とTMPS4−EKに対して35個(表3)など、総50個の単一ファージクローンを選別した。
【0111】
【表2】

【0112】
【表3】

【0113】
<5−3>単一クローンファージ分類及び検査
<5−3−1>フィンガープリンティングによる検証
1次選別された単一クローン50個の単一クローン細胞1μlとTaq.DNAポリメラーゼ(ゼンダックス5U/μl)0.2μl、50p/μlの正方向プライマー(pelB5、配列番号5:5’−CTAGATAACGAGGGCAAATCATG−3’)及び逆方向プライマー(cla3、配列番号6:5’−CGTCACCAATGAAACCATC−3’)0.2μl、10X緩衝溶液3μl、10mM dNTP mix0.6μl、蒸留水24.8μlを混合してコロニーPCR(iCycler iQ,BIO−RAD)を行なった。PCRプログラムの条件は、下記の表4のとおりである。
【0114】
【表4】

【0115】
前記コロニーPCR産物は、1%アガロースゲル(Seakem LE,CAMERES 50004)で確認し、BstNI(Roche11288075001,10U/μl)0.2μlを取って、37℃で2〜3時間反応させた。反応条件は、下記の表5のとおりである。前記切断した産物を8%DNAポリアクリルアミドゲルで確認した。
【0116】
【表5】

【0117】
その結果、図7に示したように BstNIによって切断された単一クローンファージ抗体の断片に対して多様性が確認された。
【0118】
<5−3−2>塩基配列分析による検証
前記50種の単一ファージクローンを2×YTCM、2%グルコース、5mM MgCl2培地(5ml)に37℃で16時間の間培養した。培養した単一クローンからDNA精製キット(Nuclogen5112)を用いてDNAを収得した後、配列番号5のpelB5プライマーを用いた配列分析を依頼した(ソルゼント、韓国)。
【0119】
その結果、表6及び図8に示したように選別された抗体のVHとVLのCDR領域を確認した。
【0120】
これら抗体と生殖細胞系列(germ line)抗体群の類似性をNCBIのIg BLASTプログラム(//www.ncbi.nlm.nih.gov/igblast/)を用いて調査した結果、13種のTMPRSS4に特異的なファージ抗体を得て、それを下記の表7に整理して提示した。
【0121】
【表6−1】

【0122】
【表6−2】

【0123】
【表7】

【実施例6】
【0124】
TMPRSS4に対するヒト抗体の特性分析
【0125】
<6−1>ファージウエスタンブロット分析
前記抗原TMPRSS4−FLAGが各ウェルに0.1〜200ngずつローディングされた10%SDS−PAGEゲル2枚を100Vで2時間程度電気泳動した後、NC膜(millipore Cat.No.HATF00010)に85Vで2時間の間伝達した。以後、膜を4%スキムミルクin TBSTで4℃で一日晩中ブロッキングした。以後、実施例4で製造した多クローンα−TMPRSS4抗体(1mg/ml)を4%スキムミルクin TBSTに1:2000に希釈し、実施例5で選別された単一クローンファージ抗体の上澄み液を4%スキムミルクin TBSTに1:50に希釈して常温で1時間30分間反応させた。TBSTで10分に一回ずつ5回洗浄した後、それぞれ抗−マウスIgG−HRP(Sigma)と抗−M13−HRP(Amersham bioscience)を用いて、4%スキムミルクin TBSTに1:3000に希釈して常温で30分間反応させた後、同じ方法で洗浄した。洗浄後、現象(Intron,Cat.No.12145)して多クローン性抗体と単一ファージ抗体を検出することができる抗原タンパク質の量を比較した。
【0126】
その結果、図9に示したようにTE−6Cファージ抗体の場合、多クローン性抗体に比べて信号の強さは小さかったが、非特異的結合なしにきれいに約30KDaの抗原タンパク質を検出することができた。
【0127】
<6−2>ファージFACS分析
100mmプレートでTMPRSS4を過多発現することが知られた大腸癌細胞株(colo205;ATCC)細胞株をPBSで2回洗浄した後、無酵素PBS基盤−解離緩衝溶液(Gibco)を添加して、37℃で10分間培養した。以後、細胞をスクレイパーで集めた後、1300rpmで3分間遠心分離してペレットを2%PBF(2%FBS含有1XPBS)溶液で二度洗浄した後、2%PBF溶液を入れて再懸濁して≧5×105細胞の濃度で準備した。本発明の単一クローンファージ抗体100μlをPEGで10倍濃縮した後、1/2に希釈して前記細胞に混合した。氷で1時間の間反応させた後、1300rpmで4℃で3分間遠心分離して上澄み液を除去した。200μlの2%PBF溶液で3回洗浄した後、2%PBF溶液に1:200に希釈させた抗−g8p抗体(Abcam)100μlを入れてよく混合して、氷で30分間反応させた。1300rpmで4℃で3分間遠心分離した後、上澄み液を除去して200μlの2%PBF溶液で3回洗浄した。2%PBF溶液に1:1000で希釈させたFITC−連結された抗−マウスIgG 100μlをそれぞれの試料に混合した後、氷で30分間反応させた。追加で洗浄した後、500μlの2%PBF溶液を添加してFACS用チューブ(Falcon)に試料を移してボルテキシングした後、染色された細胞を流細胞分析機(Beckman Coulter)で分析した。毎実験時に単一ファージ抗体を同一な条件で試料に処理して内部対照群(internal control)に用いた。データは、WINMDI2.9ソフトウエア(//facs.scripps.edu/software.html,The Scripps Research Institute)を用いて分析した。
【0128】
その結果、図10に示したようにTMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合する単一クローンファージ抗体T2−6G、T2−12A ALC T1−9Fなどを選別した。その外にも、T2−6C、T2−3A、T2−8Fなども選別したが、結果は本明細書に別途記載しなかっただけである。
【0129】
<6−3>全長IgG変換分析
TMPRSS4に対する単一クローンファージ抗体をファージからIgG全長ベクターに転換するために、重鎖は単一クローンDNA 1μlと10pmole/μl表8の重鎖正方向プライマーと重鎖逆方向プライマー、10X緩衝溶液5μl、10mM dNTP mix 1μl、pfu DNA重合酵素(ソルゼント、2.5U/μl)0.5μl、蒸留水を混合して、コロニーPCR(iCycler iQ、BIO−RAD)を行なった。また、軽鎖は表8の軽鎖正方向及び逆方向プライマーを用いて同一な方法でコロニーPCRを行なった。
【0130】
【表8】

【0131】
PCRの結果収得した重鎖遺伝子をDNA−ゲル抽出キット(Qiagen)で精製した後、pNATAB Hベクター(図11a)1μl(10ng)、重鎖(100〜200ng)15μl、10×緩衝溶液2μl、リガーゼ(1U/μl)1μl、蒸留水を混合して室温で1〜2時間放置して前記ベクターと連結した。前記ベクターを形質転換用細胞(XL1−blue)とともに氷に30分間放置後、42℃で90秒間熱衝撃を与えて形質導入した。再び、氷に5分間放置後、LB培地1mlを注入して1時間の間37℃で培養した。LB Amp(アンピシリン)固体培地に塗抹した後、37℃で16時間の間培養した。単一コロニーをLB Amp液体培地5mlに接種して、37℃で16時間の間培養した。前記培養液からDNA−prep.キット(Nuclogen)を用いてDNAを抽出した。
【0132】
また、軽鎖は、pNATAB Lベクター(図11b)を用いて前記のような方法でDNAを抽出した。
【0133】
前記収得したDNAのCMV−proFプライマー(配列番号3:AAA TGG GCG GTA GGC GTG)を用いた塩基配列分析を依頼した(ソルゼント)。
【0134】
その結果、全長IgGに転換したTMPRSS4に対する4個のクローンファージの重鎖と軽鎖の配列がファージ抗体の配列と一致することを確認した。
【0135】
<6−4>全長IgGの検証
293E細胞(Invitrogen)にPEI(Cat#23966,Polysciences,Inc)40μgと全長形態抗体重鎖DNA10μg、軽鎖DNA10μgを入れて共同形質感染をして得た上澄み液をウエスタンブロットで確認した。対照群には、正常ヒトIgG(Jackson Lab)を用いた。
【0136】
その結果、図12に示したように対照群と比べて4個のクローンファージが全長IgG形態に転換されたことを確認した。
【0137】
前記4個のクローンファージ中のT2−6CとT2−6G全長形態IgGをタンパク質A−親和度クロマトグラフィーカラム(Pharmacia,GE,米国)を用いて精製した後(図13)、実施例6−2の方法でTMPRSS4に対する結合力をFACSで確認した(図14)。
【実施例7】
【0138】
TMPRSS4ヒト抗体が大腸癌細胞株の浸潤及び移動に及ぼす影響研究
【0139】
<7−1>Colo205細胞浸潤分析
トリプシン(trypsin)(Gibco25300)でColo205細胞を採取した後、RPMI浸潤培養液(invasion media)(RPMI,10mM HEPES,0.5%BSA)で二度洗浄した後、浸潤培養液に細胞を2×106/mlの濃度に懸濁して準備した。精製されたTMPRSS4多クローン性抗体及び単一クローンT2−6C抗体を浸潤培養液にそれぞれ30及び75ng/50mlに希釈して細胞懸濁液50μlとTMPRSS4抗体溶液50μlを混合した後、37℃で二時間前培養した。24ウェルトランスウェルプレート(well transwell plate)(8μm pore size,costar3422)は、マトリゲル(BD354234)を1mg/mlで無血清培地(RPMI,10mM HEPES)に希釈してインサート(insert)の上側面に室温で一時間の間コーティングした。一時間経過後、インサートに残っているマトリゲルを除去して無血清培地で一度洗浄した。その後、5%FBSが添加されたRPMI浸潤培養液600μlをチャンバー(chamber)に入れた。消毒された鉗子(forceps)を用いてインサートを培養液が入っているチャンバーに入れた後、あらかじめ反応させておいた細胞と抗体の混合物をインサート中に100μl入れて、37℃/5%CO2で24時間の間培養した。マトリゲルを通過した浸潤された細胞を測定するために、インサートの上側面をPBSに湿らせた綿棒で拭いて3.7%パラホルムアルデヒド500μl(Sigma HT50)が入っているチャンバーにインサートを入れて、室温で30分間固定した。その後、1%クリスタルバイオレット(Sigma C3886)/100mM NaBorate(Sigma S9640)500μlに30分間染色して水で洗浄した後、乾燥させて顕微鏡で100倍の倍率で細胞をカウンティングした。
【0140】
その結果、図15、図16及び図17に示したように大腸癌細胞株であるColo205で精製された多クローン及びTMPRSS4単一クローン抗体(T2−6CとT2−6G)は、対照群に用いたラビット(図15)及びヒト正常IGg(図16及び図17)と比較して50%以上の明らかな浸潤阻害を示した。
【0141】
<7−2>Colo205細胞移動分析
TMPRSS4を過発現することが知られたColo205細胞株及びTMPRSS4を低発現することが知られたSw480(ATCC,CCL−228)細胞株をトリプシンで採取した後、RPMI移動培養液(RPMI,10mM HEPES,0.5%BSA)で二度洗浄した後、8×105/mlの濃度に懸濁して準備した。細胞懸濁液50μlと三種類の濃度(0、1及び2μM)に希釈しておいた多クローンTMPS4抗体溶液、及び単一クローンT2−6C及びT2−6G抗体50μl(TMPRSS4抗体を移動培養液に希釈して1000ng/50μlに製造)をそれぞれ混ぜて37℃で二時間の間前培養した。24ウェルトランスウェルプレートは挿入下側面に0.05%ゼラチン(Sigma G1393)を用いて室温で一時間の間コーティングした。一時間経過後、インサートに残っているゼラチンを除去してPBSで一度洗浄した。前記過程が終わった後、5%FBSが添加されたRPMI移動培養液600μlをチャンバーに入れた。消毒された鉗子を用いてインサートをチャンバーに入れた後、あらかじめ反応させておいた細胞と抗体の混合物をインサート中に100μlを入れて、37℃/5%CO2で24時間の間培養した。細胞の移動を測定するために先にインサートの上側面をPBSに湿らせた綿棒で拭いて、3.7%パラホルムアルデヒド500μlが入っているチャンバーにインサートを入れて室温で30分間固定した。その後、1%クリスタルバイオレット/100mM NaBorate 500μlに30分間染色して水で洗浄した後、乾燥させて顕微鏡で100倍の倍率で細胞をカウンティングした。
【0142】
その結果、図18に見られるように二つの大腸癌細胞株の移動に明らかな差を示し、標的抗原であるTMPRSS4によって惹起された移動をTMPRSS4特異的な多クローン性抗体で阻害したことを確認した。TMPRSS4に対する多クローン性抗体のみならず精製された単一クローンT2−6C(図19)及びT2−6G(図20)抗体も、TMPRSS4が過発現された大腸癌細胞株であるcolo205において、対照群に用いたヒト正常IgGに比べて二つともそれぞれ約50%以上の明らかな移動の阻害を示した。
【0143】
<7−3>Colo205増殖分析
トリプシンでColo205細胞を採取した後、2%FBSが添加されたRPMI培養液で二度洗浄した後、無血清培養液(RPMI,10mM HEPES)に細胞を2×105/mlで懸濁して準備した。精製されたTMPRSS4抗体を無血清培養液に250、500及び1000ng/40μlに希釈して細胞懸濁液50μlとTMPRSS4 T2−6C抗体溶液40μlを混ぜて37℃で二時間の間前培養した。反応を終えた細胞と抗体の混合物90μlに10μlのFBSを添加して、96ウェルプレートに100μlずつ入れて37℃/5%CO2で24、48及び72時間培養した。それぞれのタイムポイントに合わせてPreMix WST−1細胞増殖溶液(takara,MK400)を10μl添加して二時間の間37℃で反応させた後、VERSA maxマイクロプレートリーダー機で、440nmでサンプルの吸光度を測定した。
【0144】
その結果、精製されたTMPRSS4 T2−6C抗体が、Colo205細胞増殖に対し顕著な阻害を誘発したことを確認した(データは記載しなかった)。
【実施例8】
【0145】
結合能測定
TMPRSS4に対する抗体の抗原に対する結合力をELISAで測定し、GraphPad PRISM4.0プログラムで分析した結果、結合定数KD値が約1.03×10−9Mと確認された。
【配列表フリーテキスト】
【0146】
配列番号1:TMPRSS4フォワードプライマー
配列番号2:TMPRSS4リバースプライマー
配列番号3:CMV-proFプライマー
配列番号4:NATJK-R4
配列番号5:pelB5
配列番号6:cla3
配列番号7:T1-11G VH CDR 1
配列番号8:T1-12C VH CDR 1
配列番号9:T1-9F VH CDR 1
配列番号10:T2-8F VH CDR 1
配列番号11:T2-12C VH CDR 1
配列番号12:T2-3A VH CDR 1
配列番号13:T2-7B VH CDR 1
配列番号14:T2-10E VH CDR 1
配列番号15:T2-6C VH CDR 1
配列番号16:T1-5G VH CDR 1
配列番号17:T2-6A VH CDR 1
配列番号18:T2-12A VH CDR 1
配列番号19:T1-11G VH CDR 2
配列番号20:T1-12C VH CDR 2
配列番号21:T1-9F VH CDR 2
配列番号22:T2-8F VH CDR 2
配列番号23:T2-12C VH CDR 2
配列番号24:T2-3A VH CDR 2
配列番号25:T2-7B VH CDR 2
配列番号26:T2-6G VH CDR 2
配列番号27:T2-10E VH CDR 2
配列番号28:T2-6C VH CDR 2
配列番号29:T1-5G VH CDR 2
配列番号30:T2-6A VH CDR 2
配列番号31:T2-12A VH CDR 2
配列番号32:T1-11G VH CDR 3
配列番号33:T1-12C VH CDR 3
配列番号34:T1-9F VH CDR 3
配列番号35:T2-8F VH CDR 3
配列番号36:T2-12C VH CDR 3
配列番号37:T2-3A VH CDR 3
配列番号38:T2-7B VH CDR 3
配列番号39:T2-6G VH CDR 3
配列番号40:T2-10E VH CDR 3
配列番号41:T2-6C VH CDR 3
配列番号42:T1-5G VH CDR 3
配列番号43:T2-6A VH CDR 3
配列番号44:T2-12A VH CDR 3
配列番号45:T1-11G重鎖
配列番号46:T2- 6A重鎖
配列番号47:T1-12C重鎖
配列番号48:T1- 9F重鎖
配列番号49:T2-12F重鎖
配列番号50:T2- 8F重鎖
配列番号51:T2-12A重鎖
配列番号52:T2-12C重鎖
配列番号53:T2- 3A重鎖
配列番号54:T2- 7B重鎖
配列番号55:T2- 6G重鎖
配列番号56:T2-10E重鎖
配列番号57:T2- 6C重鎖
配列番号58:T1-11G VL CDR 1
配列番号59:T1-12C VL CDR 1
配列番号60:T1-9F VL CDR 1
配列番号61:T2-8F VL CDR 1
配列番号62:T2-12C VL CDR 1
配列番号63:T2-3A VL CDR 1
配列番号64:T2-7B VL CDR 1
配列番号65:T2-6G VL CDR 1
配列番号66:T2-10E VL CDR 1
配列番号67:T2-6C VL CDR 1
配列番号68:T1-5G VL CDR 1
配列番号69:T2-6A VL CDR 1
配列番号70:T2-12A VL CDR 1
配列番号71:T1-11G VL CDR 2
配列番号72:T1-12C VL CDR 2
配列番号73:T1-9F VL CDR 2
配列番号74:T2-8F VL CDR 2
配列番号75:T2-12C VL CDR 2
配列番号76:T2-3A VL CDR 2
配列番号77:T2-7B VL CDR 2
配列番号78:T2-6G VL CDR 2
配列番号79:T2-10E VL CDR 2
配列番号80:T2-6C VL CDR 2
配列番号81:T1-5G VL CDR 2
配列番号82:T2-6A VL CDR 2
配列番号83:T2-12A VL CDR 2
配列番号84:T1-11G VL CDR 3
配列番号85:T1-12C VL CDR 3
配列番号86:T1-9F VL CDR 3
配列番号87:T2-8F VL CDR 3
配列番号88:T2-12C VL CDR 3
配列番号89:T2-3A VL CDR 3
配列番号90:T2-7B VL CDR 3
配列番号91:T2-6G VL CDR 3
配列番号92:T2-10E VL CDR 3
配列番号93:T2-6C VL CDR 3
配列番号94:T1-5G VL CDR 3
配列番号95:T2-6A VL CDR 3
配列番号96:T2-12A VL CDR 3
配列番号97:T1-11G軽鎖
配列番号98:T2- 6A軽鎖
配列番号99:T1-12C軽鎖
配列番号100:T1- 9F軽鎖
配列番号101:T2-12F軽鎖
配列番号102:T2- 8F軽鎖
配列番号103:T2-12A軽鎖
配列番号104:T2-12C軽鎖
配列番号105:T2- 3A軽鎖
配列番号106:T2- 7B軽鎖
配列番号107:T2- 6G軽鎖
配列番号108:T2-10E軽鎖
配列番号109:T2- 6C軽鎖
配列番号110:NATVH1-2
配列番号111:NATVH1-2
配列番号112:NATVH3-2
配列番号113:NATVH3-2
配列番号114:NATJH-ALL
配列番号115:NATVL4
配列番号116:NATVK1-1
配列番号117:NATVL4
配列番号118:NATVK3
配列番号119:NATJL1-R
配列番号120:NATJK-R5
配列番号121:NATJL2-R
【技術分野】
【0001】
本発明のTMPRSS4(Transmembrane protease,serine4)−特異的なヒト抗体に関するものである。
【背景技術】
【0002】
TMPRSS4は、肺癌、肝臓癌、大腸癌、膵臓癌と胃癌においてその遺伝子が顕著に上向き調節されて発現され、大多数の膵臓癌細胞株で高く過発現されることが確認され、悪性甲状腺腫瘍で過発現し、このような類型の腫瘍の診断及び予後の評価マーカーとして提案された(非特許文献1、2)。
【0003】
最近、TMPRSS4の癌での生物学的機能が明らかにされているが(非特許文献3)、それによると、TMPRSS4が浸潤、転移、移動及び癒着とヒト上皮性腫瘍細胞でのEMT(epithelial mesenchymal transition)に重要な媒介物であり、TMPRSS4の癌に対する新しい治療用標的可能性を説明している。TMPRSS4に対する研究はあまり多くないが、強力で独立的な予後マーカーとしての可能性と、それに対する阻害剤の開発が浸潤及び転移抑制ターゲットとして可能性が大きいので、抗癌ターゲットとしてのTMPRSS4に対する抗体を開発する必要性もまた増大している。
【0004】
それで、本発明者等は、大腸癌細胞株の表面で発現するTMPRSS4に特異的に結合する13種のヒト抗体を選別して、前記ヒト抗体が既存の非ヒト由来抗体と類似水準の結合能を有することを確認して本発明を完成した。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Kebebew E.等,Ann Surg,2005年,第242(3)巻,p.353−361
【非特許文献2】Kebebew E.等,Cancer,2006年,第106(12)巻,p.2592−2597
【非特許文献3】Jung H.等,Oncogene17,2007年,第27(18)巻,p.2635−2647
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の目的は、TMPRSS4に特異的なヒト抗体を提供することである。
【0007】
本発明の他の目的は、前記ヒト抗体の重鎖またはその断片をコードするポリヌクレオチド、及び前記ポリヌクレオチド及びヒト重鎖の不変領域を含む発現ベクターを提供することである。
【0008】
本発明の他の目的は、前記ヒト抗体の軽鎖またはその断片をコードするポリヌクレオチド、及び前記ポリヌクレオチド及びヒト軽鎖の不変領域を含む発現ベクターを提供することである。
【0009】
本発明の他の目的は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを宿主細胞に導入して製造された形質転換体を提供することである。
【0010】
本発明の他の目的は、前記ヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供することである。
【0011】
本発明の他の目的は、前記ヒト抗体の重鎖またはその断片をコードするポリヌクレオチドを含む発現ベクター、及び軽鎖またはその断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供することである。
【0012】
本発明の他の目的は、前記形質転換体を培養してTMPRSS4に特異的なヒト抗体を製造する方法を提供することである。
【0013】
また、本発明は、前記ヒト抗体を含む組成物を提供することである。
【0014】
また、本発明は、前記ヒト抗体を含む薬学的組成物を提供することである。
【0015】
本発明の他の目的は、薬学的に有効な量の前記ヒト抗体をTMPRSS4が過発現される癌にかかった個体に投与する工程を含む、TMPRSS4が過発現される癌を予防及び治療する方法を提供することである。
【0016】
また、本発明は、前記ヒト抗体、ヒト抗体の軽鎖または重鎖、またはその免疫学的に活性を有した断片及び放射性同位元素を含む組成物を提供することである。
【0017】
本発明の他の目的は、前記癌の検出用組成物を癌細胞と接触させる工程を含む試験管内のTMPRSS4が過発現される癌の免疫検出方法を提供することである。
【0018】
本発明の他の目的は、前記癌の検出用組成物の診断的有効量を個体に投与する工程を含む、生体内TMPRSS4が過発現される癌の映像化方法を提供することである。
【0019】
本発明の他の目的は、前記検出用組成物を用いたTMPRSS4が過発現される癌の生体内治療方法を提供することである。
【0020】
本発明の他の目的は、前記検出用組成物を用いた癌治療の予後評価方法を提供することである。
【課題を解決するための手段】
【0021】
前記目的を達成するため、本発明は、配列番号7〜18からなる群から選択されるいずれか一つのアミノ酸配列を有する重鎖相補性決定領域(以下、HCDR)1、配列番号19〜31からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR2、及び配列番号32〜44からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR3を含む重鎖可変領域(VH)を含む重鎖またはその断片、及び、配列番号58〜70からなる群から選択されるいずれか一つのアミノ酸配列を有する軽鎖相補性決定領域(以下、LCDR)1、配列番号71〜83からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR2、及び配列番号84〜96からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR3を含む軽鎖可変領域(VL)を含む軽鎖またはその断片を含むTMPRSS4に特異的なヒト抗体を提供する。
【0022】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチド、及び前記ポリヌクレオチドを含む発現ベクターを提供する。
【0023】
また、本発明は、前記ヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチド、及び前記ポリヌクレオチドを含む発現ベクターを提供する。
【0024】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを宿主細胞に導入して製造された形質転換体を提供する。
【0025】
また、本発明は、前記ヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供する。
【0026】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクター、及び軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供する。
【0027】
また、本発明は、前記形質転換体を培養してTMPRSS4に特異的なヒト抗体を製造する方法を提供する。
【0028】
また、本発明は、前記ヒト抗体を含む組成物を提供する。
【0029】
また、本発明は、前記ヒト抗体を含む薬学的組成物を提供する。
【0030】
また、本発明の薬学的に有効な量の前記ヒト抗体をTMPRSS4が過発現される癌にかかった個体に投与する工程を含む、TMPRSS4が過発現される癌を治療する方法を提供する。
【0031】
また、本発明は、前記ヒト抗体、ヒト抗体の軽鎖または重鎖、またはその免疫学的に活性を有した断片及び放射性同位元素を含む組成物を提供する。
【0032】
また、本発明は、前記癌の検出用組成物を癌細胞と接触させる工程を含む試験管内のTMPRSS4が過発現される癌の免疫検出方法を提供する。
【0033】
また、本発明は、前記検出用組成物の診断的有効量を個体に投与する工程、及び、前記個体に対する検出映像を得る工程を含む、生体内TMPRSS4が過発現される癌の映像化方法を提供する。
【0034】
また、本発明は、
1)前記放射性同位元素を含む組成物を個体の静脈内に投与する工程、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、
3)工程2)で確認された腫瘍細胞を手術的切除によって除去する工程を含む、TMPRSS4が過発現される癌の生体内治療方法を提供する。
【0035】
同時に、本発明は、
1)前記放射性同位元素を含む組成物を腫瘍細胞が除去された患者の静脈内に投与する工程、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、
3)工程2)で腫瘍細胞が検出されなければ、腫瘍細胞がすべて除去されたと判断することを特徴とする、癌治療患者の予後評価方法を提供する。
【発明の効果】
【0036】
本発明の大腸癌細胞で発現するTMPRSS4に特異的なヒト抗体は、前記TMPRSS4が過発現した癌の診断、疾患の分類、映像化、治療及び予後判定などに用いることができる。
【図面の簡単な説明】
【0037】
【図1】TMPRSS4−FLAG発現ベクターの開列地図である。
【図2】精製された2XFLAG−TMPRSS4をSDS−PAGEで確認した結果を示した図である。
【図3】FLAGが除去されて精製されたTM−EKをSDS−PAGEで確認した結果を示した図で、a:TM−EK製造模式図、及び、b:精製されたTM−EKをSDS−PAGEで確認した結果。
【図4】TMPRSS4のタンパク質分解活性を測定した結果を示した図である。
【図5】精製された抗−TMPS4−FLAG多クローン性抗体をSDS−PAGEで確認した結果を示した図である。
【図6】パニング1〜3次でのファージ抗体探索結果を示した図で、a:TMPS4−EK、及び、b:TMPS4−FLAG。
【図7】TMPRSS4に対する単一ファージクローン抗体の多様性をフィンガープリンティングを通じて確認した結果を示した図である。
【図8a】TMPRSS4に対する単一ファージクローン抗体の重鎖及び軽鎖CDRで用いられているポリペプチドを分析した結果を示した図で、a:重鎖、及び、b:軽鎖。
【図8b】TMPRSS4に対する単一ファージクローン抗体の重鎖及び軽鎖CDRで用いられているポリペプチドを分析した結果を示した図で、a:重鎖、及び、b:軽鎖。
【図9】TMPRSS4多クローン性抗体と単一クローン抗体の結合特異性を比較した結果を示した図で、a:多クローン性抗体、及び、b:単一クローン抗体。
【図10】TMPRSS4多クローン性抗体と単一クローン抗体が大腸癌細胞株に特異的に結合することを確認した結果を示した図で、a:多クローン性抗体、b:単一クローン抗体T2−6G、c:単一クローン抗体T2−12A、及び、d:単一クローン抗体T1−9F。
【図11】pNATAB Hベクター及びpNATAB Lベクターの開列地図を示した図で、a:pNATAB Hベクター、及び、b:pNATAB Lベクター。
【図12】全長形態のIgGを発現及び精製してウエスタンブロットで確認した結果を示した図で、a:単一クローン抗体T2−6C、及び、b:単一クローン抗体T2−6G、T2−3A及びT2−8F。
【図13】精製された単一クローン抗体T2−6C及びT2−6GをSDS−PAGEで確認した結果を示した図である。
【図14】TMPRSS4多クローン性抗体と精製された単一クローン抗体T2−6C及びT2−6Gが、大腸癌細胞株に特異的に結合することを確認した結果を示した図で、a:多クローン性抗体、b:単一クローン抗体T2−6C、及び、c:単一クローン抗体T2−6G。
【図15】TMPRSS4多クローン性抗体が、大腸癌細胞株colo205の浸潤を阻害することを確認した結果を示した図である。
【図16】単一クローン抗体T2−6Cが、大腸癌細胞株Colo205の浸潤を阻害することを確認した結果を示した図である。
【図17】単一クローン抗体T2−6Gが、大腸癌細胞株Colo205の浸潤を阻害することを確認した結果を示した図である。
【図18】TMPRSS4過発現細胞株Colo205及び低発現細胞株Sw480の移動に、TMPRSS4多クローン性抗体が及ぼす影響を確認した結果を示した図である。
【図19】単一クローン抗体T2−6Cが、TMPRSS4過発現細胞株Colo205の移動を阻害することを確認した結果を示した図である。
【図20】単一クローン抗体T2−6Gが、TMPRSS4過発現細胞株Colo205の移動を阻害することを確認した結果を示した図である。
【発明を実施するための形態】
【0038】
以下、本発明で用いた用語を説明する。
【0039】
「可変領域」と言うのは、抗原と特異的に結合する機能を遂行しながら配列上の多くの変異を見せる抗体分子の部分を意味し、可変領域には、CDR1、CDR2及びCDR3が存在する。前記CDRの間には、フレームワーク領域(FR)部分が存在してCDR環を支持する役割をする。
【0040】
「相補性決定領域」は、抗原の認識に関与する環状の部位で、この部位の配列が変わることによって抗体の抗原に対する特異性が決定される。
【0041】
「パニング(panning)」は、ファージの外壁(coat)にペプチドを発現するファージライブラリーから、標的分子(抗体、酵素、細胞表面レセプターなど)と結合する性質を有したペプチドを表面に発現しているファージのみを選択し出す過程をいう。
【0042】
以下、本発明を詳しく説明する。
【0043】
本発明の配列番号7〜18からなる群から選択されるいずれか一つのアミノ酸配列を有する重鎖相補性決定領域(以下、HCDR)1、配列番号19〜31からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR2及び配列番号32〜44からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR3を含む重鎖可変領域(VH)を含む重鎖またはその断片、及び、配列番号58〜70からなる群から選択されるいずれか一つのアミノ酸配列を有する軽鎖相補性決定領域(以下、LCDR)1、配列番号71〜83からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR2及び配列番号84〜96からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR3を含む軽鎖可変領域(VL)を含む軽鎖またはその断片を含むTMPRSS4に特異的なヒト抗体を提供する。
【0044】
好ましくは、前記重鎖可変領域は、配列番号45〜57からなる群から選択されるいずれか一つのアミノ酸配列を有し、前記軽鎖可変領域は配列番号97〜109からなる群から選択されるいずれか一つのアミノ酸配列を有する。
【0045】
前記抗体は、全長抗体形態であるのみならず抗体分子の機能的な断片を含む。全長抗体は、2個の全長の軽鎖及び2個の全長の重鎖を有する構造でそれぞれの軽鎖は、重鎖とジスルフィド結合で連結されている。抗体分子の機能的な断片と言うのは、抗原結合機能を保有している断片を意味し、抗体断片の例は、(i)軽鎖の可変領域(VL)及び重鎖の可変領域(VH)と軽鎖の不変領域(CL)及び重鎖の一番目不変領域(CH1)からなるFab断片;(ii)VH及びCH1ドメインからなるFd断片;(iii)単一抗体のVL及びVHドメインからなるFv断片;(iv)VHドメインからなるdAb断片(Ward ES等,Nature,1989年,第341巻,p.544−546)];(v)分離したCDR領域;(vi)2個の連結されたFab断片を含む2価断片のF(ab’)2断片;(vii)VHドメイン及びVLドメインが抗原結合部位を形成するように結合させるペプチドリンカーによって結合された単一鎖Fv分子(scFv);(viii)二特異的な単一鎖Fv二量体(PCT/US92/09965)及び(ix)遺伝子融合によって製作された多価または多特異的な断片のディアボディ(diabody)WO94/13804)などを含む。
【0046】
本発明では、TMPRSS4に対するヒト抗体をファージディスプレイ技術を用いて、scFv形態で得て、単一ファージクローン(mono phage clone)形態でスクリーニングすることで、TMPRSS4に特異的な13種の単一クローンファージ(monoclone phage)を得た。
【0047】
本発明の具体的な実施例で組換え技術で得たTMPRSS4(図1及び図2参照)の活性を確認した後(図3及び図4参照)、多クローン性抗体(図5参照)及び単一クローン抗体の製造に用いた。前記TMPRSS4を多様性を有したヒト由来scFvライブラリー細胞(human naive scFv library cell)から製造したライブラリーファージと反応してパニング(panning)させた後、TMPRSS4抗原に強く結合する単一クローンをスクリーニングした(表2、3及び図6参照)。前記選別された単一クローンをフィンガープリンティング(fingerprinting)で確認した後(図7参照)、それぞれの配列を分析して抗体のVHとVLのCDR部位を確認した(表6及び図8参照)。前記抗体と生殖系列抗体群の類似性をNCBIのIg BLASTプログラム(//www.ncbi.nlm.nih.gov/igblast/)を用いて確認した結果(表7参照)、13種のTMPRSS4に特異的なファージ抗体を得た。前記選別された単一クローン抗体は、多クローン性抗体に比べて信号の強さは小さかったが、非特異的結合なしにきれいに約30KDaの抗原タンパク質を検出することができ(図9参照)、TMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合することができた(図10参照)。
【0048】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチド、及び前記ポリヌクレオチドを含む発現ベクターを提供する。
【0049】
また、本発明は、前記ヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチド、及び前記ポリヌクレオチドを含む発現ベクターを提供する。
【0050】
本発明の具体的な実施例から組換え技術で得たTMPRSS4を用いて、TMPRSS4抗原に強く結合する単一クローンをスクリーニングした(表2、3及び図6参照)。前記選別された単一クローンをフィンガープリンティングで確認した後(図7参照)、それぞれの配列を分析して抗体のVHとVLのCDR部位を確認した(表6及び図8参照)。前記抗体と生殖系列抗体群の類似性を確認した結果(表7参照)、13種のTMPRSS4に特異的なファージ抗体を得た。前記選別された単一クローン抗体は、非特異的結合なしにきれいに約30KDaの抗原タンパク質を検出することができ(図9参照)、TMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合することができた(図10参照)。
【0051】
本発明のヒト抗体の軽鎖及び重鎖またはその断片をコードするポリヌクレオチドは、コドンの縮退性によってまたは前記ヒト抗体の軽鎖及び重鎖またはその断片を発現させようとする生物で選り好みされるコドンを考慮して、コーディング領域から発現されるヒト抗体の軽鎖及び重鎖またはその断片のアミノ酸配列を変化させない範囲内でコーディング領域に多様な変形が成り立ち得、コーディング領域を除いた部分でも遺伝子の発現に影響を及ぼさない範囲内で多様な変形または修飾が成り立ち得、そのような変形遺伝子も本発明の範囲に含まれることを当業者はよく理解することができるでしょう。すなわち、本発明のポリヌクレオチドは、これと同等な活性を有するタンパク質をコーディングする限り、一つ以上の核酸塩基が置換、欠失、挿入またはそれらの組合わせによって変異され得るし、それらも本発明の範囲に含まれる。このようなポリヌクレオチドの配列は、単鎖または二重鎖であり得、DNA分子またはRNA(mRNA)分子であり得る。
【0052】
前記発現ベクターの製作時には、前記ヒト抗体の軽鎖及び重鎖またはその断片を生産しようとする宿主細胞の種類によって、プロモーター、ターミネータ−、エンハンサーなどの発現調節配列、膜標的化または分泌のための配列などを適切に選択して目的によって多様に組み合わせることができる。
【0053】
本発明の発現ベクターは、プラスミドベクター、コズミドベクター、バクテリオファージベクター及びウイルスベクターなどを含むがこれに制限されない。相応しい発現ベクターは、プローモーター、オペレーター、開始コドン、終結コドン、ポリアデニル化シグナル及びエンハンサーのような発現調節エレメントの外にも、膜標的化または分泌のためのシグナル配列またはリーダー配列を含み、目的によって多様に製造することができる。発現ベクターのプローモーターは、構成的または誘導性であり得る。前記シグナル配列には、宿主がエシェリキア属菌の場合には、PhoAシグナル配列、OmpAシグナル配列などが、宿主がバシラス属菌の場合には、α−アミラーゼシグナル配列、スブチリシンシグナル配列などが、宿主が酵母の場合には、MFαシグナル配列、SUC2シグナル配列などが、宿主が動物細胞の場合には、インシュリンシグナル配列、α−インターフェロンシグナル配列、抗体分子シグナル配列などを用いることができるが、これに制限されない。また、発現ベクターは、ベクターを含む宿主細胞を選択するための選択マーカーを含むことができ、複製可能な発現ベクターの場合、複製原点を含む。
【0054】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを宿主細胞に導入して製造された形質転換体を提供する。
【0055】
また、本発明は、前記ヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供する。
【0056】
また、本発明は、前記ヒト抗体の重鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクター、及び軽鎖またはその免疫学的に活性を有した断片をコードするポリヌクレオチドを含む発現ベクターを同時に宿主細胞に導入して製造された形質転換体を提供する。
【0057】
本発明の具体的な実施例では、単一クローンファージの軽鎖及び重鎖をコードする遺伝子を収得してそれぞれベクターに連結した後、前記発現ベクターを同時に宿主細胞に導入して発現された全長IgG形態のヒト抗体を確認した(図12参照)。前記全長IgG形態のヒト抗体を精製した後(図13参照)、TMPRSS4に対する結合力をFACSで確認した(図14参照)。
【0058】
本発明による前記発現ベクターを適切な宿主細胞、例えば、大腸菌または酵母細胞などに形質転換させた後、形質転換された宿主細胞を培養することで本発明によるヒト抗体の軽鎖及び重鎖またはその断片を大量生産することができる。宿主細胞の種類による適切な培養方法及び培地条件などは、当該分野の通常の技術者に知られた公知技術から当業者が容易に選択することができる。前記宿主細胞は、大腸菌またはバシラスサブチリスのような原核生物であることができる。また、サッカロマイセスセレビシエのような酵母、昆虫細胞、植物細胞、動物細胞から由来した真核細胞であることができる。さらに好ましくは、前記動物細胞は、自家または同種異系動物細胞であることができる。自家または同種異系動物細胞に導入して製造された形質転換体は、個体に投与されて癌を治療する細胞治療などに用いることもできる。前記宿主細胞への発現ベクター導入方法は、当業者に公知されたいずれの方法を用いても構わない。
【0059】
また、本発明は、前記形質転換体を培養してTMPRSS4に特異的なヒト抗体を製造する方法を提供する。
【0060】
具体的に、
1)前記形質転換体を培養する工程、及び
2)前記培養液から前記ヒト抗体を精製する工程を含むTMPRSS4に特異的なヒト抗体の製造方法を提供する。
【0061】
前記培養培地には、当業者に公知された培養培地の中で形質転換体に相応しい培地を選択して用いるのが好ましい。前記抗体精製方法は、当業者に公知されたいずれの精製方法も使用可能である。
【0062】
本発明の具体的な実施例では、単一クローンファージの軽鎖及び重鎖をコードする遺伝子を収得して、それぞれベクターに連結した後、前記発現ベクターを同時に宿主細胞に導入して発現された全長IgG形態のヒト抗体を確認した(図12参照)。前記全長IgG形態のヒト抗体をタンパク質A−親和度クロマトグラフィーカラムを用いて精製した後(図13参照)、TMPRSS4に対する結合力をFACSで確認した(図14参照)。
【0063】
また、本発明は、前記ヒト抗体を含む組成物を提供する。
【0064】
また、本発明は、前記ヒト抗体を含む薬学的組成物を提供する。
【0065】
前記薬学的組成物は、TMPRSS4が過発現される癌の予防及び治療に有用に用いることができる。前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれかひとつであることが好ましいが、これに限定されず、TMPRSS4が過発現される癌はすべて可能である。
【0066】
本発明の具体的な実施例で、TMPRSS4単一クローン抗体は、大腸癌細胞株でラビット及びヒト正常IgGに比べて50%以上明らかな浸潤の阻害を示し(図15、図16及び図17参照)、TMPRSS4によって惹起された大腸癌細胞株の移動を、TMPRSS4特異的な多クローン性抗体及び単一クローン抗体で阻害したことを確認した(図18〜19参照)。同時に、本発明単一クローン抗体が、TMPRSS4が過発現された大腸癌細胞株の増殖を抑制するように誘発されたことを確認した。それで、本発明単一クローン抗体は、TMPRSS4が過発現された癌予防及び治療用組成物として有用に用いることができる。
【0067】
本発明の薬学的組成物は、前記TMPRSS4に特異的なヒト抗体または前記形質転換体を選択的に含むことができ、前記成分に追加で同一または類似の機能を示す有効成分を 1種以上含むことができる。また、本発明薬学的組成物の投与のために、前記に記載した有効成分以外に追加で薬剤学的許容可能な担体を1種以上含んで製造することができる。例えば、薬剤学的に許容可能な担体としては、食塩水、滅菌水、リンゲル液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エチルアルコール、リポソーム及びこれら成分中の一つ以上の成分を混合して用いることができ、必要によって抗酸化剤、緩衝液及び静菌剤など異なる通常の添加剤を添加することができる。また、希釈剤、分散剤、界面活性剤、結合剤及び滑剤を付加的に添加して水溶液、懸濁液及び乳濁液などのような注射用剤形に製剤化することができ、標的細胞に特異的に作用するように標的細胞に特異的な抗体またはその他リガンドを前記の担体とともに結合させて用いることができる。同時に、当該技術分野の適正な方法またはレミングトンの文献(Remington’s Pharmaceutical Science,Mack Publishing Company,Easton PA)に掲載されている方法などを用いて各疾患または成分によって好ましく製剤化することができる。
【0068】
本発明の薬学的組成物は、非経口で投与することができ、非経口投与としては、皮下注射、静脈注射、筋肉内注射または胸部内注射注入方式が挙げられる。非経口投与用剤形に製剤化するためには、本発明の薬学的組成物は、安定剤または緩衝液とともに混合して溶液または懸濁液に製造してこれをアンプルまたはバイアルの単位投与型に製剤化する。
【0069】
本発明の薬学的組成物は、投与経路によって多様な形態で製造することができる。例えば、本発明薬学的組成物は、注射用途に相応しい滅菌水溶液または分散液の形態に製造することができ、または凍結乾燥技術を用いて凍結乾燥された形態に製造することができる。凍結乾燥された薬学的組成物は、典型的に約4℃で維持され、補助剤を含むか含まない安定化溶液、例えば、食塩水または/及びHEPESによって復元することができる。
【0070】
本発明の方法を実施するにおいて、投与される薬学的組成物の量に影響を及ぼす因子としては、これに限定されるのではないが、投与方式、投与頻度、治療が進行中の特定疾病、疾病の重症度、疾病の病歴、個体が異なる治療剤とともに併用治療法が進行中かどうか、及び治療が進行中の個体の年齢、身長、体重、健康、及び身体条件を含む。一般的に治療が進行中の患者の体重が増加するほど、本発明の薬学的組成物をより多く投薬することが好ましい。
【0071】
また、本発明の薬学的に有効な量の前記ヒト抗体を、TMPRSS4が過発現される癌にかかった個体に投与する工程を含む、TMPRSS4が過発現される癌を治療する方法を提供する。
【0072】
前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれかひとつであることが好ましいが、これに限定されないでTMPRSS4が過発現される癌はすべて可能である。
【0073】
本発明の具体的な実施例で、TMPRSS4単一クローン抗体は、大腸癌細胞株で浸潤、移動及び増殖を阻害することを確認した(図15〜19参照)。それで、本発明の単一クローン抗体は、TMPRSS4が過発現された癌予防及び治療に有用に用いることができる。
【0074】
本発明が適用可能な個体は脊椎動物で、好ましくは哺乳動物であり、さらに好ましいのはネズミ、ウサギ、モルモット、ハムスター、犬、猫のような実験動物で、最も好ましいのはチンパンジー、ゴリラのような類人猿類動物である。
【0075】
本発明のヒト抗体の投与方法は、使用目的によって非経口投与(例えば、静脈内、皮下、腹腔内または局所などに投与する方法)が可能で、静脈投与が好ましい。場合によって固形癌に対する投与では、抗体の接近を早く容易にするために局所的な投与が好ましいこともある。投与量は、患者の体重、年齢、性別、健康状態、食餌、投与時間、投与方法、排泄率及び疾患の重症度等によってその範囲が多様である。1回の投与量は、約5〜500mg/m2の量で、一日単位または週単位で投与することができる。前記有効量は、前記患者を治療する医師の裁量によって調節することができる。
【0076】
本発明のヒト抗体は、癌患者の治療のために単独または手術、ホルモン治療、薬物治療及び生物学的反応調節剤と並行して用いることができる。
【0077】
また、本発明の前記ヒト抗体、ヒト抗体の軽鎖または重鎖、またはその免疫学的に活性を有した断片及び放射性同位元素を含む組成物を提供する。
【0078】
本発明の具体的な実施例で、単一クローンTMPRSS4抗体は、TMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合したことを確認した(図10参照)。それで、本発明単一クローン抗体は、TMPRSS4が過発現される癌の検出用組成物として有用に用いることができる。
【0079】
前記組成物は、TMPRSS4が過発現される癌の放射線免疫治療用及び検出用として有用に用いることができる。前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれか一つであることが好ましいが、これに限定されないでTMPRSS4が過発現される癌はすべて可能である。
【0080】
好ましい治療用放射性同位元素の例としては、3H、11C、14C、18F、64Cu、76Br、86Y、99mTc、111In、123I、177Lu及びこれらの混合物及び組み合わせを含む。前記治療用放射性同位元素は、ヒト抗体と結合するかヒト抗体が結合された運搬体に含まれることを特徴とする。
【0081】
また、本発明は、前記放射性同位元素を含む組成物を癌細胞と接触する工程を含む試験管内のTMPRSS4が過発現される癌の免疫検出方法を提供する。
【0082】
前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれか一つであることが好ましいが、これに限定されないでTMPRSS4が過発現される癌はすべて可能である。
【0083】
本発明の具体的な実施例で、単一クローンTMPRSS4抗体は、TMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合したことを確認した(図10参照)。それで、本発明の単一クローン抗体は、TMPRSS4が過発現される癌の検出用組成物として有用に用いることができる。
【0084】
前記放射性同位元素を含む組成物は、洗浄や複合体の分離などその後の工程を容易にするために固形基質に結合することができる。固形基質は、例えば合成樹脂、ニトロセルロース、ガラス基板、金属基板、グラスファイバー、微細球体及び微細ビードなどがある。また、前記合成樹脂には、ポリエステル、ポリ塩化ビニル、ポリスチレン、ポリプロピレン、PVDF及びナイロンなどがある。
【0085】
また、癌細胞は、前記検出用組成物と接触前に適当な程度に希釈することができる。
【0086】
また、本発明は、1)前記放射性同位元素を含む組成物の診断的有効量を個体に投与する工程、及び、
2)前記個体に対する検出映像を収得する工程を含む生体内TMPRSS4が過発現される癌の映像化方法を提供する。
【0087】
前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれか一つであることが好ましいが、これに限定されないでTMPRSS4が過発現される癌はすべて可能である。
【0088】
本発明の具体的な実施例で、単一クローンTMPRSS4抗体は、TMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合したことを確認した(図10参照)。それで、本発明の単一クローン抗体は、TMPRSS4が過発現される癌の検出用組成物として有用に用いることができる。
【0089】
前記検出映像は、近赤外光イメージング、PET、MRIまたは超音波イメージングによって得られることを特徴とする。
【0090】
また、本発明は、
1)前記放射性同位元素を含む組成物を個体の静脈内に投与する工程、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、
3)工程2)で確認された腫瘍細胞を手術的切除によって除去する工程を含む、TMPRSS4が過発現される癌の生体内治療方法を提供する。
【0091】
前記TMPRSS4が過発現される癌は、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されたいずれか一つであることが好ましいが、これに限定されないでTMPRSS4が過発現される癌はすべて可能である。
【0092】
本発明の具体的な実施例で、TMPRSS4単一クローン抗体は、大腸癌細胞株で浸潤、移動及び増殖を阻害することを確認した(図15〜19参照)。それで、本発明の単一クローン抗体は、TMPRSS4が過発現される癌予防及び治療に有用に用いることができる。
【0093】
同時に、本発明は、
1)前記放射性同位元素を含む組成物を大腸癌腫瘍細胞が除去された患者の静脈内に投与する工程、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、
3)工程2)で腫瘍細胞が検出されなければ、腫瘍細胞がすべて除去されたと判断することを特徴とする癌治療患者の予後評価方法を提供する。
(発明を実施するための形態)
以下、本発明の実施例によってさらに詳しく説明する。
【0094】
但し、下記の実施例は、本発明を例示するだけのものであって、本発明の内容が下記の実施例によって限定されるのではない。
【実施例1】
【0095】
TMPRSS4抗原タンパク質の製造
<1−1>TMPRSS4遺伝子クローニング
韓国生命工学研究院人間遺伝体機能研究産業団のKUGI(Korean UniGene Information)からヒトTMPRSS4遺伝子を含んでいるプラスミド(IRAU−61−E06;クローンID:hMU011286)の分譲を受けた。前記プラスミドを鋳型DNAにして、前記TMPRSS4のプロテアーゼドメイン(aa205〜434)のみを発現させるために、正方向プライマー(配列番号1:5’−GAGGAGCATATGGATTATAAAGATCATGATATTGATTATAAAGATGATGATGATAAAGTGGTGGGTGGGGAGGAG−3’)及び逆方向プライマー(配列番号2:5’−GAGGAGCTCGAGCAGCTCAGCCTTCCAGAC−3’)を用いて遺伝子を下記の条件で増幅した後、NdeIとXhoIで処理した後、ライゲースを用いてpET21c(Novagen,米国)にサーブクローニングした。PCR条件は、全体反応液が50μlの時、鋳型は100ngになるように加えて、94℃で2分、94℃で30秒、55℃で30秒、72℃で1分30秒で30サイクル、72℃で10分間反応させてPCR産物を得た。同時に、前記サーブクローニングされたベクターの塩基配列を確認した(図1)。
【0096】
<1−2>TMPRSS4タンパク質の発現及び精製
前記サーブクローニングされたベクターをBL21(DE3)で形質転換させた後、LB(+amp)培地に接種して一晩中培養した後、500ml LB(+amp)培地に1/100に希釈して接種した。37℃で2時間程度OD=0.5まで追加で培養した後、IPTGを1mMの濃度で処理した後、4時間の間培養した。大腸菌を5000rpmで10分間遠心分離して得た後、バグバスター(Bug buster)溶液10mlに懸濁した後、15分間砕いた後、12000rpmで30分間遠心分離して水溶性分画と不溶性分画を分離した。これをSDS−PAGEで分析した結果、TMPRSS4タンパク質は不溶性分画に存在した。不溶性分画を8Mウレア溶液(8M urea,0.1M NaH2PO4,0.01M TrisCl pH7.9)で溶解した後、Ni−NTAレジン(Qiagen,米国)1mlに結合させた後、10mlの洗浄緩衝溶液(8M urea,0.1M NaH2PO4,0.01M TrisCl pH5.9)で洗浄して、5mlの溶離緩衝溶液(8M urea,0.1M NaH2PO4,0.01M TrisCl pH4.5)で溶離した。溶離したTMPRSS4タンパク質(TMPS4−FLAG)は、PBS(+10% glycerol)溶液に透析して10%SDS−PAGEゲルで電気泳動した後、クマシー染色して約35kDaの大きさを確認した(図2)。
【0097】
前記精製されたTMPS4−FLAGタンパク質1mgを図3のaに示したように、40ngエンテロキナーゼ(Enterokinase;NEB,米国)で6時間の間室温で反応させた後、Ni−NTAレジンを用いてTMPRSS4のみを精製した(TM−EK)。前記精製されたタンパク質を10%SDS−PAGEゲルで電気泳動した後、クマシー染色して約31kDaの大きさを確認した(図3b)。
【実施例2】
【0098】
TMPRSS4タンパク質による酵素活性測定
TMPRSS4の細胞外ドメインのトリプシン類似タンパク質分解活性を測定するために、TMPS4−FLAGタンパク質(2.25μg)に蛍光ペプチドトリプシン基質であるBoc−Gln−Ala−Arg−AMC(t−butyloxycarbonylv(t−Boc)−Gln−Ala−Arg−7amido−4−メチルクマリン;B4153,Sigma,米国)とカリクレイン基質であるZ−Phe−Arg−AMC(Z−Phe−Arg7−アミド−4−メチルクマリンハイドロクロライド;C9521,Sigma,米国)をそれぞれ基質緩衝溶液(50mM tris,10mM CaCl2,1μM ZnCl2)に100μMの濃度で溶解して、TMPS4−FLAGタンパク質と混ぜた後、エンテロキナーゼ(0.09ng)を添加して時間別にVictor3プレートリーダー(PerkinElmer,米国)を用いて380/460nmでペプチド基質の加水分解による蛍光信号を測定した。
【0099】
その結果、図4に示したようにエンテロキナーゼによるTMPRSS4の活性型(TM−EK)のトリプシン類似活性による基質の加水分解が、対照群と対比して時間別に活性を示すことを確認することができた。したがって、標的抗原としてTMPRSS4が成功的に合成されたことを確認した。
【実施例3】
【0100】
ファージライブラリーの製造
多様性を有したヒト由来scFvライブラリー細胞2.7×1010を2×YT CM[Tryptone(CONDA,1612.00)17g、酵母エキス(CONDA,1702.00)10g、NaCl(sigma,S7653−5kg)5g、クロラムフェニコール(sigma,C0857)34μg/ml)]、2%グルコース(sigma,G5400)及び5mM MgCl2(sigma,M2393)を含む培地(3L)で、37℃で2〜3時間の間培養した後(OD600=0.5〜0.7)、ヘルパーファージを感染させて2×YTCMK[2×YT CM,カナマイシン(sigma,K1876)70μg/ml,1mM IPTG(ELPISBIO,IPTG025)]培地に30℃で16時間の間培養した。培養した細胞を遠心分離(4500rpm,15分,4℃)した後、上澄み液に4%PEG(Fluka,81253)6000と3%NaCl(sigma,S7653)を添加してよく溶解した後、氷で1時間の間反応させた。再び遠心分離(8000rpm,20分,4℃)した後、ペレットにPBSを添加して溶解した後、遠心分離(12000rpm,10分,4℃)してファージライブラリーを含む上澄み液を新しいチューブに入れて4℃で保管した。
【実施例4】
【0101】
多クローン性抗体の製造
TMPS4−FLAGを抗原としてエイビーフロンティア(韓国)に依頼し、2匹のウサギに3回反復注射して多クローン性抗体血清を得た。これを再び抗原特異的親和度を用いて精製を行なって、TMPS4−FLAGに特異的に結合する多クローン性抗体を2mg/mlの濃度で1mlを収得した。前記収得した多クローン性抗体を非還元性条件で、10%SDS−PAGEで確認した。
【0102】
その結果、図5に示したように精製された抗体を確認した。以後、これを陽性対照群に用いた。
【実施例5】
【0103】
単一クローン抗体の製造
<5−1>パニング(Panning)過程
実施例2で収得した精製されたTMPRSS4抗原(TMPS4−FLAGとTM−EK)各30μgをイムノソルブ(Immunosorb)チューブ(Nunc470319)に4mlのコーティング緩衝溶液[Na2CO3(sigma,S7795)1.59g、NaHCO3(sigma,S8875)2.93g、NaN3(sigma,S2002),0.2g]で4℃で16時間程度回転機でコーティングした後、室温で2時間の間PBSに溶解してスキムミルク[(BD,232100)−4%in 1XPBS]を用いて免疫チューブでブロッキングした。免疫チューブに実施例3で製造したファージライブラリー2mlを添加して室温で2時間の間反応させ、PBST(0.05%)で5回、PBSで2回洗浄した。洗浄後、特異的に結合したscFv−ファージのみ100mM TEA(Sigma T−0886)に溶離して、溶出したファージを大腸菌(XL1−Blue,stratagene,200249)に感染させて増幅した。一回目パニングで増幅されたファージを、PBST洗浄回数のみ増やして(2次:13回、3次:23回)同一な方法で2次及び3次パニングを行なった。
【0104】
その結果、表1に示したように3次で抗原に対するファージのコロニー力価が100倍以上増幅されることを確認した。
【0105】
【表1】

【0106】
<5−2>ファージELISAによるファージ抗体探索
<5−2−1>パニング結果確認
1次から3次までパニングして氷らせておいた細胞ストックを5mlの2×YTCM、2%グルコース,5mM MgCl2培地にOD600=0.1になるように入れた後、37℃で2〜3時間(OD600=0.5〜0.7)培養した。以後、M1ヘルパーファージを感染させて2×YTCMK、5mM MgCl2、1mM IPTG培地に30℃で16時間の間培養した。培養細胞を遠心分離した後(4500rpm、15分、4℃)上澄み液(1次〜3次パニング ポリscFv−ファージ)を新しいチューブに移した。96ウェル免疫プレート(NUNC 439454)に二種類の抗原をウェル当り100ngずつ4℃で16時間程度コーティング緩衝溶液で処理してコーティングした後、PBSに溶解したスキムミルク(4%)を用いて各ウェルをブロッキングした。各ウェルにPBS−ツイーン20(0.05%)0.2mlで洗浄後、1次〜3次パニング ポリscFV−ファージを各ウェルに100μlずつ入れて常温で2時間の間反応させた。また、各ウェルにPBS−ツイーン20(0.05%)0.2mlを用いて4回洗浄した後、二次抗体である抗−M13−HRP(Amersham27−9421−01)を1:2000に希釈して室温で1時間の間反応した。PBS−ツイーン20(0.05%)0.2mlで洗浄した後、OPDタブレット(Sigmap8787−TAB)をPC緩衝溶液[C6H8O7.H2O(sigma,C0706)5.1g、Na2HPO4(sigma,S7907)7.3g]に溶解した基質溶液を作って、ウェル当り100μlずつ入れて10分間発色させた後、490nmで吸光度を分光光度計(MolecularDevice,米国)で測定した。
【0107】
その結果、図6に示したように3次で抗原に対する特異的な結合能が増強されることを確認した。
【0108】
<5−2−2>単一クローン抗体の選別
前記結合能が大きい多クローンファージ抗体群(3次パニング)から得たコロニーを、2×YTCM、2%グルコース、5mM MgCl2培地1mlを含んだ96ディープウェルプレート(バイオニア90030)で、37℃で16時間の間培養した。培養した細胞のOD600値が0.1になるように100〜200μlを取って1mlの2×YTCM、2%グルコース、5mM MgCl2培地に希釈した後、96ディープウェルプレートで37℃でOD600値が0.5〜0.7になるように2〜3時間培養した。M1ヘルパーファージをMOI値が1:20になるように感染させた後、2×YTCMK、5mM MgCl2、1mM IPTG培地に30℃で16時間培養した。培養した細胞を遠心分離(4500rpm、15分、4℃)した後、上澄み液を取って4%PEG6000と3%NaClを添加してよく溶解した後、氷で1時間の間反応させた。再び遠心分離(8000rpm、20分、4℃)した後、ペレットにPBSを添加して溶解した後、遠心分離(12000rpm、10分、4℃)して上澄み液を取って新しいチューブに移して、3次パニングして得た単一クローンscFv−ファージを4℃で保管した。
【0109】
以後、96ウェル免疫プレートに二つの抗原をウェル当り100ngずつ入れて、4℃で16時間の間コーティングした後、PBSに溶解したスキムミルク(4%)を用いて各ウェルをブロッキングした。各ウェルにPBS−ツイーン20(0.05%)0.2mlを用いて洗浄した後、3次パニングして得た単一クローンscFv−ファージ(each100 scFv−phage)を各ウェルに100μlずつ入れて常温で2時間の間反応させた。再び、各ウェルにPBS−ツイーン20(0.05%)0.2mlを用いて4回洗浄した後、2次抗体である抗−M13−HRPを1/2000に希釈して室温で1時間の間反応した。PBS−ツイーン20(0.05%)0.2mlで洗浄した後、発色して吸光度490nmで測定した。
【0110】
その結果、各抗原に対する結合能が強い単一ファージクローンは、TMPS4−FLAGに対して15個(表2)とTMPS4−EKに対して35個(表3)など、総50個の単一ファージクローンを選別した。
【0111】
【表2】

【0112】
【表3】

【0113】
<5−3>単一クローンファージ分類及び検査
<5−3−1>フィンガープリンティングによる検証
1次選別された単一クローン50個の単一クローン細胞1μlとTaq.DNAポリメラーゼ(ゼンダックス5U/μl)0.2μl、50p/μlの正方向プライマー(pelB5、配列番号5:5’−CTAGATAACGAGGGCAAATCATG−3’)及び逆方向プライマー(cla3、配列番号6:5’−CGTCACCAATGAAACCATC−3’)0.2μl、10X緩衝溶液3μl、10mM dNTP mix0.6μl、蒸留水24.8μlを混合してコロニーPCR(iCycler iQ,BIO−RAD)を行なった。PCRプログラムの条件は、下記の表4のとおりである。
【0114】
【表4】

【0115】
前記コロニーPCR産物は、1%アガロースゲル(Seakem LE,CAMERES 50004)で確認し、BstNI(Roche11288075001,10U/μl)0.2μlを取って、37℃で2〜3時間反応させた。反応条件は、下記の表5のとおりである。前記切断した産物を8%DNAポリアクリルアミドゲルで確認した。
【0116】
【表5】

【0117】
その結果、図7に示したように BstNIによって切断された単一クローンファージ抗体の断片に対して多様性が確認された。
【0118】
<5−3−2>塩基配列分析による検証
前記50種の単一ファージクローンを2×YTCM、2%グルコース、5mM MgCl2培地(5ml)に37℃で16時間の間培養した。培養した単一クローンからDNA精製キット(Nuclogen5112)を用いてDNAを収得した後、配列番号5のpelB5プライマーを用いた配列分析を依頼した(ソルゼント、韓国)。
【0119】
その結果、表6及び図8に示したように選別された抗体のVHとVLのCDR領域を確認した。
【0120】
これら抗体と生殖細胞系列(germ line)抗体群の類似性をNCBIのIg BLASTプログラム(//www.ncbi.nlm.nih.gov/igblast/)を用いて調査した結果、13種のTMPRSS4に特異的なファージ抗体を得て、それを下記の表7に整理して提示した。
【0121】
【表6−1】

【0122】
【表6−2】

【0123】
【表7】

【実施例6】
【0124】
TMPRSS4に対するヒト抗体の特性分析
【0125】
<6−1>ファージウエスタンブロット分析
前記抗原TMPRSS4−FLAGが各ウェルに0.1〜200ngずつローディングされた10%SDS−PAGEゲル2枚を100Vで2時間程度電気泳動した後、NC膜(millipore Cat.No.HATF00010)に85Vで2時間の間伝達した。以後、膜を4%スキムミルクin TBSTで4℃で一日晩中ブロッキングした。以後、実施例4で製造した多クローンα−TMPRSS4抗体(1mg/ml)を4%スキムミルクin TBSTに1:2000に希釈し、実施例5で選別された単一クローンファージ抗体の上澄み液を4%スキムミルクin TBSTに1:50に希釈して常温で1時間30分間反応させた。TBSTで10分に一回ずつ5回洗浄した後、それぞれ抗−マウスIgG−HRP(Sigma)と抗−M13−HRP(Amersham bioscience)を用いて、4%スキムミルクin TBSTに1:3000に希釈して常温で30分間反応させた後、同じ方法で洗浄した。洗浄後、現象(Intron,Cat.No.12145)して多クローン性抗体と単一ファージ抗体を検出することができる抗原タンパク質の量を比較した。
【0126】
その結果、図9に示したようにTE−6Cファージ抗体の場合、多クローン性抗体に比べて信号の強さは小さかったが、非特異的結合なしにきれいに約30KDaの抗原タンパク質を検出することができた。
【0127】
<6−2>ファージFACS分析
100mmプレートでTMPRSS4を過多発現することが知られた大腸癌細胞株(colo205;ATCC)細胞株をPBSで2回洗浄した後、無酵素PBS基盤−解離緩衝溶液(Gibco)を添加して、37℃で10分間培養した。以後、細胞をスクレイパーで集めた後、1300rpmで3分間遠心分離してペレットを2%PBF(2%FBS含有1XPBS)溶液で二度洗浄した後、2%PBF溶液を入れて再懸濁して≧5×105細胞の濃度で準備した。本発明の単一クローンファージ抗体100μlをPEGで10倍濃縮した後、1/2に希釈して前記細胞に混合した。氷で1時間の間反応させた後、1300rpmで4℃で3分間遠心分離して上澄み液を除去した。200μlの2%PBF溶液で3回洗浄した後、2%PBF溶液に1:200に希釈させた抗−g8p抗体(Abcam)100μlを入れてよく混合して、氷で30分間反応させた。1300rpmで4℃で3分間遠心分離した後、上澄み液を除去して200μlの2%PBF溶液で3回洗浄した。2%PBF溶液に1:1000で希釈させたFITC−連結された抗−マウスIgG 100μlをそれぞれの試料に混合した後、氷で30分間反応させた。追加で洗浄した後、500μlの2%PBF溶液を添加してFACS用チューブ(Falcon)に試料を移してボルテキシングした後、染色された細胞を流細胞分析機(Beckman Coulter)で分析した。毎実験時に単一ファージ抗体を同一な条件で試料に処理して内部対照群(internal control)に用いた。データは、WINMDI2.9ソフトウエア(//facs.scripps.edu/software.html,The Scripps Research Institute)を用いて分析した。
【0128】
その結果、図10に示したようにTMPRSS4が過多発現された大腸癌細胞株でTMPRSS4を特異的に認識して結合する単一クローンファージ抗体T2−6G、T2−12A ALC T1−9Fなどを選別した。その外にも、T2−6C、T2−3A、T2−8Fなども選別したが、結果は本明細書に別途記載しなかっただけである。
【0129】
<6−3>全長IgG変換分析
TMPRSS4に対する単一クローンファージ抗体をファージからIgG全長ベクターに転換するために、重鎖は単一クローンDNA 1μlと10pmole/μl表8の重鎖正方向プライマーと重鎖逆方向プライマー、10X緩衝溶液5μl、10mM dNTP mix 1μl、pfu DNA重合酵素(ソルゼント、2.5U/μl)0.5μl、蒸留水を混合して、コロニーPCR(iCycler iQ、BIO−RAD)を行なった。また、軽鎖は表8の軽鎖正方向及び逆方向プライマーを用いて同一な方法でコロニーPCRを行なった。
【0130】
【表8】

【0131】
PCRの結果収得した重鎖遺伝子をDNA−ゲル抽出キット(Qiagen)で精製した後、pNATAB Hベクター(図11a)1μl(10ng)、重鎖(100〜200ng)15μl、10×緩衝溶液2μl、リガーゼ(1U/μl)1μl、蒸留水を混合して室温で1〜2時間放置して前記ベクターと連結した。前記ベクターを形質転換用細胞(XL1−blue)とともに氷に30分間放置後、42℃で90秒間熱衝撃を与えて形質導入した。再び、氷に5分間放置後、LB培地1mlを注入して1時間の間37℃で培養した。LB Amp(アンピシリン)固体培地に塗抹した後、37℃で16時間の間培養した。単一コロニーをLB Amp液体培地5mlに接種して、37℃で16時間の間培養した。前記培養液からDNA−prep.キット(Nuclogen)を用いてDNAを抽出した。
【0132】
また、軽鎖は、pNATAB Lベクター(図11b)を用いて前記のような方法でDNAを抽出した。
【0133】
前記収得したDNAのCMV−proFプライマー(配列番号3:AAA TGG GCG GTA GGC GTG)を用いた塩基配列分析を依頼した(ソルゼント)。
【0134】
その結果、全長IgGに転換したTMPRSS4に対する4個のクローンファージの重鎖と軽鎖の配列がファージ抗体の配列と一致することを確認した。
【0135】
<6−4>全長IgGの検証
293E細胞(Invitrogen)にPEI(Cat#23966,Polysciences,Inc)40μgと全長形態抗体重鎖DNA10μg、軽鎖DNA10μgを入れて共同形質感染をして得た上澄み液をウエスタンブロットで確認した。対照群には、正常ヒトIgG(Jackson Lab)を用いた。
【0136】
その結果、図12に示したように対照群と比べて4個のクローンファージが全長IgG形態に転換されたことを確認した。
【0137】
前記4個のクローンファージ中のT2−6CとT2−6G全長形態IgGをタンパク質A−親和度クロマトグラフィーカラム(Pharmacia,GE,米国)を用いて精製した後(図13)、実施例6−2の方法でTMPRSS4に対する結合力をFACSで確認した(図14)。
【実施例7】
【0138】
TMPRSS4ヒト抗体が大腸癌細胞株の浸潤及び移動に及ぼす影響研究
【0139】
<7−1>Colo205細胞浸潤分析
トリプシン(trypsin)(Gibco25300)でColo205細胞を採取した後、RPMI浸潤培養液(invasion media)(RPMI,10mM HEPES,0.5%BSA)で二度洗浄した後、浸潤培養液に細胞を2×106/mlの濃度に懸濁して準備した。精製されたTMPRSS4多クローン性抗体及び単一クローンT2−6C抗体を浸潤培養液にそれぞれ30及び75ng/50mlに希釈して細胞懸濁液50μlとTMPRSS4抗体溶液50μlを混合した後、37℃で二時間前培養した。24ウェルトランスウェルプレート(well transwell plate)(8μm pore size,costar3422)は、マトリゲル(BD354234)を1mg/mlで無血清培地(RPMI,10mM HEPES)に希釈してインサート(insert)の上側面に室温で一時間の間コーティングした。一時間経過後、インサートに残っているマトリゲルを除去して無血清培地で一度洗浄した。その後、5%FBSが添加されたRPMI浸潤培養液600μlをチャンバー(chamber)に入れた。消毒された鉗子(forceps)を用いてインサートを培養液が入っているチャンバーに入れた後、あらかじめ反応させておいた細胞と抗体の混合物をインサート中に100μl入れて、37℃/5%CO2で24時間の間培養した。マトリゲルを通過した浸潤された細胞を測定するために、インサートの上側面をPBSに湿らせた綿棒で拭いて3.7%パラホルムアルデヒド500μl(Sigma HT50)が入っているチャンバーにインサートを入れて、室温で30分間固定した。その後、1%クリスタルバイオレット(Sigma C3886)/100mM NaBorate(Sigma S9640)500μlに30分間染色して水で洗浄した後、乾燥させて顕微鏡で100倍の倍率で細胞をカウンティングした。
【0140】
その結果、図15、図16及び図17に示したように大腸癌細胞株であるColo205で精製された多クローン及びTMPRSS4単一クローン抗体(T2−6CとT2−6G)は、対照群に用いたラビット(図15)及びヒト正常IGg(図16及び図17)と比較して50%以上の明らかな浸潤阻害を示した。
【0141】
<7−2>Colo205細胞移動分析
TMPRSS4を過発現することが知られたColo205細胞株及びTMPRSS4を低発現することが知られたSw480(ATCC,CCL−228)細胞株をトリプシンで採取した後、RPMI移動培養液(RPMI,10mM HEPES,0.5%BSA)で二度洗浄した後、8×105/mlの濃度に懸濁して準備した。細胞懸濁液50μlと三種類の濃度(0、1及び2μM)に希釈しておいた多クローンTMPS4抗体溶液、及び単一クローンT2−6C及びT2−6G抗体50μl(TMPRSS4抗体を移動培養液に希釈して1000ng/50μlに製造)をそれぞれ混ぜて37℃で二時間の間前培養した。24ウェルトランスウェルプレートは挿入下側面に0.05%ゼラチン(Sigma G1393)を用いて室温で一時間の間コーティングした。一時間経過後、インサートに残っているゼラチンを除去してPBSで一度洗浄した。前記過程が終わった後、5%FBSが添加されたRPMI移動培養液600μlをチャンバーに入れた。消毒された鉗子を用いてインサートをチャンバーに入れた後、あらかじめ反応させておいた細胞と抗体の混合物をインサート中に100μlを入れて、37℃/5%CO2で24時間の間培養した。細胞の移動を測定するために先にインサートの上側面をPBSに湿らせた綿棒で拭いて、3.7%パラホルムアルデヒド500μlが入っているチャンバーにインサートを入れて室温で30分間固定した。その後、1%クリスタルバイオレット/100mM NaBorate 500μlに30分間染色して水で洗浄した後、乾燥させて顕微鏡で100倍の倍率で細胞をカウンティングした。
【0142】
その結果、図18に見られるように二つの大腸癌細胞株の移動に明らかな差を示し、標的抗原であるTMPRSS4によって惹起された移動をTMPRSS4特異的な多クローン性抗体で阻害したことを確認した。TMPRSS4に対する多クローン性抗体のみならず精製された単一クローンT2−6C(図19)及びT2−6G(図20)抗体も、TMPRSS4が過発現された大腸癌細胞株であるcolo205において、対照群に用いたヒト正常IgGに比べて二つともそれぞれ約50%以上の明らかな移動の阻害を示した。
【0143】
<7−3>Colo205増殖分析
トリプシンでColo205細胞を採取した後、2%FBSが添加されたRPMI培養液で二度洗浄した後、無血清培養液(RPMI,10mM HEPES)に細胞を2×105/mlで懸濁して準備した。精製されたTMPRSS4抗体を無血清培養液に250、500及び1000ng/40μlに希釈して細胞懸濁液50μlとTMPRSS4 T2−6C抗体溶液40μlを混ぜて37℃で二時間の間前培養した。反応を終えた細胞と抗体の混合物90μlに10μlのFBSを添加して、96ウェルプレートに100μlずつ入れて37℃/5%CO2で24、48及び72時間培養した。それぞれのタイムポイントに合わせてPreMix WST−1細胞増殖溶液(takara,MK400)を10μl添加して二時間の間37℃で反応させた後、VERSA maxマイクロプレートリーダー機で、440nmでサンプルの吸光度を測定した。
【0144】
その結果、精製されたTMPRSS4 T2−6C抗体が、Colo205細胞増殖に対し顕著な阻害を誘発したことを確認した(データは記載しなかった)。
【実施例8】
【0145】
結合能測定
TMPRSS4に対する抗体の抗原に対する結合力をELISAで測定し、GraphPad PRISM4.0プログラムで分析した結果、結合定数KD値が約1.03×10−9Mと確認された。
【配列表フリーテキスト】
【0146】
配列番号1:TMPRSS4フォワードプライマー
配列番号2:TMPRSS4リバースプライマー
配列番号3:CMV-proFプライマー
配列番号4:NATJK-R4
配列番号5:pelB5
配列番号6:cla3
配列番号7:T1-11G VH CDR 1
配列番号8:T1-12C VH CDR 1
配列番号9:T1-9F VH CDR 1
配列番号10:T2-8F VH CDR 1
配列番号11:T2-12C VH CDR 1
配列番号12:T2-3A VH CDR 1
配列番号13:T2-7B VH CDR 1
配列番号14:T2-10E VH CDR 1
配列番号15:T2-6C VH CDR 1
配列番号16:T1-5G VH CDR 1
配列番号17:T2-6A VH CDR 1
配列番号18:T2-12A VH CDR 1
配列番号19:T1-11G VH CDR 2
配列番号20:T1-12C VH CDR 2
配列番号21:T1-9F VH CDR 2
配列番号22:T2-8F VH CDR 2
配列番号23:T2-12C VH CDR 2
配列番号24:T2-3A VH CDR 2
配列番号25:T2-7B VH CDR 2
配列番号26:T2-6G VH CDR 2
配列番号27:T2-10E VH CDR 2
配列番号28:T2-6C VH CDR 2
配列番号29:T1-5G VH CDR 2
配列番号30:T2-6A VH CDR 2
配列番号31:T2-12A VH CDR 2
配列番号32:T1-11G VH CDR 3
配列番号33:T1-12C VH CDR 3
配列番号34:T1-9F VH CDR 3
配列番号35:T2-8F VH CDR 3
配列番号36:T2-12C VH CDR 3
配列番号37:T2-3A VH CDR 3
配列番号38:T2-7B VH CDR 3
配列番号39:T2-6G VH CDR 3
配列番号40:T2-10E VH CDR 3
配列番号41:T2-6C VH CDR 3
配列番号42:T1-5G VH CDR 3
配列番号43:T2-6A VH CDR 3
配列番号44:T2-12A VH CDR 3
配列番号45:T1-11G重鎖
配列番号46:T2- 6A重鎖
配列番号47:T1-12C重鎖
配列番号48:T1- 9F重鎖
配列番号49:T2-12F重鎖
配列番号50:T2- 8F重鎖
配列番号51:T2-12A重鎖
配列番号52:T2-12C重鎖
配列番号53:T2- 3A重鎖
配列番号54:T2- 7B重鎖
配列番号55:T2- 6G重鎖
配列番号56:T2-10E重鎖
配列番号57:T2- 6C重鎖
配列番号58:T1-11G VL CDR 1
配列番号59:T1-12C VL CDR 1
配列番号60:T1-9F VL CDR 1
配列番号61:T2-8F VL CDR 1
配列番号62:T2-12C VL CDR 1
配列番号63:T2-3A VL CDR 1
配列番号64:T2-7B VL CDR 1
配列番号65:T2-6G VL CDR 1
配列番号66:T2-10E VL CDR 1
配列番号67:T2-6C VL CDR 1
配列番号68:T1-5G VL CDR 1
配列番号69:T2-6A VL CDR 1
配列番号70:T2-12A VL CDR 1
配列番号71:T1-11G VL CDR 2
配列番号72:T1-12C VL CDR 2
配列番号73:T1-9F VL CDR 2
配列番号74:T2-8F VL CDR 2
配列番号75:T2-12C VL CDR 2
配列番号76:T2-3A VL CDR 2
配列番号77:T2-7B VL CDR 2
配列番号78:T2-6G VL CDR 2
配列番号79:T2-10E VL CDR 2
配列番号80:T2-6C VL CDR 2
配列番号81:T1-5G VL CDR 2
配列番号82:T2-6A VL CDR 2
配列番号83:T2-12A VL CDR 2
配列番号84:T1-11G VL CDR 3
配列番号85:T1-12C VL CDR 3
配列番号86:T1-9F VL CDR 3
配列番号87:T2-8F VL CDR 3
配列番号88:T2-12C VL CDR 3
配列番号89:T2-3A VL CDR 3
配列番号90:T2-7B VL CDR 3
配列番号91:T2-6G VL CDR 3
配列番号92:T2-10E VL CDR 3
配列番号93:T2-6C VL CDR 3
配列番号94:T1-5G VL CDR 3
配列番号95:T2-6A VL CDR 3
配列番号96:T2-12A VL CDR 3
配列番号97:T1-11G軽鎖
配列番号98:T2- 6A軽鎖
配列番号99:T1-12C軽鎖
配列番号100:T1- 9F軽鎖
配列番号101:T2-12F軽鎖
配列番号102:T2- 8F軽鎖
配列番号103:T2-12A軽鎖
配列番号104:T2-12C軽鎖
配列番号105:T2- 3A軽鎖
配列番号106:T2- 7B軽鎖
配列番号107:T2- 6G軽鎖
配列番号108:T2-10E軽鎖
配列番号109:T2- 6C軽鎖
配列番号110:NATVH1-2
配列番号111:NATVH1-2
配列番号112:NATVH3-2
配列番号113:NATVH3-2
配列番号114:NATJH-ALL
配列番号115:NATVL4
配列番号116:NATVK1-1
配列番号117:NATVL4
配列番号118:NATVK3
配列番号119:NATJL1-R
配列番号120:NATJK-R5
配列番号121:NATJL2-R
【特許請求の範囲】
【請求項1】
配列番号7〜18からなる群から選択されるいずれか一つのアミノ酸配列を有する重鎖相補性決定領域(以下、HCDR)1、配列番号19〜31からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR2及び配列番号32〜44からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR3を含む重鎖可変領域(VH)を含む重鎖またはその断片、及び、
配列番号58〜70からなる群から選択されるいずれか一つのアミノ酸配列を有する軽鎖相補性決定領域(以下、LCDR)1、配列番号71〜83からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR2及び配列番号84〜96からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR3を含む軽鎖可変領域(VL)を含む軽鎖またはその断片を含むTMPRSS4に特異的なヒト抗体。
【請求項2】
前記重鎖可変領域が、配列番号45〜57からなる群から選択されるいずれか一つのアミノ酸配列を有することを特徴とする、請求項1に記載のヒト抗体。
【請求項3】
前記軽鎖可変領域が、配列番号97〜109からなる群から選択されるいずれか一つのアミノ酸配列を有することを特徴とする、請求項1に記載のヒト抗体。
【請求項4】
請求項1に記載のヒト抗体の重鎖またはその免疫学的に活性を有した断片をコーディングするポリヌクレオチド。
【請求項5】
請求項1に記載のヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコーディングするポリヌクレオチド。
【請求項6】
請求項4に記載のポリヌクレオチドを含む発現ベクター。
【請求項7】
請求項5に記載のポリヌクレオチドを含む発現ベクター。
【請求項8】
請求項6に記載の発現ベクターを宿主細胞に導入して製造された形質転換体。
【請求項9】
請求項7に記載の発現ベクターを宿主細胞に導入して製造された形質転換体。
【請求項10】
請求項6および請求項7に記載の発現ベクターを同時に宿主細胞に導入して製造された形質転換体。
【請求項11】
1)請求項10に記載の形質転換体を培養する工程、及び
2)前記培養液から請求項1のヒト抗体を精製する工程を含むTMPRSS4に特異的なヒト抗体の製造方法。
【請求項12】
請求項1に記載のヒト抗体を含む組成物。
【請求項13】
請求項1に記載のヒト抗体を含む薬学的組成物。
【請求項14】
TMPRSS4が過発現される癌の予防及び治療に用いることを特徴とする、請求項13に記載の薬学的組成物。
【請求項15】
TMPRSS4が過発現される癌が、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されることを特徴とする、請求項14に記載の薬学的組成物。
【請求項16】
化学的療法と並行して投与することを特徴とする、請求項13に記載の薬学的組成物。
【請求項17】
薬学的に有効な量の請求項1に記載のヒト抗体をTMPRSS4が過発現される癌にかかった個体に投与する工程を含むTMPRSS4が過発現される癌の治療方法。
【請求項18】
TMPRSS4が過発現される癌が、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されることを特徴とする、請求項17に記載の癌の治療方法。
【請求項19】
請求項1に記載のヒト抗体、前記ヒト抗体の軽鎖または重鎖、またはその免疫学的に活性を有した断片及び放射性同位元素を含む組成物。
【請求項20】
TMPRSS4が過発現される癌の放射線免疫治療用及び検出用に用いることを特徴とする、請求項19に記載の組成物。
【請求項21】
TMPRSS4が過発現される癌が、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されることを特徴とする、請求項20に記載の組成物。
【請求項22】
前記治療用放射性同位元素が、3H、11C、14C、18F、64Cu、76Br、86Y、99mTc、111In、123I、177Lu及びこれらの混合物及び組み合わせからなる群から選択されることを特徴とする、請求項19に記載の癌の検出用組成物。
【請求項23】
前記治療用放射性同位元素が、ヒト抗体と結合されるかヒト抗体が結合された運搬体に含まれることを特徴とする、請求項19〜請求項22のいずれか一項に記載の薬学的組成物。
【請求項24】
請求項19に記載の組成物を癌細胞と接触させる工程を含む試験管内のTMPRSS4が過発現される癌の免疫検出方法。
【請求項25】
1)請求項19に記載の組成物の診断的有効量を個体に投与する工程、及び、
2)前記個体に対する検出映像を収得する工程を含む生体内TMPRSS4が過発現される癌の映像化方法。
【請求項26】
TMPRSS4が過発現される癌が、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されることを特徴とする、請求項25に記載の癌の映像化方法。
【請求項27】
前記検出映像が、近赤外光イメージング、PET、MRIまたは超音波イメージングによって収得されることを特徴とする、請求項25に記載の映像化方法。
【請求項28】
1)請求項21に記載の検出用組成物を個体の静脈内投与する工程と、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、および
3)前記工程2)で確認された腫瘍細胞を手術的切除によって除去する工程とを含むTMPRSS4が過発現される癌の生体内治療方法。
【請求項29】
TMPRSS4が過発現される癌が、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されることを特徴とする、請求項28に記載の癌の生体内治療方法。
【請求項30】
1)請求項19に記載の組成物を大腸癌腫瘍細胞が除去された患者の静脈内に投与する工程と、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、および
3)工程2)で腫瘍細胞が検出されなければ、腫瘍細胞がすべて除去されたと判断することを特徴とする癌治療患者の予後評価方法。
【請求項1】
配列番号7〜18からなる群から選択されるいずれか一つのアミノ酸配列を有する重鎖相補性決定領域(以下、HCDR)1、配列番号19〜31からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR2及び配列番号32〜44からなる群から選択されるいずれか一つのアミノ酸配列を有するHCDR3を含む重鎖可変領域(VH)を含む重鎖またはその断片、及び、
配列番号58〜70からなる群から選択されるいずれか一つのアミノ酸配列を有する軽鎖相補性決定領域(以下、LCDR)1、配列番号71〜83からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR2及び配列番号84〜96からなる群から選択されるいずれか一つのアミノ酸配列を有するLCDR3を含む軽鎖可変領域(VL)を含む軽鎖またはその断片を含むTMPRSS4に特異的なヒト抗体。
【請求項2】
前記重鎖可変領域が、配列番号45〜57からなる群から選択されるいずれか一つのアミノ酸配列を有することを特徴とする、請求項1に記載のヒト抗体。
【請求項3】
前記軽鎖可変領域が、配列番号97〜109からなる群から選択されるいずれか一つのアミノ酸配列を有することを特徴とする、請求項1に記載のヒト抗体。
【請求項4】
請求項1に記載のヒト抗体の重鎖またはその免疫学的に活性を有した断片をコーディングするポリヌクレオチド。
【請求項5】
請求項1に記載のヒト抗体の軽鎖またはその免疫学的に活性を有した断片をコーディングするポリヌクレオチド。
【請求項6】
請求項4に記載のポリヌクレオチドを含む発現ベクター。
【請求項7】
請求項5に記載のポリヌクレオチドを含む発現ベクター。
【請求項8】
請求項6に記載の発現ベクターを宿主細胞に導入して製造された形質転換体。
【請求項9】
請求項7に記載の発現ベクターを宿主細胞に導入して製造された形質転換体。
【請求項10】
請求項6および請求項7に記載の発現ベクターを同時に宿主細胞に導入して製造された形質転換体。
【請求項11】
1)請求項10に記載の形質転換体を培養する工程、及び
2)前記培養液から請求項1のヒト抗体を精製する工程を含むTMPRSS4に特異的なヒト抗体の製造方法。
【請求項12】
請求項1に記載のヒト抗体を含む組成物。
【請求項13】
請求項1に記載のヒト抗体を含む薬学的組成物。
【請求項14】
TMPRSS4が過発現される癌の予防及び治療に用いることを特徴とする、請求項13に記載の薬学的組成物。
【請求項15】
TMPRSS4が過発現される癌が、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されることを特徴とする、請求項14に記載の薬学的組成物。
【請求項16】
化学的療法と並行して投与することを特徴とする、請求項13に記載の薬学的組成物。
【請求項17】
薬学的に有効な量の請求項1に記載のヒト抗体をTMPRSS4が過発現される癌にかかった個体に投与する工程を含むTMPRSS4が過発現される癌の治療方法。
【請求項18】
TMPRSS4が過発現される癌が、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されることを特徴とする、請求項17に記載の癌の治療方法。
【請求項19】
請求項1に記載のヒト抗体、前記ヒト抗体の軽鎖または重鎖、またはその免疫学的に活性を有した断片及び放射性同位元素を含む組成物。
【請求項20】
TMPRSS4が過発現される癌の放射線免疫治療用及び検出用に用いることを特徴とする、請求項19に記載の組成物。
【請求項21】
TMPRSS4が過発現される癌が、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されることを特徴とする、請求項20に記載の組成物。
【請求項22】
前記治療用放射性同位元素が、3H、11C、14C、18F、64Cu、76Br、86Y、99mTc、111In、123I、177Lu及びこれらの混合物及び組み合わせからなる群から選択されることを特徴とする、請求項19に記載の癌の検出用組成物。
【請求項23】
前記治療用放射性同位元素が、ヒト抗体と結合されるかヒト抗体が結合された運搬体に含まれることを特徴とする、請求項19〜請求項22のいずれか一項に記載の薬学的組成物。
【請求項24】
請求項19に記載の組成物を癌細胞と接触させる工程を含む試験管内のTMPRSS4が過発現される癌の免疫検出方法。
【請求項25】
1)請求項19に記載の組成物の診断的有効量を個体に投与する工程、及び、
2)前記個体に対する検出映像を収得する工程を含む生体内TMPRSS4が過発現される癌の映像化方法。
【請求項26】
TMPRSS4が過発現される癌が、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されることを特徴とする、請求項25に記載の癌の映像化方法。
【請求項27】
前記検出映像が、近赤外光イメージング、PET、MRIまたは超音波イメージングによって収得されることを特徴とする、請求項25に記載の映像化方法。
【請求項28】
1)請求項21に記載の検出用組成物を個体の静脈内投与する工程と、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、および
3)前記工程2)で確認された腫瘍細胞を手術的切除によって除去する工程とを含むTMPRSS4が過発現される癌の生体内治療方法。
【請求項29】
TMPRSS4が過発現される癌が、大腸癌、肺癌、肝臓癌、膵臓癌、胃癌及び悪性甲状腺腫瘍からなる群から選択されることを特徴とする、請求項28に記載の癌の生体内治療方法。
【請求項30】
1)請求項19に記載の組成物を大腸癌腫瘍細胞が除去された患者の静脈内に投与する工程と、
2)前記工程1)の組成物を検出して腫瘍細胞を確認する工程、および
3)工程2)で腫瘍細胞が検出されなければ、腫瘍細胞がすべて除去されたと判断することを特徴とする癌治療患者の予後評価方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8a】


【図8b】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8a】


【図8b】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【公表番号】特表2012−505650(P2012−505650A)
【公表日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願番号】特願2011−532001(P2011−532001)
【出願日】平成20年11月10日(2008.11.10)
【国際出願番号】PCT/KR2008/006614
【国際公開番号】WO2010/044506
【国際公開日】平成22年4月22日(2010.4.22)
【出願人】(508139457)コリア リサーチ インスティテュート オブ バイオサイエンス アンド バイオテクノロジー (19)
【Fターム(参考)】
【公表日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願日】平成20年11月10日(2008.11.10)
【国際出願番号】PCT/KR2008/006614
【国際公開番号】WO2010/044506
【国際公開日】平成22年4月22日(2010.4.22)
【出願人】(508139457)コリア リサーチ インスティテュート オブ バイオサイエンス アンド バイオテクノロジー (19)
【Fターム(参考)】
[ Back to top ]

